第十二章 骨骼肌生理学
骨骼肌生理
肌肉细胞高度专门化,可将化学能转化为机械能。具体而言,肌肉细胞利用三磷酸腺苷 (ATP) 中的能量产生力量或做功。由于做功可以采取多种形式(例如运动、泵血或蠕动),因此已经进化出几种类型的肌肉。肌肉的三种基本类型是骨骼肌、心肌和平滑肌。
骨骼肌作用于骨骼。例如,在四肢中,骨骼肌跨越关节,从而允许杠杆作用。骨骼肌受自主控制(即由中枢神经系统控制),并在维持姿势、运动、言语和呼吸等众多活动中发挥关键作用。在显微镜下观察时,骨骼肌呈现横向条纹(间隔为 2-3 µm),这是由于骨骼肌细胞内肌动蛋白和肌球蛋白分子高度有序排列所致。因此,骨骼肌被归类为横纹肌。心脏由心肌组成,虽然它也是横纹肌,但它是一种不随意肌(即由内在起搏器控制并受自主神经系统调节)。平滑肌(缺乏骨骼肌和心肌中明显的条纹)是一种不随意肌,通常位于肠道和血管等中空器官内壁。在这三种肌肉类型中,力量都是由肌动蛋白和肌球蛋白分子相互作用产生的,这一过程需要细胞内 [Ca] 的短暂升高。
本章将重点介绍骨骼肌收缩的分子机制。还介绍了调节收缩力的机制。 为了正确理解这些信息,首先学习骨骼肌的基本组织非常重要。
骨骼肌的组织
图 12.1 显示了横跨肘关节的骨骼肌。 肌肉附着在关节两侧的骨骼上。 最靠近脊柱(近端)的附着点称为起点origin,而关节远端(远端)的附着点称为止点insertion。 这些附着点通过肌肉末端的肌腱(结缔组织)发生。 请注意,止点靠近肘关节,这使得运动范围更广。还要注意,关节一侧有一块屈肌,另一侧有一块伸肌。因此,屈肌收缩(见图 12.1 中的二头肌)会导致肘关节角度减小(使前臂更靠近肩膀),而伸肌收缩(见图 12.1 中的三头肌)会导致反向运动(伸展手臂)。
骨骼肌的基本结构如图 12.2 所示。每块肌肉都由许多称为肌纤维muscle fibers的细胞组成。一层称为肌内膜endomysium 的结缔组织层包裹着这些纤维。随后,肌纤维被组合成肌束fascicles,肌束被另一层结缔组织层(称为肌束膜perimysium)包围。肌束膜内有为单个肌肉纤维提供营养的血管和神经。肌束连接在一起形成肌肉。包裹肌肉的结缔组织鞘称为肌外膜epimysium。在肌肉的末端,结缔组织层聚集在一起形成肌腱,将肌肉连接到骨骼上。肌肉-肌腱接口 myotendinous junction是肌腱的一个特殊区域,肌纤维的末端与肌腱交叉,将肌肉的收缩力传递到肌腱,从而实现骨骼的运动(本节后面将讨论)。肌腱和结缔组织层主要由弹性蛋白和胶原纤维组成,因此它们也有助于肌肉的被动张力,并防止肌肉纤维因过度拉伸或收缩而受损。
单个骨骼肌细胞很窄(直径约为 10-80 微米),但它们可以非常长(长度可达 25 厘米)。每根骨骼肌纤维都包含沿细胞轴线延伸的细丝束,称为肌原纤维myofibrils。细胞的粗条纹图案是由肌原纤维中的重复图案引起的。具体而言,正是这些肌原纤维内粗细丝的规则排列,再加上相邻肌原纤维的高度组织化排列,才产生了骨骼肌的条纹外观。在完整的肌纤维和下面的肌原纤维中可以观察到条纹。
肌原纤维可以纵向细分为肌节sarcomeres(图 12.3)。肌节由两条称为 Z 线 的暗线分开,是骨骼肌中的重复收缩单位。肌节的平均长度为 2 µm。Z 线两侧是一条亮带(I 带),其中包含主要由蛋白质肌动蛋白组成的细丝。肌节内两个 I 带之间的区域是 A 带,其中包含主要由蛋白质肌球蛋白组成的粗丝。细肌动蛋白丝从 Z 线延伸至肌节中心并与粗丝的一部分重叠。A 带两端的深色区域代表粗丝和细丝之间重叠的区域。肌节中心的亮色区域称为 H 带。该区域代表 A 带中包含肌球蛋白粗丝但没有细肌动蛋白丝的部分。因此,细肌动蛋白丝从 Z 线延伸到 H 带的边缘,并与 A 带中粗丝的一部分重叠。肌节中心有一条暗线,称为 M 线,其中包含对肌节中粗丝的组织和排列至关重要的蛋白质。
• 图 12.1 骨骼肌通过肌腱附着在骨骼上,通常跨越关节。肌腱的近端和远端附着点分别称为起点和止点。请注意,止点靠近关节,这允许广泛的运动范围。还要注意,骨骼肌跨越关节的两侧,这允许前臂屈曲和伸展。
• 图 12.2 骨骼肌由肌纤维束组成;每个这样的束称为束。肌纤维代表单个肌肉细胞,包含肌原纤维束。条纹是由于粗细丝的排列造成的。详情请参阅正文。(重绘自 Bloom W、Fawcett DW。《组织学教科书》。第 10 版。费城:桑德斯; 1975.)
如图 12.3B 所示,肌纤维中的每个肌原纤维都被肌浆网 (SR,sarcoplasmic reticulum) 包围。SR 是一种细胞内膜网络,在调节细胞内 [Ca] 方面起着关键作用。肌膜的内陷称为 T 小管,它们在 A 带末端附近(即靠近 SR)进入肌纤维。然而,SR和 T 小管是不同的膜系统:SR 是细胞内网络,而 T 小管与细胞外空间接触。间隙(≈15 纳米宽)将 T 小管与 SR 分隔开。SR 最靠近 T 小管的部分称为终池terminal cisternae,它是 Ca 释放的位点,这对于骨骼肌的收缩至关重要(参见“兴奋收缩耦合”部分)。在肌原纤维处,T 小管位于两个终池之间(见图 12.3B)。术语“三联管”指的是 T 小管的这个区域,它与两个相邻的终池耦合,因此是兴奋-收缩耦合开始的位点。
SR 的纵向部分与终池连续,并沿着肌节的长度延伸。 SR 的这一部分含有高密度的 Ca泵(即 SERCA:肌浆内质网 Ca-ATPase),这对于 SR 中 Ca 的重新积累以及肌肉的放松至关重要。粗肌丝和细肌丝在肌原纤维的肌节中高度有序。细肌动蛋白丝从 Z 线向肌节中心延伸,而粗肌球蛋白丝位于中心并与相对的细肌动蛋白丝的一部分重叠。粗肌球蛋白丝和细肌球蛋白丝的取向方式是,在肌节内的重叠区域中,每根粗肌球蛋白丝都被六边形的细肌动蛋白丝阵列包围(见图 12.3C)。粗肌球蛋白丝和细肌动蛋白丝之间的 Ca 依赖性相互作用在刺激肌肉后产生收缩力(参见“肌动蛋白-肌球蛋白相互作用:横桥形成”一节)。
细丝由肌动蛋白分子(称为球状肌动蛋白或 G-肌动蛋白)聚集形成双链螺旋丝,称为肌动蛋白纤维或 F-肌动蛋白。细长的细胞骨架蛋白肌动蛋白沿着细丝的长度延伸,并可能参与调节细丝的长度。蛋白质原肌球蛋白tropomyosin的二聚体延伸到整个肌动蛋白丝,并覆盖肌动蛋白分子上的肌球蛋白结合位点。每个原肌球蛋白二聚体延伸到七个肌动蛋白分子,连续的原肌球蛋白二聚体以头对尾的配置排列。每个原肌球蛋白二聚体上都存在由三个亚基(肌钙蛋白 T、肌钙蛋白 I 和肌钙蛋白 C)组成的肌钙蛋白复合物troponin complex,它影响原肌球蛋白分子在肌动蛋白丝上的位置,从而影响原肌球蛋白低钙浓度下抑制肌球蛋白与肌动蛋白丝结合的能力。(参见“肌动蛋白-肌球蛋白相互作用:横桥形成”一节)。与细丝相关的其他蛋白质包括原调节蛋白tropomodulin、α-辅肌动蛋白α-actinin和 CapZ 。原调节蛋白位于细丝末端,朝向肌节中心,可能参与设定细丝的长度。CapZ 蛋白和 α-辅肌动蛋白用于将细丝锚定在 Z 线上。
粗肌球蛋白丝通过细胞骨架蛋白肌联蛋白固定在 Z 线上。肌联蛋白是一种非常大的蛋白质(分子量 > 3000 kDa),从 Z 线延伸到肌节中心(见图 12.3C),似乎对肌节中粗丝的组织和排列很重要。某些形式的肌营养不良症被归因于肌联蛋白缺陷(即肌联蛋白病)。在粗丝中发现的其他蛋白质(例如myomesin和 C 蛋白)也可能参与粗丝的双极组织或包装(或两者兼而有之)。
细胞骨架(包括中间丝蛋白desmin)参与肌节的高度组织排列。结蛋白Desmin从相邻肌节的 Z 线延伸到肌膜上的整合素蛋白复合物,因此既参与肌节在肌肉中的排列,也参与力的横向传递(本节后面将介绍)。结蛋白缺陷与肌原纤维肌病有关。
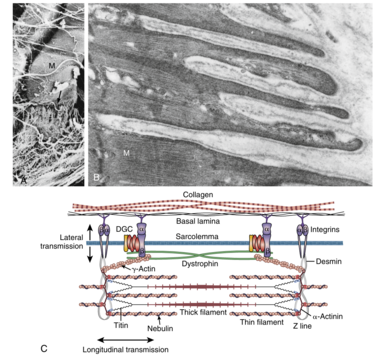
收缩力既纵向传递到肌腱(通过肌肉-肌腱接口),又横向传递到肌纤维附近的结缔组织(通过costameres)。肉-腱接口代表肌纤维与肌腱连接的特殊区域(图 12.4A、B)。肉-腱接口处的肌膜折叠导致肌腱与肌纤维末端交叉,这增加了肌纤维和结缔组织之间的接触面积,从而降低了肌纤维末端单位面积的力量。
收缩力的横向传递涉及costameres,costameres通过一系列蛋白质将肌膜下肌节的 Z 线与细胞外基质连接起来。横向传递被认为稳定了肌细胞膜sarcolemma,避免其在收缩中破损。肉-腱接口和costameres的缺陷于一些肌营养不良相关。这两者也包含信号分子。
在细胞水平上
肌营养不良症是一组遗传决定的退行性疾病。杜氏肌营养不良症(由 G.B. Duchenne 于 1861 年描述)是最常见的肌营养不良症,每 3500 名男孩(3-5 岁)中就有 1 名患有此病。该病会导致严重的肌肉萎缩,大多数患者在 12 岁时就只能坐在轮椅上;许多人在成年期(30-40 岁)死于呼吸衰竭。杜氏肌营养不良症是一种 X 连锁隐性疾病,与肌营养不良蛋白基因缺陷有关,导致骨骼肌、大脑、视网膜和平滑肌中肌营养不良蛋白缺乏。肌营养不良蛋白是一种较大的(427 kDa)蛋白质,在骨骼肌中的含量较低(0.025%)。它位于肌膜的细胞内表面,与几种膜内糖蛋白结合(形成肌营养不良蛋白-糖蛋白复合物;图 12.4C 和 12.5A)。
这种肌营养不良蛋白-糖蛋白复合物在肌膜下细胞骨架和细胞外基质之间提供了结构连接,似乎可以稳定肌膜,从而防止收缩引起的损伤(破裂)。肌营养不良蛋白-糖蛋白复合物也可以作为细胞信号级联的支架。一氧化氮合酶存在于肌营养不良蛋白-糖蛋白复合物中。
尽管肌营养不良蛋白-糖蛋白复合物中的缺陷与多种形式的肌营养不良症有关,一些涉及其他机制的肌营养不良症形式已被确定。具体而言,肌膜修复缺陷(归因于蛋白质 dysferlin 的丢失/突变)似乎是至少一种形式的肌营养不良症(肢带型肌营养不良症 2B,与骨盆区域的肌肉萎缩有关)的根本原因。蛋白质肌联蛋白(肌联蛋白病)的缺陷与其他形式的肌营养不良症有关(例如肢带型肌营养不良症 2J 和胫骨型肌营养不良症)。蛋白酶钙蛋白酶 3 的突变(导致蛋白酶活性丧失)也与某些类型的肌营养不良症(例如肢带型肌营养不良症 2A)有关,显然是继发于细胞凋亡。
图 12.6 显示了粗丝的组织。每个肌球蛋白分子(≈480 kDa)由两条重链(≈200 kDa)和四条轻链(≈20 kDa)组成。重链以 α 螺旋结构缠绕在一起,形成长棒状片段(形成粗丝的骨架)和 N 端球状头部(从每个肌球蛋白重链延伸至肌动蛋白丝)。
每个肌球蛋白分子的球状头部含有一条必需轻链essential light chain(对肌球蛋白的 ATPase 活性至关重要)和一条调节轻链regulatory light chain。调节轻链可被 Ca/钙调蛋白依赖性肌球蛋白轻链蛋白激酶磷酸化,从而影响肌球蛋白与肌动蛋白的相互作用(参见“骨骼肌类型”部分)。因此,肌球蛋白 ATPase 活性发生在肌球蛋白的两个球状头部中,并且需要每个球状头部中存在“必需”轻链。
肌球蛋白细丝由肌球蛋白分子的尾对尾结合形成,这导致粗细丝呈双极排列(见图 12.6A)。然后,粗肌丝通过肌球蛋白分子的首尾相连在中央裸露区域的两侧延伸,从而保持肌丝以 M 线为中心的双极组织。这种双极排列对于在收缩过程中将 Z 线拉到一起(即缩短肌节的长度)至关重要。
骨骼肌活动的控制
运动神经和运动单位
骨骼肌由中枢神经系统控制。具体来说,每块骨骼肌都由 α 运动神经元支配。α 运动神经元的细胞体位于脊髓腹角(图 12.7;另见第 9 章)。运动轴突通过腹根发出,并通过混合外周神经到达肌肉。α 运动神经在肌肉中分支,每个分支支配一条肌纤维。第 6 章描述了形成神经肌肉接头的特化胆碱能突触和在肌肉纤维中产生动作电位的神经肌肉传递过程。
运动单位 motor unit 由 α 运动神经和受该神经支配的所有肌肉纤维组成。运动单位是功能性收缩单位,因为当运动神经激发时,运动单位内的所有肌肉细胞都会同步收缩。肌肉内运动单位的大小各不相同,取决于肌肉的功能。激活具有少量纤维的运动单位有助于精细运动控制。激活肌肉内不同数量的运动单位是控制肌肉产生的张力的一种方式(参见“收缩力调节”部分中的“募集”)。
由 α 运动神经元形成的神经肌肉接头称为终板end plate(详情请参阅第 6 章)。神经肌肉接头处 α 运动神经元释放的乙酰胆碱在肌纤维中引发动作电位,并迅速沿其长度扩散。骨骼肌中动作电位的持续时间小于 5 毫秒。骨骼肌动作电位的短暂持续时间允许纤维非常快速地收缩,并提供了另一种可以增加收缩力的机制。通过反复刺激肌肉来增加张力称为强直tetany(参见“收缩力调节”部分)。
兴奋-收缩耦合
当动作电位沿着肌纤维的肌膜传递,然后沿着 T 小管向下传递时,Ca 从 SR 的终池释放到肌浆中(图 12.8A)。这种 Ca 释放导致细胞内 [Ca] 升高,进而促进肌动蛋白-肌球蛋白相互作用,从而导致收缩(见图 12.8B)。动作电位的持续时间极短(<5 毫秒)。细胞内 [Ca] 的升高在动作电位后不久开始,并在约 20 毫秒时达到峰值。细胞内 [Ca] 的增加引发一次称为twitch的收缩。
骨骼肌中动作电位的机制肌纤维可以诱导 SR 中 Ca 的释放,这涉及 T 小管中电压门控 Ca 通道 (CaV1.1) 与 SR 终池中附近的 Ca 释放通道 (RYR1) 的相互作用(见图 12.8A)。钙流经 T 小管中的电压门控 Ca 通道不是诱导附近 SR 中 Ca 释放所必需的。相反,T 小管中电压门控 Ca 通道的去极化诱导构象变化似乎会促进与附近 SR Ca 释放通道的蛋白质-蛋白质相互作用,导致 Ca 从 SR 释放到细胞质中。然后,细胞浆 Ca 的升高促进了肌动蛋白-肌球蛋白相互作用,从而促进收缩。
电压门控 Ca通道和 SR Ca 释放通道的拟议组织形式如图 12.9A 所示。电压门控 Ca 通道包含五个亚基 (α1s、α2、δ、β1a、γ),其中 α1s 亚基充当电压传感器和 Ca 通道。α1s 亚基也称为 CaV1.1。历史上,这种电压门控 Ca 通道是使用二氢吡啶类 L-Ca 通道阻滞剂分离的,因此 α1s 亚基 (CaV1.1) 也称为二氢吡啶受体 (DHPR)。
SR Ca 释放通道称为雷诺丁受体 (RYR),因为它是使用化合物雷诺丁ryanodine分离的。骨骼肌中雷诺丁受体的异构体是 RYR1。雷诺丁受体 (RYR1) 是一种大蛋白 (∼480 kDa),在终池中形成同源四聚体 Ca 通道。 RYR1 的大部分从终末池延伸,跨越约 15 nm 的间隙,接近 T 小管。结构分析证实了 T 小管中的电压门控 Ca 通道与从终末池延伸的 RYR1 的胞质部分密切相关(见图 12.9A)。
最近的研究表明,骨骼肌中兴奋-收缩-偶联特征的 SR 去极化诱导的 Ca 释放可以在使用以下 5 种蛋白质的表达系统中重建:(1) CaV1.1、(2) 电压门控 Ca 通道的 β1a 辅助亚基、(3) 衔接蛋白 STAC3、(4) RYR1 和 (5) junctiphilin。这些蛋白质之间拟议的相互作用如图 12.9B 所示。图 12.9 中未显示 Junctiphilin,但它在促进 SR 和 T 小管膜之间连接的形成/维持方面发挥着关键作用。Junctiphilin 也可能参与定位这种钙释放复合物。
终末池的管腔含有低亲和力的 Ca 结合蛋白calsequestrin,它允许 Ca以高浓度“储存”,从而建立有利的浓度梯度,促进当 RYR1打开时 Ca 从 SR 流出到细胞质。蛋白质 triadin 和 junctin 也位于终末池膜中,并与 RYR 和钙结合蛋白结合;它们可以将钙结合蛋白锚定在 RYR1 附近,从而增加钙释放位点的钙缓冲能力。富含组氨酸的钙结合蛋白是 SR 腔中的另一种低亲和力钙结合蛋白,尽管它不如calsequestrin丰富。
还有证据表明,在强直期间,骨骼肌中存在store-operated Ca entry (SOCE)(例如,通过 Orai/Stim1 复合物)。抑制 Ca 流入不会影响兴奋-收缩耦合,但会降低高电刺激率下的最大强直张力,这表明在强直过程中可能会有一些细胞内 Ca 的挤出,这可以通过 Ca 流入进行补偿以维持最大强直张力。
在细胞水平上
最近的研究表明,CaV1.1 和 RYR1 之间的机电耦合可以通过以下 5 种蛋白质实现:(1) CaV1.1、(2) CaV1.1 的 β1a 辅助亚基、(3) Stac3、(4) RYR1 和 (5) junctiphilin(见图 12.9B)。人们假设当动作电位的去极化波沿 T 小管向下传播时,CaV1.1 通过构象变化对电压作出反应,从而打开底层的 RYR1,导致 Ca 从 SR 的终池释放到肌肉细胞质中,从而促进肌动蛋白-肌球蛋白相互作用,从而促进收缩。参与膜内电荷运动的 CaV1.1 电压感应区被认为位于 CaV1.1 的 S4 跨膜片段中,而 CaV1.1 中跨膜结构域 II 和 III 之间的肌质环似乎对 CaV1.1、Stac3 和 RYR1 之间的相互作用很重要。 CaV1.1、RYR1 和/或 Stac3 的突变与以细胞内 [Ca] 调节改变为特征的病理有关。具体而言,CaV1.1 的突变与低钾性周期性麻痹和 1 型肌强直性营养不良有关。恶性高热易感性与 CaV1.1 或 RYR1 的突变有关。 Central core disease涉及 RYR1 缺陷,稍后讨论。Stac3 的突变存在于罕见的先天性疾病美洲原住民肌病中。
骨骼肌松弛发生在细胞内 Ca 被 SR 隔离时。Ca 进入 SR 是由于 Ca 泵(即 Ca-ATPase)的作用。这种泵并非骨骼肌独有;它存在于与内质网相关的所有细胞中。因此,它被命名为 SERCA,代表肌浆内质网钙 ATPase。SERCA 是骨骼肌 SR 中最丰富的蛋白质,分布于纵管和终末池中。它每水解一个 ATP 分子,就会将两个 Ca 转运到其管腔中。因此,在抽搐收缩期间看到的 Ca 瞬变(见图 12.8B)反映了 Ca 通过 RYR1 从终末池释放,并主要通过 SERCA 重新吸收到 SR 的纵向部分。低亲和力的 Ca 结合蛋白 sarcalumenin 存在于 SR 的纵管和nonjunctional regions of 终池,并被认为参与将 Ca 从纵向小管中的 Ca 吸收位点转移到终末池中的 Ca 释放位点。研究结果表明,sarcalumenin至少部分通过缓冲泵附近的腔内 Ca 来增加 SERCA 对 Ca 的吸收。
内源性微肽phospholamban, sarcolipin, 和myoregulin已被证明可通过降低 Ca 吸收的 Ca 敏感性来调节 SERCA 的活性。据报道,慢肌骨骼肌中phospholamban的PKA 依赖性磷酸化可增加 SR 中的 Ca 转运,类似于心脏中phospholamban磷酸化的作用。phospholamban和sarcolipin存在于myoregulin中,而肌调节蛋白存在于快肌和慢肌中。
肌动蛋白-肌球蛋白相互作用:横桥形成
如前所述,骨骼肌收缩需要增加细胞内 [Ca]。此外,收缩过程受细丝调节。如图 12.10 所示,当细胞内 [Ca] 升高到 0.1 µM 以上时,收缩力(即张力)以 S 形方式增加,而最大力的一半发生在小于 1 µM Ca 时。 Ca 促进张力增加的机制如下:从 SR 释放的 Ca 与肌钙蛋白 C 结合。一旦与 Ca 结合,肌钙蛋白 C 就会促进相关原肌球蛋白分子向肌动蛋白丝裂缝方向移动。原肌球蛋白的这种移动暴露了肌动蛋白丝上的肌球蛋白结合位点,并允许形成横桥,从而产生张力(参见“横桥循环:肌节缩短”一节)。肌钙蛋白 C 有四个 Ca 结合位点。其中两个位点对 Ca 具有高亲和力,但也在静止时结合 Mg++。这些位点似乎参与控制和增强肌钙蛋白 I 和肌钙蛋白 T 亚基之间的相互作用。另外两个结合位点的亲和力较低,并在 Ca 从 SR 释放后随着其浓度升高而结合。肌球蛋白与肌动蛋白丝的结合似乎会导致原肌球蛋白的进一步转变。据推测,尽管给定的原肌球蛋白分子延伸到七个肌动蛋白分子,肌球蛋白与肌动蛋白的强结合导致相邻的原肌球蛋白分子移动,可能暴露多达 14 个肌动蛋白分子上的肌球蛋白结合位点。一个原肌球蛋白分子能够影响另一个原肌球蛋白分子的运动,这可能是相邻原肌球蛋白分子距离很近的结果。
横桥循环:肌节缩短
一旦肌球蛋白和肌动蛋白结合,肌球蛋白分子中 ATP 依赖性构象变化会导致肌动蛋白丝向肌节中心移动。这种运动缩短了肌节的长度,从而使肌纤维收缩。肌球蛋白产生力量并缩短肌节的机制被认为涉及四个基本步骤,统称为横桥循环cross-bridge cycle(图 12.11 中标记为 a 至 d)。在静息状态下,肌球蛋白被认为已部分水解 ATP(状态 a)。当 Ca 从 SR 的终池释放出来时,它会与肌钙蛋白 C 结合,而肌钙蛋白 C 又会促使肌动蛋白丝上的原肌球蛋白移动,从而使肌动蛋白上的肌球蛋白结合位点暴露出来。这样一来,“充能”的肌球蛋白头部就能与下面的肌动蛋白结合(状态 b)。接下来,肌球蛋白会发生构象变化,称为“棘轮作用”,将肌动蛋白丝拉向肌节中心(状态 c)。肌球蛋白在过渡到状态 c 时会释放腺苷二磷酸 (ADP) 和无机磷酸盐。ATP 与肌球蛋白的结合会降低肌球蛋白对肌动蛋白的亲和力,从而导致肌球蛋白从肌动蛋白丝中释放出来(状态 d)。然后肌球蛋白部分水解ATP,ATP 中的部分能量用于recock头部,并返回到静息状态。
如果细胞内 [Ca] 仍然升高,肌球蛋白会经历另一个横桥循环并产生肌肉的进一步收缩。横桥的棘轮作用能够将细丝移动约 10 纳米。该循环持续到 SERCA 将 Ca 泵回 SR。随着 [Ca] 下降,Ca 与肌钙蛋白 C 分离,肌钙蛋白-原肌球蛋白复合物移动并阻断肌动蛋白丝上的肌球蛋白结合位点。如果 ATP 供应耗尽,就像死亡时发生的那样,循环停止在 c 状态,形成永久性肌动蛋白-肌球蛋白复合物(即僵硬状态)。在这种状态下,肌肉僵硬,这种情况称为尸僵rigor mortis。
如前所述,粗肌丝的形成涉及肌球蛋白分子以尾对尾结构结合以产生双极取向(见图 12.6)。这种双极取向允许肌球蛋白在横桥循环期间将肌动蛋白丝拉向肌节中心。肌球蛋白分子也在粗肌丝中以螺旋排列的方式定向,使得横桥延伸到粗肌丝周围的六根细肌丝中的每一根(见图 12.3C)。这些肌球蛋白突起/横桥可以在骨骼肌的电子显微照片上看到,并且似乎从静止的粗肌丝垂直延伸。在收缩状态下,肌球蛋白横桥向肌节中心倾斜,这与肌球蛋白头部的棘轮作用一致。
刚刚描述的横桥循环机制被称为肌丝滑行理论sliding filament theory,因为肌球蛋白横桥将肌动蛋白细丝拉向肌节中心,导致细丝明显“滑过”粗丝。然而,对于有多少肌球蛋白分子有助于产生力量以及给定肌球蛋白分子中的两个肌球蛋白头部是否参与其中,尚不确定。据计算,每根粗丝可能有 600 个肌球蛋白头部,化学计量为每个肌动蛋白分子 1.8 个肌球蛋白头部。由于空间因素,所有肌球蛋白头不可能都与肌动蛋白相互作用,计算表明,即使在产生最大力量时,也只有 20% 到 40% 的肌球蛋白头与肌动蛋白结合。
肌肉将化学能(即 ATP)转化为机械能的效率很高。在分离的肌肉制剂中,在最大张力的 30% 的亚最大力下可获得最大机械效率(≈65% 效率)。在进行稳态测力计锻炼的人中,机械效率范围为 40% 到 57%。
临床应用
导致骨骼肌 Ca 稳态紊乱的遗传性疾病包括恶性高热 malignant hyperthermia、中央轴空病 central core disease和布罗迪肌病Brody's disease。
恶性高热是一种常染色体显性遗传病,在某些外科手术中会产生危及生命的后果。麻醉剂(如氟烷或乙醚)和肌肉松弛剂琥珀胆碱会导致 SR 中 Ca 不受控制地释放,从而导致骨骼肌僵硬、心动过速、过度换气和高热。如果不立即治疗(通常通过施用丹曲林dantrolene来阻断 SR 中这种不受控制的 Ca 释放),这种情况是致命的。恶性高热的发病率约为每 15,000 名接受麻醉治疗的儿童 1 例,每 50,000 名接受麻醉治疗的成人 1 例。恶性高热是由于 SR Ca 释放通道 (RYR1) 出现缺陷而引起的,该通道在上述麻醉剂存在下被激活,导致 Ca 释放到细胞质中,从而延长肌肉收缩(僵硬)。RYR1 中的缺陷并不局限于单个位点。在某些情况下,恶性高热与 T 小管 CaV1.1 缺陷有关。
中央轴空病是一种罕见的常染色体显性遗传病,会导致肌肉无力、骨骼肌纤维核心线粒体丢失以及收缩丝部分解体。它通常与恶性高热密切相关,因此在外科手术中,患有中央轴空病的患者会被视为易患恶性高热。据推测,缺乏线粒体的中央核代表由于 RYR 突变而导致细胞内 Ca 升高的区域。线粒体的丢失被认为是当它们吸收升高的 Ca 时发生的,这会导致线粒体 Ca 超载。
布罗迪病的特点是无痛肌肉痉挛和运动期间肌肉放松受损。例如,当患者跑上楼时,肌肉可能会僵硬,暂时无法使用。这种松弛异常见于腿部、手臂和眼睑的肌肉,在寒冷的天气下反应会恶化。布罗迪氏病可以是常染色体隐性遗传,也可以是常染色体显性遗传,可能涉及多达三个基因的突变;然而,这种病很罕见(每 10,000,000 个新生儿中有 1 个患病)。它似乎是由于快速收缩骨骼肌中 SERCA1 Ca 泵活性降低所致(参见“骨骼肌类型”部分)。SERCA1 活性降低与编码 SERCA1 的基因突变有关,尽管另一个辅助因素可能导致布罗迪氏病患者快速收缩骨骼肌中 SR Ca 摄取减少。
先天性肌强直 Myotonia congenita还与自愿收缩后的长时间肌肉收缩(无痛性痉挛)有关,这是由于 CLCN1 基因发生突变所致,该基因编码骨骼肌肌膜和 T 小管中的氯离子电压门控通道 1。骨骼肌中的氯离子电导对于膜电位的复极化和稳定非常重要,因此先天性肌强直患者骨骼肌中氯离子电导的降低会导致肌纤维过度兴奋。因此,自愿收缩之后可能会出现肌肉中的一系列动作电位(后去极化),从而导致长时间收缩(即痉挛)。肾上腺素(例如在压力情况下)通常会使病情恶化,如肌强直(“昏厥”)山羊所见。肌肉僵硬可以通过反复收缩(即热身现象)来缓解,尽管热身现象背后的机制尚不清楚。先天性肌强直中的 CLCN1 基因突变可能以常染色体隐性方式(如贝克尔病,一种先天性肌强直)或常染色体显性方式(如汤姆森病,另一种先天性肌强直)传播。先天性肌强直的患病率约为全球每 100,000 人中有 1 人;斯堪的纳维亚北部的发病率更高(约每 10,000 人中有 1 人)。
骨骼肌类型
根据收缩速度,骨骼肌纤维可分为两大类:快肌纤维和慢肌纤维。如图 12.12A 所示,眼球外直肌在动作电位下迅速收缩,在 8 毫秒内达到峰值张力,然后迅速放松,从而导致收缩持续时间较短。相比之下,腿部比目鱼肌在动作电位下需要 90 毫秒才能达到峰值张力,然后缓慢放松。腓肠肌需要中等时间才能达到峰值张力(40 毫秒),因为该肌肉中同时存在快肌纤维和慢肌纤维。快肌和慢肌收缩速度的差异与肌球蛋白 ATPase 活性相关(见图 12.12B),而肌球蛋白 ATPase 活性又反映了肌纤维中存在的肌球蛋白类型。因此,快肌纤维含有迅速水解 ATP 的肌球蛋白同工酶,而慢肌纤维含有肌球蛋白同工酶,可缓慢水解 ATP。这两种肌球蛋白亚型具有前面描述的相同基本结构,即两条重链和两对轻链,尽管它们的氨基酸组成不同。

将慢肌纤维转化为快肌纤维非常困难,尽管可以通过交叉神经支配cross-innervation来实现,这需要通过手术将两个运动神经元连接起来。如图 12.12B 所示,当比目鱼肌和伸趾长肌接受交叉神经支配,使比目鱼肌的收缩由伸趾肌运动神经元控制(反之亦然)时,比目鱼肌的收缩速度和肌球蛋白 ATPase 活性增加(图 12.12B 中标记为 X-SOL),而伸趾长肌的缩短速度和肌球蛋白 ATPase 活性降低(标记为 X-EDL)。因此,肌纤维的运动神经支配在确定肌纤维中表达哪种类型的肌球蛋白异构体方面起着重要作用。进一步的研究表明,肌肉细胞内 Ca 浓度(由于运动神经元活动模式的差异)是决定肌纤维表达慢肌球蛋白异构体还是快肌球蛋白异构体的重要因素(参见“生长和发育”部分)。
骨骼肌中表达的肌球蛋白异构体可以根据肌球蛋白重链组成来区分。慢肌纤维表达 I 型肌球蛋白重链,而快肌纤维可能包含 IIa 型、IIx 型或 IIb 型肌球蛋白重链(图 12.13)。IIb 型肌球蛋白异构体不存在于人类骨骼肌中,因此人类骨骼肌纤维类型分为 1 型、IIa 型或 IIx 型。图 12.14A 显示了人类股外侧肌活检中 I 型、IIa 型和 IIx 型肌球蛋白的分布。请注意,一些肌纤维(用星号表示)包含两种类型的肌球蛋白重链。耐力训练或慢性刺激促进 1 型肌球蛋白异构体的表达,而力量训练促进II 型肌球蛋白异构体的表达(如图12.13 所示)。通常,肌球蛋白异构体的表达变化遵循一个进程:
TypeIIx 肌球蛋白 ↔ TypeIIa 肌球蛋白 ↔ TypeI 肌球蛋白。
图 12.14B 显示了表达 1 型、IIa 型、IIx 型或 IIb 型肌球蛋白的人类和小鼠骨骼肌纤维的最大收缩速度。人类的最大收缩速度是根据图 12.14C 所示的力-速度关系的 Y 截距确定的,使用来自人类股外侧肌活检的透化单肌纤维。在人类和小鼠中,收缩速度都与纤维中表达的肌球蛋白异构体一致:
I 型收缩速度 < IIa 型收缩速度 < IIx 型收缩速度
IIb 型肌球蛋白在人类中很少表达,但在啮齿动物中表达。表达 1Ib 型肌球蛋白的小鼠肌纤维的收缩速度是四种肌球蛋白异构体中最快的。表 12.1 显示了 1 型、IIa 型、IIx 型和 IIb 型肌纤维的其他特征。
| 分类参数 | I 型 (慢氧化) | IIa 型 (快氧化) | IIx 型 (快中间型) | IIb 型 (快糖酵解) |
|---|---|---|---|---|
| 肌球蛋白同工酶 | I 型 | IIa 型 | IIx 型 | IIb 型 |
| 肌球蛋白基因 | MYH7 | MYH2 | MYH1 | MYH4 |
| 肌球蛋白 ATP 酶活性 | 慢 | 快 | 更快 | 最快 |
| 最大缩短速度 | 慢 | 快 | 更快 | 最快 |
| 肌质网钙泵速率 | 中等 | 高 | 高 | 高 |
| 毛细血管密度 | 中等 | 中等 | 低 | 最低 |
| 氧化能力(线粒体含量) | 高 | 高 | 低 | 最低 |
| 糖酵解能力 | 中等 | 高 | 高 | 高 |
由给定 α 运动神经元支配的所有肌纤维通常表达相同的肌球蛋白同工型,因此存在慢速运动单位和两三种类型的快速运动单位(分别用于人类和啮齿动物)(见图 12.13)。支配 I 型肌纤维的 α 运动神经元具有小细胞体,并且容易兴奋(表 12.2)。支配 II 型肌纤维的 α 运动神经元较大,激活阈值较高。图 12.14D 中的数据与这种募集模式一致,因为在 24 小时内,大鼠慢速收缩运动单位的累积激活时间大大超过大鼠快速收缩运动单位。大鼠的 IIb 型运动单位很少被募集。这种募集模式与运动单位募集的大小原则一致(见第 9 章),其中具有小运动轴突的运动单位比大运动神经元更容易激活,慢肌骨骼肌还具有高氧化能力的特征(见表 12.1),这与低肌球蛋白 ATPase 活性相结合,有助于慢肌纤维的抗疲劳性。快肌纤维的氧化能力范围从相对较高(在表达 IIa 型肌球蛋白重链的肌纤维中)到较低(在表达 IIb 型肌球蛋白重链的肌纤维中)。表达 IIx 型肌球蛋白重链的肌纤维的收缩速度和氧化能力介于 IIa 型和 IIb 型纤维之间,因此在人类骨骼肌(缺乏 IIb 型纤维)中,IIx 型肌纤维具有收缩速度略快,但氧化能力低于 I 型肌纤维(见表 12.1)
尽管运动单位通常仅由一种类型的肌纤维组成(见图 12.13),但有些情况可能会引发肌纤维中表达的肌球蛋白类型的变化。例如,微重力(太空飞行)、神经支配、脊髓损伤和慢性卸载等慢性疾病与严重萎缩有关,并促进纤维中从慢肌肌球蛋白(I 型)表达逐渐转变为快肌肌球蛋白(IIa 型和 IIx 型)表达。
慢运动单位的一个重要功能是维持姿势(见图 12.13)。低 ATPase
• 图 12.14 I 型肌纤维比 II 型肌纤维收缩速度慢,等长收缩力低。 A,用 I 型、IIa 型和 IIx 型肌球蛋白亚型抗体对人类股外侧肌进行免疫染色。注意存在一些表达多种肌球蛋白的混合纤维。B,小鼠和人类 I 型和 II 型肌纤维的最大无负荷收缩速度。C,人类股外侧肌 I 型和 II 型肌纤维的力-速度关系。D,对大鼠后肢 I 型、IIa 型和 IIb 型运动单元进行 24 小时连续监测。
慢速运动单元中肌球蛋白的活性,加上其高氧化能力,促进了这些慢速运动单元以低能量成本维持姿势的能力,从而抵抗疲劳。慢速肌纤维直径较小,慢速肌中毛细血管密度较高,也有助于慢速肌抵抗疲劳。相比之下,快肌则用于需要更快动作、更大力量或两者兼而有之的活动(见图 12.13)。例如,举重可能需要在短时间内消耗大量能量。为了满足对更大力量的需求,需要招募额外的运动单位。与慢速运动单位相比,快肌通常包含更多肌肉纤维(见表 12.2)。快肌纤维的直径也比慢肌纤维大。因此,招募快肌可以帮助满足诸如举重等爆发性活动的增加的需求。然而,快肌纤维中肌球蛋白 ATPase 活性高和扩散距离增加(由快肌纤维直径大引起),增加了快肌纤维对疲劳的敏感性。快肌和慢肌之间的其他差异包括:
1. 快肌的神经肌肉接头在乙酰胆碱囊泡含量、乙酰胆碱释放量、烟碱型乙酰胆碱受体密度、乙酰胆碱酯酶活性和 Na+ 通道密度方面与慢肌不同,所有这些都使快肌在启动动作电位方面具有更高的安全系数。然而,在重复刺激过程中,快肌的安全系数会迅速下降(比慢肌更快)。
2. 快肌中的 SR 比慢肌中更发达,RYR1、SERCA、腔内 Ca 水平更高,CaV1.1/RYR1 比率也更高,所有这些都促进了快肌中更大、更快的细胞内 Ca 瞬变的形成,这对于快速、有力的收缩很重要。
除了刚才提到的快肌纤维和慢肌纤维之间的差异外,其他肌肉蛋白也以纤维类型特异性的方式表达。这些蛋白质包括三种肌钙蛋白亚基、原肌球蛋白和 C 蛋白。肌钙蛋白和原肌球蛋白异构体的差异表达影响收缩对 Ca 的依赖性。慢肌纤维在 [Ca] 较低时开始产生张力,而快肌纤维则不然。这种对 Ca 敏感性的差异部分归因于慢纤维中的肌钙蛋白 C 同工型只有一个低亲和力 Ca 结合位点,而快纤维中的肌钙蛋白 C 有两个低亲和力结合位点。然而,收缩对 Ca 的依赖性变化并不局限于肌钙蛋白 C 同工型的差异。肌钙蛋白 T 和原肌球蛋白同工型也存在差异。因此,收缩对 Ca 的依赖性的调节很复杂,涉及细丝上多种蛋白质的贡献。然而,Ca/钙调蛋白依赖性肌球蛋白轻链激酶对肌球蛋白调节轻链的磷酸化可以增加收缩的 Ca 敏感性,特别是在快肌纤维中(部分原因是据报道快肌纤维中肌球蛋白轻链激酶的活性更高)。
收缩力的调节
募集
增加肌肉收缩力的一个简单方法是募集更多的肌肉纤维。由于运动单元内的所有肌肉纤维同时被激活,因此肌肉会募集更多的肌肉通过募集更多运动单位,肌肉纤维可以增强。如前所述,肌肉纤维可分为快肌纤维或慢肌纤维。纤维的类型由其神经支配决定。由于运动单位中的所有纤维都由单个 α 运动神经元支配,因此运动单位内的所有纤维都属于同一类型。慢肌纤维运动单位往往较小(100-500 条肌纤维),并由容易兴奋的 α 运动神经元支配(见表 12.2)。相比之下,快肌纤维运动单位往往较大(包含 1000-2000 条肌纤维),并由更难兴奋的 α 运动神经元支配。因此,慢肌纤维运动单位往往首先被募集。随着需要的力量越来越多,快肌纤维运动单位被募集。这种募集策略的优点是,首先募集的肌肉纤维是那些具有高抗疲劳性的肌肉纤维。此外,慢肌收缩运动单位的体积小,可以在低强度下进行精细运动控制。通过募集更多运动单位来增加收缩力的过程称为空间总和,因为来自肌肉纤维的力量被“总和”在更大的肌肉区域内。这与下面讨论的时间总和(强直)形成对比。
强直
骨骼肌中的动作电位非常均匀,导致从 SR 释放可重复的 Ca 脉冲(图 12.15)。单个动作电位释放足够的 253
Ca 来引起抽搐收缩。然而,这种收缩的持续时间非常短,因为 Ca 被非常迅速地泵回 SR。如果在肌肉完全放松之前对其进行第二次刺激,则收缩力会增加(见图 12.15 中间)。因此,随着刺激频率的增加,抽搐力会增强。在高水平刺激下,细胞内 [Ca] 会增加,并在整个刺激期间保持这种状态(见图 12.15 右),并且产生的力量大大超过抽搐期间观察到的力量。这种反应称为 tet any。在中等刺激频率下,细胞内 [Ca] 会在下一次刺激之前恢复到基线。但是,力量会逐渐增加(见图 12.15 中间)。这种现象称为不完全性强直。在这两种情况下,刺激频率的增加都会导致抽搐融合。与强直相比,抽搐过程中产生的力较小,这可能是由于肌肉中存在一系列弹性成分。具体而言,当肌肉在动作电位开始后不久被拉伸少量时,肌肉产生的抽搐力接近最大强直力。这一结果,加上抽搐收缩过程中细胞内 Ca 瞬变的大小与强直期间的细胞内 Ca 瞬变的大小相当的观察结果,表明在抽搐过程中,有足够的 Ca 被释放到细胞质中,使肌动蛋白-肌球蛋白相互作用产生最大张力。然而,抽搐过程中细胞内 Ca 瞬变的持续时间足够短,以至于收缩元素可能没有足够的时间完全拉伸纤维和肌肉中的一系列弹性成分。因此,测量到的张力是次最大值。细胞内 Ca 瞬变持续时间的增加(如强直中发生的情况)为肌肉提供了足够的时间来完全拉伸串联弹性成分,从而导致肌动蛋白-肌球蛋白相互作用的全部收缩力(即最大张力)的表达。
串联弹性成分的部分拉伸(在单次抽搐期间可能出现),然后在完全放松之前对肌肉进行再次刺激,
• 图 12.16 慢肌在刺激频率低于快肌时表现出强直。A,腓肠肌中的快肌运动单元。B,腓肠肌中的慢肌运动单元。C,比目鱼肌中的慢肌肌肉单元。以左侧所示的频率刺激运动单元。曲线下方的垂直括号表示在集中过程中产生的张力(以克为单位)的校准条。请注意快速收缩运动单元 (A) 产生的巨大力量。(摘自 Montcastle V.
Medical Physiology。第 12 版。圣路易斯:莫斯比:1974 年。)
• 图 12.15 增加骨骼肌电刺激频率会导致收缩力增加。这归因于细胞内 Ca 瞬变的延长,称为强直。不完全性强直是由于在肌肉完全放松之前启动了另一个细胞内 Ca 瞬变。因此,存在抽搐力的总和。详情请参阅正文。
预计会产生中等程度的张力,类似于不完全性强直。系列 el 的位置骨骼肌中弹性成分的来源尚不清楚。
一个潜在来源是肌球蛋白分子本身。此外,系列弹性成分可能还有其他来源,例如结缔组织和肌动蛋白。
产生强直所需的刺激频率取决于运动单位是由慢纤维还是快纤维组成(图 12.16)。慢纤维可以在较低频率下发生强直,而快纤维则不能。慢肌在较低刺激频率下发生强直的能力至少部分反映了慢纤维中较长的收缩持续时间。如图 12.16 所示,快纤维产生的最大力量比慢纤维大,因为快纤维的直径比慢纤维大,而且快运动单位中的纤维比慢运动单位中的纤维多。
然而,即使以 I 型肌纤维的横截面积为标准,人类 I 型肌纤维的最大等长张力也小于人类 II 型肌纤维的最大等长张力。具体而言,以横截面积为标准(由图 12.14C 的 X 截距确定)的人类 I 型肌纤维的最大等长张力比 II 型肌纤维低约 20%。因此,II 型运动单位非常适合爆发高强度的力量。
反射弧对力量的调节
拉伸反射
骨骼肌包含与骨骼肌纤维平行的感觉纤维(肌梭;
也称为肌梭内纤维)。肌梭评估肌肉的伸展程度以及收缩速度。在拉伸反射中,肌肉的快速拉伸(例如,轻拍肌腱)会拉长肌肉中的肌梭,并导致肌梭传入感觉神经元的动作电位频率增加。这些传入纤维反过来会刺激脊髓中负责拉伸肌肉的 α 运动神经元。结果是反射弧是肌肉的拉伸引起的收缩,不需要来自大脑高级中枢的输入。随着肌肉缩短,传出输出也会发送到肌梭,从而消除肌梭的松弛并确保其能够对所有肌肉长度的拉伸做出反应。通过它们的作用,肌梭向肌肉提供长度方面的反馈,从而帮助将关节保持在给定的角度。高尔基腱器官
高尔基腱器官位于肌肉的腱中,提供有关肌肉收缩的反馈。腱器官的主要成分是一束细长的胶原束,它与肌纤维串联,可以对单个肌纤维的收缩作出反应。一个特定的腱器官可能附着在几个快肌纤维或慢肌纤维上(或两者兼有),并通过 Ib 型传入神经纤维发送脉冲以响应肌肉收缩。Ib 型传入脉冲进入脊髓,可促进 α 运动神经元对收缩(和协同)肌肉的抑制,同时促进 α 运动神经元对拮抗肌的兴奋。抑制作用由脊髓中的中间神经元介导,这些中间神经元向 α 运动神经元释放抑制性递质并产生抑制性突触后电位。 Ib 型传入冲动也被发送到大脑的高级中枢(包括运动皮层和小脑)。据推测,肌腱器官对肌肉收缩的反馈可能会通过限制额外运动单位的募集来平滑肌肉收缩的进程。有趣的是,肌腱器官的反应与力量不是线性相关的;相反,它在更高水平的力量下会下降,这可能有助于在更高水平的努力下募集运动单位。
骨骼肌张力
骨骼系统以相对较少的能量支撑身体保持直立姿势。尽管如此,即使在休息时,肌肉通常也会表现出一定程度的收缩活动。孤立的(即失神经支配的)未受刺激的肌肉处于放松状态,被称为松弛。然而,身体中放松的肌肉相对结实。这种
紧实度或张力是由某些运动单位的低水平收缩活动引起的,并由肌梭的反射弧驱动。通过切断感觉传入纤维来中断反射弧会消除这种静息
肌肉张力。骨骼肌的张力不同于平滑肌的“张力”(见第 14 章)。
收缩期间的能量来源
三磷酸腺苷
肌肉细胞将化学能转化为机械能。
ATP 是用于这种转换的能量来源。骨骼肌中的 ATP 池很小,如果不补充,只能支持几次收缩。然而,这个池在收缩期间会不断补充,如下所述,因此即使肌肉疲劳,ATP 储备也只会适度减少。
磷酸肌酸
肌肉细胞含有磷酸肌酸,用于将 ADP 转化为 ATP,从而在肌肉收缩期间补充 ATP 储备。磷酸肌酸储备是补充骨骼肌中 ATP 供应的直接高能量来源,尤其是在剧烈运动期间。肌酸磷酸激酶催化以下反应:
ADP c 磷酸肌酸 ATP c 肌酸
虽然大部分肌酸磷酸激酶存在于肌浆中,但少量存在于粗肌丝中(靠近 M 线)。粗肌丝中的肌酸磷酸激酶可能参与肌肉收缩期间肌球蛋白头部附近 ATP 的快速再合成。然而,磷酸肌酸的储存量仅为 ATP 储存量的五倍左右,因此无法支持长时间的收缩(最大肌肉活动时间不到一分钟)。剧烈运动期间的骨骼肌疲劳与磷酸肌酸储存量的消耗有关,尽管如后所述,这并不一定意味着疲劳是由磷酸肌酸储存量的消耗引起的。由于肌酸磷酸激酶催化的反应是可逆的,肌肉细胞在疲劳恢复期间通过使用氧化磷酸化合成的 ATP 来补充磷酸肌酸池。碳水化合物肌肉细胞含有糖原,糖原可在肌肉收缩过程中代谢,为氧化磷酸化和糖酵解提供葡萄糖,这两者都会产生 ATP 来补充 ATP 储存量。肌肉细胞也能从血液中吸收葡萄糖,这个过程由胰岛素刺激(见第 39 章)。胞质酶磷酸化酶从糖原中释放葡萄糖 1-磷酸残基,然后通过糖酵解(在胞质中)和氧化磷酸化(在线粒体中)的组合代谢,每摩尔葡萄糖 1-磷酸产生相当于 37 摩尔 ATP。血糖每摩尔葡萄糖产生 36 摩尔 ATP,因为在糖酵解开始时 1 ATP 用于磷酸化葡萄糖。然而,这些 ATP 产量取决于充足的氧气供应。相反,在无氧条件下,糖原和葡萄糖的代谢每摩尔葡萄糖 1-磷酸和葡萄糖仅产生 3 和 2 摩尔 ATP(以及 2 摩尔乳酸)。如后所述,长时间运动期间的肌肉疲劳与肌肉中糖原储存的消耗有关。
脂肪酸和甘油三酯
脂肪酸是长时间运动期间肌肉细胞的重要能量来源。肌肉细胞含有脂肪酸,但也可以从血液中吸收脂肪酸。此外,肌肉细胞可以储存甘油三酯,在需要时可以水解产生脂肪酸。脂肪酸在线粒体内进行 β 氧化。然而,脂肪酸进入线粒体时,会在细胞质中转化为酰基肉碱,然后运输到线粒体,在那里转化为酰基辅酶 A (CoA)。在线粒体中,酰基辅酶 A 发生 β 氧化,生成乙酰辅酶 A,乙酰辅酶 A 随后进入柠檬酸循环,最终产生 ATP。
氧债
如果运动的能量需求不能通过氧化磷酸化来满足,就会产生氧债。运动结束后,呼吸作用仍保持在静息水平以上,以“偿还”氧债。恢复阶段的额外氧消耗用于恢复代谢物水平(如磷酸肌酸和 ATP)并代谢糖酵解产生的乳酸。恢复期间心脏和呼吸工作量增加也会导致此时氧气消耗增加,并解释了为什么需要“偿还”的氧气比“借入”的氧气更多。 即使在低水平运动中也会出现一些氧债,因为缓慢的氧化运动单位会消耗大量来自磷酸肌酸或糖酵解的 ATP,然后氧化代谢才能增加 ATP 的产生以满足稳态需求。 剧烈运动时,氧债要大得多,因为快速糖酵解运动单位被消耗。
• 图 12.17 当肌肉运动的能量消耗率超过氧化代谢的能量产生率时,就会产生氧债。 上图,剧烈运动期间的能量消耗。 下图,耐力运动期间的能量消耗。 详情见正文。
使用(图 12.17)。氧债大约等于运动期间消耗的能量减去氧化代谢提供的能量(即图 12.17 中的深色和浅色区域大致相等)。如前所述,运动后恢复期间消耗的额外氧气代表能量需求恢复正常细胞代谢水平的措施。
疲劳
肌肉满足能量需求的能力是决定运动持续时间的主要因素。然而,疲劳不是能量储备耗尽的结果。相反,代谢副产物似乎是疲劳发生的重要因素。疲劳可能发生在肌肉收缩的任何部位,从大脑到肌肉细胞,以及维持能量供应(即脂肪酸和葡萄糖)和向运动肌肉输送氧气的心血管和呼吸系统。
肌肉疲劳与多种因素有关。
在短暂的强直期间,只要循环完好,肌肉的氧气供应就足够了。然而,在这些短暂的强直期间产生的力量/压力会迅速衰减到可以维持很长时间的水平(图 12.18)。这种衰退代表快速运动单位的快速和几乎完全失效。能量消耗率下降会导致疲劳,尤其是在个人如何感知疲劳方面。
无论肌肉在高强度运动或长时间运动期间是否疲劳,肌浆 ATP 水平都不会大幅下降。鉴于所有细胞都依赖 ATP 的可用性来维持活力,疲劳被描述为一种保护机制,以最大限度地降低肌肉细胞受伤或死亡的风险。
因此,骨骼肌细胞很可能已经开发出冗余系统来确保 ATP 水平不会降至危险的低水平,从而危及细胞的活力。
大多数人在运动单位疲劳之前很久就感到疲倦并停止锻炼。一般的身体疲劳可以定义为工作产生的稳态紊乱。感知到的不适(甚至疼痛)的基础可能涉及许多因素。这些因素可能包括血浆葡萄糖水平下降和代谢物积累。中枢神经系统的运动系统功能没有受损。
积极性和训练有素的运动员可以承受疲劳的不适,并可能锻炼到出现一些运动单元疲劳的程度。训练后观察到的表现增强部分涉及动机因素。
生长和发展
骨骼肌纤维在内分泌之前分化,一些神经肌肉接头在出生后形成。在神经支配之前,肌肉纤维在生理上类似于慢细胞(I 型)。乙酰胆碱受体分布在这些非神经支配细胞的肌膜中,并且对该神经递质高度敏感。当第一个生长的神经末端与肌肉细胞建立接触时,会形成终板。细胞不再与神经形成关联,乙酰胆碱受体集中在终板膜中。由小运动神经元支配的细胞形成慢速(I 型)氧化运动单位。由大运动神经支配的纤维会发展出快速(II 型)运动单位的所有特征。支配会产生重大的细胞变化,包括合成快速和慢速肌球蛋白同工型,这些同工型会取代胚胎或新生儿变体。因此,肌肉纤维类型由支配纤维的神经决定。肌肉强度和大小在成熟过程中会增加。随着骨骼的生长,肌肉细胞会变长。变长是通过在肌肉细胞末端形成额外的肌节来实现的(图 12.19),这是一个可逆的过程。例如,当末端肌节被消除时,细胞的长度会减少,这种情况可能发生在肢体固定且肌肉处于缩短位置或骨折固定不当导致肢体节段缩短时。肌肉长度的变化会影响缩短的速度和程度,但不会影响肌肉可以产生的力量。肌肉在生长过程中强度和直径的逐渐增加主要是通过肥大实现的。
• 图 12.18 骨骼肌的一系列短暂强直刺激导致力量快速下降(强直应激,以图中的“整个肌肉”线为例),这是由于肌肉中快速收缩(II 型)运动单位的疲劳造成的。然而,在这些条件下,慢速收缩(I 型)运动单位对疲劳具有抵抗力。力量/压力的下降与糖原和磷酸肌酸储备的消耗以及乳酸的积累同时发生。重要的是,力量/压力的下降发生在 ATP 池没有大幅减少的情况下,因此肌肉纤维不会进入僵硬状态。相反,慢速运动单元可以满足纤维在这种情况下的能量需求,即使在几个小时后也不会表现出明显的疲劳。显然,与 e 相关的一些因素能量代谢可以抑制收缩(例如,在快纤维中),但这一因素尚未明确确定。在剧烈运动期间,肌浆中无机磷酸盐 (Pi) 和乳酸的积累会导致肌肉疲劳。乳酸的积累水平高达 15 至 26 mmol/L,会降低肌浆 pH 值(从 ≈7 降至 ≈6.2)并抑制肌动蛋白-肌球蛋白相互作用。pH 值的降低通过改变 Ca 与肌钙蛋白 C 的结合并减少肌动蛋白-肌球蛋白相互作用的最大数量来降低肌动蛋白-肌球蛋白相互作用对 Ca 的敏感性。Pi 也被认为是剧烈运动期间疲劳发展的重要因素。磷酸盐浓度可以从静息时的约 2 mmol/L 增加到工作肌肉中的近 40 mmol/L。
[Pi
] 的这种升高至少可以通过以下三种不同的机制来减轻张力:(1) 抑制 SR 释放 Ca,(2) 降低收缩对 Ca 的敏感性,以及 (3) 改变肌动蛋白-肌球蛋白结合。
其他几个因素,包括特殊隔室的糖原耗竭、[ADP] 的局部增加、[K+
] 的细胞外升高以及氧自由基的产生,也与各种形式的运动引起的肌肉疲劳有关。最后,图 12.20B 显示了已确定和/或提议用于骨骼肌对耐力运动反应的中枢神经信号通路,肌肉收缩导致细胞内 [Ca] 升高,从而通过钙调磷酸酶和 Ca-钙调蛋白依赖性蛋白激酶通路刺激收缩蛋白基因的表达。耐力运动还通过似乎涉及刺激过氧化物酶体增殖激活受体 γ 辅激活因子 1α (PGC-1α;见图 12.20B) 的信号通路促进运动肌肉的氧化能力(包括线粒体生物合成)和灌注(通过血管生成)的增加。当收缩蛋白降解率超过收缩蛋白合成率时,就会发生骨骼肌萎缩。这种情况发生在许多情况下,例如
(1) 肢体被石膏固定、(2) 长期卧床、(3) 脊髓损伤和 (4) 太空飞行(微重力)。衰老和严重疾病(如癌症晚期)也会促进骨骼肌萎缩(分别称为肌肉减少症和恶病质)。此外,太空飞行使宇航员处于微重力环境中,从而机械地减轻肌肉负荷。这种卸载会导致肌肉质量快速下降(即萎缩)和虚弱。废用性萎缩似乎涉及抑制蛋白质合成和刺激蛋白质降解(伴随 FoxO-atrogene 通路的净激活)。经常收缩以支撑身体的肌肉通常具有大量慢速(I 型)氧化运动单位。在长时间的卸载期间,这些慢速运动单位比快速(II 型)运动单位萎缩得更快。慢速运动单位的萎缩与最大强直力的下降有关,但也与最大缩短速度的增加有关。速度的增加与这些纤维中快肌球蛋白异构体的表达有关。太空医学的一个重要方面是设计锻炼计划,以尽量减少长时间太空飞行期间的这种表型变化。睾酮是导致男性肌肉质量增加的主要因素,因为它既有肌营养作用,也有雄激素(男性化)作用(见第 44 章)。骨骼肌形成新纤维(增生)的能力有限。这些新纤维是由肌纤维基底膜下的卫星细胞的激活/分化产生的(稍后讨论)。去神经支配、再神经支配和交叉神经支配
如前所述,神经支配对于骨骼肌表型至关重要。如果切断运动神经,就会发生肌肉束。肌束的特征是小的、不规则的收缩,这是由退化的轴突远端部分的末端释放乙酰胆碱引起的。去神经支配几天后,肌肉开始颤动。颤动的特征是自发的、重复的收缩。此时,胆碱能受体有
• 图 12.19 生长对肌肉细胞机械输出的影响。通常,骨骼肌细胞生长涉及延长(在肌纤维末端增加更多肌节)或增加肌纤维直径(由于在肌纤维内平行增加更多肌丝/肌原纤维而导致的肥大)。新肌纤维的形成称为肌肉增生,在骨骼肌中很少见。通过平行增加更多肌节使肌原纤维直径加倍(肥大,用于例如)可能会使产生的力量增加一倍,但对最大缩短速度没有影响。阻力训练可以通过激活 Akt-mTOR 信号通路(图 12.20A)并同时抑制叉头盒 O 蛋白 (FoxO)-atrogene 通路来促进肥大,从而导致净蛋白质合成增加。
导致骨骼肌肥大和萎缩的信号通路很复杂,当收缩蛋白合成率超过收缩蛋白降解率时,就会导致肥大。在发育过程中,为了应对阻力训练,胰岛素样生长因子 1 (IGF-1) 水平升高通常会通过 Akt-mTOR 通路促进骨骼肌肥大的发展(见图 12.20A)。然而,还发现或提出了许多其他刺激,包括通过骨骼肌细胞骨架和细胞外基质/肌腱之间的粘附复合物(例如,通过肌营养不良相关糖蛋白复合物 [DGC)])传导收缩的机械力(特别是在阻力运动训练中)。 258 遍布整个细胞膜,实际上恢复到其神经支配前的胚胎排列。 肌肉颤动反映了对乙酰胆碱的超敏性。 受影响的肌肉也会萎缩,肌肉及其细胞的尺寸会减小。 萎缩在人类中是渐进性的,在神经支配 3 或 4 个月后,一些细胞会退化。 大多数肌肉纤维在 1 到 2 年后被脂肪和结缔组织取代。如果在几个月内重新神经支配,这些变化可以逆转。 缰绳神经支配通常是通过运动神经轴突的外周残端沿着旧神经鞘生长而实现的。
小运动轴突对以前的快速(II 型)纤维进行再神经支配会导致该细胞重新分化为慢速(I 型)纤维,反之亦然。 这表明大运动神经和小运动神经在性质上有所不同,并且神经对肌肉纤维具有特定的“营养”作用。 这种“营养”作用反映了纤维刺激的速率。 例如,通过植入肌肉的电极进行刺激可以减轻失神经萎缩。 更引人注目的是,对快速运动单位的慢性低频刺激会导致这些单位转化为慢速运动单位。 收缩频率通过基因表达和蛋白质合成的变化决定纤维的发育和表型。频繁收缩活动的纤维形成许多线粒体并合成慢速
• 图 12.20 参与促进骨骼肌在运动反应中净蛋白质合成 (A)、线粒体生物合成和血管生成 (B) 的基本分子信号通路。详情见正文。
AKT,一种丝氨酸/苏氨酸特异性蛋白激酶(蛋白激酶 B);AMPK,5′ 腺苷单磷酸活化蛋白激酶;CaMK,Ca/钙调蛋白依赖性蛋白激酶;CnA,钙调磷酸酶 A;DGC,肌营养不良蛋白-糖蛋白复合物;DGKζ,二酰甘油激酶-zeta;ERRα,雌激素相关受体 α;HDAC,组蛋白去乙酰化酶;IGF-1,胰岛素样生长因子;IGF1R,IGF-1 受体; MEF2,肌细胞增强因子 2;mTORC1,雷帕霉素复合物 1 的哺乳动物靶蛋白;NFAT,活化 T 细胞的核因子;
NRF1/2,核呼吸因子 1/2;PA,磷脂酸;PGC-1α,过氧化物酶体增殖激活受体 γ 辅激活因子 1α;PKD1,蛋白激酶 D1。 (A,转载自 Schiaffino S、Reggiani C、Akimotod
T、Blaauw B。骨骼肌肥大的分子机制。J Neuromuscul Dis 2021;8(2):169,经 IOS Press 许可。该出版物可在 IOS Press 上通过 http://dx.doi.org/10.3233/
JND-200568 获取。B,来自 Yan Z、Okutsu M、Akhtar Y、Lira V。运动诱导的纤维类型转变、线粒体生物合成和骨骼肌血管生成的调节。J Appl Physiol 2011;110(1):264。)
在细胞水平上
转录因子活化 T 细胞核因子
(NFAT)与从快肌
到慢肌的转变有关(图。 12.21A)。具体而言,似乎以与慢肌细胞一致的频率刺激成年快肌细胞可以激活 Ca 依赖性磷酸酶钙调磷酸酶,而钙调磷酸酶钙调磷酸酶又可以使 NFAT 去磷酸化,导致 NFAT 从肌浆易位到细胞核,随后转录慢肌基因(并抑制快肌基因)。根据这种机制,快肌中组成性活性 NFAT 的表达促进了慢肌肌球蛋白的表达,同时抑制了快肌肌球蛋白的表达。转录因子肌细胞增强因子 2 (MEF2) 也与从快肌到慢肌的转变有关(见图 12.21B)。 MEF2 的激活是被认为是 MEF2 抑制剂组蛋白去乙酰化酶 (HDAC) 的 Ca/钙调蛋白依赖性磷酸化的结果。肌球蛋白异构体。由较大的、不太容易兴奋的轴突支配的纤维很少收缩。这种相对不活跃的纤维通常形成少量线粒体,具有高浓度的糖酵解酶,并合成快肌球蛋白异构体。259 快肌刺激伴随着静息肌浆 [Ca] 增加 2.5 倍,这先于慢肌肌球蛋白表达增加和快肌肌球蛋白表达减少。类似地,在表达快肌肌球蛋白的肌肉细胞中,细胞内 Ca 的长期升高(约 5 倍)会在 8 天内诱导基因表达从快肌肌球蛋白异构体转变为慢肌肌球蛋白异构体。柠檬酸合成酶活性(氧化能力指标)增加,乳酸脱氢酶活性(糖酵解能力指标)降低,伴随着这种 Ca 依赖性从快肌肌球蛋白到慢肌肌球蛋白的转变。这些 Ca 依赖性变化可通过减少细胞内 [Ca] 来逆转。
对运动的反应
运动生理学家确定了三类训练方案和反应:学习、耐力和力量训练(表 12.3)。通常,大多数运动活动都涉及这三者的元素。训练的学习方面涉及动机因素以及神经肌肉协调。训练的这一方面不涉及肌肉纤维本身的适应性变化。然而,运动技能可以在没有定期训练的情况下持续数年,这与肌肉细胞对运动的反应不同。肌肉力量可以通过定期的大量努力来增加,这些努力涉及大多数运动单位。这种努力会招募快速糖酵解运动单位以及缓慢氧化运动单位。在这些努力过程中,当组织压力超过血管内压力时,工作肌肉的血液供应可能会中断。血流量减少会限制收缩的持续时间。定期的最大强度锻炼,如举重,会诱导更多肌原纤维的合成,从而导致活跃肌肉细胞的肥大。增加的压力也会诱导肌腱和骨骼的生长。阻力训练刺激
肥大的机制很复杂,但通常涉及刺激 Akt-mTOR 信号通路(见图 12.20A)。
运动引起的 IGF-1 产生可能来自多种来源,包括骨骼肌,从而构成自分泌或旁分泌效应。据报道,通过肌肉细胞骨架和细胞外基质或肌腱之间的粘附复合物传导的收缩力也通过刺激 Akt-mTOR 通路促进运动肌肉的肥大(见图 12.20A)。运动过程中产生的微小 RNA 和
长链非编码 RNA 也可能影响导致运动引起的骨骼肌肥大的信号通路。
耐力训练已被证明可以促进运动肌纤维的氧化能力和灌注(血管生成)增加。氧化能力的提高与 I 型和 II 型肌纤维中氧化酶水平和线粒体生物合成的增加有关。耐力肌:
• 图 12.21 促进从快肌到慢肌转变的分子信号通路。以与慢肌一致的模式对快肌进行慢性电刺激会导致慢肌表型的发展,这是因为 Ca/钙调蛋白依赖性蛋白磷酸酶钙调磷酸酶 (CaN) 对活化 T 细胞 (NFAT) 的转录因子核因子进行去磷酸化;这反过来又导致 NFAT 的核易位和慢肌纤维基因的表达 (A)。
转录因子肌细胞增强因子 2 (MEF2) 的激活似乎也有助于这种纤维类型转变 (B),其中 MEF2 的激活涉及抑制剂组蛋白去乙酰化酶 (HDAC) 的 Ca/钙调蛋白依赖性磷酸化。CaMK,Ca/钙调蛋白依赖性蛋白激酶;ECC,兴奋-收缩偶联;P,HDAC 的磷酸化。(来自 Liu Y、Shen T、Randall W、Schneider
M。成人骨骼肌中活动依赖性纤维类型可塑性的信号通路。J Muscle Res Cell Motil 2005;26:13-21。)
细胞内 [Ca] 似乎在慢肌球蛋白异构体的表达中起着重要作用。慢肌纤维的细胞内 Ca 静息水平高于快肌纤维。此外,慢性电 260 锻炼引起的毛细血管密度增加可发生在 I 型和 II 型肌纤维中。氧化能力和血管生成过程很复杂,但似乎涉及转录辅激活因子 PGC-1a 的激活(见图 12.20B)。血管生成似乎涉及 VEGF,位于 PGC-1a 刺激的下游。耐力运动期间产生的微 RNA 和/或长非编码 RNA 也可能影响导致上述氧化能力、线粒体生物合成和血管生成变化的信号通路。肥大可能伴随这些耐力运动引起的氧化能力和灌注变化,通过钙调磷酸酶和钙钙调蛋白依赖性蛋白激酶信号通路(见图 12.20B)。需要注意的一点是,锻炼程序不太可能将 II 型肌纤维转化为 I 型肌纤维。肌纤维中 IIx 型和 IIa 型的表达可能会发生变化(偶尔出现混合纤维就是证据),但锻炼程序并未显示肌纤维从 II 型转变为 I 型。相反,需要显著改变刺激频率才能使表达模式从 II 型肌球蛋白转变为 I 型肌球蛋白(慢性电刺激研究和交叉神经支配研究就是证据)。肌纤维在锻炼过程中可能会受伤。高负荷离心锻炼尤其如此。如果肌肉肌膜损伤较小(导致 Ca 流入量较少),dysferlin 与 annexin II 结合可能能够修复肌膜。损伤还可能引发一系列修复机制,包括激活肌膜外部(但位于基底膜下方)的卫星细胞。激活的卫星细胞经历(1)增殖、(2)成熟/分化阶段和(3)融合形成肌管(具有位于中心的细胞核),然后成熟为功能性骨骼肌纤维(具有肌膜下细胞核)(图 12.22A)。再生纤维可通过胚胎肌球蛋白异构体的表达和中心细胞核的位置来识别。在肌营养不良症和多发性肌炎等病症中也可以观察到再生骨骼肌纤维的存在(见图 12.22B)。需要注意的一点是,这种再生还涉及免疫系统的参与,其中(1)M1 巨噬细胞参与清除碎片并促进卫星细胞增殖,(2)M2 巨噬细胞促进卫星细胞成熟和融合。
延迟性肌肉酸痛
诸如徒步旅行或下坡跑步之类的活动,其中收缩的肌肉被过度拉伸和拉长,随后的疼痛和僵硬感比不涉及剧烈肌肉拉伸和拉长的同类运动(例如骑自行车)更强烈。由此产生的钝痛发展缓慢,并在 24 至 48 小时内达到顶峰。疼痛与受影响肌肉的运动范围减小、僵硬和无力有关。引起疼痛的主要因素是肌肉细胞损伤引起的肿胀和炎症,最常见于肉-腱接口处附近。II 型运动单位受到的影响大于 I 型运动单位,因为大细胞的最大力量最大,而大细胞中施加的负荷比细胞可以产生的最大力量大约高 60%。恢复缓慢,取决于受损肌节的再生。
骨骼肌的生物物理特性
前面描述的肌肉收缩的分子机制是肌肉生物物理特性的基础和决定因素。从历史上看,这些生物物理特性在阐明收缩的分子机制之前就得到了很好的描述。它们仍然是描述肌肉功能的重要方式。
长度-张力关系
当肌肉收缩时,它们会产生力量(通常以张力或压力来衡量)并缩短长度。在检查肌肉的生物物理特性时,通常保持其中一个参数不变,另一个参数在实验操作后进行测量。因此,等长收缩是指肌肉长度保持不变,然后测量收缩期间产生的力量。等张收缩是指力量(或张力)保持不变,然后测量肌肉长度的变化。当静止的肌肉被拉伸时,它会通过一种力量来抵抗拉伸,这种力量最初缓慢增加,然后随着拉伸程度的增加而增加得更快(图 12.23)。这种纯被动特性是由于肌肉组织的弹性。如果
12.3 锻炼的效果
训练类型示例主要适应性反应
学习/协调技能打字提高运动单位(中枢神经系统)的速度和准确性
耐力(次最大、持续努力)
马拉松跑步提高氧化能力在所有参与的运动单位中,细胞肥大有限
力量(短暂,最大努力)
举重肥大和所用运动单位的糖酵解能力增强
当刺激肌肉以这些不同长度收缩时,会获得不同的关系。具体而言,收缩力随着肌肉长度增加到某一点(指定为 LO 以表示最佳长度)而增加。当肌肉被拉伸超过 LO 时,收缩力会减小。该长度-张力曲线与先前描述的滑动细丝理论一致。在非常长的肌节长度(3.7 µm)下,肌动蛋白丝不再与肌球蛋白丝重叠,因此不会收缩。随着肌肉长度向 LO 减小,重叠量增加,收缩力逐渐增加。当肌节长度
减小到 2 µm 以下时,细丝会在肌节中间发生碰撞,肌动蛋白-肌球蛋白相互作用受到干扰,因此收缩力会降低。为了构建
长度-张力曲线,肌肉保持在给定的长度,然后测量收缩力(即等长收缩)。因此,长度-张力关系
支持肌肉收缩的滑动丝理论。
力-速度关系
肌肉缩短的速度在很大程度上取决于肌肉必须产生的力量
• 图 12.22 受伤骨骼肌的再生。A,骨骼肌损伤导致受伤骨骼肌纤维基底膜下的卫星细胞被激活。卫星细胞通过一系列步骤再生肌纤维。 B,再生肌纤维表达胚胎肌球蛋白异构体。该活检样本来自多发性肌炎患者,用针对胚胎肌球蛋白重链(红色)和层粘连蛋白(绿色)的抗体染色(详情见正文)。(A,来自 Giordani L,巴黎
A,Le Grand F。卫星细胞自我更新。Curr Top Dev Biol 2018;126:177。B,来自 Schiafino S。抗肌球蛋白重链抗体揭示的肌肉纤维类型多样性。FEBS J 2018;285:3688。)(图 12.24)。在没有任何负荷的情况下,肌肉的缩短速度最大(表示为 V0)。 V0 对应于横桥的最大循环速率
(即,它与肌球蛋白的最大能量周转率 [ATPase 活性] 成正比)。因此,快肌的 V0 高于慢肌(见图 12.14B、C)。增加负荷会降低肌肉缩短的速度,直到最大负荷时,肌肉无法举起负荷,因此无法缩短(零速度)。进一步增加负荷会导致肌肉拉伸
(负速度)。最大等长张力(即缩短速度为零时的力)与肌动蛋白和肌球蛋白之间活性横桥的数量成正比,并且对于快肌收缩运动单位来说,它通常更大(因为快肌收缩肌纤维的直径较大,并且典型的快肌收缩运动单位中的肌纤维数量较多)。在图 12.24 中,功率-应力曲线反映了每次负荷下的工作速率,并表明最大工作速率是在次最大负荷下完成的(即,当收缩力约为最大强直张力的 30% 时)。要计算后一条曲线,只需将 x 和 y 坐标相乘,然后将乘积绘制为 x 坐标的函数。
• 图 12.23 骨骼肌的长度-张力关系。 A、实验装置,其中测量不同肌肉长度的最大等长强直张力。B、如何计算不同肌肉长度的主动张力(即,从每个肌肉长度的总张力中减去被动张力)。C、主动张力与肌肉长度的关系图,其中预测了选定点处粗细肌丝的重叠。
• 图 12.24 骨骼肌的力-速度关系。实验装置显示在右侧。
初始肌肉长度保持不变,但强直刺激期间肌肉必须举起的重量会有所不同。在举起这些不同重量的同时,测量了肌肉缩短速度。详情请参阅正文。F、力;V、速度。
要点
1. 骨骼肌由许多肌细胞(肌纤维)组成,肌细胞的直径通常为 10 至 80 µm,长度可达 25 cm。骨骼肌中出现条纹是由于骨骼肌纤维的肌原纤维中粗细纤维高度有序排列。肌节是骨骼肌中的收缩单位。每个肌节在静止时长约 2 µm,由两条 Z 线界定。肌节沿肌原纤维的长度串联排列。含有肌动蛋白的细丝从 Z 线延伸至肌节的中心。含有肌球蛋白的粗肌丝位于肌节中心,与肌动蛋白细丝重叠。肌肉收缩是由钙离子依赖性的肌球蛋白和肌动蛋白相互作用引起的,肌球蛋白将细肌丝拉向肌节中心。
2. 骨骼肌收缩受中枢神经系统控制(即自愿)。大脑中的运动中枢控制脊髓腹角中 α 运动神经元的活动。这些 α 运动神经元反过来与骨骼肌纤维进行突触传递。虽然每根骨骼肌纤维仅由一个运动神经元支配,但一个运动神经元却支配肌肉内的几根肌纤维。运动单位是指由单个运动神经元支配的所有肌纤维。 3. 运动神经元通过在肌纤维中产生动作电位来启动骨骼肌的收缩。当动作电位沿着肌纤维的 T 小管传递时,T 小管中的电压门控 Ca 通道 (CaV1.1) 会发生构象变化,从而导致邻近的 SR Ca 通道(称为瑞诺丁受体 (RYR1))打开,然后将 Ca 从 SR 释放到肌浆中。T 小管中的动作电位不需要通过 CaV1.1 的 Ca 流入来诱导 RYR1 中的 Ca 释放。相反,T 小管中 CaV1.1 蛋白的电压诱导构象变化促进了与 RYR1 的蛋白质-蛋白质相互作用,刺激了 SR 中的 Ca 释放。肌浆 Ca 的增加通过暴露肌动蛋白细丝上的肌球蛋白结合位点来促进肌肉收缩(该过程涉及 Ca 与肌钙蛋白 C 的结合,随后原肌球蛋白向细丝中的凹槽移动)。然后肌球蛋白横桥似乎经历了棘轮作用,细丝被拉向肌节中心并收缩骨骼肌纤维。随着肌浆 Ca 被 SR 中的 Ca-ATPase(SERCA)隔离,肌肉随之放松。4. 收缩力可以通过激活更多运动神经元(即募集更多肌纤维)或增加肌纤维中动作电位的频率来增加,从而产生强直。强直收缩期间力量的增加是由于细胞内 [Ca] 的长期升高。
5. 两种基本类型的骨骼肌纤维根据其收缩速度(即快肌纤维与慢肌纤维)进行区分。收缩速度的差异归因于不同肌球蛋白亚型的表达,这些肌球蛋白亚型的肌球蛋白 ATPase 活性不同。除了肌球蛋白 ATPase 活性的差异外,快肌和慢肌在代谢活性、纤维直径、运动单位大小、对强直的敏感性和募集模式方面也不同。
6. 通常,慢肌纤维在快肌纤维之前募集,因为支配慢肌的运动神经元的兴奋性更高。慢肌纤维的高氧化能力支持持续的收缩活动。由快肌糖酵解纤维(IIx 型)组成的运动单位具有更高的激活阈值、更多的纤维数量和更低的氧化能力,因此最适合需要高强度的短时间活动。
7. 根据刺激模式,快肌纤维可以转化为慢肌纤维(反之亦然)。对快肌进行慢性电刺激会导致慢肌肌球蛋白表达和快肌肌球蛋白表达减少,同时氧化能力增加。
这种基因表达变化的潜在机制尚不清楚,但这种变化似乎是由于静息细胞内 [Ca] 升高所致。 Ca 依赖性磷酸酶钙调磷酸酶 和转录因子 NFAT 与从快肌纤维向慢肌纤维表型的转变有关。Ca/钙调蛋白依赖性激酶 和转录因子 MEF2 也可能参与表型转变。
8. 骨骼肌纤维在去神经支配后萎缩。肌肉纤维依靠其运动神经的活动来维持分化表型。通过沿原始神经鞘生长的轴突再神经支配可以逆转这些变化。骨骼肌替换因创伤或疾病而丢失的细胞的能力有限。 PI3K/Akt 信号通路的抑制和 FoxO 通路的激活似乎分别导致废用性萎缩期间蛋白质合成率降低和蛋白质降解率增加。萎缩期间蛋白质降解增加归因于蛋白酶活性(例如 caspase 3 的激活)和泛素化(通过升高的泛素水平)的增加胰岛素连接酶)。
9. 骨骼肌表现出相当大的表型可塑性。正常生长与细胞肥大有关,这是由于在细胞末端增加了更多的肌原纤维和更多的肌节以配合骨骼生长。力量训练诱导细胞肥大(通常通过涉及激活 Akt-mTOR 通路的信号通路)。耐力训练增加所有相关运动单位的氧化能力和毛细血管密度,通常通过涉及刺激转录辅激活因子 PGC-1a 的信号通路。训练方案不能将 II 型肌纤维转化为 I 型肌纤维
10. 运动期间的肌肉疲劳不是由于 ATP 耗尽造成的。运动引起的疲劳背后的机制尚不清楚,尽管各种代谢产物(乳酸、Pi、ADP)的积累已被证实与此有关。鉴于防止肌浆 ATP 耗竭的重要性,这会影响细胞的生存能力,很可能已经开发出多种机制来诱导疲劳,从而降低 ATP 水解率,以免个体面临骨骼肌细胞受伤或死亡的风险。
11. 当运动肌肉的能量需求无法通过氧化代谢满足时,就会产生氧债。运动后恢复期呼吸增加反映了这种氧债。肌肉收缩的能量需求对无氧代谢的依赖越大,氧债就越大。 12. 骨骼肌肌膜的轻微损伤可以通过膜联蛋白/肌球蛋白修复,而更广泛的损伤可能导致肌纤维再生。肌纤维再生涉及肌肉基底膜下卫星细胞的激活。激活的卫星细胞增殖并分化为肌细胞,肌细胞融合产生肌管。肌管成熟后成为再生肌纤维,具有位于中心的细胞核和胚胎肌球蛋白重链。根据 α 运动神经支配,再生肌纤维将表达 I 型或 II 型肌球蛋白。