生物化学比较解剖学
生物化学比较解剖学
绪论
其实我很早就想写一点关于生物化学的内容了。但是我想写的,不是那种完全按结构和代谢分开写的,而是以结构为基础,去理解代谢的原理的一种思路;我们不再是按照书本上写的,各章之间泾渭分明,或者是一个重要的知识点在相隔很远的章节里反复提及,而是将各个知识点按思维逻辑整理在一起,就像搭建一个生物化学的思维框架一样。像很多同学学了就忘,这很正常,毕竟生物化学这么多的内容不可能一下子就全部记住。理科思维需要的是理解记忆,我们如果能完善思维体系,把各知识点串联起来,自然就不会轻易遗忘。
有一位老师说,他最喜欢的书就是《脊椎动物比较解剖学》。当他初学时,发现里面的知识点繁杂而深奥,晦涩难懂的名词更让他望而生畏。但读完一遍又一遍,当他理解了脊椎动物结构的演化过程时,当他领悟到比较解剖的真谛时,他发现自己爱上了这门学科。与其将生物学当做记忆大赛,我们不如找到在各个分支中都用得上的一种思维模式。回想我们初中时老师都讲过的“结构与功能相适应”,不论在宏观动植物的器官系统中,还是微观世界的分子细胞,我想这一直都是毋庸置疑的。结构决定性质,性质决定功能,在我看来这是生物各个层次里面亘古不变的真理。这也正是比较解剖的关键所在:解剖结构、比较性质、发掘功能。所以当我们把比较解剖的思想放入生物化学中,将得到的是一个没有人能拒绝的“学科”——生物化学比较解剖学!
也感谢車佬,在我查阅osm.bio时发现了他的生化比解小论,让我有所启发,并接续着高一时的思路进行拓展创作。
§0 生物?化学!
顾名思义,生物化学这门学科与化学分不了干系(甚至近几年的诺贝尔化学奖大多都颁给了生物化学的研究成果),基本上所有原理都得用化学知识来解释。虽然作为一名生物学学生,我们不需要完全把各种化学反应机理都搞懂,但至少得懂一些基本的化学原理。
0.1 生命元素
让我们把目光缩到最小,从原子层面来观察生物体,我们发现构成生命体的主要元素无非就这么一些。根据其在生命体中的含量,我们把它们分为大量元素和微量元素。大量元素在生命体中广泛存在,且含量较大:C,H,O,N,P,S,K,Ca,Mg,Na,Cl……还有一些十分稀少,可能在某些动物中不存在的,称作微量元素,比如Fe,Cu,Mn,B,Zn,Mo……
看到这些元素,我们不禁发问:为什么生物会用这些元素作为生命的依靠呢?这是因为这些元素满足了生命元素需要的特质:适合性和可得性。
(1)适合性
根据基础的化学知识,地壳中含量最高的元素依次为O、Si、Al、Fe,这与生物中最丰富的四类元素C、H、O、N差别很大,除了氧元素其他都有较大变动。其实这也很好理解:CHON四者作为分子量更小的元素,一般来说元素越轻成键越强。这是因为较轻的元素原子半径更小,成键的键长更短,因此键能更大。此外我们还想到,CHON是非金属元素,原子间成的是更稳固的共价键,同时具有了更广泛的化学结合方式,能构成各种各样的有机化合物;而像Fe这样的过渡金属和非金属成的离子键则更容易断开,成键也更单调。
另一方面我们还注意到C和Si都属于第IV主族元素,最多都可以成四个键,但为什么生物偏向于C呢?这也很好理解,让我们想想地球的环境,CO2是一种气体,有利于进行碳元素循环;而SiO2作为固体会沉积下来,不利于地表循环,而且Si的许多化合物与水易发生反应,那在海洋中诞生的原始生物更不可能用硅元素了。
综上,我们认为C、H、O、N是根据适合性被生物选择的四种主要元素,它们能为生物提供稳定而多样的有机化合物,同时也更加有利于元素的全球循环。
同样被生物选择的元素还有P和S。我们知道,生物内最常用的高能化合物无非两种:带磷酸的与带硫酯的。这是因为在有水存在的时候,P和S在有机物里成键不稳定,带有较大能量,因此常作为能量载体分子的关键原子,这才有了我们所熟知的ATP与乙酰CoA等分子。
(2)可得性
一般来说,我们通常认为的地球上最早的生物是在海洋中起源的。那么理所当然的细胞里面就会带着许多海洋富含的元素,比如钠钾氯镁钙这些金属或卤素。在海洋里,它们以单原子离子形式存在,同理,在细胞里面也是一样。这种与环境的丰富含量有关的性质叫做元素的可得性。通常这些元素在生物里起着一般性作用,比如调节渗透平衡、电荷中和、神经传导、主动运输等等。
此外一些微量元素也会起着重要功能,这些一般是在某些蛋白质的活性基团中发挥功能,比如铁和铜可以作为电子的供受体参与细胞色素氧化酶的催化;或是参与某些分子的合成,比如硅细胞的硅和维生素B12中的钴。
但同时我们也清楚,许多元素对生物有害。重金属Hg、Pb有着剧毒,可以干扰蛋白质的工作,引起蛋白质变性;W竞争性抑制Mo吸收,As与P相似干扰糖代谢(但近期发现有些生物能在缺少P的环境内用As代替P发挥生物功能)。此外还有很多有害元素,在此不一一列出,感兴趣的读者可以自行整理。
0.2 非共价相互作用
可以说,非共价相互作用就是在生物大分子内维持其结构功能的重要力量。在以前我们没有单独拎出来讲,但在这里,我想先讲原理,再带入一些实例,更好地来分析他们的本质。
(1)离子相互作用
(离子相互作用、离子键、盐键的内涵稍有差别,但在生物里面一般混用)
在带电离子之间的排斥或吸引。本质是静电相互作用,有库仑力公式:F=Qq/(εr2),即作用力与电荷大小成正比,与ε(介电常数)和半径的平方成反比。在这里提出的一个比较重要的因素,就是介质的介电常数。想象一下,两个离子在极性条件下的作用大小与非极性条件下的作用大小应该是不一样的,离子相互作用在非极性条件下应该会更大一些(想象一下,你在异国他乡孤独生活。诸事不顺,处处碰壁,惹得你心烦意乱。这时,你遇到了一个与你同乡的女孩子,如萍水相逢,你们俩一见钟情,从此缠缠绵绵,过起了没羞没臊的幸福生活)。用物理来解释,就是非极性条件的介电常数低于极性常数,因而前者库仑力更大。
就以我们最熟悉的蛋白质折叠为例吧。在蛋白质一级结构中我们知道,有某些特殊的带电氨基酸,比如带负电的Glu、Asp、Sec,带正电的Lys、Arg、His、Pyl(这些我们将在§1中讲到)。这些氨基酸在一级结构(未折叠)中一般会和水中的其他离子(盐)结合形成离子键,但在折叠时则会与周围(空间上而不一定是序列上)的氨基酸发生作用。这里就有一个问题:既然在折叠前也会和水环境中的离子相互作用,折叠后也会和其他带电氨基酸互作。那么,聪明的你告诉我,到底是为什么盐键会促进蛋白质的折叠呢?很简单,因为在蛋白质内部疏水性更强,成的离子键强度更大,强度大的更稳定,稳定就代表能量更低,也就是焓变小于零,反应由焓驱动。
不过我们也知道,同性相斥异性相吸,离子相互作用不仅有吸引现象,也会有排斥的情况出现。不妨先来看看Linus Pauling和Robert Corey在1952年提出的DNA三螺旋结构:DNA由三条链组成,不同碱基分子朝外,磷酸基团朝内,分子呈螺旋状。
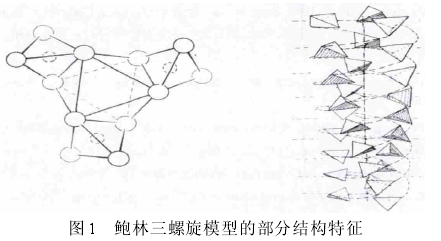
很明显,带负电荷的磷酸基团相互排斥就是反驳这种观点的有力证据。即使是Watson和Crick提出的DNA双螺旋,磷酸基团也在高盐环境下才会更加稳固。而如果组蛋白发生乙酰化修饰,其带有的正电荷被消除了,自然与DNA的结合将松弛下来,从而更有利于转录相关因子与DNA的结合。