第十五章 细胞信号转导
-
当事物发生变化时,细胞就会做出反应。从不起眼的细菌到最复杂的真核细胞,每个细胞都会监测其细胞内和细胞外环境,处理其收集的信息并做出相应的反应。例如,单细胞生物会根据环境营养物或毒素的变化改变其行为。多细胞生物的细胞会检测并响应无数的内部和细胞外信号,这些信号控制着它们在发育过程中的生长、分裂和分化,以及它们在成年组织中的行为。所有这些通信系统的核心是产生化学信号的调节蛋白,这些信号在体内或细胞内从一个地方发送到另一个地方,以及识别信号并对其作出反应的其他蛋白质,这些蛋白质通常会整合信号并将它们传递下去以产生信号。--
-
细胞信号传导的研究传统上侧重于真核细胞使用激素和生长因子等细胞外信号分子相互通信的机制。在本章中,我们描述了一些细胞通信系统的特征,并用它们来说明任何调节系统(无论是细胞内还是细胞外)能够产生、处理和响应信号的一般原理。我们主要关注动物细胞,但最后我们考虑植物细胞信号的特殊特征。--
-
细胞信号的基本原理
早在多细胞生物在地球上漫游之前,单细胞生物就已经发展出响应环境中物理和化学变化的机制。这些机制几乎肯定包括对其他细胞的存在作出反应的机制。证据来自对当今单细胞生物(如细菌和酵母)的研究。虽然这些细胞大多独立生活,但它们可以交流并影响彼此的行为。例如,许多细菌对其邻居分泌的化学信号作出反应,并在更高的种群密度下积累。这一过程称为群体感应,它使细菌能够协调其行为,包括运动、抗生素产生、孢子形成和有性结合。同样,酵母细胞在准备交配时也会相互交流。芽殖酵母酿酒酵母提供了一个经过充分研究的例子:当单倍体个体准备交配时,它会分泌一种肽交配因子,向相反交配类型的细胞发出信号,使其停止增殖并准备交配。随后两个相反交配类型的单倍体细胞融合。
在多细胞生物的进化过程中,细胞间通讯达到了惊人的复杂程度。这些生物体是紧密结合的细胞社会,其中单个细胞的福祉通常被放在一边,以造福整个生物体。复杂的细胞间通讯系统已经进化,允许不同组织和细胞类型之间的协作和协调。令人眼花缭乱的信号系统阵列控制着发育过程中和成年期细胞和组织功能的每个可能特征。
多细胞生物体中的细胞间通讯主要由细胞外信号分子介导。其中一些在长距离内运作,向远处的细胞发出信号;其他则只向近邻发出信号。多细胞生物体中的大多数细胞都会发出和接收信号。信号的接收依赖于受体蛋白,这些蛋白通常(但并非总是)位于细胞表面,与信号分子结合。结合激活受体,进而激活一个或多个细胞内信号通路或系统。这些系统依赖于细胞内信号蛋白,它们在接收细胞内处理信号并将其分发到适当的细胞内靶标。其中一些蛋白质会产生称为第二信使的小化学信使,将信号传送给其他信号蛋白。位于信号通路末端的靶标通常称为效应蛋白,它们会以某种方式被传入信号改变并实现细胞行为的适当变化。根据信号和接收细胞的类型和状态,这些效应物可以是转录调节剂、离子通道、代谢途径的组成部分或细胞骨架的一部分。
细胞信号传导的基本特征在真核生物的整个进化过程中一直被保留下来。例如,在芽殖酵母中,对交配因子的反应取决于细胞表面受体蛋白、细胞内GTP结合蛋白和蛋白激酶,这些蛋白与功能相似的蛋白明显相关动物细胞中的蛋白质。然而,通过基因复制和分化,动物的信号系统变得比酵母中的信号系统复杂得多;例如,人类基因组包含1500多个编码受体蛋白的基因,而不同受体蛋白的数量通过替代RNA剪接和翻译后修饰进一步增加。
细胞外信号可以在短距离或长距离内起作用
许多细胞外信号分子仍然与信号细胞的表面结合,并且只影响与其接触的细胞(图152A)。这种接触依赖性信号在发育和免疫反应过程中尤为重要。如果通讯细胞延伸出细长的突起,则发育过程中的接触依赖性信号有时可以在相对较远的距离上进行。
然而,在大多数情况下,信号细胞会将信号分子分泌到细胞外液中。通常,分泌的分子是局部介质,仅作用于信号细胞局部环境中的细胞。这称为旁分泌信号(图152B)。通常,旁分泌信号中的信号和靶细胞属于不同的细胞类型,但细胞也可能产生它们自己响应的信号:这称为自分泌信号。例如,癌细胞通常会产生刺激自身生存的细胞外信号。像我们这样的大型多细胞生物也需要远程信号机制来协调身体远程部位细胞的行为。因此,它们已经进化出专门用于远距离细胞间通讯的细胞类型。其中最复杂的是神经细胞或神经元,它们通常延伸出长长的分支过程(轴突),使它们能够接触远处的目标细胞,这些过程终止于称为化学突触的专门信号传输位点。当神经元被来自其他神经细胞的刺激激活时,它会沿着轴突快速发送电脉冲(动作电位);当脉冲到达轴突末端的突触时,它会触发分泌一种充当神经递质的化学信号。突触的紧密结构确保神经递质被特异性地传递到突触后靶细胞上的受体(图15-2C)。第11章将讨论此突触信号传导过程的细节。一种完全不同的长距离信号传导策略利用内分泌细胞,内分泌细胞将其信号分子(称为激素)分泌到血液中。血液将这些分子输送到很远的地方,使它们能够作用于几乎位于身体任何位置的靶细胞(图15-2D)。
细胞外信号分子与特定受体结合
多细胞动物中的细胞通过数百种细胞外信号分子进行通信。这些包括蛋白质、小肽、氨基酸、核苷酸、类固醇、类视黄酸、脂肪酸衍生物,甚至溶解的气体,如一氧化氮和一氧化碳。大多数这些信号分子通过胞吐从信号细胞释放到细胞外空间,如第13章所述。然而,有些是通过扩散穿过信号细胞的质膜发射的,而另一些则显示在细胞的外表面上并保持附着在其上,仅在接触时向靶细胞发出信号。跨膜信号蛋白可能以这种方式运作,尽管在某些情况下,它们的细胞外结构域通过蛋白水解裂解从信号细胞表面释放出来,然后在远处起作用。无论信号的性质如何,靶细胞都会通过受体做出反应,受体会结合信号分子,然后在靶细胞中启动反应。受体的结合位点具有复杂的结构,其形状可以高度特异性地识别信号分子,有助于确保受体仅对适当的信号做出反应,而不会对细胞接触到的许多其他信号分子做出反应。许多信号分子在非常低的浓度下起作用(通常=10-8M),它们的受体通常以高亲和力结合它们(解离常数Kd=10-8M;见图3-42)。在大多数情况下,受体是靶细胞表面的跨膜蛋白。当这些蛋白质与细胞外信号分子(配体)结合时,它们就会被激活并产生各种细胞内信号,从而改变细胞的行为。在其他情况下,受体蛋白位于靶细胞内,信号分子s进入细胞并与其结合:这要求信号分子足够小且疏水性,以便扩散穿过目标细胞的质膜(图15-3)。本章主要关注通过细胞表面受体的信号传导,但我们将简要描述通过
每个细胞都被编程为对特定组合作出反应
多细胞生物中的典型细胞在其环境中暴露于数百种不同的信号分子。这些分子可以是可溶的,与细胞外基质结合,或与邻近细胞的表面结合;它们可以是刺激性的或抑制性的;它们可以以无数不同的组合起作用;它们可以影响细胞行为的几乎任何方面。细胞选择性地对大量信号作出反应,主要是通过仅表达那些对所需信号作出反应的受体和细胞内信号系统。
大多数细胞对环境中的许多不同信号作出反应,其中一些信号可能会影响对其他信号的响应。细胞生物学的关键挑战之一是确定细胞如何整合所有这些信号信息以做出决定——分裂、移动、分化等。例如,许多细胞需要特定的细胞外生存因子组合才能继续存活;当这些信号被剥夺时,细胞会启动自杀程序并杀死自己——通常是通过细胞凋亡,如第18章所述。细胞增殖通常依赖于促进细胞分裂和存活的信号组合,以及刺激细胞生长的信号(图15-4)。另一方面,分化为非分裂状态(称为终末分化)通常需要不同的生存和分化信号组合,这些组合必须覆盖任何分裂信号。
信号分子通常对不同类型的靶细胞有不同的影响。例如,神经递质乙酰胆碱(图155A)会降低心脏起搏细胞的动作电位发放率(图155B),并刺激唾液腺细胞产生唾液(图155C),尽管两种细胞类型的乙酰胆碱受体相同。在骨骼肌中,乙酰胆碱通过与不同类型的乙酰胆碱受体结合而导致细胞收缩(图155D)。乙酰胆碱在这些细胞类型中的不同作用源于细胞内信号蛋白、效应蛋白和被激活的基因的差异。因此,细胞外信号本身几乎没有信息内容;它只是诱导细胞根据其预定状态做出反应,这取决于细胞的发育历史和特异的基因表达。
细胞表面受体蛋白主要有三类
大多数细胞外信号分子与它们影响的靶细胞表面上的特定受体蛋白结合,不会进入细胞溶胶或细胞核。
这些细胞表面受体通过将细胞外配体结合事件转化为改变细胞行为的细胞内信号,充当信号转导器
大多数细胞表面受体蛋白质属于三类之一,由其传导机制定义。离子通道偶联受体,也称为递质门控离子通道或离子型受体,参与神经细胞与其他可电兴奋靶细胞(如肌肉细胞)之间的快速突触信号传导(图156A)。这种类型的信号传导由少数神经递质介导,这些神经递质暂时打开或关闭由它们结合的蛋白质形成的离子通道,短暂改变质膜的离子通透性,从而改变突触后靶细胞的兴奋性。大多数离子通道偶联受体属于一个大家族,同源、多通道跨膜蛋白。由于它们在第11章中详细讨论,因此我们在此不再讨论它们。
G蛋白偶联受体通过间接调节单独的质膜结合靶蛋白的活性来发挥作用,该靶蛋白通常是酶或离子通道。异三聚体GTP结合蛋白(G蛋白)介导活化受体与该靶蛋白之间的相互作用(图156B)。靶蛋白的激活可以改变一种或多种小细胞内信号分子的浓度(如果靶蛋白是酶),或者可以改变质膜的离子通透性(如果靶蛋白是离子通道)。小细胞内信号分子反过来又会改变细胞中其他信号蛋白的行为。
酶偶联受体可以作为酶发挥作用,也可以直接与它们激活的酶结合(图156C)。它们通常是单次跨膜蛋白,其配体结合位点在细胞外,催化或酶结合位点在细胞内。与其他两类相比,酶偶联受体的结构是异质的;然而,绝大多数要么是蛋白激酶,要么与蛋白激酶有关,后者在激活时会磷酸化靶细胞中的特定蛋白质组。还有一些类型的细胞表面受体不容易归入这些类别中的任何一个,但在控制成人发育过程中不同细胞类型的特化以及组织更新和修复方面具有重要作用。在解释G蛋白偶联受体和酶偶联受体如何运作之后,我们将在后面的部分讨论这些内容。首先,我们继续一般性讨论通过细胞表面受体进行信号传导的原理。
细胞表面受体通过细胞内信号传递信号
许多细胞内信号分子将细胞表面受体接收到的信号传递到细胞内部。由此产生的细胞内信号事件链最终会改变负责改变行为的效应蛋白。一些细胞内信号分子是小化学物质,通常被称为第二信使(“第一信使”是细胞外信号
)。它们在受体激活后大量产生并从其来源扩散,将信号传播到细胞的其他部分。一些,如环磷酸腺苷和Ca2+,是水溶性的,在细胞溶胶中扩散,而另一些,如二酰甘油,是脂溶性的,在质膜平面中扩散。在任一情况下,它们通过结合并改变所选信号或效应蛋白的行为来传递信号。
大多数细胞内信号分子都是蛋白质,它们通过产生第二信使或激活通路中的下一个信号或效应蛋白来帮助将信号传递到细胞中。许多这样的蛋白质表现得像分子开关。当它们接收到信号时,它们会从非活性状态切换到活性状态,直到另一个过程将它们关闭,使它们返回到非活性状态。关闭与打开同样重要。如果一条信号通路要在传输一个信号后恢复,以便准备好传输另一个信号,那么该通路中每个激活的分子都必须返回到其状态。最大的一类分子开关由通过磷酸化激活或失活的蛋白质组成(第3章讨论)。对于这些蛋白质,蛋白激酶将开关转向一个方向,蛋白激酶将一个或多个磷酸基团共价添加到信号蛋白上的特定氨基酸上,而蛋白磷酸酶则将开关转向另一个方向,蛋白磷酸酶去除磷酸基团(图15-7A)。任何受磷酸化调控的蛋白质的活性都取决于磷酸化激酶活性之间的平衡磷酸化它和去磷酸化的磷酸酶。大约3050%的人类蛋白质含有共价连接的磷酸盐,人类基因组编码约520种蛋白激酶和约150种蛋白磷酸酶。典型的哺乳动物细胞利用数百种不同类型的蛋白激酶将磷酸盐附着到目标蛋白质上特定氨基酸的羟基上。真核细胞中有两种主要类型的蛋白激酶。绝大多数是丝氨酸/苏氨酸激酶,它们磷酸化目标中的丝氨酸和苏氨酸的羟基。其他是酪氨酸激酶,它们磷酸化酪氨酸上的蛋白质。酪氨酸激酶主要存在于多细胞动物中;例如,这些激酶并不存在,许多受磷酸化控制的细胞内信号传导蛋白本身就是蛋白激酶,这些蛋白激酶通常被组织成激酶级联。在这样的级联中,一种由磷酸化激活的蛋白激酶磷酸化序列中的下一个蛋白激酶,依此类推,将信号向前传递,在某些情况下,将其放大或传播到其他信号通路。与蛋白激酶一样,蛋白磷酸酶也根据其对丝氨酸/苏氨酸磷酸盐或酪氨酸磷酸盐的特异性进行分类。人类基因组中编码了大约100种蛋白酪氨酸磷酸酶,包括一些也能使丝氨酸脱磷酸化的双特异性磷酸酶。另一类重要的分子开关由GTP结合蛋白组成(第3章讨论)。这些蛋白质在两种不同的结构构象之间切换:GTP结合时为“开”状态,GDP结合时为“关”。在“开”状态下,它们结合并从而激活特定的信号蛋白。GTP结合蛋白通常具有内在的GTPase活性,并通过将其结合的GTP水解为GDP来关闭自身(图15-7B)。然后,当GDP解离时,
非活性蛋白质会返回“开启”状态,从而允许
新的GTP结合。
GTP结合蛋白主要有两种类型。
大型异三聚体GTP结合蛋白(也称为G蛋白)有助于传递来自激活它们的G蛋白偶联受体的信号(见图15-6B)。
小单体GTPase(也称为单体GTP结合蛋白)有助于传递来自多种细胞表面受体的信号。
对于大多数GTP结合蛋白,在没有其他蛋白质的情况下,失活过程(GTP水解为
GDP)和激活过程(GDP解离)会很慢。在细胞内,调节蛋白用于加速一个或另一个过程,从而控制GTP结合蛋白的激活状态。GTPase活化蛋白(GAP)通过增加结合GTP的水解速率,使蛋白质进入“关闭”状态。相反,鸟嘌呤核苷酸交换因子(GEF)通过促进结合GDP的释放来激活GTP结合蛋白,从而允许新的GTP结合。在异三聚体G蛋白的情况下,激活的受体充当GEF。图15-8说明了调节信号系统中并非所有分子开关都依赖于磷酸化或GTP结合。我们稍后会看到,一些信号蛋白通过另一种信号蛋白或第二信使(例如环磷酸腺苷或Ca2+)的结合来开启或关闭,或者通过除磷酸化或去磷酸化之外的共价修饰(例如泛素化)(在第3章中讨论)。为简单起见,我们通常将信号通路描绘为一系列激活步骤(见图151)。但需要注意的是,大多数信号通路都包含抑制步骤,两个抑制步骤的序列可以具有与一个激活步骤相同的效果(图159)。这种激活方案在信号系统中非常常见,正如我们在描述特定信号时所看到的那样。在如图151所示的理想信号通路中,每个细胞内信号分子仅与适当的下游靶标相互作用。类似地,靶标仅由适当的上游信号激活。然而,实际上,细胞中挤满了密切相关的信号分子,它们控制着各种各样的细胞过程。信号分子有时会与其他信号通路中的分子相互作用,这不可避免地会在信号系统之间产生不必要的串扰和干扰。在这些嘈杂的条件下,信号如何保持强烈和特异性?信号特异性的关键是相互作用的高亲和力和特异性细胞内信号分子和其正确伙伴之间的相互作用。信号分子与其靶标的结合由两个分子互补表面之间精确而复杂的相互作用决定。例如,一些蛋白激酶含有活性位点,可识别正确靶蛋白磷酸化位点周围的特定氨基酸序列,许多信号酶在其活性位点之外使用额外的对接位点,以促进与靶标互补位点的特定高亲和力相互作用。这些机制和相关机制在正确的伙伴之间提供了强大而持久的相互作用,从而增强了信号系统特异性还取决于减少或消除不良背景信号的噪声过滤器。例如,考虑一条信号通路,其中响应是由靶蛋白上几个位点的磷酸化触发的。在细胞内,我们通常可以假设存在恒定的低水平磷酸酶活性来去除这些磷酸化。因此,只有当适当的蛋白激酶达到足以克服相反的磷酸酶活性的高且持久的活性水平时,才有可能产生强烈的反应。如果由于某种偶然事件,另一种蛋白激酶与目标蛋白短暂相互作用并催化一两个位点的磷酸化,这些位点将被相反的磷酸酶去除,并且不会发生任何反应。群体中的细胞通常会表现出其细胞内信号分子浓度或活性的随机变化。同样,大量分子中的单个分子在其活性或与其他分子的相互作用方面也有所不同。这种信号变异性引入了另一种形式的噪声,可能会干扰信号传导的准确性和效率。然而,即使上游信号不稳定或系统某些组件失效,大多数信号系统也能产生非常稳健和精确的响应。在某些情况下,这种稳健性取决于并行机制的存在;例如,一个信号可能采用两条并行路径来激活一个共同的下游靶蛋白,即使一条路径失效,也能产生响应。MBOC7_ptr_ch15_873-948.indd881MBOC7_ptr_ch15_873-948.indd88108/12/2112:23PM08/12/2112:23PM
细胞内信号复合物在活化细胞表面形成
增强细胞内信号分子之间相互作用特异性并降低背景噪音的一种简单有效的策略是
将分子定位在细胞的同一部分,通常在大型蛋白质复合物内,从而促进它们彼此之间的相互作用,而不是
与不合适的伙伴相互作用。此类机制通常涉及支架蛋白,
它们将相互作用的信号蛋白组聚集到信号复合物中,通常在接收到信号之前(图1510A)。由于
(B)在活化受体上组装信号复合物
(C)在磷脂酰肌醇对接位点上组装信号复合物
MBOC7_ptr_ch15_873-948.indd882MBOC7_ptr_ch15_873-948.indd88208/12/2112:23PM08/12/2112:23PM
882第15章:细胞信号传导883细胞信号传导原理
支架将蛋白质保持在近距离,它们可以在高局部浓度下相互作用,并迅速、有效和选择性地响应适当的细胞外信号而被激活,避免与其他不必要的串扰
在其他情况下,这种信号复合物在响应
细胞外信号,并在信号消失后迅速解体。它们通常在细胞外信号分子激活细胞表面受体后聚集在受体周围。在许多情况下,活化的酶偶联受体的细胞质尾部在活化过程中被磷酸化,磷酸化的氨基酸随后作为其他信号蛋白组装的对接位点(图1510B)。在其他情况下,受体活化导致在相邻的质膜中产生修饰的磷脂分子(称为磷酸肌醇),然后将特定的细胞内信号蛋白募集到膜的这个区域,在那里它们被
模块化相互作用域介导相互作用
简单地将细胞内信号蛋白聚集到近距离有时就足以激活它们。因此,诱导接近(信号触发信号复合物的组装)通常用于沿信号通路将信号从蛋白质传递到蛋白质。此类信号复合物的组装依赖于各种高度保守的小相互作用域,这些域存在于许多细胞内信号蛋白。这些紧凑的蛋白质模块中的每一个都与另一个蛋白质或脂质中的特定结构基序结合。相互作用蛋白质中识别的基序可以是短肽序列、共价修饰(例如磷酸化氨基酸)或另一个蛋白质结构域。模块化相互作用结构域的使用可能促进了新信号通路的进化。由于它可以插入蛋白质的许多位置而不会干扰蛋白质的折叠或功能,因此新的相互作用结构域可以将蛋白质连接到其他信号蛋白中有许多类型的相互作用结构域。例如,Src同源性2(SH2)结构域和磷酸酪氨酸结合(PTB)结构域与活化受体或细胞内信号蛋白上特定肽序列中的磷酸化酪氨酸结合。Src同源性3(SH3)结构域与短的、富含脯氨酸的氨基酸序列结合。一些pleckstrin同源性(PH)结构域与特定磷酸肌醇的带电头部基团结合,这些磷酸肌醇是在细胞外信号的作用下在质膜中产生的;它们使它们所属的蛋白质能够停靠在膜上并与其他类似招募的信号蛋白相互作用(见图15-10C)。一些信号蛋白仅由两个或多个相互作用结构域组成,仅作为衔接子将信号通路中的两个其他蛋白质连接在一起。一些衔接蛋白具有多个相互作用结构域以及它们自己的相互作用结构域,使信号蛋白能够以多种特定组合相互结合。就像乐高积木一样,蛋白质可以形成线性或分支链或三维网络,从而决定信号通路所遵循的路线。例如,图15-11说明了一些相互作用域如何介导大型信号复合物的形成。模块化相互作用域通常位于信号蛋白的灵活、非结构化区域,沿着串上的多肽状珠子排列。因此,具有多个相互作用域的蛋白质可以成核,在激活受体簇周围形成大的交联蛋白质基质(图15-12)。这些蛋白质基质的行为类似于凝胶或生物分子凝聚物,从而形成局部微环境,其成分与周围的细胞溶胶不同(第3章讨论)。MBOC7_ptr_ch15_873-948.indd883MBOC7_ptr_ch15_873-948.indd88308/12/2112:23PM08/12/2112:23PM
这些基质中活性受体和特定信号蛋白的浓度被认为可以增强受体信号的强度和特异性
将受体和细胞内信号蛋白结合在一起的另一种方法是将它们定位在细胞的特定区域。一个重要的例子是初级纤毛,它像天线一样从大多数脊椎动物细胞的表面伸出(第16章讨论)。许多表面受体和信号蛋白都集中在那里——特别是Hedgehog信号系统的组成部分,正如我们稍后讨论的那样。光和嗅觉受体也集中在
图1512通过信号蛋白之间的多价相互作用形成大型受体簇。此处所示的系统
包含激活的受体酪氨酸激酶,这些激酶在受体尾部的无序区域上被广泛磷酸化。该系统还包括两个衔接蛋白。一个衔接蛋白(粉红色)包含一个SH2结构域,该结构域
与受体上的磷酸化酪氨酸结合,以及两个SH3结构域。另一个衔接蛋白(蓝色)包含三个
可以结合SH3结构域的富含脯氨酸的区域,以及一个蛋白激酶结构域。该系统中的三个组分之间可以发生许多多价结合相互作用
,从而产生交联蛋白基质或凝聚物,其中受体和衔接蛋白的蛋白激酶浓缩,可能提供更有效的信号输出。可以通过包括具有与修饰的相互作用的结构域的衔接蛋白来进一步增强基质的交联。
MBOC7_ptr_ch15_873-948.indd884MBOC7_ptr_ch15_873-948.indd88408/12/2112:23PM08/12/2112:23PM
884第15章:细胞信号传导885细胞信号传导原理
信号和响应之间的关系在不同情况下有所不同
细胞内信号系统的功能是检测和测量细胞一个位置的特定刺激,然后产生适当定时和测量的响应,通常在另一个位置。该系统通过将信息以分子“信号”的形式从受体发送到最终的效应蛋白来完成这项任务,通常通过一系列中介,这些中介不仅传递信号,而且还在传递过程中对其进行处理。信号系统以各种方式工作:每种系统都进化出一种适合于系统控制的细胞功能的反应。在以下段落中,我们列出了一些基本的信号特性以及它们在不同系统中的变化,作为基础1.根据响应所需的速度,不同信号系统的响应时间差异很大。在某些情况下,例如突触信号(见图152C),响应可以在几毫秒内发生。在其他情况下,如在发育过程中形态发生素对细胞命运的控制中2.对细胞外信号的敏感性可能有很大差异。激素往往以非常低的浓度作用于远处的靶细胞,因此对低浓度的信号高度敏感。另一方面,神经递质在突触处以高得多的浓度起作用,从而降低了对突触后受体高灵敏度的需求。灵敏度通常由靶细胞上受体的数量或亲和力的变化控制。提高灵敏度的一个特别重要的机制是信号放大,即少量激活的细胞表面受体通过产生大量的第二信使或激活许多下调的拷贝来引起大的细胞内反应。3.信号系统的动态范围与其灵敏度有关。一些系统,如参与简单发育决策的系统,对很窄的细胞外信号浓度范围有反应。其他系统,如控制视觉或某些对激素的代谢反应的系统,对更大范围的信号强度有高度反应。我们将看到,广泛的动态范围通常是通过适应机制实现的,该机制根据预先调整响应性。4.反应的持久性可能有很大差异。例如,在某些突触反应中,少于一秒的瞬时响应是合适的,而在发育过程中的细胞命运决定中则需要长时间甚至永久的响应。可以使用多种机制(包括正反馈和负反馈)来改变响应的持续时间和可逆性。
5.信号处理可以将简单信号转换为复杂响应。例如,在许多系统中,细胞外信号的逐渐增加会转换为突然的开关式响应。在其他情况下,简单的输入信号会转换为振荡响应,由一系列重复的瞬时细胞内信号产生。反馈通常是生化开关和振荡器的核心,我们将在后面描述。
6.集成允许响应由多个输入控制。例如,如前所述,通常需要特定的细胞外信号组合来刺激复杂的细胞行为,例如细胞生长、增殖和分化(见图154)。因此,细胞必须整合来自多个信号的信息,这通常取决于细胞内巧合检测器;这些蛋白质相当于计算机微处理器中的与门,因为它们只有在接收到多个汇聚信号时才会被激活(图1513)。
MBOC7_ptr_ch15_873-948.indd885MBOC7_ptr_ch15_873-948.indd88508/12/2112:23PM08/12/2112:23PM
7.一个细胞中的多个反应的协调可以通过一个细胞外信号实现。例如,一些细胞外信号分子刺激细胞生长和分裂。这种协调通常依赖于通过在信号通路中创建分支将信号分发给多个效应器的机制。在某些情况下,信号通路的分支可以允许一个细胞外信号调节对其他细胞外信号的响应强度。鉴于信号整合、协调和反馈等行为的复杂性,很明显信号系统很少依赖于简单的线性步骤序列,而是更经常像信号网络一样运行,其中信息在多个方向流动,包括向后流动。一个主要的研究挑战是了解这些网络的性质以及它们如何控制任何信号响应的速度取决于执行目标细胞响应的细胞内信号分子的性质。当反应只需要改变细胞中已经存在的蛋白质时,它可以非常迅速地发生:例如,神经递质门控离子通道的变构变化(第11章讨论)可以在几毫秒内改变质膜电位,而仅依赖于蛋白质磷酸化的反应可以在几秒或几分钟内发生。然而,当反应涉及基因表达的变化和新蛋白质的合成时,它通常不管信号传递方式如何,一个过程通常需要几分钟或几小时。
当考虑响应速度时,很自然地会从信号传递时产生的变化的角度来考虑信号系统。但考虑信号撤回时会发生什么也同样重要。在许多信号通路中,当信号停止时,响应就会减弱。通常,这种影响是短暂的,因为信号通过增加短暂(不稳定)的细胞内分子的浓度来发挥作用,这些分子会不断周转。因此,当细胞外信号被移除时,分子的降解会迅速抹去信号作用的所有痕迹。同样的原理也适用于通过激活蛋白激酶来诱导蛋白质磷酸化的信号:因为大多数磷酸化被磷酸酶不断去除,所以当激酶活性下降时,增加的蛋白激酶活性的影响会迅速逆转。因此,细胞对信号消除的反应速度取决于分子的破坏或周转率。尽管不那么明显,但周转率确实可以决定细胞外信号到达时反应的及时性。例如,考虑两个细胞内信号分子X和Y,它们通常都保持在每细胞1000个分子的稳定浓度。细胞以每秒100个分子的速度合成和降解分子Y,每个分子的平均寿命为10秒。分子X的周转率比Y慢10倍:它以每秒10个分子的速度合成和降解,因此每个分子在细胞中的平均寿命为100秒。如果作用于细胞的信号导致X和Y的合成率增加十倍,而分子寿命没有变化,那么在1秒结束时,Y的浓度将增加近900个分子/细胞(10×100-100),而X的浓度将仅增加90个分子/细胞。事实上,在分子的合成率突然增加或减少后,分子从旧平衡浓度向新平衡浓度转变一半所需的时间等于其半衰期;也就是说,等于如果所有合成都停止,其浓度下降一半所需的时间(图15-15)。细胞可以对逐渐增加的信号做出突然反应
一些信号系统能够在广泛的细胞外信号浓度范围内产生平滑的分级响应(图1516,蓝线);
例如,此类系统在微调代谢过程方面很有用
图1515快速周转的重要性。图表显示了当分子的合成率(A)降低或(B)突然增加10倍时,具有不同周转时间的分子细胞内浓度预测的相对变化率。在这两种情况下,
那些通常在细胞内快速降解的分子(红线)的浓度变化很快,而那些通常缓慢降解的分子(绿线)的浓度变化则相对较慢。右侧的数字(蓝色)是某些激素假设的半衰期。其他信号系统仅当信号浓度超过某个阈值时才会产生显着的反应。这些突然的反应有两种类型。一种是S形反应,其中低浓度的刺激没有太大影响,但随后反应在中等刺激水平下急剧上升且持续(图1516,红线)。这样的系统提供了一个过滤器来减少对低水平背景信号的不适当反应,但当刺激上升到生理信号浓度时会以高灵敏度响应。第二种类型的突然反应是不连续或全或无反应,其中当信号达到某个阈值浓度时,反应会完全(并且通常是不可逆地)开启(图1516,绿线)。此类反应对于控制两种替代细胞状态之间的选择特别有用,并且它们通常涉及正反馈,正如我们稍后更详细地描述的。细胞使用各种分子机制来对增加的信号浓度产生S形反应。在一种机制中,必须有多个细胞内信号分子与其下游信号分子结合。流靶蛋白来诱导反应。例如,正如我们稍后讨论的那样,四个第二信使环磷酸腺苷分子必须同时与每个环磷酸腺苷依赖性蛋白激酶(PKA)分子结合才能激活激酶。当激活细胞内信号蛋白需要在多个位点进行磷酸化时,也会出现类似的反应增强。随着所需分子或磷酸基团数量的增加,这种反应会变得更加敏锐,如果数量足够大,反应几乎会变得敏锐。当细胞内信号分子激活一种酶并抑制另一种催化相反反应的酶时,反应也会变得更加敏锐。这种常见调节类型的一个研究得很好的例子是激素肾上腺素诱导的骨骼肌细胞糖原分解刺激。肾上腺素与G蛋白偶联细胞表面受体结合,会增加细胞内环磷酸腺苷的浓度,而环磷酸腺苷既激活一种促进糖原分解的酶,又抑制一种促进糖原分解的酶。
正反馈可以产生全或无反应
与细胞内代谢途径(第2章讨论)和控制基因活动的系统(第7章讨论)一样,大多数细胞内信号传导系统都包含反馈回路,其中一个过程的输出会反馈来调节同一过程。我们在第8章中讨论了反馈回路的数学分析。在正反馈中,输出会刺激其自身的生产;在负反馈中,输出会抑制其自身的生产(图1518)。反馈回路在生物学中具有普遍的重要性,它们调节细胞中的许多化学和物理过程。即使是最简单的环路也能
信号通路中的正反馈可以改变响应细胞的行为。如果正反馈只有中等强度,其效果将只是使对信号的响应变得陡峭,产生像前面描述的S形响应;但如果反馈足够强,它可以产生全有或全无的响应(见图1516)。这种响应与另一个特性密切相关:一旦响应系统切换到高激活水平,这种情况通常是自我维持的,即使在信号强度降至临界值以下后仍能持续。在这种情况下,系统被称为双稳态的:它可以存在于“关闭”或“打开”状态,并且瞬时刺激可以将其从一种状态切换到另一种状态。通过正反馈,瞬时细胞外信号可以诱导细胞及其后代的长期变化,这些变化可以持续到生物体的一生。例如,触发肌肉细胞特异的信号打开了一系列编码肌肉特异性转录刺激的基因的转录,激活蛋白质A,进而激活蛋白质B。蛋白质然后又起作用来增加或减少
MBOC7_ptr_ch15_873-948.indd888MBOC7_ptr_ch15_873-948.indd88808/12/2112:23PM08/12/2112:23PM
888第15章:细胞信号传导889细胞信号传导原理
调节蛋白,刺激自身基因的转录,以及
编码各种其他肌肉细胞蛋白的基因;这样,成为肌肉细胞的决定就永久了。这种依赖于正反馈的细胞记忆是细胞在不改变其DNA的情况下经历持久特性变化的基本方式之一。
对大量细胞信号反应的研究可能会给人一种错误的印象,即反应是平稳分级的,即使强烈的正反馈导致单个细胞的反应突然、不连续地切换。
只有通过研究单个细胞的反应,才有可能看到它的全有或全无
图1519一些简单反馈的影响。这些图显示了简单正反馈和负反馈回路的计算效果(第8章讨论)。在每种情况下,输入信号都是活化的蛋白激酶(S),它会磷酸化并从而激活另一种蛋白激酶(E);蛋白磷酸酶(I)会使活化的E激酶去磷酸化并失活。在图中,红线表示E激酶随时间变化的活性;下面的黑色括号表示输入信号(激活的S激酶)存在的时间。
(A)正反馈回路图,其中激活的E激酶反作用以促进其自身的磷酸化和激活;I磷酸酶的基础活性以稳定的低速率使激活的E去磷酸化。(B)上面的图表显示,在没有饲料的情况下反过来,E激酶的活性与S激酶的刺激水平成正比。底部图表显示,通过正反馈回路,S激酶的瞬时刺激将系统从“关闭”状态切换到“开启”状态,并且在刺激被移除后仍保持这种状态。(C)负反馈回路图,其中激活的E激酶磷酸化并激活I磷酸酶,从而增加磷酸酶去磷酸化和灭活磷酸化E激酶的速率。(D)顶部图表再次显示了没有反馈时E激酶活性的响应。其他图表显示了短暂或长时间延迟后负反馈对E激酶活性的影响。在短暂的延迟后,系统会在信号首次增加时显示响应,但反馈会迅速抑制响应,然后下降到某个中间水平,在此水平上输入信号和反馈保持平衡。在长时间的延迟后,响应首先会不受阻碍地上升,使激酶活性达到最大水平,然后反馈关闭自身。然后,活性的突然下降消除了负反馈,释放了另一个激酶活性脉冲。如果条件合适,只要刺激存在,结果就是持续振荡。
MBOC7_ptr_ch15_873-948.indd889MBOC7_ptr_ch15_873-948.indd88908/12/2112:23PM08/12/2112:23PM
字符(图1520)。细胞群中误导性的平滑反应是由于我们之前描述的信号系统中随机的内在变异性:群体中的所有细胞对相同浓度的细胞外信号的反应并不相同,尤其是在中间信号浓度下,负反馈是细胞内信号的共同特征。与正反馈相比,负反馈抵消了刺激的影响,从而缩短和限制了反应水平,使系统对扰动的敏感度降低(第8章讨论)。然而,与正反馈一样,当反馈以不同的方式运作时,可以获得定性不同的响应。具有长延迟的负反馈可以产生振荡的响应。只要刺激存在,振荡就可能持续(图15-19C和D),或者它们甚至可以自发产生,而不需要外部信号来驱动它们。许多这样的振荡器还包含产生更尖锐振荡的正反馈回路。在本章后面,我们将遇到细胞内对细胞外信号的反应中振荡行为的具体例子;它们都依赖于负反馈,通常伴随着正反馈。如果负反馈以短暂的延迟运行,系统会对刺激产生短暂的反应,但即使在刺激持续时,反应也会迅速衰减。如果刺激进一步增加,系统会再次强烈响应,但反应很快就会再次衰减。这是适应现象,我们已经看到大多数信号系统产生的输出响应与输入信号的强度成比例。在许多情况下,只要输入信号保持不变,响应
就会保持不变,随着孕酮浓度的增加,响应会下降
孕酮(µM)
图1520检查单个细胞以检测对细胞外信号浓度增加的全或无响应的重要性。在这些实验中,未成熟的蛙卵(卵母细胞)受到激素孕酮浓度增加的刺激。通过分析MAP激酶(稍后讨论)的活化来评估反应,MAP激酶是响应中通过磷酸化激活的蛋白激酶之一。对卵母细胞提取物中磷酸化(活化)MAP激酶的量进行了生化评估。在(A)中,分析了受刺激卵母细胞群的提取物,MAP激酶的活化似乎随着孕酮浓度的增加而逐渐增加。有两种可能的方式可以解释这一结果:(B)随着孕酮浓度的增加,每个细胞中的MAP激酶可能逐渐增加;或(C)单个细胞可能以全有或全无的方式作出反应,总MAP激酶活性的逐渐增加反映了随着孕酮浓度的增加而作出反应的细胞数量增加。当分析单个卵母细胞的提取物时,发现细胞中活化的激酶量要么非常低,要么非常高,但不是中等量,这表明在单个细胞水平上反应基本上是全有或全无的,如图C所示。后续研究表明,这种全有或全无反应部分归因于强烈的p孕酮信号系统中的正反馈。(改编自J.E.Ferrell和E.M.Machleder,Science280:895898,1998。使用
MBOC7_ptr_ch15_873-948.indd890MBOC7_ptr_ch15_873-948.indd89008/12/2112:23PM08/12/2112:23PM
890第15章:细胞信号传导891细胞信号传导原理
当输入信号停止时。在其他系统中,例如涉及正反馈的系统,输入信号可以产生强输出信号,即使在输入信号被移除后,该信号仍然存在。最后,我们刚刚讨论了负反馈系统,其中输入信号触发响应,即使刺激持续存在,该响应也会上升然后下降。然后,第二个更强的输入信号可以产生另一个
这种现象称为适应或脱敏,它允许细胞对输入信号强度的变化(而不是信号的绝对量)做出反应,信号水平变化范围非常广。本章后面讨论的视觉系统为这一概念提供了理想的说明:它使用适应不同信号强度的方法,使我们能够在从星光到明亮阳光的惊人光强度范围内清晰地看到。
适应要求信号系统的某些组成部分产生延迟的抑制信号,从而降低输出强度。这个主题有几种变体。正如刚才讨论的那样,一种常见的机制是短暂延迟的负反馈(图15-21A)。例如,许多以酶偶联受体开始的信号通路包括蛋白激酶,这些蛋白激酶磷酸化并从而抑制通路中的上游信号蛋白。第二种适应机制发生在细胞外信号通过一条通路快速激活信号反应,同时触发一条平行的、较慢的信号通路,抑制反应时(图15-21B)。例如,在某些酶偶联信号通路中,激活的受体促进GEF膜的募集,称为Sos,从而刺激一种名为Ras的小GTP结合蛋白的活性(见图15-11)。受体的激活还会导致GAP的募集速度更慢,GAP会在延迟后使Ras失活,从而导致细胞活力降低。一种特别有效的适应机制(本章后面将详细讨论)取决于受体失活,即一些激活的受体在短暂的活动期后自行关闭。例如,配体与某些G蛋白偶联受体结合会导致受体发生变化,从而促进其与异三聚体G蛋白的结合,并产生下游反应。配体结合还会导致受体磷酸化并与抑制分子(称为抑制蛋白)结合,从而干扰G蛋白的活化,从而降低反应。配体结合受体的内吞作用进一步抑制了这种反应,这些受体可以被隔离在细胞内或被简单地破坏(图15-21C,
尽管它们复杂得令人困惑,但我们在本章中描述的多个交叉调节信号通路和反馈回路不仅仅是
图15-21靶细胞可以适应(脱敏)细胞外信号分子的一些方式。(A)短暂延迟的负反馈可以抑制对受体激活的初始反应。(B)在某些情况下,激活的受体会迅速激活刺激通路,同时也启动较慢的抑制通路——导致瞬时输出响应。这称为延迟前馈回路。(C、D、E)信号分子结合后,各种机制都可以使细胞表面受体失活,包括依赖于内化的机制受体进入内体,受体可以从内体返回细胞
MBOC7_ptr_ch15_873-948.indd891MBOC7_ptr_ch15_873-948.indd89108/12/2112:23PM08/12/2112:23PM
杂乱无章的纠缠,但却是一个高度进化的系统,用于处理和解释大量冲击动物细胞的细胞外信号。整个信号网络可以看作是一个计算设备;就像另一个生物计算设备大脑一样,它提出了生物学中最困难的问题之一。我们可以识别组件并发现它们如何单独工作。我们可以理解小的组件子集如何作为调节模块、噪声过滤器或适应机制一起工作,正如我们所见。然而,要了解整个系统如何运作则是一项艰巨得多的任务。这不仅是因为系统很复杂;还因为它的行为方式在很大程度上取决于分子相互作用的定量细节,而对于大多数动物细胞,我们只有粗略的定性信息。信号研究未来面临的主要挑战是开发更复杂的定量和计算方法来分析信号系统,因为多细胞动物中的每个细胞都被编程为对其他细胞产生的一组特定的细胞外信号分子作出反应。信号分子通过与靶细胞表达的一组互补受体蛋白结合而起作用。大多数细胞外信号分子激活细胞表面受体蛋白,后者充当信号转导器,将细胞外信号转换成改变靶细胞行为的细胞内信号。激活的受体通过激活细胞内信号蛋白将信号传递到细胞内部。总的来说,其中一些信号蛋白在传递信号时有助于传递、放大和传播信号,而另一些信号蛋白则整合来自不同信号通路的信号。一些信号蛋白充当开关,通过磷酸化或GTP结合暂时激活。大型信号复合物通过信号蛋白中的模块化相互作用域形成,这使得蛋白质能够形成复杂的靶细胞使用各种机制,包括反馈回路,来调整它们对细胞外信号的反应方式。正反馈回路可以帮助细胞以全有或全无的方式响应逐渐增加的细胞外信号浓度,或将短暂的信号转换为持久的甚至不可逆的反应。负反馈是允许细胞适应信号分子的一种方式,这使它们能够对信号分子浓度的微小变化做出反应,而不是大的变化。
通过G蛋白偶联受体的信号转导
G蛋白偶联受体(GPCR)形成最大的细胞表面受体家族,它们介导对来自外部世界信号的大部分反应,以及来自其他细胞的信号,包括激素、神经递质和局部介质。我们的视觉、嗅觉和味觉也依赖于它们。人类有800多个GPCR,小鼠中约有1000个GPCR仅与嗅觉有关。作用于GPCR的信号分子结构各异,功能各异,包括蛋白质和小肽、氨基酸和脂肪酸衍生物、光子以及我们能闻到或尝到的所有分子。相同的信号分子可以激活许多不同的GPCR家族成员;例如,肾上腺素至少激活9种不同的GPCR,乙酰胆碱激活另外5种,神经递质血清素至少激活14种。相同信号的不同受体通常在不同的细胞中表达。
尽管激活它们的信号分子在化学和功能上存在多样性,但所有GPCR都具有相似的结构。它们由一条多肽链组成,该多肽链在脂质双层上来回穿梭七次,形成圆柱形结构,其核心通常有一个深层配体结合位点(图1522)。除了它们在质膜中的特征性方向外,它们都使用G蛋白将信号传递到细胞内部。
GPCR超家族包括视紫红质(脊椎动物眼睛中的光激活蛋白)以及脊椎动物鼻子中的大量嗅觉受体。其他家族成员存在于单细胞生物中:酵母中识别分泌交配因子的受体就是一个例子。介导多细胞生物中细胞信号传导的GPCR很可能是从其单细胞真核生物祖先中的感觉受体进化而来的。令人惊讶的是,几乎一半的已知药物都是通过GPCR或GPCR偶联信号通路起作用的。在人类基因组中编码GPCR的数百个基因中,约有150个编码孤儿受体,其配体未知。其中许多可能是新药的靶点,这些新药仍有待开发
异三聚体G蛋白传递来自GPCR的信号
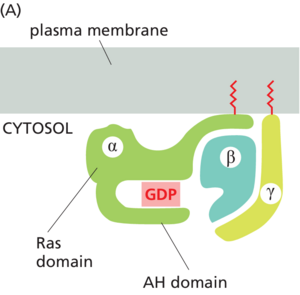
当细胞外信号分子与GPCR结合时,受体会发生构象变化,使其能够激活异三聚体GTP结合蛋白(G蛋白),该蛋白将受体与质膜中的酶或离子通道偶联。在某些情况下,G蛋白在受体被激活之前与受体物理相关,而在其他情况下,它仅在受体激活后结合。G蛋白有多种类型,每种类型都针对特定的一组GPCR和质膜中的一组特定的靶蛋白。然而,它们都具有相似的结构,并且操作方式也相似。
G蛋白由三个蛋白质亚基组成:a、β和γ。在未受刺激的状态下,a亚基与GDP结合,G蛋白处于非活性状态(图1523)。当GPCR被激活时,它的作用类似于鸟嘌呤核苷酸交换因子(GEF)并诱导a亚基释放其结合的GDP,允许GTP在其位置结合。GTP结合然后导致Ga亚基发生激活构象变化,将G蛋白从受体中释放出来并触发GTP结合的Ga亚基与Gβ?对分离-两者随后与各种靶标相互作用,例如质膜中的酶和离子通道,从而将信号传递出去(图1524)。

a亚基是一种GTPase,当它将其结合的GTP水解为GDP时,它就会失去活性。GTP水解所需的时间通常很短,因为GTPase活性因a亚基与第二个蛋白质的结合而大大增强,该第二个蛋白质可以是靶蛋白,也可以是G蛋白信号传导调节剂(RGS)。RGS蛋白充当a亚基特异性GTPase活化蛋白质(GAP)(见图158),它们有助于所有真核生物关闭G蛋白介导的反应。人类基因组中编码了大约25种RGS蛋白,每种蛋白都与一组特定的G蛋白相互作用。
一些G蛋白调节环磷酸腺苷的产生
环磷酸腺苷(cAMP)在某些信号通路中充当第二信使。
细胞外信号可以在几秒钟内将cAMP浓度增加二十多倍(图1525)。如前所述(见图15-15),如此快速的反应需要在分子的快速合成与快速分解或去除之间取得平衡。环磷酸腺苷由一种称为腺苷酸环化酶的酶从ATP合成,并被环磷酸腺苷磷酸二酯酶快速而持续地破坏(图15-26)。腺苷酸环化酶是一种大型、多跨膜蛋白,其催化域位于质膜的胞浆侧。哺乳动物中至少有八种同工酶,其中大多数是受调控的。许多细胞外信号通过增加细胞内的cAMP浓度起作用。这些信号激活与刺激性G蛋白(Gs)。Gs的激活a亚基结合并从而激活腺苷酸环化酶。
其他细胞外信号通过不同的GPCR起作用,通过激活抑制性G蛋白(Gi)来降低cAMP水平,然后抑制腺苷酸环化酶。
Gs和Gi都是医学上重要的细菌毒素的靶标。霍乱毒素是由引起霍乱的细菌产生的,它是一种酶,可催化ADP核糖从细胞内NAD+转移到Gs的a亚基。这种ADP核糖基化会改变a亚基,使其不再水解其结合的GTP,使其保持活性状态,无限期地刺激腺苷酸环化酶。由此导致的肠上皮细胞内cAMP浓度长期升高导致大量Cl-和水流入肠道,从而导致霍乱所特有的严重腹泻。百日咳毒素是由引起百日咳的细菌产生的,它催化Gi的a亚基的ADP核糖基化,阻止蛋白质与受体相互作用;因此,G蛋白保持非活性GDP结合状态,无法调节其靶蛋白。这两种毒素广泛用于实验,以确定细胞对信号是否具有GPCR依赖性反应。表15-1列出了由Gs刺激的cAMP浓度增加介导的一些反应。如表所示,不同类型的细胞对cAMP浓度增加的反应不同。某些细胞类型,例如脂肪细胞,在多种激素的作用下激活腺苷酸环化酶,从而刺激甘油三酯(脂肪的储存形式)分解为脂肪酸。Gsa亚基遗传缺陷的个体对某些激素的反应降低,导致代谢异常、骨骼发育异常
环磷酸腺苷依赖性蛋白激酶(PKA)介导大多数cAMP反应
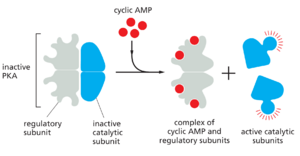
在大多数动物细胞中,cAMP主要通过激活环磷酸腺苷依赖性蛋白激酶(蛋白激酶A;PKA)发挥作用。这种激酶磷酸化选定靶蛋白(包括细胞内信号传导蛋白和效应蛋白)上的特定丝氨酸或苏氨酸,从而调节其活性。靶蛋白因细胞类型而异,这解释了为什么cAMP的影响会因细胞类型而有如此显著的差异(见表15-1)。在非活性状态下,PKA由两个催化亚基和两个调节亚基的复合物组成。cAMP与调节亚基的结合会改变它们的构象,导致它们与复合物分离。释放的催化亚基因此被激活,以磷酸化特定的靶蛋白(图15-27)。
PKA的调节亚基对于将激酶定位在细胞内非常重要:特殊的A-激酶锚定蛋白(A-kinaseanchoringproteins,AKAP)既与调节亚基结合,又与细胞骨架的成分或细胞器的膜结合,从而将酶复合物束缚在特定的亚细胞区室中。一些AKAP还与其他信号蛋白结合,形成信号复合物。AKAP位于心肌细胞核周围,例如,结合PKA和磷酸二酯酶水解cAMP。在未受刺激的细胞中,磷酸二酯酶使局部cAMP浓度保持在较低水平,因此结合的PKA处于非活性状态;在受刺激的细胞中,cAMP浓度迅速上升,压倒磷酸二酯酶并激活PKA。在这些细胞中,PKA磷酸化和激活的靶蛋白包括相邻的磷酸二酯酶,它再次迅速降低cAMP浓度。这种负反馈安排将原本可能延长的PKA反应转化为短暂的局部PKA活动脉冲。而一些由cAMP的激活在几秒钟内发生(见图15-25),其他的则依赖于特定基因转录的变化,需要数小时才能完全发展。例如,在分泌肽激素生长抑素的细胞中,cAMP激活编码这种激素的基因。
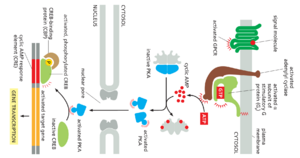
生长抑素基因的调节区包含一个短的顺式调节序列,称为环磷酸腺苷反应元件(CRE),它也存在于cAMP激活的许多其他基因的调节区中。一种称为CRE结合(CREB)蛋白的特定转录调节因子识别该序列。当PKA被cAMP激活时,它会在单个丝氨酸上磷酸化CREB;磷酸化的CREB然后招募一种称为CREB结合蛋白(CBP)的转录辅激活因子,从而刺激靶基因的转录(图15-28)。因此,CREB可以将短cAMP信号转化为细胞内的长期变化.
一些G蛋白通过磷脂传递信号
许多GPCR通过激活质膜结合酶磷脂酶C-β(PLCβ)的G蛋白发挥作用。表152列出了以这种方式激活的一些反应示例。磷脂酶作用于一种称为磷脂酰肌醇4,5-二磷酸酯[PI(4,5)P2]的磷酸化肌醇磷脂(一种磷酸肌醇),这种磷脂酰肌醇4,5-二磷酸酯[PI(4,5)P2]少量存在于质膜脂质双层的内半部分(图1529)。激活这种肌醇磷脂信号通路的受体主要通过一种称为Gq的G蛋白来实现,Gq激活磷脂酶C-β的方式与Gs激活腺苷酸环化酶的方式非常相似。然后,激活的磷脂酶裂解PI(4,5)P2生成两种产物:肌醇1,4,5-三磷酸酯(IP3)和二酰甘油。在此步骤中,信号通路IP3是一种水溶性分子,它离开质膜并通过细胞质扩散到内质网(ER),在那里它与ER膜中的IP3受体结合。IP3受体是一种大型跨膜Ca2+通道,在没有IP3的情况下会关闭。IP3结合会触发构象变化,从而暴露出高亲和力的Ca2+结合位点。尽管未受刺激的细胞中的细胞质Ca2+浓度较低(~107M),但足以促进Ca2+与某些IP3受体结合。IP3和Ca2+同时与IP3受体结合会打开受体Ca2+通道。储存在ER中的Ca2+被释放并与其他IP3结合受体结合,从而引起广泛的通道开放。因此,细胞浆Ca2+的浓度上升了10到20倍(图1530)。细胞浆Ca2+的增加通过影响Ca2+敏感的细胞内蛋白的活性来传播信号,正如我们稍后描述的。
在PI(4,5)P2水解产生的IP3增加细胞质中Ca2+浓度的同时,PI(4,5)P2的另一种裂解产物二酰甘油也发挥着不同的作用。它也充当第二信使,但它仍然嵌入质膜中,在那里它具有几种潜在的信号传导作用。它的主要功能之一是激活一种称为蛋白激酶C(PKC)的蛋白激酶,之所以这样命名是因为它依赖于Ca2+。IP3诱导的细胞质Ca2+的初始升高改变了PKC,使其从细胞质转移到质膜的细胞质面。在那里,它被Ca2+、二酰甘油和带负电荷的膜磷脂磷脂酰丝氨酸的组合激活(见图1530)。一旦被激活,PKC就会磷酸化因细胞类型而异的靶蛋白。原理与前面讨论的PKA相同,尽管大多数靶标蛋白不同。
二酰甘油可以进一步裂解以释放花生四烯酸,花生四烯酸可以作为信号本身,也可以用于合成其他称为二十烷酸的小脂质信号分子。大多数脊椎动物细胞类型都会产生二十烷酸,包括前列腺素,它们具有许多生物活性。例如,它们参与疼痛和炎症反应,许多抗炎药物(如阿司匹林、布洛芬和可的松)部分通过抑制它们的合成起作用。
Ca2+作为一种普遍存在的细胞内介质发挥作用
许多细胞外信号(不仅仅是通过G蛋白起作用的信号)都会引发细胞质Ca2+浓度的增加。在肌肉细胞中,Ca2+会引发收缩,在许多分泌细胞中,包括神经在细胞中,它会触发分泌。Ca2+在各种细胞类型中具有许多其他功能。Ca2+是一种非常有效的信号传导介质,因为它在细胞溶胶中的浓度通常非常低(~107M),而其在细胞外液(~103M)和ER[和肌肉中的肌浆网(SR)]腔中的浓度很高。因此,存在一个大的梯度,倾向于将Ca2+穿过质膜和ER或SR膜进入细胞溶胶。当信号暂时打开这些膜中的Ca2+通道时,Ca2+会冲入细胞溶胶,导致局部Ca2+浓度增加,从而激活细胞中的Ca2+反应蛋白。一些刺激,包括膜去极化、膜拉伸和某些细胞外信号,激活质膜中的Ca2+通道,导致Ca2+从细胞外流入。其他信号,包括前面描述的GPCR介导的信号,主要通过IP3受体起作用,刺激ER中的细胞内储存释放Ca2+(见图1530)。
内质网膜还含有第二种受调节的Ca2+通道,称为雷诺丁受体(之所以这样称呼,是因为它对植物碱雷诺丁敏感),该通道在Ca2+水平升高时打开,从而放大Ca2+信号。有几种机制可以快速终止Ca2+信号,并且还负责保持静息细胞中细胞质中Ca2+的浓度较低。最重要的是,质膜和内质网膜中有Ca2+泵,它们利用ATP水解的能量将Ca2+泵出细胞质。肌肉细胞和神经细胞等细胞大量使用Ca2+信号,它们的质膜中有一个额外的Ca2+转运体(Na+驱动的Ca2+交换体),可将Ca2+的流出与Na+的流入耦合。
ER膜的IP3受体和瑞安诺丁受体具有一个重要特征:它们都受到低至中等细胞质Ca2+浓度的刺激。这种Ca2+诱导的钙释放(CICR)会产生正反馈,这对Ca2+信号的性质有重大影响。这种反馈的重要性在使用Ca2+敏感荧光指示剂(例如水母发光蛋白或fura-2)的研究中清晰可见,这些指示剂使研究人员能够在显微镜下监测单个细胞中的细胞质Ca2+(图1531和电影15.4)。当携带Ca2+指示剂的细胞用少量细胞外信号分子处理时,这种信号分子会刺激细胞质IP3浓度略有增加,在细胞的一个或多个离散区域中可以看到微小的Ca2+爆发。这些Ca2+爆发或火花反映了内质网膜中少量IP3受体的局部开放,这些受体结合了IP3和Ca2+,但这些受体的浓度太低,无法与所有这些受体结合。由于各种Ca2+结合蛋白和Ca2+泵限制了Ca2+的扩散,因此Ca2+信号通常仍局限于Ca2+进入细胞质的部位。但是,如果细胞外信号较强,IP3会升至更高的浓度并与其许多受体结合,尽管低Ca2+浓度仍会在一定程度上限制这些受体的激活。尽管如此,局部爆发的Ca2+释放现在可以更容易地传播到邻近的IP3结合受体并激活它们,从而产生Ca2+释放的再生波,该波穿过细胞质(图1532),就像动作电位沿轴突膜扩散一样(见图1133)。内质网膜中Ca2+刺激的雷诺丁受体的存在进一步增强了正反馈。除了受正反馈调节外,IP3受体和瑞安诺定受体还受负反馈调节,因为它们受到高Ca2+浓度的抑制。因此,受刺激细胞中Ca2+的升高最终导致Ca2+释放的抑制。由于Ca2+泵移除了Ca2+,细胞质中的Ca2+浓度下降(见图1532)。Ca2+的下降最终缓解了负反馈,使细胞质Ca2+再次上升。
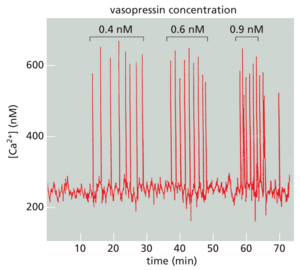
与其他延迟负反馈的情况一样(见图1519),这一系列事件导致Ca2+浓度波动,只要细胞表面受体被激活,这种波动就会持续。振荡频率反映了细胞外刺激的强度(图1533)。振荡频率和振幅可以还可以通过其他信号机制进行调节,例如磷酸化,这会影响Ca2+通道的Ca2+敏感性或Ca2+振荡的频率可以转化为频率依赖性细胞反应。在某些情况下,频率依赖性反应本身也是振荡的:例如,在分泌激素的垂体细胞中,细胞外信号的刺激会诱发重复的Ca2+尖峰,每个尖峰都与激素分泌的爆发有关。在其他情况下,频率依赖性响应是非振荡性的:例如,在某些类型的细胞中,一种频率的Ca2+尖峰激活一组基因的转录,而更高的频率激活另一组基因的转录。
细胞如何感知Ca2+尖峰的频率并相应地改变其反应?该机制可能取决于Ca2+敏感蛋白,这些蛋白根据Ca2+尖峰频率改变其活性。充当分子记忆装置的蛋白激酶似乎具有这种非凡的特性,我们将在下文中讨论。
Ca2+/CaM依赖性蛋白激酶介导许多不同的Ca2+相应
多种多样的C2+结合蛋白有助于传递细胞质Ca2+信号。最重要的是CaM,它存在于所有真核细胞中,可占细胞总蛋白质质量的1%。CaM是一种多功能细胞内Ca2+受体,控制许多Ca2+调节过程。
它由高度保守的单多肽链组成,具有四个高亲和力的Ca2+结合位点(图15-34A)。当它与Ca2+结合时,会发生激活构象变化。由于CaM必须结合两个或更多个Ca2+离子才能采用其活性构象,因此该蛋白质对Ca2+浓度的增加表现出S形反应(见图15-17)。
Ca2+对CaM的变构激活类似于环磷酸腺苷对PKA的激活,不同之处在于活性Ca2+/CaM复合物本身不具有酶活性,而是通过结合并激活其他蛋白质起作用。在某些情况下,CaM充当酶复合物的永久调节亚基,但通常Ca2+的结合使CaM能够与细胞中的各种靶蛋白结合以改变其活性。
当Ca2+/CaM与其靶蛋白结合时,CaM会进一步改变其构象,其性质取决于特定的靶蛋白(图1534B)。CaM调节的众多靶标包括酶和膜转运蛋白。例如,Ca2+/CaM结合并激活质膜Ca2+泵,该泵利用ATP水解将Ca2+泵出细胞。因此,每当细胞质中的Ca2+浓度升高时,泵就会被激活,这有助于将细胞质Ca2+水平恢复到静息水平。
然而,Ca2+的许多作用是更为间接的,并且是由一类称为Ca2+/CaM依赖性激酶(CaM-kinases)的蛋白激酶家族催化的蛋白质磷酸化介导的。一些CaM激酶磷酸化转录调节剂,例如CREB蛋白(见图1528),并以这种方式激活或抑制特定基因转录。
研究最深入的CaM激酶之一是CaM激酶II,它存在于大多数动物细胞中,但在神经系统中尤其丰富。它占大脑某些区域总蛋白质质量的2%,并且在突触中高度集中。CaM-激酶II具有几个显着的特性。首先,它具有壮观的四级结构:12个酶拷贝组装成一对堆叠的环,外部的激酶结构域连接到中央枢纽(图1535)。这种结构有助于酶发挥图1535CaM-激酶II的逐步激活作用。(A)每个CaM-激酶II蛋白都有两个主要结构域:氨基末端激酶结构域(绿色)和羧基末端枢纽结构域(蓝色),由调节片段连接。六个CaM-激酶II蛋白组装成一个巨大的环,其中枢纽结构域紧密相互作用以产生被激酶结构域包围的中央结构。完整的酶包含两个堆叠的环,总共12个激酶蛋白,但为了清晰起见,这里只显示一个环。当酶不活跃时,环处于两种状态之间的动态平衡中。第一个(左上)是紧凑状态,其中激酶结构域与枢纽结构域相互作用,因此调节片段被埋在激酶活性位点中,从而阻止催化活性。在第二nd非活性状态(中上),激酶结构域弹出并通过其调节片段与其中心结构域相连,该调节片段继续抑制激酶结构域,但现在Ca2+/CaM可访问。如果存在,Ca2+/CaM将结合调节片段并阻止其抑制激酶,从而将激酶锁定在活性状态(右上)。如果相邻的激酶结构域也从中心弹出,它也将被Ca2+/CaM激活,然后两个激酶结构域将在其调节片段上相互磷酸化(右下)。这种自身磷酸化进一步激活酶。它还以两种方式延长酶的活性。首先,它捕获结合的Ca2+/CaM,使其不会与酶分离,直到细胞浆Ca2+水平至少10秒后恢复到基础值(未显示)。其次,它将酶转化为Ca2+非依赖性
形式,这样即使Ca2+/CaM与其分离后,激酶仍保持活性(左下)。这种活性持续到
蛋白磷酸酶的作用超过CaM-激酶II的自磷酸化活性。(B)该酶模型基于x射线晶体学
酶的显著十二聚体结构使其能够响应不同的Ca2+
振荡频率实现广泛的中间活性状态:更高的频率往往会导致酶中更多的亚基达到磷酸化活性状态(见图1536)。
CaM-激酶II的行为也受激酶和枢纽域之间连接片段长度的控制。在酶的某些同工型中,连接片段较长;在这些同工型中,激酶域往往更频繁地从环中弹出,使其对Ca2+更敏感。这些
和其他机制允许细胞根据不同类型神经元的需求调整酶的响应性。(A,改编自L.H.Chao
等人,Cell146:732745,2011;B,PDB代码:3SOA。)
MBOC7_ptr_ch15_873-948.indd903MBOC7_ptr_ch15_873-948.indd90308/12/2112:23PM08/12/2112:23PM
分子记忆装置,在暴露于Ca2+/
CaM时切换到活性状态,然后在Ca2+信号衰减后仍保持活性。
这是因为当Ca2+/CaM激活相邻的激酶亚基时,它们可以相互磷酸化(称为自身磷酸化的过程)(图1535)。一旦激酶亚基被自身磷酸化,它即使在没有Ca2+的情况下也会保持活性,从而延长激酶活性的持续时间,超过初始激活Ca2+信号的持续时间。酶保持这种活性,直到蛋白磷酸酶去除自身磷酸化并关闭激酶。CaM-激酶II激活可以作为先前Ca2+脉冲的记忆痕迹,它似乎在脊椎动物大脑的某些类型的记忆和学习中发挥作用。缺乏大脑特异性酶的突变小鼠在记住事物位置的能力方面存在特定缺陷。CaM-kinaseII的另一个显著特性是,该酶可以使用其内在记忆机制来解码Ca2+振荡的频率。当CaM-kinaseII暴露于蛋白磷酸酶和重复的Ca2+/CaM脉冲(频率不同,模拟受刺激细胞中观察到的频率)时,酶活性会随着脉冲频率的增加而急剧增加(图15-36)。这种特性被认为在神经细胞突触中尤为重要,突触后细胞中由于神经活动而导致的细胞内Ca2+水平的变化会导致该突触后续有效性的长期变化(第11章讨论)。G蛋白的作用不仅仅是调节膜结合酶的活性,这些酶会改变细胞溶胶中环磷酸腺苷或Ca2+的浓度。例如,一种G蛋白(称为G12)的
a亚基可激活鸟嘌呤核苷酸交换因子,该因子可激活Rho家族的单体GTPase(稍后和第16章中讨论),从而调节肌动蛋白细胞骨架。
在其他一些情况下,G蛋白直接激活或灭活靶细胞质膜中的离子通道,从而改变膜的离子通透性,从而改变其电兴奋性。例如,迷走神经释放的乙酰胆碱会降低心率(见图15-5B)。这种效果是由一类特殊的乙酰胆碱受体介导的,这些受体可激活前面讨论过的
Gi蛋白。一旦被激活,Gi的
a亚基就会抑制腺苷酸环化酶(如前所述),而β?亚基与心肌细胞质膜上的K+通道结合并打开它们。这些K+通道的打开使得细胞更难去极化,从而有助于抑制乙酰胆碱对心脏的影响。(这些乙酰胆碱
受体可被真菌生物碱毒蕈碱激活,被称为
(A)低频Ca2+振荡(B)高频Ca2+振荡
MBOC7_ptr_ch15_873-948.indd904MBOC7_ptr_ch15_873-948.indd90408/12/2112:23PM08/12/2112:23PM
904第15章:细胞信号传导905通过G蛋白偶联受体进行信号传导
毒蕈碱乙酰胆碱受体,以将其与非常不同的
烟碱乙酰胆碱受体区分开来,后者是骨骼肌和神经细胞上的离子通道偶联受体,可被尼古丁的结合,因为
其他G蛋白以不太直接的方式调节离子通道的活性,要么通过
刺激通道磷酸化(例如通过PKA、PKC或CaM-激酶)
或通过引起直接激活或灭活离子通道的环核苷酸的产生或破坏。这些环核苷酸门控离子通道在嗅觉和视觉中都起着至关重要的作用,正如我们现在讨论的那样。
嗅觉和视觉依赖于调节离子通道的GPCR
人类可以区分10,000多种不同的气味,它们使用鼻腔内壁中专门的嗅觉受体神经元来检测这些气味。这些细胞
使用称为嗅觉受体的特定GPCR来识别气味;这些受体
显示在从每个嗅觉神经元延伸出的改良纤毛的表面上(图1537)。受体通过增加cAMP起作用;当受到气味结合的刺激时,它们会激活嗅觉特异性G蛋白(称为Golf),进而激活腺苷酸环化酶。由此导致的cAMP增加会打开环磷酸腺苷门控阳离子通道,从而允许Na+流入,Na+会使嗅觉受体神经元的质膜去极化并启动神经冲动,该神经冲动沿其轴突传递到大脑。小鼠中有大约1000种不同的嗅觉受体,人类中有大约350种,每种受体都由不同的基因编码,并且每种受体都识别不同的气味。每个嗅觉受体神经元只产生其中一种受体;神经元通过其显示的特定受体对一组特定的气味作出反应,每种气味都会激活其自己的一组特征嗅觉受体神经元。同一受体还有助于将每个正在发育的嗅觉神经元的伸长轴突引导到大脑中它将与之连接的特定目标神经元。在某些脊椎动物中,不同的GPCR组以类似的方式起作用,以介导对信息素的反应,信息素是在鼻子的不同部位检测到的化学信号,用于同一物种成员之间的交流。然而,人们认为人类缺乏功能性信息素受体。脊椎动物的视觉采用类似的复杂、高度敏感的信号检测机制,该机制使用环核苷酸门控阳离子通道,但关键的环核苷酸是环鸟苷酸(图1538)而不是cAMP。与cAMP一样,持续快速合成(由鸟苷酸环化酶)和快速降解(由环鸟苷酸磷酸二酯酶)控制环鸟苷酸的浓度。然而,该系统中光激活的GPCR不会刺激鸟苷酸环化酶并提高环鸟苷酸水平;相反,它会刺激环鸟苷酸磷酸二酯酶,导致环鸟苷酸水平降低,从而减少阳离子通道开放。
视觉信号系统在脊椎动物视网膜的视杆光感受器(视杆)中得到了特别深入的研究。视杆负责昏暗光线下的非彩色视觉,而视锥光感受器(视锥细胞)负责明亮光线下的彩色视觉。两种类型的光感受器都是高度特化的细胞,具有外节和内节、细胞体和突触区域,光感受器在该突触区域将化学信号传递给视网膜神经元(图1539)。在视网膜神经元网络处理信号后,神经元子集的轴突会传递化学信号,从而产生光传导装置,该装置位于视杆的外节中,其中包含一堆圆盘,每个圆盘由一个封闭的膜囊形成,该膜囊中密集地填充着一种称为视紫红质的光敏GPCR。围绕外节的质膜包含环鸟苷酸门控阳离子通道。与这些通道结合的环鸟苷酸使它们在黑暗中保持开放。光诱导的视紫红质分子在视盘膜中的激活会降低细胞浆环磷酸鸟苷浓度并关闭质膜中的阳离子通道(图15-40)。因此,光会引起超极化(第11章中讨论的更负的膜电位),从而抑制视紫红质是GPCR家族的成员,但激活它的细胞外信号不是分子而是光子。每个视紫红质分子ecule
含有共价连接的发色团11-顺式视黄醛,当它吸收单个光子时,几乎立即异构化为全反式视黄醛。
异构化改变了视黄醛的形状,迫使视紫红质蛋白质发生构象变化。激活的视紫红质分子随后改变G蛋白转导蛋白(Gt)的构象,导致转导蛋白a亚单位激活环鸟苷酸磷酸二酯酶。然后磷酸二酯酶
水解细胞溶质环鸟苷酸,导致其浓度下降。结果,
与质膜阳离子通道结合的环鸟苷酸的数量减少,从而允许更多这些通道关闭。这样,信号
就从视盘膜快速传递到质膜,光
信号通过视杆细胞的超极化转换为电信号。视杆细胞使用几个负反馈回路,使细胞在闪光后迅速恢复到静止的黑暗状态——这是感知闪光短暂性的必要条件。一种称为视紫红质激酶(RK)的视紫红质特异性蛋白激酶使活化视紫红质的胞浆尾部在多个丝氨酸上磷酸化,部分抑制视紫红质激活传导蛋白的能力。然后,一种称为抑制蛋白(arrestin)的抑制蛋白(稍后讨论)与磷酸化的视紫红质结合,进一步抑制视紫红质的活性。携带RK基因突变的小鼠或人类的视紫红质活性会延长。在抑制蛋白关闭视紫红质的同时,RGS蛋白(前面讨论过)与激活的传导蛋白结合,刺激传导蛋白将其结合的GTP水解为GDP,从而使传导蛋白恢复到非活性状态。此外,响应光线而关闭的阳离子通道对Ca2+和Na+均具有渗透性,因此当它们关闭时,Ca2+的正常流入会受到抑制,导致细胞质中的Ca2+浓度下降。Ca2+浓度的降低会刺激鸟苷酸环化酶补充环GMP,使其水平迅速恢复到打开光线之前的水平。一种特定的Ca2+敏感蛋白
介导鸟苷酸环化酶的激活,以响应Ca2+水平的下降。与CaM相反,这种蛋白质在Ca2+与其结合时不活跃,而在无Ca2+时活跃。因此,当Ca2+水平在
之后下降时,它会刺激环化酶。
负反馈机制的作用不仅仅是在瞬时闪光后使视杆细胞恢复到静止状态;它们还通过降低视杆细胞持续暴露在光线下时的反应来帮助视杆细胞适应。正如我们之前讨论的那样,适应使受体细胞能够作为敏感的刺激强度变化检测器,在刺激的基线水平范围内变化范围非常广。
这就是为什么我们可以在黑暗的天空中看到微弱的星星,或在明亮的阳光下看到相机闪光的原因。
我们在本章中讨论的各种异三聚体G蛋白分为四个主要家族,如表153中总结的那样。
MBOC7_ptr_ch15_873-948.indd906MBOC7_ptr_ch15_873-948.indd90608/12/2112:23PM08/12/2112:23PM
906第15章:细胞信号传导907通过G蛋白偶联受体进行信号传导
表153四个主要的异三聚体G蛋白家族*
*家族由a亚基的氨基酸序列相关性决定。仅包括选定的
示例。大约20个a亚基和至少6个ß亚基和11个?亚基具有
MBOC7_ptr_ch15_873-948.indd907MBOC7_ptr_ch15_873-948.indd90708/12/2112:23PM08/12/2112:23PM
一氧化氮气体可以介导细胞间信号传导
环核苷酸和Ca2+等小信号分子是亲水性小分子,它们在产生的细胞内起作用。然而,一些小信号分子的疏水性足以穿过质膜,从而影响附近的细胞。一个重要而显著的例子是气体一氧化氮(NO),它在动物的许多组织中充当信号分子-在哺乳动物中,NO的众多功能之一是放松血管壁中的平滑肌。神经递质乙酰胆碱通过激活血管内壁内皮细胞膜上的GPCR来刺激NO合成。激活的受体触发IP3合成和Ca2+释放(见图15-30),从而刺激合成NO的酶。由于溶解的NO很容易穿过膜,它会从产生它的细胞中扩散到邻近的平滑肌细胞中,在那里它会引起肌肉松弛,从而导致血管扩张(图15-41)。它只在局部起作用,因为它在细胞外空间的半衰期很短,约为5-10秒,之后氧气和水会将其转化为硝酸盐和亚硝酸盐。NO对血管的影响提供了一个解释硝酸甘油的作用机制,约100年来一直用于治疗心绞痛(因心肌供血不足而引起的疼痛)。硝酸甘油转化为NO,可放松血管。这减少了心脏的工作负荷,从而减少了氧气。NO由氨基酸精氨酸脱氨生成,由称为NO合酶(NOS)的酶催化;见图1541。内皮细胞中的NOS称为eNOS,而神经和肌肉细胞中的NOS称为nNOS。eNOS和nNOS均受细胞溶质Ca2+增加的刺激。相比之下,巨噬细胞又会产生另一种NOS,称为诱导型NOS(iNOS),这种NOS具有组成活性,但仅在细胞被激活时才会合成,通常是在细胞应答过程中。在某些靶细胞(包括平滑肌细胞)中,NO可逆地与鸟苷酸环化酶活性位点的铁结合,从而刺激环磷酸鸟苷的合成。NO
MBOC7_ptr_ch15_873-948.indd908MBOC7_ptr_ch15_873-948.indd90808/12/2112:23PM08/12/2112:23PM
908第15章:细胞信号传导909通过G蛋白偶联受体进行信号传导
可以在几秒钟内增加细胞溶胶中的环GMP,因为
环GMP的正常周转率很高:磷酸二酯酶快速降解为GMP
不断平衡鸟苷酸环化酶产生的环GMP。伟哥及其类似药物可抑制阴茎中的环鸟苷酸磷酸二酯酶,从而延长局部神经末梢诱导NO产生后阴茎血管平滑肌细胞中环鸟苷酸水平升高的时间。而环鸟苷酸又可使血管松弛,从而使阴茎勃起。NO还可以独立于环鸟苷酸向细胞发出信号。例如,它可以通过共价硝化蛋白质中特定半胱氨酸上的硫醇(SH)基团来改变细胞内蛋白质的活性。第二信使和酶级联放大信号尽管分子细节存在差异,但GPCR触发的不同细胞内信号通路具有某些共同的特征和一般原理。它们依赖于细胞内信号蛋白和第二信使的中继链。这些中继链为放大对细胞外信号的响应提供了大量机会。例如,在视杆细胞视觉传导级联中,单个激活的视紫红质分子每秒可催化约500个传导蛋白分子的激活。每个激活的传导蛋白分子激活一个环鸟苷酸磷酸二酯酶分子,导致超过105个环鸟苷酸分子水解。环鸟苷酸浓度的下降反过来又暂时关闭了质膜中的数百个阳离子通道(图1542)。因此,视杆细胞甚至可以对单个光子做出反应,其时间和幅度具有高度可重复性。同样,当细胞外信号分子与通过Gs间接激活腺苷酸环化酶的受体结合时,每个受体蛋白可能激活许多Gs蛋白分子,每个Gs蛋白分子都可以激活一个环化酶分子。反过来,每个环化酶分子又可以催化大量ATP分子转化为cAMP分子。类似的放大作用在IP3信号通路中起作用。通过这些方式,细胞外信号浓度的纳摩尔(10-9M)变化可以诱导第二信使(如cAMP或Ca2+)浓度的微摩尔(10-6M)变化。由于这些信使
起着变构效应物的作用,可以激活特定的酶或离子通道,因此单个细胞外信号分子可以改变数千个蛋白质分子
在与嗅觉和视觉有关的信号系统中,任何刺激信号的放大级联都需要在级联的每一步都有平衡机制,以便在刺激停止时将系统恢复到静止状态。如前所述,只有当失活机制也快速时,这些系统对刺激的反应才能快速。因此,细胞具有有效的机制来快速降解(和重新合成)环状核苷酸并缓冲和去除细胞浆Ca2+,以及在激活后使响应酶和离子通道失活。这不仅对于关闭响应至关重要,而且对于建立信号中继链中的每个蛋白质都可以成为单独的调节目标,包括受体本身,如下所述。
GPCR脱敏取决于受体磷酸化
如前所述,当靶细胞长时间暴露于细胞外信号时,它们可以通过几种不同的方式脱敏或适应。一类重要的适应适应机制取决于受体分子本身的数量或状态的改变。
对于GPCR,有三种一般的适应模式,均以受体失活为中心(见图15-21C、D和E):(1)在受体失活时,它们发生改变,因此它们不再能与G蛋白相互作用。
(2)在受体隔离中,它们暂时移动到细胞内部(内化),因此它们不再能够接触其配体。(3)在受体破坏中,它们在内化后在溶酶体中被破坏。在每种情况下,
GPCR的脱敏取决于PKA、PKC或GPCR激酶家族(GRK)成员对它们的磷酸化,其中包括前面讨论过的参与杆状光感受器脱敏的视紫红质激酶。
GRK磷酸化GPCR上的多个丝氨酸和苏氨酸,但它们仅在配体结合激活受体后才会这样做,因为是激活的受体变构激活了GRK。与视紫红质一样,一旦受体被GRK磷酸化,它就会以高亲和力与
结合的抑制蛋白至少可以通过两种方式促进脱敏过程。首先,它阻止激活的受体与G蛋白相互作用。其次,它充当衔接蛋白,帮助将受体与网格蛋白依赖性内吞机制(第13章讨论)偶联,诱导受体介导的内吞作用。内化的GPCR-arrestin复合物的命运取决于复合物中的其他蛋白质。在某些情况下,内化的受体被去磷酸化并再循环回质膜进行受体内吞作用不一定会阻止受体发出信号。在某些情况下,结合的抑制蛋白会招募其他信号蛋白,将信号从内化的GPCR沿着新途径传递出去。GPCR可以通过G蛋白间接激活或灭活质膜结合酶或离子通道。当激活的受体刺激G蛋白时,G蛋白会发生构象变化,从而激活其a亚基,从而触发bg复合物的释放。任何一种成分都可以直接调节质膜中靶蛋白的活性。一些GPCR激活或灭活腺苷酸环化酶,从而改变第二信使环磷酸腺苷的细胞内浓度。其他GPCR激活磷酸肌醇特异性磷脂酶C(PLCb),产生两种第二信使。一种是肌醇1,4,5-三磷酸(IP3),它从ER中释放Ca2+,从而增加细胞溶胶中Ca2+的浓度。另一种是二酰甘油,它留在质膜中并有助于激活蛋白激酶C(PKC)。胞浆环磷酸腺苷或Ca2+水平的增加主要通过刺激cAMP依赖性蛋白激酶(PKA)和Ca2+/CaM依赖性激酶PKC、PKA和CaM激酶磷酸化特定靶蛋白并从而改变蛋白质的活性来影响细胞。每种类型的细胞都有自己特有的靶蛋白集,这些靶蛋白以这些方式进行调节,使细胞能够制造自己的图1543GPCR激酶(GRK)和抑制蛋白在GPCR脱敏中的作用。GRK仅磷酸化激活的受体,因为激活的GPCR会打开GRK。抑制蛋白与磷酸化受体的结合会阻止受体与其G蛋白结合,并指导其内吞作用(未显示)。例如,缺乏一种形式的抑制蛋白的小鼠无法对吗啡脱敏,这证明了抑制蛋白的重要性
MBOC7_ptr_ch15_873-948.indd910MBOC7_ptr_ch15_873-948.indd91008/12/2112:23PM08/12/2112:23PM
910第15章:细胞信号传导911通过酶偶联受体进行信号传导
对第二信使的独特反应。GPCR激活的细胞内信号传导级联大大放大了反应,因此,每与受体结合一个细胞外信号传导配体分子,就会改变数千个靶蛋白分子。当细胞外信号被移除时,GPCR介导的反应会迅速关闭,而激活的GPCR会被磷酸化灭活。
与GPCR一样,酶偶联受体是跨膜蛋白,其配体结合域位于质膜的外表面。然而,它们的胞质域并不具有与异三聚体G蛋白结合的胞质域,而是具有内在酶活性或直接与酶结合。GPCR有七个跨膜片段,而酶偶联受体的每个亚基通常只有一个。GPCR和酶偶联受体偶联受体通常会激活一些相同的信号通路。在本节中,我们将描述酶偶联受体信号传导的一些重要特征,重点介绍这些蛋白质中最常见的一类,即活化受体酪氨酸激酶(RTK)磷酸化许多细胞外信号蛋白通过受体酪氨酸激酶(RTK)起作用。这些包括许多分泌和细胞表面结合蛋白,它们控制发育和成年动物的细胞行为。其中一些信号蛋白及其大约有60种人类RTK,可分为大约20个结构亚家族,每个亚家族都专门用于其互补的蛋白质配体家族。图1544显示了在哺乳动物中起作用的许多家族的基本结构特征。在所有情况下,信号蛋白与受体胞外侧的配体结合域的结合会激活胞质侧的酪氨酸激酶域。这会导致酪氨酸磷酸化
表154一些通过RTK起作用的胞外信号蛋白
信号蛋白家族受体家族一些代表性反应
表皮生长因子(EGF)EGF受体刺激各种细胞类型的细胞存活、生长、增殖或分化;在发育过程中充当诱导信号
胰岛素胰岛素受体刺激碳水化合物的利用和蛋白质的合成
胰岛素样生长因子(IGF1)IGF受体-1刺激多种细胞类型的细胞生长和存活
神经生长因子(NGF)Trk受体刺激某些神经元的存活和生长
血小板衍生生长因子(PDGF)PDGF受体刺激存活、生长、增殖和迁移
MCSF受体刺激单核细胞/巨噬细胞增殖和
成纤维细胞生长因子(FGF)FGF受体刺激各种细胞类型的增殖;抑制
某些前体细胞的分化;充当诱导信号
血管内皮生长因子(VEGF)VEGF受体刺激血管生成
EphrinEph受体刺激血管生成;引导细胞和轴突迁移
MBOC7_ptr_ch15_873-948.indd911MBOC7_ptr_ch15_873-948.indd91108/12/2112:23PM08/12/2112:23PM
受体胞质部分的侧链,为传递信号的各种胞内信号蛋白创建磷酸酪氨酸对接位点。
胞外配体的结合如何激活质膜另一侧的激酶结构域?对于GPCR,配体结合被认为会改变几个跨膜α螺旋的相对方向,从而改变胞质环相对于彼此的位置。然而,构象变化不太可能通过单个跨膜螺旋传播到脂质双层。相反,RTK激活机制取决于配体刺激的两个受体相互作用的变化,将两个胞质激酶结构域结合在一起,从而促进RTK的胞质激酶结构域二聚化并通过多种机制激活。在许多情况下,例如血小板衍生生长的受体
图1545通过二聚化激活RTK。在缺乏细胞外信号的情况下,许多RTK以单聚体形式存在,其中内部激酶域保持活性。结合配体并将两个单聚体结合在一起形成二聚体。二聚体中的紧密接近导致两个激酶域互相阻止磷酸化,从而产生了两种效应。首先,激酶结构域中部分酪氨酸的磷酸化促进了结构域的完全活化。第二,受体基因其他部分的酪氨酸发生磷酸化,与细胞内信号蛋白的对接位点结合,形成大量的信号复合物,能够然后通过多条信号路径广播信号。
不同RTK家族成员的激活机制各不相同。在某些情况下(如此处所示),团体本身就是一个二元体并带来
两个受体通过结合在一起同时地。在其他情况下,两个配体可以独立地结合两个受体启动子受体。
二聚化。一些RTK通常以二聚体形式存在(见图15-44),并且配体和结合可能发生结构改变,使两个内部激酶域靠得更近。尽管此处显示许多RTK是通过自动磷酸化装置重新激活的,但仍有一些重要的因素
例外情况,包括图1546中所示的EGF受体。
已标明亚科。请注意,有些
案例中,酪氨酸激酶领域是
折叠后出现的额外片段
和纤连蛋白型III型结构域
表154中列出了受体,
与一些代表一起tativeresonses
MBOC7_ptr_ch15_873-948.indd912MBOC7_ptr_ch15_873-948.indd91208/12/2112:23PM08/12/2112:23PM
912第15章:细胞信号传导913通过酶偶联受体进行信号传导
因子(PDGF),外部受体结构域的二聚化只是使两个激酶结构域以稳定的方向彼此靠近,从而使它们能够在激酶活性位点的特定酪氨酸上相互磷酸化,从而促进构象变化,完全激活两个激酶结构域。一些RTK,包括胰岛素受体,在没有配体的情况下以二聚体的形式存在(见图1544),并且配体结合重新定向细胞外结构域,使内部激酶结构域处于更近的位置以促进激酶活化。在其他情况下,例如表皮生长因子(EGF)的受体,激酶不是通过磷酸化激活的,而是由两个激酶结构域在其活性位点之外相互作用引起的构象变化激活的(图1546)。
磷酸化RTK上的酪氨酸作为对接位点
一旦RTK二聚体的激酶结构域被激活,它们就会磷酸化受体胞质部分的多个额外位点,通常是在激酶结构域外的无序区域(见图1545)。这种磷酸化为特定的细胞内信号蛋白创建了高亲和力的对接位点。每个信号蛋白都与激活受体上的特定磷酸化位点结合,因为它含有特定的磷酸酪氨酸结合域,除了识别多肽链周围的特征外,还识别磷酸酪氨酸。
一旦与激活的RTK结合,信号蛋白可能在酪氨酸上发生磷酸化,从而被激活。然而,在许多情况下,仅结合就足以激活对接的信号蛋白,通过诱导构象变化受体磷酸化可以作为触发细胞内信号复合物组装的开关,然后信号复合物可以沿着多条路径将信号传递到细胞内的各种目的地。由于不同的RTK结合这些信号的不同组合,一些RTK使用额外的对接蛋白来扩大激活受体处的信号复合物。例如,胰岛素受体信号传导依赖于一种称为胰岛素受体底物-1(IRS1)的特殊衔接蛋白。IRS1与活化受体上的特定磷酸化酪氨酸结合,然后在多个位点磷酸化,从而产生比受体单独容纳的更多的对接位点(见图1511)。
具有SH2结构域的蛋白质与磷酸化的酪氨酸结合
A各种细胞内信号传导蛋白都能与活化RTK(或对接蛋白,如IRS1)上的磷酸酪氨酸结合。它们有助于将信号向前传递,主要通过由模块化相互作用域介导的蛋白质相互作用链,如前所述(见图15-11)。一些对接的蛋白质是酶,例如磷脂酶C-g(PLCg),
其功能与磷脂酶C-ß相同激活肌醇
MBOC7_ptr_ch15_873-948.indd913MBOC7_ptr_ch15_873-948.indd91308/12/2112:23PM08/12/2112:23PM
讨论磷脂信号通路早期与GPCR结合(见图1529和1530)。通过此途径,RTK可以增加细胞浆Ca2+水平并激活PKC。另一种停靠在这些受体上的酶是细胞质酪氨酸激酶Src,它可以磷酸化酪氨酸上的其他信号蛋白(第3章讨论)。还有一种是磷酸肌醇3-激酶(PI3-激酶),它可以磷酸化脂质而不是蛋白质;正如我们稍后讨论的那样,磷酸化的脂质随后作为停靠位点来吸引各种与磷酸酪氨酸结合的细胞内信号蛋白具有多种结构和功能。然而,它们通常共享高度保守的磷酸酪氨酸结合域,可以是SH2域(用于Src同源性2)或不太常见的PTB域(用于磷酸酪氨酸结合)。通过识别特定的磷酸化酪氨酸,这些小相互作用结构域使包含它们的蛋白质能够与活化的RTK以及许多其他在酪氨酸上被暂时磷酸化的细胞内信号传导蛋白结合(图1547)。许多信号传导蛋白还含有其他相互作用结构域,使它们能够作为信号传导过程的一部分与其他蛋白质特异性相互作用。这些结构域包括SH3结构域,它与细胞内蛋白质中富含脯氨酸的基序结合(见图1511和1512)。并非所有通过SH2结构域与活化的RTK结合的蛋白质都有助于将信号传递下去。有些蛋白质会减少信号传导过程,提供负反馈。一个例子是c-Cbl蛋白,它可以停靠在某些激活的受体上并催化其泛素化,将一个或多个泛素分子共价添加到受体上的特定位点。这促进了溶酶体中受体的内吞作用和降解——受体破坏的一个例子(见图15-21E)。含有泛素相互作用基序的内吞蛋白
MBOC7_ptr_ch15_873-948.indd914MBOC7_ptr_ch15_873-948.indd91408/12/2112:23PM08/12/2112:23PM
914第15章:细胞信号传导915通过酶偶联受体进行信号传导
(UIM)识别泛素化的RTK并将它们引导到网格蛋白包被的囊泡中,最终进入溶酶体(第13章讨论)。使c-Cbl依赖性RTK下调失活的突变会导致RTK信号传导延长
与GPCR的情况一样,配体诱导的RTK内吞作用并不总是会减少信号传导。在某些情况下,激活的RTK会与其结合的信号蛋白一起内吞,并继续从内体或其他细胞内区室发出信号。例如,这种机制允许神经生长因子(NGF)结合到长神经细胞轴突末端的特定RTK(称为TrkA)上,并向远处的同一细胞的细胞体发出信号。含有激活的TrkA的信号内吞囊泡,NGF结合在腔侧,信号蛋白停靠在胞浆侧,沿着轴突运输到细胞体,在那里它们向细胞发出信号以求生存。
一些信号蛋白几乎完全由SH2和SH3
结构域组成,并作为衔接子将酪氨酸磷酸化蛋白与没有自己的SH2结构域的其他蛋白偶联(见图1511和
1512)。这种类型的衔接蛋白有助于将激活的RTK与重要的信号蛋白Ras偶联,Ras是一种单体GTPase,反过来,它可以激活各种
单体GTPaseRas介导大多数RTK的信号传导
Ras超家族由各种单体GTPase家族组成,但只有
Ras和Rho家族传递来自细胞表面受体的信号(表155)。通过与不同的细胞内信号传导蛋白相互作用,单个Ras或Rho家族成员可以协调地沿着几个不同的下游信号传导途径传播信号。人类有三种主要的、密切相关的Ras蛋白:H-、K-和N-Ras(见表155)。虽然它们的功能略有不同,但它们被认为以相同的方式工作,我们将它们简称为Ras。与许多单体GTPase一样,Ras含有一个或多个共价连接的脂质基团,有助于将蛋白质锚定到质膜的细胞质表面,从那里它将信号传递到细胞的其他部分。例如,当RTK向细胞核发出信号以刺激细胞增殖或分化时,Ras通常是必需的,这两者都需要基因表达的变化。如果Ras功能被各种实验方法抑制,则通常由激活的RTK诱导的细胞增殖或分化反应不会发生。相反,
表155单体GTPase的Ras超家族
Rho*Rho、Rac、Cdc42将信号从表面受体传递到
ARF*ARF1ARF6调节蛋白质外壳的组装
Rab*Rab160调节细胞内囊泡运输
*第16章讨论了Rho家族,第13章讨论了ARF和Rab蛋白,第12章讨论了Ran和17.Ras的三维结构如图364所示。
MBOC7_ptr_ch15_873-948.indd915MBOC7_ptr_ch15_873-948.indd91508/12/2112:23PM08/12/2112:23PM
30%的人类肿瘤表达Ras的高活性突变形式,这导致癌细胞不受控制地增殖。
与其他GTP结合蛋白一样,Ras起着分子开关的作用,在两种不同的构象状态之间循环-当GTP结合时处于活性状态,当GDP结合时处于非活性状态(电影15.7)。如前所述,对于单体GTPases,两类信号蛋白通过影响其在活性和非活性状态之间的转换来调节Ras活性(见图158)。Ras
鸟嘌呤核苷酸交换因子(RasGEFs)刺激GDP的解离
以及随后GTP从细胞质的结合,从而激活Ras。Ras
GTPase活化蛋白(RasGAPs)增加Ras水解结合
GTP的速率,从而使Ras失活。Ras的高活性突变形式对RasGAPs具有抗性,因此被锁定在GTP结合的活性状态,即
RTKs通常如何激活Ras?原则上,它们可以激活
RasGEF或抑制RasGAP。即使一些GAP直接(通过其
SH2结构域)与活化的RTKs结合(参见图1547A),但正是活化受体与RasGEF的间接耦合驱动Ras进入其活性状态。RasGEF的功能丧失与Ras本身的功能丧失具有类似的效果。
其他Ras超家族蛋白(包括Rho家族蛋白)的激活也通过GEF的激活而发生。特定的GEF决定GTPase在哪个膜上被激活,并且通过充当支架,它还可以决定GTPase激活哪些下游蛋白。
介导RTK激活Ras的GEF是在果蝇眼睛发育的遗传研究中发现的,其中一种称为Sevenless(Sev)的RTK是形成称为R7的感光细胞所必需的。对该信号通路成分的遗传筛选导致发现了一种称为Son-of-sevenless(Sos)的RasGEF。进一步的基因筛选发现了另一种蛋白质,现在称为Grb2,它是一种将Sev受体与Sos蛋白连接起来的衔接蛋白;Grb2衔接子的SH2结构域与激活的受体结合,而其一个或两个SH3结构域与Sos结合。Sos随后促进Ras激活。
生化和细胞生物学研究表明,Grb2和Sos还将哺乳动物细胞中的激活RTK与Ras连接起来,揭示了RTK信号传导中的这种机制在进化过程中高度保守(图1548)。一旦被激活,Ras就会激活各种其他信号蛋白,将信号传递到下游。
酪氨酸磷酸化和由激活的RTK触发的Ras激活通常都是短暂的(图1549)。酪氨酸特异性蛋白磷酸酶可逆转磷酸化,而RasGAP则诱导活化的Ras通过将结合的GTP水解为GDP而使自身失活。为了刺激细胞增殖或分化,这些短暂的信号事件必须转化为更持久的信号,以维持信号并将其传递到细胞核下游,从而改变基因表达模式。用于此目的的关键机制之一是称为丝裂原活化蛋白激酶的蛋白质系统
MBOC7_ptr_ch15_873-948.indd916MBOC7_ptr_ch15_873-948.indd91608/12/2112:23PM08/12/2112:23PM
916第15章:细胞信号传导917通过酶偶联受体进行信号传导
模块(MAP激酶模块)(图1550)。该系统的三个组成部分形成了一个功能性信号传导模块,该模块在进化过程中得到了很好的保存,并在许多不同的信号传导环境中以不同的方式使用。
这三种成分都是蛋白激酶,主要对丝氨酸和苏氨酸进行磷酸化。该系列中的最后一种激酶简称为MAP激酶(MAPK)。其上游的下一个激酶是MAP激酶激酶(MAPKK):它进行磷酸化,从而激活MAP激酶。再往上,直接从Ras接收激活信号的是MAP激酶激酶激酶(MAPKKK):它进行磷酸化,从而激活MAPKK。在哺乳动物RasMAP激酶信号通路中,这三种激酶的简称为:Raf
一旦被激活,MAP激酶就会通过磷酸化细胞中的各种蛋白质(包括转录调节剂和其他蛋白激酶)将信号传递到下游(见图1550)。例如,Erk进入细胞核,磷酸化转录调控复合物的一个或多个成分。这会激活一组立即早期基因的转录,之所以这样命名,是因为这些基因在RTK收到细胞外信号后几分钟内就会启动,即使蛋白质合成是药物可以完全阻断这些基因。其中一些基因编码其他转录调节因子,这些转录调节因子可以启动其他基因,这个过程需要蛋白质合成和更多时间。通过这种方式,RasMAP-激酶信号通路将信号从细胞表面传递到细胞核,并改变基因表达模式。该通路激活的基因中有一些会刺激细胞增殖,例如编码G1细胞周期蛋白的基因。MAP激酶激活持续时间不同,具体取决于细胞外信号。例如,当EGF激活神经前体细胞系中的受体时,ErkMAP激酶活性在5分钟时达到峰值并迅速下降,
MBOC7_ptr_ch15_873-948.indd917MBOC7_ptr_ch15_873-948.indd91708/12/2112:23PM08/12/2112:23PM
然后细胞继续分裂。相反,当NGF激活相同细胞上的受体时,Erk活性会持续数小时,细胞停止分裂。许多细胞内机制影响信号反应的持续时间和其他特征,包括正反馈和负反馈回路,它们可以结合起来产生分级或开关式、短暂或持久的反应。在前面说明的示例中,如图15-20所示,当青蛙卵母细胞通过短暂暴露于激素黄体酮而受到刺激而成熟时,MAP激酶激活复杂的正反馈回路,从而产生全有或全无、不可逆的反应。在许多细胞中,MAP激酶通过增加蛋白磷酸酶的浓度来激活负反馈回路,从而去除MAP激酶中的磷酸盐。磷酸酶的增加既是由于磷酸酶基因转录的增加,也是磷酸酶蛋白的稳定化以防止降解。在图15-50所示的Ras-MAP激酶通路中,Erk还会磷酸化和灭活Raf,从而提供另一个有助于关闭MAP激酶模块的负反馈回路。支架蛋白减少不同MAP之间的串扰
三组分MAP激酶信号模块在所有真核细胞中起作用,
不同的模块介导同一细胞中的不同反应。例如,在芽殖酵母中,一个MAP激酶模块介导对交配信息素的反应,另一个介导对饥饿的反应,还有一个介导对渗透休克的反应。其中一些MAP激酶模块使用一个或多个相同的激酶,但设法激活不同的下游蛋白质,从而产生不同的反应。如前所述,细胞避免不同平行信号通路之间串扰并确保每个反应都是特异性的一种方法是使用支架蛋白(见图1510A)。在芽殖酵母细胞中,
此类支架结合每个MAP激酶模块中的所有或部分激酶以形成
复合物,从而有助于确保反应特异性(图1551)。
哺乳动物细胞也使用这种支架策略来防止不同MAP激酶模块之间的串扰。
哺乳动物细胞中至少有五个平行的MAP激酶模块可以运行。
这些模块至少使用12种MAP激酶、
7种MAPKK和7种MAPKKK。
其中两个模块(终止于称为JNK和p38的MAP激酶)由不同类型的细胞应激激活,例如紫外线(UV)照射、热休克和渗透应激;其他介导反应
尽管支架策略提供了精确度并避免了串扰,但它减少了信号放大和扩散到细胞不同部分的机会,这需要至少一些成分是可扩散的。它
MAP激酶模块由芽殖酵母中的支架蛋白组成。芽殖酵母至少具有六种生物学过程,包括此处所述的两种反应——匹配反应和高摩尔质量反应。(A)当配对因子分泌到GPCR时,配对反应被触发。这激活了一个G蛋白,这个复合物间接激活了MAPKKK(激酶A),然后MAPKKK再将反应传递下去。一旦被激活,
并由此激活几个下游蛋白,
介导配对反应,
并为融合做准备。该模块中的三个激酶被绑定到1中的支架蛋白。(B)如果响应,环境诱导合成甘油,以增加其内部摩尔质量。
这种反应是由一种不同的传感受体蛋白和与第二个支架蛋白结合的MAP激酶模块介导的。(请注意,scaffold2的激酶域提供(激酶A,绿色),没有交叉连接模块与不同的scaffold蛋白结合,并且渗透压敏感受体与相同的scaff结合旧
蛋白作为肝细胞激酶激活。
MBOC7_ptr_ch15_873-948.indd918MBOC7_ptr_ch15_873-948.indd91808/12/2112:23PM08/12/2112:23PM
918第15章:细胞信号传导919通过酶偶联受体进行信号传导
尚不清楚MAP激酶模块的各个组成部分在多大程度上可以在激活过程中与支架分离以允许扩增。
Rho家族GTPases功能性地偶联细胞表面受体
除了Ras蛋白是另一类Ras超家族GTPase,它从细胞表面受体传递信号,即大型Rho家族(见表155)。Rho家族单体GTPase调节肌动蛋白和微管细胞骨架,控制细胞形状、极性、运动性和粘附性(第16章讨论);它们还调节细胞周期进程、基因转录和膜运输。它们在引导细胞迁移和神经轴突生长方面发挥着关键作用,介导细胞骨架对一类特殊引导受体激活的反应。我们在这里重点介绍Rho家族功能的这一方面。三个最具代表性的家族成员是Rho本身、Rac和Cdc42,它们各自影响多个下游靶蛋白。与Ras一样,GEF激活而GAP使Rho家族GTPases失活;人类中有80多种RhoGEF和70多种RhoGAP。一些GEF和GAP特定于某个家族成员,而其他则不那么特定。与Ras不同,Ras即使在失活时(与GDP结合)也与膜相关,而失活的Rho家族GTPase通常与胞质溶胶中的鸟嘌呤核苷酸解离抑制剂(GDI)结合,从而阻止GTPases与质膜上的RhoGEF相互作用。ephrin家族的细胞外信号蛋白的信号传导提供了RTK如何激活RhoGTPase的一个例子。Ephrins结合并激活Eph家族RTKs成员(见图1544)。Eph家族的一个成员位于运动神经元表面,有助于引导轴突的迁移尖端(称为生长锥)到达其肌肉目标。细胞表面Ephrin蛋白的结合可激活Eph受体,导致生长锥塌陷,从而将它们从不适当的路径上排斥出来并保持其正常生长。该反应取决于一种称为ephexin的RhoGEF,它与Eph受体的胞浆尾部稳定相关。当Ephrin结合激活Eph受体时,该受体会激活细胞质酪氨酸激酶,该激酶在酪氨酸上磷酸化ephexin,从而增强ephexin激活Rho蛋白RhoA的能力。激活的RhoA(RhoA-GTP)随后调节各种下游靶蛋白,包括一些控制肌动蛋白细胞骨架的效应蛋白,导致生长锥塌陷(图1552)。
MBOC7_ptr_ch15_873-948.indd919MBOC7_ptr_ch15_873-948.indd91908/12/2112:23PM08/12/2112:23PM
在考虑了RTK如何使用GEF和单体GTPases将信号传递到细胞中之后,我们现在考虑第二种主要的RTK信号传导策略,它依赖于不同的细胞内中继机制。
PI3-激酶在血浆中产生脂质对接位点
如前所述(见图1547A),与RTK分子胞内尾部结合的蛋白质之一是质膜结合酶磷酸肌醇3-激酶(PI3-激酶)。这种激酶主要磷酸化肌醇磷脂而不是蛋白质,RTK和GPCR都可以激活它。它在促进细胞存活和生长方面起着核心作用。
磷脂酰肌醇(PI)在膜脂质中很不寻常,因为它可以在其肌醇头部基团的多个位点进行可逆磷酸化,从而生成多种称为磷酸肌醇的磷酸化PI脂质。当
被激活时,PI3-激酶会催化肌醇环
3位上的磷酸化,生成多个磷酸肌醇(图1553)。PI(3,4,5)P3的产生最为重要,因为它可以作为各种细胞内信号蛋白的对接位点,这些信号蛋白组装成信号复合物,将信号从质膜的胞浆面传递到细胞中(见图15-29)。相反,PI(3,4,5)P3不会被任何一种PLC切割。它由PI(4,5)P2制成,然后留在质膜中,直到特定的磷酸肌醇磷酸酶将其去磷酸化。其中最突出的是PTEN磷酸酶,它能使肌醇环的3位去磷酸化。许多癌症中都发现了PTEN突变:通过延长PI3-激酶的信号传导,它们促进了不受控制的细胞生长。
PI3-激酶有多种类型。由RTK和GPCR激活的PI3-激酶属于I类。这些是由共同的催化亚基和不同的调节亚基组成的异二聚体。RTK激活Ia类PI3-激酶,其中
调节亚基是一种接头蛋白,可与两个磷酸酪氨酸结合
MBOC7_ptr_ch15_873-948.indd920MBOC7_ptr_ch15_873-948.indd92008/12/2112:23PM08/12/2112:23PM
920第15章:细胞信号传导921通过酶偶联受体进行信号传导
通过其两个SH2结构域激活RTK(见图1547A)。GPCR
激活Ib类PI3-激酶,该酶具有与ß?结合的调节亚基。当GPCR被其细胞外配体激活时,活化的异源三聚体G蛋白(Gq)的复合物。活化的Ras的直接结合也可以激活
细胞内信号传导蛋白通过特定的相互作用域(例如pleckstrin同源性(PH)域)与活化的PI
3-激酶产生的PI(3,4,5)P3结合,该域首先在血小板蛋白pleckstrin中发现。PH域主要作为蛋白质-蛋白质相互作用域发挥作用,其中只有一小部分与PI(3,4,5)P3结合;其中至少有一些还识别特定的膜结合蛋白以及PI(3,4,5)P3,这大大增加了结合的特异性,并有助于解释为什么具有PI(3,4,5)P3结合PH结构域的信号蛋白不会全部停靠在所有PI(3,4,5)P3位点。PH结构域出现在约200种人类蛋白质中,包括RasGEFSosdis-一种特别重要的含有PH结构域的蛋白质是丝氨酸/苏氨酸蛋白激酶Akt。PI-3-激酶-Akt信号通路是激素胰岛素激活的主要通路。它还在促进无脊椎动物和脊椎动物中许多细胞类型的生存和生长方面发挥着关键作用,PI-3-激酶-Akt信号通路刺激动物细胞如前所述,动物细胞生长和分裂以及生存通常需要细胞外信号(见图15-4)。例如,胰岛素样生长因子(IGF)信号蛋白家族的成员刺激许多类型的动物细胞生存和生长。和胰岛素一样,它们与特定的RTK结合(见图15-44),后者激活PI3-激酶,产生PI(3,4,5)P3。PI(3,4,5)P3通过其PH结构域将两种蛋白激酶招募到质膜上——Akt(也称为蛋白激酶B或PKB)和磷酸肌醇依赖性蛋白激酶1(PDK1)——这会导致Akt的激活(图15-54)。一旦被激活,Akt就会磷酸化质膜、细胞质和细胞核中的各种靶蛋白。对大多数已知靶标的作用是
使它们失活,但这些靶标使得Akt的这些作用都合谋
MBOC7_ptr_ch15_873-948.indd921MBOC7_ptr_ch15_873-948.indd92108/12/2112:23PM08/12/2112:23PM
增强细胞存活和生长,如PI-3-激酶-Akt通路对细胞生长的控制部分取决于
一种称为TOR的蛋白激酶,该激酶被命名为雷帕霉素的靶标,雷帕霉素是一种细菌毒素,可灭活某些形式的激酶,在临床上用作
免疫抑制剂和抗癌药物。在哺乳动物细胞中,它被称为mTOR
并以两种功能不同的多蛋白复合物存在于细胞中。mTOR复合物1(mTORC1)含有蛋白质raptor;该复合物对雷帕霉素敏感,并刺激细胞生长。mTOR复合物2(mTORC2)含有蛋白质rictor,对雷帕霉素不敏感;它通过激活Akt(见图1554)帮助促进细胞存活,并通过
mTORC1调节肌动蛋白细胞骨架,它是细胞生理学的关键调节器,可整合来自
多种来源的输入。mTORC1的两个最了解的激活剂是细胞外信号蛋白,称为生长因子因子和营养物质,如氨基酸,两者都能激活mTORC1,从而促进细胞生长。控制mTORC1活性的复杂信号网络包括我们在本章中讨论过的许多信号分子类别的例子(图1555)。我们在第17章中讨论了激活的mTORC1如何刺激细胞图1555生长因子和氨基酸激活mTOR复合物1(mTORC1)。mTORC1活性依赖于与两种Ras相关GTPasesRag和Rheb的GTP结合形式的结合。在存在丰富的胞浆氨基酸的情况下,Rag-GTP将mTORC1募集到溶酶体表面。然后,mTORC1的完全激活需要与Rheb-GTP相互作用,后者在生长因子信号传导下被激活。在这两种情况下,增强的GTP结合主要由特定GTPase活化蛋白(GAP)的抑制所驱动。在Rag的情况下,GAP是一种称为Gator1的蛋白质复合物,它锚定在溶酶体上并受一系列抑制相互作用的调节:胞浆氨基酸与受体蛋白结合,从而消除其对Gator2的抑制作用,然后Gator2可以自由抑制Gator1的GAP活性,导致Rag活化并与mTORC1结合。Rag与溶酶体的相互作用依赖于大型蛋白质复合物Ragulator,它充当Rag的活化GEF;溶酶体中的氨基酸刺激这种GEF活性,进一步促进mTORC1活化。图表左侧是导致生长因子激活RhebGTPase的机制。如本章前面所述,生长因子结合激活RTK会启动各种信号通路,包括激活PI3-激酶(见图1554)和GTPaseRas(见图1548),从而分别激活蛋白激酶Akt和Erk。这些激酶的一个靶标是称为TSC的三聚体蛋白复合物,它是Rheb的GAP。它的磷酸化会抑制TSC,使Rheb-GTP积累,TSC是结节性硬化症的缩写。编码其三个亚基中的两个亚基Tsc1和Tsc2的基因突变会导致遗传性疾病结节性硬化症,这种疾病与含有异常大细胞的良性肿瘤有关。MBOC7_ptr_ch15_873-948.indd922MBOC7_ptr_ch15_873-948.indd92208/12/2112:23PM08/12/2112:23PM
922第15章:细胞信号传导923通过酶偶联受体进行信号传导
RTK和GPCR激活重叠信号通路
如前所述,RTK和GPCR激活一些相同的细胞内信号通路。例如,两者都可以激活由磷脂酶C触发的肌醇磷脂通路。此外,即使它们激活不同的通路,不同的通路也可以汇聚在相同的靶蛋白上。图1556说明了这两种类型的信号重叠:它总结了我们迄今为止讨论过的五种平行的细胞内信号通路一种由GPCR触发,两种由RTK触发,两种由两种受体触发。这些通路之间的相互作用允许不同的细胞外信号分子调节和协调彼此一些酶偶联受体与细胞质相关许多细胞表面受体的活性依赖于酪氨酸磷酸化,但缺乏酪氨酸激酶结构域。这些受体通过细胞质酪氨酸激酶起作用,酪氨酸激酶与受体相关,并在受体与其配体结合时磷酸化各种靶蛋白,通常包括受体本身。因此,这些酪氨酸激酶相关受体的功能与RTK非常相似,只是它们的激酶结构域由单独的基因编码,并与受体多肽链非共价结合。多种受体类型属于此类别,包括淋巴细胞上的抗原和白细胞介素受体(第24章讨论)、整合素(第19章讨论)以及各种细胞因子和一些激素的受体。与RTK一样,许多此类受体依赖于二聚化
其中一些受体与哺乳动物细胞质酪氨酸激酶最大的家族Src家族成员一起发挥作用,该家族包括Src、Yes、Fgr、Fyn、
MBOC7_ptr_ch15_873-948.indd923MBOC7_ptr_ch15_873-948.indd92308/12/2112:23PM08/12/2112:23PM
Lck、Lyn、Hck和Blk。这些蛋白激酶都含有SH2和SH3结构域
并且位于质膜的细胞质侧,部分通过与跨膜受体蛋白的相互作用保持在那里,部分通过共价连接的脂质链(第3章讨论)。不同的家族成员与不同的受体相关,并磷酸化重叠但不同的细胞内信号蛋白组。例如,Lyn、Fyn和Lck各自与d与淋巴细胞上的不同受体组结合。在每种情况下,当细胞外配体与适当的受体蛋白结合时,激酶就会被激活。Src本身以及其他几个家族成员也可以与激活的RTK结合;在这些情况下,受体和细胞质激酶相互刺激彼此的催化活性,从而加强和延长信号(见图15-52)。甚至有一些G蛋白(Gs和Gi)可以激活Src,这是GPCR的激活可以导致细胞内信号蛋白和效应蛋白酪氨酸磷酸化的一种方式。另一种细胞质酪氨酸激酶与整合素有关,整合素是细胞用来与细胞外基质结合的主要受体(第19章讨论)。基质成分与整合素的结合激活了影响细胞行为的细胞内信号通路。当整合素聚集在与细胞外基质接触的部位时,它们有助于触发细胞基质连接(称为粘着斑)的组装。在这些连接中招募的众多蛋白质中,有一种称为粘着斑激酶(FAK)的细胞质酪氨酸激酶,它在其他蛋白质的帮助下与整合素亚基之一的胞浆尾部结合。聚集的FAK分子相互磷酸化,形成Src激酶可以结合的磷酸酪氨酸对接位点。然后,Src和FAK相互磷酸化,并磷酸化在连接处组装的其他蛋白质,包括RTK使用的许多信号蛋白。通过这种方式,两种酪氨酸激酶向细胞发出信号,表明它已经附着在合适的基质上,细胞现在可以在此生存、生长、分裂、迁移等。依赖细胞质酪氨酸激酶的最大和最多样化的受体类是细胞因子受体,我们接下来将讨论它。细胞因子受体激活JAKSTAT信号通路细胞因子受体大家族包括多种局部介质(统称为细胞因子)的受体,以及某些激素的受体,例如生长激素和催乳素(电影15.9)。这些受体与胞质酪氨酸激酶(称为Janus激酶,JAK;以罗马神话中的双面神命名)稳定相关,后者可磷酸化并激活转录调节剂(称为STAT,即信号转导和转录激活因子)。STAT蛋白位于胞质溶胶中,被称为潜在转录调节剂,因为它们迁移到细胞核中并仅调节基因转录。虽然许多细胞内信号通路从细胞表面受体通向细胞核,在那里改变基因转录(见图15-56),但JAK-STAT信号通路提供了更直接的途径之一。细胞因子受体是二聚体或三聚体,与四种已知JAK(JAK1、JAK2、JAK3和Tyk2)中的一种或两种稳定相关。细胞因子结合会改变这种排列,使两个JAK靠近,使它们相互磷酸化,从而增加其酪氨酸激酶结构域的活性。然后,JAK磷酸化细胞因子受体胞质尾部的酪氨酸,为STAT产生磷酸酪氨酸对接位点(图15-57)。一些衔接蛋白也可以结合这些位点中的一些,并将细胞因子受体与前面讨论过的Ras-MAP-激酶信号通路偶联,但本文不讨论这些。哺乳动物中至少有六种STAT。每个都有一个SH2结构域,可执行两种功能。首先,它介导STAT蛋白与激活的细胞因子受体上的磷酸酪氨酸对接位点的结合。一旦结合,JAK就会磷酸化酪氨酸上的STAT,导致STAT与受体分离。其次,释放的STAT上的SH2结构域现在介导其与另一个STAT分子上的磷酸酪氨酸结合,形成STAT同型二聚体
MBOC7_ptr_ch15_873-948.indd924MBOC7_ptr_ch15_873-948.indd92408/12/2112:23PM08/12/2112:23PM
924第15章:细胞信号传导925通过酶偶联受体进行信号传导
或异二聚体。然后,STAT二聚体转移到细胞核中,与其他转录调节因子结合,与各种基因中的特定顺式调节序列结合并刺激其转录(见图15-57)。
例如,作为对刺激乳腺细胞产生乳汁的激素催乳素的反应,激活的STAT5会刺激编码乳蛋白的基因的转录。表15-6列出了30多种通过与细胞因子受体结合激活JAK-STAT通路的细胞因子和激素中的一部分。
负反馈调节由JAK-STAT通路介导的反应。除了激活编码介导细胞因子诱导反应的蛋白质的基因外,STAT二聚体还可以激活编码抑制蛋白的基因,这些抑制蛋白有助于关闭反应。其中一些蛋白质与磷酸化的JAK及其相关的磷酸化结合并使其失活
表156一些通过细胞因子受体和JAKSTAT信号传导起作用的细胞外信号蛋白
信号蛋白受体相关JAKSTAT激活一些反应
干扰素?(IFN?)JAK1和JAK2STAT1激活巨噬细胞
干扰素-a(IFNa)Tyk2和JAK2STAT1和STAT2增强细胞对病毒感染的抵抗力
促红细胞生成素JAK2STAT5刺激红细胞生成
催乳素JAK1和JAK2STAT5刺激产奶
生长激素JAK2STAT1和STAT5通过诱导IGF1刺激生长
JAK2STAT5刺激粒细胞和
MBOC7_ptr_ch15_873-948.indd925MBOC7_ptr_ch15_873-948.indd92508/12/2112:23PM08/12/2112:23PM
受体;其他一些与磷酸化的STAT二聚体结合并阻止它们与DNA靶标结合。然而,这种负反馈机制本身不足以关闭响应。要使激活的
JAK和STAT失活,需要对其磷酸酪氨酸进行去磷酸化。
TGFβ超家族的细胞外信号蛋白通过以下方式起作用:
转化生长因子-b(TGFb)超家族由大量(人类为33种)结构相关的分泌性二聚体蛋白组成。它们充当激素或更常见的局部介质,以调节所有动物的广泛生物功能。在发育过程中,它们调节模式形成并影响各种细胞行为,包括增殖、
特化和分化、细胞外基质产生和细胞死亡。
在成人中,它们参与组织修复和免疫调节,以及许多其他过程。该超家族由TGFβ/活化素家族和较大的骨形态发生蛋白(BMP)家族组成。所有这些蛋白质都通过受体起作用,这些受体是单次跨膜蛋白,在质膜的胞浆侧具有丝氨酸/苏氨酸激酶结构域。这些受体丝氨酸/苏氨酸激酶有两种类型:I型和II型。当TGFβ二聚体与两个I型受体和两个II型受体的胞外结构域相互作用时,信号传导开始,激酶结构域结合在一起,使II型受体可以磷酸化并激活I型受体,形成活性四聚体受体复合物。一旦被激活,受体复合物就会使用一种策略将信号快速传递到细胞核,该策略非常类似于细胞因子受体使用的JAKSTAT策略。激活的I型受体直接结合并磷酸化Smad家族的潜在转录调节因子(以最先发现的两种蛋白质命名,秀丽隐杆线虫中的Sma和果蝇中的Mad)。激活的TGFβ/活化素受体磷酸化Smad2或Smad3,而激活的BMP受体磷酸化Smad1、Smad5或Smad8。一旦这些受体激活的Smad(R-Smad)之一被磷酸化,它就会与Smad4(称为co-Smad)结合,后者可以与五种R-Smad中的任何一种形成复合物。然后,Smad复合物转移到细胞核中,在那里它与其他转录调节因子结合并控制特定靶基因的转录(图1558)。由于细胞核中的伴侣蛋白随细胞类型和细胞状态而变化,受影响的基因也各不相同。
活化的TGFβ受体及其结合配体通过两种不同的途径被内吞,一种导致进一步活化,另一种导致失活。活化途径依赖于网格蛋白包被的囊泡,并导致早期内体(第13章讨论),大多数Smad活化都发生在这里。一种称为SARA(受体活化的Smad锚)的锚定蛋白在此途径中起着重要作用;它集中在早期内体中并与活化的TGFβ受体和Smad结合,从而提高受体介导的Smad磷酸化的效率。失活途径依赖于小窝(第13章讨论),并导致受体泛素化和蛋白酶体降解。
在信号传导反应过程中,Smads不断在细胞质和细胞核之间穿梭:它们在细胞核中去磷酸化并输出到细胞质中,在那里它们可以被激活的受体重新磷酸化。这样,对靶基因的影响既反映了细胞外信号的浓度,也反映了信号持续作用于细胞表面受体的时间(通常为几个小时)。暴露于高浓度或长时间或两者的形态发生素的细胞将开启一组基因,而接受较低或更短暂暴露的细胞将开启另一组基因。在其他信号系统中,负反馈调节Smad通路。Smad复合物激活的靶基因包括编码抑制性Smad的基因,即Smad6或Smad7。Smad7(可能还有Smad6)与活化受体的胞质尾部结合,并通过至少三种方式抑制其信号传导能力:(1)它与R-Smads竞争受体上的结合位点,降低R-Smad磷酸化;(2)它招募一种名为Smurf的泛素连接酶,该酶对受体进行泛素化,导致受体内化和降解(由于Smurf也泛素化并促进Smads的降解,因此被称为Smad泛素化调节因子,或Smurf);(3)它招募一种蛋白磷酸酶,对受体进行去磷酸化和灭活。此外,抑制性Smads结合辅Smad、Smad4,并通过阻止其与R-Smads结合或促进其泛素化来抑制它。
酶偶联受体有多种类型,其中最常见的是受体酪氨酸激酶(RTK)、酪氨酸激酶相关受体和
配体与RTK的结合会导致它们二聚化,从而激活它们的激酶结构域。这些活化的激酶结构域磷酸化受体上的多个酪氨酸,产生一组磷酸酪氨酸,作为一组细胞内信号蛋白的对接位点,这些信号蛋白通过其SH2(或PTB)结构域结合。一种这样的信号蛋白作为适配器将一些活化的受体偶联到RasGEF(Sos),从而激活单体GTPaseRas;反过来,Ras激活一个三组分MAP激酶信号模块,该模块通过磷酸化转录调节剂将信号传递到细胞核。另一种可以停靠在激活的RTK上的重要信号蛋白是PI3-激酶,它磷酸化特定的磷酸肌醇,在质膜上产生脂质停靠位点,用于具有磷酸肌醇结合PH结构域的信号蛋白,包括丝氨酸/苏氨酸蛋白激酶Akt,它在控制细胞存活和细胞生长方面起着关键作用。许多受体类别,包括一些RTK,可激活Rho家族单体GTPase,后者将受体功能性地偶联到细胞骨架上。酪氨酸激酶相关受体的作用依赖于各种细胞质酪氨酸激酶。这些激酶包括Src家族成员,它们与多种受体相关,以及粘着斑激酶(FAK),它与粘着斑处的整合素相关。然后,细胞质酪氨酸激酶磷酸化各种信号蛋白以将信号传递出去。酪氨酸激酶相关受体中最大的家族是细胞因子受体家族。当受到配体结合的刺激时,这些受体会激活JAK细胞质酪氨酸激酶,从而磷酸化STAT。然后,STAT二聚化,转位到细胞核,并激活特定基因的转录。由TGFb超家族的信号蛋白激活的受体丝氨酸/苏氨酸激酶的作用类似:它们直接磷酸化并激活Smad,然后Smad与另一个Smad寡聚化,转位到细胞核,并调节基因转录。细胞行为的重大变化往往取决于许多基因表达的变化。因此,许多细胞外信号分子全部或部分地通过启动改变转录调节剂活性的信号通路来发挥其作用。GPCR和酶偶联受体途径中有许多基因调控的例子(见图1528和1550)。在本节中,我们将描述一些不太常见的信号机制,通过这些机制,基因表达可由细胞外信号控制。我们首先从几种依赖于受调节的蛋白水解来控制潜在转录调节剂的活性和位置的途径开始。然后,我们转向一类不使用细胞表面受体而是进入细胞并直接与转录调节剂相互作用以发挥其功能的细胞外信号分子。最后,我们简要讨论了一些基因表达受昼夜节律控制的机制:昼夜节律是光和暗的每日循环。受体Notch是一种潜在的转录调节剂通过Notch蛋白的信号传导在动物发育中得到广泛应用。正如第21章所讨论的,它在控制细胞命运选择和调节大多数组织发育过程中的模式形成方面起着一般作用s,以及肠道内壁等组织中细胞的不断更新。然而,它最出名的是它在果蝇神经细胞的产生中的作用,这些神经细胞通常作为前体细胞上皮片中的孤立单细胞出现。在此过程中,当前体细胞承诺成为神经细胞时,它会向其近邻发出信号,不要这样做;受抑制的细胞会发育成表皮细胞。这个过程称为侧向抑制,依赖于一种接触依赖性信号机制,该机制由一种名为Delta的单次跨膜信号蛋白激活,该蛋白显示在未来的神经细胞表面上。通过与邻近细胞上的受体Notch蛋白结合,Delta向邻近细胞发出信号,不要变成神经细胞(图1559)。当这种信号传导过程出现缺陷时,就会产生大量的神经细胞,而表皮细胞则会受到损害,这是致命的。Notch是一种单次跨膜蛋白,需要经过蛋白水解加工才能发挥作用。它充当潜在的转录调节剂,并提供从细胞表面受体到细胞核的最简单、最直接的信号传导途径。当Delta结合另一个细胞而激活时,质膜结合蛋白酶会切除Notch的胞质尾部,而释放的尾部会转移到细胞核中,从而激活一组Notch反应基因的转录。Notch尾部片段通过结合DNA结合蛋白起作用,将其从转录抑制因子转化为Notch,经历三个连续的蛋白水解切割步骤,但只有最后两个步骤依赖于Delta结合。作为其正常生物合成的一部分,它在高尔基体中被切割形成异二聚体,然后作为成熟受体被运输到细胞表面。Delta与Notch的结合会诱导胞外域的第二次切割,由胞外蛋白酶介导。随后迅速发生最终的裂解,切开激活的Notch的胞质尾部(图1560)。请注意,与大多数受体不同,Notch的激活是不可逆的;一旦通过配体结合激活,蛋白质就不能再次使用。
Notch尾部的最终裂解发生在跨膜片段内,由一种称为g-分泌酶的蛋白酶复合物介导,该复合物也是
图1560通过蛋白水解裂解处理和激活Notch。编号的红色箭头表示蛋白水解裂解的位点。第一个蛋白水解处理步骤发生在反高尔基网络内,以生成成熟的异二聚体Notch,然后显示在细胞表面。与邻近细胞上的Delta结合会触发接下来的两个蛋白水解步骤:Delta和与其结合的Notch片段的复合物被Delta表达细胞内吞,从而暴露跨膜Notch亚基中的细胞外裂解位点。请注意,Notch和Delta通过其重复的EGF样结构域相互作用。释放的Notch尾部迁移到细胞核中,在那里它与Rbpsuh蛋白结合,并将其从转录抑制因子转化为转录激活因子。MBOC7_ptr_ch15_873-948.indd929MBOC7_ptr_ch15_873-948.indd92908/12/2112:23PM08/12/2112:23PM
负责各种其他单次跨膜蛋白的膜内裂解。其必需亚基之一是早老素,之所以这样称呼,是因为编码它的基因突变是早发性家族性阿尔茨海默病(一种早老性痴呆症)的常见原因。蛋白酶复合物被认为通过从跨膜神经元蛋白中产生细胞外肽片段来导致这种和其他形式的阿尔茨海默病;这些碎片会过量积累,形成错误折叠的蛋白质聚集体,即淀粉样斑块,这可能会损伤神经细胞,导致其退化和丢失。
Wnt蛋白激活Frizzled并从而抑制β-Catenin
Wnt蛋白是分泌信号分子,可控制动物发育的各个方面。它们是在苍蝇和小鼠中分别发现的:在果蝇中,Wingless(Wg)基因最初是因为它在翅膀发育中的作用而被发现,而在小鼠中,Int1基因被发现是因为它在被旁边的病毒整合激活时会促进乳腺肿瘤的形成。这两个基因都编码Wnt蛋白。人类有19个Wnt,每个都有不同的但经常重叠的功能。
Wnt是不寻常的细胞外信号蛋白,因为它们在合成后共价连接到脂肪酸链上内质网中的esis。因此,Wnt是疏水性分子,倾向于与细胞膜结合,不会在细胞外环境中快速扩散。它们被认为主要作为局部(旁分泌)信号分子(见图152B)。Wnt与几种信号通路有关。最容易理解的,也是我们这里的主要关注点,是Wnt/b-catenin通路(也称为经典Wnt通路),它以一种叫做b-catenin的蛋白质为中心。β-catenin是一个有趣的信号蛋白例子,它在同一个细胞中具有两种看似不相关的功能。细胞的一部分β-catenin位于细胞细胞连接处,从而有助于控制细胞细胞粘附;此功能在第19章中讨论,我们这里不涉及。Wnt信号主要作用于细胞质β-catenin,这是一种潜在的转录调节剂,在未受刺激的细胞中会迅速降解,但Wnt信号会使其稳定。
在没有Wnt信号的情况下,细胞质β-catenin会通过依赖于大型蛋白质降解复合物的过程进行降解,该复合物会结合β-catenin,
使其脱离细胞核,并促进其破坏。该复合物至少含有四种其他蛋白质,包括一种称为酪蛋白激酶1(CK1)的蛋白激酶,
该蛋白激酶在丝氨酸上磷酸化β-catenin,为另一种称为糖原合酶激酶3(GSK3)的蛋白激酶进一步磷酸化做好准备。这种最终的磷酸化标志着蛋白质在蛋白酶体中泛素化和快速降解。两种支架蛋白(称为轴蛋白和腺瘤性息肉病
(APC))将蛋白质复合物结合在一起(图1561A)。APC的名称来自这样的发现:编码它的基因经常在一种结肠良性肿瘤(腺瘤)中发生突变;肿瘤以息肉的形式突出到管腔中,并最终变成恶性肿瘤。(这种APC不应与后期促进复合物或APC/C混淆,后者在细胞周期期间的选择性蛋白质降解中起着核心作用-在第17章中讨论。)
Wnt蛋白通过与两种细胞表面共受体Frizzled和LDL受体相关蛋白(LRP)相互作用来调节β-catenin蛋白水解。Frizzled是一种七次跨膜蛋白,其结构类似于GPCR,但通常不通过激活G蛋白起作用。LRP是一种相对简单的单次跨膜蛋白。Frizzled含有一个与Wnt具有高亲和力的细胞外结构域,部分原因是受体结构域上的疏水口袋与Wnt上的脂质修饰相互作用;因此,这种脂质是Wnt信号传导所必需的。LRP与Wnt上的另一个位点相互作用。因此,与许多其他信号传导途径一样,Wnt配体驱动共受体二聚体的形成。活化受体复合物的形成促进了两种蛋白激酶CK1和GSK3对LRP受体的磷酸化。受体激活还会导致支架蛋白Dishevelled的募集。Axin被带到
MBOC7_ptr_ch15_873-948.indd930MBOC7_ptr_ch15_873-948.indd93008/12/2112:23PM08/12/2112:23PM
930第15章:细胞信号传导931基因调控中的替代信号传导途径
受体复合物并失活,从而破坏细胞质中的β-catenin降解
复合物。这样,β-catenin的磷酸化和降解被阻止,使β-catenin积累并转移到
细胞核,在那里它改变了基因转录的模式(图1561B)。
在没有Wnt信号的情况下,Wnt反应基因被转录调节剂的抑制复合物所抑制。该复合物包括LEF1/TCF家族的蛋白质,这些蛋白质与Groucho家族的辅阻遏蛋白结合(见图1561A)。响应Wnt信号,β-catenin进入细胞核并与LEF1/TCF蛋白结合,取代Groucho。β-catenin现在充当辅激活因子,诱导Wnt靶基因的转录(见图1561B)。因此,与Notch信号的情况一样,Wnt/β-catenin信号触发从转录抑制到转录激活的转变。β-catenin激活的基因包括Myc,它编码一种蛋白质
(Myc),它是细胞生长和增殖的重要调节剂(第17章讨论)。80%的人类结肠癌中发生Apc基因突变
(第20章讨论)。这些突变抑制了蛋白质结合
β-catenin的能力,因此β-catenin会在细胞核中积累并刺激
c-Myc和其他Wnt靶基因的转录,即使在没有Wnt信号传导的情况下也是如此。由此产生的不受控制的细胞生长和增殖促进
图1561中显示的Wnt信号通路补充了
额外的调节输入,可以微调Wnt信号的强度。例如,一些Wnt刺激基因会抑制Wnt信号,从而产生负反馈。其中一个基因编码一种分泌酶Notum,该酶可从Wnt中去除脂肪酸修饰,从而使其失活。另一个Wnt刺激基因编码一种细胞表面跨膜蛋白Rnf43,这是一种泛素连接酶,可靶向Frizzled蛋白进行降解。这种负反馈机制可以通过来自其他细胞的细胞外信号分子来抑制:例如,一种名为R-spondin的信号蛋白与一种名为Lgr的GPCR结合,从而使Rnf43失活,从而增强Wnt信号。通过这些机制和各种其他机制,可以在不同组织中微调Wnt信号的定位和强度。MBOC7_ptr_ch15_873-948.indd931MBOC7_ptr_ch15_873-948.indd93108/12/2112:23PM08/12/2112:23PM
Hedgehog蛋白在
Hedgehog蛋白和Wnt蛋白的作用方式相似。两者都是分泌信号分子,在许多发育中的无脊椎动物和
脊椎动物组织中充当局部介质。这两种蛋白质都由共价连接的脂质修饰,并且
都触发从转录抑制到转录激活的转换。
成体细胞中任一途径的过度信号传导都可能导致癌症。
第一个Hedgehog蛋白是在果蝇中发现的,Hedgehog基因突变会形成一种幼虫,幼虫身上布满尖刺(齿状突起),就像一只刺猬。脊椎动物中至少有三个基因编码Hedgehog蛋白——Sonic、Desert和IndianHedgehog。所有Hedgehog蛋白的活性形式都与胆固醇以及脂肪酸链共价结合。胆固醇是在一个不寻常的加工步骤中添加的,在这个步骤中,前体蛋白会自我裂解,产生一个较小的、含有胆固醇的信号蛋白。由Hedgehog激活的信号蛋白也是在果蝇中首次发现的,并且在脊椎动物和其他动物中得到保存。我们在这里关注的脊椎动物通路提供了一个重要概念的惊人例子:可以通过将其成分集中在小体积或隔间中来增强信号系统的灵敏度和效率。脊椎动物Hedgehog通路的大多数信号蛋白位于初级纤毛内,初级纤毛是一种小的膜突起,在大多数脊椎动物细胞类型的表面上都存在一个副本。正如我们在第16章中讨论的那样,初级纤毛沿其中心轴包含微管阵列,但它不像其他基于微管的纤毛或鞭毛那样具有运动能力;相反,它的微管被用作各种信号蛋白往返于尖端的运输轨道。Hedgehog通路中的所有早期信号步骤都发生在纤毛中,并且在初级纤毛形成或功能有缺陷的细胞中信号会丢失。因此,初级纤毛充当细胞外Hedgehog信号的天线,该信号始于细胞表面受体Patched,该受体采用复杂的机制激活一组转录调节因子,称为Gli蛋白,从而增加驱动靶细胞增殖或发育命运变化的基因表达。在没有Hedgehog配体的情况下,未占用的Patched蛋白位于纤毛膜中,并抑制位于纤毛外部的另一种跨膜蛋白Smoothened的活性(图15-62A)。Smoothened是一种类似于Wnt受体Frizzled的GPCR样蛋白;与Frizzled一样,它具有一个外部结构域,可作为脂质结合激活结构域,其激活需要该结构域与细胞膜中的胆固醇结合。相反,Patched是一种大型跨膜蛋白,可将胆固醇转运出膜。有人提出,Patched通过减少纤毛膜中的胆固醇含量来抑制Smoothened,而Hedgehog通过阻断胆固醇转运通道来抑制Patched。在缺乏Hedgehog信号的细胞中,Hedgehog反应基因的表达受到两种机制的阻断。首先,一种名为SuFu的抑制蛋白使纤毛内的Gli转录调节因子处于非活性状态。其次,该家族的一个成员Gli3经过蛋白水解处理形成一个较小的片段,可作为转录抑制剂,帮助保持Hedgehog反应基因沉默。Gli3蛋白的这种加工依赖于一种信号通路
,该通路始于一种名为Gpr161的GPCR,它存在于纤毛膜中
并刺激腺苷酸环化酶产生环磷酸腺苷;环磷酸腺苷随后刺激PKA,后者磷酸化Gli3以促进其部分加工成
Hedgehog与Patched蛋白的结合促进了
Patched从纤毛中移出,并消除了其对Smoothened的抑制作用,后者
进入纤毛。Gpr161从纤毛中移除,从而减少了Gli3转录阻遏物的形成。Gli蛋白和
SuFu的非活性复合物被运送到纤毛尖端,在那里,激活的Smoothened
MBOC7_ptr_ch15_873-948.indd932MBOC7_ptr_ch15_873-948.indd93208/12/2112:23PM08/12/2112:23PM
932第15章:细胞信号传导933基因调控中的替代信号传导途径
促进其解离并触发Gli2蛋白的修饰,从而
将它们转化为活性转录调节剂。激活的Gli2蛋白
沿着微管轨道从纤毛运输到细胞质,从
那里它们扩散到细胞核以促进基因表达(图1562B)。
结果是大量Hedgehog靶基因的表达增加。
Hedgehog信号传导可促进细胞增殖,而过度的Hedgehog信号传导可导致癌症。例如,导致过度Hedgehog信号传导的两个人类
Patched基因之一的失活突变经常发生在皮肤基底细胞癌中,这是白种人最常见的癌症形式。一种由草地百合产生的名为环巴胺的小分子被用于治疗与过度Hedgehog信号传导相关的癌症。它通过紧密结合Smoothened并抑制其活性来阻断Hedgehog信号传导。它最初被发现是因为它会导致以这种百合为食的绵羊后代出现严重的发育缺陷;这些特征包括
存在一只中央眼(一种称为独眼的疾病),这种症状也出现在
图1562脊椎动物Hedgehog在初级纤毛中的信号传导。(A)在没有Hedgehog的情况下,其受体Patched
在纤毛膜中活跃,并抑制Smoothened,后者位于纤毛相邻的膜中。Gli转录调节剂(主要是Gli2和Gli3)被SuFu保持在非活性状态。此外,活性GPCR(Gpr161)刺激
腺苷酸环化酶,产生环磷酸腺苷,导致PKA依赖的Gli3蛋白磷酸化。磷酸化的
Gli3被加工成转录阻遏物,它在细胞核中积累,以帮助保持Hedgehog靶基因
不活跃。(B)Hedgehog与Patched结合可消除对Smoothened的抑制。Smoothened转位到纤毛,
在那里它触发SuFuGli2复合物的解离和Gli2转化为活性转录调节剂;
然后激活的Gli2被转运到细胞质,从那里移动到细胞核以刺激Hedgehog反应基因的表达。Hedgehog还促进Gpr161从纤毛中去除(未显示),从而减少加工
MBOC7_ptr_ch15_873-948.indd933MBOC7_ptr_ch15_873-948.indd93308/12/2112:23PM08/12/2112:23PM
NFkB蛋白是存在于大多数动物细胞中的潜在转录调节剂,是许多炎症和先天免疫反应的核心。
这些反应是感染或损伤的反应,有助于保护应激的多细胞生物及其细胞(第24章讨论)。动物过度或不适当的炎症反应也会损伤组织并引起剧烈疼痛,而慢性炎症则会导致癌症。NF?B蛋白在动物正常发育过程中也发挥着重要作用:例如,果蝇NF?B家族成员Dorsal在指定发育中的苍蝇胚胎的背腹轴方面起着至关重要的作用(第22章讨论)。各种细胞表面受体激活动物细胞中的NF?B信号通路。例如,果蝇中的Toll受体和脊椎动物中的Toll样受体可识别病原体并激活该通路以触发先天免疫反应(第24章讨论)。肿瘤坏死因子
a(TNFa)和白细胞介素1(IL1)的受体也是激活该信号通路的受体,它们是脊椎动物中在诱导炎症反应方面特别重要的细胞因子。
Toll、Toll样和IL1受体属于同一蛋白质家族,而
TNF受体属于不同的家族;但它们都以类似的方式激活NF?B。当它们被激活时,它们会触发多蛋白泛素化和
磷酸化级联,从而将NF?B从抑制蛋白复合物中释放出来,
这样它就可以转移到细胞核中并启动数百个参与炎症和先天免疫反应的基因的转录。
哺乳动物中有几种NF?B蛋白,它们形成各种同型二聚体和异型二聚体,每种二聚体都会激活其自身特有的一组基因。
抑制蛋白IβB与二聚体紧密结合,使二聚体在未受刺激的细胞的细胞质中处于非活性状态。释放NF?B
二聚体的信号通过触发信号通路来实现,该信号通路导致I?B蛋白的磷酸化、
泛素化和随之而来的降解(图1563)。
由释放的NF?B激活的基因中包括编码I?Ba的基因。
这种激活导致I?Ba蛋白的合成增加,该蛋白与NF?B结合并使其失活,从而产生负反馈回路(图1564A)。对TNFa诱导反应的实验以及对这些反应的计算机建模研究表明,负反馈产生两种类型的NF?B反应,具体取决于TNFa刺激的持续时间。重要的是,这两种反应会诱导不同的基因表达模式(图1564B、C和D)。
到目前为止,我们一直关注细胞外信号分子利用细胞表面受体启动基因表达变化的机制。
现在我们来谈谈一类完全绕过质膜并以最直接的方式控制转录调节剂的细胞外信号。
核受体是配体调节的转录。
各种小的疏水性信号分子直接扩散穿过靶细胞的质膜并与作为转录调节剂的细胞内受体结合。
这些信号分子包括类固醇激素、甲状腺激素、
类视黄酸和维生素D。虽然它们在化学结构(图1565)和功能上彼此有很大差异,但它们都通过类似的机制起作用。
它们与各自的细胞内受体蛋白结合,并改变这些蛋白控制特定基因转录的能力。因此,这些蛋白既可作为细胞内受体,也可作为信号的细胞内效应物。这些受体在结构上都是相关的,是庞大的核受体超家族的一部分。许多家族成员仅通过DNA测序确定,其配体尚不清楚;因此它们被称为图1564NFkB信号通路中的负反馈会诱发NFkB激活的振荡。(A)图表显示激活的NF?B如何刺激IkBa基因的转录,其蛋白质产物在细胞质中起作用,在那里隔离和抑制NF?B。如果刺激持续存在,新产生的I?Ba蛋白将被泛素化和降解,再次释放活性NF?B,使其返回细胞核并激活转录(见图1563)。(B)短暂暴露于TNFa会产生一个短暂的NF?B激活脉冲,在几分钟内开始并在1小时内结束。此反应会启动基因A的转录,但不启动基因B的转录。(C)在整个实验的6小时内持续暴露于TNFa会产生NF?B激活的振荡,并随着时间的推移逐渐减弱。此反应会启动基因A和B的转录;基因B仅在几个小时后才启动,这表明基因B转录需要长时间激活NF?B,原因尚不清楚。(D)这些延时共聚焦荧光显微照片来自另一项TNFa刺激研究,显示了培养细胞中NF?B的振荡,如由NF?B与红色荧光蛋白融合而成的融合蛋白周期性地进入细胞核(N)所示。在显微照片中心的细胞中,NF?B处于活性状态,并在6、60、210、380和480分钟时位于细胞核中,但在0、120、300、410和510分钟时仅位于细胞质中。(AC,基于A.Hoffmann等人,Science298:12411245,
2002的数据,并改编自A.Y.Ting和D.Endy,Science298:11891190,2002;D,来自D.E.Nelson等人,Science306:
MBOC7_ptr_ch15_873-948.indd935MBOC7_ptr_ch15_873-948.indd93508/12/2112:24PM08/12/2112:24PM
作为孤儿核受体,它们占人类、果蝇和线虫C.elegans基因组中编码的核受体的很大一部分。一些哺乳动物核受体是由细胞内代谢物而不是分泌的信号分子调节;例如,过氧化物酶体增殖激活受体(PPAR)结合细胞内脂质代谢物并调节参与脂质代谢和脂肪细胞分化的基因的转录。激素的核受体很可能是从细胞内代谢物的受体进化而来的,这可能有助于解释它们的类固醇激素——包括皮质醇、类固醇性激素、维生素D(脊椎动物)和蜕皮激素蜕皮激素(昆虫)——都是由胆固醇制成的。皮质醇在肾上腺皮质中产生,影响多种细胞的新陈代谢。类固醇性激素是在睾丸和卵巢中产生的,是区分男性和女性的第二性征。维生素D是在皮肤对阳光的反应中合成的;在肝脏或肾脏中转化为活性形式后,它会调节Ca2+代谢,促进肠道对Ca2+的吸收,减少肾脏对Ca2+的排泄。由氨基酸酪氨酸制成的甲状腺激素可提高多种细胞类型的代谢率,而类视黄酸(如视黄酸)则由维生素A制成,在脊椎动物发育过程中作为局部介质发挥着重要作用。尽管所有这些信号分子在水中的溶解性都相对较差,但它们通过与特定的载体蛋白结合而变得可溶,以便在血液和其他细胞外液中运输,并在进入靶细胞之前从载体蛋白中分离(见图15-3B)。
核受体与配体调节的基因附近的特定DNA序列结合。一些受体,例如皮质醇受体,主要位于细胞溶胶中,仅在配体结合后进入细胞核;其他受体,例如甲状腺和类视黄酸受体,即使在没有配体的情况下也会与细胞核中的DNA结合。在这两种情况下,无活性受体通常与抑制蛋白复合物结合。配体结合会改变受体蛋白的构象,导致抑制复合物分离,受体与刺激基因转录的辅激活蛋白结合(图15-66)。然而,在其他情况下,配体与核受体的结合会抑制转录:例如,一些甲状腺激素受体在没有激素的情况下充当转录激活剂,而当激素结合时则成为转录抑制物。
到目前为止,我们一直专注于其他细胞产生的细胞外信号分子对基因表达的控制。我们现在通过更全球性的环境信号来研究基因调控:由
MBOC7_ptr_ch15_873-948.indd936MBOC7_ptr_ch15_873-948.indd93608/12/2112:24PM08/12/2112:24PM
936第15章:细胞信号传导937基因调控中的替代信号传导途径
昼夜节律使用负反馈回路来控制
地球上的生命是在昼夜循环的存在下进化的,许多当今的生物体都具有一种内部节律,可以在白天和夜晚的不同时间调节不同的行为。这些行为包括细菌代谢酶活动的周期性变化和人类复杂的睡眠-觉醒周期。控制这种昼夜节律的细胞内振荡器拥有昼夜节律时钟使生物体能够预测其环境中的日常变化并提前采取适当的行动。当然,内部时钟不可能完全准确,因此它必须能够通过外部线索(例如日光)重置。尽管如此,即使环境线索(光明和黑暗的变化)被移除,昼夜节律时钟仍会继续运行,但这种自由运行节律的周期通常略少于或多于24小时。指示一天中的时间的外部信号会导致时钟运行的微小调整,以使生物体与其环境保持同步。经过更剧烈的变化后,昼夜节律会逐渐被新的明暗循环所重置(同步),任何经历过时差的人都可以证明这一点。
我们可能认为昼夜节律钟是一种复杂的多细胞装置,不同的细胞群负责振荡机制的不同部分。然而,值得注意的是,在包括人类在内的几乎所有多细胞生物中,计时员都是单个细胞。因此,我们的睡眠和清醒、体温和激素释放的昼夜节律由下丘脑视交叉上核(SCN)中一组特殊脑细胞的每个成员体内运行的时钟控制。即使将这些细胞从大脑中取出并分散在培养皿中,它们仍将继续单独振荡,显示出周期约为24小时的基因表达周期模式。在完整的身体中,SCN细胞从视网膜接收神经信号,使SCN细胞适应每日的明暗循环。SCN细胞将有关一天中的时间的信息发送到大脑的其他区域,以及松果体,松果体通过释放激素将时间信号传递给身体的其他部位-
MBOC7_ptr_ch15_873-948.indd937MBOC7_ptr_ch15_873-948.indd93708/12/2112:24PM08/12/2112:24PM
虽然SCN是哺乳动物昼夜节律的中央调节器,但哺乳动物体内的大多数其他细胞也有昼夜节律钟,
它能够根据光线进行重置。同样,在果蝇中,许多不同类型的细胞都有类似的昼夜节律钟,当与果蝇的其他部分隔离时,它仍会继续循环,并且可以通过外部施加的光线进行重置。
因此,昼夜节律钟是许多细胞的基本特征。虽然我们还不了解这些时钟的详细工作原理,但对各种生物体的研究已经揭示了其中一些时钟的基本原理和分子成分。一个关键原理是,昼夜节律钟通常依赖于
负反馈回路。如前所述,如果细胞内信号蛋白长时间抑制其自身活性,则该蛋白的活性可能会发生振荡(见图15-19C和D)。在果蝇和许多其他动物(包括人类)中,昼夜节律时钟的核心是一个基于转录调节剂的延迟负反馈回路:某些基因产物的积累会关闭其自身基因的转录,但会延迟,因此细胞在产物存在且转录关闭的状态与产物不存在且转录开启的状态之间振荡(图1567)。然而,昼夜节律背后的负反馈并不总是基于转录调节剂。在某些细胞类型中,昼夜节律时钟由通过翻译后机制控制自身活动的蛋白质构成,正如我们接下来讨论的那样。三种纯化蛋白质可以重建蓝藻最了解的昼夜节律时钟是在光合蓝藻Synechococcuselongatus中发现的。该生物体中的核心振荡器非常简单,仅由三种蛋白质组成——KaiA、KaiB和KaiC。核心参与者是KaiC,这是一种多功能酶,可在24小时循环中催化自身的磷酸化和去磷酸化:它在白天逐渐在两个位点依次磷酸化自身,在夜间去磷酸化自身。这个时间取决于与其他两种Kai蛋白的相互作用:KaiA在早晨与未磷酸化的KaiC结合并刺激KaiC的自身磷酸化,首先在一个位点,然后经过较长的延迟,在另一个位点。夜幕降临时,第二次磷酸化促进第三个蛋白KaiB的逐渐结合,从而阻断KaiA的刺激作用,从而使KaiC自身去磷酸化,在夜间缓慢地将KaiC恢复到去磷酸化状态。这个时钟依赖于一个负反馈回路:KaiC驱动其自身的磷酸化,直到经过一段时间后,它招募抑制剂KaiB,刺激KaiC自身去磷酸化。令人惊奇的是,当三种Kai蛋白被纯化并与ATP一起在试管中孵育时,KaiC磷酸化循环会以大约24小时的周期持续数天(图1568)。
KaiC磷酸化的昼夜节律振荡导致大量参与控制代谢活动和细胞分裂的基因表达出现平行节律(见图1568)。细胞行为的许多方面因此而发生变化。
即使在持续黑暗中,蓝藻细胞也会以大约24小时的周期产生KaiC磷酸化的自由振荡。与其他昼夜节律时钟一样,蓝藻时钟也受到环境光暗循环的影响。光被认为会间接影响生物钟:Kai蛋白的活动受到细胞内氧化还原电位变化的影响,而氧化还原电位的变化是由于白天光合作用增加而发生的。
一些在动物发育中特别重要的信号通路依赖于蛋白水解来控制潜在转录调节剂的活性和位置。Notch蛋白是潜在的转录调节剂,当另一个细胞上的Delta蛋白与其结合时,它们会通过裂解而激活;裂解的Notch胞浆尾部会迁移到细胞核中,在那里刺激Notch反应基因的转录。相反,在Wnt/b-catenin信号通路中,当分泌的Wnt蛋白与Frizzled和LRP受体蛋白结合时,潜在转录调节蛋白b-catenin的蛋白水解会受到抑制;
MBOC7_ptr_ch15_873-948.indd939MBOC7_ptr_ch15_873-948.indd93908/12/2112:24PM08/12/2112:24PM
因此,b-catenin在细胞核中积累并激活转录
Hedgehog信号传导还依赖于潜在转录调节剂的激活——Gli蛋白家族成员。在没有信号的情况下,Gli3
被蛋白水解切割形成一种转录抑制因子,可使Hedgehog靶基因保持沉默。未被占据的Hedgehog受体Patched还会阻止另一个Gli家族成员Gli2的激活。Hedgehog与Patched的结合具有两种作用:它抑制Gli3的蛋白水解加工,从而消除其对基因表达的抑制作用,同时还触发Gli2的激活,进一步促进靶基因表达。因此,在Notch、Wnt和Hedgehog信号传导中,细胞外信号触发从转录抑制到通过潜在转录调节因子NFkB的信号传导也依赖于蛋白水解。NFkB蛋白通常由抑制性IkB蛋白保持在细胞质中的非活性状态。各种细胞外刺激,包括促炎细胞因子,触发IkB的降解,使NFkB易位到细胞核并激活其靶基因的转录。
一些小的疏水性信号分子,包括类固醇和甲状腺激素,扩散到靶细胞的质膜上并激活直接调节特定基因转录的细胞内受体蛋白。
在许多细胞类型中,基因表达受昼夜节律控制,其中延迟的负反馈在转录调节剂的活动中产生24小时的振荡,预测细胞在一天中不断变化的需求
在植物中,就像在动物中一样,细胞之间保持着不断的交流。
植物细胞通过交流来协调它们的活动,以响应光、暗和温度的变化条件,从而指导植物的生长、开花和结果周期。植物细胞也通过通讯来协调其根、茎和叶的活动。在最后一节中,我们将讨论植物细胞如何相互发送信号以及它们如何对光作出反应。人们对植物细胞通讯中涉及的受体和细胞内信号机制的了解比对动物的了解要少,我们将主要集中讨论受体和细胞内信号机制与多细胞和细胞通讯独立进化的不同之处。虽然植物和动物都是真核生物,但它们已经分别进化了十多亿年。它们的最后共同祖先被认为是一种有线粒体但没有叶绿体的单细胞真核生物;植物谱系在植物和动物分化后获得了叶绿体。多细胞动物和植物最早的化石可以追溯到近6亿年前。因此,植物和动物似乎是独立进化出多细胞性的,
各自从不同的单细胞真核生物开始,大约在公元1.6到
700年之间。如果多细胞性在植物和动物中独立进化,那么用于细胞通讯的一些分子和机制将会分别进化,并且预计会有所不同。事实上,尽管植物和动物都使用一氧化氮、环磷酸鸟苷、Ca2+、蛋白激酶和小GTP酶进行信号传导,但现代开花植物似乎不含有核受体家族、JAK、STAT、TGFβ、Notch、Wnt或Hedgehog信号传导途径的同源物。同样,植物似乎不使用环磷酸腺苷进行细胞内信号传导。尽管如此,植物和动物信号传导的一般策略是相似的。例如,两者都使用酶偶联细胞表面受体,如
MBOC7_ptr_ch15_873-948.indd940MBOC7_ptr_ch15_873-948.indd94008/12/2112:24PM08/12/2112:24PM
940第15章:细胞信号传导941植物中的信号传导
受体丝氨酸/苏氨酸激酶是最大的一类
植物中的大多数细胞表面受体都是酶偶联的。然而,尽管
动物中最大的酶偶联受体类是受体酪氨酸激酶(RTK)类,但这种类型的受体在植物中极为罕见。相反,植物主要依赖于多种跨膜受体丝氨酸/苏氨酸激酶,这些激酶具有典型的丝氨酸/苏氨酸激酶胞质域和胞外配体结合域。这些受体中最丰富的类型具有串联排列的胞外富含亮氨酸重复结构,因此被称为富含亮氨酸重复(LRR)受体激酶。小型开花植物拟南芥的基因组中编码了大约175种LRR受体激酶。其中包括一种名为Bri1的蛋白质,它是细胞表面类固醇激素受体的一部分。植物合成一类被称为油菜素类固醇的类固醇,因为它们最初是在包括拟南芥在内的十字花科中发现的。这些信号分子在植物的整个生命周期中调节植物的生长和分化。油菜素类固醇与Bri1细胞表面受体激酶的结合启动这是一种细胞内信号级联,利用GSK3蛋白激酶和
蛋白磷酸酶来调节细胞核中特定转录调节蛋白的磷酸化和降解,从而调节特定基因的转录。缺乏Bri1受体激酶的突变植物对油菜素类固醇不敏感,因此矮化。
LRR受体激酶只是植物中许多跨膜受体丝氨酸/苏氨酸激酶类别中的一种。至少还有六个其他家族,每个家族都有自己特有的一组细胞外结构域。例如,凝集素受体激酶具有结合碳水化合物信号分子的细胞外结构域。拟南芥基因组编码了300多种受体丝氨酸/苏氨酸激酶,使其成为植物中已知的最大受体家族。许多受体参与对病原体的防御反应。乙烯阻断特定转录的降解各种植物生长调节剂(也称为植物激素)有助于协调植物发育。它们包括乙烯、生长素、细胞分裂素、赤霉素和脱落酸以及油菜素类固醇。生长调节剂都是由大多数植物细胞产生的小分子。它们很容易通过细胞壁扩散,可以局部起作用,也可以被运输到更远的地方影响细胞。每种生长调节剂都有多种作用。具体作用取决于环境条件、植物的营养状态、靶细胞的反应性,乙烯就是一个重要的例子。这种小气体分子(图1570A)可以以各种方式影响植物的发育;例如,它可以促进果实成熟、叶片脱落和植物衰老。它还可以作为对伤害、感染、洪水等的应激信号。例如,当发芽幼苗的枝条遇到障碍物时,乙烯会促进复杂的反应,使幼苗能够安全地绕过障碍物。植物有各种乙烯受体,它们位于内质网中,结构上都是相关的。它们是二聚体、多通道跨膜蛋白,具有含铜乙烯结合域和与称为CTR1的细胞质蛋白相互作用的域,该域在氨基酸序列上与前面讨论过的RafMAP激酶激酶激酶密切相关(见图1550)。令人惊讶的是,空受体是活跃的,并保持CTR1活跃。通过一种未知的信号机制,活性CTR1刺激核转录调节因子EIN3在蛋白酶体中的泛素化和降解,而EIN3是乙烯反应基因转录所必需的。这样,空的但活跃的受体就使乙烯反应基因处于关闭状态。乙烯结合使受体失活,改变其构象,使它们不再激活CTR1。EIN3蛋白不再泛素化和降解,现在可以激活大量乙烯的转录-图1571乙烯信号通路。(A)在没有乙烯的情况下,受体和CTR1是活跃的,导致EIN3泛素化和破坏,EIN3是细胞核中的转录调节蛋白,负责乙烯反应基因的转录。(B)乙烯的结合使受体失活并破坏CTR1的激活。EIN3蛋白不会降解,因此可以激活乙烯反应基因的转录。(A)乙烯不存在(B)乙烯存在
MBOC7_ptr_ch15_873-948.indd942MBOC7_ptr_ch15_873-948.indd94208/12/2112:24PM08/12/2112:24PM
942第15章:细胞信号传导943植物信号传导
生长素转运蛋白的调节定位模式植物生长
植物激素生长素(图1572A)与细胞核中的受体蛋白结合。它帮助植物向光生长,向上生长而不是分枝,
并向下生长根。它还调节器官的起始和定位,
并帮助植物开花结果。与乙烯(以及我们在本章中描述的一些动物信号分子)一样,生长素通过控制转录调节剂的降解来影响基因表达。它通过刺激阻遏蛋白的泛素化和降解来发挥作用,这些阻遏蛋白会阻止未受刺激的细胞中生长素靶基因的转录(图15-72B和C)。
生长素的运输方式很独特。与通常由特定内分泌腺分泌并通过循环系统运输到靶细胞的动物激素不同,生长素有自己的运输系统。特定的质膜结合流入转运蛋白和流出转运蛋白分别将生长素移入和移出植物细胞。外排转运蛋白可以在质膜上不对称分布,使生长素的流出具有方向性。例如,一排生长素外排转运蛋白局限于基底质膜的细胞将把生长素从植物顶部运输到在植物的某些区域,生长素转运蛋白的定位,以及生长素流动的方向,是高度动态和受调节的。细胞可以通过控制含有转运蛋白的囊泡的运输来快速重新分配转运蛋白。例如,生长素外排转运蛋白通常在细胞内囊泡和质膜之间循环。细胞可以通过抑制质膜一个域中的内吞作用来重新分配这些转运蛋白,从而使转运蛋白在那里积累。一个例子发生在根部,重力影响生长方向。生长素流出转运蛋白通常对称分布在根的冠细胞中。然而,在重力矢量方向改变的几分钟内,流出转运蛋白会重新分布到细胞的一侧,这样生长素就会被泵送到指向下方的根侧。由于生长素抑制根细胞伸长,生长素运输的这种重定向会导致根尖重新定向,植物色素检测红光,隐花色素检测植物发育受环境条件的影响很大。与动物不同,植物在环境变得不利时无法移动;它们必须适应,否则就会死亡。环境对植物最重要的影响是光,光是植物的能量来源,在植物的整个生命周期中都发挥着重要作用——从发芽、幼苗发育到开花和衰老。因此,植物进化出了大量感光蛋白来监测光的数量、质量、方向和持续时间。这些通常被称为光感受器。然而,因为术语“光感受器”也用于动物视网膜中的感光细胞(见图15-39),所以我们将使用术语“光蛋白”。所有光蛋白都通过共价连接的吸光发色团来感知光,发色团会根据光改变形状,然后诱导蛋白质构象的变化。最广为人知的植物光蛋白是
光敏色素,它存在于所有植物和一些藻类中,但在动物中不存在。它们是二聚体、细胞质丝氨酸/苏氨酸激酶,对红光和远红光的反应不同且可逆:红光
通常会激活光敏色素的激酶活性,而远红光会使其失活。当被红光激活时,光敏色素被认为会磷酸化自身
图1573生长素运输和根系重力感应。(AC)根对重力矢量的90°变化作出反应,并调整其生长方向,使其再次向下生长。对重力作出反应的细胞位于根冠的中心,而更靠后(在下侧)的表皮细胞会降低其伸长率以恢复向下生长。(D)根冠中重力响应细胞响应根的位移重新分配其生长素流出转运蛋白。这将生长素通量主要重定向到位移根的下部,在那里它抑制表皮细胞的伸长。这里显示的拟南芥根尖中生长素的不对称分布是间接评估的,使用编码与绿色荧光蛋白(GFP)融合的蛋白质的生长素响应报告基因;根部下方的表皮细胞是绿色的,而上方的表皮细胞不是绿色的,反映了生长素的不对称分布。根部不同区域细胞质膜中生长素流出转运蛋白的分布(显示为灰色矩形)用红色表示,生长素流出的方向用绿色箭头表示。(D,照片来自T.Paciorek
etal.,Nature435:12511256,2005年由NaturePublishingGroup出版。复制于
MBOC7_ptr_ch15_873-948.indd944MBOC7_ptr_ch15_873-948.indd94408/12/2112:24PM08/12/2112:24PM
944第15章:细胞信号传导945植物信号传导
然后磷酸化细胞中的一种或多种其他蛋白质。在某些光反应中,活化的光敏色素会转移到细胞核中,在那里激活转录调节因子来改变基因转录(图1574)。在其他情况下,活化的光敏色素会激活潜在的转录调节剂位于细胞质中,然后转移到细胞核中以调节基因转录。在其他情况下ses,激活的光敏色素触发细胞质中的信号通路,从而改变细胞的行为而不涉及细胞核。
植物使用另外两种光蛋白,即向光素和隐花色素来感知蓝光。向光素与质膜相关,是向光性(植物向光生长的趋势)的部分原因。
向光性由定向细胞伸长引起,这是由生长素刺激的,但向光素和生长素之间的联系尚不清楚。
隐花色素是对蓝光敏感的黄素蛋白。它们在结构上与蓝光敏感酶(称为光解酶)相关,后者参与修复除大多数哺乳动物外所有生物体中紫外线诱导的DNA损伤。与植物色素不同,隐花色素也存在于动物中,它们在昼夜节律中起着重要作用(见图1567)。
尽管人们认为隐花色素是从光解酶进化而来的,但它们
动物和植物细胞间信号传递机制既有相似之处,也有不同之处。动物严重依赖GPCR和RTK,而植物主要依赖受体丝氨酸/苏氨酸激酶类型的酶偶联受体,尤其是那些具有细胞外富含亮氨酸重复序列的受体。各种植物激素或生长调节剂,包括乙烯和生长素,有助于协调植物的发育。乙烯通过细胞内受体起作用,阻止特定核转录调节剂的降解,然后可以激活乙烯反应基因的转录。包括生长素在内的其他一些植物激素的受体也调节特定转录调节剂的降解,尽管细节各不相同。生长素信号传导的不同寻常之处在于它有自己高度受调控的运输系统,其中质膜结合生长素转运体的动态定位控制着生长素流动的方向,从而控制着植物生长的方向。光在调节植物发育方面起着重要作用。这些光反应由各种感光蛋白介导,包括对红光敏感的植物色素和对蓝光敏感的隐花色素和向光素。MBOC7_ptr_ch15_873-948.indd945MBOC7_ptr_ch15_873-948.indd94508/12/2112:24下午08/12/2112:24下午