第十七章 细胞周期
制造新细胞的唯一方法是复制已经存在的细胞。这个简单的事实最早是在十九世纪中叶建立的,它为生命的延续带来了深刻的信息。从单细胞细菌到多细胞哺乳动物,所有生物都是细胞反复生长和分裂的产物,这些过程可以追溯到30多亿年前地球上生命的开始。
细胞通过执行有序的事件序列进行繁殖,在这些事件中,它会复制其内容,然后一分为二。这种复制和分裂的循环被称为细胞周期,是所有生物繁殖的基本机制。在单细胞物种中,例如细菌和酵母,每次细胞分裂都会产生一个全新的生物体。在多细胞物种中,需要长时间和复杂的细胞分裂序列才能产生一个功能正常的生物体。即使在成人体内,通常也需要细胞分裂来替换死亡的细胞。事实上,我们每个人每秒钟都必须制造数百万个细胞才能生存:例如,如果所有细胞分裂都因暴露在非常大剂量的x射线下而停止,我们将在几天内死亡。
细胞周期的细节因生物体而异,并且在生物体生命的不同时期也各不相同。然而,某些特征是普遍存在的。至少,细胞必须完成其最基本的任务:将其遗传信息传递给下一代细胞。为了产生两个遗传上相同的子细胞,每个染色体中的DNA都会被忠实地复制以产生两个完整的副本。复制的染色体然后被分配(分离)到两个子细胞中,以便每个子细胞都收到整个基因组的副本(图171)。除了复制基因组外,大多数细胞还会复制其他细胞器和大分子;否则,子细胞每次分裂都会变小。为了保持大小,分裂细胞会协调其生长(即细胞质量的增加)与分裂。
本章介绍真核细胞周期的事件及其控制和协调方式。我们首先简要概述细胞周期。然后,我们描述细胞周期控制系统,这是一个复杂的调节蛋白网络,可触发周期的不同事件。接下来,我们详细考虑细胞周期的主要阶段,其中染色体被复制,然后分离到两个子细胞中。最后,我们考虑细胞外信号如何控制细胞生长和分裂的速度,以及这两个过程如何协调。
细胞周期概述
细胞周期最基本的功能是复制染色体中的大量DNA,然后将这些副本分离成两个遗传上相同的子细胞。这些过程定义了细胞周期的两个主要阶段。染色体复制发生在S期(S代表DNA合成),这需要10-12小时,占据典型哺乳动物细胞中细胞周期时间的一半左右。S期后,染色体分离和细胞分裂发生在M期(M代表有丝分裂),所需时间要少得多(哺乳动物细胞中不到一小时)。M期包括两个主要事件:核分裂或有丝分裂,在此过程中,复制的染色体分布到一对子核中;胞质分裂或胞质分裂,此时细胞本身一分为二(图17-2)。
在S期结束时,每对复制染色体中的DNA分子仍然交织在一起,并通过专门的蛋白质键紧密结合在一起。在有丝分裂的早期,在称为前期的阶段,两个DNA分子解开并凝结成对刚性、紧凑的杆状物,称为姐妹染色单体,它们仍然通过姐妹染色单体凝聚力连接在一起。当核膜解体时,姐妹染色单体对会附着在有丝分裂纺锤体上,纺锤体是一个巨大的双极微管阵列(第16章讨论)。
姐妹染色单体附着在纺锤体的相反极上,最终在称为中期的阶段在纺锤体赤道处对齐。在后期开始时,姐妹染色单体凝聚力的破坏使姐妹染色单体分离,它们被拉向纺锤体的相反极。然后纺锤体被拆解,分离的染色体在末期被包装到单独的细胞核中。然后,胞质分裂将染色体分裂成细胞分裂成两个,因此每个子细胞继承两个细胞核中的一个(图173)。
真核细胞周期通常由四个阶段组成
大多数细胞生长和使其蛋白质和细胞器质量翻倍所需的时间比复制染色体和分裂所需的时间要多得多。部分为了留出生长时间,大多数细胞周期都有间隙期(M期和S期之间的G1期和S期与有丝分裂之间的G2期)。因此,真核细胞周期传统上分为四个连续阶段:G1、S、G2和M。G1、S和G2合称为间期(图174,参见图173)。在培养中增殖的典型人类细胞中,间期可能占据24小时周期中的23小时,其中1小时为M期。细胞生长发生在整个细胞周期中。
两个间隙阶段不仅仅是允许细胞生长的简单时间延迟。它们还为细胞提供时间来监测内部和外部环境,以确保在细胞开始进行S期和有丝分裂的复杂事件之前,条件适宜且准备工作完成。G1期在这方面尤其重要。其长度可能因外部条件和来自其他细胞的细胞外信号而有很大差异。例如,如果细胞外条件不利,细胞会延迟通过G1的进程,甚至可能进入一种称为G0的特殊静止状态,它们可以在该状态下停留数天、数周甚至数年。事实上,许多细胞会永久停留在G0状态,直到生物体死亡。如果细胞外条件变得有利或引入生长和分裂的信号,G0中的细胞会通过G1中称为启动点(在酵母中)或限制点(在哺乳动物细胞中)的commitment点。我们将使用术语启动来表示酵母和动物细胞。过了这个点之后,细胞就开始进行DNA复制,即使刺激细胞生长和分裂的细胞外信号被移除。
并非所有细胞都会经历传统的四相细胞周期。例如,脊椎动物胚胎的早期卵裂分裂并不伴随细胞生长,这些快速分裂只是交替出现S和M阶段,中间没有间隙。另一个重要且常见的变异是细胞内周期,也称为细胞内再复制,其中发生多轮S阶段而没有中间的M阶段,从而产生具有许多副本的细胞,从而能够快速增加大量基因产物的产生。最后,正如我们稍后描述的,一些细胞类型在没有胞质分裂的情况下进行有丝分裂,从而产生具有多个细胞核的大细胞。
所有真核生物的细胞周期控制都相似
细胞周期的一些特征,包括完成某些事件所需的所有过程的时间,即使在同一生物体中,在不同细胞类型之间也存在很大差异。然而,在所有真核细胞中,细胞周期的基本组织基本相同,所有真核生物似乎都使用类似的机制和控制机制来驱动和调节细胞周期事件。例如,细胞周期控制系统的蛋白质最早出现在十多亿年前。值得注意的是,它们在进化过程中得到了很好的保存,以至于它们中的许多在从人类细胞转移到酵母细胞时都能完美地发挥作用。因此,我们可以研究各种生物体的细胞周期及其调控,并利用所有这些生物体的发现来绘制真核细胞如何分裂的统一图景。
在真核细胞周期的分析中使用了几种模型生物。芽殖酵母酿酒酵母和裂殖酵母粟酒裂殖酵母是简单的真核生物,它们可以利用强大的分子和遗传方法来识别和描述控制细胞分裂基本特征的基因和蛋白质。某些动物的早期胚胎,特别是青蛙非洲爪蟾的胚胎,是生化解剖细胞周期控制机制的极好工具,而果蝇果蝇则可用于遗传分析控制和协调多细胞生物细胞生长和分裂的机制。培养的人类细胞为分子和微观探索我们自身细胞分裂的复杂过程提供了一个极好的系统。
细胞周期进程可以通过多种方式研究
我们如何知道细胞在细胞周期中达到了哪个阶段?一种方法就是用显微镜观察活细胞。观察培养中增殖的哺乳动物细胞群,可以发现一部分细胞已经变圆并处于有丝分裂状态(细胞变圆使有丝分裂纺锤体更有效地发挥作用)。可以观察到胞质分裂过程中的其他细胞。我们可以用DNA结合荧光染料(显示有丝分裂中染色体的凝聚)或识别特定细胞成分(如微管)的抗体(显示有丝分裂纺锤体)对细胞进行染色,从而获得有关细胞周期位置的其他线索。可以通过向S期细胞提供可可视化的分子来识别S期细胞,这些分子被整合到新合成的DNA中,例如人工胸苷类似物5-乙炔基-2'-脱氧尿苷(EdU);然后,通过使用与EdU共价连接的荧光染料处理,显示已掺入EdU的细胞核(图175)。通常,在一群培养的哺乳动物细胞中,所有细胞都在快速但异步地增殖,大约30到40%的细胞会在任何时刻处于S期,并通过EdU的短暂脉冲进行标记。根据此类细胞群中被标记的细胞比例,我们可以估计S期的持续时间占整个细胞周期持续时间的比例。同样,根据有丝分裂细胞比例(有丝分裂指数),我们可以估计M期的持续时间。细胞周期阶段的时间也可以在活细胞中使用荧光标记的蛋白质来测量,这些蛋白质在特定阶段出现和消失(图176)。
评估细胞在细胞周期中所处阶段的另一种方法是测量其DNA含量,DNA含量在S期翻倍。这种方法在很大程度上得益于荧光DNA结合染料和流式细胞仪的使用,它们可以快速自动分析大量细胞(图177)。我们可以使用流式细胞仪通过测量细胞群中的DNA含量来确定G1、S和G2+M期细胞的比例。
摘要
细胞分裂通常始于细胞内容物的复制,然后是y将这些内容分配到两个子细胞中。染色体复制发生在细胞周期的S期,而大多数其他细胞成分则在整个周期中不断复制。在M期,复制的染色体被分离到单个细胞核中(有丝分裂),然后细胞分裂成两个(胞质分裂)。S期和M期通常被称为G1和G2的间隙期分开,此时各种细胞内和细胞外信号调节细胞周期进程。细胞周期的组织和控制在进化过程中得到了高度保守,对各种生物的研究已经形成了对真核细胞周期控制的统一观点。
细胞周期控制系统
多年来,细胞生物学家观看了DNA合成、有丝分裂和胞质分裂的木偶戏,但不知道幕后控制这些事件的是什么。甚至不清楚是否存在一个单独的控制系统,或者DNA合成、有丝分裂和胞质分裂过程是否以某种方式自我控制。20世纪80年代末,随着控制系统关键蛋白质的识别,以及认识到它们与执行DNA复制、染色体分离等过程的蛋白质不同,出现了重大突破。
在本节中,我们首先考虑细胞周期控制系统运行的基本原理。然后,我们讨论系统的蛋白质成分,以及它们如何协同工作以计时和协调细胞周期事件。
细胞周期控制系统触发细胞周期的主要事件
细胞周期控制系统的运行方式与计时器非常相似,它按设定的顺序触发细胞周期的事件(图178)。例如,在最简单的形式中,如早期动物胚胎的简化细胞周期所示,控制系统被严格编程以提供完成每个细胞周期事件的固定时间。这些早期胚胎分裂中的控制系统独立于它所控制的事件,因此即使这些事件发生,其计时机制仍会继续运行系统会失效。然而,在大多数细胞中,控制系统确实会对从其控制的过程收到的信息作出反应。例如,如果某些故障阻碍了DNA合成的成功完成,则会向控制系统发送信号以延迟进入M期。这种延迟为机器的修复提供了时间,并且还可以防止如果周期过早进入下一阶段并分离不完全复制的染色体而可能导致的灾难。
细胞周期控制系统基于一系列连接的生化开关,每个开关都会启动特定的细胞周期事件。该开关系统具有许多重要特征,可提高细胞周期进程的准确性和可靠性。首先,开关通常是二进制的(开/关),并以完整、不可逆的方式启动事件。例如,如果染色体凝聚或核膜破裂等事件仅部分开始而未完成,显然将是灾难性的。其次,细胞周期控制系统非常强大和可靠,即使某些组件发生故障,该系统也能在各种条件下有效运行。最后,控制系统具有高度适应性,可以进行修改以适应特定细胞类型或响应特定的细胞内或细胞外信号。
在大多数真核细胞中,细胞周期控制系统在三个主要调节转换处控制细胞周期进程(见图178)。第一个是G1晚期的起始点(或限制点),此时细胞致力于进入细胞周期和染色体复制。第二个是G2/M转换,此时控制系统触发早期有丝分裂事件,导致中期有丝分裂纺锤体上的染色体排列。第三个阶段是中期到后期的过渡,此时控制系统刺激姊妹染色单体分离,导致有丝分裂和胞质分裂完成。控制系统阻止进程如果检测到细胞内部或外部的问题,它会通过这些转换中。例如,如果控制系统感觉到DNA复制完成存在问题,它会将细胞保持在G2/M转换,直到这些问题得到解决。同样,如果细胞外条件不适合细胞增殖,控制系统会阻止细胞通过Start的进展,从而阻止细胞分裂,直到条件变得有利。
细胞周期控制系统依赖于周期性激活的周期蛋白依赖性蛋白激酶
细胞周期控制系统的核心成分是蛋白激酶家族的成员,称为细胞周期依赖性激酶(Cdks)。这些激酶的活性随着细胞在周期中的进展而上升和下降,导致启动或调节细胞周期主要事件的细胞内蛋白质磷酸化的周期性变化。例如,G2/M转换时Cdk活性的增加会增加控制染色体凝聚、核膜破裂、纺锤体组装和早期有丝分裂中发生的其他事件的蛋白质的磷酸化。
Cdk活性的周期性变化由一系列复杂的其他蛋白质控制。这些Cdk调节剂中最重要的是称为周期蛋白的蛋白质。顾名思义,Cdks的活性依赖于周期蛋白:除非它们与周期蛋白紧密结合,否则它们没有蛋白激酶活性(图179)。
周期蛋白最初之所以被命名为周期蛋白,是因为它们在每个细胞周期中都会经历一个合成和降解的循环。相比之下,Cdk蛋白的水平是恒定的。周期蛋白水平的周期性变化导致周期蛋白Cdk复合物在特定时间周期性组装和激活细胞周期的各个阶段。
有三种主要的周期蛋白,每种都由它们结合Cdks并发挥其功能的细胞周期阶段定义(图1710):
1.G1/S-周期蛋白在G1晚期激活Cdks,从而帮助触发从起始阶段的进展,导致细胞周期进入。它们的水平在S期下降。
2.S-周期蛋白在从起始阶段进展后不久与Cdks结合,并帮助刺激染色体复制。S-周期蛋白水平一直保持升高直到有丝分裂,这些周期蛋白也有助于控制一些早期有丝分裂事件。
3.M-周期蛋白激活Cdks,在G2/M过渡期刺激进入有丝分裂。M-周期蛋白水平在有丝分裂中期下降。
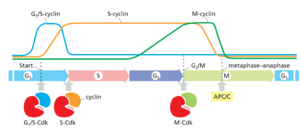
在大多数细胞中,第四类周期蛋白,即G1-周期蛋白,有助于控制G细胞的活动1/S-周期蛋白,从而控制G1晚期开始的进程。
在酵母细胞中,单个Cdk蛋白结合所有类别的周期蛋白,并通过在周期的不同阶段改变周期蛋白伴侣来触发不同的细胞周期事件。
相比之下,在脊椎动物细胞中有四种Cdk。两种与G1-周期蛋白相互作用,一种与G1/S-和S-周期蛋白相互作用,一种与S-和M-周期蛋白相互作用。在本章中,我们
简单地将不同的周期蛋白Cdk复合物称为G1-Cdk、G1/S-Cdk、S-Cdk和M-Cdk。表171列出了各个Cdk和周期蛋白的名称。
单独的周期蛋白结合不能完全激活相关的Cdk。完全激活需要一种单独的激酶,即Cdk活化激酶(CAK),它磷酸化Cdk活性位点入口附近的氨基酸。这会导致构象变化,从而大大增加Cdk亚基的活性(图1711)。CAK活性在整个细胞周期中保持不变,因此这种修饰在整个周期中都会发生。在某些细胞周期阶段,一种称为Wee1的蛋白激酶对激酶活性位点附近的一对氨基酸进行磷酸化,可抑制Cdk活性。一种称为Cdc25的磷酸酶对这些位点进行去磷酸化,可增加Cdk活性(图1712)。这种调节机制尤为重要-用于在有丝分裂开始时,我们将在后面讨论。
细胞周期早期中G1/S-和S-Cdks的活动部分由Cdk抑制蛋白(CKI)控制。这些小蛋白包裹在周期蛋白Cdk复合物周围,促进Cdk活性位点的重排,使其失活(图1713)。
蛋白磷酸酶逆转Cdks的作用
正如我们在第3章和第15章中了解到的那样,蛋白质磷酸化不仅受附着磷酸盐的蛋白激酶控制,还受去除磷酸盐的蛋白磷酸酶控制。因此,逆转Cdks和其他激酶作用的磷酸酶是细胞周期控制系统中的关键参与者。
我们可以将蛋白质磷酸化水平想象成水槽中的水位,这取决于水从水龙头流入的速度(蛋白激酶活性)和从排水管流出的速率(磷酸酶活性)。提高水位最快的方法是在增加水龙头流量的同时堵住排水管。事实上,我们会看到,当Cdk活性增加时,磷酸酶的活性趋于下降,从而导致蛋白质磷酸化状态更加强劲地增加。
蛋白磷酸酶2A(PP2A)是细胞周期中Cdk底物的一个特别重要的调节剂。这种三亚基酶有多种形式,取决于称为调节亚基或B亚基的亚基的身份(图1714)。B亚基影响酶的底物选择性、定位和调节。两个B亚基,B55和B56,是最重要的。
与B55亚基相关的PP2A的细胞周期调控尤其容易理解,并说明了在细胞周期中如何协调相反的Cdk和磷酸酶活性。PP2A-B55活性在间期很高,但在有丝分裂早期(当M-Cdk活性升高时)受到抑制。潜在机制在概念上很简单:M-Cdk通过磷酸化一种名为Greatwall的中间蛋白激酶关闭PP2A-B55(图1715)。因此,M-Cdk的激酶活性在有丝分裂早期相对不受阻碍,导致M-Cdk底物的快速磷酸化。当后期开始时并且M-Cdk活性在周期蛋白破坏后下降,系统反向工作:PP2A-B55被重新激活以促进后期和末期Cdk底物的快速去磷酸化。
数百种Cdk底物以确定的顺序被磷酸化
Cdks催化细胞中数百种不同蛋白质的磷酸化。但显然,这些蛋白质并非同时全部被磷酸化:例如,在S期早期触发DNA复制的蛋白质比在有丝分裂早期促进纺锤体组装的蛋白质更早被磷酸化。如何实现底物磷酸化的正确排序?
答案只是部分理解。首先,很明显,周期蛋白不仅激活Cdk伙伴,还将其引导至特定的靶蛋白。每个周期蛋白的表面都含有一个在某些Cdk底物上发现的短氨基酸序列的结合位点。因此,每个周期蛋白Cdk复合物与特定靶标更紧密地相互作用:例如,S-Cdk对DNA复制蛋白具有高亲和力,因此以高速率磷酸化这些蛋白质,同时基本上忽略低亲和力的有丝分裂靶标。因此,底物磷酸化的顺序可能部分取决于每个周期蛋白Cdk复合物的激活时间。
然而,周期蛋白特异性并不是全部。即使是同一种周期蛋白Cdk复合物,在周期的不同时间也能诱导不同的效应,这表明单一酶以特定的顺序磷酸化不同的靶标。这种顺序很可能是由于Cdk活性位点和底物之间相互作用的亲和力不同:高亲和力的底物更早被磷酸化。酶活性的总量也很重要:例如,M-Cdk活性在细胞有丝分裂过程中持续升高,某些低亲和力靶标在有丝分裂后期被磷酸化,而磷酸化可能需要更高的活性。
最后,我们不能忘记,蛋白质磷酸化的时间也取决于相反的磷酸酶,每种磷酸酶的活化时间、定位和对特定靶标的亲和力都不同。考虑到所有这些因素的作用,很容易看出,多种机制的组合很可能在细胞周期中产生蛋白质磷酸化的完美定时编排。解开这些机制是当前研究的主要目标。
正反馈产生细胞周期转换的开关式行为
如前所述,细胞周期控制系统的一个关键特征是它能够产生开关式二元决策:通过每个主要细胞周期转换的进展都是一个完整的、不可逆转的承诺。细胞周期控制系统通过使用正反馈实现这种行为。正如我们在第8章和第15章中讨论的那样,正反馈经常用于细胞调节以产生强大的、全有或全无的调节效应,并且这种机制非常适合产生在细胞周期进展中至关重要的开关行为。
M-Cdk在G2/M转换中的激活提供了细胞周期控制中正反馈最容易理解的例子。M-Cdk激活始于G2期间M-周期蛋白的积累,这导致细胞接近有丝分裂时M-Cdk复合物的相应积累。虽然这些复合物中的Cdk亚基在激活位点被Cdk活化激酶(CAK)磷酸化,如前所述,但蛋白激酶Wee1通过在两个相邻位点抑制磷酸化使其处于非活性状态(见图1712)。因此,当细胞到达G2期末时,它含有丰富的M-Cdk储备,这些储备已准备就绪并准备发挥作用,但受到阻断激酶活性位点的磷酸盐的抑制。那么,是什么导致了M-Cdk储备的激活呢?关键事件是蛋白磷酸酶Cdc25的激活,它去除了抑制M-Cdk的抑制性磷酸盐(图1716)。同时,激酶Wee1的抑制活性受到抑制,进一步确保M-Cdk活性增加。值得注意的是,Cdc25至少部分地被其靶标M-Cdk激活。M-Cdk还抑制抑制性激酶Wee1。M-Cdk能够激活其自身的激活剂(Cdc25)并抑制其自身的抑制剂(Wee1),从而产生正反馈(见图1716)。结果是细胞中的所有M-Cdk复合物都被迅速且不可逆地激活,导致驱动有丝分裂早期事件的许多蛋白质快速磷酸化。
与所有正反馈系统一样,必须存在某种外部触发机制,首先释放反馈回路,在这种情况下,会导致Cdc25活性略有增加。有丝分裂触发机制尚不清楚,但很可能是在G2和早期前期活跃的S-Cdks有助于启动Cdc25活化。
正如我们之前讨论的那样,早期有丝分裂中蛋白质磷酸化的增加还取决于M-Cdk通过蛋白激酶Greatwall抑制磷酸酶PP2A-B55的能力(见图1715)。值得注意的是,PP2A-B55可以通过去磷酸化并从而抑制其抑制剂Greatwall进行反击。
这种相互拮抗本质上是一种正反馈形式:当通过增加M-Cdk触发少量Greatwall激活时,由此产生的PP2A-B55抑制会增加Greatwall磷酸化和激活,系统会突然切换到低PP2A-B55活性状态。
该系统的一个迷人之处在于PP2A-B55也是M-Cdk激活的抑制剂,因为它使Cdc25(导致其失活)和Wee1(导致其激活)去磷酸化(见图1716)。因此,M-Cdk和PP2A-B55是相互拮抗剂,产生了另一层正反馈。
总体结果是一个非凡的调节回路,其中两个正反馈回路本身通过正反馈连接在一起(图1717)。这种高度集成的反馈系统会产生一个强大的生化开关,即使某些组件发生故障,它也能正常工作。
M-Cdk底物的去磷酸化对于有丝分裂和胞质分裂的完成至关重要。在有丝分裂早期促进磷酸化的正反馈回路可以在后期翻转到替代的去磷酸化状态,此时M-Cdk因周期蛋白的破坏而突然失活。我们接下来讨论周期蛋白破坏的机制。
后期促进复合物/周期蛋白(APC/C)触发中期到后期的转变
特定周期蛋白Cdk复合物的激活会推动Start和G2/M转变的进程(见图1710),而中期到后期的转变进程不是由蛋白质磷酸化触发的而是由蛋白质破坏触发的,从而导致细胞分裂的最后阶段。
关键中期到后期转变的关键调节器是后期促进复合体或cyclosome(APC/C),它是泛素连接酶家族的成员。如第3章所述,泛素连接酶用于多种细胞过程,以刺激特定调节蛋白的蛋白酶解破坏。它们多泛素化特定靶蛋白,导致其在蛋白酶体中被破坏。其他泛素连接酶标记蛋白质用于破坏以外的目的(第3章讨论)。
APC/C催化两种主要蛋白质的泛素化和破坏。第一种是securin;它在中期的破坏会激活一种蛋白酶,该蛋白酶会分离姐妹染色单体对并释放后期,如下所述。S和M周期蛋白是APC/C的第二大靶点。破坏这些周期蛋白会使细胞中的大多数Cdks失活(见图1710)。因此,从S期到有丝分裂早期被Cdks磷酸化的许多蛋白质在后期细胞中被PP2A和其他磷酸酶去磷酸化。Cdk靶点的这种去磷酸化是完成M期所必需的,包括有丝分裂的最后步骤和胞质分裂。
APC/C活性在有丝分裂中期增加,并在G1期保持高活性。激活主要取决于与两个激活亚基之一:Cdc20或Cdh1的结合。这些亚基对APC/C活性至关重要,原因有两个。首先,它们的结合会引起构象变化,从而增强酶活性。其次,它们为酶的蛋白质底物提供主要结合位点。激活剂与APC/C底物上的短氨基酸序列相互作用,将它们固定在原位,而APC/C在靶标上构建多泛素链(图1718)。
两个APC/C激活剂亚基依次与APC/C相互作用。Cdc20首先在中期起作用,触发securin和周期蛋白的破坏,导致后期染色体分离。然后Cdc20被Cdh1取代,后者在晚期有丝分裂和G1期维持APC/C活性,确保周期蛋白和其他蛋白质保持在低水平,直到下一个细胞周期。
Cdc20和Cdh1依次激活APC/C是基于M-Cdk的相反作用:磷酸化激活APC/C-Cdc20并抑制APC/C-Cdh1。因此,当M-Cdk水平在有丝分裂早期升高时,APC/C-Cdc20被开启,而APC/C-Cdh1激活仅在M-Cdk活性因后期周期蛋白破坏而下降后发生(图17-19)。
细胞周期控制系统还使用另一种称为SCF的泛素连接酶(见图3-67)。它在细胞周期中的主要作用是在G1期晚期泛素化某些CKI蛋白,从而帮助控制S-Cdks的激活和DNA复制。SCF还负责在S期早期破坏G1/S-周期蛋白。SCF活性依赖于称为F-box蛋白的底物结合亚基。然而,与APC/C活性不同,SCF活性在细胞周期中是恒定的。SCF的泛素化由其靶蛋白的磷酸化状态的变化控制,因为F-box亚基仅识别特异性磷酸化的蛋白质。
G1期是Cdk失活的稳定状态
M期后期的一个关键调节事件是Cdks的失活,这会在细胞准备进入新细胞周期时重置细胞周期控制系统。在大多数细胞中,这种Cdk失活状态会产生稳定的G1间隙期,在此期间,细胞生长并监测其环境,然后进入新细胞周期。
细胞采用多种机制来抑制有丝分裂后的Cdk活性。正如我们刚刚看到的,一种机制取决于APC/C-Cdh1的晚期有丝分裂激活,这确保了周期蛋白破坏在整个G1期持续进行。抑制Cdk的第二种机制取决于CKI(前面讨论过的Cdk抑制蛋白)的增加。
芽殖酵母细胞是这种机制最容易理解的细胞,它含有一种名为Sic1的CKI蛋白,该蛋白在有丝分裂晚期和G1中与M-Cdk结合并使其失活。与Cdh1一样,Sic1受到M-Cdk的抑制,后者在有丝分裂期间磷酸化Sic1,从而促进其被SCF泛素化。因此,Sic1和M-Cdk就像Cdh1和M-Cdk一样,相互抑制,从而产生更多的正反馈例子。结果,在有丝分裂晚期发生的M-Cdk活性下降导致Sic1蛋白积累,而这种CKI有助于在有丝分裂后保持M-Cdk活性较低。一种名为p27的CKI蛋白可能在动物细胞中发挥类似功能。
在许多细胞中,M-周期蛋白基因转录减少有助于降低有丝分裂晚期的M-Cdk活性。例如,在芽殖酵母中,M-Cdk促进这些基因的表达,从而产生另一个正反馈回路。当细胞退出有丝分裂时,该环路被关闭:Cdh1和Sic1使M-Cdk失活,导致M-周期蛋白基因转录减少,从而导致M-周期蛋白合成减少。促进G1/S和S-周期蛋白表达的基因调节蛋白也在G1期间受到抑制。
因此,APC/C-Cdh1活性、CKI积累和周期蛋白基因表达减少共同作用,确保G1期是大多数Cdk活性受到抑制的时期。与细胞周期控制的许多其他方面一样,使用多种调节机制可以使系统以合理的效率运行,即使一种机制有缺陷。那么细胞如何逃离这种稳定的G1状态以启动新的细胞周期呢?答案是,G1/S-Cdk活性(在G1晚期升高)释放了所有抑制Cdk活性的制动机制,正如我们在本章后面讨论细胞增殖控制时所描述的那样。
细胞周期调控系统作为一连串生化开关发挥作用
表17-2总结了细胞周期控制系统的一些主要组成部分。这些蛋白质在功能上相互连接,形成一个强大的网络,该网络基本上自主运行以激活一系列生化开关,每个开关都会触发特定的细胞周期事件。
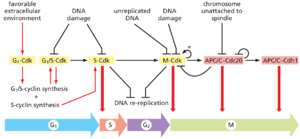
当细胞增殖条件合适时,各种外部和内部信号刺激G1-Cdk的活化,进而刺激编码G1/S和S-周期蛋白的基因的表达(图1720)。G1/S-Cdk的活化随后推动通过Start的进展,部分是通过释放许多上述抑制机制来抑制G1期的Cdk活性。通过我们稍后讨论的机制,G1/S-Cdks还会释放一波S-Cdk活性,它在S期启动染色体复制,也有助于M-Cdk激活和有丝分裂的一些早期事件。然后,M-Cdk触发G2/M转换和早期有丝分裂事件的进展,导致有丝分裂纺锤体上姊妹染色单体对的排列。最后,M-Cdk还激活APC/CCdc20,从而触发securin和cyclins的破坏,导致姊妹染色单体分离和晚期有丝分裂事件。Cdk失活还会导致APC/C-Cdh1和其他抑制Cdk活性的机制的激活,从而导致稳定的G1期。我们现在准备更详细地讨论这些细胞周期阶段,从S期开始。
摘要
细胞周期控制系统触发细胞周期事件并确保它们的时间安排正确且相互协调。控制系统的核心成分是周期蛋白依赖性蛋白激酶(Cdks),其活性依赖于周期蛋白亚基。不同周期蛋白Cdk复合物的活性波动控制着各种细胞周期事件。因此,S期周期蛋白Cdk复合物(S-Cdk)的激活会启动S期,而M期周期蛋白Cdk复合物(M-Cdk)的激活会触发有丝分裂。控制周期蛋白Cdk复合物活性的机制包括Cdk亚基的磷酸化和Cdk抑制蛋白(CKI)的结合。包括PP2A在内的蛋白磷酸酶会抑制Cdks的作用,从而帮助控制Cdk底物磷酸化,从而控制细胞周期进程。细胞周期控制系统还在很大程度上依赖于一种名为APC/C的泛素连接酶,该酶催化泛素化并随之破坏周期蛋白和其他调控蛋白,这些蛋白控制着晚期有丝分裂的进程。细胞周期控制系统的许多组成部分共同组装成一个复杂的调控系统,其中包含一系列相互关联的生化开关,可推动细胞周期各个阶段的逐步进展。
S期
真核细胞的线性染色体是DNA和蛋白质的庞大而动态的组装体,它们的复制是一个复杂的过程,占据了细胞周期的大部分时间。不仅每条染色体的长DNA分子必须被准确复制(这本身就是一项了不起的壮举),而且该DNA的每个区域的染色质蛋白质也必须被复制,以确保子细胞继承染色体结构的所有特征。
DNA复制给细胞带来了两个问题。首先,复制必须极其精确地进行,以最大限度地降低下一代细胞发生突变的风险。其次,基因组中的每个核苷酸必须复制一次,但只能复制一次,以防止基因扩增的破坏性影响。在第5章中,我们讨论了以惊人的速度和准确性进行DNA复制的复杂蛋白质机制。在本节中,我们将考虑细胞周期控制系统启动复制过程的精妙机制,同时防止其在每个周期中发生超过一次。
S-Cdk在每个细胞周期中只启动一次DNA复制
正如我们在第5章中讨论的那样,真核细胞中的DNA复制始于复制起点,这些起点分散在每个染色体的许多位置。在S期,当DNA解旋酶解开双螺旋并将DNA复制酶加载到两个单链模板上时,DNA复制在这些起点处启动。这导致复制的延长阶段,此时复制机制从两个复制叉处的起点向外移动。
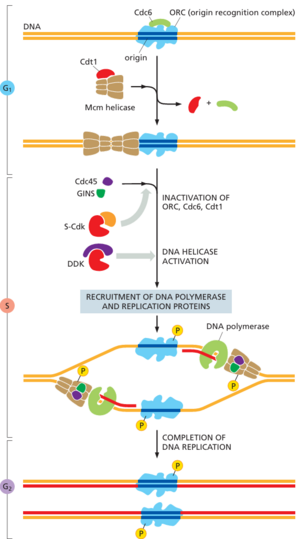
为了确保染色体复制在每个细胞周期中只发生一次,DNA复制的启动分为两个不同的步骤,发生在细胞周期的不同时间(图1721)。第一步只发生在有丝分裂晚期或G1期早期,两个不活跃的DNA解旋酶(称为Mcm解旋酶)被加载到复制起点的DNA上。此步骤有时称为复制起点许可licensing of replication origins ,因为只有在预先加载了Mcm解旋酶的起点上才允许启动DNA合成。第二步发生在S期,此时Mcm解旋酶被激活,主要由S-Cdks激活,导致DNA解旋并启动DNA合成。一旦复制起点以这种方式被激活,它就不能被重新使用,直到新的Mcm解旋酶被加载到该起点,这只能在细胞达到晚期有丝分裂或G1期时发生。因此,起点每个细胞周期只能被激活一次,确保DNA被复制一次且仅一次。
图17-22说明了DNA复制启动中两个步骤控制的一些分子细节。一个关键因素是称为起点识别复合物(ORC)的大型多蛋白复合物,它与复制起点结合。在有丝分裂后期和G1早期,蛋白质Cdc6和Cdt1与ORC协作,将Mcm解旋酶加载到DNA附近的起点附近。起点现在已获得复制许可。
在S期开始时,S-Cdk通过磷酸化特定的辅助蛋白触发起点激活,这些辅助蛋白结合并激活起点处的Mcm解旋酶。两条DNA链分离,活性解旋酶被加载到每条链周围。DNA合成机制被招募到起点,DNA合成开始。另一种称为DDK的蛋白激酶也在S期被激活,并通过磷酸化Mcm解旋酶的特定亚基来帮助驱动起点激活。
在S-Cdk启动DNA复制的同时,S-CDk也采用多种机制来阻止起点处新Mcm解旋酶的加载。S-Cdk磷酸化并从而抑制ORC和Cdc6蛋白。APC/C-Cdh1的失活(在G1期末期)也有助于防止Mcm解旋酶加载,如下所示。在有丝分裂晚期和G1期早期,APC/C-Cdh1触发Cdt1抑制剂(称为geminin)的破坏,从而使Cdt1活跃。当APC/C-Cdh1在G1期末期关闭时,geminin会积聚并抑制与DNA不相关的Cdt1。此外,Cdt1与活性复制叉上的蛋白质结合会刺激Cdt1泛素化,这种泛素连接酶称为CRL4-Cdt2,从而导致Cdt1降解。通过这些不同的方式,Mcm复合物的加载从S期到有丝分裂中期都被阻断。因此,一旦使用了起点,就不能在同一细胞周期中用新的Mcm复合物重新加载。
那么,细胞周期控制系统是如何重置的,以允许在下一个细胞周期中进行复制?在有丝分裂后期,APC/C激活会导致Cdks失活和geminin破坏。ORC和Cdc6被去磷酸化,Cdt1被激活,从而允许Mcm解旋酶加载,为细胞进入下一个S期做好准备。
染色体复制需要染色质结构的复制
染色体的DNA与多种蛋白质成分复合,包括组蛋白和参与控制基因表达的各种调节蛋白(第4章讨论)。因此,染色体的复制不仅仅是复制其核心的DNA,还需要复制这些染色质蛋白及其在DNA上的正确组装。
染色质蛋白的产生在S期增加,以提供包装新合成DNA所需的原材料。最重要的是,S-Cdks刺激四个组蛋白亚基的合成大幅增加,这些亚基形成每个核小体核心的组蛋白八聚体。
这些亚基通过核小体组装因子组装成DNA上的核小体,这些因子通常与复制叉相关,并在核小体从DNA合成机制中出现时将其分布在DNA的两条链上。染色质包装有助于控制基因表达。在染色体的某些部分,染色质高度浓缩,称为异染色质,而在其他区域,染色质具有更开放的结构,称为真染色质(第4章讨论)。染色质结构的这些差异取决于多种机制,包括组蛋白尾部的修饰和非组蛋白的存在。由于这些差异在基因调控中很重要,因此染色质结构(如其中的DNA)在S期准确再现至关重要。然而,染色质结构是如何再现的还不太清楚。在DNA合成过程中,组蛋白修饰酶和各种非组蛋白可能在两条新的DNA链从复制叉中出现时沉积在它们上面,这些蛋白质被认为可以复制母体染色体的局部染色质结构(见图444)。
黏连蛋白保持姐妹染色单体结合在一起
在S期结束时,每个复制的染色体由一对沿其长度粘合在一起的相同姐妹染色单体组成。这种姐妹染色单体的凝聚力为成功的有丝分裂奠定了基础,因为它极大地促进了两个姐妹染色单体附着在有丝分裂纺锤体的相反极上。想象一下,如果姐妹染色单体在S期后分开,实现双极纺锤体附着将有多么困难。事实上,例如,酵母突变体中姐妹染色单体凝聚力的缺陷不可避免地会导致染色体分离的重大错误。
姐妹染色单体的凝聚力依赖于一种称为黏连蛋白的大型蛋白质复合物,它形成一个围绕两个染色单体的环状结构(图1723)。在S期之前,黏连蛋白首先在专门的加载复合物的帮助下加载到未复制的染色体周围。在S期期间,通过尚不清楚的机制,黏连蛋白环在复制叉通过时保持在原位,这样黏连蛋白环在合成新的姐妹染色单体对时就环绕着它们。同样在S期,乙酰转移酶会修饰黏连蛋白的一部分,将它们锁定在姐妹染色单体周围,以提供稳定的姐妹染色单体黏连,这是将姐妹染色单体保持在一起直到有丝分裂所必需的。
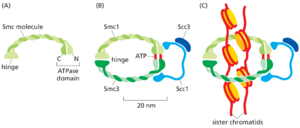
姐妹染色单体黏连也至少部分地来自姐妹DNA分子的缠绕,这种缠绕发生在DNA合成过程中两个复制叉相遇时。拓扑异构酶II酶通过切割一个DNA分子、让另一个DNA分子穿过断裂处,然后重新密封切割的DNA,在S期和早期有丝分裂之间逐渐解开姐妹DNA(见图523)。一旦缠绕被去除,姐妹染色单体黏连就依赖于黏连蛋白。因此,在中期到后期的过渡中,姐妹黏连的丧失主要取决于这些复合物的破坏,我们将在后面进行描述。
摘要
S期染色体的复制涉及每个染色体中整个DNA分子的准确复制,以及与DNA相关并控制染色体功能各个方面的染色质蛋白的复制。染色体复制由S-Cdk的激活触发,S-Cdk激活蛋白质,使DNA解开并在复制起点处启动其复制。一旦复制起点被激活,S-Cdk还会抑制允许该起点再次启动DNA复制所需的蛋白质。因此,每个起点在每个S期只被激发一次,并且不能重复使用,直到下一个细胞周期。在S期,复制的染色体通过黏连蛋白连接在一起,黏连蛋白提供姐妹染色单体黏连力,这是有丝分裂中双极纺锤体上姐妹染色单体对对齐所必需的。
有丝分裂
在S期完成并过渡到G2期后,细胞经历了M期的剧烈变化。这始于有丝分裂,在此期间,姊妹染色单体分离并分布(分离)到一对相同的子核中,每个子核都有自己的基因组副本。有丝分裂传统上分为五个阶段:前期、前中期、中期、后期和末期,主要根据显微镜下看到的染色体行为来定义。有丝分裂完成后,M期胞质分裂的第二个主要事件将细胞分成两半,每半都有相同的细胞核。面板171总结了M期的主要事件(电影17.2、电影17.3、电影17.4和电影17.5)。
从调节的角度来看,有丝分裂可以分为两个主要部分,每个部分都由细胞周期控制系统的不同组成部分控制。首先,G2/M转换时M-Cdk活性的增加触发了早期有丝分裂(前期、前中期和中期)事件。M-Cdk和其他有丝分裂蛋白激酶磷酸化多种蛋白质,导致有丝分裂纺锤体的组装及其与姐妹染色单体对的附着。
有丝分裂的第二个主要部分始于中期到后期的过渡,此时APC/C触发了securin的破坏,释放出一种蛋白酶,该蛋白酶裂解黏连蛋白,从而启动姐妹染色单体的分离。APC/C还促进周期蛋白的破坏,从而导致Cdk失活和Cdk靶标的去磷酸化,这是M期后期事件所必需的,包括后期的完成、有丝分裂纺锤体的解体以及细胞通过胞质分裂而分裂。
M-Cdk和其他蛋白激酶驱动有丝分裂的进入
细胞周期控制最显著的特征之一是,单一蛋白激酶M-Cdk会引起有丝分裂早期发生的许多多样而复杂的细胞重排。至少,M-Cdk必须诱导有丝分裂纺锤体的组装并确保一对姐妹染色单体都附着在纺锤体的相反极上。它还会触发染色体凝聚,即将相互缠绕的姊妹染色单体大规模重组为紧密的棒状结构。在动物细胞中,M-Cdk还会促进核膜的分解以及肌动蛋白细胞骨架和高尔基体的重排。当M-Cdk磷酸化参与该过程的特定蛋白质时,这些过程便会启动。许多Cdk底物已被鉴定,在许多情况下,我们非常详细地了解了它们的磷酸化如何改变其功能。M-Cdk直接磷酸化参与有丝分裂过程的许多蛋白质,但它也通过磷酸化并激活其他执行某些有丝分裂功能的蛋白激酶来间接发挥作用。两种蛋白激酶家族,即Polo样激酶和Aurora激酶,对早期有丝分裂事件的控制做出了特别重要的贡献。例如,Polo样激酶Plk1是双极有丝分裂纺锤体正常组装所必需的,部分原因是它磷酸化了参与有丝分裂早期纺锤体极点分离的蛋白质。Aurora激酶Aurora-A也有助于控制控制纺锤体组装和稳定性的蛋白质,而Aurora-B控制姐妹染色单体与纺锤体的附着,我们将在后面讨论。
凝聚蛋白有助于配置重复染色体以进行分离
在S期结束时,姐妹染色单体的超长DNA分子缠绕在部分交织的DNA和蛋白质团块中。在此状态下,任何试图将姐妹染色体拉开的尝试无疑都会导致染色体断裂。为了避免这种灾难,细胞在有丝分裂早期投入大量时间和精力将姐妹染色单体重组为相对较短、不同的结构,以便在后期更容易被拉开。这些染色体变化涉及两个重叠的过程:染色体凝聚,其中染色单体被显著压缩;姐妹染色单体分解,其中两个姐妹被分解成不同的可分离单元(图1724A)。分解是由于姐妹DNA解开,同时染色体臂上的黏连蛋白分子被部分去除。因此,当细胞达到中期时,姐妹染色单体在显微镜下呈现为紧凑的棒状结构,其着丝粒区域紧密连接,而臂部则松散连接。

姐妹染色单体的凝聚和分解至少部分取决于一种称为凝聚蛋白的五亚基蛋白复合物,该复合物集中在有丝分裂染色体的中心轴上(图1724B)。凝聚蛋白的结构与将姐妹染色单体结合在一起的黏连蛋白复合物的结构相关(见图1723)。它包含两个与黏连蛋白类似的SMC亚基,加上三个非SMC亚基(图1725A)。与黏连蛋白一样,凝聚蛋白形成一个环绕DNA的环。此外,凝聚蛋白能够利用ATP水解提供的能量来促进姐妹染色单体的压缩。有证据表明,凝聚蛋白的ATPase结构域充当马达,使DNA穿过环,从而使其能够形成染色体环(图1725B)。然而,在我们理解M-Cdk如何编排凝聚蛋白、黏连蛋白和组蛋白的局部协调,以实现姐妹染色单体的有效包装和分离之前,还有很多事情需要学习。
有丝分裂纺锤体是一种动态的微管机器
有丝分裂染色体分离的核心事件在所有真核生物中都依赖于一种复杂而美丽的机器,称为有丝分裂纺锤体(见图171)。纺锤体是一种双极微管阵列,它在后期将姐妹染色单体拉开,从而将两组染色体分离到细胞的两端,在那里它们被包装成子核(电影17.6)。M-Cdk在有丝分裂早期触发纺锤体的组装,与染色体组装同时进行。纺锤体的结构和微管的结构与前面描述的相同。在讨论纺锤体如何组装以及其微管如何附着在姐妹染色单体上之前,我们先简要回顾一下中期纺锤体结构的主要特征。
正如我们在第16章中讨论的那样,微管是具有正端和负端的动态极性聚合物,它们表现出不同的行为。动物细胞的中期纺锤体包含数千个从纺锤体两极辐射出来的微管,负端朝向极点,正端向外(图17-26)。动粒微管是染色体分离的核心参与者:它们的正端附着在大型蛋白质结构(称为动粒)上的姐妹染色单体对上,动粒位于每个姐妹染色单体的着丝粒上。每个动粒结合大量微管,这些微管交联形成厚的微管束,称为K-纤维。这些纤维负责在后期将分离的姊妹染色单体移向极点。
纺锤体微管的第二种主要类型是非动粒微管(也称为极间微管),也是迄今为止数量最多的一种。这些相对较短且不稳定的微管密集地堆积在极点之间,由各种蛋白质交联形成动态且适应性强的支架折叠网络,为纺锤体提供结构稳定性。其中一些微管嵌入纺锤体极点,但许多微管远离极点,有时负端附着在其他微管的侧面。在纺锤体赤道附近,它们通常与反向平行的微管交联,这些微管的负端朝向纺锤体相反的极点。
在大多数动物细胞中,纺锤体还包含从极点向外辐射并与细胞皮层接触的星体微管,有助于将纺锤体定位在细胞中。这些纺锤体的两个极点中都集中在一个称为中心体centrosome的大型蛋白质细胞器上。如第16章所述(见图1642和1643),中心体由一团无定形物质(称为中心粒周围物质pericentriolar material)组成,该物质围绕着一对中心粒(图1727)。中心粒周围物质成核形成微管的放射状阵列,其动态正端向外突出,其负端与中心体相关联。一些细胞,特别是高等植物的细胞和许多脊椎动物的卵母细胞,没有中心体,因此没有星体微管。因此,正如我们稍后讨论的那样,中心体对于纺锤体组装不是必需的。
双极纺锤体的组装和功能取决于数百种不同的微管相关蛋白,这些蛋白可分为三类:控制新微管形成的成核因子、控制微管两端聚合和解聚速率的调节蛋白以及交联和移动微管的运动蛋白。我们将在以下章节中简要介绍这些重要的微管调节剂,然后讨论这些成分如何在纺锤体的组装中协作。
微管在纺锤体的多个区域成核
微管是纺锤体的组成部分,纺锤体的组装需要合成大量新的微管。成熟的中期纺锤体含有数万或数十万个微管,其中大多数是旋转的细胞快速地分裂,因此需要不断供应新的微管。为了满足这一需求,纺锤体含有大量微管成核因子。迄今为止,其中最重要的是γ-微管蛋白环复合物(γ-TuRC;见图1641),它从负端成核微管组装,使正端快速生长。
在许多含有着丝粒的动物细胞中,大量的γ-TuRC被锚定和激活在着丝粒周围物质中,并驱动从着丝粒向外辐射的微管的形成(见图16-42)。每个着丝粒中的γ-TuRC数量在有丝分裂开始时大大增加,这一过程称为着丝粒成熟。
微管的形成也发生在两极之间的中期纺锤体内。一种称为augmin的大型蛋白质复合物将活性γ-TuRC锚定在微管的一侧,导致新微管成核并从另一侧分支出来(见图16-47)。Augmin以这样一种方式与微管结合,即它使新微管的正端指向与其结合的微管相同的方向;因此,当新的微管被释放并重新定位在纺锤体微管网络中时,它具有正确的方向。
纺锤体的组装还依赖于染色体附近微管合成的增加。有丝分裂染色体产生局部信号,激活γ-TuRC,从而促进微管形成。正如我们稍后描述的,这种机制与各种运动蛋白对微管的分选一起,使染色体能够对双极纺锤体的形成做出重大贡献,特别是在没有着丝粒的情况下。
有丝分裂中微管不稳定性大大增加
如第16章所述,微管处于动态不稳定状态,其中单个微管要么生长,要么收缩,并随机在两种状态之间切换。新的微管不断产生,以平衡因解聚而完全消失的微管的损失。
进入有丝分裂标志着细胞微管的突然变化。在前期,特别是在前中期和中期(见图171),微管的平均寿命急剧下降,特别是非动粒微管的寿命,它们仅存在15至30秒。微管不稳定性增加,加上纺锤体微管成核能力增强,可产生非常密集和动态的纺锤体微管阵列。
细胞中的微管动力学由多种调节蛋白控制,包括促进稳定性的微管相关蛋白(MAP)和使微管正末端不稳定的解聚因子。这些蛋白质活性的变化是导致有丝分裂期间微管动力学变化的原因。这些变化中的许多是由M-Cdk和其他有丝分裂蛋白激酶对特定蛋白质的磷酸化引起的。
基于微管的运动蛋白控制纺锤体的组装和功能
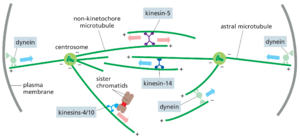
有丝分裂纺锤体的组装和功能依赖于许多微管依赖性运动蛋白。如第16章所述,这些蛋白质属于两个家族:驱动蛋白相关蛋白大家族,通常向微管的正端移动,而动力蛋白则向负端移动。两种运动蛋白:驱动蛋白-5和细胞质动力蛋白在纺锤体的组装和功能中尤为重要,许多其他蛋白,包括驱动蛋白-14和驱动蛋白-4/10,也参与其中(图1728)。
驱动蛋白-5是一个大的四聚体,两端各有两个二聚运动域。运动域都向微管的正端移动,但可以朝相反的方向移动;因此,它们可以与两个反向平行的微管相关联并使其向相反的方向滑动。当这种情况发生在纺锤体中心附近时,结果是微管的负端被推向极点。这个过程对于纺锤体产生双极性至关重要。
细胞质动力蛋白是一种负端定向马达,它与相关蛋白一起在细胞的各个位置组织微管。通过附着在一根微管的负端并将其运送到第二根微管的负端,动力蛋白的作用是将纺锤体中形成的新微管与在着丝粒处成核的微管连接起来,并聚焦纺锤极。动力蛋白也存在于细胞皮层的星体微管的正端。通过向星体微管的负端移动,动力蛋白马达将纺锤极拉向细胞皮层并相互远离。
与大多数动力蛋白不同,动力蛋白-14是一种负端定向马达。它包含一个二聚体马达结构域和一个可以以特定方向与相邻微管结合的第二个结构域,使其能够交联纺锤体中心的反向平行微管并将极点拉到一起。
驱动蛋白4和驱动蛋白10也称为染色质驱动蛋白chromokinesins,是正端定向马达,它们与染色体臂结合并将附着的染色体推离极点(或将极点推离染色体)。
大多数动物细胞中的双极纺锤体组装始于中心体复制
有丝分裂纺锤体必须具有两个极点,才能在后期将两组姊妹染色单体拉到细胞的两端。在大多数动物细胞中,有几种机制确保纺锤体的双极性。
一种取决于中心体。典型的动物细胞在进入有丝分裂时具有一对中心体,每个着丝粒都会形成放射状微管阵列。两个中心体提供预制的纺锤体极,极大地促进了双极纺锤体的组装。
其他机制取决于有丝分裂染色体成核和稳定微管的能力,以及运动蛋白将微管组织成双极阵列的能力。我们将在本节后面讨论这些自组织机制。
在间期,大多数动物细胞含有一个中心体,该中心体使大多数细胞质微管成核。当细胞进入细胞周期时,中心体会复制,因此当细胞达到有丝分裂时,就会有两个中心体。中心体复制开始的时间与细胞进入S期的时间大致相同。触发细胞周期进入的G1/S-Cdk(动物细胞中周期蛋白E和Cdk2的复合物;见表171)也有助于启动中心体复制,与另一种称为Plk4的蛋白激酶一起。中心体中的两个中心粒中的每一个都会形成一个新的中心粒,该中心粒在S期逐渐构建,以产生紧密连接的中心体对(图1729)。这对中心体一直留在细胞核的一侧,直到细胞进入有丝分裂,此时两个着丝粒经历无数变化,形成纺锤体的极点。
中心体复制和染色体复制之间存在有趣的相似之处。两者都使用半保留复制机制,两半分离并作为构建新半部分的模板。中心粒与染色体一样,每个细胞周期必须复制一次且仅复制一次,以确保细胞以精确两个拷贝进入有丝分裂:着丝粒数量不正确会导致纺锤体组装缺陷,从而导致染色体分离错误。

我们开始揭示将着丝粒复制限制为每个细胞周期一次且仅复制一次的复杂机制。这些机制让人想起将DNA复制限制为每个细胞周期一次的机制:在S期发生复制后,需要通过有丝分裂才能在下一个细胞周期中允许着丝粒复制(见图1729)。
动物细胞中的纺锤体组装需要核膜破裂
含有中心体的细胞中,纺锤体组装开始于两个中心体在前期沿着核膜分开时,由连接星状微管和细胞皮层的动力蛋白牵引(见图1728)。着丝粒之间的微管正端相互交叉形成反向平行微管阵列,而驱动蛋白-5将这些微管交联并将着丝粒推开。
着丝粒和微管位于细胞质中,它们无法接触到细胞核内的姐妹染色单体对。因此,新生纺锤体与姐妹染色单体对的附着需要去除核膜。此外,许多促进纺锤体组装的运动蛋白和微管调节器与细胞核内的染色体有关,它们需要核膜破裂才能发挥其功能。
核膜破裂是一个复杂的多步骤过程,据认为,当M-Cdk磷酸化核膜中核孔复合物的几个亚基时,这个过程就开始了。这种磷酸化引发了核孔复合物的分解及其与核膜的分离。M-Cdk还会磷酸化核纤层(核膜下方的结构框架)的成分,导致核层分解。同时,几种内核膜蛋白的磷酸化导致核纤层蛋白和染色体从核膜分离,然后被整合到内质网膜中。
有丝分裂染色体促进双极纺锤体组装
当它们存在时,中心体会驱动纺锤体组装。中心体是非常有效的微管成核剂,也起到组织纺锤体极的作用,快速产生当核膜被移除时会降落到染色体上的双极微管阵列。然而,染色体不仅仅是纺锤体组装过程中的被动乘客。通过创造有利于微管成核和微管稳定的局部环境,染色体在纺锤体的形成中发挥着积极作用。在纺锤体形成后,可以用细玻璃针重新定位染色体来证明染色体的影响。对于一些处于中期的细胞,如果一条染色体被拉出排列,大量新的纺锤体微管会迅速出现在新定位的染色体周围,而染色体原先位置上的纺锤体微管会解聚。染色体的这种特性似乎至少部分取决于与染色质结合的鸟嘌呤核苷酸交换因子(GEF);GEF刺激细胞溶胶中一种名为Ran的小GTP酶结合GTP代替GDP。激活的Ran-GTP也参与核转运(第12章讨论),它会从胞质溶胶中的蛋白质复合物中释放微管调节蛋白,从而刺激染色体周围微管的局部成核和稳定(图1730)。
最容易理解的机制取决于一种名为TPX2的蛋白质的释放,该蛋白质随后结合并激活蛋白激酶Aurora-A。Aurora-A磷酸化激活γ-TuRC的调节蛋白,导致局部新微管形成增加。TPX2还可能激活augmin以促进现有微管两侧新微管分支的形成。蛋白激酶Aurora-B也促进局部微管稳定,它与有丝分裂染色体相关。
在没有着丝粒的情况下,纺锤体的组装被认为是从染色体周围微管的形成开始的。然后,各种微管相关蛋白将微管组织成双极纺锤体(图1731)。我们之前讨论过的两个运动蛋白是尤其重要的。驱动蛋白-5过交联反向平行微管并将其负端向外推,对纺锤体的双极特性至关重要。动力蛋白通过将一个微管负端运送到另一个微管的负端,是将负端聚焦在双极阵列两端的离散极点上所必需的。许多其他微管调节器,包括其他运动蛋白和增强蛋白,也有助于纺锤体的组装。
通常缺乏着丝粒的细胞,例如高等植物和许多动物卵母细胞的细胞,使用基于染色体的自组织机制来形成纺锤体。这些机制还在实验系统中组装纺锤体,其中中心体被移除,例如在某些动物胚胎中,这些胚胎被诱导从卵子发育而无需受精(称为孤雌生殖)。由于精子通常在使卵子受精时提供着丝粒,因此这些孤雌生殖胚胎中的有丝分裂纺锤体在没有着丝粒的情况下发育(图1732)。尽管由此产生的无着丝粒纺锤体可以正常分离染色体,但它缺乏星状微管,星状微管负责在动物细胞中定位纺锤体;因此,纺锤体可能会在细胞中定位错误。
动粒将姐妹染色单体附着到纺锤体上
在双极微管阵列组装后,纺锤体形成的第二个主要步骤是将阵列附着到姐妹染色单体对上。
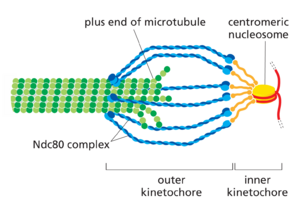
纺锤体微管在动粒处附着到每条染色单体上,动粒是一个巨大的多层蛋白质结构,位于染色单体的着丝粒区域(图1733;另见第4章)。在中期,动粒微管的正端正面嵌入动粒外部区域内距离DNA最远的专门微管附着位点。动物细胞的动粒可以结合10-40个微管,而芽殖酵母的动粒只能结合一个。每个微管的附着依赖于称为Ndc80复合物的杆状蛋白质复合物的多个拷贝,该复合物的一端锚定在动粒中,另一端与纺锤体相互作用,从而将微管连接到动粒,同时仍允许在此端添加或去除微管蛋白亚基(图1734)。动粒处正端聚合和解聚的调节对于控制纺锤体上的染色体运动至关重要,我们稍后会讨论。
动粒附着在纺锤体上是通过一系列复杂的事件发生的。在动物细胞的前期末期,生长纺锤体的中心体通常位于核膜的相对两侧。因此,当核膜破裂时,姐妹染色单体对会受到来自两个方向的动态微管正端的轰击。然而,动粒不会立即实现与纺锤体两极正确的端对端微管附着。相反,光学和电子显微镜的详细研究表明,大多数初始附着都是不稳定的侧向附着,其中动粒在动粒外部的动力蛋白的帮助下附着在经过的微管的侧面。最终,微管正端以正确的端对端方向被一个动粒捕获,然后被另一个动粒捕获。

另一种附着机制也起作用,特别是在没有中心体的情况下。染色体附近的短微管嵌入动粒的正端结合位点。这些正端的聚合导致微管远离动粒生长。这些动粒微管的负端最终与其他负端交联,并由纺锤体极处的动力蛋白马达蛋白聚焦(见图1731)。
双向定位是通过反复试验实现的
有丝分裂的成功要求一对姊妹染色单体附着在有丝分裂纺锤体的相反极上,这样当它们在后期分离时,它们就会移动到细胞的相反两端。这种称为双向定位的连接方式是如何实现的?是什么阻止了两个动粒附着到同一个纺锤体极上或一个动粒附着到两个纺锤体极上?部分答案是姐妹动粒以背对背方向构建降低了两个动粒面对同一纺锤体极点的可能性。然而,不正确的连接确实会发生,并且已经进化出精妙的调节机制来纠正它们。
不正确的连接通过一个反复试验的系统来纠正,该系统基于一个简单的原则:大多数不正确的连接非常不稳定并且不会持久,而正确的连接则保持。动粒如何感知正确的连接?答案似乎是张力(图17-35)[知道张力吧?对,那是我同学]。当一对姐妹染色单体在纺锤体上正确地双向定向时,两个动粒被强大的极向力拉向相反的方向。姐妹染色单体的凝聚力抵抗这些极向力,在动粒内产生高水平的张力。当两条姊妹染色单体附着在同一纺锤体极上时,染色体附着不正确,张力较低,动粒产生抑制信号,松开微管附着位点的抓握,从而发生分离。当发生双向取向时,动粒的高张力会关闭抑制信号,加强微管附着。在动物细胞中,张力不仅增加了附着位点的亲和力,还导致额外的微管附着到动粒上。这导致形成由多个微管组成的粗动粒纤维。

张力感应机制依赖于蛋白激酶Aurora-B,它与动粒相关,被认为会产生抑制信号,在没有张力的情况下降低微管附着的强度。它磷酸化微管附着位点的几个成分,包括Ndc80复合物,降低位点对微管正端的亲和力。当双向取向发生时,产生的张力会降低Aurora-B的磷酸化,从而增加了附着位点的亲和力(图1736)。
在染色体附着于纺锤体的两个极点后,染色体被来回拉扯,最终占据两极之间等距的位置,这个位置称为中期板metaphase plate.。在脊椎动物细胞中,染色体随后在中期板上轻轻振荡,等待姐妹染色单体分离的信号。信号是在最后一对姐妹染色单体双向附着后产生的,具有可预测的滞后时间。
多种力作用于纺锤体中的染色体
中期纺锤体,其姐妹染色单体排列在中期板上,看起来像一个固定长度的稳定双极结构,但外表可能具有欺骗性。纺锤体是一个高度动态的组装体,它处于稳定状态,这取决于各种运动蛋白以及微管聚合和解聚产生的众多力的精确平衡。这些力在染色体附着到纺锤体上后会移动染色体,并产生张力,而这种张力对于稳定正确的附着非常重要。在后期,类似的力将分离的染色单体拉向纺锤体的两端。三种主要的纺锤体力特别重要,尽管它们的强度和重要性在有丝分裂的不同阶段有所不同。
第一种主要力将动粒及其相关染色单体沿着动粒微管拉向纺锤极。这种力是由微管正端的解聚产生的。它在前中期和中期拉动染色体,但对于在后期分离后将姐妹染色单体移向极点尤为重要。值得注意的是,这种动粒产生的极向力不需要ATP或运动蛋白。乍一看,这似乎难以置信,但事实表明,在没有ATP存在的试管中,纯化的动粒可以附着在正在解聚的微管上,从而移动。驱动运动的能量储存在微管中,并在微管解聚时释放;它最终来自微管蛋白亚基添加到微管末端后发生的GTP水解(第16章讨论)。
正端解聚如何驱动动粒向极点移动?正如我们之前讨论过的(见图1734C),动粒中的Ndc80复合物在微管侧面形成多个低亲和力附着。由于附着物不断在新的位置断裂和重新形成,因此即使微管解聚,动粒仍附着在微管上。原则上,这可以将动粒移向纺锤极。
在某些细胞类型中,微管流量microtubule flux提供了第二种向极的力,从而将微管本身拉向纺锤极。纺锤体极点处,负端解聚。这种向极运动的潜在机制尚不清楚,尽管它可能取决于运动蛋白产生的力量和纺锤体极点处的负端解聚。在中期,添加微管正端新微管蛋白补偿负端微管蛋白的损失,因此尽管微管向纺锤体极移动,微管长度仍保持不变(图1737)。任何附着在经历这种流动的微管上的动粒都会受到向极的力,这有助于在中期在动粒处产生张力。除了上面讨论的基于动粒的力之外,流动还有助于向极的力,这种力在后期姐妹染色单体分离后会移动它们。
作用于染色体的第三种力是极地弹射力或极地风 polar ejection force, or polar wind。染色体臂上正端定向的驱动蛋白4和驱动蛋白10马达与微管相互作用,将染色体从纺锤体极点运走(见图1728)。这种力在前中期和中期尤为重要,因为它有助于将染色体臂从纺锤体中推出。这种力也可能有助于将姐妹染色单体对排列在中期板上。
APC/C触发姐妹染色单体分离和有丝分裂的完成
细胞周期在从中期到后期的过渡期随着姐妹染色单体的分离而达到最戏剧性的时刻(图1738)。虽然M-Cdk活性为这一事件奠定了基础,但前面讨论过的后期促进复合体或环体(APC/C)会通过泛素化几种有丝分裂调节蛋白来触发启动姐妹染色单体分离的开关,从而触发它们的破坏(见图1718)。
正如我们前面讨论过的,黏连蛋白在S期后将姐妹染色单体对保持在一起。在有丝分裂早期,姊妹染色单体的分解伴随着染色体臂上大部分黏连蛋白的去除,这种去除的机制依赖于一种蛋白质,该蛋白质在其Smc3和Scc1亚基连接处拉开黏连蛋白环(见图1723)。当细胞到达中期时,黏连蛋白主要停留在染色体的着丝粒区域,毗邻dongli,在那里它们起到抵抗将姐妹染色单体拉开的极向力的作用。后期始于剩余黏连蛋白的突然去除,这使得姐妹染色单体分离并移至纺锤体的相反两极。APC/C通过靶向抑制蛋白securin进行破坏来启动该过程。在后期之前,securin会结合并抑制一种名为分离酶的蛋白酶的活性。中期securin的破坏会释放分离酶,然后分离酶可以自由切割黏连蛋白的Scc1亚基(见图1723)。黏连蛋白脱落,姐妹染色单体就此别过[单押!原文如此The cohesins fall away, and the sister chromatids separate。](图1739)。
我们之前看到,M-Cdk对各种蛋白质的磷酸化促进了纺锤体组装、染色体凝聚和核膜破裂。因此,这些相同蛋白质的去磷酸化是纺锤体分解和末期子核重新形成所必需的,这并不奇怪。Cdk靶标的去磷酸化部分取决于细胞中大多数Cdks的失活,这是APC/C靶向S和M周期蛋白进行破坏的结果。蛋白质去磷酸化还会导致来自磷酸酶的激活。回想一下我们之前的讨论,例如,磷酸酶PP2A-B55被M-Cdk灭活(见图1715和1717)。当周期蛋白破坏后Cdk活性下降时,PP2A和其他磷酸酶被激活,进一步驱动蛋白质去磷酸化和有丝分裂的完成。
未附着的染色体阻断姐妹染色单体分离:纺锤体组装检查点
使微管不稳定的药物,如秋水仙碱或长春花碱(第16章讨论),可使细胞在有丝分裂中停滞数小时甚至数天。这一观察结果导致人们发现了纺锤体组装检查点机制,该机制由药物治疗激活并阻止中期到后期的过渡。检查点机制确保细胞在有丝分裂纺锤体上所有染色体都正确双向定向之前不会进入后期。
纺锤体组装检查点依赖于传感器机制,该机制监测运动细胞的微管附着情况任务。任何未正确附着于微管的动粒都会发出可扩散的负信号,阻止整个细胞中的APC/C-Cdc20激活,从而阻止中期到后期的转变。当最后一对姐妹染色单体正确连接并双向定向时,此阻断被移除,从而允许姐妹染色单体分离。
负检查点信号依赖于几种蛋白质,包括Mad2,它们被募集到未连接的动粒(图1740)。未连接的动粒充当催化Mad2构象变化的酶,因此Mad2随后与其他蛋白质相互作用形成一个大的多蛋白复合物,该复合物结合并从而抑制APC/C-Cdc20。当微管正确附着时,这些抑制复合物被分解,从而缓解APC/C-Cdc20抑制。
在哺乳动物细胞中,纺锤体组装检查点决定了后期的正常时间。这些细胞中的securin破坏开始于纺锤体上最后一对姐妹染色单体双向定向之后,而后期大约在20分钟后开始。实验性抑制检查点机制会导致姐妹染色单体过早分离和后期。
染色体在后期A和B中分离
在后期开始时,姐妹染色单体内聚力的突然丧失导致姐妹染色单体分离,这允许有丝分裂纺锤体的力量将姐妹拉向细胞的相反极点,称为染色体分离。染色体通过两个独立且重叠的过程移动。第一个阶段,后期A,是染色体最初的向极运动,同时伴随着着丝粒微管的缩短。第二个阶段,后期B,是纺锤体极点本身的分离,在姊妹染色单体分离并且子染色体移动了一段距离后开始(图1741)。后期A中的染色体运动取决于前面描述的两种主要向极力的组合。第一个是着丝粒微管解聚产生的力,当着丝粒向极点移动时,它导致正端微管蛋白亚基的丢失。第二个是由微管通量提供,微管向纺锤体极点移动(见图1737)。后期这两种力的相对重要性在不同细胞类型中有所不同:例如,在胚胎细胞中,染色体运动主要依赖于微管通量,而酵母和脊椎动物体细胞中的运动主要来自动粒产生的力。
后期B期间纺锤体极分离依赖于类似于早期有丝分裂中两个着中心粒分离的马达驱动机制。将星状微管正端锚定到细胞皮层的动力蛋白将极点拉开。驱动蛋白5在纺锤体中心交联反向平行微管,将极点推开(见图1728)。
虽然姊妹染色单体分离启动了后期A的染色体运动,但其他机制也能确保后期A中染色体的正确运动和后期B中纺锤体的伸长。最重要的是,正常后期的完成取决于Cdk底物的去磷酸化,这在大多数细胞中是由APC/C依赖的周期蛋白破坏引起的。如果通过产生APC/C无法识别的突变形式来阻止M-周期蛋白的破坏,姊妹染色单体分离通常会发生,但后期的染色体运动和微管行为会异常。
后期A和后期B对染色体分离的相对贡献因细胞类型而异。在哺乳动物细胞中,后期B在后期A之后不久开始,并在纺锤体长度约为中期长度的两倍时停止;相反,酵母和某些原生动物的纺锤体主要利用后期B来分离后期的染色体,它们的纺锤体可延长至中期长度的15倍。
分离的染色体在末期被包装在子核中
到后期结束时,子染色体已分离成细胞两端的两个相等组。在末期,即有丝分裂的最后阶段,两组染色体被包装到一对子核中。末期的第一个主要事件是有丝分裂纺锤体的解体,随后是核膜的重新形成。这个过程发生在多个阶段。首先,染色体表面的蛋白质促进它们之间的相互作用,导致所有染色体形成一个紧密的簇。接下来,含有内核膜蛋白的内质网膜碎片与染色体簇的表面结合,最终融合以重新形成完整的核膜。核孔复合物被整合到核膜中,核层重新形成。孔复合体泵入核蛋白,细胞核膨胀,有丝分裂染色体重组为凝聚度较低的间期状态。新细胞核已产生,有丝分裂完成。剩下的就是细胞完成分裂成两个。
摘要
M-Cdk触发早期有丝分裂事件,包括染色体凝聚、有丝分裂纺锤体的组装以及姊妹染色单体对与纺锤体微管的双极附着。动物细胞中的纺锤体组装依赖于微管在多个位置的成核。着丝粒在有丝分裂前复制,然后在有丝分裂早期分离,使微管成核以帮助形成纺锤体的两极。纺锤体的形成还取决于有丝分裂染色体刺激局部微管形成的能力以及运动蛋白将微管组织成双极阵列的能力。后期由APC/C触发,APC/C刺激将姊妹染色单体结合在一起的蛋白质的破坏。APC/C还促进周期蛋白的破坏,从而导致M-Cdk失活。Cdk靶标的去磷酸化是完成有丝分裂事件所必需的,包括纺锤体的分解和核膜的重新形成。
胞质分裂
细胞周期的最后一步是胞质分裂,即将细胞质一分为二。在大多数细胞中,胞质分裂在每次有丝分裂后都会发生,但有些细胞,如早期果蝇胚胎和一些哺乳动物肝细胞和心肌细胞,在有丝分裂时不会发生胞质分裂,从而获得多个细胞核。在大多数动物细胞中,胞质分裂始于后期,并在末期有丝分裂完成后不久结束。
动物细胞的胞质分裂始于细胞表面出现分裂沟。该沟迅速加深并扩散到细胞周围,直到将细胞完全一分为二。这一过程的基础结构是收缩环,这是一种由肌动蛋白丝、肌球蛋白II丝和许多结构和调节蛋白组成的动态组件。在后期,收缩环在质膜正下方组装(图1742;另见面板171)。环逐渐收缩,同时细胞内囊泡融合与质膜一起插入新的膜。膜的增加补偿了伴随胞质分裂的表面积增加。当环收缩完成时,收缩环解体,子细胞之间的窄膜桥被切断。
收缩环中的肌动蛋白和肌球蛋白II引导胞质分裂过程
在间期细胞中,肌动蛋白和肌球蛋白II细丝形成位于质膜下方的皮质网络。在某些细胞中,它们还形成称为应力纤维的大细胞质束(第16章讨论)。当细胞进入有丝分裂时,这些肌动蛋白和肌球蛋白阵列解体;大部分肌动蛋白重组,肌球蛋白II细丝被释放。当姐妹染色单体在后期分离时,肌动蛋白和肌球蛋白II开始在快速组装的收缩环中积累(图1743),其中还含有许多其他提供结构支撑或协助环组装的蛋白质。收缩环的组装部分是由于局部形成新的肌动蛋白丝,这取决于形成平行排列的线性、无分支肌动蛋白丝(第16章讨论)的formin蛋白。在后期,重叠的肌动蛋白丝和肌球蛋白II丝阵列收缩,产生将细胞质一分为二的力量。一旦收缩开始,环就会施加足够大的力,足以弯曲插入其路径的细玻璃针。当环收缩时,它保持相同的粗细,这表明它的总体积和它所含的细丝数量稳步减少。此外,与肌肉中的肌动蛋白不同,环中的肌动蛋白丝具有高度动态性,并且它们的排列在细胞分裂期间不断变化。
当分裂结束时,收缩环最终完全消失,分裂沟的质膜变窄形成中体midbody。中体作为两个子细胞之间的系绳而存在,并包含纺锤体的残余部分,是一种大型蛋白质结构,源自纺锤体中区的反向平行微管,紧密堆积在致密的基质内(图1744)。胞质分裂通过称为脱落abscission的过程完成:中体两侧的膜被由称为ESCRT-III的聚合蛋白形成的细丝收缩和切断。
RhoA的局部激活触发收缩环的组装和收缩
RhoA是Ras超家族的一个小GTPase(见表155),控制收缩环在分裂部位的组装和功能。RhoA附着在未来分裂部位的细胞膜内表面,促进肌动蛋白丝形成、肌球蛋白II组装和环收缩。它通过激活formins刺激肌动蛋白丝形成,并通过激活多种蛋白激酶(包括Rho相关激酶(ROCK))促进肌球蛋白II组装和收缩(图1745)。这些激酶磷酸化调节性肌球蛋白轻链(肌球蛋白II的一个亚基),从而刺激双极肌球蛋白II丝形成和运动活动。
RhoA由一种称为Ect2的鸟嘌呤核苷酸交换因子(GEF)激活,后者刺激GDP的释放和GTP与RhoA的结合(见图1745)。Ect2位于分裂位点,由涉及纺锤体微管的复杂机制激活,我们将在下文讨论。
有丝分裂纺锤体的微管决定动物细胞分裂的平面
胞质分裂的核心问题是如何确保分裂在正确的时间和正确的平面上发生。胞质分裂必须在两组染色体完全分离后才能发生,分裂部位必须位于两组子染色体之间,从而确保每个子细胞都获得一套完整的染色体。动物细胞中胞质分裂的正确时间和定位是通过依赖于有丝分裂纺锤体的机制实现的。在后期,纺锤体产生信号,在纺锤体两极中间的位置启动沟的形成,从而确保分裂发生在两组分离的染色体之间。由于这些信号源自后期纺锤体,因此这种机制也有助于在有丝分裂后期正确安排胞质分裂的时间。
对海洋无脊椎动物受精卵的研究首次揭示了纺锤体微管在确定收缩环位置方面的重要性。受精后,这些胚胎迅速分裂,中间没有生长期。这样,原始卵逐渐分裂成越来越小的细胞。由于细胞质透明,可以用显微镜实时观察纺锤体。如果在早期后期用细玻璃针将纺锤体拉到新的位置,初始的分裂沟就会消失,新的分裂沟会根据新的纺锤体位置发展,这支持了纺锤体产生的信号会诱导局部沟形成的观点。
有丝分裂纺锤体如何指定分裂位置?关键机制似乎是后期纺锤体的中间区产生促进细胞皮层沟形成的信号。该调节系统的核心成分是一种称为中央纺锤蛋白centralspindlin的双亚基蛋白复合物,它形成的寡聚体主要集中在纺锤体中间区的反向平行微管上(图1746)。蛋白激酶Aurora-B刺激中间区的中央纺锤蛋白组装,该激酶也在后期定位到纺锤体中间区(见图1745)。Aurora-B定位到中央纺锤体依赖于Cdk底物的去磷酸化,从而提供了一种延迟胞质分裂直至后期的机制。
中央纺锤蛋白与RhoA-GEF:Ect2相互作用,激活位于纺锤体两极中间的赤道细胞皮质的RhoA(图1747)。在某些细胞类型中,可以看到中央纺锤蛋白和Ect2的小亚群从纺锤体中区迁移到细胞皮质,然后Ect2与RhoA相互作用以触发沟形成(见图1745)。中央纺锤蛋白和Ect2在赤道处的聚焦部分取决于星体微管以某种方式抑制中央纺锤蛋白在赤道区域外定位的能力。
在某些细胞类型中,环组装的位置是在有丝分裂之前选择的。例如,在芽殖酵母中,一圈称为septins的蛋白质在G1后期在未来的分裂位点组装。septins是被认为形成一个支架,收缩环的其他成分(包括肌球蛋白II)可以组装到该支架上。在植物细胞中,一条由微管和肌动蛋白丝组成的有组织的带,称为前期带 preprophase band,在有丝分裂前组装,标志着细胞壁组装和将细胞一分为二的位点,正如我们现在讨论的那样。
成膜体Phragmoplast引导高等植物的细胞分裂
在大多数动物细胞中,分裂沟的向内运动取决于质膜表面积的增加。新膜主要在分裂沟处添加,通常由小膜囊泡提供,这些小膜囊泡通过微管从高尔基体运输到分裂沟。膜沉积对于高等植物细胞的胞质分裂尤为重要。这些细胞被半刚性的细胞壁包裹。植物细胞的细胞质不是由收缩环从外向内划分细胞质,而是通过在两个子核之间构建新的细胞壁(称为细胞板)从内向外划分(图1748;图1749)。细胞板的组装始于后期,由称为成膜体的结构引导,成膜体包含来自有丝分裂的纺锤体微管。马达蛋白沿着这些微管将小囊泡从高尔基体运送到细胞中心。这些囊泡充满了合成新细胞壁所需的多糖和糖蛋白,融合形成一个圆盘状的膜包裹结构,称为早期细胞板。细胞板通过进一步的囊泡融合向外扩展,直到到达质膜和原始细胞壁并将细胞一分为二。后来,纤维素微纤维被放置在细胞内细胞板基质完成新细胞壁的构建。
膜包裹的细胞器必须在胞质分裂期间分配给子细胞
有丝分裂过程确保每个子细胞获得完整的染色体。然而,当真核细胞分裂时,每个子细胞还必须继承所有其他必需的细胞成分,包括膜包裹的细胞器。如第12章所述,线粒体和叶绿体等细胞器不能从其各个成分中重新组装;它们只能通过先前存在的细胞器的生长和分裂产生。同样,细胞不能制造新的内质网(ER),除非其中的某些部分已经存在。
那么,当细胞分裂时,各种膜包裹的细胞器如何分离?线粒体和叶绿体等细胞器通常数量足够多,如果平均而言,它们的数量在每个周期大约翻一番,则可以安全地遗传。间期细胞中的内质网与核膜相连,并由微管细胞骨架组织。进入M期后,微管重组和核膜破裂会释放内质网。在大多数细胞中,内质网基本保持完整,并在胞质分裂期间被切成两半。高尔基体在有丝分裂期间重组和碎裂。高尔基碎片与纺锤体极点相关联,从而分布到纺锤体的两端,确保每个子细胞都能继承在末期重建高尔基体所需的材料。
一些细胞重新定位纺锤体以进行不对称分裂
大多数动物细胞对称分裂:收缩环在母细胞赤道周围形成,产生两个大小相同且具有相同成分的子细胞。这种对称性是由有丝分裂纺锤体的位置引起的,在大多数情况下,纺锤体倾向于在细胞质中居中。星体微管和推动或拉动这些微管的运动蛋白有助于居中过程。
然而,在发育过程中,有很多情况是细胞不对称分裂产生两个大小不同的细胞,它们继承的细胞质内容物或两者均有。通常,两个不同的子细胞注定要沿着不同的途径发育。为了以这种方式产生具有不同命运的子细胞,母细胞必须首先将某些成分(称为细胞命运决定因素)分离到细胞的一侧,然后定位分裂平面,以便适当的子细胞继承这些成分(图1750)。为了不对称地定位分裂平面,纺锤体必须在分裂细胞内以受控方式移动。细胞皮层局部区域的变化似乎会指导这种纺锤体运动,并且位于那里的运动蛋白通过其星体微管将纺锤体极之一拉到适当的区域。对秀丽隐杆线虫和果蝇的遗传分析已确定了这种不对称分裂所需的一些蛋白质,其中一些蛋白质似乎在脊椎动物中具有类似的作用。
有丝分裂可以在没有胞质分裂的情况下发生
虽然核分裂通常随后是胞质分裂,但也有例外。一些细胞经历多轮核分裂而没有中间的胞质分裂。例如,在早期果蝇胚胎中,前13轮核分裂发生在没有胞质分裂的情况下,导致形成一个包含数千个细胞核的单个大细胞,这些细胞核排列在靠近表面的单层中。多个细胞核排列成单层,细胞内有多个胞质分裂。细胞核共享同一细胞质的结构称为合胞体。这种结构大大加快了早期发育,因为细胞不必花时间完成每次分裂的所有胞质分裂步骤。在这些快速的核分裂之后,在每个细胞核周围形成膜,这是一轮协调的胞质分裂,称为细胞化。质膜向内延伸,在肌动蛋白肌球蛋白环的帮助下,收缩以包裹每个细胞核(图1751)。某些类型的哺乳动物细胞也会发生没有胞质分裂的核分裂。例如,产生血小板的巨核细胞以及一些肝细胞和肌肉细胞就是这样变成多核的。
摘要
减数分裂
大多数真核生物进行有性繁殖:两个亲本的基因组混合,产生与亲本遗传不同的后代。这些生物的细胞通常是二倍体;也就是说,它们包含两个略有不同的每个染色体的拷贝或同源染色体,每个亲本一个。有性繁殖依赖于称为减数分裂的专门核分裂过程,该过程产生仅携带每个染色体单个拷贝的单倍体细胞。在许多生物体中,单倍体细胞分化成称为配子(大多数物种中的卵子和精子)的专门生殖细胞。在这些物种中,当精子和卵子融合形成二倍体合子时,生殖周期结束,二倍体合子具有形成新个体的潜力。在本节中,我们将考虑减数分裂的基本机制和调节,重点介绍它们与有丝分裂的比较。
减数分裂包括两轮染色体分离
减数分裂使用许多相同的分子机器和控制将染色体数量减少一半在有丝分裂中运作的系统。与有丝分裂细胞周期一样,细胞通过在减数分裂S期复制其染色体来开始减数分裂程序,从而产生通过黏连蛋白复合物沿其整个长度紧密连接的姊妹染色单体对。然而,与有丝分裂不同,然后发生两轮连续的染色体分离(图1752)。这些分裂中的第一次(减数分裂I)解决了减数分裂特有的同源染色体分离问题。复制的父系和母系同源染色体彼此配对并通过基因重组过程物理连接。这些同源染色体对,每个都包含一对姊妹染色单体,然后排列在第一个减数分裂纺锤体上。在第一次减数分裂后期,重复的同源染色体(而不是姐妹染色单体)被拉开并分离成两个子核。只有在第二次分裂(减数分裂II)中,姐妹染色单体才会被拉开并分离(如在有丝分裂中一样)以产生单倍体子核。这样,每个进入减数分裂的二倍体核都会产生四个单倍体核,每个单倍体核都包含每条染色体的母本或父本拷贝,但不会同时包含两者(电影17.7)。
减数分裂前期重复同源染色体配对
在大多数生物的有丝分裂过程中,同源染色体的行为彼此独立。然而,在减数分裂I期间,同源染色体必须相互识别并进行物理关联,才能使母系和父系同源染色体在第一个减数分裂纺锤体上双向定向。特殊机制介导这些相互作用。
同源染色体的逐渐并置发生在一个称为减数分裂前期(或前期I)的较长时期内,这在酵母中可能需要数小时,在小鼠中可能需要数天,在高等植物中可能需要数周。与有丝分裂的染色体一样,重复的减数分裂前期染色体首先以长线状结构出现,其中姐妹染色单体紧密粘合在一起,以至于它们看起来像一个。正是在早期的前期I期间,同源染色体开始沿其长度关联,这个过程称为配对,至少在某些生物体中,这个过程始于两个同源染色体中互补DNA序列(称为配对位点)之间的相互作用。随着前期的进展,同源染色体变得更加紧密地并列,形成称为二价体的四染色单体结构(图1753A)。在大多数物种中,同源染色体对随后通过同源重组锁定在一起:DNA双链断裂在每个姐妹染色单体的几个位置形成,导致同源染色体之间发生大量DNA重组事件(如第5章所述)。其中一些事件导致相互的DNA交换称为交叉,其中染色单体的DNA交叉并与同源染色单体的DNA连续(图1753B;另见图553)。
同源染色体配对最终形成联会复合体
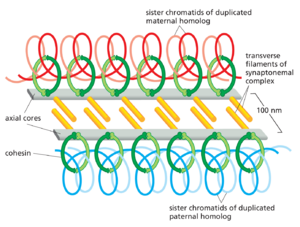
配对的同源染色体被带到紧密的并列位置,其结构轴((axial cores))相距约400nm,其机制在大多数物种中取决于姐妹染色单体中发生的双链DNA断裂。是什么将轴拉到一起?一种可能性是,在染色单体的双链断裂处组装的大型蛋白质机器(称为重组复合体)结合附近同源染色体中的匹配DNA序列并帮助卷入该伴侣。这种所谓的联会前对齐 presynaptic alignment 之后是联会,其中同源染色体的轴核通过密集排列的横向细丝与其配偶体的轴核紧密相连,形成联会复合体 synaptonemal complex,该复合体填补了同源染色体之间现在只有100nm的间隙(图1754)。虽然交叉开始在联会复合体组装之前,最后的步骤发生在DNA被保持在复合体中时。
同源染色体配对期间发生的形态变化是将减数分裂前期分为五个连续阶段的基础:细线期、偶线期、粗线期、双线期和终变期(图1755)。
前期从细线期开始,此时同源染色体凝聚并配对,基因重组开始。
在偶线期,联会复合体开始在同源染色体紧密相关且发生重组事件的位点组装。
在粗线期,组装过程完成,同源染色体沿其整个长度联会(见图928)。
粗线期可以持续数天或更长时间,直到双线期联会开始脱联,联会复合体解体,染色体随之凝聚和缩短。只有在这个阶段,在复合体解体后,非姊妹染色单体之间的单个交叉事件才可以看作是同源体间连接,称为交叉,现在它在将紧凑的同源体结合在一起方面发挥着至关重要的作用(图1756)。同源体现在已准备好开始分离过程。
同源染色体分离取决于减数分裂I的几个独特特征
减数分裂I与有丝分裂(和减数分裂II)之间的根本区别在于,在减数分裂I中,同源染色体而不是姐妹染色单体分离然后分离(见图1752)。这种差异取决于减数分裂I的三个特征,这些特征将其与有丝分裂区分开来(图1757)。
首先,同源染色体中的两个姐妹动粒必须稳定地附着在同一纺锤体极上。这种类型的附着通常在有丝分裂期间避免(见图1735)。然而,在减数分裂I中,两个姐妹动粒融合成一个单个微管结合单元,该单元仅附着在一个极上(见图1757A)。姐妹着丝粒的融合是通过位于减数分裂I中的着丝粒上的蛋白质复合物实现的,但我们并不详细了解这些蛋白质是如何起作用的。它们在减数分裂I后从着丝粒中移除,因此在减数分裂II中,姐妹染色单体对可以在纺锤体上双向定向,就像它们在有丝分裂中一样。
其次,交叉在同源染色体之间产生强大的物理连接,允许它们在纺锤体的赤道处双向定向,就像姐妹染色单体之间的凝聚力对于它们在有丝分裂(和减数分裂II)中的双向定向很重要一样。交叉将同源对保持在一起只是因为姐妹染色单体的臂通过姐妹染色单体内聚力连接(见图1757A)。
第三,在后期I,黏连蛋白仅从染色体臂中去除,而不是从着丝粒附近的区域去除,着丝粒位于着丝粒处。臂黏连力的丧失会在后期I开始时触发同源染色体分离。该过程依赖于APC/C激活,从而导致securin破坏、分离酶激活和黏连蛋白沿臂裂解(见图1739)。
在减数分裂I中,着丝粒附近的黏连蛋白受到一种名为shugoshin(来自日语单词“守护神”)的着丝粒相关蛋白的保护,免受分离酶的破坏。Shugoshin通过招募一种蛋白磷酸酶来发挥作用,这种磷酸酶可从着丝粒黏连蛋白中去除磷酸。黏连蛋白磷酸化通常是分离酶裂解黏连蛋白所必需的;因此,去除着丝粒附近的这种磷酸化可防止黏连蛋白裂解。因此,姐妹染色单体对通过减数分裂I保持连接,从而允许它们在减数分裂II中在纺锤体上正确双向定位。减数分裂I后,Shugoshin失活。在后期II开始时,APC/C激活会触发着丝粒黏连蛋白裂解和姐妹染色单体分离,就像在有丝分裂中一样。后期II后,核膜在染色体周围形成,产生四个单倍体核,之后胞质分裂和其他分化过程导致单倍体配子的产生。
交叉受到严格监管
交叉在减数分裂中具有两种不同的功能:它有助于将同源染色体保持在一起,以便它们正确地分离到减数分裂I产生的两个子核中,并且它有助于最终产生的配子的遗传多样化。因此,正如可以预料的那样,交叉受到严格调控:每条染色体上双链断裂的数量和位置受到控制,断裂转化为交叉的可能性也受到控制。平均而言,这种调控的结果是,每对人类同源染色体都通过大约两到三个交叉连接在一起(图1758)。
虽然在减数分裂I中发生的双链断裂几乎可以位于染色体的任何地方,但它们的分布并不均匀:它们聚集在DNA可接触的热点处,很少发生在冷点,例如着丝粒和端粒周围的异染色质区域。
至少有两种调控影响形成的交叉的位置和数量,这两种调控方式都不太清楚。两者都在联会复合体组装之前起作用。一个机制确保每个同源染色体对的成员之间至少形成一次交叉,这是正常同源染色体在减数分裂I中的分离所必须的。在另一种称为交叉干扰 crossover interference的调控中,一个交叉事件的存在会抑制另一个交叉事件在附近形成,可能是通过局部消耗将双链DNA断裂转化为稳定交叉所需的蛋白质来实现的。
减数分裂经常出错
减数分裂期间发生的染色体分类是细胞内记账bookkeeping的一项了不起的壮举。在人类中,每次减数分裂都需要起始细胞跟踪92条染色单体(46条染色体,每条染色体都有重复),将每种类型的常染色体的完整组合分配给四个单倍体后代。毫不奇怪,在这个复杂的过程中,染色体的分配可能会出现错误。错误在人类女性减数分裂中尤其常见,在双线期后数年才会停止:减数分裂I仅在排卵时完成,减数分裂II仅在卵子受精后完成。事实上,卵子发育过程中的这种染色体分离错误是人类自然流产(流产)和智力残疾的最常见原因。当同源体无法正确分离时(一种称为不分离的现象),结果是一些产生的单倍体配子缺少特定的染色体,而另一些则有多个染色体拷贝。受精后,这些配子形成异常胚胎,其中大多数会死亡。然而,有些会存活下来。例如,人类的唐氏综合症是智力残疾的主要原因,它是由21号染色体的额外拷贝引起的,通常是由于女性卵巢在减数分裂I期间不分离造成的。减数分裂I期间的分离错误会随着母亲年龄的增长而大大增加。
摘要
单倍体配子由减数分裂产生,其中二倍体细胞核在一轮DNA复制后经历两次连续的细胞分裂。减数分裂以延长的前期为主。在前期开始时,染色体已复制并由两个紧密连接的姐妹染色单体组成。同源染色体随后配对,并在前期进行时逐渐变得更加紧密地并列。紧密排列的同源体发生基因重组,形成交叉,有助于在中期I将每对同源体保持在一起。减数分裂特异性的着丝粒相关蛋白有助于确保同源体中的两个姐妹染色单体附着在同一纺锤体极上;其他着丝粒相关蛋白确保同源体在减数分裂I期间,同源染色体在着丝粒处保持连接,因此在减数分裂I中分离的是同源染色体而不是姐妹染色单体。减数分裂I之后,减数分裂II迅速发生,没有DNA复制,其过程类似于有丝分裂,因为姐妹染色单体在减数分裂后期被拉开。
细胞分裂和细胞生长的控制
小鼠受精卵和人类受精卵大小相似,但它们产生的动物大小却大不相同。人类和小鼠细胞行为控制中的哪些因素导致了这些尺寸差异?对于动物体内的每个器官和组织,都可以提出相同的基本问题。哪些因素决定了大象鼻子的长度或其大脑或肝脏的大小?这些问题大部分尚未得到解答,但仍然可以说出答案的要素。器官或生物体的大小取决于其总细胞质量,而总细胞质量又取决于细胞总数和细胞大小。反过来,细胞数量又取决于细胞分裂和细胞死亡率。因此,器官和身体的大小由三个基本过程决定:细胞生长、细胞分裂和细胞存活。每个过程都受到细胞内程序和控制这些程序的细胞外信号分子的严格调控。
调节细胞生长、分裂和存活的细胞外信号分子通常是可溶性分泌蛋白、与细胞表面结合的蛋白质或细胞外基质的成分。它们在操作上可以分为三大类:
1.有丝分裂原Mitogens,主要通过触发一波G1/S-Cdk活性来刺激细胞分裂,从而缓解细胞内的负控制,否则会阻碍细胞周期的进展。
2.生长因子Growth factors,,通过促进蛋白质和其他大分子的合成并抑制其降解来刺激细胞生长(增加细胞质量)。
3.生存因子 Survival factors, ,通过抑制程序性细胞死亡(称为细胞凋亡)来促进细胞存活。
许多细胞外信号分子促进所有这些过程,而其他细胞外信号分子则促进其中一两个过程。事实上,生长因子这个术语经常被不恰当地用来描述具有这些活性的因子。更糟糕的是,细胞生长这个术语通常被用来表示细胞数量的增加或细胞增殖。
除了这三类刺激信号外,还有抑制细胞增殖、细胞生长或两者的细胞外信号分子。还有激活细胞凋亡的细胞外信号分子。
在本节中,我们主要关注有丝分裂原和其他因素(如DNA损伤)如何控制细胞分裂的速度。然后,我们转向一个重要但不太清楚的问题,即增殖细胞如何协调其生长与细胞分裂以保持其适当的大小。我们在第18章中讨论了细胞凋亡对细胞存活和细胞死亡的控制。
有丝分裂原刺激细胞分裂
单细胞生物倾向于尽可能快地生长和分裂,其增殖速度在很大程度上取决于环境中营养物质的可用性。然而,多细胞生物的细胞仅在生物体需要更多细胞时才会分裂。因此,动物细胞要增殖,必须从其他细胞(通常是其邻居)接收刺激性细胞外信号(有丝分裂原的形式)。有丝分裂原克服了阻碍细胞周期进展的细胞内制动机制。
已知有50多种动物蛋白质可充当有丝分裂原。这些蛋白质中的大多数具有广泛的特异性。例如,血小板衍生的生长因子(PDGF)可以刺激多种类型的细胞分裂,包括成纤维细胞、平滑肌细胞和神经胶质细胞。同样,表皮生长因子(EGF)不仅作用于表皮细胞,还作用于许多其他类型的细胞,包括上皮细胞和非上皮细胞。然而,一些有丝分裂原具有狭窄的特异性:例如,促红细胞生成素仅诱导红细胞前体的增殖。许多有丝分裂原,包括PDGF,除了刺激细胞分裂外还具有其他作用:它们可以刺激细胞生长、存活、分化或迁移,具体取决于环境和细胞类型。
在某些组织中,抑制性细胞外信号蛋白会对抗正向调节剂,从而抑制器官生长。最容易理解的抑制信号蛋白是转化生长因子(TGF)及其相关蛋白。TGF抑制几种细胞类型的增殖,主要通过阻断G1期细胞周期进程来实现。
细胞可以进入一种特殊的非分裂状态
在没有促有丝分裂信号来增殖的情况下,G1期Cdk抑制由前面讨论的多种机制维持,并阻止进入新的细胞周期。在某些情况下,细胞会部分分解其细胞周期控制系统,并从周期中退出,进入一种称为G0的特殊非分裂状态。
我们体内的大多数细胞都处于G0期,但这种状态的分子基础和可逆性在不同的细胞类型中有所不同。我们大多数的神经元和骨骼肌,细胞处于终末分化的G0状态,其中它们的细胞周期控制系统被完全拆除:编码各种Cdks和周期蛋白的基因的表达被永久关闭,并且细胞分裂很少发生。一些细胞类型仅暂时退出细胞周期,并保留快速重组细胞周期控制系统并重新进入周期的能力。例如,大多数肝细胞处于G0期,但如果肝脏受损,它们可以受到刺激而分裂。其他类型的细胞,包括成纤维细胞和一些淋巴细胞,在其一生中反复退出和重新进入细胞周期。
成人体内几乎所有的细胞周期长度变化都发生在细胞处于G1或G0期的时间内。相比之下,细胞从S期开始到有丝分裂所需的时间通常很短(哺乳动物通常为12至24小时)且相对恒定,无论一次分裂到下一次分裂的间隔如何。
有丝分裂原刺激G1-Cdk和G1/S-Cdk活性
对于绝大多数动物细胞,有丝分裂原通过在细胞周期的G1期起作用来控制细胞分裂的速度。如前所述,多种机制在G1期起作用以抑制Cdk活性。有丝分裂原释放了Cdk活性的这些制动器,从而允许进入新的细胞周期。
正如我们在第15章中讨论的那样,有丝分裂原与细胞表面受体相互作用,触发多个细胞内信号通路。一条主要通路通过单体GTPase:Ras起作用,从而激活有丝分裂原活化蛋白激酶(MAP激酶)级联(见图1550)。这导致转录调节蛋白(包括Myc)的产生增加。
Myc被认为通过几种机制促进细胞周期进入,其中一种机制是增加编码G1-周期蛋白(D周期蛋白)的基因表达,从而增加G1-Cdk(周期蛋白D-Cdk4)活性。Myc在刺激增加细胞生长的基因转录方面也发挥着重要作用。
G1-Cdk复合物在动物细胞中的关键功能是激活一组称为E2F蛋白的基因调控因子,这些因子与多种基因启动子中的特定DNA序列结合,这些基因编码S期进入所需的蛋白质,包括G1/S-周期蛋白、S-周期蛋白以及参与DNA合成和染色体复制的蛋白质。在没有有丝分裂原刺激的情况下,E2F依赖性基因表达受到E2F与视网膜母细胞瘤蛋白(Rb)家族成员之间相互作用的抑制。当细胞受到有丝分裂原刺激而分裂时,活性G1-Cdk会积聚并磷酸化Rb家族成员,从而降低它们与E2F的结合。然后,释放的E2F蛋白激活其靶基因的表达(图1759)。这种转录控制系统与调节细胞周期的许多其他控制系统一样,包括反馈回路,以确保进入细胞周期是完整且不可逆的。例如,释放的E2F蛋白会增加其自身基因的转录。此外,E2F依赖的G1/S-周期蛋白(周期蛋白E)和S-周期蛋白(周期蛋白A)基因转录会导致G1/S-Cdk和S-Cdk活性增加,进而增加Rb蛋白磷酸化并促进进一步释放E2F(见图1759)。
Rb家族的核心成员Rb蛋白本身最初是通过对一种儿童遗传性眼癌(称为视网膜母细胞瘤)的研究而发现的(第20章讨论)。Rb基因的两个拷贝的丢失导致发育中的视网膜中某些细胞过度增殖,这表明Rb蛋白对于抑制该组织的细胞分裂尤为重要。Rb的完全丢失不会立即导致视网膜或其他类型细胞的增殖增加,部分原因是Cdh1和CKI也有助于抑制G1期的进展,部分原因是其他细胞类型含有Rb相关蛋白,可在Rb缺失时提供后备支持。其他与Rb无关的蛋白质也可能有助于调节E2F的活性。
额外的控制层促进S-Cdk活性在S期开始时大幅增加。我们之前提到过,APC/C激活剂Cdh1抑制有丝分裂后的周期蛋白水平。然而,在动物细胞中,G1-和G1/S-周期蛋白对APC/C-Cdh1具有抗性,因此可以不受APC/C的阻碍地促进Rb蛋白磷酸化和E2F依赖性基因表达。相比之下,S-周期蛋白不具有抗性,其水平最初受到APC/C-Cdh1活性的限制。然而,G1/S-Cdk也会磷酸化和灭活APC/C-Cdh1,从而允许S-周期蛋白积累,进一步促进S-Cdk活化。G1/S-Cdk还会灭活抑制S-Cdk活性的CKI蛋白。所有这些相互作用的总体效果是快速完全激活S期启动所需的S-Cdk复合物。
DNA损伤阻断细胞分裂
细胞周期的进展以及细胞增殖的速度不仅受细胞外有丝分裂原控制,还受其他细胞外和细胞内信号控制。其中最重要的影响因素之一是DNA损伤,这可能是由于DNA中的自发化学反应、DNA复制中的错误或暴露于辐射或某些化学物质(第5章中讨论)而发生的。在尝试复制或分离受损染色体之前,必须先修复受损的染色体。细胞周期控制系统可以很容易地检测到DNA损伤,并在两个转换点之一阻止细胞周期:一个是在启动阶段,阻止细胞进入细胞周期和S期;另一个是在G2/M转换阶段,阻止细胞进入有丝分裂(见图1720)。
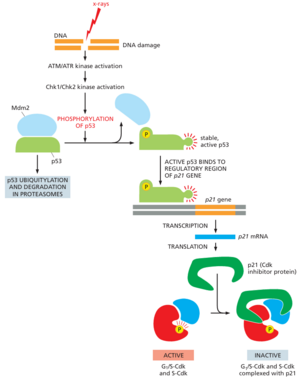
DNA损伤通过激活一对相关蛋白激酶ATM和ATR中的一种来启动信号通路,这两种蛋白激酶与损伤部位相关,并磷酸化各种靶蛋白,包括另外两种蛋白激酶Chk1和Chk2。这些不同的激酶磷酸化其他靶蛋白,导致细胞周期停滞。一个主要靶点是基因调节蛋白p53,它刺激编码p21(一种CKI蛋白)的基因的转录;p21与G1/S-Cdk和S-Cdk复合物结合并抑制其活性,从而有助于阻止进入细胞周期(图1760和电影17.8)。
DNA损伤通过间接机制激活p53。在未受损的细胞中,p53非常不稳定,浓度非常低。这主要是因为它与另一种蛋白质Mdm2相互作用,后者充当泛素连接酶,以p53为目标,由蛋白酶体破坏。p53磷酸化后DNA损伤会降低其与Mdm2的结合。这会降低p53降解,从而导致细胞中p53浓度显着增加。此外,与Mdm2的结合减少会增强p53刺激基因转录的能力(见图1760)。
蛋白激酶Chk1和Chk2还通过磷酸化Cdc25蛋白磷酸酶家族成员来阻止细胞周期进程,从而抑制其功能。如前所述,这些磷酸酶在有丝分裂开始时激活M-Cdk时特别重要(见图1716)。Chk1和Chk2在抑制位点磷酸化Cdc25,这些位点不同于刺激Cdc25活性的磷酸化位点。DNA损伤对Cdc25活性的抑制有助于阻止进入有丝分裂(见图1720)。
DNA损伤反应也可由复制叉在DNA复制过程中出现的问题激活。例如,当核苷酸耗尽时,复制叉会在DNA合成的延长阶段停滞。为了防止细胞试图分离部分复制的染色体,响应DNA损伤的相同机制会检测停滞的复制叉并阻止进入有丝分裂,直到问题得到解决。
任何细胞的正常生命过程中都会发生低水平的DNA损伤,如果DNA损伤反应不起作用,这种损伤就会在细胞的后代中积累。从长远来看,缺乏DNA损伤反应的细胞中遗传损伤的积累会导致促癌突变的频率增加。事实上,至少一半的人类癌症都发生了p53基因突变(第20章讨论)。p53功能的丧失使癌细胞更容易积累突变。同样,一种称为毛细血管扩张性共济失调的罕见遗传病是由ATM缺陷引起的,ATM是一种蛋白激酶,在X射线引起的DNA损伤反应中被激活;患有这种疾病的人对X射线非常敏感,患癌症的几率也更高。如果DNA损伤严重到无法修复,会发生什么?答案在不同的生物体中有所不同。单细胞生物(如芽殖酵母)会停止其细胞周期以尝试修复损伤,但即使修复无法完成,细胞周期也会恢复。对于单细胞生物来说,有突变的生命显然比没有生命要好。然而,在多细胞生物中,生物体的健康优先于单个细胞的生命。
分裂时DNA损伤严重的细胞会威胁生物体的生命,因为基因损伤通常会导致癌症和其他疾病。因此,DNA损伤严重的动物细胞不会试图继续分裂,而是通过凋亡自杀。因此,除非DNA损伤得到修复,否则DNA损伤反应可能导致细胞周期停滞或细胞死亡。DNA损伤诱导的细胞凋亡通常取决于p53的激活。
许多人类细胞在分裂次数上有内在限制
许多人类细胞分裂的次数有限,然后停止分裂并经历永久性的细胞周期停滞。例如,从正常人体组织中提取的成纤维细胞在标准有丝分裂培养基中培养时仅经历约25至50次群体倍增。在这段时间结束时,增殖会减慢并最终停止,细胞进入非分裂状态,并且永远不会恢复。这种现象称为复制性细胞衰老。
复制人类成纤维细胞中的细胞衰老似乎是由端粒结构的变化引起的,端粒是染色体末端的重复DNA序列和相关蛋白质。如第5章所述,当细胞分裂时,端粒DNA序列不会以与基因组其余部分相同的方式复制,而是由端粒酶合成。端粒酶还促进保护染色体末端的蛋白质帽结构的形成。由于人类成纤维细胞和许多其他人类体细胞不产生端粒酶,因此它们的端粒会随着每次细胞分裂而变短,并且它们的保护性蛋白质帽会逐渐恶化。最终,暴露的染色体末端被视为DNA损伤,从而激活p53依赖性细胞周期停滞(见图1760)。相比之下,啮齿动物细胞在培养中增殖时保持端粒酶活性,因此没有这种限制增殖的端粒依赖性机制。利用基因工程技术在正常人类成纤维细胞中强制表达端粒酶,可以阻止这种形式的衰老。不幸的是,大多数癌细胞已经恢复了产生端粒酶的能力,因此在增殖时保持了端粒功能;因此,它们不会经历复制性细胞衰老。
细胞增殖伴随着细胞生长
如果细胞增殖而不生长,它们会逐渐变小,总细胞质量不会净增加。因此,在大多数增殖细胞群中,细胞生长伴随着细胞分裂。在酵母等单细胞生物中,细胞生长和细胞分裂都只需要营养物质。相比之下,在动物中,细胞生长和细胞增殖都依赖于其他细胞产生的细胞外信号分子,我们分别称之为生长因子和有丝分裂原。
与有丝分裂原一样,刺激动物细胞生长的细胞外生长因子与细胞表面的受体结合并激活细胞内信号通路。这些通路刺激蛋白质和其他大分子的积累,它们通过增加其合成率和降低其降解率来实现这一点。它们还会触发营养物质的吸收增加和ATP的产生,以促进蛋白质合成的增加。生长因子受体激活的最重要的细胞内信号通路之一涉及磷酸肌醇3-激酶(PI3-激酶),它将ATP中的磷酸盐添加到质膜中肌醇磷脂的3'位置(第15章讨论)。PI3-激酶的激活会导致一种名为mTORC1的蛋白激酶的激活,该蛋白激酶是所有真核生物细胞生长调节途径的核心(见图1555)。mTORC1激活细胞中的许多靶标,刺激代谢过程,包括蛋白质和脂质合成,或减少蛋白质周转(图1761)。
增殖细胞通常协调其生长和分裂
为了使增殖细胞保持恒定的大小,它们必须协调其生长与细胞分裂,以确保细胞大小在每次分裂时翻倍:如果细胞生长太慢,它们会随着每次分裂而变小,如果细胞生长太快,它们会随着每次分裂而变大。目前尚不清楚细胞如何实现这种协调,但很可能涉及多种机制在不同的生物体中,甚至在同一生物体的不同细胞类型中也各不相同(图1762)。然而,动物细胞的生长和分裂并不总是协调的。在许多情况下,它们完全脱钩,允许生长而不分裂或分裂而不生长。例如,肌肉细胞和神经细胞在永久退出细胞周期后可以急剧生长。同样,许多动物的卵子在没有分裂的情况下长到非常大的尺寸;然而,受精后,这种关系被逆转,并且会发生多轮分裂而不会生长。与细胞分裂相比,关于动物细胞大小如何控制的研究令人惊讶地少。因此,细胞大小如何确定以及为什么同一动物的不同细胞类型会长成如此不同的大小仍然是一个谜。哺乳动物中最为人熟知的案例之一是成年交感神经元,它已永久退出细胞周期。它的大小取决于它所支配的靶细胞分泌的神经生长因子(NGF)的数量;神经元能够获得的NGF数量越多,它就越大。细胞表达的基因似乎限制了它的大小,而细胞外信号分子和营养物质则在这些限制内调节大小。挑战在于确定每种细胞类型的相关基因和信号分子。
摘要
多细胞生物的发育和维持不仅取决于细胞生长和细胞分裂,还取决于细胞死亡。例如,在动物发育过程中,精心安排的细胞生长、分裂和死亡模式有助于确定肢体和器官的大小和形状。成年动物组织大小的维持通常需要细胞以与产生相同的速度死亡,这一过程称为细胞周转。这种正常的细胞死亡也发生在植物的发育过程中以及花叶的衰老过程中,也可能发生在单细胞生物中,包括酵母和细菌。大多数正常的细胞死亡都是自杀,其中一系列分子事件从内部摧毁了细胞,但分子机制可能大不相同。在本章中,我们将重点介绍一种分子上不同的细胞自杀形式,称为凋亡(来自希腊语,意思是脱落,如树叶从树上掉下来),尽管它只发生在动物细胞中。细胞凋亡被认为发生在所有动物中,而且它是迄今为止我们细胞死亡最常见的方式。它也是研究最深入的细胞死亡形式。凋亡细胞会经历特征性的形态和生物化学变化,部分原因是将自身包装起来,以便被附近的细胞快速吞噬和消化。图181显示正常大鼠细胞(图A)和经历两种不同细胞死亡形式的同类型大鼠细胞(图BD)。在凋亡中,细胞收缩和凝聚,细胞骨架崩溃,核膜解体,核染色质凝聚和碎裂(图181B)。凋亡细胞表面通常形成多个大突起,称为水泡(电影18.1),如果细胞很大,它会分裂成膜包裹的碎片,称为凋亡小体。重要的是,细胞及其碎片的表面会发生化学改变,因此邻近细胞(通常是脊椎动物中的巨噬细胞)会在细胞和碎片溢出其内容物之前迅速吞噬它们(图181C)。这样,细胞就会干净利落地死亡,细胞及其碎片也会迅速被清除,而不会引起破坏性的炎症反应。由于凋亡细胞被吃掉和消化得如此之快,因此即使在大量细胞因凋亡而死亡的组织中,也通常很少看到死细胞。受损或感染的细胞也会因凋亡而死亡,确保它们在威胁动物健康之前被消灭。然而,严重受损或受压的动物细胞有许多非凋亡方式死亡。这些通常被归类为细胞坏死。一种常见的、主要是被动形式的细胞坏死发生在细胞因急性组织损伤(如创伤或血液供应受阻)而溶解时:细胞肿胀并破裂(图181D),将其内容物溢出到邻近细胞上并引发炎症反应。在其他形式的细胞坏死中,细胞积极参与死亡过程,并根据诱导应激的性质和所涉及的分子机制,赋予它们特殊名称,例如坏死性凋亡或焦亡。
在本章中,我们讨论了脊椎动物中细胞凋亡的主要功能、其分子机制和调控,以及过度或不足的细胞凋亡如何导致人类疾病。
细胞死亡
第18章
MBOC7_ptr_ch18_1089-1104.indd1089MBOC7_ptr_ch18_1089-1104.indd108902/12/2112:26PM02/12/2112:26PM
1090第18章:细胞死亡
凋亡消除不需要的细胞
许多发育和成年脊椎动物组织中发生的细胞凋亡数量令人震惊:健康成年人中每秒至少有100万个细胞以这种方式死亡(并被细胞分裂取代)。这么多细胞死亡似乎非常浪费,尤其是绝大多数细胞在自杀时都是完全健康的。如此大规模的细胞死亡有什么好处?在某些情况下,特别是在动物发育过程中,细胞死亡的作用是显而易见的。细胞凋亡有助于在胚胎发育过程中塑造我们的手和脚:这些附属物最初是铲状结构,各个手指只有在它们之间的细胞死亡时才会分开,如图182中的小鼠爪子所示。在其他情况下,当细胞形成的结构不再需要时,它们会因细胞凋亡而死亡。例如,当蝌蚪在变态过程中变成青蛙时,尾巴中的细胞会因细胞凋亡而死亡,而青蛙不需要的尾巴会消失。细胞凋亡在发育过程中也起着质量控制过程的作用,消除异常、错位、无功能或对动物有潜在危险的细胞。脊椎动物的适应性免疫系统中就出现了引人注目的例子,细胞凋亡会消灭正在发育的T和B淋巴细胞,这些细胞要么无法产生可能有用的抗原特异性受体,要么产生使细胞具有潜在危险性的自身反应性受体(第24章将对此进行讨论);它还会消灭大多数因感染而激活并增殖的淋巴细胞,因为它们已经帮助消灭了致病微生物。在既不生长也不萎缩的成人组织中,必须严格控制细胞死亡和细胞分裂以确保它们保持平衡。例如,如果成年大鼠的部分肝脏被切除,肝细胞增殖就会增加以弥补损失。相反,如果给大鼠服用苯巴比妥这种刺激肝细胞生长和分裂(从而导致肝脏增大)的药物,然后停止苯巴比妥治疗,肝脏细胞凋亡会大大增加,直到肝细胞数量恢复正常,通常在一周左右。因此,通过调节细胞死亡率和细胞出生率,肝细胞数量保持恒定。负责控制这种显著的调节在很大程度上是未知的。
动物细胞可以识别其各种细胞器中的损伤,如果损伤足够大,它们可以通过凋亡自杀。一个重要的例子是DNA损伤,它可以产生促进癌症的
图181两种不同的细胞死亡形式。这些电子显微照片显示了不同状态下的大鼠少突胶质细胞前体细胞:(A)培养中的正常细胞;(B)培养中的细胞因缺乏细胞外生存信号而因凋亡而死亡(稍后讨论);(C)正常发育视神经中的细胞因凋亡而死亡并被邻近的吞噬细胞吞噬;(D)培养中的细胞因坏死而死亡。请注意,B和C中的凋亡细胞具有完整的质膜,但染色质已浓缩、扭曲并集中在细胞核边缘,而D中的坏死细胞似乎已爆炸。B中细胞的细胞质中可见的大空泡是凋亡的一个可变特征。(由JuliaBurne和MartinRaff提供。)
图182通过凋亡在发育中的小鼠爪中塑造手指。
(A)这只小鼠胎儿的爪子已用染料吖啶橙染色,染料进入凋亡细胞,从而在正常发育的爪子中明亮地标记它们。
凋亡细胞呈现为集中在发育手指之间的亮绿色点。(B)指间细胞死亡已经消除了发育中的指间大部分组织,如一天后所见,此时凋亡细胞非常少。(来自W.Wood等人,Development
127:52455252,2000。经生物学家公司许可。)
1毫米
(B)
(A)
MBoC7m18.02/18.02
(D)(B)10米(A)10米(C)吞噬
死细胞
吞噬细胞
MBoC7m18.01/18.01
MBOC7_ptr_ch18_1089-1104.indd1090MBOC7_ptr_ch18_1089-1104.indd109002/12/2112:26PM02/12/2112:26PM
1091
突变如果不是修复。细胞有多种检测DNA损伤的方法(见图1760),如果无法修复,细胞就会因凋亡而死亡。
细胞凋亡依赖于由胱天蛋白酶介导的细胞内蛋白水解级联反应
一类专门的细胞内蛋白酶家族通过在特定氨基酸序列处裂解大量但特定的细胞内蛋白质来触发细胞凋亡,从而引起细胞凋亡期间发生的剧烈变化。由于这些蛋白酶在其活性位点处具有半胱氨酸,并在特定的天冬氨酸处裂解其靶蛋白,因此它们被称为胱天蛋白酶(c代表半胱氨酸,asp代表天冬氨酸)。并非所有的胱天蛋白酶都参与细胞凋亡:事实上,第一个被鉴定的人类胱天蛋白酶,胱天蛋白酶-1,主要通过裂解两种促炎性细胞外信号分子(细胞因子,第24章讨论)的前体来帮助刺激炎症反应。参与细胞凋亡的胱天蛋白酶在几乎所有细胞的胞质溶胶中都以无活性的前体(通常称为procas-
pases)的形式存在,在细胞凋亡期间被激活。这些凋亡胱天蛋白酶主要分为两类:启动胱天蛋白酶和执行胱天蛋白酶。启动胱天蛋白酶,顾名思义,启动凋亡程序。在哺乳动物中,它们主要是胱天蛋白酶-8和胱天蛋白酶-9。它们以无活性的可溶性单体形式存在,只有当单体二聚化时才会被激活。当凋亡信号触发特定衔接蛋白复合物的组装时,就会发生二聚化,然后该复合物会募集多个相同的启动蛋白酶单体以形成更大的活化复合物,单体在其中二聚化并被活化。活化的蛋白酶二聚体中的每个单体随后在特定位点切割其伴侣,形成成熟的、活化的启动蛋白酶二聚体(图183)。启动蛋白酶的主要功能是激活执行蛋白酶,从而协调凋亡程序。脊椎动物中有三种执行蛋白酶:caspase-3、caspase-6和caspase-7。与启动蛋白酶不同,执行蛋白酶通常以无活性的可溶性二聚体形式存在,通过裂解激活,几乎总是由启动蛋白酶介导(图184)。每个启动蛋白酶可以激活一个或多个执行蛋白酶的许多副本,从而导致蛋白酶级联扩增。一旦被激活,执行者胱天蛋白酶就会催化广泛的蛋白质裂解事件,这些事件负责以特征性方式杀死细胞,并为快速吞噬和消化做好准备
前结构域
(适配器结合)
蛋白酶结构域
裂解位点
非活性启动子
胱天蛋白酶单体
活化启动子
胱天蛋白酶二聚体
成熟活性启动子胱天蛋白酶
凋亡
信号
组装适配器-
蛋白质复合物
胱天蛋白酶通过二聚化激活
交叉裂解、
亚基重排和释放OF活性胱天蛋白酶二聚体来自前结构域衔接子复合物
大亚基
小亚基
MBoC718.03top/18.03
图183凋亡开始时启动胱天蛋白酶的激活。启动胱天蛋白酶在其较大的羧基末端区域包含一个蛋白酶结构域,在其氨基末端区域包含一个较小的衔接子蛋白结合前结构域。胱天蛋白酶以无活性单体的形式存在,通过二聚化激活。二聚化和激活仅当凋亡信号触发特定衔接子蛋白复合物的组装时才会发生(此处显示为假设最简单的同型二聚体)。然后,每种类型的衔接子复合物都会招募一种类型的启动胱天蛋白酶单体的多个副本,使它们二聚化并从而变得活跃。在图示的情况下,一旦被激活,活化的
胱天蛋白酶二聚体中的每个单体都会在特定位点交叉切割其伴侣;蛋白酶结构域中的切割使大和小
胱天蛋白酶亚基能够重新排列,大蛋白酶结构域和前结构域之间的切割会从前结构域衔接复合物中释放出成熟的
活性胱天蛋白酶二聚体。
MBOC7_ptr_ch18_1089-1104.indd1091MBOC7_ptr_ch18_1089-1104.indd109102/12/2112:26PM02/12/2112:26PM
1092第18章:细胞死亡
邻近细胞。胱天蛋白酶启动的蛋白水解级联不仅具有自我扩增和破坏性,而且不可逆,因此一旦细胞开始走向凋亡,就无法回头。
执行者胱天蛋白酶在凋亡过程中切割数百种不同的细胞蛋白,但这些靶蛋白在凋亡中的作用仅在少数情况下为人所知,我们在此提到了其中几种。例如,胱天蛋白酶-6切割核层蛋白会导致核层不可逆破裂(第12章讨论)。胱天蛋白酶-3切割抑制蛋白,该抑制蛋白通常将特定的DNA降解内切酶保持在非活性形式,从而释放内切酶以在凋亡期间切割细胞核中的DNA(图185)。某些调节肌动蛋白细胞骨架的蛋白质的裂解会导致细胞皮层中的肌动蛋白聚合,而这会导致细胞凋亡时表面起泡,如前所述(参见电影18.1)。其他肌动蛋白调节剂和一些将细胞附着到其邻近细胞上的细胞粘附蛋白的裂解有助于凋亡细胞聚集并与邻近细胞分离,从而使邻近细胞更容易吞噬它。正如我们稍后讨论的那样,质膜中两种磷脂转移蛋白的裂解会导致磷脂酰丝氨酸暴露在凋亡细胞的表面,在那里它充当邻近吞噬细胞的“吃我”信号。重要的是,阻止任何单个蛋白质裂解步骤都不能阻止凋亡细胞死亡,尽管它会按预期在每种情况下改变其特性。启动蛋白酶如何在凋亡信号的作用下首先被激活?
我们的细胞使用两种主要的激活途径:一种是从细胞外部发出信号
,称为外部途径,另一种是从线粒体发出信号
蛋白酶
结构域
前结构域
非活性执行者
蛋白酶二聚体
成熟活性
执行者蛋白酶
通过切割、
亚基重排和
前结构域去除激活
活性启动蛋白酶
多种类型的细胞蛋白的切割,
导致细胞凋亡
大亚基
小亚基
MBoC7m18.03bottom/18.04
图184细胞凋亡期间执行者蛋白酶的激活。执行者胱天蛋白酶具有非常短的脯氨酸结构域,缺乏与其他蛋白质相互作用的位点。它们最初形成为无活性二聚体,通过在每个蛋白酶结构域的位点处进行切割而激活,几乎总是由启动胱天蛋白酶进行。切割使大亚基和小亚基重新排列以形成两个活性蛋白酶位点,然后每个位点从其伴侣单体的脯氨酸结构域上切下,产生成熟的活性执行者胱天蛋白酶,如图所示。成熟的活化胱天蛋白酶随后切割各种细胞靶蛋白,导致细胞受控凋亡。图185凋亡期间的DNA碎片。(A)在健康细胞中,胱天蛋白酶活化的DNase(CAD)由抑制蛋白iCAD保持在非活性状态。在细胞凋亡过程中,执行者caspase-3的激活导致iCAD裂解,释放活性DNase以切割核小体之间的染色体DNA。(B)由于DNA裂解仅发生在核小体之间连接区域的可接近位点,因此DNA被切割成大小不等的片段,相当于与一个或多个核小体相关的DNA(如A所示),在DNA凝胶电泳时产生梯形图。显示的模式是获得的该方法通过用地塞米松诱导小鼠胸腺淋巴细胞凋亡,在凝胶顶部指示的时间提取DNA,通过琼脂糖凝胶电泳按大小分离片段,并用溴化乙锭对凝胶中的DNA进行染色。(B,来自D.McIlroy等人,GenesDev.14:549558,2000。
经ColdSpringHarbor
LaboratoryPress许可。)(B)(A)
MBoC7m18.04/18.05
013612
时间(小时)
iCAD
iCAD
切割
活性执行者
胱天蛋白酶(胱天蛋白酶-3)
非活性
CAD
活性
CAD
染色质片段
iCAD的切割
核小体之间
DNA的切割
MBOC7_ptr_ch18_1089-1104.indd1092MBOC7_ptr_ch18_1089-1104.indd109202/12/2112:26PM02/12/2112:26PM
1092第18章:细胞死亡1093
细胞内,称为内在或线粒体途径。正如我们现在讨论的那样,每个途径都使用自己的启动蛋白酶和衔接蛋白。
细胞表面死亡受体的激活启动细胞凋亡的外在途径
与细胞表面死亡受体结合的细胞外信号蛋白触发细胞凋亡的外在途径。死亡受体是跨膜蛋白,包含细胞外配体结合结构域、单个跨膜结构域和细胞内死亡结构域,这是受体激活凋亡程序所必需的。这些受体是同源三聚体,属于肿瘤坏死因子(TNF)受体家族,该家族有8个成员,包括TNF本身的受体和Fas死亡受体。激活死亡受体的配体也是同源三聚体,属于TNF信号蛋白家族。
关于死亡受体如何触发细胞凋亡的外部途径的一个相对容易理解的例子是杀伤性(细胞毒性)淋巴细胞表面的Fas配体激活靶细胞表面的Fas受体(第24章讨论)。Fas信号在调节T和B淋巴细胞数量方面发挥着作用,正如Fas信号失活导致这些细胞异常增加的研究结果所表明的那样。如图186所示,
非活性
caspase-8
单体
蛋白酶
结构域
杀伤性
淋巴细胞
caspase-8
丝状体
28
caspase-8
复制
caspase-8
DISC
杀伤性
淋巴细胞
质膜
细胞核
死亡
结构域
激活的Fas
死亡受体
暴露的
死亡
结构域
FADD适配器
暴露的
死亡
效应域(DED)
未暴露的
死亡
效应域(DED)
FADD适配器蛋白
非活性的Fas
死亡受体
Fas配体
靶细胞
质膜
FAS受体
活化、圆盘组装
和通过二聚化激活Caspase-8
CASPASE-8
交叉裂解、亚基
重排和释放
成熟活化的
CASPASE-8二聚体进入细胞溶胶
通过切割
执行者caspase
3和7激活
凋亡靶细胞
凋亡
MBoC7m18.05/18.06
活化的
caspase-8
二聚体
图186通过Fas死亡受体激活的细胞凋亡的外在途径。杀伤性淋巴细胞表面的三聚体Fas配体与靶细胞表面的三聚体Fas死亡受体结合,诱导靶细胞通过外部途径进行细胞凋亡而自我杀死。虽然图中未显示,但至少两个三聚体Fas配体必须与至少两个三聚体Fas受体结合并聚集在一起才能激活该途径;为清晰起见,图中仅显示了配体和受体的单个副本。配体诱导的受体聚集(未显示)在受体尾部暴露出死亡结构域,如这里所示,结构域的颜色在暴露后从浅红色变为深红色。每个暴露的死亡结构域都与细胞溶质衔接蛋白FADD(Fas相关死亡结构域)上类似的暴露死亡结构域结合。结合的FADD蛋白随后暴露出死亡效应域(DED;深蓝色),使FADD能够通过与caspase前结构域上暴露的DED(深蓝色)结合来招募无活性的单体启动caspase(主要是caspase-8)。每个caspase-8单体都有两个DED,当一个与暴露的DED结合时,另一个就会暴露出来(如DED颜色从浅蓝色变为深蓝色所示)并且可以招募另一个caspase-8单体;这会导致链式反应,其中caspase-8单体寡聚化为三维螺旋细丝(未显示),每个FADD蛋白最多可附着八个caspase-8分子。最终结果是组装一个由多个Fas、FADD和caspase-8副本组成的大型死亡诱导信号复合物(DISC)。在DISC中,相邻的caspase-8单体相互作用形成
活化二聚体,这些二聚体现在可以交叉切割其伴侣单体(未显示,但见图183),切割前结构域并形成
成熟的活化二聚体,这些二聚体被释放到细胞溶胶中,在那里它们可以切割并激活执行者胱天蛋白酶以诱导细胞凋亡。在人类细胞中,胱天蛋白酶-10启动胱天蛋白酶也可以被整合到DISC中,但与胱天蛋白酶-8不同,它对于Fas诱导的细胞凋亡并非必不可少。
MBOC7_ptr_ch18_1089-1104.indd1093MBOC7_ptr_ch18_1089-1104.indd109302/12/2112:26PM02/12/2112:26PM
1094第18章:细胞死亡
三聚体Fas配体与三聚体Fas受体聚集,在受体尾部暴露死亡结构域,然后结合并聚集一种称为FADD的小细胞内衔接蛋白。成簇的FADD蛋白依次募集多个无活性的单体启动蛋白酶(主要是caspase-8)的拷贝,这些蛋白酶寡聚化,在靶细胞质膜的细胞质表面形成一个大的死亡诱导信号复合物(DISC)。
caspase-8的寡聚化使caspase二聚化和活化,然后caspase自身裂解形成成熟、活性的caspase-8二聚体,这些二聚体可以裂解和激活下游执行蛋白酶以诱导细胞凋亡。
不同细胞类型对Fas诱导的细胞凋亡的敏感性各不相同。许多细胞产生抑制蛋白,可抑制外在凋亡途径。例如,一些细胞会产生一种称为FLIP的蛋白质,这种蛋白质与caspase-8相似,但缺乏蛋白酶活性,因为它缺少活性位点所需的关键半胱氨酸。FLIP与DISC中的caspase-8二聚化,并阻止其激活执行者caspase来启动细胞凋亡。这样,FLIP设置了一个抑制阈值,外部途径必须通过激活caspase-8来克服该阈值才能触发细胞凋亡。正如我们稍后讨论的那样,外部途径要杀死某些细胞类型,就必须克服另一种caspase抑制剂,它通过招募内部凋亡途径(我们现在讨论的途径)来实现这一点。
细胞凋亡的内在途径取决于线粒体释放的蛋白质
细胞还可以从细胞内部激活其凋亡程序,通常是对发育信号或DNA损伤等损伤作出反应。在脊椎动物细胞中,这些凋亡反应由细胞凋亡的内在途径介导,该途径也称为线粒体途径,因为它取决于线粒体蛋白质释放到细胞溶胶中,这些蛋白质通常位于这些细胞器的膜间隙中(见图1247)。这些释放的蛋白质中最重要的是细胞色素c,它是线粒体电子传递链的水溶性成分,因此在线粒体氧化磷酸化产生ATP的过程中起着核心作用(见图1418)。
然而,当它被释放到细胞溶胶中(图187)时,它就具有了全新的功能:它可以诱导细胞凋亡,而与其电子传递活性无关。
25m10m
细胞色素cGFP线粒体染料细胞色素cGFP
MBoC7m18.06/18.07
(A)对照细胞(B)紫外线处理的细胞
图187在细胞凋亡的内在途径中,细胞色素c从线粒体释放到细胞溶胶中。这些荧光显微照片显示了培养中的人类癌细胞。
这些细胞被转染了一种编码融合蛋白的基因,该融合蛋白由与绿色荧光蛋白(细胞色素cGFP)连接的细胞色素c组成,并且还用一种在线粒体中积累的红色染料处理。(A)未受刺激的对照细胞:绿色和红色的重叠分布证实细胞色素cGFP位于线粒体中。(B)用紫外线(UV)照射细胞以诱导细胞凋亡的内在途径,并在5小时后拍照。这张显微照片右下方的七个细胞已将其细胞色素c从线粒体释放到细胞溶胶中,而显微照片中的其他细胞尚未这样做。(摘自J.C.Goldstein等人,《自然细胞生物学》2:156162,2000年由NaturePublishingGroup出版。经SNCSC许可转载。)
MBOC7_ptr_ch18_1089-1104.indd1094MBOC7_ptr_ch18_1089-1104.indd109402/12/2112:26PM02/12/2112:26PM
1094第18章:细胞死亡1095
(在进化过程中,线粒体和细胞色素c如何获得其在细胞凋亡中的惊人作用,这仍然是一个重要的谜团。)
一旦释放到细胞溶胶中,细胞色素c就会与一种名为Apaf1(凋亡蛋白酶活化因子)的衔接蛋白结合1),导致适配器结合脱氧ATP并寡聚化成一个大的轮状七聚体。然后,七聚体将无活性的启动蛋白酶9单体招募到复合物中,形成更大的结构,称为凋亡小体(图188)。Caspase-9由凋亡小体内的二聚化激活,就像另一种主要启动蛋白酶caspase-8由DISC内的二聚化激活一样(见图186)。一旦被激活,caspase-9就会裂解并激活下游执行者caspases,介导细胞凋亡。
内在途径是脊椎动物中绝大多数细胞凋亡的原因。上游信号要激活内在途径,它们必须改变线粒体外膜,以便膜间隙中的可溶性蛋白质(如细胞色素c)可以扩散到细胞溶胶中。
这一关键的外膜通透步骤由Bcl2蛋白家族成员之间的相互作用控制,正如我们现在所讨论的。
Bcl2蛋白是细胞凋亡内在途径的关键控制者
内在途径受到严格调控,以确保细胞仅在适当的时候通过凋亡自杀。这种调节主要是Bcl2蛋白家族的功能,该家族以第一个描述的家族成员(B细胞淋巴瘤-2)命名,如下所述。在哺乳动物细胞中,这些蛋白质之间复杂的相互作用控制着线粒体外膜的通透性,从而控制细胞色素c和
图188细胞凋亡的内在途径。细胞内凋亡刺激导致线粒体释放细胞色素c。
细胞色素c与细胞质衔接蛋白Apaf1的结合诱导Apaf1发生构象变化,从而激活它,暴露出脱氧ATP(dATP)的结合位点、寡聚化结构域和caspase募集结构域
(CARD)。暴露的寡聚化结构域介导Apaf1组装成轮状七聚体。七聚体中的每个CARD随后通过其自身的CARD募集一个无活性的caspase-9单体,形成一个大的凋亡体,相互作用的CARD聚集在凋亡体的中心枢纽上方。在组装过程中,dATP水解为dADP。在凋亡体中,caspase-9单体通过二聚化被激活。活化的caspase-9二聚体随后裂解并激活下游执行者caspase,导致细胞凋亡。请注意,CARD结构域在结构和功能上与caspase-8的死亡效应域(DED)相关(参见图186)。
dATP结合
dATP
dADP
非活性Apaf1
衔接蛋白
活性Apaf1
释放
细胞色素c胞质溶胶
细胞色素c
在膜间隙中
细胞色素c和
dATP结合
激活Apaf1
Apaf1的寡聚化
招募
胱天蛋白酶9
单体形成
凋亡体
并通过二聚化激活胱天蛋白酶
非活性
胱天蛋白酶9
单体
活性
胱天蛋白酶9
二聚体
线粒体
暴露
CARD
未暴露
CARD
通过切割和激活执行者胱天蛋白酶
活化的胱天蛋白酶-9
二聚体
细胞凋亡
MBoC7m18.07/18.08
凋亡刺激
凋亡体
埋藏
卡
阻断
dATP-
结合位点
埋藏
寡聚化
域
暴露
寡聚化
域
MBOC7_ptr_ch18_1089-1104.indd1095MBOC7_ptr_ch18_1089-1104.indd109502/12/2112:26PM02/12/2112:26PM
1096第18章:细胞死亡
膜间隙中的其他可溶性蛋白质,这一过程称为线粒体外膜通透性(MOMP)。与caspase家族一样,
Bcl2蛋白家族存在于所有动物中,并且得到了显著的保守性;
例如,人类Bcl2蛋白在秀丽隐杆线虫中表达时可以抑制细胞凋亡。
哺乳动物Bcl2家族蛋白有三种结构和功能类别:(1)抗凋亡Bcl2家族蛋白,包括Bcl2本身,通过阻止MOMP来抑制细胞凋亡。(2)促凋亡Bcl2家族效应物可以通过在外线粒体膜上产生开口来直接诱导MOMP。
(3)第二类促凋亡Bcl2家族蛋白,称为BH3特异性蛋白(原因稍后解释),通过调节其他两类来促进细胞凋亡。这三类蛋白活性之间的平衡在很大程度上决定了MOMP是否发生,从而决定了哺乳动物细胞是通过细胞凋亡的内在途径生存还是死亡。
如图189所示,抗凋亡Bcl2家族蛋白(包括Bcl2本身和Bcl特大(BclxL))具有四个独特的Bcl2同源性(BH)结构域(BH14)。两种主要的促凋亡Bcl2家族效应物Bak和Bax在结构上与Bcl2相似,但缺少BH4结构域。第二类促凋亡Bcl2家族蛋白的成员仅在BH3结构域中与Bcl2具有序列同源性,因此被称为仅BH3蛋白;它们是迄今为止最大的Bcl2蛋白类。
当凋亡刺激触发内在途径时,促凋亡的
Bcl2家族效应物Bak和Bax被激活,并通过
在线粒体外膜中聚集成各种大小的寡聚体来触发MOMP,
通过不确定的机制在膜上产生开口,允许
细胞色素c和其他膜间蛋白逃逸进入细胞溶胶(图1810A和B)。这些促凋亡效应物中的至少一种是内在凋亡途径在哺乳动物细胞中起作用所必需的:缺乏这两种蛋白质的突变小鼠细胞不会经历MOMP或参与内在凋亡途径。即使在没有凋亡信号的情况下,Bak也会与线粒体外膜结合(见图1810A和B),而Bax主要位于细胞溶胶中,直到凋亡信号激活它,导致它重新定位到外膜,在那里它寡聚化。正如我们下面讨论的那样,Bak和Bax的激活通常依赖于激活的BH3特异性蛋白。抗凋亡Bcl2家族蛋白(如Bcl2和BclxL)也位于线粒体外膜的胞浆表面,它们有助于防止不适当的MOMP。它们通过与活性促凋亡效应物Bak和Bax的BH3结构域结合,从而防止其寡聚化(图1810C)。哺乳动物抗凋亡Bcl2家族蛋白至少有五种,每个哺乳动物细胞都需要至少一种来避免凋亡并因此存活。此外,许多这些抗凋亡蛋白必须被抑制才能通过内在途径诱导凋亡,而BH3独有蛋白介导这种抑制。BH3特异性蛋白是Bcl2家族蛋白中最大的亚类,当它们在细胞中响应凋亡刺激而产生或激活时,会促进MOMP,从而导致细胞凋亡。它们至少通过两种方式实现这一点。
(1)一些BH3特异性蛋白,包括Bad(见图189),抑制某些
抗凋亡
Bcl2家族蛋白
(例如,Bcl2、BclxL、Mcl1)
促凋亡
Bcl2家族效应物
(例如,Bak、Bax)
促凋亡
BH3特异性蛋白
(例如,Bad、Bim、
Bid、Puma、Noxa)
BH4BH3BH1BH2
MBoC7m18.08/18.09
图189三类Bcl2家族蛋白中的BH结构域示意图。请注意,
BH3结构域是所有Bcl2家族成员共享的四个BH结构域中唯一的一个;它介导促凋亡和抗凋亡家族成员之间的直接相互作用(见图1810C和D)。
MBOC7_ptr_ch18_1089-1104.indd1096MBOC7_ptr_ch18_1089-1104.indd109602/12/2112:26PM02/12/2112:26PM
1096第18章:细胞死亡1097
抗凋亡Bcl2家族蛋白通过其BH3结构域与抗凋亡蛋白上的BH3结合槽结合。这种结合阻断了Bcl2家族蛋白的抗凋亡活性,从而使Bax和/或Bak在粒线体外膜上寡聚化以触发MOMP(图1810D)。(2)一些BH3特异性蛋白,包括Bim和Bid(见图189),可以直接结合并激活Bak和Bax,刺激它们寡聚化并触发MOMP。通过这些方式,BH3特异性蛋白提供了凋亡刺激和凋亡内在途径之间的重要联系,不同的刺激激活或诱导不同的BH3特异性蛋白的产生。例如,当细胞遭受无法修复的DNA损伤时,肿瘤抑制蛋白p53(第17章和第20章讨论)会在细胞核中积聚,并激活编码BH3独有蛋白Puma和Noxa的基因转录(见图189),然后触发MOMP和细胞凋亡,从而消除可能变成癌细胞的潜在危险细胞。我们将看到,一些细胞外生存信号通过阻止细胞存活来促进细胞存活
BclxL的结合阻断了
活化Bak的寡聚化
Bad与BclxL结合,
释放活化Bak
抑制的
活化Bak
+
凋亡刺激
凋亡刺激
凋亡刺激
非活性Bak
膜间
外
线粒体
膜
内
线粒体
膜
细胞色素c
膜间
中的其他蛋白质
MBoC7m18.09/18.10
活化Bak的寡聚化
诱导MOMP
活化Bak的寡聚化
诱导MOMP
膜间空间
胞质溶胶
膜间空间
胞质溶胶
胞质溶胶
外线粒体
膜
外线粒体
膜
非活性Bak蛋白
活化Bak
BH3
结构域
BH3结构域活性Bad
非活性Bak蛋白
暴露于活化Bak
BH3结构域
BH3结合槽
(A)Bak的活化和寡聚化BclxL预防MOMP(C)
(B)Bak寡聚体诱导MOMP(D)A诱导MOMPBH3唯一蛋白(如Bad)
BclxL
BclxL
MOMP
阻断
寡聚化
暴露的BH3结合槽
激活
图1810促凋亡Bcl2家族效应物如何诱导MOMP以及抗凋亡Bcl2家族蛋白如何阻断它。(A)大多数促凋亡效应物Bak在蛋白质被激活之前已经附着在线粒体外膜上。当受到凋亡刺激激活时,蛋白质会发生构象变化,从而h
暴露BH3结构域并产生BH3结合槽,使BakBak在外膜中发生寡聚化。(B)
Bak寡聚体通过在外膜上产生开口来诱导MOMP,从而使细胞色素c和膜间隙中的其他可溶性蛋白质
扩散到细胞溶胶中;尽管Bak(和Bax)寡聚体如何产生
开口的细节尚不确定,但人们认为它们会形成破坏外膜完整性的大环结构。一旦
释放到细胞溶胶中,细胞色素c就会刺激凋亡体的组装(见图188)。(C)抗凋亡的Bcl2家族蛋白BclxL与Bak一样,通常与线粒体外膜结合,在那里它可以通过其BH3结合槽与活化Bak上暴露的BH3结构域相互作用,从而阻止BakBak寡聚化、MOMP和凋亡。(D)仅含BH3的蛋白质(如Bad)被认为间接诱导MOMP和凋亡的一种方式是通过抑制某些抗凋亡的Bcl2家族蛋白(如BclxL)。
MBOC7_ptr_ch18_1089-1104.indd1097MBOC7_ptr_ch18_1089-1104.indd109702/12/2112:26PM02/12/2112:26PM
1098第18章:细胞死亡
通过抑制某些BH3特异性蛋白的合成或活性而发生细胞凋亡(见图1813B)。
如前所述,在某些细胞中,外在凋亡途径必须招募内在途径来帮助杀死靶细胞;BH3特异性蛋白
Bid是这两条途径之间的纽带。Bid在这些细胞中通常处于非活性状态,但当死亡受体激活外在途径时(见图186),启动蛋白酶caspase-8会裂解Bid,产生一种活性形式的蛋白质,该蛋白质会转移到线粒体外膜以激活Bax和/或Bak,导致它们寡聚化并触发MOMP。激活的死亡受体需要MOMP来杀死这些细胞,因为它会从线粒体膜间隙释放蛋白质,中和这些细胞胞质中存在的抑制蛋白,这种抑制蛋白通常会阻止细胞凋亡,我们将在下文中解释。
一种凋亡抑制剂(IAP)和两种抗IAP蛋白
有助于控制某些哺乳动物细胞胞质中的胱天蛋白酶活化
由于凋亡胱天蛋白酶级联的激活会导致某些细胞死亡,因此细胞采用多种机制来帮助确保这些蛋白酶仅在适当的时候被激活。FLIP蛋白在外在凋亡途径中对胱天蛋白酶-8的抑制就是前面讨论的一个例子(见第1095页)。
胱天蛋白酶抑制蛋白(称为凋亡抑制剂(IAP))提供了另一道防线,以防止不适当的胱天蛋白酶活化。这些蛋白质首先在某些昆虫病毒(杆状病毒)中发现,这些病毒编码IAP蛋白,以防止被病毒感染的宿主细胞激活caspase并通过凋亡杀死自己,从而抑制病毒的复制。大多数动物细胞也产生IAP蛋白,尽管大多数这些蛋白质并不调节caspase和凋亡。哺乳动物细胞似乎只有一种IAP可以直接抑制caspase活性。它被称为XIAP(因为它在X染色体上编码),它存在于我们许多细胞的细胞质中。它与caspase-9(启动caspase)和caspase-3和caspase-7结合并抑制它们,从而设置这些caspase必须克服的抑制阈值才能触发凋亡。在这些细胞中,XIAP还有助于调节三种caspase蛋白的水平:它具有泛素连接酶结构域,可对XIAP结合的caspase进行多泛素化,标记它们以便在蛋白酶体中破坏(见图367)。
当细胞凋亡的内在途径被激活时,MOMP从线粒体膜间隙释放的蛋白质中有两种抗IAP蛋白,称为Smac和Omi。在胞质溶胶中含有XIAP的细胞中,这些抗IAP蛋白与XIAP结合并阻止其抑制caspase,从而促进caspase活化和细胞凋亡(图1811)。这就是为什么
外在凋亡途径需要招募内在途径(涉及
MOMP和caspases9、3和7)来诱导某些细胞凋亡,如前所述;这些细胞在胞质溶胶中表达XIAP。
细胞外存活因子以各种方式抑制细胞凋亡
如第15章和第21章所述,细胞外信号调节动物细胞的大多数活动,包括细胞凋亡。它们是正常社会控制的一部分,在这种情况下,确保单个细胞的行为有利于整个生物体,当需要细胞时存活,当不需要细胞时自杀。一些细胞外信号分子刺激细胞凋亡,而另一些抑制细胞凋亡。我们已经讨论了激活死亡受体进行tr的信号蛋白,例如Fas配体刺激细胞凋亡的外在途径。其他刺激细胞凋亡的细胞外信号分子在脊椎动物发育过程中尤为重要:例如,血液中甲状腺激素的激增会向蝌蚪尾部的细胞发出信号,使其在变态时发生细胞凋亡。在小鼠中,局部产生的信号蛋白刺激发育中的手指和线粒体膜间隙之间的细胞
线粒体膜间隙
胞质溶胶
细胞色素c
Bak或Bax
寡聚体
MBoC7n18.103/18.11
MOMP
细胞凋亡
SmacOmi
XIAP
caspase-9
caspases
3和7
线粒体外膜
图1811MOMP如何克服XIAP抑制。在某些哺乳动物细胞中,胞质溶胶中XIAP的存在会抑制启动子caspase-9和执行子caspase3和7;XIAP与这三种酶的活性位点结合,从而阻断它们的活性。然而,除了释放细胞色素c外,MOMP还会释放两种抗IAP蛋白Smac和Omi,它们会抑制XIAP的抗caspase活性,从而允许在细胞凋亡的内在途径期间在胞质溶胶中激活这些caspase(见图188)。
MBOC7_ptr_ch18_1089-1104.indd1098MBOC7_ptr_ch18_1089-1104.indd109802/12/2112:26PM02/12/2112:26PM
1098第18章:细胞死亡1099
脚趾自杀,从而塑造了这些手指(见图182)。然而,在这里,我们关注通过抑制细胞凋亡促进细胞存活的细胞外信号分子,它们统称为存活因子。大多数动物细胞需要来自其他细胞的此类信号来避免发生细胞凋亡,通常通过内在途径。这种令人惊讶的安排显然有助于确保细胞仅在需要时和需要的地方存活。例如,一些神经细胞在发育中的神经系统中过量产生,然后争夺它们通常连接的靶细胞分泌的有限数量的生存因子。接收到足够生存信号的神经细胞存活,而其他神经细胞则因凋亡而死亡。这样,存活的神经元数量会自动调整,以使其适合它们连接的靶细胞数量(图1812)。局部或系统产生的有限数量的生存因子的类似竞争可能有助于控制其他组织中的细胞数量,无论是在发育期间还是在成年期。生存因子通常与细胞表面受体结合,从而激活抑制凋亡程序的细胞内信号通路(第15章中讨论),通常通过调节Bcl2蛋白家族成员的表达或活性来抑制凋亡程序。例如,一些生存因子刺激抗凋亡Bcl2家族蛋白(如Bcl2本身或BclxL)的合成(图1813A)。其他一些生存因子通过抑制促凋亡BH3特异性蛋白(如Bad)的功能起作用(图1813B)。一些正在发育的神经元(如图1812所示)使用一种违反直觉的替代策略,其中生存因子受体在未被占用时刺激细胞凋亡,而在生存因子结合时停止这样做。所有这些情况的最终结果都是一样的:细胞存活取决于生存因子与细胞表面受体的结合。
神经细胞
凋亡
神经细胞
神经细胞
神经细胞
体
神经细胞
轴突
靶细胞
凋亡
调整神经细胞数量
以适应靶细胞释放的生存因子的大小
MBoC7m18.11/18.12
图1812生存因子和
凋亡如何帮助调整发育中的神经细胞数量
以适应神经细胞所支配的靶组织的大小。
在此示例中,产生的神经细胞数量多于靶组织中细胞产生的有限生存因子所能支持的神经细胞数量。因此,一些神经细胞接收的生存因子数量不足以避免
凋亡。这种在发育过程中先过量生产然后进行剔除的策略有助于确保所有适当的靶细胞都能与适当的神经细胞接触,而多余的神经细胞则被自动消除。
图1813细胞外存活因子抑制细胞凋亡的两种不同方式。(A)一些存活因子通过刺激编码抗凋亡Bcl2家族蛋白(如Bcl2(如图所示)或BclxL)的基因转录来抑制细胞凋亡。(B)许多其他因子激活丝氨酸/苏氨酸蛋白激酶Akt,除了其他许多靶标外,它还磷酸化和灭活促凋亡的BH3特异性蛋白Bad(见图189)。当未磷酸化时,
Bad通过结合并抑制抗凋亡Bcl2家族蛋白(如Bcl2本身)来促进细胞凋亡。一旦磷酸化,Bad就会解离,
释放Bcl2以抑制细胞凋亡(见图1810C和图1554)。
Akt也可以抑制细胞凋亡通过磷酸化和灭活转录调节蛋白,这些蛋白刺激编码促进细胞凋亡的蛋白质的基因转录,例如BH3独有的蛋白质Bim(未显示)。存活因子还可以通过许多其他方式抑制细胞凋亡,但这里没有说明。
生存因子生存因子
激活
受体
激活
转录
调节器
激活
受体
核
RNA
DNA
Bcl2
凋亡
凋亡
激活
Akt激酶
未抑制
Bcl2
抑制
Bcl2
活性
Bad
非活性
磷酸化
Bad
抗凋亡Bcl2家族蛋白产量增加
(A)(B)促凋亡BH3-only蛋白失活
MBoC7m18.12/18.13
PP
P
MBOC7_ptr_ch18_1089-1104.indd1099MBOC7_ptr_ch18_1089-1104.indd109902/12/2112:26PM02/12/2112:26PM
1100第18章:细胞死亡
健康邻居吞噬并消化凋亡细胞
凋亡细胞死亡是一个整洁的过程。凋亡细胞及其碎片不会破裂并释放其内容物。相反,它们通常保持完整,直到它们被邻近细胞(通常是人类的巨噬细胞)迅速吞噬和消化,不留痕迹。这样,细胞凋亡就避免了引发破坏性的炎症反应。吞噬过程依赖于凋亡细胞表面的化学变化,这种变化显示出吞噬细胞识别的各种吞噬信号。
这些信号中最重要的是带负电荷的磷脂磷脂酰丝氨酸。在健康细胞中,磷脂酰丝氨酸通常仅位于质膜脂质双层的内层(见图1015);它由特定的磷脂翻转酶保持在那里,该酶利用ATP水解将磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)从外层翻转到内层。然而,在正在经历凋亡的细胞中,PS通过两种机制在细胞表面积累。首先,执行者胱天蛋白酶裂解磷脂翻转酶,从而使其失活,阻止PS和PE从外层转移到内层。其次,执行者caspases裂解并激活磷脂乱序酶,该酶将质膜磷脂非特异性地转移到内外脂质小叶之间,从而使它们在两个小叶之间乱序。这两种导致PS暴露在凋亡细胞表面的机制如图1814和电影18.2所示。即使在没有caspase激活的情况下,PS也会出现在细胞表面的某些形式的坏死性细胞死亡中;破坏质膜就足以做到这一点。凋亡和坏死细胞上的PS被各种可溶性桥接蛋白识别,这些蛋白与暴露的PS和邻近吞噬细胞表面上的特定受体相互作用,从而触发细胞骨架和其他变化,从而启动吞噬过程。巨噬细胞是专业的吞噬细胞,会吞噬死细胞、微生物、细胞碎片、乳胶珠和几乎任何其他颗粒,但它们不会吞噬生物体内的健康细胞,即使是那些在激活时会在其表面暂时暴露磷脂酰丝氨酸的健康细胞,例如血小板和一些T淋巴细胞。原因之一是,我们几乎所有的细胞表面都显示信号蛋白,这些蛋白与巨噬细胞表面的抑制受体结合,刺激受体阻止吞噬作用。因此,除了表达细胞表面的“吃我”信号(如刺激吞噬作用的磷脂酰丝氨酸)外,凋亡细胞还必须去除或灭活阻止吞噬作用的“不吃我”信号。
细胞凋亡过度或不足都会导致疾病
许多人类疾病中,过多的细胞发生凋亡,从而导致病理性组织损失。最常见和最显著的例子是心脏病发作和中风,它们分别由心脏或大脑血液供应的急性中断引起。在这些情况下,许多细胞最初会因坏死而死亡。如果通过动脉导管或使用凝块破坏药物疏通阻塞的血管,缺氧组织中的一些存活细胞会因细胞凋亡而死亡,从而导致组织损失。希望未来能够阻止细胞凋亡的药物以及能够阻止某些形式的坏死性细胞死亡的药物能够减少组织损失及其致残性后果。
还有其他疾病,其中细胞凋亡导致的死亡太少。例如,
如前所述,小鼠和人类的突变会使编码Fas死亡受体或其配体的基因失活,从而阻止n某些类型的淋巴细胞正常死亡,导致这些细胞在脾脏和淋巴腺中异常积聚。在许多情况下,这会导致自身免疫性疾病,因为一些自身反应性淋巴细胞无法被消除并对个体自身组织产生反应。淋巴细胞的增加还会导致淋巴细胞癌,称为淋巴瘤。事实上,凋亡减少对许多类型的癌症有重要影响,因为癌细胞中对凋亡的正常抑制控制通常存在缺陷。例如,Bcl2基因首次在一种常见的人类淋巴瘤中发现,其中染色体易位导致抗凋亡Bcl2蛋白的过量产生(如前所述,Bcl2因这种B细胞淋巴瘤而得名)。携带易位的淋巴细胞中Bcl2蛋白的增加通过抑制凋亡促进癌症的发展,从而异常延长细胞存活时间并增加其数量;Bcl2的增加还降低了细胞对抗癌药物的敏感性,这些药物通常通过导致癌细胞凋亡而起作用(第20章讨论)。
活性
?ippase细胞外
空间
胞质溶胶
非活性
scramblase
失活?ippase激活的scramblase血浆
膜
caspase
裂解
位点
caspase
裂解位点
FLIPPASE被EXECUTIONER
灭活
caspase介导的
裂解
SCRAMBLASE被EXECUTIONER
激活
caspase介导的
裂解
其他血浆
膜
磷脂
氨基磷脂
(PS和PE)
激活的执行者
caspase
激活的执行者
caspase
健康细胞
凋亡细胞
MBoC7n18.104/18.14
图1814两种caspase依赖性机制导致磷脂酰丝氨酸在凋亡细胞表面积累。在健康细胞中(图上半部分),ATP依赖性氨基磷脂翻转酶(ATP11C)主动将磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)从质膜脂质双层的外层翻转到内层,使这些脂质主要局限于内层。在细胞凋亡期间(图下半部分),激活的执行者caspase(caspase-3、caspase-7或两者)裂解并从而使ATP11C翻转酶失活,从而阻止其脂质转位活性;同时,激活的执行者caspase裂解并激活质膜中的磷脂乱序酶(Xkr8),该酶非特异性地在膜的两个脂质小叶之间翻转磷脂,使它们在小叶之间乱序。(虽然没有显示,但ATP11C翻转酶与较小的跨膜蛋白CDC50紧密相关,后者需要陪伴翻转酶到达质膜并可能协助脂质易位过程。)随着翻转酶永久失活和乱序酶永久激活,PS和PE迅速且不可逆地暴露在凋亡细胞表面,其中PS作为邻近吞噬细胞的“吃我”信号。这两种caspase依赖性机制
都是产生这种快速有效的“吃我”信号所必需的:如果仅使翻转酶失活,
则PS可能需要很长时间才能在凋亡细胞
表面积累有效量,因为磷脂很少在没有酶(例如翻转酶)催化的情况下在脂质双层的两个小叶之间自发翻转(见图1010B)。同样,如果仅激活翻转酶,活性翻转酶会迅速将任何翻转的PS从外部小叶返回到内部小叶,从而将PS从细胞表面去除。图1239
说明了磷脂翻转酶在内质网膜脂质双层合成中的作用
以及磷脂翻转酶在某些其他细胞内膜中产生脂质双层不对称的作用。(改编自S.Nagata等人,CellDeathDiffer.23:952961,2016.)
MBOC7_ptr_ch18_1089-1104.indd1101MBOC7_ptr_ch18_1089-1104.indd110102/12/2112:26PM02/12/2112:26PM
1102第18章:细胞死亡
同样,编码肿瘤抑制蛋白p53的基因在约50%的人类癌症中发生突变,因此它不再促进细胞凋亡或细胞周期停滞以响应DNA损伤(如第17章和第20章所述)。因此,缺乏p53功能使癌细胞即使在DNA受损的情况下也能存活和增殖;这样,细胞逐渐积累更多的突变,其中一些突变使癌症更加恶性。由于许多抗癌药物通过p53依赖机制诱导细胞凋亡(和细胞周期停滞),p53功能的丧失也会使癌细胞对这些药物的敏感性较低。
如果凋亡减少会导致癌症,那么我们应该能够用促进凋亡的药物治疗癌症。这种方法最近导致了小分子化学物质的开发,这些化学物质通过与这些蛋白质的BH3结合槽高亲和力结合来阻断抗凋亡Bcl2家族蛋白(如Bcl2和BclxL)的功能,其方式与促凋亡的BH3特异性蛋白非常相似(见图1810D)。这些BH3模拟药物(图1815)激活细胞凋亡的内在途径,增加某些癌症中肿瘤细胞死亡的数量,尤其是那些依赖特定抗凋亡Bcl2家族蛋白生存的癌症。
大多数人类癌症都是癌,发生在肺、肠道、乳腺和前列腺等上皮组织中(第20章讨论)。
此类上皮癌细胞表现出许多行为异常,包括在特殊细胞连接处粘附细胞外基质和彼此的能力下降。在下一章中,我们将讨论这些至关重要的结构,它们负责将我们的细胞保持在组织和器官中的正确位置。
摘要
当动物细胞受到严重损坏或压力、不再需要或对生物体构成威胁时,它们可以激活各种细胞内死亡程序并自杀。在大多数情况下,这些死亡都是由细胞凋亡引起的,在凋亡过程中,细胞萎缩,细胞核和细胞凝聚并经常碎裂,邻近的吞噬细胞在细胞质内容物泄漏之前迅速吞噬细胞或碎片。细胞凋亡是由一种称为胱天蛋白酶的蛋白水解酶介导的,这种酶会裂解特定的细胞内蛋白质,从而快速而干净地杀死细胞。凋亡胱天蛋白酶以无活性前体的形式存在于几乎所有有核动物细胞中。当凋亡刺激激活衔接蛋白时,就会发生启动胱天蛋白酶的激活,衔接蛋白会使无活性的启动胱天蛋白酶单体在大型活化复合物中靠近,单体通过二聚化被激活。活化的启动胱天蛋白酶二聚体会自我裂解,然后通过裂解激活下游执行胱天蛋白酶二聚体;激活的
执行者胱天蛋白酶随后裂解细胞中的数百种靶蛋白。
扩增的、不可逆的胱天蛋白酶级联负责所有细胞凋亡事件,
包括那些集体杀死细胞并准备被邻近细胞吞噬和快速消化的事件。
细胞使用两种不同的途径激活启动胱天蛋白酶以触发细胞凋亡:
外在途径由细胞外配体与细胞表面死亡受体结合激活;
内在途径由发育信号或应激信号从细胞内部激活。每条途径都使用自己的启动胱天蛋白酶、
衔接蛋白和活化复合物。在外在途径中,死亡受体通过衔接蛋白募集胱天蛋白酶-8以形成称为DISC的活化复合物。在内在途径中,细胞内信号诱导线粒体外膜通透化(MOMP),从而将可溶性蛋白质从线粒体膜间隙释放到细胞质中;释放的细胞色素c激活衔接蛋白Apaf1,后者募集caspase-9单体形成称为凋亡体的大型活化复合物。抗凋亡和促凋亡的细胞内Bcl2家族蛋白相互作用,严格控制MOMP,以确保凋亡的内在途径通常仅在细胞死亡对动物有利时才被激活。
S
Cl
(B)
MBoC7m18.13/18.15
O
N
N
O
O
O
O
NH
NH
NH
N+
O
(A)
图1815一种特异性抑制Bcl2抗凋亡Bcl2家族蛋白的BH3模拟药物。如图1810D所示,BH3-only蛋白可以促进细胞凋亡的一种方式是通过结合抗凋亡Bcl2家族蛋白(如Bcl2本身)中的长BH3结合槽,从而阻止该蛋白阻断细胞凋亡。(A)维奈克拉的化学结构,其设计和合成是为了紧密且特异性地结合Bcl2的BH3结合凹槽。(B)维奈克拉(红色)与人类Bcl2蛋白(黄色)结合的晶体结构。通过抑制Bcl2的活性,该药物可促进任何依赖该蛋白生存的细胞凋亡,例如人类慢性淋巴细胞白血病细胞,该药物正在临床用于治疗该病。
(PDB代码:60OK。)
MBOC7_ptr_ch18_1089-1104.indd1102MBOC7_ptr_ch18_1089-1104.indd110202/12/2112:26PM02/12/2112:26PM
1102第18章:细胞死亡1103问题
问题
哪些陈述是正确的?解释为什么或为什么不正确。
181否在正常成体组织中,细胞死亡通常会平衡细胞分裂。
182没有细胞色素c的哺乳动物细胞应该对DNA损伤引起的细胞凋亡具有抵抗力。
讨论以下问题。
183Fas配体是杀伤性淋巴细胞上的同源三聚体质膜蛋白,可与靶细胞表面的同源三聚体死亡受体Fas结合,包括一些淋巴细胞(图Q181)。通过Fas配体簇的结合使三聚体Fas聚集,从而改变了Fas的构象,使其与衔接蛋白结合,然后该衔接蛋白募集并激活caspase-8,引发caspase级联,导致细胞凋亡。
在人类中,自身免疫性淋巴增生综合征(ALPS)与Fas的显性突变有关,包括点突变和C端截断。
在此类突变杂合的个体中,一些淋巴细胞不会以正常速度死亡,并会异常大量地积累,从而导致各种临床问题。与这些患者相比,突变杂合的个体完全消除了Fas表达,因此不会出现这些临床问题。
假设Fas的正常形式和显性形式表达到相同水平并随机组装成三聚体,那么杂合ALPS患者的淋巴细胞上FasFas配体复合物中有多少部分预计完全由正常Fas亚基组成?
您的计算是否能解释为什么表达Fas突变体的杂合子个体有临床问题,而未表达Fas突变体的杂合子个体没有临床问题?
184与类似的大脑异常相比,缺乏Apaf1或caspase-9的新生小鼠的爪子有明显的异常。缺乏Apaf1的小鼠无法消除正在发育的手指之间的网状结构,而缺乏caspase-9的小鼠的手指可以正常形成(图Q182)。如果Apaf1和caspase-9在相同的凋亡途径中发挥作用,那么这些缺乏的小鼠在网状细胞凋亡方面怎么可能有所不同?
185当人类癌细胞暴露于90mJ/cm2的紫外线(UV)光下时,大多数细胞会在24小时内凋亡。早在将此类细胞群暴露于紫外线后6小时,就可以检测到线粒体释放的细胞色素c,并且此后10多个小时内细胞色素c持续增加。这是否意味着单个细胞在此时间段内缓慢释放其细胞色素c?或者,单个细胞是否快速释放其细胞色素c,但不同的细胞在不同的时间被触发?为了回答这个基本问题,您已将绿色荧光蛋白(GFP)基因与细胞色素c基因融合,以便您可以通过共聚焦荧光显微镜观察单个细胞的行为。在表达细胞色素c
GFP融合蛋白的细胞中,荧光显示出线粒体蛋白的典型点状图案。然后,用紫外线照射这些细胞,观察单个细胞的点状图案变化。图Q183A和B显示了两个这样的细胞(白色轮廓)。释放
图Q181三聚体Fas配体与Fas的结合(问题183)。
虽然没有显示,但至少两个三聚体Fas配体必须结合并聚集至少两个三聚体Fas受体才能激活该途径;
为清楚起见,仅显示了配体和受体的单个副本。
杀伤性淋巴细胞
质膜
细胞核
未暴露的
死亡域
激活的Fas
死亡受体
与暴露的
死亡域
无活性的Fas
死亡受体
Fas配体
淋巴细胞
质膜
FAS受体
激活
MBoC7Q18.03/Q18.01
图Q182Apaf1/
和Casp9/新生小鼠的爪子外观与正常新生小鼠相比(问题184)。(摘自H.Yoshida等人,Cell94:739750,1998。经Elsevier许可。)
Casp9
Apaf1
MBoC7Q18.01/Q18.02
/
/+/+
+/
图Q183通过延时视频荧光显微镜分析单个细胞线粒体释放的细胞色素cGFP(问题185)。(A)在紫外线照射后10小时观察细胞6分钟。(B)在紫外线照射后17小时观察细胞8分钟。A中的一个细胞和B中的一个细胞(每个细胞都以白色勾勒出轮廓)在观察的时间范围内释放了细胞色素cGFP,每个面板下方显示为小时:分钟。(摘自
J.C.Goldstein等人,《自然细胞生物学》2:156162,2000年由
NaturePublishingGroup出版。经SNCSC许可转载。)
MBoC7Q18.02/Q18.03
(B)
(A)
17:1017:18
10:0910:15
MBOC7_ptr_ch18_1089-1104.indd1103MBOC7_ptr_ch18_1089-1104.indd110302/12/2112:26PM02/12/2112:26PM
1104第18章:细胞死亡
JiangX&Wan