第六单元 血细胞,免疫和凝血:修订间差异
创建页面,内容为“ = 红细胞、贫血和红细胞增多症 = 在本章中,我们开始讨论血细胞以及巨噬细胞系统和淋巴系统的细胞。我们首先介绍红细胞(RBCs)的功能,红细胞是血液中最丰富的细胞,对于向组织输送氧气是必要的。 == 红细胞(ERYTHROCYTES) == 红细胞(RBCs),也称为erythrocytes,的一个主要功能是运输血红蛋白,血红蛋白又将氧气从肺部输送到组织。在一些动物…” |
自动添加《Guyton&Hall 生理学 第十四版》章节导航 |
||
| (未显示2个用户的3个中间版本) | |||
| 第1行: | 第1行: | ||
= 红细胞、贫血和红细胞增多症 = | = 33 红细胞、贫血和红细胞增多症 = | ||
在本章中,我们开始讨论血细胞以及巨噬细胞系统和淋巴系统的细胞。我们首先介绍红细胞(RBCs)的功能,红细胞是血液中最丰富的细胞,对于向组织输送氧气是必要的。 | 在本章中,我们开始讨论血细胞以及巨噬细胞系统和淋巴系统的细胞。我们首先介绍红细胞(RBCs)的功能,红细胞是血液中最丰富的细胞,对于向组织输送氧气是必要的。 | ||
== | == 红细胞 == | ||
红细胞(RBCs),也称为erythrocytes,的一个主要功能是运输血红蛋白,血红蛋白又将氧气从肺部输送到组织。在一些动物中,包括许多无脊椎动物,血红蛋白作为游离蛋白质在循环液中循环,并不包裹在红细胞中。当它在人血浆中游离时,每次血液通过毛细血管时,大约有3%的血红蛋白会通过毛细血管膜渗入组织间隙或通过肾脏的肾小球膜进入肾小球滤液。因此,血红蛋白必须保持在红细胞内才能有效地在人体中执行其功能。 | 红细胞(RBCs),也称为erythrocytes,的一个主要功能是运输血红蛋白,血红蛋白又将氧气从肺部输送到组织。在一些动物中,包括许多无脊椎动物,血红蛋白作为游离蛋白质在循环液中循环,并不包裹在红细胞中。当它在人血浆中游离时,每次血液通过毛细血管时,大约有3%的血红蛋白会通过毛细血管膜渗入组织间隙或通过肾脏的肾小球膜进入肾小球滤液。因此,血红蛋白必须保持在红细胞内才能有效地在人体中执行其功能。 | ||
除了运输血红蛋白外,红细胞还有其他功能。例如,它们<u>含有大量的碳酸酐酶</u>,这是一种催化二氧化碳(CO₂)和水之间可逆反应形成碳酸(H₂CO₃)的酶,使该反应的速率增加数千倍。该反应的快速性使得血液中的水能够以碳酸氢根离子(HCO₃⁻)的形式从组织向肺部运输大量的CO₂,在那里它被重新转化为CO₂并作为身体废物排出到大气中。细胞中的血红蛋白是一种极好的酸碱缓冲剂(大多数蛋白质也是如此),因此<u>红细胞负责全血的大部分酸碱缓冲能力</u>。 | |||
'''红细胞的形状和大小。'''正常红细胞,如图33-3所示,是双凹盘状,平均直径约为7.8微米,最厚处的厚度为2.5微米,中心处为1微米或更少。红细胞的平均体积为90到95立方微米。 | |||
红细胞的形状在细胞通过毛细血管时可以显著变化。实际上,红细胞类似于一个可以变形为几乎任何形状的袋子。 | 红细胞的形状在细胞通过毛细血管时可以显著变化。实际上,红细胞类似于一个可以变形为几乎任何形状的袋子。 | ||
| 第14行: | 第14行: | ||
此外,由于正常细胞的细胞膜相对于内部物质的数量有极大的富余,变形不会显著拉伸细胞膜,因此也不会导致细胞破裂,而许多其他细胞则不然。 | 此外,由于正常细胞的细胞膜相对于内部物质的数量有极大的富余,变形不会显著拉伸细胞膜,因此也不会导致细胞破裂,而许多其他细胞则不然。 | ||
'''血液中红细胞(Red Blood Cells, RBCs)的浓度''' | '''血液中红细胞(Red Blood Cells, RBCs)的浓度'''。在健康男性中,每立方毫米血液中的红细胞平均数量为'''5,200,000 (±300,000)''';在健康女性中,这一数值为'''4,700,000 (±300,000)'''。生活在高海拔地区的人红细胞数量更多,这一点将在后文讨论。 | ||
'''细胞中血红蛋白(Hemoglobin)的含量'''。红细胞可以将细胞液中的血红蛋白浓度浓缩至约34 g/ | '''细胞中血红蛋白(Hemoglobin)的含量'''。红细胞可以将细胞液中的血红蛋白浓度浓缩至约34 g/100ml。浓度不会超过这一数值,因为这是细胞血红蛋白形成机制的代谢极限。此外,在正常人中,每个细胞中的血红蛋白百分比几乎总是接近最大值。然而,当血红蛋白形成不足时,细胞中的血红蛋白百分比可能会显著低于这一数值,并且由于填充细胞的血红蛋白减少,红细胞的体积也可能减小。 | ||
当血细胞比容(血液中细胞所占的百分比——通常为40%至45% | 当血细胞比容(血液中细胞所占的百分比——通常为40%至45%)和每个细胞中的血红蛋白含量正常时,男性全血中的血红蛋白平均含量为'''15g血红蛋白/ 100ml''';女性则为'''14g血红蛋白/ 100ml'''。 | ||
正如第41章关于血液运输氧气的讨论所述,如果血红蛋白饱和度为100%,每克血红蛋白可以与1. | 正如第41章关于血液运输氧气的讨论所述,如果血红蛋白饱和度为100%,每克血红蛋白可以与1.34ml的氧气结合。因此,在平均男性中,<u>每100毫升血液中最多可以携带约20毫升的氧气与血红蛋白结合,而在女性中则可以携带19毫升的氧气。</u> | ||
=== 红细胞的生产 === | |||
'''体内产生红细胞的部位'''。在胚胎发育的早期几周内,原始的有核红细胞在'''卵黄囊'''中产生。在妊娠的中期,'''肝脏'''是红细胞生产的主要器官,但'''脾脏和淋巴结'''也会产生相当数量的红细胞。然后,在妊娠的最后一个月左右以及出生后,红细胞仅在'''骨髓'''中产生。 | |||
[[文件:GT-33.1.png|缩略图|图33-1. 不同年龄阶段不同骨骼骨髓中红细胞生产的相对速率。]] | |||
如图33-1所示,几乎所有骨骼的骨髓都会产生红细胞,直到一个人大约5岁。长骨的骨髓(除了肱骨和胫骨的近端部分)在大约20岁后会变得脂肪化,不再产生红细胞。超过这个年龄后,大多数红细胞继续在膜性骨骼的骨髓中产生,例如椎骨、胸骨、肋骨和髂骨。即使在这些骨骼中,随着年龄的增长,骨髓的生产能力也会下降。 | 如图33-1所示,几乎所有骨骼的骨髓都会产生红细胞,直到一个人大约5岁。长骨的骨髓(除了肱骨和胫骨的近端部分)在大约20岁后会变得脂肪化,不再产生红细胞。超过这个年龄后,大多数红细胞继续在膜性骨骼的骨髓中产生,例如椎骨、胸骨、肋骨和髂骨。即使在这些骨骼中,随着年龄的增长,骨髓的生产能力也会下降。 | ||
=== 血细胞的生成 === | === 血细胞的生成 === | ||
[[文件:GT-33.2.png|缩略图|图33-2. 骨髓中原始多能造血干细胞形成多种不同血细胞的过程。]] | |||
'''多能造血干细胞、生长诱导因子和分化诱导因子。'''血细胞的生命始于骨髓中的一种单一类型的细胞,称为多能造血干细胞(multipotential hematopoietic stem cell),所有循环血液中的细胞最终都来源于此。图33-2展示了多能细胞通过连续分裂形成不同循环血细胞的过程。当这些细胞繁殖时,其中一小部分细胞保持与原始多能细胞完全相同,并保留在骨髓中以维持其供应,尽管它们的数量随着年龄的增长而减少。然而,大多数繁殖的细胞会分化形成其他类型的细胞,如图33-2右侧所示。中间阶段的细胞非常类似于多能干细胞,尽管它们已经定向于某一特定细胞系;这些细胞被称为定向干细胞(committed stem cells)。 | |||
血细胞的生命始于骨髓中的一种单一类型的细胞,称为多能造血干细胞(multipotential hematopoietic stem cell),所有循环血液中的细胞最终都来源于此。图33-2展示了多能细胞通过连续分裂形成不同循环血细胞的过程。当这些细胞繁殖时,其中一小部分细胞保持与原始多能细胞完全相同,并保留在骨髓中以维持其供应,尽管它们的数量随着年龄的增长而减少。然而,大多数繁殖的细胞会分化形成其他类型的细胞,如图33-2右侧所示。中间阶段的细胞非常类似于多能干细胞,尽管它们已经定向于某一特定细胞系;这些细胞被称为定向干细胞(committed stem cells)。 | |||
当不同的定向干细胞在培养中生长时,会产生特定类型血细胞的集落。产生红细胞的定向干细胞称为红细胞集落形成单位(colony-forming unit-erythrocyte),缩写为CFU-E。同样,形成粒细胞和单核细胞的集落形成单位被命名为CFU-GM,依此类推。 | 当不同的定向干细胞在培养中生长时,会产生特定类型血细胞的集落。产生红细胞的定向干细胞称为红细胞集落形成单位(colony-forming unit-erythrocyte),缩写为CFU-E。同样,形成粒细胞和单核细胞的集落形成单位被命名为CFU-GM,依此类推。 | ||
不同干细胞的生长和繁殖由多种称为生长诱导因子(growth | 不同干细胞的生长和繁殖由多种称为生长诱导因子(growth inducers)的蛋白质控制。至少已经描述了四种主要的生长诱导因子,每种都具有不同的特性。其中之一是白细胞介素-3(interleukin-3),它促进几乎所有不同类型的定向干细胞的生长和繁殖,而其他生长诱导因子则仅诱导特定类型细胞的生长。 | ||
生长诱导因子促进细胞的生长,但不促进其分化,这是另一组称为分化诱导因子(differentiation inducers)的蛋白质的功能。每种分化诱导因子都会使一种定向干细胞向最终成熟血细胞分化一个或多个步骤。 | 生长诱导因子促进细胞的生长,但不促进其分化,这是另一组称为分化诱导因子(differentiation inducers)的蛋白质的功能。每种分化诱导因子都会使一种定向干细胞向最终成熟血细胞分化一个或多个步骤。 | ||
| 第49行: | 第40行: | ||
=== 红细胞的分化阶段 === | === 红细胞的分化阶段 === | ||
[[文件:GT-33.3.png|缩略图|图33-3. 正常红细胞(RBCs)的生成过程及不同类型贫血中红细胞的特征。]] | |||
第一个可以被识别为属于红细胞系列的细胞是原红细胞(proerythroblast),如图33-3的起点所示。在适当的刺激下,大量这些细胞由CFU-E干细胞形成。 | 第一个可以被识别为属于红细胞系列的细胞是原红细胞(proerythroblast),如图33-3的起点所示。在适当的刺激下,大量这些细胞由CFU-E干细胞形成。 | ||
一旦原红细胞(proerythroblast)形成,它就会多次分裂,最终形成许多成熟的红细胞(RBCs)。 | 一旦原红细胞(proerythroblast)形成,它就会多次分裂,最终形成许多成熟的红细胞(RBCs)。 | ||
第一代细胞被称为嗜碱性成红细胞(basophil erythroblasts),因为它们能被碱性染料染色。血红蛋白(hemoglobin)首先出现在多染性成红细胞(polychromatophil erythroblasts)中。在接下来的几代中,如图33-3所示,细胞中充满了浓度约为34%的血红蛋白,细胞核浓缩到很小的尺寸,其最后的残余被细胞吸收或挤出。同时,内质网( | 第一代细胞被称为嗜碱性成红细胞(basophil erythroblasts),因为它们能被碱性染料染色。血红蛋白(hemoglobin)首先出现在多染性成红细胞(polychromatophil erythroblasts)中。在接下来的几代中,如图33-3所示,细胞中充满了浓度约为34%的血红蛋白,细胞核浓缩到很小的尺寸,其最后的残余被细胞吸收或挤出。同时,内质网()也被重新吸收。这个阶段的细胞被称为网织红细胞(reticulocyte),因为它仍然含有少量的嗜碱性物质,包括高尔基体()、线粒体()和其他一些细胞质细胞器的残余。在网织红细胞阶段,细胞通过'''渗出(diapedesis)('''挤压通过毛细血管膜的孔隙)从骨髓进入毛细血管。 | ||
网织红细胞中剩余的嗜碱性物质通常在1到2天内消失,然后细胞就变成了成熟的红细胞。由于网织红细胞的寿命很短,它们在所有红细胞中的浓度通常略低于1%。 | 网织红细胞中剩余的嗜碱性物质通常在1到2天内消失,然后细胞就变成了成熟的红细胞。由于网织红细胞的寿命很短,它们在所有红细胞中的浓度通常略低于1%。 | ||
=== | === 促红细胞生成素调节红细胞生成 === | ||
[[文件:GT-33.4.png|缩略图|图33-4. 当组织氧合减少时,促红细胞生成素机制增加红细胞生成的功能。]] | |||
循环系统中红细胞的总质量被严格控制在狭窄的范围内,因此(1)始终有足够的红细胞可用于将氧气从肺部输送到组织,同时(2)细胞不会变得过多以至于阻碍血液流动。这种控制机制如图33-4所示,并在以下部分中描述。 | 循环系统中红细胞的总质量被严格控制在狭窄的范围内,因此(1)始终有足够的红细胞可用于将氧气从肺部输送到组织,同时(2)细胞不会变得过多以至于阻碍血液流动。这种控制机制如图33-4所示,并在以下部分中描述。 | ||
'''组织氧合——红细胞生成的重要调节因素。'''减少输送到组织的氧气量的条件通常会增加红细胞的生成速率。因此,当一个人因出血或任何其他情况而变得极度贫血时,骨髓开始大量生成红细胞。此外,骨髓主要部分的破坏,特别是通过X射线治疗,会导致剩余骨髓的增生,以试图满足身体对红细胞的需求。 | |||
在海拔非常高的地方,空气中的氧气量大大减少,输送到组织的氧气不足,红细胞的生成大大增加。在这种情况下,控制红细胞生成的不是血液中红细胞的浓度,而是输送到组织的氧气量与组织对氧气的需求之间的关系。 | 在海拔非常高的地方,空气中的氧气量大大减少,输送到组织的氧气不足,红细胞的生成大大增加。在这种情况下,控制红细胞生成的不是血液中红细胞的浓度,而是输送到组织的氧气量与组织对氧气的需求之间的关系。 | ||
| 第68行: | 第59行: | ||
各种减少组织血流的循环系统疾病,特别是那些导致血液通过肺部时氧气吸收失败的疾病,也会增加红细胞的生成速率。这种结果在长期心脏衰竭和许多肺部疾病中尤为明显,因为这些情况导致的组织缺氧会增加红细胞的生成,从而导致血细胞比容(hematocrit)和通常总血量的增加。 | 各种减少组织血流的循环系统疾病,特别是那些导致血液通过肺部时氧气吸收失败的疾病,也会增加红细胞的生成速率。这种结果在长期心脏衰竭和许多肺部疾病中尤为明显,因为这些情况导致的组织缺氧会增加红细胞的生成,从而导致血细胞比容(hematocrit)和通常总血量的增加。 | ||
'''低氧增加促红细胞生成素的形成,从而刺激红细胞生成。'''在低氧状态下,红细胞生成的主要刺激是一种称为促红细胞生成素(erythropoietin)的循环激素,它是一种分子量约为34,000的糖蛋白。在没有促红细胞生成素的情况下,低氧对刺激红细胞生成几乎没有影响。然而,当促红细胞生成素系统功能正常时,低氧会导致促红细胞生成素的显著增加,而促红细胞生成素反过来又会增强红细胞生成,直到低氧状态得到缓解。 | |||
'''促红细胞生成素主要在肾脏中形成。'''<u>正常情况下,约90%的促红细胞生成素在肾脏中形成,其余主要形成于肝脏。</u>目前尚不清楚促红细胞生成素在肾脏中的确切形成位置。一些研究表明,促红细胞生成素主要由皮质和外髓质中围绕肾小管的成纤维细胞样间质细胞分泌,这些区域是肾脏耗氧量较大的部位。其他细胞,包括肾上皮细胞,也可能在低氧状态下分泌促红细胞生成素。 | |||
肾组织低氧会导致低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)的组织水平升高,HIF-1作为许多低氧诱导基因的转录因子,包括促红细胞生成素基因。HIF-1与促红细胞生成素基因中的低氧反应元件结合,诱导信使RNA的转录,最终增加促红细胞生成素的合成。 | 肾组织低氧会导致低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)的组织水平升高,HIF-1作为许多低氧诱导基因的转录因子,包括促红细胞生成素基因。HIF-1与促红细胞生成素基因中的低氧反应元件结合,诱导信使RNA的转录,最终增加促红细胞生成素的合成。 | ||
<u>有时,身体其他部位而非肾脏的低氧会刺激肾脏分泌促红细胞生成素</u>,这表明可能存在某种非肾脏传感器向肾脏发送额外信号以产生这种激素。特别是,去甲肾上腺素(norepinephrine)、肾上腺素(epinephrine)和几种前列腺素(prostaglandins)会刺激促红细胞生成素的产生。 | |||
当一个人的双肾被切除,或肾脏因肾脏疾病而受损时,这个人必定会变得非常贫血。这是因为其他组织(主要是肝脏)中形成的正常促红细胞生成素的10%仅足以引起身体所需红细胞生成量的三分之一到一半。 | 当一个人的双肾被切除,或肾脏因肾脏疾病而受损时,这个人必定会变得非常贫血。这是因为其他组织(主要是肝脏)中形成的正常促红细胞生成素的10%仅足以引起身体所需红细胞生成量的三分之一到一半。 | ||
促红细胞生成素刺激造血干细胞生成原红细胞。当动物或人处于低氧环境中时,促红细胞生成素在几分钟到几小时内开始形成,并在24小时内达到最大产量。然而,<u>几乎没有任何新的红细胞出现在循环血液中,直到大约5天后</u>。由此以及其他研究可以确定,<u>促红细胞生成素的重要作用是刺激骨髓中造血干细胞生成原红细胞</u>。此外,一旦原红细胞形成,促红细胞生成素会促使这些细胞比正常情况下更快地通过不同的红细胞生成阶段,进一步加快新红细胞的生成。只要人处于低氧状态,或直到产生足够的红细胞以在低氧水平下向组织输送足够的氧气,细胞的快速生成就会持续;此时,促红细胞生成素的生成速率会降低到维持所需红细胞数量但不产生过量的水平。 | |||
在没有促红细胞生成素(erythropoietin)的情况下,骨髓只能生成少量的红细胞(RBCs)。在另一个极端,当大量促红细胞生成素生成,并且有充足的铁和其他必需营养物质时,红细胞的生成速率可以提高到正常水平的10倍甚至更多。因此,促红细胞生成素调控红细胞生成的机制是非常强大的。 | 在没有促红细胞生成素(erythropoietin)的情况下,骨髓只能生成少量的红细胞(RBCs)。在另一个极端,当大量促红细胞生成素生成,并且有充足的铁和其他必需营养物质时,红细胞的生成速率可以提高到正常水平的10倍甚至更多。因此,促红细胞生成素调控红细胞生成的机制是非常强大的。 | ||
=== | === 红细胞的成熟需要维生素B12(氰钴胺,Cyanocobalamin)和叶酸(Folic Acid) === | ||
由于持续需要补充红细胞,骨髓中的红细胞生成细胞(erythropoietic cells)是全身生长和繁殖最快的细胞之一。因此,正如预期的那样,它们的成熟和生成速率在很大程度上受到一个人营养状况的影响。 | 由于持续需要补充红细胞,骨髓中的红细胞生成细胞(erythropoietic cells)是全身生长和繁殖最快的细胞之一。因此,正如预期的那样,它们的成熟和生成速率在很大程度上受到一个人营养状况的影响。 | ||
对红细胞最终成熟特别重要的是两种维生素,维生素B12和叶酸。这两种维生素对DNA的合成都是必不可少的,因为每一种都以不同的方式参与胸苷三磷酸(thymidine triphosphate)的形成,而胸苷三磷酸是DNA的基本组成部分之一。因此,缺乏维生素B12或叶酸会导致DNA异常和减少,进而导致核成熟和细胞分裂的失败。此外,骨髓中的成红细胞(erythroblastic cells) | 对红细胞最终成熟特别重要的是两种维生素,维生素B12和叶酸。这两种维生素对DNA的合成都是必不可少的,因为每一种都以不同的方式参与胸苷三磷酸(thymidine triphosphate)的形成,而胸苷三磷酸是DNA的基本组成部分之一。因此,缺乏维生素B12或叶酸会导致DNA异常和减少,进而导致核成熟和细胞分裂的失败。此外,骨髓中的成红细胞(erythroblastic cells)除了不能快速增殖外,主要产生比正常红细胞更大的'''巨红细胞'''(macrocytes),<u>这些细胞膜脆弱,通常不规则、大且呈椭圆形,而不是通常的双凹圆盘状。</u>这些形成不良的细胞进入循环血液后,虽然能够正常携带氧气,但由于其脆弱性,寿命较短,只有正常红细胞的一半到三分之一。因此,维生素B12或叶酸缺乏会导致红细胞生成过程中的成熟障碍。 | ||
=== | === 由于胃肠道吸收维生素B12不良导致的成熟障碍性贫血——恶性贫血(Pernicious Anemia) === | ||
红细胞成熟障碍的一个常见原因是胃肠道吸收维生素B12障碍。这种情况经常发生在恶性贫血(pernicious anemia)中,其基本异常是萎缩的胃黏膜无法产生正常的胃分泌物。胃腺的壁细胞(parietal cells)分泌一种称为内因子(intrinsic factor)的糖蛋白,它与食物中的维生素B12结合,并通过以下方式使B12能够被肠道吸收: | 红细胞成熟障碍的一个常见原因是胃肠道吸收维生素B12障碍。这种情况经常发生在恶性贫血(pernicious anemia)中,其基本异常是萎缩的胃黏膜无法产生正常的胃分泌物。胃腺的壁细胞(parietal cells)分泌一种称为内因子(intrinsic factor)的糖蛋白,它与食物中的维生素B12结合,并通过以下方式使B12能够被肠道吸收: | ||
| 第98行: | 第89行: | ||
一旦维生素B12从胃肠道吸收后,首先大量储存在肝脏中,然后根据需要缓慢释放到骨髓中。每天维持正常红细胞(RBC)成熟所需的最小维生素B12量仅为1至3微克,而肝脏和其他身体组织中的正常储存量约为这个量的1000倍。因此,通常需要3到4年的维生素B12吸收缺陷才会导致成熟障碍性贫血(anemia)。 | 一旦维生素B12从胃肠道吸收后,首先大量储存在肝脏中,然后根据需要缓慢释放到骨髓中。每天维持正常红细胞(RBC)成熟所需的最小维生素B12量仅为1至3微克,而肝脏和其他身体组织中的正常储存量约为这个量的1000倍。因此,通常需要3到4年的维生素B12吸收缺陷才会导致成熟障碍性贫血(anemia)。 | ||
由叶酸(Pteroylglutamic Acid) | '''由叶酸(Pteroylglutamic Acid)缺乏引起的成熟障碍性贫血'''。叶酸是绿色蔬菜、一些水果和肉类(尤其是肝脏)的正常成分。然而,它在烹饪过程中容易被破坏。此外,患有胃肠道吸收异常的人,如常见的小肠疾病sprue,通常难以吸收叶酸和维生素B12。因此,在许多成熟障碍的情况下,原因是肠道对叶酸和维生素B12的吸收不足。 | ||
== 血红蛋白的形成 == | == 血红蛋白的形成 == | ||
血红蛋白的合成始于多染性成红细胞(polychromatophil erythroblasts),并持续到红细胞(RBC)的网织红细胞(reticulocyte)阶段。因此,当网织红细胞离开骨髓进入血液时,它们会继续形成微量的血红蛋白,直到它们成为成熟的红细胞。 | 血红蛋白的合成始于多染性成红细胞(polychromatophil erythroblasts),并持续到红细胞(RBC)的网织红细胞(reticulocyte)阶段。因此,当网织红细胞离开骨髓进入血液时,它们会继续形成微量的血红蛋白,直到它们成为成熟的红细胞。 | ||
[[文件:GT-33.5.png|缩略图|图33-5. 血红蛋白的形成]] | |||
图33-5显示了血红蛋白形成的基本化学步骤。首先,在Krebs代谢循环中形成的琥珀酰-CoA(succinyl-CoA)与甘氨酸(glycine)结合形成吡咯分子(pyrrole molecule)。接着,四个吡咯结合形成原卟啉IX(protoporphyrin IX),然后与铁结合形成血红素分子(heme molecule)。最后,每个血红素分子与一个由核糖体合成的长多肽链(globin)结合,形成血红蛋白的一个亚基,称为血红蛋白链(hemoglobin chain)(图33-6)。每条链的分子量约为16,000;四条链松散地结合在一起,形成整个血红蛋白分子。 | 图33-5显示了血红蛋白形成的基本化学步骤。首先,在Krebs代谢循环中形成的琥珀酰-CoA(succinyl-CoA)与甘氨酸(glycine)结合形成吡咯分子(pyrrole molecule)。接着,四个吡咯结合形成原卟啉IX(protoporphyrin IX),然后与铁结合形成血红素分子(heme molecule)。最后,每个血红素分子与一个由核糖体合成的长多肽链(globin)结合,形成血红蛋白的一个亚基,称为血红蛋白链(hemoglobin chain)(图33-6)。每条链的分子量约为16,000;四条链松散地结合在一起,形成整个血红蛋白分子。 | ||
不同的血红蛋白链亚基有几种轻微的变异,取决于多肽部分的氨基酸组成。不同类型的链被指定为α链(alpha chains)、β链(beta chains)、γ链(gamma chains)和δ链(delta chains)。成人中最常见的血红蛋白形式,血红蛋白A,是两个α链和两个β链的组合。血红蛋白A的分子量为64,458。 | 不同的血红蛋白链亚基有几种轻微的变异,取决于多肽部分的氨基酸组成。不同类型的链被指定为α链(alpha chains)、β链(beta chains)、γ链(gamma chains)和δ链(delta chains)。成人中最常见的血红蛋白形式,血红蛋白A,是两个α链和两个β链的组合。血红蛋白A的分子量为64,458。 | ||
图33-6. 血红素部分的基本结构,显示了四条血红素链中的一条,它们与珠蛋白多肽(globin polypeptide)一起结合形成血红蛋白分子。 | 图33-6. 血红素部分的基本结构,显示了四条血红素链中的一条,它们与珠蛋白多肽(globin polypeptide)一起结合形成血红蛋白分子。 | ||
| 第116行: | 第105行: | ||
血红蛋白可逆地与氧结合。血红蛋白分子最重要的特性是它能够松散且可逆地与氧结合。这种能力在第41章关于呼吸的部分详细讨论,因为血红蛋白在体内的主要功能是在肺部与氧结合,然后在周围组织毛细血管中释放氧,那里的氧分压远低于肺部。 | 血红蛋白可逆地与氧结合。血红蛋白分子最重要的特性是它能够松散且可逆地与氧结合。这种能力在第41章关于呼吸的部分详细讨论,因为血红蛋白在体内的主要功能是在肺部与氧结合,然后在周围组织毛细血管中释放氧,那里的氧分压远低于肺部。 | ||
氧不与血红蛋白分子中铁的两个正键结合。相反,它与铁原子的所谓配位键之一松散结合。这种键非常松散,因此结合是可逆的。此外,氧不会变成离子氧,而是以分子氧(由两个氧原子组成)的形式被运输到组织,在那里,由于松散且可逆的结合,它以分子氧的形式而不是离子氧的形式释放到组织液中。 | 氧不与血红蛋白分子中铁的两个正键结合。相反,它与铁原子的所谓配位键之一松散结合。这种键非常松散,因此结合是可逆的。此外,氧不会变成离子氧,而是以分子氧(由两个氧原子组成)的形式被运输到组织,在那里,由于松散且可逆的结合,它以分子氧的形式而不是离子氧的形式释放到组织液中。 | ||
== 铁的代谢 == | == 铁的代谢 == | ||
由于铁不仅对血红蛋白的形成重要,还对体内其他必需元素(如肌红蛋白(myoglobin)、细胞色素(cytochromes)、细胞色素氧化酶(cytochrome oxidase)、过氧化物酶(peroxidase)和过氧化氢酶(catalase) | 由于铁不仅对血红蛋白的形成重要,还对体内其他必需元素(如肌红蛋白(myoglobin)、细胞色素(cytochromes)、细胞色素氧化酶(cytochrome oxidase)、过氧化物酶(peroxidase)和过氧化氢酶(catalase))的形成也很重要,因此了解铁在体内的利用方式非常重要。<u>体内铁的总量平均为4到5克,其中约65%以血红蛋白的形式存在。约4%以肌红蛋白的形式存在,1%以促进细胞内氧化的各种血红素化合物的形式存在,0.1%与血浆中的转铁蛋白(transferrin)结合,15%到30%以铁蛋白(ferritin)的形式储存,主要在网状内皮系统(reticuloendothelial system)和肝实质细胞(liver parenchymal cells)中。</u> | ||
[[文件:GT-33.7.png|缩略图|图33-7. 铁的运输和代谢]] | |||
'''铁的运输和储存。'''铁的运输、储存和代谢在图33-7中图示,可以解释如下。当铁从小肠吸收后,它立即与血浆中的β球蛋白——脱铁转铁蛋白(apotransferrin)结合,形成转铁蛋白(transferrin),然后在血浆中运输。铁在转铁蛋白中松散结合,因此可以在体内的任何部位释放到任何组织细胞中。血液中过量的铁主要沉积在肝细胞中,较少沉积在骨髓的网状内皮细胞中。 | |||
在细胞质( | 在细胞质()中,铁主要与一种蛋白质——脱铁铁蛋白(apoferritin)结合,形成铁蛋白(ferritin)。脱铁铁蛋白的分子量约为460,000,不同数量的铁可以以铁自由基簇的形式与这个大分子结合;因此,铁蛋白可能只含有少量或大量的铁。这种以铁蛋白形式储存的铁称为储存铁(storage iron)。 | ||
储存池中较少量的铁以一种极不溶的形式存在,称为含铁血黄素(hemosiderin)。当体内的铁总量超过脱铁铁蛋白储存池的容量时,这种情况尤其明显。含铁血黄素以大簇的形式聚集在细胞中,可以在显微镜下观察到大的颗粒。相比之下,铁蛋白颗粒非常小且分散,通常只能在电子显微镜下观察到。 | 储存池中较少量的铁以一种极不溶的形式存在,称为含铁血黄素(hemosiderin)。当体内的铁总量超过脱铁铁蛋白储存池的容量时,这种情况尤其明显。含铁血黄素以大簇的形式聚集在细胞中,可以在显微镜下观察到大的颗粒。相比之下,铁蛋白颗粒非常小且分散,通常只能在电子显微镜下观察到。 | ||
| 第134行: | 第121行: | ||
当红细胞存活约120天后被破坏时,从细胞中释放的血红蛋白被单核-巨噬细胞(monocyte-macrophage cells)摄取。在那里,铁被释放并主要储存在铁蛋白池中,以备需要时用于新血红蛋白的形成。 | 当红细胞存活约120天后被破坏时,从细胞中释放的血红蛋白被单核-巨噬细胞(monocyte-macrophage cells)摄取。在那里,铁被释放并主要储存在铁蛋白池中,以备需要时用于新血红蛋白的形成。 | ||
'''铁的每日丢失'''。一个普通男性每天排泄约0.6mg的铁,主要进入粪便。当出血发生时,还会丢失额外的铁。对于女性来说,额外的月经失血使长期铁丢失平均达到约1.3~mg/day。 | |||
=== 从肠道吸收铁 === | === 从肠道吸收铁 === | ||
| 第142行: | 第128行: | ||
从肠道吸收铁的速度非常慢,最大速率仅为每天几毫克。这种缓慢的吸收速度意味着即使食物中含有大量的铁,也只能吸收一小部分。 | 从肠道吸收铁的速度非常慢,最大速率仅为每天几毫克。这种缓慢的吸收速度意味着即使食物中含有大量的铁,也只能吸收一小部分。 | ||
'''通过控制吸收率调节全身铁含量。'''当身体铁含量饱和,以至于铁储存区域中几乎所有的脱铁铁蛋白(apoferritin)都已与铁结合时,肠道对额外铁的吸收率显著下降。相反,当铁储存耗尽时,吸收率可能会加速到正常水平的五倍或更多。因此,全身铁含量主要通过改变吸收率来调节。 | |||
=== 红细胞的寿命约为120天 === | === 红细胞的寿命约为120天 === | ||
当红细胞从骨髓释放到循环系统时,它们通常在循环中平均存活120天,然后被破坏。尽管成熟的红细胞没有细胞核、线粒体或内质网,但它们具有能够代谢葡萄糖并形成少量三磷酸腺苷(adenosine triphosphate, ATP)的细胞质酶。这些酶还具有以下功能:(1) 维持细胞膜的柔韧性;(2) 维持离子的膜运输;(3) 保持细胞血红蛋白中的铁处于亚铁形式而非三价铁形式;(4) 防止红细胞中蛋白质的氧化。即便如此,老化红细胞的代谢系统逐渐变得不活跃,细胞变得越来越脆弱,可能是因为它们的生命过程逐渐耗尽。 | 当红细胞从骨髓释放到循环系统时,它们通常在循环中平均存活120天,然后被破坏。尽管成熟的红细胞没有细胞核、线粒体或内质网,但它们具有能够代谢葡萄糖并形成少量三磷酸腺苷(adenosine triphosphate, ATP)的细胞质酶。这些酶还具有以下功能:(1) 维持细胞膜的柔韧性;(2) 维持离子的膜运输;(3) 保持细胞血红蛋白中的铁处于亚铁形式而非三价铁形式;(4) 防止红细胞中蛋白质的氧化。即便如此,老化红细胞的代谢系统逐渐变得不活跃,细胞变得越来越脆弱,可能是因为它们的生命过程逐渐耗尽。 | ||
一旦红细胞膜变得脆弱,细胞在通过循环系统中的某些狭窄部位时会破裂。许<u>多红细胞在脾脏中自毁,它们在那里挤过脾脏的红髓。</u>红髓的结构小梁之间的空间只有3微米宽,而红细胞的直径为8微米,大多数细胞必须通过这些狭窄的空间。<u>当脾脏被切除后,血液中循环的老化异常红细胞数量显著增加。</u> | |||
'''巨噬细胞对血红蛋白的破坏。'''当红细胞破裂并释放其血红蛋白时,血红蛋白几乎立即被身体许多部位的巨噬细胞吞噬,尤其是肝脏的库普弗细胞(Kupffer cells)以及脾脏和骨髓的巨噬细胞。在接下来的几小时到几天内,巨噬细胞从血红蛋白中释放铁,并将其传递回血液中,由转铁蛋白(transferrin)携带,要么进入骨髓用于生产新的红细胞,要么进入肝脏和其他组织以铁蛋白(ferritin)的形式储存。血红蛋白分子的卟啉部分被巨噬细胞通过一系列步骤转化为胆色素胆红素(bilirubin),胆红素被释放到血液中,随后通过肝脏分泌到胆汁中排出体外。这一过程将在第71章中与肝功能相关的内容中讨论。 | |||
== 贫血 == | == 贫血 == | ||
贫血意味着血液中血红蛋白的缺乏,这可能是由于红细胞数量过少或细胞中血红蛋白含量过低引起的。以下部分描述了一些类型的贫血及其生理原因。 | 贫血意味着血液中血红蛋白的缺乏,这可能是由于红细胞数量过少或细胞中血红蛋白含量过低引起的。以下部分描述了一些类型的贫血及其生理原因。 | ||
'''失血性贫血。'''在快速失血后,身体在1到3天内替换血浆的液体部分,但这种反应导致红细胞浓度降低。如果没有发生第二次失血,红细胞浓度通常在3到6周内恢复正常。 | |||
当发生慢性失血时,一个人通常无法从肠道吸收足够的铁来迅速形成血红蛋白以弥补其损失。此时会产生比正常小得多且内部血红蛋白含量过少的红细胞(RBCs),从而导致小细胞低色素性贫血(microcytic hypochromic anemia),如图33-3所示。 | 当发生慢性失血时,一个人通常无法从肠道吸收足够的铁来迅速形成血红蛋白以弥补其损失。此时会产生比正常小得多且内部血红蛋白含量过少的红细胞(RBCs),从而导致小细胞低色素性贫血(microcytic hypochromic anemia),如图33-3所示。 | ||
| 第166行: | 第152行: | ||
'''溶血性贫血(Hemolytic Anemia)'''。红细胞的不同异常,其中许多是通过遗传获得的,使细胞变得脆弱,因此它们在通过毛细血管,尤其是通过脾脏时容易破裂。尽管在某些溶血性疾病中,形成的红细胞数量可能是正常的,甚至比正常多得多,但脆弱红细胞的生命周期如此之短,以至于细胞被破坏的速度快于它们形成的速度,从而导致严重的贫血。 | '''溶血性贫血(Hemolytic Anemia)'''。红细胞的不同异常,其中许多是通过遗传获得的,使细胞变得脆弱,因此它们在通过毛细血管,尤其是通过脾脏时容易破裂。尽管在某些溶血性疾病中,形成的红细胞数量可能是正常的,甚至比正常多得多,但脆弱红细胞的生命周期如此之短,以至于细胞被破坏的速度快于它们形成的速度,从而导致严重的贫血。 | ||
在'''遗传性球形红细胞增多症(hereditary spherocytosis)'''中,红细胞非常小且呈球形,而不是双凹盘状。这些细胞无法承受压缩力,因为它们没有双凹盘状细胞的正常松散、袋状细胞膜结构。在通过脾髓和其他紧密的血管床时,它们甚至会被轻微的压缩轻易破裂。 | |||
在'''镰状细胞贫血(sickle cell anemia)'''中,细胞含有一种异常的血红蛋白(hemoglobin),称为血红蛋白S,其血红蛋白分子中的β链存在缺陷,正如本章前面所解释的那样。这种疾病在西非和美国黑人中的发病率为0.3%至1.0%。当这种血红蛋白暴露于低氧浓度时,它会在红细胞(RBC)内沉淀成长晶体。这些晶体会拉长细胞,使其呈现镰刀状而非双凹圆盘状。沉淀的血红蛋白还会损害细胞膜,导致细胞变得非常脆弱,从而引发严重的贫血。这类患者经常经历一种称为镰状细胞危象(sickle cell disease crisis)的恶性循环,即组织中的低氧张力导致镰状化,进而导致红细胞破裂,进一步降低氧张力,导致更多的镰状化和红细胞破坏。一旦这一过程开始,它会迅速进展,在几小时内导致红细胞数量严重减少,在某些情况下甚至导致死亡。 | |||
在'''胎儿成红细胞增多症(erythroblastosis fetalis)'''中,胎儿的Rh阳性红细胞受到Rh阴性母亲的抗体攻击。这些抗体使Rh阳性细胞变得脆弱,导致细胞迅速破裂,使孩子出生时患有严重的贫血。这种情况将在第36章中与血液的Rh因子一起讨论。为了弥补胎儿成红细胞增多症中被破坏的细胞,红细胞以极快的速度生成,导致大量早期红细胞母细胞从骨髓释放到血液中。 | |||
=== 贫血对循环系统功能的影响 === | === 贫血对循环系统功能的影响 === | ||
| 第178行: | 第164行: | ||
== 红细胞增多症(POLYCYTHEMIA) == | == 红细胞增多症(POLYCYTHEMIA) == | ||
继发性红细胞增多症(secondary polycythemia) | '''继发性红细胞增多症(secondary polycythemia)。'''当组织因吸入空气中的氧气过少(如在高海拔地区)或氧气输送至组织失败(如心力衰竭)而缺氧时,造血器官会自动产生大量额外的红细胞。这种情况称为继发性红细胞增多症,红细胞计数通常升至600万至700万/立方毫米,比正常值高出约30%。 | ||
一种常见的继发性红细胞增多症称为生理性红细胞增多症(physiological polycythemia),发生在生活在海拔14,000至17,000英尺的人群中,那里的大气氧气含量非常低。这些人的红细胞计数通常为600万至700万/立方毫米,这使得他们即使在稀薄的大气中也能进行相当高水平的持续工作。 | 一种常见的继发性红细胞增多症称为生理性红细胞增多症(physiological polycythemia),发生在生活在海拔14,000至17,000英尺的人群中,那里的大气氧气含量非常低。这些人的红细胞计数通常为600万至700万/立方毫米,这使得他们即使在稀薄的大气中也能进行相当高水平的持续工作。 | ||
真性红细胞增多症(polycythemia vera) | '''真性红细胞增多症(polycythemia vera)(Erythremia)'''。除了生理性红细胞增多症外,还存在一种称为真性红细胞增多症的病理状况,其中红细胞计数可能为700万至800万/立方毫米,血细胞比容可能为60%至70%,而正常值为40%至45%。真性红细胞增多症是由产生血细胞的成血细胞(hemocytoblastic cells)的遗传畸变引起的。当成血细胞已经存在过多时,它们不再停止产生红细胞。这导致红细胞过度产生,就像乳腺肿瘤导致特定类型的乳腺细胞过度产生一样。它通常还会导致白细胞和血小板的过度产生。 | ||
在真性红细胞增多症中,不仅血细胞比容增加,而且总血容量也增加,有时几乎达到正常值的两倍。结果,整个血管系统变得极度充血。此外,许多毛细血管被粘稠的血液堵塞;真性红细胞增多症中的血液粘度有时从正常的水的3倍增加到水的10倍。 | 在真性红细胞增多症中,不仅血细胞比容增加,而且总血容量也增加,有时几乎达到正常值的两倍。结果,整个血管系统变得极度充血。此外,许多毛细血管被粘稠的血液堵塞;真性红细胞增多症中的血液粘度有时从正常的水的3倍增加到水的10倍。 | ||
| 第191行: | 第177行: | ||
大多数红细胞增多症患者的动脉压也正常,尽管其中约三分之一的人动脉压升高。这意味着血压调节机制通常可以抵消血液粘度增加导致外周阻力增加的趋势,从而增加动脉压。然而,超过一定限度后,这些调节机制失效,高血压就会发生。 | 大多数红细胞增多症患者的动脉压也正常,尽管其中约三分之一的人动脉压升高。这意味着血压调节机制通常可以抵消血液粘度增加导致外周阻力增加的趋势,从而增加动脉压。然而,超过一定限度后,这些调节机制失效,高血压就会发生。 | ||
皮肤的颜色在很大程度上取决于皮肤乳头下静脉丛(subpapillary venous plexus)中的血液量。在真性红细胞增多症(polycythemia vera)中,该静脉丛中的血液量大大增加。此外,由于血液在进入静脉丛之前缓慢地通过皮肤毛细血管,因此比正常情况更多的血红蛋白(hemoglobin) | 皮肤的颜色在很大程度上取决于皮肤乳头下静脉丛(subpapillary venous plexus)中的血液量。在真性红细胞增多症(polycythemia vera)中,该静脉丛中的血液量大大增加。此外,由于血液在进入静脉丛之前缓慢地通过皮肤毛细血管,因此比正常情况更多的血红蛋白(hemoglobin)被脱氧。所有这些脱氧血红蛋白的蓝色掩盖了氧合血红蛋白的红色。<u>因此,真性红细胞增多症患者通常面色红润,皮肤带有蓝色(发绀,cyanotic)的色调。</u> | ||
= 机体对感染的抵抗力:I. 白细胞、粒细胞、单核-巨噬细胞系统和炎症 = | = 34 机体对感染的抵抗力:I. 白细胞、粒细胞、单核-巨噬细胞系统和炎症 = | ||
我们的身体不断暴露于细菌、病毒、真菌和寄生虫中,这些微生物通常存在于皮肤、口腔、呼吸道、肠道、眼膜甚至尿道中,程度各不相同。如果这些感染性病原体侵入更深层的组织,许多都能导致严重的生理功能异常甚至死亡。我们还会间歇性地暴露于其他高度传染性的细菌和病毒中,这些病原体可以引起急性致命疾病,如肺炎、链球菌感染和伤寒。 | 我们的身体不断暴露于细菌、病毒、真菌和寄生虫中,这些微生物通常存在于皮肤、口腔、呼吸道、肠道、眼膜甚至尿道中,程度各不相同。如果这些感染性病原体侵入更深层的组织,许多都能导致严重的生理功能异常甚至死亡。我们还会间歇性地暴露于其他高度传染性的细菌和病毒中,这些病原体可以引起急性致命疾病,如肺炎、链球菌感染和伤寒。 | ||
| 第649行: | 第635行: | ||
两种抗原——A型和B型——出现在大部分人的红细胞(RBCs)表面。正是这些抗原(也称为凝集原(agglutinogens),因为它们经常引起红细胞凝集)导致了大多数输血反应。由于这些凝集原的遗传方式,人们可能在其细胞上没有任何一种凝集原,可能有一种,或者可能同时有两种。 | 两种抗原——A型和B型——出现在大部分人的红细胞(RBCs)表面。正是这些抗原(也称为凝集原(agglutinogens),因为它们经常引起红细胞凝集)导致了大多数输血反应。由于这些凝集原的遗传方式,人们可能在其细胞上没有任何一种凝集原,可能有一种,或者可能同时有两种。 | ||
主要的O-A- | '''主要的O-A-B血型。'''在将血液从一个人输给另一个人时,供血者和受血者的血液通常根据A和B两种凝集原的存在与否分为四种主要的O-A-B血型,如表36-1所示。当A和B凝集原都不存在时,血液为O型。当只有A凝集原存在时,血液为A型。当只有B凝集原存在时,血液为B型。当A和B凝集原都存在时,血液为AB型。 | ||
'''凝集原的遗传决定。'''ABO血型基因座有三个等位基因(alleles),这意味着同一基因有三种不同的形式。这三个等位基因——I<sup>A</sup>、I<sup>B</sup>和I<sup>O</sup>——决定了三种血型。我们通常称这些等位基因为A、B和O,但遗传学家通常用同一符号的变体来表示一个基因的等位基因。在这种情况下,常用符号是字母"I",代表免疫球蛋白(immunoglobulin)。 | |||
O型等位基因是无功能的或几乎无功能的,因此它不会在细胞上产生显著的O型凝集原。相反,A型和B型等位基因确实会在细胞上产生强凝集原。因此,O型等位基因对A型和B型等位基因都是隐性的,而A型和B型等位基因表现为共显性(co-dominance)。 | O型等位基因是无功能的或几乎无功能的,因此它不会在细胞上产生显著的O型凝集原。相反,A型和B型等位基因确实会在细胞上产生强凝集原。因此,O型等位基因对A型和B型等位基因都是隐性的,而A型和B型等位基因表现为共显性(co-dominance)。 | ||
| 第662行: | 第648行: | ||
• O型: 47% • A型: 41% ·B型: 9% • AB型: 3% | • O型: 47% • A型: 41% ·B型: 9% • AB型: 3% | ||
从这些百分比可以明显看出,O和A基因出现频率高,而B基因出现频率低。 | 从这些百分比可以明显看出,O和A基因出现频率高,而B基因出现频率低。 | ||
| 第684行: | 第666行: | ||
图36-1. 不同血型人群血浆中抗A和抗B凝集素的平均滴度。 | 图36-1. 不同血型人群血浆中抗A和抗B凝集素的平均滴度。 | ||
=== 输血反应中的凝集过程 | === 输血反应中的凝集过程 === | ||
当血液不匹配时,抗A或抗B血浆凝集素与含有A或B凝集原的红细胞混合,凝集素附着在红细胞上,导致红细胞凝集。由于凝集素有两个结合位点(IgG型)或十个结合位点(IgM型),单个凝集素可以同时附着在两个或更多的红细胞上,从而使这些细胞被凝集素结合在一起。这种结合导致细胞聚集,这就是凝集过程。然后这些凝块堵塞循环系统中的小血管。<u>在随后的几小时到几天内,细胞的物理变形或吞噬性白细胞的攻击会破坏凝集细胞的膜,将血红蛋白释放到血浆中,称为红细胞的溶血(hemolysis)。</u> | |||
在某些输血反应中会发生急性溶血(acute hemolysis)。有时,当受血者和供血者的血液不匹配时,循环血液中的红细胞(RBCs) | 在某些输血反应中会发生急性溶血(acute hemolysis)。有时,当受血者和供血者的血液不匹配时,循环血液中的红细胞(RBCs)会立即发生溶血。在这种情况下,抗体通过激活'''补体'''系统(complement system)并形成'''膜攻击复合物'''(membrane attack complex,也称为溶细胞复合物(cytolytic complex))来引起红细胞溶解,该复合物插入细胞膜的脂双层中;这种插入形成了对离子具有通透性的膜孔,并导致细胞的'''渗透性溶解'''(osmotic lysis),如第35章所述。<u>立即发生的血管内溶血(intravascular hemolysis)远不如凝集(agglutination)后发生的延迟溶血常见,因为不仅需要高滴度的抗体才能发生溶血,而且似乎还需要不同类型的抗体,主要是IgM抗体;这些抗体被称为溶血素(hemolysins)。</u> | ||
=== 血型鉴定(BLOOD TYPING) === | === 血型鉴定(BLOOD TYPING) === | ||
| 第698行: | 第680行: | ||
表36-2列出了四种类型红细胞的凝集反应存在(+)或不存在(-)。O型红细胞没有凝集原(agglutinogens),因此不与抗A或抗B凝集素发生反应。A型血液具有A凝集原,因此与抗A凝集素发生凝集反应。B型血液具有B凝集原,并与抗B凝集素发生凝集反应。AB型血液同时具有A和B凝集原,并与两种类型的凝集素发生凝集反应。 | 表36-2列出了四种类型红细胞的凝集反应存在(+)或不存在(-)。O型红细胞没有凝集原(agglutinogens),因此不与抗A或抗B凝集素发生反应。A型血液具有A凝集原,因此与抗A凝集素发生凝集反应。B型血液具有B凝集原,并与抗B凝集素发生凝集反应。AB型血液同时具有A和B凝集原,并与两种类型的凝集素发生凝集反应。 | ||
== Rh血型 | == Rh血型 == | ||
除了O-A-B血型系统外,Rh血型系统在输血时也很重要。O-A-B系统和Rh系统之间的主要区别如下。在O-A-B系统中,引起输血反应的血清凝集素(plasma agglutinins)是自发产生的,而在Rh系统中,几乎从不发生自发的凝集素。相反,一个人必须首先大量接触Rh抗原——例如通过输注含有Rh抗原的血液——才能产生足够的凝集素以引起显著的输血反应。 | 除了O-A-B血型系统外,Rh血型系统在输血时也很重要。O-A-B系统和Rh系统之间的主要区别如下。在O-A-B系统中,引起输血反应的血清凝集素(plasma agglutinins)是自发产生的,而在Rh系统中,几乎从不发生自发的凝集素。相反,一个人必须首先大量接触Rh抗原——例如通过输注含有Rh抗原的血液——才能产生足够的凝集素以引起显著的输血反应。 | ||
| 第707行: | 第689行: | ||
大约85%的白种人是Rh阳性,15%是Rh阴性。在美国黑人中,Rh阳性的比例约为95%,而在非洲黑人中,这一比例接近100%。超过95%的居住在'''中国'''、'''日本'''和'''韩国'''的'''美洲原住民'''和'''亚洲人'''也是Rh阳性。据估计,全球范围内Rh阳性和Rh阴性血型的频率分别为95%和6%。 | 大约85%的白种人是Rh阳性,15%是Rh阴性。在美国黑人中,Rh阳性的比例约为95%,而在非洲黑人中,这一比例接近100%。超过95%的居住在'''中国'''、'''日本'''和'''韩国'''的'''美洲原住民'''和'''亚洲人'''也是Rh阳性。据估计,全球范围内Rh阳性和Rh阴性血型的频率分别为95%和6%。 | ||
=== Rh免疫反应 | === Rh免疫反应 === | ||
'''抗Rh凝集素(anti-Rh agglutinins)的形成'''。当含有Rh因子的红细胞(RBCs)被注入到不含Rh因子的人体内(即Rh阴性个体)时,抗Rh凝集素会缓慢形成,并在约2至4个月后达到最大浓度。这种免疫反应在某些人中比在其他人中更为显著。随着多次接触Rh因子,Rh阴性个体最终会对Rh因子产生强烈的致敏反应(sensitization)。 | '''抗Rh凝集素(anti-Rh agglutinins)的形成'''。当含有Rh因子的红细胞(RBCs)被注入到不含Rh因子的人体内(即Rh阴性个体)时,抗Rh凝集素会缓慢形成,并在约2至4个月后达到最大浓度。这种免疫反应在某些人中比在其他人中更为显著。随着多次接触Rh因子,Rh阴性个体最终会对Rh因子产生强烈的致敏反应(sensitization)。 | ||
'''Rh输血反应(Rh transfusion reactions)的特征'''。如果Rh阴性个体从未接触过Rh阳性血液,向其输注Rh阳性血液通常不会引起立即反应。然而,在接下来的2至4周内,抗Rh抗体(anti-Rh antibodies)可能会大量产生,导致仍在血液中循环的输注细胞发生凝集(agglutination)。这些细胞随后会被组织巨噬细胞系统(tissue macrophage system)溶血(hemolyzed) | '''Rh输血反应(Rh transfusion reactions)的特征'''。如果Rh阴性个体从未接触过Rh阳性血液,向其输注Rh阳性血液通常不会引起立即反应。然而,在接下来的2至4周内,抗Rh抗体(anti-Rh antibodies)可能会大量产生,导致仍在血液中循环的输注细胞发生凝集(agglutination)。这些细胞随后会被组织巨噬细胞系统(tissue macrophage system)溶血(hemolyzed)。因此,<u>尽管通常较为轻微,但会发生延迟性输血反应(delayed transfusion reaction)</u>。在随后的Rh阳性血液输注中,由于该个体已经对Rh因子产生了免疫,输血反应会显著增强,可能立即发生,并且严重程度与A型或B型血型不匹配引起的输血反应相当。 | ||
=== 胎儿成红细胞增多症(Erythroblastosis Fetalis)(新生儿溶血病(Hemolytic Disease of the Newborn)) === | === 胎儿成红细胞增多症(Erythroblastosis Fetalis)(新生儿溶血病(Hemolytic Disease of the Newborn)) === | ||
| 第717行: | 第699行: | ||
'''胎儿成红细胞增多症的发病率'''。Rh阴性母亲在怀第一个Rh阳性孩子时通常不会产生足够的抗Rh凝集素来造成任何伤害。然而,大约3%的第二个Rh阳性婴儿会出现一些胎儿成红细胞增多症的症状,大约10%的第三个婴儿会表现出这种疾病,并且发病率随着后续妊娠逐渐上升。 | '''胎儿成红细胞增多症的发病率'''。Rh阴性母亲在怀第一个Rh阳性孩子时通常不会产生足够的抗Rh凝集素来造成任何伤害。然而,大约3%的第二个Rh阳性婴儿会出现一些胎儿成红细胞增多症的症状,大约10%的第三个婴儿会表现出这种疾病,并且发病率随着后续妊娠逐渐上升。 | ||
'''母亲抗体对胎儿的影响。'''母亲体内形成抗Rh抗体后,这些抗体会缓慢通过胎盘膜扩散到胎儿的血液中。在胎儿血液中,它们会引起胎儿血液的凝集(agglutination)。凝集的红细胞(RBCs)随后发生溶血(hemolysis),将血红蛋白释放到血液中。胎儿的巨噬细胞(macrophages)随后将血红蛋白转化为胆红素(bilirubin),导致婴儿皮肤变黄(黄疸,jaundice)。这些抗体还可能攻击并损伤身体的其他细胞。 | |||
母亲体内形成抗Rh抗体后,这些抗体会缓慢通过胎盘膜扩散到胎儿的血液中。在胎儿血液中,它们会引起胎儿血液的凝集(agglutination)。凝集的红细胞(RBCs)随后发生溶血(hemolysis),将血红蛋白释放到血液中。胎儿的巨噬细胞(macrophages)随后将血红蛋白转化为胆红素(bilirubin),导致婴儿皮肤变黄(黄疸,jaundice)。这些抗体还可能攻击并损伤身体的其他细胞。 | |||
'''胎儿成红细胞增多症的临床表现。'''患有黄疸的成红细胞增多症(erythroblastosis)的新生儿通常在出生时贫血(anemic),母亲体内的抗Rh凝集素(anti-Rh agglutinins)通常会在婴儿出生后继续在血液中循环1到2个月,破坏越来越多的红细胞。 | |||
患有黄疸的成红细胞增多症(erythroblastosis)的新生儿通常在出生时贫血(anemic),母亲体内的抗Rh凝集素(anti-Rh agglutinins)通常会在婴儿出生后继续在血液中循环1到2个月,破坏越来越多的红细胞。 | |||
婴儿的造血组织(hematopoietic tissues)试图替代被溶血的红细胞。肝脏和脾脏会显著增大,并以与妊娠中期相同的方式产生红细胞。由于红细胞的快速生成,许多早期形式的红细胞,包括许多有核的成红细胞(nucleated blastic forms),会从婴儿的骨髓进入循环系统。正是由于这些有核成红细胞的存在,这种疾病被称为胎儿成红细胞增多症(erythroblastosis fetalis)。 | 婴儿的造血组织(hematopoietic tissues)试图替代被溶血的红细胞。肝脏和脾脏会显著增大,并以与妊娠中期相同的方式产生红细胞。由于红细胞的快速生成,许多早期形式的红细胞,包括许多有核的成红细胞(nucleated blastic forms),会从婴儿的骨髓进入循环系统。正是由于这些有核成红细胞的存在,这种疾病被称为胎儿成红细胞增多症(erythroblastosis fetalis)。 | ||
| 第727行: | 第707行: | ||
尽管胎儿成红细胞增多症的严重贫血通常是导致死亡的原因,但许多勉强从贫血中幸存下来的儿童由于胆红素在神经元细胞中的沉淀而表现出永久性的智力障碍或大脑运动区域的损伤,导致许多这些细胞的破坏,这种情况称为核黄疸(kernicterus)。 | 尽管胎儿成红细胞增多症的严重贫血通常是导致死亡的原因,但许多勉强从贫血中幸存下来的儿童由于胆红素在神经元细胞中的沉淀而表现出永久性的智力障碍或大脑运动区域的损伤,导致许多这些细胞的破坏,这种情况称为核黄疸(kernicterus)。 | ||
'''胎儿成红细胞增多症新生儿的治疗。'''胎儿成红细胞增多症的一种治疗方法是使用Rh阴性血液替换新生儿的血液。Rh阴性血液在1.5小时或更长时间内输注,同时移除新生儿自身的Rh阳性血液。这一过程可能在出生后的前几周内重复多次,主要是为了保持胆红素水平低,从而预防核黄疸。当这些输注的Rh阴性细胞被婴儿自身的Rh阳性细胞替代时,这一过程需要6周或更长时间,来自母亲的抗Rh凝集素将被破坏。 | |||
胎儿成红细胞增多症的一种治疗方法是使用Rh阴性血液替换新生儿的血液。Rh阴性血液在1.5小时或更长时间内输注,同时移除新生儿自身的Rh阳性血液。这一过程可能在出生后的前几周内重复多次,主要是为了保持胆红素水平低,从而预防核黄疸。当这些输注的Rh阴性细胞被婴儿自身的Rh阳性细胞替代时,这一过程需要6周或更长时间,来自母亲的抗Rh凝集素将被破坏。 | |||
'''胎儿成红细胞增多症的预防。'''Rh血型系统的D抗原是导致Rh阴性母亲对Rh阳性胎儿免疫的主要元凶。在20世纪70年代,随着R h免疫球蛋白(Rh immunoglobulin globin)的开发,胎儿成红细胞增多症的发病率显著降低。这种抗D抗体从妊娠28到30周开始给予孕妇。抗D抗体也给予分娩Rh阳性婴儿的Rh阴性女性,以防止母亲对D抗原的致敏。这一步骤大大降低了在第二次怀孕期间产生大量D抗体的风险。 | |||
Rh血型系统的D抗原是导致Rh阴性母亲对Rh阳性胎儿免疫的主要元凶。在20世纪70年代,随着R h免疫球蛋白(Rh immunoglobulin globin)的开发,胎儿成红细胞增多症的发病率显著降低。这种抗D抗体从妊娠28到30周开始给予孕妇。抗D抗体也给予分娩Rh阳性婴儿的Rh阴性女性,以防止母亲对D抗原的致敏。这一步骤大大降低了在第二次怀孕期间产生大量D抗体的风险。 | |||
Rh免疫球蛋白防止D抗原致敏的机制尚不完全清楚,但抗D抗体的一个作用是抑制孕妇体内抗原诱导的B淋巴细胞抗体生成。给予的抗D抗体还会附着在Rh阳性胎儿红细胞上的D抗原位点上,这些红细胞可能穿过胎盘进入孕妇的循环系统,从而干扰对D抗原的免疫反应。 | Rh免疫球蛋白防止D抗原致敏的机制尚不完全清楚,但抗D抗体的一个作用是抑制孕妇体内抗原诱导的B淋巴细胞抗体生成。给予的抗D抗体还会附着在Rh阳性胎儿红细胞上的D抗原位点上,这些红细胞可能穿过胎盘进入孕妇的循环系统,从而干扰对D抗原的免疫反应。 | ||
== 由于血型不匹配导致的输血反应 == | |||
如果将一种血型的供体血液输给另一种血型的受体,很可能会发生输血反应,导致供体血液的红细胞(RBCs)发生凝集。输注的血液很少会引起受体细胞的凝集,原因如下。供体血液的血浆部分会立即被受体的所有血浆稀释,从而将输注的凝集素(agglutinins)的滴度降低到通常不足以引起凝集的水平。然而,少量输注的血液不会显著稀释受体血浆中的凝集素。因此,受体的凝集素仍然可以凝集不匹配的供体细胞。 | 如果将一种血型的供体血液输给另一种血型的受体,很可能会发生输血反应,导致供体血液的红细胞(RBCs)发生凝集。输注的血液很少会引起受体细胞的凝集,原因如下。供体血液的血浆部分会立即被受体的所有血浆稀释,从而将输注的凝集素(agglutinins)的滴度降低到通常不足以引起凝集的水平。然而,少量输注的血液不会显著稀释受体血浆中的凝集素。因此,受体的凝集素仍然可以凝集不匹配的供体细胞。 | ||
| 第780行: | 第758行: | ||
人体活体组织的移植之所以成功,主要是因为开发了抑制免疫系统反应的药物。随着改进的免疫抑制剂的引入,成功的器官移植变得更加普遍。目前的免疫抑制治疗方法试图在可接受的排斥率和免疫抑制剂的不良反应之间取得平衡。 | 人体活体组织的移植之所以成功,主要是因为开发了抑制免疫系统反应的药物。随着改进的免疫抑制剂的引入,成功的器官移植变得更加普遍。目前的免疫抑制治疗方法试图在可接受的排斥率和免疫抑制剂的不良反应之间取得平衡。 | ||
= 止血与血液凝固 = | = 37 止血与血液凝固 = | ||
== 止血事件 == | == 止血事件 == | ||
止血(Hemostasis)一词意味着防止血液流失。每当血管被切断或破裂时,止血通过几种机制实现:(1) 血管收缩;(2) 形成血小板栓子(Platelet plug);(3) 由于血液凝固(Blood coagulation)形成血块;(4) 最终纤维组织生长到血块中,永久性地封闭血管上的孔洞。 | 止血(Hemostasis)一词意味着防止血液流失。每当血管被切断或破裂时,止血通过几种机制实现:(1) 血管收缩;(2) 形成血小板栓子(Platelet plug);(3) 由于血液凝固(Blood coagulation)形成血块;(4) 最终纤维组织生长到血块中,永久性地封闭血管上的孔洞。 | ||
=== 血管收缩 | === 血管收缩 === | ||
血管被切割或破裂后,血管壁的创伤会立即导致壁内的平滑肌收缩;这会瞬间减少从破裂血管流出的血液量。这种收缩是由以下因素引起的:(1) 局部肌源性痉挛 (local myogenic spasm);(2) 来自创伤组织、血管内皮 (vascular endothelium) 和血小板 (platelets) 的局部自体活性物质 (local autacoid factors);(3) 神经反射 (nervous reflexes)。神经反射是由疼痛神经冲动或其他感觉冲动引发的,这些冲动源自受创伤的血管或附近组织。然而,更多的血管收缩可能是由于血管壁直接损伤引发的局部肌源性收缩。对于较小的血管,血小板通过释放一种血管收缩物质——血栓素 A2 (thromboxane A2),在血管收缩中起主要作用。 | 血管被切割或破裂后,血管壁的创伤会立即导致壁内的平滑肌收缩;这会瞬间减少从破裂血管流出的血液量。这种收缩是由以下因素引起的:(1) 局部肌源性痉挛 (local myogenic spasm);(2) 来自创伤组织、血管内皮 (vascular endothelium) 和血小板 (platelets) 的局部自体活性物质 (local autacoid factors);(3) 神经反射 (nervous reflexes)。神经反射是由疼痛神经冲动或其他感觉冲动引发的,这些冲动源自受创伤的血管或附近组织。然而,更多的血管收缩可能是由于血管壁直接损伤引发的局部肌源性收缩。对于较小的血管,血小板通过释放一种血管收缩物质——血栓素 A2 (thromboxane A2),在血管收缩中起主要作用。 | ||
血管受到的创伤越严重,血管痉挛的程度就越大。痉挛可以持续数分钟甚至数小时,在此期间,血小板栓塞和血液凝固的过程可以发生。 | 血管受到的创伤越严重,血管痉挛的程度就越大。痉挛可以持续数分钟甚至数小时,在此期间,血小板栓塞和血液凝固的过程可以发生。 | ||
=== | === 血小板栓的形成 === | ||
如果血管的切口非常小——每天体内血管上都会形成许多非常小的孔——切口通常会被血小板栓塞 (platelet plug) 而不是血凝块 (blood clot) 封闭。为了理解这一过程,我们首先需要讨论血小板本身的性质。 | |||
== 物理和化学特性 | ==== 物理和化学特性 ==== | ||
血小板(也称为血小板细胞 (thrombocytes))是直径为 1 至 4 微米的微小圆盘。它们由骨髓中的巨核细胞 (megakaryocytes) 形成,巨核细胞是骨髓中极大的造血细胞 (hematopoietic cells);巨核细胞在骨髓中或进入血液后不久,尤其是在通过毛细血管时,会碎裂成微小的血小板。血液中血小板的正常浓度在 150,000 至 450,000/ | 血小板(也称为血小板细胞 (thrombocytes))是直径为 1 至 4 微米的微小圆盘。它们由骨髓中的巨核细胞 (megakaryocytes) 形成,巨核细胞是骨髓中极大的造血细胞 (hematopoietic cells);巨核细胞在骨髓中或进入血液后不久,尤其是在通过毛细血管时,会碎裂成微小的血小板。血液中血小板的正常浓度在 150,000 至 450,000/μl 之间。 | ||
血小板具有许多完整细胞的功能特性,尽管它们没有细胞核且不能繁殖。它们的细胞质中包含以下成分:(1) 肌动蛋白 (actin) | 血小板具有许多完整细胞的功能特性,尽管它们没有细胞核且不能繁殖。它们的细胞质中包含以下成分:(1) '''肌动蛋白''' (actin) 和'''肌球蛋白''' (myosin) 分子,这些是与肌肉细胞中发现的收缩蛋白 (contractile proteins) 相似的蛋白质,以及另一种收缩蛋白——'''血栓收缩蛋白''' (thrombosthenin),它可以使血小板收缩;(2) 内质网 (endoplasmic reticulum) 和高尔基体 (Golgi apparatus) 的残余物,它们合成各种酶,尤其是<u>储存大量钙离子</u>;(3) 线粒体 (mitochondria) 和酶系统,能够形成三磷酸腺苷 (adenosine triphosphate, ATP) 和二磷酸腺苷 (adenosine diphosphate, ADP);(4) 合成'''前列腺素''' (prostaglandins) 的酶系统,前列腺素是局部激素,会引起许多血管和其他局部组织反应;(5) 一种重要的蛋白质,称为'''纤维蛋白稳定因子''' (fibrin-stabilizing factor),我们稍后会在讨论血液凝固时提到它;(6) 一种生长因子 (growth factor),它会导致血管内皮细胞、血管平滑肌细胞和成纤维细胞 (fibroblasts) 增殖和生长,从而促进细胞生长,最终帮助修复受损的血管壁。 | ||
在血小板细胞膜表面有一层糖蛋白 (glycoproteins),它可以排斥与正常内皮的粘附,但会促进与血管壁受损区域的粘附,尤其是受损的内皮细胞,甚至更倾向于与血管壁深处暴露的胶原蛋白 (collagen) 粘附。此外,血小板膜含有大量磷脂 (phospholipids),它们可以激活血液凝固过程中的多个阶段,这一点稍后会讨论。 | 在血小板细胞膜表面有一层糖蛋白 (glycoproteins),它可以排斥与正常内皮的粘附,但会促进与血管壁受损区域的粘附,尤其是受损的内皮细胞,甚至更倾向于与血管壁深处暴露的胶原蛋白 (collagen) 粘附。此外,血小板膜含有大量磷脂 (phospholipids),它们可以激活血液凝固过程中的多个阶段,这一点稍后会讨论。 | ||
| 第803行: | 第781行: | ||
=== 血小板栓形成机制 === | === 血小板栓形成机制 === | ||
[[文件:GT-37.1.png|缩略图|图37-1. 血小板栓在破裂的血管中的形成。内皮损伤和血管细胞外基质的暴露促进了血小板的粘附和激活,这改变了它们的形状并导致腺苷二磷酸(ADP)、血栓素A2 (TxA2)和血小板激活因子(PAF)的释放。这些血小板分泌的因子招募更多的血小板(聚集)以形成止血栓。Von Willebrand因子(vWF)作为内皮下方胶原与糖蛋白Ib(GpIb)血小板受体之间的粘附桥梁。]] | |||
血小板对血管开口的修复基于血小板的几个重要功能。当血小板接触到受损的血管表面,特别是血管壁中的胶原纤维时,血小板会迅速且显著地改变其自身特性(图37-1)。它们开始膨胀,呈现出不规则形状,表面伸出许多放射状的伪足,其收缩蛋白强力收缩,导致含有多种活性因子的颗粒释放,并且它们变得粘附,从而粘附到组织中的胶原以及一种称为von Willebrand因子(vWF)的蛋白质上,vWF从血浆渗入受损组织。血小板表面糖蛋白与受损内皮下方暴露的基质中的vWF结合。然后,血小板分泌更多的ADP和血小板激活因子(PAF),其酶形成血栓素A2。血栓素是一种血管收缩剂,与ADP和PAF一起作用于附近的血小板,使它们也被激活;这些额外激活的血小板的粘附性使它们粘附到最初激活的血小板上。 | 血小板对血管开口的修复基于血小板的几个重要功能。当血小板接触到受损的血管表面,特别是血管壁中的胶原纤维时,血小板会迅速且显著地改变其自身特性(图37-1)。它们开始膨胀,呈现出不规则形状,表面伸出许多放射状的伪足,其收缩蛋白强力收缩,导致含有多种活性因子的颗粒释放,并且它们变得粘附,从而粘附到组织中的胶原以及一种称为von Willebrand因子(vWF)的蛋白质上,vWF从血浆渗入受损组织。血小板表面糖蛋白与受损内皮下方暴露的基质中的vWF结合。然后,血小板分泌更多的ADP和血小板激活因子(PAF),其酶形成血栓素A2。血栓素是一种血管收缩剂,与ADP和PAF一起作用于附近的血小板,使它们也被激活;这些额外激活的血小板的粘附性使它们粘附到最初激活的血小板上。 | ||
因此,在血管壁穿刺处,受损的血管壁激活了越来越多的血小板,这些血小板吸引了越来越多的额外血小板,从而形成血小板栓。这个栓最初是松散的,但如果血管开口很小,通常能够成功阻止血液流失。然后,在随后的血液凝固过程中,形成纤维蛋白线。这些线紧密地附着在血小板上,从而构建出一个坚固的栓。 | 因此,在血管壁穿刺处,受损的血管壁激活了越来越多的血小板,这些血小板吸引了越来越多的额外血小板,从而形成血小板栓。这个栓最初是松散的,但如果血管开口很小,通常能够成功阻止血液流失。然后,在随后的血液凝固过程中,形成纤维蛋白线。这些线紧密地附着在血小板上,从而构建出一个坚固的栓。 | ||
血小板机制对封闭血管孔的重要性。血小板栓机制对于封闭每天发生数千次的微小血管中的微小破裂极为重要。事实上,内皮细胞本身的多个小孔通常通过血小板与内皮细胞融合形成额外的内皮细胞膜来封闭。每天在皮肤下(紫癜,表现为皮肤上的紫色或红色斑点)和全身内部组织中会出现数千个小出血区域,这种情况在血小板数量较少的人中常见。这种现象在血小板数量正常的人中不会发生。 | 血小板机制对封闭血管孔的重要性。血小板栓机制对于封闭每天发生数千次的微小血管中的微小破裂极为重要。事实上,内皮细胞本身的多个小孔通常通过血小板与内皮细胞融合形成额外的内皮细胞膜来封闭。每天在皮肤下(紫癜,表现为皮肤上的紫色或红色斑点)和全身内部组织中会出现数千个小出血区域,这种情况在血小板数量较少的人中常见。这种现象在血小板数量正常的人中不会发生。 | ||
== 破裂血管中的血液凝固 == | == 破裂血管中的血液凝固 == | ||
[[文件:GT-37.2.png|缩略图|图37-2. 受伤血管中的凝血过程。]] | |||
止血的第三种机制是血凝块的形成。如果血管壁受到严重创伤,血凝块会在15到20秒内开始形成;如果创伤较轻,则会在1到2分钟内开始形成。来自受伤血管壁、血小板以及附着在受伤血管壁上的血液蛋白的激活物质会启动凝血过程。该过程的物理事件如图37-2所示;表37-1列出了最重要的凝血因子。 | 止血的第三种机制是血凝块的形成。如果血管壁受到严重创伤,血凝块会在15到20秒内开始形成;如果创伤较轻,则会在1到2分钟内开始形成。来自受伤血管壁、血小板以及附着在受伤血管壁上的血液蛋白的激活物质会启动凝血过程。该过程的物理事件如图37-2所示;表37-1列出了最重要的凝血因子。 | ||
| 第819行: | 第795行: | ||
=== 血凝块的纤维化或溶解 === | === 血凝块的纤维化或溶解 === | ||
一旦血凝块形成,它可能遵循以下两种途径之一:(1) 它可能被成纤维细胞侵入,随后在整个血凝块中形成结缔组织;或(2) | 一旦血凝块形成,它可能遵循以下两种途径之一:<u>(1) 它可能被成纤维细胞侵入,随后在整个血凝块中形成结缔组织;或(2) 它可能溶解。</u>通常,在血管壁小孔中形成的血凝块会被成纤维细胞侵入,这一过程在血凝块形成后的几小时内开始,至少部分由血小板分泌的生长因子促进。这一过程继续,大约在1到2周内将血凝块完全组织成纤维组织。 | ||
相反,当过多的血液渗入组织,并且在不需要的地方形成组织血凝块时,血凝块中的特殊物质通常会被激活。这些物质作为酶溶解血凝块,稍后将在本章讨论。 | 相反,当过多的血液渗入组织,并且在不需要的地方形成组织血凝块时,血凝块中的特殊物质通常会被激活。这些物质作为酶溶解血凝块,稍后将在本章讨论。 | ||
| 第833行: | 第803行: | ||
=== 一般机制 === | === 一般机制 === | ||
在血液和组织中已经发现了超过50种引起或影响血液凝固的重要物质——一些促进凝固的物质称为促凝剂(procoagulants),另一些抑制凝固的物质称为抗凝剂(anticoagulants)。血液是否会凝固取决于这两类物质之间的平衡。在血流中,抗凝剂通常占主导地位,因此血液在血管中循环时不会凝固。然而,当血管破裂时,来自组织损伤区域的促凝剂被激活并压倒抗凝剂,然后就会形成血凝块。 | 在血液和组织中已经发现了超过50种引起或影响血液凝固的重要物质——一些促进凝固的物质称为促凝剂(procoagulants),另一些抑制凝固的物质称为抗凝剂(anticoagulants)。血液是否会凝固取决于这两类物质之间的平衡。在血流中,抗凝剂通常占主导地位,因此血液在血管中循环时不会凝固。然而,当血管破裂时,来自组织损伤区域的促凝剂被激活并压倒抗凝剂,然后就会形成血凝块。 | ||
凝血过程包括三个基本步骤: | 凝血过程包括三个基本步骤: | ||
| 第843行: | 第811行: | ||
我们将首先讨论血凝块形成的机制,从凝血酶原转化为凝血酶开始,然后再回到凝血过程中形成凝血酶原激活物的起始阶段。 | 我们将首先讨论血凝块形成的机制,从凝血酶原转化为凝血酶开始,然后再回到凝血过程中形成凝血酶原激活物的起始阶段。 | ||
[[文件:GT-37.3.png|缩略图|图37-3 凝血酶原转化为凝血酶以及纤维蛋白原聚合形成纤维蛋白纤维的示意图。]] | |||
=== 凝血酶原转化为凝血酶 === | === 凝血酶原转化为凝血酶 === | ||
# 凝血酶原激活物的形成是由于血管破裂或血液中特殊物质受损的结果。 | # 凝血酶原激活物的形成是由于血管破裂或血液中特殊物质受损的结果。 | ||
# | # 在足够量的离子钙存在下,凝血酶原激活物促使凝血酶原转化为凝血酶(图37-3和37-4)。 | ||
# 凝血酶在接下来的10到15秒内促使纤维蛋白原分子聚合成纤维蛋白纤维。 | # 凝血酶在接下来的10到15秒内促使纤维蛋白原分子聚合成纤维蛋白纤维。 | ||
| 第856行: | 第825行: | ||
血小板在凝血酶原转化为凝血酶的过程中也起着重要作用,因为大部分凝血酶原首先附着在已经结合到受损组织的血小板上的凝血酶原受体上。 | 血小板在凝血酶原转化为凝血酶的过程中也起着重要作用,因为大部分凝血酶原首先附着在已经结合到受损组织的血小板上的凝血酶原受体上。 | ||
凝血酶原(prothrombin)和凝血酶(thrombin) | '''凝血酶原(prothrombin)和凝血酶(thrombin)。'''凝血酶原是一种血浆蛋白,属于\bfa2-球蛋白(globulin),分子量为68,700。它在正常血浆中的浓度约为15mg/dl。凝血酶原是一种不稳定的蛋白质,容易分解成较小的化合物,其中之一就是凝血酶,其分子量为33,700,几乎是凝血酶原的一半。 | ||
凝血酶原由肝脏持续合成,并在全身不断用于血液凝固。如果肝脏不能产生凝血酶原,血浆中的凝血酶原浓度会在一天左右下降到无法提供正常血液凝固的水平。 | 凝血酶原由肝脏持续合成,并在全身不断用于血液凝固。如果肝脏不能产生凝血酶原,血浆中的凝血酶原浓度会在一天左右下降到无法提供正常血液凝固的水平。 | ||
| 第869行: | 第838行: | ||
凝血酶作用于纤维蛋白原形成纤维蛋白。凝血酶是一种具有弱蛋白水解能力的蛋白酶。它作用于纤维蛋白原,从每个纤维蛋白原分子中去除四个低分子量肽,形成一个具有自动聚合能力的纤维蛋白单体分子,与其他纤维蛋白单体分子聚合形成纤维蛋白纤维。因此,许多纤维蛋白单体分子在几秒钟内聚合成构成血凝块网状结构的纤维蛋白纤维。 | 凝血酶作用于纤维蛋白原形成纤维蛋白。凝血酶是一种具有弱蛋白水解能力的蛋白酶。它作用于纤维蛋白原,从每个纤维蛋白原分子中去除四个低分子量肽,形成一个具有自动聚合能力的纤维蛋白单体分子,与其他纤维蛋白单体分子聚合形成纤维蛋白纤维。因此,许多纤维蛋白单体分子在几秒钟内聚合成构成血凝块网状结构的纤维蛋白纤维。 | ||
在聚合的早期阶段,纤维蛋白单体分子通过弱的非共价氢键结合在一起,新形成的纤维之间没有交联。因此,形成的凝块较弱,容易破裂。然而,在接下来的几分钟内会发生另一个过程,大大增强了纤维蛋白网状结构的强度。<u>这个过程涉及一种称为纤维蛋白稳定因子(fibrin stabilizing factor)的物质,它在正常血浆球蛋白中少量存在,但也从被困在凝块中的血小板中释放出来。</u>纤维蛋白稳定因子在作用于纤维蛋白纤维之前必须被激活。导致纤维蛋白形成的凝血酶也会激活纤维蛋白稳定因子。这种激活的物质随后作为酶发挥作用,在越来越多的纤维蛋白单体分子之间形成共价键,并在相邻的纤维蛋白纤维之间形成多重交联,从而极大地增强了纤维蛋白网状结构的三维强度。 | |||
血凝块。血凝块由向各个方向延伸的纤维蛋白(fibrin)纤维网组成,这些纤维网捕获了血细胞、血小板(platelet)和血浆(plasma)(见图37-4)。纤维蛋白纤维还粘附在血管的受损表面;因此,血凝块会粘附在任何血管开口处,从而防止进一步失血。 | 血凝块。血凝块由向各个方向延伸的纤维蛋白(fibrin)纤维网组成,这些纤维网捕获了血细胞、血小板(platelet)和血浆(plasma)(见图37-4)。纤维蛋白纤维还粘附在血管的受损表面;因此,血凝块会粘附在任何血管开口处,从而防止进一步失血。 | ||
| 第1,054行: | 第1,023行: | ||
类似于凝血酶原时间和INR的测试已被设计用于测定其他凝血因子的数量。在这些测试中,除了被测因子外,过量的钙离子和其他所有因子都会一次性加入草酸化血液中。然后,以与凝血酶原时间相同的方式测定凝血所需的时间。如果被测因子缺乏,凝血时间会延长。凝血时间本身可以用来定量该因子的浓度。 | 类似于凝血酶原时间和INR的测试已被设计用于测定其他凝血因子的数量。在这些测试中,除了被测因子外,过量的钙离子和其他所有因子都会一次性加入草酸化血液中。然后,以与凝血酶原时间相同的方式测定凝血所需的时间。如果被测因子缺乏,凝血时间会延长。凝血时间本身可以用来定量该因子的浓度。 | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
{{:Guyton&Hall 生理学 第十四版}} | |||
2025年8月23日 (六) 17:13的最新版本
33 红细胞、贫血和红细胞增多症
在本章中,我们开始讨论血细胞以及巨噬细胞系统和淋巴系统的细胞。我们首先介绍红细胞(RBCs)的功能,红细胞是血液中最丰富的细胞,对于向组织输送氧气是必要的。
红细胞
红细胞(RBCs),也称为erythrocytes,的一个主要功能是运输血红蛋白,血红蛋白又将氧气从肺部输送到组织。在一些动物中,包括许多无脊椎动物,血红蛋白作为游离蛋白质在循环液中循环,并不包裹在红细胞中。当它在人血浆中游离时,每次血液通过毛细血管时,大约有3%的血红蛋白会通过毛细血管膜渗入组织间隙或通过肾脏的肾小球膜进入肾小球滤液。因此,血红蛋白必须保持在红细胞内才能有效地在人体中执行其功能。
除了运输血红蛋白外,红细胞还有其他功能。例如,它们含有大量的碳酸酐酶,这是一种催化二氧化碳(CO₂)和水之间可逆反应形成碳酸(H₂CO₃)的酶,使该反应的速率增加数千倍。该反应的快速性使得血液中的水能够以碳酸氢根离子(HCO₃⁻)的形式从组织向肺部运输大量的CO₂,在那里它被重新转化为CO₂并作为身体废物排出到大气中。细胞中的血红蛋白是一种极好的酸碱缓冲剂(大多数蛋白质也是如此),因此红细胞负责全血的大部分酸碱缓冲能力。
红细胞的形状和大小。正常红细胞,如图33-3所示,是双凹盘状,平均直径约为7.8微米,最厚处的厚度为2.5微米,中心处为1微米或更少。红细胞的平均体积为90到95立方微米。
红细胞的形状在细胞通过毛细血管时可以显著变化。实际上,红细胞类似于一个可以变形为几乎任何形状的袋子。
此外,由于正常细胞的细胞膜相对于内部物质的数量有极大的富余,变形不会显著拉伸细胞膜,因此也不会导致细胞破裂,而许多其他细胞则不然。
血液中红细胞(Red Blood Cells, RBCs)的浓度。在健康男性中,每立方毫米血液中的红细胞平均数量为5,200,000 (±300,000);在健康女性中,这一数值为4,700,000 (±300,000)。生活在高海拔地区的人红细胞数量更多,这一点将在后文讨论。
细胞中血红蛋白(Hemoglobin)的含量。红细胞可以将细胞液中的血红蛋白浓度浓缩至约34 g/100ml。浓度不会超过这一数值,因为这是细胞血红蛋白形成机制的代谢极限。此外,在正常人中,每个细胞中的血红蛋白百分比几乎总是接近最大值。然而,当血红蛋白形成不足时,细胞中的血红蛋白百分比可能会显著低于这一数值,并且由于填充细胞的血红蛋白减少,红细胞的体积也可能减小。
当血细胞比容(血液中细胞所占的百分比——通常为40%至45%)和每个细胞中的血红蛋白含量正常时,男性全血中的血红蛋白平均含量为15g血红蛋白/ 100ml;女性则为14g血红蛋白/ 100ml。
正如第41章关于血液运输氧气的讨论所述,如果血红蛋白饱和度为100%,每克血红蛋白可以与1.34ml的氧气结合。因此,在平均男性中,每100毫升血液中最多可以携带约20毫升的氧气与血红蛋白结合,而在女性中则可以携带19毫升的氧气。
红细胞的生产
体内产生红细胞的部位。在胚胎发育的早期几周内,原始的有核红细胞在卵黄囊中产生。在妊娠的中期,肝脏是红细胞生产的主要器官,但脾脏和淋巴结也会产生相当数量的红细胞。然后,在妊娠的最后一个月左右以及出生后,红细胞仅在骨髓中产生。
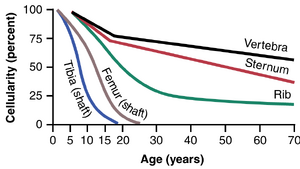
如图33-1所示,几乎所有骨骼的骨髓都会产生红细胞,直到一个人大约5岁。长骨的骨髓(除了肱骨和胫骨的近端部分)在大约20岁后会变得脂肪化,不再产生红细胞。超过这个年龄后,大多数红细胞继续在膜性骨骼的骨髓中产生,例如椎骨、胸骨、肋骨和髂骨。即使在这些骨骼中,随着年龄的增长,骨髓的生产能力也会下降。
血细胞的生成
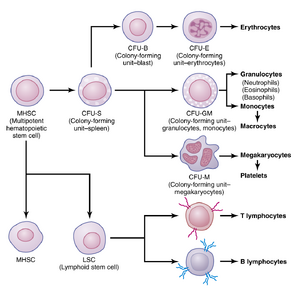
多能造血干细胞、生长诱导因子和分化诱导因子。血细胞的生命始于骨髓中的一种单一类型的细胞,称为多能造血干细胞(multipotential hematopoietic stem cell),所有循环血液中的细胞最终都来源于此。图33-2展示了多能细胞通过连续分裂形成不同循环血细胞的过程。当这些细胞繁殖时,其中一小部分细胞保持与原始多能细胞完全相同,并保留在骨髓中以维持其供应,尽管它们的数量随着年龄的增长而减少。然而,大多数繁殖的细胞会分化形成其他类型的细胞,如图33-2右侧所示。中间阶段的细胞非常类似于多能干细胞,尽管它们已经定向于某一特定细胞系;这些细胞被称为定向干细胞(committed stem cells)。
当不同的定向干细胞在培养中生长时,会产生特定类型血细胞的集落。产生红细胞的定向干细胞称为红细胞集落形成单位(colony-forming unit-erythrocyte),缩写为CFU-E。同样,形成粒细胞和单核细胞的集落形成单位被命名为CFU-GM,依此类推。
不同干细胞的生长和繁殖由多种称为生长诱导因子(growth inducers)的蛋白质控制。至少已经描述了四种主要的生长诱导因子,每种都具有不同的特性。其中之一是白细胞介素-3(interleukin-3),它促进几乎所有不同类型的定向干细胞的生长和繁殖,而其他生长诱导因子则仅诱导特定类型细胞的生长。
生长诱导因子促进细胞的生长,但不促进其分化,这是另一组称为分化诱导因子(differentiation inducers)的蛋白质的功能。每种分化诱导因子都会使一种定向干细胞向最终成熟血细胞分化一个或多个步骤。
生长诱导因子和分化诱导因子的形成受骨髓外部因素的控制。例如,在红细胞的情况下,血液长时间暴露于低氧水平会导致生长诱导、分化以及红细胞数量的显著增加,如本章后面所讨论的。在某些白细胞的情况下,感染性疾病会导致生长、分化以及最终形成对抗每种感染所需的特定类型的白细胞。
红细胞的分化阶段
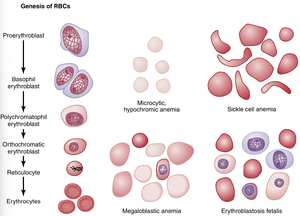
第一个可以被识别为属于红细胞系列的细胞是原红细胞(proerythroblast),如图33-3的起点所示。在适当的刺激下,大量这些细胞由CFU-E干细胞形成。
一旦原红细胞(proerythroblast)形成,它就会多次分裂,最终形成许多成熟的红细胞(RBCs)。
第一代细胞被称为嗜碱性成红细胞(basophil erythroblasts),因为它们能被碱性染料染色。血红蛋白(hemoglobin)首先出现在多染性成红细胞(polychromatophil erythroblasts)中。在接下来的几代中,如图33-3所示,细胞中充满了浓度约为34%的血红蛋白,细胞核浓缩到很小的尺寸,其最后的残余被细胞吸收或挤出。同时,内质网()也被重新吸收。这个阶段的细胞被称为网织红细胞(reticulocyte),因为它仍然含有少量的嗜碱性物质,包括高尔基体()、线粒体()和其他一些细胞质细胞器的残余。在网织红细胞阶段,细胞通过渗出(diapedesis)(挤压通过毛细血管膜的孔隙)从骨髓进入毛细血管。
网织红细胞中剩余的嗜碱性物质通常在1到2天内消失,然后细胞就变成了成熟的红细胞。由于网织红细胞的寿命很短,它们在所有红细胞中的浓度通常略低于1%。
促红细胞生成素调节红细胞生成
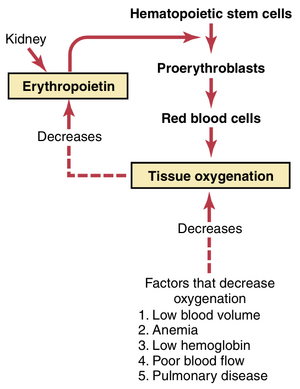
循环系统中红细胞的总质量被严格控制在狭窄的范围内,因此(1)始终有足够的红细胞可用于将氧气从肺部输送到组织,同时(2)细胞不会变得过多以至于阻碍血液流动。这种控制机制如图33-4所示,并在以下部分中描述。
组织氧合——红细胞生成的重要调节因素。减少输送到组织的氧气量的条件通常会增加红细胞的生成速率。因此,当一个人因出血或任何其他情况而变得极度贫血时,骨髓开始大量生成红细胞。此外,骨髓主要部分的破坏,特别是通过X射线治疗,会导致剩余骨髓的增生,以试图满足身体对红细胞的需求。
在海拔非常高的地方,空气中的氧气量大大减少,输送到组织的氧气不足,红细胞的生成大大增加。在这种情况下,控制红细胞生成的不是血液中红细胞的浓度,而是输送到组织的氧气量与组织对氧气的需求之间的关系。
各种减少组织血流的循环系统疾病,特别是那些导致血液通过肺部时氧气吸收失败的疾病,也会增加红细胞的生成速率。这种结果在长期心脏衰竭和许多肺部疾病中尤为明显,因为这些情况导致的组织缺氧会增加红细胞的生成,从而导致血细胞比容(hematocrit)和通常总血量的增加。
低氧增加促红细胞生成素的形成,从而刺激红细胞生成。在低氧状态下,红细胞生成的主要刺激是一种称为促红细胞生成素(erythropoietin)的循环激素,它是一种分子量约为34,000的糖蛋白。在没有促红细胞生成素的情况下,低氧对刺激红细胞生成几乎没有影响。然而,当促红细胞生成素系统功能正常时,低氧会导致促红细胞生成素的显著增加,而促红细胞生成素反过来又会增强红细胞生成,直到低氧状态得到缓解。
促红细胞生成素主要在肾脏中形成。正常情况下,约90%的促红细胞生成素在肾脏中形成,其余主要形成于肝脏。目前尚不清楚促红细胞生成素在肾脏中的确切形成位置。一些研究表明,促红细胞生成素主要由皮质和外髓质中围绕肾小管的成纤维细胞样间质细胞分泌,这些区域是肾脏耗氧量较大的部位。其他细胞,包括肾上皮细胞,也可能在低氧状态下分泌促红细胞生成素。
肾组织低氧会导致低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)的组织水平升高,HIF-1作为许多低氧诱导基因的转录因子,包括促红细胞生成素基因。HIF-1与促红细胞生成素基因中的低氧反应元件结合,诱导信使RNA的转录,最终增加促红细胞生成素的合成。
有时,身体其他部位而非肾脏的低氧会刺激肾脏分泌促红细胞生成素,这表明可能存在某种非肾脏传感器向肾脏发送额外信号以产生这种激素。特别是,去甲肾上腺素(norepinephrine)、肾上腺素(epinephrine)和几种前列腺素(prostaglandins)会刺激促红细胞生成素的产生。
当一个人的双肾被切除,或肾脏因肾脏疾病而受损时,这个人必定会变得非常贫血。这是因为其他组织(主要是肝脏)中形成的正常促红细胞生成素的10%仅足以引起身体所需红细胞生成量的三分之一到一半。
促红细胞生成素刺激造血干细胞生成原红细胞。当动物或人处于低氧环境中时,促红细胞生成素在几分钟到几小时内开始形成,并在24小时内达到最大产量。然而,几乎没有任何新的红细胞出现在循环血液中,直到大约5天后。由此以及其他研究可以确定,促红细胞生成素的重要作用是刺激骨髓中造血干细胞生成原红细胞。此外,一旦原红细胞形成,促红细胞生成素会促使这些细胞比正常情况下更快地通过不同的红细胞生成阶段,进一步加快新红细胞的生成。只要人处于低氧状态,或直到产生足够的红细胞以在低氧水平下向组织输送足够的氧气,细胞的快速生成就会持续;此时,促红细胞生成素的生成速率会降低到维持所需红细胞数量但不产生过量的水平。
在没有促红细胞生成素(erythropoietin)的情况下,骨髓只能生成少量的红细胞(RBCs)。在另一个极端,当大量促红细胞生成素生成,并且有充足的铁和其他必需营养物质时,红细胞的生成速率可以提高到正常水平的10倍甚至更多。因此,促红细胞生成素调控红细胞生成的机制是非常强大的。
红细胞的成熟需要维生素B12(氰钴胺,Cyanocobalamin)和叶酸(Folic Acid)
由于持续需要补充红细胞,骨髓中的红细胞生成细胞(erythropoietic cells)是全身生长和繁殖最快的细胞之一。因此,正如预期的那样,它们的成熟和生成速率在很大程度上受到一个人营养状况的影响。
对红细胞最终成熟特别重要的是两种维生素,维生素B12和叶酸。这两种维生素对DNA的合成都是必不可少的,因为每一种都以不同的方式参与胸苷三磷酸(thymidine triphosphate)的形成,而胸苷三磷酸是DNA的基本组成部分之一。因此,缺乏维生素B12或叶酸会导致DNA异常和减少,进而导致核成熟和细胞分裂的失败。此外,骨髓中的成红细胞(erythroblastic cells)除了不能快速增殖外,主要产生比正常红细胞更大的巨红细胞(macrocytes),这些细胞膜脆弱,通常不规则、大且呈椭圆形,而不是通常的双凹圆盘状。这些形成不良的细胞进入循环血液后,虽然能够正常携带氧气,但由于其脆弱性,寿命较短,只有正常红细胞的一半到三分之一。因此,维生素B12或叶酸缺乏会导致红细胞生成过程中的成熟障碍。
由于胃肠道吸收维生素B12不良导致的成熟障碍性贫血——恶性贫血(Pernicious Anemia)
红细胞成熟障碍的一个常见原因是胃肠道吸收维生素B12障碍。这种情况经常发生在恶性贫血(pernicious anemia)中,其基本异常是萎缩的胃黏膜无法产生正常的胃分泌物。胃腺的壁细胞(parietal cells)分泌一种称为内因子(intrinsic factor)的糖蛋白,它与食物中的维生素B12结合,并通过以下方式使B12能够被肠道吸收:
- 内因子与维生素B12紧密结合。在这种结合状态下,维生素B12受到保护,不会被胃肠道分泌物消化。
- 仍然在结合状态下,内因子与回肠(ileum)黏膜细胞刷状缘膜上的特定受体位点结合。
- 然后,维生素B12在接下来的几个小时内通过胞饮作用(pinocytosis)被转运到血液中,内因子和维生素一起通过细胞膜。
因此,内因子的缺乏会由于维生素吸收障碍而降低维生素B12的可用性。
一旦维生素B12从胃肠道吸收后,首先大量储存在肝脏中,然后根据需要缓慢释放到骨髓中。每天维持正常红细胞(RBC)成熟所需的最小维生素B12量仅为1至3微克,而肝脏和其他身体组织中的正常储存量约为这个量的1000倍。因此,通常需要3到4年的维生素B12吸收缺陷才会导致成熟障碍性贫血(anemia)。
由叶酸(Pteroylglutamic Acid)缺乏引起的成熟障碍性贫血。叶酸是绿色蔬菜、一些水果和肉类(尤其是肝脏)的正常成分。然而,它在烹饪过程中容易被破坏。此外,患有胃肠道吸收异常的人,如常见的小肠疾病sprue,通常难以吸收叶酸和维生素B12。因此,在许多成熟障碍的情况下,原因是肠道对叶酸和维生素B12的吸收不足。
血红蛋白的形成
血红蛋白的合成始于多染性成红细胞(polychromatophil erythroblasts),并持续到红细胞(RBC)的网织红细胞(reticulocyte)阶段。因此,当网织红细胞离开骨髓进入血液时,它们会继续形成微量的血红蛋白,直到它们成为成熟的红细胞。
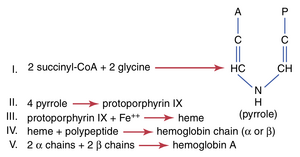
图33-5显示了血红蛋白形成的基本化学步骤。首先,在Krebs代谢循环中形成的琥珀酰-CoA(succinyl-CoA)与甘氨酸(glycine)结合形成吡咯分子(pyrrole molecule)。接着,四个吡咯结合形成原卟啉IX(protoporphyrin IX),然后与铁结合形成血红素分子(heme molecule)。最后,每个血红素分子与一个由核糖体合成的长多肽链(globin)结合,形成血红蛋白的一个亚基,称为血红蛋白链(hemoglobin chain)(图33-6)。每条链的分子量约为16,000;四条链松散地结合在一起,形成整个血红蛋白分子。
不同的血红蛋白链亚基有几种轻微的变异,取决于多肽部分的氨基酸组成。不同类型的链被指定为α链(alpha chains)、β链(beta chains)、γ链(gamma chains)和δ链(delta chains)。成人中最常见的血红蛋白形式,血红蛋白A,是两个α链和两个β链的组合。血红蛋白A的分子量为64,458。
图33-6. 血红素部分的基本结构,显示了四条血红素链中的一条,它们与珠蛋白多肽(globin polypeptide)一起结合形成血红蛋白分子。
因为每条血红蛋白链都有一个含有铁原子的血红素辅基(heme prosthetic group),并且每个血红蛋白分子中有四条血红蛋白链,所以每个血红蛋白分子中有四个铁原子。每个铁原子可以松散地与一个氧分子结合,使得每个血红蛋白分子可以运输总共四个氧分子(或八个氧原子)。
血红蛋白分子中血红蛋白链的类型决定了血红蛋白与氧的结合亲和力。链的异常也会改变血红蛋白分子的物理特性。例如,在镰状细胞贫血(sickle cell anemia)中,两个β链中的某个位点的谷氨酸被缬氨酸取代。当这种类型的血红蛋白暴露于低氧环境时,它会在红细胞内形成长达15微米的细长晶体。这些晶体使得细胞几乎无法通过许多小毛细血管,并且晶体的尖刺末端可能会刺破细胞膜,导致镰状细胞贫血。
血红蛋白可逆地与氧结合。血红蛋白分子最重要的特性是它能够松散且可逆地与氧结合。这种能力在第41章关于呼吸的部分详细讨论,因为血红蛋白在体内的主要功能是在肺部与氧结合,然后在周围组织毛细血管中释放氧,那里的氧分压远低于肺部。
氧不与血红蛋白分子中铁的两个正键结合。相反,它与铁原子的所谓配位键之一松散结合。这种键非常松散,因此结合是可逆的。此外,氧不会变成离子氧,而是以分子氧(由两个氧原子组成)的形式被运输到组织,在那里,由于松散且可逆的结合,它以分子氧的形式而不是离子氧的形式释放到组织液中。
铁的代谢
由于铁不仅对血红蛋白的形成重要,还对体内其他必需元素(如肌红蛋白(myoglobin)、细胞色素(cytochromes)、细胞色素氧化酶(cytochrome oxidase)、过氧化物酶(peroxidase)和过氧化氢酶(catalase))的形成也很重要,因此了解铁在体内的利用方式非常重要。体内铁的总量平均为4到5克,其中约65%以血红蛋白的形式存在。约4%以肌红蛋白的形式存在,1%以促进细胞内氧化的各种血红素化合物的形式存在,0.1%与血浆中的转铁蛋白(transferrin)结合,15%到30%以铁蛋白(ferritin)的形式储存,主要在网状内皮系统(reticuloendothelial system)和肝实质细胞(liver parenchymal cells)中。
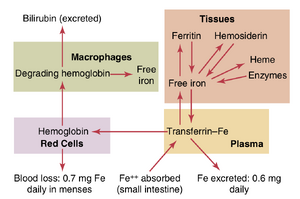
铁的运输和储存。铁的运输、储存和代谢在图33-7中图示,可以解释如下。当铁从小肠吸收后,它立即与血浆中的β球蛋白——脱铁转铁蛋白(apotransferrin)结合,形成转铁蛋白(transferrin),然后在血浆中运输。铁在转铁蛋白中松散结合,因此可以在体内的任何部位释放到任何组织细胞中。血液中过量的铁主要沉积在肝细胞中,较少沉积在骨髓的网状内皮细胞中。
在细胞质()中,铁主要与一种蛋白质——脱铁铁蛋白(apoferritin)结合,形成铁蛋白(ferritin)。脱铁铁蛋白的分子量约为460,000,不同数量的铁可以以铁自由基簇的形式与这个大分子结合;因此,铁蛋白可能只含有少量或大量的铁。这种以铁蛋白形式储存的铁称为储存铁(storage iron)。
储存池中较少量的铁以一种极不溶的形式存在,称为含铁血黄素(hemosiderin)。当体内的铁总量超过脱铁铁蛋白储存池的容量时,这种情况尤其明显。含铁血黄素以大簇的形式聚集在细胞中,可以在显微镜下观察到大的颗粒。相比之下,铁蛋白颗粒非常小且分散,通常只能在电子显微镜下观察到。
当血浆中的铁含量降低时,铁蛋白储存池中的一些铁很容易被移除,并以转铁蛋白(transferrin)的形式在血浆中运输到身体需要的部位。转铁蛋白分子的一个独特特性是它能与骨髓中成红细胞(erythroblasts)细胞膜上的受体(receptors)紧密结合。然后,连同其结合的铁,通过内吞作用(endocytosis)被摄入成红细胞中。在那里,转铁蛋白将铁直接输送到线粒体(mitochondria),血红素(heme)在线粒体中合成。在血液中转铁蛋白不足的人群中,无法以这种方式将铁运输到成红细胞可能导致严重的低色素性贫血(hypochromic anemia)(即红细胞中的血红蛋白含量远低于正常水平)。
当红细胞存活约120天后被破坏时,从细胞中释放的血红蛋白被单核-巨噬细胞(monocyte-macrophage cells)摄取。在那里,铁被释放并主要储存在铁蛋白池中,以备需要时用于新血红蛋白的形成。
铁的每日丢失。一个普通男性每天排泄约0.6mg的铁,主要进入粪便。当出血发生时,还会丢失额外的铁。对于女性来说,额外的月经失血使长期铁丢失平均达到约1.3~mg/day。
从肠道吸收铁
铁从小肠的各个部分吸收,主要通过以下机制。肝脏分泌适量的脱铁转铁蛋白(apotransferrin)进入胆汁,胆汁通过胆管流入十二指肠。在这里,脱铁转铁蛋白与游离铁以及某些铁化合物(如肉类中的血红蛋白和肌红蛋白)结合,这是饮食中最重要的两种铁来源。这种结合物称为转铁蛋白。接着,它被吸引并与肠上皮细胞(intestinal epithelial cells)膜上的受体结合。然后,通过胞饮作用(pinocytosis),携带铁储存的转铁蛋白分子被吸收到上皮细胞中,随后以血浆转铁蛋白的形式释放到这些细胞下方的毛细血管中。
从肠道吸收铁的速度非常慢,最大速率仅为每天几毫克。这种缓慢的吸收速度意味着即使食物中含有大量的铁,也只能吸收一小部分。
通过控制吸收率调节全身铁含量。当身体铁含量饱和,以至于铁储存区域中几乎所有的脱铁铁蛋白(apoferritin)都已与铁结合时,肠道对额外铁的吸收率显著下降。相反,当铁储存耗尽时,吸收率可能会加速到正常水平的五倍或更多。因此,全身铁含量主要通过改变吸收率来调节。
红细胞的寿命约为120天
当红细胞从骨髓释放到循环系统时,它们通常在循环中平均存活120天,然后被破坏。尽管成熟的红细胞没有细胞核、线粒体或内质网,但它们具有能够代谢葡萄糖并形成少量三磷酸腺苷(adenosine triphosphate, ATP)的细胞质酶。这些酶还具有以下功能:(1) 维持细胞膜的柔韧性;(2) 维持离子的膜运输;(3) 保持细胞血红蛋白中的铁处于亚铁形式而非三价铁形式;(4) 防止红细胞中蛋白质的氧化。即便如此,老化红细胞的代谢系统逐渐变得不活跃,细胞变得越来越脆弱,可能是因为它们的生命过程逐渐耗尽。
一旦红细胞膜变得脆弱,细胞在通过循环系统中的某些狭窄部位时会破裂。许多红细胞在脾脏中自毁,它们在那里挤过脾脏的红髓。红髓的结构小梁之间的空间只有3微米宽,而红细胞的直径为8微米,大多数细胞必须通过这些狭窄的空间。当脾脏被切除后,血液中循环的老化异常红细胞数量显著增加。
巨噬细胞对血红蛋白的破坏。当红细胞破裂并释放其血红蛋白时,血红蛋白几乎立即被身体许多部位的巨噬细胞吞噬,尤其是肝脏的库普弗细胞(Kupffer cells)以及脾脏和骨髓的巨噬细胞。在接下来的几小时到几天内,巨噬细胞从血红蛋白中释放铁,并将其传递回血液中,由转铁蛋白(transferrin)携带,要么进入骨髓用于生产新的红细胞,要么进入肝脏和其他组织以铁蛋白(ferritin)的形式储存。血红蛋白分子的卟啉部分被巨噬细胞通过一系列步骤转化为胆色素胆红素(bilirubin),胆红素被释放到血液中,随后通过肝脏分泌到胆汁中排出体外。这一过程将在第71章中与肝功能相关的内容中讨论。
贫血
贫血意味着血液中血红蛋白的缺乏,这可能是由于红细胞数量过少或细胞中血红蛋白含量过低引起的。以下部分描述了一些类型的贫血及其生理原因。
失血性贫血。在快速失血后,身体在1到3天内替换血浆的液体部分,但这种反应导致红细胞浓度降低。如果没有发生第二次失血,红细胞浓度通常在3到6周内恢复正常。
当发生慢性失血时,一个人通常无法从肠道吸收足够的铁来迅速形成血红蛋白以弥补其损失。此时会产生比正常小得多且内部血红蛋白含量过少的红细胞(RBCs),从而导致小细胞低色素性贫血(microcytic hypochromic anemia),如图33-3所示。
骨髓功能障碍导致的再生障碍性贫血(Aplastic Anemia Due to Bone Marrow Dysfunction)。骨髓再生障碍(bone marrow aplasia)意味着缺乏功能性骨髓。例如,暴露于高剂量辐射或用于癌症治疗的化疗可能会损害骨髓干细胞,随后在几周内出现贫血。同样,高剂量的某些有毒化学物质,如杀虫剂或汽油中的苯,可能会产生相同的效果。在自身免疫性疾病(autoimmune disorders)中,如红斑狼疮(lupus erythematosus),免疫系统开始攻击健康细胞,如骨髓干细胞,这可能导致再生障碍性贫血。在大约一半的再生障碍性贫血病例中,原因不明,这种情况称为特发性再生障碍性贫血(idiopathic aplastic anemia)。
严重的再生障碍性贫血患者通常会死亡,除非他们接受输血治疗——这可以暂时增加红细胞数量——或进行骨髓移植。
巨幼细胞性贫血(Megaloblastic Anemia)。基于之前对维生素B12、叶酸(folic acid)和胃黏膜内因子(intrinsic factor)的讨论,我们可以很容易理解,失去其中任何一种都可能导致骨髓中幼红细胞(erythroblasts)的缓慢繁殖。结果,红细胞变得过大,形状奇特,被称为巨幼细胞(megaloblasts)。因此,胃黏膜萎缩,如恶性贫血(pernicious anemia)中发生的情况,或手术全胃切除术后失去整个胃,都可能导致巨幼细胞性贫血。此外,巨幼细胞性贫血常发生在患有肠炎(intestinal sprue)的患者中,这些患者对叶酸、维生素B12和其他维生素B化合物的吸收不良。由于这些状态下的幼红细胞无法迅速增殖以形成正常数量的红细胞,形成的红细胞大多过大,形状怪异,且膜脆弱。这些细胞容易破裂,使患者急需足够数量的红细胞。
溶血性贫血(Hemolytic Anemia)。红细胞的不同异常,其中许多是通过遗传获得的,使细胞变得脆弱,因此它们在通过毛细血管,尤其是通过脾脏时容易破裂。尽管在某些溶血性疾病中,形成的红细胞数量可能是正常的,甚至比正常多得多,但脆弱红细胞的生命周期如此之短,以至于细胞被破坏的速度快于它们形成的速度,从而导致严重的贫血。
在遗传性球形红细胞增多症(hereditary spherocytosis)中,红细胞非常小且呈球形,而不是双凹盘状。这些细胞无法承受压缩力,因为它们没有双凹盘状细胞的正常松散、袋状细胞膜结构。在通过脾髓和其他紧密的血管床时,它们甚至会被轻微的压缩轻易破裂。
在镰状细胞贫血(sickle cell anemia)中,细胞含有一种异常的血红蛋白(hemoglobin),称为血红蛋白S,其血红蛋白分子中的β链存在缺陷,正如本章前面所解释的那样。这种疾病在西非和美国黑人中的发病率为0.3%至1.0%。当这种血红蛋白暴露于低氧浓度时,它会在红细胞(RBC)内沉淀成长晶体。这些晶体会拉长细胞,使其呈现镰刀状而非双凹圆盘状。沉淀的血红蛋白还会损害细胞膜,导致细胞变得非常脆弱,从而引发严重的贫血。这类患者经常经历一种称为镰状细胞危象(sickle cell disease crisis)的恶性循环,即组织中的低氧张力导致镰状化,进而导致红细胞破裂,进一步降低氧张力,导致更多的镰状化和红细胞破坏。一旦这一过程开始,它会迅速进展,在几小时内导致红细胞数量严重减少,在某些情况下甚至导致死亡。
在胎儿成红细胞增多症(erythroblastosis fetalis)中,胎儿的Rh阳性红细胞受到Rh阴性母亲的抗体攻击。这些抗体使Rh阳性细胞变得脆弱,导致细胞迅速破裂,使孩子出生时患有严重的贫血。这种情况将在第36章中与血液的Rh因子一起讨论。为了弥补胎儿成红细胞增多症中被破坏的细胞,红细胞以极快的速度生成,导致大量早期红细胞母细胞从骨髓释放到血液中。
贫血对循环系统功能的影响
血液的粘度(viscosity)主要取决于红细胞的血浆浓度,这在第14章中已讨论过。在严重贫血患者中,血液粘度可能降至水的1.5倍,而不是正常值约3倍。这种变化降低了外周血管中的血流阻力,因此通过组织并返回心脏的血流量远高于正常水平,从而大大增加了心输出量(cardiac output)。此外,由于血液运输氧气的能力下降导致的缺氧(hypoxia)会使外周组织血管扩张,进一步增加血液回流到心脏的量,并将心输出量提高到更高的水平——有时是正常值的三到四倍。因此,贫血的主要影响之一是心输出量显著增加,同时增加了心脏的泵血负荷。
贫血患者心输出量的增加部分抵消了贫血导致的携氧能力下降,因为即使每单位血液携带的氧气量较少,血流速度的增加可能足以使组织实际获得的氧气量接近正常水平。然而,当贫血患者开始运动时,心脏无法泵出比当前更多的血液。因此,在运动期间,组织对氧气的需求大大增加,导致极度的组织缺氧,并可能引发急性心力衰竭(acute cardiac failure)。
红细胞增多症(POLYCYTHEMIA)
继发性红细胞增多症(secondary polycythemia)。当组织因吸入空气中的氧气过少(如在高海拔地区)或氧气输送至组织失败(如心力衰竭)而缺氧时,造血器官会自动产生大量额外的红细胞。这种情况称为继发性红细胞增多症,红细胞计数通常升至600万至700万/立方毫米,比正常值高出约30%。
一种常见的继发性红细胞增多症称为生理性红细胞增多症(physiological polycythemia),发生在生活在海拔14,000至17,000英尺的人群中,那里的大气氧气含量非常低。这些人的红细胞计数通常为600万至700万/立方毫米,这使得他们即使在稀薄的大气中也能进行相当高水平的持续工作。
真性红细胞增多症(polycythemia vera)(Erythremia)。除了生理性红细胞增多症外,还存在一种称为真性红细胞增多症的病理状况,其中红细胞计数可能为700万至800万/立方毫米,血细胞比容可能为60%至70%,而正常值为40%至45%。真性红细胞增多症是由产生血细胞的成血细胞(hemocytoblastic cells)的遗传畸变引起的。当成血细胞已经存在过多时,它们不再停止产生红细胞。这导致红细胞过度产生,就像乳腺肿瘤导致特定类型的乳腺细胞过度产生一样。它通常还会导致白细胞和血小板的过度产生。
在真性红细胞增多症中,不仅血细胞比容增加,而且总血容量也增加,有时几乎达到正常值的两倍。结果,整个血管系统变得极度充血。此外,许多毛细血管被粘稠的血液堵塞;真性红细胞增多症中的血液粘度有时从正常的水的3倍增加到水的10倍。
红细胞增多症对循环系统功能的影响
由于红细胞增多症中血液粘度大大增加,外周血管中的血流通常非常缓慢。根据第20章讨论的调节血液回心的因素,增加血液粘度会降低静脉回心速率。相反,红细胞增多症中的血容量大大增加,这往往会增加静脉回心。实际上,红细胞增多症中的心输出量并不远离正常值,因为这两个因素或多或少相互抵消。
大多数红细胞增多症患者的动脉压也正常,尽管其中约三分之一的人动脉压升高。这意味着血压调节机制通常可以抵消血液粘度增加导致外周阻力增加的趋势,从而增加动脉压。然而,超过一定限度后,这些调节机制失效,高血压就会发生。
皮肤的颜色在很大程度上取决于皮肤乳头下静脉丛(subpapillary venous plexus)中的血液量。在真性红细胞增多症(polycythemia vera)中,该静脉丛中的血液量大大增加。此外,由于血液在进入静脉丛之前缓慢地通过皮肤毛细血管,因此比正常情况更多的血红蛋白(hemoglobin)被脱氧。所有这些脱氧血红蛋白的蓝色掩盖了氧合血红蛋白的红色。因此,真性红细胞增多症患者通常面色红润,皮肤带有蓝色(发绀,cyanotic)的色调。
34 机体对感染的抵抗力:I. 白细胞、粒细胞、单核-巨噬细胞系统和炎症
我们的身体不断暴露于细菌、病毒、真菌和寄生虫中,这些微生物通常存在于皮肤、口腔、呼吸道、肠道、眼膜甚至尿道中,程度各不相同。如果这些感染性病原体侵入更深层的组织,许多都能导致严重的生理功能异常甚至死亡。我们还会间歇性地暴露于其他高度传染性的细菌和病毒中,这些病原体可以引起急性致命疾病,如肺炎、链球菌感染和伤寒。
我们的身体有一个特殊的系统来对抗不同的感染性和毒性病原体。这个系统由血液中的白细胞(white blood cells, WBCs)和由白细胞衍生的组织细胞组成。这些细胞通过两种方式共同作用来预防疾病:(1) 通过吞噬作用(phagocytosis)实际破坏入侵的细菌或病毒;(2) 形成抗体和致敏淋巴细胞,这些抗体和淋巴细胞可以破坏或灭活入侵者。本章讨论第一种方法,第35章讨论第二种方法。
白细胞(WHITE BLOOD CELLS)
白细胞,也称为白血球,是机体保护系统的移动单位。它们部分在骨髓中形成(粒细胞、单核细胞和少量淋巴细胞),部分在淋巴组织中形成(淋巴细胞和浆细胞)。形成后,它们通过血液被运输到身体需要的不同部位。
白细胞的实际价值在于,它们中的大多数被专门运输到严重感染和炎症的区域,从而提供快速而有效的防御机制来对抗感染性病原体。正如我们稍后将看到的,粒细胞和单核细胞具有“寻找并摧毁”外来入侵者的特殊能力。
白细胞的一般特征
白细胞类型
血液中通常存在六种类型的白细胞(WBCs):中性粒细胞(多形核)、嗜酸性粒细胞(多形核)、嗜碱性粒细胞(多形核)、单核细胞、淋巴细胞,偶尔还有浆细胞。此外,血液中还有大量的血小板,它们是另一种类似于骨髓中发现的WBCs的细胞碎片,即巨核细胞。前三种细胞,即多形核细胞,都具有颗粒状外观,如图34-1中的细胞编号7、10和12所示,因此它们被称为粒细胞(granulocytes)。粒细胞和单核细胞通过吞噬(phagocytosis)或释放具有多种效应的抗菌或炎症物质来保护身体免受入侵生物体的侵害,这些物质有助于消灭有害生物体。淋巴细胞和浆细胞主要与免疫系统相关,如第35章所述。最后,血小板的功能是专门激活血液凝固机制,如第37章所述。
血液中不同类型白细胞的浓度
一个成年人的血液中每微升约有7000个白细胞(相比之下,每微升有500万个红细胞[RBCs])。在总白细胞中,不同类型的正常百分比大约如下:
- 中性粒细胞:62.0%
- 嗜酸性粒细胞:2.3%
- 嗜碱性粒细胞:0.4%
- 单核细胞:5.3%
- 淋巴细胞:30.0%
每微升血液中血小板的数量通常在150,000到450,000之间,平均约为300,000。
白细胞的生成
多能造血干细胞(multipotential hematopoietic stem cell)早期分化为不同类型的定向干细胞(committed stem cells)的过程已在上一章的图33-2中展示。除了形成红细胞的细胞外,还形成了两种主要的白细胞谱系,即髓细胞系(myelocytic lineage)和淋巴细胞系(lymphocytic lineage)。图34-1的左侧显示了髓细胞系,从原始粒细胞(myeloblast)开始;右侧显示了淋巴细胞系,从原始淋巴细胞(lymphoblast)开始。
图 34-1. 白细胞的生成。显示了髓细胞系的不同细胞:1,原始粒细胞;2,早幼粒细胞;3,巨核细胞;4,中性粒细胞;5,幼中性粒细胞;6,带状中性粒细胞;7,中性粒细胞;8,嗜酸性粒细胞;9,嗜酸性粒细胞;10,嗜酸性粒细胞;11,嗜碱性粒细胞;12,嗜碱性粒细胞;13–16,单核细胞形成的各个阶段。
粒细胞和单核细胞仅在骨髓中形成。淋巴细胞和浆细胞主要在多种淋巴生成组织(lymphogenous tissues)中产生——尤其是淋巴结、脾脏、胸腺、扁桃体以及身体其他部位的淋巴组织,如骨髓和肠道壁上皮下的Peyer's patches。
在骨髓中形成的白细胞会储存在骨髓中,直到循环系统需要它们。然后,当需要时,各种因素会导致它们被释放(这些因素将在后面讨论)。通常,骨髓中储存的白细胞数量是循环血液中的三倍。这个数量大约代表了这些细胞的6天供应量。
淋巴细胞主要储存在各种淋巴组织中,只有少量暂时在血液中运输。
如图34-1所示,巨核细胞(细胞3)也在骨髓中形成。这些巨核细胞在骨髓中分裂,形成的小片段称为血小板(或血小板细胞),然后进入血液。它们在血液凝固的启动中非常重要。
白细胞的生命周期
粒细胞从骨髓释放后,通常在血液中循环4到8小时,然后在需要的组织中存活4到5天。在严重的组织感染时,这个总生命周期通常缩短到只有几个小时,因为粒细胞更快地前往感染区域,执行其功能,并在此过程中被破坏。
单核细胞在血液中的过渡时间也很短,为10到20小时,然后穿过毛细血管膜进入组织。一旦进入组织,它们会膨胀到更大的尺寸,成为组织巨噬细胞,在这种形式下,它们可以存活数月,除非在执行吞噬功能时被破坏。这些组织巨噬细胞是组织巨噬细胞系统的基础(稍后详细讨论),该系统提供了持续的感染防御。
淋巴细胞随着淋巴结和其他淋巴组织的淋巴引流不断进入循环系统。几小时后,它们通过渗出/外渗从血液中回到组织中。然后,它们再次进入淋巴并返回血液,因此,淋巴细胞在体内不断循环。淋巴细胞的生命周期为几周或几个月,取决于身体对这些细胞的需求。
血液中的血小板大约每10天更换一次。换句话说,每天每微升血液中大约形成30,000个血小板。
中性粒细胞和巨噬细胞防御感染
主要是中性粒细胞和组织巨噬细胞攻击并摧毁入侵的细菌、病毒和其他有害物质。中性粒细胞是成熟的细胞,即使在循环血液中也能攻击并摧毁细菌。相反,组织巨噬细胞最初是血液中的单核细胞,这些细胞在血液中时是不成熟的,当时几乎没有能力对抗感染物质。然而,一旦它们进入组织,它们开始膨胀——有时直径增加多达五倍——达到60到80微米,这个大小几乎可以用肉眼看到。这些细胞现在被称为巨噬细胞,它们在组织中非常能够对抗疾病物质。
图 34-2. 中性粒细胞通过毛细血管孔的渗出或外渗以及向组织损伤区域的趋化性移动。
白细胞通过渗出作用进入组织间隙。中性粒细胞(neutrophils)和单核细胞(monocytes)可以通过渗出作用(diapedesis)挤过毛细血管(capillaries)和后毛细血管微静脉(postcapillary venules)内皮细胞(endothelial cells)之间的间隙。尽管细胞间间隙比细胞小得多,但细胞的一小部分可以一次滑过间隙;滑过的部分会暂时收缩到间隙的大小,如图34-2所示(另见图34-6)。
白细胞通过阿米巴运动(ameboid motion)在组织间隙中移动。中性粒细胞和巨噬细胞(macrophages)都可以通过阿米巴运动在组织中移动,如第2章所述。一些细胞的移动速度可达每分钟40微米(40μm/ min),每分钟移动的距离可达其自身长度。
白细胞通过趋化性(chemotaxis)被吸引到发炎的组织区域。组织中的许多不同化学物质会导致中性粒细胞和巨噬细胞向化学物质的来源移动。这种现象被称为趋化性,如图34-2所示。当组织发炎时,会形成至少十几种不同的产物,可以引起向发炎区域的趋化性(视频34-1)。它们包括:(1)一些细菌或病毒毒素;(2)发炎组织的变性产物;(3)在发炎组织中激活的补体复合物(complement complex)的几种反应产物(将在第35章讨论);以及(4)由发炎区域血浆凝固引起的几种反应产物,以及其他物质。
如图34-2所示,趋化性取决于趋化物质的浓度梯度。在来源附近浓度最高,这引导了白细胞(WBCs)的单向运动。趋化性在距离发炎组织100微米以内有效。因此,由于几乎没有组织区域距离毛细血管超过50微米,趋化信号可以很容易地将大量白细胞从毛细血管移动到发炎区域。
吞噬作用(phagocytosis)
中性粒细胞和巨噬细胞的一个主要功能是吞噬作用,即细胞摄取有害物质。吞噬细胞(phagocytes)必须对吞噬的物质具有选择性;否则,可能会摄取体内的正常细胞和结构。吞噬作用是否会发生尤其取决于三个选择性过程(图34-3)。
首先,组织中的大多数天然结构具有光滑的表面,可以抵抗吞噬作用。然而,如果表面粗糙,吞噬作用的可能性就会增加。
其次,体内的大多数天然物质具有保护性蛋白质外壳,可以排斥吞噬细胞。相反,大多数死亡组织和外来颗粒没有保护性外壳,这使得它们容易被吞噬。
第三,身体的免疫系统(将在第35章讨论)会产生针对细菌等感染因子的抗体(antibodies)。然后抗体附着在细菌膜上,从而使细菌特别容易被吞噬。为此,抗体分子还与补体级联(complement cascade)的C3产物结合,这是下一章将讨论的免疫系统的另一个部分。C3分子反过来附着在吞噬细胞膜上的受体上,从而启动吞噬作用。这种选择病原体进行吞噬和破坏的过程称为调理作用(opsonization)。
中性粒细胞(neutrophils)的吞噬作用(phagocytosis)。进入组织的中性粒细胞已经是成熟的细胞,可以立即开始吞噬作用。当接近要被吞噬的颗粒时,中性粒细胞首先附着在颗粒上,然后在颗粒周围向各个方向伸出伪足(pseudopodia)。伪足在颗粒的另一侧相遇并融合。这一动作形成了一个封闭的腔室,其中包含了被吞噬的颗粒。然后,腔室内陷到细胞质腔内,并从外细胞膜脱离,在细胞质内形成一个自由漂浮的吞噬囊泡(phagocytic vesicle)(也称为吞噬体(phagosome))。一个中性粒细胞通常可以吞噬3到20个细菌,然后中性粒细胞就会失活并死亡。
图 34-3. 吞噬细胞(如巨噬细胞(macrophage))对病原体(如细菌)的吞噬作用。抗体覆盖在细菌上,使它们更容易被巨噬细胞吞噬,巨噬细胞将细菌吞入细胞内并形成吞噬体。然后溶酶体(lysosomes)附着在吞噬体上形成吞噬溶酶体(phagolysosome),消化入侵的病原体。吞噬细胞随后通过胞吐作用(exocytosis)释放消化后的产物。
巨噬细胞的吞噬作用。巨噬细胞是从血液进入组织的单核细胞(monocytes)的终末产物。当被免疫系统激活时(如第35章所述),它们比中性粒细胞具有更强的吞噬能力,通常能够吞噬多达100个细菌。它们还能够吞噬更大的颗粒,甚至是整个红细胞(RBCs),或者偶尔是疟原虫(malarial parasites),而中性粒细胞无法吞噬比细菌大得多的颗粒。此外,在消化颗粒后,巨噬细胞可以排出残留产物,并且通常可以存活并继续发挥功能数月之久。
一旦被吞噬,大多数颗粒会被细胞内酶消化。一旦外来颗粒被吞噬,中性粒细胞或巨噬细胞中的溶酶体和其他细胞质颗粒立即与吞噬囊泡接触,它们的膜融合,从而将许多消化酶和杀菌剂释放到囊泡中。因此,吞噬囊泡现在变成了消化囊泡,被吞噬的颗粒立即开始被消化。
中性粒细胞和巨噬细胞都含有大量的溶酶体,其中充满了专门用于消化细菌和其他外来蛋白质物质的蛋白水解酶(proteolytic enzymes)。巨噬细胞(但不是中性粒细胞)的溶酶体还含有大量的脂肪酶(lipases),可以消化某些细菌(如结核杆菌(tuberculosis bacillus))所拥有的厚脂膜。
中性粒细胞(neutrophils)和巨噬细胞(macrophages)能够杀死细菌。除了在吞噬体(phagosome)中消化被吞噬的细菌外,中性粒细胞和巨噬细胞还含有杀菌剂(bactericidal agents),即使溶酶体酶(lysosomal enzymes)无法消化细菌,这些杀菌剂也能杀死大多数细菌。这一特性尤为重要,因为某些细菌具有保护性外壳或其他因素,可以防止它们被消化酶破坏。杀菌作用主要来自吞噬体膜或称为过氧化物酶体(peroxisome)的特殊细胞器中酶形成的几种强氧化剂(oxidizing agents)。这些氧化剂包括大量的超氧化物(superoxide) \left(O2^-\right)、过氧化氢(hydrogen peroxide) (H2O2) 和氢氧根离子(hydroxyl ions) \left(OH^-\right),即使少量也能对大多数细菌致命。此外,溶酶体酶中的髓过氧化物酶(myeloperoxidase)催化 H2O2 和氯离子之间的反应,形成次氯酸盐(hypochlorite),其杀菌效果极强。
一些细菌,特别是结核杆菌(tuberculosis bacillus),具有抵抗溶酶体消化的外壳,并分泌部分抵抗中性粒细胞和巨噬细胞杀菌作用的物质。这些细菌是许多慢性疾病(如结核病)的罪魁祸首。
单核细胞-巨噬细胞系统(Monocyte-Macrophage Cell System)(网状内皮系统(Reticuloendothelial System))
在前几段中,我们主要将巨噬细胞描述为能够在组织中游走的移动细胞。然而,单核细胞进入组织并成为巨噬细胞后,另一大部分单核细胞会附着在组织上,并保持附着状态数月甚至数年,直到它们被召唤执行特定的局部保护功能。它们与移动巨噬细胞具有相同的能力,能够吞噬组织中的大量细菌、病毒、坏死组织或其他外来颗粒。此外,当受到适当刺激时,它们可以从附着处脱离,再次成为移动巨噬细胞,对趋化性(chemotaxis)和与炎症过程相关的其他刺激作出反应。因此,身体在几乎所有组织区域都有一个广泛的单核细胞-巨噬细胞系统。
单核细胞、移动巨噬细胞、固定组织巨噬细胞以及骨髓、脾脏和淋巴结中的一些特殊内皮细胞(endothelial cells)的总和称为网状内皮系统。然而,所有这些或几乎所有这些细胞都起源于单核细胞干细胞(monocytic stem cells);因此,网状内皮系统几乎与单核细胞-巨噬细胞系统同义。由于网状内皮系统这一术语在医学文献中比单核细胞-巨噬细胞系统更为人熟知,因此应将其视为位于所有组织中的广义吞噬系统(phagocytic system),特别是在需要大量颗粒、毒素和其他有害物质被破坏的组织区域。
图 34-4. 淋巴结的功能示意图。
皮肤和皮下组织中的组织巨噬细胞(histiocytes)
皮肤对感染因子基本上是难以渗透的,除非皮肤破损。当感染在皮下组织开始并引发局部炎症时,局部组织巨噬细胞可以在原位分裂并形成更多的巨噬细胞。然后,它们执行攻击和破坏感染因子的常规功能,如前所述。
淋巴结中的巨噬细胞
基本上,进入组织的颗粒物质,如细菌,不能直接通过毛细血管膜吸收进入血液。相反,如果这些颗粒在组织中未被局部破坏,它们会进入淋巴液并流向沿淋巴流动路径间歇分布的淋巴结。然后,这些外来颗粒会被困在这些淋巴结的窦状隙网中,窦状隙内衬有组织巨噬细胞。
图34-4展示了淋巴结的一般组织结构,显示淋巴通过传入淋巴管进入淋巴结囊,然后流经淋巴结髓质窦,最后通过门部进入传出淋巴管,最终排入静脉血。
大量巨噬细胞排列在淋巴窦中,如果有任何颗粒通过淋巴进入窦状隙,巨噬细胞会吞噬它们,防止其在全身扩散。
肺中的肺泡巨噬细胞
另一个入侵生物体经常进入身体的途径是通过肺部。大量组织巨噬细胞作为肺泡壁的组成部分存在。它们可以吞噬被困在肺泡中的颗粒。如果颗粒是可消化的,巨噬细胞还可以消化它们并将消化产物释放到淋巴中。如果颗粒不可消化,巨噬细胞通常会在颗粒周围形成一个巨细胞囊,直到它能够缓慢溶解(如果有的话)。这种囊经常在结核杆菌、硅尘颗粒甚至碳颗粒周围形成。
图34-5. 肝窦状隙内衬的Kupffer细胞,显示印度墨水颗粒被吞噬到Kupffer细胞的细胞质中。
肝窦状隙中的巨噬细胞(Kupffer细胞)
另一个细菌入侵身体的途径是通过胃肠道。来自摄入食物的大量细菌不断通过胃肠道黏膜进入门静脉血。在血液进入全身循环之前,它会通过肝窦状隙,这些窦状隙内衬有称为Kupffer细胞的组织巨噬细胞,如图34-5所示。这些细胞形成了一个如此有效的颗粒过滤系统,以至于几乎没有来自胃肠道的细菌从门静脉血进入全身循环。事实上,Kupffer细胞吞噬作用的视频显示,单个细菌的吞噬作用在不到0.01秒内完成。
脾脏和骨髓的巨噬细胞
如果入侵的生物体成功进入全身循环,组织巨噬细胞系统,尤其是脾脏和骨髓的巨噬细胞,将提供其他防御线。在这两种组织中,巨噬细胞被两个器官的网状结构所捕获,当外来颗粒与这些巨噬细胞接触时,它们会被吞噬。
图 34-6. 脾脏的功能结构。
脾脏与淋巴结相似,不同的是血液而非淋巴液流经脾脏的组织间隙。图34-6显示了脾脏组织的一个小外周部分。注意,一条小动脉从脾脏被膜穿透进入脾脏髓质,并终止于小毛细血管。这些毛细血管具有高度通透性,允许全血从毛细血管流出进入红髓索。血液随后逐渐通过这些索的小梁网状结构挤压,最终通过静脉窦的内皮壁返回循环。红髓索和静脉窦的小梁上排列着大量的巨噬细胞。血液通过红髓索的这种特殊通道提供了一种特殊的方式,用于吞噬血液中不需要的碎片,尤其是老化和异常的红细胞。
炎症:中性粒细胞和巨噬细胞的作用
炎症
当组织损伤发生时,无论是由于细菌、创伤、化学物质、热量还是其他现象,受损组织会释放多种物质,导致周围未受损组织发生显著的继发性变化。这一系列复杂的组织变化称为炎症。
炎症的特征包括:(1) 局部血管扩张,导致局部血流增加;(2) 毛细血管通透性增加,允许大量液体渗入间质间隙;(3) 由于毛细血管渗出的纤维蛋白原和其他蛋白质增加,间质间隙中的液体常常凝固;(4) 大量粒细胞和单核细胞迁移到组织中;(5) 组织细胞肿胀。引起这些反应的许多组织产物包括组胺、缓激肽、血清素、前列腺素、补体系统的几种不同反应产物(在第35章中描述)、血液凝固系统的反应产物,以及由致敏T细胞(免疫系统的一部分;也在第35章中讨论)释放的多种称为淋巴因子的物质。其中一些物质强烈激活巨噬细胞系统,几小时内,巨噬细胞开始吞噬受损组织。然而,有时巨噬细胞也可能进一步损伤仍然存活的组织细胞。
炎症的隔离效应。炎症的最早结果之一是将损伤区域与其余组织隔离开来。炎症区域的间质间隙和淋巴管被纤维蛋白原凝块阻塞,因此一段时间后,液体几乎无法通过这些间隙。这种隔离过程延缓了细菌或有毒产物的扩散。
炎症过程的强度通常与组织损伤的程度成正比。例如,当Staphylococci(葡萄球菌)侵入组织时,它们会释放出极具杀伤力的细胞毒素。结果,炎症迅速发展——实际上,比Staphylococci繁殖和传播的速度要快得多。因此,局部Staphylococcal感染通常会被迅速隔离,并防止其扩散到全身。相比之下,Streptococci(链球菌)不会引起如此强烈的局部组织破坏。因此,隔离过程在数小时内缓慢发展,而许多Streptococci在此期间繁殖和迁移。结果,Streptococci往往比Staphylococci更容易扩散到全身并导致死亡,尽管Staphylococci对组织的破坏性要大得多。
炎症期间的巨噬细胞和中性粒细胞反应
组织巨噬细胞提供第一道防线。在炎症开始后的几分钟内,组织中已经存在的巨噬细胞,无论是皮下组织中的组织细胞、肺中的肺泡巨噬细胞、脑中的小胶质细胞,还是其他类型的巨噬细胞,都会立即开始其吞噬作用。当被感染和炎症产物激活时,这些细胞的第一个反应是迅速增大。接着,许多原本固定的巨噬细胞会从附着处脱离并变得可移动,形成在最初一小时内对抗感染的第一道防线。这些早期动员的巨噬细胞数量通常不多,但它们具有救命的作用。
中性粒细胞侵入炎症区域是第二道防线。在炎症开始后的最初一小时内,大量中性粒细胞开始从血液中侵入炎症区域。这种侵入是由炎症细胞因子(如肿瘤坏死因子和白细胞介素-1)以及炎症组织产生的其他生化产物引发的,这些物质启动了以下反应:
图 34-7. 中性粒细胞从血液迁移到炎症组织中。炎症组织的细胞因子和其他生化产物导致内皮细胞表面选择素和细胞间粘附分子-1(ICAM-1)的表达增加。这些粘附分子与中性粒细胞上的互补分子或受体结合,使其粘附在毛细血管或小静脉壁上。随后,中性粒细胞通过血管壁的渗出或外渗迁移到组织损伤部位。
- 它们导致毛细血管和小静脉内皮细胞表面粘附分子(如选择素和细胞间粘附分子-1(ICAM-1))的表达增加。这些粘附分子与中性粒细胞上的互补整合素分子反应,使中性粒细胞粘附在炎症区域的毛细血管和小静脉壁上。这种效应称为边缘化(margination),如图34-2所示,并在图34-7中更详细地展示。
- 它们还导致毛细血管和小静脉内皮细胞之间的细胞间连接松动,形成足够大的开口,使中性粒细胞能够通过毛细血管的渗出进入组织间隙。
- 如前所述,它们随后引起中性粒细胞(neutrophils)向受损组织的趋化作用(chemotaxis)。中性粒细胞(或其他物质和细胞,如单核细胞(monocytes))通过毛细血管(capillaries)转移到周围组织的整个过程称为外渗(extravasation);血细胞通过完整的毛细血管壁的特定通道称为血细胞渗出(diapedesis),尽管在讨论血细胞通过毛细血管进入组织的运动时,这个术语经常与外渗互换使用。
因此,在组织损伤开始后的几个小时内,该区域就会得到充分的中性粒细胞供应。由于血液中的中性粒细胞已经是成熟细胞,它们可以立即开始其清除功能,杀死细菌并清除异物。
血液中中性粒细胞数量的急性增加——中性粒细胞增多症(Neutrophilia)。此外,在急性严重炎症发作后的几个小时内,血液中的中性粒细胞数量有时会增加四到五倍——从正常的4,000到5,000增加到15,000到25,000个中性粒细胞/微升。这被称为中性粒细胞增多症,意味着血液中中性粒细胞数量的增加。中性粒细胞增多症是由进入血液的炎症产物引起的,这些产物被运输到骨髓(bone marrow),并在那里作用于骨髓中储存的中性粒细胞,将其动员到循环血液中。这使得更多的中性粒细胞可用于炎症组织区域。
巨噬细胞(macrophages)第二次侵入炎症组织是第三道防线。随着中性粒细胞的侵入,血液中的单核细胞进入炎症组织并增大成为巨噬细胞。然而,循环血液中的单核细胞数量较少。此外,骨髓中单核细胞的储存池远少于中性粒细胞。因此,炎症组织区域中巨噬细胞的积累比中性粒细胞慢得多,需要几天时间才能生效。此外,即使在侵入炎症组织后,单核细胞仍然是未成熟的细胞,需要8小时或更长时间才能膨胀到更大的尺寸并产生大量的溶酶体(lysosomes)。只有这样,它们才能获得组织巨噬细胞的完全吞噬能力(phagocytosis)。在几天到几周后,巨噬细胞最终会主导炎症区域的吞噬细胞,因为骨髓中新单核细胞的产生大大增加,如下所述。
如前所述,巨噬细胞可以吞噬比中性粒细胞多得多的细菌(大约五倍)和更大的颗粒,甚至包括中性粒细胞和大量的坏死组织。此外,巨噬细胞在启动抗体(antibodies)发育中起着重要作用,如第35章所述。
图 34-8. 炎症组织中激活的巨噬细胞释放的多种生长因子对骨髓粒细胞和单核-巨噬细胞产生的控制。GCSF,粒细胞集落刺激因子(Granulocyte colony-stimulating factor);GM-CSF,粒细胞-单核细胞集落刺激因子(granulocytemonocyte colony-stimulating factor);IL-1,白细胞介素-1(interleukin-1);M-CSF,单核细胞集落刺激因子(monocyte colony-stimulating factor);TNF,肿瘤坏死因子(tumor necrosis factor)。
骨髓增加粒细胞和单核细胞的产生是第四道防线。第四道防线是骨髓大大增加粒细胞和单核细胞的产生。这一作用是由于骨髓中粒细胞和单核细胞祖细胞(progenitor cells)的刺激所致。然而,新形成的粒细胞和单核细胞需要3到4天才能达到离开骨髓的阶段。如果来自发炎组织的刺激持续存在,骨髓可以继续大量产生这些细胞,持续数月甚至数年,有时速度是正常的20到50倍。
巨噬细胞和中性粒细胞反应的反馈控制
尽管有超过二十种因子被认为与巨噬细胞对炎症反应的控制有关,但其中五种被认为起主导作用。它们如图34-8所示,包括以下内容:(1)肿瘤坏死因子(TNF);(2)白细胞介素-1(IL-1);(3)粒细胞-单核细胞集落刺激因子(GM-CSF);(4)粒细胞集落刺激因子(G-CSF);(5)单核细胞集落刺激因子(MCSF)。这些因子由发炎组织中的活化巨噬细胞形成,其他发炎组织细胞也少量形成。
骨髓增加粒细胞和单核细胞产生的原因主要是三种集落刺激因子;其中一种,GM-CSF,刺激粒细胞和单核细胞的产生;另外两种,G-CSF和M-CSF,分别刺激粒细胞和单核细胞的产生。TNF、IL-1和集落刺激因子的这种组合提供了一个强大的反馈机制,从组织炎症开始,进而形成大量防御性白细胞,帮助消除炎症的原因。
脓液的形成
当中性粒细胞和巨噬细胞吞噬大量细菌和坏死组织时,基本上所有的中性粒细胞和许多(如果不是大多数)巨噬细胞最终都会死亡。几天后,发炎组织中通常会形成一个腔。这个腔包含不同比例的坏死组织、死亡的中性粒细胞、死亡的巨噬细胞和组织液。这种混合物通常被称为脓液。在感染被抑制后,脓液中的死亡细胞和坏死组织在几天内逐渐自溶,最终产物最终被周围组织和淋巴吸收,直到大部分组织损伤的证据消失。
嗜酸性粒细胞
嗜酸性粒细胞通常占所有血白细胞的大约2%。嗜酸性粒细胞是弱吞噬细胞(phagocytes),它们表现出趋化性(chemotaxis),但与中性粒细胞相比,嗜酸性粒细胞在保护免受常见类型感染方面的重要性值得怀疑。
然而,嗜酸性粒细胞在寄生虫感染的人中经常大量产生,并且它们迁移到被寄生虫感染的病变组织中。尽管大多数寄生虫太大,无法被嗜酸性粒细胞或任何其他吞噬细胞吞噬,但嗜酸性粒细胞通过特殊的表面分子附着在寄生虫上,并释放杀死许多寄生虫的物质。例如,最广泛的感染之一是血吸虫病(schistosomiasis),这是一种在非洲、亚洲和南美洲一些发展中国家多达三分之一人口中发现的寄生虫感染。据估计,全球85%到90%的血吸虫病病例在非洲。
血吸虫(parasitic worms)可以侵入身体的任何部位。嗜酸性粒细胞(eosinophils)会附着在寄生虫的幼体上并杀死其中的许多个体。它们通过以下几种方式实现这一目标:(1) 从颗粒中释放水解酶(hydrolytic enzymes),这些颗粒是经过修饰的溶酶体(lysosomes);(2) 可能还通过释放对寄生虫特别致命的高活性氧形式;(3) 从颗粒中释放一种对幼虫具有高度杀伤力的多肽,称为主要碱性蛋白(major basic protein)。
在世界上的少数地区,另一种引起嗜酸性粒细胞增多症(eosinophilia)的寄生虫病是旋毛虫病(trichinosis)。这种疾病是由于人体食用了未煮熟的感染猪肉后,旋毛虫(Trichinella)寄生虫(猪肉蠕虫)侵入人体肌肉所致。
嗜酸性粒细胞还具有在发生过敏反应的组织中聚集的特殊倾向,例如哮喘患者的肺支气管周围组织以及皮肤过敏反应后的皮肤中。这种作用至少部分是由于许多肥大细胞(mast cells)和嗜碱性粒细胞(basophils)参与了过敏反应,如下一段所述。肥大细胞和嗜碱性粒细胞释放一种嗜酸性粒细胞趋化因子(eosinophil chemotactic factor),使嗜酸性粒细胞向发炎的过敏组织迁移。嗜酸性粒细胞被认为可以解毒肥大细胞和嗜碱性粒细胞释放的一些炎症诱导物质,并且可能还会吞噬和破坏过敏原-抗体复合物(allergen-antibody complexes),从而防止局部炎症过程的过度扩散。
嗜碱性粒细胞(BASOPHILS)
循环血液中的嗜碱性粒细胞与位于许多毛细血管外的大组织肥大细胞相似。肥大细胞和嗜碱性粒细胞都会向血液中释放肝素(heparin)。肝素是一种可以防止血液凝固的物质。
肥大细胞和嗜碱性粒细胞还释放组胺(histamine),以及少量的缓激肽(bradykinin)和血清素(serotonin)。在炎症期间,主要是发炎组织中的肥大细胞释放这些物质。
肥大细胞和嗜碱性粒细胞在某些类型的过敏反应中起着重要作用,因为引起过敏反应的抗体类型——免疫球蛋白E(immunoglobulin E, IgE)——具有附着在肥大细胞和嗜碱性粒细胞上的特殊倾向。然后,当特定IgE抗体的特异性抗原与抗体反应时,抗原与抗体的结合会导致肥大细胞或嗜碱性粒细胞释放更多的组胺、缓激肽、血清素、肝素、过敏性慢反应物质(slow-reacting substance of anaphylaxis)(三种白三烯(leukotrienes)的混合物)以及几种溶酶体酶(lysosomal enzymes)。这些物质引起局部血管和组织反应,介导了许多(如果不是大多数)过敏表现。这些反应将在第35章中更详细地讨论。
白细胞减少症(LEUKOPENIA)
一种称为白细胞减少症(leukopenia)的临床状况偶尔会发生,在这种情况下,骨髓产生的白细胞(WBCs)非常少。这种状况使身体对许多细菌和其他可能侵入组织的病原体失去了保护。
正常情况下,人体与许多细菌共生(symbiosis),因为身体的黏膜(mucous membranes)不断暴露于大量细菌中。口腔几乎总是含有各种螺旋体(spirochetal)、肺炎球菌(pneumococcal)和链球菌(streptococcal)细菌,这些细菌在整个呼吸道中的存在程度较低。远端胃肠道(distal gastrointestinal tract)尤其富含大肠杆菌(colon bacilli)。此外,眼睛、尿道和阴道的表面也总能发现细菌。白细胞(WBCs)数量的任何减少都会立即导致已经存在的细菌侵入邻近组织。
在骨髓停止产生白细胞后的2天内,口腔和结肠可能会出现溃疡,或者可能发生某种形式的严重呼吸道感染。来自溃疡的细菌迅速侵入周围组织和血液。如果不进行治疗,通常在急性全白细胞减少症(acute total leukopenia)开始后不到1周内就会死亡。
身体受到X射线或γ射线的照射,或接触含有苯(benzene)或蒽(anthracene)核的药物和化学物质,可能会导致骨髓再生障碍(aplasia of the bone marrow)。一些常见药物如氯霉素(chloramphenicol)(一种抗生素)、硫氧嘧啶(thiouracil)(用于治疗甲状腺毒症(thyrotoxicosis)),甚至各种巴比妥类催眠药(barbiturate hypnotics)在极少数情况下也会引起白细胞减少症(leukopenia),从而引发这种疾病的整个感染序列。
在骨髓受到中度辐射损伤后,一些干细胞(stem cells)、成髓细胞(myeloblasts)和造血细胞(hemocytoblasts)可能仍然存在于骨髓中,并且能够在有足够时间的情况下再生骨髓。经过适当输血、抗生素和其他药物以防止感染的患者,通常在数周至数月内产生足够的新骨髓,使血细胞浓度恢复正常。
白血病(LEUKEMIAS)
白细胞的不受控制的生产可能是由髓源性(myelogenous)或淋巴源性(lymphogenous)细胞的癌性突变(cancerous mutation)引起的。这一过程导致白血病(leukemia),通常表现为循环血液中异常白细胞数量的大幅增加。
白血病有两种主要类型:淋巴细胞性(lymphocytic)和髓源性(myelogenous)。淋巴细胞性白血病是由淋巴样细胞(lymphoid cells)的癌性生产引起的,通常始于淋巴结或其他淋巴组织,并扩散到身体的其他部位。第二种类型的白血病,髓源性白血病,始于骨髓中年轻髓源性细胞的癌性生产,然后扩散到全身,以至于在许多髓外组织(extramedullary tissues)中产生白细胞——尤其是在淋巴结、脾脏和肝脏中。
在髓源性白血病中,癌性过程偶尔会产生部分分化的细胞,导致所谓的嗜中性粒细胞性白血病(neutrophilic leukemia)、嗜酸性粒细胞性白血病(eosinophilic leukemia)、嗜碱性粒细胞性白血病(basophilic leukemia)或单核细胞性白血病(monocytic leukemia)。然而,更常见的是,白血病细胞是奇异且未分化的,与任何正常白细胞都不相同。通常,细胞分化程度越低,白血病越急性,如果不治疗,通常会在几个月内导致死亡。对于一些分化程度较高的细胞,这一过程可能是慢性的,有时会缓慢发展10到20年。白血病细胞,尤其是非常未分化的细胞,通常无法提供正常的抗感染保护功能。
白血病对身体的影响
白血病(leukemia)的第一个影响是白血病细胞在身体异常区域的转移性生长(metastatic growth)。来自骨髓(bone marrow)的白血病细胞可能会大量繁殖,以至于侵入周围的骨骼,引起疼痛,并最终导致骨骼容易骨折。
几乎所有白血病最终都会扩散到脾脏(spleen)、淋巴结(lymph nodes)、肝脏(liver)和其他血管区域,无论白血病是起源于骨髓还是淋巴结。白血病的常见影响包括感染的发展、严重的贫血(anemia)以及由血小板减少症(thrombocytopenia)引起的出血倾向。这些影响主要是由于非功能性的白血病细胞取代了正常的骨髓和淋巴样细胞(lymphoid cells)。
最后,白血病对身体的一个重要影响是不断增长的癌细胞过度消耗代谢底物(metabolic substrates)。白血病组织以极快的速度繁殖新细胞,以至于对身体的食物储备、特定氨基酸(amino acids)和维生素(vitamins)产生了巨大的需求。因此,患者的能量大大耗尽,白血病细胞过度利用氨基酸导致身体正常蛋白质组织的快速恶化。因此,当白血病组织生长时,其他组织变得虚弱。在代谢饥饿持续足够长时间后,仅此因素就足以导致死亡。
身体对感染的抵抗:II. 免疫(Immunity)与过敏(Allergy)
人体有能力抵抗几乎所有类型的生物体或毒素(toxins),这些生物体或毒素往往会损害组织和器官。这种能力被称为免疫(immunity)。大部分免疫是获得性免疫(acquired immunity),这种免疫直到身体首次受到细菌、病毒或毒素攻击后才会发展;通常需要数周或数月的时间才能形成免疫。另一种免疫成分是由一般过程而非针对特定病原体的过程产生的,称为先天免疫(innate immunity),包括以下方面:
- 白细胞(white blood cells)和组织巨噬细胞系统(tissue macrophage system)的细胞对细菌和其他入侵者的吞噬作用(phagocytosis),如第34章所述
- 胃酸分泌物和消化酶对吞咽的生物体的破坏
- 皮肤对生物体入侵的抵抗
- 血液中存在某些化学物质和细胞,它们附着在外来生物体或毒素上并破坏它们。其中一些包括:(1) 溶菌酶(lysozyme),一种能够攻击细菌并使其溶解的粘多糖(mucolytic polysaccharide);(2) 碱性多肽(basic polypeptides),它们与某些类型的革兰氏阳性菌(gram-positive bacteria)反应并使其失活;(3) 补体复合物(complement complex),稍后描述,这是一个由约20种蛋白质组成的系统,可以通过多种方式激活以破坏细菌;(4) 自然杀伤淋巴细胞(natural killer lymphocytes),它们能够识别并破坏外来细胞、肿瘤细胞甚至一些受感染的细胞。
这种先天免疫使人体对某些疾病具有抵抗力,例如动物的某些麻痹性病毒感染、猪瘟(hog cholera)、牛瘟(cattle plague)和犬瘟热(distemper)——一种导致大量感染犬只死亡的病毒性疾病。同样,许多动物对人类许多疾病具有抵抗力甚至免疫力,例如脊髓灰质炎(poliomyelitis)、腮腺炎(mumps)、人类霍乱(human cholera)、麻疹(measles)和梅毒(syphilis),这些疾病对人类非常有害甚至致命。
获得性(适应性)免疫(ACQUIRED (ADAPTIVE) IMMUNITY)
除了其广泛的先天免疫(innate immunity)外,人体还具有针对个别入侵因子(如致命细菌、病毒、毒素,甚至来自其他动物的异体组织)发展出极其强大的特异性免疫(specific immunity)的能力。这种能力被称为获得性免疫(acquired immunity)或适应性免疫(adaptive immunity)。获得性免疫是由一种特殊的免疫系统引起的,该系统形成抗体和/或活化的淋巴细胞(activated lymphocytes),攻击并摧毁特定的入侵生物或毒素。
获得性免疫通常可以提供极高程度的保护。例如,某些毒素,如麻痹性肉毒杆菌毒素或破伤风的破伤风毒素,可以在没有免疫的情况下致死剂量的10万倍剂量下得到保护。正是由于这个原因,被称为免疫接种(immunization)的治疗过程在保护人们免受疾病和毒素侵害方面如此重要,本章后面将对此进行解释。
获得性免疫的基本类型——体液免疫和细胞介导免疫
体内存在两种基本但密切相关的获得性免疫类型。其中一种,身体会产生循环抗体(circulating antibodies),这些抗体是血浆中的球蛋白分子,能够攻击入侵因子。这种类型的免疫被称为体液免疫(humoral immunity)或B细胞免疫(B-cell immunity),因为B淋巴细胞(B lymphocytes)产生抗体。第二种获得性免疫是通过形成大量活化的T淋巴细胞(activated T lymphocytes)来实现的,这些淋巴细胞在淋巴结中专门设计用于摧毁外来因子。这种类型的免疫被称为细胞介导免疫(cell-mediated immunity)或T细胞免疫(T-cell immunity),因为活化的淋巴细胞是T淋巴细胞(T lymphocytes)。抗体和活化的淋巴细胞都是在身体的淋巴组织中形成的。
两种获得性免疫都是由抗原引发的
由于获得性免疫只有在被外来生物或毒素入侵后才会发展,因此很明显,身体必须有一些机制来识别这种入侵。每种毒素或生物几乎总是含有一种或多种特定的化学化合物,这些化合物在其组成中与其他所有化合物不同。通常,这些是蛋白质或大分子多糖,它们引发获得性免疫;这些物质被称为抗原(antigens)(抗体生成物(antibody generators))。
要使一种物质具有抗原性(antigenic),它通常必须具有8000或更高的分子量。此外,抗原性(antigenicity)的过程通常依赖于大分子表面上的规则重复分子基团,称为表位(epitopes)。这一因素也解释了为什么蛋白质和大分子多糖几乎总是具有抗原性,因为这两种物质都具有这种立体化学特性。
淋巴细胞负责获得性免疫
获得性免疫是身体淋巴细胞的产物。在那些遗传上缺乏淋巴细胞或淋巴细胞被辐射或化学物质破坏的人中,无法发展出获得性免疫。在出生后的几天内,除非采取极端措施进行治疗,否则这样的人会死于暴发性细菌感染。因此,很明显,淋巴细胞对人类生存至关重要。
淋巴细胞(lymphocytes)最广泛地分布在淋巴结(lymph nodes)中,但也存在于特殊的淋巴组织(lymphoid tissues)中,如脾脏(spleen)、胃肠道(gastrointestinal tract)的黏膜下层(submucosal areas)、胸腺(thymus)和骨髓(bone marrow)。淋巴组织在体内的分布有利于在入侵生物体或毒素扩散得太广之前拦截它们。
在大多数情况下,入侵物质首先进入组织液(tissue fluids),然后通过淋巴管(lymph vessels)被带到淋巴结或其他淋巴组织。例如,胃肠道壁的淋巴组织会立即暴露于从肠道入侵的抗原(antigens)。喉咙和咽部(pharynx)的淋巴组织(包括扁桃体(tonsils)和腺样体(adenoids))位于有利位置,可以拦截通过上呼吸道(upper respiratory tract)进入的抗原。淋巴结中的淋巴组织暴露于入侵身体外周组织(peripheral tissues)的抗原,而脾脏、胸腺和骨髓的淋巴组织则专门负责拦截成功进入循环血液(circulating blood)的抗原物质。
T淋巴细胞和B淋巴细胞分别促进细胞介导免疫(cell-mediated immunity)和体液免疫(humoral immunity)。尽管在显微镜下观察时,正常淋巴组织中的大多数淋巴细胞看起来相似,但这些细胞明显分为两大类群。其中一类是T淋巴细胞,负责形成提供细胞介导免疫的活化淋巴细胞(activated lymphocytes);另一类是B淋巴细胞,负责形成提供体液免疫的抗体(antibodies)。
这两种类型的淋巴细胞最初在胚胎(embryo)中来源于多能造血干细胞(multipotent hematopoietic stem cells),这些干细胞在分化过程中形成共同的淋巴祖细胞(common lymphoid progenitor cells)作为其最重要的后代之一。几乎所有形成的淋巴细胞最终都会进入淋巴组织,但在进入之前,它们会通过以下方式进一步分化或预处理。
最终注定形成活化T淋巴细胞的淋巴祖细胞首先迁移到胸腺(thymus gland)并在其中进行预处理;因此,它们被称为T淋巴细胞,以表明胸腺的作用。它们负责细胞介导免疫。
另一类淋巴细胞——注定形成抗体的B淋巴细胞——在胎儿中期(fetal life)在肝脏(liver)中进行预处理,在胎儿晚期和出生后在骨髓中进行预处理。这类细胞最初在鸟类中被发现,鸟类有一个特殊的预处理器官,称为法氏囊(bursa of Fabricius)。因此,这些淋巴细胞被称为B淋巴细胞,以表明法氏囊的作用,它们负责体液免疫。图35-1显示了分别形成(1)活化T淋巴细胞和(2)抗体的两种淋巴细胞系统。
图35-1. 淋巴结响应抗原形成抗体和致敏淋巴细胞的过程。该图还显示了胸腺(T)和法氏囊(B)淋巴细胞的起源,它们分别负责细胞介导和体液免疫过程。
T淋巴细胞和B淋巴细胞的预处理
尽管体内所有的淋巴细胞都起源于胚胎中定向分化为淋巴细胞的干细胞,但这些干细胞无法直接形成激活的T淋巴细胞或抗体。在它们能够做到这一点之前,它们必须在适当的处理区域进一步分化,如下所述。
胸腺预处理T淋巴细胞。T淋巴细胞在骨髓中起源后,首先迁移到胸腺。在这里,它们迅速分裂,同时发展出对不同的特定抗原反应的极端多样性。也就是说,一个胸腺淋巴细胞对一种抗原发展出特异性反应,而下一个淋巴细胞则对另一种抗原发展出特异性。这个过程持续进行,直到有成千上万种不同类型的胸腺淋巴细胞,它们对成千上万种不同的抗原有特异性反应。这些不同类型的预处理T淋巴细胞现在离开胸腺,并通过血液遍布全身,定居在全身的淋巴组织中。
胸腺还确保任何离开胸腺的T淋巴细胞不会对体内自身组织中的蛋白质或其他抗原产生反应;否则,T淋巴细胞在几天内就会对人体自身组织产生致命影响。胸腺通过首先将这些T淋巴细胞与体内自身组织中的几乎所有特异性自身抗原混合来选择哪些T淋巴细胞将被释放。如果一个T淋巴细胞发生反应,它会被破坏并被吞噬,而不是被释放,这种情况发生在高达90%的细胞中。因此,最终被释放的细胞是那些对体内自身抗原无反应的细胞——它们只对外部来源的抗原产生反应,例如来自细菌、毒素,甚至来自另一个人的移植组织。
胸腺中T淋巴细胞的大部分预处理发生在婴儿出生前不久以及出生后的几个月内。超过这个时期,胸腺的移除会削弱(但不会消除)T淋巴细胞免疫系统。然而,在出生前几个月移除胸腺可以阻止所有细胞介导的免疫的发展,包括对移植器官的排斥。
肝脏和骨髓预处理B淋巴细胞。在人类中,B淋巴细胞在胎儿中期在肝脏中预处理,在胎儿晚期和出生后在骨髓中预处理。B淋巴细胞与T淋巴细胞在两个方面有所不同:
- 与T淋巴细胞整个细胞对抗原产生反应不同,B淋巴细胞主动分泌抗体作为反应剂。这些抗体是能够与抗原物质结合并破坏它们的大蛋白质,这在本章和第34章中有详细解释。
- B淋巴细胞比T淋巴细胞具有更大的多样性,从而形成数百万种具有不同特异性反应的B淋巴细胞抗体。预处理后,B淋巴细胞像T淋巴细胞一样迁移到全身的淋巴组织中,它们定居在T淋巴细胞区域附近但稍微远离的地方。
T淋巴细胞和B淋巴细胞抗体对抗特定抗原——淋巴细胞克隆的作用
当特定抗原与淋巴组织中的T淋巴细胞和B淋巴细胞接触时,部分T淋巴细胞被激活形成激活的T细胞,部分B淋巴细胞被激活形成抗体(antibodies)。激活的T细胞和抗体反过来对引发它们发育的特定类型抗原具有高度特异性反应。接下来将描述这种特异性的机制。
淋巴组织中储存着数百万种特异性淋巴细胞
如前所述,淋巴组织中储存着数百万种不同类型的预形成的B淋巴细胞和T淋巴细胞,它们能够形成高度特异性的抗体或T细胞。这些预形成的淋巴细胞中的每一种都只能形成一种具有单一特异性的抗体或T细胞,并且只有特定类型的抗原才能激活它。一旦特定淋巴细胞被其抗原激活,它就会大量繁殖,形成大量的重复淋巴细胞(图35-2)。如果是B淋巴细胞,其后代最终会分泌特定类型的抗体,然后这些抗体在全身循环。如果是T淋巴细胞,其后代是特异性致敏的T细胞,它们被释放到淋巴中,被带到血液中,然后通过所有组织液循环并返回淋巴,有时在这种循环中反复循环数月或数年。
所有能够形成一种特异性抗体或T细胞的不同淋巴细胞被称为一个淋巴细胞克隆(clone of lymphocytes)。也就是说,每个克隆中的淋巴细胞都是相似的,最初来源于一个或几个特定类型的早期淋巴细胞。
许多淋巴细胞克隆的起源
只有几百到几千个基因编码数百万种不同类型的抗体和T淋巴细胞。起初,人们无法理解如此少的基因如何能够编码淋巴组织产生的数百万种不同特异性的抗体或T细胞。这个谜团现在已经解开了。
形成每种类型T细胞或B细胞的完整基因从未存在于形成功能性免疫细胞的原始干细胞中。相反,只有基因片段——实际上有数百个这样的片段——但没有完整的基因。在相应的T细胞和B细胞淋巴细胞的预处理过程中,这些基因片段以随机组合的方式相互混合,最终形成完整的基因。
图35-2. 抗原只激活那些具有互补并能识别特定抗原的细胞表面受体的淋巴细胞。存在数百万种不同的淋巴细胞克隆(显示为B1,B2,和B3)。当淋巴细胞克隆(本例中为B2)被其抗原激活时,它会繁殖形成大量重复的淋巴细胞,然后这些淋巴细胞分泌抗体。
由于存在数百种基因片段,以及这些片段在单个细胞中可以排列的数百万种不同组合,我们可以理解可能出现的数百万种不同细胞基因类型。对于最终形成的每个功能性T或B淋巴细胞(lymphocyte),其基因结构仅编码单一抗原特异性(antigen specificity)。这些成熟细胞随后成为高度特异性的T和B细胞,扩散并定居于淋巴组织(lymphoid tissue)中。
激活淋巴细胞克隆的机制
每个淋巴细胞克隆(lymphocyte clone)仅对单一类型的抗原(antigen)(或几种具有几乎完全相同立体化学特性的相似抗原)有反应。原因如下。对于B淋巴细胞(B lymphocyte),每个细胞的表面膜上约有100,000个抗体分子(antibody molecule),这些抗体分子仅与一种类型的抗原高度特异性反应。因此,当适当的抗原出现时,它会立即附着在细胞膜上的抗体上;这导致了激活过程,随后将更详细地描述。对于T淋巴细胞(T lymphocyte),类似于抗体的分子,称为表面受体蛋白(surface receptor protein)(或T细胞受体(T-cell receptor)),位于T细胞膜的表面,这些受体也对一种特定的激活抗原高度特异。因此,抗原仅刺激那些具有互补受体并已经准备好对其作出反应的细胞。
巨噬细胞(macrophage)在激活过程中的作用。除了淋巴组织中的淋巴细胞外,同一组织中还存在数百万个巨噬细胞。这些巨噬细胞排列在淋巴结(lymph node)、脾脏(spleen)和其他淋巴组织的窦状隙(sinusoid)中,并与许多淋巴结淋巴细胞紧密相邻。大多数入侵的微生物首先被巨噬细胞吞噬(phagocytize)并部分消化,抗原产物被释放到巨噬细胞的细胞质(cytosol)中。然后,巨噬细胞通过细胞间接触将这些抗原直接传递给淋巴细胞,从而导致特定淋巴细胞克隆的激活。此外,巨噬细胞还分泌一种特殊的激活物质——白细胞介素-1(interleukin-1),促进特定淋巴细胞的进一步生长和繁殖。
T细胞在B淋巴细胞激活中的作用。大多数抗原同时激活T淋巴细胞和B淋巴细胞。形成的一些T细胞,称为辅助性T细胞(T-helper cell),分泌特定的物质(统称为淋巴因子(lymphokine)),激活特定的B淋巴细胞。事实上,如果没有这些辅助性T细胞的帮助,B淋巴细胞形成的抗体数量通常很少。我们将在描述T细胞免疫系统的机制后讨论辅助性T细胞和B细胞之间的这种合作关系。
B淋巴细胞系统的特定属性——体液免疫(humoral immunity)和抗体
浆细胞(plasma cell)的抗体形成。在暴露于特定抗原之前,B淋巴细胞克隆在淋巴组织中保持休眠状态。当外来抗原进入时,淋巴组织中的巨噬细胞吞噬抗原并将其呈递给相邻的B淋巴细胞。同时,抗原也被呈递给T细胞,并形成激活的辅助性T细胞。这些辅助性T细胞也有助于B淋巴细胞的极度激活,如后所述。
特异性针对抗原的B淋巴细胞(lymphocytes)立即增大并呈现淋巴母细胞(lymphoblasts)的外观。
一些淋巴母细胞进一步分化形成浆母细胞(plasmablasts),这是浆细胞(plasma cells)的前体。在浆母细胞中,细胞质(cytoplasm)扩张,粗面内质网(rough endoplasmic reticulum)大量增殖。然后,浆母细胞开始以大约每10小时一次的速度分裂,大约分裂9次,在4天内每个原始浆母细胞产生约500个细胞。成熟的浆细胞然后以极快的速度产生γ球蛋白抗体(gamma globulin antibodies)——每个浆细胞每秒约2000个分子。接着,抗体被分泌到淋巴中并输送到循环血液中。这个过程持续数天或数周,直到最终浆细胞耗尽并死亡。
记忆细胞(memory cells)的形成增强了对抗原再次暴露的抗体反应。由B淋巴细胞克隆(clone)激活形成的少数淋巴母细胞不会继续形成浆细胞,而是形成中等数量的新B淋巴细胞,类似于原始克隆的B淋巴细胞。换句话说,特异性激活的克隆的B细胞群大大增强,新的B淋巴细胞被添加到同一克隆的原始淋巴细胞中。它们还循环到全身,定居在所有淋巴组织中;然而,在免疫学上,它们保持休眠状态,直到再次被相同抗原的新数量激活。这些淋巴细胞被称为记忆细胞。随后再次暴露于相同抗原将导致更快、更强的抗体反应,因为记忆细胞的数量远远多于特定克隆的原始B淋巴细胞。
图35-3显示了首次暴露于特定抗原时形成抗体的初次反应(primary response)与再次暴露于相同抗原时的二次反应(secondary response)之间的差异。注意初次反应出现有1周的延迟,其效力较弱,且持续时间较短。相比之下,二次反应在暴露于抗原后迅速开始(通常在几小时内),效力更强,并且形成抗体的时间长达数月,而不仅仅是几周。二次反应的效力和持续时间增加解释了为什么免疫通常通过多次注射抗原来实现,注射间隔时间为数周或数月。
图35-3. 循环血液中对抗原初次注射和数周后二次注射的抗体反应时间过程。
通过浆细胞(plasma cells)产生终身免疫
当初始B淋巴细胞(naïve B lymphocytes)遇到其相关抗原(antigens)时,它们会被激活并经历克隆扩增(clonal expansion),随后分化为短寿命或长寿命的浆细胞(plasma cells),这些细胞能够产生大量抗体(antibodies)。短寿命浆细胞提供快速保护,但在几天的高强度抗体分泌后会经历凋亡(apoptosis)。然而,长寿命浆细胞存在于骨髓(bone marrow)和肠道相关淋巴组织(gut-associated lymphoid tissue)等组织中,能够持续多年产生抗体,从而提供对麻疹(measles)和天花(smallpox)等传染病的终身免疫。例如,在70年前接种过天花疫苗的受试者血液中检测到了高滴度的天花特异性抗体。此外,1918年H1N1流感病毒大流行的老年幸存者在感染90年后仍具有高效的中和该病毒的抗体。因此,产生病毒中和抗体的浆细胞可以在暴露后持续数十年,甚至在人类生命的第十个十年中仍然存在。
抗体的性质
抗体(antibodies)是一种称为免疫球蛋白(immunoglobulins, Igs)的γ球蛋白(gamma globulins),其分子量在160,000至970,000之间,约占所有血浆蛋白(plasma proteins)的20%。所有免疫球蛋白都由轻链(light polypeptide chains)和重链(heavy polypeptide chains)的组合构成。大多数免疫球蛋白由两条轻链和两条重链组成,如图35-4所示。然而,一些免疫球蛋白具有多达10条重链和10条轻链的组合,从而形成高分子量免疫球蛋白。在所有免疫球蛋白中,每条重链的一端都与一条轻链平行,形成一个重-轻链对;每个免疫球蛋白分子中至少有两个,最多有10个这样的对。
图35-4. 典型的IgG抗体结构,显示其由两条重多肽链和两条轻多肽链组成。抗原结合在链的可变部分(variable portions)的两个不同位点。
图35-4显示了每条轻链和重链的一个指定末端,称为可变部分(variable portion);每条链的其余部分称为恒定部分(constant portion)。可变部分对于每种特定抗体都是不同的,正是这一部分特异性地结合到特定类型的抗原上。恒定部分决定了抗体的其他特性,例如抗体在组织中的扩散性(diffusivity)、对组织中特定结构的粘附性(adherence)、与补体复合物(complement complex)的结合、抗体通过膜的难易程度以及其他生物学特性。轻链和重链通过非共价键(noncovalent bonds)和共价键(covalent bonds)(二硫键(disulfide bonds))结合在一起。
抗体的特异性
每种抗体对特定的抗原具有特异性(antibody specificity);这一特性是由轻链和重链可变部分氨基酸的独特结构组织所决定的。每种抗原特异性的氨基酸组织具有不同的立体形状,因此当抗原与其接触时,抗原的多个辅基与抗体的辅基像镜像一样匹配,从而使抗体和抗原之间能够快速且紧密地结合。当抗体具有高度特异性时,结合位点非常多,抗体-抗原的结合极其牢固,主要通过以下方式维持:(1) 疏水键(hydrophobic bonding);(2) 氢键(hydrogen bonding);(3) 离子吸引力(ionic attractions);(4) 范德华力(van der Waals forces)。它还遵循热力学质量作用定律:
Ka 称为亲和常数(affinity constant),是衡量抗体与抗原结合紧密程度的指标。
特别需要注意的是,在图35-4中,所示抗体上有两个可变位点用于结合抗原,使得这种抗体具有双价性(bivalent)。一小部分抗体由多达10条轻链和10条重链组合而成,具有多达10个结合位点。
抗体的五大类
抗体共有五大类,分别命名为IgM、IgG、IgA、IgD和IgE。“Ig”代表免疫球蛋白(immunoglobulin),其他五个字母分别代表各类抗体。
在我们有限的讨论范围内,其中两类抗体尤为重要——IgG,它是一种双价抗体,约占正常人抗体的75%;以及IgE,它只占抗体的一小部分,但特别与过敏反应相关。IgM类抗体也很有趣,因为在初次免疫反应中形成的大部分抗体都属于这一类型。这些抗体具有10个结合位点,使其在保护机体免受入侵者侵害方面非常有效,尽管IgM抗体的数量并不多。
图35-5. 双价抗体将抗原分子相互结合。
抗体的作用机制
抗体主要通过两种方式保护机体免受入侵者的侵害:(1) 直接攻击入侵者;(2) 激活补体系统(complement system),补体系统随后通过多种方式破坏入侵者。
抗体对入侵者的直接作用
图35-5显示了抗体(用红色Y形条表示)与抗原(用阴影物体表示)的反应。由于抗体的双价性和大多数入侵者上的多个抗原位点,抗体可以通过以下几种方式使入侵者失活:
- 凝集反应(agglutination):表面带有抗原的多个大颗粒(如细菌或红细胞)被结合在一起形成团块。
- 沉淀反应(precipitation):可溶性抗原(如破伤风毒素)与抗体形成的分子复合物变得如此之大,以至于变得不溶并沉淀下来。
- 中和反应(neutralization):抗体覆盖抗原物质的毒性位点。
- 溶解(lysis),其中一些强效抗体偶尔能够直接攻击细胞因子的膜,从而导致因子的破裂
这些抗体的直接作用通常不足以在保护身体免受入侵者侵害方面发挥主要作用。大部分保护作用是通过接下来描述的补体系统的放大效应实现的。
抗体作用的补体系统
补体系统的主要功能是增强(complement)抗体和吞噬细胞在中和和破坏病原体、从体内清除受损细胞以及促进炎症方面的作用。补体是一个统称,描述了一个由大约20种蛋白质组成的系统,其中许多是酶前体。该系统的主要参与者是11种蛋白质,分别命名为C1到C9、B和D,如图35-6所示。所有这些蛋白质通常存在于血液的血浆蛋白中,也存在于从毛细血管渗漏到组织间隙的蛋白质中。酶前体通常是无活性的,但可以通过所谓的经典途径(classical pathway)被激活。
经典途径。经典途径由抗原-抗体反应启动。也就是说,当抗体与抗原结合时,抗体恒定部分上的一个特定反应位点被暴露或激活,这反过来直接与补体系统的C1分子结合。这引发了一系列级联反应,如图35-6所示,从酶前体C1的激活开始。形成的C1酶随后依次激活系统中后期阶段越来越多的酶,从而从一个小的起点开始,发生一个极其巨大的放大反应。形成了多种终产物,如图右侧所示,其中几种具有重要作用,有助于防止入侵生物或毒素对机体组织造成的损害。其中更重要的效应包括:
- 调理作用(opsonization)和吞噬作用(phagocytosis)。补体级联反应的产物之一C3b强烈激活中性粒细胞和巨噬细胞的吞噬作用,导致这些细胞吞噬附着有抗原-抗体复合物的细菌。这个过程称为调理作用。它通常可以将可被破坏的细菌数量增加数百倍。
- 溶解(lysis)。补体级联反应中最重要的产物之一是膜攻击复合物(membrane attack complex)(也称为溶细胞复合物(cytolytic complex)),它是多种补体因子的组合,命名为C5b6789。这种膜攻击复合物插入细胞膜的脂双层中,形成对离子可渗透的孔,导致细菌或其他入侵生物细胞膜的渗透性破裂。
- 凝集(agglutination)。补体产物还改变了入侵生物的表面,使它们彼此粘附,从而促进凝集。
- 病毒中和(neutralization of viruses)。补体酶和其他补体产物可以攻击某些病毒的结构,从而使它们失去毒性。
- 趋化作用(chemotaxis)。片段C5a启动中性粒细胞和巨噬细胞的趋化作用,从而使大量这些吞噬细胞迁移到抗原因子附近的组织区域。
- 肥大细胞(mast cells)和嗜碱性粒细胞(basophils)的激活。C3a、C4a和C5a片段激活肥大细胞和嗜碱性粒细胞,导致它们向局部体液中释放组胺(histamine)、肝素(heparin)和其他几种物质。这些物质反过来又会导致局部血流量增加、液体和血浆蛋白渗漏到组织中增加,以及其他有助于灭活或固定抗原物质的局部组织反应。这些相同的因素在炎症(第34章讨论)和过敏(稍后讨论)中起主要作用。
图35-6. 补体经典途径激活过程中的级联反应。
- 炎症效应。除了肥大细胞和嗜碱性粒细胞激活引起的炎症效应外,其他几种补体产物也有助于局部炎症。这些产物导致(1)已经增加的血流量进一步增加;(2)毛细血管蛋白渗漏增加;(3)间质液蛋白在组织间隙中凝固,从而阻止入侵生物体在组织中的移动。
T淋巴细胞系统的特殊属性——激活的T细胞和细胞介导的免疫
激活的T细胞从淋巴组织中释放和记忆细胞的形成。当暴露于邻近巨噬细胞(macrophages)呈现的适当抗原时,特定淋巴细胞克隆的T淋巴细胞增殖并以类似于激活的B细胞释放抗体的方式释放大量激活的、特异性反应的T细胞。主要区别在于,不是释放抗体,而是形成并释放整个激活的T细胞到淋巴中。这些T细胞随后进入循环,分布到全身,穿过毛细血管壁进入组织间隙,再次回到淋巴和血液中,并在体内反复循环,有时持续数月甚至数年。
此外,T淋巴细胞记忆细胞的形成方式与抗体系统中B记忆细胞的形成方式相同。也就是说,当T淋巴细胞克隆被抗原激活时,许多新形成的淋巴细胞被保存在淋巴组织中,成为该特定克隆的额外T淋巴细胞;事实上,这些记忆细胞甚至扩散到全身的淋巴组织中。因此,在身体任何地方再次暴露于相同抗原时,激活的T细胞的释放比第一次暴露时更快、更强大。
抗原呈递细胞、主要组织相容性复合体蛋白和T淋巴细胞上的抗原受体。T细胞反应与B细胞的抗体反应一样,具有极强的抗原特异性,并且在防御感染方面至少与抗体同等重要。事实上,获得性免疫反应通常需要T细胞的协助才能启动,T细胞在帮助消除入侵病原体方面起着重要作用。
尽管B淋巴细胞能够识别完整的抗原,但T淋巴细胞只有在抗原与淋巴组织中抗原呈递细胞表面的特定分子——MHC蛋白(major histocompatibility complex proteins)结合时才会对它们作出反应(图35-7)。三种主要的抗原呈递细胞是巨噬细胞、B淋巴细胞和树突状细胞。树突状细胞(也称为辅助细胞)是最有效的抗原呈递细胞,它们遍布全身,主要功能是向T细胞呈递抗原。细胞黏附蛋白(cell adhesion proteins)的相互作用对于使T细胞能够与抗原呈递细胞结合足够长时间以被激活至关重要。
图35-7. T细胞的激活需要T细胞受体与抗原(外来蛋白质)的相互作用,该抗原通过主要组织相容性复合物(MHC)蛋白被转运到抗原呈递细胞的表面。细胞间黏附蛋白使T细胞能够与抗原呈递细胞结合足够长时间以被激活。
MHC蛋白由一组称为主要组织相容性复合物(MHC)的基因编码。MHC蛋白结合在抗原呈递细胞内降解的抗原蛋白的肽片段,然后将它们转运到细胞表面。MHC蛋白有两种类型:(1) MHC I蛋白,它们向细胞毒性T细胞呈递抗原;(2) MHC II蛋白,它们向辅助性T细胞呈递抗原。细胞毒性和辅助性T细胞的具体功能将在后面讨论。
抗原呈递细胞表面的抗原与T细胞表面的受体分子结合的方式与它们与血浆蛋白抗体结合的方式相同。这些受体分子由一个可变单元组成,类似于体液抗体的可变部分,但其茎部牢固地结合在T淋巴细胞的细胞膜上。单个T细胞上有多达100,000个受体位点。
T细胞的不同类型及其功能
现在已经清楚,T细胞有多种类型,分为三大类:(1) 辅助性T细胞;(2) 细胞毒性T细胞;(3) 调节性T细胞(也称为抑制性T细胞)。这些T细胞的功能各不相同。
辅助性T细胞是数量最多的T细胞
辅助性T细胞是数量最多的T细胞,通常占所有T细胞的75%以上。正如它们的名字所示,它们以多种方式帮助免疫系统的功能。它们是几乎所有免疫功能的主要调节者,如图35-8所示。它们通过形成一系列称为淋巴因子(lymphokines)的蛋白质介质来实现这一点,这些介质作用于免疫系统的其他细胞以及骨髓细胞。
当受到刺激时,初始的CD4+辅助性T细胞可以分化为产生不同淋巴因子并执行不同功能的亚群。表35-1总结了辅助性T细胞的主要亚群、诱导每个亚群的淋巴因子、亚群产生的淋巴因子以及每个亚群触发的免疫反应。
淋巴因子(lymphokines)的特定调节功能。在没有T辅助细胞(T-helper cells)分泌的淋巴因子的情况下,免疫系统的其余部分几乎处于瘫痪状态。事实上,正是T辅助细胞被人类免疫缺陷病毒(HIV)灭活或破坏,使身体几乎完全失去对传染病的防御能力,从而导致众所周知的获得性免疫缺陷综合征(AIDS)的衰弱和致命影响。以下部分将描述一些特定的调节功能。
图35-8. 免疫系统的调节,强调T辅助细胞的关键作用。MHC,主要组织相容性复合体(Major histocompatibility complex)
刺激细胞毒性T细胞(cytotoxic T cells)和调节性T细胞(regulatory T cells)的生长和增殖。在没有T辅助细胞的情况下,产生细胞毒性T细胞和调节性T细胞的克隆只能被大多数抗原轻微激活。淋巴因子白细胞介素-2(interleukin-2)在引起细胞毒性和调节性T细胞的生长和增殖方面具有特别强的刺激作用。此外,其他几种淋巴因子的作用较弱。
刺激B细胞(B-cells)生长和分化为浆细胞(plasma cells)和抗体(antibodies)。在没有T辅助细胞帮助的情况下,抗原引起B细胞生长、增殖、形成浆细胞和分泌抗体的直接作用也很微弱。几乎所有白细胞介素都参与B细胞反应,但尤其是白细胞介素4、5和6。这三种白细胞介素对B细胞的作用如此强大,以至于它们被称为B细胞刺激因子(B-cell stimulating factors)或B细胞生长因子(B-cell growth factors)。
激活巨噬细胞系统(macrophage system)。淋巴因子也影响巨噬细胞。首先,它们在巨噬细胞被趋化性吸引到炎症组织区域后,减缓或停止巨噬细胞的迁移,从而导致巨噬细胞的大量积累。其次,它们激活巨噬细胞以引起更有效的吞噬作用(phagocytosis),使它们能够攻击和消灭越来越多的入侵细菌或其他破坏组织的物质。
对T辅助细胞的反馈刺激作用。一些淋巴因子,特别是白细胞介素-2,对刺激T辅助细胞的激活具有直接的正面反馈作用。这作为一个放大器,进一步增强辅助细胞反应,以及整个免疫系统对入侵抗原的反应。
细胞毒性T细胞是杀伤细胞
细胞毒性T细胞(cytotoxic T cell)是一种直接攻击细胞,能够杀死微生物,有时甚至能杀死身体自身的某些细胞。因此,这些细胞被称为杀伤细胞(killer cells)。CD8+细胞毒性T细胞表面的受体蛋白使它们能够紧密结合到含有适当结合特异性抗原的微生物或细胞上。然后,它们以图35-9所示的方式杀死被攻击的细胞。结合后,细胞毒性T细胞分泌形成孔洞的蛋白质,称为穿孔素(perforins),这些蛋白质在被攻击细胞的膜上打出圆形孔洞。随后,液体迅速从间质空间流入细胞。此外,细胞毒性T细胞直接将细胞毒性物质释放到被攻击的细胞中。几乎立即,被攻击的细胞会显著肿胀,通常在不久后溶解。
表35-1 T辅助细胞亚群
<html><body><table><tr><td></td><td>TH1</td><td>TH2</td><td>TH17</td></tr><tr><td>诱导亚群的淋巴因子</td><td>IFN-, IL-12</td><td>1I-4</td><td>TGF-β, II-1, II-6, IL-23</td></tr><tr><td>主要产生的淋巴因子/因子</td><td>IFN-, II-2 TNF-C, GM-CSF</td><td>IL-4,IL-5,11-6, IL-10, II-13</td><td>1I-17, IL-22</td></tr><tr><td>主要免疫反应</td><td>巨噬细胞激活,刺激IgG抗体产生</td><td>刺激IgE产生,激活肥大细胞和嗜酸性粒细胞</td><td>招募中性粒细胞和单核细胞</td></tr></table></body></html>
图35-9. 致敏淋巴细胞(细胞毒性T细胞)对入侵细胞的直接破坏。
特别重要的是,这些细胞毒性杀伤细胞在打出孔洞并释放细胞毒性物质后,可以从受害细胞中脱离,然后继续杀死更多细胞。其中一些细胞在组织中可以持续存在数月。
一些细胞毒性T细胞对已被病毒入侵的组织细胞特别致命,因为许多病毒颗粒被困在组织细胞的膜中,并吸引T细胞对病毒抗原性作出反应。细胞毒性T细胞在破坏癌细胞、心脏移植细胞或其他类型的与个体自身身体不同的细胞中也起着重要作用。
调节性T细胞
关于调节性T细胞(regulatory T cells)的了解远少于其他细胞,但它们能够抑制细胞毒性和T辅助细胞的功能。CD4+调节性T细胞的这些抑制功能被认为可以防止细胞毒性细胞引起可能损害身体自身组织的过度免疫反应。调节性T细胞系统可能在限制免疫系统攻击个体自身组织的能力方面起着重要作用,称为免疫耐受(immune tolerance),这将在下一节中讨论。
获得性免疫系统对自身组织的耐受——胸腺和骨髓预处理的作用
如果个体对自身组织产生免疫反应,获得性免疫的过程将破坏个体的身体。免疫机制通常能够识别个体的自身组织与细菌或病毒的区别,并且个体的免疫系统很少会形成针对自身抗原的抗体或激活的T细胞。
大多数耐受性(immunological tolerance)源于预处理过程中的克隆选择。大多数耐受性被认为是在胸腺中的T淋巴细胞和骨髓中的B淋巴细胞的预处理过程中产生的。这是因为在淋巴细胞在这两个区域进行预处理时,向胎儿注射强抗原会阻止淋巴组织中特异性针对注射抗原的淋巴细胞克隆的发育。实验表明,胸腺中特定的未成熟淋巴细胞在暴露于强抗原时,会变成淋巴母细胞(lymphoblast),大量增殖,然后与刺激抗原结合——这种效应被认为会导致这些细胞在迁移到全身淋巴组织并定殖之前被胸腺上皮细胞(thymic epithelial cells)破坏。
在胸腺和骨髓中淋巴细胞的预处理过程中,所有或大多数特异性破坏机体自身组织的淋巴细胞克隆似乎由于持续暴露于机体抗原而自我毁灭。
耐受机制(immunological tolerance mechanism)的失败会导致自身免疫性疾病(autoimmune diseases)。有时,人们会失去对自身组织的免疫耐受性。这种现象随着年龄的增长而更加明显。它通常发生在机体自身组织部分破坏之后,这会释放大量自身抗原(self-antigens)在体内循环,并可能以激活的T细胞或抗体的形式引起获得性免疫(acquired immunity)。
已经描述了100多种由自身免疫引起的疾病,包括:(1)风湿热(rheumatic fever),在暴露于特定类型的链球菌毒素后,机体对关节和心脏组织(尤其是心脏瓣膜)产生免疫,这种毒素的分子结构中有一个表位(epitope)与机体自身抗原的结构相似;(2)一种类型的肾小球肾炎(glomerulonephritis),患者对肾小球的基底膜产生免疫;(3)重症肌无力(myasthenia gravis),对神经肌肉接头处的乙酰胆碱受体蛋白产生免疫,导致瘫痪;(4)多发性硬化症(multiple sclerosis, MS),免疫系统攻击覆盖神经纤维的髓鞘(myelin),破坏神经系统的通讯;(5)系统性红斑狼疮(systemic lupus erythematosus, SLE),患者同时对多种机体组织产生免疫,当SLE严重时,这种疾病会导致广泛的损害甚至死亡。
通过注射抗原进行免疫接种
多年来,免疫接种(immunization)一直被用于产生针对特定疾病的获得性免疫。可以通过注射不再能够引起疾病但仍保留一些化学抗原的死微生物来对一个人进行免疫接种。这种类型的免疫接种用于预防伤寒、百日咳、白喉和许多其他类型的细菌性疾病。
可以通过对毒素进行化学处理来获得免疫力,使其毒性被破坏,尽管其引起免疫的抗原仍然完好无损。这种方法用于预防破伤风、肉毒中毒和其他类似的毒性疾病。
最后,一个人可以通过感染减毒(attenuated)的活体生物来获得免疫。也就是说,这些生物在特殊的培养基中生长,或者通过一系列动物传代,直到它们发生足够的突变,以至于不会引起疾病,但仍然携带免疫所需的特定抗原。这种方法用于预防天花、黄热病、脊髓灰质炎、麻疹和许多其他病毒性疾病。
被动免疫(passive immunity)
到目前为止,我们所讨论的所有获得性免疫都是主动免疫(active immunity)——也就是说,人体自身在受到外来抗原入侵时会产生抗体或激活的T细胞。然而,在不注射任何抗原的情况下,也可以获得暂时的免疫力。这种暂时的免疫力是通过输注从其他人或某些其他动物的血液中获得的抗体、激活的T细胞或两者来实现的,这些动物已经对该抗原进行了主动免疫。
抗体在受者体内持续存在2到3周,在此期间,人体受到保护,免受入侵疾病的侵害。如果从另一个人输注,激活的T细胞可以持续几周,但如果从动物输注,则只能持续几小时到几天。这种通过输注抗体或T淋巴细胞来赋予免疫力的方法称为被动免疫。
过敏(allergy)和超敏反应(hypersensitivity)
免疫的一个重要不良副作用是在某些情况下会发展出过敏或其他类型的免疫超敏反应。过敏和其他超敏反应有几种类型,其中一些只发生在具有特定过敏倾向的人身上。
由激活的T细胞引起的过敏:迟发型过敏(delayed-reaction allergy)
迟发型过敏是由激活的T细胞引起的,而不是由抗体引起的。以毒葛为例,毒葛的毒素本身对组织没有太大伤害。然而,在反复接触后,它确实会导致激活的辅助性和细胞毒性T细胞的形成。然后,在随后接触毒葛毒素后,大约一天内,激活的T细胞会从循环血液中大量扩散到皮肤中,以应对毒葛毒素。同时,这些T细胞引发一种细胞介导的免疫反应。记住,这种类型的免疫可以导致从激活的T细胞中释放许多有毒物质,以及巨噬细胞对组织的广泛入侵及其后续影响,人们可以理解,某些迟发型过敏的最终结果可能是严重的组织损伤。损伤通常发生在引发抗原存在的组织区域,例如在毒葛的情况下是皮肤,或者在某些空气传播抗原的情况下是肺部,导致肺水肿或哮喘发作。
与过量IgE抗体相关的特应性过敏(atopic allergies)
一些人具有过敏倾向。他们的过敏被称为特应性过敏(atopic allergies),因为它们是由免疫系统的非正常反应引起的。这种过敏倾向通过基因从父母传递给孩子,其特征是血液中存在大量的IgE抗体。这些抗体被称为反应素(reagins)或致敏抗体(sensitizing antibodies),以区别于更常见的IgG抗体。当过敏原(allergen)(定义为与特定类型的IgE反应素抗体特异性反应的抗原)进入体内时,会发生过敏原-反应素反应,随后发生过敏反应。
IgE抗体(反应素)的一个特殊特征是它们强烈倾向于附着在肥大细胞(mast cells)和嗜碱性粒细胞(basophils)上。事实上,一个肥大细胞或嗜碱性粒细胞可以结合多达50万个IgE抗体分子。然后,当具有多个结合位点的抗原(过敏原)与已经附着在肥大细胞或嗜碱性粒细胞上的几个IgE抗体结合时,肥大细胞或嗜碱性粒细胞的膜会立即发生变化,这可能是由于抗体分子的物理效应导致细胞膜扭曲。无论如何,许多肥大细胞和嗜碱性粒细胞会破裂;其他细胞会立即或不久后释放特殊物质,包括组胺(histamine)、蛋白酶(protease)、过敏性慢反应物质(slow-reacting substance of anaphylaxis)(一种毒性白三烯(toxic leukotrienes)的混合物)、嗜酸性粒细胞趋化物质(eosinophil chemotactic substance)、中性粒细胞趋化物质(neutrophil chemotactic substance)、肝素(heparin)和血小板活化因子(platelet-activating factors)。这些物质会引起局部血管扩张、嗜酸性粒细胞和中性粒细胞向反应部位的趋化、毛细血管通透性增加导致液体渗入组织以及局部平滑肌细胞收缩等效应。因此,根据过敏原-反应素反应发生的组织类型,可能会发生几种不同的组织反应。接下来将描述一些由此引起的不同类型的过敏反应。
过敏性反应(Anaphylaxis)——广泛的过敏反应。当特定的过敏原直接注入循环系统时,如果嗜碱性粒细胞和肥大细胞已经被IgE反应素的附着致敏,过敏原可以与血液中的嗜碱性粒细胞和位于小血管外组织中的肥大细胞发生反应。因此,整个血管系统及其紧密相关的组织会发生广泛的过敏反应。这种反应被称为过敏性反应。组胺被释放到循环系统中,引起全身血管扩张以及毛细血管通透性增加,导致血浆从循环系统中显著流失。有时,经历这种反应的人会在几分钟内死于循环休克,除非使用肾上腺素(epinephrine)来对抗组胺的作用。
从激活的嗜碱性粒细胞和肥大细胞中还会释放出一种称为过敏性慢反应物质的白三烯混合物。这些白三烯可以引起细支气管平滑肌的痉挛,引发类似哮喘的发作,有时会导致窒息死亡。
荨麻疹——局部过敏样反应。荨麻疹是由于抗原进入特定皮肤区域并引起局部过敏样反应所致。局部释放的组胺(histamine)引起:(1)血管扩张,导致立即出现红色斑块;(2)毛细血管局部通透性增加,导致皮肤在几分钟内出现局部局限性肿胀。这些肿胀通常被称为风团(hives)。在接触抗原前给予抗组胺药物可以预防风团的发生。
花粉症。在花粉症中,过敏原-反应素(allergen-reagin)反应发生在鼻腔内。反应释放的组胺引起鼻内血管扩张,导致毛细血管压力增加和毛细血管通透性增加。这两种效应都会导致液体迅速渗入鼻腔和鼻部深层组织,鼻黏膜变得肿胀并分泌增多。同样,使用抗组胺药物可以预防这种肿胀反应。然而,过敏原-反应素反应的其他产物仍可引起鼻腔刺激,引发典型的打喷嚏综合征。
哮喘。哮喘常发生在过敏体质的人身上。在这些个体中,过敏原-反应素反应发生在肺的细支气管中。这里,肥大细胞释放的一个重要产物被认为是过敏反应的慢反应物质(slow-reacting substance of anaphylaxis)(三种白三烯的混合物),它会引起细支气管平滑肌痉挛。因此,患者在过敏反应的反应产物被清除之前会出现呼吸困难。抗组胺药物对哮喘病程的影响较小,因为组胺似乎不是引发哮喘反应的主要因素。
血型;输血;组织和器官移植
抗原性引起血液的免疫反应
当首次尝试将一个人的血液输给另一个人时,经常会发生红细胞(RBCs)的立即或延迟凝集和溶血,导致典型的输血反应,常常导致死亡。很快发现,不同人的血型具有不同的抗原和免疫特性,因此一种血型的血浆中的抗体会与另一种血型的红细胞表面的抗原发生反应。如果采取适当的预防措施,可以提前确定供体和受体血液中存在的抗体和抗原是否会引起输血反应。
血细胞中抗原的多样性
在人类血细胞的细胞膜表面至少发现了30种常见抗原和数百种其他稀有抗原,每种抗原有时都会引起抗原-抗体反应。大多数抗原都很弱,因此主要用于研究基因的遗传以确定亲子关系。
有两种特定类型的抗原比其他抗原更容易引起输血反应。它们是O-A-B抗原系统和R h系统。
O-A-B血型
A和B抗原——凝集原
两种抗原——A型和B型——出现在大部分人的红细胞(RBCs)表面。正是这些抗原(也称为凝集原(agglutinogens),因为它们经常引起红细胞凝集)导致了大多数输血反应。由于这些凝集原的遗传方式,人们可能在其细胞上没有任何一种凝集原,可能有一种,或者可能同时有两种。
主要的O-A-B血型。在将血液从一个人输给另一个人时,供血者和受血者的血液通常根据A和B两种凝集原的存在与否分为四种主要的O-A-B血型,如表36-1所示。当A和B凝集原都不存在时,血液为O型。当只有A凝集原存在时,血液为A型。当只有B凝集原存在时,血液为B型。当A和B凝集原都存在时,血液为AB型。
凝集原的遗传决定。ABO血型基因座有三个等位基因(alleles),这意味着同一基因有三种不同的形式。这三个等位基因——IA、IB和IO——决定了三种血型。我们通常称这些等位基因为A、B和O,但遗传学家通常用同一符号的变体来表示一个基因的等位基因。在这种情况下,常用符号是字母"I",代表免疫球蛋白(immunoglobulin)。
O型等位基因是无功能的或几乎无功能的,因此它不会在细胞上产生显著的O型凝集原。相反,A型和B型等位基因确实会在细胞上产生强凝集原。因此,O型等位基因对A型和B型等位基因都是隐性的,而A型和B型等位基因表现为共显性(co-dominance)。
因为每个人只有两套染色体,所以在任何个体的两条染色体上,每条染色体上只存在其中一个等位基因。然而,三个不同等位基因的存在意味着有六种可能的等位基因组合,如表36-1所示:OO、OA、OB、AA、BB和AB。这些等位基因组合被称为基因型(genotypes),每个人都是这六种基因型之一。
从表36-1中还可以观察到,基因型为OO的人不产生任何凝集原,因此血型为O型。基因型为OA或AA的人产生A型凝集原,因此血型为A型。基因型OB和BB的人为B型血,基因型AB的人为AB型血。
不同血型的相对频率。在一组研究对象中,不同血型的流行率大致如下:
• O型: 47% • A型: 41% ·B型: 9% • AB型: 3%
从这些百分比可以明显看出,O和A基因出现频率高,而B基因出现频率低。
凝集素
当一个人的红细胞中没有A型凝集原时,血浆中会产生称为抗A凝集素(anti-A agglutinins)的抗体。同样,当红细胞中没有B型凝集原时,血浆中会产生称为抗B凝集素(anti-B agglutinins)的抗体。
再次参考表36-1,注意O型血虽然不含有凝集原(agglutinogens),但含有抗A和抗B凝集素(anti-A and anti-B agglutinins)。A型血含有A型凝集原和抗B凝集素,B型血含有B型凝集原和抗A凝集素。最后,AB型血含有A和B两种凝集原,但不含有任何凝集素。
不同年龄段的凝集素滴度(Titer of Agglutinins at Different Ages)。出生后不久,血浆中的凝集素含量几乎为零。在出生后2至8个月,婴儿开始产生凝集素——当细胞中不存在A型凝集原时产生抗A凝集素,当细胞中不存在B型凝集原时产生抗B凝集素。图36-1显示了不同年龄段抗A和抗B凝集素的滴度变化。通常在8至10岁时达到最大滴度,随后这一滴度在生命的剩余年份中逐渐下降。
血浆中凝集素的来源(Origin of Agglutinins in Plasma)。凝集素是γ球蛋白(gamma globulins),几乎所有的抗体都是γ球蛋白,它们由产生其他抗原抗体的骨髓和淋巴腺细胞产生。大多数凝集素是IgM和IgG免疫球蛋白分子。
但为什么在没有相应凝集原的红细胞(RBCs)中的人体内会产生这些凝集素?一个可能的答案是,少量的A型和B型抗原通过食物、细菌和其他途径进入体内,这些物质引发了抗A和抗B凝集素的产生。
例如,将A型抗原输注给非A型血的受体会引发典型的免疫反应,形成比以往更多的抗A凝集素。此外,新生儿几乎没有凝集素,这表明凝集素的形成几乎完全发生在出生后。
图36-1. 不同血型人群血浆中抗A和抗B凝集素的平均滴度。
输血反应中的凝集过程
当血液不匹配时,抗A或抗B血浆凝集素与含有A或B凝集原的红细胞混合,凝集素附着在红细胞上,导致红细胞凝集。由于凝集素有两个结合位点(IgG型)或十个结合位点(IgM型),单个凝集素可以同时附着在两个或更多的红细胞上,从而使这些细胞被凝集素结合在一起。这种结合导致细胞聚集,这就是凝集过程。然后这些凝块堵塞循环系统中的小血管。在随后的几小时到几天内,细胞的物理变形或吞噬性白细胞的攻击会破坏凝集细胞的膜,将血红蛋白释放到血浆中,称为红细胞的溶血(hemolysis)。
在某些输血反应中会发生急性溶血(acute hemolysis)。有时,当受血者和供血者的血液不匹配时,循环血液中的红细胞(RBCs)会立即发生溶血。在这种情况下,抗体通过激活补体系统(complement system)并形成膜攻击复合物(membrane attack complex,也称为溶细胞复合物(cytolytic complex))来引起红细胞溶解,该复合物插入细胞膜的脂双层中;这种插入形成了对离子具有通透性的膜孔,并导致细胞的渗透性溶解(osmotic lysis),如第35章所述。立即发生的血管内溶血(intravascular hemolysis)远不如凝集(agglutination)后发生的延迟溶血常见,因为不仅需要高滴度的抗体才能发生溶血,而且似乎还需要不同类型的抗体,主要是IgM抗体;这些抗体被称为溶血素(hemolysins)。
血型鉴定(BLOOD TYPING)
在给一个人输血之前,有必要确定受血者和供血者的血型,以便血液能够适当匹配。这个过程被称为血型鉴定(blood typing)和血液匹配(blood matching),这些程序按以下方式进行。首先将红细胞与血浆分离并用生理盐水稀释。然后将一部分与抗A凝集素(anti-A agglutinin)混合,另一部分与抗B凝集素(anti-B agglutinin)混合。几分钟后,在显微镜下观察混合物。如果红细胞已经凝集(agglutinated),则发生了抗体-抗原反应。
表36-2 血型鉴定:不同血型的细胞与血清中的抗A或抗B凝集素的凝集反应
<html><body><table><tr><td rowspan="2">红细胞类型</td><td colspan="2">血清</td></tr><tr><td>抗A</td><td>抗B</td></tr><tr><td>0</td><td>一</td><td></td></tr><tr><td>A</td><td>+</td><td></td></tr><tr><td>B</td><td>一</td><td>+</td></tr><tr><td>AB</td><td>+</td><td>+</td></tr></table></body></html>
表36-2列出了四种类型红细胞的凝集反应存在(+)或不存在(-)。O型红细胞没有凝集原(agglutinogens),因此不与抗A或抗B凝集素发生反应。A型血液具有A凝集原,因此与抗A凝集素发生凝集反应。B型血液具有B凝集原,并与抗B凝集素发生凝集反应。AB型血液同时具有A和B凝集原,并与两种类型的凝集素发生凝集反应。
Rh血型
除了O-A-B血型系统外,Rh血型系统在输血时也很重要。O-A-B系统和Rh系统之间的主要区别如下。在O-A-B系统中,引起输血反应的血清凝集素(plasma agglutinins)是自发产生的,而在Rh系统中,几乎从不发生自发的凝集素。相反,一个人必须首先大量接触Rh抗原——例如通过输注含有Rh抗原的血液——才能产生足够的凝集素以引起显著的输血反应。
Rh抗原——Rh阳性和Rh阴性。有六种常见的Rh抗原类型,每种都称为Rh因子(Rh factor)。这些类型被命名为C、D、E、c、d和e。具有C抗原的人不具有c抗原,但缺少C抗原的人总是具有C抗原。D-d和E-e抗原也是如此。此外,由于这些因子的遗传方式,每个人在三对抗原中都具有其中一种。
D型抗原在人群中广泛存在,并且比其他Rh抗原具有更强的抗原性(antigenicity)。任何拥有这种抗原的人被称为Rh阳性(Rh positive),而没有D型抗原的人则被称为Rh阴性(Rh negative)。然而,必须注意的是,即使在Rh阴性人群中,其他一些Rh抗原仍可能引起输血反应(transfusion reactions),尽管这些反应通常要轻微得多。
大约85%的白种人是Rh阳性,15%是Rh阴性。在美国黑人中,Rh阳性的比例约为95%,而在非洲黑人中,这一比例接近100%。超过95%的居住在中国、日本和韩国的美洲原住民和亚洲人也是Rh阳性。据估计,全球范围内Rh阳性和Rh阴性血型的频率分别为95%和6%。
Rh免疫反应
抗Rh凝集素(anti-Rh agglutinins)的形成。当含有Rh因子的红细胞(RBCs)被注入到不含Rh因子的人体内(即Rh阴性个体)时,抗Rh凝集素会缓慢形成,并在约2至4个月后达到最大浓度。这种免疫反应在某些人中比在其他人中更为显著。随着多次接触Rh因子,Rh阴性个体最终会对Rh因子产生强烈的致敏反应(sensitization)。
Rh输血反应(Rh transfusion reactions)的特征。如果Rh阴性个体从未接触过Rh阳性血液,向其输注Rh阳性血液通常不会引起立即反应。然而,在接下来的2至4周内,抗Rh抗体(anti-Rh antibodies)可能会大量产生,导致仍在血液中循环的输注细胞发生凝集(agglutination)。这些细胞随后会被组织巨噬细胞系统(tissue macrophage system)溶血(hemolyzed)。因此,尽管通常较为轻微,但会发生延迟性输血反应(delayed transfusion reaction)。在随后的Rh阳性血液输注中,由于该个体已经对Rh因子产生了免疫,输血反应会显著增强,可能立即发生,并且严重程度与A型或B型血型不匹配引起的输血反应相当。
胎儿成红细胞增多症(Erythroblastosis Fetalis)(新生儿溶血病(Hemolytic Disease of the Newborn))
胎儿成红细胞增多症是一种胎儿和新生儿的疾病,其特征是胎儿红细胞的凝集和吞噬(phagocytosis)。在大多数胎儿成红细胞增多症病例中,母亲是Rh阴性,父亲是Rh阳性。婴儿从父亲那里继承了Rh阳性抗原,而母亲由于接触胎儿的Rh抗原而产生了抗Rh凝集素。随后,母亲的凝集素通过胎盘(placenta)扩散到胎儿体内,引起红细胞凝集。
胎儿成红细胞增多症的发病率。Rh阴性母亲在怀第一个Rh阳性孩子时通常不会产生足够的抗Rh凝集素来造成任何伤害。然而,大约3%的第二个Rh阳性婴儿会出现一些胎儿成红细胞增多症的症状,大约10%的第三个婴儿会表现出这种疾病,并且发病率随着后续妊娠逐渐上升。
母亲抗体对胎儿的影响。母亲体内形成抗Rh抗体后,这些抗体会缓慢通过胎盘膜扩散到胎儿的血液中。在胎儿血液中,它们会引起胎儿血液的凝集(agglutination)。凝集的红细胞(RBCs)随后发生溶血(hemolysis),将血红蛋白释放到血液中。胎儿的巨噬细胞(macrophages)随后将血红蛋白转化为胆红素(bilirubin),导致婴儿皮肤变黄(黄疸,jaundice)。这些抗体还可能攻击并损伤身体的其他细胞。
胎儿成红细胞增多症的临床表现。患有黄疸的成红细胞增多症(erythroblastosis)的新生儿通常在出生时贫血(anemic),母亲体内的抗Rh凝集素(anti-Rh agglutinins)通常会在婴儿出生后继续在血液中循环1到2个月,破坏越来越多的红细胞。
婴儿的造血组织(hematopoietic tissues)试图替代被溶血的红细胞。肝脏和脾脏会显著增大,并以与妊娠中期相同的方式产生红细胞。由于红细胞的快速生成,许多早期形式的红细胞,包括许多有核的成红细胞(nucleated blastic forms),会从婴儿的骨髓进入循环系统。正是由于这些有核成红细胞的存在,这种疾病被称为胎儿成红细胞增多症(erythroblastosis fetalis)。
尽管胎儿成红细胞增多症的严重贫血通常是导致死亡的原因,但许多勉强从贫血中幸存下来的儿童由于胆红素在神经元细胞中的沉淀而表现出永久性的智力障碍或大脑运动区域的损伤,导致许多这些细胞的破坏,这种情况称为核黄疸(kernicterus)。
胎儿成红细胞增多症新生儿的治疗。胎儿成红细胞增多症的一种治疗方法是使用Rh阴性血液替换新生儿的血液。Rh阴性血液在1.5小时或更长时间内输注,同时移除新生儿自身的Rh阳性血液。这一过程可能在出生后的前几周内重复多次,主要是为了保持胆红素水平低,从而预防核黄疸。当这些输注的Rh阴性细胞被婴儿自身的Rh阳性细胞替代时,这一过程需要6周或更长时间,来自母亲的抗Rh凝集素将被破坏。
胎儿成红细胞增多症的预防。Rh血型系统的D抗原是导致Rh阴性母亲对Rh阳性胎儿免疫的主要元凶。在20世纪70年代,随着R h免疫球蛋白(Rh immunoglobulin globin)的开发,胎儿成红细胞增多症的发病率显著降低。这种抗D抗体从妊娠28到30周开始给予孕妇。抗D抗体也给予分娩Rh阳性婴儿的Rh阴性女性,以防止母亲对D抗原的致敏。这一步骤大大降低了在第二次怀孕期间产生大量D抗体的风险。
Rh免疫球蛋白防止D抗原致敏的机制尚不完全清楚,但抗D抗体的一个作用是抑制孕妇体内抗原诱导的B淋巴细胞抗体生成。给予的抗D抗体还会附着在Rh阳性胎儿红细胞上的D抗原位点上,这些红细胞可能穿过胎盘进入孕妇的循环系统,从而干扰对D抗原的免疫反应。
由于血型不匹配导致的输血反应
如果将一种血型的供体血液输给另一种血型的受体,很可能会发生输血反应,导致供体血液的红细胞(RBCs)发生凝集。输注的血液很少会引起受体细胞的凝集,原因如下。供体血液的血浆部分会立即被受体的所有血浆稀释,从而将输注的凝集素(agglutinins)的滴度降低到通常不足以引起凝集的水平。然而,少量输注的血液不会显著稀释受体血浆中的凝集素。因此,受体的凝集素仍然可以凝集不匹配的供体细胞。
如前所述,所有输血反应最终都会导致由溶血素(hemolysins)引起的立即溶血或由凝集细胞的吞噬作用(phagocytosis)引起的后期溶血。从红细胞中释放的血红蛋白(hemoglobin)随后被吞噬细胞转化为胆红素(bilirubin),然后通过肝脏排泄到胆汁中,如第71章所述。体液中胆红素的浓度通常会上升到足以引起黄疸(jaundice)的水平——即,人体的内部组织和皮肤会被黄色的胆汁色素染色。然而,如果肝功能正常,胆汁色素会通过肝脏胆汁排泄到肠道中,因此成年人通常不会出现黄疸,除非在不到一天的时间内溶血超过400毫升。
输血反应后的急性肾衰竭 输血反应最致命的后果之一是肾衰竭,它可能在几分钟到几小时内开始,并持续到患者死于急性肾衰竭。
肾衰竭似乎有三个原因:
- 输血反应的抗原-抗体反应会从溶血血液中释放有毒物质,导致强烈的肾血管收缩(renal vasoconstriction)。
- 受体循环红细胞的丢失,加上溶血细胞和免疫反应产生的有毒物质,通常会导致循环休克(circulatory shock)。动脉血压急剧下降,肾血流量和尿量减少。
- 如果释放到循环血液中的游离血红蛋白总量超过了与结合珠蛋白(haptoglobin)(一种能够结合少量血红蛋白的血浆蛋白)结合的量,大部分多余的血红蛋白会通过肾小球膜(glomerular membranes)渗入肾小管(kidney tubules)。
如果这个量仍然很小,它可以通过肾小管上皮(tubular epithelium)重新吸收到血液中,不会造成伤害;如果量很大,则只有一小部分被重新吸收。然而,水继续被重新吸收,导致肾小管中的血红蛋白浓度上升到如此之高,以至于血红蛋白沉淀并阻塞许多肾小管。因此,肾血管收缩、循环休克和肾小管阻塞共同导致急性肾衰竭。如果肾衰竭完全且无法缓解,患者将在7到12天内死亡,如第32章所述,除非使用人工肾进行治疗。
组织和器官的移植
大多数引起输血反应的红细胞(RBCs)不同抗原也广泛存在于身体的其他细胞中,每个身体组织都有自己额外的抗原补体(complement of antigens)。因此,移植到受体身体任何部位的外来细胞都可能产生免疫反应。换句话说,大多数受体抵抗外来组织细胞入侵的能力与抵抗外来细菌或红细胞入侵的能力一样强。
自体移植(autografts)、同系移植(isografts)、同种异体移植(allografts)和异种移植(xenografts)。将组织或整个器官从同一动物的一个部位移植到另一个部位称为自体移植;从一个同卵双胞胎移植到另一个同卵双胞胎称为同系移植;从一个人移植到另一个人或从一种动物移植到同种动物的另一个个体称为同种异体移植;从非人类动物移植到人类或从一种动物移植到另一种动物称为异种移植。
细胞组织移植。在自体移植和同系移植的情况下,移植细胞中的抗原类型与受体组织中的抗原类型几乎相同,如果提供足够的血液供应,这些细胞几乎总是能够继续正常且无限期地存活。在另一个极端,异种移植几乎总是会发生免疫反应,导致移植细胞在移植后1天到5周内死亡,除非使用某种特定疗法来防止免疫反应。
一些已经作为同种异体移植从一个人移植到另一个人的不同细胞组织和器官,无论是实验性的还是治疗性的,包括皮肤、肾脏、心脏、肝脏、腺体组织、骨髓和肺。通过适当匹配人与人之间的组织,许多肾脏同种异体移植至少成功存活了5到15年,肝脏和心脏同种异体移植成功存活了1到15年。
克服移植组织中免疫反应的尝试
由于移植某些组织和器官的极端潜在重要性,已经进行了认真的尝试来防止与移植相关的抗原-抗体反应。以下特定程序在临床或实验上取得了一定程度的成功。
组织分型——人类白细胞抗原复合体。导致移植排斥的最重要抗原是一种称为人类白细胞抗原(HLA)复合体的抗原。每个人的组织细胞膜上存在六种这样的抗原,但大约有150种不同的HLA抗原可供选择,代表了超过1万亿种可能的组合。因此,除了同卵双胞胎的情况外,两个人几乎不可能拥有相同的六种HLA抗原。对这些抗原中的任何一种产生显著的免疫力都可能导致移植排斥。
HLA抗原存在于白细胞以及组织细胞上。因此,对这些抗原的组织分型是在从人体血液中分离出的淋巴细胞膜上进行的。将淋巴细胞与适当的抗血清和补体混合;孵育后,通常通过测定淋巴细胞对特殊染料的跨膜摄取速率来测试细胞的膜损伤。
一些HLA抗原的抗原性并不强烈。因此,供体和受体之间某些抗原的精确匹配并不总是同种异体移植物(Allograft)接受所必需的。通过使用更先进的基因检测方法并获得供体和受体之间尽可能好的匹配,移植手术的风险已经大大降低。最成功的案例是兄弟姐妹之间以及父母与子女之间的组织类型匹配。同卵双胞胎之间的匹配是完全一致的,因此同卵双胞胎之间的移植几乎不会因为免疫反应而被排斥。
通过抑制免疫系统预防移植物排斥
如果免疫系统被完全抑制,移植物排斥就不会发生。事实上,在免疫系统严重抑制的人中,即使不使用显著的预防排斥治疗,移植物也可以成功。然而,在免疫系统健康的人中,即使有最好的组织分型,如果不使用特定的免疫系统抑制治疗,同种异体移植物很少能抵抗排斥超过几天或几周。此外,由于T细胞主要是免疫系统中杀死移植细胞的重要部分,因此抑制T细胞比抑制血浆抗体更为重要。用于此目的的一些治疗剂包括:
- 来自肾上腺皮质的糖皮质激素(Glucocorticoid hormones)(或具有糖皮质激素样活性的药物)。这些药物抑制编码几种细胞因子(Cytokines)的基因,特别是白细胞介素-2(IL-2)。IL-2是诱导T细胞增殖和抗体形成的重要因子。
- 对淋巴系统有毒性的各种药物,因此可以阻断抗体和T细胞的形成,特别是药物硫唑嘌呤(Azathioprine)。
- 环孢素(Cyclosporine)和他克莫司(Tacrolimus),它们抑制辅助性T细胞的形成,因此在阻断T细胞排斥反应方面特别有效。这些药物已被证明是非常有价值的,因为它们不会抑制免疫系统的其他部分。
- 免疫抑制抗体疗法,包括特定的抗淋巴细胞或IL-2受体抗体。
使用这些药物通常会使人体对传染病失去保护;因此,有时细菌和病毒感染会变得猖獗。此外,免疫抑制的人患癌症的几率是正常人的几倍,可能是因为免疫系统在破坏许多早期癌细胞方面很重要,防止它们开始增殖。
人体活体组织的移植之所以成功,主要是因为开发了抑制免疫系统反应的药物。随着改进的免疫抑制剂的引入,成功的器官移植变得更加普遍。目前的免疫抑制治疗方法试图在可接受的排斥率和免疫抑制剂的不良反应之间取得平衡。
37 止血与血液凝固
止血事件
止血(Hemostasis)一词意味着防止血液流失。每当血管被切断或破裂时,止血通过几种机制实现:(1) 血管收缩;(2) 形成血小板栓子(Platelet plug);(3) 由于血液凝固(Blood coagulation)形成血块;(4) 最终纤维组织生长到血块中,永久性地封闭血管上的孔洞。
血管收缩
血管被切割或破裂后,血管壁的创伤会立即导致壁内的平滑肌收缩;这会瞬间减少从破裂血管流出的血液量。这种收缩是由以下因素引起的:(1) 局部肌源性痉挛 (local myogenic spasm);(2) 来自创伤组织、血管内皮 (vascular endothelium) 和血小板 (platelets) 的局部自体活性物质 (local autacoid factors);(3) 神经反射 (nervous reflexes)。神经反射是由疼痛神经冲动或其他感觉冲动引发的,这些冲动源自受创伤的血管或附近组织。然而,更多的血管收缩可能是由于血管壁直接损伤引发的局部肌源性收缩。对于较小的血管,血小板通过释放一种血管收缩物质——血栓素 A2 (thromboxane A2),在血管收缩中起主要作用。
血管受到的创伤越严重,血管痉挛的程度就越大。痉挛可以持续数分钟甚至数小时,在此期间,血小板栓塞和血液凝固的过程可以发生。
血小板栓的形成
如果血管的切口非常小——每天体内血管上都会形成许多非常小的孔——切口通常会被血小板栓塞 (platelet plug) 而不是血凝块 (blood clot) 封闭。为了理解这一过程,我们首先需要讨论血小板本身的性质。
物理和化学特性
血小板(也称为血小板细胞 (thrombocytes))是直径为 1 至 4 微米的微小圆盘。它们由骨髓中的巨核细胞 (megakaryocytes) 形成,巨核细胞是骨髓中极大的造血细胞 (hematopoietic cells);巨核细胞在骨髓中或进入血液后不久,尤其是在通过毛细血管时,会碎裂成微小的血小板。血液中血小板的正常浓度在 150,000 至 450,000/μl 之间。
血小板具有许多完整细胞的功能特性,尽管它们没有细胞核且不能繁殖。它们的细胞质中包含以下成分:(1) 肌动蛋白 (actin) 和肌球蛋白 (myosin) 分子,这些是与肌肉细胞中发现的收缩蛋白 (contractile proteins) 相似的蛋白质,以及另一种收缩蛋白——血栓收缩蛋白 (thrombosthenin),它可以使血小板收缩;(2) 内质网 (endoplasmic reticulum) 和高尔基体 (Golgi apparatus) 的残余物,它们合成各种酶,尤其是储存大量钙离子;(3) 线粒体 (mitochondria) 和酶系统,能够形成三磷酸腺苷 (adenosine triphosphate, ATP) 和二磷酸腺苷 (adenosine diphosphate, ADP);(4) 合成前列腺素 (prostaglandins) 的酶系统,前列腺素是局部激素,会引起许多血管和其他局部组织反应;(5) 一种重要的蛋白质,称为纤维蛋白稳定因子 (fibrin-stabilizing factor),我们稍后会在讨论血液凝固时提到它;(6) 一种生长因子 (growth factor),它会导致血管内皮细胞、血管平滑肌细胞和成纤维细胞 (fibroblasts) 增殖和生长,从而促进细胞生长,最终帮助修复受损的血管壁。
在血小板细胞膜表面有一层糖蛋白 (glycoproteins),它可以排斥与正常内皮的粘附,但会促进与血管壁受损区域的粘附,尤其是受损的内皮细胞,甚至更倾向于与血管壁深处暴露的胶原蛋白 (collagen) 粘附。此外,血小板膜含有大量磷脂 (phospholipids),它们可以激活血液凝固过程中的多个阶段,这一点稍后会讨论。
因此,血小板是一种活跃的结构。它在血液中的半衰期仅为8到12天,因此在几周内其功能过程就会耗尽;随后主要通过组织巨噬细胞系统从循环中清除。超过一半的血小板被脾脏中的巨噬细胞清除,血液通过紧密的小梁网络流过脾脏。
血小板栓形成机制
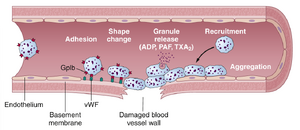
血小板对血管开口的修复基于血小板的几个重要功能。当血小板接触到受损的血管表面,特别是血管壁中的胶原纤维时,血小板会迅速且显著地改变其自身特性(图37-1)。它们开始膨胀,呈现出不规则形状,表面伸出许多放射状的伪足,其收缩蛋白强力收缩,导致含有多种活性因子的颗粒释放,并且它们变得粘附,从而粘附到组织中的胶原以及一种称为von Willebrand因子(vWF)的蛋白质上,vWF从血浆渗入受损组织。血小板表面糖蛋白与受损内皮下方暴露的基质中的vWF结合。然后,血小板分泌更多的ADP和血小板激活因子(PAF),其酶形成血栓素A2。血栓素是一种血管收缩剂,与ADP和PAF一起作用于附近的血小板,使它们也被激活;这些额外激活的血小板的粘附性使它们粘附到最初激活的血小板上。
因此,在血管壁穿刺处,受损的血管壁激活了越来越多的血小板,这些血小板吸引了越来越多的额外血小板,从而形成血小板栓。这个栓最初是松散的,但如果血管开口很小,通常能够成功阻止血液流失。然后,在随后的血液凝固过程中,形成纤维蛋白线。这些线紧密地附着在血小板上,从而构建出一个坚固的栓。
血小板机制对封闭血管孔的重要性。血小板栓机制对于封闭每天发生数千次的微小血管中的微小破裂极为重要。事实上,内皮细胞本身的多个小孔通常通过血小板与内皮细胞融合形成额外的内皮细胞膜来封闭。每天在皮肤下(紫癜,表现为皮肤上的紫色或红色斑点)和全身内部组织中会出现数千个小出血区域,这种情况在血小板数量较少的人中常见。这种现象在血小板数量正常的人中不会发生。
破裂血管中的血液凝固
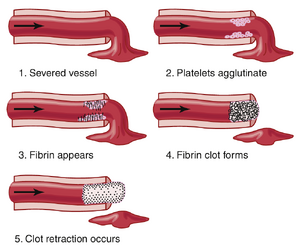
止血的第三种机制是血凝块的形成。如果血管壁受到严重创伤,血凝块会在15到20秒内开始形成;如果创伤较轻,则会在1到2分钟内开始形成。来自受伤血管壁、血小板以及附着在受伤血管壁上的血液蛋白的激活物质会启动凝血过程。该过程的物理事件如图37-2所示;表37-1列出了最重要的凝血因子。
在血管破裂后的3到6分钟内,如果血管开口不是太大,整个开口或断裂端会被血凝块填满。20到60分钟后,血凝块会收缩,进一步封闭血管。血小板在这一血凝块收缩过程中也起着重要作用,稍后将讨论。
血凝块的纤维化或溶解
一旦血凝块形成,它可能遵循以下两种途径之一:(1) 它可能被成纤维细胞侵入,随后在整个血凝块中形成结缔组织;或(2) 它可能溶解。通常,在血管壁小孔中形成的血凝块会被成纤维细胞侵入,这一过程在血凝块形成后的几小时内开始,至少部分由血小板分泌的生长因子促进。这一过程继续,大约在1到2周内将血凝块完全组织成纤维组织。
相反,当过多的血液渗入组织,并且在不需要的地方形成组织血凝块时,血凝块中的特殊物质通常会被激活。这些物质作为酶溶解血凝块,稍后将在本章讨论。
血液凝固的机制
一般机制
在血液和组织中已经发现了超过50种引起或影响血液凝固的重要物质——一些促进凝固的物质称为促凝剂(procoagulants),另一些抑制凝固的物质称为抗凝剂(anticoagulants)。血液是否会凝固取决于这两类物质之间的平衡。在血流中,抗凝剂通常占主导地位,因此血液在血管中循环时不会凝固。然而,当血管破裂时,来自组织损伤区域的促凝剂被激活并压倒抗凝剂,然后就会形成血凝块。
凝血过程包括三个基本步骤:
- 作为对血管破裂或血液本身损伤的响应,血液中发生了一系列复杂的化学反应,涉及超过12种凝血因子(blood coagulation factors)。最终结果是形成了一组被统称为凝血酶原激活物(prothrombin activator)的活化物质复合物。
- 凝血酶原激活物催化凝血酶原(prothrombin)转化为凝血酶(thrombin)。
- 凝血酶作为一种酶,将纤维蛋白原(fibrinogen)转化为纤维蛋白(fibrin)纤维,这些纤维网罗血小板、血细胞和血浆,形成血凝块。
我们将首先讨论血凝块形成的机制,从凝血酶原转化为凝血酶开始,然后再回到凝血过程中形成凝血酶原激活物的起始阶段。
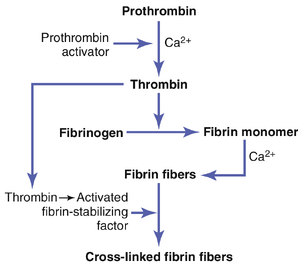
凝血酶原转化为凝血酶
- 凝血酶原激活物的形成是由于血管破裂或血液中特殊物质受损的结果。
- 在足够量的离子钙存在下,凝血酶原激活物促使凝血酶原转化为凝血酶(图37-3和37-4)。
- 凝血酶在接下来的10到15秒内促使纤维蛋白原分子聚合成纤维蛋白纤维。
因此,导致血液凝固的限速因素通常是凝血酶原激活物的形成,而不是其后的反应,因为这些最终步骤通常迅速发生以形成血凝块。
图37-4. 血管损伤后的凝血级联反应。血液暴露于血管壁导致内皮细胞释放组织因子(也称为因子III或凝血活酶),磷脂表达,凝血酶激活,然后作用于纤维蛋白原形成纤维蛋白,纤维蛋白聚合形成网状结构,稳定血小板栓。
血小板在凝血酶原转化为凝血酶的过程中也起着重要作用,因为大部分凝血酶原首先附着在已经结合到受损组织的血小板上的凝血酶原受体上。
凝血酶原(prothrombin)和凝血酶(thrombin)。凝血酶原是一种血浆蛋白,属于\bfa2-球蛋白(globulin),分子量为68,700。它在正常血浆中的浓度约为15mg/dl。凝血酶原是一种不稳定的蛋白质,容易分解成较小的化合物,其中之一就是凝血酶,其分子量为33,700,几乎是凝血酶原的一半。
凝血酶原由肝脏持续合成,并在全身不断用于血液凝固。如果肝脏不能产生凝血酶原,血浆中的凝血酶原浓度会在一天左右下降到无法提供正常血液凝固的水平。
肝脏需要维生素K来正常激活凝血酶原以及其他一些凝血因子。因此,缺乏维生素K或存在阻碍正常凝血酶原形成的肝脏疾病,都会使凝血酶原水平降低到导致出血倾向的程度。
纤维蛋白原(fibrinogen)转化为纤维蛋白(fibrin)——血凝块的形成
肝脏合成的纤维蛋白原是血凝块形成的关键。纤维蛋白原是一种高分子量蛋白质(分子量\approx340,000,),在血浆中的含量为100到700~mg/dl。纤维蛋白原在肝脏中合成,肝脏疾病会降低循环中纤维蛋白原的浓度,正如之前提到的凝血酶原浓度降低一样。
由于其分子量大,正常情况下纤维蛋白原很少从血管渗漏到组织液中,而由于纤维蛋白原是凝血过程中的关键因子之一,组织液通常不会凝固。然而,当毛细血管的通透性病理性增加时,纤维蛋白原确实会渗漏到组织液中,其量足以使这些液体凝固,就像血浆和全血可以凝固一样。
凝血酶作用于纤维蛋白原形成纤维蛋白。凝血酶是一种具有弱蛋白水解能力的蛋白酶。它作用于纤维蛋白原,从每个纤维蛋白原分子中去除四个低分子量肽,形成一个具有自动聚合能力的纤维蛋白单体分子,与其他纤维蛋白单体分子聚合形成纤维蛋白纤维。因此,许多纤维蛋白单体分子在几秒钟内聚合成构成血凝块网状结构的纤维蛋白纤维。
在聚合的早期阶段,纤维蛋白单体分子通过弱的非共价氢键结合在一起,新形成的纤维之间没有交联。因此,形成的凝块较弱,容易破裂。然而,在接下来的几分钟内会发生另一个过程,大大增强了纤维蛋白网状结构的强度。这个过程涉及一种称为纤维蛋白稳定因子(fibrin stabilizing factor)的物质,它在正常血浆球蛋白中少量存在,但也从被困在凝块中的血小板中释放出来。纤维蛋白稳定因子在作用于纤维蛋白纤维之前必须被激活。导致纤维蛋白形成的凝血酶也会激活纤维蛋白稳定因子。这种激活的物质随后作为酶发挥作用,在越来越多的纤维蛋白单体分子之间形成共价键,并在相邻的纤维蛋白纤维之间形成多重交联,从而极大地增强了纤维蛋白网状结构的三维强度。
血凝块。血凝块由向各个方向延伸的纤维蛋白(fibrin)纤维网组成,这些纤维网捕获了血细胞、血小板(platelet)和血浆(plasma)(见图37-4)。纤维蛋白纤维还粘附在血管的受损表面;因此,血凝块会粘附在任何血管开口处,从而防止进一步失血。
血凝块收缩和血清(serum)的排出。血凝块形成后几分钟内,它开始收缩,通常在20到60分钟内排出大部分液体。排出的液体称为血清,因为其中所有的纤维蛋白原(fibrinogen)和大多数其他凝血因子(clotting factor)已被去除;因此,血清与血浆不同,由于缺乏这些因子,血清无法凝固。
血小板对于血凝块收缩是必需的。因此,血凝块收缩失败表明循环血液中的血小板数量可能较低。血凝块中血小板的电子显微照片显示,它们以某种方式附着在纤维蛋白纤维上,实际上将不同的纤维结合在一起。此外,被困在血凝块中的血小板继续释放促凝物质(procoagulant substance),其中最重要的是纤维蛋白稳定因子(fibrin stabilizing factor),它导致相邻纤维蛋白纤维之间越来越多的交联键。此外,血小板通过激活血小板中的血栓收缩蛋白(thrombosthenin)、肌动蛋白(actin)和肌球蛋白(myosin)分子直接促进血凝块收缩,这些都是血小板中的收缩蛋白;它们导致附着在纤维蛋白上的血小板棘突强烈收缩。这一作用也有助于将纤维蛋白网压缩成更小的块。凝血酶(thrombin)和从血小板线粒体、内质网和高尔基体中的钙库释放的钙离子激活并加速了这种收缩。
随着血凝块收缩,破裂血管的边缘被拉在一起,从而进一步促进止血(hemostasis)。
血凝块形成的正反馈
一旦血凝块开始形成,它通常会在几分钟内扩展到周围的血液中——也就是说,血凝块启动了一个正反馈以促进更多的凝血。这种凝血促进的最重要原因之一是凝血酶的蛋白水解作用使其能够作用于除纤维蛋白原之外的许多其他凝血因子。例如,凝血酶对凝血酶原(prothrombin)有直接的蛋白水解作用,倾向于将其转化为更多的凝血酶,并且它作用于一些负责形成凝血酶原激活物(prothrombin activator)的凝血因子。(这些效应,在后续段落中讨论,包括加速因子VIII、IX、X、XI和XII的作用以及血小板的聚集。)一旦形成临界量的凝血酶,就会产生正反馈,导致更多的血液凝固和越来越多的凝血酶形成;因此,血凝块继续增长,直到血液泄漏停止。
凝血启动:凝血酶原激活物的形成
在讨论了凝血过程之后,接下来将描述更为复杂的启动凝血机制。这些机制由以下因素触发:(1) 血管壁及邻近组织的损伤;(2) 血液的损伤;或 (3) 血液与受损的内皮细胞或血管外的胶原及其他组织成分接触。在每种情况下,这些都会导致凝血酶原激活物(prothrombin activator)的形成,进而促使凝血酶原(prothrombin)转化为凝血酶(thrombin),并引发后续的所有凝血步骤。
图 37-5. 启动血液凝固的外源性途径(extrinsic pathway)
凝血酶原激活物通常被认为通过两种方式形成,尽管实际上这两种方式会不断相互作用:(1) 通过外源性途径(extrinsic pathway),该途径始于血管壁及周围组织的损伤;(2) 通过内源性途径(intrinsic pathway),该途径始于血液内部。
在外源性和内源性途径中,一系列被称为凝血因子(blood-clotting factors)的不同血浆蛋白起着主要作用。这些蛋白质大多数是蛋白水解酶(proteolytic enzymes)的非活性形式。当它们转化为活性形式时,其酶促作用会导致凝血过程的连续级联反应。
表 37-1 中列出的大多数凝血因子用罗马数字表示。为了表示因子的活化形式,在罗马数字后添加一个小写字母“a”,例如因子 VIIIa 表示因子 VIII 的活化状态。
启动凝血的外源性途径
启动凝血酶原激活物形成的外源性途径始于受损的血管壁或与血液接触的受损血管外组织。这种情况会导致以下步骤,如图 37-4 和图 37-5 所示:
- 组织因子的释放:受损组织释放一种由多种因子组成的复合物,称为组织因子(tissue factor)或组织凝血活酶(tissue thromboplastin)。该因子主要由组织膜中的磷脂(phospholipids)和一种主要作为蛋白水解酶(proteolytic enzyme)起作用的脂蛋白复合物(lipoprotein complex)组成。
- 因子 X 的激活——因子 VII 和组织因子的作用:组织因子的脂蛋白复合物进一步与血液凝固因子 VII 结合,并在钙离子存在下,以酶促方式作用于因子 X,形成活化因子 X (Xa)。
Xa因子形成凝血酶原激活物的作用——因子V的作用。激活的X因子立即与组织因子中的组织磷脂或从血小板释放的额外磷脂以及因子V结合,形成称为凝血酶原激活物的复合物。在Ca^2+存在的情况下,凝血酶原在几秒钟内被裂解形成凝血酶,凝血过程如之前所述继续进行。最初,凝血酶原激活物复合物中的因子V是无活性的,但一旦凝血开始且凝血酶开始形成,凝血酶的蛋白水解作用会激活因子V。这种激活随后成为凝血酶原激活的额外强加速剂。因此,在最终的凝血酶原激活物复合物中,激活的X因子是实际导致凝血酶原裂解形成凝血酶的蛋白酶。激活的因子V大大加速了这种蛋白酶活性,而血小板磷脂则作为进一步加速该过程的载体。特别要注意的是,凝血酶通过因子V的正反馈作用,一旦开始就会加速整个过程。
启动凝血的内源性途径
启动凝血酶原激活物形成并因此启动凝血的第二种机制始于血液创伤或血液暴露于创伤血管壁的胶原蛋白。然后,该过程通过图37-6所示的一系列级联反应继续进行。
- 血液创伤导致(1)因子Xll的激活和(2)血小板磷脂的释放。血液创伤或血液暴露于血管壁胶原蛋白会改变血液中的两个重要凝血因子:因子XII和血小板。当因子XII受到干扰时,例如通过与胶原蛋白或玻璃等可湿润表面接触,它会采取新的分子构型,将其转化为称为激活因子XII的蛋白水解酶。同时,血液创伤也会因血小板粘附于胶原蛋白或可湿润表面(或以其他方式受损)而损伤血小板;这会释放含有称为血小板因子3的脂蛋白的血小板磷脂,该脂蛋白在随后的凝血反应中也起作用。
- 因子Xl的激活。激活的因子XII还以酶促方式作用于因子XI以激活该因子,这是内源性途径的第二步。
图37-6. 启动凝血的内源性途径。HMW,高分子量。
该反应还需要高分子量激肽原,并被前激肽释放酶加速。3. 激活的因子Xl对因子IX的激活。激活的因子XI然后以酶促方式作用于因子IX以激活该因子。
- 因子X的激活——因子Vlll的作用。激活的因子IX与激活的因子VIII、血小板磷脂以及来自创伤血小板的因子III协同作用,激活因子X。显然,当因子VIII或血小板供应不足时,这一步就会不足。因子VIII是经典血友病患者所缺乏的因子,因此被称为抗血友病因子。血小板是称为血小板减少症的出血性疾病中缺乏的凝血因子。
- 激活的因子X形成凝血酶原激活物(prothrombin activator)的作用——因子V的作用。内源性途径(intrinsic pathway)中的这一步与外源性途径(extrinsic pathway)的最后一步相同。也就是说,激活的因子X与因子V以及血小板或组织磷脂结合,形成称为凝血酶原激活物的复合物。凝血酶原激活物反过来在几秒钟内启动凝血酶原(prothrombin)的裂解,形成凝血酶(thrombin),从而启动最终的凝血过程,如前所述。
钙离子在内源性和外源性途径中的作用
除了内源性途径的前两步外,所有凝血反应都需要钙离子来促进或加速。因此,在缺乏钙离子的情况下,无论是通过哪种途径,血液都不会凝固。
在活体中,钙离子浓度很少低到足以显著影响凝血动力学。然而,当血液从人体中取出时,可以通过将钙离子浓度降低到凝血阈值以下来防止其凝固,这可以通过使钙离子与柠檬酸根离子等物质反应而去离子化,或者通过使用草酸根离子等物质沉淀钙离子来实现。
外源性和内源性途径的相互作用——凝血启动的总结
从内源性和外源性系统的示意图中可以清楚地看出,血管破裂后,凝血会同时通过两种途径发生。组织因子(tissue factor)启动外源性途径,而因子XII和血小板与血管壁中的胶原接触则启动内源性途径。
外源性和内源性途径之间的一个重要区别是,外源性途径可能是爆炸性的;一旦启动,其完成最终凝血的速度仅受限于从受损组织中释放的组织因子的量以及血液中因子X、VII和V的数量。在严重的组织创伤下,凝血可能在短短15秒内发生。内源性途径的进行要慢得多,通常需要1到6分钟才能引起凝血。
血管内抗凝剂防止正常血管系统中的血液凝固
内皮表面因素。防止正常血管系统中凝血的最重要因素可能是以下几点:(1) 内皮细胞表面的光滑性,防止内源性凝血系统的接触激活;(2) 内皮上的一层糖萼(glycocalyx)(糖萼是一种吸附在内皮细胞表面的粘多糖),它排斥凝血因子和血小板,从而防止凝血激活;(3) 与内皮膜结合的蛋白质,血栓调节蛋白(thrombomodulin),它与凝血酶结合。凝血酶与血栓调节蛋白的结合不仅通过去除凝血酶来减缓凝血过程,而且血栓调节蛋白-凝血酶复合物还激活一种血浆蛋白,蛋白C,它通过灭活激活的因子V和VIII来发挥抗凝作用。
当内皮壁受损时,其光滑性和糖萼-血栓调节蛋白层会丢失,这会激活因子XII和血小板,从而启动内源性凝血途径。如果因子XII和血小板与内皮下胶原接触,激活作用会更加强大。
完整的血管内皮细胞还会产生其他物质,如前列环素(prostacyclin)和一氧化氮(nitric oxide, NO),它们能够抑制血小板聚集和血液凝固的启动。前列环素,也称为前列腺素I2 (PGI2),是类二十烷酸(eicosanoid)家族脂质的一员,具有血管扩张作用,同时也是血小板聚集的抑制剂。正如第17章所讨论的,NO是一种强效的血管扩张剂,由全身健康的血管内皮细胞释放,并且是血小板聚集的重要抑制剂。当内皮细胞受损时,它们产生前列环素和NO的能力会大大降低。
纤维蛋白和抗凝血酶III的抗凝血作用
血液中最重要的抗凝剂之一是那些能够从血液中去除凝血酶的物质。其中最强大的包括:(1) 在凝血过程中形成的纤维蛋白纤维;(2) 一种称为抗凝血酶III(antithrombin III)或抗凝血酶-肝素辅因子(antithrombinheparin cofactor)的α球蛋白。
在血凝块形成过程中,大约85%到90%的由凝血酶原(prothrombin)生成的凝血酶会被吸附到正在形成的纤维蛋白纤维上。这种吸附有助于防止凝血酶扩散到剩余的血液中,从而防止血凝块的过度扩散。
未吸附到纤维蛋白纤维上的凝血酶很快会与抗凝血酶III结合。这进一步阻断了凝血酶对纤维蛋白原(fibrinogen)的作用,并在接下来的12到20分钟内使凝血酶本身失活。
肝素(Heparin)。肝素是另一种强效的抗凝剂,但由于其在血液中的浓度通常较低,只有在特殊的生理条件下才具有显著的抗凝作用。然而,肝素在医疗实践中被广泛用作药物,以更高的浓度来预防血管内凝血。
肝素分子是一种高度带负电荷的共轭多糖。它本身几乎没有或完全没有抗凝特性,但当它与抗凝血酶III结合时,抗凝血酶III去除凝血酶的效率会提高百倍到千倍,从而起到抗凝作用。因此,在过量肝素存在的情况下,抗凝血酶III从循环血液中去除游离凝血酶几乎是瞬间完成的。
肝素和抗凝血酶III的复合物除了去除凝血酶外,还能去除其他几种活化的凝血因子,进一步增强抗凝效果。这些因子包括活化的因子IX到XII。
肝素由体内许多不同的细胞产生,但最大量的肝素是由位于全身毛细血管周围结缔组织中的嗜碱性肥大细胞(basophilic mast cells)形成的。这些细胞持续分泌少量肝素,扩散到循环系统中。血液中的嗜碱性细胞(basophil cells)在功能上与肥大细胞几乎相同,也会向血浆中释放少量肝素。
肥大细胞在肺毛细血管周围组织中非常丰富,在肝毛细血管周围组织中则较少。很容易理解为什么这些区域可能需要大量的肝素,因为肺和肝的毛细血管会接收许多在缓慢流动的静脉血中形成的栓塞性血凝块;足够的肝素生成可以防止这些血凝块的进一步生长。
纤溶酶(plasmin)引起血凝块的溶解
血浆蛋白中含有一种称为纤溶酶原(profibrinolysin)的优球蛋白,当其被激活时,会变成一种称为纤溶酶(fibrinolysin)的物质。纤溶酶是一种类似于胰蛋白酶(trypsin)的蛋白水解酶,胰蛋白酶是胰腺分泌的最重要的蛋白水解消化酶。纤溶酶消化纤维蛋白纤维和一些其他蛋白质凝固剂,如纤维蛋白原(fibrinogen)、因子V(factor V)、因子VIII(factor VIII)、凝血酶原(prothrombin)和因子XII(factor XII)。因此,每当纤溶酶形成时,它可以通过破坏许多凝血因子来引起血凝块的溶解,从而有时甚至会导致血液的低凝状态。
纤溶酶原激活形成纤溶酶,然后溶解血凝块。当血凝块形成时,大量的纤溶酶原与其他血浆蛋白一起被困在血凝块中。在被激活之前,它不会变成纤溶酶或引起血凝块的溶解。受伤的组织和血管内皮非常缓慢地释放一种强大的激活剂,称为组织纤溶酶原激活剂(tissue plasminogen activator, t-PA);在血凝块止血几天后,t-PA最终将纤溶酶原转化为纤溶酶,纤溶酶进而清除剩余的不必要的血凝块。事实上,许多被血凝块阻塞血流的小血管通过这种机制重新开放。因此,纤溶酶系统的一个特别重要的功能是从数百万个最终会被阻塞的微小外周血管中清除微小的血凝块,如果没有办法清除它们的话。
导致人类过度出血的情况
过度出血可能是由于许多凝血因子中的任何一种缺乏引起的。这里讨论三种研究最多的出血倾向——由(1)维生素K缺乏、(2)血友病和(3)血小板减少症(血小板缺乏)引起的出血。
维生素K缺乏导致的凝血酶原、因子VII、因子IX和因子X减少
几乎没有例外,几乎所有凝血因子都是由肝脏形成的。因此,肝脏疾病如肝炎、肝硬化和急性黄色萎缩(由毒素、感染或其他因素引起的肝脏变性)有时会严重抑制凝血系统,以至于患者出现严重的出血倾向。
肝脏凝血因子形成减少的另一个原因是维生素K缺乏。维生素K是肝脏羧化酶(carboxylase)的必需因子,该酶在五种重要的凝血因子——凝血酶原、因子VII、因子IX、因子X和蛋白C——的谷氨酸残基上添加羧基。在未成熟的凝血因子的谷氨酸残基上添加羧基后,维生素K被氧化并失活。另一种酶,维生素K环氧化物还原酶复合物1(vitamin K epoxide reductase complex 1, VKORC1),将维生素K还原为其活性形式。在没有活性维生素K的情况下,血液中这些凝血因子的后续不足可能导致严重的出血倾向。
维生素K在肠道中由细菌持续合成,因此健康人很少因饮食中缺乏维生素K而发生维生素K缺乏(新生儿除外,在他们建立肠道菌群之前)。然而,在患有胃肠道疾病的人中,维生素K缺乏通常是由于胃肠道对脂肪的吸收不良引起的,因为维生素K是脂溶性的,通常与脂肪一起被吸收到血液中。
维生素K缺乏最常见的原因之一是肝脏未能将胆汁分泌到胃肠道中,这是由于胆管阻塞或肝脏疾病引起的。缺乏胆汁会阻碍脂肪的充分消化和吸收,因此也会抑制维生素K的吸收。因此,肝脏疾病通常会导致凝血酶原和其他一些凝血因子的生成减少,这是由于维生素K吸收不良以及肝细胞病变所致。因此,在手术前,患有肝脏疾病或胆管阻塞的患者通常会注射维生素K。通常,如果在手术前4到8小时给缺乏维生素K的患者补充维生素K,并且肝实质细胞的功能至少有一半正常,那么将产生足够的凝血因子以防止手术过程中过度出血。
一种具有不同特征的疾病,称为von Willebrand病,是由于大分子成分的缺失引起的。
当患有经典血友病的人经历严重且长时间的出血时,几乎唯一真正有效的治疗方法是注射纯化的因子VIII或因子IX。这两种凝血因子现在都可以作为重组蛋白使用,尽管它们价格昂贵且半衰期相对较短;因此,这些产品对于许多血友病患者来说并不容易获得,尤其是在经济欠发达国家。
血友病
血友病是一种几乎只发生在男性中的出血性疾病。在85%的病例中,它是由因子VIII的异常或缺乏引起的;这种类型的血友病称为血友病A或经典血友病。在美国,每10,000名男性中约有1人患有经典血友病。在其他15%的血友病B患者中,出血倾向是由因子IX的缺乏引起的。这两种因子都是通过女性(X)染色体遗传的,并且在遗传上是隐性的。因此,女性很少会患有血友病,因为她的两条X染色体中至少有一条具有适当的基因。如果她的其中一条X染色体有缺陷,她将成为血友病携带者;她的男性后代有50%的机会继承这种疾病,而她的女性后代有50%的机会继承携带者状态。
尽管女性携带者有一个正常的等位基因,通常不会发展出有症状的血友病,但有些人可能会经历轻微的出血倾向。女性携带者也可能由于部分或全部正常X染色体的丢失(如在Turner综合征中)或X染色体的失活(lyonization)而发展出轻度血友病。女性要继承完全有症状的血友病A或B,她必须获得两条有缺陷的X染色体,一条来自她的携带者母亲,另一条来自她的父亲,而她的父亲必须患有血友病。大多数血友病病例是遗传的,但大约三分之一的血友病患者没有家族病史,这似乎是由新的突变事件引起的。
血友病(hemophilia)的出血特征可能有不同程度的严重性,这取决于遗传缺陷。通常只有在创伤后才会发生出血,但在一些患者中,导致严重和长时间出血所需的创伤程度可能非常轻微,以至于几乎无法察觉。例如,拔牙后出血通常会持续数天。
因子VIII(Factor VIII)有两个活性成分,一个分子量达数百万的大成分和一个分子量约为230,000的小成分。小成分在内源性凝血途径(intrinsic pathway)中最为重要,正是因子VIII这一部分的缺乏导致了典型的血友病。另一种出血
血小板减少症(THROMBOCYTOPENIA)
血小板减少症(thrombocytopenia)意味着循环血液中血小板数量非常低。与血友病患者一样,血小板减少症患者也有出血倾向,只是出血通常来自许多小静脉或毛细血管,而不是像血友病那样来自较大的血管。因此,全身组织都会出现小的点状出血。这种患者的皮肤会出现许多小的瘀点(petechiae),即红色或紫色的斑点,因此该病被称为血小板减少性紫癜(thrombocytopenic purpura)。如前所述,血小板对于修复毛细血管和其他小血管的微小破损尤为重要。
血小板计数低于30,000/μ(正常值为150,000至450,000/μ)会增加手术或受伤后过度出血的风险。然而,通常只有当血液中的血小板数量低于30,000/μ时才会发生自发性出血。低至10,000/μ的水平通常是致命的。
即使不测定血液中的具体血小板计数,有时如果患者的血凝块未能收缩,也可以怀疑存在血小板减少症。如前所述,血凝块收缩通常依赖于从被困在血凝块纤维蛋白网中的大量血小板释放的多种凝血因子。
血小板减少症的主要原因包括:(1)由于感染或败血症、营养缺乏或骨髓增生异常综合征(myelodysplastic disorders)导致骨髓中血小板生成减少,这些疾病通常也会减少其他细胞(红细胞[RBCs]和白细胞)的生成;(2)抗体破坏外周血小板;(3)血小板在脾脏中的滞留(汇集),特别是在门静脉高压(portal hypertension)和脾脏过大(splenomegaly)的个体中;(4)血栓中血小板的消耗;以及(4)液体复苏或大量输血导致的血液稀释。
大多数血小板减少症患者患有特发性血小板减少症(idiopathic thrombocytopenia),这意味着原因不明的血小板减少症。在大多数这类患者中,发现由于未知原因形成了特异性抗体并作用于血小板以破坏它们。通过输注含有大量血小板的新鲜全血,通常可以在1至4天内缓解血小板减少症患者的出血。此外,脾切除术(splenectomy)可能有所帮助,有时几乎可以完全治愈,因为脾脏通常会从血液中清除大量血小板。
血栓栓塞性疾病(THROMBOEMBOLIC CONDITIONS)
血栓和栓塞
在血管中形成的异常凝块被称为血栓(thrombus)。一旦凝块形成,持续的血液流动可能会使其脱离附着部位,并随血液流动;这种自由流动的凝块被称为栓塞(emboli)。此外,起源于大动脉或心脏左侧的栓塞可能会流向周围,堵塞大脑、肾脏或其他部位的动脉或小动脉。起源于静脉系统或心脏右侧的栓塞通常会流入肺部,导致肺动脉栓塞(pulmonary arterial embolism)。
血栓栓塞性疾病的原因
人类血栓栓塞性疾病的原因通常有两个:(1)血管内皮表面粗糙——可能由动脉硬化(arteriosclerosis)、感染或创伤引起——可能启动凝血过程;(2)当血液在血管中流动非常缓慢时,通常会形成凝血块,因为此时会不断形成少量的凝血酶(thrombin)和其他促凝物质(procoagulants)。
组织纤溶酶原激活剂在治疗血管内凝块中的应用
基因工程组织纤溶酶原激活剂(tissue plasminogen activator, t-PA)已经可用。当通过导管输送到有血栓的区域时,它能有效激活纤溶酶原(plasminogen)转化为纤溶酶(plasmin),从而溶解一些血管内凝块。例如,如果在冠状动脉血栓闭塞后的1或2小时内使用,通常可以避免心脏受到严重损害。
股静脉血栓和大面积肺栓塞
由于当血液在身体的任何血管中被阻塞数小时时几乎总是会发生凝血,因此卧床不起的患者,加上用枕头垫高膝盖的做法,常常会导致血管内凝血,因为血液在一条或多条腿部静脉中停滞数小时。然后,凝块主要在缓慢流动的静脉血液方向上生长,有时会生长到整个腿部静脉的长度,偶尔甚至会向上延伸到髂总静脉(common iliac vein)和下腔静脉(inferior vena cava)。大约10%的情况下,凝块的大部分会脱离血管壁的附着,随静脉血液自由流动,通过心脏右侧进入肺动脉,导致肺动脉大面积阻塞;这被称为大面积肺栓塞(massive pulmonary embolism)。如果凝块足够大,同时阻塞两条肺动脉,就会立即导致死亡。如果只有一条肺动脉被阻塞,可能不会立即死亡,或者栓塞可能会在几小时到几天后由于凝块在肺血管中的进一步生长而导致死亡。然而,t-PA治疗再次可以成为救命的手段。
弥散性血管内凝血
偶尔,凝血机制会在循环系统的广泛区域被激活,导致一种称为弥散性血管内凝血(disseminated intravascular coagulation, DIC)的病症。这种情况通常是由于体内存在大量受损或死亡的组织,这些组织释放大量组织因子进入血液所致。通常,这些血凝块很小但数量众多,它们堵塞了大部分外周小血管。这一过程尤其常见于广泛性败血症患者,其中循环的细菌或细菌毒素——尤其是内毒素——激活了凝血机制。外周小血管的堵塞大大减少了氧气和其他营养物质向组织的输送,这种情况会导致或加重循环性休克。这也是为什么败血症性休克在35%到50%的患者中是致命的部分原因。
弥散性血管内凝血的一个奇特效应是,患者有时会开始出血。这种出血的原因是,由于广泛的凝血消耗了太多的凝血因子,导致剩余的血液中几乎没有足够的促凝物质来维持正常的止血功能。
临床使用的抗凝剂
在某些血栓栓塞性疾病中,延缓凝血过程是可取的。为此,已经开发了各种抗凝剂。临床上最有用的抗凝剂是肝素和香豆素类。
肝素——静脉抗凝剂
商业肝素是从几种不同的动物组织中提取的,并以几乎纯的形式制备。注射相对少量的肝素,大约0.5到1 mg/kg体重,可以使血液凝固时间从正常的约6分钟增加到30分钟或更长。此外,这种凝血时间的变化是即时发生的,从而立即预防或减缓血栓栓塞性疾病的进一步发展。
肝素的作用持续约1.5到4小时。注射的肝素会被血液中的一种称为肝素酶的酶破坏。
香豆素类作为抗凝剂
当给患者服用香豆素类药物(如华法林)时,由肝脏形成的活性凝血酶原和因子VII、IX、X的量开始下降。华法林通过抑制酶VKORC1产生这种效果。如前所述,这种酶将无活性的氧化形式的维生素K转化为其活性的还原形式。通过抑制VKORC1,华法林减少了组织中可用的活性维生素K的量。当这种减少发生时,凝血因子不再被羧化,并且在生物学上无活性。在几天内,体内的活性凝血因子储存降解并被无活性的因子取代。尽管凝血因子继续产生,但它们的凝血活性大大降低。
在服用有效剂量的华法林后,血液的凝血活性在12小时后降至正常的约50%,在24小时后降至正常的约20%。换句话说,凝血过程不会立即被阻断,而是必须等待血浆中已有的活性凝血酶原和其他受影响的凝血因子的降解。通常在停止香豆素治疗后1到3天,凝血功能恢复正常。
体外预防血液凝固
尽管从体内取出并置于玻璃试管中的血液通常会在约6分钟内凝固,但在硅化容器中收集的血液通常1小时或更长时间都不会凝固。这种延迟的原因是,用硅酮处理容器表面可以防止血小板和因子XII的接触激活,这是启动内源性凝血机制的两个主要因素。相反,未经处理的玻璃容器允许血小板和因子XII的接触激活,从而迅速形成血凝块。
肝素(heparin)可用于防止体外和体内的血液凝固。肝素特别用于外科手术中,在这些手术中,血液必须通过心肺机或人工肾机,然后再返回患者体内。
各种降低血液中钙离子浓度的物质也可用于防止体外血液凝固。例如,将少量可溶性草酸盐化合物与血液样本混合,会导致血浆中的草酸钙沉淀,从而大大降低离子钙水平,以至于血液凝固被阻断。
任何使血液钙去离子化的物质都会阻止凝固。带负电荷的柠檬酸根离子在这方面特别有价值;它通常以柠檬酸钠、柠檬酸铵或柠檬酸钾的形式与血液混合。柠檬酸根离子与血液中的钙结合,生成非离子化的钙化合物,缺乏离子钙会阻止凝固。柠檬酸盐抗凝剂比草酸盐抗凝剂有一个重要的优势,因为草酸盐对身体有毒,而适量的柠檬酸盐可以静脉注射。注射后,柠檬酸根离子在几分钟内被肝脏从血液中移除,并聚合成葡萄糖或直接代谢为能量。因此,通常可以在几分钟内将500毫升用柠檬酸盐处理过的不可凝固血液输给受血者,而不会产生严重后果。然而,如果肝脏受损,或者大量柠檬酸盐血液或血浆输注过快(在几分钟内),柠檬酸根离子可能无法迅速移除,在这种情况下,柠檬酸盐会大大降低血液中的钙离子水平,从而导致手足抽搐和抽搐性死亡。
血液凝固测试
出血时间
当用锋利的刀刺破指尖或耳垂时,出血通常持续1到6分钟。这个时间在很大程度上取决于伤口的深度和测试时手指或耳垂的充血程度。缺乏任何一种凝血因子都会延长出血时间,但缺乏血小板尤其会延长出血时间。
凝血时间
已经设计了许多测定血液凝固时间的方法。最广泛使用的方法是将血液收集在化学清洁的玻璃试管中,然后每隔约30秒倾斜试管,直到血液凝固。通过这种方法,正常凝血时间为6到10分钟。还设计了使用多个试管的程序,以更准确地测定凝血时间。
不幸的是,凝血时间(blood clotting time)因测量方法的不同而有很大差异,因此许多诊所不再使用这种方法。取而代之的是,使用复杂的化学程序直接测量凝血因子(clotting factors)的浓度。
凝血酶原时间(Prothrombin Time)和国际标准化比值(International Normalized Ratio, INR)
凝血酶原时间(prothrombin time)反映了血液中凝血酶原(prothrombin)的浓度。图37-7显示了凝血酶原浓度与凝血酶原时间之间的关系。测定凝血酶原时间的方法如下:
从患者身上抽取的血液立即加入草酸盐(oxalate),以防止凝血酶原转化为凝血酶(thrombin)。然后,将过量的钙离子(calcium ion)和组织因子(tissue factor)迅速与草酸化血液混合。过量的钙离子中和了草酸盐的作用,而组织因子通过外源性凝血途径(extrinsic clotting pathway)激活凝血酶原转化为凝血酶的反应。凝血所需的时间称为凝血酶原时间。时间的短长主要取决于凝血酶原的浓度。正常的凝血酶原时间约为12秒。在每个实验室中,都会根据所使用的方法绘制凝血酶原浓度与凝血酶原时间的关系曲线,如图37-7所示,以便对血液中的凝血酶原进行定量分析。
图37-7. 血液中凝血酶原浓度与凝血酶原时间的关系。
凝血酶原时间的测定结果可能会有很大差异,即使在同一人身上,如果使用的组织因子活性和分析系统不同,结果也会有所不同。组织因子是从人体组织(如胎盘组织(placental tissue))中分离出来的,不同批次的组织因子可能具有不同的活性。国际标准化比值(INR)是为了标准化凝血酶原时间的测量而设计的。对于每批组织因子,制造商会指定一个国际敏感指数(international sensitivity index, ISI),该指数表示组织因子与标准化样品的活性。ISI通常在1.0到2.0之间变化。INR是患者凝血酶原时间(PT)与正常对照样本凝血酶原时间的比值,再乘以ISI的幂:
|N R=\left(\fracP Tt e s tP Tn o r m a l\right)^|S|
健康人的INR正常范围为0.9到1.3。较高的INR值(例如4或5)表明出血风险较高,而较低的INR值(例如0.5)则表明可能存在血栓的风险。接受华法林(warfarin)治疗的患者通常INR值在2.0到3.0之间。
类似于凝血酶原时间和INR的测试已被设计用于测定其他凝血因子的数量。在这些测试中,除了被测因子外,过量的钙离子和其他所有因子都会一次性加入草酸化血液中。然后,以与凝血酶原时间相同的方式测定凝血所需的时间。如果被测因子缺乏,凝血时间会延长。凝血时间本身可以用来定量该因子的浓度。
