第十一单元 神经系统:运动和整合神经生理学:修订间差异
自动添加《Guyton&Hall 生理学 第十四版》章节导航 |
|||
| (未显示同一用户的1个中间版本) | |||
| 第2,046行: | 第2,046行: | ||
神经元葡萄糖输送的一个特殊特征是,尽管大多数其他体细胞的葡萄糖输送需要胰岛素(insulin),但葡萄糖通过细胞膜进入神经元的过程不依赖于胰岛素。因此,在胰岛素分泌几乎为零的严重糖尿病患者中,葡萄糖仍然能够轻易地扩散到神经元中,这对于防止糖尿病患者出现精神功能丧失是非常幸运的。然而,当糖尿病患者被过度使用胰岛素治疗时,血糖浓度可能会降至极低水平,因为过量的胰岛素会导致血液中几乎所有葡萄糖迅速转运到全身大量对胰岛素敏感的非神经细胞中,尤其是肌肉和肝细胞。当这种情况发生时,血液中没有足够的葡萄糖来正常供应神经元,导致精神功能严重紊乱,有时甚至会导致昏迷,更常见的是导致精神失衡和精神障碍——这些都是由于胰岛素过度治疗引起的。 | 神经元葡萄糖输送的一个特殊特征是,尽管大多数其他体细胞的葡萄糖输送需要胰岛素(insulin),但葡萄糖通过细胞膜进入神经元的过程不依赖于胰岛素。因此,在胰岛素分泌几乎为零的严重糖尿病患者中,葡萄糖仍然能够轻易地扩散到神经元中,这对于防止糖尿病患者出现精神功能丧失是非常幸运的。然而,当糖尿病患者被过度使用胰岛素治疗时,血糖浓度可能会降至极低水平,因为过量的胰岛素会导致血液中几乎所有葡萄糖迅速转运到全身大量对胰岛素敏感的非神经细胞中,尤其是肌肉和肝细胞。当这种情况发生时,血液中没有足够的葡萄糖来正常供应神经元,导致精神功能严重紊乱,有时甚至会导致昏迷,更常见的是导致精神失衡和精神障碍——这些都是由于胰岛素过度治疗引起的。 | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
{{:Guyton&Hall 生理学 第十四版}} | |||
2025年8月23日 (六) 17:13的最新版本
第五十五章 脊髓的运动功能;脊髓反射
感觉信息在神经系统的各个层次进行整合,并引发适当的运动反应,这些反应从脊髓中相对简单的肌肉反射开始,延伸到脑干中更复杂的反应,最后延伸到大脑,控制最复杂的肌肉技能。
在本章中,我们讨论脊髓对肌肉功能的控制。如果没有脊髓的特殊神经回路,即使大脑中最复杂的运动控制系统也无法引发任何有目的的肌肉运动。例如,大脑中没有任何神经回路能够引发行走所需的腿部来回运动。相反,这些运动的回路位于脊髓中,大脑只需向脊髓发送命令信号,即可启动行走过程。
我们不应低估大脑的作用。大脑发出指令,控制脊髓的顺序活动——例如,在需要时促进转身动作,在加速时使身体前倾,根据需要将动作从行走转变为跳跃,并持续监测和控制平衡。所有这些都通过大脑中产生的“分析”和“命令”信号来完成。然而,脊髓中的许多神经回路也是命令的对象,这些回路提供了对肌肉的直接控制的大部分。
脊髓运动功能的组织
脊髓灰质是脊髓反射的整合区域。图55-1显示了单个脊髓节段中脊髓灰质的典型组织。感觉信号几乎完全通过感觉根(也称为后根或背根)进入脊髓。进入脊髓后,每个感觉信号都会传递到两个不同的目的地:感觉神经的一个分支几乎立即终止于脊髓灰质,并引发局部节段性脊髓反射和其他局部效应;另一个分支将信号传递到神经系统的更高层次——即脊髓的更高层次、脑干,甚至大脑皮层,如前面章节所述。
每个脊髓节段(在每个脊神经的水平)的灰质中有数百万个神经元。除了第48章和第49章中讨论的感觉中继神经元外,其他神经元分为两种类型:(1) 前角运动神经元和 (2) 中间神经元。
前角运动神经元 (Anterior Motor Neurons)。位于脊髓灰质前角每个节段中的数千个神经元,比其他大多数神经元大50%到100%,被称为前角运动神经元(图55-2)。它们发出的神经纤维通过前根离开脊髓,直接支配骨骼肌纤维。这些神经元分为两种类型:α运动神经元和γ运动神经元。
图55-1. 外周感觉纤维和皮质脊髓纤维与脊髓中间神经元和前角运动神经元的连接。
图55-2. 支配骨骼肌的外周感觉纤维和前角运动神经元。
α运动神经元 (Alpha Motor Neurons)。α运动神经元发出大的Aα型运动神经纤维,平均直径为14微米;这些纤维进入肌肉后多次分支,支配大的骨骼肌纤维。刺激单个α神经纤维可以兴奋3到数百个骨骼肌纤维,这些纤维统称为运动单位 (motor unit)。神经冲动传递到骨骼肌及其对运动单位的刺激将在第6章和第7章中讨论。
γ运动神经元 (Gamma Motor Neurons)。与α运动神经元一起,脊髓前角中还有大约一半数量的γ运动神经元,它们要小得多。这些γ运动神经元通过更小的Aγ型运动神经纤维传递冲动,平均直径为5微米,这些纤维支配一种特殊的骨骼肌纤维,称为梭内纤维 (intrafusal fibers),如图55-2和图55-3所示。这些纤维构成了肌梭 (muscle spindle) 的中心部分,肌梭有助于控制基本的肌肉“张力 (tone)”,本章稍后将讨论这一点。
中间神经元 (Interneurons)。中间神经元存在于脊髓灰质的各个区域——背角、前角以及它们之间的中间区域,如图55-1所示。这些细胞的数量大约是前角运动神经元的30倍。它们体积小且高度兴奋,常常表现出自发性活动,并能够以每秒1500次的速度放电。它们之间有许多相互连接,其中许多还直接与前角运动神经元形成突触,如图55-1所示。中间神经元和前角运动神经元之间的相互连接负责脊髓的大部分整合功能,这些功能将在本章的其余部分讨论。
基本上,第47章中描述的所有不同类型的神经元回路都可以在脊髓的中间神经元细胞池中找到,包括发散 (diverging)、汇聚 (converging)、重复放电 (repetitive-discharge) 以及其他类型的回路。在本章中,我们将探讨这些不同回路在脊髓执行特定反射动作中的许多应用。
来自脊神经的少数传入感觉信号或来自大脑的信号直接终止于前角运动神经元(anterior motor neurons)。相反,几乎所有信号都首先通过中间神经元(interneurons)传递,并在那里进行适当的处理。因此,在图55-1中,来自大脑的皮质脊髓束(corticospinal tract)几乎完全终止于脊髓中间神经元,来自该束的信号与其他脊髓束或脊神经的信号结合,最终汇聚到前角运动神经元以控制肌肉功能。
Renshaw细胞向周围的运动神经元传递抑制信号。位于脊髓前角,与运动神经元紧密相连的还有大量称为Renshaw细胞的小神经元。几乎在前角运动神经元轴突离开神经元体后,轴突的侧支就会传递到相邻的Renshaw细胞。Renshaw细胞是抑制性细胞,向周围的运动神经元传递抑制信号。因此,每个运动神经元的刺激往往会抑制相邻的运动神经元,这种效应称为侧向抑制(lateral inhibition)。运动系统利用这种侧向抑制来聚焦或锐化其信号,就像感觉系统利用相同的原理来确保主要信号在所需方向上不受阻碍地传递,同时抑制信号向侧面扩散的趋势。
从一个脊髓节段到其他节段的多节段连接——固有脊髓纤维(Propriospinal Fibers)。在脊髓中上下行的所有神经纤维中,超过一半是固有脊髓纤维。这些纤维从一个脊髓节段延伸到另一个节段。此外,当感觉纤维从后根进入脊髓时,它们会分叉并向脊髓上下分支;一些分支仅传递信号到一个或两个节段,而其他分支则传递信号到多个节段。这些上下行的固有脊髓纤维为本章后面描述的多节段反射提供了通路,包括协调前肢和后肢同时运动的反射。
肌肉感觉感受器——肌梭和Golgi腱器官——及其在肌肉控制中的作用
肌肉功能的适当控制不仅需要脊髓前角运动神经元对肌肉的兴奋,还需要来自每块肌肉的持续感觉反馈信息传递到脊髓,以指示每块肌肉在每一时刻的功能状态。也就是说,肌肉的长度是多少,它的瞬时张力是多少,它的长度或张力变化的速度有多快?为了提供这些信息,肌肉及其肌腱中富含两种特殊类型的感觉感受器:(1) 肌梭(muscle spindles)(见图55-2),它们分布在肌肉的腹部,并向神经系统传递有关肌肉长度或长度变化速率的信息;(2) Golgi腱器官(Golgi tendon organs)(见图55-2和图55-8),它们位于肌肉肌腱中,传递有关肌腱张力或张力变化速率的信息。
图 55-3. 肌梭(muscle spindle),显示其与大型梭外骨骼肌纤维(extrausal skeletal muscle fibers)的关系。同时注意肌梭的运动和感觉神经支配。
来自这两种感受器的信号几乎完全用于内在肌肉控制。它们几乎完全在潜意识水平上运作。即便如此,它们不仅向脊髓传递大量信息,还向小脑甚至大脑皮层传递信息,帮助神经系统的这些部分控制肌肉收缩。
肌梭的感受器功能
肌梭的结构和运动神经支配。肌梭的组织结构如图 55-3 所示。每个肌梭长 3 至 10 毫米。它由 3 至 12 条微小的梭内肌纤维(intrafusal muscle fibers)构成,这些纤维的末端呈尖状,并附着于周围大型梭外骨骼肌纤维的糖萼(glycocalyx)上(视频 55-1)。
每条梭内肌纤维都是一条微小的骨骼肌纤维。然而,每条纤维的中央区域——即两端之间的中间区域——几乎没有或完全没有肌动蛋白(actin)和肌球蛋白(myosin)丝。因此,当两端收缩时,中央部分不会收缩。相反,它作为感觉感受器发挥作用,如下所述。能够收缩的末端部分由起源于脊髓前角的小型 A 型 γ 运动神经元的小型 γ 运动神经纤维兴奋,如前所述。这些 γ 运动神经纤维也称为 γ 传出纤维(gamma efferent fibers),与支配梭外骨骼肌的大型 α 传出纤维(type Aα nerve fibers)形成对比。
图 55-4. 核袋(nuclear bag)和核链(nuclear chain)肌梭纤维的神经连接细节。(修改自 Stein RB: Peripheral control of movement. Physiol Rev 54:225, 1974。)
肌梭的感觉神经支配。肌梭的感受器部分是其中央部分。如图 55-3 和图 55-4 所示,感觉纤维起源于该区域,并受到肌梭中间部分拉伸的刺激。可以清楚地看到,肌梭感受器可以通过两种方式被兴奋:
- 拉长整个肌肉会拉伸肌梭的中间部分,从而兴奋感受器。
- 即使整个肌肉的长度没有改变,肌梭梭内纤维末端的收缩也会拉伸肌梭的中间部分,从而兴奋感受器。
在肌梭的中央感受器区域发现了两种类型的感觉末梢,即初级传入末梢(primary afferent ending)和次级传入末梢(secondary afferent ending)。
初级末梢。在感受器区域的中心,一条大的感觉神经纤维环绕着每条梭内纤维的中央部分,形成初级传入末梢或环状螺旋末梢(annulospiral ending)。这条神经纤维是 Ia 型纤维,平均直径为 17 微米,它以 70 至 120 米/秒的速度向脊髓传递感觉信号,与体内任何类型的神经纤维一样快。
次级末梢。通常有一个,但有时有两个较小的感觉神经纤维——平均直径为8微米的II型纤维——支配初级末梢一侧或两侧的感受器区域,如图55-3和图55-4所示。这种感觉末梢被称为次级传入末梢 (secondary afferent ending);有时它会像Ia型纤维一样环绕肌梭纤维,但通常它会像灌木上的分枝一样展开。
肌梭纤维分为核袋纤维和核链纤维——肌梭的动态和静态反应。肌梭内纤维也有两种类型:(1) 核袋肌纤维 (nuclear bag muscle fibers)(每个肌梭中有1到3个),其中多个肌纤维核聚集在感受器区域中央的扩张“袋”中,如图55-4中的顶部纤维所示;(2) 核链纤维 (nuclear chain fibers)(3到9个),其直径和长度约为核袋纤维的一半,核在感受器区域中呈链状排列,如图55-4中的底部纤维所示。初级感觉神经末梢由核袋肌梭纤维和核链纤维共同兴奋。相反,次级末梢通常仅由核链纤维兴奋。这些关系如图55-4所示。
初级和次级末梢均对感受器长度的变化作出反应——“静态”反应。当肌梭的感受器部分被缓慢拉伸时,从初级和次级末梢传递的冲动数量几乎与拉伸程度成正比增加,并且这些末梢会持续传递这些冲动数分钟。这种效应称为肌梭感受器的静态反应,意味着如果肌梭保持拉伸状态,初级和次级末梢都会持续传递信号至少数分钟。
初级末梢(而非次级末梢)对感受器长度变化速率作出反应——“动态”反应 (Dynamic Response)。当肌梭感受器的长度突然增加时,初级末梢(而非次级末梢)会受到强烈刺激。这种对初级末梢的刺激称为动态反应 (dynamic response),这意味着初级末梢对肌梭长度的快速变化极为敏感。即使肌梭感受器的长度仅增加了几分之一微米且仅持续了几分之一秒,初级感受器也会向直径为17微米的感觉神经纤维传递大量额外的冲动,但仅在长度实际增加时传递。一旦长度停止增加,这种额外的冲动放电速率就会恢复到信号中仍然存在的较小的静态反应水平。
相反,当肌梭感受器缩短时,会发生完全相反的感觉信号。因此,初级末梢会向脊髓发送极强的信号,无论是正向还是负向,以告知脊髓肌梭感受器长度的任何变化。
静态和动态反应强度的γ运动神经控制。肌梭的γ运动神经可分为两种类型:γ-动态(γ-d)和γ-静态(γ-s)。第一种γ运动神经主要兴奋核袋型肌梭内纤维,第二种主要兴奋核链型肌梭内纤维。当γ-d纤维兴奋核袋纤维时,肌梭的动态反应大大增强,而静态反应几乎不受影响。相反,兴奋核链纤维的γ-s纤维的刺激增强了静态反应,而对动态反应几乎没有影响。随后的段落将说明这两种肌梭反应在不同类型的肌肉控制中都很重要。
图55-5。牵张反射的神经元回路。
正常情况下肌梭的持续放电。通常,当存在一定程度的γ神经兴奋时,肌梭会持续发出感觉神经冲动。拉伸肌梭会增加放电频率,而缩短肌梭会降低放电频率。因此,肌梭可以向脊髓发送正信号(增加冲动数量以指示肌肉拉伸)或负信号(减少冲动数量)以指示肌肉未拉伸。
肌肉牵张反射
肌梭功能的最简单表现是肌肉牵张反射。每当肌肉突然被拉伸时,肌梭的兴奋会导致被拉伸肌肉和密切相关的协同肌的大骨骼肌纤维发生反射性收缩。
牵张反射的神经元回路。图55-5展示了肌梭牵张反射的基本回路,显示了一种起源于肌梭并进入脊髓背根的Ia型本体感受器神经纤维。该纤维的一个分支然后直接进入脊髓灰质的前角,并与前运动神经元突触,这些前运动神经元将运动神经纤维发送回肌梭纤维起源的同一肌肉。因此,这种单突触通路允许反射信号在肌梭兴奋后以最短的时间延迟返回到肌肉。来自肌梭的大多数II型纤维终止于脊髓灰质中的多个中间神经元,这些中间神经元将延迟信号传递到前运动神经元或执行其他功能。
动态牵张反射和静态牵张反射。牵张反射可分为两个部分:动态牵张反射和静态牵张反射。动态牵张反射是由肌梭初级感觉末梢传递的强动态信号引起的,这些信号由快速拉伸或未拉伸引起。也就是说,当肌肉突然被拉伸或未拉伸时,一个强信号被传递到脊髓,这会导致信号起源的同一肌肉发生瞬时强反射收缩(或收缩减少)。因此,该反射的功能是抵抗肌肉长度的突然变化。
动态牵张反射(dynamic stretch reflex)在肌肉被拉伸(或未拉伸)到新长度后的几分之一秒内结束,但随后较弱的静态牵张反射(static stretch reflex)会持续较长时间。这种反射是由初级和次级末梢传递的持续静态感受器信号引发的。静态牵张反射的重要性在于,它使肌肉收缩的程度保持相对恒定,除非人的神经系统另有意图。
动态和静态牵张反射在平滑肌肉收缩中的"阻尼(damping)"功能。牵张反射的一个特别重要的功能是它能够防止身体运动的振荡或抖动,这是一种阻尼或平滑功能。
来自脊髓的信号通常以不光滑的形式传递到肌肉,强度在几毫秒内增加,然后强度降低,然后改变到另一个强度水平,依此类推。当肌梭(muscle spindle)装置不能令人满意地工作时,肌肉收缩在这样的信号过程中是抖动的。这种效应在图55-6中得到了证明。在A部分,兴奋肌肉的肌梭反射是完整的。请注意,即使肌肉的运动神经以每秒仅8个信号的慢频率兴奋,收缩也相对平滑。B部分显示了在3个月前切断肌梭感觉神经的动物中进行的相同实验。请注意不光滑的肌肉收缩。因此,图55-6A以图形方式展示了阻尼机制平滑肌肉收缩的能力,即使肌肉运动系统的主要输入信号本身可能是抖动的。这种效应也可以称为肌梭反射的信号平均功能。
肌梭在随意运动活动中的作用
要理解γ传出系统的重要性,应该认识到,所有到肌肉的运动神经纤维中有31%是小的A型γ传出纤维,而不是大的A型α运动纤维。每当信号从运动皮层或大脑的任何其他区域传递到α运动神经元时,在大多数情况下,γ运动神经元也会同时受到刺激,这种效应称为α和γ运动神经元的共激活(coactivation)。这种效应导致骨骼肌外纤维(extrafusal skeletal muscle fibers)和肌梭内纤维(muscle spindle intrafusal muscle fibers)同时收缩。
图55-6. 在两种情况下由脊髓信号引起的肌肉收缩。描绘的是曲线A, 在正常肌肉中,和曲线B,在82天前通过切断脊髓后根使肌梭失神经支配的肌肉中。请注意曲线A中肌梭反射的平滑效果。(修改自Creed RS, Denney-Brown D, Eccles JC, 等: Reflex Activity of the Spinal Cord. New York: Oxford University Press, 1932.)
在大型骨骼肌纤维收缩的同时,肌梭(muscle spindle)内的梭内纤维(intrafusal fibers)收缩的目的有两个:首先,它使肌梭感受器部分在整个肌肉收缩过程中保持长度不变。因此,协同激活(coactivation)防止了肌梭反射(muscle spindle reflex)对抗肌肉收缩。其次,无论肌肉长度如何变化,它都能维持肌梭的适当阻尼功能。例如,如果肌梭没有随着大型肌肉纤维的收缩和松弛而收缩和松弛,肌梭的感受器部分有时会松弛,有时会过度拉伸,这两种情况都不利于肌梭功能的最佳发挥。
控制γ运动系统的脑区
γ传出系统(gamma efferent system)主要受到来自脑干网状结构易化区的信号兴奋,其次还受到来自以下区域的冲动兴奋:(1) 小脑(cerebellum);(2) 基底神经节(basal ganglia);(3) 大脑皮层(cerebral cortex)。
由于网状结构易化区特别与抗重力收缩(antigravity contractions)有关,并且抗重力肌肉具有特别高的肌梭密度,因此γ传出机制被认为在行走和跑步过程中对阻尼身体各部分的运动非常重要。
肌梭系统在紧张动作中稳定身体位置。肌梭系统最重要的功能之一是在紧张的运动动作中稳定身体位置。为了执行这一功能,网状结构易化区及其相关的脑干区域通过γ神经纤维向肌梭的梭内肌纤维传递兴奋信号。这一动作缩短了肌梭的两端并拉伸了中央感受器区域,从而增加了它们的信号输出。然而,如果关节两侧的肌梭同时被激活,关节两侧的骨骼肌的反射兴奋也会增加,导致关节两侧的肌肉紧张并相互对抗。最终效果是关节的位置被强烈稳定,任何试图将关节从其当前位置移动的力量都会受到关节两侧高度敏感的牵张反射(stretch reflex)的对抗。
每当一个人需要执行需要高度精细和准确定位的肌肉功能时,脑干网状结构易化区的信号会兴奋相应的肌梭,从而稳定主要关节的位置。这种稳定极大地帮助执行复杂运动程序所需的额外详细随意运动(如手指或其他身体部位)。
牵张反射的临床应用
几乎每次临床医生对患者进行体格检查时,都会引出多个牵张反射。目的是确定大脑向脊髓发送了多少背景兴奋或“张力”(tone)。这种反射的引出方式如下。
膝跳反射和其他肌肉反射可用于评估牵张反射的敏感性。临床上,评估牵张反射敏感性的一种方法是引出膝跳反射和其他肌肉反射。膝跳反射可以通过用反射锤轻轻敲击髌腱来引出;这一动作会瞬间拉伸股四头肌,并激发动态牵张反射,导致小腿向前“跳动”(视频55-2)。图55-7的上半部分显示了在膝跳反射期间记录的股四头肌的肌电图。
类似的反射几乎可以从身体的任何肌肉中引出,方法是通过敲击肌肉的肌腱或肌肉本身。换句话说,突然拉伸肌梭就足以引发动态牵张反射。
神经科医生使用肌肉反射来评估脊髓中枢的易化程度。当大量易化冲动从中枢神经系统的高位区域传递到脊髓时,肌肉反射会显著增强。相反,如果易化冲动被抑制或消除,肌肉反射会显著减弱或消失。这些反射最常用于确定是否存在由大脑运动区病变或兴奋脑干网状结构易化区的疾病引起的肌肉痉挛。通常,大脑皮层运动区的大面积病变(但不在低级运动控制区,尤其是由中风或脑肿瘤引起的病变)会导致身体对侧肌肉的反射显著增强。
图55-7:在引出膝跳反射期间记录的股四头肌肌电图(上图)和在踝阵挛期间记录的腓肠肌肌电图(下图)。
阵挛——肌肉反射的振荡。在某些情况下,肌肉反射会振荡,这种现象称为阵挛(clonus)(见图55-7下方的肌电图)。阵挛的振荡现象在踝阵挛中尤为明显,解释如下:
如果一个人用脚尖站立时突然将身体向下移动并拉伸腓肠肌,牵张反射冲动会从肌梭传递到脊髓。这些冲动会反射性地兴奋被拉伸的肌肉,从而再次将身体抬起。几分之一秒后,肌肉的反射性收缩减弱,身体再次下落,从而第二次拉伸肌梭。再次,动态牵张反射将身体抬起,但这也在一瞬间减弱,身体再次下落,开始新的循环。这样,腓肠肌的牵张反射会持续振荡,通常持续很长时间,这就是阵挛。
阵挛通常只有在牵张反射被来自大脑的易化冲动高度敏感化时才会发生。例如,在牵张反射高度易化的去大脑动物中,阵挛很容易发生。为了确定脊髓的易化程度,神经科医生通过突然拉伸肌肉并施加持续的拉伸力来测试患者的阵挛。如果出现阵挛,易化程度必定很高。
高尔基腱反射 (Golgi Tendon Reflex)
高尔基腱器官 (Golgi Tendon Organ) 帮助控制肌肉张力。如图55-8所示,高尔基腱器官是一种被包裹的感觉感受器 (sensory receptor),肌腱纤维从中穿过。通常,每个高尔基腱器官连接约10至15条肌纤维,当这一小束肌纤维因肌肉收缩或拉伸而“紧张”时,高尔基腱器官会被激活。因此,高尔基腱器官与肌梭 (muscle spindle) 在兴奋机制上的主要区别在于:肌梭检测肌肉长度及其变化,而腱器官检测肌肉张力,这种张力通过其自身的张力反映出来。
与肌梭的初级感受器 (primary receptor) 类似,腱器官具有动态反应和静态反应。当肌肉张力突然增加时,腱器官会强烈反应(动态反应),但在不到一秒的时间内会稳定到一个较低的稳态放电水平,该水平几乎与肌肉张力成正比(静态反应)。因此,高尔基腱器官为神经系统提供了关于每块肌肉每一小段张力程度的即时信息。
图55-8. 高尔基腱反射。肌肉的过度张力会刺激高尔基腱器官中的感觉感受器。来自感受器的信号通过感觉传入神经纤维 (sensory afferent nerve fiber) 传递,兴奋脊髓中的抑制性中间神经元 (inhibitory interneuron),抑制前角运动神经元 (anterior motor neuron) 的活动,导致肌肉放松,从而保护肌肉免受过度张力的伤害。
腱器官冲动向中枢神经系统 (Central Nervous System) 的传递。来自腱器官的信号通过直径平均为16微米的大型快速传导Ib型神经纤维 (type Ib nerve fiber) 传递,这些纤维仅略小于肌梭初级末梢 (primary endings) 的纤维。与肌梭初级末梢的纤维类似,这些纤维将信号传递到脊髓的局部区域,并在脊髓背角 (dorsal horn) 突触后,通过长纤维通路(如脊髓小脑束 (spinocerebellar tracts))进入小脑 (cerebellum),并通过其他通路到达大脑皮层 (cerebral cortex)。局部脊髓信号兴奋一个抑制性中间神经元,抑制前角运动神经元。这种局部回路直接抑制单个肌肉,而不影响邻近肌肉。关于大脑信号与小脑及其他脑区在肌肉控制中的功能关系,将在第57章讨论。
腱反射防止肌肉过度张力。当肌肉肌腱中的高尔基腱器官因连接肌肉的张力增加而被激活时,信号会传递到脊髓,从而在相应肌肉中引起反射效应。这种反射完全是抑制性的。因此,这种反射提供了一种负反馈机制 (negative feedback mechanism),防止肌肉产生过大的张力。
当肌肉上的张力——以及肌腱上的张力——变得极大时,来自肌腱器官的抑制效应可能会非常强,以至于导致脊髓中的突然反应,从而引起整个肌肉的瞬时放松。这种效应被称为延长反应(lengthening reaction);它可能是一种保护机制,用于防止肌肉撕裂或肌腱从其骨骼附着处撕脱。
肌腱反射在均衡肌纤维收缩力中的可能作用。Golgi肌腱反射的另一个可能功能是均衡各个肌纤维的收缩力。也就是说,施加过大张力的纤维会被反射抑制,而施加过小张力的纤维由于缺乏反射抑制而变得更加兴奋。这种现象将肌肉负荷分散到所有纤维上,并防止在肌肉的孤立区域中少数纤维可能超负荷而受损。
肌梭和Golgi肌腱器官在高级脑运动控制中的功能
尽管我们强调了肌梭和Golgi肌腱器官在脊髓运动控制中的功能,这两种感觉器官也会向高级运动控制中枢报告肌肉中发生的瞬时变化。例如,背侧脊髓小脑束以接近120m/sec的传导速度将来自肌梭和Golgi肌腱器官的瞬时信息直接传递到小脑,这是大脑或脊髓中任何地方最快的传导速度。其他通路将类似的信息传递到脑干的网状区域,并在较小程度上传递到大脑皮层的运动区域。正如第56章和第57章所讨论的,来自这些感受器的信息对于源自所有这些区域的运动信号的反馈控制至关重要。
屈肌反射和退缩反射
在脊髓或去大脑动物中,几乎任何类型的来自肢体的皮肤感觉刺激都可能导致肢体的屈肌收缩,从而使肢体从刺激物体中退缩。这种反射被称为屈肌反射。
在经典形式中,屈肌反射最强烈地由疼痛末端的刺激引起,例如针刺、热或伤口,因此它也被称为伤害性反射,或简称为疼痛反射。触觉感受器的刺激也可以引发较弱且持续时间较短的屈肌反射。
图55-9. 屈肌反射、交叉伸肌反射和交互抑制。
如果身体的某个部位(非肢体)受到疼痛刺激,该部位同样会从刺激中退缩,但反射可能不仅限于屈肌,尽管它基本上是相同类型的反射。因此,这些反射在身体不同区域的多种模式被称为退缩反射。
屈肌反射的神经元机制。图55-9的左侧部分显示了屈肌反射的神经元通路。在这个例子中,疼痛刺激施加在手部;结果,上臂的屈肌被兴奋,使手从疼痛刺激中退缩。
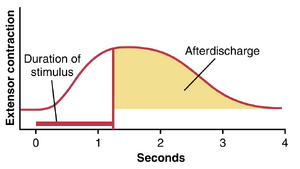
引发屈肌反射的路径并不直接传递到前角运动神经元,而是首先传递到脊髓的中间神经元池,然后才传递到运动神经元。最短的回路可能是一个三或四个神经元的路径;然而,大多数反射信号会经过更多的神经元,并涉及以下基本类型的回路:(1) 发散回路,将反射扩散到需要收缩的肌肉;(2) 抑制拮抗肌的回路,称为交互抑制回路 (reciprocal inhibition circuits);(3) 引起后放电 (afterdischarge) 的回路,这种放电会在刺激结束后持续数分之一秒。
图55-10显示了屈肌反射期间屈肌的典型肌电图。在疼痛感觉神经开始受到刺激后的几毫秒内,屈肌反应出现。然后,在接下来的几秒钟内,反射开始疲劳,这是脊髓几乎所有复杂整合反射的典型特征。最后,在刺激结束后,肌肉的收缩逐渐恢复到基线水平,但由于后放电,这种收缩需要许多毫秒才能完成。后放电的持续时间取决于引发反射的感觉刺激的强度;轻微的触觉刺激几乎不会引起后放电,但在强烈的疼痛刺激后,后放电可能会持续一秒或更长时间。
图55-10. 屈肌反射的肌电图,显示了反射的快速启动、疲劳期以及输入刺激结束后的后放电。
屈肌反射中的后放电几乎可以肯定是由第47章讨论的两种类型的重复放电回路引起的。电生理学研究表明,持续约6到8毫秒的即时后放电是由兴奋的中间神经元的重复放电引起的。此外,强烈的疼痛刺激后会出现延长的后放电,这几乎可以肯定是由在回响中间神经元回路中引发振荡的循环路径引起的。这些回路随后将冲动传递到前角运动神经元,有时在传入的感觉信号结束后持续数秒。
因此,屈肌反射的组织方式非常适合将身体受到疼痛或其他刺激的部位从刺激源中撤回。此外,由于后放电,反射可以在刺激结束后将受刺激的部位保持在远离刺激源的位置0.1到3秒。在此期间,中枢神经系统的其他反射和动作可以将整个身体从疼痛刺激中移开。
屈肌反射期间的撤回模式。当引发屈肌反射时,撤回的模式取决于哪个感觉神经受到刺激。因此,手臂内侧的疼痛刺激不仅会引起手臂屈肌的收缩,还会引起外展肌的收缩,以将手臂向外拉。换句话说,脊髓整合中心会引起那些能够最有效地将身体疼痛部位从引起疼痛的物体中移开的肌肉收缩。尽管这一原则适用于身体的任何部位,但由于其高度发达的屈肌反射,尤其适用于四肢。
交叉伸肌反射
在刺激引发一侧肢体的屈肌反射后约0.2至0.5秒,对侧肢体开始伸展。这种反射称为交叉伸肌反射。对侧肢体的伸展可以将整个身体推离引起疼痛刺激的物体。
交叉伸肌反射的神经元机制。图55-9的右侧部分显示了负责交叉伸肌反射的神经元回路,表明来自感觉神经的信号交叉到脊髓的对侧以兴奋伸肌。由于交叉伸肌反射通常在初始疼痛刺激开始后200至500毫秒才开始,因此可以确定许多中间神经元参与了传入感觉神经元和对侧脊髓运动神经元之间的回路。在疼痛刺激移除后,交叉伸肌反射的后放电时间比屈肌反射更长。再次推测,这种延长的后放电是由于中间神经元细胞之间的回响回路。
图55-11显示了从参与交叉伸肌反射的肌肉记录的典型肌电图。该肌电图显示了反射开始前相对较长的潜伏期和刺激结束时的长后放电。延长的后放电有助于将身体的疼痛区域保持在远离疼痛物体的位置,直到其他神经反应导致整个身体移动。
交互抑制和交互神经支配
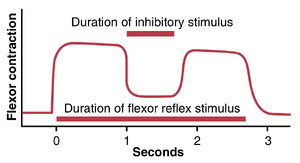
我们之前指出,一组肌肉的兴奋通常与另一组肌肉的抑制相关。例如,当牵张反射兴奋一块肌肉时,它通常会同时抑制拮抗肌,这是交互抑制的现象,导致这种交互关系的神经元回路称为交互神经支配。同样,身体两侧的肌肉之间通常存在交互关系,如之前描述的屈肌和伸肌反射所示。
图55-12显示了交互抑制的典型例子。在这种情况下,从身体一侧的肢体引发了一个中等但持久的屈肌反射;当这个反射仍在进行时,身体对侧的肢体引发了一个更强的屈肌反射。这个更强的反射向第一个肢体发送交互抑制信号,并抑制其屈曲程度。最后,移除更强的反射使原始反射恢复其之前的强度。
姿势和运动的反射
脊髓的姿势和运动反射
正向支撑反应 (Positive Supportive Reaction)。对去大脑动物的足垫施加压力会导致肢体伸展以对抗施加在足部的压力。事实上,这种反射非常强烈,如果一只脊髓被切断数月的动物——在反射变得夸张之后——被放置在它的脚上,这种反射通常会足够僵硬肢体以支撑身体的重量。这种反射被称为正向支撑反应。
正向支撑反应涉及中间神经元中的一个复杂回路,类似于负责屈肌和交叉伸肌反射的回路。足垫上压力的位置决定了肢体伸展的方向;一侧的压力会导致肢体向该方向伸展,这种效应被称为磁铁反应 (magnet reaction)。这种反应有助于防止动物向该侧倒下。
脊髓“翻正”反射 (Cord “Righting” Reflexes)。当脊髓动物被侧放时,它会做出不协调的动作,试图将自己抬起到站立位置。这种反射被称为脊髓翻正反射 (cord righting reflex)。这种反射表明,一些与姿势相关的相对复杂的反射在脊髓中整合。事实上,一只在前肢和后肢神经支配水平之间胸髓被切断且愈合良好的动物可以从躺卧位置翻正,甚至可以使用其后肢和前肢行走。在胸髓被类似切断的负鼠 (opossum) 中,后肢的行走动作与正常负鼠几乎没有区别,只是后肢的行走动作与前肢不同步。
踏步和行走动作
单肢的节律性踏步动作。在脊髓动物的肢体中经常观察到节律性踏步动作。事实上,即使脊髓的腰部部分与脊髓的其余部分分离,并且在脊髓中心进行纵向切割以阻断脊髓两侧和两肢之间的神经元连接,每个后肢仍然可以执行单独的踏步功能。肢体的前屈随后约一秒钟后是后伸。然后再次发生屈曲,循环反复进行。
这种屈肌和伸肌之间的来回振荡甚至可以在感觉神经被切断后发生,它似乎主要源于脊髓基质内的相互抑制回路,在控制激动肌和拮抗肌的神经元之间振荡。
当脚被允许沿着表面行走时,来自足垫和关节周围位置传感器的感觉信号在控制足部压力和踏步频率方面起着重要作用。事实上,控制踏步的脊髓机制可能更加复杂。例如,如果在向前推进时脚顶遇到障碍物,向前推进会暂时停止;然后,在快速序列中,脚会被抬得更高并向前推进以越过障碍物。这就是绊倒反射 (stumble reflex)。因此,脊髓是一个智能的行走控制器。
对侧肢体的交替步进(Reciprocal Stepping of Opposite Limbs)。如果腰椎脊髓(lumbar spinal cord)没有从中线分开,每当一侧肢体向前迈步时,对侧肢体通常会向后移动。这种效应是由两侧肢体之间的交互神经支配(reciprocal innervation)引起的。
四肢对角线步进——“原地踏步”反射(“Mark Time” Reflex)。如果一只愈合良好的脊髓动物(脊髓在颈部前肢区域上方横断)被从地面提起,让它的腿悬垂,肢体偶尔会受到牵拉,从而引发涉及所有四肢的踏步反射。一般来说,踏步发生在前肢和后肢之间的对角线上。这种对角线反应是交互神经支配的另一种表现,这次发生在脊髓上下前肢和后肢之间的整个距离上。这种行走模式被称为原地踏步反射(mark time reflex)。
搔抓反射(Scratch Reflex)
在某些动物中,一个特别重要的脊髓反射是搔抓反射(scratch reflex),它由痒或刺痛感引发。该反射涉及两个功能:(1)位置觉(position sense),使爪子能够找到体表刺激的确切位置;(2)来回搔抓运动(to-and-fro scratching movement)。
搔抓反射的位置觉是一种高度发达的功能。如果一只跳蚤在脊髓动物的肩部向前爬行,后爪仍然可以找到它的位置,即使肢体中的19块肌肉必须以精确的模式同时收缩才能将爪子带到跳蚤爬行的位置。为了使反射更加复杂,当跳蚤越过中线时,第一只爪子停止搔抓,对侧爪子开始来回运动,最终找到跳蚤。
这种来回运动,就像运动的踏步动作一样,涉及引起振荡的交互神经支配回路(reciprocal innervation circuits)。
引起肌肉痉挛的脊髓反射
在人类中,经常观察到局部肌肉痉挛(local muscle spasm)。在许多情况下,如果不是大多数情况下,局部疼痛是局部痉挛的原因。
骨折引起的肌肉痉挛。一种临床上重要的痉挛发生在骨折周围的肌肉中。痉挛是由骨折边缘引发的疼痛冲动引起的,这些冲动导致周围区域的肌肉强直性收缩。通过在骨折边缘注射局部麻醉剂来缓解疼痛可以缓解痉挛;全身深度麻醉,如乙醚麻醉,也可以缓解痉挛。
腹膜炎患者的腹肌痉挛。另一种由脊髓反射引起的局部痉挛是由腹膜炎(peritonitis)刺激壁腹膜(parietal peritoneum)引起的腹部痉挛。同样,缓解腹膜炎引起的疼痛可以使痉挛的肌肉放松。同样的痉挛经常发生在手术过程中;例如,在腹部手术中,来自壁腹膜的疼痛冲动经常导致腹肌广泛收缩,有时会将肠管挤出手术伤口。因此,腹腔内手术通常需要深度麻醉。
肌肉痉挛 (muscle cramp)。另一种局部痉挛是典型的肌肉痉挛。任何局部刺激因素或肌肉代谢异常,如严寒、血流不足或过度运动,都可能引发从肌肉传递到脊髓的疼痛或其他感觉信号,进而导致反射性反馈的肌肉收缩。这种收缩被认为会进一步刺激相同的感觉感受器 (sensory receptors),从而使脊髓增加收缩强度。因此,正反馈 (positive feedback) 形成,导致初始的少量刺激引发越来越多的收缩,直到完全形成肌肉痉挛。
脊髓中的自主反射
许多类型的节段性自主反射 (segmental autonomic reflexes) 在脊髓中整合,其中大多数在其他章节中讨论。简而言之,这些反射包括:(1) 由局部皮肤热量变化引起的血管张力变化(见第74章);(2) 由体表局部热量引起的出汗(见第74章);(3) 控制肠道某些运动功能的肠-肠反射 (intestinointestinal reflexes)(见第63章);(4) 腹膜刺激抑制胃肠道运动的腹膜-肠反射 (peritoneointestinal reflexes)(见第67章);以及(5) 排空充盈膀胱(见第26章)或结肠(见第64章)的排空反射 (evacuation reflexes)。此外,所有节段性反射有时可以同时引发,形成所谓的整体反射 (mass reflex),如下所述。
整体反射 (Mass Reflex)。在脊髓动物或人类中,有时脊髓会突然变得过度活跃,导致脊髓大部分区域的大量放电。通常引发这种过度活动的刺激是皮肤的强烈疼痛刺激或内脏的过度充盈,例如膀胱或肠道的过度扩张。无论刺激类型如何,由此产生的反射称为整体反射,涉及脊髓的大部分甚至全部区域。其效果如下:(1) 身体大部分骨骼肌进入强烈的屈肌痉挛;(2) 结肠和膀胱可能排空;(3) 动脉血压通常升至最大值,有时收缩压可超过 200mmHg;(4) 身体大面积区域大量出汗。
由于整体反射可以持续数分钟,推测其原因是大量回响回路 (reverberating circuits) 的激活,这些回路同时兴奋脊髓的大片区域。这种机制类似于癫痫发作 (epileptic seizures) 的机制,后者涉及大脑而非脊髓中的回响回路。
脊髓横断 (Spinal Cord Transection) 与脊髓休克 (Spinal Shock)
当脊髓在颈部上方突然横断时,脊髓的所有功能,包括脊髓反射,立即被抑制到完全静止的状态,这种反应称为脊髓休克。这种反应的原因是,脊髓神经元的正常活动在很大程度上依赖于从高级中枢进入脊髓的神经纤维放电的持续紧张性兴奋 (tonic excitation),特别是通过网状脊髓束 (reticulospinal tracts)、前庭脊髓束 (vestibulospinal tracts) 和皮质脊髓束 (corticospinal tracts) 传递的放电。
在几小时到几周后,脊髓神经元逐渐恢复其兴奋性(Excitability)。这种现象似乎是神经系统各处神经元的自然特性;当它们失去促进性冲动(Impulses)的来源后,会增加自身的自然兴奋性,以至少部分弥补这种损失。在大多数非灵长类动物中,脊髓中心的兴奋性通常在几小时到一天左右基本恢复正常,但在人类中,恢复往往延迟数周,有时甚至永远无法完全恢复;相反,有时恢复过度,导致部分或全部脊髓功能的过度兴奋(Hyperexcitability)。
脊髓休克(Spinal Shock)期间或之后特别受影响的脊髓功能包括:
- 在脊髓休克开始时,动脉血压几乎瞬间急剧下降,有时低至40~mm Hg,这表明交感神经系统(Sympathetic Nervous System)的活动几乎完全被阻断。即使在人类中,血压通常也会在几天内恢复正常。
- 在休克的初始阶段,所有整合在脊髓中的骨骼肌反射(Skeletal Muscle Reflexes)都被阻断。在低等动物中,这些反射需要几小时到几天才能恢复正常;在人类中,有时需要2周到几个月。在动物和人类中,一些反射最终可能变得过度兴奋,特别是如果大脑和脊髓之间的一些促进性通路(Facilitatory Pathways)保持完整,而其余脊髓被切断。首先恢复的是牵张反射(Stretch Reflexes),随后依次是更复杂的反射:屈肌反射(Flexor Reflexes)、姿势抗重力反射(Postural Antigravity Reflexes)和步进反射(Stepping Reflexes)的残余。
- 在脊髓切断后的最初几周内,控制膀胱和结肠排空的骶反射(Sacral Reflexes)在人类中被抑制,但在大多数情况下最终会恢复。这些效应将在第26章和第67章中讨论。
第五十六章 运动功能的皮层和脑干控制
大多数由大脑皮层发起的“随意”运动是通过皮层激活存储在较低脑区(脊髓、脑干、基底神经节和小脑)中的功能“模式”来实现的。这些较低的中心反过来向肌肉发送特定的控制信号。
然而,对于某些类型的运动,皮层几乎直接通过一条通路到达脊髓的前运动神经元,绕过了途中的一些运动中心。这在控制手指和手的精细灵巧运动时尤为明显。本章和第57章解释了大脑和脊髓不同运动区域之间的相互作用,以提供随意运动功能的整体综合。
运动皮层和皮质脊髓束
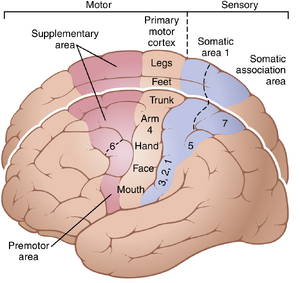
图56-1显示了大脑皮层的功能区域。中央皮层沟前方,占据额叶后约三分之一的区域是运动皮层。中央沟后方是躯体感觉皮层(在前几章中详细讨论的区域),它为运动皮层提供了许多启动运动活动的信号。
运动皮层分为三个子区域,每个子区域都有其自己的肌肉群和特定运动功能的拓扑表示:(1) 初级运动皮层;(2) 前运动区;(3) 辅助运动区。
初级运动皮层
初级运动皮层,如图56-1所示,位于中央沟前方的额叶第一回。它从外侧的Sylvian裂开始,向上延伸至大脑的最上部,然后深入纵裂。(该区域与Brodmann大脑皮层区域分类中的第4区相同,如图48-5所示。)
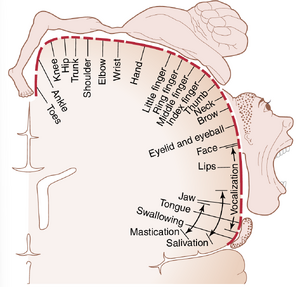
图56-1列出了身体不同肌肉区域在初级运动皮层中的近似地形分布,从靠近外侧裂(sylvian fissure)的面部和口部区域开始;手臂和手部区域位于初级运动皮层的中部;躯干区域靠近大脑的顶端;腿部和足部区域位于初级运动皮层深入纵裂(longitudinal fissure)的部分。这种地形分布在图56-2中表现得更加直观,图中显示了Penfield和Rasmussen绘制的不同肌肉区域在运动皮层中的代表程度。这种映射是通过在人类进行神经外科手术时电刺激运动皮层的不同区域完成的。需要注意的是,超过一半的初级运动皮层与手部肌肉和言语肌肉的控制有关。在这些手部和言语运动区域进行点刺激时,偶尔会引起单一肌肉的收缩,但大多数情况下,刺激会引起一组肌肉的收缩。换句话说,单个运动皮层神经元的兴奋通常会引起特定的运动,而不是单一的特定肌肉。为此,它会激发一组“模式”的独立肌肉,每块肌肉都贡献其自身的运动方向和力量。
前运动区(PREMOTOR AREA)
前运动区(premotor area)也显示在图56-1中,位于初级运动皮层前方1至3厘米处。它向下延伸至外侧裂(sylvian fissure),向上延伸至纵裂(longitudinal fissure),在那里它与辅助运动区(supplementary motor area)相邻,后者具有与前运动区相似的功能。前运动皮层的地形分布与初级运动皮层大致相同,口部和面部区域位于最外侧;随着向上移动,手部、手臂、躯干和腿部区域依次出现。
前运动区产生的神经信号引起的运动“模式”比初级运动皮层产生的离散模式复杂得多。例如,这种模式可能是将肩膀和手臂定位,以便手部能够正确定位以执行特定任务。为了实现这些结果,前运动区的最前部首先会形成一个要执行的总体肌肉运动的“运动图像”。然后,在后部前运动皮层中,这个图像会激发实现该图像所需的每个连续的肌肉活动模式。前运动皮层的后部将其信号直接发送到初级运动皮层以激发特定肌肉,或者经常通过基底神经节(basal ganglia)和丘脑(thalamus)返回到初级运动皮层。
一类特殊的神经元称为镜像神经元(mirror neurons),当一个人执行特定的运动任务或观察他人执行相同的任务时,这些神经元会被激活。因此,这些神经元的活动"镜像"了另一个人的行为,就好像观察者正在执行特定的运动任务一样。脑成像研究表明,这些神经元将听到或看到的行为的感觉表征转化为这些行为的运动表征。许多神经生理学家认为,这些镜像神经元可能对理解他人的行为以及通过模仿学习新技能很重要。因此,前运动皮层(premotor cortex)、基底神经节(basal ganglia)、丘脑(thalamus)和初级运动皮层构成了一个复杂的整体系统,用于控制协调肌肉活动的复杂模式。
图56-3. 运动皮层中身体不同肌肉的表征以及负责特定类型运动的其他皮层区域的位置。
辅助运动区(Supplementary Motor Area)
辅助运动区(Supplementary Motor Area)具有另一种用于控制运动功能的拓扑组织。它主要位于纵裂(longitudinal fissure)内,但延伸到额叶上皮质(superior frontal cortex)几厘米。刺激该区域引起的收缩通常是双侧的,而不是单侧的。例如,刺激经常导致双手同时进行双侧抓握运动;这些运动可能是攀爬所需的手部功能的雏形。总的来说,该区域与前运动区协同工作,提供全身的姿态运动、身体不同部位的固定运动、头部和眼睛的位置运动等,作为前运动区和初级运动皮层对手臂和手部更精细运动控制的背景。
人类运动皮层中发现的一些特殊运动控制区域
人类大脑皮层的几个高度专门化的运动区域(如图56-3所示)控制特定的运动功能。这些区域要么通过电刺激定位,要么通过观察特定皮层区域发生破坏性病变时运动功能的丧失来定位。以下部分描述了一些更重要的区域。
布洛卡区(Broca's Area,运动语言区)。图56-3显示了一个标记为"单词形成"的前运动区,它紧邻初级运动皮层前方,紧靠外侧裂(sylvian fissure)上方。这个区域被称为布洛卡区(Broca's area)。它的损伤不会阻止一个人发声,但会使这个人无法说出完整的单词,而只能发出不协调的声音或偶尔简单的单词,如"不"或"是"。一个密切相关的皮层区域也会引起适当的呼吸功能,因此在说话时,声带的呼吸激活可以与嘴和舌头的运动同时发生。因此,与语言相关的前运动神经元活动非常复杂。
“随意”眼动区(Voluntary Eye Movement Field)。在紧邻Broca区上方的运动前区(premotor area)中,有一个控制随意眼动的区域。该区域的损伤会阻止一个人随意地将眼睛移向不同的物体。相反,眼睛往往会不由自主地锁定在特定物体上,这种效应由枕叶视觉皮层(occipital visual cortex)的信号控制,如第52章所述。这个额叶区域还控制眼睑运动,如眨眼。
头部旋转区(Head Rotation Area)。在运动联合区(motor association area)稍高的位置,电刺激会引起头部旋转。该区域与眼动区密切相关;它将头部引导向不同的物体。
手部技能区。在紧邻手和手指初级运动皮层前方的运动前区(premotor area)中,有一个对手部技能至关重要的区域。也就是说,当肿瘤或其他病变导致该区域受损时,手部运动变得不协调且无目的性,这种情况称为运动性失用症(motor apraxia)。
从运动皮层到肌肉的信号传递
运动信号通过皮质脊髓束(corticospinal tract)直接从皮层传递到脊髓,并通过涉及基底节(basal ganglia)、小脑(cerebellum)和脑干(brain stem)多个核团的多个辅助通路间接传递。一般来说,直接通路与离散和精细的运动有关,尤其是肢体远端部分,特别是手和手指。
皮质脊髓束(锥体束)
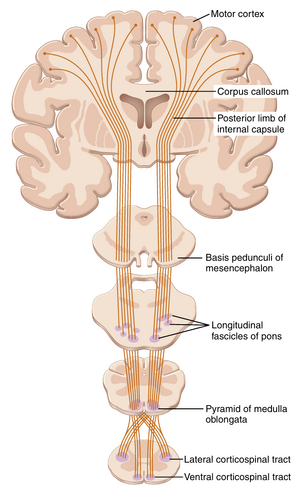
从运动皮层最重要的输出通路是皮质脊髓束(corticospinal tract),也称为锥体束(pyramidal tract),如图56-4所示。皮质脊髓束约30%起源于初级运动皮层,30%起源于运动前区和辅助运动区(premotor and supplementary motor areas),40%起源于中央沟后方的躯体感觉区(somatosensory areas)。
离开皮层后,它穿过内囊(internal capsule)的后肢(位于基底节(basal ganglia)的尾状核(caudate nucleus)和壳核(putamen)之间),然后向下穿过脑干,形成延髓的锥体。大多数锥体纤维随后在延髓下部交叉到对侧,并下行进入脊髓的侧皮质脊髓束(lateral corticospinal tracts),最终主要终止于脊髓灰质中间区域的中间神经元(interneurons)。少数终止于背角(dorsal horn)的感觉中继神经元(sensory relay neurons),极少数直接终止于引起肌肉收缩的前运动神经元(anterior motor neurons)。
少数纤维在延髓中不交叉到对侧,而是同侧下行进入脊髓的腹侧皮质脊髓束(ventral corticospinal tracts)。这些纤维中的许多(如果不是大多数)最终在颈部或上胸区交叉到脊髓的对侧。这些纤维可能与辅助运动皮层(supplementary motor cortex)控制双侧姿势运动有关。
锥体束中最引人注目的纤维是一群平均直径为16微米的有髓大纤维。这些纤维起源于仅存在于初级运动皮层中的巨型锥体细胞,称为Betz细胞。Betz细胞的直径约为60微米,其纤维以约70m/sec的速度将神经冲动传递到脊髓,这是从大脑到脊髓的任何信号中最快的传递速度。每个皮质脊髓束中约有34,000条这种大型Betz细胞纤维。每个皮质脊髓束中的纤维总数超过100万条,因此这些大纤维仅占总数的3%。其余的97%主要是直径小于4微米的纤维,它们向脊髓的运动区域传导背景性紧张信号。
来自运动皮层的其他纤维通路
运动皮层还发出大量额外的纤维,主要是小纤维,它们进入大脑和脑干的深部区域,包括以下内容:
- 来自巨型Betz细胞的轴突向皮层发出短侧支。这些侧支被认为在Betz细胞放电时抑制皮层的相邻区域,从而“锐化”兴奋信号的边界。
- 大量纤维从运动皮层进入尾状核和壳核。从那里,额外的通路延伸到脑干和脊髓,主要控制身体姿势的肌肉收缩,这将在下一章中讨论。
- 适量的运动纤维进入中脑的红核。从这些核中,额外的纤维通过红核脊髓束向下传递到脊髓。
- 适量的运动纤维偏离进入脑干的网状物质和前庭核;从那里,信号通过网状脊髓束和前庭脊髓束传递到脊髓,其他信号通过网状小脑束和前庭小脑束传递到小脑。
- 大量的运动纤维在桥脑核中形成突触,桥脑核发出桥脑小脑纤维,将信号传递到小脑半球。
- 侧支也终止于下橄榄核,从那里,次级橄榄小脑纤维将信号传递到小脑的多个区域。
因此,每当信号传递到脊髓以引起运动活动时,基底节、脑干和小脑都会从皮质脊髓系统接收到强烈的运动信号。
传入运动皮层的感觉纤维通路
运动皮层的功能主要由来自体感系统的神经信号控制,但也部分由其他感觉系统(如听觉和视觉)控制。一旦接收到感觉信息,运动皮层就会与基底节和小脑协同工作,以激发适当的运动动作。传入运动皮层的更重要的纤维通路如下:
- 来自大脑皮层相邻区域的皮层下纤维,特别是来自(a)顶叶皮层的体感区域,(b)运动皮层前方的额叶皮层相邻区域,以及(c)视觉和听觉皮层。
- 通过胼胝体(corpus callosum)从对侧大脑半球到达的皮层下纤维(subcortical fibers)。这些纤维连接大脑两侧皮层的相应区域。
- 直接从丘脑(ventrobasal complex)腹侧基底复合体到达的体感纤维(somatosensory fibers)。这些纤维主要传递来自外周身体的皮肤触觉信号以及关节和肌肉信号。
- 来自丘脑腹外侧核(ventrolateral nuclei)和腹前核(ventroanterior nuclei)的纤维束(tracts),这些核团依次接收来自小脑(cerebellum)和基底节(basal ganglia)的信号。这些纤维束提供了运动皮层(motor cortex)、基底节和小脑之间运动控制功能协调所必需的信号。
- 来自丘脑板内核(intralaminar nuclei)的纤维。这些纤维以控制大脑皮层大多数其他区域兴奋性水平的方式控制运动皮层的一般兴奋性水平。
红核(red nucleus)作为将皮层信号传递到脊髓(spinal cord)的替代途径
位于中脑(mesencephalon)的红核与皮质脊髓束(corticospinal tract)密切关联。如图56-5所示,它通过皮质红核束(corticorubral tract)从初级运动皮层接收大量直接纤维,以及皮质脊髓束在通过中脑时发出的分支纤维。这些纤维在红核的下部,即大细胞部(magnocellular portion)形成突触,该部分包含与运动皮层中的Betz细胞大小相似的大神经元。这些大神经元随后发出红核脊髓束(rubrospinal tract),该束在脑干下部交叉到对侧,并紧邻皮质脊髓束的前方进入脊髓的侧柱(lateral columns)。
图56-5. 用于运动控制的皮质-红核-脊髓通路,还显示了该通路与小脑的关系。
红核脊髓纤维主要终止于脊髓灰质(gray matter)中间区的中间神经元(interneurons),与皮质脊髓纤维一起,但一些红核脊髓纤维与一些皮质脊髓纤维一起直接终止于前角运动神经元(anterior motor neurons)。红核还与小脑有密切的联系,类似于运动皮层与小脑之间的联系。
皮质-红核-脊髓系统(corticorubrospinal system)是将相对离散的信号从运动皮层传递到脊髓的辅助通路。红核的大细胞部具有与运动皮层相似的身体所有肌肉的体表定位(somatotopic representation)。因此,刺激红核这一部分的单个点会导致单个肌肉或一小群肌肉的收缩。然而,不同肌肉的精细定位远不如运动皮层发达,尤其是在红核相对较小的人类中。
皮质红核脊髓通路(corticorubrospinal pathway)是运动皮层向脊髓传递相对离散信号的辅助通路。当皮质脊髓纤维被破坏但皮质红核脊髓通路完好时,离散运动仍然可以发生,只是手指和手的精细控制运动明显受损。腕部运动仍然可以执行,但当皮质红核脊髓通路也被阻断时则不然。
因此,通过红核到脊髓的通路与皮质脊髓系统相关联。此外,红核脊髓束(rubrospinal tract)与皮质脊髓束一起位于脊髓的外侧柱,终止于控制肢体远端肌肉的中间神经元和运动神经元。因此,皮质脊髓束和红核脊髓束一起被称为脊髓的外侧运动系统(lateral motor system of the cord),与主要位于脊髓内侧的前庭网状脊髓系统(vestibuloreticulospinal system)相对,后者被称为脊髓的内侧运动系统(medial motor system of the cord),本章稍后将讨论。
初级运动皮层和红核对脊髓运动控制区的兴奋
运动皮层中的神经元以垂直柱状排列。在第48章和第52章中,我们指出躯体感觉皮层和视觉皮层中的细胞以垂直柱状排列。运动皮层的细胞也以直径几分之一毫米的垂直柱状排列,每个柱中有数千个神经元。
每个细胞柱作为一个单元发挥作用,通常刺激一组协同肌(synergistic muscles),但有时只刺激一块肌肉。此外,每个柱有六个不同的细胞层,这在几乎所有大脑皮层中都是如此。产生皮质脊髓纤维的锥体细胞(pyramidal cells)都位于从皮层表面算起的第五层细胞中。输入信号都通过第2到第4层进入,第六层主要产生与大脑皮层其他区域通信的纤维。
每个神经元柱作为一个整合处理系统发挥作用。每个柱的神经元作为一个整合处理系统(integrative processing system)运作,利用来自多个输入源的信息来确定柱的输出反应。此外,每个柱可以作为一个放大系统(amplifying system)发挥作用,同时刺激大量锥体纤维到同一肌肉或协同肌。这种能力很重要,因为单个锥体细胞的刺激很少能兴奋肌肉。通常需要同时或快速连续兴奋50到100个锥体细胞才能实现明确的肌肉收缩。
动态和静态信号由锥体神经元( pyramidal neurons )传递。如果向肌肉发送强信号以引起初始快速收缩,那么随后更弱的持续信号可以长时间维持收缩。这一过程是通常提供兴奋以引起肌肉收缩的方式。为了提供这种兴奋,每一列细胞都会兴奋两组锥体细胞神经元,一组称为动态神经元(dynamic neurons),另一组称为静态神经元(static neurons)。动态神经元在收缩开始时以高频率兴奋,导致力的初始快速发展。然后静态神经元以更慢的频率放电,但只要需要收缩,它们就会继续以这种慢频率放电以维持收缩力。
红核(red nucleus)的神经元具有类似的动态和静态特性,只是红核中动态神经元的比例更高,而初级运动皮层中静态神经元的比例更高。这可能与红核与小脑(cerebellum)密切相关有关,而小脑在肌肉收缩的快速启动中起重要作用,这将在下一章中解释。
体感反馈(somatosensory feedback)到运动皮层有助于控制肌肉收缩的精确性
当来自运动皮层的神经信号引起肌肉收缩时,体感信号从身体的激活区域一路返回到启动动作的运动皮层神经元。这些体感信号大多来自以下部位:(1) 肌梭(muscle spindles);(2) 肌腱器官(muscle tendon organs);(3) 覆盖肌肉的皮肤触觉感受器(tactile receptors)。
这些体感信号通常通过以下方式引起肌肉收缩的正反馈增强。在肌梭的情况下,如果肌梭中的梭内肌纤维(fusimotor muscle fibers)比大骨骼肌纤维收缩得更多,肌梭的中心部分会被拉伸并因此兴奋。来自这些肌梭的信号随后迅速返回到运动皮层的锥体细胞,告知它们大肌纤维收缩得不够。锥体细胞进一步兴奋肌肉,帮助其收缩赶上肌梭的收缩。在触觉感受器的情况下,如果肌肉收缩导致皮肤对物体的压缩,例如手指围绕抓握物体的压缩,来自皮肤感受器的信号可以在必要时进一步兴奋肌肉,从而增加手抓握的紧度。
脊髓运动神经元的刺激
图56-6显示了脊髓节段的横截面,展示了以下内容:(1) 进入脊髓节段的多个运动和感觉运动控制束;(2) 前角灰质中间的代表性前运动神经元(anterior motor neuron)。皮质脊髓束(corticospinal tract)和红核脊髓束(rubrospinal tract)位于外侧白柱的背侧部分。它们的纤维主要终止于脊髓灰质中间区域的中间神经元(interneurons)。
在脊髓的颈膨大处,手和手指的神经支配区域,大量的皮质脊髓束(corticospinal tract)和红核脊髓束(rubrospinal tract)纤维也直接终止于前角运动神经元(anterior motor neurons),从而提供了从大脑直接激活肌肉收缩的途径。这一机制与初级运动皮层对手、手指和拇指动作的精细控制具有极高程度的神经支配这一事实相符。
脊髓中枢引发的运动模式。从第55章回顾可知,脊髓能够对感觉神经刺激产生某些特定的反射运动模式。当脊髓前角运动神经元被来自大脑的信号兴奋时,这些模式中的许多也同样重要。例如,牵张反射(stretch reflex)在任何时候都起作用,有助于抑制由大脑引发的运动振荡。当肌梭(muscle spindle)的梭内肌纤维(intrafusal fibers)比大骨骼肌纤维收缩更多时,该反射可能还提供了引起肌肉收缩所需的至少部分动力,从而在皮质脊髓纤维的直接刺激之外,还引发了肌肉的反射性"伺服辅助(servo-assist)"刺激。
图56-6. 不同运动控制通路在前角运动神经元上的汇聚。
此外,当大脑信号兴奋一块肌肉时,通常不需要同时传递一个相反的信号来放松拮抗肌(antagonist muscle);这种放松是通过脊髓中始终存在的交互神经支配(reciprocal innervation)回路来实现的,该回路用于协调拮抗肌对的功能。
最后,其他脊髓反射机制,如屈曲反射(withdrawal reflex)、踏步和行走(stepping and walking)、抓挠(scratching)和姿势机制(postural mechanisms),都可以被来自大脑的"命令(command)"信号激活。因此,来自大脑的简单命令信号可以启动许多正常的运动活动,特别是对于行走和获得身体不同姿势等功能。
运动皮层或皮质脊髓束通路病变的影响
中风(Stroke)引起的脑血供减少。运动控制系统可能会被一种常见的异常情况——"中风"所损害。中风是由破裂的血管在大脑中出血或供应大脑的主要动脉之一血栓形成(thrombosis)引起的。无论哪种情况,结果都是皮层或皮质脊髓束在通过尾状核(caudate nucleus)和壳核(putamen)之间的内囊(internal capsule)时失去血液供应。
初级运动皮层(Area Pyramidalis)的切除
手术切除初级运动皮层的一部分——包含巨大Betz锥体细胞的区域——会导致相应肌肉不同程度的瘫痪。如果下方的尾状核以及邻近的前运动区和辅助运动区未受损,粗大的姿势和肢体“固定”运动仍然可以发生,但会失去对肢体远端部分(尤其是手和手指)离散运动的自主控制。这并不意味着手和手指的肌肉不能收缩,而是失去了对精细运动的控制能力。从这些观察中,我们可以得出结论,Area Pyramidalis对于自主启动精细控制的运动,尤其是手和手指的运动,是必不可少的。
由损伤运动皮层邻近大面积区域引起的肌肉痉挛
初级运动皮层通常对脊髓的运动神经元施加持续的紧张性刺激作用;当这种刺激作用被移除时,会导致肌张力减退。大多数运动皮层的损伤,尤其是由中风引起的损伤,不仅涉及初级运动皮层,还涉及大脑的邻近部分,如基底神经节。在这些情况下,几乎总是会在身体对侧的受影响肌肉区域发生肌肉痉挛(因为运动通路交叉到对侧)。这种痉挛主要是由于来自运动皮层非锥体部分的辅助通路受损所致。这些通路通常抑制前庭和网状脑干运动核。当这些核停止其抑制状态(即“去抑制”)时,它们会自发激活并导致相关肌肉的过度痉挛性张力,正如我们将在本章后面更详细讨论的那样。这种痉挛通常伴随着人类的“中风”。
脑干对运动功能的控制
脑干由延髓、脑桥和中脑组成。从某种意义上说,它是脊髓向上延伸至颅腔的部分,因为它包含执行面部和头部区域运动和感觉功能的运动和感觉核,就像脊髓从颈部向下执行这些功能一样。然而,从另一种意义上说,脑干是它自己的主宰,因为它提供了许多特殊的控制功能,例如:
- 呼吸控制
- 心血管系统控制
- 部分胃肠道功能控制
- 身体许多刻板运动的控制
- 平衡控制
- 眼球运动控制
最后,脑干作为来自更高神经中枢的“命令信号”的中转站。这些功能中的许多将在本书的其他章节中讨论。在以下部分中,我们将讨论脑干在控制全身运动和平衡中的作用。对于这些目的,脑干的网状核和前庭核尤为重要。
对抗重力的身体支持——网状核和前庭核的作用
图56-7显示了脑干中网状核和前庭核的位置。
脑桥和延髓网状核之间的兴奋-抑制拮抗作用
网状核(reticular nuclei)分为两大组:(1) 脑桥网状核(pontine reticular nuclei),位于脑桥稍后外侧,并延伸至中脑;(2) 延髓网状核(medullary reticular nuclei),贯穿整个延髓,位于腹侧和内侧靠近中线处。这两组核团主要起相互拮抗的作用,脑桥网状核兴奋抗重力肌肉(antigravity muscles),而延髓网状核则放松这些肌肉。
脑桥网状系统传递兴奋信号。如图56-8所示,脑桥网状核通过脊髓前柱中的脑桥网状脊髓束(pontine reticulospinal tract)向下传递兴奋信号至脊髓。该通路的纤维终止于内侧前运动神经元(medial anterior motor neurons),这些神经元兴奋身体的轴向肌肉(axial muscles),这些肌肉支撑身体对抗重力——即脊柱的肌肉和四肢的伸肌。
图56-7. 脑干中网状核和前庭核的位置。
脑桥网状核具有高度的自然兴奋性。此外,它们还从前庭核(vestibular nuclei)以及小脑深部核团(deep nuclei of the cerebellum)接收强烈的兴奋信号。因此,当脑桥网状兴奋系统不受延髓网状系统的对抗时,它会强烈兴奋全身的抗重力肌肉,以至于四足动物可以在没有任何来自大脑高级中枢信号的情况下站立,支撑身体对抗重力。
延髓网状系统传递抑制信号。延髓网状核通过位于脊髓外侧柱中的延髓网状脊髓束(medullary reticulospinal tract)向相同的抗重力前运动神经元传递抑制信号,如图56-8所示。延髓网状核从以下通路接收强烈的输入侧支:(1) 皮质脊髓束(corticospinal tract);(2) 红核脊髓束(rubrospinal tract);(3) 其他运动通路。这些通路通常会激活延髓网状抑制系统,以平衡来自脑桥网状系统的兴奋信号,因此在正常情况下,身体肌肉不会异常紧张。
然而,当大脑希望兴奋脑桥系统以引起站立时,来自大脑高级区域的一些信号可以“解除抑制”延髓系统。在其他时候,延髓网状系统的兴奋可以抑制身体某些部位的抗重力肌肉,以便这些部位执行特殊的运动活动。兴奋性和抑制性网状核构成了一个可控系统,该系统由来自大脑皮层和其他部位的运动信号操纵,以提供对抗重力站立所需的背景肌肉收缩,并在需要时抑制适当的肌肉群,以便执行其他功能。
前庭核在兴奋抗重力肌肉中的作用
所有的前庭核(vestibular nuclei),如图56-7所示,与脑桥网状核(pontine reticular nuclei)共同作用以控制抗重力肌肉(antigravity muscles)。前庭核通过脊髓前柱中的外侧和内侧前庭脊髓束(lateral and medial vestibulospinal tracts)向抗重力肌肉传递强烈的兴奋信号,如图56-8所示。如果没有前庭核的支持,脑桥网状系统将失去对轴向抗重力肌肉的大部分兴奋作用。
然而,前庭核的具体作用是选择性地控制对不同抗重力肌肉的兴奋信号,以响应来自前庭器官(vestibular apparatus)的信号来维持平衡。我们将在本章后面更详细地讨论这一概念。
去大脑动物出现痉挛性强直(Decerebrate Animal Develops Spastic Rigidity)
当动物的脑干在中脑(mesencephalon)中部以下被切断,但脑桥和延髓网状系统以及前庭系统保持完整时,会出现一种称为去大脑强直(decerebrate rigidity)的状态。这种强直并不发生在身体的所有肌肉中,而是发生在抗重力肌肉——颈部、躯干的肌肉以及腿部的伸肌中。
去大脑强直的原因是大脑皮层(cerebral cortex)、红核(red nuclei)和基底神经节(basal ganglia)对延髓网状核(medullary reticular nuclei)的正常强烈输入被阻断。
图56-8. 前庭脊髓束和网状脊髓束在脊髓中下行,以兴奋(实线)或抑制(虚线)控制身体轴向肌肉的前运动神经元(anterior motor neurons)。
由于缺乏这种输入,延髓网状抑制系统变得无法正常工作,脑桥兴奋系统完全过度活跃,从而导致强直。我们将在后面看到,其他神经运动疾病,特别是基底神经节的病变,也会导致强直。
前庭感觉与平衡维持(VESTIBULAR SENSATIONS AND MAINTENANCE OF EQUILIBRIUM)
前庭器官(VESTIBULAR APPARATUS)
前庭器官(vestibular apparatus),如图56-9所示,是检测平衡感觉的感觉器官。它被包裹在位于颞骨岩部(petrous portion of the temporal bone)的骨性管道和腔室系统中,称为骨迷路(bony labyrinth)。在这个系统内有膜性管道和腔室,称为膜迷路(membranous labyrinth)。膜迷路是前庭器官的功能部分。
图56-9的顶部显示了膜迷路。它主要由耳蜗(cochlea, ductus cochlearis)、三个半规管(semicircular canals)和两个大腔室——椭圆囊(utricle)和球囊(saccule)组成。耳蜗是听觉的主要感觉器官(见第53章),与平衡关系不大。然而,半规管、椭圆囊和球囊都是平衡机制的重要组成部分。
图56-9. 膜迷路及壶腹嵴(crista ampullaris)和斑(macula)的组织结构。
“斑(maculae)”——椭圆囊(utricle)和球囊(saccule)中用于检测头部相对于重力方向的感觉器官。如图56-9上图所示,在每个椭圆囊和球囊的内表面上,有一个直径略大于2毫米的小感觉区域,称为斑。椭圆囊的斑主要位于椭圆囊下表面的水平面上,在头部直立时对确定头部方向起着重要作用。相反,球囊的斑主要位于垂直面上,当人躺下时发出头部方向的信号。
每个斑都被一层凝胶状层覆盖,其中嵌有许多称为耳石(statoconia)的小碳酸钙晶体。斑中还有成千上万的毛细胞(hair cells),其中一个如图56-10所示;这些毛细胞将纤毛(cilia)投射到凝胶状层中。毛细胞的基底和侧面与前庭神经(vestibular nerve)的感觉末梢形成突触。
钙化的耳石的比重是周围液体和组织比重的两到三倍。耳石的重量使纤毛向重力方向弯曲。
毛细胞的方向敏感性——动纤毛(kinocilium)。如图56-10所示,每个毛细胞有大约100根称为静纤毛(stereocilia)的小纤毛,外加一根大纤毛,即动纤毛。动纤毛总是位于细胞的一侧,而静纤毛向细胞的另一侧逐渐变短。微小的丝状附着物,即使在电子显微镜下也几乎看不见,将每根静纤毛的尖端连接到下一根较长的静纤毛,最后连接到动纤毛。
图56-10。平衡装置的毛细胞及其与前庭神经的突触。
由于这些附着物,当静纤毛向动纤毛方向弯曲时,丝状附着物依次拉动静纤毛,将它们从细胞体向外拉。这种运动在静纤毛基部周围的神经元细胞膜上打开了数百个阳离子通道,这些通道能够传导大量正离子。因此,正离子从周围的内淋巴液(endolymphatic fluid)涌入细胞,导致受体膜去极化(depolarization)。相反,将静纤毛堆向相反方向弯曲(向后,远离动纤毛)会减少附着物的张力;这种运动关闭了离子通道,从而导致受体超极化(hyperpolarization)。
在正常静息条件下,来自毛细胞的神经纤维以每秒约100次的速率传递连续的神经冲动。当静纤毛向动纤毛方向弯曲时,冲动传递增加,通常达到每秒数百次;相反,将纤毛远离动纤毛弯曲会减少冲动传递,通常会完全停止。因此,当头部在空间中的方向发生变化并且耳石的重量使纤毛弯曲时,适当的信号会传递到大脑以控制平衡。
在每个斑(macula)中,每个毛细胞(hair cell)都朝向不同的方向,因此当头部向前弯曲时,一些毛细胞会受到刺激,当头部向后弯曲时,另一些毛细胞会受到刺激,当头部向一侧弯曲时,其他毛细胞会受到刺激,依此类推。因此,头部在重力场中的每个方向都会在斑神经纤维中产生不同的兴奋模式。正是这种“模式”让大脑了解头部在空间中的方向。
半规管(Semicircular Ducts)。每个前庭器官中的三个半规管,分别称为前、后和外侧(水平)半规管,彼此成直角排列,因此它们代表了空间中的所有三个平面。当头部向前弯曲约30度时,外侧半规管相对于地球表面大致水平;前管位于向前和向外45度的垂直平面中,而后管位于向后和向外45度的垂直平面中。
每个半规管在其一端都有一个称为壶腹(ampulla)的膨大结构,半规管和壶腹中充满了一种称为内淋巴(endolymph)的液体。这种液体通过其中一个半规管及其壶腹的流动会以以下方式刺激壶腹的感觉器官:图56-11显示了每个壶腹中一个称为壶腹嵴(crista ampullaris)的小嵴。在这个嵴的顶部是一个松散的胶状组织块,称为壶腹帽(cupula)。当一个人的头部开始向任何方向旋转时,一个或多个半规管中的液体的惯性会使液体保持静止,而半规管随头部旋转。这个过程导致液体从半规管流出并通过壶腹,使壶腹帽向一侧弯曲,如图56-11中彩色壶腹帽的位置所示。头部向相反方向旋转会使壶腹帽向相反方向弯曲。
位于壶腹嵴上的毛细胞的数百根纤毛(cilia)伸入壶腹帽中。这些毛细胞的动纤毛(kinocilia)在壶腹帽中都朝向同一方向,向该方向弯曲壶腹帽会导致毛细胞去极化(depolarization),而向相反方向弯曲则会使细胞超极化(hyperpolarization)。然后,毛细胞通过前庭神经向中枢神经系统发送适当的信号,以告知头部旋转的变化以及空间三个平面中每个平面的变化速率。
图56-11. 旋转开始时壶腹帽及其嵌入的纤毛的运动。
椭圆囊(utricle)和球囊(saccule)在维持静态平衡中的功能
特别重要的是,毛细胞在椭圆囊和球囊的斑中朝向不同的方向,因此随着头部的不同位置,不同的毛细胞会受到刺激。不同毛细胞的刺激“模式”让大脑了解头部相对于重力拉力的位置。反过来,大脑的前庭、小脑和网状运动神经系统会激发适当的姿势肌肉以维持适当的平衡。
当头部接近垂直位置时,这个椭圆囊(utricle)和球囊(saccule)系统在维持平衡方面非常有效。事实上,当身体从精确的直立位置倾斜时,一个人可以检测到小至半度的失衡。
椭圆囊和球囊斑(maculae)对线性加速度的检测。当身体突然向前推进——即当身体加速时——由于质量惯性比周围液体更大的耳石(statoconia)会向后落在毛细胞(cilia)上,失衡的信息被传递到神经中枢,使人感觉好像正在向后倾倒。这种感觉会自动使人向前倾斜,直到耳石的前移正好抵消由于加速度导致的耳石向后倾倒的趋势。此时,神经系统感知到适当的平衡状态,身体不再向前倾斜。因此,斑在检测线性加速度时维持平衡的方式与在静态平衡时完全相同。
斑并不用于检测线性速度。当跑步者刚开始跑步时,由于初始加速度,他们必须大幅向前倾斜以防止向后倾倒,但一旦达到跑步速度,如果他们在真空中跑步,就不需要向前倾斜。在空气中跑步时,他们向前倾斜以维持平衡仅仅是因为空气对身体产生的阻力;在这种情况下,使他们倾斜的不是斑,而是作用于皮肤压力感受器(pressure end-organs)的空气压力,这些感受器启动适当的平衡调整以防止倾倒。
半规管(semicircular ducts)对头部旋转的检测
当头部突然开始向任何方向旋转(称为角加速度(angular acceleration))时,半规管中的内淋巴(endolymph)由于其惯性倾向于保持静止,而半规管则旋转。这种机制导致管内的液体相对于头部旋转方向相反的方向流动。
图56-12显示了当动物旋转40秒时,壶腹嵴(crista ampullaris)中单个毛细胞的典型放电信号,展示了以下内容:(1) 即使壶腹(cupula)处于静止位置,毛细胞也会以每秒约100次的频率持续放电;(2) 当动物开始旋转时,毛细胞向一侧弯曲,放电速率大大增加;(3) 随着旋转的继续,毛细胞的过度放电在接下来的几秒内逐渐恢复到静止水平。
这种感受器适应(receptor adaptation)的原因是,在旋转的最初几秒内,半规管中液体流动的背向阻力以及弯曲的壶腹导致内淋巴开始以与半规管本身相同的速度旋转。然后,在接下来的5到20秒内,由于壶腹自身的弹性回缩,它缓慢地回到壶腹中央的静止位置。
当旋转突然停止时,会发生完全相反的效果:内淋巴(endolymph)继续旋转,而半规管(semicircular duct)停止旋转。此时,壶腹嵴(cupula)向相反方向弯曲,导致毛细胞(hair cell)完全停止放电。几秒钟后,内淋巴停止运动,壶腹嵴逐渐恢复到静止位置,从而使毛细胞放电恢复到正常的紧张性水平,如图56-12右侧所示。因此,当头部开始旋转时,半规管传递一种极性的信号,而当头部停止旋转时,则传递相反极性的信号。
半规管系统在维持平衡中的“预测”功能
由于半规管无法检测到身体在前方、侧方或后方失去平衡,人们可能会问:“半规管在维持平衡中的功能是什么?”它们只能检测到人的头部开始或停止向某个方向旋转。因此,半规管的功能不是维持静态平衡,也不是在稳定的方向性或旋转性运动中维持平衡。然而,半规管功能的丧失确实会导致人在尝试进行快速、复杂的身体运动时平衡能力下降。
图56-12. 当半规管首先受到头部旋转开始刺激,然后受到旋转停止刺激时,毛细胞的反应。
半规管的功能可以通过以下例子来解释:如果一个人快速向前跑,然后突然开始向一侧转弯,除非提前做出适当的调整,否则他或她会在几分之一秒后失去平衡。然而,椭圆囊(utricle)和球囊(saccule)的斑(maculae)只有在失去平衡之后才能检测到平衡的丧失。然而,半规管会提前检测到人正在转弯,这一信息可以轻松告知中枢神经系统(central nervous system),除非做出一些预期的调整,否则人将在接下来的几分之一秒内失去平衡。
换句话说,半规管机制预测到失衡即将发生,从而使平衡中心做出适当的预期性预防调整,帮助人在情况得到纠正之前保持平衡。
切除小脑(cerebellum)的绒球小结叶(flocculonodular lobes)会阻止对半规管信号的正常检测,但对检测斑信号的影响较小。特别有趣的是,小脑不仅作为身体大多数快速运动的“预测”器官,还作为涉及平衡的运动的预测器官。小脑的这些其他功能将在第57章中讨论。
稳定眼睛的前庭机制
当一个人快速改变运动方向,甚至将头部向侧面、前或后倾斜时,除非他有某种自动控制机制来稳定眼睛的注视方向,否则不可能在视网膜上保持稳定的图像。此外,除非眼睛在每物体上停留足够长的时间以获得清晰的图像,否则它们在检测图像方面几乎没有用处。幸运的是,每次头部突然旋转时,来自半规管(semicircular ducts)的信号会使眼睛向与头部旋转相反的方向旋转。这种运动是通过前庭核(vestibular nuclei)和内侧纵束(medial longitudinal fasciculus)传递到动眼神经核(oculomotor nuclei)的反射引起的。这些反射将在第52章中详细描述。
与平衡相关的其他因素
颈部本体感受器(Neck Proprioceptors)。前庭器官(vestibular apparatus)仅检测头部的方向和运动。因此,神经系统中心还必须接收有关头部相对于身体方向的适当信息。这些信息从颈部和身体的本体感受器直接传递到脑干中的前庭核和网状核(reticular nuclei),或通过小脑间接传递。
在维持平衡所需的最重要的本体感受信息中,来自颈部关节感受器(joint receptors)的信息尤为重要。当通过弯曲颈部使头部向一侧倾斜时,来自颈部本体感受器的冲动会阻止来自前庭器官的信号使人产生失衡感。它们通过传递与前庭器官信号完全相反的信号来实现这一功能。然而,当整个身体向一侧倾斜时,来自前庭器官的冲动不会被颈部本体感受器的信号所抵消;因此,在这种情况下,人会感知到整个身体平衡状态的变化。
来自身体其他部位的本体感受和外感受信息(Proprioceptive and Exteroceptive Information From Other Parts of the Body)。来自颈部以外身体部位的本体感受信息在维持平衡中也十分重要。例如,来自足底的压力感觉可以告诉我们(1)重量是否均匀分布在双脚之间,以及(2)脚上的重量是更靠前还是更靠后。
当一个人跑步时,外感受信息对于维持平衡尤为重要。身体前部的气压信号表明有一种力在与重力不同的方向上对抗身体;因此,人会向前倾斜以对抗这种力。
视觉信息对维持平衡的重要性(Importance of Visual Information for Maintaining Equilibrium)。即使在前庭器官被破坏后,甚至在失去大部分来自身体的本体感受信息后,一个人仍然可以相当有效地利用视觉机制来维持平衡。即使是身体的轻微线性或旋转运动也会立即改变视网膜上的视觉图像,这些信息会被传递到平衡中枢。一些双侧前庭器官被破坏的人在睁开眼睛且动作缓慢时,几乎可以保持正常的平衡。然而,当快速移动或闭上眼睛时,平衡会立即丧失。
前庭装置与中枢神经系统的神经元连接
图53-13显示了前庭神经在后脑中的连接。大多数前庭神经纤维终止于脑干中的前庭核(vestibular nuclei),这些核团大致位于延髓和脑桥的交界处。一些纤维直接传递到脑干网状核(reticular nuclei)而不进行突触连接,同时也传递到小脑的顶核(fastigial nucleus)、蚓垂(uvular nucleus)和绒球小结叶(flocculonodular lobe)核团。终止于脑干前庭核的纤维与第二级神经元形成突触,这些神经元也发出纤维进入小脑、前庭脊髓束(vestibulospinal tracts)、内侧纵束(medial longitudinal fasciculus)以及脑干的其他区域,特别是网状核(reticular nuclei)。
平衡反射的主要通路始于前庭神经,这些神经由前庭装置兴奋。然后,通路传递到前庭核和小脑。接下来,信号被发送到脑干的网状核,并通过前庭脊髓束和网状脊髓束(reticulospinal tracts)传递到脊髓。传递到脊髓的信号控制着许多抗重力肌的促进和抑制之间的相互作用,从而自动控制平衡。
小脑的绒球小结叶特别关注来自半规管(semicircular ducts)的动态平衡信号。事实上,这些叶的破坏会导致与半规管破坏几乎完全相同的临床症状。也就是说,无论是叶还是半规管的严重损伤都会导致在运动方向快速变化时失去动态平衡,但在静态条件下不会严重干扰平衡。据信,小脑的蚓垂在静态平衡中起着类似的重要作用。
从脑干的前庭核和小脑通过内侧纵束向上传递的信号会在头部每次旋转时引起眼睛的纠正运动,从而使眼睛保持固定在特定的视觉对象上。信号也向上传递(通过相同的束或通过网状束)到大脑皮层,终止于位于顶叶的初级皮层平衡中心,该中心位于颞上回听觉区域对侧的西尔维安裂(sylvian fissure)深处。这些信号使心理意识到身体的平衡状态。
脑干核团在控制潜意识、刻板运动中的功能
偶尔会有婴儿出生时没有中脑区域以上的脑结构,这种情况称为无脑畸形(anencephaly)。其中一些婴儿能够存活数月。他们能够执行一些刻板的进食动作,如吸吮、将不愉快的食物从口中挤出,以及将手移动到口中吸吮手指。此外,他们可以打哈欠和伸展。他们可以哭泣,并可以通过眼睛和头部的运动跟随物体。此外,在他们的腿前上部施加压力会使他们拉起到坐姿。显然,人类的许多刻板运动功能是在脑干中整合的。
图 56-13. 前庭神经通过前庭核(大的粉红色椭圆形区域)与中枢神经系统其他区域的连接。
参考文献
Cembrowski MS, Spruston N: Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nat Rev Neurosci 20:193, 2019. Cullen KE: Vestibular processing during natural self-motion: implications for perception and action. Nat Rev Neurosci 20:346, 2019. Cullen KE, Taube JS: Our sense of direction: progress, controversies and challenges. Nat Neurosci 20:1465, 2017. Dokka K, Park H, Jansen M, DeAngelis GC, Angelaki DE: Causal inference accounts for heading perception in the presence of object motion. Proc Natl Acad Sci U S A 116:9060, 2019. Ebbesen CL, Brecht M: Motor cortex - to act or not to act? Nat Rev Neurosci 18:694, 2017. Fetsch CR, DeAngelis GC, Angelaki DE: Bridging the gap between theories of sensory cue integration and the physiology of multisensory neurons. Nat Rev Neurosci 14:429, 2013. Harrison TC, Murphy TH: Motor maps and the cortical control of movement. Curr Opin Neurobiol 24:88, 2014. Holtmaat A, Svoboda K: Experience-dependent structural synaptic plasticity in the mammalian brain. Nat Rev Neurosci 10:647, 2009. Kim HR, Angelaki DE, DeAngelis GC: The neural basis of depth perception from motion parallax. Philos Trans R Soc Lond B Biol Sci 2016 Jun 19;371(1697). pii: 20150256. doi: 10.1098/rstb.2015.0256. Laurens J, Angelaki DE: The brain vompass: a perspective on how selfmotion updates the head direction cell attractor. Neuron 97:275, 2018. Nachev P, Kennard C, Husain M: Functional role of the supplementary and pre-supplementary motor areas. Nat Rev Neurosci 9:856, 2008. Proske U, Allen T: The neural basis of the senses of effort, force and heaviness. Exp Brain Res 237:589, 2019. Proske U, Gandevia SC: Kinesthetic senses. Compr Physiol 8:1157, 2018. Proske U, Gandevia SC: The proprioceptive senses: their roles in signaling body shape, body position and movement, and muscle force. Physiol Rev 92:1651, 2012. Rizzolatti G, Cattaneo L, Fabbri-Destro M, Rozzi S: Cortical mechanisms underlying the organization of goal-directed actions and mirror neuron-based action understanding. Physiol Rev 94:655, 2014. Rizzolatti G, Sinigaglia C: The mirror mechanism: a basic principle of brain function. Nat Rev Neurosci. 17:757, 2016. Robles L, Ruggero MA: Mechanics of the mammalian cochlea. Physiol Rev 81:1305, 2001. Roelfsema PR, Holtmaat A: Control of synaptic plasticity in deep cortical networks. Nat Rev Neurosci 19:166, 2018. Scott SK, McGettigan C, Eisner F: A little more conversation, a little less action—candidate roles for the motor cortex in speech perception. Nat Rev Neurosci 10:295, 2009. Svoboda K, Li N: Neural mechanisms of movement planning: motor cortex and beyond. Curr Opin Neurobiol 49:33, 2018.
小脑和基底神经节对整体运动控制的贡献
除了刺激肌肉收缩的大脑皮层区域外,还有两个脑结构对正常运动功能至关重要——小脑(cerebellum)和基底神经节(basal ganglia)。这两个结构都不能单独控制肌肉功能。相反,这些结构总是与其他运动控制系统协同工作。
小脑在运动活动的时间安排以及从一个肌肉运动到下一个肌肉运动的快速、平稳过渡中起着重要作用。它还在肌肉负荷变化时帮助控制肌肉收缩的强度,并控制主动肌(agonist)和拮抗肌(antagonist)群之间必要的瞬时相互作用。
基底神经节(basal ganglia)帮助计划和控制复杂的肌肉运动模式。它们控制各个运动的相对强度、运动方向以及多个连续和平行运动的顺序,以实现特定的复杂运动目标。本章解释了小脑和基底神经节的基本功能,并讨论了实现整体运动活动复杂协调的总体大脑机制。
小脑及其运动功能
如图57-1和57-2所示,小脑长期以来被称为大脑的静默区(silent area),主要是因为小脑的电刺激不会引起任何有意识的感觉,也很少引起任何运动。然而,小脑的切除会导致身体运动变得高度异常。小脑在快速肌肉活动中尤为重要,如跑步、打字、弹钢琴甚至说话。大脑这一区域的丧失几乎会导致这些活动的完全缺乏协调,尽管其丧失不会导致任何肌肉的瘫痪。
当小脑没有直接引起肌肉收缩的能力时,它怎么会如此重要呢?答案是它帮助排序和监控运动活动,并在活动执行时进行纠正性调整,以便它们符合由大脑运动皮层(cerebral motor cortex)和大脑其他部分指导的运动信号。
小脑从大脑运动控制区域持续接收有关所需肌肉收缩序列的更新信息;它还从身体的外周部分持续接收感觉信息,提供身体每个部分状态的顺序变化——其位置、运动速度、作用在其上的力等。然后,小脑将外周感觉反馈信息所描述的实际运动与运动系统预期的运动进行比较。如果两者不匹配,则瞬时潜意识纠正信号会传回运动系统,以增加或减少特定肌肉的激活水平。
小脑还帮助大脑皮层在当前运动仍在执行时提前几分之一秒计划下一个顺序运动,从而帮助人们从一个运动平稳过渡到下一个运动。此外,它通过错误学习。如果一个运动没有完全按预期发生,小脑回路会学会在下一次做出更强或更弱的运动。为了进行这种调整,适当的小脑神经元的兴奋性会发生变化,从而使随后的肌肉收缩更好地与预期运动相对应。
小脑的解剖和功能区域
从解剖学上看,小脑(cerebellum)被两条深沟分为三个叶(lobe),如图57-1和图57-2所示:(1)前叶(anterior lobe),(2)后叶(posterior lobe),以及(3)绒球小结叶(flocculonodular lobe)。绒球小结叶是小脑最古老的部分,它与前庭系统(vestibular system)共同发育并协同工作,以控制身体的平衡,这一点在第56章中已讨论过。
前叶和后叶的纵向功能分区。从功能的角度来看,前叶和后叶并不是按叶来组织的,而是沿纵轴(longitudinal axis)组织的,如图57-2所示,图中显示了人类小脑的后视图,其中小脑后叶的下端从其通常隐藏的位置向下展开。注意,在小脑的中心有一条狭窄的带状结构,称为蚓部(vermis),它通过浅沟与小脑的其余部分分开。大多数控制躯干、颈部、肩部和臀部肌肉运动的小脑功能都位于这个区域。
图57-1 从小脑侧面观察到的解剖学叶。
图57-2 从小脑后下方观察到的功能分区,小脑的最下端向外展开以使表面平坦。
在蚓部的两侧各有一个向外侧突出的小脑半球(cerebellar hemisphere);每个半球又分为中间区(intermediate zone)和外侧区(lateral zone)。半球的中间区负责控制上肢和下肢远端部分的肌肉收缩,尤其是手、手指、脚和脚趾。半球的外侧区则在一个更宏观的层面上运作,因为该区域与大脑皮层(cerebral cortex)共同参与整体运动序列的计划。如果没有这个外侧区,身体的大多数离散运动活动将失去其适当的时间安排和顺序,从而变得不协调,这一点我们将在本章后面更详细地讨论。
图57-3 小脑皮层中的体感投射区。
小脑蚓部和小脑中间区的身体拓扑表征
与大脑感觉皮层(sensory cortex)、运动皮层(motor cortex)、基底神经节(basal ganglia)、红核(red nuclei)和网状结构(reticular formation)一样,小脑的蚓部(vermis)和中间区(intermediate zones)也具有身体不同部位的拓扑表征(topographical representations)。图57-3展示了两种这样的表征。需要注意的是,身体的轴心部分位于小脑的蚓部,而四肢和面部区域则位于中间区。这些拓扑表征接收来自身体各部分的传入神经信号,以及来自大脑皮层和脑干中相应拓扑运动区的信号。反过来,它们将运动信号发送回大脑运动皮层的相应拓扑区域,以及脑干中红核和网状结构的拓扑区域。
需要注意的是,小脑半球的大面积外侧部分并没有身体的拓扑表征。小脑的这些区域几乎完全接收来自大脑皮层的输入信号,特别是额叶皮层(frontal cortex)的运动前区(premotor areas),以及顶叶皮层(parietal cortex)的体感(somatosensory)和其他感觉联合区(sensory association areas)。这种与大脑皮层的连接使得小脑半球的外侧部分在计划和协调身体快速连续的肌肉活动中发挥重要作用,这些活动在几分之一秒内一个接一个地发生。
小脑的神经元回路
人类的小脑皮层实际上是一个大的折叠片,宽约17厘米,长约120厘米,折叠方向为横向,如图57-2和57-3所示。每个折叠称为一个叶(folium)。在小脑皮层折叠结构的深处是小脑深部核团(deep cerebellar nuclei)。
小脑的输入通路
来自大脑其他部分的传入通路。小脑的基本输入通路如图57-4所示。一个广泛且重要的传入通路是皮质-脑桥-小脑通路(corticopontocerebellar pathway),它起源于大脑运动皮层和运动前皮层,也起源于大脑体感皮层。它通过脑桥核(pontile nuclei)和脑桥-小脑束(pontocerebellar tracts)主要传递到大脑对侧小脑半球的外侧部分。
图57-4 小脑的主要传入束
此外,重要的传入束起源于脑干的每一侧。这些束包括:(1) 广泛的橄榄-小脑束(olivocerebellar tract),它从下橄榄核(inferior olive)传递到小脑的所有部分,并在橄榄核中由来自大脑运动皮层、基底神经节、广泛网状结构区域和脊髓的纤维激活;(2) 前庭-小脑纤维(vestibulocerebellar fibers),其中一些起源于前庭器官本身,另一些起源于脑干前庭核,几乎所有这些纤维都终止于小脑的绒球小结叶(flocculonodular lobe)和顶核(fastigial nucleus);(3) 网状-小脑纤维(reticulocerebellar fibers),它起源于脑干网状结构的不同部分,终止于小脑的中线区域(主要在蚓部)。
来自外周的感觉传入通路(afferent pathways)。小脑还直接从身体的外周部分接收重要的感觉信号,主要通过每侧的四条传导束,其中两条位于脊髓背侧,两条位于腹侧。这些传导束中最重要的两条如图57-5所示,即脊髓小脑背侧束(dorsal spinocerebellar tract)和脊髓小脑腹侧束(ventral spinocerebellar tract)。背侧束通过小脑下脚进入小脑,终止于同侧小脑的蚓部和小脑中间区。腹侧束通过小脑上脚进入小脑,但终止于小脑的两侧。
脊髓小脑背侧束传递的信号主要来自肌梭(muscle spindles),其次来自全身的其他躯体感受器(somatic receptors),如高尔基腱器官(Golgi tendon organs)、皮肤的大型触觉感受器和关节感受器。所有这些信号都向小脑报告(1)肌肉收缩、(2)肌腱张力程度、(3)身体各部位的位置和运动速度以及(4)作用于身体表面的力的瞬时状态。
图57-5 脊髓小脑束
脊髓小脑腹侧束从外周感受器接收的信息要少得多。相反,它们主要被来自(1)大脑通过皮质脊髓束(corticospinal tract)和红核脊髓束(rubrospinal tract)以及(2)脊髓本身的内部运动模式发生器(internal motor pattern generators)到达脊髓前角的运动信号所兴奋。因此,这条腹侧纤维通路告诉小脑哪些运动信号已经到达前角;这种反馈被称为前角运动驱动的传出副本(efference copy)。
脊髓小脑通路的冲动传导速度可达120m/sec,是中枢神经系统所有通路中最快的。这种速度对于小脑即时了解外周肌肉动作的变化非常重要。
除了来自脊髓小脑束的信号外,信号还通过脊髓背柱(dorsal columns)从身体外周传递到延髓的背柱核(dorsal column nuclei),然后中继到小脑。同样,信号通过脊髓网状通路(spinoreticular pathway)向上传递到脑干的网状结构(reticular formation),也通过脊髓橄榄通路(spinoolivary pathway)传递到下橄榄核(inferior olivary nucleus)。然后信号从这两个区域中继到小脑。因此,小脑不断收集身体各部位运动和位置的信息,尽管它是在潜意识水平上运作的。
图57-6 小脑的主要传出束
小脑的输出信号
小脑深部核团及传出通路
位于小脑深部两侧的是三个小脑深部核团——齿状核(dentate)、中间核(interposed)和顶核(fastigial)。(延髓中的前庭核在某些方面也像小脑深部核团一样发挥作用,因为它们与绒球小结叶皮层有直接连接。)所有小脑深部核团都接收来自两个来源的信号:(1) 小脑皮层和(2) 通向小脑的深部感觉传入通路。
每当输入信号到达小脑时,它会分成两个方向:(1) 直接传递到小脑深部核团之一,以及(2) 传递到覆盖深部核团的小脑皮层的相应区域。然后,几分之一秒后,小脑皮层将抑制性输出信号传递到深部核团。因此,所有进入小脑的输入信号最终都以初始兴奋性信号的形式传递到深部核团,随后几分之一秒后传递抑制性信号。从深部核团发出的输出信号离开小脑,并分布到大脑的其他部分。
从小脑发出的主要传出通路的总体布局如图57-6所示,包括以下通路:
- 一条通路起源于小脑的中线结构(蚓部),然后通过顶核进入脑干的延髓和脑桥区域。该通路与平衡装置和脑干前庭核密切协作,控制平衡,并与脑干的网状结构协作,控制身体的姿势。第56章详细讨论了与平衡相关的部分。
- 一条通路起源于(1) 小脑半球的中间区,然后通过(2) 中间核传递到(3) 丘脑的腹外侧核和腹前核,再到(4) 大脑皮层,接着到(5) 丘脑的多个中线结构,再到(6) 基底神经节和(7) 上脑干的红核和网状结构。这个复杂的通路主要帮助协调四肢外周部分的主动肌和拮抗肌的交替收缩,特别是在手、手指和拇指中。
- 一条通路始于小脑半球外侧区的小脑皮层,然后传递到齿状核,接着到丘脑的腹外侧核和腹前核,最后到大脑皮层。该通路在帮助协调由大脑皮层发起的连续运动活动中起重要作用。
小脑皮层的功能单位——浦肯野细胞和深部核团细胞
图57-7 深部核团细胞接收兴奋性和抑制性输入。图的左侧显示了小脑的基本神经元回路,兴奋性神经元用红色表示,浦肯野细胞(抑制性神经元)用黑色表示。右侧显示了小脑深部核团与小脑皮层及其三层结构的物理关系。
小脑(cerebellum)大约有3000万个几乎相同的功能单位(functional unit),其中一个如图57-7左侧所示。这个功能单位以一个非常大的Purkinje细胞和一个相应的深部核细胞(deep nuclear cell)为中心。
在图57-7的顶部和右侧,显示了小脑皮层(cerebellar cortex)的三个主要层次:分子层(molecular layer)、Purkinje细胞层(Purkinje cell layer)和颗粒细胞层(granule cell layer)。在这些皮层层次之下,位于小脑质量的中心,是深部小脑核(deep cerebellar nuclei),它们向神经系统的其他部分发送输出信号。
功能单位的神经回路(Neuronal Circuit of the Functional Unit)。图57-7的左侧还显示了功能单位的神经回路,该回路在小脑中重复了3000万次,几乎没有变化。功能单位的输出来自深部核细胞。这个细胞持续受到兴奋性和抑制性影响。兴奋性影响来自与从小脑或外周进入小脑的传入纤维(afferent fibers)的直接连接。抑制性影响完全来自小脑皮层中的Purkinje细胞。
小脑的传入输入主要有两种类型,一种称为攀爬纤维(climbing fiber)类型,另一种称为苔藓纤维(mossy fiber)类型。
攀爬纤维都起源于延髓(medulla)的下橄榄核(inferior olives)。大约每5到10个Purkinje细胞有一个攀爬纤维。在向几个深部核细胞发出分支后,攀爬纤维一直延伸到小脑皮层的外层,在那里它与每个Purkinje细胞的胞体和树突形成大约300个突触。这种攀爬纤维的特点是,其中的单个冲动总是会在每个与之连接的Purkinje细胞中引起一个单一的、延长的(长达1秒)、特殊类型的动作电位(action potential),开始是一个强烈的尖峰,随后是一系列逐渐减弱的次级尖峰。这种动作电位被称为复合尖峰(complex spike)。
苔藓纤维是从多个来源进入小脑的所有其他纤维——高级脑、脑干和脊髓。这些纤维也发出侧支以兴奋深部核细胞。然后它们进入皮层的颗粒细胞层,在那里它们还与数百到数千个颗粒细胞形成突触。反过来,颗粒细胞发出直径小于1微米的极细轴突,向上延伸到小脑皮层外表面的分子层。在这里,轴突分成两个分支,每个分支沿着叶片(folia)平行方向延伸1到2毫米。由于每个Purkinje细胞大约有500到1000个颗粒细胞,因此存在数百万条这样的平行神经纤维。Purkinje细胞的树突投射到这个分子层中,每条Purkinje细胞与80,000到200,000条平行纤维形成突触。
苔藓纤维对Purkinje细胞的输入与攀爬纤维的输入非常不同,因为突触连接较弱,因此必须同时刺激大量苔藓纤维才能兴奋Purkinje细胞。此外,激活通常表现为一种更弱、持续时间更短的Purkinje细胞动作电位,称为简单尖峰(simple spike),而不是由攀爬纤维输入引起的延长的复合动作电位。
小脑的Purkinje细胞和深部核细胞在正常静息状态下持续放电
Purkinje细胞和深部核细胞的一个共同特征是,在正常情况下,它们都会持续放电;Purkinje细胞的放电频率约为每秒50到100个动作电位,而深部核细胞的放电频率则要高得多。此外,这两种细胞的输出活动都可以被上调或下调。
小脑深部核的兴奋与抑制之间的平衡
再次参考图57-7的电路,注意攀爬纤维和苔藓纤维对深部核细胞的直接刺激会使其兴奋。相比之下,来自Purkinje细胞的信号则会抑制它们。通常情况下,这两种效应之间的平衡略微偏向于兴奋,因此在安静状态下,深部核细胞的输出保持在中等水平的持续刺激下相对恒定。
在执行快速运动时,来自大脑运动皮层或脑干的启动信号首先会大大增加深部核细胞的兴奋性。然后,几毫秒后,来自Purkinje细胞电路的反馈抑制信号到达。这样,深部核细胞首先向运动输出通路发送一个快速的兴奋信号,以增强运动,随后在极短的时间内又发送一个抑制信号。这个抑制信号类似于一种“延迟线”负反馈信号,能够有效地提供阻尼。也就是说,当运动系统被激发时,一个负反馈信号会在短暂的延迟后出现,以防止肌肉运动过度。否则,运动将会出现振荡。
小脑中的篮状细胞和星状细胞引起Purkinje细胞的侧向抑制
除了深部核细胞、颗粒细胞和Purkinje细胞外,小脑中还有两种其他类型的神经元——篮状细胞和星状细胞,它们都是具有短轴突的抑制性细胞。篮状细胞和星状细胞都位于小脑皮层的分子层中,位于小平行纤维之间并受其刺激。这些细胞反过来将其轴突以直角穿过平行纤维,引起相邻Purkinje细胞的侧向抑制,从而以与神经系统许多其他神经回路中侧向抑制增强信号对比相同的方式,锐化信号。
小脑的开启/关闭和关闭/开启输出信号
小脑的典型功能是在运动开始时帮助提供快速的开启信号给主动肌,同时提供相互的关闭信号给拮抗肌。然后,在接近运动结束时,小脑主要负责计时并执行对主动肌的关闭信号和对拮抗肌的开启信号。虽然具体的细节尚不完全清楚,但可以从图57-7的基本小脑电路中推测这一过程可能如何工作,如下所述。
让我们假设运动开始时主动肌/拮抗肌收缩的开启/关闭模式始于来自大脑皮层的信号。这些信号通过非小脑的脑干和脊髓通路直接传递到主动肌,以开始初始收缩。
同时,平行的信号通过桥脑苔藓纤维(pontile mossy fibers)传入小脑(cerebellum)。每条苔藓纤维的一个分支直接到达齿状核(dentate nucleus)或其他小脑深部核团(deep cerebellar nuclei)的深部核细胞,这些细胞立即通过丘脑(thalamus)返回信号到大脑皮层(cerebral cortex)或通过脑干(brain stem)的神经元回路,向大脑皮层已经启动的肌肉收缩信号提供支持。因此,启动信号在几毫秒后变得比开始时更强大,因为它成为大脑皮层和小脑信号的叠加。这是小脑完好时的正常效应,但在小脑缺失的情况下,这种额外的支持信号会缺失。小脑的支持使得启动的肌肉收缩比没有小脑时更强。
那么,在运动结束时,是什么导致了主动肌(agonist muscles)的关闭信号?记住,所有苔藓纤维都有第二个分支,通过颗粒细胞(granule cells)将信号传递到小脑皮层(cerebellar cortex),最终通过“平行”纤维(parallel fibers)传递到浦肯野细胞(Purkinje cells)。浦肯野细胞反过来抑制深部核细胞。这条通路经过神经系统中最细小、传导最慢的神经纤维之一——小脑皮层分子层(molecular layer)的平行纤维,其直径仅为几分之一毫米。此外,这些纤维的信号较弱,因此需要一定的时间在浦肯野细胞的树突(dendrites)中积累足够的兴奋性才能激发它。然而,一旦浦肯野细胞被激发,它会向最初启动运动的深部核细胞发送一个强烈的抑制信号。因此,这个信号有助于在短时间内关闭运动。
因此,我们可以看到,完整的小脑回路如何在运动开始时迅速启动主动肌收缩,并在给定时间后精确地关闭相同的主动肌收缩。
现在,让我们推测一下拮抗肌(antagonist muscles)的回路。最重要的是,记住脊髓(spinal cord)中几乎每一个运动都有相互的主动肌-拮抗肌回路。因此,这些回路是拮抗肌在运动开始时关闭、运动结束时启动的基础,反映了主动肌中发生的任何情况。但也要记住,小脑除了浦肯野细胞外,还包含其他几种类型的抑制性细胞。其中一些细胞的功能仍有待确定;它们也可能在运动开始时对拮抗肌的初始抑制和运动结束时的后续兴奋中发挥作用。
这些机制仍然部分属于推测。这里提出它们是为了说明小脑如何通过增强启动和关闭信号来控制主动肌和拮抗肌以及时间。
浦肯野细胞“学习”纠正运动错误——攀爬纤维(Climbing Fibers)的作用
小脑(cerebellum)支持肌肉收缩的开始和结束以及收缩时间的能力必须通过学习获得。通常,当一个人首次执行一个新的运动动作时,小脑在收缩开始时增强运动的程度、在收缩结束时抑制的程度以及这些动作的时间安排几乎总是不准确的。然而,在多次执行该动作后,各个事件逐渐变得更加精确,有时只需要几次动作就能达到预期的结果,但有时可能需要数百次动作。
这些调整是如何发生的?确切答案尚不清楚,尽管已知小脑回路在训练过程中逐渐适应其敏感性水平,特别是浦肯野细胞(Purkinje cells)对颗粒细胞(granule cell)兴奋的反应敏感性。此外,这种敏感性变化是由来自下橄榄核(inferior olivary complex)进入小脑的攀爬纤维(climbing fibers)的信号引起的。
在静息状态下,攀爬纤维每秒大约放电一次,但每次放电都会导致浦肯野细胞整个树突的极度去极化,持续时间可达1秒。在此期间,浦肯野细胞会先产生一个强烈的初始输出尖峰,随后是一系列逐渐减弱的尖峰。当一个人首次执行一个新的动作时,来自肌肉和关节本体感受器的反馈信号通常会向小脑指示实际动作与预期动作的偏差程度,而攀爬纤维信号会以某种方式改变浦肯野细胞的长期敏感性。随着时间的推移,这种敏感性的变化,加上小脑可能的其他“学习”功能,被认为可以使小脑对运动的控制时间和其他方面趋于完美。当达到这种状态时,攀爬纤维不再需要向小脑发送“错误”信号以引起进一步的变化。
小脑在整体运动控制中的功能
神经系统利用小脑在三个层次上协调运动控制功能:
- 前庭小脑(vestibulocerebellum)。这一层次主要由位于小脑后部下方和蚓部(vermis)相邻部分的小脑小结叶(flocculonodular lobes)组成。它为身体的大部分平衡运动提供神经回路。
- 脊髓小脑(spinocerebellum)。这一层次由小脑后部和前部的大部分蚓部以及蚓部两侧的中间区(intermediate zones)组成。它主要为协调四肢远端部分的运动,尤其是手和手指的运动提供回路。
- 大脑小脑(cerebrocerebellum)。这一层次由小脑半球外侧的大片区域组成,位于中间区的外侧。它几乎所有的输入都来自大脑的运动皮层(motor cortex)以及邻近的前运动皮层(premotor cortex)和体感皮层(somatosensory cortex)。它以反馈方式与大脑皮层的感觉运动系统一起工作,向上传输信息以计划顺序的自主身体和肢体运动。这些运动在实际运动前十分之一秒就已经计划好了。这个过程被称为“运动意象(motor imagery)”的发展。
前庭小脑(Vestibulocerebellum)与脑干和脊髓协同控制平衡和姿势运动
前庭小脑在系统发育上与内耳前庭器官(vestibular apparatus)的发育几乎同时出现。此外,如第56章所述,构成前庭小脑的小脑绒球小结叶(flocculonodular lobes)和邻近蚓部(vermis)的损伤会导致平衡和姿势运动的严重紊乱。
在前庭小脑功能障碍的患者中,快速运动时的平衡失调比静止时更为明显,尤其是当这些运动涉及运动方向的改变并刺激半规管(semicircular ducts)时。这一现象表明,前庭小脑在快速改变身体位置时,对控制脊柱、臀部和肩部的主动肌(agonist)和拮抗肌(antagonist)收缩之间的平衡至关重要,这是前庭器官所必需的。
控制平衡的主要问题之一是将身体不同部位的位置信号和运动速度信号传递到大脑所需的时间。即使使用传导速度最快的脊髓小脑传入通路(spinocerebellar afferent tracts),传导速度可达120米/秒,从足部到大脑的传导延迟仍有15到20毫秒。在这段时间内,快速奔跑的人的足部可以移动多达10英寸。因此,来自身体外周部位的反馈信号永远不可能与运动实际发生时同时到达大脑。那么,大脑如何在快速运动时知道何时停止一个动作并执行下一个连续动作呢?答案是,来自外周的信号告诉大脑身体部位的运动速度和方向。然后,前庭小脑的功能就是根据这些速度和方向提前计算出在接下来的几毫秒内身体不同部位的位置。这些计算的结果是大脑进行下一个连续运动的关键。
图57-8 大脑和小脑对随意运动的控制,尤其涉及小脑的中间区(intermediate zone)。
因此,在控制平衡时,推测来自身体外周和前庭器官的信息被用于典型的反馈控制回路(feedback control circuit),以提供姿势运动信号的预期校正(anticipatory correction),即使在包括快速改变运动方向的极快运动中也能保持平衡。
脊髓小脑(Spinocerebellum)——通过小脑中间皮质(Intermediate Cerebellar Cortex)和间位核(Interposed Nucleus)对远端肢体运动的反馈控制
如图57-8所示,当执行运动时,每个小脑半球的中间区接收两种信息:(1)来自大脑运动皮层和中脑红核的信息,告诉小脑接下来几秒钟内预期的运动顺序计划;(2)来自身体外周部分的反馈信息,特别是来自肢体远端本体感受器(proprioceptors)的信息,告诉小脑实际发生的运动。
在小脑中间区将预期运动与实际运动进行比较后,插入核的深部核细胞发出纠正性输出信号:(1)通过丘脑中的中继核返回大脑运动皮层;(2)到红核的大细胞部分(下部),该部分发出红核脊髓束(rubrospinal tract)。红核脊髓束随后与皮质脊髓束(corticospinal tract)一起支配脊髓灰质前角最外侧的运动神经元,这些神经元控制肢体的远端部分,特别是手和手指。
小脑运动控制系统的这一部分为执行精确的有目的的模式化运动提供了远端肢体主动肌(agonist)和拮抗肌(antagonist)的平滑、协调运动。小脑似乎将运动控制系统较高层次的“意图”(通过皮质-脑桥-小脑束(corticopontocerebellar tract)传递到小脑中间区)与身体各部分的“表现”(从外周传递回小脑)进行比较。事实上,腹侧脊髓小脑束(ventral spinocerebellar tract)甚至将到达前运动神经元的实际运动控制信号的“传出”(efference)副本传递回小脑,这些信息也与来自肌梭(muscle spindles)和其他本体感受器感觉器官的信号整合,主要通过背侧脊髓小脑束(dorsal spinocerebellar tract)传递。类似的比较信号也传递到下橄榄复合体(inferior olivary complex);如果信号比较不理想,橄榄-浦肯野细胞系统(olivary–Purkinje cell system)以及可能的小脑其他学习机制最终会纠正运动,直到它们执行所需的功能。
小脑防止过冲和“阻尼”运动的功能。身体的几乎所有运动都是“钟摆式的”。例如,当手臂移动时,会产生动量(momentum),必须在运动停止之前克服动量。由于动量的存在,所有钟摆式运动都有过冲(overshoot)的趋势。如果小脑被破坏的人发生过冲,大脑的意识中枢最终会识别这一错误,并启动反向运动以试图将手臂带到预期位置。然而,由于动量的作用,手臂会再次向相反方向过冲,必须再次发出适当的纠正信号。因此,手臂会在其预期点前后振荡几个周期,直到最终固定在目标位置。这种效应称为动作震颤(action tremor)或意向震颤(intention tremor)。
如果小脑完好无损,适当的学习和潜意识信号会在预定点精确地停止运动,从而防止过度运动和震颤。这种活动是阻尼系统的基本特征。所有调节具有惯性的摆动元件的控制系统都必须在机制中内置阻尼电路。对于神经系统的运动控制,小脑提供了大部分的阻尼功能。
小脑对弹道运动的控制。身体的大多数快速运动,如打字时手指的运动,发生得如此之快,以至于在运动结束之前无法从外周向小脑或从小脑向运动皮层接收反馈信息。这些运动被称为弹道运动,意味着整个运动是预先计划好的,并启动以到达特定距离然后停止。另一个重要的例子是眼睛的扫视运动,当阅读或当一个人在汽车中移动时,眼睛从一个位置跳到下一个位置,沿着道路看连续的点。
当小脑被移除时,这些弹道运动会发生三个主要变化:(1) 运动发展缓慢,没有小脑通常提供的额外启动冲动;(2) 产生的力量较弱;(3) 运动关闭缓慢,通常允许运动远远超过预定目标。因此,在小脑回路缺失的情况下,运动皮层必须额外努力地思考以开启和关闭弹道运动。因此,弹道运动的自动化丧失了。
再次考虑小脑的回路,可以看到它被精美地组织起来,以执行这种双相功能,首先是兴奋性,然后是延迟的抑制性功能,这是预先计划的快速弹道运动所必需的。此外,小脑皮层的内置计时电路对小脑的这种特殊能力至关重要。
大脑小脑——小脑半球大外侧区的功能:计划、排序和计时复杂运动
在人类中,两个小脑半球的外侧区高度发达且大大扩展。这一特征与人类计划和执行复杂顺序运动模式的能力,尤其是手和手指的运动以及说话能力密切相关。然而,小脑半球的大外侧区没有来自身体外周部分的直接信息输入。此外,这些外侧小脑区域与大脑皮层之间的几乎所有通信都不是与主要大脑运动皮层,而是与前运动区以及主要和联合体感区。
即便如此,小脑半球外侧区及其深部核团(齿状核)的破坏会导致手、手指、脚和言语器官的复杂有目的运动的极度不协调。这种情况一直难以理解,因为小脑的这一部分与主要运动皮层之间没有直接通信。然而,实验研究表明,小脑的这些部分涉及运动控制的另外两个重要但间接的方面:(1) 顺序运动的计划和 (2) 顺序运动的“计时”。
顺序运动的规划
顺序运动的规划要求大脑半球的侧区与大脑皮层的前运动区(premotor)和感觉区(sensory)进行交流,并且需要这些大脑皮层区域与基底神经节(basal ganglia)的相应区域进行双向交流。顺序运动的"计划"似乎实际上始于大脑皮层的感觉区和前运动区,然后从那里传递到小脑半球的侧区。随后,在小脑和大脑皮层之间的大量双向交流中,适当的运动信号提供了从一个运动序列到下一个运动序列的过渡。
支持这一观点的一个有趣观察是,小脑齿状核(cerebellar dentate nuclei)中的许多神经元在当前运动仍在进行时,就显示出即将到来的顺序运动的活动模式。因此,小脑侧区似乎并不关注某一时刻正在发生的运动,而是关注几分之一秒甚至几秒后下一个顺序运动期间将要发生的事情。
总结来说,正常运动功能的最重要特征之一是一个人能够有序地从一个运动顺利过渡到下一个运动。如果小脑半球的大侧区缺失,这种能力在快速运动中会受到严重干扰。
顺序运动的时间功能
小脑半球侧区的另一个重要功能是为每个后续运动提供适当的时间安排。如果这些小脑区域缺失,人们将失去潜意识中预测身体不同部位在给定时间内移动距离的能力。没有这种时间安排能力,人们将无法确定下一个顺序运动何时需要开始。因此,后续运动可能开始得太早,或者更有可能开始得太晚。因此,小脑侧区的病变会导致复杂运动(例如书写、跑步甚至说话所需的运动)变得不协调,并且缺乏从一个运动到下一个运动有序进行的能力。这种小脑病变被称为导致运动平滑进展的失败。
小脑的运动外预测功能
小脑(大侧叶)还有助于"计时"身体运动以外的事件。例如,大脑可以预测听觉和视觉现象的进展速度,但这两者都需要小脑的参与。举个例子,一个人可以从变化的视觉场景中预测他或她接近物体的速度。一个显著的实验证明了小脑在这种能力中的重要性,即移除猴子小脑大侧部分的影响。这样的猴子偶尔会撞到走廊的墙壁,因为它无法预测何时会到达墙壁。
很有可能小脑提供了一个"时间基准",可能是使用时间延迟电路(time-delay circuits),以便与中枢神经系统其他部分的信号进行比较。人们常说,小脑在解释感觉信息中快速变化的时空关系方面特别有帮助。
小脑的临床异常
小脑外侧皮质的小部分损伤很少会引起可检测的运动功能异常。事实上,在切除大脑一侧多达一半的小脑外侧皮质后几个月,如果深部小脑核团没有与皮质一起被切除,只要动物进行所有动作时速度较慢,其运动功能几乎看起来是正常的。因此,运动控制系统的剩余部分能够在很大程度上补偿小脑部分缺失的影响。
要引起小脑的严重且持续的功能障碍,小脑损伤通常必须涉及一个或多个深部小脑核团——齿状核(dentate nucleus)、间位核(interposed nucleus)或顶核(fastigial nucleus)。
辨距不良(dysmetria)和共济失调(ataxia)
小脑疾病的两个最重要症状是辨距不良和共济失调。在小脑缺失的情况下,潜意识运动控制系统无法预测动作会进行多远。因此,动作通常会超过其预期的目标;然后,大脑的有意识部分会在相反方向上过度补偿,以进行后续的补偿动作。这种效应称为辨距不良,它会导致不协调的动作,称为共济失调。辨距不良和共济失调也可能由脊髓小脑束(spinocerebellar tracts)的损伤引起,因为来自身体运动部位的反馈信息对于小脑终止运动的时机至关重要。
过指(past pointing)
过指意味着在小脑缺失的情况下,一个人通常会移动手或身体的其他运动部位,远远超过预期的目标。这种动作是由于正常情况下,小脑会启动大部分运动信号,在动作开始后将其关闭;如果小脑无法启动这种运动信号,动作通常会超过预期的目标。因此,过指实际上是辨距不良的一种表现。
运动进展失败
轮替运动障碍(dysdiadochokinesia)——无法执行快速交替动作。当运动控制系统无法预测身体不同部位在特定时间的位置时,它在快速运动过程中会“失去”对这些部位的感知。结果,后续动作可能会开始得太早或太晚,因此无法发生有序的“运动进展”。可以通过让患有小脑损伤的患者快速上下翻转一只手来轻松演示这种效应。患者在动作的任何部分都会迅速“失去”对手瞬时位置的所有感知。结果,一系列停滞的尝试动作会发生,而不是正常的协调上下运动。这种情况称为轮替运动障碍。
构音障碍(Dysarthria)——说话过程中的进展失败
另一个进展失败的例子是说话,因为词语的形成依赖于喉部、口腔和呼吸系统中各个肌肉运动的快速有序连续。这些结构之间缺乏协调,以及无法提前调整声音强度或每个连续声音的持续时间,会导致声音混乱,有些音节响亮,有些微弱,有些持续很长时间,有些则持续很短,最终导致言语常常难以理解。这种情况被称为构音障碍(Dysarthria)。
小脑性眼球震颤(Cerebellar Nystagmus)——眼球的震颤
小脑性眼球震颤(Cerebellar nystagmus)是指当一个人试图将眼睛固定在头部一侧的场景时,眼球发生的震颤。这种偏离中心的固定会导致眼睛快速、震颤的运动,而不是稳定的固定,这是小脑抑制功能失败的另一种表现。这种情况尤其发生在小脑的绒球小结叶(flocculonodular lobes)受损时;在这种情况下,它还伴随着平衡的丧失,因为来自半规管(semicircular ducts)通过绒球小结叶小脑的路径功能失调。
肌张力减退(Hypotonia)——肌肉张力降低
小脑深部核团,特别是齿状核(dentate nucleus)和间位核(interposed nuclei)的丧失,会导致小脑病变侧外周身体肌肉的张力降低。这种肌张力减退是由于小脑深部核团通过强直性信号对运动皮层和脑干运动核的促进作用丧失所致。
基底神经节(Basal Ganglia)及其运动功能
基底神经节(Basal ganglia)与小脑一样,构成了另一个辅助运动系统,通常不单独运作,而是与大脑皮层和皮质脊髓运动控制系统密切合作。事实上,基底神经节从大脑皮层接收大部分输入信号,并将几乎所有输出信号返回到皮层。
图57-9显示了基底神经节与大脑其他结构的解剖关系。在大脑的每一侧,这些神经节包括尾状核(caudate nucleus)、壳核(putamen)、苍白球(globus pallidus)、黑质(substantia nigra)和底丘脑核(subthalamic nucleus)。它们主要位于丘脑的外侧并围绕丘脑,占据了大脑半球内部区域的大部分。几乎所有连接大脑皮层和脊髓的运动和感觉神经纤维都通过基底神经节主要部分——尾状核和壳核之间的空间。这个空间被称为大脑的内囊(internal capsule)。由于基底神经节与皮质脊髓系统在运动控制中的密切关联,它对我们当前的讨论非常重要。
基底神经节的神经元回路
基底神经节与其他提供运动控制的大脑元素之间的解剖连接非常复杂,如图57-10所示。左侧显示了运动皮层、丘脑以及相关的脑干和小脑回路。右侧是基底神经节系统的主要回路,显示了基底神经节之间的巨大互连,以及大脑其他运动区域与基底神经节之间的广泛输入和输出路径。
在接下来的几节中,我们将特别关注两个主要回路,即壳核回路(putamen circuit)和尾状核回路(caudate circuit)。
基底神经节在执行运动活动模式中的功能——壳核回路
基底神经节在运动控制中的一个主要作用是与皮质脊髓系统(corticospinal system)协同工作,以控制复杂的运动活动模式。例如,书写字母表。当基底神经节受到严重损伤时,运动控制的皮质系统将无法提供这些模式。相反,书写会变得粗糙,就像一个人第一次学习写字一样。
其他需要基底神经节参与的模式包括用剪刀剪纸、锤钉子、投篮、传球、投掷棒球、铲土动作、发声的大部分方面、眼睛的受控运动,以及几乎任何其他我们熟练的运动,其中大多数是无意识完成的。
壳核回路的神经通路。图57-11显示了通过基底神经节执行学习到的运动模式的主要通路。它们主要始于运动皮层的运动前区和辅助区,以及感觉皮层的躯体感觉区。接下来,它们传递到壳核(主要绕过尾状核),然后到苍白球(globus pallidus)的内部部分,再到丘脑的腹前核(ventroanterior)和腹外侧核(ventrolateral)中继核,最后返回到大脑初级运动皮层以及与初级运动皮层密切相关的运动前区和辅助区。因此,壳核回路的输入主要来自与初级运动皮层相邻的大脑部分,而不是来自初级运动皮层本身。然后,其输出主要返回到初级运动皮层或密切相关的运动前区和辅助皮层。与这个主要的壳核回路密切相关的辅助回路从壳核通过苍白球外部、底丘脑(subthalamus)和黑质(substantia nigra),最终通过丘脑返回到运动皮层。
图57-10 基底神经节回路与皮质脊髓-小脑系统在运动控制中的关系。
壳核回路的异常功能:手足徐动症(Athetosis)、偏侧投掷症(Hemiballismus)和舞蹈症(Chorea)。壳核回路如何帮助执行运动模式?关于这一功能知之甚少。然而,当回路的一部分受损或阻塞时,某些运动模式会变得严重异常。例如,苍白球的病变通常会导致手、手臂、颈部或面部的自发且通常是持续的扭动运动。这些运动被称为手足徐动症(athetosis)。
图57-12 通过基底神经节的尾状核回路,用于认知规划以实现特定有意识目标的顺序和平行运动模式。
底丘脑的病变通常会导致整个肢体的突然挥动,这种情况称为偏侧投掷症(hemiballismus)。
壳核中的多个小病变会导致手、面部和身体其他部位出现抽动运动,称为舞蹈症(chorea)。
黑质(substantia nigra)的病变会导致一种常见且极其严重的疾病,表现为僵硬(rigidity)、运动不能(akinesia)和震颤(tremors),即帕金森病(Parkinson's disease),我们将在本章后面详细讨论。
基底神经节在运动模式序列认知控制中的作用——尾状核环路
认知(cognition)一词指的是大脑的思维过程,既使用大脑的感觉输入,也使用已经存储在记忆中的信息。我们的大多数运动行为都是大脑中产生的思想的结果,这一过程称为运动活动的认知控制(cognitive control of motor activity)。尾状核(caudate nucleus)在这种运动活动的认知控制中起着重要作用。
图57-12显示了尾状核与皮质脊髓运动控制系统之间的神经连接,这些连接与壳核环路(putamen circuit)的连接有些不同。造成这种差异的部分原因是,如图57-9所示,尾状核延伸至大脑的所有脑叶,从前方的额叶(frontal lobes)开始,然后向后穿过顶叶(parietal lobes)和枕叶(occipital lobes),最后再次向前弯曲,像字母"C"一样进入颞叶(temporal lobes)。此外,尾状核从覆盖其上的大脑皮层联合区(association areas)接收大量输入,主要是那些也将不同类型的感觉和运动信息整合为可用思维模式的区域。
信号从大脑皮层传递到尾状核后,被传输到内侧苍白球(internal globus pallidus),然后到丘脑腹前核(ventroanterior thalamus)和腹外侧核(ventrolateral thalamus)的中继核,最后返回到大脑皮层的前额叶(prefrontal)、运动前区(premotor)和辅助运动区(supplementary motor areas),但几乎没有返回信号直接传递到初级运动皮层。相反,返回信号进入运动前区和辅助运动区的辅助运动区域,这些区域与构建持续5秒或更长时间的运动序列模式有关,而不是兴奋单个肌肉运动。
这种现象的一个很好的例子是,一个人看到狮子接近,然后立即自动做出反应:(1)转身远离狮子,(2)开始奔跑,(3)甚至试图爬树。如果没有认知功能,这个人可能没有本能的知识,不需要思考太长时间,就能快速适当地做出反应。因此,运动活动的认知控制在潜意识中,并在几秒钟内决定将使用哪些运动模式来实现一个可能持续数秒的复杂目标。
基底神经节在改变运动时间和调节运动强度方面的功能
大脑在控制运动方面的两个重要能力是:(1)确定运动执行的速度,(2)控制运动的幅度。例如,一个人可以缓慢或快速地书写字母"a"。他或她可以在纸上写一个小的"a",也可以在黑板上写一个大的"A"。无论选择如何,字母的比例特征几乎保持不变。
在基底节(basal ganglia)严重损伤的患者中,这些时间调节和幅度调节功能很差——事实上,有时它们根本不存在。同样,基底节并不是单独发挥功能的;相反,它们与大脑皮层(cerebral cortex)密切协作。一个特别重要的皮层区域是后顶叶皮层(posterior parietal cortex),它是全身运动控制的空间坐标的所在地,也是身体及其各部分与周围环境关系的所在地。该区域的损伤不会产生简单的感觉知觉缺陷,如触觉丧失、失明或失聪。相反,后顶叶皮层的损伤会导致无法通过正常运作的感觉机制准确感知物体,这种情况称为失认症(agnosia)。图57-13展示了一位右后顶叶皮层损伤的患者可能如何尝试复制图画。
图57-13 展示了由右后顶叶皮层严重损伤引起的忽视综合征(neglect syndrome)患者可能绘制的图画,与患者被要求复制的实际图画进行比较。注意,患者复制图画左侧的能力严重受损。
在这些病例中,患者复制图画左侧的能力严重受损。此外,这样的人总是试图避免使用左臂、左手或身体左侧的其他部分来完成任务;患者甚至可能不洗身体的这一侧(个人忽视综合征(personal neglect syndrome)),几乎不知道这些身体部位的存在。
由于基底节系统的尾状核回路(caudate circuit)主要与大脑皮层的联合区(association areas)(如后顶叶皮层)协同工作,推测运动的时序和幅度调节是这一尾状核认知运动控制回路的功能。然而,我们对基底节功能的理解仍然非常不精确,以至于最后几节中讨论的大部分内容都是分析性推论,而非已证实的事实。
基底节系统中特定神经递质物质的功能
图57-14展示了已知在基底神经节中起作用的几种特定神经递质之间的相互作用,显示了以下内容:(1) 从黑质(substantia nigra)到尾状核(caudate nucleus)和壳核(putamen)的多巴胺(dopamine)通路;(2) 从尾状核和壳核到苍白球(globus pallidus)和黑质的γ-氨基丁酸(gamma-aminobutyric acid, GABA)通路;(3) 从皮质(cortex)到尾状核和壳核的乙酰胆碱(acetylcholine)通路;(4) 从脑干(brain stem)发出的多种一般通路,这些通路在基底神经节以及大脑的其他部分分泌去甲肾上腺素(norepinephrine)、血清素(serotonin)、脑啡肽(enkephalin)和其他几种神经递质。除此之外,还有多种谷氨酸(glutamate)通路提供了大部分的兴奋性信号(图中未显示),这些信号平衡了由多巴胺、GABA和血清素等抑制性递质传递的大量抑制性信号。我们将在后续章节讨论基底神经节疾病时,以及在讨论行为、睡眠、觉醒和自主神经系统功能的章节中,进一步讨论这些神经递质和激素系统。
图57-14 基底神经节中分泌不同类型神经递质的神经元通路。Ach,乙酰胆碱;GABA,γ-氨基丁酸。
目前,应记住GABA作为一种抑制性神经递质发挥作用。因此,从皮质通过基底神经节再返回皮质的反馈回路中的GABA神经元几乎使所有这些回路成为负反馈回路,而不是正反馈回路,从而为运动控制系统提供了稳定性。多巴胺在大脑的多数部位也作为抑制性神经递质发挥作用,因此在某些条件下也起到稳定剂的作用。
基底神经节损伤导致的临床综合征
除了已经提到的与苍白球和丘脑下部病变相关的手足徐动症(athetosis)和偏侧投掷症(hemiballismus)外,基底神经节损伤还会导致另外两种主要疾病。这些疾病是帕金森病(Parkinson’s disease)和亨廷顿病(Huntington’s disease)。
帕金森病
帕金森病,也称为震颤性麻痹(paralysis agitans),是由于黑质(substantia nigra)中向尾状核和壳核分泌多巴胺的神经纤维部分(致密部,pars compacta)广泛退化所致。该疾病的特征包括:(1) 身体大部分肌肉的僵硬;(2) 受累区域即使在休息时也会以固定的3至6次/秒的频率发生不自主震颤;(3) 启动运动的严重困难,称为运动不能(akinesia);(4) 由于姿势反射受损导致的姿势不稳定,导致平衡能力差和跌倒;(5) 其他运动症状,包括吞咽困难(dysphagia)、言语障碍、步态异常和疲劳。
这些异常运动效应的原因尚未完全明了。然而,尾状核(caudate nucleus)和壳核(putamen)中分泌的多巴胺(dopamine)是一种抑制性递质(inhibitory transmitter);因此,理论上,黑质(substantia nigra)中多巴胺能神经元(dopaminergic neurons)的破坏会使尾状核和壳核变得过度活跃,并可能导致向皮质脊髓运动控制系统(corticospinal motor control system)持续输出兴奋性信号。这些信号可能会过度兴奋身体的许多或所有肌肉,从而导致帕金森病(Parkinson’s disease)患者的僵硬。
一些反馈回路(feedback circuits)在失去抑制后,由于反馈增益(feedback gains)较高,可能会轻易振荡,导致帕金森病的震颤(tremor)。这种震颤与小脑疾病(cerebellar disease)的震颤完全不同,因为它发生在所有清醒时段,因此是一种不自主震颤(involuntary tremor),与小脑震颤(cerebellar tremor)形成对比,后者仅在患者有意进行运动时发生。
帕金森病中出现的运动不能(akinesia)通常比肌肉僵硬和震颤的症状更令患者痛苦,因为患有严重帕金森病的患者必须集中最高程度的注意力才能完成最简单的动作。为了实现所需的运动,所需的精神努力,甚至是精神痛苦,通常达到了患者意志力的极限。然后,当运动确实发生时,它们通常是僵硬和断断续续的,而不是流畅的。这种运动不能的原因仍然是推测性的。然而,边缘系统(limbic system)中的多巴胺分泌,特别是在伏隔核(nucleus accumbens)中,通常与基底节(basal ganglia)中的多巴胺分泌一起减少。有人认为,这种减少可能会大大降低运动活动的心理驱动力,从而导致运动不能。
帕金森病的非运动特征包括睡眠障碍、抑郁和焦虑、自主神经功能障碍(autonomic dysfunction),以及在晚期阶段的认知障碍(cognitive impairment)。
L-多巴治疗。给帕金森病患者服用L-多巴(L-dopa)通常可以改善许多运动障碍,特别是僵硬和运动不能,但对非运动症状几乎没有益处。运动障碍改善的原因被认为是L-多巴在大脑中转化为多巴胺,然后多巴胺恢复了尾状核和壳核中抑制和兴奋之间的正常平衡。服用多巴胺不会产生相同的效果,因为多巴胺的化学结构不允许它通过血脑屏障(blood-brain barrier);L-多巴的略微不同结构使其能够通过这一屏障。
单胺氧化酶抑制剂治疗。帕金森病的另一种治疗方法包括抑制单胺氧化酶(monoamine oxidase)的药物,单胺氧化酶负责在分泌后破坏大部分多巴胺。因此,任何释放的多巴胺都会在基底节组织中停留更长时间。此外,由于尚不清楚的原因,这种治疗有助于减缓黑质中分泌多巴胺的神经元的破坏。因此,L-多巴治疗与单胺氧化酶抑制剂治疗的适当组合通常比单独使用其中一种药物提供更好的治疗效果。
移植胎儿多巴胺细胞治疗
将胎儿分泌多巴胺的脑细胞移植到尾状核和壳核中,已在短期内成功用于治疗帕金森病。如果能够实现持久性,这种治疗方法可能成为未来的治疗手段。
亨廷顿病(Huntington’s Chorea)
亨廷顿病是一种常染色体显性遗传病,通常在30至40岁时开始出现症状。最初表现为个别肌肉的抽动,随后发展为全身的进行性严重扭曲运动。此外,随着运动功能障碍的发展,还会出现严重的痴呆。
亨廷顿病的异常运动被认为是由尾状核和壳核中大多数分泌GABA(γ-氨基丁酸)的神经元细胞体的丧失以及大脑多个部位分泌乙酰胆碱的神经元的丧失引起的。GABA神经元的轴突末梢通常抑制苍白球和黑质的部分区域。这种抑制的丧失被认为会导致苍白球和黑质活动的自发性爆发,从而引起扭曲运动。
亨廷顿病患者的痴呆可能不是由GABA神经元的丧失引起的,而是由乙酰胆碱分泌神经元的丧失引起的,尤其是在大脑皮层的思维区域。
导致亨廷顿病的异常基因已被发现;它有一个密码子(CAG)重复多次,并在一种称为亨廷顿蛋白(huntingtin)的异常神经元细胞蛋白的分子结构中编码多个额外的谷氨酰胺氨基酸。这种蛋白质如何引起疾病效应是目前主要研究的问题。
整个运动控制系统的多个部分的整合
最后,我们将尽可能总结关于运动整体控制的已知内容。为此,让我们首先简要介绍不同层次的控制。
脊髓水平
脊髓中编程了身体所有肌肉区域的局部运动模式——例如,编程的撤回反射可以将身体的任何部分从疼痛源拉离。脊髓也是复杂节奏运动模式的场所,例如四肢的来回运动用于行走,以及身体两侧或四足动物后肢与前肢的交替运动。
所有这些脊髓程序都可以由更高层次的运动控制命令执行,也可以在更高层次接管控制时被抑制。
后脑水平
后脑为身体的整体运动控制提供了两个主要功能:(1)维持身体的轴向张力以保持站立姿势;(2)根据前庭器官的信息持续调整不同肌肉的张力程度,以维持身体平衡。
运动皮层水平
运动皮层系统(motor cortex system)向脊髓提供大部分激活的运动信号。它部分通过发出顺序和平行的指令来发挥作用,这些指令启动各种脊髓运动模式。它还可以改变不同模式的强度或修改它们的时间或其他特征。当需要时,皮质脊髓系统(corticospinal system)可以绕过脊髓模式,用来自脑干(brain stem)或大脑皮层(cerebral cortex)的更高级模式替换它们。皮层模式通常很复杂;此外,它们可以被“学习”,而脊髓模式主要由遗传决定,被称为“硬连线”。
小脑的相关功能。小脑(cerebellum)在所有层次的肌肉控制中发挥作用。它与脊髓一起工作,特别是增强牵张反射(stretch reflex),因此当收缩的肌肉遇到意外的重负荷时,通过小脑传递并返回脊髓的长牵张反射信号强烈增强了基本牵张反射的负荷抵抗效果。
在脑干水平,小脑的功能是使身体的姿势运动,特别是平衡系统(equilibrium system)所需的快速运动,变得平滑、连续且没有异常振荡。
在大脑皮层水平,小脑与皮层协同工作,提供许多辅助运动功能,特别是在运动开始时迅速启动肌肉收缩提供额外的运动力。在每次运动接近结束时,小脑在正确的时间以适当的力量启动拮抗肌(antagonist muscles),以在预定点停止运动。此外,小脑的这种启动/停止模式几乎所有的方面都可以通过经验学习。
小脑在大脑皮层的另一个运动控制层次上发挥作用;它帮助预先编程肌肉收缩,这些收缩是从一个方向的快速运动平滑过渡到另一个方向的快速运动所需的,所有这些都在几分之一秒内发生。这种神经回路从大脑皮层传递到小脑半球的大外侧区,然后返回大脑皮层。
小脑主要在需要快速肌肉运动时发挥作用。没有小脑,缓慢和计算好的运动仍然可以发生,但皮质脊髓系统很难实现快速和变化的预期运动来执行特定目标,特别是从一个快速运动平滑过渡到下一个快速运动。
基底神经节的相关功能。基底神经节(basal ganglia)在运动控制中的作用与小脑完全不同。它们最重要的功能是(1)帮助皮层执行潜意识但已学习的运动模式,(2)帮助计划多个并行和顺序的运动模式,这些模式由大脑组合起来以完成有目的的任务。
需要基底神经节的运动模式类型包括书写字母表中的所有不同字母、投掷球和打字。此外,基底神经节需要修改这些模式以书写小字或大字,从而控制模式的尺寸。
在更高层次的控制中,存在另一个结合大脑和基底神经节的回路,它始于大脑的思维过程,为应对每个新情况提供整体的连续行动步骤,例如规划对攻击者的即时运动反应或对意外拥抱的连续反应。
是什么驱使我们行动?
是什么让我们从静止状态中唤醒并启动我们的运动序列?我们正在开始了解大脑的动机系统。基本上,大脑有一个较古老的核心,位于丘脑的下方、前方和侧面——包括下丘脑、杏仁核、海马体、位于下丘脑和丘脑前方的隔区,甚至丘脑和大脑皮层的古老区域。所有这些区域共同作用,启动大脑的大部分运动和其他功能活动。这些区域统称为大脑的边缘系统。我们将在第59章中更详细地讨论这一系统。
参考文献
Beckinghausen J, Sillitoe RV: Insights into cerebellar development and connectivity. Neurosci Lett 688:2, 2019. Bostan AC, Strick PL: The basal ganglia and the cerebellum: nodes in an integrated network. Nat Rev Neurosci 19:338, 2018. Bushart DD, Shakkottai VG: Ion channel dysfunction in cerebellar ataxia. Neurosci Lett 688:41, 2019. Cerminara NL, Lang EJ, Sillitoe RV, Apps R: Redefining the cerebellar cortex as an assembly of non-uniform Purkinje cell microcircuits Nat Rev Neurosci 16:79, 2015. Chadderton P, Schaefer AT, Williams SR, Margrie TW: Sensory-evoked synaptic integration in cerebellar and cerebral cortical neurons. Nat Rev Neurosci 15:71, 2014. De Zeeuw CI, Hoebeek FE, Bosman LW, et al: Spatiotemporal firing patterns in the cerebellum. Nat Rev Neurosci 12:327, 2011. De Zeeuw CI, Ten Brinke MM: Motor learning and the cerebellum. Cold Spring Harb Perspect Biol 2015 Sep 1;7(9):a021683. doi: 10.1101/cshperspect.a021683 Eidelberg D, Surmeier DJ: Brain networks in Huntington disease. J Clin Invest 121:484, 2011. Elkouzi A, Vedam-Mai V, Eisinger RS, Okun MS: Emerging therapies in Parkinson disease - repurposed drugs and new approaches. Nat Rev Neurol 15:204, 2019. Gao Z, van Beugen BJ, De Zeeuw CI: Distributed synergistic plasticity and cerebellar learning. Nat Rev Neurosci 13:619, 2012. Hallett PJ, Cooper O, Sadi D et al: Long-term health of dopaminergic neuron transplants in Parkinson’s disease patients. Cell Rep 7:1755, 2014. Hikosaka O, Kim HF, Amita H et al: Direct and indirect pathways for choosing objects and actions. Eur J Neurosci 49:637, 2019. Okun MS: Deep-brain stimulation for Parkinson's disease. N Engl J Med 367:1529, 2012. Sathyanesan A, Zhou J, Scafidi J, Heck DH, Sillitoe RV, Gallo V: Emerging connections between cerebellar development, behaviour and complex brain disorders. Nat Rev Neurosci 20:298, 2019. Shepherd GM: Corticostriatal connectivity and its role in disease. Nat Rev Neurosci 14:278, 2013. Ten Brinke MM, Boele HJ, De Zeeuw CI: Conditioned climbing fiber responses in cerebellar cortex and nuclei. Neurosci Lett 688:26, 2019. Therrien AS, Bastian AJ: The cerebellum as a movement sensor. Neurosci Lett 688:37, 2019. Ullsperger M, Danielmeier C, Jocham G: Neurophysiology of performance monitoring and adaptive behavior. Physiol Rev 94:35, 2014.
Zuccato C, Valenza M, Cattaneo E: Molecular mechanisms and potential therapeutical targets in Huntington’s disease. Physiol Rev 90:905, 2010.
大脑皮层、大脑的智力功能、学习和记忆
具有讽刺意味的是,尽管大脑皮层是神经系统中最庞大且可能是研究最多的部分,但我们对它的功能却知之甚少。然而,我们确实知道大脑皮层不同区域受损或受到刺激的影响。在本章的第一部分,将讨论已知的皮层功能,然后简要介绍与思维过程、记忆、感觉信息分析等相关的神经元机制的基本理论。
大脑皮层的生理解剖
大脑皮层的功能部分是一层覆盖在大脑所有回旋表面的薄层神经元。这层神经元的厚度仅为2至5毫米,总面积约为0.25平方米。据估计,整个大脑皮层包含超过800亿个神经元。
图58-1展示了大体皮层神经元表面的典型组织学结构,其中包含不同类型的神经元层。大多数神经元分为三种类型:(1) 颗粒状(也称为星状);(2) 梭形;(3) 锥体形,后者因其特征性的锥体形状而得名。
颗粒状神经元通常具有短的轴突,因此主要作为中间神经元在皮层内短距离传递神经信号。其中一些是兴奋性的,主要释放兴奋性神经递质谷氨酸,而另一些是抑制性的,主要释放抑制性神经递质γ-氨基丁酸(GABA)。皮层的感觉区域以及感觉和运动区域之间的联合区域中,这些颗粒细胞高度集中,表明在感觉区域和联合区域中对传入感觉信号进行了高度的皮层内处理。
锥体形和梭形细胞几乎产生了所有从皮层发出的输出纤维。锥体细胞比梭形细胞更大且数量更多,是延伸到脊髓的长而大的神经纤维的来源。锥体细胞还产生了大多数大的皮层下联合纤维束,这些纤维束在大脑的不同主要部分之间传递信息。
在图58-1的右侧,展示了大体皮层不同层内神经纤维的典型组织。特别要注意的是,大量水平纤维在皮层的相邻区域之间延伸,但也要注意垂直纤维,它们从皮层延伸到大脑的较低区域,有些甚至通过长联合束延伸到脊髓或大脑皮层的远处区域。
大脑皮层特定层次的功能将在第48章和第52章中讨论。作为回顾,让我们记住,来自身体的大多数传入特异性感觉信号终止于皮层第IV层。大多数输出信号通过位于第V层和第VI层的神经元离开皮层,其中通向脑干和脊髓的非常大的纤维通常起源于第V层,而通向丘脑的大量纤维起源于第VI层。第I、II和III层执行大部分皮层内联合功能,尤其是第II层和第III层中的大量神经元与相邻皮层区域形成短的水平连接。
图58-1. 大脑皮层的结构,显示以下层次:I,分子层;II,外颗粒层;III,锥体细胞层;IV,内颗粒层;V,大锥体细胞层;VI,梭形或多形细胞层。(修改自Ranson SW, Clark SL: Anatomy of the Nervous System. Philadelphia: WB Saunders, 1959.)
图58-2. 与丘脑特定部分连接的大脑皮层区域。N.,神经。
大脑皮层与丘脑及其他低级中枢的解剖和功能关系
大脑皮层的所有区域都与大脑的深层结构有着广泛的往返传出和传入连接。强调大脑皮层与丘脑之间的关系非常重要。当丘脑与皮层一起受损时,大脑功能的丧失远大于仅皮层受损时,因为丘脑对皮层的兴奋对于几乎所有皮层活动都是必要的。
图58-2显示了与丘脑特定部分连接的大脑皮层区域。这些连接在两个方向上起作用,既从丘脑到皮层,又从皮层返回到丘脑的同一区域。此外,当丘脑连接被切断时,相应皮层区域的功能几乎完全丧失。因此,皮层与丘脑密切协作,几乎可以被视为解剖和功能上与丘脑为一体的单元;因此,丘脑和皮层有时一起被称为丘脑皮层系统。几乎所有从感觉受体和感觉器官到皮层的通路都通过丘脑,主要例外是一些嗅觉的感觉通路。
图58-3. 人类大脑皮层的功能区域,通过在神经外科手术中对皮层进行电刺激以及对皮层区域受损患者的神经学检查确定。(修改自Penfield W, Rasmussen T: The Cerebral Cortex of Man: A Clinical Study of Localization of Function. New York: Hafner, 1968.)
特定皮层区域的功能
图58-3展示了通过电刺激清醒患者的皮层或在患者部分皮层被切除后进行神经学检查所确定的不同大脑皮层区域的一些功能分布图。电刺激的患者会报告刺激引发的思维活动,有时他们会经历运动。偶尔,他们会自发发出声音甚至单词,或表现出其他刺激的证据。
通过整合来自许多不同来源的大量信息,可以得到一个更通用的分布图,如图58-4所示。该图显示了皮层的主要初级和次级前运动区及辅助运动区,以及体感、视觉和听觉的主要初级和次级感觉区,所有这些都在前面的章节中讨论过。初级运动区与特定肌肉直接连接,以引发离散的肌肉运动。初级感觉区检测从外周感觉器官传递到大脑的特定感觉——视觉、听觉或体感。
次级区域对初级区域的信号进行理解。例如,辅助运动区和前运动区与初级运动皮层和基底神经节一起工作,提供运动活动的“模式”。在感觉方面,位于初级区域几厘米内的次级感觉区开始分析特定感觉信号的意义,例如:(1)解释手中物体的形状或质地;(2)解释颜色、光强度、线条和角度的方向以及其他视觉方面;(3)解释听觉信号中音调和音调序列的意义。
联合区
图58-4还显示了大脑皮层的几个大区域,这些区域不符合严格的初级和次级运动及感觉区的分类。这些区域被称为联合区(association areas),因为它们同时接收和分析来自运动皮层和感觉皮层多个区域以及皮层下结构的信号。然而,即使是联合区也有其专门化。重要的联合区包括:(1)顶枕颞联合区(parieto-occipitotemporal association area),(2)前额联合区(prefrontal association area),以及(3)边缘联合区(limbic association area)。
图58-4. 大脑皮层主要联合区以及初级和次级运动及感觉区的位置。
顶枕颞联合区
顶枕颞联合区位于顶叶和枕叶皮层的大片区域,前界为体感皮层,后界为视觉皮层,外侧为听觉皮层。正如预期的那样,它为来自所有周围感觉区的信号提供了高水平的解释意义。然而,即使是顶枕颞联合区也有其功能亚区,如图58-5所示。
身体空间坐标的分析
一个始于后顶叶皮层(posterior parietal cortex)并延伸至上枕叶皮层(superior occipital cortex)的区域,持续分析身体各部位以及周围环境的空间坐标。该区域接收来自后枕叶皮层(posterior occipital cortex)的视觉感觉信息,同时接收来自前顶叶皮层(anterior parietal cortex)的体感信息。基于所有这些信息,它计算视觉、听觉和身体周围环境的坐标。
Wernicke区对语言理解至关重要
语言理解的主要区域称为Wernicke区(Wernicke’s area),位于颞叶(temporal lobe)上回(superior gyrus)后部,紧邻初级听觉皮层(primary auditory cortex)后方。我们稍后会更详细地讨论这个区域;它是整个大脑中最重要的高级智力功能区域之一,因为大多数智力功能都基于语言。
图58-5. 大脑皮层特定功能区域图,特别显示了Wernicke区和Broca区,分别负责语言理解和语言产生。在95%的人中,这些区域位于左半球。
角回区是视觉语言(阅读)初步处理所必需的
位于语言理解区后方,主要在枕叶(occipital lobe)前外侧区域,有一个视觉联合区(visual association area),它将通过阅读书籍传递的视觉信息输入到Wernicke区,即语言理解区。角回区(angular gyrus area)是将视觉感知的单词转化为意义所必需的。如果缺失这一区域,一个人仍然可以通过听觉获得良好的语言理解,但无法通过阅读理解;角回区的损伤可能导致失写症(agraphia)(无法书写)和失读症(alexia)(无法阅读),即一个人无法阅读、书写或拼写单词。
物体命名区
在前枕叶(anterior occipital lobe)和后颞叶(posterior temporal lobe)的最外侧部分,有一个物体命名区。物体的名称主要通过听觉输入学习,而物体的物理特性主要通过视觉输入学习。反过来,这些名称对于听觉和视觉语言理解都至关重要(这些功能由位于听觉“命名”区域上方和视觉单词处理区域前方的Wernicke区执行)。
前额叶联合区
如第57章所述,前额叶联合区(prefrontal association area)与运动皮层(motor cortex)密切合作,以计划复杂的运动模式和序列。为了辅助这一功能,它通过一个巨大的皮层下神经纤维束接收强烈的输入,该纤维束连接顶枕颞联合区(parieto-occipitotemporal association area)和前额叶联合区。通过这一纤维束,前额叶皮层接收大量预先分析的感觉信息,尤其是身体的空间坐标信息,这对于计划有效的运动至关重要。前额叶区向运动控制系统的许多输出通过基底神经节-丘脑反馈回路(basal ganglia–thalamic feedback circuit)的尾状核(caudate)部分进行运动规划,该回路提供了许多运动和刺激的序列和平行组件。
前额叶联合区(prefrontal association area)对于执行“思考”过程也至关重要。这一特性可能源于前额叶皮层(prefrontal cortex)的某些能力,使其能够计划运动活动。它似乎能够处理来自大脑广泛区域的非运动和运动信息,从而实现非运动类型的思维以及运动类型的思维。事实上,前额叶联合区通常被简单地描述为对思维的精细化至关重要,并且据说它短期存储“工作记忆(working memories)”,这些记忆用于在进入大脑时组合新的思维。
Broca区为词语形成提供神经回路。如图58-5所示,Broca区部分位于后外侧前额叶皮层(posterior lateral prefrontal cortex),部分位于前运动区(premotor area)。正是在这里,表达单个词语甚至短语的计划和运动模式被启动和执行。该区域还与颞叶联合皮层(temporal association cortex)中的Wernicke语言理解中心密切合作,我们将在本章后面更详细地讨论这一点。
一个特别有趣的发现是:当一个人已经学会一种语言,然后学习一种新语言时,大脑中存储新语言的区域与存储第一种语言的区域略有不同。如果两种语言同时学习,它们会存储在大脑的同一区域。
边缘联合区
图58-4和58-5显示了另一个称为边缘联合区(limbic association area)的区域。该区域位于颞叶(temporal lobe)的前极、额叶(frontal lobe)的腹侧部分,以及位于每个大脑半球中表面纵裂深处的扣带回(cingulate gyrus)。它主要与行为、情绪和动机有关。我们将在第59章讨论,边缘皮层(limbic cortex)是一个更为广泛的系统——边缘系统(limbic system)的一部分,该系统包括大脑中基底区域的复杂神经元结构。这个边缘系统为激活大脑其他区域提供了大部分情绪驱动力,甚至为学习过程本身提供了动机驱动力。
面部识别区
一种有趣的大脑异常称为面容失认症(prosopagnosia),即无法识别面孔。这种情况发生在双侧枕叶(occipital lobes)内侧下部和颞叶(temporal lobes)中腹侧表面广泛受损的人身上,如图58-6所示。奇怪的是,这些面部识别区域的丧失几乎不会导致其他大脑功能异常。
人们可能会想知道,为什么大脑皮层中如此多的区域被保留用于面部识别这一简单任务。然而,我们日常的大部分任务都涉及与他人的互动,因此可以看出这一智力功能的重要性。
面部识别区的枕叶部分与视觉皮层(visual cortex)相邻,而颞叶部分与边缘系统密切相关,边缘系统涉及情绪、大脑激活以及对环境行为反应的控制,我们将在第59章中看到。
后上颞叶的综合解释功能——“Wernicke区”(一个综合解释区)
躯体、视觉和听觉联合区(association areas)都在颞叶(superior temporal lobe)的后部相互交汇,如图58-7所示,颞叶、顶叶(parietal lobe)和枕叶(occipital lobe)在此处汇聚。这一不同感觉解释区的汇合区域在优势半球(几乎所有的右利手人群中都是左半球)中尤其高度发达,它在大脑皮层(cerebral cortex)中扮演着最重要的单一角色,负责我们称之为智力的高级理解水平的脑功能。因此,这一区域被赋予了不同的名称,暗示其具有近乎全局的重要性:一般解释区(general interpretative area)、认知区(gnostic area)、知晓区(knowing area)、三级联合区(tertiary association area)等。它最广为人知的名称是Wernicke区,以纪念首次描述其在智力过程中特殊意义的神经学家。
图58-7. 躯体、听觉和视觉联合区组织成一个解释感觉经验的通用机制。所有这些也输入到位于颞叶后上部的Wernicke区。还请注意前额叶区(prefrontal area)和额叶(frontal lobe)中的Broca语言区(Broca’s speech area)。
在Wernicke区严重受损后,一个人可能听力完好,甚至能识别不同的单词,但仍然无法将这些单词组织成连贯的思想。同样,这个人可能能够从印刷页面上读出单词,但无法识别所传达的思想。
图58-6. 位于大脑底面内侧枕叶和颞叶的面部识别区。(修改自Geschwind N: Specializations of the human brain. Sci Am 241:180, 1979.)
在清醒的人中,电刺激Wernicke区偶尔会引起高度复杂的思想,特别是当刺激电极深入大脑接近丘脑(thalamus)的相应连接区域时。可能经历的思想类型包括从童年记忆中的复杂视觉场景、听觉幻觉(如特定的音乐片段),甚至是特定人物所说的话。因此,人们认为Wernicke区的激活可以唤起涉及多种感觉模式的复杂记忆模式,尽管大多数个体记忆可能存储在其他地方。这一观点与Wernicke区在解释不同感觉经验模式的复杂意义中的重要性是一致的。
角回(Angular Gyrus)——视觉信息的解释。
角回(angular gyrus)是顶叶后部的最下部分,紧邻Wernicke区后方,并向后与枕叶的视觉区融合。如果该区域受损而颞叶的Wernicke区仍然完好,患者仍能像往常一样解释听觉体验,但从视觉皮层传入Wernicke区的视觉体验流主要被阻断。因此,患者可能能看到单词,甚至知道它们是单词,但可能无法解释它们的含义。这种情况被称为失读症(alexia)或词盲(word blindness)。术语"阅读障碍(dyslexia)"用于描述学习书面语言的困难,而不是完全的词盲。
优势半球(dominant hemisphere)的概念
Wernicke区和角回的一般解释功能,以及语言和运动控制区的功能,通常在一个大脑半球比另一个半球发达得多。因此,这个半球被称为优势半球。在大约95%的人中,左半球是优势半球。
即使在出生时,最终将成为Wernicke区的皮层区域在超过一半的新生儿中,左半球比右半球大50%。因此,很容易理解为什么大脑左侧可能比右侧更具优势。然而,如果由于某种原因在儿童早期这个左侧区域受损或被切除,大脑的另一侧通常会发展出优势特征。
以下理论可以解释一个半球支配另一个半球的能力。"心智"的注意力似乎一次只集中于一个主要思想。据推测,由于出生时左后颞叶通常比右叶略大,左侧通常开始比右侧更多地被使用。此后,由于倾向于将注意力集中在更发达的区域,获得先机的大脑半球的学习速度迅速增加,而在相反的不太使用的一侧,学习仍然不太发达。因此,左侧通常比右侧更具优势。
在大约95%的人中,左颞叶和角回成为优势,而在剩下的5%中,要么两侧同时发展具有双重功能,要么更罕见的是,只有右侧高度发达,具有完全优势。
正如本章后面所讨论的,位于额叶中间外侧的运动前语言区(Broca区)也几乎总是位于大脑左侧的优势区域。这个语言区通过同时兴奋喉部肌肉、呼吸肌和口腔肌肉来负责单词的形成。
控制手的运动区在大约90%的人中也位于大脑左侧的优势区域,从而导致大多数人的右利手。
尽管颞叶(temporal lobe)和角回(angular gyrus)的解释区域以及许多运动区域通常只在左半球高度发达,但这些区域接收来自两个半球的感觉信息,并且也能够控制两个半球的运动活动。为此,它们主要使用胼胝体(corpus callosum)中的纤维通路进行两个半球之间的通信。这种统一的、相互补充的组织结构防止了大脑两侧之间的干扰;这种干扰可能会对心理思维和运动反应造成严重破坏。
语言在Wernicke区功能及智力功能中的作用
我们的大部分感觉体验在存储到大脑的记忆区域之前,以及在为其他智力目的进行处理之前,都被转换为其语言等价物。例如,当我们阅读一本书时,我们不会存储印刷文字的视觉图像,而是存储文字本身或其传达的思想,通常以语言形式存储。
用于解释语言的优势半球的感觉区域是Wernicke区,该区域与颞叶的初级和次级听觉区域密切相关。这种密切关系可能是由于语言的首次引入是通过听觉实现的。在以后的生活中,当通过阅读发展出语言的视觉感知时,书面文字传达的视觉信息可能会通过角回(一个视觉联合区域)传递到已经发展的优势颞叶的Wernicke语言解释区域。
非优势半球顶枕颞叶皮层的功能
当成年人的优势半球中的Wernicke区被破坏时,该人通常会失去几乎所有与语言或言语符号相关的智力功能,例如阅读能力、执行数学运算的能力,甚至通过逻辑问题思考的能力。许多其他类型的解释能力,其中一些使用对侧半球的颞叶和角回区域,仍然保留。
对非优势半球受损患者的心理学研究表明,该半球可能特别重要,用于理解和解释音乐、非语言视觉体验(尤其是视觉模式)、人与周围环境之间的空间关系、“肢体语言”和人们声音语调的意义,以及可能与四肢和手的使用相关的许多躯体体验。因此,尽管我们谈论的是“优势”半球,但这种优势主要是针对基于语言的智力功能;所谓的非优势半球实际上可能在某些其他类型的智力方面占主导地位。
前额叶联合区的高级智力(“执行”)功能
多年来,人们一直认为前额叶皮层(prefrontal cortex)是人类“高级智力”的所在地,主要是因为猴子和人类大脑之间的主要区别在于人类前额叶区域的显著发达。然而,试图证明前额叶皮层在高级智力功能中比其他大脑部分更重要的努力并未成功。事实上,破坏优势半球后上颞叶的语言理解区(Wernicke区)和相邻的角回区域对智力的损害要比破坏前额叶区域严重得多。
然而,前额叶区域确实具有一些不那么明确但重要的智力功能。前额叶皮层受损的患者可能具有正常的运动功能,甚至在某些智力测试中表现正常。然而,他们在日常生活中无法有效运作。这些功能可以通过描述前额叶区域受损患者的情况来解释,如下所述。
几十年前,在现代药物治疗精神疾病之前,人们发现,通过一种称为前额叶切除术(prefrontal lobotomy)的手术切断前额叶区域与大脑其余部分之间的神经元连接,可以使一些患有严重精神病性抑郁的患者获得显著缓解。该手术通过在头部两侧的侧额骨上开一个小口,插入一把钝的薄刃刀,从前额叶的后缘从上到下切开大脑。随后的研究表明,这些患者出现了以下心理变化:
- 患者失去了解决复杂问题的能力。
- 他们无法将连续的任务串联起来以实现复杂的目标。
- 他们无法学会同时进行多个并行任务。
- 他们的攻击性水平下降,有时显著下降,并且常常失去雄心。
- 他们的社交反应常常不合时宜,常常包括道德丧失,对性活动和排泄几乎没有保留。
- 患者仍然能够说话和理解语言,但他们无法进行任何长时间的思考,他们的情绪迅速从甜蜜变为愤怒,再变为兴奋,最后变为疯狂。
- 患者仍然能够执行他们一生中大多数常见的运动功能模式,但常常没有目的。
从这些信息中,让我们尝试拼凑出对前额叶联合区域功能的连贯理解。
攻击性降低和不适当的社交反应。攻击性降低和不适当的社交反应可能是由于大脑下侧额叶腹侧部分的丧失。如前所述,如图58-4和58-5所示,该区域是边缘联合皮层(limbic association cortex)的一部分,而不是前额叶联合皮层的一部分。该边缘区域有助于控制行为,这将在第59章详细讨论。
无法向目标推进或无法完成连续思考
在本章的前面部分,我们已经了解到,前额叶联合区(prefrontal association areas)能够从大脑的广泛区域中提取信息,并利用这些信息来实现更深层次的思维模式,从而达到目标。
尽管没有前额叶皮层(prefrontal cortices)的人仍然可以思考,但他们在逻辑序列上的协同思考能力通常只能持续几秒钟或最多一分钟左右。因此,没有前额叶皮层的人很容易从他们的核心思维主题中分心,而拥有功能正常的前额叶皮层的人则能够推动自己完成思维目标,不受干扰的影响。
前额叶区的思维扩展、预测和高级智力功能的执行——“工作记忆”的概念
前额叶区的另一个功能是思维扩展(elaboration of thought),这意味着将从多个信息源整合的不同思维的深度和抽象性增加。心理测试表明,前额叶切除的低等动物在面对连续的感觉信息时,无法在临时记忆中跟踪这些信息,可能是因为它们太容易分心,以至于无法将思维保持足够长的时间以进行记忆存储。
前额叶区能够同时跟踪许多信息片段,并在需要时立即回忆这些信息以供后续思考的能力被称为“大脑的工作记忆(working memory)”,这可能解释了大脑与更高智力相关的许多功能。事实上,研究表明,前额叶区被划分为不同的部分,用于存储不同类型的临时记忆,例如一个区域用于存储物体或身体部位的形状和形式,另一个区域用于存储运动。
通过结合所有这些临时的工作记忆片段,我们具备以下能力:(1) 预测;(2) 为未来做计划;(3) 延迟对传入感觉信号的反应,以便在决定最佳反应方案之前权衡感觉信息;(4) 在执行运动动作之前考虑其后果;(5) 解决复杂的数学、法律或哲学问题;(6) 在诊断罕见疾病时关联所有信息渠道;(7) 根据道德法则控制我们的活动。
大脑在交流中的功能——语言输入和语言输出
由于神经学测试可以轻松评估一个人与他人交流的能力,我们对与交流相关的感觉和运动系统的了解比对大脑皮层功能的任何其他部分都要多。因此,借助图58-8中的神经通路解剖图,我们将回顾大脑皮层在交流中的功能。通过这一分析,人们将立即看到感觉分析和运动控制的原理如何应用于这一艺术。
图 58-8. 大脑通路:(上) 感知听到的单词然后说出相同的单词;(下) 感知书写的单词然后说出相同的单词。(修改自 Geschwind N: Specializations of the human brain. Sci Am 241:180, 1979.)
交流有两个方面——感觉(语言输入),涉及耳朵和眼睛,以及运动(语言输出),涉及发声及其控制。
交流的感觉方面
我们在本章前面提到,听觉或视觉联合皮层的部分破坏可能导致无法理解口头或书面语言。这些效应分别称为听觉感受性失语症(auditory receptive aphasia)和视觉感受性失语症(visual receptive aphasia),或更常见的词聋(word deafness)和词盲(word blindness,也称为失读症 alexia)。
Wernicke 失语症和完全性失语症。有些人能够理解口头或书面语言,但无法解释所表达的思想。这种情况最常见于优势半球颞上回后部的 Wernicke 区受损或破坏时。因此,这种类型的失语症称为 Wernicke 失语症。
当 Wernicke 区的病变广泛并延伸至 (1) 向后进入角回区域,(2) 向下进入颞叶下部区域,以及 (3) 向上进入外侧裂的上边界时,患者可能会几乎完全丧失语言理解或交流能力,因此被称为完全性失语症(global aphasia)。
交流的运动方面
言语过程涉及两个主要的心理阶段:(1) 在头脑中形成要表达的思想,并选择要使用的词语;然后 (2) 发声的运动控制及发声的实际行为。
思想的形成甚至大多数词语的选择都是大脑感觉联合区的功能。再次强调,颞上回后部的 Wernicke 区对这一能力最为重要。因此,患有 Wernicke 失语症或完全性失语症的人无法形成要交流的思想。或者,如果病变较轻,患者可能能够形成思想,但无法组织适当的词语序列来表达思想。有时患者甚至能够流利地说出词语,但这些词语是混乱的。
Broca 区的丧失导致运动性失语症。有时,一个人能够决定他或她想说什么,但无法使发声系统发出词语而不是噪音。这种效应称为运动性失语症(motor aphasia),是由于 Broca 言语区的损伤所致,该区位于大脑皮层的前额叶和运动前区面部区域——约 95% 的时间位于左半球,如图 58-5 和 58-8 所示。控制喉部、嘴唇、口腔、呼吸系统和其他辅助言语肌肉的熟练运动模式都从这个区域启动。
发音 (Articulation)
最后,我们有发音的行为,这指的是口腔、舌头、喉部、声带等肌肉的运动,这些运动负责语调、时间顺序和连续声音强度的快速变化。运动皮层的面部和喉部区域激活这些肌肉,而小脑 (cerebellum)、基底神经节 (basal ganglia) 和感觉皮层 (sensory cortex) 都帮助控制肌肉收缩的顺序和强度,充分利用第56章和第57章中描述的基底神经节和小脑反馈机制。这些区域的任何损伤都可能导致完全或部分无法清晰地说话。
总结
图58-8展示了两种主要的交流途径。图的上半部分显示了与听力和说话相关的路径。这一顺序如下:(1) 在初级听觉区接收编码词语的声音信号;(2) 在Wernicke区解释词语;(3) 同样在Wernicke区确定要表达的思想和词语;(4) 通过弓状束 (arcuate fasciculus) 将信号从Wernicke区传递到Broca区;(5) 在Broca区激活控制词语形成的熟练运动程序;(6) 将适当的信号传递到运动皮层以控制发音肌肉。
图的下半部分展示了阅读和随后回应说话的类似步骤。词语的初始接收区域位于初级视觉区,而不是初级听觉区。信息随后通过角回 (angular gyrus) 区域的早期解释阶段,最终在Wernicke区达到完全识别水平。从这里开始,顺序与回应说话时的顺序相同。
胼胝体 (Corpus Callosum) 和前连合 (Anterior Commissure) 在两个大脑半球之间传递思想、记忆、训练和其他信息
胼胝体中的纤维提供了两个大脑半球大部分皮层区域之间的丰富双向神经连接,除了颞叶 (temporal lobes) 的前部;这些颞叶区域,特别是杏仁核 (amygdala),通过前连合的纤维相互连接。
胼胝体和前连合的功能之一是使存储在一个半球皮层中的信息可用于对侧半球的相应皮层区域。以下重要例子展示了两半球之间的这种合作。
- 切断胼胝体会阻止信息从优势半球的Wernicke区传递到对侧大脑的运动皮层。因此,位于左半球的Wernicke区的智力功能失去了对右运动皮层的控制,该皮层负责启动左手和手臂的随意运动功能,尽管左手和手臂的常规潜意识运动是正常的。
- 切断胼胝体会阻止从右半球传递到左优势半球的Wernicke区的体感和视觉信息。因此,来自身体左侧的体感和视觉信息经常无法到达大脑的这一一般解释区域,因此无法用于决策。
- 最后,胼胝体完全切断的人会有两个独立的大脑意识部分。例如,在一个胼胝体被切断的青少年男孩中,只有左半脑能够理解书面语言和口头语言,因为左脑是优势半球。相反,右脑能够理解书面语言,但不能理解口头语言。此外,右脑皮层可以对书面语言引发运动反应,而左脑皮层却不知道为什么会做出这种反应。当右脑引发情绪反应时,效果则完全不同:在这种情况下,左脑也会出现潜意识的情绪反应。这种反应无疑是因为大脑两侧的情绪区域,即前颞叶皮层及其邻近区域,仍然通过未被切断的前连合相互通信。例如,当“亲吻”这个指令被写出来让右脑看到时,男孩立即充满情感地说:“不行!”这种反应需要左脑的Wernicke区和语言运动区的功能,因为这些左脑区域是说出“不行!”这句话所必需的。然而,当被问及为什么这么说时,男孩无法解释。
因此,大脑的两半具有独立的意识、记忆存储、交流和运动活动控制能力。胼胝体是两侧在大脑浅层潜意识水平上协同运作所必需的,而前连合在统一大脑两侧的情绪反应中起着重要的补充作用。
思维、意识和记忆
在讨论意识、思维、记忆和学习时,我们面临的最大难题是我们不知道思维的神经机制,并且对记忆的机制知之甚少。我们知道,大脑皮层的大面积破坏并不会阻止一个人产生思维,但它会降低思维的深度以及对周围环境的意识程度。
每个思维肯定涉及大脑皮层、丘脑、边缘系统和脑干网状结构的多个部分同时发出的信号。一些基本思维可能几乎完全依赖于低级中枢;疼痛的思维可能是一个很好的例子,因为对人类大脑皮层的电刺激很少能引发超过轻微疼痛的感觉,而对下丘脑、杏仁核和中脑某些区域的刺激则可能引发剧烈的疼痛。相反,视觉这种思维模式确实需要大脑皮层的大量参与,因为视觉皮层的丧失会导致完全无法感知视觉形状或颜色。
我们可以根据神经活动对思维(thought)做出一个初步的定义。思维是由神经系统多个部分同时受到刺激的“模式(pattern)”所产生的结果,可能最重要的部分包括大脑皮层(cerebral cortex)、丘脑(thalamus)、边缘系统(limbic system)和脑干(brain stem)的上部网状结构(reticular formation)。这一理论被称为思维的整体理论(holistic theory of thoughts),简单来说,就是整体大于部分之和。边缘系统、丘脑和网状结构的受刺激区域被认为决定了思维的一般性质,赋予其诸如愉悦、不悦、疼痛、舒适、粗糙的感觉模式、身体大致的定位以及其他一般特征。然而,大脑皮层的特定受刺激区域决定了思维的离散特征,例如:(1)身体表面感觉和视野中物体定位的特定位置,(2)丝绸质感的感受,(3)对混凝土块墙矩形图案的视觉识别,以及(4)进入特定时刻整体意识的其他个体特征。意识(consciousness)或许可以被描述为我们对周围环境或连续思维的持续意识流。
记忆——突触易化(synaptic facilitation)和突触抑制(synaptic inhibition)的作用
记忆(memory)是通过改变神经元之间突触传递(synaptic transmission)的基本敏感性来存储在大脑中的,这种改变是由先前的神经活动引起的。新的或被易化的通路被称为记忆痕迹(memory traces)。它们之所以重要,是因为一旦这些痕迹被建立,思考的大脑可以选择性地激活它们以重现记忆。
在低等动物中的实验表明,记忆痕迹可以发生在神经系统的所有层次。即使是脊髓反射(spinal cord reflexes)也会因重复的脊髓激活而发生至少轻微的变化,这些反射变化是记忆过程的一部分。此外,长期记忆(long-term memories)是由较低脑中枢的突触传导(synaptic conduction)变化引起的。然而,我们通常与智力过程相关的记忆大多基于大脑皮层的记忆痕迹。
正性记忆和负性记忆——突触传递的“敏感化(sensitization)”或“习惯化(habituation)”。虽然我们通常认为记忆是对先前思维或经历的正性回忆,但可能我们记忆中的大部分是负性的,而非正性的。也就是说,我们的大脑被来自所有感官的感觉信息所淹没。如果我们的大脑试图记住所有这些信息,大脑的记忆容量将迅速被超过。幸运的是,大脑有能力忽略无关紧要的信息。这种能力是通过对这种类型信息的突触通路进行抑制来实现的;由此产生的效果被称为习惯化(habituation),这是一种负性记忆(negative memory)。
相反,对于引起重要后果(如疼痛或愉悦)的传入信息,大脑具有不同的自动能力来增强和存储记忆痕迹,这被称为积极记忆(positive memory)。它源于突触通路的促进,这一过程被称为记忆敏感化(memory sensitization)。正如我们稍后讨论的那样,大脑基底边缘区的特殊区域决定了信息是否重要,并潜意识地决定是将该思想存储为敏感化的记忆痕迹还是抑制它。
记忆的分类
我们知道,有些记忆仅持续几秒钟,而另一些则持续数小时、数天、数月或数年。为了讨论这些类型的记忆,我们可以使用一种常见的分类方法,将记忆分为以下几类:
- 短期记忆(short-term memory):包括持续几秒或最多几分钟的记忆,除非它们被转化为更长期的记忆。
- 中期长期记忆(intermediate long-term memories):持续数天到数周,但随后逐渐消失。
- 长期记忆(long-term memory):一旦存储,可以在数年后甚至一生中回忆起来。
除了这种一般的记忆分类外,我们之前还讨论了(与前额叶相关)另一种类型的记忆,称为工作记忆(working memory),主要包括在智力推理过程中使用的短期记忆,但在问题的每个阶段解决后终止。
记忆通常根据存储的信息类型进行分类。其中一种分类将记忆分为陈述性记忆(declarative memory)和技能记忆(skill memory),如下所示:
- 陈述性记忆(declarative memory)基本上是指对综合思想的各种细节的记忆,例如对重要经历的记忆,包括以下内容:(1) 周围环境;(2) 时间关系;(3) 经历的原因;(4) 经历的意义;(5) 留在个人脑海中的推论。
- 技能记忆(skill memory)通常与个人身体的运动活动相关,例如为击打网球而发展的所有技能,包括自动记忆:(1) 观察球;(2) 计算球与球拍的关系和速度;(3) 快速推断出身体、手臂和球拍所需的动作,以按预期击球——所有这些技能都基于先前对游戏的学习而立即激活——然后继续进行游戏的下一个击球动作,同时忘记前一个击球的细节。
短期记忆
短期记忆的典型例子是个人对电话号码中的7到10个数字(或其他7到10个离散事实)的记忆,持续几秒到几分钟,但只有在个人继续思考这些数字或事实时才会持续。
许多生理学家认为,这种短期记忆(short-term memory)是由持续的神经活动引起的,这种活动源于神经信号在回响神经元(reverberating neurons)回路中的临时记忆痕迹(memory trace)周围循环。目前尚未能证明这一理论。短期记忆的另一种可能解释是突触前易化(presynaptic facilitation)或抑制(inhibition),这发生在位于神经纤维末梢的突触上,就在这些纤维与后续神经元形成突触之前。在这些末梢分泌的神经递质(neurotransmitter)化学物质经常引起持续数秒至数分钟的易化或抑制。这种类型的回路可能导致短期记忆。
图58-9. 在Aplysia(海兔)中发现的记忆系统。cAMP,环磷酸腺苷(cyclic adenosine monophosphate)。
中期长期记忆(INTERMEDIATE LONG-TERM MEMORY)
中期长期记忆可能持续数分钟甚至数周。除非记忆痕迹被充分激活以变得更加持久,否则它们最终会消失;然后它们被归类为长期记忆(long-term memory)。动物实验表明,中期长期类型的记忆可能源于突触前末梢(presynaptic terminals)或突触后膜(postsynaptic membrane)的临时化学或物理变化,或两者兼有,这些变化可以持续几分钟到几周。这些机制非常重要,值得特别描述。
基于突触前末梢或突触后神经元膜化学变化的记忆
图58-9展示了一种记忆机制,由Eric Kandel及其同事特别研究,可以在大型海兔Aplysia中引起持续数分钟至3周的记忆。在图58-9中,有两个突触末梢。一个末梢来自感觉输入神经元(sensory input neuron),直接终止于要被刺激的神经元表面,称为感觉末梢(sensory terminal)。另一个末梢是位于感觉末梢表面的突触前末梢(presynaptic ending),称为易化末梢(facilitator terminal)。当感觉末梢被反复刺激但没有刺激易化末梢时,信号传递最初很强,但随着反复刺激逐渐减弱,直到传递几乎停止。这种现象称为习惯化(habituation),如前所述。这是一种负面记忆(negative memory),导致神经元回路对重复发生的不重要事件失去反应。
相反,如果在感觉末梢被刺激的同时,有害刺激(noxious stimulus)激发了易化末梢,传递到突触后神经元的信号不会逐渐减弱,而是传递的便利性变得越来越强。即使不再刺激易化末梢,这种强度也会保持数分钟、数小时、数天,或者在更强烈的训练下,持续约3周。因此,有害刺激导致通过感觉末梢的记忆通路在之后的数天或数周内被易化。特别有趣的是,即使在习惯化发生后,只需几次有害刺激,这条通路就可以重新转变为易化通路。
中期记忆的分子机制
习惯化机制
在分子水平上,感觉末梢的习惯化效应是由于钙通道通过末梢膜的逐渐关闭所致,尽管这种钙通道关闭的原因尚不完全清楚。然而,与正常情况相比,更少量的钙离子可以扩散到习惯化的末梢中,因此释放的感觉末梢递质也大大减少,因为钙离子的进入是递质释放的主要刺激(如第46章所讨论的)。
易化机制
在易化的情况下,至少部分分子机制被认为是以下过程:
- 当感觉末梢受到刺激时,同时刺激易化性突触前末梢会导致5-羟色胺在感觉末梢表面的易化性突触处释放。
- 5-羟色胺作用于感觉末梢膜上的5-羟色胺受体,这些受体激活膜内的腺苷酸环化酶。腺苷酸环化酶随后在感觉突触前末梢内引起环磷酸腺苷(cAMP)的形成。
- cAMP激活一种蛋白激酶,该激酶导致感觉突触末梢膜中钾通道的一部分蛋白质磷酸化;这反过来又阻断了钾传导通道。这种阻断可以持续几分钟到几周。
- 钾传导的缺乏导致突触末梢的动作电位大大延长,因为钾离子从末梢流出是动作电位快速恢复所必需的。
- 延长的动作电位导致钙通道的长时间激活,允许大量钙离子进入感觉突触末梢。这些钙离子导致突触释放的递质大大增加,从而显著促进突触传递到后续神经元。
因此,以一种非常间接的方式,在感觉末梢受到刺激的同时刺激易化性末梢的关联效应会导致感觉末梢的兴奋性敏感性长时间增加,从而建立记忆痕迹。
在软体动物Aplysia中的进一步研究表明,还存在另一种突触记忆机制。这些研究表明,在适当条件下,来自不同来源的刺激作用于单个神经元,可以导致突触后神经元膜特性的长期变化,而不是突触前神经元膜的变化,但最终导致基本相同的记忆效应。
长期记忆
在更持久的中间长期记忆和真正的长期记忆之间没有明显的分界线。区别在于程度。然而,长期记忆通常被认为是由突触的实际结构变化引起的,而不仅仅是化学变化,这些变化增强或抑制信号传导。再次,让我们回顾一下在原始动物(其神经系统更容易研究)中进行的实验,这些实验极大地帮助了我们理解长期记忆的可能机制。
长期记忆发展过程中突触的结构变化
从无脊椎动物中拍摄的电子显微镜图片显示,在长期记忆痕迹的发展过程中,许多突触发生了多种物理结构变化。如果给予一种药物阻断突触前神经元中的蛋白质合成,这些结构变化将不会发生,永久记忆痕迹也不会形成。因此,真正的长期记忆的发展似乎依赖于以某种方式物理重构突触,从而改变它们传递神经信号的敏感性。
以下重要的结构变化会发生:
- 增加用于分泌递质物质的囊泡释放位点
- 增加释放的递质囊泡数量
- 增加突触前末端的数量
- 改变树突棘的结构,使其能够传递更强的信号
因此,在真正的长期记忆痕迹建立过程中,突触传递信号的结构能力似乎以几种不同的方式增加。
在学习过程中,神经元的数量及其连接性通常会发生显著变化
在生命的最初几周、几个月,甚至可能一年或更长时间内,大脑的各个部分会产生许多新的神经元,这些神经元会发出大量的轴突分支与其他神经元建立连接。如果新的轴突未能与适当的神经元、肌肉细胞或腺细胞连接,新的轴突将在几周内退化。因此,神经元连接的数量是由受刺激细胞逆行释放的特定神经生长因子决定的。此外,当连接性不足时,发出轴突分支的整个神经元最终可能会消失。
因此,出生后不久,“用进废退”的原则决定了人类神经系统各个部分中神经元的最终数量及其连接性。这是一种学习形式。例如,如果新生动物的一只眼睛在出生后数周内被遮盖,大脑视觉皮层交替条纹中的神经元——通常与遮盖的眼睛相连的神经元——将会退化,被遮盖的眼睛在余生中将部分或完全失明。直到最近,人们还认为成年人和动物通过改变记忆回路中神经元的数量来实现的“学习”非常少;然而,最近的研究表明,即使是成年人也在某种程度上使用这种机制。
记忆的巩固
要将短期记忆转化为可以在数周或数年后回忆的长期记忆,它必须“巩固”。也就是说,如果短期记忆被反复激活,它将启动突触中的化学、物理和解剖变化,这些变化负责长期记忆的形成。这个过程需要5到10分钟进行最小程度的巩固,1小时或更长时间进行强巩固,这需要神经元中信使RNA和蛋白质的合成。例如,如果大脑受到强烈的感官印象,但随后在一分钟左右的时间内发生电诱导的脑痉挛,感官体验将不会被记住。同样,脑震荡、突然的深度全身麻醉或任何其他暂时阻断大脑动态功能的效果都可能阻止记忆的巩固。
巩固(consolidation)及其所需的时间可能可以通过短期记忆的复述(rehearsal)现象来解释,如下一节所述。
复述增强短期记忆向长期记忆的转移
研究表明,在脑海中反复复述相同的信息可以加速和增强短期记忆向长期记忆的转移程度,从而加速和增强巩固。大脑有一种自然倾向去复述新获得的信息,尤其是那些引起注意的新信息。因此,随着时间的推移,感觉体验的重要特征会逐渐在记忆存储中变得越来越固定。这种现象解释了为什么一个人可以记住少量深入学习的信 息,而大量浅尝辄止的信息则记不住。它也解释了为什么一个清醒的人比一个处于精神疲劳状态的人能更好地巩固记忆。
新记忆在巩固过程中被编码
巩固最重要的特征之一是新记忆被编码(codified)成不同类别的信息。在这个过程中,相似类型的信息从记忆存储库中被提取出来,用于帮助处理新信息。新旧信息被比较相似性和差异性,存储过程的一部分就是存储这些相似性和差异性的信息,而不是存储未经处理的新信息。因此,在巩固过程中,新记忆不是随机存储在大脑中,而是与同类型的其他记忆直接关联存储。这个过程对于日后能够"搜索"记忆存储以找到所需信息是必要的。
海马体和其他脑区在记忆中的作用
顺行性遗忘(anterograde amnesia)——海马体损伤后无法创建新的陈述性长期记忆。海马体是颞叶皮层的最内侧部分,它首先向内侧折叠到大脑下方,然后向上进入侧脑室的下内侧表面。少数患者的两个海马体被切除以治疗癫痫。这个手术不会严重影响患者在切除海马体之前存储在大脑中的信息记忆。然而,切除后,这些人几乎无法将语言和符号类型的记忆(陈述性记忆)存储到长期记忆甚至持续几分钟以上的中间记忆中。因此,这些人无法创建那些作为智力基础的信息类型的新长期记忆。这种情况被称为顺行性遗忘。
但是,为什么海马体在帮助大脑存储新记忆方面如此重要?可能的答案是,海马体是边缘系统“奖励”和“惩罚”区域最重要的输出通路之一,正如第59章所解释的那样。引起疼痛或厌恶的感觉刺激或思想会激活边缘系统的惩罚中心,而引起愉悦、快乐或奖励感的感觉刺激则会激活边缘系统的奖励中心。所有这些共同构成了一个人的背景情绪和动机。在这些动机中,大脑有一种驱动力去记住那些愉快或不愉快的经历和思想。海马体,尤其是丘脑背内侧核(另一个边缘结构),在决定哪些思想基于奖励或惩罚足够重要以至于值得记忆方面,被证明特别重要。
逆行性遗忘(Retrograde Amnesia)——海马体或丘脑损伤后无法回忆过去的记忆。当发生逆行性遗忘时,患者无法回忆起在导致遗忘的损伤或疾病之前学习的事件和信息。
在一些海马体受损的患者中,逆行性遗忘与顺行性遗忘(anterograde amnesia)同时发生,这表明这两种类型的遗忘至少部分相关,并且海马体损伤可能导致两者。然而,某些丘脑区域的损伤可能特别导致逆行性遗忘,而不会引起显著的顺行性遗忘。对此的一个可能解释是,丘脑可能在帮助人们“搜索”记忆库并“读取”记忆方面发挥作用。也就是说,记忆过程不仅需要存储记忆,还需要在以后能够搜索和找到记忆。丘脑在这一过程中的可能功能将在第59章进一步讨论。
海马体在反射性学习中并不重要
海马体受损的人通常在学习不涉及言语化或符号化智力的身体技能方面没有困难。例如,这些人仍然可以学习许多体育项目所需的快速手部和身体技能。这种类型的学习被称为技能学习或反射性学习(reflexive learning);它依赖于身体上反复重复所需的任务,而不是依赖于在头脑中进行符号化的排练。
参考文献
Asok A, Leroy F, Rayman JB, Kandel ER: Molecular mechanisms of the memory trace. Trends Neurosci 42:14, 2019. Constantinidis C, Klingberg T: The neuroscience of working memory capacity and training. Nat Rev Neurosci 17:438, 2016. Duszkiewicz AJ, McNamara CG, Takeuchi T, Genzel L: Novelty and dopaminergic modulation of memory persistence: a tale of two systems. Trends Neurosci 42:102, 2019. Eichenbaum H: Prefrontal-hippocampal interactions in episodic memory. Nat Rev Neurosci 18:547, 2017. Fernández G, Morris RGM: Memory, novelty and prior knowledge. Trends Neurosci 41:654, 2018. Friederici AD: The brain basis of language processing: from structure to function. Physiol Rev 91:1357, 2011. Gazzaniga MS: The human brain is actually two brains, each capable of advanced mental functions. When the cerebrum is divided surgically, it is as if the cranium contained two separate spheres of consciousness. Sci Am 217:24, 1967.
Haggard P: 人类大脑中的主体感。Nat Rev Neurosci 18:196, 2017. Holtmaat A, Caroni P: 学习中神经元组装形成的功能和结构基础。Nat Neurosci 19:1553, 2016. Izquierdo I, Furini CR, Myskiw JC: 恐惧记忆。Physiol Rev 96:695, 2016. Joo HR, Frank LM: 海马尖波-波纹在记忆检索中的即时使用和巩固。Nat Rev Neurosci 19:744, 2018. Kandel ER, Dudai Y, Mayford MR: 记忆的分子和系统生物学。Cell 157:163, 2014. Koch C, Massimini M, Boly M, Tononi G: 意识的神经相关性:进展和问题。Nat Rev Neurosci 17:307, 2016. Mansouri FA, Koechlin E, Rosa MGP, Buckley MJ: 管理竞争目标——前额极皮层的关键作用。Nat Rev Neurosci 18:645, 2017. Murray EA, Rudebeck PH: 灵长类腹侧前额叶皮层中奖励引导决策的特化。Nat Rev Neurosci 19:404, 2018. Ólafsdóttir HF, Bush D, Barry C: 海马重播在记忆和规划中的作用。Curr Biol 28:R37-R50, 2018. Ralph MA, Jefferies E, Patterson K, Rogers TT: 语义认知的神经和计算基础。Nat Rev Neurosci 18:42, 2017. Rasch B, Born J: 睡眠在记忆中的作用。Physiol Rev 93:681, 2013. Rizzolatti G, Cattaneo L, Fabbri-Destro M, Rozzi S: 目标导向行动组织和基于镜像神经元行动理解的皮层机制。Physiol Rev 94:655, 2014. Roelfsema PR, Holtmaat A: 深层皮层网络中突触可塑性的控制。Nat Rev Neurosci 19:166, 2018. Sreenivasan KK, D’Esposito M: 延迟活动的什么、在哪里和如何。Nat Rev Neurosci 20:466, 2019. Tanji J, Hoshi E: 外侧前额叶皮层在执行行为控制中的作用。Physiol Rev 88:37, 2008. Tonegawa S, Morrissey MD, Kitamura T: 记忆系统巩固中的记忆印迹细胞的作用。Nat Rev Neurosci 19:485, 2018. Tononi G, Boly M, Massimini M, Koch C: 整合信息理论:从意识到其物理基质。Nat Rev Neurosci 17:450, 2016. Volz LJ, Gazzaniga MS: 孤立中的互动:分裂脑研究50年的洞见。Brain 140:2051, 2017.
边缘系统和下丘脑——大脑的行为和动机机制
行为的控制是整个神经系统的功能。即使是第60章中讨论的清醒和睡眠周期也是我们最重要的行为模式之一。
在本章中,我们首先讨论控制大脑不同部分活动水平的机制。然后我们讨论动机驱动的原因,特别是学习过程的动机控制以及愉悦和惩罚的感觉。神经系统的这些功能主要由大脑的基底区域执行,这些区域统称为边缘系统,意为“边界”系统。
大脑的激活——驱动系统
如果没有来自下脑的神经信号持续传递到大脑(cerebrum),大脑将变得无用。事实上,脑干(brain stem)在中脑(mesencephalon)和大脑交界处的严重压迫,有时由松果体(pineal)肿瘤引起,常常导致患者进入持续的昏迷状态,直至生命结束。
脑干中的神经信号通过两种方式激活大脑:(1) 直接刺激大脑广泛区域的神经元活动背景水平,以及 (2) 激活神经激素系统(neurohormonal systems),释放特定的促进性或抑制性激素样神经递质(neurotransmitters)到大脑的选定区域。
通过来自脑干的持续兴奋信号控制大脑活动
脑干的网状兴奋区(Reticular Excitatory Area)——大脑活动的驱动者
图59-1展示了控制大脑活动水平的总体系统。该系统的核心驱动部分位于脑桥(pons)和中脑的网状结构(reticular substance)中的兴奋区。这个区域也被称为球网状促进区(bulboreticular facilitory area)。我们在第56章也讨论了这个区域,因为它是相同的脑干网状区,向下传递促进信号到脊髓(spinal cord),以维持抗重力肌肉(antigravity muscles)的张力并控制脊髓反射(spinal cord reflexes)的活动水平。除了这些向下的信号外,该区域还向上发送大量信号。大多数这些信号首先到达丘脑(thalamus),在那里它们兴奋一组不同的神经元,这些神经元将神经信号传递到大脑皮层(cerebral cortex)的所有区域,以及多个皮层下(subcortical)区域。
通过丘脑传递的信号有两种类型。第一种是快速传递的动作电位(action potentials),仅兴奋大脑几毫秒。这些信号源自遍布脑干网状区的大神经元细胞体。它们的神经末梢释放神经递质乙酰胆碱(acetylcholine),作为一种兴奋剂,仅持续几毫秒就被破坏。
第二种兴奋信号源自遍布脑干网状兴奋区的大量小神经元。同样,大多数这些信号传递到丘脑,但通过小的、传导缓慢的纤维,主要与丘脑的内板核(intralaminar nuclei)和丘脑表面的网状核(reticular nuclei)突触(synapse)。从这里,额外的小纤维分布到整个大脑皮层。由这种纤维系统引起的兴奋效应可以逐渐累积数秒到一分钟或更长时间,这表明其信号对于控制大脑的长期背景兴奋性水平尤为重要。
外周感觉信号对网状兴奋区的兴奋作用。脑干网状兴奋区的活动水平,以及整个大脑的活动水平,在很大程度上取决于从外周进入大脑的感觉信号的数量和类型。特别是疼痛信号会增加这个兴奋区的活动,从而强烈地激发大脑的注意力。
感觉信号在激活兴奋区中的重要性通过切断脑干在第五对脑神经进入脑桥处上方的效果得以证明。这些神经是进入大脑的最高神经,将大量体感信号(somatosensory signals)传递到大脑。当所有这些输入感觉信号消失时,大脑兴奋区的活动水平急剧下降,大脑立即进入活动大大减少的状态,接近永久性昏迷状态。然而,当脑干在第五对神经下方被切断时,保留了来自面部和口腔区域的大量感觉信号输入,昏迷得以避免。
图59-1 大脑的兴奋-激活系统。还显示了延髓中的一个抑制区,可以抑制或抑制激活系统。
由大脑皮层返回的反馈信号引起的兴奋区活动增加。不仅兴奋信号从脑干的网状结构兴奋区传递到大脑皮层,反馈信号也从大脑皮层返回到同一区域。因此,每当大脑皮层被大脑思维过程或运动过程激活时,信号就会从皮层发送到脑干兴奋区,兴奋区又会向皮层发送更多的兴奋信号。这个过程有助于维持甚至增强大脑皮层的兴奋水平。这是一个正反馈机制,允许大脑皮层中的任何初始活动支持更多的活动,从而导致“清醒”的意识。
丘脑是一个控制皮层特定区域活动的分配中心。正如第58章所指出的,几乎每个大脑皮层区域都与其在丘脑中的高度特定区域相连。因此,电刺激丘脑中的特定点通常会激活其特定的皮层小区域。此外,信号定期在丘脑和大脑皮层之间来回回荡,丘脑兴奋皮层,皮层通过返回纤维重新兴奋丘脑。这些来回回荡信号的激活被认为可以建立长期记忆。
丘脑是否还具有从皮层唤起特定记忆或激活特定思维过程的功能尚不清楚,但丘脑确实具有用于这些目的的适当神经元回路。
网状抑制区位于下脑干
图59-1显示了另一个在控制大脑活动中重要的区域——网状抑制区,位于延髓的内侧和腹侧。在第56章中,我们了解到这个区域可以抑制上脑干的网状易化区,从而减少大脑上部的活动。这种活动的机制之一是兴奋5-羟色胺能神经元(serotonergic neurons),这些神经元在大脑的关键点分泌抑制性神经激素5-羟色胺(serotonin);我们将在后面更详细地讨论这个概念。
大脑活动的神经激素控制
除了通过从下脑区到大脑皮层区域的神经信号的特异性传递直接控制大脑活动外,另一种生理机制也常用于控制大脑活动。这种机制是将兴奋性或抑制性神经递质激素分泌到大脑组织中。这些神经激素通常持续数分钟或数小时,从而提供长时间的控制,而不仅仅是瞬时激活或抑制。
图59-2展示了在大鼠大脑中详细研究的三种神经激素系统:(1) 去甲肾上腺素系统,(2) 多巴胺系统,以及 (3) 5-羟色胺系统。去甲肾上腺素通常作为兴奋性激素发挥作用,而5-羟色胺通常是抑制性的,多巴胺在某些区域是兴奋性的,而在其他区域则是抑制性的。正如预期的那样,这三种系统对大脑不同部位的兴奋性水平有不同的影响。去甲肾上腺素系统几乎扩散到大脑的每个区域,而5-羟色胺和多巴胺系统则更多地针对特定的大脑区域——多巴胺系统主要进入基底神经节区域,而5-羟色胺系统更多地进入中线结构。
人类大脑中的神经激素系统。图59-3展示了人类大脑中激活四种神经激素系统的脑干区域,其中三种与在大鼠中讨论的相同,另一种是乙酰胆碱系统。这些系统的一些具体功能如下。
图59-2 在大鼠大脑中绘制的三种神经激素系统——去甲肾上腺素系统、多巴胺系统和5-羟色胺系统。(改编自Kandel ER, Schwartz JH [eds]: Principles of Neural Science, 2nd ed. New York: Elsevier, 1985。)
- 蓝斑核和去甲肾上腺素系统。蓝斑核是一个位于桥脑和中脑交界处后部的小区域。来自该区域的神经纤维遍布整个大脑,如图59-2顶部框架所示,它们分泌去甲肾上腺素。去甲肾上腺素通常会激发大脑增加活动。然而,由于某些神经元突触上的抑制性受体,它在少数大脑区域具有抑制作用。第60章将描述该系统如何在引起梦境中发挥重要作用,从而导致一种称为快速眼动(REM)睡眠的睡眠类型。
- 黑质和多巴胺系统。第57章讨论了黑质与基底神经节的关系。它位于中脑上部的腹侧,其神经元主要向大脑的尾状核和壳核发送神经末梢,并在那里分泌多巴胺。位于邻近区域的其他神经元也分泌多巴胺,但它们将末梢发送到大脑的更腹侧区域,特别是下丘脑和边缘系统。多巴胺被认为在基底神经节中作为抑制性递质发挥作用,但在大脑的其他区域可能是兴奋性的。此外,请记住,第57章中提到,黑质中多巴胺能神经元的破坏是帕金森病的基本原因。
图59-3 脑干中的多个中枢。这些神经元分泌不同的神经递质(在括号中指定)。这些神经元向上发送控制信号到间脑和大脑,向下发送到脊髓。
- 中缝核和5-羟色胺系统。在脑桥和延髓的中线上有几个薄核,称为中缝核。这些核中的许多神经元分泌5-羟色胺。它们发出纤维到间脑,少数纤维到大脑皮层;还有一些纤维下行到脊髓。在脊髓纤维末梢分泌的5-羟色胺具有抑制疼痛的能力,这在第49章中讨论过。在间脑和大脑中释放的5-羟色胺几乎肯定在帮助引起正常睡眠中起着重要的抑制作用,正如我们在第60章中讨论的那样。
- 网状兴奋区的巨细胞神经元和乙酰胆碱系统。我们之前讨论过脑桥和中脑网状兴奋区的巨细胞神经元(巨细胞)。这些大细胞的纤维立即分成两个分支,一个向上传递到大脑的更高层次,另一个通过网状脊髓束向下传递到脊髓。在它们的末梢分泌的神经激素是乙酰胆碱。在大多数地方,乙酰胆碱作为兴奋性神经递质发挥作用。这些乙酰胆碱神经元的激活导致神经系统急剧清醒和兴奋。
图59-4 边缘系统的解剖结构,显示在深粉色区域。(改编自Warwick R, Williams PL: Gray's Anatomy, 第35版。伦敦:Longman Group Ltd, 1973。)
大脑中分泌的其他神经递质和神经激素物质。在不描述它们功能的情况下,以下是其他一些神经激素物质的部分列表,它们要么在特定的突触处发挥作用,要么通过释放到大脑的液体中发挥作用:脑啡肽、γ-氨基丁酸、谷氨酸、血管加压素、促肾上腺皮质激素、α-黑素细胞刺激激素(α-MSH)、神经肽-Y(NPY)、肾上腺素、组胺、内啡肽、血管紧张素II和神经降压素。因此,大脑中有多个神经激素系统,每个系统的激活在控制大脑功能的不同质量方面发挥着各自的作用。
边缘系统
“边缘”一词意为“边界”。最初,“边缘”一词用于描述大脑基底区域周围的边界结构,但随着我们对边缘系统功能的了解越来越多,边缘系统一词已扩展为指控制情绪行为和动机驱动的整个神经元回路。
边缘系统的主要部分是下丘脑及其相关结构。除了它们在行为控制中的作用外,这些区域还控制着身体的许多内部条件,如体温、体液的渗透压、饮食和饮水的驱动力以及体重的控制。这些内部功能统称为大脑的植物性功能,它们的控制与行为密切相关。
边缘系统(limbic system)的功能解剖学——下丘脑(hypothalamus)的关键位置
图59-4展示了边缘系统的解剖结构,表明它们是由基底脑(basal brain)元素组成的相互连接的复合体。位于所有这些结构中间的是极其微小的下丘脑,从生理学角度来看,它是边缘系统的核心元素之一。图59-5示意性地展示了下丘脑在边缘系统中的关键位置,并显示了围绕它的其他边缘系统皮层下结构(subcortical structures),包括隔区(septum)、旁嗅区(paraolfactory area)、丘脑前核(anterior nucleus of the thalamus)、基底神经节(basal ganglia)的部分区域、海马(hippocampus)和杏仁核(amygdala)。
围绕皮层下边缘区域的是边缘皮层(limbic cortex),由大脑两侧的皮层环组成——(1)始于额叶(frontal lobes)腹侧表面的眶额区(orbitofrontal area),(2)向上延伸至胼胝体下回(subcallosal gyrus),(3)然后越过胼胝体(corpus callosum)顶部到达大脑半球内侧的扣带回(cingulate gyrus),最后(4)经过胼胝体后方并向下延伸至颞叶(temporal lobe)腹内侧表面的海马旁回(parahippocampal gyrus)和钩回(uncus)。
图59-5 边缘系统,展示了下丘脑的关键位置。
因此,在每个大脑半球的内侧和腹侧表面,都有一个主要由古皮层(paleocortex)组成的环,围绕着一组与整体行为和情绪密切相关的深层结构。反过来,这个边缘皮层环作为新皮层(neocortex)和较低边缘结构之间的双向通信和关联纽带。
从下丘脑和其他边缘结构引发的许多行为功能也通过脑干(brain stem)中的网状核(reticular nuclei)及其相关核团介导。我们在第56章以及本章前面提到,刺激网状结构(reticular formation)的兴奋部分可以引起高度的脑兴奋性,同时也会增加脊髓(synapses)中许多突触的兴奋性。在第61章中,我们将看到控制自主神经系统(autonomic nervous system)的大多数下丘脑信号也通过位于脑干的突触核团传递。
边缘系统和脑干之间的一个重要通信途径是内侧前脑束(medial forebrain bundle),它从大脑皮层的隔区和眶额区向下延伸,穿过下丘脑中部到达脑干网状结构。这个束在两个方向上传递纤维,形成了一个主干通信系统。第二个通信途径是通过脑干网状结构、丘脑、下丘脑和基底脑大多数相邻区域之间的短通路。
下丘脑,边缘系统的主要控制中枢
下丘脑(hypothalamus)尽管体积仅有几立方厘米(重量仅约4克),但与边缘系统(limbic system)的各个层次都有双向的通信通路。反过来,下丘脑及其紧密相关的结构向三个方向发送输出信号:(1) 向后和向下到达脑干,主要进入中脑(mesencephalon)、脑桥(pons)和延髓(medulla)的网状区域,并从这些区域进入自主神经系统(autonomic nervous system)的外周神经;(2) 向上到达间脑(diencephalon)和大脑(cerebrum)的许多高级区域,特别是前丘脑(anterior thalamus)和大脑皮层(cerebral cortex)的边缘部分;(3) 进入下丘脑漏斗部(hypothalamic infundibulum),以控制或部分控制垂体后叶(posterior pituitary gland)和垂体前叶(anterior pituitary gland)的大部分分泌功能。
因此,下丘脑虽然仅占脑质量的不到1%,却是边缘系统最重要的控制通路之一。它控制着身体的大部分植物性(vegetative)和内分泌(endocrine)功能,以及情绪行为的许多方面。
下丘脑的植物性和内分泌控制功能
下丘脑控制身体多种功能的不同机制非常重要,因此在本教材的多个章节中都有讨论。例如,下丘脑在帮助调节动脉压(arterial pressure)中的作用在第18章中讨论,口渴和水分保持(thirst and water conservation)在第30章中讨论,食欲和能量消耗(appetite and energy expenditure)在第72章中讨论,温度调节(temperature regulation)在第74章中讨论,内分泌控制(endocrine control)在第76章中讨论。为了说明下丘脑作为一个功能单元的组织结构,我们在此也总结了一些其植物性和内分泌功能。
图59-6和图59-7展示了下丘脑的放大矢状面和冠状面视图,这些区域在图59-4中仅占一小部分。特别要注意图59-6中,当相应的下丘脑核团被刺激时,多种活动被激发或抑制。除了这些中心外,下丘脑的两侧还有一个大的外侧下丘脑区域(lateral hypothalamic area)(如图59-7所示)。这些外侧区域在控制口渴、饥饿和许多情绪驱动方面尤为重要。
在研究这些图表时必须谨慎,因为引起特定活动的区域并不像图中所示的那样精确地定位。此外,尚不清楚图中所示的效果是由于特定控制核团的刺激,还是仅仅由于来自或通向其他位置的控制核团的纤维束的激活。在牢记这一点的前提下,我们可以对下丘脑的植物性和控制功能进行以下一般性描述。
心血管调节(Cardiovascular Regulation)。刺激下丘脑的不同区域可以对心血管系统产生许多神经源性(neurogenic)效应,包括动脉压和心率的变化。一般来说,刺激后部和外侧下丘脑会增加动脉压和心率,而刺激视前区(preoptic area)通常会产生相反的效果,导致心率和动脉压的下降。这些效应主要通过脑桥和延髓网状区域的特定心血管控制中心传递。
图59-6 下丘脑的控制中心(矢状面视图)。GI,胃肠道。
图59-7 下丘脑的冠状面视图,显示各个下丘脑核的中间外侧位置。
体温调节。下丘脑的前部,尤其是视前区,与体温调节有关。流经该区域的血液温度升高会增加温度敏感神经元的活动,而温度降低则会减少其活动。反过来,这些神经元控制着增加或减少体温的机制,如第74章所述。
体液调节。下丘脑通过两种方式调节体液:(1) 通过产生口渴感,驱使动物或人饮水;(2) 通过控制水分的尿液排泄。一个称为口渴中心的区域位于下丘脑的外侧。当该中心或邻近区域的液体电解质浓度过高时,动物会产生强烈的饮水欲望;它会寻找最近的水源并饮用足够的水,以使口渴中心的电解质浓度恢复正常。
肾脏水分排泄的控制主要由视上核负责。当体液浓度过高时,这些区域的神经元会受到刺激。来自这些神经元的神经纤维通过下丘脑的漏斗部向下投射到垂体后叶,神经末梢在那里分泌抗利尿激素(也称为血管加压素)。然后,这种激素被吸收到血液中并运输到肾脏,作用于肾脏的集合管和集合小管,导致水分重吸收增加。这一作用减少了水分通过尿液的流失,但允许电解质继续排泄,从而使体液浓度恢复到正常水平。这些功能在第29章中介绍。
子宫收缩和乳房乳汁排出的调节。刺激室旁核会导致其神经元细胞分泌催产素。这种激素反过来会增加子宫的收缩性,并引起乳房腺泡周围的肌上皮细胞收缩,从而使腺泡通过乳头排出乳汁。
在妊娠结束时,尤其是大量的催产素被分泌,这种分泌有助于促进分娩收缩,从而排出婴儿。然后,每当婴儿吮吸母亲的乳房时,从乳头到后下丘脑的反射信号也会引起催产素的释放,催产素现在执行收缩乳房小管的必要功能,从而通过乳头排出乳汁,使婴儿能够获得营养。这些功能在第83章中讨论。
胃肠道和摄食调节
刺激下丘脑的多个区域会导致动物感到极度饥饿、食欲旺盛,并强烈渴望寻找食物。与饥饿相关的一个区域是下丘脑外侧区(lateral hypothalamic area)。相反,如果下丘脑两侧的这一区域受损,动物会失去对食物的欲望,有时会导致致命的饥饿,如第72章所述。
一个与食欲相反的中心称为饱腹中心(satiety center),位于腹内侧核(ventromedial nuclei)。当这个中心受到电刺激时,正在进食的动物会突然停止进食,并对食物表现出完全的漠不关心。然而,如果这个区域被双侧破坏,动物将无法感到饱腹;相反,其下丘脑的饥饿中心会变得过度活跃,导致食欲旺盛,最终导致极度肥胖。下丘脑的弓状核(arcuate nucleus)包含至少两种不同类型的神经元,当受到刺激时,会导致食欲增加或减少。下丘脑的另一个区域——乳头体(mammillary bodies)也参与胃肠道活动的整体控制,至少部分控制许多摄食反射的模式,例如舔唇和吞咽。
下丘脑对前垂体内分泌激素分泌的调控
刺激下丘脑的某些区域还会导致前垂体分泌其内分泌激素。这一主题将在第75章中详细讨论,涉及内分泌腺的神经调控。简而言之,基本机制如下:前垂体的血液供应主要来自首先流经下丘脑下部,然后流经前垂体血管窦的血液。当血液流经下丘脑到达前垂体之前,各种下丘脑核团会向血液中分泌特定的释放激素和抑制激素。这些激素随后通过血液运输到前垂体,作用于腺体细胞,控制特定前垂体激素的释放。
下丘脑对昼夜节律的调控——视交叉上核
下丘脑的视交叉上核(suprachiasmatic nucleus, SCN)包含约20,000个神经元,位于视交叉上方,视神经在下丘脑下方交叉处,如第52章所述。SCN的神经元充当“主时钟”,其起搏器放电频率遵循昼夜节律(circadian rhythm)(图59-8)。这一起搏器功能对于将睡眠组织成24小时的昼夜节律模式至关重要。SCN的损伤会导致许多生理和行为紊乱,包括昼夜睡眠-觉醒节律的丧失。因此,SCN指导我们生理和行为的日常周期,设定我们生活的节奏。
图59-8 下丘脑的视交叉上核(suprachiasmatic nucleus, SCN)作为许多生理、心理和行为活动的"主时钟"。SCN通过视网膜下丘脑束(retinohypothalamic tract, RHT)接受来自视网膜的直接神经支配,使其活动与昼夜周期同步。SCN神经元投射到包含局部昼夜节律钟的各个脑中枢,这些局部钟控制进食-禁食、睡眠-觉醒、自主神经和神经内分泌的昼夜节律。这些系统信号同步外周组织中的局部分子钟,然后这些局部钟指导调节生理节律的昼夜节律基因表达,包括与精神警觉性和认知、心血管调节、代谢和肾功能相关的节律。
这些每日周期对人类健康的重要性导致人们对时间生物学(chronobiology)领域的兴趣日益增加,时间生物学是研究这些昼夜节律的学科。2017年,Jeffrey C. Hall、Michael Rosbash和Michael W. Young因发现控制果蝇昼夜节律的分子机制而获得诺贝尔生理学或医学奖。
SCN被组织成特定的功能组,控制身体其他部位生物钟的节律模式。这些生物钟由一组复杂的基因转录因子、蛋白质/酶和其他调节因子组成,它们在大多数生物体(包括哺乳动物、微生物甚至植物)中运作以建立昼夜节律。这些生物钟几乎存在于身体的每个组织和器官中,并且能够维持自己的昼夜节律,尽管在没有SCN信号的情况下,它们的昼夜节律通常只能维持几天。
SCN和其他组织中时钟机制的关键成分是两个反馈环路,它们依赖于转录激活因子CLOCK和BMAL1,它们相互结合并在转移到细胞核后启动"时钟基因"(PER1、PER2和PER3)和"隐花色素基因"(CRY1和CRY2)的转录。这些基因开启PER和CRY蛋白的合成;随着蛋白质的积累,它们抑制CLOCK和BMAL1,从而抑制PER和CRY的转录。这种PER和CRY蛋白合成的开关反馈序列通常以24小时的昼夜节律模式发生。
一旦SCN时钟建立了其昼夜节律,这些信息就会通过动作电位传递到其他大脑区域,并通过神经和激素信号传递到各种器官和组织。来自SCN的轴突投射到下丘脑的其他区域,这些区域对于体温的昼夜变化、睡眠-觉醒周期和各种激素变化特别重要。
尽管SCN的昼夜节律是内源性和自我维持的,但它们会因环境变化(如温度和光暗周期的时间)而改变("同步")。SCN从含有光色素黑视蛋白并通过视网膜下丘脑束传递信号的特化内在光敏视网膜神经节细胞接收神经输入。这条通路在改变昼夜节律时间方面的重要性可以通过以下观察来说明:一个人跨越多个时区旅行可能会经历"时差反应",但他或她的昼夜节律时钟最终会与当地的昼夜时间同步。
总结。下丘脑(hypothalamus)的多个区域控制特定的植物性(vegetative)和内分泌(endocrine)功能。这些区域的功能尚未完全阐明,因此之前关于不同下丘脑功能对应不同区域的描述仍部分具有推测性。
下丘脑及相关边缘系统(limbic system)结构的行为功能
下丘脑刺激引起的影响。除了下丘脑的植物性和内分泌功能外,下丘脑的刺激或损伤通常对动物和人类的情绪行为有深远影响。刺激引起的一些行为影响如下:
- 外侧下丘脑(lateral hypothalamus)的刺激不仅会引起口渴和进食,如前所述,还会提高动物的整体活动水平,有时会导致明显的愤怒和打斗,这将在后面讨论。
- 腹内侧核(ventromedial nucleus)及周围区域的刺激主要引起与外侧下丘脑刺激相反的影响,即饱腹感、进食减少和安宁。
- 位于第三脑室(third ventricle)紧邻的室周核(periventricular nuclei)薄带区域的刺激(或与下丘脑这部分连续的中脑(mesencephalon)中央灰质(central gray area)的刺激),通常会导致恐惧和惩罚反应。
- 性驱力(sexual drive)可由下丘脑的多个区域刺激引起,尤其是最前部和最后部。
下丘脑损伤引起的影响。一般来说,下丘脑的损伤会引起与刺激相反的影响,例如:
- 外侧下丘脑的双侧损伤会使饮水和进食几乎降至零,通常导致致命的饥饿。这些损伤还会导致动物极度被动,丧失大部分明显驱力。
- 下丘脑腹内侧区的双侧损伤主要引起与外侧下丘脑损伤相反的影响:过度饮水和进食,以及多动和经常因轻微刺激而频繁发作的极度愤怒。
边缘系统其他区域的刺激或损伤,尤其是杏仁核(amygdala)、隔区(septal area)和中脑区域,通常会引起与下丘脑相似的影响。我们将在后面更详细地讨论其中一些影响。
边缘系统的"奖赏"和"惩罚"功能
从目前的讨论中已经很清楚,一些边缘结构特别关注感觉的情感性质,即感觉是愉快的还是不愉快的。这些情感性质也被称为奖赏(reward)或惩罚(punishment),或满足(satisfaction)或厌恶(aversion)。某些边缘区域的电刺激会使动物感到愉悦或满足,而其他区域的电刺激则会引起恐惧、疼痛、害怕、防御、逃跑反应以及惩罚的所有其他要素。这两个相反反应系统的刺激程度极大地影响了动物的行为。
奖赏中枢
通过使用电刺激器进行实验研究,以绘制大脑的奖励和惩罚中心,主要的奖励中心被发现位于内侧前脑束的路径上,特别是在下丘脑的外侧核和腹内侧核中。有趣的是,外侧核被包括在奖励区域中,因为该区域的强刺激实际上可能引发愤怒。然而,这种现象在许多区域都会发生,较弱的刺激会带来奖励感,而较强的刺激则会带来惩罚感。较弱的奖励中心,可能是下丘脑中主要奖励中心的次要区域,存在于隔区、杏仁核、丘脑和基底神经节的某些区域,并向下延伸到中脑的基底被盖。
惩罚中心
最强烈的惩罚和逃避倾向区域被发现位于中脑的Sylvius导水管周围的中央灰质区,并向上延伸到下丘脑和丘脑的室周区。较弱的惩罚区域存在于杏仁核和海马体的某些位置。特别有趣的是,刺激惩罚中心经常可以完全抑制奖励和愉悦中心,这表明惩罚和恐惧可以优先于愉悦和奖励。
愤怒与惩罚中心的关联
涉及下丘脑和其他边缘结构惩罚中心的情感模式,即愤怒模式,已经被很好地描述。这被描述如下。
强烈刺激大脑的惩罚中心,特别是在下丘脑的室周区和外侧下丘脑,会导致动物(1)采取防御姿势;(2)伸出爪子;(3)抬起尾巴;(4)发出嘶嘶声;(5)吐口水;(6)咆哮;以及(7)出现毛发竖立、眼睛睁大和瞳孔放大的现象。此外,即使是最轻微的挑衅也会立即引发野蛮的攻击。这种行为大致上是一个人预期从受到严重惩罚的动物身上看到的行为,这是一种被称为愤怒的行为模式。
幸运的是,在正常动物中,愤怒现象主要通过来自下丘脑腹内侧核的抑制信号来控制。此外,海马体和前边缘皮层的部分,特别是在前扣带回和胼胝体下回,有助于抑制愤怒现象。
平静和温顺。当奖励中心受到刺激时,会出现完全相反的情感行为模式——平静和温顺。
奖励或惩罚对行为的重要性
我们做的几乎所有事情都以某种方式与奖励和惩罚相关。如果我们正在做的事情是有奖励的,我们会继续做;如果是有惩罚的,我们会停止做。因此,奖励和惩罚中心无疑构成了我们身体活动、驱动力、厌恶和动机的最重要控制器之一。
镇静剂对奖赏或惩罚中心的影响。给予镇静剂(tranquilizer),如氯丙嗪(chlorpromazine),通常会抑制奖赏和惩罚中心,从而降低动物的情感反应性。因此,推测镇静剂在精神病状态中的作用是通过抑制下丘脑及其相关边缘脑区的许多重要行为区域来实现的。
奖赏或惩罚在学习和记忆中的重要性——习惯化与强化
动物实验表明,既不引起奖赏也不引起惩罚的感觉体验几乎不会被记住。大脑的电记录显示,新经历的感觉刺激几乎总是会激发大脑皮层的多个区域。然而,如果感觉体验没有引发奖赏或惩罚感,重复刺激会导致大脑皮层反应几乎完全消失——也就是说,动物会对特定的感觉刺激产生习惯化(habituation),之后会忽略它。
如果刺激确实引起奖赏或惩罚而不是漠然,大脑皮层反应在重复刺激期间会逐渐变得越来越强烈,而不是逐渐消失,这种反应被称为强化(reinforcement)。动物会对奖赏性或惩罚性的感觉建立强烈的记忆痕迹,但相反,对漠然的感觉刺激会产生完全的习惯化。
显然,边缘系统的奖赏和惩罚中心与我们选择学习的信息有很大关系,通常会丢弃超过99%的信息,并选择不到1%的信息进行保留。
边缘系统其他部分的特定功能
海马的功能
海马是大脑皮层的延长部分,向内折叠形成侧脑室内侧的大部分腹侧表面。海马的一端紧邻杏仁核(amygdaloid nuclei),沿其外侧边界与海马旁回(parahippocampal gyrus)融合,海马旁回是颞叶腹内侧外表面的皮层。
海马(及其邻近的颞叶和顶叶结构,统称为海马结构)与大脑皮层的许多部分以及边缘系统的基底结构——杏仁核、下丘脑、隔膜和乳头体——有许多但主要是间接的连接。几乎任何类型的感觉体验都会激活海马的至少某些部分,而海马反过来通过穹窿(fornix)这一主要通信通路向前丘脑、下丘脑和边缘系统的其他部分分发许多传出信号。因此,海马是一个额外的通道,通过它,传入的感觉信号可以启动不同目的的行为反应。与其他边缘结构一样,刺激海马的不同区域可以引起几乎任何不同的行为模式,如愉悦、愤怒、被动或过度的性欲。
海马体的另一个特征是它可以变得过度兴奋。例如,微弱的电刺激可以引起海马体小区域的局灶性癫痫发作。这些发作通常在刺激结束后持续许多秒,这表明即使在正常功能条件下,海马体也可能发出延长的输出信号。在海马体癫痫发作期间,患者会经历各种精神运动效应,包括嗅觉、视觉、听觉、触觉和其他类型的幻觉,这些幻觉在发作持续期间无法被抑制,即使患者没有失去意识并且知道这些幻觉是不真实的。海马体这种过度兴奋性的原因之一可能是它与大脑其他部位的皮层类型不同,某些区域只有三层神经细胞,而不是其他部位的六层。
海马体在学习中的作用
双侧海马体切除后的顺行性遗忘(anterograde amnesia)。在一些人类中,为了治疗癫痫,双侧海马体的一部分被手术切除。这些人可以满意地回忆起大部分以前学到的记忆。然而,他们通常无法学习基于语言符号的新信息——他们甚至无法记住每天接触的人的名字。但他们可以暂时记住活动过程中发生的事情。因此,他们能够保持几秒到一两分钟的短期记忆,尽管他们建立持续几分钟以上记忆的能力完全或几乎完全丧失。这种现象称为顺行性遗忘(anterograde amnesia),在第58章中讨论过。
海马体在学习中的理论功能。海马体起源于嗅觉皮层的一部分。在许多低等动物中,这个皮层在决定动物是否会吃某种食物、某种物体的气味是否暗示危险、或者气味是否具有性吸引力方面起着至关重要的作用,从而做出生死攸关的决定。在大脑进化的早期,海马体可能成为一个关键的决策神经元机制,决定传入感觉信号的重要性。一旦这种关键的决策能力建立起来,大脑的其他部分也可能开始依赖海马体进行决策。因此,如果海马体信号表明神经元输入是重要的,信息很可能会被记住。
因此,一个人会迅速对无关紧要的刺激产生习惯,但会努力学习任何引起愉悦或痛苦的感觉体验。但这是如何发生的机制呢?有人认为,海马体提供了将短期记忆转化为长期记忆的动力——也就是说,海马体传递的信号似乎使大脑反复演练新信息,直到永久存储发生。无论机制如何,没有海马体,语言或符号思维类型的长期记忆的巩固会较差或根本不会发生。
杏仁核的功能
杏仁核(amygdala)是一个由多个小核团组成的复合体,位于每个颞叶内侧前极的大脑皮层(cerebral cortex)下方。它与下丘脑(hypothalamus)以及边缘系统(limbic system)的其他区域有着丰富的双向连接。
在低等动物中,杏仁核在很大程度上与嗅觉刺激及其与边缘脑的相互关系有关。第54章中提到,嗅束(olfactory tract)的主要分支之一终止于杏仁核的一部分,称为皮质内侧核(corticomedial nuclei),它位于颞叶嗅觉梨状区(pyriform area)的大脑皮层下方。在人类中,杏仁核的另一部分,即基底外侧核(basolateral nuclei),比嗅觉部分发育得更为发达,在许多通常与嗅觉刺激无关的行为活动中起着重要作用。
杏仁核接收来自边缘皮层(limbic cortex)所有部分的神经元信号,以及来自颞叶、顶叶和枕叶新皮层(neocortex)的信号——特别是来自听觉和视觉联合区(auditory and visual association areas)的信号。由于这些多重连接,杏仁核被称为“窗口”,通过它,边缘系统可以看到人在世界中的位置。反过来,杏仁核将信号传递回这些相同的皮层区域,传递到海马体(hippocampus)、隔区(septum)、丘脑(thalamus),特别是下丘脑(hypothalamus)。
刺激杏仁核的效果。一般来说,刺激杏仁核可以引起与直接刺激下丘脑几乎相同的效果,以及其他效果。从杏仁核发起并通过下丘脑传递的效果包括:(1) 动脉压和心率的增加或减少;(2) 胃肠动力和分泌的增加或减少;(3) 排便或排尿;(4) 瞳孔扩张或偶尔收缩;(5) 竖毛;(6) 各种垂体前叶激素的分泌,特别是促性腺激素(gonadotropins)和促肾上腺皮质激素(adrenocorticotropic hormone)。
除了这些通过下丘脑介导的效果外,刺激杏仁核还可以引起几种类型的非自主运动。这些类型包括:(1) 强直性运动,如抬头或弯曲身体;(2) 旋转运动;(3) 偶尔的阵挛性、节律性运动;(4) 与嗅觉和进食相关的不同类型的运动,如舔舐、咀嚼和吞咽。
刺激某些杏仁核核团还可以引起一种愤怒、逃避、惩罚、剧烈疼痛和恐惧的模式,类似于前面描述的从下丘脑引发的愤怒模式。刺激其他杏仁核核团可以引起奖励和愉悦的反应。
最后,兴奋杏仁核的其他部分可以引起性活动,包括勃起、交配动作、射精、排卵、子宫活动和早产。
双侧杏仁核切除的影响——Kluver-Bucy综合征
当猴子的双侧颞叶前部被破坏时,这一过程不仅移除了部分颞叶皮层,还移除了位于这些颞叶内部的杏仁核。这种移除会导致行为上的变化,称为Klüver-Bucy综合征,表现为动物(1)对任何事物都不感到恐惧,(2)对一切事物表现出极强的好奇心,(3)迅速遗忘,(4)倾向于将一切放入口中,有时甚至试图吞食固体物体,(5)性欲极强,可能会试图与未成熟的动物、错误性别的动物,甚至是不同物种的动物交配。尽管人类中类似的病变较为罕见,但受影响的人的反应与猴子的反应并无太大差异。
杏仁核的总体功能
杏仁核似乎是行为意识区域,在半意识水平上运作。它们似乎还将个体当前的状态投射到与周围环境和思想相关的边缘系统中。基于这些信息,杏仁核被认为能够使个体的行为反应适应每个场合。
边缘皮质的功能
边缘系统中最不为人理解的部分是称为边缘皮质的脑皮质环,它围绕着皮质下的边缘结构。这个皮质作为一个过渡区域,信号通过它从大脑皮质的其余部分传递到边缘系统,反之亦然。因此,边缘皮质实际上起到了控制行为的脑关联区域的作用。
对边缘皮质不同区域的刺激未能给出其功能的清晰概念。然而,通过刺激边缘皮质的特定部分,可以引发许多行为模式。同样,切除某些边缘皮质区域可能会导致动物行为的持久变化,如下所述。
前颞叶皮质的切除
当双侧前颞叶皮质被切除时,杏仁核几乎总是同时受损,如前所述,Kluver-Bucy综合征会发生。动物特别会发展出完成性行为:它会调查所有物体,对不合适的动物甚至无生命物体表现出强烈的性欲,失去所有恐惧——从而变得温顺。
眶额皮质后部的切除
双侧切除眶额皮质后部通常会导致动物出现与强烈运动不安相关的失眠;动物变得无法静坐,持续移动。
前扣带回和胼胝体下回的切除
前扣带回和胼胝体下回是边缘皮质的一部分,它们在前额叶皮质和皮质下边缘结构之间进行通信。双侧破坏这些回会释放隔区和下丘脑的愤怒中心,使其脱离前额叶的抑制影响。因此,动物可能会变得凶猛,比正常情况下更容易发怒。
总结
在获得更多信息之前,或许最好这样描述:边缘系统(limbic system)的皮层区域占据了大脑皮层特定区域功能与皮层下边缘结构功能之间的中间关联位置,用于控制行为模式。因此,在前颞叶皮层(anterior temporal cortex)中,尤其可以发现与味觉和嗅觉行为相关的关联。在海马旁回(parahippocampal gyri)中,倾向于出现复杂的听觉关联以及源自后颞叶Wernicke区的复杂思维关联。在中后扣带皮层(middle and posterior cingulate cortex)中,有理由相信存在感觉运动行为关联。
参考文献
Anacker C, Hen R: Adult hippocampal neurogenesis and cognitive flexibility - linking memory and mood. Nat Rev Neurosci 18:335, 2017. Challet E: The circadian regulation of food intake. Nat Rev Endocrinol 15:393, 2018. Crunelli V, Lőrincz ML, Connelly WM, et al: Dual function of thalamic low-vigilance state oscillations: rhythm-regulation and plasticity Nat Rev Neurosci 19:107, 2018. Fenster RJ, Lebois LAM, Ressler KJ, Suh J: Brain circuit dysfunction in post-traumatic stress disorder: from mouse to man. Nat Rev Neurosci 19:535, 2018. Gizowski C, Bourque CW: The neural basis of homeostatic and anticipatory thirst. Nat Rev Nephrol 14:11, 2018. Hastings MH, Maywood ES, Brancaccio M: Generation of circadian rhythms in the suprachiasmatic nucleus Nat Rev Neurosci 19:453, 2018. Izquierdo I, Furini CR, Myskiw JC: Fear memory. Physiol Rev 96:695, 2016. Maddox SA, Hartmann J, Ross RA, Ressler KJ: Deconstructing the gestalt: mechanisms of fear, threat, and trauma memory encoding. Neuron 102:60, 2019. Maren S, Phan KL, Liberzon I: The contextual brain: implications for fear conditioning, extinction and psychopathology. Nat Rev Neurosci 14:417, 2013. Morton GJ, Meek TH, Schwartz MW: Neurobiology of food intake in health and disease. Nat Rev Neurosci 15:367, 2014. Ressler RL, Maren S: Synaptic encoding of fear memories in the amygdala. Curr Opin Neurobiol 54:54, 2019. Ross DA, Arbuckle MR, Travis MJ, Dwyer JB et al: An Integrated neuroscience perspective on formulation and treatment planning for posttraumatic stress disorder: an educational review. JAMA Psychiatry 74:407, 2017. Russo SJ, Nestler EJ: The brain reward circuitry in mood disorders. Nat Rev Neurosci 14:609, 2013. Schultz W: Neuronal reward and decision signals: from theories to data. Physiol Rev 95:853, 2015. Shalev A, Liberzon I, Marmar C: Post-traumatic stress disorder. N Engl J Med 376:2459, 2017. Sherman SM: Functioning of circuits connecting thalamus and cortex. Compr Physiol 7:713, 2017. Stanton CH, Holmes AJ, Chang SWC, Joormann J: From stress to anhedonia: Molecular processes through functional circuits. Trends Neurosci 42:23, 2019. Young Mw: Time travels: a 40-year journey from Drosophila's clock mutants to human circadian disorders (Nobel Lecture). Angew Chem Int Ed Engl 57:11532, 2018. Zimmerman CA, Leib DE, Knight ZA: Neural circuits underlying thirst and fluid homeostasis. Nat Rev Neurosci 18:459, 2017.
大脑活动状态——睡眠、脑电波、癫痫、精神病和痴呆
我们所有人都意识到大脑活动的许多不同状态,包括睡眠、清醒、极度兴奋,甚至不同的情绪水平,如兴奋、抑郁和恐惧。所有这些状态通常都是由大脑内部产生的不同激活或抑制力量引起的。在第59章中,我们开始部分讨论了这个主题,当时我们描述了能够激活大脑大部分区域的不同系统。在本章中,我们将简要介绍大脑活动的特定状态,从睡眠开始。
睡眠
睡眠被定义为一种无意识状态,人可以通过感觉或其他刺激被唤醒。它应与昏迷区分开来,昏迷是一种无法通过刺激唤醒的无意识状态。睡眠有多个阶段,从非常浅的睡眠到非常深的睡眠。睡眠研究人员还将睡眠分为两种完全不同的类型,它们具有不同的特性,如下一节所述。
两种类型的睡眠——慢波睡眠和快速眼动睡眠
每晚,一个人会经历两种主要类型的睡眠阶段,它们交替出现(图60-1)。这些类型被称为(1)快速眼动睡眠(REM睡眠),在这种睡眠中,尽管人仍在睡觉,但眼睛会快速移动;(2)慢波睡眠或非快速眼动睡眠(NREM睡眠),在这种睡眠中,脑波强烈且频率低,我们稍后会讨论。
REM睡眠在年轻人中约占睡眠时间的25%;每个阶段通常每90分钟重复一次。这种类型的睡眠并不那么宁静,通常与生动的梦境相关。每晚的大部分睡眠是慢波(NREM)睡眠,这是人在清醒数小时后在睡眠的第一个小时内经历的深度、宁静的睡眠。
REM(反常、去同步化)睡眠
在正常的夜间睡眠中,年轻人通常平均每90分钟出现一次持续5到30分钟的REM睡眠。当一个人非常困倦时,每次REM睡眠的时间很短,甚至可能没有。随着人在夜间逐渐休息,REM睡眠的持续时间会增加。
REM睡眠有几个重要特征:
- 它是一种活跃的睡眠形式,通常与做梦和身体肌肉的活跃运动相关。
- 与深度慢波睡眠相比,人在REM睡眠中更难通过感觉刺激被唤醒,但人们通常在早晨的REM睡眠阶段自发醒来。
- 全身的肌肉张力极度降低,表明脊髓肌肉控制区域受到强烈抑制。
- 心率和呼吸频率通常变得不规则,这是梦境状态的特征。
- 尽管外周肌肉受到极度抑制,但除了眼睛的快速运动外,还会发生不规则的肌肉运动。
- 在REM睡眠中,大脑高度活跃,整体大脑代谢可能增加多达20%。脑电图(EEG)显示出与清醒时相似的脑波模式。这种类型的睡眠也被称为反常睡眠,因为尽管大脑中存在显著活动,人仍然可以保持睡眠状态,这是一种悖论。
总之,快速眼动睡眠(REM sleep)是一种大脑非常活跃的睡眠类型。然而,人并没有完全意识到周围环境,因此是真正处于睡眠状态。
慢波睡眠(Slow-Wave Sleep)
我们可以通过回忆上一次超过24小时不睡觉的经历,以及入睡后第一小时内发生的深度睡眠,来理解深度慢波睡眠的特征。这种睡眠非常有助于恢复体力,并与外周血管张力(peripheral vascular tone)和许多其他植物性功能(vegetative functions)的降低有关。例如,血压、呼吸频率和基础代谢率(basal metabolic rate)会降低10%到30%。
尽管慢波睡眠常被称为“无梦睡眠”,但在慢波睡眠期间确实会发生梦境,有时甚至会出现噩梦。慢波睡眠中的梦境与快速眼动睡眠中的梦境的区别在于,快速眼动睡眠中的梦境伴随着更多的身体肌肉活动。此外,慢波睡眠中的梦境通常不会被记住,因为这些梦境在记忆中没有得到巩固(consolidation)。
图60-1. 清醒、快速眼动睡眠(REM sleep)以及睡眠第一阶段到第四阶段期间脑波特征的渐进变化。
睡眠的基本理论
睡眠是由主动抑制过程引起的
早期的睡眠理论认为,上脑干(upper brain stem)的兴奋区域,即网状激活系统(reticular activating system),在白天清醒时变得疲劳,并因此变得不活跃。一个重要实验改变了这一观点,转而认为睡眠是由主动抑制过程引起的,因为研究发现,在中脑桥(midpons)水平切断脑干会使得大脑皮层(brain cortex)永远不会进入睡眠状态。换句话说,位于脑干中脑桥水平以下的一个中心似乎通过抑制大脑的其他部分来引起睡眠。
引起睡眠的神经元中心、神经体液物质和机制——5-羟色胺(Serotonin)的可能作用
刺激大脑的几个特定区域可以产生接近自然睡眠特征的睡眠。其中一些区域包括:
- 脑桥下半部和延髓(medulla)中的中缝核(raphe nuclei)是引起接近自然睡眠的最显著的刺激区域。这些核由位于中线的一薄层特殊神经元组成。来自这些核的神经纤维在脑干网状结构(reticular formation)中局部扩散,并向上延伸到丘脑(thalamus)、下丘脑(hypothalamus)、边缘系统(limbic system)的大部分区域,甚至大脑的新皮层(neocortex)。此外,纤维向下延伸到脊髓(spinal cord),终止于后角(posterior horns),在那里它们可以抑制传入的感觉信号,包括疼痛,如第49章所述。来自这些中缝核神经元的纤维的许多神经末梢分泌5-羟色胺(serotonin)。当给动物注射一种阻断5-羟色胺形成的药物时,动物往往在接下来的几天内无法入睡。因此,人们认为5-羟色胺是一种与睡眠产生相关的神经递质(transmitter substance)。
- 刺激孤束核(nucleus of the tractus solitarius)的某些区域也能引起睡眠。该核团是内脏感觉信号通过迷走神经(vagus nerve)和舌咽神经(glossopharyngeal nerve)传入后,在延髓(medulla)和脑桥(pons)中的终止部位。
- 刺激间脑(diencephalon)的多个区域也能促进睡眠,包括:(1)下丘脑(hypothalamus)的喙侧部分,主要位于视交叉上区(suprachiasmal area);(2)丘脑(thalamus)弥散核团中的偶发区域。
促睡眠中枢的损伤可导致强烈的觉醒状态。中缝核(raphe nuclei)的离散损伤会导致高度觉醒状态。这种现象也见于前下丘脑(anterior hypothalamus)内侧喙侧视交叉上区的双侧损伤。在这两种情况下,中脑(mesencephalon)和上脑桥(upper pons)的兴奋性网状核似乎从抑制中释放出来,从而导致强烈的觉醒状态。事实上,有时前下丘脑的损伤会导致如此强烈的觉醒状态,以至于动物实际上会因衰竭而死亡。
与睡眠相关的其他可能的递质物质。实验表明,被剥夺睡眠数天的动物的脑脊液(cerebrospinal fluid)和血液或尿液中含有一种或多种物质,当注射到另一动物的脑室系统(brain ventricular system)时会引起睡眠。一种可能的物质已被鉴定为胞壁酰肽(muramyl peptide),这是一种低分子量物质,在被剥夺睡眠数天的动物的脑脊液和尿液中积累。当仅注射微克级的这种促睡眠物质到第三脑室时,几乎会在几分钟内出现自然睡眠,动物可能会持续睡眠数小时。
另一种具有类似促睡眠作用的物质是δ睡眠诱导肽(delta sleep-inducing peptide),这是一种在电刺激丘脑诱导睡眠后在脑脊液中发现的九肽(nonapeptide)。从被剥夺睡眠数天的动物的脑脊液或脑干(brain stem)神经元组织中还分离出了几种其他潜在的睡眠因子,主要是肽类。长时间觉醒可能导致脑干或脑脊液中一种或多种睡眠因子的逐渐积累,从而引发睡眠。
快速眼动睡眠(REM sleep)的可能原因。目前尚不清楚为什么慢波睡眠(slow-wave sleep)会周期性地被快速眼动睡眠打断。然而,模拟乙酰胆碱(acetylcholine)作用的药物会增加快速眼动睡眠的发生。因此,有人推测,上脑干网状结构(upper brain stem reticular formation)中大量分泌乙酰胆碱的神经元可能通过其广泛的传出纤维激活大脑的许多部分。从理论上讲,这种机制可能会导致快速眼动睡眠期间某些大脑区域活动的增加,尽管这些信号在大脑中没有被适当地引导以产生觉醒状态特有的正常意识。
睡眠与觉醒的循环
前面的讨论仅识别了与睡眠相关的神经元区域、递质和机制;它们并未解释睡眠-觉醒循环的周期性、相互作用的运作。目前尚无明确的解释。因此,我们可以提出以下可能的机制来解释睡眠-觉醒循环。
当睡眠中枢未被激活时,中脑(mesencephalic)和上桥脑(upper pontile)的网状激活核(reticular activating nuclei)从抑制中释放出来,这使得网状激活核能够自发激活。这种自发活动反过来又兴奋大脑皮层(cerebral cortex)和周围神经系统(peripheral nervous system),两者都会向相同的网状激活核发送大量正反馈信号,进一步激活它们。
因此,一旦觉醒开始,由于所有这些正反馈活动,它自然倾向于维持自身。
然后,在大脑保持激活状态数小时后,即使是激活系统中的神经元也可能变得疲劳。因此,中脑网状核(mesencephalic reticular nuclei)和大脑皮层之间的正反馈循环逐渐减弱,睡眠中枢的促睡眠作用占据主导地位,导致从觉醒状态迅速过渡到睡眠状态。
这一整体理论可以解释从睡眠到觉醒以及从觉醒到睡眠的快速过渡。它还可以解释觉醒(arousal)——即当一个人的思想被某种想法占据时发生的失眠——以及由身体活动产生的觉醒。
Orexin神经元在觉醒和清醒中的作用
Orexin(也称为hypocretin)由下丘脑(hypothalamus)中的神经元产生,这些神经元向大脑中许多存在orexin受体的区域提供兴奋性输入。Orexin神经元在清醒时最为活跃,在慢波睡眠(slow wave sleep)和快速眼动睡眠(REM sleep)期间几乎停止放电。由于orexin受体缺陷或产生orexin的神经元被破坏而导致的orexin信号丢失会引起发作性睡病(narcolepsy),这是一种以白天极度嗜睡和突然发作的睡眠为特征的睡眠障碍,甚至可能发生在一个人说话或工作时。发作性睡病患者还可能经历突然的肌张力丧失(猝倒症,cataplexy),这种丧失可能是部分的,甚至严重到在发作期间导致瘫痪。这些观察结果表明,orexin神经元在维持清醒状态中起着重要作用,但它们对睡眠和清醒之间正常日常周期的贡献尚不清楚。
睡眠具有重要的生理功能
毫无疑问,睡眠具有重要的功能。它存在于所有哺乳动物中,并且在完全剥夺睡眠后通常会有一段“追赶”或“反弹”睡眠;在选择性剥夺快速眼动睡眠或慢波睡眠后,这些特定睡眠阶段也会出现选择性反弹。即使是几天的轻度睡眠限制也可能降低认知和身体表现、整体生产力以及一个人的健康状况。睡眠在稳态中的重要作用或许最能生动地体现在被剥夺睡眠2至3周的大鼠实际上可能会死亡这一事实上。尽管睡眠的重要性显而易见,但我们对为什么睡眠是生命中不可或缺的一部分的理解仍然有限。
睡眠引起两种主要的生理效应:首先是对神经系统的影响,其次是对身体其他功能系统的影响。哺乳动物,甚至无脊椎动物,在感染性和非感染性疾病的情况下睡眠更多。疾病诱导的睡眠被认为是一种有益的反应,它将生物体的能量资源从神经和运动需求转移到对抗感染或损伤性侵害上。
睡眠不足确实会影响中枢神经系统(central nervous system)的功能。长时间的清醒通常与思维过程的逐渐失调有关,有时甚至会导致异常的行为活动。我们都熟悉在长时间清醒期结束时思维迟钝的增加,但除此之外,一个人在被迫清醒后可能会变得易怒甚至精神失常。因此,我们可以假设,睡眠在多个方面恢复了大脑活动的正常水平和中枢神经系统不同功能之间的正常“平衡”。
睡眠被认为具有多种功能,包括以下方面:(1) 神经成熟(neural maturation);(2) 促进学习或记忆(facilitation of learning or memory);(3) 有针对性地消除突触以“忘记”可能堵塞突触网络的不重要信息(targeted erasure of synapses to “forget” unimportant information that might clutter the synaptic network);(4) 认知(cognition);(5) 清除清醒大脑中神经活动产生的代谢废物(clearance of metabolic waste products generated by neural activity in the awake brain);(6) 节约代谢能量(conservation of metabolic energy)。对于这些功能中的每一个都有一些证据,但支持这些观点的证据也受到了挑战。我们可以假设,睡眠的主要价值是恢复神经元中心之间的自然平衡,这对整体健康是必要的。然而,睡眠的具体生理功能仍然是一个谜,并且是许多研究的主题。
脑电波
从大脑表面甚至头部外表面记录的电活动表明,大脑中存在持续的电活动。这种电活动的强度和模式取决于由睡眠、清醒或脑部疾病(如癫痫甚至精神病)引起的大脑不同部位的兴奋水平。记录到的电位波动,如图60-2所示,被称为脑电波(brain waves),整个记录被称为脑电图(electroencephalogram, EEG)。
从头皮表面记录的脑电波强度范围从0到200微伏,频率范围从每秒几次到每秒50次或更多。波的特征取决于大脑皮层(cerebral cortex)各个部分的活动程度,并且波在清醒、睡眠和昏迷状态之间显著变化。
大多数时候,脑电波是不规则的,脑电图中无法辨别出特定的模式。在其他时候,确实会出现明显的模式,其中一些是大脑特定异常(如癫痫)的特征,这将在后面讨论。
在健康人群中,脑电图中的大多数波可以分为α波(alpha waves)、β波(beta waves)、θ波(theta waves)和δ波(delta waves),如图60-2所示。
α波是频率在8到13次/秒之间的节律性波,几乎在所有健康成年人的脑电图中都可以发现,当他们处于清醒和安静、休息的思维状态时。这些波在枕叶区域(occipital region)最为强烈,但也可以从头皮的顶叶(parietal)和额叶(frontal)区域记录到。
图60-2. 正常脑电图中的不同类型脑电波。
图 60-3. 当眼睛睁开时,α节律被异步、低电压的β节律所取代。
它们的电压通常约为50微伏。在深度睡眠期间,α波消失。
当清醒者的注意力集中在某种特定类型的心理活动时,α波会被异步、频率更高但电压更低的β波取代。图60-3展示了在明亮光线下睁开眼睛然后闭上眼睛对α波的影响。注意,视觉感受会立即导致α波的停止,这些波被低电压、异步的β波所取代。
β波的频率大于14次/秒,最高可达80次/秒。它们主要在大脑这些部分特定激活时从顶叶和额叶区域记录到。
θ波的频率在4到7次/秒之间。它们通常出现在儿童的顶叶和颞叶区域,但在一些成年人中,特别是在失望和沮丧时,也会在情绪压力下出现。θ波也出现在许多脑部疾病中,通常是在退行性脑状态下。
δ波包括所有频率小于3.5次/秒的脑电图波,它们的电压通常是大多数其他类型脑波的两到四倍。它们出现在深度睡眠、婴儿期以及患有严重器质性脑疾病的人中。它们也出现在皮层下横断的动物皮层中,其中大脑皮层与丘脑分离。因此,δ波可以严格地出现在皮层中,独立于大脑较低区域的活动。
脑波的起源
大脑中单个神经元或单个神经纤维的放电永远无法从头表面记录到。相反,必须有成千上万甚至数百万个神经元或纤维同步放电,才能使来自单个神经元或纤维的电位总和足够大,从而通过颅骨记录下来。因此,头皮上脑波的强度主要由同步放电的神经元和纤维的数量决定,而不是由大脑中总电活动水平决定。事实上,强烈的非同步神经信号通常由于极性相反而在记录的脑波中相互抵消。这一现象在图60-3中得到了展示,图中显示,当眼睛闭上时,大脑皮层中许多神经元以约12次/秒的频率同步放电,从而产生α波。然后,当眼睛睁开时,大脑活动大大增加,但信号的同步性变得如此之小,以至于脑波主要相互抵消。最终效果是低电压、通常高但不规则频率的波,即β波。
图 60-4. 不同程度的大脑活动对脑电图基本节律的影响。
α波的起源
如果没有大脑皮层与丘脑的连接,α波就不会在大脑皮层中产生。相反,刺激丘脑周围网状核的非特异性层或丘脑深处的“弥散”核,通常会在丘脑皮层系统中产生频率在8到13次/秒之间的电波,这正是α波的自然频率。因此,α波被认为是由这种弥散的丘脑皮层系统中的自发反馈振荡引起的,可能还包括脑干中的网状激活系统。这种振荡可能是α波周期性的原因,并且在每个波期间同步激活了数百万个皮层神经元。
δ波的起源
切断从丘脑到大脑皮层的纤维束,虽然会阻断丘脑对皮层的激活,从而消除α波,但并不会阻断皮层中的δ波。这表明皮层神经元系统本身可以发生某种同步机制——主要独立于大脑的下部结构——从而产生δ波。
δ波也出现在深度慢波睡眠期间,这表明此时皮层主要从丘脑和其他下部中枢的激活影响中释放出来。
不同脑活动水平对脑电图频率的影响
脑活动水平与脑电图节律的平均频率之间存在普遍的相关性,随着活动程度的增加,平均频率逐渐增加。这在图60-4中得到了展示,图中显示了在外科麻醉和深度睡眠中存在δ波,在精神运动状态下存在θ波,在放松状态下存在α波,在强烈精神活动或恐惧期间存在β波。在精神活动期间,脑电波通常变得不同步而不是同步,因此尽管皮层活动显著增加,电压却显著下降,如图60-3所示。
清醒和睡眠不同阶段的脑电图变化
图60-1显示了清醒和睡眠不同阶段的典型脑电图模式。警觉清醒以高频β波为特征,而安静清醒通常与α波相关,如图中前两个脑电图所示。
慢波睡眠分为四个阶段。在第一阶段,即浅睡眠阶段,脑电波的电压变低。这个阶段被“睡眠纺锤波”(即周期性出现的短纺锤形α波爆发)打断。在慢波睡眠的第2、3和4阶段,脑电波的频率逐渐变慢,直到在第4阶段达到每秒仅一到三个波的频率;这些波是δ波。
图60-1还显示了快速眼动(REM)睡眠期间的脑电图。通常很难区分这种脑波模式与清醒、活跃的人的脑波模式。这些波是不规则且高频的,通常暗示着与清醒状态下发现的去同步神经活动相似。因此,REM睡眠通常被称为去同步睡眠,因为尽管大脑活动显著,但神经元的放电缺乏同步性。
癫痫发作和癫痫
癫痫发作(seizures)是由不受控制的过度神经元活动引起的脑功能暂时性紊乱。根据神经元放电的分布情况,癫痫发作的表现可以从几乎不被注意到的体验现象到剧烈的抽搐不等。如果潜在疾病得到纠正,这些暂时性的症状性癫痫发作通常不会持续。它们可能由多种神经或医学状况引起,例如急性电解质紊乱、低血糖、药物(如可卡因)、子痫、肾衰竭、高血压脑病、脑膜炎等。大约5%到10%的人一生中至少会有一次癫痫发作。
与症状性癫痫发作不同,癫痫(epilepsy)是一种慢性复发性癫痫发作的疾病,其症状也可以从短暂且几乎无法察觉的症状到剧烈的颤抖和抽搐不等。癫痫不是单一的疾病。其临床症状是异质性的,反映了导致脑功能障碍和损伤的多种潜在病理生理机制,如创伤、中风、肿瘤、感染或退行性变化。遗传因素似乎很重要,尽管在许多患者中无法确定具体原因,并且多种因素可能共存,反映了获得性脑病理和遗传易感性。据估计,癫痫影响约1%的人口,即全球6500万人。
从基本层面来看,癫痫发作是由大脑一个或多个区域的抑制性和兴奋性电流或传递之间的正常平衡被破坏引起的。增加神经元兴奋性或损害抑制的药物或病理因素往往具有致癫痫性(即使人易患癫痫),而有效的抗癫痫药物则减弱兴奋性并促进抑制性。在一个人因创伤、中风或感染而遭受脑损伤的情况下,可能在损伤后数月或数年才会开始癫痫发作。
癫痫发作可分为两大类:(1)局限于一个大脑半球局部区域的局灶性癫痫发作(也称为部分性癫痫发作),以及(2)弥漫性涉及大脑皮层两个半球的全面性癫痫发作。然而,部分性癫痫发作有时可能演变为全面性癫痫发作。
局灶性(部分性)癫痫发作
局灶性癫痫发作始于大脑皮层或大脑和脑干深层结构的一个小局部区域,其临床表现反映了受影响脑区的功能。大多数情况下,局灶性癫痫是由某些局部器质性病变或功能异常引起的,例如(1)大脑中的瘢痕组织拉扯邻近的神经元组织,(2)压迫大脑某个区域的肿瘤,(3)被破坏的脑组织区域,或(4)先天性紊乱的局部回路。
这些病变可以促进局部神经元的极快速放电;当放电速率上升到每秒数百次以上时,同步波开始扩散到邻近的皮层区域。这些波可能是由局部回响回路引起的,这些回路可能逐渐将皮层的邻近区域招募到癫痫放电区。该过程以每分钟几毫米到每秒几厘米的速度向邻近区域扩散。
局灶性癫痫发作可以从一个病灶局部扩散,或通过向丘脑的投射更远地扩散到对侧皮层和大脑的皮层下区域(subcortical areas),丘脑与两个半球都有广泛的连接(图60-5)。当这种兴奋波扩散到运动皮层时,会导致身体对侧肌肉收缩的渐进性“行进”,最典型的起始于口腔区域,并逐渐向下行进到腿部,但有时也会向相反方向行进。这种现象称为Jackson 行进。
局灶性癫痫发作通常分为单纯部分性发作(simple partial seizures)(当意识没有明显改变时)或复杂部分性发作(complex partial seizures)(当意识受损时)。单纯部分性发作可能以先兆(aura)为前兆,伴随恐惧等感觉,随后出现运动体征,如身体某部位的节律性抽搐或强直性僵硬运动。局灶性癫痫发作可能局限于大脑的单一区域,通常是颞叶(temporal lobe),但在某些情况下,强烈的信号从局灶区域扩散,患者可能会失去意识。复杂部分性发作也可能以先兆开始,随后出现意识受损和奇怪的重复运动(自动症(automatisms)),如咀嚼或咂嘴。发作恢复后,患者可能对发作没有记忆,除了先兆。
图60-5。A,癫痫发作可以从皮层的局灶区域通过同侧大脑半球的纤维或连接到对侧皮层的纤维传播。B,局灶性癫痫发作的继发性泛化有时可以通过向丘脑的投射扩散到皮层下区域,导致两个半球的激活。C,原发性全面性癫痫发作通过丘脑和皮层之间的相互连接迅速且同时扩散到两个大脑半球。
发作后到神经功能恢复正常之前的时间称为发作后期(postictal period)。
精神运动性(psychomotor)、颞叶(temporal lobe)和边缘系统(limbic)癫痫发作是过去用来描述许多现在归类为复杂部分性发作的行为的术语。然而,这些术语并不等同。复杂部分性发作可以起源于颞叶以外的区域,并不总是涉及边缘系统。此外,自动症(“精神运动性”元素)并不总是出现在复杂部分性发作中。这种类型的发作通常涉及大脑边缘系统的一部分,如海马(hippocampus)、杏仁核(amygdala)、隔膜(septum)和/或颞叶皮层的部分。
图60-6。不同类型癫痫的脑电图。
图60-6的最下方轨迹展示了精神运动性癫痫发作期间的典型脑电图,显示频率在2到4/秒之间的低频矩形波,偶尔叠加14/秒的波。
全面性癫痫发作
全身性癫痫发作(Generalized epileptic seizures)的特点是弥漫性、过度且不受控制的神经元放电,这些放电最初通过丘脑(thalamus)和皮层(cortex)之间的相互连接迅速同时扩散到两个大脑半球(图60-5)。然而,在临床上有时很难区分原发性全身性发作和迅速扩散的局灶性发作。全身性发作主要根据发作期的运动表现进行细分,而这些表现又取决于皮层下(subcortical)和脑干(brain stem)区域参与发作的程度。
全身性强直-阵挛发作(大发作,Generalized Tonic-Clonic (Grand Mal) Seizures)
全身性强直-阵挛发作(Generalized tonic-clonic seizures),以前称为大发作(grand mal seizures),其特点是突然意识丧失和大脑所有区域(包括大脑皮层(cerebral cortex)、大脑深部结构以及脑干)的极端神经元放电。此外,放电一直传递到脊髓(spinal cord),有时会导致全身的强直性发作(tonic seizures),随后在发作接近尾声时,出现交替的强直性和痉挛性肌肉收缩,称为强直-阵挛发作(tonic-clonic seizures)。患者常常咬伤或“吞咽”舌头,并可能出现呼吸困难,有时甚至导致发绀(cyanosis)。此外,从大脑传递到内脏的信号经常导致排尿和排便。
典型的全身性强直-阵挛发作持续几秒到3到4分钟。其特点还包括发作后整个神经系统的抑制;患者在发作结束后会处于昏迷状态(stupor)1分钟到数分钟,随后通常会感到极度疲劳并入睡数小时。
图60-6的顶部记录显示了在全身性强直-阵挛发作的强直期(tonic phase)期间,来自几乎任何皮层区域的典型脑电图(EEG)。这表明整个皮层都发生了高电压、高频率的放电。此外,大脑两侧同时发生相同类型的放电,表明导致发作的异常神经元回路强烈涉及驱动大脑两半球的脑基底区域。
在全身性强直-阵挛发作期间,来自丘脑和脑干网状结构(reticular formation)的电记录显示,这些区域也出现了与大脑皮层记录相似的高电压活动。因此,全身性强直-阵挛发作可能不仅涉及丘脑和大脑皮层的异常激活,还涉及脑激活系统的丘脑下脑干部分的异常激活。
什么引发了全身性强直-阵挛发作?
大多数全身性发作是特发性(idiopathic)的,这意味着原因不明。许多患有全身性强直-阵挛发作的人具有癫痫的遗传倾向,这种倾向大约每100人中就有1人存在。在这些人群中,可能增加异常“致癫痫”回路兴奋性并引发发作的因素包括:(1) 强烈的情绪刺激,(2) 过度呼吸引起的碱中毒(alkalosis),(3) 药物,(4) 发热,以及(5) 巨大的噪音或闪烁的灯光。
即使在那些没有遗传倾向的人群中,几乎大脑任何部位的某些类型的创伤性病变也可能导致局部脑区的过度兴奋性(excess excitability),我们稍后会讨论这一点。这些局部脑区有时也会向大脑的激活系统传递信号,从而引发强直-阵挛发作(tonic-clonic seizures)。
是什么阻止了全身性强直-阵挛发作? 在强直-阵挛发作期间,极端的神经元过度活动被认为是由大脑中许多回响神经元通路的同时大规模激活引起的。尽管终止发作的因素尚不完全清楚,但很可能是由于发作激活了抑制性神经元,从而产生了主动抑制(active inhibition)。
失神发作(Absence Seizures, Petit Mal Seizures)
失神发作(absence seizures),以前称为小发作(petit mal seizures),通常始于儿童期或青春期早期,占儿童癫痫病例的15%至20%。失神发作几乎肯定涉及丘脑-皮层脑激活系统(thalamocortical brain activating system)。它们通常表现为3到30秒的无意识或意识减弱,在此期间,患者常常凝视并出现肌肉的抽搐样收缩,通常发生在头部区域,尤其是眼睛的眨动;随后迅速恢复意识并继续之前的活动。整个过程被称为失神综合征(absence syndrome)或失神癫痫(absence epilepsy)。
患者可能在许多个月内只发作一次,或者在极少数情况下,可能会连续快速发作多次。通常的病程是失神发作首先在儿童期或青春期出现,然后在30岁之前消失。有时,失神发作会引发全身性强直-阵挛发作(大发作,grand mal)。
失神发作癫痫患者的脑电波模式如图60-6中的中间记录所示,其特征是尖波和圆顶波(spike and dome pattern)。这种尖波和圆顶波可以在大部分或整个大脑皮层上记录到,表明发作涉及大脑的大部分或全部丘脑-皮层激活系统。事实上,动物研究表明,这是由于(1)抑制性丘脑网状神经元(产生抑制性γ-氨基丁酸[GABA]的神经元)和(2)兴奋性丘脑-皮层和皮层-丘脑神经元的振荡引起的。
癫痫的治疗(Treatment of Epilepsy)
目前用于治疗癫痫的大多数药物似乎都能阻止发作的启动或扩散,尽管某些药物的确切作用机制尚不清楚或可能涉及多种作用。各种抗癫痫药物的一些主要作用包括:(1)阻断电压依赖性钠通道(如卡马西平和苯妥英);(2)改变钙电流(如乙琥胺);(3)增加GABA活性(如苯巴比妥和苯二氮卓类药物);(4)抑制谷氨酸受体,谷氨酸是最主要的兴奋性神经递质(如吡仑帕奈);以及(5)多种作用机制(如丙戊酸钠和托吡酯,它们阻断电压依赖性钠通道并增加大脑中的GABA水平)。根据当前指南推荐的抗癫痫药物选择取决于发作类型、患者年龄和其他因素,但在可能的情况下,纠正发作的根本原因是最佳选择。
癫痫通常可以通过适当的药物控制。然而,当癫痫对药物治疗无效且难以控制时,脑电图(EEG)有时可以用于定位源自脑部器质性病变区域的异常尖波,这些区域容易引发局灶性癫痫发作。一旦找到这样的局灶点,手术切除病灶通常可以预防未来的发作。
特定神经递质系统在脑部疾病中的作用
对不同精神病或不同类型痴呆患者的临床研究表明,许多这些疾病是由于分泌特定神经递质的神经元功能减弱所致。使用适当的药物来对抗相应神经递质的损失,已成功治疗了一些患者。
在第57章中,我们讨论了帕金森病(Parkinson's disease)的病因,该病是由于黑质(substantia nigra)中的神经元损失所致,这些神经元的神经末梢在尾状核(caudate nucleus)和壳核(putamen)中分泌多巴胺(dopamine)。同样在第57章中,我们指出,在亨廷顿病(Huntington's disease)中,分泌GABA的神经元和分泌乙酰胆碱(acetylcholine)的神经元的损失与特定的异常运动模式以及同一患者中出现的痴呆有关。
抑郁症和躁郁症:去甲肾上腺素和5-羟色胺神经递质系统活动减少
越来越多的证据表明,美国超过800万人中出现的精神抑郁精神病(mental depression psychosis)可能是由于大脑中去甲肾上腺素(norepinephrine)或5-羟色胺(serotonin)的形成减少,或两者兼而有之。(新的证据还涉及其他神经递质。)抑郁症患者会经历悲伤、不快乐、绝望和痛苦等症状。此外,他们通常食欲减退、性欲下降,并伴有严重的失眠。尽管抑郁,这些症状通常还伴随着精神运动性激越(psychomotor agitation)的状态。
中等数量的分泌去甲肾上腺素的神经元位于脑干,特别是在蓝斑(locus ceruleus)。这些神经元向上发送纤维到大脑边缘系统(limbic system)、丘脑(thalamus)和大脑皮层(cerebral cortex)的大部分区域。此外,位于下脑桥(pons)和延髓(medulla)中线缝核(raphe nuclei)中的许多分泌5-羟色胺的神经元也向边缘系统的许多区域以及大脑的其他一些区域发送纤维。
认为抑郁症可能是由于去甲肾上腺素和5-羟色胺分泌神经元活动减少所致的一个主要原因是,阻断去甲肾上腺素和5-羟色胺分泌的药物(如利血平(reserpine))经常会引起抑郁。相反,大约70%的抑郁症患者可以通过增加去甲肾上腺素和5-羟色胺在神经末梢的兴奋作用的药物有效治疗,例如:(1)单胺氧化酶抑制剂(monoamine oxidase inhibitors),它们阻止去甲肾上腺素和5-羟色胺在形成后被破坏;(2)三环类抗抑郁药(tricyclic antidepressants),如丙咪嗪(imipramine)和阿米替林(amitriptyline),它们阻止神经末梢对去甲肾上腺素和5-羟色胺的再摄取,从而使这些递质在分泌后保持更长时间的活性。
一些患有精神抑郁症(mental depression)的患者会在抑郁和躁狂之间交替发作,这种情况被称为双相情感障碍(bipolar disorder)或躁狂抑郁性精神病(manic-depressive psychosis),而只有少数患者仅表现出躁狂而没有抑郁发作。减少去甲肾上腺素(norepinephrine)和5-羟色胺(serotonin)形成或作用的药物,如锂化合物,可以有效治疗该病的躁狂期。
据推测,去甲肾上腺素和5-羟色胺系统通常会驱动大脑的边缘系统(limbic system)区域,以增加一个人的幸福感,并创造快乐、满足、良好的食欲、适当的性欲和精神运动平衡——尽管过多的好事可能会导致躁狂。支持这一概念的事实是,下丘脑(hypothalamus)及其周围区域的愉悦和奖励中心接收了大量来自去甲肾上腺素和5-羟色胺系统的神经末梢。
精神分裂症(Schizophrenia)——多巴胺(dopamine)系统部分功能可能过度
精神分裂症有许多种类。最常见的一种类型是患者会听到声音并产生妄想、强烈的恐惧或其他不真实的感觉。许多精神分裂症患者高度偏执,有一种来自外部来源的迫害感。他们可能会出现语无伦次、思维分离和思维序列异常,并且常常退缩,有时伴有异常姿势甚至僵硬。
有理由相信精神分裂症是由以下三种可能性中的一种或多种引起的:(1)大脑皮层(cerebral cortex)前额叶(prefrontal lobes)的多个区域,其中神经信号被阻断或信号处理变得功能障碍,因为许多通常由神经递质谷氨酸(glutamate)兴奋的突触失去了对这种递质的反应性;(2)包括前额叶在内的大脑行为中心分泌多巴胺的一组神经元过度兴奋;和/或(3)以海马体(hippocampus)为中心的大脑边缘行为控制系统的关键部分功能异常。
认为前额叶与精神分裂症有关的原因是,通过在广泛的前额叶区域制造多个微小病变,可以在猴子身上诱导出类似精神分裂症的心理活动模式。
多巴胺与精神分裂症有关,因为许多帕金森病(Parkinson's disease)患者在接受名为L-多巴(L-dopa)的药物治疗时会出现类似精神分裂症的症状。这种药物在大脑中释放多巴胺,这对治疗帕金森病是有利的,但与此同时,它会抑制前额叶和其他相关区域的各种部分。
有人认为,在精神分裂症患者中,过量的多巴胺是由一组多巴胺分泌神经元分泌的,这些神经元的细胞体位于中脑(mesencephalon)的腹侧被盖区(ventral tegmentum),位于黑质(substantia nigra)的内侧和上方。这些神经元产生了所谓的中脑边缘多巴胺能系统(mesolimbic dopaminergic system),该系统将神经纤维和多巴胺分泌投射到边缘系统的内侧和前部,特别是海马体、杏仁核(amygdala)、前尾状核(anterior caudate nucleus)和前额叶的部分区域。所有这些区域都是强大的行为控制中心。
相信精神分裂症(schizophrenia)可能由多巴胺(dopamine)过量产生引起的更有力理由是,许多有效治疗精神分裂症的药物,如氯丙嗪(chlorpromazine)、氟哌啶醇(haloperidol)和替沃噻吨(thiothixene),要么减少多巴胺能神经末梢的多巴胺分泌,要么降低多巴胺对神经元(neuron)的作用。
最后,当发现精神分裂症患者的海马体(hippocampus)体积常常缩小,尤其是在优势半球时,发现了海马体可能参与精神分裂症。
阿尔茨海默病(Alzheimer's Disease)——淀粉样斑块(Amyloid Plaques)和记忆减退
阿尔茨海默病被定义为大脑的过早衰老,通常始于中年,并迅速发展到智力极度丧失——类似于高龄时所见。阿尔茨海默病的临床特征包括:(1)遗忘型记忆障碍(amnesic type of memory impairment),(2)语言能力退化,以及(3)视觉空间缺陷(visuospatial deficits)。运动(motor)和感觉(sensory)异常、步态障碍(gait disturbances)和癫痫发作(seizures)在疾病晚期之前并不常见。阿尔茨海默病的一个一致发现是驱动记忆过程的边缘系统(limbic pathway)部分神经元丧失。这种记忆功能的丧失是毁灭性的。
阿尔茨海默病是一种进行性和致命性的神经退行性疾病(neurodegenerative disorder),导致患者日常生活活动能力受损,以及在疾病晚期出现各种神经精神症状(neuropsychiatric symptoms)和行为障碍(behavioral disturbances)。阿尔茨海默病患者通常在疾病开始后的几年内需要持续护理。
阿尔茨海默病是老年人中常见的痴呆症(dementia)形式;据估计,美国有超过550万人患有这种疾病。大约三分之二的美国阿尔茨海默病患者是女性。65岁以上人群中,阿尔茨海默病的患病率大约每5年翻一番,85岁人群中约有30%患有此病。
阿尔茨海默病与脑内β-淀粉样肽(Beta-Amyloid Peptide)的积累有关。病理学上,阿尔茨海默病患者脑内β-淀粉样肽的含量增加。该肽在淀粉样斑块中积累,斑块直径从10微米到数百微米不等,广泛分布于大脑的各个区域,包括大脑皮层(cerebral cortex)、海马体、基底节(basal ganglia)、丘脑(thalamus),甚至小脑(cerebellum)。因此,阿尔茨海默病似乎是一种代谢性退行性疾病(metabolic degenerative disease)。
以下观察表明,β-淀粉样肽(beta-amyloid peptide)的过度积累在阿尔茨海默病(Alzheimer's disease)的发病机制中起关键作用:(1) 目前已知的所有与阿尔茨海默病相关的突变都会增加β-淀粉样肽的产生;(2) 21三体综合征(Down syndrome)患者有三份淀粉样前体蛋白(amyloid precursor protein)基因拷贝,并在中年时出现阿尔茨海默病的神经学特征;(3) 控制载脂蛋白E(apolipoprotein E)的基因异常的患者(载脂蛋白E是一种将胆固醇运输到组织的血液蛋白),其淀粉样蛋白沉积加速,并大大增加了患阿尔茨海默病的风险;(4) 过度产生人类淀粉样前体蛋白的转基因小鼠在学习与记忆方面存在缺陷,并与淀粉样斑块的积累相关;(5) 在阿尔茨海默病患者中生成抗淀粉样抗体似乎可以减缓疾病进程。
血管疾病可能促进阿尔茨海默病的进展。越来越多的证据表明,由高血压和动脉粥样硬化引起的脑血管疾病可能在阿尔茨海默病相关的痴呆中起关键作用。脑血管疾病是获得性认知障碍和痴呆的第二大常见原因,并可能加剧阿尔茨海默病患者的认知衰退。事实上,许多脑血管疾病的常见风险因素,如高血压、糖尿病和高脂血症,也被认为会大大增加痴呆和阿尔茨海默病进展的风险。约10%至20%的痴呆患者大脑仅显示血管性痴呆的证据。在老年阿尔茨海默病患者中,血管疾病很常见,约50%的患者有“无症状中风”(silent strokes)的病理证据——即不会引起明显症状的小脑梗死,但可能导致认知障碍。
自主神经系统和肾上腺髓质
自主神经系统是神经系统的一部分,控制着身体的大部分内脏功能。该系统有助于控制动脉压、胃肠蠕动、胃肠分泌、膀胱排空、出汗、体温和许多其他活动。其中一些活动几乎完全由自主神经系统控制,而另一些则仅部分受其控制。
自主神经系统最显著的特征之一是其改变内脏功能的速度和强度。例如,在3到5秒内,它可以使心率增加到正常的两倍,而在10到15秒内,动脉压可以翻倍。在另一个极端,动脉压可以在10到15秒内降低到足以引起晕厥的程度。出汗可以在几秒钟内开始,膀胱也可能在几秒钟内不自主地排空。
自主神经系统的一般组织
自主神经系统主要由位于脊髓、脑干和下丘脑的中心激活。此外,大脑皮层的部分区域,特别是边缘皮层,可以向较低的中心传递信号,从而影响自主控制。
自主神经系统也经常通过内脏反射来运作。也就是说,来自内脏器官的潜意识感觉信号可以进入自主神经节、脑干或下丘脑,然后直接返回潜意识反射反应到内脏器官以控制其活动。
传出自主信号通过两个主要分支传递到身体的各个器官,这两个分支称为交感神经系统和副交感神经系统,其特性和功能将在以下部分中描述。
交感神经系统的生理解剖
图61-1显示了交感神经系统(sympathetic nervous system)外周部分的一般组织结构。图中具体展示了:(1) 位于脊柱两侧并与脊神经相连的两条椎旁交感神经链(paravertebral sympathetic chains of ganglia)之一;(2) 椎前神经节(prevertebral ganglia)(包括腹腔神经节(celiac)、肠系膜上神经节(superior mesenteric)、主动脉肾神经节(aorticorenal)、肠系膜下神经节(inferior mesenteric)和腹下神经节(hypogastric));以及(3) 从神经节延伸到不同内脏器官的神经。
交感神经纤维起源于脊髓,与脊神经一起从脊髓节段T1到L2之间发出,首先进入交感神经链,然后到达由交感神经刺激的组织和器官。
节前和节后交感神经元
交感神经与骨骼运动神经在以下方面有所不同。从脊髓到受刺激组织的每条交感神经通路由两个神经元组成,即节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron),而骨骼运动通路中只有一个神经元。每个节前神经元的细胞体位于脊髓的中间外侧角(intermediolateral horn);其纤维通过脊髓的腹根进入相应的脊神经,如图61-2所示。
脊神经离开脊髓管后,节前交感神经纤维立即离开脊神经,通过白交通支(white ramus)进入交感神经链的一个神经节。然后,这些纤维可以采取以下三种路径之一:(1) 它们可以在进入的神经节中与节后交感神经元形成突触;(2) 它们可以在神经链中向上或向下传递,并在神经链的其他神经节中形成突触;或(3) 它们可以通过神经链传递一定距离,然后通过从神经链向外辐射的交感神经之一,最终在外周交感神经节中形成突触。
因此,节后交感神经元要么起源于交感神经链的一个神经节,要么起源于外周交感神经节中的一个。从这两个来源之一,节后纤维随后到达它们在各种器官中的目的地。
骨骼神经中的交感神经纤维。一些节后纤维通过灰交通支(gray rami)从交感神经链返回到脊髓的所有节段的脊神经中,如图61-2所示。这些交感神经纤维都是非常小的C型纤维,它们通过骨骼神经延伸到身体的各个部位。它们控制血管、汗腺和毛发的立毛肌(piloerector muscles)。平均而言,骨骼神经中约8%的纤维是交感神经纤维,这表明它们的重要性。
图61-1. 交感神经系统。黑线代表节后纤维,红线代表节前纤维。
###
交感神经纤维的节段分布
起源于脊髓不同节段的交感神经通路并不一定与来自相同节段的躯体脊髓神经纤维分布到身体的同一部位。相反,来自脊髓T1节段的交感神经纤维通常如下分布:(1) 向上通过交感链终止于头部;(2) 来自T2节段的纤维终止于颈部;(3) 来自T3、T4、T5和T6节段的纤维进入胸腔;(4) 来自T7、T8、T9、T10和T11节段的纤维进入腹部;
图61-2. 脊髓、脊神经、交感链和外周交感神经之间的神经连接。
以及(5) 来自T12、L1和L2节段的纤维进入腿部。这种分布只是近似值,并且有很大的重叠。
交感神经对每个器官的分布部分取决于该器官在胚胎中的起源位置。例如,心脏从交感链的颈部部分接收许多交感神经纤维,因为心脏在胚胎颈部起源后迁移到胸腔。同样,腹部器官的大部分交感神经支配来自下胸段脊髓,因为大部分原始肠道起源于此区域。
肾上腺髓质中的特殊交感神经末梢
节前交感神经纤维从脊髓的中间外侧角细胞出发,不经过突触,穿过交感链,然后穿过内脏神经,最后进入两个肾上腺髓质。它们直接终止于分泌肾上腺素和去甲肾上腺素进入血液的修饰神经元细胞。这些分泌细胞在胚胎学上来源于神经组织,实际上是节后神经元;事实上,它们甚至具有原始的神经纤维,正是这些纤维的末梢分泌肾上腺激素肾上腺素和去甲肾上腺素。
副交感神经系统的生理解剖
副交感神经系统如图61-3所示,图中显示副交感纤维通过颅神经III、VII、IX和X离开中枢神经系统;额外的副交感纤维通过第二和第三骶神经以及偶尔的第一和第四骶神经离开脊髓的最下部。大约75%的副交感神经纤维位于迷走神经(颅神经X)中,分布到整个胸部和腹部区域。迷走神经为心脏、肺、食管、胃、整个小肠、结肠的近端一半、肝脏、胆囊、胰腺、肾脏和输尿管的上部提供副交感神经。
图61-3. 副交感神经系统。蓝线代表节前纤维,黑线代表节后纤维。
第三对脑神经中的副交感神经纤维(parasympathetic fibers)支配瞳孔括约肌(pupillary sphincter)和睫状肌(ciliary muscle)。第七对脑神经的纤维支配泪腺(lacrimal gland)、鼻腺(nasal gland)和下颌下腺(submandibular gland),第九对脑神经的纤维支配腮腺(parotid gland)。
骶部副交感神经纤维位于盆神经(pelvic nerves)中,这些神经纤维在脊髓两侧的S2和S3水平穿过骶神经丛(sacral plexus)。这些纤维随后分布到降结肠(descending colon)、直肠(rectum)、膀胱(urinary bladder)和输尿管(ureters)的下部。此外,这一组骶部副交感神经还向外部生殖器(external genitalia)提供神经信号,引起勃起(erection)。
副交感神经的节前和节后神经元(Preganglionic and Postganglionic Parasympathetic Neurons)。与交感神经系统(sympathetic system)一样,副交感神经系统也有节前和节后神经元。然而,除了少数颅部副交感神经外,节前纤维(preganglionic fibers)会一直不间断地传递到要控制的器官。节后神经元(postganglionic neurons)位于器官的壁内。节前纤维与这些神经元形成突触(synapse),极短的节后纤维(长度从几分之一毫米到几厘米不等)离开神经元,支配器官的组织。副交感节后神经元在内脏器官中的这种位置与交感神经节(sympathetic ganglia)的排列方式有很大不同,因为交感节后神经元的细胞体几乎总是位于交感链(sympathetic chain)的神经节或腹部其他离散的神经节中,而不是在受刺激的器官中。
交感和副交感功能的基本特征
胆碱能和肾上腺素能纤维——乙酰胆碱或去甲肾上腺素的分泌
交感和副交感神经纤维主要分泌两种突触递质(synaptic transmitter substances)之一,即乙酰胆碱(acetylcholine)或去甲肾上腺素(norepinephrine)。分泌乙酰胆碱的纤维被称为胆碱能纤维(cholinergic fibers)。分泌去甲肾上腺素的纤维被称为肾上腺素能纤维(adrenergic fibers),这一术语来源于肾上腺素(adrenalin),它是肾上腺素(epinephrine)的另一种名称。
在交感和副交感神经系统中,所有的节前神经元都是胆碱能的(图61-4)。乙酰胆碱或类似乙酰胆碱的物质,当应用于神经节时,会兴奋交感和副交感节后神经元。副交感系统的所有或几乎所有节后神经元也是胆碱能的。相比之下,大多数交感节后神经元是肾上腺素能的。然而,支配汗腺(sweat glands)的交感节后神经纤维以及可能支配极少数血管的交感节后神经纤维是胆碱能的。
因此,副交感系统的神经末梢全部或几乎全部分泌乙酰胆碱。几乎所有的交感神经末梢都分泌去甲肾上腺素,但少数分泌乙酰胆碱。这些神经递质依次作用于不同的器官,引起相应的副交感或交感效应。因此,乙酰胆碱被称为副交感递质(parasympathetic transmitter),去甲肾上腺素被称为交感递质(sympathetic transmitter)。
图61-4。节前交感神经和副交感神经轴突都是轻度有髓鞘的,并且都使用乙酰胆碱(Ach)作为神经递质。节后轴突是无髓鞘的。大多数交感神经节后轴突在其膨体(varicosities)中储存去甲肾上腺素(NE),并在靶组织表面释放这种神经递质。副交感神经节后轴突在膨体中储存Ach,并将Ach释放到靶组织表面。
乙酰胆碱和去甲肾上腺素的分子结构如下:
节后末梢神经递质分泌和清除的机制
节后神经末梢分泌乙酰胆碱和去甲肾上腺素。少数节后自主神经末梢,特别是副交感神经末梢,与骨骼肌神经肌肉接头相似,但要小得多。然而,许多副交感神经纤维和几乎所有的交感神经纤维在通过时仅仅接触它们支配的器官的效应细胞,或者在某些情况下,它们终止于位于待刺激细胞附近的结缔组织中。在这些细丝接触、经过或靠近待刺激细胞的地方,它们通常有称为膨体的球状膨大(见图61-4)。正是在这些膨体中,乙酰胆碱或去甲肾上腺素的递质囊泡被合成和储存。膨体中还有大量的线粒体,它们提供合成乙酰胆碱或去甲肾上腺素所需的能量物质三磷酸腺苷(ATP)。
当动作电位扩散到末梢纤维时,去极化过程增加了纤维膜对钙离子的通透性,使这些离子扩散到神经末梢或神经膨体中。钙离子反过来导致末梢或膨体将其内容物排到外部。因此,递质被分泌出来。
乙酰胆碱的合成、分泌后的破坏及其作用持续时间。乙酰胆碱在胆碱能神经纤维的末梢和膨体中合成,在那里它以高度浓缩的形式储存在囊泡中,直到被释放。该合成的基本化学反应如下(CoA=辅酶A):
胆碱+乙酰辅酶A ^+ 胆碱乙酰转移酶→乙酰胆碱
一旦乙酰胆碱被胆碱能神经末梢分泌到组织中,它就会在组织中持续存在几秒钟,同时执行其神经信号传递功能。然后它在乙酰胆碱酯酶的催化下分解为乙酸根离子和胆碱,乙酰胆碱酯酶与局部结缔组织中的胶原蛋白和糖胺聚糖结合。这种机制与骨骼神经纤维神经肌肉接头处发生的乙酰胆碱信号传递和随后的乙酰胆碱破坏相同。形成的胆碱随后被转运回神经末梢,在那里一次又一次地用于合成新的乙酰胆碱。
去甲肾上腺素(Norepinephrine)的合成、清除和作用持续时间。去甲肾上腺素的合成始于肾上腺素能神经纤维末梢神经末梢的轴浆(axoplasm)中,但在分泌囊泡(secretory vesicles)内完成。基本步骤如下:
羟化(Hydroxylation)
- 酪氨酸(Tyrosine) \longrightarrow 多巴(Dopa) 脱羧(Decarboxylation)
- 多巴(Dopa) \longrightarrow 多巴胺(Dopamine)
- 多巴胺转运至囊泡内
4. 多巴胺羟化 \longrightarrow 去甲肾上腺素(Norepinephrine)
在肾上腺髓质(adrenal medulla)中,该反应更进一步,将约80%的去甲肾上腺素转化为肾上腺素(epinephrine),如下所示:
5. 去甲肾上腺素(Norepinephrine) \longrightarrow 肾上腺素(Epinephrine)
去甲肾上腺素由神经末梢分泌后,通过三种方式从分泌部位清除:(1)通过主动转运(active transport)过程重新摄取到肾上腺素能神经末梢中,清除50%至80%的分泌的去甲肾上腺素;(2)从神经末梢扩散到周围的体液中,然后进入血液,清除大部分剩余的去甲肾上腺素;(3)被组织酶破坏少量。其中一种酶是单胺氧化酶(monoamine oxidase),存在于神经末梢中,另一种是儿茶酚-O-甲基转移酶(catechol-O-methyl transferase),广泛存在于组织中。
通常,直接分泌到组织中的去甲肾上腺素仅保持活性几秒钟,表明其重新摄取和从组织中扩散的速度很快。然而,由肾上腺髓质分泌到血液中的去甲肾上腺素和肾上腺素保持活性,直到它们扩散到某些组织中,在那里被儿茶酚-O-甲基转移酶破坏;这种作用主要发生在肝脏中。因此,当分泌到血液中时,去甲肾上腺素和肾上腺素保持活性10到30秒,但它们的活性在1分钟到几分钟内逐渐消失。
效应器官上的受体
在自主神经末梢分泌的乙酰胆碱(acetylcholine)、去甲肾上腺素或肾上腺素能够刺激效应器官之前,它们必须首先与效应细胞上的特定受体结合。受体位于细胞膜外侧,作为辅基(prosthetic group)与贯穿细胞膜的蛋白质分子结合。递质物质与受体的结合导致蛋白质分子结构的构象变化。反过来,改变的蛋白质分子通过以下方式激发或抑制细胞:(1)引起细胞膜对一种或多种离子的通透性变化,或(2)激活或失活附着在受体蛋白另一端(突出到细胞内部)的酶。
通过改变效应细胞膜的通透性来兴奋或抑制效应细胞。由于受体蛋白是细胞膜的一个组成部分,受体蛋白结构的构象变化通常会打开或关闭通过蛋白质分子间隙的离子通道,从而改变细胞膜对各种离子的通透性。例如,钠离子和/或钙离子通道经常被打开,允许相应的离子快速流入细胞,通常会使细胞膜去极化并兴奋细胞。在其他时候,钾离子通道被打开,允许钾离子从细胞中扩散出去,这通常会抑制细胞,因为带正电的钾离子的流失会在细胞内产生超负性。在一些细胞中,改变的细胞内离子环境会引起细胞内部的动作,例如钙离子直接促进平滑肌收缩。
通过改变细胞内“第二信使”酶来发挥受体作用。受体通常发挥作用的另一种方式是激活或失活细胞内的酶(或其他细胞内化学物质)。该酶通常附着在受体蛋白上,受体蛋白突出到细胞内部。例如,去甲肾上腺素与许多细胞外部的受体结合会增加细胞内腺苷酸环化酶的活性,从而导致环磷酸腺苷(cAMP)的形成。cAMP反过来可以启动许多不同的细胞内动作中的任何一种,具体效果取决于特定的效应细胞及其化学机制。
很容易理解自主神经递质物质如何在某些器官中引起抑制或在其他器官中引起兴奋。这通常由细胞膜中受体蛋白的性质以及受体结合对其构象状态的影响决定。在每个器官中,最终的效果可能与其他器官中的效果不同。
两种主要的乙酰胆碱受体——毒蕈碱型和烟碱型受体
乙酰胆碱主要激活两种类型的受体,分别称为毒蕈碱型受体和烟碱型受体。这些名称的原因是,毒蕈碱(一种来自毒蘑菇的毒素)只激活毒蕈碱型受体,不会激活烟碱型受体,而尼古丁只激活烟碱型受体。乙酰胆碱同时激活这两种受体。
毒蕈碱型受体使用G蛋白作为其信号传导机制,存在于所有由副交感神经系统或交感系统的节后胆碱能神经元刺激的效应细胞上。
烟碱型受体是配体门控离子通道,存在于自主神经节中,位于交感神经系统和副交感神经系统的节前和节后神经元之间的突触处。(烟碱型受体也存在于许多非自主神经末梢——例如,在第7章讨论的骨骼肌的神经肌肉接头处。)
理解这两种类型的受体特别重要,因为特定药物经常被用作药物来刺激或阻断这两种类型受体中的一种或另一种。
α和β肾上腺素能受体
存在两种主要的肾上腺素能受体(adrenergic receptors)类别;它们被称为α受体(alpha receptors)和β受体(beta receptors)。α受体主要有两种类型,alpha1和alpha2.,它们与不同的G蛋白(G proteins)相连。β受体分为b e t a1,~b e t a2,和b e t a3受体,因为某些化学物质仅影响特定的β受体。β受体也使用G蛋白进行信号传导。
表61-1 肾上腺素能受体及其功能
<html><body><table><tr><td>AlphaReceptor</td><td>BetaReceptor</td></tr><tr><td>血管收缩(Vasoconstriction)</td><td>血管舒张(β2)</td></tr><tr><td>瞳孔扩张(Iris dilation)</td><td>心率加快(β1)</td></tr><tr><td>肠道松弛(Intestinalrelaxation)</td><td>心肌收缩力增强(β1)</td></tr><tr><td>肠道括约肌收缩(Intestinalsphincter contraction)</td><td>肠道松弛(β2) 子宫松弛(β2)</td></tr><tr><td>立毛肌收缩(Pilomotorcontraction)</td><td>支气管扩张(β2)</td></tr><tr><td>膀胱括约肌收缩(Bladdersphincter contraction)</td><td>产热(β2)</td></tr><tr><td>抑制神经递质释放(α2)</td><td>糖原分解(β2) 脂肪分解(β) 膀胱壁松弛(β2) 产热(β3)</td></tr></table></body></html>
去甲肾上腺素(norepinephrine)和肾上腺素(epinephrine)都由肾上腺髓质(adrenal medulla)分泌到血液中,它们在兴奋α和β受体方面有略微不同的效果。去甲肾上腺素主要兴奋α受体,但也较少程度地兴奋β受体。肾上腺素几乎同等程度地兴奋两种受体。因此,去甲肾上腺素和肾上腺素对不同效应器官的相对效果取决于器官中的受体类型。如果它们都是β受体,肾上腺素将是更有效的兴奋剂。
表61-1列出了由交感神经控制的某些器官和系统中α和β受体的分布。请注意,某些α功能是兴奋性的,而另一些是抑制性的。同样,某些β功能是兴奋性的,而另一些是抑制性的。因此,α和β受体不一定与兴奋或抑制相关,而是与激素对给定效应器官中受体的亲和力相关。
正如本章后面所讨论的,已经开发了几种拟交感神经药物(sympathomimetic drugs),它们模仿内源性儿茶酚胺(endogenous catecholamines)、去甲肾上腺素和肾上腺素的作用。其中一些化合物选择性地激活α或β肾上腺素能受体。例如,一种化学结构与肾上腺素和去甲肾上腺素相似的合成药物异丙肾上腺素(isoprenaline, isoproterenol)对β受体有极强的活性,但对α受体几乎没有作用。
交感神经和副交感神经刺激的兴奋性和抑制性作用
表61-2列出了刺激副交感神经或交感神经对身体不同内脏功能的影响。再次注意,交感神经刺激在某些器官中引起兴奋作用,而在其他器官中引起抑制作用。同样,副交感神经刺激在某些器官中引起兴奋作用,而在其他器官中引起抑制作用。此外,当交感神经刺激兴奋某个特定器官时,副交感神经刺激有时会抑制它,这表明这两个系统偶尔会相互反向作用。然而,大多数器官主要由其中一个系统主导控制。
无法用一般化的解释来说明交感神经或副交感神经的刺激会导致特定器官的兴奋或抑制。因此,要理解交感神经和副交感神经的功能,必须学习这两个神经系统对每个器官的所有单独功能,如表61-2所列。其中一些功能需要更详细地澄清,如下所述。
交感神经和副交感神经刺激对特定器官的影响
眼睛。眼睛的两个功能由自主神经系统控制:(1) 瞳孔的开口和 (2) 晶状体的聚焦。
交感神经刺激收缩虹膜的经线纤维,使瞳孔扩大,而副交感神经刺激收缩虹膜的环形肌肉,使瞳孔缩小。
当过多的光线进入眼睛时,控制瞳孔的副交感神经会反射性地受到刺激,这将在第52章中解释;这种反射减少了瞳孔的开口,减少了照射到视网膜的光量。相反,交感神经在兴奋期间受到刺激,并在这些时候增加瞳孔的开口。
晶状体的聚焦几乎完全由副交感神经系统控制。晶状体通常由其放射状韧带的内在弹性张力保持在扁平状态。副交感神经兴奋收缩睫状肌,睫状肌是一个环状的平滑肌纤维体,环绕在晶状体放射状韧带的外端。这种收缩释放了韧带的张力,使晶状体变得更凸,从而使眼睛聚焦在近处的物体上。详细的聚焦机制将在第50章和第52章中与眼睛的功能相关讨论。
身体的腺体。鼻腺、泪腺、唾液腺和许多胃肠道腺体受到副交感神经系统的强烈刺激,通常导致大量水样分泌物的产生。副交感神经最强烈刺激的消化道腺体是上消化道的腺体,尤其是口腔和胃的腺体。另一方面,小肠和大肠的腺体主要由肠道内的局部因素和肠道神经系统控制;它们受自主神经的控制要少得多。
交感神经刺激对大多数消化道腺细胞有直接影响,导致形成含有高比例酶和粘液的浓缩分泌物。然而,它也会导致供应腺体的血管收缩,从而有时减少它们的分泌速率。
当交感神经受到刺激时,汗腺会分泌大量汗液,但刺激副交感神经不会产生任何效果。然而,大多数汗腺的交感神经纤维是胆碱能的(除了少数到手掌和脚底的肾上腺素能纤维),这与几乎所有其他交感神经纤维(它们是肾上腺素能的)形成对比。此外,汗腺主要由下丘脑的中心刺激,这些中心通常被认为是副交感神经中心。因此,出汗可以被称为副交感神经功能,尽管它由解剖学上通过交感神经系统分布的神经纤维控制。
表61-2 自主神经对身体各器官的影响
markdown
身体各器官的交感神经和副交感神经刺激效应
腋窝的顶浆分泌腺(apocrine glands)在交感神经(sympathetic)刺激下分泌一种浓稠、有气味的分泌物,但它们对副交感神经(parasympathetic)刺激没有反应。这种分泌物实际上起到润滑剂的作用,使肩关节下的内表面能够轻松滑动。尽管顶浆分泌腺与汗腺在胚胎学上有密切关系,但它们由肾上腺素能纤维(adrenergic fibers)而非胆碱能纤维(cholinergic fibers)激活,并且由中枢神经系统(central nervous system)的交感中枢而非副交感中枢控制。
胃肠系统的壁内神经丛(intramural plexus)。胃肠系统拥有自己的一套内在神经,称为壁内神经丛(intramural plexus)或肠神经系统(enteric nervous system),位于肠道壁内。此外,源自大脑的副交感和交感神经刺激主要通过增加或减少胃肠壁内神经丛的特定活动来影响胃肠活动。一般来说,副交感神经刺激通过促进蠕动(peristalsis)和放松括约肌(sphincters)来增加胃肠道的整体活动,从而使内容物沿消化道快速推进。这种推进作用与许多胃肠道腺体分泌速率的增加同时发生,如前所述。
胃肠道的正常运动功能并不十分依赖交感神经刺激。然而,强烈的交感神经刺激会抑制蠕动并增加括约肌的张力。最终结果是食物通过消化道的推进速度大大减慢,有时还会减少分泌,甚至有时会导致便秘(constipation)。
心脏。一般来说,交感神经刺激会增加心脏的整体活动。这种效果是通过增加心率和心脏收缩力来实现的。
副交感神经刺激主要引起相反的效果——降低心率和收缩力。换句话说,交感神经刺激会增加心脏作为泵的效率,这在剧烈运动时是必需的,而副交感神经刺激会减少心脏泵血,使心脏在剧烈活动之间得到休息。
全身血管。大多数全身血管,尤其是腹部内脏和四肢皮肤的血管,在交感神经刺激下会收缩。副交感神经刺激对大多数血管几乎没有影响。在某些情况下,交感神经的β肾上腺素能功能(beta adrenergic function)会导致血管扩张而非通常的血管收缩;然而,这种扩张很少发生,除非药物麻痹了交感神经的α血管收缩效应(alpha vasoconstrictor effects),在大多数血管中,α效应通常远远超过β效应。
交感神经和副交感神经刺激对动脉压的影响。动脉压由两个因素决定:心脏推动血液和血液通过外周血管的阻力。交感神经刺激既增加了心脏的推动力,也增加了血流阻力,这通常会导致动脉压显著急性升高,但长期压力变化很小,除非交感神经同时刺激肾脏保留盐和水。
相反,通过迷走神经的中等程度副交感神经(parasympathetic)刺激会减少心脏的泵血,但对血管外周阻力几乎没有影响。因此,通常的效果是动脉压(arterial pressure)略有下降。然而,非常强烈的迷走神经副交感刺激几乎可以或偶尔完全停止心脏跳动几秒钟,并导致所有或大部分动脉压暂时丧失。
交感神经(sympathetic)和副交感神经(parasympathetic)刺激对身体其他功能的影响。由于交感神经和副交感神经控制系统的重要性,本文多次讨论了它们与多种身体功能的关系。一般来说,大多数内胚层结构(entodermal structures),如肝脏、胆囊、输尿管、膀胱和支气管的导管,会被交感神经刺激抑制,但会被副交感神经刺激兴奋。交感神经刺激还具有多种代谢效应,如从肝脏释放葡萄糖、增加血糖浓度、肝脏和肌肉中的糖原分解(glycogenolysis)、骨骼肌力量、基础代谢率(basal metabolic rate)和精神活动。最后,交感神经和副交感神经参与男女性行为的执行,如第81章和第82章所述。
肾上腺髓质(adrenal medullae)的功能
刺激肾上腺髓质的交感神经会导致大量肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)释放到循环血液中,这两种激素随后通过血液输送到身体的所有组织。平均而言,约80%的分泌是肾上腺素,20%是去甲肾上腺素,尽管在不同的生理条件下,相对比例可能会有很大变化。
循环中的肾上腺素和去甲肾上腺素对不同器官的影响与直接交感神经刺激引起的影响几乎相同,只是这些影响持续的时间要长5到10倍,因为这两种激素在2到4分钟内缓慢从血液中清除。
循环中的去甲肾上腺素会引起身体大部分血管的收缩;它还会增加心脏的活动,抑制胃肠道,扩张瞳孔等。
肾上腺素引起的影响与去甲肾上腺素引起的影响几乎相同,但在以下方面有所不同。首先,由于肾上腺素在刺激β受体(beta receptors)方面有更大的作用,因此它对心脏的刺激作用比去甲肾上腺素更大。其次,与去甲肾上腺素引起的更强收缩相比,肾上腺素仅引起肌肉血管的微弱收缩。由于肌肉血管代表了身体血管的主要部分,这种差异尤为重要,因为去甲肾上腺素大大增加了总外周阻力(total peripheral resistance)并升高了动脉压,而肾上腺素在较小程度上提高了动脉压,但更多地增加了心输出量(cardiac output)。
肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)作用的第三个区别在于它们对组织代谢的影响。肾上腺素的代谢效应是去甲肾上腺素的5到10倍。事实上,肾上腺髓质分泌的肾上腺素可以使全身的代谢率比正常水平提高多达100%,从而增加机体的活动和兴奋性。它还会增加其他代谢活动的速率,例如肝脏和肌肉中的糖原分解(glycogenolysis)以及葡萄糖释放到血液中。
总之,肾上腺髓质的刺激会导致肾上腺素和去甲肾上腺素的释放,这两种激素在全身的作用几乎与直接的交感神经刺激相同,只是作用时间更长,在刺激结束后持续2到4分钟。
肾上腺髓质支持交感神经系统功能。肾上腺素和去甲肾上腺素几乎总是在广泛交感神经激活直接刺激不同器官的同时由肾上腺髓质释放。因此,器官实际上受到两种方式的刺激——直接通过交感神经和间接通过肾上腺髓质激素。这两种刺激方式相互支持,并且在大多数情况下可以相互替代。例如,破坏通向不同身体器官的直接交感神经通路并不会消除器官的交感兴奋,因为去甲肾上腺素和肾上腺素仍然会释放到循环血液中并间接引起刺激。同样,失去两个肾上腺髓质通常对交感神经系统的运作影响很小,因为直接通路仍然可以执行几乎所有必要的功能。因此,交感刺激的双重机制提供了一个安全因素,如果一个机制缺失,另一个机制可以替代。
肾上腺髓质的另一个重要价值是肾上腺素和去甲肾上腺素能够刺激身体中不受直接交感神经纤维支配的结构。例如,这些激素,尤其是肾上腺素,会增加身体几乎每个细胞的代谢率,尽管身体中只有一小部分细胞直接受交感神经纤维支配。
刺激频率与交感和副交感效应的关系
自主神经系统(autonomic nervous system)和骨骼神经系统(skeletal nervous system)之间的一个特殊区别是,自主效应器的完全激活只需要低频率的刺激。一般来说,每几秒钟一个神经冲动就足以维持正常的交感或副交感效应,当神经纤维以每秒10到20次的频率放电时,就会发生完全激活。相比之下,骨骼神经系统的完全激活需要每秒50到500次或更多的冲动。
交感和副交感“紧张度”
正常情况下,交感神经系统(sympathetic nervous system)和副交感神经系统(parasympathetic nervous system)持续处于活动状态,其基础活动水平分别称为交感紧张(sympathetic tone)和副交感紧张(parasympathetic tone)。紧张(tone)的意义在于,它使得单一神经系统能够同时增加或减少受刺激器官的活动。例如,交感紧张通常使几乎所有全身小动脉(systemic arterioles)收缩至其最大直径的一半左右。通过增加交感刺激程度至高于正常水平,这些血管可以进一步收缩;相反,通过将刺激降低至低于正常水平,小动脉可以扩张。因此,交感神经系统可以通过分别增加或减少其活动来引起血管收缩(vasoconstriction)或血管舒张(vasodilation)。
另一个有趣的紧张例子是胃肠道(gastrointestinal tract)中副交感神经的背景"紧张"。通过切断迷走神经(vagus nerves)来手术移除大部分肠道的副交感神经供应,会导致严重且长期的胃和肠"无力"(atony),从而阻塞大部分正常的胃肠道推进运动,导致严重的便秘,这表明肠道通常非常需要副交感紧张。大脑可以降低这种紧张,从而抑制胃肠道运动,或者可以增加这种紧张,从而促进胃肠道活动增加。
由肾上腺髓质(adrenal medullae)基础分泌肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)引起的紧张。肾上腺髓质的正常静息分泌速率约为0.2μg/kg/min的肾上腺素和约0.05μg/kg/min的去甲肾上腺素。这些量足以维持血压几乎正常,即使所有通向心血管系统的直接交感神经通路被移除。因此,很明显,交感神经系统的整体紧张很大程度上源于肾上腺素和去甲肾上腺素的基础分泌,以及直接交感刺激引起的紧张。
去神经支配(denervation)后失去交感或副交感紧张的影响。在交感或副交感神经被切断后,受神经支配的器官立即失去其交感或副交感紧张。例如,在许多血管中,切断交感神经会在5到30秒内导致显著的血管舒张。然而,在几分钟、几小时、几天或几周内,血管平滑肌的内在紧张(intrinsic tone)会增加——即由平滑肌收缩力增加引起的紧张增加,这不是交感刺激的结果,而是平滑肌纤维中化学适应的结果,包括对肾上腺髓质分泌的循环儿茶酚胺(catecholamines)作用的敏感性增加。这种内在紧张和对循环儿茶酚胺的敏感性增加最终会恢复几乎正常的血管收缩。
图61-5. 交感神经切除术(sympathectomy)对手臂血流的影响以及测试剂量的去甲肾上腺素在交感神经切除术前后的影响,显示血管对去甲肾上腺素的超敏化(supersensitization)。
在大多数其他效应器官中,当交感或副交感神经张力(tonus)丧失时,基本上会发生相同的效应。也就是说,内在补偿(intrinsic compensation)很快就会发展,使器官的功能几乎恢复到其正常的基线水平。然而,在副交感神经系统中,补偿有时需要许多个月。例如,心脏迷走神经切断术后副交感神经张力的丧失会使狗的心率增加到160次/分钟,而这种心率在6个月后仍会部分升高。同样,胃肠道系统副交感神经张力的丧失对肠道有长期的影响。
去神经后对去甲肾上腺素(norepinephrine)和乙酰胆碱(acetylcholine)的“超敏感性(supersensitivity)”
在交感或副交感神经被破坏后的第一周左右,受神经支配的器官分别对注射的去甲肾上腺素或乙酰胆碱变得更加敏感。这种效应在图61-5中得到了展示,图中显示在去除交感神经之前,前臂的血流量约为200毫升/分钟;测试剂量的去甲肾上腺素仅导致血流量的轻微下降,持续约一分钟。然后去除星状神经节(stellate ganglion),正常的交感神经张力丧失。起初,由于血管张力的丧失,血流量显著增加,但在几天到几周的时间内,由于血管肌肉本身的内在张力逐渐增加,血流量大部分恢复到正常水平,从而部分补偿了交感神经张力的丧失。然后,再次给予测试剂量的去甲肾上腺素,血流量比之前下降得更多,表明血管对去甲肾上腺素的反应性比以前增加了约两到四倍。这种现象被称为去神经超敏感性(denervation supersensitivity)。它发生在交感神经和副交感神经器官中,但在某些器官中的程度远大于其他器官,偶尔会使反应增加超过10倍。
去神经超敏感性的机制。去神经超敏感性的原因仅部分已知。部分原因是当去甲肾上腺素或乙酰胆碱不再在突触(synapse)释放时,效应细胞突触后膜(postsynaptic membrane)上的受体数量增加——有时增加很多倍——这一过程称为受体的“上调(upregulation)”。因此,当现在将一剂量的激素注入循环血液时,效应反应大大增强。
自主神经反射(autonomic reflexes)
身体的许多内脏功能由自主神经反射调节。在本教材中,这些反射的功能与各个器官系统的关系进行了讨论;为了说明它们的重要性,这里简要介绍几个。
心血管自主神经反射。心血管系统中的几个反射有助于控制动脉血压和心率。其中一个反射是压力感受器反射(baroreceptor reflex),该反射在第18章中与其他心血管反射一起描述。简而言之,称为压力感受器(baroreceptor)的牵张感受器(stretch receptor)位于几条主要动脉的壁中,特别是颈内动脉(internal carotid artery)和主动脉弓(arch of the aorta)。当这些感受器因高压而被拉伸时,信号被传递到脑干(brain stem),在那里它们抑制心脏和血管的交感神经冲动,并兴奋副交感神经;这使得动脉压力回落到正常水平。
胃肠道自主反射
胃肠道的最上端和直肠主要由自主反射控制。例如,诱人食物的气味或食物在口中的存在会从鼻子和口腔向脑干的迷走神经、舌咽神经和唾液核发出信号。这些核随后通过副交感神经向口腔和胃的分泌腺传递信号,导致消化液的分泌,有时甚至在食物进入口腔之前就开始分泌。
当粪便填满消化道的另一端——直肠时,直肠的拉伸会引发感觉冲动,传递到脊髓的骶部,并通过骶部副交感神经反射性地传递回结肠的远端部分;这些信号导致强烈的蠕动收缩,从而引发排便。
其他自主反射
膀胱的排空与直肠的排空以相同的方式控制;膀胱的拉伸会向骶部脊髓发送冲动,进而引发膀胱的反射性收缩和尿道括约肌的松弛,从而促进排尿。
同样重要的是性反射,这些反射既由大脑的心理刺激引发,也由性器官的刺激引发。来自这些来源的冲动汇聚到骶部脊髓,在男性中,首先导致勃起(主要是副交感神经功能),然后是射精(部分为交感神经功能)。
其他自主控制功能包括对胰腺分泌、胆囊排空、肾脏尿液排泄、出汗、血糖浓度以及许多其他内脏功能的调节的反射性贡献,所有这些内容都将在本书的其他部分详细讨论。
交感神经和副交感神经系统对靶器官的选择性刺激或“大规模放电”
交感神经系统有时通过大规模放电响应
在某些情况下,交感神经系统的几乎所有部分会同时放电,作为一个完整的单位,这种现象称为大规模放电。当丘脑下部因恐惧或剧烈疼痛而被激活时,这种情况经常发生。结果是在全身范围内产生一种称为警报或应激反应的广泛反应,这将在稍后讨论。
在其他时候,交感神经系统的孤立部分会被激活。重要的例子包括:
- 在体温调节过程中,交感神经控制皮肤的出汗和血流,而不影响其他由交感神经支配的器官。
- 许多涉及感觉传入纤维的“局部反射”通过外周神经向交感神经节和脊髓传递,并引发高度局部化的反射反应。例如,加热皮肤区域会导致局部血管扩张和局部出汗增加,而冷却则会产生相反的效果。
- 许多控制胃肠道功能的交感反射通过神经通路运作,这些通路甚至不进入脊髓,而是主要从肠道传递到椎旁神经节,然后通过交感神经返回肠道,以控制运动或分泌活动。
副交感神经系统通常引起特定的局部反应。副交感神经系统的控制功能通常非常具体。例如,副交感心血管反射通常仅作用于心脏,以增加或减少其跳动速率,而对收缩力的直接影响较小。同样,其他副交感反射主要引起口腔腺体的分泌,而在其他情况下,分泌主要由胃腺体引起。最后,直肠排空反射不会对其他肠道部分产生重大影响。
然而,密切相关的副交感功能之间通常存在关联。例如,尽管唾液分泌可以独立于胃液分泌发生,但这两者经常同时发生,胰腺分泌也经常同时发生。此外,直肠排空反射通常会引发膀胱排空反射,导致膀胱和直肠同时排空。相反,膀胱排空反射也可以帮助引发直肠排空。
交感神经系统的“警报”或“应激”反应
当交感神经系统的大部分同时放电时——即大规模放电——这种作用以多种方式提高了身体进行剧烈肌肉活动的能力,如下列清单所总结:
- 动脉压增加
- 活跃肌肉的血流量增加,同时不需要快速运动活动的器官(如胃肠道和肾脏)的血流量减少
- 全身细胞代谢速率增加
- 血糖浓度增加
- 肝脏和肌肉中的糖酵解增加
- 肌肉力量增加
- 心理活动增加
- 血液凝固速率增加
这些效应的总和使一个人能够进行比正常情况下更为剧烈的体力活动。由于心理或身体压力都可以激发交感神经系统,因此常说交感神经系统的目的是在压力状态下提供身体的额外激活,这被称为交感应激反应。
在许多情绪状态下,交感神经系统尤其强烈地被激活。例如,在愤怒状态下,这种状态在很大程度上是通过刺激下丘脑引起的,信号通过脑干网状结构向下传递到脊髓,导致大规模的交感放电;大多数上述交感事件立即随之发生。这被称为交感警报反应。它也被称为战斗或逃跑反应,因为处于这种状态的动物几乎立即决定是站立战斗还是逃跑。无论哪种情况,交感警报反应都会使动物的后续活动变得剧烈。
延髓、脑桥和中脑对自主神经系统的控制
脑干网状结构以及延髓、脑桥和中脑的孤束核(tractus solitarius)路径上的许多神经元区域,以及许多特殊核团(图61-6),控制着不同的自主神经功能(autonomic functions),如动脉血压(arterial pressure)、心率(heart rate)、胃肠道(gastrointestinal tract)的腺体分泌(glandular secretion)、胃肠道蠕动(gastrointestinal peristalsis)和膀胱(urinary bladder)的收缩程度。这些功能的控制将在本书的适当部分进行讨论。脑干控制的一些最重要的因素是动脉血压、心率和呼吸频率(respiratory rate)。事实上,在脑桥中部水平以上切断脑干,可以使动脉血压的基础控制像以前一样继续进行,但阻止了下丘脑(hypothalamus)等高级神经中枢对其的调节。相反,在延髓下方立即切断会导致动脉血压下降到正常值的一半以下。
图61-6. 脑干和下丘脑中的自主神经控制区域。
与脑干中的心血管调节中心密切相关的是延髓和脑桥的呼吸调节中心,这些内容在第42章中讨论。虽然呼吸调节不被认为是自主神经功能,但它是身体的无意识功能之一。
高级区域对脑干自主神经中心的控制。来自下丘脑甚至大脑的信号可以影响几乎所有脑干自主神经控制中心的活动。例如,在适当区域(主要是下丘脑后部)的刺激可以强烈激活延髓心血管控制中心,使动脉血压增加到正常值的两倍以上。同样,其他下丘脑中心控制体温,增加或减少唾液分泌和胃肠道活动,并导致膀胱排空。在某种程度上,脑干中的自主神经中心充当了由大脑高级区域(尤其是下丘脑)发起的控制活动的中继站。
在第59章和第60章中,我们还指出,许多行为反应是通过以下途径介导的:(1) 下丘脑,(2) 脑干的网状区域,以及 (3) 自主神经系统。事实上,大脑的一些高级区域可以强烈改变整个自主神经系统或其部分的功能,导致严重的自主神经诱发的疾病,如胃或十二指肠的消化性溃疡(peptic ulcer)、便秘(constipation)、心悸(heart palpitation),甚至心脏病发作(heart attack)。
自主神经系统的药理学
作用于肾上腺素能效应器官的药物——拟交感神经药物(Sympathomimetic Drugs)
从前面的讨论中可以明显看出,静脉注射去甲肾上腺素(norepinephrine)在全身引起的效果与交感神经刺激基本相同。因此,去甲肾上腺素被称为拟交感神经药物或肾上腺素能药物(adrenergic drug)。肾上腺素(epinephrine)和甲氧胺(methoxamine)也是拟交感神经药物,还有许多其他药物。它们在刺激交感效应器官中不同受体的程度和作用持续时间上有所不同。去甲肾上腺素和肾上腺素的作用时间短至1到2分钟,而一些其他常用的拟交感神经药物的作用时间则持续30分钟到2小时。
作用于肾上腺素能效应器官的药物
刺激特定肾上腺素能受体的重要药物包括苯肾上腺素(alpha受体)、异丙肾上腺素(beta受体)和沙丁胺醇(仅beta2受体)。
促使去甲肾上腺素从神经末梢释放的药物。某些药物具有间接的拟交感神经作用,而不是直接兴奋肾上腺素能效应器官。这些药物包括麻黄碱、酪胺和苯丙胺。它们的作用是促使去甲肾上腺素从交感神经末梢的储存囊泡中释放出来。释放的去甲肾上腺素进而引起交感神经效应。
阻断肾上腺素能活性的药物。肾上腺素能活性可以在刺激过程中的多个环节被阻断,如下:
- 阻止去甲肾上腺素在交感神经末梢的合成和储存。最著名的引起这种效果的药物是利血平。
- 阻断去甲肾上腺素从交感神经末梢的释放。这种效果可以由胍乙啶引起。
- 阻断交感神经alpha受体。同时阻断alpha1和alpha2肾上腺素能受体的两种药物是酚苄明和酚妥拉明。选择性alpha1肾上腺素能阻断剂包括哌唑嗪和特拉唑嗪,而育亨宾阻断alpha2受体。
- 阻断交感神经beta受体。同时阻断beta1和beta2受体的药物是普萘洛尔。主要阻断beta1受体的药物包括阿替洛尔、奈必洛尔和美托洛尔。
- 通过阻断自主神经节的神经冲动传递来阻断交感神经活性。这些药物将在后面的章节中讨论,但通过神经节同时阻断交感和副交感神经传递的药物包括六甲溴铵和戊双铵。
作用于胆碱能效应器官的药物
拟副交感神经药物(胆碱能药物)。静脉注射乙酰胆碱通常不会在全身引起与副交感神经刺激完全相同的效果,因为大部分乙酰胆碱在到达所有效应器官之前就被血液和体液中的胆碱酯酶破坏。然而,其他几种不易被迅速破坏的药物可以产生典型的广泛副交感神经效应;这些药物被称为拟副交感神经药物。
两种常用的拟副交感神经药物是毛果芸香碱和乙酰甲胆碱。它们直接作用于胆碱能受体的毒蕈碱型。
具有副交感神经增强作用的药物——抗胆碱酯酶药物。一些药物对副交感神经效应器官没有直接作用,但能增强副交感神经末梢自然分泌的乙酰胆碱的效果。这些药物与第7章中讨论的增强神经肌肉接头处乙酰胆碱效果的药物相同。这些药物包括新斯的明、吡啶斯的明和安贝氯铵。它们抑制乙酰胆碱酯酶,从而防止副交感神经末梢释放的乙酰胆碱被迅速破坏。因此,乙酰胆碱的量随着连续刺激而增加,作用程度也随之增加。
阻断效应器官胆碱能活性的药物——抗毒蕈碱药物
Atropine 和类似的药物,如 homatropine 和 scopolamine,能够阻断乙酰胆碱(acetylcholine)在毒蕈碱型胆碱能效应器官上的作用。这些药物不会影响乙酰胆碱在节后神经元或骨骼肌上的烟碱作用。
刺激或阻断交感神经和副交感神经节后神经元的药物
刺激自主神经节后神经元的药物
副交感神经和交感神经系统的节前神经元在其末梢分泌乙酰胆碱,而乙酰胆碱反过来刺激节后神经元。此外,注射的乙酰胆碱也可以同时刺激这两个系统的节后神经元,从而在全身同时引起交感和副交感效应。
Nicotine 是另一种可以像乙酰胆碱一样刺激节后神经元的药物,因为这些神经元的膜都含有烟碱型乙酰胆碱受体。因此,通过刺激节后神经元引起自主神经效应的药物被称为烟碱类药物。其他一些药物,如 methacholine,同时具有烟碱和毒蕈碱作用,而 pilocarpine 仅具有毒蕈碱作用。
Nicotine 同时兴奋交感和副交感节后神经元,导致腹部器官和四肢的强烈交感血管收缩,但同时也会引起副交感效应,如增加胃肠道活动。
神经节阻断药物
阻断自主神经节前神经元向节后神经元传递冲动的药物包括 tetraethyl ammonium ion、hexamethonium ion 和 pentolinium。这些药物同时阻断乙酰胆碱对交感和副交感系统节后神经元的刺激。它们通常用于阻断交感活动,但很少用于阻断副交感活动,因为它们的交感阻断效果通常远远超过副交感阻断效果。神经节阻断药物尤其能够迅速降低动脉压,但由于其效果难以控制,临床上并不常用。
脑血流、脑脊液和脑代谢
到目前为止,我们讨论大脑功能时,仿佛它独立于其血流、代谢和液体。然而,事实远非如此,因为这些方面的任何异常都可能深刻影响大脑功能。例如,大脑血流完全停止会在5到10秒内导致意识丧失,因为缺乏氧气(O2)输送到脑细胞几乎会关闭这些细胞的代谢。此外,在更长的时间尺度上,脑脊液的异常,无论是其成分还是其液体压力,都可能对大脑功能产生同样严重的影响。
非神经元细胞似乎将神经元活动与局部血流调节耦合在一起(见图62-1)。
\mathfrakc o2 或 H^+ 浓度的增加会增加脑血流。灌注大脑的动脉血中 CO2 浓度的增加会显著增加脑血流。这如图62-2所示,图中显示动脉 CO2 分压(PCO2)增加 70% 大约会使脑血流翻倍。
CO2 被认为通过首先与体液中的水结合形成碳酸,随后这种酸解离形成 \Hat 来增加脑血流。
脑血流
大脑的血流由四条大动脉供应——两条颈动脉和两条椎动脉——它们在脑底部汇合形成Willis环。从Willis环发出的动脉沿着大脑表面行进,并产生软脑膜动脉,这些动脉分支成更小的血管,称为穿通动脉和小动脉(图62-1)。穿通血管通过称为Virchow-Robin空间的蛛网膜下腔延伸与脑组织略微分离。穿通血管深入脑组织,产生脑内小动脉,最终分支成毛细血管,在这里血液和组织的 O2、营养物质、二氧化碳(CO2)和代谢物之间发生交换。
脑血流的调节
成年人大脑的正常血流量平均为每100克脑组织每分钟50至65毫升。对于整个大脑而言,这相当于每分钟750至900毫升。因此,大脑仅占体重的约2%,但在静息状态下却接收了15%的心输出量。
与大多数其他组织一样,脑血流量与组织代谢密切相关。据信,有几个代谢因素参与了脑血流量的调节:(1) CO2 浓度;(2) 氢离子 \left(H^+\right) 浓度;(3) O2 浓度;以及(4) 由星形胶质细胞释放的物质,这些细胞是特化的,
图62-1. 脑血管的构造及星形胶质细胞调节血流的潜在机制。软脑膜动脉位于胶质界膜上,穿通动脉被星形胶质细胞的足突包围。注意,星形胶质细胞还有与突触密切相关的细突。
图62-2. 动脉 P C O2 与脑血流量的关系。
\Hat 然后引起脑血管的扩张,扩张的程度几乎与 \ H^+ 浓度的增加成正比,直到血流量达到正常值的约两倍。
其他增加脑组织酸度并因此增加 \ H^+ 浓度的物质同样会增加脑血流量。这些物质包括乳酸、丙酮酸以及由组织代谢形成的任何其他酸性物质。
\mathfrakc o2 和 H^+ 对脑血流量控制的重要性。增加的 \Hat 浓度会极大地抑制神经元活动。因此,幸运的是,增加的 H^+ 浓度也会引发血流量增加,从而将 \Hat 、CO2 和其他酸性物质从脑组织中带走。CO2 的流失会从组织中去除碳酸;这一作用,连同其他酸的去除,将 \Hat 浓度降低回正常水平。因此,这一机制有助于维持脑液中的恒定 H^+ 浓度,从而有助于维持正常的、恒定的神经元活动水平。
缺氧作为脑血流量的调节因素。除了在脑活动剧烈期间,脑组织的 O2 利用率几乎始终保持在狭窄的范围内——几乎正好是每100克脑组织每分钟3.5(±0.2)毫升。如果脑血流量不足以供应足够的 O2,O2 缺乏几乎立即会引起血管扩张,使脑血流量和 O2 向脑组织的输送恢复到接近正常水平。因此,这种局部血流量调节机制在脑中与冠状动脉、骨骼肌以及身体大多数其他循环区域几乎完全相同。
实验表明,当脑组织氧分压(partial pressure of O2\left(Po2\right))降至约30mmHg以下时(正常值为35-40mmHg),脑血流量会立即增加。这是幸运的,因为当Po2值较低时,尤其是低于20mmHg时,脑功能会变得紊乱。甚至在这些低水平下,可能会导致昏迷。因此,O2机制对局部脑血流调节是防止脑神经元活动减弱以及精神能力紊乱的重要保护性反应。
星形胶质细胞释放的物质调节脑血流量。越来越多的证据表明,神经元活动与脑血流量之间的紧密耦合部分归因于中枢神经系统血管周围的星形胶质细胞(astrocytes,也称为星形胶质细胞)释放的物质。星形胶质细胞是星形的非神经元细胞,它们支持和保护神经元,并提供营养。它们有许多突起,与神经元和周围的血管接触,为神经血管通讯提供了潜在的机制。灰质中的星形胶质细胞(原生质星形胶质细胞)延伸出细小的突起,覆盖大多数突触,并形成大的足突,这些足突与血管壁紧密接触(见图62-1)。
实验研究表明,兴奋性谷氨酸能神经元的电刺激会导致星形胶质细胞足突内钙离子浓度增加,并引起附近小动脉的扩张。进一步的研究表明,这种血管扩张是由星形胶质细胞释放的几种血管活性代谢物介导的。尽管确切的介质尚不清楚,但一氧化氮、花生四烯酸代谢物、钾离子、腺苷以及星形胶质细胞在邻近兴奋性神经元刺激下产生的其他物质都被认为在介导局部血管扩张中起重要作用。
脑血流量的测量及脑活动对血流的影响。已经开发出一种方法,可以同时记录多达256个分离的人脑皮层段的血流量。为了记录这些段的血流量,将放射性物质(如放射性氙(Xe))注入颈动脉;然后,当放射性物质通过脑组织时,记录每个皮层段的放射性。为此,256个小型放射性闪烁探测器被压在皮层表面。每个组织段中放射性的快速上升和衰减是流经该段血流量的直接测量指标。
使用这种技术,已经明确的是,大脑每个独立区域的血流量在几秒钟内会随着局部神经元活动(neuronal activity)的变化而发生高达100%到150%的变化。例如,仅仅握紧拳头就会立即导致对侧大脑运动皮层(motor cortex)的血流量增加。阅读书籍会增加血流量,尤其是在枕叶皮层(occipital cortex)的视觉区域和颞叶皮层(temporal cortex)的语言感知区域。这种测量方法还可以用于定位癫痫发作的起源,因为每次发作的焦点处局部脑血流量会急剧且显著增加。
图62-3展示了局部神经元活动对脑血流量的影响,图中显示了当强光照射猫的眼睛半分钟时,其大脑枕叶血流量典型增加的记录。
大脑不同区域的血流量和神经活动也可以通过功能性磁共振成像(functional magnetic resonance imaging, fMRI)间接评估。这种方法基于观察到血液中富含氧的血红蛋白(oxyhemoglobin)和缺氧血红蛋白(deoxyhemoglobin)在磁场中的行为不同。缺氧血红蛋白是一种顺磁性分子(paramagnetic molecule)(即被外部施加的磁场吸引),而富含氧的血红蛋白是抗磁性分子(diamagnetic molecule)(即被磁场排斥)。血管中缺氧血红蛋白的存在会导致血管及其周围组织的磁共振(magnetic resonance, MR)质子信号出现可测量的差异。然而,从fMRI获得的血氧水平依赖(blood oxygen level–dependent, BOLD)信号取决于被评估的脑组织特定三维空间(体素,voxel)中缺氧血红蛋白的总量。这反过来又受到该特定脑组织体素中血流量、血容量和O2消耗率的影响。因此,BOLD fMRI只能提供区域血流量的间接估计,尽管它也可以用于生成显示大脑哪些部分在特定心理过程中被激活的图谱。
图62-3. 当光线照射猫的眼睛时,其大脑枕叶区域血流量的增加。
另一种称为动脉自旋标记(arterial spin labeling, ASL)的MRI方法可以用于提供区域血流量的更定量评估。ASL通过在动脉血液被输送到大脑不同区域之前操纵其MR信号来工作。通过减去两幅动脉血液被不同方式操纵的图像,其余组织中的静态质子信号被减去,只留下来自输送的动脉血液的信号。ASL和BOLD成像可以同时使用,以提供区域脑血流量和神经元功能的探测。
脑血流自动调节保护大脑免受动脉压变化的影响
在日常活动中,动脉压可能会大幅波动,在兴奋或剧烈活动时升高至高水平,而在睡眠时降至低水平。然而,脑血流在动脉压约为60至150mmHg的范围内“自动调节”得非常好(图62-4)。也就是说,对于具有正常自动调节功能的人,平均动脉压急剧降低至60mm Hg或升高至150mmHg并不会引起脑血流的显著变化。
对于患有慢性高血压(chronic hypertension)的人,其脑血管以及其他器官的血管会发生肥大性重塑(hypertrophic remodeling)(详见第17章),并且自动调节曲线会向更高的血压方向偏移。这种脑血流自动调节的重置部分保护了大脑免受高血压的损害,但也使得如果血压过快降低到自动调节范围以下,大脑容易受到严重缺血的影响。如果动脉压降至自动调节范围以下,脑血流会显著减少。
图62-4. 在正常血压(蓝色曲线)和慢性高血压(红色曲线)受试者中,平均动脉压急性变化时的脑血流自动调节。虚线垂直线表示大致的正常自动调节范围。
自动调节功能受损会使脑血流更加依赖于动脉压。例如,在子痫前期(preeclampsia)中,这是一种与血管功能障碍和高血压相关的妊娠疾病,脑血流自动调节可能会受损,导致脑血流依赖血压的增加、血管内皮破坏、水肿,在某些情况下还会引发癫痫发作。在老年时,动脉粥样硬化(atherosclerosis)和各种脑部疾病也可能导致脑血流自动调节受损,增加了血压依赖性脑损伤的风险。
交感神经系统在控制脑血流中的作用
脑循环系统具有强大的交感神经支配,这些神经从颈部的颈上交感神经节向上延伸,并随脑动脉进入大脑。这种神经支配既供应大脑的大动脉,也供应深入脑实质的动脉。然而,切断交感神经或对其进行轻度至中度刺激通常对脑血流影响不大,因为血流自动调节机制可以覆盖神经效应。
当平均动脉压急剧升高至异常高水平时,例如在剧烈运动或其他循环活动过度状态下,交感神经系统通常会收缩大脑的大中型动脉,以防止高压传递到较小的脑血管。这种机制在预防脑内血管出血——即预防“脑卒中”方面非常重要。
脑微循环
与身体几乎所有其他组织一样,大脑中毛细血管的数量在代谢需求最大的地方最多。神经元细胞体所在的大脑灰质的总体代谢率大约是白质的四倍;相应地,灰质中的毛细血管数量和血流速率也大约是白质的四倍。
大脑毛细血管的一个重要结构特征是,它们中的大多数比身体几乎任何其他组织中的毛细血管“渗漏”要少得多。这种现象的一个原因是,毛细血管的四周由“胶质足”(glial feet)支撑,这些胶质足是周围胶质细胞(例如星形胶质细胞)的小突起,紧贴毛细血管的所有表面,并在毛细血管血压高时提供物理支撑,防止毛细血管过度拉伸。
在高血压患者中,通向大脑毛细血管的小动脉壁会显著增厚,这些动脉会一直保持显著收缩状态,以防止高压传递到毛细血管。我们将在本章后面看到,每当这些防止液体渗入大脑的系统失效时,就会发生严重的脑水肿,这可能导致迅速昏迷和死亡。
当脑血管阻塞或破裂时发生脑“中风”
几乎所有老年人都有大脑中一些小动脉的阻塞,高达10%的人最终会有足够的阻塞导致大脑功能的严重紊乱,这种情况被称为“中风”。
许多中风是由大脑供血动脉中的一个或多个动脉粥样硬化斑块引起的。这些斑块可以激活血液的凝血机制,导致血栓形成并阻塞动脉中的血流,从而导致局部区域大脑功能的急性丧失。
在约25%的中风患者中,高血压使其中一根血管破裂;随后发生出血,压迫局部脑组织并进一步损害其功能。中风的神经学效应取决于受影响的大脑区域。最常见的中风类型之一是供应大脑半球中部的中脑动脉阻塞。例如,如果左侧大脑的中脑动脉被阻塞,患者可能会失去左侧大脑半球Wernicke语言理解区的功能,并且由于Broca语言形成运动区的丧失,患者也无法说话。此外,左侧半球神经运动控制区功能的丧失可能导致身体对侧大部分肌肉的痉挛性瘫痪。
类似地,后脑动脉的阻塞会导致阻塞侧半球枕极的梗死,这会导致与中风病变同侧的视网膜半侧双眼视力丧失。特别具有破坏性的是涉及中脑血液供应的中风,因为这种影响可能阻断大脑和脊髓之间的主要神经传导通路,导致感觉和运动异常。
图62-5。箭头显示了脑脊液从侧脑室中的脉络丛流向突入硬脑膜窦的蛛网膜颗粒的路径。
如第60章所述,小血管中的小梗死或微出血可能导致“无症状卒中(silent strokes)”,除了轻微的认知下降外,没有明显的症状。然而,这些发生梗死的小区域可以通过磁共振成像(MRI)或计算机断层扫描(CT)成像检测到。据估计,大约25%的80岁以上人群曾经历过一次或多次无症状脑梗死。
脑脊液系统
包围大脑和脊髓的整个颅腔容量约为1600至1700毫升。其中约150毫升由脑脊液占据,其余部分由大脑和脊髓占据。如图62-5所示,这种液体存在于脑室、大脑外部的脑池以及大脑和脊髓周围的蛛网膜下腔中。所有这些腔室相互连接,液体的压力保持在一个惊人的恒定水平。
脑脊液的缓冲功能
脑脊液的一个主要功能是在其坚固的颅腔内缓冲大脑。大脑和脑脊液的比重几乎相同(仅有约4%的差异),因此大脑只是漂浮在液体中。因此,如果头部受到不太强烈的打击,整个大脑会与颅骨同时移动,不会导致大脑的某一部分因打击而暂时扭曲。
对侧损伤(Contrecoup)。当头部受到极严重的打击时,可能不会损伤打击侧的脑组织,但可能会损伤对侧。这种现象被称为“对侧损伤(contrecoup)”,其原因如下:当打击发生时,打击侧的液体几乎不可压缩,因此当颅骨移动时,液体会同时推动大脑与颅骨同步移动。在打击对侧,整个颅骨的突然移动会由于大脑的惯性使颅骨暂时与大脑分离,在打击对侧的颅腔内瞬间形成真空空间。然后,当颅骨不再因打击而加速时,真空突然坍塌,大脑撞击颅骨的内表面。
额叶和颞叶的极部和下表面,这些部位的大脑与颅底骨性突起接触,通常是头部受到严重打击(如拳击手所经历的)后损伤和挫伤(淤血)的部位。如果挫伤发生在与冲击伤相同的侧面,则为同侧损伤(coup injury);如果发生在对侧,则为对侧损伤(contrecoup injury)。
对冲伤和对冲性挫伤(coup and contrecoup injuries)也可能仅由快速加速或减速引起,而无需头部受到物理冲击。在这些情况下,大脑可能会撞击颅骨壁,导致对冲伤,然后还会撞击对侧,导致对冲性挫伤(contrecoup contusion)。例如,这种损伤被认为发生在“摇晃婴儿综合征”(shaken baby syndrome)或有时在车辆事故中。
脑脊液(cerebrospinal fluid)以每天约500毫升的速度生成,这是整个脑脊液系统中液体总量的三到四倍。其中约三分之二或更多的液体来源于四个脑室(主要是两个侧脑室)中脉络丛(choroid plexuses)的分泌。少量液体由所有脑室的室管膜表面和蛛网膜膜分泌。少量液体通过围绕穿过大脑的血管的血管周围间隙从大脑中产生。
图62-6. 侧脑室中的脉络丛。
脑脊液的形成、流动和吸收
图62-5中的箭头显示了从脉络丛开始,然后通过脑脊液系统的主要液体流动通道。在侧脑室中分泌的液体首先进入第三脑室;然后,在第三脑室添加少量液体后,它沿着Sylvius导水管向下流入第四脑室,在那里再添加少量液体。最后,液体通过三个小开口从第四脑室流出,两个侧向的Luschka孔和一个中线的Magendie孔,进入位于延髓后方和小脑下方的大池(cisterna magna)。
大池与围绕整个大脑和脊髓的蛛网膜下腔(subarachnoid space)相连。几乎所有脑脊液随后从大池向上流动,通过围绕大脑的蛛网膜下腔。从这里,液体流入并穿过多个蛛网膜绒毛(arachnoidal villi),这些绒毛投射到大脑的大矢状静脉窦(sagittal venous sinus)和其他静脉窦中。因此,任何多余的液体通过这些绒毛的孔隙排入静脉血。
脉络丛的分泌。图62-6中显示的脉络丛是一部分,它是一种由薄层上皮细胞覆盖的血管的菜花状生长物。这个丛投射到每个侧脑室的颞角、第三脑室的后部和第四脑室的顶部。
脉络丛将液体分泌到脑室中主要依赖于钠离子通过丛外上皮细胞的主动运输(active transport)。钠离子的正电荷反过来吸引大量带负电荷的氯离子。这两种离子增加了脑脊液中渗透活性氯化钠的量,然后几乎立即通过膜引起水的渗透,从而提供分泌的液体。
次要的运输过程将少量葡萄糖(glucose)移入脑脊液(cerebrospinal fluid),并将钾离子(potassium ions)和碳酸氢根离子(bicarbonate ions)从脑脊液移入毛细血管(capillaries)。因此,脑脊液的最终特性如下:渗透压(osmotic pressure)与血浆(plasma)大致相等;钠离子(sodium ion)浓度也与血浆大致相等;氯离子(chloride ion)比血浆高约15%;钾离子比血浆低约40%;葡萄糖比血浆低约30%。
通过蛛网膜绒毛(arachnoidal villi)吸收脑脊液。蛛网膜绒毛是蛛网膜(arachnoidal membrane)的微小指状内向突起,穿过静脉窦(venous sinuses)壁进入其中。这些绒毛的聚集体形成肉眼可见的蛛网膜颗粒(arachnoidal granulations),突出于静脉窦内。电子显微镜显示,覆盖绒毛的内皮细胞(endothelial cells)具有直接穿过细胞体的囊泡通道,足以允许(1)脑脊液,(2)溶解的蛋白质分子(protein molecules),以及(3)甚至像红细胞(red blood cells)和白细胞(white blood cells)这样大的颗粒相对自由地流入静脉血(venous blood)。
图62-7. 血管周围间隙(perivascular space)引流至蛛网膜下腔(subarachnoid space)。(改编自Ranson SW, Clark SL: Anatomy of the Nervous System. Philadelphia: WB Saunders, 1959.)
血管周围间隙与脑脊液。大脑的大动脉和大静脉位于大脑表面,但其末端向内穿透,携带一层软脑膜(pia mater),即覆盖大脑的膜,如图62-7所示。软脑膜与血管的粘附较松,因此在软脑膜与每个血管之间存在一个间隙,即血管周围间隙。因此,血管周围间隙随着动脉和静脉进入大脑,直至小动脉(arterioles)和小静脉(venules)。
血管周围间隙的淋巴功能。与身体其他部位一样,少量蛋白质从大脑毛细血管渗漏到大脑的间质间隙(interstitial spaces)中。渗漏到大脑间质间隙中的蛋白质随液体通过血管周围间隙流入蛛网膜下腔。到达蛛网膜下腔后,蛋白质随脑脊液流动,通过蛛网膜绒毛吸收进入大脑静脉。因此,血管周围间隙实际上为大脑提供了一个专门的淋巴系统(lymphatic system)。
除了运输液体和蛋白质外,血管周围间隙还将外来颗粒物质从大脑中运出。例如,每当大脑发生感染时,死亡的白细胞和其他感染性碎片会通过血管周围间隙被带走。
长期以来,科学家们认为大脑缺乏真正的淋巴管(lymphatic vessels)来引流间质间隙中的多余液体、蛋白质和其他大分子。然而,一些研究报告称,至少在啮齿动物中,颅底存在脑膜淋巴管(meningeal lymphatic vessels)。
这些淋巴管是否存在于人类中仍不确定。
脑脊液压力
当一个人处于水平卧位时,脑脊液系统的正常压力平均为130mm水柱(10mmHg),尽管在正常健康人中,这一压力可能低至65mm水柱或高达195~mm水柱。
蛛网膜颗粒对脑脊液压力的调节。脑脊液生成的正常速率几乎保持恒定,因此液体生成的变化很少是压力控制的因素。蛛网膜颗粒的功能类似于阀门,允许脑脊液及其内容物容易地流入静脉窦的血液中,同时防止血液反向流动。正常情况下,当脑脊液压力比静脉窦中的血液压力高约1.5mmHg时,蛛网膜颗粒的这种阀门作用使脑脊液开始流入血液。然后,如果脑脊液压力进一步升高,阀门会开得更大。在正常情况下,脑脊液压力几乎不会比脑静脉窦的压力高出几毫米汞柱。
在疾病状态下,蛛网膜颗粒有时会被大颗粒物质、纤维化或脑疾病中渗入脑脊液的血细胞阻塞。这种阻塞可能导致高脑脊液压力,如下一节所述。
脑病理状态下的高脑脊液压力。通常,大的脑肿瘤通过减少脑脊液重新吸收回血液而升高脑脊液压力。结果,脑脊液压力可以升高到500mm水柱(37mmHg)或约为正常值的四倍。
当颅腔内发生出血或感染时,脑脊液压力也会显著升高。在这两种情况下,大量红血细胞和/或白血细胞突然出现在脑脊液中,并可能导致通过蛛网膜颗粒的小吸收通道严重阻塞。这有时也会将脑脊液压力升高到400至600mm水柱(约为正常值的四倍)。
一些婴儿出生时就有高脑脊液压力,这通常是由于通过蛛网膜颗粒的液体重新吸收阻力异常高所致,原因可能是蛛网膜颗粒数量过少或颗粒的吸收特性异常。这将在后面与脑积水相关的内容中讨论。
脑脊液压力的测量。测量脑脊液压力的常规程序很简单。首先,人完全水平侧卧,使椎管中的液体压力与颅腔中的压力相等。然后将一根脊髓针插入脊髓下端以下的腰椎椎管中,并将针连接到顶部开口的垂直玻璃管上。允许脊髓液在管中上升到尽可能高的位置。如果它上升到针头水平以上136mm的高度,则压力被称为136mm水柱压力——或者,将这个数字除以13.6(汞的比重),约为10 mm Hg压力。
脑脊液流动受阻可导致脑积水
“脑积水”(hydrocephalus)是指颅腔内水分过多。这种情况通常分为交通性脑积水(communicating hydrocephalus)和非交通性脑积水(noncommunicating hydrocephalus)。在交通性脑积水中,液体可以自由地从脑室系统流入蛛网膜下腔,而在非交通性脑积水中,液体从一个或多个脑室流出受阻。
通常,非交通性脑积水是由Sylvius导水管阻塞引起的,许多婴儿在出生前由于闭锁(atresia)或任何年龄由于脑肿瘤阻塞所致。随着两侧脑室和第三脑室的脉络丛(choroid plexuses)产生液体,这三个脑室的体积大大增加,将大脑压扁成紧贴颅骨的薄壳。在新生儿中,由于颅骨尚未融合,压力增加还会导致整个头部肿胀。
交通性脑积水通常是由于大脑基底区域周围的蛛网膜下腔液体流动受阻,或液体通常被吸收进入静脉窦的蛛网膜绒毛(arachnoidal villi)阻塞所致。因此,液体在大脑外部和较小程度上在脑室内积聚。如果在婴儿期发生,当颅骨仍然柔韧并可伸展时,这也会导致头部极度肿胀,并且在任何年龄都可能损害大脑。对于许多类型的脑积水,一种治疗方法是通过手术将硅胶管分流器从脑室一直放置到腹膜腔,在那里多余的液体可以被吸收进入血液。
血-脑脊液屏障和血-脑屏障
已经指出,脑脊液中几种重要成分的浓度与身体其他部位的细胞外液不同。此外,许多大分子几乎无法从血液进入脑脊液或大脑的间质液(interstitial fluids),尽管这些物质可以轻易进入身体的常规间质液。因此,据说在血液和脑脊液及脑液之间存在屏障,分别称为血-脑脊液屏障(blood-cerebrospinal fluid barrier)和血-脑屏障(blood-brain barrier)。
这些屏障存在于脉络丛和大脑实质几乎所有区域的毛细血管膜上,除了下丘脑(hypothalamus)、松果体(pineal gland)和最后区(area postrema)的一些区域,在这些区域物质更容易扩散到组织间隙。这些区域的扩散容易性很重要,因为它们具有对体液特定变化(如渗透压和葡萄糖浓度的变化)以及调节口渴的肽激素(如血管紧张素II)的受体。血-脑屏障还具有特定的载体分子,促进激素(如瘦素(leptin))从血液进入下丘脑,在那里它们与特定受体结合,控制其他功能,如食欲和交感神经系统活动。
一般来说,血-脑脊液屏障(blood–cerebrospinal fluid barrier)和血-脑屏障(blood–brain barrier)对水、CO2,O2,以及大多数脂溶性物质如酒精和麻醉剂具有高度通透性;对钠、氯和钾等电解质具有轻微的通透性;对血浆蛋白和大多数非脂溶性大有机分子几乎完全不透过。因此,血-脑脊液屏障和血-脑屏障常常使得治疗药物,如蛋白质抗体和非脂溶性药物,在脑脊液或脑实质中难以达到有效浓度。
血-脑脊液屏障和血-脑屏障低通透性的原因是脑组织毛细血管内皮细胞相互连接的方式。它们通过所谓的紧密连接(tight junctions)相连。也就是说,相邻内皮细胞的膜紧密融合,而不是像身体大多数其他毛细血管那样有大的缝隙孔。
脑水肿(Brain Edema)
脑脊液动力学异常最严重的并发症之一是脑水肿的发生。由于大脑被封闭在坚硬的颅骨内,额外的水肿液积累会压迫血管,常常导致血流严重减少和脑组织破坏。
脑水肿的常见原因要么是毛细血管压力大大增加,要么是毛细血管壁受损,使壁对液体泄漏。一个常见的原因是头部受到严重打击,导致脑震荡,脑组织和毛细血管受到创伤,毛细血管液体渗漏到受创伤的组织中。
一旦脑水肿开始,由于以下正反馈,通常会引发两个恶性循环:
- 水肿压迫血管系统,进而减少血流并导致脑缺血。缺血反过来导致小动脉扩张,进一步增加毛细血管压力。增加的毛细血管压力然后导致更多的水肿液,因此水肿逐渐恶化。
- 减少的脑血流也减少了O2的输送,这增加了毛细血管的通透性,允许更多的液体泄漏。减少的血流也减少了产生足够三磷酸腺苷(adenosine triphosphate, ATP)所需的底物的输送,而ATP又是神经元组织细胞钠泵所需的,从而使这些细胞肿胀。
一旦这些恶性循环开始,必须采取极端措施来防止大脑的完全破坏。一种措施是静脉注射浓缩的渗透物质,如浓缩的甘露醇溶液,通过渗透作用从脑组织中抽出液体并打破恶性循环。另一种方法是通过脑室针穿刺快速从大脑的侧脑室中移除液体,从而减轻颅内压。
脑代谢(BRAIN METABOLISM)
与其他组织一样,大脑需要O2和食物营养素来满足其代谢需求。然而,脑代谢具有需要特别提及的特殊属性。
大脑总代谢率与神经元代谢率
在静息但清醒的状态下,大脑代谢占全身总代谢的约15%,尽管大脑质量仅占全身总质量的2%。因此,在静息状态下,大脑单位组织质量的代谢率是非神经系统组织平均代谢率的约7.5倍。
大部分大脑代谢发生在神经元中,而不是在胶质支持组织中。神经元代谢的主要需求是通过其膜泵送离子,主要是将钠离子和钙离子转运到神经元膜外,并将钾离子转运到膜内。每次神经元传导动作电位时,这些离子会通过膜移动,增加了额外的膜转运需求,以恢复神经元膜两侧的适当离子浓度差异。因此,在大脑活动水平较高时,神经元代谢可以增加多达100%至150%。
大脑对氧气的特殊需求——缺乏显著的无氧代谢
身体的大多数组织可以在没有O2的情况下存活数分钟,有些甚至可以存活长达30分钟。在此期间,组织细胞通过无氧代谢过程获取能量,这意味着通过部分分解葡萄糖和糖原释放能量,但不与O2结合。这一过程提供能量,但代价是消耗大量的葡萄糖和糖原。然而,它确实能维持组织的存活。
在O2供应突然减少后,大脑无法进行大量的无氧代谢。其中一个原因是神经元的高代谢率,因此大多数神经元活动依赖于血液中O2的秒级供应。综合这些因素,可以理解为什么大脑血流突然停止或血液中O2突然完全缺乏会在5到10秒内导致意识丧失。
正常情况下,大脑能量主要由葡萄糖供应
在正常情况下,脑细胞使用的几乎所有能量都由血液中的葡萄糖供应。与O2一样,大部分葡萄糖是每分钟甚至每秒从毛细血管血液中获取的,在任何给定时间,神经元中通常仅储存约2分钟的葡萄糖供应,以糖原形式存在。
神经元葡萄糖输送的一个特殊特征是,尽管大多数其他体细胞的葡萄糖输送需要胰岛素(insulin),但葡萄糖通过细胞膜进入神经元的过程不依赖于胰岛素。因此,在胰岛素分泌几乎为零的严重糖尿病患者中,葡萄糖仍然能够轻易地扩散到神经元中,这对于防止糖尿病患者出现精神功能丧失是非常幸运的。然而,当糖尿病患者被过度使用胰岛素治疗时,血糖浓度可能会降至极低水平,因为过量的胰岛素会导致血液中几乎所有葡萄糖迅速转运到全身大量对胰岛素敏感的非神经细胞中,尤其是肌肉和肝细胞。当这种情况发生时,血液中没有足够的葡萄糖来正常供应神经元,导致精神功能严重紊乱,有时甚至会导致昏迷,更常见的是导致精神失衡和精神障碍——这些都是由于胰岛素过度治疗引起的。
