第十四单元 内分泌和生殖:修订间差异
自动添加《Guyton&Hall 生理学 第十四版》章节导航 |
|||
| (未显示2个用户的2个中间版本) | |||
| 第1,849行: | 第1,849行: | ||
=== 甲状旁腺功能减退症(Hypoparathyroidism) === | === 甲状旁腺功能减退症(Hypoparathyroidism) === | ||
当甲状旁腺(parathyroid glands)分泌的甲状旁腺激素(PTH) | 当甲状旁腺(parathyroid glands)分泌的甲状旁腺激素(PTH)不足时,可交换钙的骨细胞(osteocytic)吸收减少,破骨细胞(osteoclasts)几乎完全失活。结果,骨骼释放的钙减少,导致体液中的钙水平下降。然而,由于钙和磷酸盐(phosphates)没有从骨骼中释放出来,骨骼通常保持强壮。 | ||
当甲状旁腺突然被切除时,血液中的钙水平在2到3天内从正常的9.4mg/dl下降到6到7mg/dl,血磷酸盐浓度可能翻倍。当达到这种低钙水平时,通常会出现手足抽搐(tetany)的迹象。在身体肌肉中,喉部肌肉(laryngeal muscles)对抽搐性痉挛特别敏感。这些肌肉的痉挛会阻碍呼吸,这是手足抽搐患者死亡的常见原因,除非提供适当的治疗。 | 当甲状旁腺突然被切除时,血液中的钙水平在2到3天内从正常的9.4mg/dl下降到6到7mg/dl,血磷酸盐浓度可能翻倍。当达到这种低钙水平时,通常会出现手足抽搐(tetany)的迹象。在身体肌肉中,喉部肌肉(laryngeal muscles)对抽搐性痉挛特别敏感。这些肌肉的痉挛会阻碍呼吸,这是手足抽搐患者死亡的常见原因,除非提供适当的治疗。 | ||
| 第1,970行: | 第1,970行: | ||
= 男性生殖和激素功能(以及松果体功能) = | = 第81章 男性生殖和激素功能(以及松果体功能) = | ||
男性生殖功能可以分为三个主要部分:(1) 精子的形成——精子发生(spermatogenesis);(2) 男性性行为的执行;(3) 各种激素对男性生殖功能的调控。与这些生殖功能相关的是男性性激素对附属性器官、细胞代谢、生长以及身体其他功能的影响。 | 男性生殖功能可以分为三个主要部分:(1) 精子的形成——精子发生(spermatogenesis);(2) 男性性行为的执行;(3) 各种激素对男性生殖功能的调控。与这些生殖功能相关的是男性性激素对附属性器官、细胞代谢、生长以及身体其他功能的影响。 | ||
----'''男性性器官的生理解剖''' | |||
图 81-1A 显示了雄性再生系统的各个部分,图 81-1B 给出了睾丸和附睾的更细节结构。睾丸由多达 900 个盘绕的生精小管组成,每个小管平均长度超过半米,其中形成精子。然后精子排入附睾,附睾是另一根约 6 米长的盘绕管。附睾通向输精管,输精管在输精管进入前列腺体之前立即扩大到输精管壶腹。 | |||
两个精囊(seminal vesicles),分别位于前列腺的两侧,排入壶腹(ampulla)的前列腺端,壶腹和精囊的内容物进入射精管(ejaculatory duct),射精管穿过前列腺体,然后排入尿道内口。前列腺导管也从前列腺排入射精管,然后进入前列腺尿道。 | 两个精囊(seminal vesicles),分别位于前列腺的两侧,排入壶腹(ampulla)的前列腺端,壶腹和精囊的内容物进入射精管(ejaculatory duct),射精管穿过前列腺体,然后排入尿道内口。前列腺导管也从前列腺排入射精管,然后进入前列腺尿道。 | ||
最后,尿道是从睾丸到外部的最后连接部分。尿道由大量微小的尿道腺(urethral glands)分泌的黏液供应,这些腺体沿尿道的整个长度分布,尤其是位于尿道起始处的双侧尿道球腺(bulbourethral glands)(Cowper 腺)。 | 最后,尿道是从睾丸到外部的最后连接部分。尿道由大量微小的尿道腺(urethral glands)分泌的黏液供应,这些腺体沿尿道的整个长度分布,尤其是位于尿道起始处的双侧尿道球腺(bulbourethral glands)(Cowper 腺)。 | ||
---- | |||
== 精子发生(SPERMATOGENESIS) == | == 精子发生(SPERMATOGENESIS) == | ||
[[文件:GT-81.1.png|缩略图|图81-1 A,男性生殖系统。B,睾丸的内部结构及其与附睾的关系。(A,改编自Bloom V, Fawcett DW: Textbook of Histology, 10th ed. Philadelphia: WB Saunders, 1975. B,改编自Guyton AC: Anatomy and Physiology. Philadelphia: Saunders College Publishing, 1985.)]] | |||
在胚胎形成过程中,原始生殖细胞(primordial germ cells)迁移到睾丸中,成为未成熟的生殖细胞,称为精原细胞(spermatogonia),它们位于曲细精管(seminiferous tubules)内表面的两到三层中(图81-2A显示了曲细精管的横截面)。在青春期,精原细胞开始进行有丝分裂(mitotic division),并通过一定的发育阶段不断增殖和分化,形成精子(sperm),如图81-2B所示。 | 在胚胎形成过程中,原始生殖细胞(primordial germ cells)迁移到睾丸中,成为未成熟的生殖细胞,称为精原细胞(spermatogonia),它们位于曲细精管(seminiferous tubules)内表面的两到三层中(图81-2A显示了曲细精管的横截面)。在青春期,精原细胞开始进行有丝分裂(mitotic division),并通过一定的发育阶段不断增殖和分化,形成精子(sperm),如图81-2B所示。 | ||
| 第1,984行: | 第1,988行: | ||
精子发生在性活跃期由垂体前叶促性腺激素(anterior pituitary gonadotropic hormones)的刺激下在曲细精管中进行。精子发生在男性平均13岁时开始,并在大部分余生中持续进行,但在老年时显著减少。 | 精子发生在性活跃期由垂体前叶促性腺激素(anterior pituitary gonadotropic hormones)的刺激下在曲细精管中进行。精子发生在男性平均13岁时开始,并在大部分余生中持续进行,但在老年时显著减少。 | ||
图81-1A显示了男性生殖系统的各个部分,图81-1B更详细地展示了睾丸和附睾的结构。睾丸由多达900条卷曲的曲细精管组成,每条平均长度超过半米,精子在其中形成。然后精子排入附睾(epididymis),附睾是另一条长约6米的卷曲管道。附睾通向输精管(vas deferens),输精管在进入前列腺(prostate gland)体之前扩大形成输精管壶腹(ampulla of the vas deferens)。 | 图81-1A显示了男性生殖系统的各个部分,图81-1B更详细地展示了睾丸和附睾的结构。睾丸由多达900条卷曲的曲细精管组成,每条平均长度超过半米,精子在其中形成。然后精子排入附睾(epididymis),附睾是另一条长约6米的卷曲管道。附睾通向输精管(vas deferens),输精管在进入前列腺(prostate gland)体之前扩大形成输精管壶腹(ampulla of the vas deferens)。 | ||
在精子发生的第一阶段,精原细胞在支持细胞(Sertoli cells)之间迁移,向曲细精管的中央管腔移动。支持细胞较大,其细胞质包膜环绕着发育中的精原细胞,一直延伸到曲细精管的中央管腔。 | 在精子发生的第一阶段,精原细胞在支持细胞(Sertoli cells)之间迁移,向曲细精管的中央管腔移动。支持细胞较大,其细胞质包膜环绕着发育中的精原细胞,一直延伸到曲细精管的中央管腔。 | ||
减数分裂(Meiosis)。穿过屏障进入支持细胞层的精原细胞逐渐改变并增大,形成初级精母细胞(primary spermatocytes)(图81-3)。每个初级精母细胞随后进行减数分裂,形成两个次级精母细胞(secondary spermatocytes)。几天后,这些次级精母细胞也分裂形成精细胞(spermatids),最终精细胞经过修饰成为精子(spermatozoa)。 | '''减数分裂(Meiosis)'''。穿过屏障进入支持细胞层的精原细胞逐渐改变并增大,形成初级精母细胞(primary spermatocytes)(图81-3)。每个初级精母细胞随后进行减数分裂,形成两个次级精母细胞(secondary spermatocytes)。几天后,这些次级精母细胞也分裂形成精细胞(spermatids),最终精细胞经过修饰成为精子(spermatozoa)。 | ||
在从精母细胞阶段到精细胞阶段的变化过程中,精母细胞的46条染色体(23对染色体)被分裂,因此23条染色体进入一个精细胞,另外23条染色体进入第二个精细胞。染色体基因也被分裂,因此最终胎儿的遗传特征只有一半由父亲提供,另一半由母亲提供的卵母细胞(oocyte)提供。 | 在从精母细胞阶段到精细胞阶段的变化过程中,精母细胞的46条染色体(23对染色体)被分裂,因此23条染色体进入一个精细胞,另外23条染色体进入第二个精细胞。染色体基因也被分裂,因此最终胎儿的遗传特征只有一半由父亲提供,另一半由母亲提供的卵母细胞(oocyte)提供。 | ||
| 第1,996行: | 第2,000行: | ||
从精原细胞到精子的整个精子发生过程大约需要74天。 | 从精原细胞到精子的整个精子发生过程大约需要74天。 | ||
性染色体(Sex Chromosomes)。在每个精原细胞中,23对染色体中的一对携带决定每个后代性别的遗传信息。这对染色体由一个X染色体(称为女性染色体)和一个Y染色体(男性染色体)组成。在减数分裂过程中,男性的Y染色体进入一个精子细胞,然后成为男性精子,而女性的X染色体进入另一个精子细胞,成为女性精子。最终后代的性别由这两种精子中的哪一种使卵子受精决定。这个过程在第83章中进一步讨论。 | '''性染色体(Sex Chromosomes''')。在每个精原细胞中,23对染色体中的一对携带决定每个后代性别的遗传信息。这对染色体由一个X染色体(称为女性染色体)和一个Y染色体(男性染色体)组成。在减数分裂过程中,男性的Y染色体进入一个精子细胞,然后成为男性精子,而女性的X染色体进入另一个精子细胞,成为女性精子。最终后代的性别由这两种精子中的哪一种使卵子受精决定。这个过程在第83章中进一步讨论。 | ||
图81-4 人类精子的结构。 | 图81-4 人类精子的结构。 | ||
'''精子的形成。'''<u>当精子细胞最初形成时,它们仍然具有上皮样细胞的常见特征</u>,但很快它们开始分化并伸长成精子。如图81-4所示,每个精子由头部和尾部组成。头部包含细胞的浓缩核,表面只有一层薄薄的细胞质和细胞膜。头部前三分之二的外部有一个厚厚的帽状结构,称为顶体(acrosome),主要由高尔基体形成。顶体含有几种与典型细胞溶酶体中发现的酶相似的酶,包括'''透明质酸酶'''(hyaluronidase)(可以消化组织的蛋白多糖丝)和强大的'''蛋白水解酶'''(可以消化蛋白质)。这些酶在允许精子进入卵子并使其受精方面起着重要作用。 | |||
以及(3)在尾部近端部分围绕轴丝的一群线粒体,称为尾部主体。 | 精子的尾部称为鞭毛(flagellum),有三个主要组成部分:(1)由11个微管构成的中央骨架,统称为轴丝(axoneme);轴丝的结构类似于第2章中描述的其他类型细胞表面发现的纤毛的结构;(2)覆盖轴丝的薄细胞膜;以及(3)在尾部近端部分围绕轴丝的一群线粒体,称为尾部主体。 | ||
尾部的来回运动(鞭毛运动)为精子提供动力。这种运动是由构成轴丝的前后微管之间的有节奏的纵向滑动运动产生的。这个过程的能量以三磷酸腺苷(adenosine triphosphate)的形式提供,由尾部主体中的线粒体合成。 | 尾部的来回运动(鞭毛运动)为精子提供动力。这种运动是由构成轴丝的前后微管之间的有节奏的纵向滑动运动产生的。这个过程的能量以三磷酸腺苷(adenosine triphosphate)的形式提供,由尾部主体中的线粒体合成。 | ||
| 第2,013行: | 第2,015行: | ||
激素在生殖中的作用将在后面详细讨论;现在需要注意的是,有几种激素在精子发生(spermatogenesis)中起着至关重要的作用。这些作用如下: | 激素在生殖中的作用将在后面详细讨论;现在需要注意的是,有几种激素在精子发生(spermatogenesis)中起着至关重要的作用。这些作用如下: | ||
# | # 由位于睾丸间质中的'''Leydig细胞分泌的睾酮'''(testosterone)(见图81-2),对于睾丸生精细胞的生长和分裂是必不可少的,这是形成精子的第一阶段。 | ||
# | # 由垂体前叶分泌的'''黄体生成素刺激Leydig细胞分泌睾酮'''。 | ||
# | # 同样由垂体前叶分泌的'''促卵泡激素刺激Sertoli细胞''';没有这种刺激,精子细胞转化为精子(精子形成(spermiogenesis)过程)将不会发生。 | ||
# | # 当Sertoli细胞受到促卵泡激素刺激时,由'''睾酮形成的雌激素'''(estrogens)可能也对精子形成至关重要。 | ||
# | # '''生长激素'''(以及大多数其他身体激素)对于控制睾丸的背景代谢功能是必要的。生长激素特别促进精原细胞的早期分裂;在缺乏生长激素的情况下,如垂体性侏儒症患者,精子发生严重不足或缺失,从而导致不育。 | ||
=== 精子在附睾中的成熟 === | === 精子在附睾中的成熟 === | ||
在生精小管中形成后,精子需要几天时间通过6米长的附睾管。从生精小管和附睾早期部分取出的精子是不动的,不能使卵子受精。然而,当精子'''在附睾中停留18至24小时'''后,它们会<u>发展出'''运动能力''',尽管附睾液中的几种抑制蛋白仍然阻止最终的运动,直到射精后。</u> | |||
'''精子在睾丸中的储存。'''成年人的两个睾丸每天形成多达1.2亿个精子。这些精子'''大部分储存在附睾'''中,尽管少量储存在输精管中。它们可以保持储存状态,同时保持其生育能力,至少一个月。在此期间,它们被导管分泌物中的多种抑制物质保持在深度抑制、不活跃的状态。相反,在高水平的性活动和射精情况下,它们可能只能储存几天。 | |||
射精后,精子变得能动并能够使卵子受精,这一过程称为'''成熟(maturation)'''。Sertoli细胞和附睾上皮分泌一种特殊的营养液,与精子一起射出。这种液体含有激素(包括睾酮和雌激素)、酶和特殊营养物质,这些对于精子成熟至关重要。 | |||
'''成熟精子的生理学。'''正常能动、有生育能力的精子能够在液体介质中以1至4毫米/分钟的速度进行鞭毛运动。精子的活动在中性和微碱性介质中大大增强,如射出的精液中存在的情况,但在微酸性介质中大大减弱。强酸性介质可以导致精子的快速死亡。 | |||
精子的活动随着温度的升高而显著增加,但代谢率也随之增加,导致精子的寿命大大缩短。虽然精子可以在睾丸的生殖导管中以抑制状态存活数周,但射出精子在女性生殖道中的预期寿命仅为1至2天。 | 精子的活动随着温度的升高而显著增加,但代谢率也随之增加,导致精子的寿命大大缩短。虽然精子可以在睾丸的生殖导管中以抑制状态存活数周,但射出精子在女性生殖道中的预期寿命仅为1至2天。 | ||
=== 精囊的功能 === | === 精囊的功能 === | ||
每个精囊都是一个弯曲的、分叶的管道,内衬有分泌上皮(secretory epithelium) | 每个精囊都是一个弯曲的、分叶的管道,内衬有分泌上皮(secretory epithelium),分泌一种含有丰富'''果糖'''()、'''柠檬酸'''()和其他营养物质()的黏液物质,以及大量的'''前列腺素'''()和'''纤维蛋白原'''()。在射精(emission and ejaculation)过程中,<u>每个精囊在输精管(vas deferens)排出精子后不久将其内容物排入射精管(ejaculatory duct)。这一行为大大增加了射出精液(semen)的体积,精液中的果糖和其他物质对射出的精子具有重要的营养价值,直到其中一个精子使卵子受精为止。</u> | ||
前列腺素被认为通过两种方式帮助受精(fertilization):(1) 通过与女性宫颈黏液(cervical mucus)反应,使其更易于精子运动;(2) | 前列腺素被认为通过两种方式帮助受精(fertilization):<u>(1) 通过与女性宫颈黏液(cervical mucus)反应,使其更易于精子运动;(2) 可能引起子宫和输卵管的逆向蠕动收缩(reverse peristaltic contractions),将射出的精子推向卵巢(少数精子在5分钟内到达输卵管的上端)。</u> | ||
=== 前列腺的功能 === | === 前列腺的功能 === | ||
前列腺分泌一种稀薄的乳状液体,其中含有'''钙'''、'''柠檬酸'''、'''磷酸根'''(phosphate ion)、一种'''凝固酶'''(clotting enzyme)和一种'''纤维蛋白溶酶原'''(profibrinolysin)。在射精过程中,前列腺的囊(capsule)与输精管的收缩同时收缩,使得前列腺的稀薄乳状液体进一步增加了精液的体积。<u>前列腺液的微碱性特性可能对卵子的成功受精非常重要,因为输精管中的液体由于柠檬酸和精子代谢终产物的存在而相对酸性,从而有助于抑制精子的生育能力</u>。此外,女性的阴道分泌物也是酸性的(pH值为3.5–4.0)。<u>精子只有在周围液体的pH值上升到约6.0至6.5时才能达到最佳运动状态。</u>因此,前列腺液的微碱性可能在射精过程中帮助中和其他精液的酸性,从而增强精子的运动能力和生育能力。 | |||
== 精液 == | === 精液 === | ||
在男性性行为中射出的精液由来自输精管的液体和精子(约占总量的10%)、来自精囊的液体(几乎占60%)、来自前列腺的液体(约30%)以及少量来自黏液腺(尤其是尿道球腺(bulbourethral glands))的液体组成。因此,精液的大部分是精囊液,它是最后被射出的,用于将精子冲洗出射精管和尿道。 | 在男性性行为中射出的精液由来自输精管的液体和精子(约占总量的10%)、来自精囊的液体(几乎占60%)、来自前列腺的液体(约30%)以及少量来自黏液腺(尤其是尿道球腺(bulbourethral glands))的液体组成。因此,精液的大部分是精囊液,它是最后被射出的,用于将精子冲洗出射精管和尿道。 | ||
混合精液的平均pH值约为7.5,其中前列腺液的碱性中和了精液其他部分的弱酸性。前列腺液使精液呈现乳白色,而精囊液和黏液腺的分泌物则使精液具有黏液样的稠度。此外,前列腺液中的一种凝固酶使精囊液中的纤维蛋白原形成一种弱纤维蛋白凝块,将精液固定在子宫颈所在的阴道深处。随后,由于前列腺前纤维蛋白溶酶形成的纤维蛋白溶酶的作用,凝块在接下来的15到30分钟内溶解。在射精后的最初几分钟内,精子保持相对不动,可能是由于凝块的黏稠性。随着凝块的溶解,精子同时变得高度活跃。 | 混合精液的平均pH值约为7.5,其中前列腺液的碱性中和了精液其他部分的弱酸性。前列腺液使精液呈现乳白色,而精囊液和黏液腺的分泌物则使精液具有黏液样的稠度。此外,前列腺液中的一种凝固酶使精囊液中的纤维蛋白原形成一种弱纤维蛋白凝块,将精液固定在子宫颈所在的阴道深处。随后,由于前列腺前纤维蛋白溶酶形成的纤维蛋白溶酶的作用,凝块在接下来的15到30分钟内溶解。在射精后的最初几分钟内,精子保持相对不动,可能是由于凝块的黏稠性。随着凝块的溶解,精子同时变得高度活跃。 | ||
尽管精子在男性生殖管道中可以存活数周,但一旦它们被射入精液中,在体温下的最长寿命仅为24到48小时。然而,在较低温度下,精液可以保存数周,当冷冻在- | 尽管精子在男性生殖管道中可以存活数周,但一旦它们被射入精液中,在体温下的最长寿命仅为24到48小时。然而,在较低温度下,精液可以保存数周,当冷冻在-100℃_\iota以下时,精子可以保存数年。 | ||
=== 精子的“获能”(capacitation)是卵子受精所必需的 === | ==== 精子的“获能”(capacitation)是卵子受精所必需的 ==== | ||
尽管精子在离开附睾时被认为是“成熟”的,但它们的活动受到生殖管道上皮分泌的多种抑制因子的抑制。因此,当它们首次被射入精液时,它们无法使卵子受精。然而,当精子接触到女性生殖道的液体时,会发生多种变化,激活精子以完成受精的最终过程。这些集体变化被称为精子的'''获能(capacitation)''',通常需要'''1到10小时'''。据信会发生以下变化: | |||
# | # 子宫和输卵管液体洗去了<u>抑制精子活动的各种'''抑制因子'''</u>,这些因子在男性生殖管道中抑制了精子的活动。 | ||
# 当精子停留在男性生殖管道的液体中时,它们不断暴露于来自生精小管的许多漂浮囊泡,这些囊泡含有大量的胆固醇。这些胆固醇不断添加到覆盖精子顶体(acrosome) | # 当精子停留在男性生殖管道的液体中时,它们不断暴露于来自生精小管的许多漂浮囊泡,这些囊泡含有大量的胆固醇。这些胆固醇不断添加到覆盖精子顶体(acrosome)的细胞膜上,使该膜变得坚韧并阻止其酶的释放。射精后,沉积在阴道中的精子游离胆固醇囊泡,向上进入子宫腔,并在接下来的几个小时内逐渐'''失去大部分其他多余的胆固醇'''。在此过程中,精子头部(顶体)的'''膜变得脆弱得多'''。 | ||
# | # 精子的'''膜对钙离子的通透性也大大增加''',因此钙离子现在大量进入精子,改变了鞭毛(flagellum)的活动,使其从之前的微弱波动运动转变为'''强有力的鞭打运动'''。此外,钙离子引起覆盖顶体前缘的细胞膜发生变化,使顶体在精子穿透卵子周围的颗粒细胞群时能够快速且容易地释放其酶,尤其是在试图穿透卵子的透明带(zona pellucida)时。 | ||
因此,在获能过程中发生了多种变化。没有这些变化,精子无法进入卵子内部以引起受精。 | 因此,在获能过程中发生了多种变化。没有这些变化,精子无法进入卵子内部以引起受精。 | ||
| 第2,061行: | 第2,063行: | ||
当精子到达卵子的透明带时,精子的前膜与透明带中的受体蛋白特异性结合。接着,整个顶体迅速溶解,所有顶体酶释放出来。几分钟内,这些酶为精子头部打开一条穿透通路,使其穿过透明带进入卵子内部。在接下来的30分钟内,精子头部和卵母细胞的细胞膜相互融合,形成一个单一细胞。同时,精子和卵母细胞的遗传物质结合,形成一个全新的细胞基因组,包含来自父母双方等量的染色体和基因。这就是受精过程;随后胚胎开始发育,如第83章所述。 | 当精子到达卵子的透明带时,精子的前膜与透明带中的受体蛋白特异性结合。接着,整个顶体迅速溶解,所有顶体酶释放出来。几分钟内,这些酶为精子头部打开一条穿透通路,使其穿过透明带进入卵子内部。在接下来的30分钟内,精子头部和卵母细胞的细胞膜相互融合,形成一个单一细胞。同时,精子和卵母细胞的遗传物质结合,形成一个全新的细胞基因组,包含来自父母双方等量的染色体和基因。这就是受精过程;随后胚胎开始发育,如第83章所述。 | ||
'''为什么只有一个精子进入卵母细胞?'''尽管有如此多的精子,为什么只有一个进入卵母细胞?原因尚不完全清楚,但在第一个精子穿透卵子透明带后的几分钟内,钙离子通过卵母细胞膜向内扩散,并导致多个皮质颗粒通过胞吐作用从卵母细胞释放到卵周间隙(perivitelline space)中。这些颗粒含有能够渗透透明带所有部分并阻止其他精子结合的物质,甚至会导致已经开始结合的精子脱落。因此,在受精过程中几乎不会有一个以上的精子进入卵母细胞。 | |||
----'''异常精子发生与男性生育能力''' | |||
睾丸曲细精管上皮可能被多种疾病破坏。例如,由腮腺炎引起的双侧睾丸炎(orchitis)会导致部分受影响的男性不育。此外,一些男性婴儿出生时由于生殖管道的狭窄或其他异常而具有退化的曲细精管上皮。最后,另一个通常为暂时性的不育原因是睾丸温度过高。 | 睾丸曲细精管上皮可能被多种疾病破坏。例如,由腮腺炎引起的双侧睾丸炎(orchitis)会导致部分受影响的男性不育。此外,一些男性婴儿出生时由于生殖管道的狭窄或其他异常而具有退化的曲细精管上皮。最后,另一个通常为暂时性的不育原因是睾丸温度过高。 | ||
'''温度对精子发生的影响.'''提高睾丸的温度会阻止精子发生(spermatogenesis),导致除精原细胞(spermatogonia)外的生精小管(seminiferous tubules)中的大多数细胞退化。通常认为,睾丸位于悬垂的阴囊(scrotum)中的原因是为了将这些腺体的温度维持在低于体内温度的水平,尽管通常只比体内温度低约2℃。在寒冷的日子里,阴囊反射会使阴囊的肌肉收缩,将睾丸拉近身体以维持这2℃的温差。因此,阴囊充当了睾丸的冷却机制(但是一种受控的冷却),如果没有这种机制,在炎热的天气中精子发生可能会受到影响。 | |||
提高睾丸的温度会阻止精子发生(spermatogenesis),导致除精原细胞(spermatogonia)外的生精小管(seminiferous tubules)中的大多数细胞退化。通常认为,睾丸位于悬垂的阴囊(scrotum) | |||
'''隐睾症(Cryptorchidism)。'''隐睾症是指睾丸未能在胎儿出生时或接近出生时从腹部下降到阴囊。在男性胎儿的发育过程中,睾丸起源于腹部的生殖嵴(genital ridges)。然而,通常在婴儿出生前约3周至1个月,睾丸会通过腹股沟管(inguinal canals)下降到阴囊。有时这种下降不会发生或发生不完全,导致一个或两个睾丸留在腹部、腹股沟管或下降路径的其他位置。 | |||
隐睾症是指睾丸未能在胎儿出生时或接近出生时从腹部下降到阴囊。在男性胎儿的发育过程中,睾丸起源于腹部的生殖嵴(genital ridges)。然而,通常在婴儿出生前约3周至1个月,睾丸会通过腹股沟管(inguinal canals)下降到阴囊。有时这种下降不会发生或发生不完全,导致一个或两个睾丸留在腹部、腹股沟管或下降路径的其他位置。 | |||
终生留在腹腔中的睾丸无法形成精子。生精小管上皮会退化,仅留下睾丸的间质结构。有人认为,腹腔中比阴囊高几度的温度足以导致生精小管上皮的退化,从而导致不育,尽管这种影响尚不确定。然而,出于这个原因,可以在成年性生活开始之前对患有隐睾症的男孩进行手术,将隐睾从腹腔重新定位到阴囊。 | 终生留在腹腔中的睾丸无法形成精子。生精小管上皮会退化,仅留下睾丸的间质结构。有人认为,腹腔中比阴囊高几度的温度足以导致生精小管上皮的退化,从而导致不育,尽管这种影响尚不确定。然而,出于这个原因,可以在成年性生活开始之前对患有隐睾症的男孩进行手术,将隐睾从腹腔重新定位到阴囊。 | ||
胎儿睾丸分泌的睾酮(testosterone) | 胎儿睾丸分泌的睾酮(testosterone)是促使睾丸从腹部下降到阴囊的正常刺激因素。因此,<u>许多(如果不是大多数)隐睾症病例是由无法分泌足够睾酮的异常睾丸引起的。</u>对于这些患者,隐睾症的手术治疗不太可能成功。 | ||
'''精子数量对生育能力的影响。'''每次性交时射出的精液量平均约为3.5毫升,每毫升精液平均含有约1.2亿个精子,尽管即使在“正常”男性中,这一数量也可能在3500万到2亿之间变化。这意味着每次射出的几毫升精液中通常平均含有约4亿个精子。当每毫升精液中的精子数量低于约2000万时,该人可能会不育。因此,尽管只需要一个精子即可使卵子受精,但由于尚不清楚的原因,射出的精液中通常必须含有大量精子才能确保一个精子成功受精。 | |||
每次性交时射出的精液量平均约为3.5毫升,每毫升精液平均含有约1.2亿个精子,尽管即使在“正常”男性中,这一数量也可能在3500万到2亿之间变化。这意味着每次射出的几毫升精液中通常平均含有约4亿个精子。当每毫升精液中的精子数量低于约2000万时,该人可能会不育。因此,尽管只需要一个精子即可使卵子受精,但由于尚不清楚的原因,射出的精液中通常必须含有大量精子才能确保一个精子成功受精。 | |||
'''精子形态和运动能力对生育能力的影响。'''有时,男性的精子数量正常,但仍然不育。当这种情况发生时,有时会发现多达一半的精子在形态上异常,例如有两个头、头部形状异常或尾部异常,如图81-5所示。在其他情况下,精子在结构上看起来是正常的,但由于不明原因,它们要么完全不动,要么相对不动。每当大多数精子在形态上异常或不动时,即使其余的精子看起来正常,该人也可能不育。 | |||
图81-5 异常不育精子,与右侧的正常精子进行比较。 | 图81-5 异常不育精子,与右侧的正常精子进行比较。 | ||
---- | |||
== 男性性行为 == | == 男性性行为 == | ||
| 第2,116行: | 第2,116行: | ||
=== 男性性激素的分泌、代谢和化学 === | === 男性性激素的分泌、代谢和化学 === | ||
睾丸间质细胞(Leydig cells)分泌睾酮(testosterone)。睾丸分泌几种男性性激素,统称为雄激素(androgens) | '''睾丸间质细胞(Leydig cells)分泌睾酮(testosterone)'''。睾丸分泌几种男性性激素,统称为雄激素(androgens),包括'''睾酮'''(testosterone)、'''二氢睾酮'''(dihydrotestosterone)和'''雄烯二酮'''(androstenedione)。<u>睾酮的含量远高于其他激素</u>,因此可以认为它是主要的睾丸激素,尽管大部分睾酮最终<u>在靶组织中转化为活性更强的激素二氢睾酮</u>。 | ||
[[文件:GT-81.7.png|缩略图|'''图81-7''' 间质细胞(Leydig cells),分泌睾酮的细胞,位于曲细精管(seminiferous tubules)之间的间隙中。]] | |||
睾酮由位于曲细精管(seminiferous tubules)之间的间质细胞(Leydig cells)形成,这些细胞约占成年睾丸质量的20%,如图81- | 睾酮由位于曲细精管(seminiferous tubules)之间的间质细胞(Leydig cells)形成,这些细胞约占成年睾丸质量的20%,如图81-7所示。在儿童时期,睾丸几乎不分泌睾酮,此时睾丸中的Leydig细胞几乎不存在,但在<u>新生男婴出生后的头几个月和成年男性青春期后,Leydig细胞数量众多</u>;在这两个时期,睾丸分泌大量的睾酮。此外,当Leydig细胞间质细胞发生肿瘤时,会分泌大量的睾酮。当睾丸的生发上皮(germinal epithelium)因X射线治疗或过度加热而被破坏时,Leydig细胞通常继续产生睾酮,因为它们较不容易被破坏。 | ||
在成年男性中,肾上腺分泌的雄激素(androgens)总量非常少(<5%),即使在女性中,它们也不会引起显著的男性化特征,除了导致阴毛和腋毛的生长。然而,当肾上腺产生雄激素的细胞发生肿瘤时,雄激素的量可能变得足够大,以至于即使在女性中也会引起所有常见的男性第二性征。这些效应将在第78章中与肾上腺生殖综合征(adrenogenital syndrome)一起讨论。 | 在成年男性中,肾上腺分泌的雄激素(androgens)总量非常少(<5%),即使在女性中,它们也不会引起显著的男性化特征,除了导致阴毛和腋毛的生长。然而,当肾上腺产生雄激素的细胞发生肿瘤时,雄激素的量可能变得足够大,以至于即使在女性中也会引起所有常见的男性第二性征。这些效应将在第78章中与肾上腺生殖综合征(adrenogenital syndrome)一起讨论。 | ||
| 第2,125行: | 第2,125行: | ||
'''体内其他部位的雄激素分泌'''。术语“雄激素”指的是任何具有男性化效应的类固醇激素(steroid hormone),包括睾酮(testosterone);它还包括除睾丸外体内其他部位产生的男性性激素。例如,肾上腺至少分泌五种雄激素,尽管所有这些雄激素的总男性化活性通常非常微弱(<5%)。 | '''体内其他部位的雄激素分泌'''。术语“雄激素”指的是任何具有男性化效应的类固醇激素(steroid hormone),包括睾酮(testosterone);它还包括除睾丸外体内其他部位产生的男性性激素。例如,肾上腺至少分泌五种雄激素,尽管所有这些雄激素的总男性化活性通常非常微弱(<5%)。 | ||
'''雄激素是类固醇'''。所有雄激素都是类固醇化合物(steroid compounds),如图81-8中所示的睾酮和二氢睾酮(dihydrotestosterone)的分子式所示。无论是在睾丸还是肾上腺中,雄激素都可以从胆固醇(cholesterol)或直接从乙酰辅酶A(acetyl coenzyme A)合成。 | '''雄激素是类固醇'''。所有雄激素都是类固醇化合物(steroid compounds),如图81-8中所示的睾酮和二氢睾酮(dihydrotestosterone)的分子式所示。无论是在睾丸还是肾上腺中,雄激素都可以从胆固醇(cholesterol)或直接从乙酰辅酶A(acetyl coenzyme A)合成。 | ||
| 第2,616行: | 第2,614行: | ||
女性高潮 (female orgasm)。当局部性刺激达到最大强度时,尤其是当局部感觉得到来自大脑 (cerebrum) 的适当心理调节信号支持时,会引发反射,导致女性高潮 (female orgasm),也称为女性性高潮 (female climax)。女性高潮类似于男性的射精 (emission and ejaculation),并且可能有助于促进卵子的受精。事实上,已知人类女性在通过正常性交而非人工方法受精时,生育能力会稍强一些,这表明女性高潮具有重要功能。这种现象可能的原因如下。 | 女性高潮 (female orgasm)。当局部性刺激达到最大强度时,尤其是当局部感觉得到来自大脑 (cerebrum) 的适当心理调节信号支持时,会引发反射,导致女性高潮 (female orgasm),也称为女性性高潮 (female climax)。女性高潮类似于男性的射精 (emission and ejaculation),并且可能有助于促进卵子的受精。事实上,已知人类女性在通过正常性交而非人工方法受精时,生育能力会稍强一些,这表明女性高潮具有重要功能。这种现象可能的原因如下。 | ||
首先,在高潮期间,女性的会阴部肌肉 (perineal muscles) 会节律性收缩,这是由类似于男性射精的脊髓反射引起的。这些反射可能会在高潮期间增加子宫 | 首先,在高潮期间,女性的会阴部肌肉 (perineal muscles) 会节律性收缩,这是由类似于男性射精的脊髓反射引起的。这些反射可能会在高潮期间增加子宫 和输卵管 (fallopian tube) 的运动性,从而帮助精子向上通过子宫向卵子运输;然而,关于这一主题的信息很少。此外,高潮似乎会导致宫颈管 (cervical canal) 扩张长达30分钟,从而使精子更容易运输。 | ||
其次,在许多动物中,交配会导致垂体后叶 (posterior pituitary gland) 分泌催产素 (oxytocin);这种效应可能是通过大脑杏仁核 (amygdaloid nuclei) 然后通过下丘脑 传递到垂体的。催产素会导致子宫节律性收缩增加,这可能会增加精子的运输。一些精子已被证明可以在大约5分钟内穿过牛的整个输卵管长度,这一速度至少是精子游泳运动可能达到的速度的10倍。这种现象是否发生在人类女性中尚不清楚。 | 其次,在许多动物中,交配会导致垂体后叶 (posterior pituitary gland) 分泌催产素 (oxytocin);这种效应可能是通过大脑杏仁核 (amygdaloid nuclei) 然后通过下丘脑 传递到垂体的。催产素会导致子宫节律性收缩增加,这可能会增加精子的运输。一些精子已被证明可以在大约5分钟内穿过牛的整个输卵管长度,这一速度至少是精子游泳运动可能达到的速度的10倍。这种现象是否发生在人类女性中尚不清楚。 | ||
| 第3,207行: | 第3,205行: | ||
早产儿不同器官系统的不成熟导致体内稳态机制的高度不稳定性。例如,酸碱平衡可能会发生巨大变化,尤其是在食物摄入量不时变化的情况下。同样,由于肝脏发育不成熟,血液蛋白浓度通常较低,常常导致低蛋白血症性水肿(hypoproteinemic edema)。婴儿无法调节其钙离子浓度可能会导致低钙血症性手足搐搦(hypocalcemic tetany)。此外,血糖浓度可能在极宽的范围内变化,从20到超过100mg/dl_:,主要取决于喂养的规律性。 | 早产儿不同器官系统的不成熟导致体内稳态机制的高度不稳定性。例如,酸碱平衡可能会发生巨大变化,尤其是在食物摄入量不时变化的情况下。同样,由于肝脏发育不成熟,血液蛋白浓度通常较低,常常导致低蛋白血症性水肿(hypoproteinemic edema)。婴儿无法调节其钙离子浓度可能会导致低钙血症性手足搐搦(hypocalcemic tetany)。此外,血糖浓度可能在极宽的范围内变化,从20到超过100mg/dl_:,主要取决于喂养的规律性。 | ||
'''体温不稳定性'''。早产儿的一个重要问题是无法维持正常体温。早产儿的体温往往会接近周围环境的温度。在正常室温下,婴儿的体温(以华氏度计)可能会稳定在90度以下,甚至低至80度。研究表明,体温维持在96\circF [(35. | '''体温不稳定性'''。早产儿的一个重要问题是无法维持正常体温。早产儿的体温往往会接近周围环境的温度。在正常室温下,婴儿的体温(以华氏度计)可能会稳定在90度以下,甚至低至80度。研究表明,体温维持在96\circF [(35.5℃])以下与特别高的死亡率相关,这解释了在治疗早产儿时几乎必须使用保温箱的原因。 | ||
==== 早产儿因过量氧疗导致失明的危险 ==== | ==== 早产儿因过量氧疗导致失明的危险 ==== | ||
| 第3,227行: | 第3,225行: | ||
图84-9. 婴儿在生命第一年内的行为发育。 | 图84-9. 婴儿在生命第一年内的行为发育。 | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
{{:Guyton&Hall 生理学 第十四版}} | |||
2025年8月23日 (六) 17:13的最新版本
内分泌学导论
通过化学信使协调身体功能
身体细胞、组织和器官的多种活动通过几种类型的化学信使系统的相互作用来协调:
- 神经递质(Neurotransmitters)由神经元的轴突末端释放到突触连接处,并在局部作用以控制神经细胞功能。
- 内分泌激素(Endocrine hormones)由腺体或特化细胞释放到循环血液中,并影响身体其他部位的靶细胞功能。
- 神经内分泌激素(Neuroendocrine hormones)由神经元分泌到循环血液中,并影响身体其他部位的靶细胞功能。
- 旁分泌因子(Paracrines)由细胞分泌到细胞外液中,并影响邻近的不同类型的靶细胞。
- 自分泌因子(Autocrines)由细胞分泌到细胞外液中,并影响产生它们的同一细胞的功能。
- 细胞因子(Cytokines)是由细胞分泌到细胞外液中的肽类,可以作为自分泌因子、旁分泌因子或内分泌激素发挥作用。细胞因子的例子包括由辅助细胞分泌并作用于免疫系统其他细胞的白细胞介素和其他淋巴因子(见第35章)。由脂肪细胞产生的细胞因子激素(如瘦素)有时被称为脂肪因子(adipokines)。
在接下来的几章中,我们将主要讨论内分泌和神经内分泌激素系统,同时记住体内的许多化学信使系统相互作用以维持稳态(homeostasis)。例如,肾上腺髓质和垂体腺主要响应神经刺激分泌激素。位于下丘脑的神经内分泌细胞,其轴突终止于垂体后叶和正中隆起,并分泌多种神经激素,包括抗利尿激素、催产素和垂体调节激素,这些激素控制垂体前叶激素的分泌。
内分泌激素通过循环系统被输送到全身的细胞,包括在某些情况下到达神经系统,它们在那里与受体结合并引发许多细胞反应。一些内分泌激素影响体内许多不同类型的细胞;例如,垂体前叶分泌的生长激素会导致身体大部分部位的生长,而甲状腺分泌的甲状腺素(thyroxine)则增加几乎所有身体细胞的化学反应速率。
其他激素主要影响特定的靶组织,因为这些组织具有丰富的激素受体。例如,垂体前叶分泌的促肾上腺皮质激素(adrenocorticotropic hormone)专门刺激肾上腺皮质,使其分泌肾上腺皮质激素,而卵巢激素主要影响女性性器官和女性身体的第二性征。
图75-1显示了身体主要内分泌腺和内分泌组织的解剖位置,除了胎盘,它是性激素的额外来源。表75-1概述了不同的激素系统及其主要作用。
多种激素系统在调节几乎所有身体功能中起着关键作用,包括代谢、生长发育、水和电解质平衡、生殖和行为。例如,如果没有生长激素,一个人的身高会非常矮小。如果没有甲状腺分泌的甲状腺素和三碘甲状腺原氨酸(triiodothyronine),几乎所有的身体化学反应都会变得迟缓,人也会变得迟钝。如果没有胰腺分泌的胰岛素,身体的细胞几乎无法利用食物中的碳水化合物来获取能量。如果没有性激素,性发育和性功能将不存在。
激素的化学结构和合成
激素主要分为三大类:
- 蛋白质和多肽类,包括由垂体前叶和后叶、胰腺(胰岛素和胰高血糖素)、甲状旁腺(甲状旁腺激素)以及许多其他腺体分泌的激素(见表75-1)。
- 类固醇类,由肾上腺皮质(皮质醇和醛固酮)、卵巢(雌激素和孕激素)、睾丸(睾酮)和胎盘(雌激素和孕激素)分泌。
- 酪氨酸衍生物,由甲状腺(甲状腺素和三碘甲状腺原氨酸)和肾上腺髓质(肾上腺素和去甲肾上腺素)分泌。目前尚未发现多糖或核酸类激素。
图75-1. 身体主要内分泌腺和组织的解剖位置。
多肽和蛋白质激素(peptide and protein hormones)在需要之前储存在分泌囊泡(secretory vesicles)中。体内大多数激素是多肽和蛋白质。这些激素的大小从只有三个氨基酸的小肽(如促甲状腺激素释放激素)到近200个氨基酸的蛋白质(如生长激素和催乳素)不等。一般来说,100个或更多氨基酸的多肽被称为蛋白质(proteins),而少于100个氨基酸的则被称为肽(peptides)。
蛋白质和肽激素在内分泌细胞的粗面内质网(rough endoplasmic reticulum)上合成,与大多数其他蛋白质的合成方式相同(图75-2)。它们通常首先合成为不具有生物活性的大蛋白质(前激素原,preprohormones),并在内质网中被切割形成较小的激素原(prohormones)。这些激素原随后被转移到高尔基体(Golgi apparatus)进行包装,形成分泌囊泡。在这个过程中,囊泡中的酶将激素原切割,产生较小的具有生物活性的激素和无活性的片段。囊泡储存在细胞质中,许多囊泡与细胞膜结合,直到需要分泌时。当分泌囊泡与细胞膜融合并通过胞吐作用(exocytosis)将颗粒内容物排出到间质液或直接进入血液时,激素(以及无活性片段)的分泌就发生了。
在许多情况下,胞吐作用的刺激是由质膜去极化引起的胞质钙离子浓度增加。在其他情况下,内分泌细胞表面受体的刺激导致环磷酸腺苷(cyclic adenosine monophosphate, cAMP)增加,随后激活蛋白激酶(protein kinases),从而启动激素的分泌。肽激素是水溶性的,这使得它们能够很容易地进入循环系统,并被运送到它们的靶组织。
类固醇激素(steroid hormones)通常由胆固醇合成,并且不被储存。类固醇激素的化学结构与胆固醇相似,在大多数情况下是由胆固醇合成的。它们是脂溶性的,由三个环己基环和一个环戊基环结合成一个单一的结构(图75-3)。虽然在产生类固醇的内分泌细胞中通常很少有激素储存,但在受到刺激后,细胞质液泡中的大量胆固醇酯可以迅速动员用于类固醇合成。产生类固醇的细胞中的大部分胆固醇来自血浆,但细胞中也有胆固醇的从头合成(de novo synthesis)。由于类固醇是高度脂溶性的,一旦合成,它们就可以简单地扩散穿过细胞膜,进入间质液,然后进入血液。
胺类激素(amine hormones)由酪氨酸(tyrosine)衍生而来。由酪氨酸衍生的两类激素,即甲状腺激素(thyroid hormones)和肾上腺髓质激素(adrenal medullary hormones),是由腺体细胞胞质区室(cytoplasmic compartments)中的酶作用形成的。甲状腺激素在甲状腺(thyroid gland)中合成并储存,并整合到甲状腺球蛋白(thyroglobulin)的大分子中,后者储存在甲状腺内的大滤泡(follicles)中。当胺类从甲状腺球蛋白上裂解下来时,激素分泌发生,游离的激素随后释放到血液中。进入血液后,大多数甲状腺激素与血浆蛋白(plasma proteins)结合,特别是甲状腺素结合球蛋白(thyroxine-binding globulin),后者缓慢地将激素释放到靶组织(target tissues)。
markdown
表75-1 内分泌腺、激素及其功能和结构
表 75-1 内分泌腺、激素及其功能和结构—续
图 75-2. 肽类激素的合成与分泌。激素分泌的刺激通常涉及细胞内钙的变化或细胞内环磷酸腺苷 (cAMP) 的变化。
图 75-3. 几种类固醇激素的化学结构。
肾上腺素 和去甲肾上腺素 (Norepinephrine) 在肾上腺髓质中形成,肾上腺髓质通常分泌的肾上腺素是去甲肾上腺素的四倍。儿茶酚胺 (Catecholamines) 被摄取到预先形成的囊泡中并储存,直到分泌。与储存在分泌颗粒中的蛋白质激素类似,儿茶酚胺也通过胞吐作用从肾上腺髓质细胞中释放。一旦儿茶酚胺进入循环,它们可以以游离形式或与其他物质结合的形式存在于血浆中。
激素的分泌、运输和从血液中的清除
激素在刺激后的分泌及不同激素的作用持续时间。一些激素,如去甲肾上腺素和肾上腺素,在腺体受到刺激后几秒钟内分泌,并可能在几秒到几分钟内发挥完全作用;而其他激素,如甲状腺素或生长激素,可能需要数月才能完全发挥作用。因此,每种激素都有其特定的起效时间和作用持续时间,以适应其特定的控制功能。
循环血液中的激素浓度和激素分泌速率。控制大多数代谢和内分泌功能所需的激素浓度非常低。它们在血液中的浓度范围从每毫升血液中仅有1皮克(即一克的百万分之一百万)到最多每毫升血液中几微克(即几百万分之一克)。同样,各种激素的分泌速率也非常低,通常以每天微克或毫克为单位进行测量。我们将在本章后面看到,靶组织中存在高度特化的机制,使得即使这些微量的激素也能对生理系统产生强大的控制作用。
激素分泌的反馈控制
负反馈防止激素系统的过度活跃。尽管许多激素的血浆浓度会随着一天中发生的各种刺激而波动,但迄今为止研究的所有激素似乎都受到严格控制。在大多数情况下,这种控制是通过负反馈机制(在第1章中描述)来实现的,以确保靶组织中激素活动的适当水平。在刺激引起激素释放后,激素作用产生的条件或产物往往会抑制其进一步释放。换句话说,激素(或其产物之一)具有负反馈效应,以防止激素的过度分泌或靶组织的过度活动。激素的反馈调节可以发生在所有水平,包括激素合成中涉及的基因转录和翻译步骤,以及处理激素或释放储存激素的步骤。
有时,受控变量是靶组织的活动程度,而不是激素的合成或分泌速率。因此,只有当靶组织活动上升到适当水平时,反馈信号才会变得足够强大,以减缓激素的进一步合成和分泌。
激素的激增可能伴随正反馈发生。在少数情况下,当激素的生物作用导致激素的额外分泌时,会发生正反馈。正反馈的一个例子是黄体生成素(LH)的激增,这是由于排卵前雌激素对垂体前叶的刺激作用引起的。分泌的LH随后作用于卵巢,刺激额外的雌激素分泌,这反过来又导致更多的LH分泌。最终,LH达到适当的浓度,随后发挥典型的激素分泌负反馈控制。
激素释放存在周期性变化。在激素分泌的负反馈和正反馈控制之上,激素释放还存在周期性变化,这些变化受季节变化、发育和衰老的不同阶段、昼夜(每日)周期和睡眠的影响。例如,生长激素的分泌在睡眠早期显著增加,但在睡眠后期减少。在许多情况下,激素分泌的这些周期性变化是由于控制激素释放的神经通路活动变化引起的。
内分泌信号的振荡部分由生物钟驱动。如第59章所述(见图59-8),下丘脑的视交叉上核(suprachiasmatic nucleus, SCN)作为“主时钟”,控制着身体许多部位的生物钟节律模式,包括神经内分泌细胞和内分泌腺。还有证据表明,外周内分泌组织(如肾上腺和胰腺)中存在局部时钟控制,这些组织对各种信号的敏感性会发生周期性变化。
组织反应性的周期性变化和激素浓度的波动为身体提供了重要的机制,以预测和适应一天中通常发生的压力和需求的剧烈变化——从安静的睡眠到进食以及高强度的精神和体力活动。女性性激素的节律性变化平均以28天为一个周期,对生殖也至关重要,如第82章所述。
激素在血液中的运输
水溶性激素(肽类和儿茶酚胺类)溶解在血浆中,并从其合成部位运输到靶组织,在那里它们从毛细血管中扩散出来,进入间质液,最终到达靶细胞。
相比之下,类固醇激素和甲状腺激素在血液中循环时主要与血浆蛋白结合。通常,血浆中不到10%的类固醇或甲状腺激素以游离形式存在。例如,血液中超过99%的甲状腺素与血浆蛋白结合。然而,与蛋白质结合的激素不容易通过毛细血管扩散并进入其靶细胞,因此在它们从血浆蛋白解离之前,它们在生物学上是无活性的。
与蛋白质结合的大量激素作为储备库,当它们与靶受体结合或从循环中丢失时,补充游离激素的浓度。激素与血浆蛋白的结合大大减缓了它们从血浆中的清除。
激素从血液中的“清除”。有两个因素可以增加或减少血液中激素的浓度:(1)激素分泌到血液中的速率;(2)激素从血液中去除的速率,这被称为代谢清除率(metabolic clearance rate),通常以每分钟清除激素的血浆毫升数表示。为了计算这一清除率,需要测量(1)激素从血浆中消失的速率(例如,每分钟纳克)和(2)激素的血浆浓度(例如,每毫升血浆的纳克数)。然后,使用以下公式计算代谢清除率:
代谢清除率 = 激素从血浆中消失的速率/激素的浓度
进行这种测量的通常步骤如下。将要测量的激素的纯化溶液用放射性物质标记。然后以恒定速率将放射性激素注入血液中,直到血浆中的放射性浓度达到稳定。此时,放射性激素从血浆中的消失速率等于其注入速率,从而得出消失速率。同时,使用标准的放射性计数程序测量放射性激素的血浆浓度。然后,使用刚刚提到的公式计算代谢清除率(metabolic clearance rate)。
激素从血浆中被“清除”的方式有几种,包括:(1) 组织代谢破坏(metabolic destruction by the tissues),(2) 与组织结合(binding with the tissues),(3) 通过肝脏排泄到胆汁中(excretion by the liver into the bile),以及(4) 通过肾脏排泄到尿液中(excretion by the kidneys into the urine)。对于某些激素,代谢清除率的降低可能导致体液循环中激素浓度过高。例如,当肝脏患病时,过量的类固醇激素会积累,因为这些激素主要在肝脏中结合,然后“清除”到胆汁中。
激素有时在其靶细胞中被酶促过程降解,这些过程导致细胞膜激素-受体复合物的内吞作用(endocytosis);激素随后在细胞内代谢,受体通常被回收到细胞膜上。
大多数肽类激素(peptide hormones)和儿茶酚胺(catecholamines)是水溶性的,并在血液中自由循环。它们通常被血液和组织中的酶降解,并迅速通过肾脏和肝脏排泄,因此在血液中只停留很短的时间。例如,血液中循环的血管紧张素II(angiotensin II)的半衰期不到一分钟。
与血浆蛋白结合的激素从血液中清除的速率要慢得多,可能在循环中停留数小时甚至数天。例如,肾上腺类固醇(adrenal steroids)在循环中的半衰期在20到100分钟之间,而与蛋白质结合的甲状腺激素(thyroid hormones)的半衰期可能长达1到6天。
激素的作用机制
激素受体及其激活
激素作用的第一步是与靶细胞上的特定受体结合。缺乏激素受体的细胞不会作出反应。一些激素的受体位于靶细胞膜上,而其他激素的受体位于细胞质或细胞核中。当激素与其受体结合时,这一作用通常会在细胞内引发一系列反应,每个阶段都被更强烈地激活,因此即使是小浓度的激素也能产生巨大的效果。
激素受体是大蛋白质,每个被刺激的细胞通常有大约2000到100,000个受体。此外,每个受体通常对单一激素具有高度特异性,这决定了作用于特定组织的激素类型。受激素影响的靶组织是那些含有其特定受体的组织。
不同类型激素受体的位置通常如下:
- 在细胞膜上或表面。膜受体主要对蛋白质、肽类和儿茶酚胺激素具有特异性。
- 在细胞质(cytoplasm)中。不同类固醇激素(steroid hormones)的主要受体主要存在于细胞质中。
- 在细胞核(nucleus)中。甲状腺激素(thyroid hormones)的受体存在于细胞核中,并被认为与一个或多个染色体直接相关。
激素受体的数量和敏感性是受调控的。靶细胞(target cell)中的受体数量通常不会日复一日甚至分分钟保持不变。受体蛋白(receptor proteins)在其功能过程中经常失活或被破坏,而在其他时候它们会被重新激活或由细胞制造新的受体。例如,激素浓度增加和与靶细胞受体结合增加有时会导致活性受体数量减少。这种受体的下调(down-regulation)可能由于以下原因发生:(1) 部分受体分子失活;(2) 部分细胞内蛋白信号分子(intracellular protein signaling molecules)失活;(3) 受体暂时被隔离到细胞内部,远离与细胞膜受体相互作用的激素作用位点;(4) 受体被内化后由溶酶体(lysosomes)破坏;或 (5) 受体生成减少。在每种情况下,受体下调都会降低靶组织对激素的反应性。
一些激素会导致受体和细胞内信号蛋白的上调(up-regulation);也就是说,刺激激素会诱导靶细胞形成比正常更多的受体或细胞内信号分子,或增加受体与激素相互作用的可用性。当上调发生时,靶组织对激素的刺激作用变得越来越敏感。
激素受体激活后的细胞内信号传导
几乎无一例外,激素通过首先形成激素-受体复合物(hormone-receptor complex)来影响其靶组织。这种复合物的形成改变了受体的功能,激活的受体启动了激素效应。为了解释这一过程,让我们举几个不同类型相互作用的例子。
离子通道偶联受体(Ion Channel–Linked Receptors)。几乎所有神经递质(neurotransmitter substances),如乙酰胆碱(acetylcholine)和去甲肾上腺素(norepinephrine),都与突触后膜(postsynaptic membrane)中的受体结合。这种结合几乎总是引起受体结构的变化,通常打开或关闭一个或多个离子的通道。一些离子通道偶联受体打开(或关闭)钠离子通道,其他则打开钾离子通道,还有一些打开钙离子通道,等等。这些离子通过通道的运动改变导致了对突触后细胞的后续影响。虽然少数激素可能通过激活离子通道受体发挥其部分作用,但大多数打开或关闭离子通道的激素是通过与G蛋白偶联受体(G protein–linked receptors)或酶偶联受体(enzyme-linked receptors)偶联间接实现的,如下所述。
G蛋白偶联激素受体。许多激素通过激活受体间接调节靶蛋白(如酶或离子通道)的活性,这些受体与称为异源三聚体鸟苷三磷酸(GTP)结合蛋白(G蛋白)的细胞膜蛋白群偶联(图75-4)。所有已知的G蛋白偶联受体(\mathord\sim1000)都具有七个跨膜片段,这些片段在细胞膜内外形成环状结构。受体的一些部分突出到细胞质中(尤其是受体的细胞质尾部),并与G蛋白偶联,这些G蛋白包括三个(即三聚体)部分——α、β和γ亚基。当配体(激素)与受体的细胞外部分结合时,受体发生构象变化,激活G蛋白并诱导细胞内信号,这些信号要么(1)打开或关闭细胞膜离子通道,(2)改变细胞质中酶的活性,要么(3)激活基因转录。
三聚体 G蛋白因其结合鸟苷核苷酸的能力而得名。在非活性状态下,G蛋白的α、β和γ亚基形成一个复合物,该复合物在α亚基上结合鸟苷二磷酸(GDP)。
图75-4. G蛋白偶联受体的激活机制。当激素激活受体时,非活性的α_i、β和γ G蛋白复合物与受体结合并被激活,同时鸟苷三磷酸(G T P)取代鸟苷二磷酸(GDP)。这一过程导致α亚基(与GTP结合)从G蛋白的β和γ亚基上解离,并与膜结合的靶蛋白(酶)相互作用,从而启动细胞内信号。
当受体被激活时,它会发生构象变化,导致与GDP结合的三聚体G蛋白与受体的细胞质部分结合,并将GDP交换为GTP。GDP被GTP取代导致α亚基从三聚体复合物中解离,并与其他细胞内信号蛋白结合;这些蛋白反过来改变离子通道或细胞内酶(如腺苷酸环化酶或磷脂酶C_)的活性,从而改变细胞功能。
当激素被移除时,信号事件终止,α亚基通过将其结合的GTP转化为GDP而失活;然后α亚基再次与β和γ亚基结合,形成非活性的膜结合三聚体G蛋白。关于G蛋白信号传导的更多细节在第46章中讨论,并在图46-7中展示。
一些激素与抑制性G蛋白(表示为G_i蛋白)偶联,而另一些则与刺激性G蛋白(表示为G_s蛋白)偶联。因此,根据激素受体与抑制性或刺激性 G蛋白的偶联,激素可以增加或减少细胞内酶的活性。这种复杂的细胞膜G蛋白系统为身体不同靶组织对不同激素的潜在细胞反应提供了广泛的可能。
酶联激素受体 (Enzyme-Linked Hormone Receptors)。一些受体在被激活时,直接作为酶发挥作用或与它们激活的酶密切相关。这些酶联受体是仅一次穿过膜的蛋白质,与七次跨膜的G蛋白偶联受体 (G protein-coupled receptors) 形成对比。酶联受体在细胞膜外侧具有激素结合位点,在细胞膜内侧具有催化或酶结合位点。当激素与受体的细胞外部分结合时,位于细胞膜内侧的酶立即被激活(或偶尔被抑制)。尽管许多酶联受体具有内在的酶活性,但其他受体则依赖于与受体密切相关的酶来产生细胞功能的变化。
表75-2列出了许多使用酶联受体酪氨酸激酶 (receptor tyrosine kinases) 进行细胞信号传导的肽类生长因子 (peptide growth factors)、细胞因子 (cytokines) 和激素。酶联受体的一个例子是瘦素受体 (leptin receptor)(图75-5)。瘦素 (leptin) 是由脂肪细胞分泌的一种激素,具有许多生理效应,但它在调节食欲和能量平衡方面尤为重要,如第72章所述。瘦素受体是一个大型细胞因子受体家族的成员,这些受体本身不含有酶活性,但通过相关酶进行信号传导。在瘦素受体的情况下,其中一个信号传导途径是通过Janus激酶 (JAK) 家族的酪氨酸激酶 JAK2进行的。瘦素受体以二聚体形式存在(即由两部分组成),瘦素与受体的细胞外部分结合会改变其构象,从而使细胞内相关的JAK2分子磷酸化并激活。激活的JAK2分子随后磷酸化瘦素受体-JAK2复合物内的其他酪氨酸残基,以介导细胞内信号传导。这些细胞内信号包括信号转导和转录激活因子 (STAT) 蛋白的磷酸化,从而激活瘦素靶基因的转录以启动蛋白质合成。JAK2的磷酸化还导致其他细胞内酶途径的激活,如丝裂原活化蛋白激酶 (MAPK) 和磷脂酰肌醇3-激酶 (PI3K)。瘦素的一些效应由于这些细胞内酶的激活而迅速发生,而其他作用则发生较慢,需要新蛋白质的合成。
表75-2 使用受体酪氨酸激酶信号传导的激素
<html><body><table><tr><td>成纤维细胞生长因子 (Fibroblast growth factor)</td></tr><tr><td>生长激素 肝细胞生长因子 (Hepatocyte growth factor)</td></tr><tr><td>胰岛素 胰岛素样生长因子-1 (Insulin-like growth factor-1)</td></tr><tr><td>瘦素 (Leptin)</td></tr><tr><td>催乳素 (Prolactin)</td></tr><tr><td></td></tr><tr><td>血管内皮生长因子 (Vascular endothelial growth factor)</td></tr></table></body></html>
另一个广泛用于细胞功能激素调控的例子是激素与一种特殊的跨膜受体结合,该受体随后在突出到细胞内部的一端成为激活的腺苷酸环化酶 (adenylyl cyclase)。这种环化酶催化cAMP的形成,cAMP在细胞内具有多种效应以控制细胞活动,如后文所述。cAMP被称为第二信使 (second messenger),因为直接引发细胞内变化的不是激素本身,而是cAMP作为第二信使引起这些效应。
图75-5. 一种酶联受体——瘦素受体。该受体以同源二聚体(两个相同的部分)形式存在,瘦素与受体的细胞外部分结合,导致磷酸化(P)并激活细胞内相关的janus激酶2(JAK2)。这一机制导致信号转导和转录激活因子(STAT)蛋白的磷酸化,从而激活目标基因的转录和蛋白质的合成。JAK2的磷酸化还激活了其他几种酶系统,这些酶系统介导了瘦素的一些更快速效应。Y,特定的酪氨酸磷酸化位点。
对于少数肽类激素,如心房利钠肽,环磷酸鸟苷(cyclic guanosine monophosphate)与cAMP略有不同,但以类似的方式作为第二信使发挥作用。
细胞内激素受体与基因激活。包括肾上腺和性腺类固醇激素、甲状腺激素、视黄醇激素和维生素D在内的几种激素,与细胞内的蛋白质受体结合,而不是在细胞膜上。由于这些激素是脂溶性的,它们很容易穿过细胞膜,并与细胞质或细胞核中的受体相互作用。激活的激素-受体复合物随后与DNA的特定调控(启动子)序列——激素反应元件结合,从而激活或抑制特定基因的转录和信使RNA(mRNA)的形成(图75-6)。因此,在激素进入细胞几分钟、几小时甚至几天后,新形成的蛋白质出现在细胞中,并成为新或改变的细胞功能的控制者。
许多不同的组织具有相同的细胞内激素受体,但受体调控的基因在不同组织中是不同的。只有在适当的基因调控蛋白组合存在的情况下,细胞内受体才能激活基因反应,而这些调控蛋白中的许多是组织特异性的。因此,不同组织对激素的反应不仅由受体的特异性决定,还由受体调控的基因表达决定。
介导细胞内激素功能的第二信使机制
我们之前提到,激素发挥细胞内作用的一种方式是刺激细胞膜内第二信使cAMP的形成。cAMP随后引起激素的后续细胞内效应。因此,激素对细胞的唯一直接作用是激活单一类型的膜受体。第二信使则完成其余的工作。
cAMP并不是不同激素使用的唯一第二信使。另外两个特别重要的第二信使是(1)钙离子及其相关的钙调蛋白和(2)膜磷脂分解的产物。在某些情况下,激素可能在同一靶组织中刺激多个第二信使系统。
腺苷酸环化酶-cAMP第二信使系统
表75-3展示了部分使用腺苷酸环化酶-cAMP机制来刺激其靶组织的激素,图75-7展示了腺苷酸环化酶-cAMP第二信使系统。激素与受体结合后,受体可以与G蛋白偶联。如果G蛋白刺激腺苷酸环化酶-cAMP系统,则称为G_s蛋白,表示一种刺激性G蛋白。G_s蛋白刺激膜结合的腺苷酸环化酶,催化少量胞质中的三磷酸腺苷(ATP)转化为细胞内的cAMP。随后,cAMP激活cAMP依赖性蛋白激酶,该激酶磷酸化特定的细胞蛋白,触发生化反应,最终导致细胞对激素的反应。
图75-6. 脂溶性激素(如类固醇)与靶细胞内受体相互作用的机制。激素与细胞质或细胞核中的受体结合后,激素-受体复合物与DNA上的激素反应元件(启动子)结合。这一作用要么激活要么抑制基因转录、信使RNA(mRNA)的形成以及蛋白质合成。
表75-3 使用腺苷酸环化酶-cAMP第二信使系统的激素
<html><body><table><tr><td>促肾上腺皮质激素(ACTH) 血管紧张素II(上皮细胞) 降钙素 儿茶酚胺(β受体) 促肾上腺皮质激素释放激素(CRH) 促卵泡激素(FSH)</td></tr><tr><td>胰高血糖素 生长激素释放激素(GHRH) 人绒毛膜促性腺激素(hcG) 黄体生成素(LH)</td></tr><tr><td>甲状旁腺激素(PTH) 分泌素</td></tr><tr><td>生长抑素 促甲状腺激素(TSH)</td></tr></table></body></html>
cAMP, 环磷酸腺苷。
图75-7. 许多激素通过环磷酸腺苷(C A M P)机制控制细胞功能。ADP, 二磷酸腺苷; ATP, 三磷酸腺苷; GTP, 三磷酸鸟苷。
表75-4 使用磷脂酶C第二信使系统的激素
<html><body><table><tr><td>血管紧张素II(血管平滑肌)</td></tr><tr><td>儿茶酚胺(α受体) 促性腺激素释放激素(GnRH)</td></tr><tr><td>生长激素释放激素(GHRH)</td></tr><tr><td>甲状旁腺激素(PTH)</td></tr><tr><td>催产素</td></tr><tr><td>促甲状腺激素释放激素(TRH)</td></tr><tr><td>血管加压素(V受体,血管平滑肌)</td></tr></table></body></html>
一旦cAMP在细胞内形成,通常会激活一系列酶级联反应。也就是说,首先激活一种酶,该酶激活第二种酶,第二种酶再激活第三种酶,依此类推。这种机制的重要性在于,细胞膜内侧仅需少量激活的腺苷酸环化酶分子即可激活更多的第二种酶分子,进而激活更多的第三种酶分子,依此类推。通过这种方式,即使细胞表面仅有极微量的激素作用,也能为整个细胞启动强大的级联激活效应。
如果激素与其受体的结合与抑制性G蛋白(denoted G_i protein)偶联,腺苷酸环化酶(adenylyl cyclase)将被抑制,从而减少cAMP的形成,最终导致细胞内的抑制作用。因此,根据激素受体与抑制性或刺激性G蛋白的偶联情况,激素可以增加或减少细胞内cAMP的浓度以及关键蛋白质的磷酸化(phosphorylation)。
每种靶细胞中cAMP增加或减少所引发的具体反应取决于细胞内机制的性质;一些细胞具有一组酶,而其他细胞则具有另一组酶。因此,在不同的靶细胞中会引发不同的功能,例如启动特定细胞内化学物质的合成、引起肌肉收缩或松弛、启动细胞分泌以及改变细胞通透性(permeability)。
因此,被cAMP刺激的甲状腺细胞会形成代谢激素甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine),而相同的cAMP在肾上腺皮质细胞中则会导致肾上腺皮质类固醇激素的分泌。在肾脏远端小管和集合管的一些上皮细胞中,cAMP会增加它们对水的通透性。
细胞膜磷脂第二信使系统
一些激素激活跨膜受体,进而激活附着在受体内部突起上的磷脂酶C(phospholipase C)(表75-4)。该酶催化细胞膜中某些磷脂的分解,特别是磷脂酰肌醇二磷酸(phosphatidylinositol biphosphate, [(PIP_2])),分解为两种不同的第二信使产物:三磷酸肌醇(inositol triphosphate, IP_3)和二酰基甘油(diacylglycerol, DAG)。IP_3从线粒体和内质网中动员钙离子,钙离子随后产生其自身的第二信使效应,例如平滑肌收缩和细胞分泌的变化。
图75-8. 细胞膜磷脂第二信使系统,某些激素通过该系统控制细胞功能。DAG,二酰基甘油;I P_3, 三磷酸肌醇;P|P_2, 磷脂酰肌醇二磷酸。
DAG是另一种脂质第二信使,它激活酶蛋白激酶C_i,然后磷酸化大量蛋白质,从而引发细胞的反应(图75-8)。除了这些效应外,DAG的脂质部分是花生四烯酸(arachidonic acid),它是前列腺素(prostaglandins)和其他局部激素的前体,这些激素在全身组织中引起多种效应。
钙-钙调蛋白第二信使系统
另一个第二信使系统在钙离子进入细胞时发挥作用。钙离子的进入可能由以下两种方式引发:(1) 膜电位变化打开钙通道,或 (2) 激素与膜受体相互作用打开钙通道。
进入细胞后,钙离子与蛋白质钙调蛋白(calmodulin)结合。这种蛋白质有四个钙结合位点,当其中三个或四个位点与钙结合时,钙调蛋白会改变其形状并启动细胞内的多种效应,包括激活或抑制蛋白激酶(protein kinases)。钙调蛋白依赖性蛋白激酶的激活通过磷酸化(phosphorylation)作用,导致参与细胞对激素反应的蛋白质被激活或抑制。例如,钙调蛋白的一个特定功能是激活肌球蛋白轻链激酶(myosin light chain kinase),该酶直接作用于平滑肌的肌球蛋白(myosin),引起平滑肌收缩(见图8-3)。
在体内大多数细胞中,正常的钙离子浓度为10-8至10-7mol/L,这不足以激活钙调蛋白系统。然而,当钙离子浓度上升到10-6至10-5mol/L时,足够的结合会发生,从而引发钙调蛋白的所有细胞内作用。这与骨骼肌中激活肌钙蛋白C(troponin C)所需的钙离子变化量几乎完全相同,肌钙蛋白C会引起骨骼肌收缩,如第7章所述。有趣的是,肌钙蛋白C在功能和蛋白质结构上都与钙调蛋白相似。
主要作用于细胞遗传机制的激素
类固醇激素增加蛋白质合成
激素作用的另一种方式,尤其是类固醇激素,是促进靶细胞中的蛋白质合成。这些蛋白质随后作为酶、转运蛋白或结构蛋白发挥作用,从而提供细胞的其他功能。
类固醇激素的作用顺序基本上如下(见图75-6):
- 类固醇激素穿过细胞膜扩散进入细胞质,在那里与特定的受体蛋白结合。
- 受体蛋白-激素复合物随后扩散或转运进入细胞核。
- 该复合物结合在染色体DNA链上的特定位点,激活特定基因的转录过程,形成mRNA。
- mRNA扩散到细胞质中,在核糖体上促进翻译过程,形成新的蛋白质。
举个例子,醛固酮(aldosterone)是肾上腺皮质分泌的一种激素,它进入肾小管细胞的细胞质,这些细胞含有一种特定的受体蛋白,通常称为盐皮质激素受体(mineralocorticoid receptor)。因此,在这些细胞中,上述事件顺序会发生。大约45分钟后,蛋白质开始在肾小管细胞中出现,并促进钠从肾小管重吸收和钾分泌到肾小管中。因此,类固醇激素的完全作用通常至少延迟45分钟,甚至可能持续数小时或数天。这与某些肽类和氨基酸衍生激素(如血管加压素(vasopressin)和去甲肾上腺素(norepinephrine))的快速作用形成鲜明对比。
甲状腺激素增加细胞核中的基因转录
甲状腺激素甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)通过细胞核中的特定基因增加转录。为了实现这种转录增加,这些激素首先直接与细胞核中的受体蛋白结合,如第77章所述(见图77-5);这些受体是位于染色体复合物中的激活转录因子,它们控制基因启动子的功能,如第3章所述。
甲状腺激素在细胞核中功能的以下两个特征很重要:
- 它们激活合成多种细胞内蛋白质的遗传机制——可能有100种或更多。许多这些细胞内蛋白质是酶,它们促进体内几乎所有细胞的细胞内代谢活动增强。
- 一旦与核内受体结合,甲状腺激素可以持续表达其控制功能数天甚至数周。
血液中激素浓度的测量
大多数激素在血液中的含量极低;有些浓度低至每毫升十亿分之一毫克(1皮克)。因此,用通常的化学方法很难测量这些浓度。然而,Rosalyn Yalow和Solomon Berson在1959年开发了一种极其灵敏的方法,称为放射免疫测定法(radioimmunoassay),彻底改变了激素、其前体及其代谢终产物的测量。最近,还开发了其他方法,如酶联免疫吸附测定(enzyme-linked immunosorbent assays),用于准确、高通量的激素测量。
放射免疫测定法
进行放射免疫测定的方法如下。首先,产生一种对要测量的激素高度特异性的抗体。
其次,将少量这种抗体(1)与含有待测激素的动物体液混合,并(2)同时与适量用放射性同位素标记的纯化标准激素混合。然而,必须满足一个特定条件。抗体的量必须不足以完全结合放射性标记的激素和待测体液中的激素。因此,待测体液中的天然激素和放射性标准激素竞争抗体的结合位点。在竞争过程中,两种激素(天然激素和放射性激素)的结合量与其在待测体液中的浓度成正比。
第三,在结合达到平衡后,将抗体-激素复合物与溶液的其余部分分离,并通过放射性计数技术测量该复合物中结合的放射性激素的量。如果大量放射性激素与抗体结合,则表明只有少量天然激素与放射性激素竞争,因此待测体液中天然激素的浓度较低。相反,如果只有少量放射性激素结合,则表明有大量天然激素竞争结合位点。
图75-9. 醛固酮放射免疫测定的标准曲线。(由Manis Smith博士提供)
第四,为了使测定具有高度定量性,还需要对未标记激素的“标准”溶液在多个浓度水平上进行放射免疫测定程序。然后绘制“标准曲线”,如图75-9所示。通过将“未知”测定程序中记录的放射性计数与标准曲线进行比较,可以在10%到15%的误差范围内确定“未知”测定液体中激素的浓度。通常可以通过这种方式测定少至十亿分之一甚至万亿分之一克的激素。
酶联免疫吸附测定
酶联免疫吸附测定(Enzyme-linked immunosorbent assays, ELISAs)可用于测量几乎所有蛋白质,包括激素。该测试结合了抗体的特异性和简单酶测定的敏感性。图75-10显示了该方法的基本要素,该方法通常在具有96个小孔的塑料板上进行。每个孔都涂有特异性针对待测激素的抗体(AB_1)。将样品或标准品添加到每个孔中,然后加入第二种抗体(AB_2),该抗体也特异性针对激素,但结合在激素分子的不同位点上。加入的第三种抗体(AB_3)识别AB_2,并与一种酶偶联,该酶将合适的底物转化为可以通过比色或荧光光学方法轻松检测的产物。
由于每个酶分子催化形成数千个产物分子,因此即使少量的激素分子也可以被检测到。与竞争性放射免疫测定方法相比,ELISA方法使用过量的抗体,因此所有激素分子都被捕获在抗体-激素复合物中。因此,样品或标准品中存在的激素量与形成的产物量成正比。
ELISA方法在临床和研究实验室中得到了广泛应用,因为(1)它不使用放射性同位素,(2)大部分测定可以使用96孔板自动化进行,(3)它已被证明是一种经济有效且准确的评估激素水平的方法。
图75-10. 用于测量激素(H)浓度的酶联免疫吸附测定的基本原理。A B_1和A B_2是在不同结合位点识别激素的抗体,A B_3是识别A B_2的抗体。E是与A B_3偶联的酶,它催化底物(S)形成有色荧光产物(P)。产物的量使用光学方法测量,并且如果孔中有过量抗体,则与孔中激素的量成正比。
垂体激素及其下丘脑控制
垂体腺及其与下丘脑的关系
垂体腺的前叶与后叶
垂体腺(图76-1),也称为脑下垂体,是一个小腺体——直径约1厘米,重量在0.5至1克之间——位于脑底的蝶鞍(sella turcica)中,并通过垂体柄(pituitary stalk)与下丘脑相连。从生理学角度来看,垂体腺可分为两个不同的部分:前叶垂体(anterior pituitary),也称为腺垂体(adenohypophysis),和后叶垂体(posterior pituitary),也称为神经垂体(neurohypophysis)。在这两部分之间有一个相对无血管的区域,称为中间部(pars intermedia),在人类中发育较差,但在某些动物中较大且功能更强。
从胚胎学角度来看,垂体的两个部分起源于不同的来源——前叶垂体来自Rathke囊(Rathke’s pouch),这是咽部上皮的胚胎内陷,而后叶垂体则来自下丘脑的神经组织突起。前叶垂体来自咽部上皮的起源解释了其细胞的上皮样性质,而后叶垂体来自神经组织的起源解释了该腺体中大量胶质型细胞的存在。
前垂体分泌六种主要的肽类激素(peptide hormones)以及几种重要性尚不明确的其他激素,后垂体则分泌两种重要的肽类激素。
前垂体激素在控制全身代谢功能中起主要作用,如图76-2所示。
- 生长激素通过影响蛋白质形成、细胞增殖和细胞分化促进全身生长。
- 促肾上腺皮质激素(adrenocorticotropic hormone, corticotropin)控制部分肾上腺皮质激素的分泌,这些激素影响葡萄糖、蛋白质和脂肪的代谢。
- 促甲状腺激素(thyroid-stimulating hormone, thyrotropin)控制甲状腺分泌甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)的速率,这些激素控制体内大多数细胞内化学反应的速率。
- 催乳素(prolactin)促进乳腺发育和乳汁分泌。
- 两种独立的促性腺激素(gonadotropic hormones),即促卵泡激素(follicle-stimulating hormone)和黄体生成素(luteinizing hormone),控制卵巢和睾丸的生长以及它们的激素和生殖活动。
后垂体分泌的两种激素则发挥其他作用。
- 抗利尿激素(antidiuretic hormone, 也称为血管加压素vasopressin)控制水排泄到尿液中的速率,从而帮助控制体液中的水浓度。
- 催产素(oxytocin)在哺乳期间帮助将乳汁从乳腺腺体排出到乳头,并在妊娠末期帮助分娩。
前垂体含有几种不同类型的细胞,这些细胞合成和分泌激素。通常,前垂体中每种主要激素都由一种细胞类型形成。通过与特定激素结合的高亲和力抗体附着的特殊染色,至少可以区分出五种细胞类型(图76-3)。表76-1总结了这些细胞类型、它们产生的激素及其生理作用。这五种细胞类型如下:
图76-1. 垂体。
图76-2. 前垂体激素的代谢功能。ACH,肾上腺皮质激素。
- 生长激素细胞(somatotropes)——人类生长激素(human growth hormone, hGH)
- 促肾上腺皮质激素细胞(corticotropes)——促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)
- 促甲状腺激素细胞(thyrotropes)——促甲状腺激素(thyroid-stimulating hormone, TSH)
- 促性腺激素细胞(gonadotropes)——促性腺激素(gonadotropic hormones),包括黄体生成素(luteinizing hormone, LH)和促卵泡激素(follicle-stimulating hormone, FSH)
- 催乳素细胞(lactotropes)——催乳素(prolactin, PRL)
前垂体细胞中约30%至40%是分泌生长激素(growth hormone, GH)的生长激素细胞,约20%是分泌ACTH的促肾上腺皮质激素细胞。其他每种细胞类型仅占总数的3%至5%;然而,它们分泌的强效激素控制着甲状腺功能、性功能和乳腺的乳汁分泌。
生长激素细胞对酸性染料染色强烈,因此被称为嗜酸性细胞(acidophils)。因此,分泌大量hGH的垂体肿瘤被称为嗜酸性肿瘤(acidophilic tumors)。
垂体后叶激素由下丘脑的细胞体合成。分泌垂体后叶激素的细胞体并不位于垂体腺中,而是位于下丘脑的视上核和室旁核中的大型神经元,称为大细胞神经元(magnocellular neurons)。这些激素随后通过神经元的轴浆(axoplasm)从下丘脑运输到垂体后叶。这一机制将在本章后面讨论。
图76-3. 垂体前叶的细胞结构。(改编自Guyton AC: Physiology of the Human Body, 第6版. 费城: Saunders College Publishing, 1984.)
下丘脑控制垂体分泌
几乎所有的垂体分泌都受到来自下丘脑的激素或神经信号的控制。事实上,当垂体从其正常位置(下丘脑下方)移除并移植到身体的其他部位时,其各种激素(除了催乳素)的分泌率会降至非常低的水平。
垂体后叶的分泌由起源于下丘脑并终止于垂体后叶的神经信号控制。相比之下,垂体前叶的分泌则由称为下丘脑释放激素和下丘脑抑制激素(或因子)的激素控制,这些激素在下丘脑内分泌,然后通过称为下丘脑-垂体门脉血管(hypothalamic-hypophysial portal vessels)的微小血管传导到垂体前叶,如图76-4所示。在垂体前叶,这些释放和抑制激素作用于腺体细胞以控制其分泌。这一控制系统将在本章的下一节中讨论。
下丘脑接收来自神经系统多个来源的信号。因此,当一个人暴露于疼痛时,部分疼痛信号会传递到下丘脑。同样,当一个人经历一些强烈的抑郁或兴奋情绪时,部分信号也会传递到下丘脑。表示愉快或不愉快气味的嗅觉刺激通过杏仁核直接或间接传递强信号到下丘脑。甚至血液中的营养物质、电解质、水和各种激素的浓度也会兴奋或抑制下丘脑的各个部分。因此,下丘脑是整合有关身体内部健康信息的中心,其中许多信息用于控制许多全球重要垂体激素的分泌。
表76-1 垂体前叶的细胞和激素及其生理功能
图76-4. 下丘脑-垂体门脉系统。
前叶垂体腺的下丘脑-垂体门脉血管
前叶垂体是一个高度血管化的腺体,腺细胞之间有广泛的毛细血管窦。
几乎所有进入这些窦的血液首先通过下丘脑下部的另一个毛细血管床。然后,血液通过小的下丘脑-垂体门脉血管流入前叶垂体的窦。图76-4显示了称为正中隆起的下丘脑最下部,它与垂体柄相连。正中隆起是下丘脑和前叶垂体之间的功能连接。小动脉穿透正中隆起,然后其他小血管返回到其表面,合并形成下丘脑-垂体门脉血管。这些血管沿着垂体柄向下流动,向前叶垂体的窦供血。
下丘脑释放和抑制激素分泌到正中隆起。下丘脑中的特殊神经元合成并分泌控制前叶垂体激素分泌的下丘脑释放和抑制激素。这些神经元起源于下丘脑的各个部分,并将其神经纤维发送到正中隆起和垂体柄中的下丘脑组织延伸部分——灰结节。
这些纤维的末端与中枢神经系统中的大多数末端不同,其功能不是将信号从一个神经元传递到另一个神经元,而是将下丘脑释放激素和抑制激素分泌到组织液中。这些激素立即被吸收到下丘脑-垂体门脉系统中,并直接输送到垂体前叶的窦状隙中。
表 76-2 控制垂体前叶分泌的下丘脑释放激素和抑制激素
ACTH, 促肾上腺皮质激素; FSH, 促卵泡激素; LH, 促黄体生成激素; TSH, 促甲状腺激素。
下丘脑释放激素和抑制激素控制垂体前叶的分泌。释放激素和抑制激素的功能是控制垂体前叶激素的分泌。对于大多数垂体前叶激素来说,释放激素是重要的,但对于催乳素来说,下丘脑抑制激素可能发挥更多的控制作用。表76-2中总结的主要下丘脑释放激素和抑制激素如下:
- 促甲状腺激素释放激素 (TRH),导致TSH的释放
- 促肾上腺皮质激素释放激素 (CRH),导致ACTH的释放
- 生长激素释放激素 (GHRH),导致GH的释放,以及生长激素抑制激素 (GHIH),也称为生长抑素,抑制GH的释放
- 促性腺激素释放激素 (GnRH),导致两种促性腺激素LH和FSH的释放
- 催乳素抑制激素 (PIH),也称为多巴胺,抑制催乳素的分泌
其他下丘脑激素包括一种刺激催乳素分泌的激素,可能还有其他抑制垂体前叶激素释放的激素。随着本章及后续章节中介绍的由这些激素控制的特定激素系统的讨论,每个更重要的下丘脑激素都将被详细讨论。
下丘脑的特定区域控制特定下丘脑释放激素和抑制激素的分泌。所有或大多数下丘脑激素在转运到垂体前叶之前,都在正中隆起(median eminence)的神经末梢分泌。对该区域进行电刺激会兴奋这些神经末梢,从而导致几乎所有下丘脑激素的释放。然而,产生这些正中隆起神经末梢的神经元细胞体位于下丘脑的其他离散区域或基底脑的密切相关的区域。
生长激素的生理功能
除生长激素(GH)外,所有主要的垂体前叶激素主要通过刺激靶腺体(包括甲状腺、肾上腺皮质、卵巢、睾丸和乳腺)发挥其主要作用。这些垂体激素的功能与各自靶腺体的功能密切相关,因此除GH外,它们的功能将在后续章节中与靶腺体一起讨论。然而,GH直接作用于身体的所有或几乎所有组织。
生长激素促进多种身体组织的生长
GH,也称为促生长激素(somatotropic hormone)或生长激素(somatotropin),是一种含有191个氨基酸的单链小蛋白质分子,分子量为22,005。它导致几乎所有能够生长的身体组织的生长。它促进细胞大小的增加和有丝分裂的增加,从而产生更多的细胞,并促进某些类型细胞(如骨生长细胞和早期肌肉细胞)的特异性分化。
图76-5显示了两只同窝生长大鼠的典型体重图表;一只每天注射GH,另一只不注射GH。该图显示,在生命早期甚至两只大鼠成年后,给予GH的大鼠的生长显著增强。在发育的早期阶段,接受治疗的大鼠的所有器官都按比例增大;成年后,大多数骨骼停止延长,但许多软组织继续生长。一旦长骨的骨骺与骨干融合,即使身体的其他许多组织可以继续生长,骨骼的进一步延长也无法发生。
图76-5. 每天注射生长激素的大鼠与正常同窝大鼠的体重增加比较。
生长激素具有多种代谢效应
除了其导致生长的一般效应外,GH还具有多种特定的代谢效应(图76-6),包括以下内容:(1) 增加大多数身体细胞中蛋白质合成的速率;(2) 增加脂肪组织中脂肪酸的动员,增加血液中的游离脂肪酸,并增加脂肪酸用于能量的使用;(3) 降低全身葡萄糖的利用率。因此,实际上,GH增强了身体蛋白质,减少了脂肪储存,并节约了碳水化合物。
生长激素促进组织中的蛋白质沉积
尽管生长激素增加蛋白质沉积的确切机制尚未完全了解,但已知一系列不同的效应,所有这些效应都可能导致蛋白质沉积的增加。
细胞膜氨基酸转运的增强。生长激素(GH)直接增强大多数氨基酸通过细胞膜进入细胞内部的转运。这增加了细胞内的氨基酸浓度,并被认为是至少部分导致蛋白质合成增加的原因。这种对氨基酸转运的控制类似于胰岛素在控制葡萄糖通过膜转运中的作用,如第68章和第79章所讨论的。
增强RNA翻译以促进核糖体蛋白质合成。即使细胞内的氨基酸浓度没有增加,GH仍然增加RNA的翻译,导致细胞质中的核糖体合成更多的蛋白质。
增加DNA的核转录以形成RNA。在更长时间(24-48小时)内,GH还刺激细胞核中DNA的转录,导致RNA数量的增加。如果有足够的能量、氨基酸、维生素和其他生长所需的物质,这将促进更多的蛋白质合成和生长。从长远来看,这可能是GH最重要的功能。
图76-6. 生长激素和胰岛素样生长因子-1(IGF-1)对生长和代谢的影响。生长激素的分泌受到生长激素释放激素(GHRH)的刺激,并受到生长抑素(SST)以及生长激素和IGF-1对垂体前叶和下丘脑神经元的负反馈效应的抑制。控制生长激素分泌的其他因素见表76-3。
表76-3 刺激或抑制生长激素分泌的因素
<html><body><table><tr><td>刺激生长激素分泌</td><td>抑制生长激素分泌</td></tr><tr><td>血糖水平降低 血液游离脂肪酸水平降低</td><td>血糖水平升高 血液游离脂肪酸水平升高</td></tr><tr><td>血液氨基酸水平升高(精氨酸) 饥饿或禁食,</td><td>衰老 肥胖 生长激素抑制</td></tr><tr><td>蛋白质缺乏 创伤、压力、兴奋 运动 睾酮、雌激素</td><td>激素(生长抑素) 生长激素</td></tr><tr><td>深度睡眠(第2和第4阶段) 生长激素释放激素 胃饥饿素</td><td>(外源性) 胰岛素样生长因子(生长调节素)</td></tr></table></body></html>
减少蛋白质和氨基酸的分解代谢。除了增加蛋白质合成外,GH还减少细胞蛋白质的分解。这种减少的一个可能原因是GH还从脂肪组织中动员大量游离脂肪酸,这些脂肪酸用于供应身体细胞的大部分能量,从而作为一种有效的“蛋白质节约剂”。
总结:GH增强了细胞对氨基酸摄取和蛋白质合成的几乎所有方面,同时减少了蛋白质的分解。
生长激素增强脂肪利用以提供能量
GH 具有特定的作用,可以促使脂肪组织释放脂肪酸,从而增加体液中脂肪酸的浓度。此外,在全身组织中,GH 增强了脂肪酸向乙酰辅酶 A (acetyl-CoA) 的转化及其随后的能量利用。因此,在 GH 的影响下,脂肪优先于碳水化合物和蛋白质被用于能量供应。
GH 促进脂肪利用的能力,加上其蛋白质合成代谢作用,导致瘦体重增加。然而,GH 引起的脂肪动员需要数小时才能发生,而在 GH 的影响下,蛋白质合成的增强可以在几分钟内开始。
过量生长激素的“生酮”效应。在过量 GH 的影响下,脂肪从脂肪组织中的动员有时会变得如此之大,以至于肝脏形成大量乙酰乙酸并释放到体液中,从而引起酮症。这种脂肪从脂肪组织中的过度动员也经常导致脂肪肝。
生长激素减少碳水化合物的利用
GH 对碳水化合物代谢有多种影响,包括:(1) 减少骨骼肌和脂肪等组织中的葡萄糖摄取,(2) 增加肝脏的葡萄糖生成,以及 (3) 增加胰岛素分泌。
这些变化中的每一个都是由于 GH 诱导的“胰岛素抵抗”所致,这种抵抗减弱了胰岛素在骨骼肌和脂肪组织中刺激葡萄糖摄取和利用的作用,以及抑制肝脏的糖异生(葡萄糖生成)的作用;这导致血糖浓度升高和胰岛素分泌的代偿性增加。由于这些原因,GH 的作用被称为致糖尿病性,GH 的过量分泌可以产生类似于 2 型(非胰岛素依赖型)糖尿病患者的代谢紊乱,这些患者也对胰岛素的代谢作用具有抵抗性。然而,GH 分泌过多的肢端肥大症患者通常较瘦,内脏脂肪较少,而 2 型糖尿病患者通常超重,内脏脂肪过多,这推动了胰岛素抵抗。
我们尚不清楚 GH 导致胰岛素抵抗和细胞葡萄糖利用减少的确切机制。然而,GH 诱导的脂肪分解增加和血液中脂肪酸浓度的升高可能有助于削弱胰岛素对组织葡萄糖利用的作用。实验研究表明,将血液中的脂肪酸水平提高到正常水平以上会迅速降低肝脏和骨骼肌对胰岛素在碳水化合物代谢中作用的敏感性。
胰岛素和碳水化合物对生长激素促生长作用的必要性
GH 无法在缺乏胰腺的动物中引起生长;如果饮食中排除碳水化合物,GH 也无法引起生长。因此,足够的胰岛素活性和足够的碳水化合物供应是 GH 发挥作用的必要条件。对碳水化合物和胰岛素的部分需求是为了提供生长代谢所需的能量,但似乎还有其他作用。特别重要的是胰岛素增强某些氨基酸进入细胞的能力,就像它刺激葡萄糖转运一样。
生长激素刺激软骨和骨骼生长
尽管生长激素(GH)几乎能刺激体内所有组织的蛋白质沉积和生长增加,但其最显著的作用是促进骨骼框架的生长。这是由于生长激素对骨骼的多重作用,包括:(1) 通过软骨细胞(chondrocytic)和成骨细胞(osteogenic cells)增加蛋白质沉积,从而促进骨骼生长;(2) 增加这些细胞的繁殖速率;(3) 将软骨细胞转化为成骨细胞的特定作用,从而导致新骨的沉积。
骨骼生长主要有两种机制。首先,在GH的刺激下,长骨在骨骺软骨(epiphyseal cartilages)处生长,骨骺(epiphyses)位于骨的两端,与骨干(shaft)分离。这种生长首先导致新软骨的沉积,随后转化为新骨,从而使骨干延长并将骨骺推得越来越远。同时,骨骺软骨逐渐被消耗,因此到了青春期晚期,骨骺软骨不再提供长骨的进一步生长。此时,骨干与骨骺之间发生骨性融合(bony fusion),因此长骨无法进一步延长。
其次,骨膜(periosteum)和某些骨腔中的成骨细胞(osteoblasts)在旧骨表面沉积新骨。同时,骨中的破骨细胞(osteoclasts)(在第80章详细讨论)会移除旧骨。当沉积速率大于吸收速率时,骨的厚度增加。生长激素强烈刺激成骨细胞。因此,在GH的影响下,骨骼可以在一生中继续增厚;这对于膜性骨(membranous bones)尤其明显。例如,下颌骨可以在青春期后继续生长,导致下巴和下牙向前突出。同样,颅骨可以增厚并在眼睛上方形成骨性突起。
生长激素通过胰岛素样生长因子(生长调节素)发挥其大部分作用
GH促使肝脏(以及其他组织,但程度较轻)形成几种称为胰岛素样生长因子(insulin-like growth factors, IGFs,也称为生长调节素(somatomedins))的小蛋白质,这些蛋白质介导了GH的部分生长和代谢作用(图76-6)。
目前已分离出至少四种IGFs,但其中最重要的是IGF-1(生长调节素C)。IGF-1的分子量约为7500,其在血浆中的浓度与GH分泌速率密切相关。
IGF缺乏的儿童即使GH分泌正常或升高,也无法正常生长。例如,非洲的俾格米人(pygmy peoples)由于先天性无法合成大量IGF-1而身材矮小。尽管他们的血浆GH浓度正常或偏高,但血浆中IGF-1的含量减少,这显然是这些人身材矮小的原因。其他一些侏儒症患者(如Laron综合征)也有类似的问题,通常是由于GH受体突变导致GH无法刺激IGF-1的形成。
据推测,GH(生长激素,Growth Hormone)的大部分生长效应是由IGF-1(胰岛素样生长因子-1,Insulin-like Growth Factor-1)和其他IGF(胰岛素样生长因子,Insulin-like Growth Factors)介导的,而不是GH直接作用于骨骼和其他外周组织的结果。即便如此,实验表明,将GH直接注射到活体动物的骨骺软骨中会导致这些软骨区域的生长,而所需的GH量非常微小。这一发现的一个可能解释是,GH可以在局部组织中形成足够的IGF-1,从而引起局部生长。然而,GH还具有不依赖IGF的效应,能够刺激某些组织(如软骨的软骨细胞)的生长。
生长激素的短效作用与IGF-1的长效作用。GH与血液中的血浆蛋白结合较弱,因此它会迅速从血液中释放到组织中,在血液中的半衰期不到20分钟。相比之下,IGF-1与血液中的一种载体蛋白紧密结合,这种载体蛋白与IGF-1一样,是在GH的作用下产生的。因此,IGF-1从血液中缓慢释放到组织中,半衰期约为20小时。这种缓慢释放大大延长了GH分泌爆发所促进的生长效应,如图76-7所示。
图76-7。一天中生长激素分泌的典型变化,展示了剧烈运动的特别强大效应,以及深度睡眠前几小时内生长激素分泌的高速率。
生长激素分泌的调节
青春期后,GH的分泌随着年龄增长而缓慢减少,最终在老年时降至青春期水平的约25%。
GH以脉冲模式分泌,呈现增加和减少的波动。控制GH分泌的确切机制尚未完全阐明,但已知与个体的营养状态或应激状态相关的几个因素会刺激其分泌:(1) 饥饿,尤其是严重蛋白质缺乏时;(2) 低血糖或血液中脂肪酸浓度低;(3) 运动;(4) 兴奋;(5) 创伤;(6) 胃在餐前分泌的一种激素——胃饥饿素(ghrelin);以及(7) 一些氨基酸,包括精氨酸。GH在深度睡眠的前2小时内也会显著增加,如图76-7所示。表76-3总结了已知影响生长激素分泌的一些因素。
成人血浆中GH的正常浓度在1.6至3ng/ml之间;儿童或青少年约为6~ng/ml。在长期饥饿导致体内蛋白质或碳水化合物储备耗尽后,这些值可能增加到高达50ng/ml。
在急性情况下,低血糖比蛋白质摄入的急性减少更能强烈刺激GH分泌。相反,在慢性情况下,GH的分泌似乎与细胞蛋白质的消耗程度更相关,而不是与葡萄糖不足的程度相关。例如,饥饿期间极高的GH水平与蛋白质消耗量密切相关。
图76-8展示了蛋白质缺乏对血浆生长激素(GH)的影响,以及随后在饮食中添加蛋白质的效果。第一列显示了在蛋白质营养不良(kwashiorkor)状态下,极端蛋白质缺乏的儿童中GH水平非常高;第二列显示了同一组儿童在饮食中添加足够碳水化合物治疗3天后的GH水平,表明碳水化合物并未降低血浆GH浓度。
图76-8. 极端蛋白质缺乏对疾病kwashiorkor中血浆生长激素浓度的影响。图中还显示了碳水化合物治疗未能降低GH浓度,而蛋白质治疗则有效降低了GH浓度。(数据来自Pimstone B L, Barbezat \scriptstyle G, Hansen \mathcalID, 等:蛋白质-热量营养不良中生长激素分泌的研究。Am J Clin Nutr 21:482, 1968。)
第三列和第四列分别显示了在补充蛋白质治疗3天和25天后的GH水平,伴随着激素水平的下降。
这些结果表明,在严重的蛋白质营养不良条件下,仅靠足够的热量不足以纠正GH的过量产生。必须同时纠正蛋白质缺乏,才能使GH浓度恢复正常。
下丘脑生长激素释放激素(GHRH)促进生长激素分泌,而生长抑素抑制生长激素分泌
从前述影响GH分泌的多种因素的描述中,可以理解生理学家在试图解开GH分泌调节之谜时的困惑。已知GH分泌受下丘脑分泌的两种因子调控,这些因子通过下丘脑-垂体门脉系统运输到垂体前叶。它们是生长激素释放激素(GHRH)和生长激素抑制激素(也称为生长抑素)。这两种激素都是多肽;GHRH由44个氨基酸组成,生长抑素由14个氨基酸组成。
下丘脑的弓状核和腹内侧核中的神经元分泌GHRH;这是下丘脑中对血糖浓度敏感的区域,导致高血糖状态下的饱腹感和低血糖状态下的饥饿感。生长抑素的分泌由下丘脑附近的室周神经元控制。因此,可以合理地推测,某些调节个体进食行为的信号也会改变GH的分泌速率。
类似地,描绘情绪、压力和创伤的下丘脑信号都可以影响下丘脑对GH分泌的调控。事实上,实验表明,儿茶酚胺、多巴胺和5-羟色胺(每种都由下丘脑中的不同神经元系统释放)都会增加GH的分泌速率。
大多数对GH(生长激素)分泌的控制可能是通过GHRH(生长激素释放激素)而不是通过抑制性激素生长抑素介导的。GHRH通过与垂体GH细胞外表面的特定细胞膜受体结合来刺激GH分泌。这些受体激活细胞膜内的腺苷酸环化酶系统,增加细胞内环磷酸腺苷(cAMP)的水平。这种增加具有短期和长期效应。短期效应是增加钙离子向细胞内的转运;在几分钟内,这种增加导致GH分泌囊泡与细胞膜融合并将激素释放到血液中。长期效应是通过基因增加细胞核内的转录以刺激新GH的合成。
当GH在数小时内直接注入动物血液时,内源性GH分泌速率会降低。这种降低表明GH分泌受到典型的负反馈控制,正如几乎所有激素一样。这种反馈机制的性质以及它主要是通过抑制GHRH还是增强抑制生长激素分泌的生长抑素来介导的尚不确定。
总之,我们对GH分泌调节的了解还不足以描述一个完整的图景。然而,由于GH在饥饿期间的极度分泌及其促进蛋白质合成和组织生长的重要长期效应,我们可以提出以下假设:GH分泌的主要长期控制因素是组织的长期营养状态,特别是它们的蛋白质营养水平。也就是说,营养缺乏或组织对细胞蛋白质的过度需求——例如,在剧烈运动后肌肉的营养状态受到压力时——以某种方式增加了GH的分泌速率。反过来,GH促进新蛋白质的合成,同时保护细胞中已经存在的蛋白质。
生长激素分泌异常
全垂体功能减退症——所有垂体前叶激素分泌减少。全垂体功能减退症患者所有垂体前叶激素分泌减少可能是先天性的(出生时就存在),也可能在生命中的任何时间突然或缓慢发生,最常见的原因是破坏垂体的垂体肿瘤。
成人全垂体功能减退症。首次发生在成年的全垂体功能减退症通常由以下三种异常之一引起。两种肿瘤性疾病,颅咽管瘤或嫌色细胞瘤,可能会压迫垂体,直到功能性垂体前叶细胞完全或几乎完全被破坏。第三个原因是垂体血管血栓形成。这种异常偶尔发生在新妈妈在分娩后经历循环休克时。
成人全垂体功能减退症(panhypopituitarism)的一般影响包括:(1)甲状腺功能减退(hypothyroidism),(2)肾上腺皮质醇(glucocorticoids)分泌减少,以及(3)促性腺激素(gonadotropic hormones)分泌受抑制,导致性功能丧失。因此,患者表现为嗜睡(由于缺乏甲状腺激素)、体重增加(由于缺乏生长激素、促肾上腺皮质激素、肾上腺皮质激素和甲状腺激素的脂肪动员作用)以及性功能完全丧失。除了异常的性功能外,患者通常可以通过给予肾上腺皮质激素和甲状腺激素得到满意的治疗。
儿童期全垂体功能减退症与侏儒症。大多数侏儒症病例是由于儿童期前垂体分泌全面缺乏(全垂体功能减退症)所致。一般来说,身体各部位的发育比例适当,但发育速度大大减慢。一个10岁的孩子可能只有4到5岁孩子的身体发育水平,而20岁时可能只有7到10岁孩子的身体发育水平。
全垂体功能减退性侏儒症患者不会经历青春期,也从未分泌足够的促性腺激素来发展成人的性功能。然而,在三分之一的此类侏儒症患者中,只有生长激素(GH)缺乏;这些人确实会性成熟,偶尔还能生育。在Laron侏儒症和非洲俾格米人中,GH的分泌率正常或较高,但由于GH受体突变或遗传性无法形成IGF-1(GH促进生长的关键步骤),对GH的反应性受损。
人类生长激素治疗。不同动物物种的生长激素彼此之间差异很大,以至于它们只能在一种物种或最多在密切相关的物种中引起生长。因此,从其他动物(除了在某种程度上从灵长类动物)制备的GH对人类无效。因此,人类的GH被称为人类生长激素(hGH),以区别于其他物种的GH。
过去,由于GH必须从人类垂体中制备,因此很难获得足够的量来治疗GH缺乏患者,除非在实验基础上。然而,由于重组DNA技术的成功应用,现在可以通过Escherichia coli细菌合成hGH。因此,这种激素现在可以用于治疗目的。如果早期治疗,纯GH缺乏的侏儒症患者可以完全治愈。
青春期前的巨人症和生长激素过量。偶尔,前垂体的嗜酸性GH产生细胞会变得过度活跃,有时甚至会在腺体中发生嗜酸性肿瘤。结果,产生大量的GH。所有身体组织,包括骨骼,都会迅速生长。如果这种情况发生在青春期之前,长骨的骨骺尚未与骨干融合,身高会增加,使患者成为巨人——高达8英尺。
巨人通常有高血糖症,由于高血糖症导致胰岛β细胞过度活跃,容易退化。因此,大约10%的巨人最终会发展为完全成熟的糖尿病。
在大多数巨人症患者中,如果未经治疗,最终会发展为全垂体功能减退(panhypopituitarism),因为巨人症通常是由垂体腺肿瘤引起的,肿瘤会不断生长直至破坏腺体。这种最终的垂体激素普遍缺乏通常会导致患者在成年早期死亡。然而,一旦诊断出巨人症,通常可以通过显微手术切除肿瘤或对垂体腺进行放射治疗来阻止进一步的效应。
青春期后的肢端肥大症和生长激素过量
如果在青春期后——即长骨的骨骺与骨干融合后——发生嗜酸性肿瘤,患者的身高不会继续增长,但骨骼会变厚,软组织会继续生长。这种情况如图76-9所示,被称为肢端肥大症(acromegaly)。骨骼的增大在手和脚的骨骼以及膜性骨(包括颅骨、鼻子、额头的隆起、眶上嵴、下颌骨和部分椎骨)中尤为明显,因为这些骨骼的生长在青春期后并未停止。因此,下颌向前突出,有时可达半英寸,由于眶上嵴的过度发育,额头向前倾斜,鼻子增大到正常大小的两倍,脚需要穿14号或更大的鞋子,手指变得极度增厚,以至于手的大小几乎是正常的两倍。除了这些效应外,椎骨的改变通常会导致驼背,临床上称为脊柱后凸(kyphosis)。最后,许多软组织器官,如舌头、肝脏,尤其是肾脏,会显著增大。
生长激素分泌减少可能导致与衰老相关的变化
在失去分泌生长激素(GH)能力的人群中,衰老过程的某些特征会加速。例如,一个50岁且多年缺乏GH的人可能看起来像65岁或更老的人。这种衰老的外观似乎主要是由于身体大多数组织中蛋白质沉积减少和脂肪沉积增加所致。生理效应包括皮肤皱纹增加、某些器官功能下降以及肌肉质量和力量减少。
随着年龄的增长,正常人的平均血浆生长激素浓度大致变化如下:
<html><body><table><tr><td>年龄(岁)</td><td>ng/ml</td></tr><tr><td>5至20</td><td>6</td></tr><tr><td>20至40</td><td></td></tr><tr><td>40至70</td><td>1.6</td></tr></table></body></html>
因此,某些正常的衰老效应可能是由于生长激素分泌减少所致。事实上,一些关于老年人使用生长激素治疗的研究已经证明了三个重要的有益效果:(1) 体内蛋白质沉积增加,尤其是在肌肉中;(2) 脂肪沉积减少;(3) 感觉精力增加。然而,其他研究表明,使用重组GH治疗老年患者可能会产生一些不良副作用,包括胰岛素抵抗和糖尿病、水肿、腕管综合征和关节痛(arthralgias)。因此,通常不建议对内分泌功能正常的健康老年患者使用重组GH治疗。
图76-9. 肢端肥大症患者。(由Vishnu Garla博士提供。)
垂体后叶及其与下丘脑的关系
垂体后叶(posterior pituitary gland),也称为神经垂体(neurohypophysis),主要由称为垂体细胞(pituicytes)的胶质样细胞组成。垂体细胞不分泌激素;它们仅作为大量神经纤维末梢和神经末梢的支持结构,这些神经纤维来自下丘脑的视上核(supraoptic nuclei)和室旁核(paraventricular nuclei),如图76-10所示。这些神经束通过垂体柄(pituitary stalk,hypophysial stalk)进入神经垂体。神经末梢呈球状膨大,含有许多分泌颗粒。这些末梢位于毛细血管表面,分泌两种垂体后叶激素:(1)抗利尿激素(antidiuretic hormone, ADH),也称为血管加压素(vasopressin),和(2)催产素(oxytocin)。
如果垂体柄在垂体上方被切断,但整个下丘脑保持完整,垂体后叶激素在短暂减少几天后仍能正常分泌;这些激素随后由下丘脑内切断的纤维末端分泌,而不是由垂体后叶的神经末梢分泌。原因是这些激素最初在视上核和室旁核的细胞体中合成,然后与称为神经垂体素(neurophysins)的“载体”蛋白结合,运输到垂体后叶的神经末梢,需要几天时间才能到达垂体。
ADH主要在视上核中形成,而催产素主要在室旁核中形成。每个核可以合成其主要激素的约六分之一的第二种激素。
当神经冲动从视上核或室旁核沿神经纤维向下传递时,激素通过通常的胞吐分泌机制立即从神经末梢的分泌颗粒中释放,并被邻近的毛细血管吸收。神经垂体素和激素一起分泌,但由于它们之间的结合较为松散,激素几乎立即分离。神经垂体素在离开神经末梢后没有已知的功能。
抗利尿激素和催产素的化学结构
催产素和ADH(血管加压素)都是多肽,每种含有九个氨基酸。它们的氨基酸序列如下:
血管加压素:Cys-Tyr-Phe-Gln-Asn-Cys-Pro-ArgGlyNH_2
催产素:Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu \cdotGlyNH_2
注意,这两种激素几乎完全相同,只是在血管加压素中,苯丙氨酸和精氨酸取代了催产素分子中的异亮氨酸和亮氨酸。分子的相似性解释了它们部分功能的相似性。
抗利尿激素的生理功能
注射极微量的ADH(抗利尿激素)——小至2纳克——即可导致肾脏减少水分排泄(抗利尿作用)。这种抗利尿效应将在第28章和第29章中讨论。简而言之,在缺乏ADH的情况下,集合管和导管对水几乎不渗透,这阻止了水的大量重吸收,从而导致水分大量流失到尿液中,同时也导致尿液极度稀释,这种情况称为中枢性尿崩症。相反,在高水平ADH存在的情况下,集合管和导管对水的渗透性大大增加,使得大部分水分在管状液体通过这些导管时被重吸收,从而在体内保存水分并产生非常浓缩的尿液。
图76-10. 下丘脑对后叶垂体的控制
在没有ADH的情况下,集合管的上皮细胞管腔膜对水几乎不渗透。然而,紧邻细胞膜内侧有大量特殊的囊泡,这些囊泡具有高度透水性的孔道,称为水通道蛋白(aquaporins)(见图28-19)。当ADH作用于细胞时,它首先与膜受体结合,激活腺苷酸环化酶,导致管状细胞质内形成cAMP。这种形成导致特殊囊泡中的元素磷酸化,从而使囊泡插入顶端细胞膜,从而提供许多高透水性区域。所有这些过程在5到10分钟内完成。然后,在缺乏ADH的情况下,整个过程在另外5到10分钟内逆转。因此,这一过程暂时提供了许多新的孔道,允许水从管状液体中自由扩散通过管状上皮细胞进入肾间质液。然后,水通过渗透作用从集合管和导管中被吸收,如第29章中关于肾脏尿液浓缩机制的讨论。
抗利尿激素产生的调节
细胞外液渗透压增加刺激ADH分泌。当向供应下丘脑的动脉中注射浓缩的电解质溶液时,视上核和室旁核中的ADH神经元立即传递冲动到后叶垂体,释放大量ADH进入循环血液,有时ADH分泌量可高达正常水平的20倍。相反,向该动脉注射稀释溶液会导致这些冲动停止,从而几乎完全停止ADH分泌。因此,体液中的ADH浓度可以在几分钟内从少量变为大量,反之亦然。
在下丘脑或其附近存在一种称为渗透压感受器(osmoreceptors)的改良神经元受体。当细胞外液变得过于浓缩时,液体会通过渗透作用从渗透压感受器细胞中被抽出,导致其体积减小,并启动下丘脑中的适当神经信号,从而引起额外的抗利尿激素(ADH)分泌。相反,当细胞外液变得过于稀释时,水会通过渗透作用向相反方向移动,进入细胞,从而减少ADH分泌的信号。尽管一些研究人员将这些渗透压感受器定位在下丘脑(在视上核中),但其他人认为它们位于第三脑室前腹壁(AV3V区域)中的血管器官(organum vasculosum),这是一个高度血管化的结构。如第29章所述,AV3V区域的损伤会大大削弱ADH的分泌,而电刺激或血管紧张素II的刺激则会增加ADH的分泌。
无论机制如何,浓缩的体液会刺激这些渗透压感受器和ADH分泌,而稀释的体液则会抑制它们,从而为控制体液的总渗透压提供了一个强大的反馈控制系统。关于ADH分泌的控制以及ADH在控制肾功能和体液渗透压中的作用,更多细节将在第29章中介绍。
低血容量和低血压刺激ADH分泌——ADH的血管收缩效应。虽然微量的ADH会导致肾脏增加水分保留,但较高浓度的ADH具有强烈的收缩全身小动脉的作用,从而增加动脉压。因此,ADH也被称为加压素(vasopressin)。
引起强烈ADH分泌的刺激之一是血容量减少。当血容量减少15%至25%或更多时,这种情况尤为明显;此时分泌速率有时会上升到正常水平的50倍。
心房具有被过度充盈所兴奋的牵张感受器。当它们兴奋时,会向大脑发送信号以抑制ADH分泌。相反,当这些感受器由于充盈不足而不兴奋时,情况则相反,ADH分泌会大大增加。颈动脉、主动脉和肺区域的压力感受器的牵张减少也会刺激ADH分泌。关于这种血容量-压力反馈机制的更多细节,请参阅第29章。
催产素的生理功能
催产素引起妊娠子宫的收缩。催产素(oxytocin)这一激素,正如其名,强烈刺激妊娠子宫的收缩,尤其是在妊娠末期。因此,许多产科医生认为这种激素至少部分负责引起婴儿的出生。这一观点得到了以下事实的支持:(1)在切除垂体的动物中,分娩时间延长,表明催产素在分娩过程中可能起作用;(2)在分娩过程中,血浆中的催产素含量增加,尤其是在最后阶段;(3)在妊娠动物中刺激子宫颈会引发神经信号,这些信号传递到下丘脑并导致催产素分泌增加。这些效应以及这种可能有助于分娩过程的机制将在第83章中更详细地讨论。
催产素(Oxytocin)有助于乳房排乳。催产素在泌乳(lactation)中也起着特别重要的作用——这一作用比其在分娩中的作用更为人所熟知。在泌乳过程中,催产素促使乳汁从乳腺泡(alveoli)排入乳腺导管(ducts),从而使婴儿能够通过吸吮获得乳汁。
这一机制的运作过程如下:乳头上的吸吮刺激通过感觉神经传递信号到下丘脑的室旁核(paraventricular nuclei)和视上核(supraoptic nuclei)中的催产素神经元,促使垂体后叶(posterior pituitary gland)释放催产素。催产素随后通过血液输送到乳房,在那里它引起位于乳腺泡外并形成网状结构的肌上皮细胞(myoepithelial cells)收缩。在吸吮开始后不到一分钟内,乳汁开始流出。这一机制被称为排乳反射(milk letdown)或排乳(milk ejection)。关于泌乳生理学的进一步讨论将在第83章中进行。
甲状腺代谢激素
甲状腺位于气管两侧和前方,紧靠喉部下方,是最大的内分泌腺之一,成人的正常重量为15至20克。甲状腺分泌两种主要的代谢激素,分别是甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine),通常分别称为T_4和T_3。这两种激素都能显著提高身体的代谢率。完全缺乏甲状腺分泌通常会导致基础代谢率下降至正常水平的40%至50%,而甲状腺分泌的极度过量则可以使基础代谢率增加至正常水平的60%至100%。甲状腺的分泌主要由垂体前叶分泌的促甲状腺激素(thyroid-stimulating hormone, TSH)控制。
甲状腺还分泌降钙素(calcitonin),这是一种参与钙代谢的激素,将在第80章讨论。
本章的目的是讨论甲状腺激素的形成和分泌、它们的代谢功能以及分泌的调节。
甲状腺代谢激素的合成与分泌
甲状腺分泌的代谢活性激素中,约93%是甲状腺素,7%是三碘甲状腺原氨酸。然而,几乎所有甲状腺素最终都会在组织中转化为三碘甲状腺原氨酸,因此两者在功能上都很重要。这两种激素的功能在性质上是相同的,但它们在作用的迅速性和强度上有所不同。三碘甲状腺原氨酸的效力约为甲状腺素的四倍,但它在血液中的含量要少得多,且与甲状腺素相比,它在体内的持续时间要短得多。
甲状腺的生理解剖
如图77-1所示,甲状腺由大量封闭的滤泡(直径100-300微米)组成,这些滤泡内充满了一种称为胶体(colloid)的分泌物质,并由立方上皮细胞排列,这些细胞向滤泡内部分泌。胶体的主要成分是大型糖蛋白甲状腺球蛋白(thyroglobulin),其中含有甲状腺激素。一旦分泌进入滤泡,它必须通过滤泡上皮重新吸收回血液中,才能在体内发挥作用。甲状腺的血液流量约为每分钟腺体重量的五倍,这是除了肾上腺皮质以外,身体任何其他区域都无法比拟的血液供应。
甲状腺还含有C细胞,这些细胞分泌降钙素,这是一种有助于调节血浆钙离子浓度的激素,将在第80章讨论。
甲状腺素的形成需要碘
为了形成正常量的甲状腺素,每年需要摄入约50mg的碘化物形式的碘,或约每周1毫克。为了防止碘缺乏,普通食盐通常以每100,000份氯化钠中加入1份碘化钠的比例进行碘化。
摄入碘化物的命运。口服摄入的碘化物从胃肠道吸收进入血液的方式与氯化物类似。通常情况下,大部分碘化物会迅速通过肾脏排出,但约有五分之一的碘化物会被甲状腺细胞选择性地从循环血液中移除,并用于甲状腺激素的合成。
碘泵-钠碘共转运体(碘捕获)
甲状腺激素形成的第一阶段,如图77-2所示,是从血液中运输碘化物到甲状腺腺细胞和滤泡中。甲状腺细胞的基底膜具有将碘化物主动泵入细胞内的特殊能力。这种泵送是通过钠-碘同向转运体(sodium-iodide symporter)的作用实现的,它共转运一个碘离子和两个钠离子穿过基底外侧(质膜)膜进入细胞。逆浓度梯度运输碘化物的能量来自钠-钾腺苷三磷酸酶(/N a+-K+ ATPase)泵,它将钠泵出细胞,从而建立低细胞内钠浓度和钠进入细胞的促进扩散梯度。
图77-1 甲状腺的解剖和显微外观,显示甲状腺球蛋白分泌到滤泡中。
这种在细胞内浓缩碘化物的过程称为碘化物捕获(iodide trapping)。在正常腺体中,碘化物泵将碘化物浓缩到血液中浓度的约30倍。当甲状腺活动达到最大时,这种浓度比可以上升到250倍。甲状腺捕获碘化物的速率受多种因素影响,最重要的是TSH的浓度;TSH刺激甲状腺细胞中的碘化物泵活性,而垂体切除术则大大降低其活性。
碘化物通过一种称为pendrin的氯-碘离子反向转运体分子从甲状腺细胞跨过顶膜运输到滤泡中。甲状腺上皮细胞还分泌含有酪氨酸氨基酸的甲状腺球蛋白到滤泡中,碘将与这些酪氨酸结合,如下一节所述。
图77-2 甲状腺细胞机制,显示碘运输、甲状腺素和三碘甲状腺原氨酸的形成,以及甲状腺素和三碘甲状腺原氨酸释放到血液中。DIT,二碘酪氨酸;ER,内质网;|-, ,碘离子;|2, 碘;MIT,单碘酪氨酸;NIs,钠-碘同向转运体;R T_3, 反三碘甲状腺原氨酸;T_3, 三碘甲状腺原氨酸;T_4, 甲状腺素;\sf T\odot, 甲状腺球蛋白。
甲状腺球蛋白以及甲状腺素和三碘甲状腺原氨酸的形成
甲状腺细胞形成和分泌甲状腺球蛋白。甲状腺细胞是典型的蛋白质分泌腺细胞,如图77-2所示。内质网和高尔基体合成并分泌一种称为甲状腺球蛋白的大糖蛋白分子到滤泡中,其分子量约为335,000。
每个甲状腺球蛋白分子含有约70个酪氨酸氨基酸,它们是结合碘形成甲状腺激素的主要底物。因此,甲状腺激素在甲状腺球蛋白分子内形成。也就是说,由酪氨酸氨基酸形成的甲状腺素和三碘甲状腺原氨酸在甲状腺激素合成过程中甚至作为储存激素在滤泡胶体中仍然是甲状腺球蛋白分子的一部分。
碘离子的氧化(Oxidation of the Iodide Ion)。甲状腺激素形成的第一步关键步骤是将碘离子转化为氧化形式的碘,即初生碘(I0)或I_3-,然后能够直接与氨基酸酪氨酸结合。这种碘的氧化是由过氧化物酶(peroxidase)及其伴随的过氧化氢促进的,它们提供了一个能够氧化碘化物的强大系统。过氧化物酶要么位于细胞的顶膜(apical membrane)上,要么附着在顶膜上,从而在细胞中甲状腺球蛋白分子从高尔基体(Golgi apparatus)发出并通过细胞膜进入储存的甲状腺胶质(thyroid gland colloid)的确切位置提供氧化碘。当过氧化物酶系统被阻断或当它在细胞中遗传性缺失时,甲状腺激素的形成速率降至零。
酪氨酸的碘化和甲状腺激素的形成——甲状腺球蛋白的"有机化"(Organification)。碘与甲状腺球蛋白分子的结合被称为甲状腺球蛋白的有机化。即使是分子形式的氧化碘也会直接但缓慢地与氨基酸酪氨酸结合。然而,在甲状腺细胞中,氧化碘与甲状腺过氧化物酶(thyroid peroxidase)相关(见图77-2),这使得该过程在几秒或几分钟内发生。因此,几乎与甲状腺球蛋白从高尔基体释放或通过顶膜分泌到滤泡(follicle)中的速度一样快,碘与甲状腺球蛋白分子中约六分之一的酪氨酸氨基酸结合。
图77-3显示了酪氨酸碘化的连续阶段以及甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)的最终形成。酪氨酸首先被碘化为单碘酪氨酸(monoiodotyrosine),然后被碘化为二碘酪氨酸(diiodotyrosine)。然后,在接下来的几分钟、几小时甚至几天内,越来越多的碘酪氨酸残基相互结合。
偶联反应(coupling reaction)的主要激素产物是甲状腺素(T_4)分子,当两个二碘酪氨酸分子结合在一起时形成;然后甲状腺素仍然是甲状腺球蛋白分子的一部分。或者一个单碘酪氨酸分子与一个二碘酪氨酸分子结合形成三碘甲状腺原氨酸(T_3),它约占最终激素的十五分之一。少量的反向T_3 (R T_3)是由二碘酪氨酸与单碘酪氨酸结合形成的,但RT_3似乎在人类中没有功能意义。
甲状腺球蛋白的储存(Storage of Thyroglobulin)。甲状腺在内分泌腺中具有储存大量激素的能力,这是不寻常的。在甲状腺激素的合成过程完成后,每个甲状腺球蛋白分子含有多达30个甲状腺素分子和几个三碘甲状腺原氨酸分子。以这种形式,甲状腺激素储存在滤泡中,其数量足以满足身体2到3个月的正常甲状腺激素需求。因此,当甲状腺激素的合成停止时,几个月内不会观察到缺乏的生理效应。
甲状腺素和三碘甲状腺原氨酸从甲状腺的释放(RELEASE OF THYROXINE AND TRIIODOTHYRONINE FROM THE THYROID GLAND)
大部分甲状腺球蛋白(thyroglobulin)不会释放到循环血液中;相反,甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)从甲状腺球蛋白分子上被切割下来,然后这些游离激素被释放。这一过程如下:甲状腺细胞的顶端表面伸出伪足延伸,包围一小部分胶质(colloid),形成进入甲状腺细胞顶端的胞饮小泡(pinocytic vesicles)。然后,细胞质中的溶酶体(lysosomes)立即与这些小泡融合,形成含有溶酶体消化酶和胶质的消化小泡(digestive vesicles)。酶中的多种蛋白酶(proteases)消化甲状腺球蛋白分子,释放出游离形式的甲状腺素和三碘甲状腺原氨酸,然后这些激素通过甲状腺细胞的基底扩散到周围的毛细血管中。因此,甲状腺激素被释放到血液中。
胶质中的部分甲状腺球蛋白在与位于细胞腔膜上的megalin蛋白结合后,通过内吞作用(endocytosis)进入甲状腺细胞。megalin-甲状腺球蛋白复合物随后通过跨细胞运输(transcytosis)穿过细胞到达基底外侧膜,其中一部分megalin仍然与甲状腺球蛋白结合,并释放到毛细血管血液中。
图77-3 甲状腺素和三碘甲状腺原氨酸形成的化学过程。
甲状腺球蛋白中约四分之三的碘化酪氨酸(iodinated tyrosine)从未成为甲状腺激素,而是以单碘酪氨酸(monoiodotyrosine)和二碘酪氨酸(diiodotyrosine)的形式存在。在消化甲状腺球蛋白分子以释放甲状腺素和三碘甲状腺原氨酸的过程中,这些碘化酪氨酸也从甲状腺球蛋白分子中释放出来。然而,它们不会被分泌到血液中。相反,它们的碘被脱碘酶(deiodinase)切割下来,使得几乎所有这种碘都可以在腺体内循环利用,以形成更多的甲状腺激素。先天性缺乏这种脱碘酶可能会导致碘缺乏,因为这种循环过程无法进行。
甲状腺素和三碘甲状腺原氨酸的每日分泌率。正常情况下,甲状腺释放的甲状腺激素中约93%是甲状腺素,只有7%是三碘甲状腺原氨酸。然而,在接下来的几天里,约一半的甲状腺素会缓慢脱碘,形成更多的三碘甲状腺原氨酸。因此,最终递送到组织并使用的激素主要是三碘甲状腺原氨酸——每天总共约35微克的三碘甲状腺原氨酸。
甲状腺素和三碘甲状腺原氨酸向组织的运输
甲状腺素和三碘甲状腺原氨酸与血浆蛋白结合。进入血液后,超过99%的甲状腺素和三碘甲状腺原氨酸立即与几种血浆蛋白结合,这些血浆蛋白均由肝脏合成。它们主要与甲状腺素结合球蛋白(thyroxine-binding globulin)结合,较少与甲状腺素结合前白蛋白(thyroxine-binding prealbumin)和白蛋白(albumin)结合。
甲状腺素和三碘甲状腺原氨酸缓慢释放到组织细胞。由于血浆结合蛋白对甲状腺激素的高亲和力,这些物质——尤其是甲状腺素——缓慢释放到组织细胞中。血液中一半的甲状腺素大约每6天释放到组织细胞中,而由于亲和力较低,一半的三碘甲状腺原氨酸大约在1天内释放到细胞中。
进入组织细胞后,甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)再次与细胞内蛋白质结合,其中甲状腺素的结合力强于三碘甲状腺原氨酸。因此,它们再次被储存,但这次是在靶细胞中,并在数天或数周内缓慢使用。
甲状腺激素起效缓慢且作用持久。将大量甲状腺素注射到人体后,2至3天内几乎无法观察到对代谢率的影响,这表明甲状腺素活性开始前存在较长的潜伏期。一旦活性开始,它会逐渐增加,并在10至12天内达到最大值,如图77-4所示。此后,其活性以约15天的半衰期逐渐下降。部分活性可持续长达6周至2个月。
图77-4 单次大剂量甲状腺素给药对基础代谢率的长期影响。
三碘甲状腺原氨酸的作用速度约为甲状腺素的四倍,潜伏期短至6至12小时,细胞活性在2至3天内达到最大。
这些激素的潜伏期和作用持久期可能主要是由于它们与血浆和组织细胞中的蛋白质结合,随后缓慢释放所致。然而,在后续讨论中我们将看到,部分潜伏期也源于这些激素在细胞内发挥作用的方式。
甲状腺激素的生理功能
甲状腺激素增加许多基因的转录
甲状腺激素的总体效应是激活许多基因的核转录(图77-5)。因此,在身体的几乎所有细胞中,大量蛋白质酶、结构蛋白、转运蛋白和其他物质被合成。最终结果是全身功能活动的普遍增加。
甲状腺分泌的大部分甲状腺素转化为三碘甲状腺原氨酸。在作用于基因以增加基因转录之前,几乎所有甲状腺素都会去除一个碘原子,从而形成三碘甲状腺原氨酸。细胞内甲状腺激素受体对三碘甲状腺原氨酸具有高亲和力。因此,与受体结合的甲状腺激素中超过90%是三碘甲状腺原氨酸。
甲状腺激素激活核受体。甲状腺激素受体要么附着在DNA基因链上,要么位于其附近。甲状腺激素受体通常与视黄醇X受体(RXR)在DNA上的特定甲状腺激素反应元件处形成异二聚体。与甲状腺激素结合后,受体被激活并启动转录过程。随后形成大量不同类型的信使RNA,并在几分钟或几小时内在细胞质核糖体上进行RNA翻译,形成数百种新的细胞内蛋白质。然而,并非所有蛋白质都以相似的百分比增加——有些仅略微增加,而其他则至少增加六倍。甲状腺激素的大部分作用源于这些新蛋白质的后续酶促和其他功能。
图77-5 甲状腺激素对靶细胞的激活作用。甲状腺素(thyroxine, T_4)和三碘甲状腺原氨酸(triiodothyronine, T_3)通过载体介导的腺苷三磷酸(adenosine triphosphate, ATP)依赖的转运过程进入细胞膜。大部分T_4被脱碘形成T_3,T_3与甲状腺激素受体结合,该受体与视黄醇X受体(retinoid X receptor)形成异二聚体,结合在基因的甲状腺激素反应元件上。这一作用导致基因转录的增加或减少,从而形成蛋白质,产生细胞的甲状腺激素反应。图中展示了甲状腺激素对多个不同系统细胞的作用。BMR,基础代谢率(basal metabolic rate);CNS,中枢神经系统(central nervous system);mRNA,信使核糖核酸(messenger ribonucleic acid);Na+-K+-ATPase,钠-钾-腺苷三磷酸酶(sodium-potassium-adenosine triphosphatase)。
甲状腺激素似乎还具有不依赖于基因转录的非基因组细胞效应(nongenomic cellular effects)。例如,甲状腺激素的某些效应在几分钟内发生,速度太快,无法用蛋白质合成的变化来解释,并且不受基因转录和翻译抑制剂的影响。这种作用已在多个组织中被描述,包括心脏、垂体以及脂肪组织。非基因组甲状腺激素作用的位点似乎是质膜、细胞质,以及一些细胞器如线粒体。甲状腺激素的非基因组作用包括调节离子通道和氧化磷酸化(oxidative phosphorylation),并似乎涉及细胞内第二信使(secondary messengers)如环磷酸腺苷(cyclic adenosine monophosphate, cAMP)或蛋白激酶信号级联的激活。
甲状腺激素增加细胞代谢活动
甲状腺激素增加了几乎所有身体组织的代谢活动。当大量甲状腺激素分泌时,基础代谢率(basal metabolic rate, BMR)可以增加到正常水平的60%至100%。食物用于能量的利用率大大加快。虽然蛋白质合成的速率增加,但蛋白质分解的速率也同时增加。年轻人的生长速度大大加快。心理过程被激发,大多数其他内分泌腺的活动也增加。
甲状腺激素增加线粒体的数量和活性。当给动物注射甲状腺素或三碘甲状腺原氨酸时,动物体内大多数细胞的线粒体大小和数量都会增加。此外,线粒体的总膜表面积几乎与整个动物代谢率的增加成正比增加。因此,甲状腺素的主要功能之一可能仅仅是增加线粒体的数量和活性,从而增加腺苷三磷酸的形成速率,为细胞功能提供能量。然而,线粒体数量和活性的增加可能是细胞活性增加的结果,也可能是其增加的原因。
甲状腺激素通过细胞膜增加离子的主动转运(active transport)。甲状腺激素增加其活性的酶之一是Na+-K+ ATP酶。这种增加的活性反过来又增加了某些组织细胞膜对钠离子和钾离子的转运速率。由于这一过程消耗能量并增加体内产生的热量,有人认为这可能是甲状腺激素提高机体代谢率(metabolic rate)的机制之一。事实上,甲状腺激素还会导致大多数细胞的细胞膜对钠离子变得"渗漏",这进一步激活了钠泵(sodium pump),并进一步增加了热量产生。
甲状腺激素对生长的影响
甲状腺激素对生长既有普遍性影响,也有特异性影响。例如,长期以来人们都知道甲状腺激素对蝌蚪向青蛙的变态(metamorphic change)是必不可少的。
在人类中,甲状腺激素对生长的影响主要体现在正在发育的儿童身上。在甲状腺功能减退(hypothyroidism)的儿童中,生长速度大大减慢。在甲状腺功能亢进(hyperthyroidism)的儿童中,常常发生过度的骨骼生长,导致儿童在较早的年龄就变得相当高。然而,骨骼也成熟得更快,骨骺(epiphyses)在较早的年龄就闭合,因此实际上可能会缩短生长期和成人的最终身高。
甲状腺激素的一个重要作用是促进胎儿期和出生后最初几年大脑的生长和发育。如果胎儿没有分泌足够的甲状腺激素,出生前后大脑的生长和成熟都会大大延迟,大脑会保持比正常更小的状态。如果在出生后几天或几周内没有进行特定的甲状腺治疗,没有甲状腺的儿童将终生保持智力低下。这种情况将在本章后面讨论。
甲状腺激素对特定身体功能的影响
刺激碳水化合物代谢。甲状腺激素刺激碳水化合物代谢(carbohydrate metabolism)的几乎所有方面,包括细胞对葡萄糖的快速摄取、糖酵解(glycolysis)增强、糖异生增强、胃肠道吸收速率增加,甚至胰岛素分泌增加及其对碳水化合物代谢的次级效应。所有这些效应可能都是由于甲状腺激素引起的细胞代谢酶的整体增加所致。
刺激脂肪代谢。甲状腺激素也增强了脂肪代谢(fat metabolism)的几乎所有方面。特别是,脂质(lipids)从脂肪组织中迅速动员,这使得身体的脂肪储存减少的程度几乎超过任何其他组织成分。脂肪组织中脂质的动员也增加了血浆中游离脂肪酸(free fatty acids)的浓度,并大大加速了细胞对游离脂肪酸的氧化。
对血浆和肝脏脂肪的影响
甲状腺激素(thyroid hormone)增加会降低血浆中胆固醇(cholesterol)、磷脂(phospholipids)和甘油三酯(triglycerides)的浓度,尽管它会增加游离脂肪酸(free fatty acids)的浓度。相反,甲状腺分泌减少会显著增加血浆中胆固醇、磷脂和甘油三酯的浓度,并且几乎总是导致脂肪在肝脏中的过度沉积。长期甲状腺功能减退(hypothyroidism)时,循环血浆胆固醇的大幅增加通常与严重的动脉粥样硬化相关,这一点在第69章中讨论过。
甲状腺激素降低血浆胆固醇浓度的机制之一是显著增加胆汁中胆固醇的分泌,从而导致其在粪便中的丢失。胆固醇分泌增加的一个可能机制是,甲状腺激素诱导肝细胞上低密度脂蛋白(low-density lipoprotein, LDL)受体的数量增加,从而使肝脏迅速从血浆中清除低密度脂蛋白,随后肝细胞将这些脂蛋白中的胆固醇分泌出去。
图77-6 甲状腺激素(T_3,三碘甲状腺原氨酸(triiodothyronine)和T_4,甲状腺素(thyroxine))每日分泌率与基础代谢率(basal metabolic rate)百分比变化的大致关系,与正常情况相比。
维生素需求的增加
由于甲状腺激素增加了体内许多酶(enzymes)的数量,而维生素(vitamins)是某些酶或辅酶(coenzymes)的重要组成部分,因此甲状腺激素增加了对维生素的需求。因此,当甲状腺激素分泌过多时,可能会出现相对的维生素缺乏,除非同时增加了维生素的供应量。
基础代谢率的增加
由于甲状腺激素几乎增加了体内所有细胞的代谢,过量的激素有时可以使基础代谢率(basal metabolic rate)比正常水平提高60%至100%。相反,当没有甲状腺激素产生时,基础代谢率会下降到几乎正常水平的一半。图77-6显示了甲状腺激素每日供应量与基础代谢率之间的大致关系。需要极大量的激素才能导致基础代谢率显著升高。
体重的减少
甲状腺激素的大量增加几乎总是会导致体重下降,而甲状腺激素的大量减少几乎总是会导致体重增加。然而,这些效果并不总是发生,因为甲状腺激素也会增加食欲,这可能会抵消代谢率的变化。
血流量和心输出量的增加
组织中代谢的增加导致氧气的利用速度比正常情况更快,并且代谢终产物从组织中的释放增加。这些效应导致大多数身体组织的血管扩张(vasodilation),从而增加血流量。特别是皮肤中的血流量增加,因为身体需要更多的热量散发。由于血流量增加,心输出量(cardiac output)也随之增加,当甲状腺激素过多时,心输出量有时会比正常水平增加60%或更多,而在严重的甲状腺功能减退时,心输出量会下降到正常水平的50%。
心率增加。在甲状腺激素的影响下,心率的增加远远超过了心输出量增加所能解释的范围。因此,甲状腺激素似乎对心脏的兴奋性有直接影响,从而增加了心率。这一效应尤为重要,因为心率是临床医生用来判断患者甲状腺激素分泌过多或减少的敏感体征之一。
心脏力量增强。甲状腺激素的轻微过量可以增强心脏的力量。这种效应类似于轻度发热和运动时心脏力量的增强。然而,当甲状腺激素显著增加时,由于长期过度的蛋白质分解代谢,心肌力量会减弱。事实上,一些严重的甲状腺毒症患者会因心肌衰竭和心输出量增加所导致的心脏负荷增加而死于心脏代偿失调。
正常动脉压。在给予甲状腺激素后,平均动脉压通常保持正常。由于心跳间期组织血流量的增加,脉压通常会增加,甲状腺功能亢进时收缩压升高10至15mm Hg,舒张压相应降低。
呼吸增加。代谢率的增加增加了氧气的利用和二氧化碳的生成;这些效应激活了所有增加呼吸速率和深度的机制。
胃肠道运动增加。除了之前讨论过的食欲和食物摄入增加外,甲状腺激素还增加了消化液的分泌和胃肠道的运动。因此,甲状腺功能亢进通常会导致腹泻,而甲状腺激素缺乏则可能导致便秘。
对中枢神经系统的兴奋作用。一般来说,甲状腺激素增加了思维的敏捷性,尽管思维过程可能会分离;相反,甲状腺激素的缺乏会降低思维的敏捷性。甲状腺功能亢进的患者可能会极度紧张,并有许多精神神经症倾向,如焦虑症、极度担忧和偏执。
对肌肉功能的影响。甲状腺激素的轻微增加通常会使肌肉反应有力,但当甲状腺激素过量时,由于过度的蛋白质分解代谢,肌肉会变得无力。相反,甲状腺激素的缺乏会使肌肉变得迟钝,并且在收缩后缓慢放松。
肌肉震颤。甲状腺功能亢进最典型的体征之一是细微的肌肉震颤。这种症状不同于帕金森病或人因寒冷而颤抖时出现的粗大震颤,因为它以每秒10至15次的快速频率发生。通过将一张纸放在伸出的手指上并观察纸张的振动程度,可以很容易地观察到这种震颤。这种震颤被认为是由控制肌张力的脊髓区域神经元突触的反应性增加引起的。这种震颤是评估甲状腺激素对中枢神经系统影响程度的重要指标。
对睡眠的影响
由于甲状腺激素对肌肉系统和中枢神经系统(central nervous system)的耗竭作用,甲状腺功能亢进(hyperthyroidism)患者常常感到持续的疲倦,但由于甲状腺激素对突触(synapses)的兴奋作用,他们往往难以入睡。相反,极度嗜睡(somnolence)是甲状腺功能减退(hypothyroidism)的特征,患者有时每天睡眠时间可达12至14小时。
对其他内分泌腺的影响
甲状腺激素的增加会提高其他几种内分泌腺的分泌速率,但也会增加组织对这些激素的需求。例如,甲状腺素(thyroxine)分泌的增加几乎会提高全身的葡萄糖代谢速率,从而导致胰腺需要相应增加胰岛素的分泌。此外,甲状腺激素会增加与骨形成相关的许多代谢活动,因此也会增加对甲状旁腺激素(parathyroid hormone)的需求。甲状腺激素还会增加肾上腺糖皮质激素(adrenal glucocorticoids)在肝脏中的失活速率。这种失活速率的增加会导致前垂体(anterior pituitary)分泌促肾上腺皮质激素(adrenocorticotropic hormone)的反馈性增加,从而增加肾上腺分泌糖皮质激素的速率。
甲状腺激素对性功能的影响
为了维持正常的性功能,甲状腺分泌需要大致正常。在男性中,甲状腺激素的缺乏可能导致性欲(libido)减退;然而,甲状腺激素的过量有时会导致阳痿(impotence)。
在女性中,甲状腺激素的缺乏常常导致月经过多(menorrhagia)和月经频繁(polymenorrhea),即分别表现为月经出血过多和频繁。然而,奇怪的是,在其他女性中,甲状腺激素的缺乏可能导致月经不规律,偶尔甚至出现闭经(amenorrhea)(即无月经出血)。
与男性一样,女性甲状腺功能减退也可能导致性欲显著下降。更令人困惑的是,在甲状腺功能亢进的女性中,月经稀发(oligomenorrhea)(即月经出血显著减少)很常见,偶尔也会出现闭经。
甲状腺激素对性腺(gonads)的作用无法归结为某一特定功能,但可能是由于甲状腺激素对性腺的直接代谢作用,以及通过控制性功能的前垂体激素产生的兴奋性和抑制性反馈效应的综合结果。
甲状腺激素分泌的调节
为了维持体内代谢活动的正常水平,甲状腺激素的分泌量必须始终保持在精确的范围内;为了实现这一理想的分泌水平,特定的反馈机制通过下丘脑和前垂体来调控甲状腺的分泌速率。这些机制将在以下部分中详细描述。
前垂体分泌的TSH增加甲状腺分泌
TSH(促甲状腺激素(thyrotropin))是一种前垂体激素;它是一种分子量约为28,000的糖蛋白(glycoprotein)。这种激素在第75章中也有讨论,它能够增加甲状腺分泌甲状腺素和三碘甲状腺原氨酸(triiodothyronine)。它对甲状腺有以下具体作用:
- 增加已经储存在滤泡中的甲状腺球蛋白(thyroglobulin)的蛋白水解(proteolysis),从而将甲状腺激素释放到循环血液中,并减少滤泡中的物质。
- 碘泵(iodide pump)活性增加,增加了腺体细胞中“碘捕获(iodide trapping)”的速率,有时使腺体物质中细胞内与细胞外碘浓度的比率增加到正常值的八倍
- 酪氨酸(tyrosine)的碘化作用(iodination)增加,形成甲状腺激素(thyroid hormones)
- 甲状腺细胞的大小和分泌活性增加
- 甲状腺细胞数量增加,加上从立方细胞(cuboidal cells)变为柱状细胞(columnar cells),以及甲状腺上皮(thyroid epithelium)向滤泡(follicles)的大量内折
总之,TSH增加了甲状腺腺体细胞所有已知的分泌活动。
给予TSH后最重要的早期效应是启动甲状腺球蛋白(thyroglobulin)的蛋白水解(proteolysis),这导致甲状腺素(thyroxine)和三碘甲状腺原氨酸(triiodothyronine)在30分钟内释放到血液中。其他效应需要数小时甚至数天和数周才能完全发展。
环磷酸腺苷(cyclic adenosine monophosphate, cAMP)介导TSH的刺激作用。TSH对甲状腺细胞的大多数不同效应是由于激活了细胞的“第二信使(second messenger)”cAMP系统。
这种激活的第一个事件是TSH与甲状腺细胞基底膜表面的特定TSH受体结合。这种结合随后激活膜中的腺苷酸环化酶(adenylyl cyclase),从而增加细胞内cAMP的形成。最后,cAMP作为第二信使激活蛋白激酶(protein kinase),导致整个细胞中的多重磷酸化(phosphorylations)。结果是甲状腺激素的分泌立即增加,并且甲状腺腺体组织的生长延长。
这种控制甲状腺细胞活动的方法与cAMP作为“第二信使”在体内许多其他靶组织中的功能相似,如第75章所述。
前垂体(pituitary)分泌TSH受下丘脑释放的促甲状腺激素释放激素(thyrotropin-releasing hormone, TRH)调节
前垂体分泌TSH受下丘脑激素——促甲状腺激素释放激素(thyrotropin-releasing hormone, TRH)的控制,TRH由下丘脑室旁核(paraventricular nucleus, PVN)的神经元合成,并从其在下丘脑正中隆起(median eminence)的神经末梢分泌。TRH随后通过下丘脑-垂体门脉系统(hypothalamic-hypophysial portal blood)被运输到前垂体,如第75章所述。
TRH是一种三肽酰胺(tripeptide amide)——焦谷氨酰-组氨酰-脯氨酰胺(pyroglutamyl-histidyl proline-amide)。TRH刺激前垂体细胞增加其TSH的输出。当下丘脑到前垂体的门脉系统被阻断时,前垂体分泌TSH的速率大大降低,但不会降至零。
TRH导致前垂体的TSH分泌细胞产生TSH的分子机制首先是与垂体细胞膜中的TRH受体结合。这种结合随后激活垂体细胞内的磷脂酶(phospholipase)第二信使系统,产生大量的磷脂酶C(phospholipase C),随后是一系列其他第二信使,包括钙离子(calcium ions)和二酰甘油(diacyl glycerol),最终导致TSH的释放。
寒冷和其他神经源性刺激对TRH和TSH分泌的影响。已知最著名的刺激下丘脑增加TRH分泌,从而增加垂体前叶TSH分泌的因素之一是动物暴露于寒冷环境中。这种效应几乎可以肯定是由控制体温的下丘脑中枢的兴奋引起的。将大鼠暴露于严寒中数周,可以增加甲状腺激素的输出,有时超过正常水平的100%,并且可以将基础代谢率提高多达50%。事实上,已知迁移到北极地区的人的基础代谢率比正常水平高出15%到20%。
图77-7 甲状腺分泌的调节。T_3, 三碘甲状腺原氨酸; T_4, 甲状腺素。
PVN中的TRH神经元接收来自下丘脑弓状核中调节能量平衡的瘦素反应神经元的输入——这些神经元包括神经肽Y (NPY)/agouti相关蛋白 (AGRP) 和前阿黑皮素 (POMC) 神经元,这些在第72章中讨论过。长时间的禁食会降低血浆瘦素水平,进而降低POMC活性并增加NPY/AGRP神经元活性。瘦素水平的降低也可能直接抑制TRH神经元。这些效应共同减少了TRH、TSH和甲状腺激素的分泌,导致代谢率降低并在食物供应不足时节约能量。
各种情绪反应也会影响TRH和TSH的输出,从而间接影响甲状腺激素的分泌。兴奋和焦虑——这些强烈刺激交感神经系统的状态——会导致TSH分泌的急性减少,可能是因为这些状态增加了代谢率和体温,从而对体温控制中心产生相反的影响。
甲状腺激素对减少垂体前叶TSH分泌的反馈效应
体液中甲状腺激素的增加会减少垂体前叶的TSH分泌。当甲状腺激素分泌速率上升到正常水平的约1.75倍时,TSH分泌速率几乎降至零。即使垂体前叶与下丘脑分离,几乎所有的这种反馈抑制作用仍然会发生。因此,如图77-7所示,增加的甲状腺激素可能主要通过直接作用于垂体前叶来抑制TSH的分泌。然而,也有证据表明甲状腺激素通过下丘脑抑制促甲状腺激素释放激素的负反馈效应。无论机制如何,这种反馈维持了循环体液中游离甲状腺激素的几乎恒定浓度。
抗甲状腺物质抑制甲状腺分泌
最著名的抗甲状腺药物包括硫氰酸盐、丙硫氧嘧啶和高浓度的无机碘化物。这些药物中的每一种阻断甲状腺分泌的机制都不同,可以解释如下。
硫氰酸根离子(thiocyanate ions)减少碘离子(iodide)的捕获。将碘离子转运到甲状腺细胞中的同一个主动泵(active pump)也可以泵送硫氰酸根离子、高氯酸根离子(perchlorate ions)和硝酸根离子(nitrate ions)。因此,给予足够高浓度的硫氰酸根离子(或其他离子)可以竞争性抑制(competitive inhibition)碘离子向细胞内的转运,即抑制碘离子捕获机制(iodide-trapping mechanism)。
腺细胞(glandular cells)中碘离子可用性的降低并不会阻止甲状腺球蛋白(thyroglobulin)的形成;它只是阻止已形成的甲状腺球蛋白被碘化(iodinated),从而阻止甲状腺激素(thyroid hormones)的形成。甲状腺激素的缺乏反过来又导致垂体前叶分泌更多的促甲状腺激素(TSH),这会导致甲状腺过度生长,尽管腺体仍然不能形成足够数量的甲状腺激素。因此,使用硫氰酸盐和其他一些离子来阻断甲状腺分泌,可导致甲状腺显著增大,称为甲状腺肿(goiter)。
丙硫氧嘧啶(propylthiouracil)减少甲状腺激素的形成。丙硫氧嘧啶(以及其他类似化合物,如甲巯咪唑(methimazole)和卡比马唑(carbimazole))阻止碘离子和酪氨酸(tyrosine)形成甲状腺激素。这种作用机制部分是通过阻断酪氨酸碘化所需的过氧化物酶(peroxidase enzyme),部分是通过阻断两个碘化酪氨酸的偶联(coupling)以形成甲状腺素(thyroxine)或三碘甲腺原氨酸(triiodothyronine)。
与硫氰酸根离子一样,丙硫氧嘧啶不会阻止甲状腺球蛋白的形成。甲状腺球蛋白中缺乏甲状腺素和三碘甲腺原氨酸可导致垂体前叶分泌促甲状腺激素的反馈性显著增强,从而促进腺体组织的生长并形成甲状腺肿。
高浓度碘离子减少甲状腺活动和甲状腺大小。当血液中碘离子浓度很高(正常血浆水平的100倍)时,甲状腺的大多数活动都会减少,但通常只会持续几周。其作用是降低碘离子捕获率,从而也降低酪氨酸碘化形成甲状腺激素的速率。更重要的是,甲状腺腺细胞从滤泡(follicles)中正常的内吞作用(endocytosis)被高浓度碘离子所麻痹。由于这是从储存的胶体(colloid)中释放甲状腺激素的第一步,因此甲状腺激素向血液中的分泌几乎立即停止。
由于高浓度碘离子减少了甲状腺活动的所有阶段,它们略微减小了甲状腺的大小,特别是减少了其血液供应,这与大多数其他抗甲状腺药物(antithyroid agents)引起的相反作用形成鲜明对比。因此,在手术切除甲状腺前2-3周,经常给患者服用碘离子以减少必要的手术量,特别是减少出血量。
甲状腺疾病
甲状腺功能亢进(hyperthyroidism)
从前面讨论的甲状腺激素的各种生理效应中,甲状腺功能亢进的大多数效应是显而易见的。然而,应该提到一些特定的效应,特别是在甲状腺功能亢进的发展、诊断和治疗方面。
甲状腺功能亢进症的原因(毒性甲状腺肿、甲状腺毒症、Graves病)
在大多数甲状腺功能亢进症患者中,甲状腺增大至正常大小的两到三倍,滤泡细胞层显著增生并向滤泡内折叠,因此细胞数量大大增加。此外,每个细胞的分泌速率也提高了数倍;放射性碘摄取研究表明,这些增生的腺体中有一些分泌甲状腺激素的速率是正常水平的5到15倍。
Graves病是甲状腺功能亢进症最常见的形式,是一种自身免疫性疾病,患者体内会产生一种称为甲状腺刺激免疫球蛋白(thyroid-stimulating immunoglobulins, TSIs)的抗体,这些抗体针对甲状腺中的TSH受体。这些抗体与结合TSH的膜受体结合,并持续激活细胞的cAMP系统,从而导致甲状腺功能亢进症的发生。TSI抗体对甲状腺的刺激作用持续时间较长,可达12小时,而TSH的作用时间仅为1小时多一点。TSI引起的高水平甲状腺激素分泌反过来抑制了垂体前叶TSH的生成。因此,几乎所有Graves病患者的TSH浓度都低于正常水平(通常几乎为零),而不是升高。
引起甲状腺功能亢进症的抗体几乎可以肯定是由针对甲状腺组织的自身免疫反应产生的。据推测,在患者的某个时期,甲状腺细胞释放了过量的甲状腺细胞抗原,导致针对甲状腺的抗体形成。
甲状腺腺瘤
甲状腺功能亢进症偶尔是由甲状腺组织中形成的局部腺瘤(一种肿瘤)引起的,这些腺瘤会分泌大量甲状腺激素。这种表现与更常见的甲状腺功能亢进症不同,因为它通常不伴随任何自身免疫疾病的证据。只要腺瘤继续分泌大量甲状腺激素,甲状腺其余部分的分泌功能几乎完全被抑制,因为腺瘤分泌的甲状腺激素会抑制垂体TSH的产生。
甲状腺功能亢进症的症状
从前述甲状腺激素的生理学讨论中可以明显看出甲状腺功能亢进症的症状:(1) 高度兴奋状态,(2) 对热不耐受,(3) 出汗增多,(4) 轻度到极端的体重减轻(有时可达100磅),(5) 不同程度的腹泻,(6) 肌肉无力,(7) 神经紧张或其他精神障碍,(8) 极度疲劳但无法入睡,以及(9) 手部震颤。
图77-8 一位患有突眼性甲状腺功能亢进症的患者。注意眼球突出和上眼睑回缩。她的基础代谢率为+40。(由Leonard Posey博士提供)
眼球突出 (Exophthalmos)
大多数甲状腺功能亢进 (hyperthyroidism) 患者都会表现出一定程度的眼球突出,如图 77-8 所示。这种情况被称为眼球突出 (exophthalmos)。大约三分之一的甲状腺功能亢进患者会出现严重的眼球突出,有时情况会变得非常严重,以至于眼球突出会拉伸视神经,导致视力受损。更常见的情况是,由于患者在眨眼或睡觉时眼睑无法完全闭合,眼睛会受到损伤。结果,眼睛的上皮表面变得干燥、刺激,并常常感染,导致角膜溃疡。
眼球突出的原因是眼眶后组织的肿胀 (edematous swelling) 以及眼外肌的退行性变化。在大多数患者中,可以在血液中发现与眼肌反应的免疫球蛋白 (immunoglobulins)。此外,这些免疫球蛋白的浓度通常在具有高浓度甲状腺刺激免疫球蛋白 (TSIs) 的患者中最高。因此,眼球突出与甲状腺功能亢进一样,可能是一种自身免疫过程 (autoimmune process)。通过治疗甲状腺功能亢进,眼球突出通常会得到显著改善。
甲状腺功能亢进的诊断测试
对于典型的甲状腺功能亢进病例,最准确的诊断测试是使用适当的免疫测定程序直接测量血浆中“游离”甲状腺素 (thyroxine)(有时是三碘甲状腺原氨酸 (triiodothyronine))的浓度。
以下测试有时也会使用:
- 基础代谢率 (basal metabolic rate) 在严重的甲状腺功能亢进中通常增加到 +30 到 +60。
- 通过免疫测定测量血浆中的促甲状腺激素 (TSH) 浓度。在典型的甲状腺毒症 (thyrotoxicosis) 中,由于大量循环的甲状腺素和三碘甲状腺原氨酸完全抑制了垂体前叶的 TSH 分泌,因此血浆中几乎没有 TSH。
- 通过免疫测定测量甲状腺刺激免疫球蛋白 (TSI) 的浓度。在甲状腺毒症中,TSI 浓度通常较高,但在甲状腺腺瘤 (thyroid adenoma) 中较低。
甲状腺功能亢进的治疗
甲状腺功能亢进最直接的治疗方法是手术切除大部分甲状腺。通常,在手术前通过给予丙硫氧嘧啶 (propylthiouracil) 来为患者做准备,通常持续数周,直到患者的基础代谢率恢复正常。然后,在手术前 1 到 2 周内给予高浓度的碘化物,使甲状腺缩小并减少其血液供应。使用这些术前程序后,手术死亡率低于千分之一,而在现代程序发展之前,手术死亡率为二十五分之一。
使用放射性碘治疗增生性甲状腺
注射的碘化物剂量的 80% 到 90% 在注射后 1 天内被增生性、毒性甲状腺吸收。如果注射的碘是放射性的,它可以破坏甲状腺的大部分分泌细胞。通常给予患者 5 毫居里的放射性碘,几周后重新评估患者的状况。如果患者仍处于甲状腺功能亢进状态,则给予额外的剂量,直到达到正常的甲状腺状态。
甲状腺功能减退 (Hypothyroidism)
甲状腺功能减退症( hypothyroidism )的影响通常与甲状腺功能亢进症( hyperthyroidism )相反,但有一些生理机制是甲状腺功能减退症特有的。与甲状腺功能亢进症一样,甲状腺功能减退症通常由针对甲状腺的自身免疫( Hashimoto病 )引发,但在这种情况下,自身免疫会破坏腺体而不是刺激它。大多数患者的甲状腺首先表现出自身免疫性“甲状腺炎( thyroiditis )”,即甲状腺炎症。甲状腺炎会导致腺体逐渐恶化,最终纤维化,从而导致甲状腺激素分泌减少或缺失。还有其他几种类型的甲状腺功能减退症,通常与甲状腺肿大(称为甲状腺肿( thyroid goiter ))的发展有关,如下文所述。
地方性胶样甲状腺肿( Endemic Colloid Goiter )由饮食中碘缺乏引起。术语“甲状腺肿( goiter )”指的是甲状腺显著肿大。正如在碘代谢讨论中指出的那样,每年需要约50毫克的碘来形成足够量的甲状腺激素。在世界某些地区,特别是在瑞士阿尔卑斯山、安第斯山脉和美国五大湖地区,土壤中的碘含量不足,导致食物中甚至无法含有这种微量碘。因此,在加碘食盐出现之前,这些地区的许多人会患上极大的甲状腺肿,称为地方性甲状腺肿( endemic goiters )。
以下机制导致地方性甲状腺肿的形成:碘缺乏会阻止甲状腺素( thyroxine )和三碘甲状腺原氨酸( triiodothyronine )的产生。结果,没有激素可以抑制垂体前叶( anterior pituitary )分泌促甲状腺激素( TSH ),导致垂体分泌过量的TSH。TSH随后刺激甲状腺细胞向滤泡中分泌大量甲状腺球蛋白胶质( thyroglobulin colloid ),腺体逐渐增大。然而,由于缺乏碘,甲状腺球蛋白分子中无法产生甲状腺素和三碘甲状腺原氨酸,因此无法正常抑制垂体前叶的TSH分泌。滤泡显著增大,甲状腺可能增大到正常大小的10到20倍。
特发性非毒性胶样甲状腺肿( Idiopathic Nontoxic Colloid Goiter )。与地方性胶样甲状腺肿相似的甲状腺肿大也可能发生在没有碘缺乏的人群中。这些甲状腺肿的腺体可能分泌正常量的甲状腺激素,但更常见的是激素分泌减少,如地方性胶样甲状腺肿。
特发性胶样甲状腺肿患者甲状腺肿大的确切原因尚不清楚,但大多数患者表现出轻度甲状腺炎的迹象;因此,有人认为甲状腺炎会导致轻微的甲状腺功能减退,进而导致TSH分泌增加和腺体非炎症部分的逐渐生长。这一理论可以解释为什么这些腺体通常是结节状的,腺体的某些部分在生长,而其他部分则被甲状腺炎破坏。
在一些胶样甲状腺肿患者中,甲状腺的甲状腺激素形成所需的酶系统存在异常。常见的异常包括:
- 碘捕获机制缺陷( deficient iodide-trapping mechanism ),即碘无法充分泵入甲状腺细胞
- 过氧化物酶系统缺陷( deficient peroxidase system ),即碘化物无法氧化为碘状态
- 甲状腺球蛋白分子中碘化酪氨酸的偶联缺陷,导致无法形成最终的甲状腺激素
- 脱碘酶(deiodinase)缺乏,阻碍了从未偶联形成甲状腺激素的碘化酪氨酸中回收碘(这约占碘的三分之二),从而导致碘缺乏
最后,某些食物中含有具有丙硫氧嘧啶(propylthiouracil)型抗甲状腺活性的致甲状腺肿物质,因此也会导致TSH刺激的甲状腺肿大。这类致甲状腺肿物质尤其存在于某些品种的芜菁和卷心菜中。
甲状腺功能减退的生理特征。无论甲状腺功能减退是由于甲状腺炎、地方性胶样甲状腺肿、特发性胶样甲状腺肿、放射线破坏甲状腺,还是手术切除甲状腺,其生理效应都是相同的。这些效应包括疲劳和极度嗜睡,患者每天睡眠时间可达12至14小时,极度肌肉迟缓,心率减慢,心输出量减少,血容量减少,有时体重增加,便秘,精神迟钝,体内许多营养功能衰竭,表现为毛发生长抑制和皮肤鳞屑化,出现蛙鸣样嘶哑的声音,严重时全身出现水肿样外观,称为黏液性水肿(myxedema)。
黏液性水肿。黏液性水肿发生在几乎完全缺乏甲状腺激素功能的人身上。图77-9展示了这样一位患者,表现为眼袋和面部肿胀。在这种情况下,由于尚未完全解释的原因,大量透明质酸(hyaluronic acid)和硫酸软骨素(chondroitin sulfate)与蛋白质结合,在间质间隙中形成过量的组织凝胶,导致间质液总量增加。由于过量液体的凝胶性质,它主要是不可移动的,因此水肿是非凹陷性的。
图77-9 一位黏液性水肿患者。(由Herbert Langford博士提供)
甲状腺功能减退中的动脉粥样硬化。如前所述,由于脂肪和胆固醇代谢的改变以及肝脏胆汁中胆固醇排泄的减少,甲状腺激素缺乏会增加血液中胆固醇的含量。血液中胆固醇的增加通常与动脉粥样硬化的增加有关。因此,许多甲状腺功能减退患者,尤其是那些患有黏液性水肿的患者,会发展为动脉粥样硬化,进而导致外周血管疾病、耳聋和冠状动脉疾病,最终导致早逝。
甲状腺功能减退的诊断测试。之前描述的用于诊断甲状腺功能亢进的测试在甲状腺功能减退中会呈现相反的结果。血液中的游离甲状腺素水平较低。黏液性水肿患者的基础代谢率(basal metabolic rate)降低了30%至50%。此外,当给予测试剂量的TRH时,垂体前叶分泌的TSH通常会显著增加(除非在罕见的由垂体对TRH反应减弱引起的甲状腺功能减退病例中)。
甲状腺功能减退症的治疗。图77-4显示了甲状腺素对基础代谢率的影响,表明该激素通常具有超过1个月的作用持续时间。因此,通过每天口服一片或多片含有甲状腺素的片剂,可以轻松维持体内甲状腺激素活性的稳定水平。此外,适当的甲状腺功能减退症治疗可以带来完全的正常状态,以至于曾经患有黏液性水肿的患者在接受治疗超过50年后,活到了90多岁。
克汀病
克汀病是由胎儿期、婴儿期或儿童期极度甲状腺功能减退引起的。这种情况尤其以身体生长迟缓和智力发育迟缓为特征。它可能是由于先天性甲状腺缺失(先天性克汀病)、由于甲状腺遗传缺陷导致甲状腺无法产生甲状腺激素,或由于饮食中缺乏碘(地方性克汀病)引起的。
没有甲状腺的新生儿可能在外观和功能上表现正常,因为他们在子宫内时由母亲提供了一些(但通常不足)甲状腺激素。然而,出生后几周,新生儿的动作变得迟缓,身体和智力发育开始显著滞后。在任何时候对克汀病新生儿进行适当的碘或甲状腺素治疗通常会导致身体生长的正常恢复,但除非在出生后几周内进行治疗,否则智力发育将永久性滞后。这是由于在智力正常发育的关键时期,中枢神经系统神经细胞的生长、分支和髓鞘形成受到抑制所致。
克汀病患儿的骨骼生长通常比软组织生长受到更大的抑制。由于这种不成比例的生长速度,软组织可能会过度增大,使克汀病患儿呈现出肥胖、矮壮和矮小的外观。偶尔,舌头的生长相对于骨骼生长过大,以至于阻碍吞咽和呼吸,引起特征性的喉音呼吸,有时会导致患儿窒息。
肾上腺皮质激素
两个肾上腺,每个重约4克,位于两肾的上极。如图78-1所示,每个腺体由两个主要部分组成,即肾上腺髓质和肾上腺皮质。肾上腺髓质占腺体中央的20%,在功能上与交感神经系统相关;它分泌激素肾上腺素和去甲肾上腺素以响应交感神经的刺激。这些激素反过来会引起与直接刺激全身交感神经几乎相同的效果。这些激素及其效果在第61章中与交感神经系统相关的内容中详细讨论。
肾上腺皮质分泌一组完全不同的激素,称为皮质类固醇。这些激素都是从类固醇胆固醇合成的,它们的化学式相似。然而,分子结构的微小差异使它们具有几种不同但非常重要的功能。
图78-1. 肾上腺皮质不同区域分泌的肾上腺皮质激素和肾上腺髓质分泌的儿茶酚胺。
皮质类固醇:盐皮质激素、糖皮质激素和雄激素
肾上腺皮质分泌两种主要类型的肾上腺皮质激素,即盐皮质激素和糖皮质激素。除了这些激素外,还分泌少量的性激素,尤其是雄激素,它们在体内的效果与男性性激素睾酮相似。它们通常只有轻微的重要性,尽管在某些肾上腺皮质异常情况下,可能会分泌极大量的雄激素(本章稍后讨论),并可能导致男性化效应。
盐皮质激素之所以得名,是因为它们特别影响细胞外液的电解质(“矿物质”),尤其是钠和钾。糖皮质激素之所以得名,是因为它们表现出增加血糖浓度的重要效果。它们对蛋白质和脂肪代谢的其他效果与对碳水化合物代谢的效果同样重要。
从肾上腺皮质中分离出超过30种类固醇,但有两种对人体正常内分泌功能尤为重要:醛固酮,它是主要的盐皮质激素;皮质醇,它是主要的糖皮质激素。
肾上腺皮质激素的合成与分泌
肾上腺皮质有三个不同的层次
图78-1显示,肾上腺皮质由三个相对不同的层次组成:
- 球状带(zona glomerulosa)是位于被膜下方的一层薄细胞,约占肾上腺皮质的15%。这些细胞是肾上腺中唯一能够分泌大量醛固酮(aldosterone)的细胞,因为它们含有醛固酮合成酶(aldosterone synthase),这是合成醛固酮所必需的。这些细胞的分泌主要受细胞外液中血管紧张素II(angiotensin II)和钾离子浓度的调控,两者都能刺激醛固酮的分泌。
- 束状带(zona fasciculata)是肾上腺皮质的中间和最宽的区域,约占肾上腺皮质的75%,分泌糖皮质激素(glucocorticoids)皮质醇和皮质酮(corticosterone),以及少量的肾上腺雄激素(adrenal androgens)和雌激素(estrogens)。这些细胞的分泌在很大程度上由下丘脑-垂体轴(hypothalamic-pituitary axis)通过促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)调控。
- 网状带(zona reticularis)是皮质的内层区域,分泌肾上腺雄激素脱氢表雄酮(dehydroepiandrosterone)和雄烯二酮(androstenedione),以及少量的雌激素和一些糖皮质激素。ACTH也调控这些细胞的分泌,尽管其他因素如垂体释放的皮质雄激素刺激激素(cortical androgen-stimulating hormone)也可能参与其中。然而,调控肾上腺雄激素生成的机制远不如糖皮质激素和盐皮质激素(mineralocorticoids)的机制那样被充分理解。
醛固酮和皮质醇的分泌由独立的机制调控。例如,血管紧张素II等因子特异性地增加醛固酮的输出并导致球状带的肥大,但对其他两个区域没有影响。同样,ACTH等因子增加皮质醇和肾上腺雄激素的分泌并导致束状带和网状带的肥大,但对球状带的影响很小。
肾上腺皮质激素是由胆固醇衍生的类固醇。所有人类类固醇激素,包括肾上腺皮质产生的激素,都是由胆固醇合成的。尽管肾上腺皮质细胞可以从乙酸从头合成少量胆固醇,但用于类固醇合成的胆固醇中约80%来自循环血浆中的低密度脂蛋白(low-density lipoproteins, LDLs)。LDL含有高浓度的胆固醇,从血浆扩散到间质液中,并附着在肾上腺皮质细胞膜上称为被膜小窝(coated pits)的结构中的特定受体上。被膜小窝随后通过内吞作用被内化,形成囊泡,最终与细胞溶酶体融合并释放可用于合成肾上腺类固醇激素的胆固醇。
胆固醇进入肾上腺细胞的运输受反馈机制调控,这些机制可以显著改变可用于类固醇合成的胆固醇量。例如,ACTH刺激肾上腺类固醇合成,增加肾上腺皮质细胞对LDL的受体数量,以及从LDL中释放胆固醇的酶的活性。
一旦胆固醇进入细胞,它会被输送到线粒体(mitochondria),在那里被胆固醇裂解酶(cholesterol desmolase)切割形成孕烯醇酮(pregnenolone);这是最终形成肾上腺类固醇(adrenal steroids)的限速步骤(rate-limiting step)(图78-2)。在肾上腺皮质(adrenal cortex)的三个区域中,类固醇合成的这一初始步骤受到控制主要激素产物醛固酮(aldosterone)和皮质醇分泌的不同因素的刺激。例如,刺激皮质醇分泌的促肾上腺皮质激素(ACTH)和刺激醛固酮分泌的血管紧张素II(angiotensin II)都会增加胆固醇向孕烯醇酮的转化。
肾上腺类固醇的合成途径。图78-2展示了肾上腺皮质重要类固醇产物醛固酮、皮质醇和雄激素(androgens)形成的主要步骤。基本上所有这些步骤都发生在细胞的两个细胞器(organelles)中,即线粒体和内质网(endoplasmic reticulum),其中一些步骤发生在一个细胞器中,另一些步骤发生在另一个细胞器中。每个步骤都由特定的酶系统催化。即使在这个模式中改变一个酶,也可能导致形成完全不同类型和相对比例的激素。例如,仅改变该途径中一个酶的活性,就可能导致大量男性化性激素或其他通常不在血液中存在的类固醇化合物的产生。
图78-2显示了醛固酮和皮质醇的化学式,它们分别是主要的盐皮质激素(mineralocorticoid)和糖皮质激素(glucocorticoid)。皮质醇在第3个碳上有一个酮氧(keto oxygen),并在第11和第21个碳上羟基化(hydroxylated)。盐皮质激素醛固酮在第18个碳上结合了一个氧原子。
除了醛固酮和皮质醇外,肾上腺皮质通常还会分泌少量具有糖皮质激素或盐皮质激素活性(或两者兼有)的其他类固醇。此外,几种通常不在肾上腺中形成的强效类固醇激素已被合成,并用于各种形式的治疗。表78-1总结了一些更重要的皮质类固醇激素,包括合成的激素。
盐皮质激素
• 醛固酮(非常强效;占所有盐皮质激素活性的~90%) • 去氧皮质酮(deoxycorticosterone)(效力为醛固酮的1/30,但分泌量非常少) 皮质酮(corticosterone)(轻微的盐皮质激素活性) • 9α -氟氢可的松(9α -Fluorocortisol)(合成;比醛固酮略强效) 皮质醇(轻微的盐皮质激素活性,但分泌量较大) 可的松(cortisone)(轻微的盐皮质激素活性)
糖皮质激素
• 皮质醇(非常强效;占所有糖皮质激素活性的~95%) 皮质酮(占总糖皮质激素活性的~4%,但效力远低于皮质醇) 可的松(几乎与皮质醇一样强效) • 泼尼松(prednisone)(合成;效力为皮质醇的四倍) • 甲基泼尼松(methylprednisone)(合成;效力为皮质醇的五倍) • 地塞米松(dexamethasone)(合成;效力为皮质醇的30倍)
从这份列表中可以看出,某些激素和合成类固醇同时具有糖皮质激素(glucocorticoid)和盐皮质激素(mineralocorticoid)活性。特别值得注意的是,皮质醇通常具有一定的盐皮质激素活性,因为某些皮质醇分泌过多的综合征可能会引起显著的盐皮质激素效应,同时伴随其更强大的糖皮质激素效应。
合成激素地塞米松(dexamethasone)具有极强的糖皮质激素活性,而几乎没有任何盐皮质激素活性,这使得它成为刺激特定糖皮质激素活性的重要药物。
图78-2. 肾上腺皮质合成类固醇激素的途径。酶以斜体显示。
肾上腺皮质激素与血浆蛋白结合。大约90%到95%的血浆皮质醇与血浆蛋白结合,尤其是一种称为皮质醇结合球蛋白(cortisol-binding globulin)或转皮质素(transcortin)的球蛋白,以及较少程度地与白蛋白(albumin)结合。这种与血浆蛋白的高度结合减缓了皮质醇从血浆中的清除;因此,皮质醇的半衰期相对较长,为60到90分钟。大约60%的循环醛固酮(aldosterone)与血浆蛋白结合,约40%以游离形式存在;因此,醛固酮的半衰期相对较短,约为20分钟。这些激素以结合和游离形式在细胞外液(extracellular fluid compartment)中运输。
肾上腺类固醇与血浆蛋白的结合可能起到缓冲作用,减少游离激素浓度的快速波动,例如在短暂应激期间和ACTH的间歇性分泌期间,皮质醇的波动。这种缓冲功能也可能有助于确保肾上腺激素相对均匀地分布到组织中。
表78-1 成人肾上腺类固醇激素;合成类固醇及其相对糖皮质激素和盐皮质激素活性
<html><body><table><tr><td>类固醇</td><td>平均血浆浓度(游离和结合,μg/100 ml)</td><td>平均分泌量(mg/24小时)</td><td>糖皮质激素活性</td><td>盐皮质激素活性</td></tr><tr><td>肾上腺类固醇</td><td></td><td></td><td></td><td></td></tr><tr><td>皮质醇</td><td>12</td><td>15</td><td>1.0</td><td>1.0</td></tr><tr><td>皮质酮</td><td>0.4</td><td>3</td><td>0.3</td><td>15.0</td></tr><tr><td>醛固酮</td><td>0.006</td><td>0.15</td><td>0.3</td><td>3000</td></tr><tr><td>脱氧皮质酮</td><td>0.006</td><td>0.2</td><td>0.2</td><td>100</td></tr><tr><td>脱氢表雄酮</td><td>175</td><td>20</td><td></td><td></td></tr><tr><td>合成类固醇</td><td></td><td></td><td></td><td></td></tr><tr><td>可的松</td><td></td><td></td><td>0.7</td><td>0.5</td></tr><tr><td>泼尼松龙</td><td></td><td></td><td>4</td><td>0.8</td></tr><tr><td>甲基泼尼松龙</td><td></td><td></td><td>5</td><td></td></tr><tr><td>地塞米松</td><td></td><td></td><td>30</td><td></td></tr><tr><td>9α-氟皮质醇</td><td></td><td></td><td>10</td><td>125</td></tr></table></body></html>
类固醇的糖皮质激素和盐皮质激素活性相对于皮质醇,皮质醇为1.0。
肾上腺皮质激素在肝脏中代谢。肾上腺类固醇主要在肝脏中降解,并与葡萄糖醛酸(glucuronic acid)结合,较少部分与硫酸盐(sulfates)结合。这些物质没有活性,不具有盐皮质激素(mineralocorticoid)或糖皮质激素(glucocorticoid)活性。大约25%的这些结合物通过胆汁排出,随后通过粪便排出。肝脏形成的其余结合物进入循环,但不与血浆蛋白结合,在血浆中高度溶解,因此容易被肾脏过滤并通过尿液排出。肝脏疾病显著降低肾上腺皮质激素的失活速率,而肾脏疾病则减少无活性结合物的排泄。
血液中醛固酮(aldosterone)的正常浓度约为每100毫升6纳克(6十亿分之一克),平均分泌速率约为每天150~μg(0.15毫克/天)。然而,醛固酮的血液浓度在很大程度上取决于多种因素,包括钠和钾的膳食摄入量。
血液中皮质醇的平均浓度为每100毫升12微克,平均分泌速率为每天15至20毫克。然而,皮质醇的血液浓度和分泌速率在一天中波动,早晨上升,晚上下降,如后文所述。
盐皮质激素的功能——醛固酮
盐皮质激素缺乏会导致严重的肾氯化钠丢失和高钾血症(hyperkalemia)。如果肾上腺皮质激素分泌完全丧失,除非接受大量盐疗法或注射盐皮质激素,否则可能在3至14天内死亡。
在没有盐皮质激素的情况下,细胞外液中的钾离子浓度显著上升,钠和氯迅速从体内丢失,细胞外液总量和血容量大大减少。心输出量很快减少,进而发展为休克样状态,最终导致死亡。通过给予醛固酮或其他盐皮质激素可以防止这一系列过程。因此,盐皮质激素被称为肾上腺皮质激素中急性“救命”的部分。然而,糖皮质激素同样必要,因为它们使个体能够抵抗生活中间歇性的身体和心理“压力”的破坏性影响,如本章后文所述。
醛固酮是肾上腺分泌的主要盐皮质激素。在人类中,醛固酮占肾上腺皮质激素分泌的盐皮质激素活性的近90%,但皮质醇——肾上腺皮质分泌的主要糖皮质激素——也提供了显著的盐皮质激素活性。醛固酮的盐皮质激素活性约为皮质醇的3000倍,但皮质醇的血浆浓度约为醛固酮的2000倍。
皮质醇也能以高亲和力与盐皮质激素受体(mineralocorticoid receptors)结合。然而,肾上皮细胞表达11β-羟类固醇脱氢酶2型(11β-HSD2),该酶的作用可防止皮质醇激活盐皮质激素受体。11β-HSD2的一个作用是将皮质醇转化为皮质酮(cortisone),后者不会强烈结合盐皮质激素受体。还有证据表明,11β-HSD2可能对细胞内氧化还原(reduction and oxidation)状态有影响,从而阻止皮质醇激活盐皮质激素受体。在11β-HSD2活性遗传缺陷的患者中,皮质醇可能具有显著的盐皮质激素效应。这种情况被称为假性盐皮质激素过多综合征(apparent mineralocorticoid excess syndrome, AME),因为患者的病理生理变化与醛固酮(aldosterone)分泌过多的患者基本相同,只是AME患者的血浆醛固酮水平非常低。摄入大量含有甘草酸(glycyrrhetinic acid)的甘草也可能导致AME,因为它能够阻断11β-HSD2酶的活性。
醛固酮的肾脏和循环效应
醛固酮增加肾小管对钠的重吸收和钾的分泌。如第28章所述,醛固酮增加钠的重吸收,同时增加肾小管上皮细胞对钾的分泌,尤其是在集合管(collecting tubules)的主细胞(principal cells)中,在远端小管(distal tubules)和集合管(collecting ducts)中也有较小程度的作用。因此,醛固酮导致钠在细胞外液(extracellular fluid)中保留,同时增加尿液中钾的排泄。
血浆中高浓度的醛固酮可以暂时将尿液中钠的丢失减少到每天仅几毫当量(milliequivalents)。同时,尿液中钾的丢失暂时增加数倍。因此,血浆中醛固酮过多的净效应是增加细胞外液中钠的总量,同时减少钾的含量。
相反,完全缺乏醛固酮分泌可能导致每天尿液中钠的暂时丢失10至20克,这相当于体内所有钠的十分之一到五分之一。同时,钾在细胞外液中顽固地保留。
醛固酮过多增加细胞外液容量和动脉压,但对血浆钠浓度影响很小;醛固酮缺乏导致低钠血症(hyponatremia)。尽管醛固酮对减少肾脏钠排泄率有很强的作用,但细胞外液中钠的浓度通常仅上升几毫当量。原因是当钠被肾小管重吸收时,几乎等量的水也会同时被渗透吸收。此外,细胞外液钠浓度的轻微增加会刺激口渴和增加水的摄入(如果有水可用),并增加抗利尿激素(antidiuretic hormone)的分泌,从而增强肾脏远端小管和集合管对水的重吸收。因此,细胞外液容量的增加几乎与保留的钠量相当,但钠浓度变化不大。
尽管醛固酮(aldosterone)是人体最强大的保钠激素之一,但当其分泌过量时,只会引起短暂的钠潴留。正如第19章所解释的,醛固酮介导的细胞外液(extracellular fluid)容量增加持续超过1到2天也会导致动脉压(arterial pressure)升高。动脉压升高进而增加肾脏对钠和水的排泄,分别称为压力性尿钠排泄(pressure natriuresis)和压力性利尿(pressure diuresis)。因此,当细胞外液容量增加到正常值的5%到15%以上时,动脉压也会升高15到25mmHg,这种升高的血压使肾脏对钠和水的排泄恢复到正常水平,尽管醛固酮过量(图78-3)。
图78-3. 醛固酮输注对犬动脉压、细胞外液容量和钠排泄的影响。尽管醛固酮以使血浆浓度升高至正常值约20倍的速率输注,但请注意在输注第二天随着动脉压升高和尿钠排泄恢复正常,钠潴留的“逃逸”现象。(数据来自Hall JE, Granger JP, Smith MJ Jr, et al: Role of hemodynamics and arterial pressure in aldosterone "escape." Hypertension 6[suppl l]:1183-l192, 1984.)
由于压力性尿钠排泄和利尿作用,肾脏对钠和水的排泄恢复到正常水平的现象称为醛固酮逃逸(aldosterone escape)。此后,尽管醛固酮持续过量,身体对钠和水的净增加率为零,肾脏在钠和水的摄入和排泄之间保持平衡。然而,在此期间,高血压已经形成,只要个体持续暴露于高水平的醛固酮,高血压就会持续存在。
相反,严重的醛固酮缺乏可能导致血浆钠浓度显著降低(低钠血症(hyponatremia)),这是由于肾脏钠重吸收减少和钠排泄增加所致。肾脏钠丢失导致细胞外液容量、动脉压和心输出量(cardiac output)降低,从而刺激抗利尿激素(antidiuretic hormone, ADH)的分泌。ADH水平升高减弱了肾脏的水排泄,并导致低钠血症,同时低血容量(hypovolemia)和低血压(hypotension)也会刺激口渴和水的摄入。
当醛固酮分泌为零时,大量钠从尿中丢失,不仅减少了细胞外液中的氯化钠含量,还降低了细胞外液容量。结果是严重的细胞外液脱水和低血容量,导致循环休克(circulatory shock)。如果不进行治疗,通常在肾上腺突然停止分泌醛固酮后的几天内会导致死亡。
过量的醛固酮(aldosterone)会导致低钾血症(hypokalemia)和肌肉无力;醛固酮缺乏则会导致高钾血症(hyperkalemia)和心脏毒性。过量的醛固酮不仅会导致钾离子从细胞外液流失到尿液中,还会刺激钾离子从细胞外液转运到身体的大多数细胞中。因此,醛固酮的过度分泌,如某些类型的肾上腺肿瘤所导致的,可能会引起血浆钾浓度的严重下降(低钾血症),有时从正常值4.5 mEq/L降至低至2~mEq/L。当血浆钾离子浓度降至正常值的一半以下时,通常会出现严重的肌肉无力。这种肌肉无力是由于神经和肌肉纤维膜的电兴奋性改变(见第5章)所致,这会阻止正常动作电位的传递。
相反,当醛固酮缺乏时,细胞外液的钾离子浓度可能会远高于正常值。当钾离子浓度上升到正常值的60%至100%时,严重的心脏毒性,包括心脏收缩无力和心律失常的发展,会变得明显,而钾离子浓度的进一步升高不可避免地会导致心力衰竭。
过量的醛固酮会增加肾小管氢离子的分泌并导致碱中毒(alkalosis)。醛固酮不仅会导致钾离子在肾集合管主细胞中分泌以交换钠的重吸收,还会导致氢离子在皮质集合管的间细胞中分泌以交换钾离子,如第28章和第31章所讨论的。这会降低细胞外液中的氢离子浓度,导致代谢性碱中毒(metabolic alkalosis)。
醛固酮刺激汗腺、唾液腺和肠上皮细胞中的钠和钾转运
醛固酮对汗腺和唾液腺的作用几乎与对肾小管的作用相同。这两种腺体都会形成含有大量氯化钠的初级分泌物,但在通过排泄管时,大部分氯化钠会被重吸收,而钾离子和碳酸氢根离子则会被分泌。醛固酮大大增加了氯化钠的重吸收和钾离子的分泌。醛固酮对汗腺的作用在炎热环境中对保存体内盐分很重要(见第74章),而对唾液腺的作用在唾液大量流失时对保存盐分是必要的。
图78-4. 醛固酮反应性上皮细胞信号通路。醛固酮激活的盐皮质激素受体(MR)可以被螺内酯拮抗。阿米洛利是一种可以用于阻断上皮钠通道(ENaC)蛋白的药物。ATP,ROMK,肾外髓钾通道。
醛固酮还大大增强了肠道对钠的吸收,尤其是在结肠中,这可以防止钠在粪便中的流失。相反,在缺乏醛固酮的情况下,钠的吸收可能会很差,导致无法吸收氯离子和其他阴离子以及水。未吸收的氯化钠和水会导致腹泻,进一步导致体内盐分的流失。
醛固酮作用的细胞机制
尽管多年来我们已经知道盐皮质激素(mineralocorticoids)对身体的总体影响,但醛固酮(aldosterone)作用于肾小管细胞以增加钠转运的分子机制仍未完全理解。然而,导致钠重吸收增加的细胞事件序列似乎如下展开。
首先,由于醛固酮在细胞膜中的脂溶性,它很容易扩散到肾小管上皮细胞的内部。
其次,在肾小管细胞的细胞质中,醛固酮与一种高度特异性的细胞质盐皮质激素受体(MR)蛋白结合(图78-4),该受体具有立体分子构型,只允许醛固酮或类似化合物与其结合。尽管肾小管上皮细胞的MR受体对皮质醇也有很高的亲和力,但酶11β-HSD2通常将大部分皮质醇转化为皮质酮(cortisone),后者不易与MR受体结合,如前所述。
第三,醛固酮-受体复合物或该复合物的产物扩散到细胞核中,在那里可能经历进一步的改变,最终诱导DNA的一个或多个特定部分形成与钠和钾转运过程相关的一种或多种类型的信使RNA(mRNA)。
第四,mRNA扩散回细胞质中,与核糖体协同作用,导致蛋白质的形成。形成的蛋白质是(1)一种或多种酶和(2)膜转运蛋白的混合物,所有这些共同作用,是钠、钾和氢通过细胞膜转运所必需的(见图78-4)。特别增加的一种酶是钠-钾腺苷三磷酸酶(Na+-K+ ATPase),它作为肾小管细胞基底外侧膜上钠和钾交换泵的主要部分。其他蛋白质,可能同样重要,是插入到同一肾小管细胞管腔膜中的上皮钠通道和钾通道;这些通道允许钠离子从肾小管腔快速扩散到细胞内,以及钾从细胞内部扩散到肾小管腔。(关于醛固酮对肾小管上皮细胞钠、钾和氢转运的影响的进一步讨论,请参见第28章和第30章。)
因此,醛固酮对钠转运没有主要的即时影响;相反,这种影响必须等待导致形成钠转运所需的特定细胞内物质的事件序列。大约需要30分钟,新的RNA才会出现在细胞中,大约需要45分钟,钠和钾的转运速率才开始增加;这些效应只有在几个小时后才能达到最大值。
醛固酮和其他类固醇激素可能的非基因组作用
一些研究表明,包括醛固酮在内的许多类固醇不仅会引起缓慢发展的基因组效应,这些效应有45到60分钟的潜伏期,需要基因转录和新蛋白质的合成,还会引起更快速的非基因组效应,这些效应在几秒或几分钟内发生。
这些非基因组作用被认为是通过类固醇与细胞膜受体结合来介导的,这些受体与第二信使系统(second messenger systems)相偶联,类似于肽类激素信号转导所使用的系统。例如,醛固酮(aldosterone)已被证明能在不到2分钟的时间内增加血管平滑肌细胞和肾集合管上皮细胞中环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成,这一时间远远短于基因转录和新蛋白质合成所需的时间。在其他细胞类型中,醛固酮已被证明能快速刺激磷脂酰肌醇第二信使系统(phosphatidylinositol second messenger system)。然而,负责醛固酮快速作用的受体的精确结构尚未确定,这些类固醇非基因组作用的生理意义也尚未完全阐明。
醛固酮分泌的调节
醛固酮分泌的调节与细胞外液电解质浓度、细胞外液容量、血容量、动脉压以及肾脏功能的许多特殊方面的调节密切相关,因此很难独立于所有这些其他因素来讨论醛固酮分泌的控制。这一主题在第28章和第30章中有更详细的介绍,读者可参考这些章节。然而,在此列出一些醛固酮分泌控制的重要要点仍然很重要。
由球状带(zona glomerulosa)细胞调节的醛固酮分泌几乎完全独立于由束状带(zona fasciculata)和网状带(zona reticularis)调节的皮质醇和雄激素(androgens)的分泌。
以下因素已知在醛固酮的调节中起作用:
- 细胞外液中钾离子浓度的增加会显著增加醛固酮的分泌。
- 细胞外液中血管紧张素II(angiotensin II)浓度的增加也会显著增加醛固酮的分泌。
- 细胞外液中钠离子浓度的增加会略微减少醛固酮的分泌。
- 心房钠尿肽(atrial natriuretic peptide, ANP)的增加会减少醛固酮的分泌,ANP是一种由心脏在心房特定细胞受到牵拉时分泌的激素(见第28章)。
- 来自垂体前叶的促肾上腺皮质激素(ACTH)对醛固酮的分泌是必要的,但在大多数生理条件下对控制分泌速率的影响很小。
在这些因素中,钾离子浓度和血管紧张素II在调节醛固酮分泌方面最为有效。钾离子浓度的轻微增加可以导致醛固酮分泌的数倍增加。同样,血管紧张素II的增加(通常是对肾脏血流减少或钠丢失的反应)也可以使醛固酮分泌增加数倍。反过来,醛固酮作用于肾脏:(1)帮助其排泄多余的钾离子;(2)增加血容量和动脉压,从而使肾素-血管紧张素系统(renin-angiotensin system)恢复到其正常活动水平。这些反馈控制机制对维持生命至关重要,读者可再次参考第28章和第30章以获取更完整的描述。
图78-5. 使用血管紧张素转换酶(ACE)抑制剂治疗钠缺乏的狗7天以阻断血管紧张素II(Ang II)的形成,并在ACE抑制后输注外源性Ang II以恢复血浆Ang II水平的效果。注意,阻断Ang II的形成降低了血浆醛固酮浓度,而对皮质醇几乎没有影响,这表明在钠缺乏期间Ang II在刺激醛固酮分泌中的重要作用。(数据来自Hall JE, Guyton AC, Smith MJ Jr, et al: 钠缺乏期间长期阻断血管紧张素II的形成。Am J Physiol 237:F424, 1979。)
图78-5显示了在几周的低钠饮食后,使用血管紧张素转换酶抑制剂阻断血管紧张素II的形成对血浆醛固酮浓度的影响,低钠饮食会增加血浆醛固酮浓度。注意,阻断血管紧张素II的形成显著降低了血浆醛固酮浓度,而皮质醇浓度没有显著变化,这表明在钠摄入量和细胞外液量减少时,血管紧张素II在刺激醛固酮分泌中的重要作用。
相比之下,ANP(心房利钠肽)、钠离子浓度本身和ACTH(促肾上腺皮质激素)在控制醛固酮分泌中的作用通常较小。然而,在罕见情况下,细胞外液钠离子浓度下降10%至20%可能会使醛固酮分泌增加约50%。血浆容量扩张和心房牵张引起的ANP浓度增加可能通过抑制醛固酮分泌部分诱导利尿。在ACTH的情况下,即使前垂体分泌少量ACTH,通常也足以使肾上腺分泌所需的任何量的醛固酮,但完全缺乏ACTH会显著减少醛固酮分泌。因此,ACTH似乎在调节醛固酮分泌中起到“允许”作用。
糖皮质激素的功能
尽管盐皮质激素可以挽救急性肾上腺切除动物的生命,但该动物仍然远未恢复正常。相反,该动物的蛋白质、碳水化合物和脂肪代谢系统仍然严重紊乱。此外,该动物无法抵抗不同类型的身体甚至精神压力,轻微的疾病如呼吸道感染可能导致死亡。因此,糖皮质激素对动物长期生存的功能与盐皮质激素同样重要。这些功能将在以下部分中解释。
肾上腺皮质分泌的糖皮质激素活性至少有95%来自皮质醇的分泌,也称为氢化可的松(hydrocortisone)。此外,皮质酮(corticosterone)也提供了少量但显著的糖皮质激素活性。
皮质醇对碳水化合物代谢的影响
刺激糖异生。皮质醇和其他糖皮质激素对代谢的最著名影响是能够刺激肝脏的糖异生(即从蛋白质和其他一些物质形成碳水化合物),通常使糖异生速率增加6到10倍。这种增加的糖异生速率主要来自皮质醇对肝脏的直接作用,以及通过拮抗胰岛素的作用。
- 皮质醇增加了肝细胞中将氨基酸转化为葡萄糖所需的酶。糖皮质激素(glucocorticoids)以醛固酮(aldosterone)在肾小管细胞中相同的方式激活肝细胞核中的DNA转录,形成mRNAs,进而导致糖异生所需的一系列酶的产生。
- 皮质醇引起氨基酸从肝外组织(主要是肌肉)的动员。结果,血浆中有更多的氨基酸可用于进入肝脏的糖异生过程,从而促进葡萄糖的形成。
- 皮质醇拮抗胰岛素抑制肝脏糖异生的作用。如第79章所讨论的,胰岛素刺激肝脏中的糖原合成并抑制肝脏中参与葡萄糖生成的酶。皮质醇的净效应是增加肝脏的葡萄糖生成。
伴随糖异生增加的肝细胞中糖原储存的显著增加增强了其他糖酵解激素(如肾上腺素和胰高血糖素)在需要时(如两餐之间)动员葡萄糖的作用。
细胞对葡萄糖利用的减少。皮质醇还导致体内大多数细胞对葡萄糖利用的中度减少。虽然这种减少的确切原因尚不清楚,但皮质醇的一个重要作用是减少葡萄糖转运蛋白GLUT 4向细胞膜的转运,特别是在骨骼肌细胞中,导致胰岛素抵抗(insulin resistance)。糖皮质激素还可能抑制其他信号级联的表达和磷酸化,这些信号级联通过影响蛋白质和脂质代谢直接或间接影响葡萄糖利用。例如,糖皮质激素减少胰岛素受体底物-1(insulin receptor substrate–1)和磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase)的表达,这两者都参与介导胰岛素的作用,以及烟酰胺腺嘌呤二核苷酸(nicotinamide-adenine dinucleotide, NADH)氧化形成NAD+。由于NADH必须被氧化以允许糖酵解,这种效应也可能导致细胞对葡萄糖利用的减少。
血糖浓度升高和“肾上腺糖尿病(Adrenal Diabetes)”。糖异生的增加和细胞对葡萄糖利用的中度减少都会导致血糖浓度升高。血糖的升高反过来刺激胰岛素分泌。然而,血浆胰岛素水平的增加在维持血浆葡萄糖方面不如在正常情况下有效。由于之前讨论的原因,高水平的糖皮质激素降低了许多组织(特别是骨骼肌和脂肪组织)对胰岛素在葡萄糖摄取和利用方面的刺激作用的敏感性。除了皮质醇对葡萄糖转运蛋白和参与葡萄糖调节的酶表达的潜在直接影响外,糖皮质激素从脂肪库中动员脂质的作用所导致的高水平脂肪酸可能会损害胰岛素对组织的作用。通过这种方式,糖皮质激素的过量分泌会产生类似于生长激素水平过高的患者中发现的碳水化合物代谢紊乱。
血糖浓度的增加有时非常显著(达到正常的250%),以至于这种情况被称为肾上腺糖尿病(adrenal diabetes)。在肾上腺糖尿病中,胰岛素的给药仅能适度降低血糖浓度——远不如在胰腺糖尿病(pancreatic diabetes)中那样显著——因为组织对胰岛素的作用产生了抵抗。
皮质醇对蛋白质代谢的影响
细胞蛋白质的减少。皮质醇对机体代谢系统的主要影响之一是减少体内几乎所有细胞(除肝脏细胞外)的蛋白质储存。这种减少是由于蛋白质合成减少和细胞内已有蛋白质的分解增加所致。这两种效应可能部分是由于氨基酸向肝外组织的转运减少,正如后面所讨论的,但这可能不是主要原因,因为皮质醇还抑制了许多肝外组织(尤其是肌肉和淋巴组织)中RNA的形成和随后的蛋白质合成。
在皮质醇过量存在的情况下,肌肉可能变得非常虚弱,以至于人无法从蹲姿站起。此外,淋巴组织的免疫功能可能降至正常的一小部分。
皮质醇增加肝脏和血浆蛋白质。与糖皮质激素减少体内其他部位蛋白质的作用同时发生的是,肝脏蛋白质增加。此外,血浆蛋白质(由肝脏产生并释放到血液中)也增加。这些增加是体内其他部位蛋白质消耗的例外。据信,这种差异是由于皮质醇可能增强了氨基酸向肝细胞的转运——但不包括大多数其他细胞——并增强了蛋白质合成所需的肝脏酶。
血液氨基酸增加,氨基酸向肝外细胞转运减少,向肝细胞转运增强。在离体组织中的研究表明,皮质醇抑制了氨基酸向肌肉细胞以及其他肝外细胞的转运。
氨基酸向肝外细胞转运的减少降低了它们的细胞内氨基酸浓度,从而减少了蛋白质的合成。然而,细胞的蛋白质分解继续释放氨基酸,这些氨基酸扩散出细胞,增加了血浆氨基酸浓度。因此,皮质醇从非肝组织中动员氨基酸,从而减少了组织的蛋白质储存。
皮质醇增加的血浆氨基酸浓度和增强的氨基酸向肝细胞的转运也可能解释了肝脏对氨基酸利用的增加,从而导致以下效应:(1) 肝脏对氨基酸的脱氨速率增加,(2) 肝脏中蛋白质合成增加,(3) 肝脏中血浆蛋白质的形成增加,以及 (4) 氨基酸向葡萄糖的转化增加——即糖异生增强。因此,皮质醇对机体代谢系统的许多影响可能主要源于其从外周组织动员氨基酸的能力,同时增加了肝脏效应所需的肝脏酶。
皮质醇对脂肪代谢的影响
脂肪酸的动员。与皮质醇促进肌肉中氨基酸动员的方式类似,它也能促进脂肪组织中脂肪酸的动员。这种动员增加了血浆中游离脂肪酸的浓度,从而也增加了它们作为能量的利用。皮质醇似乎还对细胞中脂肪酸的氧化有直接的促进作用。
皮质醇促进脂肪酸动员的机制尚未完全明确。然而,部分效应可能是由于葡萄糖向脂肪细胞的转运减少所致。回想一下,α-甘油磷酸(α-glycerophosphate)是由葡萄糖衍生的,它是这些细胞中甘油三酯沉积和维持所必需的。在缺乏葡萄糖的情况下,脂肪细胞开始释放脂肪酸。
皮质醇引起的脂肪动员增加,加上细胞中脂肪酸氧化的增加,有助于在饥饿或其他应激情况下将细胞的代谢系统从利用葡萄糖作为能量转向利用脂肪酸。然而,这种皮质醇机制需要数小时才能完全发挥作用——远不如胰岛素减少引起的类似转变迅速或强大,正如我们在第79章中讨论的那样。尽管如此,增加脂肪酸作为代谢能量的利用是长期保存体内葡萄糖和糖原的重要因素。
过量的皮质醇导致肥胖。尽管皮质醇可以从脂肪组织中引起中等程度的脂肪酸动员,但在许多皮质醇分泌过多的人中,会出现一种特殊的肥胖类型,脂肪在身体的胸部和头部区域过度沉积,形成类似水牛的躯干和圆形的“月亮脸”。尽管原因尚不明确,但有人认为这种肥胖是由于食物摄入的过度刺激所致,脂肪在身体的某些组织中生成的速度比其动员和氧化的速度更快。
皮质醇在抵抗应激和炎症中起重要作用
几乎任何类型的应激,无论是物理性的还是神经源性的,都会立即显著增加垂体前叶分泌的ACTH(促肾上腺皮质激素),随后在几分钟内肾上腺皮质分泌的皮质醇大幅增加。这一效应在图78-6所示的实验中得到了显著展示,其中在大鼠的两条腿骨骨折后的4到20分钟内,皮质类固醇的形成和分泌增加了六倍。
以下列表详细说明了增加皮质醇释放的不同类型的应激:
- 创伤
- 感染
- 强烈的热或冷
- 注射去甲肾上腺素和其他拟交感神经药物
- 手术
- 在皮下注射坏死性物质
- 限制动物使其无法移动
- 消耗性疾病
图78-6. 大鼠肾上腺皮质对由胫骨和腓骨骨折引起的应激的快速反应。(在大鼠中,分泌的是皮质酮而非皮质醇。)
尽管在压力情况下皮质醇的分泌常常会大幅增加,但我们并不确定这对动物有什么显著的好处。一种可能性是,糖皮质激素(glucocorticoids)会迅速从细胞储存中动员氨基酸和脂肪,使它们立即可用于能量供应和合成其他化合物,包括身体不同组织所需的葡萄糖(glucose)。事实上,在一些情况下已经证明,暂时缺乏蛋白质的受损组织可以利用新获得的氨基酸来形成对细胞生命至关重要的新蛋白质。此外,氨基酸可能还用于合成其他必需的细胞内物质,如嘌呤(purines)、嘧啶(pyrimidines)和磷酸肌酸(creatine phosphate),这些物质对维持细胞生命和新细胞的繁殖是必要的。
所有这些主要是推测,并且仅由以下事实支持:皮质醇通常不会动员细胞的基本功能蛋白质,如肌肉收缩蛋白和神经元蛋白质,直到几乎所有其他蛋白质都被释放。皮质醇在动员不稳定蛋白质时的这种优先效应可能使需要的细胞获得氨基酸,以合成对生命至关重要的物质。
高水平皮质醇的抗炎作用
当组织因创伤、细菌感染或其他方式受损时,它们几乎总是会“发炎”。在某些情况下,如类风湿性关节炎(rheumatoid arthritis),炎症比创伤或疾病本身更具破坏性。给予大量皮质醇通常可以阻止这种炎症,甚至在炎症开始后逆转其许多影响。在尝试解释皮质醇阻止炎症的作用方式之前,让我们回顾一下炎症过程的基本步骤,这些步骤在第34章中有更详细的讨论。
炎症的五个主要阶段包括:(1) 受损组织细胞释放化学物质,如组胺(histamine)、缓激肽(bradykinin)、蛋白水解酶(proteolytic enzymes)、前列腺素(prostaglandins)和白三烯(leukotrienes),这些物质激活炎症过程;(2) 由于组织释放的一些产物,炎症区域的血液流量增加,这种效应称为红斑(erythema);(3) 由于毛细血管通透性增加,大量几乎纯的血浆从毛细血管渗漏到受损区域,随后组织液凝固,从而引起非凹陷性水肿(nonpitting edema);(4) 白细胞浸润该区域;(5) 几天或几周后,纤维组织的生长通常有助于愈合过程。
当大量皮质醇分泌或注入人体时,糖皮质激素具有两种基本的抗炎作用:(1) 它可以在明显的炎症开始之前阻止炎症过程的早期阶段,或 (2) 如果炎症已经开始,它会导致炎症迅速消退并加快愈合速度。这些作用在以下部分中有进一步解释。
皮质醇通过稳定溶酶体和其他作用防止炎症的发展。皮质醇在预防炎症方面具有以下作用:
- 皮质醇稳定溶酶体(lysosomal)膜。这种稳定作用是皮质醇最重要的抗炎(antiinflammatory)作用之一,因为细胞内溶酶体膜比正常情况下更难破裂。因此,储存在溶酶体中并由受损细胞释放以引起炎症的蛋白水解酶(proteolytic enzymes)的释放量大大减少。
- 皮质醇降低毛细血管(capillaries)的通透性(permeability),这可能是蛋白水解酶释放减少的次级效应。这种通透性的降低防止了血浆(plasma)向组织中的流失。
- 皮质醇减少白细胞(white blood cells)向炎症区域的迁移(migration)以及对受损细胞的吞噬作用(phagocytosis)。这些效应可能是由于皮质醇减少了前列腺素(prostaglandins)和白三烯(leukotrienes)的形成,否则这些物质会增加血管舒张(vasodilation)、毛细血管通透性和白细胞的运动性(mobility)。
- 皮质醇抑制免疫系统(immune system),导致淋巴细胞(lymphocyte)的繁殖显著减少。T淋巴细胞(T lymphocytes)尤其受到抑制。反过来,炎症区域中T细胞和抗体(antibodies)的减少减轻了组织反应,否则这些反应会促进炎症。
- 皮质醇减轻发热(fever),主要是因为它减少了白细胞释放白细胞介素-1(interleukin-1),这是下丘脑(hypothalamic)温度控制系统的主要刺激物之一。温度的降低反过来减少了血管舒张的程度。
因此,皮质醇在减少炎症过程的所有方面具有几乎全局性的效应。目前尚不清楚这种减少有多少是由于皮质醇稳定溶酶体和细胞膜的简单效应,还是由于它减少受损细胞膜中花生四烯酸(arachidonic acid)形成前列腺素和白三烯的效应,以及皮质醇的其他效应。
皮质醇促进炎症的消退(resolution of inflammation)。即使在炎症已经充分发展后,给予皮质醇通常也可以在几小时到几天内减少炎症。其即时效应是阻断大多数促进炎症的因素。然而,此外,愈合速率也得到提高。这可能是由于相同的、主要是未明确的因素,这些因素使身体在分泌大量皮质醇时能够抵抗许多其他类型的物理应激。这可能是由于:(1) 氨基酸(amino acids)的动员和利用这些酸修复受损组织;(2) 糖异生(glucogenesis)增加,使关键代谢系统中获得额外的葡萄糖(glucose);(3) 脂肪酸(fatty acids)的增加,为细胞提供能量;(4) 皮质醇对灭活或清除炎症产物的某种效应。
无论抗炎效应的确切机制如何,皮质醇的这种效应在对抗某些类型的疾病(如类风湿性关节炎(rheumatoid arthritis)、风湿热(rheumatic fever)和急性肾小球肾炎(acute glomerulonephritis))中起着重要作用。所有这些疾病都以严重的局部炎症为特征,对身体的危害主要是由与疾病相关的炎症引起的。
当给予这些疾病患者皮质醇或其他糖皮质激素(glucocorticoids)时,几乎无一例外地,炎症在24小时内开始消退。尽管皮质醇并不能纠正基本的疾病状况,但防止炎症反应的破坏性效应通常可以成为一种挽救生命的措施。
皮质醇的其他效应
皮质醇阻断过敏反应的炎症反应。抗原和抗体之间的基本过敏反应不受皮质醇的影响,甚至过敏反应的一些次级效应仍然会发生。然而,由于炎症反应是导致过敏反应许多严重甚至致命效应的原因,因此使用皮质醇,并通过其减少炎症和炎症产物释放的作用,可以挽救生命。例如,皮质醇能有效预防过敏性休克或死亡,这种情况在未使用皮质醇的情况下会导致许多人死亡,如第35章所述。
对血细胞和感染性疾病免疫的影响。皮质醇会减少血液中嗜酸性粒细胞(eosinophils)和淋巴细胞(lymphocytes)的数量;这种效应在注射皮质醇后几分钟内开始,并在几小时内变得显著。事实上,淋巴细胞减少症(lymphocytopenia)或嗜酸性粒细胞减少症(eosinopenia)的发现是肾上腺皮质醇分泌过多的重要诊断标准。
同样,使用大剂量皮质醇会导致全身淋巴组织的显著萎缩,从而减少淋巴组织中T细胞和抗体的输出。结果,身体对几乎所有外来入侵者的免疫力水平都会下降。这种下降有时会导致暴发性感染和死亡,而这些疾病在正常情况下并不致命,例如在疾病先前已被控制的人中暴发性结核病(fulminating tuberculosis)。然而,皮质醇和其他糖皮质激素(glucocorticoids)抑制免疫的能力使它们成为预防移植心脏、肾脏和其他组织免疫排斥的有用药物。
皮质醇通过尚不清楚的机制增加红细胞的生成。当肾上腺分泌过多的皮质醇时,常导致红细胞增多症(polycythemia);相反,当肾上腺不分泌皮质醇时,常导致贫血(anemia)。
皮质醇作用的细胞机制
皮质醇与其他类固醇激素(steroid hormones)一样,首先通过与靶细胞内的细胞内受体(intracellular receptors)相互作用来发挥其作用。由于皮质醇是脂溶性的,它可以轻松通过细胞膜扩散。进入细胞后,皮质醇与细胞质中的蛋白质受体结合,激素-受体复合物随后与特定的DNA调控序列(称为糖皮质激素反应元件(glucocorticoid response elements))相互作用,以诱导或抑制基因转录。细胞中的其他蛋白质(称为转录因子(transcription factors))也是激素-受体复合物与糖皮质激素反应元件适当相互作用所必需的。
糖皮质激素增加或减少许多基因的转录,从而改变介导其多种生理效应的蛋白质的mRNA合成。因此,皮质醇的大多数代谢效应并不是立即发生的,而是需要45到60分钟来合成蛋白质,并需要数小时或数天才能完全发展。一些证据表明,糖皮质激素,尤其是在高浓度下,可能还对细胞膜离子转运具有一些快速的非基因组效应(nongenomic effects),这可能有助于其治疗效果。
11β-羟基类固醇脱氢酶(11β-Hydroxysteroid Dehydrogenase)对糖皮质激素效应的调节
调节皮质醇生理效应的一个重要机制是局部组织中11β-羟基类固醇脱氢酶(11β-HSD)同工酶的表达。如前所述,一种同工酶11β-HSD2在肾小管的受体前水平将皮质醇代谢为无活性的皮质酮,从而保护盐皮质激素受体不被皮质醇激活。这种酶也存在于其他组织中,如结肠、汗腺、唾液腺和胎盘(图78-7)。当11β-HSD2缺乏时,如由于基因突变或过量摄入甘草引起的明显盐皮质激素过多综合征,或当循环皮质醇浓度极高时,如库欣综合征,这种皮质醇代谢机制可能会被压倒。结果,高水平的皮质醇强烈激活盐皮质激素受体,导致钠潴留、高血压和低钾血症。
图78-7. 两种11β-羟基类固醇脱氢酶同工酶(\boldsymbol1β-HSD1和11β-HSD2)在不同组织中活性皮质醇和无活性皮质酮的相互转化。
相反,肝脏、大脑、脂肪组织、骨骼肌、肺和皮肤等组织表达另一种同工酶11β-HSD1,它将无活性的皮质酮转化为有活性的皮质醇(见图78-7)。因此,11β-HSD1的表达放大了糖皮质激素在组织中的生理效应,而11β-HSD2则具有相反的效果。因此,11β-HSD2的同工酶可能作为组织糖皮质激素作用的细胞内“守门人”。
一些研究表明,脂肪组织中11β-HSD1表达增加和过度的糖皮质激素活性可能与代谢异常有关,包括胰岛素抵抗和糖尿病,这些异常与肥胖相关。大脑中11β-HSD1升高也与衰老过程中的认知衰退有关。然而,调节这些11β-HSD同工酶的生理因素及其在常见疾病如肥胖和痴呆中的作用仍知之甚少。
由垂体腺分泌的促肾上腺皮质激素调节皮质醇分泌
ACTH刺激皮质醇分泌。与主要由钾和血管紧张素II直接作用于肾上腺皮质细胞控制的醛固酮分泌不同,皮质醇的分泌几乎完全由垂体前叶分泌的ACTH控制。这种激素,也称为促肾上腺皮质激素或促皮质素,还增强肾上腺雄激素的产生。
ACTH的化学性质。ACTH已从垂体前叶中分离出纯品。它是一种大分子多肽,链长为39个氨基酸。一种较小的多肽,ACTH的消化产物,链长为24个氨基酸,具有整个分子的所有效应。
ACTH的分泌受下丘脑的促肾上腺皮质激素释放因子(CRF)调控。与其他垂体激素受下丘脑释放因子调控的方式相同,ACTH的分泌也受到一个重要释放因子的调控。这个因子被称为促肾上腺皮质激素释放因子(CRF)。它被分泌到下丘脑正中隆起的垂体门脉系统的初级毛细血管丛中,然后被运送到垂体前叶,在那里诱导ACTH的分泌。CRF是由41个氨基酸组成的肽。分泌CRF的神经元细胞体主要位于下丘脑的室旁核。这个核团反过来接收来自边缘系统和低位脑干的许多神经连接。
在没有CRF的情况下,垂体前叶只能分泌微量的ACTH。相反,大多数导致ACTH分泌率升高的情况都是通过始于大脑基底区域(包括下丘脑)的信号启动这种分泌的,然后通过CRF传递到垂体前叶。
ACTH通过增加cAMP激活肾上腺皮质细胞产生类固醇。ACTH对肾上腺皮质细胞的主要作用是激活细胞膜上的腺苷酸环化酶。这种激活随后诱导细胞质中cAMP的形成,在大约3分钟内达到最大效果。cAMP反过来激活细胞内酶,导致肾上腺皮质激素的形成,这是cAMP作为第二信使信号系统的另一个例子。
在所有ACTH刺激的步骤中,控制肾上腺皮质分泌的最重要步骤是激活酶蛋白激酶A,它导致胆固醇最初转化为孕烯醇酮。这种最初的转化是所有肾上腺皮质激素的"限速"步骤,这解释了为什么ACTH通常是形成任何肾上腺皮质激素所必需的。ACTH对肾上腺皮质的长期刺激不仅增加了分泌活性,还导致肾上腺皮质细胞的肥大和增殖,特别是在分泌皮质醇和雄激素的束状带和网状带。
生理应激增加ACTH和肾上腺皮质分泌。正如本章前面所指出的,几乎任何类型的身体或精神压力都可能在几分钟内导致ACTH分泌大大增加,从而也导致皮质醇分泌增加,通常使皮质醇分泌增加多达20倍。这种效应通过图78-6所示的创伤后快速而强烈的肾上腺皮质分泌反应得到了证明。
由身体压力或组织损伤引起的疼痛刺激首先通过脑干向上传递到室旁核的神经元,最终传递到下丘脑的正中隆起,如图78-8所示。在这里,CRF被分泌到垂体门脉系统中。在几分钟内,整个控制序列导致血液中出现大量皮质醇。
图78-8. 糖皮质激素分泌的调节机制。ACTH,促肾上腺皮质激素; CRF,促肾上腺皮质激素释放因子。
心理压力同样可以导致ACTH分泌的迅速增加。这种增加被认为是由边缘系统(limbic system)活动增强引起的,特别是在杏仁核(amygdala)和海马(hippocampus)区域,这两个区域随后将信号传递到后内侧下丘脑(posterior medial hypothalamus)。
皮质醇对下丘脑和垂体前叶的抑制作用以减少ACTH分泌。皮质醇对(1)下丘脑有直接的负反馈作用,减少CRF的形成;(2)对垂体前叶有直接的负反馈作用,减少ACTH的形成。这两种反馈都有助于调节皮质醇的血浆浓度。也就是说,每当皮质醇浓度过高时,反馈机制会自动将ACTH降低到正常控制水平。
皮质醇控制系统的总结
图78-8展示了控制皮质醇分泌的整体系统。这一控制的关键在于不同类型的压力对下丘脑的兴奋作用。压力刺激激活整个系统,导致皮质醇的快速释放,而皮质醇反过来启动一系列代谢效应,旨在缓解压力状态的有害性。
皮质醇对下丘脑和垂体前叶的直接反馈也会在身体未经历压力时发生,以减少血浆中的皮质醇浓度。然而,压力刺激是最强的刺激;它们总能突破皮质醇的这种直接抑制性反馈,导致在一天中的多个时间点皮质醇分泌的周期性加剧(图78-9)或在慢性压力期间皮质醇分泌的延长。
糖皮质激素分泌的昼夜节律。CRF、ACTH和皮质醇的分泌速率在清晨较高,而在傍晚较低,如图78-9所示;血浆皮质醇水平在早晨起床前一小时达到约20μg/dl的高峰,而在午夜左右降至约5μg/dl的低谷。这种效应是由下丘脑引起的皮质醇分泌信号的24小时周期性变化引起的。当一个人改变其日常睡眠习惯时,这一周期也会相应改变。因此,只有在测量时考虑到周期中的时间点,血液皮质醇水平的测量才有意义。
图78-9. 一天中皮质醇浓度的典型模式。注意分泌的波动,以及早晨醒来后一小时左右的每日分泌高峰。
ACTH的合成与分泌与黑色素细胞刺激激素、脂解素和内啡肽的关系
当促肾上腺皮质激素(ACTH)由垂体前叶分泌时,几种具有相似化学结构的其他激素也会同时分泌。转录形成RNA分子的基因最初会导致形成一种更大的蛋白质,称为前激素原(prohormone)的pro-opiomelanocortin (POMC),它是ACTH和其他几种肽类的前体,包括促黑素细胞激素(melanocyte-stimulating hormone, MSH)、β-促脂解素(β-lipotropin)、β-内啡肽(β-endorphin)等(图78-10)。在正常情况下,这些激素大多不会由垂体分泌足够的量来对人体产生重大影响,但当ACTH分泌速率很高时,如Addison病患者,其他一些POMC衍生激素的形成也可能增加。
POMC基因在多种组织中活跃转录,包括垂体前叶的促肾上腺皮质激素细胞(corticotroph cells)、下丘脑弓状核(arcuate nucleus)的POMC神经元、真皮细胞和淋巴组织。在所有这些细胞类型中,POMC被加工形成一系列较小的肽类。特定组织中POMC衍生产物的确切类型取决于该组织中存在的加工酶类型。因此,垂体促肾上腺皮质激素细胞表达前激素原转化酶1(prohormone convertase 1, PC1),导致产生N端肽(N-terminal peptide)、连接肽(joining peptide)、ACTH和β-促脂解素(β-lipotropin)。在下丘脑中,PC2的表达导致产生α-MSH、β-MSH、γ-MSH和β-内啡肽(β-endorphin),但不产生ACTH。如第72章所讨论的,由下丘脑神经元形成的α-MSH在食欲调节中起主要作用。
在位于皮肤真皮和表皮之间的黑素细胞(melanocytes)中,MSH刺激黑色素(melanin)的形成并将其分散到表皮中。将MSH注射到人体8到10天可以大大增加皮肤的变黑。这种效果在遗传性深色皮肤的人中比在浅色皮肤的人中要大得多。
图78-10. 前激素原转化酶1(prohormone convertase 1, PC1; 红色箭头)和PC2(蓝色箭头)对pro-opiomelanocortin的加工。这两种酶的组织特异性表达导致在不同组织中产生不同的肽类。ACTH, 促肾上腺皮质激素; CLIP, 促肾上腺皮质激素样中间肽; MSH, 促黑素细胞激素。
在一些动物中,垂体中间叶(pars intermedia)高度发达,位于垂体前叶和后叶之间。这个叶分泌特别大量的MSH。此外,这种分泌由下丘脑独立控制,以响应动物暴露的光量或其他环境因素。例如,一些北极动物在夏季会形成深色毛发,而在冬季则完全变成白色毛发。
由于ACTH含有MSH序列,其促黑素细胞效应约为MSH的%。此外,由于人体分泌的纯MSH量极少,而ACTH的量很大,因此在决定皮肤中黑色素的量时,ACTH通常比MSH更重要。
肾上腺雄激素
几种中等活性的雄性激素(adrenal androgens)(其中最重要的是脱氢表雄酮(dehydroepiandrosterone))由肾上腺皮质(adrenal cortex)持续分泌,尤其是在胎儿期,如第84章所述。此外,女性激素(progesterone)和雌激素(estrogens)也以微量分泌。
通常情况下,肾上腺雄激素在人体中的作用较弱。男性性器官的早期发育可能部分源于儿童期肾上腺雄激素的分泌。肾上腺雄激素在女性中也发挥轻微作用,不仅在青春期前,而且贯穿一生。女性阴毛和腋毛的生长很大程度上归因于这些激素的作用。
在肾上腺外组织中,部分肾上腺雄激素转化为主要的男性激素睾酮(testosterone),这可能是其雄激素活性的主要原因。雄激素的生理作用在第81章中与男性性功能相关的内容中讨论。
肾上腺皮质分泌异常 肾上腺功能减退(Adrenal Insufficiency)——Addison病
Addison病是由于肾上腺皮质无法产生足够的肾上腺皮质激素所致,这通常是由肾上腺皮质的原发性萎缩或损伤引起的。在大约80%的病例中,萎缩是由针对皮质的自身免疫引起的。肾上腺功能减退也可能由结核病破坏肾上腺或癌症侵袭肾上腺皮质引起。
在某些情况下,肾上腺功能减退继发于垂体功能受损,垂体无法产生足够的促肾上腺皮质激素(ACTH)。当ACTH分泌过低时,皮质醇和醛固酮(aldosterone)的生成减少,最终肾上腺可能因缺乏ACTH刺激而萎缩。继发性肾上腺功能减退比Addison病(有时称为原发性肾上腺功能减退)更为常见。严重肾上腺功能减退的紊乱将在以下部分描述。
盐皮质激素缺乏。醛固酮分泌不足会大大降低肾小管钠重吸收,从而导致钠离子、氯离子和水大量流失到尿液中。最终结果是细胞外液量大大减少和低钠血症(hyponatremia)。此外,由于钾离子和氢离子未能分泌以交换钠重吸收,会出现高钾血症(hyperkalemia)和轻度酸中毒。
随着细胞外液耗尽,血浆容量下降,红细胞浓度显著上升,心输出量和血压下降,患者可能陷入休克,未经治疗的患者通常在盐皮质激素分泌完全停止后4天至2周内死亡。
糖皮质激素缺乏症(Glucocorticoid Deficiency)。Addison病患者由于无法分泌皮质醇,因此无法在餐间维持正常的血糖浓度,因为他或她无法通过糖异生合成大量葡萄糖。此外,皮质醇的缺乏会减少从组织中动员蛋白质和脂肪的能力,从而抑制身体的许多其他代谢功能。当皮质醇不可用时,能量动员的这种迟缓是糖皮质激素缺乏的主要有害影响之一。即使有大量的葡萄糖和其他营养物质可用,患者的肌肉仍然无力,这表明除了能量代谢外,糖皮质激素对于维持组织的其他代谢功能也是必要的。
糖皮质激素分泌不足还会使Addison病患者对各种压力的恶化效应高度敏感,即使是轻微的呼吸道感染也可能导致死亡。
黑色素沉着(Melanin Pigmentation)。大多数Addison病患者的另一个特征是粘膜和皮肤的黑色素沉着。这种黑色素并不总是均匀沉积,偶尔会以斑块形式沉积,特别是在薄皮肤区域,如嘴唇的粘膜和乳头的薄皮肤。
当皮质醇分泌减少时,对下丘脑和垂体前叶的正常负反馈也会减少,因此允许ACTH的大量分泌,同时也会增加MSH的分泌。大量的ACTH可能是导致色素沉着的主要原因,因为它们可以像MSH一样刺激黑色素细胞(melanocytes)形成黑色素。
Addison病患者的治疗(Treatment of People With Addison's Disease)。未经治疗的肾上腺完全破坏的患者会在几天到几周内因虚弱和通常的循环休克而死亡。然而,如果每天给予少量的盐皮质激素(mineralocorticoids)和糖皮质激素,这样的患者可以存活多年。
肾上腺危象(Adrenal Crisis)。正如本章前面提到的,偶尔会因不同类型的身体或精神压力而分泌大量的糖皮质激素。在Addison病患者中,糖皮质激素的输出在压力期间不会增加。然而,在创伤、疾病或其他压力(如手术)期间,患者可能会急性需要增加糖皮质激素的量,通常必须给予正常量的10倍或更多的糖皮质激素以防止死亡。
图78-11。Cushing综合征患者在部分肾上腺切除术前(左)和术后(右)。(由Leonard Posey博士提供。)
这种在急性压力时期对额外糖皮质激素的迫切需求以及相关的严重虚弱被称为肾上腺(或Addisonian)危象。
肾上腺功能亢进——Cushing综合征
肾上腺皮质分泌过多会引起一系列复杂的激素效应,称为库欣综合征(Cushing's syndrome)。库欣综合征的许多异常可归因于皮质醇的异常分泌,但雄激素(androgens)的过量分泌也可能引起重要影响。皮质醇增多症(hypercortisolism)可由多种原因引起,包括:(1) 分泌大量促肾上腺皮质激素(ACTH)的垂体前叶腺瘤(adenomas),导致肾上腺增生(adrenal hyperplasia)和皮质醇分泌过多;(2) 下丘脑功能异常导致促肾上腺皮质激素释放激素(corticotropin-releasing hormone)水平升高,刺激ACTH过量释放;(3) 身体其他部位的肿瘤(如腹部癌)"异位分泌"(ectopic secretion)ACTH;(4) 肾上腺皮质腺瘤。当库欣综合征继发于垂体前叶ACTH分泌过多时,这种情况被称为库欣病(Cushing's disease)。
ACTH分泌过多是库欣综合征最常见的原因,其特征是血浆ACTH和皮质醇水平升高。肾上腺原发性皮质醇分泌过多约占库欣综合征临床病例的20%至25%,通常与ACTH水平降低有关,这是由于皮质醇对垂体前叶ACTH分泌的反馈抑制(feedback inhibition)所致。
使用大剂量地塞米松(dexamethasone)(一种合成的糖皮质激素(glucocorticoid))可用于区分ACTH依赖性和ACTH非依赖性库欣综合征。对于因分泌ACTH的垂体腺瘤或下丘脑-垂体功能障碍导致ACTH分泌过多的患者,低剂量地塞米松通常不能正常抑制ACTH分泌。通过将地塞米松剂量增加到非常高的水平,大多数库欣病患者的ACTH最终可以被抑制。相比之下,原发性肾上腺皮质醇分泌过多(ACTH非依赖性库欣综合征)患者的ACTH水平通常较低或检测不到。
尽管地塞米松试验(dexamethasone test)被广泛使用,但有时可能导致误诊,因为一些分泌ACTH的垂体肿瘤确实会对地塞米松产生反应,抑制ACTH分泌。此外,异位分泌ACTH的非垂体恶性肿瘤(如某些肺癌)对糖皮质激素的负反馈(negative feedback)无反应。因此,地塞米松试验通常被认为是库欣综合征鉴别诊断(differential diagnosis)的第一步。
当长期大剂量使用糖皮质激素进行治疗时,也可能发生库欣综合征。例如,患有类风湿性关节炎(rheumatoid arthritis)等疾病相关慢性炎症的患者通常使用糖皮质激素治疗,可能会出现库欣综合征的一些临床症状。
库欣综合征(Cushing’s syndrome)的一个特殊特征是脂肪从身体下部动员,同时在胸部和上腹部区域出现额外的脂肪沉积,形成类似水牛的身躯。类固醇的过量分泌还会导致面部水肿,某些激素的雄激素活性有时会引起痤疮和多毛症(面部毛发过度生长)。面部外观常被描述为“满月脸”,如图78-11左侧未治疗的库欣综合征患者所示。约80%的患者患有高血压,推测是由于皮质醇的盐皮质激素作用。
库欣综合征对碳水化合物和蛋白质代谢的影响。库欣综合征中分泌的大量皮质醇会增加血糖浓度,有时餐后血糖值可高达200~mg/dl,是正常值的两倍。这种增加主要是由于糖异生增强和组织对葡萄糖的利用减少所致。
在库欣综合征中,糖皮质激素(glucocorticoids)对蛋白质分解代谢的影响通常非常显著,导致全身几乎所有组织(除肝脏外)的蛋白质显著减少;血浆蛋白也不受影响。特别是肌肉中蛋白质的丢失会导致严重的虚弱。淋巴组织中蛋白质合成的减少导致免疫系统受到抑制,因此这些患者极易感染。甚至皮下组织中的蛋白质胶原纤维也会减少,使得皮下组织容易撕裂,导致撕裂处出现大面积的紫色条纹。此外,骨骼中蛋白质沉积的严重减少通常会导致严重的骨质疏松症(osteoporosis),从而使骨骼变得脆弱。
库欣综合征的治疗。库欣综合征的治疗包括切除肾上腺肿瘤(如果这是病因)或尽可能减少ACTH的分泌。肥大的垂体腺或甚至垂体中的小肿瘤(过度分泌ACTH)有时可以通过手术切除或放射治疗破坏。当手术不可行时,也可以使用阻断类固醇生成(steroidogenesis)的药物,如美替拉酮(metyrapone)、酮康唑(ketoconazole)和氨鲁米特(aminoglutethimide),或抑制ACTH分泌的药物,如5-羟色胺拮抗剂(serotonin antagonists)和GABA转氨酶抑制剂(GABAtransaminase inhibitors)。如果ACTH分泌不能轻易减少,通常唯一令人满意的治疗方法是双侧部分(甚至全部)肾上腺切除术(adrenalectomy),随后给予肾上腺类固醇以弥补可能出现的不足。
原发性醛固酮增多症(Primary Aldosteronism)(Conn综合征)
偶尔,球状带细胞的小肿瘤会发生并分泌大量的醛固酮(aldosterone);由此产生的病症被称为原发性醛固酮增多症(primary aldosteronism)或Conn综合征(Conn’s syndrome)。此外,在少数情况下,增生的肾上腺皮质会分泌醛固酮而非皮质醇。过量的醛固酮的影响在本章前面已详细讨论。最重要的影响包括低钾血症(hypokalemia)、轻度代谢性碱中毒(metabolic alkalosis)、细胞外液量和血容量轻微增加、血浆钠浓度适度增加(通常增加<4-6-mEq/L),以及几乎总是伴随的高血压(hypertension)。在原发性醛固酮增多症患者中,特别有趣的是偶尔会因低钾血症而出现肌肉麻痹。这种麻痹是由低细胞外钾浓度对神经纤维动作电位传递的抑制作用引起的,如第5章所述。
原发性醛固酮增多症的诊断标准之一是血浆肾素(renin)浓度降低。这种降低是由于过量的醛固酮或由醛固酮增多症引起的过量细胞外液量和动脉压对肾素分泌的反馈抑制所致。原发性醛固酮增多症的治疗可能包括手术切除肿瘤或在增生的情况下切除大部分肾上腺组织。另一种治疗选择是使用螺内酯(spironolactone)或依普利酮(eplerenone)对盐皮质激素受体(mineralocorticoid receptor)进行药理学拮抗。
肾上腺生殖综合征(Adrenogenital Syndrome)
偶尔,肾上腺皮质肿瘤会分泌过量的雄激素(androgens),导致全身出现强烈的男性化效应。如果这种现象发生在女性身上,会出现男性化特征,包括胡须生长、声音变得更深沉、如果她也有秃顶的遗传特征则偶尔会出现秃顶、体毛和阴毛的男性化分布、阴蒂(clitoris)生长类似阴茎(penis),以及皮肤尤其是肌肉中蛋白质的沉积,从而呈现出典型的男性特征。
图78-12. 一名4岁男孩的肾上腺生殖综合征。(由Leonard Posey博士提供)
在青春期前的男性中,男性化的肾上腺肿瘤会导致与女性相同的特征,再加上男性性器官的快速发育,如图78-12所示,图中描绘了一名患有肾上腺生殖综合征的4岁男孩。在成年男性中,肾上腺生殖综合征的男性化特征通常被睾丸(testes)分泌的睾酮(testosterone)的正常男性化特征所掩盖。在成年男性中,肾上腺生殖综合征的诊断通常较为困难。在肾上腺生殖综合征中,尿液中17-酮类固醇(17-ketosteroids)(来源于雄激素)的排泄量可能是正常值的10到15倍。这一发现可用于诊断该疾病。
第79章 胰岛素、胰高血糖素与糖尿病
胰腺除了其消化功能外,还分泌两种主要激素,胰岛素和胰高血糖素,这些激素对葡萄糖、脂质和蛋白质代谢的正常调节至关重要。尽管胰腺还分泌其他激素,如胰淀素(amylin)、生长抑素和胰多肽(pancreatic polypeptide),但它们的功能尚未完全明确。本章的主要目的是讨论胰岛素和胰高血糖素的生理作用,以及由这些激素分泌或活性异常引起的疾病,特别是糖尿病的病理生理学。
胰腺的生理解剖
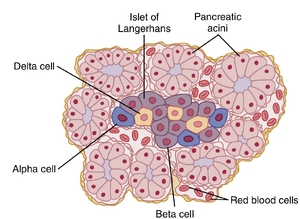
胰腺由两种主要类型的组织组成,如图79-1所示:(1) 腺泡,其分泌消化液进入十二指肠;(2) 胰岛(Langerhans islets),其直接向血液中分泌胰岛素和胰高血糖素。胰腺的消化分泌功能在第65章中讨论。
人类胰腺中有100万到200万个胰岛(Islets of Langerhans)。每个胰岛的直径仅为约0.3毫米,围绕着小毛细血管组织,其细胞将激素分泌到这些毛细血管中。胰岛包含三种主要类型的细胞——α细胞(alpha cells)、β细胞(beta cells)和δ细胞(delta cells)——它们通过形态学和染色特性相互区分。
β细胞约占胰岛所有细胞的60%,主要位于每个胰岛的中央,分泌胰岛素和胰淀素(amylin)。胰淀素通常与胰岛素同时分泌,尽管其功能尚不明确。α细胞约占胰岛总细胞的25%,分泌胰高血糖素;δ细胞约占胰岛总细胞的10%,分泌生长抑素。此外,胰岛中还存在至少一种其他类型的细胞,即PP细胞(PP cells),数量较少,分泌一种称为胰多肽(pancreatic polypeptide)的激素。
胰岛中这些细胞类型之间的密切相互关系使得细胞间能够进行通讯,并通过其他激素直接控制某些激素的分泌。例如,胰岛素抑制胰高血糖素的分泌,胰淀素抑制胰岛素的分泌,而生长抑素则抑制胰岛素和胰高血糖素的分泌。
胰岛素及其代谢作用
胰岛素于1922年由Banting和Best首次从胰腺中分离出来,几乎在一夜之间挽救了严重糖尿病患者的健康迅速恶化和早期死亡。历史上,胰岛素与“血糖”相关联,确实,胰岛素对碳水化合物代谢有深远影响。然而,脂肪代谢异常导致的酸中毒和动脉硬化等状况也是糖尿病患者发病和死亡的重要原因。长期未经治疗的糖尿病患者合成蛋白质的能力下降,导致组织消耗和许多细胞功能障碍。因此,很明显,胰岛素对脂肪和蛋白质代谢的影响几乎与对碳水化合物代谢的影响一样大。
胰岛素是一种与能量的充足相关的激素
在接下来的几页中讨论胰岛素时,我们会发现胰岛素分泌与能量的充足有关。也就是说,当一个人的饮食中包含大量提供能量的食物,尤其是过量的碳水化合物时,胰岛素分泌会增加。反过来,胰岛素在储存多余能量方面起着重要作用。在碳水化合物过量的情况下,胰岛素会促使它们以糖原的形式储存,主要在肝脏和肌肉中。此外,所有无法以糖原形式储存的多余碳水化合物在胰岛素的刺激下转化为脂肪,并储存在脂肪组织(adipose tissue)中。对于蛋白质,胰岛素直接促进细胞摄取氨基酸(amino acids)并将这些氨基酸转化为蛋白质。此外,它还抑制细胞中已有蛋白质的分解。
胰岛素化学与合成
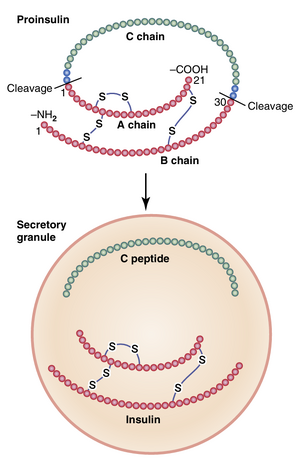
人类胰岛素的分子量为5808,由两条氨基酸链组成,如图79-2所示,这两条链通过二硫键连接。当两条氨基酸链分开时,胰岛素的功能活性丧失。
胰岛素在β细胞中通过通常的蛋白质合成机制合成,如第3章所述,从附着在内质网上的核糖体翻译胰岛素RNA开始,形成前胰岛素原(preproinsulin)。这个最初的前胰岛素原分子量约为11,500,然后在内质网中被切割,形成分子量约为9000的胰岛素原,由A、B和C三条肽链组成。大部分胰岛素原在高尔基体中被进一步切割,形成由二硫键连接的A链和B链组成的胰岛素,以及称为连接肽(C peptide)的C链肽。胰岛素和C肽被包装在分泌颗粒中,并以等摩尔量分泌。最终分泌产物中约有5%至10%仍以胰岛素原的形式存在。
胰岛素原和C肽几乎没有胰岛素活性。然而,C肽与膜结构结合,很可能是G蛋白偶联膜受体,并引发至少两种酶系统的激活,即NaK泵和内皮一氧化氮合酶。尽管这两种酶具有多种生理功能,但C肽在调节这些酶中的重要性仍不确定。
在胰岛素治疗的糖尿病患者中,可以通过放射免疫测定法测量C肽水平,以确定他们自身仍在产生多少天然胰岛素。无法产生胰岛素的1型糖尿病患者通常也会显著降低C肽水平。
当胰岛素分泌到血液中时,它几乎完全以未结合的形式循环。由于其血浆半衰期平均仅为约6分钟,因此主要在10至15分钟内从循环中清除。除了与靶细胞中的受体结合的部分胰岛素外,胰岛素主要在肝脏中被胰岛素酶insulinase降解,较少部分在肾脏和肌肉中降解,在大多数其他组织中略有降解。这种从血浆中的快速清除很重要,因为有时快速关闭胰岛素的控制功能与开启它们同样重要。
胰岛素激活靶细胞受体及其引起的细胞效应
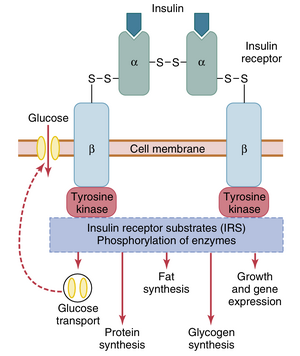
为了启动其对靶细胞的作用,胰岛素必须首先与分子量约为300,000的膜受体蛋白结合并激活它(图79-3)。
胰岛素受体是由四个亚基通过二硫键连接而成的复合物:两个完全位于细胞膜外的α亚基和两个穿透细胞膜并伸入细胞质中的β亚基。胰岛素与细胞外部的α亚基结合,但由于与β亚基的连接,伸入细胞内的β亚基部分会发生自磷酸化(autophosphorylation)。因此,胰岛素受体是酶联受体的一个例子,这将在第75章中讨论。受体β亚基的自磷酸化会激活局部的酪氨酸激酶,进而导致多种其他细胞内酶的磷酸化,包括一组称为胰岛素受体底物(insulin-receptor substrates, IRS)的分子。不同类型的IRS(例如IRS-1、IRS-2和IRS-3)在不同组织中表达。最终效果是激活某些酶,同时抑制其他酶。通过这种方式,胰岛素指导细胞内代谢机制,对碳水化合物、脂肪和蛋白质代谢产生预期效果。以下是胰岛素刺激的主要最终效应:
- 在胰岛素与其膜受体结合后的几秒钟内,约80%的体细胞膜显著增加了对葡萄糖的摄取。这种作用在肌肉细胞和脂肪细胞中尤为明显,但对大脑中的大多数神经元不适用。进入细胞的葡萄糖立即被磷酸化,并成为所有常见碳水化合物代谢功能的底物。增加的葡萄糖转运被认为是由多个细胞内囊泡向细胞膜的转运引起的;这些囊泡携带多个葡萄糖转运蛋白分子,这些分子与细胞膜结合并促进葡萄糖进入细胞。当胰岛素不再存在时,这些囊泡在约3到5分钟内从细胞膜上分离,并返回细胞内部,以便根据需要重复使用。
- 细胞膜对许多氨基酸、钾离子和磷酸离子的通透性增加,导致这些物质进入细胞的转运增加。
- 在接下来的10到15分钟内,会发生较慢的效应,改变更多细胞内代谢酶的活性水平。这些效应主要是由酶的磷酸化状态变化引起的。
- 更慢的效应会持续数小时甚至数天。这些效应是由于信使RNA(messenger RNAs)在核糖体上翻译为新蛋白质的速率改变,以及细胞核中DNA转录速率改变所导致的更慢效应。通过这种方式,胰岛素重塑了大部分细胞酶机制,以实现其部分代谢效应。
胰岛素对碳水化合物代谢的影响
在高碳水化合物餐后立即摄入的葡萄糖被吸收进入血液,导致胰岛素的快速分泌,这将在本章后面详细讨论。胰岛素反过来导致几乎所有身体组织(尤其是肌肉、脂肪组织和肝脏)快速摄取、储存和利用葡萄糖。
胰岛素促进肌肉葡萄糖摄取和代谢
在一天中的大部分时间里,肌肉组织并不依赖葡萄糖,而是依赖脂肪酸作为能量来源。这种依赖脂肪酸的主要原因是,正常静息状态下的肌肉膜对葡萄糖的渗透性较低,除非肌纤维受到胰岛素的刺激;在餐间,分泌的胰岛素量太少,无法促进大量葡萄糖进入肌肉细胞。
然而,在两种情况下,肌肉确实会使用大量葡萄糖。一种情况是在中度或剧烈运动期间。这种葡萄糖的使用不需要大量胰岛素,因为肌肉收缩会增加葡萄糖转运蛋白4(GLUT 4)从细胞内储存库向细胞膜的转运,从而促进葡萄糖扩散进入细胞。
肌肉使用大量葡萄糖的第二种情况是在餐后几小时内。此时血糖浓度较高,胰腺分泌大量胰岛素。额外的胰岛素导致葡萄糖快速转运进入肌肉细胞,使肌肉细胞在此期间优先使用葡萄糖而不是脂肪酸,这将在后面讨论。
肌肉中糖原的储存。如果餐后肌肉没有运动,但葡萄糖大量转运进入肌肉细胞,大部分葡萄糖不会用于能量供应,而是以肌肉糖原的形式储存,浓度上限为2%至3%。糖原可以在以后被肌肉用于能量供应。糖原特别适用于肌肉在短时间内极端能量需求的情况,甚至可以通过糖原的糖酵解分解为乳酸,提供几分钟的无氧能量爆发,这甚至可以在无氧条件下发生。
胰岛素促进葡萄糖通过肌肉细胞膜转运的定量效应
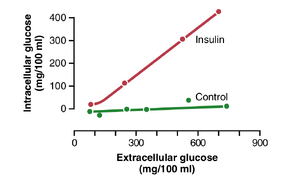
图79-4所示的实验结果证明了胰岛素促进葡萄糖通过肌细胞膜转运的定量效应。标记为“对照”的下方曲线显示了细胞内测量的游离葡萄糖浓度,表明尽管细胞外葡萄糖浓度高达750mg/100ml,细胞内葡萄糖浓度仍几乎为零。相比之下,标记为“胰岛素”的曲线显示,当添加胰岛素时,细胞内葡萄糖浓度上升至400mg/100ml。因此,很明显,胰岛素可以将葡萄糖转运到静息肌细胞的速率提高至少15倍。
胰岛素促进肝脏对葡萄糖的摄取、储存和利用
胰岛素最重要的作用之一是促使餐后吸收的大部分葡萄糖以糖原的形式迅速储存在肝脏中。然后,在餐间,当食物不可用且血糖浓度开始下降时,胰岛素分泌迅速减少,肝糖原分解回葡萄糖,释放回血液中,以防止血糖浓度下降过低。
胰岛素引起肝脏摄取和储存葡萄糖的机制包括几个几乎同时发生的步骤:
- 胰岛素使肝脏(糖原)磷酸化酶phosphorylase失活,这是导致肝糖原分解为葡萄糖的主要酶。这种失活阻止了储存在肝细胞中的糖原的分解。
- 胰岛素通过增加葡萄糖激酶的活性来增强肝细胞从血液中摄取葡萄糖的能力,葡萄糖激酶是葡萄糖扩散到肝细胞后引起其初始磷酸化的酶之一。一旦磷酸化,葡萄糖暂时被困在肝细胞内,因为磷酸化的葡萄糖无法通过细胞膜扩散回去。
- 胰岛素增加促进糖原合成的酶的活性,特别是糖原合酶。这负责单糖单位的聚合以形成糖原分子。
所有这些作用的净效应是增加肝脏中的糖原量。糖原可以增加到肝脏总质量的约5%至6%,相当于整个肝脏中储存的近100克糖原。
餐间葡萄糖从肝脏释放。当餐间血糖水平开始下降到较低水平时,会发生几个事件,导致肝脏将葡萄糖释放回循环血液中:
- 血糖下降导致胰腺减少胰岛素分泌。
- 胰岛素的缺乏随后逆转了之前列出的所有糖原储存效应,基本上停止了肝脏中糖原的进一步合成,并阻止了肝脏从血液中进一步摄取葡萄糖。
- 胰岛素的缺乏(以及随后讨论的胰高血糖素的增加)激活了糖原磷酸化酶,导致糖原分解为葡萄糖磷酸盐。
- 葡萄糖磷酸酶(之前被胰岛素抑制)现在因胰岛素的缺乏而被激活,导致磷酸基团从葡萄糖上分离,使游离葡萄糖能够扩散回血液中。
因此,当餐后血液中葡萄糖过多时,肝脏会从血液中移除葡萄糖,并在餐间血糖浓度下降时将其返回血液。通常,餐后约60%的葡萄糖以这种方式储存在肝脏中,随后再返回血液。
胰岛素促进过量葡萄糖转化为脂肪酸并抑制肝脏中的糖异生。当进入肝细胞的葡萄糖量超过可以储存为糖原或用于局部肝细胞代谢的量时,胰岛素会促进所有这些过量葡萄糖转化为脂肪酸。这些脂肪酸随后被包装成极低密度脂蛋白中的甘油三酯,通过血液运输到脂肪组织,并沉积为脂肪。
胰岛素还通过减少糖异生所需的肝酶的数量和活性来抑制糖异生。然而,部分效果是由于胰岛素的作用减少了肌肉和其他肝外组织释放氨基酸,从而减少了糖异生所需的这些必要前体的可用性。这一现象将在讨论胰岛素对蛋白质代谢的影响时进一步探讨。
胰岛素对脑部葡萄糖摄取和利用的缺乏影响
大脑与身体大多数其他组织有很大不同,因为胰岛素对其摄取或利用葡萄糖几乎没有影响。相反,大多数脑细胞对葡萄糖具有通透性,可以在没有胰岛素介导的情况下利用葡萄糖。
脑细胞与身体大多数其他细胞也有很大不同,因为它们通常仅使用葡萄糖作为能量来源,并且很难使用其他能量底物,如脂肪。因此,必须始终将血糖水平维持在临界水平以上,这是血糖控制系统最重要的功能之一。当血糖水平过低,降至20至50mg/100ml范围内时,会出现低血糖休克症状,其特征是进行性神经兴奋性增加,导致晕厥、癫痫发作甚至昏迷。
胰岛素对其他细胞碳水化合物代谢的影响
胰岛素以与影响肌肉细胞葡萄糖转运和利用相同的方式,增加了身体大多数其他细胞(除了大多数脑细胞)的葡萄糖转运和利用。葡萄糖进入脂肪细胞的转运主要为脂肪分子的甘油部分提供底物。因此,通过这种间接方式,胰岛素促进了这些细胞中脂肪的沉积。
胰岛素对脂肪代谢的影响
尽管胰岛素对脂肪代谢的影响不如其对碳水化合物代谢的急性效应那么明显,但从长远来看,这些影响同样重要。特别引人注目的是胰岛素缺乏在导致极端动脉粥样硬化方面的长期效应,这通常会导致心脏病发作、脑卒中和其他血管意外。然而,首先让我们讨论胰岛素对脂肪代谢的急性效应。
胰岛素促进脂肪合成和储存
胰岛素具有多种促进脂肪在脂肪组织中储存的作用。首先,胰岛素增加了大多数身体组织对葡萄糖的利用,这自动减少了脂肪的利用,从而起到节约脂肪的作用。然而,胰岛素也促进脂肪酸合成,尤其是在摄入的碳水化合物超过即时能量需求时,从而为脂肪合成提供了底物。几乎所有这些合成都在肝细胞中进行,然后脂肪酸通过血液脂蛋白从肝脏运输到脂肪细胞中储存。以下因素导致肝脏中脂肪酸合成的增加:
- 胰岛素增加了葡萄糖向肝细胞的转运。当肝糖原浓度达到5%到6%时,进一步的糖原合成受到抑制。所有进入肝细胞的额外葡萄糖随后可用于形成脂肪。葡萄糖首先在糖酵解途径中分解为丙酮酸,随后丙酮酸转化为乙酰辅酶A(acetyl-CoA),这是脂肪酸合成的底物。
- 当过量葡萄糖用于能量时,柠檬酸循环会形成过量的柠檬酸和异柠檬酸离子。这些离子随后直接激活乙酰辅酶A羧化酶(acetyl-CoA carboxylase),这是将乙酰辅酶A羧化为丙二酰辅酶A(malonyl-CoA)所需的酶,这是脂肪酸合成的第一阶段。
- 大多数脂肪酸随后在肝脏内合成,并用于形成甘油三酯,这是储存脂肪的常见形式。它们从肝细胞释放到血液中的脂蛋白中。胰岛素激活脂肪组织毛细血管壁中的脂蛋白脂肪酶(lipoprotein lipase),将甘油三酯再次分解为脂肪酸,这是它们被吸收到脂肪细胞中的必要条件,在脂肪细胞中它们再次转化为甘油三酯并储存。
胰岛素在脂肪细胞中储存脂肪的作用。胰岛素还有两个其他必需的作用,这些作用对于脂肪在脂肪细胞中的储存是必要的:
- 胰岛素抑制激素敏感性脂肪酶(hormone-sensitive lipase)的作用。脂肪酶是导致脂肪细胞中已储存的甘油三酯水解的酶。因此,脂肪组织向循环血液中释放脂肪酸的过程受到抑制。
- 胰岛素促进葡萄糖通过细胞膜进入脂肪细胞,其方式与促进葡萄糖进入肌肉细胞的方式相同。其中一些葡萄糖随后用于合成少量脂肪酸,但更重要的是,它还形成大量的α-甘油磷酸(α-glycerol phosphate)。这种物质提供了与脂肪酸结合形成甘油三酯的甘油,甘油三酯是脂肪细胞中脂肪的储存形式。因此,当胰岛素不足时,即使是从肝脏通过脂蛋白运输的大量脂肪酸的储存也几乎被阻断。
胰岛素缺乏增加脂肪用于能量的利用
在胰岛素缺乏的情况下,脂肪分解及其用于提供能量的所有方面都大大增强。这种增强通常在两餐之间胰岛素分泌最少时发生,但在糖尿病患者中,当胰岛素分泌几乎为零时,这种增强变得极端。
胰岛素缺乏导致储存脂肪的脂解和游离脂肪酸的释放。在缺乏胰岛素的情况下,之前提到的所有导致脂肪储存的胰岛素效应都会逆转。最重要的效应是脂肪细胞中的激素敏感性脂肪酶(hormone-sensitive lipase)被强烈激活。这种激活导致储存的三酰甘油(triglycerides)水解,释放大量脂肪酸和甘油进入循环血液。因此,血浆中游离脂肪酸的浓度在几分钟内开始上升。这些游离脂肪酸随后成为除大脑外几乎所有身体组织使用的主要能量底物。
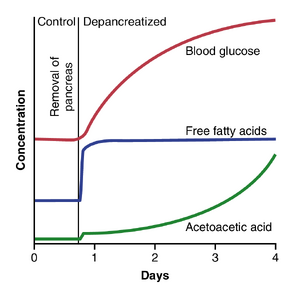
图 79-5 显示了胰岛素缺乏对血浆中游离脂肪酸、葡萄糖和乙酰乙酸浓度的影响。请注意,在切除胰腺后几乎立即,血浆中的游离脂肪酸浓度开始上升,甚至比葡萄糖浓度上升得更快。
胰岛素缺乏增加血浆胆固醇和磷脂浓度。与胰岛素缺乏相关的血浆中过量脂肪酸也促进肝脏将部分脂肪酸转化为磷脂(phospholipids)和胆固醇(cholesterol),这是脂肪代谢的两种主要产物。这两种物质,连同同时期在肝脏中形成的过量三酰甘油,随后以脂蛋白(lipoproteins)的形式释放到血液中。在缺乏胰岛素的情况下,血浆脂蛋白有时会增加多达三倍,使血浆脂质总浓度达到几个百分点,而不是正常的0.6%。这种高脂质浓度——尤其是高胆固醇浓度——促进了严重糖尿病患者动脉粥样硬化的发展。
胰岛素缺乏期间过量使用脂肪导致酮症和酸中毒。胰岛素缺乏还导致肝细胞中形成过量的乙酰乙酸(acetoacetic acid)。在缺乏胰岛素但肝细胞中存在过量脂肪酸的情况下,将脂肪酸转运到线粒体中的肉碱(carnitine)转运机制变得越来越活跃。在线粒体中,脂肪酸的β-氧化(beta oxidation)随后迅速进行,释放出大量的乙酰辅酶A(acetyl-CoA)。这些过量的乙酰辅酶A中的大部分随后被缩合形成乙酰乙酸,然后释放到循环血液中。大部分乙酰乙酸随后传递到外周细胞,在那里再次转化为乙酰辅酶A,并以通常的方式用于能量。
同时,胰岛素的缺乏也抑制了外周组织对乙酰乙酸的利用。因此,从肝脏释放的乙酰乙酸如此之多,以至于组织无法全部代谢。如图 79-5 所示,在胰岛素分泌停止后的几天内,乙酰乙酸的浓度上升,有时达到10mEq/L或更高的浓度,这是体液酸中毒的严重状态。
如第69章所述,部分乙酰乙酸(acetoacetic acid)也会转化为β-羟基丁酸(β-hydroxybutyric acid)和丙酮(acetone)。这两种物质与乙酰乙酸一起被称为酮体(ketone bodies),它们在体液中大量存在时被称为酮症(ketosis)。我们稍后会看到,在严重的糖尿病中,乙酰乙酸和β-羟基丁酸会导致严重的酸中毒和昏迷(coma),这可能导致死亡。
胰岛素对蛋白质代谢和生长的影响
胰岛素促进蛋白质合成和储存
在餐后几小时内,当循环血液中有过量的营养物质时,蛋白质、碳水化合物和脂肪会被储存在组织中;这种储存需要胰岛素的参与。胰岛素导致蛋白质储存的方式不如葡萄糖和脂肪储存的机制那样被充分理解。以下是一些事实:
- 胰岛素刺激许多氨基酸(amino acids)进入细胞。其中被强烈转运的氨基酸包括缬氨酸(valine)、亮氨酸(leucine)、异亮氨酸(isoleucine)、酪氨酸(tyrosine)和苯丙氨酸(phenylalanine)。因此,胰岛素与生长激素一样,具有增加细胞摄取氨基酸的能力。然而,受影响的氨基酸不一定相同。
- 胰岛素增加信使RNA(messenger RNA)的翻译,从而形成新的蛋白质。胰岛素“开启”核糖体(ribosomal)机制,而在缺乏胰岛素的情况下,核糖体几乎停止工作,仿佛胰岛素通过“开关”机制运作。
- 在较长时间内,胰岛素还增加了细胞核中特定DNA遗传序列的转录(transcription)速率,从而形成更多的RNA和更多的蛋白质合成——尤其是促进大量用于储存碳水化合物、脂肪和蛋白质的酶(enzymes)的合成。
- 胰岛素抑制蛋白质的分解代谢(catabolism),从而减少氨基酸从细胞中释放的速率,尤其是从肌肉细胞中释放。这可能是由于胰岛素能够减少细胞溶酶体(lysosomes)对蛋白质的正常降解。
- 在肝脏中,胰岛素通过降低促进糖异生的酶的活性来抑制糖异生的速率。由于糖异生合成葡萄糖最常用的底物是血浆氨基酸,这种对糖异生的抑制有助于保存体内的蛋白质储存中的氨基酸。
总之,胰岛素促进蛋白质的形成并防止蛋白质的降解。
胰岛素缺乏导致蛋白质耗竭和血浆氨基酸增加
当胰岛素不可用时,几乎所有蛋白质储存都会停止。蛋白质的分解代谢(protein catabolism)增加,蛋白质合成(protein synthesis)停止,大量氨基酸被释放到血浆中。血浆中的氨基酸浓度显著上升,大部分多余的氨基酸要么直接用于能量供应,要么作为糖异生的底物。这种氨基酸的降解还会导致尿液中尿素排泄的增加。由此产生的蛋白质浪费是严重糖尿病所有影响中最严重的之一。它可能导致极度虚弱和许多器官功能的紊乱。
胰岛素和生长激素协同促进生长
由于蛋白质合成需要胰岛素,因此胰岛素与生长激素一样对动物的生长至关重要。如图79-6所示,未经替代治疗的胰腺切除、垂体切除的大鼠几乎不会生长。此外,单独给予生长激素或胰岛素几乎不会引起生长。然而,这两种激素的组合会引起显著的生长。因此,这两种激素似乎协同作用以促进生长,每种激素都执行与另一种激素不同的特定功能。也许这两种激素的必要性的一小部分源于每种激素促进不同氨基酸的细胞摄取,而这些氨基酸都是生长所必需的。
胰岛素分泌的机制
图79-7显示了胰腺β细胞响应血糖浓度升高而分泌胰岛素的基本细胞机制,血糖浓度是胰岛素分泌的主要调控因素。β细胞具有大量的葡萄糖转运蛋白,允许葡萄糖以与生理范围内血糖浓度成比例的速率进入细胞。一旦进入细胞,葡萄糖会被葡萄糖激酶(glucokinase)磷酸化为葡萄糖-6-磷酸(glucose-6-phosphate)。这种磷酸化似乎是β细胞中葡萄糖代谢的限速步骤,并被认为是葡萄糖感知和根据血糖水平调整胰岛素分泌量的主要机制。
葡萄糖-6-磷酸随后被氧化形成ATP,ATP会抑制细胞的ATP敏感性钾通道(ATP-sensitive potassium channels)。钾通道的关闭会使细胞膜去极化,从而打开对膜电压变化敏感的电压门控钙通道(voltage-gated calcium channels)。这种效应会导致钙离子内流,刺激含有胰岛素的囊泡与细胞膜融合,并通过胞吐作用(exocytosis)将胰岛素分泌到细胞外液中。
胰岛素分泌的调节
曾经认为胰岛素分泌几乎完全由血液中的葡萄糖浓度控制。然而,随着对胰岛素在蛋白质和脂肪代谢中的功能了解得越来越多,显然血液中的氨基酸和其他因素也在控制胰岛素分泌中起着重要作用(见表79-1)。
增加胰岛素分泌的因素
- 血糖升高
- 血液游离脂肪酸增加
- 血液氨基酸增加
- 胃肠激素(gastrin, cholecystokinin, secretin, glucose-dependent insulinotropic peptide, glucagon-like peptide-1)
- 胰高血糖素、生长激素、皮质醇
- 副交感神经刺激;乙酰胆碱
- β-肾上腺素能刺激
- 胰岛素抵抗;肥胖
- 磺脲类药物(glyburide,tolbutamide)
减少胰岛素分泌的因素
- 血糖降低
- 空腹
- 生长抑素
- α-肾上腺素能活性
- 瘦素
其他营养物质,如某些氨基酸,也可以被β细胞代谢以增加细胞内ATP水平并刺激胰岛素分泌。一些激素,如胰高血糖素、胰高血糖素样肽-1(GLP1)、葡萄糖依赖性促胰岛素肽(胃抑制肽)和乙酰胆碱,通过其他信号通路增加细胞内钙水平并增强葡萄糖的作用,尽管在缺乏葡萄糖的情况下它们对胰岛素分泌没有显著影响。其他激素,包括生长抑素和去甲肾上腺素(通过激活α-肾上腺素能受体),抑制胰岛素的胞吐作用。
磺脲类药物通过与ATP敏感的钾通道结合并阻断其活性来刺激胰岛素分泌。这种机制导致去极化效应,从而触发胰岛素分泌,使这些药物在刺激2型糖尿病患者的胰岛素分泌中非常有用,我们将在后面讨论。表79-1总结了一些可以增加或减少胰岛素分泌的因素。
胰岛素分泌的控制
曾经认为胰岛素分泌几乎完全由血液中的葡萄糖浓度控制。然而,随着对胰岛素在蛋白质和脂肪代谢中的功能了解得越来越多,显然血液中的氨基酸和其他因素也在控制胰岛素分泌中起着重要作用(见表79-1)。
血糖升高刺激胰岛素分泌
在正常空腹血糖水平为80至90 mg/100 ml时,胰岛素分泌速率非常低——大约为25 ng/min/kg体重,这一水平只有轻微的生理活性。如果血糖浓度突然增加到正常水平的两到三倍并保持在这一高水平,胰岛素分泌会显著增加,分为两个阶段,如图79-8所示血浆胰岛素浓度的变化:
- 血糖急剧升高后,血浆中的胰岛素浓度在3到5分钟内几乎增加10倍。这种增加是由于胰岛(islets of Langerhans)的β细胞立即释放预先形成的胰岛素。然而,初始的高分泌速率不会持续;相反,胰岛素浓度在接下来的5到10分钟内会下降约一半,接近正常水平。
- 从大约15分钟开始,胰岛素分泌再次上升,并在2到3小时内达到一个新的平台期,这次的分泌速率通常甚至高于初始阶段。这种分泌是由于额外释放预先形成的胰岛素以及激活了合成并释放新胰岛素的酶系统。
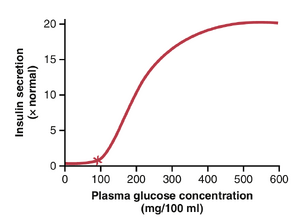
血糖浓度与胰岛素分泌速率之间的反馈关系。当血糖浓度上升到超过100mg/100ml时,胰岛素分泌迅速增加,在血糖浓度达到400到600mg/100ml时,胰岛素分泌达到峰值,约为基础水平的10到25倍,如图79-9所示。因此,在葡萄糖刺激下,胰岛素分泌的增加在速度和达到的高水平上都非常显著。此外,胰岛素分泌的关闭几乎同样迅速,在血糖浓度回落到空腹水平后的3到5分钟内发生。
胰岛素分泌对血糖浓度升高的这种反应为调节血糖浓度提供了一个极其重要的反馈机制。也就是说,任何血糖的升高都会增加胰岛素分泌,而胰岛素反过来会增加葡萄糖进入肝脏、肌肉和其他细胞的速率,从而将血糖浓度降低回正常值。
刺激胰岛素分泌的其他因素
氨基酸。一些氨基酸在刺激胰岛素分泌方面具有与过量血糖相似的效果。这些氨基酸中最有效的是精氨酸和赖氨酸。这种效果与葡萄糖刺激胰岛素分泌的不同之处在于:在没有血糖升高的情况下给予氨基酸只会引起胰岛素分泌的少量增加。然而,当在血糖浓度升高的同时给予氨基酸时,葡萄糖诱导的胰岛素分泌可能会在过量氨基酸的存在下增加一倍。因此,氨基酸强烈增强了葡萄糖对胰岛素分泌的刺激作用。
氨基酸对胰岛素分泌的刺激作用很重要,因为胰岛素反过来促进氨基酸进入组织细胞以及细胞内蛋白质的形成。也就是说,胰岛素对于适当利用过量氨基酸的重要性与它对碳水化合物利用的重要性相同。
胃肠道激素.几种重要的胃肠道激素——胃泌素、促胰液素 、胆囊收缩素 、胰高血糖素样肽-1 (GLP-1) 和葡萄糖依赖性促胰岛素肽 (GIP)——的混合物可以引起胰岛素分泌的适度增加。其中两种激素,GLP-1 和 GIP,似乎是最有效的,并且通常被称为肠促胰岛素 (incretins),因为它们能够增强胰腺β细胞对血浆葡萄糖升高的反应,从而增加胰岛素的释放速率。它们还抑制胰岛α细胞分泌胰高血糖素。
这些激素在人体进食后在胃肠道中释放。随后,它们会引起血液中胰岛素的“预期性”增加,为从食物中吸收的葡萄糖和氨基酸做准备。这些胃肠道激素通常与氨基酸的作用方式相同,能够增加胰岛素对血糖升高的反应敏感性,使胰岛素分泌速率几乎翻倍,随着血糖水平的上升。正如本章后面所讨论的,已经开发了几种药物来模拟或增强肠促胰岛素的作用,用于治疗糖尿病。
其他激素与自主神经系统 。其他直接增加胰岛素分泌或增强葡萄糖刺激胰岛素分泌的激素包括胰高血糖素 ()、生长激素 、皮质醇 (),以及较小程度的孕酮 和雌激素 ()。这些激素的刺激作用的重要性在于,如果其中任何一种激素长时间大量分泌,偶尔会导致胰岛β细胞衰竭,从而增加患糖尿病的风险。事实上,糖尿病通常发生在接受高剂量药物维持治疗的人群中,特别是那些分泌生长激素的肿瘤患者(如巨人症或肢端肥大症患者),以及肾上腺分泌过量糖皮质激素的人群。
胰岛富含交感神经和副交感神经的支配。在高血糖条件下,刺激胰腺的副交感神经可以增加胰岛素分泌,而在低血糖条件下,交感神经刺激可能会增加胰高血糖素分泌并减少胰岛素分泌。葡萄糖浓度被认为是由下丘脑和脑干的特殊神经元以及外周部位(如肝脏)的葡萄糖感应细胞检测到的。
胰岛素(及其他激素)在碳水化合物和脂质代谢“切换”中的作用
从前面的讨论中可以看出,胰岛素促进碳水化合物用于能量代谢,并抑制脂肪的利用。相反,胰岛素的缺乏会导致脂肪的利用,主要排除了葡萄糖的利用,除了脑组织。此外,控制这种转换机制的信号主要是血糖浓度。当血糖浓度低时,胰岛素分泌受到抑制,除了大脑外,脂肪几乎被专门用于能量供应。当血糖浓度高时,胰岛素分泌受到刺激,碳水化合物被用来代替脂肪。多余的血糖以肝糖原、肝脏脂肪和肌肉糖原的形式储存。因此,胰岛素在体内最重要的功能之一就是控制这两种食物中哪一种会被细胞随时用于能量供应。
至少还有四种已知的激素在这一转换机制中发挥重要作用——来自垂体前叶的生长激素、来自肾上腺皮质的皮质醇、来自肾上腺髓质的肾上腺素以及来自胰腺胰岛α细胞的胰高血糖素。胰高血糖素将在本章的下一节中讨论。生长激素和皮质醇都是在低血糖时分泌的,它们都抑制细胞对葡萄糖的利用,同时促进脂肪的利用。然而,这两种激素的作用发展缓慢,通常需要数小时才能达到最大效果。
在交感神经系统兴奋的应激状态下,肾上腺素在增加血浆葡萄糖浓度方面尤为重要。然而,肾上腺素的作用与其他激素不同,因为它同时增加了血浆脂肪酸的浓度。这些效应的原因如下:(1) 肾上腺素具有强烈的肝糖原分解作用,从而在几分钟内将大量葡萄糖释放到血液中;(2) 它还对脂肪细胞有直接的脂解作用,因为它激活了脂肪组织中的激素敏感性脂肪酶(hormone-sensitive lipase),从而也大大增加了血液中脂肪酸的浓度。从数量上看,脂肪酸的增加远远大于血糖的增加。因此,在运动、循环休克和焦虑等应激状态下,肾上腺素特别增加了脂肪的利用。
胰高血糖素及其功能
胰高血糖素是一种由胰岛α细胞在血糖浓度下降时分泌的激素,其功能与胰岛素截然相反。其中最重要的功能是增加血糖浓度,这一效应与胰岛素相反。
与胰岛素一样,胰高血糖素是一种大分子多肽。它的分子量为3485,由29个氨基酸组成的链构成。将纯化的胰高血糖素注射到动物体内后,会产生显著的高血糖效应。仅需1μg/kg的胰高血糖素就能在大约20分钟内将血糖浓度提高约20mg/100ml(增加25%)。因此,胰高血糖素也被称为高血糖激素hyperglycemic hormone。
对葡萄糖代谢的影响
胰高血糖素对葡萄糖代谢的主要影响是:(1) 肝糖原分解(glycogenolysis)和(2) 肝脏中糖异生的增加。这两种效应都大大提高了葡萄糖在身体其他器官中的可用性。
胰高血糖素引起糖原分解和血糖浓度升高
胰高血糖素最显著的作用是它能够引起肝脏中的糖原分解,从而在几分钟内增加血糖浓度。它通过以下复杂的事件级联来实现这一功能:
- 胰高血糖素激活肝细胞膜中的腺苷酸环化酶(adenylyl cyclase),
- 导致环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成,
- 激活蛋白激酶调节蛋白(protein kinase regulator protein),
- 激活蛋白激酶(protein kinase),
- 激活磷酸化酶b激酶(phosphorylase b kinase),
- 将磷酸化酶b转化为磷酸化酶a(phosphorylase a),
- 促进糖原降解为1-磷酸葡萄糖(glucose-1-phosphate),
- 然后去磷酸化,葡萄糖从肝细胞中释放出来。
这一系列事件极其重要,原因有几个。首先,它是环磷酸腺苷(cAMP)作为第二信使(second messenger)功能中被研究得最透彻的一个。其次,它展示了一个级联系统,其中每个后续产物的产量都比前一个产物多。因此,它代表了一种强大的放大机制。这种类型的放大机制在全身广泛用于控制许多(如果不是大多数)细胞代谢系统,通常会引起高达百万倍的放大反应。这种机制解释了为什么仅仅几微克的胰高血糖素就能在几分钟内使血糖水平翻倍或更多。
持续输注胰高血糖素约4小时可以引起如此强烈的肝糖原分解,以至于肝脏中所有的糖原储备都会被耗尽。
胰高血糖素增加糖异生
即使在胰高血糖素的影响下肝脏中的所有糖原都已耗尽,继续输注这种激素仍会导致持续的高血糖(hyperglycemia)。这种高血糖是由于胰高血糖素增加了肝细胞对氨基酸的摄取速率,然后通过糖异生将许多氨基酸转化为葡萄糖。这一效应是通过激活多种氨基酸转运和糖异生所需的酶来实现的,特别是激活将丙酮酸转化为磷酸烯醇丙酮酸()的酶系统,这是糖异生中的限速步骤()。
胰高血糖素的其他作用
胰高血糖素的大多数其他作用只有在它的浓度远高于血液中正常最大值时才会发生。也许最重要的作用是胰高血糖素激活脂肪细胞脂肪酶(adipose cell lipase),使更多的脂肪酸可用于身体的能量系统。胰高血糖素还抑制肝脏中甘油三酯()的储存,这可以防止肝脏从血液中移除脂肪酸;这也帮助其他组织获得更多的脂肪酸。
高浓度的胰高血糖素还具有以下作用:(1) 增强心脏的收缩力;(2) 增加某些组织(尤其是肾脏)的血流量;(3) 促进胆汁分泌;(4) 抑制胃酸分泌。与胰高血糖素对葡萄糖的作用相比,这些效应在机体正常功能中的重要性可能低得多。
胰高血糖素分泌的调节
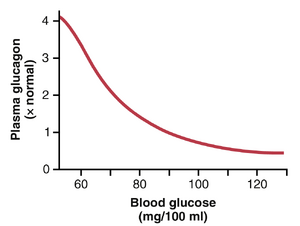
血糖升高抑制胰高血糖素分泌。血糖浓度是迄今为止控制胰高血糖素分泌的最强因素。但需要注意的是,血糖浓度对胰高血糖素分泌的影响与对胰岛素分泌的影响方向完全相反。
这一点在图79-10中得到了证明,图中显示,当血糖浓度从正常空腹水平(约90mg/100ml)下降到低血糖水平时,血浆胰高血糖素浓度可增加数倍。相反,将血糖升高到高血糖水平则会降低血浆胰高血糖素浓度。因此,在低血糖时,胰高血糖素大量分泌,从而显著增加肝脏的葡萄糖输出,起到纠正低血糖的重要作用。
血液氨基酸增加刺激胰高血糖素分泌。高浓度的氨基酸(例如在摄入含蛋白质的餐后血液中出现的氨基酸,尤其是丙氨酸和精氨酸)会刺激胰高血糖素的分泌。这与氨基酸刺激胰岛素分泌的作用相同。因此,在这种情况下,胰高血糖素和胰岛素的反应并不相反。氨基酸刺激胰高血糖素分泌的重要性在于,胰高血糖素随后促进氨基酸迅速转化为葡萄糖,从而使组织获得更多的葡萄糖。
运动刺激胰高血糖素分泌。在剧烈运动期间,血液胰高血糖素浓度通常会增加四到五倍。这种增加的原因尚不完全清楚,因为血糖浓度并不一定会下降。胰高血糖素的一个有益作用是防止血糖下降。
运动期间可能增加胰高血糖素分泌的因素之一是循环氨基酸的增加。其他因素,如胰岛的β肾上腺素能刺激,也可能起到一定作用。
生长抑素抑制胰高血糖素和胰岛素分泌
胰岛的δ细胞分泌生长抑素,这是一种由14个氨基酸组成的多肽,在循环血液中的半衰期极短,仅为3分钟。几乎所有与食物摄入相关的因素都会刺激生长抑素的分泌。这些因素包括:(1) 血糖升高,(2) 氨基酸增加,(3) 脂肪酸增加,以及(4) 上消化道响应食物摄入释放的多种胃肠道激素浓度增加。
反过来,生长抑素具有多种抑制作用,如下所示:
- 生长抑素在胰岛内局部作用,抑制胰岛素和胰高血糖素的分泌。
- 生长抑素降低胃、十二指肠和胆囊的运动性(motility)。
- 生长抑素降低胃肠道的分泌(secretion)和吸收(absorption)。
综合这些信息,有人认为生长抑素的主要作用是延长食物营养物质被吸收进入血液的时间。同时,生长抑素抑制胰岛素和胰高血糖素分泌的作用减少了组织对吸收的营养物质的利用,从而防止食物快速耗尽,使其在更长的时间内可用。
生长抑素(somatostatin)也是与生长激素抑制激素(growth hormone inhibitory hormone)相同的化学物质,它在下丘脑分泌,并抑制垂体前叶分泌生长激素。
血糖调节总结
血糖浓度通常被严格控制,通常在早餐前空腹状态下保持在80至90mg/100ml之间。在餐后大约1小时内,这一浓度会增加到120至140mg/100ml,但控制血糖的反馈系统会迅速将血糖浓度恢复到控制水平,通常在最后一次碳水化合物吸收后2小时内。相反,在饥饿状态下,肝脏的糖异生功能提供了维持空腹血糖水平所需的葡萄糖。
实现这种高度控制的机制已在本章中介绍,可以总结如下:
- 肝脏作为重要的血糖缓冲系统发挥作用。也就是说,当餐后血糖浓度升高且胰岛素分泌增加时,从肠道吸收的葡萄糖中多达三分之二会迅速以糖原的形式储存在肝脏中。然后,在接下来的几个小时内,当血糖浓度和胰岛素分泌下降时,肝脏将葡萄糖释放回血液中。通过这种方式,肝脏将血糖浓度的波动减少到原本可能的三分之一左右。事实上,在严重肝病患者中,几乎不可能维持血糖浓度的狭窄范围。
- 胰岛素和胰高血糖素都作为重要的反馈控制系统来维持正常的血糖浓度。当血糖浓度过高时,胰岛素分泌增加会导致血糖浓度向正常水平下降。相反,血糖浓度下降会刺激胰高血糖素分泌;胰高血糖素则朝相反方向作用,使血糖浓度向正常水平上升。在大多数正常情况下,胰岛素反馈机制比胰高血糖素机制更重要,但在饥饿或运动期间过度利用葡萄糖以及其他应激情况下,胰高血糖素机制也变得有价值。
- 在严重低血糖(severe hypoglycemia)的情况下,低血糖对下丘脑的直接作用也会刺激交感神经系统(sympathetic nervous system)。肾上腺(adrenal glands)分泌的肾上腺素进一步增加肝脏释放葡萄糖,这也有助于防止严重低血糖。
- 最后,在数小时到数天的时间内,生长激素和皮质醇会因长期低血糖而分泌。它们都会降低身体大多数细胞的葡萄糖利用率,转而增加脂肪的利用。这一过程也有助于使血糖浓度恢复正常。
血糖调节的重要性。有人可能会问:“为什么维持恒定的血糖浓度如此重要,尤其是在大多数组织可以在缺乏葡萄糖的情况下转而利用脂肪和蛋白质供能的情况下?”答案是,葡萄糖是唯一一种通常能够被大脑、视网膜和性腺的生殖上皮以足够数量利用的营养物质,以最佳方式为它们提供所需的能量。因此,维持血糖浓度在足以提供这种必要营养的水平非常重要。
在消化间期(interdigestive period)通过糖异生形成的葡萄糖大部分用于大脑的代谢。事实上,重要的是胰腺在此期间不分泌胰岛素;否则,可用的少量葡萄糖将全部进入肌肉和其他外周组织,导致大脑缺乏营养来源。
同样重要的是,血糖浓度不应过高,原因如下:
- 葡萄糖在细胞外液中可以产生大量的渗透压,血糖浓度过高会导致细胞严重脱水。
- 血糖浓度过高会导致葡萄糖从尿液中流失。
- 尿液中葡萄糖的流失还会引起肾脏的渗透性利尿(osmotic diuresis),这可能导致体液和电解质流失。
- 长期血糖升高可能会对许多组织造成损害,尤其是血管。与未控制的糖尿病相关的血管损伤会增加心脏病发作、中风、终末期肾病和失明的风险。
糖尿病
糖尿病是一种由于胰岛素分泌不足或组织对胰岛素的敏感性降低而导致的碳水化合物、脂肪和蛋白质代谢紊乱的综合征。糖尿病主要有两种类型:
- 1型糖尿病(Type 1 diabetes),也称为胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus),是由于胰岛素分泌不足引起的。
- 2型糖尿病(Type 2 diabetes),也称为非胰岛素依赖型糖尿病(non-insulin-dependent diabetes mellitus),最初是由于靶组织对胰岛素代谢作用的敏感性降低引起的。这种对胰岛素的敏感性降低通常被称为胰岛素抵抗(insulin resistance)。
在这两种类型的糖尿病中,所有主要食物的代谢都会受到影响。胰岛素缺乏或胰岛素抵抗对葡萄糖代谢的基本影响是阻止身体大多数细胞(除了大脑细胞)对葡萄糖的有效摄取和利用。结果,血糖浓度升高,细胞对葡萄糖的利用逐渐降低,而对脂肪和蛋白质的利用增加。
1型糖尿病——胰腺β细胞胰岛素生成不足
胰腺β细胞的损伤或损害胰岛素生成的疾病可能导致1型糖尿病(type 1 diabetes)。在许多1型糖尿病患者中,病毒感染或自身免疫性疾病(autoimmune disorders)可能参与了β细胞的破坏,尽管遗传也在决定β细胞对这些损伤的易感性方面起着重要作用。在某些情况下,即使没有病毒感染或自身免疫性疾病,人们也可能具有β细胞退化的遗传倾向。
在美国,1型糖尿病的通常发病年龄约为14岁,因此它通常被称为青少年糖尿病(juvenile diabetes mellitus)。然而,1型糖尿病可以在任何年龄发生,包括成年期,尤其是在导致胰腺β细胞破坏的疾病之后。1型糖尿病可能突然发展,在几天或几周的时间内,出现三个主要后遗症:(1)血糖水平升高,(2)脂肪的利用增加以提供能量和肝脏形成胆固醇(cholesterol),以及(3)体内蛋白质的消耗。大约5%到10%的糖尿病患者患有1型糖尿病。
在糖尿病中,血糖浓度升高到高水平。缺乏胰岛素会降低外周葡萄糖利用的效率,并增加葡萄糖生成,使血浆葡萄糖升高到300到1200 mg/100 ml。升高的血浆葡萄糖随后在全身产生多种不良影响。
血糖升高导致尿液中葡萄糖的丢失。高水平的血糖导致更多的葡萄糖过滤到肾小管中,超过其重吸收能力,多余的葡萄糖溢出到尿液中,如第28章所述。当血糖浓度上升到约200 mg/100 ml以上时,通常会发生这种溢出,这个水平被称为尿液中葡萄糖出现的血糖“阈值”。当血糖水平上升到300到500 mg/100 ml时——在严重未治疗的糖尿病患者中常见的值——每天可能有100克或更多的葡萄糖丢失到尿液中。
血糖升高导致脱水。极高的血糖水平(在严重未治疗的糖尿病中有时高达正常水平的8到10倍)可能导致全身严重的细胞脱水。这种脱水部分是因为葡萄糖不容易通过细胞膜的孔扩散,细胞外液(extracellular fluids)中增加的渗透压导致水从细胞中渗透转移。
除了过量葡萄糖的直接细胞脱水效应外,尿液中葡萄糖的丢失导致渗透性利尿(osmotic diuresis)——即肾小管中葡萄糖的渗透效应大大减少了液体的重吸收。总体效应是尿液中大量液体的丢失,导致细胞外液脱水,进而导致细胞内液(intracellular fluid)的代偿性脱水。因此,多尿(polyuria)、细胞内和细胞外脱水以及口渴增加是糖尿病的典型症状。
慢性高血糖浓度导致组织损伤。当糖尿病患者的血糖长期控制不佳时,全身多个组织的血管开始功能异常并发生结构改变,导致组织血液供应不足。这种情况进而增加了心脏病发作、中风、终末期肾病、视网膜病变和失明以及肢体缺血和坏疽的风险。
慢性高血糖浓度还会对许多其他组织造成损害。例如,周围神经病变(peripheral neuropathy),即周围神经功能异常,以及自主神经系统功能障碍是慢性、未控制的糖尿病的常见并发症。这些异常可能导致心血管反射受损、膀胱控制受损、四肢感觉减退以及其他周围神经损伤的症状。
导致糖尿病中组织损伤的确切机制尚不完全清楚,但可能涉及高血糖浓度和其他代谢异常对内皮细胞和血管平滑肌细胞蛋白质的多重影响,以及其他组织的影响。此外,继发于肾损伤的高血压和继发于异常脂质代谢的动脉粥样硬化通常在糖尿病患者中发展,并加剧由血糖升高引起的组织损伤。
糖尿病导致脂肪利用增加和代谢性酸中毒(metabolic acidosis)。糖尿病中从碳水化合物代谢向脂肪代谢的转变增加了酮酸(keto acids)如乙酰乙酸(acetoacetic acid)和β-羟基丁酸(β-hydroxybutyric acid)的释放速度,超过了组织细胞摄取和氧化的速度。结果,过量的酮酸导致代谢性酸中毒,结合脱水可导致严重的酸中毒。这种情况会迅速导致糖尿病昏迷和死亡,除非患者立即接受大量胰岛素治疗。
所有在代谢性酸中毒中发生的常见生理代偿机制也发生在糖尿病酸中毒中,如第31章所述。这些机制包括快速而深的呼吸,导致二氧化碳排出增加;这种机制缓冲了酸中毒,但也耗尽了细胞外液中的碳酸氢盐储备。肾脏通过减少碳酸氢盐排泄并生成新的碳酸氢盐来代偿,这些新的碳酸氢盐被重新加入细胞外液。
图79-11. 糖尿病昏迷中血液成分的变化,显示正常值(蓝色条)和糖尿病昏迷值(红色条)。
尽管极端酸中毒仅发生在最严重的未控制糖尿病病例中,当血液的pH降至约7.0以下时,酸中毒昏迷和死亡可能在数小时内发生。严重糖尿病酸中毒导致的血液电解质总体变化如图79-11所示。
长期过量的脂肪利用导致肝脏中大量胆固醇进入循环血液,并增加胆固醇在动脉壁的沉积。这种情况导致严重的动脉硬化和其他血管病变,如前所述。
糖尿病导致体内蛋白质的消耗。无法利用葡萄糖供能会导致蛋白质和脂肪的利用增加和储存减少。因此,未经治疗的严重糖尿病患者尽管摄入大量食物(多食症,polyphagia),仍会经历快速的体重减轻和虚弱(乏力,asthenia)。如果不进行治疗,这些代谢异常会导致身体组织的严重消耗,并在几周内死亡。
1型糖尿病的治疗。1型糖尿病(type 1 diabetes mellitus)的有效治疗需要给予足够的胰岛素,以使患者的碳水化合物、脂肪和蛋白质代谢尽可能正常。胰岛素有多种形式。“常规”胰岛素的作用持续时间从3到8小时不等,而其他形式的胰岛素(与锌或各种蛋白质衍生物沉淀)从注射部位缓慢吸收,因此其作用可持续10至48小时。通常,严重的1型糖尿病患者每天会注射一次长效胰岛素,以增加全天的碳水化合物代谢。然后在血糖水平可能升高的时间(如进餐时)给予额外的常规胰岛素。因此,每位患者都会得到个性化的治疗方案。
过去,用于治疗的胰岛素是从动物胰腺中提取的。然而,通过重组DNA技术生产的人胰岛素(human insulin)已得到更广泛的使用,因为一些患者会对动物胰岛素产生免疫和致敏反应,从而限制其有效性。
2型糖尿病——对胰岛素代谢效应的抵抗
2型糖尿病(type 2 diabetes)比1型糖尿病更为常见,约占所有糖尿病病例的90%至95%。在大多数情况下,2型糖尿病的发病年龄在30岁以后,通常在50至60岁之间,并且疾病发展缓慢。因此,这种综合征通常被称为成人发病型糖尿病(adult-onset diabetes)。然而,近年来,年轻人群中2型糖尿病的发病率稳步上升,一些患者甚至不到20岁。这一趋势似乎主要与肥胖的日益普遍有关,肥胖是儿童和成人2型糖尿病最重要的风险因素。
肥胖、胰岛素抵抗和“代谢综合征”通常先于2型糖尿病的发生。与1型糖尿病不同,2型糖尿病与血浆胰岛素浓度升高有关。高胰岛素血症(hyperinsulinemia)是胰腺β细胞对胰岛素抵抗(insulin resistance)的补偿反应,胰岛素抵抗是指靶组织对胰岛素代谢效应的敏感性降低。胰岛素敏感性的下降会损害碳水化合物的利用和储存,导致血糖升高并刺激胰岛素分泌的补偿性增加。
胰岛素抵抗(insulin resistance)和糖代谢(glucose metabolism)受损的发展通常是一个渐进的过程,始于体重过度增加和肥胖。一些研究表明,与瘦个体相比,肥胖个体的胰岛素受体数量较少,尤其是在骨骼肌(muscle)、肝脏和脂肪组织(adipose tissue)中。然而,大多数胰岛素抵抗似乎是由连接受体激活与多种细胞效应的信号通路(signaling pathways)异常引起的。胰岛素信号传导受损可能与体重过度增加导致的骨骼肌和肝脏等组织中脂质积累的毒性作用密切相关。
胰岛素抵抗是被称为“代谢综合征(metabolic syndrome)”的一系列疾病的一部分。代谢综合征的一些特征包括:(1) 肥胖,尤其是腹部脂肪的积累;(2) 胰岛素抵抗;(3) 空腹高血糖(fasting hyperglycemia);(4) 脂质异常,如血液中甘油三酯(triglycerides)增加和高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol)减少;(5) 高血压(hypertension)。代谢综合征的所有特征都与内脏器官周围腹腔内多余脂肪组织的积累密切相关。
尽管胰岛素抵抗是血糖浓度升高的主要原因,但其在代谢综合征某些组成部分中的作用尚不明确。代谢综合征的一个主要不良后果是心血管疾病(cardiovascular disease),包括动脉粥样硬化和全身各器官的损伤。与该综合征相关的几种代谢异常会增加心血管疾病的风险,而胰岛素抵抗易导致2型糖尿病(type 2 diabetes mellitus)的发展,这也是心血管疾病的主要原因之一。
表79-2 导致胰岛素抵抗的因素
- 肥胖/超重(尤其是内脏脂肪过多)
- 过量糖皮质激素(库欣综合征或类固醇治疗)
- 过量生长激素(肢端肥大症)
- 妊娠、妊娠糖尿病
- 多囊卵巢疾病
- 脂肪营养不良(获得性或遗传性;与肝脏脂质积累相关)
- 胰岛素受体自身抗体
- 胰岛素受体突变
- 过氧化物酶体增殖物激活受体γ (PPARγ)突变
- 导致遗传性肥胖的突变(如黑皮质素受体突变)
- 血色病(一种导致组织铁积累的遗传性疾病)
其他可能导致胰岛素抵抗和2型糖尿病的因素。尽管大多数2型糖尿病患者超重或有大量内脏脂肪积累,但严重的胰岛素抵抗和2型糖尿病也可能由其他获得性或遗传性疾病引起,这些疾病会损害外周组织中的胰岛素信号传导(表79-2)。
例如,多囊卵巢综合征(polycystic ovary syndrome, PCOS)与卵巢雄激素(androgen)生成显著增加和胰岛素抵抗有关。PCOS是女性中最常见的内分泌疾病之一,影响约6%的育龄女性。尽管PCOS的发病机制尚不明确,但约80%的患病女性存在胰岛素抵抗和高胰岛素血症(hyperinsulinemia)。长期后果包括糖尿病风险增加、血脂升高和心血管疾病。
糖皮质激素(glucocorticoids)过量形成(库欣综合征)或生长激素过量形成(肢端肥大症)也会降低各种组织对胰岛素代谢效应的敏感性,并可能导致糖尿病的发生。肥胖和胰岛素抵抗(insulin resistance)的遗传原因如果足够严重,也可能导致2型糖尿病(type 2 diabetes)和代谢综合征(metabolic syndrome)的许多其他特征,包括心血管疾病(cardiovascular disease)。
在长期胰岛素抵抗期间2型糖尿病的发展。随着长期和严重的胰岛素抵抗,即使胰岛素水平增加也不足以维持正常的葡萄糖调节。因此,在疾病的早期阶段,摄入碳水化合物后会出现中度高血糖(hyperglycemia)。
在2型糖尿病的后期,胰腺β细胞变得“衰竭”或受损,无法产生足够的胰岛素来防止更严重的高血糖,尤其是在摄入富含碳水化合物的膳食后。
在一些肥胖人群中,即使他们有明显胰岛素抵抗和餐后血糖升高超过正常水平,临床上显著的糖尿病可能也不会发生;显然,这些人的胰腺产生了足够的胰岛素来防止葡萄糖代谢的严重异常。然而,在其他肥胖人群中,胰腺逐渐因分泌大量胰岛素而衰竭或因与胰腺中脂质积累相关的因素而受损,从而发生完全的糖尿病。一些研究表明,遗传因素在决定个体的胰腺是否能够维持多年高胰岛素输出以避免2型糖尿病中葡萄糖代谢的严重异常方面起着重要作用。
通过生活方式改变、增加胰岛素敏感性和增强胰岛素分泌治疗2型糖尿病。在许多情况下,2型糖尿病可以有效治疗,至少在早期阶段,通过旨在增加体力活动、限制热量和减轻体重的生活方式改变,不需要外源性胰岛素(exogenous insulin)的给药。也可以使用增加胰岛素敏感性的药物,如噻唑烷二酮类(thiazolidinediones)、抑制肝脏葡萄糖生成的药物,如二甲双胍(metformin),或导致胰腺额外释放胰岛素的药物,如磺脲类(sulfonylureas)。然而,在2型糖尿病的后期,通常需要胰岛素给药来控制血浆葡萄糖水平。
模拟GLP-1作用的肠促胰岛素(incretin)药物已被开发用于治疗2型糖尿病。这些药物增强胰岛素分泌,旨在与其他抗糖尿病药物联合使用。另一种治疗方法是抑制二肽基肽酶4(dipeptidyl peptidase 4, DPP-4)的酶,该酶使GLP-1和GIP失活。通过阻断DPP-4的作用,可以延长GLP-1和GIP的肠促胰岛素效应,从而增加胰岛素分泌并改善血糖水平的控制。
通过抑制SGLT2治疗2型糖尿病。如第28章所述,肾小球毛细血管过滤的葡萄糖中约90%通过钠-葡萄糖共转运蛋白2(SGLT2)从近端小管重吸收。目前已开发出多种称为格列净类药物(gliflozins)的药物,通过抑制SGLT2来治疗2型糖尿病。这些SGLT2抑制剂显著减少了肾脏对葡萄糖的重吸收,导致大量葡萄糖随尿液排出,从而降低血糖浓度。SGLT2抑制剂通常与其他增强胰岛素敏感性或刺激胰岛素分泌的药物联合使用,临床试验表明,它们能为糖尿病患者提供显著的心血管和肾脏疾病保护作用。
除了增加葡萄糖排泄外,SGLT2抑制剂还由于肾小管中残留葡萄糖的渗透作用而引起显著的利尿作用。这种利尿作用对于常伴有高血压的2型糖尿病患者可能有益,可轻微降低血压,但对于已经服用其他利尿剂和降压药物的患者,可能会增加脱水和低血压的风险。
通过手术治疗2型糖尿病。对于许多患有严重肥胖和2型糖尿病的患者,以饮食、运动和药物治疗为重点的治疗方案无法显著减少体脂和血糖。在这些情况下,可以使用各种减重手术来减少脂肪量并改善血糖控制。两种最广泛使用的手术——胃旁路手术和垂直袖状胃切除术(见第72章)——通常被称为“代谢手术”,因为许多接受这些手术的患者糖尿病完全缓解,不再需要抗糖尿病药物。血糖、血脂和血压的改善通常在手术后几天或几周内出现,这表明这些心血管和代谢益处的机制可能不仅仅是体重减轻和体脂减少。然而,这些手术对代谢产生有利影响的生理因素仍不明确。
表79-3 1型和2型糖尿病患者的临床特征
糖尿病的诊断生理学
表79-3比较了1型和2型糖尿病的一些临床特征。诊断糖尿病的常用方法基于尿液和血液的各种化学检测。
尿糖(Urinary Glucose)。简单的office测试或更复杂的定量实验室测试可用于测定尿液中排泄的葡萄糖量。一般来说,非糖尿病患者排泄的葡萄糖量无法检测到,而糖尿病患者则会排泄少量到大量的葡萄糖,其量与疾病的严重程度和碳水化合物的摄入量成正比。
空腹血糖(Fasting Blood Glucose)和胰岛素浓度。清晨空腹血糖浓度通常为80至90mg/100ml,115mg/100ml被认为是正常上限。空腹血糖水平高于此值通常表明患有糖尿病或至少存在明显的胰岛素抵抗和糖尿病前期。
在1型糖尿病患者中,空腹时甚至餐后血浆胰岛素水平非常低或无法检测到。在2型糖尿病患者中,血浆胰岛素浓度可能比正常值高出数倍,并且在葡萄糖耐量试验(Glucose Tolerance Test)期间摄入标准葡萄糖负荷后通常会增加更多(见下一节)。
糖化血红蛋白(Glycated Hemoglobin)。当血糖水平长期升高时,葡萄糖会附着在红细胞中的血红蛋白上,形成糖化血红蛋白,通常称为血红蛋白A1c(HbA1c)。高血糖持续时间越长,与血红蛋白结合的葡萄糖就越多,一旦血红蛋白被糖化,它就会在细胞的整个生命周期中保持这种状态。因此,红细胞中HbA1c的积累反映了细胞在其生命周期中暴露的平均葡萄糖浓度。由于红细胞的平均寿命约为120天,且单个细胞的寿命各不相同,HbA1c测试主要用于评估过去三个月的平均血糖浓度,并可作为糖尿病的诊断测试或糖尿病患者血糖控制的评估测试。
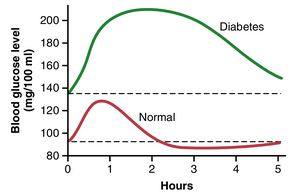
葡萄糖耐量试验(Glucose Tolerance Test)。如图79-12中的底部曲线所示,称为“葡萄糖耐量曲线”,当正常空腹的人摄入每公斤体重1克葡萄糖时,血糖水平从约90mg/100ml上升到120至140mg/100ml,并在约2小时内回落到正常水平以下。
在糖尿病患者中,空腹血糖浓度几乎总是高于115mg/100ml,且常常高于140mg/100ml。此外,葡萄糖耐量试验的结果几乎总是异常。在摄入葡萄糖后,这些人的血糖水平上升幅度远高于正常水平,如图79-12中的上曲线所示,且血糖水平仅在4至6小时后才回落到对照值;此外,它未能降至对照水平以下。该曲线的缓慢下降及其未能降至对照水平以下表明,要么(1)摄入葡萄糖后胰岛素分泌的正常增加没有发生,要么(2)患者对胰岛素的敏感性降低。通常可以根据这样的曲线来诊断糖尿病,并且通过测量血浆胰岛素(plasma insulin)可以区分1型糖尿病和2型糖尿病,1型糖尿病患者的血浆胰岛素水平低或检测不到,而2型糖尿病患者的血浆胰岛素水平升高。
丙酮味香气(Acetone Breath)。正如第69章所指出的,血液中的少量乙酰乙酸(acetoacetic acid)在严重糖尿病中会大幅增加,并转化为丙酮(acetone)。丙酮是挥发性的,会蒸发到呼出的空气中。因此,通过闻患者呼吸中的丙酮气味,通常可以诊断1型糖尿病。此外,酮酸(keto acids)可以通过化学方法在尿液中检测到,其定量有助于确定糖尿病的严重程度。然而,在2型糖尿病的早期阶段,通常不会产生过量的酮酸。然而,当胰岛素抵抗变得严重且脂肪用于能量的利用大幅增加时,2型糖尿病患者也会产生酮酸。
治疗与动脉硬化和慢性肾脏疾病的关系。主要由于糖尿病患者的高血压和循环中胆固醇及其他脂质水平较高,动脉粥样硬化、动脉硬化、严重的冠心病(coronary heart disease)、慢性肾脏疾病(chronic kidney disease)以及多种微循环病变比非糖尿病患者更容易发生。事实上,那些在童年时期糖尿病控制不佳的人很可能在成年早期死于心脏病。
在糖尿病治疗的早期,倾向于严重减少饮食中的碳水化合物(carbohydrates)以最小化胰岛素需求。这种方法可以防止血糖水平过高,并减少尿液中葡萄糖的流失,但它并不能阻止脂肪代谢的许多异常。因此,目前的趋势是允许患者摄入几乎正常的碳水化合物饮食,同时给予足够的胰岛素来代谢这些碳水化合物。这种方法降低了脂肪代谢的速度,并抑制了血液中高水平的胆固醇。
由于糖尿病的并发症如动脉粥样硬化、感染易感性增加、糖尿病视网膜病变(diabetic retinopathy)、白内障(cataracts)、高血压(hypertension)和慢性肾脏疾病(chronic renal disease)与血液中脂质和葡萄糖的水平密切相关,大多数医生还会开具降脂药物以帮助预防这些紊乱。
胰岛素瘤——高胰岛素血症
尽管胰岛素分泌过多的情况比糖尿病少见得多,但它偶尔可能是胰岛腺瘤(adenoma of an islet of Langerhans)的结果。大约10%到15%的这些腺瘤是恶性的,偶尔胰岛的转移瘤会扩散到全身,导致原发性和转移性癌症大量分泌胰岛素。事实上,一些患者每24小时需要超过1000克的葡萄糖来预防低血糖(hypoglycemia)。
胰岛素休克与低血糖。正如已经强调的那样,中枢神经系统(central nervous system)通常从葡萄糖代谢中获得几乎所有的能量,而这种葡萄糖的利用并不需要胰岛素。然而,如果高水平的胰岛素导致血糖下降到低水平,中枢神经系统的代谢就会受到抑制。因此,在患有胰岛素分泌肿瘤的患者或糖尿病患者中,如果注射了过多的胰岛素,可能会出现一种称为胰岛素休克(insulin shock)的综合征,具体表现如下。
当血糖水平下降到50到70 mg/100ml时,中枢神经系统通常会变得兴奋,因为这种程度的低血糖会增强神经元活动。有时会出现各种形式的幻觉,但更多情况下,患者只是感到极度紧张、全身颤抖并出汗。当血糖水平下降到20到50mg/100ml时,可能会出现阵挛性抽搐(clonic seizures)和意识丧失。当血糖水平进一步下降时,抽搐停止,只剩下昏迷状态。事实上,仅通过简单的临床观察,有时很难区分由于胰岛素缺乏引起的酸中毒导致的糖尿病昏迷(diabetic coma)和由于胰岛素过多引起的低血糖昏迷(hypoglycemic coma)。糖尿病昏迷患者的丙酮呼吸和快速深呼吸在低血糖昏迷患者中并不存在。
对于低血糖休克或昏迷的患者,正确的治疗是立即静脉注射大量葡萄糖。这种治疗通常在一分钟或更短时间内使患者脱离休克状态。此外,注射胰高血糖素(或效果较差的肾上腺素)可以引起肝脏中的糖原分解(glycogenolysis),从而极快地提高血糖水平。如果不立即进行治疗,中枢神经系统的神经元细胞通常会受到永久性损伤。
第80章 甲状旁腺激素、降钙素、钙与磷酸盐代谢、维生素D、骨骼与牙齿
钙与磷酸盐代谢的生理学、骨骼与牙齿的形成,以及维生素D、甲状旁腺激素(PTH)和降钙素的调节都密切相关。例如,细胞外钙离子浓度由肠道钙吸收、肾脏钙排泄以及骨骼钙摄取和释放的相互作用决定,而这些过程都受到上述激素的调节。由于磷酸盐稳态和钙稳态密切相关,本章将一起讨论它们。
细胞外液与血浆中钙和磷酸盐调节的概述
细胞外液(extracellular fluid)中的钙浓度通常被精确调节;它很少从正常值约9.4~mg/dl(相当于每升2.4毫摩尔的钙)上升或下降超过几个百分点。这种精确控制是必要的,因为钙在许多生理过程中起着关键作用,包括骨骼肌、心肌和平滑肌的收缩、血液凝固以及神经冲动的传递等。可兴奋细胞(如神经元)对钙离子浓度的变化敏感,钙浓度高于正常值(高钙血症(hypercalcemia))会导致神经系统的逐渐抑制;相反,钙浓度降低(低钙血症(hypocalcemia))会使神经系统变得更加兴奋。
细胞外钙调节的一个重要特征是,全身钙总量中只有约0.1%存在于细胞外液中,约1%存在于细胞及其细胞器中,其余则储存在骨骼中。因此,骨骼可以作为巨大的储存库,储存多余的钙,并在细胞外液钙浓度降低时释放钙。
体内约85%的磷酸盐储存在骨骼中,14%至15%存在于细胞内,不到1%存在于细胞外液中。尽管细胞外液磷酸盐浓度的调节远不如钙浓度那样精确,但磷酸盐具有多种重要功能,并且受到许多与钙调节相同的因素控制。
血浆和组织间液中的钙
血浆中的钙以三种形式存在,如图80-1所示:(1) 约41%(1mmol/L)的钙与血浆蛋白结合,这种形式无法通过毛细血管膜扩散;(2) 约9%的钙(0.2mmol/L)可以通过毛细血管膜扩散,但与血浆和组织间液中的阴离子物质(如柠檬酸盐和磷酸盐)结合,因此未离子化;(3) 剩余的50%血浆钙可以通过毛细血管膜扩散并呈离子化状态。
因此,血浆和组织间液的正常钙离子浓度约为1.2mmol/L(或2.4~mEq/L,因为它是二价离子),这一水平仅为血浆总钙浓度的一半。这种离子钙是钙在体内大多数功能中的重要形式,包括钙对心脏、神经系统和骨骼形成的影响。
细胞外液中的无机磷酸盐
血浆中的无机磷酸盐主要以两种形式存在,HPO_4=和H_2P O_4-。HPO_4=的浓度约为
图80-1. 血浆中离子化钙(C a2+)、可扩散但未离子化的钙与阴离子复合物以及不可扩散的蛋白结合钙的分布。
1.05mmol/L,而H_2P O_4-的浓度约为0.26mmol/L。当细胞外液中的磷酸盐总量增加时,这两种磷酸盐离子的量也会增加。此外,当细胞外液的pH变得更酸性时,H_2P O_4-相对增加,而HPO_4=减少;相反,当细胞外液变为碱性时,情况则相反。这些关系在第31章关于酸碱平衡的讨论中已经介绍过。
由于化学上难以准确测定血液中HPO_4=和H_2P O_4-的确切量,通常磷酸盐的总量以每分升(100毫升)血液中的磷毫克数表示。由这两种磷酸盐离子代表的无机磷的平均总量约为4mg/dl,正常范围在成人中为3到4mg/dl,在儿童中为4到5mg/dl。
体液中钙和磷酸盐浓度改变的非骨骼生理效应
将细胞外液中的磷酸盐水平从远低于正常值提高到正常值的两到三倍,不会对身体产生主要的即时影响。相比之下,即使细胞外液中钙离子的轻微增加或减少也会引起极端的即时生理效应。此外,慢性低钙血症(hypocalcemia)或低磷血症(hypophosphatemia)会大大降低骨矿化,这一点将在本章后面解释。
低钙血症引起神经系统兴奋和手足搐搦(tetany)。当细胞外液中的钙离子浓度低于正常值时,由于神经元膜对钠离子的通透性增加,神经系统逐渐变得更加兴奋,从而容易引发动作电位。当血浆钙离子浓度比正常值低约50%时,周围神经纤维变得如此兴奋,以至于它们开始自发放电,引发一系列神经冲动传递到周围骨骼肌,导致强直性肌肉收缩。因此,低钙血症会引起手足搐搦。它偶尔也会因为增加大脑兴奋性而引起癫痫发作。
图80-2显示了手部的手足搐搦,这通常发生在身体其他部位出现手足搐搦之前。这被称为腕足痉挛(carpopedal spasm)。
手足搐搦通常发生在血液中钙浓度从正常水平的9.4mg/dl下降到约6mg/dl时,这仅比正常钙浓度低35%,而在约4mg/dl时通常是致命的。
在实验动物中,极端的低钙血症可以引起其他效应,这些效应在患者中很少见,例如心脏显著扩张、细胞酶活性改变、某些细胞(除了神经细胞外)膜通透性增加以及血液凝固功能受损。
图80-2. 手部的低钙血症性手足搐搦,称为腕足痉挛。
高钙血症抑制神经系统和肌肉活动。当体液中的钙浓度升高到正常水平以上时,神经系统会受到抑制,中枢神经系统的反射活动变得迟缓。此外,钙离子浓度的增加会缩短心脏的QT间期,并导致食欲不振和便秘,这可能是由于胃肠道肌肉壁的收缩力受到抑制所致。
当血钙水平上升到约12mg/dl以上时,这些抑制作用开始显现,并且随着钙水平上升到15mg/dl以上,这些作用会变得显著。当血钙浓度上升到约17mg/dl以上时,磷酸钙晶体可能会在全身各处沉淀;这种情况将在后面与甲状旁腺中毒相关的内容中讨论。
钙和磷酸盐的吸收与排泄
钙和磷酸盐的肠道吸收和粪便排泄。通常的摄入量约为每天1000mg的钙和磷,大约相当于1升牛奶中的含量。正常情况下,二价阳离子如钙离子在肠道中的吸收较差。然而,正如后面所讨论的,维生素D促进肠道对钙的吸收,通常约35% (350~mg/day)的摄入钙被吸收;剩余的钙在肠道中通过粪便排出。另外,每天有250mg的钙通过分泌的胃肠液和脱落的黏膜细胞进入肠道。因此,约90% (900~mg/day)的每日钙摄入量通过粪便排出(图80-3)。
磷酸盐的肠道吸收很容易。除了与未吸收的钙结合并通过粪便排出的那部分磷酸盐外,几乎所有膳食中的磷酸盐都从肠道吸收进入血液,随后通过尿液排出。
图80-3. 每天摄入1000~mg钙的人体内不同组织间钙交换的概述。请注意,尽管肾脏有能力通过减少肾小管对钙的重吸收来排出大量钙,但大多数摄入的钙通常通过粪便排出。
钙和磷酸盐的肾脏排泄。约10% (100mg/day)的摄入钙通过尿液排出。约41%的血浆钙与血浆蛋白结合,因此不会被肾小球毛细血管过滤。其余部分与阴离子如磷酸盐(9%)结合或离子化(50%),并通过肾小球过滤进入肾小管。
正常情况下,肾小管重吸收99%的过滤钙,约100mg/day通过尿液排出(有关肾脏钙排泄的进一步讨论,请参见第30章)。约90%的肾小球滤液中的钙在近端小管、Henle袢和早期远端小管中被重吸收。
在远端小管晚期和早期集合管中,剩余10%的重吸收更为多变,取决于血液中的钙离子浓度。
当钙浓度低时,这种重吸收(Reabsorption)作用很强,尿液中几乎不会丢失钙。相反,即使血钙离子浓度比正常值略微升高,钙的排泄也会显著增加。我们将在本章后面看到,控制肾单位远端钙重吸收的最重要因素,从而控制钙排泄速率的是PTH(甲状旁腺激素)。
肾脏对磷酸盐的排泄是通过一种溢出机制(Overflow Mechanism)来控制的,如第30章所述。也就是说,当血浆中的磷酸盐浓度低于约1mmol/L的临界值时,肾小球滤液中的所有磷酸盐都会被重吸收,尿液中不会丢失磷酸盐。然而,超过这个临界浓度时,磷酸盐的丢失速率与额外的增加成正比。因此,肾脏通过根据血浆磷酸盐浓度和肾脏对磷酸盐的滤过速率来改变磷酸盐的排泄速率,从而调节细胞外液中的磷酸盐浓度。
图80-4. 皮质骨(致密骨)和松质骨(海绵骨)
然而,正如本章后面所讨论的,PTH可以显著增加肾脏对磷酸盐的排泄,从而在控制血浆磷酸盐和钙浓度方面发挥重要作用。
骨骼及其与细胞外钙和磷酸盐的关系
骨骼组织一般分为两种类型——皮质骨(致密骨)和松质骨(海绵骨)(图80-4)。皮质骨形成坚硬的外层(皮质),比松质骨密度大得多,约占人体骨骼总质量的80%。皮质骨在长骨的骨干处特别厚,例如腿部,这些骨骼支撑着整个身体的重量。
松质骨约占骨骼质量的20%,位于骨骼的内部。它比皮质骨多孔得多,通常位于长骨的末端、关节附近以及椎骨的内部。松质骨包含呈格子状的单位,骨小梁(Trabeculae)分支并相互连接,形成不规则的网状结构。骨小梁之间的空间充满了红骨髓,这里是造血(Hematopoiesis)发生的地方,即血细胞的生成。松质骨的合成和吸收速率,以及骨转换率(Bone Turnover Rate),都比皮质骨高得多。
骨骼由坚韧的有机基质组成,钙盐的沉积使其强度大大增强。平均而言,皮质骨按重量计算约含有30%的基质和70%的盐类。新形成的骨骼中,基质相对于盐类的比例可能更高。
骨骼的有机基质。骨骼的有机基质中,90%至95%是胶原纤维(Collagen Fibers),其余是一种称为基质(Ground Substance)的均质凝胶状介质。胶原纤维主要沿着张力线延伸,赋予骨骼强大的抗拉强度。
基质由细胞外液和蛋白聚糖(Proteoglycans)组成,特别是硫酸软骨素(Chondroitin Sulfate)和透明质酸(Hyaluronic Acid)。这些蛋白聚糖有助于控制钙盐的沉积,并在骨骼损伤后的修复中起重要作用,尽管它们的一些功能仍不清楚。
骨盐。沉积在骨有机基质中的结晶盐主要由钙和磷酸盐组成。主要结晶盐的化学式为羟基磷灰石(hydroxyapatite),如下所示:
C a_10\big(P O_4\big)6\big(O H\big)2
每个晶体——长约400埃(angstroms, \AA),厚10至30 Å,宽100 Å——形状像一个长而平的板。在不同的营养条件下,钙与磷的相对比例可以显著变化,钙磷重量比在1.3到2.0之间变化。
镁、钠、钾和碳酸根离子也存在于骨盐中,尽管X射线衍射研究未能显示它们形成的明确晶体。因此,它们被认为与羟基磷灰石晶体结合,而不是形成自己独特的晶体。许多类型的离子与骨晶体结合的能力延伸到许多通常不属于骨的离子,如锶、铀、钚、其他超铀元素、铅、金和其他重金属。放射性物质在骨中的沉积会导致骨组织的长期辐射,如果沉积量足够大,最终可能发展为成骨肉瘤(osteogenic sarcoma, 骨癌)。
骨的抗拉和抗压强度。皮质骨(cortical bone, 密质骨)的每个胶原纤维由沿其长度每隔640\textup\AA重复的周期性片段组成;羟基磷灰石晶体位于纤维的每个片段旁边并与其紧密结合。这种紧密结合防止了骨中的“剪切”;也就是说,它防止了晶体和胶原纤维滑出位置,这对于提供骨的强度至关重要。此外,相邻胶原纤维的片段重叠,也导致羟基磷灰石晶体像砖墙中的砖块一样相互重叠。
骨的胶原纤维,像肌腱的胶原纤维一样,具有很大的抗拉强度(tensile strength),而钙盐具有很大的抗压强度(compressional strength)。这些组合特性加上胶原纤维和晶体之间的结合程度,提供了一个具有极高抗拉强度和抗压强度的骨结构。
骨中钙和磷酸盐的沉淀和吸收——与细胞外液的平衡
尽管钙和磷酸盐离子过饱和,羟基磷灰石不会在细胞外液中沉淀。细胞外液中钙和磷酸盐离子的浓度远高于导致羟基磷灰石沉淀所需的浓度。然而,几乎所有的身体组织以及血浆中都存在抑制剂来防止沉淀;其中一种抑制剂是焦磷酸盐(pyrophosphate)。因此,尽管离子处于过饱和状态,羟基磷灰石晶体不会在正常组织中沉淀,除了在骨中。
骨钙化机制
骨生成的最初阶段是由成骨细胞(osteoblasts)分泌胶原分子(称为胶原单体)和基质(主要是蛋白聚糖)。胶原单体迅速聚合形成胶原纤维;由此产生的组织成为类骨质(osteoid),这是一种类似于软骨的物质,但与软骨不同的是,钙盐很容易在其中沉淀。随着类骨质的形成,一些成骨细胞被困在类骨质中并变得静止。在这个阶段,它们被称为骨细胞(osteocytes)。
在类骨质形成后的几天内,钙盐开始沉淀在胶原纤维的表面。沉淀物首先沿着每条胶原纤维间隔出现,形成微小的核心,这些核心在几天到几周内迅速繁殖和生长,最终形成羟基磷灰石晶体。
最初沉积的钙盐不是羟基磷灰石晶体,而是无定形化合物(非结晶),是诸如CaHPO_4\times 2H_2O, Ca_3(P O_4)_2\times3H_2O,等盐的混合物。然后,通过原子替换和添加或重吸收和再沉淀的过程,这些盐在几周或几个月内转化为羟基磷灰石晶体。有少量可能永久保持无定形状态,这很重要,因为当细胞外液需要额外的钙时,这些无定形盐可以迅速被吸收。
尽管导致钙盐在类骨质中沉积的机制尚未完全了解,但这一过程的调节似乎在很大程度上依赖于焦磷酸盐,它抑制羟基磷灰石结晶和骨钙化。焦磷酸盐的水平又受到至少三种其他分子的调节。其中最重要的分子之一是一种称为组织非特异性碱性磷酸酶(tissue-nonspecific alkaline phosphatase, TNAP)的物质,它能分解焦磷酸盐并控制其水平,以便在需要时进行骨钙化。TNAP由成骨细胞分泌到类骨质中以中和焦磷酸盐,一旦焦磷酸盐被中和,胶原纤维对钙盐的天然亲和力就会导致羟基磷灰石结晶。TNAP在骨矿化中的重要性体现在以下发现中:具有TNAP遗传缺陷的小鼠,其焦磷酸盐水平过高,出生时骨骼柔软且钙化不足。
成骨细胞还分泌至少两种其他调节骨钙化的物质:(1)核苷酸焦磷酸酶磷酸二酯酶1(nucleotide pyrophosphatase phosphodiesterase 1, NPP1),它在细胞外产生焦磷酸盐;(2)强直蛋白(ankylosis protein, ANK),它通过将焦磷酸盐从细胞内部运输到细胞表面来贡献于细胞外的焦磷酸盐池。NPP1或ANK的缺乏会导致细胞外焦磷酸盐减少和骨过度钙化,如骨刺,甚至其他组织如脊柱的肌腱和韧带的钙化,这种情况发生在患有强直性脊柱炎(ankylosing spondylitis)的人身上。
异常条件下非骨组织中的钙沉淀。尽管钙盐通常不会在骨骼以外的正常组织中沉淀,但在异常条件下,它们可能会沉淀。例如,在动脉硬化中,钙盐会在动脉壁中沉淀,导致动脉变得像骨一样的管道。同样,钙盐经常在退化的组织或陈旧的血凝块中沉积。推测在这些情况下,通常阻止钙盐沉积的抑制因子从组织中消失,从而允许沉淀发生。
骨骼与细胞外液之间的钙交换
如果将可溶性钙盐静脉注射,钙离子浓度可能会立即升高到高水平。然而,在30到60分钟内,钙离子浓度会恢复正常。同样,如果从循环体液中移除大量钙离子,钙离子浓度也会在30分钟到大约1小时内恢复正常。这些效应主要是由于骨骼中含有一种可交换的钙,这种钙始终与细胞外液中的钙离子保持平衡。
这种可交换钙的一小部分也存在于所有组织细胞中,特别是在高度通透的细胞类型中,如肝脏和胃肠道的细胞。然而,大部分可交换钙存在于骨骼中,通常占骨骼总钙的约0.4%到1%。这种钙以易于动员的盐形式沉积在骨骼中,如CaHPO_4和其他无定形钙盐。
这种可交换钙提供了一种快速的缓冲机制,以防止在钙供应暂时过剩或减少的情况下,细胞外液中的钙离子浓度升高到过高水平或降低到过低水平。
图80-5. 同一骨骼中的成骨细胞和破骨细胞活动。
骨骼的沉积与吸收——骨骼的重塑
成骨细胞的骨骼沉积。骨骼不断由成骨细胞沉积,并且在破骨细胞活跃的地方不断被吸收(图80-5)。成骨细胞存在于骨骼的外表面和骨小梁腔中。在所有活骨中,成骨细胞的活动持续进行(在成年人中,任何时候约有~4%的表面有活动),因此至少有一些新骨在不断形成。
骨骼的吸收——破骨细胞的功能。
骨骼在破骨细胞存在的情况下也不断被吸收,破骨细胞是大型、吞噬性、多核细胞(含有多达50个核),它们是骨髓中形成的单核细胞或类似单核细胞的衍生物。破骨细胞通常在成年人骨骼表面不到1%的地方活跃,并且如后面所讨论的,PTH控制破骨细胞的骨骼吸收活动。
在组织学上,骨吸收(osteoclasts)发生在紧邻破骨细胞(osteoclasts)的区域。这种吸收的机制被认为是以下过程:破骨细胞向骨组织伸出绒毛状突起,形成与骨相邻的皱褶边缘(ruffled border)(图80-6)。这些绒毛分泌两种物质:(1) 从破骨细胞的溶酶体(lysosomes)中释放的蛋白水解酶(proteolytic enzymes),以及(2) 从线粒体(mitochondria)和分泌囊泡(secretory vesicles)中释放的几种酸,包括柠檬酸(citric acid)和乳酸(lactic acid)。这些酶消化或溶解骨的有机基质(organic matrix),而酸则导致骨盐(bone salts)的溶解。破骨细胞还通过吞噬作用(phagocytosis)摄取骨基质和晶体的微小颗粒,最终也溶解这些颗粒并将产物释放到血液中。
正如后面所讨论的,甲状旁腺激素(PTH)刺激破骨细胞活性和骨吸收,但这一过程是通过间接机制发生的。骨吸收的破骨细胞没有PTH受体。相反,成骨细胞(osteoblasts)向破骨细胞前体发出信号,使其形成成熟的破骨细胞。负责这种信号传递的两种成骨细胞蛋白是核因子κB配体受体激活剂(RANKL)和巨噬细胞集落刺激因子(macrophage colony-stimulating factor),这两者都是成熟破骨细胞形成所必需的。
图80-6. 破骨细胞的骨吸收。甲状旁腺激素(PTH)与成骨细胞上的受体结合,促使它们形成核因子κB配体受体激活剂(RANKL)并释放巨噬细胞集落刺激因子(M-CSF)。RANKL与RANK结合,M-CSF与前破骨细胞(preosteoclast)上的受体结合,促使它们分化为成熟的破骨细胞。PTH还减少骨保护素(osteoprotegerin, OPG)的产生,OPG通过与RANKL结合并阻止其与前破骨细胞上的受体相互作用,抑制前破骨细胞分化为成熟的破骨细胞。成熟的破骨细胞形成皱褶边缘,并从溶酶体中释放酶以及促进骨吸收的酸。骨细胞(osteocytes)是在骨组织生成过程中被骨基质包裹的成骨细胞;骨细胞形成一个相互连接的细胞系统,遍布整个骨骼。
PTH与邻近成骨细胞上的受体结合,刺激RANKL的合成,RANKL也被称为骨保护素配体(OPGL)。RANKL与前破骨细胞上的受体(RANK)结合,促使它们分化为成熟的多核破骨细胞。成熟的破骨细胞随后形成皱褶边缘,并释放促进骨吸收的酶和酸。
成骨细胞还产生骨保护素(osteoprotegerin, OPG),有时称为破骨细胞生成抑制因子(osteoclastogenesis inhibitory factor),这是一种抑制骨吸收的细胞因子(cytokine)。OPG作为“诱饵”与RANKL结合,阻止其与受体相互作用,从而抑制前破骨细胞分化为吸收骨的成熟破骨细胞。OPG对抗PTH的骨吸收活性,与具有正常OPG形成的小鼠相比,OPG基因缺陷的小鼠骨量显著减少。
尽管调节OPG(osteoprotegerin,骨保护素)的因素尚不完全清楚,但维生素D和PTH(parathyroid hormone,甲状旁腺激素)似乎通过抑制OPG生成和刺激RANKL(receptor activator of nuclear factor kappa-B ligand,核因子κB受体活化因子配体)形成的双重作用来促进成熟破骨细胞的生成。糖皮质激素也通过增加RANKL生成和减少OPG形成来促进破骨细胞活性和骨吸收。另一方面,雌激素则刺激OPG的生成。因此,成骨细胞产生的OPG和RANKL的平衡在决定破骨细胞活性和骨吸收中起着重要作用。
目前,OPG-RANKL通路的治疗重要性正在被开发利用。通过阻断RANKL与其受体的相互作用来模拟OPG作用的新型药物似乎对治疗绝经后妇女的骨质流失以及某些骨癌患者的骨质流失有用。
骨沉积和骨吸收通常处于平衡状态。除了在生长的骨骼中,骨沉积和骨吸收的速率通常是相等的,因此骨骼的总质量保持不变。破骨细胞通常以小而集中的群体存在,一旦一群破骨细胞开始发育,它们通常会侵蚀骨骼约3周,形成一个直径在0.2至1毫米之间、长度达几毫米的隧道。在这段时间结束时,破骨细胞消失,隧道被成骨细胞侵入,新骨开始发育。骨沉积持续数月,新骨以同心圆(骨板)的连续层沉积在腔的内表面,直到隧道被填满。当新骨开始侵蚀供应该区域的血管时,骨沉积停止。这些血管通过的管道称为哈弗斯管(haversian canal),是原始腔的唯一残留部分。以这种方式沉积的每个新骨区域称为骨单位(osteon),如图80-7所示。
持续骨重塑的价值。持续的骨沉积和骨吸收具有几个重要功能。首先,骨骼通常会根据骨应力的程度调整其强度。因此,当骨骼承受重负荷时,骨骼会增厚。其次,甚至可以通过根据应力模式的骨沉积和吸收来重新排列骨骼的形状,以适当支撑机械力。第三,由于旧骨变得相对脆弱和脆弱,当旧有机基质退化时,需要新的有机基质。通过这种方式,骨骼的正常韧性得以维持。事实上,儿童的骨骼,其沉积和吸收速率较快,与老年人的骨骼相比,表现出较少的脆性,而老年人的骨骼沉积和吸收速率较慢。
通过骨“应力”控制骨沉积速率。骨的沉积量与骨骼必须承受的压缩负荷成正比。例如,运动员的骨骼比非运动员的骨骼要重得多。此外,如果一个人的一条腿打了石膏,但继续用另一条腿行走,那么打石膏的腿的骨骼会变薄,并在几周内脱钙多达30%,而另一条腿的骨骼则保持厚实并正常钙化。因此,持续的物理应力会刺激成骨细胞的沉积和骨骼的钙化。
图 80-7. 皮质骨的结构。
在某些情况下,骨应力也决定了骨骼的形状。例如,如果腿部的长骨在其中部断裂,然后以一定角度愈合,角度内侧的压缩应力会导致骨沉积增加。在角度外侧,骨骼未受压的地方会发生吸收增加。经过多年在角度骨内侧的沉积增加和外侧的吸收,骨骼可以变得几乎笔直,尤其是在儿童中,因为年轻时骨骼的重塑速度较快。
骨折的修复激活成骨细胞(osteoblasts)。骨折以某种方式最大限度地激活了所有参与断裂的骨膜和骨内成骨细胞。此外,几乎立即从骨祖细胞(osteoprogenitor cells)中形成大量新的成骨细胞,这些细胞是骨表面组织中的骨干细胞,称为“骨膜”。因此,在短时间内,在骨折的两端之间会形成一个大的成骨细胞组织和新的有机骨基质,随后不久就会有钙盐沉积。这个区域被称为骨痂(callus)。
许多骨科医生利用骨应力现象来加速骨折愈合。这种加速是通过使用特殊的机械固定装置来实现的,这些装置将骨折的两端固定在一起,使患者可以立即继续使用骨骼。这种使用会导致骨折两端的应力,从而加速骨折处的成骨细胞活动,并常常缩短康复时间。
图 80-8. 维生素 D_3 激活形成 1,25-二羟基胆钙化醇以及维生素 D 在控制血浆钙浓度中的作用。
维生素 D
维生素 D 具有增加肠道钙吸收的强大作用;它还对骨沉积和骨吸收有重要影响,如后文所述。然而,维生素 D 本身并不是实际引起这些效应的活性物质。相反,维生素 D 必须首先在肝脏和肾脏中通过一系列反应转化为最终的活性产物 1,25-二羟基胆钙化醇,也称为 1,25(OH)_2D_3。图 80-8 显示了从维生素 D 形成这种物质的一系列步骤。
胆钙化醇(维生素 \bf D_3) 在皮肤中形成。几种来自固醇的化合物属于维生素 D 家族,它们都执行相似的功能。维生素 D_3(也称为胆钙化醇)是这些化合物中最重要的,它在皮肤中通过太阳紫外线照射 7-脱氢胆固醇(皮肤中正常存在的一种物质)而形成。因此,适当的阳光照射可以预防维生素 D 缺乏。我们在食物中摄入的其他维生素 D 化合物与皮肤中形成的胆钙化醇相同,除了一个或多个原子的替换,这些替换不会影响它们的功能。
胆钙化醇(Cholecalciferol)在肝脏中转化为25-羟基胆钙化醇(25-Hydroxycholecalciferol)。胆钙化醇活化的第一步是在肝脏中将其转化为25-羟基胆钙化醇。这一过程是有限的,因为25-羟基胆钙化醇对转化反应具有反馈抑制作用。这种反馈效应极其重要,原因有二。
图80-9. 增加维生素D_3摄入对血浆中25-羟基胆钙化醇浓度的影响。该图显示,维生素D摄入量增加至正常水平的2.5倍时,对最终形成的活化维生素D的量几乎没有影响。只有在维生素D摄入量极低时,才会出现活化维生素D的缺乏。
首先,反馈机制精确调节血浆中25-羟基胆钙化醇的浓度,如图80-9所示。请注意,维生素D_3的摄入量可以增加许多倍,但25-羟基胆钙化醇的浓度仍保持接近正常水平。这种高度的反馈控制防止了当维生素D_3摄入量在很大范围内变化时维生素D的过度作用。
其次,维生素D_3向25-羟基胆钙化醇的受控转化保留了储存在肝脏中的维生素D以供将来使用。一旦维生素D_3被转化,25-羟基胆钙化醇在体内仅持续几周,而以维生素D的形式,它可以在肝脏中储存数月。
肾脏中1,25-二羟基胆钙化醇(1,25-Dihydroxycholecalciferol)的形成及其受甲状旁腺激素(Parathyroid Hormone, PTH)的调控。图80-8还显示了在肾脏近端小管中25-羟基胆钙化醇向1,25-二羟基胆钙化醇的转化。后者是迄今为止维生素D最活跃的形式,因为图80-8中之前的产物具有不到1/1000的维生素D效应。因此,在缺乏肾脏的情况下,维生素D几乎失去了所有效力。
还请注意,在图80-8中,25-羟基胆钙化醇向1,25-二羟基胆钙化醇的转化需要PTH。在缺乏PTH的情况下,几乎不会形成1,25-二羟基胆钙化醇。因此,PTH在决定维生素D在体内的功能效应方面具有强大的影响。
钙离子浓度控制1,25-二羟基胆钙化醇的形成。图80-10显示,1,25-二羟基胆钙化醇的血浆浓度受血浆中钙浓度的反向影响。这种效应有两个原因。首先,钙离子在阻止25-羟基胆钙化醇向1,25-二羟基胆钙化醇的转化方面有轻微作用。其次,更重要的是,正如我们将在本章后面讨论的那样,当血浆钙离子浓度上升到9至10mg/100ml以上时,PTH的分泌速率大大降低。因此,在钙浓度低于此水平时,PTH促进肾脏中25-羟基胆钙化醇向1,25-二羟基胆钙化醇的转化。在钙浓度较高时,当PTH被抑制时,25-羟基胆钙化醇被转化为另一种化合物——24,25-二羟基胆钙化醇——它几乎没有维生素D效应。
图80-10. 血浆钙浓度对1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol)血浆浓度的影响。该图显示,钙浓度略微低于正常水平会导致活性维生素D的形成增加,进而导致肠道对钙的吸收大幅增加。
当血浆钙浓度已经过高时,1,25-二羟基胆钙化醇的形成会受到显著抑制。缺乏1,25-二羟基胆钙化醇会减少肠道、骨骼和肾小管对钙的吸收,从而使钙离子浓度回落到正常水平。
维生素D的作用
维生素D的活性形式1,25-二羟基胆钙化醇对肠道、肾脏和骨骼有多种作用,这些作用增加了钙和磷酸盐进入细胞外液的吸收,并有助于这些物质的反馈调节。
维生素D受体存在于体内大多数细胞中,主要位于靶细胞的细胞核内。与类固醇和甲状腺激素的受体类似,维生素D受体具有激素结合和DNA结合结构域。维生素D受体与另一种细胞内受体——视黄醇X受体(retinoid-X receptor)形成复合物,该复合物在大多数情况下与DNA结合并激活转录。然而,在某些情况下,维生素D会抑制转录。尽管维生素D受体可以与多种形式的胆钙化醇结合,但其对1,25-二羟基胆钙化醇的亲和力大约是对25-羟基胆钙化醇的1000倍,这解释了它们的相对生物活性。
维生素D促进肠道钙吸收的“激素”效应。1,25-二羟基胆钙化醇作为一种“激素”,主要通过在大约2天的时间内增加肠道上皮细胞中钙结合蛋白(calbindin)的形成来促进肠道对钙的吸收。这种蛋白质在这些细胞的刷状缘中发挥作用,将钙转运到细胞质中。然后钙通过细胞的基底外侧膜通过易化扩散(facilitated diffusion)移动。钙的吸收速率与这种钙结合蛋白的数量成正比。此外,即使在1,25-二羟基胆钙化醇从体内移除后,这种蛋白质仍会在细胞中存留数周,从而对钙吸收产生持久的影响。
1,25-二羟基胆钙化醇的其他可能促进钙吸收的作用包括:(1)在上皮细胞刷状缘形成钙刺激的腺苷三磷酸酶(calcium-stimulated adenosine triphosphatase)和(2)在上皮细胞中形成碱性磷酸酶(alkaline phosphatase)。所有这些作用的具体细节尚不清楚。
维生素D促进肠道对磷酸盐的吸收。尽管磷酸盐通常容易被吸收,但维生素D增强了磷酸盐通过胃肠道上皮的通量。这种增强被认为是由1,25-二羟基胆钙化醇的直接作用引起的,但也有可能是由于这种激素对钙吸收的作用间接引起的,钙反过来作为磷酸盐的转运介质。
维生素D减少肾脏钙和磷的排泄。维生素D还通过肾小管上皮细胞增加钙和磷的重吸收,从而倾向于减少这些物质在尿液中的排泄。然而,这种作用较弱,可能在调节这些物质的细胞外液浓度方面并不重要。
维生素D对骨骼的影响及其与甲状旁腺激素活性的关系。维生素D在骨吸收和骨沉积中起重要作用。给予极大量的维生素D会导致骨吸收。在缺乏维生素D的情况下,PTH(甲状旁腺激素)引起的骨吸收作用(在下一节讨论)会大大减弱甚至被阻止。维生素D的这种作用机制尚不完全清楚,但据信是由于1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol)增加钙通过细胞膜运输的效果。
小剂量的维生素D促进骨钙化。它促进这种钙化的方式之一是增加肠道对钙和磷的吸收。然而,即使没有这种增加,它也能增强骨的矿化。同样,这种作用的机制尚不清楚,但它可能也是由于1,25-二羟基胆钙化醇能够通过细胞膜运输钙离子——但在这种情况下,可能是通过成骨细胞或骨细胞膜的反方向运输。
甲状旁腺激素
PTH通过调节肠道重吸收、肾脏排泄以及细胞外液与骨骼之间的离子交换,提供了一种强大的机制来控制细胞外钙和磷的浓度。甲状旁腺的过度活动会导致钙盐从骨骼中迅速释放,从而导致细胞外液中的高钙血症;相反,甲状旁腺功能减退会导致低钙血症,通常伴有抽搐。
甲状旁腺的生理解剖
正常情况下,人类有四个甲状旁腺,它们位于甲状腺后面——每个甲状腺的上极和下极后面各有一个。每个甲状旁腺长约6毫米,宽3毫米,厚2毫米,外观呈深棕色脂肪。在甲状腺手术中,甲状旁腺很难定位,因为它们通常看起来像甲状腺的另一个小叶。因此,在这些腺体的重要性被普遍认识之前,全甲状腺切除术或次全甲状腺切除术经常导致甲状旁腺也被切除。
切除一半的甲状旁腺通常不会引起重大的生理异常。切除四个正常腺体中的三个会导致短暂的甲状旁腺功能减退,但即使是少量的剩余甲状旁腺组织通常也能够肥大,以满意地执行所有腺体的功能。
成年人的甲状旁腺,如图80-11所示,主要包含主细胞和少量到中等数量的嗜酸性细胞,但在许多动物和年轻人中,嗜酸性细胞不存在。据信主细胞分泌大部分(如果不是全部)PTH。嗜酸性细胞的功能尚不确定,但据信这些细胞是经过修饰或耗尽的主细胞,不再分泌激素。
甲状旁腺激素的化学。PTH首先在核糖体上以前激素原(preprohormone)的形式合成,这是一个由110个氨基酸组成的多肽链。内质网和高尔基体首先将这个前激素原切割成90个氨基酸的激素原(prohormone),然后再切割成84个氨基酸的激素本身,最后被包装在细胞质中的分泌颗粒中。最终的激素分子量约为9500。从甲状旁腺中还分离出了分子N端附近仅含34个氨基酸的较小化合物,这些化合物表现出完全的PTH活性。事实上,由于肾脏在几分钟内就会迅速清除整个84个氨基酸的激素,但许多片段却需要数小时才能被清除,因此很大一部分激素活性是由这些片段引起的。
图80-11。四个甲状旁腺位于甲状腺的正后方。几乎所有的甲状旁腺激素(PTH)都是由主细胞(chief cells)合成和分泌的。嗜酸性细胞(oxyphil cells)的功能尚不确定,但它们可能是经过修饰或耗竭的主细胞,不再分泌PTH。
图80-12。以中等速率输注甲状旁腺激素的前5小时内,钙和磷酸盐浓度的近似变化。
甲状旁腺激素对细胞外液钙和磷酸盐浓度的影响
图80-12显示了突然向动物体内输注PTH并持续数小时对血钙和磷酸盐浓度的近似影响。请注意,在输注开始时,钙离子浓度开始上升,并在约4小时内达到平台期。然而,磷酸盐浓度的下降速度比钙的上升速度更快,并在1或2小时内达到较低水平。钙浓度的上升主要由两个效应引起:(1) PTH增加从骨骼中吸收钙和磷酸盐的效应,以及(2) PTH迅速减少肾脏排泄钙的效应。磷酸盐浓度的下降是由PTH强烈增加肾脏磷酸盐排泄的效应引起的,这一效应通常足以抵消从骨骼中增加的磷酸盐吸收。
甲状旁腺激素从骨骼中动员钙和磷酸盐
PTH有两个效应可以从骨骼中动员钙和磷酸盐。一个是快速阶段,在几分钟内开始,并在数小时内逐渐增加。这一阶段是由于激活已有的骨细胞(主要是骨细胞(osteocytes))以促进钙和磷酸盐的释放。第二个阶段则要慢得多,需要数天甚至数周才能完全发展;这是由于破骨细胞(osteoclasts)的增殖,随后是破骨细胞对骨骼的显著增加吸收,而不仅仅是骨骼中磷酸钙盐的释放。
钙和磷酸盐从骨骼中快速动员的阶段——骨溶解(Osteolysis)
当大量PTH被注射时,血液中的钙离子浓度在几分钟内就开始上升,远早于任何新骨细胞的生成。组织学和生理学研究表明,PTH会导致骨盐从骨骼的两个区域被移除:(1) 位于骨内的骨细胞(osteocytes)附近的骨基质,以及(2) 沿骨表面的成骨细胞(osteoblasts)附近。
人们通常不会认为成骨细胞或骨细胞具有动员骨盐的功能,因为这两种细胞本质上是成骨性的,通常与骨沉积及其钙化有关。然而,成骨细胞和骨细胞形成了一个相互连接的细胞系统,遍布整个骨骼和所有骨表面,除了邻近破骨细胞(osteoclasts)的小表面区域(见图80-6)。事实上,长而薄的突起从骨细胞延伸到骨细胞,贯穿整个骨结构,并与表面骨细胞和成骨细胞相连。这个广泛的系统被称为骨细胞膜系统(osteocytic membrane system),据信它提供了一个将骨骼与细胞外液分隔开的膜。
在骨细胞膜和骨骼之间有一小部分骨液。实验表明,骨细胞膜将钙离子从骨液泵入细胞外液,使得骨液中的钙离子浓度仅为细胞外液的三分之一。当骨细胞泵过度激活时,骨液中的钙浓度进一步下降,磷酸钙盐随后从骨骼中释放出来。这种效应被称为骨溶解(osteolysis),它发生时骨骼的纤维和凝胶基质并未被吸收。当泵失活时,骨液中的钙浓度上升到较高水平,磷酸钙盐重新沉积在基质中。
PTH在这个过程中起什么作用呢?首先,成骨细胞和骨细胞的细胞膜上都有PTH受体。PTH强烈激活钙泵,从而导致靠近细胞的非晶态骨晶体中的磷酸钙盐被快速移除。据信,PTH通过增加骨细胞膜骨液侧的钙通透性来刺激这个泵,从而使钙离子从骨液扩散到膜细胞中。然后,细胞膜另一侧的钙泵将钙离子转移到细胞外液中。
骨吸收和磷酸钙释放的缓慢阶段——破骨细胞的激活
PTH的一个更为人熟知且证据更为明确的作用是激活破骨细胞。然而,破骨细胞本身并没有PTH的膜受体。相反,激活的成骨细胞和骨细胞向破骨细胞发送次级“信号”。如前所述,一个主要的次级信号是RANKL,它激活前破骨细胞上的受体,并将它们转化为成熟的破骨细胞,这些细胞在数周或数月内开始其吞噬骨骼的常规任务。
破骨细胞系统的激活分为两个阶段:(1) 已形成的破骨细胞的立即激活和 (2) 新破骨细胞的形成。几天的过量 PTH(甲状旁腺激素)通常会导致破骨细胞系统发育良好,但在强 PTH 刺激的影响下,它可以继续生长数月。
在过量 PTH 几个月后,破骨细胞的骨吸收可能导致骨骼变弱,并刺激成骨细胞(osteoblasts)试图纠正这种弱化状态。因此,晚期效应实际上是增强成骨细胞和破骨细胞的活性。然而,即使在晚期,持续过量的 PTH 存在下,骨吸收仍然多于骨沉积。
骨骼中的钙含量与所有细胞外液中的总钙量相比(约为 1000 倍)如此之大,以至于即使 PTH 导致液体中钙浓度大幅上升,也无法立即观察到对骨骼的任何影响。长期给药或过量分泌 PTH——持续数月或数年——最终会导致所有骨骼中非常明显的吸收,甚至形成充满大型多核破骨细胞的大腔。
甲状旁腺激素减少钙排泄并增加肾脏的磷酸盐排泄
PTH 的给药会导致尿液中磷酸盐的快速流失,这是由于激素减少了近端小管对磷酸盐离子的重吸收。
PTH 同时增加了肾小管对钙的重吸收,同时减少了磷酸盐的重吸收(见第 30 章)。此外,它增加了镁离子和氢离子的重吸收,同时减少了钠、钾和氨基酸离子的重吸收,其方式与影响磷酸盐的方式非常相似。增加的钙重吸收主要发生在亨利氏袢的厚升支和远端小管。
如果不是 PTH 对肾脏增加钙重吸收的作用,钙持续流失到尿液中最终会耗尽细胞外液和骨骼中的这种矿物质。
甲状旁腺激素增加肠道对钙和磷酸盐的吸收
在这一点上,我们应该再次提醒,PTH 通过增加肾脏中从维生素 D 形成 1,25-二羟基胆钙化醇,大大增强了肠道对钙和磷酸盐的吸收,正如本章前面所讨论的。
环磷酸腺苷介导甲状旁腺激素的作用。PTH 对其靶器官的大部分作用是通过环磷酸腺苷(cAMP)第二信使机制介导的。在 PTH 给药后几分钟内,骨细胞、破骨细胞和其他靶细胞中的 cAMP 浓度增加。这种 cAMP 反过来可能是破骨细胞分泌酶和酸以引起骨吸收以及肾脏中 1,25-二羟基胆钙化醇形成等功能的原因。PTH 的其他直接作用可能独立于第二信使机制发挥作用。
钙离子浓度对甲状旁腺分泌的控制
即使细胞外液中的钙离子浓度有最轻微的下降,也会在几分钟内导致甲状旁腺增加甲状旁腺激素(PTH)的分泌;如果钙浓度持续降低,腺体将会肥大,有时可达五倍或更多。例如,在患有佝偻病的人中,甲状旁腺会显著增大,尽管他们的钙水平通常只下降了一小部分。在怀孕期间,即使母亲细胞外液中的钙离子浓度几乎没有可测量的下降,这些腺体也会显著增大;在哺乳期间,由于钙被用于乳汁的形成,它们也会显著增大。
相反,使钙离子浓度高于正常水平的情况会导致甲状旁腺活动减少和体积缩小。这些情况包括:(1) 饮食中过量的钙,(2) 饮食中增加的维生素D,以及(3) 由非PTH因素(如骨骼废用)引起的骨吸收。
细胞外液钙离子浓度的变化由甲状旁腺细胞膜上的钙感应受体(CSR)检测。钙感应受体是一种G蛋白偶联受体,当被钙离子刺激时,会激活磷脂酶C并增加细胞内1,4,5-三磷酸肌醇和二酰甘油的形成。这种活性刺激了细胞内钙的释放,从而减少了PTH的分泌。相反,细胞外液钙离子浓度的降低抑制了这些途径并刺激了PTH的分泌。这个过程与许多内分泌组织中的情况形成对比,在这些组织中,当这些途径被激活时,激素分泌会被刺激。
图80-13. 血浆钙浓度对血浆甲状旁腺激素和降钙素浓度的近似影响。特别注意,长期钙浓度的仅几个百分点的变化可以导致甲状旁腺激素浓度高达100%的变化。
图80-13显示了血浆钙浓度与血浆PTH浓度之间的近似关系。红色实线显示了当钙浓度在几小时内变化时的急性效应,并说明了即使钙浓度从正常值略微下降,也可以使血浆PTH增加两倍或三倍。红色虚线显示了当钙离子浓度在数周内变化时的慢性效应,从而允许腺体显著肥大,这表明血浆钙浓度仅下降几分之一毫克每分升就可以使PTH分泌增加一倍。这是身体极其有效的反馈系统长期控制血浆钙离子浓度的基础。
甲状旁腺激素效应的总结
图80-14总结了PTH分泌增加对细胞外液钙离子浓度降低的主要影响:(1) PTH刺激骨吸收(osteoclasts),导致钙释放到细胞外液中;(2) PTH增加肾小管对钙的重吸收(calcium reabsorption)并减少对磷酸盐的重吸收(phosphate reabsorption),导致钙的排泄减少和磷酸盐的排泄增加;(3) PTH是25-羟基胆钙化醇(25-hydroxycholecalciferol)转化为1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol)的必要条件,后者反过来增加肠道对钙的吸收。这些作用共同提供了调节细胞外液钙浓度的强大手段。
图80-14. 甲状旁腺激素(parathyroid hormone, PTH)对骨、肾脏和肠道在细胞外液钙离子浓度降低时的作用总结。CaSR,钙感应受体(Calcium-sensing receptor)。
降钙素(Calcitonin)
降钙素(Calcitonin)是由甲状腺分泌的一种肽类激素,倾向于降低血浆钙浓度,并且通常具有与PTH相反的作用。然而,降钙素在人类中调节钙离子浓度的定量作用远不如PTH。
降钙素的合成和分泌发生在甲状腺滤泡间质液中的滤泡旁细胞(parafollicular cells)或C细胞(C cells)中。这些细胞仅占人类甲状腺的约0.1%,是鱼类、两栖类、爬行类和鸟类后鳃腺(ultimobranchial glands)的残余。降钙素是一种由32个氨基酸组成的肽,分子量约为3400。
血浆钙浓度增加刺激降钙素分泌。降钙素分泌的主要刺激因素是细胞外液钙离子浓度的增加。相比之下,PTH的分泌是由钙浓度降低刺激的。
在年轻动物中,血浆钙浓度增加约10%会立即导致降钙素分泌率增加两倍或更多,如图80-13中的蓝线所示。这种增加提供了控制血浆钙离子浓度的第二种激素反馈机制,但这种机制相对较弱,并且与PTH系统的作用方式相反。
降钙素降低血浆钙浓度。在一些年轻动物中,降钙素在注射后几分钟内迅速降低血钙离子浓度,至少通过两种方式:
- 立即效应是降低破骨细胞(osteoclasts)的吸收活性,并可能降低骨细胞膜(osteocytic membrane)在整个骨骼中的溶骨作用(osteolytic effect),从而有利于可交换骨钙盐中钙的沉积。这种效应在年轻动物中尤为重要,因为钙的吸收和沉积速度较快。
- 降钙素(calcitonin)的第二个且更持久的作用是减少新的破骨细胞(osteoclasts)的形成。此外,由于破骨细胞对骨的吸收会间接导致成骨细胞(osteoblasts)的活性增加,因此破骨细胞数量的减少会伴随着成骨细胞数量的减少。因此,长期来看,净结果是破骨细胞和成骨细胞的活性降低,从而对血浆钙离子浓度的长期影响很小。也就是说,对血浆钙的影响主要是短暂的,最多持续几小时到几天。
降钙素对肾小管(kidney tubules)和肠道(intestines)中的钙处理也有轻微影响。同样,这些影响与甲状旁腺激素(PTH)的作用相反,但它们似乎微不足道,因此很少被考虑。
降钙素对成人血浆钙浓度的影响较弱。降钙素对血浆钙影响较弱的原因有两个。首先,降钙素引起的钙离子浓度的任何初始降低都会在几小时内导致甲状旁腺激素(PTH)分泌的强烈刺激,这几乎抵消了降钙素的作用。当甲状腺被切除且不再分泌降钙素时,长期的血钙离子浓度并未发生可测量的变化,这再次证明了甲状旁腺激素(PTH)控制系统的压倒性作用。
其次,在成人中,钙的每日吸收和沉积速率较小,即使在降钙素减慢吸收速率后,对血浆钙离子浓度的影响仍然很小。降钙素在儿童中的影响要大得多,因为儿童的骨重塑(remodeling)发生得很快,钙的吸收和沉积每天可达5克或更多——相当于所有细胞外液中总钙量的5到10倍。此外,在某些骨疾病中,如Paget's disease,破骨细胞活性大大加快,降钙素在减少钙吸收方面具有更强的效果。
钙离子浓度控制的总结
有时,体液吸收或丢失的钙量在1小时内可达0.3克。例如,在腹泻的情况下,每天可能有几克钙被分泌到肠液中,进入肠道,并随粪便排出。
相反,在摄入大量钙后,特别是在维生素D活性过高的情况下,一个人可能在1小时内吸收多达0.3克钙。这个数字与所有细胞外液中约1克的总钙量相比。在如此少量的细胞外液钙中增加或减少0.3克会导致严重的高钙血症(hypercalcemia)或低钙血症(hypocalcemia)。然而,在甲状旁腺和降钙素激素反馈系统有机会发挥作用之前,就有一道防线来防止这种情况的发生。
骨骼中可交换钙的缓冲功能——第一道防线。本章前面讨论的骨骼中的可交换钙盐是无定形磷酸钙化合物,可能主要是CaHPO_4或一些类似的化合物,松散地结合在骨骼中,并与细胞外液中的钙和磷酸根离子处于可逆平衡状态。
这些可用于交换的盐量约占骨骼总钙盐的0.5%至1%,即总共5至10克的钙。由于这些可交换盐易于沉积且易于重新溶解,细胞外液(extracellular fluid)中钙和磷酸根离子浓度高于正常水平会立即导致可交换盐的沉积。相反,这些浓度的降低会立即导致可交换盐的吸收。这种反应迅速,因为无定形骨晶体非常小,其暴露于骨液体的总表面积很大——可能达到1英亩或更多。
此外,每分钟约有5%的血液流经骨骼——即每分钟约有1%的细胞外液。因此,大约70分钟内,细胞外液中出现的任何过量钙的一半会通过骨骼的这种缓冲功能被移除。
除了骨骼的缓冲功能外,许多组织的线粒体(mitochondria),尤其是肝脏和肠道的线粒体,含有大量可交换钙(全身约10克),这提供了额外的缓冲系统,帮助维持细胞外液钙离子浓度的恒定。
钙离子浓度的激素控制——第二道防线。在骨骼中的可交换钙机制“缓冲”细胞外液中的钙的同时,甲状旁腺(parathyroid)和降钙素(calcitonin)激素系统也开始发挥作用。在钙离子浓度急剧增加后的3至5分钟内,甲状旁腺激素(PTH)的分泌速率降低。正如已经解释的那样,这会启动多种机制,将钙离子浓度降低回正常水平。
在PTH减少的同时,降钙素增加。在年轻动物和可能的幼儿中(但在成人中可能程度较小),降钙素会导致钙在骨骼中迅速沉积,可能也在其他组织的一些细胞中沉积。因此,在非常年轻的动物中,过量的降钙素可以使高钙离子浓度迅速恢复正常,可能比仅通过可交换钙缓冲机制实现的速度快得多。
在长期的钙过量或钙缺乏中,只有PTH机制似乎在维持正常血浆钙离子浓度方面真正重要。当一个人持续缺乏饮食中的钙时,PTH通常可以刺激足够的钙从骨骼中吸收,以维持正常血浆钙离子浓度1年或更长时间,但最终,即使是骨骼也会耗尽钙。因此,实际上,骨骼是一个大的钙缓冲库,可以通过PTH进行调节。然而,当骨骼库要么耗尽钙,要么被钙饱和时,细胞外钙离子浓度的长期控制几乎完全依赖于PTH和维生素D在控制肠道钙吸收和尿液钙排泄中的作用。
甲状旁腺激素、维生素D和骨疾病的病理生理学
甲状旁腺功能减退症(Hypoparathyroidism)
当甲状旁腺(parathyroid glands)分泌的甲状旁腺激素(PTH)不足时,可交换钙的骨细胞(osteocytic)吸收减少,破骨细胞(osteoclasts)几乎完全失活。结果,骨骼释放的钙减少,导致体液中的钙水平下降。然而,由于钙和磷酸盐(phosphates)没有从骨骼中释放出来,骨骼通常保持强壮。
当甲状旁腺突然被切除时,血液中的钙水平在2到3天内从正常的9.4mg/dl下降到6到7mg/dl,血磷酸盐浓度可能翻倍。当达到这种低钙水平时,通常会出现手足抽搐(tetany)的迹象。在身体肌肉中,喉部肌肉(laryngeal muscles)对抽搐性痉挛特别敏感。这些肌肉的痉挛会阻碍呼吸,这是手足抽搐患者死亡的常见原因,除非提供适当的治疗。
使用PTH和维生素D治疗甲状旁腺功能减退症(hypoparathyroidism)。PTH偶尔用于治疗甲状旁腺功能减退症。然而,甲状旁腺功能减退症通常不用PTH治疗,因为这种激素昂贵,其效果最多持续几个小时,而且身体产生抗体的倾向使其效果逐渐减弱。
在大多数甲状旁腺功能减退症患者中,给予极大量的维生素D,同时摄入1到2克钙,可以保持钙离子浓度在正常范围内。有时,可能需要给予1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol)而不是非活性形式的维生素D,因为它的作用更强且更快。然而,给予1,25-二羟基胆钙化醇也可能引起不良影响,因为有时难以防止这种活性形式的维生素D的过度作用。
原发性甲状旁腺功能亢进症(primary hyperparathyroidism)
在原发性甲状旁腺功能亢进症中,甲状旁腺的异常导致不适当的、过量的PTH分泌。原发性甲状旁腺功能亢进症的原因通常是其中一个甲状旁腺的肿瘤;这种肿瘤在女性中比在男性或儿童中更常见,主要是因为怀孕和哺乳刺激甲状旁腺,因此容易发生这种肿瘤。
甲状旁腺功能亢进症导致骨骼中破骨细胞活动极度增强,这提高了细胞外液(extracellular fluid)中的钙离子浓度,同时通常由于磷酸盐的肾脏排泄增加而降低了磷酸盐离子的浓度。
甲状旁腺功能亢进症中的骨病。在轻度甲状旁腺功能亢进症患者中,新骨可以迅速沉积,足以补偿增加的破骨细胞吸收。然而,在严重的甲状旁腺功能亢进症中,破骨细胞的吸收很快远远超过成骨细胞(osteoblastic)的沉积,骨骼可能几乎完全被侵蚀。事实上,骨折通常是甲状旁腺功能亢进症患者寻求医疗帮助的原因。骨骼的X光片通常显示广泛的脱钙(decay)和偶尔的大面积囊性区域,这些区域充满了所谓的巨细胞破骨细胞“肿瘤”。由于轻微的创伤,特别是在囊肿形成的地方,可能导致弱化骨骼的多发性骨折。甲状旁腺功能亢进症的囊性骨病被称为纤维囊性骨炎(osteitis fibrosa cystica)。
骨骼中的成骨细胞(osteoblast)活性也显著增加,试图形成足够的新骨以弥补被破骨细胞(osteoclast)吸收的旧骨。当成骨细胞变得活跃时,它们会分泌大量的碱性磷酸酶(alkaline phosphatase)。因此,甲状旁腺功能亢进症(hyperparathyroidism)的一个重要诊断指标是血浆碱性磷酸酶水平升高。
甲状旁腺功能亢进症中高钙血症(hypercalcemia)的影响。甲状旁腺功能亢进症有时会导致血浆钙水平升高至12到15mg/dl,甚至偶尔更高。如本章前面所述,这种钙水平升高的影响包括中枢和外周神经系统抑制、肌肉无力、便秘、腹痛、消化性溃疡、食欲不振以及心脏舒张期松弛抑制。
甲状旁腺中毒和转移性钙化(metastatic calcification)。在极少数情况下,当分泌极大量的甲状旁腺激素(PTH)时,体液中的钙水平迅速升高至很高的水平。甚至细胞外液中的磷酸盐浓度也常常显著上升而不是下降,这可能是由于肾脏无法迅速排出从骨骼吸收的所有磷酸盐。因此,体液中的钙和磷酸盐变得高度过饱和,磷酸钙(CaHPO_4)晶体开始沉积在肺的肺泡、肾小管、甲状腺、胃黏膜的产酸区以及全身动脉壁中。这种广泛的磷酸钙转移性沉积可以在几天内形成。
通常,血液中的钙水平必须超过17mg/dl才会有甲状旁腺中毒的危险,但一旦这种升高伴随着磷酸盐的同时升高,死亡可能在几天内发生。
甲状旁腺功能亢进症中肾结石的形成。大多数轻度甲状旁腺功能亢进症患者几乎没有骨病的迹象,也没有因钙水平升高而出现的一般异常,但他们确实有极高的形成肾结石的倾向。这种倾向的原因是,甲状旁腺功能亢进症中从肠道吸收或从骨骼动员的过量钙和磷酸盐最终必须通过肾脏排出,导致尿液中这些物质的浓度成比例增加。结果,磷酸钙晶体倾向于在肾脏中沉淀,形成磷酸钙结石。此外,草酸钙结石也会形成,因为即使在正常草酸水平下,高钙水平也会导致钙沉淀。
由于大多数肾结石在碱性介质中的溶解度较低,因此在碱性尿液中形成肾结石的倾向比在酸性尿液中大得多。因此,酸中毒饮食和酸性药物经常用于治疗肾结石。
继发性甲状旁腺功能亢进症(secondary hyperparathyroidism)
在继发性甲状旁腺功能亢进症中,高水平的PTH是作为低钙血症(hypocalcemia)的补偿而不是甲状旁腺的原发性异常。相比之下,原发性甲状旁腺功能亢进症(primary hyperparathyroidism)与高钙血症相关。
继发性甲状旁腺功能亢进(secondary hyperparathyroidism)可由维生素D缺乏或慢性肾脏疾病引起,受损的肾脏无法产生足够量的活性维生素D形式,即1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol)。正如下一节将详细讨论的那样,维生素D缺乏会导致骨软化症(osteomalacia)(骨骼矿化不足),而高水平的甲状旁腺激素(PTH)会导致骨骼吸收。
维生素D缺乏引起的佝偻病(Rickets)
佝偻病主要发生在儿童中。它是由细胞外液中钙或磷酸盐缺乏引起的,通常由维生素D缺乏引起。如果儿童充分暴露在阳光下,皮肤中的7-脱氢胆固醇(7-dehydrocholesterol)会被紫外线激活并形成维生素D_3,正如本章前面所讨论的那样,它通过促进肠道对钙和磷酸盐的吸收来预防佝偻病。
在冬季一直待在室内的儿童通常无法获得足够的维生素D,除非在饮食中补充。佝偻病往往在春季发生,因为前一个夏季形成的维生素D储存在肝脏中,可以在初冬使用。此外,在维生素D缺乏的最初几个月,骨骼中钙和磷酸盐的动员可以防止佝偻病的临床症状。
佝偻病中钙和磷酸盐的血浆浓度降低。佝偻病中的血浆钙浓度仅略有下降,但磷酸盐水平大大降低。这种现象的发生是因为每当钙水平开始下降时,甲状旁腺通过促进骨吸收来防止钙水平下降。然而,没有良好的调节系统来防止磷酸盐水平的下降,而甲状旁腺活动的增加实际上会增加尿液中磷酸盐的排泄。
佝偻病使骨骼变弱。在长期的佝偻病病例中,PTH分泌的显著代偿性增加导致极端的破骨细胞骨吸收。这反过来导致骨骼逐渐变弱,并对骨骼施加明显的物理压力,从而导致快速的成骨细胞活动。成骨细胞沉积大量类骨质(osteoid),由于钙和磷酸盐离子不足,这些类骨质不会钙化。因此,新形成的、未钙化的、脆弱的类骨质逐渐取代了被吸收的旧骨。
佝偻病中的手足搐搦(tetany)。在佝偻病的早期阶段,手足搐搦几乎不会发生,因为甲状旁腺不断刺激骨的破骨细胞吸收,从而维持细胞外液中几乎正常的钙水平。然而,当骨骼最终耗尽钙时,钙浓度可能会迅速下降。当血钙水平降至7~mg/dl;以下时,通常会出现手足搐搦的迹象,除非静脉注射钙以立即缓解手足搐搦,否则儿童可能会死于手足搐搦性呼吸痉挛。
佝偻病的治疗。佝偻病的治疗需要在饮食中提供足够的钙和磷酸盐,同样重要的是,给予大量的维生素D。如果不给予维生素D,肠道吸收的钙和磷酸盐很少。
骨软化症——“成人佝偻病”
成年人很少出现严重的维生素D或钙的饮食缺乏,因为与儿童不同,成年人不需要大量的钙来支持骨骼生长。然而,由于脂肪泻(steatorrhea,脂肪吸收不良),偶尔会出现维生素D和钙的严重缺乏,因为维生素D是脂溶性的,而钙容易与脂肪形成不溶性肥皂;因此,在脂肪泻的情况下,维生素D和钙往往会随粪便排出。在这些情况下,成年人偶尔会出现钙和磷酸盐吸收不良,导致佝偻病的发生。成人佝偻病几乎不会发展到手足抽搐的阶段,但常常是严重骨骼功能障碍的原因。
由肾脏疾病引起的骨软化症和佝偻病
“肾性佝偻病”是一种由于长期肾脏损伤导致的骨软化症。这种情况的主要原因是受损的肾脏无法形成1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol),这是维生素D的活性形式。对于肾脏被切除或破坏并接受血液透析治疗的患者,肾性佝偻病的问题可能非常严重。
另一种导致佝偻病和骨软化症的肾脏疾病是先天性低磷血症(congenital hypophosphatemia),这是由于肾小管对磷酸盐的先天性重吸收减少所致。这种类型的佝偻病必须用磷酸盐化合物而不是钙和维生素D来治疗,因此被称为维生素D抵抗性佝偻病(vitamin D-resistant rickets)。
骨质疏松症——骨基质减少
骨质疏松症是成年人中最常见的骨骼疾病,尤其是在老年人群中。它与骨软化症和佝偻病不同,因为它是由有机骨基质减少而不是骨钙化不良引起的。在骨质疏松症患者中,骨中的成骨细胞(osteoblastic)活性通常低于正常水平,因此骨样物质(osteoid)的沉积速率降低。然而,偶尔也会出现骨减少的原因是破骨细胞(osteoclastic)活性过高,例如在甲状旁腺功能亢进症(hyperparathyroidism)中。
骨质疏松症的常见原因包括以下几点:
- 由于缺乏活动,骨骼缺乏物理应力;
- 营养不良,导致无法形成足够的蛋白质基质;
- 缺乏维生素C,维生素C是所有细胞分泌细胞间物质所必需的,包括成骨细胞形成骨样物质;
- 绝经后雌激素分泌不足,因为雌激素会减少破骨细胞的数量和活性;
- 老年,生长激素和其他生长因子显著减少,加上许多蛋白质合成功能随着年龄增长而退化,导致骨基质无法充分沉积;
- 库欣综合征(Cushing syndrome),因为在这种疾病中分泌的大量糖皮质激素会导致全身蛋白质沉积减少和蛋白质分解代谢增加,并具有抑制成骨细胞活性的特定作用。因此,许多蛋白质代谢缺陷的疾病都可能导致骨质疏松症。
图80-15. 牙齿的功能部分
牙齿的冠部和根部被牙龈包围的部分称为颈部。
牙釉质(Enamel)。牙齿的外表面覆盖着一层牙釉质,这层牙釉质是由称为成釉细胞(ameloblasts)的特殊上皮细胞在牙齿萌出前形成的。一旦牙齿萌出,就不再形成牙釉质。牙釉质由大而致密的羟基磷灰石晶体组成,晶体中吸附有碳酸盐、镁、钠、钾和其他离子,这些晶体嵌入到由强韧且几乎不溶的蛋白质纤维构成的精细网状结构中,这些蛋白质纤维在物理特性上与头发的角蛋白相似(但化学性质不同)。
牙齿的生理学
牙齿负责切割、研磨和混合所吃的食物。为了执行这些功能,颌部拥有强大的肌肉,能够在前牙之间提供50到100磅的咬合力,而在后牙之间提供150到200磅的咬合力。此外,上下牙齿具有相互咬合的突起和面,因此上牙与下牙相吻合。这种吻合称为咬合(occlusion),它使得即使是微小的食物颗粒也能被捕获并在牙齿表面之间研磨。
牙齿不同部分的功能
图80-15显示了牙齿的矢状切面,展示了其主要功能部分——牙釉质、牙本质(dentin)、牙骨质(cementum)和牙髓(pulp)。牙齿还可以分为牙冠(crown)和牙根(root),牙冠是从牙龈突出到口腔中的部分,而牙根是位于颌骨牙槽窝内的部分。牙冠和牙根之间的部分称为牙颈(collar)。
盐类的晶体结构使牙釉质极其坚硬,比牙本质硬得多。此外,特殊的蛋白质纤维网状结构虽然仅占牙釉质质量的约1%,但由于这种蛋白质是已知的最不溶和最耐腐蚀的蛋白质之一,因此牙釉质对酸、酶和其他腐蚀性物质具有抵抗力。
牙本质(Dentin)。牙齿的主体由牙本质组成,牙本质具有坚固的骨性结构。牙本质主要由与骨中相似的羟基磷灰石晶体组成,但密度更大。这些晶体嵌入到由胶原纤维构成的强韧网状结构中。因此,牙本质的主要成分与骨非常相似。主要区别在于其组织学结构,因为牙本质不包含任何成骨细胞(osteoblasts)、骨细胞(osteocytes)、破骨细胞(osteoclasts)或血管和神经的空间。相反,它是由一层称为成牙本质细胞(odontoblasts)的细胞沉积和滋养的,这些细胞沿着牙髓腔壁的内表面排列。
牙本质中的钙盐使其对压缩力具有极强的抵抗力,而胶原纤维使其坚韧,能够抵抗牙齿受到固体物体撞击时可能产生的张力。
牙骨质(Cementum)。牙骨质是由牙周膜(periodontal membrane)细胞分泌的一种骨性物质,牙周膜位于牙槽窝内。许多胶原纤维直接从颌骨穿过牙周膜,然后进入牙骨质。这些胶原纤维和牙骨质将牙齿固定在原位。当牙齿受到过度应力时,牙骨质层会变得更厚更强。此外,随着年龄的增长,牙骨质的厚度和强度也会增加,使牙齿在成年后更加牢固地固定在颌骨中。
牙髓(pulp)。每颗牙齿的牙髓腔(pulp cavity)中都充满了牙髓,牙髓由富含神经纤维、血管和淋巴管的结缔组织(connective tissue)组成。牙髓腔表面的细胞是成牙本质细胞(odontoblasts),在牙齿的形成过程中,它们会沉积牙本质(dentin),但同时也会逐渐侵占牙髓腔,使其变小。在后期生活中,牙本质停止生长,牙髓腔的大小基本保持不变。然而,成牙本质细胞仍然具有活性,并向贯穿牙本质的小牙本质小管(dentinal tubules)中伸出突起;它们对于与牙本质交换钙、磷酸盐和其他矿物质具有重要意义。
牙列(dentition)。人类和大多数其他哺乳动物在一生中会发育出两套牙齿。第一套牙齿称为乳牙(deciduous teeth)或乳齿(milk teeth),人类共有20颗乳牙。它们在出生后第七个月到第二年之间萌出,并持续到第六到第十三年。每颗乳牙脱落后,恒牙(permanent tooth)会替换它,并且在颌骨后部还会长出额外的8到12颗臼齿(molars),使恒牙总数达到28到32颗,具体取决于四颗智齿(wisdom teeth)是否最终萌出,而并非所有人都会长出智齿。
牙齿的形成。图80-16展示了牙齿的形成和萌出过程。图80-16A显示了口腔上皮(oral epithelium)向内凹陷形成牙板(dental lamina),随后发育出牙齿生成器官(tooth-producing organ)。上方的上皮细胞形成成釉细胞(ameloblasts),它们在牙齿外部形成釉质(enamel)。下方的上皮细胞向内凹陷进入牙齿中部,形成牙髓腔和分泌牙本质的成牙本质细胞。因此,釉质在牙齿外部形成,而牙本质在内部形成,从而形成早期牙齿,如图80-16B所示。
牙齿的萌出。在幼儿期,牙齿开始从骨中向外突出,穿过口腔上皮进入口腔。牙齿“萌出”的原因尚不清楚,尽管最可能的解释是牙根(tooth root)和牙齿下方骨骼的生长逐渐将牙齿向前推动。
图80-16。A,原始牙齿器官。B,发育中的牙齿。C,萌出的牙齿。
恒牙的发育。在胚胎期,每个恒牙的深层牙板中也会发育出牙齿生成器官,这些器官将在乳牙脱落后形成恒牙。这些牙齿生成器官在生命的前6到20年中缓慢形成恒牙。当每颗恒牙完全形成后,它会像乳牙一样向外推动穿过骨骼。在此过程中,它会侵蚀乳牙的牙根,最终导致乳牙松动并脱落。此后不久,恒牙萌出以取代原来的牙齿。
代谢因素影响牙齿的发育。甲状腺激素和生长激素可以加速牙齿的发育速度和萌出速度。此外,早期形成的牙齿中盐类的沉积也受到多种代谢因素的显著影响,例如饮食中钙和磷酸盐的可用性、维生素D的含量以及PTH(甲状旁腺激素)的分泌速率。当所有这些因素都正常时,牙本质和牙釉质将相应地健康,但当它们缺乏时,牙齿的钙化也可能出现缺陷,牙齿将终生异常。
牙齿中的矿物质交换。牙齿中的盐类与骨骼中的盐类一样,由羟基磷灰石组成,其中吸附了碳酸盐和各种阳离子,结合在一起形成坚硬的晶体物质。此外,新的盐类不断沉积,而旧的盐类则从牙齿中被吸收,就像骨骼中发生的那样。沉积和吸收主要发生在牙本质和牙骨质中,而在牙釉质中则有限。在牙釉质中,这些过程主要通过矿物质与唾液的扩散交换发生,而不是与牙髓腔中的液体交换。
牙骨质中矿物质的吸收和沉积速率与周围颌骨的速率大致相等,而牙本质中矿物质的沉积和吸收速率仅为骨骼的三分之一。牙骨质具有与普通骨骼几乎相同的特征,包括成骨细胞和破骨细胞的存在,而牙本质则没有这些特征,如前所述。这种差异无疑解释了矿物质交换速率的不同。
总之,牙齿的牙本质和牙骨质中持续发生矿物质交换,尽管牙本质中这种交换的机制尚不清楚。然而,牙釉质表现出极慢的矿物质交换,因此它在整个生命周期中保留了大部分原始矿物质。
牙齿异常
最常见的两种牙齿异常是龋齿和错颌畸形。龋齿指的是牙齿的侵蚀,而错颌畸形是指上下牙齿的突起未能正确咬合。
龋齿及细菌和摄入碳水化合物的作用。龋齿是由细菌对牙齿的作用引起的,其中最常见的是Streptococcus mutans。龋齿发展的第一个事件是牙菌斑的沉积,牙菌斑是唾液和食物沉淀物的薄膜。大量细菌栖息在这种牙菌斑中,很容易引起龋齿。这些细菌在很大程度上依赖碳水化合物作为食物。当碳水化合物可用时,它们的代谢系统被强烈激活并繁殖。此外,它们形成酸(特别是乳酸)和蛋白水解酶。酸是导致龋齿的主要罪魁祸首,因为牙齿的钙盐在高酸性介质中缓慢溶解。一旦盐类被吸收,剩余的有机基质就会被蛋白水解酶迅速消化。
牙齿的釉质(Enamel)是龋齿发展的主要屏障。釉质比牙本质(Dentin)更能抵抗酸的脱矿作用,主要是因为釉质的晶体密度高,而且每个釉质晶体的体积大约是每个牙本质晶体的200倍。一旦龋病过程穿透釉质到达牙本质,由于牙本质盐类的高度可溶性,龋病的发展速度会快很多倍。
由于龋齿细菌依赖碳水化合物(Carbohydrates)作为营养,人们经常认为摄入高碳水化合物含量的饮食会导致龋齿的过度发展。然而,重要的不是摄入的碳水化合物数量,而是摄入的频率。如果碳水化合物以小块的形式全天多次摄入,比如以糖果的形式,细菌就会在一天中的许多小时内获得其优先的代谢底物,从而大大增加龋齿的发展。
氟在预防龋齿中的作用。饮用含少量氟的水的儿童形成的釉质比饮用不含氟的水的儿童形成的釉质更能抵抗龋齿。氟并不会使釉质比平常更硬,但氟离子会取代羟基磷灰石晶体中的许多羟基离子,从而使釉质的溶解度降低几倍。氟也可能对细菌有毒。最后,当釉质中确实出现小坑时,氟被认为能促进磷酸钙的沉积以“愈合”釉质表面。无论氟保护牙齿的确切机制如何,已知沉积在釉质中的少量氟能使牙齿对龋齿的抵抗力提高约三倍。
错颌畸形(Malocclusion)。错颌畸形通常是由遗传异常引起的,这种异常导致一个颌骨的牙齿生长到异常位置。在错颌畸形中,牙齿不能正确咬合,因此无法充分执行其正常的研磨或切割动作。错颌畸形偶尔也会导致下颌相对于上颌的异常位移,引起下颌关节疼痛和牙齿退化等不良影响。
正畸医生通常可以通过使用适当的矫正器对牙齿施加长时间的轻柔压力来纠正错颌畸形。这种轻柔的压力会导致牙齿受压侧的牙槽骨吸收,并在牙齿的张力侧沉积新骨。通过这种方式,牙齿在施加的压力下逐渐移动到新的位置。
第81章 男性生殖和激素功能(以及松果体功能)
男性生殖功能可以分为三个主要部分:(1) 精子的形成——精子发生(spermatogenesis);(2) 男性性行为的执行;(3) 各种激素对男性生殖功能的调控。与这些生殖功能相关的是男性性激素对附属性器官、细胞代谢、生长以及身体其他功能的影响。
男性性器官的生理解剖
图 81-1A 显示了雄性再生系统的各个部分,图 81-1B 给出了睾丸和附睾的更细节结构。睾丸由多达 900 个盘绕的生精小管组成,每个小管平均长度超过半米,其中形成精子。然后精子排入附睾,附睾是另一根约 6 米长的盘绕管。附睾通向输精管,输精管在输精管进入前列腺体之前立即扩大到输精管壶腹。
两个精囊(seminal vesicles),分别位于前列腺的两侧,排入壶腹(ampulla)的前列腺端,壶腹和精囊的内容物进入射精管(ejaculatory duct),射精管穿过前列腺体,然后排入尿道内口。前列腺导管也从前列腺排入射精管,然后进入前列腺尿道。
最后,尿道是从睾丸到外部的最后连接部分。尿道由大量微小的尿道腺(urethral glands)分泌的黏液供应,这些腺体沿尿道的整个长度分布,尤其是位于尿道起始处的双侧尿道球腺(bulbourethral glands)(Cowper 腺)。
精子发生(SPERMATOGENESIS)
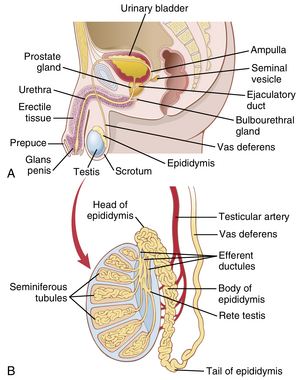
在胚胎形成过程中,原始生殖细胞(primordial germ cells)迁移到睾丸中,成为未成熟的生殖细胞,称为精原细胞(spermatogonia),它们位于曲细精管(seminiferous tubules)内表面的两到三层中(图81-2A显示了曲细精管的横截面)。在青春期,精原细胞开始进行有丝分裂(mitotic division),并通过一定的发育阶段不断增殖和分化,形成精子(sperm),如图81-2B所示。
精子发生(spermatogenesis)的步骤
精子发生在性活跃期由垂体前叶促性腺激素(anterior pituitary gonadotropic hormones)的刺激下在曲细精管中进行。精子发生在男性平均13岁时开始,并在大部分余生中持续进行,但在老年时显著减少。
图81-1A显示了男性生殖系统的各个部分,图81-1B更详细地展示了睾丸和附睾的结构。睾丸由多达900条卷曲的曲细精管组成,每条平均长度超过半米,精子在其中形成。然后精子排入附睾(epididymis),附睾是另一条长约6米的卷曲管道。附睾通向输精管(vas deferens),输精管在进入前列腺(prostate gland)体之前扩大形成输精管壶腹(ampulla of the vas deferens)。
在精子发生的第一阶段,精原细胞在支持细胞(Sertoli cells)之间迁移,向曲细精管的中央管腔移动。支持细胞较大,其细胞质包膜环绕着发育中的精原细胞,一直延伸到曲细精管的中央管腔。
减数分裂(Meiosis)。穿过屏障进入支持细胞层的精原细胞逐渐改变并增大,形成初级精母细胞(primary spermatocytes)(图81-3)。每个初级精母细胞随后进行减数分裂,形成两个次级精母细胞(secondary spermatocytes)。几天后,这些次级精母细胞也分裂形成精细胞(spermatids),最终精细胞经过修饰成为精子(spermatozoa)。
在从精母细胞阶段到精细胞阶段的变化过程中,精母细胞的46条染色体(23对染色体)被分裂,因此23条染色体进入一个精细胞,另外23条染色体进入第二个精细胞。染色体基因也被分裂,因此最终胎儿的遗传特征只有一半由父亲提供,另一半由母亲提供的卵母细胞(oocyte)提供。
图81-3 精子发生过程中的细胞分裂。在胚胎发育过程中,原始生殖细胞迁移到睾丸,在那里它们成为精原细胞(spermatogonia)。在青春期(通常在出生后12到14年),精原细胞通过有丝分裂迅速增殖。一些细胞开始减数分裂成为初级精母细胞(primary spermatocytes),并继续通过减数分裂I成为次级精母细胞(secondary spermatocytes)。在完成减数分裂II后,次级精母细胞产生精子细胞(spermatids),这些精子细胞分化形成精子(spermatozoa)。
从精原细胞到精子的整个精子发生过程大约需要74天。
性染色体(Sex Chromosomes)。在每个精原细胞中,23对染色体中的一对携带决定每个后代性别的遗传信息。这对染色体由一个X染色体(称为女性染色体)和一个Y染色体(男性染色体)组成。在减数分裂过程中,男性的Y染色体进入一个精子细胞,然后成为男性精子,而女性的X染色体进入另一个精子细胞,成为女性精子。最终后代的性别由这两种精子中的哪一种使卵子受精决定。这个过程在第83章中进一步讨论。
图81-4 人类精子的结构。
精子的形成。当精子细胞最初形成时,它们仍然具有上皮样细胞的常见特征,但很快它们开始分化并伸长成精子。如图81-4所示,每个精子由头部和尾部组成。头部包含细胞的浓缩核,表面只有一层薄薄的细胞质和细胞膜。头部前三分之二的外部有一个厚厚的帽状结构,称为顶体(acrosome),主要由高尔基体形成。顶体含有几种与典型细胞溶酶体中发现的酶相似的酶,包括透明质酸酶(hyaluronidase)(可以消化组织的蛋白多糖丝)和强大的蛋白水解酶(可以消化蛋白质)。这些酶在允许精子进入卵子并使其受精方面起着重要作用。
精子的尾部称为鞭毛(flagellum),有三个主要组成部分:(1)由11个微管构成的中央骨架,统称为轴丝(axoneme);轴丝的结构类似于第2章中描述的其他类型细胞表面发现的纤毛的结构;(2)覆盖轴丝的薄细胞膜;以及(3)在尾部近端部分围绕轴丝的一群线粒体,称为尾部主体。
尾部的来回运动(鞭毛运动)为精子提供动力。这种运动是由构成轴丝的前后微管之间的有节奏的纵向滑动运动产生的。这个过程的能量以三磷酸腺苷(adenosine triphosphate)的形式提供,由尾部主体中的线粒体合成。
正常精子在液体介质中以1到4毫米/分钟的速度移动,这使它们能够通过女性生殖道寻找卵子。
刺激精子发生的激素因素
激素在生殖中的作用将在后面详细讨论;现在需要注意的是,有几种激素在精子发生(spermatogenesis)中起着至关重要的作用。这些作用如下:
- 由位于睾丸间质中的Leydig细胞分泌的睾酮(testosterone)(见图81-2),对于睾丸生精细胞的生长和分裂是必不可少的,这是形成精子的第一阶段。
- 由垂体前叶分泌的黄体生成素刺激Leydig细胞分泌睾酮。
- 同样由垂体前叶分泌的促卵泡激素刺激Sertoli细胞;没有这种刺激,精子细胞转化为精子(精子形成(spermiogenesis)过程)将不会发生。
- 当Sertoli细胞受到促卵泡激素刺激时,由睾酮形成的雌激素(estrogens)可能也对精子形成至关重要。
- 生长激素(以及大多数其他身体激素)对于控制睾丸的背景代谢功能是必要的。生长激素特别促进精原细胞的早期分裂;在缺乏生长激素的情况下,如垂体性侏儒症患者,精子发生严重不足或缺失,从而导致不育。
精子在附睾中的成熟
在生精小管中形成后,精子需要几天时间通过6米长的附睾管。从生精小管和附睾早期部分取出的精子是不动的,不能使卵子受精。然而,当精子在附睾中停留18至24小时后,它们会发展出运动能力,尽管附睾液中的几种抑制蛋白仍然阻止最终的运动,直到射精后。
精子在睾丸中的储存。成年人的两个睾丸每天形成多达1.2亿个精子。这些精子大部分储存在附睾中,尽管少量储存在输精管中。它们可以保持储存状态,同时保持其生育能力,至少一个月。在此期间,它们被导管分泌物中的多种抑制物质保持在深度抑制、不活跃的状态。相反,在高水平的性活动和射精情况下,它们可能只能储存几天。
射精后,精子变得能动并能够使卵子受精,这一过程称为成熟(maturation)。Sertoli细胞和附睾上皮分泌一种特殊的营养液,与精子一起射出。这种液体含有激素(包括睾酮和雌激素)、酶和特殊营养物质,这些对于精子成熟至关重要。
成熟精子的生理学。正常能动、有生育能力的精子能够在液体介质中以1至4毫米/分钟的速度进行鞭毛运动。精子的活动在中性和微碱性介质中大大增强,如射出的精液中存在的情况,但在微酸性介质中大大减弱。强酸性介质可以导致精子的快速死亡。
精子的活动随着温度的升高而显著增加,但代谢率也随之增加,导致精子的寿命大大缩短。虽然精子可以在睾丸的生殖导管中以抑制状态存活数周,但射出精子在女性生殖道中的预期寿命仅为1至2天。
精囊的功能
每个精囊都是一个弯曲的、分叶的管道,内衬有分泌上皮(secretory epithelium),分泌一种含有丰富果糖()、柠檬酸()和其他营养物质()的黏液物质,以及大量的前列腺素()和纤维蛋白原()。在射精(emission and ejaculation)过程中,每个精囊在输精管(vas deferens)排出精子后不久将其内容物排入射精管(ejaculatory duct)。这一行为大大增加了射出精液(semen)的体积,精液中的果糖和其他物质对射出的精子具有重要的营养价值,直到其中一个精子使卵子受精为止。
前列腺素被认为通过两种方式帮助受精(fertilization):(1) 通过与女性宫颈黏液(cervical mucus)反应,使其更易于精子运动;(2) 可能引起子宫和输卵管的逆向蠕动收缩(reverse peristaltic contractions),将射出的精子推向卵巢(少数精子在5分钟内到达输卵管的上端)。
前列腺的功能
前列腺分泌一种稀薄的乳状液体,其中含有钙、柠檬酸、磷酸根(phosphate ion)、一种凝固酶(clotting enzyme)和一种纤维蛋白溶酶原(profibrinolysin)。在射精过程中,前列腺的囊(capsule)与输精管的收缩同时收缩,使得前列腺的稀薄乳状液体进一步增加了精液的体积。前列腺液的微碱性特性可能对卵子的成功受精非常重要,因为输精管中的液体由于柠檬酸和精子代谢终产物的存在而相对酸性,从而有助于抑制精子的生育能力。此外,女性的阴道分泌物也是酸性的(pH值为3.5–4.0)。精子只有在周围液体的pH值上升到约6.0至6.5时才能达到最佳运动状态。因此,前列腺液的微碱性可能在射精过程中帮助中和其他精液的酸性,从而增强精子的运动能力和生育能力。
精液
在男性性行为中射出的精液由来自输精管的液体和精子(约占总量的10%)、来自精囊的液体(几乎占60%)、来自前列腺的液体(约30%)以及少量来自黏液腺(尤其是尿道球腺(bulbourethral glands))的液体组成。因此,精液的大部分是精囊液,它是最后被射出的,用于将精子冲洗出射精管和尿道。
混合精液的平均pH值约为7.5,其中前列腺液的碱性中和了精液其他部分的弱酸性。前列腺液使精液呈现乳白色,而精囊液和黏液腺的分泌物则使精液具有黏液样的稠度。此外,前列腺液中的一种凝固酶使精囊液中的纤维蛋白原形成一种弱纤维蛋白凝块,将精液固定在子宫颈所在的阴道深处。随后,由于前列腺前纤维蛋白溶酶形成的纤维蛋白溶酶的作用,凝块在接下来的15到30分钟内溶解。在射精后的最初几分钟内,精子保持相对不动,可能是由于凝块的黏稠性。随着凝块的溶解,精子同时变得高度活跃。
尽管精子在男性生殖管道中可以存活数周,但一旦它们被射入精液中,在体温下的最长寿命仅为24到48小时。然而,在较低温度下,精液可以保存数周,当冷冻在-100℃_\iota以下时,精子可以保存数年。
精子的“获能”(capacitation)是卵子受精所必需的
尽管精子在离开附睾时被认为是“成熟”的,但它们的活动受到生殖管道上皮分泌的多种抑制因子的抑制。因此,当它们首次被射入精液时,它们无法使卵子受精。然而,当精子接触到女性生殖道的液体时,会发生多种变化,激活精子以完成受精的最终过程。这些集体变化被称为精子的获能(capacitation),通常需要1到10小时。据信会发生以下变化:
- 子宫和输卵管液体洗去了抑制精子活动的各种抑制因子,这些因子在男性生殖管道中抑制了精子的活动。
- 当精子停留在男性生殖管道的液体中时,它们不断暴露于来自生精小管的许多漂浮囊泡,这些囊泡含有大量的胆固醇。这些胆固醇不断添加到覆盖精子顶体(acrosome)的细胞膜上,使该膜变得坚韧并阻止其酶的释放。射精后,沉积在阴道中的精子游离胆固醇囊泡,向上进入子宫腔,并在接下来的几个小时内逐渐失去大部分其他多余的胆固醇。在此过程中,精子头部(顶体)的膜变得脆弱得多。
- 精子的膜对钙离子的通透性也大大增加,因此钙离子现在大量进入精子,改变了鞭毛(flagellum)的活动,使其从之前的微弱波动运动转变为强有力的鞭打运动。此外,钙离子引起覆盖顶体前缘的细胞膜发生变化,使顶体在精子穿透卵子周围的颗粒细胞群时能够快速且容易地释放其酶,尤其是在试图穿透卵子的透明带(zona pellucida)时。
因此,在获能过程中发生了多种变化。没有这些变化,精子无法进入卵子内部以引起受精。
顶体酶、“顶体反应”与卵子穿透
精子顶体中储存有大量的透明质酸酶(hyaluronidase)和蛋白水解酶(proteolytic enzymes)。透明质酸酶能够解聚卵巢颗粒细胞间粘合质中的透明质酸聚合物。蛋白水解酶则能消化仍附着在卵子上的组织细胞结构中的蛋白质。
当卵子从卵巢卵泡排出进入输卵管时,仍携带有数层颗粒细胞。在精子能够使卵子受精之前,必须溶解这些颗粒细胞层,然后穿透卵子的厚覆盖层——透明带(zona pellucida)。为了实现这一穿透,储存在顶体中的酶开始释放。其中透明质酸酶在打开颗粒细胞之间的通路方面尤为重要,使精子能够到达卵子。
当精子到达卵子的透明带时,精子的前膜与透明带中的受体蛋白特异性结合。接着,整个顶体迅速溶解,所有顶体酶释放出来。几分钟内,这些酶为精子头部打开一条穿透通路,使其穿过透明带进入卵子内部。在接下来的30分钟内,精子头部和卵母细胞的细胞膜相互融合,形成一个单一细胞。同时,精子和卵母细胞的遗传物质结合,形成一个全新的细胞基因组,包含来自父母双方等量的染色体和基因。这就是受精过程;随后胚胎开始发育,如第83章所述。
为什么只有一个精子进入卵母细胞?尽管有如此多的精子,为什么只有一个进入卵母细胞?原因尚不完全清楚,但在第一个精子穿透卵子透明带后的几分钟内,钙离子通过卵母细胞膜向内扩散,并导致多个皮质颗粒通过胞吐作用从卵母细胞释放到卵周间隙(perivitelline space)中。这些颗粒含有能够渗透透明带所有部分并阻止其他精子结合的物质,甚至会导致已经开始结合的精子脱落。因此,在受精过程中几乎不会有一个以上的精子进入卵母细胞。
异常精子发生与男性生育能力
睾丸曲细精管上皮可能被多种疾病破坏。例如,由腮腺炎引起的双侧睾丸炎(orchitis)会导致部分受影响的男性不育。此外,一些男性婴儿出生时由于生殖管道的狭窄或其他异常而具有退化的曲细精管上皮。最后,另一个通常为暂时性的不育原因是睾丸温度过高。
温度对精子发生的影响.提高睾丸的温度会阻止精子发生(spermatogenesis),导致除精原细胞(spermatogonia)外的生精小管(seminiferous tubules)中的大多数细胞退化。通常认为,睾丸位于悬垂的阴囊(scrotum)中的原因是为了将这些腺体的温度维持在低于体内温度的水平,尽管通常只比体内温度低约2℃。在寒冷的日子里,阴囊反射会使阴囊的肌肉收缩,将睾丸拉近身体以维持这2℃的温差。因此,阴囊充当了睾丸的冷却机制(但是一种受控的冷却),如果没有这种机制,在炎热的天气中精子发生可能会受到影响。
隐睾症(Cryptorchidism)。隐睾症是指睾丸未能在胎儿出生时或接近出生时从腹部下降到阴囊。在男性胎儿的发育过程中,睾丸起源于腹部的生殖嵴(genital ridges)。然而,通常在婴儿出生前约3周至1个月,睾丸会通过腹股沟管(inguinal canals)下降到阴囊。有时这种下降不会发生或发生不完全,导致一个或两个睾丸留在腹部、腹股沟管或下降路径的其他位置。
终生留在腹腔中的睾丸无法形成精子。生精小管上皮会退化,仅留下睾丸的间质结构。有人认为,腹腔中比阴囊高几度的温度足以导致生精小管上皮的退化,从而导致不育,尽管这种影响尚不确定。然而,出于这个原因,可以在成年性生活开始之前对患有隐睾症的男孩进行手术,将隐睾从腹腔重新定位到阴囊。
胎儿睾丸分泌的睾酮(testosterone)是促使睾丸从腹部下降到阴囊的正常刺激因素。因此,许多(如果不是大多数)隐睾症病例是由无法分泌足够睾酮的异常睾丸引起的。对于这些患者,隐睾症的手术治疗不太可能成功。
精子数量对生育能力的影响。每次性交时射出的精液量平均约为3.5毫升,每毫升精液平均含有约1.2亿个精子,尽管即使在“正常”男性中,这一数量也可能在3500万到2亿之间变化。这意味着每次射出的几毫升精液中通常平均含有约4亿个精子。当每毫升精液中的精子数量低于约2000万时,该人可能会不育。因此,尽管只需要一个精子即可使卵子受精,但由于尚不清楚的原因,射出的精液中通常必须含有大量精子才能确保一个精子成功受精。
精子形态和运动能力对生育能力的影响。有时,男性的精子数量正常,但仍然不育。当这种情况发生时,有时会发现多达一半的精子在形态上异常,例如有两个头、头部形状异常或尾部异常,如图81-5所示。在其他情况下,精子在结构上看起来是正常的,但由于不明原因,它们要么完全不动,要么相对不动。每当大多数精子在形态上异常或不动时,即使其余的精子看起来正常,该人也可能不育。
图81-5 异常不育精子,与右侧的正常精子进行比较。
男性性行为
男性性行为的神经元刺激
启动男性性行为的最重要的感觉神经信号来源是阴茎头(glans penis)。阴茎头包含一个特别敏感的感觉末梢器官系统,它将一种特殊的感觉模式——性感觉(sexual sensation)——传递到中枢神经系统。性交时对阴茎头的滑润按摩动作刺激了这些感觉末梢器官,性信号随后通过阴部神经(pudendal nerve),再通过骶丛(sacral plexus)进入脊髓的骶部(sacral portion),最后沿着脊髓上传到大脑。
冲动也可能从阴茎附近的区域进入脊髓,以帮助刺激性行为。例如,对肛门上皮(anal epithelium)、阴囊(scrotum)和会阴(perineal structures)的刺激可以向脊髓发送信号,增强性感觉。性感觉甚至可以起源于内部结构,例如尿道(urethra)、膀胱(bladder)、前列腺(prostate)、精囊(seminal vesicles)、睾丸(testes)和输精管(vas deferens)的区域。事实上,“性驱力”(sexual drive)的原因之一是性器官被分泌物充满。这些性器官的轻微感染和炎症有时可能会刺激性欲,一些“催情药”(aphrodisiac drugs),如斑蝥素(cantharidin),会刺激膀胱和尿道黏膜,引起炎症和血管充血。
男性性刺激的心理因素。适当的心理刺激可以极大地增强一个人进行性行为的能力。仅仅思考性行为或甚至梦到性交行为就可以启动男性性行为,最终导致射精。事实上,许多男性在性生活的某些阶段,尤其是在青少年时期,会在梦中发生遗精(nocturnal emissions),通常称为“梦遗”(wet dreams)。
男性性行为在脊髓中的整合。尽管心理因素通常在男性性行为中起着重要作用,并且可以启动或抑制它,但大脑功能可能对其执行并非必需。
图81-6 阴茎的勃起组织。
润滑是副交感神经(parasympathetic)的功能。在性刺激期间,副交感神经冲动除了促进勃起外,还会引起尿道腺(urethral glands)和尿道球腺(bulbourethral glands)分泌黏液。这种黏液在性交期间通过尿道流动,以帮助性交时的润滑。然而,性交时的大部分润滑是由女性性器官而非男性器官提供的。如果没有满意的润滑,男性的性行为很少能成功,因为未润滑的性交会引起摩擦和疼痛感,这会抑制而非激发性感觉。
因为适当的生殖器刺激可以在某些动物中引起射精,偶尔在人类中,当他们的脊髓在腰部以上被切断后也会发生。男性的性行为是由骶骨和腰部脊髓中整合的固有反射机制引起的,这些机制可以由大脑的心理刺激或性器官的实际性刺激引发,但通常是两者的结合。
男性性行为的阶段
阴茎勃起——副交感神经的作用。阴茎勃起是男性性刺激的第一个效果,勃起的程度与刺激的程度成正比,无论是心理上的还是身体上的。勃起是由从脊髓骶部通过盆神经传递到阴茎的副交感神经冲动引起的。与大多数其他副交感神经纤维不同,这些副交感神经纤维被认为除了释放乙酰胆碱(acetylcholine)外,还释放一氧化氮(nitric oxide)和/或血管活性肠肽(vasoactive intestinal peptide)。一氧化氮激活酶鸟苷酸环化酶(guanylyl cyclase),导致环磷酸鸟苷(cyclic guanosine monophosphate, GMP)的形成增加。环磷酸鸟苷特别放松了阴茎的动脉和阴茎干中海绵体(corpora cavernosa)和尿道海绵体(corpus spongiosum)的勃起组织中的平滑肌纤维的小梁网状结构(trabecular meshwork),如图81-6所示。随着血管平滑肌的放松,血液流入阴茎增加,导致血管内皮细胞释放一氧化氮,进一步引起血管扩张。
阴茎的勃起组织由大的海绵状窦(cavernous sinusoids)组成,这些窦在正常情况下相对缺乏血液,但当动脉血液在压力下快速流入时,它们会极大地扩张,同时静脉流出部分受阻。此外,勃起体,特别是两个海绵体,被强韧的纤维鞘包围;因此,窦内的高压导致勃起组织膨胀到阴茎变得坚硬和延长的程度,这就是勃起的现象。
排放和射精是交感神经(sympathetic nerves)的功能。排放和射精是男性性行为的高潮。当性刺激变得极其强烈时,脊髓的反射中心开始发出交感神经冲动,这些冲动从T12到L2离开脊髓,通过腹下神经丛(hypogastric plexus)和盆交感神经丛(pelvic sympathetic nerve plexuses)传递到生殖器官,以启动排放,这是射精的前兆。
射精(emission)开始于输精管(vas deferens)和壶腹(ampulla)的收缩,导致精子被排入尿道内(internal urethra)。随后,前列腺(prostate gland)的肌层收缩,接着精囊(seminal vesicles)收缩,将前列腺液和精液也排入尿道,推动精子向前移动。所有这些液体在尿道内与尿道球腺(bulbourethral glands)已经分泌的黏液混合,形成精液(semen)。这一过程称为射精(emission)。
尿道内充满精液会引发感觉信号,这些信号通过阴部神经(pudendal nerves)传递到脊髓的骶部(sacral regions),产生内生殖器官突然充盈的感觉。此外,这些感觉信号进一步激发内生殖器官的节律性收缩,并引起坐骨海绵体肌(ischiocavernosus)和球海绵体肌(bulbocavernosus)的收缩,这些肌肉压迫阴茎勃起组织的基部。这些效应共同导致阴茎勃起组织、生殖管道和尿道内的压力呈节律性波浪状增加,从而将精液从尿道“射出”到体外。这一最终过程称为射精(ejaculation)。同时,骨盆肌肉甚至躯干某些肌肉的节律性收缩导致骨盆和阴茎的推进运动,这也有助于将精液推入阴道的最深处,甚至可能略微进入子宫颈(cervix of the uterus)。
射精和射精的整个过程称为男性性高潮(male orgasm)。在其结束时,男性的性兴奋几乎在1到2分钟内完全消失,勃起停止,这一过程称为消退(resolution)。
睾酮和其他男性性激素
男性性激素的分泌、代谢和化学
睾丸间质细胞(Leydig cells)分泌睾酮(testosterone)。睾丸分泌几种男性性激素,统称为雄激素(androgens),包括睾酮(testosterone)、二氢睾酮(dihydrotestosterone)和雄烯二酮(androstenedione)。睾酮的含量远高于其他激素,因此可以认为它是主要的睾丸激素,尽管大部分睾酮最终在靶组织中转化为活性更强的激素二氢睾酮。
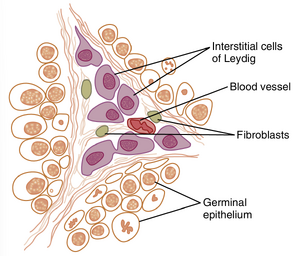
睾酮由位于曲细精管(seminiferous tubules)之间的间质细胞(Leydig cells)形成,这些细胞约占成年睾丸质量的20%,如图81-7所示。在儿童时期,睾丸几乎不分泌睾酮,此时睾丸中的Leydig细胞几乎不存在,但在新生男婴出生后的头几个月和成年男性青春期后,Leydig细胞数量众多;在这两个时期,睾丸分泌大量的睾酮。此外,当Leydig细胞间质细胞发生肿瘤时,会分泌大量的睾酮。当睾丸的生发上皮(germinal epithelium)因X射线治疗或过度加热而被破坏时,Leydig细胞通常继续产生睾酮,因为它们较不容易被破坏。
在成年男性中,肾上腺分泌的雄激素(androgens)总量非常少(<5%),即使在女性中,它们也不会引起显著的男性化特征,除了导致阴毛和腋毛的生长。然而,当肾上腺产生雄激素的细胞发生肿瘤时,雄激素的量可能变得足够大,以至于即使在女性中也会引起所有常见的男性第二性征。这些效应将在第78章中与肾上腺生殖综合征(adrenogenital syndrome)一起讨论。
极少情况下,卵巢中的胚胎嵴细胞(embryonic crest cells)可能发展成一种肿瘤,导致女性体内产生过量的雄激素;其中一种肿瘤是男性母细胞瘤(arrhenoblastoma)。正常卵巢也会产生微量的雄激素,但它们并不显著。
体内其他部位的雄激素分泌。术语“雄激素”指的是任何具有男性化效应的类固醇激素(steroid hormone),包括睾酮(testosterone);它还包括除睾丸外体内其他部位产生的男性性激素。例如,肾上腺至少分泌五种雄激素,尽管所有这些雄激素的总男性化活性通常非常微弱(<5%)。
雄激素是类固醇。所有雄激素都是类固醇化合物(steroid compounds),如图81-8中所示的睾酮和二氢睾酮(dihydrotestosterone)的分子式所示。无论是在睾丸还是肾上腺中,雄激素都可以从胆固醇(cholesterol)或直接从乙酰辅酶A(acetyl coenzyme A)合成。
睾酮的代谢。睾丸分泌后,大约97%的睾酮要么与血浆白蛋白(plasma albumin)松散结合,要么与一种称为性激素结合球蛋白(sex hormone–binding globulin)的β球蛋白更紧密地结合,并在这些状态下在血液中循环30分钟到数小时。到那时,睾酮要么转移到组织中,要么被降解为无活性的产物,随后被排出体外。
许多固定在组织中的睾酮在组织细胞内转化为二氢睾酮,特别是在某些靶器官中,如成人的前列腺(prostate gland)和男性胎儿的外生殖器(external genitalia)。睾酮的某些作用(但不是全部)依赖于这种转化。细胞内功能将在本章后面讨论。
睾酮的降解和排泄。未固定在组织中的睾酮迅速被肝脏转化为雄酮(androsterone)和脱氢表雄酮(dehydroepiandrosterone),并同时与葡萄糖醛酸(glucuronides)或硫酸盐(sulfates)结合(特别是葡萄糖醛酸)。这些物质要么通过肝脏胆汁排入肠道,要么通过肾脏排入尿液。
男性中雌激素的产生。除了睾酮外,男性体内也会形成少量的雌激素(estrogens)(约为非妊娠女性量的五分之一),并且可以从男性的尿液中回收相当数量的雌激素。
图81-8 睾酮和二氢睾酮。
男性中雌激素的确切来源尚不清楚,但已知以下信息:
- 精曲小管(seminiferous tubules)液体中的雌激素(estrogen)浓度相当高,可能在精子发生(spermiogenesis)中起重要作用。据信,这种雌激素是由Sertoli细胞通过将睾酮(testosterone)转化为雌二醇(estradiol)而形成的。
- 在身体的其他组织,尤其是肝脏中,由睾酮和雄烷二醇(androstanediol)形成的雌激素量要大得多,可能占男性总雌激素产量的80%。
睾酮的功能
总的来说,睾酮负责男性身体的显著特征。即使在胎儿期,睾丸也会受到胎盘绒毛膜促性腺激素(chorionic gonadotropin)的刺激,在整个胎儿发育期间和出生后10周或更长时间内产生适量的睾酮;此后,在10至13岁之前的儿童期基本上不产生睾酮。然后在青春期开始时,在前叶垂体促性腺激素(anterior pituitary gonadotropic hormones)的刺激下,睾酮的产量迅速增加,并持续到生命的大部分剩余时间,如图81-9所示,在50至60岁之后有所下降。然而,一些研究表明,大多数健康男性随着年龄的增长,血浆睾酮水平可能保持在正常范围内;只有约10%至20%的60岁以上男性和50%的80岁以上男性的睾酮水平“低”于3ng/ml(通常在临床上表示为<300ng/dl或<10.4nmol/L)。近年来,已经明确,睾酮的晚期减少与代谢紊乱(如肥胖和2型糖尿病)之间存在明显关联。
胎儿发育期间睾酮的功能
睾酮在胚胎生命的第七周左右开始由男性胎儿睾丸产生。事实上,女性和男性性染色体之间的主要功能差异之一是男性染色体具有性别决定区域Y(SRY)基因,该基因编码一种称为睾丸决定因子(也称为SRY蛋白)的蛋白质。SRY蛋白启动一系列基因激活,导致生殖嵴细胞分化为最终成为睾丸并分泌睾酮的细胞,而女性染色体则导致该嵴分化为分泌雌激素的细胞。
向怀孕动物注射大量雄性激素会导致雄性性器官的发育,即使胎儿是雌性。同样,早期切除男性胎儿的睾丸会导致雌性性器官的发育。
因此,胎儿睾丸分泌的睾酮负责男性身体特征的发育,包括阴茎和阴囊的形成,而不是阴蒂和阴道的形成。它还导致前列腺、精囊和男性生殖管道的形成,同时抑制女性生殖器官的形成。
睾酮(Testosterone)对睾丸下降的影响。睾丸通常在妊娠的最后2到3个月内下降到阴囊(scrotum),此时睾丸开始分泌适量的睾酮。如果一名男婴出生时睾丸未下降但其他方面正常,只要腹股沟管(inguinal canals)足够大以允许睾丸通过,给予睾酮通常会使睾丸以正常方式下降。
图81-9 不同年龄段的男性性功能不同阶段,通过平均血浆睾酮浓度(红线)和精子产量(蓝线)反映。(修改自Griffin JF, Wilson JD: The testis. In: Bondy PK, Rosenberg LE [eds]: Metabolic Control and Disease, 8th ed. Philadelphia: WB Saunders, 1980.)
给予促性腺激素(gonadotropic hormones),刺激新生儿睾丸的Leydig细胞产生睾酮,也可以使睾丸下降。因此,睾丸下降的刺激因素是睾酮,这再次表明睾酮是胎儿期男性性发育的重要激素。
睾酮对成年期第一性征和第二性征发育的影响
青春期后,睾酮分泌量的增加导致阴茎、阴囊和睾丸在20岁前增大约八倍。此外,睾酮导致男性的第二性征(secondary sexual characteristics)发育,从青春期开始到成熟期结束。这些第二性征,除了性器官外,还使男性与女性区分如下。
对体毛分布的影响。睾酮导致毛发在以下部位生长:(1) 阴部,(2) 沿腹白线(linea alba)向上,有时到脐部及以上,(3) 面部,(4) 通常在胸部,(5) 较少在其他身体部位,如背部。它还使身体其他部位的毛发变得更加浓密。
男性型秃发(Male Pattern Baldness)。睾酮减少头顶毛发的生长;没有功能性睾丸的男性不会秃发。然而,许多有男性气概的男性从未秃发,因为秃发是两个因素的结果:首先,秃发发展的遗传背景,其次,叠加在这种遗传背景上的大量雄激素(androgenic hormones)。当一位具有适当遗传背景的女性发展出长期持续的雄激素肿瘤时,她会像男性一样秃发。
对声音的影响。由睾丸分泌或注射到体内的睾酮会导致喉黏膜(laryngeal mucosa)肥大和喉部(larynx)增大。这些影响最初会导致相对不和谐的“变声”声音,逐渐转变为典型的成年男性声音。
睾酮(Testosterone)增加皮肤厚度并可能导致痤疮(Acne)的发生。睾酮会增加全身皮肤的厚度和皮下组织的粗糙度。睾酮还会增加身体某些或所有皮脂腺(Sebaceous Glands)的分泌速率。尤其是面部皮脂腺的过度分泌,可能导致痤疮。因此,痤疮是男性青春期最常见的特征之一,此时身体首次接触到增加的睾酮。在几年的睾酮分泌后,皮肤通常会以某种方式适应睾酮,从而克服痤疮。
睾酮增加蛋白质形成和肌肉发育。最重要的男性特征之一是青春期后肌肉组织的发育,平均比女性增加约50%的肌肉质量。这种肌肉质量的增加也与身体非肌肉部分蛋白质的增加有关。皮肤的许多变化是由于蛋白质在皮肤中的沉积,而声音的变化也部分是由于睾酮的这种蛋白质合成代谢功能。
由于睾酮和其他雄激素(Androgens)对身体肌肉组织的巨大影响,合成雄激素被运动员广泛用于提高肌肉表现。这种做法应受到严厉谴责,因为过量雄激素的长期有害影响,如第85章关于运动生理学的讨论所述。睾酮或合成雄激素偶尔也会在老年时作为"青春激素"使用,以提高肌肉力量和活力,但效果存疑。一些研究表明,老年男性的睾酮替代疗法可能会增加不良心血管事件的风险。
睾酮增加骨基质(Bone Matrix)并导致钙保留。在青春期循环睾酮大幅增加(或长期注射睾酮)后,骨骼会显著增厚并沉积大量额外的钙盐。因此,睾酮增加了骨基质的总量并导致钙保留。骨基质的增加被认为是由于睾酮的一般蛋白质合成代谢功能加上对增加的蛋白质的响应而沉积的钙盐。
睾酮对骨盆有特定作用:(1) 使骨盆出口变窄,(2) 使其变长,(3) 导致漏斗状形状而不是女性骨盆的宽椭圆形,(4) 大大增加整个骨盆的承重强度。在没有睾酮的情况下,男性骨盆会发育成类似于女性骨盆的骨盆。
由于睾酮能够增加骨骼的大小和强度,有时会用于老年男性治疗骨质疏松症(Osteoporosis)。
当大量睾酮(testosterone)(或任何其他雄激素(androgen))在仍在生长的儿童中异常分泌时,骨骼生长速度显著增加,导致整体身高迅速增长。然而,睾酮还会导致长骨的骨骺(epiphyses)在较早的年龄与骨干(shafts)融合。因此,尽管生长速度很快,这种骨骺的早期融合会阻止个体达到如果没有分泌睾酮时可能达到的身高。即使在正常男性中,最终的成年身高也略低于在青春期前被阉割的男性。
睾酮增加基础代谢率。注射大量睾酮可以使基础代谢率(basal metabolic rate)增加多达15%。此外,即使在青春期和成年早期由睾丸分泌的正常量睾酮,也会使代谢率增加约5%至10%,高于睾丸不活跃时的水平。这种代谢率的增加可能是睾酮对蛋白质合成代谢(protein anabolism)影响的间接结果,蛋白质数量的增加——尤其是酶——增加了所有细胞的活性。
睾酮增加红细胞数量。当向被阉割的成年个体注射正常量的睾酮时,每立方毫米血液中的红细胞数量增加15%至20%。此外,平均男性每立方毫米血液中的红细胞数量比平均女性多约700,000个。尽管睾酮与血细胞比容(hematocrit)的增加有很强的关联,但睾酮似乎并不直接增加促红细胞生成素(erythropoietin)水平或对红细胞生成有直接影响。睾酮增加红细胞生成的作用可能至少部分是间接的,因为睾酮给药后代谢率增加。
对电解质和水平衡的影响。正如第78章所指出的,许多类固醇激素(steroid hormones)可以增加肾脏远曲小管(distal tubules)对钠的重吸收。睾酮也有这种作用,但与肾上腺盐皮质激素(adrenal mineralocorticoids)相比,其作用较小。然而,青春期后,男性血液和细胞外液(extracellular fluid)体积相对于体重的增加可达5%至10%。
睾酮作用的基本细胞内机制
睾酮的大部分作用基本上是由于靶细胞(target cells)中蛋白质形成速率的增加。例如,在前列腺(prostate gland)中,睾酮在分泌后几分钟内进入前列腺细胞。然后,在细胞内酶5α-还原酶(5α-reductase)的作用下,睾酮通常被转化为二氢睾酮(dihydrotestosterone),后者与细胞质中的“受体蛋白(receptor protein)”结合。这种结合物迁移到细胞核,与核蛋白结合并诱导DNA-RNA转录。在30分钟内,RNA聚合酶(RNA polymerase)被激活,前列腺细胞中RNA的浓度开始增加,随后细胞蛋白质逐渐增加。几天后,前列腺中的DNA数量也增加,同时前列腺细胞的数量也增加。
一些研究表明,睾酮(testosterone)与其他类固醇激素(steroidal hormones)一样,可能也会发挥一些快速的、非基因组(nongenomic)效应,这些效应不需要新蛋白质的合成。然而,睾酮的这些非基因组作用的生理角色仍有待确定。
下丘脑和垂体前叶激素对男性性功能的控制
男性和女性性功能的主要控制始于下丘脑分泌的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)(图81-10)。这种激素刺激垂体前叶分泌另外两种称为促性腺激素(gonadotropic hormones)的激素:(1) 黄体生成素(luteinizing hormone, LH) 和 (2) 卵泡刺激素(follicle-stimulating hormone, FSH)。反过来,LH是睾丸(testes)分泌睾酮的主要刺激因素,而FSH主要刺激精子生成(spermatogenesis)。
睾酮几乎在全身各处刺激蛋白质的产生,尽管它更具体地影响“靶”器官或组织中的蛋白质,这些器官或组织负责男性第一性和第二性征的发育。
促性腺激素释放激素增加黄体生成素和卵泡刺激素的分泌
GnRH是一种由神经元分泌的10个氨基酸的肽(peptide),这些神经元的细胞体位于下丘脑的弓状核(arcuate nuclei)。这些神经元的末梢主要终止于下丘脑的正中隆起(median eminence),在那里它们将GnRH释放到下丘脑-垂体门脉系统(hypothalamic-hypophysial portal vascular system)中。GnRH随后通过垂体门脉血液被运输到垂体前叶,并刺激两种促性腺激素LH和FSH的释放。
GnRH以间歇性方式分泌,每次持续几分钟,每隔1到3小时一次。这种激素的刺激强度由两种方式决定:(1) 这些分泌周期的频率和 (2) 每个周期释放的GnRH的量。
垂体前叶分泌的LH也是周期性的,LH相当忠实地跟随GnRH的脉冲式释放。相比之下,FSH的分泌随着GnRH分泌的每次波动仅略有增减;相反,它会在数小时内对GnRH的长期变化做出更缓慢的反应。由于GnRH分泌与LH分泌之间的密切关系,GnRH也被广泛称为LH释放激素(LH-releasing hormone)。
促性腺激素:黄体生成素和卵泡刺激素
两种促性腺激素LH和FSH都由垂体前叶中称为促性腺细胞(gonadotropes)的相同细胞分泌。在下丘脑不分泌GnRH的情况下,垂体中的促性腺细胞几乎不分泌LH或FSH。
图81-10 男性下丘脑-垂体-睾丸轴的反馈调节。刺激效应用加号表示,负反馈抑制效应用减号表示。CNS,中枢神经系统(central nervous system);FSH,卵泡刺激素;GnRH,促性腺激素释放激素;LH,黄体生成素。
LH和FSH是糖蛋白(glycoproteins)。它们主要通过激活环磷酸腺苷(cyclic adenosine monophosphate, cAMP)第二信使系统在睾丸中的靶组织上发挥作用,进而激活相应靶细胞中的特定酶系统。
促黄体生成素(LH)对睾酮(testosterone)分泌的调节
睾酮由睾丸中的Leydig细胞(间质细胞)分泌,但只有在受到来自垂体前叶的LH刺激时才会分泌。此外,睾酮的分泌量与可利用的LH量大致成正比。
成熟的Leydig细胞通常在婴儿出生后的几周内存在于睾丸中,但随后会消失,直到大约10岁以后才会再次出现。然而,在任何年龄给儿童注射纯化的LH,或在青春期分泌LH,都会使看起来像成纤维细胞的睾丸间质细胞演变为有功能的Leydig细胞。
睾酮对垂体前叶分泌促黄体生成素(LH)和促卵泡激素(FSH)的抑制——睾酮分泌的负反馈调节
睾丸在LH作用下分泌的睾酮具有抑制垂体前叶分泌LH的相反作用(见图81-10)。这种抑制作用大多可能是由于睾酮直接作用于下丘脑,减少了促性腺激素释放激素(GnRH)的分泌。这种作用反过来又导致垂体前叶LH和FSH分泌的相应减少,而LH的减少又降低了睾丸分泌睾酮。因此,每当睾酮分泌过多时,这种通过下丘脑和垂体前叶起作用的自动负反馈效应就会将睾酮分泌降低到所需的操作水平。相反,睾酮过少会使下丘脑分泌大量GnRH,垂体前叶LH和FSH分泌相应增加,从而导致睾丸睾酮分泌增加。
促卵泡激素(FSH)和睾酮对精子发生(spermatogenesis)的调节
FSH与附着在曲细精管中Sertoli细胞上的特定FSH受体结合,导致Sertoli细胞生长并分泌各种生精物质。同时,从间质中的Leydig细胞扩散到曲细精管中的睾酮(和二氢睾酮)对精子发生也有很强的营养作用。因此,FSH和睾酮都是启动精子发生所必需的。
抑制素(inhibin)在曲细精管活动负反馈调节中的作用
当曲细精管不能产生精子时,垂体前叶分泌的FSH显著增加。相反,当精子发生进行得太快时,垂体分泌的FSH就会减少。这种对垂体前叶的负反馈效应的原因被认为是Sertoli细胞分泌的另一种激素,称为抑制素(见图81-10)。这种激素对垂体前叶有很强的直接抑制作用,可抑制FSH的分泌。
抑制素是一种糖蛋白,与LH和FSH类似,分子量在10,000到30,000之间。它已经从培养的Sertoli细胞中分离出来。它对垂体前叶的强效抑制作用为精子发生的控制提供了一个重要的负反馈机制,与睾酮分泌控制的负反馈机制同时并行运作。
妊娠期间胎盘分泌的人绒毛膜促性腺激素(hCG)刺激胎儿睾丸分泌睾酮
在怀孕期间,胎盘分泌的激素人绒毛膜促性腺激素(human chorionic gonadotropin, hCG)在母体和胎儿体内循环。这种激素对性器官的作用几乎与黄体生成素(luteinizing hormone, LH)相同。
在怀孕期间,如果胎儿是男性,胎盘分泌的hCG会促使胎儿的睾丸分泌睾酮(testosterone)。正如前面所指出的,这种睾酮对于促进男性性器官的形成至关重要。我们将在第83章更详细地讨论hCG及其在怀孕期间的功能。
青春期及其开始的调控
青春期开始的启动长期以来一直是个谜,但现在已确定在儿童时期,下丘脑不会分泌大量的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)。其中一个原因是,在儿童时期,任何性类固醇激素(sex steroid hormones)的轻微分泌都会对下丘脑分泌GnRH产生强烈的抑制作用。然而,由于尚未完全理解的原因,在青春期时,下丘脑GnRH的分泌突破了儿童时期的抑制,成年性生活开始。
男性成年生活与男性更年期。青春期后,男性垂体(pituitary gland)在余生中都会产生促性腺激素(gonadotropic hormones),并且至少有一些精子发生(spermatogenesis)通常会持续到死亡。然而,许多男性在50多岁或60多岁时开始表现出性功能缓慢下降,特别是如果他们吸烟或肥胖并伴有相关的心血管和代谢紊乱,如高血压(hypertension)、动脉粥样硬化和2型糖尿病(type 2 diabetes mellitus)。性功能下降的程度有很大的差异,健康的男性可以保持生育能力直到80多岁和90多岁。
性功能的缓慢逐渐下降也部分与睾酮分泌的减少有关,如图81-9所示。男性性功能的下降被称为男性更年期(male climacteric)。
男性性功能异常
前列腺及其异常
前列腺(prostate gland)在整个儿童时期保持相对较小,并在青春期在睾酮的刺激下开始生长。这个腺体在20岁时达到几乎固定的尺寸,并保持这个尺寸直到大约50岁。那时,在一些男性中,随着睾丸睾酮分泌的减少,它开始退化。
良性前列腺纤维腺瘤(benign prostatic fibroadenoma)经常在许多老年男性的前列腺中发展,并可能导致尿路梗阻。这种肥大不是由睾酮引起的,而是由前列腺组织的异常过度生长引起的。
前列腺癌(prostate cancer)是另一个问题,约占所有男性死亡的2%至3%。一旦发生前列腺癌,癌细胞通常会被睾酮刺激以更快的速度生长,并通过切除两个睾丸来抑制,这样就不能形成睾酮。前列腺癌通常可以通过给予雌激素(estrogens)来抑制。即使是一些已经转移到几乎所有身体骨骼的前列腺癌患者,也可以通过切除睾丸、雌激素治疗或两者结合成功治疗几个月到几年;在开始这种治疗后,转移灶通常会缩小,骨骼部分愈合。这种治疗并不能阻止癌症,但可以减缓它,有时可以大大减轻严重的骨痛。
男性性腺功能减退症
男性性腺功能减退症(hypogonadism)是指睾丸功能减退,导致睾酮分泌不足和/或精子生成减少。这可能是由于睾丸本身的疾病(原发性性腺功能减退症)或下丘脑-垂体轴(hypothalamic-pituitary axis)的异常(继发性性腺功能减退症)引起的。性腺功能减退症的症状可能包括性欲减退、勃起功能障碍、肌肉质量减少、体毛减少和不育。治疗通常涉及睾酮替代疗法(testosterone replacement therapy)以缓解症状并改善生活质量。
当男性胎儿的睾丸在胎儿期无功能时,胎儿的男性性征不会发育。相反,会形成女性器官。这是因为胎儿的基本遗传特征,无论是男性还是女性,都是在没有性激素的情况下形成女性性器官。然而,在睾酮存在的情况下,女性性器官的形成被抑制,而男性器官则被诱导形成。
如果男孩在青春期前失去睾丸,将会出现阉割状态(eunuchism),其性器官和其他性征将终生保持婴儿状态。成年阉人的身高略高于正常男性,因为骨骺愈合较慢,尽管骨骼较薄且肌肉明显比正常男性弱。声音像儿童一样,头部不会脱发,面部和其他部位的成年男性毛发分布也不会出现。
如果男性在青春期后被阉割,其部分男性第二性征会恢复到儿童状态,而其他特征则保持成年男性特征。性器官的尺寸会略有缩小,但不会恢复到儿童状态,声音的低音特征也只会略有减弱。然而,男性毛发的生长会减少,厚实的男性骨骼会消失,强壮的男性肌肉也会减少。
此外,在成年男性阉割后,性欲会降低但不会完全消失,前提是之前有过性活动。勃起仍然可以像以前一样发生,尽管较为困难,但射精很少发生,主要是因为精液生成器官退化,并且缺乏睾酮驱动的心理欲望。
某些性腺功能减退症(hypogonadism)的病例是由于下丘脑无法分泌正常量的促性腺激素释放激素(GnRH)的遗传缺陷引起的。这种情况通常与下丘脑摄食中枢的异常同时发生,导致患者过度进食。因此,肥胖与阉割状态同时出现。图81-11展示了一名患有这种病症的患者;这种病症被称为肥胖生殖无能综合征(adiposogenital syndrome)、Fröhlich综合征或下丘脑性阉割症(hypothalamic eunuchism)。
图81-11 一名青春期男性的肥胖生殖无能综合征。注意肥胖和儿童般的性器官。(由Leonard Posey博士提供)
男性睾丸肿瘤和性腺功能亢进
在极少数情况下,睾丸中会发展出间质Leydig细胞肿瘤(interstitial Leydig cell tumors)。这些肿瘤有时会产生高达正常量100倍的睾酮。当这些肿瘤在儿童中发展时,会导致肌肉和骨骼的快速生长,但也会导致骨骺过早愈合,因此最终的成年身高实际上比正常情况下要低得多。这种间质细胞肿瘤还会导致男性性器官、所有骨骼肌和其他男性性征的过度发育。在成年男性中,小的间质细胞肿瘤很难诊断,因为男性特征已经存在。
比间质Leydig细胞肿瘤更常见的是生殖上皮( germinal epithelium )的肿瘤。由于生殖细胞( germinal cells )能够分化为几乎任何类型的细胞,许多这类肿瘤包含多种组织,如胎盘组织、毛发、牙齿、骨骼、皮肤等,所有这些组织都聚集在同一个肿瘤块中,称为畸胎瘤( teratoma )。这些肿瘤通常分泌很少的激素,但如果肿瘤中发育出大量的胎盘组织,它可能会分泌大量的hCG,其功能类似于LH。此外,这些肿瘤有时会分泌雌激素( estrogenic hormones ),导致称为男性乳房发育症( gynecomastia )的情况(乳房过度生长)。
男性勃起功能障碍( Erectile Dysfunction )
勃起功能障碍( erectile dysfunction ),也称为“阳痿( impotence )”,其特征是男性无法形成或维持足够硬度的勃起以进行满意的性交。神经系统问题,如前列腺手术导致的副交感神经( parasympathetic nerves )损伤、睾酮( testosterone )水平不足以及某些药物(如尼古丁、酒精和抗抑郁药)也可能导致勃起功能障碍。
在40岁以上的男性中,勃起功能障碍最常见的原因是潜在的血管疾病( vascular disease )。如前所述,充足的血流和一氧化氮( nitric oxide )的形成对于阴茎勃起至关重要。血管疾病可能由未控制的高血压、糖尿病和动脉粥样硬化( atherosclerosis )引起,它会降低身体血管(包括阴茎中的血管)扩张的能力。这种血管扩张功能受损的部分原因是由于一氧化氮释放减少。
由血管疾病引起的勃起功能障碍通常可以通过磷酸二酯酶-5( phosphodiesterase-5, PDE5 )抑制剂(如西地那非( sildenafil, Viagra )、伐地那非( vardenafil, Levitra )或他达拉非( tadalafil, Cialis ))成功治疗。这些药物通过抑制磷酸二酯酶-5(一种迅速降解环磷酸鸟苷( cyclic GMP )的酶)来增加勃起组织中的环磷酸鸟苷水平。因此,通过抑制环磷酸鸟苷的降解,PDE-5抑制剂增强并延长了环磷酸鸟苷的作用,从而引起勃起。
松果体( Pineal Gland )在控制某些动物季节性生育中的作用
自从松果体被发现以来,人们赋予了它无数的功能,包括(1)增强性功能,(2)抵御感染,(3)促进睡眠,(4)改善情绪,以及(5)延长寿命(多达10%至25%)。从比较解剖学( comparative anatomy )中得知,松果体是一些低等动物头部后方高处的第三只眼的退化残余。许多生理学家认为这个腺体是一个无功能的残余物,但其他人多年来一直声称它在控制性活动和生殖中起着重要作用。
经过多年的研究,现在似乎松果体确实在性和生殖功能中起着调节作用。在某些季节生育幼崽的动物中,如果松果体被移除或通向松果体的神经回路被切断,正常的季节性生育期就会消失。对这些动物来说,这种季节性生育很重要,因为它使幼崽在一年中的某个时间(通常是春季或初夏)出生,此时生存的可能性最大。这种效应的机制尚不完全清楚,但似乎是以下情况。
首先,松果体(pineal gland)受每天眼睛接收到的光照量或“光照时间模式”控制。例如,在hamster中,每天超过13小时的黑暗会激活松果体,而少于这个时间的黑暗则无法激活它,激活与非激活之间存在一个关键的平衡。神经通路涉及光信号从眼睛传递到下丘脑的视交叉上核(suprachiasmal nucleus),然后传递到松果体,激活松果体的分泌。
其次,松果体分泌褪黑激素(melatonin)和其他几种类似物质。据信,褪黑激素或其他类似物质之一通过血液或第三脑室的液体传递到垂体前叶,从而减少促性腺激素(gonadotropic hormone)的分泌。
因此,在松果体分泌存在的情况下,某些动物物种的促性腺激素分泌受到抑制,性腺(gonads)被抑制甚至部分退化,这可能是冬季早期黑暗增加时发生的情况。然而,在大约4个月的功能障碍后,促性腺激素分泌突破了松果体的抑制作用,性腺再次变得功能正常,准备迎接春季的全面活动。
松果体在人类生殖控制中是否具有类似的功能?这个问题的答案尚不清楚。然而,松果体区域有时会发生肿瘤。其中一些肿瘤分泌过量的松果体激素,而另一些则是周围组织的肿瘤,压迫松果体并破坏它。这两种类型的肿瘤通常与性腺功能减退(hypogonadal)或性腺功能亢进(hypergonadal)有关,因此松果体可能在控制人类的性欲和生殖方面至少起到了一定的作用。
孕前女性生理学和女性激素
女性生殖功能可以分为两个主要阶段:(1) 女性身体为受孕和怀孕做准备,以及 (2) 怀孕期本身。本章关注的是女性身体为怀孕所做的准备,而第83章将介绍怀孕和分娩的生理学。
女性性器官的生理解剖
图82-1和图82-2展示了人类女性生殖道的主要器官,包括卵巢、输卵管(也称为子宫管)、子宫和阴道。生殖始于卵巢中卵子的发育。在每个月的性周期中期,一个卵子从卵巢的卵泡中排出,进入腹腔,靠近两条输卵管的开放伞端。然后,这个卵子通过其中一条输卵管进入子宫;如果它被精子受精,它会在子宫内着床,并发育成胎儿、胎盘和胎膜——最终发育成婴儿。
卵巢中的卵子发生和卵泡发育
一个发育中的卵子(卵母细胞)通过一系列称为卵子发生(oogenesis)的步骤分化为成熟的卵子(卵子)(图82-3)。在早期胚胎发育过程中,来自卵黄囊背侧内胚层的原始生殖细胞沿着后肠的肠系膜迁移到卵巢的外表面,卵巢表面覆盖着一层生殖上皮,胚胎学上来源于生殖嵴的上皮。在此迁移过程中,生殖细胞反复分裂。一旦这些原始生殖细胞到达生殖上皮,它们就会迁移到卵巢皮质的实质中,并成为卵原细胞或原始卵子。
每个原始卵子随后在其周围聚集一层来自卵巢基质(卵巢的支持组织)的梭形细胞,并使它们呈现出上皮样特征;这些上皮样细胞随后被称为颗粒细胞。被单层颗粒细胞包围的卵子被称为原始卵泡。在这个阶段,卵子仍然不成熟,被称为初级卵母细胞,需要再进行两次细胞分裂才能被精子受精。
胚胎卵巢中的卵原细胞完成有丝分裂复制,减数分裂的第一阶段在胎儿发育的第五个月开始。随后,生殖细胞的有丝分裂停止,不再形成额外的卵母细胞。出生时,卵巢中大约含有100万到200万个初级卵母细胞。
减数分裂(meiosis)的第一阶段在胎儿发育期间开始,但在前期I(prophase I)的晚期停滞,直到青春期才恢复。女性的青春期通常发生在10至14岁之间。卵母细胞(oocyte)的第一次减数分裂在青春期后完成。每个卵母细胞分裂成两个细胞,一个大的卵子(secondary oocyte)和一个小的第一极体(first polar body)。这些细胞中的每一个都含有23对重复的染色体。第一极体可能会或不会进行第二次减数分裂,然后解体。卵子进行第二次减数分裂,在姐妹染色单体(sister chromatids)分离后,减数分裂暂停。如果卵子受精,减数分裂的最后一步发生,卵子中的姐妹染色单体会分配到不同的细胞中。
当卵巢释放卵子(排卵, ovulation)时,如果卵子受精,最终的减数分裂发生。一半的姐妹染色单体留在受精卵中,另一半在第二极体中释放,然后解体。
在青春期,卵巢中只剩下大约30万个卵母细胞,其中只有一小部分会成熟。成千上万未成熟的卵母细胞会退化。在成年生活的所有生殖年中,平均大约在13至46岁之间,只有400到500个原始卵泡(primordial follicles)发育到足以每月排出一个卵子;其余的退化(即闭锁, atretic)。在生殖能力结束时(绝经期, menopause),卵巢中只剩下少数原始卵泡,甚至这些卵泡也会很快退化。
女性激素系统
女性激素系统,与男性激素系统一样,由三个层次的激素组成,如下:
- 下丘脑释放激素(hypothalamic releasing hormone),称为促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)
- 前垂体性激素(anterior pituitary sex hormones),促卵泡激素(follicle-stimulating hormone, FSH)和黄体生成素(luteinizing hormone, LH),两者都是在GnRH从下丘脑释放后分泌的
- 卵巢激素(ovarian hormones),雌激素(estrogen)和孕激素(progesterone),它们是由卵巢在前垂体的两种女性性激素的作用下分泌的
这些不同的激素在女性每月性周期的不同阶段以显著不同的速率分泌。图82-4显示了前垂体促性腺激素FSH和LH(底部两条曲线)以及卵巢激素雌二醇(estradiol, 雌激素)和孕激素(顶部两条曲线)的近似变化浓度。
在每月性周期中,从下丘脑释放的GnRH的量增加和减少的幅度要小得多。它以短脉冲形式分泌,平均每90分钟一次,与男性相同。
每月卵巢周期和促性腺激素的功能
女性的正常生殖年以女性激素分泌速率的每月节律性变化以及卵巢和其他性器官的相应物理变化为特征。这种节律模式称为女性每月性周期(或不太准确的月经周期, menstrual cycle)。周期的持续时间平均为28天。在某些女性中,周期可能短至20天或长达45天,尽管异常的周期长度通常与生育能力下降有关。
女性性周期有两个重要的结果。首先,通常每个月只有一个卵子从卵巢中释放出来,因此通常一次只会有一个胎儿开始生长。其次,子宫内膜会在每月的特定时间提前准备好,以便受精卵着床。
促性腺激素及其对卵巢的影响
图82-1. 女性生殖器官。
性周期期间卵巢的变化完全依赖于由垂体前叶分泌的促性腺激素FSH(促卵泡激素)和LH(黄体生成素)。FSH和LH都是分子量约为30,000的小糖蛋白。在没有这些激素的情况下,卵巢保持不活跃状态,这在儿童期是常态,因为此时几乎不分泌垂体促性腺激素。在9到12岁时,垂体开始逐渐分泌更多的FSH和LH,这导致了正常的每月性周期的开始,通常在11到15岁之间。这个变化的时期被称为青春期,第一次月经周期的时间被称为初潮。在女性性周期的每个月,FSH和LH都会出现周期性的增加和减少,如图82-4底部所示。这些周期性变化导致了卵巢的周期性变化,这将在接下来的部分中解释。
图82-2. 子宫、卵巢和输卵管内部结构。
图82-3. 卵子发生和卵泡发育。
图82-4. 正常女性性周期期间促性腺激素和卵巢激素的近似血浆浓度。FSH,促卵泡激素;LH,黄体生成素。
FSH和LH通过与卵巢靶细胞膜上高度特异性的FSH和LH受体结合来刺激它们的卵巢靶细胞。反过来,激活的受体增加了细胞的分泌速率,通常也促进了细胞的生长和增殖。几乎所有这些刺激效应都是由于细胞质中环磷酸腺苷第二信使系统的激活,这导致了蛋白激酶的形成和关键酶的多次磷酸化,从而刺激性激素的合成,如第75章所述。
卵泡生长——卵巢周期的卵泡期
图82-5展示了卵巢中卵泡生长的渐进阶段。当女婴出生时,每个卵母细胞被一层颗粒细胞(granulosa cells)包围;这种带有颗粒细胞鞘的卵母细胞被称为原始卵泡(primordial follicle),如图所示。在整个童年时期,颗粒细胞被认为为卵母细胞提供营养,并分泌一种卵母细胞成熟抑制因子(oocyte maturation inhibiting factor),使卵母细胞停留在减数分裂前期(prophase stage)的原始状态。然后,在青春期后,当来自垂体前叶的FSH和LH开始大量分泌时,卵巢(以及其中的一些卵泡)开始生长。
图82-5. 卵巢中卵泡生长的阶段,同时展示了黄体(corpus luteum)的形成。
卵泡生长的第一阶段是卵母细胞的适度增大,其直径增加了2到3倍。随后,一些卵泡中的颗粒细胞层进一步生长。这些卵泡被称为初级卵泡(primary follicles)。
窦状卵泡和囊状卵泡的发育。在每个女性月经周期的前几天,垂体前叶分泌的FSH和LH浓度略有增加,FSH的增加略大于LH,并且比LH提前几天。这些激素,尤其是FSH,导致每个月6到12个初级卵泡加速生长。最初的效果是颗粒细胞的快速增殖,形成更多的颗粒细胞层。此外,来自卵巢间质(ovary interstitium)的梭形细胞在颗粒细胞外聚集,形成第二层细胞,称为卵泡膜(theca)。卵泡膜分为两层。在卵泡内膜(theca interna)中,细胞呈现出与颗粒细胞相似的上皮样特征,并发展出分泌额外类固醇性激素(estrogen and progesterone)的能力。外层,即卵泡外膜(theca externa),发展成一个高度血管化的结缔组织囊,成为发育中卵泡的囊。
在持续几天的早期增殖期后,颗粒细胞团分泌一种含有高浓度雌激素(estrogen)的卵泡液,雌激素是重要的女性性激素之一(稍后讨论)。这种液体的积累导致颗粒细胞团内出现一个窦腔(antrum),如图82-5所示。
初级卵泡到窦状卵泡阶段的早期生长主要由FSH单独刺激。随后发生极大的加速生长,导致形成更大的卵泡,称为囊状卵泡(vesicular follicles)。这种加速生长由以下机制引起:
- 雌激素分泌到卵泡中,促使颗粒细胞形成越来越多的FSH受体,这导致正反馈效应,因为颗粒细胞对FSH更加敏感。
- 垂体FSH和雌激素共同促进原始颗粒细胞上的LH受体形成,从而允许LH刺激与FSH刺激同时发生,进一步加速卵泡分泌。
- 来自卵泡的雌激素(estrogen)增加以及来自垂体前叶的促黄体生成素(LH)增加共同作用,导致卵泡膜细胞(follicular thecal cells)增殖并增加其分泌。
一旦窦卵泡(antral follicles)开始生长,它们的生长几乎呈爆发式。卵母细胞(ovum)的直径也增加了3到4倍,使卵母细胞的总直径增加达到10倍,或质量增加1000倍。随着卵泡的增大,卵母细胞仍然嵌在位于卵泡一极的颗粒细胞(granulosa cells)团中。
每个月只有一个卵泡完全成熟,其余的卵泡发生闭锁(atresia)。经过一周或更长时间的生长——但在排卵(ovulation)发生之前——其中一个卵泡开始超过所有其他卵泡,而剩余的5到11个发育中的卵泡退化(这一过程称为闭锁)。
闭锁的原因尚不清楚,但推测如下:来自生长最快的卵泡的大量雌激素作用于下丘脑,抑制垂体前叶进一步增加促卵泡激素(FSH)的分泌,从而阻止发育较差的卵泡进一步生长。因此,最大的卵泡由于其内在的正反馈效应继续生长,而所有其他卵泡停止生长并实际上退化。
闭锁过程很重要,因为它通常每个月只允许一个卵泡生长到足够大以排卵,这通常防止每次怀孕时发育出多个孩子。单个卵泡在排卵时直径达到1到1.5厘米,称为成熟卵泡(mature follicle)。
排卵
在具有正常28天女性性周期的女性中,排卵发生在月经开始后14天。在排卵前不久,卵泡突出的外壁迅速肿胀,卵泡囊中央的一个小区域,称为柱头(stigma),像乳头一样突出。大约30分钟后,液体开始通过柱头从卵泡渗出,大约2分钟后,柱头广泛破裂,使占据卵泡中央部分的更粘稠的液体向外翻出。这种粘稠液体携带着被数千个小颗粒细胞(称为放射冠(corona radiata))包围的卵母细胞。
促黄体生成素(LH)的激增是排卵所必需的。LH对于最终的卵泡生长和排卵是必要的。没有这种激素,即使有大量的FSH,卵泡也不会进展到排卵阶段。
在排卵前约2天,垂体前叶分泌LH的速率显著增加,上升6到10倍,并在排卵前约16小时达到峰值。FSH也同时增加约2到3倍,FSH和LH协同作用,在排卵前几天引起卵泡的快速肿胀。LH还对颗粒细胞和膜细胞有特定作用,将它们主要转化为分泌孕酮(progesterone)的细胞。因此,雌激素分泌速率在排卵前约1天开始下降,而孕酮的分泌量开始增加。
正是在以下环境中发生排卵:(1) 卵泡快速生长,(2) 在长时间过度分泌雌激素后,雌激素分泌减少,(3) 开始分泌孕酮。如果没有排卵前的LH(黄体生成素)初始激增,排卵将不会发生。
图82-6. 假设的排卵机制。
排卵的启动。图82-6提供了一个排卵启动的示意图,展示了由垂体前叶分泌的大量LH的作用。这种LH导致含有孕酮的卵泡类固醇激素快速分泌。在几小时内,发生两个事件,这两个事件都是排卵所必需的:
- 卵泡外膜(即卵泡的囊)开始从溶酶体中释放蛋白水解酶。这些酶导致卵泡囊壁的溶解,从而使囊壁变弱,导致整个卵泡进一步肿胀和柱头退化。
- 同时,新的血管快速生长进入卵泡壁。与此同时,前列腺素(引起血管扩张的局部激素)被分泌到卵泡组织中。
这两种效应导致血浆渗出进入卵泡,从而促进卵泡肿胀。最终,卵泡肿胀和柱头同时退化的结合导致卵泡破裂,卵子排出。
黄体——卵巢周期的黄体期
在卵子从卵泡排出后的最初几小时内,剩余的颗粒细胞和内膜细胞迅速转变为黄体细胞。它们的直径增大两倍或更多,并充满脂质内含物,使它们呈现黄色。这个过程称为黄体化,所有细胞的总和称为黄体,如图82-5所示。一个发达的血管供应也生长进入黄体。
黄体中的颗粒细胞发展出广泛的细胞内平滑内质网,形成大量的雌性性激素孕酮和雌激素(在黄体期,孕酮多于雌激素)。内膜细胞主要形成雄激素雄烯二酮和睾酮,而不是雌性性激素。然而,这些激素中的大多数也被颗粒细胞中的芳香化酶转化为雌激素。
黄体通常生长到约1.5厘米的直径,在排卵后7到8天达到这个发育阶段。然后黄体开始退化,最终在排卵后约12天失去其分泌功能和黄色的脂质特征,变成白体;在接下来的几周内,白体被结缔组织取代,并在几个月内被吸收。
黄体生成激素(Luteinizing Hormone, LH)的黄体生成功能。颗粒细胞(granulosa)和内膜细胞(theca interna)转变为黄体细胞(lutein cells)主要依赖于垂体前叶分泌的LH。事实上,这一功能赋予了LH其名称——“黄体生成”即“黄化”。黄体化(luteinization)还依赖于卵子从卵泡中排出。卵泡液中一种尚未被完全表征的因子,称为黄体化抑制因子(luteinization-inhibiting factor),似乎在排卵前抑制黄体化过程。
黄体的分泌:黄体生成激素的额外功能。黄体(corpus luteum)是一个高度分泌的器官,分泌大量的孕酮(progesterone)和雌激素(estrogen)。一旦LH(主要是排卵期分泌的LH)作用于颗粒细胞和内膜细胞引起黄体化,新形成的黄体细胞会经历一系列过程:(1) 增殖,(2) 增大,和 (3) 分泌,随后是 (4) 退化。所有这些过程大约在12天内完成。如第83章所述,另一种与LH几乎具有完全相同特性的激素——绒毛膜促性腺激素(chorionic gonadotropin),由胎盘分泌,可以作用于黄体以延长其寿命——通常在怀孕的前2至4个月内维持其功能。
黄体的退化和下一个卵巢周期的开始。在卵巢周期的黄体期(luteal phase)中,黄体分泌的雌激素(尤其是)和孕酮(在较小程度上)对垂体前叶有强烈的反馈作用,以维持FSH和LH的低分泌率。
此外,黄体细胞分泌少量的抑制素(inhibin),与男性睾丸中Sertoli细胞分泌的抑制素相同。这种激素抑制垂体前叶分泌FSH。FSH和LH的血液浓度降低,最终导致黄体完全退化,这一过程称为黄体退化(involution of the corpus luteum)。
黄体通常在几乎正好12天的寿命结束时发生最终退化,这大约在正常女性性周期的第26天,即月经开始前2天。此时,黄体突然停止分泌雌激素、孕酮和抑制素,解除了对垂体前叶的反馈抑制,使其再次开始分泌越来越多的FSH和LH。FSH和LH启动新卵泡的生长,开始一个新的卵巢周期。此时孕酮和雌激素分泌的缺乏也会导致子宫的月经,这将在后面解释。
总结
大约每28天,垂体前叶分泌的促性腺激素(gonadotropic hormones)会促使卵巢中的8到12个新卵泡开始生长。其中一个卵泡最终“成熟”并在周期的第14天排卵。在卵泡生长期间,主要分泌雌激素。
排卵后,排卵卵泡的分泌细胞发育成黄体,分泌大量的孕酮和雌激素。再过2周后,黄体退化,卵巢激素雌激素和孕酮大幅减少,月经开始。随后,一个新的卵巢周期开始。
卵巢激素的功能——雌二醇和孕酮
卵巢性激素有两种类型:雌激素(estrogens)和孕激素(progestins)。迄今为止,最重要的雌激素是雌二醇(estradiol),而最重要的孕激素是孕酮(progesterone)。雌激素主要促进体内特定细胞的增殖和生长,这些细胞负责女性大多数第二性征的发育。孕激素的主要功能是为子宫妊娠和乳房泌乳做准备。
性激素的化学
雌激素。在正常非妊娠女性中,雌激素主要由卵巢分泌,尽管肾上腺皮质也会分泌少量。在妊娠期间,胎盘也会分泌大量雌激素,这将在第83章讨论。
在女性血浆中,只有三种雌激素的含量显著——\cdotβ-雌二醇(estradiol)、雌酮(estrone)和雌三醇(estriol),它们的化学结构如图82-7所示。卵巢分泌的主要雌激素是β-雌二醇。也会分泌少量雌酮,但大部分雌酮是由肾上腺皮质和卵巢卵泡膜细胞分泌的雄激素在外周组织中形成的。雌三醇是一种弱效雌激素;它是雌二醇和雌酮的氧化产物,主要在肝脏中转化。
β-雌二醇的雌激素效力是雌酮的12倍,是雌三醇的80倍。考虑到这些相对效力,可以看出β-雌二醇的总雌激素效应通常是其他两种雌激素总和的数倍。因此,β-雌二醇被认为是主要的雌激素,尽管雌酮的雌激素效应也不可忽视。
孕激素。迄今为止,最重要的孕激素是孕酮。然而,少量另一种孕激素——17α-羟基孕酮(17α-hydroxyprogesterone)也会与孕酮一起分泌,并具有基本相同的效应。然而,出于实际目的,孕酮通常被认为是唯一重要的孕激素。
在非妊娠女性中,孕酮通常只在每个卵巢周期的后半段大量分泌,此时由黄体(corpus luteum)分泌。
如第83章所述,妊娠期间胎盘也会分泌大量孕酮,尤其是在妊娠第四个月后。
雌激素和孕激素的合成。从图82-7中雌激素和孕酮的化学结构可以看出,它们都是类固醇(steroids)。它们主要在卵巢中由血液中的胆固醇合成,但也少量由乙酰辅酶A合成,多个乙酰辅酶A分子可以结合形成适当的类固醇核。
在合成过程中,首先主要合成孕酮和雄激素(睾酮(testosterone)和雄烯二酮(androstenedione));然后,在卵巢周期的卵泡期,在这两种初始激素离开卵巢之前,几乎所有的雄激素和大部分孕酮都会在颗粒细胞(granulosa cells)中被芳香化酶(aromatase)转化为雌激素。由于卵泡膜细胞(theca cells)缺乏芳香化酶,它们无法将雄激素转化为雌激素。然而,雄激素从卵泡膜细胞扩散到邻近的颗粒细胞中,在那里被芳香化酶转化为雌激素,芳香化酶的活性受FSH(图82-8)的刺激。
图82-7. 主要女性激素的合成。前体激素(包括孕酮)的化学结构如图78-2所示。
图82-8. 卵泡膜细胞和颗粒细胞在雌激素生成中的相互作用。卵泡膜细胞在黄体生成素(luteinizing hormone, LH)的控制下产生雄激素,这些雄激素扩散到颗粒细胞中。在成熟卵泡中,卵泡刺激素(follicle-stimulating hormone, FSH)作用于颗粒细胞,刺激芳香化酶活性,将雄激素转化为雌激素。AC,腺苷酸环化酶;ATP,三磷酸腺苷;cAMP,环磷酸腺苷;LDL,低密度脂蛋白。
在周期的黄体期,形成的孕酮量远超过其转化能力,这解释了此时大量孕酮分泌到循环血液中的原因。此外,女性卵巢分泌到血浆中的睾酮量约为男性睾丸分泌量的十五分之一。
雌激素和孕酮在血液中与血浆蛋白结合运输。雌激素和孕酮主要在血液中与血浆白蛋白及特定的雌激素和孕酮结合球蛋白结合运输。这些激素与血浆蛋白的结合较为松散,因此它们可以在约30分钟内迅速释放到组织中。
肝脏在雌激素降解中的作用。肝脏将雌激素结合形成葡萄糖醛酸苷和硫酸盐,约五分之一的这些结合产物通过胆汁排出;其余大部分通过尿液排出。此外,肝脏将强效雌激素雌二醇和雌酮转化为几乎完全无活性的雌激素雌三醇。因此,肝功能下降实际上会增加体内雌激素的活性,有时会导致雌激素过多症。
孕酮的命运。在分泌后的几分钟内,几乎所有的孕酮都被降解为其他无孕激素作用的类固醇。与雌激素一样,肝脏在这种代谢降解中尤为重要。
孕酮降解的主要终产物是孕烷二醇。约10%的原始孕酮以这种形式通过尿液排出。因此,可以通过这种排泄速率来估计体内孕酮的生成速率。
雌激素的功能——对女性第一性征和第二性征的影响
雌激素的主要功能之一是引起性器官及其他与生殖相关组织的细胞增殖和生长。
雌激素对子宫和女性外生殖器的影响
在儿童期,雌激素仅以微量分泌,但在青春期,受垂体促性腺激素的影响,女性体内分泌的雌激素量增加了20倍或更多。此时,女性的生殖器官从儿童状态转变为成人状态。卵巢、输卵管、子宫和阴道的大小都增加了数倍。此外,外生殖器也增大,阴阜和大阴唇中的脂肪沉积增加,小阴唇也增大。
此外,雌激素将阴道上皮从立方型转变为复层型,这种上皮比青春期前的立方型上皮更能抵抗创伤和感染。儿童的阴道感染通常可以通过给予雌激素来治愈,这仅仅是因为阴道上皮的抵抗力因此增强。
在青春期后的最初几年,子宫的大小增加了2到3倍,但比子宫大小增加更重要的是在雌激素影响下子宫内膜发生的变化。雌激素引起子宫内膜基质的显著增殖,并大大增加了子宫内膜腺体的发育,这些腺体将在以后为植入的卵子提供营养。这些效果将在本章后面与子宫内膜周期相关的部分讨论。
雌激素对输卵管的影响
雌激素对输卵管黏膜的影响与对子宫内膜的影响相似。它们引起该黏膜的腺体组织增殖,尤其重要的是,它们增加了输卵管内衬的纤毛上皮细胞的数量。此外,纤毛的活动也显著增强。这些纤毛总是向子宫方向摆动,这有助于将受精卵推向子宫方向。
雌激素对乳房的影响
女性和男性的原始乳房是完全相同的。事实上,在适当的激素影响下,男性乳房在生命的前20年可以发育到足以像女性乳房一样产生乳汁。
雌激素引起(1)乳房基质组织的发育,(2)广泛的导管系统的生长,以及(3)乳房中脂肪的沉积。乳房的腺小叶和腺泡在仅受雌激素影响下略有发育,但最终完成这些结构的生长和功能的是孕酮和催乳素。
总之,雌激素启动了乳房和产乳器官的生长。它们还负责成熟女性乳房的特征性生长和外观。然而,它们并不完成将乳房转化为产乳器官的工作。
雌激素对骨骼的影响
雌激素抑制骨骼中的破骨细胞活动,从而刺激骨骼生长。正如第80章所讨论的,这种效果的至少一部分是由于刺激了骨保护素(osteoprotegerin),也称为破骨细胞生成抑制因子(osteoclastogenesis inhibitory factor),这是一种抑制骨吸收的细胞因子。
在青春期,当女性进入生殖年龄时,她的身高增长会迅速加快,持续数年。然而,雌激素也会导致长骨的骨骺与骨干融合。雌激素在女性中的这种作用比睾酮在男性中的类似作用要强得多。因此,女性的生长通常比男性早几年停止。缺乏雌激素生成的女性阉人通常比正常成熟女性高几英寸,因为她的骨骺不会在正常时间融合。
老年期雌激素缺乏引起的骨质疏松。绝经后,卵巢几乎不分泌雌激素。这种雌激素缺乏会导致:(1) 骨骼中破骨细胞活动增加,(2) 骨基质减少,以及 (3) 骨钙和磷酸盐沉积减少。在一些女性中,这种影响极为严重,由此产生的状况被称为骨质疏松症(osteoporosis),在第80章中有详细描述。由于骨质疏松会大大削弱骨骼并导致骨折,尤其是脊椎骨折,许多绝经后女性会接受预防性雌激素替代治疗,以防止骨质疏松的影响。
雌激素轻微增加蛋白质沉积。雌激素会导致全身蛋白质轻微增加,这可以通过给予雌激素时轻微的氮正平衡来证明。这种效应主要源于雌激素对性器官、骨骼和身体其他一些组织的生长促进作用。睾酮引起的蛋白质沉积增强比雌激素引起的更为普遍且更为强大。
雌激素增加身体代谢和脂肪沉积。雌激素会轻微增加全身代谢率,但仅为睾酮引起的增加的三分之一左右。雌激素还会导致皮下组织中脂肪沉积增加。因此,女性体脂比例明显高于男性,而男性体内含有更多的蛋白质。除了在乳房和皮下组织中沉积脂肪外,雌激素还会导致脂肪在臀部和 thighs(大腿)沉积,这是女性体型的特征。
雌激素对毛发分布的影响较小。雌激素对毛发分布的影响不大。然而,青春期后,阴部和腋下确实会生长毛发。青春期后女性肾上腺分泌的雄激素增加,主要是这种毛发发育的原因。
雌激素对皮肤的影响。雌激素使皮肤质地变得柔软且通常光滑,但即便如此,女性的皮肤比儿童或阉割女性的皮肤更厚。雌激素还会使皮肤血管增多,这通常与皮肤温度升高以及切割表面出血量增加有关,这些现象在男性中较少见。
雌激素对电解质平衡的影响。雌激素与肾上腺皮质激素的化学相似性已在前面讨论过。雌激素与醛固酮和其他一些肾上腺皮质激素一样,会导致肾小管对钠和水的重吸收增加。雌激素的这种作用通常很轻微,很少具有显著意义,但在怀孕期间,胎盘大量生成雌激素可能会导致体液潴留,这将在第83章中讨论。
孕酮的功能
孕酮促进子宫的分泌性变化。孕酮的一个主要功能是在女性每月性周期的后半段促进子宫内膜的分泌性变化,从而为受精卵的着床准备子宫。
这一功能将在后面与子宫内膜周期相关的内容中进一步讨论。
除了对子宫内膜的这种影响外,孕酮还能减少子宫收缩的频率和强度,从而有助于防止已着床的受精卵被排出。
孕酮促进输卵管分泌。孕酮还能促进输卵管黏膜层的分泌增加。这些分泌物对于受精卵在着床前通过输卵管时的营养供应是必要的。
孕酮促进乳房的发育
孕酮促进乳房小叶和腺泡的发育,使腺泡细胞增殖、增大并变得具有分泌功能。然而,孕酮并不会导致腺泡分泌乳汁;正如第83章所讨论的,只有在准备好的乳房进一步受到来自垂体前叶的催乳素刺激后,乳汁才会分泌。
孕酮还会导致乳房肿胀。部分肿胀是由于小叶和腺泡的分泌性发育,但部分也是由于组织中液体增加所致。
每月子宫内膜周期与月经
与卵巢每月周期性产生雌激素和孕酮相关的是子宫内膜周期,子宫内膜周期通过以下阶段运作:(1) 子宫内膜的增殖;(2) 子宫内膜分泌性变化的发展;(3) 子宫内膜的脱落,即月经。图82-9展示了子宫内膜周期的各个阶段。参见视频82-1。
子宫内膜周期的增殖期(雌激素期)发生在排卵前。在每个月经周期开始时,大部分子宫内膜已通过月经脱落。月经后,仅剩下一层薄薄的子宫内膜基质,剩下的上皮细胞仅位于子宫内膜腺体和隐窝的较深部分。在每月卵巢周期的前半段,卵巢分泌的雌激素量逐渐增加,基质细胞和上皮细胞在雌激素的影响下迅速增殖。子宫内膜表面在月经开始后的4至7天内重新上皮化。
图82-9. 每月女性性周期中子宫内膜生长和月经的各个阶段。
然后,在接下来的一个半星期内,排卵发生之前,由于基质细胞数量的增加以及子宫内膜腺体和新生血管的逐渐生长,子宫内膜厚度大大增加。在排卵时,子宫内膜厚度为3至5毫米。
子宫内膜腺体,尤其是宫颈区域的腺体,分泌稀薄、粘稠的黏液。这些黏液实际上沿着宫颈管的长度排列,形成通道,帮助引导精子从阴道进入子宫的正确方向。
子宫内膜周期的分泌期(黄体期)发生在排卵后。在月经周期后半段的大部分时间里,即排卵发生后,黄体大量分泌孕酮(progesterone)和雌激素(estrogen)。在这一阶段,雌激素引起子宫内膜细胞的轻微增殖,而孕酮则导致子宫内膜显著肿胀和分泌性发育。腺体变得更加弯曲,腺上皮细胞中积累过多的分泌物质。此外,基质细胞的细胞质增加,脂质和糖原沉积在基质细胞中大大增加,子宫内膜的血液供应随着分泌活动的增加而进一步增加,血管变得高度弯曲。在分泌期的高峰期,即排卵后约1周,子宫内膜的厚度达到5至6毫米。
所有这些子宫内膜变化的目的是产生一个高度分泌的子宫内膜,其中含有大量储存的营养物质,为月经周期后半段受精卵的着床提供适当的条件。从受精卵从输卵管进入子宫腔(发生在排卵后3至4天)到卵子着床(排卵后7至9天)期间,子宫分泌物(称为“子宫乳汁”)为早期分裂的卵子提供营养。然后,一旦卵子着床于子宫内膜,着床卵子表面的滋养层细胞(在囊胚阶段)开始消化子宫内膜并吸收子宫内膜储存的物质,从而为早期着床的胚胎提供大量营养。
月经。如果卵子未受精,大约在月经周期结束前2天,卵巢中的黄体退化,卵巢激素(雌激素和孕酮)的分泌减少到低水平,如图82-9所示。随后发生月经。
月经是由月经周期结束时雌激素和孕酮(尤其是孕酮)的减少引起的。首先的影响是这两种激素对子宫内膜细胞的刺激减少,随后子宫内膜迅速退化至其先前厚度的约65%。然后,在月经开始前的24小时内,通向子宫内膜黏膜层的弯曲血管发生血管痉挛,可能是由于退化的某种影响,例如释放了一种血管收缩物质——可能是此时大量存在的一种前列腺素类血管收缩物质。
血管痉挛、子宫内膜营养物质的减少以及激素刺激的丧失引发了子宫内膜的坏死,尤其是血管的坏死。结果,血液首先渗入子宫内膜的血管层,出血区域在24至36小时内迅速扩大。逐渐地,子宫内膜的坏死外层在出血部位与子宫分离,直到月经开始约48小时后,子宫内膜的所有表层都已脱落。子宫腔内脱落的组织和血液团块,加上前列腺素或其他物质在脱落组织中的收缩作用,共同引发子宫收缩,排出子宫内容物。
在正常月经期间,大约会流失40毫升的血液和额外的35毫升浆液。月经液通常不会凝固,因为与坏死子宫内膜物质一起释放的纤维蛋白溶酶。如果子宫表面发生大量出血,纤维蛋白溶酶的量可能不足以防止凝血,导致血块排出。月经血块并不罕见,通常发生在月经的最初几天,此时出血量最大;然而,月经期间过度出血和大血块可能是子宫疾病的临床证据。
月经开始后4至7天内,血液流失停止,因为此时子宫内膜已经重新上皮化。
月经期间的白带。在月经期间,大量白细胞与坏死物质和血液一起释放。子宫内膜坏死释放的一种物质可能导致了白细胞的流出。由于这些白细胞的存在以及可能的其他因素,即使在子宫内膜表面裸露的情况下,子宫在月经期间对感染具有高度抵抗力。这种对感染的抵抗力具有极其重要的保护价值。
女性每月节律的调控——卵巢与下丘脑-垂体激素之间的相互作用
现在我们已经介绍了女性每月性周期中发生的主要周期性变化,我们可以解释导致这些周期性变化的基本节律机制。
下丘脑分泌GnRH,刺激垂体前叶分泌LH和FSH
如第75章所讨论的,大多数垂体前叶激素的分泌由下丘脑形成的“释放激素”控制,然后通过下丘脑-垂体门脉系统运输到垂体前叶。在促性腺激素的情况下,一种释放激素GnRH非常重要。这种激素已被纯化,并被发现是一种具有以下分子式的十肽:
下丘脑间歇性、脉冲式分泌GnRH刺激垂体前叶脉冲式释放LH。下丘脑并不连续分泌GnRH,而是以持续5至25分钟的脉冲形式分泌,每1至2小时发生一次。图82-10中的下曲线显示了导致下丘脑脉冲式输出GnRH的电脉冲信号。
有趣的是,当GnRH(促性腺激素释放激素)持续输注时,它始终存在而不是以脉冲形式释放,其引起垂体前叶释放LH(黄体生成素)和FSH(卵泡刺激素)的能力会丧失。因此,GnRH的脉冲式释放对其功能至关重要。
GnRH的脉冲式释放还导致LH分泌大约每90分钟间歇性输出,如图82-10中的上曲线所示。
释放促性腺激素释放激素的下丘脑中心。在人类中,引起GnRH脉冲式释放的神经元活动主要发生在下丘脑内侧基底区,特别是该区域的弓状核。位于下丘脑前部视前区的神经元也会分泌适量的GnRH。大脑高级“边缘”系统(心理控制系统)中的多个神经元中心将信号传递到下丘脑,以调节GnRH释放的强度和脉冲频率,从而部分解释了为什么心理因素经常影响女性性功能。
雌激素和孕激素对LH和FSH分泌的负反馈效应
少量的雌激素对LH和FSH的产生有强烈的抑制作用。此外,当孕激素存在时,雌激素的抑制作用会增强,尽管孕激素本身几乎没有作用(图82-11)。
这些反馈效应似乎主要直接作用于垂体前叶,但它们也在较小程度上作用于下丘脑,以减少GnRH的分泌,特别是通过改变GnRH脉冲的频率。
图82-10。显示了在戊巴比妥麻醉的去卵巢恒河猴外周循环中LH(黄体生成素)的脉冲变化(红线)和下丘脑内侧基底区多单位电活动(MUA)的每分钟记录(蓝线)。(数据来自Wilson RC, Kesner JS, Kaufman JM, et al: Central electrophysiologic correlates of pulsatile luteinizing hormone secretion. Neuroendocrinology 39:256, 1984.)
黄体中的抑制素抑制FSH和LH分泌。除了雌激素和孕激素的反馈效应外,还涉及其他激素,特别是抑制素,它与性类固醇激素一起由卵巢黄体的颗粒细胞分泌,类似于男性睾丸中的Sertoli细胞分泌抑制素(见图82-11)。这种激素在女性中的作用与在男性中相同——它抑制垂体前叶分泌FSH,并在较小程度上抑制LH。因此,抑制素可能在女性每月性周期结束时引起FSH和LH分泌减少方面特别重要。
排卵前雌激素的正反馈效应——排卵前黄体生成素激增
垂体前叶在排卵前24至48小时开始分泌大量增加的LH,持续1至2天。这种效应在图82-4中得到了展示。图中还显示了较小的排卵前FSH激增。
图 82-11. 女性下丘脑-垂体-卵巢轴( hypothalamic-pituitary-ovarian axis)的反馈调节。刺激效应用加号(+)表示;负反馈抑制效应用减号(-)表示。雌激素(estrogens)和孕激素(progestins)对垂体前叶(anterior pituitary)和下丘脑发挥负反馈和正反馈作用,具体取决于卵巢周期(ovarian cycle)的阶段。抑制素(inhibin)对垂体前叶有负反馈作用,而激活素(activin)则有相反的作用,刺激垂体前叶分泌促卵泡激素(follicle-stimulating hormone, FSH)。CNS,中枢神经系统(central nervous system);GnRH,促性腺激素释放激素(gonadotropin-releasing hormone);LH,黄体生成素(luteinizing hormone)。
实验表明,在卵巢周期的前半段后期,以超过临界速率向女性输注雌激素2至3天,会导致卵巢卵泡(ovarian follicles)的快速生长,以及卵巢雌激素的快速分泌。在此期间,垂体前叶分泌的FSH和LH最初略有抑制。随后,LH分泌突然增加6至8倍,FSH分泌增加约2倍。LH分泌的大幅增加导致排卵(ovulation)发生。
LH分泌突然激增的原因尚不清楚。然而,以下解释是可能的:1. 有人认为,在周期的这个阶段,雌激素对垂体分泌LH有特殊的正反馈刺激作用,对FSH的刺激作用较小(见图82-11),这与女性月经周期其余阶段发生的雌激素正常负反馈效应形成鲜明对比。2. 卵泡的颗粒细胞(granulosa cells)在排卵前LH激增前一天左右开始分泌少量但逐渐增加的孕酮(progesterone),有人认为这种分泌可能是刺激过量LH分泌的因素。
如果没有这种正常的排卵前LH激增,排卵就不会发生。
下丘脑-垂体-卵巢系统的反馈振荡
既然我们已经讨论了女性激素系统不同组成部分之间的相互关系,我们就可以解释控制女性性周期节奏的反馈振荡。它似乎按照以下三个事件的顺序运行。
- 卵巢激素的排卵后分泌和垂体促性腺激素的抑制。在排卵和月经开始之间,黄体(corpus luteum)分泌大量的孕酮和雌激素,以及抑制素。所有这些激素共同对垂体前叶和下丘脑产生联合负反馈效应,导致FSH和LH分泌受到抑制,并在月经开始前约3至4天降至最低水平。这些效应如图82-4所示。
- 卵泡生长期。月经前2到3天,黄体已经退化到几乎完全消退,黄体分泌的雌激素(estrogen)、孕激素(progesterone)和抑制素(inhibin)减少到最低点,这解除了下丘脑和垂体前叶(anterior pituitary)受这些激素的负反馈(negative feedback)影响。因此,大约一天后,在月经开始时,垂体分泌的促卵泡激素(FSH)再次开始增加,最多增加2倍;然后,在月经开始几天后,黄体生成素(LH)的分泌也略有增加。这些激素启动了新的卵泡生长和雌激素分泌的逐渐增加,在新的女性每月性周期开始后约12.5到13天达到雌激素分泌的峰值。在卵泡生长的前11到12天,由于雌激素对垂体前叶的负反馈作用,促性腺激素FSH和LH的垂体分泌率略有下降。然后,LH的分泌突然显著增加,FSH的分泌也略有增加。这种增加的分泌是LH和FSH的排卵前激增(preovulatory surge),随后是排卵。
- LH和FSH的排卵前激增导致排卵。在每月周期开始后约11.5到12天,FSH和LH分泌的下降突然停止。此时的高水平雌激素(或卵泡开始分泌孕激素)被认为对垂体前叶产生了正反馈(positive feedback)刺激作用,如前所述,这导致LH分泌的大幅激增,FSH的分泌也略有增加。无论排卵前LH和FSH激增的原因是什么,LH的过量都会导致排卵以及黄体的后续发育和分泌。因此,激素系统开始了新一轮的分泌,直到下一次排卵。
无排卵周期——青春期性周期
如果LH的排卵前激增幅度不足,排卵将不会发生,这种周期被称为“无排卵周期”。性周期的各个阶段继续,但它们以以下方式改变:
- 缺乏排卵导致黄体发育失败,因此在周期的后半部分几乎没有孕激素的分泌。
- 周期缩短了几天,但节律继续。
因此,尽管孕激素可以改变周期的节律,但它可能不是维持周期所必需的。
青春期开始后的最初几个周期通常是无排卵的,绝经前几个月到几年的周期也是如此,大概是因为这些时期的LH激增不足以引起排卵。
青春期和初潮
青春期意味着成年性生活的开始,初潮意味着月经周期的开始。青春期是由垂体分泌的促性腺激素逐渐增加引起的,大约从8岁开始,如图82-12所示,通常在女孩10到14岁之间(平均12岁)达到青春期和月经的开始。
图 82-12. 女性和男性人类在整个性生活中的促性腺激素(gonadotropic hormones)分泌总量,显示女性在更年期时促性腺激素的急剧增加。
图 82-13. 女性人类在整个性生活中的雌激素(estrogen)分泌情况。
在女性中,与男性一样,婴儿期的垂体(pituitary gland)和卵巢(ovaries)如果受到适当的刺激,能够完全发挥功能。然而,与男性一样,由于某些尚未理解的原因,下丘脑在儿童期不会分泌大量的促性腺激素释放激素(GnRH)。实验表明,下丘脑能够分泌这种激素,但缺乏来自大脑其他区域的适当信号来引发分泌。因此,现在认为青春期的开始是由大脑其他部位的某种成熟过程引发的,可能发生在边缘系统(limbic system)的某个区域。
图 82-13 显示了(1)青春期雌激素分泌水平的增加,(2)每月性周期中的周期性变化,(3)在生育期的最初几年中雌激素分泌的进一步增加,(4)在生育期结束时雌激素分泌的逐渐减少,以及(5)在更年期后几乎没有任何雌激素或孕酮(progesterone)的分泌。
更年期(MENOPAUSE)
在 40 到 50 岁时,性周期通常变得不规律,排卵(ovulation)常常无法发生。经过几个月到几年后,周期完全停止,如图 82-13 所示。周期停止且女性性激素减少到几乎为零的时期被称为更年期(menopause)。
更年期的原因是卵巢的“衰竭”。在女性的生育期内,大约有 400 个原始卵泡(primordial follicles)发育为成熟卵泡并排卵,而数十万个卵子退化。在大约 45 岁时,只剩下少数原始卵泡可以被促卵泡激素(FSH)和黄体生成素(LH)刺激,如图 82-13 所示,随着原始卵泡数量接近零,卵巢的雌激素分泌减少。当雌激素分泌低于临界值时,雌激素不再能够抑制 FSH 和 LH 的产生。相反,如图 82-12 所示,更年期后促性腺激素 FSH 和 LH(主要是 FSH)以大量且持续的方式产生,但随着剩余的原始卵泡闭锁(atretic),卵巢的雌激素分泌几乎降至零。
在更年期时,女性必须从生理上由雌激素和孕酮分泌刺激的生活重新调整为没有这些激素的生活。雌激素的丧失通常会导致身体功能的显著生理变化,包括(1)以皮肤极度潮红为特征的“潮热”(hot flushes),(2)呼吸困难的心理感觉,(3)易怒,(4)疲劳,(5)焦虑,以及(6)全身骨骼的强度和钙化减少。这些症状在大约 15% 的女性中达到需要治疗的程度。每天小剂量服用雌激素通常可以逆转这些症状,通过逐渐减少剂量,更年期女性可以避免严重的症状。
大型临床试验提供的证据表明,绝经后给予雌激素(estrogen)虽然可以缓解许多绝经症状,但可能会增加心血管疾病的风险。因此,雌激素的激素替代疗法(hormone replacement therapy)不再常规用于绝经后妇女。然而,一些研究表明,如果在绝经早期开始雌激素治疗,实际上可能会降低心血管疾病的风险。因此,目前建议考虑激素替代疗法的绝经后妇女应与医生讨论其益处是否大于风险。
卵巢分泌异常
性腺功能减退症(hypogonadism)——卵巢分泌减少。卵巢分泌不足可能是由于卵巢发育不良、卵巢缺失或遗传异常的卵巢因分泌细胞中缺乏酶而分泌错误的激素所致。如果女性从出生时就没有卵巢,或者在青春期前卵巢失去功能,就会发生女性阉割症(female eunuchism)。在这种情况下,通常的第二性征不会出现,性器官保持婴儿状态。这种情况的一个特别特征是长骨的生长延长,因为骨骺(epiphyses)不像正常女性那样早与骨干融合。因此,女性阉割者的身高与具有相似遗传背景的男性相当,甚至可能略高。
当一个完全发育的女性的卵巢被切除后,性器官会有所退化,子宫几乎恢复到婴儿大小,阴道变小,阴道上皮变薄且容易受损。乳房萎缩并变得下垂,阴毛变稀疏。绝经后女性也会发生同样的变化。
月经不规律和由性腺功能减退引起的闭经(amenorrhea)。正如前面关于绝经的讨论所指出的,卵巢产生的雌激素(estrogens)量必须超过临界值才能引起规律的性周期。因此,在性腺功能减退症或由于其他因素(如甲状腺功能减退)导致性腺分泌少量雌激素的情况下,卵巢周期通常不会正常发生。相反,月经周期之间可能会间隔几个月,或者月经可能完全停止(闭经)。延长的卵巢周期通常与排卵失败有关,推测是由于在排卵前LH激增时LH分泌不足,而LH是排卵所必需的。
卵巢分泌过多。卵巢激素的过度分泌是一种罕见的临床现象,因为雌激素的过度分泌会自动减少垂体促性腺激素(gonadotropins)的产生,从而限制卵巢激素的产生。因此,女性化激素的过度分泌通常只有在发生女性化肿瘤时才会被临床识别。
一种罕见的颗粒细胞瘤(granosa cell tumor)可能在卵巢中发展;这种肿瘤的发生在绝经后比绝经前更常见。这些肿瘤分泌大量雌激素,产生通常的雌激素效应,包括子宫内膜肥大和子宫内膜不规则出血。事实上,出血往往是这种肿瘤存在的第一个也是唯一的迹象。
女性性行为
女性性行为的刺激
与男性性行为一样,女性性行为的成功表现依赖于心理刺激和局部性刺激。
思考性相关的内容可以引发女性的性欲(sexual desire),这极大地有助于女性性行为的表现。这种欲望基于心理和生理驱动,尽管性欲确实会随着分泌的性激素水平增加而增强。性欲在每月的性周期中也会发生变化,在排卵期附近达到峰值,这可能是由于排卵前期雌激素分泌水平较高所致。
女性的局部性刺激与男性大致相同,因为对外阴(vulva)、阴道(vagina)和其他会阴(perineal)区域的按摩和其他类型的刺激可以产生性感觉。阴蒂(clitoris)的龟头(glans)尤其敏感,是引发性感觉的关键部位。
与男性一样,性感觉信号通过阴部神经(pudendal nerve)和骶神经丛(sacral plexus)传递到脊髓的骶段(sacral segments)。一旦这些信号进入脊髓,它们就会被传递到大脑。此外,整合在骶部和腰部脊髓中的局部反射至少部分负责女性性器官的一些反应。
女性勃起和润滑
位于阴道口(introitus)周围并延伸到阴蒂的勃起组织(erectile tissue)几乎与阴茎的勃起组织完全相同。这种勃起组织与阴茎的勃起组织一样,由副交感神经(parasympathetic nerves)控制,这些神经通过骶神经丛的勃起神经(nervi erigentes)传递到外生殖器。在性刺激的早期阶段,副交感信号扩张勃起组织的动脉,这可能是由于神经末梢释放乙酰胆碱(acetylcholine)、一氧化氮(nitric oxide)和血管活性肠肽(vasoactive intestinal polypeptide)所致。这使得血液迅速积聚在勃起组织中,从而使阴道口紧贴阴茎,这有助于男性获得足够的性刺激以实现射精。
副交感信号还传递到位于小阴唇(labia minora)下方的双侧巴氏腺(Bartholin glands),并使其在阴道口内立即分泌黏液。这种黏液在性交过程中提供了大部分的润滑作用,尽管阴道上皮分泌的黏液也提供了大量润滑,还有少量润滑来自男性尿道腺。这种润滑在性交过程中是必要的,以建立令人满意的按摩感,而不是由干燥阴道引发的刺激感。按摩感是引发适当反射的最佳刺激,最终导致男性和女性的性高潮。
女性高潮 (female orgasm)。当局部性刺激达到最大强度时,尤其是当局部感觉得到来自大脑 (cerebrum) 的适当心理调节信号支持时,会引发反射,导致女性高潮 (female orgasm),也称为女性性高潮 (female climax)。女性高潮类似于男性的射精 (emission and ejaculation),并且可能有助于促进卵子的受精。事实上,已知人类女性在通过正常性交而非人工方法受精时,生育能力会稍强一些,这表明女性高潮具有重要功能。这种现象可能的原因如下。
首先,在高潮期间,女性的会阴部肌肉 (perineal muscles) 会节律性收缩,这是由类似于男性射精的脊髓反射引起的。这些反射可能会在高潮期间增加子宫 和输卵管 (fallopian tube) 的运动性,从而帮助精子向上通过子宫向卵子运输;然而,关于这一主题的信息很少。此外,高潮似乎会导致宫颈管 (cervical canal) 扩张长达30分钟,从而使精子更容易运输。
其次,在许多动物中,交配会导致垂体后叶 (posterior pituitary gland) 分泌催产素 (oxytocin);这种效应可能是通过大脑杏仁核 (amygdaloid nuclei) 然后通过下丘脑 传递到垂体的。催产素会导致子宫节律性收缩增加,这可能会增加精子的运输。一些精子已被证明可以在大约5分钟内穿过牛的整个输卵管长度,这一速度至少是精子游泳运动可能达到的速度的10倍。这种现象是否发生在人类女性中尚不清楚。
除了高潮对受精的可能影响外,高潮期间产生的强烈性感觉也会传递到大脑,并导致全身肌肉紧张。在性行为达到顶点后,这种紧张感在接下来的几分钟内逐渐消退,取而代之的是一种以放松和平静为特征的满足感,这种效应称为消退 (resolution)。
女性生育能力 (Female Fertility)
每个性周期的可孕期 (Fertile Period of Each Sexual Cycle)。卵子在从卵巢排出后,可能保持活力和受精能力的时间不超过24小时。因此,如果受精要发生,精子必须在排卵后不久可用。一些精子可以在女性生殖道中保持受精能力长达5天。因此,为了使受精发生,性交必须在排卵前4到5天到排卵后几小时之间的某个时间进行。因此,女性每月的可孕期很短,大约为4到5天。
避孕的节律法 (Rhythm Method of Contraception)
一种常见的避孕方法是避免在排卵期附近进行性行为。这种避孕方法的难点在于准确预测排卵时间。然而,从排卵到下一次月经开始的间隔几乎总是在13到15天之间。因此,如果月经周期规律,周期为28天,排卵通常发生在周期的第14天前后1天内。相反,如果周期为40天,排卵通常发生在周期的第26天前后1天内。最后,如果周期为21天,排卵通常发生在周期的第7天前后1天内。因此,通常建议在计算出的排卵日前4天和后3天避免性行为,以防止受孕。然而,这种避孕方法只能在月经周期规律的情况下使用。这种避孕方法的失败率(导致意外怀孕)可能高达每年20%到25%。
激素抑制生育——“避孕药” (Hormonal Suppression of Fertility—“The Pill”)
在月经周期的前半段适量给予雌激素 (estrogen) 或孕酮 (progesterone) 可以抑制排卵。原因是适量给予这些激素中的任何一种都可以阻止垂体 (pituitary gland) 分泌的黄体生成素 (LH) 在排卵前的激增,而这是导致排卵的关键因素。
目前尚不完全清楚为什么给予雌激素或孕酮会阻止LH分泌的排卵前激增。然而,实验研究表明,在激增发生之前,卵巢卵泡 (ovarian follicles) 可能会突然减少雌激素的分泌,这可能是导致后续对前垂体 (anterior pituitary) 的反馈效应并引发LH激增的必要信号。给予性激素(雌激素或孕酮)可能会阻止卵巢激素的初始减少,而这可能是排卵的启动信号。
设计激素抑制排卵方法的挑战在于开发适当的雌激素和孕激素 (progestins) 组合,既能抑制排卵,又不会引起其他不良影响。例如,过多的任何一种激素都可能导致异常的月经出血模式。然而,使用某些合成孕激素代替孕酮,尤其是19-去甲类固醇 (19-norsteroids),并与少量雌激素结合,通常可以阻止排卵,同时允许几乎正常的月经模式。因此,几乎所有用于控制生育的“避孕药”都由合成雌激素和合成孕激素的某种组合组成。使用合成雌激素和孕激素的主要原因是,天然激素在从胃肠道吸收进入门脉循环 (portal circulation) 后不久几乎完全被肝脏破坏。然而,许多合成激素可以抵抗肝脏的这种破坏倾向,从而允许口服给药。
两种最常用的合成雌激素是炔雌醇(ethinyl estradiol)和美雌醇(mestranol)。最常用的孕激素包括炔诺酮(norethindrone)、异炔诺酮(norethynodrel)、双醋炔诺醇(ethynodiol)和炔诺孕酮(norgestrel)。药物通常在月经周期的早期开始使用,并持续到正常排卵时间之后。然后停药,使月经来潮,开始新的周期。
使用各种形式的"避孕药"进行激素避孕的失败率(即意外怀孕)约为每年8%到9%。
导致女性不育的异常情况
大约5%到10%的女性不育。有时,女性生殖器官没有发现异常,在这种情况下,不育被认为是由于生殖系统的生理功能异常或卵子的遗传发育异常所致。
女性不育的最常见原因是排卵失败。排卵失败可能是由于促性腺激素分泌不足,在这种情况下,激素刺激的强度不足以引起排卵,也可能是由于卵巢异常导致排卵困难。例如,卵巢外部偶尔存在较厚的卵巢包膜,使排卵困难。
由于不育女性中无排卵的发生率很高,因此经常使用特殊方法来确定是否发生排卵。这些方法主要基于孕酮对身体的影响,因为在无排卵周期的后半段,通常不会发生孕酮分泌的正常增加。在没有孕激素作用的情况下,可以认为该周期是无排卵的。
其中一项测试是在性周期的后半段分析尿液中孕二醇(pregnanediol)的激增,孕二醇是孕酮代谢的终产物;缺乏这种物质表明排卵失败。
图82-14. 排卵后不久体温升高。
另一个常见的测试是让女性在整个周期内记录她的体温。在周期的后半段,孕酮的分泌会使体温升高约0.5华氏度,体温升高在排卵时突然发生。图82-14展示了一张显示排卵点的体温图。
由垂体促性腺激素分泌不足引起的排卵失败有时可以通过适时给予人绒毛膜促性腺激素(human chorionic gonadotropin)来治疗,这是一种从人类胎盘中提取的激素(在第83章讨论)。这种激素虽然由胎盘分泌,但其作用几乎与黄体生成素(LH)相同,因此是一种强有力的排卵刺激剂。然而,过量使用这种激素会导致多个卵泡同时排卵,从而导致多胎妊娠,这种效应曾导致接受该激素治疗不育的母亲生下多达八个婴儿(许多情况下是死产)。
女性不育最常见的原因之一是子宫内膜异位症(endometriosis),这是一种常见疾病,其中与正常子宫内膜几乎相同的子宫内膜组织在子宫、输卵管和卵巢周围的盆腔内生长甚至月经。子宫内膜异位症会导致整个盆腔纤维化(fibrosis),这种纤维化有时会包裹卵巢,使卵子无法释放到腹腔。通常,子宫内膜异位症会阻塞输卵管,无论是在伞端还是沿其长度的其他部位。
女性不孕的另一个常见原因是输卵管炎(salpingitis),即输卵管的炎症;这种炎症会导致输卵管纤维化,从而阻塞输卵管。在过去,这种炎症主要是由于淋球菌感染引起的。然而,随着现代治疗的发展,输卵管炎作为女性不孕的原因变得越来越不普遍。
不孕的另一个原因是子宫颈分泌异常黏液。通常,在排卵时,雌激素的激素环境会导致分泌具有特殊特性的黏液,这些特性使精子能够快速进入子宫,并实际上引导精子沿着黏液“线”上升。子宫颈的异常,如低度感染或炎症,或子宫颈的异常激素刺激,可能导致粘稠的黏液栓,阻止受精。
妊娠与哺乳
在第81章和第82章中,男性和女性的性功能被描述到卵子受精的阶段。如果卵子受精,一系列新的事件——称为妊娠或怀孕——就会发生,受精卵最终发育成一个足月的胎儿。本章的目的是讨论受精后卵子发育的早期阶段,然后讨论妊娠的生理学。在第84章中,将讨论胎儿和幼儿生理学的一些特殊方面。
卵子的成熟与受精
当卵子仍在卵巢中时,它处于初级卵母细胞阶段。在它从卵泡释放前不久,其细胞核通过减数分裂分裂,第一极体从卵母细胞的细胞核中排出(见图82-3)。初级卵母细胞随后变为次级卵母细胞。在这个过程中,每对23对染色体中的一条染色体丢失,这条染色体被纳入一个极体中并被排出。这使得次级卵母细胞中剩下23条未配对的染色体。正是在这个时候,仍处于次级卵母细胞阶段的卵子被排卵进入腹腔。然后,几乎立即,它进入其中一个输卵管(输卵管)的伞端。
卵子进入输卵管(子宫管)。当排卵发生时,卵子与构成放射冠的数百个或更多的附着颗粒细胞一起被直接排入腹膜腔,然后必须进入其中一个输卵管(也称为子宫管)以到达子宫腔。每个输卵管的伞端自然地围绕在卵巢周围。伞状触手的内部表面覆盖有纤毛上皮,纤毛被来自卵巢的雌激素激活,这使得纤毛朝向相关输卵管的开口或口部摆动。实际上可以看到一股缓慢的液体流向口部。通过这种方式,卵子进入其中一个输卵管。
尽管人们可能会怀疑许多卵子未能进入输卵管,但受孕研究表明,高达98%的卵子成功完成了这一任务。事实上,在一些记录在案的案例中,一侧卵巢被切除且对侧输卵管被切除的女性在相对容易的情况下怀上了几个孩子,这表明卵子甚至可以进入对侧输卵管。
卵子的受精(fertilization of the ovum)。在性交过程中,男性将精液射入阴道后,几分钟内就有少量精子从阴道向上游动,经过子宫和输卵管,到达输卵管靠近卵巢端的壶腹部。精子的这种运输过程受到男性精液中前列腺素(prostaglandins)刺激的子宫和输卵管收缩的帮助,同时也受到女性在性高潮时从垂体后叶释放的催产素(oxytocin)的辅助。在阴道中沉积的近5亿个精子中,只有几千个能够成功到达每个壶腹部。
卵子的受精(图83-1)通常在精子和卵子都进入壶腹部后不久在其中一个输卵管的壶腹部发生。然而,在精子能够进入卵子之前,它必须首先穿透附着在卵子外部的多层颗粒细胞(放射冠,corona radiata),然后结合并穿透围绕卵子的透明带(zona pellucida)。精子用于这些目的的机制在第81章中介绍。
一旦精子进入卵子(此时卵子仍处于次级卵母细胞阶段),卵母细胞再次分裂,形成成熟的卵子和一个被排出的第二极体(见图82-3)。成熟的卵子仍然在其细胞核(现在称为雌性原核,female pronucleus)中携带23条染色体。其中一条染色体是雌性染色体,称为X染色体。
与此同时,受精的精子也发生了变化。进入卵子后,它的头部膨胀形成雄性原核(male pronucleus),如图83-1D所示。随后,雄性原核的23条未配对染色体和雌性原核的23条未配对染色体排列在一起,重新形成受精卵或合子(zygote)中完整的46条染色体(23对)(见图83-1E)。
图83-1. 卵子的受精。A,被放射冠包围的成熟卵子。B,放射冠的分散。C,精子的进入。D,雄性和雌性原核的形成。E,染色体的完整重组和卵子的开始分裂。(修改自Arey LB: Developmental Anatomy: A Textbook and Laboratory Manual of Embryology, 7th ed. Philadelphia: WB Saunders, 1974.)
什么决定了胎儿的性别?
一半的成熟精子在其基因组中携带X染色体(雌性染色体),另一半携带Y染色体(雄性染色体)。因此,如果精子中的X染色体与卵子中的X染色体结合,形成XX组合,将出生一个女孩,如第81章所述。如果精子中的Y染色体与卵子中的X染色体配对,形成XY组合,将出生一个男孩。
受精卵在输卵管中的运输
受精发生后,通常需要额外的3到5天时间将受精卵通过输卵管(oviduct)的剩余部分运输到子宫腔(uterine cavity)中(图83-2)。这种运输主要是由输卵管上皮分泌产生的微弱液体流动以及输卵管内衬的纤毛上皮(cilated epithelium)的作用实现的;纤毛总是朝向子宫方向摆动。输卵管的微弱收缩也可能有助于卵子的通过。
输卵管内衬有粗糙的隐窝状表面,尽管有液体流动,但仍会阻碍卵子的通过。此外,输卵管的峡部(isthmus)(输卵管进入子宫前的最后2厘米)在排卵后的大约前3天内保持痉挛性收缩。此后,卵巢黄体(corpus luteum)分泌的迅速增加的孕酮(progesterone)首先促进输卵管平滑肌细胞上孕酮受体的增加;然后孕酮激活这些受体,使输卵管松弛,允许卵子进入子宫。
图83-2。A,排卵,卵子在输卵管中的受精,以及囊胚(blastocyst)在子宫中的植入。B,滋养层细胞(trophoblast cells)在囊胚植入子宫内膜(uterine endometrium)中的作用。
受精卵在输卵管中的延迟运输使得在分裂的卵子(现在称为囊胚,大约有100个细胞)进入子宫之前,可以发生多个阶段的细胞分裂。在此期间,输卵管分泌细胞产生大量分泌物,用于发育中的囊胚的营养。
囊胚在子宫中的植入
到达子宫后,发育中的囊胚通常在子宫腔中再停留1到3天,然后植入子宫内膜;因此,植入通常发生在排卵后的大约第5到第7天。在植入之前,囊胚从子宫内膜分泌物中获取营养,这些分泌物被称为“子宫乳(uterine milk)”。
植入是由囊胚表面发育的滋养层细胞的作用引起的。这些细胞分泌蛋白水解酶(proteolytic enzymes),消化并液化邻近的子宫内膜细胞。释放的部分液体和营养物质被同样的滋养层细胞主动运输到囊胚中,为生长提供更多的营养。图83-3显示了一个早期植入的人类囊胚,其中包含一个小胚胎。一旦植入发生,滋养层细胞和其他邻近细胞(来自囊胚和子宫内膜)迅速增殖,形成胎盘(placenta)和妊娠的各种膜。
图83-3。早期人类胚胎的植入,显示滋养层细胞的消化和子宫内膜的侵入。(由Arthur Hertig博士提供)
胚胎的早期营养
在第82章中,我们指出,在每个月经周期的后半段,卵巢黄体分泌的孕激素(progesterone)对子宫内膜(endometrium)有影响,将子宫内膜基质细胞(endometrial stromal cells)转化为含有大量糖原、蛋白质(proteins)、脂类(lipids)甚至一些胚胎发育所需矿物质的肿胀细胞。然后,当胚胎(conceptus)植入子宫内膜时,孕激素的持续分泌使子宫内膜细胞进一步肿胀并储存更多的营养物质。这些细胞现在被称为蜕膜细胞(decidual cells),而细胞的总质量被称为蜕膜(decidua)。
当滋养层细胞(trophoblast cells)侵入蜕膜并消化和吸收它时,蜕膜中储存的营养物质被胚胎用于生长发育。在植入后的第一周,这是胚胎获取营养的唯一方式;尽管在受精后约16天(植入后略多于1周)胎盘(placenta)也开始提供营养,但胚胎继续以这种方式获取至少部分营养,直到8周。图83-4显示了这种滋养层营养期,它逐渐让位于胎盘营养。
胎盘的解剖与功能
当来自囊胚(blastocyst)的滋养层索(trophoblastic cords)附着到子宫时,毛细血管从新形成胚胎的血管系统长入这些索中。受精后约21天,人类胚胎的心脏也开始泵血。同时,由母体供血的血液窦(blood sinuses)在滋养层索的外围发育。滋养层细胞发出越来越多的突起,这些突起成为胎盘绒毛(placental villi),胎儿毛细血管长入其中。因此,携带胎儿血液的绒毛被含有母体血液的窦所包围。
图83-4. 胎儿的营养。早期的大部分营养来自于滋养层对子宫内膜蜕膜中营养物质的消化和吸收,而后期几乎所有营养都通过胎盘膜(placental membrane)的扩散获得。
胎盘的最终结构如图83-5所示。注意,胎儿的血液通过两条脐动脉(umbilical arteries)流动,然后进入绒毛的毛细血管,最后通过一条脐静脉(umbilical vein)返回胎儿体内。同时,母体的血液从子宫动脉(uterine arteries)流入围绕绒毛的大型母体窦,然后返回母体的子宫静脉(uterine veins)。图83-5的下部显示了完全发育的胎盘中每个胎儿胎盘绒毛的胎儿血液与绒毛外围母体血液之间的关系。
成熟胎盘所有绒毛的总表面积仅为几平方米——远小于肺中肺泡膜(pulmonary membrane)的面积。然而,营养物质和其他物质主要通过扩散通过胎盘膜,其方式与通过肺泡膜(alveolar membranes)和身体其他部位的毛细血管膜的扩散方式非常相似。
胎盘通透性与膜扩散导度
胎盘的主要功能是促进营养物质和氧气从母体血液扩散到胎儿血液中,并将排泄产物从胎儿血液扩散回母体血液中。
在怀孕的早期,胎盘膜(placental membrane)仍然较厚,因为它尚未完全发育。因此,其通透性(permeability)较低。此外,由于胎盘尚未显著生长,表面积较小。
图83-5。上,成熟胎盘的组织结构。下,绒毛毛细血管中的胎儿血液与绒毛间隙中的母体血液的关系。
因此,最初的扩散传导性(diffusion conductance)非常小。在怀孕后期,由于膜扩散层的变薄以及表面积的显著扩大,通透性增加,从而使胎盘扩散显著增加,如图83-4所示。
偶尔,胎盘膜会出现“破裂”,这使得胎儿血细胞进入母体,或者更罕见的是,母体细胞进入胎儿。幸运的是,由于胎盘膜破裂导致胎儿严重出血进入母体循环的情况非常罕见。
氧气通过胎盘膜的扩散。氧气通过胎盘膜扩散的原理与通过肺膜(pulmonary membrane)扩散的原理几乎相同(详见第40章)。溶解在母体大窦血液中的氧气通过简单的扩散进入胎儿血液,这是由从母体血液到胎儿血液的氧气压力梯度驱动的。在怀孕末期,母体血液在胎盘窦中的平均氧分压(partial pressure of oxygen, Po_2)约为50mmHg,而胎儿血液在胎盘中被氧合后的平均Po_2约为30mmHg。因此,氧气通过胎盘膜扩散的平均压力梯度约为20mmHg。
图83-6。母体(蓝色曲线)和胎儿(红色曲线)血液的氧合血红蛋白解离曲线,显示在给定的血液P o_2下,胎儿血液可以携带比母体血液更多的氧气。(数据来自Metcalfe J_ Moll W, Bartels H: Gas exchange across the placenta. Fed Proc 23:775, 1964.)
人们可能会好奇,当离开胎盘的胎儿血液的Po_2仅为30mmHg时,胎儿如何获得足够的氧气。有三个原因使得即使这种低Po_2也能使胎儿血液向胎儿组织输送几乎与母体血液向母体组织输送的氧气量相当。
首先,胎儿的血红蛋白主要是胎儿血红蛋白(fetal hemoglobin),这是一种在出生前由胎儿合成的血红蛋白。图83-6显示了母体血红蛋白和胎儿血红蛋白的氧解离曲线比较,表明胎儿血红蛋白的曲线相对于母体血红蛋白向左偏移。这意味着在胎儿血液中较低的Po_2水平下,胎儿血红蛋白可以比母体血红蛋白多携带20%到50%的氧气。
其次,胎儿血液中的血红蛋白浓度比母体高约50%,这是增强向胎儿组织输送氧气量的一个更重要的因素。
第三,Bohr效应(Bohr effect),在第41章中解释了与肺中二氧化碳和氧气交换有关的内容,提供了另一种增强胎儿血液中氧气输送的机制。也就是说,血红蛋白在低Pco_2下比在高PCO_2下可以携带更多的氧气。进入胎盘的胎儿血液携带大量二氧化碳,但大部分二氧化碳从胎儿血液扩散到母体血液中。二氧化碳的丢失使胎儿血液更加碱性,而母体血液中二氧化碳的增加使其更加酸性。
这些变化增加了胎儿血液与氧气结合的能力,并减少了母体血液中的氧气结合,这迫使更多的氧气从母体血液中释放,同时增强了胎儿血液对氧气的摄取。因此,Bohr效应在母体血液中向一个方向作用,在胎儿血液中向另一个方向作用。这两种效应使得Bohr效应在这里的重要性是其在肺中氧气交换的两倍;因此,它被称为双Bohr效应(double Bohr effect)。
通过这三种方式,尽管离开胎盘的胎儿血液的Po_2仅为30mmHg,胎儿仍能够通过胎盘膜获得充足的氧气。
足月时整个胎盘对氧气的总扩散能力约为每分钟每毫米Hg氧气压力差1.2ml氧气,这与新生儿的肺相比毫不逊色。
二氧化碳通过胎盘膜的扩散。二氧化碳在胎儿组织中不断形成,与母体组织中的形成方式相同,胎儿排出二氧化碳的唯一途径是通过胎盘进入母体血液。胎儿血液中二氧化碳的分压[(PCO_2])比母体血液高2到3mmHg。这种跨膜的二氧化碳小压力梯度足以允许足够的二氧化碳扩散,因为二氧化碳在胎盘膜中的极高溶解度使其扩散速度约为氧气的20倍。
营养物质通过胎盘膜(placental membrane)的扩散。胎儿所需的其他代谢底物以与氧气相同的方式扩散到胎儿血液中。例如,在妊娠晚期,胎儿通常使用与母亲整个身体一样多的葡萄糖。为了提供如此多的葡萄糖,胎盘绒毛(placental villi)内衬的滋养层细胞(trophoblast cells)促进了葡萄糖通过胎盘膜的扩散——也就是说,葡萄糖由膜滋养层细胞中的载体分子运输。即便如此,胎儿血液中的葡萄糖水平仍比母体血液低20%至30%。
由于脂肪酸在细胞膜中的高溶解性,这些脂肪酸也从母体血液扩散到胎儿血液中,但比葡萄糖慢,因此葡萄糖更容易被胎儿用于营养。此外,酮体(ketone bodies)和钾、钠、氯离子等物质也相对容易地从母体血液扩散到胎儿血液中。
废物通过胎盘膜的排泄。二氧化碳从胎儿血液扩散到母体血液的方式相同,胎儿体内形成的其他排泄产物也通过胎盘膜扩散到母体血液中,然后与母亲的排泄产物一起排出。这些产物尤其包括非蛋白氮(nonprotein nitrogens),如尿素(urea)、尿酸(uric acid)和肌酐(creatinine)。胎儿血液中的尿素水平仅略高于母体血液,因为尿素很容易通过胎盘膜扩散。然而,肌酐的扩散不如尿素容易,胎儿血液中的浓度明显高于母体血液。因此,胎儿的排泄主要(如果不是完全)取决于胎盘膜两侧的扩散梯度及其通透性和表面积。由于胎儿血液中排泄产物的浓度高于母体血液,这些物质会不断从胎儿血液扩散到母体血液中。
妊娠中的激素因素
在妊娠期间,胎盘会形成特别大量的人绒毛膜促性腺激素(human chorionic gonadotropin)、雌激素(estrogens)、孕酮(progesterone)和人绒毛膜生长催乳素(human chorionic somatomammotropin),前三种激素(可能也包括第四种)对正常妊娠都是必不可少的。
人绒毛膜促性腺激素导致黄体(corpus luteum)持续存在并防止月经
在非妊娠女性中,月经通常发生在排卵后约14天,此时子宫的大部分子宫内膜(endometrium)从子宫壁脱落并排出体外。如果在卵子着床后发生这种情况,妊娠将终止。然而,新发育的胚胎组织分泌的人绒毛膜促性腺激素可以防止这种脱落。
在早期受精卵发育成滋养层细胞(trophoblast cells)的同时,人绒毛膜促性腺激素(human chorionic gonadotropin)由合体滋养层细胞(syncytial trophoblast cells)分泌到母体体液中,如图83-7所示。这种激素的分泌最早可以在排卵后8到9天,即囊胚(blastocyst)植入子宫内膜(endometrium)后不久,在血液中检测到。然后,分泌速率迅速上升,在妊娠10到12周左右达到最大值,并在16到20周时回落到较低水平。在整个妊娠期的剩余时间里,它都保持在这个水平。
人绒毛膜促性腺激素的功能。人绒毛膜促性腺激素是一种糖蛋白(glycoprotein),分子量约为39,000,其分子结构和功能与垂体分泌的黄体生成素(luteinizing hormone)非常相似。人绒毛膜促性腺激素最重要的功能是防止女性每月性周期结束时黄体(corpus luteum)的退化(involution)。相反,它使黄体在接下来的几个月里分泌更多的性激素——孕酮(progesterone)和雌激素(estrogens)。这些性激素阻止月经来潮,使子宫内膜继续生长并储存大量营养物质,而不是在月经中脱落。因此,在正常女性性周期中子宫内膜发育的蜕膜样细胞(decidua-like cells)在囊胚植入时变成了真正的蜕膜细胞(decidual cells)——极度肿胀且富含营养。
图83-7. 妊娠不同阶段雌激素(蓝色曲线)和孕酮(黑色曲线)的分泌速率以及人绒毛膜促性腺激素(红色曲线)的浓度。
在人绒毛膜促性腺激素的作用下,母亲卵巢中的黄体在妊娠开始后一个月左右生长到其初始大小的两倍。它持续分泌雌激素和孕酮,维持子宫内膜的蜕膜性质,这对胎儿的早期发育是必要的。
如果在妊娠约7周前切除黄体,几乎总是会发生自然流产,有时甚至到第12周。在那之后,胎盘(placenta)分泌足够量的孕酮和雌激素,以维持妊娠期的剩余时间。黄体在妊娠13到17周后缓慢退化。
人绒毛膜促性腺激素刺激男性胎儿睾丸产生睾酮(testosterone)。人绒毛膜促性腺激素还对男性胎儿的睾丸产生间质细胞刺激作用(interstitial cell–stimulating effect),导致男性胎儿在出生前产生睾酮。妊娠期间这种少量的睾酮分泌是导致胎儿生长男性性器官而不是女性性器官的原因。在妊娠末期,胎儿睾丸分泌的睾酮还导致睾丸下降到阴囊(scrotum)中。
胎盘分泌雌激素
与黄体一样,胎盘也分泌雌激素和孕酮。组织化学(histochemical)和生理学研究表明,这两种激素与大多数其他胎盘激素一样,都是由胎盘的合体滋养层细胞分泌的。
图83-7显示,在妊娠末期,胎盘雌激素的每日产量增加到母亲正常水平的约30倍。然而,胎盘分泌雌激素的方式与卵巢分泌的方式有很大不同。最重要的是,胎盘分泌的雌激素并不是在胎盘内从基本底物从头合成的。相反,它们几乎完全由母体和胎儿的肾上腺中形成的雄激素类固醇化合物——脱氢表雄酮和16-羟基脱氢表雄酮——转化而来。这些弱雄激素通过血液运输到胎盘,并由滋养层细胞转化为雌二醇、雌酮和雌三醇。胎儿肾上腺的皮质非常大,约80%由所谓的胎儿区组成,其主要功能似乎是在妊娠期间分泌脱氢表雄酮。
雌激素在妊娠中的功能。在第82章中,我们指出雌激素主要对母亲的生殖器官和相关器官发挥增殖功能。在妊娠期间,大量的雌激素导致:(1) 母亲子宫的增大,(2) 母亲乳房的增大和乳腺导管结构的生长,以及 (3) 母亲外生殖器的增大。
雌激素还松弛母亲的骨盆韧带,使骶髂关节变得相对灵活,耻骨联合变得有弹性。这些变化使胎儿更容易通过产道。有理由相信,雌激素还影响妊娠期间胎儿发育的许多一般方面——例如,通过影响早期胚胎中细胞的繁殖速率。
胎盘分泌孕酮
孕酮与雌激素一样,对于成功妊娠至关重要。除了在妊娠初期由黄体分泌适量孕酮外,胎盘在后期也会分泌大量孕酮,如图83-7所示。
孕酮的以下特殊效应对妊娠的正常进展至关重要:
- 孕酮促使子宫内膜中的蜕膜细胞发育。这些细胞在早期胚胎的营养中起重要作用。
- 孕酮降低妊娠子宫的收缩性,从而防止子宫收缩导致自然流产。
- 孕酮在植入前就促进孕体的发育,因为它特别增加母亲的输卵管和子宫的分泌,为发育中的桑椹胚(在囊胚形成前由16至32个卵裂球组成的球形团块)和囊胚提供适当的营养。孕酮还可能影响早期发育胚胎中的细胞分裂。
- 妊娠期间分泌的孕酮帮助雌激素为母亲的乳房泌乳做准备,这将在本章后面讨论。
人绒毛膜促生长催乳素
人绒毛膜促生长催乳素(human chorionic somatomammotropin)是一种分子量约为22,000的蛋白质激素,在妊娠约第5周开始由胎盘分泌。这种激素的分泌在整个妊娠期间逐渐增加,与胎盘重量成正比。尽管绒毛膜促生长催乳素的功能尚不明确,但其分泌量是其他所有妊娠激素总和的数倍。它可能具有几个重要的生理作用。
首先,当给予几种动物时,人绒毛膜促生长催乳素至少能部分促进动物乳房的发育,在某些情况下还能引起泌乳。由于这是该激素最早被发现的功能,因此最初被命名为人胎盘催乳素(human placental lactogen),并被认为具有与催乳素(prolactin)相似的功能。然而,尝试用它来促进人类泌乳并未取得成功。
其次,这种激素具有与生长激素相似的微弱作用,能以与生长激素相同的方式促进组织蛋白质的形成。它的化学结构也与生长激素相似,但促进生长所需的人绒毛膜促生长催乳素是生长激素的100倍。
第三,人绒毛膜促生长催乳素会降低母体对胰岛素的敏感性,减少葡萄糖的利用,从而使更多的葡萄糖可供胎儿使用。由于葡萄糖是胎儿生长的主要能量来源,这种激素作用的潜在重要性显而易见。
此外,该激素还能促进母体脂肪储存中游离脂肪酸的释放,从而为母体在妊娠期间的新陈代谢提供另一种能量来源。因此,人绒毛膜促生长催乳素似乎是一种对母体和胎儿具有特定营养意义的全身代谢激素。
妊娠期的其他激素因素
母体几乎所有非性腺内分泌腺对妊娠都有显著反应。这种反应主要源于母体代谢负荷的增加,但也部分源于胎盘激素对垂体和其他腺体的影响。以下是一些最显著的影响。
垂体分泌。母体的垂体前叶在妊娠期间至少增大50%,并增加促肾上腺皮质激素(ACTH)、促甲状腺激素(thyrotropin)和催乳素(prolactin)的分泌。相反,由于胎盘雌激素和孕酮的抑制作用,垂体促卵泡激素(follicle-stimulating hormone)和黄体生成素(luteinizing hormone)的分泌几乎完全被抑制。
皮质类固醇分泌增加。妊娠期间,肾上腺皮质分泌糖皮质激素(glucocorticoids)的速率适度增加。这些糖皮质激素可能有助于从母体组织中动员氨基酸,用于胎儿组织的合成。
孕妇的醛固酮(aldosterone)分泌通常增加约2倍,在妊娠末期达到峰值。这种增加,加上雌激素的作用,导致即使是正常孕妇也倾向于从肾小管重吸收过量的钠,从而导致液体潴留。
甲状腺分泌增加。母亲的甲状腺在怀孕期间通常会增大至50%,并相应增加甲状腺素(thyroxine)的分泌量。甲状腺素分泌的增加至少部分是由胎盘分泌的人绒毛膜促性腺激素(human chorionic gonadotropin)的促甲状腺作用以及胎盘分泌的少量特定甲状腺刺激激素——人绒毛膜促甲状腺素(human chorionic thyrotropin)引起的。
甲状旁腺分泌增加。母亲的甲状旁腺在怀孕期间通常会增大,尤其是在饮食中缺乏钙的情况下。这些腺体的增大会导致从母亲的骨骼中吸收钙,从而维持母亲细胞外液中钙离子浓度的正常水平,即使胎儿需要钙来骨化其自身的骨骼。在婴儿出生后的哺乳期,甲状旁腺激素的分泌甚至更多,因为成长中的婴儿比胎儿需要多倍的钙。
卵巢和胎盘分泌“松弛素(relaxin)”。卵巢的黄体(corpus luteum)和胎盘组织也会分泌一种称为松弛素的激素。在人绒毛膜促性腺激素的刺激作用下,松弛素的分泌增加,同时黄体和胎盘分泌大量的雌激素(estrogens)和孕酮(progesterone)。
松弛素是一种由48个氨基酸组成的多肽(polypeptide),分子量约为9000。当注射这种激素时,会导致发情期大鼠和豚鼠的耻骨联合(symphysis pubis)韧带松弛。这种效应在孕妇中较弱,甚至可能不存在。相反,这种作用可能主要由雌激素发挥,雌激素也会导致骨盆韧带松弛。也有人认为,松弛素在分娩时软化孕妇的宫颈。松弛素还被认为具有血管舒张作用,有助于增加包括肾脏在内的各种组织的血流量,并增加怀孕期间的静脉回流和心输出量。
母亲身体对怀孕的反应
母亲对胎儿和怀孕激素水平升高的众多反应中,最明显的是各种性器官的增大。例如,子宫从约50克增加到1100克,乳房大约增大一倍。同时,阴道增大,阴道口(introitus)开得更宽。此外,各种激素会导致孕妇外观的显著变化,有时会导致水肿(edema)、痤疮(acne)以及男性化或肢端肥大症(acromegalic)特征的出现。
孕妇的体重增加
怀孕期间的平均体重增加约为25至35磅,其中大部分增加发生在最后两个孕期。在这增加的体重中,约8磅是胎儿,4磅是羊水(amniotic fluid)、胎盘和胎膜(fetal membranes)。子宫增加约3磅,乳房增加2磅,仍然留下平均8至18磅的体重增加。其中约5磅是血液和细胞外液中的额外液体,剩下的3至13磅通常是脂肪积累。这些额外的液体在分娩后的最初几天通过尿液排出——即在胎盘失去保液激素之后。
在怀孕期间,女性通常对食物的需求大大增加,部分原因是胎儿从母体血液中摄取营养物质,部分原因是激素因素。如果没有适当的产前饮食控制,母亲的体重增加可能高达75磅,而不是通常的25到35磅。
怀孕期间的代谢
由于怀孕期间许多激素分泌增加,包括甲状腺素、肾上腺皮质激素和性激素,孕妇的基础代谢率在怀孕后半期增加约15%。因此,她经常感到过热。此外,由于她所承受的额外负担,肌肉活动所需的能量比正常情况要多。
怀孕期间的营养
到目前为止,胎儿的最大生长发生在怀孕的最后三个月;在怀孕的最后两个月,胎儿的体重几乎翻倍。通常,母亲在怀孕的最后几个月从饮食中吸收的蛋白质、钙、磷酸盐和铁不足以满足胎儿的这些额外需求。然而,为了应对这些额外需求,母亲的身体已经储存了这些物质——一些在胎盘中,但大多数在母亲的正常储存库中。
如果孕妇的饮食中没有适当的营养元素,可能会出现几种母体缺乏症,尤其是钙、磷酸盐、铁和维生素。例如,胎儿需要约375毫克的铁来形成其血液,而母亲需要额外的600毫克来形成自己的额外血液。母亲在怀孕初期的非血红蛋白铁的正常储存量通常仅为100毫克,几乎从未超过700毫克。因此,如果食物中没有足够的铁,孕妇可能会患上低色素性贫血。此外,她摄入维生素D尤为重要,因为尽管胎儿使用的钙总量很小,但如果没有维生素D,母亲的胃肠道通常很难吸收钙。最后,在婴儿出生前不久,母亲通常会补充维生素K,以便婴儿有足够的凝血酶原,以防止由分娩过程引起的出血,特别是脑出血。
图83-8. 怀孕对增加母亲血容量的影响。
怀孕期间母体循环系统的变化
怀孕期间胎盘血流和母体心输出量增加。在怀孕的最后一个月,每分钟约有625毫升的血液流经胎盘的母体循环。这种血流,加上母亲代谢的普遍增加,使母亲的心输出量在怀孕第27周时增加到比正常高30%到40%;然后,由于不明原因,尽管子宫血流很高,心输出量在怀孕的最后8周下降到仅略高于正常水平,这表明其他一些组织的血流可能减少。
孕期母体血容量增加
在妊娠末期,母体血容量比正常水平高出约30%。这种增加主要发生在妊娠的后半期,如图83-8所示。血容量增加的原因可能至少部分是由于醛固酮(aldosterone)和雌激素(estrogens)的增加,这些激素在妊娠期间显著增加,并且肾脏对液体的保留也增加。此外,骨髓变得更加活跃,产生额外的红细胞以适应多余的液体容量。因此,在婴儿出生时,母亲的循环系统中大约有1到2升的额外血液。通常只有约四分之一的血量在分娩过程中通过出血流失,从而为母亲提供了相当大的安全系数。
孕期母体呼吸增加
由于孕妇的基础代谢率(basal metabolic rate)增加以及体型增大,母亲在婴儿出生前的氧气总消耗量比正常水平高出约20%,并且相应量的二氧化碳(carbon dioxide)也会产生。这些效应导致母亲的每分钟通气量(minute ventilation)增加。此外,妊娠期间高水平的孕酮(progesterone)被认为会进一步增加每分钟通气量,因为孕酮增加了呼吸中枢对二氧化碳的敏感性。最终结果是每分钟通气量增加约50%,并且动脉PCO_2降低到比非孕妇低几毫米汞柱(mm Hg)。同时,增大的子宫向上压迫腹腔内容物,进而向上压迫膈肌(diaphragm),因此膈肌的总运动幅度减少。为了维持额外的通气量,呼吸频率增加。
孕期母体肾功能
由于液体摄入增加和排泄产物负荷增加,孕妇的尿液生成率通常略有增加。此外,肾功能发生了一些特殊的变化。
首先,由于盐和水保留激素(salt and water-retaining hormones)的增加,尤其是胎盘(placenta)和肾上腺皮质(adrenal cortex)产生的类固醇激素(steroid hormones),肾小管对钠、氯和水的重吸收能力增加了多达50%。
其次,由于肾血管扩张(renal vasodilation),正常妊娠期间肾血流量(renal blood flow)和肾小球滤过率(glomerular filtration rate)增加了多达50%。尽管妊娠期间导致肾血管扩张的机制尚不清楚,但一些研究表明,一氧化氮(nitric oxide)或卵巢激素松弛素(relaxin)水平的增加可能促成了这些变化。肾小球滤过率的增加可能至少部分是为了补偿肾小管对盐和水的重吸收增加。因此,正常孕妇通常只积累约5磅的额外水分和盐分。
羊水及其形成
正常情况下,羊水(amniotic fluid)(子宫内胎儿漂浮的液体)的体积在500ml到1升之间,但也可能只有几毫升或多达几升。平均而言,羊水中的水分每3小时更换一次,电解质钠和钾平均每15小时更换一次。大部分液体来源于胎儿的肾脏排泄。同样,胎儿胃肠道和肺部也会吸收一定量的液体。然而,即使在胎儿宫内死亡后,羊水仍会发生一定的更新,这表明部分液体是通过羊膜直接形成和吸收的。
子痫前期和子痫
约5%的孕妇会经历妊娠期高血压(pregnancy-induced hypertension),即在妊娠最后几个月内动脉血压迅速升高至高血压水平,并可能伴有大量蛋白质渗入尿液中。这种情况被称为子痫前期(preeclampsia)或妊娠毒血症(toxemia of pregnancy)。它通常表现为母亲肾脏对盐和水的过度潴留,以及体重增加、水肿和高血压的发展。此外,血管内皮功能受损,母亲身体的许多部位发生动脉痉挛,尤其是在肾脏、大脑和肝脏。肾血流量和肾小球滤过率下降,这与正常孕妇发生的变化正好相反。肾脏的影响还包括肾小球丛增厚,基底膜中含有蛋白质沉积。
图83-9. 正常妊娠期间子宫内膜螺旋动脉的重塑及子痫前期螺旋动脉未能充分重塑。在正常妊娠中,滋养层细胞(trophoblasts)迁移到母体子宫螺旋动脉中,并将其转变为更大、低阻力、高流量的血管。在子痫前期,滋养层细胞未能充分侵入螺旋动脉的内皮,导致胎盘血管狭窄和相对胎盘缺血。
已有多种尝试证明子痫前期是由胎盘或肾上腺激素的过度分泌引起的,但仍缺乏激素基础的证据。另一种理论认为,子痫前期是由于胎儿的存在导致母亲某种类型的自身免疫或过敏反应。支持这一理论的是,急性症状通常在婴儿出生后几天内消失。
证据还表明,先兆子痫(preeclampsia)是由胎盘(placenta)供血不足引发的,导致胎盘释放出引起母体血管内皮(vascular endothelium)广泛功能障碍的物质。在正常的胎盘发育过程中,滋养层细胞(trophoblasts)侵入子宫内膜(endometrium)的螺旋动脉(spiral arteries),并将母体动脉完全重塑为血流阻力低得多的更大血管(图83-9)。在先兆子痫患者中,母体螺旋动脉未能经历这些适应性变化,原因尚不清楚,导致胎盘供血不足。这种供血不足反过来又导致胎盘释放各种物质进入母体循环,引起血管内皮功能受损、肾脏血流减少、盐和水潴留过多以及血压升高。
尽管将胎盘供血减少与母体内皮功能障碍联系起来的因素尚不确定,但一些实验研究表明,炎症细胞因子(inflammatory cytokines)如肿瘤坏死因子-α(tumor necrosis factor-α)和白介素-6(interleukin-6)水平升高可能起到一定作用。阻碍血管生成(angiogenesis)的胎盘因子也被证明与炎症细胞因子增加和先兆子痫有关。例如,在先兆子痫患者的血液中,抗血管生成蛋白可溶性fms样酪氨酸激酶1(soluble fms-related tyrosine kinase 1, s-Fltl)和可溶性内皮糖蛋白(soluble endoglin)水平升高。这些物质是胎盘在缺血(ischemia)和缺氧(hypoxia)条件下释放到母体循环中的。可溶性内皮糖蛋白和s-Fltl具有多种效应,可能损害母体血管内皮功能,导致高血压、蛋白尿(proteinuria)以及先兆子痫的其他全身表现。然而,缺血胎盘释放的各种因素在导致先兆子痫患者多种心血管和肾脏异常中的确切作用仍不确定。
子痫(eclampsia)是先兆子痫的极端表现,其特征是全身血管痉挛(vascular spasm);母体出现阵挛性抽搐(clonic seizures),有时随后昏迷;肾脏输出量大大减少;肝功能异常;通常伴有极度高血压;以及全身中毒状态。它通常发生在婴儿出生前不久。如果不进行治疗,大多数子痫患者会死亡。然而,通过立即使用快速作用的血管扩张药物将动脉压降至正常水平,随后立即终止妊娠(必要时通过剖宫产(cesarean section)),即使是子痫患者的死亡率也已降至1%或更低。
分娩(PARTURITION)
临产时子宫兴奋性增加
分娩(parturition)是指婴儿的出生。在妊娠末期,子宫逐渐变得更加兴奋,直到最终产生强烈的节律性收缩,将婴儿排出。子宫活动增加的确切原因尚不清楚,但至少有两类主要效应导致了分娩所需的强烈收缩:(1) 导致子宫肌层(uterine musculature)兴奋性增加的渐进性激素变化;(2) 渐进性机械变化。
增加子宫收缩性的激素因素
雌激素与孕激素比例增加。孕激素在怀孕期间抑制子宫收缩性,从而有助于防止胎儿排出。相反,雌激素倾向于增加子宫收缩性,部分原因是雌激素增加了相邻子宫平滑肌细胞之间的间隙连接数量,但也因为其他尚不完全理解的作用。在怀孕的大部分时间里,孕激素和雌激素的分泌量逐渐增加,但从第七个月开始,雌激素的分泌继续增加,而孕激素的分泌保持稳定或可能略有下降。因此,有人推测,在怀孕末期,雌激素与孕激素的比例增加得足够多,至少部分地导致了子宫收缩性的增加。
催产素引起子宫收缩。催产素是由神经垂体分泌的一种激素,专门引起子宫收缩(见第76章)。有四个理由相信催产素在增加子宫收缩性方面在临近分娩时很重要:
- 子宫肌肉增加了其催产素受体,因此在怀孕的最后几个月里,对给定剂量的催产素的反应性增加。
- 在分娩时,神经垂体的催产素分泌率显著增加。
- 尽管切除垂体的动物仍然可以在足月时分娩,但分娩时间延长。
- 动物实验表明,子宫颈的刺激或拉伸,如在分娩时发生的那样,可以通过下丘脑的室旁核和视上核引起神经源性反射,导致后垂体(神经垂体)增加催产素的分泌。
胎儿激素对子宫的影响。胎儿的垂体分泌越来越多的催产素,这可能对刺激子宫起作用。此外,胎儿的肾上腺分泌大量的皮质醇,这是另一种可能的子宫刺激剂。此外,胎儿膜在分娩时释放高浓度的前列腺素。这些前列腺素也可以增加子宫收缩的强度。
增加子宫收缩性的机械因素
子宫肌肉的拉伸。简单地拉伸平滑肌通常会增加其收缩性。此外,由于胎儿运动而在子宫中反复发生的间歇性拉伸也可以引起平滑肌收缩。特别要注意的是,双胞胎平均比单胎早出生19天,这强调了机械拉伸在引起子宫收缩中的重要性。
子宫颈的拉伸或刺激。有理由相信,拉伸或刺激子宫颈在引起子宫收缩方面特别重要。例如,产科医生经常通过破膜来引产,使婴儿的头部比平常更强烈地拉伸子宫颈或以其他方式刺激它。
子宫颈刺激引起子宫体兴奋的机制尚不清楚。有人提出,子宫颈神经的拉伸或刺激会引发对子宫体的反射,但这种效应也可能仅仅是由于从子宫颈到子宫体的肌源性信号传递。
分娩的启动——一种正反馈机制
在怀孕期间,子宫会经历周期性的微弱且缓慢的节律性收缩,称为Braxton Hicks收缩。这些收缩通常在怀孕的第二或第三个月才会被感觉到,并在怀孕末期逐渐增强;随后,它们在几小时内突然转变为异常强烈的收缩,开始拉伸宫颈,最终迫使胎儿通过产道,从而引发分娩。这一过程称为分娩(labor),导致最终分娩的强烈收缩称为分娩收缩(labor contractions)。
我们尚不清楚是什么突然将子宫缓慢而微弱的节律性收缩转变为强烈的分娩收缩。然而,正反馈理论(positive feedback theory)认为,胎儿头部对宫颈的拉伸最终达到足以引发子宫体收缩力强烈反射性增加的程度。这会将胎儿向前推进,进一步拉伸宫颈,并对子宫体产生更多的正反馈。因此,这一过程会不断重复,直到胎儿被排出。这一理论如图83-10所示,以下观察结果支持了这一理论。
首先,分娩收缩遵循所有正反馈的原则。也就是说,一旦子宫收缩的强度超过临界值,每次收缩都会引发后续更强的收缩,直到达到最大效果。通过参考第1章中关于控制系统中正反馈的讨论,可以看出这正是所有正反馈机制在反馈增益超过临界值时的精确特性。
其次,已知有两种类型的正反馈在分娩过程中增强子宫收缩:(1) 宫颈的拉伸导致整个子宫体收缩,而由于胎儿头部的向下推力,这种收缩会进一步拉伸宫颈;(2) 宫颈的拉伸还会导致垂体分泌催产素(oxytocin),这是另一种增强子宫收缩力的方式。
图83-10. 分娩期间强烈收缩启动的理论。
总结来说,多种因素在怀孕末期增强了子宫的收缩力。最终,子宫收缩变得足够强烈,刺激子宫,尤其是宫颈,这种刺激由于正反馈进一步增强了子宫的收缩力,导致第二次子宫收缩比第一次更强,第三次比第二次更强,依此类推。一旦这些收缩变得足够强烈以引发这种类型的反馈,每次后续收缩都比前一次更强,这一过程就会持续进行直至完成。有人可能会问,许多假性分娩(false labor)的情况中,收缩逐渐增强后又逐渐减弱。需要记住的是,要使正反馈持续进行,每次新的正反馈循环必须比前一次更强。如果在分娩开始后的任何时间,某些收缩未能充分重新刺激子宫,正反馈可能会进入逆行衰退,分娩收缩也会逐渐减弱。
分娩期间的腹肌收缩
一旦分娩过程中子宫收缩变得强烈,疼痛信号既来自子宫也来自产道。这些信号除了引起痛苦外,还会在脊髓中引发神经源性反射,导致腹肌强烈收缩。腹肌的收缩大大增加了推动胎儿娩出的力量。
分娩的机制
分娩期间的子宫收缩主要从子宫底顶部开始,向下扩散到子宫体。此外,收缩的强度在子宫顶部和体部较大,但在靠近宫颈的子宫下部较弱。因此,每次子宫收缩都倾向于将胎儿推向宫颈方向。
在分娩的早期阶段,收缩可能每30分钟才发生一次。随着分娩的进展,收缩最终会频繁到每1到3分钟一次,并且收缩强度大大增加,收缩之间只有短暂的放松期。在胎儿娩出期间,子宫和腹部肌肉的联合收缩每次强烈收缩时对胎儿产生约25磅的向下力。
幸运的是,分娩收缩是间歇性的,因为强烈的收缩会阻碍甚至有时会停止通过胎盘的血流,如果收缩是连续的,会导致胎儿死亡。事实上,过度使用各种子宫刺激剂,如催产素,可能会导致子宫痉挛而不是有节奏的收缩,并可能导致胎儿死亡。
在超过95%的分娩中,头部是胎儿首先被娩出的部分,在大多数剩余的情况下,臀部首先出现。以臀部或脚先进入产道被称为臀位分娩。
头部作为楔子,随着胎儿被向下推动,打开产道的结构。胎儿娩出的第一个主要障碍是子宫颈。在怀孕末期,宫颈变软,这使得当子宫开始收缩时,宫颈能够伸展。所谓的第一产程是宫颈逐渐扩张的时期,持续到宫颈开口与胎儿头部一样大。这一阶段在第一次怀孕时通常持续8到24小时,但在多次怀孕后可能只需几分钟。
一旦宫颈完全扩张,胎膜通常会破裂,羊水突然通过阴道流失。然后胎儿的头部迅速进入产道,并在来自上方的额外力量下,继续楔入产道直到分娩发生。这被称为第二产程,它可能从多次怀孕后的1分钟到第一次怀孕的30分钟或更长时间不等。
胎盘的分离和娩出。在婴儿出生后的10到45分钟内,子宫继续收缩到越来越小的尺寸,这导致子宫壁和胎盘之间的剪切效应,从而将胎盘从其植入部位分离。胎盘的分离打开了胎盘窦并引起出血。出血量通常通过以下机制限制在平均350毫升:
- 子宫肌层中的平滑肌纤维(smooth muscle fibers)在血管穿过子宫壁时,以八字形围绕血管排列。因此,在分娩后,子宫的收缩会压迫先前为胎盘供血的血管。
- 此外,据信在胎盘分离部位形成的血管收缩性前列腺素(vasoconstrictor prostaglandins)会引起额外的血管痉挛。
分娩疼痛
每次子宫收缩时,母亲都会经历相当大的疼痛。早期分娩时的痉挛性疼痛可能主要是由于子宫内血管受压导致的子宫肌缺氧(hypoxia)引起的。当携带来自子宫的内脏感觉纤维(visceral sensory fibers)的内脏感觉下腹神经(visceral sensory hypogastric nerves)被切断时,这种疼痛不会被感受到。
在分娩的第二阶段,当胎儿通过产道排出时,宫颈拉伸、会阴拉伸以及阴道内结构的拉伸或撕裂会引起更剧烈的疼痛。这种疼痛通过体神经(somatic nerves)而不是内脏感觉神经传导到母亲的脊髓和大脑。
分娩后子宫的复旧(Involution of the Uterus After Parturition)
在分娩后的前4到5周内,子宫会复旧。其重量在1周内会减少到产后即刻重量的一半以下,并且在4周内,如果母亲哺乳,子宫可能会变得像怀孕前一样小。这种哺乳的效果是由于在哺乳的前几个月内垂体促性腺激素(pituitary gonadotropin)和卵巢激素(ovarian hormone)分泌的抑制所致,这一点将在后面讨论。在子宫早期复旧期间,子宫内膜表面的胎盘部位自溶(autolyzes),导致一种称为恶露(lochia)的阴道分泌物,最初是血性的,随后是浆液性的,总共持续约10天。此后,子宫内膜表面重新上皮化(reepithelialized),并准备好再次进行正常的非妊娠性生活。
哺乳(LACTATION)
乳房的发育(DEVELOPMENT OF THE BREASTS)
如图83-11所示,乳房在青春期开始发育。这种发育是由每月女性性周期中的雌激素(estrogens)刺激的;雌激素刺激乳房乳腺(mammary glands)的生长以及脂肪的沉积,使乳房具有质量。此外,在怀孕期间的高雌激素状态下,乳房会发生更大的生长,只有在那时,腺体组织才会完全发育以产生乳汁。
雌激素刺激乳房导管系统(Ductal System of the Breasts)的生长。在整个怀孕期间,胎盘分泌的大量雌激素导致乳房的导管系统生长和分支。同时,乳房的基质(stroma)数量增加,并且基质中沉积了大量脂肪。
对于导管系统的生长,至少还有四种其他激素也很重要:生长激素、催乳素(prolactin)、肾上腺糖皮质激素(adrenal glucocorticoids)和胰岛素。已知这些激素中的每一种都在蛋白质代谢中至少起到一定作用,这可能是它们在乳房发育中的功能的原因。
图83-11. A, 乳房及其分泌小叶(lobules)、肺泡(alveoli)和乳管(lactiferous ducts)(乳腺管)构成的乳腺(mammary gland)。B, 放大图显示了一个小叶和一个肺泡的乳汁分泌细胞(C)。
孕酮是乳腺小叶-肺泡系统完全发育所必需的。乳房最终发育为泌乳器官也需要孕酮。一旦导管系统发育完成,孕酮与雌激素以及其他上述激素协同作用,促使乳腺小叶进一步生长,肺泡萌芽,并在肺泡细胞中形成分泌特性。这些变化类似于孕酮在女性月经周期后半段对子宫内膜的分泌作用。
催乳素促进泌乳
尽管雌激素和孕酮在怀孕期间对乳房的物理发育至关重要,但这两种激素的特定作用是抑制实际的乳汁分泌。相反,催乳素具有相反的作用,促进乳汁分泌。催乳素由母亲的垂体前叶分泌,其血液中的浓度从怀孕第五周开始稳步上升,直到婴儿出生时达到正常非怀孕水平的10到20倍。这种高水平的催乳素在怀孕末期如图83-12所示。
此外,胎盘分泌大量的人绒毛膜促生长激素,可能具有催乳特性,从而在怀孕期间支持母亲垂体分泌的催乳素。即便如此,由于雌激素和孕酮的抑制作用,在婴儿出生前每天分泌的液体不超过几毫升。在分娩前几天和分娩后几天分泌的液体称为初乳;它基本上含有与乳汁相同浓度的蛋白质和乳糖,但几乎不含脂肪,其最大分泌速率约为随后乳汁分泌速率的1/100。
婴儿出生后,胎盘突然停止分泌雌激素和孕酮,使得母亲垂体分泌的催乳素的催乳作用得以发挥其自然的促乳作用,在接下来的1到7天内,乳房开始分泌大量乳汁而不是初乳。这种乳汁分泌还需要母亲其他大多数激素的适当背景分泌,但最重要的是生长激素、皮质醇、甲状旁腺激素和胰岛素。这些激素对于提供形成乳汁所需的氨基酸、脂肪酸、葡萄糖和钙是必要的。
婴儿出生后,催乳素的基础分泌水平在接下来的几周内恢复到非怀孕水平,如图83-12所示。然而,每次母亲哺乳时,从乳头到下丘脑的神经信号会导致催乳素分泌激增10到20倍,持续约1小时,这也如图83-12所示。这种催乳素作用于母亲的乳房,使乳腺在随后的哺乳期间继续向肺泡分泌乳汁。如果这种催乳素激增由于下丘脑或垂体损伤而缺失或被阻断,或者如果哺乳不继续,乳房将在大约1周内失去产奶能力。然而,如果孩子继续吸吮,乳汁生产可以持续数年,尽管通常在7到9个月后乳汁形成的速率会显著下降。
图83-12. 分娩前8周和分娩后36周雌激素、孕酮和催乳素分泌速率的变化。特别注意分娩后几周内催乳素分泌回落到基础水平,但在哺乳期间和之后会出现明显的间歇性催乳素分泌(每次约1小时)。
下丘脑分泌催乳素抑制激素。下丘脑在控制催乳素分泌中起着至关重要的作用,就像它对几乎所有其他垂体前叶激素一样。然而,这种控制在一个方面有所不同:下丘脑主要刺激所有其他激素的产生,但它主要抑制催乳素的产生。因此,下丘脑损伤或下丘脑-垂体门脉系统的阻塞通常会增加催乳素的分泌,同时抑制其他垂体前叶激素的分泌。
因此,人们认为垂体前叶催乳素的分泌完全或几乎完全由下丘脑形成的抑制因子控制,并通过下丘脑-垂体门脉系统运输到垂体前叶。这个因子有时被称为催乳素抑制激素,但它几乎可以肯定与儿茶酚胺多巴胺相同,已知多巴胺由下丘脑的弓状核分泌,可以将催乳素分泌减少多达10倍。
哺乳期母亲在分娩后数月内女性卵巢周期的抑制。在大多数哺乳期母亲中,卵巢周期(和排卵)在停止哺乳后几周内不会恢复。原因似乎是来自乳房到下丘脑的相同神经信号在哺乳期间引起催乳素分泌——无论是由于神经信号还是由于催乳素增加的后续效应——抑制了下丘脑促性腺激素释放激素的分泌。这种抑制反过来又抑制了垂体促性腺激素——黄体生成素和卵泡刺激素的形成。然而,在几个月的哺乳期后,在一些母亲(特别是那些只部分时间哺乳的母亲)中,垂体开始分泌足够的促性腺激素以恢复每月性周期,即使哺乳仍在继续。
乳汁分泌中的排出(或“下奶”)过程——催产素的功能
乳汁持续分泌到乳房的腺泡中,但它不容易从腺泡流入导管系统,因此不会持续从乳头泄漏。相反,乳汁必须从腺泡排出到导管中,婴儿才能获得。这种排出是由涉及垂体后叶激素催产素的神经和激素反射共同引起的。
当婴儿吸吮时,最初大约半分钟内几乎不会获得乳汁。感觉冲动首先必须通过体神经从乳头传递到母亲的脊髓,然后到达下丘脑,在那里它们引发神经信号,促进催产素(oxytocin)分泌,同时也会促进催乳素(prolactin)分泌。催产素通过血液被输送到乳房,在那里它促使肌上皮细胞(myoepithelial cells)(围绕在肺泡(alveoli)外壁的细胞)收缩,从而将乳汁从肺泡中以+10到20mmHg的压力挤压到导管中。随后,婴儿的吸吮才能有效地将乳汁排出。因此,在婴儿开始吸吮后的30秒到1分钟内,乳汁开始流动。这个过程被称为排乳反射(milk ejection)或下奶(milk let-down)。
吸吮一侧乳房不仅会导致该侧乳房排乳,还会导致对侧乳房排乳。特别有趣的是,母亲对婴儿的爱抚或听到婴儿的哭声通常会向下丘脑传递足够的情感信号,从而引发排乳反射。
表83-1 乳汁成分
<html><body><table><tr><td>成分</td><td>人乳(%)</td><td>牛乳(%)</td></tr><tr><td>水</td><td>88.5</td><td>87.0</td></tr><tr><td>脂肪</td><td>3.3</td><td>3.5</td></tr><tr><td>乳糖</td><td>6.8</td><td>4.8</td></tr><tr><td>酪蛋白</td><td>0.9</td><td>2.7</td></tr><tr><td>乳清蛋白及其他蛋白质</td><td>0.4</td><td>0.7</td></tr><tr><td>灰分</td><td>0.2</td><td>0.7</td></tr></table></body></html>
排乳反射的抑制。哺乳婴儿时的一个特殊问题是,许多心理因素甚至母亲全身的交感神经系统(sympathetic nervous system)刺激都可能抑制催产素分泌,从而抑制排乳反射。因此,许多母亲在分娩后必须有一段不受干扰的适应期,才能成功哺乳婴儿。
乳汁成分及哺乳对母亲造成的代谢负担
表83-1列出了人乳和牛乳的大致成分。人乳中的乳糖浓度比牛乳高约50%,但牛乳中的蛋白质浓度通常是人乳的两倍或更多。最后,人乳中的灰分(含钙和其他矿物质)仅为牛乳的三分之一。
在母亲哺乳高峰期,每天可能产生1.5升乳汁(如果母亲有双胞胎,甚至更多)。在这种程度的哺乳下,母亲会消耗大量能量;尽管乳汁的成分和热量含量取决于母亲的饮食和乳房充盈程度等因素,但每升母乳中大约含有650至750千卡(或每盎司19至22千卡)的能量。
大量的代谢底物也会从母体中流失。例如,每天约有50克脂肪进入乳汁,还有约100克乳糖(lactose),这些乳糖必须通过母体葡萄糖的转化而来。此外,每天可能会流失2至3克磷酸钙(calcium phosphate);除非母亲饮用大量牛奶并摄入足够的维生素D,否则哺乳期乳腺排出的钙和磷酸盐通常会远高于这些物质的摄入量。为了提供所需的钙和磷酸盐,甲状旁腺(parathyroid glands)会显著增大,骨骼会逐渐脱钙(decalsified)。母亲的骨骼脱钙在怀孕期间通常不是一个大问题,但在哺乳期可能会变得更加重要。
乳汁中的抗体和其他抗感染物质。乳汁不仅为新生儿提供所需的营养物质,还提供了重要的抗感染保护。例如,多种类型的抗体(antibodies)和其他抗感染物质与营养物质一起分泌到乳汁中。此外,还分泌了几种不同类型的白细胞(white blood cells),包括中性粒细胞(neutrophils)和巨噬细胞(macrophages),其中一些对可能导致新生儿致命感染的细菌特别致命。尤其重要的是能够破坏大肠杆菌(Escherichia coli)的抗体和巨噬细胞,这种细菌可能导致新生儿致命的腹泻。
当用牛奶代替母乳为婴儿提供营养时,其中的保护性物质通常价值不大,因为它们通常在人体内部环境中几分钟内就会被破坏。
胎儿和新生儿生理学
关于胎儿发育、出生后儿童的生理学以及生命早期几年的生长发育的完整讨论属于妇产科和儿科学正式课程的范畴。然而,许多生理学原理是婴儿特有的,本章将讨论其中一些更重要的原理。
胎儿的生长发育
胎盘和胎膜最初发育的速度远快于胎儿。事实上,在胚泡植入后的前2到3周内,胎儿几乎保持微观大小,但此后,如图84-1所示,胎儿的长度几乎与年龄成正比增加。在12周时,长度约为10厘米;在20周时,25厘米;在足月(40周)时,53厘米(~21英寸)。由于胎儿的重量大约与长度的立方成正比,因此重量几乎与胎儿年龄的立方成正比增加。
请注意,在图84-1中,重量在前12周内保持极小,仅在妊娠23周(5.5个月)时达到1磅。然后,在妊娠的最后三个月,胎儿体重迅速增加,因此在出生前2个月,平均体重为3磅;出生前1个月,平均体重为4.5磅;出生时,平均体重为7磅,正常婴儿的最终出生体重在正常妊娠期内从低至4.5磅到高达11磅不等。
器官系统的发育
在卵子受精后的1个月内,胎儿所有不同器官的宏观特征已经开始发育,在接下来的2到3个月内,大多数器官的细节已经建立。超过4个月后,胎儿的器官在宏观上与新生儿的器官相同。然而,每个器官的细胞发育通常远未完成,需要剩余的5个月妊娠期才能完全发育。即使在出生时,某些结构仍未完全发育,特别是在神经系统、肾脏和肝脏中,本章稍后将讨论这些内容。
循环系统。人类心脏在受精后的第四周开始跳动,收缩速率约为65次/分钟。这个速率在出生前稳步增加到约140次/分钟。
血细胞的形成。有核红细胞在胎儿发育的第三周左右开始在卵黄囊和胎盘的间皮层中形成。随后1周(4-5周)后,胎儿的间充质以及胎儿血管的内皮开始形成无核红细胞。在6周时,肝脏开始形成血细胞,在第三个月,脾脏和身体的其他淋巴组织开始形成血细胞。最后,从第三个月开始,骨髓逐渐成为红细胞的主要来源,也是大多数白细胞的来源,除了淋巴组织中持续的淋巴细胞和浆细胞生成。
呼吸系统
在胎儿期,由于羊膜腔中没有空气可供呼吸,因此无法进行呼吸。然而,从妊娠的第一孕期末开始,胎儿会尝试进行呼吸运动。触觉刺激和胎儿窒息尤其会引发这些尝试性的呼吸运动。
在妊娠的最后3到4个月,胎儿的呼吸运动主要受到抑制,原因尚不明确,肺部几乎完全处于塌陷状态。胎儿期后期呼吸的抑制可以防止肺部被胎儿胃肠道排入羊水中的胎粪和碎片所填充。此外,肺泡上皮在出生前会分泌少量液体进入肺部,从而保持肺部仅有清洁的液体。
神经系统
在妊娠的第3到第4个月,涉及脊髓甚至脑干的胎儿反射大多已经存在。然而,涉及大脑皮层的神经系统功能在出生时仍处于早期发育阶段。事实上,大脑中一些主要传导束的髓鞘化直到出生后约1年才完全完成。
胃肠道
在妊娠中期,胎儿开始摄入和吸收大量羊水,而在妊娠的最后2到3个月,胃肠功能接近正常新生儿的水平。此时,胃肠道中会不断形成少量胎粪,并从肛门排入羊水中。胎粪部分由吞咽的羊水残渣组成,部分由粘液、上皮细胞以及胃肠道黏膜和腺体的排泄物残渣组成。
图84-1. 胎儿的生长。
肾脏
胎儿的肾脏在妊娠的第二孕期开始排泄尿液,胎儿尿液约占羊水的70%到80%。胎儿肾脏发育异常或肾功能严重受损会大大减少羊水的形成(羊水过少),并可能导致胎儿死亡。
尽管胎儿的肾脏能够形成尿液,但调节胎儿细胞外液容量和电解质平衡(尤其是酸碱平衡)的肾脏控制系统在胎儿期后期几乎不存在,直到出生后几个月才完全发育成熟。
胎儿代谢
胎儿主要利用葡萄糖作为能量来源。胎儿具有较高的脂肪和蛋白质储存能力,其中大部分(如果不是全部)脂肪是由葡萄糖合成的,而不是直接从母体血液中吸收的。除了这些一般情况外,胎儿代谢还涉及钙、磷酸盐、铁和一些维生素的特殊问题。
钙和磷酸盐的代谢
图84-2显示了胎儿体内钙和磷酸盐的积累速率,表明在妊娠期间,平均胎儿体内积累了约22.5克钙和13.5克磷。其中约一半是在妊娠的最后4周内积累的,这与胎儿骨骼快速骨化和胎儿体重快速增加的时期相吻合。
在胎儿生命的早期阶段,骨骼相对未骨化(ossification),主要由软骨基质(cartilaginous matrix)组成。骨化通常要到怀孕第四个月之后才会发生。
特别需要注意的是,胎儿在妊娠期间所需的钙和磷酸盐总量仅占母体骨骼中这些物质总量的约2%,因此这些物质从母体的流失是极少的。更大的流失发生在出生后的哺乳期。
铁的积累
图84-2还显示,铁在胎儿体内的积累速度甚至比钙和磷酸盐更快。大部分铁以血红蛋白(hemoglobin)的形式存在,血红蛋白早在卵子受精后的第三周就开始形成。
图84-2. 妊娠不同阶段胎儿体内铁、钙和磷的储存情况。
在卵子着床之前,少量的铁就已经集中在母体的子宫孕前内膜(progestational endometrium)中;这些铁被滋养层细胞(trophoblastic cells)摄取到胚胎中,并用于形成早期的红细胞。在完全发育的胎儿中,约三分之一的铁通常储存在肝脏中。这些铁可以在出生后几个月内被新生儿用于形成额外的血红蛋白。
维生素的利用和储存
胎儿对维生素的需求与成人一样多,在某些情况下甚至更多。一般来说,维生素在胎儿体内的功能与成人相同,如第72章所述。然而,应特别提到几种维生素的特殊功能。
B族维生素,尤其是维生素B_12和叶酸(folic acid),对于红细胞和神经组织的形成以及胎儿的整体生长是必需的。
维生素C对于细胞间物质(intercellular substances)的适当形成是必要的,尤其是骨基质和结缔组织纤维。
维生素D对于胎儿的正常骨骼生长是必要的,但更重要的是,母体需要它来从胃肠道充分吸收钙。如果母体体液中有足够的维生素D,胎儿肝脏会储存大量的维生素,供新生儿在出生后几个月内使用。
维生素E的功能机制尚不完全清楚,但它对于早期胚胎的正常发育是必要的。在实验室动物中,如果缺乏维生素E,通常会在怀孕早期发生自然流产(spontaneous abortion)。
胎儿肝脏利用维生素K来形成因子VII(Factor VII)、凝血酶原(prothrombin)和其他几种凝血因子。当母体缺乏维生素K时,胎儿和母体中的因子VII和凝血酶原也会不足。由于大部分维生素K是由母体结肠中的细菌作用形成的,新生儿在出生后的第一周左右没有足够的维生素K来源,直到新生儿的正常结肠菌群建立。因此,胎儿肝脏中至少储存少量来自母体的维生素K有助于预防胎儿出血,特别是在头部通过产道挤压时发生的脑出血。
婴儿对宫外生活的适应
呼吸的开始。出生对婴儿最明显的影响是与母亲胎盘连接的丧失,因此也失去了代谢支持。婴儿需要立即进行的最重要的适应之一就是开始呼吸。
出生时呼吸的原因。在母亲未被麻醉剂抑制的情况下正常分娩后,婴儿通常会在几秒钟内开始呼吸,并在出生后不到1分钟内形成正常的呼吸节律。胎儿迅速开始呼吸表明,呼吸是由突然暴露于外界环境引发的,这可能是由于出生过程中轻微的窒息状态以及突然冷却的皮肤产生的感觉冲动所致。对于没有立即呼吸的婴儿,身体会逐渐变得更加缺氧和高碳酸血症,这为呼吸中枢提供了额外的刺激,通常会在出生后额外的一分钟内引发呼吸。
出生时呼吸延迟或异常——缺氧的危险。如果母亲在分娩过程中被全身麻醉剂抑制,这也会至少部分麻醉胎儿,呼吸的开始可能会延迟几分钟,从而证明了尽可能少使用麻醉的重要性。此外,许多在分娩过程中头部受伤或经历长时间分娩的婴儿呼吸缓慢,有时甚至完全不呼吸。这可能是由于两种可能的影响:(1) 少数婴儿颅内出血或脑挫伤导致脑震荡综合征,呼吸中枢严重抑制;(2) 可能更为重要的是,分娩过程中长时间的胎儿缺氧会导致呼吸中枢的严重抑制。
分娩过程中缺氧的原因。分娩过程中缺氧可能是由于:(1) 脐带受压;(2) 胎盘早剥;(3) 子宫过度收缩,可能切断母体流向胎盘的血流;或 (4) 母亲过度麻醉,甚至抑制了她血液的氧合。
婴儿能耐受的缺氧程度。在成人中,仅4分钟不呼吸通常会导致死亡,但新生儿在出生后可能存活长达10分钟而不呼吸。如果呼吸延迟超过8到10分钟,通常会引发永久性和严重的脑损伤。实际上,病变主要发生在丘脑、下丘和其他脑干区域,从而永久影响身体的许多运动功能。
出生时肺的扩张。出生时,肺泡壁最初由于充满其中的粘稠液体的表面张力而塌陷。通常需要超过25mmHg的负吸气压力来对抗这种表面张力的影响,并首次打开肺泡。然而,一旦肺泡打开,进一步的呼吸可以通过相对较弱的呼吸运动实现。幸运的是,正常新生儿的第一次吸气非常有力;它们通常能够在胸膜腔内产生高达60mmHg的负压。
图84-3. 新生儿出生后立即的肺压力-容积曲线(“顺应性”曲线),显示了生命最初两次呼吸所需的极端力量,以及在出生后40分钟内发展出接近正常的顺应性曲线。(修改自Smith CA: The first breath. Sci Am 209:32, 1963. 版权所有1963年,Scientific American, Inc.)
图84-3显示了在呼吸开始时打开肺部所需的巨大负性胸膜内压。在图的顶部,显示了出生后第一次呼吸的压力-容积曲线(“顺应性”曲线)。首先观察到,曲线的下部从零压力点开始并向右侧移动。曲线显示,直到负压达到-40厘米水柱(-30mmHg)时,肺内的空气量几乎保持为零。然后,随着负压增加到-60厘米水柱,大约40~ml的空气进入肺部。为了使肺部放气,由于细支气管中液体的粘性阻力,需要相当大的正压,大约+40厘米水柱。
注意到第二次呼吸要容易得多,所需的负压和正压要小得多。直到出生后约40分钟,呼吸才完全正常,如第三条顺应性曲线所示,其形状与正常成人的曲线相比具有优势,如第38章所示。
当表面活性物质分泌不足时会发生呼吸窘迫综合征。在一小部分婴儿中,尤其是早产儿和糖尿病母亲的婴儿,在出生后的最初几小时到几天内会出现严重的呼吸窘迫,一些婴儿在接下来的几天内死亡。这些婴儿死亡时,肺泡中含有大量的蛋白质液体,几乎就像纯血浆从毛细血管渗漏到肺泡中一样。液体中还含有脱落的肺泡上皮细胞。这种情况被称为透明膜病,因为肺的显微镜切片显示填充肺泡的物质看起来像透明膜。
呼吸窘迫综合征的一个特征性发现是呼吸道上皮细胞未能分泌足够的表面活性物质(surfactant),这是一种通常分泌到肺泡中的物质,能够降低肺泡液的表面张力,从而使肺泡在吸气时容易打开。表面活性物质分泌细胞(II型肺泡上皮细胞)直到妊娠的最后1到3个月才开始分泌表面活性物质。因此,许多早产儿和一些足月儿出生时没有分泌足够表面活性物质的能力,这导致肺泡的塌陷倾向和肺水肿的发展。表面活性物质在预防这些效应中的作用在第38章中讨论。
出生时的循环调整
与出生时开始呼吸同样重要的是立即发生的循环调整,这些调整使得足够的血液能够流经肺部。此外,生命最初几小时内的循环调整导致越来越多的血液流经婴儿的肝脏,而在此之前,肝脏的血液流量很少。为了描述这些重新调整,我们首先考虑胎儿循环的解剖结构。
胎儿循环的特定解剖结构
由于胎儿时期肺部主要无功能,而肝脏仅部分功能,因此胎儿心脏不需要将大量血液泵入肺部或肝脏。然而,胎儿心脏必须将大量血液泵入胎盘。因此,特殊的解剖安排使得胎儿循环系统的运作方式与新生儿的循环系统大不相同。
首先,如图84-4所示,从胎盘通过脐静脉返回的血液经过静脉导管(ductus venosus),主要绕过肝脏。然后,从下腔静脉进入右心房的大部分血液沿着右心房后部的直线路径通过卵圆孔(foramen ovale)直接进入左心房。因此,来自胎盘的高氧血液主要进入心脏的左侧,而不是右侧,并由左心室主要泵入头部和前肢的动脉。
图84-4. 胎儿循环的组织结构。
从上腔静脉进入右心房的血液向下通过三尖瓣(tricuspid valve)进入右心室。这部分血液主要是来自胎儿头部区域的低氧血液。它由右心室泵入肺动脉,然后主要通过动脉导管(ductus arteriosus)进入降主动脉,再通过两条脐动脉进入胎盘,在那里低氧血液被氧合。
图84-5显示了胎儿心脏泵出的总血液通过不同血管回路的相对百分比。大约55%的血液通过胎盘,只有45%的血液通过胎儿的所有组织。此外,在胎儿时期,只有12%的血液流经肺部,而在出生后,几乎所有血液都流经肺部。
出生时胎儿循环的变化
出生时胎儿循环的基本变化在第23章中讨论,涉及动脉导管和卵圆孔的先天性异常,这些异常在少数人中会持续终生。以下部分简要描述了这些变化。
出生时肺血管阻力降低和体循环血管阻力增加。出生时循环的主要变化首先是胎盘大量血流的丧失,这大约使体循环血管阻力翻倍。体循环血管阻力的这种翻倍增加了主动脉压力,以及左心室和左心房的压力。
图84-5. 胎儿循环系统示意图,显示血液流向不同血管区域的相对分布。数字代表心脏两侧总输出量中流经每个特定区域的百分比。
其次,由于肺的扩张,肺血管阻力( pulmonary vascular resistance )大大降低。在未扩张的胎儿肺中,由于肺体积小,血管受到压迫。一旦扩张,这些血管不再受压,血流阻力降低数倍。此外,在胎儿期,肺部的缺氧( hypoxia )导致肺血管的紧张性血管收缩( tonic vasoconstriction ),但当肺部通气消除缺氧时,血管扩张( vasodilation )发生。所有这些变化共同使肺部的血流阻力降低多达5倍,从而降低了肺动脉压( pulmonary arterial pressure )、右心室压( right ventricular pressure )和右心房压( right atrial pressure )。
卵圆孔( foramen ovale )的闭合。出生后,由于肺和体循环阻力( pulmonary and systemic resistances )的变化,右心房压降低,左心房压升高,导致血液试图通过卵圆孔从左心房流向右心房,而不是像胎儿期那样从右心房流向左心房。因此,位于房间隔左侧卵圆孔上方的小瓣膜( valve )关闭了这个开口,从而阻止了通过卵圆孔的进一步血流。
在三分之二的人中,瓣膜在几个月到几年内与卵圆孔粘连,形成永久性闭合。然而,即使没有发生永久性闭合——这种情况称为卵圆孔未闭( patent foramen ovale )——在正常情况下,左心房压通常比右心房压高2到4毫米汞柱( mmHg ),这种反向压力使瓣膜保持关闭状态。
动脉导管( ductus arteriosus )的闭合。动脉导管也会闭合,但原因不同。首先,体循环阻力增加使主动脉压升高,而肺循环阻力降低使肺动脉压降低。因此,出生后,血液开始通过动脉导管从主动脉反向流入肺动脉,而不是像胎儿期那样从肺动脉流入主动脉。然而,仅几小时后,动脉导管的肌壁显著收缩,通常在1到8天内,收缩足以停止所有血流。这被称为动脉导管的功能性闭合( functional closure )。然后,在接下来的1到4个月内,动脉导管通常由于纤维组织( fibrous tissue )向管腔内生长而解剖性闭塞( anatomically occluded )。
动脉导管闭合的原因与流经导管的血液氧合( oxygenation )增加以及前列腺素E2( prostaglandin E2, PGE2 )的血管松弛作用丧失有关。在胎儿期,导管血液的氧分压( partial pressure of oxygen, Po2 )仅为15到20毫米汞柱( mmHg ),但在出生后几小时内增加到约100毫米汞柱( mmHg )。此外,实验表明,导管壁平滑肌的收缩程度与氧的可用性高度相关。
在数千名婴儿中,有一例的动脉导管未能闭合,导致动脉导管未闭(patent ductus arteriosus),其后果将在第23章讨论。未能闭合的原因被推测为由于导管壁中血管舒张性前列腺素(vasodilating prostaglandins),尤其是PGE2,引起的导管过度扩张所致。事实上,使用阻断前列腺素合成的药物吲哚美辛(indomethacin)通常会导致导管闭合。
静脉导管(ductus venosus)的闭合。在胎儿期,来自胎儿腹部的门静脉血与来自脐静脉的血液汇合,这些血液通过静脉导管直接流入心脏下方但位于肝脏上方的下腔静脉,从而绕过肝脏。
出生后,脐静脉的血流立即停止,但大部分门静脉血液仍流经静脉导管,只有少量通过肝脏的通道。然而,在1到3小时内,静脉导管的肌壁强烈收缩并关闭了这一血流通道。结果,门静脉压力从接近0上升到6到10mmHg,这足以迫使门静脉血液流经肝窦。尽管静脉导管很少未能闭合,但其闭合的机制尚不明确。
新生儿的营养
在出生前,胎儿几乎所有的能量都来自从母体血液中获得的葡萄糖。出生后,婴儿体内以肝糖原和肌糖原形式储存的葡萄糖量仅足以满足婴儿几小时的需求。新生儿的肝脏在出生时功能还远未完善,这阻碍了显著的糖异生。因此,婴儿的血糖浓度在第一天经常下降到低至30到40mg/dl血浆,这不到正常值的一半。幸运的是,适当的机制使婴儿能够利用其储存的脂肪和蛋白质进行代谢,直到2到3天后可以提供母乳。
由于婴儿的体液周转率平均是成人的七倍,而母乳供应需要几天时间才能建立,因此新生儿获得足够液体供应也常常伴随特殊问题。通常,婴儿的体重在出生后的2到3天内会减少5%到10%,有时甚至多达20%。这种体重减轻主要是体液的流失,而不是固体物质的减少。
新生儿的特殊功能问题
新生儿的一个重要特征是各种激素和神经控制系统的稳定性较差。这种不稳定性部分是由于身体各器官的发育不成熟,部分是由于控制系统尚未适应新的生活方式。
呼吸系统
新生儿正常的呼吸频率约为每分钟40次,每次呼吸的潮气量(tidal air)平均为16~ml,这使得每分钟的总呼吸量达到640ml/min——相对于体重而言,大约是成人的两倍。婴儿肺的功能残气量(functional residual capacity)相对于体重而言仅为成人的一半。这种差异导致如果呼吸频率减慢,新生儿的血气体浓度会出现过度的周期性波动,因为正是肺中的残余空气缓冲了血气体的变化。
循环
血容量。新生儿出生后的血容量平均约为300ml,但如果婴儿在出生后几分钟内仍与胎盘相连,或者通过挤压脐带将血液从脐带血管中挤入婴儿体内,则会有额外的75ml血液进入婴儿体内,使总血容量达到375ml。随后,在接下来的几小时内,血液中的液体会流失到新生儿的组织间隙中,这会增加血细胞比容(hematocrit),但血容量会再次恢复到正常值约300~ml。一些儿科医生认为,通过挤压脐带获得的额外血容量可能导致轻度肺水肿(pulmonary edema)并伴随一定程度的呼吸窘迫(respiratory distress),但额外的红细胞对婴儿也可能是有益的。
心输出量。新生儿的心输出量(cardiac output)平均为500ml/min,与呼吸和身体代谢一样,相对于体重而言大约是成人的两倍。偶尔会有婴儿出生时心输出量特别低,这是由于出生时胎盘出血导致大量血容量流失所致。
动脉压。出生后第一天的动脉压(arterial pressure)平均约为收缩压70mmHg和舒张压50mmHg,并在接下来的几个月内缓慢增加到约90/60mmHg。随后几年内,动脉压会以更慢的速度上升,直到青春期达到成人的115/70mmHg。
血液特性。新生儿的红细胞计数(red blood cell count)平均约为每立方毫米400万。如果通过挤压脐带将血液挤入婴儿体内,红细胞计数在出生后的最初几小时内会增加50万到75万,使红细胞计数达到每立方毫米约475万,如图84-6所示。然而,在出生后的最初几周内,婴儿体内几乎没有新的红细胞生成,这可能是由于胎儿时期的缺氧刺激(hypoxic stimulus)不再存在,无法刺激红细胞生成。因此,如图84-6所示,红细胞计数在6到8周龄时平均下降到每立方毫米不到400万。从那时起,婴儿活动量的增加为红细胞计数提供了适当的刺激,使其在接下来的2到3个月内恢复到正常水平。出生后,新生儿的白细胞计数(white blood cell count)约为每立方毫米45,000,大约是正常成人的五倍。
图84-6. 生命最初16周内红细胞计数和血清胆红素浓度的变化,显示在6至12周时出现生理性贫血(physiological anemia),在最初2周内出现生理性高胆红素血症(physiological hyperbilirubinemia)。
新生儿黄疸(Neonatal Jaundice)和胎儿成红细胞增多症(Erythroblastosis Fetalis)。胎儿体内形成的胆红素(bilirubin)可以穿过胎盘进入母体,并通过母体的肝脏排出。出生后,新生儿排出胆红素的唯一途径是通过其自身的肝脏,而新生儿的肝脏在出生后第一周左右功能较差,无法将大量胆红素与葡萄糖醛酸(glucuronic acid)结合以排入胆汁。因此,血浆胆红素浓度从正常值小于1 mg/dl上升到出生后3天内的平均5~mg/dl,然后随着肝脏功能的恢复逐渐回落到正常水平。这种效应称为生理性高胆红素血症(physiological hyperbilirubinemia),如图84-6所示,它与婴儿皮肤尤其是眼巩膜(sclerae)的轻度黄疸(jaundice)(发黄)相关,持续一到两周。
然而,迄今为止,严重新生儿黄疸最重要的异常原因是胎儿成红细胞增多症(erythroblastosis fetalis),这将在第33章和第36章中详细讨论,涉及胎儿和母亲之间Rh因子的不相容性。简而言之,患有成红细胞增多症的婴儿从父亲那里遗传了Rh阳性的红细胞,而母亲是Rh阴性的。母亲随后对胎儿血细胞中的Rh阳性因子(一种蛋白质)产生免疫,她的抗体破坏胎儿的红细胞,释放大量胆红素进入胎儿的血浆,并常常由于缺乏足够的红细胞而导致胎儿死亡。在现代产科治疗出现之前,每50至100名新生儿中就有1例发生轻度或严重的这种情况。
体液平衡(Fluid Balance)、酸碱平衡(Acid-Base Balance)和肾功能(Renal Function)
新生儿液体摄入和排泄的速率是成人的七倍(相对于体重而言),这意味着即使液体摄入或输出的轻微百分比变化也可能导致快速发展的异常。
婴儿的代谢速率也是成人的两倍(相对于体重而言),这意味着正常情况下会形成两倍的酸,导致婴儿倾向于酸中毒。肾脏的功能发育直到出生后第一个月结束时才完全成熟。例如,新生儿的肾脏只能将尿液浓缩到血浆渗透压(osmolality)的1.5倍,而成人可以将尿液浓缩到血浆渗透压的三到四倍。因此,考虑到肾脏的不成熟,加上婴儿显著的体液周转和酸的快速形成,我们可以很容易理解,婴儿期最重要的问题之一是酸中毒、脱水(dehydration),以及较少见的过度水合(overhydration)。
肝功能(Liver Function)
在生命的最初几天,新生儿的肝功能可能相当不足,表现为以下效应:
- 新生儿的肝脏与葡萄糖醛酸(glucuronic acid)结合胆红素的能力较差,因此在生命的最初几天只能排出少量胆红素。
- 由于新生儿的肝脏在形成血浆蛋白(plasma proteins)方面存在缺陷,血浆蛋白浓度在出生后的前几周内下降至比年长儿童低15%至20%。偶尔,蛋白质浓度下降得如此之低,以至于会发生低蛋白血症性水肿(hypoproteinemic edema)。
- 新生儿的肝脏在糖异生功能方面特别不足。因此,未进食的新生儿血糖水平下降至约30至40mg/dl(~40%的正常值),婴儿必须主要依赖其储存的脂肪来获取能量,直到能够获得足够的喂养。
- 新生儿的肝脏通常也形成过少的正常血液凝固所需的血液因子(blood factors)。
能量食物和营养的消化、吸收和代谢
一般来说,新生儿消化、吸收和代谢食物的能力与年长儿童没有区别,但有以下几个例外:
- 新生儿的胰腺淀粉酶(pancreatic amylase)分泌不足,因此新生儿对淀粉的利用不如年长儿童充分。
- 从胃肠道吸收脂肪的能力略低于年长儿童。因此,高脂肪含量的牛奶(如牛乳)往往吸收不良。
- 由于肝脏在至少出生后的第一周内功能不完善,血液中的葡萄糖浓度不稳定且较低。
新生儿特别擅长合成和储存蛋白质。事实上,在充足的饮食条件下,摄入的氨基酸中高达90%用于形成体蛋白,这一比例远高于成人。
图84-7. 新生儿出生后体温的下降,以及生命最初几天体温的不稳定性。
代谢率增加和体温调节不良。新生儿相对于体重的正常代谢率约为成人的两倍,这也解释了为什么婴儿相对于体重的心输出量和每分钟呼吸量是成人的两倍。
由于体表面积相对于体质量较大,身体容易散失热量。因此,新生儿的体温,特别是早产儿的体温,容易下降。图84-7显示,即使是正常婴儿的体温在出生后的最初几小时内也常常下降几度,但在7至10小时内恢复正常。然而,生命早期的体温调节机制仍然不完善,导致体温出现显著偏差,如图84-7所示。
生命最初几周的营养需求
出生时,如果母亲有充足的饮食,新生儿通常处于完全的营养平衡状态。此外,如果饮食中提供了适当的营养素,胃肠系统的功能通常足以消化和吸收婴儿的所有营养需求。然而,婴儿的早期营养中存在三个具体问题。
钙和维生素D的需求
由于新生儿在出生时处于骨骼快速骨化(ossification)的阶段,因此在婴儿期需要持续供应钙。通常,牛奶的日常饮食足以提供足够的钙。然而,在缺乏维生素D的情况下,胃肠道对钙的吸收较差。因此,在仅几周内,缺乏维生素D的婴儿可能会发展为严重的佝偻病(rickets)。这在早产儿(premature babies)中尤为明显,因为他们的胃肠道对钙的吸收效率甚至低于正常婴儿。
饮食中铁的需求
如果母亲在饮食中摄入了足够的铁,婴儿的肝脏通常会在出生后储存足够的铁,以维持4到6个月的血细胞生成。然而,如果母亲的饮食中铁摄入不足,婴儿在出生后约3个月可能会出现严重的贫血(anemia)。为了防止这种情况发生,建议在婴儿出生后的第二或第三个月开始喂食含有适量铁的蛋黄,或以其他形式补充铁。
婴儿维生素C缺乏
抗坏血酸(ascorbic acid, 维生素C)在胎儿组织中不会大量储存,但它是婴儿软骨、骨骼和其他细胞间结构正常形成所必需的。然而,除非母亲有严重的维生素C缺乏,母乳通常能提供足够的维生素C。牛奶中的维生素C含量仅为母乳的四分之一。在某些情况下,医生会为缺乏维生素C的婴儿开具橙汁或其他抗坏血酸来源的处方。
免疫力
新生儿从母亲那里继承了一定程度的免疫力,因为许多蛋白质抗体(antibodies)会从母亲的血液通过胎盘扩散到胎儿体内。然而,新生儿自身不会显著形成抗体。到第一个月结束时,婴儿的γ球蛋白(gamma globulins)(含有抗体)会减少到原来水平的一半以下,免疫力相应下降。此后,婴儿自身的免疫系统开始形成抗体,γ球蛋白浓度在12到20个月时基本恢复到正常水平。
尽管出生后不久γ球蛋白水平下降,但从母亲那里继承的抗体可以在大约6个月内保护婴儿免受大多数主要儿童传染病的侵害,包括白喉(diphtheria)、麻疹(measles)和脊髓灰质炎(polio)。因此,通常在6个月之前不需要对这些疾病进行免疫接种。然而,从母亲那里继承的百日咳(whooping cough)抗体通常不足以保护新生儿;因此,为了完全安全,婴儿需要在出生后第二个月左右开始接种百日咳疫苗。医疗保健专业人员建议儿童在2、4、6、15至18个月以及4至6岁时接种五剂联合疫苗,包括白喉、破伤风(tetanus)和百日咳(DTaP)疫苗。
过敏(Allergy)
新生儿很少出现过敏反应。然而,几个月后,当婴儿自身的抗体开始形成时,可能会出现极端的过敏状态,有时会导致严重的湿疹(eczema)、胃肠道异常(gastrointestinal abnormalities),甚至过敏性休克(anaphylaxis)。随着孩子年龄的增长和免疫力的进一步提高,这些过敏表现通常会消失。免疫与过敏的关系将在第35章讨论。
内分泌问题(Endocrine Problems)
通常,婴儿的内分泌系统在出生时已经高度发育,婴儿很少表现出任何即刻的内分泌异常。然而,在以下特殊情况下,婴儿的内分泌学非常重要:
- 如果怀孕的母亲怀有女婴并接受了雄激素(androgenic hormone)治疗,或者在怀孕期间发生了雄激素肿瘤,孩子出生时性器官会出现高度男性化,从而导致一种两性畸形(hermaphroditism)。
- 怀孕期间胎盘和母亲腺体分泌的性激素偶尔会导致新生儿在生命的最初几天形成乳汁。有时乳房会发炎,或发生感染性乳腺炎(infectious mastitis)。
- 未接受治疗的糖尿病母亲所生的婴儿,其胰腺中的胰岛(Langerhans islets)会出现显著的肥大和功能亢进。因此,婴儿的血糖浓度可能在出生后不久降至低于20mg/dl。幸运的是,与成人不同,新生儿很少因这种低血糖浓度而发生胰岛素休克(insulin shock)或昏迷。母亲患有2型糖尿病(type 2 diabetes)是导致巨大婴儿的最常见原因。母亲的2型糖尿病与对胰岛素代谢效应的抵抗和血浆胰岛素浓度的代偿性增加有关。高水平的胰岛素被认为会刺激胎儿生长并导致出生体重增加。胎儿获得的葡萄糖和其他营养物质的增加也可能促进胎儿生长。然而,胎儿体重的增加主要是由于体脂的增加;通常身长几乎没有增加,尽管某些器官的大小可能会增加(器官肥大(organomegaly))。当母亲患有未控制的1型糖尿病(type 1 diabetes)(由胰岛素分泌不足引起)时,由于母亲的代谢缺陷,胎儿生长可能会受到阻碍,新生儿的生长和组织成熟也常常受到阻碍。此外,宫内死亡率很高。在足月出生的胎儿中,死亡率仍然很高。三分之二的死亡婴儿死于呼吸窘迫综合征(respiratory distress syndrome),这在本章前面已经描述过。
- 偶尔会有孩子出生时肾上腺皮质功能低下(hypofunctional adrenal cortices),这通常是由于肾上腺发育不全(agenesis of the adrenal glands)或衰竭性萎缩(exhaustion atrophy)引起的,当肾上腺受到过度刺激时可能会发生这种情况。
- 如果孕妇患有甲状腺功能亢进(hyperthyroidism)或接受了过量的甲状腺激素治疗,婴儿出生时可能会出现暂时性的甲状腺分泌不足(hyposecreting thyroid gland)。相反,如果女性在怀孕前切除了甲状腺,她的垂体在妊娠期间可能会分泌大量的促甲状腺激素(thyrotropin),孩子出生时可能会出现暂时性的甲状腺功能亢进(hyperthyroidism)。
- 在缺乏甲状腺激素分泌的胎儿中,骨骼生长不良,并伴有智力发育迟缓,导致称为克汀病性侏儒症(cretin dwarfism)的病症,这将在第77章中讨论。
早产的特殊问题
上述新生儿期的所有问题在早产儿中都会严重加剧。这些问题可以分为以下两类:(1) 某些器官系统的不成熟性(immaturity)和 (2) 不同稳态控制系统的稳定性不足(instability)。近年来,医疗护理的进步极大地改善了早产儿的预后。在现代医疗护理下,“极早产儿”(extremely preterm,妊娠不足28周出生)的存活率约为80%至90%。然而,随着妊娠周数低于28周,存活率逐渐下降;在妊娠22周或更短时,早产儿很少能存活。
早产儿的不成熟发育
早产儿的几乎所有器官系统都不成熟,如果要挽救早产儿的生命,需要特别注意这些系统。
呼吸系统。极早产儿的呼吸系统尤其可能发育不全。与婴儿的体型相比,肺的肺活量(vital capacity)和功能残气量(functional residual capacity)特别小。此外,表面活性物质(surfactant)的分泌减少或缺失。因此,呼吸窘迫综合征(respiratory distress syndrome)是常见的死亡原因。此外,早产儿的功能残气量低通常与Cheyne-Stokes型周期性呼吸(periodic breathing)有关。
胃肠功能。早产儿的另一个主要问题是摄入和吸收足够的食物。在早产超过2个月的婴儿中,消化和吸收系统几乎总是不足。脂肪的吸收非常差,因此早产儿必须采用低脂饮食。此外,由于早产儿对钙的吸收异常困难,在问题被发现之前可能会发展为严重的佝偻病(rickets)。因此,必须特别注意钙和维生素D的摄入。
其他器官的功能。早产儿中其他器官系统的不成熟性也常导致严重问题,包括:(1) 肝脏不成熟,导致中间代谢(intermediary metabolism)不良,并常因凝血因子(coagulation factors)生成不足而导致出血倾向;(2) 肾脏不成熟,特别是其排除体内酸的能力不足,从而使婴儿易患酸中毒和严重的体液平衡异常;(3) 骨髓造血机制(blood-forming mechanism)不成熟,导致贫血迅速发生;(4) 淋巴系统生成γ球蛋白(gamma globulin)减少,常导致严重感染。
早产儿稳态控制系统的不稳定性
早产儿不同器官系统的不成熟导致体内稳态机制的高度不稳定性。例如,酸碱平衡可能会发生巨大变化,尤其是在食物摄入量不时变化的情况下。同样,由于肝脏发育不成熟,血液蛋白浓度通常较低,常常导致低蛋白血症性水肿(hypoproteinemic edema)。婴儿无法调节其钙离子浓度可能会导致低钙血症性手足搐搦(hypocalcemic tetany)。此外,血糖浓度可能在极宽的范围内变化,从20到超过100mg/dl_:,主要取决于喂养的规律性。
体温不稳定性。早产儿的一个重要问题是无法维持正常体温。早产儿的体温往往会接近周围环境的温度。在正常室温下,婴儿的体温(以华氏度计)可能会稳定在90度以下,甚至低至80度。研究表明,体温维持在96\circF [(35.5℃])以下与特别高的死亡率相关,这解释了在治疗早产儿时几乎必须使用保温箱的原因。
早产儿因过量氧疗导致失明的危险
由于早产儿经常出现呼吸窘迫,氧疗常被用于治疗这些婴儿。然而,过量使用氧气治疗早产儿,尤其是在早期早产时,可能导致失明,因为过多的氧气会阻止视网膜中新血管的生长。然后,当停止氧疗时,血管试图弥补失去的时间,大量血管在玻璃体中生长,阻挡光线从瞳孔到达视网膜。随后,这些血管被纤维组织取代,而这些纤维组织本应位于眼睛的透明玻璃体中。
图84-8。从婴儿期到20岁男孩(蓝色曲线)和女孩(红色曲线)的平均身高。
这种情况被称为晶状体后纤维增生症(retrolental fibroplasias),会导致永久性失明。因此,避免使用高浓度呼吸氧气治疗早产儿尤为重要。生理学研究表明,早产儿在呼吸空气中氧气浓度高达40%时通常是安全的,但一些儿童生理学家认为,只有在呼吸空气中氧气浓度正常时才能完全确保安全。
儿童的生长与发育
新生儿期后儿童的主要生理问题与生长所需的特殊代谢需求有关,这些内容已在本书的代谢和内分泌学部分中全面涵盖。
图84-8展示了从出生到20岁期间男孩和女孩身高的变化。特别需要注意的是,这些身高变化在生命的前十年几乎完全平行。在11到13岁之间,女性雌激素开始形成,导致身高快速增长,但在14到16岁左右,长骨的骨骺(epiphyses)早期闭合,因此身高增长停止。相比之下,男性睾酮(testosterone)的作用在稍晚的年龄(主要在13到17岁之间)导致额外的生长。然而,由于骨骺闭合较晚,男性的生长持续时间更长,因此其最终身高明显高于女性。
行为发育(Behavioral Growth)
行为发育主要与神经系统的成熟有关。很难将神经系统的解剖结构成熟与由训练引起的成熟区分开来。解剖学研究表明,中枢神经系统(central nervous system)中的某些主要神经束直到生命的第一年结束时才完全髓鞘化(myelinated)。因此,人们经常认为神经系统在出生时并未完全发挥功能。大脑皮层及其相关功能(如视觉)似乎需要在出生后几个月才能完成最终的功能发育。
出生时,婴儿的脑质量仅为成人的26%,1岁时为55%,但在第二年末几乎达到成人比例。这一过程还与颅骨囟门(fontanels)和骨缝(sutures)的闭合有关,这使得大脑在生命的前两年之后只能再增长20%。图84-9展示了婴儿在生命第一年内的正常发育进度表。将该图表与婴儿的实际发育情况进行比较,可用于临床评估其心理和行为发育。
图84-9. 婴儿在生命第一年内的行为发育。
