第三单元 心脏:修订间差异
自动添加 Sofia 模板和分类 |
自动添加《Guyton&Hall 生理学 第十四版》章节导航 |
||
| 第949行: | 第949行: | ||
[[Category:生理学]] | [[Category:生理学]] | ||
{{:Guyton&Hall 生理学 第十四版}} | |||
2025年8月23日 (六) 17:13的最新版本
第九章 心肌;心脏作为泵和心脏瓣膜的功能
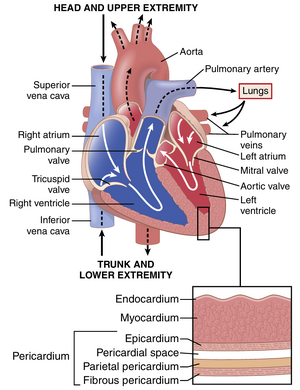
如图9-1所示,心脏实际上是两个独立的泵,右心将血液泵入肺部,左心将血液泵入体循环,为身体的其他器官和组织提供血流。每个心脏都是一个脉动的双腔泵,由心房和心室组成。每个心房都是心室的弱启动泵,帮助将血液移入心室。然后,心室提供主要的泵力,推动血液(1)通过右心室的肺循环或(2)通过左心室的体循环。心脏被一个称为心包(pericardium)的双层囊包围,保护心脏并将其固定在适当的位置。
心脏中的特殊机制导致一系列连续的收缩,称为心脏节律性(cardiac rhythmicity),将动作电位传递到整个心肌,引起心脏的节律性跳动。这个节律性控制系统将在第10章讨论。在本章中,我们将解释心脏如何作为泵工作,从心肌的特殊特性开始(视频9-1)。
心肌的生理学
心脏由三种主要类型的心肌组成——心房肌、心室肌和特化的兴奋传导肌纤维。心房肌和心室肌的收缩方式与骨骼肌非常相似,只是收缩持续时间更长。然而,心脏的特化兴奋传导纤维收缩微弱,因为它们含有很少的收缩纤维;相反,它们以动作电位的形式表现出自动节律性电放电,或通过心脏传导动作电位,提供了一个控制心脏节律性跳动的兴奋系统。
心肌解剖学
图9-2显示了心肌的组织学,展示了心肌纤维以网格状排列,纤维分裂、重组,然后再次扩散。注意,心肌与骨骼肌一样具有横纹。此外,心肌具有典型的肌原纤维(myofibrils),其中含有与骨骼肌几乎相同的肌动蛋白(actin)和肌球蛋白(myosin)丝;这些丝并排排列,在收缩时滑动,与骨骼肌中的情况相同(见第6章)。然而,在其他方面,心肌与骨骼肌有很大不同,我们将会看到。
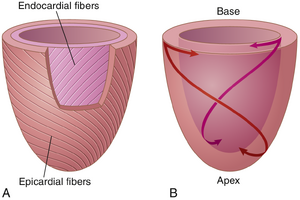
左心室旋转(扭转Twist)有助于左心室射血和松弛。左心室组织成复杂的肌纤维层,这些层以不同的方向运行,使心脏在收缩期以扭转运动收缩。心外膜下(外层)层向左螺旋,心内膜下(内层)层向相反方向(向右)螺旋,导致心脏顶端的顺时针旋转和左心室基部的逆时针旋转(图9-3)。这导致左心室的拧绞运动,在收缩期(收缩)将基部向下拉向顶端。在收缩期结束时,左心室类似于一个加载的弹簧,在舒张期(松弛)回弹或解开,使血液迅速进入泵腔。
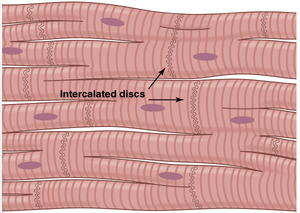
心肌是一个合胞体。图9-2中横跨心肌纤维的暗区称为闰盘(intercalated discs);它们实际上是分隔单个心肌细胞的细胞膜。也就是说,心肌纤维由许多相互串联和并联的单个细胞组成。
在每个闰盘处,细胞膜相互融合形成可渗透的通讯连接(间隙连接),允许离子快速扩散。因此,从功能角度来看,离子在细胞内液中沿心肌纤维的纵轴轻松移动,使得动作电位容易从一个心肌细胞传递到下一个,穿过闰盘。因此,心肌是由许多心肌细胞组成的合胞体,其中心肌细胞相互连接,当一个细胞兴奋时,动作电位迅速传播到所有细胞。
心脏实际上由两个合胞体组成:心房合胞体(atrial syncytium),构成两个心房的壁;以及心室合胞体(ventricular syncytium),构成两个心室的壁。心房和心室之间由纤维组织分隔,这些纤维组织围绕在心房和心室之间的房室瓣(A-V valvular)开口周围。通常情况下,电位不会通过这种纤维组织直接从心房合胞体传导到心室合胞体。相反,它们只能通过一种称为房室束(A-V bundle)的特殊传导系统传导,房室束是一束直径几毫米的传导纤维,将在第10章讨论。
心脏肌肉分为两个功能性合胞体,使得心房可以在心室收缩之前短暂收缩,这对心脏泵血的有效性非常重要。
心肌中的动作电位
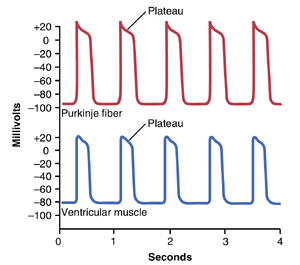
图9-4中记录的心室肌纤维的动作电位平均约为105毫伏,这意味着在每个心跳期间,细胞内电位从心跳之间的非常负的值(约-85毫伏)上升到略微正的值(约+20毫伏)。在初始尖峰之后,膜保持去极化状态约0.2秒,表现出一个平台期(plateau),随后在平台期结束时突然复极化(repolarization)。动作电位中平台期的存在使得心肌中的心室收缩持续时间比骨骼肌长15倍。
什么导致了心肌的长动作电位和平台期?心肌和骨骼肌的膜特性至少存在两个主要差异,这些差异导致了心肌动作电位的延长和平台期的出现。首先,骨骼肌的动作电位几乎完全由大量快速钠通道的突然开放引起,这些通道允许大量钠离子从细胞外液进入骨骼肌纤维。这些通道被称为快速通道,因为它们只开放千分之几秒,然后突然关闭。在关闭结束时,复极化发生,动作电位在大约千分之一秒内结束。
在心肌中,动作电位由两种通道的开放引起:(1) 与骨骼肌中相同的电压激活快速钠通道;(2) 另一种完全不同的 L 型钙通道(慢钙通道),也称为钙-钠通道。这第二种通道与快速钠通道的不同之处在于它们开放较慢,更重要的是,它们会保持开放十分之几秒。在这段时间内,大量钙离子和钠离子通过这些通道流入心肌纤维内部,这种活动维持了长时间的除极化,导致动作电位的平台期。此外,在平台期进入的钙离子激活了肌肉收缩过程,而骨骼肌收缩的钙离子则来自细胞内的肌浆网。
心肌和骨骼肌之间的第二个主要功能差异是,动作电位开始后,心肌膜对钾离子的通透性立即下降约五倍,这种效应在骨骼肌中不会发生。这种钾离子通透性的下降可能是由于前述钙通道中钙离子的过量流入所致。无论原因如何,钾离子通透性的下降大大减少了动作电位平台期带正电荷的钾离子的外流,从而防止动作电位电压过早恢复到静息水平。当慢钙-钠通道在0.2到0.3秒结束时关闭,钙离子和钠离子的流入停止时,钾离子的膜通透性也迅速增加。纤维中钾离子的迅速流失立即将膜电位恢复到静息水平,从而结束动作电位。
心肌动作电位的阶段。图9-5总结了心肌动作电位的各个阶段以及每个阶段发生的离子流动。
图9-5. 心室外肌细胞动作电位的阶段及相关离子电流,包括钠离子 \left(↑↑↓a^+\right) 、钙离子 \big(i\big(a2+\big), 和钾离子 (\romannumeral1) 。
0期(去极化期):快速钠通道开放。当心肌细胞受到刺激并去极化时,膜电位变得更正。电压门控钠通道(快速钠通道)开放,允许钠离子快速流入细胞内,导致细胞去极化。膜电位达到约+20毫伏后,钠通道关闭。
1期(初始复极化期):快速钠通道关闭。钠通道关闭,细胞开始复极化,钾离子通过开放的钾通道离开细胞。
2期(平台期):钙通道开放,快速钾通道关闭。短暂的初始复极化发生后,由于钙离子通透性增加和钾离子通透性降低,动作电位进入平台期。电压门控钙离子通道在1期和0期缓慢开放,钙离子进入细胞。随后钾通道关闭,钾离子外流减少和钙离子内流增加共同作用,导致动作电位进入平台期。
3期(快速复极化期):钙通道关闭,慢速钾通道开放。钙离子通道关闭,钾离子通透性增加,允许钾离子快速离开细胞,平台期结束,细胞膜电位恢复到静息水平。
4期(静息膜电位期):静息膜电位平均约为-80到-90毫伏。
心肌信号传导速度.兴奋性动作电位信号在心房和心室肌纤维中的传导速度约为0.3到0.5m/sec,约为大神经纤维传导速度的1/250,约为骨骼肌纤维传导速度的1/10。在心脏的特殊传导系统——Purkinje纤维中,传导速度高达4m/sec,使得兴奋信号能够快速传导到心脏的不同部位,如第10章所述。
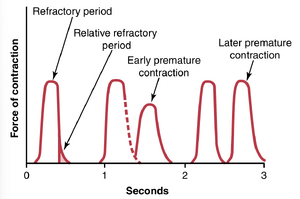
心肌的不应期.心肌与所有可兴奋组织一样,在动作电位期间对再刺激不敏感。因此,心脏的不应期是指正常心脏冲动无法再次兴奋已经兴奋的心肌区域的时间间隔,如图9-6左侧所示。心室的正常不应期为0.25到0.30秒,大约与延长的平台期动作电位的持续时间相当。此外,还有一个约0.05秒的相对不应期,在此期间肌肉比正常情况下更难兴奋,但可以通过非常强的兴奋信号兴奋,如图9-6第二个示例中的早期早搏所示。心房肌的不应期比心室短得多(心房约为0.15秒,而心室为0.25到0.30秒)。
兴奋-收缩耦联中钙离子和横小管的功能
兴奋-收缩耦联(excitation-contraction coupling)这一术语指的是动作电位引起肌纤维收缩的机制。第7章中已经讨论了骨骼肌的这一机制。而在心肌中,这一机制存在一些差异,这些差异对心肌收缩的特性有重要影响。
与骨骼肌一样,当动作电位通过心肌细胞膜时,动作电位会沿着横小管(transverse tubules, T tubules)的膜传播到心肌纤维的内部。随后,横小管的动作电位作用于纵行肌质网(longitudinal sarcoplasmic tubules)的膜,导致钙离子从肌质网(sarcoplasmic reticulum)释放到肌质(sarcoplasm)中。在接下来的几千分之一秒内,这些钙离子扩散到肌原纤维中,催化化学反应,促进肌动蛋白(actin)和肌球蛋白(myosin)丝相互滑动,从而产生肌肉收缩。
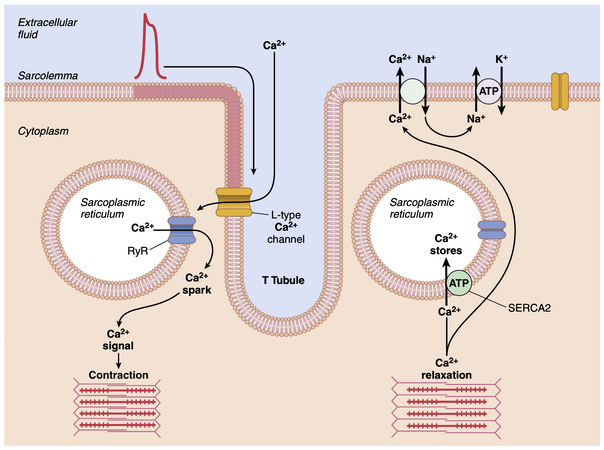
到目前为止,这种兴奋-收缩耦联机制与骨骼肌的机制相同,但还存在一个显著不同的第二效应。除了从肌质网的池(cisternae)释放到肌质中的钙离子外,动作电位期间,钙离子还会从横小管扩散到肌质中,这打开了横小管膜上的电压依赖性钙通道(voltage-dependent calcium channels)(图9-7)。进入细胞的钙随后激活肌质网膜上的钙释放通道(calcium release channels),也称为ryanodine受体通道(ryanodine receptor channels),触发钙释放到肌质中。肌质中的钙离子随后与肌钙蛋白(troponin)相互作用,通过第6章中描述的与骨骼肌相同的基本机制启动横桥(cross-bridge)形成和收缩。
如果没有来自横小管的钙,心肌收缩的强度将大大降低,因为心肌的肌质网不如骨骼肌发达,无法储存足够的钙以提供充分的收缩。然而,心肌的横小管直径是骨骼肌横小管的五倍,这意味着其体积是骨骼肌横小管的25倍。此外,横小管内部含有大量带负电的多糖(mucopolysaccharides),它们结合了大量的钙离子,使这些钙离子在横小管动作电位出现时能够扩散到心肌纤维内部。
心肌收缩的强度在很大程度上取决于细胞外液中钙离子的浓度。事实上,将心脏置于无钙溶液中会迅速停止跳动。这种反应的原因是横小管的开口直接穿过心肌细胞膜进入细胞周围的细胞外空间,使得心肌间质中的细胞外液能够渗透通过横小管。因此,横小管系统中的钙离子数量(即引起心肌收缩的钙离子的可用性)在很大程度上取决于细胞外液中的钙离子浓度。
相比之下,骨骼肌收缩的强度几乎不受细胞外液钙离子浓度适度变化的影响。这是因为骨骼肌收缩几乎完全由骨骼肌纤维内部的肌浆网释放的钙离子引起。
在心脏动作电位平台期结束时,钙离子向肌纤维内部的流入突然中断,肌浆中的钙离子迅速被泵出肌纤维,进入肌浆网和T管-细胞外液空间。钙离子被泵回肌浆网的过程依赖于钙-三磷酸腺苷酶(ATPase)泵(肌浆网内质网钙ATP酶,SERCA2;见图9-7)。钙离子还通过钠-钙交换器从细胞中移除。在此交换过程中进入细胞的钠离子随后通过钠-钾ATP酶泵被泵出细胞。结果,收缩停止,直到新的动作电位到来。
收缩持续时间。心肌在动作电位开始后几毫秒开始收缩,并持续收缩直到动作电位结束后几毫秒。因此,心肌收缩的持续时间主要取决于动作电位的持续时间,包括平台期——心房肌约为0.2秒,心室肌约为0.3秒。
心脏周期
从一个心跳开始到下一个心跳开始之间发生的心脏事件称为心脏周期。每个周期由窦房结自发产生动作电位启动,如第10章所述。窦房结位于右心房上外侧壁,靠近上腔静脉开口处,动作电位从这里迅速通过两个心房,然后通过房室束进入心室。由于从心房到心室的传导系统的特殊排列,心脏冲动从心房传递到心室的过程中会有超过0.1秒的延迟。这种延迟使心房在心室收缩之前收缩,从而在强烈的心室收缩开始之前将血液泵入心室。因此,心房充当心室的启动泵,而心室则为血液通过身体血管系统提供主要动力。
舒张期和收缩期
心脏周期(cardiac cycle)的总持续时间,包括收缩期和舒张期,是心率的倒数。例如,如果心率为72次/分钟,心脏周期的持续时间为1/72min/次——大约0.0139分钟/次,或0.833秒/次。
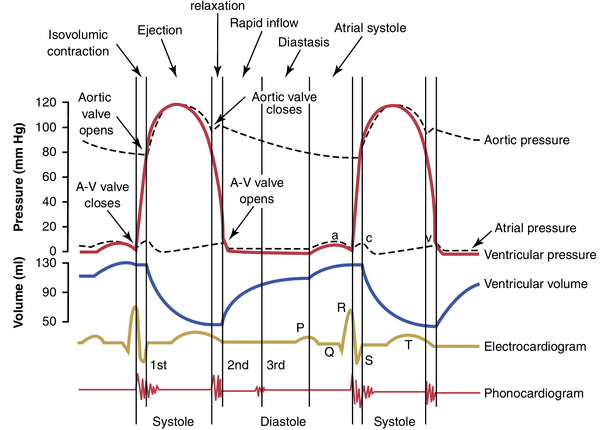
图9-8显示了心脏左侧在心脏周期中的不同事件。前三条曲线分别显示了主动脉、左心室和左心房中的压力变化。第四条曲线描绘了左心室容积的变化,第五条曲线描绘了心电图(electrocardiogram),第六条曲线描绘了心音图(phonocardiogram),这是心脏——主要是心脏瓣膜——在泵血时产生的声音的记录。读者特别需要详细研究此图并理解所有显示事件的原因。
增加心率会减少心脏周期的持续时间。当心率增加时,每个心脏周期的持续时间减少,包括收缩和舒张阶段。动作电位(action potential)和收缩期的持续时间也会减少,但减少的百分比不如舒张期大。在正常心率72次/分钟时,收缩期约占整个心脏周期的0.4。在正常心率的三倍时,收缩期约占整个心脏周期的0.65。这意味着心脏在快速跳动时没有足够长的放松时间,以允许心脏腔室在下一次收缩前完全充盈。
心电图与心脏周期的关系
图9-8中的心电图显示了P,Q,R,S,和T波,这些在第11章和第12章中讨论。这些是由心脏产生的电压,并由心电图从体表记录。
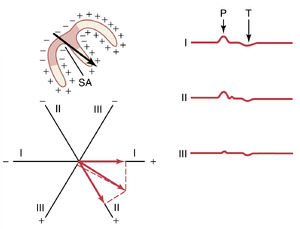
P波是由心房去极化(depolarization)的传播引起的,随后是心房收缩,这导致在心电图P波之后立即出现心房压力曲线的轻微上升。
在P波开始后约0.16秒,QRS波出现,这是心室电去极化的结果,它引发心室收缩并导致心室压力开始上升。因此,QRS复合波在心室收缩开始前略微开始。
最后,心室的T波代表心室复极化(repolarization)的阶段,此时心室肌纤维开始放松。因此,T波在心室收缩结束前略微发生。
心房作为心室的启动泵
血液通常从大静脉持续流入心房;约80%的血液直接通过心房流入心室,甚至在心房收缩之前。然后,心房收缩通常会导致心室的额外20%充盈。因此,心房作为启动泵(primer pumps)的功能,将心室泵血效率提高了多达20%。然而,心脏在大多数情况下即使没有这额外的20%效率也能继续运作,因为它通常有能力泵出比静息身体所需多300%到400%的血液。因此,当心房功能失效时,除非一个人进行运动,否则这种差异不太可能被注意到;然后,偶尔会出现心力衰竭的症状,尤其是呼吸急促。
心房压力变化——a、c 和 v 波。 在图 9-8 的心房压力曲线中,显示了三个较小的压力升高,称为 a,c, 和 v 心房压力波。
α 波由心房收缩引起。通常,右心房压力在心房收缩期间增加 4 至 6 mmHg,左心房压力增加约 7 至 8mmHg。
c 波发生在心室开始收缩时;它部分是由于心室收缩开始时血液轻微回流到心房,但主要是由于心室压力增加导致房室瓣向心房方向膨出。
v 波发生在心室收缩接近结束时;它是由心室收缩期间房室瓣关闭时,血液从静脉缓慢流入心房引起的。然后,当心室收缩结束时,房室瓣打开,使这些储存的心房血液迅速流入心室,导致 v 波消失。
心室作为泵的功能
心室在舒张期充盈血液。在心室收缩期,由于房室瓣关闭,大量血液积聚在右心房和左心房。因此,一旦收缩期结束,心室压力再次降至其低舒张值,心室收缩期间心房中形成的适度增加的压力立即推开房室瓣,使血液迅速流入心室,如图 9-8 中左心室容积曲线的上升所示。这一时期称为心室快速充盈期。
在健康的心脏中,快速充盈期持续约舒张期的前三分之一。在舒张期的中间三分之一,通常只有少量血液流入心室。这是从静脉继续排入心房并直接通过心房进入心室的血液。在舒张期的最后三分之一,心房收缩并给血液流入心室增加额外的推力。这一机制在每个心动周期中约占心室充盈的 20%。
随着年龄增长或导致心脏纤维化的疾病(如高血压或糖尿病),心室会变得僵硬。这导致舒张早期心室充盈的血液减少,需要更多的容积(前负荷;稍后讨论)或更多来自后期心房收缩的充盈以维持足够的心输出量。
收缩期血液从心室流出
等容(等长)收缩期。心室收缩开始后,心室压力急剧上升,如图 9-8 所示,导致房室瓣关闭。然后,心室需要额外的 0.02 至 0.03 秒来建立足够的压力,以推开半月瓣(主动脉瓣和肺动脉瓣)对抗主动脉和肺动脉中的压力。因此,在此期间,心室发生收缩,但没有排空。这一时期称为等容或等长收缩期,意味着心肌张力在增加,但肌纤维几乎没有或没有缩短。
射血期。当左心室压力略高于 80mmHg(右心室压力略高于 8mmHg)时,心室压力将半月瓣推开。随即,血液从心室射入主动脉和肺动脉。在舒张期末,心室中约 60% 的血液在收缩期被射出;其中约 70% 在射血期的前三分之一流出,剩余的 30% 在后三分之二排出。因此,前三分之一称为快速射血期 (period of rapid ejection),后三分之二称为缓慢射血期 (period of slow ejection)。
等容(等长)舒张期。在收缩期末,心室突然开始舒张,使左右心室内压迅速下降。刚刚被收缩期心室充盈的扩张大动脉中的高压立即将血液推回心室,导致主动脉瓣和肺动脉瓣迅速关闭。在接下来的 0.03 至 0.06 秒内,尽管心室容积没有变化,但心室肌肉继续舒张,形成等容或等长舒张期 (period of isovolumic or isometric relaxation)。在此期间,心室内压迅速降至舒张期的低水平。随后,房室瓣 (A-V valves) 打开,开始新的心室泵血周期。
舒张末期容积、收缩末期容积和每搏输出量。在舒张期,心室的正常充盈使每个心室的容积增加到约 110 至 120~ml。这一容积称为舒张末期容积 (end-diastolic volume)。随后,在收缩期心室排空时,容积减少约 70~ml,称为每搏输出量 (stroke volume output)。每个心室中剩余的容积,约 40 至 50~ml,称为收缩末期容积 (end-systolic volume)。舒张末期容积中被射出的部分称为射血分数 (ejection fraction),通常约为 0.6(即 60%)。射血分数百分比常用于临床评估心脏收缩(泵血)能力。
当心脏强烈收缩时,收缩末期容积可能减少至仅 10 至 20~ml。相反,当舒张期大量血液流入心室时,健康心脏的心室舒张末期容积可达到 150 至 180ml。通过增加舒张末期容积和减少收缩末期容积,每搏输出量可以增加到正常值的两倍以上。
心脏瓣膜在收缩期防止血液回流
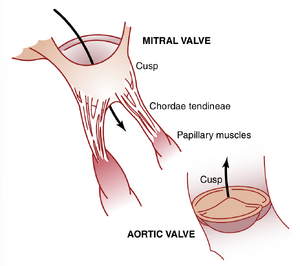
房室瓣。房室瓣(即三尖瓣和二尖瓣)在收缩期防止血液从心室回流到心房,而半月瓣(即主动脉瓣和肺动脉瓣)在舒张期防止血液从主动脉和肺动脉回流到心室。这些瓣膜,如图9-9左心室所示,是被动关闭和打开的。也就是说,当反向压力梯度推动血液回流时,它们关闭;当正向压力梯度推动血液向前流动时,它们打开。由于解剖学原因,薄弱的房室瓣几乎不需要回流就能关闭,而较重的半月瓣则需要几毫秒的快速回流才能关闭。
乳头肌(Papillary Muscles)的功能。图9-9还显示了通过腱索(chordae tendineae)连接到房室瓣瓣叶的乳头肌。当心室壁收缩时,乳头肌也会收缩,但与预期相反,它们并不帮助瓣膜关闭。相反,它们将瓣膜的瓣叶向内拉向心室,以防止在心室收缩时瓣膜向心房过度膨出。如果腱索断裂,或者由于心肌梗死(myocardial infarction)导致血流减少而使乳头肌瘫痪,瓣膜在心室收缩时会向后过度膨出,有时甚至会严重泄漏,导致严重甚至致命的心脏功能障碍。
主动脉瓣和肺动脉瓣。主动脉瓣和肺动脉半月瓣的功能与房室瓣有很大不同。首先,收缩末期动脉中的高压使半月瓣迅速关闭,这与房室瓣的较柔和关闭形成对比。其次,由于开口较小,血液通过主动脉瓣和肺动脉瓣的喷射速度比通过较大的房室瓣快得多。此外,由于快速关闭和快速喷射,主动脉瓣和肺动脉瓣的边缘比房室瓣承受更大的机械磨损。最后,房室瓣由腱索支撑,而半月瓣则不然。从主动脉瓣和肺动脉瓣的解剖结构(如图9-9底部所示的主动脉瓣)可以明显看出,它们必须由特别坚固且非常柔韧的纤维组织构成,以承受额外的物理应力。
主动脉压力曲线
当左心室收缩时,心室压力迅速增加,直到主动脉瓣打开。然后,在瓣膜打开后,心室压力的上升速度明显减慢,如图9-7所示,因为血液立即从心室流出进入主动脉,然后进入全身分布的动脉。
在收缩期,血液进入动脉会导致动脉壁伸展,压力增加到约120mmHg。接下来,在收缩末期,左心室停止射血且主动脉瓣关闭后,动脉的弹性壁即使在舒张期也能维持动脉中的高压。
当主动脉瓣关闭时,主动脉压力曲线上会出现一个切迹(incisura)。这是由于在瓣膜关闭前血液短暂回流,随后回流突然停止所致。
在主动脉瓣关闭后,主动脉内的压力在整个舒张期缓慢下降,因为储存在扩张的弹性动脉中的血液持续通过外周血管回流到静脉。在心室再次收缩之前,主动脉压力通常下降到约80mmHg(舒张压),这是心室收缩期间主动脉内最大压力120mmHg(收缩压)的三分之二。
右心室和肺动脉中的压力曲线与主动脉中的压力曲线相似,只是压力仅为主动脉的六分之一左右,如第14章所述。
心音与心脏泵血的关系
当用听诊器听心脏时,人们听不到瓣膜打开的声音,因为这是一个相对缓慢的过程,通常不会产生噪音。然而,当瓣膜关闭时,瓣膜叶片和周围的液体在突然的压力变化下振动,发出声音,声音通过胸部向各个方向传播。
当心室收缩时,首先听到的是由房室瓣(A-V valves)关闭引起的声音。振动音调低且持续时间相对较长,称为第一心音(S1)。当主动脉瓣和肺动脉瓣在收缩末期关闭时,由于这些瓣膜关闭迅速,周围组织在短时间内振动,因此会听到一个快速的“啪”声。这个声音称为第二心音(S2)。心音的确切原因将在第23章中更详细地讨论,涉及用听诊器听心音的内容。
心脏的功输出
心脏的每搏功输出(stroke work output)是心脏在每次心跳期间将能量转化为功的量,同时将血液泵入动脉。心脏的功输出有两种形式。首先,主要部分用于将血液从低压静脉移动到高压动脉。这称为容积-压力功(volume-pressure work)或外功(external work)。其次,一小部分能量用于加速血液通过主动脉瓣和肺动脉瓣的喷射速度,这是功输出中血流动能的组成部分。
由于两个心室泵出的收缩压相差六倍,右心室的外功输出通常约为左心室的六分之一。每个心室为产生血流动能所需的额外功输出与喷射血液的质量乘以喷射速度的平方成正比。
通常情况下,左心室为产生血流动能所需的功输出仅占心室总功输出的约1%,因此在计算总每搏功输出时通常忽略不计。然而,在某些异常情况下,例如主动脉狭窄(aortic stenosis),血液以高速通过狭窄的瓣膜,可能需要超过50%的总功输出来产生血流动能。
心室泵血的图形分析
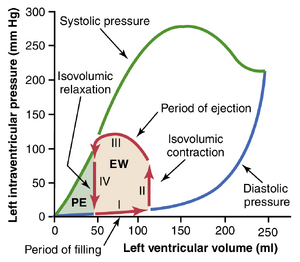
图9-10显示了一个特别有用的图表,用于解释左心室的泵血机制。图表中最重要的组成部分是标有“舒张压”和“收缩压”的两条曲线。这些曲线是容积-压力曲线 volume- pressure curves。
舒张压曲线是通过逐渐增加心脏内血液量,然后在心室收缩前立即测量舒张压来确定的,这就是心室的舒张末期压力。
收缩压曲线是通过记录在每个充盈量下心室收缩期间达到的收缩压来确定的。
直到非收缩心室的容积上升到约150ml以上,舒张压不会显著增加。因此,在这个容积之前,血液可以轻松地从心房流入心室。超过150ml后,心室舒张压迅速增加,部分原因是心脏中的纤维组织不再伸展,部分原因是包围心脏的心包几乎达到了其极限。
【译者注:类似人卫第十版图4-3】
在心室收缩期间,收缩压增加,即使在低心室容积下也是如此,并在心室容积为150至170ml时达到最大值。然后,随着容积进一步增加,在某些条件下收缩压实际上会下降,如图9-10中下降的收缩压曲线所示。这是因为在大容积下,心肌纤维的肌动蛋白和肌球蛋白丝被拉开得足够远,以至于每个心脏纤维的收缩强度变得不如最佳。
特别要注意的是,图中正常左心室的最大收缩压在250至300mmHg之间,但这因每个人的心脏强度和心脏神经刺激程度而有很大差异。对于正常右心室,最大收缩压在60至80mmHg之间。
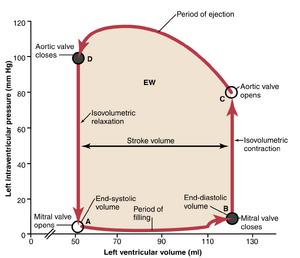
心动周期中的容积-压力图;心脏功输出。图9-10中的红色线条形成了一个称为左心室正常功能的心动周期容积-压力图的循环。图9-11中显示了该循环的更详细版本。它分为四个阶段。
第一阶段:充盈期。 容积-压力图中的阶段I开始于心室容积约为50ml和舒张压为2至3mmHg。前一次心跳后留在心室中的血液量,50ml,称为收缩末期容积。随着静脉血从左心房流入心室,心室容积通常增加到约120ml,称为舒张末期容积,增加了70ml。因此,阶段I期间的容积-压力图沿着图9-10中标有“I”的线延伸,并从图9-11中的点A到点B,容积增加到120ml,舒张压上升到约5至7mmHg。
第二阶段:等容收缩期。在等容收缩期间,心室体积不发生变化,因为所有瓣膜都关闭。然而,心室内压力增加至与主动脉压力相等,压力值约为80mmHg,如图中点C所示(见图9-11)。
第三阶段:射血期。在射血期间,由于心室进一步收缩,收缩压进一步升高。同时,由于主动脉瓣现在打开,血液从心室流出进入主动脉,心室体积减小。因此,在图9-10中,标记为“III”或“射血期”的曲线追踪了射血期间体积和收缩压的变化。
第四阶段:等容舒张期。在射血期结束时(图9-11中的点D),主动脉瓣关闭,心室压力回落到舒张压水平。标记为Ⅳ的线(图9-10)追踪了心室内压力的下降,而体积没有变化。因此,心室回到其起点,心室内剩余约50~ml的血液,心房压力为2至3mmHg。
这个功能性体积-压力图所包围的区域(阴影区域,标记为“EW”)代表了心室在其收缩周期期间输出的净外部功。在心脏收缩的实验研究中,该图用于计算心脏功输出。
当心脏泵送大量血液时,功图的面积变得更大。也就是说,它向右延伸得更远,因为心室在舒张期填充了更多的血液;它上升得更高,因为心室以更大的压力收缩;并且它通常向左延伸得更远,因为心室收缩到更小的体积——特别是如果心室受到交感神经系统的刺激而增加活动时。
前负荷和后负荷的概念。在评估肌肉的收缩特性时,重要的是指定肌肉开始收缩时的张力程度,称为前负荷(preload),并指定肌肉施加其收缩力的负载,称为后负荷(afterload)。
对于心脏收缩,前负荷通常被认为是心室充盈时的舒张末期压力。心室的后负荷是从心室引出的主动脉中的压力。在图9-10中,这对应于体积-压力图的第二阶段曲线所描述的收缩压。(有时后负荷被宽松地认为是循环中的阻力而不是压力。)
前负荷和后负荷概念的重要性在于,在许多心脏或循环的异常功能状态下,心室充盈期间的压力(前负荷)、心室必须对抗的动脉压力(后负荷)或两者都从正常状态严重改变。
心脏收缩所需的化学能:心脏的氧利用
心肌与骨骼肌一样,利用化学能来提供收缩的功。通常,大约70%到90%的能量来自脂肪酸的氧化代谢(oxidative metabolism),约10%到30%来自其他营养物质,尤其是葡萄糖和乳酸。因此,心脏的耗氧率是衡量心脏做功时释放的化学能的极好指标。释放这种能量的不同化学反应将在第68和69章中讨论。
实验研究表明,心脏的耗氧量和收缩过程中消耗的化学能与图9-10中的总阴影面积直接相关。这个阴影部分包括外部功(external work, EW),如前所述,以及一个额外的部分称为势能(potential energy),标记为“PE”。势能代表了如果心室每次收缩都能完全排空其腔室中的所有血液,心室收缩可以完成的额外功。
耗氧量也被证明几乎与收缩期间心肌中产生的张力(tension)乘以收缩持续的时间成正比;这被称为张力-时间指数(tension-time index)。根据拉普拉斯定律(Laplace's law),心室壁张力(T)与左心室压力(P)和半径(r)有关:T=P×r
因为当收缩压(因此左心室压力)高时,张力也高,相应地消耗更多的氧气。当收缩压长期升高时,壁应力和心脏负荷也会增加,导致左心室壁增厚,这可以减少心室腔半径(向心性肥大(concentric hypertrophy)),并至少部分缓解增加的壁张力。此外,即使在正常收缩压下,当心室异常扩张(离心性肥大(eccentric hypertrophy))时,也会消耗更多的化学能,因为收缩期间心肌的张力与压力乘以心室半径成正比。这在心力衰竭时变得尤为重要,当心室扩张时,矛盾的是,尽管心脏已经衰竭,但给定工作量所需的化学能比正常情况更多。
心脏效率(Cardiac Efficiency)。在心肌收缩期间,大部分消耗的化学能转化为热量,只有一小部分转化为功输出。心脏效率是功输出与用于做功的总化学能的比率。正常心脏的最大效率在20%到25%之间。在心力衰竭患者中,这一效率可以降低到5%。
心脏泵血的调节
当一个人处于休息状态时,心脏每分钟只泵出4到6升血液。在剧烈运动期间,心脏可能泵出四到七倍于此的血液量。调节心脏泵血的基本机制如下:(1) 对流入心脏的血液量变化的内在心脏泵血调节;(2) 自主神经系统对心率和心脏强度的控制。
心脏泵血的内在调节-弗兰克-斯塔林机制(FRANK-STARLING MECHANISM)
在第20章中,我们将了解到,在大多数情况下,心脏每分钟泵出的血量通常几乎完全由静脉回流(venous return)到心脏的血液流量决定。也就是说,身体的每个外周组织控制其自身的局部血流,所有局部组织的血流通过静脉汇合并回流到右心房。心脏则自动将这些流入的血液泵入动脉,使其能够在循环中再次流动。
心脏这种适应流入血液量增加的内在能力被称为Frank-Starling机制(Frank-Starling mechanism),以纪念两位伟大的生理学家Otto Frank和Ernest Starling。基本上,Frank-Starling机制意味着心脏在充盈过程中被拉伸得越多,收缩力就越强,泵入主动脉的血液量也就越多。或者换句话说——在生理限度内,心脏会泵出所有通过静脉回流到它的血液。
Frank-Starling机制的解释是什么?当额外的血液流入心室时,心肌被拉伸到更大的长度。这种拉伸使肌肉以更大的力量收缩,因为肌动蛋白(actin)和肌球蛋白(myosin)丝被带到更接近最佳重叠程度的位置,从而产生更大的力量。因此,由于心室泵血能力的增强,它会自动将额外的血液泵入动脉。这种拉伸肌肉在达到最佳长度时以增加的工作输出收缩的能力是所有横纹肌(striated muscle)的特征,正如第6章所解释的那样,而不仅仅是心肌的特征。
[译者注:在Berne上,对这一机制有不同的、看起来更新的解释。]
除了延长心肌的重要作用外,另一个因素在心脏容量增加时也会增加心脏的泵血能力。右心房壁的拉伸直接使心率增加10%到20%,这也有助于增加每分钟泵出的血液量,尽管其贡献远小于Frank-Starling机制。正如第18章所讨论的,心房的拉伸还会激活牵张感受器(stretch receptors)和一种神经反射——Bainbridge反射(Bainbridge reflex),该反射通过迷走神经(vagus nerve)传递,可能使心率额外增加40%到60%。
心室功能曲线
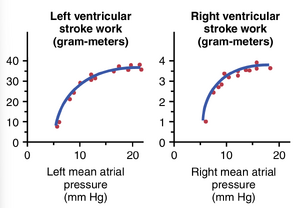
表达心室泵血功能的最佳方式之一是心室功能曲线(ventricular function curves)。图9-12展示了一种称为每搏功输出曲线(stroke work output curve)的心室功能曲线。请注意,随着心脏每侧心房压力的增加,该侧的每搏功输出也会增加,直到达到心室泵血能力的极限。
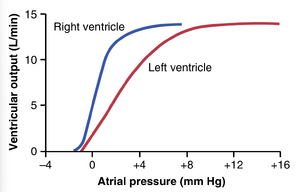
图 9-13 展示了另一种类型的心室功能曲线,称为心室输出量曲线。图中的两条曲线代表了基于实验动物研究数据推断出的人类心脏两个心室的功能。随着右心房和左心房压力的增加,每分钟的相应心室输出量也会增加。
因此,心室功能曲线是表达心脏 Frank-Starling 机制的另一种方式。也就是说,随着心室因心房压力增加而充盈,每个心室的容积和心肌收缩的强度都会增加,从而使心脏将更多的血液泵入动脉。
交感神经和副交感神经对心脏的控制
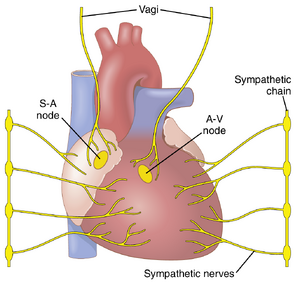
心脏的泵血效果也受到交感神经和副交感神经(迷走神经)的控制,这些神经大量供应心脏,如图 9-14 所示。在给定的心房压力水平下,每分钟泵出的血液量(心输出量)通常可以通过交感神经刺激增加超过 100%。相比之下,通过迷走神经(副交感神经)刺激,输出量可以几乎降至零。
交感神经兴奋心脏的机制。强烈的交感神经刺激可以将年轻成年人的心率从正常的 70 次/分钟增加到 180 到 200 次/分钟,甚至偶尔可以达到 250 次/分钟。此外,交感神经刺激可以使心脏收缩的力量增加一倍,从而增加泵出的血液量和射血压力。因此,交感神经刺激通常可以使最大心输出量增加两到三倍,这还不包括之前讨论的 Frank-Starling 机制引起的输出量增加。
相反,抑制心脏的交感神经可以适度减少心脏的泵血功能。在正常情况下,心脏的交感神经纤维以缓慢的速度持续放电,使泵血保持在无交感神经刺激时的约 30% 以上。因此,当交感神经系统活动低于正常水平时,心率和心室肌收缩的强度都会降低,从而使心脏泵血水平降低至正常水平的 30% 以下。
副交感神经(迷走神经)刺激降低心率和收缩强度。强烈刺激心脏的迷走神经中的副交感神经纤维可以使心跳停止几秒钟,但随后心脏通常会“逃脱”并在副交感神经刺激持续期间以 20 到 40 次/分钟的速度跳动。此外,强烈的迷走神经刺激可以使心肌收缩的强度降低 20% 到 30%。
迷走神经纤维主要分布于心房,而较少分布于心室,心脏的强力收缩发生在心室。这种分布解释了为什么迷走神经刺激的主要效果是降低心率,而不是显著降低心脏收缩的强度。然而,心率的显著降低,加上心脏收缩强度的轻微下降,可以使心室泵血量减少 50% 或更多。
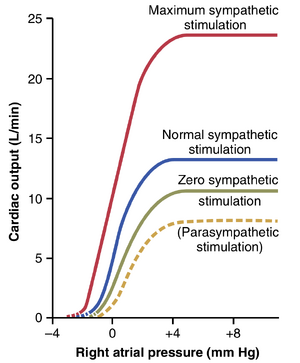
交感或副交感刺激对心功能曲线的影响。图 9-15 显示了四条心功能曲线。这些曲线类似于图 9-13 中的心室功能曲线。然而,它们代表的是整个心脏的功能,而不是单个心室的功能。它们显示了右心房输入压力与左心室进入主动脉的心输出量之间的关系。
图 9-15 的曲线表明,在任何给定的右心房压力下,心输出量在交感神经刺激增加时增加,而在副交感神经刺激增加时减少。这些由自主神经系统刺激引起的输出变化是由于心率和心脏收缩强度的变化所致。
钾离子和钙离子对心脏功能的影响
在第 5 章讨论膜电位时,我们指出钾离子对膜电位有显著影响,而在第 6 章中我们注意到钙离子在激活肌肉收缩过程中起着特别重要的作用。因此,这两种离子在细胞外液中的浓度对心脏泵血有重要影响也就不足为奇了。
钾离子的影响。细胞外液中过量的钾会使心脏扩张和松弛,并减慢心率。大量的钾还可以阻断心脏冲动从心房通过房室束传导到心室。钾浓度升高到仅 8 至 12~mEq/L ——正常值的两到三倍——可能导致心脏严重无力、心律异常和死亡。
这些影响部分是由于细胞外液中高钾浓度降低了心肌纤维的静息膜电位,如第 5 章所述。也就是说,高细胞外液钾浓度部分去极化细胞膜,导致膜电位不那么负。随着膜电位的降低,动作电位的强度也降低,这使得心脏的收缩逐渐减弱。
钙离子的影响。过量的钙离子会产生几乎与钾离子完全相反的效果,使心脏趋向于痉挛性收缩。这种效果是由于钙离子直接启动心脏收缩过程,如本章前面所述。
相反,钙离子缺乏会导致心脏无力,类似于高钾的效果。幸运的是,血液中的钙离子水平通常在一个非常狭窄的范围内调节。因此,异常钙浓度的心脏影响很少成为临床关注的问题。
温度对心脏功能的影响
体温升高,例如在发烧期间发生的体温升高,会显著增加心率,有时甚至会使心率翻倍。体温降低则会显著降低心率,当一个人因体温过低而接近死亡时,心率可能会降至每分钟仅几次,此时体温范围在60-70℉(15.5-21℃)之间。这些效应可能是由于热量增加了心肌膜对控制心率的离子的通透性,从而加速了自我兴奋过程。
心脏的收缩强度通常会因体温的适度升高而暂时增强,例如在身体运动期间发生的体温升高,但长时间的体温升高会耗尽心脏的代谢系统,最终导致心脏功能减弱。因此,最佳的心脏功能在很大程度上依赖于第74章中解释的控制机制对体温的适当控制。
增加动脉压力负荷(在一定限度内)不会减少心脏输出量
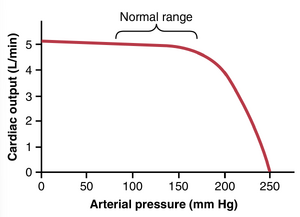
请注意,在图9-16中,增加主动脉中的动脉压力不会减少心脏输出量,直到平均动脉压力上升到约160mmHg以上。换句话说,在正常心脏功能和正常收缩期动脉压力80-140~m m~H g)下,心脏输出量几乎完全由血液通过身体组织的流动难易程度决定,这反过来又控制了血液回心。这个机制是第20章的主要主题。
第十章 心脏的节律性兴奋
人类心脏具有一个特殊的系统,用于节律性自我兴奋和重复收缩,每天大约100,000次,或平均人类寿命中30亿次。这一令人印象深刻的壮举是由一个系统完成的,该系统执行以下功能:(1) 产生电脉冲以启动心肌的节律性收缩;(2) 迅速将这些脉冲传导通过心脏。当这个系统正常运作时,心房在心室收缩前约六分之一秒收缩,这使得心室在它们通过肺部和外周循环泵血之前能够充盈。该系统的另一个特别重要的特点是,它允许心室的所有部分几乎同时收缩,这对于心室腔中最有效的压力生成至关重要。
心脏的这一节律性和传导系统容易受到心脏疾病的损害,特别是由于冠状动脉血流不足导致的缺血。其影响往往是心脏节律异常或心脏腔室收缩顺序异常,心脏的泵血效果可能会受到严重影响,甚至可能导致死亡。
心脏的特殊兴奋和传导系统
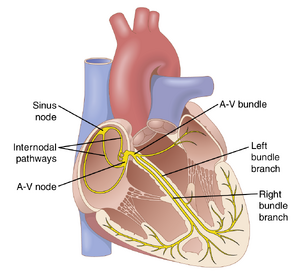
图10-1显示了控制心脏收缩的专门兴奋和传导系统。图中显示了窦房结(也称为窦房结),其中产生正常的节律性冲动;房内传导路径将冲动从窦房结传导到房室结(A-V结);房室结在冲动从心房传递到心室之前延迟;房室束将冲动从心房传导到心室;以及浦肯野纤维的左右束支,将心脏冲动传导到心室的所有部分。
窦房结
窦房结是一小块扁平、椭圆形的特化的心肌,宽约3mm,长约15mm,厚约1mm。它位于右心房的后上外侧壁,紧靠上腔静脉开口的下方和稍外侧。该结的纤维几乎没有收缩性肌丝,直径仅为3至5微米(μm),而周围心房肌纤维的直径为10至15μm。然而,窦房结纤维直接与心房肌纤维连接,因此任何在窦房结开始的动作电位都会立即传播到心房肌壁。
窦房结纤维的自动电节律性
一些心脏纤维具有自我兴奋的能力,这一过程可以引起自动节律性放电和收缩。这种能力尤其适用于心脏的专门传导系统,包括窦房结的纤维。因此,窦房结通常控制整个心脏的跳动速率,本章后面将详细讨论。首先,让我们描述这种自动节律性。
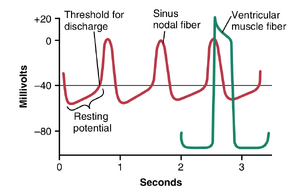
窦房结节律性的机制。图10-2显示了从窦房结纤维内部记录的三个心跳的动作电位,以及与之相比的单个心室肌纤维动作电位。注意,窦房结纤维在放电之间的静息膜电位约为-55至-60毫伏,而心室肌纤维的静息膜电位为-85至-90毫伏。这种较低的负性是由于窦房结纤维的细胞膜对钠和钙离子自然具有渗透性,进入的钠和钙离子的正电荷中和了部分细胞内负性。
在我们解释窦房结纤维的节律性之前,首先回顾第5章和第9章的讨论,心肌有三种主要的膜离子通道,它们在引起动作电位的电压变化中起重要作用。它们是(1)快速钠通道,(2)钙通道(特别是L型或“慢”钙通道),和(3)钾通道(见图9-5)。
快速钠通道的开放持续几万分之一秒,负责心室肌中观察到的动作电位的快速上升峰,这是由于正钠离子快速流入纤维内部。然后,心室动作电位的平台期主要由慢钠钙通道的较慢开放引起,持续约0.3秒。最后,钾通道的开放允许大量正钾离子通过纤维膜向外扩散,并将膜电位恢复到静息水平。
然而,这些通道在窦房结纤维中的功能有所不同,因为静息电位要低得多——窦房结纤维的静息电位仅为-55毫伏,而心室肌纤维的静息电位为-90毫伏。在-55毫伏的水平下,快速钠通道主要已经失活或阻塞。这是因为每当膜电位保持在-55毫伏以下超过几毫秒时,细胞膜内侧的失活门就会关闭快速钠通道并保持关闭状态。因此,只有慢钠钙通道可以开放(即可以被激活),从而引起动作电位。因此,心房结动作电位的形成比心室肌的动作电位慢。此外,动作电位发生后,电位恢复到负状态的过程也较慢,而不是心室纤维的突然恢复。
窦房结纤维对钠和钙的泄漏导致自兴奋。由于窦房结纤维外细胞外液中钠离子浓度高,以及已经开放的钠通道数量适中,来自纤维外部的正钠离子通常倾向于通过内向的“滑稽”电流泄漏到内部。因此,在心跳之间,正钠离子的流入导致静息膜电位向正方向缓慢上升。因此,如图10-2所示,静息电位逐渐上升,并在每两次心跳之间变得不那么负。当电位达到约-40毫伏的阈值电压时,L型钙通道被激活,从而引起动作电位。因此,基本上,窦房结纤维对钠和钙离子的固有泄漏性导致其自兴奋。
为什么这种对钠离子和钙离子的通透性不会导致窦房结纤维一直处于去极化状态?在动作电位过程中,有两个事件发生,以防止这种持续的去极化状态。首先,L型钙通道在打开后大约100到150毫秒内失活(即关闭);其次,大约在同一时间,大量钾通道打开。因此,通过L型钙通道的正钙离子和钠离子的内流停止,同时大量正钾离子从纤维中扩散出去。这两种效应都将细胞内电位降低回其负的静息水平,从而终止动作电位。此外,钾通道在接下来的十分之几秒内保持开放,暂时继续将正电荷移出细胞,导致纤维内部出现过度的负性;这个过程称为超极化(hyperpolarization)。超极化状态最初将静息膜电位降低到动作电位结束时的约-55到-60毫伏。
为什么这种新的超极化状态不会永远维持下去?原因是,在动作电位结束后的接下来的十分之几秒内,越来越多的钾通道逐渐关闭。内向漏钠(“funny”电流)和钙离子再次超过钾离子的外向通量,这导致静息电位再次向上漂移,最终达到约-40毫伏的放电阈值。然后,整个过程再次开始:自激引起动作电位,从动作电位中恢复,动作电位结束后的超极化,静息电位漂移到阈值,最后再次激发以引发另一个周期。这个过程在人的一生中持续进行。
图10-3 房室结(A-V node)的组织结构。数字表示从窦房结冲动起源开始的时间间隔。这些值已被外推到人类。
结间和房间路径通过心房传输心脏冲动
窦房结纤维的末端直接与周围的心房肌纤维相连。因此,起源于窦房结的动作电位向外传播到这些心房肌纤维中。通过这种方式,动作电位扩散到整个心房肌群,并最终到达房室结(A-V node)。大多数心房肌的传导速度约为0.3m/sec,但在几条小的心房纤维束中,传导速度更快,约为1m/sec。其中一条称为前房间束(anterior interatrial band,也称为Bachman束)的纤维束穿过心房前壁到达左心房。此外,另外三条小纤维束分别穿过心房的前壁、侧壁和后壁,并终止于房室结,如图10-1和图10-3所示;这些纤维束分别称为前、中、后房间传导通路(anterior, middle, and posterior internodal pathways)。这些纤维束中传导速度更快的原因是存在特殊的传导纤维。这些纤维与心室中传导速度更快的浦肯野纤维(Purkinje fibers)相似,下文将讨论这一点。
房室结延迟从心房到心室的冲动传导
心房传导系统的组织方式使得心脏冲动不会从心房过快传导到心室;这种延迟为心房在心室收缩开始之前将血液排入心室提供了时间。主要是房室结及其邻近的传导纤维延迟了这种传导到心室的过程。
房室结位于右心房的后壁,紧邻三尖瓣后方,如图10-1所示。图10-3展示了该结的不同部分,以及其与进入的心房间传导通路纤维和离开的房室束(A-V bundle)的连接。该图还显示了从窦房结初始冲动开始到其在房室结系统中出现的大致时间间隔(以秒为单位)。注意,冲动在通过房间传导通路后,大约在窦房结起源后0.03秒到达房室结。然后,在冲动进入房室束的穿透部分之前,房室结本身还有0.09秒的延迟,冲动通过该部分进入心室。最后的0.04秒延迟主要发生在穿透性房室束中,该束由多个穿过分隔心房和心室的纤维组织的小束组成。
因此,房室结和房室束系统的总延迟约为0.13秒。这一延迟加上从窦房结到房室结的初始传导延迟0.03秒,使得兴奋信号最终到达心室收缩肌之前的总延迟为0.16秒。
传导缓慢的原因。过渡区、结区和穿透性房室束纤维中的传导缓慢主要是由于传导通路中连续细胞之间的间隙连接(gap junctions)数量减少,因此兴奋性离子从一个传导纤维传导到下一个传导纤维的阻力很大。因此,很容易理解为什么每个后续细胞的兴奋速度较慢。
心室浦肯野系统中心脏冲动的快速传导
特殊的Purkinje纤维从A-V结(atrioventricular node)通过A-V束(atrioventricular bundle)进入心室。除了这些纤维的初始部分,即它们穿透A-V纤维屏障的地方外,它们的功能特性与A-V结纤维相反。它们是非常大的纤维,甚至比正常的心室肌纤维还要大,它们以1.5到4.0米/秒的速度传递动作电位(action potential),这个速度大约是普通心室肌的六倍,是某些A-V结纤维的150倍。这种速度使得心脏冲动几乎可以瞬间传递到整个心室肌的其余部分。
Purkinje纤维快速传递动作电位(action potential)的原因被认为是由于构成Purkinje纤维的连续细胞之间的闰盘(intercalated discs)上的间隙连接(gap junctions)具有非常高的通透性。因此,离子很容易从一个细胞传递到下一个细胞,从而提高了传递速度。Purkinje纤维的肌原纤维(myofibrils)也非常少,这意味着它们在冲动传递过程中几乎不收缩或完全不收缩。
A-V束通常是单向传导路径。A-V束的一个特殊特性是,除了在异常状态下,动作电位(action potential)无法从心室向后传递到心房。这一特性防止了心脏冲动通过这条路径从心室重新进入心房,只允许从心房到心室的向前传导。
此外,应该记住,除了A-V束之外,心房肌和心室肌之间在任何地方都被连续的纤维屏障隔开,其中一部分如图10-3所示。这个屏障通常起到绝缘体的作用,防止心脏冲动通过A-V束以外的任何其他路径在心房肌和心室肌之间传递。在极少数情况下,异常的肌桥或辅助通路确实会在A-V束以外的其他地方穿透纤维屏障。在这种情况下,心脏冲动可以从心室重新进入心房,并导致严重的心律失常(arrhythmias)。
Purkinje纤维在心室中的分布——左束支和右束支。在穿透心房肌和心室肌之间的纤维组织后,A-V束的远端部分在心室间隔中向下传递5到15毫米,朝向心脏的尖端,如图10-1和10-3所示。然后,束分为左束支和右束支,分别位于心室间隔两侧的心内膜下。每个分支向下延伸到心室的尖端,逐渐分成更小的分支。这些分支依次围绕每个心室腔并向心脏基部延伸。Purkinje纤维的末端穿透约三分之一的心肌质量,最终与心肌纤维连续。
从心脏冲动进入心室间隔的束支到到达Purkinje纤维末端的总时间平均仅为0.03秒。因此,一旦心脏冲动进入心室Purkinje传导系统,它几乎立即扩散到整个心室肌质量。
心室肌中心脏冲动的传导
一旦冲动到达Purkinje纤维的末端,它就会通过心室肌纤维本身在心室肌群中传导。此时的传导速度仅为0.3到0.5m/sec,是Purkinje纤维中的六分之一。
心肌以双螺旋的形式包裹心脏,螺旋层之间有纤维间隔;因此,心脏冲动并不一定直接向外朝向心脏表面传导,而是沿着螺旋的方向向表面倾斜传导。由于这种倾斜,从心内膜表面到心室心外膜表面的传导需要多达0.03秒,大约等于通过Purkinje系统的整个心室部分所需的时间。因此,在正常心脏中,心脏冲动从最初的束支传导到最后的心室肌纤维的总时间约为0.06秒。
心脏冲动在心脏中的传导总结
图10-4总结了心脏冲动在人类心脏中的传导。图中的数字表示心脏冲动在窦房结起源后到心脏各个特定点出现之间的时间间隔,以秒的分数表示。注意,冲动以中等速度在心房中传播,但在A-V结区域延迟超过0.1秒后才出现在心室间隔的A-V束中。一旦进入这个束,它就会通过Purkinje纤维非常迅速地传播到心室的整个心内膜表面。然后,冲动再次以稍慢的速度通过心室肌传播到心外膜表面。
图10-4 心脏冲动在心脏中的传导,显示了心脏不同部分出现的时间(以窦房结初始出现后的秒分数表示)。A-V, 房室;S-A, 窦房。
学生详细学习心脏冲动在心脏中的传导过程及其在心脏各个部分出现的精确时间非常重要。对这一过程的全面定量了解对于理解心电图学至关重要,这将在第11至13章中讨论。
心脏兴奋和传导的控制
窦房结是心脏的正常起搏器
在讨论心脏冲动的产生和传导时,我们注意到冲动通常起源于窦房结。在某些异常情况下,情况并非如此。心脏的其他部分也可以表现出与窦房结纤维相同的固有节律性兴奋;这在A-V结纤维和Purkinje纤维中尤为明显。
A-V结纤维在没有外部刺激的情况下,以40到60次/分钟的固有节律性速率放电,而Purkinje纤维的放电速率在15到40次/分钟之间。这些速率与窦房结的正常速率70到80次/分钟形成对比。
那么,为什么是窦房结而不是房室结(A-V node)或浦肯野纤维(Purkinje fibers)控制心脏的节律性?答案在于窦房结的放电速率明显快于房室结或浦肯野纤维的自然自发放电速率。每次窦房结放电时,其冲动会传导到房室结和浦肯野纤维,同时也会使它们的可兴奋膜放电。然而,窦房结在房室结或浦肯野纤维达到其自身的自兴奋阈值之前再次放电。因此,来自窦房结的新冲动会在这些部位发生自兴奋之前使房室结和浦肯野纤维放电。
因此,窦房结控制心脏的跳动,因为它的节律性放电速率比心脏的任何其他部分都快。因此,窦房结几乎总是正常心脏的起搏器(pacemaker)。
异常起搏器——异位起搏器(Ectopic Pacemaker)。偶尔,心脏的其他部分会发展出比窦房结更快的节律性放电速率。例如,当房室结或浦肯野纤维中的某一部位变得异常时,这种情况有时会发生。在这两种情况下,心脏的起搏器会从窦房结转移到房室结或兴奋的浦肯野纤维。在更罕见的情况下,心房或心室肌肉的某个部位会发展出过度的兴奋性并成为起搏器。
不在窦房结的起搏器称为异位起搏器。异位起搏器会导致心脏不同部位的收缩顺序异常,并可能导致心脏泵血的显著减弱。
起搏器转移的另一个原因是心脏冲动从窦房结传导到心脏其他部分的阻滞。新的起搏器通常出现在房室结或房室束(A-V bundle)的穿透部分,通向心室。
当发生房室传导阻滞(A-V block)时——即心脏冲动无法通过房室结和束系统从心房传递到心室时——心房继续以窦房结的正常节律跳动,而新的起搏器通常会在心室的浦肯野系统中发展,并以新的速率驱动心室肌肉,速率在每分钟15到40次之间。在突然的房室束阻滞后,浦肯野系统直到5到20秒后才会开始发出其固有的节律性冲动,因为在阻滞之前,浦肯野纤维已被快速的窦房结冲动“过度驱动”,因此处于抑制状态。在这5到20秒内,心室无法泵血,人在4到5秒后由于大脑血流不足而晕倒。这种心跳延迟恢复的现象称为斯托克斯-亚当斯综合征(Stokes-Adams syndrome)。如果延迟时间过长,可能会导致死亡。
浦肯野系统在引起心室肌肉同步收缩中的作用
Purkinje系统(传导系统)的快速传导通常允许心脏冲动在短时间内到达心室的几乎所有部位,使第一个心室肌纤维的兴奋仅比最后一个心室肌纤维的兴奋提前0.03至0.06秒。这种时间安排使得两个心室的心室肌的所有部分几乎同时开始收缩,然后继续收缩约0.3秒。
两个心室的有效泵血需要这种同步收缩。如果心脏冲动缓慢地通过心室,大部分心室肌会在其余部分收缩之前收缩,在这种情况下,整体泵血效果将大大降低。事实上,在某些类型的心脏功能障碍中(其中一些在第12章和第13章中讨论),确实会发生缓慢传导,心室的泵血效果会降低多达20%至30%。植入式心脏再同步装置是一种使用电线或导线的起搏器,可以插入心腔以恢复心房和两个心室之间的适当时间,从而提高心脏扩大和衰弱患者的泵血效果。
交感神经和副交感神经通过心脏神经控制心脏节律和冲动传导
心脏由交感神经和副交感神经支配,如第9章图9-14所示。副交感神经(迷走神经)主要分布在S-A结和A-V结,较少分布在两个心房的心肌,几乎不直接分布到心室肌。相反,交感神经分布到心脏的所有部分,在心室肌以及其他所有区域都有很强的分布。
副交感(迷走)刺激减慢心脏节律和传导。刺激心脏的副交感神经(迷走神经)会导致迷走神经末梢释放乙酰胆碱。这种神经递质对心脏有两个主要影响。首先,它降低了窦房结的节律速率,其次,它降低了心房肌和A-V结之间的A-V交界纤维的兴奋性,从而减慢心脏冲动向心室的传导。
弱到中度的迷走神经刺激会减慢心脏泵血的速率,通常降至正常的一半。此外,强烈的迷走神经刺激可以完全停止窦房结的节律性兴奋,或完全阻止心脏冲动通过A-V结从心房传导到心室。在这两种情况下,节律性兴奋信号不再传导到心室。心室可能会停止跳动5到20秒,但随后A-V束的室间隔部分中的Purkinje纤维的某个小区域会自行发展出节律,并以每分钟15到40次的速率引起心室收缩。这种现象称为心室逸搏。
迷走神经效应的机制
迷走神经末梢释放的乙酰胆碱(acetylcholine)大大增加了纤维膜对钾离子(permeability to potassium ions)的通透性,这使得钾离子能够快速从传导纤维中泄漏出去。这一过程导致纤维内部的负性增加,这种效应称为超极化(hyperpolarization),使得这种可兴奋组织的兴奋性大大降低,如第5章所述。
在窦房结中,超极化状态使得窦房结纤维的静息膜电位(resting membrane potential)比通常更为负性,即-65到-75毫伏,而不是正常的-55到-60毫伏。因此,由钠离子和钙离子内漏引起的窦房结膜电位的初始上升需要更长的时间才能达到兴奋的阈值电位(threshold potential)。这一要求大大减缓了这些结纤维的节律性速率。如果迷走神经刺激足够强,甚至可以完全停止该结的自律性兴奋。
在房室结(A-V node)中,迷走神经刺激引起的超极化状态使得进入结的小心房纤维难以产生足够的电活动来兴奋结纤维。因此,通过过渡纤维(transitional fibers)传递到房室结纤维的心脏冲动的安全系数(safety factor)降低。中等程度的降低只会延迟冲动的传导,而大幅度的降低则会完全阻断传导。
交感神经刺激增加心脏节律和传导
交感神经刺激对心脏的影响与迷走神经刺激基本相反,具体如下:
- 它增加了窦房结放电的速率。
- 它增加了传导速率,以及心脏所有部分的兴奋性水平。
- 它大大增加了所有心脏肌肉(包括心房和心室)的收缩力,如第9章所述。
简而言之,交感神经刺激增加了心脏的整体活动。最大刺激几乎可以使心跳频率增加三倍,并使心脏收缩的强度增加两倍。
交感神经效应的机制
交感神经刺激在交感神经末梢释放去甲肾上腺素(norepinephrine)。去甲肾上腺素反过来刺激β-1肾上腺素能受体(beta-1 adrenergic receptors),这些受体介导了对心率的影响。β-1肾上腺素能刺激作用于心肌纤维的确切机制尚不完全清楚,但被认为增加了纤维膜对钠离子和钙离子的通透性。在窦房结中,钠-钙通透性的增加导致静息电位更为正性。它还导致舒张期膜电位(diastolic membrane potential)向自兴奋阈值水平的上升速率增加,从而加速自兴奋,进而增加心率。
在房室结和房室束(A-V bundles)中,钠-钙通透性的增加使得动作电位更容易兴奋传导纤维束的每个后续部分,从而减少了从心房到心室的传导时间。
钙离子通透性的增加至少部分负责了在交感神经刺激影响下心肌收缩力的增加。这是因为钙离子在兴奋肌原纤维(myofibrils)的收缩过程中起着强大的作用。
第十一章 心电图基础
当心脏冲动通过心脏时,电流也会从心脏扩散到周围的组织中。一小部分电流会一直扩散到体表。如果将电极放置在心脏两侧的皮肤上,就可以记录到由电流产生的电位;这种记录称为心电图 (electrocardiogram, ECG)。图11-1显示了两次心跳的正常心电图。
正常心电图 (ECG) 的波形
正常心电图(见图11-1)由P波、QRS复合波和T波组成。QRS复合波通常(但不总是)由三个独立的波组成:Q波、R波和S波。
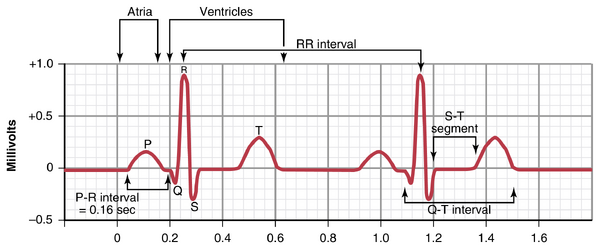
P波是由心房在收缩开始前去极化时产生的电位引起的。QRS复合波是由心室在收缩前去极化时产生的电位引起的,即去极化波在心室中扩散时产生的。因此,P波和QRS复合波的组成部分都是去极化波。
T波是由心室从去极化恢复时产生的电位引起的。这一过程通常发生在心室肌去极化后0.25至0.35秒。T波被称为复极化波 (repolarization wave)。
因此,心电图由去极化波和复极化波组成。去极化和复极化的原理在第5章中讨论。去极化波和复极化波的区别在心电图中非常重要,因此需要进一步澄清。
心脏去极化波与复极化波
图11-2显示了一个心肌纤维在去极化和复极化的四个阶段,红色表示去极化。在去极化过程中,纤维内部的正常负电位反转,内部变为轻微正电位,外部变为负电位。
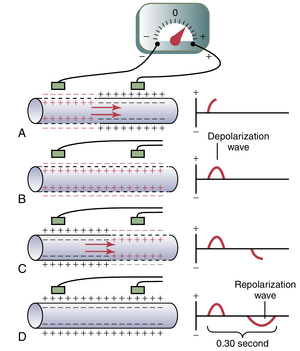
在图11-2A中,去极化由内部的正电荷(红色)和外部的负电荷(红色)表示,从左向右传播。纤维的前半部分已经去极化,而后半部分仍然处于极化状态。因此,纤维外部的左侧电极处于负电位区域,而右侧电极处于正电位区域,这导致记录仪显示正电位。在心肌纤维的右侧,显示了由高速记录仪记录的两个电极之间的电位变化。注意,当去极化达到图11-2A中的中间点时,右侧的记录上升到最大正值。
在图11-2B中,去极化已经扩展到整个心肌纤维,右侧的记录返回到零基线,因为两个电极现在都处于相同的负电位区域。完成的波是去极化波,因为它是由去极化沿心肌纤维膜扩散引起的。
图11-2C显示了同一心肌纤维的中间复极化过程,正电位返回到纤维的外部。此时,左侧电极处于正电位区域,而右侧电极处于负电位区域。这种极性与图11-2A中的极性相反。因此,如右侧所示,记录变为负值。
在图11-2D中,肌纤维已经完全复极化(repolarized),两个电极现在都处于正电位区域,因此它们之间没有记录到电位差。因此,在右侧的记录中,电位再次回到零。这个完整的负波是复极化波(repolarization wave),因为它是由复极化沿肌纤维膜的扩散引起的。
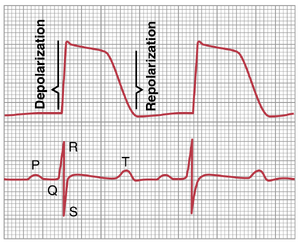
心室肌的单相动作电位(monophasic action potential)与标准心电图中的QRS波和T波的关系。心室肌的单相动作电位,在第10章中讨论过,通常持续0.25到0.35秒。图11-3的上部显示了从插入单个心室肌纤维内部的微电极记录到的单相动作电位。该动作电位的上升部分由去极化(depolarization)引起,而电位回到基线则由复极化(repolarization)引起。
图11-3的下半部分显示了同一心室的同步心电图记录。注意,QRS波出现在单相动作电位的开始,而T波出现在其结束时。特别要注意的是,当心室肌完全极化或完全去极化时,心电图中没有记录到电位。只有当肌肉部分极化和部分去极化时,电流才会从心室的一部分流向另一部分,因此电流也会流向体表以产生心电图。
心房和心室收缩与心电图波形的关系
在肌肉收缩发生之前,去极化必须通过肌肉扩散以启动收缩的化学过程。再次参考图11-1;P波出现在心房收缩开始时,而QRS波群出现在心室收缩开始时。心室保持收缩状态直到复极化发生之后——即直到T波结束之后。
心房在P波终止后约0.15到0.20秒复极化,这大约也是心电图中记录到QRS波群的时候。因此,心房复极化波,称为心房T波,通常被更大的QRS波群所掩盖。因此,心电图中很少观察到心房T波。
心室复极波是正常心电图(ECG)中的T波。通常,心室肌在去极化波(QRS波群)开始后约0.20秒开始在一些纤维中复极,但在许多其他纤维中,复极需要长达0.35秒。因此,心室复极过程持续较长时间,约0.15秒。由于这个原因,正常心电图中的T波是一个延长的波,但T波的电压明显低于QRS波群的电压,部分原因是其持续时间较长。
心电图校准和显示
所有心电图的记录都在显示网格上带有适当的校准线。历史上,心电图是电子记录并打印在纸上的;现在心电图通常以数字方式显示。如图11-1所示,水平校准线的排列方式是,标准心电图中向上或向下的10个小线格代表1毫伏,正方向向上,负方向向下。
心电图上的垂直线是时间校准线。典型的心电图以每秒25毫米的速度运行,尽管有时会使用更快的速度。因此,水平方向上每25毫米为1秒,由深色垂直线表示的每5毫米段代表0.20秒。然后,0.20秒的间隔被细线分成五个较小的间隔,每个间隔代表0.04秒。
心电图中的正常电压。正常心电图中记录的波电压取决于电极在体表的放置方式以及电极与心脏的距离。当一个电极直接放置在心室上方,另一个电极放置在远离心脏的身体其他部位时,QRS波群的电压可能高达3到4毫伏。即使这个电压与直接在心肌膜上记录的110毫伏的单相动作电位相比也很小。当心电图从两个手臂或一个手臂和一条腿上的电极记录时,QRS波群的电压通常为1.0到1.5毫伏(从R波的顶部到S波的底部),P波的电压在0.1到0.3毫伏之间,T波的电压在0.2到0.3毫伏之间。
[译者注:为何如此命名?OPQ,SRT,UVW……]
P-Q或P-R间期。P波开始到QRS波群开始之间的时间是心房电兴奋开始到心室兴奋开始之间的间隔。这个时期称为P -Q间期。正常的P-Q间期约为0.16秒。(通常,这个间期被称为P-R间期,因为Q波可能不存在。)P-R间期在较快的心率下缩短,这是由于交感神经活动增加或副交感神经活动减少,从而增加了房室结的传导速度。相反,P-R间期在较慢的心率下延长,这是由于副交感神经张力增加或交感神经活动减少导致的房室结传导速度减慢。
Q-T间期 (Q-T Interval)。心室收缩几乎从Q波(如果Q波不存在,则为R波)开始持续到T波结束。这段时间称为Q-T间期,通常约为0.35秒。
通过心电图确定心率 。通过心电图 (ECG) 可以轻松确定心率,因为心率是两次连续心跳之间时间间隔(R-R间期)的倒数。如果根据时间校准线确定两次心跳之间的间隔为1秒,则心率为60次/分钟。成年人两次连续QRS复合波之间的正常间隔约为0.83秒,即心率为60/0.83次/分钟,或72次/分钟。
心脏周期期间心脏周围的电流流动
从部分去极化的合胞体心肌块记录电位
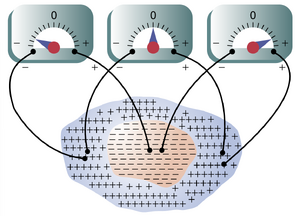
图11-4显示了一个在中心点被刺激的合胞体心肌块。在刺激之前,所有心肌细胞的外部都带正电,内部带负电。如第5章关于膜电位 (membrane potentials) 的讨论所述,一旦心脏合胞体的某个区域去极化,负电荷就会泄漏到去极化肌纤维的外部,使这部分表面带负电,如图11-4中的减号所示。心脏的其余表面仍然极化,用加号表示。因此,如图右侧所示,将仪器的负极端连接到去极化区域,正极端连接到仍然极化的区域时,仪器会记录到正电位。
图11-4还展示了另外两种电极放置方式和仪表读数。应仔细研究这些放置方式和读数,读者应能够解释各自仪表读数的原因。由于去极化通过心脏向各个方向扩散,图中所示的电位差异仅持续千分之几秒,实际的电压测量只能通过高速记录设备完成。
心脏周围胸腔内的电流流动
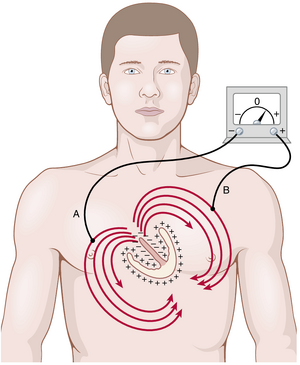
图11-5显示了位于胸腔内的心室肌。尽管肺部大部分充满空气,但其导电性令人惊讶,而心脏周围其他组织中的液体导电性更强。因此,心脏实际上是悬浮在导电介质中的。当心室的一部分去极化并因此相对于其余部分带负电时,电流会从去极化区域流向极化区域,沿着图中所示的大回路流动。
应该回顾第10章中关于Purkinje系统的讨论,心脏冲动首先到达心室间隔,随后迅速扩散到心室其余部分的内表面,如图11-5中的红色区域和负号所示。这一过程在心室内部产生电负性(negativity),在心室外壁产生电正性(positively),电流沿着椭圆形路径通过心室周围的液体流动,如图中的弯曲箭头所示。如果对所有电流流动的线条(椭圆形线条)进行代数平均,平均电流流动的方向是朝向心脏基底部为负,朝向心尖部为正。
在去极化(depolarization)过程的其余大部分时间里,电流继续沿相同方向流动,而去极化从心内膜表面向外扩散通过心室肌群。然后,在去极化完成通过心室的路径之前,电流的平均方向会反转约0.01秒,从心尖部流向基底部,因为心脏最后去极化的部分是靠近基底部的心室外壁。
因此,在正常的心室中,电流从负到正主要沿从心脏基底部向心尖部的方向流动,几乎贯穿整个去极化周期,除了最后阶段。如果将仪表连接到体表的电极上,如图11-5所示,靠近基底部的电极为负,靠近心尖部的电极为正,记录仪表将在心电图上显示正记录。
心电图导联(ELECTROCARDIOGRAPHIC LEADS)
三个标准双极肢体导联
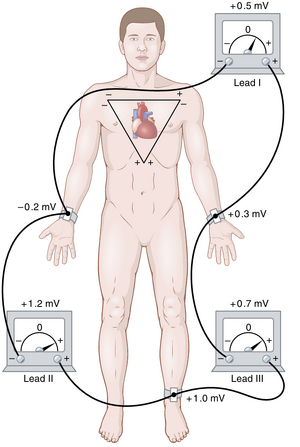
图11-6显示了患者肢体与心电图仪之间的电气连接,用于记录所谓的标准双极肢体导联的心电图。术语“双极”意味着心电图是从位于心脏两侧的两个电极记录的——在这种情况下,位于肢体上。因此,导联不是从身体连接的单根导线,而是两根导线及其电极的组合,以在身体和心电图仪之间形成完整电路。在每种情况下,心电图仪在图中由电表表示,尽管实际的心电图仪是一个高速、基于计算机的系统,带有电子显示屏。
导联I(Lead I)。在记录肢体导联I时,心电图仪的负极端连接到右臂,正极端连接到左臂。因此,当右臂连接到胸部的点相对于左臂连接的点为负时,心电图仪记录为正——即高于心电图中的零电压线。当情况相反时,心电图仪记录在零电压线以下。
导联II (Lead II)。为了记录肢体导联II (limb lead II),心电图机(ECG)的负极端连接到右臂,正极端连接到左腿。因此,当右臂相对于左腿为负时,心电图机记录为正。
导联III (Lead III)。为了记录肢体导联III (limb lead III),心电图机的负极端连接到左臂,正极端连接到左腿。这种配置意味着当左臂相对于左腿为负时,心电图机记录为正。
Einthoven三角 (Einthoven's Triangle)。在图11-6中,围绕心脏区域绘制的三角形称为Einthoven三角。该三角形说明了两臂和左腿形成了围绕心脏的三角形的顶点。三角形上部的两个顶点代表了两臂与心脏周围液体电连接的点,而下部的顶点是左腿与液体连接的点。
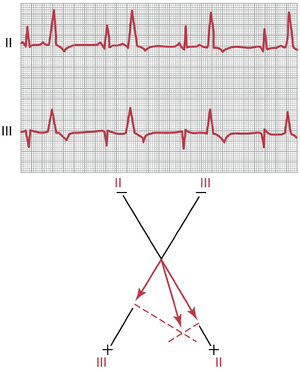
Einthoven定律 (Einthoven’s Law)。Einthoven定律指出,如果同时用三个肢体导联记录心电图,导联I和导联III记录到的电位之和将等于导联II的电位:
导联I电位 + 导联III电位 = 导联II电位
换句话说,如果在任何给定时刻已知三个双极肢体心电图导联中的任意两个的电势,第三个可以通过简单地将前两个相加来确定。然而,在进行此求和时,必须注意不同导联的正负符号。
例如,假设在图11-6中,右臂相对于身体的平均电位为-0.2毫伏(负),左臂为+0.3毫伏(正),左腿为+1.0毫伏(正)。观察图中的仪表,可以看到导联I记录到的正电位为+0.5毫伏,因为这是右臂的-0.2毫伏与左臂的+0.3毫伏之间的差值。同样,导联III记录到的正电位为+0.7毫伏,导联II记录到的正电位为+1.2毫伏,因为这些是相应肢体对之间的瞬时电位差。
现在,注意导联I和导联III的电压之和等于导联II的电压;即0.5加0.7等于1.2。从数学上讲,这一原理称为Einthoven定律,在记录三个“标准”双极心电图时,在任何给定时刻都成立。
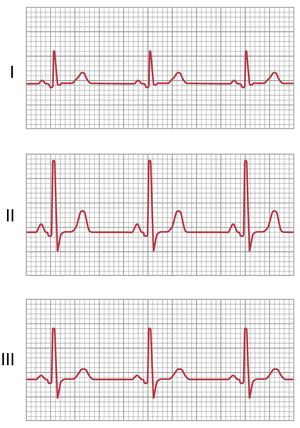
从三个标准双极肢体导联记录的正常心电图。图11-7显示了导联I、II和III的心电图记录。很明显,这三个导联的心电图彼此相似,因为它们都记录到正向的P波和T波,并且每个心电图中的QRS波群的主要部分也是正向的。通过对这三个心电图的分析,通过仔细测量和正确观察极性,可以证明在任何给定时刻,导联I和III中的电位之和等于导联II中的电位,从而证明了Einthoven定律的有效性。
由于所有双极肢体导联的记录彼此相似,因此在诊断不同心律失常时,记录哪个导联并不重要,因为心律失常的诊断主要取决于心动周期中不同波之间的时间关系。然而,当诊断心室或心房肌肉或Purkinje传导系统的损伤时,记录哪个导联非常重要,因为心肌收缩或心脏冲动传导的异常会显著改变某些导联中的心电图模式,而可能不会影响其他导联。这两种情况——心肌病和心律失常——的心电图解释分别在第12章和第13章中讨论。
胸导联
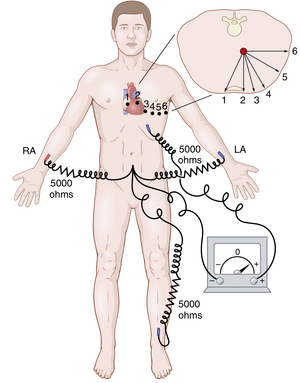
通常,心电图记录时会在心脏正前方的胸壁上放置一个电极,如图11-8所示。该电极连接到心电图仪的正极,而负极(称为无关电极或Wilson中心端)通过相等的电阻同时连接到右臂、左臂和左腿,如图所示。通常,从前胸壁上依次记录六个标准胸导联,胸电极依次放置在图中所示的六个点上。不同的记录分别称为导联V1, V2 , V3, V4,V5,和V6。
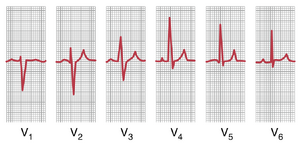
图11-9展示了从这六个标准胸导联记录的健康心脏的心电图。由于心脏表面靠近胸壁,每个胸导联主要记录电极下方心肌的电势。因此,心室中相对微小的异常,特别是前壁心室,可能会导致单个胸导联记录的心电图发生显著变化。
在导联 V1 和 V2 中,正常心脏的 QRS 波群记录主要为负向,因为如图 11-8 所示,这些导联中的胸电极更靠近心脏的基底部而不是心尖部,而心脏基底部在心室去极化(ventricular depolarization)过程中的大部分时间内是电负性的方向。相反,导联 V4,V5, 和 V6 中的 QRS 波群主要为正向,因为这些导联中的胸电极更靠近心尖部,而心尖部在去极化过程中的大部分时间内是电正性的方向。
加压肢体导联(augmented limb leads)
另一种广泛使用的导联系统是加压肢体导联。在这种记录方式中,两个肢体通过电阻连接到心电图机的负极端子,第三个肢体连接到正极端子。当正极端子在右臂时,导联称为 aVR 导联;当在左臂时,称为 aVL 导联;当在左腿时,称为 aVF 导联。
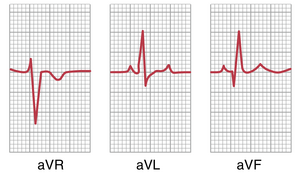
图 11-10 显示了加压肢体导联的正常记录。它们与标准肢体导联记录相似,只是 aVR 导联的记录是倒置的。(为什么会出现这种倒置?研究心电图机的极性连接以确定这个问题的答案。)
心电图显示
导联通常分为三组,如图 11-11 所示:标准双极肢体导联(I、II、III),然后是加压导联(aVR、aVL 和 aVF),最后是胸导联(V1-V6)。
动态心电图(ambulatory electrocardiography)
标准心电图(ECG)提供了短时间内心脏电活动的评估,通常在患者休息时进行。在与不频繁但重要的心脏节律异常相关的情况下,可能需要在一段较长的时间内检查心电图,从而允许评估短暂的心脏电现象,这些现象可能是标准静息心电图所遗漏的。将心电图扩展到允许在患者进行日常活动时评估心脏电活动称为动态心电图。
动态心电图监测通常用于当患者表现出被认为是由短暂性心律失常(arrhythmias)或其他短暂性心脏异常引起的症状时。这些症状可能包括胸痛、晕厥(syncope)或接近晕厥、头晕和心悸(palpitations)。诊断严重的短暂性心律失常或其他心脏状况所需的关键信息是在症状发生的精确时间记录心电图。这些设备还可用于检测无症状的心律失常,如心房颤动(atrial fibrillation),这可能会增加血栓形成的风险,进而导致中风。由于心律失常频率的日常变化很大,通常需要全天进行动态心电图监测以进行检测。
有多种类型的动态心电图记录仪。连续记录仪(Holter monitors)通常用于24至48小时,以调查症状与可能在该时间范围内发生的心电图事件之间的关系。间歇记录仪用于更长时间(数周至数月),以提供短暂的间歇记录,用于检测不常发生的事件;这些记录通常由患者在出现症状时启动。在某些情况下,一种小型设备,大小约为一个大回形针,称为植入式循环记录仪(implantable loop recorder),被植入胸部皮下,以连续监测心脏的电活动长达2至3年。该设备可以编程为在心率低于或高于预定水平时启动记录,或者患者可以在出现头晕等症状时手动激活。固态数字技术和配备微处理器的记录仪的改进现在允许通过电话线连续或间歇传输数字心电图数据,复杂的软件系统在数据获取时提供快速的在线计算机分析。新型可穿戴设备,包括手表或手持心电图监测设备,也正在开发中,用于家庭心律监测。
第十二章 心肌和冠状动脉血流异常的心电图解释:向量分析
从第10章讨论的心脏冲动传导来看,显然任何传导模式的改变都会导致心脏周围的异常电位,从而改变心电图(ECG)中波的形状。因此,大多数严重的心肌异常可以通过分析不同心电图导联中波的轮廓来诊断。
心电图的向量分析
向量可以表示电位
要理解心脏异常如何影响心电图的轮廓,首先必须熟悉向量和向量分析的概念,这些概念适用于心脏内外的电位。在第11章中,我们指出心脏电流在心脏周期中的特定时刻以特定方向流动。向量是一个箭头,指向电流产生的电位方向,箭头指向正方向。此外,按照惯例,箭头的长度与电位的电压成比例绘制。
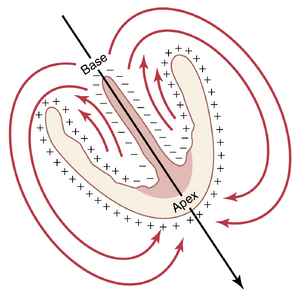
心脏在任意时刻的合成向量。图12-1中的阴影区域和减号显示了心室间隔和两个心室心尖部心内膜壁的部分去极化(depolarization)。在心脏兴奋的瞬间,电流在心脏内部的去极化区域和心脏外部的非去极化区域之间流动,如长椭圆形箭头所示。一些电流也直接在心脏腔内从去极化区域流向仍然极化的区域。总体而言,从心室基部向心尖部向下流动的电流明显多于向上流动的电流。因此,在这个特定时刻产生的电位的总和向量,称为瞬时平均向量(instantaneous mean vector),由穿过心室中心的长黑色箭头表示,方向从基部指向心尖。此外,由于总电流相当大,电位也很大,向量也很长。
向量的方向以度数表示
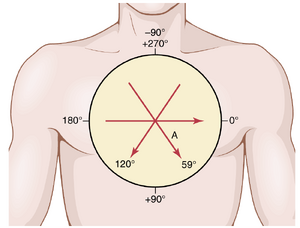
当一个向量完全水平并指向人的左侧时,该向量被称为沿0度方向延伸,如图12-2所示。从这个零参考点开始,向量的刻度顺时针旋转;当向量从上方向下延伸时,其方向为+90度;当向量从人的左侧向右延伸时,其方向为+180度;当向量直接向上延伸时,其方向为-90(或+270)度。
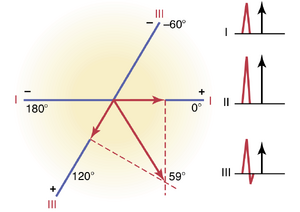
在正常心脏中,去极化波通过心室传播期间向量的平均方向,称为平均QRS向量(mean QRS vector),约为+59度,如图12-2中通过中心绘制的向量A所示,方向为+59度。这意味着在去极化波的大部分时间内,心尖相对于心脏基部保持正电位,本章稍后将讨论这一点。
每个标准双极导联和每个单极D肢体导联的轴
在第11章中,描述了三个标准双极导联和三个单极肢体导联。每个导联实际上是一对电极,分别连接在心脏相对两侧的身体上,从负电极到正电极的方向称为导联的轴(axis)。导联I是从分别放置在两个手臂上的两个电极记录的。由于电极完全位于水平方向,正电极在左侧,导联I的轴为0度。
在记录导联II时,电极放置在右臂和左腿上。右臂连接在躯干的右上角,左腿连接在左下角。因此,该导联的方向约为+60度。
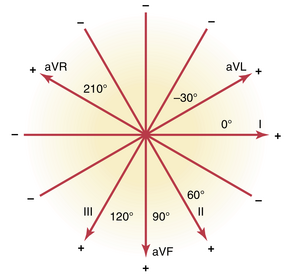
通过类似的分析,可以看出导联III的轴约为+120度,导联aVR为+210度,导联aVF为+90度,导联aVL为-30度。所有这些导联的轴方向如图12-3所示,称为六轴参考系统(hexagonal reference system)。电极的极性由图中的加号和减号表示。读者必须学习这些轴及其极性,特别是双极肢体导联I、II和III,以便理解本章的其余部分。
不同导联记录电位的向量分析
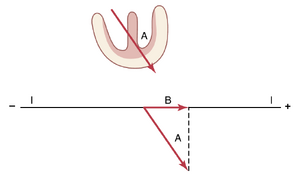
图12-4显示了一个部分去极化的心脏,向量A代表心室中电流流动的瞬时平均方向。在这种情况下,向量的方向为+55度,电位的电压(由向量A的长度表示)为2毫伏。在心脏下方的图中,再次显示了向量A,并绘制了一条线表示导联I在0度方向的轴。为了确定向量A中有多少电压会在导联I中记录,从向量A的尖端向导联I轴绘制一条垂直线,并沿导联I轴绘制一个所谓的投影向量(B)。该投影向量的箭头指向导联I轴的正端,这意味着在导联I的心电图中记录的瞬时记录是正的。瞬时记录的电压将等于B的长度除以A的长度乘以2毫伏,约为1毫伏。
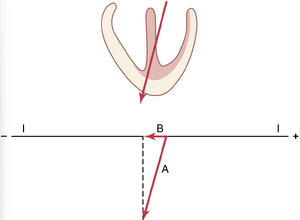
图12-5展示了另一个向量分析的例子。在这个例子中,向量A代表心室去极化过程中某一时刻的电势及其轴,其中左心室的去极化速度比右心室快。在这种情况下,瞬时向量的方向为100度,其电压再次为2毫伏。为了确定导联I中实际记录的电势,我们从向量A的尖端向导联I轴绘制一条垂直线,并找到投影向量B。向量B非常短,并且这次是负方向的,表明在这一特定时刻,导联I中的记录将是负的(在心电图中低于零线),记录的电压将很小,约为-0.3毫伏。该图表明,当心脏中的向量方向几乎垂直于导联轴时,该导联心电图中记录的电压非常低。相反,当心脏向量的轴几乎与导联轴完全一致时,基本上会记录到向量的全部电压。
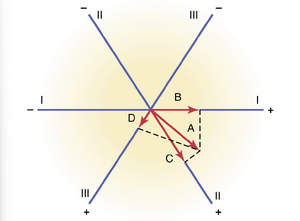
三个标准双极肢体导联中电位的向量分析。在图 12-6 中,向量 A 描绘了部分去极化心脏的瞬时电位。为了确定此时在心电图中记录的三个标准双极肢体导联中每一个导联的电位,从向量 A 的尖端绘制垂直线(虚线)到代表三个不同标准导联轴的三条线,如图所示。投影向量 B 描绘了此时在导联 I 中记录的电位,投影向量 C 描绘了导联 II 中的电位,投影向量 D 描绘了导联 III 中的电位。在每一种情况下,心电图中的记录都是正的——即高于零线——因为投影向量指向所有导联轴的正方向。导联 I 中的电位(向量 B)大约是心脏实际电位(向量 A)的一半,导联 II 中的电位(向量 C)几乎等于心脏中的电位,而导联 III 中的电位(向量 D)大约是心脏中的三分之一。
可以使用相同的分析来确定增强肢体导联中记录的电位,只是使用增强导联的各自轴(见图 12-3)代替用于图 12-6 的标准双极肢体导联轴。
正常心电图的向量分析
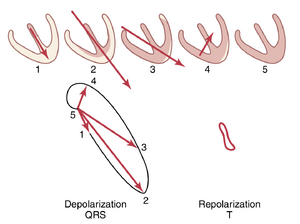
心室去极化期间连续间隔发生的向量——QRS 复合波
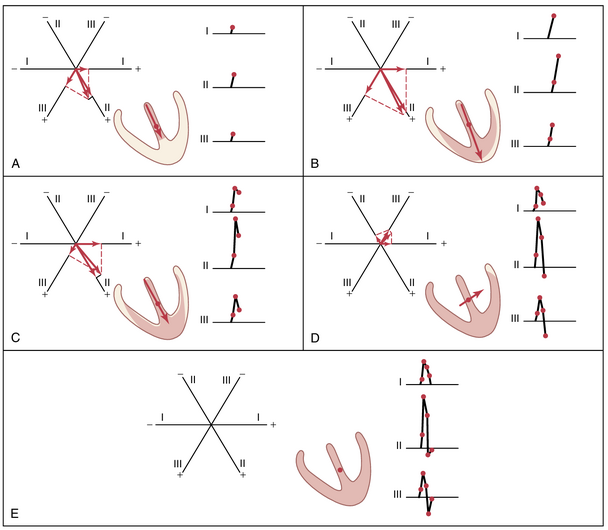
当心脏冲动通过房室束进入心室时,心室中首先去极化的部分是室间隔的左心内膜表面。然后,去极化迅速扩散到涉及室间隔的两个心内膜表面,如图 12-7A 中阴影较深的心室部分所示。接下来,去极化沿着两个心室其余部分的心内膜表面扩散,如图 12-7B 和 C 所示。最后,它通过心室肌肉扩散到心脏外部,如图12-7C 到 E 所示。
在图 12-7 的每个阶段,A 到 E,心室的瞬时平均电位由叠加在每个图中心室上的红色向量表示。然后通过前一节中描述的方法分析这些向量中的每一个,以确定在每个标准心电图导联中每个时刻记录的电压。在每个图的右侧显示了心电图 QRS 复合波的逐步发展。请记住,导联中的正向量将导致心电图记录在零线上方,而负向量将导致记录在零线下方。
在进一步考虑向量分析之前,必须理解图12-7中展示的连续正常向量的分析。每个分析都应按照此处给出的程序进行详细研究。以下是这一序列的简要总结。
在图12-7A中,心室肌刚刚开始去极化(Depolarization),代表去极化开始后约0.01秒的瞬间。此时,向量较短,因为只有一小部分心室——室间隔——被去极化。因此,所有心电图导联记录的电压都较低,如每个导联记录在心室肌右侧所示。导联II的电压大于导联I和III的电压,因为心脏向量主要延伸在与导联II轴相同的方向上。
在图12-7B中,代表去极化开始后约0.02秒,心脏向量较长,因为大部分心室肌质量已经去极化。因此,所有心电图导联的电压都增加了。
在图12-7C中,去极化开始后约0.035秒,心脏向量变短,记录的心电图电压较低,因为心脏心尖的外部现在带负电,中和了心脏其他心外膜表面的正电。此外,向量的轴开始向胸部左侧移动,因为左心室的去极化速度略慢于右心室。因此,导联I与导联III的电压比增加。
在图12-7D中,去极化开始后约0.05秒,心脏向量指向左心室的基部,并且较短,因为只有极小部分的心室肌仍带正电。由于此时向量的方向,导联II和III记录的电压均为负——即在线以下——而导联I的电压仍为正。
在图12–7E,中,去极化开始后约0.06秒,整个心室肌质量已去极化,因此心脏周围没有电流流动,也没有电位产生。向量变为零,所有导联的电压变为零。
因此,QRS复合波在三个标准双极肢体导联中完成。
有时,QRS波群在一个或多个导联的起始处会有一个轻微的负向凹陷,这在图12-7中没有显示;这个凹陷就是Q波。当它出现时,是由于室间隔左侧在右侧之前发生初始去极化(initial depolarization)引起的,这会在通常的基底到心尖向量出现之前,产生一个从左到右的弱向量,持续几分之一秒。图12-7中显示的主要正向偏转是R波,最后的负向偏转是S波。
心室复极化期间的心电图——T波
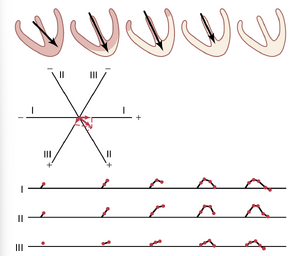
在心室肌去极化(depolarization)后,大约0.15秒后,复极化开始并持续到完成,大约在0.35秒时。这种复极化在心电图中产生了T波。
由于室间隔和心室肌的心内膜区域首先去极化,逻辑上这些区域也应该首先复极化。然而,通常情况并非如此,因为室间隔和其他心内膜区域的收缩期比心脏的大部分外表面更长。因此,首先复极化的最大部分心室肌质量是整个心室的外表面,尤其是靠近心尖的区域。相反,心内膜区域通常最后复极化。这种复极化的顺序被认为是由于心室收缩期间内部的高血压,这大大减少了心内膜的冠状动脉血流,从而减缓了心内膜区域的复极化。
由于心室的外表面心尖区域在内表面之前复极化,复极化期间整体心室向量的正端朝向心尖。因此,所有三个双极肢体导联中的正常T波都是正向的,这也是大多数正常QRS波群的极性。
在图12-8中,心室的五个复极化阶段通过浅棕色区域的逐渐增加来表示——复极化区域。在每个阶段,向量从心脏的基底延伸到心尖,直到在最后一个阶段消失。最初,向量相对较小,因为复极化的区域较小。后来,由于复极化程度的增加,向量变得更强。最后,向量再次变弱,因为仍然持续的去极化区域变得如此轻微,以至于总电流量减少。这些变化还表明,当大约一半的心脏处于极化状态,另一半处于去极化状态时,向量最大。
在复极化过程中,三个标准肢体导联的心电图(ECG)变化在每个心室下方被记录,描绘了复极化的渐进阶段。因此,在大约0.15秒的时间内,即整个过程所需的时间段内,心电图的T波被生成。
心房去极化——P波
心房去极化始于窦房结,并向心房的所有方向扩散。因此,心房中原始电负性的点位于上腔静脉入口处,即窦房结所在的位置,初始去极化的方向由图12-9中的黑色向量表示。此外,在正常心房去极化过程中,向量通常保持在这个方向上。由于这个方向通常与三个标准双极肢体导联I、II和III的正方向一致,因此在去极化过程中记录的心房心电图通常在这三个导联中也是正向的,如图12-9所示。这种心房去极化的记录被称为心房P波。
心房复极化——心房T波。去极化通过心房肌的传播速度比心室慢得多,因为心房没有浦肯野系统(Purkinje system)来快速传导去极化信号。因此,窦房结周围的肌肉在远端心房肌肉之前很长时间就已经去极化。因此,心房中首先复极化的区域也是最初去极化的区域,即窦房结区域。
因此,当复极化开始时,窦房结周围的区域相对于心房的其余部分变为正电。因此,心房复极化向量与去极化向量相反。(注意,这与心室中发生的情况相反。)因此,如图12-9右侧所示,所谓的心房T波在心房P波之后大约0.15秒出现,但这个T波位于零参考线的另一侧,与P波相反;也就是说,在三个标准双极肢体导联中,它通常是负向的,而不是正向的。
在正常的心电图中,心房T波出现的时间大约与心室的QRS复合波出现的时间相同。因此,它几乎总是被大的心室QRS复合波完全掩盖,尽管在某些非常异常的状态下,它确实会出现在记录的心电图中。
向量心电图
如前所述,随着冲动通过心肌的传播,心脏电流的向量迅速变化。它在两个方面发生变化。首先,由于向量电压的增加和减少,向量的长度增加和减少。其次,由于心脏电位的平均方向的变化,向量的方向发生变化。向量心电图描绘了心脏周期中不同时间点的这些变化,如图12-10所示。
在图12-10的大向量心电图中,点5是零参考点,这个点是所有连续向量的负端。当心肌在心跳之间处于极化状态时,向量的正端保持在零点,因为没有向量电势。然而,一旦心室去极化开始时电流开始流过心室,向量的正端就会离开零参考点。
当室间隔首次去极化时,向量向下延伸到心室的尖端,但它相对较弱,因此生成了心室向量心电图的第一个部分,如向量1的正端所示。随着更多的心室肌肉去极化,向量变得越来越强,通常会稍微向一侧摆动。因此,图12-10中的向量2代表了在向量1之后约0.02秒时心室的去极化状态。再过0.02秒后,向量3代表了电势,向量4在另一个0.01秒后出现。最后,心室完全去极化,向量再次变为零,如点5所示。
由向量正端生成的椭圆图形称为QRS向量心电图。
心室QRS的平均电轴及其意义
图12-10中显示的心室去极化期间的向量心电图(QRS向量心电图)是正常心脏的。请注意,在心室去极化的大部分时间,电势的方向(从负到正)是从心室的基部向尖端。这种从心脏基部到尖端的去极化期间电势的主要方向称为心室的平均电轴。正常心室的平均电轴为59度。在许多心脏病理条件下,这个方向会显著变化,有时甚至会指向心脏的相反极。
从标准导联心电图确定电轴
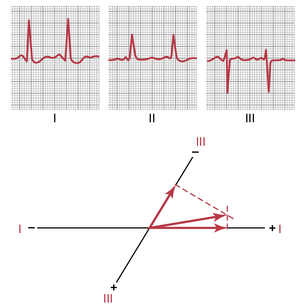
临床上,心脏的电轴通常通过标准双极肢体导联心电图(ECG)而非心向量图(vectorcardiogram)来估计。图12-11展示了一种进行这种估计的方法。在记录标准导联后,需要确定导联I和III记录中的净电位和极性。在图12-11的导联I中,记录为正,而在导联III中,记录主要为正,但在部分周期中为负。如果记录的任何部分为负,则从电位的正部分中减去该负电位,以确定该导联的净电位,如导联III的QRS波群右侧箭头所示。然后,将导联I和III的每个净电位分别绘制在各自导联的轴上,电位的基点在轴的交点处,如图12-11所示。
为了确定总QRS心室平均电位的向量,分别从导联I和III的顶点绘制垂直线(图中的虚线)。通过向量分析,这两条垂直(虚线)线的交点代表心室中平均QRS向量的顶点,而导联I和导联III轴的交点代表平均向量的负端。因此,平均QRS向量绘制在这两点之间。心室在去极化期间产生的近似平均电位由该平均QRS向量的长度表示,而平均电轴由平均向量的方向表示。因此,如图12-11所示,正常心室的平均电轴方向为+59度。
导致电轴偏移的异常心室状况
尽管心室的平均电轴平均约为59度,但即使在正常心脏中,该轴也可能在大约20度到100度之间摆动。正常变化的原因主要是Purkinje分布系统或不同心脏肌肉本身的解剖学差异。然而,许多心脏异常状况可能导致电轴偏移超出正常范围,如下所述。
心脏在胸腔中位置的变化。如果心脏向左倾斜,心脏的平均电轴也会向左偏移。这种偏移发生在(1)深呼气结束时,(2)当一个人躺下时,因为腹腔内容物向上压迫膈肌,以及(3)在肥胖人群中相当常见,由于内脏脂肪增加,膈肌通常一直向上压迫心脏。
同样,心脏向右倾斜会导致心室的平均电轴向右偏移。这种偏移发生在(1)深吸气结束时,(2)当一个人站立时,以及(3)通常发生在身材高瘦的人中,他们的心脏向下垂挂。
一侧心室肥大。当一侧心室显著肥大时,心脏的电轴会向肥大的一侧偏移,原因有二。首先,心脏肥大的一侧肌肉量多于另一侧,这使得该侧能够产生更大的电位。其次,去极化波通过肥大心室所需的时间比通过正常心室更长。因此,正常心室在肥大心室之前显著去极化,这种情况导致从心脏正常侧向肥大侧产生一个强向量,而肥大侧仍然保持强正电荷。因此,电轴偏向肥大的一侧。
左心室肥大导致的左轴偏转的向量分析。图 12-12 展示了三个标准双极肢体导联的心电图。向量分析显示左轴偏转,平均电轴指向 -15 度的方向。这是由左心室肌肉质量增加引起的典型心电图。在这种情况下,轴偏转是由高血压(动脉血压升高)引起的,高血压导致左心室肥大,以便能够对抗升高的全身动脉压力泵血。当左心室因主动脉瓣狭窄、主动脉瓣反流或先天性心脏病而肥大时,也会出现类似的左轴偏转图像,此时左心室扩大而右心室保持相对正常的大小。
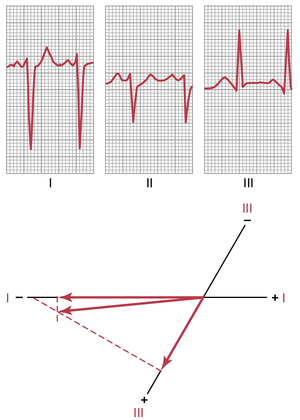
右心室肥大导致的右轴偏转的向量分析。图 12-13 的心电图显示了强烈的右轴偏转,电轴达到 170 度,比正常的 59 度平均心室 QRS 轴偏右 111 度。图中显示的右轴偏转是由先天性肺动脉瓣狭窄引起的右心室肥大所致。右轴偏转也可能发生在其他导致右心室肥大的先天性心脏病中,例如法洛四联症和室间隔缺损。
束支传导阻滞导致电轴偏移。通常情况下,两个心室的外侧壁几乎同时去极化(Depolarization),因为Purkinje系统的左右束支几乎同时将心脏冲动传递到两个心室壁。因此,两个心室(在心脏的两侧)产生的电位几乎相互抵消。然而,如果只有一个主要束支被阻滞,心脏冲动会先通过正常的心室传播,然后再通过另一个心室传播。因此,两个心室的去极化不会同时发生,甚至几乎不会同时发生,去极化电位也不会相互抵消。结果,电轴偏移如下所示。
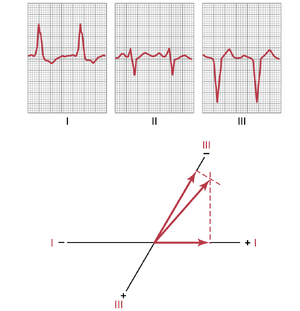
左束支传导阻滞时左电轴偏移的向量分析。当左束支被阻滞时,心脏去极化通过右心室的传播速度是左心室的两到三倍。因此,在右心室完全去极化后,左心室的大部分仍保持极化状态长达0.1秒。因此,在去极化过程中,右心室变为电负性,而左心室保持电正性,并且一个强向量从右心室指向左心室。换句话说,由于向量的正端指向左心室,因此发生了大约-50度的强烈左电轴偏移。这种情况在图12-14中得到了展示,图中显示了由左束支传导阻滞引起的典型左电轴偏移。
由于Purkinje系统被阻滞时冲动传导的缓慢性,除了电轴偏移外,QRS波群的持续时间也因心脏受影响一侧的去极化极度缓慢而显著延长。通过观察图12-14中QRS波的过度宽度可以看到这种效果(本章后面将更详细地讨论)。这种极度延长的QRS波群将束支传导阻滞与由肥大引起的电轴偏移区分开来。
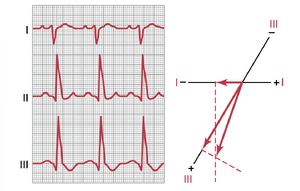
右束支传导阻滞时右电轴偏移的向量分析。当右束支被阻滞时,左心室的去极化速度远快于右心室,因此心室左侧在右心室之前长达0.1秒变为电负性。因此,形成了一个强向量,其负端指向左心室,正端指向右心室。换句话说,发生了强烈的右电轴偏移。在图12-15中,展示了由右束支传导阻滞引起的右电轴偏移,并对其向量进行了分析;该分析显示电轴约为105度,而不是正常的59度,并且由于传导缓慢,QRS波群延长。
导致QRS波群电压异常的情况
标准双极肢体导联中电压增加
通常情况下,从R波峰值到S波底部测量的三个标准双极肢体导联的电压在0.5到2.0毫伏之间变化,其中导联III通常记录到最低电压,导联II记录到最高电压。然而,即使对于正常心脏,这些关系也不是一成不变的。一般来说,当三个标准导联的所有QRS波群的电压总和大于4毫伏时,患者被认为具有高电压心电图(high-voltage ECG)。
高电压QRS波群的原因通常是心脏肌肉质量的增加,这通常是由于心脏某一部分或另一部分对过度负荷的反应而导致肌肉肥大(hypertrophy)。例如,当右心室必须通过狭窄的肺动脉瓣(pulmonary valve)泵血或肺动脉压升高时,右心室会肥大;当一个人有高系统性动脉血压时,左心室会肥大。增加的肌肉质量在心脏周围产生更多的电活动。因此,在心电图导联中记录到的电位显著高于正常值,如图12-12和12-13所示。
心电图电压降低
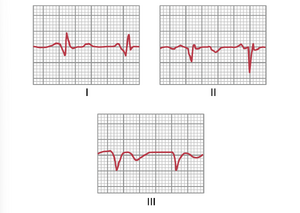
由心肌病(cardiac myopathies)引起的电压降低。QRS波群电压降低的最常见原因之一是一系列陈旧性心肌梗死(old myocardial infarctions)导致肌肉质量减少。这种情况还会导致去极化波缓慢通过心室,并阻止心脏的大部分区域同时发生大规模去极化。因此,这种情况会导致QRS波群的延长以及电压降低。图12-16显示了一个典型的低电压心电图(low-voltage ECG),伴有QRS波群的延长,这在多次小面积心肌梗死后常见,这些梗死导致局部冲动传导延迟,并由于整个心室肌肉质量的减少而导致电压降低。浸润性心肌病(infiltrative myocardial diseases)也会导致心电图电压降低。例如,在心脏淀粉样变性(cardiac amyloidosis)中,异常蛋白质浸润心肌,导致电压降低,特别是在肢体导联中。
心脏周围环境导致的电压降低。心电图导联中电压降低的最重要原因之一是心包内液体过多(心包积液,pericardial effusion)。由于细胞外液容易导电,从心脏流出的大部分电流会通过心包液从心脏的一部分传导到另一部分。因此,这种积液有效地“短路”了心脏产生的电位,降低了到达体表的心电图电压。胸腔积液(pleural effusion)在较小程度上也会导致心脏周围的电流短路,从而使体表和心电图中的电压降低。
肺气肿(pulmonary emphysema)也会降低心电图电位,但其原因与心包积液不同。在肺气肿患者中,由于肺部空气过多,电流通过肺部的传导显著减弱。此外,胸腔扩大,肺部倾向于比正常情况下更多地包裹心脏。因此,肺部充当了绝缘体,阻止电压从心脏传播到体表,从而导致各导联中的心电图电位降低。
QRS波群的延长和异常模式
心脏肥大或扩张延长QRS波群
QRS波群的持续时间与去极化继续在心室中传播的时间相同——也就是说,只要心室的一部分去极化而另一部分仍然极化,QRS波群就会持续。因此,冲动通过心室的传导延长总是会导致QRS波群延长。当一个或两个心室因肥大或扩张而需要更长的传导路径时,这种延长经常发生。正常的QRS波群持续时间为0.06至0.08秒,而在左心室或右心室肥大或扩张时,QRS波群可能会延长至0.09至0.12秒。
浦肯野系统的阻滞会延长QRS波群
当浦肯野纤维(Purkinje fibers)被阻滞时,心脏冲动必须通过心室肌传导,而不是通过浦肯野系统。这一动作将冲动传导速度降低到正常速度的三分之一左右。因此,如果其中一个束支完全阻滞,QRS波群的持续时间通常会增加到0.14秒或更长。
一般来说,当QRS波群持续时间超过0.09秒时,被认为是异常延长。当持续时间超过0.12秒时,几乎可以肯定是由心室传导系统中某处的病理阻滞引起的,如图12-14和12-15中所示的束支阻滞心电图。
导致QRS波群奇异的情况
QRS波群的奇异模式通常由两种情况引起:(1) 心室系统各区域的心肌破坏,并被瘢痕组织取代;(2) Purkinje系统中多个点的冲动传导发生局部小阻滞。结果,心脏冲动传导变得不规则,导致电压快速变化和轴偏移。这种不规则性通常在某些心电图导联中引起双峰甚至三峰,如图12-14所示。
损伤电流
许多不同的心脏异常,尤其是那些损害心肌的异常,可能导致心脏的某部分始终处于部分或完全去极化状态。当这种情况发生时,即使在心跳之间,电流也会在病理去极化和正常极化区域之间流动。这种情况称为损伤电流(current of injury)。特别要注意的是,心脏的受损部分为负,因为这是去极化的部分,并向周围液体释放负电荷,而心脏的其余部分为中性或正极性。
一些可能导致损伤电流的异常情况如下:(1) 机械创伤,有时会使膜保持高度通透性,导致完全复极化无法发生;(2) 损害肌肉膜的感染;(3) 局部冠状动脉闭塞引起的心肌局部缺血,这是心脏损伤电流最常见的原因。在缺血期间,冠状动脉供血不足以提供足够营养以维持心肌的正常膜极化。
损伤电流对QRS波群的影响
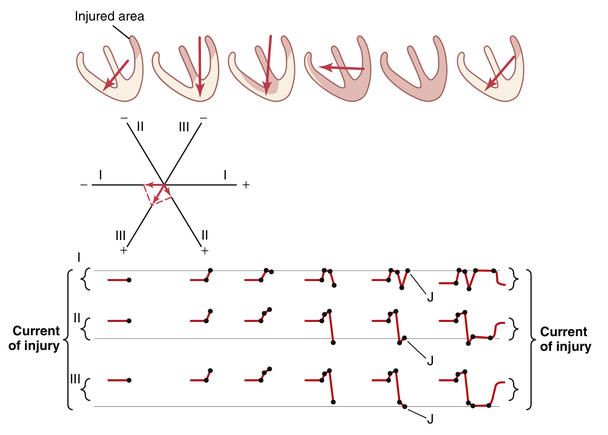
在图12-17中,左心室底部的一个小区域新近发生了梗死(即冠状动脉血流丧失)。因此,在T-P间期——即正常心室肌完全极化时——异常的负电流仍然从左心室底部的梗死区域流出,并向心室的其他部分扩散。
如图12-17中的第一个心脏所示,损伤电流的向量方向约为125度,向量的基部(负端)朝向受损肌肉。如图所示,即使在QRS波群开始之前,该向量也会导致导联I的初始记录低于零电位线,因为导联I中损伤电流的投影向量指向导联I轴的负端。在导联II中,记录位于线上方,因为投影向量更指向导联的正极端。在导联III中,投影向量指向导联III的正极端,因此记录为正。此外,由于向量几乎完全位于导联III轴的方向上,导联III中损伤电流的电压远大于导联I或导联II。
随着心脏继续进行其正常的去极化过程,室间隔首先去极化;然后去极化向下扩散到心尖,并向心室基部返回。心室最后完全去极化的部分是右心室的基部,因为左心室的基部已经完全且永久地去极化。通过矢量分析,可以图形化地构建去极化波穿过心室时心电图生成的连续阶段,如图12-17的下部所示。
当心脏完全去极化时,在去极化过程结束时(如图12-17中倒数第二阶段所示),所有心室肌都处于负性状态。因此,在心电图的这一瞬间,没有电流从心室流向心电图电极,因为现在受损的心肌和收缩的心肌都已去极化。
接下来,随着复极化(Repolarization)的发生,除了左心室受损基部的永久去极化区域外,所有心脏最终都会复极化。因此,复极化导致每个导联的损伤电流恢复,如图12-17最右侧所示。
J点是分析损伤电流的零参考电位
人们可能会认为心电图机可以确定心脏周围何时没有电流流动。然而,体内存在许多杂散电流,例如由皮肤电位和体内不同液体中离子浓度差异引起的电流。因此,当两个电极连接在手臂之间或手臂与腿之间时,这些杂散电流使得无法预先确定心电图中的确切零参考水平。
出于这些原因,必须使用以下程序来确定零电位水平:首先,注意去极化波刚刚通过心脏的确切点,这发生在QRS波群的末端。正是在这一点上,心室的所有部分都已去极化,包括受损部分和正常部分,因此心脏周围没有电流流动。甚至损伤电流也在这一点消失。因此,心电图在这一瞬间的电位为零电压。这一点在心电图中被称为J点,如图12-18所示。
然后,为了分析由损伤电流引起的损伤电位的电轴,在心电图中为每个导联在J点水平绘制一条水平线。这条水平线就是心电图中的零电位水平,所有由损伤电流引起的电位都必须从这一点测量。

使用J点绘制损伤电位轴。图12-18显示了来自受损心脏的心电图(导联I和III)。两条记录都显示了损伤电位。换句话说,这两条心电图的J点不在T-P段的同一水平线上。在图中,通过J点绘制了一条水平线,代表两条记录中的零电压水平。每个导联中的损伤电位是P波开始前心电图电压与由J点确定的零电压水平之间的差异。在导联I中,记录的损伤电位电压高于零电位水平,因此为正。相反,在导联III中,损伤电位低于零电压水平,因此为负。
在图12-18的底部,导联I和III中的各自损伤电位被绘制在这些导联的坐标上,并通过矢量分析确定了整个心室肌群的损伤电位合成矢量。在这种情况下,合成矢量从心室的右侧向左并略微向上延伸,轴约为-30度。如果将这个损伤电位矢量直接放在心室上,矢量的负端指向心室的永久去极化、“受损”区域。在图12-18所示的例子中,受损区域将位于右心室的外侧壁。
这种分析显然很复杂。然而,学生必须反复复习,直到完全理解为止。在心电图分析中,没有其他方面比这更重要。
冠状动脉缺血作为损伤电位的原因
心肌血流不足会抑制肌肉的代谢,至少有三个原因:(1) 缺氧;(2) 二氧化碳过度积累;(3) 缺乏足够的营养物质。因此,在严重心肌缺血的区域,肌肉膜的复极化无法发生。通常,尽管血流不足以引起膜的正常复极化,但足以维持肌肉的生命。只要这种状态存在,损伤电位就会在每个心脏周期的舒张期(T-P段)持续流动。
冠状动脉闭塞后,心肌会发生极度缺血,并且在心跳之间的T-P间隔期间,从心室的梗死区域会流出强烈的损伤电流,如图12-19和12-20所示。因此,急性冠状动脉血栓形成后记录的心电图的最重要诊断特征之一是损伤电流。
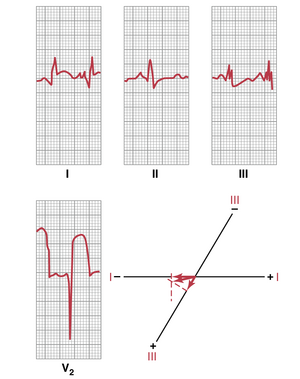
急性前壁心肌梗死(acute anterior wall infarction)。图12-19显示了三个标准双极肢体导联和一个胸导联(导联V2)的心电图,该心电图来自一名急性前壁心肌梗死患者。该心电图最重要的诊断特征是胸导联V2的强烈损伤电位(injury potential)。如果通过该心电图的J点画一条零水平电位线,可以发现T-P间期存在强烈的负性损伤电位,这意味着心脏前部的胸电极处于强负电位区域。换句话说,该心脏损伤电位向量的负端指向胸壁前部。这意味着损伤电流(injury current)来自心室前壁,从而诊断为前壁心肌梗死。
当分析导联I和III的损伤电位时,可以发现导联I为负电位,导联III为正电位。这一发现意味着心脏损伤电位的合成向量约为+150度,负端指向左心室,正端指向右心室。因此,在这份心电图中,损伤电流主要来自左心室以及心脏前壁。因此,可以得出结论,该前壁心肌梗死几乎可以肯定是由左冠状动脉前降支血栓形成(thrombosis)引起的。
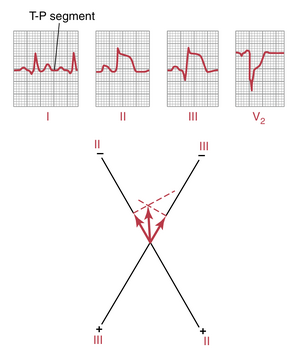
后壁心肌梗死(posterior wall infarction)。图12-20显示了来自一名后壁心肌梗死患者的三个标准双极肢体导联和一个胸导联(导联V2)。该心电图的主要诊断特征也在胸导联。如果通过该导联的J点画一条零电位参考线,可以很容易地发现,在T-P间期,损伤电流的电位为正。这意味着向量的正端指向胸壁前部,而负端(向量的损伤端)背离胸壁。换句话说,损伤电流来自与胸壁前部相对的心脏后部,这就是这种类型心电图是诊断后壁心肌梗死基础的原因。
如果分析图12-20中导联II和III的损伤电位,可以很容易地发现这两个导联的损伤电位均为负。通过向量分析,如图所示,可以发现损伤电位的合成向量约为-95度,负端指向下方,正端指向上方。因此,由于胸导联显示梗死位于心脏后壁,而导联II和III的损伤电位显示梗死位于心脏心尖部,因此可以推测该梗死位于左心室后壁靠近心尖的部位。
心脏其他部位的梗死。使用前面讨论前壁和后壁梗死时展示的相同方法,通常可以确定发出损伤电流的梗死区域的位置。在进行这种向量分析时,应记住损伤电位向量的正极指向正常的心肌,而负极指向发出损伤电流的心脏受损部分。
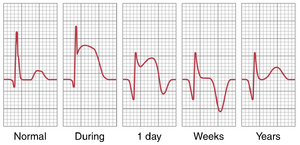
急性冠状动脉血栓形成期间和之后的心电图进展。图12-21显示了一名急性前壁梗死患者的V3胸导联心电图,展示了从发病当天到1周后、3周后以及最后1年后的心电图变化。从这张心电图中可以看出,急性发作后立即出现强烈的损伤电位(T-P段相对于S-T段正向偏移)。然而,大约1周后,损伤电位显著减弱,3周后完全消失。之后,心电图在接下来的一年中没有发生显著变化。这是中度急性心肌梗死后的典型恢复模式,表明新的侧支冠状动脉血流足以重新建立梗死区域大部分的营养供应。
在一些经历心肌梗死的患者中,梗死区域从未重新获得足够的冠状动脉血液供应。通常,部分心肌会死亡,但如果心肌没有死亡,只要缺血存在,特别是在心脏超负荷的运动期间,它将继续显示损伤电位。
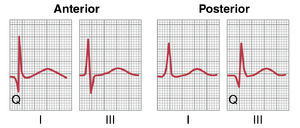
心电图上Q波代表陈旧性心肌梗死。图12-22显示了急性心脏病发作后约1年的前壁和后壁梗死后的I导联和III导联心电图。通常,由于左心室前壁肌肉质量的丧失,前壁梗死会在I导联的QRS复合波开始时出现Q波;而在后壁梗死中,由于心室后尖部肌肉的丧失,III导联的QRS复合波开始时会出现Q波。
这些形态并非在所有陈旧性心肌梗死病例中都能找到。局部肌肉丧失和心脏信号传导阻滞的局部点可能导致非常奇怪的QRS模式(例如,特别显著的Q波)、电压降低和QRS延长。
心绞痛中的损伤电流。术语“心绞痛”(angina pectoris)指的是从心脏发出的疼痛,感觉在胸部的胸肌区域。这种疼痛通常还会向左颈部区域和左臂放射。疼痛通常由中度心脏缺血引起。通常,只要患者保持安静,就不会感到疼痛,但一旦心脏超负荷,疼痛就会出现。
在严重心绞痛发作期间,心电图上有时会出现损伤电位,因为冠状动脉供血不足变得过于严重,以至于在舒张期阻止了心脏某些区域的充分复极化。
T波的异常
在本章的前面部分,我们提到T波在所有标准双极肢体导联中通常是正向的,这是由于心尖和外表面在心室内表面之前复极化所致。也就是说,当正常的复极化顺序没有发生时,T波就会变得异常。多种因素,包括心肌缺血(myocardial ischemia),都可以改变这种复极化顺序。
去极化波传导缓慢对T波特性的影响
参考图12-14,注意QRS波群显著延长。这种延长的原因是左束支传导阻滞(left bundle branch block)导致的左心室传导延迟。这种延迟传导使得左心室在右心室去极化后约0.08秒才去极化,从而产生一个强烈的向左的平均QRS向量。然而,右心室和左心室肌肉的不应期并没有显著差异。因此,右心室在左心室之前很久就开始复极化,这导致在T波形成时右心室强烈正向,而左心室负向。换句话说,T波的平均轴现在向右偏移,这与同一心电图中QRS波群的平均电轴相反。因此,当去极化冲动通过心室的传导显著延迟时,T波的极性几乎总是与QRS波群相反。
心室肌肉部分去极化缩短可能导致T波异常
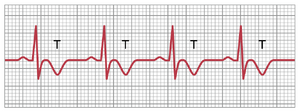
如果心室基底部表现出异常短的去极化期——即动作电位缩短——心室的复极化将不会像正常情况下那样从心尖开始。相反,心室基底部会在心尖之前复极化,复极化向量将从心尖指向心脏基底部,与标准的复极化向量相反。因此,所有三个标准导联中的T波将是负向的,而不是通常的正向。因此,心室基底部去极化期缩短这一简单事实足以引起T波的显著变化,甚至可能改变整个T波的极性,如图12-23所示。
轻度缺血(ischemia)是心肌去极化(depolarization)缩短的最常见原因,因为这种情况会增加钾离子通道的电流。当缺血仅发生在心脏的一个区域时,该区域的去极化期会比其他区域不成比例地缩短。因此,T波形态的变化,如倒置或双相波形,可能是心肌缺血的证据。缺血可能由慢性、进行性冠状动脉狭窄(narrowing)、急性冠状动脉闭塞、冠状动脉痉挛或运动或严重贫血期间发生的相对冠状动脉供血不足引起。
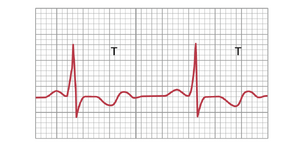
洋地黄(digitalis)对T波的影响。如第22章所述,洋地黄是一种可用于心力衰竭期间以增加心肌收缩力的药物。然而,当洋地黄过量时,心室某一部分的去极化持续时间可能会比其他部分不成比例地增加。因此,在一个或多个心电图导联中可能会出现非特异性变化,如T波倒置或双相T波。图12-24显示了由过量使用洋地黄引起的双相T波。因此,洋地黄使用期间T波的变化通常是洋地黄毒性的最早迹象。
第13章 心律失常及其心电图解读
一些最令人痛苦的心脏功能障碍类型是由于心脏节律异常引起的。例如,有时心房的跳动与心室的跳动不协调,因此心房不再发挥优化心室充盈的功能。
本章的目的是讨论常见心律失常的生理学及其对心脏泵血的影响,以及通过心电图进行诊断。心律失常的原因通常是心脏节律传导系统中以下一种或多种异常的组合:
• 起搏器节律异常
· 起搏器从窦房结转移到心脏的其他部位
· 冲动在心脏传播过程中在不同点的阻滞
• 冲动在心脏传播的异常路径
· 在心脏的几乎任何部位自发产生虚假冲动
异常窦性节律
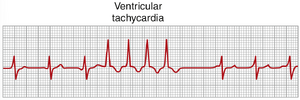
心动过速
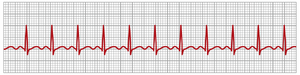
心动过速(tachycardia)一词意味着心率过快,通常定义为成人每分钟超过100次。图13-1显示了从一名心动过速患者记录的心电图(ECG)。除了QRS复合波之间的时间间隔确定的心率约为每分钟150次而不是正常的每分钟72次外,该心电图是正常的。心动过速的一些原因包括体温升高、脱水、失血性贫血、交感神经对心脏的刺激以及心脏的毒性状况。
心率通常随着体温的升高而增加,每升高1华氏度,心率增加约10次/分钟(每升高1摄氏度,心率增加18次/分钟),直到体温达到约105℉(40.5℃)。超过这个温度,心率可能会因为心肌逐渐衰弱而下降。发热引起心动过速,因为体温升高会增加窦房结的代谢率,从而直接增加其兴奋性和节律率。
许多因素可以导致交感神经系统兴奋心脏,如本文所述。例如,当患者失血严重时,交感反射刺激心脏可能会使心率增加到150至180次/分钟。心肌的简单衰弱通常会增加心率,因为衰弱的心脏无法将血液泵入动脉树到正常程度,导致血压下降并引发交感反射以增加心率。
心动过缓 (BRADYCARDIA)
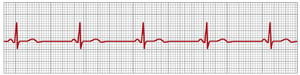
心动过缓 (bradycardia) 一词意味着心率缓慢,通常定义为少于60次/分钟。图13-2中的心电图显示了心动过缓。
运动员的心动过缓。训练有素的运动员的心脏通常比正常人的心脏更大且更强壮,这使得运动员的心脏即使在休息期间也能每搏输出大量血液。当运动员处于休息状态时,每次搏动泵入动脉树的血液量增加会引发反馈循环反射或其他效应,导致心动过缓。
迷走神经刺激引起心动过缓。任何刺激迷走神经的循环反射都会导致心脏迷走神经末梢释放乙酰胆碱,从而产生副交感效应。这种现象最显著的例子可能发生在颈动脉窦综合征患者中。在这些患者中,颈动脉壁颈动脉窦区域的压力感受器(baroreceptors)过度敏感。因此,即使是轻微的颈部外部压力也会引发强烈的压力感受器反射,导致迷走神经-乙酰胆碱对心脏的强烈影响,包括极度心动过缓。有时这种反射非常强大,以至于实际上会使心脏停止5到10秒,导致意识丧失(晕厥)。
窦性心律失常 (SINUS ARRHYTHMIA)
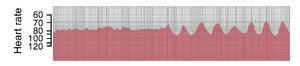
图13-3显示了心率的心率计记录,首先是在正常呼吸期间,然后在记录的后半部分是在深呼吸期间。心率计是一种通过连续尖峰的高度记录心电图中连续QRS波群之间间隔持续时间的仪器。从该记录中可以看出,在安静呼吸期间(显示在记录的左半部分),心率的增加和减少不超过5%。然后,在深呼吸期间,心率随着每个呼吸周期增加和减少多达30%。
窦性心律失常可能由多种循环状况引起,这些状况会改变心脏窦房结的交感神经(sympathetic nerve)和副交感神经(parasympathetic nerve)信号的强度。呼吸性窦性心律失常主要是由于在呼吸的吸气和呼气周期中,来自延髓呼吸中枢(medullary respiratory center)的信号溢出到邻近的血管运动中枢(vasomotor center)所致。这些溢出信号导致通过交感神经和迷走神经(vagus nerve)传递到心脏的冲动数量交替增加和减少。
心内传导通路中的心脏阻滞
窦房阻滞
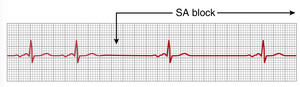
在极少数情况下,来自窦房结的冲动在进入心房肌之前被阻断。这种现象在图13-4中展示,图中显示P波突然停止,导致心房静止。然而,心室会重新建立新的节律,冲动通常自发地起源于房室结(atrioventricular node, A-V node),因此心室QRS-T复合波的速率减慢,但其他方面没有改变。窦房阻滞可能是由于影响窦房结的心肌缺血(myocardial ischemia)、心脏的炎症或感染,或某些药物的副作用所致,并且在训练有素的运动员中也可以观察到。
房室阻滞
通常,冲动从心房传递到心室的唯一途径是通过房室束(A-V bundle),也称为希氏束(bundle of His)。以下情况可能会降低该束中的冲动传导速率或完全阻断冲动:
- 房室结或房室束纤维的缺血(ischemia)通常会延迟或阻断从心房到心室的传导。冠状动脉供血不足(coronary insufficiency)可以以与引起心肌缺血相同的方式导致房室结和束的缺血。
- 房室束被瘢痕组织或心脏的钙化部分压迫可能会抑制或阻断从心房到心室的传导。
- 房室结或房室束的炎症可能会抑制从心房到心室的传导。炎症通常由不同类型的心肌炎(myocarditis)引起,例如由白喉(diphtheria)或风湿热(rheumatic fever)引起的心肌炎。
- 在极少数情况下,迷走神经的过度刺激会阻断通过房室结的冲动传导。这种迷走神经兴奋偶尔会由于颈动脉窦综合征(carotid sinus syndrome)患者的压力感受器(baroreceptor)受到强烈刺激而引起,这在之前与心动过缓(bradycardia)的关系中讨论过。
- 房室传导系统的退化(degeneration),这在老年患者中有时可见。
- 某些药物如洋地黄(digitalis)或β-肾上腺素能拮抗剂(beta-adrenergic antagonists)在某些情况下可能会损害房室传导。
不完全房室阻滞
一级传导阻滞——P-R间期延长。当心脏以正常速率跳动时,P波开始到QRS波群开始之间的时间间隔通常约为0.16秒。这种所谓的P-R间期通常会随着心跳加快而缩短,随着心跳减慢而延长。一般来说,当P-R间期延长至超过0.20秒时,称为P-R间期延长,患者被认为存在一级不完全性心脏传导阻滞。
图13-5显示了一例P-R间期延长的心电图;在这种情况下,P-R间期约为0.30秒,而不是正常的0.20秒或更短。因此,一级传导阻滞被定义为从心房到心室的传导延迟,而不是实际的传导阻断。P-R间期很少超过0.35至0.45秒,因为到那时,通过房室束(A-V bundle)的传导会显著减弱,以至于完全停止。例如,测量P-R间期是评估某些心脏疾病(如急性风湿性心脏病)严重程度的一种方法。
二级传导阻滞。当通过房室束的传导减慢到足以使P-R间期延长至0.25至0.45秒时,动作电位有时足够强以通过房室束进入心室,有时则不足以进入心室。在这种情况下,会出现心房的P波,但没有QRS-T波,这被称为心室的“漏搏”。这种情况称为二级传导阻滞。
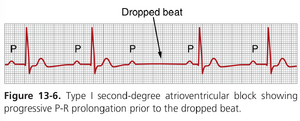
二级房室传导阻滞有两种类型:Mobitz I型(也称为Wenckebach周期性)和Mobitz II型。I型阻滞的特点是P-R间期逐渐延长,直到心室搏动漏搏,随后P-R间期重置并重复异常周期。I型阻滞几乎总是由房室结(A-V node)异常引起。在大多数情况下,这种类型的阻滞是良性的,不需要特殊治疗。
在II型阻滞中,通常每个QRS波群对应固定数量的未传导P波。例如,2:1阻滞意味着每个QRS波群对应两个P波。在其他情况下,可能会出现3:2或3:1的节律。与I型阻滞不同,II型阻滞在漏搏前P-R间期不会改变;它保持固定。II型阻滞通常由希氏-浦肯野系统(bundle of His–Purkinje system)异常引起,可能需要植入起搏器以防止进展为完全性心脏传导阻滞和心脏骤停。
图13-6显示了典型的I型(Wenckebach)阻滞的P-R间期逐渐延长。注意漏搏前P-R间期的延长,随后在漏搏后P-R间期缩短。
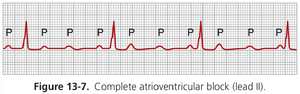
完全性房室传导阻滞(三度传导阻滞)。当导致房室结(A-V node)或房室束(A-V bundle)传导不良的情况变得严重时,心房向心室的冲动传导会完全阻滞。在这种情况下,心室会自发地建立自己的信号,通常起源于阻滞点远端的房室结或房室束。因此,P波与QRS-T复合波分离,如图13-7所示。请注意,此心电图中心房节律的速率约为100次/分钟,而心室搏动的速率小于40次/分钟。此外,P波的节律与QRST复合波的节律之间没有关系,因为心室已经“逃脱”了心房的控制,并以它们自身的自然速率搏动,通常由阻滞点远端的房室结或房室束产生的节律性信号控制。
Stokes-Adams综合征——心室逸搏。在一些房室传导阻滞的患者中,完全性阻滞会间歇性出现;也就是说,冲动会在一段时间内从心房传导到心室,然后突然停止传导。阻滞的持续时间可能是几秒钟、几分钟、几小时,甚至几周或更长时间,直到传导恢复。这种情况发生在传导系统处于边缘性缺血状态的心脏中。
每次房室传导停止时,心室通常不会立即开始自主搏动,而是延迟5到30秒。这种延迟是由于一种称为超速抑制(overdrive suppression)的现象。超速抑制意味着心室的兴奋性最初被抑制,因为心室被心房以高于其自然节律的速率驱动。然而,几秒钟后,阻滞点远端的浦肯野系统(Purkinje system)的某一部分,通常是房室结阻滞点远端的远端部分或房室束,开始以15到40次/分钟的速率节律性放电,充当心室的起搏器。这种现象称为心室逸搏(ventricular escape)。
由于大脑在没有血液供应的情况下无法保持活动超过4到7秒,大多数人在完全性阻滞发生后几秒钟内会晕厥,因为心脏在5到30秒内没有泵出任何血液,直到心室“逸搏”。然而,逸搏后,缓慢搏动的心室(通常搏动速率小于40次/分钟)通常泵出足够的血液,使患者迅速从晕厥中恢复,并维持生命。这些周期性的晕厥发作(syncope)被称为Stokes-Adams综合征。
偶尔,完全性传导阻滞(complete block)开始时的心室停搏(ventricular standstill)间隔时间过长,以至于对患者的健康有害,甚至导致死亡。因此,大多数这类患者会被植入人工起搏器(artificial pacemaker),这是一种小型电池驱动的电刺激器,通常植入皮下,电极通常连接到右心室。起搏器向心室提供持续的节律性冲动。
不完全性心室内传导阻滞——电交替(electrical alternans)
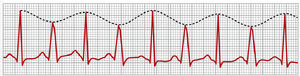
大多数可能导致房室传导阻滞(A-V block)的因素也可能阻断外周心室浦肯野系统(Purkinje system)的冲动传导。图13-8显示了电交替(electrical alternans)的情况,这是由于每隔一次心跳发生部分心室内传导阻滞所致。该心电图还显示了心动过速(tachycardia)(心率过快),这可能是导致传导阻滞的原因。这是因为当心率过快时,浦肯野系统的某些部分可能无法从前一次不应期中迅速恢复,以在每次后续心跳中做出反应。此外,许多抑制心脏的情况,如缺血(ischemia)、心肌炎(myocarditis)或洋地黄中毒(digitalis toxicity),也可能导致不完全性心室内传导阻滞,从而引起电交替。
早搏
早搏(premature contractions)是指心脏在预期正常收缩时间之前发生的收缩。这种情况也称为期外收缩(extrasystole)、早搏(premature beat)或异位搏动(ectopic beat)。
早搏的原因
大多数早搏是由心脏中的异位灶(ectopic foci)引起的,这些异位灶在心脏节律的异常时间发出异常冲动。异位灶的可能原因如下:(1)局部缺血区域;(2)心脏不同部位的小钙化斑块,这些斑块压迫邻近的心肌,导致部分纤维受到刺激;(3)由感染、药物、尼古丁或咖啡因引起的房室结(A-V node)、浦肯野系统或心肌的毒性刺激。在心导管插入术(cardiac catheterization)期间,机械性引发的早搏也很常见;当导管进入心室并压迫心内膜(endocardium)时,通常会发生大量早搏。
房性早搏(premature atrial contractions)
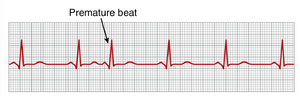
图13-9显示了一次单一的房性早搏(premature atrial contraction, PAC)。这次心跳的P波在心周期中出现得过早;P-R间期缩短,表明该早搏的异位起源位于靠近房室结(atria near the A-V node)的心房内。此外,早搏与下一次收缩之间的间隔略有延长,这被称为代偿性间歇(compensatory pause)。这种代偿性间歇的原因之一是早搏起源于距离窦房结较远的心房,冲动在放电窦房结之前必须通过相当数量的心房肌肉。因此,窦房结在早搏周期中放电较晚,这使得随后的窦房结放电也出现得较晚。
PAC在健康人群中经常发生。它们经常发生在心脏非常健康的运动员身上。由吸烟、睡眠不足、摄入过多咖啡、酗酒和使用各种药物等因素引起的轻度中毒状态也可能引发这种收缩。
脉搏短绌(Pulse Deficit)。当心脏提前收缩时,心室不会正常充满血液,该次收缩期间的心搏量输出减少或几乎不存在。因此,早搏后传递到外周动脉的脉搏波可能非常微弱,以至于在桡动脉(radial artery)中无法感觉到。因此,与心脏实际收缩次数相比,桡动脉脉搏次数会出现短绌。
房室结或房室束早搏
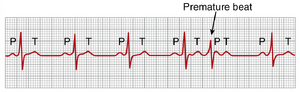
图13-10显示了一次起源于房室结(A-V node)或房室束(A-V bundle)的早搏。早搏的心电图记录中缺少P波。相反,P波叠加在QRS-T复合波上,因为心脏冲动同时向后进入心房和向前进入心室。这个P波略微扭曲了QRS-T复合波,但P波本身无法被识别。一般来说,房室结早搏与房性早搏具有相同的意义和原因。
室性早搏(Premature Ventricular Contractions)
图13-11中的心电图显示了一系列室性早搏(PVCs)与正常收缩交替出现,这种模式被称为二联律(bigeminy)。PVCs在心电图中引起特定的效应,如下:
- QRS波群通常显著延长。延长的原因是冲动主要通过心室缓慢传导的肌肉传导,而不是通过Purkinje系统传导。
- QRS波群具有高电压。当正常冲动通过心脏时,它几乎同时通过两个心室。因此,在正常心脏中,心脏两侧的去极化波(主要是相反的极性)在心电图中部分相互中和。当发生室性早搏(PVC)时,冲动几乎总是只向一个方向传导,因此没有这种中和效应,心室的整个一侧或一端先于另一侧去极化,这会导致大的电位,如图13-11中的PVC所示。
- 几乎所有PVC之后,T波的电位极性与QRS波群完全相反,因为冲动通过心肌的缓慢传导导致首先去极化的肌纤维也首先复极化。
一些PVC对心脏整体泵血的影响相对良性;它们可能由诸如香烟、过量摄入咖啡、睡眠不足、各种轻度中毒状态甚至情绪易怒等因素引起。相反,许多其他PVC是由源自心脏梗死或缺血区域边界的杂散冲动或再入信号引起的。这种PVC的存在不容忽视。具有大量PVC的人通常发生自发性致命性心室颤动的风险远高于正常水平,推测是由其中一个PVC引发的。当PVC发生在易导致颤动的脆弱期时,这种情况尤其真实,即T波结束时,当心室从不应期中恢复时,如本章后面所述。
异位性室性早搏起源的向量分析。在第12章中,解释了向量分析的原理。通过应用这些原理,可以从图13-11的心电图中确定PVC的起源点,如下所示。注意,导联II和III中的早搏电位均为强阳性。将这些电位绘制在导联II和III的轴上,并通过向量分析求解心脏中的平均QRS向量,可以发现该早搏的向量的负端(起源)位于心脏基部,正端朝向心尖。因此,在此早搏期间首先去极化的心脏部分靠近心室基部,因此是异位焦点的起源。
心脏复极化障碍——长QT综合征。回想一下,Q波对应于心室去极化,而T波对应于心室复极化。Q-T间期是从Q点到T波结束的时间。延迟心室肌动作电位后复极化的障碍会导致心室动作电位延长,因此心电图上Q-T间期过长,这种情况称为长QT综合征(LQTS)。
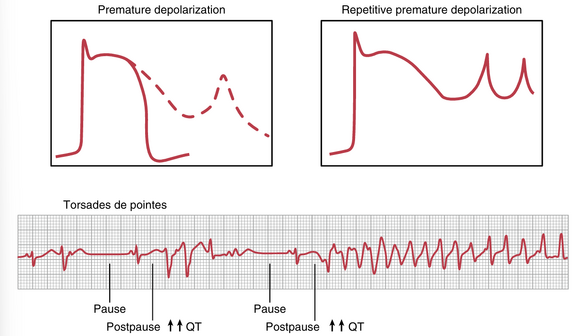
LQTS(长QT综合征)之所以备受关注,主要原因是心室肌复极延迟会增加个体发生一种称为torsades de pointes(尖端扭转型室速)的心室性心律失常的易感性,其字面意思是“尖端的扭转”。这种类型的心律失常具有如图13-12所示的特征。QRS波群的形态可能随时间变化,心律失常的发作通常跟随一个早搏、一个停顿,然后是另一个具有长QT间期的搏动,这可能会触发心律失常、心动过速,在某些情况下甚至会导致心室颤动。
导致LQTS的心脏复极障碍可能是遗传性或获得性的。先天性LQTS是由钠或钾通道基因突变引起的罕见疾病。目前已发现至少17种不同的基因突变会导致不同程度的QT间期延长。
更为常见的是获得性LQTS,其与血浆电解质紊乱(如低镁血症、低钾血症或低钙血症)或过量使用抗心律失常药物(如奎尼丁)或某些抗生素(如氟喹诺酮类或红霉素)有关,这些药物会延长QT间期。
尽管一些LQTS患者没有表现出明显症状(除了QT间期延长),但其他患者可能会出现晕厥,并在体力活动、强烈情绪(如恐惧或愤怒)或被噪音惊吓时发生心室性心律失常。在某些情况下,与LQTS相关的心室性心律失常可能恶化为心室颤动和猝死。
治疗可能包括急性LQTS时使用硫酸镁,以及长期LQTS时使用抗心律失常药物(如β-肾上腺素能阻滞剂)或手术植入心脏除颤器。
阵发性心动过速
心脏不同部位(包括心房、浦肯野系统或心室)的某些异常偶尔会导致快速而有节律的冲动放电,这些冲动会向心脏各个方向扩散。这种现象通常被认为是由再入环运动反馈通路引起的,这些通路建立了局部重复的自我再兴奋。由于易激灶的快速节律,该灶成为心脏的起搏点。
“阵发性paroxysmal”一词意味着心率在阵发性发作时变得快速,阵发性发作突然开始并持续几秒、几分钟、几小时或更长时间。阵发性发作通常像开始时一样突然结束,心脏的起搏点立即转回窦房结。
阵发性心动过速(paroxysmal tachycardia)通常可以通过引发迷走神经反射(vagal reflex)来停止。为此目的,有时会通过按压颈动脉窦区域来引发一种迷走神经反射,这可能足以引发足够的迷走神经反射来停止阵发性发作。抗心律失常药物(antiarrhythmic drugs)也可用于减缓心脏组织的传导或延长不应期。
阵发性房性心动过速(PAROXYSMAL ATRIAL TACHYCARDIA)
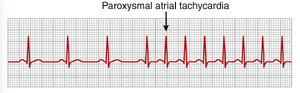
图13-13显示了记录中间心率从约95次/分钟突然增加到约150次/分钟。仔细研究心电图(ECG)可以发现,在快速心跳期间,每个QRS-T复合波之前出现一个倒置的P波,并且这个P波部分叠加在前一个心搏的正常T波上。这一发现表明,这种阵发性心动过速起源于心房,但由于P波形状异常,起源不在窦房结附近。
房室结性阵发性心动过速(A-V Nodal Paroxysmal Tachycardia)。阵发性心动过速通常由涉及房室结(A-V node)的异常节律引起,这通常会导致几乎正常的QRS-T复合波,但P波完全缺失或被掩盖。
房性或房室结性阵发性心动过速,两者都被称为室上性心动过速(supraventricular tachycardias),通常发生在年轻且其他方面健康的人群中,并且通常在青春期后不再有心动过速的倾向。一般来说,室上性心动过速会使人极度恐惧,并可能在阵发性发作期间导致虚弱,但通常不会因发作而造成永久性伤害。
室性心动过速(VENTRICULAR TACHYCARDIA)
图13-14显示了一次典型的短阵发性室性心动过速(ventricular tachycardia)。室性心动过速的心电图(ECG)表现为一系列连续的室性早搏(ventricular premature beats),中间没有任何正常的心跳。
室性心动过速通常是一种严重的状况,原因有二。首先,这种类型的心动过速通常不会发生,除非心室存在相当程度的缺血性损伤。其次,室性心动过速常常会引发致命的心室颤动,因为心室肌肉受到快速重复的刺激,这一点将在下一节讨论。
有时,心力衰竭治疗药物洋地黄(digitalis)中毒会导致易激惹的病灶(irritable foci),从而引发室性心动过速。抗心律失常药物(antiarrhythmic drugs)如胺碘酮(amiodarone)或利多卡因(lidocaine)可用于治疗室性心动过速。利多卡因抑制动作电位(action potential)产生期间心肌膜钠离子通透性的正常增加,从而常常阻断导致阵发性发作的病灶的节律性放电。胺碘酮具有多种作用,例如延长心肌的动作电位和不应期,并减慢房室传导(A-V conduction)。在某些情况下,可以使用电击来电复律cardioversion,以恢复正常心律。
心室颤动
所有心律失常中最严重的是心室颤动,如果不在1到3分钟内停止,几乎总是致命的。心室颤动是由于心室肌内的心脏冲动失控,首先刺激一部分心室肌,然后刺激另一部分,最终反馈到自身,反复刺激同一心室肌,永不停止。当这种现象发生时,许多小部分的心室肌会同时收缩,而同样多的其他部分则会放松。因此,所有心室肌从未同时协调收缩,这是心脏泵血周期所必需的。尽管刺激信号在整个心室内大量移动,但心室既不扩大也不收缩,而是保持在部分收缩的不确定阶段,泵出极少或几乎没有血液。因此,颤动开始后,由于大脑血流不足,4到5秒内会发生意识丧失,几分钟内全身组织开始发生不可逆的死亡。
多种因素可能引发心室颤动的开始;一个人可能前一秒心跳正常,但1秒后心室就进入颤动状态。特别容易引发颤动的情况包括心脏突然受到电击、心肌缺血(ischemia)或心脏特殊传导系统缺血。
再入-环形运动(RE- ENTRY—CIRCUS MOVEMENTS)作为心室颤动的基础
在正常心脏中,当正常的心室冲动通过心室后,它无处可去,因为所有的心室肌肉都处于不应期,无法进一步传导冲动。因此,该冲动消失,心脏等待窦房结产生新的动作电位。
然而,在某些情况下,这种正常的事件序列不会发生。因此,以下是对可能引发再入(re-entry)并导致所谓的环形运动(circus movements)的背景条件的更完整解释,这些环形运动反过来会导致心室颤动。
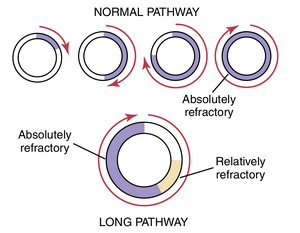
图13-15显示了几个切成圆形的小心肌条。如果这样的心肌条在12点钟位置受到刺激,使得冲动仅沿一个方向传播,冲动会逐渐沿着圆形传播,直到回到12点钟位置。如果最初受刺激的肌肉纤维仍处于不应期,冲动则会消失,因为不应期的肌肉无法传递第二次冲动。然而,三种不同的条件可能导致这种冲动继续沿着圆形传播——即导致冲动再入已经兴奋过的肌肉(环形运动):
- 如果围绕环路的路径比正常情况长得多,当冲动返回到12点钟位置时,最初被刺激的肌肉将不再处于不应期,冲动将一次又一次地继续围绕环路传导。
- 如果路径的长度保持不变,但传导速度降低到足够程度,冲动返回到12点钟位置所需的时间间隔将会增加。到那时,最初被刺激的肌肉可能已经脱离了不应期(refractory state),冲动可以一次又一次地继续围绕环路传导。
- 肌肉的不应期可能会大大缩短。在这种情况下,冲动也可以一次又一次地围绕环路传导。
所有这些情况都发生在人类心脏的不同病理状态中:(1)长路径通常发生在扩张的心脏中;(2)传导速度降低通常是由于浦肯野系统的阻滞、肌肉缺血、高血钾水平或许多其他因素引起的;(3)不应期缩短通常是对各种药物(如肾上腺素)或重复电刺激的反应。因此,在许多心脏紊乱中,折返(re-entry)可以导致异常的心脏收缩模式或异常的心律(cardiac rhythms),这些异常会忽略窦房结的起搏作用。
纤维性颤动的链式反应机制
在心室颤动中,可以看到许多独立的小收缩波同时以不同方向在心肌上传播。纤维性颤动中的折返冲动(re-entrant impulses)并不是简单地像图13-15所示的那样单一冲动围绕环路移动。相反,它们已经退化为一系列多波阵面(multiple wave fronts),呈现出链式反应(chain reaction)的外观。解释纤维性颤动中这一过程的最佳方法之一是描述通过60周交流电(60-cycle alternating electric current)电击引发纤维性颤动的过程。
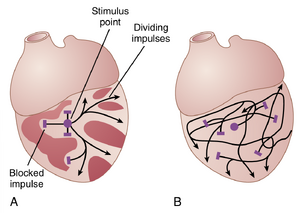
由60周交流电引起的纤维性颤动。在图13-16中的心脏A的心室中心点,通过刺激电极施加了一个60周期的电刺激。电刺激的第一个周期引起去极化波向各个方向扩散,使电极下的所有肌肉处于不应期状态。大约0.25秒后,这部分肌肉的一部分开始脱离不应期状态。某些部分比其他部分更早脱离不应期。这种状态在心脏A中通过许多较亮的斑块表示,这些斑块代表可兴奋的心肌,而较暗的斑块代表仍处于不应期的肌肉。现在,来自电极的持续60周期刺激只能使冲动在某些方向上通过心脏传播,而不是所有方向。因此,在心脏A中,某些冲动传播了短距离,直到它们到达心脏的不应期区域,然后被阻断。然而,其他冲动在不应期区域之间通过,并继续在可兴奋区域传播。然后,几个事件迅速连续发生,所有这些事件同时发生,最终导致纤维性颤动的状态。
首先,冲动在某些方向上被阻断,但在其他方向上成功传播,这为再入信号的发展创造了必要条件之一,即某些去极化波仅在心脏的某些方向上传播,而不是其他方向。
其次,心脏的快速刺激引起心肌的两个变化,这两个变化都倾向于环行运动:(1) 通过心肌的传导速度降低,这使冲动在心脏周围传播的时间间隔更长;(2) 肌肉的不应期缩短,使冲动在比正常时间短得多的时间内重新进入先前兴奋的心肌。
第三,心室纤维性颤动最重要的特征之一是冲动的分裂,如图13-16中的心脏A所示。当去极化波到达心脏的不应期区域时,它会向不应期区域的两侧传播。因此,单个冲动变成两个冲动。然后,当每个冲动到达另一个不应期区域时,它会分裂形成更多的冲动。通过这种方式,许多新的波前通过连续的链式反应在心脏中不断形成,直到最终许多小的去极化波同时向多个方向传播。此外,这种不规则的冲动传播模式导致许多迂回的传播路径,大大延长了传导路径,这是维持纤维性颤动的条件之一。它还导致心脏中不断出现不规则的不应期区域。
人们可以很容易地看出恶性循环何时开始。越来越多的冲动形成;这些冲动导致越来越多的不应期肌肉斑块,而不应期斑块导致越来越多的冲动分裂。因此,每当心肌的某个区域脱离不应期时,冲动就会重新进入该区域。
图13-16中的心脏B展示了心室颤动的最终状态。在这里,可以看到许多冲动(impulses)向各个方向传播,其中一些冲动分裂并增加冲动的数量,而另一些则被不应期区域(refractory areas)阻断。在这个易损期(vulnerable period)内,一次电击常常会导致一种奇特的冲动模式,这些冲动围绕肌肉的不应期区域多方向传播,从而导致心室颤动。
心室颤动时的心电图
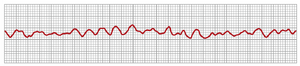
在心室颤动中,心电图(ECG)是异常的(图13-17),通常不显示任何类型的规律性节律。在心室颤动的最初几秒钟内,相对较大的肌肉群同时收缩,导致心电图中出现粗大的不规则波。再过几秒钟后,心室的粗大收缩消失,心电图转变为一种新的低电压、非常不规则的波形。因此,心室颤动没有重复的心电图模式。相反,心室肌肉一次收缩多达30到50个小块肌肉,心电图电位不断且痉挛性地变化,因为心脏中的电流首先流向一个方向,然后流向另一个方向,很少重复任何特定的周期。
心室颤动开始时,心电图中波的电压通常约为0.5毫伏,但它们迅速衰减;因此,20到30秒后,通常只有0.2到0.3毫伏。心室颤动开始后10分钟或更长时间,可能会记录到0.1毫伏或更小的微小电压。如前所述,由于心室颤动期间没有血液泵出,这种状态是致命的,除非通过成功的治疗(如立即通过心脏进行电击(除颤(defibrillation))来停止,这将在下一节中解释。
心室除颤(VENTRICULAR DEFIBRILLATION)
虽然直接施加到心室的适度交流电压几乎总是会使心室进入颤动状态,但通过心室传递的强高压电流在几分之一秒内可以通过使所有心室肌肉同时进入不应期来停止颤动。这是通过将强电流通过放置在心脏两侧的大电极来实现的。电流同时穿透心室的大部分纤维,从而基本上同时刺激心室的所有部分,并使它们都进入不应期。所有动作电位(action potentials)停止,心脏保持静止3到5秒,之后它再次开始跳动,通常由窦房结或心脏的其他部分成为起搏器(pacemaker)。然而,如果最初使心室进入颤动的再入焦点(re-entrant focus)仍然存在,颤动可能会立即再次开始。
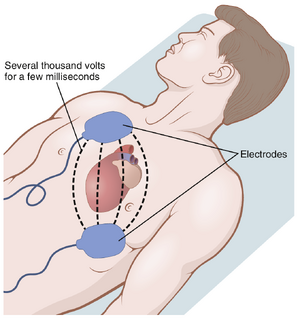
当电极直接施加到心脏的两侧时,通常可以使用1000伏的直流电在几千分之一秒内停止颤动。当通过胸壁上的两个电极施加时,如图13-18所示,通常的程序是将一个大的电容器充电到几千伏,然后使电容器在几千分之一秒内通过电极和心脏放电。
在大多数情况下,除颤电流以双相波形(biphasic waveforms)的形式传递到心脏,通过心脏交替改变电流脉冲的方向。这种传递方式显著降低了成功除颤所需的能量,从而减少了烧伤和心脏损伤的风险。
对于心室颤动高风险患者,可以植入一种小型、电池供电的植入式心脏复律除颤器(implantable cardioverter-defibrillator, ICD),其电极导线位于右心室(right ventricle)。该设备被编程为检测心室颤动,并通过向心脏传递短暂的电脉冲来恢复心律。电子技术和电池的进步使得ICD能够通过皮下植入的电极导线传递足够的电流进行除颤,这些导线位于心脏附近的肋骨外,而不是在心脏内部或表面。这些设备可以通过一个小型外科手术植入。
手动心脏按压(心肺复苏)作为除颤的辅助手段
除非在心室颤动开始后1分钟内进行除颤,否则由于缺乏冠状动脉血流(coronary blood flow)提供的营养,心脏通常过于虚弱,无法通过除颤恢复。然而,通过手动按压心脏(间歇性手挤压)然后再进行除颤,仍然有可能恢复心脏功能。通过这种方式,少量血液被输送到主动脉(aorta),并重新建立冠状动脉供血。然后,经过几分钟的手动按压后,电除颤通常变得可行。有记录显示,心室颤动的心脏经过长达90分钟的手动按压后,成功进行了除颤。
一种无需开胸的心脏按压技术包括对胸壁进行间歇性压力冲击以及人工呼吸。这一过程加上除颤,被称为心肺复苏(cardiopulmonary resuscitation, CPR)。
大脑血流中断超过5到8分钟通常会导致永久性智力损伤甚至脑组织破坏。即使心脏恢复,患者也可能因脑损伤的影响而死亡,或者可能伴有永久性智力损伤。
心房颤动
请记住,除了通过房室束(A-V bundle)的传导路径外,心房肌群与心室肌群之间由纤维组织分隔。因此,心室颤动通常不会伴随心房颤动。同样,心房颤动也常常不伴随心室颤动(如图13-20右侧所示)。
心房颤动(atrial fibrillation)的机制与心室颤动相同,只是该过程仅发生在心房肌群而非心室肌群中。心房颤动的一个常见原因是心房扩大,例如,心脏瓣膜病变导致心房无法充分排空至心室,或心室衰竭导致血液在心房中过度淤积。扩张的心房壁提供了长传导路径和缓慢传导的理想条件,这两者都容易导致心房颤动。
心房颤动期间心房泵血功能受损。与心室颤动时心室无法泵血的原因相同,心房颤动时心房也无法泵血。因此,心房作为心室的启动泵(primer pump)变得无用。即便如此,血液仍会被动地通过心房流入心室,心室泵血效率仅降低20%至30%。因此,与心室颤动的致命性不同,心房颤动患者可以存活多年,尽管整体心脏泵血效率降低。然而,由于心房收缩功能减弱,血液可能会停滞,导致心房耳中形成血栓。这些血栓可能脱落并进入大脑,导致中风(stroke),或进入身体其他部位。因此,心房颤动患者通常需要服用抗凝药物以降低栓塞风险。
心房颤动时的心电图(ELECTROCARDIOGRAM IN ATRIAL FIBRILLATION)
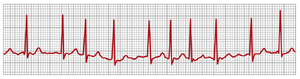
图13-19显示了心房颤动期间的心电图。在心房颤动期间,许多小的去极化波(depolarization waves)向各个方向在心房中传播。由于这些波很弱,并且在任何给定时间许多波的极性相反,它们通常会几乎完全电性中和。因此,在心电图中,要么看不到心房的P波,要么只能看到细微的、高频的、极低电压的波记录。相反,除非心室存在某种病理变化,否则QRS-T复合波是正常的,但其时间不规则,如下所述。
心房颤动期间心室节律的不规则性
当心房发生颤动时,来自心房肌的冲动快速但不规则地到达房室结(A-V node)。由于房室结在前一个冲动后约0.35秒内不会传递第二个冲动,因此一次心室收缩与下一次心室收缩之间至少必须间隔0.35秒。然后,在其中一个不规则的心房颤动冲动恰好到达房室结之前,还会出现0到0.6秒的额外但可变的间隔。因此,连续心室收缩之间的间隔从最短约0.35秒到最长约0.95秒不等,导致心跳非常不规则。事实上,这种不规则性(如图13-19所示的心电图中心跳间隔的变化所示)是用于诊断该病症的临床发现之一。此外,由于心房中颤动冲动的快速速率,心室被快速地驱动,通常在125到150次/分钟之间。
心房颤动的电击治疗
类似于心室颤动可以通过电击恢复为正常节律,心房颤动也可以通过电击恢复。该过程与心室颤动转换的过程类似,只是单一电击被编程(或同步)为仅在QRS复合波期间触发,此时心室对刺激不敏感。如果心脏能够产生正常节律,通常会恢复正常节律。在心室颤动的情况下,此过程称为同步电复律(synchronized cardioversion),而不是除颤(defibrillation)。
心房扑动
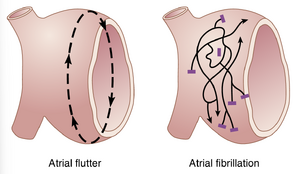
心房扑动(atrial flutter)是另一种由心房中的环形运动引起的病症。心房扑动与心房颤动的不同之处在于,电信号以单一的大波形式传播,始终沿一个方向环绕心房肌群,如图13-20左侧所示。心房扑动导致心房快速收缩,通常在200到350次/分钟之间。然而,由于心房的一侧在收缩时另一侧在放松,心房泵出的血液量减少。此外,信号到达房室结的速度太快,以至于无法全部传递到心室,因为房室结和房室束的不应期太长,无法传递超过一小部分的心房信号。因此,通常每有一次心室搏动,心房会有两到三次搏动。
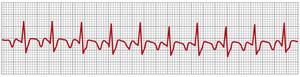
图13-21显示了心房扑动的典型心电图。由于半协调的肌肉群收缩,P波很强。然而,请注意,每两次心房搏动后,QRS-T复合波才跟随一次心房P波,形成2:1节律。
心脏骤停
心脏节律传导系统的最后一个严重异常是心脏骤停,这是由于心脏中所有电控制信号的停止引起的。也就是说,没有自发的节律存在。
在深度麻醉期间,可能会发生心脏骤停,此时由于呼吸不足可能导致严重的缺氧。缺氧会阻止肌纤维和传导纤维维持其膜两侧的正常电解质浓度差异,其兴奋性(excitability)可能因此受到影响,以至于自动节律性(automatic rhythmicity)消失。
在许多因麻醉引起的心脏骤停病例中,长时间的心肺复苏(CPR)(持续数分钟甚至数小时)在恢复正常心律方面非常成功。在某些患者中,严重的心肌疾病可能导致永久性或半永久性心脏骤停,从而导致死亡。为了治疗这种情况,植入式电子心脏起搏器产生的节律性电冲动已成功用于维持患者的生命数月甚至数年。
