调控RNA:修订间差异
外观
自动添加 Sofia 模板和分类 |
|||
| (未显示2个用户的2个中间版本) | |||
| 第208行: | 第208行: | ||
* 只有失活X染色体中出现一种罕见组蛋白macroH2A(又名H2AFY),替代正常组蛋白H2A。 | * 只有失活X染色体中出现一种罕见组蛋白macroH2A(又名H2AFY),替代正常组蛋白H2A。 | ||
* 将XIC区域移入其它染色体,该染色体也会出现上述失活现象。 | * 将XIC区域移入其它染色体,该染色体也会出现上述失活现象。 | ||
== 环状RNA(Circular RNA) == | |||
* 环状RNA(或circRNA)是一种单链RNA,与线性RNA不同,它形成共价闭合的连续环。在环状 RNA 中, RNA 分子中通常存在的3' 和 5' 末端已连接在一起。许多类型的环状 RNA 均源自蛋白质编码基因。一些环状RNA已被证明可以编码蛋白质。某些类型的环状 RNA 最近也显示出调节基因表达的潜力。大多数环状RNA的生物学功能尚不清楚。由于环状 RNA 没有 5' 或 3' 末端,因此它们能够抵抗核酸外切酶介导的降解,并且可能比细胞中大多数线性 RNA 更稳定。环状RNA与癌症等一些疾病有关。 | |||
* 大多数circRNA来自非规范性剪接,如外显子乱序。外显子乱序,也称为外显子改组,描述了外显子以“非规范”(非典型)顺序剪接的事件。外显子乱序可以通过三种方式发生: | |||
*# 基因组中的串联外显子重复,通常发生在癌症中。 | |||
*# 反式剪接,其中两个 RNA 转录物融合,产生包含外显子的线性转录物,例如,该外显子可能源自两条不同染色体上编码的基因。反式剪接在秀丽隐杆线虫中非常常见。 | |||
*# 剪接供体位点与初级转录本上游的剪接受体位点连接,产生环状转录本。 | |||
* 大多数circRNA的低丰度和缺乏序列保守性支持了环化转录本是不完美剪接的副产物的观点,但也受到了挑战。 | |||
* 除此之外,Alu序列的存在被认为对于circRNA的形成是有帮助的。与形成circRNA的第一个和最后一个外显子相邻的蛋白质编码基因的侧翼内含子中Alu元件的存在可通过RNA互补的方式促进环化。RNA编辑也可以影响这一过程,从A到I的编辑可能由于互补配对的因素减少circRNA的形成。 | |||
* circRNA已被发现可以充当miRNA海绵,一个典型的例子便是CDR1as/CiRS-7,CDR1as/CiRS-7在人类基因组CDR1位点反义编码(因此称为CDR1as),并靶向miR-7(因此称为CiRS-7-miR-7的圆形RNA海绵)。它具有超过60个miR-7结合位点,远远多于任何已知的线性miRNA海绵。另一种值得注意的圆形miRNA海绵是SRY。 SRY在小鼠睾丸中高度表达,起到miR-138海绵的作用。 在基因组中,SRY两侧是长度超过15.5kb的长反向重复序列(IR)。当删除一个或两个IR时,不会发生环化。正是这一发现引入了反向重复序列实现环化的想法。由于环状RNA海绵具有高表达水平、稳定性和大量miRNA结合位点的特点,因此它们可能是比线性RNA更有效的海绵。 | |||
* circRNA的其他潜在功能如: | |||
** 与RNA 结合蛋白(RBP)和除miRNA外的 RNA结合,形成 RNA-蛋白质复合物。 这些复合物可以调节RBP和RNA与基因或病毒感染的典型线性转录物的相互作用。 | |||
** 蛋白质翻译。含有IRES(内部核糖体进入位点)的合成circRNA在体外可以产生蛋白质产物,而没有IRES的合成circRNA则不会,但包含翻译“起始密码子”的天然circRNA均未与核糖体结合,这表明许多circRNA可能无法在体内翻译。 | |||
** 在细胞内运输miRNA。CiRS-7可以被miR-671切割的事实表明可能存在一个在适当的时间释放“负载”miRNA的系统。 | |||
** 通过有限的碱基配对调节细胞中的mRNA。 | |||
* 需要注意的是,很多单链RNA分子(如类病毒、丁型肝炎病毒等)也被认为属于circRNA这一类分子。我们所熟知的II类内含子在剪接过程中会产生套索样内含子RNA,通常,内含子会脱支并迅速降解。然而,脱支失败可能导致环状内含子长非编码RNA(也称为 ciRNA)的形成。CiRNA与circRNA不同,因为它们主要存在于细胞核而不是细胞质中。此外,这些分子含有很少(如果有的话)的miRNA结合位点。ciRNA似乎不是充当海绵,而是调节其亲代基因的表达(有关类病毒的知识,敬请参阅[[病毒分类整理]])。 | |||
== 参考文献 == | == 参考文献 == | ||
* 《Molecular Biology of the Cell》第7章 | * 《Molecular Biology of the Cell》第7章 | ||
* 《Molecular Biology of the Gene》第20章 | * 《Molecular Biology of the Gene》第20章 | ||
*Circular RNA -- Wikipedia | |||
{{学科分类}} | |||
[[Category:分子生物学]] | |||
2025年8月23日 (六) 16:25的最新版本
总论
- 调控RNA(Regulatory RNA)控制RNA的翻译,也有其它功能。
细菌的sRNA
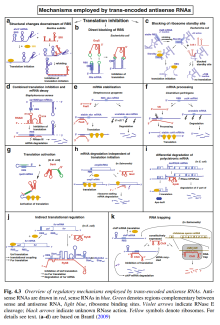
sRNA的功能
- sRNA既可与其它RNA互补(称为反义RNA(Antisense RNA)),也可与蛋白质结合,发挥功能。
- 古菌、真核生物也有反义RNA。
- sRNA本身可监测温度、某种物质浓度等环境因子。
- 根据反义RNA与其影响的RNA是否完全配对,将反义RNA分为顺式(Cis-encoded)和反式(Trans-encoded)两种。
- 编码顺式反义RNA的基因出现在细菌染色体、质粒、噬菌体、转位子中。
- 它控制质粒的复制、接合。
- 它决定噬菌体是否将宿主裂解。
- 它控制转位子转位的频率。
- 它控制(通常是有毒的)蛋白合成。
- 顺式反义RNA的工作机制:(图1)
- 与mRNA结合,阻止核糖体翻译mRNA。
- 促进mRNA降解,通常由RNase III水解。
- 与mRNA结合,掩盖切割位点,防止mRNA被水解。
- 转录弱化(Transcription Attenuation),只出现在革兰氏阳性细菌。
- 转录干扰(Transcriptional Interference)。
- “伪结”干扰(Pseudoknot Formation Interference)。
- 启动子干扰。
- 反式反义RNA在数量、功能、工作机制上都较丰富。
- 有些反式反义RNA同时是mRNA。
- 很多反式反义RNA需要Hfq蛋白(一种分子伴侣)的帮助才能和RNA结合。
- 反式反义RNA的工作机制:(图2)
- 抑制、促进翻译。
- 促进mRNA降解。
- 抑制翻译,同时促进mRNA降解。
- 稳定mRNA。
- 促进mRNA的后加工。
- RNA陷阱(RNA Trapping)。
- 古菌、真核生物也有“反义RNA”,但功能仅限于与mRNA互补,物理干扰mRNA翻译。
转录弱化
- mRNA存在两种可能二级结构,其中一种有转录终止柄环(Transcriptional Terminator Stem-loop)结构。
- 未完成转录的mRNA与反义RNA结合时,形成有转录终止环的二级结构。
- 转录终止环使mRNA转录提前终止,称为转录弱化现象。
转录干扰
- 转录干扰现象至今只观察到一例。
- 某细菌染色体有ubiGmccBA基因,其下游有一个反义RNA的启动子。
- 从该启动子可转录出四种反义RNA。
- 细胞中甲硫氨酸较高时,转录出的反义RNA最短,不干扰ubiGmccBA的转录。
- 细胞中甲硫氨酸越低,转录出的反义RNA越长,通过积累正超螺旋抑制ubiGmccBA的转录,称为转录干扰现象。
“伪结”干扰
- 翻译某个mRNA需要它有个“伪结”结构。
- 必须先合成repY,再合成repZ,由repZ干扰mRNA的一个柄环结构,才能形成伪结结构。
- 反义RNA既抑制repY的翻译,也抑制伪结结构的形成,称为伪结干扰现象。
启动子干扰
- 某些质粒复制时需复制原点有一个启动子RNAII。
- 对应的反义RNA(RNAI)与RNAII结合,阻止质粒复制,称为启动子干扰现象。
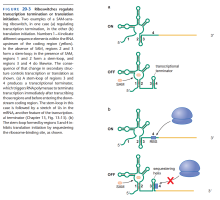
RNA陷阱
- ChiX是某细菌中的一种反式反义RNA。
- 一般情况下,ChiX抑制chiP(一种mRNA)的翻译并促进它降解。(但ChiX本身不被降解)
- 细菌细胞内出现某种物质时,细胞转录一种陷阱mRNA,与ChiX结合,二者同时被降解。
- ChiX被降解后,chiP得以翻译。
与蛋白质结合的sRNA
6S RNA
- 细菌在营养不足时,产生6S RNA。
- 6S RNA与σ70转录因子结合,抑制相关基因转录。
- 细菌同时产生σS转录因子,6S RNA帮助细菌过渡到新转录因子。
CsrB
- CsrA是一种蛋白质,通过翻译调控促进糖酵解,抑制糖异生。
- CsrB是一种sRNA,通过与CsrA结合,抑制CsrA的功能。
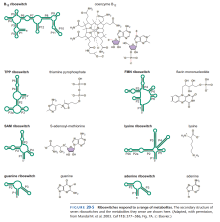
监测环境因子的sRNA(图3、4)
- 核开关(Riboswitch)能监测细胞中的环境因子。
- 核开关有时是mRNA的一部分。
- 温度或与某物质非共价结合能使核开关的二级结构改变。
- 二级结构的改变既可调控转录也可调控翻译。
细菌和古菌的CRISPR

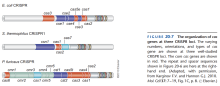

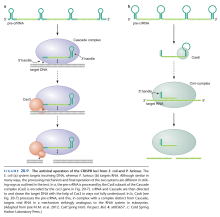
- 大部分细菌和古菌的基因组中有结构如图5所示的CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)结构。
- 每个基因组中可以有不止一个CRISPR结构。
- CRISPR是原核生物的免疫系统。
- CRISPR由高度保守的Repeat序列和高度自由的Spacer序列交替构成。
- Repeat和Spacer的长度都约为30 bp。
- CRISPR的一端有Leader序列,长约500 bp,富含A-T。
- 在Leader序列方向有若干编码蛋白质的基因,这些蛋白质与CRISPR功能有关。
- 上述基因中最保守的是cas1和cas2。
- 细菌被噬菌体或质粒感染时,感染者DNA的一部分(靠近一种叫PAM的序列)被写入靠近Leader序列的一端。
- CRISPR结构的转录启动子在Leader序列内。
- 整个CRISPR结构被转录为一个RNA,称为pre-crRNA。
- pre-crRNA被切割为若干crRNA。
- 每个crRNA的5'端为8个Repeat序列的碱基,中间为一个Spacer序列,3'端为下一个Repeat序列剪去8个碱基。
- crRNA随后与一个蛋白质复合体结合,识别外来核酸。如配对正确,则蛋白质复合体将外来核酸在配对处切开。
- CRISPR系统中的Cas9蛋白可用于一切生物的基因组编辑。
真核生物的RNA干扰(RNA Interference,RNAi)
- 真核生物的部分非编码RNA通过RNA干扰机制调控基因表达。(图9)
- 若上述RNA与mRNA结合紧密,则mRNA被立刻水解。
- “结合紧密”的关键是RNA的第9~11个核苷酸。
- 若上述RNA与mRNA结合不紧密,则mRNA先被抑制翻译,然后被水解。
- 若上述RNA与正在转录的RNA结合,则引起DNA构象改变,抑制其转录。
- 上述RNA有三类:siRNA、miRNA、piRNA,长度均约为20 nt,统称为小RNA(Small RNA,注意不是sRNA)。(piRNA略长)
miRNA
- miRNA参与细胞自身基因表达调控。
- miRNA由pri-miRNA经两次剪切产生。
- 绝大部分pri-miRNA源于基因的内含子或外显子,由RNA聚合酶II转录,此时pri-miRNA是mRNA。
- 基因组中5'端有Alu元素、MWIR元素、tRNA的pri-miRNA由RNA聚合酶III转录。
- miRNA在pri-miRNA中呈柄环结构。(图10、11)
- 每个pri-miRNA可含1~6个miRNA。
- 细胞核中,pri-miRNA被DGCR8蛋白(无脊椎动物中称为Pasha蛋白)识别,然后被Drosha酶(属于RNase III)将柄环结构剪切为pre-miRNA。
- DGCR8蛋白和Drosha酶共同构成“微处理”复合体(Microprocessor Complex)。
- pre-miRNA长约为70 nt。
- miRNA出现于柄环结构中柄的上半部分。
- pre-miRNA利用Exportin-5通过核孔进入细胞质。
- 细胞质内,Dicer酶将pre-miRNA从中间切下22 nt左右,切下部分为dsRNA。(下文暂称此RNA为pro-miRNA)
- pre-miRNA和pro-miRNA的每条链的3'端多出2个核苷酸。(RNase III切割的特征)
- 如果pre-miRNA富含G,可能形成G四联体结构,则不被Dicer酶处理。
- 植物细胞中产生miRNA的过程与上述略有不同,见图13。(它们的进化起源可能不同)
- 植物的miRNA处理不经过Drosha酶切。
- 植物的miRNA通常不在基因内,动物的miRNA通常在内含子内。
- 动物的miRNA主要与mRNA的3'端不翻译区结合,次要与外显子结合,少数与内含子结合。
- 植物的miRNA一般与外显子结合。
- RISC复合体结合Dicer酶切下的dsRNA,使它变性,抛弃其中一条链,另一条链成为miRNA,此过程称为RISC复合体的成熟(Maturation)。
- 若切下的dsRNA只有一条链成为miRNA,此链称为Guide Strand,另一条链称为Passenger Strand。(也可能两条链都成为miRNA)
siRNA
- siRNA帮助细胞抵抗外来RNA。
- siRNA绝大部分产生于外源的dsRNA,极少数产生于细胞转录的dsRNA。
- siRNA是双链结构,而pre-miRNA是发夹结构。(区分siRNA和miRNA的唯一标准)
- Dicer酶处理dsRNA产生新的dsRNA(暂称为pro-siRNA),它与RISC复合体结合。(类似于pro-miRNA)
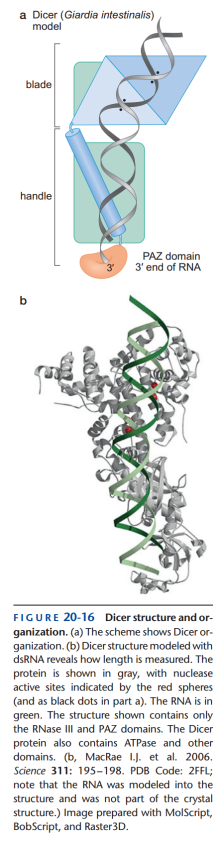
Dicer酶(图12)
- Dicer酶由2个RNase III亚基、1个PAZ亚基组成。
- Dicer酶既可切割发夹结构,也可切割双链结构,但每条链一3'端要多出2个核苷酸。
- PAZ亚基固定3'端的2个核苷酸。
- 两个RNase III的切割位点距离PAZ亚基约20个核苷酸长,从而切下的dsRNA每条链也约为此长度。
piRNA
- piRNA只出现于动物细胞内,帮助细胞抑制转位子。(植物用siRNA对抗转位子)
- piRNA几乎只在生殖细胞中表达。
- piRNA源于细胞转录出的ssRNA,具体产生过程尚不清楚,但Dicer酶一定不参与。
- piRNA的5‘端一般是U,3'端磷酸基团的3'羟基一般变为氧甲基。
- 细胞核内也有piRNA,作用不明。
RISC复合体及其它
- 5'端的核苷酸以A或U为主的链更容易被选为Guide Strand。
- RISC复合体的核心是Argonaute酶。
- Argonaute酶将与Guide Strand紧密配对的RNA剪断,从而阻止翻译。(图14)
- Argonaute酶亦可抑制RNA翻译。(图15)
- 植物(包括真菌)、低等动物(不包括果蝇)的细胞内有以RNA为模板的RNA聚合酶(RdRP)。
- 未与RISC复合体结合的小RNA可直接与mRNA结合,此时RdRP以小RNA为引物,合成一条链,组成dsRNA。
- 上述dsRNA可被Dicer酶处理,形成新小RNA,从而放大RNAi现象。
RNAi与生物技术
- 转基因技术中,导入同一基因的多个拷贝会引起共抑制现象(Cosuppresion)。
- 共抑制现象原因尚不清楚,但转录组研究显示细胞产生了对应于多拷贝基因的miRNA。
- RNAi被用于人工基因表达调控:
- 最早,先在试管内合成特定dsRNA,然后注入秀丽隐杆线虫细胞。
- 随后,发现直接将秀丽隐杆线虫浸泡在dsRNA溶液里也能注入dsRNA。(但哺乳动物细胞不行)
- 后来,先将dsRNA对应的DNA导入大肠杆菌的质粒,使大肠杆菌产生dsRNA,然后给线虫喂食大肠杆菌。
- 哺乳动物细胞中,以上方法成功率都不高,因为较长的dsRNA易引起干扰素(Interferon)反应,进而细胞凋亡。
- 现代,先将构造的DNA序列导入动物细胞的基因组中,该序列转录产生自动折叠为柄环结构的RNA(shRNA),模仿pre-RNA的功能。
- 此方法可使线虫的全部细胞永久具有该dsRNA的干扰效果。
真核生物的长非编码RNA(lncRNA)
- lncRNA指长度大于200 nt的非编码RNA。
- lncRNA的功能非常复杂,包括:
- 抑制或激活特定基因的转录;
- 控制通用转录因子(General Transcription Factor)或RNA聚合酶本身;(此类lncRNA多由RNA聚合酶III转录)
- 控制mRNA剪接(Slicing);
- 控制mRNA翻译;(此现象在神经细胞中尤为明显)
- 控制表观遗传。(典型:Xist控制形成巴氏小体,见下文)
Xist
- 雌性胎盘动物(后兽亚纲和真兽亚纲)在胚胎有32~64个细胞时,每个细胞中两条X染色体中任意一条变为异染色质(失活),称为巴氏小体(Barr's Body)。
- 若失活的X染色体来自父方(母方),则该细胞分裂产生的所有细胞中失活的X染色体都来自父方(母方)。
- 正常的X染色体记作Xa,失活的X染色体记作Xi。
- 后兽亚纲动物中,总是来自父方的X染色体变为异染色质。
- 老鼠胚胎有2~4个细胞时,来自父方的X染色体因染色体印记而失活,但在囊胚早期此染色体复活。(但胚外组织,包括胎盘,其细胞中此X染色体永久失活)
- X染色体上有XIC区域(X-inactivation Center)。
- XIC区域包含4个基因:Xist、Tsix、Jpx、Ftx。
- Xist和Tsix互为反义RNA,互相抑制转录。
- 胚胎初期,所有细胞少量转录Xist。
- 胚胎达到32细胞时,每个细胞中其中一个X染色体不再转录Xist,另一个大量转录Xist。
- Xist有3'端多聚A,要经历剪接,但不编码蛋白质,属于伪基因(Pseudogene)。
- Xist是唯一Xa不表达,Xi大量表达的基因。
- Xist先逐步包裹转录出它的X染色体。(尚不清楚为何不包裹另一条X染色体)
- Xist吸引其它蛋白质(如PRC2)对X染色体进行修饰。
- X染色体失活修饰包括:高DNA甲基化、低组蛋白乙酰化、低H3K4甲基化、高H3K9甲基化。
- 只有失活X染色体中出现一种罕见组蛋白macroH2A(又名H2AFY),替代正常组蛋白H2A。
- 将XIC区域移入其它染色体,该染色体也会出现上述失活现象。
环状RNA(Circular RNA)
- 环状RNA(或circRNA)是一种单链RNA,与线性RNA不同,它形成共价闭合的连续环。在环状 RNA 中, RNA 分子中通常存在的3' 和 5' 末端已连接在一起。许多类型的环状 RNA 均源自蛋白质编码基因。一些环状RNA已被证明可以编码蛋白质。某些类型的环状 RNA 最近也显示出调节基因表达的潜力。大多数环状RNA的生物学功能尚不清楚。由于环状 RNA 没有 5' 或 3' 末端,因此它们能够抵抗核酸外切酶介导的降解,并且可能比细胞中大多数线性 RNA 更稳定。环状RNA与癌症等一些疾病有关。
- 大多数circRNA来自非规范性剪接,如外显子乱序。外显子乱序,也称为外显子改组,描述了外显子以“非规范”(非典型)顺序剪接的事件。外显子乱序可以通过三种方式发生:
- 基因组中的串联外显子重复,通常发生在癌症中。
- 反式剪接,其中两个 RNA 转录物融合,产生包含外显子的线性转录物,例如,该外显子可能源自两条不同染色体上编码的基因。反式剪接在秀丽隐杆线虫中非常常见。
- 剪接供体位点与初级转录本上游的剪接受体位点连接,产生环状转录本。
- 大多数circRNA的低丰度和缺乏序列保守性支持了环化转录本是不完美剪接的副产物的观点,但也受到了挑战。
- 除此之外,Alu序列的存在被认为对于circRNA的形成是有帮助的。与形成circRNA的第一个和最后一个外显子相邻的蛋白质编码基因的侧翼内含子中Alu元件的存在可通过RNA互补的方式促进环化。RNA编辑也可以影响这一过程,从A到I的编辑可能由于互补配对的因素减少circRNA的形成。
- circRNA已被发现可以充当miRNA海绵,一个典型的例子便是CDR1as/CiRS-7,CDR1as/CiRS-7在人类基因组CDR1位点反义编码(因此称为CDR1as),并靶向miR-7(因此称为CiRS-7-miR-7的圆形RNA海绵)。它具有超过60个miR-7结合位点,远远多于任何已知的线性miRNA海绵。另一种值得注意的圆形miRNA海绵是SRY。 SRY在小鼠睾丸中高度表达,起到miR-138海绵的作用。 在基因组中,SRY两侧是长度超过15.5kb的长反向重复序列(IR)。当删除一个或两个IR时,不会发生环化。正是这一发现引入了反向重复序列实现环化的想法。由于环状RNA海绵具有高表达水平、稳定性和大量miRNA结合位点的特点,因此它们可能是比线性RNA更有效的海绵。
- circRNA的其他潜在功能如:
- 与RNA 结合蛋白(RBP)和除miRNA外的 RNA结合,形成 RNA-蛋白质复合物。 这些复合物可以调节RBP和RNA与基因或病毒感染的典型线性转录物的相互作用。
- 蛋白质翻译。含有IRES(内部核糖体进入位点)的合成circRNA在体外可以产生蛋白质产物,而没有IRES的合成circRNA则不会,但包含翻译“起始密码子”的天然circRNA均未与核糖体结合,这表明许多circRNA可能无法在体内翻译。
- 在细胞内运输miRNA。CiRS-7可以被miR-671切割的事实表明可能存在一个在适当的时间释放“负载”miRNA的系统。
- 通过有限的碱基配对调节细胞中的mRNA。
- 需要注意的是,很多单链RNA分子(如类病毒、丁型肝炎病毒等)也被认为属于circRNA这一类分子。我们所熟知的II类内含子在剪接过程中会产生套索样内含子RNA,通常,内含子会脱支并迅速降解。然而,脱支失败可能导致环状内含子长非编码RNA(也称为 ciRNA)的形成。CiRNA与circRNA不同,因为它们主要存在于细胞核而不是细胞质中。此外,这些分子含有很少(如果有的话)的miRNA结合位点。ciRNA似乎不是充当海绵,而是调节其亲代基因的表达(有关类病毒的知识,敬请参阅病毒分类整理)。
参考文献
- 《Molecular Biology of the Cell》第7章
- 《Molecular Biology of the Gene》第20章
- Circular RNA -- Wikipedia
