Western blot条带结果分析整理:修订间差异
自动添加 Sofia 模板和分类 |
|||
| (未显示1个用户的2个中间版本) | |||
| 第10行: | 第10行: | ||
* 一抗浓度过低(小小的细微条带)。 | * 一抗浓度过低(小小的细微条带)。 | ||
* ECL发光液失效(小小的细微条带)。<br> | * ECL发光液失效(小小的细微条带)。<br> | ||
[[文件:Wb 3.PNG|缩略图|无结果1]] | |||
[[文件:Wb 2.PNG|缩略图|无结果2]] | |||
[[文件:Wb 1.PNG|缩略图|无结果3]] | |||
解决方案: | 解决方案: | ||
* 如果使用湿转法,则需增加转移时间。 | * 如果使用湿转法,则需增加转移时间。 | ||
| 第41行: | 第44行: | ||
* 避免对同一印迹膜进行多次重复再杂交。 | * 避免对同一印迹膜进行多次重复再杂交。 | ||
* 蛋白质未转移→优化目标蛋白转移效率。 | * 蛋白质未转移→优化目标蛋白转移效率。 | ||
== 高背景 == | == 高背景 == | ||
目的条带单一清晰,但其他地方弥漫着连续性的单一背景。是WB最常见的问题之一,注意操作规范,不偷工减料,洗膜按照规定来5min×5次或者10min×3次,不要改成5min×3次,或者10min×2次。<br> | 目的条带单一清晰,但其他地方弥漫着连续性的单一背景。是WB最常见的问题之一,注意操作规范,不偷工减料,洗膜按照规定来5min×5次或者10min×3次,不要改成5min×3次,或者10min×2次。<br> | ||
| 第48行: | 第50行: | ||
* 一抗浓度过高导致出现了非特异性结合。 | * 一抗浓度过高导致出现了非特异性结合。 | ||
* 洗膜的时间及次数不足导致未洗脱游离抗体。 | * 洗膜的时间及次数不足导致未洗脱游离抗体。 | ||
== 出现异常的多个条带 == | == 出现异常的多个条带 == | ||
[[文件:Wb 4.PNG|缩略图|多条带1]][[文件:Wb 5.PNG|缩略图|多条带2]] | |||
出现原因: | 出现原因: | ||
* 可能是一抗与杂蛋白出现了非特异性结合。 | * 可能是一抗与杂蛋白出现了非特异性结合。 | ||
| 第67行: | 第69行: | ||
== 条带中出现圆圈 == | == 条带中出现圆圈 == | ||
出现的原因是电转时PAGE胶与尼龙膜之间存在气泡。 出现气泡的原因基本上是在转膜过程中转移“三明治”组装不恰当。<br> | 出现的原因是电转时PAGE胶与尼龙膜之间存在气泡。 出现气泡的原因基本上是在转膜过程中转移“三明治”组装不恰当。<br> | ||
解决方法: | [[文件:Wb 7.PNG|缩略图|半干法]][[文件:Wb 8.PNG|缩略图|湿法]]解决方法: | ||
* 在组装转移“三明治”的时候使用更多的转印缓冲液。 | * 在组装转移“三明治”的时候使用更多的转印缓冲液。 | ||
* 确保在组装“三明治”的时候移除凝胶和印迹膜之间所有的气泡。 | * 确保在组装“三明治”的时候移除凝胶和印迹膜之间所有的气泡。 | ||
| 第75行: | 第77行: | ||
操作注意:<br> | 操作注意:<br> | ||
我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧中间,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。注意不要来回赶气泡,这样反而会带入气泡。 | 我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧中间,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。注意不要来回赶气泡,这样反而会带入气泡。 | ||
== 条带中出现浅色 == | == 条带中出现浅色 == | ||
中心部位高浓度的辣根过氧化物酶(HRP)等消耗底物过快,使得胶片曝光时底物已消耗殆尽。解决方法是降低蛋白量,降低一抗和二抗浓度,加快X光片定影。 | 中心部位高浓度的辣根过氧化物酶(HRP)等消耗底物过快,使得胶片曝光时底物已消耗殆尽。解决方法是降低蛋白量,降低一抗和二抗浓度,加快X光片定影。 | ||
| 第83行: | 第84行: | ||
* 抗体聚合。 | * 抗体聚合。 | ||
* 缓冲液污染。 | * 缓冲液污染。 | ||
* 一抗与膜某些地方非特异性结合。 <br> | * 一抗与膜某些地方非特异性结合。 <br>[[文件:Wb 6.PNG|缩略图|黑点和黑斑]] | ||
解决方案: | 解决方案: | ||
* 将印迹膜表面残留的丙烯酰胺凝胶碎片移除。 | * 将印迹膜表面残留的丙烯酰胺凝胶碎片移除。 | ||
| 第92行: | 第93行: | ||
* 使用新的缓冲液或使用0.2μm的过滤器过滤缓冲液。 | * 使用新的缓冲液或使用0.2μm的过滤器过滤缓冲液。 | ||
* 封闭牛奶一定要纯,封闭结束之后要洗,如果没有完全溶解的情况下加牛奶倒膜上,会导致很多不溶性颗粒附着在膜上,这就会导致发光时候膜上的黑点。 | * 封闭牛奶一定要纯,封闭结束之后要洗,如果没有完全溶解的情况下加牛奶倒膜上,会导致很多不溶性颗粒附着在膜上,这就会导致发光时候膜上的黑点。 | ||
== 条带拖尾 == | == 条带拖尾 == | ||
蛋白量过大,一抗的浓度过大,加入的时间过长,洗一抗和洗二抗不要凑活,一定要5min×5次。样品溶解度不佳。 | 蛋白量过大,一抗的浓度过大,加入的时间过长,洗一抗和洗二抗不要凑活,一定要5min×5次。样品溶解度不佳。 | ||
== 出现重影 == | == 出现重影 == | ||
荧光强度较高,压片曝光时,胶片放好后又移动了一段距离。不要瞎动,放歪了也不要调整。(有的时候出现重新刚好在上下位置,并且重影会相对弱一些,不要误以为抗体识别了该蛋白的另外一种异构形式。) | 荧光强度较高,压片曝光时,胶片放好后又移动了一段距离。不要瞎动,放歪了也不要调整。(有的时候出现重新刚好在上下位置,并且重影会相对弱一些,不要误以为抗体识别了该蛋白的另外一种异构形式。) | ||
== 出现非均一性背景 == | == 出现非均一性背景 == | ||
可能的原因是膜干了失水皱缩,所以多加点水。 | 可能的原因是膜干了失水皱缩,所以多加点水。 | ||
== 某个条带变形 == | == 某个条带变形 == | ||
PAGE胶中可能存在气泡或不溶性颗粒,故配胶时要小心,使用无杂质液体。制作“三明治”时也要压紧。更换陈年老用的海绵垫。 | PAGE胶中可能存在气泡或不溶性颗粒,故配胶时要小心,使用无杂质液体。制作“三明治”时也要压紧。更换陈年老用的海绵垫。 | ||
== 条带哑铃型 == | == 条带哑铃型 == | ||
更换更高品质的PAGE胶。 | 更换更高品质的PAGE胶。 | ||
== 最边缘的条带弯曲 == | == 最边缘的条带弯曲 == | ||
电泳电流不均一,可换用新的电泳槽,不使用两边的泳道。 | |||
== 蛋白质分子量过高或过低 == | == 蛋白质分子量过高或过低 == | ||
出现原因: | 出现原因: | ||
| 第120行: | 第116行: | ||
蛋白质降解,下方产生的模糊不清的小条带是其碎片。提取蛋白的时候PMSF(苯甲基磺酰氟,蛋白酶抑制剂)多加点。 | 蛋白质降解,下方产生的模糊不清的小条带是其碎片。提取蛋白的时候PMSF(苯甲基磺酰氟,蛋白酶抑制剂)多加点。 | ||
== 条带“╰╯”笑脸状(U 形状) == | == 条带“╰╯”笑脸状(U 形状) == | ||
凝胶冷却不均一,电泳槽老化,在上样的时候没有吹打干净、跑胶电压过大造成拖尾。 | 凝胶冷却不均一,电泳槽老化,在上样的时候没有吹打干净、跑胶电压过大造成拖尾。 [[文件:Wb 9.PNG|缩略图|笑脸]] | ||
== 条带“╭╮”哭脸状 == | == 条带“╭╮”哭脸状 == | ||
凝胶的左右两头没有固定好。 | 凝胶的左右两头没有固定好。 | ||
| 第132行: | 第128行: | ||
缓冲液pH不正确,或者SDS加的太少。 | 缓冲液pH不正确,或者SDS加的太少。 | ||
== 边缘效应 == | == 边缘效应 == | ||
出现于胶图的两端最靠边的条带,会发现跑出来的带不是水平直线。<br> | 出现于胶图的两端最靠边的条带,会发现跑出来的带不是水平直线。<br> [[文件:Wb 12.PNG|缩略图|边缘效应]] | ||
解决方案:<br>宁可将Loading buffer加到两边也不要将样品加到两边。 | 解决方案:<br>宁可将Loading buffer加到两边也不要将样品加到两边。 | ||
== 脏……全屏条带 == | == 脏……全屏条带 == | ||
| 第142行: | 第138行: | ||
* 曝光时间过长。 | * 曝光时间过长。 | ||
* 印迹过程中印迹膜变干。 | * 印迹过程中印迹膜变干。 | ||
* 缓冲液重复利用导致污染。 | * 缓冲液重复利用导致污染。<br> | ||
解决方案:<br>[[文件:Wb 11.PNG|缩略图|全屏黑]] | |||
解决方案:<br> | |||
* 稀释一抗和/或二抗浓度。 | * 稀释一抗和/或二抗浓度。 | ||
* 提高封闭剂浓度,如3~5% 的牛血清蛋白、酪蛋白、脱脂牛奶. | * 提高封闭剂浓度,如3~5% 的牛血清蛋白、酪蛋白、脱脂牛奶. | ||
| 第156行: | 第151行: | ||
* 确保印迹膜保持湿润,覆盖有足够液体以防止其变干。 | * 确保印迹膜保持湿润,覆盖有足够液体以防止其变干。 | ||
* 使用新制缓冲液。 | * 使用新制缓冲液。 | ||
== 脏……区域性黑屏 == | == 脏……区域性黑屏 == | ||
出现原因: | 出现原因: | ||
| 第163行: | 第157行: | ||
* 洗涤缓冲液与某些印迹区域接触不足。 | * 洗涤缓冲液与某些印迹区域接触不足。 | ||
* 印迹膜污染。<br> | * 印迹膜污染。<br> | ||
解决方案: | 解决方案:[[文件:Wb 10.PNG|缩略图|局域黑]] | ||
* 确保印迹膜保持湿润,一直覆盖有足够液体以防止其变干。 | * 确保印迹膜保持湿润,一直覆盖有足够液体以防止其变干。 | ||
* 增加洗涤缓冲液用量。 | * 增加洗涤缓冲液用量。 | ||
| 第171行: | 第165行: | ||
<ref>本文档由拟态章鱼编写,由恺凌、Eric校对审核。</ref> | <ref>本文档由拟态章鱼编写,由恺凌、Eric校对审核。</ref> | ||
<ref>[https://www.dxy.cn/bbs/newweb/pc/post/41165994]Western Blot 原理、protocol--及条带常见问题分析.与你畅游世界</ref> | <ref>[https://www.dxy.cn/bbs/newweb/pc/post/41165994]Western Blot 原理、protocol--及条带常见问题分析.与你畅游世界</ref> | ||
<references /> | |||
{{学科分类}} | |||
[[Category:生物技术]] | |||
2025年8月23日 (六) 16:27的最新版本
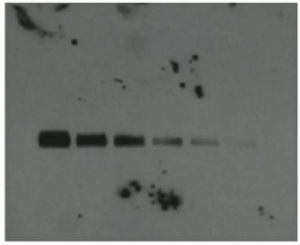
Western Blot条带结果分析
未检测到任何结果
出现原因:
- 加错了抗体,如一抗加的是小鼠抗人,二抗加的是山羊抗兔。
- 提取的总蛋白中压根没有目的蛋白,如用改变离子强度的方式提取膜蛋白(所以做Input很重要啊)。当然,梦想总是要有的,说不定你也可以在五车酵母上清中提到Cyt c;转移时间过短。
- 转移电场过弱;转移缓冲液未优化。
- 凝胶选择不恰当。
- 转膜时膜放反了(真是个小机灵鬼)。
- 蛋白上样量太少(小小的细微条带)。
- 一抗浓度过低(小小的细微条带)。
- ECL发光液失效(小小的细微条带)。



解决方案:
- 如果使用湿转法,则需增加转移时间。
- 增加转移电压或电流。
- 在转移缓冲液中加入0.01~0.05%的SDS。
- 将转移缓冲液中的甲醇浓度减少至5%或更少。
- 使用更低百分比的丙烯酰胺凝胶。
- 检查上样的量、抗体和反光液的量(小小的细微条带)
其他原因及解决办法:
- 转移时间过长→减少转印时间。
- 转移电场过强→降低转印电压或电流。
- 转移缓冲液未优化→组装“三明治”之前,在转印缓冲液中平衡凝胶20分钟以降低凝胶中SDS浓度,从而避免小分子量蛋白的过度转移。将转印缓冲液中的甲醇浓度增加至40%提高其极性有助于从蛋白质中移除残留SDS。
- 凝胶选择不恰当→使用更高百分比的丙烯酰胺凝胶当目标蛋白分子量小于10KD时使用Tris/tricine 凝胶。
- 使用0.2μm的印迹膜解决小蛋白转印过度的情况。
- 小蛋白会穿过大孔径的印迹膜→使用0.2 μm的印迹膜检测小蛋白转印过度情况
抗体问题:
低活性或低浓度,低亲和力的一抗,错配的一抗和二抗结合比率提高。
抗体浓度:
- 抗体可能已经丧失活性;进行斑点杂交以确定其活性和最佳浓度。
- 测试不同一抗和/或一抗/二抗组合。
- 同时使用阳性对照和阴性对照。
- 抗原提呈不足增加凝胶中每个样品的总蛋白上样量。
- 检查样品的完整性;确保蛋白未降解。
- 抗原被封闭缓冲液封闭尝试不同的封闭液(比如,在检测磷蛋白时避免使用牛奶)。
- 优化封闭液浓度→建议使用浓度为3~5%的牛血清白蛋白或脱脂奶粉
- 化学发光底物性能不佳→增加底物孵育时间。
- 准备少量工作液以确定底物是否已经丧失活性。暗室内,在底物工作液中加入少量HPR偶联物则应该会出现蓝光。如果没有的话,必定是底物或HRP偶联物已丧失活性。
- 确保底物试剂盒中的两个瓶子之间没有发生交叉污染。两种试剂之间如果发生交叉污染,则会引起试剂活性下降。
- 叠氮化物是HRP的抑制剂,所以不要在二抗缓冲液中使用叠氮化物。
- 印迹膜抗体剥离和再杂交优化抗体剥离条件。
- 仅在必要时进行再杂交检测。
- 避免对同一印迹膜进行多次重复再杂交。
- 蛋白质未转移→优化目标蛋白转移效率。
高背景
目的条带单一清晰,但其他地方弥漫着连续性的单一背景。是WB最常见的问题之一,注意操作规范,不偷工减料,洗膜按照规定来5min×5次或者10min×3次,不要改成5min×3次,或者10min×2次。
出现原因:
- 为封闭不完善(脱脂牛奶多加点)。
- 一抗浓度过高导致出现了非特异性结合。
- 洗膜的时间及次数不足导致未洗脱游离抗体。
出现异常的多个条带
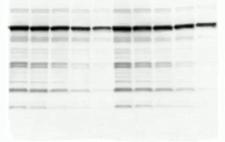
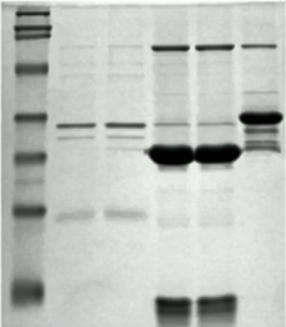
出现原因:
- 可能是一抗与杂蛋白出现了非特异性结合。
- 抗体浓度过高。
- 非特异位点封闭不足。
- 向封闭缓冲溶液中加入0.05%的Tween®20。
- SDS使抗体和固定的蛋白条带发生非特异性结合。
解决方案:
- 可尝试更换一抗(你的一抗实在是太屎了花点钱重买一个吧)。
- 降低抗体浓度。
- 提高封闭剂浓度,如从5%提高到7%。
- 增加封闭时间和/或提高温度。
- 抗体稀释液采用相同的封闭缓冲液(加入0.05%的 Tween®20)。
- 转移后洗涤印迹膜。
- 在免疫检测过程中不要使用SDS。
- 抗体质量尝试使用不同抗体。
条带中出现圆圈
出现的原因是电转时PAGE胶与尼龙膜之间存在气泡。 出现气泡的原因基本上是在转膜过程中转移“三明治”组装不恰当。


解决方法:
- 在组装转移“三明治”的时候使用更多的转印缓冲液。
- 确保在组装“三明治”的时候移除凝胶和印迹膜之间所有的气泡。
- 在抗体孵育前用丽春红S为印迹膜染色,以检查转移质量。
- 尽量不要使用半干法(使用湿法转膜,即泡在整个的转移buffer溶液中)。
- 将“三明治”压压紧。
操作注意:
我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧中间,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。注意不要来回赶气泡,这样反而会带入气泡。
条带中出现浅色
中心部位高浓度的辣根过氧化物酶(HRP)等消耗底物过快,使得胶片曝光时底物已消耗殆尽。解决方法是降低蛋白量,降低一抗和二抗浓度,加快X光片定影。
出现黑点和黑斑
出现原因:
解决方案:
- 将印迹膜表面残留的丙烯酰胺凝胶碎片移除。
- 确保封闭剂在使用前完全溶解。
- 向封闭缓冲溶液中加入0.1%的Tween-20®。
- 使用0.2μm的过滤器过滤抗体缓冲液。
- 使用新鲜抗体、向抗体缓冲溶液中加入0.1%的 Tween-20®。
- 使用新的缓冲液或使用0.2μm的过滤器过滤缓冲液。
- 封闭牛奶一定要纯,封闭结束之后要洗,如果没有完全溶解的情况下加牛奶倒膜上,会导致很多不溶性颗粒附着在膜上,这就会导致发光时候膜上的黑点。
条带拖尾
蛋白量过大,一抗的浓度过大,加入的时间过长,洗一抗和洗二抗不要凑活,一定要5min×5次。样品溶解度不佳。
出现重影
荧光强度较高,压片曝光时,胶片放好后又移动了一段距离。不要瞎动,放歪了也不要调整。(有的时候出现重新刚好在上下位置,并且重影会相对弱一些,不要误以为抗体识别了该蛋白的另外一种异构形式。)
出现非均一性背景
可能的原因是膜干了失水皱缩,所以多加点水。
某个条带变形
PAGE胶中可能存在气泡或不溶性颗粒,故配胶时要小心,使用无杂质液体。制作“三明治”时也要压紧。更换陈年老用的海绵垫。
条带哑铃型
更换更高品质的PAGE胶。
最边缘的条带弯曲
电泳电流不均一,可换用新的电泳槽,不使用两边的泳道。
蛋白质分子量过高或过低
出现原因:
- 胶配置的浓度与蛋白质分子浓度不符。
- 当然也有可能是蛋白质中碱性氨基酸过多导致SDS无法屏蔽这些正电荷,或者蛋白质中脯氨酸含量过高。
- 抗体用错了,变性不彻底出现二聚体或者多聚体;
- 蛋白修饰,蛋白剪切;
- 非特异性的蛋白强于待检测的样品。
解决方案:
用特异性高的抗体检测,变性彻底。
在主条带下方出现条带
蛋白质降解,下方产生的模糊不清的小条带是其碎片。提取蛋白的时候PMSF(苯甲基磺酰氟,蛋白酶抑制剂)多加点。
条带“╰╯”笑脸状(U 形状)
凝胶冷却不均一,电泳槽老化,在上样的时候没有吹打干净、跑胶电压过大造成拖尾。

条带“╭╮”哭脸状
凝胶的左右两头没有固定好。
溴酚蓝(前沿染料)拖尾
样品溶解度不好。
条带出现纵向纹理
上样样品中存在不溶性颗粒。
溴酚蓝占据的范围很粗
浓缩胶效果不好。
分离胶中条带无法分离
缓冲液pH不正确,或者SDS加的太少。
边缘效应
出现于胶图的两端最靠边的条带,会发现跑出来的带不是水平直线。

解决方案:
宁可将Loading buffer加到两边也不要将样品加到两边。
脏……全屏条带
出现原因:
- 一抗和/或二抗浓度过高。
- 非特异位点封闭不足。
- 使用了错误的封闭缓冲溶液。
- 洗涤不足增加洗涤次数和缓冲液用量(最少5×5分钟)。
- 曝光时间过长。
- 印迹过程中印迹膜变干。
- 缓冲液重复利用导致污染。
解决方案:

- 稀释一抗和/或二抗浓度。
- 提高封闭剂浓度,如3~5% 的牛血清蛋白、酪蛋白、脱脂牛奶.
- 降低封闭时间和/或温度。
- 向封闭缓冲溶液中加入0.05%的Tween®-20。
- 一抗和/或二抗与 封闭缓冲液中的蛋白相结合或者尝试其他封闭剂(白蛋白、酪蛋白、脱脂牛奶等)。
- 在使用亲和素-生物素系统时不要使用牛奶来封闭印迹膜,因为牛奶含有生物素。
- 增加洗涤次数和缓冲液用量(最少5×5分钟)。
- 如果洗涤液中未含有0.1%的Tween®-20,请添加。
- 减少成像曝光时间。
- 确保印迹膜保持湿润,覆盖有足够液体以防止其变干。
- 使用新制缓冲液。
脏……区域性黑屏
出现原因:
- 部分印迹膜变干。
- 洗涤缓冲液与某些印迹区域接触不足。
- 洗涤缓冲液与某些印迹区域接触不足。
- 印迹膜污染。
解决方案:
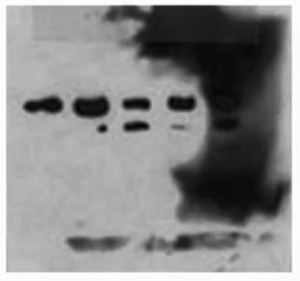
- 确保印迹膜保持湿润,一直覆盖有足够液体以防止其变干。
- 增加洗涤缓冲液用量。
- 避免过多印迹堆叠在一个孵育容器内。
- 使用干净的或新的转移三明治;请勿用手直接接触印迹膜,一直配戴清洁手套或使用医用镊子。
- 确保电泳设备、转移设备和孵育盘清洁,远离外部污染源。