用户:野狼君卡共和/实验笔记本:修订间差异
| 第8行: | 第8行: | ||
②一个孔只需要200μL,若给的药少,得在孔中反应(混匀可以拿着96孔板在桌上轻敲) | ②一个孔只需要200μL,若给的药少,得在孔中反应(混匀可以拿着96孔板在桌上轻敲) | ||
==== 3、实验设计(标题) ==== | |||
1、假设(对照、因变量、自变量) | |||
2、设备材料 | |||
3、实验步骤 | |||
4、预期结果(模糊数据说明) | |||
5、结论 | |||
=== 第一模块 === | === 第一模块 === | ||
| 第875行: | 第886行: | ||
==== <big>一、动物学实验</big> ==== | ==== <big>一、动物学实验</big> ==== | ||
===== 0、总论 ===== | |||
'''''一、分类检索''''' | |||
'''''二、无脊椎动物解剖''''' | |||
1、草履虫 | |||
2、海绵→线形动物(轮虫)<sub>(观察永久切片)</sub> | |||
3、蚯蚓、蚂蝗 | |||
4、虾(=螃蟹) | |||
5、蜘蛛 | |||
6、马陆/蜈蚣(只有一条马氏管) | |||
7、蝗虫<sub>(东亚飞蝗)</sub>、蟑螂、蜜蜂、蝴蝶、金龟子、家蚕、面包虫(黄粉虫幼虫)、蟋蟀(输卵管很长) | |||
8、田螺、河蚌、扇贝、文蛤、蛏、鲍、牡蛎、贻贝、乌贼、章鱼 | |||
9、海星、海胆 | |||
'''''三、脊椎动物解剖''''' | |||
1、骨骼:脊椎骨、头骨、鱼鳍、股骨? | |||
2、肌肉'''(鸡腿:栖肌、贯趾屈肌)''' | |||
===== Ⅰ、河蚌解剖 ===== | ===== Ⅰ、河蚌解剖 ===== | ||
| 第1,119行: | 第1,159行: | ||
'''5、排泄系统(绿腺)''' | '''5、排泄系统(绿腺)''' | ||
腺体部上有凸起(端囊),下以排泄管(白色海绵体)连接膀胱,膀胱有排泄孔。 | 腺体部上有凸起(端囊),下以排泄管(白色海绵体)连接膀胱,膀胱有排泄孔。<ref>基围虾海产,绿腺不发达</ref> | ||
'''6、神经系统''' | '''6、神经系统''' | ||
| 第1,150行: | 第1,190行: | ||
'''体分部''' | '''体分部''' | ||
'''头:''' | '''头:'''外骨骼(额、颊、头顶、后头),触角(分三节,柄梗鞭,鞭节分亚节,'''丝状'''触角),单眼(3,倒品型),复眼(肾形,小眼则成六边形),*口器(上唇<sub>防止食物外溢、夹持食物</sub>、上颚、下颚、下唇<sub>下唇须有味觉功能</sub>、舌)<ref>蝴蝶前足的第二/三跗节具有味觉功能</ref> | ||
'''胸:'''翅(革质+膜质,覆翅,翅脉/脉向),三对足(前跗:中垫+ | '''胸:'''翅(革质+膜质,覆翅,翅脉/脉向),三对足(前跗:中垫+爪;跗节分为真(3)假体节,跗节式:3/3/3)两对气门,外骨骼(背/腹/侧板,前胸背板大、侧板小) | ||
'''腹:'''分节【背板(雌雄:1~8正常,9+10愈合,11-肛上板),侧板(11-肛侧板),腹板(雌性:1~7正常,8以后愈合,并形成导卵器;雄性:1~ | '''腹:'''分节【背板(雌雄:1~8正常,9+10愈合,11-肛上板),侧板(11-肛侧板),腹板(雌性:1~7正常,8以后愈合,并形成导卵器;雄性:1~8正常,9以后愈合,并形成生殖下板),附肢(尾须/肛须,由10或11体节的附肢变来;产卵瓣),听器,八对气门,外生殖器 | ||
'''''三、内部结构''''' | '''''三、内部结构''''' | ||
| 第1,160行: | 第1,200行: | ||
'''1、呼吸系统''' | '''1、呼吸系统''' | ||
气门,气囊(气门气囊,仅储藏;内脏气囊<sub>白色</sub>,还可交换),气管(支气管制片<sub>可从马氏管中找到</sub>) | |||
'''2、循环系统''' | '''2、循环系统''' | ||
心脏('''八个心室''',每个心室旁连有'''翼状肌'''<sub>属于循环系统</sub>,'''八对心孔''',后端封闭,血液从心孔入,从前部的背大动脉流出) | |||
'''3、生殖系统''' | '''3、生殖系统''' | ||
悬系带<sub>(悬挂于第一腹节背面)</sub>——两侧附性腺——卵巢——两侧输卵管——在'''第七节'''愈合为总输卵管——通到'''第八节'''(此处还连有纳精囊,仅一个) | |||
悬系带——精巢——输精管——射精管—<sub>连有附性腺</sub>—阴茎(还连有贮精囊<sub>管状</sub>) | |||
'''4、消化系统''' | '''4、消化系统''' | ||
口、咽、食道、嗉囊、砂囊(被从后发出的6个胃盲囊<sub>向后还发出6个</sub>遮盖)、中肠(胃)、回肠、结肠、直肠 | |||
消化腺:'''胃盲囊,唾液腺'''(腺体+唾液管,在胸部,小心不要搞烂) | |||
'''5、排泄系统''' | '''5、排泄系统''' | ||
马氏管(单细胞围成,黄色,250余条,制片),脂肪体(尿酸) | |||
'''6、神经系统''' | '''6、神经系统''' | ||
脑:围咽神经、单眼神经(3)、复眼神经(2)、围食道神经(2)、上唇神经(2)、触角神经(2) | |||
围咽神经环 | |||
咽下神经(头后3,胸前3) | 咽下神经(头后3,胸前3) | ||
| 第1,195行: | 第1,235行: | ||
胸部肌肉制片 | 胸部肌肉制片 | ||
'''''四、问题扩展''''' | |||
1、请从遗传学角度分析蝗虫为什么有群居相和散居相? | |||
===== '''Ⅴ、家蚕解剖''' ===== | ===== '''Ⅴ、家蚕解剖''' ===== | ||
| 第1,312行: | 第1,356行: | ||
心脏(一心室、两心耳),心耳上的颗粒为围心腔腺。 | 心脏(一心室、两心耳),心耳上的颗粒为围心腔腺。 | ||
===== Ⅶ、蚂蝗解剖 ===== | |||
'''一、形态结构''' | |||
1、体分部:分为头部、中央部/躯干部、后部 | |||
2、外部结构: | |||
①叶片状,背面隆起,腹面平,前窄后宽 | |||
②附属结构 | |||
头部(六个体节):前吸盘(前有突起-口前叶)、眼点(10)、口躯干部:生殖环带(生殖季节出现)<sub>环带前部3个体节、环带部4个体节、环带后部11个体节(可见肾孔)</sub>、雄孔雌孔(位于环带部,各一个,前雄后雌)、 | |||
后部:后吸盘(七个体节)、肛门(肛节) | |||
3、体环:一般来说,三个体环为一个体节<sub>(看起来只有27个体节)</sub> | |||
'''二、内部结构''' | |||
1、解剖方法 | |||
2、循环系统:开管,血窦(4个) | |||
3、消化系统:口、咽、嗉囊、嗉囊盲囊*(储存,延伸形成侧盲囊)、肠、肠盲囊,蛭素 | |||
4、排泄系统:肾管(17对) | |||
5、生殖系统:精巢(11对)、<sub>(向前)</sub>输精管、储精囊、射精管、前列腺(腔)、阴茎 | |||
(在雄性生殖系统后方)卵巢、输卵管、总输卵管、蛋白腺、阴道(很硬)、雌孔 | |||
6、神经系统:<sub>去掉消化系统后,先找咽下神经,再找脑</sub> | |||
脑(咽背面)、围咽神经、咽下神经、腹神经链 | |||
'''三、问题拓展''' | |||
1、蚂蝗吸血为什么血液储存于其体内大半年而不变质?(1、体内没有蛋白质水解酶<sub>消化由细菌完成</sub>;2、蛭素;3、共生菌) | |||
2、设计实验证明蚂蝗是怎样感知人和动物而去吸血的。 | |||
=== 第四模块 === | === 第四模块 === | ||
2025年6月8日 (日) 11:27的版本
第零模块-重要提醒
1、记录结果
记得分析(偏差、原因分析/'自卖自夸'/哪怕结果反了,因为实验与结果分开算,分析好了也能拿分)
2、96孔板
①沿着长边点样
②一个孔只需要200μL,若给的药少,得在孔中反应(混匀可以拿着96孔板在桌上轻敲)
3、实验设计(标题)
1、假设(对照、因变量、自变量)
2、设备材料
3、实验步骤
4、预期结果(模糊数据说明)
5、结论
第一模块
一、细胞学实验
一、PAS反应(高碘酸-Schiff反应)
实验原理:高碘酸将多糖中的C-C键打断,生成乙二醇,并氧化为乙二醛;乙二醛与希夫试剂(无色品红)反应,产生紫红色。
实验材料:小鼠肝脏组织,酒精,水,二甲苯,高碘酸,希夫试剂,亚硫酸水
石蜡切片过程:肝脏组织块——固定(维持其状态,4%甲醛/10%福尔马林)——梯度酒精脱水(70%-80%-90%-95%-无水乙醇)——透明(二甲苯)——浸蜡——包埋成蜡块——切片(石蜡切片机,2~4μm)——展片-捞片-烤干——///脱蜡(二甲苯)——梯度酒精复水(100%-95%-75%-纯水)——染色(PAS试剂)——梯度酒精脱水——封片(含有二甲苯的中性树胶)——晾片(2~3天)——永久切片
实验步骤(上述'///'后):
1、从烤箱中取出切片,趁热(石蜡成液态,效率高)放入二甲苯中,静置10min。
2、用铅笔写名字(***区分正反),依次投入无水乙醇(3min)、95%乙醇(3min)、75%乙醇(3min)、清水(1min)
3、用吸水纸将组织周围的水轻轻擦干;用滴管向组织上滴加高碘酸(完全没过组织),氧化10min
4、将切片投入75%乙醇片刻(洗净高碘酸),吸干
5、滴加希夫试剂,避光静置15~30min
6、向组织上滴加亚硫酸水,漂洗(1次30秒,漂洗2~3次)
7、梯度酒精脱水:75%乙醇(2min)、95%乙醇(2min)、无水乙醇(2min),然后充分晾干
8、封片
PS:偏重亚硫酸钠+酸+碱性品红生成无色品红,再加入活性炭震荡,过滤,即可生成遇醛变红的希夫试剂。
捎带一些理论知识:
肝动脉与肝门静脉汇合通入肝静脉;肝内胆管收集肝细胞分泌的胆汁通入总胆管,后运至胆囊。
猪肝的肝小叶明显,呈现六边形;小鼠与人的则不明显。
二、福尔根反应
原理:DNA经过1mol/L的HCl水解,嘌呤碱与脱氧核糖之间的共价键被打断,露出C1的醛基,再与希夫试剂反应。(1mol/L盐酸不会氧化多糖,也不会水解RNA,避免多糖和RNA的影响)

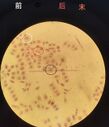
材料:根尖,1mol/LHCl,希夫试剂,清水
步骤:
1、取3~5个根尖,轻轻擦干(防止盐酸稀释),放入装有1mol/L HCl
的EP管中(60度10min)
2、吸干EP管中的盐酸,加入清水漂洗3次,一次30s
3、将根尖移入希夫试剂中,避光染色15~20min
4、根尖被染为紫红色,取出根尖,用刀片切下最前端(米粒大小)
5、在载玻片上滴加一滴清水,放上根尖,盖上载玻片,用枪尖/镊子钝头轻轻敲击(均匀)
6、压片:盖上一张吸水纸,用拇指用力下压
7、镜下观察(间、前、中、末)
注意:挑根时注意要带有根尖;不要用镊子夹根尖。
三、Brachet反应

原理:甲基绿-吡咯红为碱性染料,合成Unna试剂,其中甲基绿易与聚合程度高的DNA结合呈现蓝绿色,吡咯红(派洛宁)易与聚合程度低的RNA结合呈现红色。

步骤:
1、蛙——双毁髓——打开胸腔——蛙心取血——抗凝
2、涂片:①在一个载玻片上滴上血②斜着另一个载玻片(在45度角之下)涂片③自然晾干
(注意:载玻片干净;血量适中;血滴在45度角之下;匀速)
3、固定:95%乙醇固定5分钟
4、漂洗——轻轻晾干、擦干——滴加unna染液(保持染料不干),染色15min
5、漂洗——加入丙酮,2s——晾干
6、镜检
四、细胞死活鉴定
试剂:
通透性差异:台盼蓝、伊红、苯胺黑、赤藓红、PI、EB等(死细胞着色)
代谢差异:荧光二乙/丙/丁酸酯等(活细胞着色)/亚甲基蓝(死细胞着色,活细胞会将其还原为无色状态)
二、分子实验
Ⅰ、质粒的碱裂解提取
1、原理:gRNA在碱性下完全变性/质粒DNA在碱性下不完全变性;在中性条件下gDNA不复性(沉淀),质粒DNA复性(溶解),可以通过离心分离。
2、实验步骤:
①大肠杆菌LB培养液摇床过夜。
②取1.5ml菌液于EP管中,12000转速离心2min收集菌体,弃尽培养液
③在沉淀中加入250μLBuffer P1,彻底悬浮菌体(移液枪抽吸)
④加入350μLBuffer P2,立即温和颠倒离心管5~10次,静置2~4min
⑤加入350μLBuffer P3,立即温和颠倒离心管5~10次
⑥12000转速离心10分钟。将上清液移入吸附柱,12000转速离心30秒,倒掉收集管中液体
⑦(选做)加入500μLBuffer DW1,9000转速离心30秒,倒掉收集管中液体(DW1试剂可以去除多余的蛋白质,一般实验不用)
⑧加入500μLWash Solution,12000转速离心30秒,倒掉收集管中液体
⑨重复步骤8一次
⑩空吸附柱于12000转速离心1分钟
十①将吸附柱放入一个干净的1.5mL离心管中,在吸附膜中央加入50μLElution Buffer,室温静置1分钟后,离心1分钟。保存管中DNA溶液。(可以加入EDTA螯合镁离子制成TE缓冲液,避免环境中的DNase)
PS:
1、只有在抗生素压力之下才能迫使细菌保留质粒,否则都丢失了。
2、对数后期最适合进行实验或者保留'种子'。
3、硅胶在高盐低pH环境下吸附RNA,反过来释放。
4、6×Roding Buffer 意味着需要一份Roding Buffer /五份样品。
5、Roding Buffer:①助沉剂(蔗糖/甘油)②指示剂(溴酚蓝100~200bp;二甲苯氢2000bp)③缓冲
| 成分 | 作用 | 现象 | 注意事项 | |
|---|---|---|---|---|
| S1(P1) | Tris-HCl
Glc |
重悬沉淀
(LB中杂质多) |
浑浊菌液 | 充分混匀(防止出现菌块) |
| S2(P2) | SDS+NaOH | 1、裂解菌体
2、变性蛋白质 3、完全变性gDNA 4、不完全变性质粒DNA |
菌液变澄清 | 1、充分混匀
2、轻柔操作(防止打断DNA) |
| S3(P3) | HAc+KAc的缓冲液 | 1、复性
2、形成K-SDS-蛋白质沉淀 |
大量白色沉淀 | 同上 |
Ⅱ、电泳
区分:自由电泳(直接在水中);区带电泳(在支持物中进行)
电渗现象(会导致分辨率降低,纸层析/纤维素层析电渗强,琼脂糖/PAGE电渗弱)
(PS:之所以不用琼脂粉是因为其中除了琼脂糖还含有琼脂酸,其电渗强)
1、琼脂糖凝胶电泳(溴酚蓝跑一半即可)
制备:琼脂糖+TBE(硼酸)/TAE(醋酸)/TPE(磷酸,会干扰后续实验,一般不用了)Buffer,加热后冷却成胶
缓冲液:用什么缓冲液就用什么跑胶
Roding Buffer:助沉剂/指示剂/Tris-HCl(pH=8,使DNA带负电)
染色:可用EB等
2、聚丙烯酰胺凝胶电泳(溴酚蓝跑到底)
制备:单体-丙烯酰胺,交联剂-Bis,催化剂-过硫酸铵Aps,加速剂-TEMED
混合:将上述试剂混合溶于Tris-HCl中(pH6.7-浓缩胶/pH8.9-分离胶)
缓冲液:Tris-Gly(pH=8.3)
Roding Buffer:在琼脂糖凝胶电泳Roding Buffer的基础上加入SDS、DTT、β-巯基乙醇
染色:DNA-银染/蛋白质-银染 或 考马斯亮蓝染(R250)
电荷效应、分子筛效应
Ⅲ、PCR
1、体系:①模板:dsDNA/ssDNA,不用RNA(AMV或者MMLV)
②4种dNTP
③引物:注意设计原则**
④Taq酶和Pfu酶
⑤Buffer+镁离子
2、体系配置操作与注意事项:
①冰上操作
②不要少加、漏加(1μL注射时注意)
③顺序:水和Buffer(镁离子)——四种dNTP、模板、引物——Taq酶
④混匀:迷你离心机
举例:
2×PCR mix——25μL
上引——2μL
下引——2μL
模板——1μL
3dw——20μL
总的——50μL
3、反应条件
①94度——5min——变性
②94度——30s——变性
③55度——30s——退火(引物Tm-5,上下引物Tm相差不大)
④72度——t=s/v(稍长)——延伸
⑤72度——5min——终延伸
循环:②~⑤循环30~35次(RT-qPCR一般在40次以上)
PS:菌落PCR、等温环介导PCR
三、生化实验
Ⅰ、还原糖的测定
滴定法:次甲基蓝、碘量法(主要用于Glc,因为氧化性弱无法氧化酮糖)/斐林试剂(所有还原糖)

比色法:蒽酮试剂、DNS试剂(所有还原糖)
滴定法更准确,但比色法*更便捷。(搞清各种方法的优劣)
1、DNS法
原理:
实验过程:
①标准曲线的制作【平行实验(至少两套)***】:
1)取5支试管按下表配置不同浓度的葡萄糖标准溶液。(初液浓度1000μg/mL葡萄糖)
| 管号 | 1000μg/mL葡萄糖(mL) | 水(mL) | 葡萄糖终浓度(μg/mL) |
|---|---|---|---|
| 1 | 1 | 9 | 100 |
| 2 | 2 | 8 | 200 |
| 3 | 3 | 7 | 300 |
| 4 | 4 | 6 | 400 |
| 5 | 5 | 5 | 500 |
2)另取6个试管按下表加入各种溶液
| 管号 | 水 | 100μg/mL | 200μg/mL | 300μg/mL | 400μg/mL | 500μg/mL | DNS |
|---|---|---|---|---|---|---|---|
| 1 | 0.5mL | 0.5mL | |||||
| 2 | 0.5mL | 0.5mL | |||||
| 3 | 0.5mL | 0.5mL | |||||
| 4 | 0.5mL | 0.5mL | |||||
| 5 | 0.5mL | 0.5mL | |||||
| 6 | 0.5mL | 0.5mL |
3)混匀后沸水浴加热5min,取出冷却,加入4mL水混匀,以1号管作为空白调零,测定其OD540
4)以葡萄糖含量(μg)为横坐标,光密度值为纵坐标作标准曲线
②淀粉中还原糖的鉴定:
1)称取淀粉1克放入烧杯中,先用少量水调成糊状*(如果加大量很难搅匀)
2)再加50~60mL水摇匀,50度保温20min,使还原糖浸出,定容至100mL
3)过滤(一部分就好)
4)取滤液0.5mL测定还原糖,方法与标准曲线制作相同(空白不要忘了再做一次)
5)根据OD值在标准曲线上查出还原糖含量
③测总糖
将淀粉完全水解(酸/碱水解,沸水浴加热30m)
注意事项:
①平行实验(同时)
②用酒精浸泡比色皿让其保持无色,再用水冲洗(不挂水珠)
③用一个比色皿,减少系统误差
④一定从低浓度到高浓度(高浓度颜色深),做完低浓度的可以用高浓度溶液冲洗
Ⅱ、酶的测定
酶活测定方法:比色法(加或不加显色剂,POD是后者)、紫外法(还原型辅酶Ⅰ/Ⅱ在340nm处有吸收,黄素脱氢酶不行)、比浊法(溶菌酶,使得溶液逐渐变澄清)PS:比浊法用缓冲液和加底物不加酶的溶液进行调零。
1、唾液淀粉酶的活力测定以及Km的测定
原理:碘与淀粉作用呈蓝色,蓝色在600nm处为最大吸收值,颜色的深浅与淀粉浓度成正比。唾液淀粉酶可以将淀粉水解为不与碘呈色的寡糖。单位时间内此酶水解淀粉的量与酶的活性成正相关。
操作步骤:
①标准曲线的制作
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| 0.4g/100mL淀粉液μL | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| 0.01M碘液mL | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
| 水mL | 2.9 | 2.88 | 2.86 | 2.84 | 2.82 | 2.80 | 2.78 |
| 50mM pH6.8 磷酸缓冲液mL | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
混合均匀后,以1号试管作对照测定600nm的吸收值,以淀粉的μg数为横坐标,以OD600为纵坐标作图。
②酶促反应初速度范围(产物与时间成正比)的测定
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| 1g/100mL淀粉液μL | 0 | 150 | 150 | 150 | 150 | 150 | 150 | 150 |
| 水mL | 2.4 | 2.25 | 2.25 | 2.25 | 2.25 | 2.25 | 2.25 | 2.25 |
| 缓冲液mL | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 酶液mL | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 每支试管加酶混合均匀37度保温,2~8号试管保温时间分别为1~7分钟。
每支试管保温后取出,立即加碘液(钝化淀粉酶)。 | ||||||||
| 碘液mL | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
混合均匀后,以1号试管为对照测定600nm的吸收值。根据OD值在标准曲线上查出淀粉的量,由加入淀粉的总量减去查出淀粉的量即为水解的淀粉量,以反应时间为横坐标,以淀粉的水解量为纵坐标作图,找出初速度范围。
③酶的活力测定
| 管号 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| 1g/100mL淀粉液μL | 0 | 200 | 200 | 200 |
| 水mL | 2.4 | 2.2 | 2.2 | 2.2 |
| 缓冲液mL | 1 | 1 | 1 | 1 |
| 酶液mL | 0.5 | 0.5 | 0.5 | 0.5 |
| 混合均匀后37度保温X分钟(根据初速度范围),取出,立即加碘液 | ||||
| 碘液mL | 0.1 | 0.1 | 0.1 | 0.1 |
混合均匀后,以1号试管为对照测定600nm的吸收值。根据OD值在标准曲线上查出淀粉的量,由加入淀粉的总量减去查出淀粉的量即为水解的淀粉量,求出酶的活力单位数(每分钟水解1μg所需要的酶量为一个活性单位)。
④Km的测定
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| 1g/100mL淀粉液μL | 0 | 75 | 100 | 125 | 150 | 175 | 200 |
| 水mL | 2.4 | 2.325 | 2.3 | 2.275 | 2.25 | 2.225 | 2.2 |
| 缓冲液mL | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 酶液mL | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 混合均匀后37度保温X分钟(根据初速度范围),取出,立即加碘液 | |||||||
| 碘液mL | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
混合均匀后,以1号试管为对照测定600nm的吸收值。根据OD值在标准曲线上查出淀粉的量,由加入淀粉的总量减去查出淀粉的量即为水解的淀粉量,以1/[S]为横坐标,以1/[酶水解的淀粉量]为纵坐标作图,求出Km。
注意事项:
①配置酶液需要放在冰里
②先做不需要酶的实验,酶最好现配现用
③酶活性需要调节(1:XX)
③*一定要记得中止酶促反应
④*控制时间
2、最大吸收峰的测定(以防险恶的出题老师)
①取第一管和中间管(3、4、5)
②以第一管为对照测定在420~700nm(每次间隔20nm)的OD值
Ⅲ、蛋白质浓度测定
方法:双缩脲法、考马斯亮蓝法(μg级,非化学反应,稳定性较差,且受pH影响)、紫外法(最简单)、Lowry/福林酚法(μg级,最好)、凯氏定氮法(前四种要求无色溶液,但最后一种会受到其他含氮物质的干扰)
1、双缩脲法
原理:无需多言。紫红色络合物最大吸收峰在540nm,稳定性好,灵敏度差1~10mg。
步骤:
①标准曲线的制定
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| 标准蛋白质/mL | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
| 水/mL | 1.0 | 0.8 | 0.6 | 0.4 | 0.2 | 0 |
| 双缩脲试剂/mL | 4 | 4 | 4 | 4 | 4 | 4 |
充分摇匀后,恒温水浴25度(其实跟室温差不多,也不用水浴了)保温30min,以1号试管作对照调零测定其他试管540nm处的吸收值。取两组测定的平均值,以蛋白质含量作横坐标,吸收值作纵坐标绘制标准曲线。
②取两支试管各加入未知浓度蛋白液1mL,加入双缩脲试剂4mL 25度保温30min,测定540nm吸收值,通过此吸收值在标准曲线上查出样品中蛋白质的含量。
2、考马斯亮蓝法(G250-测蛋白质/R250-电泳染色)**
原理:考马斯亮蓝G250染料。在酸性溶液中与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基结合。考马斯亮蓝G250溶液颜色为棕黑色,λmax=465nm,蛋白质-染料复合物为蓝色,λmax=595nm.颜色深浅与蛋白质的量成正比,通过测定A595吸光值可知与其结合的蛋白的量。
考马斯亮蓝法测定蛋白质浓度,是一种微量方法。此法快速、灵敏、优点突出,因而得到广泛应用。考马斯亮蓝法是目前灵敏度最高的蛋白质定量方法之一。但稳定性较差。除了pH影响外,有一些物质干扰此法的测定,主要干扰物质有:去污剂、Triton X-100、SDS等。
步骤:
①蛋白质浓度标准曲线制作
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| 标准蛋白质/mL | 0 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 | 0.12 |
| 0.9%NaCl/mL | 1.00 | 0.98 | 0.96 | 0.94 | 0.92 | 0.90 | 0.88 |
| 考马斯亮蓝/mL | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 |
| A595 |
混匀,室温静置3min,以第一管为空白,于波长595nm处比色,测定吸光值。以蛋白质浓度为横坐标,A595吸收值为纵坐标作图。
PS:加入食盐的主要目的是为了提高染色效果和染色的稳定性。
②样品蛋白质浓度测定
取两支试管,分别加入蛋清稀释液1.0mL以及考马斯亮蓝染液4.0mL,混匀,室温静置3min。,于波长595处比色,读取吸光值。
第二模块
一、植物学实验
Ⅰ、实验基本操作
一、显微镜的使用
无他,记一下科勒照明。
二、制片技术
切片(洋葱鳞片叶)、涂片(番茄果肉)、刮片(辣椒表皮,观察初生纹孔场)
(PS:洋葱外表皮有紫色液泡,内表皮液泡无色;若要观察胞间连丝,可使用柿胚乳)
三、徒手切片
注意事项:①横切时记得使用双面刀片,单面刀片太厚了。②多切一些,以量取胜。③无他,唯手熟尔。
四、植物组织观察
1、保护组织
2、同化组织
黑藻(ps:黑藻是单子叶植物,水鳖科),还可以观察到胞质环流
3、疏导组织
黄豆芽(纵切),不用绿豆芽(输导组织不发达),番红染色(间苯三酚染木质素特异性更强,但需要高氢离子浓度)
4、机械组织
厚角组织(**芹菜的茎,徒手切片,位于维管束外侧,中间隔了一些薄壁组织),石细胞(梨的果实,涂片,番红染色)
5、分泌组织
分泌道、分泌腔【裂生型、溶生型、裂溶生型(**柑橘皮徒手切片)】(PS:裂生型周围细胞完整,溶生型不完整)
五、植物内含物观察(染料)
1、淀粉
玉米胚乳(碘液,淀粉粒被染为黑蓝色)
2、蛋白质
**小麦糊粉层(碘液,糊粉粒被染为黄色)
3、油类
花生(苏丹系列染料,油滴特异性染为橘红色)
4、结晶
菠萝细胞液(无需细胞结构/无需染色,直接可以观察到草酸钙针状结晶)
Ⅱ、植物营养器官切片”鉴赏“
[1]切片
Ⅲ、植物检索表的使用与制作
Ⅳ、植物繁殖器官解剖
一、花图式
*花被卷叠式的判断需要使用花蕾。
二、花程式
三、各种代表性植物花的解剖
1、木兰类
木兰科-含笑属-白兰
2、单子叶植物
六出花科-六出花
兰科-石斛
禾本科-小麦
3、(蔷薇超群)锦葵类
十字花科-豆瓣菜
4、(蔷薇超群)豆类
蔷薇科-粉花绣线菊
5、(菊类超群)石竹,示特立中央胎座
6、(菊类超群)唇形类
木樨科-女贞
7、(菊类超群)桔梗类
菊科-向日葵
第三模块
一、动物学实验
0、总论
一、分类检索
二、无脊椎动物解剖
1、草履虫
2、海绵→线形动物(轮虫)(观察永久切片)
3、蚯蚓、蚂蝗
4、虾(=螃蟹)
5、蜘蛛
6、马陆/蜈蚣(只有一条马氏管)
7、蝗虫(东亚飞蝗)、蟑螂、蜜蜂、蝴蝶、金龟子、家蚕、面包虫(黄粉虫幼虫)、蟋蟀(输卵管很长)
8、田螺、河蚌、扇贝、文蛤、蛏、鲍、牡蛎、贻贝、乌贼、章鱼
9、海星、海胆
三、脊椎动物解剖
1、骨骼:脊椎骨、头骨、鱼鳍、股骨?
2、肌肉(鸡腿:栖肌、贯趾屈肌)
Ⅰ、河蚌解剖
一、分类,检索,种
注意平时常见的解剖对象大概率是皱纹冠蚌而非无齿蚌(本人经验)
二、外形结构
1、贝壳位置区分(前后、背腹、左右)
2、测量(清华年喜欢考测量):壳长、壳宽(壳高)、壳厚
3、贝壳外部形态(注意看要求去的是哪个壳)
①壳顶②韧带(有内外之分,扇贝是内韧带,河蚌和文蛤是外韧带)③生长线(不完全可以显示年龄)
4、贝壳内部形态
①壳顶②韧带③铰合部(无齿蚌无前/后侧齿,冠蚌有;无中央齿,文蛤有)
5、肌肉痕迹:前后闭壳肌、前后缩足肌、前伸足肌、外套膜原肌(外套线)、水管肌(外套窦)
PS:绘制左壳时一定要北部朝上(前部在右)
三、内部解剖结构(体分部:头部(不明显)、足部、内脏团、外套膜、外套腔)建议解剖时按一下顺序观察
1、外套膜(出入水管/孔,出背入腹),外套膜与内脏团/两个外套膜之间的空隙形成外套腔。
2、肌肉系统(见上)
3、呼吸系统(两对瓣鳃其中外瓣鳃在雌性中变为育儿囊,鳃小体、鳃丝、鳃小腔)PS:牡蛎和扇贝仅一对瓣鳃
4、循环系统
围心腔膜、围心腔、心脏(一心室两心耳)
动脉管:前/后大动脉(后大动脉向下走)
补充:心跳实验——加兴奋剂(升温)/抑制剂(降温/酒精),观察河蚌心跳变化
5、排泄系统
围心腔腺(即凯伯尔氏器,两个,咖啡色,在心脏前)肾脏(即鲍牙氏器,肾口从围心腔腺通到肾小体、肾小体、膀胱返回、肾孔→外套腔)
PS:肾孔紧靠生殖孔,大而光滑的是肾孔
6、神经系统
脑神经节(两个,位于三肌之间)脏神经节(位于后闭壳肌肌肉柱上)足神经节(两个或愈合为一个,位于足与内脏团相接处)
PS:建议先看口、咽、食胃,再看足神经节。
7、消化系统
(两对)唇瓣(切忌不要弄掉了)、口、咽、食道、胃(从此开始都是单层细胞)晶杆(搅拌、分泌消化物质、有或无)、胰脏、肝脏(中肠突出形成,中肠腺)、肠(盘曲于足内)、直肠(穿过心室)、肛门(后闭壳肌顶)
8、生殖系统:生殖腺,雄白雌黄,内脏团内除消化系统外大部分
四、问题扩展
请以现有条件设计实验证明河蚌的摄食方法和食性以及在生产上的影响。(提示:可以利用食物残渣)
补充
标注结构时,可用一张三角形小纸片写上数字,插入相关结构,再在纸上标注。
Ⅱ、文蛤解剖(主要是记住与河蚌的不同点)
1、文蛤的壳顶前为小月面,后为盾面。
2、有中央齿,三枚;左壳前侧齿一枚,右壳两枚。
3、肌肉痕迹中,前缩足肌在前闭壳肌上方。
4、50度温水可以使文蛤开壳。
5、其后端愈合为出入水管。
6、围心腔腺在心耳上。
7、肾脏在围心腔外。(河蚌在内)
8、神经节红色容易观察。(脑神经节移至前闭壳肌背上方)
9、晶杆更容易被观察到。
10、文蛤穴居。
Ⅲ、克氏原鳌虾解剖
一、分类、检索、种
二、外形结构
1、分部:头(6)胸(8)部、腹(7)部(因为头部第一体节和腹部最后一·体节无附肢,故附肢数只有19)
2、各部分附属物(不包括附肢)
①头胸部:头胸甲:额剑(鳌虾上下扁平/对虾则左右扁平),有齿,可作为分类标准;鳃盖(有刺,胃刺、肝刺);颈沟
柄眼:复眼(切片观察形状),测量——小眼(方形)/复眼的面积、小眼的数目
②腹部:外骨骼:背板/侧板(肋片、排骨)/腹板
注意雌雄的区别
③体表开孔:雌雄均有:绿腺孔(大触角基部),肛门,口
雌性特有:雌孔(第三步足基部一对),纳精囊孔(第四、五对步足之间)
雄性特有:雄孔(第五步足基部一对)
3、(建议从后往前解剖)
| 名称 | 类型 | 原肢节数 | 功能 |
|---|---|---|---|
| 小触角 | 单(只有内肢) | 3 | 感觉、平衡(有平衡囊)、触觉 |
| 大触角 | 双 | 2 | 感觉、触觉 |
| 大颚 | 单(内肢形成大颚须[1]) | / | 嚼食 |
| 第一小颚 | 单 | 2 | 摄食、感觉 |
| 第二小颚(颚舟片) | 双,自此往下均为双肢型 | 2 | 摄食、辅助呼吸 |
| 第一颚足 | 1 | 摄食、感觉、呼吸 | |
| 第二颚足 | 2 | 摄食、感觉 | |
| 第三颚足 | 2 | 摄食、感觉 | |
| 第一步足 | (前三对步足成鳌状) | 2,自此往下均为2 | 取食 |
| 二 | 取食、攻击 | ||
| 三、四、五 | 步行 | ||
| 第一腹足(雌性退化,只剩一肢) | 游泳,辅助生殖 | ||
| 二~五 | 游泳,辅助生殖 | ||
| 六(尾肢) | 与尾节结合组成尾扇 | ||
| 雄性第一、二对腹足 | 交接肢,辅助输精 |
ps:步足分为底节、基节、座节、长节、腕节、掌节、指节
三、内部结构
1、原始种类胸部8个体节各四对鳃(一对足鳃、两对关节鳃、一对侧鳃)
| 鳃的类型 | 鳌虾 | 对虾、基围虾 | 沼虾 |
|---|---|---|---|
| 侧鳃 | 0 | 6 | 6 |
| 足鳃 | 6(第二颚足到第四步足) | 6 | 1 |
| 关节鳃 | 11(第二颚足一对,第三颚足到第四步足两对) | 12 | 1 |
| 肢鳃(驱动水流) | 1(第一颚足基部) | 2(第一、二颚足基部) | 3 |
2、循环系统
组成:心脏(无心耳,马鞍形对虾等为三角形)-心孔三对-动脉管7条(咽动脉1/触角动脉2/肝动脉2/腹上动脉1/胸直动脉1)
3、生殖系统
呈现H型,颜色越深,发育越成熟
4、消化系统
口、咽、食道、胃、中肠(肝,黄色)、后肠、肛门
胃磨(三个硬质突起,属于贲门胃)与过滤器(隔板和刚毛,属于幽门胃)
胼胝体(研磨食物??)
5、排泄系统(绿腺)
腺体部上有凸起(端囊),下以排泄管(白色海绵体)连接膀胱,膀胱有排泄孔。[2]
6、神经系统
脑神经(三对:视神经、围食道神经、上唇神经)
围咽神经环
咽下神经(头部后三对神经节(口器)和胸部前三对神经节(足)愈合形成)
腹神经(胸5腹6)
7、肌肉系统
制片(成束横纹肌)
四、问题扩展
1、以现有条件设计实验证明克氏原鳌虾的食性。
2、虾和蝗虫在生活史上最大的区分。(虾成体仍然蜕皮)
3、虾和蝗虫中枢神经系统的区别。(虾两个神经节之间的神经索愈合)
Ⅲ、蝗虫解剖
一、分类、检索、种(棉蝗/大青蝗)
二、外形结构
体分部
头:外骨骼(额、颊、头顶、后头),触角(分三节,柄梗鞭,鞭节分亚节,丝状触角),单眼(3,倒品型),复眼(肾形,小眼则成六边形),*口器(上唇防止食物外溢、夹持食物、上颚、下颚、下唇下唇须有味觉功能、舌)[3]
胸:翅(革质+膜质,覆翅,翅脉/脉向),三对足(前跗:中垫+爪;跗节分为真(3)假体节,跗节式:3/3/3)两对气门,外骨骼(背/腹/侧板,前胸背板大、侧板小)
腹:分节【背板(雌雄:1~8正常,9+10愈合,11-肛上板),侧板(11-肛侧板),腹板(雌性:1~7正常,8以后愈合,并形成导卵器;雄性:1~8正常,9以后愈合,并形成生殖下板),附肢(尾须/肛须,由10或11体节的附肢变来;产卵瓣),听器,八对气门,外生殖器
三、内部结构
1、呼吸系统
气门,气囊(气门气囊,仅储藏;内脏气囊白色,还可交换),气管(支气管制片可从马氏管中找到)
2、循环系统
心脏(八个心室,每个心室旁连有翼状肌属于循环系统,八对心孔,后端封闭,血液从心孔入,从前部的背大动脉流出)
3、生殖系统
悬系带(悬挂于第一腹节背面)——两侧附性腺——卵巢——两侧输卵管——在第七节愈合为总输卵管——通到第八节(此处还连有纳精囊,仅一个)
悬系带——精巢——输精管——射精管—连有附性腺—阴茎(还连有贮精囊管状)
4、消化系统
口、咽、食道、嗉囊、砂囊(被从后发出的6个胃盲囊向后还发出6个遮盖)、中肠(胃)、回肠、结肠、直肠
消化腺:胃盲囊,唾液腺(腺体+唾液管,在胸部,小心不要搞烂)
5、排泄系统
马氏管(单细胞围成,黄色,250余条,制片),脂肪体(尿酸)
6、神经系统
脑:围咽神经、单眼神经(3)、复眼神经(2)、围食道神经(2)、上唇神经(2)、触角神经(2)
围咽神经环
咽下神经(头后3,胸前3)
腹神经:胸3腹5(不包括咽下神经)
7、肌肉系统
胸部肌肉制片
四、问题扩展
1、请从遗传学角度分析蝗虫为什么有群居相和散居相?
Ⅴ、家蚕解剖
一、分类、检索、科
二、外形结构
体分部
头:触角一对(短小,分三节,丝/刚毛状),口器(咀嚼式,下唇由吐丝孔),外骨骼(头部有Y形蜕裂缝),单眼(6对,侧单眼)
胸:气门一对,胸足三对(分节,具爪)
腹:气门八对,腹足五对(最后一对称为臀足,不分节,具钩列,被称为伪足),雌性臀足前有四孔,雄性仅两孔
三、内部结构
1、循环系统
心脏:直管状(背/肠壁上,通过从侧部解剖可以观察到)
2、呼吸系统
气门、支气管(制片)呈现辐射状
3、消化系统(背部解剖时小心)
口、咽、食道、肠(中肠+回/结/直肠)
无消化腺,特化为丝腺
4、丝腺系统
(从前往后)口器——射丝部—分叉—输送部?——贮泌部——泌丝部
5、排泄系统
马氏管(在回肠前,两个各分三支),脂肪体(白色,不是蝗虫的黄色)
6、生殖系统
生殖芽球
7、神经系统
口球神经(很小)——一对脑神经节——咽下神经节——围食道神经——腹神经(胸5腹6)
包括脑神经节、咽下神经节、腹神经在内,一共13对神经节
Ⅵ、扇贝解剖
一、分类、检索、种
二、外形结构
1、贝壳外观
位置区分(前后前后壳顶突起,前耳长/后耳短、背腹、左右)
壳顶、生长线(海产、区分度不大)
2、贝壳内面(去左壳)
铰合线
三、内部结构
1、外套膜/腔
膜:外层,背贴壳;中层:触手、外套膜眼、纤毛;内层:触手(短)
无出入水管(触手控制)
2、肌肉系统
足肌、外套膜原肌、闭壳肌(只有后,绝大部分是横纹肌,右上少部分为平滑肌)、缩足肌(后)
足丝(非肌肉,附着)
3、呼吸系统
鳃:假瓣鳃,无育儿囊(无钩介幼虫)
4、生殖系统
雌:黄/红,月牙形,有肠穿过
雄:白,月牙形,有肠穿过
有雌雄同体
5、排泄系统
肾脏:月牙形(位于生殖腺与闭壳肌之间)
围心腔腺
6、神经系统
脑神经节与足神经节(各两个),位于足与口唇之间
脏神经节(一个),四方形,位于后部生殖腺下方
PS:若生殖腺发达,脑神经节被挤入肝脏
7、消化系统
口唇、口、咽、食道、胃/肝脏、肠、直肠(穿过心室)、肛门
肠穿过生殖腺,分为下行肠和上行肠
消化腺:肝脏、晶杆
8、循环系统
心脏(一心室、两心耳),心耳上的颗粒为围心腔腺。
Ⅶ、蚂蝗解剖
一、形态结构
1、体分部:分为头部、中央部/躯干部、后部
2、外部结构:
①叶片状,背面隆起,腹面平,前窄后宽
②附属结构
头部(六个体节):前吸盘(前有突起-口前叶)、眼点(10)、口躯干部:生殖环带(生殖季节出现)环带前部3个体节、环带部4个体节、环带后部11个体节(可见肾孔)、雄孔雌孔(位于环带部,各一个,前雄后雌)、
后部:后吸盘(七个体节)、肛门(肛节)
3、体环:一般来说,三个体环为一个体节(看起来只有27个体节)
二、内部结构
1、解剖方法
2、循环系统:开管,血窦(4个)
3、消化系统:口、咽、嗉囊、嗉囊盲囊*(储存,延伸形成侧盲囊)、肠、肠盲囊,蛭素
4、排泄系统:肾管(17对)
5、生殖系统:精巢(11对)、(向前)输精管、储精囊、射精管、前列腺(腔)、阴茎
(在雄性生殖系统后方)卵巢、输卵管、总输卵管、蛋白腺、阴道(很硬)、雌孔
6、神经系统:去掉消化系统后,先找咽下神经,再找脑
脑(咽背面)、围咽神经、咽下神经、腹神经链
三、问题拓展
1、蚂蝗吸血为什么血液储存于其体内大半年而不变质?(1、体内没有蛋白质水解酶消化由细菌完成;2、蛭素;3、共生菌)
2、设计实验证明蚂蝗是怎样感知人和动物而去吸血的。
