第17行:
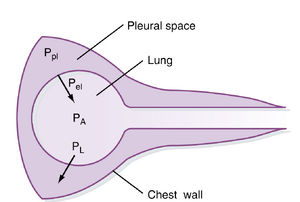
第17行: 此外,根据惯例,跨越肺或胸壁等表面的压力被定义为表面内部压力与外部压力之差。跨越肺和胸壁的压力差被称为跨壁压(transmural pressure,即跨越壁或表面的压力)。对于肺而言,这种跨壁压称为跨肺压(transpulmonary pressure或translung pressure,PL),其定义为气腔(肺泡压[alveolar pressure,PA])与肺周围压力(胸膜压[pleural pressure,Ppl])之差:
此外,根据惯例,跨越肺或胸壁等表面的压力被定义为表面内部压力与外部压力之差。跨越肺和胸壁的压力差被称为跨壁压(transmural pressure,即跨越壁或表面的压力)。对于肺而言,这种跨壁压称为跨肺压(transpulmonary pressure或translung pressure,PL),其定义为气腔(肺泡压[alveolar pressure,PA])与肺周围压力(胸膜压[pleural pressure,Ppl])之差:
公式 21.1:PL=PA-Ppl
''' 公式 21.1:PL=PA-Ppl'''
跨越胸壁的跨壁压(Pw)是胸膜压(内部压力,Ppl)与胸壁周围压力(Pb,即大气压或体表外部压力)之差:
跨越胸壁的跨壁压(Pw)是胸膜压(内部压力,Ppl)与胸壁周围压力(Pb,即大气压或体表外部压力)之差:
公式 21.2
''' 公式 21.2:Pw=Ppl-Pb'''
呼吸系统的跨壁压(Prs)是肺的跨壁压与胸壁的跨壁压之和:
<nowiki>{\mathrm{P}}_{\mathrm{w}}={\mathrm{P}}_{\mathrm{pl}}-{\mathrm{P}}_{\mathrm{b}}</nowiki>
'''公式 21.3:Prs =PL+Pw=(PA-Ppl)+(Ppl-Pb)=PA -Pb'''
== 压力梯度如何形成 ==
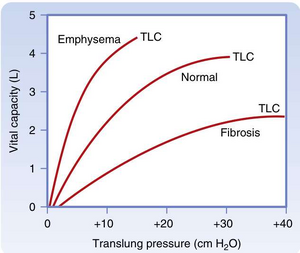
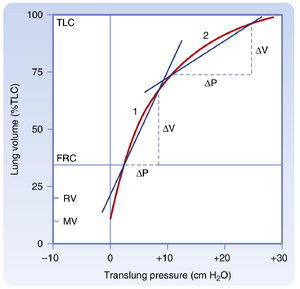
[[文件:BL-21.1.png|缩略图|• 图21.1 正常与疾病状态下肺容积随跨肺压(transpulmonary pressure)变化的关系。跨肺压增大时,肺容积随之增加。图中同时显示了肺气肿(emphysema)和肺纤维化(pulmonary fibrosis)对肺容积的影响。需注意,在相同跨肺压变化下,这两种疾病导致的肺容积改变存在差异。TLC(总肺容量)指肺内气体总体积。]]
空气从高压区域流向低压区域,从而进出肺部。若无压力梯度,则无气流。因此,在吸气末和呼气末(无气流的时间段),肺泡压(PA)与大气压(Pb)相等,此时无压力梯度(Pb-PA=0)。然而,此时的胸膜压并非0。在吸气开始前,正常个体的胸膜压约为−3至−5 cm H₂O。因此,胸膜腔内的压力相对于大气压为负压。这种负压由肺的内向弹性回缩压(inward elastic recoil pressure)产生,其作用是“将肺拉离”胸壁。然而,由于肺与胸壁作为整体协同运动,肺无法真正脱离胸壁。因此,肺的内向弹性回缩压与胸壁的外向回缩压(outward recoil)相互平衡。
吸气开始时,膈肌和胸壁肌肉收缩,导致膈肌向下运动、胸廓向外向上运动。因此,胸膜压(pleural pressure)在吸气过程中降低。这种负压通过肺组织传递,导致肺泡压(alveolar pressure)下降。当肺泡压降至低于0时(即从大气压降至低于大气压),声门开放使气体进入气道。随着气体沿气道流向肺泡,气道内的压力梯度逐渐减小;当肺泡与大气之间不再存在压力梯度时,气流停止。
<nowiki>跨越呼吸系统的压力(\mathrm{P_{rs}})是肺的跨壁压与胸壁的跨壁压之和:</nowiki>
呼气时,膈肌上抬入胸腔,胸膜压升高(即负值减小),肺泡压转为正值,声门开放使气体再次从高压(肺泡)流向低压(大气)。肺泡内呼气的驱动力是肺弹性回缩力(elastic recoil)与胸膜压的总和(见第22章)。图21.2展示了吸气和呼气过程中压力变化、气流变化与容积变化的关系。正常个体平静呼吸时,吸气初期的肺泡压下降幅度较小(1-3cmH2O)。对于存在气道阻塞的个体,由于阻塞气道两侧产生更大的压力差,该下降幅度会显著增大。当肺泡压与大气压相等导致压力梯度消失时,气流即停止。
公式 21.3
== 肺容积及其测量 ==
肺容积( Lung volumes,图21 .3)及其决定因素是肺力学的重要组成部分。各种疾病可能改变特定肺容积,导致呼吸功增加(见第22章)。所有肺容积都是总肺容量(total lung capacity,TLC)的细分,TLC指最大吸气时肺内所含气体的总量。 <u >TLC由四个独立肺容积组成:补吸气量(IRV)、潮气量(Vt)、补呼气量(ERV)和残气量(RV)。 </u >潮气量(Tidal Volume, Vt)指每次平静呼吸时进出肺部的气体量。补吸气量(Inspiratory Reserve Volume, IRV)指正常潮气呼吸后能额外吸入的气体量,这部分气体储备用于通气需求增加时(如运动或疾病)。补呼气量(Expiratory Reserve Volume, ERV)指正常潮气呼吸后能额外呼出的气体量,与IRV类似,在呼吸努力增强时使用。残气量(Residual Volume, RV)指完全呼气后仍"滞留"于肺内的气体量。
<nowiki>\begin{array}{r l} {\mathrm{P_{rs}=P_{L}+P_{w}}} \\ {\quad\quad=\left(\mathrm{PA-Ppl\right)+\left(\mathrm{P_{pl}-P_{b}}\right)} \\ {\quad\quad=\mathrm{PA-P_{b}}} \end{array}</nowiki>
== 压力梯度如何形成 ==
[[文件:BL-21.1.png|缩略图|• 图21.1 正常与疾病状态下肺容积随跨肺压(transpulmonary pressure)变化的关系。跨肺压增大时,肺容积随之增加。图中同时显示了肺气肿(emphysema)和肺纤维化(pulmonary fibrosis)对肺容积的影响。需注意,在相同跨肺压变化下,这两种疾病导致的肺容积改变存在差异。TLC(总肺容量)指肺内气体总体积。]]
空气从高压区域流向低压区域,从而进出肺部。若无压力梯度,则无气流。因此,在吸气末和呼气末(无气流的时间段),肺泡压(PA)与大气压(Pb)相等,此时无压力梯度(Pb-PA=0)。然而,此时的胸膜压并非0。在吸气开始前,正常个体的胸膜压约为−3至−5 cm H₂O。因此,胸膜腔内的压力相对于大气压为负压。这种负压由肺的内向弹性回缩压(inward elastic recoil pressure)产生,其作用是“将肺拉离”胸壁。然而,由于肺与胸壁作为整体协同运动,肺无法真正脱离胸壁。因此,肺的内向弹性回缩压与胸壁的外向回缩压(outward recoil)相互平衡。
吸气开始时,膈肌和胸壁肌肉收缩,导致膈肌向下运动、胸廓向外向上运动。因此,胸膜压(pleural pressure)在吸气过程中降低。这种负压通过肺组织传递,导致肺泡压(alveolar pressure)下降。当肺泡压降至低于0时(即从大气压降至低于
肺容量(lung capacity)被定义为两个或多个上述肺容积的总和。肺活量(Vital Capacity, VC)是Vt、IRV和ERV的总和,表示从最大吸气到最大呼气能排出的气体总量。TLC则是VC与RV的总和。
大气压),声门开放使气体进入气道。随着气体沿气道流向肺泡,气道内的压力梯度逐渐减小;当肺泡与大气之间不再存在压力梯度时,气流停止。
呼气时,膈肌上抬入胸腔,胸膜压升高(即负值减小),肺泡压转为正值,声门开放使气体再次从高压(肺泡)流向低压(大气)。肺泡内呼气的驱动力是肺弹性回缩力(elastic recoil)与胸膜压的总和(见第22章)。图21.2展示了吸气和呼气过程中压力变化、气流变化与容积变化的关系。正常个体平静呼吸时,吸气初期的肺泡压下降幅度较小(1-3\mathrm{cm}\mathrm{H}_{2}\mathrm{O})。对于存在气道阻塞的个体,由于阻塞气道两侧产生更大的压力差,该下降幅度会显著增大。当肺泡压与大气压相等导致压力梯度消失时,气流即停止。
== 肺容积及其测量 ==
多数肺容积和容量可通过肺活量计(spirometer)测量。患者通过该装置呼吸时,气流运动被记录。通过平静呼吸可测得潮气量。随后患者进行最大吸气(确定IRV)并用力呼气至无法继续呼出,此时呼出的气体量即为VC。ERV可通过从VC中减去IRV和Vt计算得出。RV无法通过肺活量计直接测量,需采用更复杂的测试方法。
肺容积(图21.3)及其决定因素是肺力学的重要组成部分。各种疾病可能改变特定肺容积,导致呼吸功增加(见第22章)。所有肺容积都是总肺容量(TLC)的细分,TLC指最大吸气时肺内所含气体的总量。TLC由四个独立肺容积组成:补吸气量(IRV)、潮气量(Vt)、补呼气量(ERV)和残气量(RV)。潮气量(Tidal Volume, Vt)指每次平静呼吸时进出肺部的气体量。补吸气量(Inspiratory Reserve Volume, IRV)指正常潮气呼吸后能额外吸入的气体量,这部分气体储备用于通气需求增加时(如运动或疾病)。补呼气量(Expiratory Reserve Volume, ERV)指正常潮气呼吸后能额外呼出的气体量,与IRV类似,在呼吸努力增强时使用。残气量(Residual Volume, RV)指完全呼气后仍"滞留"于肺内的气体量。
肺容量被定义为两个或多个上述肺容积的总和。肺活量(Vital Capacity, VC)是Vt、IRV和ERV的总和,表示从最大吸气到最大呼气能排出的气体总量。TLC则是VC与RV的总和。
'''临床应用'''
多数肺容积和容量可通过肺活量计(spirometer)测量。患者通过该装置呼吸时,气流运动被记录。通过平静呼吸可测得潮气量。随后患者进行最大吸气(确定IRV)并用力呼气至无法继续呼出,此时呼出的气体量即为VC。ERV可通过从VC中减去IRV和Vt计算得出。RV无法通过肺活量计直接测量,需采用更复杂的测试方法。<blockquote>临床应用
肺功能测试常用于诊断肺功能异常及评估肺部疾病的进展。它们可区分两种主要的肺病理生理过程:阻塞性肺疾病和限制性肺疾病。例如, <u >在正常个体中,残气量 (RV)与肺总量(TLC)的比值小于0.25。</u>健康个体呼气末约有25 %的气体总量残留在肺内("被截留")。<u>在阻塞性肺疾病中,RV/TLC比值可能因RV增加超出TLC的任何增加比例而继发性升高< /u>。胸部影像学检查中,由于截留气体量增加,肺部可能呈现 "过度充气"表现。相反,<u>在限制性肺疾病中,胸廓无法扩张至正常预期程度,因此TLC下降导致RV /TLC比值升高。</u >
肺功能测试常用于诊断肺功能异常及评估肺部疾病的进展。它们可区分两种主要的肺病理生理过程:阻塞性肺疾病和限制性肺疾病。例如,在正常个体中,残气量(RV)与肺总量(TLC)的比值小于0.25。健康个体呼气末约有25%的气体总量残留在肺内("被截留")。在阻塞性肺疾病中,RV/TLC比值可能因RV增加超出TLC的任何增加比例而继发性升高。胸部影像学检查中,由于截留气体量增加,肺部可能呈现"过度充气"表现。相反,在限制性肺疾病中,胸廓无法扩张至正常预期程度,因此TLC下降导致RV/TLC比值升高。</blockquote>
=== 肺容积与肺容量 ===
== 肺容积与肺容量 ==
RV和TLC可通过两种方法测量:氦气稀释法和体容积描记法。这两种方法均用于临床,可提供有关肺功能和肺部疾病的重要信息。氦气稀释法是较传统且简单的方法,但其准确性通常低于需要精密昂贵设备的体容积描记法。
RV和TLC可通过两种方法测量:氦气稀释法和体容积描记法。这两种方法均用于临床,可提供有关肺功能和肺部疾病的重要信息。氦气稀释法是较传统且简单的方法,但其准确性通常低于需要精密昂贵设备的体容积描记法。
在正常个体中,通过氦气稀释法测量的功能残气量(FRC)与体容积描记法测得的FRC相同(表21.1)。但肺部疾病患者的情况则不同。氦气稀释法测得的FRC是与气道相通的气体容积,而体容积描记法测得的FRC是呼气末肺内气体总容积。若有大量气体被截留于肺内(因气道过早闭合;见第22章),体容积描记法测得的FRC将显著高于氦气稀释法结果。
在正常个体中,通过氦气稀释法测量的功能残气量(FRC)与体容积描记法测得的FRC相同(表21.1)。但肺部疾病患者的情况则不同。氦气稀释法测得的FRC是与气道相通的气体容积,而体容积描记法测得的FRC是呼气末肺内气体总容积。若有大量气体被截留于肺内(因气道过早闭合;见第22章),体容积描记法测得的FRC将显著高于氦气稀释法结果。
=== 正常参考值示例* ===
<blockquote>'''肺容积'''
==== 肺容积 ====
功能性残气量:2 .4L
功能残气量(FRC) 2.4升 肺总量(TLC) 6升 潮气量(\lor_{\top}) 0.5升 呼吸频率(f) 12次/分
==== 静态力学 ====
肺总量TLC:6L
<nowiki>胸膜压(\mathsf{P}_{\mathsf{p}\mathsf{I}}),平均 −5厘米水柱 功能残气位胸壁顺应性(\mathrm{C}_{\mathrm{w}}) 0.2升/厘米水柱 功能残气位肺顺应性(\mathsf C_{\mathsf L}) 0.2升/厘米水柱</nowiki>
<nowiki>*</nowiki>个体预测正常值会因身高、体重、种族背景和生理性别而有所差异
潮气量:0.5L
=== 临床视角 ===
呼吸频率:12/分
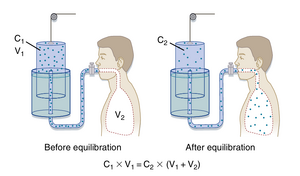
氦气稀释法的操作原理是:向已知容积(\vee_{1})的密闭容器内注入已知浓度(C1)的惰性气体(如氦气),随后将该容器连接至待测的未知容积(\mathsf{V}_{2})(即待测肺容积)。待惰性气体充分分布后,测量其新浓度(\mathrm{C}_{2})。通过惰性气体浓度的变化即可计算其分布的总容积(图21.4)。具体公式为:
'''静态参数'''
\mathsf C_{1}×\mathsf V_{1}=\mathsf C_{2}\left(\mathsf V_{1}+\mathsf V_{2}\right)
胸膜压Ppl:-5cmH2O
功能残气量时胸壁顺应性:0.2L/cmH2O
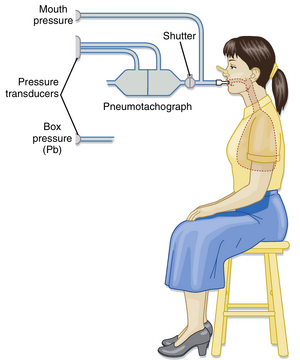
markdown 当使用体描计(body plethysmograph,身体容积描记箱)测量肺容积时,波义耳气体定律——压力与体积的乘积为常数(在恒温条件下)——被用于计算肺容积。患者坐在一个气密箱中(图21.5),通过连接气流传感器(流速仪,pneumotach)的咬嘴进行呼吸。随后患者对着关闭的咬嘴进行急促呼吸动作。在此操作的呼气阶段,肺内气体被压缩,肺容积减少,而箱内压力因箱内气体体积增加而下降。已知箱体容积和口腔处箱压变化后,即可计算肺容积变化量(\Delta V):
功能残气量时肺顺应性:0 .2L/cmH2O</blockquote>
[[文件:BL-21.4.png|缩略图|• 图21.4 通过氦稀释法测量肺容积。C_{ \tau }:惰性气体的已知浓度;C_ {2 }:气体的新(先前未知)浓度;V_ {\uparrow }:箱体的已知容积;V_ {2}:肺容积(初始未知)。]]
\mathsf{P}_{1}×\mathsf{V}=\mathsf{P}_{2}\big(\mathsf{V}-\Delta\mathsf{V}\big)
=== 临床视角 ===
氦气稀释法的操作原理是:向已知容积(V1)的密闭容器内注入已知浓度(C1)的惰性气体(如氦气),随后将该容器连接至待测的未知容积(V2)(即待测肺容积)。待惰性气体充分分布后,测量其新浓度(C2)。通过惰性气体浓度的变化即可计算其分布的总容积(图21.4)。具体公式为:
其中\mathsf{P}_{1}和{\sf P}_{2}为口腔压力,\vee表示功能残气量(FRC)。通过FRC测量,吸气量可记录为高于FRC的吸入气体体积,补呼气量(ERV)可确定为从FRC呼出的气体体积。这些测量值随后可用于计算其他肺容积参数。
C1×V1=C2(V1+V2)
[[文件:BL-21.5.png|缩略图|• 图21.5 体描计装置。注意患者所处的箱体未在图中显示。]]
当使用体描计(body plethysmograph,body box,身体容积描记箱)测量肺容积时,波义耳气体定律——压力与体积的乘积为常数(在恒温条件下)——被用于计算肺容积。患者坐在一个气密箱中(图21.5),通过连接气流传感器(流速仪,pneumotach)的咬嘴进行呼吸。随后患者对着关闭的咬嘴进行急促呼吸动作。在此操作的呼气阶段,肺内气体被压缩,肺容积减少,而箱内压力因箱内气体体积增加而下降。已知箱体容积和口腔处箱压变化后,即可计算肺容积变化量(Δ V):
=== 肺容积的决定因素 ===
P1×V =P2 (V-ΔV )
是什么决定了肺总量(TLC)或残气量(RV)时的肺内气体体积?答案在于肺实质的特性以及肺与胸廓的相互作用。在健康个体中,肺和胸廓始终作为一个整体协同运动。肺内含有弹性纤维,其具有以下功能:(1)在应力作用下伸展,导致肺容积增加;(2)应力解除后被动回缩,导致肺容积减少。肺实质的弹性回缩力非常强。若无外力作用(如胸廓产生的力),肺将几乎不含气体(约为TLC的10%)。同理,当呼吸肌伸展时胸廓容积可增大,呼吸肌长度缩短时则减小。在理论上去除肺实质的情况下,胸廓的静息容积会增大至约TLC的60%。
• 图21.4 通过氦稀释法测量肺容积。C_{\tau}:惰性气体的已知浓度;C_{2}:气体的新(先前未知)浓度;V_{\uparrow}:箱体的已知容积;V_{2}:肺容积(初始未知)。
其中P1、P2为口腔压力,V表示功能残气量(FRC)。通过FRC测量,吸气量可记录为高于FRC的吸入气体体积,补呼气量(ERV)可确定为从FRC呼出的气体体积。这些测量值随后可用于计算其他肺容积参数。
• 图21.5 体描计装置。注意患者所处的箱体未在图中显示。
== 肺容积的决定因素 ==
是什么决定了肺总量(TLC)或残气量(RV)时的肺内气体体积?答案在于肺实质的特性以及肺与胸廓的相互作用。在健康个体中,肺和胸廓始终作为一个整体协同运动。肺内含有弹性纤维,其具有以下功能:(1)在应力作用下伸展,导致肺容积增加;(2)应力解除后被动回缩,导致肺容积减少。肺实质的弹性回缩力非常强。<u>若无外力作用(如胸廓产生的力),肺将几乎不含气体(约为TLC的10%)。</u>同理,当呼吸肌伸展时胸廓容积可增大,呼吸肌长度缩短时则减小。<u>在理论上去除肺实质的情况下,胸廓的静息容积会增大至约TLC的60%。</u>
=== 肺容积的调节机制 ===
肺容积由肺的弹性特性与胸壁肌肉特性之间的平衡决定。肺和胸壁内所含空气的最大容积(即总肺容量,TLC)由吸气肌控制(参见第20章)。随着肺容积增大,胸壁肌肉逐渐拉长。肌肉拉长时,其产生力的能力随之下降。当吸气肌无法产生进一步扩张肺和胸壁所需的额外力量时,即达到TLC。
肺容积由肺的弹性特性与胸壁肌肉特性之间的平衡决定。肺和胸壁内所含空气的最大容积(即总肺容量,TLC)由吸气肌控制(参见第20章)。随着肺容积增大,胸壁肌肉逐渐拉长。肌肉拉长时,其产生力的能力随之下降。当吸气肌无法产生进一步扩张肺和胸壁所需的额外力量时,即达到TLC。
第97行:
第91行: 功能残气量(FRC)指正常呼气末的肺容积,由肺实质为缩小体积产生的弹性回缩压(向内回缩)与胸壁为扩大体积产生的压力(向外回缩)之间的平衡决定。当胸壁肌力薄弱时,FRC会降低(肺弹性回缩压>胸壁肌力)。存在气道阻塞时,由于气道过早闭合导致气体滞留,FRC会升高(参见第22章)。
功能残气量(FRC)指正常呼气末的肺容积,由肺实质为缩小体积产生的弹性回缩压(向内回缩)与胸壁为扩大体积产生的压力(向外回缩)之间的平衡决定。当胸壁肌力薄弱时,FRC会降低(肺弹性回缩压>胸壁肌力)。存在气道阻塞时,由于气道过早闭合导致气体滞留,FRC会升高(参见第22章)。
=== 压力-容积关系 ===
== 压力-容积关系 ==
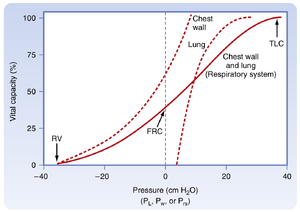
[[文件:BL-21.6.png|缩略图|• 图21.6 肺、胸壁及呼吸系统的静态压力-容积曲线。呼吸系统曲线是各组成部分曲线的总和。肺的曲线与图21.1中正常肺的曲线相同。FRC,功能残气量;P_{L},跨肺压;P_{r s},呼吸系统跨壁压;P_{w},胸壁跨壁压;RV,残气量;TLC,肺总量。]]
通过分析肺、胸壁和呼吸系统的压力-容积曲线(图21.6),可得出若干重要结论:
通过分析肺、胸壁和呼吸系统的压力-容积曲线(图21.6),可得出若干重要结论:
* 在肺的静息容积(FRC)状态下,肺的弹性回缩力使肺容积减小,但这种向内回缩力被胸壁的向外回缩力所抵消
* 在肺的静息容积(FRC)状态下,肺的弹性回缩力使肺容积减小,但这种向内回缩力被胸壁的向外回缩力所抵消
* 在FRC时,这两种力量大小相等、方向相反,此时肌肉处于松弛状态
* 在FRC时,这两种力量大小相等、方向相反,此时肌肉处于松弛状态
* <nowiki>因此FRC状态下的呼吸系统跨壁压(\mathrm{P_{r\mathrm{s}}})为0</nowiki>
* 因此FRC状态下的呼吸系统跨壁压Prs为0
* 在TLC状态下,肺压和胸壁压均为正压,均需要正跨壁扩张压
* 在TLC状态下,肺压和胸壁压均为正压,均需要正跨壁扩张压
无肺组织存在时,胸壁的静息容积是其跨壁压为0时的容积,约为TLC的60%。当容积超过TLC的60%时,胸壁向内回缩需要正跨壁压;当容积低于TLC的60%时,胸壁倾向于向外回缩。
无肺组织存在时,胸壁的静息容积是其跨壁压为0时的容积,约为TLC的60%。当容积超过TLC的60%时,胸壁向内回缩需要正跨壁压;当容积低于TLC的60%时,胸壁倾向于向外回缩。
当经肺压(transpulmonary pressure)为0时,肺的容积最小。然而,由于表面活性物质(surfactant)降低表面张力的特性(见"表面活性物质"章节),当经肺压为0时肺内并非完全无气。单独的肺在跨壁压(transmural pressure)超过20\mathrm{cm}\mathrm{H}_{2}\mathrm{O}时趋于平坦,因为此时已达到肺的弹性极限。因此,跨壁压的进一步增加几乎不会引起容积变化,顺应性(compliance)(见"肺顺应性"章节)降低。肺的进一步扩张受限于其结缔组织(胶原蛋白、弹性蛋白)。若施加更大压力,靠近肺表面的肺泡可能破裂,空气可逸入胸膜腔,这种现象称为气胸(pneumothorax)。气胸可分为自发性(肺泡破裂)、创伤性(穿透性胸壁损伤)或某些侵入性胸部操作后的并发症。气胸发生时,肺与胸壁不再作为整体运作:肺回缩直至经肺压为0;胸壁则扩张直至跨胸壁压(trans chest wall pressure)为0。
当跨肺压(transpulmonary pressure)为0时,肺的容积最小。然而,由于表面活性物质(surfactant)降低表面张力的特性(见"表面活性物质"章节),当跨肺压为0时肺内并非完全无气。单独的肺在跨壁压(transmural pressure)超过20cmH2O时趋于平坦,因为此时已达到肺的弹性极限。因此,跨壁压的进一步增加几乎不会引起容积变化,顺应性(compliance)(见 "肺顺应性"章节)降低。肺的进一步扩张受限于其结缔组织(胶原蛋白、弹性蛋白)。若施加更大压力,靠近肺表面的肺泡可能破裂,空气可逸入胸膜腔,这种现象称为气胸(pneumothorax)。气胸可分为自发性(肺泡破裂)、创伤性(穿透性胸壁损伤)或某些侵入性胸部操作后的并发症。气胸发生时,肺与胸壁不再作为整体运作:肺回缩直至跨肺压为0;胸壁则扩张直至跨胸壁压(trans chest wall pressure)为0。
• 图21.6 肺、胸壁及呼吸系统的静态压力-容积曲线。呼吸系统曲线是各组成部分曲线的总和。肺的曲线与图21.1中正常肺的曲线相同。FRC,功能残气量;P_{L},经肺压;P_{r s},呼吸系统跨壁压;P_{w},胸壁跨壁压;RV,残气量;TLC,肺总量。
<nowiki>经肺压与胸膜腔压、肺泡压及弹性回缩压的关系见图21.7。肺泡压是胸膜腔压与肺弹性回缩压(\mathrm{P_{el}})之和:</nowiki>
公式21.4
<nowiki>\mathrm{PA=P_{p l}+p_{e l}}</nowiki>
由于经肺压(PL)=PA-Ppl,可得:
公式21.5
<nowiki>\begin{array}{r l}&{PL=\left(\mathrm{P_{el}}+Ppl\right)-Ppl}\ &{PL=\mathrm{P_{el}}}\end{array}</nowiki>
<nowiki>通常,PL是使肺扩张的压力,而\mathrm{P_{el}}是促使肺塌陷的压力。肺弹性回缩力随肺充气量的增加而增强。</nowiki>
跨肺压与胸膜腔压、肺泡压及弹性回缩压的关系见图21.7。肺泡压是胸膜腔压与肺弹性回缩压Pel之和:
=== 肺顺应性(Lung Compliance) ===
'''公式21.4:PA =Ppl+Pel'''
<nowiki>肺顺应性(compliance)\left(\mathrm{C_{L}}\right)反映肺的弹性特性,表示肺被扩张的难易程度。其定义为:在扩张压改变1 cm \mathrm{H}_{2}\mathrm{O}时引起的肺容积变化量。顺应性单位为毫升(或升)/厘米水柱。当肺顺应性高时,肺容易扩张;当顺应性低(肺"僵硬")时,肺难以扩张。肺顺应性\left(\mathrm{C_{L}}\right)可表示为:</nowiki>
公式21.6
由于跨肺压(PL)=PA-Ppl,可得:
'''公式21.5:PL=(Pel+Ppl)-Ppl=Pel'''
<nowiki>\mathrm{C_{L}}=\Delta\mathrm{V}/\Delta\mathrm{P}</nowiki>
通常,PL是使肺扩张的压力,而Pel是促使肺塌陷的压力。肺弹性回缩力随肺充气量的增加而增强。
== 肺顺应性(Lung Compliance) ==
[[文件:BL-21.7.png|缩略图|• 图21.7 跨肺压(P_L)与胸膜压(P_pI)、肺泡压(P_A)及肺弹性回缩压(P_el)的关系。肺泡压是胸膜压与弹性回缩压之和。跨肺压是肺泡压与胸膜压之差。]]
肺顺应性(compliance,CL)反映肺的弹性特性,表示肺被扩张的难易程度。其定义为:在扩张压改变1 cm H2O时引起的肺容积变化量。顺应性单位为毫升(或升)/厘米水柱。当肺顺应性高时,肺容易扩张;当顺应性低(肺"僵硬")时,肺难以扩张。肺顺应性CL可表示为:
'''公式21.6:CL=ΔV/ΔP'''
[[文件:BL-21.8.png|缩略图|• 图21.8 呼气压力-容积曲线。患者吸气至肺总量(total lung capacity)后,使用食管气囊(测量胸膜压)测量跨肺压。随后患者缓慢呼气,在无气流且呼吸肌松弛时记录压力点。肺的压力-容积曲线在吸气(未显示)和呼气时并不重合,这种差异称为滞后现象(hysteresis),由表面活性物质作用所致。根据惯例,采用呼气压力-容积曲线进行测量。曲线上任意点的顺应性即单位压力变化引起的容积变化。该曲线显示肺顺应性随肺容积变化。在曲线上任取两点连线,其斜率即压力变化(ΔP)对应的容积变化(ΔV)。比较线1与线2的顺应性:线2斜率较线1平缓,说明高肺容积时顺应性低于低肺容积。根据惯例,肺顺应性指从功能残气量(FRC)到FRC+1升的跨压变化。MV:最小容积;RV:残气量;TLC:肺总量。]]
其中,ΔV 表示容积变化,ΔP 表示压力变化。图示上,肺顺应性(lung compliance)是压力-容积环(pressure-volume loop)呼气支上任意两点连线的斜率(图21.8)。正常人肺顺应性约为0.2升/厘米水柱(L/cm H₂O),但会随肺容积变化。值得注意的是,肺在高肺容积时扩张性较低。因此,顺应性需根据测量时的肺容积进行校正(比顺应性(specific compliance);图21.9)。临床实践中很少测量顺应性,因为这需要放置食管气囊(esophageal balloon)。该气囊通过压力传感器连接,作为胸膜压(pleural pressure)的替代指标——直接测量胸膜压非常困难。胸膜压变化(Pₚₗ)是肺容积变化的函数,即Cₗ=ΔV/ΔPₚₗ 或 ΔPₚₗ=ΔCₗ。
其中,ΔV 表示容积变化,ΔP 表示压力变化。图示上,肺顺应性(lung compliance)是压力-容积环(pressure-volume loop)呼气支上任意两点连线的斜率(图21.8)。正常人肺顺应性约为0.2升/厘米水柱(L/cm H₂O),但会随肺容积变化。值得注意的是,肺在高肺容积时扩张性较低。因此,顺应性需根据测量时的肺容积进行校正(比顺应性(specific compliance);图21.9)。临床实践中很少测量顺应性,因为这需要放置食管气囊(esophageal balloon)。该气囊通过压力传感器连接,作为胸膜压(pleural pressure)的替代指标——直接测量胸膜压非常困难。胸膜压变化(Pₚₗ)是肺容积变化的函数,即Cₗ=ΔV/ΔPₚₗ 或 ΔPₚₗ=ΔCₗ。
• 图21.7 跨肺压(P_L)与胸膜压(P_pI)、肺泡压(P_A)及肺弹性回缩压(P_el)的关系。肺泡压是胸膜压与弹性回缩压之和。跨肺压是肺泡压与胸膜压之差。
'''临床知识'''
• 图21.8 呼气压力-容积曲线。患者吸气至肺总量(total lung capacity)后,使用食管气囊(测量胸膜压)测量跨肺压。随后患者缓慢呼气,在无气流且呼吸肌松弛时记录压力点。肺的压力-容积曲线在吸气(未显示)和呼气时并不重合,这种差异称为滞后现象(hysteresis),由表面活性物质作用所致。根据惯例,采用呼气压力-容积曲线进行测量。曲线上任意点的顺应性即单位压力变化引起的容积变化。该曲线显示肺顺应性随肺容积变化。在曲线上任取两点连线,其斜率即压力变化(ΔP)对应的容积变化(ΔV)。比较线1与线2的顺应性:线2斜率较线1平缓,说明高肺容积时顺应性低于低肺容积。根据惯例,肺顺应性指从功能残气量(FRC)到FRC+1升的跨压变化。MV:最小容积;RV:残气量;TLC:肺总量。
肺顺应性受多种呼吸系统疾病影响。在<u>肺气肿(emphysema)(一种与肺泡间隔破坏相关的阻塞性肺疾病)中,由于弹性回缩力丧失,肺顺应性增加</u>;即压力每增加1 cm H2O,容积增量大于正常肺(见图21 .1)。相反,在<u>肺纤维化(pulmonary fibrosis)(一种与间质胶原纤维沉积增加相关的限制性肺疾病)中,肺顺应性降低</u>;即压力每改变1 cm H2O,容积变化量更小。这些顺应性变化具有临床意义,因为低顺应性肺("僵硬肺")需要更大的胸膜压力变化才能改变肺容积,导致个体每次呼吸的代谢做功增加。
=== 表面张力与表面活性物质 ===
== 表面张力与表面活性物质 ==
=== 表面张力 ===
=== 表面张力 ===
除了肺的弹性特性外,肺顺应性的另一个主要决定因素是表面活性物质(surfactant)及其对表面张力(surface tension)的影响。表面张力由气-液界面处水分子之间的吸引力引起。这种作用倾向于通过使肺泡塌陷来最小化表面积,从而导致肺顺应性下降。因此,肺的膨胀变得更加困难,需要呼吸肌消耗更多能量。通过比较盐水填充肺(无气-液界面)和空气填充肺的容积-压力曲线,可以实验性地展示表面张力对肺膨胀的影响。由于空气填充肺的表面张力高于盐水填充肺,完全膨胀空气填充肺需要比盐水填充肺更高的压力。表面张力是衡量材料表面分子每单位长度附着力的指标,其单位为每单位长度所施加的力。
除了肺的弹性特性外,肺顺应性的另一个主要决定因素是表面活性物质(surfactant)及其对表面张力(surface tension)的影响。表面张力由气-液界面处水分子之间的吸引力引起。这种作用倾向于通过使肺泡塌陷来最小化表面积,从而导致肺顺应性下降。因此,肺的膨胀变得更加困难,需要呼吸肌消耗更多能量。通过比较盐水填充肺(无气-液界面)和空气填充肺的容积-压力曲线,可以实验性地展示表面张力对肺膨胀的影响。由于空气填充肺的表面张力高于盐水填充肺,完全膨胀空气填充肺需要比盐水填充肺更高的压力。表面张力是衡量材料表面分子每单位长度附着力的指标,其单位为每单位长度所施加的力。
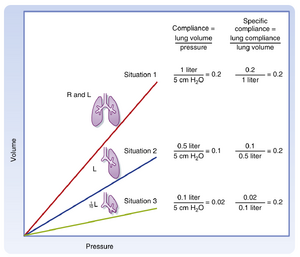
[[文件:BL-21.9.png|缩略图|• 图21.9 顺应性与肺容积的关系。假设某肺中5 cm H2O的压力变化导致1 L的容积变化(情况1)。若切除一侧肺(情况2),顺应性降低,但根据肺容积校正后无变化(比顺应性)。即使剩余肺容积减少90%(情况3),比顺应性仍保持不变。]]
对于球体(如肺泡),球内压力(Ps)与壁张力的关系由拉普拉斯定律描述:
对于球体(如肺泡),球内压力(\mathrm{P}_{s})与壁张力的关系由拉普拉斯定律描述:
''' 公式21.7 Ps =2T /r'''
• 图21.9 顺应性与肺容积的关系。假设某肺中5 cm \mathsf{H}_{2}\mathsf{O}的压力变化导致1 L的容积变化(情况1)。若切除一侧肺(情况2),顺应性降低,但根据肺容积校正后无变化(比顺应性)。即使剩余肺容积减少90%(情况3),比顺应性仍保持不变。
=== 临床知识 ===
肺顺应性受多种呼吸系统疾病影响。在肺气肿(emphysema)(一种与肺泡间隔破坏相关的阻塞性肺疾病)中,由于弹性回缩力丧失,肺顺应性增加;即压力每增加1 cm \mathsf{H}_{2}\mathsf{O},容积增量大于正常肺(见图21.1)。相反,在肺纤维化(pulmonary fibrosis)(一种与间质胶原纤维沉积增加相关的限制性肺疾病)中,肺顺应性降低;即压力每改变1 cm \mathsf{H}_{2}\mathsf{O},容积变化量更小。这些顺应性变化具有临床意义,因为低顺应性肺("僵硬肺")需要更大的胸膜压力变化才能改变肺容积,导致个体每次呼吸的代谢做功增加。
公式21.7
<nowiki>\mathrm{P_{s}}=2\mathrm{T}/\mathrm{r}</nowiki>
其中T为壁张力(单位:达因/厘米),r为球体半径。
其中T为壁张力(单位:达因/厘米),r为球体半径。
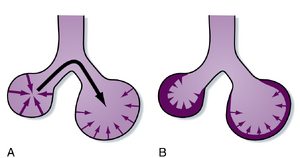
[[文件:BL-21.10.png|缩略图|• 图21.10 球体表面力试图减小表面积并在球体内产生压力。根据拉普拉斯定律(Laplace’s law),产生的压力与球体半径成反比。A. 无表面活性物质时,小球体表面力产生的压力(深紫色箭头)比大球体(浅紫色箭头)更高。这导致气体从小球体(高压)流向大球体(低压;黑色箭头),使小球体塌陷而大球体过度扩张。B. 表面活性物质(阴影层)能降低表面张力,且对小球体的降低作用更显著。最终结果是大小球体内的压力趋于平衡,球体容积得以稳定。]]
肺泡内衬主要由一种称为表面活性物质(surfactant)的脂质基物质构成。肺表面活性物质具有多种生理功能,包括:(1) 通过降低表面张力来减少呼吸做功;(2) 防止呼气时肺泡塌陷和粘连;(3) 稳定肺泡,特别是那些在低表面张力下容易萎缩的肺泡。若无表面活性物质,气-液界面的表面张力将保持恒定,当肺泡容积减小时,维持该容积所需的肺泡跨壁压(transalveolar pressure)会更高(图21.10A)。因此,在低肺容积状态下,需要更高的肺泡跨壁压才能实现与高肺容积状态下相同的肺泡容积增量。表面活性物质通过使表面张力随肺泡扩张而增加,从而稳定肺泡的膨胀(见图21.10B)。其结果是,维持肺泡膨胀所需的肺泡跨壁压会随肺容积和跨肺压(transpulmonary pressure)的增加而增加,并随肺容积的减小而降低。在表面活性物质存在时,高肺容积状态下的表面张力会增加,而低肺容积状态下的表面张力会降低。这使得肺能在多种不同容积下维持肺泡的稳定。否则,小肺泡中的气体会排入大肺泡。
肺泡内衬主要由一种称为表面活性物质(surfactant)的脂质基物质构成。肺表面活性物质具有多种生理功能,包括:<u> (1) 通过降低表面张力来减少呼吸做功;(2) 防止呼气时肺泡塌陷和粘连;(3) 稳定肺泡,特别是那些在低表面张力下容易萎缩的肺泡。</u>若无表面活性物质,气 -液界面的表面张力将保持恒定,当肺泡容积减小时,维持该容积所需的肺泡跨壁压(transalveolar pressure)会更高(图21.10A)。因此,在低肺容积状态下,需要更高的肺泡跨壁压才能实现与高肺容积状态下相同的肺泡容积增量。表面活性物质通过使表面张力随肺泡扩张而增加,从而稳定肺泡的膨胀(见图21.10B)。其结果是,维持肺泡膨胀所需的肺泡跨壁压会随肺容积和跨肺压(transpulmonary pressure)的增加而增加,并随肺容积的减小而降低。在表面活性物质存在时,高肺容积状态下的表面张力会增加,而低肺容积状态下的表面张力会降低。这使得肺能在多种不同容积下维持肺泡的稳定。否则,小肺泡中的气体会排入大肺泡。
• 图21.10 球体表面力试图减小表面积并在球体内产生压力。根据拉普拉斯定律(Laplace’s law),产生的压力与球体半径成反比。A. 无表面活性物质时,小球体表面力产生的压力(深紫色箭头)比大球体(浅紫色箭头)更高。这导致气体从小球体(高压)流向大球体(低压;黑色箭头),使小球体塌陷而大球体过度扩张。B. 表面活性物质(阴影层)能降低表面张力,且对小球体的降低作用更显著。最终结果是大小球体内的压力趋于平衡,球体容积得以稳定。
=== 表面活性物质 ===
=== 表面活性物质 ===
<u>肺表面活性物质由II型肺泡细胞合成,储存于细胞内的'''板层小体(lamellar bodies)'''中,并以前体形式(tubular myelin)分泌至肺泡腔。</u>随后其扩散至整个肺泡表面,获得降低表面张力的能力。表面活性物质含85%至90%的脂质(以磷脂为主)和10%至15%的蛋白质(表21.2)。主要磷脂成分为磷脂酰胆碱(phosphatidylcholine),其中约<u>75%以二棕榈酰磷脂酰胆碱(DPPC)形式存在</u>。DPPC可降低表面张力,是表面活性物质中主要的表面活性成分。第二丰富的磷脂是磷脂酰甘油(phosphatidylglycerol),占总表面活性物质的1%至10%。这些脂质对肺泡-空气界面单分子层的形成至关重要,其中磷脂酰甘油对表面活性物质在大面积表面的铺展起重要作用。研究最深入的表面活性蛋白A(surfactant protein A)在II型肺泡细胞中表达,参与表面活性物质的代谢调节、肺内免疫调节及管状髓磷脂的形成。
= 肺表面活性物质(pulmonary surfactant)的组成与功能 21.2 =
表面活性物质通过组成性和调节性机制,经板层小体的胞吐作用分泌至气道。包括β-肾上腺素能激动剂、蛋白激酶C激活剂、白三烯和嘌呤能激动剂在内的多种物质均可刺激表面活性物质的胞吐。肺内表面活性物质的主要清除途径包括:II型细胞再摄取、淋巴管吸收以及肺泡巨噬细胞清除。 <u >当病理过程导致蛋白质类物质进入胸膜腔时(如感染、肺水肿液和血浆蛋白渗漏至气腔),表面活性物质会迅速失活。失活后肺泡表面张力升高,肺顺应性下降,呼吸做功增加。 </u >
肺表面活性物质由II型肺泡细胞合成,储存于细胞内的板层小体(lamellar bodies)中,并以前体形式(管状髓磷脂,tubular myelin)分泌至肺泡腔。随后其扩散至整个肺泡表面,获得降低表面张力的能力。表面活性物质含85%至90%的脂质(以磷脂为主)和10%至15%的蛋白质(表21.2)。主要磷脂成分为磷脂酰胆碱(phosphatidylcholine),其中约75%以二棕榈酰磷脂酰胆碱(DPPC)形式存在。DPPC可降低表面张力,是表面活性物质中主要的表面活性成分。第二丰富的磷脂是磷脂酰甘油(phosphatidylglycerol),占总表面活性物质的1%至10%。这些脂质对肺泡-空气界面单分子层的形成至关重要,其中磷脂酰甘油对表面活性物质在大面积表面的铺展起重要作用。研究最深入的表面活性蛋白A(surfactant protein A)在II型肺泡细胞中表达,参与表面活性物质的代谢调节、肺内免疫调节及管状髓磷脂的形成。
表面活性物质通过组成性和调节性机制,经板层小体的胞吐作用分泌至气道。包括β-肾上腺素能激动剂、蛋白激酶C激活剂、白三烯和嘌呤能激动剂在内的多种物质均可刺激表面活性物质的胞吐。肺内表面活性物质的主要清除途径包括:II型细胞再摄取、淋巴管吸收以及肺泡巨噬细胞清除。当病理过程导致蛋白质类物质进入胸膜腔时(如感染、肺水肿液和血浆蛋白渗漏至气腔),表面活性物质会迅速失活。失活后肺泡表面张力升高,肺顺应性下降,呼吸做功增加。
除表面活性物质外,另一种机制——相互依赖机制(interdependence)也有助于维持肺泡稳定性。除胸膜表面的肺泡外,其他肺泡均被其他肺泡包围。单个肺泡的塌陷趋势会受到周围肺泡施加的牵拉力对抗。因此,单个肺泡的塌陷会引起周围肺泡的拉伸和变形,而这些肺泡又与其他肺泡相连。肺泡壁上的小孔(Kohn孔,pores of Kohn)连接相邻肺泡,而Lambert管(canals of Lambert)连接终末气道与邻近肺泡。Kohn孔和Lambert管提供侧支通气,防止肺泡塌陷(肺不张,atelectasis)。
=== 临床关联 ===
1959年,Avery和Mead发现死于透明膜病(hyaline membrane disease, HMD)的早产儿肺部存在表面活性物质(surfactant)缺乏。HMD又称新生儿呼吸窘迫综合征,其特征是肺单位进行性不张(去气化)、呼吸衰竭和(严重时)死亡。这是新生儿期发病和死亡的主要原因。早产儿表面活性物质缺乏的主要成分是磷脂酰甘油(phosphatidylglycerol)不足。一般而言,随着羊水中磷脂酰甘油水平的升高,婴儿死亡率会降低。该领域的研究最终成功实现了通过表面活性物质替代疗法治疗早产儿HMD。目前,表面活性物质替代疗法已成为早产儿的标准化治疗方案。此外,分娩前会对产妇使用倍他米松(betamethasone)等类固醇药物以加速胎儿肺成熟。类固醇可穿过胎盘进入胎儿肺部,与II型肺泡细胞(type II pneumocytes)内表面活性物质DNA序列上游的固醇调节结构域结合,从而增加表面活性物质RNA转录和表面活性物质蛋白的生成。
=== 关键要点 ===
# 气体从高压区域流向低压区域。需要正的跨肺压(transpulmonary pressure)来增加肺容积。在无气流时(吸气末和呼气末),呼吸系统的跨系统压差为0。在功能残气量(functional residual capacity, FRC)时,呼吸系统的跨系统压差为0,此时使肺容积减小的肺弹性回缩压(lung elastic recoil pressure)与胸壁为扩大容积产生的压力处于等值反向状态。
# 呼吸系统的压力梯度由呼吸肌的主动收缩及随后的舒张所形成。
# 肺容积由肺的弹性回缩特性与胸壁肌肉及结缔组织特性之间的平衡决定。
= 22 动态肺与胸壁力学 =
=== 学习目标 ===
完成本章学习后,学生应能回答以下问题:
# 层流与湍流有何区别?
# 气道阻力如何影响气流?
# 哪些因素会导致气道阻力?
# 查看呼吸描记图时,FEV1是什么?FVC是什么?峰值流量在何处测量?为何吸气流量-容积曲线与呼气流量-容积曲线不同?
# 什么是呼气等压点?导致呼气流量受限的常见原因有哪些?
# 在何种情况下呼吸功可能增加?如何评估呼吸功?
# 动态顺应性与静态顺应性有何不同?
== 动态肺力学 ==
本章将探讨控制气体进出肺部的原理。动态力学是研究运动中的物理系统的学科,对呼吸系统而言,即研究随时间变化而改变容积的肺部特性。
=== 气道中的气流 ===
当气道两端存在压力差时,气体将流入或流出气道。回顾前文,吸气时膈肌收缩,胸膜腔内压变得更负,气体流入肺部(见图21.2)。为满足机体代谢需求的变化,气体交换取决于新鲜气体到达肺泡的速度以及呼吸代谢产物(如CO2)被清除的速率。对于特定压力变化下气体流入气道的速度,两个主要因素起决定作用:气流模式和气道对气流的阻力。
==== 气流模式 ====
气道中存在两种主要气流模式——层流(laminar flow)和湍流(turbulent flow)。层流平行于气道壁,存在于低流速时。随着流速增加(尤其在气道分叉处),气流变得不稳定并形成小涡流。在更高流速时,气流结构紊乱,出现湍流。
法国医生Poiseuille首次描述了层流的压力-流量特性,该原理适用于液体和气体。在直圆管中,流量(\dot{\nabla})由以下方程定义:
公式22.1
<nowiki>\dot{\mathrm{V}}{=}\frac{\mathrm{P}\pi\mathrm{r}^{4}}{8\eta\mathrm{l}}</nowiki>
其中P为驱动压,r为管半径,\eta为流体粘度,l为管长。可见驱动压(driving pressure)(P)与流量(\dot{\nabla})成正比;因此压力越大,流量越大。
流动阻力(flow resistance)(R)的定义为驱动压变化(\Delta\mathrm{P})除以流量,即:
公式 22.2
<nowiki>\mathrm{R}={\frac{\Delta P}{\dot{V}}}{=}{\frac{8\Pi}{\pi r^{4}}}</nowiki>
阻力单位为cm \mathrm{H}_{2}\mathrm{O}/\mathrm{L}·秒。该公式适用于层流(laminar flow),表明管半径是决定阻力的最重要因素。若管半径减半,阻力将增加16倍;但若管长增加两倍,阻力仅增加两倍。因此,管半径是决定阻力的主要因素。换言之,阻力与半径的四次方成反比,与管长和气体粘度成正比。要增加流量,需增大管半径、缩短管长或降低流动化合物的粘度。
在湍流(turbulent flow)中,气体运动方向既平行又垂直于管轴。压力与流速的平方成正比。气体粘度随密度增加而增大,因此特定流量下的压降会增大。总体上,由于能量消耗于产生涡流和混沌运动,气体流速被削弱。因此,维持同等湍流所需的驱动压高于层流。
管中流动性质(层流或湍流)取决于雷诺数(Reynolds number)。雷诺数\mathrm{(R_{e})}是无量纲值,表示两个量纲相同项(运动粘度/动力粘度)的比值,如公式所示:
公式 22.3
<nowiki>\mathrm{R_{e}}=\frac{2\mathrm{rvd}}{\upeta}</nowiki>
其中d为流体密度,\upsilon为平均速度,r为半径,\eta为粘度。直管中,当雷诺数超过2000时发生湍流。由此关系可见,当气体平均流速高且半径大时最易发生湍流。相反,低密度气体(如氦气)引发湍流的可能性较低。这在气道阻力增高状态具有临床意义:降低气体密度可改善气流(例如通过用含氦混合气Heliox替代吸入空气中的氮气)。呼吸氦气时气流速度增加还会引起声调的可听变化。
=== 气道阻力 ===
<nowiki>气道阻力是决定气道内气体流速的第二大因素。不同尺寸气道的气流阻力(\mathrm{R}_{\mathrm{aw}})存在差异。从气管向肺泡移动时,单个气道逐渐变细,而气道分支的数量急剧增加。\mathrm{R}_{\mathrm{aw}}等于所有气道阻力的总和(即\mathrm{R_{aw}=R_{large}+R_{medium}+R_{small}})。根据泊肃叶方程(Poiseuille's equation),人们可能会认为气道阻力的主要部位位于最细小的气道。然而实际上,支气管树中的主要阻力部位位于前八级气道。最细小的气道对支气管树总阻力的贡献非常小(图22.1)。其原因有两点:(1) 随着有效横截面积的增加,气流速度显著下降(即流动变为层流);(2) 最重要的是,每一级气道分支以并联而非串联方式存在。并联气道的总阻力是各分支阻力倒数的总和,因此细小气道对总阻力的整体贡献非常小。例如,假设三根管道的阻力均为3{\mathrm{cm}}\mathrm{H}_{2}\mathrm{O}:</nowiki>
若管道串联,总阻力(\mathrm<nowiki>{{R}}</nowiki>_{\mathrm<nowiki>{{tot}}</nowiki>})为各阻力之和:
公式 22.4
<nowiki>\mathrm{R_{\mathrm{tot}}}=\mathrm{R_{1}}+\mathrm{R_{2}}+\mathrm{R_{3}}=3+3+3=9\mathrm{cmH_{2}O}/\mathrm{L}\cdot\mathrm{sec}</nowiki>
若管道并联(如细小气道中的情况),总阻力为各阻力倒数之和的倒数:
公式 22.5
<nowiki>\mathrm{R_{\mathrm{tot}}}=1/(1/\mathrm{R_{1}}+1/\mathrm{R_{2}}+1/\mathrm{R_{3}})=1/(1/3+1/3+1/3)=1\mathrm{cmH_{2}O}/\mathrm{L}\cdot\mathrm{sec}</nowiki>
因此,并联气道系统的总阻力远小于串联系统。这一原理解释了为何细小气道对总阻力的贡献可以忽略不计,即使单个细小气道的阻力较高。
\begin{array}{c}<nowiki>{{1/\mathrm{R}_{\mathrm{{\scriptsize{ot}}}}</nowiki>=1/\mathrm{R}_{1}+1/\mathrm{R}_{2}+1/\mathrm{R}_{3}=1/3+1/3+1/3}}\ <nowiki>{{\mathrm{R}_{\mathrm{{\scriptsize{tot}}}}</nowiki>=1{\mathrm{cm}}\mathrm{H}_{2}\mathrm{O}/\mathrm{L}\cdot{\mathrm{sec}}}}\end{array}
这种关系与肺血管形成鲜明对比——肺血管的大部分阻力位于小血管(见第23章)。因此,随着气道直径的减小,单个气道产生的阻力会增加,但由于平行通路数量和横截面积的急剧增加,使得每次分支时小气道的总阻力反而降低。
在正常呼吸时,约80%的气流阻力发生在功能残气量(FRC)下直径大于2 mm的气道中。由于小气道对总肺阻力的贡献极小,气道阻力的测量对于检测小气道阻塞的诊断价值有限。
=== 影响气道阻力的因素 ===
健康个体的气道阻力约为1 cm H₂O/L·秒。影响阻力的最重要因素是肺容积。肺容积的增加通过产生正跨气道压而扩大气道口径,因此气流阻力随肺容积增加而降低,随肺容积减少而增加。若将阻力的倒数(即传导率(conductance))与肺容积作图,可发现两者呈线性关系(图22.2)。其他增加气道阻力的因素包括气道黏液、水肿和支气管平滑肌收缩,这些都会减小气道口径。
吸入气体的密度和黏度也会影响气道阻力。潜水时气体密度升高会导致气道阻力增加,这可能对哮喘和阻塞性肺疾病患者造成问题。吸入低密度气体(如氦氧混合气)可降低气道阻力,这一特性已被用于治疗哮喘持续状态(''status asthmaticus'')——一种由支气管痉挛、气道炎症和黏液分泌过多共同导致气道阻力突然升高的危急状态。
=== 气道阻力的神经体液调节 ===
除了疾病的影响外,气道阻力还受到多种神经和体液因子的调节。直接或反射性刺激传出迷走神经纤维会增加气道阻力,并因气道收缩而减少解剖死腔(anatomic dead space)(见第23章)(迷走神经支配气道平滑肌)。相反,交感神经的刺激和节后神经递质去甲肾上腺素的释放会抑制气道收缩。吸入烟雾、粉尘、冷空气或其他刺激物对迷走神经的反射性刺激也可导致气道收缩和咳嗽。
组胺(histamine)、乙酰胆碱(acetylcholine)、血栓素A₂(thromboxane A₂)、前列腺素F₂(prostaglandin F₂)和白三烯(LTB₄、LTC₄和LTD₄)等介质由常驻气道细胞(如肥大细胞、气道上皮细胞)和募集细胞(如中性粒细胞、嗜酸性粒细胞)在过敏原和病毒感染等触发因素作用下释放。这些介质直接作用于气道平滑肌,引起收缩并增加气道阻力。吸入乙酰甲胆碱(methacholine)(乙酰胆碱衍生物)可用于诊断气道高反应性(airway hyperresponsiveness),这是某些哮喘表型的核心特征之一。尽管所有人对乙酰甲胆碱都有反应能力,但哮喘患者在吸入浓度低得多的乙酰甲胆碱时即可发生气道阻塞。
• 图22.2 气道阻力(AWR)和传导度(Cond.)随肺容积变化的函数关系。
=== 呼气流量测定 ===
呼气流量和呼气容积的测量是评估和监测呼吸系统疾病的重要临床工具。常用临床测试要求患者尽力吸气至肺总量(total lung capacity, TLC),然后尽可能快速、完全地呼气至残气量(residual volume, RV)。测试结果以肺量图(spirogram)(图22.3A)或流量-容积环(flow-volume loop)(图22.3B)形式显示。疑似肺部疾病患者的检测结果需与健康志愿者的预测值进行比较。预测值或正常值因年龄、性别、种族、身高及体重(影响较小)而异(表22.1)。数值异常提示肺功能异常,并可用于预测气体交换异常。这些指标可在呼吸道症状出现前早期发现肺功能异常,也可用于评估疾病严重程度和治疗反应。
=== 肺量图 ===
肺量图显示呼出气体容积随时间的变化(见图22.3A),可测量:(1)用力肺活量(forced vital capacity, FVC);(2)第1秒用力呼气容积(forced expiratory volume in 1 second, FEV₁);(3)FEV₁与FVC的比值(FEV₁/FVC);(4)平均最大呼气中期流量(forced midmaximal expiratory flow, FEF₂₅₋₇₅)。
从TLC到RV期间通过最大用力呼气动作所呼出的总气量称为'''用力肺活量'''(forced vital capacity,FVC)。在此动作中第一秒内呼出的气量称为'''第一秒用力呼气量'''(forced expiratory volume in 1 second,FEV₁)。正常人群中,70%至85%(取决于年龄)的FVC可在第一秒内呼出。因此健康成人的正常FEV₁/FVC比值应大于70%。
• 图22.3 临床肺量图(A)与流量-容积环(B)。受试者首先最大吸气至TLC,然后尽可能快速用力呼气直至达到RV。呼出气量随时间变化的曲线被记录下来。在临床报告中,肺量图的呼出气量从轨迹底部向顶部递增(A),这与生理学家展示的同一操作轨迹方向相反(见图21.3),后者呼出气量从轨迹顶部向底部递增。在流量-容积环(B)中,呼出气量被绘制为瞬时流率的函数,该流率通过呼吸速度描记器测量。此操作期间达到的最大呼气流速称为'''峰值呼气流速'''(peak expiratory flow rate)。注意两图中TLC与RV的位置标记。FEV₁,第一秒用力呼气量;FVC,用力肺活量;PEFR,峰值呼气流速;RV,残气量;TLC,肺总量。
=== 肺功能检测模式22.1 异常表现 ===
当FEV₁/FVC比值低于70%时提示存在呼气困难(因气道阻塞所致),是阻塞性肺疾病的特征性表现。从肺量图可计算出一个呼气流量指标——即肺活量中段平均流量。该呼气流量有多个名称,包括'''最大呼气中期流量'''(midmaximal expiratory flow,MMEF)和'''FEF25-75'''(25%-75%肺活量时的用力呼气流量)。虽然可通过肺量图轨迹识别该指标,但现代肺量计可自动计算FEF25-75。
=== 流量-容积环 ===
=== 临床肺功能测量的另一种方法:流量-容积环 ===
流量-容积环(flow-volume loop)是通过显示强制呼吸动作期间的瞬时流速(instantaneous flow rate)随吸入或呼出气体容积变化的函数关系而构建的。这种瞬时流速可在呼气期间(呼气流量-容积曲线)和吸气期间(吸气流量-容积曲线)分别显示(见图22.3B)。按照惯例,呼气流速显示在水平线以上,吸气流速显示在水平线以下。流量-容积环可测量以下参数:(1) 用力肺活量(FVC);(2) 呼气动作期间达到的最大流速,称为呼气峰流速(peak expiratory flow rate, PEFR);(3) 不同肺容积下的多个呼气流速。当呼气流量-容积曲线被分为四等份时:
* 剩余50%肺活量(VC)待呼出时的瞬时流速称为FEF_{50}(亦称\dot{V}_{max50});
* 已呼出75%VC时的瞬时流速称为FEF_{75}(\dot{V}_{max75});
* 已呼出25%VC时的瞬时流速称为FEF_{25}(\dot{V}_{max25})。
当传导性气道狭窄时,峰流速(PEFR)可能在临床中下降。峰流速仪可作为居家工具用于追踪总体气流。在哮喘治疗中,峰流速测量可用于指导基于治疗方案的药物调整。
----
=== 临床关联 ===
乙酰甲胆碱激发试验(methacholine challenge test,亦称支气管激发试验)用于评估气道反应性,有助于哮喘的诊断。乙酰甲胆碱(methacholine)是一种毒蕈碱受体激动剂,可引起支气管收缩(即气道狭窄)。在该试验中,患者吸入浓度递增的乙酰甲胆碱。在基线状态和每次剂量递增后,进行肺量计(spirometry)测量。当FEV1下降达20%或以上,或吸入最大浓度(25\mathrm{mg/mL})的乙酰甲胆碱时,试验终止。使\mathrm{FEV}_1下降20%的乙酰甲胆碱浓度称为激发浓度(provocation concentration, PC_{20})。PC_{20}越低,个体对乙酰甲胆碱越敏感。多数哮喘患者的PC_{20}低于8\mathrm{mg/mL}。
----
=== 最大流速的决定因素 ===
流量-容积环的形态揭示了正常肺生理的重要信息,这些信息可能因疾病而改变。观察流量-容积环可见,最大吸气流速与最大呼气流速相同或略高。最大吸气流速由三个因素决定:
# '''吸气肌产生的力'''随肺容积从残气量(RV)增加而减弱;
# '''肺的回缩压'''随肺容积从RV增加而增强,对抗吸气肌的力并降低最大吸气流速;
# '''气道阻力'''随肺容积增加、气道口径增大而降低。
吸气肌力、肺回缩压和气道阻力变化的综合作用,使最大吸气流速出现在肺总量(TLC)与RV之间的中点附近。
在呼气过程中,最大流量出现在动作的早期阶段(前20%),随后流量逐渐降低直至残气量(RV)。即使增加用力程度,随着接近RV,最大流量也会降低。这种现象称为呼气流量限制(expiratory flow limitation),可通过要求个体以递增的用力程度进行三次用力呼气动作来验证。图22.4展示了三次动作的结果。随着用力程度增加,呼气峰流量(peak expiratory flow)上升。然而,在较低肺容积时的流量趋于一致;这表明,中等程度的用力即可达到最大呼气流量。当肺容积减小时,无论施加多少用力都无法增加流量。因此,低肺容积时的呼气流量被称为用力无关且流量受限的,因为中等用力即可达到最大流量,任何额外的用力都无法使流量超越此限制。相反,呼气动作早期的过程被称为用力依赖的,即增加用力程度会提高流量。一般而言,呼气流量-容积环(expiratory flow-volume loop)中前20%的流量是用力依赖的。
• 图22.4 等容曲线。三次叠加的呼气流量动作以递增的用力程度完成。注意吸气峰流量和呼气峰流量是用力依赖的,而呼气后期的流量是用力无关的。FRC,功能残气量;TLC,肺总量;RV,残气量;TV(或V_T),潮气量。
=== 流量限制与等压点 ===
为何呼气流量受限且基本与用力无关?限制呼气流量的因素至关重要,因为许多肺部疾病会通过这些因素影响进出肺部的气体容积和速度。当气道(本质上是柔软可扩张的管道)被压缩时,便发生流量限制。当气道外压力超过气道内压力时,气道会被压缩。这种现象的发生机制和时机对理解肺部疾病具有重要意义。图22.5展示了两种不同肺容积下呼气流量限制时发生的事件。气道和肺泡被胸膜腔和胸壁包围。气道呈锥形,因为从肺泡到气管的总气道横截面积逐渐减小。在呼气开始时(气体流动发生前),肺泡内压(P_A)为零(无气流),而胸膜腔内压(本例中)为-30 cmH₂O。因此,经肺压(transpulmonary pressure)为+30 cmH₂O(P_L = P_A - P_pl)。由于无气流,气道内压为零,跨气道压(transairway pressure, P_ta)为+30 cmH₂O(P_ta = P_airway - P_pl = 0 - [-30 cmH₂O])。这种正向的经肺压和经气道压使肺泡和气道保持开放。
当主动呼气开始且呼气肌收缩时,胸膜压(pleural pressure)上升至+60\mathrm{cm}\mathrm{H}_{2}\mathrm{O}(本例中)。肺泡压(alveolar pressure)也会升高,部分原因是胸膜压的升高(+60\mathrm{cmH}_{2}\mathrm{O}),另一部分是该肺容积下肺的弹性回缩压(elastic recoil pressure)(本例中为30cm~\mathrm{H}_{2}\mathrm{O})。肺泡压等于胸膜压与弹性回缩压之和(即\mathrm{PA=P_{e l}+P_{p l}=30c m H_{2}O+60c m} \mathrm{H}_{2}\mathrm{O}=90cm~\mathrm{H}_{2}\mathrm{O},本例中)。这是呼气气流(expiratory gas flow)的驱动压。由于肺泡压超过大气压,当声门打开时,气体开始从肺泡流向口腔。
随着气体流出肺泡,跨气道壁的透壁压(transmural pressure)会降低(即呼气气流的压头消散)。这由三个原因导致:
# 由气流摩擦压力损失引起的阻力性压降(呼气气流阻力);
# 随着气道横截面积向气管方向减小,气体流速增加,这种气流加速会进一步降低压力;
# 随着肺容积减小,弹性回缩压降低。
因此,当空气排出肺部时,呼气气流的驱动压逐渐降低。此外,高肺容积时维持气道开放的机械牵拉作用也随肺容积减小而减弱。在肺泡与口腔之间的某一点,气道内压等于周围压力,该点称为等压点(equal pressure point)。位于等压点向口腔方向但仍处于胸壁内的气道会发生压缩,因为外部压力大于内部压力(动态气道压缩,dynamic airway compression)。因此,在刚过等压点的位置,跨气道压变为负值\mathrm{(P_{\mathrm<nowiki>{{ta}}</nowiki>}=P_{\mathrm<nowiki>{{aw}}</nowiki>}-P_{\mathrm<nowiki>{{pl}}</nowiki>}=58~-~[+60]=-2~c m~H_{2}O)}。
此时任何程度的用力都无法进一步增加流量,因为较高的胸膜压会促使等压点处的气道塌陷,尽管它同时也会增加呼气气流的压力梯度。在此条件下,气流与总驱动压无关,因此呼气流量是用力无关且受限的(effort independent and flow limited)。这也解释了为何呼气时气道阻力(airway resistance)大于吸气时。在无肺部疾病的情况下,等压点出现在含软骨的气道中,这些气道能抵抗塌陷。然而等压点并非固定不变,随着肺容积减少和弹性回缩压降低,等压点会逐渐向肺泡方向移动。
• 图22.5 流量限制。A,吸气末,呼气开始前。B,用力呼气开始时。C,用力呼气后期的呼气流量限制。呼气流量限制发生在透壁压为负导致气道直径缩小的位置。详见正文。TLC,肺总量(Total lung capacity)。
=== 临床关联(IN THE CLINIC) ===
=== 肺部疾病患者的病理生理变化 ===
对于存在黏液蓄积和气道炎症继发气道阻塞的患者(图22.6A),其呼气过程会发生何种改变?在呼气初期,驱动气体流动的压力与正常人相同,即由弹性回缩压(elastic recoil pressure)和胸膜腔内压共同组成。然而随着呼气进行,由于黏液蓄积和炎症导致气道半径显著减小,此时压力抵抗性下降(resistive drop)较正常人更为显著。结果,等压点(equal pressure point)会移至缺乏软骨支撑的小气道区域,导致这些气道塌陷。这种现象称为气道过早闭合(premature airway closure),将引起呼气容积低于最大值,并导致肺容积增加(称为空气潴留,air trapping)。
肺容积的增加初期可通过扩大气道直径和增强弹性回缩力,部分代偿黏液蓄积和炎症引起的气道阻力升高。但随着病情进展,炎症和黏液蓄积进一步加剧,呼气阻力显著增加,最大呼气流速随之下降。
再以弹性回缩力丧失的肺气肿患者为例(图22.6B)。由于弹性回缩力下降,呼气初期的驱动压力已降低。尽管压力抵抗性下降程度正常,但初始驱动压力减小会导致等压点更靠近肺泡侧的无软骨气道区域。此时同样发生气道过早闭合,但其机制与气道阻力增加患者的气道闭合存在本质差异。
==== 临床表现与机制 ====
气道过早闭合患者常出现爆裂音(crackles,有时称为rales),即听诊时在吸气相出现的断续爆裂声。这些声音源于呼气期间闭合(即受压塌陷)的气道在吸气时重新开放。爆裂音的成因包括黏液蓄积、气道炎症、气道内液体潴留或其他导致气道狭窄/受压的机制。肺气肿患者由于肺弹性回缩力降低,也会出现类似体征。
急慢性肺部疾病可通过以下机制改变呼气流量-容积关系:
# 静态肺回缩压(static lung recoil pressure)变化
# 气道阻力及其沿气道分布的改变
# 肺实质内气道机械性牵拉作用丧失
# 气道硬度或机械特性的改变
# 不同肺区域上述病理改变程度的差异性
• 图22.6 A:气道阻力增加时的流量限制;B:弹性回缩力丧失时的流量限制。TLC:肺总量(Total lung capacity)
=== 动态顺应性(Dynamic Compliance) ===
=== 呼吸功 ===
呼吸需要呼吸肌(膈肌、肋间肌等)的参与,这会消耗能量。克服肺的固有机械特性(即弹性和流阻阻力)以及移动肺和胸壁都需要做功。这种功被称为呼吸功(work of breathing)。疾病状态下肺或胸壁(或两者)机械特性的改变会导致呼吸功增加。呼吸肌可以在长时间内完成额外增加的功。然而与其他骨骼肌类似,它们也会疲劳,最终可能导致呼吸衰竭。呼吸肌疲劳是呼吸衰竭最常见的原因,该过程指气体交换不足以满足机体代谢需求。
在呼吸系统中,呼吸功的计算方法是将容积变化乘以呼吸系统所承受的压力:
\begin{array}{r} {\mathrm{~呼吸功}(\mathrm{W})=\mathrm{压力}(\mathrm{P})}\\ {×\mathrm{容积变化}(\Delta\mathrm{V})} \end{array}
<nowiki>需要特别说明的另一个动态肺力学测量指标是动态顺应性(dynamic compliance)的测量。通过让个体在正常肺容积范围内呼吸(通常从FRC到\mathrm{FRC}+1\mathrm{L}),可以绘制出动态压力-容积曲线。肺的平均动态顺应性(dyn \mathrm{C_{L}})被定义为连接无气流时吸气末和呼气末点连线的斜率(图22.7)。</nowiki>
动态顺应性总是小于静态顺应性,且在运动时会增加。这是因为在潮气量呼吸期间,肺泡表面积的小幅变化不足以将额外的表面活性物质分子带到表面,因此肺的顺应性较低。在运动中则发生相反情况:潮气量变化较大,更多表面活性物质被整合到气-液界面。因此肺的顺应性更高。
叹息和打哈欠通过增加潮气量并恢复正常的表面活性物质层来提高动态顺应性。这两种呼吸活动对维持正常肺顺应性都很重要。与肺不同,胸壁的动态顺应性与其静态顺应性无显著差异。
• 图22.7 充气-放气压力-容积曲线。箭头显示吸气和呼气的方向。充气与放气压力-容积曲线的差异源于表面张力随肺容积变化而产生的改变。注意连接无气流点的连线斜率,该斜率比相同肺容积下放气压力-容积曲线的斜率更平缓。FRC,功能残气量;TLC,总肺容量。
=== 在临床中的应用 ===
虽然目前尚无方法能直接测量呼吸过程中所需的总做功量,但可通过测量呼吸周期中的容积和压力变化来估算机械功。压力-容积曲线的分析可用于说明这些要点。图22.8A展示了正常肺的呼吸周期。静态充气-排气曲线由线段ABC表示。总机械做功量由梯形区域OAECD表示。
在限制性肺疾病(如肺纤维化)中,肺顺应性(compliance)降低,压力-容积曲线右移。如图22.8B所示,OAECD梯形区域的扩大表明呼吸功显著增加。在阻塞性肺疾病(如哮喘急性发作期或慢性支气管炎)中,气道阻力升高(见图22.8C),需更大的胸膜腔负压以维持正常吸气流量。除总吸气功(OAECD)增加外,阻塞性肺疾病患者因阻力增加和呼气功(表现为区域DFO)升高,呼气时胸膜腔正压也会增加。图22.8A中区域ABCF所代表的储存弹性势能不足以完成呼气,需额外能量参与呼气过程。随着时间推移或疾病进展,呼吸肌可能疲劳并导致呼吸衰竭。
当呼吸加深(潮气量增加需克服更多弹性功)或呼吸频率加快(分钟通气量增加需克服更多气流阻力)时,呼吸功也会增加(图22.9)。正常人群和肺部疾病患者会采取最小化呼吸功的呼吸模式。因此,肺纤维化患者(弹性功增加)表现为浅快呼吸,而阻塞性肺疾病患者(弹性功正常但阻力功增加)则表现为深慢呼吸。
• 图22.8 正常肺(A)、低顺应性肺(B)和高气道阻力肺(C)在呼吸周期中的机械功分解。梯形区域细分可帮助理解机械功的各组成部分:OABCD为克服弹性阻力所需的功;AECF为克服非弹性阻力所需的功;AECB为吸气时克服非弹性阻力所需的功;ABCF为呼气时克服非弹性阻力所需的功(代表吸气时储存的弹性势能)。
• 图22.9 特定肺泡通气水平下,呼吸频率对弹性功、非弹性功及呼吸总机械功的影响。无肺部疾病者倾向于选择总呼吸功最小的呼吸频率(箭头所示)。
=== 临床知识 ===
=== 慢性阻塞性肺疾病 ===
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一个通用术语,包括肺气肿(emphysema)和慢性支气管炎(chronic bronchitis)等疾病。COPD最常见于吸烟者,这类患者的肺部可同时存在肺气肿和慢性支气管炎的病理改变。其他长期环境暴露(生物燃料烟雾或其他空气污染)、遗传条件或肺部发育异常也可能导致COPD。对于以肺气肿为主的COPD患者,肺泡和毛细血管壁的弹性组织会逐渐被破坏,导致肺顺应性(lung compliance)增加和弹性回缩力(elastic recoil)下降。弹性回缩力降低会使等压点(equal pressure point)向肺泡方向移动,并导致气道过早闭合。这种现象会引起气体陷闭(air trapping),并增加残气量(RV)、功能残气量(FRC)和肺总量(TLC)。气道阻力(airway resistance)也会增加。这些肺容积的增大通过牵拉呼吸肌并降低其效率,导致呼吸做功增加。
在慢性支气管炎中,黏液积聚和气道炎症会使等压点向肺泡方向移动,导致气道过早闭合,并增加RV、FRC和TLC。气道阻力和呼吸做功增加,但肺顺应性正常。
在限制性肺疾病(如肺纤维化)中,肺顺应性降低。肺容积减少,但流速基本正常。表22.1显示了阻塞性和限制性肺疾病中肺功能值的部分变化。
妊娠后期,增大的子宫会增加腹内压(intra-abdominal pressure)并限制膈肌运动,导致FRC减少。此外,黄体酮(progesterone)会引起气道血流增加(充血)和黏膜水肿,从而导致气道阻力增加。这些变化会导致健康女性的肺容积减少、肺顺应性下降及气道阻力增加。
=== 关键概念 ===
# 气道中存在两种主要气流模式:湍流(turbulent)和层流(laminar)。
# 气道阻力是单位流量下的压力变化值。气道阻力与半径的四次方成反比,且湍流的阻力高于层流。气道阻力的主要产生部位是前八级气道。气道阻力随肺容积增大而降低,随气体密度降低(如用氦气替代氮气)而减少。神经和体液因子也可调节气道阻力。
# 肺功能测试(肺量测定法[spirometry]、流速-容积环[flow-volume loop]、体积描记法[body plethysmography])可在个体出现症状前检测肺功能异常。测试结果需与正常人群数据对比,并需考虑性别、种族、年龄和身高的差异。COPD的特征是肺容积和气道阻力增加、呼气流量降低。肺气肿(COPD的特定类型)还表现为肺顺应性增加。限制性肺疾病的特征是肺容积减少、呼气流量和阻力正常,以及肺顺应性显著下降。
= 23 通气、灌注及通气/灌注关系 =
完成本章学习后,学生应能回答以下问题:
# 死腔通气有哪两种类型?潮气量变化时死腔通气如何变化?
# 环境空气、气管和肺泡中的气体组成是什么?氧浓度分数(\mathsf{F i O}_{2})增加时该组成如何变化?大气压变化如何改变气体组成?
# 用于计算肺泡-动脉氧分压差(\mathsf{A a D o}_{2})的肺泡气体方程如何有助于评估低氧血症?
# 肺泡通气量变化对肺泡二氧化碳分压有何影响?
# 静息状态下,肺血流分布与通气分布的匹配程度如何?运动时会发生什么变化?
# 缺氧的四种类型和低氧性缺氧的六种病因是什么?
# 给予100%吸入氧(<nowiki>{{\sf O}_{2}}</nowiki>)如何帮助确定低氧性缺氧的病因?
# 高碳酸血症的两种病因是什么?它们有何区别?
<nowiki>正常气体交换及血液中\mathrm{Po}_{2}和\mathrm{Pco}_{2}水平的主要决定因素是通气(\dot{\nabla})与灌注({\dot{\mathrm{Q}}})之间的关系。这种关系称为通气/灌注({\dot{\mathrm{V}}}/{\dot{\mathrm{Q}}})比值。</nowiki>
== 通气 ==
<nowiki>通气是空气进出肺部的过程。吸入气体包括填充传导气道的气体量(死腔通气)和填充肺泡的部分(肺泡通气)。每分通气量(\dot{\mathrm{V_{E}}})是指每分钟进入或离开肺部的气体体积:</nowiki>
公式23.1
<nowiki>\dot{\mathrm{V}}_{\mathrm{E}}=\mathrm{f}×\mathrm{V}_{\mathrm{T}}</nowiki>
# 等压点(equal pressure point)是指气道内外压力相等的位点。等压点的位置是动态变化的。具体而言,在正常个体中,随着肺容积和弹性回缩力(elastic recoil)的减少,等压点会向肺泡方向移动。在慢性阻塞性肺疾病(COPD)患者中,任何肺容积下的等压点都更靠近肺泡。呼气流速限制发生在等压点处。
# 呼吸过程中需要消耗能量以克服肺的固有机械特性。呼吸肌疲劳是呼吸衰竭最常见的原因。个体会通过选择使做功最小化同时维持充分氧合和通气的呼吸频率进行呼吸。对于气道阻力增加的个体,通过采用低频大潮气量呼吸可使做功最小化。对于限制性肺疾病患者,通过高频小潮气量呼吸可使做功最小化。
# 肺的动态顺应性(dynamic compliance)始终小于静态顺应性(static compliance),并在运动、叹息和打哈欠时增加。
<nowiki>其中,f 为呼吸频率(即每分钟呼吸次数),\mathrm{V_{T}}(亦称 TV)为潮气量(tidal volume),即每次呼吸吸入(或呼出)的气体量。潮气量随年龄、性别、体位和代谢活动而变化。静息状态下普通成年人的潮气量为 500 mL。儿童潮气量为 3 至 5 mL/kg。随着代谢活动增强,分钟通气量增加。</nowiki>
=== 无效腔通气:解剖性与生理性 ===
==== 解剖无效腔 ====
<nowiki>无效腔通气指不参与气体交换的气道通气。无效腔分为两类:解剖无效腔(anatomical dead space)与生理无效腔(physiological dead space)。解剖无效腔(\mathrm{V_{D}})由填充传导气道的气体容积组成:</nowiki>
<nowiki>#</nowiki>公式 23.2
<nowiki>\mathrm{V_{T}=V_{D}+V_{A}}</nowiki>
其中 \mathrm{V} 表示容积,下标 \mathrm{T}、\mathrm{D} 和 A 分别代表潮气、无效腔和肺泡。\mathrm{V} 上方的"点"表示单位时间内容积(n):
<nowiki>#</nowiki>公式 23.3
<nowiki>\mathrm{V_{\mathrm{r}}}×\mathrm{n}=\mathrm{\left(V_{\mathrm{D}}×\mathrm{n}\right)}+\left(\mathrm{V_{\mathrm{A}}}×\mathrm{n}\right)</nowiki>
或
<nowiki>#</nowiki>公式 23.4
<nowiki>\dot{\mathrm{V}}_{\mathrm{E}}=\dot{\mathrm{V}}_{\mathrm{D}}+\dot{\mathrm{V}}_{\mathrm{A}}</nowiki>
<nowiki>其中 \dot{\mathrm{V}}_{\mathrm{E}} 为每分钟从肺部排出的气体总容积(升)(亦称呼气分钟通气量),\dot{\mathrm{V}}_{\mathrm{D}} 为每分钟无效腔通气量,\dot{\mathrm{V}}_{\mathrm{A}} 为每分钟肺泡通气量。</nowiki>
<nowiki>健康成年人功能残气量(FRC)状态下传导气道内的气体容积约为 100 至 200 mL,而全肺气体容积为 3 L。传导气道容积(无效腔)与潮气量的比值表示每次呼吸中"浪费"于填充传导气道的气体比例。该容积与潮气量(\mathrm{V_{T}})及呼气分钟通气量(\dot{\mathrm{V}}_{\mathrm{E}})的关系如下:</nowiki>
<nowiki>#</nowiki>公式 23.5
<nowiki>\dot{\mathrm{V}}_{\mathrm{D}}{=}\frac{\mathrm{V}_{\mathrm{D}}}{\mathrm{V}_{\mathrm{T}}}{×}\dot{\mathrm{V}}_{\mathrm{E}}</nowiki>
=== 临床视角 ===
若无效腔容积为 150 mL,潮气量从 500 mL 增至 600 mL 而呼气分钟通气量保持不变,无效腔通气量将发生何种变化?
<nowiki>\begin{array}{r l}&{\mathsf{V}_{\top}=500\mathsf{m L}}\ &{\mathsf{V}_{\mathsf{D}}=\left(\frac{150\mathsf{m L}}{500\mathsf{m L}}\right)×\dot{\mathsf{V}}_{\mathsf{E}}}\ &{\mathsf{V}_{\mathsf{D}}=0.3×\dot{\mathsf{V}}_{\mathsf{E}}}\end{array}</nowiki>
同理,
<nowiki>\begin{array}{r l}&{\mathsf{V}_{\top}=600\mathsf{m L}}\ &{\mathsf{V}_{\mathsf{D}}=\left(\frac{150\mathsf{m L}}{600\mathsf{m L}}\right)×\dot{\mathsf{V}}_{\mathsf{E}}}\ &{\mathsf{V}_{\mathsf{D}}=0.25×\dot{\mathsf{V}}_{\mathsf{E}}}\end{array}</nowiki>
增加潮气量是提升肺泡通气量的有效方式。这种情况可能发生在运动或代谢应激期间。随着潮气量增加,在相同呼气分钟通气量条件下,无效腔通气的比例将降低。
=== 死腔通气 ===
<nowiki>死腔通气(dead space ventilation,\mathrm{V_{D}})与潮气量(tidal volume,\mathrm{V_{T}})呈反比关系。潮气量越大,死腔通气所占比例越小。正常情况下,\mathrm{V_{D}/V_{T}}占呼气分钟通气量的20%至30%。死腔变化是呼吸做功的重要影响因素。若死腔增大,个体必须吸入更大的潮气量以维持正常肺泡通气水平。这会增加呼吸做功,并可能导致呼吸肌疲劳和呼吸衰竭。当代谢需求增加时(如运动或发热期间),肺部疾病患者可能无法充分增加潮气量。这种现象可通过水下游泳时使用通气管(snorkel)延伸气道至水面观察到。该装置增加了"解剖"死腔,因此需要增大潮气量以维持足够的肺泡通气。由于水下压力增大,呼吸的机械功随之增加。通气管装置设计为较短的管状结构,以降低水下通气不足和CO2蓄积的风险。</nowiki>
=== 生理死腔 ===
第二类死腔称为生理死腔(physiological dead space)。在病变肺脏中,常存在部分肺泡有灌注但无通气的情况。每次呼吸中未参与气体交换的气体总量称为生理死腔。该容量包括解剖死腔以及继发于有灌注但未通气肺泡的额外死腔。生理死腔容量至少等于解剖死腔,在肺部疾病存在时可显著增大。
解剖死腔和生理死腔均可测量,但在临床诊疗过程中并不常规进行此类测量。
=== 临床关联 ===
在某些类型的慢性阻塞性肺疾病(COPD)(如肺气肿)患者中,生理死腔会增大。若死腔容量翻倍,为维持相同水平的肺泡通气量,潮气量必须相应增加。假设潮气量为500 mL且\vee_{\mathrm<nowiki>{{p}}</nowiki>}/\vee_{\intercal}为0.25,则:
<nowiki>\mathsf{V}_{\top}=\mathsf{V}_{\mathsf{D}}+\mathsf{V}_{\mathsf{A}}</nowiki>
500mL=125mL+375mL
<nowiki>在此示例中,若\vee_{\mathrm{D}}从125 mL增加至250 mL,为维持正常肺泡通气量(即\mathsf{V}_{\mathsf{A}}=375\mathsf{m L}),潮气量(\lor_{\top})必须增加至625 mL:</nowiki>
\begin{array}{l l}<nowiki>{{V_{\top}=250\mathsf{m L}+375\mathsf{m L}}</nowiki>}\ {{}}\ <nowiki>{{V_{\top}=625\mathsf{m L}}</nowiki>}\end{array}
=== 肺泡通气 ===
=== 空气组成 ===
吸气过程将环境空气(大气)输送至肺泡,在此处进行O2摄取和CO2清除。环境空气是由\Nu_{_2}和O2组成的气体混合物,含微量CO2、氩气及其他惰性气体。该气体混合物的组成可通过气体分数或对应分压进行描述。
环境空气作为气体,适用气体定律。这引出两个重要原则:首先,当以气体分数(F)描述混合气体各组分时,各气体分数之和必等于1。
公式23.6
=== 方程 23.7 ===
<nowiki>Pb=\mathrm{P_{N_{2}}}+\mathrm{P_{O_{2}}}+\mathrm{P_{CO_{2}}}+\mathrm{P_{H_{2}O}}+\mathrm{P_{(OTHERGLASES)}}</nowiki>
三个重要的气体定律支配着环境空气和肺泡通气。根据波义耳定律(Boyle’s law),当温度恒定时,压力(P)与体积(V)呈反比关系,即 \mathrm{P}_{1}\mathrm{V}_{1}=\mathrm{P}_{2}\mathrm{V}_{2}。波义耳定律用于肺容积的测量(见图 21.4)。道尔顿定律(Dalton’s law)指出,气体混合物中某一种气体的分压是该气体在无其他组分时占据混合物总体积时所施加的压力。方程 23.7 展示了道尔顿定律在肺中的应用实例。根据亨利定律(Henry’s law),溶解于液体中的气体浓度与其分压成正比。
<nowiki>第二个重要原则是,气体的分压 (\mathrm{P_{gas}}) 等于该气体在气体混合物中的分数 \left(\mathrm{F_{gas}}\right) 乘以大气压(气压):</nowiki>
=== 方程 23.8 ===
<nowiki>\mathrm{P_{gas}=F_{g a s}× P_{b}}</nowiki>
环境空气约由 21% 的 O2 和 79% 的 \mathrm{N}_{2} 组成。(CO2 的贡献 {<}0.01%,通常被忽略。)因此,吸入的环境空气中 O2 的分压 (\mathrm{Po}_{2}) 计算如下:
=== 方程 23.9 ===
<nowiki>\begin{array}{r l}&{\mathrm{Po}_{2}=\mathrm{Fi}\mathbf{O}_{2}×\mathrm{P}_{\mathrm{b}}}\ &{\mathrm{Po}_{2}=0.21×760mmHg}\ &{\mathrm{Po}_{2}=159\mathrm{mmHgor}159\mathrm{torr}}\end{array}</nowiki>
<u >除表面活性物质外,另一种机制——'''相互依赖机制'''(interdependence)也有助于维持肺泡稳定性。除胸膜表面的肺泡外,其他肺泡均被其他肺泡包围。单个肺泡的塌陷趋势会受到周围肺泡施加的牵拉力对抗。因此,单个肺泡的塌陷会引起周围肺泡的拉伸和变形,而这些肺泡又与其他肺泡相连。肺泡壁上的小孔(Kohn孔,pores of Kohn)连接相邻肺泡,而Lambert管(canals of Lambert)连接终末气道与邻近肺泡。Kohn孔和Lambert管提供侧支通气,防止肺泡塌陷(肺不张,atelectasis)。 </u >
其中 (\mathrm{Fio}_{2}) 是吸入空气中氧气的分数。因此,在吸气开始时,口腔处环境空气中的 O2 分压(氧张力)为 159\mathrm{mm}\mathrm{Hg},即 159 托。口腔处的 O2 张力可通过两种方式改变:改变吸入空气中的 O2 分数 \left(\mathrm{Fio}_{2}\right) 或改变气压。因此,环境中的 O2 张力可通过补充 O2 或增加气压来提升。在高海拔地区,\mathrm{FiO}_{2} 不变,但大气压降低,导致氧分压下降。
=== 临床关联 ===
环境空气中 {\sf O}_{2} 的分压随海拔高度变化。美国本土的最高点和最低点分别为红杉国家公园/因约国家森林的惠特尼峰(海拔 14,505 英尺;气压 437 毫米汞柱)和死亡谷国家公园的恶水盆地(低于海平面 282 英尺;气压 768\mathrm{mm}\mathsf{H g})。在惠特尼峰,环境空气中的 {\sf O}_{2} 分压计算如下:
\mathsf{P O}_{2}{=}0.21{×}437\mathsf{m m}\mathsf{H g}{=}92\mathsf{m m H g}
而在死亡谷恶水盆地,氧气分压(partial pressure)的计算如下:
\mathsf{P O}_{2}=0.21×768\mathsf{mmHg}=161\mathsf{mmHg}
<nowiki>若在惠特尼峰使用补充氧气将\scriptstyle{\mathsf{F i O}}_{2}从0.21提高到0.40,则\mathsf{P o}_{2}=0.40×437\mathsf{mmHg}=175\mathsf{mmHg}。需注意\mathsf{F i O}_{2}在不同海拔并不变化;变化的仅是大气压。这些氧分压的差异对动脉血气值有深远影响。</nowiki>
<nowiki>当吸气开始时,环境空气进入鼻咽和喉咽部,在此处被加温至体温并湿润。吸入空气在到达声门时已完全被水蒸气饱和。水蒸气会产生分压并稀释其他气体的总压力分布。体温下的水蒸气压为47mmHg。要计算湿润混合气体中O2和\Nu_{_{2}}的分压,必须从总大气压中减去水蒸气压。因此在始于气管的导气部(conducting airways),O2分压的计算如下:</nowiki>
公式23.10
<nowiki>\begin{array}{r l}{\mathrm{P}_{\mathrm{trachea}}\mathbf{O}_{2}=(\mathrm{P}_{\mathrm{b}}-\mathrm{PH}_{2}\mathbf{O})×\mathrm{Fi}\mathbf{O}_{2}}&{{}}\\ {=\left(760~mmHg-47~mmHg\right)×0.21}&{{}}\\ {=150~mmHg}&{{}}\end{array}</nowiki>
<nowiki>\Nu_{_{2}}的分压类似计算如下:</nowiki>
公式23.11
<nowiki>\begin{array}{r l}{\mathrm{P}_{\mathrm{trachea}}\mathrm{N}_{2}=\left(\mathrm{P}_{\mathrm{b}}-\mathrm{P}_{\mathrm{H}_{2}\mathrm{O}}\right)×\mathrm{FiN}_{2}}&{{}}\\ {=\left(760~mmHg-47~mmHg\right)×0.79}&{{}}\\ {=563~mmHg}&{{}}\end{array}</nowiki>
<nowiki>需注意总压力保持760mmHg恒定(150+563+47mmHg),且O2和\Nu_{_2}的比例未改变。但水蒸气压降低了O2和\Nu_{_{2}}的分压。另需注意在计算环境空气分压时(公式23.9),水蒸气被忽略,环境空气被视为"干燥"。导气部不参与气体交换。O2、\mathrm{N}_{2}和水蒸气的分压在气道中保持不变,直至空气到达肺泡。</nowiki>
=== 肺泡气体组成 ===
当吸入空气到达肺泡时,O2通过肺泡膜扩散进入毛细血管床,CO2则从毛细血管床扩散进入肺泡。该过程详见第24章。在吸气末且声门开放时,肺泡内的总压力等于大气压。肺泡内各气体分压之和必须等于总压力(此时为大气压)。但气体混合物的组成已改变,可描述如下:
公式23.12
其中\Nu_{_2}和氩气是惰性气体;这些气体在肺泡中的分数不随环境分数变化。水蒸气的分数也不改变,因为吸入气体已完全被水蒸气饱和且处于体温。然而,由于气体交换,肺泡中O2的分数减少,而CO2的分数增加。由于O2和CO2分数的变化,这些气体所施加的分压也随之改变。肺泡中O2的分压(\mathrm{PAo}_{2})由肺泡气体方程给出,该方程也称为理想肺泡氧方程:
=== 方程 23.13 ===
<nowiki>{\begin{array}{r l}{\mathrm{PAo}_{2}=\mathrm{Pio}_{2}-{\frac{\mathrm{PACO}_{2}}{\mathrm{R}}}}&{}\ {=\left[\mathrm{FiO}_{2}×(\mathrm{P_{\mathrm{b}}}-\mathrm{PH}_{2}\mathrm{O})\right]-{\frac{\mathrm{PACO}_{2}}{\mathrm{R}}}}&{}\end{array}}</nowiki>
<nowiki>其中\mathrm{Pio}_{2}是吸入O2的分压,等于O2的分数\mathrm{(Fio_{2})}乘以大气压(Pb)减去水蒸气压(\mathrm{P_{H_{2}O}});{\mathrm{PAco}}_{2}是肺泡CO2的分压;\mathrm{R}是呼吸交换率(respiratory exchange ratio)或呼吸商(respiratory quotient)。呼吸商是肺部排泄的CO2量(\dot{\bf V}CO2)与摄取的O2量(\dot{\bf V}{\bf o}_{2})的比值。该商值反映了代谢中产生的CO2量与消耗的O2量的关系,并在一定程度上依赖于代谢的卡路里来源。呼吸商在0.7至1.0之间变化:纯脂肪酸代谢状态下为0.7,纯碳水化合物代谢状态下为1.0。在正常饮食条件下,呼吸商假定为0.8。因此,肺泡中摄取的O2量超过释放的CO2量。海平面环境空气至肺泡中O2、CO2和\Nu_{_2}的分压如表23.1所示。</nowiki>
类似方法可用于估算\mathrm{PAco}_{2}。肺泡中CO2的分数是代谢过程中细胞产生CO2的速率与CO2从肺泡清除速率的函数。这一CO2清除过程称为肺泡通气(alveolar ventilation)。CO2产生与肺泡通气的关系由肺泡二氧化碳方程定义:
=== 方程 23.14 ===
<nowiki>\begin{array}{c}{\dot{\mathrm{VCO}}_{2}=\dot{\mathrm{V}}_{\mathrm{A}}×\mathrm{FACO}_{2}}\ {\text{或}}\ {\mathrm{FACO}_{2}=\dot{\mathrm{V}}CO2\big/\dot{\mathrm{V}}_{\mathrm{A}}}\end{array}</nowiki>
<nowiki>其中,\dot{\mathrm{VCO}}_{2} 是机体的二氧化碳生成率(\dot{\mathrm{VCO}}_{2}),\dot{\mathrm{V}}_{\mathrm{A}} 是每分钟肺泡通气量(alveolar ventilation),\mathrm{FAco}_{2} 是干燥肺泡气中二氧化碳的容积分数。该关系式表明,二氧化碳从肺泡的清除速率与肺泡通气量和肺泡内二氧化碳的容积分数相关。与其他任何气体的分压类似(见公式23.8),{\mathrm{PAco}}_{2} 由以下公式定义:</nowiki>
公式23.15
<nowiki>\mathrm{PACO}_{2}=\mathrm{FACO}_{2}×(\mathrm{P}_{\mathrm{b}}-\mathrm{PH}_{2}\mathrm{O})</nowiki>
将上式中的\mathrm{FAco}_{2}代入原方程,可得以下关系式:
公式23.16
<nowiki>\mathrm{PACO}_{2}=\frac{\Big[\dot{\mathrm{VCO}}_{2}×(\mathrm{P_{\mathrm{b}}}-\mathrm{PH}_{2}\mathrm{O})\Big]}{\dot{\mathrm{V}}_{\mathrm{A}}}</nowiki>
<nowiki>该方程揭示了几个重要关系。首先,肺泡二氧化碳分压(\mathrm{PAco}_{2})与每分钟肺泡通气量(\dot{\mathbf{V}}_{\mathrm{A}})呈反比,与呼出二氧化碳量无关。具体而言,若通气量翻倍,{\mathrm{PAco}}_{2}将下降50%;反之,若通气量减半,\mathrm{PAco}_{2}将翻倍。其次,在每分钟肺泡通气量(\dot{\mathbf{V}}_{\mathrm{A}})恒定时,二氧化碳的代谢生成量(\dot{\bf V}_{CO2})翻倍会导致{\mathrm{PAco}}_{2}翻倍。\dot{\mathbf{V}}_{\mathrm{A}}与{\mathrm{PAco}}_{2}的关系如图23.1所示。</nowiki>
=== 动脉血气组成 ===
正常肺脏中,\mathrm{Paco}_{2}受脑干呼吸中枢的精密调控,维持在40\pm2\mathrm{mm}\mathrm{Hg}。\mathrm{Paco}_{2}的升高或降低(尤其当伴随动脉\mathrm{pH}变化时)会对细胞功能(包括酶和蛋白活性)产生深远影响。脑干内的特殊化学感受器(见第25章)持续监测\mathrm{Paco}_{2},呼出分钟通气量(公式23.1)将根据\mathrm{Paco}_{2}水平进行调节。
\mathrm{Paco}_{2}的急性升高会导致呼吸性酸中毒(\mathrm{pH}<7.35),而急性降低则引发呼吸性碱中毒(\mathrm{pH>7.45})。高碳酸血症(hypercapnia)指\mathrm{Paco}_{2}升高,发生于二氧化碳生成超过肺泡通气量时(即通气不足)。相反,当肺泡通气量超过二氧化碳生成量时会发生过度通气(hyperventilation),导致\mathrm{Paco}_{2}下降(低碳酸血症,hypocapnia)。
=== 理想肺泡气与血液中呼吸气体的总压与分压(海平面23.1(760 mmHg)) ===
markdown
{| class="wikitable"
{| class="wikitable"
| colspan="3" |
|+表21.2 表面活性物质的组成和功能
| rowspan="2" |湿润气管肺泡气体 (R = 0.8)
!成分
| rowspan="2" |体循环动脉血
!组成百分比
| rowspan="2" |混合静脉血
!功能
|-
|'''磷脂(Phospholipids)'''
|80-85
|
|-
|磷脂酰胆碱
|70-80
|降低表面张力(Decrease surface tension)
|-
|磷脂酰甘油
|1-10
|铺展能力(Spreading ability)
|-
|-
|参数
|磷脂酰乙醇胺
|环境空气(干燥)
|1-2
|气道空气
|不明(Unclear)
|-
|-
|PO2
|磷脂酰丝氨酸
|159
|1-2
|150
|不明(Unclear)
|102
|90
|40
|-
|-
|PCO2
|磷脂酰肌醇
|0
|1-2
|0
|不明(Unclear)
|40
|40
|46
|-
|-
|PH2O, 37°C
|'''中性脂类(Neutral Lipids)'''
|0
|5-10
|47
|
|47
|47
|47
|-
|-
|PN2
|胆固醇
|601
|3-5
|563
|稳定作用(Stabilization)
|571a
|571
|571
|-
|-
|总压
|胆固醇酯
|760
|1-3
|760
|稳定作用(Stabilization)
|760
|-
|748
|'''游离脂肪酸'''
|704b
|1-3
|
|-
|'''蛋白质(Proteins)'''
|2-5
|
|-
|表面活性物质蛋白A
|2-4
|代谢更新、免疫调节、管状髓磷脂形成(Tubular myelin formation)
|-
|表面活性物质蛋白B
|2-4
|降低表面张力、铺展能力
|-
|表面活性物质蛋白C
|2-4
|降低表面张力、铺展能力、脂质层形成(Lipid layering)
|-
|表面活性物质蛋白D
|1-2
|未知(Unknown)
|}
|}
<nowiki>{\mathsf{a}}\mathsf{P}\mathsf{N}_{2}在肺泡气体中因呼吸商(R)通常小于1而增加1%。\mathsf{\Delta P}_{\mathrm{总压}}在静脉血中低于动脉血,因为\mathsf{PO}_{2}的下降幅度大于\mathsf{PCO}_{2}的上升幅度。PCO2:二氧化碳分压;PH2O:水蒸气分压;PN2:氮气分压;PO2:氧气分压;P总压}:所有参数的总压;R:呼吸商。</nowiki>
'''临床关联'''
<nowiki>• 图23.1 肺泡二氧化碳分压(\mathsf{PCO}_{2},y轴)与每分钟肺泡通气量(\dot{\mathbf{V}}_{\mathrm{A}},x轴)的关系。每条线对应特定代谢率下的恒定CO2生成量(\dot{V}CO_{2}等代谢线)。正常情况下,肺泡通气量受调控以维持肺泡\mathsf{PCO}_{2}约40 mm H9。静息状态下,当\dot{\pmb{\upnu}}_{CO2}约为250 mL/分钟时,5 L/分钟的肺泡通气量可使肺泡\mathsf{PCO}_{2}维持在40 mm Hg。静息时通气量减少50%(即从5降至2.5 L/分钟)会导致肺泡\mathsf{PCO}_{2}翻倍。运动时,CO2生成量增加(\dot{\mathbf{N}}_{CO2}=750 mL/分钟),为维持正常肺泡\mathsf{PCO}_{2},通气量必须增加(本例中需增至15 L/分钟)。同样,若此时通气量减少50%(从15降至7.5 L/分钟),肺泡\mathsf{PCO}_{2}也会翻倍。</nowiki>
1959年,Avery和Mead发现死于透明膜病(hyaline membrane disease , HMD)的早产儿肺部存在表面活性物质(surfactant)缺乏。HMD又称新生儿呼吸窘迫综合征,其特征是肺单位进行性不张(去气化)、呼吸衰竭和(严重时)死亡。这是新生儿期发病和死亡的主要原因。早产儿表面活性物质缺乏的主要成分是磷脂酰甘油(phosphatidylglycerol)不足。一般而言,随着羊水中磷脂酰甘油水平的升高,婴儿死亡率会降低。该领域的研究最终成功实现了通过表面活性物质替代疗法治疗早产儿HMD。目前,表面活性物质替代疗法已成为早产儿的标准化治疗方案。此外,分娩前会对产妇使用倍他米松(betamethasone)等类固醇药物以加速胎儿肺成熟。类固醇可穿过胎盘进入胎儿肺部,与II型肺泡细胞(type II pneumocytes)内表面活性物质DNA序列上游的固醇调节结构域结合,从而增加表面活性物质RNA转录和表面活性物质蛋白的生成。
=== 通气分布 ===
=== 通气在肺内的分布 ===
肺内通气并非均匀分布,这主要受重力效应影响。在直立位时,大多数肺容积状态下,靠近肺尖端的肺泡比基底部肺泡扩张更明显。重力将肺向下牵拉使其远离胸壁,导致肺尖部的胸膜腔内压(Ppl)比基底部更低(即更负),静态跨肺压(PL = PA - Ppl)增大,从而使肺尖部肺泡容积增加。
由于肺尖部与基底部肺泡容积的差异(图23.2),基底部肺泡位于压力-容积曲线的陡峭段,因此获得更多通气量(即顺应性(compliance)更高)。相反,肺尖部肺泡更靠近压力-容积曲线的顶部或平坦段,顺应性较低,因而获得的潮气量比例较小。当人体处于仰卧位而非直立位时,重力效应减弱;仰卧位与俯卧位相比,重力效应也更小。这是因为仰卧位时膈肌被推向头侧(cephalad),从而影响所有肺泡的尺寸。
==== 时间常数对通气分布的影响 ====
除重力对通气分布的影响外,肺泡通气的非均匀性还与气道阻力(R)或顺应性(C)的差异有关,这可通过时间常数(τ)进行定量描述: '''图23.2''' 肺容积的区域性分布,包括不同肺容积下肺泡大小(圆圈表示)及其在肺压力-容积曲线上的位置。由于直立位时肺被悬吊,肺尖部肺单位的胸膜腔内压(Ppl)和跨肺压(PL)均大于基底部。在任何肺容积下,尖部肺单位均比基底部更大。这种效应在残气量(RV)时最显著,功能残气量(FRC)时减弱,而在肺总量(TLC)时消失。需注意,由于在压力-容积曲线上的“位置”不同,吸入气体在这些肺单位中的分布存在差异:尖部顺应性较低,获得的吸入气体比例小于基底部顺应性更高的肺单位(即位于压力-容积曲线更陡峭段的部分)。
时间常数较长的肺泡单位充盈和排空速度较慢。因此,气道阻力增加或顺应性增高的肺泡单位需要更长时间完成充盈和排空。成人的正常呼吸频率约为12次/分钟,吸气时间约2秒,呼气时间约3秒。正常肺中,这一时间足以接近容积平衡(图23.3)。然而,当存在阻力增加或顺应性增高时,容积平衡将无法达成。
=== 临床意义 ===
=== 慢性阻塞性肺疾病患者的呼吸力学改变 ===
慢性阻塞性肺疾病(COPD)患者由于气道阻力增加(在肺气肿病例中还伴有顺应性增加)而具有较长的时间常数(time constant)。因此,这类患者倾向于以较低的呼吸频率进行呼吸。当COPD患者进行体力活动(如爬楼梯)时,呼吸频率的增加会导致呼气时间不足,从而引发称为动态过度充气(dynamic hyperinflation)的过程(图23.4)。本已增大的肺容积会进一步增加,过度膨胀的肺顺应性降低,呼吸功(已高于健康个体)进一步升高。
=== 肺血管阻力 ===
<nowiki>肺循环中的血流具有搏动性,其受肺血管阻力(pulmonary vascular resistance, PVR)、重力、肺泡压力及动静脉压力梯度的影响。PVR的计算公式为肺动脉压(\mathrm{P_{\mathrm{PA}}})与左心房压(\mathrm{P_{LA}}})之差除以血流量(\mathrm{Q_{T}}})(即心输出量):</nowiki>
• 图23.3 不同肺单位因阻力(R)或顺应性(C)差异导致的局部通气调节示例。上图示三个不同肺单位的阻力与顺应性参数。下图显示这三个肺单位随时间变化的容积。在正常肺(N)中,时间常数(\tau)为0.56秒,该肺单位在正常吸气时间(2秒)内达到97%的最终容积平衡。右侧肺单位(↑R)阻力增加两倍,时间常数倍增,导致其在正常吸气时间内仅达到80%容积平衡(见图表),表现为通气不足。左侧肺单位(↓C)顺应性降低("僵硬"),时间常数缩短,虽在1秒内达到最大容积,但通气量仅为正常肺单位的一半。
公式23.18
<nowiki>\mathrm{PVR}=\frac{\mathrm{P_{\mathrm{PA}}-P_{\mathrm{LA}}}}{\mathrm{Q_{T}}}</nowiki>
正常情况下:
公式23.19
<nowiki>\mathrm{PVR}=\frac{14~\mathrm{mm}~\mathrm{Hg}-8~\mathrm{mm}~\mathrm{Hg}}{6~\mathrm{L/minute}}{=}1.00~\mathrm{mm}~\mathrm{Hg/L/minute}</nowiki>
该阻力约为体循环阻力的十分之一。肺循环具有两大独特机制,可在需求增加时提高血流量而不升高压力:(1)在运动等需求增加情况下,通常会募集正常情况下关闭的肺血管;(2)肺循环血管具有高度可扩张性,其直径在肺动脉压轻微升高时即可显著增加。
<nowiki>图23.4 动态性过度充气。呼吸总时间(\top_{\mathrm{tot}})由吸气时间(T_{j})和呼气时间(T_{e})组成。当呼吸频率增加时(如运动期间),\top_{\mathrm{tot}}缩短。在慢性阻塞性肺疾病(COPD)患者中,\top_{\mathrm{tot}}增加对T_{e}的影响可能使长时间常数的肺泡无法完全排空,随着每次呼吸的进行,肺容积逐渐增加(气体陷闭)。这种肺容积的升高最终导致过度充气程度加剧,使得患者无法继续完成克服高肺容积状态下肺顺应性降低所需做的功。这是此类患者活动时呼吸短促的主要原因。FRC为功能残气量。</nowiki>
肺容积通过影响肺泡毛细血管(图23.5)来改变肺血管阻力(PVR)。在吸气末,充满气体的肺泡会压迫肺泡毛细血管,增加PVR。与体循环中的毛细血管床不同,肺部的毛细血管床约占PVR的40%。较大的肺泡外血管直径在吸气末因径向牵引和弹性回缩而增大,其PVR在较高肺容积时较低。呼气期间,萎陷的肺泡对肺泡毛细血管的阻力最小,其PVR降低,而呼气时较高的胸膜压会增加肺泡外血管的PVR。由于肺容积对PVR的这些相反效应,肺总PVR在FRC时达到最低值。
=== 肺血流分布 ===
由于肺循环是低压/低阻力系统,其受重力影响的程度远大于体循环。这种重力效应导致肺内血流分布不均。正常直立位静息状态下,肺尖至肺底的血流量逐渐增加,肺底血流量最大。类似地,仰卧位时,最上部(前部)区域血流量最少,而较低(后部)区域血流量最大。在应激状态下(如运动),直立位患者肺尖与肺底的血流量差异会减小,这主要归因于动脉压的升高。
图23.5 肺活量变化对总肺血管阻力影响的示意图,以及肺泡血管与肺泡外血管对总阻力的贡献。从残气量(RV)到肺总量(TLC)的充气过程中,肺泡血管的血流阻力增加,而肺泡外血管的阻力降低。因此,肺充气期间总肺血管阻力的变化呈U型曲线,最低点位于功能残气量(FRC)。
=== 肺血流分布的重力效应 ===
在直立人体内,血液离开肺动脉后必须克服重力才能到达肺尖部。肺动脉段每高于心脏位置1厘米,其流体静压(hydrostatic pressure)就会相应降低0.74 mmHg。因此,位于心脏上方10厘米处的肺动脉段压力,比心脏水平处的肺动脉段压力低7.4 mmHg。反之,位于心脏下方5厘米的肺动脉段压力会增加3.7 mmHg。重力对血流的这种效应对动脉和静脉的影响程度相同,导致从肺尖到肺底的动静脉压力存在显著差异。这些差异会影响血流和通气/灌注比值。
=== 肺泡压对血流的影响 ===
除了肺动脉压(Pₐ)与肺静脉压(Pᵥ)的梯度外,肺泡压(Pₐₗ)的差异也会影响肺部血流。经典理论认为,肺可分为三个功能分区(图23.6)。 '''第1区'''代表肺尖部,此处Pₐ过低以致可能被Pₐₗ超过。由于外部Pₐₗ较高,毛细血管发生塌陷;
• '''图23.6''' 解释肺部血流不均匀分布的模型,图示影响毛细血管的压力。Pₐₗ:肺泡压;Pₐ:肺动脉压;Pᵥ:肺静脉压。(引自West JB, Dollery CT, Naimark A. ''J Appl Physiol''. 1964;19:713.)
血流因此中断。正常情况下该区并不存在,但在正压机械通气或Pₐ显著降低时(如循环血容量急剧减少)可能形成。'''第2区'''(肺上1/3区域)的Pₐ大于Pₐₗ,而Pₐₗ又大于Pᵥ。由于Pₐₗ高于Pᵥ,较高的外部Pₐₗ会使毛细血管部分塌陷,产生"蓄水效应(damming effect)",从而减少该区域整体血流。这种现象常被称为瀑布效应(waterfall effect)。'''第3区'''的Pₐ大于Pᵥ,而Pᵥ又大于Pₐₗ,血流在此区域依压力梯度流动。肺底部血流较大,因为增加的跨壁压使血管扩张并降低阻力。
=== 血流的主动调节 ===
肺内血流主要通过前述被动机制调节。然而,也存在若干主动调节机制。尽管肺血管周围的平滑肌比体循环血管薄得多,但其厚度足以改变血管口径从而影响肺血管阻力(PVR,pulmonary vascular resistance)。氧浓度对血流有重要影响。小动脉会因肺泡氧分压(PAO₂)降低而发生低氧性血管收缩(hypoxic vasoconstriction)。该反应具有局部性,其效应是将血流从低氧区域转移到氧合更好的肺区域,以增强气体交换。孤立的局部缺氧不会改变PVR;只有当约20%的血管处于缺氧状态时,才能检测到PVR的变化。因高海拔导致的吸入氧浓度降低对PVR影响更大,因为所有血管都会受到影响。吸入高浓度氧气可使肺血管扩张并降低PVR。其他因素及某些激素(Box23.1)也可影响血管口径,但其效应通常呈局部性、短暂性,且仅在病理状态下具有重要意义。肺毛细血管缺乏平滑肌,因此不受这些机制影响。
部分人群的肺动脉血管阻力及后续肺动脉压会升高(肺动脉高压)。肺动脉高压的病理生理学病因众多,包括慢性缺氧、结缔组织病、特定药物/毒素和慢性肺栓塞。某些病例(特发性肺动脉高压)的病因尚不明确。
=== 肺血管收缩因子 ===
低PAO₂ 血栓素A₂ α-肾上腺素能儿茶酚胺 血管紧张素 白三烯 神经肽 5-羟色胺 内皮素 组胺 前列腺素 高CO₂
=== 肺血管舒张因子 ===
高PAO₂ 前列环素 一氧化氮 乙酰胆碱 缓激肽 多巴胺 β-肾上腺素能儿茶酚胺
PAO₂:肺泡内氧分压
=== 细胞水平 ===
''Endothelin-1''是由血管内皮产生的21氨基酸肽。内皮素调节肺动脉张力,是强效血管收缩剂。在肺动脉高压患者中发现内皮素-1表达增加。内皮素-1还可降低一氧化氮合酶的内皮表达。由于一氧化氮是血管舒张因子,其浓度降低会导致血管舒张减弱。内皮素-1拮抗剂(如bosentan、ambrisentan、sitaxentan)已被研发,成为治疗肺动脉高压的重要药物。磷酸二酯酶抑制剂(如sildenafil、tadalafil)可增强一氧化氮效应,从而产生更强的血管舒张作用。
=== 通气/灌注关系 ===
=== 通气/血流比 ===
<nowiki>通气(ventilation,\dot{\mathbf{V}})与肺灌注(perfusion,\dot{\mathbf{Q}})是正常气体交换的关键组成部分,但二者间的正常关系并不足以确保气体交换正常进行。通气/血流比(ventilation/perfusion ratio,亦称\dot{\mathbf{V}}/\dot{\mathbf{Q}}比)定义为通气量与血流量的比值。这一比值可针对单个肺泡、一组肺泡或全肺进行定义。在单个肺泡水平,该比值定义为每分钟肺泡通气量(alveolar ventilation,\dot{\mathbf{V}}_{\mathrm{A}})除以毛细血管血流量(capillary flow,\dot{\mathbf{Q}}_{c})。在肺整体水平,该比值定义为总肺泡通气量除以心输出量。</nowiki>
<nowiki>正常肺中,肺泡通气量约为4.0~\mathrm{L}/分钟,而肺血流量约为5.0~\mathrm{L}/分钟。因此正常肺的整体通气/血流比约为0.8,但不同肺单位的\dot{\mathbf{V}}/\dot{\mathbf{Q}}比范围差异显著。当通气超过灌注时,通气/血流比大于1(\dot{V}/\dot{Q}>1);当灌注超过通气时,通气/血流比小于1(\dot{\mathbf{V}}/\dot{\mathbf{Q}}<1)。肺血流量与通气的失调会导致O2和CO2转运受损。在患有心肺疾病的个体中,肺血流量与肺泡通气的失调是体循环动脉低氧血症(\mathrm{PaO}_{2}降低)最常见的原因。一般而言,\dot{\mathbf{V}}/\dot{\mathbf{Q}}比大于1的情况不会导致低氧血症。</nowiki>
<nowiki>正常的通气/血流比并不意味着该肺单位的通气和灌注本身正常,仅表明二者的比例关系正常。例如,在大叶性肺炎(lobar pneumonia)中,受累肺叶的通气减少。若该区域灌注未改变,则灌注将超过通气(即通气/血流比小于1,\dot{\mathbf{V}}/\dot{\mathbf{Q}}<1)。然而,该区域通气的下降会引起供应该肺叶的肺动脉床发生低氧性血管收缩(hypoxic vasoconstriction),导致受累区域灌注减少,从而使通气/血流比趋于"正常"。尽管如此,该区域的通气和灌注均未恢复正常(二者均降低),但二者关系可能接近正常范围。</nowiki>
=== 通气/血流比的区域差异 ===
<nowiki>通气/血流比在肺的不同区域存在差异。在直立个体中,尽管通气和灌注均从肺尖向肺底递增,但通气的增幅小于血流量的增幅。因此,肺尖的正常\dot{\mathbf{V}}/\dot{\mathbf{Q}}比远大于1(通气超过灌注),而肺底的\dot{\mathbf{V}}/\dot{\mathbf{Q}}比远小于1(灌注超过通气)。图23.7展示了从肺尖到肺底的通气与灌注关系。</nowiki>
=== 肺泡-动脉氧分压差 ===
【注:原文"\bf\hat{\chi}(\dot{V}/\dot{Q}>1)"和"\bf\ddot{V}/\dot{Q}"可能存在排版错误,此处保留原符号形式】
= 动物生理学教材翻译 =
== 气体交换的生理学基础 ==
由于二氧化碳(CO₂)的溶解特性,肺泡二氧化碳分压(PAco₂)与动脉血二氧化碳分压(Paco₂)相等(详见第24章)。然而,氧气(O₂)的肺泡分压(PAo₂)与动脉血氧分压(Pao₂)并不相同。即使在肺功能正常的个体中,PAo₂也略高于Pao₂。两者之间的差值称为'''肺泡-动脉氧分压差(alveolar-arterial difference for oxygen, AaDo₂)'''。AaDo₂升高是氧气交换异常的标志。健康个体中的这一微小差异并非由“不完美”的气体交换引起,而是由于少量静脉血绕过肺部直接汇入动脉循环所致。左心室心肌的'''thebesian vessels'''直接引流至左心室(而非右心房的冠状窦),部分支气管和纵隔静脉则汇入肺静脉。这会导致'''静脉血掺杂(venous admixture)''',从而降低Pao₂(此为解剖分流的示例,参见“解剖分流”章节)。约2%至3%的心输出量通过此类分流绕过肺部。
<nowiki>• 图23.7 直立位正常肺的通气/血流比值关系。为简化图示,仅显示肺尖与肺底数值。每列中,上方数字代表肺尖值,下方数字代表肺底值。PCO_{2}:二氧化碳分压;PN_{2}:氮气分压;PO_{2}:氧气分压;\dot{\pmb{Q}}:每分钟血流量;\dot{\pmb{v}}_{\pmb{A}}:每分钟肺泡通气量。</nowiki>
为评估肺部气体交换的临床效能,需测量Pao₂与Paco₂。PAo₂可通过'''肺泡气方程(alveolar air equation)'''(公式23.13)计算得出。计算所得的PAo₂与实测Pao₂的差值即为AaDo₂。对于呼吸空气且肺功能正常的个体,AaDo₂小于15 mmHg。30岁后,该值每十年平均升高约3 mmHg。因此,AaDo₂低于25 mmHg被视为正常范围上限。
----
=== 临床案例 ===
一名肺炎患者通过面罩接受30%的辅助供氧(O₂)。动脉血气分析显示pH为7.40,Paco₂为44 mmHg,Pao₂为70 mmHg。该患者的AaDo₂为多少?(假设患者处于海平面且呼吸商(respiratory quotient, R)为0.8。)根据肺泡气方程(公式23.13):
<nowiki>\begin{array}{rl} & \mathrm{PAO}_{2} = \left[ \mathrm{FiO}_{2} × (\mathrm{P}_{\mathrm{b}} - \mathrm{PH}_{2}\mathrm{O}) \right] - \frac{\mathrm{PACO}_{2}}{\mathrm{R}} \\ & \mathrm{PAO}_{2} = \left[ 0.3 × (760 - 47) \right] - \frac{44}{0.8} \\ & \qquad = 159 \, mmHg \end{array}</nowiki>
因此:
\begin{array}{c} \mathrm{AaDO}_{2} = \mathrm{PAO}_{2} - \mathrm{PaO}_{2} \\ = 159 - 70 = 89 \, mmHg \end{array}
=== 23.2 低氧性缺氧的病因 ===
<nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki>病因<nowiki></td></nowiki><nowiki><td></nowiki>PaO₂<nowiki></td></nowiki><nowiki><td></nowiki>AaDO₂<nowiki></td></nowiki><nowiki><td></nowiki>100%氧疗后PaO₂反应<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>解剖分流<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki><td></nowiki>无显著变化<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>生理分流<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>吸入氧浓度降低<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>正常<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>低通气/血流比<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>弥散异常<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>低通气<nowiki></td></nowiki><nowiki><td></nowiki>降低<nowiki></td></nowiki><nowiki><td></nowiki>正常<nowiki></td></nowiki><nowiki><td></nowiki>升高<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki>
AaDO₂:肺泡-动脉氧分压差;FIO₂:吸入氧浓度;PaO₂:动脉血氧分压
=== 动脉血低氧血症、缺氧与高碳酸血症 ===
动脉低氧血症(arterial hypoxemia)定义为海平面呼吸空气的成人动脉血氧分压(PaO₂)低于80 mmHg。缺氧(hypoxia)指氧气不足以维持正常代谢功能,当PaO₂低于60 mmHg时常发生缺氧。缺氧可分为四大类:
第一类为'''低氧性缺氧(hypoxic hypoxia)''',是最常见的类型。与低氧性缺氧相关的六种主要肺部病变——解剖分流(anatomical shunt)、生理分流(physiological shunt)、吸入氧浓度(FIO₂)降低、通气/血流(V̇/Q̇)比例失调、弥散异常(diffusion abnormalities)和低通气(hypoventilation)——将在下文和表23.2中详细阐述。
第二类为'''贫血性缺氧(anemic hypoxia)''',由功能性血红蛋白量减少引起,原因包括血红蛋白含量过低、血红蛋白异常或氧与血红蛋白的化学结合受阻(如一氧化碳中毒;见下文"临床聚焦"专栏)。
第三类为'''低灌注性缺氧(hypoperfusion hypoxia)''',源于血流量减少(如心输出量下降)导致的组织氧输送降低。
第四类'''组织中毒性缺氧(histotoxic hypoxia)'''发生于细胞利用氧产生能量的机制被毒素抑制时(如氰化物中毒)。这种情况下,由于氧未被利用,动脉和静脉血氧分压(PO₂)可正常或升高。
=== IN THE CLINIC ===
=== 一氧化碳中毒 ===
一氧化碳是燃烧副产物,可通过燃料加热器、汽车尾气或建筑物火灾等多种来源产生。暴露于一氧化碳浓度升高环境中的人会出现头痛、恶心和头晕症状。若暴露程度严重,可能导致死亡。一氧化碳中毒时,患者嘴唇常呈现樱桃红色,且脉搏血氧仪测得的氧饱和度可能假性升高。即使进行动脉血气分析,\mathsf{P A o}_{2}(肺泡氧分压)也可能显示正常。然而由于一氧化碳与血红蛋白分子紧密结合,可用于结合和运输氧气的血红蛋白所剩无几,从而导致组织低氧血症。因此临床医生必须识别潜在的一氧化碳中毒病例,并使用一氧化碳血氧仪(CO-oximeter)或通过动脉血气分析进行氧饱和度检测。若患者存在一氧化碳中毒,血氧仪测得的氧饱和度与一氧化碳血氧仪测量值之间会出现显著差异。动脉血气分析可确认碳氧血红蛋白的升高。
=== 通气/血流异常与分流 ===
=== 解剖性分流 ===
<nowiki>研究通气与血流关系的有效方法是使用假设的双肺单位模型(图23.8)。两个肺泡"肺单位"接受通气,每个单位均由心脏供血。当通气均匀分布时,一半的吸入气体进入每个肺泡;当血流均匀分布时,一半的心输出量进入每个肺泡。在此正常模型中,每个肺泡的通气/血流比值(V/Q ratio)相同且等于1。肺泡由脱氧的混合静脉血灌注,这些血液含有升高的\mathrm{Paco}_{2}(混合静脉血二氧化碳分压)。\mathrm{PAo}_{2}(肺泡氧分压)高于混合静脉血O2分压,这形成了氧气向血液中移动的梯度。相反,混合静脉血CO2分压高于{\mathrm{PAco}}_{2}(肺泡二氧化碳分压),这形成了二氧化碳向肺泡移动的梯度。需注意在此理想模型中,肺泡-动脉氧分压差值不存在。</nowiki>
• 图23.8 两个正常平行肺单位的简化肺模型。两个单位按其体积接受等量的气体和血流。血液和肺泡气体分压值为海平面静息状态下的正常值。P A C O_{2}:肺泡二氧化碳分压;P A O_{2}:肺泡氧分压;P i c o_{2}:吸入气二氧化碳分压;P i O_{2}:吸入气氧分压;P p v c o_{2}:肺静脉血二氧化碳分压;P p v o_{2}:肺静脉血氧分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{C O}_{2}:混合静脉血二氧化碳分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{O}_{2}:混合静脉血氧分压。
== 解剖分流(anatomical shunt) ==
当混合静脉血(mixed venous blood)绕过气体交换单元直接进入动脉循环时,即发生解剖分流(图23.9)。此时肺泡通气量、肺泡气体分布及肺泡气体成分均正常,但心输出量的分布发生改变。部分心输出量流经供应气体交换单元的肺毛细血管床,其余部分则绕过气体交换单元直接进入动脉循环。绕过气体交换单元的血液因此被分流,由于该血液处于脱氧状态,这种分流类型称为右向左分流(right-to-left shunt)。大多数解剖分流发生在心脏内部,当右心房或右心室的脱氧血液通过间隔缺损与左心房或左心室的血液混合时即形成分流。这种右向左分流的作用是将脱氧血液与氧合血液混合,导致不同程度的动脉低氧血症。
解剖分流的一个重要特征是:若让受影响的个体呼吸100% O2,其血氧饱和度仅出现极小幅度升高。
• 图23.9 右向左分流。肺泡通气正常,但部分心输出量绕过肺部与氧合血液混合。\mathsf{P a o}_{2}随分流量大小而变化。P A C O_{2}:肺泡二氧化碳分压;P A o_{2}:肺泡氧分压;P i c o_{2}:吸入气二氧化碳分压;P i O_{2}:吸入气氧分压;P p v c o_{2}:肺静脉血二氧化碳分压;P p v o_{2}:肺静脉血氧分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{C O}_{2}:混合静脉血二氧化碳分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{O}_{2}:混合静脉血氧分压。
绕过气体交换单元的血液从未接触富氧的O2,因此持续处于脱氧状态。未被分流的血液中\mathrm{PO}_{2}升高,并与脱氧血液混合。因此,吸入100% O2后持续低氧血症的程度取决于分流血液的量。正常情况下,灌注通气肺泡的血液中血红蛋白几乎完全饱和,因此增加的O2主要以溶解形式存在(见第24章)。
解剖分流的\mathrm{Paco}_{2}通常不会升高,尽管分流血液的CO2水平增高。这是由于中枢化学感受器(见第25章)会对任何CO2升高产生反应,通过增加通气量使\mathrm{Paco}_{2}降至正常范围。若低氧血症严重,低氧血症继发的呼吸驱动力增强会提高通气量,可能使\mathrm{Paco}_{2}降至正常范围以下。
=== 生理分流(Physiological Shunts) ===
<nowiki>当肺单元在持续灌注的情况下缺乏通气时,就会形成生理性分流(physiological shunt,也称为静脉血掺杂(venous admixture))(图23.10)。在这种双肺单元模型中,所有通气都流向另一个肺单元,而灌注则在两个肺单元之间均等分布。无通气但有灌注的肺单元其\dot{\mathbf{V}}/\dot{\mathbf{Q}}比值为0。灌注该单元的血液是混合静脉血;由于没有通气,该单元内不发生气体交换,离开该单元的血液仍保持混合静脉血的特征。生理性分流对氧合的影响类似于解剖性分流,即脱氧血液绕过气体交换单元并与动脉血混合。临床上,肺不张(atelectasis)(部分肺组织塌陷或脱气)是肺区域出现\dot{\mathbf{V}}/\dot{\mathbf{Q}}为0的典型情况,因为塌陷的肺单元没有通气。肺不张的病因包括黏液栓、气道水肿、异物和气道内肿瘤。术后吸气努力减弱是肺不张的常见诱因。</nowiki>
• 图23.10 生理性分流(静脉血掺杂)示意图。注意与\mathsf{P C O}_{2}相比,\mathsf{P a o}_{2}显著降低。本例中氧气的肺泡-动脉差(\mathsf{A a D o}_{2})为85 mmHg。P A C O_{2}:肺泡二氧化碳分压;P A O_{2}:肺泡氧分压;P i c o_{2}\mathrm{:\Gamma}:吸入气二氧化碳分压;P i O_{2}:吸入气氧分压;P p v c o_{2}:肺静脉血二氧化碳分压;P p v o_{2}:肺静脉血氧分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{C O}_{2}\mathrm{:}:混合静脉血二氧化碳分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{O}_{2},:混合静脉血氧分压。注意来自未通气肺单元(上部)与完全通气肺单元(下部)的肺静脉血中\mathsf{P p v o}_{2}和{\mathsf{P p v c o}}_{2}水平不同。混合后的\mathsf{P p v o}_{2}显著低于完全通气肺单元产生的\mathsf{P p v o}_{2}。
=== 低通气/灌注(Low Ventilation/Perfusion) ===
=== 通气与血流比例失调 ===
<nowiki>通气与血流比例失调是呼吸系统疾病患者发生动脉低氧血症(arterial hypoxemia)最常见的原因。在典型病例中,混合静脉血成分、总血流量(心输出量(cardiac output))及血流分布均正常。但当两个气体交换单元之间的肺泡通气分布不均(图23.11)而血流量均等分布时,通气减少的单元其通气/血流比值(\dot{\mathbf{V}}/\dot{\mathbf{Q}})小于1,而通气增加的单元其\dot{\mathbf{V}}/\dot{\mathbf{Q}}则大于1。这会导致肺泡和毛细血管末端的气体成分发生变化。</nowiki>
<nowiki>来自通气减少单元(\dot{\mathbf{V}}/\dot{\mathbf{Q}}<1)的血液中,动脉血氧含量(O2 content)和二氧化碳含量(CO2 content)均异常。通气增加的单元(\dot{\mathbf{V}}/\dot{\mathbf{Q}}>1)因过度通气,其CO2含量较低而O2含量较高。实际动脉血氧分压(\mathrm{Pao}_{2})和二氧化碳分压(\mathrm{Paco}_{2})取决于这两个单元对动脉血的相对贡献比例。肺泡-动脉氧分压差(\mathrm{AaDo}_{2})会增大,因为一个单元的过度通气无法完全补偿另一单元的通气不足(无论是通过增加额外O2还是清除多余CO2)。</nowiki>
这种补偿不足对O2的影响比对CO2更显著,这体现在氧解离曲线(oxyhemoglobin dissociation curve)上段趋于平坦的特性,与CO2解离曲线的斜率形成对比(见第24章)。换言之,通气增加会提高肺泡氧分压(\mathrm{PAo}_{2}),但由于血红蛋白在过度通气区域已接近100%饱和,血液中的O2含量几乎不再增加。而CO2的情况不同,其解离曲线较陡的斜率表明,当通气增加时可清除更多CO2。因此,只要维持CO2分压梯度,CO2即可通过扩散持续排出。
• 图23.11 通气/血流比例失调对气体交换的影响。单侧肺单元通气量减少可能由黏液阻塞、气道水肿、支气管痉挛、异物或肿瘤引起。P A C O_{2}:肺泡二氧化碳分压;P A O_{2}:肺泡氧分压;P i c o_{2}:吸入气二氧化碳分压;P i O_{2}:吸入气氧分压;P p v c o_{2}:肺静脉血二氧化碳分压;P p v o_{2}:肺静脉血氧分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{C O}_{2}:混合静脉血二氧化碳分压;\mathsf{P}\overline<nowiki>{{\mathsf{V}}</nowiki>}\mathsf{O}_{2}:混合静脉血氧分压。
=== 肺泡低通气 ===
(Alveolar Hypoventilation)
\mathrm{PAO_2} 由氧摄取速率与通气补充氧速率之间的平衡决定。氧摄取取决于流经肺部的血流量及组织的代谢需求。当通气量减少时,\mathrm{PAO_2} 降低,随后 \mathrm{PaO_2} 也降低。此外,肺泡通气量(\dot{V}_A)与 \mathrm{PACO_2} 呈直接但反向相关。当通气量减半时,\mathrm{PACO_2} 会加倍,\mathrm{PaCO_2} 也随之加倍(见公式23.16)。不足以维持正常 \mathrm{CO_2} 水平的通气称为低通气(hypoventilation)。低通气总是导致 \mathrm{PaO_2} 下降和 \mathrm{PaCO_2} 升高。
低通气的一个标志是正常的肺泡-动脉氧分压差(\mathrm{AaDO_2})。低通气会降低 \mathrm{PAO_2},进而导致 \mathrm{PaO_2} 下降。由于气体交换正常,\mathrm{AaDO_2} 仍保持正常。低通气常见于中枢呼吸驱动力下降的疾病、呼吸肌无力,以及使用抑制呼吸驱动的药物时。然而在低通气状态下,肺部某些区域可能发生气体脱失(去通气,即肺不张),这些区域的通气/血流比(\dot{V}/\dot{Q})为0。此时,\mathrm{AaDO_2} 会升高。
=== 弥散异常 ===
氧气(\mathrm{O_2})跨肺泡-毛细血管屏障的弥散异常可能导致动脉低氧。肺泡与毛细血管中 \mathrm{O_2} 和 \mathrm{CO_2} 的平衡发生极为迅速——其耗时仅占红细胞通过肺毛细血管网络所需时间的极小部分。因此,在正常人身上几乎总能实现弥散平衡,即使在运动时(此时红细胞通过肺部的转运时间显著增加)也是如此。仅在高原(≥10,000英尺)运动时,可观察到因不完全弥散(弥散失衡)导致的 \mathrm{AaDO_2} 升高。即使对于弥散能力异常的个体,静息状态下的弥散失衡也较为罕见,但可能发生于代谢需求增加的场景(如运动、疾病或高原环境)。肺泡-毛细血管阻滞(alveolar-capillary block),即气-血屏障增厚,是低氧血症的罕见病因。即使肺泡壁增厚,只要红细胞转运时间未增加,通常仍有足够时间完成气体弥散。二氧化碳的弥散速率约为氧气的20倍,因此 \mathrm{CO_2} 弥散障碍在临床上极少具有实际意义。
=== 高碳酸血症的机制 ===
=== 高碳酸血症(\mathrm{Pco}_{2}升高)的发生机制 ===
<nowiki>高碳酸血症(\mathrm{Pco}_{2}升高)的发生主要有两种机制:通气不足(hypoventilation)和死腔通气(dead space ventilation)增加。如前所述,肺泡通气量与肺泡CO2呈负相关。当通气量减半时,{\mathrm{PAco}}_{2}和\mathrm{Paco}_{2}会加倍。通气不足总是会降低\mathrm{Pao}_{2}并升高\mathrm{Paco}_{2},从而导致低氧血症(hypoxemia),而此类低氧血症可通过补充高浓度O2缓解。死腔通气增加则发生在肺血流中断但通气正常的情况下,这种现象有时称为“无效通气”。最常见的原因是血凝块(肺栓塞,pulmonary embolus)阻塞肺循环某区域的血流。栓子使肺局部区域的血流中断,但该区域仍保持正常通气(\dot{\mathbf{V}}/\dot{\mathbf{Q}}=\infty)。在此情况下,通气是无效的,因为它无法为任何混合静脉血进行氧合,该区域成为生理性死腔。</nowiki>
<nowiki>肺内剩余灌注区域会接收全部的血流(局部灌注增加)并保持正常通气(局部通气未改变)。因此,由于\tilde{\mathbf{V}}/\dot{\mathbf{Q}}比值降低,会出现相对的“通气不足”。若未发生代偿,则\mathrm{Paco}_{2}升高,\mathrm{Pao}_{2}降低。然而,肺栓塞后的代偿几乎立即启动:局部支气管收缩发生,通气分布转向灌注区域。最终,动脉CO2和O2含量的变化被最小化。</nowiki>
=== 100%氧气对动脉血气异常的影响 ===
区分右向左分流(right-to-left shunt)与其他低氧血症原因的方法之一是让个体通过非重复呼吸面罩(nonrebreathing face mask)吸入100% O2约15分钟。当个体吸入100% O2时,肺泡内所有\mathrm{N}_{2}均被O2取代。根据肺泡气方程式(Eq. 23.13),此时\mathrm{PAo}_{2}的计算如下:
=== Equation 23.20 ===
\begin{array}{c}<nowiki>{{\mathrm{PAO}_{2}=\left[1.0×(\mathrm{P}_{\mathrm{b}}</nowiki>-\mathrm{P}_{\mathrm{H}_{2}\mathrm{O}})\right]-\mathrm{Paco}_{2}/0.8}}\ <nowiki>{{=\left[1.0×(760-47)\right]-40/0.8}}</nowiki>\ <nowiki>{{=713-50}}</nowiki>\ <nowiki>{{=663~\mathrm{mm}~\mathrm{Hg}}</nowiki>}\end{array}
在正常肺部,\mathrm{PAO}_{2}会迅速升高,这为氧气(O2)向毛细血管血液的转移提供了梯度。这与动脉血氧分压(\mathrm{PaO}_{2})的显著升高相关(见表23.2)。类似地,在吸入100% O2的15分钟内,即使通气/血流(V̇/Q̇)比值极低的区域,随着N₂被O2取代,其肺泡氧分压也会升高。若这些区域存在正常血流灌注,气体交换梯度得以维持,毛细血管末梢血液的氧含量将显著增加。相反,若存在右向左分流(right-to-left shunt),氧合作用无法得到改善,因为混合静脉血持续流经分流区域,并与灌注正常肺单位的血液混合。来自分流的低氧合血液降低了动脉血氧含量,并维持肺泡-动脉氧分压差(AaDO₂)。在规范实施的100% O2吸入实验中,若AaDO₂升高,则提示存在分流(解剖性或生理性);AaDO₂的幅度可用于量化分流部分占心输出量的比例。
=== 区域差异 ===
本章前文已讨论了通气与血流的区域差异及其相互关系,并描述了不同生理异常(如分流、V̇/Q̇失调和低通气)对动脉血O2和CO2水平的影响。然而还需指出,由于肺部不同区域的V̇/Q̇比值存在差异,来自这些区域的毛细血管末梢血液具有不同的O2和CO2水平。这些差异如图23.7所示,体现了肺部的复杂性。首先需注意,肺尖部容积小于肺底部容积。如前所述,肺尖部的通气和血流均少于肺底部,但血流的差异程度大于通气的差异。因此,肺尖部的V̇/Q̇比值较高,而肺基底部较低。这种通气/血流比差异导致肺尖与基底部肺泡的O2和CO2含量不同:肺尖部的\mathrm{PAO}_{2}高于基底部,而\mathrm{PACO}_{2}则低于基底部。这最终导致毛细血管末梢血液中气体含量的差异。肺基底部的毛细血管末梢\mathrm{PO}_{2}较低,因此其血液氧含量也低于肺尖部。此外,由于CO2含量的差异,这些区域毛细血管末梢的血液pH值也存在显著变化。运动时,流向肺尖部的血流增加,肺部血流分布趋于均匀化,因此肺尖与基底部的气体含量差异随运动而减小。
=== 关键要点 ===
=== 关键要点 ===
# 传导气道中的气体容积称为解剖死腔(anatomical dead space)。死腔通气量与潮气量呈反比。每次呼吸中未参与气体交换的气体总容积称为生理死腔(physiological dead space),其包括解剖死腔及由通气但未灌注肺泡形成的次级死腔。
# 气体从高压区域流向低压区域。需要正的跨肺压(transpulmonary pressure)来增加肺容积。在无气流时(吸气末和呼气末),呼吸系统的跨系统压差为0。在功能残气量(functional residual capacity, FRC)时,呼吸系统的跨系统压差为0,此时使肺容积减小的肺弹性回缩压(lung elastic recoil pressure)与胸壁为扩大容积产生的压力处于等值反向状态。
# <nowiki>混合气体中各组分分压之和等于总压力。某气体的分压(\mathrm{P_{gas}})等于该气体在混合气体中的分数(\mathrm{F_{gas}})乘以总压力(\mathrm{P_{total}})。传导气道不参与气体交换,因此加湿空气中的O2、\mathrm{N}_{2}和水蒸气分压在到达肺泡前保持恒定。</nowiki>
# 呼吸系统的压力梯度由呼吸肌的主动收缩及随后的舒张所形成。
# 肺泡内O2分压可通过肺泡气方程(Equation 23.13)得出。该方程用于计算\mathrm{AaDO}_{2}(肺泡-动脉氧分压差),这是评估动脉O2异常的实用指标。
# 肺容积由肺的弹性回缩特性与胸壁肌肉及结缔组织特性之间的平衡决定。
# <nowiki>CO2生成量与肺泡通气量的关系由肺泡二氧化碳方程(Equation 23.14)定义。无论CO2呼出量如何,{\mathrm{PAco}}_{2}与\mathrm{V_{A}}均呈反比。在正常肺中,脑干呼吸中枢严格调控\mathrm{Paco}_{2},使其稳定在约40mmHg。</nowiki>
# <nowiki>由于重力作用,通气和血流存在区域性差异。通气/血流比值(\dot{\mathbf{V}}/\dot{\mathbf{Q}})定义为通气量与血流量的比率。正常肺的整体通气/血流比值约为0.8。当通气超过灌注时,\dot{\mathbf{V}}/\dot{\mathbf{Q}}>1;当灌注超过通气时,\dot{\mathbf{V}}/\dot{\mathbf{Q}}<1。肺尖部\dot{\mathbf{V}}/\dot{\mathbf{Q}}比值较高(通气量增加而血流量极少),肺底部\dot{\mathbf{V}}/\dot{\mathbf{Q}}比值较低。正常肺个体呼吸空气时,\mathrm{AaDO}_{2}小于15mmHg,正常值上限为25mmHg。</nowiki>
# <nowiki>肺循环是一个低压、低阻力系统。在不增加压力的情况下募集新毛细血管和扩张小动脉是肺的独特特性,使其能在应激(如运动)时进行调节。肺血管阻力(PVR)为肺动脉压(\mathrm{P_{PA}})至左心房压(\mathrm{P_{LA}})的压力差除以心输出量(\mathrm{Q_{T}})。此阻力约为体循环的十分之一。</nowiki>
# <nowiki>缺氧分为四类(低氧性缺氧、贫血性缺氧、扩散性缺氧和组织中毒性缺氧),低氧性缺氧和低氧血症有六种机制(解剖分流、生理分流、\mathrm{Fio}_{2}降低、\dot{\mathbf{V}}/\dot{\mathbf{Q}}失调、扩散异常及通气不足)。</nowiki>
# 高碳酸血症的发生机制有两种:死腔通气增加和通气不足。
完成本章学习后,学生应能回答以下问题:
肺泡压(alveolar pressure)与胸膜压(pleural pressure)有何不同?
跨胸膜压力梯度(transpleural pressure gradient)是如何形成的?
肺容积(lung volume)与肺容量(lung capacity)有何区别?如何通过肺活量测定法(spirometry)测量肺活量(vital capacity)?为何残气量(residual volume)无法通过肺活量测定法测量?
为什么肺静态力学特性的改变会导致肺容积测量值的显著变化?
什么是肺顺应性(lung compliance)?
什么是肺表面活性物质(pulmonary surfactant),它如何帮助维持肺顺应性? 为实现气体交换的主要功能,空气必须进出肺部。肺与胸壁的力学特性决定了这种大量气体运动的难易程度。肺力学是研究肺和胸壁(包括膈肌、腹腔和前腹壁肌肉)力学特性的学科。理解肺力学对认识正常肺功能及疾病如何破坏这种正常功能至关重要。大多数肺部疾病会影响肺、胸壁或两者的力学特性。此外,肺部疾病导致的死亡几乎总是源于呼吸肌疲劳,这是由于呼吸肌无法克服肺、胸壁或两者力学特性的改变所致。肺力学包括静态力学(肺容积不随时间变化的力学特性)和动态力学(肺容积随时间变化的特性)。肺与胸壁的动态力学将在第22章讨论。
在健康人群中,肺和胸壁作为一个整体协同运动。这些结构之间存在胸膜腔(pleural space),在正常情况下最好将其视为潜在腔隙。由于肺和胸壁协同运动,吸气与呼气时它们的容积变化是相等的。肺和胸壁的容积变化由周围压力的变化驱动。根据惯例,肺和胸壁内部的压力以大气压为参照(大气压被视为0)。因此,胸膜腔内的负压是指低于大气压的压力。
此外,根据惯例,跨越肺或胸壁等表面的压力被定义为表面内部压力与外部压力之差。跨越肺和胸壁的压力差被称为跨壁压(transmural pressure,即跨越壁或表面的压力)。对于肺而言,这种跨壁压称为跨肺压(transpulmonary pressure或translung pressure,PL),其定义为气腔(肺泡压[alveolar pressure,PA])与肺周围压力(胸膜压[pleural pressure,Ppl])之差:
公式 21.1:PL=PA-Ppl
跨越胸壁的跨壁压(Pw)是胸膜压(内部压力,Ppl)与胸壁周围压力(Pb,即大气压或体表外部压力)之差:
公式 21.2:Pw=Ppl-Pb
呼吸系统的跨壁压(Prs)是肺的跨壁压与胸壁的跨壁压之和:
公式 21.3:Prs=PL+Pw=(PA-Ppl)+(Ppl-Pb)=PA-Pb
• 图21.1 正常与疾病状态下肺容积随跨肺压(transpulmonary pressure)变化的关系。跨肺压增大时,肺容积随之增加。图中同时显示了肺气肿(emphysema)和肺纤维化(pulmonary fibrosis)对肺容积的影响。需注意,在相同跨肺压变化下,这两种疾病导致的肺容积改变存在差异。TLC(总肺容量)指肺内气体总体积。 空气从高压区域流向低压区域,从而进出肺部。若无压力梯度,则无气流。因此,在吸气末和呼气末(无气流的时间段),肺泡压(PA)与大气压(Pb)相等,此时无压力梯度(Pb-PA=0)。然而,此时的胸膜压并非0。在吸气开始前,正常个体的胸膜压约为−3至−5 cm H₂O。因此,胸膜腔内的压力相对于大气压为负压。这种负压由肺的内向弹性回缩压(inward elastic recoil pressure)产生,其作用是“将肺拉离”胸壁。然而,由于肺与胸壁作为整体协同运动,肺无法真正脱离胸壁。因此,肺的内向弹性回缩压与胸壁的外向回缩压(outward recoil)相互平衡。
吸气开始时,膈肌和胸壁肌肉收缩,导致膈肌向下运动、胸廓向外向上运动。因此,胸膜压(pleural pressure)在吸气过程中降低。这种负压通过肺组织传递,导致肺泡压(alveolar pressure)下降。当肺泡压降至低于0时(即从大气压降至低于大气压),声门开放使气体进入气道。随着气体沿气道流向肺泡,气道内的压力梯度逐渐减小;当肺泡与大气之间不再存在压力梯度时,气流停止。
呼气时,膈肌上抬入胸腔,胸膜压升高(即负值减小),肺泡压转为正值,声门开放使气体再次从高压(肺泡)流向低压(大气)。肺泡内呼气的驱动力是肺弹性回缩力(elastic recoil)与胸膜压的总和(见第22章)。图21.2展示了吸气和呼气过程中压力变化、气流变化与容积变化的关系。正常个体平静呼吸时,吸气初期的肺泡压下降幅度较小(1-3cmH2O)。对于存在气道阻塞的个体,由于阻塞气道两侧产生更大的压力差,该下降幅度会显著增大。当肺泡压与大气压相等导致压力梯度消失时,气流即停止。
肺容积( Lung volumes,图21.3)及其决定因素是肺力学的重要组成部分。各种疾病可能改变特定肺容积,导致呼吸功增加(见第22章)。所有肺容积都是总肺容量(total lung capacity,TLC)的细分,TLC指最大吸气时肺内所含气体的总量。TLC由四个独立肺容积组成:补吸气量(IRV)、潮气量(Vt)、补呼气量(ERV)和残气量(RV)。 潮气量(Tidal Volume, Vt)指每次平静呼吸时进出肺部的气体量。补吸气量(Inspiratory Reserve Volume, IRV)指正常潮气呼吸后能额外吸入的气体量,这部分气体储备用于通气需求增加时(如运动或疾病)。补呼气量(Expiratory Reserve Volume, ERV)指正常潮气呼吸后能额外呼出的气体量,与IRV类似,在呼吸努力增强时使用。残气量(Residual Volume, RV)指完全呼气后仍"滞留"于肺内的气体量。
肺容量(lung capacity)被定义为两个或多个上述肺容积的总和。肺活量(Vital Capacity, VC)是Vt、IRV和ERV的总和,表示从最大吸气到最大呼气能排出的气体总量。TLC则是VC与RV的总和。
多数肺容积和容量可通过肺活量计(spirometer)测量。患者通过该装置呼吸时,气流运动被记录。通过平静呼吸可测得潮气量。随后患者进行最大吸气(确定IRV)并用力呼气至无法继续呼出,此时呼出的气体量即为VC。ERV可通过从VC中减去IRV和Vt计算得出。RV无法通过肺活量计直接测量,需采用更复杂的测试方法。
临床应用
肺功能测试常用于诊断肺功能异常及评估肺部疾病的进展。它们可区分两种主要的肺病理生理过程:阻塞性肺疾病和限制性肺疾病。例如,在正常个体中,残气量(RV)与肺总量(TLC)的比值小于0.25。 健康个体呼气末约有25%的气体总量残留在肺内("被截留")。在阻塞性肺疾病中,RV/TLC比值可能因RV增加超出TLC的任何增加比例而继发性升高 。胸部影像学检查中,由于截留气体量增加,肺部可能呈现"过度充气"表现。相反,在限制性肺疾病中,胸廓无法扩张至正常预期程度,因此TLC下降导致RV/TLC比值升高。
RV和TLC可通过两种方法测量:氦气稀释法和体容积描记法。这两种方法均用于临床,可提供有关肺功能和肺部疾病的重要信息。氦气稀释法是较传统且简单的方法,但其准确性通常低于需要精密昂贵设备的体容积描记法。
在正常个体中,通过氦气稀释法测量的功能残气量(FRC)与体容积描记法测得的FRC相同(表21.1)。但肺部疾病患者的情况则不同。氦气稀释法测得的FRC是与气道相通的气体容积,而体容积描记法测得的FRC是呼气末肺内气体总容积。若有大量气体被截留于肺内(因气道过早闭合;见第22章),体容积描记法测得的FRC将显著高于氦气稀释法结果。
肺容积
功能性残气量:2.4L
肺总量TLC:6L
潮气量:0.5L
呼吸频率:12/分
静态参数
胸膜压Ppl:-5cmH2O
功能残气量时胸壁顺应性:0.2L/cmH2O
功能残气量时肺顺应性:0.2L/cmH2O
• 图21.4 通过氦稀释法测量肺容积。C_{\tau}:惰性气体的已知浓度;C_{2}:气体的新(先前未知)浓度;V_{\uparrow}:箱体的已知容积;V_{2}:肺容积(初始未知)。
氦气稀释法的操作原理是:向已知容积(V1)的密闭容器内注入已知浓度(C1)的惰性气体(如氦气),随后将该容器连接至待测的未知容积(V2)(即待测肺容积)。待惰性气体充分分布后,测量其新浓度(C2)。通过惰性气体浓度的变化即可计算其分布的总容积(图21.4)。具体公式为:
C1×V1=C2(V1+V2)
• 图21.5 体描计装置。注意患者所处的箱体未在图中显示。 当使用体描计(body plethysmograph,body box,身体容积描记箱)测量肺容积时,波义耳气体定律——压力与体积的乘积为常数(在恒温条件下)——被用于计算肺容积。患者坐在一个气密箱中(图21.5),通过连接气流传感器(流速仪,pneumotach)的咬嘴进行呼吸。随后患者对着关闭的咬嘴进行急促呼吸动作。在此操作的呼气阶段,肺内气体被压缩,肺容积减少,而箱内压力因箱内气体体积增加而下降。已知箱体容积和口腔处箱压变化后,即可计算肺容积变化量(Δ V):
P1×V=P2(V-ΔV)
其中P1、P2为口腔压力,V表示功能残气量(FRC)。通过FRC测量,吸气量可记录为高于FRC的吸入气体体积,补呼气量(ERV)可确定为从FRC呼出的气体体积。这些测量值随后可用于计算其他肺容积参数。
是什么决定了肺总量(TLC)或残气量(RV)时的肺内气体体积?答案在于肺实质的特性以及肺与胸廓的相互作用。在健康个体中,肺和胸廓始终作为一个整体协同运动。肺内含有弹性纤维,其具有以下功能:(1)在应力作用下伸展,导致肺容积增加;(2)应力解除后被动回缩,导致肺容积减少。肺实质的弹性回缩力非常强。若无外力作用(如胸廓产生的力),肺将几乎不含气体(约为TLC的10%)。 同理,当呼吸肌伸展时胸廓容积可增大,呼吸肌长度缩短时则减小。在理论上去除肺实质的情况下,胸廓的静息容积会增大至约TLC的60%。
肺容积由肺的弹性特性与胸壁肌肉特性之间的平衡决定。肺和胸壁内所含空气的最大容积(即总肺容量,TLC)由吸气肌控制(参见第20章)。随着肺容积增大,胸壁肌肉逐渐拉长。肌肉拉长时,其产生力的能力随之下降。当吸气肌无法产生进一步扩张肺和胸壁所需的额外力量时,即达到TLC。
同理,肺内空气的最小容积(即残气量,RV)由呼气肌力量控制。肺容积减小时,呼气肌缩短,导致肌肉力量下降。肺容积减小还伴随胸壁向外回缩压的增强。当呼气肌力量不足以进一步缩小胸壁容积时,即达到RV。
功能残气量(FRC)指正常呼气末的肺容积,由肺实质为缩小体积产生的弹性回缩压(向内回缩)与胸壁为扩大体积产生的压力(向外回缩)之间的平衡决定。当胸壁肌力薄弱时,FRC会降低(肺弹性回缩压>胸壁肌力)。存在气道阻塞时,由于气道过早闭合导致气体滞留,FRC会升高(参见第22章)。
• 图21.6 肺、胸壁及呼吸系统的静态压力-容积曲线。呼吸系统曲线是各组成部分曲线的总和。肺的曲线与图21.1中正常肺的曲线相同。FRC,功能残气量;P_{L},跨肺压;P_{r s},呼吸系统跨壁压;P_{w},胸壁跨壁压;RV,残气量;TLC,肺总量。 通过分析肺、胸壁和呼吸系统的压力-容积曲线(图21.6),可得出若干重要结论:
在肺的静息容积(FRC)状态下,肺的弹性回缩力使肺容积减小,但这种向内回缩力被胸壁的向外回缩力所抵消
在FRC时,这两种力量大小相等、方向相反,此时肌肉处于松弛状态
因此FRC状态下的呼吸系统跨壁压Prs为0
在TLC状态下,肺压和胸壁压均为正压,均需要正跨壁扩张压 无肺组织存在时,胸壁的静息容积是其跨壁压为0时的容积,约为TLC的60%。当容积超过TLC的60%时,胸壁向内回缩需要正跨壁压;当容积低于TLC的60%时,胸壁倾向于向外回缩。
当跨肺压(transpulmonary pressure)为0时,肺的容积最小。然而,由于表面活性物质(surfactant)降低表面张力的特性(见"表面活性物质"章节),当跨肺压为0时肺内并非完全无气。单独的肺在跨壁压(transmural pressure)超过20cmH2O时趋于平坦,因为此时已达到肺的弹性极限。因此,跨壁压的进一步增加几乎不会引起容积变化,顺应性(compliance)(见"肺顺应性"章节)降低。肺的进一步扩张受限于其结缔组织(胶原蛋白、弹性蛋白)。若施加更大压力,靠近肺表面的肺泡可能破裂,空气可逸入胸膜腔,这种现象称为气胸(pneumothorax)。气胸可分为自发性(肺泡破裂)、创伤性(穿透性胸壁损伤)或某些侵入性胸部操作后的并发症。气胸发生时,肺与胸壁不再作为整体运作:肺回缩直至跨肺压为0;胸壁则扩张直至跨胸壁压(trans chest wall pressure)为0。
跨肺压与胸膜腔压、肺泡压及弹性回缩压的关系见图21.7。肺泡压是胸膜腔压与肺弹性回缩压Pel之和:
公式21.4:PA=Ppl+Pel
由于跨肺压(PL)=PA-Ppl,可得:
公式21.5:PL=(Pel+Ppl)-Ppl=Pel
通常,PL是使肺扩张的压力,而Pel是促使肺塌陷的压力。肺弹性回缩力随肺充气量的增加而增强。
• 图21.7 跨肺压(P_L)与胸膜压(P_pI)、肺泡压(P_A)及肺弹性回缩压(P_el)的关系。肺泡压是胸膜压与弹性回缩压之和。跨肺压是肺泡压与胸膜压之差。 肺顺应性(compliance,CL)反映肺的弹性特性,表示肺被扩张的难易程度。其定义为:在扩张压改变1 cm H2O时引起的肺容积变化量。顺应性单位为毫升(或升)/厘米水柱。当肺顺应性高时,肺容易扩张;当顺应性低(肺"僵硬")时,肺难以扩张。肺顺应性CL可表示为:
公式21.6:CL=ΔV/ΔP
• 图21.8 呼气压力-容积曲线。患者吸气至肺总量(total lung capacity)后,使用食管气囊(测量胸膜压)测量跨肺压。随后患者缓慢呼气,在无气流且呼吸肌松弛时记录压力点。肺的压力-容积曲线在吸气(未显示)和呼气时并不重合,这种差异称为滞后现象(hysteresis),由表面活性物质作用所致。根据惯例,采用呼气压力-容积曲线进行测量。曲线上任意点的顺应性即单位压力变化引起的容积变化。该曲线显示肺顺应性随肺容积变化。在曲线上任取两点连线,其斜率即压力变化(ΔP)对应的容积变化(ΔV)。比较线1与线2的顺应性:线2斜率较线1平缓,说明高肺容积时顺应性低于低肺容积。根据惯例,肺顺应性指从功能残气量(FRC)到FRC+1升的跨压变化。MV:最小容积;RV:残气量;TLC:肺总量。 其中,ΔV 表示容积变化,ΔP 表示压力变化。图示上,肺顺应性(lung compliance)是压力-容积环(pressure-volume loop)呼气支上任意两点连线的斜率(图21.8)。正常人肺顺应性约为0.2升/厘米水柱(L/cm H₂O),但会随肺容积变化。值得注意的是,肺在高肺容积时扩张性较低。因此,顺应性需根据测量时的肺容积进行校正(比顺应性(specific compliance);图21.9)。临床实践中很少测量顺应性,因为这需要放置食管气囊(esophageal balloon)。该气囊通过压力传感器连接,作为胸膜压(pleural pressure)的替代指标——直接测量胸膜压非常困难。胸膜压变化(Pₚₗ)是肺容积变化的函数,即Cₗ=ΔV/ΔPₚₗ 或 ΔPₚₗ=ΔCₗ。
临床知识
肺顺应性受多种呼吸系统疾病影响。在肺气肿(emphysema)(一种与肺泡间隔破坏相关的阻塞性肺疾病)中,由于弹性回缩力丧失,肺顺应性增加 ;即压力每增加1 cm H2O,容积增量大于正常肺(见图21.1)。相反,在肺纤维化(pulmonary fibrosis)(一种与间质胶原纤维沉积增加相关的限制性肺疾病)中,肺顺应性降低 ;即压力每改变1 cm H2O,容积变化量更小。这些顺应性变化具有临床意义,因为低顺应性肺("僵硬肺")需要更大的胸膜压力变化才能改变肺容积,导致个体每次呼吸的代谢做功增加。
除了肺的弹性特性外,肺顺应性的另一个主要决定因素是表面活性物质(surfactant)及其对表面张力(surface tension)的影响。表面张力由气-液界面处水分子之间的吸引力引起。这种作用倾向于通过使肺泡塌陷来最小化表面积,从而导致肺顺应性下降。因此,肺的膨胀变得更加困难,需要呼吸肌消耗更多能量。通过比较盐水填充肺(无气-液界面)和空气填充肺的容积-压力曲线,可以实验性地展示表面张力对肺膨胀的影响。由于空气填充肺的表面张力高于盐水填充肺,完全膨胀空气填充肺需要比盐水填充肺更高的压力。表面张力是衡量材料表面分子每单位长度附着力的指标,其单位为每单位长度所施加的力。
• 图21.9 顺应性与肺容积的关系。假设某肺中5 cm H2O的压力变化导致1 L的容积变化(情况1)。若切除一侧肺(情况2),顺应性降低,但根据肺容积校正后无变化(比顺应性)。即使剩余肺容积减少90%(情况3),比顺应性仍保持不变。 对于球体(如肺泡),球内压力(Ps)与壁张力的关系由拉普拉斯定律描述:
公式21.7 Ps=2T/r
其中T为壁张力(单位:达因/厘米),r为球体半径。
• 图21.10 球体表面力试图减小表面积并在球体内产生压力。根据拉普拉斯定律(Laplace’s law),产生的压力与球体半径成反比。A. 无表面活性物质时,小球体表面力产生的压力(深紫色箭头)比大球体(浅紫色箭头)更高。这导致气体从小球体(高压)流向大球体(低压;黑色箭头),使小球体塌陷而大球体过度扩张。B. 表面活性物质(阴影层)能降低表面张力,且对小球体的降低作用更显著。最终结果是大小球体内的压力趋于平衡,球体容积得以稳定。 肺泡内衬主要由一种称为表面活性物质(surfactant)的脂质基物质构成。肺表面活性物质具有多种生理功能,包括:(1) 通过降低表面张力来减少呼吸做功;(2) 防止呼气时肺泡塌陷和粘连;(3) 稳定肺泡,特别是那些在低表面张力下容易萎缩的肺泡。 若无表面活性物质,气-液界面的表面张力将保持恒定,当肺泡容积减小时,维持该容积所需的肺泡跨壁压(transalveolar pressure)会更高(图21.10A)。因此,在低肺容积状态下,需要更高的肺泡跨壁压才能实现与高肺容积状态下相同的肺泡容积增量。表面活性物质通过使表面张力随肺泡扩张而增加,从而稳定肺泡的膨胀(见图21.10B)。其结果是,维持肺泡膨胀所需的肺泡跨壁压会随肺容积和跨肺压(transpulmonary pressure)的增加而增加,并随肺容积的减小而降低。在表面活性物质存在时,高肺容积状态下的表面张力会增加,而低肺容积状态下的表面张力会降低。这使得肺能在多种不同容积下维持肺泡的稳定。否则,小肺泡中的气体会排入大肺泡。
肺表面活性物质由II型肺泡细胞合成,储存于细胞内的板层小体(lamellar bodies) 中,并以前体形式(tubular myelin)分泌至肺泡腔。 随后其扩散至整个肺泡表面,获得降低表面张力的能力。表面活性物质含85%至90%的脂质(以磷脂为主)和10%至15%的蛋白质(表21.2)。主要磷脂成分为磷脂酰胆碱(phosphatidylcholine),其中约75%以二棕榈酰磷脂酰胆碱(DPPC)形式存在 。DPPC可降低表面张力,是表面活性物质中主要的表面活性成分。第二丰富的磷脂是磷脂酰甘油(phosphatidylglycerol),占总表面活性物质的1%至10%。这些脂质对肺泡-空气界面单分子层的形成至关重要,其中磷脂酰甘油对表面活性物质在大面积表面的铺展起重要作用。研究最深入的表面活性蛋白A(surfactant protein A)在II型肺泡细胞中表达,参与表面活性物质的代谢调节、肺内免疫调节及管状髓磷脂的形成。
表面活性物质通过组成性和调节性机制,经板层小体的胞吐作用分泌至气道。包括β-肾上腺素能激动剂、蛋白激酶C激活剂、白三烯和嘌呤能激动剂在内的多种物质均可刺激表面活性物质的胞吐。肺内表面活性物质的主要清除途径包括:II型细胞再摄取、淋巴管吸收以及肺泡巨噬细胞清除。当病理过程导致蛋白质类物质进入胸膜腔时(如感染、肺水肿液和血浆蛋白渗漏至气腔),表面活性物质会迅速失活。失活后肺泡表面张力升高,肺顺应性下降,呼吸做功增加。
除表面活性物质外,另一种机制——相互依赖机制 (interdependence)也有助于维持肺泡稳定性。除胸膜表面的肺泡外,其他肺泡均被其他肺泡包围。单个肺泡的塌陷趋势会受到周围肺泡施加的牵拉力对抗。因此,单个肺泡的塌陷会引起周围肺泡的拉伸和变形,而这些肺泡又与其他肺泡相连。肺泡壁上的小孔(Kohn孔,pores of Kohn)连接相邻肺泡,而Lambert管(canals of Lambert)连接终末气道与邻近肺泡。Kohn孔和Lambert管提供侧支通气,防止肺泡塌陷(肺不张,atelectasis)。
表21.2 表面活性物质的组成和功能
成分
组成百分比
功能
磷脂(Phospholipids)
80-85
磷脂酰胆碱
70-80
降低表面张力(Decrease surface tension)
磷脂酰甘油
1-10
铺展能力(Spreading ability)
磷脂酰乙醇胺
1-2
不明(Unclear)
磷脂酰丝氨酸
1-2
不明(Unclear)
磷脂酰肌醇
1-2
不明(Unclear)
中性脂类(Neutral Lipids)
5-10
胆固醇
3-5
稳定作用(Stabilization)
胆固醇酯
1-3
稳定作用(Stabilization)
游离脂肪酸
1-3
蛋白质(Proteins)
2-5
表面活性物质蛋白A
2-4
代谢更新、免疫调节、管状髓磷脂形成(Tubular myelin formation)
表面活性物质蛋白B
2-4
降低表面张力、铺展能力
表面活性物质蛋白C
2-4
降低表面张力、铺展能力、脂质层形成(Lipid layering)
表面活性物质蛋白D
1-2
未知(Unknown)
临床关联
1959年,Avery和Mead发现死于透明膜病(hyaline membrane disease, HMD)的早产儿肺部存在表面活性物质(surfactant)缺乏。HMD又称新生儿呼吸窘迫综合征,其特征是肺单位进行性不张(去气化)、呼吸衰竭和(严重时)死亡。这是新生儿期发病和死亡的主要原因。早产儿表面活性物质缺乏的主要成分是磷脂酰甘油(phosphatidylglycerol)不足。一般而言,随着羊水中磷脂酰甘油水平的升高,婴儿死亡率会降低。该领域的研究最终成功实现了通过表面活性物质替代疗法治疗早产儿HMD。目前,表面活性物质替代疗法已成为早产儿的标准化治疗方案。此外,分娩前会对产妇使用倍他米松(betamethasone)等类固醇药物以加速胎儿肺成熟。类固醇可穿过胎盘进入胎儿肺部,与II型肺泡细胞(type II pneumocytes)内表面活性物质DNA序列上游的固醇调节结构域结合,从而增加表面活性物质RNA转录和表面活性物质蛋白的生成。
气体从高压区域流向低压区域。需要正的跨肺压(transpulmonary pressure)来增加肺容积。在无气流时(吸气末和呼气末),呼吸系统的跨系统压差为0。在功能残气量(functional residual capacity, FRC)时,呼吸系统的跨系统压差为0,此时使肺容积减小的肺弹性回缩压(lung elastic recoil pressure)与胸壁为扩大容积产生的压力处于等值反向状态。
呼吸系统的压力梯度由呼吸肌的主动收缩及随后的舒张所形成。
肺容积由肺的弹性回缩特性与胸壁肌肉及结缔组织特性之间的平衡决定。