第二十七章 消化道的功能解剖和调节的基本原则:修订间差异
| 第53行: | 第53行: | ||
=== 内分泌调节 === | === 内分泌调节 === | ||
内分泌调节(endocrine regulation)是指胃肠道中的感受细胞——肠内分泌细胞(enteroendocrine cell,EEC)通过分泌调节肽(regulatory peptide)或激素,经血液运输作用于远离分泌部位的靶细胞的过程。对胃肠激素产生反应的细胞需表达该激素的特异性受体。胃肠道释放的激素不仅作用于胃肠道其他区域细胞,还可影响胰腺等与胃肠道相关的腺体结构。此外,胃肠激素对肝、肌肉和脑等组织也具有调节作用。 | 内分泌调节(endocrine regulation)是指胃肠道中的感受细胞——肠内分泌细胞(enteroendocrine cell,EEC)通过分泌调节肽(regulatory peptide)或激素,经血液运输作用于远离分泌部位的靶细胞的过程。对胃肠激素产生反应的细胞需表达该激素的特异性受体。胃肠道释放的激素不仅作用于胃肠道其他区域细胞,还可影响胰腺等与胃肠道相关的腺体结构。此外,胃肠激素对肝、肌肉和脑等组织也具有调节作用。 | ||
肠内分泌细胞富含分泌颗粒,其内容物在胃肠道壁受到化学或机械刺激时释放(图27.5)。此外,肠内分泌细胞也可被神经输入或与摄食无关的其他因素激活。肠壁中最常见的肠内分泌细胞属于'''"开放型"'''(open type),<u>这类细胞的顶膜与肠腔接触(通常为感受刺激的部位),基底外侧膜负责分泌</u>。另存在'''"闭合型"'''(closed type)肠内分泌细胞,<u>其细胞膜不与肠腔表面接触,例如胃上皮中分泌组胺的肠嗜铬样细胞</u>(enterochromaffin-like cell,ECL cell)。 | 肠内分泌细胞富含分泌颗粒,其内容物在胃肠道壁受到化学或机械刺激时释放(图27.5)。此外,肠内分泌细胞也可被神经输入或与摄食无关的其他因素激活。肠壁中最常见的肠内分泌细胞属于'''"开放型"'''(open type),<u>这类细胞的顶膜与肠腔接触(通常为感受刺激的部位),基底外侧膜负责分泌</u>。另存在'''"闭合型"'''(closed type)肠内分泌细胞,<u>其细胞膜不与肠腔表面接触,例如胃上皮中分泌组胺的肠嗜铬样细胞</u>(enterochromaffin-like cell,ECL cell)。 | ||
2025年6月26日 (四) 10:04的版本
学习目标
完成本章学习后,您应能够回答以下问题:
- 胃肠道的神经支配是什么?胃肠道功能是如何被调节的?
- 胃肠功能的神经、旁分泌和体液调节有哪些实例?
胃肠道(gastrointestinal, GI)由从口腔到肛门的消化道及其附属腺体器官组成,这些腺体将其分泌物排入消化道。胃肠道的主要功能是将营养物质和水吸收进入循环系统,并排出废物。胃肠道中发生的主要生理过程包括运动(motility)、分泌(secretion)、消化(digestion)和吸收(absorption)。哺乳动物饮食中的大部分营养物质以固体和大分子形式摄入,这些形式不易通过细胞膜转运进入循环系统。因此,消化过程包括对食物进行物理和化学修饰,使其能够通过肠上皮细胞被吸收。消化和吸收需要胃肠道肌壁的运动来推动内容物沿管道移动,并使食物与分泌物混合。胃肠道及其附属器官的分泌物包括酶类、生物去污剂和离子,它们共同营造出最适于消化和吸收的管腔内环境。这些生理过程受到高度调控以最大化消化吸收效率,胃肠道配备有复杂的调控系统来确保这一过程的实现。此外,胃肠道还负责经口服或直肠途径给药药物的吸收。
胃肠道也是重要的排泄器官。它能储存并排出摄入食物中的废物,以及来自肝脏的代谢产物如胆固醇、类固醇和药物代谢物(这些物质均具有脂溶性分子的共同特性)。
在研究胃肠道生理时,需要特别注意它是一个与机体外环境相接触的长管状结构。因此,它容易受到随食物和水进入的病原微生物侵袭。为保护自身,胃肠道拥有由免疫细胞和其他非特异性防御机制组成的复杂防御系统。事实上,胃肠道是人体最大的免疫器官。本章将概述胃肠系统的功能解剖结构和调节的一般原则。
功能解剖学
胃肠道各部位结构差异显著,但其组织构成具有共同特征。本质上,胃肠道是一个中空的管道,分为若干主要功能节段:口腔、咽、食管、胃、十二指肠(duodenum)、空肠(jejunum)、回肠(ileum)、结肠(colon)、直肠(rectum)和肛门(anus)(图27.1)。十二指肠、空肠和回肠共同组成小肠(small intestine),而结肠、直肠和肛门则被称为大肠(large intestine)。与管道相连的还有盲端腺体结构,这些结构是管壁内陷形成的,其分泌物排入肠腔(例如十二指肠中的Brunner腺,可分泌大量HCO3-)。此外,还存在通过导管与消化道相连的腺体器官(如唾液腺和外分泌胰腺),其分泌物也排入肠腔。
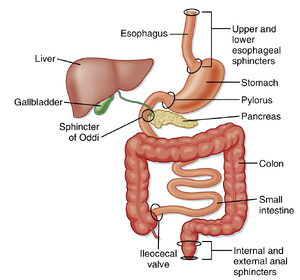
胃肠道(GI tract)的主要结构具有多种功能。一个重要功能是储存;胃和结肠作为加工后食物(亦称食糜(chyme))的重要储存器官,其功能解剖学(如形状与大小)和调控机制(平滑肌产生强直性收缩的特性)均表现出特化特征,使其能高效执行此功能。小肠的主要功能是消化与吸收;该胃肠道区域的主要特化特征在于拥有可进行吸收的巨大表面积。结肠则通过重吸收水分和离子来确保这些物质不被排出体外。摄入的食物通过管壁肌肉的作用沿胃肠道移动。分隔胃肠道各区域的还有称为括约肌(sphincters)的特化肌肉结构,其功能是隔离相邻区域,选择性滞留内容物或防止反流,或兼具二者功能。
肠道血液供应对于将吸收的营养物质运输至全身至关重要。与身体其他器官系统不同,胃肠道的静脉回流并非直接返回心脏,而是首先进入通往肝脏的门脉循环(portal circulation)。因此,肝脏的特殊性在于其相当部分的血液供应并非来自动脉循环。胃肠道血流的动态调节也值得注意:内脏血流约占心输出量的25%,这一比例与其供应的胃肠道质量不成比例。餐后,血液可被重新分配,从肌肉转移至胃肠道以满足肠壁代谢需求,并移除吸收的营养物质。
胃肠道的淋巴引流对运输脂溶性吸收物质至关重要。如第30章所述,脂质及其他脂溶性分子(包括部分维生素和药物)会被组装成体积过大而无法进入毛细血管的颗粒,转而进入肠壁淋巴管。这些淋巴管汇入更大的淋巴导管,最终注入胸导管从而进入动脉侧的体循环。这对脂质代谢具有重要生理意义,同时也影响药物直接进入体循环的能力。
细胞特化
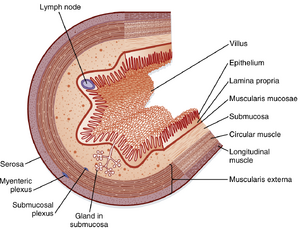
管状消化道的管壁由多层特化细胞构成(图27.2)。
黏膜层
黏膜(mucosa)是胃肠道(GI tract)的最内层。它由上皮(epithelium)、固有层(lamina propria)和黏膜肌层(muscularis mucosae)组成。上皮是排列于胃肠道管腔表面的单层特化细胞,沿消化道形成连续层,并与排入管腔的腺体和器官相连。该细胞层包含多种特化上皮细胞,其中数量最多的是称为吸收性肠上皮细胞(absorptive enterocytes)的细胞,它们表达许多对常量营养素消化吸收至关重要的蛋白质。肠内分泌细胞(enteroendocrine cells)含有分泌颗粒,可释放调节肽和胺类物质以帮助调节胃肠道功能。此外,胃黏膜细胞特化用于产生质子,而整个胃肠道的黏液分泌细胞可产生糖蛋白(黏蛋白,mucin),帮助保护胃肠道并润滑管腔内容物。
柱状上皮细胞通过称为紧密连接(tight junctions)的细胞间连接结构相连。这些连接是细胞内和跨膜蛋白的复合体,其紧密性在餐后期间受到调节。根据消化道不同区域的主要功能,上皮的性质存在显著差异。例如,肠上皮专为吸收设计,这些细胞介导营养物质、离子和水分的选择性摄取;相反,食管具有无吸收功能的复层扁平上皮,作为吞咽食物的运输通道,其扁平上皮可为纤维等粗糙食物提供保护。
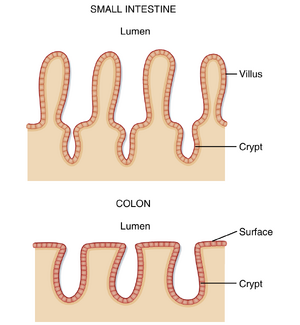
上皮表面积通过绒毛(villi)和隐窝(crypts)进行组织(图27.3)。绒毛是手指状突起,用于增加黏膜表面积;隐窝是上皮的内陷或褶皱。胃肠道上皮通过细胞分裂持续更新替换,在人类中此过程约需3天。这些增殖细胞定位于隐窝,该处存在肠道干细胞(intestinal stem cells)的增殖区。
紧邻上皮下方的固有层主要由含胶原和弹性纤维的疏松结缔组织构成(图27.2)。固有层富含多种腺体,并含有淋巴管、淋巴小结、毛细血管和神经纤维。黏膜肌层是肠道平滑肌的最内的一薄层。通过内窥镜观察时,由黏膜肌层收缩形成的褶皱和嵴清晰可见。
黏膜下层(Submucosa)
下一层是黏膜下层(submucosa)(图27.2),主要由含有胶原蛋白和弹性蛋白纤维的疏松结缔组织构成。在胃肠道的某些区域,黏膜下层存在腺体(黏膜的内陷或皱襞)。肠壁中较大的神经干、血管和淋巴管位于黏膜下层,与肠神经系统(ENS)的其中一个神经丛——黏膜下神经丛(submucosal plexus)共同分布。
肌层
外肌层(muscularis externa)或称固有肌层(muscularis propria),通常由两层厚实的平滑肌细胞组成:内层的环行肌层和外层的纵行肌层(图27.2)。环行肌层的肌纤维呈环形排列,而纵行肌层的肌纤维沿管道的长轴方向分布。在环行肌层和纵行肌层之间,分布着ENS的另一个神经丛——肌间神经丛(myenteric plexus)。外肌层的收缩可混合并循环管腔内容物,并推动其沿胃肠道移动。
胃肠道壁包含许多相互连接的神经元。黏膜下层存在密集的神经细胞网络,称为黏膜下神经丛(submucosal plexus,也称Meissner’s plexus)。显著的肌间神经丛(myenteric plexus,Auerbach’s plexus)位于环行和纵行平滑肌层之间。这些壁内神经丛共同构成ENS。ENS有助于整合胃肠系统的运动和分泌活动。即使切断支配肠道的交感神经和副交感神经,许多运动和分泌活动仍能持续进行,因为ENS直接控制这些过程。
浆膜层
浆膜层(serosa)或称外膜(adventitia),是胃肠道的最外层,由一层鳞状间皮细胞(squamous mesothelial cells)构成(图27.2)。它是肠系膜的一部分,覆盖腹壁表面并将腹腔内的器官悬吊固定。肠系膜分泌稀薄的黏性液体,可润滑腹腔器官,使器官在肌层收缩和松弛时能够移动。
胃肠道的调节机制
与心血管或呼吸系统不同,胃肠道会经历相对静止期(餐间期)和摄食后的高强度活动期(餐后期)。因此,胃肠道需要检测并恰当响应食物的摄入。此外,膳食中的宏量营养素组成可能存在显著差异,胃肠道需通过特定机制检测这些差异并启动相应的生理反应。因此,胃肠道必须与胰腺等关联器官进行信息交流。最后,由于胃肠道本质上是一条长管状结构,其近端发生的事件需通过机制向远端传递信号,反之亦然。
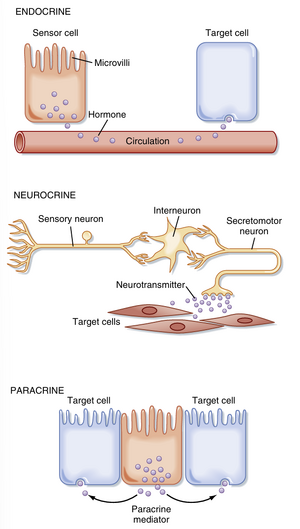
胃肠道功能的调节主要涉及三种控制机制:内分泌(endocrine)、旁分泌(paracrine)和神经分泌(neurocrine)(图27.4)。
内分泌调节
内分泌调节(endocrine regulation)是指胃肠道中的感受细胞——肠内分泌细胞(enteroendocrine cell,EEC)通过分泌调节肽(regulatory peptide)或激素,经血液运输作用于远离分泌部位的靶细胞的过程。对胃肠激素产生反应的细胞需表达该激素的特异性受体。胃肠道释放的激素不仅作用于胃肠道其他区域细胞,还可影响胰腺等与胃肠道相关的腺体结构。此外,胃肠激素对肝、肌肉和脑等组织也具有调节作用。
肠内分泌细胞富含分泌颗粒,其内容物在胃肠道壁受到化学或机械刺激时释放(图27.5)。此外,肠内分泌细胞也可被神经输入或与摄食无关的其他因素激活。肠壁中最常见的肠内分泌细胞属于"开放型"(open type),这类细胞的顶膜与肠腔接触(通常为感受刺激的部位),基底外侧膜负责分泌。另存在"闭合型"(closed type)肠内分泌细胞,其细胞膜不与肠腔表面接触,例如胃上皮中分泌组胺的肠嗜铬样细胞(enterochromaffin-like cell,ECL cell)。
胃肠道分泌的激素种类繁多(表27.1),值得指出的是,历史上首个被鉴定的激素即为胃肠激素促胰液素(secretin)。其中表征最明确的胃肠激素是胃泌素(gastrin),由胃远端壁内的内分泌细胞释放。胃泌素分泌受胃肠道副交感神经活动增强的刺激,在餐后阶段可强力促进胃酸分泌。
旁分泌调节
旁分泌调节是指化学信使或调节肽从肠壁的感应细胞(通常是肠内分泌细胞)释放后,通过细胞间质扩散作用于邻近靶细胞的过程。旁分泌物质可作用于胃肠道壁的多种细胞类型,包括平滑肌细胞、吸收性肠上皮细胞、腺体分泌细胞,甚至其他肠内分泌细胞。表27.1列出了几种重要的旁分泌物质及其产生部位、作用位点和功能。
肠壁中一种重要的旁分泌介质是组胺。在胃中,组胺由位于胃腺的ECL细胞储存和释放,通过固有层间质扩散至邻近壁细胞,刺激胃酸分泌。5-羟色胺(5-hydroxytryptamine [5-HT])由肠神经元、黏膜肥大细胞和特化的肠嗜铬细胞(enterochromaffin cells)释放,可调节平滑肌功能和肠壁水分吸收。肠壁中还存在其他旁分泌介质,如前列腺素、腺苷和一氧化氮(NO),这些介质的功能尚未完全阐明,但能够引起胃肠道功能变化。
许多物质可同时作为旁分泌和内分泌调节因子影响胃肠道功能。例如,胆囊收缩素在十二指肠响应膳食蛋白质和脂质时释放,既以旁分泌方式局部作用于神经末梢,也影响胰腺功能。这将在第30章详细讨论。
| 激素 | 分泌部位 | 释放刺激物 | 作用途径 | 靶目标 | 效应 |
|---|---|---|---|---|---|
| 胃泌素(Gastrin) | 胃窦部(G细胞) | 寡肽 | 内分泌 | 胃体部的ECL细胞和壁细胞 | 刺激壁细胞分泌H⁺,刺激ECL细胞分泌组胺 |
| 胆囊收缩素(CCK) | 十二指肠(I细胞) | 脂肪酸、水解蛋白 | 旁分泌、内分泌 | 迷走传入神经末梢、胰腺腺泡细胞 | 抑制胃排空和H⁺分泌;刺激胰酶分泌、胆囊收缩,抑制摄食 |
| 促胰液素(Secretin) | 十二指肠(S细胞) | 质子 | 旁分泌、内分泌 | 迷走传入神经末梢、胰腺导管细胞 | 刺激胰腺导管分泌(水和HCO₃⁻) |
| 葡萄糖依赖性促胰岛素肽(GIP) | 肠道(K细胞) | 脂肪酸、葡萄糖 | 内分泌 | 胰腺β细胞 | 刺激胰岛素分泌 |
| 肽YY(PYY) | 肠道(L细胞) | 脂肪酸、葡萄糖、水解蛋白 | 内分泌、旁分泌 | 神经元、平滑肌 | 抑制胃排空、胰液分泌、胃酸分泌、肠道运动和摄食 |
| 胰高血糖素样肽1/2(GLP-1/2) | 肠道(L细胞) | 脂肪酸、葡萄糖、水解蛋白 | 内分泌、旁分泌 | 神经元、上皮细胞 | 葡萄糖稳态调控,上皮细胞增殖 |
胃肠道功能的神经调节
神经和神经递质在调节胃肠道功能中发挥重要作用。神经调节的最简单形式是:当位于胃肠道中的神经末梢释放神经递质,并且该递质对受神经支配的细胞产生作用时,就会发生神经调节。然而,在某些情况下,胃肠道中运动神经与效应细胞之间并不存在突触连接。胃肠道功能的神经调节在器官内部以及胃肠道远隔部位之间均具有重要意义。
细胞水平
肠道壁内分泌细胞释放的调节性肽类激素(regulatory peptide hormones)存在多种受体亚型。这些受体对肽类激素的选择性由翻译后修饰决定,这种修饰赋予受体特异性。肽YY(peptide YY, PYY)就是一个例子。PYY存在Y1至Y7多种受体亚型。PYY主要由脂肪酸刺激引发,从肠道壁内分泌细胞释放。它以36个氨基酸组成的肽链形式释放,可与Y1、Y2和Y5受体结合;但也可通过膜肽酶——二肽基肽酶IV(dipeptidyl peptidase IV)切割为PYY3-36。这种形式的肽对Y2受体更具选择性。因此,切割肽的酶的存在可以改变对PYY分泌的生物学反应。
临床应用
胰高血糖素样肽1(glucagon-like peptide 1, GLP-1)是一种调节性肽,当肠腔存在碳水化合物和脂质时,由肠壁肠内分泌细胞(EECs)释放。GLP-1源自胰高血糖素基因的差异性加工,该基因在胰腺中表达并生成胰高血糖素。GLP-1通过刺激胰岛分泌胰岛素、抑制胰高血糖素释放来参与葡萄糖稳态调节,从而降低餐后血糖。基于GLP-1的这些作用已开发出两种疗法并用于治疗2型糖尿病:长效GLP-1激动剂(如exenatide)和二肽基肽酶4(dipeptidyl peptidase 4)抑制剂(该酶可快速降解血浆和组织中的GLP-1)。这些疗法不仅通过影响胰岛素分泌发挥作用,还因其胰腺外效应(延缓胃排空、抑制食欲、改善胰岛素敏感性、优化脂质谱)而在临床广泛应用。事实上,基于GLP-1的疗法也被用于治疗肠易激综合征、短肠综合征和非酒精性脂肪性肝病。这些胰腺外作用可能源于GLP-1受体的广泛分布。
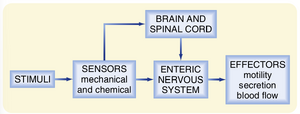
胃肠道的神经调控机制具有惊人的复杂性。肠道受两套神经系统支配:外在神经系统和内在神经系统。外在神经系统(extrinsic nervous system)指支配肠道且胞体位于肠壁之外的神经,这些外在神经属于自主神经系统(autonomic nervous system, ANS)。内在神经系统(intrinsic nervous system)又称为肠神经系统(enteric nervous system, ENS),其神经元胞体位于肠壁内(黏膜下神经丛和肌间神经丛)。部分胃肠道功能高度依赖外在神经系统,而另一些功能可不依赖外在神经系统,完全由ENS介导。然而,外在神经常可调节内在神经系统的功能(图27.6)。
外在神经支配
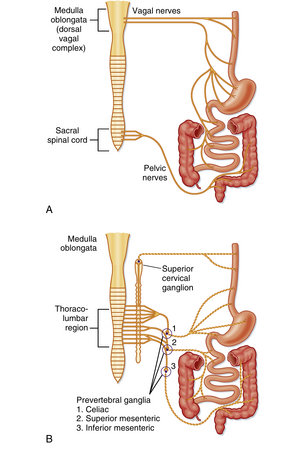
胃肠道的外在神经支配通过自主神经系统的两大分支实现,即副交感神经和交感神经支配(图27.7)。胃肠道的副交感神经支配通过迷走神经和盆神经实现。第10对脑神经——迷走神经支配食管、胃、胆囊、胰腺、小肠首段、盲肠和结肠近端。盆神经除支配非胃肠道盆腔器官外,还支配结肠远端和肛门直肠区域。
与副交感神经系统的典型组织结构一致,节前神经元的胞体位于脑干(迷走神经)或骶段脊髓(盆神经)。这些神经元的轴突分别通过迷走神经和盆神经延伸至胃肠道,与器官壁内的节后神经元形成突触联系(此处即肠壁内的肠神经元)。这些传出神经不直接支配肠壁内的效应细胞,其传导通路始终需通过ENS神经元。
根据自主神经系统的传导特性,节前神经元与节后神经元之间的突触联系属于必需型烟碱能突触。即节前神经元末梢释放乙酰胆碱,作用于节后神经元(此处为内在神经元)上的烟碱型受体,介导两者间的突触传递。
交感神经支配的节前神经元胞体位于脊髓,其纤维终止于椎前神经节(腹腔神经节、肠系膜上神经节和肠系膜下神经节)。这些神经纤维在神经节内与节后神经元形成突触,随后离开神经节并沿主要血管及其分支到达终末器官。与支配其他器官系统的交感神经不同,胃肠道交感神经极少在椎旁神经节(交感链)形成突触。部分缩血管交感纤维直接支配胃肠道血管,另一些交感纤维则支配肠壁内的腺体结构。
自主神经系统(ANS),包括副交感神经和交感神经,也包含传入(向中枢神经系统 [CNS])神经元的纤维;这些纤维本质上属于感觉性。迷走神经传入纤维的胞体位于结状神经节中。
这些神经元的中枢投射终止于脑干的孤束核,另一末端位于肠壁。与交感神经通路伴行的脊髓传入神经元的胞体呈节段性分布,位于背根神经节中。脊髓和迷走传入神经的外周末梢分布于肠壁各层,用于检测肠道状态信息。传入神经元将这些信息传递至CNS。传递至CNS的信息包括管腔内容物的性质(如酸度、营养成分、渗透压)以及平滑肌的牵张或收缩程度。传入神经支配还负责将疼痛刺激传递至CNS。
反射通路的组成——传入神经元、中间神经元和传出神经元——存在于胃肠道的外源性神经支配中。这些反射可完全通过迷走神经介导(称为迷走-迷走反射【vagovagal reflex】),迷走神经同时包含传入和传出纤维。迷走传入神经将感觉信息传递至CNS,在此与中间神经元形成突触,进而驱动传出运动神经元的活动。这些外源性反射在摄食后调节胃肠道功能中起重要作用。一个重要迷走-迷走反射的实例是胃容受性舒张反射(gastric receptive relaxation reflex),即胃的扩张导致胃平滑肌松弛;这使得胃充盈时腔内压力不会升高。
一般而言,与其他内脏器官系统类似,副交感神经和交感神经系统通常起拮抗作用。然而,这种关系并不像心血管系统那样简单。副交感神经系统的激活对摄食后的整合反应至关重要,这将在后续章节讨论。副交感神经系统通常激活肠壁的生理过程,但也存在显著例外。相反,交感神经系统往往抑制胃肠道功能,且更多在病理生理状态下被激活。总体而言,交感神经激活抑制平滑肌功能。例外的是胃肠道括约肌的交感神经支配,其中交感神经激活通常诱导平滑肌收缩。此外,交感神经系统在调节胃肠道血流方面尤为重要。
内在神经支配
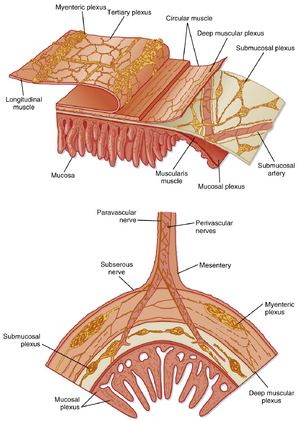
ENS由两个主要神经丛组成,这些神经丛是由神经细胞体(神经节)及其纤维构成的集合体,均起源于肠壁(图27.8)。肌间神经丛(myenteric plexus)位于纵行肌层与环形肌层之间,而黏膜下神经丛(submucosal plexus)位于黏膜下层。节间纤维束将两个神经丛中的神经元连接起来。
ENS中的神经元在功能上可分为传入神经元(afferent neurons)、中间神经元(interneurons)或传出神经元(efferent neurons),类似于自主神经系统(ANS)外源部分中的神经元。因此,反射通路的所有组成部分都可以包含在ENS内部。肠壁内的刺激由传入神经元检测,进而激活中间神经元和传出神经元以改变功能。通过这种方式,ENS可以独立于外源性神经支配发挥作用。然而如前所述,ENS中的神经元也接受外源性神经元的支配,因此这些反射通路的功能可受外源性神经系统的调控。由于ENS能够执行自身的整合功能和复杂反射通路,其重要性和复杂性使其常被称为"肠道中的小脑"。据估计,ENS中的神经元数量与脊髓相当。此外,许多胃肠激素在ENS和大脑自主神经传出相关区域也发挥神经递质作用。这些介质和调节肽因此被称为脑-肠肽(brain-gut peptides),而支配肠道的外源性和内源性成分有时被称为脑-肠轴(brain-gut axis)。
消化道对摄食的反应
本章导论部分概述了消化道的解剖结构和调控机制。后续章节将讨论机体对摄食的整合反应,以详述消化道生理学。
对摄食的反应经典分为若干时相:头期、口腔期、食管期、胃期、十二指肠期和肠期。每个时相中,食物会呈现特定刺激(如化学、机械和渗透性刺激),激活不同通路(如神经、旁分泌和体液反射通路),最终导致效应器功能改变(如分泌和运动)。已概述的调控机制之间存在显著交叉对话,这将在后续章节讨论。与维持机体其他系统的稳态类似,消化道功能的控制需要复杂的调控机制以动态感知和执行相应活动。
临床视角
Hirschsprung病(先天性巨结肠)是一种消化道神经系统的先天性疾病,特征包括出生时胎粪排出障碍、婴儿期严重慢性便秘、腹部肿胀和呕吐。其典型病理特征为结肠远端和直肠缺乏神经嵴来源的肌间神经丛和黏膜下神经丛神经元。该病属于多基因遗传病,至少涉及三类参与神经元发育和分化的基因特征性突变。
核心概念
- 消化道是一条管道,可细分为不同区域,各区域在消化和吸收过程中行使不同功能。
- 消化道内壁分为若干层——黏膜层、黏膜下层、肌层以及浆膜/外膜层。
- 存在三种主要的调节机制:激素调节、旁分泌调节和神经内分泌调节。
- 消化道的神经支配具有特殊意义,因其包含两个相互作用的组成部分:外在神经支配和内在神经支配。
- 外在神经支配(神经元胞体位于消化道壁外)由自主神经系统(ANS)的两个分支组成:副交感神经和交感神经。两者均包含重要的感觉(传入性)成分。
- 内在神经系统(即肠神经系统,神经元胞体位于消化道壁内)能够独立于外在神经支配而发挥作用。
- 当食物存在于消化道的不同区域时,感觉机制会检测到营养物质的存在,并在该区域以及更远端的消化道区域启动相应的生理反应。这些反应由内分泌、旁分泌及神经内分泌通路介导。
