第四十四章 男性和女性生殖系统:修订间差异
| 第85行: | 第85行: | ||
==== Leydig细胞功能的调控 ==== | ==== Leydig细胞功能的调控 ==== | ||
'''Leydig细胞表达LH受体''' | '''Leydig细胞表达LH受体''',LH作用于Leydig细胞的方式与促肾上腺皮质激素(ACTH,或促皮质素)作用于肾上腺皮质束状带细胞的方式非常相似(见第43章)。<u>快速效应包括胆固醇酯的水解和StAR蛋白的新表达。较不急性效应包括类固醇生成酶基因表达的增加和低密度脂蛋白受体(LDLR)的表达。长期来看,LH促进Leydig细胞的生长和增殖。</u> | ||
睾酮以及由睾酮外周转化产生的雌二醇通过抑制产生'''kisspeptin'''的神经元间接负反馈于下丘脑GnRH神经元(见图44.10)。睾酮和雌二醇也负反馈于垂体促性腺激素细胞。相比之下,睾酮外周转化的另一主要产物'''DHT对LH或FSH水平几乎没有影响'''。 | |||
[[文件:BL-44.10.png|居中|缩略图|517x517像素|• 图44.10 下丘脑-垂体-睾丸轴。DHT,二氢睾酮;E2,雌二醇;T,睾酮。]] | |||
==== Sertoli细胞功能的调控 ==== | ==== Sertoli细胞功能的调控 ==== | ||
'''Sertoli细胞受到睾酮和FSH的刺激。'''除了刺激与Sertoli细胞“护理细胞”功能相关的蛋白质(如ABP)的合成外,FSH还刺激二聚体蛋白抑制素的合成。抑制素由FSH诱导,并负反馈于促性腺激素细胞,选择性抑制FSH的产生(见图44.10)。 | |||
----'''在细胞水平''' | |||
• | 在男性生殖轴中存在一个重要的“漏洞”,这一现象基于以下事实:睾丸内睾酮水平需要比循环中的睾酮水平高出100倍以上,才能维持正常的精子生成速率,然而,正是循环中的睾酮(和雌二醇)水平对垂体和下丘脑提供了负反馈调节。这意味着<u>外源性睾酮的摄入可以提高循环中的睾酮和雌二醇水平,足以抑制促黄体生成素(LH)的分泌,但不足以在睾丸内积累到维持正常精子生成所需的浓度。</u>然而,LH水平的降低会减少睾丸间质细胞(Leydig cells)产生的睾酮,从而导致精子生成水平下降(图44.11)。目前,这一“漏洞”正在被研究,作为开发男性口服避孕药的一种可能策略。它也是某些'''男性滥用类固醇导致不育的基础'''。 | ||
[[文件:BL-44.11.png|居中|缩略图|537x537像素|• 图 44.11 睾丸内睾酮与循环睾酮浓度的差异及其在下丘脑-垂体-睾丸轴中的重要性。上图,正常成年男性的反馈环路。下图,睾酮(或雄激素类似物)的给药增加了循环睾酮(雄激素)水平,进而增加了对LH释放的负反馈。LH水平的降低减少了Leydig细胞的活性和睾丸内雄激素的产生。睾丸内睾酮水平的降低导致精子生成减少,并可能导致不育。(该图中省略了抑制素的反馈环路)。]] | |||
---- | |||
=== 男性生殖道 === | |||
一旦精子从输出小管中排出,它们就离开了性腺并进入男性生殖道(见图44.1)。男性生殖道的部分包括:附睾(头部、体部和尾部)、输精管、射精管、前列腺尿道、膜性尿道和阴茎尿道。与女性生殖道不同,男性生殖道从曲细精管到男性生殖道末端(即阴茎尿道尖端)有一个连续的管腔,并且男性生殖道与远端尿道(即男性尿道)相连。除了输送精子外,男性生殖道的主要功能包括: | 一旦精子从输出小管中排出,它们就离开了性腺并进入男性生殖道(见图44.1)。男性生殖道的部分包括:附睾(头部、体部和尾部)、输精管、射精管、前列腺尿道、膜性尿道和阴茎尿道。与女性生殖道不同,男性生殖道从曲细精管到男性生殖道末端(即阴茎尿道尖端)有一个连续的管腔,并且男性生殖道与远端尿道(即男性尿道)相连。除了输送精子外,男性生殖道的主要功能包括: | ||
# '''精子成熟'''。精子在附睾中停留约一个月,在此期间它们进一步成熟。附睾的上皮细胞具有分泌功能,并向精液中添加多种成分。进入附睾头部的精子运动能力较弱,但在离开附睾尾部时,它们已经具备了强烈的单向运动能力。精子还经历去获能(decapacitation)过程,这一过程涉及细胞膜的变化,以防止精子在与卵子接触之前发生顶体反应(见后文)。精子在女性生殖道的输卵管中重新获能。附睾的功能依赖于来自曲细精管的管腔睾酮-雄激素结合蛋白(ABP)复合物以及血液中的外周睾酮。 | # '''精子成熟'''。精子在附睾中停留约一个月,在此期间它们进一步成熟。附睾的上皮细胞具有分泌功能,并向精液中添加多种成分。进入附睾头部的精子运动能力较弱,但在离开附睾尾部时,它们已经具备了强烈的单向运动能力。精子还经历去获能(decapacitation)过程,这一过程涉及细胞膜的变化,以防止精子在与卵子接触之前发生顶体反应(见后文)。精子在女性生殖道的输卵管中重新获能。附睾的功能依赖于来自曲细精管的管腔睾酮-雄激素结合蛋白(ABP)复合物以及血液中的外周睾酮。 | ||
# '''精子储存和排放'''。精子在附睾尾部和输精管中储存数月而不会失去活力。输精管除了提供储存场所外,其主要功能是在性交时将精子推进到男性尿道中。输精管具有非常厚的肌层,并且富含交感神经支配。通常在性交过程中,阴茎的反复触觉刺激会引发输精管肌层接受交感神经的爆发性刺激,从而导致蠕动性收缩。输精管内容物排入前列腺尿道的过程称为排放(emission)。排放紧接在射精之前,射精是将精液推出男性尿道的过程。 | # '''精子储存和排放'''。精子在附睾尾部和输精管中储存数月而不会失去活力。输精管除了提供储存场所外,其主要功能是在性交时将精子推进到男性尿道中。输精管具有非常厚的肌层,并且富含交感神经支配。通常在性交过程中,阴茎的反复触觉刺激会引发输精管肌层接受交感神经的爆发性刺激,从而导致蠕动性收缩。输精管内容物排入前列腺尿道的过程称为排放(emission)。排放紧接在射精之前,射精是将精液推出男性尿道的过程。 | ||
# '''精子的产生与精液成分的混合''' | # '''精子的产生与精液成分的混合'''。在排放过程中,输精管的收缩与两个附属性腺(即精囊腺,左右各一)以及前列腺(围绕前列腺尿道)的肌层收缩同时发生。此时,精子与精液的所有成分混合。精囊分泌约60%的精液体积。这些腺体是果糖的主要来源,果糖是精子的关键营养物质。精囊还分泌精液凝集素,这些物质在射精后立即诱导精液凝固。前列腺的碱性分泌物约占精液体积的30%,富含柠檬酸、锌、精胺和酸性磷酸酶。前列腺特异性抗原(PSA)是一种丝氨酸蛋白酶,可在几分钟后液化凝固的精液。在前列腺感染、良性前列腺肥大和前列腺癌的情况下,可以在血液中检测到PSA,目前它被用作前列腺健康的一个指标。精液中的主要缓冲剂是磷酸盐和碳酸氢盐。第三个附属腺体,尿道球腺(也称为Cowper腺),在射精前响应性兴奋而排入阴茎尿道。这种分泌物富含黏液,可润滑、清洁和缓冲尿道。平均精子计数在6000万至1亿/mL精液之间。精子计数低于2000万/mL、活动精子少于50%或正常形态精子少于60%的男性通常不育。 | ||
# 勃起、插入和射精。射精和射精发生在性交过程中,响应于一个反射弧,该反射弧涉及来自阴茎的感觉刺激(通过阴部神经),随后是对男性道平滑肌的交感运动刺激和对与阴茎基部相关的肌肉组织的躯体运动刺激。然而,首先,男性必须实现并维持阴茎的勃起。阴茎已经进化成为一种插入器官,旨在分离阴道壁,通过阴道腔的潜在空间,并在靠近宫颈的阴道腔远端沉积精液。这种内部授精过程只有在阴茎通过勃起过程变硬时才能进行。 | # 勃起、插入和射精。射精和射精发生在性交过程中,响应于一个反射弧,该反射弧涉及来自阴茎的感觉刺激(通过阴部神经),随后是对男性道平滑肌的交感运动刺激和对与阴茎基部相关的肌肉组织的躯体运动刺激。然而,首先,男性必须实现并维持阴茎的勃起。阴茎已经进化成为一种插入器官,旨在分离阴道壁,通过阴道腔的潜在空间,并在靠近宫颈的阴道腔远端沉积精液。这种内部授精过程只有在阴茎通过勃起过程变硬时才能进行。 | ||
勃起是一种神经血管事件。阴茎由三个勃起体组成:两个海绵体和一个尿道海绵体(图44.12A)。尿道贯穿尿道海绵体。这三个勃起体由勃起组织组成——一种在疏松结缔组织支撑下的连续内皮内衬的潜在海绵状血管空间的吻合网络。在松弛状态下,流向海绵状空间的血流极少(见图44.12A)。这是由于血管(称为螺旋动脉)的血管收缩以及血流从海绵状空间分流所致。在性兴奋的刺激下,支配螺旋动脉血管平滑肌的副交感海绵体神经释放一氧化氮(NO)。NO激活鸟苷酸环化酶,从而增加环磷酸鸟苷(cGMP),降低细胞内\left[\mathrmCa^++\right]并引起肌肉松弛(见图44.12B)。血管扩张使血液流入海绵状空间,导致充血和勃起。它还会压迫阴茎中的静脉并减少静脉回流(见图44.12B)。 | 勃起是一种神经血管事件。阴茎由三个勃起体组成:两个海绵体和一个尿道海绵体(图44.12A)。尿道贯穿尿道海绵体。这三个勃起体由勃起组织组成——一种在疏松结缔组织支撑下的连续内皮内衬的潜在海绵状血管空间的吻合网络。在松弛状态下,流向海绵状空间的血流极少(见图44.12A)。这是由于血管(称为螺旋动脉)的血管收缩以及血流从海绵状空间分流所致。在性兴奋的刺激下,支配螺旋动脉血管平滑肌的副交感海绵体神经释放一氧化氮(NO)。NO激活鸟苷酸环化酶,从而增加环磷酸鸟苷(cGMP),降低细胞内\left[\mathrmCa^++\right]并引起肌肉松弛(见图44.12B)。血管扩张使血液流入海绵状空间,导致充血和勃起。它还会压迫阴茎中的静脉并减少静脉回流(见图44.12B)。 | ||
=== 男性更年期 === | |||
男性没有明显的更年期。然而,随着年龄的增长,性腺对LH的敏感性降低,雄激素的产生减少。随着这种情况的发生,血清LH和FSH水平上升。尽管精子产生通常在50岁后开始下降,但许多男性可以终生维持生殖功能和精子发生。 | 男性没有明显的更年期。然而,随着年龄的增长,性腺对LH的敏感性降低,雄激素的产生减少。随着这种情况的发生,血清LH和FSH水平上升。尽管精子产生通常在50岁后开始下降,但许多男性可以终生维持生殖功能和精子发生。 | ||
----临床相关 | |||
无法达到或维持勃起称为勃起功能障碍(ED),是男性不育的原因之一。多种因素可导致ED,包括雄激素产生不足;神经血管损伤(如糖尿病、脊髓损伤);阴茎、会阴或骨盆的结构损伤;心理因素(如抑郁、表现焦虑);以及处方药物和娱乐性药物,包括酒精和烟草。治疗某些形式的勃起功能障碍的一个重大进展是使用选择性cGMP磷酸二酯酶抑制剂,有助于维持勃起(见图44.12B)。 | 无法达到或维持勃起称为勃起功能障碍(ED),是男性不育的原因之一。多种因素可导致ED,包括雄激素产生不足;神经血管损伤(如糖尿病、脊髓损伤);阴茎、会阴或骨盆的结构损伤;心理因素(如抑郁、表现焦虑);以及处方药物和娱乐性药物,包括酒精和烟草。治疗某些形式的勃起功能障碍的一个重大进展是使用选择性cGMP磷酸二酯酶抑制剂,有助于维持勃起(见图44.12B)。 | ||
---- | |||
== 女性生殖系统 == | == 女性生殖系统 == | ||
2025年7月18日 (五) 16:58的版本
学习目标
完成本章后,学生应能够回答以下问题:
- 描述男性和女性生殖系统的一般解剖结构。
- 绘制睾丸的组织结构图,包括曲细精管内的支持细胞(Sertoli cells)和发育中的精子细胞,以及小叶间/间质内的间质细胞(Leydig cells)和毛细血管丛。
- 图示精子发生(spermatogenesis)和精子形成(spermiogenesis)的过程。
- 列出支持细胞的功能。
- 图示间质细胞内睾酮的合成过程,以及睾酮在外周转化为雌二醇(estradiol)或二氢睾酮(dihydrotestosterone)的过程。
- 图示男性下丘脑/垂体/睾丸轴,包括所有涉及的细胞类型和激素。
- 绘制卵巢的组织结构图,并描述卵泡发育、排卵和黄体形成的各个阶段。
- 列出女性生殖细胞从卵原细胞(oogonia)到卵子的进展阶段及其调控。
- 图示在相应细胞类型中导致雄激素、雌激素和孕激素合成的类固醇生成途径。
- 图示月经周期中女性下丘脑/垂体/卵巢轴,包括所有涉及的细胞类型和激素。
- 解释女性生殖道在月经周期中的变化,特别是子宫内膜的变化。
- 列出受精过程中涉及的事件。
- 描述胎盘(placenta)的发育和功能。
- 描述乳腺(mammary glands)的发育和功能。
生殖系统最基本的两个解剖组成部分是性腺(gonads)和生殖道(reproductive tract)。性腺(睾丸和卵巢)具有内分泌功能,其调节在下丘脑-垂体-性腺轴内进行。性腺与其他内分泌腺体的不同之处在于它们还执行配子发生(gametogenesis)。生殖道涉及配子发育、功能和运输的多个方面,在女性中,还允许受精、着床和妊娠。性腺中的配子发生以及生殖道的发育和生理功能完全依赖于性腺的内分泌功能。这种激素依赖性的临床影响包括性激素生成低下导致的不孕症、激素或激素受体表达失调导致的生殖器模糊,以及激素依赖性癌症,特别是女性的子宫癌和乳腺癌以及男性的前列腺癌。
男性生殖系统
雄性生殖系统已经进化到能够进行终身的连续配子发生,并偶尔进行内部授精,精子密度高达60×106,精液量为3-5mL。在成年男性中,性腺激素的基本功能包括:(1) 支持配子发生(精子发生),(2) 维持男性生殖道并产生精液,以及(3) 维持第二性征和性欲。男性的这些活动没有整体周期性。
睾丸
组织生理学
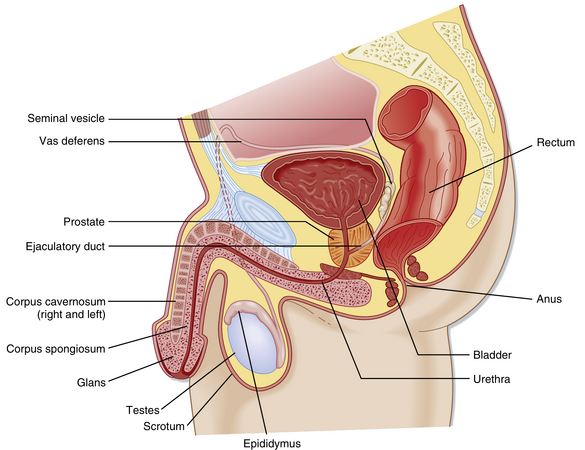
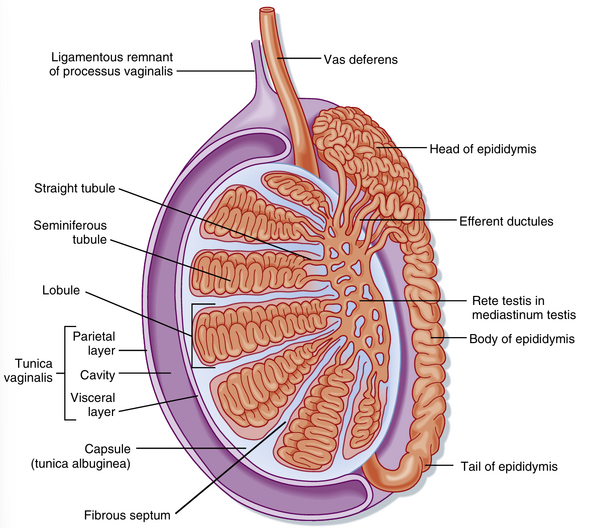
与卵巢不同,睾丸位于腹腔外的阴囊中(图44.1)。这种位置使睾丸温度保持在比体温低约2℃的水平,这对精子的最佳发育至关重要。人类睾丸被一层结缔组织囊覆盖,并被纤维隔膜分为约300个小叶(图44.2)。每个小叶内有2到4个曲细精管环。每个环排入一个称为睾丸网的管状吻合网络。睾丸网与一些小管(输出小管)相连,这些小管将精子从睾丸引出到位于睾丸上极的附睾头部(见图44.2)。一旦进入附睾,精子从头部经过体部到达尾部,然后进入输精管。有活力的精子可以在附睾尾部和输精管中储存数月。
曲细精管的存在在每个小叶内形成了两个隔室:一个管内隔室,由曲细精管的无血管曲细精上皮组成;另一个管周隔室,由神经血管元素、结缔组织细胞、免疫细胞和间质细胞(Leydig细胞)组成,其主要功能是产生睾酮(图44.3)。
管内隔室
曲细精管内衬有复杂的曲细精上皮,由两种细胞类型组成:处于不同精子发生阶段的精子细胞和支持细胞( Sertoli cells ,“nurse cells”),这些支持细胞与所有精子细胞密切接触(图44.4)。
发育中的精子细胞
精子发生(spermatogenesis)涉及有丝分裂和减数分裂的过程。称为精原细胞(spermatogonia)的干细胞位于生精上皮(seminiferous epithelium)的基底层(见图44.4,SA和SB)。精原细胞通过有丝分裂产生子代精原细胞(精原细胞发生,spermatocytogenesis)。一个或多个精原细胞保留在干细胞群体中,牢固地附着在基底层上。然而,大多数子代精原细胞进入减数分裂,最终在减数分裂完成后形成单倍体精子(spermatozoa)。这些分裂伴随着不完全的细胞质分裂,因此所有子细胞通过细胞质桥保持相互连接。这种结构有助于克隆精子细胞群体的发育同步性。精原细胞在进入第一次减数分裂前期时,从基底层向顶端迁移。此时它们被称为初级精母细胞(见图44.4,S1)。在第一次减数分裂前期,涉及染色体复制、联会、交叉互换和同源重组的有性生殖标志性过程发生。第一次减数分裂完成后,产生次级精母细胞,它们迅速(即在20分钟内)完成第二次减数分裂。减数分裂的初始产物是单倍体的精子细胞(spermatids)(见图44.4,S3)。
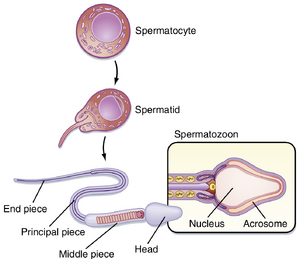
精子细胞是小而圆的细胞,经历一个显著的变态过程,称为精子形成(spermiogenesis)(图44.5)。精子形成的产物是流线型的精子(见图44.4,S4)。随着精子细胞成熟为精子,细胞核的尺寸减小,并形成一个显著的尾部。尾部含有微管结构,类似于鞭毛,推动精子运动。精子细胞核中的染色质物质浓缩,大部分细胞质丢失。顶体(acrosome)是精子头部的一个膜包被结构,作为溶酶体发挥作用,含有对受精重要的水解酶。这些酶在顶体反应(acrosomal reaction)发生之前保持非活性状态(见受精部分)。
精子位于生精小管(seminiferous tubule)的管腔表面。精子的释放,或称精子释放(spermiation),由Sertoli细胞控制。精子发生(spermatogenesis)的过程大约需要72天。每隔16天,一组相邻的精原细胞(spermatogonia)进入这一过程,因此这一过程在生精小管的某一点上是交错的。此外,这一过程在生精小管的长度上也是交错的(即并非所有精原细胞在整条小管的长度上同时进入精子发生过程,也不是所有小管同步进行;每个睾丸中约有500条生精小管;详见后文)。由于一个睾丸内的生精小管长度约为400m,因此在任何给定时间内,睾丸内的多个部位都在持续生成精子。
Sertoli细胞
Sertoli细胞是生精上皮的真上皮细胞,从基膜(basal lamina)延伸到管腔(见图44.4,St)。Sertoli细胞包围着精子细胞,并在上皮内提供结构支持,它们与所有阶段的精子细胞形成粘附连接(adhering junctions)和间隙连接(gap junctions)。通过这些连接的形成和分解,Sertoli细胞在精子细胞向精子发生的后期阶段推进时,引导它们向管腔移动。精子释放需要Sertoli细胞与精子细胞之间的最终连接分解。
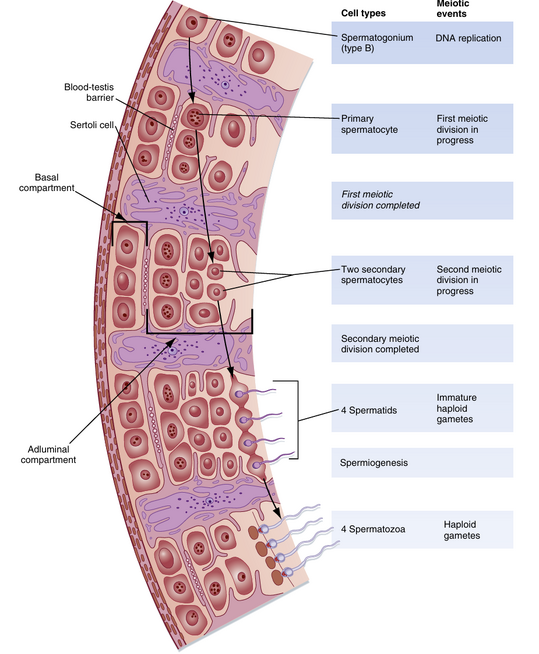
Sertoli细胞的另一个重要结构特征是在相邻的Sertoli细胞之间形成紧密连接(tight junctions)(图44.6)。这些Sertoli-Sertoli细胞的封闭连接将生精上皮分为一个包含精原细胞和早期初级精母细胞的基底室(basal compartment),以及一个包含晚期初级精母细胞和所有后续阶段精子细胞的近腔室(adluminal compartment)。当早期初级精母细胞从基底室向近腔室顶端移动时,紧密连接需要被分解并重新组装。这些紧密连接形成了血-睾屏障(blood-testis barrier)的物理基础(见图44.6),为发育中的精子创造了一个特殊的免疫安全微环境。通过阻止细胞旁扩散(paracellular diffusion),紧密连接限制了物质在血液和发育中的生殖细胞之间的移动,这些物质通过跨Sertoli细胞的运输途径进行转运。这种组织结构使Sertoli细胞能够控制生殖细胞的营养供应。
健康的Sertoli细胞功能对于精子细胞的存活和发育至关重要。此外,精子发生绝对依赖于由管周Leydig细胞产生的睾酮(见Leydig细胞部分),然而表达雄激素受体并对睾酮作出反应的是Sertoli细胞,而不是发育中的精子细胞。同样,垂体激素促卵泡激素也是最大精子产量所必需的,而表达FSH受体的也是Sertoli细胞,而不是发育中的精子。因此,睾酮和FSH通过刺激Sertoli细胞功能间接支持精子发生。
Sertoli细胞具有多种附加功能。它们表达CYP19酶(也称为芳香化酶),该酶将Leydig细胞衍生的睾酮转化为强效雌激素17β-雌二醇(见睾丸内雄激素)。这种局部产生的雌激素可能增强人类的精子发生。Sertoli细胞还产生雄激素结合蛋白(androgen-binding protein, ABP),该蛋白在管腔室、曲细精管管腔和男性生殖道近端维持高水平的雄激素。Sertoli细胞还产生大量液体。这种液体为精子提供了适当的浸泡介质,并协助将不动的精子从曲细精管移动到附睾。Sertoli细胞通过吞噬残余体(residual bodies)执行重要的吞噬功能,这些残余体代表精子在精子形成过程中脱落的细胞质。
最后,Sertoli细胞具有重要的内分泌功能。在发育过程中,Sertoli细胞产生抗苗勒管激素(antimüllerian hormone, AMH;也称为苗勒管抑制物质),该激素诱导胚胎苗勒管的退化,苗勒管原本会发育为女性生殖道(稍后讨论)。Sertoli细胞还产生抑制素(inhibin)。抑制素是一种异二聚体蛋白激素,与转化生长因子β家族相关。FSH刺激抑制素的产生,随后抑制素负反馈作用于促性腺激素细胞,抑制FSH的产生。因此,抑制素将FSH水平维持在设定点内。
管周室
管周室包含睾丸的主要内分泌细胞,即Leydig细胞(图44.7)。该室还包含疏松结缔组织的常见细胞类型和极其丰富的管周毛细血管网络,该网络为曲细精管提供营养(通过Sertoli细胞),同时将睾酮从睾丸运输到外周循环。
Leydig细胞
Leydig细胞是生成类固醇的基质细胞。这些细胞从头合成胆固醇,并通过LDL受体、HDL受体(也称为清道夫受体BI (SR-BI))获取胆固醇,并将胆固醇储存为胆固醇酯,如肾上腺皮质细胞所述(见第43章)。游离胆固醇由胆固醇酯水解酶生成,并以类固醇生成急性调节蛋白(steroidogenic acute regulatory, StAR)依赖的方式转移到线粒体外膜,然后转移到线粒体内膜。与所有类固醇生成细胞一样,胆固醇通过CYP11A1转化为孕烯醇酮。然后,孕烯醇酮通过3β-羟基类固醇脱氢酶(3β-HSD)和CYP17加工为孕酮、17-羟基孕酮和雄烯二酮(图44.8)。回忆第43章,CYP17是一种双功能酶,具有17-羟化酶活性和17,20-裂解酶活性。CYP17在Leydig细胞中表现出高水平的这两种活性。在这方面,Leydig细胞与网状带细胞相似,只是它表达更高水平的3β-HSD,因此最终倾向于Δ4途径。另一个主要区别是,Leydig细胞表达Leydig细胞特异性的17β-羟基类固醇脱氢酶(178-HSD type 3)同工酶,该酶有效地将雄烯二酮转化为睾酮(见图44.8)。
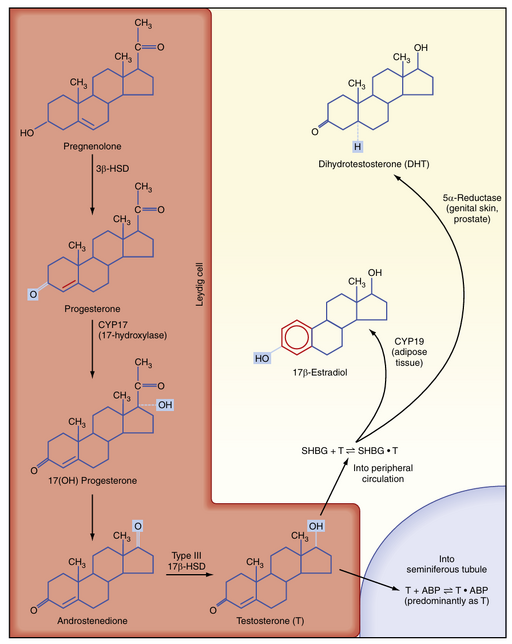
雄激素的命运与作用
睾丸内雄激素
由Leydig细胞产生的睾酮有多种命运和多重作用。由于Leydig细胞靠近生精小管,大量睾酮扩散进入生精小管,并通过雄激素结合蛋白(ABP)在管腔内隔室中浓缩(见图44.8)。生精小管内的睾酮水平比循环中的睾酮水平高出100倍以上,这对正常的精子发生是绝对必需的。如前所述,Sertoli细胞表达CYP19(芳香化酶),该酶将少量睾酮转化为强效雌激素178-雌二醇。人类精子细胞至少表达一种雌激素受体亚型,并且有来自芳香化酶缺乏男性的证据表明,这种局部产生的雌激素优化了人类的精子发生。
外周转化为雌激素
在多种组织(尤其是脂肪组织)中,睾酮被转化为雌激素(见图44.8)。对芳香化酶缺乏男性的研究表明,无法产生雌激素会导致身材高大,这是由于长骨骨骺未闭合,以及骨质疏松症。因此,外周雌激素在男性的骨骼成熟和维持中起着重要作用。这些研究还表明,雌激素在促进胰岛素敏感性、改善脂蛋白谱(即增加HDL,降低甘油三酯和LDL)以及对垂体和下丘脑的促性腺激素产生负反馈方面具有重要作用。
外周转化为二氢睾酮
睾酮也可以通过5α-还原酶(5α-reductase)转化为一种强效的非芳香化雄激素——5α-二氢睾酮(5α-dihydrotestosterone, DHT)(见图44.8)。5α-还原酶有两种同工酶,即1型和2型。5α-还原酶2型的主要表达部位包括男性泌尿生殖道、生殖器皮肤、毛囊和肝脏。5α-还原酶2型生成DHT,DHT在子宫内对男性外生殖器的男性化以及青春期相关的许多变化是必需的,包括前列腺的生长和活动(见男性生殖道)、阴茎的生长、阴囊的变暗和褶皱、阴毛和腋毛的生长、面部和体毛的生长以及肌肉质量的增加(图44.9)。5α-还原酶1型的表达在青春期开始。这种同工酶主要在皮肤中表达,并促进皮脂腺的活动和与青春期相关的痤疮。由于DHT对其靶器官具有强烈的生长促进(即营养)作用,开发选择性5α-还原酶2型抑制剂已被证明对治疗前列腺肥大和前列腺癌有益。
睾酮的外周作用
睾酮在几种细胞类型中具有直接作用(即无需转化为DHT)(见图44.9)。如前所述,睾酮调节支持细胞(Sertoli cell)的功能。在缺乏5α-还原酶的情况下,睾酮诱导中肾管(mesonephric duct)发育为男性生殖道。睾酮具有多种代谢作用,包括增加极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL),同时降低高密度脂蛋白(HDL),促进腹部脂肪组织的沉积,增加红细胞生成,促进骨骼生长和健康,并对肌肉产生蛋白质合成代谢作用。睾酮足以维持勃起功能和性欲。
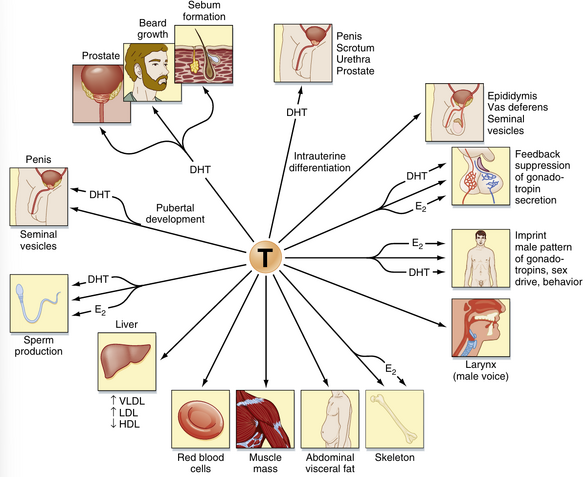
雄激素的作用机制
睾酮和DHT通过相同的雄激素受体(AR)发挥作用。在没有配体的情况下,AR位于细胞质中,与伴侣蛋白结合。睾酮-AR结合或DHT-AR结合导致伴侣蛋白解离,随后雄激素-AR复合物核转位、二聚化、结合到雄激素反应元件,并募集共激活蛋白和通用转录因子到特定基因启动子附近。目前尚不清楚睾酮和DHT在不同细胞类型中激活AR的能力有何不同。有人提出,不同细胞类型中可能存在不同的共激活蛋白,这些蛋白可能对睾酮激活的AR构象与DHT激活的AR构象具有不同的亲和力。
雄激素的运输和代谢
当睾酮进入外周循环时,它会与血清蛋白结合并迅速达到平衡。大约60%的循环睾酮与性激素结合球蛋白(SHBG)结合,38%与白蛋白结合,约2%保持为“游离”激素。睾酮及其代谢物主要通过尿液排泄。大约50%的排泄雄激素以尿17-酮类固醇的形式存在,其余大部分为结合雄激素或二醇或三醇衍生物。尿液中约30%的17-酮类固醇来自睾丸;其余由肾上腺雄激素产生。雄激素在肝脏中与葡萄糖醛酸或硫酸结合,这些结合类固醇通过尿液排泄。
下丘脑-垂体-睾丸轴
睾丸由一个内分泌轴(图44.10)调控,该轴涉及下丘脑的小细胞性促性腺激素释放激素(GnRH)神经元和垂体促性腺激素细胞,后者产生黄体生成素(LH)和卵泡刺激素(FSH)。
Leydig细胞功能的调控
Leydig细胞表达LH受体,LH作用于Leydig细胞的方式与促肾上腺皮质激素(ACTH,或促皮质素)作用于肾上腺皮质束状带细胞的方式非常相似(见第43章)。快速效应包括胆固醇酯的水解和StAR蛋白的新表达。较不急性效应包括类固醇生成酶基因表达的增加和低密度脂蛋白受体(LDLR)的表达。长期来看,LH促进Leydig细胞的生长和增殖。
睾酮以及由睾酮外周转化产生的雌二醇通过抑制产生kisspeptin的神经元间接负反馈于下丘脑GnRH神经元(见图44.10)。睾酮和雌二醇也负反馈于垂体促性腺激素细胞。相比之下,睾酮外周转化的另一主要产物DHT对LH或FSH水平几乎没有影响。
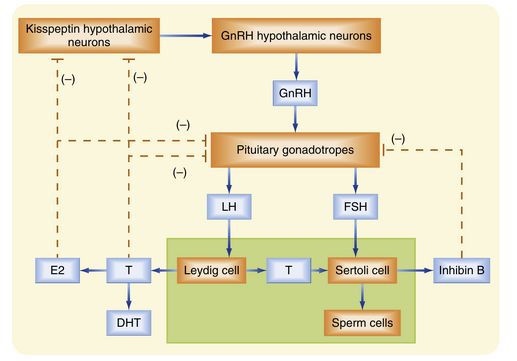
Sertoli细胞功能的调控
Sertoli细胞受到睾酮和FSH的刺激。除了刺激与Sertoli细胞“护理细胞”功能相关的蛋白质(如ABP)的合成外,FSH还刺激二聚体蛋白抑制素的合成。抑制素由FSH诱导,并负反馈于促性腺激素细胞,选择性抑制FSH的产生(见图44.10)。
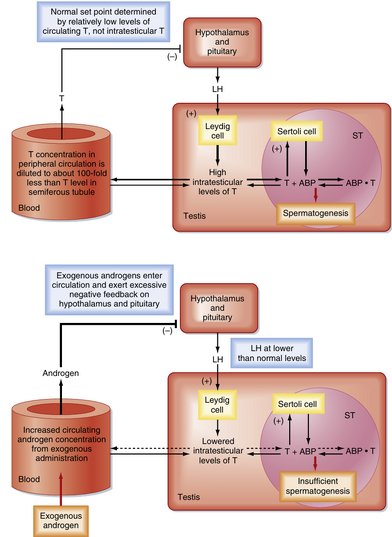
在细胞水平
在男性生殖轴中存在一个重要的“漏洞”,这一现象基于以下事实:睾丸内睾酮水平需要比循环中的睾酮水平高出100倍以上,才能维持正常的精子生成速率,然而,正是循环中的睾酮(和雌二醇)水平对垂体和下丘脑提供了负反馈调节。这意味着外源性睾酮的摄入可以提高循环中的睾酮和雌二醇水平,足以抑制促黄体生成素(LH)的分泌,但不足以在睾丸内积累到维持正常精子生成所需的浓度。然而,LH水平的降低会减少睾丸间质细胞(Leydig cells)产生的睾酮,从而导致精子生成水平下降(图44.11)。目前,这一“漏洞”正在被研究,作为开发男性口服避孕药的一种可能策略。它也是某些男性滥用类固醇导致不育的基础。
男性生殖道
一旦精子从输出小管中排出,它们就离开了性腺并进入男性生殖道(见图44.1)。男性生殖道的部分包括:附睾(头部、体部和尾部)、输精管、射精管、前列腺尿道、膜性尿道和阴茎尿道。与女性生殖道不同,男性生殖道从曲细精管到男性生殖道末端(即阴茎尿道尖端)有一个连续的管腔,并且男性生殖道与远端尿道(即男性尿道)相连。除了输送精子外,男性生殖道的主要功能包括:
- 精子成熟。精子在附睾中停留约一个月,在此期间它们进一步成熟。附睾的上皮细胞具有分泌功能,并向精液中添加多种成分。进入附睾头部的精子运动能力较弱,但在离开附睾尾部时,它们已经具备了强烈的单向运动能力。精子还经历去获能(decapacitation)过程,这一过程涉及细胞膜的变化,以防止精子在与卵子接触之前发生顶体反应(见后文)。精子在女性生殖道的输卵管中重新获能。附睾的功能依赖于来自曲细精管的管腔睾酮-雄激素结合蛋白(ABP)复合物以及血液中的外周睾酮。
- 精子储存和排放。精子在附睾尾部和输精管中储存数月而不会失去活力。输精管除了提供储存场所外,其主要功能是在性交时将精子推进到男性尿道中。输精管具有非常厚的肌层,并且富含交感神经支配。通常在性交过程中,阴茎的反复触觉刺激会引发输精管肌层接受交感神经的爆发性刺激,从而导致蠕动性收缩。输精管内容物排入前列腺尿道的过程称为排放(emission)。排放紧接在射精之前,射精是将精液推出男性尿道的过程。
- 精子的产生与精液成分的混合。在排放过程中,输精管的收缩与两个附属性腺(即精囊腺,左右各一)以及前列腺(围绕前列腺尿道)的肌层收缩同时发生。此时,精子与精液的所有成分混合。精囊分泌约60%的精液体积。这些腺体是果糖的主要来源,果糖是精子的关键营养物质。精囊还分泌精液凝集素,这些物质在射精后立即诱导精液凝固。前列腺的碱性分泌物约占精液体积的30%,富含柠檬酸、锌、精胺和酸性磷酸酶。前列腺特异性抗原(PSA)是一种丝氨酸蛋白酶,可在几分钟后液化凝固的精液。在前列腺感染、良性前列腺肥大和前列腺癌的情况下,可以在血液中检测到PSA,目前它被用作前列腺健康的一个指标。精液中的主要缓冲剂是磷酸盐和碳酸氢盐。第三个附属腺体,尿道球腺(也称为Cowper腺),在射精前响应性兴奋而排入阴茎尿道。这种分泌物富含黏液,可润滑、清洁和缓冲尿道。平均精子计数在6000万至1亿/mL精液之间。精子计数低于2000万/mL、活动精子少于50%或正常形态精子少于60%的男性通常不育。
- 勃起、插入和射精。射精和射精发生在性交过程中,响应于一个反射弧,该反射弧涉及来自阴茎的感觉刺激(通过阴部神经),随后是对男性道平滑肌的交感运动刺激和对与阴茎基部相关的肌肉组织的躯体运动刺激。然而,首先,男性必须实现并维持阴茎的勃起。阴茎已经进化成为一种插入器官,旨在分离阴道壁,通过阴道腔的潜在空间,并在靠近宫颈的阴道腔远端沉积精液。这种内部授精过程只有在阴茎通过勃起过程变硬时才能进行。
勃起是一种神经血管事件。阴茎由三个勃起体组成:两个海绵体和一个尿道海绵体(图44.12A)。尿道贯穿尿道海绵体。这三个勃起体由勃起组织组成——一种在疏松结缔组织支撑下的连续内皮内衬的潜在海绵状血管空间的吻合网络。在松弛状态下,流向海绵状空间的血流极少(见图44.12A)。这是由于血管(称为螺旋动脉)的血管收缩以及血流从海绵状空间分流所致。在性兴奋的刺激下,支配螺旋动脉血管平滑肌的副交感海绵体神经释放一氧化氮(NO)。NO激活鸟苷酸环化酶,从而增加环磷酸鸟苷(cGMP),降低细胞内\left[\mathrmCa^++\right]并引起肌肉松弛(见图44.12B)。血管扩张使血液流入海绵状空间,导致充血和勃起。它还会压迫阴茎中的静脉并减少静脉回流(见图44.12B)。
男性更年期
男性没有明显的更年期。然而,随着年龄的增长,性腺对LH的敏感性降低,雄激素的产生减少。随着这种情况的发生,血清LH和FSH水平上升。尽管精子产生通常在50岁后开始下降,但许多男性可以终生维持生殖功能和精子发生。
临床相关
无法达到或维持勃起称为勃起功能障碍(ED),是男性不育的原因之一。多种因素可导致ED,包括雄激素产生不足;神经血管损伤(如糖尿病、脊髓损伤);阴茎、会阴或骨盆的结构损伤;心理因素(如抑郁、表现焦虑);以及处方药物和娱乐性药物,包括酒精和烟草。治疗某些形式的勃起功能障碍的一个重大进展是使用选择性cGMP磷酸二酯酶抑制剂,有助于维持勃起(见图44.12B)。
女性生殖系统
女性生殖系统由性腺(称为卵巢)和女性生殖道组成,后者包括输卵管、子宫、宫颈、阴道和外生殖器。
卵巢
卵巢位于称为阔韧带的腹膜褶皱内,通常靠近盆腔的侧壁(图44.13)。由于卵巢延伸到腹膜腔,排卵后的卵子在输卵管捕获之前短暂地停留在腹膜腔内。
卵巢分为外部的皮质(cortex)和内部的髓质(medulla)(图44.14)。神经血管成分支配卵巢的髓质。卵巢皮质由密集的细胞基质(stroma)组成。在这个基质中存在着卵泡(ovarian follicles)(见图44.14,F),卵泡内包含一个初级卵母细胞(primary oocyte),周围环绕着卵泡细胞(follicle cells)。皮质被一层结缔组织囊——白膜(tunica albuginea)和一层由卵巢表面上皮细胞(ovarian surface epithelial cells)组成的单层上皮覆盖。卵巢没有导管将其配子输送到生殖道。因此,排卵过程涉及一个侵蚀卵巢壁的炎症事件。排卵后,卵巢表面上皮细胞迅速分裂以修复卵巢壁。大多数卵巢癌起源于这种高度增殖的上皮。
卵泡的生长、发育和功能
卵泡是卵巢的功能单位,它既执行配子生成功能,也执行内分泌功能。从一名绝经前周期性女性的卵巢组织切片中可以看到处于不同发育阶段的卵泡结构。卵泡的生命史可以分为以下几个阶段:
- 静止的原始卵泡(resting primordial follicle)。
- 生长的前窦卵泡(growing preantral follicle)(初级和次级卵泡)。
- 生长的窦卵泡(growing antral follicle)(三级卵泡)。
- 优势卵泡(dominant follicle)(排卵前卵泡,格拉夫卵泡)。
- 排卵期内的优势卵泡(dominant follicle within the periovulatory period)。
- 黄体(corpus luteum)(月经黄体或妊娠黄体)。
- 闭锁卵泡(atretic follicles)。
• 图44.12 A,阴茎内血管系统和海绵体组织的排列。在松弛状态下,螺旋动脉(helicine arteries)的收缩限制了血液流入海绵体间隙。B,导致阴茎勃起的神经血管事件的概述。(A,引自Parhon CI, Devila C. In: Melmed S, Auchus RJ, Goldfine AB, Koenig RJ, Rosen CJ, eds. Williams Textbook of Endocrinology. 14th ed. Philadelphia: Elsevier; 2019。)
• 图44.13 女性生殖系统的解剖结构。(修改自Drake RL, Vogl W, Mitchell AWM. Gray’s Anatomy for Students. Philadelphia: Churchill Livingstone; 2005。)
• 图44.14 卵巢的组织学结构。CL,黄体;F,卵泡。(修改自Young B, Lowe JS, Stevens A, Heath JW, Deakin PJ. Wheater’s Functional Histology. A Text and Colour Atlas. 5th ed. London: Churchill Livingstone; 2006。)
静止的原始卵泡
生长与结构
静止的原始卵泡(primordial follicles)(图44.15)代表了卵巢中最早且最简单的卵泡结构。原始卵泡在妊娠中期通过配子与体细胞的相互作用形成。迁移到性腺的原始生殖细胞(primordial germ cells)在有丝分裂中继续分裂为卵原细胞(oogonia),直到人类妊娠的第五个月。此时,大约700万个卵原细胞进入减数分裂过程,成为初级卵母细胞(primary oocytes)。在此期间,初级卵母细胞被一层简单的体细胞卵泡上皮细胞包围,从而形成原始卵泡(见图44.15)。卵泡细胞之间以及卵泡细胞与卵母细胞之间形成间隙连接(gap junctions)。卵泡细胞本身代表了一层真正的无血管上皮,被基底膜(basal lamina)包围。与Sertoli细胞-精子的相互作用类似,一部分颗粒细胞(granulosa cells)在整个发育过程中与卵母细胞保持紧密连接。颗粒细胞提供氨基酸、核酸和丙酮酸等营养物质,以支持卵母细胞的成熟。
原始卵泡代表了卵巢的卵泡储备(图44.16)。这一储备从最初的约700万个减少到生殖成熟时的不到30万个。在这些卵泡中,女性从初潮(第一次月经周期)到绝经(月经周期停止)期间会排卵约450个。在绝经时,卵巢中剩下的原始卵泡不到1000个。原始卵泡的减少主要是由于卵泡闭锁(follicular atresia)导致的死亡。然而,一小部分原始卵泡会以波动的形式进入卵泡生长。由于卵巢卵泡储备是一个固定的有限数量,静止的原始卵泡死亡或开始发育(或两者兼有)的速度将决定女性的生殖寿命。绝经开始的年龄具有强烈的遗传因素,但也受环境因素的影响。例如,吸烟显著消耗卵巢储备。闭锁或发育速度过快会耗尽储备,导致卵巢功能早衰(premature ovarian insufficiency)。
• 图44.15 从原始卵泡到次级前窦卵泡的发育过程。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
垂体促性腺激素(pituitary gonadotropins)通过促进卵巢的整体健康来维持正常的卵巢储备。然而,静止的原始卵泡进入生长过程的速度似乎与垂体促性腺激素无关。静止卵泡进入早期生长阶段的决定主要依赖于卵泡细胞和卵母细胞产生的卵巢内旁分泌因子(intraovarian paracrine factors)。
配子
在原始卵泡中,配子来源于已进入第一次减数分裂的卵原细胞;这些卵原细胞被称为初级卵母细胞。初级卵母细胞在2周的时间内经历第一次减数分裂的前期(称为前期I),随后停滞在双线期阶段。这一阶段的特征是染色质的去浓缩,这支持了卵母细胞成熟所需的转录。减数分裂在这一阶段的停滞可能持续长达50年。这一过程似乎是由于“成熟无能”,即缺乏支持减数分裂完成的细胞周期蛋白。卵母细胞的细胞核,称为生发泡,在这一阶段保持完整。
生长中的前窦卵泡
生长与结构
卵泡生长的第一阶段是前窦期,指的是在形成充满液体的窦腔之前发生的发育过程。卵泡生长的第一个可见迹象是立方颗粒细胞的出现。此时,卵泡被称为初级卵泡(见图44.15)。随着颗粒细胞的增殖,它们在卵母细胞周围形成多层(即分层)上皮。此时,卵泡被称为次级卵泡(见图44.15)。
一旦次级卵泡获得三到六层颗粒细胞,它会分泌旁分泌因子,诱导附近的基质细胞分化为上皮样膜细胞。膜细胞在卵泡周围形成一层扁平细胞。一旦膜层形成,卵泡就被称为成熟的前窦卵泡(见图44.15)。在人类中,初级卵泡需要几个月的时间才能达到成熟的前窦阶段。
• 图44.16 卵巢卵泡的命运。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
卵泡发育与卵泡从外皮质向内皮质的移动相关,更接近卵巢髓质的血管系统。卵泡释放血管生成因子,诱导形成一到两条小动脉,围绕卵泡形成血管环。
配子
在前窦阶段,卵母细胞开始生长并产生细胞和分泌蛋白。卵母细胞开始分泌称为ZP1、ZP2和ZP3的细胞外基质糖蛋白,形成透明带(见图44.15)。透明带厚度增加,并在受精过程中为精子提供物种特异性结合位点(见妊娠)。重要的是,颗粒细胞和卵母细胞通过透明带中的细胞突起保持间隙连接接触。卵母细胞还继续分泌旁分泌因子,调节卵泡细胞的生长和分化。
内分泌功能。 在这一时期,颗粒细胞(granulosa cells)表达FSH受体,但它们主要依赖于卵母细胞(oocyte)提供的因子来生长。在卵泡发育的早期阶段,它们并不产生卵巢激素。新获得的膜细胞(thecal cells)与睾丸的Leydig细胞类似,因为它们位于上皮“护理”细胞之外,表达LH受体,并产生雄激素(androgens)。Leydig细胞和膜细胞之间的主要区别在于,膜细胞不表达高水平的17β-HSD。因此,膜细胞的主要产物是雄烯二酮(androstenedione),而不是睾酮。在这一阶段,雄烯二酮的产生量非常少。
• 图44.17 早期窦卵泡(early antral follicle)发育为成熟排卵前卵泡(mature preovulatory follicle)的过程。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
生长中的窦卵泡
生长与结构。 成熟的排卵前卵泡(preantral follicles)在大约25天的时间内发育为早期窦卵泡(图44.17),在此期间,它们的直径从约0.1\mathrmmm增长到约0.2\mathrmmm。一旦颗粒上皮增加到六到七层,细胞之间就会出现充满液体的空间,并融合成窦腔(antrum)。在大约45天的时间内,这一波小窦卵泡将继续生长为直径2到5\mathrmmm的大型可募集窦卵泡(large recruitable antral follicles)。这一生长阶段的特征是颗粒细胞数量增加约100倍(从约10,000-1,000,000-\mathrmells)。窦腔的膨胀也是这一阶段的特征,窦腔的膨胀逐渐将颗粒细胞分为两个不同的群体:壁颗粒细胞(mural granulosa cells)和卵丘细胞(cumulus cells)(见图44.17)。
壁颗粒细胞(也称为颗粒层,stratum granulosum)形成卵泡的外壁。基底层附着在基膜上,并与外层的膜层紧密相邻。壁颗粒细胞变得高度类固醇生成,并在排卵后留在卵巢中,分化为黄体(corpus luteum)。
卵丘细胞是围绕卵母细胞的内层细胞(它们也被称为卵丘复合体,cumulus oophorus和放射冠,corona radiata)。卵丘细胞的最内层与卵母细胞保持间隙连接和粘附连接。在排卵过程中,卵丘细胞与卵母细胞一起释放(统称为卵丘-卵母细胞复合体,cumulus-oocyte complex)。卵丘细胞对于输卵管伞端通过纤毛运输机制“捕获”并移动卵母细胞至受精部位的能力至关重要(见妊娠部分)。
早期窦卵泡依赖于垂体FSH(follicle-stimulating hormone)的正常生长。大型窦卵泡在生长和维持活力方面高度依赖于垂体FSH。正如后面所讨论的,2到5\cdot\mathrmmm的卵泡通过在前一次月经周期结束时发生的FSH短暂增加被募集进入快速生长期。
配子
在窦卵泡的早期阶段,卵母细胞迅速生长;随后在较大的卵泡中生长速度减慢。在早期初级和次级卵泡中,由于缺乏特定的减数分裂相关蛋白,卵母细胞未能完成第一次减数分裂。在窦卵泡阶段,卵母细胞合成了足够的细胞周期成分,使其能够在排卵时完成第一次减数分裂。然而,较大的窦卵泡获得了减数分裂能力,但仍保持减数分裂阻滞,直到周期中期的LH(黄体生成素)激增。减数分裂阻滞是通过维持成熟卵母细胞中高水平的环磷酸腺苷(cAMP)来实现的(图44.18和44.19)。组成性激活(即不需要配体)的Gs蛋白偶联受体GPR3维持高水平的cAMP。卵母细胞特异性的磷酸二酯酶PDE3A将cAMP降解为无活性的AMP。在LH激增之前,PDE3A被cGMP抑制,cGMP在卵丘细胞和颗粒细胞内产生,并通过间隙连接进入卵母细胞。需要注意的是,人类卵子在排卵后会在第二个点——中期II期——阻滞,直到被精子受精(见图44.18)。
• 图44.18 卵母细胞减数分裂阻滞和成熟的相关事件。MAPK,丝裂原活化蛋白激酶。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013。)
• 图44.19 LH激增如何导致减数分裂恢复的模型。PDE,磷酸二酯酶。
内分泌功能
大窦卵泡的膜细胞产生大量的雄烯二酮和较少的睾酮。雄激素通过颗粒细胞转化为17β-雌二醇(图44.20)。在此阶段,FSH(促卵泡激素)刺激颗粒细胞的增殖,并诱导雌激素合成所需的CYP19(芳香化酶)的表达。此外,大窦卵泡的壁颗粒细胞在卵泡早期产生越来越多的抑制素。低水平的雌激素和抑制素对FSH分泌产生负反馈,从而有助于选择具有最高FSH反应性的卵泡。
优势卵泡
生长与结构
如前所述,在前一个月经周期结束时,一批大窦卵泡(2-5毫米)(见图44.17)被FSH的上升招募,开始快速依赖促性腺激素的发育。在年轻女性(<33岁)中,双侧卵巢中被招募的卵泡总数可高达20个,但随着年龄的增长迅速减少。通过选择过程,被招募的卵泡数量减少到排卵配额(人类为一个)。随着FSH水平的下降,快速生长的卵泡逐渐发生闭锁,直到只剩下一个卵泡。通常,被招募的卵泡中具有最多FSH受体的最大卵泡成为优势卵泡。选择发生在卵泡早期。到周期中期,优势卵泡成为一个大的排卵前卵泡,直径达20毫米,并在周期中期的促性腺激素激增时包含约5000万个颗粒细胞。
配子
卵母细胞(oocyte)能够完成第一次减数分裂,但在优势卵泡(dominant follicle)中保持停滞状态,直到黄体生成素(LH)激增。卵母细胞的生长持续进行,但速度较慢,直到排卵时卵母细胞的直径达到约140\upmu\mathrmm(即约为红细胞直径的20倍)。
• 图44.20 优势卵泡中类固醇生成的双细胞模型。上图:MG,壁颗粒细胞(Mural granulosa);T,卵泡膜细胞(theca)。(修改自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013。)
内分泌功能
新选择的卵泡作为一个重要的类固醇生成“腺体”出现。卵巢的类固醇生成需要卵泡膜细胞和颗粒细胞。如前所述,卵泡膜细胞(见图44.20,T)表达LH受体,主要生成雄烯二酮(androstenedione)。基础水平的LH刺激卵泡膜细胞中类固醇生成酶的表达。卵泡膜细胞血管丰富,因此能够获取低密度脂蛋白(LDL)和高密度脂蛋白(HDL)颗粒中的胆固醇。LH促进LDL受体和HDL受体(SR-B1)的表达,这些受体负责胆固醇的摄取。LH还促进CYP11A1(侧链裂解酶)、3β-HSD和CYP17(具有17-羟化酶活性和17,20-裂解酶活性)的强烈表达。从卵泡膜细胞释放的雄激素(主要是雄烯二酮,但也包括一些睾酮)扩散到壁颗粒细胞或进入卵泡周围的血管系统。
选择的卵泡的壁颗粒细胞(见图44.20,MG)具有大量的FSH受体,对FSH非常敏感,FSH上调CYP19(芳香化酶)基因的表达和活性。CYP19将雄烯二酮转化为弱雌激素雌酮(estrone),并将睾酮转化为强效雌激素17β-雌二醇(estradiol)。颗粒细胞表达激活型的17β-HSD异构体,将活性较低的雌酮转化为高活性的17β-雌二醇。此外,FSH在卵泡期诱导抑制素B(inhibin B)的表达。
重要的是,FSH还在卵泡期的后半段诱导壁颗粒细胞中LH受体的表达(见图44.20)。因此,壁颗粒细胞获得了对LH的响应能力,这使得这些细胞在FSH水平下降的情况下仍能维持高水平的CYP19。LH受体的获得还确保了壁颗粒细胞能够对LH激增作出反应。
围排卵期的优势卵泡
围排卵期(periovulatory period)被定义为从LH(黄体生成素)激增开始到卵丘-卵母细胞复合体(cumulus-oocyte complex)排出卵巢(即排卵)的时间段。这一过程在女性中持续32至36小时。与此同时,卵泡膜细胞(theca cells)和壁颗粒细胞(mural granulosa cells)的类固醇生成功能也发生了变化,这一过程被称为黄体化(luteinization),并在排卵后几天内形成能够产生大量孕酮(progesterone)和雌激素(estrogen)的黄体(corpus luteum)。因此,LH激增诱导了围排卵期复杂的生理过程,完成了卵巢在一个月内的配子生成功能,并将内分泌功能转变为为女性生殖道准备着床和妊娠的状态。
生长与结构
LH激增诱导了优势卵泡(dominant follicle)发生显著的结构变化,包括卵泡破裂、卵丘-卵母细胞复合体排卵,以及由剩余的卵泡膜细胞和壁颗粒细胞形成一个新的结构——黄体。在这一转变过程中,发生了以下主要结构变化:
- 排卵前的结构变化 在排卵前,较大的排卵前卵泡压迫卵巢表面,形成一个血管化较差的卵巢壁突起,称为排卵斑(stigma)。LH激增诱导卵泡膜细胞和颗粒细胞释放炎性细胞因子(inflammatory cytokines)和水解酶(hydrolytic enzymes)。这些分泌成分导致卵泡壁、白膜(tunica albuginea)和排卵斑附近的表面上皮(surface epithelium)发生分解(图44.21)。在这一过程结束时,卵泡腔(antral cavity)与腹膜腔(peritoneal cavity)连通。
- 卵丘-卵母细胞复合体的释放 卵丘细胞(cumulus cells)与壁颗粒细胞的连接退化,卵丘-卵母细胞复合体在卵泡腔内自由漂浮(见图44.21)。卵丘细胞也对LH激增作出反应,分泌透明质酸(hyaluronic acid)和其他细胞外基质成分。这些物质使整个卵丘-卵母细胞复合体膨胀,这一过程称为卵丘扩张(cumulus expansion)(见图44.21)。扩张后的卵丘-卵母细胞复合体更容易被输卵管捕获和运输。扩张的卵丘也使精子更容易找到卵丘-卵母细胞复合体。精子表达一种膜透明质酸酶(membrane hyaluronidase),使其能够穿透扩张的卵丘。卵丘-卵母细胞复合体通过破裂的排卵斑缓慢释放。
• 图44.21 排卵。GVBD,生发泡破裂(Germinal vesicle breakdown)。(修改自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
- 黄体形成 壁颗粒细胞的基底膜(basal lamina)被分解,使血管和外层的卵泡膜细胞能够进入颗粒细胞。颗粒细胞分泌血管生成因子(angiogenic factors),如血管内皮生长因子(vascular endothelial growth factor)、血管生成素2(angiopoietin 2)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF),这些因子显著增加了新黄体的血液供应。
配子
在排卵前,初级卵母细胞(primary oocyte)能够完成减数分裂,但它停滞在第一次减数分裂的前期(prophase I)(见图44.18)。LH(黄体生成素)的激增抑制了颗粒细胞(granulosa cells)和卵丘细胞(cumulus cells)产生cGMP(环磷酸鸟苷),从而解除了对卵母细胞特异性PDE3A(磷酸二酯酶3A)的抑制。PDE3A继续将cAMP(环磷酸腺苷)降解为无活性的AMP(腺苷单磷酸),从而解除了对减数分裂进程的抑制(图44.19)。随后,卵母细胞进入第二次减数分裂的中期(metaphase II),并在中期II停滞,直到受精。
内分泌功能
在LH激增时,卵泡膜细胞(theca cells)和壁颗粒细胞(mural granulosa cells)都表达LH受体。LH激增诱导颗粒细胞的分化——这一过程在排卵后持续数天。在排卵期前后,LH激增诱导壁颗粒细胞(现在正在转变为颗粒黄体细胞(granulosa lutein cells))的类固醇生成活性发生以下变化:
- 短暂抑制CYP19的表达,从而抑制雌激素的生成。雌激素的迅速下降有助于关闭对LH分泌的正反馈。
- 基底膜的分解和颗粒细胞的血管化。这使得LDL(低密度脂蛋白)和HDL(高密度脂蛋白)胆固醇能够被这些细胞用于类固醇生成。LH激增还增加了颗粒细胞中LDL受体和HDL受体(SR-BI)的表达。
• 图44.22 黄体中的类固醇生成途径。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
- StAR蛋白、CYP11A1(侧链裂解酶)和3\beta-HSD的表达开始(图44.22)。这些酶的表达是这些细胞开始产生高水平孕酮的关键。正如后面所讨论的,高水平的孕酮合成对于维持妊娠是绝对必要的。由于CYP17的活性,特别是其17,20-裂解酶功能,在颗粒黄体细胞中基本不存在,因此孕酮不会被进一步代谢为其他类固醇,而是离开细胞进入血液循环。
黄体
生长与结构
排卵后,卵泡腔的残余部分充满了来自柱头附近受损血管的血液,形成了出血性黄体(corpus hemorrhagicum)。几天内,红细胞和碎片被巨噬细胞清除,成纤维细胞用透明样细胞外基质填充卵泡腔。在成熟的黄体中,颗粒细胞(现在称为颗粒黄体细胞)增大并充满脂质(胆固醇酯)。增大的颗粒黄体细胞塌陷并部分填充旧的卵泡腔。卵泡膜细胞与血管、肥大细胞、巨噬细胞、白细胞和其他常驻结缔组织细胞一起,在多个部位浸润颗粒层。
人类的黄体(corpus luteum)被设定为存活14天,加减2天(月经黄体),除非被来自植入胚胎的类LH激素人绒毛膜促性腺激素(hCG)所“拯救”。如果被拯救,妊娠黄体将在整个妊娠期间保持活力(通常约为9个月)。月经黄体在14天内退化的机制尚未完全理解。黄体似乎逐渐对基础水平的LH变得不敏感,因此需要hCG与LH受体结合以维持黄体的健康和功能。退化似乎涉及在前黄体期的第二周,随着孕酮水平的下降,黄体颗粒细胞和子宫释放前列腺素PGF_2\upalpha。来自免疫和血管细胞的几种旁分泌因子(内皮素、单核细胞趋化蛋白-1)可能在黄体颗粒细胞的死亡和清除中起作用。黄体最终转化为一个称为白体的疤痕样结构,沉入卵巢髓质并缓慢被吸收。
配子。LH激增诱导两个平行事件,排卵和黄体化。如果排卵正常发生,黄体中没有配子。
内分泌功能。在LH激增之前,颗粒细胞将胆固醇转化为类固醇激素的能力非常低。LH激增诱导CYP11A1、3β-HSD和StAR蛋白的表达开始,使黄体颗粒细胞能够将胆固醇转化为孕酮。由于CYP17的表达极低,孕酮积累并从黄体颗粒细胞中移出,进入血管系统。黄体的孕酮产量(见图44.22)从LH激增开始稳步增加,并在黄体中期达到峰值。这种时间安排的主要目的是将子宫内膜转化为一个粘附和支撑的结构,以便植入和早期妊娠。正如后面所讨论的,黄体中期与早期胚胎发生同步,以便在月经周期的第22天左右囊胚进入子宫时,子宫处于最佳准备状态。雌二醇继续由黄体膜细胞和黄体颗粒细胞产生。雌二醇的产生在LH激增后暂时下降,但在黄体中期反弹并达到峰值。雌二醇在孕酮靶细胞(如子宫内膜)中诱导孕酮受体,从而确保对孕酮的完全反应。
黄体激素输出绝对依赖于基础LH水平(见图44.22)。事实上,孕酮输出与女性LH释放的脉冲模式密切相关。在黄体期,FSH和LH都被孕酮和雌激素的负反馈降低到基础水平。此外,黄体颗粒细胞分泌抑制素,选择性地抑制FSH分泌。
黄体必须产生大量的孕酮(progesterone)以支持着床和早期妊娠。因此,黄体的寿命非常规律,黄体期缩短通常会导致不孕。黄体的质量在很大程度上取决于其发育而来的优势卵泡的大小和健康状况,而优势卵泡的发育又依赖于卵泡期正常的丘脑和垂体刺激。许多因素会干扰卵泡期丘脑和垂体的输出,包括剧烈运动、饥饿、高催乳素水平和甲状腺功能异常,这些因素都可能导致黄体期缺陷和不孕。
闭锁卵泡
卵泡闭锁(atretic follicles)是指卵巢卵泡的消亡。在闭锁过程中,颗粒细胞和卵母细胞发生凋亡。卵泡膜细胞通常持续存在并重新填充卵巢的细胞基质。卵泡膜细胞保留LH受体和产生雄激素的能力,并统称为卵巢的“间质腺”。卵泡在发育的任何阶段都可能发生闭锁。
与月经周期相关的卵泡发育
人类的月经周期严格指的是每月通过月经过程排出废弃的子宫内膜作为经血或月经流量的过程(称为月经期)。事实上,女性自身检测到的月经来潮或缺失是月经停止(例如由于怀孕或绝经)或月经周期持续时间和/或频率变化的主要证据。然而,从内分泌学的角度来看,将人类的月经周期视为具有卵巢周期和子宫周期是有用的,后者由前者驱动。正如后面所讨论的,人类的月经周期还包括丘脑、垂体、输卵管和阴道等组成部分。月经周期的生殖功能是由卵巢激素对丘脑、垂体、子宫、输卵管、宫颈和阴道——甚至卵巢本身——功能的集体协调,以达到以下目的:(1)产生可受精的配子(卵子);(2)为性交、精子接收、卵子受精和早期胚胎发生提供支持性环境;(3)为子宫内膜的着床、胎盘形成和妊娠做好准备;(4)尽量减少叠加着床(即第二次着床)发生的可能性,和/或防止上行感染从阴道向子宫移动。
月经周期的前半部分被称为卵巢的卵泡期,其特征是募集和生长一个大的窦卵泡,选择优势卵泡,以及优势卵泡的生长直至排卵。优势卵泡必须包含一个完全发育的卵母细胞和分泌高水平雌激素的体细胞卵泡细胞。
月经周期的后半部分(排卵后)被称为卵巢的黄体期,主要由黄体的激素分泌主导。黄体必须分泌孕酮和雌二醇以推动正常周期的进展。
卵泡发育晚期、排卵和黄体化的调控:人类的月经周期
如前所述,卵泡发育的晚期和黄体功能的维持绝对依赖于正常的下丘脑和垂体功能。与雄性类似,下丘脑神经元以脉冲方式分泌促性腺激素释放激素(GnRH)。GnRH反过来刺激垂体促性腺激素细胞产生促黄体生成素(LH)和促卵泡激素(FSH)。高频率的GnRH脉冲(每60-90分钟一次)选择性地促进LH的产生,而低频率的脉冲则促进FSH的产生。雄性和雌性生殖轴之间的一个主要区别是周期中的促性腺激素激增,这依赖于来自优势卵泡的持续高水平雌激素。
卵巢、垂体和下丘脑之间发生了一种高度动态的“对话”,这种对话协调了月经周期的事件,从前一个非受孕周期的黄体期结束时开始(图44.23)。随后的事件根据图44.24编号:
事件1:在没有受精和着床的情况下,黄体退化并死亡(称为黄体溶解)。这导致月经周期第24天时孕酮、雌激素和抑制素水平急剧下降。
事件2:垂体促性腺激素细胞感知到黄体功能的结束,从而从负反馈中释放出来(见图44.23B,黄体晚期)。这导致在月经开始前约2天FSH的增加。FSH选择性增加的基础尚不完全清楚,但可能是由于黄体期GnRH脉冲的低频率,而这又是由高孕酮水平引起的。
• 图44.23 A,在月经周期的卵泡期结束时,内分泌信号导致优势卵泡排卵。B,在非妊娠月经周期的黄体期,内分泌信号导致黄体死亡并募集卵泡以开始下一个周期。
• 图44.24 人类月经周期,重点在于卵巢和垂体促性腺激素细胞之间的“对话”。注意,\mathsfE_2和抑制素水平的相对变化由同一条线表示。
事件3:FSH水平的上升募集了一批大(直径2-5毫米)的窦卵泡,开始快速且高度依赖促性腺激素的生长。这些卵泡产生低水平的雌激素和抑制素B。
事件4:促性腺激素细胞对缓慢上升的雌激素和抑制素B水平作出反应,减少FSH的分泌(见图44.23A,卵泡早期)。孕酮的缺乏促进了GnRH脉冲频率的增加,从而选择性地增加了促性腺激素细胞合成和分泌LH。因此,LH:FSH比率在整个卵泡期缓慢增加。
事件5:卵巢对FSH水平下降的反应是除了一个优势卵泡外,所有被募集的卵泡发生卵泡闭锁(见图44.23A,卵泡早期)。因此,选择过程是由卵泡在FSH分泌下降的情况下对FSH的极度依赖所驱动的。通常只有具有最多FSH受体和最佳血液供应的最大卵泡能够存活。这个卵泡产生越来越多的178-雌二醇和抑制素B。此时FSH的一个关键作用是诱导优势卵泡的壁颗粒细胞中LH受体的表达(见图44.23A,卵泡晚期)。
事件6:一旦优势卵泡使女性循环中的雌激素水平超过200\mathrmpg/mL并持续约50小时,雌激素会对促性腺激素细胞产生正反馈,导致周期中期的LH激增。这一过程被周期中期分泌的少量孕酮增强。正反馈的确切机制尚不清楚。然而,它需要在垂体水平发生变化,因为促性腺激素细胞中的GnRH受体和对GnRH信号的敏感性显著增加。下丘脑通过增加GnRH脉冲的频率来促进促性腺激素的激增。周期中期的孕酮似乎在下丘脑的启动中起到一定作用。
事件7:LH激增驱动减数分裂成熟、排卵以及颗粒细胞分化为产生孕酮的细胞(见图44.23A,卵泡晚期)。
事件8:成熟黄体产生的孕酮、雌激素和抑制素A水平的上升对垂体促性腺激素细胞产生负反馈。尽管雌二醇水平超过了正反馈的200\mathrmpg/mL阈值,但黄体现在产生的高水平孕酮会阻断雌二醇的任何正反馈。因此,FSH和LH水平都下降到基础水平(见图44.23B,黄体中期)。
事件9:LH(而非FSH)的基础水平对正常黄体功能是绝对必需的。然而,黄体对LH信号逐渐变得不敏感,除非LH样活性(即来自植入胚胎的hCG)增加,否则黄体将死亡。在非受孕周期中,月经黄体将在14天内退化,孕酮和雌激素水平将在大约10天后开始下降,从而循环回到事件1(见图44.23B,黄体晚期)。
从这一系列事件中可以看出,卵巢是月经周期的主要时钟。两个主要的垂体事件——募集大窦卵泡的FSH短暂上升和诱导排卵的LH激增——的时间是由两个卵巢事件决定的。这些事件是:(1)黄体的高度规律寿命及其在14天后的消亡;(2)优势卵泡的生长达到能够维持持续高雌激素产生的程度,从而在垂体诱导正反馈的转换。本质上,优势卵泡告诉垂体它已经准备好进行排卵和黄体化。
输卵管
结构与功能
输卵管(oviducts,也称为子宫管和输卵管)是肌肉管,其远端靠近每个卵巢的表面,近端穿过子宫壁。输卵管分为四个部分(从远端到近端):漏斗部(infundibulum),即输卵管的开口端,具有称为伞部(fimbriae)的指状突起,这些突起在卵巢表面扫过;壶腹部(ampulla),其管腔相对较宽,黏膜有广泛的褶皱;峡部(isthmus),其管腔相对较窄,黏膜褶皱较少;以及壁内段或子宫段(intramural or uterine segment),该段穿过子宫壁,位于子宫的上角(图44.25)。
输卵管的主要功能是:
- 在排卵时捕获卵丘-卵母细胞复合体(cumulus-oocyte complex),并将其转移到受精发生的中点(壶腹-峡部交界处)。输卵管分泌物覆盖并渗透卵丘-卵母细胞复合体,可能是其存活和受精能力所必需的。
- 提供精子储存的场所。在性交后5天内排卵的女性仍可能怀孕。精子通过附着在峡部内衬的上皮细胞上保持存活。输卵管的分泌物还能诱导精子的获能(capacitation)和超活化(hyperactivity)。
- 分泌液体,为植入前的胚胎提供营养支持。
胚胎进入子宫的时间至关重要,因为子宫有一个大约3天的植入窗口期。输卵管需要将早期胚胎保持在囊胚阶段(受精后5天),然后让其进入子宫腔。
输卵管壁由黏膜(称为输卵管内膜,endosalpinx)、两层肌肉层(称为输卵管肌层,myosalpinx)和外部结缔组织(输卵管外膜,perisalpinx)组成。输卵管内膜形成许多褶皱,几乎使管腔消失。内膜由两种细胞类型的单层上皮组成:纤毛细胞和分泌细胞。纤毛在漏斗部最多,推动卵丘-卵母细胞复合体向子宫移动。伞部上的纤毛是运输排卵后的卵丘-卵母细胞复合体的唯一机制。一旦复合体通过输卵管口进入壶腹部,它就会通过纤毛和肌肉层的蠕动收缩移动。
• 图44.25 女性生殖系统示意图。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013。)
输卵管内膜的分泌细胞产生一种富含蛋白质的黏液,这种黏液通过纤毛沿着输卵管输送到子宫。这种纤毛-黏液“电梯”机制维持了健康的上皮组织,将卵丘-卵母细胞复合体推向子宫,并可能为游动的精子提供方向指引。卵丘-卵母细胞复合体的运动在壶腹-峡部交界处减慢,通常受精发生在这里。这似乎部分是由于峡部产生的浓稠黏液以及峡部肌层张力的增加。输卵管分泌物的成分复杂,包括生长因子、酶和输卵管特异性糖蛋白。需要注意的是,体外受精的临床过程表明,输卵管的分泌物并非生育的绝对必要条件。然而,在体内受精(即自然性交)后,正常的输卵管功能对于受精和着床是绝对必需的。正常的输卵管功能还能最大限度地降低异位着床和异位妊娠的风险,这种情况最常发生在输卵管内。
月经周期中的激素调节
一般来说,卵泡期分泌的雌激素会增加输卵管内膜上皮细胞的大小和高度。雌激素增加了输卵管的固有层血流,促进了输卵管特异性糖蛋白的产生(其功能尚不清楚),并增加了整个输卵管的纤毛生成。雌激素促进峡部分泌浓稠黏液,并增加峡部肌层的张力,从而使卵丘-卵母细胞复合体停留在壶腹-峡部交界处进行受精。此外,值得注意的是,输卵管上皮细胞表达LH受体,这可能与雌激素协同作用,在排卵期优化输卵管功能。排卵后,黄体早期到中期的高孕酮水平与雌激素一起降低了上皮细胞的大小和功能。孕酮进一步促进纤毛脱落,减少浓稠黏液的分泌,并放松峡部的张力。
子宫
结构与功能
子宫是位于盆腔中线的一个单一器官,位于膀胱和直肠之间。子宫的黏膜称为子宫内膜,三层厚的肌层称为子宫肌层,外层的结缔组织和浆膜称为子宫外膜。子宫的部分包括:(1)子宫底,即从输卵管入口向上延伸的部分;(2)子宫体,构成子宫的大部分;(3)峡部,子宫体下端的一个短而狭窄的部分;(4)子宫颈,延伸到阴道内(见图44.13和44.25)。由于子宫颈的黏膜与子宫的其他部分不同,并且不经历月经过程,因此将在后面单独讨论。
子宫的既定功能都与受精和妊娠有关(稍后讨论)。子宫的主要功能是:
- 协助精子从阴道移动到输卵管。
- 为囊胚的附着和着床提供合适的场所,包括富含营养的厚基质。
- 限制着床胚胎的侵袭性,使其停留在子宫内膜内而不到达子宫肌层。
- 提供成熟的胎盘结构的母体侧,包括胎儿侧附着的基板(basal plate),以及在妊娠头三个月后充满母体血液的大片绒毛间隙(intervillous spaces)。
- 随着胎儿的生长而增长和扩展,使其在非粘性的水环境中发育。
- 在足月时提供强烈的肌肉收缩以排出胎儿和胎盘。
为了理解子宫的功能以及非生育性月经周期中子宫的变化,我们将回顾子宫内膜的精细结构以及子宫血液供应与子宫内膜的关系(图44.26)。子宫内膜的腔面覆盖着单层立方/柱状上皮。该上皮与延伸到子宫内膜深处的粘膜腺体(称为子宫腺体)相连。粘膜由螺旋动脉(spiral arteries)供血,这些动脉是穿过子宫肌层的子宫动脉的分支。螺旋动脉的终末小动脉正好投射在表面上皮下方。这些小动脉形成了一个上皮下毛细血管和小静脉的丛,这些血管具有膨胀的薄壁段,称为静脉湖(venous lakes)或腔隙(lacunae)。固有层本身细胞密集。固有层的基质细胞在妊娠和月经期间都起着重要作用。
子宫内膜的腔面约三分之二在月经期间脱落,称为功能层(functional zone)(也称为功能层(stratum functionalis))(见图44.26)。月经后剩余的子宫内膜基底三分之一称为基底层(basal zone)(也称为基底层(stratum basale))。基底层包含子宫内膜的所有细胞类型(即来自腺体剩余尖端的上皮细胞、基质细胞和内皮细胞)。血液供应由与螺旋动脉分开的直动脉提供。
• 图44.26 子宫内膜内腺体和血流的组织示意图。(来自Straus III。见:Yen SSC等编。生殖内分泌学。第4版。费城:Saunders;1999。)
月经周期中子宫内膜的激素调节
增殖期
卵巢类固醇的每月波动诱导子宫内膜进入不同阶段。在优势卵泡选择及其雌二醇产量增加时,子宫内膜刚刚结束月经。功能层已经脱落,只剩下基底层(图44.27)。卵巢卵泡期中后期雌激素水平的上升诱导子宫内膜进入增殖期。
雌激素诱导基底层中的所有细胞类型生长和分裂。事实上,“雌激素”化合物的定义历史上一直是“子宫营养性”的。雌激素通过其同源受体(ER- \upalpha 和 \mathrmER-β )直接增加细胞增殖,这些受体调节基因表达(图44.28)。雌激素还通过局部产生的生长因子间接控制子宫生长。此外,雌激素诱导孕酮受体的表达,从而“启动”子宫内膜,使其在卵巢黄体期能够对孕酮作出反应。
• 图44.27 子宫内膜的月经周期。(修改自White BA, Porterfield SP. Endocrine Physiology. 第4版. Philadelphia: Mosby; 2013.)
• 图44.28 雌激素受体(ER)调节基因表达的分子机制。左图,17β-雌二醇与ER结合并改变其构象,使其以二聚体形式结合到雌激素反应元件(ERE)上,并招募共激活蛋白(Co-Act),从而刺激基因表达。右图,选择性雌激素受体调节剂(SERMs),如乳房中的他莫昔芬,改变ER的构象,使其招募共抑制蛋白(Co-Rep),从而抑制基因表达。在这种情况下,SERM作为ER拮抗剂,但在某些组织中,相同的SERM可以作为ER激动剂。(修改自White BA, Porterfield SP. Endocrine Physiology. 第4版. Philadelphia: Mosby; 2013.)
分泌期
在排卵时,子宫内膜的功能层厚度在17β-雌二醇的增殖作用下已经恢复(见图44.27)。排卵后,黄体产生高水平的孕酮和17β-雌二醇。由于这些激素的作用,卵巢的黄体期将子宫内膜的增殖期转变为分泌期。尽管雌二醇的增殖作用减弱,如上所述,雌二醇通过上调孕酮受体来促进孕酮的作用。一般来说,孕酮抑制子宫内膜的进一步生长,并诱导上皮细胞和基质细胞的分化。孕酮诱导子宫腺体分泌富含营养的物质,以支持囊胚的存活。随着分泌期的进行,子宫黏膜腺体变得螺旋状和囊状(见图44.27)。孕酮还诱导表面上皮细胞的黏附性变化,从而产生胚胎植入的“接受窗口”(见妊娠部分)。此外,孕酮促进基质细胞分化为“前蜕膜细胞”,这些细胞必须准备好形成妊娠蜕膜或在没有妊娠的情况下协调月经的发生。
月经期
在非受孕周期中,黄体的死亡导致孕酮的突然撤退,从而引起子宫内膜的变化,导致功能层的脱落(见图44.27)。月经通常持续4到5天(称为经期),失血量在25到35毫升之间。月经与卵巢的早期卵泡期同时发生。
在细胞水平
孕酮(progesterone)拮抗17β-雌二醇(17β-estradiol)的增殖作用,并下调雌激素受体(estrogen receptor, ER)。孕酮还诱导17β-HSD的失活亚型,从而将具有活性的17β-雌二醇转化为无活性的雌酮(estrone)。孕酮对17β-雌二醇促有丝分裂作用的这种拮抗作用对于保护子宫内膜免受雌激素诱导的子宫癌非常重要。相比之下,给女性使用"无拮抗的雌激素"会显著增加患子宫癌的风险。
已经开发出称为选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs)的药物,它们以组织特异性方式抑制ER功能(见图44.28)。例如,SERM他莫昔芬(tamoxifen)被用作ER拮抗剂,用于治疗ER阳性乳腺癌,其早期进展由雌激素促进。SERM与ER结合诱导构象变化,使共抑制因子(co-repressors)能够与ER结合或促进ER的降解(或两者兼有;见图44.28)。由于他莫昔芬具有子宫营养活性(即使子宫内膜组织生长),因此开发了更新的SERMs,如雷洛昔芬(raloxifene),它们在乳房上表现出ER拮抗活性,在骨骼上表现出有益的ER激动活性(见后文),而在子宫内膜上则没有活性或具有ER拮抗活性。
子宫肌层的激素调节
子宫肌层的平滑肌细胞也对类固醇激素的变化有反应。子宫肌层的蠕动收缩有利于排卵时管腔内容物从宫颈向宫底移动,这些收缩可能在将射精的精子从宫颈快速大量运输到输卵管中发挥作用。在月经期间,收缩从宫底向宫颈传播,从而促进脱落的功能层(stratum functionalis)排出。平滑肌细胞的大小和数量由雌激素和孕酮决定。健康的有周期性月经的女性维持着强健的子宫肌层,而绝经后女性的子宫肌层逐渐变薄。最剧烈的变化发生在怀孕期间,此时平滑肌细胞的长度从50微米增加到500~\upmu\mathrmm。怀孕的子宫肌层也有更多的平滑肌细胞和更多的细胞外基质。
临床相关
月经失调相对常见,包括月经过多(menorrhagia)(月经量过多导致失血超过80\mathsfm L)、子宫不规则出血(metrorrhagia)(正常月经周期之间不规则且有时延长的月经出血)和痛经(dysmenorrhea)(疼痛的月经)。少数不规则的月经周期,称为月经稀发(oligomenorrhea),以及月经缺失,称为闭经(amenorrhea),通常是由于下丘脑-垂体-卵巢轴的功能障碍,而不是局部盆腔病理生理学。
由于子宫内膜组织自然脱落的碎片中含有活细胞,子宫内膜组织偶尔会进入女性生殖道的其他部分(如输卵管、卵巢),以及腹部下部和相关结构(如直肠子宫陷凹,如图44.13所示)。这些移植组织会导致子宫内膜异位症——子宫外存在对激素敏感的子宫内膜组织病灶。子宫内膜异位症的扩散可能是由于月经组织反流入输卵管或通过淋巴系统移动,或两者兼有。子宫内膜异位症常表现为周期性出血,并与不孕、排便疼痛、排尿疼痛、性交疼痛或广泛的盆腔疼痛相关。
宫颈
结构与功能
宫颈是子宫的下部延伸部分,突入阴道(见图44.25)。其黏膜覆盖宫颈管,具有高度弹性的固有层和与子宫肌层连续的肌层。宫颈突入阴道穹窿的部分称为宫颈外口,而围绕宫颈管的部分称为宫颈内口。宫颈管在子宫和阴道的开口分别称为宫颈内口和宫颈外口。宫颈作为上生殖道的门户——在月经周期中期,宫颈管有助于精子的存活和进入。在黄体期,宫颈管阻碍精子和微生物的通过,从而抑制第二个胚胎的叠加植入或上行感染进入胎盘、胎膜和胎儿。宫颈在物理上支持不断增长的胎儿的重量。在分娩时,宫颈软化和扩张允许新生儿和胎盘从子宫进入阴道。
月经周期中宫颈黏液的激素调节
宫颈管内衬有单层柱状上皮,以激素敏感的方式分泌宫颈黏液。雌激素刺激产生大量稀薄、水样、微碱性的黏液,这是精子的理想环境。孕激素刺激产生少量黏稠、微酸性的黏液,对精子不利。在正常月经周期中,宫颈黏液的条件在排卵时最适合精子的穿透和存活。
阴道
结构与功能
阴道是女性的交配结构之一,并作为产道(见图44.13和44.25)。其黏膜由非角化的复层鳞状上皮覆盖。黏膜具有富含弹性纤维的厚固有层,并且血管丰富。阴道内没有腺体,因此性交时的润滑来自(1)宫颈黏液(尤其是在月经周期中期性交时),(2)来自固有层血管的渗出液(即超滤液),以及(3)前庭腺。黏膜被相对较薄(相对于子宫和宫颈)的两层肌层和外部结缔组织包围。阴道壁由阴部神经的分支支配,这些分支在性交时有助于性快感和高潮。
月经周期中的激素调节
阴道上皮的表层细胞不断脱落,这些细胞的性质受激素环境的影响。雌激素刺激阴道上皮的增殖并增加其糖原含量(称为“角化”——但在人类中,真正的角化或角质化不会发生)。糖原被共生的乳酸菌代谢为乳酸,从而维持酸性环境。这抑制了非共生细菌和真菌的感染。孕酮增加上皮细胞的脱落。
外生殖器
结构与功能
女性外生殖器由外侧的大阴唇(阴囊的同源结构)和前方的阴阜包围(见图44.25)。外阴(vulva)统指包括大阴唇、阴阜、小阴唇、阴蒂、阴道前庭、前庭球(腺体)和尿道外口在内的区域。临床医生也将外阴称为阴部(pudendum)。外阴的结构具有性唤起和高潮、引导尿液流动以及部分覆盖阴道开口的功能,从而抑制病原体的进入。
阴蒂是阴茎的胚胎学同源结构,由两个海绵体(corpora cavernosa)和一个龟头(glans)组成,这些结构将阴蒂附着在坐骨耻骨支上。这些结构由勃起组织组成,并以与阴茎基本相同的方式经历勃起过程。与阴茎不同,阴蒂组织完全与尿道分离。因此,阴蒂参与性唤起和高潮。阴道同样参与性满足,但也作为交配器官和产道。
月经周期中的激素调节
外阴的结构在月经周期中没有显著变化。然而,这些结构的健康和功能依赖于激素的支持。外生殖器和阴道对雄激素(睾酮和二氢睾酮)和雌激素有反应。雄激素还作用于中枢神经系统(CNS),以增加女性的性欲。
17\beta-雌二醇和孕酮的生物学
雌激素和孕酮的生物学效应
17\beta-雌二醇和孕酮在月经周期中波动,它们具有多种效应,可以根据是否与生殖系统直接相关进行分类。这两种激素对卵巢、输卵管、子宫、宫颈、阴道和外生殖器以及下丘脑和垂体有深远的影响。雌激素和孕酮对非生殖组织也有重要影响:
骨骼:雌激素是两性长骨骨骺板闭合所必需的。17\beta-雌二醇具有骨合成代谢和钙调节作用(见第40章)。它刺激肠道\mathrmCa^++的吸收。17\beta-雌二醇也是成骨细胞和破骨细胞功能的最强调节剂之一。雌激素促进成骨细胞的存活和破骨细胞的凋亡,从而有利于骨形成而非骨吸收。与更年期相关的低雌激素水平会导致骨量减少和骨质疏松。
肝脏
17β-雌二醇(estradiol)对肝脏的总体作用是改善循环中的脂蛋白(lipoprotein)谱。雌激素(estrogen)增加低密度脂蛋白(LDL)受体的表达,从而增加肝脏对富含胆固醇的LDL颗粒的清除。雌激素还增加循环中高密度脂蛋白(HDL)的水平。雌激素调节肝脏中多种转运蛋白(transport proteins)的产生,包括皮质醇结合蛋白(cortisol-binding protein)、甲状腺激素结合蛋白(thyroid hormone–binding protein)和性激素结合球蛋白(SHBG)。
心血管器官
绝经前女性的心血管疾病(cardiovascular disease)发病率显著低于男性或绝经后女性。雌激素通过增加一氧化氮(nitric oxide)的产生来促进血管舒张,从而放松血管平滑肌并抑制血小板活化。雌激素受体中的单核苷酸多态性(single-nucleotide polymorphisms)与心血管疾病风险的增加有关。
皮肤
雌激素和孕激素(progesterone)维持健康光滑的皮肤,并保持正常的表皮和真皮厚度。雌激素刺激角质形成细胞(keratinocytes)的增殖并抑制其凋亡。在真皮中,雌激素和孕激素增加胶原蛋白(collagen)的合成,并通过抑制基质金属蛋白酶(matrix metalloproteinases)来抑制胶原蛋白的分解。雌激素还增加糖胺聚糖(glycosaminoglycan)的产生和沉积,并促进伤口愈合。
中枢神经系统(CNS)
雌激素具有神经保护作用,即它能抑制神经元细胞在缺氧或其他损伤情况下的死亡。雌激素对血管生成(angiogenesis)的积极影响可能是其对中枢神经系统产生有益和类似兴奋剂作用的部分原因。孕激素作用于下丘脑,提高体温调节的设定点,从而使体温升高约0.5^\circ\mathrmF。这是通过测量体温来确定是否发生排卵的基础。孕激素是一种中枢神经系统抑制剂。月经黄体(corpus luteum)退化后孕激素的丧失是经前情绪障碍(premenstrual dysphoria,即经前综合征[PMS])的基础。孕激素还作用于脑干,使通气对\mathrmPco_2的反应敏感化,从而增加通气量并降低\mathrmPco_2。
脂肪组织
雌激素通过降低脂蛋白脂肪酶(lipoprotein lipase)活性和增加激素敏感性脂肪酶(hormone-sensitive lipase)来减少脂肪组织(即具有脂解作用)。雌激素的丧失会导致脂肪组织的积累,尤其是在腹部。
卵巢类固醇的运输和代谢
类固醇激素(steroid hormones)是疏水性的,在血液中与血浆蛋白(plasma proteins)结合运输。大约60\%的雌激素与性激素结合球蛋白(SHBG)结合运输,20\%与白蛋白(albumin)结合,20\%以游离形式存在。孕激素主要与皮质醇结合球蛋白(cortisol-binding globulin,即转皮质素[transcortin])和白蛋白结合。由于其对这两种蛋白的结合亲和力相对较低,其循环半衰期约为5分钟。
尽管卵巢是雌激素产生的主要部位,但雄激素(androgens)在外周芳香化(aromatization)为雌激素可以在某些组织中产生局部高水平的17β-雌二醇。肾上腺和卵巢雄激素的外周转化是绝经后雌激素的重要来源(稍后讨论)。CYP19(芳香化酶[aromatase])在乳腺中表达的事实是芳香化酶抑制剂用于治疗绝经后女性雌激素依赖性乳腺癌的基础。
雌激素(estrogens)和孕激素(progestins)在肝脏中被降解为无活性的代谢物,与硫酸盐或葡萄糖醛酸结合,并通过尿液排出。雌二醇(estradiol)的主要代谢物包括雌酮(estrone)、雌三醇(estriol)和儿茶酚雌激素(catechol estrogens)(如2-羟基雌酮和2-甲氧基雌酮)。孕酮(progesterone)的主要代谢物是孕二醇(pregnanediol),它与葡萄糖醛酸结合后通过尿液排出。
生殖系统的个体发育
与大多数其他器官系统不同,生殖系统在男性和女性的生命周期中会经历显著的活动变化(图44.29)。生殖系统的发育发生在子宫内,并形成女性或男性胎儿。出生后及婴儿期,生殖系统基本处于静止状态。青春期时,下丘脑-垂体-性腺轴“觉醒”,性腺开始分泌性类固醇激素,进而诱导与男性和女性相关的性别二态性外观和行为变化。女性的生殖寿命由其卵巢储备和卵泡发育程度决定(见前文),并在更年期结束,通常在生命的第五个十年。卵巢停止产生雌激素对许多绝经后女性有明显的临床影响。男性则终生持续产生精子,但可能会经历雄激素分泌下降(男性更年期),这与一系列临床后遗症相关。
妊娠
女性的生殖系统在妊娠期间会发生显著变化。促性腺激素和性腺类固醇的产生从母体的下丘脑-垂体-卵巢轴(在妊娠期间受到强烈抑制)转移到胎儿胎盘。事实上,胎儿胎盘组织的内分泌功能(1)维持妊娠子宫的静止状态,(2)改变母体生理以确保胎儿在子宫内的营养,(3)改变母体垂体功能和乳腺发育以确保出生后胎儿的持续营养,(4)决定分娩时间(也称为分娩)。在胎儿下丘脑和垂体发育成功能性轴之前,胎盘还在胎儿睾酮产生和男性生殖系统分化中发挥重要作用。
受精、早期胚胎发生、着床和胎盘形成
与母体卵巢和生殖道功能的同步
受精、早期胚胎发生、着床和早期妊娠都与人类月经周期同步(图44.30)。在排卵前,卵巢处于卵泡晚期并产生高水平的雌激素。雌激素促进子宫内膜的生长并诱导孕酮受体的表达。雌激素最终诱导黄体生成素(LH)激增,进而诱导卵母细胞的减数分裂成熟和卵丘-卵母细胞复合体的排卵。
• 图44.29 生命周期中促性腺激素分泌的模式。注意妊娠期和婴儿早期的短暂峰值以及儿童期的低水平。女性随后每月有周期性激增,黄体生成素(LH)超过促卵泡激素(FSH);男性则没有。两性在50岁后促性腺激素分泌增加,FSH超过LH。
从受精到着床的过程大约需要6天时间完成,因此着床通常发生在月经周期的第22天左右。此时,卵巢处于黄体中期,分泌大量的孕酮(progesterone)。孕酮刺激子宫腺体的分泌,为胚胎提供营养。这被称为组织营养(histiotropic nutrition),是妊娠前三个月母体向胎儿传递营养的重要方式,之后被血液营养(hemotropic nutrition)所取代(详见后文)。孕酮抑制子宫肌层的收缩,并阻止导致月经的旁分泌因子(如细胞因子、前列腺素、趋化因子和血管收缩剂)的释放。孕酮诱导子宫内膜的“接受窗口期”,这一窗口期通常存在于月经周期的第20天至第24天。这一接受期与子宫内膜上皮细胞的粘附性增加有关,涉及子宫内膜上皮细胞顶端表面形成称为胞饮突起(pinopodes)的细胞延伸,同时顶端细胞膜上粘附蛋白(如整合素、钙粘蛋白)的表达增加,而抗粘附蛋白(如粘蛋白)的表达减少。
当受精卵在子宫内着床时,子宫内膜处于最厚的状态,正在积极分泌,并且能够紧密粘附于着床的胚胎。
受精
受精既完成了遗传物质的重组以形成一个新的遗传上独特的个体,也启动了胚胎发育的过程。
要实现成功(无辅助)的受精,必须完成以下几个步骤(图44.31):
步骤1:精子穿透扩展的卵丘。这涉及精子通过膜上的透明质酸酶PH-20消化卵丘的细胞外基质。
步骤2:精子穿透透明带。这涉及精子与透明带蛋白ZP3的结合(步骤2a),这诱导顶体酶(称为顶体反应)的释放(步骤2b)。精子随后与另一个透明带蛋白ZP2结合(步骤2c),同时透明带被消化,精子游向卵子(步骤2d)。
步骤3:精子和卵子的膜融合发生。
步骤4:发生钙离子(\mathrmCa^++)信号级联反应(见第3章)。
步骤5:信号级联反应激活位于未受精卵最外层(即皮质区)的充满酶的囊泡(称为皮质颗粒)的外排作用。皮质颗粒中的酶在外排过程中被释放到卵子外部。这些酶修饰透明带的ZP2和ZP3,使得ZP2不再能够结合已发生顶体反应的精子,而ZP3不再能够结合已获能的顶体完整精子。因此,通常只有一个精子进入卵子。偶尔,会有多个精子进入卵子,这会导致形成无法进一步发育的三倍体细胞。因此,防止多精受精对于受精卵的正常发育至关重要。
步骤6:在融合过程中,整个精子进入卵子。精子的鞭毛和线粒体解体,因此细胞中的大部分线粒体DNA来自母体。一旦进入卵子,精子DNA发生去浓缩。在新激活的卵子完成第二次减数分裂时,精子DNA周围形成一个称为原核的膜。
• 图 44.30 月经周期(卵巢和子宫内膜)事件与受精、输卵管内的早期胚胎发育以及胚胎(囊胚)植入子宫内膜的同步化。E_2 雌二醇;P4,孕酮。(改编自 White BA, Porterfield SP. Endocrine Physiology. 第4版. Philadelphia: Mosby; 2013.)
在哺乳动物的卵子中,初始的大量\mathrmCa^++释放之后,会伴随一系列较小的\mathrmCa^++振荡,这些振荡可以持续数小时。这一信号通路的主要后果是它“唤醒”了代谢静止的卵子,使其能够恢复减数分裂并开始胚胎发育。这一过程被称为卵子激活(egg activation)。
激活的卵子在精子DNA解聚并形成原核(pronucleus)的同时完成第二次减数分裂(图44.32)。一旦卵子完成减数分裂,女性染色体周围也会形成一个原核。精子贡献的中心体(centrosome)成为微管组织中心,微管从中延伸直至与女性原核接触。随着两个原核被拉近,男性和女性的DNA进行复制。一旦原核相互接触,核膜破裂,染色体排列在一个共同的赤道板上,第一次卵裂(cleavage)发生。
早期胚胎发育与植入
受精通常发生在月经周期的第16至17天,植入则在大约6天后发生。因此,胚胎发育的第一周发生在输卵管和子宫的腔内。在此期间,胚胎大部分时间被透明带(zona pellucida)包裹。前两次卵裂大约需要2天,胚胎在第3天达到16细胞的桑椹胚(morula)阶段。桑椹胚的外层细胞彼此紧密粘附,并开始将液体运输到胚胎团块中。在第4和第5天,液体的运输形成了一个称为囊胚腔(blastocyst cavity)的空腔,此时胚胎被称为囊胚(blastocyst)(图44.33)。囊胚由两个细胞亚群组成:一个偏心的内细胞团(inner cell mass)和一个外层的上皮样滋养层细胞(trophoblasts)。滋养层细胞层紧邻内细胞团的区域被称为胚胎极(embryonic pole),正是这一区域在植入时附着于子宫内膜(见图44.33)。
• 图 44.31 受精过程中涉及的事件(详见正文)。(改编自 White BA, Porterfield SP. Endocrine Physiology. 第4版. Philadelphia: Mosby; 2013.)
胚胎在前3天停留在输卵管内,随后进入子宫。到发育的第5至6天,囊胚的滋养层细胞分泌蛋白酶,消化外层的透明带。此时,大约对应于月经周期的第22天,“孵化”的囊胚能够附着并植入到接受性的子宫内膜中(见图44.33)。
在附着和植入时,滋养层细胞分化为两种细胞类型:内层的细胞滋养层细胞(cytotrophoblasts)和外层的多核/多细胞合体滋养层细胞(syncytiotrophoblasts)(见图44.33)。细胞滋养层细胞最初提供一层不断分裂的细胞作为滋养层。合体滋养层细胞最初执行三种主要功能:粘附、侵袭和内分泌。合体滋养层细胞表达粘附表面蛋白(如钙粘蛋白和整合素),这些蛋白与子宫表面上皮结合,并在胚胎植入时与子宫细胞外基质成分结合。在人类中,胚胎完全嵌入子宫内膜的表层(见图44.33)。这种植入方式称为间质植入(interstitial implantation),是胎盘哺乳动物中最具侵袭性的植入方式。侵袭性植入涉及合体滋养层细胞在粘附支持下迁移到子宫内膜中,同时通过分泌基质金属蛋白酶和其他水解酶分解细胞外基质。
• 图44.32 受精后至第一次胚胎分裂期间的遗传事件概述。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
内分泌功能始于植入开始时,此时合体滋养层细胞开始分泌类似LH的蛋白hCG,hCG维持黄体的活性,从而维持孕酮的分泌。合体滋养层细胞还变得高度类固醇生成。到第10周时,合体滋养层细胞获得足够水平的孕酮生成能力,以独立于黄体维持妊娠。合体滋养层细胞还产生其他几种激素以及修饰激素的酶。
随着植入和胎盘形成的进展,合体滋养层细胞承担起吞噬作用(在组织营养期间)以及气体、营养物质和废物的双向胎盘转移的重要功能。通过合体滋养层细胞的交换涉及扩散(如气体)、易化运输(如GLUT1介导的葡萄糖转移)、主动运输(如通过特定转运体的氨基酸)以及胞饮/跨细胞运输(如铁-转铁蛋白复合物)。
植入还会引发母体反应,称为蜕膜化(decidualization),涉及子宫内膜基质的转化。蜕膜化涉及基质细胞的增大,这些细胞变成充满脂质和糖原的蜕膜细胞,此时子宫内膜被称为蜕膜。蜕膜形成一层类似上皮的片层,具有粘附连接,抑制植入胚胎的迁移。蜕膜还分泌组织金属蛋白酶抑制剂(TIMPs)等因子,调节子宫内膜基质中合体滋养层细胞来源的水解酶的活性。因此,蜕膜化允许在植入期间进行受控的侵袭。通常,植入的胚胎和胎盘不会延伸到子宫肌层并涉及子宫肌层。
临床相关
胎盘植入(placenta accreta)是指胚胎完全穿过子宫内膜,胎盘与子宫肌层粘连,这种情况可能导致危及生命的产后出血。蜕膜反应仅发生在子宫内。因此,在异位植入的情况下,人类胚胎的高度侵入性对母亲构成了相当大的风险。异位植入(ectopic implantation)是指胚胎在子宫以外的部位植入,而异位妊娠(ectopic pregnancy)则是指在异位植入部位发育的胚胎。大多数异位妊娠(>90%)发生在输卵管内(称为输卵管妊娠),但也可能发生在卵巢和腹腔内。输卵管内的植入通常与长期感染和炎症(称为盆腔炎性疾病)以及输卵管阻塞有关。在输卵管妊娠中,人类合体滋养层的高度侵入性(通常由子宫蜕膜反应调节)通常会导致植入的胚胎穿过输卵管壁。尽管腹腔妊娠可以持续到足月,但未被发现的输卵管妊娠通常会导致输卵管壁破裂。由此产生的内出血可能对母亲造成灾难性后果,需要立即进行手术干预。
胎盘内分泌学
人绒毛膜促性腺激素(Human Chorionic Gonadotropin, hCG) 合体滋养层产生的第一种激素是hCG,它在结构上与垂体糖蛋白激素相关(见第41章)。因此,hCG由一个共同的α-糖蛋白亚基(α-GSU)和一个激素特异性的β亚基(β-hCG)组成。用于检测hCG的抗体(即在实验室检测和家用妊娠测试中)设计用于特异性检测β亚基。hCG与LH最为相似,并与LH受体具有高亲和力结合。hCG的β亚基比LH的β亚基更长,并含有更多的糖基化位点,这大大延长了hCG的半衰期至24至30小时。hCG的稳定性使其能够在母体循环中迅速积累,因此在植入后24小时内即可在母体血清中检测到hCG。在最初的6周内,血清hCG水平每2天翻倍,并在约10周时达到峰值。随后,血清hCG水平下降至峰值水平的约50%并保持恒定(图44.34A)。
• 图44.33 A,植入的开始。滋养层已分化为细胞滋养层(cytotrophoblast)和合体滋养层(syncytiotrophoblast)。B,随着合体滋养层体积增大并深入侵入,该层开始包围并侵蚀母体血管,形成充满母体血液的腔隙(lacunae)。C,间质植入几乎完成。细胞滋养层的延伸已形成,并将被一层合体滋养层覆盖。此时,它们被称为“初级绒毛(primary villi)”。D,间质植入完成。胚外中胚层(extraembryonic mesodermal)已从上皮层(羊膜、初级卵黄囊)发育而来,并将形成绒毛的内层,形成“次级绒毛(secondary villi)”。最终,中胚层将在绒毛核心内形成脐带血管,从而形成三级绒毛(tertiary villi)。(引自Carlson BM. Human Embryology and Developmental Biology. Philadelphia: Mosby; 2004.)
• 图44.34 妊娠期间母体血液中人绒毛膜促性腺激素(human chorionic gonadotropin, hCG)和人胎盘催乳素(human placental lactogen, hPL)的循环水平。(修改自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
hCG的主要作用是刺激黄体上的LH受体。这可以防止黄体溶解,并在前10周内维持高水平的黄体源性孕酮(progesterone)生成。hCG的快速增加是导致早孕期间“晨吐(morning sickness)”相关恶心的原因。少量(即1%-10%)的hCG进入胎儿循环。hCG在胎儿促性腺激素轴完全成熟之前刺激胎儿Leydig细胞产生睾酮。hCG还在妊娠早期刺激胎儿肾上腺皮质(见后文)。
孕酮(Progesterone)。胎盘产生大量的孕酮,这是维持子宫肌层静止和妊娠子宫的绝对必要条件。胎盘的孕酮生成在很大程度上不受调控——胎盘生成孕酮的量取决于胆固醇的供应以及CYP11A1和3β-HSD的水平(图44.35)。值得注意的是,胎盘的类固醇生成与肾上腺皮质、卵巢和睾丸不同,因为胆固醇通过一种不依赖于StAR蛋白的机制被转运到胎盘线粒体中。因此,类固醇生成的第一步在胎盘中不是一个受调控的限速步骤,而在其他类固醇生成腺体中则是。这意味着,StAR蛋白失活突变的胎儿将发展为脂质性先天性肾上腺增生症(见第43章)和性腺功能减退症,但其胎盘产生的孕酮水平正常。胎盘的孕酮生成不需要胎儿组织。因此,孕酮水平在很大程度上与胎儿健康无关,不能用作胎儿健康的衡量标准。母体孕酮水平在整个妊娠期间持续增加。
孕酮(progesterone)主要释放到母体循环中,是胚胎着床和维持妊娠所必需的。孕酮还对母体生理有多种影响,包括乳腺的生长和分化、免疫抑制以及核心体温的升高。从黄体来源的孕酮到胎盘来源的孕酮的转换(称为黄体-胎盘转换)在妊娠约第八周时完成。孕酮(以及孕烯醇酮)在妊娠晚期被胎儿皮质的过渡区用于合成皮质醇。
雌激素(estrogen)也由合体滋养层细胞(syncytiotrophoblasts)产生。合体滋养层细胞与卵巢颗粒细胞类似,因为它们缺乏CYP17,并依赖另一种细胞类型提供19碳雄激素进行芳香化(见图44.35)。辅助的雄激素生成细胞位于胎儿肾上腺皮质中。
胎儿肾上腺皮质包含外部确定区(definitive zone)、中间过渡区(transitional zone)和内部胎儿区(fetal zone)。确定区和过渡区分别形成球状带(zona glomerulosa)和束状带(zona fasciculata)。醛固酮的合成在接近分娩时开始。皮质醇的合成在约6个月时开始,并在妊娠晚期增加。胎儿区是胎儿肾上腺皮质的主要部分;它占胎儿肾上腺体积的80%,是大多数胎儿肾上腺类固醇生成的主要部位。胎儿区与网状带(zona reticularis)非常相似,因为它表达很少或不表达3β-HSD(见图44.35)。胎儿区在妊娠的大部分时间内主要释放无活性雄激素硫酸脱氢表雄酮(DHEAS)的硫酸化形式。胎儿肾上腺产生的DHEAS在妊娠第一期末完全依赖于胎儿垂体分泌的胎儿ACTH。
从胎儿区释放的DHEAS有两种命运。首先,DHEAS可以直接进入合体滋养层细胞,在那里被胎盘类固醇硫酸酯酶脱硫酸化,并作为19碳底物用于合成17β-雌二醇和雌酮(见图44.35)。DHEAS的第二种命运是在胎儿肝脏中通过CYP3A7酶进行16-羟基化。16-羟基-DHEAS随后被合体滋养层细胞转化为妊娠的主要雌激素——雌三醇(见图44.35)。在X连锁鱼鳞病中,类固醇硫酸酯酶水平低或缺失,导致胎儿-胎盘单位无法产生活性(即脱硫酸化)雌激素。妊娠过程正常,但由于雌激素促进分娩,妊娠期延长,通常以医生诱导分娩结束。男婴出生时伴有不同程度的皮肤疾病,称为鱼鳞病(鳞状皮肤),这是由于角质层内脱落细胞层的积累所致。这种鱼鳞病可以通过局部乳膏轻松治疗。
• 图44.35 合体滋养层细胞产生孕酮和胎儿-胎盘单位产生雌激素的过程。
母体雌激素水平在整个妊娠期间持续增加。由于雌激素的产生依赖于健康的胎儿,雌三醇水平可以作为胎儿健康的一个指标。在雌激素产生的背景下,用于描述胎盘合体滋养层细胞和胎儿器官的集合术语是胎儿-胎盘单位(fetoplacental unit)。雌激素增加了子宫-胎盘血流量,增强了合体滋养层细胞中LDL受体的表达,并诱导了与分娩相关的几种成分(例如前列腺素、催产素受体)的产生。雌激素通过刺激母体垂体催乳素的产生,直接和间接地促进了乳房的生长。雌激素还增加了催乳素细胞的大小和数量,从而使垂体的总体质量在妊娠末期增加了两倍以上。雌激素还影响了母体生理的其他几个方面。
人胎盘催乳素。人胎盘催乳素(human placental lactogen, hPL),也称为人绒毛膜促生长催乳素(human chorionic somatomammotropin, hCS),是一种由合体滋养层细胞产生的191个氨基酸的蛋白质激素,其结构与生长激素(growth hormone, GH)和催乳素(prolactin, PRL)相似。其功能与GH和PRL都有重叠。它可以在受孕后10天内在合体滋养层细胞中检测到,并在妊娠3周时在母体血清中检测到(见图44.34)。母体血清水平在妊娠的剩余时间内逐渐上升。激素的产生量与胎盘的大小直接相关,因此随着妊娠期间胎盘的生长,hPL的分泌也会增加。在妊娠晚期,每天可以分泌多达1克的hPL。
与GH一样,hPL具有蛋白质合成和脂肪分解的作用。其对胰岛素的拮抗作用是妊娠期糖尿病发生的主要原因。与PRL一样,它刺激乳腺的生长和发育。妊娠期乳腺的发育是由hPL、PRL、雌激素和孕激素的作用共同促成的。hPL抑制母体对葡萄糖的摄取和利用,从而增加了血清葡萄糖水平。葡萄糖是胎儿的主要能量底物,hPL增加了胎儿对葡萄糖的可用性。
与hCG一样,胎儿循环中的hPL含量远低于母体循环中的含量。这表明这些激素在母体中的作用可能比在胎儿中更为重要。hPL对于妊娠和分娩健康婴儿并不是必需的。
• 图44.36 母体和胎儿能量使用的概述。(修改自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
hPL和PRL都作为胎儿的生长激素,刺激胎儿生长促进激素胰岛素样生长因子IGF-1和IGF-2的产生。具有讽刺意味的是,胎儿的生长激素似乎并不调节生长,无脑儿和生长激素缺乏的儿童通常出生体重正常。
妊娠期糖尿病
妊娠代表了一种胰岛素抵抗状态(图44.36)。在妊娠后半期,当hPL水平最高时,母体能量代谢从合成代谢状态(营养物质被储存)转变为分解代谢状态。在这种分解代谢状态中,有时被描述为加速的饥饿状态,母体能量代谢转向脂肪利用,同时节省葡萄糖。随着母体利用葡萄糖作为能量的减少,脂肪分解增加,脂肪酸成为主要的能量来源。外周对胰岛素的反应性降低,胰腺胰岛素分泌增加。妊娠期间会发生β细胞增生。虽然这通常不会导致临床病症,但妊娠会加重已有的糖尿病,并且糖尿病可能在妊娠期间首次发生。如果糖尿病在分娩后自发缓解,这种情况被称为妊娠糖尿病。其他导致妊娠糖尿病的激素包括雌激素和孕激素,因为这两种激素都会降低胰岛素敏感性。
分娩
人类妊娠从最后一次月经开始平均持续40周(妊娠年龄)。
这对应于平均胎儿年龄为38周。分娩是子宫收缩导致分娩的过程。分娩包括三个阶段:强烈的子宫收缩迫使胎儿压迫宫颈,宫颈扩张和变薄(数小时);胎儿娩出(\bf\tilde\rho_<1小时);以及胎盘娩出,同时子宫肌层收缩以止血($\tt\cdot<10$分钟)。
人类分娩的控制是复杂的,其控制的确切机制尚不清楚。
胎盘CRH与胎儿肾上腺轴
胎盘产生促肾上腺皮质激素释放激素(CRH),与下丘脑产生的41个氨基酸肽相同。胎盘CRH的产生和母体血清CRH水平在妊娠晚期和分娩期间迅速增加。此外,循环中的CRH要么是游离的CRH(具有生物活性),要么是与CRH结合蛋白复合的形式。母体CRH结合蛋白水平在妊娠晚期和分娩期间急剧下降,因此游离CRH水平增加。胎盘CRH也在胎儿循环中积累并刺激胎儿ACTH分泌。ACTH刺激胎儿肾上腺皮质醇的产生和胎儿-胎盘雌激素的产生。与皮质醇对下丘脑CRH产生的抑制作用相反,皮质醇刺激胎盘CRH的产生。这建立了一个自我放大的正反馈。CRH本身通过使子宫对催产素和前列腺素敏感来促进子宫肌层收缩(见催产素,前列腺素)。
雌激素也直接和间接刺激子宫肌层的收缩性。除了CRH-ACTH轴在分娩中的作用外,该模型将分娩的开始与皮质醇诱导的胎儿系统成熟(包括肺和胃肠道)相关联。
雌激素和孕激素分泌
尽管在某些物种中,妊娠晚期母体血清雌激素水平上升而孕激素水平下降,但在人类血清中未见两种激素比例的变化。然而,已经提出了“功能性”孕激素撤退,涉及子宫孕激素受体和孕激素代谢的变化。
催产素
催产素(oxytocin)由神经部(pars nervosa)(后叶垂体(posterior pituitary))分泌(见第41章)。催产素能刺激强烈的子宫收缩,在分娩的进程和完成中起主要作用。催产素的释放是对宫颈牵张通过神经内分泌反射的反应,其释放刺激子宫收缩,从而促进分娩。在分娩前,子宫对催产素的敏感性增加,催产素可用于诱导分娩。由于母体血清催产素水平直到分娩开始后才升高,因此认为催产素并不启动分娩,而是在启动后促进宫缩。孕酮(progesterone)抑制而雌激素(estrogen)刺激催产素受体的合成。虽然在人类分娩前母体血清孕酮水平不会立即下降,但雌激素水平升高,催产素受体合成增加,足以促进对催产素的敏感性。
前列腺素(Prostaglandins)
由于雌激素刺激子宫、羊膜和绒毛膜中前列腺素的合成,妊娠晚期雌激素水平的升高可在分娩前增加子宫前列腺素的形成。虽然前列腺素在启动分娩中的作用尚不清楚,但前列腺素和其他细胞因子(cytokines)可增加子宫运动性,这些化合物的水平在分娩期间升高,从而促进分娩。羊水、胎膜和子宫蜕膜中的前列腺素水平在分娩开始前升高。前列腺素F_2\upalpha和前列腺素\bf E_2增加子宫运动性,大剂量的这些药物已被用于引产。
子宫大小(Uterine Size)
子宫大小被认为是调节分娩的一个因素。平滑肌(包括子宫肌层)的牵张可增加肌肉收缩。此外,子宫牵张刺激子宫前列腺素的产生,进一步增加运动性。多胎通常早产。早产的趋势可能是由于子宫增大、胎儿产生刺激分娩的化学物质增加或两者兼而有之。
乳腺发育和泌乳(Mammogenesis and Lactation)
乳腺的结构(Structure of the Mammary Gland)
乳腺由15至20个叶组成,每个叶都有一个排泄性的乳管,开口于乳头(图44.37)。每个叶又由若干小叶组成,小叶在导管的末端含有称为腺泡的分泌结构。腺泡和导管的上皮由两层细胞组成:顶端的管腔上皮细胞和基底部的肌上皮细胞。有强有力的证据表明,这种上皮中存在成体乳腺干细胞。腺泡的管腔上皮细胞是乳汁的生产者,而导管的管腔细胞则负责输送和修饰分泌的乳汁。肌上皮细胞是星形的平滑肌样细胞,这些细胞在受到刺激(即排乳)时收缩,将乳汁从腺泡和导管的管腔中排出。叶和小叶由结缔组织基质支撑。乳房的其他主要组织成分是脂肪组织。乳管在乳头处排空,乳头是一个高度神经支配的无毛突起,设计用于婴儿的吸吮。乳头周围是一个色素沉着的无毛乳晕,由皮脂腺润滑。乳头的突起,称为勃起,是由平滑肌纤维在吸吮和其他机械刺激、性刺激和寒冷刺激下的交感神经刺激介导的。
乳腺发育的激素调节
在青春期,雌激素增加导管的生长和分支。随着卵巢黄体期的开始,孕酮和雌激素诱导导管生长和原始腺泡的形成。在非妊娠周期中,乳房会有一定程度的发育,然后退化。雌激素还增加了脂肪组织的沉积,这对乳房的大小和整体形态有重要贡献。脂肪组织表达CYP19/芳香酶,因此乳房中这种组织的积累增加了从循环雄激素中局部产生雌激素的量。
妊娠促进了乳房的发育,期间发生了广泛的导管生长和分支以及小叶腺泡的发育。乳房发育期间的实质生长是以间质为代价的,间质被降解以为扩大的小叶腺泡结构腾出空间。几种胎盘激素刺激乳房发育,包括雌激素、孕酮、胎盘催乳素和一种生长激素变体(GH-V)。雌激素通过增加母体垂体PRL直接和间接作用于乳房。雌激素增加了垂体催乳素细胞的PRL分泌。雌激素还刺激催乳素细胞的肥大和增殖,这解释了人类妊娠期间垂体体积的两倍增加。尽管上皮细胞表达编码乳蛋白和参与乳汁生产的酶的基因,但孕酮抑制乳汁生产和分泌的开始(泌乳)。
• 图44.37 乳房结构的示意图,以及一些乳房病理状况及其发生位置。(来自Crum CP等。见:Kumar V, Cotran RS, Robbins SL, 编。Robbins基础病理学。第7版。费城:Saunders;2003。)
分娩后,人类乳房会产生初乳(colostrum),其中富含抗菌和抗炎蛋白。在分娩后胎盘孕酮(placental progesterone)缺失的情况下,正常的母乳分泌会在几天内开始。乳腺小叶-肺泡结构(lobuloalveolar structures)产生乳汁,随后由导管上皮(ductal epithelium)进行修饰。泌乳启动(lactogenesis)和乳汁分泌的维持(galactopoiesis)需要在其他激素(包括胰岛素、皮质醇和甲状腺激素)正常水平的情况下,由垂体催乳素(pituitary PRL)的刺激来完成。尽管胎盘雌激素(placental estrogen)在妊娠期间会刺激PRL的分泌,但在哺乳期间PRL分泌的刺激来自于婴儿的吸吮(图44.38)。PRL的水平与乳头吸吮的频率和持续时间直接相关。乳头吸吮与PRL分泌之间的联系涉及一种神经内分泌反射,其中正中隆起(median eminence)的多巴胺分泌被抑制(PRL释放抑制因子;见第41章)。吸吮也可能增加未识别的PRL释放激素的分泌。
PRL还抑制促性腺激素释放激素(GnRH)的释放,因此哺乳可能与哺乳期闭经(lactational amenorrhea)相关(见图44.38)。催乳素的这种效应被称为“自然的避孕药”,它可能在间隔妊娠中发挥作用。然而,只有在24小时内定期哺乳才能诱导母亲进入PRL诱导的无排卵状态。因此,哺乳期闭经对大多数女性来说并不是一种有效或可靠的避孕方式。高水平的PRL对GnRH的抑制在临床上具有重要意义。催乳素瘤(prolactinoma)是最常见的激素分泌性垂体肿瘤,而高催乳素血症(hyperprolactinemia)是导致男女不育的重要原因。高催乳素血症同样可能与男性和女性的溢乳(galactorrhea,即不适当的乳汁流出)相关。
乳头吸吮还通过神经内分泌反射刺激神经垂体(pars nervosa)释放催产素(oxytocin)(见第41章;见图44.38)。肌上皮细胞(myoepithelial cells)的收缩诱导乳汁排出(milk let-down),即乳汁从肺泡和导管腔中排出。因此,哺乳的婴儿并不是通过在吸吮时对乳房施加负压来获取乳汁。相反,乳汁是通过神经内分泌反射主动排出的。催产素的释放和乳汁排出可以通过心理刺激诱导,例如母亲听到电视上婴儿的哭声或想到她的婴儿。这种心理刺激不会影响PRL的释放。
• 图44.38 由乳头吸吮引起的神经内分泌反射,导致催产素和催乳素的分泌。这些激素反过来诱导持续的乳汁分泌(galactopoiesis)和乳汁排出。催乳素还诱导哺乳期闭经。(改编自White BA, Porterfield SP. Endocrine Physiology. 4th ed. Philadelphia: Mosby; 2013.)
临床相关
浸润性乳腺癌(Invasive breast cancer, IBC)是女性中的主要癌症之一,可分为多种类型。大多数新诊断的IBC被归类为luminal A型,通常来源于终末导管或肺泡的luminal细胞。Luminal A型IBC表现出一定的上皮组织特征,包括由E-钙粘蛋白介导的细胞间接触,且其运动性和侵袭性较低。这种类型的乳腺癌还表达雌激素受体\upalpha(ERα),并依赖雌激素刺激生长。luminal A型IBC的早期诊断通常预后良好。对于早期小肿瘤且“淋巴结阴性”(即未扩散至附近淋巴结)的患者,治疗通常包括手术切除(“乳房肿瘤切除术”),随后进行放射治疗,并持续5年每日服用他莫昔芬(tamoxifen)。他莫昔芬是一种选择性雌激素受体调节剂(SERM),在乳腺中拮抗雌激素的作用。
绝经期
尽管与卵巢卵泡的耗竭有关,但绝经的原因和过程尚不完全清楚。中枢神经系统(CNS)中与年龄相关的变化,包括GnRH分泌的关键模式,先于卵泡耗竭,可能在绝经过程中起重要作用。由于卵泡不再对LH和FSH的分泌作出反应,雌激素和孕激素水平下降。雌激素对GnRH和LH/FSH的负反馈抑制作用丧失,导致血清LH和FSH显著升高。FSH水平的上升幅度大于LH水平,这可能是由于卵巢抑制素(inhibin)的丧失所致。
绝经通常发生在45至55岁之间,并持续数年。最初,月经周期变得不规律,并间歇性无排卵。
周期倾向于缩短,主要是在卵泡期。最终,女性完全停止月经周期。血清雌二醇水平降至年轻女性平均水平的约六分之一,孕激素水平降至年轻女性卵泡期水平的三分之一左右。这些激素的产生并未完全停止,但绝经后女性这些激素的主要来源变为肾上腺,尽管卵巢间质细胞仍继续产生一些类固醇。大多数循环中的雌激素现在是由外周组织中的雄激素转化而来。由于雌酮(estrone)是脂肪组织中产生的主要雌激素,因此它成为绝经后女性中的主要雌激素。
与绝经相关的大多数症状是由雌激素缺乏引起的。阴道上皮萎缩并变得干燥,骨质流失加速,可能导致骨质疏松症。绝经后冠状动脉疾病的发病率显著增加。潮热是由于核心体温的周期性升高引起的,这会导致外周血管扩张和出汗。潮热被认为与LH释放的增加有关,但可能与LH分泌的脉冲性上升无关,而是与控制GnRH释放的中枢机制相关。潮热通常在绝经症状开始后的1至5年内逐渐消退。
有多种行为避孕方法。完全禁欲是避免怀孕的最有效方法。另外两种行为方法包括射精前中断性交(体外射精)和节律法。节律法依赖于在排卵前后的生育期内避免性交,包括排卵前三到四天直到排卵后三到四天。这两种方法的失败率(20%-30%)高于屏障法(2%-12%)、宫内节育器(IUDs)(<2%)和口服避孕药(<1%)。当与杀精剂一起使用时,避孕套或隔膜等屏障方法更为有效。在所有方法中,只有避孕套能为性活跃个体提供有效的性传播疾病防护。宫内节育器相对有效,这些装置通过在子宫内膜局部产生炎症反应来阻止着床。某些类型的宫内节育器含有铜、锌或孕激素,这些成分可以抑制精子在女性生殖道中的运输或存活能力。
自20世纪60年代初以来,口服避孕药已在美国上市。如今使用的类固醇剂量显著低于35年前。正确使用时,口服避孕药的失败率较低。如今市场上有多种口服避孕药。多年来,趋势是减少类固醇的剂量,因为副作用与剂量相关。所有口服类固醇避孕药要么含有雌激素和孕激素的组合,要么仅含有孕激素。口服避孕药通过多种机制起作用。大多数阻断触发排卵的LH(黄体生成素)激增。然而,某些药片(例如仅含孕激素的小剂量药片)并不阻止LH激增。一般来说,口服避孕药还通过改变宫颈粘液的性质、改变子宫内膜的发育或调节输卵管运动来阻断生育能力。由于这些避孕药抑制FSH(促卵泡激素),它们也会损害早期卵泡发育。
紧急避孕涉及激素或宫内节育器治疗,旨在抑制或延迟排卵、抑制黄体功能、破坏输卵管和子宫的功能,或这些机制的任何组合。例如,紧急避孕的适用者包括遭受性侵犯或屏障方法失败(例如避孕套破裂)的女性。市场上有超过20种“事后”避孕药。目前首选的药物是左炔诺孕酮(Plan B),这是一种仅含合成孕激素的药片。该药片的功效与性交后服用时间呈反比,尽管其确切作用机制尚不清楚。如果已经发生着床,治疗将无效。最有效的紧急避孕类型是ParaGard铜宫内节育器,它可以在无保护性交后五天内插入。铜作为杀精剂,该装置改变子宫内膜环境,从而阻止着床。
医学(激素)终止妊娠(流产)可以在妊娠49天内通过服用米非司酮(RU-486)实现,米非司酮是一种孕激素受体拮抗剂,可诱导妊娠子宫内膜的崩溃。服用米非司酮48小时后,口服或阴道插入合成前列腺素E(例如米索前列醇),以诱导子宫肌层收缩。
关键概念
- 生殖系统由性腺(gonads)、内部生殖道及其附属腺体以及外生殖器组成。乳腺是女性的附属生殖腺。
- 性腺有两个主要功能:产生配子(gametes)和产生激素。激素(主要是性类固醇)对生殖系统的正常功能绝对必要,其产生受下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis)的调控。
- 睾丸中的曲细精管(seminiferous tubules)含有支持细胞(Sertoli cells)和发育中的精子细胞。
- 精子发生(spermatogenesis)是指精子细胞从精原细胞(spermatogonia)经过减数分裂(meiosis)和精子形成(spermiogenesis)过程形成成熟精子(spermatozoa)的过程。
- 正常精子生成需要睾酮和垂体促卵泡激素(FSH)。只有支持细胞表达雄激素受体(androgen receptor)和FSH受体,因此这些激素通过作用于支持细胞间接调控精子发生。支持细胞产生抑制素(inhibin),抑制素对垂体FSH的产生起负反馈作用。
- 支持细胞具有多种功能,包括产生雄激素结合蛋白(androgen-binding protein, ABP)和液体,以及形成血睾屏障(blood-testis barrier)。
- 间质细胞(Leydig cells)是位于曲细精管外的基质细胞(stromal cells)。它们通过响应黄体生成素(LH)产生睾酮。
- 睾酮是一种活性雄激素。它可以在外周转化为二氢睾酮(DHT),后者在某些组织(如前列腺)中活性更强,或转化为雌二醇(estradiol)。
- 间质细胞受下丘脑-垂体-睾丸轴(hypothalamic-pituitary-testicular axis)的调控。下丘脑产生促性腺激素释放激素(GnRH),刺激垂体促性腺细胞分泌LH和FSH。睾酮、DHT和雌二醇在垂体和下丘脑水平起负反馈作用,对LH分泌的抑制作用强于FSH。来自支持细胞的抑制素选择性地抑制FSH。
- 睾酮、DHT和雌二醇对男性生殖道、外生殖器和男性第二性征以及其他器官系统(如血细胞生成、脂蛋白生成、骨骼成熟)具有多种作用。
- 男性生殖道包括管状结构(附睾(epididymis)、输精管(ductus deferens)和男性尿道)、附属性腺(精囊(seminal vesicles)、前列腺(prostate))和阴茎。精囊和前列腺产生大部分精液,为精子提供营养、缓冲和保护。
- 阴茎勃起涉及复杂的神经血管反应,导致阴茎基部和轴内的勃起组织充血。
- 卵泡(follicle)是卵巢的功能单位。卵泡包含上皮细胞(颗粒细胞(granulosa)和卵丘细胞(cumulus))和外层基质细胞(膜细胞(thecal))。所有这些细胞包围着一个初级卵母细胞(primary oocyte),该卵母细胞在第一次减数分裂前期(meiotic prophase)停滞,直到排卵前才恢复。
- 卵泡从最小的(原始卵泡(primordial))发育到大的窦状卵泡(antral follicle)需要数月时间。卵泡发育的后期需要促性腺激素(gonadotropins)的参与。
- 月经周期(menstrual cycle)是指大约28天的周期,由以下卵巢事件驱动:一个大的窦状卵泡发育为排卵前卵泡(preovulatory follicle)(卵泡期(follicular phase))、排卵(ovulation)以及月经黄体(corpus luteum of menstruation)的形成和退化(黄体期(luteal phase))。
- 卵巢的卵泡期对应于子宫内膜的月经期和增殖期。卵巢的黄体期对应于子宫内膜的分泌期。
- 每个月经周期中会选择一个优势卵泡——通常是具有最多FSH受体的最大卵泡。
- 在周期中期,雌二醇水平升高,并对促性腺激素分泌产生正反馈。这诱导了LH(和较小的FSH)激增。周期中期的促性腺激素激增诱导(a)初级卵母细胞的减数分裂成熟,使其进展为次级卵母细胞(带有一个极体),并在第二次减数分裂的中期停滞,(b)卵巢和卵泡壁的破裂,使卵母细胞-卵丘复合体被排出(称为排卵),以及(c)剩余卵泡细胞分化为黄体。黄体产生高水平的孕酮、雌二醇和抑制素。
- 如果未发生妊娠,黄体将在14天内死亡。这构成了月经周期的黄体期。
- 输卵管捕获排出的卵丘-卵母细胞复合体,并将其向内侧运输至输卵管并朝向子宫。雌激素促进纤毛运动和运输;孕酮抑制运输。
- 子宫黏膜,称为子宫内膜,是胚胎着床的正常部位。黏膜在准备着床时增厚,如果未发生妊娠,则脱落。
- 在卵泡期的中后期(月经周期的第6-14天),卵巢产生雌二醇,诱导子宫内膜的所有细胞增殖(称为子宫的增殖期)。
- 排卵后,卵巢进入黄体期(第16-28天)并产生孕酮。孕酮促进腺体分化并刺激子宫腺体的分泌(称为子宫的分泌期)。
- 在没有着床胚胎的情况下,黄体死亡,孕酮产生停止,子宫内膜脱落(称为子宫的月经期或月经——这对应于卵巢卵泡期的第1-5天)。
- 宫颈是子宫的下部。宫颈黏液受激素调节,在周期中期,响应雌激素,宫颈黏液促进精子从阴道进入子宫。在黄体期,响应孕酮,宫颈黏液变厚,形成屏障,阻止精子和微生物进入子宫。
- 受精是在输卵管中发生的一系列复杂事件,导致精子穿透卵母细胞。
- 早期胚胎发生(受精后至第6天)发生在输卵管中,并产生一个从透明带中孵出的囊胚。
- 胎盘由外胚层滋养层发育而来。胎盘的内分泌功能包括产生hCG、孕酮、雌激素和胎盘催乳素。雌激素的产生需要胎盘细胞(合体滋养层)以及胎儿肾上腺和肝脏——统称为胎儿胎盘单位。
- 妊娠及妊娠激素引起母体生理的重大变化,包括胰岛素抵抗(insulin resistance)的增加、母体对游离脂肪酸(free fatty acids)利用的增加以及乳腺(mammary glands)的发育。乳腺的发育(但不包括泌乳)由雌激素(estrogen)、孕酮(progesterone)和胎盘催乳素(placental lactogen)促进,同时也由母体垂体催乳素(maternal pituitary prolactin)促进,其分泌由胎盘雌激素(placental estrogens)刺激。
- 催产素(Oxytocin)是一种垂体激素,能促进某些平滑肌的收缩,包括分娩时的子宫肌层(myometrial)收缩和乳房中的肌上皮(myoepithelial)收缩,后者在哺乳时导致乳汁的排出。
- 绝经(Menopause)是由于卵巢储备的耗竭所致,其特征是卵巢激素水平低和促性腺激素(gonadotropin)水平升高。
