第十单元 神经系统:特殊感觉:修订间差异
| 第188行: | 第188行: | ||
== 视网膜结构元素的解剖和功能 == | == 视网膜结构元素的解剖和功能 == | ||
视网膜从外到内按层次或边界排列如下:(1) 色素层;(2) 包含投射到色素层的视杆细胞和视锥细胞的光感受器层;(3) 外界膜;(4) 包含视杆细胞和视锥细胞细胞体的外核层;(5) 外丛状层;(6) 内核层;(7) 内丛状层;(8) 神经节细胞层;(9) 视神经纤维层;(10) 内界膜。 | 视网膜从外到内按层次或边界排列如下:<u>(1) 色素层;(2) 包含投射到色素层的视杆细胞和视锥细胞的光感受器层;(3) 外界膜;(4) 包含视杆细胞和视锥细胞细胞体的外核层;(5) 外丛状层;(6) 内核层;(7) 内丛状层;(8) 神经节细胞层;(9) 视神经纤维层;(10) 内界膜。</u> | ||
[[文件:GT-51.1.png|缩略图|图51-1. 视网膜的层次。]] | |||
光线通过眼睛的晶状体系统后,再通过玻璃体,从眼睛内部进入视网膜(见图51-1);也就是说,光线首先通过神经节细胞,然后通过丛状层和核层,最后到达位于视网膜最外缘的视杆细胞和视锥细胞层。这段距离有几百微米的厚度;通过这种非均质组织的传递会降低视觉敏锐度。然而,在视网膜的中央凹区域,如后续讨论的,内部层被拉向一侧以减少这种敏锐度的损失。 | 光线通过眼睛的晶状体系统后,再通过玻璃体,从眼睛内部进入视网膜(见图51-1);也就是说,光线首先通过神经节细胞,然后通过丛状层和核层,最后到达位于视网膜最外缘的视杆细胞和视锥细胞层。这段距离有几百微米的厚度;通过这种非均质组织的传递会降低视觉敏锐度。然而,在视网膜的中央凹区域,如后续讨论的,内部层被拉向一侧以减少这种敏锐度的损失。 | ||
视网膜由十个层或边界组成。图51-1显示了视网膜的功能组成部分。 | |||
[[文件:GT-51.2.png|缩略图|图51-2. 光线投射到视网膜上的光感受器(视锥细胞)。注意在中央凹区域,光感受器完全由视锥细胞组成,神经元细胞全部偏向一侧,使得光线可以无障碍地到达视锥细胞。]] | |||
图51-2. 光线投射到视网膜上的光感受器(视锥细胞)。注意在中央凹区域,光感受器完全由视锥细胞组成,神经元细胞全部偏向一侧,使得光线可以无障碍地到达视锥细胞。 | '''视网膜中央凹区域及其在敏锐视觉中的重要性'''。'''fovea'''是视网膜中心的一个微小区域,如图51-2所示;它的总面积略大于1平方毫米。它特别擅长敏锐和细致的视觉。'''central fovea'''直径仅为0.3毫米,几乎完全由视锥细胞组成。这些视锥细胞具有特殊的结构,有助于它们检测视觉图像中的细节——即中央凹的视锥细胞具有特别长而细的细胞体,与位于视网膜外围的较胖的视锥细胞形成鲜明对比。此外,在中央凹区域,血管、神经节细胞、内颗粒层细胞和丛状层都偏向一侧,而不是直接位于视锥细胞上方,这使得光线可以无障碍地到达视锥细胞。 | ||
'''视网膜中央凹区域及其在敏锐视觉中的重要性''' | |||
'''视杆细胞和视锥细胞是光感受器的重要组成部分'''。图51-3是光感受器(无论是视杆细胞还是视锥细胞)的基本组成部分的示意图。如图51-4所示,视锥细胞的外段呈圆锥形。一般来说,视杆细胞比视锥细胞更窄更长,但并非总是如此。在视网膜的外围部分,视杆细胞的直径为2至5微米,而视锥细胞的直径为5至8微米;在视网膜的中心部分,即中央凹,没有视杆细胞,视锥细胞细长,直径仅为1.5微米。 | '''视杆细胞和视锥细胞是光感受器的重要组成部分'''。图51-3是光感受器(无论是视杆细胞还是视锥细胞)的基本组成部分的示意图。如图51-4所示,视锥细胞的外段呈圆锥形。一般来说,视杆细胞比视锥细胞更窄更长,但并非总是如此。在视网膜的外围部分,视杆细胞的直径为2至5微米,而视锥细胞的直径为5至8微米;在视网膜的中心部分,即中央凹,没有视杆细胞,视锥细胞细长,直径仅为1.5微米。 | ||
[[文件:GT-51.3.png|缩略图|图51-3. 视杆细胞和视锥细胞功能部分的示意图。]] | |||
图51-3. 视杆细胞和视锥细胞功能部分的示意图。 | |||
图51-3显示了视杆细胞或视锥细胞的主要功能部分:(1) 外段;(2) 内段;(3) 细胞核;(4) 突触体。光敏感的感光化学物质位于外段。在视杆细胞中,这种感光化学物质是视紫红质(rhodopsin);在视锥细胞中,它是三种“颜色”感光化学物质之一,通常简称为颜色色素,其功能几乎与视紫红质完全相同,只是光谱敏感性不同。 | 图51-3显示了视杆细胞或视锥细胞的主要功能部分:(1) 外段;(2) 内段;(3) 细胞核;(4) 突触体。光敏感的感光化学物质位于外段。在视杆细胞中,这种感光化学物质是视紫红质(rhodopsin);在视锥细胞中,它是三种“颜色”感光化学物质之一,通常简称为颜色色素,其功能几乎与视紫红质完全相同,只是光谱敏感性不同。 | ||
[[文件:GT-51.4.png|缩略图|图51-4. 视杆细胞(左)和视锥细胞(右)外段的膜结构。(由Richard Young博士提供)]] | |||
在图51-3和图51-4的视杆细胞和视锥细胞的外段中,注意大量的盘状结构。每个盘状结构实际上是细胞膜的内折层。每个视杆细胞或视锥细胞中多达1000个盘状结构。 | 在图51-3和图51-4的视杆细胞和视锥细胞的外段中,注意大量的盘状结构。每个盘状结构实际上是细胞膜的内折层。每个视杆细胞或视锥细胞中多达1000个盘状结构。 | ||
| 第212行: | 第208行: | ||
突触体(synaptic body)是视杆细胞(rod)或视锥细胞(cone)中与后续神经元细胞(neuronal cells)连接的部分,这些后续细胞包括水平细胞(horizontal cells)和双极细胞(bipolar cells),它们代表了视觉链中的下一阶段。 | 突触体(synaptic body)是视杆细胞(rod)或视锥细胞(cone)中与后续神经元细胞(neuronal cells)连接的部分,这些后续细胞包括水平细胞(horizontal cells)和双极细胞(bipolar cells),它们代表了视觉链中的下一阶段。 | ||
'''视网膜的色素层()。'''色素层中的黑色素(melanin)可以防止光线在眼球内反射,这对于清晰的视觉极为重要。这种色素在眼睛中的作用与相机内部的黑漆相同。如果没有它,光线会在眼球内各个方向反射,导致视网膜的漫射照明,而不是形成精确图像所需的明暗对比。 | |||
色素层中黑色素的重要性在患有白化病(albinism)的人身上得到了很好的体现(白化病是一种先天性缺乏黑色素的疾病,患者全身各部位均缺乏黑色素)。<u>当白化病患者进入明亮的房间时,照射到视网膜上的光线会在眼球内各个方向反射,这是由于视网膜和下方的巩膜(sclera)缺乏色素。</u>因此,通常只会刺激少数视杆细胞或视锥细胞的单个离散光点会在各处反射并刺激许多感受器。因此,即使经过最佳的光学矫正,白化病患者的视力也很少能超过20/100到20/200,而不是正常的20/20。 | |||
<u>色素层还储存了大量的维生素A(vitamin A)。</u>这些维生素A通过视杆细胞和视锥细胞外段的细胞膜在色素层中来回交换。我们稍后会讨论到,维生素A是视杆细胞和视锥细胞中光敏化学物质的重要前体。 | |||
----'''视网膜的血液供应——中央视网膜动脉(Central Retinal Artery)和脉络膜(Choroid)。'''视网膜内层的营养血液供应来自中央视网膜动脉,该动脉通过视神经(optic nerve)的中心进入眼球,然后分支供应整个视网膜内表面。因此,视网膜的内层有自己的血液供应,独立于眼睛的其他结构。 | |||
然而,视网膜的最外层与脉络膜紧密相连,脉络膜是位于视网膜和巩膜之间的高度血管化的组织。视网膜的外层,尤其是视杆细胞和视锥细胞的外段,主要依赖于脉络膜血管的扩散来获取营养,特别是氧气。 | |||
'''视网膜脱离(Retinal Detachment)。'''神经视网膜偶尔会从色素上皮(pigment epithelium)脱离。在某些情况下,这种脱离的原因是眼球受伤,导致液体或血液在神经视网膜和色素上皮之间积聚。脱离有时是由玻璃体(vitreous humor)中细小的胶原纤维收缩引起的,这些纤维将视网膜区域拉向眼球内部。 | |||
视网膜脱离(Retinal Detachment) | |||
部分由于脱离间隙的扩散作用,部分由于通过视网膜动脉对神经视网膜的独立血液供应,脱离的视网膜可以在几天内抵抗退化,并且如果通过手术将其恢复到与色素上皮的正常关系中,它可以再次恢复功能。然而,如果不尽快复位,视网膜将被破坏,即使在手术修复后也无法恢复功能。 | 部分由于脱离间隙的扩散作用,部分由于通过视网膜动脉对神经视网膜的独立血液供应,脱离的视网膜可以在几天内抵抗退化,并且如果通过手术将其恢复到与色素上皮的正常关系中,它可以再次恢复功能。然而,如果不尽快复位,视网膜将被破坏,即使在手术修复后也无法恢复功能。 | ||
---- | |||
== 视觉的光化学 == | == 视觉的光化学 == | ||
| 第233行: | 第229行: | ||
=== 视紫红质-视网膜视觉循环及视杆细胞的兴奋 === | === 视紫红质-视网膜视觉循环及视杆细胞的兴奋 === | ||
'''视紫红质及其在光能作用下的分解'''。视杆细胞的外段伸入视网膜的色素层,其中含有约40%的光敏色素,称为视紫红质(rhodopsin)或视紫质(visual purple)。这种物质是蛋白质视蛋白(scotopsin)和类胡萝卜素色素视黄醛(retinal)(也称为“视黄素”)的结合物。此外,视黄醛是一种特定类型,称为11-顺式视黄醛(11-cis retinal)。这种顺式视黄醛很重要,因为只有这种形式才能与视蛋白结合合成视紫红质。 | '''视紫红质及其在光能作用下的分解'''。视杆细胞的外段伸入视网膜的色素层,其中含有约40%的光敏色素,称为视紫红质(rhodopsin)或视紫质(visual purple)。这种物质是蛋白质视蛋白(scotopsin)和类胡萝卜素色素视黄醛(retinal)(也称为“视黄素”)的结合物。此外,视黄醛是一种特定类型,称为11-顺式视黄醛(11-cis retinal)。这种顺式视黄醛很重要,因为只有这种形式才能与视蛋白结合合成视紫红质。 | ||
[[文件:GT-51.5.png|缩略图|图51-5. 视杆细胞中的视紫红质-视网膜视觉循环,展示了在光照下视紫红质的分解以及随后通过化学过程缓慢重新形成视紫红质。]] | |||
当光能被视紫红质吸收时,视紫红质在极短的时间内开始分解,如图51-5顶部所示。这种快速分解的原因是视紫红质中视黄醛部分的电子被光激活,导致顺式视黄醛瞬间转变为全反式视黄醛(all-trans retinal),后者具有与顺式相同的化学结构但不同的物理结构——它是一个直线分子而不是弯曲分子。由于全反式视黄醛的反应位点的三维取向不再与视蛋白上的反应位点匹配,全反式视黄醛开始从视蛋白上脱离。立即的产物是视紫红质前体(bathorhodopsin),它是全反式视黄醛和视蛋白的部分分离结合物。视紫红质前体极不稳定,在纳秒内衰变为光视紫红质(lumirhodopsin)。然后该产物在微秒内衰变为间视紫红质I(metarhodopsin I),随后在大约一毫秒内衰变为间视紫红质II(metarhodopsin II),最后,更缓慢地(在几秒内)完全分解为视蛋白和全反式视黄醛。 | 当光能被视紫红质吸收时,视紫红质在极短的时间内开始分解,如图51-5顶部所示。这种快速分解的原因是视紫红质中视黄醛部分的电子被光激活,导致顺式视黄醛瞬间转变为全反式视黄醛(all-trans retinal),后者具有与顺式相同的化学结构但不同的物理结构——它是一个直线分子而不是弯曲分子。由于全反式视黄醛的反应位点的三维取向不再与视蛋白上的反应位点匹配,全反式视黄醛开始从视蛋白上脱离。立即的产物是视紫红质前体(bathorhodopsin),它是全反式视黄醛和视蛋白的部分分离结合物。视紫红质前体极不稳定,在纳秒内衰变为光视紫红质(lumirhodopsin)。然后该产物在微秒内衰变为间视紫红质I(metarhodopsin I),随后在大约一毫秒内衰变为间视紫红质II(metarhodopsin II),最后,更缓慢地(在几秒内)完全分解为视蛋白和全反式视黄醛。 | ||
正是间视紫红质II(也称为活化视紫红质)激发了视杆细胞中的电变化,随后视杆细胞以视神经动作电位的形式将视觉图像传递到中枢神经系统,我们将在后面讨论。 | 正是间视紫红质II(也称为活化视紫红质)激发了视杆细胞中的电变化,随后视杆细胞以视神经动作电位的形式将视觉图像传递到中枢神经系统,我们将在后面讨论。 | ||
'''视紫红质(visual pigment)的重组。'''视紫红质的重组第一阶段,如图51-5所示,是将全反式视黄醛(all-trans retinal)重新转化为11-顺式视黄醛(11-cis retinal)。这一过程需要代谢能量,并由视黄醛异构酶(retinal isomerase)催化。一旦11-顺式视黄醛形成,它会自动与视蛋白(scotopsin)重新结合,形成视紫红质,随后视紫红质保持稳定,直到再次被光能吸收触发分解。 | |||
视紫红质的重组第一阶段,如图51-5所示,是将全反式视黄醛(all-trans retinal)重新转化为11-顺式视黄醛(11-cis retinal)。这一过程需要代谢能量,并由视黄醛异构酶(retinal isomerase)催化。一旦11-顺式视黄醛形成,它会自动与视蛋白(scotopsin)重新结合,形成视紫红质,随后视紫红质保持稳定,直到再次被光能吸收触发分解。 | |||
'''维生素A对视紫红质形成的作用。'''请注意图51-5中,全反式视黄醛可以通过第二条化学途径转化为11-顺式视黄醛。这条途径首先将全反式视黄醛转化为全反式视黄醇(all-trans retinol),这是维生素A的一种形式。然后,全反式视黄醇在异构酶(isomerase)的作用下转化为11-顺式视黄醇(11-cis retinol)。最后,11-顺式视黄醇转化为11-顺式视黄醛,后者与视蛋白结合形成新的视紫红质。 | |||
请注意图51-5中,全反式视黄醛可以通过第二条化学途径转化为11-顺式视黄醛。这条途径首先将全反式视黄醛转化为全反式视黄醇(all-trans retinol),这是维生素A的一种形式。然后,全反式视黄醇在异构酶(isomerase)的作用下转化为11-顺式视黄醇(11-cis retinol)。最后,11-顺式视黄醇转化为11-顺式视黄醛,后者与视蛋白结合形成新的视紫红质。 | |||
维生素A存在于视杆细胞的细胞质和视网膜的色素层中。因此,维生素A通常总是可用于在需要时形成新的视黄醛。相反,当视网膜中存在过量的视黄醛时,它会被转化回维生素A,从而减少视网膜中光敏色素的数量。我们稍后会看到,视黄醛和维生素A之间的这种相互转换在视网膜对不同光强度的长期适应中尤为重要。 | 维生素A存在于视杆细胞的细胞质和视网膜的色素层中。因此,维生素A通常总是可用于在需要时形成新的视黄醛。相反,当视网膜中存在过量的视黄醛时,它会被转化回维生素A,从而减少视网膜中光敏色素的数量。我们稍后会看到,视黄醛和维生素A之间的这种相互转换在视网膜对不同光强度的长期适应中尤为重要。 | ||
----'''维生素A缺乏导致的夜盲症''' | |||
夜盲症发生在严重缺乏维生素A的人群中,因为如果没有维生素A,可以形成的视黄醛和视紫红质的数量会严重减少。这种情况被称为夜盲症,因为夜间可用的光线太少,无法让维生素A缺乏的人获得足够的视力。 | 夜盲症发生在严重缺乏维生素A的人群中,因为如果没有维生素A,可以形成的视黄醛和视紫红质的数量会严重减少。这种情况被称为夜盲症,因为夜间可用的光线太少,无法让维生素A缺乏的人获得足够的视力。 | ||
夜盲症的发生通常需要一个人持续数月缺乏维生素A的饮食,因为大量的维生素A通常储存在肝脏中,并可以提供给眼睛。一旦夜盲症发生,有时可以通过静脉注射维生素A在不到1小时内逆转。 | 夜盲症的发生通常需要一个人持续数月缺乏维生素A的饮食,因为大量的维生素A通常储存在肝脏中,并可以提供给眼睛。一旦夜盲症发生,有时可以通过静脉注射维生素A在不到1小时内逆转。 | ||
---- | |||
=== 当视紫红质被光激活时视杆细胞的兴奋 === | === 当视紫红质被光激活时视杆细胞的兴奋 === | ||
'''视杆细胞在光照下超极化。'''视杆细胞暴露在光线下会导致细胞内膜电位的负性增加,这是一种超极化状态。这与几乎所有其他感觉受体中发生的负性减少(“去极化”过程)完全相反。 | |||
视紫红质的激活如何导致超极化?答案是,当视紫红质分解时,它会降低视杆细胞外段对钠离子的膜电导,从而导致超极化。 | 视紫红质的激活如何导致超极化?答案是,当视紫红质分解时,它会降低视杆细胞外段对钠离子的膜电导,从而导致超极化。 | ||
[[文件:GT-51.6.png|缩略图|图51-6. A, 钠离子通过环磷酸鸟苷(cGMP)门控通道流入光感受器(例如视杆细胞)。钾离子通过非门控钾通道流出细胞。钠钾泵维持细胞内钠和钾的稳定水平。B, 在黑暗中,cGMP水平较高,钠通道打开。在光照下,cGMP水平降低,钠通道关闭,导致细胞超极化。ATP, 三磷酸腺苷。]] | |||
图51-6展示了钠离子和钾离子在完整电路中的运动,通过视杆细胞的内段和外段。内段持续将钠离子从视杆细胞内部泵出到外部,而钾离子则被泵入细胞内。钾离子通过仅限于视杆细胞内段的非门控钾通道泄漏出细胞。与其他细胞一样,这种钠钾泵在整个细胞内部产生负电位。然而,视杆细胞的外段,即光感受器盘所在的位置,则完全不同。在这里,视杆细胞膜在黑暗状态下对钠离子具有泄漏性,钠离子通过环磷酸鸟苷(cGMP)门控通道流动。在黑暗状态下,cGMP水平较高,允许带正电荷的钠离子持续泄漏回视杆细胞内部,从而中和整个细胞内的大部分负电性。因此,在正常的黑暗条件下,当视杆细胞未被激发时,视杆细胞膜内部的电负性降低,测量值约为-40毫伏,而不是大多数感觉受体中常见的-70至-80毫伏。 | 图51-6展示了钠离子和钾离子在完整电路中的运动,通过视杆细胞的内段和外段。内段持续将钠离子从视杆细胞内部泵出到外部,而钾离子则被泵入细胞内。钾离子通过仅限于视杆细胞内段的非门控钾通道泄漏出细胞。与其他细胞一样,这种钠钾泵在整个细胞内部产生负电位。然而,视杆细胞的外段,即光感受器盘所在的位置,则完全不同。在这里,视杆细胞膜在黑暗状态下对钠离子具有泄漏性,钠离子通过环磷酸鸟苷(cGMP)门控通道流动。在黑暗状态下,cGMP水平较高,允许带正电荷的钠离子持续泄漏回视杆细胞内部,从而中和整个细胞内的大部分负电性。因此,在正常的黑暗条件下,当视杆细胞未被激发时,视杆细胞膜内部的电负性降低,测量值约为-40毫伏,而不是大多数感觉受体中常见的-70至-80毫伏。 | ||
[[文件:GT-51.7.png|缩略图|图51-7. 光感受器(视杆细胞或视锥细胞)膜外段的光转导过程。当光照射到光感受器(例如视杆细胞)时,视紫红质的光吸收部分视黄醛被激活。这种激活刺激了转导蛋白(transducin),一种G蛋白,随后激活环磷酸鸟苷(cGMP)磷酸二酯酶(phosphodiesterase)。该酶催化cGMP降解为5'-GMP。cGMP的减少导致钠通道关闭,进而引起光感受器的超极化(hyperpolarization)。]] | |||
图51- | 当视杆细胞外段中的视紫红质暴露在光线下时,它被激活并开始分解。随后,cGMP门控钠通道关闭,视杆细胞外段膜对钠离子向内部传导的能力通过三个步骤减少(图51-7):(1) 光被视紫红质吸收,导致视网膜部分中的电子光活化,如前所述;(2) 激活的视紫红质刺激一种称为转导蛋白的G蛋白,然后激活cGMP磷酸二酯酶,这种酶催化cGMP分解为5'-GMP;(3) cGMP的减少关闭了cGMP门控钠通道,并减少了内向钠电流。钠离子继续通过内段膜被泵出。因此,现在离开视杆细胞的钠离子比泄漏回内部的更多。由于它们是正离子,它们从视杆细胞内部的损失增加了膜内部的负电性,而照射到视杆细胞的光能越多,电负性就越大——即超极化程度越大。在最大光强下,膜电位接近-70至-80毫伏,这接近钾离子跨膜的平衡电位。 | ||
当视杆细胞外段中的视紫红质暴露在光线下时,它被激活并开始分解。随后,cGMP门控钠通道关闭,视杆细胞外段膜对钠离子向内部传导的能力通过三个步骤减少(图51-7):(1) 光被视紫红质吸收,导致视网膜部分中的电子光活化,如前所述;(2) 激活的视紫红质刺激一种称为转导蛋白的G蛋白,然后激活cGMP磷酸二酯酶,这种酶催化cGMP分解为5 | |||
'''感受器电位的持续时间及其与光强度的对数关系'''。当光脉冲突然照射到视网膜时,视杆细胞中发生的瞬时超极化(感受器电位)在大约0.3秒内达到峰值,并持续超过1秒。在视锥细胞中,这种变化的速度是视杆细胞的四倍。有时,仅持续百万分之一秒的视觉图像照射到视网膜的视杆细胞上,可能会引起持续超过1秒的视觉感知。 | '''感受器电位的持续时间及其与光强度的对数关系'''。当光脉冲突然照射到视网膜时,视杆细胞中发生的瞬时超极化(感受器电位)在大约0.3秒内达到峰值,并持续超过1秒。在视锥细胞中,这种变化的速度是视杆细胞的四倍。有时,仅持续百万分之一秒的视觉图像照射到视网膜的视杆细胞上,可能会引起持续超过1秒的视觉感知。 | ||
| 第282行: | 第271行: | ||
视锥细胞(cones)的敏感性比视杆细胞低约30到300倍,但即使是这种程度的敏感性,也使得在比极暗的黄昏更亮的光线下能够进行色觉(color vision)。 | 视锥细胞(cones)的敏感性比视杆细胞低约30到300倍,但即使是这种程度的敏感性,也使得在比极暗的黄昏更亮的光线下能够进行色觉(color vision)。 | ||
=== 视锥细胞的色觉光化学 | === 视锥细胞的色觉光化学 === | ||
我们之前指出,视锥细胞中的光化学物质与视杆细胞中的视紫红质(rhodopsin)的化学组成几乎完全相同。唯一的区别是蛋白质部分,即视蛋白(opsins)——在视锥细胞中称为光视蛋白(photopsins)——与视杆细胞中的暗视蛋白(scotopsin)略有不同。所有视觉色素中的视黄醛(retinal)部分在视锥细胞和视杆细胞中完全相同。因此,视锥细胞的色敏色素是视黄醛和光视蛋白的组合。 | 我们之前指出,视锥细胞中的光化学物质与视杆细胞中的视紫红质(rhodopsin)的化学组成几乎完全相同。唯一的区别是蛋白质部分,即视蛋白(opsins)——在视锥细胞中称为光视蛋白(photopsins)——与视杆细胞中的暗视蛋白(scotopsin)略有不同。所有视觉色素中的视黄醛(retinal)部分在视锥细胞和视杆细胞中完全相同。因此,视锥细胞的色敏色素是视黄醛和光视蛋白的组合。 | ||
[[文件:GT-51.8.png|缩略图|图51-8. 视杆细胞色素和人类视网膜中三种色觉视锥细胞色素的光吸收。]] | |||
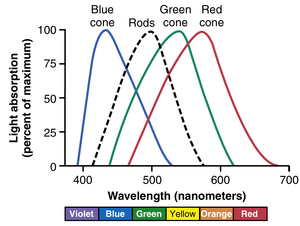
每种不同的视锥细胞中只存在三种色觉色素中的一种,从而使视锥细胞对不同的颜色——蓝色、绿色或红色——具有选择性敏感性。这些色觉色素分别称为蓝敏色素(blue-sensitive pigment)、绿敏色素(green-sensitive pigment)和红敏色素(red-sensitive pigment)。三种视锥细胞中色素的吸收特性分别在445、535和570纳米的光波长处显示出峰值吸收率。这些波长也是每种视锥细胞对光的峰值敏感性的波长,这开始解释了视网膜如何区分颜色。图51-8显示了这三种色素的近似吸收曲线。图中还显示了视杆细胞中视紫红质的吸收曲线,其峰值在505纳米处。 | 每种不同的视锥细胞中只存在三种色觉色素中的一种,从而使视锥细胞对不同的颜色——蓝色、绿色或红色——具有选择性敏感性。这些色觉色素分别称为蓝敏色素(blue-sensitive pigment)、绿敏色素(green-sensitive pigment)和红敏色素(red-sensitive pigment)。三种视锥细胞中色素的吸收特性分别在445、535和570纳米的光波长处显示出峰值吸收率。这些波长也是每种视锥细胞对光的峰值敏感性的波长,这开始解释了视网膜如何区分颜色。图51-8显示了这三种色素的近似吸收曲线。图中还显示了视杆细胞中视紫红质的吸收曲线,其峰值在505纳米处。 | ||
=== 视网膜敏感性的自动调节——光适应和暗适应 === | |||
=== | |||
如果一个人在强光下待了几个小时,视杆细胞和视锥细胞中的大部分光化学物质将被还原为视黄醛和视蛋白。此外,视杆细胞和视锥细胞中的大部分视黄醛将被转化为维生素A。由于这两种效应,视杆细胞和视锥细胞中剩余的光敏化学物质的浓度显著降低,眼睛对光的敏感性也相应降低。这个过程称为光适应(light adaptation)。 | 如果一个人在强光下待了几个小时,视杆细胞和视锥细胞中的大部分光化学物质将被还原为视黄醛和视蛋白。此外,视杆细胞和视锥细胞中的大部分视黄醛将被转化为维生素A。由于这两种效应,视杆细胞和视锥细胞中剩余的光敏化学物质的浓度显著降低,眼睛对光的敏感性也相应降低。这个过程称为光适应(light adaptation)。 | ||
相反,如果一个人在黑暗中待了很长时间,视杆细胞和视锥细胞中的视黄醛和视蛋白将被转化回光敏色素。此外,维生素A将被转化回视黄醛以增加光敏色素,最终的限制由视杆细胞和视锥细胞中与视黄醛结合的视蛋白的量决定。这个过程称为暗适应(dark adaptation)。 | 相反,如果一个人在黑暗中待了很长时间,视杆细胞和视锥细胞中的视黄醛和视蛋白将被转化回光敏色素。此外,维生素A将被转化回视黄醛以增加光敏色素,最终的限制由视杆细胞和视锥细胞中与视黄醛结合的视蛋白的量决定。这个过程称为暗适应(dark adaptation)。 | ||
[[文件:GT-51.9.png|缩略图|图51-9. 暗适应曲线,展示了视锥细胞( cone )适应与视杆细胞( rod )适应的关系。]] | |||
图51-9展示了一个人在暴露于强光数小时后进入完全黑暗环境时的暗适应( dark adaptation )过程。请注意,视网膜在刚进入黑暗时的敏感度非常低,但在1分钟内,敏感度已经增加了10倍——也就是说,视网膜可以对之前所需光强的十分之一的光作出反应。20分钟后,敏感度增加了约6000倍,40分钟后,敏感度增加了约25,000倍。 | 图51-9展示了一个人在暴露于强光数小时后进入完全黑暗环境时的暗适应( dark adaptation )过程。请注意,视网膜在刚进入黑暗时的敏感度非常低,但在1分钟内,敏感度已经增加了10倍——也就是说,视网膜可以对之前所需光强的十分之一的光作出反应。20分钟后,敏感度增加了约6000倍,40分钟后,敏感度增加了约25,000倍。 | ||
图51-9中的曲线被称为暗适应曲线。请注意曲线中的拐点。曲线的早期部分是由视锥细胞的适应引起的,因为所有视觉的化学过程,包括适应,在视锥细胞中发生的速度大约是视杆细胞的四倍。然而,视锥细胞在黑暗中的敏感度变化远不及视杆细胞。因此,尽管视锥细胞适应迅速,但它们在几分钟后就停止了适应,而缓慢适应的视杆细胞则继续适应数分钟甚至数小时,其敏感度大幅增加。视杆细胞的额外敏感度是由视网膜中100个或更多的视杆细胞汇聚到一个神经节细胞( ganglion cell )的神经元信号汇聚引起的;这些视杆细胞通过叠加来增加其敏感度,这一点将在本章后面讨论。 | 图51-9中的曲线被称为暗适应曲线。请注意曲线中的拐点。曲线的早期部分是由视锥细胞的适应引起的,因为所有视觉的化学过程,包括适应,在视锥细胞中发生的速度大约是视杆细胞的四倍。然而,视锥细胞在黑暗中的敏感度变化远不及视杆细胞。因此,尽管视锥细胞适应迅速,但它们在几分钟后就停止了适应,而缓慢适应的视杆细胞则继续适应数分钟甚至数小时,其敏感度大幅增加。视杆细胞的额外敏感度是由视网膜中100个或更多的视杆细胞汇聚到一个神经节细胞( ganglion cell )的神经元信号汇聚引起的;这些视杆细胞通过叠加来增加其敏感度,这一点将在本章后面讨论。 | ||
----'''光适应( light adaptation )和暗适应的其他机制。'''除了由视紫红质( rhodopsin )或彩色光化学物质浓度变化引起的适应外,眼睛还有两种其他机制用于光适应和暗适应。第一种是'''瞳孔大小的变化''',如第50章所讨论的。由于通过瞳孔开口的光量变化,这种变化可以在几分之一秒内引起约30倍的适应。 | |||
另一种机制是'''神经适应''',涉及视网膜和大脑中视觉链各阶段的神经元。也就是说,当光强首次增加时,双极细胞( bipolar cell )、水平细胞( horizontal cell )、无长突细胞( amacrine cell )和神经节细胞传递的信号都很强烈。然而,大多数这些信号在神经回路的不同传输阶段迅速减弱。尽管适应程度只有几倍,而不是光化学系统适应时的数千倍,但神经适应发生在几分之一秒内,而光化学物质的完全适应则需要数分钟到数小时。 | |||
----'''光适应和暗适应在视觉中的价值'''。在最大暗适应和最大光适应的极限之间,眼睛可以将其对光的敏感度改变多达50万到100万倍,敏感度会自动根据光照变化进行调整。 | |||
由于视网膜对图像的记录需要检测图像中的暗点和亮点,因此必须始终调整视网膜的敏感性,使感受器对较亮的区域作出反应,而对较暗的区域不作出反应。视网膜适应不良的一个例子是当一个人离开电影院进入明亮的阳光下时。此时,即使是图像中的暗点也显得非常明亮,结果整个视觉图像被漂白,不同部分之间的对比度很小。这种视力不佳的情况会持续到视网膜充分适应,使得图像中的较暗区域不再过度刺激感受器。 | 由于视网膜对图像的记录需要检测图像中的暗点和亮点,因此必须始终调整视网膜的敏感性,使感受器对较亮的区域作出反应,而对较暗的区域不作出反应。视网膜适应不良的一个例子是当一个人离开电影院进入明亮的阳光下时。此时,即使是图像中的暗点也显得非常明亮,结果整个视觉图像被漂白,不同部分之间的对比度很小。这种视力不佳的情况会持续到视网膜充分适应,使得图像中的较暗区域不再过度刺激感受器。 | ||
| 第313行: | 第296行: | ||
从前面的章节中,我们了解到不同的视锥细胞对不同颜色的光敏感。本节将讨论视网膜如何检测视觉光谱中不同颜色梯度的机制。 | 从前面的章节中,我们了解到不同的视锥细胞对不同颜色的光敏感。本节将讨论视网膜如何检测视觉光谱中不同颜色梯度的机制。 | ||
=== 色觉检测的三色机制 | === 色觉检测的三色机制 === | ||
所有的色觉理论都基于一个众所周知的观察结果,即当仅将红色、绿色和蓝色单色光以不同的组合适当混合时,人眼可以检测到几乎所有颜色的梯度。 | 所有的色觉理论都基于一个众所周知的观察结果,即当仅将红色、绿色和蓝色单色光以不同的组合适当混合时,人眼可以检测到几乎所有颜色的梯度。 | ||
三种视锥细胞的光谱敏感性 | '''三种视锥细胞的光谱敏感性'''。根据色觉测试,人类三种视锥细胞的光谱敏感性与视锥细胞中发现的三种色素的光吸收曲线基本相同。这些曲线如图51-8所示,图51-10中略有不同。它们可以解释大多数色觉现象。 | ||
神经系统对颜色的解释 | '''神经系统对颜色的解释''' 。在图51-10中,可以看到波长为580纳米的橙色单色光刺激红色视锥细胞达到约99(99%的峰值刺激在最佳波长);它刺激绿色视锥细胞达到约42,但蓝色视锥细胞完全没有被刺激。因此,在这种情况下,三种视锥细胞的刺激比例为99:42:0。神经系统将这一组比例解释为橙色的感觉。相反,波长为450纳米的单色蓝光刺激红色视锥细胞的刺激值为0,绿色视锥细胞为0,蓝色视锥细胞为97。这一组比例——0:0:97——被神经系统解释为蓝色。同样,83:83:0的比例被解释为黄色,31:67:36的比例被解释为绿色。 | ||
图51-10。四种颜色——蓝色、绿色、黄色和橙色——的单色光对不同颜色敏感视锥细胞的刺激程度的演示。 | 图51-10。四种颜色——蓝色、绿色、黄色和橙色——的单色光对不同颜色敏感视锥细胞的刺激程度的演示。 | ||
'''白光的感知。'''所有红色、绿色和蓝色视锥细胞(cone)受到大致相等的刺激时,会让人产生看到白色的感觉。然而,并没有单一波长的光对应白色;相反,白色是光谱中所有波长的组合。此外,通过仅使用三种选定的颜色以适当的组合刺激视网膜,使相应的视锥细胞类型受到大致相等的刺激,也可以实现白色的感知。 | |||
所有红色、绿色和蓝色视锥细胞(cone)受到大致相等的刺激时,会让人产生看到白色的感觉。然而,并没有单一波长的光对应白色;相反,白色是光谱中所有波长的组合。此外,通过仅使用三种选定的颜色以适当的组合刺激视网膜,使相应的视锥细胞类型受到大致相等的刺激,也可以实现白色的感知。 | ----'''色盲''' | ||
'''红绿色盲'''。当眼睛中缺少某一组颜色感知视锥细胞时,人将无法区分某些颜色。例如,从图51-10中可以看到,绿色、黄色、橙色和红色(波长在525到675纳米之间的颜色)通常由红色和绿色视锥细胞区分。如果这两种视锥细胞中的任何一种缺失,人就无法使用这种机制来区分这四种颜色;尤其是无法区分红色和绿色,因此被称为红绿色盲。 | |||
缺少红色视锥细胞的人被称为红色盲(protanope);由于缺少红色视锥细胞,整体可见光谱在长波长端明显缩短。缺少绿色视锥细胞的人被称为绿色盲(deuteranope);由于红色视锥细胞可以检测长波长的红色,因此绿色盲的人具有完全正常的可见光谱宽度。然而,绿色盲的人只能区分2到3种不同的色调,而正常视力的人可以看到7种独特的色调。 | 缺少红色视锥细胞的人被称为红色盲(protanope);由于缺少红色视锥细胞,整体可见光谱在长波长端明显缩短。缺少绿色视锥细胞的人被称为绿色盲(deuteranope);由于红色视锥细胞可以检测长波长的红色,因此绿色盲的人具有完全正常的可见光谱宽度。然而,绿色盲的人只能区分2到3种不同的色调,而正常视力的人可以看到7种独特的色调。 | ||
| 第341行: | 第321行: | ||
==== 色觉测试图 ==== | ==== 色觉测试图 ==== | ||
确定色盲的快速方法是使用如图51-11所示的斑点图。这些图表由几种不同颜色的斑点混合排列而成。在上方的图表中,正常色觉的人会读出“74”,而红绿色盲的人会读出“21”。在下方的图表中,正常色觉的人会读出“42”,而红色盲的人会读出“2”,绿色盲的人会读出“4”。 | 确定色盲的快速方法是使用如图51-11所示的斑点图。这些图表由几种不同颜色的斑点混合排列而成。在上方的图表中,正常色觉的人会读出“74”,而红绿色盲的人会读出“21”。在下方的图表中,正常色觉的人会读出“42”,而红色盲的人会读出“2”,绿色盲的人会读出“4”。 | ||
---- | |||
== 视网膜的神经功能 == | == 视网膜的神经功能 == | ||
2025年8月2日 (六) 07:41的版本
眼睛:I. 视觉光学
光学的物理原理
理解眼睛的光学系统需要熟悉光学的基本原理,包括光的折射、聚焦和景深等物理因素。本章将简要回顾这些物理原理,随后讨论眼睛的光学特性。
光的折射
透明物质的折射率。光线在空气中的传播速度约为300,000km/sec,但在透明固体和液体中的传播速度要慢得多。透明物质的折射率是光在空气中的速度与在该物质中的速度之比。空气的折射率为1.00。因此,如果光在某种玻璃中的传播速度为200,000 km/sec,则该玻璃的折射率为300,000除以200,000,即1.50。
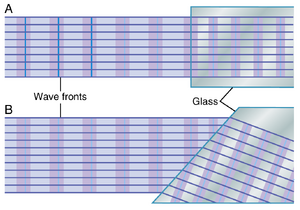
光线在两种不同折射率介质界面处的折射。当光线在光束中向前传播(如图50-1A所示)并垂直于光束的界面时,光线进入第二种介质而不会偏离其路径。唯一发生的影响是传播速度的降低和波长的缩短,如图中波前之间距离的缩短所示。
如果光线通过一个成角度的界面,如图50-1B所示,当两种介质的折射率(refractive index)不同时,光线会发生弯曲。在该图中,光线从折射率为1.00的空气进入折射率为1.50的玻璃块。当光束首次撞击成角度的界面时,光束的下边缘比上边缘先进入玻璃。光束上部分的波前继续以300,000km/sec的速度传播,而进入玻璃的部分则以200,000km/sec的速度传播。这种速度差异导致波前的上部分比下部分移动得更快,因此波前不再垂直,而是向右倾斜。由于光的传播方向始终垂直于波前的平面,光束的传播方向向下弯曲。
光线在成角度界面处的这种弯曲现象称为折射(refraction)。特别要注意的是,折射程度随着以下因素增加:(1) 两种透明介质的折射率之比;(2) 界面与入射波前之间的角度。
折射原理在透镜中的应用
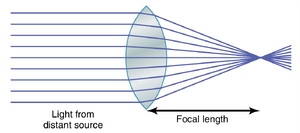
凸透镜(convex lens)聚焦光线。图50-2显示了平行光线进入凸透镜的情况。通过透镜中心的光线恰好垂直于透镜表面,因此通过透镜时不会发生折射。然而,向透镜边缘靠近时,光线撞击的界面逐渐变得更加倾斜。外侧的光线越来越向中心弯曲,这种现象称为光线的会聚(convergence)。光线进入透镜时发生一半的弯曲,另一半弯曲发生在光线从另一侧射出时。如果透镜的曲率恰到好处,通过透镜每一部分的平行光线将被精确弯曲,使得所有光线都通过一个点,称为焦点(focal point)。
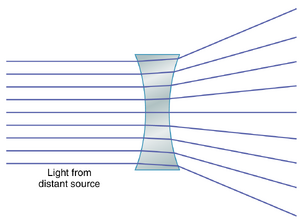
凹透镜使光线发散。图50-3展示了凹透镜对平行光线的影响。进入透镜中心的光线撞击到与光束垂直的界面,因此不发生折射。透镜边缘的光线比中心的光线更早进入透镜。这种效果与凸透镜的效果相反,它导致外围光线从通过透镜中心的光线发散。因此,凹透镜使光线发散,而凸透镜使光线汇聚。
柱面透镜仅在一个平面内弯曲光线——与球面透镜相比。图50-4展示了一个凸球面透镜和一个凸柱面透镜。注意,柱面透镜从透镜的两侧弯曲光线,但不从顶部或底部弯曲——也就是说,弯曲发生在一个平面内,而不是另一个平面内。因此,平行光线被弯曲成一条焦线。相反,通过球面透镜的光线在透镜的所有边缘(在两个平面内)向中心光线折射,所有光线汇聚到一个焦点。
柱面透镜可以通过使用装满水的试管很好地演示。如果将试管放在阳光光束中,并将一张纸逐渐靠近试管的另一侧,会发现一个特定的距离,光线在此汇聚成一条焦线。球面透镜可以通过普通的放大镜演示。如果这样的透镜放在阳光光束中,并将一张纸逐渐靠近透镜,光线会在适当的距离上汇聚到一个共同的焦点。
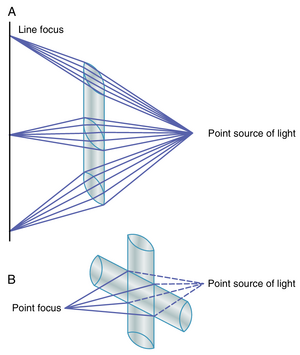
凹柱面透镜仅在一个平面内使光线发散,与凸柱面透镜在一个平面内使光线汇聚的方式相同。图50-5A展示了柱面透镜如何将点光源的光线聚焦成一条焦线。
两个垂直交叉的柱面透镜组合等同于一个球面透镜。图50-5B展示了两个相互垂直的凸柱面透镜。垂直柱面透镜汇聚通过透镜两侧的光线,水平柱面透镜汇聚顶部和底部的光线。因此,所有光线汇聚到一个单一的焦点。换句话说,两个垂直交叉的柱面透镜与一个具有相同折射能力的球面透镜具有相同的功能。
透镜的焦距
平行光线通过凸透镜汇聚到一个共同焦点的距离称为透镜的焦距。图50-6顶部的图示展示了平行光线的这种聚焦。
在中间的图中,进入凸透镜的光线不是平行的,而是发散的,因为光源是一个离透镜不远的点光源。由于这些光线从点光源向外发散,它们不会像平行光线那样在离透镜相同距离处聚焦。换句话说,当已经发散的光线进入凸透镜时,透镜另一侧的聚焦距离比平行光线的焦距要远。
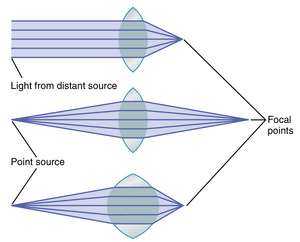
图50-6的底部图显示了光线向一个曲率远大于图中其他两个透镜的凸透镜发散。在这张图中,光线聚焦的距离与第一张图中透镜的距离完全相同,尽管第一张图中的透镜曲率较小,但进入的光线是平行的。这表明,只要透镜改变其曲率,平行光线和发散光线都可以在透镜后相同距离处聚焦。
凸透镜成像
图50-7A展示了一个凸透镜,左侧有两个点光源。由于光线通过凸透镜的中心时不会发生任何方向的折射,因此每个点光源的光线在透镜的另一侧直接与点光源和透镜中心对齐的位置聚焦成点。
实际上,透镜前的任何物体都是由许多点光源组成的马赛克。其中一些点非常明亮,一些非常微弱,并且它们的颜色各不相同。物体上的每个点光源在透镜的另一侧与透镜中心对齐的位置聚焦成单独的点。如果在透镜的焦点距离处放置一张白纸,就可以看到物体的图像,如图50-7B所示。然而,这个图像相对于原始物体是倒置的,并且图像的两侧是反转的。相机的镜头通过这种方法将图像聚焦在胶片上。
透镜折射能力的测量——屈光度
透镜对光线的弯曲程度越大,其“屈光力(refractive power)”越强。屈光力以屈光度(diopter)为单位进行测量。凸透镜的屈光度等于1米除以焦距。因此,一个将平行光线汇聚到透镜后方1米处焦点的球面透镜的屈光力为+1屈光度,如图50-8所示。如果透镜能够将平行光线弯曲到+1屈光度透镜的两倍程度,则称其屈光力为+2屈光度,光线将在透镜后方0.5米处汇聚成焦点。一个能够将平行光线汇聚到透镜后方仅10厘米(0.10米)处的透镜,其屈光力为+10屈光度。
凹透镜的屈光力不能用透镜后方的焦距来表示,因为光线是发散而不是汇聚到一个点。然而,如果凹透镜以与1屈光度凸透镜汇聚光线相同的速率发散光线,则称该凹透镜的屈光力为-1屈光度。同样,如果凹透镜以与+10屈光度透镜汇聚光线相同的程度发散光线,则称该透镜的屈光力为-10屈光度。
凹透镜可以“中和”凸透镜的屈光力。因此,将1屈光度的凹透镜紧贴在1屈光度的凸透镜前方,会形成一个屈光力为零的透镜系统。
柱面透镜的屈光力计算方式与球面透镜相同,只是除了屈光力外,还必须说明柱面透镜的轴。如果柱面透镜将平行光线汇聚到透镜后方1米处的线焦点,则其屈光力为+1屈光度。相反,如果凹型柱面透镜以与+1屈光度柱面透镜汇聚光线相同的程度发散光线,则其屈光力为^-1屈光度。如果聚焦线是水平的,则其轴为0度;如果是垂直的,则其轴为90度。
图50-7. A,两个点光源在透镜两侧的两个独立点聚焦。B,凸球面透镜成像的形成。
图50-8. 透镜屈光力对焦距的影响。
眼睛的光学
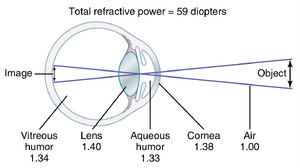
眼睛的透镜系统(图50-9)由四个折射界面组成:(1) 空气与角膜前表面的界面;(2) 角膜后表面与房水(aqueous humor)的界面;(3) 房水与晶状体前表面的界面;(4) 晶状体后表面与玻璃体(vitreous humor)的界面。空气的折射率为1,角膜为1.38,房水为1.33,晶状体(平均)为1.40,玻璃体为1.34。
将眼睛的所有折射面视为单一透镜——“简化”眼。如果将眼睛的所有折射面代数相加,然后视为一个单一透镜,正常眼睛的光学系统可以被简化并示意性地表示为“简化眼(reduced eye)”。这种表示在简单计算中非常有用。在简化眼中,认为存在一个单一的折射面,其中心点位于视网膜前方17毫米处,当眼睛调节至远视时,总折射力为59屈光度。
眼睛的59屈光度折射力中,约三分之二由角膜的前表面提供(而不是由晶状体提供)。这种现象的主要原因是角膜的折射率与空气的折射率显著不同,而晶状体的折射率与房水和玻璃体的折射率差异不大。
眼睛内部晶状体的总折射力,当它正常位于眼睛中并被两侧的液体包围时,仅为20屈光度,约为眼睛总折射力的三分之一。然而,内部晶状体的重要性在于,它可以响应来自大脑的神经信号,显著增加其曲率以提供“调节”,这将在本章后面讨论。
视网膜上图像的形成。与玻璃透镜可以在纸上聚焦图像的方式相同,眼睛的透镜系统可以在视网膜上聚焦图像。
图像相对于物体是倒置和反转的。然而,尽管视网膜上的图像是倒置的,大脑仍然将物体感知为直立状态,因为大脑被训练为将倒置的图像视为正常。
“调节”机制
在儿童中,眼睛晶状体的折射力可以自主地从20屈光度增加到约34屈光度,这是一种14屈光度的“调节”。为了实现这种调节,晶状体的形状从中等凸的透镜变为非常凸的透镜。
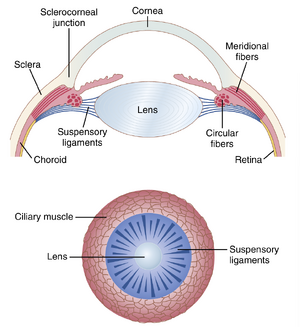
在年轻人中,晶状体由一个强韧的弹性囊组成,囊内充满粘稠、蛋白质丰富但透明的液体。当晶状体处于松弛状态时,囊上没有张力,它主要由于晶状体囊的弹性回缩而呈现几乎球形的形状。然而,如图50-10所示,大约70条悬韧带径向附着在晶状体周围,将晶状体边缘拉向眼球的外圈。这些韧带通过它们在脉络膜和视网膜前缘的附着点不断受到张力。韧带的张力使晶状体在正常眼睛条件下保持相对平坦。
位于晶状体韧带与眼球侧向连接处的还有睫状肌(ciliary muscle),它由两组独立的平滑肌纤维组成——经线纤维(meridional fibers)和环状纤维(circular fibers)。经线纤维从悬韧带的周边端延伸到角膜巩膜交界处。当这些肌纤维收缩时,晶状体韧带的周边附着点向内拉向角膜边缘,从而释放韧带对晶状体的张力。环状纤维围绕韧带附着点呈环形排列,当它们收缩时,会产生类似括约肌的作用,减小韧带附着圈的直径;这种作用也使韧带对晶状体囊的拉力减小。
因此,睫状肌中任一组平滑肌纤维的收缩都会使晶状体囊的韧带松弛,由于晶状体囊的自然弹性,晶状体会呈现出更接近球形的形状,就像气球一样。
调节()由副交感神经控制。睫状肌几乎完全由副交感神经信号控制,这些信号通过第三脑神经从脑干中的第三神经核传递到眼睛,如第52章所述。副交感神经的刺激会使两组睫状肌纤维收缩,从而使晶状体韧带松弛,使晶状体变厚并增加其屈光力。随着屈光力的增加,眼睛能够聚焦在比屈光力较低时更近的物体上。因此,当远处物体向眼睛移动时,为了使眼睛始终保持物体清晰聚焦,作用于睫状肌的副交感神经冲动必须逐渐增加。交感神经刺激对睫状肌的松弛也有额外作用,但这种作用非常微弱,在正常的调节机制中几乎不起作用;该机制的神经生理学将在第52章讨论。
老视——晶状体调节能力的丧失。随着年龄的增长,晶状体会变得更大、更厚,并且弹性大大降低,部分原因是晶状体蛋白的逐渐变性。晶状体改变形状的能力随着年龄的增长而下降。调节能力从儿童的约14屈光度(diopters)下降到45至50岁时的不到2屈光度,到70岁时基本降至0屈光度。此后,晶状体几乎完全失去调节能力,这种情况称为老视(presbyopia)。
一旦一个人进入老视状态,每只眼睛都会永久聚焦在一个几乎恒定的距离上;这个距离取决于每个人眼睛的物理特性。眼睛不再能够同时调节近处和远处的视力。为了清晰地看到远处和近处的物体,老年人必须佩戴双光眼镜,上部分用于远视,下部分用于近视(例如阅读)。
瞳孔直径
虹膜(iris)的主要功能是在黑暗时增加进入眼睛的光量,在白天时减少进入眼睛的光量。控制这一机制的反射将在第52章讨论。
通过瞳孔(pupil)进入眼睛的光量与瞳孔的面积或瞳孔直径的平方成正比。人眼的瞳孔直径可以小至约1.5毫米,大至8毫米。由于瞳孔孔径的变化,进入眼睛的光量可以改变约30倍。
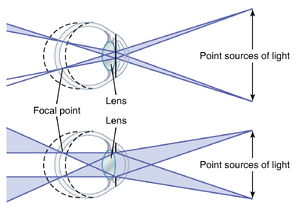
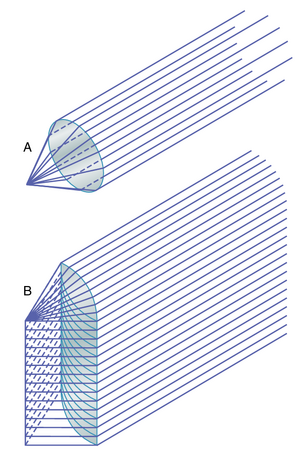
随着瞳孔直径的减小,透镜系统的"焦深"(depth of focus)增加。图50-11显示了两只眼睛,除了瞳孔孔径的直径外完全相同。在上面的眼睛中,瞳孔孔径较小,而在下面的眼睛中,孔径较大。在这两只眼睛的前面各有两个小点光源;来自每个光源的光线通过瞳孔孔径并聚焦在视网膜(retina)上。因此,在两只眼睛中,视网膜都看到两个完美聚焦的光点。如果视网膜向前或向后移动到失焦位置(虚线),在上面的眼睛中,每个光点的大小变化不大,但在下面的眼睛中,每个光点的大小会大大增加,变成"模糊圈"。换句话说,上面的透镜系统的焦深远大于下面的透镜系统。当透镜系统的焦深较大时,视网膜可以显著偏离焦平面,或者透镜的屈光力可以显著偏离正常值,图像仍然保持几乎清晰聚焦,而当透镜系统的焦深"较浅"时,视网膜仅稍微偏离焦平面就会导致极度模糊。
当瞳孔极小时,焦深最大。这是因为在孔径非常小的情况下,几乎所有光线都通过透镜的中心,而中心光线总是聚焦的,如前所述。
屈光不正
参见视频50-1。
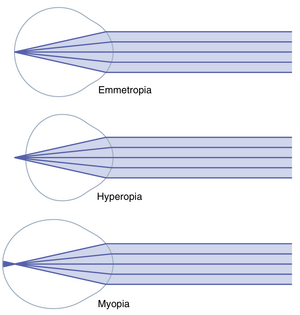
正视眼(emmetropia, normal vision)。如图50-12所示,如果来自远处物体的平行光线在睫状肌(ciliary muscle)完全放松时清晰地聚焦在视网膜上,则认为眼睛是正常的,或正视的。这意味着正视眼可以在睫状肌放松的情况下清晰地看到所有远处的物体。然而,为了聚焦近处的物体,眼睛必须收缩其睫状肌,从而提供适当的调节(accommodation)。
远视 (Hyperopia,Farsightedness)。远视 (),也称为“远视眼”,通常是由于眼球过短或偶尔由于晶状体系统过弱引起的。在这种情况下,如图50-12中间面板所示,平行光线在松弛的晶状体系统中未能充分折射,以至于在到达视网膜时无法聚焦。为了克服这种异常,睫状肌必须收缩以增强晶状体的强度。通过使用调节机制 (accommodation),远视者能够将远处的物体聚焦在视网膜上。如果此人仅使用了少量睫状肌的力量来调节远处的物体,他或她仍然有大量的调节能力,并且随着物体越来越靠近眼睛,仍然可以清晰地聚焦,直到睫状肌收缩到极限。在老年时,当晶状体变得“老花” (presbyopic) 时,远视者通常无法充分调节晶状体以聚焦远处的物体,更不用说近处的物体了。
近视 (Myopia,Nearsightedness)。在近视 () 或“近视眼”中,当睫状肌完全放松时,来自远处物体的光线聚焦在视网膜前方,如图50-12底部面板所示。这种情况通常是由于眼球过长,但也可能是由于眼睛的晶状体系统折射力过强引起的。
眼睛没有机制可以减少晶状体的强度,使其低于睫状肌完全放松时的强度。近视者没有机制可以将远处的物体清晰地聚焦在视网膜上。然而,当物体靠近眼睛时,最终会达到一个足够近的距离,使得其图像可以聚焦。然后,当物体进一步靠近眼睛时,此人可以使用调节机制 (accommodation) 来保持图像清晰聚焦。近视者有一个明确的“远点” (far point),超过这个点就无法清晰视物。
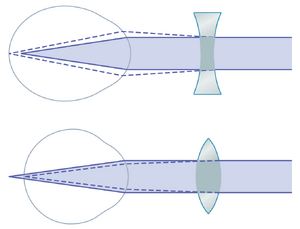
通过使用镜片矫正近视和远视。如果眼睛的折射面折射力过强,如近视眼,可以通过在眼睛前放置凹球面镜片来中和这种过度的折射力,该镜片会使光线发散。这种矫正方法如图50-13的上图所示。
相反,对于远视者——即晶状体系统过弱的人——可以通过在眼睛前放置凸透镜来增加折射力,从而矫正异常视力。这种矫正方法如图50-13的下图所示。
通常通过“试错法” (trial and error) 来确定所需的凹透镜或凸透镜的强度——即首先尝试一个强镜片,然后尝试更强或更弱的镜片,直到找到能提供最佳视力的镜片。
散光(Astigmatism)。散光(Astigmatism)是一种眼睛的屈光不正(refractive error),它会导致一个平面上的视觉图像聚焦在与垂直平面不同的距离上。散光通常是由于眼睛角膜(cornea)在某一平面上曲率(curvature)过大所致。散光透镜的一个例子是像鸡蛋侧面那样的透镜表面,其长轴方向的曲率远小于短轴方向的曲率。
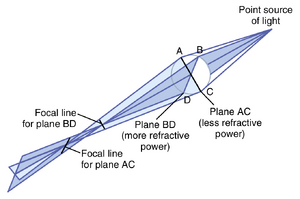
由于散光透镜在一个平面上的曲率小于另一个平面上的曲率,因此在一个平面上击中透镜边缘部分的光线弯曲程度远小于另一个平面上击中透镜边缘部分的光线。这种效应在图50-14中得到了展示,图中显示了从一个点光源发出的光线通过一个椭圆形散光透镜的情况。垂直平面(由平面BD表示)上的光线由于垂直方向的曲率大于水平方向,因此被散光透镜大大折射(refract)。相比之下,水平平面(由平面AC表示)上的光线弯曲程度远小于垂直平面BD上的光线。因此,通过散光透镜的光线不会全部汇聚到一个共同的焦点(focal point)上,因为通过一个平面的光线聚焦在通过另一个平面的光线前方很远的位置。
眼睛的调节力(accommodative power)永远无法补偿散光,因为在调节过程中,眼睛晶状体(lens)的曲率在两个平面上大致相等地变化;因此,在散光的情况下,两个平面各自需要不同程度的调节。因此,没有眼镜的帮助,散光患者永远无法看到清晰的焦点。
使用柱面透镜(Cylindrical Lens)矫正散光。可以将散光眼视为由两个不同强度的柱面透镜组成的透镜系统,这两个透镜彼此垂直放置。为了矫正散光,通常的做法是通过试错法找到一个球面透镜(spherical lens),以矫正散光透镜两个平面之一的焦点。然后,使用一个额外的柱面透镜来矫正剩余平面中的剩余误差。为此,必须确定所需柱面透镜的轴线和强度。
存在几种方法用于确定眼睛晶状体系统中异常圆柱形组件的轴。其中一种方法基于使用如图50-15所示的平行黑条。这些平行条中有些是垂直的,有些是水平的,还有一些与垂直和水平轴成不同角度。在散光眼前放置各种球面镜片后,通常会找到一个强度的镜片,它能使一组平行条清晰聚焦,但不会校正与清晰条成直角的另一组条的模糊。从本章前面讨论的光学物理原理可以证明,光学系统中失焦的圆柱形组件的轴与模糊的条平行。一旦找到这个轴,检查者会尝试逐渐加强或减弱的正或负圆柱形镜片,其轴与失焦的条对齐,直到患者看到所有交叉的条具有相同的清晰度。当达到这个目标时,检查者会指示眼镜师磨制一个特殊的镜片,结合球面校正和圆柱形校正,并在适当的轴上。
使用隐形眼镜校正光学异常。可以插入与角膜前表面紧密贴合的玻璃或塑料隐形眼镜。这些镜片通过一层薄薄的泪液保持在位,泪液填充了隐形眼镜和眼睛前表面之间的空间。
隐形眼镜的一个特殊特点是它几乎完全消除了通常在角膜前表面发生的折射。这种消除的原因是隐形眼镜和角膜之间的泪液的折射率几乎与角膜的折射率相等,因此角膜前表面在眼睛的光学系统中不再起重要作用。相反,隐形眼镜的外表面起主要作用。因此,隐形眼镜表面的折射替代了角膜的通常折射。这个因素对于那些由于角膜形状异常而导致眼睛折射错误的人尤其重要,例如那些角膜形状奇特、凸出的人,这种情况称为圆锥角膜。没有隐形眼镜,凸出的角膜会导致严重的视力异常,几乎没有任何眼镜可以令人满意地校正视力;然而,当使用隐形眼镜时,角膜折射被中和,隐形眼镜外表面的正常折射被替代。
隐形眼镜还有其他几个优点,包括:(1) 镜片随眼睛转动,提供比眼镜更广阔的清晰视野;(2) 隐形眼镜对通过镜片看到的物体大小几乎没有影响,而放置在眼睛前约1厘米的镜片除了校正焦点外,还会影响图像的大小。
白内障——晶状体中的不透明区域。“白内障”是一种特别常见的眼睛异常,主要发生在老年人中。白内障是晶状体中的一个或多个混浊或不透明的区域。在白内障形成的早期阶段,一些晶状体纤维中的蛋白质变性。后来,这些相同的蛋白质凝固,形成不透明区域,取代了正常的透明蛋白质纤维。
当白内障严重阻碍光线传输以至于严重影响视力时,可以通过手术摘除晶状体来纠正这种情况。当晶状体被摘除后,眼睛失去了大部分的屈光能力,必须通过在眼睛前放置一个强凸透镜来替代;然而,通常会在眼睛内植入一个人工塑料晶状体以替代被摘除的晶状体。
视力
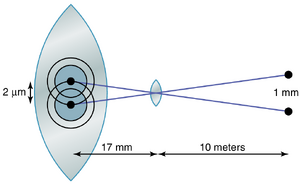
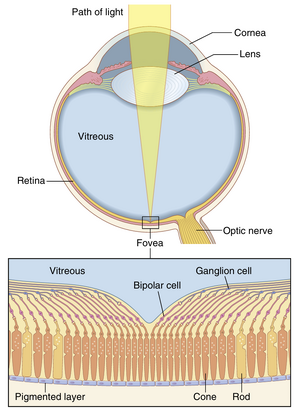
理论上,来自远处点光源的光线在聚焦到视网膜上时应该是无限小的。然而,由于眼睛的晶状体系统并不完美,即使在正常眼睛光学系统的最大分辨率下,这样的视网膜光斑通常也有约11微米的总直径。光斑的中心最亮,向边缘逐渐变暗,如图50-16中的两点图像所示。
视网膜中央凹(fovea)中的视锥细胞(cones)的平均直径约为1.5微米,这是光斑直径的七分之一。然而,由于光斑有一个明亮的中心点和渐暗的边缘,如果两个点的中心在视网膜上相距不超过2微米,正常人通常可以区分这两个点,这略大于中央凹视锥细胞的宽度。这种点之间的区分也在图50-16中显示。
人眼区分点光源的正常视力约为25弧秒。也就是说,当来自两个不同点的光线以至少25弧秒的角度射入眼睛时,通常可以将它们识别为两个点而不是一个点。这意味着,一个视力正常的人在观察10米外的两个亮点时,当它们相距1.5到2毫米时,勉强可以将它们区分为两个独立的实体。
中央凹的直径小于0.5mm,这意味着最大视力发生在视野中不到2度的范围内。在这个中央凹区域之外,视力逐渐变差,接近视网膜周边时,视力下降超过10倍。这是由于在非中央凹的视网膜更周边部分,越来越多的视杆细胞(rods)和视锥细胞连接到同一个视神经纤维上,如第52章所述。
临床上表达视力的方法。测试眼睛的图表通常由不同大小的字母组成,放置在距离被测试者20英尺的地方。如果被测试者能够清楚地看到应该在20英尺处看到的字母大小,那么该人的视力为20/20,即正常视力。如果被测试者只能看到应该在200英尺处看到的字母,那么该人的视力为20/200。换句话说,临床表达视力的方法是使用一个数学分数,表示两个距离的比率,这也是一个人的视力与正常视力者的比率。
确定物体与眼睛的距离——“深度感知”
人通常通过三种主要方式感知距离:(1) 已知物体在视网膜上的图像大小;(2) 运动视差现象;(3) 立体视觉现象。这种确定距离的能力称为深度感知。
通过已知物体在视网膜上的图像大小确定距离。如果一个人知道被观察者的身高是6英尺,他可以通过该人在视网膜上的图像大小简单地确定其距离。人们并不会有意识地思考图像的大小,但大脑已经学会在已知物体尺寸的情况下自动从图像大小计算物体的距离。
通过运动视差确定距离。眼睛确定距离的另一个重要方式是运动视差,即物体沿两条不同视线观察时表观位置的位移。如果一个人完全静止地望向远方,他或她不会感知到运动视差,但当头部向一侧移动时,附近物体的图像会在视网膜上快速移动,而远处物体的图像几乎保持静止。例如,当物体距离眼睛仅1英寸时,头部向一侧移动1英寸,图像几乎会横跨整个视网膜,而距离眼睛200英尺的物体的图像则几乎不会移动。因此,通过使用这种运动视差机制,即使只用一只眼睛,也可以判断不同物体的相对距离。
通过立体视觉——双眼视觉确定距离。另一种感知视差的方式是双眼视觉。由于一只眼睛位于另一只眼睛的侧边超过2英寸的位置,两只眼睛视网膜上的图像彼此不同。例如,距离鼻子1英寸的物体在左眼视网膜的左侧形成图像,而在右眼视网膜的右侧形成图像,而距离鼻子20英尺的小物体在两视网膜中心的位置几乎对应。这种视差类型在图50-17中展示,图中显示了一个红点和一个黄方块的图像在两视网膜上实际反转,因为它们位于眼睛前方不同的距离。这种视差在双眼使用时始终存在。几乎完全是由于这种双眼视差(或立体视觉),使得拥有两只眼睛的人在判断附近物体的相对距离时比只有一只眼睛的人能力更强。然而,立体视觉在距离超过50到200英尺时几乎对深度感知无用。
眼的液体系统——眼内液
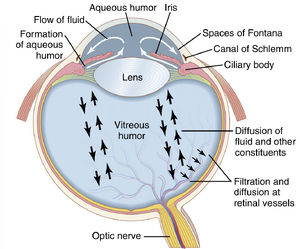
眼睛内充满了眼内液(intraocular fluid),这些液体维持眼球内的足够压力以保持其膨胀状态。图50-18展示了这种液体可以分为两部分——位于晶状体前方的房水(aqueous humor),以及位于晶状体后表面和视网膜之间的玻璃体液(vitreous humor)。房水是一种自由流动的液体,而玻璃体液有时被称为玻璃体(vitreous body),它是一种由主要由高度延长的蛋白聚糖分子组成的细纤维网络结合在一起的胶状物质。水和溶解物质可以在玻璃体液中缓慢扩散,但几乎没有液体流动。
房水不断生成并被重吸收。房水的生成和重吸收之间的平衡调节着眼内液的总体积和压力。
睫状体生成房水
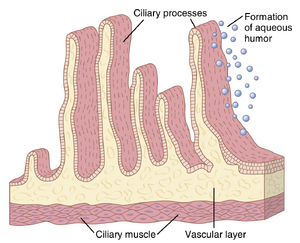
房水在眼睛中以平均每分钟2至3微升的速率生成。几乎所有房水都是由睫状突(ciliary processes)分泌的,这些睫状突是从睫状体(ciliary body)投射到虹膜后方空间的线性褶皱,晶状体韧带和睫状肌附着在眼球上。这些睫状突的横截面如图50-19所示,它们与眼内液体腔室的关系可以在图50-18中看到。由于其褶皱结构,每个眼睛中睫状突的总表面积约为6平方厘米——考虑到睫状体的微小尺寸,这是一个很大的面积。这些突起的表面覆盖着高度分泌的上皮细胞,紧贴其下方是一个高度血管化的区域。
房水几乎完全是由睫状突上皮细胞主动分泌生成的。分泌过程始于钠离子主动转运到上皮细胞之间的间隙中。钠离子带动氯离子和碳酸氢根离子以维持电中性。然后,所有这些离子共同导致水从下方的毛细血管渗透到相同的上皮细胞间隙中;生成的溶液从睫状突的间隙中冲洗到眼睛的前房中。此外,几种营养物质通过主动转运或促进扩散穿过上皮细胞,包括氨基酸、抗坏血酸和葡萄糖。
房水从眼睛的流出
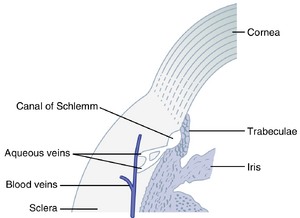
房水()由睫状突()产生后,首先如图50-18所示,通过瞳孔流入眼前房(anterior chamber)。从这里,液体流经晶状体()前方,进入角膜()和虹膜()之间的角度,然后通过小梁网(trabecular meshwork),最后进入Schlemm管(canal of Schlemm),后者排入眼外静脉(extraocular veins)。图50-20展示了这个虹膜角膜角(iridocorneal angle)的解剖结构,显示小梁之间的间隙从前房一直延伸到Schlemm管。Schlemm管是一根薄壁静脉,环绕眼球一周。它的内皮膜(endothelial membrane)非常疏松,甚至大分子蛋白质以及红细胞大小的颗粒物质都可以从前房进入Schlemm管。尽管Schlemm管实际上是一根静脉血管,但通常有如此多的房水流入其中,以至于它只充满房水而不是血液。从Schlemm管通向眼内较大静脉的小静脉通常只含有房水;它们被称为房水静脉(aqueous veins)。
眼内压
平均正常眼内压约为15毫米汞柱(mm Hg),范围在12至20毫米汞柱之间。
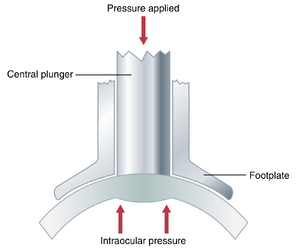
通过眼压计(Tonometry)测量眼内压。由于将针头插入患者眼睛以测量眼内压是不切实际的,临床上使用"眼压计(tonometer)"来测量这种压力,其原理如图50-21所示。用局部麻醉剂麻醉眼睛的角膜,将眼压计的脚板放在角膜上。然后对中央柱塞施加一个小的力,使柱塞下方的角膜部分向内移位。位移量记录在眼压计的刻度上,并根据眼内压进行校准。
眼内压的调节(Regulation of Intraocular Pressure)。在正常眼睛中,眼内压保持恒定,通常在其正常水平(平均约15毫米汞柱)的±2毫米汞柱范围内。这种压力水平主要由房水从前房流入Schlemm管的流出阻力决定。这种流出阻力来自小梁网,液体必须从前房的侧角渗透到Schlemm管壁。这些小梁的微小开口只有2到3微米。随着压力的升高,液体流入Schlemm管的速率显著增加。在正常眼睛中,当压力约为15毫米汞柱时,通过Schlemm管离开眼睛的液体量通常平均为2.5微升/分钟,等于来自睫状体的液体流入量。压力通常保持在这个约15毫米汞柱的水平。
小梁间隙和眼内液的清洁机制。当房水()中存在大量碎片时,例如眼内出血或眼内感染后,这些碎片可能会积聚在从前房()通向Schlemm管()的小梁间隙()中;这些碎片可能会阻碍房水从前房的充分重吸收(reabsorption),有时会导致“青光眼(glaucoma)”,如下所述。然而,在小梁板的表面有大量的吞噬细胞(phagocytic cells)。在Schlemm管的外侧是一层间质凝胶(interstitial gel),其中含有大量的网状内皮细胞(reticuloendothelial cells),这些细胞具有极高的吞噬碎片并将其消化成可被吸收的小分子物质的能力。因此,这种吞噬系统保持着小梁间隙的清洁。虹膜(iris)的表面和虹膜后方的其他眼表面覆盖着上皮细胞(epithelium),这些上皮细胞可以吞噬房水中的蛋白质和小颗粒,从而帮助维持房水的清澈。
“青光眼”导致眼内压升高,是失明的主要原因。青光眼()是最常见的失明原因之一,是一种眼内压(intraocular pressure)病理性升高的眼病,有时会急剧升高至60至70 mmHg。长期维持在25至30 mmHg以上的压力会导致视力丧失。极高的压力可能在几天甚至几小时内导致失明。随着压力的升高,视神经()的轴突()在离开眼球处的视盘()处受到压迫。这种压迫被认为会阻止细胞质()从视网膜神经元()细胞体向大脑的视神经纤维的轴突流动。结果是纤维缺乏适当的营养,最终导致相关纤维的死亡。进入眼球视盘的视网膜动脉()的压迫也可能通过减少视网膜()的营养而加剧神经元损伤。
在大多数青光眼病例中,异常高的压力是由于房水通过小梁间隙流向虹膜角膜连接处(iridocorneal junction)的Schlemm管的阻力增加所致。例如,在急性眼部炎症中,白细胞和组织碎片可能会阻塞这些小梁间隙,导致眼内压急剧升高。在慢性情况下,尤其是在老年人中,小梁间隙的纤维性闭塞(fibrous occlusion)似乎是可能的罪魁祸首。
青光眼有时可以通过在眼中滴入含有药物的滴眼液来治疗,这些药物会扩散到眼球内,减少房水的分泌或增加其吸收。当药物治疗失败时,手术技术可以打开小梁间隙或制造通道,使液体直接从眼球的液体空间流入眼球外的结膜下间隙(subconjunctival space),从而有效降低压力。
眼睛:II. 视网膜的感受器和神经功能
视网膜是眼睛中对光敏感的部分,包含以下内容:(1) 视锥细胞(cones),负责色觉;(2) 视杆细胞(rods),能够检测弱光,主要负责黑白视觉和暗视觉。当视杆细胞或视锥细胞被激活时,信号首先通过视网膜中的连续神经元层传递,最终进入视神经纤维和大脑皮层。在本章中,我们将解释视杆细胞和视锥细胞如何检测光线和颜色,并将视觉图像转换为视神经信号的机制。
视网膜结构元素的解剖和功能
视网膜从外到内按层次或边界排列如下:(1) 色素层;(2) 包含投射到色素层的视杆细胞和视锥细胞的光感受器层;(3) 外界膜;(4) 包含视杆细胞和视锥细胞细胞体的外核层;(5) 外丛状层;(6) 内核层;(7) 内丛状层;(8) 神经节细胞层;(9) 视神经纤维层;(10) 内界膜。
光线通过眼睛的晶状体系统后,再通过玻璃体,从眼睛内部进入视网膜(见图51-1);也就是说,光线首先通过神经节细胞,然后通过丛状层和核层,最后到达位于视网膜最外缘的视杆细胞和视锥细胞层。这段距离有几百微米的厚度;通过这种非均质组织的传递会降低视觉敏锐度。然而,在视网膜的中央凹区域,如后续讨论的,内部层被拉向一侧以减少这种敏锐度的损失。
视网膜由十个层或边界组成。图51-1显示了视网膜的功能组成部分。
视网膜中央凹区域及其在敏锐视觉中的重要性。fovea是视网膜中心的一个微小区域,如图51-2所示;它的总面积略大于1平方毫米。它特别擅长敏锐和细致的视觉。central fovea直径仅为0.3毫米,几乎完全由视锥细胞组成。这些视锥细胞具有特殊的结构,有助于它们检测视觉图像中的细节——即中央凹的视锥细胞具有特别长而细的细胞体,与位于视网膜外围的较胖的视锥细胞形成鲜明对比。此外,在中央凹区域,血管、神经节细胞、内颗粒层细胞和丛状层都偏向一侧,而不是直接位于视锥细胞上方,这使得光线可以无障碍地到达视锥细胞。
视杆细胞和视锥细胞是光感受器的重要组成部分。图51-3是光感受器(无论是视杆细胞还是视锥细胞)的基本组成部分的示意图。如图51-4所示,视锥细胞的外段呈圆锥形。一般来说,视杆细胞比视锥细胞更窄更长,但并非总是如此。在视网膜的外围部分,视杆细胞的直径为2至5微米,而视锥细胞的直径为5至8微米;在视网膜的中心部分,即中央凹,没有视杆细胞,视锥细胞细长,直径仅为1.5微米。
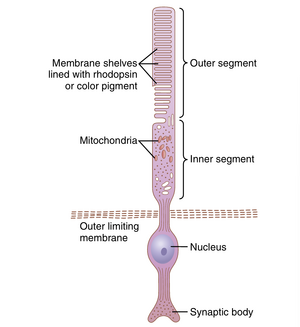
图51-3显示了视杆细胞或视锥细胞的主要功能部分:(1) 外段;(2) 内段;(3) 细胞核;(4) 突触体。光敏感的感光化学物质位于外段。在视杆细胞中,这种感光化学物质是视紫红质(rhodopsin);在视锥细胞中,它是三种“颜色”感光化学物质之一,通常简称为颜色色素,其功能几乎与视紫红质完全相同,只是光谱敏感性不同。
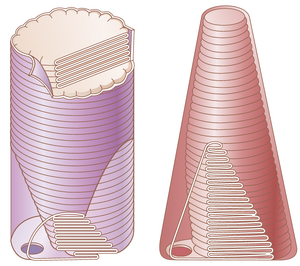
在图51-3和图51-4的视杆细胞和视锥细胞的外段中,注意大量的盘状结构。每个盘状结构实际上是细胞膜的内折层。每个视杆细胞或视锥细胞中多达1000个盘状结构。
视紫红质和颜色色素都是结合蛋白。它们以跨膜蛋白的形式嵌入盘状结构的膜中。这些光敏色素在盘状结构中的浓度非常高,以至于色素本身约占外段总质量的40%。
视杆细胞或视锥细胞的内段包含通常的细胞质和细胞器。特别重要的是线粒体,正如后面所解释的,它们为光感受器的功能提供能量。
突触体(synaptic body)是视杆细胞(rod)或视锥细胞(cone)中与后续神经元细胞(neuronal cells)连接的部分,这些后续细胞包括水平细胞(horizontal cells)和双极细胞(bipolar cells),它们代表了视觉链中的下一阶段。
视网膜的色素层()。色素层中的黑色素(melanin)可以防止光线在眼球内反射,这对于清晰的视觉极为重要。这种色素在眼睛中的作用与相机内部的黑漆相同。如果没有它,光线会在眼球内各个方向反射,导致视网膜的漫射照明,而不是形成精确图像所需的明暗对比。
色素层中黑色素的重要性在患有白化病(albinism)的人身上得到了很好的体现(白化病是一种先天性缺乏黑色素的疾病,患者全身各部位均缺乏黑色素)。当白化病患者进入明亮的房间时,照射到视网膜上的光线会在眼球内各个方向反射,这是由于视网膜和下方的巩膜(sclera)缺乏色素。因此,通常只会刺激少数视杆细胞或视锥细胞的单个离散光点会在各处反射并刺激许多感受器。因此,即使经过最佳的光学矫正,白化病患者的视力也很少能超过20/100到20/200,而不是正常的20/20。
色素层还储存了大量的维生素A(vitamin A)。这些维生素A通过视杆细胞和视锥细胞外段的细胞膜在色素层中来回交换。我们稍后会讨论到,维生素A是视杆细胞和视锥细胞中光敏化学物质的重要前体。
视网膜的血液供应——中央视网膜动脉(Central Retinal Artery)和脉络膜(Choroid)。视网膜内层的营养血液供应来自中央视网膜动脉,该动脉通过视神经(optic nerve)的中心进入眼球,然后分支供应整个视网膜内表面。因此,视网膜的内层有自己的血液供应,独立于眼睛的其他结构。
然而,视网膜的最外层与脉络膜紧密相连,脉络膜是位于视网膜和巩膜之间的高度血管化的组织。视网膜的外层,尤其是视杆细胞和视锥细胞的外段,主要依赖于脉络膜血管的扩散来获取营养,特别是氧气。
视网膜脱离(Retinal Detachment)。神经视网膜偶尔会从色素上皮(pigment epithelium)脱离。在某些情况下,这种脱离的原因是眼球受伤,导致液体或血液在神经视网膜和色素上皮之间积聚。脱离有时是由玻璃体(vitreous humor)中细小的胶原纤维收缩引起的,这些纤维将视网膜区域拉向眼球内部。
部分由于脱离间隙的扩散作用,部分由于通过视网膜动脉对神经视网膜的独立血液供应,脱离的视网膜可以在几天内抵抗退化,并且如果通过手术将其恢复到与色素上皮的正常关系中,它可以再次恢复功能。然而,如果不尽快复位,视网膜将被破坏,即使在手术修复后也无法恢复功能。
视觉的光化学
视杆细胞和视锥细胞都含有在光照下分解的化学物质,并在此过程中激发从眼睛发出的神经纤维。视杆细胞中的光敏化学物质称为视紫红质(rhodopsin);视锥细胞中的光敏化学物质称为视锥色素(cone pigments)或颜色色素(color pigments),其组成与视紫红质仅有轻微差异。
在本节中,我们主要讨论视紫红质的光化学,但同样的原理也适用于视锥色素。
视紫红质-视网膜视觉循环及视杆细胞的兴奋
视紫红质及其在光能作用下的分解。视杆细胞的外段伸入视网膜的色素层,其中含有约40%的光敏色素,称为视紫红质(rhodopsin)或视紫质(visual purple)。这种物质是蛋白质视蛋白(scotopsin)和类胡萝卜素色素视黄醛(retinal)(也称为“视黄素”)的结合物。此外,视黄醛是一种特定类型,称为11-顺式视黄醛(11-cis retinal)。这种顺式视黄醛很重要,因为只有这种形式才能与视蛋白结合合成视紫红质。
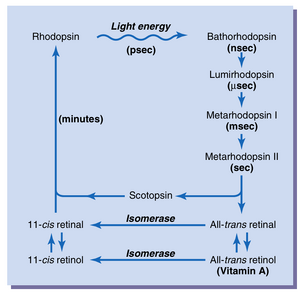
当光能被视紫红质吸收时,视紫红质在极短的时间内开始分解,如图51-5顶部所示。这种快速分解的原因是视紫红质中视黄醛部分的电子被光激活,导致顺式视黄醛瞬间转变为全反式视黄醛(all-trans retinal),后者具有与顺式相同的化学结构但不同的物理结构——它是一个直线分子而不是弯曲分子。由于全反式视黄醛的反应位点的三维取向不再与视蛋白上的反应位点匹配,全反式视黄醛开始从视蛋白上脱离。立即的产物是视紫红质前体(bathorhodopsin),它是全反式视黄醛和视蛋白的部分分离结合物。视紫红质前体极不稳定,在纳秒内衰变为光视紫红质(lumirhodopsin)。然后该产物在微秒内衰变为间视紫红质I(metarhodopsin I),随后在大约一毫秒内衰变为间视紫红质II(metarhodopsin II),最后,更缓慢地(在几秒内)完全分解为视蛋白和全反式视黄醛。
正是间视紫红质II(也称为活化视紫红质)激发了视杆细胞中的电变化,随后视杆细胞以视神经动作电位的形式将视觉图像传递到中枢神经系统,我们将在后面讨论。
视紫红质(visual pigment)的重组。视紫红质的重组第一阶段,如图51-5所示,是将全反式视黄醛(all-trans retinal)重新转化为11-顺式视黄醛(11-cis retinal)。这一过程需要代谢能量,并由视黄醛异构酶(retinal isomerase)催化。一旦11-顺式视黄醛形成,它会自动与视蛋白(scotopsin)重新结合,形成视紫红质,随后视紫红质保持稳定,直到再次被光能吸收触发分解。
维生素A对视紫红质形成的作用。请注意图51-5中,全反式视黄醛可以通过第二条化学途径转化为11-顺式视黄醛。这条途径首先将全反式视黄醛转化为全反式视黄醇(all-trans retinol),这是维生素A的一种形式。然后,全反式视黄醇在异构酶(isomerase)的作用下转化为11-顺式视黄醇(11-cis retinol)。最后,11-顺式视黄醇转化为11-顺式视黄醛,后者与视蛋白结合形成新的视紫红质。
维生素A存在于视杆细胞的细胞质和视网膜的色素层中。因此,维生素A通常总是可用于在需要时形成新的视黄醛。相反,当视网膜中存在过量的视黄醛时,它会被转化回维生素A,从而减少视网膜中光敏色素的数量。我们稍后会看到,视黄醛和维生素A之间的这种相互转换在视网膜对不同光强度的长期适应中尤为重要。
维生素A缺乏导致的夜盲症
夜盲症发生在严重缺乏维生素A的人群中,因为如果没有维生素A,可以形成的视黄醛和视紫红质的数量会严重减少。这种情况被称为夜盲症,因为夜间可用的光线太少,无法让维生素A缺乏的人获得足够的视力。
夜盲症的发生通常需要一个人持续数月缺乏维生素A的饮食,因为大量的维生素A通常储存在肝脏中,并可以提供给眼睛。一旦夜盲症发生,有时可以通过静脉注射维生素A在不到1小时内逆转。
当视紫红质被光激活时视杆细胞的兴奋
视杆细胞在光照下超极化。视杆细胞暴露在光线下会导致细胞内膜电位的负性增加,这是一种超极化状态。这与几乎所有其他感觉受体中发生的负性减少(“去极化”过程)完全相反。
视紫红质的激活如何导致超极化?答案是,当视紫红质分解时,它会降低视杆细胞外段对钠离子的膜电导,从而导致超极化。
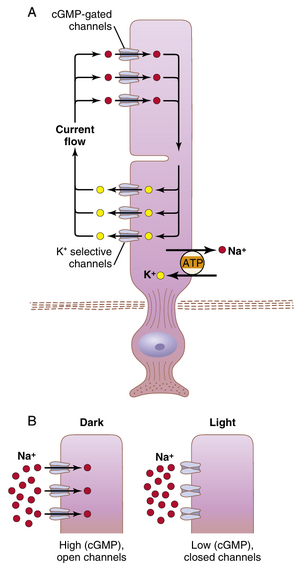
图51-6展示了钠离子和钾离子在完整电路中的运动,通过视杆细胞的内段和外段。内段持续将钠离子从视杆细胞内部泵出到外部,而钾离子则被泵入细胞内。钾离子通过仅限于视杆细胞内段的非门控钾通道泄漏出细胞。与其他细胞一样,这种钠钾泵在整个细胞内部产生负电位。然而,视杆细胞的外段,即光感受器盘所在的位置,则完全不同。在这里,视杆细胞膜在黑暗状态下对钠离子具有泄漏性,钠离子通过环磷酸鸟苷(cGMP)门控通道流动。在黑暗状态下,cGMP水平较高,允许带正电荷的钠离子持续泄漏回视杆细胞内部,从而中和整个细胞内的大部分负电性。因此,在正常的黑暗条件下,当视杆细胞未被激发时,视杆细胞膜内部的电负性降低,测量值约为-40毫伏,而不是大多数感觉受体中常见的-70至-80毫伏。
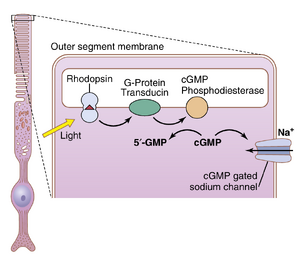
当视杆细胞外段中的视紫红质暴露在光线下时,它被激活并开始分解。随后,cGMP门控钠通道关闭,视杆细胞外段膜对钠离子向内部传导的能力通过三个步骤减少(图51-7):(1) 光被视紫红质吸收,导致视网膜部分中的电子光活化,如前所述;(2) 激活的视紫红质刺激一种称为转导蛋白的G蛋白,然后激活cGMP磷酸二酯酶,这种酶催化cGMP分解为5'-GMP;(3) cGMP的减少关闭了cGMP门控钠通道,并减少了内向钠电流。钠离子继续通过内段膜被泵出。因此,现在离开视杆细胞的钠离子比泄漏回内部的更多。由于它们是正离子,它们从视杆细胞内部的损失增加了膜内部的负电性,而照射到视杆细胞的光能越多,电负性就越大——即超极化程度越大。在最大光强下,膜电位接近-70至-80毫伏,这接近钾离子跨膜的平衡电位。
感受器电位的持续时间及其与光强度的对数关系。当光脉冲突然照射到视网膜时,视杆细胞中发生的瞬时超极化(感受器电位)在大约0.3秒内达到峰值,并持续超过1秒。在视锥细胞中,这种变化的速度是视杆细胞的四倍。有时,仅持续百万分之一秒的视觉图像照射到视网膜的视杆细胞上,可能会引起持续超过1秒的视觉感知。
感受器电位的另一个特征是它大致与光强度的对数成正比。这一特征极为重要,因为它使眼睛能够辨别光强度,其范围比没有这一特征时大数千倍。
视紫红质分解降低膜钠电导的机制——兴奋“级联”。在最佳条件下,单个光子(光能量的最小量子单位)可以在视杆细胞中引起约1毫伏的感受器电位。仅30个光子就能使视杆细胞达到半饱和状态。如此少量的光如何能引起如此大的兴奋?答案是光感受器具有极其敏感的化学级联反应,将刺激效应放大约一百万倍,具体过程如下:
- 光子激活视紫红质中11-顺式视黄醛部分的电子;这种激活导致形成变视紫红质II(metarhodopsin II),这是视紫红质的活性形式,如图51-5所示。
- 激活的视紫红质作为酶激活许多转导蛋白分子,转导蛋白是一种以非活性形式存在于视杆细胞盘膜和细胞膜中的蛋白质。
- 激活的转导蛋白激活更多的磷酸二酯酶分子。
- 激活的磷酸二酯酶立即水解许多cGMP分子,从而破坏它。在被破坏之前,cGMP与视杆细胞外膜的钠通道蛋白结合,使其保持在开放状态。然而,在光照下,磷酸二酯酶对cGMP的水解作用移除了这种“夹板”作用,使钠通道关闭。每个最初激活的视紫红质分子会导致数百个通道关闭。由于通过这些通道的钠离子流动速度极快,通道关闭前会阻止超过100万个钠离子的流动。这种钠离子流动的减少正是视杆细胞兴奋的原因,如前所述。
- 在大约1秒内,视杆细胞中始终存在的另一种酶——视紫红质激酶(rhodopsin kinase)使激活的视紫红质(变视紫红质II)失活,整个级联反应逆转回正常状态,钠通道重新开放。
因此,视杆细胞(rods)发展出了一种重要的化学级联反应(cascade),将单个光子的效应放大,导致数百万钠离子的移动。这一机制解释了视杆细胞在黑暗条件下的极端敏感性。
视锥细胞(cones)的敏感性比视杆细胞低约30到300倍,但即使是这种程度的敏感性,也使得在比极暗的黄昏更亮的光线下能够进行色觉(color vision)。
视锥细胞的色觉光化学
我们之前指出,视锥细胞中的光化学物质与视杆细胞中的视紫红质(rhodopsin)的化学组成几乎完全相同。唯一的区别是蛋白质部分,即视蛋白(opsins)——在视锥细胞中称为光视蛋白(photopsins)——与视杆细胞中的暗视蛋白(scotopsin)略有不同。所有视觉色素中的视黄醛(retinal)部分在视锥细胞和视杆细胞中完全相同。因此,视锥细胞的色敏色素是视黄醛和光视蛋白的组合。
每种不同的视锥细胞中只存在三种色觉色素中的一种,从而使视锥细胞对不同的颜色——蓝色、绿色或红色——具有选择性敏感性。这些色觉色素分别称为蓝敏色素(blue-sensitive pigment)、绿敏色素(green-sensitive pigment)和红敏色素(red-sensitive pigment)。三种视锥细胞中色素的吸收特性分别在445、535和570纳米的光波长处显示出峰值吸收率。这些波长也是每种视锥细胞对光的峰值敏感性的波长,这开始解释了视网膜如何区分颜色。图51-8显示了这三种色素的近似吸收曲线。图中还显示了视杆细胞中视紫红质的吸收曲线,其峰值在505纳米处。
视网膜敏感性的自动调节——光适应和暗适应
如果一个人在强光下待了几个小时,视杆细胞和视锥细胞中的大部分光化学物质将被还原为视黄醛和视蛋白。此外,视杆细胞和视锥细胞中的大部分视黄醛将被转化为维生素A。由于这两种效应,视杆细胞和视锥细胞中剩余的光敏化学物质的浓度显著降低,眼睛对光的敏感性也相应降低。这个过程称为光适应(light adaptation)。
相反,如果一个人在黑暗中待了很长时间,视杆细胞和视锥细胞中的视黄醛和视蛋白将被转化回光敏色素。此外,维生素A将被转化回视黄醛以增加光敏色素,最终的限制由视杆细胞和视锥细胞中与视黄醛结合的视蛋白的量决定。这个过程称为暗适应(dark adaptation)。
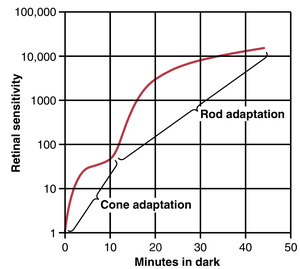
图51-9展示了一个人在暴露于强光数小时后进入完全黑暗环境时的暗适应( dark adaptation )过程。请注意,视网膜在刚进入黑暗时的敏感度非常低,但在1分钟内,敏感度已经增加了10倍——也就是说,视网膜可以对之前所需光强的十分之一的光作出反应。20分钟后,敏感度增加了约6000倍,40分钟后,敏感度增加了约25,000倍。
图51-9中的曲线被称为暗适应曲线。请注意曲线中的拐点。曲线的早期部分是由视锥细胞的适应引起的,因为所有视觉的化学过程,包括适应,在视锥细胞中发生的速度大约是视杆细胞的四倍。然而,视锥细胞在黑暗中的敏感度变化远不及视杆细胞。因此,尽管视锥细胞适应迅速,但它们在几分钟后就停止了适应,而缓慢适应的视杆细胞则继续适应数分钟甚至数小时,其敏感度大幅增加。视杆细胞的额外敏感度是由视网膜中100个或更多的视杆细胞汇聚到一个神经节细胞( ganglion cell )的神经元信号汇聚引起的;这些视杆细胞通过叠加来增加其敏感度,这一点将在本章后面讨论。
光适应( light adaptation )和暗适应的其他机制。除了由视紫红质( rhodopsin )或彩色光化学物质浓度变化引起的适应外,眼睛还有两种其他机制用于光适应和暗适应。第一种是瞳孔大小的变化,如第50章所讨论的。由于通过瞳孔开口的光量变化,这种变化可以在几分之一秒内引起约30倍的适应。
另一种机制是神经适应,涉及视网膜和大脑中视觉链各阶段的神经元。也就是说,当光强首次增加时,双极细胞( bipolar cell )、水平细胞( horizontal cell )、无长突细胞( amacrine cell )和神经节细胞传递的信号都很强烈。然而,大多数这些信号在神经回路的不同传输阶段迅速减弱。尽管适应程度只有几倍,而不是光化学系统适应时的数千倍,但神经适应发生在几分之一秒内,而光化学物质的完全适应则需要数分钟到数小时。
光适应和暗适应在视觉中的价值。在最大暗适应和最大光适应的极限之间,眼睛可以将其对光的敏感度改变多达50万到100万倍,敏感度会自动根据光照变化进行调整。
由于视网膜对图像的记录需要检测图像中的暗点和亮点,因此必须始终调整视网膜的敏感性,使感受器对较亮的区域作出反应,而对较暗的区域不作出反应。视网膜适应不良的一个例子是当一个人离开电影院进入明亮的阳光下时。此时,即使是图像中的暗点也显得非常明亮,结果整个视觉图像被漂白,不同部分之间的对比度很小。这种视力不佳的情况会持续到视网膜充分适应,使得图像中的较暗区域不再过度刺激感受器。
相反,当一个人首次进入黑暗环境时,视网膜的敏感性通常非常低,以至于图像中的亮点也无法激发视网膜。经过暗适应后,亮点开始被记录。作为光适应和暗适应极端的例子,阳光的强度大约是星光的100亿倍,但眼睛在光适应后可以在明亮的阳光下工作,在暗适应后也可以在星光下工作。
色觉 (Color Vision)
从前面的章节中,我们了解到不同的视锥细胞对不同颜色的光敏感。本节将讨论视网膜如何检测视觉光谱中不同颜色梯度的机制。
色觉检测的三色机制
所有的色觉理论都基于一个众所周知的观察结果,即当仅将红色、绿色和蓝色单色光以不同的组合适当混合时,人眼可以检测到几乎所有颜色的梯度。
三种视锥细胞的光谱敏感性。根据色觉测试,人类三种视锥细胞的光谱敏感性与视锥细胞中发现的三种色素的光吸收曲线基本相同。这些曲线如图51-8所示,图51-10中略有不同。它们可以解释大多数色觉现象。
神经系统对颜色的解释 。在图51-10中,可以看到波长为580纳米的橙色单色光刺激红色视锥细胞达到约99(99%的峰值刺激在最佳波长);它刺激绿色视锥细胞达到约42,但蓝色视锥细胞完全没有被刺激。因此,在这种情况下,三种视锥细胞的刺激比例为99:42:0。神经系统将这一组比例解释为橙色的感觉。相反,波长为450纳米的单色蓝光刺激红色视锥细胞的刺激值为0,绿色视锥细胞为0,蓝色视锥细胞为97。这一组比例——0:0:97——被神经系统解释为蓝色。同样,83:83:0的比例被解释为黄色,31:67:36的比例被解释为绿色。
图51-10。四种颜色——蓝色、绿色、黄色和橙色——的单色光对不同颜色敏感视锥细胞的刺激程度的演示。
白光的感知。所有红色、绿色和蓝色视锥细胞(cone)受到大致相等的刺激时,会让人产生看到白色的感觉。然而,并没有单一波长的光对应白色;相反,白色是光谱中所有波长的组合。此外,通过仅使用三种选定的颜色以适当的组合刺激视网膜,使相应的视锥细胞类型受到大致相等的刺激,也可以实现白色的感知。
色盲
红绿色盲。当眼睛中缺少某一组颜色感知视锥细胞时,人将无法区分某些颜色。例如,从图51-10中可以看到,绿色、黄色、橙色和红色(波长在525到675纳米之间的颜色)通常由红色和绿色视锥细胞区分。如果这两种视锥细胞中的任何一种缺失,人就无法使用这种机制来区分这四种颜色;尤其是无法区分红色和绿色,因此被称为红绿色盲。
缺少红色视锥细胞的人被称为红色盲(protanope);由于缺少红色视锥细胞,整体可见光谱在长波长端明显缩短。缺少绿色视锥细胞的人被称为绿色盲(deuteranope);由于红色视锥细胞可以检测长波长的红色,因此绿色盲的人具有完全正常的可见光谱宽度。然而,绿色盲的人只能区分2到3种不同的色调,而正常视力的人可以看到7种独特的色调。
红绿色盲是一种几乎只发生在男性中的遗传性疾病。这是因为女性X染色体上的基因编码了相应的视锥细胞。然而,女性几乎不会出现色盲,因为两条X染色体中至少有一条几乎总是具有每种视锥细胞的正常基因。由于男性只有一条X染色体,基因缺失可能导致色盲。
由于男性的X染色体总是从母亲那里遗传而来,而不是从父亲那里遗传,因此色盲是从母亲传给儿子的,母亲被称为色盲携带者。大约8%的女性是色盲携带者。
蓝色弱视
蓝色视锥细胞很少缺失,尽管有时在一种称为蓝色弱视(blue weakness)的遗传性疾病中,蓝色视锥细胞的数量较少。
色觉测试图
确定色盲的快速方法是使用如图51-11所示的斑点图。这些图表由几种不同颜色的斑点混合排列而成。在上方的图表中,正常色觉的人会读出“74”,而红绿色盲的人会读出“21”。在下方的图表中,正常色觉的人会读出“42”,而红色盲的人会读出“2”,绿色盲的人会读出“4”。
视网膜的神经功能
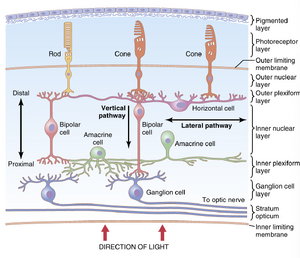
图51-12展示了视网膜神经连接的基本结构,左侧显示了周边视网膜的电路,右侧显示了中央凹视网膜的电路。不同的神经元细胞类型如下:
- 光感受器(photoreceptors)——视杆细胞(rods)和视锥细胞(cones)——将信号传递到外网状层(outer plexiform layer),在那里它们与双极细胞(bipolar cells)和水平细胞(horizontal cells)形成突触(synapse)。
- 水平细胞(horizontal cells)在外网状层(outer plexiform layer)中水平传递信号,从视杆细胞(rods)和视锥细胞(cones)到双极细胞(bipolar cells)。
- 双极细胞(bipolar cells)垂直传递信号,从视杆细胞(rods)、视锥细胞(cones)和水平细胞(horizontal cells)到内网状层(inner plexiform layer),在那里它们与神经节细胞(ganglion cells)和无长突细胞(amacrine cells)形成突触(synapse)。
- 无长突细胞(amacrine cells)在两个方向上传递信号,要么直接从双极细胞(bipolar cells)到神经节细胞(ganglion cells),要么在内网状层(inner plexiform layer)中水平传递信号,从双极细胞(bipolar cells)的轴突(axons)到神经节细胞(ganglion cells)的树突(dendrites)或其他无长突细胞(amacrine cells)。
- 神经节细胞(ganglion cells)通过视神经(optic nerve)将输出信号从视网膜(retina)传递到大脑(brain)。视网膜(retina)中的第六种神经元细胞是丛间细胞(interplexiform cell),这种细胞并不显著,图中未显示。这种细胞从内网状层(inner plexiform layer)向外网状层(outer plexiform layer)逆向传递信号。这些信号是抑制性的,被认为通过外网状层(outer plexiform layer)中的水平细胞(horizontal cells)控制视觉信号的横向扩散。它们的作用可能是帮助控制视觉图像中的对比度。
图51-12. 视网膜(retina)的神经组织,左侧为周边区域,右侧为中央凹区域(foveal area)。
从视锥细胞(cones)到神经节细胞(ganglion cells)的视觉通路与视杆细胞(rods)通路的功能不同。与我们的许多其他感觉系统一样,视网膜(retina)既有基于视杆细胞(rods)视觉的旧类型视觉,也有基于视锥细胞(cones)视觉的新类型视觉。传导视锥细胞(cones)视觉信号的神经元和神经纤维比传导视杆细胞(rods)视觉信号的神经元和神经纤维大得多,并且信号传导到大脑的速度快两到五倍。此外,这两个系统的电路略有不同。
图51-11. 两张石原氏色盲检测图。在这张图(上板)中,正常视力的人读作“74”,但红绿色盲的人读作“21”。在这张图(下板)中,红色盲的人(protanope)读作“2”,但绿色盲的人(deuteranope)读作“4”。正常视力的人读作“42”。(来自石原S. 色盲测试。东京:本乡春木町,1917年。请注意,色盲测试不能使用此材料进行。为了准确测试,应使用原始图版。)
在图51-12的右侧是从视网膜(retina)中央凹部分(foveal portion)的视觉通路,代表新的、快速的视锥细胞(cones)系统。此图显示了直接通路中的三个神经元:(1) 视锥细胞(cones);(2) 双极细胞(bipolar cells);(3) 神经节细胞(ganglion cells)。此外,水平细胞(horizontal cells)在外网状层(outer plexiform layer)中横向传递抑制信号,无长突细胞(amacrine cells)在内网状层(inner plexiform layer)中横向传递信号。
在图51-12的左侧是外周视网膜(peripheral retina)的神经连接,这里既有视杆细胞(rods)也有视锥细胞(cones)。图中显示了三个双极细胞(bipolar cells);中间的那个只与视杆细胞连接,代表了在许多低等动物中存在的视觉系统类型。双极细胞的输出仅传递到无长突细胞(amacrine cells),这些细胞再将信号传递给神经节细胞(ganglion cells)。因此,对于纯视杆视觉,直接视觉通路中有四个神经元:(1) 视杆细胞;(2) 双极细胞;(3) 无长突细胞;以及 (4) 神经节细胞。此外,水平细胞(horizontal cells)和无长突细胞提供了横向连接。
图51-12中外周视网膜回路中显示的另外两个双极细胞与视杆细胞和视锥细胞都有连接;这些双极细胞的输出既直接传递到神经节细胞,也通过无长突细胞传递。
视网膜神经元释放的神经递质(Neurotransmitters)。视网膜中用于突触传递(synaptic transmission)的神经递质化学物质尚未完全阐明。然而,视杆细胞和视锥细胞在与双极细胞的突触处都会释放谷氨酸(glutamate)。
组织学和药理学研究已经证明存在多种类型的无长突细胞,它们至少分泌八种类型的递质物质,包括γ-氨基丁酸(GABA)、甘氨酸(glycine)、多巴胺(dopamine)、乙酰胆碱(acetylcholine)和吲哚胺(indolamine),所有这些通常都作为抑制性递质发挥作用。双极细胞、水平细胞和丛间细胞(interplexiform cells)的递质尚不清楚,但至少有一些水平细胞释放抑制性递质。
大多数信号通过电紧张传导(Electrotonic Conduction)在视网膜神经元中传递,而不是通过动作电位(Action Potentials)。唯一始终通过动作电位传递视觉信号的视网膜神经元是神经节细胞,它们通过视神经(optic nerve)将信号一直传递到大脑。偶尔,在无长突细胞中也记录到动作电位,尽管这些动作电位的重要性尚存疑问。除此之外,所有视网膜神经元都通过电紧张传导而不是动作电位来传导视觉信号。
电紧张传导意味着电流在神经元细胞质和神经轴突中从兴奋点一直流向输出突触,而不是通过动作电位。即使在视杆细胞和视锥细胞中,从它们的外段到突触体的传导也是通过电紧张传导进行的。也就是说,当视杆细胞或视锥细胞的外段因光而发生超极化(hyperpolarization)时,几乎相同程度的超极化通过细胞质中的直接电流传导到突触体,而不需要动作电位。然后,当来自视杆细胞或视锥细胞的递质刺激双极细胞或水平细胞时,信号再次通过直接电流从输入传递到输出,而不是通过动作电位。
电紧张传导的重要性在于它允许信号强度的分级传导。因此,对于视杆细胞和视锥细胞,超极化输出信号的强度与光照强度直接相关;信号不是全或无的,就像每个动作电位那样。
通过横向抑制增强视觉对比——水平细胞的功能
水平细胞(horizontal cells),如图51-12所示,横向连接视杆细胞(rods)和视锥细胞(cones)的突触体(synaptic bodies)以及双极细胞(bipolar cells)的树突(dendrites)。水平细胞的输出总是抑制性的。因此,这种横向连接提供了与其他感觉系统中同样重要的侧向抑制(lateral inhibition)现象——即有助于确保视觉模式以适当的视觉对比度传递。这一现象在图51-13中得到了展示,图中显示了一束聚焦在视网膜上的微小光点。光线照射的中心区域被兴奋,而旁边的区域则被抑制。换句话说,由于丛状层(plexiform layers)中树突和轴突树的广泛分布,兴奋信号不会在视网膜中广泛扩散,而是通过水平细胞的横向抑制在周围区域阻止了这种扩散。这一过程对于在视觉图像中传递对比边界时实现高视觉精度至关重要。
图51-13. 由一束小光束引起的视网膜区域的兴奋和抑制,展示了侧向抑制的原理。
一些无长突细胞(amacrine cells)可能也在视网膜的内丛状层(inner plexiform layer)中提供了额外的侧向抑制,并进一步增强了视觉对比度。
去极化(depolarizing)和超极化(hyperpolarizing)双极细胞
两种类型的双极细胞在视觉通路中提供了相反的兴奋性和抑制性信号:(1) 去极化双极细胞(depolarizing bipolar cell);(2) 超极化双极细胞(hyperpolarizing bipolar cell)。也就是说,一些双极细胞在视杆细胞和视锥细胞兴奋时去极化,而另一些则超极化。
对于这种差异,有两种可能的解释。一种解释是,这两种双极细胞是完全不同的类型,其中一种对由视杆细胞和视锥细胞释放的谷氨酸神经递质(glutamate neurotransmitter)作出去极化反应,而另一种则作出超极化反应。另一种可能性是,其中一种双极细胞直接从视杆细胞和视锥细胞接收兴奋信号,而另一种则通过水平细胞间接接收信号。由于水平细胞是抑制性细胞,这会逆转电反应的极性。
无论这两种双极细胞反应的机制如何,这一现象的重要性在于它使得一半的双极细胞传递正信号,而另一半传递负信号。我们稍后会看到,正信号和负信号都被用于将视觉信息传递到大脑。
去极化和超极化双极细胞之间这种相互关系的另一个重要方面是,除了水平细胞机制外,它还提供了第二种侧向抑制机制。由于去极化和超极化双极细胞彼此紧邻,这为分离视觉图像中的对比边界提供了一种机制,即使边界恰好位于两个相邻的光感受器之间。相比之下,水平细胞的侧向抑制机制在更远的距离上起作用。
无长突细胞及其功能
已通过形态学或组织化学方法鉴定出约30种无长突细胞(amacrine cells)。其中约六种无长突细胞的功能已被表征,且它们的功能各不相同:
- 一种无长突细胞是杆状细胞视觉的直接通路的一部分——即从杆状细胞到双极细胞再到无长突细胞,最后到神经节细胞。
- 另一种无长突细胞在持续视觉信号开始时强烈响应,但响应迅速消失。
- 其他无长突细胞在视觉信号结束时强烈响应,但同样,响应迅速消退。
- 还有一些无长突细胞在光线开启或关闭时响应,仅表示光照的变化,而不论方向如何。
- 另一种无长突细胞对特定方向上视网膜上的光点移动作出响应;因此,这些无长突细胞被称为具有方向敏感性。
在某种意义上,许多或大多数无长突细胞是中间神经元(interneurons),它们在视觉信号离开视网膜之前帮助分析这些信号。
神经节细胞和视神经纤维
每个视网膜包含约1亿个杆状细胞和300万个锥状细胞,但神经节细胞的数量仅为约160万个。因此,平均每个神经节细胞及其通向大脑的视神经纤维上汇聚了约60个杆状细胞和2个锥状细胞。
然而,视网膜外周和中央区域存在显著差异。当接近中央凹时,每个视神经纤维上汇聚的杆状细胞和锥状细胞数量减少,且杆状细胞和锥状细胞也变得更细长。这些效应逐渐提高了中央视网膜的视觉敏锐度。在中央凹中,只有细长的锥状细胞——约35,000个——而没有杆状细胞。此外,从视网膜这一部分引出的视神经纤维数量几乎与锥状细胞的数量完全相等,如图51-12右侧所示。这种现象解释了中央视网膜的高视觉敏锐度,相比之下,外周区域的视觉敏锐度要差得多。
视网膜外周和中央部分的另一个区别是外周视网膜对弱光的敏感性要高得多,这部分是因为杆状细胞对光的敏感性比锥状细胞高30到300倍。然而,这种更高的敏感性进一步被放大,因为在视网膜更外周的部分,多达200个杆状细胞汇聚到一个视神经纤维上,因此来自杆状细胞的信号会叠加,从而对外周神经节细胞及其视神经纤维产生更强烈的刺激。
视网膜神经节细胞及其各自的感受野
\boldsymbolW、\boldsymbolX和\boldsymbolY细胞。早期的猫研究描述了三种不同类型的视网膜神经节细胞,根据其结构和功能的差异,分别命名为W、X和Y细胞。
W细胞在其视神经纤维中以较慢的速度传递信号,并主要从杆状细胞接收兴奋,这些兴奋通过小型双极细胞和无长突细胞传递。它们在视网膜外周区域具有广泛的感受野,对检测视野中的方向性运动敏感,可能在黑暗条件下的粗略杆状细胞视觉中起重要作用。
X细胞具有较小的感受野(visual field),因为它们的树突(dendrites)在视网膜(retina)中没有广泛分布,因此X细胞的信号代表了离散的视网膜位置,并传递视觉图像的精细细节。此外,由于每个X细胞至少接收一个视锥细胞(cone)的输入,X细胞的传递可能与色觉(color vision)有关。
Y细胞是所有细胞中最大的,它们以50~m/sec或更快的速度向大脑传递信号。由于它们具有广泛的树突野(dendritic fields),这些细胞从广泛的视网膜区域接收信号。Y细胞对视觉图像的快速变化做出反应,并在视野(visual field)中任何地方发生新的视觉事件时几乎立即通知中枢神经系统(central nervous system),但它们不能非常精确地指定事件的位置,只能提供使眼睛朝向兴奋视觉移动的线索。
P细胞和M细胞。在灵长类动物中,使用了一种不同的视网膜神经节细胞(retinal ganglion cells)分类方法,已经描述了多达20种类型的视网膜神经节细胞,每种细胞对视觉场景的不同特征做出反应。一些细胞对特定的运动方向或方位做出最佳反应,而其他细胞则对精细细节、光线的增加或减少或特定颜色做出反应。在灵长类动物(包括人类)中研究最广泛的两种视网膜神经节细胞类别被指定为大细胞(magnocellular, M)和小细胞(parvocellular, P)细胞。
P细胞(也称为β细胞,或在中央视网膜中称为侏儒神经节细胞(midget ganglion cells))投射到丘脑(thalamus)外侧膝状体(lateral geniculate nucleus)的小细胞层(parvocellular layer)。M细胞(也称为α细胞或伞状细胞(parasol cells))投射到外侧膝状体的大细胞层(magnocellular layer),后者又将信息从视束(optic tract)传递到视觉皮层(visual cortex),如第52章所述。P细胞和M细胞的主要区别如下:
- P细胞的感受野(receptive fields)比M细胞小得多。
- P细胞的轴突(axons)传导冲动的速度比M细胞慢得多。
- P细胞对刺激(尤其是颜色刺激)的反应可以持续,而M细胞的反应则更为短暂。
- P细胞通常对刺激的颜色敏感,而M细胞对颜色刺激不敏感。
- M细胞对低对比度、黑白刺激的敏感性比P细胞高得多。
从它们的差异中可以明显看出M细胞和P细胞的主要功能:P细胞对与精细细节和不同颜色相关的视觉信号高度敏感,但对低对比度信号相对不敏感,而M细胞对低对比度刺激和快速运动的视觉信号高度敏感。
已经描述了第三种光敏视网膜神经节细胞(photosensitive retinal ganglion cells),它含有自己的光色素(photopigment)——黑视素(melanopsin)。关于这种细胞类型的了解要少得多,但这些细胞似乎主要向大脑的非视觉区域发送信号,特别是下丘脑(hypothalamus)的视交叉上核(suprachiasmatic nucleus),即主要的昼夜节律起搏器(circadian pacemaker)。据推测,这些信号有助于控制与昼夜同步的生理变化的昼夜节律(circadian rhythms)。
神经节细胞的兴奋
神经节细胞中的自发性、持续性动作电位
神经节细胞是视神经长纤维进入大脑的起点。由于距离较远,视网膜中视杆细胞(rod)、视锥细胞(cone)和双极细胞(bipolar cell)所采用的电紧张传导(electrotonic conduction)方式不再适用;因此,神经节细胞通过重复的动作电位(action potential)来传递信号。此外,即使在没有受到刺激的情况下,它们仍以每秒5到40次的速率持续传递冲动。视觉信号则叠加在这种背景性的神经节细胞放电之上。
光强度变化的传递——开-关反应
如前所述,许多神经节细胞专门对光强度的变化产生兴奋,如图51-14中的神经冲动记录所示。上图中,当光线首次打开时,会在几分之一秒内出现快速冲动,但这些冲动在接下来的几分之一秒内迅速减少。下图的记录来自位于光点侧面的神经节细胞;由于侧向抑制(lateral inhibition),当光线打开时,该细胞明显受到抑制。然后,当光线关闭时,会产生相反的效果。这些对光的相反反应方向分别由去极化(depolarizing)和超极化(hyperpolarizing)的双极细胞引起,而反应的瞬态特性可能至少部分由无长突细胞(amacrine cell)产生,其中许多无长突细胞本身也具有类似的瞬态反应。
眼睛检测光强度变化的能力在外周视网膜和中央视网膜中得到了高度发展。例如,一只微小的gnat飞过视野时会立即被检测到。
图51-14. 神经节细胞对光的反应:(1) 被光点兴奋的区域和(2) 邻近兴奋区域的区域。该区域的神经节细胞通过侧向抑制机制受到抑制。(改编自Granit R: Receptors and Sensory Perception: A Discussion of Aims, Means, and Results of Electrophysiological Research into the Process of Reception. New Haven, CT: Yale University Press, 1955.)
相反,同一只gnat静止不动时则保持在视觉检测的阈值以下。
传递视觉场景中对比信号的传递——侧向抑制的作用
许多神经节细胞(ganlion cells)主要对场景中的对比边界(contrast borders)作出反应,这似乎是场景模式传输到大脑的主要方式。当均匀的光线照射到整个视网膜(retina)上,并且所有光感受器(photoreceptors)都被入射光均匀刺激时,对比类型的神经节细胞既不会被刺激也不会被抑制。这是因为直接从光感受器通过去极化双极细胞(depolarizing bipolar cells)传递的信号是兴奋性的,而通过超极化双极细胞(hyperpolarizing bipolar cells)以及水平细胞(horizontal cells)横向传递的信号主要是抑制性的。因此,通过一条通路的直接兴奋信号很可能被通过侧向通路的抑制信号所中和。图51-15展示了这一过程的一个回路,图中顶部显示了三个光感受器。中央感受器兴奋一个去极化双极细胞。两侧的两个感受器通过抑制性水平细胞连接到同一个双极细胞,如果所有三个感受器同时被光刺激,这些水平细胞会中和直接兴奋信号。
现在,让我们看看当视觉场景中出现对比边界时会发生什么。再次参考图51-15,假设中央光感受器被一个亮点刺激,而两个侧向感受器中的一个处于黑暗中。亮点通过双极细胞兴奋直接通路。由于其中一个侧向光感受器处于黑暗中,导致其中一个水平细胞保持未受刺激状态。因此,这个细胞不会抑制双极细胞,从而使双极细胞获得额外的兴奋。因此,在视觉对比出现的地方,通过直接和侧向通路的信号会相互增强。
总之,侧向抑制(lateral inhibition)机制在眼睛中的作用方式与大多数其他感觉系统中的作用方式相同——提供对比检测和增强。
图51-15. 视网膜中视杆细胞(rods)、水平细胞(H)、双极细胞(B)和神经节细胞(G)的典型排列,显示了视杆细胞与双极细胞和水平细胞之间的突触兴奋,以及水平细胞对双极细胞的抑制。
神经节细胞对颜色信号的传递
单个神经节细胞可能被多个或仅少数视锥细胞(cones)刺激。当所有三种类型的视锥细胞——红色、蓝色和绿色——刺激同一个神经节细胞时,通过神经节细胞传递的信号对于光谱中的任何颜色都是相同的。因此,来自神经节细胞的信号在检测不同颜色方面不起作用。相反,它是一个“白色”信号。
相反,一些神经节细胞仅被一种颜色的视锥细胞兴奋,但被第二种类型的视锥细胞抑制。例如,这种机制经常发生在红色和绿色视锥细胞之间,红色引起兴奋而绿色引起抑制,或者反之亦然。
同样的互斥效应发生在蓝色视锥细胞与红色和绿色视锥细胞的组合(两者都被黄色兴奋)之间,从而在蓝色和黄色之间形成互斥的兴奋-抑制关系。
这种颜色对立效应的机制如下。一种类型的视锥细胞通过去极化双极细胞(depolarizing bipolar cell)的直接兴奋通路兴奋神经节细胞(ganglion cell),而另一种类型的视锥细胞则通过超极化双极细胞(hyperpolarizing bipolar cell)的间接抑制通路抑制神经节细胞。
这些颜色对比机制的重要性在于,它们代表了视网膜开始区分颜色的一种方式。因此,每种颜色对比类型的神经节细胞会被一种颜色兴奋,但会被“对立”颜色抑制。因此,颜色分析始于视网膜,而并非完全由大脑完成。
参考文献
Bringmann A, Syrbe S, Görner K, et al: The primate fovea: structure, function and development. Prog Retin Eye Res 66:49, 2018. Do MT, Yau KW: Intrinsically photosensitive retinal ganglion cells. Physiol Rev 90:1547, 2010. Douglas RH: The pupillary light responses of animals; a review of their distribution, dynamics, mechanisms and functions. Prog Retin Eye Res 66:17, 2018. Fain GL, Matthews HR, Cornwall MC, Koutalos Y: Adaptation in vertebrate photoreceptors. Physiol Rev 81:117, 2001. Gill JS, Georgiou M, Kalitzeos A, Moore AT, Michaelides M: Progressive cone and cone-rod dystrophies: clinical features, molecular genetics and prospects for therapy. Br J Ophthalmol 2019 Jan 24. pii: bjophthalmol-2018-313278. http://doi.0rg/10.1136/bjophthalmol Laha B, Stafford BK, Huberman AD: Regenerating optic pathways from the eye to the brain. Science 356:1031, 2017. Luo DG, Xue T, Yau KW: How vision begins: an odyssey. Proc Natl Acad Sci U S A 105:9855, 2008. Ingram NT, Sampath AP, Fain GL: Why are rods more sensitive than cones? J Physiol 594:5415, 2016. Masland RH: The neuronal organization of the retina. Neuron 76:266, 2012. Masland RH: The tasks of amacrine cells. Vis Neurosci 29:3, 2012. Roska B, Sahel JA: Restoring vision. Nature 557:359, 2018. Sahel JA, Bennett J, Roska B: Depicting brighter possibilities for treating blindness. Sci Transl Med 2019 May 29;11(494). pii: eaax2324. http://doi.org/10.1126/scitranslmed.aax2324 Schmidt TM, Do MT, Dacey D, et al: Melanopsin-positive intrinsically photosensitive retinal ganglion cells: from form to function. J Neurosci 31:16094, 2011. Solomon SG, Lennie P: The machinery of colour vision. Nat Rev Neurosci 8:276, 2007. Vaney DI, Sivyer B, Taylor WR: Direction selectivity in the retina: symmetry and asymmetry in structure and function. Nat Rev Neurosci 13:194, 2012. Varadarajan SG, Huberman AD: Assembly and repair of eye-to-brain connections. Curr Opin Neurobiol 53:198, 2018. Vinberg F, Chen J, Kefalov VJ: Regulation of calcium homeostasis in the outer segments of rod and cone photoreceptors. Prog Retin Eye Res 67:87, 2018. Wienbar S, Schwartz GW: The dynamic receptive fields of retinal ganglion cells. Prog Retin Eye Res 67:102, 2018. Wubben TJ, Zacks DN, Besirli CG: Retinal neuroprotection: current strategies and future directions. Curr Opin Ophthalmol 30:199, 2019.
眼睛:III. 视觉的中枢神经生理学
图52-1显示了从两个视网膜到视觉皮层的主要视觉通路。视觉神经信号通过视神经离开视网膜。在视交叉处,来自视网膜鼻侧半部的视神经纤维交叉到对侧,与对侧颞侧视网膜的纤维汇合形成视束。每个视束的纤维随后在丘脑的背外侧膝状体核(dorsal lateral geniculate nucleus)中形成突触,从那里,膝状体距状纤维(geniculocalcarine fibers)通过视辐射(optic radiation)(也称为膝状体距状束(geniculocalcarine tract))传递到枕叶内侧距状裂区域的初级视觉皮层。
视觉纤维也传递到大脑的几个较古老区域:(1)从视束到下丘脑的视交叉上核(suprachiasmatic nucleus),推测是为了控制昼夜节律(circadian rhythms),使身体的各种生理变化与昼夜同步;(2)进入中脑的顶盖前核(pretectal nuclei),以引发眼睛的反射运动,聚焦于重要的物体并激活瞳孔光反射(pupillary light reflex);(3)进入上丘(superior colliculus),以控制双眼的快速定向运动;(4)进入丘脑的腹外侧膝状体核(ventral lateral geniculate nucleus)和周围的大脑基底区域,推测是为了帮助控制身体的某些行为功能。
图52-1. 从眼睛到视觉皮层的主要视觉通路。
因此,视觉通路可以大致分为一个旧系统,通向中脑和前脑基底,以及一个新系统,用于将视觉信号直接传递到位于枕叶的视觉皮层。在人类中,新系统负责感知几乎所有方面的视觉形态、颜色和其他有意识的视觉。然而,在许多原始动物中,甚至视觉形态也是由旧系统检测的,使用上丘(superior colliculus)的方式与哺乳动物使用视觉皮层的方式相同。
丘脑背外侧膝状体核的功能
新视觉系统的视神经纤维终止于背外侧膝状体核(dorsal lateral geniculate nucleus),位于丘脑的背端,也称为外侧膝状体(lateral geniculate body),如图52-1所示。背外侧膝状体核有两个主要功能。首先,它通过视辐射(optic radiation)将视觉信息从视束传递到视觉皮层。这种中继功能非常精确,从视网膜到视觉皮层,存在精确的点对点传输,具有高度的空间保真度。
在通过视交叉后,每侧视束中的一半纤维来自一只眼睛,另一半来自另一只眼睛,代表了两侧视网膜上的对应点。然而,来自两只眼睛的信号在背外侧膝状体核(dorsal lateral geniculate nucleus)中保持分离。该核由六层核组成。第II、III和V层(从腹侧到背侧)接收来自同侧视网膜外侧半部的信号,而第I、IV和VI层接收来自对侧视网膜内侧半部的信号。两只眼睛的相应视网膜区域与在配对层中相互叠加的神经元连接,并且类似的平行传输一直保持到视觉皮层。
背外侧膝状体核的第二个主要功能是“门控”信号向视觉皮层的传输——即控制允许多少信号传递到皮层。该核从两个主要来源接收门控控制信号:(1)从初级视觉皮层返回背外侧膝状体核的皮质传出纤维(corticofugal fibers);(2)中脑的网状区域(reticular areas)。这两个来源都是抑制性的,当受到刺激时,可以关闭通过背外侧膝状体核特定部分的信号传输。这两个门控电路都有助于突出允许通过的视觉信息。
最后,背外侧膝状体核以另一种方式划分:
- 第I和II层被称为大细胞层(magnocellular layers),因为它们包含大神经元。这些神经元几乎完全从M型视网膜神经节细胞(retinal ganglion cells)接收输入。这个大细胞系统提供了一个快速传导的通路到视觉皮层。然而,该系统是色盲的,仅传输黑白信息。此外,它的点对点传输较差,因为M型神经节细胞数量不多,并且它们的树突在视网膜中广泛分布。
- 第II到VI层被称为小细胞层(parvocellular layers),因为它们包含大量中小型神经元。这些神经元几乎完全从P型视网膜神经节细胞接收输入,这些细胞传输颜色并传递精确的点对点空间信息,但传导速度仅为中等,而不是高速。
视觉皮层的组织与功能
图52-2和52-3显示了视觉皮层,它主要位于枕叶的内侧面。与其他感觉系统的皮层表示一样,视觉皮层分为初级视觉皮层和次级视觉区域。
初级视觉皮层。初级视觉皮层(见图52-2)位于距状裂区域,从枕极向前延伸至每个枕叶的内侧面。该区域是来自眼睛的直接视觉信号的终点。来自视网膜黄斑区的信号终止于枕极附近,如图52-2所示,而来自更周边视网膜的信号终止于枕极前方或同心半圆处,但仍沿着枕叶内侧面的距状裂。视网膜的上部在上方表示,下部在下方表示。
请注意图中代表黄斑(macula)的大面积区域。视网膜中央凹(fovea)将信号传递到这一区域。中央凹负责最高程度的视觉敏锐度(visual acuity)。基于视网膜面积,中央凹在初级视觉皮层(primary visual cortex)中的代表区域是视网膜最外周部分的数百倍。
图52-2. 内侧枕叶皮层(medial occipital cortex)距状裂(calcarine fissure)区域的视觉皮层。
图52-3. 视觉信号从初级视觉皮层传递到枕叶和顶叶皮层(parietal cortices)外侧表面的次级视觉区域。请注意,代表形状、三维(3D)位置和运动的信号主要传递到枕叶的上部和顶叶的后部。相比之下,视觉细节和颜色的信号主要传递到枕叶的前腹侧部分和后颞叶(posterior temporal lobe)的腹侧部分。
初级视觉皮层也被称为视觉区I(visual area I)或纹状皮层(striate cortex),因为该区域具有明显的条纹状外观。
皮层的次级视觉区域。次级视觉区域,也称为视觉联合区(visual association areas),位于初级视觉皮层的外侧、前侧、上侧和下侧。大多数这些区域也向外折叠到枕叶和顶叶皮层的外侧表面,如图52-3所示。次级信号被传递到这些区域以分析视觉意义。例如,在初级视觉皮层的周围是Brodmann的18区(见图52-3),几乎所有来自初级视觉皮层的信号都会传递到这里。因此,Brodmann的18区被称为视觉区I,或简称为V-2。其他更远的次级视觉区域有特定的名称——V-3、V-4等——多达十几个区域。所有这些区域的重要性在于,视觉图像的各种方面被逐步解剖和分析。
图52-4. 初级视觉皮层的六层。图中左侧显示的连接起源于外侧膝状体核(lateral geniculate nucleus, LGN)的大细胞层(magnocellular layers),并传递快速变化的黑白视觉信号。右侧的通路起源于LGN的小细胞层(parvocellular layers)(III–VI层);它们传递描绘精确空间细节以及颜色的信号。请特别注意称为颜色斑点(color blobs)的视觉皮层区域,这些区域对于颜色的检测是必要的。
初级视觉皮层有六层主要结构
与几乎所有其他大脑皮层部分一样,初级视觉皮层(primary visual cortex)也有六个不同的层次,如图52-4所示。此外,与其他感觉系统一样,膝距纤维(geniculocalcarine fibers)主要终止于第IV层,但这一层也被细分为多个部分。来自视网膜M型神经节细胞(M retinal ganglion cells)的快速传导信号终止于第IVcα层,并从那里垂直传递,既向外传递到皮层表面,也向内传递到更深层次。
来自中等大小视神经纤维(medium-sized optic nerve fibers)的视觉信号,源自视网膜中的P型神经节细胞(P ganglion cells),也终止于第IV层,但位置与M型信号不同。它们终止于第IVa层和第IVcβi层,即第IV层的最浅和最深处,如图52-4右侧所示。从那里,这些信号垂直传递到皮层表面和更深层次。正是这些P型神经节通路传递了精确的点对点视觉以及色觉。
视觉皮层中的垂直神经元柱(Vertical Neuronal Columns in the Visual Cortex)。视觉皮层在结构上被组织成数百万个垂直的神经元细胞柱,每个柱的直径为30至50微米。同样的垂直柱状组织也存在于大脑皮层的其他感觉区域(以及运动和解析皮层区域)。每个柱代表一个功能单元。可以粗略计算,每个视觉垂直柱可能包含1000个或更多的神经元。
在视觉信号终止于第IV层后,它们沿着每个垂直柱单元向外和向内扩散时进一步被处理。据信,这种处理在通路的连续站点上解码了视觉信息的各个部分。向外传递到第I、II和III层的信号最终在皮层中横向传递短距离的信号。向内传递到第V和VI层的信号则激活了传递更远距离信号的神经元。
视觉皮层中的“色斑”(Color Blobs)。在初级视觉柱之间,以及一些次级视觉区域的柱之间,散布着一些特殊的柱状区域,称为色斑(color blobs)。它们从相邻的视觉柱接收横向信号,并特别被颜色信号激活。因此,这些色斑可能是解码颜色的主要区域。
来自两只独立眼睛的视觉信号的相互作用。回想一下,来自两只独立眼睛的视觉信号通过外侧膝状体核中的不同神经元层进行传递。当这些信号到达初级视觉皮层的第四层时,它们仍然保持分离。事实上,第四层由神经元柱的条纹交织而成,每条条纹大约0.5毫米宽;来自一只眼睛的信号进入每隔一条条纹的柱,与来自第二只眼睛的信号交替。这个皮层区域解读来自两只独立眼睛的两个视觉图像的相应区域是否“对齐”——也就是说,来自两只视网膜的对应点是否相互匹配。反过来,解读的信息用于调整独立眼睛的注视方向,使它们能够相互融合(即“对齐”)。通过观察两只眼睛图像对齐程度的信息,人们还可以通过立体视觉机制来区分物体的距离。
视觉信息分析的两条主要途径:(1)快速的“位置”和“运动”途径,以及(2)精确的颜色途径。图52-3显示,离开初级视觉皮层后,视觉信息在次级视觉区域的两条主要途径中进行分析。
- 三维位置、大体形态和物体运动的分析。其中一条分析途径,如图52-3中的黑色箭头所示,分析视觉物体在身体周围空间中的三维位置。这条途径还分析视觉场景的大体物理形态以及场景中的运动。这条途径揭示了每个物体在每个瞬间的位置以及它是否在移动。离开初级视觉皮层后,信号通常流入后中颞区,并向上进入广泛的枕顶皮层。在顶皮层的前边界,信号与来自后躯体联合区的信号重叠,这些信号分析躯体感觉信号的三维方面。在这条位置-形态-运动途径中传输的信号主要来自视网膜M神经节细胞的大M视神经纤维,传输快速信号但仅描绘黑白而没有颜色。
- 视觉细节和颜色的分析。图52-3中的红色箭头,从初级视觉皮层进入枕叶和颞叶皮层下、腹侧和内侧区域的次级视觉区域,显示了分析视觉细节的主要途径。这条途径的独立部分还专门解析颜色。因此,这条途径涉及诸如识别字母、阅读、确定表面纹理、确定物体的详细颜色以及从所有这些信息中解读物体是什么及其含义等视觉任务。
视觉图像分析期间的刺激神经元模式
视觉图像对比分析。如果一个人看着一面空白的墙,无论墙的照明是明亮还是微弱,只有初级视觉皮层(primary visual cortex)中的少数神经元会被刺激。那么,初级视觉皮层检测的是什么呢?为了回答这个问题,让我们现在在墙上放置一个大的实心十字,如图52-5左侧所示。右侧显示了视觉皮层中最兴奋的神经元的空间模式。请注意,最大兴奋的区域出现在视觉图案的尖锐边缘处。因此,初级视觉皮层中的视觉信号主要与视觉场景中的对比有关,而不是与非对比区域有关。我们在第51章中提到,大多数视网膜神经节细胞(retinal ganglion)也是如此,因为同等刺激的相邻视网膜感受器会相互抑制。然而,在视觉场景中任何从暗到亮或从亮到暗变化的边缘处,相互抑制不会发生,大多数神经元的刺激强度与对比梯度成正比——也就是说,对比越尖锐,明暗区域之间的强度差异越大,刺激程度就越大。
图52-5. 视觉皮层中响应视网膜图像中黑色十字的兴奋模式。
视觉皮层还检测线条和边缘的方向——“简单”细胞(Simple Cells)。视觉皮层不仅检测视网膜图像中不同区域的线条和边缘的存在,还检测每条线或边缘的方向——即它是垂直的、水平的,还是以某种角度倾斜的。这种能力被认为是由相互抑制的细胞的线性组织引起的,当沿着具有对比边缘的细胞线发生抑制时,这些细胞会激发二阶神经元。因此,对于每条线的这种方向,特定的神经元细胞会被刺激。以不同方向定向的线会激发不同的细胞群。这些神经元细胞被称为简单细胞。它们主要存在于初级视觉皮层的第四层(IV)。
“复杂”细胞(Complex Cells)检测线条在视野中横向或纵向移动时的方向。随着视觉信号从第四层进一步传递,一些神经元对以相同方向定向但不特定位置的线条作出反应。也就是说,即使线条在视野中横向或纵向移动了适度的距离,如果线条的方向相同,相同的少数神经元仍然会被刺激。这些细胞被称为复杂细胞。
检测特定长度、角度或其他形状的线条。初级视觉柱外层中的一些神经元,以及一些次级视觉区域中的神经元,仅由特定长度的线条或边缘、特定角度的形状或具有其他特征的图像刺激。也就是说,这些神经元从视觉场景中检测到更高层次的信息。因此,随着视觉皮层的分析路径的深入,每个视觉场景的更多特征逐渐被解码。
颜色检测
颜色的检测方式与线条的检测方式非常相似——都是通过颜色对比来实现的。例如,红色区域通常与绿色区域形成对比,蓝色区域与红色区域形成对比,或者绿色区域与黄色区域形成对比。所有这些颜色也可以与视觉场景中的白色区域形成对比。事实上,这种与白色的对比被认为是“颜色恒常性”(color constancy)现象的主要原因——即当照明光的颜色发生变化时,“白色”的颜色会随着光线的变化而变化,而大脑中的适当计算使得红色仍然被解释为红色,尽管照明光已经改变了进入眼睛的颜色。
颜色对比分析的机制依赖于被称为“对立色”(opponent colors)的对比颜色能够激发特定的神经元细胞。据推测,颜色对比的初始细节由简单细胞(simple cells)检测,而更复杂的对比则由复杂细胞(complex cells)和超复杂细胞(hypercomplex cells)检测。
移除初级视皮层的影响
移除人类的初级视皮层会导致有意识视觉的丧失——即失明。然而,心理学研究表明,这些“失明”的人有时仍然能够对光强度的变化、视觉场景中的运动,甚至偶尔对一些粗略的视觉模式做出潜意识的反应。这些反应包括转动眼睛、转动头部和回避行为。这种视觉被认为是由从视束主要传递到上丘(superior colliculi)和其他较古老视觉系统部分的神经通路所支持的。
视野;视野检查
视野是指眼睛在某一瞬间看到的视觉区域。向鼻侧看到的区域称为鼻侧视野,向颞侧看到的区域称为颞侧视野。
为了诊断视网膜特定部位的失明,可以通过一种称为视野检查(perimetry)的过程来绘制每只眼睛的视野图。这种绘图是通过让受试者用一只眼睛直视前方的中心点来完成的;另一只眼睛则闭上。然后,在视野的所有区域来回移动一个小光点或小物体,受试者会指出何时能看到或看不到光点或物体。左眼的视野图如图52-6所示。在所有视野检查图中,由于视盘(optic disc)上视网膜缺乏视杆细胞(rods)和视锥细胞(cones),会在视野中心点外侧约15度处发现一个盲点,如图所示。
视野异常
偶尔,在视盘区域以外的视野部分也会发现盲点。这些盲点称为暗点(scotomata),通常由青光眼(眼球内液体压力过高)、视网膜过敏反应或铅中毒或过度吸烟等毒性条件引起的视神经损伤所致。
图52-6. 显示左眼视野的视野检查图。红色圆圈表示盲点。
另一种可以通过视野检查诊断的疾病是视网膜色素变性(retinitis pigmentosa)。在这种疾病中,部分视网膜退化,过量的黑色素(melanin)沉积在退化区域。视网膜色素变性通常首先导致周边视野失明,然后逐渐侵犯中央区域。
眼球运动及其控制
为了充分利用眼睛的视觉能力,将眼睛引导到要观察的物体上的大脑控制系统几乎与解释来自眼睛的视觉信号同等重要。
眼球运动的肌肉控制。眼球运动由三对肌肉控制,如图52-7所示:(1) 内直肌和外直肌;(2) 上直肌和下直肌;(3) 上斜肌和下斜肌。内直肌和外直肌收缩使眼睛左右移动。上直肌和下直肌收缩使眼睛上下移动。斜肌主要功能是旋转眼球以保持视野处于直立位置。
眼球运动的神经通路。图52-7还显示了第三、第四和第六对脑神经的脑干核团及其与眼肌周围神经的连接。还显示了通过称为内侧纵束(medial longitudinal fasciculus)的神经束在脑干核团之间的相互连接。每只眼睛的三组肌肉都是相互支配的,因此一对肌肉中的一条放松时,另一条收缩。
图52-8说明了动眼装置的皮层控制,显示了从枕叶皮层视觉区域通过枕顶束(occipitotectal tract)和枕丘束(occipitocollicular tract)到脑干顶盖前区(pretectal area)和上丘(superior colliculus)区域的信号传播。从顶盖前区和上丘区域,动眼控制信号传递到动眼神经的脑干核团。强烈的信号也从脑干的平衡控制中心通过内侧纵束从前庭核(vestibular nuclei)传递到动眼系统。
眼睛的注视运动
图52-7. 右眼前视图,显示眼外肌及其神经支配。N., 神经。
也许最重要的眼球运动是那些使眼睛“注视”视野中某个特定部分的运动。注视运动由两种神经元机制控制。第一种机制称为随意注视机制(voluntary fixation mechanism),允许一个人随意移动眼睛以找到他或她想要注视的物体。第二种是不随意注视机制(involuntary fixation mechanism),一旦找到物体,它就会将眼睛牢牢地固定在物体上。
随意注视运动由位于额叶前运动皮层区域的双侧皮层区域控制,如图52-8所示。这些区域的双侧功能障碍或破坏会使一个人难以从一点注视“解锁”眼睛并将其移动到另一点。通常需要眨眼或用手遮住眼睛一段时间,然后才能移动眼睛。
相反,一旦找到注意对象,导致眼睛“锁定”在该对象上的非自主固定机制( involuntary fixation mechanism )由枕叶皮层( occipital cortex )的次级视觉区域控制,这些区域主要位于初级视觉皮层( primary visual cortex )的前方。当动物的双侧固定区域被破坏时,动物很难将眼睛保持在给定的固定点上,或者可能完全无法做到这一点。
图52-8. 控制眼睛共轭运动的神经通路。N., 神经。
图52-9. 光斑在中央凹上的运动,显示每当光斑漂移到中央凹边缘时,突然的“闪烁”眼动将光斑移回中央凹中心。虚线表示缓慢的漂移运动,实线表示突然的闪烁运动。(修改自Whitteridge D: Central control of the eye movements. In: Field J, Magoun HW, Hall VE [eds]: Handbook of Physiology, vol. 2, sec. 1. Washington, DC: American Physiological Society, 1960.)
总结来说,后部“非自主”枕叶皮层眼动区自动将眼睛“锁定”在视野中的某个点上,从而防止图像在视网膜上移动。要解除这种视觉固定,必须从位于额叶皮层的“自主”眼动区传递自主信号。
非自主锁定固定机制——上丘( superior colliculi )的作用。前一节讨论的非自主锁定型固定是由一种负反馈机制引起的,该机制防止注意对象离开视网膜的中央凹部分。眼睛通常有三种连续但几乎不可察觉的运动:(1) 由眼肌运动单位的连续收缩引起的30至80次/秒的连续震颤;(2) 眼球向一个方向或另一个方向的缓慢漂移;(3) 由非自主固定机制控制的突然闪烁运动。
当光斑固定在视网膜的中央凹区域时,震颤运动使光斑在视锥细胞上快速来回移动,而漂移运动使光斑缓慢地在视锥细胞上漂移。每当光斑漂移到中央凹边缘时,就会发生突然的反射反应,产生闪烁运动,将光斑从边缘移回中央凹中心。因此,自动反应将图像移回视觉中心点。
这些漂移和闪烁运动在图52-9中展示。虚线显示光斑在中央凹上的缓慢漂移,实线显示防止图像离开中央凹区域的闪烁运动。当上丘被破坏时,这种非自主固定能力大多会丧失。
眼睛的扫视运动(Saccadic Movement)——连续注视点的机制。当视觉场景在眼前持续移动时,比如当一个人坐在车里时,眼睛会依次注视视野中的一个又一个亮点,以每秒两到三次的速度从一个点跳到下一个点。这种跳跃被称为扫视(saccades),而运动被称为视动运动(opticokinetic movements)。扫视发生得如此迅速,以至于移动眼睛的时间不超过总时间的10%,而90%的时间被分配给注视点。此外,大脑在扫视期间抑制视觉图像,因此人们不会意识到从一个点到另一个点的运动。
阅读时的扫视运动。在阅读过程中,一个人通常会对每一行进行几次眼睛的扫视运动。在这种情况下,视觉场景并没有从眼前移动,但眼睛通过几次连续的扫视来移动,以提取重要信息。当一个人观察一幅画时,也会发生类似的扫视,只是扫视会依次向上、向侧面、向下和成角度地从画的一个亮点到另一个亮点,依此类推。
对移动物体的注视——“追随运动(Pursuit Movement)”
眼睛也可以保持对移动物体的注视,这被称为追随运动。一个高度发达的大脑皮层机制会自动检测物体的运动轨迹,然后迅速为眼睛发展出类似的运动轨迹。例如,如果一个物体以每秒几次的速度上下波动,眼睛最初可能无法注视它。然而,大约一秒钟后,眼睛开始通过扫视以与物体大致相同的波动模式跳跃。然后,再过几秒钟,眼睛逐渐发展出更平滑的运动,最终几乎完全跟随波动。这代表了追随系统在控制眼睛运动方面的高度自动潜意识计算能力。
上丘(Superior Colliculi)主要负责将眼睛和头部转向视觉干扰。
即使视觉皮层被破坏,视野侧面的突然视觉干扰通常也会导致眼睛立即转向该方向。如果上丘也被破坏,这种转向就不会发生。为了支持这一功能,视网膜的各个点在上丘中以与初级视觉皮层相同的方式进行拓扑表示,尽管准确性较低。即便如此,外周视网膜区域中闪光的主要方向由上丘映射,并将次级信号传递到动眼神经核以转动眼睛。为了帮助眼睛的这种定向运动,上丘还具有来自身体的体感(topological maps of somatic sensations)和来自耳朵的听觉信号(acoustic signals)的拓扑图。
从眼睛到负责这些快速转动运动的丘脑的视神经纤维是快速传导的M纤维的分支,其中一个分支通向视觉皮层(visual cortex),另一个分支通向上丘(superior colliculi)。除了使眼睛转向视觉干扰的方向外,信号还从上丘通过内侧纵束(medial longitudinal fasciculus)传递到脑干的其他层次,导致整个头部甚至整个身体转向干扰的方向。其他类型的非视觉干扰,如强烈的声音或甚至身体侧面的抚摸,也会引起眼睛、头部和身体的类似转向,但前提是上丘完好无损。因此,上丘在眼睛、头部和身体对外部干扰(无论是视觉、听觉还是体感)的定向中起着全局作用。
双眼视觉图像的“融合”
为了使视觉感知更有意义,两只眼睛的视觉图像通常在两只视网膜的“对应点”上相互融合。视觉皮层在融合中起着重要作用。我们之前讨论过,两只视网膜的对应点将视觉信号传递到外侧膝状体(lateral geniculate body)的不同神经元层,这些信号又被传递到视觉皮层中的平行神经元。当两个视觉图像“未对齐”时——也就是说,没有精确“融合”——这些皮层神经元之间会发生相互作用,导致特定神经元中的干扰兴奋。这种兴奋可能提供了传递到动眼装置的信号,导致眼睛的会聚、发散或旋转,从而可以重新建立融合。一旦两只视网膜的对应点对齐,视觉皮层中特定“干扰”神经元的兴奋就会消失。
判断视觉物体距离的立体视觉神经机制
因为两只眼睛相距超过2英寸,两只视网膜上的图像并不完全相同。也就是说,右眼看到物体右侧多一点,左眼看到物体左侧多一点;物体越近,差异越大。因此,即使两只眼睛相互融合,两个视觉图像中的所有对应点也不可能同时完全对齐。此外,物体离眼睛越近,对齐程度越低。这种未对齐的程度提供了立体视觉的神经机制,这是判断视觉物体距离(可达约200英尺,即61米)的重要机制。
立体视觉的神经元细胞机制基于这样一个事实:从视网膜到视觉皮层的一些纤维通路在中央通路的两侧偏离1到2度。因此,两只眼睛的一些视通路对于2米远的物体是完全对齐的;另一组通路对于25米远的物体是对齐的。因此,距离是由哪一组或几组通路因未对齐或对齐而被兴奋来确定的。这种现象被称为深度感知(depth perception),这是立体视觉的另一个名称。
斜视——眼睛缺乏融合
斜视(strabismus),也称为斜眼(squint)或对眼(cross-eye),指的是眼睛在视觉坐标(visual coordinates)中的一个或多个方向上缺乏融合:水平、垂直或旋转。斜视的基本类型如图52-10所示:(1)水平斜视(horizontal strabismus);(2)扭转斜视(torsional strabismus);(3)垂直斜视(vertical strabismus)。两种甚至所有三种不同类型的斜视组合经常发生。
斜视通常是由视觉系统的融合机制(fusion mechanism)异常“设定”引起的。也就是说,在幼儿早期试图将两只眼睛固定在同一个物体上时,其中一只眼睛能够成功固定,而另一只则无法做到,或者两只眼睛都能成功固定,但从未同时固定。很快,眼睛的共轭运动模式(conjugate movements)在神经控制通路(neuronal control pathways)中异常“设定”,导致眼睛无法融合。
被抑制眼的视觉图像抑制(Suppression of the Visual Image From a Repressed Eye)。在一些斜视患者中,眼睛会交替固定在注意的物体上。在其他患者中,一只眼睛始终被使用,而另一只眼睛则被抑制,从未用于精确视觉。被抑制眼的视力(visual acuity)发展非常有限,有时保持在20/400或更低。如果主导眼(dominant eye)随后失明,被抑制眼的视力在成人中只能略微发展,但在幼儿中则能发展得更多。这表明视力高度依赖于眼睛与中枢神经系统(central nervous system)突触连接(synaptic connections)的适当发展。事实上,即使在解剖学上,视觉皮层(visual cortex)区域中通常接收来自被抑制眼信号的神经元连接数量也会减少。
调节和瞳孔孔径的自主神经控制(AUTONOMIC CONTROL OF ACCOMMODATION AND PUPILLARY APERTURE)
眼睛的自主神经(AUTONOMIC NERVES TO THE EYES)
眼睛由副交感神经(parasympathetic)和交感神经(sympathetic)纤维共同支配,如图52-11所示。副交感神经的节前纤维(preganglionic fibers)起源于Edinger-Westphal核——第三脑神经(third cranial nerve)的内脏核部分——然后通过第三脑神经传递到睫状神经节(ciliary ganglion),该神经节位于眼睛后方。在那里,节前纤维与节后副交感神经元(postganglionic parasympathetic neurons)形成突触,后者通过睫状神经(ciliary nerves)将纤维送入眼球。这些神经兴奋以下结构:(1)控制眼睛晶状体(eye lens)聚焦的睫状肌(ciliary muscle);(2)收缩瞳孔的虹膜括约肌(sphincter of the iris)。
图52-10. 斜视的基本类型。
图52-11. 眼睛的自主神经支配,同时显示了光反射(light reflex)的反射弧(reflex arc)。N., 神经(Nerve)。
眼睛的交感神经支配(sympathetic innervation)起源于脊髓第一胸段(thoracic segment)的中间外侧角细胞(intermediolateral horn cells)。从那里,交感神经纤维进入交感链(sympathetic chain)并向上传递到颈上神经节(superior cervical ganglion),在那里它们与节后神经元(postganglionic neurons)形成突触。来自这些神经元的节后交感神经纤维(postganglionic sympathetic fibers)沿着颈动脉(carotid artery)和逐渐变小的动脉表面分布,直到到达眼睛。在那里,交感神经纤维支配虹膜(iris)的放射状纤维(radial fibers),这些纤维使瞳孔(pupil)打开,以及支配眼外肌(extraocular muscles),这些将在后面讨论Horner综合征时进一步阐述。
调节控制(ACCOMMODATION CONTROL)(眼睛聚焦)
调节机制(accommodation mechanism)——即聚焦眼睛晶状体系统(lens system)的机制——对于高水平的视觉敏锐度(visual acuity)至关重要。调节是由眼睛睫状肌(ciliary muscle)的收缩或松弛引起的。收缩会增加晶状体的屈光力(refractive power),如第50章所述,而松弛则会降低屈光力。一个人如何调整调节以保持眼睛始终聚焦?
晶状体的调节由一个负反馈机制(negative feedback mechanism)调节,该机制自动调整晶状体的屈光力以实现最高水平的视觉敏锐度。当眼睛聚焦在某个远处的物体上,然后突然需要聚焦在近处的物体上时,晶状体通常会在不到1秒的时间内调节到最佳视觉敏锐度。尽管导致这种快速而准确的眼睛聚焦的精确控制机制尚未完全理解,但已知以下特征。
首先,当眼睛突然改变注视点(fixation point)的距离时,晶状体会在几分之一秒内朝正确的方向改变其屈光力以实现新的聚焦状态。其次,不同类型的线索帮助晶状体朝正确的方向改变屈光力,如下所述:
- 色差似乎很重要。也就是说,红光比蓝光稍微聚焦在更靠后的位置,因为晶状体对蓝光的折射比对红光的折射更强。眼睛似乎能够检测到这两种光线中哪一种聚焦得更好,这一线索将信息传递给调节机制,以决定是增强还是减弱晶状体的屈光力。
- 当眼睛注视近处物体时,眼睛必须会聚。会聚的神经机制会同时发出信号以增强眼睛的晶状体屈光力。
- 由于中央凹位于一个比视网膜其余部分稍深的凹陷中,中央凹深部的聚焦清晰度与边缘的聚焦清晰度不同。这种差异也可能为晶状体屈光力需要改变的方向提供线索。
- 晶状体的调节程度始终以每秒最多两次的频率轻微振荡。当晶状体屈光力的变化方向适当时,视觉图像会变得更清晰;而当晶状体屈光力的变化方向错误时,视觉图像会变得更模糊。这可以快速提示晶状体屈光力需要如何改变以实现适当的聚焦。控制调节的大脑皮层区域与控制眼睛注视运动的区域密切相关。视觉信号在Brodmann皮层18区和19区的分析以及运动信号向睫状肌的传递通过脑干的顶盖前区进行,然后经过Edinger-Westphal核,最后通过副交感神经纤维到达眼睛。
瞳孔直径的控制
副交感神经的刺激也会兴奋瞳孔括约肌,从而减小瞳孔孔径;这一过程称为瞳孔缩小(miosis)。相反,交感神经的刺激会兴奋虹膜的放射状纤维并导致瞳孔扩大,称为瞳孔散大(mydriasis)。
瞳孔对光反射。当光线照射到眼睛时,瞳孔会收缩,这种反应称为瞳孔对光反射。该反射的神经元通路如图52-11中的上方两个黑色箭头所示。当光线照射到视网膜时,部分产生的冲动从视神经传递到顶盖前核。从这里,次级冲动传递到Edinger-Westphal核,最后通过副交感神经返回以收缩虹膜括约肌。相反,在黑暗中,反射被抑制,导致瞳孔扩大。
对光反射的功能是帮助眼睛极快地适应变化的光线条件,如第51章所述。瞳孔直径的极限在小侧约为1.5毫米,在大侧约为8毫米。因此,由于视网膜上的光亮度与瞳孔直径的平方成正比,瞳孔反射所能实现的光暗适应范围约为30比1——即进入眼睛的光量最多可变化30倍。
中枢神经系统疾病中的瞳孔反射或反应
一些中枢神经系统疾病会损害从视网膜到Edinger-Westphal核的视觉信号神经传递,从而有时会阻断瞳孔反射。这种阻断可能由中枢神经系统梅毒、酒精中毒和脑炎等疾病引起。阻断通常发生在脑干的顶盖前区,尽管它也可能由视神经中一些小纤维的破坏引起。
通过顶盖前区到Edinger-Westphal核的通路中的最终神经纤维大多是抑制性的。当它们的抑制作用丧失时,核会持续活跃,导致瞳孔大部分时间保持收缩状态,并且对光没有反应。
然而,如果通过其他途径刺激Edinger-Westphal核,瞳孔可以稍微进一步收缩。例如,当眼睛注视近处物体时,导致晶状体调节的信号以及导致双眼会聚的信号同时会引起轻微的瞳孔收缩。这种现象称为调节性瞳孔反应。一个对光没有反应但对调节有反应并且非常小的瞳孔(Argyll Robertson瞳孔)是中枢神经系统疾病(如梅毒)的重要诊断标志。
Horner综合征
眼部的交感神经偶尔会被中断。中断通常发生在颈交感神经链中,这会导致称为Horner综合征的临床状况。该综合征包括以下效应:
- 由于瞳孔扩张肌的交感神经纤维中断,瞳孔持续收缩,直径小于对侧眼睛的瞳孔。
- 上眼睑下垂,因为它在清醒时通常通过嵌入上眼睑并由交感神经支配的平滑肌纤维的收缩保持在开放位置。因此,交感神经的破坏使得无法像正常情况下那样完全打开上眼睑。
- 面部和头部相应侧的血管持续扩张。
- 受Horner综合征影响的面部和头部一侧无法出汗(这需要交感神经信号)。
参考文献
Baird-Gunning JJD, Lueck CJ: Central control of eye movements. Curr Opin Neurol 31:90, 2018. Connor CE, Knierim JJ: Integration of objects and space in perception and memory. Nat Neurosci 20:1493, 2017. Crair MC, Mason CA: Reconnecting eye to brain. J Neurosci 36:10707, 2016. Cullen KE, Taube JS: Our sense of direction: progress, controversies and challenges. Nat Neurosci 20:1465, 2017. Handa T, Mikami A: Neuronal correlates of motion-defined shape perception in primate dorsal and ventral streams. Eur J Neurosci 48:3171, 2018. Harris KD, Mrsic-Flogel TD: Cortical connectivity and sensory coding. Nature 503:51, 2013. Hastings MH, Maywood ES, Brancaccio M: Generation of circadian rhythms in the suprachiasmatic nucleus. Nat Rev Neurosci 19:453, 2018. Hikosaka O, Kim HF, Amita H, et al: Direct and indirect pathways for choosing objects and actions. Eur J Neurosci 49:637, 2019. Khan AG, Hofer SB: Contextual signals in visual cortex. Curr Opin Neurobiol 52:131, 2018.
Kornblith S, Tsao DY: 思维如何从视觉中产生:颞下回和前额叶对视觉的贡献。Curr Opin Neurobiol 46:208, 2017. Martinez-Conde S, Otero-Millan J, Macknik SL: 微眼跳对视觉的影响:迈向眼跳功能的统一理论。Nat Rev Neurosci 14:83, 2013. Parker AJ: 双眼深度感知与大脑皮层。Nat Rev Neurosci 8:379, 2007. Stafford BK, Huberman AD: 丘脑中的信号整合:标记线交叉和模糊。Neuron 93:717, 2017. Varadarajan SG, Huberman AD: 眼到脑连接的组装和修复。Curr Opin Neurobiol 53:198, 2018.
听觉
本章描述了耳朵接收声波、区分其频率并将听觉信息传递到中枢神经系统(central nervous system)的机制,在中枢神经系统中,这些信息的含义被解读。
鼓膜和听骨系统
声音从鼓膜传导到耳蜗
图53-1显示了鼓膜(通常称为耳膜)和听骨,它们将声音从鼓膜通过中耳传导到耳蜗(内耳)。鼓膜上附着有锤骨的柄。锤骨通过微小的韧带与砧骨相连,因此每当锤骨移动时,砧骨也会随之移动。砧骨的另一端与镫骨的茎部关节相连,镫骨的底板位于卵圆窗开口处的耳蜗膜迷路上。
锤骨柄的尖端附着在鼓膜的中心,这个附着点不断被鼓膜张肌(tensor tympani muscle)拉紧,从而使鼓膜保持紧张状态。这种张力使得鼓膜任何部分的声波振动都能传递到听骨,如果鼓膜松弛,这种情况就不会发生。
中耳的听骨通过韧带悬挂,使得锤骨和砧骨组合起来像一个单一的杠杆,其支点大约位于鼓膜的边缘。
砧骨与镫骨的关节使得镫骨在每次鼓膜向内移动时(1)向前推动卵圆窗和窗另一侧的耳蜗液体;并在每次锤骨向外移动时(2)向后拉动液体。
图53-1. 外耳、鼓膜以及中耳和内耳的听骨系统。
听骨链系统的“阻抗匹配(impedance matching)”。每次声波振动时,镫骨足板的运动幅度仅为锤骨柄的四分之三。因此,听骨链杠杆系统并不会像通常认为的那样增加镫骨的运动距离。相反,该系统实际上减少了运动距离,但将运动力增加了约1.3倍。此外,鼓膜的表面积约为55平方毫米,而镫骨的平均表面积为3.2平方毫米。这种17倍的面积差异乘以杠杆系统的1.3倍比率,导致施加在耳蜗液体上的总力约为声波施加在鼓膜上的22倍。由于液体的惯性远大于空气,因此需要更大的力来引起液体的振动。因此,鼓膜和听骨链系统提供了空气中声波与耳蜗液体中声振动之间的阻抗匹配。对于300到3000周/秒的声频,阻抗匹配约为完美匹配的50%到75%,这使得传入声波的大部分能量得以利用。
在没有听骨链和鼓膜的情况下,声波仍可以直接通过中耳空气传播并进入耳蜗的卵圆窗。然而,此时的听力敏感度比听骨链传导低15到20分贝——相当于从中等音量降低到几乎难以察觉的音量。
鼓膜张肌(stapedius muscle)和镫骨肌(tensor tympani muscle)收缩对声音的衰减。当响亮的声音通过听骨链系统传入中枢神经系统时,经过40到80毫秒的潜伏期后会发生反射,导致镫骨肌收缩,并在较小程度上引起鼓膜张肌收缩。鼓膜张肌将锤骨柄向内拉,而镫骨肌将镫骨向外拉。这两种力相互对抗,从而使整个听骨链系统变得更加僵硬,从而大大减少了低频声音的听骨链传导,主要是低于1000周/秒的频率。
这种衰减反射可以将低频声音传输的强度降低30到40分贝,这大约相当于响亮声音和耳语之间的差异。这种机制的功能被认为是双重的——保护耳蜗免受过大声音引起的破坏性振动的影响,并在嘈杂环境中掩盖低频声音。掩盖通常消除了背景噪音的主要部分,使人能够专注于1000周/秒以上的声音,其中大部分语音通信的相关信息都在此范围内传输。
鼓膜张肌和镫骨肌的另一个功能是降低一个人对自己语音的听力敏感度。这种效应是通过同时传输到这些肌肉的侧支神经信号激活的,同时大脑激活语音机制。
通过骨传导的声音传输
由于内耳,即耳蜗(cochlea),嵌入颞骨(temporal bone)中的一个骨性腔室,称为骨迷路(bony labyrinth),整个颅骨的振动可以引起耳蜗内的液体振动。因此,在适当的条件下,将音叉或电子振动器放置在颅骨的任何骨性突起上,尤其是靠近耳朵的乳突(mastoid process)上,可以使人听到声音。然而,即使空气中的响亮声音所携带的能量也不足以通过骨传导(bone conduction)引起听觉,除非在骨头上应用特殊的电声放大装置。
耳蜗
耳蜗的功能解剖
耳蜗是一个盘绕的管道系统,如图53-1和图53-2的横截面所示。它由三个并排盘绕的管道组成:(1) 前庭阶(scala vestibuli);(2) 中阶(scala media);(3) 鼓阶(scala tympani)。前庭阶和中阶由Reissner膜(也称为前庭膜,vestibular membrane)分隔,如图53-2B所示;鼓阶和中阶由基底膜(basilar membrane)分隔。在基底膜的表面是Corti器(organ of Corti),它包含一系列对电机械敏感的细胞,即毛细胞(hair cells)。它们是感受性终末器官,能够响应声音振动产生神经冲动。
图53-3展示了耳蜗展开后的功能部分,用于传导声音振动。首先,注意Reissner膜在此图中未显示。这层膜非常薄且易于移动,因此不会阻碍声音振动从前庭阶传递到中阶。因此,就声音的液体传导而言,前庭阶和中阶被视为一个单一的腔室。正如后面所讨论的,Reissner膜维持中阶内的一种特殊液体,这种液体是声音感受性毛细胞正常功能所必需的。
声音振动通过镫骨(stapes)的底板(faceplate)从卵圆窗(oval window)进入前庭阶。底板覆盖了这个窗口,并通过松散的环状韧带(annular ligament)与窗口边缘连接,使其能够随着声音振动向内和向外移动。向内移动导致液体在前庭阶和中阶中向前移动,而向外移动则导致液体向后移动。
图53-2. 耳蜗(A)和耳蜗一圈的横截面(B)。
图53-3. 镫骨向前推动后耳蜗内液体的运动。
基底膜与耳蜗中的共振
基底膜(basilar membrane)是一种纤维膜,它将中阶(scala media)与鼓阶(scala tympani)分隔开。基底膜包含20,000至30,000根基底纤维,这些纤维从耳蜗的骨性中心——蜗轴(modiolus)向外壁延伸。这些纤维是坚硬、有弹性的芦苇状结构,它们的基部固定在耳蜗的中央骨性结构(蜗轴)中,但远端没有固定,除了远端嵌入松散的基底膜中。由于这些纤维在一端是坚硬的且自由的,它们可以像口琴的簧片一样振动。
基底纤维的长度从卵圆窗(oval window)开始逐渐增加,从耳蜗的基部到顶端,长度从靠近卵圆窗和圆窗(round window)的约0.04毫米增加到耳蜗顶端(“蜗孔”(helicotrema))的0.5毫米,长度增加了12倍。
然而,纤维的直径从卵圆窗到蜗孔逐渐减小,因此它们的整体刚度减少了100多倍。因此,靠近耳蜗卵圆窗的坚硬、短纤维在非常高的频率下振动最佳,而靠近耳蜗顶端的长而柔软的纤维在低频下振动最佳。
因此,基底膜的高频共振发生在基部附近,声波通过卵圆窗进入耳蜗。然而,低频共振发生在蜗孔附近,主要是由于纤维的刚度较低,但也因为必须沿着耳蜗小管振动的额外液体质量的增加“负载”。
耳蜗中声波的传输——“行波”(Traveling Wave)
当镫骨(stapes)的足板向内移动并压向卵圆窗时,圆窗必须向外凸出,因为耳蜗的四周都被骨壁包围。声波从卵圆窗进入的初始效应是使耳蜗基部的基底膜向圆窗方向弯曲。然而,当基底纤维向圆窗弯曲时,弹性张力在基底纤维中积累,引发了一个沿着基底膜向蜗孔“行进”的液体波。图53-4A显示了高频波沿基底膜向下移动,图53-4B显示了中频波,图53-4C显示了非常低频的波。波沿基底膜的运动类似于压力波沿动脉壁的运动,这在第15章中讨论过;它也类似于沿池塘表面传播的波。
不同频率声波的基底膜振动模式。请注意图53-4中不同频率声波的不同传输模式。每个波在开始时相对较弱,但当它到达基底膜的自然共振频率与相应声频相等的部分时变得强烈。在这一点上,基底膜可以轻松地来回振动,以至于波中的能量被耗散。因此,波在这一点上消失,无法继续沿基底膜传播剩余的距离。
图53-4. 沿基底膜的“行波”分别对应高(A)、中(B)和低频(C)声波
因此,高频声波沿着基底膜(basilar membrane)传播很短的距离后就会到达其共振点并消失,中频声波传播到大约一半的距离后消失,而极低频声波则会沿着基底膜传播整个距离。
行波的另一个特征是,它在基底膜的初始部分传播得很快,但随着进入耳蜗(cochlea)越深,传播速度逐渐减慢。造成这种差异的原因是靠近卵圆窗(oval window)的基底纤维具有较高的弹性系数(coefficient of elasticity),而沿着基底膜越远,弹性系数逐渐降低。波的这种快速初始传播使得高频声音能够传播到耳蜗足够远的地方,从而在基底膜上分散开来并相互分离。如果没有这种快速的初始传播,所有高频波都会聚集在基底膜的前1毫米左右,它们的频率将无法被区分。
基底膜的振动幅度模式。图53-5A中的虚线显示了当镫骨(stapes)处于以下位置时,声波在基底膜上的位置:(a)完全向内,(b)回到中性点,(c)完全向外,以及(d)再次回到中性点但正在向内移动。这些不同波周围的阴影区域显示了在一个完整的振动周期内基底膜的振动范围。这是该特定声频下基底膜的振动幅度模式。
图53-5B显示了不同频率的振动幅度模式,表明8000次/秒的声音的最大振幅出现在耳蜗基部附近,而低于200次/秒的频率的最大振幅则出现在靠近蜗孔(helicotrema)的基底膜尖端,蜗孔是鼓阶(scala tympani)和前庭阶(scala vestibuli)之间的小开口(图53-2)。
图53-5。A,中频声波下基底膜的振动幅度模式(a-d)。B,频率在200至8000次/秒之间的声音的振动幅度模式,显示了不同频率下基底膜上的最大振幅点。
区分声音频率的主要方法是基于位于基底膜上的柯蒂氏器(organ of Corti)的神经纤维的最大刺激“位置”,如下一节所述。
柯蒂氏器的功能
Corti器(organ of Corti),如图53-2和图53-6所示,是响应基底膜(basilar membrane)振动产生神经冲动的感受器(receptor organ)。注意Corti器位于基底纤维(basilar fibers)和基底膜(basilar membrane)的表面。Corti器中实际的感觉感受器(sensory receptors)是两种特殊类型的神经细胞,称为毛细胞(hair cells)——单排的内毛细胞(internal hair cells),数量约为3500个,直径约12微米,以及三到四排的外毛细胞(external hair cells),数量约为12000个,直径仅约8微米。毛细胞的基底和侧面与耳蜗神经(cochlear nerve)末梢网络形成突触(synapse)。这些末梢中有90%到95%终止于内毛细胞,强调了它们在声音检测中的特殊重要性。
由毛细胞刺激的神经纤维通向位于耳蜗(cochlea)蜗轴(modiolus)中的Corti螺旋神经节(spiral ganglion)。螺旋神经节神经元细胞发出轴突(axons)——总共约30000根——进入耳蜗神经,然后进入延髓上部(upper medulla)的中枢神经系统(central nervous system)。Corti器与螺旋神经节和耳蜗神经的关系如图53-2所示。
图53-6. Corti器,特别显示了毛细胞和压在突出毛上的盖膜(tectorial membrane)。
毛细胞的兴奋。注意在图53-6中,微小的毛(stereocilia)从毛细胞向上突出,要么接触要么嵌入位于中阶(scala media)中毛细胞上方的盖膜表面凝胶涂层中。这些毛细胞与前庭器官(vestibular apparatus)中的斑(macula)和壶腹嵴(cristae ampullaris)中的毛细胞相似,将在第56章讨论。毛向一个方向弯曲会使毛细胞去极化(depolarize),而向相反方向弯曲则会使它们超极化(hyperpolarize)。这反过来又兴奋了与它们基底形成突触的听觉神经纤维(auditory nerve fibers)。
图53-7A显示了基底膜振动如何兴奋毛细胞末端的机制。毛细胞的外端固定在一个由平板组成的刚性结构中,称为网状板(reticular lamina),由Corti杆(rods of Corti)支撑,Corti杆紧密附着在基底纤维上。基底纤维、Corti杆和网状板作为一个刚性单元移动。
基底纤维的向上运动使网状板向上并向蜗轴方向倾斜。然后,当基底膜向下移动时,网状板向下并向外倾斜。这种内外运动导致毛细胞上的毛在盖膜上来回剪切。因此,每当基底膜振动时,毛细胞就会被兴奋。
听觉信号主要由内毛细胞(inner hair cells)传递。尽管外毛细胞(outer hair cells)的数量是内毛细胞的3到4倍,但约90%的听觉神经纤维是由内毛细胞而非外毛细胞刺激的。然而,如果外毛细胞受损而内毛细胞功能完好,仍会发生严重的听力损失。因此,有人提出外毛细胞以某种方式控制内毛细胞在不同音高下的敏感性,这种现象称为感受器系统的"调谐"(tuning)。支持这一观点的是,大量逆行神经纤维从脑干延伸到外毛细胞附近。刺激这些神经纤维实际上会导致外毛细胞缩短,并可能改变其硬度。这些效应表明,通过外毛细胞激活的逆行神经机制控制着耳朵对不同音高的敏感性。
图53-7. A, 毛细胞通过伸入覆膜凝胶层的纤毛来回运动而被刺激。B, 毛细胞将机械能转换为神经信号。当静纤毛向较长的一侧弯曲时,K^+通道打开,导致去极化(depolarization),进而打开电压门控C a^2+通道。C a^2+的内流增强了去极化并引发兴奋性递质谷氨酸(glutamate)的释放,使感觉神经去极化。
毛细胞感受器电位和听觉神经纤维的兴奋。静纤毛(stereocilia)(即从毛细胞末端突出的"纤毛")是刚性结构,因为每个静纤毛都有坚固的蛋白质框架。每个毛细胞在其顶端边缘约有100根静纤毛。这些静纤毛在远离蜗轴(modiolus)的一侧逐渐变长。较短静纤毛的顶端通过细丝附着在相邻较长静纤毛的背面。因此,每当纤毛向较长的一侧弯曲时,较小静纤毛的尖端就会从毛细胞表面向外拉出。这导致机械转导(mechanical transduction),打开200到300个阳离子传导通道,使带正电的钾离子从周围的中阶(scala media)液体快速进入静纤毛,导致毛细胞膜去极化(见图53-7B)。去极化打开电压敏感的钙通道,导致钙离子内流,从而增强去极化。毛细胞的复极化(repolarization)主要通过钙离子敏感的钾通道排出钾离子来实现。
因此,当基底纤维向前庭阶(scala vestibuli)弯曲时,毛细胞去极化,而在相反方向则超极化(hyperpolarize),从而产生交替的毛细胞感受器电位,进而刺激与毛细胞基部形成突触的耳蜗神经末梢。据信,在去极化过程中,毛细胞在这些突触处释放快速作用的神经递质谷氨酸。
内淋巴电位(Endocochlear Potential)
为了更全面地解释毛细胞产生的电位,我们需要解释另一种称为内淋巴电位的电现象。中阶(scala media)充满了一种称为内淋巴(endolymph)的液体,与前庭阶(scala vestibuli)和鼓阶(scala tympani)中的外淋巴(perilymph)形成对比。前庭阶和鼓阶直接与大脑周围的蛛网膜下腔(subarachnoid space)相通,因此外淋巴几乎与脑脊液(cerebrospinal fluid)相同。相反,充满中阶的内淋巴是由中阶外壁上的血管纹(stria vascularis)分泌的一种完全不同的液体。内淋巴含有高浓度的钾和低浓度的钠,这与外淋巴的成分正好相反。
内淋巴和外淋巴之间始终存在约+80毫伏的电位差,中阶内部为正,外部为负。这被称为内淋巴电位,它是由血管纹不断向中阶分泌正钾离子产生的。
内淋巴电位的重要性在于,毛细胞的顶部通过网状板(reticular lamina)突出,并被中阶的内淋巴浸泡,而外淋巴则浸泡毛细胞的下部。此外,毛细胞的细胞内电位相对于外淋巴为^-70毫伏,但在其上部表面,即毛细胞通过网状板突出并进入内淋巴的部分,相对于内淋巴为−150毫伏。据信,这种在静纤毛(stereocilia)尖端的高电位使细胞更加敏感,从而增强了其对最轻微声音的响应能力。
声音频率的确定——“位置”原则(Place Principle)
从本章前面的讨论中可以明显看出,低频声音会引起耳蜗顶端附近的基底膜(basilar membrane)最大程度的激活,而高频声音则会激活耳蜗基部附近的基底膜。中频声音则会在两个极端之间的中间位置激活基底膜。此外,从耳蜗到大脑皮层的整个听觉通路中,神经纤维具有空间组织性。在脑干的听觉束(auditory tracts)和大脑皮层的听觉感受区(auditory receptive fields)中记录信号表明,特定的大脑神经元会被特定的声音频率激活。因此,神经系统用来检测不同声音频率的主要方法是确定基底膜上被刺激最多的位置,这被称为确定声音频率的“位置”原则。
再次参考图53-5,可以看到位于helicotrema处的基底膜(distal end)受到所有低于200赫兹的声音频率的刺激。因此,从位置原理(place principle)的角度来看,很难理解如何区分200赫兹到20赫兹范围内的低频声音。这些低频声音被认为主要通过所谓的"齐射原理"(volley principle)或频率原理(frequency principle)来区分。也就是说,20到1500至2000赫兹的低频声音可以引起神经冲动的齐射,这些齐射以相同的频率同步,并通过耳蜗神经(cochlear nerve)传递到大脑的耳蜗核(cochlear nuclei)。进一步认为,耳蜗核可以区分这些齐射的不同频率。事实上,破坏耳蜗的整个顶端部分(这会破坏通常检测所有低频声音的基底膜)并不会完全消除对低频声音的区分能力。
响度的确定
听觉系统至少通过三种方式确定响度(loudness)。
首先,随着声音变大,基底膜(basilar membrane)和毛细胞(hair cells)的振动幅度也会增加,从而使毛细胞以更快的速率刺激神经末梢。
其次,随着振动幅度的增加,基底膜共振部分边缘的越来越多的毛细胞受到刺激,从而导致冲动的空间总和(spatial summation)——即通过许多神经纤维而不是仅通过少数神经纤维传递。
第三,外毛细胞(outer hair cells)在基底膜振动达到高强度之前不会显著受到刺激,而这些细胞的刺激可能向神经系统传达声音很大的信息。
响度变化的检测——幂定律
正如第47章所指出的,人们对感觉刺激强度变化的解释大致与实际强度的反幂函数成比例。在声音的情况下,解释的感觉变化大致与实际声音强度的立方根成比例。换一种方式表达这个概念,耳朵可以区分从最轻柔的耳语到最大可能的噪音的声音强度差异,这代表了声音能量大约增加了1万亿倍或基底膜运动幅度增加了100万倍。然而,耳朵将这种声音水平的差异解释为大约10,000倍的变化。因此,听觉系统的声音感知机制极大地“压缩”了强度尺度,这使得人们能够解释比没有强度尺度压缩时更广泛的声音强度差异。
分贝单位
由于耳朵可以检测和区分声音强度的极端变化,声音强度通常以其实际强度的对数表示。声音能量增加10倍称为1贝尔(bel),0.1贝尔称为1分贝(decibel)。1分贝代表声音能量实际增加了1.26倍。
使用分贝系统表达响度变化的另一个原因是,在通常的通信声音强度范围内,耳朵几乎无法区分大约1分贝的声音强度变化。
不同频率声音的听觉阈值。图53-8显示了耳朵在不同频率声音下能够勉强听到的压力阈值。该图表明,3000赫兹的声音即使其强度低至1达因/平方厘米声压级以下70分贝(即每平方厘米百万分之一微瓦)也能被听到。相反,100赫兹的声音只有在强度是上述值的10,000倍时才能被检测到。
听觉的频率范围。年轻人能够听到的声音频率范围在20到20,000赫兹之间。然而,再次参考图53-8,我们可以看到声音范围在很大程度上取决于响度。如果响度低于1达因/平方厘米声压级60分贝,声音范围为500到5000赫兹;只有在声音强度较高时,才能达到20到20,000赫兹的完整范围。在老年时,这一频率范围通常会缩短到50到8,000赫兹或更低,如本章后面所述。
图53-8. 听觉阈值和体感感知(刺痛和触觉阈值)与每个声音频率的声能水平的关系。
中枢听觉机制
听觉神经通路
图53-9显示了主要的听觉通路。来自Corti螺旋神经节的神经纤维进入位于延髓上部的背侧和腹侧耳蜗核。在此处,所有纤维都形成突触,第二级神经元主要传递到脑干的对侧,终止于上橄榄核。少数第二级纤维也传递到同侧的上橄榄核。
从上橄榄核,听觉通路通过外侧丘系向上传递。部分纤维终止于外侧丘系核,但许多纤维绕过该核并继续传递到下丘,几乎所有听觉纤维在此形成突触。从那里,通路传递到内侧膝状体核,所有纤维在此形成突触。最后,通路通过听觉辐射传递到主要位于颞叶上回的听觉皮层。
有几个重要点需要注意。首先,来自双耳的信号通过脑干两侧的通路传递,主要在对侧通路中传递。在脑干中至少有三个地方发生两侧通路之间的交叉:(1) 在斜方体;(2) 在外侧丘系核之间的连合;(3) 在连接两侧下丘的连合。
其次,许多来自听觉通路的侧支纤维直接进入脑干的网状激活系统。该系统在脑干中向上和向下扩散投射到脊髓,并在响应大声时激活整个神经系统。其他侧支纤维传递到小脑蚓部,在突然噪音时也会立即激活。
图53-9. 听觉神经通路。N., 神经。
第三,从耳蜗到皮层的纤维束中保持了高度的空间定向。事实上,在耳蜗核中,不同声音频率的终止有三种空间模式,在下丘中有两种模式,在听觉皮层中有一个精确的离散声音频率模式,以及在听觉皮层和听觉联合区中至少还有五种不太精确的模式。
听觉通路不同水平的放电频率
从听神经进入耳蜗核的单个神经纤维的放电频率可以达到至少1000次/秒,其频率主要由声音的响度决定。在声音频率达到2000到4000周期/秒时,听神经冲动通常与声波同步,但它们不一定与每个波都同步。
在脑干的听觉束中,放电通常不再与声音频率同步,除非声音频率低于200周期/秒。在下丘以上水平,甚至这种同步也主要消失了。这些发现表明,声音信号并不是直接从耳朵传递到大脑的更高层次而不发生变化;相反,从声音信号中提取的信息从耳蜗核这样的低层次就开始从冲动流中被解析出来。我们将在后面更多地讨论这个话题,特别是与声音来源方向的感知有关的内容。
大脑皮层在听觉中的功能
听觉信号向大脑皮层的投射区域如图53-10所示,该图显示听觉皮层主要位于颞上回的颞上平面,但也延伸到颞叶的外侧,覆盖了大部分岛叶皮层,甚至延伸到顶叶盖的外侧部分。
图53-10中显示了两个独立的分区——初级听觉皮层和听觉联合皮层(也称为次级听觉皮层)。初级听觉皮层直接由内侧膝状体的投射兴奋,而听觉联合区则由初级听觉皮层的冲动以及来自内侧膝状体邻近的丘脑联合区的一些投射二次兴奋。
初级听觉皮层中的声音频率感知
在初级听觉皮层和听觉联合区中至少描述了六种音调拓扑图。在每种图中,高频声音在图的一端兴奋神经元,而低频声音在图的另一端兴奋神经元。在大多数图中,低频声音位于前部,如图53-10所示,而高频声音位于后部。这种设置并不适用于所有图。
为什么听觉皮层( auditory cortex )有这么多不同的音调拓扑图( tonotopic maps )?答案可能是,每个独立的区域都解析出声音的某些特定特征。例如,初级听觉皮层( primary auditory cortex )中的一个大型音调拓扑图几乎肯定能区分声音频率,并给人以音高的心理感觉。另一个音调拓扑图可能用于检测声音的来源方向。其他听觉皮层区域检测特殊的声音特性,如声音的突然开始,或特殊的调制,如噪声与纯频率声音的对比。
图53-10. 听觉皮层。
听觉皮层中每个神经元响应的频率范围比耳蜗( cochlea )和脑干( brain stem )中继核( relay nuclei )要窄得多。参考图53-5B,注意耳蜗基底附近的基底膜( basilar membrane )对所有频率的声音都有反应,而在耳蜗核( cochlear nuclei )中,也发现了同样的声音广度表示。然而,当兴奋到达大脑皮层( cerebral cortex )时,大多数对声音有反应的神经元只对窄范围的频率有反应,而不是对宽范围的频率。因此,在通路的某个地方,处理机制“锐化”了频率响应。这种锐化效应被认为主要是由侧向抑制( lateral inhibition )引起的,这在第47章中讨论了与神经信息传递机制相关的内容。也就是说,耳蜗在某一频率的刺激会抑制该主频率两侧的声音频率;这种抑制是由从主信号通路分支出来的侧支纤维( collateral fibers )对相邻通路施加抑制性影响引起的。同样的效应在锐化体感图像( somesthetic images )、视觉图像( visual images )和其他类型的感觉模式中也很重要。
听觉皮层中的许多神经元,特别是在听觉联合皮层( auditory association cortex )中,不仅仅对耳朵中的特定声音频率有反应。据信,这些神经元将不同的声音频率相互“关联”,或将声音信息与来自皮层其他感觉区域的信息关联起来。
事实上,听觉联合皮层的顶叶部分( parietal portion )部分重叠于体感区II( somatosensory area II ),这可能为听觉信息与体感信息的关联提供了机会。
听觉皮层对声音“模式”的区分。完全双侧切除听觉皮层并不会阻止猫或猴子检测声音或以粗略的方式对声音作出反应。然而,这确实大大降低甚至有时完全消除了动物区分不同音高,特别是声音模式的能力。例如,一只经过训练以识别特定模式中一个接一个的音调组合或序列的动物,在听觉皮层被破坏后失去了这种能力;此外,动物无法重新学习这种类型的反应。因此,听觉皮层在区分音调和序列声音模式方面尤为重要。
人类双侧初级听觉皮层(primary auditory cortex)的破坏会显著降低个体的听觉敏感性。仅破坏一侧的初级听觉皮层只会轻微降低对侧耳朵的听力;由于听觉神经通路中存在许多交叉连接,它不会导致该侧耳朵的耳聋。然而,它确实会影响个体定位声源的能力,因为声音定位需要双侧皮层的比较信号。
影响听觉联合区(auditory association areas)但不影响初级听觉皮层的病变不会降低个体听力和区分音调的能力,甚至不会影响对至少简单声音模式的解释。然而,个体通常无法解释所听到声音的含义。例如,颞上回(superior temporal gyrus)后部的病变(称为Wernicke区,是听觉联合皮层的一部分)通常会使个体无法解释词语的含义,尽管他们能很好地听到这些词语,甚至能重复它们。听觉联合区的这些功能及其与大脑整体智力功能的关系将在第58章讨论。
声源方向的确定
个体通过两种主要方式确定声音的水平方向来源:(1) 声音进入一只耳朵和进入对侧耳朵之间的时间差;(2) 两耳声音强度的差异。
第一种机制在频率低于3000周/秒时效果最佳,而第二种机制在较高频率时效果最佳,因为在这些频率下,头部是一个更大的声音屏障。时间差机制比强度机制更能精确地辨别方向,因为它不依赖于外部因素,而仅依赖于两个声学信号之间的确切时间间隔。如果个体直视声源,声音会同时到达双耳,而如果右耳比左耳更接近声源,右耳的声信号会比左耳的声信号更早进入大脑。
这两种机制无法判断声音是来自个体的前方还是后方,或者来自上方还是下方。这种辨别主要通过耳廓(pinna)(可见的外部部分)实现,耳廓起到漏斗的作用,将声音引导到双耳。耳廓的形状会根据声音的来源方向改变进入耳朵的声音质量。它通过强调来自不同方向的特定声音频率来改变声音质量。
检测声源方向的神经机制
双侧大脑听觉皮层的破坏会导致几乎完全丧失检测声源方向的能力。然而,这种检测过程的神经分析始于脑干的上橄榄核(superior olivary nuclei),尽管从这些核团到皮层的整个神经通路都需要解释这些信号。据信其机制如下。
上橄榄核(superior olivary nucleus)分为两部分:(1)内侧上橄榄核(medial superior olivary nucleus);(2)外侧上橄榄核(lateral superior olivary nucleus)。外侧核负责检测声音的来源方向,可能是通过简单地比较到达两耳的声音强度差异,并向听觉皮层(auditory cortex)发送适当的信号来估计方向。
然而,内侧上橄榄核具有一种特定的机制,用于检测进入两耳的声学信号之间的时间差。该核包含大量具有两个主要树突(dendrite)的神经元(neuron),一个投射到右侧,另一个投射到左侧。来自右耳的声学信号作用于右侧树突,而来自左耳的声学信号作用于左侧树突。每个神经元的兴奋强度对来自两耳的声学信号之间的特定时间差高度敏感。靠近核一侧边界的神经元对短时间差反应最大,而靠近另一侧边界的神经元对长时间差反应最大;位于中间的神经元则对中等时间差反应。
因此,内侧上橄榄核中形成了神经元刺激的空间模式,来自头部正前方的声音最大程度地刺激一组橄榄神经元,而来自不同侧角的声音则刺激另一侧的神经元组。这种信号的空间定向随后传递到听觉皮层,声音方向由最大程度刺激的神经元的位置决定。所有这些用于确定声音方向的信号被认为是通过不同的通路传递的,并在大脑皮层(cerebral cortex)中激发与声音音调模式传递通路和终止位置不同的位置。
这种检测声音方向的机制再次表明,当感觉信号通过不同层次的神经元活动时,特定信息是如何被解析出来的。在这种情况下,声音方向的“质量”在上橄榄核的水平上与声音音调的“质量”分离开来。
从中枢神经系统到低级听觉中心的离心信号
从大脑皮层到耳蜗(cochlea)的听觉神经系统(auditory nervous system)的每个层次都证明了逆行通路(retrograde pathway)的存在。最终的逆行通路主要从上橄榄核到Corti器(organ of Corti)中的声音感受器毛细胞(sound-receptor hair cells)。
这些逆行纤维具有抑制作用。事实上,直接刺激橄榄核中的离散点已被证明可以抑制Corti器的特定区域,将其声音敏感性降低15到20分贝。人们可以很容易理解这种机制如何允许某人将注意力集中在特定质量的声音上,同时拒绝其他质量的声音。当一个人在交响乐团中聆听单一乐器时,这种特性很容易得到体现。
耳聋的类型
耳聋通常分为两种类型:(1)由耳蜗、听神经(auditory nerve)或从耳朵到中枢神经系统(central nervous system)的回路损伤引起的耳聋,通常被归类为“神经性耳聋(nerve deafness)”;(2)由传导声音到耳蜗的耳朵物理结构损伤引起的耳聋,通常称为“传导性耳聋(conduction deafness)”。
如果耳蜗(cochlea)或听神经(auditory nerve)被破坏,人就会永久性失聪。然而,如果耳蜗和神经仍然完好,但鼓膜听骨系统(tympanumossicular system)被破坏或强直(ankylosed)(因纤维化或钙化而“冻结”在原位),声波仍然可以通过骨传导(bone conduction)从放置在耳部上方颅骨上的声源传入耳蜗。
听力计(Audiometer)。为了确定听力障碍的性质,使用听力计。该仪器是一个连接到电子振荡器的耳机,能够发出从低频到高频的纯音,并且经过校准,使得每个频率的零强度级声音是正常耳朵刚刚能听到的响度。一个经过校准的音量控制可以将响度提高到零水平以上。如果必须将响度提高到正常水平以上30分贝才能听到,那么可以说该人在该特定频率上有30分贝的听力损失。
在使用听力计进行听力测试时,测试大约8到10个覆盖听觉频谱的频率,并确定每个频率的听力损失。然后绘制所谓的听力图(audiogram),如图53-11和53-12所示,描绘了听觉频谱中每个频率的听力损失。听力计除了配备用于测试耳朵空气传导(air conduction)的耳机外,还配备了一个机械振动器,用于测试从颅骨乳突(mastoid process)到耳蜗的骨传导。
神经性耳聋(Nerve Deafness)的听力图。在神经性耳聋中,包括耳蜗、听神经或来自耳朵的中枢神经系统(central nervous system)回路的损伤,该人在通过空气传导和骨传导测试时都失去了听到声音的能力。图53-11显示了一幅描绘部分神经性耳聋的听力图。在该图中,耳聋主要是对高频声音。这种耳聋可能是由耳蜗基部的损伤引起的。这种类型的耳聋在几乎所有老年人中都有一定程度的发生。
图53-11. 老年型神经性耳聋的听力图。
图53-12. 由中耳硬化症(middle ear sclerosis)引起的空气传导耳聋的听力图。
其他常见的神经性耳聋模式如下:(1) 对低频声音的耳聋,由长时间暴露在非常响亮的声音中引起(例如,摇滚乐队或喷气式飞机发动机),因为低频声音通常更响亮,对Corti器官(organ of Corti)的损害更大;(2) 对所有频率的耳聋,由Corti器官对药物的敏感性引起——特别是对某些抗生素如链霉素(streptomycin)、庆大霉素(gentamicin)、卡那霉素(kanamycin)和氯霉素(chloramphenicol)的敏感性。
中耳传导性耳聋的听力图
一种常见的耳聋类型是由反复感染后中耳纤维化或遗传性疾病耳硬化症(otosclerosis)引起的纤维化导致的。在这两种情况下,声波无法轻易通过听小骨从鼓膜传递到卵圆窗。图53-12显示了一名患有“中耳空气传导性耳聋”患者的听力图:在这种情况下,骨传导基本正常,但通过听骨系统的传导在所有频率上都显著减弱,尤其是在低频时更为明显。在某些传导性耳聋的病例中,镫骨底板由于骨质过度生长而与卵圆窗边缘“强直”(ankylosed)固定。在这种情况下,患者会完全丧失听骨传导功能,但通过手术移除镫骨并用微小的特氟龙或金属假体替代,将声音从砧骨传递到卵圆窗,患者几乎可以恢复正常的听力。
参考文献
Angeloni C, Geffen MN: Contextual modulation of sound processing in the auditory cortex. Curr Opin Neurobiol 49:8, 2018. Avan P, Büki B, Petit C: Auditory distortions: origins and functions. Physiol Rev 93:1563, 2013. Cunningham LL, Tucci DL: Hearing loss in adults. N Engl J Med 377:2465, 2017. Fettiplace R: Hair cell transduction, tuning, and synaptic transmission in the mammalian cochlea. Compr Physiol 7:1197, 2017. Fettiplace R, Kim KX: The physiology of mechanoelectrical transduction channels in hearing. Physiol Rev 94:951, 2014. Gervain J, Geffen MN: Efficient neural coding in auditory and speech perception. Trends Neurosci 42:56, 2019. Grothe B, Pecka M, McAlpine D: Mechanisms of sound localization in mammals. Physiol Rev 90:983, 2010. Heeringa AN, Köppl C: The aging cochlea: towards unraveling the functional contributions of strial dysfunction and synaptopathy. Hear Res 376:111, 2019. Hudspeth AJ: Integrating the active process of hair cells with cochlear function. Nat Rev Neurosci 15:600, 2014. Irvine DRF: Plasticity in the auditory system. Hear Res 362:61, 2018. Jasmin K, Lima CF, Scott SK: Understanding rostral-caudal auditory cortex contributions to auditory perception. Nat Rev Neurosci 20:425, 2019. Joris PX, Schreiner CE, Rees A: Neural processing of amplitudemodulated sounds. Physiol Rev 84:541, 2004. King AJ, Nelken I: Unraveling the principles of auditory cortical processing: can we learn from the visual system? Nat Neurosci 12:698, 2009. Kuchibhotla K, Bathellier B: Neural encoding of sensory and behavioral complexity in the auditory cortex. Curr Opin Neurobiol 52:65, 2018. O Maoileidigh D, Ricci Al: A bundle of mechanisms: inner-ear hair-cell mechanotransduction. Trends Neurosci 42:221, 2019. Moser T, Starr A: Auditory neuropathy--neural and synaptic mechanisms. Nat Rev Neurol 12:135, 2016. Pangrsic T, Singer JH, Koschak A: Voltage-gated calcium channels: key players in sensory coding in the retina and the inner ear. Physiol Rev 98:2063, 2018. Rauschecker JP, Shannon RV: Sending sound to the brain. Science 295:1025, 2002. Robles L, Ruggero MA: Mechanics of the mammalian cochlea. Physiol Rev 81:1305, 2001. Takago H, Oshima-Takago T: Pre- and postsynaptic ionotropic glutamate receptors in the auditory system of mammals. Hear Res 362:1, 2018. Velez-Ortega AC, Frolenkov Gl: Building and repairing the stereocilia cytoskeleton in mammalian auditory hair cells. Hear Res 376:47, 2019.
Wang J, Puel JL: Toward cochlear therapies. Physiol Rev 98:2477, 2018.
化学感觉——味觉和嗅觉
味觉和嗅觉使我们能够将不理想甚至致命的食物与美味且营养的食物区分开来。它们还引发与食物消化和利用相关的生理反应。嗅觉使动物能够识别其他动物甚至个别动物的接近。最后,这两种感觉都与我们神经系统的原始情绪和行为功能密切相关。在本章中,我们将讨论味觉和嗅觉刺激是如何被检测的,以及它们如何被编码成传递到大脑的神经信号。
味觉
味觉主要是口腔中味蕾的功能,但通常经验表明,嗅觉也对味觉感知有重要贡献。此外,食物的质地(通过口腔的触觉感知)以及食物中刺激痛觉末梢的物质(如胡椒)会极大地改变味觉体验。味觉的重要性在于它使人们能够根据欲望选择食物,并且通常与身体组织对特定物质的代谢需求相一致。
基本味觉
许多能够激发不同味觉受体的特定化学物质的身份尚未完全明确。为了实际分析,基本味觉被分为五大类——酸、咸、甜、苦和“鲜味”。
一个人可以感知数百种不同的味道。它们都被认为是基本味觉的组合,就像我们所能看到的所有颜色都是三原色的组合一样,如第51章所述。
酸味。酸味是由酸引起的,即由氢离子浓度引起的,这种味觉的强度大约与氢离子浓度的对数成正比(即食物越酸,酸味感觉越强)。
咸味。咸味是由离子化盐引起的,主要是由钠离子浓度引起的。不同盐的味道质量略有不同,因为一些盐除了咸味外还会引发其他味觉。盐的阳离子,尤其是钠阳离子,主要负责咸味,但阴离子也在较小程度上有所贡献。
甜味。甜味并不是由任何单一类别的化学物质引起的。引起这种味道的化学物质类型包括糖类、二醇类、醇类、醛类、酮类、酰胺类、酯类、一些氨基酸、一些小蛋白质、磺酸类、卤代酸类以及铅和铍的无机盐。特别需要注意的是,大多数引起甜味的物质是有机化学物质。特别有趣的是,化学结构的微小变化(如添加一个简单的基团)通常可以将物质从甜味变为苦味。
苦味 (bitter taste)。与甜味一样,苦味也不是由单一类型的化学物质引起的。同样,产生苦味的物质几乎全部是有机物质。有两类物质特别容易引起苦味感觉:(1) 含氮的长链有机物质;(2) 生物碱 (alkaloids)。生物碱包括许多药用药物,如奎宁 (quinine)、咖啡因 (caffeine)、士的宁 (strychnine) 和尼古丁 (nicotine)。
一些最初尝起来甜的物质会有苦的余味。糖精 (saccharin) 就具有这种特性,这使得一些人不喜欢这种物质。高浓度的盐也可能导致苦味。
当苦味强度很高时,通常会导致人或动物拒绝食物。这种反应无疑是苦味感觉的一个重要功能,因为在有毒植物中发现的许多致命毒素都是生物碱,几乎所有这些生物碱都会引起强烈的苦味,通常会导致食物被拒绝。
鲜味 (umami taste)。鲜味是一个日语词,意思是“美味”,它指定了一种与酸、咸、甜或苦在性质上不同的愉悦味觉。鲜味是含有 L-谷氨酸盐 (L-glutamate) 的食物(如肉提取物和陈年奶酪)的主要味道。鲜味带来的愉悦感觉被认为对营养很重要,因为它能促进蛋白质的摄入。
味觉阈值 (THRESHOLD FOR TASTE)
盐酸 (hydrochloric acid) 刺激酸味的摩尔阈值平均为 0.0009M,氯化钠 (sodium chloride) 刺激咸味的摩尔阈值为 0.01M,蔗糖 (sucrose) 刺激甜味的摩尔阈值为 0.01M,奎宁 (quinine) 刺激苦味的摩尔阈值为 0.000008 M。特别要注意的是,苦味感觉比其他所有味觉都要敏感得多,这为抵御食物中的许多危险毒素提供了重要的保护功能。
表 54-1 列出了不同物质的相对味觉指数 (relative taste indices)(味觉阈值的倒数)。在该表中,四种基本味觉的强度分别与盐酸、奎宁、蔗糖和氯化钠的味觉强度相比较,每种物质的味觉指数被任意设定为 1。
味觉缺失 (taste blindness)。有些人对某些物质存在味觉缺失,尤其是对不同类型的硫脲化合物 (thiourea compounds)。心理学家经常使用苯硫脲 (phenylthiocarbamide) 来演示味觉缺失,大约 15% 到 30% 的人对这种物质表现出味觉缺失;具体比例取决于测试方法和物质浓度。
味蕾及其功能 (TASTE BUDS AND THEIR FUNCTION)
图54-1B显示了一个味蕾(taste bud),其直径约为%毫米,长度约为%毫米。味蕾由上皮细胞(epithelial cells)组成;其中一些是支持细胞(sustentacular cells),另一些是味细胞(taste cells)。每个味蕾中约有100个味细胞。味细胞通过周围上皮细胞的有丝分裂(mitotic division)不断更新,因此一些味细胞是年轻细胞。另一些是位于味蕾中心的成熟细胞;这些细胞很快就会分解和溶解。每个味细胞的平均寿命估计约为10天,尽管存在相当大的差异,一些味细胞仅在2天内被淘汰,而另一些可能存活超过3周。
味细胞的外端围绕着一个微小的味孔(taste pore)排列,如图54-1B所示。从每个味细胞的尖端,几个微绒毛(microvilli)或味毛(taste hairs)向外突出进入味孔,接近口腔的腔体。这些微绒毛提供了味觉的感受表面。
在味细胞体周围交织着味觉神经纤维(taste nerve fibers)的分支末梢网络,这些纤维被味觉感受细胞(taste receptor cells)刺激。其中一些纤维内陷到味细胞膜的褶皱中。在靠近纤维的细胞膜下方形成许多囊泡(vesicles)。据信这些囊泡含有一种神经递质(neurotransmitter substance),它通过细胞膜释放以响应味觉刺激,从而兴奋神经纤维末梢。
味蕾的位置。味蕾位于舌头的三种乳头(papillae)上,如下所示(见图54-1A):(1) 大量味蕾位于围绕轮廓乳头(circumvallate papillae)的沟壁,这些乳头在舌后表面形成一条V形线;(2) 中等数量的味蕾位于叶状乳头(foliate papillae)上,这些乳头位于舌头侧表面的褶皱中;(3) 中等数量的味蕾位于舌前平坦表面上的菌状乳头(fungiform papillae)上。额外的味蕾位于腭部,少数位于扁桃体柱(tonsillar pillars)、会厌(epiglottis)甚至近端食管(proximal esophagus)上。成年人有3000到10000个味蕾,儿童则稍多一些。超过45岁后,许多味蕾退化,导致老年时味觉敏感性下降。
表54-1不同物质的相对味觉指数
markdown
酸味物质
CaCl2,氯化钙;KCl,氯化钾;LiCl,氯化锂;NaBr,溴化钠;NaCl,氯化钠;NaF,氟化钠;NaI,碘化钠;NH4Cl,氯化铵。数据来自 Pfaffman C: Handbook of Physiology, vol 1. Baltimore: Williams & Wilkins, 1959, p 507.
味蕾对主要味觉刺激的特异性
单个味蕾的微电极研究表明,当味觉物质浓度较低时,每个味蕾通常主要对五种主要味觉刺激中的一种产生反应。然而,在高浓度下,大多数味蕾可以被两种或更多的主要味觉刺激以及一些不属于“主要”类别的其他味觉刺激所激活。
图 54-1. (A) 舌乳头中味蕾的分布及味觉信号传递的神经通路。(B) 味蕾的结构。n.,神经。
味蕾的刺激机制
感受器电位 (Receptor Potential)
味觉细胞的膜与大多数其他感觉感受器细胞一样,内部相对于外部带负电。将味觉物质施加到味觉毛上会导致这种负电位的部分丧失——即味觉细胞去极化。在大多数情况下,电位下降的幅度在一定范围内与刺激物质浓度的对数大致成正比。味觉细胞中的这种电位变化称为味觉的感受器电位。
大多数刺激物质与味觉绒毛反应以启动受体电位(Receptor Potential)的机制是通过味觉化学物质与位于味觉受体细胞外表面的蛋白质受体分子结合,该分子靠近或突出于绒毛膜。这一作用反过来打开了离子通道,允许带正电荷的钠离子或氢离子进入并使细胞的正常负性去极化。然后,味觉化学物质逐渐被唾液从味觉绒毛中冲走,从而去除刺激。
每个味觉绒毛中的受体蛋白类型决定了感知到的味觉类型。对于分别引起咸味和酸味感觉的钠离子和氢离子,受体蛋白在味觉细胞的顶膜中打开特定的离子通道,可能是上皮钠通道(ENaC),从而激活受体。然而,对于甜味和苦味感觉,G蛋白偶联受体(G-protein coupled receptors)突出于顶膜的部分激活味觉细胞内的第二信使(second-messenger)递质;这些第二信使引起细胞内化学变化,从而引发味觉信号。
甜味化合物由两个密切相关的G蛋白偶联味觉受体T1R2和T1R3的组合检测。负责鲜味(umami)的受体被认为是T1R1和T1R3蛋白的复合物。因此,T1R3似乎作为甜味和鲜味的共同受体发挥作用。
苦味由另一个家族(T2R)的约30种不同的\cal G蛋白偶联受体感知。单个苦味感知味觉受体细胞表达多种T2R,每种T2R识别一组独特的苦味化合物。这种受体表达模式允许通过单一类型的味觉受体细胞检测多种苦味化合物。
与酸性食物或饮料相关的酸味被认为是由氢离子打开的离子通道感知的,尽管确切的机制尚未完全理解。最近的研究表明,酸敏感钾通道(KIR2.1)和氢离子选择性离子通道(otopetrin 1)可能在味觉受体细胞中介导酸反应。
味蕾产生神经冲动。在首次施加味觉刺激时,味蕾神经纤维的放电速率在不到一秒的时间内达到峰值,但在接下来的几秒钟内适应回较低的稳定水平,只要味觉刺激持续存在。因此,味觉神经传递了一个强烈的即时信号,只要味蕾暴露于味觉刺激,就会传递一个较弱的连续信号。
味觉信号向中枢神经系统的传递
图54-1和图54-2展示了味觉信号从舌头和咽部区域传递到中枢神经系统(central nervous system)的神经通路。来自舌头前三分之二的味觉冲动首先进入舌神经(lingual nerve),然后通过鼓索(chorda tympani)进入面神经(facial nerve),最后进入脑干(brain stem)中的孤束(tractus solitarius)。来自舌头后部轮廓乳头(circumvallate papillae)以及口腔和咽喉其他后部区域的味觉通过舌咽神经(glossopharyngeal nerve)传递到孤束,但位置稍靠后。最后,少数味觉信号通过迷走神经(vagus nerve)从舌根和咽部其他区域传递到孤束。
所有味觉纤维在脑干后部的孤束核(nuclei of the tractus solitarius)中形成突触(synapse)。这些核团将第二级神经元(second-order neurons)发送到丘脑(thalamus)腹后内侧核(ventral posterior medial nucleus)的一个小区域,该区域位于背柱-内侧丘系系统(dorsal column–medial lemniscal system)面部区域丘脑终止点的稍内侧。从丘脑,第三级神经元(third-order neurons)传递到顶叶大脑皮层(parietal cerebral cortex)中央后回(postcentral gyrus)的下端,该区域深入外侧裂(sylvian fissure),并进入相邻的岛盖区(opercular insular area)。该区域位于大脑躯体感觉区I(cerebral somatic area I)中舌头触觉信号区域的稍外侧、腹侧和头侧。从味觉通路的描述中可以看出,它们与来自舌头的躯体感觉通路(somatosensory pathways)非常相似。
图54-2. 味觉信号向中枢神经系统的传递。N., 神经(nerve)。
味觉反射在脑干中整合。许多味觉信号从孤束传递到脑干本身的上、下泌涎核(superior and inferior salivatory nuclei)。这些区域将信号传递到下颌下腺(submandibular gland)、舌下腺(sublingual gland)和腮腺(parotid gland),以帮助控制食物摄入和消化过程中唾液的分泌。
味觉的快速适应。每个人都知道,味觉在持续刺激约一分钟后会迅速适应,通常几乎完全适应。然而,从味觉神经纤维的电生理学研究来看,味蕾的适应通常只占这种快速味觉适应的一半左右。因此,味觉感觉中发生的最终极端的适应几乎肯定发生在中枢神经系统中,尽管机制尚不清楚。这种适应机制与许多其他感觉系统不同,后者主要在感受器(receptors)处适应。
味觉偏好与饮食控制
味觉偏好(taste preference)简单来说就是动物会选择某些类型的食物而不是其他食物,动物会自动利用这种偏好来帮助控制其饮食。此外,其味觉偏好通常会根据身体对某些特定物质的需求而变化。
以下实验证明了动物根据身体需求选择食物的能力。首先,肾上腺切除(adrenalectomized)、盐分耗竭(salt-depleted)的动物会自动选择含有高浓度氯化钠的饮用水,而不是纯水,水中的氯化钠含量通常足以满足身体需求,并防止因盐分耗竭而死亡。其次,注射过量胰岛素的动物会出现血糖水平下降,该动物会自动从多个样本中选择最甜的食物。第三,钙耗竭(calcium-depleted)、甲状旁腺切除(parathyroidectomized)的动物会自动选择含有高浓度氯化钙的饮用水。
在日常生活中也能观察到同样的现象。例如,众所周知,沙漠地区的"盐渍地(salt licks)"会吸引远道而来的动物。此外,人类会拒绝引起不愉快情感感受的食物,这在许多情况下保护我们的身体免受不良物质的侵害。
味觉偏好(taste preference)现象几乎可以肯定是由中枢神经系统(central nervous system)中的某种机制引起的,而不是由味觉受体(taste receptors)中的机制引起的,尽管受体通常会对所需营养物质变得敏感。认为味觉偏好主要是中枢神经系统现象的一个重要原因是,先前对不愉快或愉快味道的体验在决定一个人的味觉偏好方面起着主要作用。例如,如果一个人在食用某种特定食物后不久就生病了,那么他通常会对该特定食物产生负面的味觉偏好,即味觉厌恶(taste aversion);在低等动物中也能证明同样的效果。
嗅觉(SENSE OF SMELL)
嗅觉是我们最不了解的感觉,部分原因是嗅觉是一种主观现象,难以在低等动物中进行研究。另一个复杂的问题是,与许多其他哺乳动物相比,人类的嗅觉发育较差。
嗅黏膜(OLFACTORY MEMBRANE)
嗅黏膜的组织学结构如图54-3所示,位于鼻腔的上部。在内侧,嗅黏膜沿着上鼻中隔(superior septum)的表面向下折叠;在外侧,它覆盖在上鼻甲(superior turbinate)上,甚至覆盖中鼻甲(middle turbinate)上表面的一小部分。人类的嗅黏膜总面积约为5平方厘米。
嗅觉细胞(olfactory cells)是嗅觉感受的受体细胞。嗅觉细胞(见图53-3)实际上是起源于中枢神经系统的双极神经细胞(bipolar nerve cells)。如图54-3所示,在嗅上皮(olfactory epithelium)中约有1亿个这样的细胞,散布在支持细胞(sustentacular cells)之间。嗅觉细胞的黏膜端形成一个球状突起,从其上伸出4到25根嗅觉纤毛(olfactory hairs)(也称为嗅觉纤毛(olfactory cilia)),直径0.3微米,长度可达200微米,伸入覆盖鼻腔内表面的粘液中。这些突出的嗅觉纤毛在粘液中形成密集的网状结构,正是这些纤毛对空气中的气味作出反应并刺激嗅觉细胞,这一点将在后面讨论。在嗅黏膜的嗅觉细胞之间分布着许多小的鲍曼腺(Bowman glands),它们将粘液分泌到嗅黏膜表面。
嗅觉细胞的刺激(STIMULATION OF THE OLFACTORY CELLS)
嗅觉细胞兴奋的机制
每个嗅觉细胞中对嗅觉化学刺激作出反应的部分是嗅觉纤毛(olfactory cilia)。当气味物质接触到嗅觉膜表面时,首先会扩散到覆盖纤毛的粘液中,然后与每个纤毛膜上的受体蛋白(receptor proteins)结合(图54-4)。每个受体蛋白实际上是一个长分子,它穿过膜约七次,向内和向外折叠。
图54-3. 嗅觉膜和嗅球的组织结构以及与嗅束的连接。
图54-4. 嗅觉信号转导的总结。气味物质与G蛋白偶联受体(G-protein-coupled receptor)结合,导致腺苷酸环化酶(adenylate cyclase)的激活,该酶将三磷酸腺苷(adenosine triphosphate, ATP)转化为环磷酸腺苷(cyclic adenosine monophosphate, cAMP)。cAMP激活一个门控钠通道(gated sodium channel),增加钠离子内流并使细胞去极化,从而兴奋嗅觉神经元并将动作电位传递到中枢神经系统。
气味物质与受体蛋白向外折叠的部分结合。折叠蛋白的内部与一个G蛋白(G protein)偶联,该蛋白本身由三个亚基组成。当受体蛋白被激活时,一个α亚基从G蛋白中分离并激活腺苷酸环化酶(adenylyl cyclase),该酶附着在受体细胞体附近的纤毛膜内侧。激活的环化酶反过来将许多细胞内三磷酸腺苷(ATP)分子转化为环磷酸腺苷(cAMP)。最后,cAMP激活附近的另一个膜蛋白,即门控钠离子通道(gated sodium ion channel),该通道打开其“门”并允许大量钠离子通过膜进入受体细胞质。钠离子增加了细胞膜内侧的正电位,从而兴奋嗅觉神经元并通过嗅神经将动作电位传递到中枢神经系统。
这种激活嗅觉神经的机制的重要性在于,它极大地放大了即使是最弱气味物质的兴奋效应。总结如下:(1) 气味物质激活受体蛋白,进而激活G蛋白复合物;(2) G蛋白复合物激活嗅觉细胞膜内的多个腺苷酸环化酶分子;(3) 导致形成更多的cAMP分子;(4) cAMP打开更多的钠离子通道。因此,即使是非常低浓度的特定气味物质也能引发级联效应,打开大量钠离子通道。这一过程解释了嗅觉神经元对极微量气味物质的极高敏感性。
除了嗅觉细胞(olfactory cells)受到刺激的基本化学机制外,还有几个物理因素会影响刺激的程度。首先,只有能够被吸入鼻腔的挥发性物质才能被闻到。其次,刺激物质必须至少具有轻微的水溶性,以便能够穿过黏液到达嗅觉纤毛(olfactory cilia)。第三,物质至少具有轻微的脂溶性是有帮助的,这可能是因为纤毛的脂质成分对非脂溶性气味物质是一个较弱的屏障。
嗅觉细胞中的膜电位和动作电位
通过微电极测量,未受刺激的嗅觉细胞内部的膜电位(membrane potential)平均约为-55毫伏。在这种电位下,大多数细胞以非常慢的速度产生连续的动作电位(action potentials),从每20秒一次到每秒两到三次不等。
大多数气味物质会导致嗅觉细胞膜的去极化(depolarization),将细胞内的负电位从正常的-55毫伏降低到-30毫伏或更低。与此同时,动作电位的数量增加到每秒20到30次,这对于微小的嗅觉神经纤维来说是一个很高的速率。
在很大范围内,嗅觉神经冲动的速率大致与刺激强度的对数成正比,这表明嗅觉受体遵循与其他感觉受体类似的转导(transduction)原理。
嗅觉感觉的快速适应
嗅觉受体在刺激后的第一秒左右适应约50%。此后,它们的适应非常少且非常缓慢。然而,我们都有这样的经验:在进入一个强烈气味的环境后,嗅觉感觉几乎在一分钟内就适应到几乎消失。由于这种心理适应远大于受体的适应程度,几乎可以肯定的是,大部分的额外适应发生在中枢神经系统(central nervous system)中,这似乎也适用于味觉感觉的适应。
以下是适应的一种神经元机制的假设:大量的离心神经纤维(centrifugal nerve fibers)从大脑的嗅觉区域沿着嗅觉束向后传递,并终止于嗅球(olfactory bulb)中的特殊抑制细胞——颗粒细胞(granule cells)。在嗅觉刺激开始后,中枢神经系统迅速产生强烈的反馈抑制(feedback inhibition),以抑制通过嗅球传递的气味信号。
寻找嗅觉的基本感觉
过去,大多数生理学家认为,许多嗅觉感觉是由少数相对离散的基本感觉所支持的,就像视觉和味觉是由少数选择的基本感觉所支持一样。基于心理学研究,以下是对这些感觉进行分类的一种尝试:
- 樟脑味(Camphoraceous)
- 麝香味(Musky)
- 花香味(Floral)
- 薄荷味(Pepperminty)
- 醚味(Ethereal)
- 辛辣味(Pungent)
- 腐臭味(Putrid)
可以肯定的是,这个列表并不代表真正的嗅觉基本感觉(primary sensations of smell)。包括对编码受体蛋白的基因的特定研究在内的多项线索表明,至少存在100种嗅觉基本感觉——这与眼睛仅能检测到的三种颜色基本感觉和舌头仅能检测到的五种味觉基本感觉形成鲜明对比。一些研究表明,可能存在多达1000种不同类型的气味受体(odorant receptors)。嗅觉存在多种基本感觉的进一步证据是,人们发现某些人对单一物质存在气味盲(odor blindness);这种离散的气味盲已经在50多种不同物质中被识别出来。据推测,每种物质的气味盲代表嗅觉细胞中缺乏针对该特定物质的适当受体蛋白。
嗅觉的情感性质(Affective Nature of Smell)。嗅觉,甚至比味觉更甚,具有愉快或不愉快的情感性质,因此嗅觉在食物选择中可能比味觉更为重要。一个人如果之前吃过不适合自己的食物,第二次闻到同样的食物气味时往往会感到恶心。相反,质量合适的香水可以强烈刺激人类的情感。此外,在某些动物中,气味是性欲的主要激发因素。
嗅觉阈值(Threshold for Smell)。嗅觉的主要特征之一是空气中能够引发嗅觉感觉的刺激剂的极微量。例如,当每毫升空气中仅存在25万亿分之一克的甲硫醇(methylmercaptan)时,就可以闻到这种物质。由于这种极低的阈值,这种物质被混入天然气中,以便在管道中即使泄漏少量气体时也能检测到气味。
嗅觉强度的分级(Gradations of Smell Intensities)。尽管引发嗅觉的物质的阈值浓度极低,但对于许多(如果不是大多数)气味剂来说,浓度仅比阈值高10到50倍就能引发最大强度的嗅觉。这种强度辨别范围与身体大多数其他感觉系统形成对比,后者的强度辨别范围非常大——例如,眼睛为50万比1,耳朵为1万亿比1。这种差异可能解释为,嗅觉更关注于检测气味的存在与否,而不是其强度的定量检测。
嗅觉信号向中枢神经系统的传递(TRANSMISSION OF SMELL SIGNALS INTO THE CENTRAL NERVOUS SYSTEM)
大脑的嗅觉部分是最早在原始动物中发展出来的大脑结构之一,大脑的其余部分大多围绕这些嗅觉起源发展而来。事实上,最初服务于嗅觉的大脑部分后来演化为控制情绪和人类行为其他方面的基底大脑结构;我们称这个系统为边缘系统(limbic system),如第59章所述。
嗅觉信号向嗅球的传递。嗅球如图54-5所示。从嗅球向后延伸的嗅神经纤维被称为第一对脑神经(cranial nerve I),或嗅束(olfactory tract)。实际上,嗅束和嗅球都是脑组织从脑底部向前延伸的部分;其末端的球状膨大,即嗅球(olfactory bulb),位于筛板(cribriform plate)上方,将脑腔与鼻腔的上部分隔开。筛板上有多个小孔,相同数量的小神经从鼻腔的嗅膜(olfactory membrane)向上穿过这些小孔进入颅腔的嗅球。图54-3展示了嗅膜中的嗅细胞(olfactory cells)与嗅球之间的密切关系,显示了嗅细胞的短轴突(axons)终止于嗅球中的多个球状结构,称为嗅小球(glomeruli)。每个嗅球有数千个这样的嗅小球,每个嗅小球是大约25,000个嗅细胞轴突的终点。每个嗅小球也是大约25个大僧帽细胞(mitral cells)和约60个较小的簇状细胞(tufted cells)的树突(dendrites)的终点,这些细胞的胞体位于嗅小球上方的嗅球中。这些树突接收来自嗅细胞神经元的突触(synapses);僧帽细胞和簇状细胞通过嗅束发送轴突,将嗅觉信号传递到中枢神经系统(central nervous system)的更高层次。
一些研究表明,不同的嗅小球对不同气味有反应。特定的嗅小球可能是分析传递到中枢神经系统的不同气味信号的关键。
通向中枢神经系统的原始和较新的嗅觉通路
嗅束在中脑(mesencephalon)和大脑(cerebrum)之间的前部连接处进入大脑;在那里,嗅束分为两条通路,如图54-5所示,一条向内侧进入脑干的内侧嗅觉区(medial olfactory area),另一条向外侧进入外侧嗅觉区(lateral olfactory area)。内侧嗅觉区代表一个非常原始的嗅觉系统,而外侧嗅觉区则是以下两个系统的输入:(1) 一个较老的嗅觉系统;和 (2) 一个较新的系统。
原始嗅觉系统——内侧嗅觉区。内侧嗅觉区由位于脑底部中前部的一组核团组成,紧邻下丘脑(hypothalamus)前方。最显著的是隔核(septal nuclei),它们是位于中线的核团,向下丘脑和大脑边缘系统(limbic system)的其他原始部分提供输入。这是与基本行为最相关的脑区(如第59章所述)。
通过考虑当大脑两侧的外侧嗅觉区被移除,仅保留内侧系统时动物会发生什么,可以最好地理解内侧嗅觉区的重要性。移除这些区域几乎不会影响对嗅觉的更基本反应,例如舔嘴唇、流涎以及由食物的气味或与气味相关的基本情绪驱动引起的其他进食反应。相反,移除外侧区域会消除更复杂的嗅觉条件反射。
图54-5. 嗅觉系统的神经连接。
较老的嗅觉系统——外侧嗅觉区
外侧嗅觉区主要由前梨状皮层和梨状皮层以及杏仁核的皮层部分组成。从这些区域,信号通路传递到几乎所有的边缘系统部分,特别是传递到较不原始的部分,如海马体,这些部分似乎对于根据个人经验学习喜欢或不喜欢某些食物最为重要。例如,人们认为,外侧嗅觉区及其与边缘行为系统的许多连接会导致一个人对引起恶心和呕吐的食物产生绝对的厌恶感。
外侧嗅觉区的一个重要特征是,来自该区域的许多信号通路也直接传递到大脑皮层的一个较老部分,称为颞叶前内侧的古皮层。这是整个大脑皮层中唯一一个感觉信号直接传递到皮层而不首先通过丘脑的区域。
较新的通路
已经发现了一条较新的嗅觉通路,它通过丘脑,传递到丘脑背内侧核,然后传递到眶额皮层的外侧后象限。基于对猴子的研究,这个较新的系统可能有助于对气味的意识分析。
总结
因此,似乎存在一个原始的嗅觉系统,服务于基本的嗅觉反射;一个较老的系统,提供对食物摄入的自动但部分学习的控制以及对有毒和不健康食物的厌恶感;以及一个较新的系统,与大多数其他皮层感觉系统相当,用于嗅觉的意识感知和分析。
中枢神经系统对嗅球活动的离心控制
许多起源于大脑嗅觉部分的神经纤维从大脑向外传递到嗅束,再到嗅球(即从大脑向周围离心)。这些神经纤维终止于位于嗅球中僧帽细胞和簇状细胞之间的大量小颗粒细胞。颗粒细胞向僧帽细胞和簇状细胞发送抑制信号。这种抑制反馈可能是增强一个人区分不同气味的具体能力的一种手段。
