第四单元 循环:修订间差异
无编辑摘要 |
自动添加 Sofia 模板和分类 |
||
| 第2,589行: | 第2,589行: | ||
多年来,人们认为这种对大脑的有害影响是由循环骤停期间发生的急性脑缺氧引起的。然而,实验表明,如果防止大脑血管中形成血栓,这也可以防止循环骤停期间大脑的早期恶化。例如,在动物实验中,循环骤停开始时将动物血管中的所有血液移除,然后在循环骤停结束时重新注入,以防止血管内凝血的发生。在这个实验中,大脑通常能够承受长达30分钟的循环骤停而不会出现永久性脑损伤。此外,在心脏骤停前给予肝素或链激酶(以防止血液凝固)被证明可以将大脑的存活时间延长至通常的两到四倍。 | 多年来,人们认为这种对大脑的有害影响是由循环骤停期间发生的急性脑缺氧引起的。然而,实验表明,如果防止大脑血管中形成血栓,这也可以防止循环骤停期间大脑的早期恶化。例如,在动物实验中,循环骤停开始时将动物血管中的所有血液移除,然后在循环骤停结束时重新注入,以防止血管内凝血的发生。在这个实验中,大脑通常能够承受长达30分钟的循环骤停而不会出现永久性脑损伤。此外,在心脏骤停前给予肝素或链激酶(以防止血液凝固)被证明可以将大脑的存活时间延长至通常的两到四倍。 | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 16:45的版本
循环系统概述:压力、流量和阻力
循环系统的功能是满足身体组织的需求——将营养物质运输到组织,将代谢废物运走,将激素从身体的一个部位运输到另一个部位,并总体上维持所有组织液中的适宜环境,以确保细胞的生存和最佳功能。
许多组织中的血流速率主要根据其对营养物质的需求和代谢废物的清除需求进行调节。在某些器官中,例如肾脏,循环系统还承担额外的功能。例如,肾脏的血流量远远超过其代谢需求,这与其排泄功能有关,因为排泄功能需要每分钟过滤大量的血液。
心脏和血管则被调节以提供所需的心输出量和动脉压,从而确保足够的组织血流。控制血容量和血流的机制是什么?这一过程如何与循环系统的其他功能相关联?这些是我们在本节讨论循环系统时涉及的一些主题和问题。
循环系统的物理特性
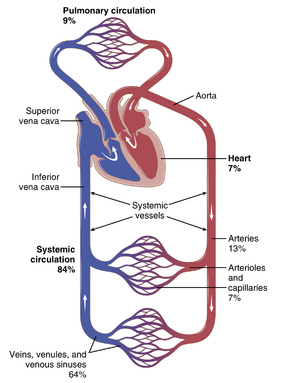
如图14-1所示,循环系统分为体循环(systemic circulation)和肺循环(pulmonary circulation)。由于体循环为除肺以外的所有身体组织提供血流,因此它也被称为大循环或外周循环。
循环系统的功能部分。在讨论循环功能的细节之前,了解循环系统每一部分的作用非常重要。
动脉的功能是将血液在高压下运输到组织。因此,动脉具有强韧的血管壁,血液在动脉中以高速流动。
微动脉(arterioles)是动脉系统的最后小分支;它们作为控制通道,通过它们将血液释放到毛细血管中。微动脉具有强壮的肌性壁,可以完全关闭微动脉,或者通过舒张使血管扩张数倍;因此,微动脉可以根据组织的需求大幅改变每个组织中的血流。
毛细血管的功能是在血液和组织液之间交换液体、营养物质、电解质、激素和其他物质。为了发挥这一作用,毛细血管壁非常薄,并且有许多微小的毛细血管孔,允许水和其他小分子物质通过。
微静脉(venules)从毛细血管中收集血液,并逐渐汇合成越来越大的静脉。
静脉的功能是将血液从微静脉运输回心脏。静脉还作为额外血液的主要储存库。由于静脉系统中的压力较低,静脉壁较薄。尽管如此,它们具有足够的肌肉组织可以收缩或扩张,从而作为可控的血液储存库,根据循环系统的需求储存少量或大量的额外血液。
循环系统各部分的血液体积。图 14-1 提供了循环系统的概览,并列出了主要循环部分中总血量的百分比。例如,大约 84% 的全身血液体积位于体循环中,而 16% 位于心脏和肺部。在体循环的 84% 中,大约 64% 位于静脉中,13% 位于动脉中,7% 位于体循环的小动脉和毛细血管中。心脏含有 7% 的血液,肺血管含有 9%。
最令人惊讶的是毛细血管中的低血容量。然而,正是在这里,循环系统最重要的功能发生——血液和组织之间的物质扩散,如第 16 章所讨论的。
血管的横截面积和血流速度。如果将每种类型的体循环血管并排放置,普通人的近似总横截面积如下:
<html><body><table><tr><td>血管</td><td>横截面积 (cm²)</td></tr><tr><td>主动脉</td><td>2.5</td></tr><tr><td>小动脉</td><td>20</td></tr><tr><td>小动脉</td><td>40</td></tr><tr><td>毛细血管</td><td>2500</td></tr><tr><td>小静脉</td><td>250</td></tr><tr><td>小静脉</td><td>80</td></tr><tr><td>腔静脉</td><td>8</td></tr></table></body></html>
特别注意,静脉的横截面积远大于动脉,平均约为相应动脉的四倍。这种差异解释了静脉系统与动脉系统相比具有较大的血液储存能力。
由于每分钟必须有相同的血流量 (F) 通过循环系统的每个部分,血流速度 (v) 与血管横截面积 (A) 成反比:
v=F/A
因此,在静息条件下,主动脉中的平均速度约为 33~cm/sec,但在毛细血管中仅为主动脉的 1/1000——约为 0.3mm/sec。然而,由于毛细血管的典型长度仅为 0.3 至 1 毫米,血液在毛细血管中停留的时间仅为 1 至 3 秒,这令人惊讶,因为所有通过毛细血管壁发生的营养物质和电解质的扩散必须在这短时间内完成。
循环系统各部分的压力。由于心脏不断将血液泵入主动脉,主动脉的平均压力较高,平均约为 100mmHg。此外,由于心脏的泵血是脉动的,动脉压力通常在静息条件下在平均收缩压水平 120~mm Hg 和舒张压水平 80mmHg 之间交替,如图 14-2 左侧所示。
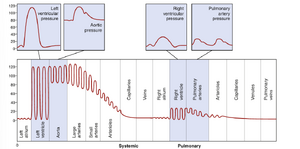
当血液流经体循环时,其平均压力逐渐下降,到达上腔静脉和下腔静脉末端时降至约 0mmHg,这些静脉在此处汇入心脏的右心房。
在许多体循环毛细血管中,压力从靠近小动脉端的最高35mmHg到靠近静脉端的最低10mmHg不等,但在大多数血管床中,其平均功能压力约为17 mm Hg,这一压力足够低,以至于即使营养物质可以轻松通过这些相同的孔隙扩散到周围的组织细胞,也很少有血浆通过这些毛细血管壁的微小孔隙泄漏。在某些毛细血管中,例如肾脏的肾小球毛细血管,压力要高得多,平均约为60mmHg,导致液体滤过率显著增加。
在图14-2的最右侧,注意肺循环不同部分的各自压力。在肺动脉中,压力是脉动的,就像在主动脉中一样,但压力要低得多;肺动脉收缩压平均约为25mmHg,舒张压平均约为8mmHg,平均肺动脉压仅为16mmHg。平均肺毛细血管压力仅为7~mm Hg。然而,每分钟通过肺部的总血流量与体循环相同。肺系统的低压与肺的需求相符,因为只需要将肺毛细血管中的血液暴露于肺泡中的氧气和其他气体。
循环功能的基本原理
尽管循环功能的细节复杂,但系统的所有功能都基于三个基本原理。
- 大多数组织的血流是根据组织需求来控制的。当组织活跃时,它们需要更多的营养供应,因此比休息时需要更多的血流,有时甚至达到休息水平的20到30倍。然而,心脏通常不能将其心输出量增加到休息水平的四到七倍以上。因此,当特定组织需要增加血流时,不可能简单地增加全身的血流。相反,每个组织的微血管,特别是小动脉,持续监测组织需求,例如氧气和其他营养物质的可用性以及二氧化碳和其他组织废物的积累。这些微血管反过来扩张或收缩,以控制局部血流,使其达到组织活动所需的水平。此外,来自中枢神经系统的循环神经控制和激素提供了额外的帮助,以控制组织血流。
- 心输出量(cardiac output)是所有局部组织血流的总和。当血液流经组织时,它会立即通过静脉返回心脏。心脏会自动对这种增加的血液流入做出反应,立即将其泵回动脉。因此,只要心脏功能正常,它就像一个自动装置,响应组织的需求。然而,心脏通常需要以特殊神经信号的形式来帮助它泵出所需的血流量。
- 动脉压(arterial pressure)的调节通常独立于局部血流控制或心输出量控制。循环系统配备了一个广泛的系统来控制动脉血压。例如,如果任何时候压力显著低于约100mmHg的正常水平,一系列神经反射会引发一系列循环变化,在几秒钟内将压力恢复到正常水平。神经信号特别会做以下事情:(a) 增加心脏泵血的力度;(b) 引起大静脉储血库的收缩,为心脏提供更多的血液;(c) 引起许多组织中微动脉的普遍收缩,使更多的血液积聚在大动脉中,从而增加动脉压。然后,在更长的时间内——几小时和几天——肾脏通过分泌压力控制激素和调节血容量,在压力控制中发挥额外的重大作用。
因此,个体组织的需求由循环系统专门满足。在本章的其余部分,我们将开始讨论组织血流、心输出量和动脉压的基本控制。
压力、流量和阻力的相互关系
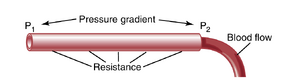
血液通过血管的流动由两个因素决定:(1) 血管两端血液的压力差,有时也称为沿血管的压力梯度(pressure gradient),它推动血液通过血管;(2) 血液通过血管的阻力,称为血管阻力(vascular resistance)。图14-3展示了这些关系,显示了位于循环系统中任何位置的血管段。
P1表示血管起始端的压力,P2表示另一端的压力。阻力是由于流动的血液与血管内内皮(intravascular endothelium)之间的摩擦而产生的。通过血管的流量可以用以下公式计算,称为欧姆定律(Ohm’s law):
F=\fracΔPR
其中,F 表示血流量(blood flow),ΔP 表示血管两端的压力差(pressure difference) \bf(P1 -P2),R 表示阻力(resistance)。该公式表明,血流量与压力差成正比,但与阻力成反比。
需要注意的是,决定血流速率的是血管两端的压力差,而不是血管内的绝对压力。例如,如果血管两端的压力均为 100mmHg,且两端之间没有压力差,那么尽管存在 100mmHg 的压力,也不会有血流。
前面公式中所示的欧姆定律(Ohm's law)表达了读者需要理解的最重要的关系之一,以便理解血液循环的血流动力学(hemodynamics)。由于该公式的极端重要性,读者还应熟悉其其他代数形式:
\beginarraylΔP=F×R\ \ R=\fracΔPF\endarray
血流量(Blood Flow)
血流量(blood flow rate)是指在给定时间内通过循环系统中某一点的血液量。
通常,血流量以毫升/分钟或升/分钟表示,但也可以以毫升/秒或任何其他流量和时间单位表示。
成年人在静息状态下的总循环血流量约为 5000ml/min。这被称为心输出量(cardiac output),因为它是心脏每分钟泵入主动脉的血液量。
测量血流量的方法。许多机械和机电流量计装置可以串联插入血管中,或在某些情况下应用于血管外部以测量血流量。
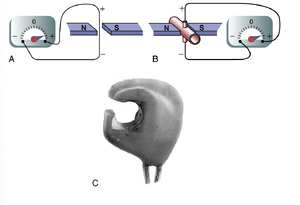
电磁流量计(Electromagnetic Flowmeter)。电磁流量计的原理如图14-4所示,可以用于实验性地测量血流量而无需打开血管。图14-4A显示了在磁场中快速横向移动的导线中产生的电动势(electromotive force)(电压)。这是发电机产生电力的著名原理。图14-4B显示了同样的原理适用于在磁场中移动的血液中产生电动势。在这种情况下,血管被放置在强磁体的两极之间,电极被放置在垂直于磁力线的血管两侧。当血液流经血管时,两个电极之间会产生与血流量成正比的电压,并使用适当的电压表或电子记录装置记录该电压。图14-4C显示了放置在大血管上以记录其血流量的实际探头。探头包含强磁体和电极。
电磁流量计的一个特殊优势是它可以在不到1/100秒的时间内记录流量的变化,从而准确记录脉动流量变化以及稳定流量。
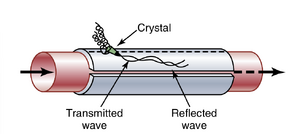
超声波多普勒流量计。另一种可以应用于血管外部且具有与电磁流量计相同优点的流量计是超声波多普勒流量计,如图14-5所示。该设备的一端安装了一个微小的压电晶体(piezoelectric crystal)。当该晶体通过适当的电子设备激发时,会沿着流动的血液向下游发射频率为每秒数十万次的超声波。部分声波被流动血液中的红细胞反射。反射的超声波随后从红细胞向晶体反向传播。这些反射波的频率低于发射波,因为红细胞正在远离发射晶体。这种现象称为多普勒效应(Doppler effect)。(这与火车接近并经过时鸣笛时人们所经历的效应相同。一旦鸣笛经过人,鸣笛声的音调突然变得比火车接近时低得多。)对于图14-5所示的流量计,高频超声波被间歇性地切断,反射波被晶体接收并由电子设备大幅放大。电子设备的另一部分确定发射波和反射波之间的频率差,从而确定血流速度。只要血管的直径不发生变化,血管内血流的变化与流速的变化直接相关。
与电磁流量计一样,超声波多普勒流量计能够记录快速脉动的血流变化以及稳定流动。
血管中的层流。当血液以稳定速率流经长而光滑的血管时,它以流线形式流动,每一层血液保持与血管壁相同的距离。此外,血液的最中心部分保持在血管的中心。这种流动称为层流(laminar flow)或流线流(streamline flow),与湍流(turbulent flow)形成对比,湍流是指血液在血管中向各个方向流动并不断混合,这将在后续讨论。
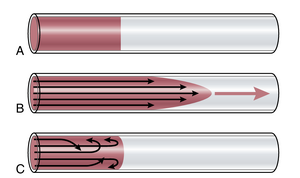
层流期间的抛物线速度分布。当发生层流时,血管中心的流速远大于靠近外缘的流速。这一现象在图14-6中得到了展示。在图14-6A中,血管内含有两种流体,左侧的流体被染料染色,右侧的流体是透明的,但血管内没有流动。当流体开始流动时,它们之间会形成一个抛物线界面,如图14-6B所示,1秒后。靠近血管壁的流体几乎没有移动,稍微远离壁的部分移动了一小段距离,而血管中心的流体则移动了很长的距离。这种现象称为血流速度的抛物线分布(parabolic profile for velocity of blood flow)。
抛物线型剖面的原因如下。由于粘附在血管壁上,接触壁的流体分子移动缓慢。下一层分子在这些分子上滑动,第三层在第二层上滑动,第四层在第三层上滑动,依此类推。因此,血管中间的流体可以快速移动,因为在血管中间和血管壁之间存在许多滑动分子层。因此,每一层向中心流动的速度都比外层快。
某些条件下的血液湍流(turbulent flow)。
当血液流速过大、通过血管中的障碍物、急转弯或经过粗糙表面时,流动可能会变得湍流(turbulent)或无序,而不是流线型(streamlined)(图14-6C)。湍流(turbulent flow)意味着血液在血管中横向和纵向流动,通常形成漩涡,称为涡流(eddy currents)。这些涡流类似于在快速流动的河流中障碍物处可以看到的漩涡。当存在涡流时,血液流动的阻力比流线型流动时大得多,因为涡流大大增加了血管中流动的总体摩擦力。
湍流(turbulent flow)的趋势与血液流速、血管直径和血液密度成正比,与血液粘度成反比,根据以下公式:
R e=\fracv\cdotd\cdotp\Pi\Pi
其中R e是雷诺数(Reynolds’ number),衡量湍流(turbulence)发生的趋势,\nu是血液的平均流速(单位为cm/sec),d是血管直径(单位为厘米),ρ是密度(单位为克/毫升),\eta是粘度(单位为泊)。血液的粘度通常约为1/30泊,密度仅略大于1。当雷诺数(Reynolds’ number)超过200到400时,湍流(turbulent flow)会在血管的某些分支处发生,但在血管的平滑部分会消失。然而,当雷诺数(Reynolds’ number)超过大约2000时,即使在直而平滑的血管中,通常也会发生湍流(turbulence)。
在血管系统中,雷诺数(Reynolds’ number)通常上升到200到400,即使在大动脉中也是如此。因此,这些血管的分支处几乎总是存在一些流动湍流(turbulence)。在主动脉和肺动脉的近端部分,雷诺数(Reynolds’ number)在心室快速射血期间可以上升到几千,这导致近端主动脉和肺动脉中出现相当大的湍流(turbulence),因为许多条件适合湍流(turbulence)的发生,例如:(1) 血液流速高;(2) 流动的脉动性;(3) 血管直径的突然变化;(4) 大血管直径。然而,在小血管中,雷诺数(Reynolds’ number)几乎从未高到足以引起湍流(turbulence)。
血压(BLOOD PRESSURE)
压力的标准单位。血压几乎总是以毫米汞柱(mmHg)为单位进行测量,因为自1846年Poiseuille发明以来,汞柱压力计一直被用作测量压力的标准参考。实际上,血压指的是血液对血管壁任何单位面积施加的力。如果血管中的压力为100mmHg,这意味着施加的力足以将汞柱推高到50毫米的高度。
偶尔,压力也会以厘米水柱(cm H2O,)为单位进行测量。10cmH2O的压力意味着足以将水柱推高到10厘米高度的压力。1毫米汞柱的压力等于1.36厘米水柱的压力,因为汞的比重是水的13.6倍,而1厘米是1毫米的10倍。
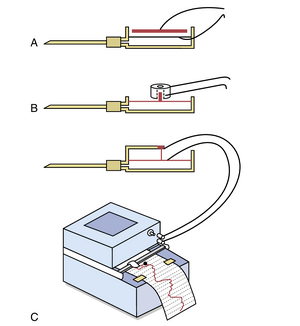
高保真血压测量方法。压力计中的汞具有很大的惯性,因此无法快速上升和下降。因此,尽管汞柱压力计非常适合记录稳定压力,但它无法响应每2到3秒发生一次的快速压力变化。每当需要记录快速变化的压力时,必须使用其他类型的压力记录器。图14-7展示了三种常用的电子压力传感器(transducer)的基本原理,这些传感器用于将血压和/或快速压力变化转换为电信号,然后通过高速电子记录器记录这些电信号。每个传感器都使用一个非常薄且高度拉伸的金属膜,该膜形成流体腔的一壁。流体腔通过插入血管中的针或导管连接到需要测量压力的血管。当压力高时,膜会略微凸起;当压力低时,膜会回到其静止位置。
在图14-7A中,一个简单的金属板放置在膜上方几百分之一厘米处。当膜凸起时,膜靠近金属板,从而增加两者之间的电容,这种电容变化可以通过适当的电子系统进行记录。
在图14-7B中,一个小铁块放置在膜上,该铁块可以向上移动进入电线线圈的中心空间。铁块进入线圈的运动增加了线圈的电感,这也可以通过电子方式记录。
最后,在图14-7C中,一根非常薄且拉伸的电阻丝连接到膜上。当这根电阻丝被大幅拉伸时,其电阻增加;当拉伸较小时,其电阻减小。这些变化也可以通过电子系统记录。
来自传感器的电信号被发送到放大器,然后发送到适当的记录设备。使用这些高保真记录系统,可以准确记录高达500次/秒的压力周期。常用的记录器能够以图14-7C中所示的方式记录20到100次/秒的快速压力变化。
血流阻力
阻力的单位。阻力是血管中血流的阻碍,但它无法通过任何直接手段测量。相反,阻力必须通过测量血管中两点之间的血流和压力差来计算。如果两点之间的压力差为1mmHg,血流为1ml/sec,则阻力被称为1个外周阻力单位,通常缩写为PRU。
用CGS单位表示阻力。有时,使用一种称为CGS(厘米、克、秒)单位的基本物理单位来表示阻力。该单位为达因sec/cm^5。这些单位中的阻力可以通过以下公式计算:
R\left(in\fracd y n e~s e cc m^5\right)=\frac1333×m mH gm l/s e c
总外周血管阻力和总肺血管阻力。通过整个循环系统的血流速率等于心脏泵血的速率——即等于心输出量。在成年人体内,这平均约为100ml/sec。从体循环动脉到体循环静脉的压力差约为100~mm Hg。因此,整个体循环的阻力,称为总外周阻力,约为100/100,即1 PRU。
在所有血管强烈收缩的情况下,总外周阻力偶尔会上升到4 PRU。相反,当血管显著扩张时,阻力可以降至0.2 PRU。
在肺系统中,平均肺动脉压为16mmHg,平均左心房压为2mmHg,净压力差为14~mm。因此,当心输出量正常约为100ml/sec时,总肺血管阻力计算为约0.14 PRU(约为体循环阻力的七分之一)。
血管中的血流传导性是阻力的倒数。传导性是在给定压力差下通过血管的血流量的度量。该测量通常以ml/sec每毫米Hg压力表示,但也可以以L/sec每mmHg或任何其他血流和压力单位表示。
显然,传导性是阻力的倒数,符合以下方程:
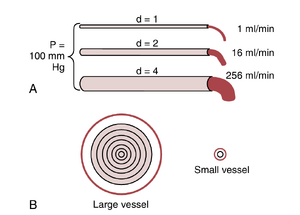
血管直径的微小变化显著改变其传导性(conductance)。当血流呈层流时,血管直径的轻微变化会导致血管传导血液的能力发生巨大变化。这一现象如图14-8A所示,图中显示了三个相对直径分别为1、2和4的血管,但血管两端的压力差相同,均为100mmHg。尽管这些血管的直径仅增加了四倍,但相应的流量分别为1、16和256~ml/min,即流量增加了256倍。因此,血管的传导性与直径的四次方成正比,符合以下公式:
传导性(conductance) \infty 直径4
泊肃叶定律(Poiseuille’s Law)。当直径增加时,传导性大幅增加的原因可以参考图14-8B来解释,该图显示了大血管和小血管的横截面。血管内的同心环表明,由于层流(laminar flow),每个环中的流速与相邻环中的流速不同,这一点在本章前面已经讨论过。也就是说,由于血液粘附在血管内皮上,接触血管壁的环中的血液几乎不流动。靠近血管中心的下一环血液滑过第一环,因此流动得更快。同样,第三、第四、第五和第六环的流速逐渐增加。因此,靠近血管壁的血液流动缓慢,而血管中间的血液流动速度要快得多。
在小血管中,基本上所有的血液都靠近管壁,因此极快流动的中心血流根本不存在。通过积分所有同心环中流动血液的速度并乘以环的面积,可以推导出以下公式,称为泊肃叶定律(Poiseuille’s law):
传导性(conductance)=\frac1阻力(resistance)
F=\fracπΔP r^48n|
其中F为血流量,ΔP为血管两端的压力差,r为血管半径,l为血管长度,\boldsymbol\mathfrakn为血液粘度。
特别要注意的是,在这个方程中,血流量与血管半径的四次方成正比,这再次表明血管直径(等于半径的两倍)在所有因素中对血管中血流量的影响最大。
血管直径四次方定律在决定小动脉阻力中的重要性。在体循环中,约三分之二的总体循环血流阻力来自于小动脉。小动脉的内径范围从4微米到25微米不等。然而,它们强韧的血管壁使得内径可以发生显著变化,通常可达四倍之多。根据之前讨论的血管直径与血流关系的四次方定律,可以看到血管直径增加四倍可以使血流增加多达256倍。因此,这一四次方定律使得小动脉能够通过仅对神经信号或局部组织化学信号作出微小直径变化,几乎完全关闭流向组织的血流,或者在另一极端情况下,导致血流的大幅增加。在最大小动脉收缩和最大小动脉扩张的范围内,已记录到不同组织区域的血流变化范围超过100倍。
串联和并联血管回路中的血流阻力。心脏泵出的血液从体循环的高压部分(即主动脉)流向低压部分(即腔静脉),通过数英里长的血管串联和并联排列。动脉、小动脉、毛细血管、小静脉和静脉共同以串联方式排列。当血管以串联方式排列时,通过每根血管的血流是相同的,总血流阻力(Rtotal)等于每根血管阻力的总和:
Rtotal=R1+R2+R3+R4...
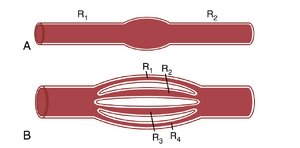
因此,总外周血管阻力等于动脉、小动脉、毛细血管、小静脉和静脉阻力的总和。在图14-9A所示的例子中,总血管阻力等于R1和R2的总和。
血管广泛分支形成并联回路,为身体的许多器官和组织供血。这种并联排列使得每个组织能够在很大程度上独立于其他组织的血流调节自身的血流。
对于以并联方式排列的血管(图14-9B),总血流阻力表示为:
\frac1R\tan=\frac1R1+\frac1R2+\frac1R3+\frac1R4\cdots
显然,对于给定的压力梯度,通过这种并联系统的血流量将远远大于通过任何单个血管的血流量。因此,总阻力远远小于任何单个血管的阻力。图14-9B中每根并联血管的血流由压力梯度和其自身的阻力决定,而不是其他并联血管的阻力。然而,增加任何血管的阻力都会增加总血管阻力。
在一个循环系统中增加更多的血管反而会降低总血管阻力(Total Vascular Resistance),这似乎是一个悖论。然而,许多并联的血管使得血液更容易流过循环系统,因为每一条并联的血管都为血液流动提供了另一条通路或电导(Conductance)。血液流动的总电导\left(Ctotal\right)是每条并联通路的电导之和:
Ct o t a l= C1+ C2+ C3+ C4\ldots
例如,脑、肾、肌肉、胃肠道、皮肤和冠状动脉循环是并联排列的,每个组织都对体循环的总电导有所贡献。通过每个组织的血流量是总血流量(心输出量(Cardiac Output))的一部分,由该组织中血液流动的阻力(电导的倒数)以及压力梯度决定。因此,截肢或手术切除肾脏也会移除一个并联的循环通路,从而降低总血管电导和总血流量(即心输出量),同时增加总外周血管阻力(Total Peripheral Vascular Resistance)。
血液红细胞压积和血液粘度对血管阻力和血流量的影响
需要注意的是,泊肃叶方程(Poiseuille’s Equation)中的另一个重要因素是血液的粘度(Viscosity)。如果其他因素保持不变,粘度越大,血管中的流量就越低。此外,正常血液的粘度大约是水的三倍。
是什么使血液如此粘稠?主要是血液中悬浮的大量红细胞,每个红细胞都会对相邻细胞和血管壁产生摩擦阻力。
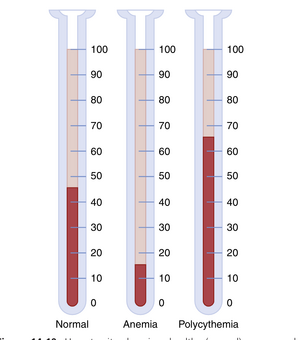
红细胞压积(Hematocrit)——红细胞占血液的比例。如果一个人的红细胞压积为40,这意味着40%的血液体积是细胞,其余是血浆(Plasma)。成年男性的红细胞压积平均约为42,而女性平均约为38。这些值可能会有很大变化,取决于一个人是否患有贫血、身体活动程度以及居住的海拔高度。这些红细胞压积的变化将在第33章中与红细胞及其氧气运输功能的关系中讨论。
红细胞压积是通过将血液在标定管中离心来确定的,如图14-10所示。标定可以直接读取细胞的百分比。
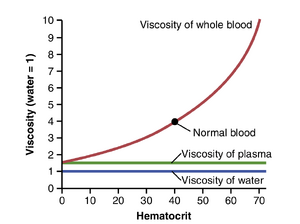
血细胞比容显著增加会显著增加血液粘度。如图14-11所示,随着血细胞比容(hematocrit)的增加,血液的粘度显著增加。正常血细胞比容下,全血的粘度约为3到4,这意味着推动全血通过血管所需的压力是推动水通过相同血管所需压力的三到四倍。当血细胞比容上升到60或70时(这在红细胞增多症(polycythemia)患者中很常见),血液的粘度可以达到水的10倍,其通过血管的流动会大大减慢。
影响血液粘度的其他因素包括血浆蛋白浓度和血浆中的蛋白质类型,但这些影响远小于血细胞比容的影响,因此在大多数血流动力学研究中并不重要。血浆的粘度约为水的1.5倍。
压力对血管阻力和组织血流的影响
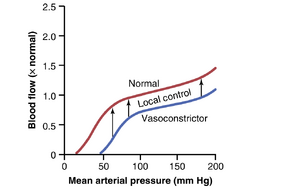
自动调节减弱了动脉压力对组织血流的影响。从目前的讨论来看,人们可能会预期动脉压力的增加会导致通过身体组织的血流成比例增加。然而,如图14-12所示,动脉压力对许多组织中血流的影响通常远小于预期。这是因为动脉压力的增加不仅增加了推动血液通过血管的力,还通过激活局部控制机制在几秒钟内启动了血管阻力的补偿性增加(第17章讨论)。相反,随着动脉压力的降低,大多数组织中的血管阻力会迅速降低,血流保持在相对恒定的速率。每个组织在动脉压力变化(大约在70到175mmHg之间)时调整其血管阻力并维持正常血流的能力称为血流自动调节(blood flow autoregulation)。
请注意,在图14-12中,血流的变化可能是由强烈的交感神经刺激引起的,这种刺激会使血管收缩。同样,激素性血管收缩剂(如去甲肾上腺素(norepinephrine)、血管紧张素II(angiotensin II)、血管加压素(vasopressin)或内皮素(endothelin))也可以减少血流,至少是暂时性的。
在大多数组织中,血流变化很少持续超过几个小时,即使动脉压力增加或血管收缩剂(vasoconstrictors)水平持续升高。血流相对恒定的原因是,每个组织的局部自动调节机制(autoregulatory mechanisms)最终会覆盖血管收缩剂的大部分效应,以提供适合组织需求的血流。
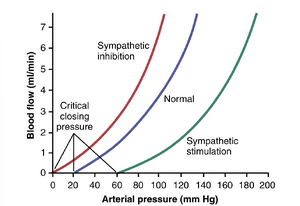
被动血管床中的压力-血流关系。在孤立的血管或不表现出自动调节的组织中,动脉压力的变化可能对血流产生重要影响。压力对血流的影响可能比泊肃叶方程(Poiseuille’s equation)预测的要大,如图14-13中向上弯曲的线所示。这是因为增加的动脉压力不仅增加了推动血液通过血管的力,还扩张了弹性血管,实际上降低了血管阻力(vascular resistance)。相反,被动血管中动脉压力的降低会随着弹性血管因扩张压力减少而逐渐塌陷,从而增加阻力。当压力降至临界水平以下时,称为临界闭合压力(critical closing pressure),血流停止,因为血管完全塌陷。
交感神经刺激(sympathetic stimulation)和其他血管收缩剂可以改变图14-13中所示的被动压力-血流关系。因此,抑制交感神经活动会大大扩张血管,并可以使血流增加两倍或更多。相反,非常强烈的交感神经刺激可以使血管收缩到如此程度,以至于尽管动脉压力很高,血流偶尔会减少到零,持续几秒钟。
实际上,很少有生理条件下组织表现出图14-13中所示的被动压力-血流关系。即使在动脉压力急性变化期间不能有效自动调节血流的组织中,当压力变化持续时,血流也会根据组织的需求进行调节,如第17章所述。
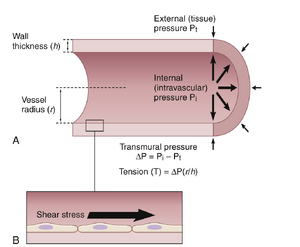
血管壁张力。血管壁张力是由于跨壁压力梯度而产生的,并导致血管平滑肌和内皮细胞在各个方向上拉伸(图14-14A)。根据拉普拉斯定律(Laplace's law),薄壁管的壁张力(T)与跨壁压力梯度(ΔP)乘以血管半径(r)除以其壁厚度(h)成正比:
T=ΔP×(r/h)
因此,暴露在高压力下的较大血管,如主动脉,必须具有更强的管壁以承受更高的张力,并且通常由胶原纤维带加固。相比之下,毛细血管的半径要小得多,因此受到的管壁张力要低得多,这使得它们能够承受某些器官(如肾脏)中高达65至70mmHg的压力。正如第17章所讨论的,血压的长期变化会导致血管的重塑,以适应管壁张力的相关变化。
血管剪切应力。当血液流动时,它会在血管内壁的内皮细胞上产生摩擦力或阻力(见图14-14B)。这种力称为剪切应力,它与血流速度和血液粘度成正比,与半径的立方成反比,通常以力/单位面积表示(例如,达因^\primec m^2.)。在临床实践中,没有一种常用的方法来测量剪切应力。然而,尽管与收缩力或血压引起的管壁拉伸相比,剪切应力的相对较低,但它在血管系统的发育和适应中起着重要作用,以满足组织的血流需求。内皮细胞含有多种蛋白质,这些蛋白质共同作为机械传感器,并在胚胎发育期间调节信号通路以塑造血管系统,并在成年后继续改变血管形态以优化血液向组织的输送,这将在第17章进一步讨论。
参考文献
参见第15章的参考文献。
血管的扩张性和动脉与静脉系统的功能
血管的扩张性
血管系统的一个宝贵特性是所有血管都具有扩张性。动脉的扩张性使它们能够适应心脏的脉动输出并平均压力脉动。这种能力提供了通过组织中的非常小血管的平滑连续血流。
所有血管中最具扩张性的是静脉。即使是静脉压力的轻微增加也会导致静脉储存0.5至1.0升的额外血液。因此,静脉提供了一个储存大量额外血液的储库,可以在循环中其他地方需要血液时调用。
血管扩张性的单位。血管扩张性通常表示为每毫米汞柱压力上升时体积的分数增加,根据以下公式:
血管扩张性 = 体积增加 压力增加 × 原始体积
也就是说,如果1mmHg导致原本含有10ml血液的血管体积增加1ml,则扩张性为每毫米汞柱0.1,或每mmHg 10%。
静脉比动脉更具扩张性。动脉的管壁比静脉的管壁更厚且更强。因此,平均而言,静脉的扩张性大约是动脉的八倍。也就是说,给定压力的增加会导致静脉中的血液增加量是同等大小动脉的八倍。
在肺循环中,肺静脉的扩张性(distensibility)与体循环相似。然而,肺动脉通常在约为体循环动脉系统压力的六分之一的情况下运作,其扩张性相应地更大——约为体循环动脉的六倍。
血管顺应性(VASCULAR COMPLIANCE)(或血管容量(VASCULAR CAPACITANCE))
在血流动力学研究中,通常更重要的是知道在循环的某个部分中,每毫米汞柱(mm Hg)压力上升时可以储存的总血量,而不是知道单个血管的扩张性。这个值被称为相应血管床的顺应性(compliance)或容量(capacitance);即:
顺应性和扩张性是完全不同的。一个具有高扩张性但体积较小的血管,其顺应性可能远低于一个扩张性较低但体积较大的血管,因为顺应性等于扩张性乘以体积。
体循环静脉的顺应性约为其相应动脉的24倍,因为它的扩张性约为动脉的8倍,体积约为动脉的3倍(8 ×3=24.)。
动脉和静脉循环的容积-压力曲线(VOLUME-PRESSURE CURVES)
表达血管或循环任何部分中压力与体积关系的一种便捷方法是使用容积-压力曲线。图15-1中的红色和蓝色实线分别代表正常体循环动脉系统和静脉系统的容积-压力曲线,显示当平均成年人的动脉系统(包括所有大动脉、小动脉和小动脉)充满约700~ml血液时,平均动脉压力为100mmHg,但当仅充满400ml血液时,压力降至零。
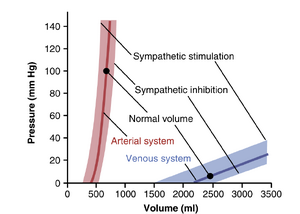
在整个体循环静脉系统中,体积通常在2000到3500~ml之间,需要数百毫升的体积变化才能使静脉压力仅变化3到5mmHg。这主要解释了为什么可以在几分钟内向健康人输注多达半升的血液而不会显著改变循环功能。
交感神经刺激或交感神经抑制对动脉和静脉系统容积-压力关系的影响
图15-1还展示了当血管交感神经兴奋或抑制时对容积-压力曲线的影响。显然,交感神经刺激引起的血管平滑肌张力增加会增加动脉或静脉在每个容积下的压力,而交感神经抑制则会降低每个容积下的压力。通过这种方式,交感神经对血管的控制是一种有价值的手段,可以减少循环系统中某一部分的容积,从而将血液转移到其他部分。例如,全身循环中血管张力的增加可以导致大量血液转移到心脏,这是身体用来快速增加心脏泵血的主要方法之一。
在出血期间,交感神经对血管容量的控制也非常重要。交感神经张力的增强,尤其是对静脉的增强,可以显著减小血管的尺寸,使得循环系统即使在总血容量损失高达25%的情况下仍能几乎正常运作。
血管的延迟顺应性(应力松弛)
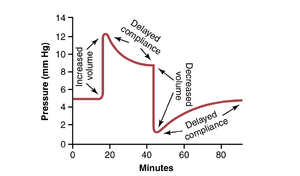
延迟顺应性(delayed compliance)这一术语意味着,当血管暴露于增加的容积时,最初会表现出压力的大幅增加,但随着时间的推移,血管壁平滑肌的逐渐延迟拉伸使得压力在几分钟到几小时内恢复到接近正常水平。这一效应如图15-2所示。在该图中,记录了一段两端被阻塞的静脉小段的压力。突然注入额外的血液,直到压力从5 mmHg上升到12 mmHg。尽管注入后没有移除任何血液,压力立即开始下降,并在几分钟后接近约9 mmHg。因此,注入的血液量首先引起静脉的即时弹性扩张,但随后静脉的平滑肌纤维开始逐渐延长,其张力相应减小。这种效应是所有平滑肌的特征,称为应力松弛(stress-relaxation),如第8章所述。
延迟顺应性是一种有价值的机制,使得循环系统在必要时能够容纳额外的血液,例如在大输血后。相反方向的延迟顺应性是循环系统在严重出血后自动调整自身以适应减少的血容量的一种方式,这一过程通常需要几分钟到几小时。
动脉压力搏动
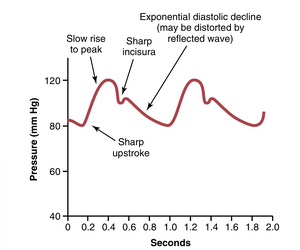
随着心脏的每一次跳动,新的血液涌入动脉。如果不是动脉系统的扩张性(distensibility),所有这些新血液几乎必须在心脏收缩期(systole)瞬间流经外周血管,而在舒张期(diastole)则不会有血流。然而,动脉树的顺应性(compliance)通常会在血液到达毛细血管时将压力脉动(pressure pulsations)减少到几乎没有脉动;因此,组织血流主要是连续的,脉动非常小。
主动脉根部的压力脉动如图15-3所示。在健康的年轻成年人中,每次脉动的最高点称为收缩压(systolic pressure),约为120mmHg。每次脉动的最低点称为舒张压(diastolic pressure),约为80mmHg。这两个压力之间的差异,约为40mm Hg,称为脉压(pulse pressure)。
影响脉压的两个主要因素是:(1)心脏的每搏输出量(stroke volume output);(2)动脉树的顺应性(compliance)(总扩张性(total distensibility))。第三个不太重要的因素是心脏在收缩期射血的特征。
一般来说,每搏输出量越大,每次心跳时动脉树中必须容纳的血液量就越多,因此,收缩期和舒张期的压力上升和下降幅度越大,从而导致更大的脉压。相反,动脉系统的顺应性越小,对于给定的每搏输出量,压力上升的幅度越大。例如,如图15-4中的中间顶部曲线所示,老年时脉压有时会上升到正常值的两倍,因为动脉因动脉硬化(arteriosclerosis)而变硬,因此相对不顺应。
实际上,脉压大致由每搏输出量与动脉树顺应性的比率决定。任何影响这两个因素之一的循环条件也会影响脉压:
脉压 \approx 每搏输出量/动脉顺应性
异常压力脉动轮廓
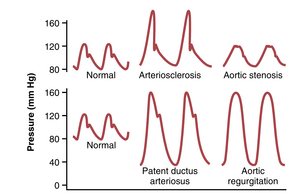
一些循环的病理生理条件除了改变脉压外,还会导致压力脉动波的异常轮廓。这些条件中特别显著的是主动脉狭窄(aortic stenosis)、动脉导管未闭(patent ductus arteriosus)和主动脉反流(aortic regurgitation),每种情况如图15-4所示。
在主动脉瓣狭窄(aortic valve stenosis)的患者中,主动脉瓣开口的直径显著减小,由于通过狭窄瓣膜的血流减少,主动脉压力脉动显著降低。
在患有动脉导管未闭(patent ductus arteriosus)的患者中,左心室泵入主动脉的血液有50%或更多会立即通过开放的导管反向流入肺动脉和肺血管,从而使舒张压在下一次心跳前降至非常低的水平,并增加脉压。
在患有主动脉瓣关闭不全(aortic regurgitation)的患者中,主动脉瓣缺失或不能完全关闭。因此,每次心跳后,刚刚被泵入主动脉的血液会立即反向流入左心室。结果,主动脉压力在心跳之间可以降至零。此外,由于没有主动脉瓣关闭,主动脉脉搏轮廓中没有切迹(incisura)。
压力脉搏向周围动脉的传递

当心脏在收缩期将血液射入主动脉时,最初只有主动脉的近端部分扩张,因为血液的惯性阻止了血液突然向周围移动。然而,主动脉近端压力的迅速上升克服了这种惯性,扩张的波前沿着主动脉越来越远地传播,如图15-5所示。这种现象称为动脉中压力脉搏的传递。
图15-6. 脉搏波向较小血管传播时脉搏压力轮廓的变化。
压力脉搏传递的速度在正常主动脉中为3到5m/秒,在大动脉分支中为7到10m/sec,在小动脉中为15到35m/sec。一般来说,每个血管段的顺应性(compliance)越大,传递速度越慢,这解释了主动脉中传递速度较慢,而在顺应性小得多的远端小动脉中传递速度快得多。在主动脉中,压力脉搏的传递速度是血流速度的15倍或更多,因为压力脉搏只是一个移动的压力波,几乎不涉及血液体积的前向运动。
压力脉搏在较小的动脉、小动脉和毛细血管中受到阻尼(damping)。图15-6显示了脉搏向周围血管传播时压力脉搏轮廓的典型变化。特别要注意的是,在下面三条曲线中,较小动脉、小动脉和特别是毛细血管中的搏动强度逐渐减弱。事实上,只有当主动脉搏动非常大或小动脉显著扩张时,才能在毛细血管中观察到搏动。
这种周围搏动逐渐减弱的现象称为压力脉搏的阻尼(damping of the pressure pulses)。这种阻尼的原因有两个:(1) 血管中血液运动的阻力(resistance);(2) 血管的顺应性(compliance)。阻力对搏动产生阻尼是因为在脉搏波前必须有一小部分血液向前流动以使血管的下一个段扩张;阻力越大,这种情况越难发生。顺应性对搏动产生阻尼是因为血管的顺应性越大,脉搏波前需要更多的血液才能引起压力增加。
因此,阻尼的程度几乎与阻力乘以顺应性的乘积成正比。
测量收缩压和舒张压的临床方法
在人类患者中进行常规动脉压测量时,使用需要将针插入动脉的压力记录器并不实际,尽管在某些特殊研究需要时,这些类型的记录器会被使用。相反,临床医生通常通过间接方法,通常是听诊法(auscultatory method),来确定收缩压和舒张压。
听诊法。图15-7展示了用于确定动脉收缩压和舒张压的听诊法。将听诊器放置在肘动脉(antecubital artery)上,并在上臂周围充气血压袖带。只要袖带继续以不足以关闭肱动脉(brachial artery)的压力压缩手臂,听诊器就听不到肘动脉的声音。然而,当袖带压力足够大,能够在动脉压力周期的部分时间内关闭动脉时,每次搏动都会听到声音。这些声音被称为Korotkoff音(Korotkoff sounds),以俄罗斯医生Nikolai Korotkoff的名字命名,他在1905年描述了这些声音。
Korotkoff音被认为主要是由血液通过部分闭塞的血管喷射以及血管壁的振动引起的。喷射在袖带之外的血管中引起湍流(turbulence),这种湍流通过听诊器产生可听到的振动。
在使用听诊法测量血压时,首先将袖带压力升高到远高于动脉收缩压的水平。只要袖带压力高于收缩压,肱动脉就会保持塌陷状态,因此在压力周期的任何部分都不会有血液喷射到下方的动脉中。因此,下方的动脉中听不到Korotkoff音。然后逐渐降低袖带压力。一旦袖带压力低于收缩压(图15-7中的点B),在收缩压峰值期间,血液开始通过袖带下方的动脉流动,并且开始听到与心跳同步的肘动脉的敲击声。一旦开始听到这些声音,连接到袖带的压力计指示的压力水平大约等于收缩压。
随着袖带压力的进一步降低,Korotkoff音的音质发生变化,敲击音减少,而节奏感和粗糙感增加。最后,当袖带压力接近舒张压时,声音突然变为沉闷的音质(图15-7中的C点)。当Korotkoff音变为沉闷音质时,记录下压力计的压力,该压力大约等于舒张压,尽管它略微高估了通过直接动脉内导管测定的舒张压。当袖带压力再降低几毫米汞柱时,动脉在舒张期不再关闭,这意味着导致声音的基本因素(血液通过受压动脉的喷射)不再存在。因此,声音完全消失。许多临床医生认为,Korotkoff音完全消失时的压力应作为舒张压,除非在某些情况下,声音的消失无法可靠确定,因为即使在袖带完全放气后,仍能听到声音。例如,在患有动静脉瘘进行血液透析或主动脉瓣关闭不全的患者中,袖带完全放气后仍可能听到Korotkoff音。
图15-7. 测量收缩压和舒张压的听诊法。
用于确定收缩压和舒张压的听诊法并不完全准确,但它通常给出的值与通过动脉内直接导管测量得到的值相差在10%以内。
自动示波法。收缩压和舒张压通常使用自动示波设备测量。这些设备使用血压计袖带,类似于听诊法,但使用电子压力传感器来检测血液流经动脉(通常是肱动脉)时袖带压力的振荡。示波动脉压设备使用特定的电子算法自动充气和放气袖带,并解释袖带压力的振荡。当袖带充气且其压力超过收缩压时,动脉中没有血流,袖带压力也没有振荡。随着袖带缓慢放气,血液开始通过动脉喷射,袖带压力随之与动脉的周期性扩张和收缩同步振荡。随着袖带压力的下降,振荡幅度增加到最大值,这对应于平均动脉压。当袖带压力低于患者的舒张压时,振荡幅度下降,血液平稳地流经动脉。使用设备特定的算法,袖带压力振荡自动转换为数字收缩压和舒张压信号以及心率,并显示出来。
振荡法动脉血压监测仪比听诊法需要更少的技能,患者可以在家中使用,避免了所谓的白大褂效应,即当医疗专业人员在场时,某些患者的血压会升高。然而,这些设备必须进行校准以确保准确性,在袖带尺寸不合适或某些异常循环条件下(如严重的动脉硬化,这会增加动脉壁的硬度),可能会产生不可靠的测量结果。
通过听诊法和振荡法测量的正常动脉血压。图15-8显示了不同年龄段的近似正常收缩压和舒张压。随着年龄的增长,血压逐渐升高是由于年龄对血压控制机制的影响。我们将在第19章中看到,肾脏主要负责这种长期的动脉血压调节;众所周知,肾脏会随着年龄的增长表现出明确的变化,尤其是在50岁以后。
通常在60岁以后,收缩压会略有额外增加。这种增加是由于动脉的扩张性降低或硬化,这通常是动脉粥样硬化的结果。最终效果是收缩压升高,脉压显著增加,如前所述。
平均动脉压。平均动脉压是在一段时间内逐毫秒测量的动脉血压的平均值。它不等于收缩压和舒张压的平均值,因为在正常心率下,心脏周期中舒张期所占的比例大于收缩期。因此,在心脏周期的大部分时间里,动脉血压更接近舒张压而不是收缩压。因此,平均动脉压大约由60%的舒张压和40%的收缩压决定。请注意,在图15-8中,所有年龄段的平均压力(绿色实线)更接近舒张压而不是收缩压。然而,在非常高的心率下,舒张期占心脏周期的比例较小,平均动脉压更接近收缩压和舒张压的平均值。
图15-8. 收缩压、舒张压和平均动脉压随年龄的变化。阴影区域显示了近似的正常范围。
静脉及其功能
静脉为血液流向心脏提供了通道,但它们还执行其他特殊功能,这些功能对循环系统的运行是必要的。特别重要的是,静脉能够收缩和扩张,从而储存少量或大量的血液,并在循环系统的其余部分需要时提供这些血液。外周静脉还可以通过所谓的静脉泵推动血液向前流动,它们甚至有助于调节心输出量,这是一个极其重要的功能,将在第20章中详细描述。
静脉压——右心房压(中心静脉压)和外周静脉压
来自所有体循环静脉的血液流入心脏的右心房。因此,右心房的压力被称为中心静脉压(central venous pressure)。
右心房压力由以下两个因素的平衡调节:(1)心脏将血液从右心房和右心室泵入肺的能力;(2)血液从外周静脉流入右心房的趋势。如果右心泵血能力强,右心房压力会降低。相反,心脏功能减弱会升高右心房压力。此外,任何导致血液从外周静脉快速流入右心房的因素都会升高右心房压力。一些可以增加静脉回流从而升高右心房压力的因素包括:(1)血容量增加;(2)全身大血管张力增加,导致外周静脉压力升高;(3)小动脉扩张,这会降低外周阻力,使血液从动脉快速流入静脉。
调节右心房压力的因素同样也参与了心输出量(cardiac output)的调节,因为心脏泵出的血量既取决于心脏的泵血能力,也取决于血液从外周血管流入心脏的趋势。因此,我们将在第20章中结合心输出量调节更深入地讨论右心房压力的调节。
正常右心房压力约为0mmHg,等于身体周围的大气压。在非常异常的情况下,例如:(1)严重心力衰竭;或(2)大量输血后,右心房压力可升高至20至30mmHg,这会显著增加总血容量并导致大量血液试图从外周血管流入心脏。
右心房压力的下限通常比大气压低约^-3至-5mmHg,这也是心脏周围胸腔内的压力。当心脏泵血异常有力或外周血管流入心脏的血流显著减少时(例如严重出血后),右心房压力会接近这些低值。
静脉阻力与外周静脉压力
当大静脉扩张时,其对血流的阻力非常小,几乎为零。然而,如图15-9所示,大多数进入胸腔的大静脉在许多点被周围组织压迫,导致血流在这些点受阻。例如,来自手臂的静脉在第一肋骨处的锐角处被压迫。此外,颈部静脉的压力通常会降低到如此低的水平,以至于颈部外部的大气压导致这些静脉塌陷。最后,穿过腹部的静脉通常被不同的器官和腹内压压迫,因此它们通常至少部分塌陷成椭圆形或狭缝状。由于这些原因,大静脉通常确实会对血流产生一定的阻力,因此,躺下的人的外周小静脉压力通常比右心房压力高+4至+6~mmHg。
高右心房压力对外周静脉压力的影响
当右心房压力(high right atrial pressure)上升到超过其正常值0mmHg时,血液开始在大静脉中回流。这种血液回流会使静脉扩张,甚至当右心房压力上升到+4至+6~mmHg时,静脉中的塌陷点也会打开。随后,随着右心房压力进一步上升,额外的增加会导致四肢及其他部位的外周静脉压力(peripheral venous pressure)相应上升。由于心脏功能必须显著受损才能导致右心房压力上升到+4至+6~mmHg,因此在心力衰竭的早期阶段,只要人体处于休息状态,外周静脉压力不会显著升高。
图15-9. 倾向于使进入胸腔的静脉塌陷的压迫点。
腹内压力对腿部静脉压力的影响
在仰卧位的人体中,腹腔内的压力(intra-abdominal pressure)通常平均为+6mmHg,但由于怀孕、大肿瘤、腹部肥胖或腹腔内过多液体(称为腹水(ascites))等原因,压力可能上升到+15至+30mmHg。当腹内压力上升时,腿部静脉的压力必须超过腹内压力,腹部的静脉才会打开,允许血液从腿部流向心脏。因此,如果腹内压力为+20mmHg,股静脉中的最低压力也约为+20mmHg。
重力压力对静脉压力的影响
在任何暴露于空气中的水体中,水表面的压力等于大气压,但每深入水面以下13.6毫米,压力就会增加1mmHg。这种压力是由水的重量引起的,因此被称为重力压力(gravitational pressure)或静水压力(hydrostatic pressure)。
图15-10. 重力压力对站立者全身静脉压力的影响。
由于血管中血液的重量,重力压力也出现在血管系统中,如图15-10所示。当人体站立时,右心房的压力保持在约0mmHg,因为心脏会将任何试图在此点积聚的多余血液泵入动脉。然而,在一个完全静止站立的成年人中,脚部静脉的压力约为+90mmHg,这仅仅是由于心脏和脚部之间静脉中血液的重力重量。身体其他部位的静脉压力按比例介于0和90mmHg之间。
在手臂的静脉中,由于锁骨下静脉在通过第一肋骨时受到压迫,第一肋骨水平的压力通常约为+6mmHg。手臂长度上的重力压力则由该肋骨水平以下的距离决定。因此,如果肋骨水平和手之间的重力差为+29mmHg,这个重力压力会加上静脉通过肋骨时受压引起的+6mmHg压力,使得手部静脉的总压力达到+35~mm Hg。
直立站立时,由于颈部外部的大气压力,颈部静脉几乎完全塌陷至颅骨。这种塌陷使得这些静脉的压力在整个长度上保持为零。任何压力上升的趋势都会打开静脉,使血液流动,从而使压力回落到零。相反,任何颈部静脉压力下降的趋势都会使静脉进一步塌陷,增加其阻力,并再次使压力回到零。
另一方面,颅骨内的静脉位于一个无法塌陷的腔室(颅腔)中。因此,头部的硬脑膜窦中可以存在负压;在站立位置,由于颅顶和颅底之间的静水“吸力”,大脑顶部的矢状窦静脉压力约为^-10 mmHg。因此,如果在手术中打开矢状窦,空气可能会立即被吸入静脉系统;空气甚至可能向下流动,导致心脏中的空气栓塞和死亡。
重力因素对动脉和其他压力的影响。重力因素也会影响外周动脉和毛细血管的压力。例如,一个站立的人,心脏水平的平均动脉压力为100mmHg,脚部的动脉压力约为190mmHg。因此,当动脉压力被描述为100mmHg时,通常意味着100mmHg是心脏重力水平的压力,但不一定是动脉血管其他部位的压力。
静脉瓣膜和静脉泵:它们对静脉压力的影响
如果没有静脉中的瓣膜,重力压力效应会使站立成人的脚部静脉压力始终约为+90mmHg。然而,每次腿部移动时,肌肉会收紧并压缩肌肉内或邻近的静脉,从而将血液挤出静脉。然而,如图15-11所示,静脉中的瓣膜排列使得静脉血流方向只能朝向心脏。因此,每次移动腿部或甚至紧张腿部肌肉时,一定量的静脉血液会被推向心脏。这个泵系统被称为静脉泵或肌肉泵,其效率足以使行走成人的脚部静脉压力在正常情况下保持在+20mmHg以下。
如果一个人完全静止站立,静脉泵(venous pump)将无法工作,大约30秒内,小腿的静脉压力会增加到完全的重力值90mmHg。毛细血管的压力也会大幅增加,导致液体从循环系统渗漏到组织间隙。结果,腿部肿胀,血容量减少;在完全静止站立15到30分钟内,循环系统中的血容量可能会减少10%到20%,这可能导致晕厥,有时在士兵立正站立时会发生这种情况。这种情况可以通过定期轻微弯曲腿部肌肉和稍微弯曲膝盖来避免,从而使静脉泵能够工作。
图15-11. 腿部的静脉瓣膜。
静脉瓣膜功能不全导致静脉曲张。
当静脉因持续数周或数月的过高静脉压力而被过度拉伸时,静脉系统的瓣膜可能会变得功能不全甚至被破坏,这种情况可能发生在怀孕期间或当一个人大部分时间站立时。拉伸静脉会增加其横截面积,但瓣膜的瓣叶不会增大。因此,瓣膜的瓣叶不再完全闭合。由于这种不完全闭合,腿部静脉的压力因静脉泵的失效而大幅增加,这进一步增加了静脉的大小,最终完全破坏了瓣膜的功能。因此,人会发展出所谓的静脉曲张(varicose veins),其特征是整个腿部特别是小腿的皮肤下静脉出现大的球状突起。
每当患有静脉曲张的人站立超过几分钟时,静脉和毛细血管的压力会变得非常高,毛细血管的液体渗漏会导致腿部持续水肿。水肿反过来又阻止了营养物质从毛细血管向肌肉和皮肤细胞的充分扩散,因此肌肉变得疼痛和无力,皮肤甚至可能发生坏疽和溃疡。这种情况的最佳治疗方法是持续将腿部抬高到至少与心脏齐平的位置。在腿部使用紧身绷带或长压缩袜也可以在很大程度上帮助预防水肿及其后遗症。
静脉压力的临床估计
静脉压力通常可以通过简单地观察外周静脉特别是颈部静脉的扩张程度来估计。例如,在坐姿下,正常安静休息的人的颈部静脉永远不会扩张。然而,当右心房压力增加到+10mmHg时,颈部下部的静脉开始突出,当心房压力达到+15mmHg时,颈部几乎所有的静脉都会扩张。
静脉压和右心房压的直接测量
静脉压可以通过直接将针插入静脉并连接到压力记录仪来轻松测量。准确测量右心房压的唯一方法是通过外周静脉插入导管并进入右心房。通过这种中心静脉导管测量的压力通常用于某些类型的住院心脏病患者,以持续评估心脏泵血能力。
测量静脉和其他循环压力的压力参考水平
尽管我们提到右心房压力为0mmHg,动脉压力为100mmHg,但我们并未说明这些压力所参考的循环系统中的重力水平。在循环系统中有一个点,健康人体位变化引起的重力压力因素通常不会使压力测量值超过1到2mmHg。这个点位于或接近三尖瓣的水平,如图15-12中的交叉轴所示。因此,本文讨论的所有循环压力测量都是参考这个水平,称为压力测量的参考水平。
三尖瓣处缺乏重力效应的原因是心脏自动防止该点压力的显著重力变化,具体方式如下:如果三尖瓣处的压力略微高于正常值,右心室会比平时更多地充盈,导致心脏更快地泵血,从而使三尖瓣处的压力回降到正常平均值。相反,如果压力下降,右心室无法充分充盈,其泵血减少,血液在静脉系统中积聚,直到三尖瓣处的压力再次上升到正常值。换句话说,心脏充当了三尖瓣处压力的反馈调节器。
当一个人平躺时,三尖瓣几乎正好位于背部前方胸部厚度的60%处。这是躺下时的零压力参考水平。
静脉的血液储存功能
我们在第14章中指出,循环系统中超过60%的血液通常位于静脉中。由于这个原因,以及静脉的顺应性,静脉系统充当了循环的血液储存库。
当身体失血,动脉压开始下降时,颈动脉窦和循环系统中其他压力敏感区域会引发神经信号,如第18章所述。这些信号反过来引发来自大脑和脊髓的神经信号,主要通过交感神经作用于静脉,使其收缩。这个过程弥补了因失血而导致的循环系统中的大部分松弛。即使总血容量损失高达20%,由于静脉的这种可变储存功能,循环系统通常仍能几乎正常运作。
图 15-12. 循环压力测量的参考点(位于三尖瓣附近)。
特定的血液储存库
循环系统的某些部分非常广泛和/或非常顺应,因此被称为特定的血液储存库。这些储存库包括以下部分:(1) 脾脏,有时可以缩小到足以释放多达 100~ml 的血液进入循环的其他区域;(2) 肝脏,其窦状隙可以释放几百毫升的血液进入循环的其余部分;(3) 腹部大静脉,可以贡献多达 300~ml;(4) 皮肤下的静脉丛,也可以贡献几百毫升。心脏和肺虽然不是体循环静脉储存系统的一部分,但也可以被视为血液储存库。例如,心脏在交感神经刺激下会收缩,从而可以贡献约 50 到 100 毫升的血液;当肺压降低到低值时,肺可以再贡献 100 到 200 毫升。
脾脏是红细胞的储存库
图 15-13 显示脾脏有两个独立的区域用于储存血液,即静脉窦和脾髓。窦状隙可以像静脉系统的任何其他部分一样膨胀并储存全血。
在脾髓中,毛细血管非常通透,全血(包括红细胞)会渗出毛细血管壁进入小梁网,形成红髓。红细胞被小梁捕获,而血浆则流入静脉窦,然后进入全身循环。因此,脾脏的红髓是一个特殊的储存库,含有大量浓缩的红细胞。当交感神经系统兴奋并导致脾脏及其血管收缩时,这些浓缩的红细胞可以被排出进入全身循环。多达 50~ml 的浓缩红细胞可以释放到循环中,使血细胞比容增加 1% 到 2%。
图 15-13. 脾脏的功能结构。
在脾髓的其他区域有白细胞岛,统称为白髓。这里制造的淋巴样细胞与淋巴结中制造的细胞相似。它们是身体免疫系统的一部分,将在第 35 章中描述。
脾脏的血液净化功能——清除老化细胞 在进入窦状隙之前通过脾髓的血液细胞会经历彻底的挤压。因此,可以预期脆弱的红细胞无法承受这种创伤。因此,许多红细胞在脾脏中被破坏。细胞破裂后,释放的血红蛋白和细胞基质被脾脏的网状内皮细胞消化,消化产物主要被身体重新利用作为营养物质,通常用于制造新的血细胞。
脾脏的网状内皮细胞( Reticuloendothelial Cells )。脾脏的髓质中含有许多大的吞噬性网状内皮细胞,静脉窦内也排列着类似的细胞。这些细胞作为血液净化系统的一部分发挥作用,与肝脏静脉窦中的类似网状内皮细胞系统协同工作。当血液被病原体入侵时,脾脏的网状内皮细胞会迅速清除碎片、细菌和寄生虫等物质。此外,在许多慢性感染中,脾脏会像淋巴结一样肿大,从而更加积极地执行其净化功能。
微循环和淋巴系统:毛细血管液体交换、组织间液和淋巴流动
微循环最重要的功能是将营养物质输送到组织并清除细胞排泄物。小动脉控制着流向每个组织的血流,而组织的局部条件反过来又控制着小动脉的直径。因此,在大多数情况下,每个组织都会根据其个体需求控制自身的血流,如第17章所述。
毛细血管壁很薄,由单层高度通透的内皮细胞构成。因此,水、细胞营养物质和细胞排泄物都可以在组织和循环血液之间快速、轻松地交换。
整个身体的周围循环系统大约有100亿根毛细血管,总表面积估计为500至700平方米(约一个足球场表面积的八分之一)。身体中任何单个功能细胞距离毛细血管超过20至30微米的情况很少见。
微循环和毛细血管系统的结构
每个器官的微循环都组织起来以满足该器官的特定需求。一般来说,进入器官的每条营养动脉在变成小动脉之前会分支六到八次,小动脉的内径通常只有10至15微米。然后,小动脉再分支两到五次,在其末端达到5至9微米的直径,为毛细血管供血。
小动脉具有高度发达的肌肉层,其直径可以变化多倍。微动脉(终末小动脉)没有连续的肌肉层,但平滑肌纤维在血管的间断点环绕,如图16-1所示。
在每条真正的毛细血管从微动脉起源的地方,通常有一条平滑肌纤维环绕毛细血管。这种结构称为毛细血管前括约肌( precapillary sphincter )。这个括约肌可以打开和关闭毛细血管的入口。
小静脉比小动脉大,肌肉层也弱得多。然而,小静脉的压力远低于小动脉,因此尽管肌肉较弱,小静脉仍然可以显著收缩。
这种典型的毛细血管床排列方式并非在身体的所有部位都存在,尽管类似的排列方式可能服务于相同的目的。最重要的是,微动脉和毛细血管前括约肌与它们所服务的组织密切接触。因此,组织的局部条件——如营养物质浓度、代谢终产物和氢离子浓度——可以直接影响血管,从而控制每个小组织区域的局部血流。
毛细血管壁的结构
图16-2展示了在身体大多数器官(尤其是肌肉和结缔组织)中发现的典型毛细血管壁内皮细胞的超微结构。请注意,毛细血管壁由单层内皮细胞组成,并在毛细血管外部被一层薄薄的基底膜包围。毛细血管壁的总厚度仅为约0.5微米。毛细血管的内径为4至9微米,刚好足够让红细胞和其他血细胞挤过。
毛细血管膜上的孔隙
图16-2显示了连接毛细血管内部与外部两条小通道。其中一条通道是细胞间裂隙(intercellular cleft),它是位于相邻内皮细胞之间的薄缝状弯曲通道,位于图的顶部。每个裂隙被蛋白质附着的短脊周期性中断,这些短脊将内皮细胞固定在一起,但在这些脊之间,液体可以自由地通过裂隙渗透。裂隙通常具有均匀的间距,宽度约为6至7纳米(60至70埃),略小于白蛋白分子的直径。
由于细胞间裂隙仅位于内皮细胞的边缘,它们通常仅占毛细血管壁总表面积的1/1000。然而,水分子以及大多数水溶性离子和小溶质的热运动速度非常快,因此所有这些物质都可以通过这些裂隙孔隙(细胞间裂隙)在毛细血管内外自由扩散。
图16-1. 微循环的组成部分。
内皮细胞中存在许多微小的质膜囊泡(plasmalemmal vesicles),也称为小窝(caveolae)。这些质膜囊泡由称为小窝蛋白(caveolins)的蛋白质寡聚体形成,这些蛋白质与胆固醇和鞘脂分子相关联。尽管小窝的确切功能尚不清楚,但它们被认为在内吞作用(endocytosis,即细胞从外部吞噬物质的过程)和大分子跨内皮细胞内部的转运(transcytosis)中发挥作用。细胞表面的小窝似乎会吸收含有血浆蛋白的小包血浆或细胞外液。这些囊泡随后可以缓慢地通过内皮细胞移动。其中一些囊泡可能会合并形成贯穿内皮细胞的囊泡通道,如图16-2所示。
某些器官毛细血管中的特殊孔隙
某些器官的毛细血管孔隙具有特殊特征,以满足器官的特定需求。其中一些特征如下:
- 在大脑中,毛细血管内皮细胞之间的连接主要是紧密连接(tight junctions),只允许极小的分子(如水、氧气和二氧化碳)通过进入或离开脑组织。
- 在肝脏中,毛细血管内皮细胞之间的裂隙几乎完全开放,因此几乎所有血浆中的溶解物质(包括血浆蛋白)都可以从血液进入肝组织。
- 胃肠道毛细血管膜( gastrointestinal capillary membrane )的孔隙大小介于肌肉和肝脏的毛细血管孔隙之间。
图16-2. 毛细血管壁的结构。特别注意相邻内皮细胞连接处的细胞间裂隙( intercellular cleft )。据信,大多数水溶性物质通过裂隙沿毛细血管膜扩散。被称为小窝( caveolae )的小膜内陷被认为在跨细胞膜运输大分子中起作用。小窝含有小窝蛋白( caveolins ),这些蛋白质与胆固醇相互作用并聚合形成小窝。
- 在肾脏的肾小球毛细血管( glomerular capillaries )中,许多称为窗孔( fenestrae )的小椭圆形窗口穿透内皮细胞的中间部分,使得大量小分子和离子物质(但不包括血浆蛋白的大分子)可以过滤通过肾小球,而无需通过内皮细胞之间的裂隙。
毛细血管中的血流——血管运动( vasomotion )
血液通常不会连续流过毛细血管。相反,它是间歇性流动的,每隔几秒或几分钟就会开启和关闭一次。这种间歇性的原因是称为血管运动( vasomotion )的现象,即微动脉( metarterioles )和毛细血管前括约肌( precapillary sphincters )(有时甚至是非常小的微动脉)的间歇性收缩。
血管运动的调节。迄今为止发现的影响微动脉和毛细血管前括约肌开闭程度的最重要因素是组织中的氧浓度。当组织对氧气的使用率很高时——导致组织氧浓度低于正常水平——毛细血管血流的间歇性发生频率增加,每次血流的持续时间延长,从而使毛细血管血液能够向组织输送更多的氧气(以及其他营养物质)。这种效应以及其他控制局部组织血流的多种因素将在第17章中讨论。
图16-3. 液体分子和溶解物质在毛细血管和间质液( interstitial fluid )之间的扩散。
毛细血管系统的平均功能。尽管通过每个毛细血管的血流是间歇性的,但由于组织中存在大量毛细血管,它们的整体功能被平均化。也就是说,每个组织毛细血管床的平均血流速率、毛细血管内的平均压力以及毛细血管血液与周围间质液之间物质交换的平均速率。在本章的其余部分,我们将关注这些平均值,尽管应该记住,平均功能实际上是数十亿个独立毛细血管的功能,每个毛细血管都根据组织的局部条件间歇性地运作。
血液与间质液之间水、营养物质和其他物质的交换
通过毛细血管膜的扩散( diffusion )是血浆和组织液( interstitial fluid )之间物质转移的最重要方式。图16-3显示,当血液沿着毛细血管腔( lumen )流动时,大量的水分子和溶解的颗粒通过毛细血管壁来回扩散,使组织液和血浆之间不断混合。电解质( electrolytes )、营养物质( nutrients )和代谢废物( waste products of metabolism )都容易通过毛细血管膜扩散。蛋白质是血浆和组织液中唯一不易通过毛细血管膜的溶解成分。
脂溶性物质( lipid-soluble substances )直接通过毛细血管内皮( capillary endothelium )的细胞膜扩散。如果一种物质是脂溶性的,它可以直接通过毛细血管的细胞膜扩散,而不需要通过孔隙( pores )。这类物质包括氧气和二氧化碳。由于这些物质可以渗透毛细血管膜的所有区域,它们通过毛细血管膜的运输速率比脂不溶性物质( lipid-insoluble substances )快许多倍,例如钠离子和葡萄糖,它们只能通过孔隙扩散。
水溶性、非脂溶性物质( water-soluble, non-lipid-soluble substances )通过毛细血管膜( capillary membrane )的细胞间孔隙( intercellular pores )扩散。
组织所需的许多物质溶于水但不能通过内皮细胞的脂质膜( lipid membranes );这些物质包括水分子、钠离子、氯离子和葡萄糖。尽管毛细血管表面积的1/1000由内皮细胞之间的细胞间裂隙( intercellular clefts )组成,但裂隙中热分子运动( thermal molecular motion )的速度如此之快,以至于即使这么小的面积也足以让水和水溶性物质通过这些裂隙孔隙( cleft pores )大量扩散。为了说明这些物质扩散的速度有多快,水分子通过毛细血管膜的扩散速率大约是血浆本身沿毛细血管线性流动速率的80倍。也就是说,在血浆流经整个毛细血管的距离之前,血浆中的水与组织液中的水交换了80次。
分子大小对通过孔隙的影响。毛细血管细胞间裂隙孔隙的宽度为6至7纳米,大约是水分子直径的20倍,水分子是通常通过毛细血管孔隙的最小分子。然而,血浆蛋白( plasma protein )分子的直径略大于孔隙的宽度。其他物质,如钠离子、氯离子、葡萄糖和尿素,具有中等直径。因此,毛细血管孔隙对不同物质的通透性( permeability )根据其分子直径而变化。
表16-1列出了骨骼肌( skeletal muscle )毛细血管孔隙对各种物质的相对通透性,例如,葡萄糖分子的通透性是水分子的0.6倍,而白蛋白( albumin )分子的通透性非常小——仅为水分子的1/1000。
在此必须提出一个警告。不同组织中的毛细血管在通透性(permeability)上存在极大差异。例如,肝脏毛细血管窦状隙的膜非常通透,以至于血浆蛋白(plasma proteins)几乎像水和其他物质一样容易通过这些壁。此外,肾小球(renal glomerular)膜对水和电解质的通透性大约是肌肉毛细血管的500倍,但对血浆蛋白则不然。对于这些蛋白质,毛细血管的通透性非常低,就像在其他组织和器官中一样。当我们稍后在本教材中研究这些不同的器官时,应该会清楚为什么某些组织需要比其他组织更高程度的毛细血管通透性。例如,肝脏需要在血液和肝实质细胞(liver parenchymal cells)之间转移大量营养物质,肾脏需要过滤大量液体以形成尿液,因此需要更高程度的毛细血管通透性。
表16-1 骨骼肌毛细血管孔对不同大小分子的相对通透性
数据来源:Pappenheimer JR: Passage of molecules through capillary walls. Physiol Rev 33:387, 1953.
通过毛细血管膜的扩散与膜两侧的浓度差成正比。毛细血管膜两侧任何给定物质的浓度差越大,该物质通过膜向一个方向的净移动就越大。例如,毛细血管血液中的氧气浓度通常高于组织间液(interstitial fluid)中的浓度。因此,大量氧气通常从血液向组织移动。相反,组织中的二氧化碳浓度高于血液中的浓度,这导致多余的二氧化碳进入血液并被带离组织。
大多数营养重要物质通过毛细血管膜的扩散速率非常大,以至于仅需轻微的浓度差就能在血浆和组织间液之间实现充分的运输。例如,毛细血管外组织间液中的氧气浓度仅比血浆中的浓度低几个百分点,但这种轻微的差异足以使足够的氧气从血液进入组织间隙,以满足组织代谢所需的所有氧气——在身体非常活跃的状态下,通常每分钟需要几升氧气。
图16-4. 间质(interstitium)的结构。蛋白多糖(proteoglycan)细丝遍布于胶原纤维束之间的空隙中。偶尔也会出现游离的液体囊泡和少量以细流形式存在的游离液体。
间质和间质液
人体总体积的约六分之一由细胞之间的空隙组成,这些空隙统称为间质(interstitium)。这些空隙中的液体称为间质液(interstitial fluid)。
间质的结构如图16-4所示。它包含两种主要的固体结构:(1) 胶原纤维束(collagen fiber bundles);(2) 蛋白多糖细丝(proteoglycan filaments)。胶原纤维束在间质中延伸很长的距离。它们非常坚固,为组织提供了大部分的张力强度。然而,蛋白多糖细丝是由约98%的透明质酸(hyaluronic acid)和2%的蛋白质组成的极细的卷曲或扭曲分子。这些分子非常细,以至于用光学显微镜无法看到,即使使用电子显微镜也难以观察到。尽管如此,它们形成了一个非常细的网状细丝垫,恰当地描述为“刷子堆”。
间质中的凝胶。间质中的液体通过毛细血管的过滤和扩散而来。它含有与血浆几乎相同的成分,只是蛋白质的浓度要低得多,因为蛋白质不容易通过毛细血管的孔隙向外扩散。间质液主要被捕获在蛋白多糖细丝之间的微小空间中。这种蛋白多糖细丝和其中捕获的液体的组合具有凝胶的特性;因此被称为组织凝胶(tissue gel)。
由于存在大量的蛋白多糖细丝,液体很难轻易流过组织凝胶。相反,液体主要通过凝胶扩散;也就是说,它通过分子的热运动从一个地方移动到另一个地方,而不是大量分子一起移动。
通过凝胶的扩散速度约为自由液体的95%到99%。对于毛细血管和组织细胞之间的短距离,这种扩散允许通过间质快速运输,不仅是水分子,还包括电解质、低分子量营养物质、细胞排泄物、氧气和二氧化碳等物质。
间质中的游离液体。虽然间质中几乎所有的液体通常都被捕获在组织凝胶中,但偶尔也会出现少量的游离液体细流和游离液体囊泡,这意味着这些液体不受蛋白多糖分子的束缚,因此可以自由流动。当染料被注入循环血液时,通常可以看到它通过间质中的小细流流动,通常沿着胶原纤维或细胞表面流动。
在大多数正常组织中,游离液体的量很少,通常不到1%。相反,当组织发生水肿时,这些游离液体的小囊泡和细流会急剧扩张,直到一半或更多的水肿液体变成自由流动的液体,不受蛋白多糖细丝的束缚。
毛细血管的液体过滤
毛细血管中的静水压(hydrostatic pressure)倾向于迫使液体及其溶解物质通过毛细血管孔进入组织间隙(interstitial spaces)。相反,由血浆蛋白引起的渗透压(称为胶体渗透压(colloid osmotic pressure))倾向于通过渗透作用使液体从组织间隙进入血液。血浆蛋白施加的这种渗透压通常可以防止血液中的液体大量流失到组织间隙中。
同样重要的是淋巴系统(lymphatic system),它将从血液渗漏到组织间隙中的少量多余蛋白质和液体返回到循环中。在本章的其余部分,我们将讨论控制毛细血管过滤和淋巴流动功能的机制,这些机制共同调节血浆和组织液的各自体积。
静水压和胶体渗透压决定了液体通过毛细血管膜的运动。图16-5显示了决定液体是从血液进入组织液还是向相反方向移动的四种主要力量。这些力量被称为Starling力,以生理学家Ernest Starling的名字命名,他首次证明了它们的重要性:
- 毛细血管静水压(Pc),它倾向于迫使液体通过毛细血管膜向外移动
- 组织液静水压(Pif),当Pif为正时,它倾向于迫使液体通过毛细血管膜向内移动,但当Pif为负时,则向外移动
- 毛细血管血浆胶体渗透压(Πp),它倾向于通过毛细血管膜向内渗透液体
- 组织液胶体渗透压(Πif),它倾向于通过毛细血管膜向外渗透液体
图16-5. 液体压力和胶体渗透压力在毛细血管膜上作用,并倾向于通过膜孔向外或向内移动液体。
如果这些力的总和——净滤过压(net filtration pressure)——为正,则会有净液体滤过毛细血管。如果Starling力的总和为负,则会有净液体从组织间隙吸收到毛细血管中。净滤过压(NFP)的计算如下:
N F P=P C-P i f-\Pip+\Pii f
正如后面所讨论的,在正常情况下,NFP略为正,导致在大多数器官中液体净滤过毛细血管进入组织间隙。组织中液体滤过的速率还取决于每个毛细血管中孔的数量和大小,以及血液流动的毛细血管数量。这些因素通常一起表示为毛细血管滤过系数(Kf)。因此,Kf是衡量毛细血管膜在给定NFP下过滤水的能力的指标,通常表示为ml/ min per mm Hg NFP。
因此,毛细血管液体滤过的速率确定如下:
F i l t r a t i o n=Kf× N F P
在以下部分中,我们将讨论决定毛细血管液体滤过速率的每种力量。
毛细血管静水压
多种方法已被用于估计毛细血管静水压(capillary hydrostatic pressure):(1) 直接通过微管插管法(micropipette cannulation)测量毛细血管,这种方法在某些组织(如骨骼肌和肠道)中测得的平均毛细血管压力约为25mmHg;(2) 间接功能测量法(indirect functional measurement)测量毛细血管压力,这些组织中测得的平均毛细血管压力约为17mmHg。
微管法测量毛细血管压力
通过插管法测量毛细血管压力时,将一根显微玻璃管直接插入毛细血管,并通过适当的微压计系统测量压力。使用这种方法,已在动物的暴露组织以及人类指甲根部的大毛细血管环中测量了毛细血管压力。这些测量结果显示,毛细血管动脉端的压力为30至40 mmHg,静脉端的压力为10至15mm Hg,中间部分的压力约为25mmHg。
在某些毛细血管中,例如肾脏的肾小球毛细血管(glomerular capillaries),通过微管法测得的压力要高得多,平均约为60mmHg。相比之下,肾脏的管周毛细血管(peritubular capillaries)的静水压平均仅为约13~mmHg。因此,不同组织中的毛细血管静水压差异很大,具体取决于特定组织和生理状态。
间质液静水压
测量间质液静水压(interstitial fluid hydrostatic pressure)有几种方法,每种方法测得的值略有不同,具体取决于所使用的方法和测量压力的组织。在松散的皮下组织中,通过不同方法测得的间质液压力通常比大气压低几毫米汞柱;也就是说,这些值被称为负间质液压力(negative interstitial fluid pressure)。在被囊包围的其他组织中,例如肾脏,间质压力通常为正(即大于大气压)。最广泛使用的方法有:(1) 使用插入组织的微管测量压力;(2) 通过植入的穿孔囊测量压力;(3) 通过插入组织的棉芯测量压力。这些不同的方法即使在相同的组织中也会提供不同的间质静水压值。
使用微管测量间质液压力。用于测量毛细血管压力的同类型微管也可以在某些组织中用于测量间质液压力。微管的尖端直径约为1微米,但这仍然是间质中蛋白多糖丝(proteoglycan filaments)之间间隙大小的20倍或更多倍。因此,测得的压力可能是自由液囊中的压力。
在松散组织(如皮肤)中,使用微管法测得的压力范围为-2至+2mmHg,但在大多数情况下,它们的平均值略低于大气压。
植入穿孔空心胶囊中自由间质液压力的测量
在正常松散的皮下组织中使用直径为2厘米的胶囊测量的自由间质液压力平均约为-6mmHg,但使用较小的胶囊时,其值与微吸管测量的-2mmHg没有显著差异。
紧密包裹组织中的间质液压力
身体的某些组织被紧密的包裹物包围,例如围绕大脑的颅腔、围绕肾脏的强韧纤维囊、围绕肌肉的纤维鞘以及围绕眼睛的巩膜。在大多数这些组织中,无论使用何种测量方法,间质液压力都是正的。然而,这些间质液压力几乎总是小于其包裹物对组织外部施加的压力。例如,侧卧动物的脑脊液压力平均约为+10mmHg,而脑间质液压力平均约为+4到+6mmHg。在肾脏中,围绕肾脏的囊压力平均约为+13mmHg,而报告的肾间质液压力平均约为+6mmHg。因此,如果记住施加在皮肤上的压力是大气压力,即被认为是零压力,那么可以制定一个一般规则:正常间质液压力通常比围绕每个组织的压力低几毫米汞柱。
在身体的大多数自然腔室中,存在与周围间质液动态平衡的自由液体,测量的压力为负值。其中一些腔室和压力测量如下:
- 胸膜腔:-8mmHg
- 关节滑膜腔:-4到-6mmHg
- 硬膜外腔:-4到-6mmHg
总结:松散皮下组织中的间质液压力通常低于大气压。 尽管上述不同方法对间质液压力给出了略有不同的值,但大多数生理学家认为,在正常情况下,松散皮下组织中的间质液压力略低于大气压,平均约为-3mmHg。
淋巴系统的泵送——负间质液压力的基本原因。 淋巴系统将在本章后面讨论,但首先我们需要了解该系统在决定间质液压力中的基本作用。淋巴系统是一种清除系统,从组织间隙中去除多余的液体、多余的蛋白质分子、碎片和其他物质。通常,当液体进入末端淋巴毛细血管时,淋巴管壁会自动收缩几秒钟,并将液体泵入血液循环。这一整体过程产生了在间质空间中测量的轻微负压。
血浆胶体渗透压
血浆蛋白引起胶体渗透压(colloid osmotic pressure)。如第4章所述,只有不能通过半透膜(semipermeable membrane)孔隙的分子或离子才会产生渗透压(osmotic pressure)。由于蛋白质是血浆和组织液(interstitial fluid)中唯一不易通过毛细血管孔隙的溶解成分,因此血浆和组织液中的蛋白质是造成毛细血管膜两侧渗透压的原因。为了将这种渗透压与细胞膜上的渗透压区分开来,它被称为胶体渗透压或渗透压(oncontic pressure)。胶体渗透压这一术语来源于蛋白质溶液类似于胶体溶液(colloidal solution)的事实,尽管它实际上是一种真正的分子溶液。
血浆胶体渗透压的正常值
正常人血浆的胶体渗透压平均约为28mmHg;其中19mm是由溶解蛋白质的分子效应引起的,9mm是由唐南效应(Donnan effect)引起的——即由与血浆蛋白结合钠、钾和其他阳离子引起的额外渗透压。
#
不同血浆蛋白对胶体渗透压的影响。血浆蛋白是含有白蛋白(albumin)、球蛋白(globulin)和纤维蛋白原(fibrinogen)的混合物,其平均分子量分别为69,000、140,000和400,000。因此,1克球蛋白所含的分子数仅为1克白蛋白的一半,1克纤维蛋白原所含的分子数仅为1克白蛋白的六分之一。从第4章关于渗透压的讨论中应该记得,渗透压是由溶解在液体中的分子数量决定的,而不是由这些分子的质量决定的。下表给出了正常血浆中不同类型蛋白质的相对质量浓度(g/dl)及其对总血浆胶体渗透压(Πp)的贡献。这些值包括与血浆蛋白结合的离子的唐南效应:
<html><body><table><tr><td>g/dl</td><td>Ip (mm Hg)</td></tr><tr><td>白蛋白 4.5 球蛋白 2.5</td><td>21.8 6.0</td></tr><tr><td>纤维蛋白原</td><td></td></tr><tr><td>0.3 总计 7.3</td><td>0.2 28.0</td></tr></table></body></html>
因此,血浆总胶体渗透压的约80%来自白蛋白,20%来自球蛋白,几乎没有任何来自纤维蛋白原。因此,从毛细血管和组织液动力学的角度来看,主要是白蛋白很重要。
组织液胶体渗透压
虽然通常毛细血管孔隙的大小小于血浆蛋白的分子大小,但并非所有孔隙都是如此。因此,少量血浆蛋白确实会通过孔隙和小囊泡的跨细胞作用(transcytosis)渗漏到组织间隙中。
整个12升组织液中的蛋白质总量略高于血浆中的蛋白质总量,但由于这个体积是血浆体积的四倍,大多数组织的组织液的平均蛋白质浓度通常仅为血浆的40%,即约3~g/dl。从数量上看,这种蛋白质浓度的平均组织液胶体渗透压约为8mmHg。
通过毛细血管膜的液体体积交换
我们已经讨论了影响液体通过毛细血管膜移动的不同因素,现在我们可以将这些因素综合起来,看看毛细血管系统如何维持血浆和组织间液之间的正常液体体积分布。
毛细血管动脉端的平均毛细血管压力比静脉端高15到25mmHg。由于这种差异,液体在毛细血管的动脉端滤出,而在静脉端,液体被重新吸收回毛细血管(见图16-3)。因此,实际上有少量液体从毛细血管的动脉端“流动”到静脉端。这种流动的动力学如下。
毛细血管动脉端滤过力的分析。在毛细血管动脉端引起液体通过毛细血管膜移动的近似平均力如下所示:
<html><body><table><tr><td></td><td>mm Hg</td></tr><tr><td>促使液体向外移动的力 毛细血管静水压(动脉端</td><td>30</td></tr><tr><td>毛细血管) 负组织间液静水压</td><td>3</td></tr><tr><td>组织间液胶体渗透压</td><td>8</td></tr><tr><td>总向外力</td><td>41</td></tr><tr><td>促使液体向内移动的力</td><td></td></tr><tr><td>血浆胶体渗透压</td><td>28</td></tr><tr><td>总向内力</td><td>28</td></tr><tr><td>力的总和</td><td></td></tr><tr><td>向外</td><td>41</td></tr><tr><td>向内</td><td>28</td></tr><tr><td>净向外力(动脉端)</td><td>13</td></tr></table></body></html>
因此,毛细血管动脉端的力的总和显示出13mmHg的净滤过压,促使液体通过毛细血管孔隙向外移动。这个13mmHg的滤过压平均每次血液通过毛细血管时,约有1/200的血浆从毛细血管的动脉端滤出到组织间隙。
毛细血管静脉端重吸收的分析。毛细血管静脉端的低血压改变了力的平衡,有利于吸收,如下所示:
<html><body><table><tr><td></td><td>mm Hg</td></tr><tr><td>促使液体向内移动的力</td><td></td></tr><tr><td>血浆胶体渗透压</td><td>28</td></tr><tr><td>总向内力</td><td>28</td></tr><tr><td>促使液体向外移动的力</td><td></td></tr><tr><td>毛细血管静水压(静脉端10毛细血管)</td><td></td></tr><tr><td>负组织间液静水压</td><td>3</td></tr><tr><td>组织间液胶体渗透压</td><td>8</td></tr><tr><td>总向外力</td><td>21</td></tr><tr><td>力的总和</td><td></td></tr><tr><td>向内</td><td>28</td></tr><tr><td>向外</td><td>21</td></tr><tr><td>净向内力</td><td>7</td></tr></table></body></html>
因此,在毛细血管的静脉端存在7 mm Hg的净重吸收压力(Net Reabsorption Pressure)。这种重吸收压力远低于毛细血管动脉端的滤过压力(Filtration Pressure),但请记住,静脉毛细血管比动脉毛细血管数量更多且更具通透性(Permeable)。因此,需要较小的重吸收压力来引起液体的内向运动。
重吸收压力导致大约十分之九从毛细血管动脉端滤出的液体在静脉端被重吸收。剩下的十分之一流入淋巴管并返回循环血液。
毛细血管交换的STARLING平衡(Starling Equilibrium)
Ernest Starling在一个多世纪前指出,在正常情况下,大多数毛细血管中存在近乎平衡的状态。也就是说,从毛细血管动脉端滤出的液体量几乎完全等于通过吸收返回循环的液体量。发生的轻微失衡解释了最终通过淋巴系统返回循环的液体。
下表展示了Starling平衡的原理。在此表中,动脉和静脉毛细血管的压力被平均计算,以得出整个毛细血管长度的平均功能性毛细血管压力(Mean Functional Capillary Pressure)。该平均功能性毛细血管压力计算为17.3mmHg。
<html><body><table><tr><td></td><td>mm Hg</td></tr><tr><td>MeanForcesTendingtoMoveFluidOutward</td><td></td></tr><tr><td>Meancapillarypressure</td><td>17.3</td></tr><tr><td>Negativeinterstitialfluidhydrostaticpressure</td><td>3.0</td></tr></table></body></html>
<html><body><table><tr><td>mmHg</td></tr><tr><td>Interstitialfluidcolloidosmoticpressure 8.0 TOTALOUTWARDFORCE 28.3</td></tr><tr><td></td></tr><tr><td>MeanForcesTendingtoMoveFluidInward</td></tr><tr><td>Plasmacolloidosmoticpressure 28.0 TOTALINWARDFORCE 28.0</td></tr><tr><td></td></tr><tr><td>SummationofMeanForces</td></tr><tr><td>Outward 28.3</td></tr><tr><td>Inward 28.0</td></tr><tr><td>NETOUTWARDFORCE 0.3</td></tr></table></body></html>
因此,对于整个毛细血管循环,我们发现总外向力(Total Outward Force)为28.3mmHg,总内向力(Total Inward Force)为28.0mmHg,两者之间存在近乎平衡。这种轻微的力不平衡,0.3mmHg.,导致液体滤入组织间隙的量略多于重吸收。这种轻微的滤过过量称为净滤过(Net Filtration),它是必须通过淋巴系统返回循环的液体。不包括肾脏在内的整个身体的正常净滤过率仅为约2ml/min。
毛细血管滤过系数(Capillary Filtration Coefficient)
在前面的例子中,毛细血管膜上的平均净力不平衡为0.3~mmHg,导致整个身体的净液体滤过率为2ml/min。将每mm Hg不平衡的净液体滤过率表达出来,可以发现整个身体的净滤过率为每mmHg 6.67ml/min。这个值被称为全身毛细血管滤过系数(Whole Body Capillary Filtration Coefficient)。
过滤系数( filtration coefficient )也可以表示为身体各部分的每分钟每毫米汞柱每100克组织的过滤速率。在此基础上,平均组织的毛细血管过滤系数约为每分钟每毫米汞柱每100克组织0.01毫升。然而,由于不同组织中毛细血管系统的通透性和表面积的极端差异,这一系数在不同组织之间的差异超过100倍。它在脑和肌肉中非常小,在皮下组织中中等大小,在肠道中较大,在肝脏和肾脏的肾小球中非常大,因为这些地方的毛细血管表面积大,孔洞多或开放。同样,蛋白质通过毛细血管膜的通透性也有很大差异。肌肉间质液中的蛋白质浓度约为1.5克/分升;在皮下组织中为2克/分升;在肠道中为4克/分升;在肝脏中为6克/分升。
毛细血管膜力量异常失衡的影响。如果平均毛细血管压力显著高于17毫米汞柱的平均值,导致液体过滤到组织间隙的净力增加。因此,平均毛细血管压力增加20毫米汞柱会导致净过滤压力从0.3增加到20.3毫米汞柱,这导致液体过滤到间质间隙的净量是正常情况的68倍。为了防止这些间隙中过多液体的积累,需要淋巴系统的液体流量是正常情况的68倍,这个量是淋巴系统能够带走量的2到5倍。结果,液体将开始在间质间隙中积累,导致水肿。
图16-6. 淋巴系统。
相反,如果毛细血管压力降得很低,将发生液体净重吸收进入毛细血管而不是净过滤,血液体积将增加,而间质液体体积将减少。这些毛细血管膜失衡的影响与不同类型水肿的发展的关系在第25章中讨论。
淋巴系统
淋巴系统代表了一个辅助途径,通过这个途径液体可以从间质间隙流入血液。最重要的是,淋巴系统可以将蛋白质和大颗粒物质从组织间隙带走,这两者都不能通过直接吸收进入毛细血管而被移除。这种蛋白质从间质间隙返回到血液的功能是必不可少的,没有它我们将在约24小时内死亡。
身体的淋巴通道
身体几乎所有组织都有特殊的淋巴通道,可以直接从组织间隙(interstitial spaces)排出多余的液体。例外包括皮肤的表层、中枢神经系统(central nervous system)、肌肉的内膜(endomysium)和骨骼。然而,即使是这些组织也有微小的组织间隙通道,称为前淋巴管(prelymphatics),组织液可以通过这些通道流动;这些液体最终排入淋巴管,或者在大脑的情况下,排入脑脊液(cerebrospinal fluid),然后直接返回血液。
基本上,来自身体下部的所有淋巴管最终都排入胸导管(thoracic duct),而胸导管又在左颈内静脉(left internal jugular vein)和左锁骨下静脉(left subclavian vein)的交界处排入静脉系统,如图16-6所示。
来自头部左侧、左臂和胸部部分区域的淋巴也在排入静脉之前进入胸导管。
来自颈部右侧和头部、右臂以及右胸部分区域的淋巴进入右淋巴导管(right lymph duct)(比胸导管小得多),该导管在右锁骨下静脉(right subclavian vein)和颈内静脉(internal jugular vein)的交界处排入静脉系统。
图16-7. 淋巴毛细血管的特殊结构,允许高分子量物质进入淋巴。
终末淋巴毛细血管及其通透性。从毛细血管动脉端过滤出来的大部分液体在细胞间流动,最终被重新吸收回毛细血管的静脉端,但平均而言,大约十分之一的液体进入淋巴毛细血管,并通过淋巴系统而不是通过静脉毛细血管返回血液。所有这些淋巴的总量通常仅为2至3升/天。
通过淋巴系统返回循环的液体极为重要,因为高分子量物质(如蛋白质)无法通过其他方式从组织中吸收,尽管它们几乎可以毫无阻碍地进入淋巴毛细血管。这种机制的原因是淋巴毛细血管的特殊结构,如图16-7所示。该图显示了淋巴毛细血管的内皮细胞通过锚定丝(anchoring filaments)附着在周围的结缔组织上。在相邻内皮细胞的连接处,一个内皮细胞的边缘以这样一种方式重叠在相邻细胞的边缘上,使得重叠的边缘可以自由地向内翻转,从而形成一个微小的阀门,向淋巴毛细血管内部打开。组织液及其悬浮颗粒可以推开阀门,直接流入淋巴毛细血管。然而,一旦进入毛细血管,这种液体就很难离开,因为任何回流都会关闭阀门。因此,淋巴管在终末淋巴毛细血管的尖端以及其较大的血管上都有阀门,直到它们排入血液循环。
淋巴的形成
淋巴来源于流入淋巴管的组织液。因此,淋巴在首次进入终末淋巴管时,其成分几乎与组织液相同。
图16-8. 狗腿中组织间液压力与淋巴流动的关系。注意,当组织间压力(Pif)略高于大气压0mm~Hg)时,淋巴流动达到最大值。(由Harry Gibson博士和Aubrey Taylor博士提供。)
大多数组织的组织间液中的蛋白质浓度平均约为2g/dl,从这些组织流出的淋巴的蛋白质浓度接近此值。在肝脏中形成的淋巴的蛋白质浓度高达6g/dl,而在肠道中形成的淋巴的蛋白质浓度高达3至4g/dl。由于正常情况下大约三分之二的淋巴来自肝脏和肠道,胸导管淋巴(来自身体所有区域的淋巴混合物)通常的蛋白质浓度为3至5g/dl。
淋巴系统也是从胃肠道吸收营养物质的主要途径之一,特别是吸收食物中几乎所有脂肪的途径,如第66章所述。在食用高脂肪餐后,胸导管淋巴有时含有高达1%至2%的脂肪。
最后,即使是细菌等大颗粒,也能通过淋巴毛细血管的内皮细胞之间进入淋巴。当淋巴通过淋巴结时,这些颗粒几乎完全被移除和破坏,如第34章所述。
淋巴流动速率
在静息状态下,人类胸导管中每小时约有100ml的淋巴流动,另外每小时约有20ml通过其他通道进入循环系统,估计总淋巴流动量约为120 ml/hr或2至3 L/天。
组织间液压力对淋巴流动的影响。图16-8显示了不同水平的组织间液静水压力对淋巴流动的影响,这是在动物中测量的。注意,当组织间液压力比正常值-6mmHg更负时,正常淋巴流动非常少。然后,当压力上升到0mm Hg(大气压)时,流动增加了20倍以上。因此,任何增加组织间液压力的因素也会增加淋巴流动,前提是淋巴管功能正常。这些因素包括:
图16-9. 淋巴毛细血管和集合淋巴管的结构,还显示了淋巴瓣膜。
· 升高的毛细血管静水压力 · 降低的血浆胶体渗透压 · 增加的组织间液胶体渗透压 · 增加的毛细血管通透性
所有这些因素都促进了净液体向组织间隙的移动,从而同时增加了组织间液体积、组织间液压力和淋巴流动。
然而,请注意图16-8中,当间质液静水压(interstitial fluid hydrostatic pressure)比大气压高1或2mmHg(>0mmHg)时,淋巴流动(lymph flow)在更高的压力下不再进一步增加。这是由于增加的组织压力不仅增加了液体进入淋巴毛细管(lymphatic capillaries)的速度,还压缩了较大淋巴管(larger lymphatics)的外表面,从而阻碍了淋巴流动。在更高的压力下,这两个因素相互平衡,因此淋巴流动达到最大流速。这个最大流速在图16-8中的上水平平台处展示。
淋巴泵增加淋巴流动。所有淋巴通道中都存在瓣膜(valves)。图16-9展示了典型的瓣膜,用于收集淋巴毛细管排出的淋巴。
动物和人类暴露的淋巴管的视频显示,当收集淋巴管(collecting lymphatic)或较大的淋巴管被液体拉伸时,管壁中的平滑肌会自动收缩。此外,每个淋巴管段在连续的瓣膜之间作为一个独立的自动泵工作。也就是说,即使轻微填充一个段,也会导致其收缩,液体被泵送到下一个瓣膜进入下一个淋巴段。这个液体填充随后的段,几秒钟后它也会收缩,这个过程沿着淋巴管一直持续,直到液体最终排入血液循环。在非常大的淋巴管中,如胸导管(thoracic duct),这个淋巴泵可以产生高达50到100mmHg的压力。
由外部间歇性压缩引起的泵送。除了由淋巴管壁内在间歇性收缩引起的泵送外,任何间歇性压缩淋巴管的外部因素也可以引起泵送。按其重要性顺序,这些因素如下:
- 周围骨骼肌的收缩
- 身体部位的运动
- 邻近淋巴管的动脉搏动
- 外部物体对组织的压缩
在运动期间,淋巴泵变得非常活跃,通常会增加淋巴流动10到30倍。相反,在休息期间,淋巴流动缓慢(几乎为零)。
淋巴毛细管泵。除了较大的淋巴管的泵送外,终末淋巴毛细管(terminal lymphatic capillary)也能够泵送淋巴。正如本章前面所解释的,淋巴毛细管壁上的锚定丝(anchoring filaments)紧密附着在周围的组织细胞上。因此,每次过量液体进入组织并导致组织肿胀时,锚定丝会拉动淋巴毛细管的壁,液体通过内皮细胞(endothelial cells)之间的连接流入终末淋巴毛细管。然后,当组织被压缩时,毛细管内的压力增加,导致内皮细胞的重叠边缘像瓣膜一样关闭。因此,压力将淋巴向前推入收集淋巴管,而不是通过细胞连接向后流动。
淋巴毛细管内皮细胞也含有少量收缩性肌动球蛋白(actomyosin)丝。在一些动物组织(如蝙蝠翅膀)中,观察到这些丝以与许多小血管和较大淋巴管相同的节律性方式引起淋巴毛细血管的节律性收缩。因此,除了较大的肌肉淋巴管的收缩外,至少部分淋巴泵送可能是由淋巴毛细血管内皮细胞收缩引起的。
决定淋巴流动的因素总结。从之前的讨论中可以看出,决定淋巴流动的两个主要因素是(1)组织液压力和(2)淋巴泵的活动。因此,可以大致说,淋巴流动的速率是由组织液压力乘以淋巴泵活动的乘积决定的。
淋巴系统在控制组织液蛋白质浓度、体积和压力中起关键作用
已经很清楚,淋巴系统作为一种溢出机制,将多余的蛋白质和多余的液体体积从组织间隙返回到循环中。因此,淋巴系统还在控制以下方面起着核心作用:(1)组织液中的蛋白质浓度;(2)组织液体积;以及(3)组织液压力。以下是这些因素如何相互作用的解释。
- 记住,少量蛋白质不断从毛细血管渗漏到间质中。只有极少量的渗漏蛋白质(如果有的话)通过毛细血管的静脉端返回到循环中。因此,这些蛋白质倾向于在组织液中积累,这反过来又增加了组织液的胶体渗透压。
- 组织液中增加的胶体渗透压改变了毛细血管膜上的力平衡,有利于液体过滤到间质中。因此,实际上,液体通过蛋白质通过毛细血管壁渗透性地向外转移到间质中,从而增加了组织液体积和组织液压力。
- 增加的组织液压力大大增加了淋巴流动的速率,这带走了在间隙中积累的多余组织液体积和多余蛋白质。
因此,一旦组织液蛋白质浓度达到一定水平并引起组织液体积和压力的相应增加,通过淋巴系统返回的蛋白质和液体就变得足够大,以平衡这些从毛细血管渗漏到间质的速率。因此,所有这些因素的定量值达到稳态,并且它们在这些稳态水平上保持平衡,直到某些因素改变了从毛细血管渗漏蛋白质和液体的速率。
负组织液压力对保持身体组织在一起的重要性
传统上,人们一直认为身体的不同组织完全由结缔组织纤维(connective tissue fibers)结合在一起。然而,结缔组织纤维在身体的许多部位非常薄弱,甚至完全缺失,特别是在组织相互滑动的部位(例如,皮肤在手背或面部滑动)。然而,即使在这些部位,组织也是通过负的间质液压力(negative interstitial fluid pressure)结合在一起的,这实际上是一种部分真空。当组织失去负压时,液体会在间隙中积聚,出现称为水肿(edema)的情况。这种情况将在第25章中讨论。
组织血流的局部和体液控制
根据组织需求对血流的局部控制
循环功能的一个基本原则是,大多数组织能够根据其特定的代谢需求控制自身的局部血流。组织对血流的一些具体需求包括:
- 向组织输送氧气
- 输送其他营养物质,如葡萄糖、氨基酸和脂肪酸
- 从组织中去除二氧化碳
- 从组织中去除氢离子
- 维持组织中离子的适当浓度
- 将各种激素和其他物质运输到不同的组织。
某些器官有特殊需求。例如,皮肤的血流决定了身体的热量散失,从而帮助控制体温。此外,向肾脏输送足够量的血浆使肾脏能够过滤和排泄身体的废物,并调节体液量和电解质。
我们将看到,这些因素对局部血流的控制具有极大的影响,并且不同组织在控制血流时对这些因素的重视程度不同。
不同组织和器官的血流变化。请注意表17-1中列出的一些器官的血流量非常大——例如,甲状腺或肾上腺组织每分钟每100克组织有数百毫升的血流,肝脏的总血流量为1350ml/min,即每100克肝组织95ml/min。
还要注意肾脏的极大血流量——-1100ml/min。这种极大的血流量是肾脏执行其功能所必需的,即清除血液中的废物并精确调节体液的组成。
相反,最令人惊讶的是身体所有不活跃肌肉的低血流量——总共只有750~ml/ min——尽管肌肉占总体重的30%到40%。在静息状态下,肌肉的代谢活动较低,血流量也较低——每100克肌肉只有4ml/min。然而,在剧烈运动期间,肌肉的代谢活动可以增加60倍以上,血流量也可以增加20倍,达到身体总肌肉血管床的16,000ml/min(或每100克肌肉80ml/min)。
局部组织对血流控制的重要性
可能会有人提出以下问题:为什么不持续为身体的每个组织提供非常大的血流,以确保无论组织的活动量是大是小,都能满足其需求?答案同样简单:这样的机制需要比心脏所能泵出的血流多出许多倍。
实验表明,流向每个组织的血流通常被调节在刚好满足组织需求的最低水平——不多不少。例如,在那些最重要的需求是氧气输送的组织中,血流总是被控制在仅略高于维持组织充分氧合所需的水平,但不会超过这个水平。通过如此精确地控制局部血流,组织几乎不会经历氧气营养缺乏,同时心脏的工作负荷也保持在最低水平。
血流控制的机制
局部血流控制可以分为两个阶段:急性控制(acute control)和长期控制(long-term control)。急性控制通过小动脉(arterioles)、中间小动脉(metarterioles)和毛细血管前括约肌(precapillary sphincters)的局部血管扩张或收缩的快速变化来实现,这些变化在几秒到几分钟内发生,以快速维持适当的局部组织血流。长期控制则是指在几天、几周甚至几个月内发生的缓慢、受控的血流变化。通常,这些长期变化能够更好地根据组织的需求比例来调节血流。这些变化是由于供应组织的血管的物理大小和数量的增加或减少所引起的。
表 17-1 基础条件下不同器官和组织的血流
<html><body><table><tr><td></td><td>心输出量百分比</td><td>毫升/分钟</td><td>毫升/分钟/100克组织重量</td></tr><tr><td>脑</td><td>14</td><td>700</td><td>50</td></tr><tr><td>心脏</td><td>4</td><td>200</td><td>70</td></tr><tr><td>支气管</td><td>2</td><td>100</td><td>25</td></tr><tr><td>肾脏</td><td>22</td><td>1100</td><td>360</td></tr><tr><td>肝脏</td><td>27</td><td>1350</td><td>95</td></tr><tr><td>·门静脉</td><td>(21)</td><td>(1050)</td><td></td></tr><tr><td>·动脉</td><td>(6)</td><td>(300)</td><td></td></tr><tr><td>肌肉(静止状态)</td><td>15</td><td>750</td><td>4</td></tr><tr><td>骨骼</td><td>5</td><td>250</td><td>3</td></tr><tr><td>皮肤(凉爽天气)</td><td>6</td><td>300</td><td>3</td></tr><tr><td>甲状腺</td><td>1</td><td>50</td><td>160</td></tr><tr><td>肾上腺</td><td>0.5</td><td>25</td><td>300</td></tr><tr><td>其他组织</td><td>3.5</td><td>175</td><td>1.3</td></tr><tr><td>总计</td><td>100.0</td><td>5000</td><td></td></tr></table></body></html>
图 17-1. 代谢率增加对组织血流的影响。
局部血流的急性控制
组织代谢增加会增加组织血流
图 17-1 显示了局部组织(如骨骼肌)代谢率增加对血流的急性影响。请注意,代谢率增加到正常水平的八倍时,血流会急性增加约四倍。
氧气供应减少会增加组织血流量。氧气是最必需的代谢营养物质之一。每当组织中的氧气供应减少时,例如在以下情况下:(1) 在高山顶的高海拔地区;(2) 肺炎时;(3) 一氧化碳中毒(这会损害血红蛋白运输氧气的能力);或 (4) 氰化物中毒(这会损害组织利用氧气的能力),通过组织的血流量会显著增加。图17-2显示,当动脉氧饱和度降低到正常值的约25%时,通过孤立腿部的血流量增加了约三倍;也就是说,血流量几乎增加得足够多,但还不足以完全弥补血液中氧气量的减少,从而几乎维持了组织中相对恒定的氧气供应。
图17-2. 动脉氧饱和度降低对通过孤立狗腿的血流量的影响。
局部组织区域对氧气利用的完全氰化物中毒可以使局部血流量增加多达七倍,从而证明了氧气缺乏对增加血流量的极端影响。组织代谢或氧气供应的变化如何改变组织血流量的机制尚未完全理解,但已经提出了两种主要理论,即血管扩张剂理论(vasodilator theory)和氧气需求理论(oxygen demand theory)。
急性局部血流量调节的血管扩张剂理论——腺苷(adenosine)的可能特殊作用。根据血管扩张剂理论,组织的代谢率越高,或者氧气或其他某些营养物质的供应越少,组织细胞中血管扩张剂物质的形成速率就越高。然后,这些血管扩张剂物质被认为会通过组织扩散到毛细血管前括约肌(precapillary sphincters)、微动脉(metarterioles)和小动脉(arterioles),引起扩张。一些被提出的不同血管扩张剂物质包括腺苷、二氧化碳、腺苷磷酸化合物、组胺(histamine)、钾离子和氢离子。
血管扩张剂物质可能会因氧气缺乏而从组织中释放。例如,实验表明,氧气供应减少会导致腺苷和乳酸(含有氢离子)释放到组织细胞之间的间隙中;这些物质随后会引起强烈的急性血管扩张,因此是局部血流量调节的全部或部分原因。其他血管扩张剂物质,如二氧化碳、乳酸和钾离子,当血流量减少而细胞代谢以相同速率继续时,或当细胞代谢突然增加时,也倾向于在组织中增加。血管扩张剂代谢物浓度的增加会引起小动脉的扩张,从而增加组织血流量并使代谢物的组织浓度恢复正常。
许多生理学家认为,腺苷(adenosine)是控制局部血流的重要局部血管扩张剂(vasodilator)。例如,当冠状动脉血流过少时,心肌细胞会释放微量的腺苷,这种腺苷的释放会导致心脏局部血管扩张,从而使冠状动脉血流恢复正常。此外,每当心脏活动超过正常水平时,心脏的代谢会增加,导致氧气利用增加,随后(1)心肌细胞中的氧气浓度降低,(2)三磷酸腺苷(adenosine triphosphate, ATP)降解,(3)腺苷的释放增加。据信,大部分腺苷从心肌细胞中泄漏出来,引起冠状动脉扩张,从而增加冠状动脉血流,以满足活跃心脏增加的营养需求。
尽管研究证据尚不明确,许多生理学家也提出,相同的腺苷机制是骨骼肌和许多其他组织以及心脏中血流的重要调节器。然而,很难证明包括腺苷在内的任何单一血管扩张物质在组织中形成足够的量,以引起所有测量的血流增加。很可能是由组织释放的几种不同血管扩张剂的组合共同调节血流。
局部血流控制的氧气需求理论
尽管血管扩张理论被广泛接受,但一些关键事实使其他生理学家倾向于另一种理论,这种理论可以称为氧气需求理论,或更准确地说,营养需求理论(因为除了氧气外,还涉及其他营养物质)。氧气是引起血管肌肉收缩所需的代谢营养物质之一,其他营养物质也是必需的。因此,在缺乏足够氧气的情况下,有理由认为血管会放松并因此扩张。此外,由于代谢增加而导致组织中氧气利用增加,理论上可能会减少局部血管中平滑肌纤维的氧气供应,从而引起局部血管扩张。
图17-3展示了一种氧气供应可能起作用的机制。该图展示了一个组织血管单元,包括一个微动脉(metarteriole)和一个单侧支毛细血管及其周围组织。在毛细血管的起点处有一个毛细血管前括约肌(precapillary sphincter),微动脉周围还有其他几个平滑肌纤维。在显微镜下观察这种组织时,毛细血管前括约肌通常完全打开或完全关闭。在任何给定时间打开的毛细血管前括约肌的数量大致与组织对营养的需求成正比。毛细血管前括约肌和微动脉每分钟循环打开和关闭几次,打开阶段的持续时间与组织对氧气的代谢需求成正比。这种循环性的打开和关闭称为血管运动(vasomotion)。
图17-3. 用于解释急性局部血流反馈控制的组织单位区域示意图,显示了一条穿过组织的微动脉(metarteriole)和一条带有毛细血管前括约肌(precapillary sphincter)的侧支毛细血管,用于控制毛细血管血流。
由于平滑肌需要氧气来维持收缩,人们可能会认为括约肌的收缩强度会随着氧气浓度的增加而增加。因此,当组织中的氧气浓度上升到一定水平以上时,毛细血管前括约肌和微动脉括约肌可能会关闭,直到组织细胞消耗掉多余的氧气。然而,当多余的氧气被消耗殆尽,氧气浓度下降到足够低时,括约肌会再次打开,重新开始这个循环。
因此,根据现有数据,血管扩张物质理论(vasodilator substance theory)或氧气需求理论(oxygen demand theory)都可以解释急性局部血流调节对组织代谢需求的响应。很可能是这两种机制的结合。
除氧气外其他营养物质在局部血流控制中的可能作用
在特殊条件下,研究表明灌注血液中葡萄糖的缺乏会导致局部组织血管扩张。同样,当其他营养物质(如氨基酸或脂肪酸)缺乏时,也可能发生相同的效应,尽管这一点尚不确定。此外,在维生素缺乏症脚气病(beriberi)中也会发生血管扩张,患者缺乏维生素B类物质硫胺素(thiamine)、烟酸(niacin)和核黄素(riboflavin)。在这种疾病中,身体几乎各处的周围血管血流通常会增加两到三倍。由于所有这些维生素都是氧气诱导磷酸化所必需的,而磷酸化是组织细胞产生ATP所必需的,因此可以理解这些维生素的缺乏可能导致平滑肌收缩能力下降,从而引起局部血管扩张。
图17-4. 在暂时阻断供应血流的动脉后,组织中的反应性充血(reactive hyperemia)以及组织代谢活动增加后的主动性充血(active hyperemia)。
局部血流急性代谢控制的特殊例子
我们迄今为止描述的局部血流控制机制被称为代谢机制,因为它们都响应组织的代谢需求而发挥作用。局部血流代谢控制的两个特殊例子是反应性充血(reactive hyperemia)和主动性充血(active hyperemia)(图17-4)。
反应性充血发生在组织血液供应短暂阻断后
当组织的血液供应被阻断几秒钟到长达1小时或更长时间,然后解除阻断时,通过组织的血流通常会立即增加到正常值的四到七倍。如果阻断只持续了几秒钟,这种增加的流量将持续几秒钟,但如果血流停止了一小时或更长时间,有时会持续长达数小时。这种现象被称为反应性充血。
图 17-5. 不同水平的动脉压对肌肉血流的影响。红色实线显示的是动脉压在几分钟内升高时的效果。绿色虚线显示的是动脉压在数周内缓慢升高时的效果。
反应性充血(reactive hyperemia)是局部代谢性血流调节机制的另一种表现——即血流不足会启动所有导致血管舒张的因素。在短暂的血管闭塞后,反应性充血阶段的额外血流持续时间足够长,几乎可以完全补偿闭塞期间积累的组织氧亏缺。这一机制强调了局部血流调节与向组织输送氧气和其他营养物质之间的密切联系。
当组织代谢率增加时,会发生主动性充血(active hyperemia)。当组织变得高度活跃时,例如运动中的肌肉、分泌亢进期的胃肠腺体,甚至是精神活动增加时的大脑,流经组织的血流速率会增加(见图 17-4)。局部代谢的增加导致细胞迅速消耗组织液中的营养物质并释放大量血管舒张物质。结果是局部血管扩张和局部血流增加。通过这种方式,活跃的组织获得了维持其新功能水平所需的额外营养物质。如前所述,在剧烈运动期间,骨骼肌的主动性充血可以使局部肌肉血流增加多达 20 倍。
动脉压变化时的血流自我调节——代谢性和肌源性机制
在身体的任何组织中,动脉压的快速增加都会导致血流的立即上升。然而,在不到 1 分钟的时间内,大多数组织的血流几乎恢复到正常水平,即使动脉压保持升高。这种血流向正常的恢复被称为自我调节(autoregulation)。在自我调节发生后,大多数组织的局部血流将与动脉压大致相关,如图 17-5 中的实线急性曲线所示。请注意,在约 70 到 175mmHg 的动脉压之间,血流仅增加 20% 到 30%,即使动脉压增加了 150%。在某些组织中,如大脑和心脏,这种自我调节甚至更为精确。
近一个世纪以来,人们提出了两种观点来解释这种急性自我调节机制。它们被称为代谢理论(metabolic theory)和肌源性理论(myogenic theory)。
通过应用前面章节讨论的局部血流调节的基本原理,可以很容易理解代谢理论。因此,当动脉压变得过大时,过量的血流向组织提供了过多的氧气和其他营养物质,并冲走了组织释放的血管舒张物质。这些营养物质(尤其是氧气)和血管舒张物质组织水平的降低随后导致血管收缩,使血流恢复到接近正常水平,尽管压力增加。
然而,肌源性理论(myogenic theory)提出,另一种与组织代谢无关的机制解释了自动调节(autoregulation)现象。该理论基于观察到小血管的突然拉伸会导致血管壁的平滑肌收缩。因此,有人提出,当高动脉压力拉伸血管时,反应性血管收缩(reactive vascular constriction)会发生,从而使血流量几乎恢复到正常水平。相反,在低压情况下,血管的拉伸程度较小,因此平滑肌放松,减少血管阻力(vascular resistance),并帮助血流量恢复到正常水平。
肌源性反应(myogenic response)是血管平滑肌固有的特性,可以在没有神经或激素影响的情况下发生。它在微动脉(arterioles)中最为明显,但也可以在动脉、微静脉(venules)、静脉甚至淋巴管中观察到。肌源性收缩(myogenic contraction)是由拉伸诱导的血管去极化(stretch-induced vascular depolarization)引发的,这会迅速增加钙离子从细胞外液进入细胞,导致细胞收缩。血管压力的变化也可能打开或关闭其他影响血管收缩的离子通道。压力变化导致血管离子通道打开或关闭的确切机制尚不确定,但可能涉及压力对与血管壁细胞骨架元件或离子通道本身相连的细胞外蛋白的机械效应。
肌源性机制似乎在防止血压升高时血管过度拉伸方面起着重要作用。然而,肌源性机制在血流调节中的作用尚不明确,因为这种压力感应机制无法直接检测组织中血流的变化。在组织代谢需求显著增加的情况下,代谢因素似乎会覆盖肌源性机制,例如在剧烈肌肉运动期间,这会导致骨骼肌血流量显著增加。
特定组织中急性血流控制的特殊机制
尽管迄今为止讨论的局部血流控制的一般机制几乎存在于身体的所有组织中,但在一些特殊区域中运作着明显不同的机制。所有机制都将在本文中与特定器官相关进行讨论,但有两个值得注意的机制如下:
- 在肾脏中,血流控制主要依赖于一种称为管球反馈(tubuloglomerular feedback)的机制,其中远端小管(early distal tubule)中的液体成分由远端小管的上皮结构——致密斑(macula densa)检测。该结构位于远端小管与肾小球旁器(nephron juxtaglomerular apparatus)处的入球小动脉(afferent arterioles)和出球小动脉(efferent arterioles)相邻的位置。当过多的液体从血液通过肾小球(glomerulus)过滤到肾小管系统时,来自致密斑的反馈信号会导致入球小动脉收缩,从而将肾血流量和肾小球滤过率(glomerular filtration rate)降低到接近正常水平。该机制的细节将在第27章中讨论。
- 在大脑中,除了组织氧浓度对血流的控制外,二氧化碳和氢离子的浓度也起着重要作用。这两种物质中的任何一种或两者的增加都会扩张脑血管,并允许快速清除脑组织中过量的二氧化碳或氢离子。这一机制非常重要,因为大脑的兴奋性水平高度依赖于二氧化碳浓度和氢离子浓度的精确控制。这一特殊的脑血流控制机制将在第62章中详细介绍。
- 在皮肤中,血流控制与体温调节密切相关。皮肤和皮下的血流通过调节从核心到体表的热量流动来调节身体的热量散失,热量在体表散失到环境中。皮肤血流主要由中枢神经系统通过交感神经控制,如第74章所述。虽然在凉爽的天气中,皮肤血流仅为每100克组织约3ml/min,但根据需要可能会发生较大的变化。当人体暴露于加热环境中时,皮肤血流可能会大幅增加,全身血流可高达7至8升/分钟。当体温降低时,皮肤血流减少,在极低温度下几乎降至零。即使有严重的血管收缩,皮肤血流通常也足以满足皮肤的基本代谢需求。
图17-6. 内皮细胞中的一氧化氮合酶(eNOS)从精氨酸和氧气中合成一氧化氮(NO)。NO激活血管平滑肌细胞中的可溶性鸟苷酸环化酶,导致环磷酸鸟苷三磷酸(cGTP)转化为环磷酸鸟苷单磷酸(cGMP),最终使血管舒张。
组织血流的控制:内皮衍生的舒张或收缩因子
血管内壁的内皮细胞合成几种物质,当这些物质释放时,可以影响血管壁的舒张或收缩程度。对于许多这些内皮衍生的舒张或收缩因子,其生理作用才刚刚开始被理解。
一氧化氮是健康内皮细胞释放的血管舒张剂。最重要的内皮衍生的舒张因子是一氧化氮(NO),这是一种脂溶性气体,由内皮细胞在多种化学和物理刺激下释放。内皮衍生的eNOS酶从精氨酸和氧气中合成NO,并通过无机硝酸盐的还原产生。NO从内皮细胞扩散出来后,在血液中的半衰期仅为约6秒,主要在释放的局部组织中发挥作用。NO激活血管平滑肌细胞中的可溶性鸟苷酸环化酶(图17-6),导致环磷酸鸟苷三磷酸(cGTP)转化为环磷酸鸟苷单磷酸(cGMP),并激活cGMP依赖性蛋白激酶(PKG),该激酶具有多种作用,导致血管舒张。
血液通过动脉(arteries)和小动脉(arterioles)流动时,由于血液对血管壁的粘性阻力(viscous drag),会对内皮细胞(endothelial cells)产生剪切应力(shear stress)。这种应力使内皮细胞沿血流方向变形,并显著增加一氧化氮(NO)的释放。幸运的是,NO会使血管舒张,因为控制组织血流的局部代谢机制主要扩张每个组织中的微小动脉和小动脉。然而,当循环中微血管部分的血流增加时,由于这些血管中血流和剪切应力的增加,这一作用会次生地刺激大血管释放NO。当下游微血管血流增加时,释放的NO会增加上游较大血管的直径。如果没有这种反应,局部血流控制的有效性会降低,因为血流阻力的很大一部分存在于上游的小动脉中。
一些血管收缩剂(vasoconstrictors),如血管紧张素II(angiotensin II),也会刺激内皮细胞合成和释放NO,它们与内皮细胞上的特定受体结合。增加的NO释放可以防止过度的血管收缩。
当内皮细胞因慢性高血压(chronic hypertension)或动脉粥样硬化(atherosclerosis)而受损时,NO合成受损可能导致过度的血管收缩,并加剧高血压和内皮损伤。如果不加以治疗,这最终可能导致血管损伤和对脆弱组织(如心脏、肾脏和大脑)的损害。
甚至在NO被发现之前,临床医生就使用硝酸甘油(nitroglycerin)、硝酸异戊酯(amyl nitrate)和其他硝酸盐衍生物来治疗心绞痛(angina pectoris)患者——即由心肌缺血(ischemia)引起的严重胸痛。这些药物在化学分解时会释放NO,并导致全身血管(包括冠状动脉)的扩张。
NO生理学和药理学的其他重要应用是开发和临床使用抑制cGMP特异性磷酸二酯酶-5(PDE-5)的药物(如西地那非(sildenafil)),PDE-5是一种降解cGMP的酶。通过防止cGMP的降解,PDE-5抑制剂有效地延长了NO引起血管舒张的作用。PDE-5抑制剂的主要临床用途是治疗勃起功能障碍(erectile dysfunction)。阴茎勃起是由通过盆神经(pelvic nerves)到阴茎的副交感神经冲动引起的,其中释放了神经递质乙酰胆碱(acetylcholine)和NO。通过防止NO的降解,PDE-5抑制剂增强了阴茎血管的扩张并有助于勃起,如第81章所述。
内皮素是一种由受损内皮释放的强效血管收缩剂(vasoconstrictor)。内皮细胞也会释放血管收缩物质。其中最重要的是内皮素(endothelin),这是一种由27个氨基酸组成的大肽类物质,仅需微量(纳克级)即可引起强烈的血管收缩。这种物质存在于所有或大多数血管的内皮细胞中,但当血管受损时会大幅增加。释放的常见刺激是内皮损伤,例如由组织挤压或将创伤性化学物质注入血管引起的损伤。在严重血管损伤后,局部释放的内皮素和随后的血管收缩有助于防止直径达5毫米的动脉因挤压伤而撕裂时发生大出血。
当内皮因高血压(hypertension)受损时,内皮素释放增加也被认为会导致血管收缩。阻断内皮素受体的药物已被用于治疗肺动脉高压(pulmonary hypertension),但通常不用于降低系统性动脉高血压(systemic arterial hypertension)患者的血压。
长期血流调节
到目前为止,我们讨论的大多数局部血流调节机制在局部组织条件改变后的几秒到几分钟内就会发挥作用。然而,即使这些急性机制完全激活,血流通常也只能调整到组织额外需求的大约四分之三。例如,当动脉压突然从100毫米汞柱(mm Hg)增加到150毫米汞柱时,血流几乎立即增加约100%。然后,在30秒到2分钟内,血流回落到比原始控制值高约10%到15%的水平。这个例子说明了局部血流调节的急性机制的快速性,但也表明调节仍然不完全,因为某些组织中仍存在10%到15%的过量血流。
然而,在数小时、数天和数周的时间内,除了急性控制外,还会发展出一种长期的局部血流调节机制。这种长期调节提供了更完整的血流控制。在前述例子中,如果动脉压无限期保持在150毫米汞柱,组织中的血流在几周内逐渐接近几乎完全正常的血流水平。图17-5(绿色虚线曲线)显示了这种长期局部血流调节的极端有效性。请注意,一旦长期调节有时间发生,动脉压在50到200毫米汞柱之间的长期变化对局部血流速率的影响很小。
当组织的代谢需求发生变化时,长期血流调节尤为重要。因此,如果组织长期过度活跃并需要更多的氧气和其他营养物质,除非循环系统已经病变或过于老化而无法响应,否则小动脉和毛细血管通常会在几周内增加数量和大小,以满足组织的需求。
通过组织血管性变化调节血流
长期局部血流调节的一个关键机制是改变组织的血管量(vascularity)。例如,如果组织的代谢(metabolism)长期增加,血管量就会增加,这一过程通常称为血管生成(angiogenesis);如果代谢减少,血管量就会减少。图17-7显示了大鼠胫骨前肌(anterior tibialis muscle)在每天短时间电刺激收缩30天后,毛细血管数量的大幅增加,与动物另一条腿未受刺激的肌肉相比。
图17-7. 大鼠胫骨前肌在每天短时间电刺激收缩30天后,毛细血管(白点)数量的大幅增加(B),与未受刺激的肌肉(A)相比。30天的间歇性电刺激将主要快肌纤维(fast-twitch)、糖酵解(glycolytic)的胫骨前肌转变为主要慢肌纤维(slow-twitch)、氧化性(oxidative)的肌肉,毛细血管数量增加,纤维直径减小,如图所示。(由Thomas Adair博士提供)
因此,组织血管的实际物理重建(physical reconstruction)会发生以满足组织的需求。这种重建在年轻动物中发生迅速(几天内)。它也在新生长的组织中迅速发生,例如在癌性组织中,但在老化的、已经建立的组织中发生得慢得多。因此,长期调节所需的时间在新生儿可能只需几天,而在老年人中可能需要数月。此外,年轻组织的最终反应程度比老年组织好得多;因此,在新生儿中,血管量会调整到几乎完全匹配组织对血流的需求,而在老年组织中,血管量经常远远落后于组织的需求。
氧气在长期调节中的作用。氧气不仅对局部血流的急性控制(acute control)重要,对长期控制(long-term control)也很重要。一个例子是生活在高海拔地区的动物组织中血管量的增加,那里的大气氧气含量低。在早产儿(premature babies)中,为了治疗目的而被放入氧气帐篷时,过量的氧气几乎立即导致早产儿眼睛视网膜(retina)中新血管生长的停止,甚至导致一些已经形成的小血管退化。当婴儿被移出氧气帐篷时,新血管的爆炸性过度生长(explosive overgrowth)会发生,以弥补可用氧气的突然减少。通常,过度生长如此严重,以至于视网膜血管从视网膜生长到眼睛的玻璃体(vitreous humor)中,最终导致失明,这种情况称为晶状体后纤维增生症(retrolental fibroplasia)。
血管生长因子在新血管形成中的重要性
已经发现了十几种或更多能够促进新血管生长的因子,其中几乎都是小肽类物质。研究最为深入的四种因子是血管内皮生长因子(VEGF, vascular endothelial growth factor)、成纤维细胞生长因子(fibroblast growth factor)、血小板衍生生长因子(PDGF, platelet-derived growth factor)和血管生成素(angiogenin),这些因子都是从血液供应不足的组织中分离得到的。组织缺氧会诱导缺氧诱导因子(HIFs, hypoxia inducible factors)的表达,这些转录因子进而上调基因表达和血管生长因子(也称为血管生成因子)的形成。
血管生成始于从其他小血管中萌发的新血管。第一步是内皮细胞基底膜在萌发点的溶解。随后,新内皮细胞快速增殖,通过血管壁向外延伸,朝向血管生成因子的来源方向生长。每个延伸索中的细胞继续分裂并迅速折叠成管状结构。接下来,这个管状结构与从另一个供体血管(另一个小动脉或小静脉)萌发的另一个管状结构连接,形成一个毛细血管环,血液开始在其中流动。如果血流足够大,平滑肌细胞最终会侵入管壁,因此一些新血管最终会生长为新的小动脉、小静脉,甚至更大的血管。因此,血管生成解释了局部组织中的代谢因子如何导致新血管的生长。
某些其他物质,如一些类固醇激素,对小血管有相反的作用,有时甚至会导致血管细胞的溶解和血管的消失。因此,当血管不再需要时,它们也可以消失。组织中产生的肽类物质也可以阻止新血管的生长。例如,血管抑素(angiostatin)是纤溶酶原(plasminogen)蛋白的一个片段,是一种天然存在的血管生成抑制剂。内皮抑素(endostatin)是另一种抗血管生成肽,来源于XVII型胶原的分解。尽管这些抗血管生成物质的精确生理功能尚不清楚,但它们在阻止癌性肿瘤中血管生长方面的潜在应用引起了极大的兴趣,从而防止快速生长的肿瘤所需的血流量大幅增加。
血管密度由最大血流量需求决定,而非平均需求
长期血管控制的一个特别有价值的特征是,血管密度主要由组织所需的最大血流量水平决定,而不是由平均需求决定。例如,在剧烈运动期间,全身血流量需求通常增加到静息血流量的六到八倍。这种大量的血流可能每天只需要几分钟。然而,即使是这种短时间的需求,也足以使肌肉产生足够的血管生成因子,从而根据需要增加其血管密度。如果没有这种能力,每次一个人尝试剧烈运动时,肌肉将无法获得所需的营养物质,特别是所需的氧气,因此肌肉将无法收缩。
然而,当血管外(extra vascularity)确实形成后,这些额外的血管通常会保持主要处于血管收缩(vasoconstricted)状态,只有在适当的局部刺激(如缺氧、神经血管舒张(nerve vasodilatory)刺激或其他刺激)出现时才会打开以允许额外的血流。
通过侧支循环(collateral circulation)发展调节血流
在身体的大多数组织中,当动脉或静脉被阻塞时,通常会在阻塞周围形成新的血管通道,并至少部分恢复受影响组织的血液供应。这个过程的第一阶段是已经连接阻塞上方和下方血管的小血管环的扩张。这种扩张发生在最初的一两分钟内,表明扩张可能是由代谢因素介导的。在侧支血管(collateral vessels)最初打开后,血流通常仍然少于满足所有组织需求所需的25%。然而,在接下来的几个小时内会发生进一步的开放,因此在1天内可以满足多达一半的组织需求,并且在几天内,血流通常足以满足组织需求。
侧支血管在此后的许多个月内继续生长,通常形成多个小的侧支通道,而不是一个单一的大血管。在静息条件下,血流可能恢复到接近正常水平,但新通道很少变得足够大以在剧烈组织活动期间提供所需的血流。因此,侧支血管的发展遵循急性和长期局部血流控制的通常原则;急性控制是快速的代谢扩张,随后在数周和数月内新血管的生长和扩大。
侧支血管发展的一个重要例子发生在冠状动脉(coronary arteries)之一血栓形成后。到60岁时,许多人已经经历过至少一个较小的冠状动脉分支的闭合或至少部分闭塞,但他们并未意识到这一点,因为侧支血管发展得足够快以防止心肌损伤。当由于冠状动脉不足的迅速性或严重性,侧支血管无法迅速发展到足以维持血流时,可能会发生严重的心脏病发作。
对慢性血流或血压变化的血管重塑(vascular remodeling)
血管生长和重塑是组织发育和生长的关键组成部分,它们作为对血压或血流量长期变化的适应性反应而发生。例如,经过几个月的长期运动训练,训练肌肉的血管密度增加,以满足其更高的血流量需求。除了毛细血管密度的变化外,大血管的结构也可能因血压和血流量的长期变化而发生改变。例如,当血压长期高于正常水平时,大、小动脉和小动脉会重塑以适应较高血压增加的机械壁应力。在大多数组织中,小动脉和小动脉会迅速(在几秒钟内)对增加的动脉压力做出反应,通过血管收缩来帮助自动调节组织血流量,如前所述。血管收缩减少了管腔直径,从而倾向于使血管壁张力(T)正常化,根据拉普拉斯方程,这是血管半径(r)和其压力(P)的乘积:T=r×P。
在因血压增加而收缩的小血管中,血管平滑肌细胞和内皮细胞逐渐——在几天或几周的时间内——围绕较小的管腔直径重新排列,这一过程称为内向性营养重塑,血管壁的总横截面积没有变化(图17-8)。在不对增加的压力做出收缩反应的大动脉中,血管壁暴露于增加的壁张力,这刺激了肥大性重塑反应和血管壁横截面积的增加。肥大性反应增加了血管平滑肌细胞的大小,并刺激了额外的细胞外基质蛋白(如胶原蛋白和纤维连接蛋白)的形成,这些蛋白增强了血管壁的强度以承受更高的血压。然而,这种肥大性反应也使大血管变得更僵硬,这是慢性高血压的标志。
血管重塑的另一个例子是当大静脉(通常是隐静脉)被植入患者体内进行冠状动脉搭桥手术时发生的变化。静脉通常暴露于比动脉低得多的压力,并且壁较薄,但当静脉被缝合到主动脉并连接到冠状动脉时,它会暴露于增加的管腔内压力和壁张力。增加的壁张力启动了血管平滑肌细胞的肥大和细胞外基质形成的增加,这使静脉壁变厚并增强;因此,在植入动脉系统几个月后,静脉通常会有与动脉相似的壁厚度。
图 17-8. 血管重塑(remodeling)对慢性血压或血流量增加的反应。在因血压升高而收缩的小动脉和小动脉中,通常会发生向心性重塑(inward eutrophic remodeling),因为管腔直径较小且血管壁较厚,但血管壁的总横截面积几乎没有变化。在不对血压升高产生收缩反应的大血管中,可能会发生肥大性重塑(hypertrophic remodeling),血管壁的厚度和总横截面积增加。如果血管长期暴露于血流量增加的环境中,通常会发生向外重塑(outward remodeling),管腔直径增加,壁厚变化不大,血管壁的总横截面积增加。如果血管长期暴露于血压和血流量增加的环境中,通常会发生向外肥大性重塑(outward hypertrophic remodeling),管腔直径、壁厚和血管壁的总横截面积均增加。如前所述,血压和血流量的长期降低会产生相反的效果。
当血管长期暴露于增加或减少的血流量时,也会发生血管重塑(remodeling)。创建连接大动脉和大静脉的瘘管(fistula),从而完全绕过高阻力的小血管和毛细血管,为受影响动脉和静脉的重塑提供了一个特别有趣的例子。在接受透析的肾衰竭患者中,从桡动脉(radial artery)到前臂肘前静脉(antecubital vein)直接创建动静脉(A-V)瘘管,以便为透析提供血管通路。桡动脉中的血流量可能会增加到正常血流量的10到50倍,具体取决于瘘管的通畅程度。由于高流量和高剪切应力(shear stress)作用于血管壁,桡动脉的管腔直径逐渐增加(向外重塑),而血管壁的厚度可能保持不变,导致血管壁的横截面积增加。相比之下,瘘管静脉侧的壁厚、管腔直径和血管壁的横截面积随着压力和血流量的增加而增加(向外肥大性重塑)。这种重塑模式与以下观点一致:血管壁张力的长期增加会导致大血管的肥大和壁厚增加,而血流量的增加和剪切应力会导致向外重塑和管腔直径增加,以适应增加的血流量。
血压和血流量的长期降低会产生与前述相反的效果。当血流量大大减少时,血管腔的直径也会减小,当血压降低时,血管壁的厚度通常会减小。因此,血管重塑是血管对组织生长和发育以及血压和血流量对组织的生理和病理变化的重要适应性反应。
循环的体液调节(HUMORAL CONTROL OF THE CIRCULATION)
体液(体液)对循环的控制是指通过分泌或吸收到体液中的物质(如激素和局部产生的因子)进行的控制。其中一些物质由特殊腺体形成,并通过血液运输到全身。另一些则在局部组织区域形成,仅引起局部循环效应。影响循环功能的最重要的体液因子将在以下部分中描述。
血管收缩剂(Vasoconstrictors)
去甲肾上腺素(Norepinephrine)和肾上腺素(Epinephrine)。去甲肾上腺素是一种特别强大的血管收缩激素;肾上腺素作为血管收缩剂的作用较弱,在某些组织中甚至会引起轻微的血管舒张(由肾上腺素引起的血管舒张的一个特殊例子是在心脏活动增加期间冠状动脉的扩张)。
当在压力或运动期间刺激身体大部分区域的交感神经系统时,各组织中的交感神经末梢会释放去甲肾上腺素,从而兴奋心脏并收缩静脉和小动脉。此外,通向肾上腺髓质的交感神经会促使这些腺体将去甲肾上腺素和肾上腺素分泌到血液中。这些激素随后循环到身体的各个区域,并对循环产生几乎与直接交感神经刺激相同的效果,从而提供双重控制系统:(1)直接神经刺激;和(2)循环血液中去甲肾上腺素和/或肾上腺素的间接作用。
血管紧张素II(Angiotensin II)。血管紧张素II是另一种强大的血管收缩物质。仅需百万分之一克即可使人的动脉压增加50毫米汞柱或更多。
血管紧张素II的作用是强烈收缩小动脉。如果这种收缩发生在孤立的组织区域,流向该区域的血流可能会严重减少。然而,血管紧张素II的真正重要性在于它通常同时作用于身体的许多小动脉,以增加总外周阻力并减少肾脏对钠和水的排泄,从而增加动脉压。因此,这种激素在动脉压的调节中起着不可或缺的作用,这将在第19章中详细讨论。
血管加压素(Vasopressin)。血管加压素,也称为抗利尿激素(Antidiuretic Hormone),作为血管收缩剂比血管紧张素II更强大,因此它是体内最有效的血管收缩物质之一。它在大脑下丘脑的神经细胞中形成(见第29章和第76章),但随后通过神经轴突向下运输到垂体后叶,最终分泌到血液中。
显然,血管加压素可能对循环功能产生巨大影响。然而,由于在大多数生理条件下仅分泌微量的血管加压素,大多数生理学家认为血管加压素在血管控制中作用不大。然而,实验表明,严重出血后循环血液中血管加压素的浓度可以增加到足以显著减轻动脉压的下降。在某些情况下,这种作用本身就可以使动脉压几乎恢复到正常水平。
加压素(vasopressin)的主要功能是显著增加肾小管对水的重吸收(将在第29章讨论),从而帮助控制体液容量。这就是为什么这种激素也被称为抗利尿激素(antidiuretic hormone)。
血管扩张剂(vasodilators)
缓激肽(bradykinin)。一些被称为激肽(kinins)的物质在某些器官的血液和组织液中形成时会引起强烈的血管扩张。激肽是由血浆或组织液中的\bf a2-球蛋白(globulin)经蛋白水解酶(proteolytic enzyme)裂解产生的小分子多肽(polypeptide)。在此过程中特别重要的蛋白水解酶是激肽释放酶(kallikrein),它以无活性形式存在于血液和组织液中。这种无活性的激肽释放酶可通过血液浸渍、组织炎症或血液或组织的其他类似化学或物理作用而被激活。当激肽释放酶被激活后,它会立即作用于\bf a2-球蛋白,释放出一种称为赖氨酰缓激肽(kallidin)的激肽,然后赖氨酰缓激肽被组织酶转化为缓激肽。一旦形成,缓激肽只能持续几分钟,因为它会被羧肽酶(carboxypeptidase)或转化酶(converting enzyme)灭活,转化酶在第19章讨论的血管紧张素(angiotensin)激活过程中也起着重要作用。激活的激肽释放酶会被体液中也存在的激肽释放酶抑制剂(kallikrein inhibitor)破坏。
缓激肽既能引起强烈的微动脉扩张,又能增加毛细血管通透性。例如,将1微克缓激肽注入人的肱动脉,可使手臂的血流量增加多达六倍,而局部注入组织的更少量缓激肽也会因毛细血管孔径增大而引起明显的局部水肿。
激肽似乎在调节炎症组织的血流和毛细血管液体渗漏方面发挥特殊作用。人们还认为,缓激肽在皮肤以及唾液腺和胃肠道腺体的血流调节中发挥正常作用。
组胺(histamine)。如果组织受损、发炎或发生过敏反应,几乎身体的每个组织都会释放组胺。大多数组胺来自受损组织中的肥大细胞(mast cell)和血液中的嗜碱性粒细胞(basophil)。
组胺对微动脉有强烈的血管扩张作用,并且像缓激肽一样,能够大大增加毛细血管孔隙度,使液体和血浆蛋白渗漏到组织中。在许多病理情况下,组胺引起的强烈微动脉扩张和毛细血管孔隙度增加会导致大量液体从循环中渗漏到组织中,引起水肿。组胺的局部血管扩张和致水肿作用在过敏反应期间尤为突出,将在第35章讨论。
离子和其他化学因素对血管的调控
许多不同的离子和其他化学因素可以扩张或收缩局部血管。以下列表详细说明了它们的一些具体作用:
- 细胞内钙离子浓度增加会引起血管收缩,因为钙离子具有刺激平滑肌收缩的一般作用,如第8章所述。
- 在生理范围内,钾离子浓度增加会引起血管扩张。这种效应源于钾离子抑制平滑肌收缩的能力。
- 镁离子浓度的增加会引起强烈的血管舒张(vasodilation),因为镁离子抑制平滑肌(smooth muscle)的收缩。
- 氢离子浓度的增加(pH值降低)会引起小动脉(arterioles)的舒张。相反,氢离子浓度的轻微降低会引起小动脉的收缩。
- 对血管有显著影响的阴离子是乙酸根(acetate)和柠檬酸根(citrate),两者都会引起轻度的血管舒张。
- 二氧化碳浓度的增加在大多数组织中会引起中度的血管舒张,但在大脑中会引起显著的血管舒张。此外,血液中的二氧化碳作用于大脑的血管运动中枢(vasomotor center),通过交感神经血管收缩系统(sympathetic nervous vasoconstrictor system)传递,具有极其强大的间接效应,导致全身广泛的血管收缩。
大多数血管舒张剂或血管收缩剂除非改变组织的代谢率,否则对长期血流几乎没有影响。在大多数实验研究中,除了1到2天外,当长期输注大量强效血管收缩剂如血管紧张素II(angiotensin II)或血管舒张剂如缓激肽(bradykinin)时,组织血流和心输出量(cardiac output)(流向身体所有组织的血流总和)不会发生显著变化。为什么在大多数组织中,即使存在大量这些血管活性物质,血流也没有显著改变?
要回答这个问题,我们必须回到之前讨论的循环功能的基本原则之一——每个组织根据其代谢需求和其他功能自动调节自身血流的能力。给予强效血管收缩剂,如血管紧张素II,可能会引起组织血流和心输出量的短暂下降,但如果不改变组织的代谢率,通常对长期影响不大。同样,大多数血管舒张剂如果不改变组织代谢,只会引起组织血流和心输出量的短期变化。因此,只要动脉压力足以灌注组织,血流通常根据组织的特定需求进行调节。
循环的神经调节和动脉压的快速控制
循环的神经调节
如第17章所述,组织和器官中血流的调节主要是局部组织控制机制的功能。在本章中,我们将讨论循环的神经控制如何具有更全局的功能,例如将血流重新分配到身体的不同区域、增加或减少心脏的泵血活动,以及提供对全身动脉压的快速控制。
神经系统几乎完全通过自主神经系统(autonomic nervous system)控制循环。该系统的总功能在第61章中介绍,该主题也在第17章中介绍。在本章中,我们将考虑更多具体的解剖和功能特征。
自主神经系统
调节循环的自主神经系统中最重要的部分是交感神经系统(sympathetic nervous system)。然而,副交感神经系统(parasympathetic nervous system)对心脏功能的调节也有重要贡献,如本章后面所述。
交感神经系统(Sympathetic Nervous System)
图18-1展示了循环系统的交感神经控制的解剖结构。交感血管运动神经纤维通过所有胸段脊神经和第一或第二腰段脊神经离开脊髓。然后它们立即进入交感神经链,每侧椎体旁各有一条。接着,它们通过两条路径到达循环系统:(1) 通过特定的交感神经,主要支配内脏和心脏的血管系统,如图18-1右侧所示;(2) 几乎立即进入脊神经的外周部分,分布到外周区域的血管系统。这些纤维在脊髓和交感神经链中的精确路径将在第61章中讨论。
血管的交感神经支配(Sympathetic Innervation of the Blood Vessels)
图18-2展示了交感神经纤维在血管中的分布,表明在大多数组织中,除毛细血管外的所有血管都受到神经支配。在某些组织中,如肠系膜血管,毛细血管前括约肌和微动脉也受到神经支配,尽管它们的交感神经支配通常不如小动脉、微动脉和静脉密集。
小动脉和微动脉的神经支配使得交感神经刺激能够增加血流阻力,从而减少通过组织的血流速率。
大血管,特别是静脉的神经支配,使得交感神经刺激能够减少这些血管的容积。这种容积的减少可以将血液推入心脏,从而在心脏泵血的调节中起主要作用,我们将在本章和后续章节中进一步解释。
交感神经刺激增加心率和收缩力(Sympathetic Stimulation Increases Heart Rate and Contractility)
如图18-1所示,交感神经纤维也直接到达心脏。正如第9章所讨论的,交感神经刺激显著增加心脏的活动,既增加心率,又增强其泵血的强度和容量。
副交感神经刺激降低心率和收缩力(Parasympathetic Stimulation Decreases Heart Rate and Contractility)
尽管副交感神经系统在身体的许多其他自主功能(如控制多种胃肠道活动)中极为重要,但在大多数组织中,它在调节血管功能方面只起次要作用。其最重要的循环效应是通过迷走神经中的副交感神经纤维控制心率,如图18-1中从脑髓直接到心脏的红色虚线所示。
第9章详细讨论了副交感神经刺激对心脏功能的影响。主要是,副交感神经刺激导致心率显著下降和心肌收缩力轻微下降。
图18-1. 循环系统的交感神经控制的解剖结构。此外,红色虚线表示迷走神经,它携带副交感信号到心脏。
交感缩血管系统及其由中枢神经系统的控制(Sympathetic Vasoconstrictor System and Its Control by the Central Nervous System)
交感神经携带大量的血管收缩神经纤维(vasoconstrictor nerve fibers)和少量的血管舒张纤维(vasodilator fibers)。血管收缩纤维分布到循环系统的几乎所有节段,但在某些组织中的分布比其他组织更多。这种交感血管收缩效应在肾脏、肠道、脾脏和皮肤中特别强,但在骨骼肌、心脏和大脑中则较弱。
图18-2. 体循环的交感神经支配。
图18-3. 在循环的神经调节中起重要作用的大脑区域。虚线表示抑制通路。
大脑中的血管运动中枢及其对血管收缩系统的控制。血管运动中枢(vasomotor center)主要位于延髓网状结构和脑桥下三分之一的双侧区域,如图18-1和图18-3所示。该中枢通过迷走神经(vagus nerves)向心脏传递副交感神经冲动,并通过脊髓和外周交感神经向几乎所有的动脉、小动脉和静脉传递交感神经冲动。
尽管血管运动中枢的整体组织仍不明确,但实验已经能够识别该中枢中的某些重要区域:
- 血管收缩区(vasoconstrictor area),位于延髓上部的双侧前外侧部分。起源于该区域的神经元将其纤维分布到脊髓的所有水平,在那里它们兴奋交感神经系统的节前血管收缩神经元。
图18-4. 全脊髓麻醉对动脉压的影响,显示由于血管运动张力丧失而导致的显著血压下降。
- 血管舒张区(vasodilator area),位于延髓下半部的双侧前外侧部分。这些神经元的纤维向上投射到上述的血管收缩区,抑制该区域的血管收缩活动并引起血管舒张。
- 感觉区(sensory area),位于延髓和脑桥下部的双侧孤束核(nucleus tractus solitarius)的后外侧部分。该区域的神经元主要通过迷走神经和舌咽神经(glossopharyngeal nerves)接收来自循环系统的感觉神经信号,然后从该感觉区输出的信号有助于控制血管运动中枢的血管收缩区和血管舒张区的活动,从而提供对许多循环功能的反射控制。一个例子是本章后面描述的用于控制动脉压的压力感受器反射(baroreceptor reflex)。
交感缩血管紧张对血管的持续部分收缩作用。在正常情况下,血管运动中枢的缩血管区持续向全身的交感缩血管神经纤维传递信号,导致这些纤维以大约每秒0.5到2次的速率缓慢放电。这种持续的放电称为交感缩血管紧张(sympathetic vasoconstrictor tone)。这些冲动通常维持血管的部分收缩状态,称为血管运动紧张(vasomotor tone)。
图18-4展示了缩血管紧张的重要性。在该图所示的实验中,给动物注射了脊髓麻醉剂。这种麻醉剂阻断了从脊髓到外周的所有交感神经冲动的传递。结果,动脉压从100降至50mmHg,展示了全身缩血管紧张丧失的效果。几分钟后,向血液中注射了少量的激素去甲肾上腺素(norepinephrine)(去甲肾上腺素是交感缩血管神经纤维末梢分泌的主要缩血管激素物质)。随着注射的激素通过血液运输到血管,血管再次收缩,动脉压在1到3分钟内上升到比正常水平更高的水平,直到去甲肾上腺素被分解。
血管运动中枢对心脏活动的控制。
在血管运动中枢调节血管收缩量的同时,它也控制心脏活动。当需要增加心率和收缩力时,血管运动中枢的外侧部分通过交感神经纤维向心脏传递兴奋性冲动。相反,当需要减少心脏泵血时,血管运动中枢的内侧部分向邻近的迷走神经背侧运动核发送信号,然后通过迷走神经向心脏传递副交感冲动,以降低心率和心脏收缩力。因此,血管运动中枢可以增加或减少心脏活动。通常,当血管收缩发生时,心率和心脏收缩力会增加;当血管收缩被抑制时,心率和心脏收缩力会减少。
高级神经中枢对血管运动中枢的控制。位于脑桥、中脑和间脑网状结构中的大量小神经元可以兴奋或抑制血管运动中枢。这种网状结构如图18-3所示。一般来说,网状结构中外侧和上部的神经元引起兴奋,而内侧和下部的神经元引起抑制。
下丘脑在控制缩血管系统中起着特殊作用,因为它可以对血管运动中枢施加强大的兴奋或抑制作用。下丘脑后外侧部分主要引起兴奋,而前部可以引起轻度兴奋或抑制,具体取决于下丘脑前部被刺激的精确部位。
大脑皮层的许多部分也可以兴奋或抑制血管运动中枢(vasomotor center)。例如,运动皮层的刺激会兴奋血管运动中枢,因为冲动向下传递到下丘脑,然后到达血管运动中枢。此外,颞叶前部、额叶皮层的眶区、扣带回前部、杏仁核、隔膜和海马的刺激都可以兴奋或抑制血管运动中枢,这取决于这些区域被刺激的精确部分以及刺激的强度。因此,大脑的广泛基底区域可以对心血管功能产生深远影响。
去甲肾上腺素(Norepinephrine)是交感缩血管神经递质。在缩血管神经末梢分泌的物质几乎完全是去甲肾上腺素,它直接作用于血管平滑肌的α-肾上腺素能受体(alpha-adrenergic receptors)引起血管收缩,如第61章所述。
肾上腺髓质(Adrenal Medullae)及其与交感缩血管系统的关系。交感神经冲动在传递到血管的同时也传递到肾上腺髓质。这些冲动使髓质向循环血液中分泌肾上腺素(epinephrine)和去甲肾上腺素。这两种激素通过血液输送到身体的各个部位,直接作用于所有血管,通常引起血管收缩。在少数组织中,肾上腺素会引起血管舒张,因为它也刺激β-肾上腺素能受体(beta-adrenergic receptors),使某些血管扩张而不是收缩,如第61章所述。
交感舒血管系统(Sympathetic Vasodilator System)及其由中枢神经系统(Central Nervous System, CNS)的控制。支配骨骼肌的交感神经既携带交感缩血管纤维,也携带舒血管纤维。在一些动物中,如猫,这些舒血管纤维在末梢释放乙酰胆碱(acetylcholine),而不是去甲肾上腺素。然而,在灵长类动物中,舒血管效应被认为是由肾上腺素兴奋肌肉血管系统中的特定β-肾上腺素能受体引起的。
图18-3中的虚线显示了中枢神经系统控制舒血管系统的通路。控制该系统的大脑主要区域是下丘脑前部。
交感舒血管系统的可能作用。交感舒血管系统似乎在人类循环控制中并不起主要作用,因为在许多生理条件下,完全阻断支配肌肉的交感神经几乎不影响这些肌肉控制自身血流的能力。然而,一些实验表明,在运动开始时,交感系统可能会引起骨骼肌的初始血管舒张,以允许血流的预期增加,甚至在肌肉需要更多营养之前。有证据表明,人类骨骼肌中的这种交感舒血管反应可能是由循环中的肾上腺素介导的,它刺激β-肾上腺素能受体,或者是由乙酰胆碱刺激后从血管内皮释放的一氧化氮(nitric oxide)介导的。
情绪性晕厥——血管迷走性晕厥(Vasovagal Syncope)。在经历强烈情绪波动导致晕厥的人群中,会出现一种有趣的血管舒张反应。在这种情况下,肌肉血管舒张系统被激活,同时,迷走神经心脏抑制中枢向心脏传递强烈信号,使心率显著减慢。动脉血压迅速下降,减少了流向大脑的血流,导致人失去意识。这种整体效应被称为血管迷走性晕厥。情绪性晕厥始于大脑皮层的干扰性思维。通路可能随后到达下丘脑前部的血管舒张中枢,靠近延髓的迷走神经中枢,通过迷走神经到达心脏,也通过脊髓到达肌肉的交感血管舒张神经。
神经系统在快速控制动脉血压中的作用
神经对循环控制的最重要功能之一是能够快速升高动脉血压。为此,交感神经系统的整个血管收缩和心脏加速功能被同时刺激。同时,对心脏的副交感迷走神经抑制信号被相互抑制。因此,以下三个主要变化同时发生,每个变化都有助于增加动脉血压:
- 体循环中的大多数小动脉收缩,这大大增加了总外周阻力,从而增加了动脉血压。
- 静脉(以及循环中的其他大血管)强烈收缩。这种收缩将血液从外周大血管推向心脏,从而增加了心脏腔室中的血液量。心脏的拉伸使心脏以更大的力量跳动,从而泵出更多的血液。这也增加了动脉血压。
- 最后,心脏受到自主神经系统的直接刺激,进一步增强了心脏泵血。这种增强的心脏泵血主要是由于心率的增加,有时心率增加到正常的三倍。此外,交感神经信号直接增加了心肌的收缩力,增加了心脏泵出更多血液的能力。在强烈的交感神经刺激下,心脏可以泵出大约两倍于正常情况下的血液,这进一步促进了动脉血压的急剧上升。
神经系统对动脉血压的控制是快速的。神经系统对动脉血压控制的一个特别重要的特征是反应的快速性,在几秒钟内开始,通常在5到10秒内将血压增加到正常的两倍。相反,突然抑制神经心血管刺激可以在10到40秒内将动脉血压降低到正常的一半。因此,神经控制是动脉血压调节的最快速机制。
肌肉运动和其他应激期间动脉血压的升高
神经系统增加动脉压能力的一个重要例子是肌肉运动期间发生的压力升高。在剧烈运动期间,肌肉需要大大增加的血流量。这种增加的部分原因是由于肌肉细胞代谢增加引起的肌肉血管局部扩张,如第17章所述。另一部分增加是由于运动期间交感神经对整个循环的刺激同时引起的动脉压升高。在剧烈运动中,动脉压上升约30%至40%,这进一步使血流量增加近2倍。
运动期间动脉压的升高主要源于神经系统的作用。当大脑的运动区域被激活以引起运动时,脑干的大部分网状激活系统也被激活,这包括对血管运动中枢的血管收缩和心脏加速区域的刺激大大增加。这些效应迅速增加动脉压,以跟上肌肉活动的增加。
除了肌肉运动外,在许多其他类型的压力下,也会发生类似的压力升高。例如,在极度恐惧时,动脉压有时在几秒钟内上升多达75至100mmHg。这种反应被称为警报反应,它提供了一个升高的动脉压,可以立即为身体可能需要立即响应的肌肉提供血液,以便逃离危险。
维持正常动脉压的反射机制
除了自主神经系统增加动脉压的运动和压力功能外,多个潜意识的特殊神经控制机制一直在运作,以维持动脉压在或接近正常水平。几乎所有这些都是负反馈反射机制,将在以下部分中描述。
压力感受器动脉压控制系统——压力感受器反射
最著名的动脉压控制神经机制是压力感受器反射。基本上,这种反射是由位于几个大系统动脉壁特定点的牵张感受器(称为压力感受器或压力感受器)启动的。动脉压的升高会拉伸压力感受器,并导致它们向中枢神经系统传递信号。然后通过自主神经系统向循环系统发送反馈信号,以将动脉压降低到正常水平。
压力感受器的生理解剖及其神经支配。压力感受器是位于动脉壁中的喷雾型神经末梢,当被拉伸时会被刺激。几乎每个胸部和颈部区域的大动脉壁中都有一些压力感受器,但如图18-5所示,压力感受器在以下区域极为丰富:(1)每个颈内动脉壁,略高于颈动脉分叉处,称为颈动脉窦的区域;和(2)主动脉弓壁。
图18-5. 控制动脉压的压力感受器系统。
图18-6. 不同动脉压水平下压力感受器(baroreceptors)的激活情况。Δ\vert,颈动脉窦神经每秒冲动变化;ΔP.,动脉血压变化(单位为m mH g)。
图18-5显示,来自颈动脉压力感受器的信号通过小的Hering神经传递到高颈部的舌咽神经,然后传递到脑干延髓区的孤束核(nucleus tractus solitarius)。来自主动脉弓中主动脉压力感受器的信号通过迷走神经传递到延髓的同一孤束核。
压力感受器对动脉压变化的响应。图18-6显示了不同动脉压水平对Hering颈动脉窦神经冲动传递速率的影响。请注意,颈动脉窦压力感受器在0到50至60mmHg之间的压力下完全不被激活,但在这些水平以上,它们的响应逐渐加快,并在约180mmHg时达到最大值。主动脉压力感受器的响应与颈动脉感受器相似,只是它们通常在动脉压水平高出约30mmHg时工作。
特别要注意的是,在动脉压的正常工作范围内,约100mmHg时,即使压力的轻微变化也会引起压力感受器反射(baroreflex)信号的强烈变化,从而使动脉压重新调整回正常水平。因此,压力感受器反馈机制在压力范围内最为有效,而这正是最需要它的地方。
压力感受器对动脉压的变化反应迅速;在每个收缩期(systole)的几分之一秒内,冲动发放速率增加,而在舒张期(diastole)再次减少。此外,压力感受器对快速变化的压力比静止压力反应更强烈。也就是说,如果平均动脉压为150mmHg,但在那一刻迅速上升,冲动传递速率可能是静止压力为150mmHg时的两倍。
由压力感受器引发的循环反射。在压力感受器信号进入延髓的孤束核后,次级信号抑制延髓的血管收缩中心(vasoconstrictor center)并兴奋迷走副交感中心(vagal parasympathetic center)。净效应如下:(1) 外周循环系统中静脉和小动脉的血管舒张(vasodilation);(2) 心率和心脏收缩力下降。因此,动脉高压对压力感受器的兴奋反射性地导致动脉压下降,这是由于外周阻力下降和心输出量(cardiac output)减少所致。相反,低压则产生相反的效果,反射性地使压力回升至正常水平。
图18-7. 典型的颈动脉窦反射对主动脉动脉压的影响,由夹闭两侧颈总动脉引起(在切断两条迷走神经后)。
图18-7显示了由阻塞两条颈总动脉引起的典型动脉血压反射变化。这降低了颈动脉窦压力;结果,来自压力感受器(baroreceptors)的信号减少,导致对血管运动中枢(vasomotor center)的抑制作用减弱。然后,血管运动中枢变得比平常活跃得多,导致主动脉压力上升,并在颈动脉阻塞的10分钟内保持升高。解除阻塞后,颈动脉窦压力上升,颈动脉窦反射现在导致主动脉压力几乎立即下降到略低于正常水平,作为短暂的过度补偿,然后在一分钟内恢复到正常水平。
压力感受器在身体姿势变化期间减弱血压变化。当一个人从躺下站起来时,压力感受器维持上半身相对恒定的动脉血压的能力非常重要。站立时,头部和上半身的动脉血压往往会下降,这种压力的显著降低可能导致意识丧失。然而,压力感受器的压力下降会立即引发反射,导致全身强烈的交感神经放电,从而最小化头部和上半身的压力下降。
图18-8。一只正常狗(上)和同一只狗(下)在压力感受器去神经后几周的动脉血压两小时记录。(修改自Cowley AW Jr, Liard JF, Guyton AC: Role of baroreceptor reflex in daily control of arterial blood pressure and other variables in dogs. Circ Res 32:564, 1973。)
压力感受器控制系统的压力缓冲功能。由于压力感受器系统反对动脉血压的升高或降低,它被称为压力缓冲系统(pressure buffer system),来自压力感受器的神经被称为缓冲神经(buffer nerves)。
图18-8显示了压力感受器这种缓冲功能的重要性。该图的上半部分显示了一只正常狗的动脉血压两小时记录,下半部分显示了一只颈动脉窦和主动脉压力感受器神经被移除的狗的动脉血压记录。注意去神经狗由于日常简单事件(如躺下、站立、兴奋、进食、排便和噪音)引起的极端压力变化。
图18-9显示了正常狗和去神经狗24小时平均动脉血压记录的频率分布。注意,当压力感受器正常工作时,平均动脉血压在一天中保持在85到115mmHg的狭窄范围内,并且在一天中的大部分时间保持在约100mmHg。然而,在压力感受器去神经后,频率分布曲线变平,显示压力范围增加了2.5倍,经常下降到低至50~mm Hg或上升到超过160mmHg。因此,可以看到在缺乏动脉压力感受器系统的情况下压力的极端变化。
图18-9. 正常狗和同一只狗在去除了压力感受器(baroreceptors)后几周内24小时动脉血压的频率分布曲线。(修改自Cowley AW Jr, Liard JP, Guyton AC: Role of baroreceptor reflex in daily control of arterial blood pressure and other variables in dogs. Circ Res 32:564, 1973.)
动脉压力感受器系统的主要目的是将每分钟的动脉血压变化减少到大约三分之一,如果没有压力感受器系统,这种变化将会更大。
压力感受器在长期动脉血压调节中重要吗? 尽管动脉压力感受器提供了强大的即时动脉血压控制,但它们在长期血压调节中的重要性一直存在争议。一些生理学家认为压力感受器在慢性动脉血压调节中相对不重要,原因之一是它们往往在1到2天内重置到它们所暴露的压力水平。也就是说,如果动脉血压从正常值100 mmHg上升到160 mmHg,最初会传递非常高的压力感受器冲动频率。在接下来的几分钟内,冲动频率显著减少。然后,在接下来的1到2天内,冲动频率会进一步缓慢减少,最终尽管平均动脉血压仍保持在160 mmHg,冲动频率几乎恢复到正常水平。相反,当动脉血压下降到非常低的水平时,压力感受器最初不传递任何冲动,但在1到2天内逐渐恢复到控制水平。
这种压力感受器的重置可能会减弱它们作为控制系统的效力,以纠正那些倾向于在几天内改变动脉血压的干扰。然而,实验研究表明,压力感受器并不会完全重置,因此可能对长期血压调节有贡献,特别是通过影响肾脏的交感神经活动。例如,随着动脉血压的长期升高,压力感受器反射可能会介导肾脏交感神经活动的减少,从而促进肾脏增加钠和水的排泄。这一作用反过来会导致血容量逐渐减少,有助于将动脉血压恢复到正常水平。因此,压力感受器对平均动脉血压的长期调节需要与其他系统的相互作用,主要是肾脏-体液-血压控制系统(及其相关的神经和激素机制),这些内容将在第19章和第30章中讨论。
实验研究和临床试验表明,慢性电刺激颈动脉窦传入神经纤维可以导致交感神经系统活动和动脉压持续降低至少15至20mmHg。这些观察结果表明,当动脉压持续升高时(如慢性高血压),发生的大部分(如果不是全部)压力感受器反射重置是由于颈动脉窦神经机械感受器本身的重置,而不是中枢神经系统血管运动中枢的重置。
颈动脉和主动脉化学感受器对动脉压的控制——低氧对动脉压的影响。与压力感受器压力控制系统密切相关的是化学感受器反射,其运作方式与压力感受器反射非常相似,只是化学感受器(而非牵张感受器)启动反应。
化学感受器细胞对低氧或升高的二氧化碳和氢离子水平敏感。它们位于几个大小约为2毫米的小型化学感受器器官中(两个颈动脉体,分别位于每条颈总动脉的分叉处,以及通常一到三个靠近主动脉的主动脉体)。化学感受器兴奋的神经纤维与压力感受器纤维一起,通过Hering神经和迷走神经进入脑干的血管运动中枢。
每个颈动脉体或主动脉体通过一条小的营养动脉获得丰富的血流供应,因此化学感受器始终与动脉血密切接触。每当动脉压降至临界水平以下时,化学感受器就会受到刺激,因为血流减少导致氧气减少,以及二氧化碳和氢离子的积累,这些物质无法被缓慢流动的血液清除。
从化学感受器传递的信号兴奋血管运动中枢,这种反应使动脉压回升至正常水平。然而,这种化学感受器反射在动脉压降至80mmHg以下之前并不是一个强大的动脉压控制器。因此,在较低压力下,这种反射变得重要,有助于防止动脉压进一步下降。
化学感受器在第42章中与呼吸控制相关的部分进行了更详细的讨论,在呼吸控制中,它们通常比在血压控制中扮演更为重要的角色。然而,在严重肥胖和阻塞性睡眠呼吸暂停(一种与夜间呼吸暂停和缺氧反复发作相关的严重睡眠障碍)等情况下,化学感受器的激活也可能导致动脉压升高。
心房和肺动脉反射调节动脉压。心房和肺动脉壁上有称为低压感受器(low-pressure receptors)的牵张感受器。低压感受器与体循环大动脉的压力感受器(baroreceptor)牵张感受器类似。这些低压感受器在最小化动脉压对血容量变化的反应中起着重要作用。例如,如果向一只所有感受器完好的狗突然输注300毫升血液,动脉压仅上升约15mmHg。如果动脉压力感受器被去神经支配,压力上升约40mm Hg。如果低压感受器也被去神经支配,动脉压上升约100mmHg。
因此,可以看出,尽管肺动脉和心房中的低压感受器无法检测体循环动脉压,但它们确实能检测到由血容量增加引起的循环低压区域压力的同时增加。此外,它们引发与压力感受器反射平行的反射,使整个反射系统对动脉压的控制更有效。
激活肾脏的心房反射——容量反射(Volume Reflex)。心房的牵张和低压心房感受器的激活也会引起肾交感神经活动的反射性减少、肾小管重吸收的减少以及肾脏传入小动脉的扩张(图18-10)。信号也同时从心房传递到下丘脑,以减少抗利尿激素(antidiuretic hormone, ADH)的分泌。肾脏传入小动脉阻力的降低导致肾小球毛细血管压力上升,从而使液体滤入肾小管的量增加。ADH水平的降低减少了从肾小管重吸收的水分。这些效应的结合——肾小球滤过增加和液体重吸收减少——增加了肾脏的液体流失,并减弱了血容量的增加。由血容量增加引起的心房牵张也会引发心房利钠肽(atrial natriuretic peptide)的释放,这是一种进一步增加尿液中钠和水排泄并使血容量恢复正常(见图18-10)的激素。
所有这些在容量超负荷后倾向于使血容量恢复正常的机制间接地作为压力控制器和血容量控制器,因为过量的容量会驱使心脏产生更大的心输出量和更高的动脉压。这种容量反射机制将在第30章中与其他血容量控制机制一起再次讨论。
心房压力增加提高心率——Bainbridge反射。心房压力的增加有时会使心率增加多达75%,特别是在心率较慢时。当心率较快时,由于液体输注引起的心房牵张可能会因动脉压力感受器的激活而降低心率。因此,血容量增加和心房牵张对心率的净效应取决于压力感受器反射(倾向于减慢心率)和Bainbridge反射(倾向于加速心率)的相对贡献,如图18-10所示。当血容量增加到正常水平以上时,尽管压力感受器反射有抑制作用,Bainbridge反射通常会增加心率。
图 18-10. 对血容量增加引起的反射反应,导致动脉压和心房牵张增加。
与血容量增加和心房牵张相关的心率增加的一小部分是由心房容量增加直接牵张窦房结引起的;在第10章中提到,这种直接牵张可以使心率增加多达15%。另外40%到60%的心率增加是由Bainbridge反射引起的。引发Bainbridge反射的心房牵张感受器通过迷走神经将传入信号传递到脑的延髓。然后传出信号通过迷走神经和交感神经传递回来,增加心率和心脏收缩力。因此,这种反射有助于防止血液在静脉、心房和肺循环中淤积。
脑血流减少引发血压升高——中枢神经系统缺血反应
大多数血压的神经控制是通过起源于压力感受器、化学感受器和低压感受器的反射实现的,所有这些感受器都位于脑外的外周循环中。然而,当流向脑干下部血管运动中枢的血流减少到足以引起营养缺乏——即引起脑缺血时,血管运动中枢中的血管收缩和心脏加速神经元直接对缺血作出反应并强烈兴奋。当这种兴奋发生时,全身动脉压通常会上升到心脏所能泵出的最高水平。这种效应被认为是由缓慢流动的血液未能将二氧化碳从脑干血管运动中枢带走引起的。在血管运动中枢血流水平较低时,局部二氧化碳浓度大大增加,对刺激脑延髓中的交感血管运动神经控制区域具有极强的效应。
其他因素,如乳酸和其他酸性物质在血管运动中枢的积累,也可能对显著的刺激和动脉压升高有贡献。这种对脑缺血的动脉压升高反应被称为中枢神经系统缺血反应。
缺血对血管运动活动的影响可以显著提高平均动脉压,有时可高达250mmHg,持续长达10分钟。强烈脑缺血引起的交感血管收缩程度通常如此之大,以至于一些外周血管完全或几乎完全闭塞。例如,肾脏通常完全停止尿液生成,因为肾小动脉收缩以响应交感神经放电。因此,中枢神经系统缺血反应是所有交感血管收缩系统激活剂中最强大的之一。
中枢神经系统缺血反应作为动脉血压调节器的重要性
尽管中枢神经系统(CNS)缺血反应具有强大的调节能力,但它只有在动脉血压远低于正常水平(降至60mmHg及以下)时才会显著发挥作用,并在血压降至15至20mmHg时达到最大程度的刺激。因此,CNS缺血反应并不是调节动脉血压的正常机制之一。相反,它主要作为一种紧急血压控制系统,在脑血流减少到接近致命水平时,迅速而有力地发挥作用,以防止动脉血压进一步下降。它有时被称为“最后一道防线”的血压控制机制。
脑周围压力增加的Cushing反应
Cushing反应是一种特殊类型的中枢神经系统缺血反应,由颅腔内脑周围脑脊液压力增加引起。例如,当脑脊液压力上升到与动脉血压相等时,它会压迫整个大脑以及脑内的动脉,从而切断大脑的血液供应。这一过程会引发CNS缺血反应,导致动脉血压上升。当动脉血压上升到高于脑脊液压力时,血液将再次流入脑部血管,缓解脑缺血。通常,血压会达到一个略高于脑脊液压力的新平衡水平,从而使血液重新开始流经大脑。Cushing反应有助于保护大脑的重要中枢,防止在脑脊液压力升高到足以压迫脑动脉时失去营养供应。
动脉血压神经控制的特殊特征
骨骼神经和骨骼肌在增加心输出量和动脉血压中的作用
尽管大多数快速作用的循环神经控制是通过自主神经系统实现的,但至少有两种情况下,骨骼神经和骨骼肌也在循环反应中发挥重要作用。
腹部压迫反射增加心输出量和动脉血压
当压力感受器(baroreceptor)或化学感受器(chemoreceptor)反射被触发时,神经信号会同时通过骨骼神经传递到身体的骨骼肌,特别是腹部肌肉。肌肉收缩会压迫腹部的所有静脉储血池,帮助将血液从腹部血管储血池转移到心脏。结果,心脏泵血的可用血量增加。这种整体反应被称为腹部压迫反射(abdominal compression reflex)。其对循环的影响与交感神经缩血管冲动引起的效果相同——即心输出量和动脉血压的增加。腹部压迫反射可能比过去认为的要重要得多,因为众所周知,骨骼肌瘫痪的人比骨骼肌正常的人更容易发生低血压事件。
骨骼肌收缩在运动期间增加心输出量和动脉血压
当骨骼肌在运动期间收缩时,它们会压缩全身的血管。即使是运动的预期也会使肌肉紧张,从而压缩肌肉和腹部的血管。这种压缩将血液从外周血管转移到心脏和肺部,从而增加心输出量(cardiac output)。这种效应对于帮助心输出量在剧烈运动期间增加五到七倍至关重要。心输出量的增加反过来又是运动期间动脉血压(arterial pressure)升高的关键因素,从正常的平均值100mmHg上升到130至160mmHg。
动脉血压中的呼吸波
在每个呼吸周期中,动脉血压通常以波动的方式上升和下降4至6mmHg,导致动脉血压中的呼吸波(respiratory waves)。这些波是由几种不同的效应引起的,其中一些是反射性的,如下所示:
- 许多在延髓(medulla)呼吸中枢产生的呼吸信号在每个呼吸周期中溢出到血管运动中枢(vasomotor center)。
- 每次人吸气时,胸腔内的压力变得比平常更负,导致胸部血管扩张。这减少了返回心脏左侧的血液量,从而暂时降低了心输出量和动脉血压。
- 呼吸引起的胸腔血管压力变化可以刺激血管和心房牵张受体(vascular and atrial stretch receptors)。
尽管很难分析所有这些因素在引起呼吸压力波中的确切关系,但在正常呼吸期间,净结果通常是呼气早期动脉血压升高,呼吸周期其余部分血压下降。在深呼吸期间,血压可以在每个呼吸周期中上升和下降多达20mmHg。
动脉血压血管运动波——压力反射控制系统的振荡
在记录动脉血压时,除了由呼吸引起的小压力波外,通常还会注意到一些更大的波——有时高达10至40mmHg——这些波比呼吸波上升和下降得更慢。每个周期的持续时间从麻醉狗的26秒到未麻醉人的7到10秒不等。这些波被称为血管运动波(vasomotor waves)或Mayer波。图18-11展示了这些记录,显示了动脉血压的周期性上升和下降。
血管运动波的原因是一个或多个神经压力控制机制的反射性振荡,其中一些如下所示。
压力感受器(baroreceptor)和化学感受器(chemoreceptor)反射的振荡
图18-11B中的血管运动波(vasomotor waves)在实验性压力记录中经常出现,尽管它们通常比图中所示的要弱得多。这些波动主要是由压力感受器反射的振荡引起的。也就是说,高压会刺激压力感受器,随后抑制交感神经系统(sympathetic nervous system),并在几秒钟后降低血压。血压的下降反过来又减少了压力感受器的刺激,使血管运动中枢(vasomotor center)再次活跃,将血压升高到一个较高的值。这种反应不是即时的,而是延迟了几秒钟。随后,这种高压又启动了另一个循环,振荡持续进行。
化学感受器反射也会振荡,产生相同类型的波动。这种反射通常与压力感受器反射同时振荡。当动脉压在40到80mmHg范围内时,化学感受器反射可能在引起血管运动波中起主要作用,因为在这个低压范围内,化学感受器对循环的控制变得更强,而压力感受器的控制则变弱。
中枢神经系统(CNS)缺血反应的振荡
图18-11A中的记录是由中枢神经系统缺血压力控制机制的振荡引起的。在这个实验中,脑脊液压力增加到160~mm Hg,压迫了脑血管并启动了中枢神经系统缺血压力反应,使动脉压上升到200mmHg。当动脉压上升到如此高的值时,脑缺血得到缓解,交感神经系统变得不活跃。结果,动脉压迅速回落到一个低得多的值,再次引起脑缺血。缺血随后又引发了另一次压力上升。再次,缺血得到缓解,压力再次下降。只要脑脊液压力保持升高,这种反应就会循环重复。
图18-11. A, 由中枢神经系统缺血反应振荡引起的血管运动波。B, 由压力感受器反射振荡引起的血管运动波。
因此,如果反馈的强度足够大,并且在压力感受器的兴奋和随后的压力反应之间存在延迟,任何反射性压力控制机制都可能振荡。血管运动波表明,控制动脉压的神经反射遵循与机械和电气控制系统相同的原理。例如,如果飞机自动驾驶仪的引导机制中的反馈增益过大,并且引导机制的响应时间也存在延迟,飞机将左右摆动而不是沿直线飞行。
Prabhakar NR: 颈动脉体化学反射:睡眠呼吸暂停中自主神经异常的驱动因素。Exp Physiol 101(8):975, 2016. Toledo C, Andrade DC, Lucero C, Schultz HD, Marcus N, Retamal M, Madrid C, Del Rio R: 外周和中枢化学感受器对心力衰竭中交感神经兴奋的贡献。J Physiol 595:43, 2017.
肾脏在长期动脉压控制和高血压中的作用:动脉压调节的整合系统
除了第18章讨论的快速作用的动脉压调节机制外,身体还具有强大的机制来调节数周甚至数月的动脉压。这种长期动脉压控制与体液量的稳态密切相关,而体液量由液体摄入和输出的平衡决定。为了长期生存,液体摄入和输出必须精确平衡,这一任务由多种神经和激素控制以及肾脏中调节盐和水排泄的局部控制系统完成。在本章中,我们将讨论这些在长期血压调节中起主要作用的肾脏-体液系统。
用于动脉压控制的肾脏-体液系统
用于动脉压控制的肾脏-体液系统作用缓慢但强大,具体如下。如果血容量增加且血管容量不变,动脉压也会增加。升高的压力反过来促使肾脏排出多余的液体,从而使压力恢复到正常水平。
在动物发育的系统发育史中,这种用于压力控制的肾脏-体液系统是一种原始机制。它在最低等的脊椎动物之一——hagfish中完全运作。这种动物的动脉压较低,仅为8至14mmHg,且其压力几乎与血容量成正比增加。Hagfish不断饮用海水,海水被吸收到血液中,增加血容量和血压。然而,当压力过高时,肾脏将多余的液体排出到尿液中,从而缓解压力。在低压下,肾脏排出的液体少于摄入的液体。因此,由于Hagfish继续饮水,细胞外液量、血容量和压力都会再次增加到较高水平。
这种原始的压力控制机制在漫长的岁月中得以保留,但增加了多种神经系统、激素和局部控制系统,这些系统也参与了盐和水排泄的调节。在人类中,肾脏对水和盐的排泄对压力变化的敏感性不亚于甚至超过Hagfish。事实上,人类动脉压仅增加几毫米Hg就可以使水的肾脏排泄量翻倍,这种现象称为压力利尿(pressure diuresis),同时也可以使盐的排泄量翻倍,称为压力利钠(pressure natriuresis)。
在人类中,与Hagfish一样,用于动脉压控制的肾脏-体液系统是长期动脉压控制的基本机制。然而,在进化过程中,增加了多种改进,使这一系统的控制更加精确。一个特别重要的改进是肾素-血管紧张素机制的加入,这将在后面讨论。
压力利尿的定量作为动脉压控制的基础
图19-1显示了不同动脉压水平对离体肾脏盐和水输出的近似平均影响,表明随着压力升高,尿液输出显著增加。这种尿液输出的增加是压力利尿(pressure diuresis)现象。图中的曲线称为肾脏尿液输出曲线或肾功能曲线。在人类中,当动脉压为50mmHg时,尿液输出基本为零。在100mmHg时,尿液输出正常,而在200~mm Hg时,尿液输出是正常的4到6倍。此外,增加动脉压不仅会增加尿液输出量,还会导致钠输出量的近似等量增加,这是压力钠尿(pressure natriuresis)现象。
实验展示肾脏-体液系统对动脉压的调控。图19-2显示了一项在狗身上进行的实验结果,实验中首先阻断了所有用于血压调控的神经反射机制。然后,通过静脉输注约400ml的血液,突然升高动脉压。注意心输出量迅速增加到正常水平的两倍左右,平均动脉压增加到205mmHg,比静息水平高出115mmHg。中间的曲线显示了这种动脉压升高对尿液输出的影响,尿液输出增加了12倍。随着尿液中大量液体的流失,心输出量和动脉压在随后的一个小时内恢复到正常水平。因此,可以看出肾脏在应对高动脉压时具有极强的能力,能够从体内排除多余的液体量,从而使动脉压恢复到正常水平。
图19-1. 在灌注的离体肾脏中测量的典型动脉压-肾脏尿液输出曲线,显示当动脉压升高到正常水平以上(点A)至约150~mm\ H9(点B)时的压力利尿现象。平衡点A描述了如果摄入量不变,动脉压将被调控到的水平。(请注意,本章中类似的图表忽略了通过非肾脏途径从体内流失的少量盐和水摄入量。)
肾脏-体液机制为长期动脉压调控提供几乎无限的反馈增益。图19-1显示了以下关系:(1) 动脉压升高时肾脏对水和盐的输出曲线;(2) 代表净水和盐摄入量的直线。在长期内,水和盐的输出必须等于摄入量。此外,图19-1中唯一一个输出等于摄入的点是两条曲线的交点,称为平衡点(点A)。让我们看看如果动脉压升高或降低到平衡点以上或以下会发生什么。
首先,假设动脉压上升到150mm Hg(点B)。在这个水平上,肾脏的水和盐的输出几乎是摄入量的三倍。因此,身体失去液体,血容量减少,动脉压下降。此外,这种负的液体平衡不会停止,直到压力完全回到平衡水平。即使动脉压仅比平衡水平高几毫米Hg,仍然会有稍微更多的水和盐的损失,因此压力继续下降,直到最终回到平衡点。
如果动脉压下降到平衡点以下,水和盐的摄入量大于输出量。因此,体液量增加,血容量增加,动脉压上升,直到再次回到平衡点。这种动脉压总是回到平衡点的现象被称为通过肾脏-体液机制控制动脉压的近无限反馈增益原理。
图19-2. 在神经压力控制机制被阻断的狗中,血容量增加导致的心输出量、尿输出量和动脉压的增加。该图显示在大约1小时的尿液流失后,动脉压恢复到正常水平。(由William Dobbs博士提供)
长期动脉压的两个关键决定因素
在图19-1中,还可以看到两个基本的长期因素决定了长期动脉压水平。只要代表肾脏水和盐输出和摄入的两条曲线保持如图19-1所示,平均动脉压水平最终将重新调整到100mmHg,这是该图平衡点所描绘的压力水平。此外,只有两种方式可以改变这个平衡点的压力水平,使其从100mmHg水平变化。一种是通过改变肾脏水和盐输出曲线的压力水平,另一种是通过改变水和盐摄入线的水平。因此,简单来说,长期动脉压水平的两个主要决定因素如下:
- 肾脏水和盐输出曲线的压力偏移程度
- 水和盐摄入的水平
这两个决定因素在控制动脉压中的作用在图19-3中得到了展示。在图19-3A中,肾脏的某些异常导致肾脏输出曲线向高压方向(向右)偏移50mmHg。注意,平衡点也比正常水平偏移了50mmHg。因此,可以说如果肾脏输出曲线偏移到一个新的压力水平,动脉压将在几天内跟随到这个新的压力水平。
图19-3. 两种增加动脉压的方式。A,通过将肾脏输出曲线向右移动至更高的压力水平,或通过增加盐和水的摄入水平(B)。
图19-3B显示了盐和水摄入水平的变化如何也能改变动脉压。在这种情况下,摄入水平增加了四倍,平衡点移动到了160 mmHg的压力水平,比正常水平高出60mmHg。相反,摄入水平的降低会减少动脉压。
因此,如果不改变长期动脉压的两个基本决定因素之一或两者,就不可能将长期平均动脉压水平改变到一个新的值,这两个决定因素要么是(1)盐和水的摄入水平,要么是(2)肾功能曲线沿压力轴的移动程度。然而,如果其中任何一个发生变化,就会发现动脉压随后被调节到一个新的压力水平,即两条新曲线相交处的动脉压。
然而,在大多数人中,肾功能曲线比图19-3中所示的要陡峭得多,盐摄入的变化对动脉压的影响较小,正如下一节所讨论的那样。
慢性肾脏输出曲线比急性曲线陡峭得多。压力性尿钠排泄(和压力性利尿)的一个重要特征是,持续数天或数月的动脉压的慢性变化对肾脏盐和水输出的影响比在急性压力变化期间观察到的要大得多(图19-4)。因此,当肾脏功能正常时,慢性肾脏输出曲线比急性曲线陡峭得多。
图19-4. 急性和慢性肾脏输出曲线。在稳态条件下,肾脏的盐和水输出等于盐和水的摄入。点A和B分别代表盐摄入正常或六倍正常时长期调节动脉压的平衡点。由于慢性肾脏输出曲线的陡峭性,增加的盐摄入通常只会引起动脉压的微小变化。在肾功能受损的人中,肾脏输出曲线的陡峭性可能会降低,类似于急性曲线,导致动脉压对盐摄入变化的敏感性增加。
动脉压慢性增加对尿液输出的强大影响是因为增加的压力不仅对肾脏有直接的血液动力学影响以增加排泄,而且还通过血压增加时发生的神经和激素变化产生间接影响。例如,增加的动脉压通过第18章讨论的压力感受器反射机制部分减少了交感神经系统的活动,并通过减少各种激素的形成,如血管紧张素II和醛固酮,这些激素倾向于减少肾脏的盐和水排泄。因此,这些抗尿钠排泄系统的活动减少增强了压力性尿钠排泄和利尿在动脉压慢性增加期间提高盐和水排泄的有效性(详见第28章和第30章的进一步讨论)。
相反,当血压降低时,交感神经系统(sympathetic nervous system)被激活,抗利尿激素(antinatriuretic hormones)的形成增加,这进一步增强了压力降低对肾脏盐和水输出的直接影响。这种压力对肾脏的直接影响以及压力对交感神经系统和各种激素系统的间接影响的结合,使得压力性尿钠排泄(pressure natriuresis)和利尿(diuresis)成为长期控制动脉压和体液容量的极其强大的因素。
神经和激素对压力性尿钠排泄的影响在钠摄入的长期变化中尤为明显。如果肾脏、神经系统和激素机制功能正常,长期增加盐和水的摄入量至正常水平的六倍通常对动脉压的影响很小。请注意,曲线上的血压平衡点B几乎与正常盐摄入下的平衡点A相同。相反,将盐和水的摄入量减少至正常水平的六分之一通常对动脉压的影响也很小。因此,许多人被称为盐不敏感(salt-insensitive),因为盐摄入量的巨大变化不会使血压变化超过几毫米汞柱。
然而,对于肾脏损伤或抗利尿激素如血管紧张素II(angiotensin II)或醛固酮(aldosterone)分泌过多的人来说,他们可能是盐敏感的(salt-sensitive),其肾脏输出曲线类似于图19-4中所示的急性曲线。在这些情况下,即使是中等程度的盐摄入量增加也可能导致动脉压显著升高。
导致血压对盐敏感的一些因素包括由于肾脏损伤导致的功能性肾单位(functional nephrons)的丧失以及抗利尿激素如血管紧张素II或醛固酮的过度形成。例如,手术减少肾脏质量或由于高血压、糖尿病或各种肾脏疾病导致的肾脏损伤都会使血压对盐摄入量的变化更加敏感。在这些情况下,需要比正常更大的动脉压升高才能使肾脏输出足够增加,以维持盐和水的摄入与输出之间的平衡。
有证据表明,长期高盐摄入,持续数年,实际上可能会损害肾脏,并最终使血压对盐更加敏感。我们将在本章后面讨论高血压患者的血压盐敏感性。
如果液体摄入和肾功能不变,增加总外周阻力(total peripheral resistance)无法长期提高动脉压水平
回顾动脉压的基本方程——动脉压等于心输出量(cardiac output)乘以总外周阻力——显然,总外周阻力的增加应该会提高动脉压。事实上,当总外周阻力急性增加时,动脉压确实会立即上升。然而,如果肾脏继续正常运作,动脉压的急性上升通常不会持续。相反,动脉压会在1到2天内完全恢复到正常水平。为什么?
这种现象的原因是,除了肾脏以外的身体其他部位血管阻力(vasculature resistance)的增加并不会改变由肾脏决定的血压控制平衡点(见图19-1和19-3)。相反,肾脏会立即开始对高动脉压作出反应,导致压力性利尿(pressure diuresis)和压力性排钠(pressure natriuresis)。在几小时内,大量的盐和水从体内流失;这个过程会持续,直到动脉压恢复到平衡压力水平。此时,血压恢复正常,而细胞外液体积(extracellular fluid volume)和血液体积(blood volume)则降低到低于正常水平。
图19-5. 不同临床异常中总外周阻力(total peripheral resistance)与动脉压和心输出量(cardiac output)长期水平的关系。在这些情况下,肾脏功能正常。请注意,改变全身总外周阻力会导致心输出量发生相等且相反的变化,但在所有情况下,对动脉压没有影响。AV,动静脉(Arteriovenous)。(改编自Guyton AC: Arterial Pressure and Hypertension. Philadelphia: WB Saunders, 1980。)
图19-5显示了在不同临床条件下的大致心输出量和动脉压,这些条件下长期总外周阻力远低于或远高于正常水平,但肾脏对盐和水的排泄功能正常。请注意,在这些不同的临床条件下,动脉压也是正常的。
在我们的讨论中,此时需要提醒一句。通常,当总外周阻力增加时,肾内血管阻力(intrarenal vascular resistance)也会同时增加,这会改变肾脏的功能,并通过将肾功能曲线(renal function curve)转移到更高的压力水平而导致高血压(hypertension),如图19-3A所示。我们将在本章后面讨论由血管收缩机制(vasoconstrictor mechanisms)引起的高血压时看到这种机制的一个例子。然而,罪魁祸首是肾内阻力的增加,而不是总外周阻力的增加——这是一个重要的区别。
增加的液体体积可以通过增加心输出量或总外周阻力来升高动脉压
图19-6显示了在血管容量(vascular capacity)没有同时增加的情况下,增加的细胞外液体积可能升高动脉压的总体机制。连续事件如下:(1) 增加的细胞外液体积,(2) 增加了血液体积,(3) 增加了平均循环充盈压(mean circulatory filling pressure),(4) 增加了静脉回心血量(venous return of blood to the heart),(5) 增加了心输出量,(6) 增加了动脉压。增加的动脉压反过来增加了肾脏对盐和水的排泄,如果肾功能正常且血管容量未改变,细胞外液体积可能会恢复到接近正常水平。
图19-6. 细胞外液(extracellular fluid)体积增加导致动脉压升高的连续步骤。特别注意,心输出量(cardiac output)的增加既有直接增加动脉压的作用,也有通过首先增加总外周阻力(total peripheral resistance)而间接增加动脉压的作用。
在这种情况下要特别注意心输出量增加可以通过两种方式增加动脉压。其一是心输出量增加直接增加压力,其二是通过血流自动调节(autoregulation)间接提高总外周血管阻力(total peripheral vascular resistance)。第二种效应可以解释如下。
参考第17章,让我们回忆一下,每当过量血液流经组织时,局部组织血管系统会收缩,使血流减少至正常水平。这种现象称为自动调节(autoregulation),即组织自身对血流的调节。当血容量增加提高心输出量时,身体所有组织的血流趋于增加;如果增加的血流超过组织的代谢需求,自动调节机制会使全身血管收缩,从而增加总外周阻力。
最后,由于动脉压等于心输出量乘以总外周阻力,自动调节机制导致的继发性总外周阻力增加有助于提高动脉压。例如,当伴随组织血流自动调节或其他引起血管收缩的因素导致总外周阻力增加时,仅5%到10%的心输出量增加就可以使动脉压从正常的平均动脉压100 mmHg升高到150 mmHg。心输出量的轻微增加通常无法测量。
盐(NaCl)在动脉压调节的肾-体液机制中的重要性
尽管到目前为止的讨论强调了体积在动脉压调节中的重要性,但实验研究表明,盐摄入量的增加比水摄入量的增加更有可能升高动脉压,尤其是在对盐敏感的人群中。这一发现的原因是,纯水通常由肾脏几乎与摄入速度一样快地排出,但盐不容易排出。当盐在体内积累时,它也会间接增加细胞外液体积,原因有两个:
- 虽然当盐在体内积累时,一些额外的钠可能储存在组织中,但细胞外液中过量的盐会增加液体渗透压(osmolality)。渗透压的增加会刺激大脑中的口渴中枢,使人喝更多的水以使细胞外盐浓度恢复正常,从而增加细胞外液体积。
- 细胞外液中过量盐引起的渗透压增加也会刺激下丘脑-垂体后叶分泌机制,增加抗利尿激素(antidiuretic hormone)的分泌(在第29章讨论)。抗利尿激素然后使肾脏从肾小管液中重吸收大量增加的水分,从而减少尿液的排泄量,但增加细胞外液体积。
因此,体内积累的盐量是细胞外液(extracellular fluid)体积的重要决定因素。细胞外液和血容量(blood volume)的相对小幅增加通常可以显著增加动脉压(arterial pressure)。然而,这种情况只有在过量的盐积累导致血容量增加且血管容量(vascular capacity)没有同时增加时才成立。如前所述,在肾功能(kidney function)未受损或抗利尿激素(antinatriuretic hormones)未过度形成的情况下,增加盐摄入通常不会显著增加动脉压,因为肾脏会迅速消除过量的盐,血容量几乎不会改变。
由肾功能受损引起的慢性高血压(CHRONIC HYPERTENSION)(高血压(HIGH BLOOD PRESSURE))
当一个人被诊断为患有慢性高血压(或高血压)时,这意味着他或她的平均动脉压(mean arterial pressure)高于公认正常范围的上限。平均动脉压大于110mmHg(正常约为\approx90mmHg)被认为是高血压。(当舒张压(diastolic blood pressure)大于\approx90mmHg且收缩压(systolic pressure)大于\approx135 mm\ Hg时,会出现这种水平的平均压力。)在严重高血压患者中,平均动脉压可升至150至170mmHg,舒张压高达130mmHg,收缩压偶尔高达250mmHg。
即使是动脉压的适度升高也会导致预期寿命缩短。在严重的高压下——即平均动脉压比正常值高出50%或更多——除非得到适当的治疗,否则一个人预计只能再活几年。高血压的致命影响主要通过三种方式引起:
- 心脏的过度负荷导致早期心力衰竭(heart failure)和冠心病(coronary heart disease),通常因心脏病发作(heart attack)而死亡。
- 高压经常损害大脑中的主要血管,随后导致大脑主要部分的死亡;这种情况称为脑梗死(cerebral infarct)。临床上称为中风(stroke)。根据大脑受累的部分,中风可能是致命的,或导致瘫痪、痴呆(dementia)、失明或其他多种严重的脑部疾病。
- 高压几乎总是导致肾脏损伤,产生许多肾脏破坏区域,最终导致肾衰竭(kidney failure)、尿毒症(uremia)和死亡。
从称为容量负荷性高血压(volume-loading hypertension)的高血压类型中学到的经验对于理解肾脏-体液体积机制(renal–body fluid volume mechanism)在动脉压调节中的作用至关重要。容量负荷性高血压是指由体内细胞外液过量积累引起的高血压,以下是一些例子。
实验性容量负荷性高血压(Experimental Volume-Loading Hypertension)由肾脏质量减少和盐摄入增加引起
图19-7展示了一项典型的实验,证明了一组肾脏质量减少70%的狗出现了容量负荷性高血压(volume-loading hypertension)。在曲线的第一个圆圈标记处,一只肾脏的两极被切除;在第二个圆圈标记处,对侧的整个肾脏被切除,使动物仅保留了正常肾脏质量的30%。需要注意的是,切除这部分肾脏质量仅使动脉压平均升高了6mmHg。随后,这些狗被给予盐水代替饮用水。由于盐水无法解渴,狗饮用了正常量的两到四倍液体,几天内,它们的平均动脉压上升到比正常值高出约40mmHg。两周后,狗再次被给予自来水代替盐水,血压在两天内恢复到正常水平。最后,在实验结束时,狗再次被给予盐水,这次血压迅速上升到一个高水平,再次证明了容量负荷性高血压。
如果再次考虑长期动脉压调节的基本决定因素,可以明显看出为什么在图19-7所示的容量负荷实验中会出现高血压。首先,肾脏质量减少到正常值的30%大大降低了肾脏排泄盐和水的能力。因此,盐和水在体内积累,并在几天内将动脉压提高到足以排泄过量盐和水摄入的水平。
图19-7. 饮用0.9%盐水(0.9% NaCl)代替水对肾脏组织减少70%的狗动脉压的平均影响。(修改自Langston JB, Guyton AC, Douglas B H, 等:部分肾切除狗盐摄入变化对动脉压和肾功能的影响。Circ Res 12:508, 1963。)
容量负荷性高血压发展过程中循环功能的顺序变化
研究容量负荷性高血压(volume-loading hypertension)逐步发展过程中循环功能的顺序变化特别具有启发性(图19-8)。在标记为“0天”的时间点之前大约一周,肾脏质量已经减少到仅为正常的30%。然后,在此时间点,盐和水的摄入量增加到正常水平的约六倍,并在此后保持这种高摄入量。急性效应是使细胞外液量、血容量和心输出量增加到比正常水平高20%至40%。同时,动脉血压开始上升,但最初远不及液体量和心输出量的上升幅度。通过研究总外周阻力曲线,可以理解这种血压上升较慢的原因,该曲线显示总外周阻力最初有所下降。这种下降是由第18章讨论的压力感受器机制引起的,该机制暂时减弱了血压的上升。然而,在2到4天后,压力感受器适应(重置)并不再能够阻止血压的上升。此时,由于心输出量的增加,动脉血压几乎上升到其最高点,尽管总外周阻力仍然几乎处于正常水平。
图19-8. 容量负荷性高血压最初几周内重要循环系统变量的逐步变化。特别要注意心输出量的初始增加是高血压的基本原因。随后,自动调节机制使心输出量几乎恢复到正常水平,同时导致总外周阻力的二次增加。(改编自Guyton AC: Arterial Pressure and Hypertension. Philadelphia: WB Saunders, 1980.)
在这些循环变量的早期急性变化发生后,接下来的几周内发生了更持久的二次变化。特别重要的是总外周阻力的逐步增加,同时心输出量逐渐恢复到正常水平,至少部分是由于第17章和本章前面讨论的长期血流自动调节机制。也就是说,在心输出量上升到高水平并引发高血压后,通过组织的过量血流导致局部小动脉逐步收缩,从而使身体组织的局部血流和心输出量恢复到正常水平,同时导致总外周阻力的二次增加。
需要注意的是,细胞外液量和血容量也随着心输出量的减少而恢复到正常水平。这一结果由两个因素引起。首先,小动脉阻力的增加降低了毛细血管压力,使得组织间隙中的液体被重新吸收回血液中。其次,升高的动脉压力现在促使肾脏排出最初在体内积累的过量液体。
在容量负荷初始发生几周后,观察到以下效应:
- 高血压
- 总外周阻力(total peripheral resistance)显著增加
- 细胞外液(extracellular fluid)体积、血容量(blood volume)和心输出量(cardiac output)几乎完全恢复正常
因此,我们可以将容量负荷性高血压(volume-loading hypertension)分为两个连续的阶段。第一阶段是由于液体容量增加导致心输出量增加。心输出量的增加介导了高血压。容量负荷性高血压的第二阶段以高血压和高总外周阻力为特征,但心输出量恢复到接近正常水平,以至于通常的测量技术常常无法检测到心输出量的异常升高。
因此,容量负荷性高血压中总外周阻力的增加发生在高血压发展之后,因此是继发于高血压,而不是高血压的原因。
无肾脏但依靠人工肾维持的患者的容量负荷性高血压
当患者依靠人工肾维持时,每次透析时通过去除适量的水和盐来保持患者的体液容量在正常水平尤为重要。如果不执行这一步骤,并且允许细胞外液容量增加,几乎总是会以与图19-8所示完全相同的方式发展出高血压。也就是说,心输出量首先增加并导致高血压。然后,自动调节机制使心输出量恢复到接近正常水平,同时导致总外周阻力的继发性增加。因此,最终,高血压表现为高外周阻力型高血压,尽管最初的原因是容量过度积累。
由醛固酮(aldosterone)过量引起的高血压
另一种类型的容量负荷性高血压是由体内醛固酮过量或偶尔由其他类型的类固醇过量引起的。肾上腺中的一个小的肿瘤偶尔会分泌大量的醛固酮,这种情况称为原发性醛固酮增多症(primary aldosteronism)。正如第28章和第30章所讨论的,醛固酮增加了肾小管对盐和水的重吸收速率,从而增加了血容量、细胞外液容量和动脉压。如果同时增加盐的摄入量,高血压会变得更加严重。此外,如果这种情况持续数月或数年,过度的动脉压通常会导致肾脏的病理变化,使肾脏除了醛固酮直接引起的外,还保留更多的盐和水。因此,高血压通常最终变得严重到致命的地步。
同样,在这种类型的高血压的早期阶段,心输出量通常会增加,但在后期阶段,心输出量通常会恢复到接近正常水平,而总外周阻力会继发性升高,正如本章前面所述的原发性容量负荷性高血压。
肾素-血管紧张素系统(renin-angiotensin system)在动脉压控制中的作用
除了肾脏通过改变细胞外液容量来控制动脉压的能力外,肾脏还有另一种强大的控制压力的机制,即肾素-血管紧张素系统。
肾素(Renin)是一种由肾脏在动脉压过低时释放的蛋白质酶。它通过多种方式提高动脉压,从而帮助纠正最初的血压下降。
肾素-血管紧张素系统的组成部分
图19-9展示了肾素-血管紧张素系统帮助调节动脉压的主要功能步骤。肾素在肾脏的近球细胞(juxtaglomerular cells,JG cells)中合成并储存。JG细胞是修饰的平滑肌细胞,主要位于肾小球附近的入球小动脉壁中。多种因素控制肾素的分泌,包括交感神经系统、各种激素以及局部自体活性物质(autacoids),如前列腺素、一氧化氮和内皮素。当动脉压下降时,JG细胞通过至少三种主要机制释放肾素:
- JG细胞中的压力敏感感受器(baroreceptors)对动脉压下降作出反应,增加肾素的释放。
- 早期远曲小管中的致密斑细胞(macula densa cells)对氯化钠输送减少作出反应,刺激肾素释放(详见第27章)。
- 交感神经系统活动增加通过激活JG细胞中的β-肾上腺素能受体(beta-adrenergic receptors)刺激肾素释放。交感刺激还激活α-肾上腺素能受体(alpha-adrenergic receptors),在强烈交感激活的情况下,可以增加肾对氯化钠的重吸收并降低肾小球滤过率。肾交感活动增加还增强了肾压力感受器和致密斑机制对肾素释放的敏感性。
大部分肾素进入肾血液,然后从肾脏流出,循环到全身。然而,少量肾素仍留在肾脏的局部体液中,并启动几种肾内功能。
肾素本身是一种酶,而不是血管活性物质。如图19-9所示,肾素以酶的方式作用于另一种血浆蛋白,称为肾素底物(renin substrate)或血管紧张素原(angiotensinogen),释放出一种10个氨基酸的肽,即血管紧张素I(angiotensin I)。血管紧张素I具有轻微的血管收缩特性,但不足以引起循环功能的显著变化。肾素在血液中持续存在30至60分钟,并在此期间继续导致更多的血管紧张素I的形成。
图19-9. 肾素-血管紧张素血管收缩机制用于动脉压控制。
在血管紧张素I形成后的几秒到几分钟内,血管紧张素I中的两个额外氨基酸被裂解,形成8个氨基酸的肽,即血管紧张素II(angiotensin II)。这种转化在很大程度上发生在血液流经肺部小血管时,由存在于肺血管内皮中的一种称为血管紧张素转换酶(angiotensin-converting enzyme,ACE)的酶催化。其他组织如肾脏和血管也含有ACE,因此局部形成血管紧张素II。
血管紧张素II是一种极其强大的血管收缩剂,它还以其他方式影响循环功能。然而,它在血液中仅持续存在1到2分钟,因为它被多种血液和组织酶迅速灭活,这些酶统称为血管紧张素酶(angiotensinases)。
血管紧张素II(Angiotensin II)有两种主要作用可以升高动脉血压。第一种作用是在身体的许多区域迅速发生血管收缩(vasoconstriction)。血管收缩在微动脉(arterioles)中尤为强烈,而在静脉中则较弱。微动脉的收缩增加了总外周阻力(total peripheral resistance),从而升高了动脉血压,如图19-9底部所示。此外,静脉的轻度收缩促进了血液回流心脏(venous return),从而帮助心脏对抗升高的压力进行泵血。
血管紧张素II升高动脉血压的第二种主要方式是通过刺激醛固酮(aldosterone)分泌以及对肾脏的直接作用,减少肾脏对盐和水的排泄。肾脏对盐和水的保留逐渐增加了细胞外液量(extracellular fluid volume),进而在随后的几小时和几天内升高动脉血压。这种长期效应,通过血管紧张素II对肾脏的直接和间接作用,最终在升高动脉血压方面甚至比急性血管收缩机制更为强大。
肾素-血管紧张素系统对血管收缩压力反应的快速性和强度
图19-10展示了一项实验,演示了在两种不同条件下出血对动脉血压的影响:(1)肾素-血管紧张素系统(renin-angiotensin system)正常运作时;(2)使用肾素阻断抗体(renin-blocking antibody)阻断该系统后。请注意,在出血后——足以导致动脉血压急性下降至50mmHg——当肾素-血管紧张素系统正常运作时,动脉血压回升至83~mm Hg。相反,当肾素-血管紧张素系统被阻断时,血压仅回升至60mmHg。这一现象表明,肾素-血管紧张素系统足够强大,能够在严重出血后的几分钟内将动脉血压至少恢复到正常水平的一半。因此,该系统在循环休克(circulatory shock)等情况下对身体的救命作用尤为重要。
图19-10. 严重出血后肾素-血管紧张素血管收缩系统的压力补偿效应。(根据Royce Brough博士的实验绘制。)
还需注意的是,肾素-血管紧张素血管收缩系统需要大约20分钟才能完全激活。因此,它在控制血压方面比神经反射和交感神经去甲肾上腺素-肾上腺素系统(sympathetic norepinephrine-epinephrine system)稍慢一些。
血管紧张素II导致肾脏保留盐和水——长期控制动脉血压的重要机制
血管紧张素II通过两种主要方式导致肾脏保留盐和水:
- 血管紧张素II直接作用于肾脏,导致盐和水保留。
- 血管紧张素II刺激肾上腺分泌醛固酮,而醛固酮反过来增加肾小管对盐和水的重吸收。
因此,每当血液中循环的血管紧张素II过量时,整个长期肾脏-体液机制(renal-body fluid mechanism)会自动将动脉血压控制设定为高于正常水平的血压值。
血管紧张素II导致肾脏保留盐和水的直接肾脏效应机制
血管紧张素II具有多种直接肾脏效应,使肾脏保留盐和水。其中一个主要效应是收缩肾小动脉,特别是肾小球出球小动脉,从而减少通过肾脏的血流量。血流缓慢降低了管周毛细血管的压力,增加了从肾小管重吸收液体的能力。血管紧张素II还对肾小管细胞有重要的直接作用,增加钠和水的肾小管重吸收,如第28章所述。血管紧张素II的综合效应有时可以将尿量减少到正常水平的五分之一以下。
血管紧张素II通过刺激醛固酮增加肾脏对盐和水的保留
血管紧张素II也是肾上腺分泌醛固酮的最强刺激物之一,我们将在第30章关于体液调节和第78章关于肾上腺功能的讨论中进一步探讨。因此,当肾素-血管紧张素系统被激活时,醛固酮的分泌速率通常也会增加;醛固酮的一个重要功能是显著增加肾小管对钠的重吸收,从而增加全身细胞外液的钠含量,并如前所述,增加细胞外液体积。因此,血管紧张素II对肾脏的直接作用以及通过醛固酮的间接作用在长期动脉血压调节中都非常重要。
血管紧张素II引起的动脉血压变化的定量分析
图19-11展示了血管紧张素在动脉血压调节中的定量分析。该图显示了两条肾功能曲线,以及一条表示正常钠摄入水平的线。左侧的肾功能曲线是在狗的肾素-血管紧张素系统被ACE抑制剂药物阻断后测量的,该药物阻断了血管紧张素I向血管紧张素II的转化。右侧的曲线是在狗体内持续输注血管紧张素II的情况下测量的,其水平约为血液中血管紧张素II正常生成速率的2.5倍。请注意,在血管紧张素II的影响下,肾输出曲线向更高的压力水平移动。这种移动是由血管紧张素II对肾脏的直接作用以及通过醛固酮分泌的间接作用引起的,如前所述。
最后,请注意两个平衡点,一个是在血管紧张素为零时显示的动脉血压水平为75~mm Hg,另一个是在血管紧张素升高时显示的血压水平为115mmHg。因此,血管紧张素导致肾脏保留盐和水的作用在促进动脉血压的慢性升高方面具有强大的效应。
图19-11. 血液中两种血管紧张素II水平对肾输出曲线的影响,显示了在血管紧张素II水平低时动脉血压在75mmH g的平衡点调节,以及在血管紧张素II水平高时在115mmH g的平衡点调节。
肾素-血管紧张素系统在维持正常动脉血压中的作用,尽管盐摄入量变化很大
肾素-血管紧张素系统(renin-angiotensin system)最重要的功能之一是使人体能够摄入极少或极多的盐分,而不会引起细胞外液(extracellular fluid)体积或动脉压(arterial pressure)的显著变化。这一功能可以通过图19-12来解释,该图显示盐摄入量增加的初始效应是提高细胞外液体积,这往往会提高动脉压。盐摄入量增加的多种效应,包括动脉压的小幅升高和与压力无关的效应,会降低肾素(renin)分泌和血管紧张素II(angiotensin II)形成的速率,从而有助于在细胞外液体积或动脉压最小增加的情况下消除额外的盐分。因此,肾素-血管紧张素系统是一种自动反馈机制,即使在盐摄入量增加的情况下,也能帮助维持动脉压在或接近正常水平。当盐摄入量低于正常水平时,则会发生完全相反的效果。
为了强调肾素-血管紧张素系统在控制动脉压方面的功效,当该系统正常运作时,即使盐摄入量增加100倍,压力通常也不会上升超过4到6mmHg(图19-13)。相反,当由于持续输注少量血管紧张素II而阻止了血管紧张素形成的通常抑制,使得血液水平无法降低时,同样的盐摄入量增加可能导致压力上升40mmHg或更多(见图19-13)。当盐摄入量减少到正常水平的十分之一时,只要肾素-血管紧张素系统正常运作,动脉压几乎不会发生变化。然而,当使用ACE抑制剂(ACE inhibitor)阻断血管紧张素II的形成时,随着盐摄入量的减少,血压会显著下降(见图19-13)。因此,肾素-血管紧张素系统可能是人体最强大的系统,能够在动脉压变化最小的情况下适应盐摄入量的广泛变化。
图19-12. 盐摄入量增加导致动脉压升高的连续事件,但肾素-血管紧张素系统活动的反馈降低使动脉压几乎恢复到正常水平。
图19-13. 在正常对照犬和用血管紧张素转换酶(ACE)抑制剂治疗以阻断血管紧张素II(Ang II)形成或输注Ang II以防止Ang II被抑制的犬中,钠摄入量慢性变化期间平均动脉压的变化。钠摄入量从低水平的5 mmol/天逐步增加到80、240和500 mmol/天,每个水平持续8天。(修改自Hall JE, Guyton AC, Smith MJ Jr, et al: Blood pressure and renal function during chronic changes in sodium intake: role of angiotensin. Am J Physiol 239:F271, 1980。)
由肾素分泌肿瘤或肾缺血引起的高血压
偶尔,分泌肾素(renin)的JG细胞会发生肿瘤,并分泌大量肾素,导致大量血管紧张素II(angiotensin II)的形成。在所有发生这种现象的患者中,都会出现严重的高血压(hypertension)。此外,当连续数天或数周向动物体内输注大量血管紧张素II时,也会出现类似的严重长期高血压。
- 通过收缩全身的小动脉(arterioles),从而增加总外周阻力(total peripheral resistance)和动脉压(arterial pressure);这种效应在开始输注大量血管紧张素II后的几秒钟内就会发生。
- 通过使肾脏保留盐和水;在几天的时间内,即使是中等量的血管紧张素II也可以通过其肾脏作用引起高血压,这是动脉压长期升高的主要原因。
我们已经注意到,血管紧张素II可以通过两种方式增加动脉压:
图19-14. 在一侧肾脏被移除后,在另一侧肾脏的肾动脉上放置一个收缩夹的效果。注意全身动脉压、夹子远端肾动脉压和肾素分泌率的变化。由此产生的高血压被称为单肾Goldblatt高血压(one-kidney Goldblatt hypertension)。
单肾Goldblatt高血压。当一侧肾脏被移除,并在剩余肾脏的肾动脉上放置一个收缩器时,如图19-14所示,立即的效果是收缩器远端的肾动脉压力大大降低,如图中的虚线所示。然后,在几秒或几分钟内,全身动脉压开始上升,并在几天内持续上升。压力通常在最初的一小时左右迅速上升,随后在接下来的几天内缓慢上升。当全身动脉压达到新的稳定水平时,收缩器远端的肾动脉压力(图中的虚线)几乎恢复到正常水平。以这种方式产生的高血压被称为单肾Goldblatt高血压,以纪念Harry Goldblatt,他首先研究了由肾动脉收缩引起的高血压的重要定量特征。
Goldblatt高血压中动脉压的早期上升是由肾素-血管紧张素血管收缩机制(renin-angiotensin vasoconstrictor mechanism)引起的。也就是说,由于肾动脉急性收缩后肾脏血流不畅,肾脏会分泌大量肾素,如图19-14中最下面的曲线所示,这一作用会增加血液中的血管紧张素II和醛固酮(aldosterone)水平。血管紧张素II反过来会迅速提高动脉压。肾素的分泌在大约1到2小时内达到峰值,但在5到7天内几乎恢复到正常水平,因为此时肾动脉压力也已经恢复到正常水平,因此肾脏不再缺血(ischemic)。
动脉血压的第二次升高是由于狭窄的肾脏对盐和水的滞留(retention)引起的,这也是由血管紧张素II(angiotensin II)和醛固酮(aldosterone)刺激的。在5到7天内,体液量增加足以使动脉血压上升到新的持续水平。这种持续血压水平的定量值由肾动脉的狭窄程度决定。也就是说,主动脉压力必须上升到足够高,以使狭窄处远端的肾动脉压力足够高,从而引起正常的尿量。
类似的情况也发生在单侧剩余肾动脉狭窄的患者中,这种情况有时发生在接受肾移植后的人身上。此外,由于动脉粥样硬化(atherosclerosis)或过高的血管收缩剂水平引起的肾小动脉阻力(functional or pathological increases in resistance)的功能性或病理性增加,可以通过与主肾动脉狭窄相同的机制引起高血压(hypertension)。
双肾Goldblatt高血压。当只有一侧肾动脉狭窄而另一侧肾动脉正常时,也可能导致高血压。狭窄的肾脏由于该侧肾动脉压力降低而分泌肾素(renin)并滞留盐和水。然后,“正常”的对侧肾脏由于缺血肾脏产生的肾素而滞留盐和水。这种肾素导致血管紧张素II和醛固酮的形成增加,两者都循环到对侧肾脏并使其也滞留盐和水。因此,两个肾脏——尽管原因不同——都成为盐和水的滞留者。结果,高血压发生。
双肾Goldblatt高血压的临床对应情况发生在一个人有两颗肾脏时,其中一条肾动脉狭窄——例如,由动脉粥样硬化引起。
由慢性分泌肾素的病变肾脏引起的高血压。通常,一个或两个肾脏的斑片状区域由于局部血管狭窄或梗死而病变并变得缺血,而肾脏的其他区域是正常的。当这种情况发生时,几乎与双肾型Goldblatt高血压相同的效应发生。也就是说,斑片状缺血的肾组织分泌肾素,肾素通过血管紧张素II的形成作用于剩余的肾组织,使其也滞留盐和水。肾性高血压(renal hypertension)最常见的原因之一,尤其是在老年人中,就是这种斑片状缺血性肾病。
由容量负荷和血管收缩组合引起的其他类型的高血压
由主动脉缩窄引起的上半身高血压。每几千名婴儿中就有一名出生时主动脉在头臂动脉分支之后但在肾动脉近端处出现病理性狭窄或阻塞,这种情况称为主动脉缩窄(coarctation of the aorta)。当这种情况发生时,下半身的血流由体壁的多个小侧支动脉携带,上主动脉和下主动脉之间存在很大的血管阻力。因此,上半身的动脉压力可能比下半身高40%到50%。
这种上半身高血压的机制几乎与单肾Goldblatt高血压相同。也就是说,当在肾动脉上方的主动脉上放置一个收缩器时,两个肾脏的血压最初都会下降,肾素(renin)被分泌,血管紧张素(angiotensin)和醛固酮(aldosterone)形成,上半身出现高血压。肾脏水平的下半身动脉压力大约上升到正常水平,但上半身的高压持续存在。肾脏不再缺血,因此肾素的分泌以及血管紧张素和醛固酮的形成恢复到接近正常水平。同样,在主动脉缩窄(coarctation of the aorta)的情况下,下半身的动脉压力通常几乎正常,而上半身的压力远高于正常水平。
主动脉缩窄引起的高血压中自动调节(autoregulation)的作用。主动脉缩窄引起的高血压的一个重要特征是,手臂的血压可能比正常高40%到60%,但血流量几乎完全正常。此外,腿部血压没有升高,血流量也几乎完全正常。为什么上半身的压力比下半身高40%到60%,但血流量却几乎相同呢?上半身和下半身的血液中没有血管收缩物质(vasoconstrictor substances)的差异,因为相同的血液流向这两个区域。同样,神经系统对两个区域的循环支配方式相似,因此没有理由认为血管的神经控制存在差异。主要原因是长期自动调节发展得几乎完全,局部血流量控制机制几乎100%地补偿了压力差异。结果是,无论是在高压区域还是低压区域,局部血流量都由局部自动调节机制控制,几乎完全符合组织的需求,而不是压力的水平。
先兆子痫(preeclampsia)(妊娠毒血症(toxemia of pregnancy))中的高血压。大约5%到10%的孕妇会出现一种称为先兆子痫(也称为妊娠毒血症)的综合征。先兆子痫的表现之一是高血压,通常在分娩后消退。尽管先兆子痫的确切原因尚不完全清楚,但胎盘缺血(ischemia of the placenta)以及随后胎盘释放的毒性因子被认为在导致该疾病的许多表现中起作用,包括母亲的高血压。缺血胎盘释放的物质反过来导致全身血管内皮细胞(vascular endothelial cells)功能障碍,包括肾脏的血管。这种内皮功能障碍减少了一氧化氮(nitric oxide)和其他血管舒张物质(vasodilator substances)的释放,导致血管收缩、肾小球(glomeruli)向肾小管(renal tubules)的液体滤过率降低、肾压力性钠排泄(renal pressure natriuresis)受损,并发展为高血压。
另一个可能导致先兆子痫(子痫前期)高血压的病理异常是肾小球膜增厚(可能是由自身免疫过程引起的),这也降低了肾小球液体滤过率。出于显而易见的原因,导致正常尿液形成所需的动脉压水平升高,长期动脉压水平也相应升高。这些患者在盐摄入过量时特别容易出现更严重的高血压。
神经源性高血压(Neurogenic Hypertension)。急性神经源性高血压可由交感神经系统的强烈刺激引起。例如,当一个人因任何原因兴奋或处于焦虑状态时,交感系统会过度兴奋,全身各处发生外周血管收缩,从而导致急性高血压。
另一种急性神经源性高血压发生在从压力感受器(baroreceptors)发出的神经被切断或延髓两侧的孤束核(tractus solitarius)被破坏时。这些是颈动脉和主动脉压力感受器的神经在脑干中连接的区域。压力感受器正常神经信号的突然停止对神经压力控制机制的影响与主动脉和颈动脉中动脉压的突然降低相同。也就是说,正常压力感受器神经信号对血管运动中枢(vasomotor center)的正常抑制作用丧失,使血管运动中枢突然变得极其活跃,平均动脉压从100mmHg升高到160mmHg。压力在大约2天内恢复到接近正常水平,因为血管运动中枢对缺失的压力感受器信号的反应逐渐消失,这被称为压力感受器压力控制机制的中枢重置(central resetting)。因此,由切断压力感受器神经引起的神经源性高血压主要是一种急性高血压,而不是慢性高血压。
交感神经系统在某些形式的慢性高血压中也起着重要作用,主要是通过激活肾交感神经。例如,体重增加过多和肥胖常常导致交感神经系统激活,进而刺激肾交感神经,损害肾压力性尿钠排泄(renal pressure natriuresis),并导致慢性高血压。这些异常似乎在很大比例的原发性(essential)高血压患者中起主要作用,正如后面讨论的那样。
高血压的遗传原因(Genetic Causes of Hypertension)。已经在几种动物品系中观察到自发性遗传性高血压,包括不同品系的大鼠和兔子以及至少一种品系的狗。在研究最深入的大鼠品系——Okamoto自发性高血压大鼠(Okamoto spontaneously hypertensive rat)中,有证据表明在高血压的早期发展中,交感神经系统比正常大鼠活跃得多。在这种类型的高血压的后期阶段,已经观察到肾脏肾单位(nephrons)的结构变化:(1)肾小球前动脉阻力增加;(2)肾小球膜通透性降低。这些结构变化也可能导致高血压的长期持续。在其他品系的高血压大鼠中,也观察到肾功能受损。
在人类中,已经鉴定出几种不同的基因突变可以导致高血压(hypertension)。这些形式的高血压被称为单基因高血压(monogenic hypertension),因为它们是由单个基因的突变引起的。这些遗传性疾病的一个有趣特征是,它们都会导致肾功能受损(impaired kidney function),要么是由于肾小动脉阻力增加(increased resistance of the renal arterioles),要么是由于肾小管过度重吸收盐和水(excessive salt and water reabsorption by the renal tubules)。在某些情况下,重吸收增加是由于基因突变直接增加了肾小管上皮细胞中钠或氯的转运。在其他情况下,基因突变导致刺激肾小管盐和水重吸收的激素的合成或活性增加。因此,在迄今为止发现的所有单基因高血压疾病中,导致高血压的最终共同途径似乎是肾功能受损。然而,单基因高血压是罕见的,所有已知的形式加起来占人类高血压病例的不到1%。
原发性(原发性)高血压(PRIMARY (ESSENTIAL) HYPERTENSION)
大约90%到95%的高血压患者被认为患有原发性高血压(primary hypertension),许多临床医生也称之为原发性高血压(essential hypertension)。这些术语仅仅意味着高血压的起源不明,与继发于已知原因的高血压形式形成对比,例如肾动脉狭窄(renal artery stenosis)或单基因形式的高血压。
在大多数患者中,体重过度增加和久坐的生活方式似乎在引起原发性高血压中起主要作用。大多数高血压患者超重,对不同人群的研究表明,过度肥胖可能占原发性高血压风险的65%到75%。临床研究清楚地表明,在大多数高血压患者中,减肥对降低血压的价值,高血压治疗临床指南建议增加体力活动和减肥作为治疗大多数高血压患者的第一步。
原发性高血压的以下特征,除其他外,是由体重过度增加和肥胖引起的:
- 心输出量(cardiac output)增加部分是由于额外的脂肪组织所需的额外血流量。然而,心脏、肾脏、胃肠道和骨骼肌中的血流量也随着体重增加而增加,这是由于代谢率增加和器官和组织响应其增加的代谢需求而生长。随着高血压持续数月和数年,总外周血管阻力(total peripheral vascular resistance)可能会增加。
- 超重患者的交感神经活动(sympathetic nerve activity),尤其是在肾脏中,增加。肥胖者交感神经活动增加的原因尚不完全清楚,但研究表明,脂肪细胞释放的激素如瘦素(leptin)可能直接刺激下丘脑(hypothalamus)的多个区域,进而对脑髓质(medulla)的血管运动中枢(vasomotor centers)产生兴奋性影响。还有证据表明,动脉压力感受器(arterial baroreceptors)在缓冲动脉压力增加方面的敏感性降低,以及肥胖者,尤其是那些还患有阻塞性睡眠呼吸暂停(obstructive sleep apnea)的人,化学感受器(chemoreceptors)的激活。
- 在许多肥胖患者中,血管紧张素II(Angiotensin II)和醛固酮(aldosterone)水平升高。这种升高可能部分是由于交感神经刺激增加所致,这会增加肾脏释放肾素(renin),从而增加血管紧张素II的形成,进而刺激肾上腺分泌醛固酮。
- 肾脏压力-钠排泄机制(renal-pressure natriuresis mechanism)受损,除非动脉压升高或肾功能有所改善,否则肾脏无法排出足够的盐和水。如果原发性高血压患者的平均动脉压为150mmHg,将平均动脉压急性降低至正常值100mmHg(但除了降低压力外不改变肾功能)将导致几乎完全无尿(anuria)。患者将保留盐和水,直到压力回升至150mmHg的高值。然而,通过有效的抗高血压治疗长期降低动脉压通常不会引起肾脏明显的盐和水潴留,因为这些治疗也改善了肾脏压力-钠排泄,如后文所述。
在肥胖动物和肥胖患者中的实验研究表明,肥胖性高血压中肾脏压力-钠排泄受损主要是由于交感神经活动增加以及血管紧张素II和醛固酮水平升高导致的肾小管对盐和水的重吸收增加所致。然而,如果高血压未得到有效治疗,肾脏可能会出现血管损伤,从而降低肾小球滤过率(glomerular filtration rate)并增加高血压的严重程度。最终,与肥胖及相关代谢紊乱相关的未控制的高血压可能导致严重的血管损伤和肾功能完全丧失。
原发性高血压中动脉压控制的图形分析。图19-15是对原发性高血压的图形分析。该图中的曲线称为钠负荷-肾功能曲线(sodium-loading renal function curves),因为在每种情况下,动脉压都是通过逐渐增加钠摄入水平在数天或数周内缓慢升高的。钠负荷型曲线可以通过每隔几天将钠摄入水平提高到一个新水平,然后等待肾脏钠输出与摄入达到平衡,同时记录动脉压的变化来确定。
图19-15. 分析(1)盐不敏感性原发性高血压和(2)盐敏感性原发性高血压中的动脉压调节。(修改自Guyton AC, Coleman TG, Young DB, et al: Salt balance and long-term blood pressure control. Annu Rev Med 31:15, 1980。)
当此方法用于原发性高血压(essential hypertension)患者时,可以记录到两种类型的曲线,如图19-15右侧所示;一种称为(1)盐不敏感性高血压(salt-insensitive hypertension),另一种称为(2)盐敏感性高血压(salt-sensitive hypertension)。请注意,在这两种情况下,曲线都向右移动,达到比正常动脉压人群更高的压力水平。对于盐不敏感性原发性高血压患者,当从正常盐摄入量转变为高盐摄入量时,动脉压不会显著增加。然而,对于盐敏感性原发性高血压患者,高盐摄入量会显著加剧高血压。
还有两点需要强调。首先,血压的盐敏感性并非全或无的现象——它是量化的,有些人比其他人对盐更敏感。其次,血压的盐敏感性并非固定不变的特征;相反,随着年龄的增长,尤其是50或60岁以后,当肾脏中的功能单位(肾单位(nephrons))数量开始逐渐减少时,血压通常会对盐更加敏感。
盐不敏感性原发性高血压和盐敏感性高血压之间的差异可能与这两种类型高血压患者肾脏的结构或功能差异有关。例如,盐敏感性高血压可能伴随不同类型的慢性肾脏疾病发生,这是由于肾单位的逐渐丧失或正常衰老所致,如第32章所讨论的。肾素-血管紧张素系统(renin-angiotensin system)的功能异常也可能导致动脉压对盐敏感,如本章前面所讨论的。
原发性高血压的治疗。作为第一步,当前的高血压治疗指南建议大多数患者通过改变生活方式来增加体力活动和减轻体重。不幸的是,许多患者无法减轻体重,因此必须开始使用抗高血压药物进行药物治疗。用于治疗高血压的药物主要有两大类:(1)血管扩张剂(vasodilator drugs),可增加肾血流量和肾小球滤过率(glomerular filtration rate);(2)利尿剂(natriuretic or diuretic drugs),可减少肾小管对盐和水的重吸收。
血管扩张剂通常不仅作用于肾脏,还会引起身体其他许多组织的血管扩张。不同的血管扩张剂通过以下方式之一发挥作用:(1)通过抑制交感神经信号向肾脏的传递,或通过阻断交感神经递质对肾血管和肾小管的作用;(2)通过直接松弛肾血管的平滑肌;或(3)通过阻断肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system)对肾血管或肾小管的作用。
减少肾小管对盐和水重吸收的药物主要包括阻断钠通过肾小管壁主动转运的药物;这种阻断反过来也阻止了水的重吸收,如本章前面所述。这些利尿剂将在第32章中详细讨论。
动脉压调节的综合多面系统总结
很明显,动脉血压(arterial pressure)不是由单一的血压控制系统调节的,而是由几个相互关联的系统共同调节的,每个系统都执行特定的功能。例如,当一个人失血严重到血压突然下降时,血压控制系统面临两个问题。首先是生存问题;动脉血压必须迅速恢复到足够高的水平,使患者能够度过急性发作期。其次是将血容量和动脉血压最终恢复到正常水平,使循环系统能够重新建立完全的正常状态,而不仅仅是恢复到生存所需的水平。
在第18章中,我们看到,抵御动脉血压急性变化的第一道防线是神经系统控制(nervous control system)。在本章中,我们强调了主要通过肾脏机制实现的第二道防线,用于长期控制动脉血压。然而,还有其他部分需要解决。图19-16有助于将这些部分整合在一起。
图19-16. 在动脉血压受到干扰后的不同时间间隔内,各种动脉血压控制机制的近似效力。特别注意几周后发生的肾体液压力控制机制(renal body fluid pressure control mechanism)的近无限增益(\infty)。CNS,中枢神经系统(central nervous system)。(改编自Guyton AC: Arterial Pressure and Hypertension. Philadelphia: WB Saunders, 1980.)
图19-16显示了八种动脉血压控制机制的近似即时(秒和分钟)和长期(小时和天)控制反应,以反馈增益(feedback gain)表示。这些机制可以分为三组:(1)在几秒或几分钟内迅速反应的机制;(2)在中等时间范围内(即几分钟或几小时)反应的机制;(3)提供长期(几天、几个月和几年)动脉血压调节的机制。
在几秒或几分钟内起作用的动脉血压控制机制。快速作用的血压控制机制几乎完全是急性神经反射或其他自主神经系统(autonomic nervous system)反应。请注意图19-16中显示在几秒内反应的三种机制:(1)压力感受器反馈机制(baroreceptor feedback mechanism);(2)中枢神经系统缺血机制(central nervous system ischemic mechanism);(3)化学感受器机制(chemoreceptor mechanism)。这些机制不仅在几秒内开始反应,而且非常强大。在血压急性下降(如严重失血引起的)后,神经机制共同作用,导致以下结果:(1)静脉收缩并将血液转移到心脏;(2)增加心率和心脏收缩力,以提供更强的心脏泵血能力;(3)大多数外周小动脉收缩。所有这些效应几乎立即发生,将动脉血压提升到生存范围内。
当血压突然升高(如快速输注过量血液时),同样的控制机制会反向运作,再次将血压恢复到正常水平。
数分钟后起效的动脉血压控制机制
一些血压控制机制在急性动脉血压变化后数分钟才会表现出显著的反应。图19-16中展示了其中三种机制,分别是:(1) 肾素-血管紧张素(renin-angiotensin)血管收缩机制;(2) 血管系统的应力松弛(stress relaxation);(3) 通过组织毛细血管壁的液体转移(shift of fluid),根据需要调整血容量。
我们已经详细描述了肾素-血管紧张素血管收缩系统的作用,它提供了一种半急性手段,在必要时增加动脉血压。应力松弛机制可以通过以下例子来说明:当血管内的压力过高时,血管会在数分钟或数小时内逐渐被拉伸,结果血管内的压力会趋于正常。这种持续的血管拉伸被称为应力松弛,它可以作为一种中期压力“缓冲器”。
毛细血管液体转移机制意味着,每当毛细血管压力过低时,液体通过毛细血管膜从组织中被吸收进入循环,从而增加血容量并提高循环中的压力。相反,当毛细血管压力过高时,液体会从循环中流失到组织中,从而减少血容量以及整个循环中的几乎所有压力。
这三种中期机制通常在30分钟到数小时内被激活。在此期间,神经机制通常会逐渐失效,这说明了这些非神经性、中期血压控制措施的重要性。
动脉血压调节的长期机制
本章的目标是解释肾脏在长期控制动脉血压中的作用。图19-16的最右侧展示了肾-血容量(renal-blood volume)血压控制机制,它与肾-体液(renal-body fluid)血压控制机制相同,表明它需要数小时才能开始表现出显著的反应。然而,它最终会发展出一种对动脉血压控制的反馈增益,几乎等于无穷大。这意味着该机制最终可以将动脉血压几乎完全恢复到正常水平,而不仅仅是部分恢复,从而使肾脏能够正常排出盐和水。
许多因素可以影响肾-体液机制的血压调节水平。图19-16中展示的其中一个因素是醛固酮(aldosterone)。动脉血压的降低会在数分钟内导致醛固酮分泌增加,并在接下来的数小时或数天内,这种效应对肾-体液机制的压力控制特性产生重要影响。
特别重要的是肾素-血管紧张素系统(renin-angiotensin system)与醛固酮(aldosterone)和肾脏液体机制的相互作用。例如,一个人的盐摄入量每天都有很大差异。我们在本章中已经看到,盐摄入量可以下降到正常水平的十分之一,也可以增加到正常水平的10到15倍,但如果肾素-血管紧张素-醛固酮系统完全运作,平均动脉压(mean arterial pressure)的调节水平只会变化几毫米汞柱。然而,如果没有功能正常的肾素-血管紧张素-醛固酮系统,血压对盐摄入量的变化会变得非常敏感。
因此,动脉压(arterial pressure)的控制始于神经压力控制(nerve pressure controls)的救命措施,然后通过中期压力控制(intermediate pressure controls)的持续特性继续,最后通过肾脏-体液机制(renal-body fluid mechanism)在长期压力水平上稳定下来。这种长期机制又与肾素-血管紧张素-醛固酮系统、神经系统和其他几个因素相互作用,为特殊目的提供特殊的血压控制能力。
心输出量、静脉回流及其调节
心输出量(cardiac output)是心脏每分钟泵入主动脉的血液量。这也是通过循环系统流动的血液量。由于心输出量是流向身体所有组织的血流量的总和,因此它是与心血管系统功能相关的最重要因素之一。
静脉回流(venous return)同样重要,因为它是每分钟从静脉流入右心房的血液量。静脉回流和心输出量必须相等,除了在血液暂时储存在心脏和肺部或从心脏和肺部移除的几次心跳之外。
静息和活动时心输出量的正常值
心输出量随身体活动水平的变化而变化很大。以下因素直接影响心输出量:(1)身体代谢的基本水平;(2)人是否在运动;(3)人的年龄;(4)身体的大小。
对于年轻健康的男性,静息心输出量平均约为5.6L/min。对于女性,这个值约为4.9L/min。当考虑到年龄因素时——因为随着年龄的增长,身体活动和某些组织(例如骨骼肌)的质量会减少——静息成人的平均心输出量通常约为5L/min。然而,健康男性和女性的心输出量差异很大,取决于肌肉质量、肥胖程度、身体活动以及其他影响代谢率和组织营养需求的因素。
心指数
实验表明,心输出量大约与体表面积成正比。因此,心输出量经常以心指数(cardiac index)表示,即每平方米体表面积的心输出量。体重70公斤的人体表面积约为1.7平方米,这意味着成人的正常平均心指数约为3L/min/m^2体表面积。
年龄对心输出量(cardiac output)的影响。图20-1显示了不同年龄时以心指数(cardiac index)表示的心输出量。心指数在10岁时迅速上升到超过4L/min/m^2的水平,到80岁时下降到约2.4 L/min/m^2。我们将在本章后面解释,心输出量在整个生命过程中几乎与整体代谢活动成正比地调节。因此,心指数的下降表明随着年龄的增长,活动度和/或肌肉质量的下降。
静脉回流-心脏的Frank-Starling机制对心输出量的控制
虽然心脏功能在决定心输出量方面显然至关重要,但影响静脉血液流入心脏的外周循环的各种因素,称为静脉回流(venous return),通常是心输出量的主要控制因素。
外周因素在控制心输出量方面通常如此重要的主要原因是,心脏具有一种内置机制,通常允许其自动泵出从静脉流入右心房的血液量。这种机制称为心脏的Frank-Starling定律(Frank-Starling law of the heart),在第9章中讨论过。基本上,该定律指出,当流入心脏的血液量增加时,增加的血液量会拉伸心腔壁。由于这种拉伸,心肌以更大的力量收缩,这种动作将来自体循环的额外血液排出。因此,流入心脏的血液会自动泵入主动脉,并再次通过循环流动。
另一个重要因素,在第10章和第18章中讨论过,是心脏的拉伸会导致心率增加。右心房壁中的窦房结(sinus node)的拉伸对节点的节律性有直接影响,可使心率增加多达10%至15%。此外,拉伸的右心房会引发一种称为Bainbridge反射(Bainbridge reflex)的神经反射,首先传递到大脑的血管运动中枢(vasomotor center),然后通过交感神经(sympathetic nerves)和迷走神经(vagi)返回心脏,这也会增加心率。
图20-1. 不同年龄时一个人的心指数——每平方米表面积的心输出量。(修改自Guyton AC, Jones C E, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
在大多数正常的无压力条件下,心输出量主要由决定静脉回流的外周因素控制。然而,正如我们将在本章后面讨论的那样,如果回流的血液超过心脏的泵血能力,那么心脏就成为决定心输出量的限制因素。
心输出量是所有组织血流的总和——组织代谢调节大多数局部血流
心脏的静脉回流是通过外周循环所有单个组织段的局部血流的总和(图20-2)。因此,心输出量的调节通常是所有局部血流调节的总和。
局部血流调节机制在第17章中已讨论。在大多数组织中,血流量主要与每个组织的新陈代谢成比例增加。例如,当组织耗氧量增加时,局部血流量几乎总是增加;图20-3展示了不同运动水平下的这种效应。注意,在运动期间,随着工作输出水平的增加,耗氧量和心输出量(cardiac output)彼此平行增加。
总结来说,心输出量通常由全身控制局部血流量的各种因素的总和决定。所有局部血流量汇总形成静脉回流(venous return),心脏自动将这种回流的血液泵回动脉,使其再次在系统中循环。
当动脉压不变时,心输出量与总外周阻力(total peripheral resistance)成反比变化。图20-3与图19-5相同。这里重复此图是为了说明心输出量控制中的一个极其重要的原则:在许多情况下,只要动脉压不变,长期心输出量水平与总外周血管阻力的变化成反比。注意在图20-4中,当总外周阻力完全正常时(在图中为100%标记处),心输出量也正常。然后,当总外周阻力高于正常时,心输出量下降;相反,当总外周阻力降低时,心输出量增加。通过重新考虑第14章中表达的一种形式的欧姆定律,可以很容易理解这一现象:
图20-2。心输出量等于静脉回流,是组织和器官血流量的总和。除非心脏严重衰弱且无法充分泵送静脉回流,心输出量(总组织血流量)主要由身体组织和器官的代谢需求决定。
图20-3。增加运动水平对心输出量(红色实线)和耗氧量(蓝色虚线)的影响。(修改自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973。)
图20-4。不同水平的总外周阻力对心输出量的长期影响,显示总外周阻力与心输出量之间的反比关系。AV,房室。(修改自Guyton AC: Arterial Pressure and Hypertension. Philadelphia: WB Saunders, 1980。)
因此,每当总外周阻力的长期水平发生变化(但循环的其他功能不变)时,心输出量会在数量上发生完全相反方向的变化。
心输出量的限制
心脏可以泵送的血液量有明确的限制,这些限制可以以心输出量曲线的形式定量表达。
图20-5展示了正常的心输出量曲线,显示了在每个右心房压力水平下的每分钟心输出量。这是心功能曲线的一种类型,已在第9章中讨论过。请注意,这条正常心输出量曲线的平台水平约为13L/min,是正常心输出量约5L/min的2.5倍。这意味着正常的人类心脏在没有特殊刺激的情况下,可以在心脏成为心输出量控制的限制因素之前,泵送静脉回流达到正常静脉回流的约2.5倍。
图20-5中还显示了其他几条心输出量曲线,这些曲线对应的是泵血不正常的心脏。最上面的曲线对应的是泵血效果优于正常的超有效心脏。最下面的曲线对应的是泵血水平低于正常的低效心脏。
导致心脏超有效的因素
可以使心脏泵血能力比正常更强的因素主要有两种类型:神经刺激和心肌肥大。
图20-5. 正常心脏、低效心脏和超有效心脏的心输出量曲线。(修改自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
神经兴奋可以增加心脏泵血能力
在第9章中,我们看到交感神经刺激和副交感神经抑制的结合可以增加心脏的泵血效果:(1) 它大大增加了心率——有时在年轻人中,心率可以从正常的72次/分钟增加到180到200次/分钟——(2) 它增加了心脏收缩的强度(称为增加收缩力),使其达到正常强度的两倍。结合这两种效果,心脏的最大神经兴奋可以将心输出量曲线的平台水平提高到几乎两倍于正常曲线的平台水平,如图20-5中最上面曲线的25-L/min水平所示。
心脏肥大可以增加泵血效果
长期增加的工作负荷(但不过度以至于损害心脏)会导致心肌质量和收缩强度的增加,就像剧烈运动导致骨骼肌肥大一样。例如,马拉松运动员的心脏质量可能增加50%到75%。这一因素增加了心输出量曲线的平台水平,有时增加60%到100%,从而使心脏能够泵送比通常量更大的心输出量。
当神经兴奋和心脏肥大结合时,如马拉松运动员的情况,总效果可以使心脏泵送多达30到40L/min,大约是普通人可以达到的水平的2.5倍。这种增加的泵血水平是决定运动员跑步时间的最重要因素之一。
导致心脏低效的因素
任何降低心脏泵血能力的因素都会导致低效。一些可能降低心脏泵血能力的因素包括:
· 心脏必须对抗的动脉压力增加,如严重高血压
· 心脏神经兴奋的抑制 · 导致心律或心率异常的病理因素 • 冠状动脉阻塞,导致心脏病发作 • 心脏瓣膜病 • 先天性心脏病 • 心肌炎,即心肌的炎症 • 心脏缺氧
神经系统对心输出量的调节
当外周血管扩张、静脉回流和心输出量增加时,神经系统对维持动脉血压的重要性。图20-6展示了在有和没有自主神经系统功能的情况下,心输出量控制的重要差异。实线曲线显示了在正常狗中,由于给予药物二硝基苯酚(dinitrophenol)引起的强烈外周血管扩张的效果,该药物使几乎所有身体组织的代谢增加了约四倍。在神经系统控制机制完整的情况下,扩张所有外周血管几乎不会引起动脉血压的变化,但心输出量增加了近四倍。然而,在自主神经系统控制被阻断后,使用二硝基苯酚扩张血管(虚线曲线)导致动脉血压显著下降至正常值的一半左右,心输出量仅增加了1.6倍,而不是四倍。
因此,通过神经系统反射维持正常动脉血压,正如第18章中解释的机制,对于在外周组织扩张血管以增加静脉回流时实现高心输出量至关重要。
图20-6. 在狗中进行的实验,展示了神经系统维持动脉血压作为心输出量控制前提的重要性。请注意,在血压控制的情况下,代谢刺激剂二硝基苯酚显著增加了心输出量;而在没有血压控制的情况下,动脉血压下降,心输出量增加非常有限。(根据M. Banet博士的实验绘制)
运动期间神经系统增加动脉血压的效果。在运动期间,活跃骨骼肌中代谢的强烈增加导致肌肉小动脉的松弛,以提供足够的氧气和其他维持肌肉收缩所需的营养物质。这大大降低了总外周阻力,通常也会降低动脉血压。然而,神经系统立即进行补偿。向肌肉发送运动信号的相同大脑活动同时向大脑的自主神经中枢发送信号,以激发循环活动,导致大静脉收缩、心率增加和心脏收缩力增强。所有这些变化共同作用,使动脉血压升高至正常水平以上,从而迫使更多的血液流经活跃的肌肉。
总之,当局部组织血管扩张并增加静脉回流和心输出量至正常水平以上时,神经系统在防止动脉血压降至灾难性低水平方面起着关键作用。在运动期间,神经系统更进一步,提供额外的信号以将动脉血压升高至正常水平以上,从而使心输出量额外增加30%至100%。
病理性的高或低心输出量
多种临床异常可能导致心脏输出量(heart output)过高或过低。图20-7展示了一些较为重要的异常心脏输出情况。
由总外周阻力(total peripheral resistance)降低引起的高心脏输出
图20-7的左侧列出了导致心脏输出异常增高的情况。这些情况的一个显著特征是,它们都源于长期的总外周阻力降低,而不是心脏本身的过度兴奋,这一点我们将在后面解释。让我们考虑一些可以降低外周阻力同时使心脏输出高于正常水平的情况。
- 脚气病(Beriberi)。这种疾病是由于饮食中维生素硫胺素(vitamin thiamine, 维生素B1)不足引起的。缺乏这种维生素会导致组织利用某些细胞营养物质的能力下降,局部组织血流控制机制进而引起显著的外周血管扩张代偿。有时总外周阻力会降低到正常的一半。因此,静脉回流(venous return)和心脏输出的长期水平也可能增加到正常值的两倍。
- 动静脉瘘(Arteriovenous fistula, AV shunt)。之前我们指出,每当大动脉和大静脉之间发生瘘管(也称为动静脉分流)时,大量血液直接从动脉流入静脉。这也会大大降低总外周阻力,同样增加静脉回流和心脏输出。
- 甲状腺功能亢进(Hyperthyroidism)。在甲状腺功能亢进中,身体大多数组织的新陈代谢大大增加。氧气的使用增加,组织释放血管扩张产物。因此,由于全身局部组织血流控制反应,总外周阻力显著降低;因此,静脉回流和心脏输出通常比正常增加40%到80%。
- 贫血(Anemia)。在贫血中,两种外周效应大大降低了总外周阻力。其中一个效应是由于红细胞浓度降低导致的血液粘度降低。另一个效应是组织氧输送减少,导致局部血管扩张。因此,心脏输出大大增加。
任何其他长期降低总外周阻力的因素,如果动脉压没有下降太多,也会增加心脏输出。
低心脏输出
图20-7的最右侧展示了几种导致心脏输出异常降低的情况。这些情况分为两类:(1) 降低心脏泵血效率的异常;(2) 降低静脉回流的异常。
由心脏因素引起的心脏输出降低。每当心脏受到严重损伤时,无论原因如何,其有限的泵血水平可能低于组织所需的足够血流。这种情况的一些例子包括:(1) 严重的冠状动脉阻塞及随之而来的心肌梗死(myocardial infarction);(2) 严重的瓣膜性心脏病(valvular heart disease);(3) 心肌炎(myocarditis);(4) 心脏压塞(cardiac tamponade);(5) 心脏代谢紊乱(cardiac metabolic derangements)。图20-7右侧展示了其中几种情况的影响,显示了由此导致的低心脏输出。
当心输出量(cardiac output)下降到如此低的水平,以至于全身组织开始遭受营养缺乏时,这种情况被称为心源性休克(cardiac shock)。这种情况将在第22章中与心力衰竭(cardiac failure)的关系中讨论。
由非心脏外周因素引起的心输出量减少——静脉回流减少。任何干扰静脉回流(venous return)的因素也可能导致心输出量减少。其中一些因素如下:
- 血容量减少。导致心输出量减少的最常见的非心脏外周因素是血容量减少,通常是由于出血(hemorrhage)。失血可能会使血管系统的充盈度降低到如此低的水平,以至于外周血管中没有足够的血液来产生足够高的外周血管压力,从而将血液推回心脏。
- 急性静脉扩张。当交感神经系统(sympathetic nervous system)突然变得不活跃时,通常会发生急性静脉扩张。例如,晕厥(fainting)通常是由于交感神经系统活动的突然丧失引起的,这会导致外周容量血管(capacitative vessels),尤其是静脉,显著扩张。这种扩张降低了血管系统的充盈压力,因为血容量无法在现在松弛的外周血管中产生足够的压力。结果,血液在血管中淤积,无法像正常情况下那样迅速回流到心脏。
- 大静脉阻塞。在极少数情况下,通向心脏的大静脉会发生阻塞,外周血管中的血液无法回流到心脏。因此,心输出量显著下降。
图20-7. 不同病理情况下的心输出量。括号中的数字表示每种情况下研究的患者数量。AV,房室(Atrioventricular)。(修改自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973。)
- 组织质量减少,尤其是骨骼肌质量减少。随着正常衰老或长时间的身体不活动,骨骼肌的大小通常会减少。这种减少反过来会降低肌肉的总氧消耗和血流需求,导致骨骼肌血流和心输出量减少。
- 组织代谢率降低。如果组织代谢率降低,如在长时间卧床休息期间骨骼肌中发生的那样,组织的氧消耗和营养需求也会降低,从而减少流向组织的血流,导致心输出量减少。其他情况,如甲状腺功能减退(hypothyroidism),也可能降低代谢率,从而减少组织血流和心输出量。
无论心输出量低的原因是什么,无论是外周因素还是心脏因素,如果心输出量下降到低于组织充分营养所需的水平,就可以说这个人经历了循环休克(circulatory shock)。这种情况可能在几分钟到几小时内致命。循环休克是一个如此重要的临床问题,将在第24章中详细讨论。
用于心输出量调节定量分析的心输出量曲线
我们迄今为止对心输出量(cardiac output)调节的讨论足以理解在大多数简单条件下控制心输出量的因素。然而,为了理解在特别应激情况下的心输出量调节,例如极端运动、心力衰竭(cardiac failure)和循环休克(circulatory shock),以下部分将进行更复杂的定量分析。
为了进行更定量的分析,有必要区分与心输出量调节有关的两个主要因素:(1)心脏的泵血能力(pumping ability),以心输出量曲线(cardiac output curves)表示;(2)影响血液从静脉流入心脏的外周因素(peripheral factors),以静脉回流曲线(venous return curves)表示。然后我们可以将这些曲线以定量的方式结合起来,展示它们如何相互作用,同时决定心输出量、静脉回流和右心房压力(right atrial pressure)。
一些用于描述定量心脏泵血效果的心输出量曲线已经在图20-5中展示。然而,还需要另一组曲线来展示心脏外部压力变化对心输出量的影响,如下一节所述。
心脏外部压力对心输出量曲线的影响。图20-8展示了外部心脏压力变化对心输出量曲线的影响。正常的外部压力等于正常的胸膜内压(intrapleural pressure)(胸腔内的压力),约为-4mmHg。请注意,图中胸膜内压升高至-2mmHg时,整个心输出量曲线向右移动相同的量。这种移动发生的原因是,填充心脏腔室需要额外的2mmHg右心房压力来克服心脏外部增加的压力。同样,胸膜内压升高至+2mmHg时,右心房压力需要从正常的-4mm Hg增加6mmHg,这使整个心输出量曲线向右移动6~mm Hg。
一些可以改变心脏外部压力从而移动心输出量曲线的因素如下:
- 呼吸过程中胸膜内压的周期性变化,正常呼吸时约为\pm2mmHg,但在剧烈呼吸时可达\pm50mmHg。
- 负压呼吸(breathing against a negative pressure),使曲线向右心房压力更负的方向移动(向左)。
- 正压呼吸(positive-pressure breathing),使曲线向右移动。
- 打开胸腔(thoracic cage),使胸膜内压增加至0mmHg,并使心输出量曲线向右移动4mmHg。
- 心包填塞(cardiac tamponade),即心包腔(pericardial cavity)内积聚大量液体,导致心脏外部压力增加,曲线向右移动。
请注意,在图20-8中,心包填塞使曲线的上部比下部更向右移动,因为在高心输出量时,心脏腔室填充到更大的体积,外部填塞压力上升到更高的值。
不同心输出量曲线模式的组合。图20-9显示,最终的心输出量曲线可能会因以下因素的同步变化而改变:(1) 外部心脏压力;(2) 心脏作为泵的有效性。例如,心脏超高效和胸膜内压增加的组合会由于心脏泵血能力的增强而导致心输出量的最大水平增加,但由于胸膜内压的增加,心输出量曲线会向右移动(向更高的心房压力)。因此,通过了解外部压力和心脏作为泵的能力的变化,可以用单一的心输出量曲线来表达心脏泵血的瞬时能力。
图20-8. 不同胸膜内压水平和不同程度心脏压塞时的心输出量曲线。(修改自Guyton AC, Jones C E, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
图20-9. 两种主要心输出量曲线模式的组合,显示了心外压力和心脏作为泵的有效性变化的影响。(修改自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脉回流曲线
在完全分析心脏调节之前,必须考虑整个体循环。为了实验性地分析体循环的功能,将动物的心脏和肺从循环中移除,并用泵和人工氧合系统替代。然后,改变不同的因素,如血容量、血管阻力和右心房中的中心静脉压,以确定体循环在不同循环状态下的运作方式。通过这些研究,发现了以下三个影响体循环静脉回流到心脏的主要因素:
- 右心房压力,它对静脉施加反向力,阻碍血液从静脉流入右心房。
- 体循环的充盈程度(通过平均体循环充盈压测量),它将体循环血液推向心脏(这是在所有血液流动停止时在体循环各处测量的压力,稍后将详细讨论)。
- 外周血管和右心房之间的血流阻力。
这些因素都可以通过静脉回流曲线定量表达,我们将在接下来的部分中解释。
图20-10. 正常静脉回流曲线。当右心房压力降至大气压以下时,进入胸部的大静脉塌陷导致平台期。还请注意,当右心房压力上升到等于平均体循环充盈压时,静脉回流变为零。
正常静脉回流曲线 (Normal Venous Return Curve)
与心输出量曲线 (cardiac output curve) 将心脏泵血与右心房压力 (right atrial pressure) 相关联的方式类似,静脉回流曲线 (venous return curve) 也将静脉回流与右心房压力相关联——即在不同右心房压力水平下,血液从体循环 (systemic circulation) 流入心脏的静脉流量。
图20-10中的曲线是正常静脉回流曲线。该曲线显示,当心脏泵血能力下降并导致右心房压力升高时,升高的心房压力对体循环静脉的反向作用力会减少血液回流至心脏。如果所有神经循环反射 (nervous circulatory reflexes) 都被抑制,当右心房压力升高至约+7mmHg时,静脉回流会降至零。右心房压力的轻微升高会导致静脉回流急剧减少,因为任何反向压力的增加都会导致血液在体循环中淤积,而不是回流至心脏。
在右心房压力升高并导致静脉淤滞 (venous stasis) 的同时,由于静脉回流减少,心脏泵血也接近于零。当体循环中的所有血流在7mmHg的压力下停止时,动脉和静脉压力达到平衡,根据定义,这一压力即为平均体循环充盈压 (mean systemic filling pressure)。
由大静脉塌陷引起的负心房压力下静脉回流曲线的平台期 (Plateau in Venous Return Curve at Negative Atrial Pressures Caused by Collapse of the Large Veins)
当右心房压力降至零以下——即低于大气压时,静脉回流的进一步增加几乎停止,当右心房压力降至约-2mmHg时,静脉回流达到一个平台期。即使右心房压力降至-20mmHg、-50mmHg甚至更低,静脉回流仍保持在这一平台水平。这一平台期是由于进入胸腔的静脉塌陷引起的。右心房的负压将静脉壁吸在一起,阻止了外周静脉 (peripheral veins) 的额外血流。因此,即使右心房压力非常负,也无法显著增加静脉回流,使其超过正常心房压力为0mmHg时的水平。
平均循环充盈压 (Mean Circulatory Filling Pressure)、平均体循环充盈压 (Mean Systemic Filling Pressure)——对静脉回流的影响
当心脏因电击导致心室颤动 (ventricular fibrillation) 或其他原因停止泵血时,循环中的血流会在几秒钟后停止。没有血流时,循环中各处的压力趋于相等。这一平衡压力水平称为平均循环充盈压。
血容量增加提高平均循环充盈压(mean circulatory filling pressure)
循环中的血容量越大,平均循环充盈压就越高,因为额外的血容量会拉伸血管壁。图20-11中的红色曲线显示了不同血容量水平对平均循环充盈压的大致正常影响。注意,当血容量约为4000ml时,平均循环充盈压接近于零,因为这是循环的无应力容量,但当血容量为5000 ml时,充盈压为正常值7mmHg。同样,在更高的血容量下,平均循环充盈压几乎呈线性增加。
交感神经刺激增加平均循环充盈压
图20-11中的绿色曲线和蓝色曲线分别显示了高水平和低水平交感神经活动对平均循环充盈压的影响。强烈的交感神经刺激会收缩所有体循环血管,以及较大的肺血管甚至心脏腔室。因此,系统的容量减少,使得在每个血容量水平下,平均循环充盈压都会增加。在正常血容量下,最大交感神经刺激将平均循环充盈压从7mmHg增加到大约两倍,即约14mmHg。
图20-11. 总血容量变化对平均循环充盈压的影响(整个循环系统的容量-压力曲线)。这些曲线还显示了强烈交感神经刺激和完全交感神经抑制的影响。
相反,完全抑制交感神经系统会使血管和心脏放松,将平均循环充盈压从正常值7 mmHg降低到约4mmHg。注意图20-11中曲线的陡峭程度,这意味着即使是由不同水平的交感神经活动引起的血容量或系统容量的轻微变化,也会对平均循环充盈压产生很大的影响。
平均体循环充盈压及其与平均循环充盈压的关系
平均体循环充盈压(mean systemic filling pressure, Psf)与平均循环充盈压略有不同。它是在通过夹住心脏处的大血管停止血流后,在体循环各处测量的压力,因此体循环的压力可以独立于肺循环的压力进行测量。尽管在活体动物中几乎不可能测量平均体循环充盈压,但它几乎总是接近平均循环充盈压,因为肺循环的容量不到体循环的八分之一,血容量也只有体循环的十分之一左右。
平均体循环充盈压变化对静脉回流曲线的影响
图20-12展示了增加或减少Psf对静脉回流曲线的影响。需要注意的是,正常的Psf约为7~mm Hg。图中最上方的曲线表示Psf增加到14mmHg,而最下方的曲线表示Psf减少到3.5mmHg。这些曲线表明,Psf越高(也意味着循环系统被血液填充得越“紧”),静脉回流曲线就越向上和向右移动。相反,Psf越低,曲线就越向下和向左移动。
图20-12. 静脉回流曲线展示了当平均体循环充盈压(PSf)为7mmH g时的正常曲线,以及将Psf改变为3.5、7或14~mm Hg时的影响。(修改自Guyton AC, Jones C E, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
换句话说,系统被填充的程度越大,血液流入心脏就越容易。系统被填充的程度越小,血液流入心脏就越困难。
当静脉回流的压力梯度为零时,没有静脉回流
当右心房压力上升到与Psf相等时,外周血管和右心房之间不再有任何压力差。因此,血液不再能从外周血管流回右心房。然而,当右心房压力逐渐低于Psf时,流向心脏的血液量会成比例增加,这可以通过研究图20-12中的任何静脉回流曲线看出。也就是说,Psf和右心房压力之间的差异越大,静脉回流就越大。因此,这两个压力之间的差异被称为静脉回流的压力梯度。
静脉回流的阻力
正如Psf代表推动静脉血液从外周流向心脏的压力一样,静脉血液流动也存在阻力。这被称为静脉回流的阻力。虽然部分阻力发生在小动脉和小动脉中,但大部分静脉回流的阻力发生在静脉中。
为什么静脉阻力(venous resistance)在决定静脉回流阻力(resistance to venous return)时如此重要?答案是当静脉中的阻力增加时,血液主要在静脉中开始积聚。然而,由于静脉具有高度的可扩张性(distensible),静脉压力上升非常小。因此,这种静脉压力的上升在克服阻力方面并不十分有效,进入右心房(right atrium)的血流量急剧减少。相反,当小动脉(arteriolar)和小动脉(small artery)阻力增加时,血液在动脉中积聚,而动脉的容量(capacitance)仅为静脉的三十分之一。因此,即使动脉中血液的轻微积聚也会使压力大幅上升——比静脉高出30倍——这种高压克服了大部分增加的阻力。从数学上看,所谓的静脉回流阻力中约三分之二由静脉阻力决定,约三分之一由小动脉和小动脉阻力决定。
静脉回流(venous return)可以通过以下公式计算:
V R=\fracP S f-P R AR V R
其中,VR是静脉回流(venous return),Psf是平均系统充盈压(mean systemic filling pressure),PRA是右心房压力(right atrial pressure),RVR是静脉回流阻力(resistance to venous return)。在健康成人中,这些值的近似值如下:静脉回流=5 L/min,Psf=7mmHg.,右心房压力=0mmHg,,静脉回流阻力=1.4mmHg/L/min。
图20-13. 描绘改变静脉回流阻力对静脉回流曲线的影响的静脉回流曲线。Psf,平均系统充盈压(mean systemic filling pressure)。(修改自Guyton AC, Jones C E, , Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脉回流阻力对静脉回流曲线的影响。图20-13展示了不同水平的静脉回流阻力对静脉回流曲线的影响,表明将这种阻力降低到正常值的一半可以使血流量增加一倍,因此将曲线向上旋转到两倍的斜率。相反,将阻力增加到正常值的两倍将曲线向下旋转到一半的斜率。
还需注意的是,当右心房压力上升到等于Psf时,无论静脉回流阻力如何,静脉回流都变为零,因为没有压力梯度(pressure gradient)来引起血液流动。因此,无论心脏如何衰竭,右心房压力能够上升的最高水平等于Psf。
静脉回流曲线模式的组合。图20-14展示了Psf和静脉回流阻力同时变化对静脉回流曲线的影响,表明这两个因素可以同时起作用。
通过同时的心输出量和静脉回流曲线分析心输出量和右心房压力
在完整的循环中,心脏和体循环必须协同工作。这意味着(1)体循环的静脉回流必须等于心脏的心输出量(cardiac output),(2)心脏和体循环的右心房压力相同。
因此,可以通过以下方式预测心输出量(cardiac output)和右心房压力(right atrial pressure):
图20-14. 主要静脉回流曲线模式的组合,显示了平均系统充盈压(mean systemic filling pressure, Psf)和静脉回流阻力同时变化的影响。(改编自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
图20-15. 两条实线展示了当心输出量曲线(红线)和静脉回流曲线(蓝线)正常时,心输出量和右心房压力的分析。输注相当于血容量20%的血液后,静脉回流曲线变为虚线。结果,心输出量和右心房压力从点A移动到点B。Psf,平均系统充盈压。
- 确定心脏的瞬时泵血能力,并以心输出量曲线的形式描绘这种能力。
- 确定从体循环流入心脏的瞬时血流状态,并以静脉回流曲线的形式描绘这种血流状态。
- 将这些曲线相互对应,如图20-15所示。
图中的两条曲线描绘了正常的心输出量曲线(红线)和正常的静脉回流曲线(蓝线)。图中只有一个点,即点A,在该点静脉回流等于心输出量,并且右心房压力对于心脏和体循环是相同的。因此,在正常循环中,右心房压力、心输出量和静脉回流都由点A表示,称为平衡点,其中心输出量的正常值为5L/min,右心房压力为0mmHg。
血容量增加对心输出量的影响
血容量突然增加约20%会使心输出量增加到正常值的2.5到3倍。图20-15展示了这种效应的分析。在输注大量额外血液后,系统的充盈增加导致Psf增加到16mmHg,从而使静脉回流曲线向右移动。同时,血容量增加使血管扩张,降低了它们的阻力,从而降低了静脉回流的阻力,使曲线向上旋转。由于这两种效应,图20-15中的静脉回流曲线向右移动。这条新曲线与心输出量曲线在点B处对应,表明心输出量和静脉回流增加了2.5到3倍,右心房压力上升到约+8mmHg。
血容量增加引发的代偿效应
由于血容量增加引起的心输出量大幅增加仅持续几分钟,因为几种代偿效应立即开始发生:
- 心输出量增加会增加毛细血管压力,使液体开始从毛细血管渗出到组织中,从而使血容量恢复正常。
- 静脉内压力的增加通过一种称为应力松弛(stress-relaxation)的机制导致静脉逐渐扩张,特别是导致静脉血库(venous blood reservoirs),如肝脏和脾脏扩张,从而降低Psf(外周静脉压)。
- 外周组织中的过量血流引起外周血管阻力(peripheral vascular resistance)的自调节性增加,从而增加静脉回流阻力(resistance to venous return)。
这些因素导致Psf逐渐恢复正常,体循环(systemic circulation)的阻力血管(resistance vessels)收缩。因此,在10到40分钟的时间内,心输出量(cardiac output)逐渐恢复到接近正常水平。
交感神经刺激对心输出量的影响 交感神经刺激(sympathetic stimulation)影响心脏和体循环:(1) 它使心脏成为一个更强的泵;(2) 在体循环中,由于外周血管(特别是静脉)的收缩,它增加了Psf,并增加了静脉回流阻力。
在图20-16中,描绘了正常的心输出量和静脉回流曲线;它们在点A处相等,点A代表正常的静脉回流、心输出量为5L/min,右心房压力(right atrial pressure)为0 mm Hg。请注意,图中最大交感神经刺激(绿色曲线)将Psf增加到17mmHg(由静脉回流曲线达到零静脉回流水平的点表示)。交感神经刺激还使心脏的泵血效率提高了近100%。结果,心输出量从平衡点A的正常值上升到平衡点D的约两倍正常值,而右心房压力几乎没有变化。因此,不同程度的交感神经刺激可以在短时间内逐步将心输出量增加到约两倍正常值,直到其他代偿效应在几秒或几分钟内发生,使心输出量恢复到接近正常水平。
图20-16. 分析(1) 中度交感神经刺激(从点A到点C)、(2) 最大交感神经刺激(点D)和(3) 由全脊髓麻醉(total spinal anesthesia)引起的交感神经抑制(点B)对心输出量的影响。(修改自Guyton AC, Jones C E, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
交感神经抑制对心输出量的影响
交感神经系统(sympathetic nervous system)可以通过诱导全脊髓麻醉或使用一种药物(如六甲溴铵(hexamethonium))来阻断自主神经节(autonomic ganglia)的神经信号传递。图20-16中最下面的曲线显示了由全脊髓麻醉引起的交感神经抑制的效果,表明:(1) Psf下降到约4 mm Hg;(2) 心脏作为泵的效率下降到约80%的正常水平。心输出量从点A下降到点B,即下降到约60%的正常水平。
开放大型动静脉瘘的影响 图20-17显示了在开放大型动静脉瘘(AV fistula)后发生的循环变化的不同阶段——即在大型动脉和大型静脉之间直接开口后。
- 两条红色曲线在点A相交,显示正常状态。
- 曲线在点B相交,显示在打开大的动静脉瘘(arteriovenous fistula)后立即出现的循环状态。
图20-17. 分析在突然打开大的动静脉瘘(arteriovenous fistula)后,人类心输出量(cardiac output)和右心房压力(right atrial pressure)的连续变化。分析的阶段,如平衡点所示,如下:A,正常状态;B,打开动静脉瘘后立即;C,交感反射激活后约1分钟;D,血容量增加和心脏开始肥大后数周。(修改自Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
主要影响如下:(a) 静脉回流曲线突然急剧向上旋转,这是由于当血液几乎无阻碍地从大动脉直接流入静脉系统时,静脉回流阻力大幅下降,绕过了外周循环的大部分阻力元素;(b) 心输出量曲线水平略有上升,因为打开瘘管会降低外周阻力,并使动脉压急剧下降,心脏更容易泵血。点B所示的结果是心输出量从5 L/min增加到13L/min,右心房压力增加到约+3 mm Hg。
- 点C表示约1分钟后的效果,在交感神经反射使动脉压几乎恢复到正常水平并引起另外两个效果之后:(a) Psf(由于所有静脉和动脉的收缩)从7增加到9mmHg,从而使静脉回流曲线向右移动2 mmHg;(b) 由于交感神经对心脏的兴奋作用,心输出量曲线进一步升高。心输出量现在上升到几乎16~L/min,右心房压力上升到约4mmHg。
- 点D显示数周后的效果。到此时,由于动脉压的轻微下降和交感神经刺激都暂时减少了肾脏的尿液输出,导致盐和水潴留,血容量增加。Psf现在上升到+12 mmHg,使静脉回流曲线再向右移动3 mm Hg。此外,心脏长期增加的工作负荷导致心肌轻微肥大,进一步提高了心输出量曲线的水平。因此,点D显示心输出量现在几乎为20L/min,右心房压力约为6mmHg。
其他心输出量调节的分析。在第21章中,介绍了运动期间心输出量调节的分析。在第22章中,讨论了充血性心力衰竭(congestive heart failure)各个阶段的心输出量调节分析。
心输出量测量方法
在现代医疗实践中,准确评估心输出量(cardiac output)至关重要,尤其是在危重患者或接受手术的高风险患者中。在动物实验中,可以通过在主动脉或肺动脉上放置电磁或超声流量计来测量心输出量。然而,在人类中,心输出量通常通过不需要手术的间接方法来测量。
通过电磁或超声流量计测量的心脏搏动输出
图20-18显示了使用电磁流量计记录的狗主动脉根部的血流情况。该记录表明,在收缩期(systole)期间,血流迅速上升到峰值,然后在收缩期结束时,血流在短时间内反向流动。这种反向流动导致主动脉瓣关闭,血流恢复到零。
使用氧菲克原理测量心输出量
菲克原理(Fick principle)由图20-19解释。该图显示每分钟有200毫升的氧气从肺部吸收到肺血液中。它还显示,进入右心的血液的氧气浓度为160毫升/升,而离开左心的血液的氧气浓度为200毫升/升。从这些数据可以计算出,每升血液通过肺部时吸收40毫升的氧气。
图20-18. 使用电磁流量计记录的主动脉根部的搏动血流。
因为每分钟从肺部吸收到血液中的氧气总量为200毫升,将200除以40计算出每分钟必须有5升血液通过肺循环以吸收这个量的氧气。因此,每分钟通过肺部的血液量为5升,这也是心输出量的一个测量值。因此,心输出量可以通过以下公式计算:
在应用菲克程序测量人类心输出量时,混合静脉血通常通过插入前臂肱静脉(brachial vein)的导管获得,导管通过锁骨下静脉(subclavian vein)进入右心房,最后进入右心室或肺动脉。全身动脉血可以从身体的任何全身动脉中获得。肺部吸收氧气的速率通过使用任何类型的氧气计测量呼吸空气中氧气消失的速率来确定。
指示剂稀释法
通过指示剂稀释法测量心输出量(cardiac output)时,将少量指示剂(如染料)注入大静脉或优选右心房(right atrium)。该指示剂迅速通过心脏右侧,然后通过肺血管,再通过心脏左侧,最后进入体循环动脉系统。当染料通过外周动脉之一时,记录染料的浓度,得到如图20-20所示的曲线。在这些实验中,每次在零时刻注入5毫克的Cardiogreen染料。在上方的记录中,染料在注射后约3秒才进入动脉树,但随后动脉中的染料浓度在约6至7秒内迅速上升到最大值。之后,浓度迅速下降,但在浓度降至零之前,部分染料已经通过一些外周体循环血管循环并再次通过心脏返回。因此,动脉中的染料浓度再次开始上升。为了计算目的,需要将曲线的早期下降部分外推至零点,如每条曲线的虚线部分所示。通过这种方式,可以测量体循环动脉中染料的外推时间-浓度曲线的第一部分,并在后一部分进行合理准确的估计。
图20-19. 用于确定心输出量的Fick原理
图20-20. 用于通过稀释法计算两个独立心输出量的外推染料浓度曲线。矩形区域是相应外推曲线持续时间内动脉血中染料的计算平均浓度。
一旦确定了外推的时间-浓度曲线,就可以计算曲线持续时间内动脉血中染料的平均浓度。例如,在图20-20的上方示例中,通过测量整个初始和外推曲线下的面积,然后对曲线持续时间内的染料浓度进行平均来完成此计算。从上图跨越曲线的阴影矩形可以看出,染料的平均浓度为0.25mg/dl血液,且该平均值的持续时间为12秒。实验开始时总共注入了5毫克的染料。为了使每100毫升血液中仅携带0.25毫克染料的血液在12秒内通过心脏和肺部携带全部5毫克染料,总共需要20份每份100毫升的血液在12秒内通过心脏,这相当于心输出量为2L/12秒,或10L/min。我们留给读者从图20-20的下方外推曲线计算心输出量。总结来说,心输出量可以使用以下公式确定:
markdown <html><body><table><tr><td colspan="2">心输出量(ml/min) = 注入染料毫克数×60</td></tr><tr><td>每毫升血液中染料的平均浓度 × 曲线持续时间</td><td>曲线持续时间(秒)</td></tr></table></body></html>
超声心动图
心输出量也可以通过超声心动图来估计,这是一种使用从放置在胸壁或插入患者食道的换能器发出的超声波来测量心脏腔室大小和从左心室流入主动脉的血液速度的方法。每搏输出量是根据流入主动脉的血液速度计算的,而主动脉的横截面积是通过超声成像测量的主动脉直径确定的。然后,心输出量通过每搏输出量和心率的乘积计算得出。
胸腔电生物阻抗法
阻抗心动图,也称为胸腔电生物阻抗,是一种无创技术,用于测量胸腔总电导率的变化,作为心输出量等血流动力学参数的间接评估。该方法检测由高频、低幅电流通过位于测量段外部的额外两对电极之间的胸腔引起的阻抗变化。电阻抗是电路在施加电压时对电流的阻力。随着每次心跳,主动脉中的血容量和速度发生变化,相应的阻抗变化及其时间被测量并用于估计心输出量。
尽管一些研究表明,在某些条件下,阻抗心动图可能提供合理的心输出量评估,但该方法也受到几种潜在误差来源的影响,包括电干扰、运动伪影、心脏周围和肺部的液体积累以及心律失常。一些研究表明,该方法的平均误差可能高达20%至40%。
准确评估心输出量可以深入了解心脏功能和组织灌注,因为心输出量代表了流向身体所有器官和组织的血流总和。因此,为了管理循环窘迫患者,正在不断开发更准确测量心输出量的无创方法。
运动期间的肌肉血流和心输出量;冠状动脉循环和缺血性心脏病
在本章中,我们将考虑以下内容:(1) 骨骼肌的血流;以及(2) 心脏的冠状动脉血流。这些血流的调节主要通过血管阻力的局部控制来响应肌肉组织的代谢需求。
我们还将讨论相关主题的生理学,包括以下内容:(1) 运动期间的心输出量控制;(2) 心脏病发作的特征;以及(3) 心绞痛的疼痛。
静息和运动期间骨骼肌的血流调节
剧烈运动是正常循环系统面临的最具压力的条件之一,因为体内有大量的骨骼肌(skeletal muscle),所有这些肌肉都需要大量的血液流动。此外,心输出量(cardiac output)通常必须增加到非运动员正常水平的四到五倍,或训练有素的运动员正常水平的六到七倍,以满足运动肌肉的代谢需求。
骨骼肌血流速率
在休息时,骨骼肌的血流平均为3到4ml/ \operatorname*min/100~g肌肉。在训练有素的运动员进行极限运动时,血流可以增加25到50倍,达到100到200ml/min/100g肌肉。据报道,耐力训练运动员的大腿肌肉的峰值血流可高达400ml/min/100g肌肉。
肌肉收缩期间的血流。图21-1显示了在强烈节律性运动期间腿部小腿肌肉的血流变化记录。注意,血流随着每次肌肉收缩而增加和减少。在收缩结束时,血流在几秒钟内保持高位,但在接下来的几分钟内恢复正常。
在运动的肌肉收缩阶段血流减少的原因是收缩的肌肉对血管的压迫。在强烈的强直收缩期间,这会导致血管持续受压,血流几乎可以停止,但这也会导致收缩迅速减弱。
运动期间肌肉毛细血管中的血流增加。在休息时,一些肌肉毛细血管几乎没有或没有流动的血液,但在剧烈运动期间,所有毛细血管都会打开。这种休眠毛细血管的打开减少了氧气和其他营养物质必须从毛细血管扩散到收缩肌肉纤维的距离;有时它会使毛细血管表面积增加两到三倍,氧气和营养物质可以通过这些表面积从血液扩散到组织。
骨骼肌血流的控制
肌肉中氧气的减少大大增加了血流。
在骨骼肌活动期间发生的肌肉血流大幅增加主要是由局部释放的化学物质引起的,这些化学物质直接作用于肌肉小动脉(arterioles)以引起扩张。最重要的化学效应之一是肌肉组织中氧气水平的降低。当肌肉活跃时,它们迅速消耗氧气,从而降低组织液中的氧气浓度。这反过来又导致局部小动脉扩张,因为低氧水平使血管放松,并且氧气不足导致血管扩张物质(vasodilator substances)的释放。腺苷(adenosine)可能是一种重要的血管扩张物质,但实验表明,即使直接将大量腺苷注入肌肉动脉,也无法像在剧烈运动期间那样增加血流,并且它无法在骨骼肌中维持血管扩张超过约2小时。
图21-1. 强节奏性收缩期间肌肉运动对小腿血流的影响。收缩期间的血流明显少于收缩间期。(修改自Barcroft H, Dornhorst AC: The blood flow through the human calf during rhythmic exercise. J Physiol 109:402, 1949.)
幸运的是,即使在肌肉血管对腺苷的血管舒张效应变得不敏感后,只要运动持续,其他血管舒张因子仍能维持毛细血管血流的增加。这些因子包括:(1) 钾离子;(2) 三磷酸腺苷(ATP);(3) 乳酸;以及(4) 二氧化碳。我们尚不清楚这些因子在肌肉活动期间对增加肌肉血流的定量贡献;这一主题在第17章中有更详细的讨论。
肌肉血流的神经控制
除了局部组织的血管舒张机制外,骨骼肌还配备了交感神经缩血管神经,在某些动物物种中,还配备了交感神经舒血管神经。
交感神经缩血管神经纤维在其神经末梢分泌去甲肾上腺素。当最大激活时,这种机制可以将静息肌肉的血流减少至正常的一半到三分之一。这种血管收缩在循环休克期间减轻动脉压下降以及其他应激时期具有生理重要性,甚至可能需要增加血压。
除了交感神经缩血管神经末梢分泌的去甲肾上腺素外,两个肾上腺髓质在剧烈运动期间也会分泌更多的去甲肾上腺素以及更多的肾上腺素进入循环血液。循环中的去甲肾上腺素作用于肌肉血管,引起与直接交感神经刺激相似的缩血管效应。然而,肾上腺素通常具有轻微的舒血管效应,因为肾上腺素更多地激活血管的β-肾上腺素能受体,这些受体是舒血管受体,与主要由去甲肾上腺素激活的α缩血管受体形成对比。这些受体在第61章中有讨论。
运动期间的循环调整
在运动期间,发生三个主要效应,这些效应对于循环系统提供肌肉所需的巨大血流至关重要:(1) 许多组织中的交感神经系统激活,从而对循环产生刺激效应;(2) 动脉压增加;(3) 心输出量增加。
交感激活的效应
在运动开始时,信号不仅从大脑传递到肌肉以引起肌肉收缩,还传递到血管运动中枢以启动许多其他组织的交感神经放电。同时,心脏的副交感神经信号被减弱。因此,产生三个主要的循环效应:
- 由于心脏的交感神经驱动以及心脏从正常的副交感神经抑制中释放,心脏被刺激以显著增加心率和泵血强度。
- 外周循环中的许多小动脉(arterioles)强烈收缩,除了活跃肌肉中的小动脉,这些肌肉中的小动脉由于局部血管舒张效应(vasodilator effects)而强烈扩张,如前所述。因此,心脏受到刺激以提供肌肉所需的增加的血流量,同时通过身体大多数非肌肉区域的血流量暂时减少,从而“借出”血液供应给肌肉。这一过程可以为肌肉提供多达2L/min的额外血流量,这在考虑一个人为了生存而奔跑时极为重要,因为即使是跑步速度的微小增加也可能决定生死。外周循环系统中的两个系统,冠状动脉系统(coronary system)和脑循环系统(cerebral system),不受这种血管收缩效应的影响,因为这两个循环区域的血管收缩神经支配较弱——幸运的是,因为心脏和大脑对运动的重要性与骨骼肌一样。
- 静脉的肌肉壁和循环中的其他容量区域强烈收缩,这大大增加了平均系统充盈压(mean systemic filling pressure)。正如我们在第20章中学到的,这种效应是促进静脉回心血量增加并因此增加心输出量的最重要因素之一。
运动期间交感神经刺激可能增加动脉压
运动期间交感神经刺激增加的一个重要效应是增加动脉压。这种增加的动脉压是由多种刺激效应引起的,包括以下内容:(1) 除了大脑和活跃肌肉(包括心脏)外,身体大多数组织中的小动脉和小动脉的血管收缩(vasoconstriction);(2) 心脏泵血活动的增加;以及(3) 主要由静脉收缩引起的平均系统充盈压的大幅增加。这些效应共同作用,几乎总是在运动期间增加动脉压。这种增加可以低至20mmHg,也可以高达80mmHg,具体取决于运动的条件。当一个人在紧张的情况下进行运动但只使用少数肌肉时,交感神经反应仍然会发生。在少数活跃的肌肉中,血管舒张(vasodilation)发生,但在身体的其他部位,效应主要是血管收缩,通常将平均动脉压增加到高达170mmHg。这种情况可能发生在一个人站在梯子上用锤子钉天花板时。这种情况的紧张性是显而易见的。
相反,当一个人进行大规模全身运动,如跑步或游泳时,动脉压的增加通常仅为20至40mmHg。这种压力没有大幅增加的原因是同时发生在大量活跃肌肉中的极端血管舒张。
为什么运动期间动脉压升高很重要?
在实验室实验中,当肌肉受到最大程度的刺激但不允许动脉压升高时,肌肉血流量很少能增加超过约八倍。然而,我们从马拉松运动员的研究中得知,肌肉血流量可以从休息时的全身仅1L/min增加到最大活动时的超过20L/min。因此,很明显,肌肉血流量可以比这个简单的实验室实验中发生的增加得更多。那么,区别在哪里呢?主要在于,正常运动期间动脉压会升高。例如,假设在剧烈运动期间动脉压升高了30%。这30%的增加会导致推动血液通过肌肉组织血管的力增加30%。然而,这并不是唯一的重要效应——额外的压力还会拉伸血管壁,这种效应与局部释放的血管扩张剂和更高的血压一起,可能使肌肉总流量增加到正常水平的20倍以上。
运动期间心输出量增加的重要性
在运动期间,许多不同的生理效应同时发生,使心输出量(cardiac output)大致与运动程度成比例增加。事实上,循环系统在运动期间提供增加的心输出量以向肌肉输送氧气和其他营养物质的能力,与肌肉本身的力量在设定持续肌肉工作的极限方面同样重要。例如,能够最大程度增加心输出量的马拉松运动员通常是那些打破纪录的跑步者。
剧烈运动期间心输出量变化的图形分析
图21-2显示了剧烈运动期间心输出量大幅增加的图形分析。心输出量和静脉回流曲线在点A处交叉代表正常循环,而在点B处交叉代表剧烈运动。请注意,心输出量的大幅增加需要心输出量曲线和静脉回流曲线的显著变化,如下所示。
图21-2. 剧烈运动开始时心输出量、静脉回流和右心房压力变化的图形分析。黑色曲线,正常循环。红色曲线,剧烈运动。
心输出量曲线的升高水平很容易理解。它几乎完全是由于心脏的交感神经刺激引起的,这导致以下结果:(1) 心率增加,最高可达170至190次/分钟;(2) 心脏收缩力增加至正常水平的两倍。如果没有这种心脏功能的增加,心输出量的增加将仅限于正常心脏的平台水平,这将使心输出量的最大增加仅为约2.5倍,而不是未经训练的跑步者通常可以达到的4倍增加,以及一些马拉松运动员可以达到的7倍增加。
现在研究静脉回流曲线(venous return curve)。如果静脉回流曲线没有发生任何变化,那么运动时心输出量(cardiac output)几乎不会增加,因为正常静脉回流曲线的上平台水平仅为6~L/min。然而,确实会发生两个重要的变化:
- 剧烈运动开始时,平均体循环充盈压(mean systemic filling pressure)升高。这种效应部分是由于交感神经刺激使静脉和循环中其他容量部分收缩。此外,腹部和其他骨骼肌的紧张会压迫许多内部血管,从而对整个容量血管系统提供更多的压迫,导致平均体循环充盈压进一步增加。在最大运动时,这两种效应一起可以将平均体循环充盈压从正常的7mmHg提高到30mmHg。
- 静脉回流曲线的斜率向上旋转。这种向上旋转是由于几乎所有活动肌肉组织中的血管阻力降低,这也导致静脉回流阻力降低,从而增加了静脉回流曲线的向上斜率。
因此,平均体循环充盈压的增加和静脉回流阻力的降低共同提高了静脉回流曲线的整体水平。
图21-3. 冠状动脉。
由于静脉回流曲线和心输出量曲线的变化,图21-2中新的心输出量和右心房压(right atrial pressure)的平衡点现在是点B,与点A的正常水平形成对比。特别要注意的是,右心房压几乎没有变化,仅上升了1.5mmHg。事实上,在心脏强壮的人中,由于心脏受到极大的交感神经刺激,右心房压在剧烈运动时通常会低于正常水平。相比之下,即使是中等强度的运动也可能导致心脏功能减弱的患者右心房压显著增加。
冠状动脉循环(CORONARY CIRCULATION)
在西方工业化国家,约三分之一的死亡是由冠状动脉疾病引起的,大多数老年人至少存在一定程度的冠状动脉循环障碍。因此,了解冠状动脉循环的正常和病理生理学是医学中最重要的课题之一。
冠状动脉血液供应的生理解剖(PHYSIOLOGIC ANATOMY OF THE CORONARY BLOOD SUPPLY)
图21-3显示了心脏及其冠状动脉血液供应。注意,主要冠状动脉位于心脏表面,较小的动脉从表面穿透进入心肌。心脏几乎完全通过这些动脉获得其营养血液供应。只有心内膜表面内侧的十分之一毫米可以直接从心腔内的血液中获得显著的营养,因此这种肌肉营养来源是微乎其微的。
左冠状动脉主要供应左心室的前部和左侧部分,而右冠状动脉则供应右心室的大部分,以及80%到90%的人左心室的后部。
图21-4. 心脏收缩期和舒张期通过人类左心室冠状动脉毛细血管的血流相位变化(根据狗的测量血流推断)。
来自左心室肌肉的大部分冠状静脉血流通过冠状窦返回心脏的右心房,约占冠状血流总量的75%。另一方面,来自右心室肌肉的大部分冠状静脉血流通过直接流入右心房的小前心静脉返回,而不是通过冠状窦。极少量的冠状静脉血也通过非常细小的Thebesian静脉回流到心脏,这些静脉直接流入心脏的所有腔室。
正常冠状动脉血流平均为心输出量的5%
在静息状态下,正常冠状动脉血流平均为70毫升/分钟/100克心脏重量,或约225毫升/分钟,约占心输出总量的4%至5%。
在剧烈运动期间,年轻成人的心脏将其心输出量增加到四到七倍,并且它将这些血液泵入高于正常的动脉压力。因此,在严重条件下,心脏的工作输出可能增加6到9倍。同时,冠状动脉血流增加3到4倍,以供应心脏所需的额外营养。这种增加不如工作负荷的增加多,这意味着心脏的能量消耗与冠状动脉血流的比率增加。因此,心脏利用能量的效率提高,以弥补冠状动脉血供的相对不足。
心肌压缩在收缩期和舒张期引起冠状动脉血流的相位变化。图21-4显示了在收缩期和舒张期通过左心室冠状动脉系统营养毛细血管的血流变化(以毫升/分钟为单位),这是根据实验动物的研究推断的。从图中可以看出,左心室肌肉中的冠状动脉毛细血管血流在收缩期降至低值,这与身体其他部位的血管床血流相反。这种现象的原因是左心室肌肉在收缩期对肌肉内血管的强烈压缩。
图21-5. 心外膜、肌肉内和心内膜下冠状动脉血管系统的示意图。
在舒张期,心肌放松,不再阻碍通过左心室肌肉毛细血管的血流,因此在整个舒张期血流迅速。
右心室冠状动脉毛细血管的血流在心脏周期中也经历相位变化,但由于右心室肌肉的收缩力远小于左心室肌肉,因此与左心室肌肉相比,逆相位变化只是部分的。
心外膜与心内膜下冠状动脉血流——心肌内压的影响
图21-5展示了心脏肌肉不同深度处冠状动脉的特殊排列,显示了位于外表面的心外膜冠状动脉(epicardial coronary arteries),这些动脉供应大部分心肌。从心外膜动脉衍生出的较小的肌内动脉(intramuscular arteries)穿透肌肉,提供所需的营养。紧邻心内膜下方的是心内膜下动脉丛(subendocardial arteries)。在收缩期,左心室心内膜下丛的血流往往会减少,因为肌内冠状动脉受到心室肌肉收缩的强烈压迫。然而,心内膜下丛的额外血管通常会补偿这种减少。在本章后面,我们将解释心外膜和心内膜下动脉血流之间的这种特殊差异如何在某些类型的冠状动脉缺血中发挥重要作用。
冠状动脉血流的控制
局部肌肉代谢是冠状动脉血流的主要调节因素
冠状动脉系统的血流主要通过局部小动脉(arteriolar)的血管舒张来调节,以响应心肌的营养需求。也就是说,每当心脏收缩的强度增加时,冠状动脉血流的速率也会增加。相反,心脏活动的减少伴随着冠状动脉血流的减少。这种冠状动脉血流的局部调节与身体许多其他组织中的调节类似,尤其是在骨骼肌中。
氧需求是局部冠状动脉血流调节的主要因素
冠状动脉中的血流通常几乎完全按照心肌对氧的需求进行调节。正常情况下,冠状动脉血液中约70%的氧气在血液流经心肌时被移除。由于剩余的氧气不多,除非冠状动脉血流增加,否则无法向心肌提供更多的氧气。幸运的是,冠状动脉血流几乎与心脏的任何额外代谢氧消耗成正比增加。
增加氧消耗导致冠状动脉舒张的确切机制尚未确定。许多研究人员推测,心脏中氧浓度的降低会导致肌肉细胞释放血管舒张物质(vasodilator substances),这些物质会使小动脉舒张。一种具有强烈血管舒张倾向的物质是腺苷(adenosine)。在肌肉细胞中氧浓度非常低的情况下,细胞中的大部分ATP会降解为单磷酸腺苷(AMP)。这种物质的一小部分会进一步降解并向心肌的组织液中释放腺苷,从而导致局部冠状动脉血流增加。腺苷引起血管舒张后,大部分腺苷会被重新吸收回心脏细胞中,用于ATP的再生。
腺苷(adenosine)并不是唯一被鉴定出的血管舒张(vasodilator)产物;其他还包括腺苷磷酸化合物(adenosine phosphate compounds)、钾离子(potassium ions)、氢离子(hydrogen ions)、二氧化碳(carbon dioxide)、前列腺素(prostaglandins)和一氧化氮(nitric oxide)。腺苷并不能完全解释心脏活动增加时冠状动脉舒张(coronary vasodilation)的机制。阻断或部分阻断腺苷血管舒张作用的药物并不能完全阻止由心肌活动增加引起的冠状动脉舒张。骨骼肌(skeletal muscle)的研究也表明,持续输注腺苷只能维持血管舒张1到3小时,然而即使腺苷不再能舒张血管,肌肉活动仍然可以舒张局部血管。因此,应该记住前面列出的其他血管舒张机制。
冠状动脉血流的神经控制(Nervous Control of Coronary Blood Flow)
刺激支配心脏的自主神经(autonomic nerves)可以直接或间接地影响冠状动脉血流。直接影响来自神经递质(nervous transmitter substances)乙酰胆碱(acetylcholine)(来自迷走神经(vagus nerves))和去甲肾上腺素(norepinephrine)(来自交感神经(sympathetic nerves))对冠状动脉血管的作用。间接影响则是由心脏活动增加或减少引起的冠状动脉血流的继发性变化所致。
间接影响与直接影响大多相反,在冠状动脉血流的正常控制中起着更为重要的作用。因此,交感神经刺激(sympathetic stimulation)会从交感神经释放去甲肾上腺素,并从肾上腺髓质(adrenal medullae)释放肾上腺素(epinephrine)和去甲肾上腺素,从而增加心率和心脏收缩力(heart contractility),并提高心脏的代谢率(rate of metabolism)。反过来,心脏代谢的增加会触发局部血流调节机制(local blood flow regulatory mechanisms),使冠状动脉血管舒张,血流增加的程度大致与心肌的代谢需求成比例。相比之下,迷走神经刺激(vagal stimulation)释放乙酰胆碱,会减慢心率,并对心脏收缩力有轻微的抑制作用。这些效应会降低心脏的氧耗,从而间接地收缩冠状动脉。
神经刺激对冠状动脉血管的直接影响(Direct Effects of Nervous Stimuli on Coronary Vasculature)。副交感神经(parasympathetic)(迷走神经)纤维在心室冠状动脉系统中的分布并不广泛。然而,副交感神经刺激释放的乙酰胆碱对冠状动脉有直接的舒张作用。
冠状动脉的交感神经支配更为广泛。在第61章中,我们看到交感神经递质去甲肾上腺素(norepinephrine)和肾上腺素(epinephrine)可以产生血管收缩或血管舒张效应,这取决于血管壁中是否存在收缩或舒张受体。收缩受体被称为α受体(alpha receptors),而舒张受体被称为β受体(beta receptors)。冠状动脉中同时存在α和β受体。一般来说,心外膜冠状动脉以α受体为主,而肌内动脉可能以β受体为主。因此,交感神经刺激至少在理论上可以引起轻微的总体冠状动脉收缩或舒张,但通常是收缩。在某些人中,α血管收缩效应似乎异常严重,这些人在交感神经过度兴奋期间可能会出现血管痉挛性心肌缺血,通常会导致心绞痛。
代谢因素,特别是心肌耗氧量,是心肌血流的主要控制因素。每当神经刺激的直接效应减少冠状动脉血流时,冠状动脉血流的代谢控制通常会在几秒钟内覆盖直接的冠状动脉神经效应。
心肌代谢的特殊特征
第68至73章讨论的细胞代谢的基本原理同样适用于心肌和其他组织,但存在一些定量差异。最重要的是,在静息条件下,心肌通常消耗更多的脂肪酸而不是碳水化合物来提供能量(约70%的能量来自脂肪酸)。然而,与其他组织一样,在无氧或缺血条件下,心肌代谢必须依赖无氧糖酵解机制来获取能量。然而,糖酵解消耗大量的血糖,同时会在心肌组织中形成大量的乳酸。这可能是心肌缺血条件下心脏疼痛的原因之一,正如本章后面所讨论的。
与其他组织一样,从食物中释放的代谢能量中超过95%用于在线粒体中形成ATP。这些ATP反过来作为心肌收缩和其他细胞功能的能量传递者。在严重的冠状动脉缺血中,ATP首先降解为二磷酸腺苷(adenosine diphosphate),然后降解为一磷酸腺苷(AMP)和腺苷(adenosine)。由于心肌细胞膜对腺苷具有轻微的渗透性,大部分腺苷可以从肌肉细胞扩散到循环血液中。
释放的腺苷(adenosine)被认为是导致冠状动脉缺氧时冠状动脉小动脉扩张的物质之一,正如之前所讨论的那样。然而,腺苷的丢失也会对细胞产生严重的后果。在严重冠状动脉缺血(如心肌梗死(myocardial infarct)后发生)的短短30分钟内,受影响的肌细胞中约有一半的腺嘌呤(adenine)碱基可能会丢失。此外,这种丢失只能以每小时2%的速度通过新的腺嘌呤合成来补充。因此,一旦严重的冠状动脉缺血持续30分钟或更长时间,缓解缺血可能为时已晚,无法防止心肌细胞的损伤和死亡。这几乎可以肯定是心肌缺血期间心肌细胞死亡的主要原因之一。
缺血性心脏病(ISCHEMIC HEART DISEASE)
西方国家最常见的死亡原因是缺血性心脏病,这是由于冠状动脉血流不足引起的。在美国,约35%的65岁及以上的人死于这一原因。一些死亡是由于急性冠状动脉闭塞或心脏颤动而突然发生的,而另一些死亡则是由于心脏泵血功能逐渐减弱而在数周至数年内缓慢发生的。在本章中,我们将讨论由急性冠状动脉闭塞和心肌梗死引起的急性冠状动脉缺血。在第22章中,我们将讨论充血性心力衰竭(congestive heart failure),这通常是由逐渐加重的冠状动脉缺血和心肌减弱引起的。
动脉粥样硬化(atherosclerosis)是缺血性心脏病的主要原因。冠状动脉血流减少的常见原因是动脉粥样硬化。动脉粥样硬化过程将在第69章中与脂质代谢(lipid metabolism)一起讨论。简而言之,在有动脉粥样硬化遗传倾向、超重或肥胖且生活方式久坐、或患有高血压并伴有冠状动脉血管内皮细胞(endothelial cells)损伤的人群中,大量的胆固醇逐渐沉积在全身多处动脉的内皮下。逐渐地,这些沉积区域被纤维组织侵入,并经常钙化。最终结果是形成动脉粥样硬化斑块(atherosclerotic plaques),这些斑块实际上会突入血管腔并完全或部分阻塞血流。动脉粥样硬化斑块形成的常见部位是主要冠状动脉的前几厘米。
急性冠状动脉闭塞(Acute Coronary Artery Occlusion)
急性冠状动脉闭塞通常发生在已经患有潜在动脉粥样硬化性冠状动脉疾病的人身上,但几乎不会发生在冠状动脉循环正常的人身上。急性闭塞可能有多种原因,其中两个如下:
- 动脉粥样硬化斑块可以引起局部血栓(blood clot)形成,称为血栓(thrombus),从而阻塞动脉。血栓通常发生在动脉粥样硬化斑块突破内皮(endothelium)的地方,因此与流动的血液直接接触。由于斑块表面不平滑,血小板(platelets)会粘附其上,纤维蛋白(fibrin)沉积,红细胞(red blood cells)被困住形成血栓,血栓逐渐增大直到阻塞血管。偶尔,血栓会从动脉粥样硬化斑块的附着处脱落,流向冠状动脉树的更外周分支,在那里阻塞动脉。以这种方式沿动脉流动并在更远端阻塞血管的血栓称为冠状动脉栓子(coronary embolus)。
- 许多临床医生认为,冠状动脉的局部肌肉痉挛(muscular spasm)也可能发生。痉挛可能是由于动脉粥样硬化斑块边缘直接刺激动脉壁平滑肌(smooth muscle)引起的,也可能是由于局部神经反射(nervous reflexes)导致冠状动脉血管壁过度收缩引起的。痉挛可能导致血管的继发性血栓形成(secondary thrombosis)。
心脏侧支循环(collateral circulation)的救命价值 由缓慢发展的冠状动脉粥样硬化性狭窄或突然的冠状动脉阻塞引起的心肌损伤程度,在很大程度上取决于已经形成或在阻塞后几分钟内可以开放的侧支循环的程度。在正常心脏中,较大的冠状动脉之间几乎没有大的交通支。然而,在直径为20至250微米的小动脉之间确实存在许多吻合支(anastomoses),如图21-6所示。
当较大的冠状动脉之一突然发生阻塞时,小的吻合支在几秒钟内开始扩张。然而,通过这些微小侧支的血流量通常不到它们现在供应的心肌存活所需的一半。在接下来的8到24小时内,侧支血管的直径不会显著增大。然而,随后侧支血流开始增加,在第二或第三天翻倍,通常在大约1个月内达到正常或接近正常的冠状动脉血流。由于这些发展的侧支通道,当受累的肌肉区域不太大时,许多患者可以从不同程度的冠状动脉阻塞中几乎完全恢复。
图21-6. 正常冠状动脉系统中的微小吻合支。
当动脉粥样硬化在多年内缓慢地使冠状动脉狭窄,而不是突然发生时,侧支血管可以同时发展,而动脉粥样硬化变得越来越严重。因此,患者可能永远不会经历急性心脏功能障碍(acute episode of cardiac dysfunction)。然而,最终,硬化过程发展到甚至侧支血液供应也无法提供所需血流的程度,有时侧支血管本身也会发生动脉粥样硬化。当这种情况发生时,心肌的工作输出受到严重限制,心脏甚至无法泵出正常所需的血流量。这是老年人心脏衰竭(cardiac failure)的最常见原因之一。
心肌梗死(Myocardial Infarction)
在急性冠状动脉闭塞后,闭塞部位远端的冠状动脉血流立即停止,除了来自周围血管的少量侧支血流。那些完全没有血流或血流极少以至于无法维持心肌功能的区域被称为梗死区。整个过程被称为心肌梗死(myocardial infarction)。
梗死发生后不久,少量侧支血液开始渗入梗死区,加上局部血管逐渐扩张,导致该区域充满淤滞的血液。同时,肌纤维利用血液中最后的氧气,使血红蛋白完全脱氧。因此,梗死区呈现蓝褐色,尽管缺乏血流,该区域的血管看起来却充血肿胀。在后期,血管壁变得高度通透并渗出液体,局部肌肉组织水肿,心肌细胞因细胞代谢减弱而开始肿胀。在几乎无血液供应的情况下,几小时内心肌细胞就会死亡。
心肌每分钟需要约1.3毫升氧气/100克肌肉组织才能存活。相比之下,每分钟约有8毫升氧气/100克输送到正常静息状态的左心室。因此,即使只有15%到30%的正常静息冠状动脉血流,肌肉也不会死亡。然而,在大面积梗死的中心区域,几乎没有侧支血流,肌肉确实会死亡。
心内膜下梗死(subendocardial infarction)。即使心脏外表面部分没有梗死迹象,心内膜下肌肉也经常发生梗死。这是因为心内膜下肌肉耗氧量较高,而且由于心脏收缩时心内膜下血管受到强烈压迫,难以获得足够的血流。因此,任何损害心脏任何区域血流的情况通常首先导致心内膜下区域受损,然后损伤向外扩散至心外膜。
急性冠状动脉闭塞后的死亡原因
急性心肌梗死后最常见的死亡原因如下:(1)心输出量减少;(2)肺血管淤血,随后死于肺水肿;(3)心脏颤动;偶尔(4)心脏破裂。
心输出量减少——收缩期膨出和心源性休克。当部分心肌纤维不工作,而其他纤维收缩力太弱时,受影响心室的整体泵血能力相应下降。由于一种称为收缩期膨出(systolic stretch)的现象(如图21-7所示),梗死心脏的整体泵血强度往往比预期的下降更多。也就是说,当心室肌肉的正常部分收缩时,缺血部分(无论是死亡还是单纯功能丧失)不是收缩,而是被心室内产生的压力向外推挤。因此,心室的大部分泵血力量因非功能性心肌区域的膨出而消散。
当心脏无法以足够的力量收缩,将足够的血液泵入外周动脉树时,就会发生心脏衰竭和外周组织因外周缺血而死亡。这种情况被称为冠状动脉休克(coronary shock)、心源性休克(cardiogenic shock)、心脏休克(cardiac shock)或低心输出量衰竭(low cardiac output failure),将在下一章中更详细地讨论。当左心室超过40%发生梗死时,几乎总是会发生心脏休克,一旦发生心脏休克,超过70%的患者会死亡。
图21-7. 缺血心肌区域的收缩期拉伸。
体静脉系统中的血液淤积。当心脏无法向前泵血时,血液必然会在心房、肺血管或体循环中淤积。这会导致毛细血管压力增加,尤其是在肺部。
心肌梗死后的最初几小时内,静脉中的血液淤积通常不会造成太大困难。相反,症状会在几天后出现,因为急性心输出量减少导致肾脏血流减少。然后,由于第22章讨论的原因,肾脏无法排出足够的尿液。这会逐渐增加总血容量,从而导致充血症状。因此,许多在心力衰竭发作后的最初几天似乎情况良好的患者会突然出现急性肺水肿,并且通常在首次出现肺部症状后的几小时内死亡。
心肌梗死后的心室颤动。在许多死于冠状动脉闭塞的人中,死亡是由于突发心室颤动(ventricular fibrillation)所致。在大面积梗死后,发生颤动的倾向尤其大,但有时在小面积闭塞后也会发生颤动。一些患有慢性冠状动脉供血不足的患者在没有急性梗死的情况下突然死于颤动。
颤动最有可能在冠状动脉梗死后的两个特别危险的时期发生。第一个时期是在梗死发生后的前10分钟内。然后,有一段相对安全的短暂时期,随后是第二个心脏易激期,大约在1小时后开始,并持续几个小时。颤动也可能在梗死发生后的许多天发生,但此时发生的可能性较小。
至少有四个因素与心脏发生颤动的倾向有关,如下所示:
- 心肌急性供血不足会导致缺血肌肉中钾的快速耗竭。这也会增加心肌纤维周围细胞外液中的钾浓度。将钾注入冠状动脉系统的实验表明,细胞外钾浓度升高会增加心肌的易激性,从而增加其发生颤动的可能性。
- 肌肉缺血(ischemia)会引起损伤电流(injury current),这在第12章中与急性心肌梗死(acute myocardial infarction)患者的心电图(electrocardiogram)相关部分有所描述。也就是说,缺血的心肌组织在心跳后通常无法完全复极(repolarize)其膜电位,因此该肌肉的外表面相对于心脏其他部位正常心肌的膜电位(membrane potential)保持负电位。因此,电流从心脏的缺血区域流向正常区域,并可能引发异常冲动(abnormal impulses),从而导致颤动(fibrillation)。
- 大面积梗死后通常会出现强烈的交感神经反射(sympathetic reflexes),主要是因为心脏无法向动脉树(arterial tree)泵送足够的血量,从而导致血压降低。交感神经刺激还会增加心肌的易激惹性(irritability),从而易于发生颤动。
- 心肌梗死引起的心肌无力(cardiac muscle weakness)通常会导致心室过度扩张(dilate)。这种过度扩张增加了心脏中冲动传导(impulse conduction)的路径长度,并经常在心肌梗死区域周围形成异常的传导通路(abnormal conduction pathways)。这两种效应都易于导致环形运动(circus movements)的发生,因为正如第13章所讨论的,心室传导路径的过度延长使得冲动能够重新进入已经从不应期(refractoriness)恢复的心肌,从而引发新的兴奋的环形运动循环,导致该过程的持续。
梗死区域的破裂。在急性梗死后的第一天左右,心脏缺血部分破裂的风险很小,但几天后,死亡的心肌纤维开始退化,心脏壁变得非常薄。当这种情况发生时,每次心脏收缩时,死亡的心肌都会严重向外膨出,这种收缩期膨出(systolic stretch)会变得越来越严重,直到心脏最终破裂。评估严重心肌梗死进展的方法之一是使用心脏成像技术,如超声心动图(echocardiography)、磁共振成像(MRI)或计算机断层扫描(CT),记录收缩期膨出是否恶化。
图21-8。上部分,冠状动脉缺血的小面积和大面积区域。下部分,心肌梗死恢复的阶段。
当心室破裂时,血液流入心包腔(pericardial space)会导致心包填塞(cardiac tamponade)的迅速发展——即心包腔内积聚的血液从外部压迫心脏。由于这种压迫,血液无法流入右心房,患者会因心输出量(cardiac output)突然下降而死亡。
急性心肌梗死的恢复阶段
图21-8的左上部分显示了急性冠状动脉闭塞(acute coronary occlusion)在心肌缺血小面积患者中的影响;右侧显示的是大面积缺血的心脏。当缺血区域较小时,可能几乎没有或没有心肌细胞死亡,但部分心肌通常会因营养不足而暂时失去功能,无法支持肌肉收缩。
当缺血区域较大时,在冠状动脉血液供应完全停止的情况下,区域中心的某些肌纤维会在1至3小时内迅速死亡。紧邻死亡区域的是一个无功能区域,表现为收缩功能丧失,通常还伴有冲动传导障碍。然后,在无功能区域的周围,还存在一个仍在收缩但仅因轻度缺血而收缩力减弱的区域。
死亡肌肉被瘢痕组织替代。在图21-8的下部,展示了大面积心肌梗死后的各个恢复阶段。闭塞发生后不久,缺血区域中心的肌纤维死亡。随后,在接下来的几天里,由于许多边缘纤维最终因长期缺血而死亡,这一死亡纤维区域会扩大。与此同时,由于供应梗死区域外缘的侧支动脉通道的扩张,大部分无功能肌肉得以恢复。几天到3周后,大多数无功能肌肉要么恢复功能,要么死亡。在此期间,纤维组织开始在死亡纤维中生长,因为缺血可以刺激成纤维细胞的生长,并促进比正常量更多的纤维组织发育。因此,死亡肌肉组织逐渐被纤维组织替代。然后,由于纤维组织具有逐渐收缩和溶解的一般特性,纤维瘢痕可能会在几个月到一年的时间内逐渐缩小。
最后,心脏的正常区域会逐渐肥大,以至少部分补偿失去的死亡心肌组织。通过这些方式,心脏在几个月内部分或几乎完全恢复,具体取决于梗死和心脏组织死亡的严重程度。
休息在治疗心肌梗死中的价值。心脏细胞死亡的程度取决于缺血的程度和心肌的工作负荷。当工作负荷大幅增加时,例如在运动、严重情绪紧张或疲劳期间,心脏需要更多的氧气和其他营养物质来维持其生命。此外,供应心脏缺血区域的吻合血管也必须继续供应它们通常供应的心脏区域。当心脏过度活跃时,正常肌肉组织的血管会显著扩张。这种扩张使得流入冠状动脉的大部分血液流经正常肌肉组织,从而只有少量血液通过小的吻合通道流入缺血区域。结果,缺血状况恶化,这种情况称为冠状动脉窃血综合征。因此,在心肌梗死患者的治疗中,恢复过程中保持绝对的身体休息是一个重要因素。
心肌梗死恢复后的心脏功能
偶尔,从大面积心肌梗死中恢复的心脏几乎可以恢复到完全的功能能力,但更常见的是,其泵血能力永久性地低于健康心脏。这并不意味着患者必然成为心脏病人或静息心输出量低于正常水平,因为正常心脏每分钟能够泵出比身体在静息状态下所需多300%到400%的血液——也就是说,正常人的心脏储备为300%到400%。即使心脏储备减少到只有100%,患者仍然可以完成大多数日常活动,但不能进行剧烈运动,因为这会加重心脏负担。
冠心病中的疼痛
通常,人们无法“感觉”到心脏,但缺血的心肌常常会引起疼痛感,有时这种疼痛非常剧烈。确切的原因尚不清楚,但据信缺血会导致肌肉释放酸性物质,如乳酸或其他促进疼痛的物质,如组胺、激肽或细胞蛋白水解酶,这些物质由于冠状动脉血流缓慢而无法迅速清除。这些异常物质的高浓度会刺激心肌中的疼痛神经末梢,通过感觉传入神经纤维将疼痛冲动传递到中枢神经系统。
心绞痛(心脏疼痛)。在大多数冠状动脉逐渐狭窄的患者中,当心脏负荷相对于可用的冠状动脉血流过大时,就会出现心脏疼痛,称为心绞痛。这种疼痛通常感觉在心脏上方的胸骨下方。此外,疼痛常常会放射到身体的远处表面区域,通常是左臂和左肩,但也经常放射到颈部甚至面部的一侧。这种疼痛分布的原因是,在胚胎期,心脏和手臂一样起源于颈部。因此,心脏和这些身体表面区域都接收来自相同脊髓节段的疼痛神经纤维。
大多数患有慢性心绞痛的患者在运动或经历情绪波动时会感到疼痛,这些情绪波动会增加心脏的代谢或由于交感神经血管收缩信号暂时收缩冠状动脉。寒冷温度或饱腹也会加剧心绞痛,这两者都会增加心脏的工作负荷。疼痛通常只持续几分钟。然而,一些患者的缺血非常严重且持久,以至于疼痛一直存在。疼痛通常被描述为灼热、压迫和紧缩感,其性质通常会使患者停止所有不必要的身体活动。
药物治疗。在急性心绞痛发作时,使用几种血管扩张药物通常可以立即缓解疼痛。常用的短效血管扩张剂包括硝酸甘油和其他硝酸盐药物。其他药物,如血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、钙通道阻滞剂和雷诺嗪,可能对治疗慢性稳定性心绞痛有益。
另一类用于长期治疗心绞痛(angina pectoris)的药物是β受体阻滞剂(beta blockers),如propranolol。这些药物阻断交感神经β肾上腺素能受体(sympathetic beta-adrenergic receptors),从而防止运动或情绪激动时交感神经对心率和心脏代谢的增强作用。因此,β受体阻滞剂治疗可以减少心脏在应激状态下对额外代谢氧的需求。出于显而易见的原因,这种治疗还可以减少心绞痛发作的次数和严重程度。
冠状动脉疾病的外科治疗
主动脉-冠状动脉搭桥手术(Aortic-Coronary Bypass Surgery)。在许多冠状动脉缺血(coronary ischemia)患者中,冠状动脉的狭窄区域仅位于少数由动脉粥样硬化疾病(atherosclerotic disease)阻塞的离散点,而其他部位的冠状动脉正常或接近正常。20世纪60年代,一种称为主动脉-冠状动脉搭桥或冠状动脉旁路移植术(coronary artery bypass grafting, CABG)的手术被开发出来,其中从手臂或腿部取出一段皮下静脉,然后将其从主动脉根部移植到动脉粥样硬化阻塞点以外的外周冠状动脉侧面。通常进行1到5个这样的移植,每个移植都为一个阻塞点以外的外周冠状动脉供血。
大多数患者在冠状动脉搭桥手术后心绞痛得到缓解。此外,对于术前心脏未受到严重损伤的患者,冠状动脉搭桥手术可以使患者获得正常的预期寿命。然而,如果心脏已经严重受损,搭桥手术可能收效甚微。
冠状动脉血管成形术(Coronary Angioplasty)。自20世纪80年代以来,一种用于在冠状动脉完全闭塞之前打开部分阻塞的冠状动脉的手术被广泛应用。这种称为冠状动脉血管成形术(coronary artery angioplasty)的手术操作如下:在放射影像引导下,将一根直径约1毫米的带有小气囊的导管插入冠状动脉系统,并推过部分阻塞的动脉,直到导管的气囊部分跨过部分阻塞点。然后,用高压充气气囊,显著扩张病变的动脉。手术后,通过血管的血流量通常增加3到4倍,超过75%的患者在手术后至少几年内冠状动脉缺血症状得到缓解,尽管许多患者最终仍需要冠状动脉搭桥手术。
有时会在血管成形术扩张的冠状动脉内放置称为支架(stent)的小型不锈钢网状管,以保持动脉开放,从而防止其再狭窄(restenosis)。在支架植入冠状动脉后的几周内,内皮(endothelium)通常会在支架的金属表面生长,使血液能够顺利通过支架。然而,在接受血管成形术治疗的患者中,约有25%到40%的患者会发生冠状动脉再闭塞(reclosure, restenosis),通常在初次手术后6个月内。再狭窄通常是由于在支架上生长的健康新内皮下方过度形成的瘢痕组织所致。缓慢释放药物的支架(drug-eluting stents)可能有助于防止瘢痕组织的过度生长。
用于打开动脉粥样硬化冠状动脉的新技术正在不断进行实验性开发。其中一种技术使用从冠状动脉导管尖端发出的激光束,瞄准动脉粥样硬化病变部位。激光能够在不显著损伤动脉壁其余部分的情况下溶解病变。
医生治疗的最重要疾病之一是心力衰竭(heart failure)。这种疾病可能由任何降低心脏泵血能力以满足身体需求的心脏疾病引起。最常见的原因是冠状动脉血流减少导致的心肌收缩力下降。然而,心力衰竭也可能由心脏瓣膜损伤、心脏外部压力、维生素B缺乏、原发性心肌疾病或任何其他使心脏泵血功能低下的异常引起。
在本章中,我们主要讨论由冠状动脉部分阻塞引起的缺血性心脏病导致的心力衰竭,这是心力衰竭最常见的原因。在第23章中,我们将讨论瓣膜性和先天性心脏病。
心力衰竭中的循环动力学
中度心力衰竭的急性效应
如果心脏突然受到严重损伤,例如心肌梗死,心脏的泵血能力会立即下降。结果会出现两个主要效应:(1) 心输出量减少;(2) 静脉血液淤积,导致静脉压升高。
图22-1以图形方式展示了急性心肌梗死后不同时间心脏泵血效果的逐步变化。图中的顶部曲线显示了正常的心输出量曲线。曲线上的点A是正常操作点,显示了在静息条件下的正常心输出量为5\textrmL/ min,右心房压力为0mmHg。
心脏受损后,心输出量曲线立即大幅下降,降至图表底部的最低曲线。几秒钟内,新的循环状态在点B建立,表明心输出量已降至2L/min,约为正常值的五分之二,而右心房压力则上升至+4mmHg,因为从身体返回心脏的静脉血液在右心房淤积。这种低心输出量仍足以维持生命数小时,但很可能伴随晕厥。幸运的是,这种急性阶段通常只持续几秒钟,因为交感神经反射几乎立即发生,并在很大程度上补偿了受损心脏,如下所述。
交感神经反射对急性心力衰竭的补偿
当心输出量危险地降低时,第18章中讨论的许多循环反射会迅速激活。其中最著名的是由动脉压降低激活的压力感受器反射(baroreceptor reflex)。化学感受器反射(chemoreceptor reflex)、中枢神经系统缺血反应(central nervous system ischemic response),甚至源自受损心脏的反射也可能有助于激活交感神经系统。因此,交感神经系统在几秒钟内被强烈刺激,同时心脏的副交感神经信号被抑制。
强烈的交感神经刺激对心脏和外周血管系统有重大影响。如果所有心室肌肉组织都受到弥漫性损伤但仍具有功能,交感神经刺激会加强这些受损的肌肉组织。如果部分肌肉失去功能,而另一部分仍然正常,交感神经刺激会强烈刺激正常肌肉,从而部分补偿失去功能的肌肉。因此,心脏在交感神经刺激下变得更加强大。这种效应如图22-1所示,图中显示在交感神经补偿后,极低的心输出量曲线大约提高了两倍。
交感神经刺激还增加了静脉回流,因为它增加了循环中大多数血管的张力,尤其是静脉,将平均系统充盈压提高到12至14~mmHg,几乎是正常水平的100%。如第20章所讨论的,这种增加的充盈压大大增加了血液从静脉回流到心脏的趋势。因此,受损的心脏比平时更容易被更多的流入血液充盈,右心房压力进一步上升,这有助于心脏泵出更多的血液。因此,在图22-1中,新的循环状态由点C表示,显示心输出量为4.2L/ min,右心房压力为5mmHg。
图22-1 急性心肌梗死后心输出量曲线的逐步变化。心输出量和右心房压力从点A到点D逐步变化(由黑线表示),这一过程持续数秒、数分钟、数天和数周。
交感神经反射在大约30秒内达到最大发展。因此,一个突然发生中度心脏病发作的人可能只会经历心脏疼痛和几秒钟的晕厥。此后不久,在交感神经反射补偿的帮助下,心输出量可能会恢复到足以维持患者生命的水平,尽管疼痛可能持续存在。
慢性衰竭阶段——液体潴留和代偿性心输出量
在急性心脏病发作的最初几分钟后,一个延长的半慢性状态开始,主要特征是两个事件:(1) 肾脏对液体的潴留;(2) 心脏在数周至数月内的不同程度恢复,如图22-1中的浅绿色曲线所示。这一主题也在第21章中讨论过。
肾脏对液体的潴留和血容量的增加持续数小时至数天
低心输出量对肾功能有深远影响,有时当心输出量下降到正常水平的50%至60%时会导致无尿。一般来说,只要心输出量和动脉压显著低于正常水平,尿量就会保持在正常水平以下;在急性心脏病发作后,尿量通常不会完全恢复到正常水平,直到心输出量和动脉压几乎上升到正常水平。
心力衰竭中适度的液体潴留可能有益
许多心脏病学家认为,液体潴留在心力衰竭中总是有害的。然而,适度的体液和血容量增加是帮助补偿心脏泵血能力下降的重要因素,因为它增加了静脉回流。血容量的增加通过两种方式增加静脉回流。首先,它增加了平均系统充盈压,从而增加了促使血液向心脏流动的压力梯度。其次,它扩张了静脉,降低了静脉阻力,使血液更容易流向心脏。
如果心脏没有受到严重损伤,这种增加的静脉回流几乎可以完全补偿心脏泵血能力的下降——即使心脏的泵血能力降低到正常的40%至50%,只要患者保持安静休息状态,增加的静脉回流通常可以使心输出量接近正常水平。
当心脏的泵血能力进一步下降时,肾脏的血流量最终变得过低,无法排出足够的盐和水以平衡摄入量。因此,液体潴留开始并无限期持续,除非采取重大治疗措施来防止这种情况发生。此外,由于心脏已经在最大容量下泵血,这些多余的液体不再对循环有益。相反,液体潴留增加了已经受损心脏的工作负荷,导致全身严重水肿,这可能非常有害并导致死亡。
严重心力衰竭中过量液体潴留的有害影响
与心力衰竭中适度液体潴留的有益效果相反,在严重心力衰竭中,过量的液体会产生严重的生理后果。这些后果包括:(1) 增加受损心脏的工作负荷;(2) 心脏过度拉伸,进一步削弱心脏功能;(3) 液体渗入肺部,导致肺水肿和血液脱氧;(4) 身体大部分部位出现广泛水肿。这些过量液体的有害影响将在本章后续部分讨论。
心肌梗死后心脏的恢复
当心脏因心肌梗死突然受损后,身体的自然修复过程开始帮助恢复正常的心脏功能。例如,新的侧支血液供应开始渗透到心脏梗死区域的周边部分,通常使边缘区域的部分心肌重新恢复功能。此外,未受损的心肌部分发生肥大,抵消了部分心脏损伤。
恢复的程度取决于心脏损伤的类型和严重程度,从无恢复到几乎完全恢复不等。在急性心肌梗死后,心脏通常在前几天和几周内迅速恢复,并在5到7周内达到大部分最终恢复状态,尽管轻微的额外恢复可能会持续数月。
部分恢复后的心输出量曲线。图22-1显示了急性心肌梗死(acute myocardial infarction)后约一周部分恢复心脏的功能。此时,体内已经保留了相当多的液体,静脉回流(venous return)的倾向也显著增加;因此,右心房压力(right atrial pressure)进一步上升。结果,循环状态从点C变为点D,显示正常的心输出量(cardiac output)为5~L/min,但右心房压力增加到6mmHg。
由于心输出量已恢复正常,肾脏的液体输出也恢复正常,除了已经发生的液体保留继续维持适度的液体过量外,不再发生进一步的液体保留。因此,除了图中点D所代表的高右心房压力外,只要患者保持休息状态,其心血管动力学(cardiovascular dynamics)基本上是正常的。
如果心脏显著恢复,并且保留了足够的液体量,心输出量将趋向正常,交感神经刺激(sympathetic stimulation)也逐渐减弱至正常。随着心脏的恢复,心力衰竭(cardiac failure)急性期由交感神经刺激引起的快速脉搏、皮肤冷感和苍白逐渐消失。
急性心力衰竭后的变化总结——代偿性心力衰竭(compensated heart failure)
总结过去几节中描述的急性中度心脏病发作后循环变化的动力学,我们可以将这些阶段分为以下几部分:(1)心脏损伤的即时效应;(2)交感神经系统(sympathetic nervous system)的代偿,主要发生在最初的30到60秒内;(3)部分心脏恢复和肾脏液体保留引起的慢性代偿。所有这些变化在图22-1中由黑线图形化显示。这条线的进展显示了循环的正常状态(点A)、心脏病发作后几秒但交感反射尚未发生时的状态(点B)、由交感刺激引起的心输出量向正常上升(点C),以及部分心脏恢复和液体保留几天到几周后心输出量几乎恢复正常(点D)。这种最终状态称为代偿性心力衰竭(compensated heart failure)。
图22-2 显著降低的心输出量表明失代偿性心脏病(decompensated heart disease)。渐进性液体保留在几天内提高了右心房压力,心输出量从点A进展到点F,直到死亡发生。
代偿性心力衰竭(compensated heart failure)。特别要注意图22-1中,部分恢复的心脏的最大泵血能力,如浅绿色曲线的平台水平所示,仍然低于正常水平的一半。这表明,尽管心脏持续衰弱,但右心房压力的增加可以维持心输出量(cardiac output)在正常水平。因此,许多人,尤其是老年人,由于不同程度的代偿性心力衰竭,静息时心输出量正常,但右心房压力轻度至中度升高。他们可能不知道自己有心脏损伤,因为损伤通常是一点一点发生的,而代偿与损伤的进展阶段同时发生。
当一个人处于代偿性心力衰竭状态时,任何试图进行剧烈运动的尝试通常都会立即导致急性心力衰竭症状的复发,因为心脏无法将其泵血能力提高到运动所需的水平。因此,可以说在代偿性心力衰竭中,心脏储备(cardiac reserve)减少了。心脏储备的概念将在本章后面讨论。
严重心力衰竭的动态变化——失代偿性心力衰竭(decompensated heart failure)
如果心脏严重受损,无论交感神经反射或液体潴留(fluid retention)如何代偿,都无法使过度衰弱的心脏泵出正常的心输出量。因此,心输出量无法上升到足以使肾脏排泄正常量的液体。因此,液体继续潴留,患者出现越来越多的水肿(edema),这种状态最终会导致死亡。这种情况被称为失代偿性心力衰竭。因此,失代偿性心力衰竭的一个主要原因是心脏无法泵出足够的血液,使肾脏每天排泄必要的液体量。
失代偿性心力衰竭的图解分析。图22-2显示了心脏严重衰弱后不同时间点(A到F点)心输出量的大幅下降。曲线上的A点代表任何代偿发生前的循环状态近似值,B点代表几分钟后的状态,此时交感神经刺激已经尽其所能地进行了代偿,但液体潴留尚未开始。此时,心输出量已上升到4L/min,右心房压力已上升到5mmHg。患者看起来状况相当好,但这种状态不会保持稳定,因为心输出量还没有上升到足以引起肾脏充分排泄液体的水平;因此,液体潴留继续,最终可能导致死亡。这些事件可以定量解释如下。
请注意图22-2中在心脏输出量为5~L/min时的直线。这个水平大约是在普通成年人中使肾脏重新建立正常体液平衡所需的关键心脏输出水平——也就是说,使盐和水的输出量与这些物质的摄入量相等。在心脏输出量低于这个水平时,前面部分讨论的体液保留机制仍然在起作用,体液量逐渐增加。由于体液量的这种逐渐增加,循环的平均系统充盈压继续上升,这迫使越来越多的血液从外周静脉进入右心房,从而增加了右心房压力。大约1天后,循环状态从图22-2中的点B变为点C,右心房压力上升到7mmHg,心脏输出量上升到4.2L/min。再次注意,心脏输出量仍然不足以引起正常的体液肾脏输出;因此,体液继续被保留。大约又过了一天,右心房压力上升到9mmHg,循环状态变为点D所示的状态。然而,心脏输出量仍然不足以建立正常的体液平衡。
在又过了几天的体液保留后,右心房压力进一步上升,但此时心脏功能开始向较低水平下降。这种下降是由心脏的过度拉伸、心肌水肿和其他降低心脏泵血性能的因素引起的。现在很明显,进一步的体液保留对循环的害处大于益处。然而,心脏输出量仍然不足以实现正常的肾功能,因此体液保留不仅继续,而且由于心脏输出量的下降(以及同时发生的动脉压下降)而加速。因此,在几天内,循环状态已经达到曲线上的点F,心脏输出量现在小于2.5~L/min,右心房压力为16mmHg。这种状态已经接近或达到与生命不相容的程度,除非这一系列事件能够逆转,否则患者将会死亡。这种心力衰竭状态,其中衰竭继续恶化,被称为失代偿性心力衰竭(decompensated heart failure)。
因此,从这个分析中可以看出,心脏输出量(和动脉压)未能上升到正常肾功能所需的关键水平会导致以下结果:(1) 逐渐保留越来越多的体液;(2) 平均系统充盈压逐渐升高;(3) 右心房压力逐渐升高,直到最后心脏过度拉伸或水肿,以至于无法泵送中等量的血液,因此完全衰竭。临床上,主要通过进展性水肿,特别是肺水肿,来检测这种严重的失代偿状态,这会导致肺部出现气泡音(一种噼啪声)和呼吸困难(空气饥饿)。在这个阶段缺乏适当的治疗会迅速导致死亡。
失代偿的治疗
失代偿过程通常可以通过以下方法停止:(1) 通过多种方式增强心脏功能,特别是通过使用强心药物(cardiotonic drug),如洋地黄(digitalis),使心脏变得足够强壮,能够泵出足够的血液,使肾脏恢复正常功能;或 (2) 使用利尿药物(diuretic drugs)增加肾脏排泄,同时减少水和盐的摄入,从而在低心输出量的情况下实现液体摄入和输出的平衡。
这两种方法通过重建正常的液体平衡来停止失代偿过程,使得至少与进入体内的液体量相当的液体离开身体。
强心药物的作用机制
强心药物,如洋地黄,在给健康心脏的人使用时,对增加心肌的收缩力几乎没有影响。然而,当给慢性心力衰竭患者使用时,同样的药物有时可以将衰竭心肌的强度提高 50% 到 100%。因此,它们是慢性心力衰竭患者治疗的主要支柱之一。
洋地黄和其他强心苷类药物被认为通过增加肌纤维中的钙离子量来增强心脏收缩。这种效应可能是由于抑制了心肌细胞膜中的钠钾三磷酸腺苷酶(sodium-potassium adenosine triphosphatase)。抑制钠钾泵会增加细胞内钠浓度,并减缓钠钙交换泵(sodium-calcium exchange pump),该泵将钙从细胞中排出以换取钠。由于钠钙交换泵依赖于细胞膜上的高钠梯度,细胞内钠的积累会降低其活性。
在衰竭的心肌中,肌浆网(sarcoplasmic reticulum)无法积累正常量的钙,因此无法释放足够的钙离子到肌纤维的自由液体区室中,从而导致肌肉完全收缩。洋地黄抑制钠钙交换泵并提高心肌中钙离子浓度的效应,提供了增加肌肉收缩力所需的额外钙。因此,通常通过适量使用洋地黄来适度抑制钙泵机制是有益的,从而使肌纤维内的钙水平略微升高。
单侧左心衰竭
到目前为止,我们考虑的是整个心脏的衰竭。然而,在许多患者中,特别是那些早期急性心力衰竭患者,左心衰竭比右心衰竭更为突出,在极少数情况下,右心衰竭而没有明显的左心衰竭。
当左心衰竭而右心没有同时衰竭时,血液继续以通常的右心力量泵入肺部,而左心无法将血液充分泵出肺部进入体循环。结果,由于大量血液从体循环转移到肺循环,平均肺充盈压上升。
随着肺部血量的增加,肺毛细血管压力也随之增加。如果这种压力上升到大约等于血浆胶体渗透压(colloid osmotic pressure)的值——约28毫米汞柱——液体就会开始从毛细血管滤出,进入肺间质间隙和肺泡,导致肺水肿(pulmonary edema)。
因此,左心衰竭(left heart failure)最重要的问题包括肺血管充血(pulmonary vascular congestion)和肺水肿。在严重、急性的左心衰竭中,肺水肿有时会迅速发生,以至于在20到30分钟内可能导致窒息死亡,本章稍后将讨论这一点。
低输出性心力衰竭(LOW-OUTPUT CARDIAC FAILURE)与心源性休克(CARDIOGENIC SHOCK)
在许多急性心脏病发作后,以及通常在长期缓慢进展的心脏功能恶化后,心脏变得无法泵出维持生命所需的最小血量。因此,身体组织开始受损甚至恶化,通常在几小时到几天内导致死亡。这种情况表现为循环休克(circulatory shock),如第24章所述。即使是心血管系统也会因缺乏营养而受损,并与身体其他部分一起恶化,从而加速死亡。这种由于心脏泵血不足引起的循环休克综合征被称为心源性休克(cardiogenic shock)或简称心脏休克(cardiac shock)。一旦心源性休克发生,即使有适当的医疗护理,存活率通常也低于30%。
心源性休克中的心脏恶化恶性循环。第24章关于循环休克的讨论强调了在休克过程中,当心脏的冠状动脉供血减少时,心脏会逐渐受损的趋势。也就是说,休克期间的低动脉压进一步减少了冠状动脉的供血。这种减少进一步削弱了心脏,导致动脉压进一步下降,使休克逐渐恶化;这个过程最终成为心脏恶化的恶性循环。在由心肌梗死(myocardial infarction)引起的心源性休克中,这个问题由于已经存在的冠状动脉阻塞而大大加剧。例如,在健康的心脏中,动脉压通常必须降低到约45毫米汞柱以下才会导致心脏恶化。然而,在已经存在主要冠状动脉阻塞的心脏中,当冠状动脉压降至80到90毫米汞柱以下时,恶化就会开始。换句话说,即使是动脉压的轻微下降也可能引发心脏恶化的恶性循环。因此,在治疗心肌梗死时,防止即使是短期的低血压(hypotension)也极为重要。
心源性休克治疗的生理学。通常,患者在心源性休克中死亡,因为各种代偿机制无法将心输出量(cardiac output)(和动脉压)恢复到维持生命的水平。因此,治疗这种情况是急性心脏病发作管理中最重要的挑战之一。
如果心室肌出现恶化迹象,通常会立即给予洋地黄(Digitalis)以增强心脏功能。此外,还会使用全血、血浆或升压药物的输注来维持动脉血压。如果动脉血压能够提高到足够高的水平,冠状动脉血流量通常会增加到足以防止恶化的恶性循环。这一过程为循环系统中适当的代偿机制提供了足够的时间来纠正休克。
通过以下方法之一,在抢救心源性休克患者的生命方面也取得了一些成功:(1) 手术清除冠状动脉中的血栓,通常结合冠状动脉搭桥术;或 (2) 对阻塞的冠状动脉进行导管插入术,并输注链激酶(streptokinase)或组织型纤溶酶原激活剂(tissue-type plasminogen activator)酶,以溶解血栓。如果在心源性休克的第一小时内实施这些手术,结果有时会令人惊讶,但在3小时后几乎没有任何益处。
心脏衰竭患者的水肿
急性心脏衰竭不会立即引起外周水肿。急性左心衰竭可导致肺部迅速充血,发展为肺水肿,甚至在几分钟到几小时内死亡。然而,左心或右心衰竭引起外周水肿的速度较慢。这种情况可以通过参考图22-3得到最好的解释。当一个先前健康的心脏突然泵功能衰竭时,主动脉压力下降,右心房压力上升。随着心输出量接近零,这两个压力在约13mmHg的平衡值附近接近。毛细血管压力也从其正常值17mmHg下降到新的平衡压力13mmHg。因此,严重的急性心脏衰竭通常会导致外周毛细血管压力下降而不是上升。因此,动物实验以及人类的经验表明,急性心脏衰竭几乎不会立即引起外周水肿。
图22-3 随着心输出量从正常降至零,平均主动脉压力、外周组织毛细血管压力和右心房压力的逐步变化。
长期肾脏液体潴留导致持续心脏衰竭中的外周水肿
在整体心脏衰竭或右心室心脏衰竭的第一天左右,外周水肿开始出现,主要是由于肾脏的液体潴留。液体潴留增加了平均系统充盈压力,导致血液返回心脏的趋势增加。这进一步提高了右心房压力,并使动脉压力恢复到正常水平。因此,毛细血管压力现在也显著上升,从而导致液体流失到组织中并发展为严重的水肿。
心脏衰竭期间尿液输出减少有几个已知的原因。
- 肾小球滤过率(glomerular filtration rate)降低。心输出量(cardiac output)的减少倾向于降低肾脏的肾小球压力,原因如下:(a) 动脉压(arterial pressure)降低;(b) 肾脏入球小动脉(afferent arterioles)的强烈交感神经收缩(sympathetic constriction)。因此,除了最轻微的心力衰竭(heart failure)外,肾小球滤过率都会降低。从第27章到第30章关于肾脏功能的讨论中可以清楚地看出,肾小球滤过率的降低通常会显著减少尿量(urine output)。心输出量降至正常水平的一半左右时,几乎可能导致完全无尿(anuria)。
- 肾素-血管紧张素系统(renin-angiotensin system)的激活和肾小管(renal tubules)对水和盐的重吸收增加。肾脏血流量的减少会导致肾脏分泌肾素(renin)显著增加,进而增加血管紧张素II(angiotensin II)的形成,如第19章所述。血管紧张素II反过来对肾脏的小动脉产生直接影响,进一步减少肾脏的血流量,从而降低肾小管周围毛细血管(peritubular capillaries)的压力,促进肾小管对水和盐的重吸收(reabsorption)显著增加。血管紧张素II还直接作用于肾小管上皮细胞(renal tubular epithelial cells),刺激盐和水的重吸收。因此,尿液中水和盐的流失大大减少,大量盐和水在全身的血液和组织液(interstitial fluids)中积聚。
- 醛固酮(aldosterone)分泌增加。在心力衰竭的慢性阶段,肾上腺皮质(adrenal cortex)会分泌大量醛固酮。这种分泌主要是由于血管紧张素II刺激肾上腺皮质分泌醛固酮的作用。然而,醛固酮分泌的增加有时也部分是由于血浆钾浓度(plasma potassium concentration)的升高。过量的钾是已知最强烈的醛固酮分泌刺激因素之一,而在心力衰竭患者中,钾浓度的升高是对肾功能降低的反应。如第28章所讨论的,升高的醛固酮水平进一步增加了肾小管对钠的重吸收,进而导致水的重吸收次生性增加。
- 抗利尿激素(antidiuretic hormone, ADH)分泌增加。在晚期心力衰竭中,抗利尿激素分泌的增加可能促进肾小管对水的过度重吸收。如第28章和第29章所讨论的,ADH由下丘脑-垂体后叶系统(hypothalamic–posterior pituitary gland system)分泌,以应对细胞外液渗透压(extracellular fluid osmolarity)的升高,以及来自低压(如左心房)和高压(如颈动脉窦)压力感受器(baroreceptors)的非渗透性刺激(nonosmotic stimuli)。在严重心力衰竭中,心输出量和动脉压降低的非渗透性效应可能占主导地位,刺激ADH的分泌,进而导致水分过度滞留和低钠血症(hyponatremia)(血浆钠浓度降低)。不适当的高水平ADH和低钠血症是心力衰竭患者预后恶化的预测因素。
- 交感神经系统(sympathetic nervous system)的激活。如前所述,心力衰竭会导致交感神经系统显著激活,进而产生多种效应,导致肾脏对盐和水的潴留:(a) 肾入球小动脉(renal afferent arterioles)收缩,降低肾小球滤过率(glomerular filtration rate);(b) 通过激活肾小管上皮细胞上的α-肾上腺素能受体(alpha-adrenergic receptors),刺激肾小管对盐和水的重吸收;(c) 刺激肾素(renin)释放和血管紧张素II(angiotensin II)形成,从而增加肾小管重吸收;(d) 刺激垂体后叶(posterior pituitary)释放抗利尿激素(ADH),进而增加肾小管对水的重吸收。这些交感神经刺激的效应将在第27章和第28章中讨论。
利钠肽(Natriuretic Peptides)在延缓心脏失代偿发生中的作用。利钠肽是心脏在受到牵张时释放的激素。心房利钠肽(Atrial natriuretic peptide, ANP)由心房壁释放,脑利钠肽(Brain natriuretic peptide, BNP)由心室壁释放。由于心力衰竭几乎总是会增加心房和心室压力,从而牵张这些心腔的壁,因此在严重心力衰竭时,血液中ANP和BNP的循环水平可能会增加数倍。这些利钠肽反过来对肾脏有直接作用,可显著增加其对盐和水的排泄。因此,利钠肽在心力衰竭期间发挥天然作用,有助于预防极端充血症状。由于BNP的半衰期显著长于ANP,并且可以在血液中轻松测量,因此常被用于诊断心力衰竭或监测已确诊心力衰竭患者的容量状态。ANP的肾脏效应将在第28章和第30章中讨论。
晚期心力衰竭中的急性肺水肿——另一个致命的恶性循环
急性肺水肿是长期心力衰竭患者常见的死亡原因。当急性肺水肿发生在没有新心脏损伤的人身上时,通常是由心脏的暂时性超负荷引发的,例如剧烈运动、情绪激动或甚至严重感冒。急性肺水肿被认为是由以下恶性循环引起的:
- 已经衰弱左心室的暂时性负荷增加启动了恶性循环。由于左心泵血能力有限,血液开始在肺部淤积。
- 肺部血液增加会提高肺毛细血管压力,少量液体开始渗出到肺组织和肺泡中。
- 肺部液体的增加会降低血液的氧合程度。
- 血液中氧气的减少进一步削弱心脏,并导致外周血管扩张。
- 外周血管扩张进一步增加了外周循环的静脉回流。
- 静脉回流的增加进一步加剧了肺部血液的淤积,导致更多的液体渗出、动脉氧饱和度进一步下降以及更多的静脉回流。因此,恶性循环已经形成。
一旦这个恶性循环( vicious cycle )超过某个临界点,除非在几分钟内采取成功的治疗措施,否则它将持续下去,直到患者死亡。能够逆转这一过程并挽救患者生命的措施包括以下内容:
- 在四肢上使用止血带( tourniquets ),以隔离静脉中的大量血液,从而减少左心的工作负荷
- 使用速效利尿剂( rapidly acting diuretic ),如furosemide,以快速排出体内液体
- 让患者吸入纯氧,以逆转血氧饱和度下降( blood oxygen desaturation )、心脏功能恶化以及外周血管扩张( peripheral vasodilation )
- 使用速效强心药( rapidly acting cardiotonic drug ),如digitalis,以增强心脏功能
急性肺水肿( acute pulmonary edema )的恶性循环可能进展得非常迅速,以至于在20到60分钟内可能导致死亡。因此,任何成功的治疗措施都必须立即实施。
心脏储备( CARDIAC RESERVE )
心输出量( cardiac output )能够增加的最大百分比称为心脏储备( cardiac reserve )。因此,在健康的年轻成年人中,心脏储备为300%到400%。在受过体育训练的人中,心脏储备为500%到600%或更高。然而,在严重心力衰竭的患者中,心脏储备为零。以正常储备为例,健康年轻成年人在剧烈运动时的心输出量可以增加到正常水平的五倍,即比正常水平增加400%——也就是说,心脏储备为400%。
任何妨碍心脏正常泵血的因素都会降低心脏储备。心脏储备的降低可能由以下疾病引起:缺血性心脏病( ischemic heart disease )、原发性心肌病( primary myocardial disease )、影响心肌的维生素缺乏、心肌的物理损伤、瓣膜性心脏病( valvular heart disease )以及其他因素,其中一些因素如图22-4所示。
低心脏储备的诊断——运动试验( Exercise Test )。只要低心脏储备的患者保持静息状态,他们通常不会出现心脏病的主要症状。然而,通常可以通过要求患者在跑步机上运动或上下楼梯来诊断低心脏储备,这两种活动都需要显著增加心输出量。心脏负荷的增加会迅速耗尽可用的小量储备,心输出量很快无法提高到足以维持身体新活动水平的程度。急性效应如下:
图22-4 不同情况下的心脏储备,其中两种情况的储备低于零。
- 立即且有时极度的呼吸急促( dyspnea ),这是由于心脏无法向组织泵送足够的血液,导致组织缺血( tissue ischemia )并产生空气饥饿感
- 由于肌肉缺血( muscle ischemia )导致的极度肌肉疲劳,从而限制了患者继续运动的能力
- 心率过度增加,因为心脏的神经反射过度反应,试图克服心输出量的不足
运动试验是心脏病学家的诊断工具之一。这些试验取代了在大多数临床环境中难以进行的心输出量测量。
心力衰竭的定量图形分析
尽管通过主要使用定性逻辑可以理解心力衰竭的大多数一般原理,正如我们在本章中迄今为止所做的那样,但通过使用更定量的方法,可以更深入地掌握心力衰竭中不同因素的重要性。其中一种方法是第20章介绍的心输出量调节分析的图形方法。在本章的其余部分,我们将使用这种图形技术来分析心力衰竭的几个方面。
急性心力衰竭和慢性代偿的图形分析
图22-5显示了心脏和外周循环不同状态下的心输出量和静脉回流曲线。通过点A的两条曲线是(1)正常心输出量曲线和(2)正常静脉回流曲线。如第20章所述,这两条曲线上只有一个点可以使循环系统运行——即两条曲线相交的点A。因此,循环的正常状态是心输出量和静脉回流为5L/min,右心房压力为0mmHg。
图22-5 心力衰竭不同阶段中心输出量、静脉回流和右心房压力的渐进变化。
急性心脏病发作降低心输出量曲线。在中等严重的心脏病发作后的最初几秒钟内,心输出量曲线下降到最下方的蓝色曲线。在这几秒钟内,静脉回流曲线尚未改变,因为外周循环系统仍在正常运作。因此,循环的新状态由点B表示,即新的心输出量曲线与正常静脉回流曲线的交点。因此,右心房压力立即上升到4mmHg,而心输出量下降到2L/min。
交感神经反射提高心输出量和静脉回流曲线。在接下来的30秒内,交感神经反射被激活。它们提高了心输出量和静脉回流曲线(棕色虚线曲线)。交感神经刺激可以使心输出量曲线的平台水平提高多达30%至100%。它还可以增加平均系统充盈压(由静脉回流曲线与零静脉回流轴的交点表示)几个毫米汞柱——在本图中,从正常值7mmHg增加到10mmHg。这种平均系统充盈压的增加使整个静脉回流曲线向右上方移动。新的心输出量和静脉回流曲线现在在点C处达到平衡——即右心房压力为+5mmHg,心输出量为4L/min。
接下来几天的代偿进一步增加心输出量和静脉回流曲线。
在接下来的几周内,心输出量(cardiac output)和静脉回流曲线(venous return curves)进一步上升(绿色虚线),原因如下:(1) 心脏部分恢复;(2) 肾脏对盐和水的保留,这进一步提高了平均系统充盈压(mean systemic filling pressure)——这次达到了+12mmHg。两条新曲线现在在点D处达到平衡。因此,心输出量现在已经恢复到正常水平。然而,右心房压力(right atrial pressure)进一步上升至+6mmHg。由于心输出量现在正常,肾脏输出也正常,因此达到了新的液体平衡状态。循环系统将继续在点D处运行并保持稳定,心输出量正常,右心房压力升高,直到某些额外的外在因素改变心输出量曲线或静脉回流曲线。
图22-6 失代偿性心脏病(decompensated heart disease)的图形分析,显示由于持续的液体保留,静脉回流曲线逐渐向右移动,右心房压力增加。
使用这种分析技术,可以特别看到适度液体保留的重要性,以及它最终如何导致轻度至中度心力衰竭(heart failure)中循环的新稳定状态。还可以看到平均系统充盈压与不同程度心力衰竭中心脏泵血之间的相互关系。
请注意,图22-5中描述的事件与图22-1中呈现的事件相同,尽管是以更定量的方式呈现的。
失代偿性心力衰竭的图形分析
图22-6中的黑色心输出量曲线与图22-2中显示的曲线相同——一条严重抑制的曲线,已经达到了心脏所能达到的最大恢复程度。在本图中,我们添加了在心输出量曲线急剧下降至这一低水平后连续几天内发生的静脉回流曲线。在点A处,时间零点的曲线与正常静脉回流曲线相等,心输出量约为3~L/min。然而,由于这种低心输出量引起的交感神经系统(sympathetic nervous system)刺激,平均系统充盈压在30秒内从7增加到10.5~mmHg。这种效应使静脉回流曲线向上和向右移动,产生了标记为“自主补偿”的曲线。因此,新的静脉回流曲线与心输出量曲线在点B处相等。心输出量已经提高到4L/min的水平,但代价是右心房压力进一步上升至5mmHg。
4L/min的心输出量仍然太低,肾脏无法正常运作。因此,液体继续保留,平均系统充盈压从10.5上升到接近13mmHg。现在,静脉回流曲线标记为“第2天”,并与心输出量曲线在点C处达到平衡。心输出量上升到4.2L/min,右心房压力上升到7mmHg。
图22-7 失代偿性心脏病(decompensated heart disease)的治疗,显示了洋地黄(digitalis)在提高心输出量曲线(cardiac output curve)方面的作用,这反过来又导致尿量增加、静脉回流曲线(venous return curve)逐渐向左移动以及右心房压力(right atrial pressure)降低。
在接下来的几天里,心输出量从未上升到足以重新建立正常肾功能(renal function)的水平。液体继续滞留,平均系统充盈压(mean systemic filling pressure)继续上升,静脉回流曲线继续向右移动,静脉回流曲线和心输出量曲线之间的平衡点也逐渐移动到D点、E点,最后到F点。平衡过程现在处于心输出量曲线的下降阶段,因此进一步的液体滞留会导致更严重的心脏水肿(cardiac edema)并对心输出量产生不利影响。这种情况会加速恶化,直到死亡发生。
因此,失代偿是由于心输出量曲线从未上升到重新建立正常液体排泄所需的5 L/min的临界水平,从而导致液体输入和输出之间的平衡。
使用洋地黄治疗失代偿性心脏病。假设失代偿阶段已经达到图22-6中的E点,然后继续到图22-7中的相同点E。此时,给予洋地黄以增强心脏功能。这种干预将心输出量曲线提高到图22-7所示的水平,但静脉回流曲线没有立即变化。因此,新的心输出量曲线在G点与静脉回流曲线相等。心输出量现在是5.7L/min,高于使肾脏排泄正常尿量所需的5升临界水平。增加的心输出量以及洋地黄众所周知的利尿作用(diuretic effect),使肾脏能够消除一些多余的液体。
在几天的时间里,液体的逐渐流失将平均系统充盈压降低到11.5mmHg,新的静脉回流曲线变为标有“几天后”的曲线。该曲线在H点与洋地黄化心脏的心输出量曲线相等,输出量为5~L/min,右心房压力为4.6mmHg。这种心输出量正是正常液体平衡所需的。因此,不会有额外的液体流失,也不会有液体增加。
因此,循环系统现在已经稳定,或者换句话说,心力衰竭的失代偿已经得到补偿。换句话说,循环的最终稳态条件由三条曲线的交叉点定义——心输出量曲线、静脉回流曲线和正常液体平衡的临界水平。当所有三条曲线在同一点交叉时,补偿机制会自动稳定循环。
舒张功能障碍(diastolic dysfunction)和正常射血分数(normal ejection fraction)的心力衰竭
我们目前的讨论主要集中在由于心肌梗死或冠状动脉血流受损导致的心肌收缩力下降所引起的心力衰竭。然而,正如本章前面所讨论的,任何降低心脏泵血能力以满足身体需求的情况都可能导致心力衰竭。与心脏收缩功能受损相关的心力衰竭通常被称为收缩性心力衰竭或射血分数降低的心力衰竭(HFrEF)。正如第9章所讨论的,射血分数(EF)通常通过超声心动图评估,是左心室舒张末期容积中每次收缩时被泵出的部分。EF为0.6意味着每次心跳泵出60%的舒张末期容积。EF的正常值被认为是50%到70%。当心肌因心肌梗死或冠状动脉血流受损而减弱时,EF通常会降低,低于40%的值被认为是HFrEF的指标。
如果心肌变厚和僵硬(向心性肥大),导致心室充盈受损,心室容纳的血液量少于正常情况,心力衰竭也可能与正常EF相关。在这种情况下,尽管心脏以正常甚至增加的EF泵血,但心脏泵出的总血量可能不足以满足身体的需求。这种情况通常被称为射血分数保留的心力衰竭(HFpEF)。
在过去的30到40年中,越来越多的心力衰竭患者表现为HFpEF。目前,超过50%的心力衰竭患者具有正常的EF。HFpEF更常见于女性和老年人,尤其是那些患有肥胖、糖尿病和高血压的人群,这些疾病通常被称为心脏代谢综合征。在这些个体中,舒张功能障碍的特征是心室充盈速率受损、心肌细胞松弛减慢、心室壁增厚、细胞外基质增殖和纤维化,这些因素导致左心室更加僵硬。
尽管临床医生通常使用50%的EF阈值将患者分类为HFpEF或HFrEF,但大多数晚期心力衰竭患者表现出心室充盈异常以及收缩功能和收缩功能受损。大多数心力衰竭中的神经体液变化,包括交感神经系统和肾素-血管紧张素系统的激活,以及肾脏过度液体潴留,无论EF是正常还是降低,都会发生。心力衰竭是一种异质性综合征,而不是一种特定疾病,只要心脏无法泵出足够的血液以满足身体需求,就会发生。
图22-8 两种可能导致高输出性心力衰竭的条件的图形分析——动静脉(AV)瘘和脚气病心脏病。
因此,尽管射血分数(EF, ejection fraction)的测量是有用的,但它并不总能提供对心脏功能的准确评估。一个舒张期充盈受损的小而厚的心脏可能无法泵出适当的心搏量(stroke volume)和心输出量(cardiac output)以满足身体的需求,但其EF可能正常或升高。这个例子说明了左心室EF作为左心室功能标志物和作为对不同原因心力衰竭患者进行分类的手段的局限性。
高输出性心力衰竭(high-output cardiac failure)
图22-8提供了对两种类型的高输出性心力衰竭的分析。一种是由动静脉瘘(arteriovenous fistula)引起的,由于静脉回流(venous return)过多而使心脏超负荷,尽管心脏的泵血能力并未下降。另一种类型是由脚气病(beriberi)引起的,其中由于全身血管阻力(systemic vascular resistance)降低,静脉回流大大增加,但与此同时,心脏的泵血能力下降。
动静脉瘘增加静脉回流。图22-8中的正常黑色曲线描绘了正常的心输出量和正常的静脉回流曲线。这些曲线在点A处相等,点A描绘了正常的心输出量为5L/min和正常的右心房压力(right atrial pressure)为0mmHg。
现在让我们假设由于大动静脉瘘的开放(大动脉和大静脉之间的直接开口),全身血管阻力(总外周血管阻力(total peripheral vascular resistance))大大降低。静脉回流曲线向上旋转,产生标记为“AV瘘管”的曲线。该静脉回流曲线与正常心输出量曲线在点B处相等,心输出量为12.5L/min,右心房压力为3mmHg。因此,心输出量大大增加,右心房压力略有升高,并且有轻微的外周充血(peripheral congestion)迹象。如果此人尝试运动,他或她的心脏储备(cardiac reserve)将很少,因为心脏已经接近最大容量以通过动静脉瘘泵送额外的血液。这种情况类似于心力衰竭状况,称为高输出性心力衰竭(high-output failure),但实际上心脏是由于静脉回流过多而超负荷。
脚气病削弱心脏,导致肾脏液体潴留(fluid retention),并增加静脉回流。图22-8显示了由脚气病引起的心输出量和静脉回流曲线的近似变化。心输出量曲线的下降水平是由于心脏的削弱,这是由于导致脚气病综合征的维生素缺乏症(avitaminosis)(主要是缺乏硫胺素(thiamine))引起的。心脏的削弱减少了肾脏的血流量。因此,肾脏保留了大量的液体,这反过来又增加了平均系统充盈压(mean systemic filling pressure)(由静脉回流曲线现在与零心输出量水平相交的点表示),从正常值7 mmHg上升到11mm Hg。这使静脉回流曲线向右移动。最后,静脉回流曲线从正常曲线向上旋转,因为维生素缺乏症扩张了外周血管,如第17章所述。
两条蓝色曲线(心输出量曲线和静脉回流曲线)在点C处相交,描述了脚气病(beriberi)的循环状况,此时右心房压力为9mmHg,心输出量比正常值高出约65%。尽管心脏功能较弱,心输出量仍然很高,这可以从心输出量曲线的低平台水平看出。
心脏瓣膜与心音;瓣膜性与先天性心脏缺陷
心脏瓣膜的功能在第9章中已经讨论过,我们指出瓣膜关闭时会产生可听的声音。通常情况下,瓣膜打开时不会产生可听的声音。在本章中,我们首先讨论在正常和异常情况下导致心脏声音的因素。然后,我们将讨论当存在瓣膜性或先天性心脏缺陷时发生的整体循环变化。
心音
正常心音
当用听诊器听正常心脏时,通常会听到“lub, dub, lub, dub”的声音:“lub”与心室收缩开始时房室瓣(A-V瓣)的关闭有关,而“dub”与心室收缩结束时半月瓣(主动脉瓣和肺动脉瓣)的关闭有关。“lub”声被称为第一心音,“dub”声被称为第二心音,因为心脏的正常泵血周期被认为是从心室收缩开始时A-V瓣关闭开始的(音频23-1)。
第一心音与A-V瓣关闭有关。第一心音的主要原因是瓣膜关闭后紧绷的瓣膜振动,以及心脏周围的心壁和大血管的振动。也就是说,在产生第一心音时,心室的收缩首先导致血液突然反流冲击A-V瓣(三尖瓣和二尖瓣),使它们关闭并向心房凸出,直到腱索突然阻止了这种反流凸出。腱索和瓣膜的弹性紧绷使反流的血液再次反弹回各自的心室。这种机制导致血液、心室壁以及紧绷的瓣膜振动,并在血液中产生振动的湍流。这些振动通过邻近组织传递到胸壁,通过听诊器可以听到这些声音。
第二心音与主动脉瓣和肺动脉瓣关闭有关。第二心音是由于心室收缩结束时半月瓣(主动脉瓣和肺动脉瓣)突然关闭引起的。当半月瓣关闭时,它们向后凸向心室,其弹性拉伸使血液反弹回动脉,导致血液在动脉壁和半月瓣之间以及这些瓣膜与心室壁之间来回振动。动脉壁中发生的振动主要沿动脉传播。当血管或心室的振动接触到胸壁等共鸣板时,会产生可以通过听诊器听到的声音。
第一心音和第二心音的持续时间和音高
每个心音的持续时间略超过0.10秒,其中第一心音约为0.14秒,第二心音约为0.11秒。第二心音较短的原因是半月瓣比房室瓣(A-V valves)更紧绷,因此它们的振动时间比房室瓣更短。
第一心音和第二心音的可听频率范围(音高),如图23-1所示,从耳朵能检测到的最低频率(约40次/秒)开始,一直上升到500次/秒以上。当使用特殊的电子设备记录这些声音时,记录到的声音中有很大一部分的频率和声级低于可听范围,低至3到4次/秒,峰值约为20次/秒,如图23-1中下方的阴影区域所示。因此,尽管无法通过听诊器听到,心音的主要部分可以通过心音图(phonocardiography)进行电子记录。
第二心音通常比第一心音具有更高的频率,原因有两个:(1) 半月瓣的紧绷程度远高于房室瓣;(2) 紧绷的动脉壁具有更大的弹性系数,这些动脉壁是第二心音的主要振动腔室,而心室腔室则较为松弛,弹性较低,是第一心音的振动系统。临床医生利用这些差异来区分两种心音的特殊特征。
图23-1 心音和心脏杂音中不同频率振动的幅度与可听阈值的关系,显示可听声音的范围在40到520次/秒之间。(改编自Butterworth JS, Chassin JL, McGrath JJ: Cardiac Auscultation, 2nd ed. New York: Grune & Stratton, 1960.)
第三心音发生在舒张期中间三分之一开始时。偶尔,在舒张期中间三分之一开始时可以听到一个微弱的、隆隆的第三心音。对这一声音的一个合乎逻辑但未经证实的解释是,来自心房的血流涌入心室,导致血液在心室壁之间来回振荡。这类似于从水龙头流出的水进入纸袋,涌入的水在袋壁之间来回反射,导致袋壁振动。第三心音直到舒张期中间三分之一才出现的原因被认为是,在舒张期早期,心室尚未充分充盈,无法产生足够的弹性张力以引起反射。这种声音的频率通常很低,以至于耳朵无法听到,但它通常可以在心音图中记录下来。第三心音在儿童、青少年和年轻成年人中可能是正常存在的,但在老年人中通常提示收缩性心力衰竭(systolic heart failure)。
心房收缩——第四心音。心房心音有时可以在心音图中记录到,但由于其微弱和极低的频率——通常为20次/秒或更低,几乎无法用听诊器听到。这种声音发生在心房收缩时,推测是由血液涌入心室引起的,这引发了类似于第三心音的振动。第四心音常见于那些因心室壁顺应性降低和心室充盈阻力增加而从心房收缩中获益以进行心室充盈的人。例如,第四心音经常在左心室肥厚的老年患者中听到。
图23-2 胸部区域,从中可以最好地听到每个瓣膜的声音。
正常心音的听诊胸部区域。用听诊器听身体的声音称为听诊(auscultation)。图23-2显示了胸壁区域,从中可以最好地区分不同的心脏瓣膜声音。尽管所有瓣膜的声音都可以从这些区域听到,但心脏病专家通过排除法来区分不同瓣膜的声音。也就是说,他或她将听诊器从一个区域移动到另一个区域,注意不同区域声音的响度,并逐渐挑选出每个瓣膜的声音成分。
听诊不同心音的区域并不直接位于瓣膜本身上方。主动脉区域沿着主动脉向上,因为声音沿着主动脉传播,而肺动脉区域沿着肺动脉向上。三尖瓣区域位于右心室上方,二尖瓣区域位于左心室心尖上方,这是心脏最靠近胸壁表面的部分;心脏旋转使得左心室的其余部分更靠后。
心音图(Phonocardiogram)。如果将专门设计用于检测低频声音的麦克风放在胸部,心音可以被放大并由高速记录设备记录下来。记录称为心音图,心音以波的形式出现,如图23-3所示。记录A是正常心音的例子,显示了第一、第二和第三心音的振动,甚至是非常微弱的心房音。特别注意,第三心音和心房心音都是非常低沉的隆隆声。第三心音只能在三分之一到一半的人中记录到,而心房心音可能只能在四分之一的人中记录到。
图23-3 A—F,正常和异常心脏的心音图。
瓣膜病变
风湿性瓣膜病变
风湿热(rheumatic fever)是一种自身免疫性疾病,心脏瓣膜可能会受损或破坏。该疾病通常由链球菌毒素引发。
事件的发生顺序几乎总是始于由A组溶血性链球菌(Group A hemolytic streptococci)引起的初步链球菌感染。这些细菌最初会引起咽喉痛、猩红热或中耳感染。然而,链球菌还会释放几种不同的蛋白质,人体的网状内皮系统(reticuloendothelial system)会针对这些蛋白质产生抗体。这些抗体不仅与链球菌蛋白质反应,还会与身体的其他蛋白质组织反应,常常造成严重的免疫损伤。只要抗体在血液中持续存在——1年或更长时间,这些反应就会继续发生。
风湿热(rheumatic fever)特别容易对某些易感区域造成损害,例如心脏瓣膜。心脏瓣膜损伤的程度与抗体的浓度和持久性直接相关。与这种反应相关的免疫原理在第35章讨论,第32章指出肾脏的急性肾小球肾炎(acute glomerular nephritis)具有类似的免疫学基础。
在风湿热患者中,大的出血性、纤维蛋白性、球状病变沿着发炎的心脏瓣膜边缘生长。由于二尖瓣(mitral valve)在瓣膜活动期间比其他任何瓣膜承受更多的创伤,因此它是最常受到严重损害的瓣膜,而主动脉瓣(aortic valve)是第二常受损的瓣膜。右心瓣膜——即三尖瓣(tricuspid valve)和肺动脉瓣(pulmonary valve)——通常受到的影响要轻得多,可能是因为作用于这些瓣膜的低压应力与作用于左心瓣膜的高压应力相比要轻微得多。
急性风湿热的病变经常同时发生在相邻的瓣膜小叶上,因此小叶的边缘会粘在一起。然后,数周、数月或数年后,病变会变成瘢痕组织,永久性地融合相邻瓣膜小叶的部分。此外,通常呈薄膜状且自由摆动的小叶自由边缘,往往会变成坚实的瘢痕组织。
当瓣膜小叶彼此广泛粘连以至于血液无法正常通过时,称为狭窄(stenosed)。相反,当瓣膜边缘被瘢痕组织破坏以至于在心室收缩时无法闭合时,就会发生血液反流(regurgitation)。狭窄通常不会在没有至少一定程度反流的情况下发生,反之亦然。
衰老与主动脉瓣狭窄
随着年龄的增长,主动脉瓣通常会增厚、钙化并变硬,可能会部分阻碍左心室的血液流出。随着预期寿命的增加和人口老龄化,主动脉瓣狭窄已成为最常见的心脏瓣膜疾病。
先前正常的主动脉瓣狭窄,通常称为老年钙化性主动脉瓣狭窄(senile calcific aortic valve stenosis),其特征是瓣膜钙沉积和骨化,导致主动脉瓣口变窄。作为对狭窄主动脉瓣施加在心脏上的增加工作负荷的补偿反应,左心室会发生向心性肥大(concentric hypertrophy)。这种类型的肥大与左心室壁厚度增加有关,这使得心脏能够更有力地泵血以对抗部分阻塞的流出。然后,在钙化瓣膜上形成逐渐增加的压力梯度,在严重的主动脉瓣狭窄病例中达到75至100mmHg。
肥厚的左心室也会变得更加纤维化(fibrotic),并且由于微循环灌注(microcirculatory perfusion)受损,往往会出现缺血(ischemic)现象,尽管一些患者可能还伴有冠状动脉粥样硬化(atherosclerosis)。射血分数(ejection fraction)可能正常,患者在静息状态下可能能够维持足够的心输出量(cardiac output),但即使是中等强度的运动,也可能出现心力衰竭(heart failure)的症状。随着狭窄(stenosis)逐渐加重,收缩期心脏功能下降,左心室无法产生足够的压力来有效泵血以对抗部分阻塞的主动脉瓣(aortic valve)所施加的负荷。因此,会出现充血性心力衰竭(congestive heart failure)的症状,伴随每搏输出量(stroke volume)和心输出量的减少。
钙化性主动脉瓣狭窄(calcific aortic valve stenosis)通常在70岁以后才会变得严重到引起临床关注。主动脉瓣狭窄的重要症状包括与运动相关的心绞痛(angina)、运动耐量(exercise tolerance)下降以及充血性心力衰竭。呼吸急促(dyspnea)是由于左心室充盈压(left ventricular filling pressure)升高或运动时无法充分增加心输出量所致。早期识别和管理主动脉瓣狭窄非常重要,因为未经治疗的有症状的主动脉瓣狭窄是进行性的,最终会致命。
经导管主动脉瓣置换术(transcatheter aortic valve replacement)技术的发展为患者提供了新的治疗机会,尤其是对于无法进行传统手术或手术风险较高的老年患者。
由瓣膜病变引起的心脏杂音
如图23-3所示的心音图(phonocardiogram),当存在瓣膜异常时,会出现许多异常心音,称为心脏杂音(heart murmurs),如下所述。
主动脉狭窄的收缩期杂音(Systolic Murmur of Aortic Stenosis)。在主动脉狭窄患者中,血液从左心室通过主动脉瓣的一个小纤维开口射出。由于射血阻力,左心室内的血压有时会升高至300mmHg;而主动脉内的压力仍然正常。因此,在收缩期(systole)会产生一种喷嘴效应,血液以极高的速度通过瓣膜的小开口喷射。这种现象导致主动脉根部的血液产生严重湍流(turbulence)。湍流血液撞击主动脉壁引起强烈振动,从而在收缩期产生响亮的杂音(见图23-3的B记录;音频23-2),并传递到整个上胸主动脉,甚至进入颈部的大动脉。这种声音刺耳,在严重狭窄的患者中,声音可能大到可以在距离患者几英尺的地方听到。此外,声音振动通常可以通过手在上胸部和下颈部感觉到,这种现象称为震颤(thrill)。
主动脉反流的舒张期杂音(Diastolic Murmur of Aortic Regurgitation)。在主动脉反流(aortic regurgitation)中,收缩期不会听到异常声音,但在舒张期(diastole),血液从高压的主动脉反流到左心室,产生一种相对高音的“吹风样”杂音,其嘶嘶声在左心室上方最为明显(见图23-3的D记录;音频23-3)。这种杂音是由于血液反流到低压的舒张期左心室中已有的血液中产生的湍流所致。
二尖瓣关闭不全的收缩期杂音
在二尖瓣关闭不全的患者中,血液在收缩期通过二尖瓣反流至左心房。这种反流还会产生一种高频的吹风样或嗖嗖声(见录音C,图23-3;音频23-4),类似于主动脉瓣关闭不全的杂音,但发生在收缩期而非舒张期。这种声音最强地传导至左心房。然而,左心房位于胸腔深处,因此很难直接在心房上方听到这种声音。因此,二尖瓣关闭不全的声音主要通过左心室传导至心尖部,进而传导至胸壁。
二尖瓣狭窄的舒张期杂音
在二尖瓣狭窄的患者中,血液难以通过狭窄的二尖瓣从左心房流入左心室,由于左心房的压力很少超过30mmHg,因此不会形成迫使血液从左心房流入左心室的大压力差。因此,二尖瓣狭窄时听到的异常声音(见录音E,图23-3;音频23-5)通常较弱且频率非常低,因此大部分声谱低于人类听觉的低频范围。
在舒张期的早期,二尖瓣狭窄的左心室中血液量极少,心室壁非常松弛,因此血液不会在心室壁之间来回震荡。因此,即使在严重二尖瓣狭窄的患者中,舒张期的前三分之一也可能听不到杂音。然后,在部分充盈后,心室拉伸到足以使血液震荡,并开始出现低沉的隆隆样杂音。
瓣膜杂音的心音图
图23-3中的心音图B、C、D和E分别显示了从主动脉瓣狭窄、二尖瓣关闭不全、主动脉瓣关闭不全和二尖瓣狭窄患者中获得的理想化记录。从这些心音图中可以明显看出,主动脉瓣狭窄病变引起的杂音最响亮,而二尖瓣狭窄病变引起的杂音最弱。心音图显示了杂音在收缩期和舒张期不同部分的强度变化,并且每个杂音的相对时间也很明显。特别要注意的是,主动脉瓣狭窄和二尖瓣关闭不全的杂音仅发生在收缩期,而主动脉瓣关闭不全和二尖瓣狭窄的杂音仅发生在舒张期。
瓣膜性心脏病中的异常循环动力学
主动脉瓣狭窄和主动脉瓣关闭不全的循环动力学
在主动脉瓣狭窄中,收缩的左心室未能充分排空,而在主动脉瓣关闭不全中,血液在心室刚刚将血液泵入主动脉后从主动脉反流回心室。因此,在这两种情况下,心脏的净每搏输出量都会减少。
一些重要的代偿机制可以减轻循环缺陷的严重程度。其中一些代偿机制将在以下部分中描述。
左心室肥大
在主动脉瓣狭窄(aortic stenosis)和主动脉瓣关闭不全(aortic regurgitation)的情况下,由于心室工作负荷增加,左心室肌会发生肥大(hypertrophy)。在关闭不全的情况下,左心室腔也会扩大以容纳从主动脉反流的血液。这种伴随心室腔扩大的肥大通常被称为离心性肥大(eccentric hypertrophy)(图23-4)。有时,左心室肌质量会增加四到五倍,导致心脏左侧显著增大。
图23-4 正常心脏、离心性左心室肥大(LVH)心脏和向心性左心室肥大(LVH)心脏的左心室比较。离心性和向心性左心室肥大时,左心室质量均增加,但离心性左心室肥大时左心室腔大小增加,而向心性左心室肥大时心室壁厚度增加。
当主动脉瓣严重狭窄时,肥大的肌肉可能使左心室在收缩期峰值时产生高达400mmHg的心室内压。这种向心性肥大(concentric hypertrophy)与心室壁增厚和心室腔缩小有关(见图23-4),并且在其他心脏后负荷增加的情况下也会发生,例如慢性高血压(chronic hypertension)。
在严重主动脉瓣关闭不全的患者中,有时扩大的左心室可以泵出高达250毫升的每搏输出量(stroke volume output),尽管其中多达75%的血液在舒张期返回到心室,只有25%通过主动脉流向身体。
血容量增加
另一个有助于补偿左心室净泵血功能减弱的效应是血容量(blood volume)的增加。这种血容量增加是由以下原因引起的:(1) 动脉压的初始轻微下降;(2) 由压力下降引起的神经反射和激素变化。这些机制共同减少了肾脏的尿液输出,导致血容量增加并使平均动脉压恢复正常。此外,由于轻微的组织缺氧,红细胞质量最终也会增加。
血容量的增加倾向于增加心脏的静脉回流(venous return),这反过来又使左心室以克服异常泵血动力学所需的额外力量进行泵血。
主动脉瓣病变可能与冠状动脉血流不足有关
当一个人患有主动脉瓣狭窄时,心室肌必须产生高张力以产生迫使血液通过狭窄瓣膜所需的高心室内压。这一动作增加了心室的工作负荷和氧耗,需要增加冠状动脉血流以输送这些氧气。然而,心室的高壁张力在收缩期显著减少了冠状动脉血流,特别是在心内膜下血管(subendocardial vessels)中。当存在主动脉瓣狭窄时,心室内舒张压也会增加,这种增加的压力可能导致心肌内层受压并减少冠状动脉血流。因此,严重的主动脉瓣狭窄常常导致心肌缺血(ischemia)。
在主动脉瓣关闭不全(aortic regurgitation)的情况下,心室内舒张压(intraventricular diastolic pressure)也会升高,压迫心肌内层并减少冠状动脉血流(coronary blood flow)。主动脉瓣关闭不全时,主动脉舒张压(aortic diastolic pressure)下降,这也会减少冠状动脉血流并导致心肌缺血(ischemia of the heart muscle)。
左心室最终衰竭和肺水肿(pulmonary edema)的发生。在主动脉瓣狭窄(aortic stenosis)或主动脉瓣关闭不全的早期阶段,左心室适应负荷增加的内在能力可以防止患者在休息时出现明显的循环功能异常,除了左心室需要增加做功输出外。因此,在患者意识到自己患有严重心脏病之前,往往已经出现了相当程度的主动脉瓣狭窄或主动脉瓣关闭不全(例如,主动脉瓣狭窄患者的静息左心室收缩压(left ventricular systolic pressure)可高达200mmHg,或主动脉瓣关闭不全患者的左心室每搏输出量(left ventricular stroke volume output)可高达正常值的两倍)。
当这些主动脉瓣病变(aortic valve lesions)超过临界阶段时,左心室最终无法满足工作需求。结果,左心室扩张,心输出量(cardiac output)开始下降;血液同时滞留在左心房和衰竭的左心室后方的肺中。左心房压力(left atrial pressure)逐渐升高,当平均左心房压力超过25至40mmHg时,肺中会出现严重的水肿,详见第39章。
二尖瓣狭窄(mitral stenosis)和二尖瓣关闭不全(mitral regurgitation)的动力学
在二尖瓣狭窄患者中,血液从左心房流入左心室的流动受阻;而在二尖瓣关闭不全患者中,舒张期流入左心室的大部分血液在收缩期泄漏回左心房,而不是被泵入主动脉。因此,这两种情况都会减少血液从左心房流入左心室的净流动。
二尖瓣疾病(mitral valvular disease)中的肺水肿。左心房中血液的积聚导致左心房压力逐渐升高,最终导致严重肺水肿的发生。通常,致死性水肿不会发生,除非平均左心房压力上升到25mmHg以上,有时甚至高达40 mmHg,因为肺淋巴管(lung lymphatic vessels)会扩大数倍,并能够迅速将液体从肺组织中带走。
左心房扩大和心房颤动(atrial fibrillation)。二尖瓣疾病中的高左心房压力也会导致左心房逐渐扩大,这增加了心脏电兴奋冲动在房壁中传播的距离。这种路径最终可能变得如此之长,以至于容易导致兴奋信号环形运动(circus movements)的发生,如第13章所述。因此,在二尖瓣疾病的晚期,尤其是二尖瓣狭窄时,常发生心房颤动。这种情况进一步降低了心脏的泵血效率,并导致进一步的心脏衰弱。
早期二尖瓣疾病的代偿(compensation)。
与主动脉瓣疾病和许多类型的先天性心脏病一样,二尖瓣疾病中的血容量增加主要是由于肾脏对水和盐的排泄减少。这种增加的血容量增加了静脉回流到心脏的量,从而有助于克服心脏功能减弱的影响。因此,在代偿后,即使左心房压力上升,心输出量可能仅轻微下降,直到二尖瓣疾病的晚期。
随着左心房压力的上升,血液开始在肺部积聚,最终一直回流到肺动脉。此外,肺部的初期水肿导致肺小动脉收缩。这两种效应共同增加了肺动脉收缩压和右心室压力,有时高达60mmHg,这是正常值的两倍多。这种增加的压力反过来导致心脏右侧的肥大,部分代偿了其增加的工作负荷。
瓣膜病变患者在运动期间的循环动力学
在运动期间,需要增加的血流量以提供额外的氧气和营养物质给运动中的肌肉,并清除增加代谢产生的废物。因此,从外周循环返回心脏的静脉血量增加。因此,所有不同类型瓣膜性心脏病中发生的动态异常都会加剧。即使在轻度瓣膜性心脏病患者中,休息时症状可能不明显,但在剧烈运动期间常常会出现严重症状。例如,在主动脉瓣病变患者中,运动可能导致急性左心室衰竭,随后出现急性肺水肿。同样,在二尖瓣疾病患者中,运动可能导致肺部血液积聚过多,以至于在短短10分钟内就可能发生严重甚至致命的肺水肿。
即使在轻度至中度瓣膜疾病病例中,患者的心脏储备也会随着瓣膜功能障碍的严重程度而减少。也就是说,运动期间心输出量的增加不如应有的多。因此,由于肌肉血流增加过少,身体肌肉迅速疲劳。
先天性心脏缺陷中的异常循环动力学
偶尔,心脏或其相关血管在胎儿期发育异常;这种缺陷称为先天性异常。心脏及其相关血管的先天性异常主要有三种类型:(1) 心脏或紧密相关的主要血管中某处的血流通道狭窄;(2) 允许血液从左心或主动脉回流到右心或肺动脉的异常,从而未能流经体循环,称为左至右分流;(3) 允许血液直接从右心流入左心的异常,从而未能流经肺部,称为右至左分流。
不同狭窄病变的影响很容易理解。例如,先天性主动脉瓣狭窄(congenital aortic valve stenosis)与其他瓣膜病变引起的主动脉瓣狭窄(aortic valve stenosis)具有相同的动态效应,即心脏肥大(cardiac hypertrophy)、心肌缺血(heart muscle ischemia)、心输出量减少(reduced cardiac output)以及发生严重肺水肿(pulmonary edema)的倾向。
另一种先天性狭窄是主动脉缩窄(coarctation of the aorta),通常发生在膈肌(diaphragm)上方。这种狭窄导致身体上部(缩窄水平以上)的动脉压力远高于身体下部的压力,因为血液通过缩窄部位流向身体下部的阻力很大;部分血液必须通过小的侧支动脉绕过缩窄部位,如第19章所述。
图23-5 动脉导管未闭(patent ductus arteriosus),蓝色显示静脉血在循环的不同部位转变为氧合血。插图显示血液从主动脉反流到肺动脉,然后再次通过肺部。
动脉导管未闭(PATENT DUCTUS ARTERIOSUS)——左向右分流(LEFT-TO-RIGHT SHUNT)
在胎儿期,肺部是塌陷的,肺部的弹性压缩使肺泡保持塌陷状态,同时也使大部分肺血管保持塌陷。因此,胎儿期通过肺部的血流阻力非常大,导致肺动脉压力较高。此外,由于从主动脉通过胎盘大血管的血流阻力较低,胎儿主动脉的压力低于正常值——实际上,低于肺动脉的压力。这种现象导致几乎所有肺动脉血液都通过胎儿中存在的一条特殊动脉流动,这条动脉连接肺动脉和主动脉(图23-5),即动脉导管(ductus arteriosus),从而绕过肺部。这种机制使得血液能够立即通过胎儿的体循环动脉重新循环,而无需经过肺部。这种缺乏肺部血流的情况对胎儿并无害处,因为血液通过胎盘进行氧合。
出生后动脉导管(ductus arteriosus)的闭合
婴儿出生并开始呼吸后,肺部立即膨胀。不仅肺泡(alveoli)充满空气,而且通过肺血管树的血流阻力也大大降低,使得肺动脉压下降。同时,由于从主动脉通过胎盘的血流突然停止,主动脉压力上升。因此,肺动脉内的压力下降,而主动脉内的压力上升。结果,出生时通过动脉导管的前向血流突然停止,实际上,血液开始反向流动,从主动脉流入肺动脉。这种新的反向血流状态导致大多数婴儿在几小时到几天内动脉导管闭合,因此通过导管的血流不会持续存在。据信,导管闭合是因为现在通过它的主动脉血液的氧浓度大约是胎儿期从肺动脉流入导管的血液的两倍。氧气可能会使导管壁的肌肉收缩。这一现象将在第84章进一步讨论。
不幸的是,大约每5500名婴儿中就有1名的导管没有闭合,导致称为动脉导管未闭(patent ductus arteriosus)的病症,如图23-5所示。
持续性动脉导管未闭的循环动力学
在婴儿生命的早期几个月,动脉导管未闭通常不会引起严重的功能异常。然而,随着孩子年龄的增长,主动脉高压和肺动脉低压之间的差异逐渐增大,相应地,从主动脉反向流入肺动脉的血流也增加。此外,主动脉高压通常会导致部分开放的导管直径随时间增加,使病情更加恶化。
通过肺部的再循环
在患有动脉导管未闭的较大儿童中,主动脉血液的一半到三分之二通过导管反向流入肺动脉,然后通过肺部,最后回到左心室和主动脉,每次通过体循环时,血液会通过肺部和心脏左侧两次或更多次。患有这种病症的人在生命后期才会出现发绀(cyanosis),此时心脏衰竭或肺部充血。事实上,在生命早期,由于血液多次通过肺部,动脉血的氧合通常比正常情况更好。
心脏和呼吸储备的减少
动脉导管未闭对患者的主要影响是心脏和呼吸储备的减少。左心室泵出的血液量约为正常心输出量的两倍或更多,而在心脏肥大发生后,左心室的最大泵血量约为正常值的四到七倍。因此,在运动期间,通过身体其余部分的净血流量永远无法增加到剧烈活动所需的水平。即使是中等强度的运动,患者也可能会感到虚弱,甚至可能因短暂的心力衰竭而晕倒。
由于肺部血流过多导致的肺血管高压也可能引起肺充血(pulmonary congestion)和肺水肿(pulmonary edema)。由于心脏负荷过重,尤其是随着年龄增长肺充血逐渐加重,大多数未矫正的动脉导管未闭(patent ductus arteriosus)患者在20至40岁之间死于心脏病。
心音:机器样杂音
在患有动脉导管未闭的新生儿中,偶尔听不到异常心音,因为通过导管的反向血流量可能不足以引起心脏杂音。然而,随着婴儿长大到1至3岁,在胸部的肺动脉区域开始听到粗糙的吹风样杂音,如图23-3中的记录F所示。这种声音在收缩期主动脉压力高时更为强烈,在舒张期主动脉压力下降时则较弱,因此杂音随着每次心跳而增强和减弱,形成所谓的机器样杂音(machinery murmur)。
手术治疗
动脉导管未闭(PDA)的手术治疗很简单;只需结扎未闭的导管或将其切断,然后闭合两端。这一手术是最早成功进行的心脏手术之一。导管介入装置常用于闭合足够大的婴儿或儿童的PDA。通过导管将一个小金属线圈或其他闭塞装置送入PDA,以阻断通过血管的血流。
法洛四联症-右向左分流
法洛四联症(Tetralogy of Fallot)如图23-6所示;它是导致蓝婴(blue baby)的最常见原因。大部分血液绕过肺部,因此主动脉血液主要是未氧合的静脉血。在这种情况下,心脏同时出现四种异常:
- 主动脉起源于右心室而非左心室,或者它跨越室间隔上的一个孔,如图23-6所示,接收来自两个心室的血流。
- 由于肺动脉狭窄,从右心室进入肺部的血流量远低于正常水平;相反,大部分血液直接进入主动脉,从而绕过肺部。
- 来自左心室的血液通过室间隔孔流入右心室,然后进入主动脉或直接进入跨越该孔的主动脉。
- 由于右心必须对抗主动脉中的高压泵送大量血液,其肌肉高度发达,导致右心室肥大。
异常循环动力学。显然,法洛四联症引起的主要生理困难是血液绕过肺部而未氧合。多达75%的静脉血返回心脏后直接从右心室进入主动脉而未氧合。这可能导致婴儿皮肤发绀(cyanosis)。其他体征包括右心室高压、右心室肥大以及通过室间隔的左向右分流,这些可以通过超声心动图观察到。
图23-6 法洛四联症,蓝色显示大部分静脉血从右心室分流到主动脉,而不经过肺部。
手术治疗。法洛四联症通常可以通过手术成功治疗。常见的手术步骤是打开肺动脉狭窄,关闭间隔缺损,并重建进入主动脉的血流通道。当手术成功时,平均预期寿命从仅3到4年增加到50年或更长。
先天性异常的原因
先天性心脏病并不罕见,每1000名活产婴儿中约有8例发生。先天性心脏缺陷最常见的原因之一是母亲在妊娠前三个月胎儿心脏形成期间感染病毒。当孕妇在妊娠前三个月感染风疹(rubella)时,特别容易发生缺陷。在妊娠期间服用某些药物,如血管紧张素转换酶(ACE)抑制剂和痤疮药物(如异维A酸),以及酒精或药物滥用,也会增加发育中胎儿心脏缺陷的风险。
一些先天性心脏缺陷是遗传性的,因为已知相同的缺陷在同卵双胞胎以及后代中发生。接受先天性心脏病手术治疗的患者的孩子患先天性心脏病的几率比其他孩子高约10倍。先天性心脏缺陷也经常与婴儿身体的其他先天性缺陷相关。
心脏手术中使用体外循环
在心脏仍在跳动的情况下,几乎不可能通过手术修复心内缺陷。因此,已经开发了许多类型的人工心肺机,以在手术过程中代替心脏和肺的功能。这种系统称为体外循环(extracorporeal circulation)。该系统主要由一个泵和一个氧合装置组成。几乎任何不会引起血液溶血(hemolysis)的泵似乎都适用。
用于氧合血液的方法包括以下内容:(1)将氧气通过血液中冒泡,并在将血液返回患者之前去除气泡;(2)在氧气存在下,将血液滴在塑料片表面;(3)将血液流过旋转盘的表面;(4)将血液流过对氧气和二氧化碳可渗透的薄膜或细管之间。
瓣膜性和先天性心脏病中的心脏肥大
心肌肥大(hypertrophy)是心脏适应增加的工作负荷的最重要机制之一,无论这些负荷是由心肌必须对抗的增加压力还是必须泵出的增加心输出量引起的。通过将心室输出量乘以心室必须对抗的压力,可以近似计算出心脏每个腔室的肥大程度,其中压力是重点。因此,在大多数类型的瓣膜性和先天性心脏病中都会发生肥大,有时会使心脏重量达到800克,而不是正常的300克。
心脏肥大后期的有害影响
尽管心脏肥大最常见的原因是高血压,但几乎所有形式的心脏疾病,包括瓣膜性和先天性心脏病,都可以刺激心脏的增大。
所谓的生理性心脏肥大通常被认为是心脏对增加的工作负荷的一种代偿反应,并且在存在损害心脏泵血效率的异常情况下,通常有助于维持心输出量。然而,极度的肥大可能导致心力衰竭。其中一个原因是冠状动脉血管通常不会随着心肌质量的增加而相应增加。第二个原因是肌肉中常常发生纤维化,特别是在冠状动脉血流较差的心内膜下肌肉中,纤维组织取代了退化的肌纤维。由于心肌质量相对于冠状动脉血流的不成比例增加,随着心肌肥大,可能会出现相对缺血,进而可能导致冠状动脉血流不足。因此,心绞痛常常伴随与瓣膜性和先天性心脏病相关的心脏肥大。心脏增大还与心律失常的更高风险相关,这反过来可能导致心脏功能的进一步损害和由于颤动引起的猝死。
循环休克及其治疗
循环休克是指全身血流不足,导致身体组织受损,特别是因为组织细胞获得的氧气和其他营养物质过少。即使是心血管系统本身——心肌、血管壁、血管运动系统和其他循环部分——也开始恶化,因此休克一旦开始,往往会逐渐恶化。
休克的生理原因
由心输出量减少引起的循环休克
休克通常是由于心输出量不足引起的。因此,任何使心输出量远低于正常水平的条件都可能导致循环休克。两种类型的因素可以严重减少心输出量:
- 降低心脏泵血能力的心脏异常。这些异常尤其包括心肌梗死,但也包括心脏的毒性状态、严重的心脏瓣膜功能障碍、心律失常和其他情况。由于心脏泵血能力减弱而引起的循环休克称为心源性休克。这种情况在第22章中讨论,其中指出多达70%的心源性休克患者无法存活。
- 减少静脉回流的因素也会减少心输出量,因为心脏无法泵送不流入其中的血液。减少静脉回流的最常见原因是血容量减少,但静脉回流也可能由于血管张力降低,特别是静脉血库的张力降低,或循环中某处的血流受阻,特别是静脉回流至心脏的路径受阻而减少。
心输出量未减少的循环休克
偶尔,心输出量正常甚至超过正常,但患者仍处于循环休克状态。
这种情况可能由以下原因引起:(1) 代谢率(excessive metabolic rate)过高,即使心输出量正常也不足以满足需求;或 (2) 组织灌注模式(tissue perfusion patterns)异常,导致大部分心输出量流经不提供局部组织营养的血管。
休克的具体原因将在本章后面讨论。目前重要的是要注意,所有这些原因都会导致关键组织和关键器官的营养供应不足,以及组织中的细胞废物清除不足。
循环性休克(CIRCULATORY SHOCK)中动脉压会发生什么变化?
在许多医生的观念中,动脉压水平是衡量循环功能是否充足的主要指标。然而,动脉压常常会严重误导判断。有时,一个人可能处于严重休克状态,但由于强大的神经反射阻止血压下降,动脉压仍然接近正常。而在其他情况下,动脉压可能下降到正常值的一半,但患者仍然有正常的组织灌注,并未处于休克状态。
在大多数类型的休克中,尤其是由严重失血引起的休克,动脉血压会随着心输出量的减少而下降,尽管通常下降幅度不如心输出量那么大。
组织恶化是循环性休克的最终结果
一旦循环性休克达到严重程度的临界状态,无论其初始原因是什么,休克本身都会导致更多的休克。也就是说,血流不足会导致身体组织开始恶化,包括心脏和循环系统。这种恶化会导致心输出量进一步减少,从而形成一个恶性循环,循环性休克逐渐加重,组织灌注越来越不足,最终导致死亡。我们特别关注循环性休克的晚期阶段,因为适当的生理治疗通常可以逆转迅速走向死亡的趋势。
休克的阶段
由于循环性休克的特征会随着严重程度的不同而变化,休克通常分为以下三个阶段:
- 非进展期(有时称为代偿期(compensated stage)),在此阶段,正常的循环代偿机制最终会在没有外部治疗的情况下导致完全恢复。
- 进展期(progressive stage),在此阶段,如果没有治疗,休克会逐渐恶化,直到死亡发生。
- 不可逆期(irreversible stage),在此阶段,休克已经发展到如此严重的程度,即使患者暂时仍然存活,所有已知的治疗方法都不足以挽救其生命。
我们现在将讨论由血容量减少引起的循环性休克的阶段,这些阶段说明了基本原理。然后我们将考虑由其他原因引起的休克的特征。
由低血容量引起的休克——失血性休克(HYPOVOLEMIC SHOCK—HEMORRHAGIC SHOCK)
低血容量(Hypovolemia)意味着血容量减少。失血是低血容量性休克的最常见原因。失血会降低循环的充盈压力,从而导致静脉回流减少。结果,心输出量下降到正常水平以下,休克可能随之发生。
失血量与心输出量和动脉压的关系
图24-1显示了在大约30分钟内从循环系统中移除血液对心输出量(cardiac output)和动脉血压(arterial pressure)的近似影响。大约10%的总血容量可以被移除,而对动脉血压或心输出量几乎没有影响,但更大的失血通常会首先减少心输出量,随后减少动脉血压,当大约40%到45%的总血容量被移除时,两者都会降至零。
图24-1 失血对心输出量和动脉血压的影响。
休克中的交感神经反射补偿——它们在维持动脉血压中的特殊价值。失血后动脉血压的下降,以及胸腔内肺动脉和静脉压力的下降,会引起强烈的交感神经反射(主要由动脉压力感受器(arterial baroreceptors)和其他血管牵张受体(vascular stretch receptors)引发,如第18章所述)。这些反射刺激了身体大多数组织中的交感神经缩血管系统,产生了三个重要效果:
- 大多数体循环中的小动脉收缩,从而增加总外周阻力(total peripheral resistance)。
- 静脉和静脉储库收缩,从而在血容量减少的情况下帮助维持足够的静脉回流(venous return)。
- 心脏活动显著增加,有时心率从正常值72次/分钟增加到160至180次/分钟。
在没有交感神经反射的情况下,一个人在大约30分钟内只能失去15%到20%的血容量就会死亡;相比之下,当反射完好时,一个人可以承受30%到40%的血容量损失。因此,这些反射将不会导致死亡的失血量增加到了没有反射时的两倍左右。
交感神经反射在维持动脉血压中的作用大于维持心输出量。再次参考图24-1,注意在失血过程中,动脉血压比心输出量更长时间地维持在或接近正常水平。这种差异的原因是交感神经反射更多地是为了维持动脉血压而不是维持心输出量。它们主要通过增加总外周阻力来增加动脉血压,这对心输出量没有益处。然而,交感神经对静脉的收缩在防止静脉回流和心输出量下降过多方面也很重要,除了它们在维持动脉血压中的作用。
特别有趣的是图24-1中动脉血压曲线在约50mmHg处出现的第二个平台。这个第二个平台是由于中枢神经系统缺血反应(central nervous system ischemic response)的激活,当大脑开始经历缺氧或二氧化碳过度积累时,这种反应会引起交感神经系统的极度刺激,如第18章所述。中枢神经系统缺血反应的这种效应可以被称为交感神经反射在防止动脉血压下降过低的“最后防线”。
反射对冠状动脉和脑血流的保护作用
维持正常动脉血压的一个特殊价值,即使在心输出量下降的情况下,也能保护通过冠状动脉和脑循环的血流。交感神经刺激不会引起脑或心脏血管的显著收缩。此外,在这两个血管床中,局部血流自动调节(autoregulation)非常出色,这可以防止动脉血压的适度下降显著减少它们的血流。因此,只要平均动脉压不低于约70mmHg,通过心脏和大脑的血流基本上保持在正常水平,尽管由于血管收缩,身体其他一些区域的血流可能已经减少到正常的三分之一到四分之一。
进行性和非进行性失血性休克
图24-2显示了一项实验,该实验展示了不同程度的急性失血对动脉血压后续变化的影响。实验中的动物被麻醉并迅速放血,直到它们的动脉血压下降到不同水平。血压立即下降到不低于45mmHg的动物(组I、II和III)最终都恢复了;如果血压仅轻微下降(组I),恢复会很快发生,但如果血压几乎下降到45-mmHg水平(组III),恢复则会缓慢发生。当动脉血压下降到45mmHg以下时(组IV、V和VI),所有动物都死亡,尽管其中许多动物在循环系统恶化到死亡阶段之前,在生死之间徘徊了数小时。
这个实验表明,只要失血程度不超过某个临界量,循环系统就可以恢复。即使失血量超过这个临界阈值几毫升,也会导致生与死的最终差异。因此,超过某个临界水平的失血会导致休克变得进行性。也就是说,休克本身会导致更多的休克,这种情况变成一个恶性循环,最终导致循环系统的恶化和死亡。
图24-2 不同程度急性失血后狗动脉血压的时间进程。每条曲线代表六只狗的平均结果(曲线I–VI)。
非进行性休克——代偿性休克
如果休克不严重到足以导致其自身进展,患者最终会恢复。因此,这种较轻程度的休克被称为非进行性休克(nonprogressive shock)或代偿性休克(compensated shock),这意味着交感神经反射和其他因素足以补偿,防止循环系统的进一步恶化。
导致患者从中度休克中恢复的因素是循环系统的负反馈控制机制(negative feedback control mechanisms),这些机制试图将心输出量和动脉血压恢复到正常水平。它们包括以下内容:
- 压力感受器反射(baroreceptor reflexes),它引发对循环系统的强烈交感神经刺激
- 中枢神经系统缺血反应(central nervous system ischemic response),这种反应会在全身引发更强烈的交感神经刺激,但直到动脉压降至50mmHg以下时才会显著激活
- 循环系统的反向应力松弛(reverse stress-relaxation),这会导致血管围绕减少的血容量收缩,从而使可用的血容量更充分地填充循环系统
- 肾脏增加分泌肾素(renin)并形成血管紧张素I I,这会收缩外周小动脉,并导致肾脏减少水和盐的输出,这两者都有助于防止休克的进展
- 垂体后叶(posterior pituitary gland)增加分泌加压素(vasopressin, 抗利尿激素antidiuretic hormone),这会收缩外周小动脉和静脉,并大大增加肾脏的水分保留
- 肾上腺髓质(adrenal medullae)增加分泌肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine),这会收缩外周小动脉和静脉,并增加心率
- 使血容量恢复正常代偿机制(compensatory mechanisms),包括从肠道吸收大量液体,从身体的间质空间吸收液体进入毛细血管,肾脏保留水和盐,以及增加口渴和对盐的食欲,这使得人们如果能够的话会喝水和吃咸的食物
交感神经反射和肾上腺髓质增加分泌儿茶酚胺(catecholamines)为恢复提供了快速帮助,因为它们在出血后30秒到几分钟内达到最大激活。
图24-3 导致休克进展的不同类型的正反馈(positive feedback)。
血管紧张素和加压素机制,以及导致血管和静脉储库收缩的反向应力松弛,都需要10到60分钟才能完全响应,但它们大大有助于增加动脉压或增加循环充盈压,从而增加血液回流到心脏。
最后,通过从间质空间和肠道吸收液体,以及口服和吸收额外的水和盐来重新调整血容量,可能需要1到48小时,但如果休克没有严重到进入进展阶段,最终会发生恢复。
进行性休克(Progressive Shock)——由心血管恶化的恶性循环引起
图24-3显示了一些在休克中进一步抑制心输出量的正反馈,从而使休克变得进行性。以下部分描述了一些更重要的反馈。
心脏抑制(Cardiac Depression)。当动脉压降至足够低时,冠状动脉血流减少到低于心肌充分营养所需的水平,削弱心肌并进一步减少心输出量。因此,形成了一个正反馈循环,使休克变得越来越严重。
图24-4显示了从实验动物研究中推断到人类心脏的心输出量曲线,展示了休克发生后不同时间点心脏的逐渐恶化。一只麻醉的动物被放血,直到动脉压降至30mmHg,然后根据需要进一步放血或回输血液以维持这一压力水平。从图中的第二条曲线可以看出,在前2小时内心脏几乎没有恶化,但到了4小时,心脏已经恶化了约40%。随后,在实验的最后1小时内(在低冠状动脉血压持续4小时后),心脏迅速完全恶化。
图24-4 出血性休克开始后不同时间点的心脏输出量曲线。(这些曲线是根据J.W. Crowell博士在狗实验中获得的数据推断到人类心脏的。)
因此,无论是由于出血性休克还是其他原因引起的进行性休克,其重要特征之一是心脏的最终逐渐恶化。在休克的早期阶段,这种恶化对患者的状况影响很小,部分原因是休克开始后的第一个小时左右心脏的恶化并不严重,但主要是因为心脏具有储备能力,通常可以泵出比身体所需多300%到400%的血液,以满足组织的充分营养需求。然而,在休克的最后阶段,心脏的恶化可能是休克最终致命进展中最重要的因素。
血管运动衰竭(Vasomotor Failure)。在休克的早期阶段,各种循环反射引起交感神经系统的强烈活动。这种活动有助于延缓心输出量的下降,特别是帮助防止动脉压的降低。然而,当脑部血管运动中枢的血流量减少到一定程度时,中枢会变得如此抑制,以至于其活动也逐渐减弱,最终完全停止。例如,在前4到8分钟内,脑部完全循环停止会导致最强烈的交感神经放电,但到了10到15分钟结束时,血管运动中枢变得如此抑制,以至于无法再检测到任何交感神经放电的迹象。幸运的是,如果动脉压保持在30mmHg以上,血管运动中枢通常不会在休克的早期阶段失效。
微小血管因血液淤滞而阻塞
随着时间的推移,循环系统中许多微小血管会发生阻塞,这种阻塞也会导致休克进一步发展。这种阻塞的初始原因是微血管中的血流缓慢。尽管血流减少,组织代谢仍在继续,大量酸性物质(包括碳酸和乳酸)继续排入局部血管,大大增加了血液的局部酸度。这种酸性效应,加上缺血组织的其他降解产物,导致局部血液凝集,形成微小的血栓,进而导致微小血管中的小栓塞。即使血管没有被完全堵塞,血细胞之间黏附的趋势增加也会使血液更难通过微血管系统,这种现象被称为“血液淤滞”。
毛细血管通透性增加
在毛细血管缺氧和缺乏其他营养物质数小时后,毛细血管的通透性逐渐增加,大量液体开始渗入组织。这种现象进一步减少了血容量,导致心输出量进一步下降,使休克更加严重。毛细血管缺氧在长时间休克的晚期才会引起毛细血管通透性增加。
缺血组织释放毒素
有研究表明,休克会导致组织释放有毒物质,如组胺、血清素和组织酶,这些物质会进一步恶化循环系统。实验研究已经证明,至少有一种毒素——内毒素,在某些类型的休克中具有重要意义。
内毒素引起的心脏抑制
内毒素是从肠道中死亡的革兰氏阴性菌体内释放出来的。肠道血流减少通常会导致这种有毒物质的形成和吸收增加。循环中的毒素随后导致细胞代谢增加,尽管细胞营养不足,这对心肌有特定的影响,引起心脏抑制。内毒素在某些类型的休克中,尤其是败血性休克(本章稍后讨论)中可能起主要作用。
全身性细胞退化
随着休克的加重,全身会出现许多全身性细胞退化的迹象。特别受影响的一个器官是肝脏,如图24-5所示。肝脏特别受影响的主要原因是缺乏足够的营养物质来支持肝细胞中通常较高的代谢率,但也部分是因为肝细胞暴露于休克中出现的任何血管毒素或其他异常代谢因子。
在大多数身体组织中已知发生的损害性细胞效应包括以下内容:
- 通过细胞膜的钠和钾的主动转运大大减少。结果,钠和氯在细胞内积聚,而钾从细胞中流失。此外,细胞开始肿胀。
图24-5 严重循环休克期间肝小叶中央部分的坏死。(由J.W. Crowell博士提供)
- 肝细胞以及身体许多其他组织中的线粒体活动严重抑制。
- 广泛组织区域的细胞中的溶酶体(lysosomes)开始破裂,细胞内释放水解酶(hydrolases),导致进一步的细胞内恶化。
- 在休克的最后阶段,营养物质(如葡萄糖)的细胞代谢(cellular metabolism)最终会大大降低。一些激素的作用也会受到抑制,包括胰岛素(insulin)的作用几乎100%被抑制。
所有这些效应都会导致身体许多器官的进一步恶化,特别是以下器官:(1) 肝脏,其许多代谢和解毒功能受到抑制;(2) 肺,最终发展为肺水肿(pulmonary edema)和血液氧合能力下降;(3) 心脏,从而进一步抑制其收缩力(contractility)。
不同器官中斑块状血流导致的组织坏死(tissue necrosis)斑块。并非所有身体细胞都受到休克的同等损害,因为一些组织的血液供应比其他组织更好。例如,靠近毛细血管动脉端的细胞比靠近同一毛细血管静脉端的细胞获得更好的营养。因此,毛细血管静脉端周围比其他地方更容易发生营养缺乏。图24-5显示了肝小叶(liver lobule)中心的坏死,这是血液通过肝窦(liver sinusoids)时最后暴露的部分。
类似的小点状病变也发生在心肌中,尽管这里无法像肝脏那样展示明确的重复模式。然而,心脏病变在导致休克的最终不可逆阶段中起着重要作用。肾脏也会发生恶化性病变,尤其是肾小管(kidney tubules)的上皮细胞,导致肾衰竭(kidney failure),有时在几天后导致尿毒症(uremic death)。肺部的恶化也常常导致呼吸窘迫(respiratory distress)并在几天后死亡,称为休克肺综合征(shock lung syndrome)。
休克中的酸中毒(acidosis)。休克组织中发生的代谢紊乱(metabolic derangements)可能导致全身性酸中毒。这是由于氧气输送不足,大大减少了食物的氧化代谢(oxidative metabolism)。当这种情况发生时,细胞通过无氧糖酵解(anaerobic glycolysis)过程获得大部分能量,这导致血液中乳酸(lactic acid)过多。此外,组织中的血流不畅阻止了二氧化碳的正常排出。二氧化碳在细胞内与水反应形成高浓度的细胞内碳酸(carbonic acid),进而与各种组织化学物质反应形成额外的细胞内酸性物质。因此,休克的另一个恶化效应是全身性和局部组织酸中毒,导致休克的进一步进展。
休克中组织的正反馈恶化与进行性休克的恶性循环。前面讨论的所有可能导致休克进一步发展的因素都属于正反馈(positive feedback)的类型——即休克程度的每一次增加都会导致休克的进一步加重。然而,正反馈并不一定会导致恶性循环。恶性循环的形成取决于正反馈的强度。在轻度休克中,循环的负反馈机制(negative feedback mechanisms),包括交感神经反射(sympathetic reflexes)、血液储存库的反向应力松弛机制(reverse stress-relaxation mechanism)以及组织间隙液体向血液的吸收,可以轻易克服正反馈的影响,从而促进恢复。然而,在严重休克中,恶化性反馈机制变得越来越强,导致循环迅速恶化,以至于所有正常的循环控制负反馈系统共同作用也无法使心输出量(cardiac output)恢复正常。
再次回顾第1章中讨论的正反馈和恶性循环原理,我们可以很容易理解为什么存在一个关键的心输出量水平:高于此水平,休克患者可以恢复;低于此水平,患者会进入循环恶化的恶性循环,直至死亡。
不可逆性休克(IRREVERSIBLE SHOCK)
当休克发展到某一阶段后,输血或任何其他类型的治疗都无法挽救患者的生命。此时,患者被认为处于休克的不可逆阶段。讽刺的是,即使在这一不可逆阶段,治疗有时也能在短时间内使动脉压(arterial pressure)甚至心输出量恢复正常或接近正常,但循环系统仍然继续恶化,并在几分钟到几小时内导致死亡。
图24-6显示,在不可逆阶段输血有时可以使心输出量(以及动脉压)恢复到接近正常水平。然而,心输出量很快又开始下降,随后的输血效果越来越弱。此时,心肌细胞已经发生了多种恶化性变化,这些变化可能不会立即影响心脏泵血的能力,但长期来看会抑制心脏泵血功能,最终导致死亡。超过某一临界点后,组织损伤已经非常严重,大量破坏性酶被释放到体液中,酸中毒(acidosis)已经发展,许多其他破坏性因素也在持续作用,以至于即使心输出量在短时间内恢复正常,也无法逆转持续的恶化。因此,在严重休克中,最终会达到一个阶段,即使积极的治疗仍可能在短时间内使心输出量恢复正常,患者也会死亡。
图24-6 输血无法阻止不可逆性休克中的死亡。
不可逆性休克中细胞高能磷酸盐储备的耗竭。在严重休克时,身体组织中的高能磷酸盐储备,特别是在肝脏和心脏中,会大大减少。基本上所有的磷酸肌酸(creatine phosphate)都已被降解,几乎所有的三磷酸腺苷(adenosine triphosphate)都降解为二磷酸腺苷(adenosine diphosphate)、单磷酸腺苷(adenosine monophosphate),最终降解为腺苷(adenosine)。然后,大部分腺苷从细胞中扩散到循环血液中,并转化为尿酸(uric acid),这是一种无法重新进入细胞以重建磷酸腺苷系统的物质。新的腺苷的合成速率仅为正常细胞量的每小时约2%,这意味着一旦细胞的高能磷酸盐储备耗尽,它们就很难再补充。
因此,休克中最具破坏性的最终结果之一,也是可能对最终不可逆状态的发展最为重要的结果,就是这些高能化合物的细胞耗竭。
由血浆丢失引起的低血容量性休克
循环系统中血浆的丢失,即使没有红细胞的丢失,有时也可能严重到足以显著减少总血容量,导致典型的低血容量性休克,其几乎所有细节都与由出血引起的休克相似。严重血浆丢失发生在以下情况:
由出血引起,除了一个额外的复杂因素:由于剩余血液中红细胞浓度的增加,血液粘度大大增加,这种粘度的增加加剧了血流的缓慢。
从身体所有液体隔室中丢失液体称为脱水(dehydration);这种情况也可能减少血容量并引起类似于出血引起的低血容量性休克。这种休克的一些原因如下:(1) 过度出汗;(2) 严重腹泻或呕吐中的液体丢失;(3) 肾脏过度丢失液体;(4) 液体和电解质摄入不足;或 (5) 肾上腺皮质破坏,伴随醛固酮(aldosterone)分泌的丢失,以及随之而来的肾脏无法重吸收钠、氯和水,这在缺乏肾上腺皮质激素醛固酮的情况下发生。
由创伤引起的低血容量性休克
循环休克最常见的原因之一是身体的创伤。通常,休克仅仅是由创伤引起的出血引起的,但它也可能在没有出血的情况下发生,因为身体的广泛挫伤可能足以损伤毛细血管,导致血浆过度丢失到组织中。这种现象导致血浆体积大大减少,从而引起低血容量性休克。
已经进行了各种尝试,将创伤组织释放的毒性因素作为创伤后休克的原因之一。然而,与正常动物的交叉输血实验未能显示出显著的毒性元素。因此,创伤性休克似乎主要是由低血容量引起的,尽管可能还有一定程度的伴随神经源性休克,这是由于血管运动张力(vasomotor tone)的丢失引起的,如下所述。
神经源性休克——血管容量增加
- 肠梗阻可能导致血浆容量严重减少。肠梗阻时肠道的扩张部分阻塞了肠壁的静脉血流,这会增加肠道毛细血管压力,导致液体从毛细血管渗漏到肠壁和肠腔中。由于丢失的液体含有高蛋白,结果是总血浆蛋白减少,同时血浆容量也减少。
- 严重烧伤或其他皮肤剥脱情况会导致血浆通过剥脱的皮肤区域丢失,从而使血浆容量显著减少。
由于血浆丢失引起的低血容量性休克与由其他原因引起的休克具有几乎相同的特征。
休克有时会在没有任何血容量丢失的情况下发生。相反,血管容量增加得如此之多,以至于即使正常的血量也无法充分填充循环系统。这种情况的主要原因之一是全身血管运动张力的突然丧失,特别是导致静脉的大规模扩张。这种情况被称为神经源性休克。
血管容量在帮助调节循环功能中的作用在第15章中讨论过,其中指出血管容量的增加或血容量的减少会降低平均系统充盈压,从而减少静脉回流到心脏。由血管扩张引起的静脉回流减少被称为静脉血池。
神经源性休克的原因。一些可能导致血管运动张力丧失的神经源性因素包括:
- 深度全身麻醉通常会抑制血管运动中枢,足以导致血管运动麻痹,从而引起神经源性休克。
- 脊髓麻醉,特别是当麻醉延伸到整个脊髓时,会阻断来自神经系统的交感神经流出,可能是神经源性休克的有力原因。
- 脑损伤通常是血管运动麻痹的原因。许多脑震荡或脑基底区挫伤的患者会经历严重的神经源性休克。此外,尽管几分钟的脑缺血几乎总是会引起极端的血管运动刺激和血压升高,但长时间的缺血(持续超过5-10分钟)可能会导致相反的效果——脑干中血管运动神经元的完全失活,从而导致动脉压下降和严重神经源性休克的发展。
过敏性休克和组胺休克
过敏性休克是一种过敏状况,其中心输出量和动脉压通常会急剧下降。这种情况在第35章中讨论。它主要是由于敏感个体进入循环的抗原迅速发生抗原-抗体反应引起的。主要效应之一是导致血液中的嗜碱性粒细胞和毛细血管周围组织中的肥大细胞释放组胺或类似组胺的物质。组胺会引起以下情况:(1) 由于静脉扩张导致血管容量增加,从而引起静脉回流的显著减少;(2) 小动脉扩张,导致动脉压大幅下降;(3) 毛细血管通透性大大增加,液体和蛋白质迅速丢失到组织间隙中。净效应是静脉回流的显著减少,有时会导致如此严重的休克,以至于患者可能在几分钟内死亡。
静脉注射大量组胺(histamine)会引起组胺休克(histamine shock),其特征几乎与过敏性休克(anaphylactic shock)完全相同。
脓毒性休克(septic shock)
脓毒性休克(septic shock)是指细菌感染广泛播散到身体的许多区域,感染通过血液从一个组织传播到另一个组织,并造成广泛的损害。由于许多类型的细菌感染都可以引起脓毒性休克,而且身体不同部位的感染会产生不同的影响,因此脓毒性休克有许多种类。然而,大多数脓毒性休克病例是由革兰氏阳性菌(Gram-positive bacteria)引起的,其次是产生内毒素(endotoxin)的革兰氏阴性菌(Gram-negative bacteria)。
脓毒性休克对临床医生极为重要,因为除了心源性休克(cardiogenic shock)外,脓毒性休克是目前医院中与休克相关的死亡的最常见原因。
脓毒性休克的一些典型原因包括:
- 感染从子宫和输卵管扩散引起的腹膜炎(peritonitis),有时是由于在非无菌条件下进行器械流产(instrumental abortion)造成的
- 胃肠道系统破裂引起的腹膜炎,有时是由肠道疾病或伤口引起的
- 皮肤感染(如链球菌(streptococcal)或葡萄球菌(staphylococcal)感染)扩散引起的全身感染
- 气性坏疽(gas gangrene)杆菌引起的全身性坏疽感染,首先通过外周组织扩散,最后通过血液扩散到内脏器官,特别是肝脏
- 感染从肾脏或泌尿道扩散到血液中,通常由大肠杆菌(colon bacilli)引起。
脓毒性休克的特点。由于脓毒性休克的类型繁多,很难对其进行分类。通常观察到以下特征:
- 高热
- 全身血管扩张(vasodilation),尤其是在感染组织中
- 大约一半的患者心输出量(cardiac output)增加,这是由于感染组织中小动脉(arteriolar)扩张,以及细菌毒素刺激细胞代谢和体温升高导致身体其他部位代谢率(metabolic rate)增加和血管扩张所致
- 血液淤滞(sludging),这是由于红细胞(red cell)对退化组织的凝集(agglutination)反应引起的
- 身体广泛区域出现微血栓(micro-blood clots),这种情况称为弥散性血管内凝血(disseminated intravascular coagulation);此外,这会导致凝血因子(blood clotting factors)被耗尽,因此在许多组织中发生出血(hemorrhaging),特别是在肠道的肠壁(gut wall)中
在脓毒性休克的早期,患者通常没有循环衰竭(circulatory collapse)的迹象,只有细菌感染的迹象。随着感染变得更加严重,由于感染的直接扩散或细菌毒素的继发作用,循环系统通常会受到影响,导致血浆(plasma)通过恶化的毛细血管壁(blood capillary walls)渗入感染组织。最终,循环恶化会像所有其他类型的休克一样进行性发展。脓毒性休克的末期与失血性休克(hemorrhagic shock)的末期没有太大区别,尽管这两种情况的起始因素明显不同。
休克治疗的生理学(PHYSIOLOGY OF TREATMENT IN SHOCK)
替代治疗(REPLACEMENT THERAPY)
血液和血浆输注
如果一个人因出血而处于休克状态,通常最好的治疗方法是输注全血。如果休克是由血浆丢失引起的,最好的治疗方法是输注血浆。当脱水是原因时,输注适当的电解质溶液可以纠正休克。
全血并不总是可用,例如在战场条件下。血浆通常可以充分替代全血,因为它增加了血容量并恢复了正常的血流动力学。血浆不能恢复正常的血细胞比容,但如果心输出量足够,身体通常可以承受血细胞比容降至正常值的一半左右,而不会产生严重后果。因此,在紧急情况下,使用血浆替代全血来治疗出血性或大多数其他类型的低血容量性休克是合理的。
有时,血浆不可用。在这种情况下,已经开发出各种血浆替代品,它们几乎与血浆具有相同的血流动力学功能。其中一种替代品是右旋糖酐溶液。
右旋糖酐溶液作为血浆替代品
真正有效的血浆替代品的主要要求是它必须留在循环系统中——也就是说,它不会通过毛细血管孔过滤到组织间隙中。此外,溶液必须是无毒的,并且必须含有适当的电解质,以防止在输注时扰乱体内的细胞外液电解质。
为了留在循环系统中,血浆替代品必须含有某种分子大小足够大的物质,以产生胶体渗透压。为此开发的一种物质是右旋糖酐,它是一种由葡萄糖组成的大分子多糖聚合物。适当分子大小的右旋糖酐不会通过毛细血管孔,因此可以替代血浆蛋白作为胶体渗透剂。
使用纯化的右旋糖酐提供胶体渗透压时,很少观察到毒性反应;因此,含有这种物质的溶液已被用作液体替代疗法中的血浆替代品。
使用拟交感神经药物治疗神经源性和过敏性休克
拟交感神经药物是一种模拟交感神经刺激的药物。这些药物包括去甲肾上腺素、肾上腺素以及许多与肾上腺素和去甲肾上腺素具有相同基本作用的长效药物。
在两种类型的休克中,拟交感神经药物已被证明特别有益。第一种是神经源性休克,其中交感神经系统严重抑制。使用拟交感神经药物可以替代减弱的交感神经作用,通常可以恢复完整的循环功能。
第二种类型的休克是过敏性休克,其中过量的组胺起着重要作用。拟交感神经药物具有血管收缩作用,可以对抗组胺的血管舒张作用。因此,肾上腺素、去甲肾上腺素或其他拟交感神经药物通常是救命的。
拟交感神经药物在出血性休克中并未被证明非常有用。原因是,在这种类型的休克中,交感神经系统几乎总是通过循环反射被最大程度地激活;血液中已经循环着大量的去甲肾上腺素和肾上腺素,因此拟交感神经药物基本上没有额外的有益效果。
其他治疗方法
头低位的治疗。在大多数类型的休克中,尤其是出血性休克和神经源性休克,当血压下降过低时,将患者的头部置于比脚部至少低12英寸的位置有助于促进静脉回流,从而增加心输出量。这种头低位是治疗多种类型休克的首要关键步骤。
氧气疗法。由于大多数类型休克的主要有害影响是组织供氧不足,因此在某些情况下,给患者提供氧气呼吸可能有益。然而,这种干预的效果通常远不如预期,因为大多数类型休克的问题不在于肺部对血液的氧合不足,而在于血液在氧合后的运输不足。
糖皮质激素治疗。糖皮质激素——控制葡萄糖代谢的肾上腺皮质激素——经常被用于严重休克的患者,原因如下:(1) 实验经验表明,糖皮质激素通常在休克的晚期阶段增强心脏的力量;(2) 糖皮质激素稳定组织细胞中的溶酶体,从而防止溶酶体酶释放到细胞质中,避免由此导致的细胞损伤;(3) 糖皮质激素可能有助于严重受损细胞的葡萄糖代谢。
循环骤停
与循环休克密切相关的一种情况是循环骤停,即所有血流停止。这种情况可能发生,例如,由于心脏骤停或心室颤动。
心室颤动通常可以通过对心脏进行强电击来停止,其基本原理在第13章中描述。
在完全心脏骤停的情况下,有时可以通过立即实施心肺复苏程序,同时为患者的肺部提供足够的通气氧气来恢复正常的心律。
循环骤停对大脑的影响
循环骤停中的一个特殊挑战是防止骤停对大脑的有害影响。一般来说,超过5到8分钟的完全循环骤停会导致超过一半的患者出现至少某种程度的永久性脑损伤。持续10到15分钟的循环骤停几乎总是会永久性地破坏大量的智力能力。
多年来,人们认为这种对大脑的有害影响是由循环骤停期间发生的急性脑缺氧引起的。然而,实验表明,如果防止大脑血管中形成血栓,这也可以防止循环骤停期间大脑的早期恶化。例如,在动物实验中,循环骤停开始时将动物血管中的所有血液移除,然后在循环骤停结束时重新注入,以防止血管内凝血的发生。在这个实验中,大脑通常能够承受长达30分钟的循环骤停而不会出现永久性脑损伤。此外,在心脏骤停前给予肝素或链激酶(以防止血液凝固)被证明可以将大脑的存活时间延长至通常的两到四倍。
