调控RNA:修订间差异
外观
导入01>Qlf2007 无编辑摘要 |
小 导入1个版本:导入01 |
||
(没有差异)
| |||
2020年5月11日 (一) 14:53的版本
总论
- 调控RNA(Regulatory RNA)控制RNA的翻译,也有其它功能。
细菌的sRNA
sRNA的功能
- sRNA既可与其它RNA互补(称为反义RNA(Antisense RNA)),也可与蛋白质结合,发挥功能。
- 古菌、真核生物也有反义RNA。
- sRNA本身可监测温度、某种物质浓度等环境因子。
- 根据反义RNA与其影响的RNA是否完全配对,将反义RNA分为顺式(Cis-encoded)和反式(Trans-encoded)两种。
- 编码顺式反义RNA的基因出现在细菌染色体、质粒、噬菌体、转位子中。
- 它控制质粒的复制、接合。
- 它决定噬菌体是否将宿主裂解。
- 它控制转位子转位的频率。
- 它控制(通常是有毒的)蛋白合成。
- 顺式反义RNA的工作机制:(图1)
- 与mRNA结合,阻止核糖体翻译mRNA。
- 促进mRNA降解,通常由RNase III水解。
- 与mRNA结合,掩盖切割位点,防止mRNA被水解。
- 转录弱化(Transcription Attenuation),只出现在革兰氏阳性细菌。
- 转录干扰(Transcriptional Interference)。
- “伪结”干扰(Pseudoknot Formation Interference)。
- 启动子干扰。
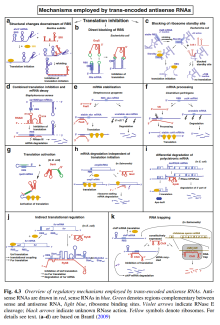
- 反式反义RNA在数量、功能、工作机制上都较丰富。
- 有些反式反义RNA同时是mRNA。
- 很多反式反义RNA需要Hfq蛋白(一种分子伴侣)的帮助才能和RNA结合。
- 反式反义RNA的工作机制:(图2)
- 抑制、促进翻译。
- 促进mRNA降解。
- 抑制翻译,同时促进mRNA降解。
- 稳定mRNA。
- 促进mRNA的后加工。
- RNA陷阱(RNA Trapping)。
- 古菌、真核生物也有“反义RNA”,但功能仅限于与mRNA互补,物理干扰mRNA翻译。
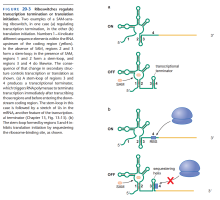
转录弱化
- mRNA存在两种可能二级结构,其中一种有转录终止柄环(Transcriptional Terminator Stem-loop)结构。
- 未完成转录的mRNA与反义RNA结合时,形成有转录终止环的二级结构。
- 转录终止环使mRNA转录提前终止,称为转录弱化现象。
转录干扰
- 转录干扰现象至今只观察到一例。
- 某细菌染色体有ubiGmccBA基因,其下游有一个反义RNA的启动子。
- 从该启动子可转录出四种反义RNA。
- 细胞中甲硫氨酸较高时,转录出的反义RNA最短,不干扰ubiGmccBA的转录。
- 细胞中甲硫氨酸越低,转录出的反义RNA越长,通过积累正超螺旋抑制ubiGmccBA的转录,称为转录干扰现象。
“伪结”干扰
- 翻译某个mRNA需要它有个“伪结”结构。
- 必须先合成repY,再合成repZ,由repZ干扰mRNA的一个柄环结构,才能形成伪结结构。
- 反义RNA既抑制repY的翻译,也抑制伪结结构的形成,称为伪结干扰现象。
启动子干扰
- 某些质粒复制时需复制原点有一个启动子RNAII。
- 对应的反义RNA(RNAI)与RNAII结合,阻止质粒复制,称为启动子干扰现象。
RNA陷阱
- ChiX是某细菌中的一种反式反义RNA。
- 一般情况下,ChiX抑制chiP(一种mRNA)的翻译并促进它降解。(但ChiX本身不被降解)
- 细菌细胞内出现某种物质时,细胞转录一种陷阱mRNA,与ChiX结合,二者同时被降解。
- ChiX被降解后,chiP得以翻译。
与蛋白质结合的sRNA
6S RNA
- 细菌在营养不足时,产生6S RNA。
- 6S RNA与σ70转录因子结合,抑制相关基因转录。
- 细菌同时产生σS转录因子,6S RNA帮助细菌过渡到新转录因子。
CsrB
- CsrA是一种蛋白质,通过翻译调控促进糖酵解,抑制糖异生。
- CsrB是一种sRNA,通过与CsrA结合,抑制CsrA的功能。
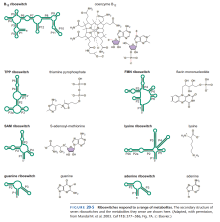
监测环境因子的sRNA(图3、4)
- 核开关(Riboswitch)能监测细胞中的环境因子。
- 核开关有时是mRNA的一部分。
- 温度或与某物质非共价结合能使核开关的二级结构改变。
- 二级结构的改变既可调控转录也可调控翻译。
细菌和古菌的CRISPR

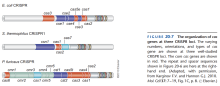

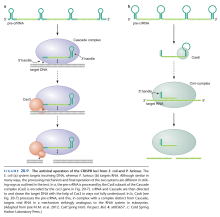
- 大部分细菌和古菌的基因组中有结构如图5所示的CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)结构。
- 每个基因组中可以有不止一个CRISPR结构。
- CRISPR是原核生物的免疫系统。
- CRISPR由高度保守的Repeat序列和高度自由的Spacer序列交替构成。
- Repeat和Spacer的长度都约为30 bp。
- CRISPR的一端有Leader序列,长约500 bp,富含A-T。
- 在Leader序列方向有若干编码蛋白质的基因,这些蛋白质与CRISPR功能有关。
- 上述基因中最保守的是cas1和cas2。
- 细菌被噬菌体或质粒感染时,感染者DNA的一部分(靠近一种叫PAM的序列)被写入靠近Leader序列的一端。
- CRISPR结构的转录启动子在Leader序列内。
- 整个CRISPR结构被转录为一个RNA,称为pre-crRNA。
- pre-crRNA被切割为若干crRNA。
- 每个crRNA的5'端为8个Repeat序列的碱基,中间为一个Spacer序列,3'端为下一个Repeat序列剪去8个碱基。
- crRNA随后与一个蛋白质复合体结合,识别外来核酸。如配对正确,则蛋白质复合体将外来核酸在配对处切开。
- CRISPR系统中的Cas9蛋白可用于一切生物的基因组编辑。
真核生物的RNA干扰(RNA Interference,RNAi)
- 真核生物的部分非编码RNA通过RNA干扰机制调控基因表达。(图9)
- 若上述RNA与mRNA结合紧密,则mRNA被立刻水解。
- “结合紧密”的关键是RNA的第9~11个核苷酸。
- 若上述RNA与mRNA结合不紧密,则mRNA先被抑制翻译,然后被水解。
- 若上述RNA与正在转录的RNA结合,则引起DNA构象改变,抑制其转录。
- 上述RNA有三类:siRNA、miRNA、piRNA,长度均约为20 nt,统称为小RNA(Small RNA,注意不是sRNA)。(piRNA略长)
miRNA
- miRNA参与细胞自身基因表达调控。
- miRNA由pri-miRNA经两次剪切产生。
- 绝大部分pri-miRNA源于基因的内含子或外显子,由RNA聚合酶II转录,此时pri-miRNA是mRNA。
- 基因组中5'端有Alu元素、MWIR元素、tRNA的pri-miRNA由RNA聚合酶III转录。
- miRNA在pri-miRNA中呈柄环结构。(图10、11)
- 每个pri-miRNA可含1~6个miRNA。
- 细胞核中,pri-miRNA被DGCR8蛋白(无脊椎动物中称为Pasha蛋白)识别,然后被Drosha酶(属于RNase III)将柄环结构剪切为pre-miRNA。
- DGCR8蛋白和Drosha酶共同构成“微处理”复合体(Microprocessor Complex)。
- pre-miRNA长约为70 nt。
- miRNA出现于柄环结构中柄的上半部分。
- pre-miRNA利用Exportin-5通过核孔进入细胞质。
- 细胞质内,Dicer酶将pre-miRNA从中间切下22 nt左右,切下部分为dsRNA。(下文暂称此RNA为pro-miRNA)
- pre-miRNA和pro-miRNA的每条链的3'端多出2个核苷酸。(RNase III切割的特征)
- 如果pre-miRNA富含G,可能形成G四联体结构,则不被Dicer酶处理。
- 植物细胞中产生miRNA的过程与上述略有不同,见图13。(它们的进化起源可能不同)
- 植物的miRNA处理不经过Drosha酶切。
- 植物的miRNA通常不在基因内,动物的miRNA通常在内含子内。
- 动物的miRNA主要与mRNA的3'端不翻译区结合,次要与外显子结合,少数与内含子结合。
- 植物的miRNA一般与外显子结合。
- RISC复合体结合Dicer酶切下的dsRNA,使它变性,抛弃其中一条链,另一条链成为miRNA,此过程称为RISC复合体的成熟(Maturation)。
- 若切下的dsRNA只有一条链成为miRNA,此链称为Guide Strand,另一条链称为Passenger Strand。(也可能两条链都成为miRNA)
siRNA
- siRNA帮助细胞抵抗外来RNA。
- siRNA绝大部分产生于外源的dsRNA,极少数产生于细胞转录的dsRNA。
- siRNA是双链结构,而pre-miRNA是发夹结构。(区分siRNA和miRNA的唯一标准)
- Dicer酶处理dsRNA产生新的dsRNA(暂称为pro-siRNA),它与RISC复合体结合。(类似于pro-miRNA)
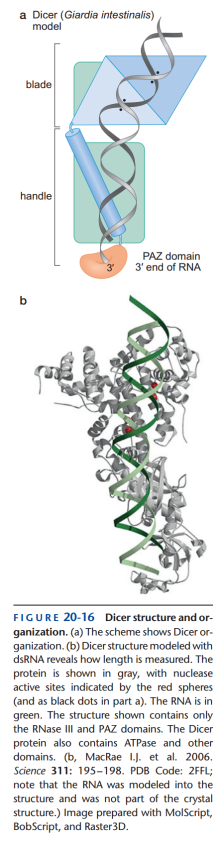
Dicer酶(图12)
- Dicer酶由2个RNase III亚基、1个PAZ亚基组成。
- Dicer酶既可切割发夹结构,也可切割双链结构,但每条链一3'端要多出2个核苷酸。
- PAZ亚基固定3'端的2个核苷酸。
- 两个RNase III的切割位点距离PAZ亚基约20个核苷酸长,从而切下的dsRNA每条链也约为此长度。
piRNA
- piRNA只出现于动物细胞内,帮助细胞抑制转位子。(植物用siRNA对抗转位子)
- piRNA几乎只在生殖细胞中表达。
- piRNA源于细胞转录出的ssRNA,具体产生过程尚不清楚,但Dicer酶一定不参与。
- piRNA的5‘端一般是U,3'端磷酸基团的3'羟基一般变为氧甲基。
- 细胞核内也有piRNA,作用不明。
RISC复合体及其它
- 5'端的核苷酸以A或U为主的链更容易被选为Guide Strand。
- RISC复合体的核心是Argonaute酶。
- Argonaute酶将与Guide Strand紧密配对的RNA剪断,从而阻止翻译。(图14)
- Argonaute酶亦可抑制RNA翻译。(图15)
- 植物(包括真菌)、低等动物(不包括果蝇)的细胞内有以RNA为模板的RNA聚合酶(RdRP)。
- 未与RISC复合体结合的小RNA可直接与mRNA结合,此时RdRP以小RNA为引物,合成一条链,组成dsRNA。
- 上述dsRNA可被Dicer酶处理,形成新小RNA,从而放大RNAi现象。
RNAi与生物技术
- 转基因技术中,导入同一基因的多个拷贝会引起共抑制现象(Cosuppresion)。
- 共抑制现象原因尚不清楚,但转录组研究显示细胞产生了对应于多拷贝基因的miRNA。
- RNAi被用于人工基因表达调控:
- 最早,先在试管内合成特定dsRNA,然后注入秀丽隐杆线虫细胞。
- 随后,发现直接将秀丽隐杆线虫浸泡在dsRNA溶液里也能注入dsRNA。(但哺乳动物细胞不行)
- 后来,先将dsRNA对应的DNA导入大肠杆菌的质粒,使大肠杆菌产生dsRNA,然后给线虫喂食大肠杆菌。
- 哺乳动物细胞中,以上方法成功率都不高,因为较长的dsRNA易引起干扰素(Interferon)反应,进而细胞凋亡。
- 现代,先将构造的DNA序列导入动物细胞的基因组中,该序列转录产生自动折叠为柄环结构的RNA(shRNA),模仿pre-RNA的功能。
- 此方法可使线虫的全部细胞永久具有该dsRNA的干扰效果。
真核生物的长非编码RNA(lncRNA)
- lncRNA指长度大于200 nt的非编码RNA。
- lncRNA的功能非常复杂,包括:
- 抑制或激活特定基因的转录;
- 控制通用转录因子(General Transcription Factor)或RNA聚合酶本身;(此类lncRNA多由RNA聚合酶III转录)
- 控制mRNA剪接(Slicing);
- 控制mRNA翻译;(此现象在神经细胞中尤为明显)
- 控制表观遗传。(典型:Xist控制形成巴氏小体,见下文)
Xist
- 雌性胎盘动物(后兽亚纲和真兽亚纲)在胚胎有32~64个细胞时,每个细胞中两条X染色体中任意一条变为异染色质(失活),称为巴氏小体(Barr's Body)。
- 若失活的X染色体来自父方(母方),则该细胞分裂产生的所有细胞中失活的X染色体都来自父方(母方)。
- 正常的X染色体记作Xa,失活的X染色体记作Xi。
- 后兽亚纲动物中,总是来自父方的X染色体变为异染色质。
- 老鼠胚胎有2~4个细胞时,来自父方的X染色体因染色体印记而失活,但在囊胚早期此染色体复活。(但胚外组织,包括胎盘,其细胞中此X染色体永久失活)
- X染色体上有XIC区域(X-inactivation Center)。
- XIC区域包含4个基因:Xist、Tsix、Jpx、Ftx。
- Xist和Tsix互为反义RNA,互相抑制转录。
- 胚胎初期,所有细胞少量转录Xist。
- 胚胎达到32细胞时,每个细胞中其中一个X染色体不再转录Xist,另一个大量转录Xist。
- Xist有3'端多聚A,要经历剪接,但不编码蛋白质,属于伪基因(Pseudogene)。
- Xist是唯一Xa不表达,Xi大量表达的基因。
- Xist先逐步包裹转录出它的X染色体。(尚不清楚为何不包裹另一条X染色体)
- Xist吸引其它蛋白质(如PRC2)对X染色体进行修饰。
- X染色体失活修饰包括:高DNA甲基化、低组蛋白乙酰化、低H3K4甲基化、高H3K9甲基化。
- 只有失活X染色体中出现一种罕见组蛋白macroH2A(又名H2AFY),替代正常组蛋白H2A。
- 将XIC区域移入其它染色体,该染色体也会出现上述失活现象。
参考文献
- 《Molecular Biology of the Cell》第7章
- 《Molecular Biology of the Gene》第20章
