脂质在质膜中的功能:修订间差异
无编辑摘要 |
无编辑摘要 |
||
| 第56行: | 第56行: | ||
在真细菌中,脂肪酸链长从 12 到 18 个碳不等,可以完全饱和或含有双键(见第 3 章)。一些革兰氏阳性菌含有奇数支链脂肪酸,而不是不饱和脂肪酸。真核生物脂质含有长达 26 个碳的脂肪酸链,具有多个双键或没有双键。磷脂的头部基团(图 1.4A)扩大了脂质的多样性。 | 在真细菌中,脂肪酸链长从 12 到 18 个碳不等,可以完全饱和或含有双键(见第 3 章)。一些革兰氏阳性菌含有奇数支链脂肪酸,而不是不饱和脂肪酸。真核生物脂质含有长达 26 个碳的脂肪酸链,具有多个双键或没有双键。磷脂的头部基团(图 1.4A)扩大了脂质的多样性。 | ||
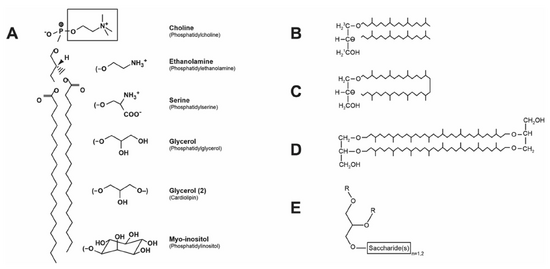
'''在古菌中,sn-1 甘油(D-甘油)形成骨架,疏水域由 2 和 3 位(古菌醇)以醚键连接的植烷基(饱和异戊二烯基)组成(图 1.4B)。'''此外,两个 sn-1- | '''在古菌中,sn-1 甘油(D-甘油)形成骨架,疏水域由 2 和 3 位(古菌醇)以醚键连接的植烷基(饱和异戊二烯基)组成(图 1.4B)。'''此外,两个 sn-1-甘油基团通过两个biphytanyl groups (dibiphyta nyldiglycerophosphatetetraether) (图 1.4C)或 biphytanyl diglycerol diether(图 1.4D)以醚键连接,形成共价连接的双层。'''许多古细菌磷脂含有甘油、丝氨酸、乙醇胺、肌醇以及甘油甲基磷酸酯和心磷脂 (CL) 类似物'''的头部基团。古细菌还具有中性聚糖脂质衍生物,其中单糖和双糖(葡萄糖或半乳糖)直接与古细菌醇的 sn-1 位相连(图 1.4E)。古细菌膜对这些嗜极生物的严酷酸性和高温环境具有很强的抵抗力。古细菌脂质双层的进一步稳定性来自许多横跨膜的碳氢化合物链,每个末端都有共价连接的头部基团。一些真细菌(主要是嗜热菌)具有'''dialkyl'''(醚键连接的长链醇)磷脂,并且在真核生物的缩醛磷脂中也发现了类似的醚键(参见第 7 章)。 | ||
[[文件:脂质1-4.png|无框|550x550像素]] | |||
(PC)。用其他头部基团取代胆碱 (方框) 可产生所示的磷脂。 (B) 古生菌二烷基甘油的结构,其植烷基链以醚键连接到 sn-1-甘油 (古生菌) 的 2 位和 3 位。图中显示的是二植烷基甘油 (C20eC20 二醚),其中标明了甘油的立体化学。 | 图 1.4 甘油磷酸基脂质的结构。 (A) 所示的脂质结构为 1,2 二硬脂酰-sn-甘油-3-磷酸胆碱或磷脂酰胆碱(PC)。用其他头部基团取代胆碱 (方框) 可产生所示的磷脂。 (B) 古生菌二烷基甘油的结构,其植烷基链以醚键连接到 sn-1-甘油 (古生菌) 的 2 位和 3 位。图中显示的是二植烷基甘油 (C20eC20 二醚),其中标明了甘油的立体化学。(C) 环状双植烷基 (C40) 二醚。 (D) 双植烷基二甘油二醚。 (E) 在 sn-1-甘油的 1 位上具有单糖或双糖(葡萄糖或半乳糖)的甘油聚糖。R 基团是醚连接的植烷基链。在真细菌和植物中也发现了类似的甘油聚糖,其具有 sn-3-甘油骨架和在 1 位和 2 位上具有酯连接的脂肪酸链。 | ||
关于脂质化学和物理性质的大部分信息来自对真细菌和真核生物的主要磷脂类的研究。在真细菌(见第 3 章)和真核生物(见第 7 章)中,脂质代谢的生物合成途径和遗传学也得到了广泛的研究。更常见的脂质的物理性质如何随环境而变化将在后面讨论。 | |||
=== 2.2 糖脂Saccharolipids === | |||
革兰氏阴性菌的 OM 含有脂多糖 (LPS) 或内毒素,其骨架由葡萄糖胺磷酸盐而非甘油磷酸盐组成(图 1.5A)。 | |||
大肠杆菌的核心脂质(脂质 A)含有两个葡萄糖胺基团,以 b1-6 键连接,在位置 2、3、2'和 3' 处用 R-3羟基肉豆蔻酸 (C14) 修饰,在位置 1 和 40 处用磷酸盐修饰(图 1.5B)。在位置 60 处用 KDO 二糖(以 1e3 键连接的两个 3-脱氧-D-甘露-辛酮糖酸)进一步修饰,产生 KDO2脂质 A,该脂质 A 进一步由内核、外核和O 抗原修饰。脂质 A 的研究具有临床重要性,因为它是导致中毒性休克综合征的主要抗原。 | |||
大肠杆菌的核心脂质(脂质 A)含有两个葡萄糖胺基团,以 | |||
核心脂质 A 形成革兰氏阴性菌 OM 双层的外单层,内单层由磷脂组成(约 90% PE)(图 1.5A)。LPS 在组装后会根据环境因素(例如生长培养基、温度、离子特性和抗菌剂)发生修饰,并在肠道和非肠道革兰氏阴性菌中表现出额外的多样性。 | 核心脂质 A 形成革兰氏阴性菌 OM 双层的外单层,内单层由磷脂组成(约 90% PE)(图 1.5A)。LPS 在组装后会根据环境因素(例如生长培养基、温度、离子特性和抗菌剂)发生修饰,并在肠道和非肠道革兰氏阴性菌中表现出额外的多样性。 | ||
| 第88行: | 第73行: | ||
OM 中 LPS(外层小叶)和 PE(周质小叶)的高度不对称跨膜排列预计处于非平衡热力学状态,这种状态在正常生长的细胞中得以维持。然而,应激条件(酸性 pH、螯合剂和洗涤剂)会将 LPS 从外层小叶移位,并促使磷脂异常易位到 OM 的外层小叶,取代已脱落的 LPS 分子。 | OM 中 LPS(外层小叶)和 PE(周质小叶)的高度不对称跨膜排列预计处于非平衡热力学状态,这种状态在正常生长的细胞中得以维持。然而,应激条件(酸性 pH、螯合剂和洗涤剂)会将 LPS 从外层小叶移位,并促使磷脂异常易位到 OM 的外层小叶,取代已脱落的 LPS 分子。 | ||
2.3 | === 2.3 鞘脂Sphingolipids === | ||
所有真核细胞都含有由棕榈酰辅酶 A 和丝氨酸缩合形成的长链基团,然后转化为核心神经酰胺分子(见第 9 章)(图 1.6A)。在高等真核生物中,来自棕榈酸的长链碱基可以具有额外的双键和羟基,以及酰胺连接脂肪酸的多样性,最多可以有 26 个碳长度。 | |||
所有真核细胞都含有由棕榈酰辅酶 A | |||
酵母细胞主要含有植物神经酰胺phytoceramide (4-羟基神经酰胺) 和酰胺键中的 C26 脂肪酸链的衍生物。鞘脂的主要类别根据在初级处酯化的头部基团分组 | |||
图 1.5 大肠杆菌双膜包膜。(A)革兰氏阴性菌被两个脂质双层包裹,由含有肽聚糖细胞壁的周质空间隔开。革兰氏阴性菌的不对称磷脂外膜 (OM) 是抵御包括抗生素在内的细胞毒性物质的第一道防线。OM 由磷脂的内单层和脂质的外单层组成。脂多糖 (LPS) 的一部分仅位于 OM 的外叶中。周质空间含有膜衍生的寡糖 (MDO),它是渗透压调节系统的组成部分。氨基酸脱糖交联肽聚糖为细胞膜提供结构刚性。(B)KDO2-脂质A的结构。脂质A是葡萄糖胺磷酸盐的二糖,通过酰胺和酯键与所示链长的脂肪酸进行多重酰化。改编自Raetz等人的《发现新的生物合成途径:脂质A的故事》,《脂质研究杂志》,2009年,50:S103eS108 | 图 1.5 大肠杆菌双膜包膜。(A)革兰氏阴性菌被两个脂质双层包裹,由含有肽聚糖细胞壁的周质空间隔开。革兰氏阴性菌的不对称磷脂外膜 (OM) 是抵御包括抗生素在内的细胞毒性物质的第一道防线。OM 由磷脂的内单层和脂质的外单层组成。脂多糖 (LPS) 的一部分仅位于 OM 的外叶中。周质空间含有膜衍生的寡糖 (MDO),它是渗透压调节系统的组成部分。氨基酸脱糖交联肽聚糖为细胞膜提供结构刚性。(B)KDO2-脂质A的结构。脂质A是葡萄糖胺磷酸盐的二糖,通过酰胺和酯键与所示链长的脂肪酸进行多重酰化。改编自Raetz等人的《发现新的生物合成途径:脂质A的故事》,《脂质研究杂志》,2009年,50:S103eS108 | ||
2025年1月26日 (日) 16:45的版本
缩写列表
- (Man)2 DAG 二甘露糖基 DAG
- CL 心磷脂
- CMC 临界胶束浓度
- EMD 膜外结构域
- GalDAG 单半乳糖基 DAG
- GalGlcDAG 半乳糖基糖基 DAG
- GlcDAG 单葡萄糖基二酰甘油
- GlcGlcDAG 或 (Glc)2 二葡萄糖基 DAG
- GlcN-PG 葡萄糖胺基 PG
- ISOvs 内外膜囊泡
- Ld 液体无序
- Lo 液体有序
- LPE Lyso PE
- LysPG 赖氨酸 PG
- MP 膜蛋白
- MPE 单甲基 PE
- OL 鸟氨酸脂质
- Orn-PG鸟氨酸 PG
- PA 磷脂酸
- PC 磷脂酰胆碱
- PE 磷脂酰乙醇胺
- PG 磷脂酰甘油
- PI 磷脂酰肌醇
- PS 磷脂酰丝氨酸
- Tm 中点温度
- TMD 跨膜结构域
1. 简介和概述
由于脂质参与细胞过程的多效性及其结构和性质的多样性,定义脂质在细胞结构和功能中的作用落后于其他大分子的进展。不同原核生物和真核生物、单细胞和多细胞生物以及不同亚细胞器和细胞内区室的脂质组成差异很大。甘油基糖脂和磷脂、固醇和鞘脂是生物膜双层结构的主要组成部分,决定了细胞和细胞器的通透性屏障(图 1.1A 和 B)。
甘油基磷脂(以下称为磷脂)约占原核和真核细胞总膜脂的 75%(见第 3 章和第 7 章)。图 1.2 和 1.3 显示了生物膜中发现的主要脂质,但没有显示次要脂质,其中许多具有重要的功能。
细菌膜的主要成分是带电和两性离子磷脂和中性糖脂,两者的平衡是维持膜总电荷所必需的(图 1.2)。中性二酰甘油聚糖是许多革兰氏阳性菌和植物的主要膜形成成分。革兰氏阴性菌利用糖脂(脂质 A)作为外膜(OM)外叶的主要结构成分,而革兰氏阳性菌则缺乏这种成分。真核细胞器膜(图 1.3)也独特地含有胆固醇、麦角固醇和植物固醇。哺乳动物细胞的主要固醇是胆固醇,而酵母含有麦角固醇(见第 10 章)。基于神经酰胺的鞘脂也大量存在于所有真核生物的膜中(见第 9 章)。一些真核微生物还含有鞘脂和疏水性固醇。细菌不合成固醇,但一些致病物种会从环境中吸收固醇。尽管存在编码生物合成酶的基因的真正直系同源物,但果蝇无法从头合成胆固醇并从外源获取胆固醇。
脂质疏水域的多样性导致了额外的多样性。在真核生物和真细菌中,这些域是饱和和不饱和脂肪酸,脂肪醇的含量较少。许多革兰氏阳性菌也含有支链脂肪酸。如果考虑一个简单的生物体,如大肠杆菌,有三种主要磷脂,含有几种不同的脂肪酸,单个磷脂物种的数量在数百种范围内。在更复杂的真核生物中,磷脂和脂肪酸的多样性都更高,单个物种的数量可达数千种(见第 2 章)。鞘脂表现出类似程度的多样性,当添加到类固醇中时,真核脂质组的大小远远超过蛋白质组的大小。
图 1.1 膜双层结构。(A)真核细胞膜的流体镶嵌模型是对 Singer 和 Nicholson 提出的原始模型的改编。磷脂双层中,完整膜蛋白呈斑点状,通过其 α-螺旋跨膜结构域 (TMD) 穿过膜双层。外周膜蛋白与脂质物种亚群或其他膜蛋白相关。脂筏(深绿色头基)富含胆固醇和鞘脂,并含有 GPI 锚定蛋白。紫色头基表示与蛋白质紧密相关的脂质。(B)模拟质膜的近乎真实的计算视图。分子动力学建模显示成分复杂性异质 TMD 和典型细胞膜的横向组织,含有数百种不同的脂质,不对称分布在两个双层小叶之间,挤满了蛋白质,估计覆盖膜面积可达 30%。经 Marrink 等人许可转载。Chem Rev 2019;119:6184e6226。
图 1.2 革兰氏阴性菌 (A) 和革兰氏阳性菌 (B) 的磷脂谱以饼图显示。成分以摩尔百分比表示。
脂质双层为膜内蛋白 (MP) 提供溶剂,膜内蛋白的跨膜结构域 (TMD) 横跨双层并整合到由亲水性和带电脂质头基包围的高度疏水性内部。后者充当外周 MP 结合的支架(图 1.1)。膜的脂质和蛋白质成分不是通过共价相互作用结合在一起的,因此处于动态平衡状态,在超分子膜结构内经历瞬时相互作用。正如将进一步讨论的那样,膜表面的界面区域以不同于细胞水相的方式组织水和反离子,这赋予与膜紧密接触的水层独特的特性。
图 1.3 真核细胞器膜中脂质的分布。图中显示了单个磷脂和鞘磷脂 (SM) 在细胞器中的分布,以及总磷脂在这些隔室中的分布。经 Yang 等人许可改编。
确定单个脂质的功能和膜脂双层的集体特性一直具有挑战性。许多脂质功能是通过体外观察到的对蛋白质和其他生物成分的偶然影响来定义的,但在体内很少得到验证。遗传学方法在定义蛋白质功能方面取得了成功,但由于脂质是通过复杂的生物合成途径而不是直接的遗传决定产生的,因此这种方法很复杂。为了改变体内的脂质组成,必须对这些生物合成途径中的酶进行突变,这可能会影响多种脂质前体和产物。由于脂质与蛋白质不同,并不局限于细胞中的特定位置,因此脂质合成的遗传操作具有全局效应。然而,将遗传研究与体内表型的生化表征和体外定义的重组系统的研究相结合,揭示了膜脂质在细胞功能中的具体和一般作用。本章将概述脂质的多种结构、化学和超分子特性。将总结研究体内脂质功能的遗传方法。最后,将回顾脂质的物理和化学性质与其在生物系统中的多种功能之间的关系,为天然膜中脂质结构的多样性提供分子基础。
2. 脂质结构的多样性
脂质最初被定义为易溶于有机溶剂(如氯仿、乙醚或甲苯)的生物分子。然而,许多肽和一些疏水性蛋白质也溶于有机溶剂,而具有较大亲水域的脂质不易溶于这些溶剂。在这里,我们将考虑那些对膜结构有重大贡献或在决定蛋白质结构或功能方面发挥作用的脂质。美国的 LIPID MAPS 联盟 (http://www.lipidmaps.org)、日本的 Lipid Bank (http://www.lipidbank.jp) 和欧洲的 LipidomicNet (http://www.lipomicnet.org) 合作设计了分类系统和方法,以造福研究人员。
2.1 甘油脂Glycerolipids
真细菌和真核生物中的二酰甘油骨架是 sn-3-甘油 (L-甘油),在 1 和 2 位与长链脂肪酸酯化 (图 1.4A)。
在真细菌中,脂肪酸链长从 12 到 18 个碳不等,可以完全饱和或含有双键(见第 3 章)。一些革兰氏阳性菌含有奇数支链脂肪酸,而不是不饱和脂肪酸。真核生物脂质含有长达 26 个碳的脂肪酸链,具有多个双键或没有双键。磷脂的头部基团(图 1.4A)扩大了脂质的多样性。
在古菌中,sn-1 甘油(D-甘油)形成骨架,疏水域由 2 和 3 位(古菌醇)以醚键连接的植烷基(饱和异戊二烯基)组成(图 1.4B)。此外,两个 sn-1-甘油基团通过两个biphytanyl groups (dibiphyta nyldiglycerophosphatetetraether) (图 1.4C)或 biphytanyl diglycerol diether(图 1.4D)以醚键连接,形成共价连接的双层。许多古细菌磷脂含有甘油、丝氨酸、乙醇胺、肌醇以及甘油甲基磷酸酯和心磷脂 (CL) 类似物的头部基团。古细菌还具有中性聚糖脂质衍生物,其中单糖和双糖(葡萄糖或半乳糖)直接与古细菌醇的 sn-1 位相连(图 1.4E)。古细菌膜对这些嗜极生物的严酷酸性和高温环境具有很强的抵抗力。古细菌脂质双层的进一步稳定性来自许多横跨膜的碳氢化合物链,每个末端都有共价连接的头部基团。一些真细菌(主要是嗜热菌)具有dialkyl(醚键连接的长链醇)磷脂,并且在真核生物的缩醛磷脂中也发现了类似的醚键(参见第 7 章)。
图 1.4 甘油磷酸基脂质的结构。 (A) 所示的脂质结构为 1,2 二硬脂酰-sn-甘油-3-磷酸胆碱或磷脂酰胆碱(PC)。用其他头部基团取代胆碱 (方框) 可产生所示的磷脂。 (B) 古生菌二烷基甘油的结构,其植烷基链以醚键连接到 sn-1-甘油 (古生菌) 的 2 位和 3 位。图中显示的是二植烷基甘油 (C20eC20 二醚),其中标明了甘油的立体化学。(C) 环状双植烷基 (C40) 二醚。 (D) 双植烷基二甘油二醚。 (E) 在 sn-1-甘油的 1 位上具有单糖或双糖(葡萄糖或半乳糖)的甘油聚糖。R 基团是醚连接的植烷基链。在真细菌和植物中也发现了类似的甘油聚糖,其具有 sn-3-甘油骨架和在 1 位和 2 位上具有酯连接的脂肪酸链。
关于脂质化学和物理性质的大部分信息来自对真细菌和真核生物的主要磷脂类的研究。在真细菌(见第 3 章)和真核生物(见第 7 章)中,脂质代谢的生物合成途径和遗传学也得到了广泛的研究。更常见的脂质的物理性质如何随环境而变化将在后面讨论。
2.2 糖脂Saccharolipids
革兰氏阴性菌的 OM 含有脂多糖 (LPS) 或内毒素,其骨架由葡萄糖胺磷酸盐而非甘油磷酸盐组成(图 1.5A)。
大肠杆菌的核心脂质(脂质 A)含有两个葡萄糖胺基团,以 b1-6 键连接,在位置 2、3、2'和 3' 处用 R-3羟基肉豆蔻酸 (C14) 修饰,在位置 1 和 40 处用磷酸盐修饰(图 1.5B)。在位置 60 处用 KDO 二糖(以 1e3 键连接的两个 3-脱氧-D-甘露-辛酮糖酸)进一步修饰,产生 KDO2脂质 A,该脂质 A 进一步由内核、外核和O 抗原修饰。脂质 A 的研究具有临床重要性,因为它是导致中毒性休克综合征的主要抗原。
核心脂质 A 形成革兰氏阴性菌 OM 双层的外单层,内单层由磷脂组成(约 90% PE)(图 1.5A)。LPS 在组装后会根据环境因素(例如生长培养基、温度、离子特性和抗菌剂)发生修饰,并在肠道和非肠道革兰氏阴性菌中表现出额外的多样性。
OM 中 LPS(外层小叶)和 PE(周质小叶)的高度不对称跨膜排列预计处于非平衡热力学状态,这种状态在正常生长的细胞中得以维持。然而,应激条件(酸性 pH、螯合剂和洗涤剂)会将 LPS 从外层小叶移位,并促使磷脂异常易位到 OM 的外层小叶,取代已脱落的 LPS 分子。
2.3 鞘脂Sphingolipids
所有真核细胞都含有由棕榈酰辅酶 A 和丝氨酸缩合形成的长链基团,然后转化为核心神经酰胺分子(见第 9 章)(图 1.6A)。在高等真核生物中,来自棕榈酸的长链碱基可以具有额外的双键和羟基,以及酰胺连接脂肪酸的多样性,最多可以有 26 个碳长度。
酵母细胞主要含有植物神经酰胺phytoceramide (4-羟基神经酰胺) 和酰胺键中的 C26 脂肪酸链的衍生物。鞘脂的主要类别根据在初级处酯化的头部基团分组
图 1.5 大肠杆菌双膜包膜。(A)革兰氏阴性菌被两个脂质双层包裹,由含有肽聚糖细胞壁的周质空间隔开。革兰氏阴性菌的不对称磷脂外膜 (OM) 是抵御包括抗生素在内的细胞毒性物质的第一道防线。OM 由磷脂的内单层和脂质的外单层组成。脂多糖 (LPS) 的一部分仅位于 OM 的外叶中。周质空间含有膜衍生的寡糖 (MDO),它是渗透压调节系统的组成部分。氨基酸脱糖交联肽聚糖为细胞膜提供结构刚性。(B)KDO2-脂质A的结构。脂质A是葡萄糖胺磷酸盐的二糖,通过酰胺和酯键与所示链长的脂肪酸进行多重酰化。改编自Raetz等人的《发现新的生物合成途径:脂质A的故事》,《脂质研究杂志》,2009年,50:S103eS108
第19章
10
图1.6鞘脂结构。(A)鞘氨醇是一种具有不饱和烃链的18碳氨基醇。神经酰胺由鞘氨醇和N酰化脂肪酸组成。头部基团 (R) 被添加到神经酰胺中以形成所示的鞘脂。 (B) 半乳糖神经酰胺 (GalCer) 与胆固醇复合的分子建模模拟,其中半乳糖头部基团通过涉及胆固醇羟基 (供体基团)、鞘氨醇氮原子和糖苷键氧原子 (均为受体基团) 的氢键网络维持。 经 Yahi 等人许可改编。 PLoS One 2010;5:e9079。 神经酰胺的 b-羟基 (图 1.6A)。 鞘磷脂在此位置有磷酸胆碱,而糖鞘脂有不同长度的寡糖。酸性鞘糖脂主要存在于哺乳动物细胞中,在末端糖位置含有硫酸化糖(硫酸脂)或唾液酸(神经节苷脂)。酵母鞘脂含有与羟基相连的肌醇磷酸和甘露糖肌醇磷酸。鞘脂的酰胺键和羟基允许与胆固醇等其他脂质发生特定的氢键相互作用(图 1.6B)。
3. 溶液中脂质的性质
定义生物膜的基质是脂质双层,由与水隔绝的疏水核心和与水相互作用的离子表面组成,并定义疏水-亲水界面。我们对溶液中脂质的物理性质以及脂质双层形成的驱动力的大部分理解都来自 Walter Kauzmann 在驱动蛋白质折叠的力的背景下描述的“疏水键”概念,后来 Charles Tanford 将其扩展为“疏水效应”,以解释生物系统中脂质的自缔合 [1]。膜结构的“流体镶嵌”模型进一步普及了这些概念 [2]。虽然该模型刺激了 MP 领域的研究,但它将脂质归为整体角色,即 MP 驻留和发挥作用的流体基质。如下文所述,我们目前对脂质在细胞功能中的作用的理解与蛋白质一样具体和动态。
3.1 为什么会形成膜?
极性脂质本质上是两亲性的,包含不与水相互作用的疏水域和易于相互作用的亲水域
第章 | 1 11
与水。疏水效应的基本前提是碳氢化合物域通过在非极性域周围诱导有序的笼状结构来扭曲水的稳定氢键结构 [1]。疏水域的自缔合使与水接触的总表面积最小化,从而导致熵驱动的水结构松弛和最终自缔合分子组织的能量最小。脂质的极性域通过氢键或离子相互作用与水或其他脂质头部基团相互作用,因此在水环境中能量稳定。极性脂质在水中的结构组织由其浓度和相反力定律决定,即驱动疏水域自缔合的疏水力与反对自缔合的紧密关联的极性域的空间和离子排斥力。在低浓度下,存在两亲分子t 作为单体存在于溶液中。随着分子浓度的增加,它们作为单体在溶液中的稳定性会降低,直到紧密堆积的极性域的不利排斥力被疏水域的有利自缔合力所抵消。此时,称为临界胶束浓度 (CMC),浓度进一步增加会导致形成越来越多的自缔合单体,并与恒定量的游离单体保持平衡。由于疏水效应的增加,疏水域越大,CMC 越低。然而,由于中性域的空间位阻或离子域的电荷排斥,增加极性域的有效尺寸会增加 CMC。由于电荷排斥效应的减弱,溶液相的离子强度增加,带净电荷的两亲分子的 CMC 会降低。这些物理特性和两亲分子的形状定义了溶液中极性脂质和洗涤剂的三种超分子结构组织(图 1.7)。洗涤剂、洗涤剂类溶血磷脂(仅含有一个烷基或酰基链)和具有短烷基或酰基链(8 个或更少碳)的磷脂具有倒锥形(相对于小疏水域,头部基团较大),并在 CMC 上方以较小的曲率半径自缔合,形成具有疏水核心(不包括水)的胶束结构。胶束表面不是光滑的球形或椭圆形结构,疏水域完全隔离在与水相互作用的极性残基壳内,而是一个非常粗糙的表面,许多疏水域暴露在水中。整体结构反映了两亲分子在能量最小时的最佳堆积,受反作用力定律支配。大多数洗涤剂的 CMC 范围从
微摩尔到毫摩尔。溶血磷脂也形成 CMC 在微摩尔范围内的胶束。然而,链长为 16
碳的磷脂在浓度约为 10 10 M 时自缔合。大多数具有长酰基链的磷脂在生理状态下呈圆柱形
12
图 1.7 脂质表现出的多态相和分子形状。胶束的空间填充
模型是 β-D-辛基葡萄糖苷胶束(50 个单体)。洗涤剂分子的极性部分(氧原子为红色)没有完全覆盖胶束表面
(碳氢化合物为灰色),使核心的大部分暴露在本体溶剂中。具有两个长烷基链的极性脂质采用双层或非双层 (HII) 结构,具体取决于分子的几何形状(分别为圆柱形或锥形)和环境条件。
温度导致脂质双层组织,从而最大限度地将水排除在疏水域之外。这就是双层排列是生物膜的共同特征的原因。由于头部基团之间的排斥力,甘油骨架附近的烃链的相当一部分暴露在水中。由于双层的自由边缘与水的结合在能量上不利,含有长链脂肪酸的磷脂倾向于自发形成围绕水性腔域的封闭囊泡。
圆柱形脂质(头部基团和疏水域直径相似),例如 PC,形成脂质双层。锥形脂质(相对于较大的疏水域,头部基团较小)如 PE,含有至少一个不饱和脂肪酸,或在二价阳离子存在下为 CL,通常随着温度升高而形成倒置胶束结构。这些后者结构被称为六边形 II (HII) 和立方相(类似于 HII 相的更复杂组织)。脂质形成多种结构关联的能力称为脂质多态性。PE、PA、CL 和二酰甘油的单糖衍生物可以存在于双层或非双层相中,具体取决于溶剂条件、酰基链组成和温度。这些相由亲水域和疏水域在自缔合时的堆积几何形状控制,如下所述。然而,非双层生物脂质,即使是纯态,在生理温度下也会显示双层结构。将非双层形成脂质添加到双层形成脂质中会改变双层的物理性质,因为双层结构中的形状差异和应变会引入横向应力。当双层形成脂质在水气界面上以单层形式铺展时,它们会以面向空气的疏水域为导向,并且不会弯曲远离或朝向水相。双层形成脂质的单层n 形脂质(HII 形成)倾向于向水界面弯曲(负曲率半径),而倒锥形脂质单层(胶束形成)倾向于远离水相弯曲(正曲率半径)。将负弯曲 PE 引入 PC 双层会导致双层“失稳”;双层内未满足的高曲率会导致存储的曲率弹性应力,这是因为每个单层都倾向于向周围的水相发生正曲率。可以通过插入双层脂质、正弯曲脂质(溶菌脂质)或蛋白质来缓解这种应力,这些蛋白质将放松“失稳”的双层。
3.2 膜双层的物理性质
溶液中磷脂的组织取决于酰基链、头部基团和溶剂条件(即离子强度、pH 和温度)的性质。纯脂质在溶液中的组织状态之间的转变可以通过物理技术测量,例如 31P NMR 和
微量热法。有序凝胶 (Lβ) 和液晶 (La) 相之间的差异在于脂质疏水域的粘度或流动性,这是温度和酰基链结构的函数。
在熔化温度 (Tm) 以下,双层存在于凝胶相中,其中脂质酰基链有序且其流动性受到限制(图 1.8)。
在 Tm 以上,双层存在于液晶相中,其中酰基链是流动的和无序的。
当双层由具有不同 Tm 的两种脂质组成时,可能会发生相分离。凝胶相似乎不存在于生物膜中,但当膜含有鞘脂和/或胆固醇时,两个流体相之间可能会发生相分离。在这种情况下,
14
图 1.8 生物膜的相特性。Lb(凝胶)和 La(液晶)双层相在疏水域内的顺序和单个脂质分子的流动性方面有所不同。经 Baoukina 和 Tieleman 许可改编,Methods Mol Biol 2015;
1232:307e322。
随着胆固醇含量的增加,液体有序 (L0) 相可以从液晶相分离,然后从液体无序 (Ld) 相分离。
在任何给定温度下,双层碳氢化合物核心的“流动性”(粘度的倒数)随着不饱和或支链酰基链含量的增加或酰基链长度的减少而增加。由于脂肪酸链随着温度升高而移动性增强,脂质疏水域的流动性和所占空间也随之增加,这也倾向于使头部基团分开。双层形成脂质(如 PC)在很宽的温度范围内呈现圆柱形,并具有不同的酰基链组成。当以纯形式分析时,PC 存在于 Lb 或 La 相中,主要取决于其酰基链组成和温度。非双层形成脂质(如 PE)在低温下存在于 Lb 相中,在中等温度下存在于 La 相中,在高温下存在于 HII 或立方相中。最后的转变也取决于脂质的形状。具有相对较小的头部基团的脂质的超分子组织可以从圆柱形变为圆锥形(HII 相),这是随着不饱和度或酰基链长度的增加或温度的升高而发生的。由于脂质混合物的物理性质由每种组成脂质决定,因此人工或生物膜的 Tm 严格取决于其脂质组成和脂质分子形式。从 Lb 相到 La 相的转变 Tm 随着脂肪酸的长度和饱和度的增加而增加,但 La 相和 HII 相之间的转变温度 (TLH) 中点随着链长的增加(或不饱和度的增加)而降低。
向脂质混合物中添加胆固醇会对双层的物理性质产生重大影响。胆固醇的增加会抑制脂质进入 Lb 相,并有利于流动性较差的 L0 相,从而导致缺乏通常在没有胆固醇的情况下观察到的相变。脂质双层周围的溶剂也主要通过影响头部基团相对于疏水域的大小来影响这些转变。 Ca2þ 和其他二价阳离子(Mg2þ、Sr2þ 但不是 Ba2þ)会降低 CL 和 PA 带负电荷的头部基团的有效尺寸,从而赋予其非双层特性。低 pH 值对 PS 的头部基团有类似的影响。由于 Ca2þ 是一种重要的信号分子,可引发许多细胞反应,因此其部分影响可能是通过物理性质的变化传递的膜。
3.3 膜双层是什么样的?
生物膜的主要作用是通过维持对小极性和带电分子以及大分子的可控渗透屏障来定义细胞或细胞器的界限。第二个作用是提供许多基本生物过程组织的溶剂和表面。
组织成柔性非共价结合超分子结构的两亲性脂质分子可最佳地满足这些要求。天然流体双层的功能特性不仅受疏水核心和亲水表面的影响,还受含有结合水和离子的界面区域的影响(图 1.9)。
图 1.9A 显示了二油酰 PC 的组成部分在双层中的分布,并说明了膜的动态而非静态性质。PC 脂肪酰基链的长度决定了双层厚度为 30 A˚。但是,厚度并不是静态的,正如在一定距离范围内随机分布的 CH2 残基的概率所示。如果脂质微区由不同的酰基链长度形成,则双层厚度可以在膜表面上变化。烃核心和本体水相之间的界面区域的宽度通常不被重视(图 1.9B)。该区域包含由磷酸二酯部分、头部基团和结合水和离子定义的复杂化学物质混合物。在此界面区域内发生的许多生物过程都依赖于其独特性质,包括表面结合细胞过程发生的陡峭极性梯度。
4. 膜脂质组成的工程
鉴于脂质结构和功能的多样性,如何在分子水平上定义给定脂质的作用?与蛋白质不同,脂质没有
16
图 1.9 PC 双层中化学成分的概率分布。 (A)
该图由 X 射线和中子衍射数据生成。每个峰的宽度定义了 PC 每种成分的迁移率。(B) 当 α 螺旋肽从双层两侧的本体水接近中心时,膜界面区域的电荷密度急剧下降,如线所示。经 White 等人许可改编。J Biol Chem
2001;276:32395e32398。
隔离时明显的功能。脂质的许多潜在功能已根据其对催化过程的影响和体外研究的其他生物功能而被偶然发现。尽管通过这种方法积累了大量信息,但此类研究容易出现伪影,而且许多研究尚未在活细胞中得到验证。脂质的物理性质与其化学性质在决定功能方面同样重要。然而,人们对体外测量的脂质物理性质与其体内功能之间的关系了解甚少。遗传方法通常是识别体内功能最有用的方法,但这种方法在应用于脂质时有相当大的局限性。首先,为了制造具有改变的脂质组成的突变细胞或生物体,必须针对脂质生物合成途径中编码酶的基因。因此,基因突变的结果是间接的,可以从原发性病变中去除。其次,膜脂质的主要功能是提供细胞的通透性屏障。因此,表明脂质对细胞生存至关重要的遗传方法可能是由于损害膜屏障功能的水平高于损害特定功能的水平。挑战在于使用遗传信息来操纵细胞的脂质组成,而不会严重损害细胞生存能力。在可能的情况下,结合遗传学方法揭示脂质组成改变的细胞表型,并在体外解剖表型的分子基础,已被证明是一种定义脂质功能的有效方法。迄今为止,重要的信息来自对原核细胞和真核微生物的遗传操作。然而,脂质功能的基本分子和热力学原理通常适用于更复杂的哺乳动物系统。
4.1 细菌脂质组成的改变
E. coli 主要磷脂的合成途径由 Eugene Kennedy 及其同事 [3] 通过生物化学方法建立,随后使用遗传方法 [4] 进行验证(图 1.10)。设计能够以系统方式遗传改变脂质组成的菌株对于定义脂质在细胞功能中的新作用非常重要 [5,6]。
大肠杆菌的主要磷脂是两性离子 PE(约 70%)加上阴离子 PG(约 20%)和 CL(约 5%)(图 1.2A)。其余磷脂占总磷脂池的不到 5%。
两性离子与阴离子磷脂的比例可以通过 pssA 和 pgsA 基因的突变和调节来改变,这些基因编码的酶分别催化合成 PE 和 PG/CL 的承诺步骤(图 1.10)。令人惊讶的是,完全缺乏 PE 和 PS 或 PG 和 CL 的大肠杆菌突变体在特定的实验室条件下或在应激反应受到抑制的突变体中是可行的。通过将 pgsA 基因置于 lac 启动子操纵子的控制之下,可以系统地调节 PG 和 CL 的水平。 PG 和 CL 完全缺失对细胞生长的影响很小,
很可能是由于阴离子磷脂前体(PA 和 CDP
二酰甘油)和阴离子 N-酰基-PE 升高,替代了 PG 和/或 CL。pssA 基因的无效突变导致所有含氨基和两性离子磷脂完全消除,只留下阴离子磷脂。这两个基因都处于可诱导启动子的控制之下,因此两性离子和阴离子磷脂的比例可以系统地变化。
使用 pgsA 突变的细胞来确定阴离子脂质的作用
作为组织完整 MP 与两性外周 MP 的位点,以形成负责细胞分裂、
DNA 复制、蛋白质分泌和 MP 插入的膜相关分子机器。完全缺乏的细胞
18
图 1.10 大肠杆菌中天然和外来脂质的合成。天然途径(蓝色箭头)、天然脂质(蓝色、橙色和黑色)和相应的基因名称以数字表示。1. CDP-二酰甘油合酶;2. 磷脂酰丝氨酸合酶;3. 磷脂酰丝氨酸脱羧酶;4. 磷脂酰甘油磷酸合酶;5. 由三个基因编码的磷脂酰甘油磷酸磷酸酶;6. 由三个基因编码的心磷脂合酶。虽然没有显示,但 ClsA 和 ClsB 缩合 2 个 PG,而 ClsC 缩合 PG 和 PE 形成 CL。ClsB 还可以使用甘油取代 PE 中的乙醇胺来生成 PG。 7. PG:由 mdoB 编码的膜前衍生寡糖
(MDO)sn-甘油-1-P 转移酶;8. 二酰甘油激酶。在大肠杆菌中表达的非天然酶
和基因名称(红色箭头)产生指示产物(绿色和灰色);9.
单葡萄糖二酰甘油合酶(Acholeplasma laidlawii);10. 二葡萄糖二酰甘油合酶(A. laidlawii);11. 磷脂酰胆碱合酶(Legionella pneumophila);12. 磷脂酰肌醇合酶(酿酒酵母);13. 和 14. PE 的 N-酰化和 PG 的 O-酰化由未知的转酰酶催化; 15. 赖氨酰 t-RNA:磷脂酰甘油赖氨酸转移酶
(金黄色葡萄球菌)。脂质的颜色编码为两性离子(蓝色)、中性(绿色)、阴离子
(橙色)或阳离子(灰色)。经 Dowhan 和 Bogdanov 许可改编,Biochim Biophys
Acta 2012;1818:1097e1107。
PE(pssA 无效菌株)依赖于毫摩尔水平的二价阳离子
(Caþ2 >Srþ2 >Mgþ2,Baþ2 无效)来防止细胞裂解并
可能支持 CL 的非双层特性。缺乏 PE 也会损害大肠杆菌和真核细胞中细胞分裂的后期阶段和最终收缩。此外,PE 还支持由几种氨基和糖通透酶催化的能量依赖性
溶质上坡运输。
下文将详细分析上坡运输功能缺失的分子基础,揭示了膜脂质
组成是某些 MP 拓扑组织的决定因素,并
进一步扩展了控制 MP 折叠和组装的规则。
大肠杆菌生存能力的特定脂质要求的可塑性已被用于设计菌株,其中磷脂组成不仅可以
消除,而且可以在培养物的稳定状态或生长周期内随时间变化。可以通过引入编码大肠杆菌中未发现的脂质的外来基因来进一步操纵大肠杆菌膜脂质组成
(图 1.10)。由于外来脂质表现出与天然脂质不同的物理和化学特性组合(图 1.11),它们抑制缺乏特定天然脂质的突变体表型的能力已用于确定给定脂质的哪些特性对于支持特定细胞功能是必需的。
采用一种微生物模型系统,其中可以完全消除特定脂质,用外来脂质替代,严格滴定或时间控制,提供了一种研究膜脂质组成变化对 MP 子集的结构、功能和折叠的影响的方法,这些 MP 子集是对膜脂质组成敏感,在自然界中高度保守。
5. 脂质在细胞功能中的作用
蛋白质结构受特定蛋白质脂质相互作用的影响,这些相互作用取决于脂质的化学和结构解剖学(头部基团、骨架、烷基链长、不饱和度、手性、电离和螯合性质)(图 1.4 和 1.11)。然而,蛋白质结构也受到脂质独特的自缔合性质的影响,这种性质是由脂质组织成脂质双层的集体性质(双层流动性、厚度、表面电荷、形状、填充性质)引起的。
5.1 双层作为超分子脂质基质
对膜脂质的生物物理研究以及对膜脂质组成的生化和遗传操纵已经证实,膜双层的 La 状态对细胞活力至关重要。然而,膜由大量具有不同物理特性的脂质组成,它们可以各自呈现不同的物理排列,并共同影响膜的最终物理特性。哺乳动物细胞膜暴露在恒定的温度、压力和溶剂环境中,因此不会因外部条件而显着改变其脂质组成。相反,较低等的生命形式暴露在广泛的环境条件下,因此已经开发出改变膜脂质组成的系统以维持 La 相。
5.2 MP 结构和功能:脂质负责?
完整 MP 的折叠通过与其环境的多种相互作用模式发生。膜外结构域 (EMD) 与结构化界面区域以及自由扩散的细胞外液中的水、溶质、离子和水溶性蛋白质相互作用(图 1.9 和 1.12)。 TMD 组成
20
图 1.11 脂质的结构和物理特性。甘油骨架(红色)在 sn-1 和 sn-2 位以酯键连接到脂肪酸(脂肪链 R1-R4),在 sn-3 位以磷酸二酯键连接到磷脂或以糖苷键连接到糖脂。头部基团采用颜色编码以指示每个头部基团的电荷性质。缩写与图 1.2 中的相同。该图经 Dowhan 许可改编,Biochim Biophys Acta
2013;1831:471e494。
第 1 21 章
图 1.12 单个氨基酸倾向于驻留在膜的哪个位置?脂质双层及其三个主要区域。灰色,碳原子;红色,氧气;白色,氢与氧结合;
橙色,磷。在 α-螺旋中,20 个氨基酸(蓝色)可以跨越烃核心,10 个氨基酸(绿色)可以跨越界面区域。箭头表示基于转移自由能测量,每种氨基酸的大多数在平衡状态下的位置。经 Bowie 许可改编。《自然》2005;433:367。
20e25 个疏水性氨基酸中,大部分被组织成 α-螺旋,埋藏在膜约 30-A 厚的疏水内部。TMD 与脂质的疏水域直接相互作用,这通过晶体学和 MP 线性序列中疏水氨基酸域分布的统计分析得到证实。TMD 还相互作用,并与固定在蛋白质内部的脂质相互作用。由此产生的脂质蛋白超分子结构,
虽然具有高度的移动性,但处于自由能最低点(图 1.13)。
两性外周 MP 可能将部分时间完全花在细胞质中,并响应各种信号被募集到膜表面,甚至部分插入膜中。
5.2.1 蛋白质脂质相互作用的选择性
MP 与膜脂质相互作用的方式有多种 [7,8]。
首先,脂质可以通过高度保守的结构结合基序特异性地结合到表面或 MP 内部,从而变构或直接改变蛋白质的生物学功能。其次,MP 可能需要一定的膜环境,这种膜环境是由累积的物理
22
图 1.13 总结了稳定流体脂质双层中膜蛋白的各种相互作用。蓝线是界面边界,红线代表脂质烃核心的边界。除了多肽链与自身、水、邻近脂质和膜界面的相互作用外,脂质双层本身的热力学和静电特性也很重要。经 Cymer 和 White 许可改编。J Mol Biol
2015;427:999e1022。
特性,而不是环状脂质的结构和化学特性。
已经观察到脂质和 MP 之间不同的直接和密切的特定相互作用在许多高分辨率 MP 晶体结构中都观察到了这一点。结果揭示了形成假定结构脂质结合基序的脂质结合位点和氨基酸残基的进化保守性。这些研究表明结合脂质具有重要作用,对于膜插入和组装、结构、稳定性或活性至关重要。
5.2.2 与非环状脂质的直接相互作用
早期尝试结晶 MP 的成功率很低,因为假设需要用洗涤剂去除和替换脂质。
使用更温和的纯化方法保留特定需要的环状脂质取得了更大的成功,并确定了脂质在稳定 MP 结构方面的特定要求。图 1.14 显示了通过 X 射线晶体学和最近的低温电子显微镜解析的一些脂质蛋白质相互作用的例子。在多亚基复合物和多聚体组装中经常观察到高分辨率脂质分子,并且通常存在于相邻亚基之间的接触点。 MP 通常使用非离子型洗涤剂进行纯化和结晶。
因此,脂质分子会从蛋白质中丢失,或者与膜脂质的分子相互作用会被蛋白质-洗涤剂相互作用所取代,从而模拟天然脂质环境(图 1.14)。晶体中剩余的脂质分子可能对应于紧密结合的脂质,这些脂质参与了
第 1 23 章
图 1.14 脂质和膜蛋白之间的结构特异性相互作用。空间填充模型表示在晶体结构中分解特定脂质时在不同 MP 表面观察到的脂质和洗涤剂分子。PDB 接入码与结合脂质一样标明。在光合反应中心 (RC) 的情况下,六个辛基-b-葡萄糖苷 (b-OG) 分子用青色表示。一个十二烷基二甲胺氧化物 (LDAO) 分子和一个 PE 分子分别用绿色和洋红色表示。经 Dingjan 和 Futerman 许可改编。BioEssays 2021:e2100021。
24
特定相互作用。此外,在异源宿主中表达期间,松散结合的脂质可能会被替换。此外,重要的脂质-蛋白质相互作用
可能仅暂时需要正确折叠,并且不再存在于
最终结构中。一些 MP 已成功结晶,而无需使用来自宿主生物的天然脂质。一个例子是使用合成的
PC 来制备大肠杆菌蛋白,尽管外来脂质有时会展开
并禁用 PE 依赖性二级结构中功能重要的元素。
脂质-蛋白质比率和脂质选择被认为是影响 X 射线衍射质量的最重要因素。当总大肠杆菌脂质逐渐添加到脱脂乳糖通透酶 (LacY) 中时,形成了三种不同的晶体 (六方、斜方、四方) [9]。四方晶体显示出最高的衍射质量,表明高度纯化的 MP 可能会失去获得最佳衍射质量所必需的磷脂。LacY 能够根据初始组装过程中 PE 的存在与否而采用两种相反的拓扑组织 [10],这是在 MP 结构研究中使用天然脂质组成的一个例子。5.2.3 脂质与 α-螺旋蛋白的关联在 b2 肾上腺素能受体和钠钾 ATP 酶的晶体结构中检测到胆固醇。CL 在大肠杆菌甲酸脱氢酶和硝酸还原酶以及牛 ADP/ATP 载体中得到解析。在细菌 KcsA 钾通道中观察到 PG,在 P4 ATPase 中观察到 PS,在 Thermochromatium tepidum 的光合反应中心和牛细胞色素氧化酶中观察到 PE(图 1.14)。CL 与 Rhodobacter sphaeroides 的光收集光合反应中心的高分辨率结构具有高度的结构互补性(图 1.15A)。CL 的头部基团位于反应中心的表面,与所有三个反应中心亚基的残基紧密接触,并与界面区域(膜的细胞质侧)中的极性残基发生氢键相互作用。一个引人注目的观察结果是,CL 的酰基链位于形成蛋白质疏水表面的 a 螺旋的凹槽中,并受到范德华相互作用的限制。 T. tepidum 的光合反应中心具有 PE 的结合分子,该分子在 X 射线结构中已解析(图 1.14)。PE 的磷酸基团通过静电相互作用与 Arg 和 Lys 结合,通过氢键与 Tyr 和 Gly 结合。PE 酰基链可嵌入复合物三个不同亚基的 α 螺旋之间形成的疏水裂缝中。脂肪酸这些磷脂的 id 链是不饱和的,因此链可以弯曲以适应这些蛋白质表面上的凹槽。
第 1 章 25
图 1.15 结合脂质的膜蛋白结构。 (A) CL 模型 (绿色) 紧密结合到 Rhodobacter
sphaeroides 的光合反应中心 (蓝色) 的表面。 (B) 脂质堆积在细菌视紫红质晶体中。从细胞外侧观察的三种不同颜色的三聚体的顶视图 (其中一个三聚体中注明域 (AeE)) 与脂质 (空间填充模型) 复合。脂质的三个植烷基链 (灰色) 位于一个单体的 (AeB) 域和相邻单体的 (DeE) 域之间形成的缝隙中。三聚体的中心核心填充有与 archaeol 连接的硫酸化三糖苷。
红色表示白色糖的氧原子。(C)FhuA 与脂多糖复合的晶体结构。带状结构(蓝色)表示 FhuA b 桶的外表面,带有氨基酸的延伸链(黄色)。芳香带的氨基酸与酰基链(灰色)相互作用,碱性氨基酸与脂质 A 的磷酸盐(绿色和红色)基团相互作用。(D)酵母复合物 III 二聚体的晶体结构,中间是单体之间的界面。前右侧和后左侧的青色 CL 和黄色 PE 靠近与复合物 IV 相互作用的拟议表面。底部面向线粒体基质。 (E) 在模拟牛心脏线粒体中一个 CIII 二聚体 (浅灰色) 和两个 CIV (深灰色) 的自组装过程中,组装的 CIII (细胞色素 bc1)/CIV (细胞色素 c 氧化酶) 超复合物中共享 CL。图中显示了 CGMD 揭示的 CL2 和 CL1a (青色) 的优选位置以及基于 CL 结合位点在 CIV 上的占用和停留时间的优先亚基间接触。(A) 经 McAuley 等人许可改编。美国国家科学院院刊 1999;96:14706e14711;(B) 经 Essen 等人许可改编。美国国家科学院院刊 1998;95:11673e11678;(C) 经 Ferguson 等人许可改编。 Structure 2000;8:585e592; (D) 经 Pfeiffer 等人许可改编。J Biol Chem
2003;278:52873e52880; (E) 经 Arnarez 等人许可改编。J Am Chem Soc
2013;135:3112e3120。
26
在厌氧条件下,大肠杆菌在硝酸盐存在下合成喹啉-硝酸盐氧化还原酶 (NarGHI),导致硝酸盐还原为亚硝酸盐并产生质子动力。双层细胞质一半上两个血红素周围的扩展电子密度似乎是 CL。尽管 CL 的酰基链几乎完全与
整合膜亚基 NarI 接触,但所有三个
亚基内的特定氨基酸残基都能稳定 CL。CL 与醌醇结合位点附近的微环境结合,这可能会增强与醌醇底物的相互作用并促进电子转移反应。
在许多 X 射线结构中,紧密结合的 CL 在蛋白质中被分解,
其中一半位于膜的细胞质小叶内。然而,在需氧和厌氧蛋白质复合物琥珀酸脱氢酶 SdhCDAB(复合物 II)[11] 和甲酸脱氢酶 FdnGHI [12] 中,在对应于周质膜的蛋白质半部中发现了高度分辨的 CL,其中磷脂酰基团指向膜的周质侧,在那里它可能通过结合在各个亚基之间的界面发挥结构作用,正如报道的甲酸脱氢酶一样。FdnGHI 是一种周质定向的膜结合甲酸:醌氧化还原酶,可将甲酸分解为二氧化碳和质子。CL 似乎对三聚体的形成和亚基间相互作用都至关重要。 FdnGH 催化二聚体的周质定位以及未加工 FdnG 的 N 端存在双精氨酸信号肽,表明在形成 FdnGHI 复合物时,CL 分子在 FdnHI 单元上的定位可能触发三聚体的形成。
在来自牛心脏线粒体的 13 亚基 CcO 的 1.8 A ˚ 晶体结构 [13] 中,一组特定的 13 个完整脂质分子被解析,包括两个 CL、一个 PC、三个 PE、四个 PG 和三个三酰甘油分子。CL 分子对酶活性至关重要,它通过与复合物的两个磷酸二酯头基形成氢键与复合物特异性相互作用。一个磷酸二酯基团直接与 Lys
和 Tyr 残基相互作用,而另一个磷酸二酯基团与第二个 Tyr 相互作用,并通过水分子与第二个 Lys 相互作用。一个 Trp 残基显然在复合物的结构中起着特殊作用。它位于结合的 CL 和 PE
分子之间,靠近这些磷脂的酯羰基。Trp
吲哚环与二聚体轴平行排列,导致层状分离,限制 CL 和 PE 的横向移动,并稳定它们与蛋白质的结合 [14]。
5.2.4 环状脂质
生物膜中的大部分脂质分子仅充当完整 MP 的“溶剂”,并且不显示与蛋白质疏水表面的任何特定相互作用。然而,存在将环状脂质组织成包裹蛋白质的壳的例子。通过 X 射线衍射确定的细菌视紫红质的 1.55 A˚ 结构显示 18 个紧密结合的脂质链的双层环。形成三聚体复合物周围环状结构的脂质被范德华力紧密结合在由疏水蛋白质表面氨基酸侧链的特定排列形成的凹槽中。
环状脂质对 MP 功能影响的一个极端例子是机械敏感通道,这些通道受其局部脂质环境变化的调节。在 PC 双层中,通道保持关闭状态。
添加锥形、非双层形成溶血磷脂可大幅降低原核生物 (MscL) 和真核生物 (TREK-1、TRAAK) 机械敏感通道转变为开放状态的激活阈值 [15]。
因此,有人推测双层内侧压的释放是圆柱形、双层形成脂质(如 PC)和锥形、胶束形成溶血磷脂之间结构不平等的结果。这种机制被认为可以提供机械力,使通道转变为开放构象。
5.2.5 脂质与 b 桶蛋白的结合
大肠杆菌 OM 的成孔蛋白被组织为反向平行的 b 链,形成桶状结构,内部有水孔,外部有与膜双层的疏水界面(图 1.15C)。大肠杆菌 OM 铁羟肟酸摄取受体 (FhuA) 的 X 射线晶体结构含有结合的 LPS,化学计量为 1:1。LPS 的酰基链在蛋白质表面上排列,大致平行于 b 桶的轴,沿着疏水带的一半朝向 OM 的细胞外表面。观察到大量与表面暴露的疏水残基的范德华相互作用。 LPS 的大极性头部基团与桶状物表面上的八个带正电残基簇发生广泛的相互作用。在膜的界面区域,有成簇的芳香族氨基酸残基,它们以带状围绕蛋白质。在其他 MP 中也观察到了膜界面区域附近 α 螺旋蛋白的芳香族氨基酸的类似组织,并且可能参与与脂质头部基团的 p 键相互作用。
5.2.6 是否存在一致的脂质结合基序?
越来越多的证据表明,保守的脂质结合结构基序确实存在。胆固醇不仅通过对流动性和膜曲率的一般影响来控制各种膜受体的活性,而且更具体地说,通过特定相互作用直接结合到这些受体的跨膜域。神经递质受体的胆固醇结合位点被定义为 TMD 4 氨基酸序列中的 3D 基序,该序列存在于许多胆固醇识别氨基酸共识(“CRAC”)基序 (Leu/Val)-X1e5-(Tyr)-X1e5-(Lys/Arg) [16] 中。Lys 或 Arg 与胆固醇羟基和 Tyr 芳香环形成氢键,与胆固醇的 4 环系统堆积在一起,而 Leu 和 Val 与其疏水异辛基链相互作用。乙酰胆碱 (AChR) 神经递质受体的 TMD 显示出一系列胆固醇共识结构域,其中氨基酸出现的序列与 CRAC(称为“CARC”)中的序列方向相反。 CARC 基序通常位于 OM 小叶中,其反向序列 CRAC 位于内部小叶中。
一些 TMD 可能同时显示 CARC 和 CRAC 结构域,这表明它们可能结合两个胆固醇分子,每个膜小叶中各一个。
假定的鞘脂结合基序 (VXXTLXXIY) 最典型的特征是在囊泡转运蛋白 p24 的跨膜螺旋中发现的。鞘脂结合基序在七个 TMD 家族的 G 蛋白偶联受体中富集,这可能意味着这些受体受鞘脂的共同调节 [17]。
与 PE 脂质优先相互作用的 MP 的具体例子非常丰富。在含有假定的
频谱蛋白样 PE 结合位点 (IAEWKDGL) 的 R. sphaeroides LHII 复合物的晶体结构中检测到了结构非环状脂质。关键谷氨酸残基 (E20) 突变为丙氨酸导致导致复合物边界脂质中 PE 特异性富集的损失和 PC 的增加 [18]。CL 的非典型结合位点由磷酸盐结合斑块中的带正电残基和酰基链结合斑块中的 Leu、Ile 和 Val 组成 [19]。CL 的疏水尾部插入蛋白质表面的浅疏水凹槽中,通过多个范德华接触精确配合稳定。与 CL 极性头基结合的区域显示出不同的灵活性增加趋势,具有较高的 Gly 含量和卷曲螺旋二级结构,以及较低的 Pro 残基含量。这种灵活的带正电结构域 ([KR]-(X)-G) 可能是两种磷酸盐与疏水斑块协同结合所必需的。柔韧性似乎是磷酸基团结合的重要特征,这表明氨基酸侧链的多种几何形状都可能参与 CL 与相同基序的结合。
值得注意的是,描述通过拟议的共识结合基序进行脂质蛋白识别的大多数数据都是通过计算机获得的。
因此,重要的是确定特定脂质是否可以与假定的结合口袋发生物理相互作用,以及这种相互作用是否具有高亲和力和可饱和性。特定位置的关键残基的影响应通过定点诱变、使用放射性标记脂质的光亲和标记或在高分辨率结构中解析来证明。
第 1 29 章
5.2.7 CL 和 OxPhos:胶水还是润滑剂,还是两者兼而有之?
许多磷脂不是与 MP 的外表面相关联,而是楔入寡聚复合物的亚基之间。
阴离子磷脂在能量传导膜(如细菌细胞质膜和线粒体内膜 (IMM))中发挥着特别重要的作用。CL 尤其需要线粒体的最佳功能,并且已知它为参与线粒体生物能量过程的几种蛋白质提供必要的结构和功能支持,包括稳定性、呼吸和能量转换。线粒体通过嵌入在 IMM 中的氧化磷酸化 (OxPhos) 系统产生能量。CL 是呼吸链蛋白的最佳活性所必需的,包括复合物 I(NADH/醌氧化还原酶)、复合物 II(琥珀酸脱氢酶 (SDH))、复合物 III(细胞色素 bc1)、复合物 IV(细胞色素 c 氧化酶)和复合物 V(ATP 合酶)。哺乳动物的 OxPhos 通过一系列电荷分离和电子转移来运作,这些电荷分离和电子转移由大型膜呼吸链超复合物或“呼吸体”进行,呼吸体由复合物 I、III 和 IV 组成,并由小电子载体(醌和细胞色素 c)补充,从而触发质子从基质泵送到 IMM 两侧的膜间隙,从而产生电化学梯度,最终由复合物 V 用于从 ADP 合成 ATP。
酵母复合物 III (CIII) 是一种同型二聚体,含有 14 个磷脂分子:四个 CL、两个 PI、六个 PE 和两个 PC(图 1.15D)。每个二聚体中有六个磷脂是结构不可或缺的。两个 PE 分子(每个单体一个,中心的黄色脂质)与二聚体两个单体的 b 亚基接触,位于两个单体之间的界面处。
两个 CL 分子(每个单体一个,中心附近的青色脂质)位于 PE 附近。酰基链紧密贴合螺旋之间的凹槽,并通过与所有催化亚基残基的疏水相互作用固定。其余磷脂是固定在复合物表面上的环状脂质,定义 CIII 的 TMD 区域(红色条)。这些环状脂质包括图 1.15D 右前侧和左后侧显示的 CL(青色)和 PE(黄色)。这些面形成包含 CL 和 PE 的左面,据推测,它们是与细胞色素氧化酶(复合物 IV (CIV))形成超复合物的界面。该 CL 分子位于与醌还原相关的质子吸收位点之一的入口处,可以作为天线,吸收质子和几个水分子。在上述情况下,特定脂质介导多聚体复合物内的蛋白质-蛋白质接触,对复合 MP 的结构和功能完整性非常重要。使用脂质分子形成相邻蛋白质亚基之间接触表面的重要部分的优势在于它们具有高度的构象灵活性,并且通常具有多种分子形状和大小。使用脂质作为界面材料减少了对高度互补的蛋白质-蛋白质相互作用的需求,并提供了亚基之间灵活且可变形的相互作用。哺乳动物线粒体呼吸链的动力学和结构分析表明,其单个复合物 IeIV 在生理上与超复合物或“呼吸体”保持平衡 [20]。在酿酒酵母线粒体中,单个复合物 III 和 IV 之间的平衡转移到由复合物 III(二聚体)组成的超复合物,复合物 IV 单体两侧各有一条。通过低温电子显微镜测定的该超复合物(IV1-III2-IV1)的三维密度图支持单个复合物的这种排列 [21]。动力学、生化、结构和遗传证据支持 CL 在以功能性方式将线粒体呼吸体的成分“粘合”在一起方面发挥着重要作用 [20]。参与该腔内 CL 结合的细胞色素 c1 赖氨酸残基的诱变导致以下结论:CL 中和该位点的正电荷对于 CIII 与 CIV 的相互作用和超级复合物的稳定非常重要。呼吸链超级复合物必须按顺序组装才能发挥作用。单个复合物和超级复合物的组装顺序、稳定性和功能似乎在很大程度上取决于 CL 分子。CL 结合位点可能通过定义蛋白质在生物发生过程中相互作用的实际位置来防止组装过程中不适当的或指导适当的蛋白质相互作用。或者,CL 可以共享并将蛋白质粘合在一起(“桥接模式”)。粗粒度分子动力学 (CGMD) 模拟可重现地可视化超级复合物组装,其中 CL 位于牛心脏和酵母线粒体 CIIIeCIV 复合物之间的界面。根据 CL 在 MD 轨迹的每一帧中的存在情况以及计算的停留时间,这些位点在模拟过程中保持被占用,计算出占用率为 85%(图 1.15E)。CL 结合位点是保守的,高占用密度表面在组装的超级复合物中是共享的,这表明 CL 以“桥接模式”运行,通过共享亚基的结合位点 t 将亚基组装成超级复合物 [20]。最近的高分辨率冷冻电子显微镜已经分辨出 CL 分子在酵母和牛心脏的超级复合物中这些单个复合物之间的界面上桥接 CIII 和 CIV 之间的残基。
5.2.8 CL 和细胞色素 c 在凋亡舞蹈中的探戈
CL 与多种疾病有关,其中 Barth 综合征是记录最多的。在低等和高等真核生物中,CL 在 IMM 的
内叶中合成,最初主要包含饱和酰基链
第 1 章 31
具有可变长度和不对称性。然而,成熟的线粒体 CL 具有
独特的物种特异性脂肪酸组成,富含不饱和脂肪酸,链长主要限制在 16 和 18 个碳。
新生 CL 通过 CL 特异性脱酰酶的作用进行重塑
(在酵母中由 CLD1 基因编码),然后进行酰基链转移
(由 TAZ1 基因编码),使 CL 富含来自其他磷脂的不饱和脂肪酸。
在心肌中,超过 80% 的 CL 物种是四亚油酸。人类 TAZ 基因突变会导致 Barth 综合征,这是一种 X 连锁遗传性疾病,其特征是心肌病、骨骼肌病、中性粒细胞减少症和生长迟缓。Barth 综合征患者的淋巴母细胞显示呼吸超级复合物的稳定性降低,表明成熟 CL 物种的丧失导致呼吸链组织的改变。
酵母 TAZ1 基因突变体中也观察到超级复合物形成的减少。
然而,启动 CL 重塑的 CLD1 脱酰酶的酵母突变体不会显示表型,即使它们的 CL 池没有被重塑。酵母中缺陷的 Tafazzin 的有害影响是由 CL 缺乏或单溶血性 CL 积累引起的,而不是由异常的 CL 分子物种引起的 [22]。这一结果提示,CL 水平(在 TAZ 突变体中也降低)在调节超复合物形成方面比其重塑程度更为关键。
最近,CL 在调节线粒体自噬方面具有新的线粒体外功能。在正常细胞功能期间,CL 将促凋亡的细胞色素 c (Cyt c) 束缚到 IMM。然而,在线粒体应激条件下,CL 被外化到线粒体表面,在那里它通过激活胱天蛋白酶和 tBid-CL 诱导的 Bax/Bak 寡聚化,作为凋亡信号通路的枢纽,促进线粒体自噬和凋亡,形成导致膜通透性的孔。CL 结合的 Cyt c 充当过氧化物酶,催化 H2O2 依赖的 Cyt ceCL 键氧化,这是释放的重要步骤在细胞凋亡过程中,Cyt c 的释放会降低其活性。在与 caspase-9 形成凋亡小体复合物之前,游离或松散结合的 Cyt c 可以使细胞对凋亡刺激敏感,作为一种监测机制来监测 Cyt c 和 CL 的比例 [23]。
5.3 脂质会告诉蛋白质如何折叠和插入吗?
人们对磷脂在整合 MP 的插入和组织中的作用的了解,比对蛋白质插入所需的蛋白质机制的了解要少。
大多数整合 MP 包含一个或多个跨越膜双层的 α-螺旋 TMD。氢键在 α-螺旋结构内得到满足,这允许能量有利地插入富含疏水性氨基酸的蛋白质域的脂质双层中。这些螺旋由交替暴露在膜两侧的 EMD 连接。脂质如何以特定的方式起作用来引导插入并确定最终的 MP 结构和组织?
32
5.3.1 脂质和转运子
蛋白质跨膜运动是将蛋白质从其合成位点转移到其功能位点所必需的。该过程涉及蛋白质的疏水和亲水片段通过膜的疏水核心转移。在细菌中,两种主要途径用于跨细胞质膜输出蛋白质:一般分泌 (Sec) 途径和双精氨酸转运酶 (Tat) 途径。后者将完全折叠的蛋白质转运到膜上,并且仅需要体内两性离子 PE,而无需特定的带负电荷的磷脂 [24]。未折叠蛋白质通过 SecYEG 转运子跨过大肠杆菌的细胞质膜并插入细胞质膜的过程,SecYEG 转运子是一种普遍保守的膜内蛋白质传导通道,可将绝大多数蛋白质转运和插入细菌包膜内。人们普遍认为,分泌蛋白(周质和外部 MP)在翻译后由 ATPase SecA 靶向 SecYEG 转运子。SecA 具有前蛋白成熟域、阴离子磷脂和 SecYEG 的结合位点,并通过 ATP 水解为前蛋白转运提供驱动力。阴离子磷脂参与蛋白质转运的第一个体内证据是从对 PG 和 CL 生物合成缺陷的大肠杆菌 pgsA 突变体进行的实验中获得的。在缺乏 PG 和 CL 的情况下,OM pro-OmpA 的体外转运受到严重损害。在大肠杆菌和枯草芽孢杆菌中脱脂的 SecYEG 复合物的重组中,也观察到对阴离子磷脂的类似依赖性。
因此,前蛋白跨内膜 (IM) 的转运需要 PG 和 CL,因为它们的头部基团带负电荷。
可以使用掺入脂质体的纯化的、脱脂的 大肠杆菌和枯草芽孢杆菌 SecYEG 复合物来重建转运活性。转运活性的程度与重组蛋白脂质体中的 PG 量成正比,并且只有在每种生物体的特定脂质组成下才能获得最佳活性。叶绿体也利用 SecA ATPase,它为多肽跨膜转运提供动力。
大肠杆菌和叶绿体中的 SecA 活性与各自的脂质环境最佳协调的观察表明,蛋白质功能进一步进化适应以产生脂质组成。
尽管 CL 与 SecYEG 共同纯化并刺激 SecA 的 ATPase 活性,但尚不清楚 PG 或 CL 是否在蛋白质转运中发挥特定作用。通过证明在缺乏所有三种 CL 合酶但含有正常水平 PG 的细胞中膜插入和跨膜蛋白质转运受损,确定了 CL 的特定作用。此外,缺乏 CL 会使体内 SecYEG 的二聚体状态不稳定并损害其与 SecA 的结合。CL 在体外变构激活 SecA 进行 ATP 依赖性蛋白质转运,并且 SecA 本身通过其带正电的 N 端与带负电的脂质相互作用而变构为与 SecYEG 的高亲和力结合(图 1.16A 和 B)。最近,CGMD 预测了 SecY 内两个高占用率 CL 结合位点(图 1.16A)。 第 1 章 33
图 1.16 大肠杆菌中转运子和 CL 介导的蛋白质共翻译和翻译后膜转运以及蛋白质的共翻译插入。 (A) CL 与细菌转运子相互作用的分子细节。 CGMD 显示的 SecYEG 上的 CL(黄色、白色和红色球体)结合位点 1 和 2。 左图和右图是与马达 ATPase SecA 结合的 SecYEG 视图。 在 SecA 中:ATP、SecAN(N 端);HSD(α-螺旋支架结构域)位于 SecY 内蛋白质传导通道的入口处。 在 SecYEG 中:LG(纬度膜转运子(SecYEG 转运子)由 SecA 依赖性途径提供,该途径由分泌的周质和 OM 蛋白利用。SecAtoa 转运 SecY 通道的有效结合需要 SecA 首先通过其 N 端与膜中带负电荷的脂质相互作用,从而丰富 SecYEG 附近的 SecA。在 CL 存在下,SecA 对膜和/或 SecYEG 的亲和力更强,SecA 更频繁地与 SecY 通道结合,从而间接加速转运过程。因此,SecYEG 二聚体附近的 CL 可以促进 SecA 在高亲和力状态和低亲和力状态之间循环的适当时间和效率,由 ADP 和 ATP 结合状态之间的平衡决定。 (C) 在二聚化的 SecYEG 通道横向释放过程中,新生的 IM 蛋白与 YidC 相互作用,后者是一种膜内插入酶,有助于膜蛋白的横向释放。 (A) 经 Corey 等人许可改编,美国国家科学院院刊 2018;115:7967e7972; (C) 经 Ryabichko 等人许可改编。 Sci Rep 2020;10:6296。
34
这些 CL 结合位点的突变会损害分离的内外膜囊泡 (ISOvs) 中的 SecA/SecYEG 蛋白易位功能。
因此,CL 分子可以为 SecA/SecYEG 易位子稳定和活细胞中的有效功能提供直接或间接的结构约束(图 1.16B)。
5.3.2 脂质作为分子伴侣
传统上,分子伴侣是一类与蛋白质折叠中间体发生短暂和非共价相互作用的蛋白质,以防止不必要的错误折叠或自聚集,从而促进或促进正确的蛋白质折叠。折叠完成后,不需要分子伴侣来维持正确的构象。不同的脂质似乎与部分折叠的蛋白质相互作用,并以类似于体外复性或体内从头蛋白质折叠中的蛋白质分子伴侣的短暂方式发挥作用。
一种称为“Eastern-Western”的印迹技术的开发允许在体外重折叠过程中探测脂质和 LacY 之间的瞬时相互作用,并使筛选参与 LacY 重折叠的脂质成为可能 [25]。缺乏 PE 的突变细胞中 LacY 上坡能量依赖性转运活性的丧失最初与 EMD P7 中 LacY 表位的错误折叠有关。LacY 的正常组装发生在含有大量 PE 的大肠杆菌膜中。使用缺乏 PE 的大肠杆菌突变体可以分离该蛋白质的磷脂辅助和磷脂非辅助蛋白质折叠途径。东方-西方技术提供了实验证据,证明 PE 在 LacY 折叠中充当非蛋白质分子伴侣。在东方-西方过程中,首先将脂质施加到固体支持物(例如硝酸纤维素)上。接下来,通过标准蛋白质印迹技术将经过十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 的蛋白质转移到固体支持物上,这样感兴趣的蛋白质就转移到脂质贴片上。蛋白质离开凝胶基质时暴露于硝酸纤维素膜表面的水合磷脂,并在去除 SDS 后开始重新折叠。此过程模仿了透析或稀释辅助蛋白质重新折叠技术以去除变性剂。将重新折叠的蛋白质附着到固体支持物上,可以使用构象敏感抗体探测蛋白质结构或通过直接测定探测蛋白质功能。在这种情况下,使用了 mAb 4B1,它可以识别 LacY 的 EMD P7 中表位的正确折叠。在体内 PE 存在下组装并通过 SDS-PAGE 变性的 LacY 重新折叠,并在经典的蛋白质印迹法后恢复构象表位 P7,这由 mAb 4B1 识别证明。因此,一旦在体内存在 PE 的情况下在 LacY 折叠过程中传递信息,这种脂质就不再需要维持蛋白质的正确构象,这与分子伴侣的最小定义一致。然而,缺乏 PE 的细胞中的 LacY 未被 mAb 4B1 检测到。使用东-西技术,在去除 SDS 并在存在 PE 但不存在 PG 或 CL 的情况下重新折叠后,在体内没有 PE 的情况下最初组装的 LacY 被 mAb 4B1 检测到。在添加 PE 的情况下,对缺乏 PE 的细胞中的 LacY 进行 SDS 溶解,然后进行蛋白质印迹分析,没有恢复 mAb 4B1 识别,这表明需要在存在 PE 的情况下进行复性,而不是将变性的 LacY 暴露于 PE 中,以重新形成天然表位。因此,所有标准都符合将 PE 定义为分子的标准lar 分子伴侣;PE 通过非共价和瞬时相互作用协助折叠,折叠完成后,不再需要保持天然构象。
发现脂质和部分折叠的 LacY 在重新折叠过程中的相互作用具有结构特异性。单个脂质分子的化学性质和磷脂混合物的集体性质都是支持正确蛋白质折叠的决定因素。重新折叠的最低要求是双层状态的脂质混合物,其中含有二酰基磷脂和可电离的伯胺。非双层形成种类的 PE 只有在与过量的双层形成脂质混合时才有效。
具有非天然骨架或头部基团配置的含氨基脂质的立体异构体不支持正确的重新折叠。因此,对具有天然手性和双层组织偏好的可电离胺磷脂有特定要求,以促进 LacY 正确折叠成其天然构象。
PE 在 LacY 组装中发挥翻译后作用的进一步证据来自原位实验,其中通过体外合成将 LacY 掺入缺乏 PE 的分离大肠杆菌膜中,然后体外合成 PE [26]。在这些实验中,除非在组装期间或组装后在这些膜中合成 PE,否则构象 mAb 4B1 在蛋白质印迹上不会识别 LacY。因此,PE 似乎是构象成熟的后期步骤所必需的,该步骤发生在膜插入后,涉及从近天然状态到天然状态的过渡的最终调整。因此,特定脂质可以作为非蛋白质分子伴侣,专门介导蛋白质的折叠。
5.3.3 脂质作为蛋白质拓扑的分子决定因素
膜生物学中的中心法则规定,多面体 MP 的 TMD 方向(即拓扑结构)主要在初始组装时确定且不可逆地固定。根据同一原则,拓扑结构主要由编码序列决定,该序列根据正内部规则在脂质双层中折叠和定向,其中净带正电荷的 EMD 面向细胞质,在细胞质中它们出现的频率是带负电荷残基的四倍。虽然正内部规则在统计和实验上都得到了很好的证实,但目前尚不清楚带正电荷的残基如何对拓扑结构产生影响。带正电荷的残基似乎比带负电荷的氨基酸残基更能决定拓扑结构,因为后者的易位潜力被未知机制所抑制。如果蛋白质和脂质共同进化以保证功能性 MP 的组装,那么脂质参与拓扑决策只有在膜脂质组成发生变化时才会变得明显。大肠杆菌菌株的发展,其中天然脂质可以被外来脂质消除或取代,以及确定蛋白质拓扑的先进方法,特别是用于确定跨膜域方向的取代半胱氨酸可及性方法(SCAM)[27],被结合起来以确定磷脂在 MP 拓扑组织中的作用。在缺乏 PE 的细胞或脂质体中组装或重组的 LacY 的 N 端六个 TMD 束,相对于膜双层平面和 C 端五个 TMD 螺旋束是倒置的(图 1.17A)。因此,TMD VII 成为暴露于周质的 EMD。在野生型细胞中表达的 LacY 忠实地遵循正内规则,含有酸性残基的细胞质 EMD 仍然显示净正电荷 [10]。因此,在没有 PE 且仅存在带负电荷的阴离子脂质的情况下组装的 LacY 违反了正内部规则,因为前三个净带正电荷(每个 +2)的 EMD 现在面向周质而不是细胞质。这一观察结果提出了带电残基在不同脂质组成背景下的相对拓扑能力的问题。同一 EMD 内存在保守的带相反电荷的氨基酸残基提出了更多关于 MP 拓扑形成的机制的问题。为了确定膜脂质组成是否对 TMD 方向的 EMD 净电荷依赖性有影响,LacY N 端六个 TMD 的细胞质 EMD 内带电残基的分布和性质随着膜脂质组成而变化。通过中和负残基或以位置无关的方式添加正残基,将 N 端束细胞质暴露 EMD(即 C2、C4 和 C6,累计电荷为 6)的净电荷改变 1,可防止缺乏 PE 的细胞发生拓扑反转。添加正电荷和负电荷均无效果。然而,为了在含 PE 的细胞中诱导 LacY 的反转,必须在 N 端束的 EMD 中引入六个负变化。这些结果表明 PE 抑制了带负电荷残基的易位电位,有利于带正电荷残基的细胞质保留电位。为了整合脂质蛋白界面瞬时相互作用的贡献并将这一发现扩展到其他多面体 MP,制定了电荷平衡规则来解释为什么增加阴离子磷脂的含量不利于保留第 1 章 37 图 1.17 依赖于 PE 的 LacY 拓扑结构的机制。(A)LacY 拓扑组织的可逆性作为膜脂质组成的函数。 TMD(罗马数字)和 EMD(阿拉伯数字)从 N 端到 C 端按顺序编号。偶数亲水性 EMD(“C”)连接膜细胞质侧的 TMD。奇数 EMD(“P”)连接膜周质侧的 TMD。显示 EMD 的净电荷。显示含 PE 细胞中初始组装后(左)或缺乏 PE 的细胞中初始组装后(右)的 LacY 拓扑结构。(B)膜蛋白拓扑形成的电荷平衡规则。根据此规则,在含有正电荷和负电荷混合物的细胞质 EMD 中,带负电荷残基的转位电位通常被 PE 和其他净零电荷脂质抑制。 PE 引起的 pKa 升高会选择性地质子化带负电荷的天冬氨酸和谷氨酸残基,从而中和它们并增加相应结构域的净正电荷 (þ3),从而有利于它们保留在膜的细胞质侧。在没有 PE 的情况下,负残基发挥其全部易位潜力,并导致表现出较低有效净正电荷的结构域易位。箭头表示膜电位(向外为正)。经 Bogdanov 等人许可改编。J Biol Chem 2009;284:9637e9641。带正电荷的 EMD(正如人们所预料的那样),似乎增加了含有酸性残基的结构域的易位潜力。根据此规则,膜表面的电荷密度和 EMD 的电荷含量共同作用以确定 TMD 方向(图 1.17B)。脂质分子或脂质双层的哪些特定特征对正确的 TM 拓扑结构很重要?显然,拓扑结构是由协同脂质蛋白质电荷相互作用决定的,而不是结构特异性的,如支持天然拓扑结构的天然和外来脂质(两性离子和中性)的光谱所示。无论确切的机制如何,通过 PG 和 CL 稀释膜表面高负电荷的脂质显然会减弱带负电荷氨基酸残基的易位潜力,有利于带正电荷残基的细胞质保留潜力 [10,28]。通过利用可以在 MP 合成和组装期间以及组装后暂时控制脂质组成的大肠杆菌菌株,首次可以观察到蛋白质拓扑结构随膜脂质组成的动态变化。如果首先在无 PE 的情况下组装 LacY,然后在组装后开始 PE 合成,则双层中的 TMD 会重新定向,同时溶质运输会恢复。在组装天然 LacY 后稀释 PE 会导致 TMD 反转。因此,MP 拓扑可以在膜插入后重新排列,挑战了以下教条:一旦在组装过程中建立了 TMD 方向,它就是静态的,不会在插入后进行拓扑编辑或改变 [29e31]。为了研究 MP 拓扑是否主要由蛋白质脂质相互作用决定,还是取决于 MP 插入和组装机制成分的脂质需求,在体外蛋白脂质体系统中分析了 LacY,其中可以使用甲基-b-环糊精 (MbCD) 介导的脂质交换技术在 MP 重构之前(脂质体)和之后(脂质体)系统地控制脂质组成。 MbCD 促进供体多层脂质囊泡和受体小单层脂质体的外单层之间的磷脂交换。
这种翻转体技术提供了一种方法来确定蛋白质在拓扑不同的状态之间翻转的最小和充分要求,以及这种相互转化是否在热力学上由蛋白质与其脂质环境相互作用的性质决定,而不受其他细胞因素的影响 [32]。值得注意的是,体外结果完全反映了体内观察结果。在在 LacY 重建后,通过增加或减少蛋白脂质体中的 PE 水平,以 PE 剂量依赖性方式观察到 LacY 拓扑构象异构体之间的相互转换,这表明没有其他细胞因素参与其中。因此,这种插入后拓扑变化是热力学驱动的概率过程,它发生在任何时间和任何细胞膜中,具体取决于脂质环境。以 LacY 为例,脂质组成似乎将已经折叠的蛋白质置于拓扑不稳定状态,它可以通过将其一半的 TMD 翻转到膜上来退出。脂质依赖性拓扑蛋白质反转似乎是热力学控制的;脂质组成只是决定了哪种拓扑在能量上是有利的。因此,双向 TM 重组过程最简单的解释是脂质组成的变化会破坏 LacY 的折叠状态并使蛋白质结构脱离平衡,导致 TMD 束重新定向,从而使蛋白质可以呈现新的最低能量状态。第 1 章 39 这些结果也可以通过电荷平衡规则从机制上解释。PE 水平的逐渐降低会增加带负电荷氨基酸的转位潜力,从而导致具有反向拓扑结构的 LacY 数量增加。PE 数量的逐渐增加只是通过降低与正内部规则相反的带负电荷氨基酸的转位潜力来提高 LacY 的 N 端一半采用正确方向的概率。因此,MP 的拓扑结构在很大程度上取决于给定的阴离子和净中性脂质的比例。这一结果为自然界中存在表现出拓扑和功能二元性的蛋白质提供了潜在的分子基础。这种新机制开启了一种有趣的可能性,即多种 MP 拓扑结构可以在插入后互换,无论是在蛋白质进出筏/脂质微区时,还是在不同的细胞内膜之间。组装后 EMD 净电荷的变化也会引起拓扑变化,正如磷酸化 LacY 重组为蛋白脂质体所证明的那样 [33]。目前的教条假设 ER 膜中蛋白质的初始拓扑结构准确反映了细胞其他部位蛋白质的拓扑结构。然而,当真核蛋白质通过分泌途径时,它们会遇到不同的膜脂质组成(图 1.3),这些组成可能会以戏剧性的方式影响蛋白质结构,从而打开或关闭功能。几条实验证据将电荷平衡规则扩展到其他蛋白质和脂质,以建立更普遍的原则 [34]。 5.4 膜成分的异源组织
已知生物膜具有横向和横向脂质异质性,它们动态地相互影响。这种动态脂质不对称对膜的物理性质以及嵌入和外周蛋白质具有深远的影响。
5.4.1 功能性膜磷脂不对称
大多数(如果不是全部)生物膜在双层膜的每一侧都表现出脂质种类的不对称分布(见第 14 章)。真核细胞质膜脂质不对称已得到充分证实,不对称的丧失和获得与一系列细胞功能障碍有关 [38]。然而,膜磷脂不对称产生、维持和控制的生理意义和详细分子机制及其在细菌膜相关过程中的具体功能尚不清楚。尽管 PE 在哺乳动物质膜的内叶中富集,但由于 IM 和 OM 的复杂包膜系统以及缺乏研究不对称性的分子工具,其在革兰氏阴性细菌细胞质膜中的拓扑结构直到最近才为人所知。
40
最近从大肠杆菌和耶尔森氏假结核杆菌中分离出均匀取向的 ISOv,这些 ISOv 基本上不含 OM,这使得确定 PE 在这些细菌的 IM 脂质双层中的分布成为可能 [35]。
ISOv 依次用两种具有不同膜通透性的一级胺探针处理。该测定通过首先与氨基特异性膜不透性探针反应,然后与膜通透性探针反应来确定受保护或完全可及的 PE 池。探针具有不同的显色特性,因此脂质衍生物的光谱测定表明了外叶和内叶中 PE 的量。这项研究表明,IM 跨双层 PE 分布不对称,PE 分布约为 75/25(细胞质/周质)在两种革兰氏阴性细菌的IM中[35]。
该方法适用于确定不同遗传改变的脂质突变体中PE的侧性,以证明PE的不对称性是动态的(图1.18A)。
为了确定PE在体内合成过程中的侧性,在PE最初不存在且细胞呈丝状的条件下,在大肠杆菌菌株生长后诱导PE合成。新合成的PE首先出现在丝状大肠杆菌细胞IM的周质侧,然后进展到接近均等分布,最后在细胞质小叶中以野生型富集,因为细胞逐渐采用杆状,总PE从接近零增加到总膜磷脂的75%(图1.18B和C)。因此,PE 在杆状细胞和丝状细胞中的跨膜分布呈负相关,并且 PE 在 IM 内动态重新分布以反映或促进细胞形状的变化。鉴于尚未鉴定出使脂质跨 IM 移动的翻转酶,细菌中可能采用其他机制。显然,在双层膜细菌中,磷脂在 IM 内以及 IM 和 OM 之间不断流动(图 1.18A)。IM 内的不对称性可能通过将 PE 插入 IM 的周质小叶,然后在转移到 OM 和细胞质小叶之间达到平衡来代谢调节。这将在 PE 主要定位在 IM 的凹细胞质小叶后减轻周质单层内的侧压力。这可能会产生脂质的稳态浓度梯度,导致 IM 脂质不对称。杆状细胞和丝状细胞之间的差异可能会扰乱 IM 内和膜之间的 PE 正常分布率,这表明 PE 分布可能促进或由细菌形状的变化引起。因此,IM 中的 PE 不对称可能起源于代谢,并在调节革兰氏阴性细菌的大小和形态以及某些细胞周期蛋白的合成中起着核心作用。
章节 | 1 41
图 1.18 双膜革兰氏阴性细菌脂质不对称的生物源性。
(A)虽然 IM 内的组成磷脂不对称可以通过 PE 合成的单侧性来解释,但它也可能依赖于 IM 和 OM 之间特定脂质的运输。
(B) 由诱导 PE 生物合成的丝状 PE 缺陷型大肠杆菌菌株制备的 ISOv 中 PE 在 IM 中的跨双层分布与磷脂组成和细胞形状的关系。在添加 PE 合成诱导剂后,在指定时间收集细胞等分试样并转化为 ISOv。显示了依次用非渗透性、然后用完全渗透性氨基特异性探针处理的 ISOv 衍生磷脂的薄层色谱图。 (C) 图表表示 ISOv 外层小叶的逐渐富集,在拓扑上对应于细胞 IM 的细胞质侧,逐渐呈现杆状。在诱导剂(无水四环素,aTC)存在下生长 30、90 和 180 分钟的代表性细胞的显微镜图像。经 Bogdanov 等人许可改编。Sci
Adv 2020; 6:eaaz6333。
5.4.2 脂质微区和脂质筏
细胞器中生物过程的区室化以及细胞质和膜之间的分隔在细胞功能中起着重要作用 [36]。
最初的流体镶嵌模型将膜双层设想为均匀分布的脂质的均质海洋,蛋白质分散在其中(图 1.1)。目前对生物膜的看法是,它们包含不同脂质和蛋白质组成的微区,用于进一步划分细胞过程。膜筏是高度复杂的域,其特征是其组分脂质向 Lo 相的横向移动性显着降低,从而将双层内的过程划分为区室。脂筏的操作定义是真核细胞膜部分,在接近 4C 的温度下,它对洗涤剂 Triton X-100 的溶解具有抗性。该部分富含胆固醇、鞘糖脂、鞘磷脂和 MP 子集。由于胆固醇和鞘脂含量高,脂筏的 Lo-to-Ld 相转变温度比周围脂质双层的转变温度高出 15C。许多细胞表面受体由于其 TMD 对筏环境的明显特异性而与脂筏共定位。脂筏内还共聚有可溶性球状蛋白结构域,这些结构域通过共价键与脂肪酸、胆固醇、异戊二烯或糖基磷脂酰肌醇 (GPI) 连接(图 1.19A)。脂筏是隔离某些 MP 的定位。GPI 连接蛋白通过其羧基末端直接附着在乙醇胺磷酸盐的氨基上,而乙醇胺磷酸盐又与三糖相连,然后与 PI 的肌醇相连(图 1.19A)。鞘脂和 GPI 连接蛋白占据质膜双层的外表面单层,这些脂质的酰基链通常比质膜磷脂的酰基链更饱和、更长。筏脂质更有序的疏水域结构相似,而它们与周围更流动的磷脂不同,有利于筏脂质和 GPI 连接蛋白的自缔合。糖鞘脂与自身以及与 GPI 连接蛋白成分的氢键特性使复合物稳定。最后,胆固醇的平面形状有利于其平行于筏脂质的有序酰基链插入,其单个羟基面向表面(图 1.19B)。这种结构的稳定性似乎解释了为什么它不会被洗涤剂萃取消散。具有不同头部基团的磷脂的不同相促进特性对于筏的形成也可能很重要。头部基团较小的 PE 的熔化温度比 PC 高得多。这种效应可能在鞘脂贫乏(但 PE 丰富)的内双层小叶中尤其重要。PS 也是一种新兴的脂质,具有与鞘脂和胆固醇合作形成横向异质簇的独特能力,对致癌蛋白的膜定位具有功能意义。脂筏的存在及其功能仍然是一个不断发展的研究领域。它们的尺寸约为几十纳米,并显示出
动态横向扩散和形成/消散。尽管超分辨率双色光激活定位显微镜取得了进展,但目前还没有技术能够同时具有时间和空间分辨率
第 1 章 43
图 1.19 基于膜脂的理论形状和相特性的脂筏模型。 (A) 在该模型中,具有扭结不饱和链的磷脂表示周围双层的无序 La 状态更严重。 (B) 在该模型中,鞘磷脂 (SM) 和糖鞘脂如
神经节苷脂 GT1b 位于外膜小叶中,而 PE 优先位于细胞质小叶中。脂筏结构域(Lo 相)在外膜小叶和细胞质小叶中都富含
胆固醇 (chol)。大部分 PC 区域是液晶无序相 (Ld),因此其胆固醇含量低于 Lo 相。 (A) 经 Simons 和 Ikonen 许可改编,Science 2000;290:1721e1726; (B) 图片由 J.
Fantini 和 N. Yahi 友情提供。
44
直接可视化筏。尽管如此,已经广泛报道了在筏状纳米簇中蛋白质分配到有序相,这表明受体聚集可能稳定预先存在的有序波动,形成持久的信号传导能力扩展有序域 [36]。
5.5 脂质和构象疾病
蛋白质无法正确折叠或无法保持正确折叠是导致各种病理状况的原因,这些病理状况被归类为“蛋白质构象障碍”。这一类疾病包括阿尔茨海默病、传染性海绵状脑病、亨廷顿病、帕金森病、2 型糖尿病和 15 多种其他鲜为人知的疾病。这些疾病的标志是正常蛋白质或其多肽片段的二级和/或三级结构发生变化,而一级结构没有改变。正常、正确折叠的蛋白质逐渐转变为不溶性和富含 b 片层的淀粉样蛋白原纤维,这些原纤维在受影响的组织中沉淀成聚集体。蛋白质构象假说的核心问题是确定诱导蛋白质折叠变化的因素。朊病毒可以像 DNA 一样存储和传递信息的发现最初被认为是异端邪说,但现在已被科学界接受为仅蛋白质假说。然而,越来越多的证据表明,通常存在于细胞膜中的特定脂质不仅可能作为脂质伴侣参与折叠,也可能作为抗伴侣参与错误折叠蛋白质的展开和聚集。非感染性细胞朊病毒蛋白 PrPC 的病理构象变化为与疾病相关的绵羊痒病异构体 PrPSc,似乎在朊病毒疾病的发病机制中起着关键作用。虽然遗传性朊病毒病被认为是一种由朊病毒错误折叠引起的蛋白质疾病,但类似蛋白质,PE 已被确定为非致病性 PrPC 向其致病性构象体 PrPSc 稳健转化所需的唯一内源性辅助因子 [37]。脑源性或合成的 PE 均可促进纯化的重组 PrPC 底物转化为感染性 PrPSc。GM1 神经节苷脂还诱导形成独特的 PrPSc 结构。由于特定的脂质可以使平衡向致病性构象体的形成方向转移,因此热力学驱动的脂质依赖性机制可以成为产生非天然感染性朊病毒样蛋白构象体的基础。
6. 流体镶嵌膜模型仍然有意义吗?
40 多年前,Singer 和 Nicolson 推出了他们的流体镶嵌模型,该模型描述了细胞膜脂质和蛋白质成分的分子结构和横向动力学 [2]。该模型是第 | 1 45
本质上是基于膜脂质和蛋白质组织的热力学平衡和疏水匹配原理。由于 MP 和脂质都是两亲分子,因此可以合理地将相同的结构约束应用于它们两者,以将膜双层描述为热力学平衡的二维流体,疏水失配最小。
MP 折叠和组装的主要驱动力是有利的热力学,它由肽链与自身、水、脂质双层头部基团和烃核心以及易位/插入机制相互作用的净能量决定。 MP 折叠和组装受平衡热力学的指导,MP 可以采用独立于组装途径的最终结构。因此,组装的功能性 MP 是平衡结构,脂质双层与蛋白质一样,处于由众多相互作用产生的自由能最小值(图 1.13)。
然而,这种简单的观点与现实相去甚远。已知生物膜在横向、横向以及空间和时间上高度异质。活膜具有不同的脂质,它们在组装期间和组装后在多个时间和长度尺度上与嵌入的蛋白质协同作用。尽管天然结构的自由能预计会比非天然构象低得多,但活膜的脂质和蛋白质成分并不处于平衡状态。膜通过使用活性磷脂泵(ATP 依赖性翻转酶和 ATP 不依赖性爬行酶)来维持跨双层不对称等非平衡热力学状态,这些磷脂泵介导脂质在膜上的双向运动。由于合成、细胞器间膜运输和周转(见第 14 章),活膜的脂质和蛋白质成分会经历许多动态过程。因此,纯化学和热力学平衡原理不太可能成为在细胞膜中观察到的组织的唯一机制。由于不同膜的成分和动态多样性,局部非平衡条件很可能实现,应与局部和全局平衡条件一起考虑。缺乏强吸引力使膜具有流动性和可变形性。主要的非共价相互作用(离子、范德华、氢键)单独比共价键弱得多,但集体作用非常强,对膜的结构和功能至关重要,最重要的是提供灵活性。目前的教条仍然认为 MP 拓扑组织是在初始膜插入和组装时确定的,因为将球状亲水域翻转通过脂质双层需要很高的能量成本。事实上,除非涉及特殊的蛋白质传导通道,否则 MP 的亲水部分需要很高的活化自由能才能穿过疏水膜。与早期关于膜的假设相反,如果膜磷脂组成发生变化、膜去极化或转运蛋白的成分在 ATP 驱动的蛋白质底物转运过程中相互作用,一些完整的 MP 具有在插入期间或插入后可逆地重新定向的能力 [34]。如果在多肽的最末端引入强拓扑保留信号,然后在插入后移除,则可以设计 MP 在组装后翻转。EMD 的磷酸化会改变其电荷性质,也会诱导插入后的拓扑变化 [33]。所有这些发现都与流动镶嵌模型相矛盾。尽管 MP 成分的横向和 TM 移动性似乎是普遍且功能重要的现象,但很明显,这种构象自由度仅限于 MP 的子集,并且在特定条件和情况下es。
如果 MP 和脂质紧密堆积在双层平面内的微区中,则它们的横向扩散会受到限制。事实上,脂质筏概念假设双层可以局部富含具有较长酰基链的饱和鞘脂,从而导致更大的疏水宽度。
由于脂质头基和酰基链不饱和的瞬时不对称分布,耦合的分子和成分不对称与双层的物理不对称密切相关,导致真核细胞质膜的外层流动性较低、堆积更紧密,内层流动性较差、堆积更松散,这似乎在原核细胞的细胞质膜中也有所体现 [35,38]。
因此,生物膜的结构、动力学和稳定性受热力学力控制,热力学力不断使系统偏离平衡状态,导致非平衡状态的形成或消散。这一新概念提出,生物膜中的脂质和蛋白质分子以亚稳态非均匀、非随机但协同的元素形式存在,处于瞬态非热力学平衡状态,具有横向和横向的成分波动(图 1.20)。
7. 关于脂质功能的一般结论
定义脂质功能是一项具有挑战性的任务,因为脂质具有多种化学和物理特性,并且每种脂质类型都可能参与细胞功能的不同水平。虽然单一磷脂可以在溶液中形成密封的双层囊泡,但脂质结构和物理特性的多样性对于满足脂质在细胞中发挥的广泛作用是必不可少的。脂质结构差异很大,从在恶劣环境中繁衍生息的古细菌,到在一两个膜结构中进行多种过程的真细菌,再到具有专门细胞器且具有不同脂质组成以适应其功能的真核细胞。脂质提供复杂的疏水亲水溶剂,MP 可在其中折叠和发挥作用,并以更具体的方式发挥作用,以确定膜中 MP 的最终折叠、组织和方向。这些不同的功能是
第 1 章 47
图 1.20 膜结构和功能的 Gibbs 自由能图解。活膜中的脂质在组装期间和组装后以不同的相互作用模式在多个时间尺度上与嵌入的蛋白质协同作用。动态脂质双层采用和重新采用不同的横向和横向排列,并处于许多局部自由耗散(亚稳态)和非耗散(动能陷阱)能量最小值,这是由有利热力学限制和允许的众多合作和非合作相互作用造成的。这些生化和结构重排使系统远离整体热力学平衡(底部迷你图位于中央)。迷你图经 Honorat 等人许可改编。 BMC Struct Biol 2013;13:7; Rivel 等人。Sci Rep 2019;9:5627(顶部,从左到右);
Yesylevskyy 等人。Sci Rep 2017;7:16078;Bozdaganyan 和 Shaitan,生物化学(莫斯科)
补充系列 A:膜和细胞生物学 2014;8:290e296(底部,从左到右)。
由一类脂质分子实现,这些分子具有流动性和可变形性
足以以灵活和特定的方式与其他大分子进行非共价相互作用。脂质是稳定的 MP 和
蛋白质复合物的组成部分,通过影响蛋白质
构象发挥特定的结构作用,充当将复合物结合在一起的“桥接胶”
和/或充当蛋白质亚基之间的灵活界面或胶水。
8. 未来方向
脂质在细胞过程中所起的作用与自然界中发现的脂质的化学结构一样多种多样。结合遗传和生化方法是定义生理重要性结构功能关系的一种非常有效的方法。在微生物中使用这种方法已被证明是最有效的。通过利用简单但特征明确的细菌系统和体外 MP 重建技术,我们可以轻松地操纵脂质组成,以分离参与 MP 拓扑等复杂过程的单个脂质的功能。然后,我们可以将得出的折叠和组装规则推广到其他更复杂的生物系统。随着哺乳动物细胞和整个动物遗传学的复杂化发展,遗传操作与生化表征相结合将开始产生有关脂质在更复杂生物体中功能的新信息和有用信息。尽管如此,体外最小化系统可以为许多直接受膜结合过程控制的过程提供原理证明。脂质蛋白质相互作用。新的高分辨率方法将增强我们对生物膜分子组织、动力学和功能的理解。应探索新的机械假设和实验模型,以了解膜脂质蛋白质异质性(横向和跨膜)如何受脂质蛋白质基质的平衡和非平衡状态控制。本章中提出和讨论的结果提出了更多有待未来解决的问题。如果针对给定的膜环境编写 MP 序列,是否存在“磷脂代码”?特定磷脂在不同位置(特别是在磷脂双层的任一表面上)的可用性如何调节?生物源 ER 和类囊体膜是对称的还是不对称的?质膜不对称是所有膜的基本原理吗?恶性细胞类型以及实体肿瘤血管中报道的质膜磷脂不对称性的丧失是否会改变脂质软化酶和脂质酶的活性,从而导致“磷脂代码”改变。宿主细胞在感染时能否抹去此代码,病原体能否劫持宿主细胞内的“磷脂代码”来促进感染?不同生物体之间的 MP 组装规则是否不同?是否存在非酶促的脂质不对称产生和维持的物理机制?最后,随着我们对脂质在正常细胞功能中的作用的了解越来越多,它们在疾病中的作用将变得更加明显。多位点蛋白质生物合成过程中发生的脂质-蛋白质相互作用可能导致遗传性拓扑紊乱。因此,消除功能性糖基化位点或引入新的拓扑信号(磷酸化)的突变可能会导致蛋白质在细胞中的最终位置产生替代拓扑结构。这种结构上重要的残基的自然突变可能导致突变蛋白在不断变化的脂质环境中具有不同的结构组织,因为蛋白质会通过相同或改变的细胞器运输路径。这种脂质依赖性的拓扑紊乱是否存在?构象的多样性,不仅在膜上,而且在不同的功能或感染状态下,都需要了解不同易感染朊病毒的构象异构体共存的自我传播构象疾病的机制。因此,了解脂质如何影响蛋白质的折叠、组装和功能将有助于开发治疗构象和拓扑蛋白质紊乱的新方法。