第七章 性选择、精子竞争和性冲突:修订间差异
创建页面,内容为“ = 第7章 性选择、精子竞争与性冲突 = 照片 \circleddash Joah Madden 在《人类由来与性选择》的第二部分,查尔斯·达尔文(1871)提出了"性选择(Sexual Selection)"理论。他一直困惑于通常仅出现在单一性别(多为雄性)身上的夸张特征。例如为何只有雄性非洲大羚羊(kudu)拥有巨大犄角,为何只有雄性极乐鸟(birds of paradise)具备如此华丽的装饰性羽衣(…” |
无编辑摘要 |
||
| 第1行: | 第1行: | ||
照片 © Joah Madden | |||
照片 | |||
在《人类由来与性选择》的第二部分,查尔斯·达尔文(1871)提出了"性选择(Sexual Selection)"理论。他一直困惑于通常仅出现在单一性别(多为雄性)身上的夸张特征。例如为何只有雄性非洲大羚羊(kudu)拥有巨大犄角,为何只有雄性极乐鸟(birds of paradise)具备如此华丽的装饰性羽衣(图7.1)?达尔文指出这些结构对生存并非必需,否则雌性也应具备。相反,他认为这些特征演化是因为在配偶竞争中具有优势,此过程他称为"性选择"。 | 在《人类由来与性选择》的第二部分,查尔斯·达尔文(1871)提出了"性选择(Sexual Selection)"理论。他一直困惑于通常仅出现在单一性别(多为雄性)身上的夸张特征。例如为何只有雄性非洲大羚羊(kudu)拥有巨大犄角,为何只有雄性极乐鸟(birds of paradise)具备如此华丽的装饰性羽衣(图7.1)?达尔文指出这些结构对生存并非必需,否则雌性也应具备。相反,他认为这些特征演化是因为在配偶竞争中具有优势,此过程他称为"性选择"。 | ||
| 第9行: | 第8行: | ||
在研究性选择证据及其影响前,需探讨为何通常是雄性竞争雌性而非反之。这将引导我们回溯到两性根本差异的起源。 | 在研究性选择证据及其影响前,需探讨为何通常是雄性竞争雌性而非反之。这将引导我们回溯到两性根本差异的起源。 | ||
图7.1 达尔文的性选择理论用于解释雄性特征(通过武力或魅力进行配偶竞争)的演化。(a) 雄性条纹羚''Tragelaphus strepsiceros'' | 图7.1 达尔文的性选择理论用于解释雄性特征(通过武力或魅力进行配偶竞争)的演化。(a) 雄性条纹羚''Tragelaphus strepsiceros''的犄角。照片© Oliver Krüger。(b) 雄性红极乐鸟''Paradisaea raggiana''(左)向雌鸟(右)展示羽饰。照片© Tim Laman/naturepl.com | ||
== 雄性(male)与雌性(female) == | == 雄性(male)与雌性(female) == | ||
| 第16行: | 第15行: | ||
有性生殖(sexual reproduction)涉及减数分裂形成配子(gamete)及两个个体的遗传物质融合。该过程通常(但非绝对)涉及称为雄性与雌性的两性。高等动物中,两性常通过外生殖器、羽衣、体型或颜色等外部特征区分,但这些并非本质差异。所有动植物的两性根本差异在于配子大小:雌性产生大而静止、富含营养的卵子(egg),雄性配子(精子,sperm)则微小、可运动,本质上是一段能够自行推进的DNA。许多单细胞生物(如草履虫''Paramecium'')进行无两性分化的有性生殖,其配子大小相同,称为同配生殖(isogamous sexual reproduction)。但更常见的是异配生殖(anisogamous sex),即大小不同的配子(一大一小)融合,几乎所有多细胞动植物均采用此方式。 | 有性生殖(sexual reproduction)涉及减数分裂形成配子(gamete)及两个个体的遗传物质融合。该过程通常(但非绝对)涉及称为雄性与雌性的两性。高等动物中,两性常通过外生殖器、羽衣、体型或颜色等外部特征区分,但这些并非本质差异。所有动植物的两性根本差异在于配子大小:雌性产生大而静止、富含营养的卵子(egg),雄性配子(精子,sperm)则微小、可运动,本质上是一段能够自行推进的DNA。许多单细胞生物(如草履虫''Paramecium'')进行无两性分化的有性生殖,其配子大小相同,称为同配生殖(isogamous sexual reproduction)。但更常见的是异配生殖(anisogamous sex),即大小不同的配子(一大一小)融合,几乎所有多细胞动植物均采用此方式。 | ||
Parker | Parker 等人(1972)提出优雅模型解释'''异配生殖如何从同配生殖演化而来'''。假设合子(zygote)存活率取决于其大小:合子越大,发育所需营养越充足,存活机会越高。若大配子带来的存活优势超过其数量劣势,则大配子将被选择青睐。例如,若个体资源可分裂为两个大配子或四个小配子,则大配子形成的合子存活率需超过小配子两倍以上,大配子才具有选择优势。 | ||
图7.2 Parker 等人(1972)提出异配生殖通过分裂选择(disruptive selection)演化自同配生殖:具有营养储备的大配子(卵子)与寄生大配子投资的小配子(精子)。 | 图7.2 Parker 等人(1972)提出异配生殖通过分裂选择(disruptive selection)演化自同配生殖:具有营养储备的大配子(卵子)与寄生大配子投资的小配子(精子)。 | ||
| 第24行: | 第23行: | ||
Parker等人指出,从理论上讲,这场古老演化军备竞赛的最终结果是个体特化为生产大量小配子(male)或生产较少的大配子(female)。中等大小配子的生产者被淘汰,因为它们既不具备数量优势,也无法为合子提供大额食物储备(图7.2)。 | Parker等人指出,从理论上讲,这场古老演化军备竞赛的最终结果是个体特化为生产大量小配子(male)或生产较少的大配子(female)。中等大小配子的生产者被淘汰,因为它们既不具备数量优势,也无法为合子提供大额食物储备(图7.2)。 | ||
Parker等人模型的一个基本假设得到了对'' | Parker等人模型的一个基本假设得到了对''团藻目''的比较研究支持。'''单细胞的属中合子生长的食物储备相对不重要,通常表现为同配生殖(isogamous),而多细胞的属中食物储备影响合子存活,大多为异配生殖(anisogamous)(Knowlton, 1974);其他藻类科也显示出类似但较不明显的趋势(Bell, 1978)。''' | ||
因此,配子竞争的原始形式可能解释为何存在两种配子生产形态——即雄性与雌性。配子竞争还能解释两性为何得以维持(Parker, 1982)。以牛的卵子为例,其体积约为公牛精子的20,000倍。假设一头突变公牛使其精子体积加倍,但精子数量减半(因资源有限)。更大的精子仅能使合子的细胞质储备增加1/20,000单位,效益微乎其微。然而,当两头公牛与同一母牛交配时,突变公牛的相对受精成功率将从1/2降至1/3,代价巨大。Parker(1982)证明,雄性间精子竞争的微弱程度就足以维持异配生殖(anisogamy)。 | 因此,配子竞争的原始形式可能解释为何存在两种配子生产形态——即雄性与雌性。配子竞争还能解释两性为何得以维持(Parker, 1982)。以牛的卵子为例,其体积约为公牛精子的20,000倍。假设一头突变公牛使其精子体积加倍,但精子数量减半(因资源有限)。更大的精子仅能使合子的细胞质储备增加1/20,000单位,效益微乎其微。然而,当两头公牛与同一母牛交配时,突变公牛的相对受精成功率将从1/2降至1/3,代价巨大。Parker(1982)证明,雄性间精子竞争的微弱程度就足以维持异配生殖(anisogamy)。 | ||
| 第43行: | 第42行: | ||
David Queller(1997)指出雌性应提供更多照料的'''两个普遍原因''',这两者都源于交配系统的共同特征:雌性多次交配(一雌多雄制,polyandry)以及性选择(sexual selection)导致雄性交配成功率不均。在这两种情况下,我们必须权衡雄性将其资源(时间和能量)投入哺育后代或争取其他配偶的相对收益。 | David Queller(1997)指出雌性应提供更多照料的'''两个普遍原因''',这两者都源于交配系统的共同特征:雌性多次交配(一雌多雄制,polyandry)以及性选择(sexual selection)导致雄性交配成功率不均。在这两种情况下,我们必须权衡雄性将其资源(时间和能量)投入哺育后代或争取其他配偶的相对收益。 | ||
首先,考虑一个已交配的配对,其中'''可能存在其他雄性参与了该窝后代的部分父权分配'''。当配对雄性必须共享该窝后代的父权时,这会降低后代对他的遗传价值,从而减少留下协助的相对收益。简而言之,留下帮助养育其他雄性的后代几乎没有好处!因此,我们<u>预计在父权由多个雄性共享的物种中,雄性更不可能提供照料。</u> | |||
其次,考虑一个性选择导致雄性交配成功率严重不均的物种,其中部分雄性获得高于平均水平的交配份额。Queller(1997)意识到,无论雄性的潜在繁殖率有多高,只要性别比为1:1,雄性的平均实际繁殖率必须与雌性完全相同。这必然成立,因为每个后代都恰好有一个母亲和一个父亲。然而,考虑那些成功交配并拥有需要照料后代的部分雄性和雌性子集。如果大多数或所有雌性都能繁殖,而只有部分雄性成功(即竞争力最强的个体),那么这些少数成功雄性的预期未来繁殖成功率确实会高于雌性。因此,这些雄性通过不提供帮助并将更多资源投入获取其他配偶将获得更大收益。例如,假设有20只展示的雄性松鸡,其中最大且最活跃的雄性完成所有交配(若性别比为1:1,将与20只雌性交配)。因此,该雄性的预期繁殖成功率是雌性的20倍。'''与雌性相比,该雄性更不愿提供照料,因为抚育行为对其潜在未来繁殖成功的损害将远大于对雌性的影响。''' | |||
因此,Queller(1997)第二点逻辑如下:如果雌性在交配前投入更多资源,雄性将竞争雌性投资;这将导致雄性成功率的更大方差(部分竞争力强的雄性将获得巨大成功,而其他雄性将无法交配);这些成功的雄性在交配后则更不愿提供照料。随着雌性提供更多照料,针对雄性的性选择增强,形成正反馈(positive feedback),进一步降低雄性提供照料的可能性(Kokko & Jennions, 2009)。框7.1总结了测量性选择强度时的一些问题。<blockquote>'''框7.1 性选择强度的测量(KLUG ET AL., 2010)''' | 因此,Queller(1997)第二点逻辑如下:如果雌性在交配前投入更多资源,雄性将竞争雌性投资;这将导致雄性成功率的更大方差(部分竞争力强的雄性将获得巨大成功,而其他雄性将无法交配);这些成功的雄性在交配后则更不愿提供照料。随着雌性提供更多照料,针对雄性的性选择增强,形成正反馈(positive feedback),进一步降低雄性提供照料的可能性(Kokko & Jennions, 2009)。框7.1总结了测量性选择强度时的一些问题。<blockquote>'''框7.1 性选择强度的测量(KLUG ET AL., 2010)''' | ||
| 第51行: | 第52行: | ||
衡量方向性性选择(directional sexual selection)最大潜在强度的常用指标是'''Is''',即交配成功率在同性个体间变异的标准化测量,计算为某性别交配成功变异系数的平方(Wade, 1979; Shuster & Wade, 2003)。人们常假设Is由特定时间可交配个体的性别比("可操作性别比",Operational Sex Ratio, OSR;Emlen & Oring, 1977)决定。雄性通常在配子和亲代抚育上投入较少,因此更常在交配池中竞争配偶,导致OSR通常偏向雄性。 | 衡量方向性性选择(directional sexual selection)最大潜在强度的常用指标是'''Is''',即交配成功率在同性个体间变异的标准化测量,计算为某性别交配成功变异系数的平方(Wade, 1979; Shuster & Wade, 2003)。人们常假设Is由特定时间可交配个体的性别比("可操作性别比",Operational Sex Ratio, OSR;Emlen & Oring, 1977)决定。雄性通常在配子和亲代抚育上投入较少,因此更常在交配池中竞争配偶,导致OSR通常偏向雄性。 | ||
图B7.1.1的简单示例表明,若不考虑OSR如何影响雄性垄断配偶的能力,就无法对OSR与性选择的关系进行普适性预测。在A中,向交配池添加新雄性可能导致顶级雄性加强配偶垄断(B),也可能使配偶垄断更难实现(C)。在D中,OSR变化未改变竞争者绝对密度(一雄进入,一雌离开),同样导致配偶垄断增强(E)或减弱(F)。在第一个图示(下方)中,Is符合预期:随配偶垄断增强而上升(A到B),随配偶垄断减弱而下降(A到C)。在第二个图示(下页)中,Is也随更多雄性未能交配而上升(D到E),但当交配成功率尽可能均等时仍会上升(D到F)。 | 图B7.1.1的简单示例表明,若不考虑OSR如何影响雄性垄断配偶的能力,就无法对OSR与性选择的关系进行普适性预测。在A中,向交配池添加新雄性可能导致顶级雄性加强配偶垄断(B),也可能使配偶垄断更难实现(C)。在D中,OSR变化未改变竞争者绝对密度(一雄进入,一雌离开),同样导致配偶垄断增强(E)或减弱(F)。在第一个图示(下方)中,Is符合预期:随配偶垄断增强而上升(A到B),随配偶垄断减弱而下降(A到C)。在第二个图示(下页)中,Is也随更多雄性未能交配而上升(D到E),但当交配成功率尽可能均等时仍会上升(D到F)。[[文件:AB-B7.1.1.png|居中|缩略图|图 B7.1.1]][[文件:AB-B7.1.2.png|居中|缩略图|图 B7.1.1(续)]] | ||
图 B7.1.1 | |||
图 B7.1.1(续) | |||
F中的性选择是否强于D?可能如此,但若交配随机则不然。理想情况下,我们首先需检验雄性成功率的方差是否显著高于随机预期(Sutherland, 1985)。接着需量化特定性状(如长尾)所受选择的强度。但这会增加跨物种比较的难度(不同物种可能具有不同性状)。</blockquote> | F中的性选择是否强于D?可能如此,但若交配随机则不然。理想情况下,我们首先需检验雄性成功率的方差是否显著高于随机预期(Sutherland, 1985)。接着需量化特定性状(如长尾)所受选择的强度。但这会增加跨物种比较的难度(不同物种可能具有不同性状)。</blockquote> | ||
| 第64行: | 第61行: | ||
人们很容易接受达尔文提出的性选择过程的第一部分,即通过选择进化出增强雄性直接争夺配偶战斗成功的性状。现有充分证据表明,在许多物种中,体型最大、力量最强或武器最发达的雄性获得最高交配成功率。例如,雌性北象海豹(''Mirounga angustirostris'')上岸产仔后,会再次交配以生产下一年的后代。由于繁殖地点的局域性,雌性聚集形成可防御的资源,雄性通过战斗垄断配偶群(图7.4)。最大最强的雄性赢得最大的配偶群;Burney Le Boeuf和Joanne Reiter(1988)在加利福尼亚的长期研究中发现,每年180只竞争雄性中仅有5只负责与470只雌性完成48-92%的交配。成年雄性体重是雌性的3至7.5倍。多数雌性4岁首次繁殖,而雄性延迟到6-9岁才开始尝试繁殖,以积累体型和力量在激烈雌性争夺战中获得机会。雌性繁殖成功取决于养育后代能力,而雄性则取决于通过战斗和保卫配偶群获得的交配成功率。 | 人们很容易接受达尔文提出的性选择过程的第一部分,即通过选择进化出增强雄性直接争夺配偶战斗成功的性状。现有充分证据表明,在许多物种中,体型最大、力量最强或武器最发达的雄性获得最高交配成功率。例如,雌性北象海豹(''Mirounga angustirostris'')上岸产仔后,会再次交配以生产下一年的后代。由于繁殖地点的局域性,雌性聚集形成可防御的资源,雄性通过战斗垄断配偶群(图7.4)。最大最强的雄性赢得最大的配偶群;Burney Le Boeuf和Joanne Reiter(1988)在加利福尼亚的长期研究中发现,每年180只竞争雄性中仅有5只负责与470只雌性完成48-92%的交配。成年雄性体重是雌性的3至7.5倍。多数雌性4岁首次繁殖,而雄性延迟到6-9岁才开始尝试繁殖,以积累体型和力量在激烈雌性争夺战中获得机会。雌性繁殖成功取决于养育后代能力,而雄性则取决于通过战斗和保卫配偶群获得的交配成功率。 | ||
图7. | 图7.4(a)雄性南象海豹。(b)两只雄性为雌性配偶群争斗。(c)雄性体型远大于雌性。图中为两只亚成体。照片© Oliver Krüger。 | ||
因此,导致雄性体型更大、力量更强或武器更发达的性二态性(sexual dimorphism)进化容易解释,因为这些性状能提升雄性在雄性间配偶争夺战中的成功率。 | 因此,导致雄性体型更大、力量更强或武器更发达的性二态性(sexual dimorphism)进化容易解释,因为这些性状能提升雄性在雄性间配偶争夺战中的成功率。 | ||
| 第73行: | 第70行: | ||
'''Malte Andersson''' '''对长尾寡妇鸟的经典实验''' | '''Malte Andersson''' '''对长尾寡妇鸟的经典实验''' | ||
在繁殖季节初期,Andersson标记了36只雄鸟的领地范围,并记录每只吸引的雌鸟数量。随后他将它们随机分为四组:第一组被剪短尾羽至约14cm;这些被剪下的尾羽被用于加长第二组的尾羽,使其平均延长25cm。剩余两组作为对照:一组保持原状,另一组被剪断后重新粘合(长度不变)。通过统计各领地内的巢穴数量(反映吸引雌鸟的数量),Andersson发现实验处理前各组求偶成功率无差异,但处理后长尾雄鸟显著优于对照组和短尾组(图7.5)。短尾雄鸟的求偶展示活跃度未降低,也未更易放弃领地。因此,长尾组成功率提升反映了雌性选择。Andersson的关键发现是:雌性偏好比正常尾羽更长的尾羽。这表明性选择(sexual selection)(偏好更长尾羽)与自然选择(natural selection)(可能因长尾妨碍生存而限制尾长)之间存在平衡。 | |||
性装饰(sexual ornaments)的代价已在类似的家燕(''Hirundo rustica'')尾羽操控实验中得到证实。实验性延长尾羽的雄性能更快配对,且更受寻求额外交配(extra-pair matings)的雌性青睐(Møller, 1988)。但这些雄鸟在觅食中处于劣势:捕获更小猎物,换羽期生长出质量更差的羽毛和更短的尾羽。因此,次年它们吸引配偶更慢,繁殖成功率降低(Møller, 1989)。 | 性装饰(sexual ornaments)的代价已在类似的家燕(''Hirundo rustica'')尾羽操控实验中得到证实。实验性延长尾羽的雄性能更快配对,且更受寻求额外交配(extra-pair matings)的雌性青睐(Møller, 1988)。但这些雄鸟在觅食中处于劣势:捕获更小猎物,换羽期生长出质量更差的羽毛和更短的尾羽。因此,次年它们吸引配偶更慢,繁殖成功率降低(Møller, 1989)。 | ||
| 第91行: | 第88行: | ||
在''Euplectes''属中,尾长与类胡萝卜素着色呈负相关。寡妇鸟类倾向于具长尾和少量类胡萝卜素着色,而主教鸟类具短尾但大面积黄/红色羽饰(图B7.2.2)。两种信号间的能量权衡可能影响了该属羽饰多样性的进化,反映了雄性竞争与雌性选择力量的平衡。主教鸟常集群繁殖,雄鸟保卫密集的小型领地,导致激烈雄性竞争(故强调类胡萝卜素展示)。相反,寡妇鸟领地大而分散,雌性选择可能更重要(故强调长尾)(Andersson et al., 2002)。 | 在''Euplectes''属中,尾长与类胡萝卜素着色呈负相关。寡妇鸟类倾向于具长尾和少量类胡萝卜素着色,而主教鸟类具短尾但大面积黄/红色羽饰(图B7.2.2)。两种信号间的能量权衡可能影响了该属羽饰多样性的进化,反映了雄性竞争与雌性选择力量的平衡。主教鸟常集群繁殖,雄鸟保卫密集的小型领地,导致激烈雄性竞争(故强调类胡萝卜素展示)。相反,寡妇鸟领地大而分散,雌性选择可能更重要(故强调长尾)(Andersson et al., 2002)。 | ||
图 B7.2.1 红领寡妇鸟。照片 | 图 B7.2.1 红领寡妇鸟。照片 © Warwick Tarboton. | ||
图 B7.2.2 红主教鸟。照片 | 图 B7.2.2 红主教鸟。照片 © Oliver Krüger. | ||
最后,对Euplectes属33个亚种(共17个种)的系统发育分析表明,长尾和更鲜艳的红色至少两次从短尾黄色信号祖先演化而来。这表明在演化过程中存在对增强展示特征的性选择(sexual selection)。此外,长尾寡妇鸟(尾羽最长的物种)近期出现了类胡萝卜素色素的丢失,进一步支持了色彩与尾羽之间存在权衡的观点(Prager & Andersson, 2009)。</blockquote>图7.7 雄性牛蛙通过摔跤争夺优质产卵领地(左)。获胜者通过鸣叫吸引雌性(中),雌性在雄性领地内产卵。引自Howard (1978a,b)。 | 最后,对Euplectes属33个亚种(共17个种)的系统发育分析表明,长尾和更鲜艳的红色至少两次从短尾黄色信号祖先演化而来。这表明在演化过程中存在对增强展示特征的性选择(sexual selection)。此外,长尾寡妇鸟(尾羽最长的物种)近期出现了类胡萝卜素色素的丢失,进一步支持了色彩与尾羽之间存在权衡的观点(Prager & Andersson, 2009)。</blockquote>图7.7 雄性牛蛙通过摔跤争夺优质产卵领地(左)。获胜者通过鸣叫吸引雌性(中),雌性在雄性领地内产卵。引自Howard (1978a,b)。 | ||
| 第118行: | 第115行: | ||
== 雌性选择的遗传收益:两种假说 == | == 雌性选择的遗传收益:两种假说 == | ||
=== | === Fisher's假说:雌性获得具吸引力的子代 === | ||
【译者注:即'''性感儿子'''】 | |||
R.A. Fisher(1930)首次明确提出,复杂的雄性展示可能通过性选择(sexual selection)演化,仅仅因为它使雄性对雌性具有吸引力。这听起来像是循环论证,确实如此,但这也正是Fisher论证的精妙之处。他最初假设,雌性偏好某个特定雄性特征(以长尾羽为例)是因为该特征反映了雄性的质量。或许尾羽更长的雄性飞行能力更强,因此在收集食物或躲避捕食者方面更具优势。另一个可能的起点是假设长尾羽更易被察觉,或雌性已存在对特定刺激做出反应的感觉偏向(sensory bias)(Ryan等,1990;第14章)。如果雄性尾长差异存在某种遗传基础……该优势将传递给雌性后代中的雄性。同时,导致雌性偏好长于平均尾羽的基因也会被选择,因为这些雌性将拥有飞行能力更强或更易被潜在配偶察觉的雄性后代。 | R.A. Fisher(1930)首次明确提出,复杂的雄性展示可能通过性选择(sexual selection)演化,仅仅因为它使雄性对雌性具有吸引力。这听起来像是循环论证,确实如此,但这也正是Fisher论证的精妙之处。他最初假设,雌性偏好某个特定雄性特征(以长尾羽为例)是因为该特征反映了雄性的质量。或许尾羽更长的雄性飞行能力更强,因此在收集食物或躲避捕食者方面更具优势。另一个可能的起点是假设长尾羽更易被察觉,或雌性已存在对特定刺激做出反应的感觉偏向(sensory bias)(Ryan等,1990;第14章)。如果雄性尾长差异存在某种遗传基础……该优势将传递给雌性后代中的雄性。同时,导致雌性偏好长于平均尾羽的基因也会被选择,因为这些雌性将拥有飞行能力更强或更易被潜在配偶察觉的雄性后代。 | ||
当雌性对长尾羽的偏好开始扩散时,长尾雄体会获得双重优势:既增强飞行能力又提高交配几率。雌性通过选择也获得双重优势:其子代将兼具优秀飞行能力和对雌性的吸引力。随着雌性偏好与尾长增长之间的正反馈发展,拥有吸引力子代的益处将逐渐成为雌性选择的主要动因,而被选择的特征最终可能降低雄体的生存能力。当生存能力下降与性吸引力达到平衡时,尾羽增长的选择压力将逐渐停止(Lande,1981;Kirkpatrick,1982)。框7.3更详细地描述了Fisher假说的某些方面。 | 当雌性对长尾羽的偏好开始扩散时,长尾雄体会获得双重优势:既增强飞行能力又提高交配几率。雌性通过选择也获得双重优势:其子代将兼具优秀飞行能力和对雌性的吸引力。随着雌性偏好与尾长增长之间的正反馈发展,拥有吸引力子代的益处将逐渐成为雌性选择的主要动因,而被选择的特征最终可能降低雄体的生存能力。当生存能力下降与性吸引力达到平衡时,尾羽增长的选择压力将逐渐停止(Lande,1981;Kirkpatrick,1982)。框7.3更详细地描述了Fisher假说的某些方面。 | ||
=== | === 给子代的优质基因 === | ||
Amotz Zahavi(1975,1977)提出了关于复杂雄性展示的另一种观点。他指出孔雀的长尾在日常生存中是种累赘(handicap) | Amotz Zahavi(1975,1977)提出了关于复杂雄性展示的另一种观点。他指出孔雀的长尾在日常生存中是种累赘(handicap)。进而提出雌性偏好长尾(或其他类似特征)'''正是因其作为累赘,能可靠传递雄性遗传质量信号。'''这种尾部展示了雄性在存在累赘的情况下仍能生存的能力,意味着他必须在其他方面格外优秀。若这种能力具有遗传性,"优秀"生存特质的倾向将传递给后代。因此,雌性通过选择展示真实遗传质量的配偶来筛选优质基因(good genes)。'''需注意该假说中的"优质基因"指生存与繁殖相关的实用基因,而非Fisher假说中纯粹吸引雌性的基因。''' | ||
Zahavi的观点最初未被接受,但后续理论研究显示累赘假说能合理解释复杂性展示的演化,或许能推广至动物信号系统(第14章)。成功的累赘原则理论模型最重要特征是:雄性仅在状态良好时表达累赘,即展现完整求偶展示(Grafen,1990a,1990b)。这解决了Zahavi原始观点中被批评的难题——原观点认为累赘作为固定性状,无论雄性能否负担都必须承受。灵活累赘概念存在不同变体(有学者提出"揭示性累赘(revealing handicaps)"反映雄性当前活力,另一些提出"状态依赖性累赘(condition dependent handicaps)"与雄性状态成比例表达),但这些模型的核心在于雄性展示程度能向雌性传递其遗传质量信息。 | Zahavi的观点最初未被接受,但后续理论研究显示累赘假说能合理解释复杂性展示的演化,或许能推广至动物信号系统(第14章)。成功的累赘原则理论模型最重要特征是:雄性仅在状态良好时表达累赘,即展现完整求偶展示(Grafen,1990a,1990b)。这解决了Zahavi原始观点中被批评的难题——原观点认为累赘作为固定性状,无论雄性能否负担都必须承受。灵活累赘概念存在不同变体(有学者提出"揭示性累赘(revealing handicaps)"反映雄性当前活力,另一些提出"状态依赖性累赘(condition dependent handicaps)"与雄性状态成比例表达),但这些模型的核心在于雄性展示程度能向雌性传递其遗传质量信息。 | ||
理论家最初困扰的另一个问题是:'''若雌性对"最佳基因"雄体施加强选择压力,遗传变异(genetic variation)可能迅速减少''',因为仅有少数雄性基因型能成功繁殖。类似地,人工选择性状最初效果显著,但随着性状遗传变异被"耗尽"效力减弱。若雌性选择需付出代价(如耗费时间寻找配偶),理'''论上当遗传变异下降时雌性应停止选择(Andersson,1994)。''' | |||
'''当前研究认为实践中问题不大''',原因有四:第一,'''群体持续承受有害突变输入''',雌性始终挑剔以避免潜在配偶携带这些突变具有进化意义(Kondrashov,1988;Agrawal,2001)。第二,若仅状态最佳雄体能负担复杂装饰或活力展示,'''雌性选择难以耗尽遗传变异,因影响雄性状态的基因数量庞大'''。事实上,雄性体内几乎所有生理过程都会影响状态,故遗传变异量极大(Rowe & Houle,1996)。第三,'''雌性可能在不同年份选择不同雄性特征''',从而维持多性状背后的遗传变异。例如在云雀鹀(''Calamospiza melanocorys'')中,某些年份雌性偏好最黑雄性,其他年份选择翅斑最大者或喙最大者等(Chaine & Lyon,2008)。这种快速变化的性选择模式与达尔文雀类自然选择的振荡模式相似——食物供给的年际变化导致某些年份选择小喙,其他年份选择大喙(Grant & Grant,2002)。 | |||
宿主- | 维持适应度遗传变异的第四个因素是'''宿主-寄生虫军备竞赛'''。Bill Hamilton(1936-2000)是达尔文之后最具影响力的进化生物学家之一。他曾指出英国乡村毕生所见最显著的两个变化由疾病引发:周期性杀死兔群并改变植被的粘液瘤病毒(myxoma virus),以及摧毁英格兰低地榆树的荷兰榆树病(Dutch elm disease)。这使他确信疾病是自然界强大的选择压力。与Marlene Zuk合作(Hamilton & Zuk,1982),他提出性展示是疾病遗传抗性的可靠指标。据此观点,雌性选择复杂展示如同诊断兽医,筛选具有当前感染抗性基因的雄性。'''由于寄生虫与宿主持续进行适应与反适应的军备竞赛,双方基因不断变化,"优质基因"始终动态变化''',因此雌性保持挑剔始终有利。 | ||
【译者注:'''Hamilton–Zuk 假说'''】 | |||
== 对遗传收益假说的检验 == | == 对遗传收益假说的检验 == | ||
要证明某性状通过Fisher过程演化,需证实雌性偏好与雄性特征均存在遗传变异,且偏好基因与特征基因存在协变(框7.3)。多项研究已证实这种预测的遗传相关性。 | 要证明某性状通过Fisher过程演化,需证实雌性偏好与雄性特征均存在遗传变异,且偏好基因与特征基因存在协变(框7.3)。多项研究已证实这种预测的遗传相关性。 | ||
----'''框7.3 鼻长的性选择的遗传协方差对费舍尔假说的重要性(LANDE, 1981)''' | |||
(1) 假设种群中最初存在鼻长和雌性偏好的变异范围。偏好略长于平均鼻长(nose lengths)的雌性会与长鼻雄性交配,反之亦然。关键事实在于这些交配的后代会同时携带鼻长基因和偏好基因:'''要么是长鼻基因加长偏好基因,要么是短鼻基因加短偏好基因'''。偏好仅在雌性中表达,鼻长仅在雄性中表达,但所有个体都携带这两种基因。简而言之,鼻长基因与偏好基因之间'''会产生关联或协方差'''(covariance)。通过雌性的偏好可预测她携带并传递给儿子的鼻长基因类型(图 B7.3.1)。 | |||
''' | (2) 在这种协方差下,演化将如何推进?若偏好高于或低于平均鼻长(\bar{x})的雌性数量相等,则不会产生变化。但<u>如果某一侧的雌性数量'''偶然略占优势'''</u>(可能是长或短,这里假设为长),'''则正反馈将启动'''(如图中箭头所示)。雌性选择长鼻雄性(长鼻雄性交配机会更高),由于协方差的存在,这也同时选择长偏好基因。这进一步推动鼻长演化,进而增强偏好强度。 | ||
(3) 该假说的量化模型中,性选择的最终结果取决于模型的具体假设,例如雌性选择是否具有代价(cost of female choice)(Pomiankowski et al., 1991)。但重要的普遍结论是:'''雄性特征与雌性偏好间的协方差(genetic covariance)是费舍尔假说的基础。''' | |||
(3) 该假说的量化模型中,性选择的最终结果取决于模型的具体假设,例如雌性选择是否具有代价(cost of female choice)(Pomiankowski et al., | |||
图 B7.3.1 长鼻基因与长偏好基因在后代中共同出现。直线的斜率代表关联或协方差的程度。 | 图 B7.3.1 长鼻基因与长偏好基因在后代中共同出现。直线的斜率代表关联或协方差的程度。 | ||
----Wilkinson 和 Reillo(1994)研究了突眼蝇(''Cyrtodiopsis dalmanni'')。这种小型蝇类的眼睛位于突出的眼柄上,雄性的眼柄特别长,其眼间距可超过体长(图7.10)。在马来半岛的溪流沿岸,它们栖息于植物根须上,眼间距最大的雄性周围聚集更多雌性。实验室选择实验显示雌性明显偏好眼间距最大的雄性。Wilkinson 和 Reillo 随后'''进行人工选择实验''':<u>一组选择眼间距最长的雄性,另一组选择眼间距最短的雄性</u>。经过13代后,发现雌性偏好也发生了相关响应(correlated response)的改变:'''长眼间距品系的雌性偏好长眼间距雄性,而短眼间距品系的雌性偏好短眼间距雄性'''。 | |||
图7.10 一只雄性(上方)和三只雌性突眼蝇栖息于根须上。注意雄性显著更大的眼间距。来自 Wilkinson 和 Reillo(1994)。 | 图7.10 一只雄性(上方)和三只雌性突眼蝇栖息于根须上。注意雄性显著更大的眼间距。来自 Wilkinson 和 Reillo(1994)。 | ||
特立尼达与委内瑞拉东北部的溪流中,雄性孔雀鱼的体色存在显著变异。高捕食压力溪流中的雄性体色暗淡,而低捕食压力溪流中的雄性则体色鲜艳,具有大型橙色斑点(第4章)。Houde 和 Endler(1990)发现种群中雄性橙色面积与雌性对橙色的偏好强度呈正相关。刺鱼种群间雄性婚配红色的鲜艳度也存在差异。雌性偏好更红的雄性(Milinski & Bakker, 1990),育种实验显示子代雄性的红色强度与父代相关。此外,红艳雄性的雌性后代偏好红艳雄性,而暗淡雄性的雌性后代对红色无偏好(Bakker, 1993)。因此,特征与偏好再次呈现正遗传相关(positive genetic correlation)。 | 特立尼达与委内瑞拉东北部的溪流中,雄性孔雀鱼的体色存在显著变异。高捕食压力溪流中的雄性体色暗淡,而低捕食压力溪流中的雄性则体色鲜艳,具有大型橙色斑点(第4章)。Houde 和 Endler(1990)发现种群中雄性橙色面积与雌性对橙色的偏好强度呈正相关。刺鱼种群间雄性婚配红色的鲜艳度也存在差异。雌性偏好更红的雄性(Milinski & Bakker, 1990),育种实验显示子代雄性的红色强度与父代相关。此外,红艳雄性的雌性后代偏好红艳雄性,而暗淡雄性的雌性后代对红色无偏好(Bakker, 1993)。因此,特征与偏好再次呈现正遗传相关(positive genetic correlation)。 | ||
这些结果表明'''费舍尔失控过程(Fisher’s runaway process)'''(框7.3)可能存在,但未验证费舍尔假说的核心假设——即雄性特征被选择的唯一收益是提高交配成功率。要证明这点,还需证实雄性特征表达与任何遗传性"实用"适合度(fitness)无关,如疾病抗性或资源获取能力(如障碍假说(handicap hypothesis)所述)。检验该预测的两种方法是:(i) 观察种群内雄性特征极端表达是否与生存力相关;(ii) 检测极端特征雄性的后代。根据费舍尔假说,这些后代不应具有增强的生存力,仅应具有增强的雄性交配成功率。这两类检验的难点在于:支持费舍尔假说需要获得阴性结果,而阴性结果可能源于样本量不足或变量选择不当。此外,费舍尔假说与优良基因假说(good genes hypothesis)并非互斥(Iwasa et al., 1991)。若偏好与特征存在遗传相关,即使特征是雄性遗传质量的诚实信号(honest signal),费舍尔失控过程仍可能运作。下面将探讨两个检验"优良基因"假说的案例研究。 | |||
图7.11 (a) 展示尾羽的雄性孔雀。照片由Marion Petrie提供。(b) 尾部具有更大眼斑的雄性所产后代存活率更高。来自Petrie(1994)。 | 图7.11 (a) 展示尾羽的雄性孔雀。照片由Marion Petrie提供。(b) 尾部具有更大眼斑的雄性所产后代存活率更高。来自Petrie(1994)。 | ||
= 孔雀 = | === 孔雀 === | ||
雄性蓝孔雀(''Pavo cristatus'')的华丽尾羽常被视为性选择的巅峰。其尾羽由大量延长的上尾覆羽构成,带有蓝心绿铜色眼斑(ocelli),雄性会竖立这些羽毛形成闪烁的扇形进行求偶展示(图7.11a)。Marion Petrie 检验了这种展示是否反映雄性的遗传质量。她研究英国南部惠普斯奈德野生动物园中的野生孔雀种群。首先,她证明尾羽眼斑数量可预测雄性交配成功率,且实验性减少眼斑数量会导致雄性次年交配成功率下降(Petrie et al., | 雄性蓝孔雀(''Pavo cristatus'')的华丽尾羽常被视为性选择的巅峰。其尾羽由大量延长的上尾覆羽构成,带有蓝心绿铜色眼斑(ocelli),雄性会竖立这些羽毛形成闪烁的扇形进行求偶展示(图7.11a)。Marion Petrie 检验了这种展示是否反映雄性的遗传质量。她研究英国南部惠普斯奈德野生动物园中的野生孔雀种群。首先,她证明尾羽眼斑数量可预测雄性交配成功率,且实验性减少眼斑数量会导致雄性次年交配成功率下降(Petrie et al., 1991)。随后进行配对实验:将雌性与不同自然尾羽装饰程度的雄性随机配对。收集所有卵并由母鸡在标准条件下孵化,幼鸟在鸟舍中自由取食。Petrie(1994)发现'''尾羽装饰更丰富的雄性子代(无论雌雄)生长更佳'''。当放归公园后,这些子代至两岁时的存活率也更高(图7.11b)。这表明该种群中雌性通过选择装饰最丰富的雄性获得更高存活率的后代。然而在日本的另一项研究中,未发现雌性偏好更复杂尾羽的证据(Takahashi et al., 2008)。可能与孔雀鱼类似,雌性选择在不同生态条件下存在差异。 | ||
= | === 刺鱼 === | ||
验证'''汉密尔顿-祖克假说(Hamilton–Zuk hypothesis)'''绝非易事。例如,仅证明雌性偏好寄生虫负荷较低的雄性并不充分。她们可能这样做并非为了为后代挑选优质基因,而仅仅是为了避免在交配过程中被感染,或因为她们希望获得能提供有效亲代抚育的配偶(高度寄生的雄性可能体质虚弱)。'''需要验证的四个关键假设'''是:<u>(i)寄生虫降低宿主的适合度(fitness);(ii)寄生虫抗性具有遗传性;(iii)性装饰的复杂化传递了寄生虫抗性信号;(iv)雌性偏好装饰最复杂的雄性</u>。这四点'''均在三刺鱼(''Gasterosteus aculeatus'')的详细研究中得到证实。''' | |||
= 刺鱼 = | |||
春季,雄性三刺鱼会发育出鲜红色体色并筑巢。随后,它们通过之字形舞蹈(zig-zag dance)试图吸引怀卵雌性(图7.12a)。若雌性被吸引,她会进入巢中产卵,雄性立即跟进并在体外完成受精。雄性随后会照料卵和幼鱼约10天。Manfred Milinski与Theo Bakker(1990)通过巧妙实验证明,雌性更倾向于与红色更鲜艳的雄性交配。当实验室水槽中的雌性面临两个筑巢雄性的选择时,在正常白光条件下她们偏好更红的雄性;但在绿光下(红色不可见时),雌性未表现出明显偏好(图7.12b)。雄性的求偶展示不受光照条件影响,因此该实验清晰地表明雌性选择受雄性红色体色驱动。 | 春季,雄性三刺鱼会发育出鲜红色体色并筑巢。随后,它们通过之字形舞蹈(zig-zag dance)试图吸引怀卵雌性(图7.12a)。若雌性被吸引,她会进入巢中产卵,雄性立即跟进并在体外完成受精。雄性随后会照料卵和幼鱼约10天。Manfred Milinski与Theo Bakker(1990)通过巧妙实验证明,雌性更倾向于与红色更鲜艳的雄性交配。当实验室水槽中的雌性面临两个筑巢雄性的选择时,在正常白光条件下她们偏好更红的雄性;但在绿光下(红色不可见时),雌性未表现出明显偏好(图7.12b)。雄性的求偶展示不受光照条件影响,因此该实验清晰地表明雌性选择受雄性红色体色驱动。 | ||
为何雌性偏好更红的雄性?Milinski与Bakker发现,雄性的红色体色是其体况(condition)的信号(更红的雄性单位体长质量更大)。当被偏好的鲜艳雄性感染寄生虫后,其体况与红色强度均下降。此时在白光下雌性不再偏好它们,而绿光下雄性感染状态不影响雌性选择。 | 为何雌性偏好更红的雄性?Milinski与Bakker发现,雄性的红色体色是其体况(condition)的信号(更红的雄性单位体长质量更大)。当被偏好的鲜艳雄性感染寄生虫后,其体况与红色强度均下降。此时在白光下雌性不再偏好它们,而绿光下雄性感染状态不影响雌性选择。 | ||
'''图7.12''' | '''图7.12''' (a)繁殖期体色的雄性三刺鱼围绕怀卵雌性进行之字形游动。照片© Manfred Milinski。(b)白光下(左图),雌性偏好两只雄性中更鲜艳者。实验使用15对雄性,绘制其红色强度差异与雌性偏好的关系。红色差异越大,雌性对更鲜艳雄性的偏好越强。绿光下(雌性无法辨别红色差异)无显著偏好(右图)。引自Milinski与Bakker(1990)。经自然出版集团许可转载。 | ||
因此,选择更红雄性的优势之一是雌性能获得更健康的配偶,后者能更好地扇动并保护其卵和幼鱼。但进一步实验表明,健康雄性还可能为雌性后代提供"优质基因" | 因此,选择更红雄性的优势之一是雌性能获得更健康的配偶,后者能更好地扇动并保护其卵和幼鱼。但进一步实验表明,健康雄性还可能为雌性后代提供"优质基因",即赋予当前感染抗性的等位基因(allele),正如汉密尔顿与祖克(1982)所假设。主要组织相容性复合体(MHC)是一组编码MHC分子(糖蛋白)的基因簇,这些分子帮助抵御寄生虫感染。不同MHC分子识别并结合不同的外源肽段(foreign peptide),随后将其销毁(细节复杂,Milinski(2006a)提供了优秀综述)。MHC包含脊椎动物中已知多态性(polymorphic)最强的基因位点(gene loci),因此个体的MHC谱(MHC profile)差异极大。'''雌性能通过气味评估雄性的MHC谱,因为MHC基因产物具有气味。'''在实验室雌性选择不同雄性气味的实验中,她们偏好那些MHC等位基因与自身形成最佳互补的雄性,包括能抵抗当前流行感染的等位基因(Reusch et al., 2001; Eizaguirre et al., 2009)。因此,通过选择健康雄性,雌性既获得更好的亲代抚育,又为后代带来遗传收益。 | ||
……以及MHC等位基因与自身互补的雄性。因此雌性选择既带来遗传收益,也改善亲代抚育 | ……以及MHC等位基因与自身互补的雄性。因此雌性选择既带来遗传收益,也改善亲代抚育 | ||
= | == 雌性受到的性选择与雄性进行的性选择 == | ||
= 雌性装饰 = | === 雌性装饰 === | ||
'''当雄性对亲代投资贡献较大时,雄性可能对配偶挑剔''';这会导致'''雌性中的性选择''',促使雌性进化出提升获得雄性机会的特征(图7.13a)。例如,在一夫一妻制鸟类中,双亲常共同投入大量亲代抚育,因此双方均有动机选择高质量配偶。某些情况下,两性具有相似装饰(如某些䴙䴘的头羽)。达尔文(1871)认为这些特征通过"相互配偶选择(mutual mate choice)"进化。另一种假说认为雌性装饰仅是雄性装饰进化时产生的非适应性相关反应(correlated response)。但选择实验表明此类相关反应较弱,且装饰表达常限于单一性别(Wiens, 2001)。此外,比较研究显示雌性装饰在进化中频繁变化(Kraaijeveld et al., 2007)。现有实验证据支持相互配偶选择。例如,冠海雀(''Aethia cristatella'')繁殖期两性均发育醒目额冠,实验显示两性均对额冠更长的异性展示更积极(Jones & Hunter, 1993)。 | |||
'''图7.13''' | '''图7.13''' 雌性性装饰。(a)凤头䴙䴘两性均具头羽装饰,可能通过相互配偶选择进化。照片© osf.co.uk。版权所有。(b)南非开普半岛雌性查克玛狒狒(''Papio ursinus'')的性肿胀(sexual swelling)。照片© Esme Beamish。 | ||
在生活在多雄群体中的某些灵长类动物中,雌性展示采取了一种极端形式,此时雌性可接触到多个雄性。在此情况下,雌性会发展出大型的性肿胀(sexual swellings),其大小和颜色在月经周期中变化,并标志着繁殖力(fecundity)的变化(图7.13b)。'''在某些物种中,这些肿胀变得如此之大,以至于雌性难以舒适地坐下''',因此这些肿胀必定像雄性孔雀的尾巴一样既是累赘也是信号。在狒狒''Papio cynocephalus anubis''中,肿胀大小的个体差异与雌性质量(养育后代的能力;Domb & Pagel, 2001)相关。雌性可能竞争与优势雄性(最能保护她们或其后代)的交配机会,也可能竞争与群体中多个雄性交配,以给予每个雄性足够的父权机会,从而使其放弃杀婴行为(第2章)。类似的性肿胀也出现在高山领岩鹨''Prunella collaris''中,这是一种同样生活在多雄群体中的山地鸣禽。雄性只有在与雌性交配并拥有父权机会时,才会帮助喂养雌性的后代。通过将交配(及父权)分配给多个雄性,雌性增加了一个或多个雄性提供帮助的可能性(Davies et al., 1996b)。雌性通过展示鲜红的泄殖腔(cloacas)(Nakamura, 1990)并在生育期鸣唱以吸引雄性(Langmore et al., 1996)来竞争雄性的关注。 | |||
= | === 性别角色反转 === | ||
在某些情况下,雌性对雄性的竞争变得如此强烈,以至于通常的性别角色发生反转。'''在海龙''Syngnathus typhle''中,怀孕的是雄性''';其拥有一个育雏袋,用于安全保存一窝受精卵并提供营养和氧气(图7.14)。在持续数周的怀孕期间,'''雌性可产下多窝卵'''。因此,雄性成为雌性繁殖成功的限制性资源,雌性竞争雄性,而雄性偏好体型更大、更具装饰性且产卵量更大的雌性(Rosenqvist, 1990; Berglund et al., 2006)。 | |||
有时'''性竞争可能存在季节性变化'''。Darryl Gwynne和Leigh Simmons(1990)揭示了食物供应的季节性变化如何导致澳大利亚''Kawanaphila''螽斯科昆虫的性别角色变化。'''当食物稀缺时''',雄性富含蛋白质的大型精荚(spermatophore)生产成本高昂,但对雌性极具价值(图7.15)。'''雌性竞争雄性''',而雄性变得挑剔,偏好产卵量更大的大型雌性。然而,'''当富含花粉的禾木树开花时''',雄性可更快地产生精荚。此时,接近可受孕雌性的机会限制了雄性的成功,'''雄性开始竞争雌性''',而雌性会拒绝部分雄性。 | |||
图7.14 性别角色反转。(a)一对海龙''Syngnathus typhle''。雄性在前,雌性倒置在其下方。(b)怀孕的雄性海龙,育雏袋中满是发育中的幼体。照片© Anders Berglund。 | |||
图7.15 澳大利亚的螽斯''Kawanaphila nartee''在袋鼠爪花上。雄性产生富含蛋白质的大型精荚。(a)交配结束时的一对,雄性(蜷缩在雌性后方)正在沉积其精荚。(b)雌性俯身取食精荚。她将利用这份食物帮助形成卵子。照片© Darryl Gwynne。 | |||
类似的季节性变化也出现在'''双斑鰕虎鱼''Gobiusculus flavescens''中''',这是西欧岩岸常见的鱼类。繁殖期雄性在海藻和空贻贝壳中守卫巢址,吸引雌性前来产卵。 | |||
雄性可同时照顾多只雌性的卵窝。在繁殖季早期,当性别比为1:1时,雄性竞争雌性并在巢址积极求偶。然而,夏季由于雄性死亡率更高(可能源于亲代抚育和交配竞争的成本),性别比偏向雌性。这导致性别角色反转,雌性开始竞争接近雄性的机会,并在求偶中扮演更主动的角色(Forsgren et al., 2004)。 | 雄性可同时照顾多只雌性的卵窝。在繁殖季早期,当性别比为1:1时,雄性竞争雌性并在巢址积极求偶。然而,夏季由于雄性死亡率更高(可能源于亲代抚育和交配竞争的成本),性别比偏向雌性。这导致性别角色反转,雌性开始竞争接近雄性的机会,并在求偶中扮演更主动的角色(Forsgren et al., 2004)。 | ||
== 竞争中的性别差异 == | |||
= 竞争中的性别差异 = | |||
在某些情况下,两性可能具有不同的装饰特征,这与竞争中的性别差异相关。澳大利亚东北部引人注目的Eclectus鹦鹉''Eclectus roratus''表现出显著的性二态性(图7.16)。鲜红与蓝色的雌性竞争稀缺的巢穴,尤其是较不易被洪水侵袭、幼鸟成活率更高的巢穴。雌性在孵卵和育雏期间隐藏于这些巢穴内,因此无需隐蔽。她们在树冠下方展示,其鲜艳色彩与树木深色的枝干形成对比。亮绿色的雄性竞争拥有最佳巢址的雌性,其颜色反映了捕食者伪装与展示时醒目性优势(猩红色下翼覆羽)之间的权衡(Heinsohn et al., 2005; Heinsohn, 2008)。 | 在某些情况下,两性可能具有不同的装饰特征,这与竞争中的性别差异相关。澳大利亚东北部引人注目的Eclectus鹦鹉''Eclectus roratus''表现出显著的性二态性(图7.16)。鲜红与蓝色的雌性竞争稀缺的巢穴,尤其是较不易被洪水侵袭、幼鸟成活率更高的巢穴。雌性在孵卵和育雏期间隐藏于这些巢穴内,因此无需隐蔽。她们在树冠下方展示,其鲜艳色彩与树木深色的枝干形成对比。亮绿色的雄性竞争拥有最佳巢址的雌性,其颜色反映了捕食者伪装与展示时醒目性优势(猩红色下翼覆羽)之间的权衡(Heinsohn et al., 2005; Heinsohn, 2008)。 | ||
Eclectus鹦鹉提醒我们,两性都可能需要与同性成员竞争。对雌性而言,其繁殖成功通常受资源限制,因此竞争更多是为了获取成功繁殖所需的资源(繁殖地、亲代抚育、社会等级)而非雄性精子。对雄性而言,其繁殖成功通常受配偶数量限制,因此竞争通常围绕接近雌性的机会展开,方式包括直接手段(力量或魅力)或间接手段(垄断雌性所需资源)。 | Eclectus鹦鹉提醒我们,两性都可能需要与同性成员竞争。对雌性而言,其繁殖成功通常受资源限制,因此竞争更多是为了获取成功繁殖所需的资源(繁殖地、亲代抚育、社会等级)而非雄性精子。对雄性而言,其繁殖成功通常受配偶数量限制,因此竞争通常围绕接近雌性的机会展开,方式包括直接手段(力量或魅力)或间接手段(垄断雌性所需资源)。 | ||
图7.16 | 图7.16 Eclectus鹦鹉的性二态性。雄性为亮绿色,具红色下翼覆羽。雌性为鲜红与蓝色。照片©(a)Lochman Transparencies,(b)© Michael Cermak。 | ||
= 精子竞争(sperm competition) = | == 精子竞争(sperm competition) == | ||
达尔文设想的性选择过程仅是故事的一半。达尔文提出该理论一个世纪后,Geoff Parker(1970c)提出了一项新颖见解。他曾观察粪蝇''Scatophaga stercoraria''在牛粪周围竞争配偶。他首先注意到雌性常与多个雄性交配,其次雌性将精子储存在称为受精囊(spermathecae)的器官中。随后他意识到,性选择必然在交配行为后持续,因为不同雄性的精液在雌性生殖道内竞争受精机会。他将此过程称为“精子竞争(sperm competition)”。现认为这是动物界生殖行为的重要选择压力(Birkhead & Moller, 1998; Parker, | 达尔文设想的性选择过程仅是故事的一半。达尔文提出该理论一个世纪后,Geoff Parker(1970c)提出了一项新颖见解。他曾观察粪蝇''Scatophaga stercoraria''在牛粪周围竞争配偶。他首先注意到雌性常与多个雄性交配,其次雌性将精子储存在称为受精囊(spermathecae)的器官中。随后他意识到,性选择必然在交配行为后持续,因为不同雄性的精液在雌性生殖道内竞争受精机会。他将此过程称为“精子竞争(sperm competition)”。现认为这是动物界生殖行为的重要选择压力(Birkhead & Moller, 1998; Parker, 2006)。与交配前的性选择类似,存在'''两种潜在过程''':'''竞争雄性精子间的对抗(类似于雄性战斗)'''和'''雌性精子选择(常称为“隐性雌性选择(cryptic female choice)”,类似于雌性配偶选择''';表7.2)。正如达尔文理论所示,第一种过程的证据很快被接受,而雌性精子选择的重要性直到近年才被认可。 | ||
= 为什么雌性与多个雄性交配? = | === 为什么雌性与多个雄性交配? === | ||
正如我们在Bateman的经典实验(图7.3)中所见,雄性通过与多个雌性交配获得的优势是显而易见的——他会有更多后代。但为什么雌性要与一个以上的雄性交配?特别是对于许多物种(如Bateman的''Drosophila'')而言,单次授精就能为雌性提供足够的精子使其所有卵子受精。我们将考虑三个假说。 | 正如我们在Bateman的经典实验(图7.3)中所见,雄性通过与多个雌性交配获得的优势是显而易见的——他会有更多后代。但为什么雌性要与一个以上的雄性交配?特别是对于许多物种(如Bateman的''Drosophila'')而言,单次授精就能为雌性提供足够的精子使其所有卵子受精。我们将考虑三个假说。 | ||
==== 抵抗的成本超过顺从的成本 ==== | |||
在某些情况下,即使雌性可能无法获得任何利益,接受额外交配也可能是划算的。例如,雌性粪蝇必须前往牛粪产卵。在那里她会遇到大量渴望交配的雄性,这些雄性试图抓住她(第5章;图5.3)。当一只雄性交配后,另一只雄性可能会取代他并继续交配。在某些情况下,雌性会在雄性争夺占有的过程中溺死于液态粪便中(Parker, 1970c)。 雄性体型大于雌性,在这种情况下似乎很少有配偶选择的余地。 | |||
= 抵抗的成本超过顺从的成本 = | |||
在某些情况下,即使雌性可能无法获得任何利益,接受额外交配也可能是划算的。例如,雌性粪蝇必须前往牛粪产卵。在那里她会遇到大量渴望交配的雄性,这些雄性试图抓住她(第5章;图5. | |||
表7.2 性选择在交配前后均发挥作用 | 表7.2 性选择在交配前后均发挥作用 | ||
==== 多重交配的物质(或直接)利益 ==== | |||
= 多重交配的物质(或直接)利益 = | |||
在某些情况下,多重交配能增加雌性可产生的后代数量。她可能通过获取更多精子来确保生育力,或从雄性处获得更多资源——无论是食物礼物还是精包中的营养物质,这些都能使她产下更多卵(Thornhill & Alcock, 1983)。当某些雄性以领域形式控制最佳产卵地点时,雌性可能不得不在每次产卵时进行交配,以便进入这些区域(例如许多蜻蜓和豆娘)。在其他案例中,与多个雄性交配可能增加雌性能为后代获得的照料量,因为如果多个雄性都有父权机会,他们会合作喂养幼雏;例如加拉帕戈斯鵟''Buteo galapagoensis''(Faaborg et al., 1995)和林岩鹨''Prunella modularis''(Davies et al., 1996b)。雌性通过多重交配同样可以减少雄性和其后代受到的骚扰。在某些雌性生活在多雄群体中的灵长类动物中,雌性通过给予每个雄性足够的父权机会以避免其杀害幼崽(Hrdy, 1999)。 | 在某些情况下,多重交配能增加雌性可产生的后代数量。她可能通过获取更多精子来确保生育力,或从雄性处获得更多资源——无论是食物礼物还是精包中的营养物质,这些都能使她产下更多卵(Thornhill & Alcock, 1983)。当某些雄性以领域形式控制最佳产卵地点时,雌性可能不得不在每次产卵时进行交配,以便进入这些区域(例如许多蜻蜓和豆娘)。在其他案例中,与多个雄性交配可能增加雌性能为后代获得的照料量,因为如果多个雄性都有父权机会,他们会合作喂养幼雏;例如加拉帕戈斯鵟''Buteo galapagoensis''(Faaborg et al., 1995)和林岩鹨''Prunella modularis''(Davies et al., 1996b)。雌性通过多重交配同样可以减少雄性和其后代受到的骚扰。在某些雌性生活在多雄群体中的灵长类动物中,雌性通过给予每个雄性足够的父权机会以避免其杀害幼崽(Hrdy, 1999)。 | ||
= 遗传(或间接)利益 = | ==== 遗传(或间接)利益 ==== | ||
此时雌性通过与多个雄性交配来提高后代的遗传质量。该假说的有力证据来自一个出人意料的来源——对鸣禽的研究,其中社会单配制(一雄一雌制)是最常见的交配系统(Lack, 1968)。自1985年DNA标记首次可用于精确测定父权以来,研究揭示了社会单配制鸣禽频繁进行婚外交配。通常,10\mathrm{-}40\%的后代由非雌性社会配偶的雄性所育(Griffith et al., 2002; Westneat & Stewart, 2003)。在鸣禽中,雄性难以强迫交配,因为雌性可通过飞离逃脱。相反,婚外交配的发生是由于雌性会溜出家园领域主动寻求这些婚外雄性。一项鸟类羽色的比较研究表明,婚外交配是性选择的重要组成部分。Owens和Hartley(1998)比较了73个已知婚外父权率的鸟类物种的两性羽色差异。他们将羽色二态性按从零(两性无差异)到十(雄性羽色远艳于雌性)的等级评分。他们发现羽色二态程度与社会配偶数量无相关性,但与婚外父权率呈强相关(图7.17)。这表明雄性演化出艳丽羽色并非为了吸引自己的配偶,而是为了吸引其他雄性的配偶进行婚外交配! | 此时雌性通过与多个雄性交配来提高后代的遗传质量。该假说的有力证据来自一个出人意料的来源——对鸣禽的研究,其中社会单配制(一雄一雌制)是最常见的交配系统(Lack, 1968)。自1985年DNA标记首次可用于精确测定父权以来,研究揭示了社会单配制鸣禽频繁进行婚外交配。通常,10\mathrm{-}40\%的后代由非雌性社会配偶的雄性所育(Griffith et al., 2002; Westneat & Stewart, 2003)。在鸣禽中,雄性难以强迫交配,因为雌性可通过飞离逃脱。相反,婚外交配的发生是由于雌性会溜出家园领域主动寻求这些婚外雄性。一项鸟类羽色的比较研究表明,婚外交配是性选择的重要组成部分。Owens和Hartley(1998)比较了73个已知婚外父权率的鸟类物种的两性羽色差异。他们将羽色二态性按从零(两性无差异)到十(雄性羽色远艳于雌性)的等级评分。他们发现羽色二态程度与社会配偶数量无相关性,但与婚外父权率呈强相关(图7.17)。这表明雄性演化出艳丽羽色并非为了吸引自己的配偶,而是为了吸引其他雄性的配偶进行婚外交配! | ||
| 第299行: | 第268行: | ||
在其他案例中,性冲突(sexual conflict)表现为相反方向:雌性通过获得额外配对交配(extra-pair matings)获益,而其社会配偶(social mate)则通过阻止此类行为来守护父权。许多社会单配制(socially monogamous)鸟类中,社会雄性会在雌性约一周的受精期内紧密跟随,驱逐入侵雄性。而雌性可能试图偷溜进行额外配对交配。当雄性无法紧密守护配偶时(例如一方需守护巢址而另一方外出觅食的海鸟和猛禽),社会雄性会通过频繁交配淹没竞争者精子,有时每窝交配数百次(Birkhead & Møller, 1992)。 | 在其他案例中,性冲突(sexual conflict)表现为相反方向:雌性通过获得额外配对交配(extra-pair matings)获益,而其社会配偶(social mate)则通过阻止此类行为来守护父权。许多社会单配制(socially monogamous)鸟类中,社会雄性会在雌性约一周的受精期内紧密跟随,驱逐入侵雄性。而雌性可能试图偷溜进行额外配对交配。当雄性无法紧密守护配偶时(例如一方需守护巢址而另一方外出觅食的海鸟和猛禽),社会雄性会通过频繁交配淹没竞争者精子,有时每窝交配数百次(Birkhead & Møller, 1992)。 | ||
'''图7.18''' (a)一对正在交配前角力的''Gerris lacustris'' | '''图7.18''' (a)一对正在交配前角力的''Gerris lacustris''水黾。雌性(下方)抬起身体将双方腹部尖端压向水面张力,常导致雄性失去抓握。照片© Ingela Danielsson和Jens Rydell。(b)在''Gerris incognitus''等物种中,雄性进化出抓握型生殖节段(A),雌性则进化出腹刺(B)以抵抗雄性抓握。其他物种如''Gerris thoracicus''的武装程度和两性异形(dimorphism)较低(C雄性;D雌性)。(c)不同''Gerris''物种的雌雄武装水平指数呈线性分布,表明性拮抗协同进化(sexually antagonistic coevolution):雄性抓握武装的增强伴随雌性反抓握防御的提升。武装最强的物种位于左下方(如''incognitus''),最弱的位于右上方(如''thoracicus'')。引自Arnqvist和Rowe(2002b),经自然出版集团许可转载。 | ||
= 交配后的性冲突 = | = 交配后的性冲突 = | ||
| 第337行: | 第306行: | ||
因此,雄性根据精子竞争和雌性繁殖力(fecundity)策略性分配精子的现象并不令人意外(Wedell等,2002)。Tommaso Pizzari等(2003)对散养原鸡(''Gallus gallus'')种群的研究提供了绝佳案例(图7.21)。他们通过给雌性安装收集装置获取精液并计数。优势雄性在面临更多雄性竞争者时会增加对雌性的精子投入,并向具有更大鸡冠(产更大卵)的雌性分配更多精子。此外,雄性对同一雌性的精子投入随重复接触而减少,但会因新雌性的出现而恢复。这种现象被称为“柯立芝效应(Coolidge effect)”,得名于…… | 因此,雄性根据精子竞争和雌性繁殖力(fecundity)策略性分配精子的现象并不令人意外(Wedell等,2002)。Tommaso Pizzari等(2003)对散养原鸡(''Gallus gallus'')种群的研究提供了绝佳案例(图7.21)。他们通过给雌性安装收集装置获取精液并计数。优势雄性在面临更多雄性竞争者时会增加对雌性的精子投入,并向具有更大鸡冠(产更大卵)的雌性分配更多精子。此外,雄性对同一雌性的精子投入随重复接触而减少,但会因新雌性的出现而恢复。这种现象被称为“柯立芝效应(Coolidge effect)”,得名于…… | ||
'''图7.21''' | '''图7.21''' 一对正在交配的原鸡。雌性佩戴收集装置,可在交配后收集精子以测量精液量。照片© Charlie Cornwallis。 雄性根据性竞争调整精子分配 | ||
……柯立芝总统夫妇参观养鸡场时,当柯立芝夫人被告知公鸡每天可交配数十次后,据说她回应:“把这事告诉总统”。总统随后询问是否每次都是同一只母鸡,并得知涉及多只不同母鸡。“把这个告诉柯立芝夫人!”,他答道。 | ……柯立芝总统夫妇参观养鸡场时,当柯立芝夫人被告知公鸡每天可交配数十次后,据说她回应:“把这事告诉总统”。总统随后询问是否每次都是同一只母鸡,并得知涉及多只不同母鸡。“把这个告诉柯立芝夫人!”,他答道。 | ||
| 第382行: | 第351行: | ||
图7.23 水禽雌雄生殖器官的协同演化。(a)在雄性具有较长阴茎的物种中,雌性阴道更复杂,具有更多螺旋结构(右)和“盲端囊”(左)。阴道螺旋方向与雄性阴茎螺旋相反,表明这是对抗性而非互利性的“锁钥”协同演化。(b)绿头鸭(''Anas platyrhynchos''),一种存在高水平强迫交配的物种,雄性具有长阴茎(右下),雌性具有长而复杂的阴道(左上)。白色标尺为2cm。引自Brennan等(2007)。 | 图7.23 水禽雌雄生殖器官的协同演化。(a)在雄性具有较长阴茎的物种中,雌性阴道更复杂,具有更多螺旋结构(右)和“盲端囊”(左)。阴道螺旋方向与雄性阴茎螺旋相反,表明这是对抗性而非互利性的“锁钥”协同演化。(b)绿头鸭(''Anas platyrhynchos''),一种存在高水平强迫交配的物种,雄性具有长阴茎(右下),雌性具有长而复杂的阴道(左上)。白色标尺为2cm。引自Brennan等(2007)。 | ||
图7.24 剑尾鱼的系统发育表明,''Xiphophorus''属的祖先缺乏长尾,剑尾特征在与斑马鱼分歧的支系中演化而来。令人惊讶的是,雌性斑马鱼和''Priapella''在实验中更偏好本物种中被延长尾部的雄性。这表明支持尾部的感觉偏差(sensory bias)先演化,随后被剑尾鱼物种利用(Basolo 1990, 1995)。雌性和雄性剑尾鱼''Xiphophorus helleri'' | 图7.24 剑尾鱼的系统发育表明,''Xiphophorus''属的祖先缺乏长尾,剑尾特征在与斑马鱼分歧的支系中演化而来。令人惊讶的是,雌性斑马鱼和''Priapella''在实验中更偏好本物种中被延长尾部的雄性。这表明支持尾部的感觉偏差(sensory bias)先演化,随后被剑尾鱼物种利用(Basolo 1990, 1995)。雌性和雄性剑尾鱼''Xiphophorus helleri''的照片。© Alexandra Basolo。 | ||
在''Schizocosa''狼蛛中,实验也显示雄性前腿的刚毛簇(tufts of bristles)对雌性性接受度的影响在缺乏该特征的物种中比具有该特征的物种更强(McClintock & Uetz, 1996)。这再次表明雄性性状的演化伴随着雌性抵抗(female resistance)的产生。 | 在''Schizocosa''狼蛛中,实验也显示雄性前腿的刚毛簇(tufts of bristles)对雌性性接受度的影响在缺乏该特征的物种中比具有该特征的物种更强(McClintock & Uetz, 1996)。这再次表明雄性性状的演化伴随着雌性抵抗(female resistance)的产生。 | ||
2025年7月7日 (一) 23:48的版本
照片 © Joah Madden
在《人类由来与性选择》的第二部分,查尔斯·达尔文(1871)提出了"性选择(Sexual Selection)"理论。他一直困惑于通常仅出现在单一性别(多为雄性)身上的夸张特征。例如为何只有雄性非洲大羚羊(kudu)拥有巨大犄角,为何只有雄性极乐鸟(birds of paradise)具备如此华丽的装饰性羽衣(图7.1)?达尔文指出这些结构对生存并非必需,否则雌性也应具备。相反,他认为这些特征演化是因为在配偶竞争中具有优势,此过程他称为"性选择"。
达尔文提出:"性竞争分为两类:其一是同性别个体(通常为雄性)为驱逐或杀死竞争对手而斗争,雌性保持被动;其二是同性别个体(仍多为雄性)为吸引异性(通常为雌性)而竞争,此时雌性不再被动,而是选择更具吸引力的配偶"。第一种过程(以力量取胜)可解释雄性武器(如非洲大羚羊犄角)及其他雄性特征(如大体型与力量)的演化,这些特征使雄性在直接对抗中占优。第二种过程(以魅力取胜)可解释雄性装饰物(如极乐鸟羽饰)的演化。值得注意的是,前者现多称为"性内选择(intrasexual selection)"或"雄性间竞争(male–male competition)",后者称"性间选择(intersexual selection)"或"雌性选择(female choice)"。这种命名易生混淆,因正如达尔文所认识,两类过程都涉及性内竞争——前者通过武力赢得配偶,后者通过魅力赢得配偶。
在研究性选择证据及其影响前,需探讨为何通常是雄性竞争雌性而非反之。这将引导我们回溯到两性根本差异的起源。
图7.1 达尔文的性选择理论用于解释雄性特征(通过武力或魅力进行配偶竞争)的演化。(a) 雄性条纹羚Tragelaphus strepsiceros的犄角。照片© Oliver Krüger。(b) 雄性红极乐鸟Paradisaea raggiana(左)向雌鸟(右)展示羽饰。照片© Tim Laman/naturepl.com
雄性(male)与雌性(female)
配子(gamete)大小的差异
有性生殖(sexual reproduction)涉及减数分裂形成配子(gamete)及两个个体的遗传物质融合。该过程通常(但非绝对)涉及称为雄性与雌性的两性。高等动物中,两性常通过外生殖器、羽衣、体型或颜色等外部特征区分,但这些并非本质差异。所有动植物的两性根本差异在于配子大小:雌性产生大而静止、富含营养的卵子(egg),雄性配子(精子,sperm)则微小、可运动,本质上是一段能够自行推进的DNA。许多单细胞生物(如草履虫Paramecium)进行无两性分化的有性生殖,其配子大小相同,称为同配生殖(isogamous sexual reproduction)。但更常见的是异配生殖(anisogamous sex),即大小不同的配子(一大一小)融合,几乎所有多细胞动植物均采用此方式。
Parker 等人(1972)提出优雅模型解释异配生殖如何从同配生殖演化而来。假设合子(zygote)存活率取决于其大小:合子越大,发育所需营养越充足,存活机会越高。若大配子带来的存活优势超过其数量劣势,则大配子将被选择青睐。例如,若个体资源可分裂为两个大配子或四个小配子,则大配子形成的合子存活率需超过小配子两倍以上,大配子才具有选择优势。
图7.2 Parker 等人(1972)提出异配生殖通过分裂选择(disruptive selection)演化自同配生殖:具有营养储备的大配子(卵子)与寄生大配子投资的小配子(精子)。
现在,一旦较大的配子(gamete)演化出来,较小的配子立即面临选择压力,需要寻找较大的配子进行融合,以寄生其食物储备。与此同时,较大的配子会被选择抵抗较小的配子,因为最具生存能力的合子(zygote)将来自两个大配子的融合。然而,小配子与大配子的融合将占主导地位,这仅仅因为小配子的产量更大。此外,大配子未能抵抗小配子的代价不会像小配子未能找到大配子那样严重:中等大小的合子仍有存活机会,而小合子则完全没有。这意味着选择对小配子的作用更强。同时,由于小配子数量更多,它们可能具有更丰富的基因型多样性,并承受更高的死亡率(均为数量优势的后果)。因此,它们会更快演化,并在演化过程中“智胜”大配子的防御机制。
Parker等人指出,从理论上讲,这场古老演化军备竞赛的最终结果是个体特化为生产大量小配子(male)或生产较少的大配子(female)。中等大小配子的生产者被淘汰,因为它们既不具备数量优势,也无法为合子提供大额食物储备(图7.2)。
Parker等人模型的一个基本假设得到了对团藻目的比较研究支持。单细胞的属中合子生长的食物储备相对不重要,通常表现为同配生殖(isogamous),而多细胞的属中食物储备影响合子存活,大多为异配生殖(anisogamous)(Knowlton, 1974);其他藻类科也显示出类似但较不明显的趋势(Bell, 1978)。
因此,配子竞争的原始形式可能解释为何存在两种配子生产形态——即雄性与雌性。配子竞争还能解释两性为何得以维持(Parker, 1982)。以牛的卵子为例,其体积约为公牛精子的20,000倍。假设一头突变公牛使其精子体积加倍,但精子数量减半(因资源有限)。更大的精子仅能使合子的细胞质储备增加1/20,000单位,效益微乎其微。然而,当两头公牛与同一母牛交配时,突变公牛的相对受精成功率将从1/2降至1/3,代价巨大。Parker(1982)证明,雄性间精子竞争的微弱程度就足以维持异配生殖(anisogamy)。
亲代照护的差异
异配生殖(anisogamous)涉及小精子对大卵子的寄生。雌性生产相对少量的大配子,雄性则生产大量小配子。此外,雌性通常在其他形式的照护上投入更多(第8章)。哺乳动物中,雌性承担怀孕和哺乳的负担;雄性极少参与后代照护(约5\%的哺乳动物物种,但雄性照护在三个目相对常见:灵长类(primates)、食肉目(carnivores)和奇蹄目(perissodactyls))。鸟类中,双亲照护是常态,但雌性往往投入更多。其他类群中,当存在亲代照护时,爬行动物和无脊椎动物以雌性照护为主,两栖动物中两性照护比例相近,而鱼类是唯一雄性照护更普遍的类群。鱼类中,雄性照护在领地性物种中尤为常见,因雄性在守护卵子时仍能吸引新配偶,故雄性照护的机会成本(失去的交配机会)低于其他类群(第8章)。
亲代投资与性竞争
Robert Trivers(1972)首次认识到配子资源投资和其他形式照护(亲代投资,parental investment)的性别差异与性竞争的联系。他写道:“当一方的投资显著超过另一方时,投资较少的一方成员将相互竞争以与投资较多的一方成员交配。”关键在于,亲代投资较少的一方具有更高的潜在繁殖速率(Clutton-Brock & Parker, 1992)。因此,通常雄性潜在受精速率远高于雌性产卵速率。即使在雄性面对过多雌性时会暂时耗尽精子的物种中,其产生后代的潜力仍高于雌性(Nakatsuru & Kramer, 1982)。这意味着雌性通常通过提高将资源转化为卵子和后代的速率来最大化繁殖成功率,而雄性则通过寻找并受精多个雌性来最大化成功。
交配率对两性繁殖成功的差异效应由A.J. Bateman(1948)通过果蝇(Drosophila)实验清晰展示,其成果尤其推动了Trivers理论的建立(图7.3)。雄性更高的繁殖潜力在哺乳动物(如人类)中得以生动体现:雌性耗费多月生产单个后代,而同期雄性可能使数百名其他配偶的卵子受精(表7.1)。
如本章后续所述,亲代投资的不对称性及由此产生的两性繁殖潜力差异,对性行为具有深远影响。当雌性对每个后代的投资超过雄性时,雄性的求偶和交配行为很大程度上指向竞争和利用雌性投资,而雌性则倾向于选择能提供最佳资源或基因的雄性。
为何雌性比雄性投入更多后代照护?
显然,雌性通常倾向于成为提供照料的一方,而雄性则倾向于竞争交配机会。我们最初可以将这种现象与配子二态性(gamete dimorphism)联系起来——小型配子(精子)会竞争雌性资源(卵子)。但为何在交配后,雌性仍然承担更多照料责任?
David Queller(1997)指出雌性应提供更多照料的两个普遍原因,这两者都源于交配系统的共同特征:雌性多次交配(一雌多雄制,polyandry)以及性选择(sexual selection)导致雄性交配成功率不均。在这两种情况下,我们必须权衡雄性将其资源(时间和能量)投入哺育后代或争取其他配偶的相对收益。
首先,考虑一个已交配的配对,其中可能存在其他雄性参与了该窝后代的部分父权分配。当配对雄性必须共享该窝后代的父权时,这会降低后代对他的遗传价值,从而减少留下协助的相对收益。简而言之,留下帮助养育其他雄性的后代几乎没有好处!因此,我们预计在父权由多个雄性共享的物种中,雄性更不可能提供照料。
其次,考虑一个性选择导致雄性交配成功率严重不均的物种,其中部分雄性获得高于平均水平的交配份额。Queller(1997)意识到,无论雄性的潜在繁殖率有多高,只要性别比为1:1,雄性的平均实际繁殖率必须与雌性完全相同。这必然成立,因为每个后代都恰好有一个母亲和一个父亲。然而,考虑那些成功交配并拥有需要照料后代的部分雄性和雌性子集。如果大多数或所有雌性都能繁殖,而只有部分雄性成功(即竞争力最强的个体),那么这些少数成功雄性的预期未来繁殖成功率确实会高于雌性。因此,这些雄性通过不提供帮助并将更多资源投入获取其他配偶将获得更大收益。例如,假设有20只展示的雄性松鸡,其中最大且最活跃的雄性完成所有交配(若性别比为1:1,将与20只雌性交配)。因此,该雄性的预期繁殖成功率是雌性的20倍。与雌性相比,该雄性更不愿提供照料,因为抚育行为对其潜在未来繁殖成功的损害将远大于对雌性的影响。
因此,Queller(1997)第二点逻辑如下:如果雌性在交配前投入更多资源,雄性将竞争雌性投资;这将导致雄性成功率的更大方差(部分竞争力强的雄性将获得巨大成功,而其他雄性将无法交配);这些成功的雄性在交配后则更不愿提供照料。随着雌性提供更多照料,针对雄性的性选择增强,形成正反馈(positive feedback),进一步降低雄性提供照料的可能性(Kokko & Jennions, 2009)。框7.1总结了测量性选择强度时的一些问题。
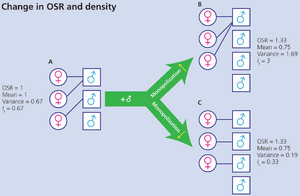
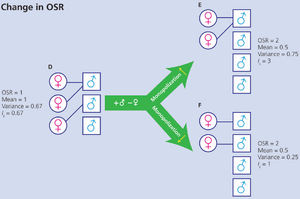
框7.1 性选择强度的测量(KLUG ET AL., 2010)
衡量方向性性选择(directional sexual selection)最大潜在强度的常用指标是Is,即交配成功率在同性个体间变异的标准化测量,计算为某性别交配成功变异系数的平方(Wade, 1979; Shuster & Wade, 2003)。人们常假设Is由特定时间可交配个体的性别比("可操作性别比",Operational Sex Ratio, OSR;Emlen & Oring, 1977)决定。雄性通常在配子和亲代抚育上投入较少,因此更常在交配池中竞争配偶,导致OSR通常偏向雄性。
图B7.1.1的简单示例表明,若不考虑OSR如何影响雄性垄断配偶的能力,就无法对OSR与性选择的关系进行普适性预测。在A中,向交配池添加新雄性可能导致顶级雄性加强配偶垄断(B),也可能使配偶垄断更难实现(C)。在D中,OSR变化未改变竞争者绝对密度(一雄进入,一雌离开),同样导致配偶垄断增强(E)或减弱(F)。在第一个图示(下方)中,Is符合预期:随配偶垄断增强而上升(A到B),随配偶垄断减弱而下降(A到C)。在第二个图示(下页)中,Is也随更多雄性未能交配而上升(D到E),但当交配成功率尽可能均等时仍会上升(D到F)。
图 B7.1.1 图 B7.1.1(续) F中的性选择是否强于D?可能如此,但若交配随机则不然。理想情况下,我们首先需检验雄性成功率的方差是否显著高于随机预期(Sutherland, 1985)。接着需量化特定性状(如长尾)所受选择的强度。但这会增加跨物种比较的难度(不同物种可能具有不同性状)。
性选择的证据
增强雄性战斗成功的性状
人们很容易接受达尔文提出的性选择过程的第一部分,即通过选择进化出增强雄性直接争夺配偶战斗成功的性状。现有充分证据表明,在许多物种中,体型最大、力量最强或武器最发达的雄性获得最高交配成功率。例如,雌性北象海豹(Mirounga angustirostris)上岸产仔后,会再次交配以生产下一年的后代。由于繁殖地点的局域性,雌性聚集形成可防御的资源,雄性通过战斗垄断配偶群(图7.4)。最大最强的雄性赢得最大的配偶群;Burney Le Boeuf和Joanne Reiter(1988)在加利福尼亚的长期研究中发现,每年180只竞争雄性中仅有5只负责与470只雌性完成48-92%的交配。成年雄性体重是雌性的3至7.5倍。多数雌性4岁首次繁殖,而雄性延迟到6-9岁才开始尝试繁殖,以积累体型和力量在激烈雌性争夺战中获得机会。雌性繁殖成功取决于养育后代能力,而雄性则取决于通过战斗和保卫配偶群获得的交配成功率。
图7.4(a)雄性南象海豹。(b)两只雄性为雌性配偶群争斗。(c)雄性体型远大于雌性。图中为两只亚成体。照片© Oliver Krüger。
因此,导致雄性体型更大、力量更强或武器更发达的性二态性(sexual dimorphism)进化容易解释,因为这些性状能提升雄性在雄性间配偶争夺战中的成功率。
雌性选择
达尔文提出的第二个过程——即雌性对最具“魅力或吸引力”雄性的选择——之所以需要更长时间才被接受,仅仅因为他几乎没有确凿证据证明雌性确实会进行选择。事实上,自达尔文首次提出该理论以来,我们不得不等待90年才有人想到通过实验进行验证。Malte Andersson(1982)在肯尼亚对长尾寡妇鸟(Euplectes progne)的经典实验,得益于强力胶的发明。这种麻雀大小的雄鸟拥有非凡的尾羽,通常超过半米长(雌鸟具有正常的短尾)。雄鸟在草原上保卫领地,可能吸引多只雌鸟前来筑巢。它们在与同性竞争时不会展示尾羽。然而,每当雌鸟飞过时,雄鸟会以缓慢巡航飞行的方式展示并展开尾羽成深龙骨状。这种特殊尾羽是否通过雌性选择(female choice)进化而来?
Malte Andersson 对长尾寡妇鸟的经典实验
在繁殖季节初期,Andersson标记了36只雄鸟的领地范围,并记录每只吸引的雌鸟数量。随后他将它们随机分为四组:第一组被剪短尾羽至约14cm;这些被剪下的尾羽被用于加长第二组的尾羽,使其平均延长25cm。剩余两组作为对照:一组保持原状,另一组被剪断后重新粘合(长度不变)。通过统计各领地内的巢穴数量(反映吸引雌鸟的数量),Andersson发现实验处理前各组求偶成功率无差异,但处理后长尾雄鸟显著优于对照组和短尾组(图7.5)。短尾雄鸟的求偶展示活跃度未降低,也未更易放弃领地。因此,长尾组成功率提升反映了雌性选择。Andersson的关键发现是:雌性偏好比正常尾羽更长的尾羽。这表明性选择(sexual selection)(偏好更长尾羽)与自然选择(natural selection)(可能因长尾妨碍生存而限制尾长)之间存在平衡。
性装饰(sexual ornaments)的代价已在类似的家燕(Hirundo rustica)尾羽操控实验中得到证实。实验性延长尾羽的雄性能更快配对,且更受寻求额外交配(extra-pair matings)的雌性青睐(Møller, 1988)。但这些雄鸟在觅食中处于劣势:捕获更小猎物,换羽期生长出质量更差的羽毛和更短的尾羽。因此,次年它们吸引配偶更慢,繁殖成功率降低(Møller, 1989)。
另一项早期证明雌性选择的精巧实验是Clive Catchpole(1980; Catchpole et al., 1984)对欧洲苇莺(Acrocephalus schoenobaenus)鸣声的研究。雄性从非洲越冬地返回繁殖领地后,会发出由颤音、哨音和嗡鸣组成的长串鸣唱。一旦配对,雄鸟便停止鸣唱(该物种为一夫一妻制)。Catchpole的测量显示,鸣唱最复杂的雄鸟最先获得配偶(图7.6a)。此外,当雌鸟在实验室被注射雌激素(oestradiol)以激活性行为时,它们对大规模鸣声库(song repertoires)的反应比对小规模库更强烈(图7.6b)。
某些情况下,雄性拥有多重装饰——部分用于吸引雌性,部分用于威慑竞争者(框7.2)。
图7.5 Malte Andersson的经典实验展示长尾寡妇鸟雄性尾长如何影响雌性选择。上图:实验处理前,四组雄鸟领地内平均巢数(反映吸引雌鸟数量)无显著差异。下图:实验处理后,长尾雄鸟比短尾组和对照组吸引更多雌鸟。插图显示雄性展示飞行。改编自Andersson(1982)。经自然出版集团许可转载。
图7.6 (a)鸣声库最大的雄性欧洲苇莺在春季最先获得配偶。鸣声库大小通过每只雄鸟的录音样本估算。结果排除了年长雄鸟或占据更优领地雄鸟同时优先交配且拥有更大鸣声库的可能性。引自Catchpole(1980)。(b)五只雌鸟对不同规模鸣声库的平均响应分数(±5.6)。响应分数衡量性行为强度。引自Catchpole et al.(1984)。经自然出版集团许可转载。
框7.2 寡妇鸟与主教鸟(Euplectes spp.)的多重装饰
红领寡妇鸟(Euplectes ardens)栖息于非洲东部和南部的草原。雌鸟和非繁殖期雄鸟呈暗棕色且尾短。繁殖期前,雄鸟换羽为醒目黑色,胸前具新月形红领,并生长出长尾(图B7.2.1)。为何存在多重装饰?
求偶期间,雄鸟以缓慢飞行展示尾羽。尾羽较长的雄鸟更快配对并吸引最多雌鸟(可达九只)。红领颜色和大小与求偶成功率无关,但与雄鸟抵御同类竞争领地成功率相关(Pryke et al., 2001, 2002)。因此,红领功能在于雄性竞争(male-male competition),而长尾功能在于雌性选择。此外,两种装饰存在权衡:红领更大或更红的雄鸟尾羽更短。这可能反映了尾部生长与红领形成(依赖从食物获取的类胡萝卜素色素)之间的生理资源分配权衡。
在Euplectes属中,尾长与类胡萝卜素着色呈负相关。寡妇鸟类倾向于具长尾和少量类胡萝卜素着色,而主教鸟类具短尾但大面积黄/红色羽饰(图B7.2.2)。两种信号间的能量权衡可能影响了该属羽饰多样性的进化,反映了雄性竞争与雌性选择力量的平衡。主教鸟常集群繁殖,雄鸟保卫密集的小型领地,导致激烈雄性竞争(故强调类胡萝卜素展示)。相反,寡妇鸟领地大而分散,雌性选择可能更重要(故强调长尾)(Andersson et al., 2002)。
图 B7.2.1 红领寡妇鸟。照片 © Warwick Tarboton.
图 B7.2.2 红主教鸟。照片 © Oliver Krüger.
最后,对Euplectes属33个亚种(共17个种)的系统发育分析表明,长尾和更鲜艳的红色至少两次从短尾黄色信号祖先演化而来。这表明在演化过程中存在对增强展示特征的性选择(sexual selection)。此外,长尾寡妇鸟(尾羽最长的物种)近期出现了类胡萝卜素色素的丢失,进一步支持了色彩与尾羽之间存在权衡的观点(Prager & Andersson, 2009)。
图7.7 雄性牛蛙通过摔跤争夺优质产卵领地(左)。获胜者通过鸣叫吸引雌性(中),雌性在雄性领地内产卵。引自Howard (1978a,b)。
雌性为何挑剔?
众多研究现已证实雌性选择(Andersson, 1994)。但雌性为何选择?达尔文再次未能提供答案,仅提出动物与人类类似具有审美意识。过去四十年来,许多理论与实证研究都在探讨雌性通过选择能获得何种收益。区分两种主要类型的收益类型是有益的:
优质资源
在长尾寡妇鸟和莎草莺中,雌性都在所选雄性的领地内筑巢,因此选择可能使雌性能获得更好的资源,如巢址或食物。雄性长尾寡妇鸟不参与育雏,但雄性莎草莺会协助喂养后代,且鸣唱曲目更丰富的雄性表现出更好的亲代抚育能力(Buchanan & Catchpole, 2000)。因此,在这两个案例中,对雄性特征(尾羽或鸣唱)的选择可能是雌性评估资源质量的线索,这些资源有助于提高其繁殖成功率。
许多动物中,雄性通过竞争控制雌性繁殖所需的资源。例如,北美牛蛙(Rana catesbeiana)雄性会保卫池塘和小型湖泊中的领地,雌性会前往这些区域产卵(图7.7)。某些领地对卵的存活更为有利(温度较高促进快速发育,且水蛭Macrobdella decora捕食较少)。雌性偏好这些优质产卵地,而最强壮的雄性往往能占据最佳领地(Howard 1978a, 1978b)。由此可见,雌性选择与雄性间竞争常相伴而生。
其他案例中,雌性可能基于雄性能提供的食物进行选择。雌性垂腹蝇(Hylobittacus apicalis)仅在雄性提供大型昆虫作为交配期间食物时才会交配。昆虫体型越大,雌性允许的交配时间越长,雄性受精的卵也越多(图7.8)。雌性通过获取更多食物资源来增加卵的营养储备。某些昆虫求偶时提供的"礼物"可能主要用于保护而非营养功能。例如蛾类Utethesia ornatrix的雄性在交配时会向雌性传递生物碱,这些物质被雌性用于抵御捕食者。有趣的是,雄性还将同种生物碱作为信息素使用,雌性可通过信息素浓度评估将获得的毒素量(Dussourd et al., 1991)。
图7.8 雌性对优质资源的选择。(a)当雄性垂腹蝇提供更大的猎物时,雌性允许更长的交配时间。(b)雄性通过延长交配时间使更多卵受精而获益。引自Thornhill (1976)。
优质基因
某些情况下,雌性从雄性处获得的仅有精子。即便如此,雌性仍表现出高度选择性。园丁鸟提供了绝佳案例:该科20个物种分布于新几内亚和澳大利亚,多数雄性不参与育雏,所有繁殖投入都用于展示行为。雄性用树枝、草茎等材料建造形态各异的求偶亭——有些呈巷道状,有些为塔形,还有带顶棚的小屋。随后用色彩鲜艳的果实、花朵、羽毛、骨骼、石块、贝壳和昆虫外骨骼装饰求偶亭。某些个体会收集人造物品,如笔帽、瓶盖、晾衣夹、车钥匙、珠宝,甚至曾发现过老人的玻璃义眼!不同物种偏好颜色各异:缎蓝园丁鸟(Ptilonorhynchus violaceus)偏爱蓝色物品,而斑园丁鸟(Chlamydera maculata)偏好白绿色物品(图7.9)。Vogelkop园丁鸟(Amblyornis inornatus)精心布置的求偶亭内分门别类地堆放着粉色花朵、绿色苔藓和闪亮甲虫鞘翅,其复杂程度曾让早期新几内亚探险者误认为是当地部落的宗教圣坛(图14.8c; Frith & Frith, 2004)。
雌性仅会为交配造访求偶亭。研究表明,在缎蓝园丁鸟(Borgia, 1985)和斑园丁鸟(Madden, 2003a)中,装饰最精美的雄性获得最多交配机会。实验性移除缎蓝园丁鸟求偶亭装饰会显著降低雄性交配成功率(Borgia, 1985)。对斑园丁鸟的选择实验显示,雄性倾向添加最能预测求偶成功的物品,特别是绿色龙葵浆果(Madden, 2003b)。雄性常窃取邻近求偶亭的装饰物,有时还会破坏其他雄性的求偶亭,因此装饰物既反映收集能力,也体现防御能力。当Joah Madden (2002)向斑园丁鸟求偶亭添加龙葵浆果时,这引发了竞争者更频繁的破坏行为。当移除浆果并提供过量浆果让雄性重新装饰时,雄性仅补充至原有数量,暗示其根据社会地位调节装饰规模,雌性可能借此评估雄性的竞争能力。
当雌性仅从交配中获得精子时(如园丁鸟案例),是否可能通过选择获得遗传收益?目前提出两种假说:
雌性选择的遗传收益:两种假说
Fisher's假说:雌性获得具吸引力的子代
【译者注:即性感儿子】
R.A. Fisher(1930)首次明确提出,复杂的雄性展示可能通过性选择(sexual selection)演化,仅仅因为它使雄性对雌性具有吸引力。这听起来像是循环论证,确实如此,但这也正是Fisher论证的精妙之处。他最初假设,雌性偏好某个特定雄性特征(以长尾羽为例)是因为该特征反映了雄性的质量。或许尾羽更长的雄性飞行能力更强,因此在收集食物或躲避捕食者方面更具优势。另一个可能的起点是假设长尾羽更易被察觉,或雌性已存在对特定刺激做出反应的感觉偏向(sensory bias)(Ryan等,1990;第14章)。如果雄性尾长差异存在某种遗传基础……该优势将传递给雌性后代中的雄性。同时,导致雌性偏好长于平均尾羽的基因也会被选择,因为这些雌性将拥有飞行能力更强或更易被潜在配偶察觉的雄性后代。
当雌性对长尾羽的偏好开始扩散时,长尾雄体会获得双重优势:既增强飞行能力又提高交配几率。雌性通过选择也获得双重优势:其子代将兼具优秀飞行能力和对雌性的吸引力。随着雌性偏好与尾长增长之间的正反馈发展,拥有吸引力子代的益处将逐渐成为雌性选择的主要动因,而被选择的特征最终可能降低雄体的生存能力。当生存能力下降与性吸引力达到平衡时,尾羽增长的选择压力将逐渐停止(Lande,1981;Kirkpatrick,1982)。框7.3更详细地描述了Fisher假说的某些方面。
给子代的优质基因
Amotz Zahavi(1975,1977)提出了关于复杂雄性展示的另一种观点。他指出孔雀的长尾在日常生存中是种累赘(handicap)。进而提出雌性偏好长尾(或其他类似特征)正是因其作为累赘,能可靠传递雄性遗传质量信号。这种尾部展示了雄性在存在累赘的情况下仍能生存的能力,意味着他必须在其他方面格外优秀。若这种能力具有遗传性,"优秀"生存特质的倾向将传递给后代。因此,雌性通过选择展示真实遗传质量的配偶来筛选优质基因(good genes)。需注意该假说中的"优质基因"指生存与繁殖相关的实用基因,而非Fisher假说中纯粹吸引雌性的基因。
Zahavi的观点最初未被接受,但后续理论研究显示累赘假说能合理解释复杂性展示的演化,或许能推广至动物信号系统(第14章)。成功的累赘原则理论模型最重要特征是:雄性仅在状态良好时表达累赘,即展现完整求偶展示(Grafen,1990a,1990b)。这解决了Zahavi原始观点中被批评的难题——原观点认为累赘作为固定性状,无论雄性能否负担都必须承受。灵活累赘概念存在不同变体(有学者提出"揭示性累赘(revealing handicaps)"反映雄性当前活力,另一些提出"状态依赖性累赘(condition dependent handicaps)"与雄性状态成比例表达),但这些模型的核心在于雄性展示程度能向雌性传递其遗传质量信息。
理论家最初困扰的另一个问题是:若雌性对"最佳基因"雄体施加强选择压力,遗传变异(genetic variation)可能迅速减少,因为仅有少数雄性基因型能成功繁殖。类似地,人工选择性状最初效果显著,但随着性状遗传变异被"耗尽"效力减弱。若雌性选择需付出代价(如耗费时间寻找配偶),理论上当遗传变异下降时雌性应停止选择(Andersson,1994)。
当前研究认为实践中问题不大,原因有四:第一,群体持续承受有害突变输入,雌性始终挑剔以避免潜在配偶携带这些突变具有进化意义(Kondrashov,1988;Agrawal,2001)。第二,若仅状态最佳雄体能负担复杂装饰或活力展示,雌性选择难以耗尽遗传变异,因影响雄性状态的基因数量庞大。事实上,雄性体内几乎所有生理过程都会影响状态,故遗传变异量极大(Rowe & Houle,1996)。第三,雌性可能在不同年份选择不同雄性特征,从而维持多性状背后的遗传变异。例如在云雀鹀(Calamospiza melanocorys)中,某些年份雌性偏好最黑雄性,其他年份选择翅斑最大者或喙最大者等(Chaine & Lyon,2008)。这种快速变化的性选择模式与达尔文雀类自然选择的振荡模式相似——食物供给的年际变化导致某些年份选择小喙,其他年份选择大喙(Grant & Grant,2002)。
维持适应度遗传变异的第四个因素是宿主-寄生虫军备竞赛。Bill Hamilton(1936-2000)是达尔文之后最具影响力的进化生物学家之一。他曾指出英国乡村毕生所见最显著的两个变化由疾病引发:周期性杀死兔群并改变植被的粘液瘤病毒(myxoma virus),以及摧毁英格兰低地榆树的荷兰榆树病(Dutch elm disease)。这使他确信疾病是自然界强大的选择压力。与Marlene Zuk合作(Hamilton & Zuk,1982),他提出性展示是疾病遗传抗性的可靠指标。据此观点,雌性选择复杂展示如同诊断兽医,筛选具有当前感染抗性基因的雄性。由于寄生虫与宿主持续进行适应与反适应的军备竞赛,双方基因不断变化,"优质基因"始终动态变化,因此雌性保持挑剔始终有利。
【译者注:Hamilton–Zuk 假说】
对遗传收益假说的检验
要证明某性状通过Fisher过程演化,需证实雌性偏好与雄性特征均存在遗传变异,且偏好基因与特征基因存在协变(框7.3)。多项研究已证实这种预测的遗传相关性。
框7.3 鼻长的性选择的遗传协方差对费舍尔假说的重要性(LANDE, 1981)
(1) 假设种群中最初存在鼻长和雌性偏好的变异范围。偏好略长于平均鼻长(nose lengths)的雌性会与长鼻雄性交配,反之亦然。关键事实在于这些交配的后代会同时携带鼻长基因和偏好基因:要么是长鼻基因加长偏好基因,要么是短鼻基因加短偏好基因。偏好仅在雌性中表达,鼻长仅在雄性中表达,但所有个体都携带这两种基因。简而言之,鼻长基因与偏好基因之间会产生关联或协方差(covariance)。通过雌性的偏好可预测她携带并传递给儿子的鼻长基因类型(图 B7.3.1)。
(2) 在这种协方差下,演化将如何推进?若偏好高于或低于平均鼻长(\bar{x})的雌性数量相等,则不会产生变化。但如果某一侧的雌性数量偶然略占优势(可能是长或短,这里假设为长),则正反馈将启动(如图中箭头所示)。雌性选择长鼻雄性(长鼻雄性交配机会更高),由于协方差的存在,这也同时选择长偏好基因。这进一步推动鼻长演化,进而增强偏好强度。
(3) 该假说的量化模型中,性选择的最终结果取决于模型的具体假设,例如雌性选择是否具有代价(cost of female choice)(Pomiankowski et al., 1991)。但重要的普遍结论是:雄性特征与雌性偏好间的协方差(genetic covariance)是费舍尔假说的基础。
图 B7.3.1 长鼻基因与长偏好基因在后代中共同出现。直线的斜率代表关联或协方差的程度。
Wilkinson 和 Reillo(1994)研究了突眼蝇(Cyrtodiopsis dalmanni)。这种小型蝇类的眼睛位于突出的眼柄上,雄性的眼柄特别长,其眼间距可超过体长(图7.10)。在马来半岛的溪流沿岸,它们栖息于植物根须上,眼间距最大的雄性周围聚集更多雌性。实验室选择实验显示雌性明显偏好眼间距最大的雄性。Wilkinson 和 Reillo 随后进行人工选择实验:一组选择眼间距最长的雄性,另一组选择眼间距最短的雄性。经过13代后,发现雌性偏好也发生了相关响应(correlated response)的改变:长眼间距品系的雌性偏好长眼间距雄性,而短眼间距品系的雌性偏好短眼间距雄性。
图7.10 一只雄性(上方)和三只雌性突眼蝇栖息于根须上。注意雄性显著更大的眼间距。来自 Wilkinson 和 Reillo(1994)。
特立尼达与委内瑞拉东北部的溪流中,雄性孔雀鱼的体色存在显著变异。高捕食压力溪流中的雄性体色暗淡,而低捕食压力溪流中的雄性则体色鲜艳,具有大型橙色斑点(第4章)。Houde 和 Endler(1990)发现种群中雄性橙色面积与雌性对橙色的偏好强度呈正相关。刺鱼种群间雄性婚配红色的鲜艳度也存在差异。雌性偏好更红的雄性(Milinski & Bakker, 1990),育种实验显示子代雄性的红色强度与父代相关。此外,红艳雄性的雌性后代偏好红艳雄性,而暗淡雄性的雌性后代对红色无偏好(Bakker, 1993)。因此,特征与偏好再次呈现正遗传相关(positive genetic correlation)。
这些结果表明费舍尔失控过程(Fisher’s runaway process)(框7.3)可能存在,但未验证费舍尔假说的核心假设——即雄性特征被选择的唯一收益是提高交配成功率。要证明这点,还需证实雄性特征表达与任何遗传性"实用"适合度(fitness)无关,如疾病抗性或资源获取能力(如障碍假说(handicap hypothesis)所述)。检验该预测的两种方法是:(i) 观察种群内雄性特征极端表达是否与生存力相关;(ii) 检测极端特征雄性的后代。根据费舍尔假说,这些后代不应具有增强的生存力,仅应具有增强的雄性交配成功率。这两类检验的难点在于:支持费舍尔假说需要获得阴性结果,而阴性结果可能源于样本量不足或变量选择不当。此外,费舍尔假说与优良基因假说(good genes hypothesis)并非互斥(Iwasa et al., 1991)。若偏好与特征存在遗传相关,即使特征是雄性遗传质量的诚实信号(honest signal),费舍尔失控过程仍可能运作。下面将探讨两个检验"优良基因"假说的案例研究。
图7.11 (a) 展示尾羽的雄性孔雀。照片由Marion Petrie提供。(b) 尾部具有更大眼斑的雄性所产后代存活率更高。来自Petrie(1994)。
孔雀
雄性蓝孔雀(Pavo cristatus)的华丽尾羽常被视为性选择的巅峰。其尾羽由大量延长的上尾覆羽构成,带有蓝心绿铜色眼斑(ocelli),雄性会竖立这些羽毛形成闪烁的扇形进行求偶展示(图7.11a)。Marion Petrie 检验了这种展示是否反映雄性的遗传质量。她研究英国南部惠普斯奈德野生动物园中的野生孔雀种群。首先,她证明尾羽眼斑数量可预测雄性交配成功率,且实验性减少眼斑数量会导致雄性次年交配成功率下降(Petrie et al., 1991)。随后进行配对实验:将雌性与不同自然尾羽装饰程度的雄性随机配对。收集所有卵并由母鸡在标准条件下孵化,幼鸟在鸟舍中自由取食。Petrie(1994)发现尾羽装饰更丰富的雄性子代(无论雌雄)生长更佳。当放归公园后,这些子代至两岁时的存活率也更高(图7.11b)。这表明该种群中雌性通过选择装饰最丰富的雄性获得更高存活率的后代。然而在日本的另一项研究中,未发现雌性偏好更复杂尾羽的证据(Takahashi et al., 2008)。可能与孔雀鱼类似,雌性选择在不同生态条件下存在差异。
刺鱼
验证汉密尔顿-祖克假说(Hamilton–Zuk hypothesis)绝非易事。例如,仅证明雌性偏好寄生虫负荷较低的雄性并不充分。她们可能这样做并非为了为后代挑选优质基因,而仅仅是为了避免在交配过程中被感染,或因为她们希望获得能提供有效亲代抚育的配偶(高度寄生的雄性可能体质虚弱)。需要验证的四个关键假设是:(i)寄生虫降低宿主的适合度(fitness);(ii)寄生虫抗性具有遗传性;(iii)性装饰的复杂化传递了寄生虫抗性信号;(iv)雌性偏好装饰最复杂的雄性。这四点均在三刺鱼(Gasterosteus aculeatus)的详细研究中得到证实。
春季,雄性三刺鱼会发育出鲜红色体色并筑巢。随后,它们通过之字形舞蹈(zig-zag dance)试图吸引怀卵雌性(图7.12a)。若雌性被吸引,她会进入巢中产卵,雄性立即跟进并在体外完成受精。雄性随后会照料卵和幼鱼约10天。Manfred Milinski与Theo Bakker(1990)通过巧妙实验证明,雌性更倾向于与红色更鲜艳的雄性交配。当实验室水槽中的雌性面临两个筑巢雄性的选择时,在正常白光条件下她们偏好更红的雄性;但在绿光下(红色不可见时),雌性未表现出明显偏好(图7.12b)。雄性的求偶展示不受光照条件影响,因此该实验清晰地表明雌性选择受雄性红色体色驱动。
为何雌性偏好更红的雄性?Milinski与Bakker发现,雄性的红色体色是其体况(condition)的信号(更红的雄性单位体长质量更大)。当被偏好的鲜艳雄性感染寄生虫后,其体况与红色强度均下降。此时在白光下雌性不再偏好它们,而绿光下雄性感染状态不影响雌性选择。
图7.12 (a)繁殖期体色的雄性三刺鱼围绕怀卵雌性进行之字形游动。照片© Manfred Milinski。(b)白光下(左图),雌性偏好两只雄性中更鲜艳者。实验使用15对雄性,绘制其红色强度差异与雌性偏好的关系。红色差异越大,雌性对更鲜艳雄性的偏好越强。绿光下(雌性无法辨别红色差异)无显著偏好(右图)。引自Milinski与Bakker(1990)。经自然出版集团许可转载。
因此,选择更红雄性的优势之一是雌性能获得更健康的配偶,后者能更好地扇动并保护其卵和幼鱼。但进一步实验表明,健康雄性还可能为雌性后代提供"优质基因",即赋予当前感染抗性的等位基因(allele),正如汉密尔顿与祖克(1982)所假设。主要组织相容性复合体(MHC)是一组编码MHC分子(糖蛋白)的基因簇,这些分子帮助抵御寄生虫感染。不同MHC分子识别并结合不同的外源肽段(foreign peptide),随后将其销毁(细节复杂,Milinski(2006a)提供了优秀综述)。MHC包含脊椎动物中已知多态性(polymorphic)最强的基因位点(gene loci),因此个体的MHC谱(MHC profile)差异极大。雌性能通过气味评估雄性的MHC谱,因为MHC基因产物具有气味。在实验室雌性选择不同雄性气味的实验中,她们偏好那些MHC等位基因与自身形成最佳互补的雄性,包括能抵抗当前流行感染的等位基因(Reusch et al., 2001; Eizaguirre et al., 2009)。因此,通过选择健康雄性,雌性既获得更好的亲代抚育,又为后代带来遗传收益。
……以及MHC等位基因与自身互补的雄性。因此雌性选择既带来遗传收益,也改善亲代抚育
雌性受到的性选择与雄性进行的性选择
雌性装饰
当雄性对亲代投资贡献较大时,雄性可能对配偶挑剔;这会导致雌性中的性选择,促使雌性进化出提升获得雄性机会的特征(图7.13a)。例如,在一夫一妻制鸟类中,双亲常共同投入大量亲代抚育,因此双方均有动机选择高质量配偶。某些情况下,两性具有相似装饰(如某些䴙䴘的头羽)。达尔文(1871)认为这些特征通过"相互配偶选择(mutual mate choice)"进化。另一种假说认为雌性装饰仅是雄性装饰进化时产生的非适应性相关反应(correlated response)。但选择实验表明此类相关反应较弱,且装饰表达常限于单一性别(Wiens, 2001)。此外,比较研究显示雌性装饰在进化中频繁变化(Kraaijeveld et al., 2007)。现有实验证据支持相互配偶选择。例如,冠海雀(Aethia cristatella)繁殖期两性均发育醒目额冠,实验显示两性均对额冠更长的异性展示更积极(Jones & Hunter, 1993)。
图7.13 雌性性装饰。(a)凤头䴙䴘两性均具头羽装饰,可能通过相互配偶选择进化。照片© osf.co.uk。版权所有。(b)南非开普半岛雌性查克玛狒狒(Papio ursinus)的性肿胀(sexual swelling)。照片© Esme Beamish。
在生活在多雄群体中的某些灵长类动物中,雌性展示采取了一种极端形式,此时雌性可接触到多个雄性。在此情况下,雌性会发展出大型的性肿胀(sexual swellings),其大小和颜色在月经周期中变化,并标志着繁殖力(fecundity)的变化(图7.13b)。在某些物种中,这些肿胀变得如此之大,以至于雌性难以舒适地坐下,因此这些肿胀必定像雄性孔雀的尾巴一样既是累赘也是信号。在狒狒Papio cynocephalus anubis中,肿胀大小的个体差异与雌性质量(养育后代的能力;Domb & Pagel, 2001)相关。雌性可能竞争与优势雄性(最能保护她们或其后代)的交配机会,也可能竞争与群体中多个雄性交配,以给予每个雄性足够的父权机会,从而使其放弃杀婴行为(第2章)。类似的性肿胀也出现在高山领岩鹨Prunella collaris中,这是一种同样生活在多雄群体中的山地鸣禽。雄性只有在与雌性交配并拥有父权机会时,才会帮助喂养雌性的后代。通过将交配(及父权)分配给多个雄性,雌性增加了一个或多个雄性提供帮助的可能性(Davies et al., 1996b)。雌性通过展示鲜红的泄殖腔(cloacas)(Nakamura, 1990)并在生育期鸣唱以吸引雄性(Langmore et al., 1996)来竞争雄性的关注。
性别角色反转
在某些情况下,雌性对雄性的竞争变得如此强烈,以至于通常的性别角色发生反转。在海龙Syngnathus typhle中,怀孕的是雄性;其拥有一个育雏袋,用于安全保存一窝受精卵并提供营养和氧气(图7.14)。在持续数周的怀孕期间,雌性可产下多窝卵。因此,雄性成为雌性繁殖成功的限制性资源,雌性竞争雄性,而雄性偏好体型更大、更具装饰性且产卵量更大的雌性(Rosenqvist, 1990; Berglund et al., 2006)。
有时性竞争可能存在季节性变化。Darryl Gwynne和Leigh Simmons(1990)揭示了食物供应的季节性变化如何导致澳大利亚Kawanaphila螽斯科昆虫的性别角色变化。当食物稀缺时,雄性富含蛋白质的大型精荚(spermatophore)生产成本高昂,但对雌性极具价值(图7.15)。雌性竞争雄性,而雄性变得挑剔,偏好产卵量更大的大型雌性。然而,当富含花粉的禾木树开花时,雄性可更快地产生精荚。此时,接近可受孕雌性的机会限制了雄性的成功,雄性开始竞争雌性,而雌性会拒绝部分雄性。
图7.14 性别角色反转。(a)一对海龙Syngnathus typhle。雄性在前,雌性倒置在其下方。(b)怀孕的雄性海龙,育雏袋中满是发育中的幼体。照片© Anders Berglund。
图7.15 澳大利亚的螽斯Kawanaphila nartee在袋鼠爪花上。雄性产生富含蛋白质的大型精荚。(a)交配结束时的一对,雄性(蜷缩在雌性后方)正在沉积其精荚。(b)雌性俯身取食精荚。她将利用这份食物帮助形成卵子。照片© Darryl Gwynne。
类似的季节性变化也出现在双斑鰕虎鱼Gobiusculus flavescens中,这是西欧岩岸常见的鱼类。繁殖期雄性在海藻和空贻贝壳中守卫巢址,吸引雌性前来产卵。
雄性可同时照顾多只雌性的卵窝。在繁殖季早期,当性别比为1:1时,雄性竞争雌性并在巢址积极求偶。然而,夏季由于雄性死亡率更高(可能源于亲代抚育和交配竞争的成本),性别比偏向雌性。这导致性别角色反转,雌性开始竞争接近雄性的机会,并在求偶中扮演更主动的角色(Forsgren et al., 2004)。
竞争中的性别差异
在某些情况下,两性可能具有不同的装饰特征,这与竞争中的性别差异相关。澳大利亚东北部引人注目的Eclectus鹦鹉Eclectus roratus表现出显著的性二态性(图7.16)。鲜红与蓝色的雌性竞争稀缺的巢穴,尤其是较不易被洪水侵袭、幼鸟成活率更高的巢穴。雌性在孵卵和育雏期间隐藏于这些巢穴内,因此无需隐蔽。她们在树冠下方展示,其鲜艳色彩与树木深色的枝干形成对比。亮绿色的雄性竞争拥有最佳巢址的雌性,其颜色反映了捕食者伪装与展示时醒目性优势(猩红色下翼覆羽)之间的权衡(Heinsohn et al., 2005; Heinsohn, 2008)。
Eclectus鹦鹉提醒我们,两性都可能需要与同性成员竞争。对雌性而言,其繁殖成功通常受资源限制,因此竞争更多是为了获取成功繁殖所需的资源(繁殖地、亲代抚育、社会等级)而非雄性精子。对雄性而言,其繁殖成功通常受配偶数量限制,因此竞争通常围绕接近雌性的机会展开,方式包括直接手段(力量或魅力)或间接手段(垄断雌性所需资源)。
图7.16 Eclectus鹦鹉的性二态性。雄性为亮绿色,具红色下翼覆羽。雌性为鲜红与蓝色。照片©(a)Lochman Transparencies,(b)© Michael Cermak。
精子竞争(sperm competition)
达尔文设想的性选择过程仅是故事的一半。达尔文提出该理论一个世纪后,Geoff Parker(1970c)提出了一项新颖见解。他曾观察粪蝇Scatophaga stercoraria在牛粪周围竞争配偶。他首先注意到雌性常与多个雄性交配,其次雌性将精子储存在称为受精囊(spermathecae)的器官中。随后他意识到,性选择必然在交配行为后持续,因为不同雄性的精液在雌性生殖道内竞争受精机会。他将此过程称为“精子竞争(sperm competition)”。现认为这是动物界生殖行为的重要选择压力(Birkhead & Moller, 1998; Parker, 2006)。与交配前的性选择类似,存在两种潜在过程:竞争雄性精子间的对抗(类似于雄性战斗)和雌性精子选择(常称为“隐性雌性选择(cryptic female choice)”,类似于雌性配偶选择;表7.2)。正如达尔文理论所示,第一种过程的证据很快被接受,而雌性精子选择的重要性直到近年才被认可。
为什么雌性与多个雄性交配?
正如我们在Bateman的经典实验(图7.3)中所见,雄性通过与多个雌性交配获得的优势是显而易见的——他会有更多后代。但为什么雌性要与一个以上的雄性交配?特别是对于许多物种(如Bateman的Drosophila)而言,单次授精就能为雌性提供足够的精子使其所有卵子受精。我们将考虑三个假说。
抵抗的成本超过顺从的成本
在某些情况下,即使雌性可能无法获得任何利益,接受额外交配也可能是划算的。例如,雌性粪蝇必须前往牛粪产卵。在那里她会遇到大量渴望交配的雄性,这些雄性试图抓住她(第5章;图5.3)。当一只雄性交配后,另一只雄性可能会取代他并继续交配。在某些情况下,雌性会在雄性争夺占有的过程中溺死于液态粪便中(Parker, 1970c)。 雄性体型大于雌性,在这种情况下似乎很少有配偶选择的余地。
表7.2 性选择在交配前后均发挥作用
多重交配的物质(或直接)利益
在某些情况下,多重交配能增加雌性可产生的后代数量。她可能通过获取更多精子来确保生育力,或从雄性处获得更多资源——无论是食物礼物还是精包中的营养物质,这些都能使她产下更多卵(Thornhill & Alcock, 1983)。当某些雄性以领域形式控制最佳产卵地点时,雌性可能不得不在每次产卵时进行交配,以便进入这些区域(例如许多蜻蜓和豆娘)。在其他案例中,与多个雄性交配可能增加雌性能为后代获得的照料量,因为如果多个雄性都有父权机会,他们会合作喂养幼雏;例如加拉帕戈斯鵟Buteo galapagoensis(Faaborg et al., 1995)和林岩鹨Prunella modularis(Davies et al., 1996b)。雌性通过多重交配同样可以减少雄性和其后代受到的骚扰。在某些雌性生活在多雄群体中的灵长类动物中,雌性通过给予每个雄性足够的父权机会以避免其杀害幼崽(Hrdy, 1999)。
遗传(或间接)利益
此时雌性通过与多个雄性交配来提高后代的遗传质量。该假说的有力证据来自一个出人意料的来源——对鸣禽的研究,其中社会单配制(一雄一雌制)是最常见的交配系统(Lack, 1968)。自1985年DNA标记首次可用于精确测定父权以来,研究揭示了社会单配制鸣禽频繁进行婚外交配。通常,10\mathrm{-}40\%的后代由非雌性社会配偶的雄性所育(Griffith et al., 2002; Westneat & Stewart, 2003)。在鸣禽中,雄性难以强迫交配,因为雌性可通过飞离逃脱。相反,婚外交配的发生是由于雌性会溜出家园领域主动寻求这些婚外雄性。一项鸟类羽色的比较研究表明,婚外交配是性选择的重要组成部分。Owens和Hartley(1998)比较了73个已知婚外父权率的鸟类物种的两性羽色差异。他们将羽色二态性按从零(两性无差异)到十(雄性羽色远艳于雌性)的等级评分。他们发现羽色二态程度与社会配偶数量无相关性,但与婚外父权率呈强相关(图7.17)。这表明雄性演化出艳丽羽色并非为了吸引自己的配偶,而是为了吸引其他雄性的配偶进行婚外交配!
鸟类婚外交配:雌性对雄性羽色或展示特征的筛选
多个物种的详细研究现已证实,雌性确实会主动寻求与展示特征或羽色特征比其社会配偶更复杂的雄性进行婚外交配,例如:更大的鸣唱曲库、更长的尾羽或更鲜艳的羽色(表7.3)。与吸引力强的雄性(通过这些特征衡量)配对的雌性往往更忠诚;而与特征发育较差的雄性配对的雌性最积极寻求婚外交配。表7.3中四个案例均有实验证据表明这些展示特征对雌性具有吸引力。此外,特征发育最完善的雄性存活率更高,暗示这些展示特征是生存力的指标。婚外雄性不提供照料,仅提供精子。雌性是否通过选择特征最发达的雄性来为后代"采购"优良基因?关键检验在于比较婚外父权后代与同巢婚内父权半同胞的生存成功率。对蓝山雀和白领姬鹟的研究表明,婚外父权后代存活率更高,提示雌性确实通过婚外交配获得了遗传利益。
图7.17 Owens和Hartley(1998)对鸟类羽色二态性的比较研究表明,性二态性与社会交配系统(配偶数量:0——社会单配制,1-3——雄性多配制程度递增)无相关性,但与婚外父权(婚外雄性育雏百分比)显著正相关。羽色二态性按从零(两性无差异)到十(雄性羽色远艳于雌性)评分。圆圈大小反映样本量。
表7.3 部分鸣禽中,雌性会寻求展示特征比社会配偶更复杂的雄性进行婚外交配
雌性通过婚外交配提高后代的遗传质量
雄性“优良基因”效应的验证难题
展示雄性“优良基因”效应的一大难题在于,雌性若与更具吸引力的雄性交配,可能会增加自身的投入。例如,绿头鸭(Anas platyrhynchos)雌性与更具吸引力的雄性交配后会产下更大的卵(从而提高后代存活率)(Cunningham & Russell, 2000)。因此,更具吸引力雄性后代的成功可能部分(或完全)反映雌性投入的增加。对澳大利亚有袋类鼠形动物棕袋鼩(Antechinus stuartii)的研究消除了这一混杂因素(Fisher et al., 2006)。该物种属于单次繁殖(semelparous)生物,雌性一生仅产一窝幼崽后死亡。雄性亦为单次繁殖,不参与后代抚育。这种情况下,雌性理应对当前幼崽投入最大化(无需为未来幼崽储备资源)。野外观察显示,雌性在两周交配期内通常与多个雄性交配。为何如此?
在严格控制的实验中,雌性被捕获并与41只"种雄"进行实验室交配。每只雌性允许交配三次:单配组(monandrous)雌性三次均与同一雄性交配;多配组(polyandrous)雌性三次分别与不同雄性交配。幼崽出生后通过皮下植入微型芯片标记个体,随后将母体及其幼崽放归野外巢箱。两个月后统计各窝存活幼崽数量。
棕袋鼩:多重交配提升雌性繁殖成功率
结果显著:两组雌性初始产仔数无差异,但多配组雌性断奶后存活幼崽数量是单配组的三倍。深入分析单配组发现,若配对雄性在多配竞争中表现优异(即与其他雌性竞争中取得高父权),该雌性后代表现更佳。这表明多配优势在于雌性更可能获得优良遗传父系(Fisher et al., 2006)。
配偶选择的限制与婚外交配
这些发现引出两个疑问:首先,雌性为何不直接选择理想雄性?当最佳雄性竞争激烈时,雌性可能被迫接受次优社会配偶,转而通过婚外交配提高后代遗传质量。
被欺骗雄性可能减少亲代抚育
其次,什么限制婚外交配?现有两种假说:其一,当雄性提供亲代抚育时,社会配偶会因被欺骗而减少抚育。白领姬鹟(Ficedula albicollis)研究为此提供证据:在雌性可育期人为移走雌性一小时(模拟其寻求婚外交配),其社会配偶的雏鸟喂食量显著减少(与不可育期对照组相比)(Sheldon et al., 1997)。因此雌性需权衡婚外受精收益与抚育协助损失。
第二假说认为不同父系分别适合生育子代与女代。这源于性别拮抗基因(sexually antagonistic genes)——对某一性别有利却对另一性别有害。例如古人类中增加髋宽的基因,可能利于女儿(分娩更易)但损害儿子(降低运动效率)。性别限制基因表达的选择可能导致两性独立进化,使各自达到最优表型。果蝇选择实验显示:对某一性别有利的基因选择会降低另一性别适合度(Chippindale et al., 2001)。自然种群中也存在性别拮抗效应:苏格兰朗姆岛马鹿(Cervus elaphus)中高繁殖成功率雄性所生女儿适合度较低(Foerster et al., 2007);蟋蟀繁殖实验显示野生高吸引力雄性所生儿子质量更优,但女儿质量较差(Fedorka & Mousseau, 2004)。这可能影响配偶选择:雌性可能因社会配偶更适某一性别后代,而婚外雄性更适另一性别后代,从而调节婚外交配。
不同父系对子代与女代的适配差异
性冲突
本章第三个主题涉及性冲突(sexual conflict)。我们从配子异型(anisogamy)的起源谈起——这是远古冲突的产物,小配子通过剥削大配子资源演化形成。随后展示雌性在交配前更高的亲代投资常与交配后投入结合,导致雄性间激烈配偶竞争与雌性对雄性资源获取能力/遗传优势的选择。这常引发性冲突,既涉及交配行为本身,也涉及交配后精子利用(表7.4)。性冲突发生于两性最优结果不一致时,理论上会驱动两性演化出偏向自身利益的适应特征,引发性别拮抗协同进化(sexually antagonistic coevolution)(Parker, 1979; Chapman et al., 2003)。下文将探讨此类冲突的证据:首先是交配本身,其次是交配后卵子受精。下章将讨论亲代投资相关的性冲突。
交配中的性冲突
性别拮抗协同进化
雄性繁殖成功率通常更受配偶获取限制,因此特定相遇中雄性倾向交配而雌性倾向抗拒。此冲突的极端表现是强制交配,如蝎蛉(Panorpa spp.):雄性通常通过献上唾液分泌物或昆虫尸体等婚礼吸引雌性(与前述Hylobittacus相似),雌性在交配时摄食礼物并转化为卵子。但有时雄性使用特殊腹器(背板器)强制交配且不献礼(Thornhill, 1980)。这构成典型性冲突:雌性因无法获得卵子营养而需自行觅食受损,雄性则规避寻找婚礼的风险受益。蝎蛉以蛛网昆虫为食,65%成体因此死亡,觅食确属高危。为何非所有雄性都强制交配?成本收益平衡尚不明确,但该策略受精成功率极低,可能仅在无法获取猎物或分泌足够唾液吸引雌性时采用。
表7.4 性冲突:部分两性适应与反适应特征总结
雄性特征与雌性特征
水黾(water striders):
雄性抓握与雌性抵抗的 协同进化(coevolution)
Goran Arnqvist和Locke Rowe(2002a, 2002b)对水黾(Gerridae)的研究为交配冲突如何导致两性间拮抗性协同进化(antagonistic coevolution)提供了特别有力的证据。这些昆虫常被观察到在池塘和溪流水面滑行觅食或寻找配偶。雄性会扑到雌性背上,试图通过抓握来确保交配。然而,多余的交配对雌性代价高昂:背上承载雄性的雌性活动能力下降,导致摄食成功率降低且被捕食风险增加,因此已交配过的雌性会竭力躲避雄性。跨物种比较显示,雄性形态(如抓握生殖器的延长)与雌性抵抗形态(如帮助对抗雄性的腹刺延长)呈现相关进化(图7.18)。这表明一方的适应(adaptations)会引发另一方的反适应(counter-adaptations)。交配机会和武装代价的差异可能解释不同物种为何处于不同的平衡武装水平。
配偶守护与频繁交配
确保父权(paternity assurance)
在其他案例中,性冲突(sexual conflict)表现为相反方向:雌性通过获得额外配对交配(extra-pair matings)获益,而其社会配偶(social mate)则通过阻止此类行为来守护父权。许多社会单配制(socially monogamous)鸟类中,社会雄性会在雌性约一周的受精期内紧密跟随,驱逐入侵雄性。而雌性可能试图偷溜进行额外配对交配。当雄性无法紧密守护配偶时(例如一方需守护巢址而另一方外出觅食的海鸟和猛禽),社会雄性会通过频繁交配淹没竞争者精子,有时每窝交配数百次(Birkhead & Møller, 1992)。
图7.18 (a)一对正在交配前角力的Gerris lacustris水黾。雌性(下方)抬起身体将双方腹部尖端压向水面张力,常导致雄性失去抓握。照片© Ingela Danielsson和Jens Rydell。(b)在Gerris incognitus等物种中,雄性进化出抓握型生殖节段(A),雌性则进化出腹刺(B)以抵抗雄性抓握。其他物种如Gerris thoracicus的武装程度和两性异形(dimorphism)较低(C雄性;D雌性)。(c)不同Gerris物种的雌雄武装水平指数呈线性分布,表明性拮抗协同进化(sexually antagonistic coevolution):雄性抓握武装的增强伴随雌性反抓握防御的提升。武装最强的物种位于左下方(如incognitus),最弱的位于右上方(如thoracicus)。引自Arnqvist和Rowe(2002b),经自然出版集团许可转载。
交配后的性冲突
雄性提升父权的策略
雄性适应(Male adaptations)
雄性采用多种策略提高精子竞争(sperm competition)成功率。无脊椎动物提供了最极端的案例,此处仅作简要介绍(Birkhead & Møller, 1998; Simmons, 2001)。
精子移除(Sperm removal):许多昆虫雌性将精子储存在受精囊(spermathecae)中。Jonathan Waage(1979)首次发现豆娘(damselflies)和蜻蜓(dragonflies)雄性会在注入自身精子前移除竞争者遗留的精子。雄性Calopteryx maculata的阴茎末端有两个特化勺状结构,用于刮除雌性体内先前雄性的精子(图7.19c, d)。其他物种雄性使用带角状附器的可膨胀阴茎,将竞争者精子挤压到受精囊角落,确保自身精子优先接触受精管(后进先出;图7.19a, b)。
移除竞争者精子
降低雌性再次交配概率
精子置换(Sperm displacement):部分昆虫雄性通过授精冲刷掉先前雄性的精子。黄粪蝇(Scatophaga stercoraria)雌性具有三个受精囊,单次交配即可填满全部。当两雄性连续交配时,第二雄性获得80%父权(第3章)。Leigh Simmons等(1999a)使用稳定同位素标记的氨基酸追踪雌性生殖道内两雄性的精子,发现第二雄性的精子将第一雄性的精子挤出受精囊,但冲刷作用并非100%有效,导致部分精子混合(因此第一雄性仍保留部分成功率)。两雄性的父权份额与其在受精囊中的精子比例相符(即"公平抽奖"结果)。
交配栓(Copulatory plugs):部分无脊椎动物(尤其是昆虫)雄性在交配后用胶状物封闭雌性生殖孔以防其他雄性受精。寄生在大鼠肠道的棘头虫(acanthocephalan worm)Moniliformes dubius雄性不仅为雌性制造"贞操带",有时还会爬上竞争者雄性,在其生殖区涂胶阻止其再次交配(Abele & Gilchrist, 1977)。半翅目昆虫Xylocoris maculipennis的习性同样惊人:该物种正常交配时,雄性直接刺穿雌性体壁注入精子,精子在雌体内游动直至遇见卵子受精。与棘头虫类似,雄性有时会进行同性"交配":雄性Xylocoris可能将精子注入竞争者体内,这些精子会游至受害者的睾丸,等待下次受害者交配时传递给雌性(Carayon, 1974)。
抗催情剂(Anti-aphrodisiacs):Larry Gilbert(1976)发现交配后的Heliconius erato雌蝶带有特殊气味。实验证实该气味非雌性自身产生,而是雄性在交配结束时释放。这种气味可能模仿雄性在其他情境中用于驱逐同类的气味,从而阻止其他雄性与该雌性交配。
图7.19 蜻蜓目(Odonata)的两种精子置换机制。Crocothemis erythraea:(a)未膨胀阴茎;(b)膨胀阴茎。角状结构将先前雄性的精子重新定位至受精囊。Orthetrum cancellatum:(c)交配时外翻的鞭状鞭毛;(d)携带倒刺的鞭毛移除受精囊狭窄管道中的精子。Siva-Jothy(1984),照片由Michael Siva-Jothy提供。
不育精子(sterile sperm)
在某些无脊椎动物中,雄性会产生两种类型的精子:具有使雌性卵子受精潜力的“真精子(eusperm)”,以及不育的“副精子(parasperm)”(可能含有或不含细胞核)。在蝴蝶和蛾类中,副精子作为雌性精子储存器官的“廉价填充物(cheap fillers)”,导致雌性延迟再次交配(Cook & Wedell, 1999)。在Drosophila pseudoobscura中,副精子帮助保护其有受精能力的兄弟真精子免受雌性生殖道内的杀精作用(spermicide)影响(Holman & Snook, 2008)。
不育精子作为“廉价填充物”
附腺蛋白(accessory gland proteins,Acps)。在许多昆虫中,雄性射精液不仅含有精子,还包含一系列影响雌性行为和生理的蛋白质混合物。在Drosophila melanogaster中已鉴定出多达80种Acps,其功能……
雌性的化学调控
图7.20 本实验中,雌性果蝇Drosophila melanogaster在交配时接受不同剂量的雄性附腺蛋白(Acps),同时保持其他高成本的繁殖因素(如卵子生成、非交配状态下的雄性接触频率和交配率)恒定。接触能产生Acps的雄性的雌性(深蓝色线)中位寿命(21天)显著短于接触其他三类雄性的雌性(中位29天),即:通过基因工程去除Acps的雄性(红线),以及两个对照组雄性(空心符号和浅蓝色线)——这些雄性以正常频率求偶但因外生殖器被切除而无法交配。引自Chapman等(1995)。经自然出版集团许可转载。
……已通过基因工程手段制造缺失或过表达这些蛋白的雄性个体进行研究。其功能包括:使竞争雄性的精子失活;保护雄性自身精子免受雌性生殖道内的酶解攻击;提高雌性产卵率;降低雌性再次交配倾向。所有这些都将有助于提高雄性的繁殖成功率,但实验表明这些雄性收益可能以雌性适合度为代价,因为它们会缩短雌性寿命(图7.20)。对雌性的有害副作用可能源于Acps通过阴道壁进入雌性血淋巴(haemolymph),进而干扰雌体腔内必需的酶促过程(Chapman等,1995,2003)。
精子的策略性分配(strategic allocation of sperm)
对多个分类群(灵长类、蝙蝠、其他哺乳动物、鸟类、蛙类、鱼类及多种昆虫)的比较研究表明,睾丸大小相对于体型的比例(反映对精子的投入)随雌性滥交程度(衡量精子竞争的指标;Wedell等,2002)增加而增大。通过雄性粪蝇(dung flies)的选择实验揭示了进化变化的潜力:当面临增强的精子竞争时,更大的睾丸和射精量在十代内即可演化形成(Hosken等,2001)。这些结果表明,在精子生产中投入资源代价高昂,只有当其带来竞争收益时才会演化。在种内层面,雄性显然也不具备无限的交配潜力(Dewsbury,1982)。例如,雄性极北蝰(Vipera berus)在精子发生期(此时不活动)损失的体重与后续搜寻和竞争雌性阶段的损失相当(Olsson等,1997)。
因此,雄性根据精子竞争和雌性繁殖力(fecundity)策略性分配精子的现象并不令人意外(Wedell等,2002)。Tommaso Pizzari等(2003)对散养原鸡(Gallus gallus)种群的研究提供了绝佳案例(图7.21)。他们通过给雌性安装收集装置获取精液并计数。优势雄性在面临更多雄性竞争者时会增加对雌性的精子投入,并向具有更大鸡冠(产更大卵)的雌性分配更多精子。此外,雄性对同一雌性的精子投入随重复接触而减少,但会因新雌性的出现而恢复。这种现象被称为“柯立芝效应(Coolidge effect)”,得名于……
图7.21 一对正在交配的原鸡。雌性佩戴收集装置,可在交配后收集精子以测量精液量。照片© Charlie Cornwallis。 雄性根据性竞争调整精子分配
……柯立芝总统夫妇参观养鸡场时,当柯立芝夫人被告知公鸡每天可交配数十次后,据说她回应:“把这事告诉总统”。总统随后询问是否每次都是同一只母鸡,并得知涉及多只不同母鸡。“把这个告诉柯立芝夫人!”,他答道。
有时雄性会出现精子耗竭(sperm depletion),这可能降低雌性生育力。在珊瑚礁鱼类蓝头锦鱼(Thalassoma bifasciatum)中,优势雄性吸引最多雌性,但与这些雄性配对的雌性因每次交配释放精子较少(体外受精;Warner等,1995)而承受生育成本。吸引力雄性的精子限制可能导致雌性间竞争交配机会。在扇尾沙锥(Gallinago media)中,雌性在求偶场(lek)上竞争与最受欢迎雄性的重复交配,但雄性会拒绝已交配过的雌性(Saether等,2001)。
雄性的精子耗竭
雌性适应(female adaptations)
当Parker(1970c)首次提出精子竞争是性选择的重要组成部分时,研究者聚焦于雄性适应,因为理论认为后交配冲突的成功对雄性比对雌性更重要。本质上,雄性被认为在进行“数量博弈(numbers game)”——受精成功率提升带来更多后代,而雌性进行“质量博弈(quality game)”——受精控制增强仅提升后代质量。然而,适应会受到成本与收益的共同影响:一旦精子进入雌体,雌性显然能更好地控制结果?特别是Bill Eberhard(1996)倡导雌性控制潜力及雌性精子选择(隐性雌性选择,cryptic female choice)的可能性。目前支持这一观点的证据日益增多。
隐性雌性选择(cryptic female choice)
原鸡(Gallus gallus)提供了雌性控制的典型案例。雌性偏好与优势雄性交配,但劣势雄性有时能通过强迫交配突破雌性抵抗。此时,雌性会在交配后立即通过泄殖腔收缩排出劣势雄性的精子作为报复(Pizzari & Birkhead,2000)。若多个雄性成功授精,雌性能否通过精子选择偏袒受精结果?果蝇实验表明,两个雄性在精子竞争中的相对成功率不仅取决于雄性基因型,也取决于雌性基因型(Clark等,1999)。这表明雌性并非单纯为雄性间精子竞争提供被动的生殖道场所,而是对结果具有某种控制。
雌性可控制精子储存(sperm storage)
Tom Tregenza、Nina Wedell及其同事最近的实验为雌性交配后的精子选择(sperm choice)提供了令人信服的证据。他们研究了田野蟋蟀(Gryllus bimaculatus),这种雌性在野外和实验室都容易与多个雄性(亲属或非亲属)交配。在实验室实验中,雌性先后与两种雄性交配:两个雌性同胞兄弟,两个非同胞兄弟,或一个同胞兄弟加一个非同胞兄弟(顺序不同)。雄性蟋蟀在交配时将精包(spermatophore)转移给雌性,且它们会在遇到雌性前就准备好精包,因此同胞与非同胞转移的精子数量相同。不同处理组间的产卵量也没有差异。然而,与两个非同胞交配的雌性相比,与两个同胞交配的雌性孵化成功率降低(图7.22),这是由有害隐性等位基因纯合导致的近交衰退(inbreeding depression)的典型结果。如果两个雄性的精子在雌性生殖道内混合,那么在同胞加非同胞处理中,我们预期平均有一半卵子会被同胞精子受精,因此这些雌性应该具有中等的繁殖成功率。然而,它们的表现与两个非同胞交配的雌性同样好(图7.22)。这表明雌性可以偏向于非亲属雄性的精液进行受精。通过使用DNA标记区分不同雄性的精子,发现雌性优先在其受精囊(spermathecae)中储存非亲属雄性的精子,正是这种偏向性储存使同胞与非同胞处理中的雌性能避免近交的代价(Bretman et al., 2009)。
雌性田野蟋蟀中的精子选择
未来研究的一个关键问题是:受精的雄性控制与雌性控制是否因物种而异?如果存在差异,原因是什么?一般而言,在雌性对交配对象选择权最小的物种中,我们可能预期雌性在交配后拥有最多的控制权。
性冲突:谁将胜出?
如果两性都进化出一系列性对抗(sexually antagonistic)适应特征以偏向自身利益,冲突的最终胜者会是谁?理论模型表明,结果通常是永无止境的进化追逐,导致双方快速进化改变(Parker, 1979; Chapman et al., 2003)。例如,果蝇(Drosophila)雄性副腺蛋白(accessory gland proteins)具有高水平的氨基酸多态性,且种间差异显著;据估计其进化速率是非生殖道蛋白的两倍,这强烈暗示着持续进行的性军备竞赛(sexual arms race)。
图7.22 (a) 田野蟋蟀Gryllus bimaculatus。照片© Tom Tregenza。(b) 双重交配实验结果。与两个同胞兄弟交配的雌性因近交衰退导致孵化成功率降低。与一个同胞加一个非同胞交配的雌性(无论顺序)表现与两个非同胞交配者同样好,表明雌性可以偏向非亲属雄性的受精成功率。来自Tregenza and Wedell (2002)。
性冲突推动两性对抗性协同进化的力量,已通过黑腹果蝇(Drosophila melanogaster)的精妙人工选择实验得到验证。Bill Rice和Brett Holland提出疑问:雄性进化中的适应特征是否会被雌性反适应(counter-adaptations)所制约?在一个实验中(Holland & Rice, 1999),他们设立两个选择系,各在实验室运行47代,期间选择最成功的雄性和雌性。在一个系中实施高强度性选择:每个培养瓶有3雄1雌。这种环境下对精子竞争成功的雄性和能应对雄性竞争的雌性产生强烈选择。第二个系通过强制随机单配制消除性选择:每个瓶中一雄一雌终生相伴。在没有雄性竞争的情况下,雄性确保其雌性所有卵子的父权,显然最大化雌性终生繁殖成功的行为对其有利。
结果显示,单配系雄性确实进化得对雌性伤害更小。例如其求偶和交配频率降低,导致雌性存活率和繁殖力高于性选择系。雌性是否也发生进化?如果性冲突促使雌性进化出代价高昂的防御来对抗……
果蝇选择实验揭示两性对抗性协同进化
雄性,那么单配系雌性应该会降低这些防御。为验证这点,将单配系雌性与高强度性选择系雄性交配。这些雌性的存活率和繁殖成功率显著低于性选择系雌雄交配组合。因此,在单配系中不仅雄性进化得更少伤害雌性,雌性也相应进化得更少抵抗。
在另一个实验中,允许雄性系进化但阻止雌性系协同进化。这种情况下,雄性进化出更高的精子竞争成功率,但以降低雌性适合度为代价(Rice, 1996)。这些实验表明,通常雄性适应必须被雌性反适应所制约。相关基因仍有待阐明——交配前和交配后的冲突可能共同导致了这些实验结果。
水禽两性生殖器形态的协同进化
交配后冲突的形态学后果在水禽两性生殖器形态的协同进化中得到生动体现。多数鸟类具有简单生殖器,雄性通过泄殖腔接触传递精子。但雄性水禽具有长度1.5到40厘米不等的阴茎(phallus),其长度与强迫性配偶外交配频率呈正相关(Coker et al., 2002)。这表明阴茎进化增强了雄性强迫插入能力。然而,雌性生殖特征与雄性形态协同进化:在雄性具有最长、最复杂阴茎(带刺和沟槽)的物种中,雌性具有最复杂的阴道形态,包括可能降低雄性在无雌性配合时插入概率的盲端囊和螺旋结构(Brennan et al., 2007; 图7.23)。
追赶式性选择
性冲突可比作进化的舞蹈,两性以代价高昂的伎俩与反制措施相互追踪。两性对抗性协同进化的发现促使Holland和Rice(1998)提出新的性选择模型。该模型设想雄性通过武力或魅力被选择来诱导雌性交配,而雌性被选择进行抵抗,导致雄性刺激特征与雌性抗性特征的"追赶式"协同进化。回想"好基因"和"费雪失控"模型,雌性因遗传利益进化出对雄性特征的偏好。"追赶式"模型恰恰相反:雌性进化出对雄性策略的抵抗,因为顺从代价高昂。果蝇选择实验结果和水禽复杂的两性生殖器协同进化都符合追赶式模型。该模型是否也能解释某些吸引雌性的雄性特征的夸张进化?
雌性进化出对雄性策略的抵抗
Holland和Rice(1998)指出了两种可能的情况。鱼类属Xiphophorus包括具有延长的尾鳍的剑尾鱼(swordtails)和没有该特征的斑马鱼(platyfishes)。它们最近的近缘属(genus Priapella)缺乏长尾,更远缘的类群也如此,因此Xiphophorus的共同祖先可能缺乏这种装饰(图7.24)。雌性剑尾鱼偏好尾鳍更长的雄性,但令人惊讶的是,无剑尾的斑马鱼和Priapella雌性也表现出相同偏好:当人工剑尾被附加到它们雄性的尾部时,雌性更倾向于选择这些雄性而非正常无尾的雄性(Basolo, 1990, 1995)。这表明这些鱼类都存在预先存在的雌性对尾部的偏好(female preference),随后被部分Xiphophorus物种所利用。根据Fisher的失控模型(runaway model),偏好和性状共同演化,因此预测剑尾鱼雌性的尾部偏好更强。然而,在缺乏剑尾的属中,雌性对剑尾的偏好反而更强烈,这表明随着剑尾的演化,雌性对剑尾的吸引力已减弱,正如追逐-逃离模型(chase-away model)所预测的那样。
图7.23 水禽雌雄生殖器官的协同演化。(a)在雄性具有较长阴茎的物种中,雌性阴道更复杂,具有更多螺旋结构(右)和“盲端囊”(左)。阴道螺旋方向与雄性阴茎螺旋相反,表明这是对抗性而非互利性的“锁钥”协同演化。(b)绿头鸭(Anas platyrhynchos),一种存在高水平强迫交配的物种,雄性具有长阴茎(右下),雌性具有长而复杂的阴道(左上)。白色标尺为2cm。引自Brennan等(2007)。
图7.24 剑尾鱼的系统发育表明,Xiphophorus属的祖先缺乏长尾,剑尾特征在与斑马鱼分歧的支系中演化而来。令人惊讶的是,雌性斑马鱼和Priapella在实验中更偏好本物种中被延长尾部的雄性。这表明支持尾部的感觉偏差(sensory bias)先演化,随后被剑尾鱼物种利用(Basolo 1990, 1995)。雌性和雄性剑尾鱼Xiphophorus helleri的照片。© Alexandra Basolo。
在Schizocosa狼蛛中,实验也显示雄性前腿的刚毛簇(tufts of bristles)对雌性性接受度的影响在缺乏该特征的物种中比具有该特征的物种更强(McClintock & Uetz, 1996)。这再次表明雄性性状的演化伴随着雌性抵抗(female resistance)的产生。
不同的性选择模型可能…… 适用于不同性状
综上,我们有三类关于雌性偏好(female preference)通过性选择演化的模型,且存在支持所有模型的证据。未来研究需探讨这三类过程在自然界中的相对重要性。某些物种的雄性可能同时具有通过所有三种过程演化的性状:例如,雄鸭可能拥有亮丽羽色以传递抗寄生虫的优良基因(good genes),通过Fisher失控过程夸张化的长尾,以及为增强额外配对交配(extra-pair matings)而演化的复杂形状阴茎——但这也引发了雌性生殖器官的“追逐-逃离”协同演化作为反制防御。
总结
雌性通常在配子(gametes)和亲代抚育(parental care)上投入更多,因此雄性在交配池(mating pool)中花费更长时间,且成功雄性的潜在繁殖率更高。这导致雄性竞争雌性,而雌性根据雄性提供的资源或遗传质量进行选择。达尔文(1871)的性选择(sexual selection)理论旨在解释通过力量或魅力在配偶竞争中有利的性状演化。充分证据表明雄性的交配成功率与体型和力量(如象海豹)或吸引雌性的装饰(如寡妇鸟的长尾)相关。雌性可能选择提供最佳资源(如巢址、食物或父代抚育)的雄性。然而,即使雄性仅提供精子(sperm),雌性仍表现出挑剔。此时,雄性的复杂展示可能通过Fisher失控过程(选择优势在于遗传上有吸引力的儿子)或遗传质量的诚实信号(honest advertisement)(雌性获得提高子代生存力的优良基因)演化。当雄性对亲代投资(parental investment)贡献较大时,雄性可能变得挑剔,而雌性会竞争配偶。
Parker(1970c)指出性选择在交配后持续进行,因为竞争雄性的精子在雌性生殖道内争夺受精(精子竞争,sperm competition)。雌性通过与多个雄性交配可能获得物质利益和遗传利益。这导致性冲突(sexual conflict):雄性演化出提高精子竞争成功的适应,而雌性演化出精子选择(sperm choice)和抵抗雄性操控的适应。其结果可能是两性间的对抗性协同演化(antagonistic coevolution),雌性演化出对雄性力量或魅力的抵抗。
延伸阅读
本章讨论的主题是研究异常活跃的领域,文献浩繁。优秀著作包括:Malte Andersson(1994)的《性选择》;Tim Birkhead和Anders Møller(1998)主编的《精子竞争》;Göran Arnqvist和Locke Rowe(2005)的《性冲突》。Tim Birkhead的《滥交》(2000)是对这三个主题的出色科普。短篇综述参见Chapman等(2003)关于性冲突,Wedell等(2002)关于精子竞争,Birkhead和Pizzari(2002)关于交配后性选择,Andersson和Iwasa(1996)关于性选择,以及Clutton-Brock(2009a)关于两性选择。Kokko等(2003)对配偶选择模型进行了精彩综述,其核心观点是直接与间接(遗传)利益常相辅相成。Bart Kempenaers(2007)综述了基于遗传质量的配偶选择。
Robert Brooks(2000)通过孔雀鱼的巧妙实验为Fisher性选择模型提供了证据(另见Brooks & Couldridge, 1999)。Pizzari和Foster(2008)综述了精子的“社交生活”(social life),揭示精子有时通过团队合作提高受精成功率。
Trevor Price的《鸟类物种形成》(2008)讨论了性选择与物种形成(第9-11章),Seddon等(2008)表明性选择促进了南美蚁鸟的物种形成。Kokko和Jennions(2009)综述了亲代投资与性选择的关系。
Richard Prum(1997)通过娇鹟(manakins,热带鸟类)雄性行为和羽色的系统发育分析,检验了不同性选择模型。
- Geoffrey Hill(1991)发现雌性家朱雀偏好更红的雄性(该颜色与类胡萝卜素摄入有关)。更红的雄性提供更好的亲代抚育(优质资源)。雌性是否也通过选择更红雄性获得“优良基因”?如何设计实验验证此假说?
- 同性性行为(same-sex sexual behaviour)在非人动物中广泛存在。如何解释此现象?如何验证假说?(参见Bailey & Zuk, 2009的综述)