第五单元 体液和肾脏:修订间差异
无编辑摘要 |
|||
| 第6行: | 第6行: | ||
=== 每日水分摄入 === | === 每日水分摄入 === | ||
水分通过两种主要来源添加到体内:(1) | 水分通过两种主要来源添加到体内:(1) 以液体或食物中的水分形式'''摄入''',通常每天向体液中添加约'''2100ml''';(2) 通过碳水化合物氧化在体内'''合成''',每天添加约'''200ml'''。这些机制提供了每天约'''2300ml'''的总水分摄入量(表25-1)。然而,不同人群甚至同一个人在不同日期的水分摄入量差异很大,这取决于气候、习惯和体力活动水平。 | ||
=== 每日体水损失 === | === 每日体水损失 === | ||
不显性失水(Insensible Water Loss)。一些水分损失无法精确调节。例如,人类通过呼吸道蒸发和皮肤扩散持续失水,在正常情况下,这两者合计每天失水约700ml。这种损失被称为不显性失水,因为我们没有意识地察觉到它,尽管它在所有活人中持续发生。 | '''不显性失水(Insensible Water Loss)'''。一些水分损失无法精确调节。例如,人类通过呼吸道蒸发和皮肤扩散持续失水,在正常情况下,这两者合计每天失水约700ml。这种损失被称为不显性失水,因为我们没有意识地察觉到它,尽管它在所有活人中持续发生。 | ||
通过皮肤的不显性失水与出汗无关,即使在没有汗腺的人中也存在;通过皮肤扩散的平均失水量约为每天300至400ml。这种损失通过皮肤中充满胆固醇的角质层最小化,该层提供了防止过度扩散损失的屏障。当角质层被剥脱时,如大面积烧伤时,蒸发速率可增加多达10倍,达到每天3至5L。因此,烧伤患者必须给予大量液体,通常通过静脉注射,以平衡液体损失。 | 通过皮肤的不显性失水与出汗无关,即使在没有汗腺的人中也存在;通过皮肤扩散的平均失水量约为每天300至400ml。这种损失通过皮肤中充满胆固醇的角质层最小化,该层提供了防止过度扩散损失的屏障。当角质层被剥脱时,如大面积烧伤时,蒸发速率可增加多达10倍,达到每天3至5L。因此,烧伤患者必须给予大量液体,通常通过静脉注射,以平衡液体损失。 | ||
| 第15行: | 第15行: | ||
通过呼吸道的不显性失水通常平均每天约300至400ml。当空气进入呼吸道时,它会被水分饱和,达到约47mmHg的蒸气压,然后被排出。由于吸入空气的蒸气压通常低于47mmHg,水分会通过呼吸持续从肺部损失。在寒冷天气中,大气蒸气压降至接近0,随着温度降低,肺部水分损失更大。这一过程解释了寒冷天气中呼吸道干燥的感觉。 | 通过呼吸道的不显性失水通常平均每天约300至400ml。当空气进入呼吸道时,它会被水分饱和,达到约47mmHg的蒸气压,然后被排出。由于吸入空气的蒸气压通常低于47mmHg,水分会通过呼吸持续从肺部损失。在寒冷天气中,大气蒸气压降至接近0,随着温度降低,肺部水分损失更大。这一过程解释了寒冷天气中呼吸道干燥的感觉。 | ||
'''汗液中的体液流失。'''通过汗液流失的水量变化很大,取决于体力活动和环境温度。正常情况下,汗液量约为100ml/天,但在非常炎热的天气或剧烈运动期间,汗液中的体液流失偶尔会增加到1到2升/小时。如果不通过激活口渴机制增加摄入量,这种体液流失会迅速耗尽体液,如第29章所述。 | |||
通过汗液流失的水量变化很大,取决于体力活动和环境温度。正常情况下,汗液量约为100ml/天,但在非常炎热的天气或剧烈运动期间,汗液中的体液流失偶尔会增加到1到2升/小时。如果不通过激活口渴机制增加摄入量,这种体液流失会迅速耗尽体液,如第29章所述。 | |||
'''粪便中的水分流失。'''正常情况下,粪便中仅流失少量水分(100ml/天)。在严重腹泻的人群中,这种流失可能增加到每天几升。因此,如果不在几天内纠正,严重腹泻可能危及生命。 | |||
正常情况下,粪便中仅流失少量水分(100ml/天)。在严重腹泻的人群中,这种流失可能增加到每天几升。因此,如果不在几天内纠正,严重腹泻可能危及生命。 | |||
'''肾脏的水分流失'''。体内剩余的水分流失发生在肾脏排泄的尿液中。多种机制控制尿液排泄速率。身体维持水分摄入和排出平衡以及体内大多数电解质摄入和排出平衡的最重要手段是通过控制肾脏排泄这些物质的速率。例如,脱水者的尿量可低至0.5L/天,而大量饮水者的尿量可高达20L/天。 | |||
{| class="wikitable" | |||
|+表25-1 每日水分摄入和排出量(ml/天) | |||
!摄入或排出 | |||
!正常 | |||
!长时间剧烈运动 | |||
|- | |||
|摄入液体 | |||
|2100 | |||
|? | |||
|- | |||
|代谢产生 | |||
|200 | |||
|200 | |||
|- | |||
|总摄入量 | |||
|2300 | |||
|? | |||
|- | |||
|不显性:皮肤 | |||
|350 | |||
|350 | |||
|- | |||
|不显性:肺 | |||
|350 | |||
|650 | |||
|- | |||
|汗液 | |||
|100 | |||
|5000 | |||
|- | |||
|粪便 | |||
|100 | |||
|100 | |||
|- | |||
|尿液 | |||
|1400 | |||
|500 | |||
|- | |||
|总排出量 | |||
|2300 | |||
|6600 | |||
|} | |||
这种摄入量的变化也适用于体内大多数电解质,如钠、氯和钾。在某些人中,钠摄入量可能低至20mEq/天,而在其他人中,钠摄入量可能高达300到500 mEq/天。肾脏的任务是调整水和电解质的排泄速率,以精确匹配这些物质的摄入量,并补偿在某些疾病状态下发生的体液和电解质的过度流失。在第26章至第32章中,我们将讨论使肾脏能够执行这些非凡任务的机制。 | 这种摄入量的变化也适用于体内大多数电解质,如钠、氯和钾。在某些人中,钠摄入量可能低至20mEq/天,而在其他人中,钠摄入量可能高达300到500 mEq/天。肾脏的任务是调整水和电解质的排泄速率,以精确匹配这些物质的摄入量,并补偿在某些疾病状态下发生的体液和电解质的过度流失。在第26章至第32章中,我们将讨论使肾脏能够执行这些非凡任务的机制。 | ||
== 体液分区 == | == 体液分区 == | ||
[[文件:GT-25.1.png|缩略图|图25-1. 体液调节的总结,包括主要的体液隔室(fluid compartments)和分隔这些隔室的膜。所示数值为一名平均体重70公斤的男性。]] | |||
总体液主要分布在两个分区之间,即'''细胞外液'''(extracellular fluid)和'''细胞内液'''(intracellular fluid)(图25-1)。细胞外液分为'''组织间液'''和'''血浆'''(blood plasma)。 | |||
还有另一个小的体液分区,称为'''细胞跨液'''(transcellular fluid)。这个分区包括<u>滑液、腹膜液、心包液和眼内液,以及脑脊液</u>;它通常被认为是一种特殊类型的细胞外液,尽管在某些情况下其成分可能与血浆或组织间液显著不同。所有细胞跨液加起来约为1到2升。 | |||
在一名体重70公斤的成年男性中,总体水(total body water)约占体重的60%,即约42升。这一比例取决于年龄、性别和肥胖程度。随着年龄的增长,体液占总体重的比例逐渐下降。这种下降部分是由于衰老通常伴随着体脂比例的增加,从而降低了体内水分的比例。 | 在一名体重70公斤的成年男性中,总体水(total body water)约占体重的60%,即约42升。这一比例取决于年龄、性别和肥胖程度。随着年龄的增长,体液占总体重的比例逐渐下降。这种下降部分是由于衰老通常伴随着体脂比例的增加,从而降低了体内水分的比例。 | ||
由于女性通常比男性有更高的体脂比例,她们的总体水平均约占体重的50%。在早产儿和新生儿中,总体水占体重的70%至75%。因此,在讨论平均体液隔室时,我们应该意识到存在因年龄、性别和体脂比例而异的差异。 | 由于女性通常比男性有更高的体脂比例,她们的总体水平均约占体重的50%。在早产儿和新生儿中,总体水占体重的70%至75%。因此,在讨论平均体液隔室时,我们应该意识到存在因年龄、性别和体脂比例而异的差异。 | ||
| 第43行: | 第76行: | ||
在许多其他国家,过去30年中平均体重(和脂肪量)迅速增加。在美国,20岁以上成年男性的平均体重估计约为88.8公斤(约196磅),成年女性为77.4公斤(约170磅)。因此,在本章及其他章节中讨论的关于平均体重70公斤男性的数据,在考虑大多数人的体液隔室时需要进行相应的调整。 | 在许多其他国家,过去30年中平均体重(和脂肪量)迅速增加。在美国,20岁以上成年男性的平均体重估计约为88.8公斤(约196磅),成年女性为77.4公斤(约170磅)。因此,在本章及其他章节中讨论的关于平均体重70公斤男性的数据,在考虑大多数人的体液隔室时需要进行相应的调整。 | ||
=== 细胞内液隔室 | === 细胞内液隔室 === | ||
体内42升液体中约有28升位于数万亿个细胞内,统称为细胞内液(intracellular fluid)。因此,细胞内液约占“平均”人体重的40%。 | 体内42升液体中约有28升位于数万亿个细胞内,统称为细胞内液(intracellular fluid)。因此,细胞内液约占“平均”人体重的40%。 | ||
每个细胞的液体含有其独特的成分混合物,但这些物质的浓度在不同细胞之间是相似的。事实上,细胞液体的组成非常相似,即使在不同的动物中,从最原始的微生物到人类都是如此。因此,所有不同细胞的细胞内液被视为一个大的液体隔室。 | 每个细胞的液体含有其独特的成分混合物,但这些物质的浓度在不同细胞之间是相似的。事实上,细胞液体的组成非常相似,即使在不同的动物中,从最原始的微生物到人类都是如此。因此,所有不同细胞的细胞内液被视为一个大的液体隔室。 | ||
=== 细胞外液隔室 | === 细胞外液隔室 === | ||
所有位于细胞外的液体统称为细胞外液(extracellular fluid)。这些液体合计约占体重的20% | 所有位于细胞外的液体统称为细胞外液(extracellular fluid)。这些液体合计约占体重的20%,即在一名体重70公斤的男性中约为14升。细胞外液的两个最大隔室是间质液,占细胞外液的四分之三以上(11升),以及血浆(plasma),占细胞外液的近四分之一,约3升。血浆是血液的非细胞部分;它通过毛细血管膜的孔隙与间质液持续交换物质。这些孔隙对细胞外液中的几乎所有溶质都具有高度通透性,除了蛋白质。因此,细胞外液不断混合,所以血浆和间质液的组成大致相同,除了蛋白质,其在血浆中的浓度较高。 | ||
=== 血容量 === | |||
血液包含细胞外液(extracellular fluid)(血浆中的液体)和细胞内液(intracellular fluid)(红细胞中的液体)。然而,血液被认为是一个独立的液体隔室,因为它被包含在自己的腔室中,即循环系统。血容量在心血管动力学的控制中尤为重要。 | 血液包含细胞外液(extracellular fluid)(血浆中的液体)和细胞内液(intracellular fluid)(红细胞中的液体)。然而,血液被认为是一个独立的液体隔室,因为它被包含在自己的腔室中,即循环系统。血容量在心血管动力学的控制中尤为重要。 | ||
| 第60行: | 第93行: | ||
在男性中,测量的血细胞比容通常约为0.40,而在女性中约为0.36。在严重贫血的患者中,血细胞比容可能低至0.10,这个值几乎不足以维持生命。相反,在某些情况下,患者会出现红细胞过度生成,导致红细胞增多症(polycythemia)。在这些患者中,血细胞比容可以上升到0.65。 | 在男性中,测量的血细胞比容通常约为0.40,而在女性中约为0.36。在严重贫血的患者中,血细胞比容可能低至0.10,这个值几乎不足以维持生命。相反,在某些情况下,患者会出现红细胞过度生成,导致红细胞增多症(polycythemia)。在这些患者中,血细胞比容可以上升到0.65。 | ||
== 细胞外液和细胞内液的组成 == | |||
[[文件:GT-25.2.png|缩略图|图25-2. 细胞内液和细胞外液的主要阳离子和阴离子。Ca++和Mg++的浓度表示这两种离子的总和。显示的浓度表示自由离子和络合离子的总和。]] | |||
细胞外液(包括血浆和组织间液)和细胞内液的组成比较如图25-2、25-3和表25-2所示。 | 细胞外液(包括血浆和组织间液)和细胞内液的组成比较如图25-2、25-3和表25-2所示。 | ||
[[文件:GT-25.3.png|缩略图|图25-3. 血浆中的非电解质]] | |||
{| class="wikitable" | |||
|+表25-2 细胞外液和细胞内液中的渗透物质 | |||
|物质 | |||
|血浆 (mOsm/L) | |||
|间质液 (mOsm/L) | |||
|细胞内液 (mOsm/L) | |||
|- | |||
|Na+ | |||
|142 | |||
|139 | |||
|14 | |||
|- | |||
|K+ | |||
|4.2 | |||
|4.0 | |||
|140 | |||
|- | |||
|Ca2+ | |||
|1.3 | |||
|1.2 | |||
|0 | |||
|- | |||
|Mg2+ | |||
|0.8 | |||
|0.7 | |||
|20 | |||
|- | |||
|CI- | |||
|106 | |||
|108 | |||
|4 | |||
|- | |||
|HCO3- | |||
|24 | |||
|28.3 | |||
|10 | |||
|- | |||
|HPO4-, H2PO4- | |||
|2 | |||
|2 | |||
|11 | |||
|- | |||
|SO4- | |||
|0.5 | |||
|0.5 | |||
|1 | |||
|- | |||
|磷酸肌酸 | |||
| | |||
| | |||
|45 | |||
|- | |||
|肌肽 | |||
| | |||
| | |||
|14 | |||
|- | |||
|氨基酸 | |||
|2 | |||
|2 | |||
|8 | |||
|- | |||
|肌酸 | |||
|0.2 | |||
|0.2 | |||
|6 | |||
|- | |||
|乳酸 | |||
|1.2 | |||
|1.2 | |||
|1.5 | |||
|- | |||
|腺苷 | |||
| | |||
| | |||
|5 | |||
|- | |||
|三磷酸腺苷 己糖 | |||
| | |||
| | |||
|3.7 | |||
|- | |||
|单磷酸葡萄糖 | |||
|5.6 | |||
|5.6 | |||
| | |||
|- | |||
|蛋白质 | |||
|1.2 | |||
|0.2 | |||
|4 | |||
|- | |||
|尿素 | |||
|4 | |||
|4 | |||
|4 | |||
|- | |||
|其他 | |||
|4.8 | |||
|3.9 | |||
|10 | |||
|- | |||
|总 mOsm/L 校正渗透压 | |||
|299.8 | |||
|300.8 | |||
|301.2 | |||
|- | |||
|活性 (mOsm/L) 总渗透压 | |||
|282.0 | |||
|281.0 | |||
|281.0 | |||
|- | |||
|37°C渗透压 (mm Hg) | |||
|5441 | |||
|5423 | |||
|5423 | |||
|} | |||
==== 血浆和组织间液的相似离子组成 ==== | ==== 血浆和组织间液的相似离子组成 ==== | ||
由于血浆和组织间液仅由高度通透的毛细血管膜分隔,它们的离子组成相似。这两个隔室之间最重要的区别是血浆中蛋白质的浓度较高;因为毛细血管对血浆蛋白的通透性较低,所以在大多数组织中只有少量蛋白质渗漏到组织间隙中。 | 由于血浆和组织间液仅由高度通透的毛细血管膜分隔,它们的离子组成相似。这两个隔室之间最重要的区别是血浆中蛋白质的浓度较高;因为毛细血管对血浆蛋白的通透性较低,所以在大多数组织中只有少量蛋白质渗漏到组织间隙中。 | ||
由于'''杜南效应(Donnan effect)''','''阳离子在血浆中的浓度略高于间质液(约2%)'''。血浆蛋白带有净负电荷,因此倾向于结合钠和钾离子等阳离子,从而在血浆中与血浆蛋白一起保留额外的阳离子。相反,'''阴离子在间质液中的浓度略高于血浆''',因为血浆蛋白的负电荷排斥带负电荷的阴离子。然而,<u>在实际应用中,间质液和血浆中的离子浓度被认为是近似相等的。</u> | |||
再次参考图25-2,可以看到细胞外液(包括血浆和间质液)含有大量的钠和氯离子以及相当数量的碳酸氢根离子,但只有少量的钾、钙、镁、磷酸根和有机酸离子。细胞外液的组成通过各种机制(尤其是肾脏)进行精细调节,这将在后面讨论。这种调节使细胞能够持续浸泡在含有适当浓度电解质和营养物质的液体中,以实现最佳的细胞功能。 | 再次参考图25-2,可以看到细胞外液(包括血浆和间质液)含有大量的钠和氯离子以及相当数量的碳酸氢根离子,但只有少量的钾、钙、镁、磷酸根和有机酸离子。细胞外液的组成通过各种机制(尤其是肾脏)进行精细调节,这将在后面讨论。这种调节使细胞能够持续浸泡在含有适当浓度电解质和营养物质的液体中,以实现最佳的细胞功能。 | ||
| 第83行: | 第227行: | ||
细胞内液(Intracellular fluid)与细胞外液(Extracellular fluid)被细胞膜隔开,细胞膜对水具有高度通透性,但对体内大多数电解质不通透。与细胞外液相比,细胞内液仅含有少量的钠离子和氯离子,几乎不含钙离子。相反,细胞内液含有大量的钾离子和磷酸根离子,以及适量的镁离子和硫酸根离子,这些物质在细胞外液中的浓度都很低。此外,细胞中含有大量的蛋白质——几乎是血浆中的四倍。 | 细胞内液(Intracellular fluid)与细胞外液(Extracellular fluid)被细胞膜隔开,细胞膜对水具有高度通透性,但对体内大多数电解质不通透。与细胞外液相比,细胞内液仅含有少量的钠离子和氯离子,几乎不含钙离子。相反,细胞内液含有大量的钾离子和磷酸根离子,以及适量的镁离子和硫酸根离子,这些物质在细胞外液中的浓度都很低。此外,细胞中含有大量的蛋白质——几乎是血浆中的四倍。 | ||
== 体液腔室体积的测量——指示剂稀释原理 == | |||
通过在腔室中放置指示剂物质,使其均匀分散在整个腔室的液体中,然后分析该物质的稀释程度,可以测量体内某个液体腔室的体积。图25-4展示了这种测量液体腔室体积的指示剂稀释方法。该方法基于质量守恒原理,即物质在液体腔室中分散后的总质量将与注入腔室的总质量相同。 | 通过在腔室中放置指示剂物质,使其均匀分散在整个腔室的液体中,然后分析该物质的稀释程度,可以测量体内某个液体腔室的体积。图25-4展示了这种测量液体腔室体积的指示剂稀释方法。该方法基于质量守恒原理,即物质在液体腔室中分散后的总质量将与注入腔室的总质量相同。 | ||
在图25-4所示的例子中,注射器中含有少量染料或其他物质被注入腔室,该物质被允许在腔室中分散,直到在所有区域达到相同的浓度。然后取出含有分散物质的液体样本,并通过化学、光电或其他方法分析其浓度。如果该物质没有从腔室中泄漏出去,腔室中物质的总质量(体积B × 浓度B)将等于注入物质的总质量(体积A × 浓度A)。通过简单的方程重排,可以计算出腔室B的未知体积如下: | 在图25-4所示的例子中,注射器中含有少量染料或其他物质被注入腔室,该物质被允许在腔室中分散,直到在所有区域达到相同的浓度。然后取出含有分散物质的液体样本,并通过化学、光电或其他方法分析其浓度。如果该物质没有从腔室中泄漏出去,腔室中物质的总质量(体积B × 浓度B)将等于注入物质的总质量(体积A × 浓度A)。通过简单的方程重排,可以计算出腔室B的未知体积如下: | ||
'''体积B = 体积A×浓度A / 浓度B''' | |||
体积B= | |||
在进行此计算时,需要知道以下信息:(1) 注入腔室中的物质总量(方程的分子);(2) 物质分散后腔室中液体的浓度(方程的分母)。 | 在进行此计算时,需要知道以下信息:(1) 注入腔室中的物质总量(方程的分子);(2) 物质分散后腔室中液体的浓度(方程的分母)。 | ||
| 第98行: | 第238行: | ||
例如,如果将1毫升含有10 mg/ml染料的溶液分散到腔室B中,并且腔室中的最终浓度为0.01mg/ml,则可以计算出腔室的未知体积如下: | 例如,如果将1毫升含有10 mg/ml染料的溶液分散到腔室B中,并且腔室中的最终浓度为0.01mg/ml,则可以计算出腔室的未知体积如下: | ||
'''体积B = 100ml''' | |||
体积B= | |||
只要满足以下条件,该方法可用于测量体内几乎任何腔室的体积:(1) 指示剂均匀分散在整个腔室中;(2) 指示剂仅分散在被测量的腔室中;(3) 指示剂不被代谢或排泄。如果指示剂被代谢或排泄,则必须对体内指示剂的损失进行校正。可以使用多种物质来测量不同体液的体积。 | 只要满足以下条件,该方法可用于测量体内几乎任何腔室的体积:(1) 指示剂均匀分散在整个腔室中;(2) 指示剂仅分散在被测量的腔室中;(3) 指示剂不被代谢或排泄。如果指示剂被代谢或排泄,则必须对体内指示剂的损失进行校正。可以使用多种物质来测量不同体液的体积。 | ||
=== 特定体液腔室体积的测定 === | |||
'''总体水量的测量'''。放射性水(氚)或重水(氘)可用于测量总体水量。这些形式的水在注入血液后几小时内与总体水混合,稀释原理可用于计算总体水量(表25-3)。另一种用于测量总体水的物质是安替比林(antipyrine),它具有很强的脂溶性,能迅速穿透细胞膜,并在细胞内和细胞外均匀分布。 | |||
{| class="wikitable" | |||
|+表25-3 体液体积的测量 | |||
!体积 | |||
表25-3 体液体积的测量 | !指示剂 | ||
|- | |||
|总体水 | |||
|重水,超重水, 安替比林 | |||
|- | |||
|细胞外液 | |||
|22Na,125I-碘他拉酸盐,硫代硫酸盐,菊粉 | |||
|- | |||
|细胞内液 | |||
|(计算为总体水减去细胞外液体积) | |||
|- | |||
|血浆体积 | |||
|125I-白蛋白,伊文思蓝染料(T-1824) | |||
= | |- | ||
|血液体积 | |||
|51Cr标记的红细胞,或计算为血液体积=血浆体积/(1-血细胞比容) | |||
|- | |||
|间质液 | |||
|计算为细胞外液体积减去血浆体积 | |||
|} | |||
'''细胞外液体积的测量。'''细胞外液的体积可以使用几种物质来估计,这些物质分散在血浆和间质液中,但不轻易穿透细胞膜。这些物质包括放射性钠、放射性氯、放射性碘他拉酸盐、硫代硫酸盐离子和菊粉。当这些物质中的任何一种注入血液后,通常会在30到60分钟内几乎完全分散到细胞外液中。然而,其中一些物质,如放射性钠,可能会少量扩散到细胞内。因此,人们经常使用钠空间或菊粉空间来代替真正的细胞外液体积的测量。 | |||
'''细胞内体积的计算。'''细胞内体积无法直接测量。然而,可以通过以下方式计算: | |||
'''细胞内体积 = 总体水 - 细胞外液体积''' | |||
'''血浆体积的测量。'''血浆体积可以使用一种不易穿透毛细血管膜但在注射后仍留在血管系统中的物质来测量。最常用的测量血浆体积的物质之一是放射性碘标记的血清白蛋白(125I-白蛋白)或与血浆蛋白强烈结合的染料,如伊文思蓝染料(也称为T-1824)。 | |||
'''间质液体积的计算。'''间质液体积无法直接测量,但可以通过以下方式计算: | |||
'''间质液体积 = 细胞外液体积 - 血浆体积''' | |||
'''血液体积的测量。'''如果使用前面描述的方法测量血细胞比容(血液总体积中细胞所占的比例)和血浆体积,则可以使用以下公式计算血液体积: | |||
'''血液总体积=血浆体积/1-血细胞比容''' | |||
例如,如果血浆体积为3升,血细胞比容为0.40,则血液总体积计算5L. | |||
另一种测量血容量的方法是向循环中注入标记有放射性物质的红细胞。这些红细胞在循环中混合后,可以测量混合血样的放射性,并使用指示剂稀释原理计算总血容量。一种可以用来标记红细胞的物质是放射性铬( | 另一种测量血容量的方法是向循环中注入标记有放射性物质的红细胞。这些红细胞在循环中混合后,可以测量混合血样的放射性,并使用指示剂稀释原理计算总血容量。一种可以用来标记红细胞的物质是放射性铬(51Cr),它与红细胞紧密结合。 | ||
== 细胞内液和细胞外液之间的液体交换和渗透平衡 == | == 细胞内液和细胞外液之间的液体交换和渗透平衡 == | ||
| 第162行: | 第301行: | ||
'''渗透压和渗透浓度'''。溶液的渗透压浓度在表示为每千克水的渗透摩尔数时称为渗透压(osmolality);在表示为每升溶液的渗透摩尔数时称为渗透浓度(osmolarity)。在像体液这样的稀溶液中,这两个术语几乎可以互换使用,因为差异很小。临床上使用的大多数计算以及接下来几章中表达的计算都是基于渗透浓度(osmolarity)而不是渗透压(osmolality)。 | '''渗透压和渗透浓度'''。溶液的渗透压浓度在表示为每千克水的渗透摩尔数时称为渗透压(osmolality);在表示为每升溶液的渗透摩尔数时称为渗透浓度(osmolarity)。在像体液这样的稀溶液中,这两个术语几乎可以互换使用,因为差异很小。临床上使用的大多数计算以及接下来几章中表达的计算都是基于渗透浓度(osmolarity)而不是渗透压(osmolality)。 | ||
'''溶液渗透压和渗透压的计算'''。利用范特霍夫定律(van't Hoff law),可以计算溶液的潜在渗透压(osmotic pressure),假设细胞膜对溶质(solute)是不可渗透的。例如,0.9% 氯化钠溶液的渗透压计算如下。0.9% 的溶液意味着每 100 毫升溶液中含有 0.9 克氯化钠,即 9g/L。由于氯化钠的分子量为 58.5g/mol_\cdot,因此溶液的摩尔浓度(molarity)为 9g/L 除以 58.5g/mol_,即约 0.154mol/L。由于每个氯化钠分子等于 2 个渗透摩尔(osmoles),因此溶液的渗透浓度(osmolarity)为 0.154×2,即 0.308Osm/L。因此,该溶液的渗透浓度为 308mOsm/L。因此,该溶液的潜在渗透压为 308mOsm/L×19.3mmHg/ mOsm/L,即 5944mmHg。 | |||
这个计算是一个近似值,因为钠离子和氯离子在溶液中由于离子间吸引力(interionic attraction)并不完全独立行为。可以通过使用称为渗透系数(osmotic coefficient)的校正因子来校正这些与范特霍夫定律预测的偏差。对于氯化钠,渗透系数约为 0.93。因此,0.9% 氯化钠溶液的实际渗透浓度为 308×0.93,即约 286 mOsm/L。出于实际原因,在确定生理溶液的渗透浓度和渗透压时,有时会忽略不同溶质的渗透系数。 | 这个计算是一个近似值,因为钠离子和氯离子在溶液中由于离子间吸引力(interionic attraction)并不完全独立行为。可以通过使用称为渗透系数(osmotic coefficient)的校正因子来校正这些与范特霍夫定律预测的偏差。对于氯化钠,渗透系数约为 0.93。因此,0.9% 氯化钠溶液的实际渗透浓度为 308×0.93,即约 286 mOsm/L。出于实际原因,在确定生理溶液的渗透浓度和渗透压时,有时会忽略不同溶质的渗透系数。 | ||
'''体液的渗透浓度。'''回顾表 25-2,注意血浆、组织间液和细胞内液(intracellular fluid)中各种渗透活性物质的近似渗透浓度。组织间液和血浆的总渗透浓度约 80% 是由钠离子和氯离子贡献的,而对于细胞内液,几乎一半的渗透浓度是由钾离子贡献的,其余部分则由许多其他细胞内物质分担。 | |||
回顾表 25- | |||
如表 25-2 所示,三个区室(compartments)的总渗透浓度均约为 300mOsm/L,其中血浆的渗透浓度比组织间液和细胞内液高约 1mOsm/L。血浆和组织间液之间的微小差异是由血浆蛋白的渗透效应引起的,这些蛋白在毛细血管中维持的压力比周围组织间隙高约 20mmHg,如第 16 章所述。 | 如表 25-2 所示,三个区室(compartments)的总渗透浓度均约为 300mOsm/L,其中血浆的渗透浓度比组织间液和细胞内液高约 1mOsm/L。血浆和组织间液之间的微小差异是由血浆蛋白的渗透效应引起的,这些蛋白在毛细血管中维持的压力比周围组织间隙高约 20mmHg,如第 16 章所述。 | ||
'''体液的校正渗透活性。'''表 25-2 的底部显示了血浆、组织间液和细胞内液的校正渗透活性(corrected osmolar activities)。这些校正的原因是阳离子和阴离子之间的离子间吸引力会导致溶解物质的渗透活性略有下降。 | |||
表 25-2 的底部显示了血浆、组织间液和细胞内液的校正渗透活性(corrected osmolar activities)。这些校正的原因是阳离子和阴离子之间的离子间吸引力会导致溶解物质的渗透活性略有下降。 | |||
=== 细胞内液和细胞外液之间的渗透平衡 === | ==== 细胞内液和细胞外液之间的渗透平衡 ==== | ||
细胞膜两侧可以产生高渗透压(high osmotic pressure),而细胞外液(extracellular fluid)中溶质浓度的相对较小变化即可导致这种高渗透压。如前所述,对于每一种不可渗透溶质(impermeant solute)(即不能透过细胞膜的溶质)的每毫渗透压摩尔浓度梯度,细胞膜两侧会产生约19.3mmHg的渗透压。如果细胞膜暴露在纯水中,且细胞内液(intracellular fluid)的渗透压为282 mOsm/L,则细胞膜两侧可能产生的潜在渗透压将超过5400mmHg。这表明,当细胞内液和细胞外液未达到渗透平衡时,可以驱动水穿过细胞膜的巨大力量。由于这些力量的作用,细胞外液中不可渗透溶质浓度的相对较小变化可能导致细胞体积的显著变化。 | 细胞膜两侧可以产生高渗透压(high osmotic pressure),而细胞外液(extracellular fluid)中溶质浓度的相对较小变化即可导致这种高渗透压。如前所述,对于每一种不可渗透溶质(impermeant solute)(即不能透过细胞膜的溶质)的每毫渗透压摩尔浓度梯度,细胞膜两侧会产生约19.3mmHg的渗透压。如果细胞膜暴露在纯水中,且细胞内液(intracellular fluid)的渗透压为282 mOsm/L,则细胞膜两侧可能产生的潜在渗透压将超过5400mmHg。这表明,当细胞内液和细胞外液未达到渗透平衡时,可以驱动水穿过细胞膜的巨大力量。由于这些力量的作用,细胞外液中不可渗透溶质浓度的相对较小变化可能导致细胞体积的显著变化。 | ||
| 第267行: | 第403行: | ||
ADH, 抗利尿激素; SIADH, 抗利尿激素分泌异常综合征。 | ADH, 抗利尿激素; SIADH, 抗利尿激素分泌异常综合征。 | ||
图25-7. 低钠血症(hyponatremia)期间的脑细胞体积调节。在急性低钠血症期间,由于N a | 图25-7. 低钠血症(hyponatremia)期间的脑细胞体积调节。在急性低钠血症期间,由于N a+的丢失或\sf H_2\sf O的过量,H_2O会扩散进入细胞(1),导致脑组织肿胀(由虚线表示)。这一过程刺激了N a+、K+和有机溶质从细胞中运出(2),随后导致水从细胞中扩散出来(3)。在慢性低钠血症中,通过溶质从细胞中运出,脑肿胀得以减轻。 | ||
低钠血症是临床实践中最常见的电解质紊乱,可能发生在高达15%至25%的住院患者中。 | 低钠血症是临床实践中最常见的电解质紊乱,可能发生在高达15%至25%的住院患者中。 | ||
| 第377行: | 第513行: | ||
蛋白聚糖(proteoglycan)细丝与细胞间隙中更大的胶原纤维(collagen fibrils)一起,充当细胞之间的间隔物。营养物质和离子不易通过细胞膜扩散;因此,如果细胞之间没有足够的间距,这些营养物质、电解质和细胞废物就无法在毛细血管和相距较远的细胞之间快速交换。 | 蛋白聚糖(proteoglycan)细丝与细胞间隙中更大的胶原纤维(collagen fibrils)一起,充当细胞之间的间隔物。营养物质和离子不易通过细胞膜扩散;因此,如果细胞之间没有足够的间距,这些营养物质、电解质和细胞废物就无法在毛细血管和相距较远的细胞之间快速交换。 | ||
蛋白聚糖细丝还能防止液体在组织间隙中流动过于容易。如果没有蛋白聚糖细丝,一个人站立的简单动作就会导致大量组织间液从上半身流向下半身。当过多的液体积聚在组织间隙中时,如水肿(edema)时,这些额外的液体会形成大的通道,使液体容易通过组织间隙流动。因此,当腿部发生严重水肿时,通常只需抬高腿部即可减少水肿液。 | |||
尽管在紧密排列的蛋白聚糖细丝存在下,液体不易通过组织流动,但液体中的不同物质在组织中扩散的容易程度至少可以达到正常扩散的95%。因此,营养物质向细胞的正常扩散和废物从细胞的清除不会受到组织间隙中蛋白聚糖细丝的影响。 | 尽管在紧密排列的蛋白聚糖细丝存在下,液体不易通过组织流动,但液体中的不同物质在组织中扩散的容易程度至少可以达到正常扩散的95%。因此,营养物质向细胞的正常扩散和废物从细胞的清除不会受到组织间隙中蛋白聚糖细丝的影响。 | ||
| 第412行: | 第548行: | ||
其他潜在空间,如胸膜腔、心包腔和关节腔,在全身性水肿存在时可能会严重肿胀。此外,任何一个腔体的损伤或局部感染通常会阻塞淋巴引流,导致腔体中的孤立性肿胀。 | 其他潜在空间,如胸膜腔、心包腔和关节腔,在全身性水肿存在时可能会严重肿胀。此外,任何一个腔体的损伤或局部感染通常会阻塞淋巴引流,导致腔体中的孤立性肿胀。 | ||
第39章详细讨论了胸膜腔中液体交换的动力学。这些动力学主要代表了所有其他潜在空间的情况。在非水肿状态下,大多数或所有潜在空间中的正常液体压力是负的,就像在松散的皮下组织中这种压力是负的(低于大气压)一样。例如,胸膜腔中的间质液静水压力通常约为-7到-8mmHg,关节腔中为 | 第39章详细讨论了胸膜腔中液体交换的动力学。这些动力学主要代表了所有其他潜在空间的情况。在非水肿状态下,大多数或所有潜在空间中的正常液体压力是负的,就像在松散的皮下组织中这种压力是负的(低于大气压)一样。例如,胸膜腔中的间质液静水压力通常约为-7到-8mmHg,关节腔中为-3到-5mmHg,心包腔中为-5到-6mmHg。 | ||
= 26-泌尿系统:肾脏的功能解剖与尿液形成 = | = 26-泌尿系统:肾脏的功能解剖与尿液形成 = | ||
| 第575行: | 第711行: | ||
不同物质在尿液中的排泄率代表了三个肾脏过程的总和,如图26-9所示:(1) 血液中物质的肾小球滤过;(2) 物质从肾小管重吸收回血液;(3) 物质从血液分泌到肾小管中,如下所示: | 不同物质在尿液中的排泄率代表了三个肾脏过程的总和,如图26-9所示:(1) 血液中物质的肾小球滤过;(2) 物质从肾小管重吸收回血液;(3) 物质从血液分泌到肾小管中,如下所示: | ||
尿液排泄率 = 滤过率 − 重吸收率 | 尿液排泄率 = 滤过率 − 重吸收率 + 分泌率 | ||
尿液的形成始于大量几乎不含蛋白质的液体从肾小球毛细血管滤过到鲍曼囊中。血浆中的大多数物质(除蛋白质外)都可以自由滤过,因此它们在鲍曼囊中的肾小球滤液中的浓度几乎与血浆中的浓度相同。当滤过的液体离开鲍曼囊并通过肾小管时,它会被水和特定溶质重吸收回血液或通过管周毛细血管分泌其他物质到肾小管中而改变。 | 尿液的形成始于大量几乎不含蛋白质的液体从肾小球毛细血管滤过到鲍曼囊中。血浆中的大多数物质(除蛋白质外)都可以自由滤过,因此它们在鲍曼囊中的肾小球滤液中的浓度几乎与血浆中的浓度相同。当滤过的液体离开鲍曼囊并通过肾小管时,它会被水和特定溶质重吸收回血液或通过管周毛细血管分泌其他物质到肾小管中而改变。 | ||
| 第614行: | 第750行: | ||
=== 肾小球滤过率约为肾血浆流量的20% === | === 肾小球滤过率约为肾血浆流量的20% === | ||
与其他毛细血管类似,肾小球毛细血管过滤液体的速率由以下因素决定:(1) 作用于毛细血管膜的静水压和胶体渗透压的平衡;(2) 毛细血管滤过系数(K_f),即毛细血管的渗透性和过滤表面积的乘积。由于肾小球静水压高且\operatornameK_\operatornamef | 与其他毛细血管类似,肾小球毛细血管过滤液体的速率由以下因素决定:(1) 作用于毛细血管膜的静水压和胶体渗透压的平衡;(2) 毛细血管滤过系数(K_f),即毛细血管的渗透性和过滤表面积的乘积。由于肾小球静水压高且\operatornameK_\operatornamef*大,肾小球毛细血管的滤过速率远高于大多数其他毛细血管。在普通成年人中,GFR约为125ml/min.,或180L/day.。被过滤的肾血浆流量的比例(滤过分数)平均约为0.2,这意味着流经肾脏的血浆中约有20%通过肾小球毛细血管被过滤(图27-1)。滤过分数计算如下: | ||
==== 滤过分数 = GFR/肾血浆流量 ==== | ==== 滤过分数 = GFR/肾血浆流量 ==== | ||
| 第654行: | 第790行: | ||
图27-4. 导致肾小球毛细血管滤过的力的总结。所示值为健康人的估计值。 | 图27-4. 导致肾小球毛细血管滤过的力的总结。所示值为健康人的估计值。 | ||
==== G F R=K_f×N | ==== G F R=K_f×N e1 t filtration pressure ==== | ||
净滤过压表示促进或阻碍肾小球毛细血管滤过的水静压和胶体渗透压的总和(图27-4)。这些力包括:(1) 肾小球毛细血管内的水静压(肾小球水静压,P_G),促进滤过;(2) 肾小囊(Bowman’s capsule)外的水静压(\left(P_B\right)),阻碍滤过;(3) 肾小球毛细血管血浆蛋白的胶体渗透压(\left(\pi_G\right)),阻碍滤过;(4) 肾小囊内蛋白质的胶体渗透压((\uppi_B)),促进滤过。在正常情况下,肾小球滤液中的蛋白质浓度非常低,因此肾小囊液的胶体渗透压被认为是零。 | 净滤过压表示促进或阻碍肾小球毛细血管滤过的水静压和胶体渗透压的总和(图27-4)。这些力包括:(1) 肾小球毛细血管内的水静压(肾小球水静压,P_G),促进滤过;(2) 肾小囊(Bowman’s capsule)外的水静压(\left(P_B\right)),阻碍滤过;(3) 肾小球毛细血管血浆蛋白的胶体渗透压(\left(\pi_G\right)),阻碍滤过;(4) 肾小囊内蛋白质的胶体渗透压((\uppi_B)),促进滤过。在正常情况下,肾小球滤液中的蛋白质浓度非常低,因此肾小囊液的胶体渗透压被认为是零。 | ||
因此,GFR可以表示为: | 因此,GFR可以表示为: | ||
G F R=K_f×(P_G-P_B-\pi_G+\pi_B) | G F R=K_f×(P_G-P_B-\pi_G+\pi_B) | ||
尽管GFR决定因素的正常值尚未在人类中直接测量,但已在狗和大鼠等动物中进行了估计。根据实验动物的结果,人类中促进和阻碍肾小球滤过的近似正常力被认为如下(见图27-4): | 尽管GFR决定因素的正常值尚未在人类中直接测量,但已在狗和大鼠等动物中进行了估计。根据实验动物的结果,人类中促进和阻碍肾小球滤过的近似正常力被认为如下(见图27-4): | ||
| 第679行: | 第813行: | ||
K_f是肾小球毛细血管的水力传导性和表面积的乘积的度量。K_f不能直接测量,但可以通过将GFR除以净滤过压来实验估计: | K_f是肾小球毛细血管的水力传导性和表面积的乘积的度量。K_f不能直接测量,但可以通过将GFR除以净滤过压来实验估计: | ||
K_f=G F R/N e tf l t r a t i o n p r e s s u r e | K_f=G F R/N e tf l t r a t i o n p r e s s u r e | ||
因为双肾的总GFR约为125 ml/min,净滤过压为10mmHg,所以正常K_f计算为约12.5ml/min每毫米Hg滤过压。当K_f以每100克肾脏重量表示时,平均约为4.2ml/min每毫米Hg,这一值约为身体其他大多数毛细血管系统的K_f的400倍。身体许多其他组织的平均K_f仅为约0.01 ml/min每毫米Hg/100g。肾小球毛细血管的高K_f有助于其快速的液体滤过率。 | 因为双肾的总GFR约为125 ml/min,净滤过压为10mmHg,所以正常K_f计算为约12.5ml/min每毫米Hg滤过压。当K_f以每100克肾脏重量表示时,平均约为4.2ml/min每毫米Hg,这一值约为身体其他大多数毛细血管系统的K_f的400倍。身体许多其他组织的平均K_f仅为约0.01 ml/min每毫米Hg/100g。肾小球毛细血管的高K_f有助于其快速的液体滤过率。 | ||
| 第880行: | 第1,012行: | ||
=== 主动运输 (Active Transport) === | === 主动运输 (Active Transport) === | ||
主动运输可以将溶质逆电化学梯度移动;这需要来自代谢的能量。直接与能量源(如三磷酸腺苷 (ATP) 的水解)耦合的运输称为初级主动运输 (primary active transport)。这种机制的一个例子是钠钾三磷酸腺苷酶 (ATPase) 泵(Na | 主动运输可以将溶质逆电化学梯度移动;这需要来自代谢的能量。直接与能量源(如三磷酸腺苷 (ATP) 的水解)耦合的运输称为初级主动运输 (primary active transport)。这种机制的一个例子是钠钾三磷酸腺苷酶 (ATPase) 泵(Na+-K+ ATPase 泵),它在肾小管的大部分区域发挥作用。间接与能量源(如离子梯度)耦合的运输称为次级主动运输 (secondary active transport)。肾小管对葡萄糖的重吸收是次级主动运输的一个例子。尽管溶质可以通过主动和/或被动机制被肾小管重吸收,但水总是通过渗透过程被动地穿过肾小管上皮膜被重吸收。 | ||
'''溶质可以通过上皮细胞或细胞间运输。'''肾小管细胞与其他上皮细胞一样,通过紧密连接 (tight junctions) 结合在一起。紧密连接后面的侧向细胞间隙 (lateral intercellular spaces) 将肾小管的上皮细胞分开。溶质可以通过跨细胞途径 (transcellular pathway) 穿过细胞重吸收或分泌,或通过旁细胞途径 (paracellular pathway) 穿过紧密连接和细胞间隙在细胞间运输。钠是一种通过两种途径移动的物质,尽管大部分钠通过跨细胞途径运输。在某些肾单位段,特别是近端小管,水也通过旁细胞途径重吸收,溶解在水中的物质,特别是钾、镁和氯离子,随着重吸收的液体在细胞间运输。 | '''溶质可以通过上皮细胞或细胞间运输。'''肾小管细胞与其他上皮细胞一样,通过紧密连接 (tight junctions) 结合在一起。紧密连接后面的侧向细胞间隙 (lateral intercellular spaces) 将肾小管的上皮细胞分开。溶质可以通过跨细胞途径 (transcellular pathway) 穿过细胞重吸收或分泌,或通过旁细胞途径 (paracellular pathway) 穿过紧密连接和细胞间隙在细胞间运输。钠是一种通过两种途径移动的物质,尽管大部分钠通过跨细胞途径运输。在某些肾单位段,特别是近端小管,水也通过旁细胞途径重吸收,溶解在水中的物质,特别是钾、镁和氯离子,随着重吸收的液体在细胞间运输。 | ||
'''通过管状膜与ATPase水解相关的主要主动转运(primary active transport)。'''主要主动转运的特殊重要性在于它能够逆电化学梯度移动溶质。这种主动转运的能量来自于通过膜结合ATP酶(ATPase)水解ATP,ATP酶也是结合并移动溶质穿过细胞膜的载体机制的一个组成部分。已知肾脏中的主要主动转运体包括N a | '''通过管状膜与ATPase水解相关的主要主动转运(primary active transport)。'''主要主动转运的特殊重要性在于它能够逆电化学梯度移动溶质。这种主动转运的能量来自于通过膜结合ATP酶(ATPase)水解ATP,ATP酶也是结合并移动溶质穿过细胞膜的载体机制的一个组成部分。已知肾脏中的主要主动转运体包括N a+-K+ ATP酶、氢ATP酶、氢钾ATP酶和钙ATP酶。 | ||
主要主动转运系统的一个很好的例子是钠离子跨近端小管膜的重吸收,如图28-2所示。在小管上皮细胞的基底外侧,细胞膜具有广泛的Na | 主要主动转运系统的一个很好的例子是钠离子跨近端小管膜的重吸收,如图28-2所示。在小管上皮细胞的基底外侧,细胞膜具有广泛的Na+-K+ ATP酶系统,该系统水解ATP并利用释放的能量将钠离子从细胞转运到间质中。同时,钾从间质转运到细胞内。这种离子泵的运作维持了细胞内低钠和高钾的浓度,并在细胞内产生了约-70毫伏的净负电荷。这种钠离子从细胞跨基底外侧膜主动泵出有利于钠离子从管腔膜被动扩散进入细胞,原因有二:(1) 由于细胞内钠浓度低((12mEq/L))而管腔液钠浓度高((140mEq/L)),存在有利于钠扩散进入细胞的浓度梯度;(2) 细胞内-70毫伏的负电位吸引管腔中的正钠离子进入细胞。 | ||
图28-2 钠离子通过小管上皮细胞主动转运的基本机制。钠钾泵将钠从细胞内部跨基底外侧膜转运出去,产生低细胞内钠浓度和负的细胞内电位。低细胞内钠浓度和负电位导致钠离子从管腔通过刷状缘扩散进入细胞。 | 图28-2 钠离子通过小管上皮细胞主动转运的基本机制。钠钾泵将钠从细胞内部跨基底外侧膜转运出去,产生低细胞内钠浓度和负的细胞内电位。低细胞内钠浓度和负电位导致钠离子从管腔通过刷状缘扩散进入细胞。 | ||
Na | Na+-K+ ATP酶的主动重吸收发生在小管的大部分区域。在肾单位的某些部分,还有额外的机制将大量钠离子移入细胞。在近端小管中,膜管腔侧(面向管腔的一侧)有广泛的刷状缘,使表面积增加了约20倍。还有载体蛋白在膜的管腔表面结合钠离子并在细胞内释放它们,提供钠通过膜进入细胞的易化扩散(facilitated diffusion)。这些钠载体蛋白对于其他物质(如葡萄糖和氨基酸)的次级主动转运(secondary active transport)也很重要,这将在后面讨论。 | ||
因此,钠离子从管腔重吸收回血液的净过程至少涉及三个步骤: | 因此,钠离子从管腔重吸收回血液的净过程至少涉及三个步骤: | ||
# 钠离子通过管腔膜(也称为顶膜)沿着由基底外侧膜上的Na | # 钠离子通过管腔膜(也称为顶膜)沿着由基底外侧膜上的Na+-K+ ATPase泵建立的电化学梯度扩散进入细胞。 | ||
# 钠离子通过基底外侧膜上的Na | # 钠离子通过基底外侧膜上的Na+-K+ ATPase泵逆着电化学梯度被转运。 | ||
# 钠、水和其他物质通过超滤从间质液被重吸收到管周毛细血管中,这是一个由静水压和胶体渗透压梯度驱动的被动过程。 | # 钠、水和其他物质通过超滤从间质液被重吸收到管周毛细血管中,这是一个由静水压和胶体渗透压梯度驱动的被动过程。 | ||
| 第904行: | 第1,036行: | ||
钠葡萄糖共转运蛋白(SGLT2和SGLT1)位于近端小管细胞的刷状缘上,并逆着浓度梯度将葡萄糖携带到细胞质中,如前所述。大约90%的滤过葡萄糖由近端小管早期部分(S1段)的SGLT2重吸收,剩余的10%由近端小管后段(S3段)的SGLT1转运。在膜的基底外侧,葡萄糖在葡萄糖转运蛋白的帮助下从细胞扩散到间质空间——S1段中的GLUT2和近端小管后段(S3段)中的GLUT1。 | 钠葡萄糖共转运蛋白(SGLT2和SGLT1)位于近端小管细胞的刷状缘上,并逆着浓度梯度将葡萄糖携带到细胞质中,如前所述。大约90%的滤过葡萄糖由近端小管早期部分(S1段)的SGLT2重吸收,剩余的10%由近端小管后段(S3段)的SGLT1转运。在膜的基底外侧,葡萄糖在葡萄糖转运蛋白的帮助下从细胞扩散到间质空间——S1段中的GLUT2和近端小管后段(S3段)中的GLUT1。 | ||
尽管葡萄糖逆着化学梯度的转运不直接使用ATP,但葡萄糖的重吸收依赖于基底外侧膜中初级主动Na | 尽管葡萄糖逆着化学梯度的转运不直接使用ATP,但葡萄糖的重吸收依赖于基底外侧膜中初级主动Na+ - K+ ATPase泵消耗的能量。由于该泵的活动,维持了钠通过管腔膜易化扩散的电化学梯度,正是钠向细胞内下坡扩散提供了葡萄糖逆着管腔膜上坡转运的能量。因此,葡萄糖的这种重吸收被称为次级主动转运,因为葡萄糖本身是逆着化学梯度重吸收的,但它是在钠的初级主动转运之后进行的。 | ||
图28-3 次级主动转运的机制。上方的细胞显示了葡萄糖和氨基酸与钠离子一起通过肾小管上皮细胞的顶膜侧进行共转运(co-transport),随后通过基底外侧膜进行易化扩散(facilitated diffusion)。下方的细胞显示了氢离子从细胞内部跨过顶膜进入肾小管腔的反向转运(counter-transport);钠离子顺电化学梯度进入细胞,基底外侧膜上的钠钾泵(sodium-potassium pump)建立了这一梯度,为氢离子从细胞内转运到肾小管腔提供了能量。ATP,三磷酸腺苷(Adenosine triphosphate);GLUT,葡萄糖转运蛋白(glucose transporter);NHE,钠氢交换体(sodium-hydrogen exchanger);SGLT,钠葡萄糖共转运蛋白(sodium-glucose co-transporter)。 | 图28-3 次级主动转运的机制。上方的细胞显示了葡萄糖和氨基酸与钠离子一起通过肾小管上皮细胞的顶膜侧进行共转运(co-transport),随后通过基底外侧膜进行易化扩散(facilitated diffusion)。下方的细胞显示了氢离子从细胞内部跨过顶膜进入肾小管腔的反向转运(counter-transport);钠离子顺电化学梯度进入细胞,基底外侧膜上的钠钾泵(sodium-potassium pump)建立了这一梯度,为氢离子从细胞内转运到肾小管腔提供了能量。ATP,三磷酸腺苷(Adenosine triphosphate);GLUT,葡萄糖转运蛋白(glucose transporter);NHE,钠氢交换体(sodium-hydrogen exchanger);SGLT,钠葡萄糖共转运蛋白(sodium-glucose co-transporter)。 | ||
| 第914行: | 第1,046行: | ||
图28-3中显示的反向转运的一个例子是氢离子的主动分泌与近端小管管腔膜中钠离子的重吸收相耦合。在这种情况下,钠离子进入细胞与氢离子从细胞中排出通过钠氢反向转运(sodium-hydrogen counter-transport)相耦合。这种转运由管腔膜刷状缘(brush border)中的一种特定蛋白质(钠氢交换体)介导。当钠离子被携带到细胞内部时,氢离子被迫向相反方向进入肾小管腔。初级和次级主动转运的基本原理在第4章中讨论。 | 图28-3中显示的反向转运的一个例子是氢离子的主动分泌与近端小管管腔膜中钠离子的重吸收相耦合。在这种情况下,钠离子进入细胞与氢离子从细胞中排出通过钠氢反向转运(sodium-hydrogen counter-transport)相耦合。这种转运由管腔膜刷状缘(brush border)中的一种特定蛋白质(钠氢交换体)介导。当钠离子被携带到细胞内部时,氢离子被迫向相反方向进入肾小管腔。初级和次级主动转运的基本原理在第4章中讨论。 | ||
'''胞饮作用(Pinocytosis)是蛋白质重吸收的主动转运机制'''。肾小管的一些部分,特别是近端小管,通过胞饮作用(一种内吞作用(endocytosis))重吸收大分子如蛋白质。在这个过程中,蛋白质附着在管腔膜的刷状缘上,然后这部分膜向内凹陷,直到完全掐断并形成一个含有蛋白质的囊泡(vesicle) | '''胞饮作用(Pinocytosis)是蛋白质重吸收的主动转运机制'''。肾小管的一些部分,特别是近端小管,通过胞饮作用(一种内吞作用(endocytosis))重吸收大分子如蛋白质。在这个过程中,蛋白质附着在管腔膜的刷状缘上,然后这部分膜向内凹陷,直到完全掐断并形成一个含有蛋白质的囊泡(vesicle)。一旦进入细胞,蛋白质被消化成其组成的氨基酸,这些氨基酸通过基底外侧膜重吸收进入间质液。由于胞饮作用需要能量,因此它被认为是一种主动转运形式。 | ||
=== 主动重吸收物质的转运最大值 (Transport Maximum for Substances That Are Actively Reabsorbed) === | === 主动重吸收物质的转运最大值 (Transport Maximum for Substances That Are Actively Reabsorbed) === | ||
| 第945行: | 第1,077行: | ||
这种类型的转运被称为梯度-时间转运 (gradient-time transport),因为转运速率取决于电化学梯度和物质在管腔内的停留时间,而后者又取决于管腔流速。 | 这种类型的转运被称为梯度-时间转运 (gradient-time transport),因为转运速率取决于电化学梯度和物质在管腔内的停留时间,而后者又取决于管腔流速。 | ||
梯度-时间转运的一个例子是近端小管中的钠重吸收,其中基底外侧的Na | 梯度-时间转运的一个例子是近端小管中的钠重吸收,其中基底外侧的Na+-K+ ATPase泵的最大转运能力通常远高于实际的净钠重吸收速率,因为大量从细胞转运出去的钠通过上皮细胞的连接处泄漏回管腔。这种回漏速率取决于: | ||
# 紧密连接的通透性 (permeability); | # 紧密连接的通透性 (permeability); | ||
| 第963行: | 第1,095行: | ||
在肾单位(nephron)的远端部分,从亨利氏袢(loop of Henle)开始并延伸到集合管(collecting tubule),紧密连接对水和溶质的通透性大大降低,上皮细胞的膜表面积也显著减少。因此,水不能轻易通过渗透作用穿过肾小管膜的紧密连接。然而,抗利尿激素(antidiuretic hormone, ADH)大大增加了远端小管和集合管的水通透性。 | 在肾单位(nephron)的远端部分,从亨利氏袢(loop of Henle)开始并延伸到集合管(collecting tubule),紧密连接对水和溶质的通透性大大降低,上皮细胞的膜表面积也显著减少。因此,水不能轻易通过渗透作用穿过肾小管膜的紧密连接。然而,抗利尿激素(antidiuretic hormone, ADH)大大增加了远端小管和集合管的水通透性。 | ||
因此,只有当膜对水具有通透性时,水才能穿过肾小管上皮细胞,无论渗透梯度有多大。在近端小管和亨利氏袢的降支(descending loop of Henle) | 因此,只有当膜对水具有通透性时,水才能穿过肾小管上皮细胞,无论渗透梯度有多大。在近端小管和亨利氏袢的降支(descending loop of Henle),水通透性总是很高,水迅速被重吸收以达到与周围间质液的渗透平衡(osmotic equilibrium)。这种高通透性是由于水通道蛋白-1(aquaporin-1, AQP-1)在管腔膜(luminal membrane)和基底外侧膜(basolateral membrane)中的丰富表达。在亨利氏袢的升支(ascending loop of Henle),水通透性总是很低,因此尽管存在大的渗透梯度,几乎没有水被重吸收。在肾小管的最后部分——远端小管(distal tubule)、集合管和集合管(collecting ducts)——水通透性通过水通道蛋白发生,并且可以高或低,取决于ADH的存在与否。 | ||
==== 氯、尿素和其他溶质通过被动扩散的重吸收 ==== | ==== 氯、尿素和其他溶质通过被动扩散的重吸收 ==== | ||
| 第986行: | 第1,118行: | ||
近端小管具有高容量的主动和被动重吸收能力。近端小管的高重吸收能力源于其特殊的细胞特征,如图28-6所示。近端小管上皮细胞具有高度的代谢活性,并拥有大量线粒体以支持强大的主动转运过程。此外,近端小管细胞在膜的腔面(顶端)具有广泛的刷状缘,以及广泛的细胞间和基底通道网络,所有这些共同提供了上皮腔面和基底外侧面的广泛膜表面积,以便快速转运钠离子和其他物质。 | 近端小管具有高容量的主动和被动重吸收能力。近端小管的高重吸收能力源于其特殊的细胞特征,如图28-6所示。近端小管上皮细胞具有高度的代谢活性,并拥有大量线粒体以支持强大的主动转运过程。此外,近端小管细胞在膜的腔面(顶端)具有广泛的刷状缘,以及广泛的细胞间和基底通道网络,所有这些共同提供了上皮腔面和基底外侧面的广泛膜表面积,以便快速转运钠离子和其他物质。 | ||
上皮刷状缘的广泛膜表面还富含蛋白质载体分子,这些分子通过共转运机制将大部分钠离子跨过腔面膜转运,并与多种有机营养物质(如氨基酸和葡萄糖)相连。额外的钠通过反向转运机制从肾小管腔进入细胞,这些机制在重吸收钠的同时将其他物质(尤其是氢离子)分泌到肾小管腔中。如第31章所述,将氢离子分泌到肾小管腔中是去除肾小管中碳酸氢根离子的重要步骤(通过将\Hat与HCO_3 | 上皮刷状缘的广泛膜表面还富含蛋白质载体分子,这些分子通过共转运机制将大部分钠离子跨过腔面膜转运,并与多种有机营养物质(如氨基酸和葡萄糖)相连。额外的钠通过反向转运机制从肾小管腔进入细胞,这些机制在重吸收钠的同时将其他物质(尤其是氢离子)分泌到肾小管腔中。如第31章所述,将氢离子分泌到肾小管腔中是去除肾小管中碳酸氢根离子的重要步骤(通过将\Hat与HCO_3-结合形成H_2CO_3,然后解离为H_2O和CO_2)。 | ||
尽管Na | 尽管Na+-K+ ATPase泵为整个近端小管中钠、氯和水的重吸收提供了主要动力,但在钠和氯通过近端小管膜早期和晚期部分的腔面转运机制上存在一些差异。 | ||
在近端小管(proximal tubule)的前半段,钠与葡萄糖、氨基酸和其他溶质一起通过共转运(co-transport)被重吸收。然而,在近端小管的后半段,几乎没有葡萄糖和氨基酸剩余可供重吸收。相反,钠现在主要与氯离子一起被重吸收。与近端小管前半段相比,近端小管后半段的氯离子浓度相对较高(约40 mEq/L),因为在近端小管前半段,当钠被重吸收时,它优先携带葡萄糖、碳酸氢盐和有机离子,留下一个氯离子浓度较高的溶液。在近端小管的后半段,较高的氯离子浓度有利于该离子从小管腔通过细胞间连接扩散到肾间质液中。少量的氯离子也可能通过近端小管细胞膜上的特定氯离子通道被重吸收。 | 在近端小管(proximal tubule)的前半段,钠与葡萄糖、氨基酸和其他溶质一起通过共转运(co-transport)被重吸收。然而,在近端小管的后半段,几乎没有葡萄糖和氨基酸剩余可供重吸收。相反,钠现在主要与氯离子一起被重吸收。与近端小管前半段相比,近端小管后半段的氯离子浓度相对较高(约40 mEq/L),因为在近端小管前半段,当钠被重吸收时,它优先携带葡萄糖、碳酸氢盐和有机离子,留下一个氯离子浓度较高的溶液。在近端小管的后半段,较高的氯离子浓度有利于该离子从小管腔通过细胞间连接扩散到肾间质液中。少量的氯离子也可能通过近端小管细胞膜上的特定氯离子通道被重吸收。 | ||
| 第1,011行: | 第1,143行: | ||
亨利袢的粗升支从升支的中部开始,具有厚上皮细胞,代谢活动高,能够主动重吸收钠、氯和钾(见图28-8)。约25%的滤过钠、氯和钾负荷在亨利袢中被重吸收,主要发生在粗升支。大量的其他离子,如钙、碳酸氢盐和镁,也在亨利袢的粗升支中被重吸收。细升支的重吸收能力远低于粗升支,而细降支几乎不重吸收这些溶质中的任何一种。 | 亨利袢的粗升支从升支的中部开始,具有厚上皮细胞,代谢活动高,能够主动重吸收钠、氯和钾(见图28-8)。约25%的滤过钠、氯和钾负荷在亨利袢中被重吸收,主要发生在粗升支。大量的其他离子,如钙、碳酸氢盐和镁,也在亨利袢的粗升支中被重吸收。细升支的重吸收能力远低于粗升支,而细降支几乎不重吸收这些溶质中的任何一种。 | ||
图28-9 Henle袢粗升支中钠、氯和钾的转运机制。基底外侧细胞膜上的N a | 图28-9 Henle袢粗升支中钠、氯和钾的转运机制。基底外侧细胞膜上的N a+\boldsymbol-K+ ATPase泵维持细胞内低钠浓度和细胞内的负电位。管腔膜上的1-钠、2-氯、1-钾共转运体(co-transporter)利用钠沿电化学梯度扩散进入细胞所释放的势能,将这三个离子从管腔转运到细胞内。钠还通过钠-氢反向转运(sodium-hydrogen countertransport)进入管状细胞。管腔相对于间质液的正电荷(+8m V)迫使阳离子如Mg++和Ca+++通过细胞旁途径(paracellular pathway)从管腔扩散到间质液中。 | ||
Henle袢粗升支中溶质重吸收的一个重要组成部分是上皮细胞基底外侧膜上的Na | Henle袢粗升支中溶质重吸收的一个重要组成部分是上皮细胞基底外侧膜上的Na+-K+ ATPase泵。与近端小管一样,Henle袢粗升支中其他溶质的重吸收与Na+-K+ ATPase泵的重吸收能力密切相关,该泵维持细胞内低钠浓度。细胞内低钠浓度反过来为钠从管腔液进入细胞提供了有利的梯度。在粗升支中,钠通过管腔膜的转运主要由1-钠、2-氯、1-钾共转运体(NKCC2)介导(图28-9)。管腔膜上的这种共转运蛋白利用钠顺浓度梯度扩散进入细胞所释放的势能,驱动钾逆浓度梯度重吸收进入细胞。 | ||
Henle袢粗升支是强效袢利尿剂(loop diuretics)呋塞米(furosemide)、依他尼酸(ethacrynic acid)和布美他尼(bumetanide)的作用部位,这些药物都抑制NKCC2共转运体的作用。这些利尿剂将在第32章讨论。粗升支的管腔细胞膜上还存在钠-氢反向转运机制,介导钠的重吸收和氢的分泌(见图28-9)。 | Henle袢粗升支是强效袢利尿剂(loop diuretics)呋塞米(furosemide)、依他尼酸(ethacrynic acid)和布美他尼(bumetanide)的作用部位,这些药物都抑制NKCC2共转运体的作用。这些利尿剂将在第32章讨论。粗升支的管腔细胞膜上还存在钠-氢反向转运机制,介导钠的重吸收和氢的分泌(见图28-9)。 | ||
由于管腔相对于间质液的轻微正电荷,粗升支中还存在显著的阳离子(如Mg | 由于管腔相对于间质液的轻微正电荷,粗升支中还存在显著的阳离子(如Mg++、Ca2+、Na+和K+)的细胞旁重吸收。尽管NKCC2共转运体将等量的阳离子和阴离子转运到细胞内,但钾离子会轻微泄漏回管腔,导致管腔内产生约+8毫伏的正电荷。这种正电荷迫使阳离子如Mg++和Ca2+从管腔通过细胞旁间隙扩散到间质液中。 | ||
Henle袢粗升支对水几乎是不通透的。因此,尽管大量溶质被重吸收,输送到该段的大部分水仍留在小管中。随着管腔液流向远端小管,粗升支中的管腔液变得非常稀释,这一特性在允许肾脏在不同条件下稀释或浓缩尿液方面非常重要,详见第29章。 | Henle袢粗升支对水几乎是不通透的。因此,尽管大量溶质被重吸收,输送到该段的大部分水仍留在小管中。随着管腔液流向远端小管,粗升支中的管腔液变得非常稀释,这一特性在允许肾脏在不同条件下稀释或浓缩尿液方面非常重要,详见第29章。 | ||
| 第1,026行: | 第1,158行: | ||
远曲小管的下一部分高度卷曲,具有与Henle袢升支厚段相似的许多重吸收特性。也就是说,它积极地重吸收大多数离子,包括钠、钾和氯,但对水和尿素几乎不渗透。因此,它被称为稀释段(diluting segment),因为它也稀释了小管液。 | 远曲小管的下一部分高度卷曲,具有与Henle袢升支厚段相似的许多重吸收特性。也就是说,它积极地重吸收大多数离子,包括钠、钾和氯,但对水和尿素几乎不渗透。因此,它被称为稀释段(diluting segment),因为它也稀释了小管液。 | ||
大约5%的过滤氯化钠负荷在远曲小管早期被重吸收。氯化钠共转运体(sodium-chloride co-transporter)将氯化钠从小管腔移动到细胞内,而Na | 大约5%的过滤氯化钠负荷在远曲小管早期被重吸收。氯化钠共转运体(sodium-chloride co-transporter)将氯化钠从小管腔移动到细胞内,而Na+-K+ ATPase泵将钠从细胞跨过基底外侧膜(basolateral membrane)转运出去(图28-10)。氯通过基底外侧膜上的氯通道扩散出细胞进入肾间质液。 | ||
噻嗪类利尿剂(thiazide diuretics)广泛用于治疗高血压和心力衰竭等疾病,它们抑制氯化钠共转运体。 | 噻嗪类利尿剂(thiazide diuretics)广泛用于治疗高血压和心力衰竭等疾病,它们抑制氯化钠共转运体。 | ||
| 第1,033行: | 第1,165行: | ||
远曲小管的后半部分和随后的皮质集合管具有相似的功能特性。在解剖学上,它们由两种不同的细胞类型组成,即主细胞(principal cells)和插入细胞(intercalated cells)(图28-11)。主细胞从管腔重吸收钠和水,并将钾离子分泌到管腔中。A型插入细胞重吸收钾离子并将氢离子分泌到小管腔中。 | 远曲小管的后半部分和随后的皮质集合管具有相似的功能特性。在解剖学上,它们由两种不同的细胞类型组成,即主细胞(principal cells)和插入细胞(intercalated cells)(图28-11)。主细胞从管腔重吸收钠和水,并将钾离子分泌到管腔中。A型插入细胞重吸收钾离子并将氢离子分泌到小管腔中。 | ||
图28-10 远曲小管早期氯化钠转运机制。钠和氯通过被噻嗪类利尿剂抑制的共转运体从小管腔转运到细胞内。钠通过N a | 图28-10 远曲小管早期氯化钠转运机制。钠和氯通过被噻嗪类利尿剂抑制的共转运体从小管腔转运到细胞内。钠通过N a+\boldsymbol-K+ ATPase腺苷三磷酸酶泵出细胞,氯通过氯通道扩散到间质液中。 | ||
==== 主细胞重吸收钠并分泌钾 ==== | ==== 主细胞重吸收钠并分泌钾 ==== | ||
主细胞对钠的重吸收和钾的分泌依赖于每个细胞基底外侧膜上的Na | 主细胞对钠的重吸收和钾的分泌依赖于每个细胞基底外侧膜上的Na+-K+ ATPase泵的活性(图28-12)。该泵维持细胞内低钠浓度,因此有利于钠通过特殊通道扩散进入细胞。这些细胞将钾从血液分泌到小管腔中涉及两个步骤:(1)钾由于Na+-K+ ATPase泵的作用进入细胞,该泵维持细胞内高钾浓度;(2)一旦进入细胞,钾沿着其浓度梯度扩散穿过管腔膜进入小管液。 | ||
主细胞(principal cells)是保钾利尿剂(potassium-sparing diuretics)的主要作用部位,包括spironolactone、eplerenone、amiloride和triamterene。Spironolactone和eplerenone是盐皮质激素受体(mineralocorticoid receptor)拮抗剂,它们与醛固酮(aldosterone)竞争主细胞上的受体位点,从而抑制醛固酮对钠重吸收(sodium reabsorption)和钾分泌(potassium secretion)的刺激作用。Amiloride和triamterene是钠通道(sodium channel)阻滞剂,它们直接抑制钠进入管腔膜(luminal membrane)的钠通道,从而减少可以通过Na | 主细胞(principal cells)是保钾利尿剂(potassium-sparing diuretics)的主要作用部位,包括spironolactone、eplerenone、amiloride和triamterene。Spironolactone和eplerenone是盐皮质激素受体(mineralocorticoid receptor)拮抗剂,它们与醛固酮(aldosterone)竞争主细胞上的受体位点,从而抑制醛固酮对钠重吸收(sodium reabsorption)和钾分泌(potassium secretion)的刺激作用。Amiloride和triamterene是钠通道(sodium channel)阻滞剂,它们直接抑制钠进入管腔膜(luminal membrane)的钠通道,从而减少可以通过Na+-K+ ATP酶泵(ATPase pump)跨基底外侧膜(basolateral membrane)转运的钠量。这反过来又减少了钾向细胞内的转运,最终减少了钾向管腔液(tubular fluid)的分泌。因此,钠通道阻滞剂以及醛固酮拮抗剂都能减少尿钾排泄(urinary excretion of potassium),起到保钾利尿剂的作用。 | ||
图28-11 远端小管(distal tubule)早期和晚期以及集合管(collecting tubule)的细胞超微结构(ultrastructure)和转运特征。远端小管早期具有与Henle袢升支粗段(thick ascending loop of Henle)相同的许多特征,重吸收钠、氯、钙和镁,但对水和尿素几乎不通透。远端小管晚期和皮质集合管由两种不同的细胞类型组成,即主细胞和闰细胞(intercalated cells)。主细胞从管腔重吸收钠并向管腔分泌钾离子。A型闰细胞从管腔重吸收钾和碳酸氢根离子(bicarbonate ions)并向管腔分泌氢离子(hydrogen ions)。该小管段对水的重吸收由抗利尿激素(antidiuretic hormone)的浓度控制。 | 图28-11 远端小管(distal tubule)早期和晚期以及集合管(collecting tubule)的细胞超微结构(ultrastructure)和转运特征。远端小管早期具有与Henle袢升支粗段(thick ascending loop of Henle)相同的许多特征,重吸收钠、氯、钙和镁,但对水和尿素几乎不通透。远端小管晚期和皮质集合管由两种不同的细胞类型组成,即主细胞和闰细胞(intercalated cells)。主细胞从管腔重吸收钠并向管腔分泌钾离子。A型闰细胞从管腔重吸收钾和碳酸氢根离子(bicarbonate ions)并向管腔分泌氢离子(hydrogen ions)。该小管段对水的重吸收由抗利尿激素(antidiuretic hormone)的浓度控制。 | ||
| 第1,046行: | 第1,178行: | ||
B型闰细胞(intercalated cells)的功能与A型细胞相反,在碱中毒(alkalosis)时向管腔分泌碳酸氢根(bicarbonate)并重吸收氢离子(hydrogen ions)。B型闰细胞的氢离子和碳酸氢根转运体(transporters)位于细胞膜的两侧,与A型细胞相反。B型细胞顶膜(apical membrane)上的氯-碳酸氢根反向转运体(chloride-bicarbonate counter-transporter)称为pendrin,与A型细胞的氯-碳酸氢根转运体不同。氢离子通过氢ATP酶(hydrogenATPase)从B型闰细胞的基底外侧膜(basolateral membrane)主动转运出细胞,碳酸氢根分泌到管腔中,从而在碱中毒时消除过多的血浆碳酸氢根。慢性代谢性碱中毒(chronic metabolic alkalosis)的诱导会增加B型闰细胞的数量,从而促进碳酸氢根的排泄增加,而酸中毒(acidosis)则会增加A型细胞的数量。 | B型闰细胞(intercalated cells)的功能与A型细胞相反,在碱中毒(alkalosis)时向管腔分泌碳酸氢根(bicarbonate)并重吸收氢离子(hydrogen ions)。B型闰细胞的氢离子和碳酸氢根转运体(transporters)位于细胞膜的两侧,与A型细胞相反。B型细胞顶膜(apical membrane)上的氯-碳酸氢根反向转运体(chloride-bicarbonate counter-transporter)称为pendrin,与A型细胞的氯-碳酸氢根转运体不同。氢离子通过氢ATP酶(hydrogenATPase)从B型闰细胞的基底外侧膜(basolateral membrane)主动转运出细胞,碳酸氢根分泌到管腔中,从而在碱中毒时消除过多的血浆碳酸氢根。慢性代谢性碱中毒(chronic metabolic alkalosis)的诱导会增加B型闰细胞的数量,从而促进碳酸氢根的排泄增加,而酸中毒(acidosis)则会增加A型细胞的数量。 | ||
图28-12 远端小管(distal tubules)和皮质集合管(cortical collecting tubules)主细胞(principal cells)中钠-氯重吸收(sodium-chloride reabsorption)和钾分泌(potassium secretion)的机制。钠通过特殊通道进入细胞,并通过N a | 图28-12 远端小管(distal tubules)和皮质集合管(cortical collecting tubules)主细胞(principal cells)中钠-氯重吸收(sodium-chloride reabsorption)和钾分泌(potassium secretion)的机制。钠通过特殊通道进入细胞,并通过N a+\boldsymbol-K+ ATP酶泵(ATPase pump)转运出细胞。醛固酮拮抗剂(aldosterone antagonists)与醛固酮竞争细胞内的结合位点,从而抑制醛固酮刺激钠重吸收和钾分泌的作用。钠通道阻滞剂(sodium channel blockers)直接抑制钠进入钠通道。 | ||
关于这一机制的更详细讨论见第31章。如图28-13所示,闰细胞也可以重吸收或分泌钾离子。 | 关于这一机制的更详细讨论见第31章。如图28-13所示,闰细胞也可以重吸收或分泌钾离子。 | ||
| 第1,151行: | 第1,283行: | ||
体液容量和溶质浓度的精确调节要求肾脏以不同的速率排泄不同的溶质和水,有时彼此独立。例如,当钾摄入量增加时,肾脏必须排泄更多的钾,同时维持钠和其他电解质的正常排泄。同样,当钠摄入量改变时,肾脏必须适当调整尿钠排泄,而不显著改变其他电解质的排泄。体内的几种激素为不同电解质和水的肾小管重吸收提供了这种特异性。表28-3总结了一些最重要的调节肾小管重吸收的激素、它们在肾小管上的主要作用部位,以及它们对溶质和水排泄的影响。其中一些激素将在第29章和第30章中更详细地讨论,但这里我们简要回顾它们在肾小管中的作用。 | 体液容量和溶质浓度的精确调节要求肾脏以不同的速率排泄不同的溶质和水,有时彼此独立。例如,当钾摄入量增加时,肾脏必须排泄更多的钾,同时维持钠和其他电解质的正常排泄。同样,当钠摄入量改变时,肾脏必须适当调整尿钠排泄,而不显著改变其他电解质的排泄。体内的几种激素为不同电解质和水的肾小管重吸收提供了这种特异性。表28-3总结了一些最重要的调节肾小管重吸收的激素、它们在肾小管上的主要作用部位,以及它们对溶质和水排泄的影响。其中一些激素将在第29章和第30章中更详细地讨论,但这里我们简要回顾它们在肾小管中的作用。 | ||
醛固酮(Aldosterone)刺激肾脏钠重吸收和钾分泌。由肾上腺皮质(adrenal cortex)的球状带(zona glomerulosa)细胞分泌的醛固酮,是肾小管(renal tubules)钠重吸收和钾、氢离子分泌的重要调节因子。醛固酮在肾小管的主要作用部位是皮质集合管(cortical collecting tubule)的主细胞(principal cells)。醛固酮通过刺激皮质集合管膜基底外侧面的Na | 醛固酮(Aldosterone)刺激肾脏钠重吸收和钾分泌。由肾上腺皮质(adrenal cortex)的球状带(zona glomerulosa)细胞分泌的醛固酮,是肾小管(renal tubules)钠重吸收和钾、氢离子分泌的重要调节因子。醛固酮在肾小管的主要作用部位是皮质集合管(cortical collecting tubule)的主细胞(principal cells)。醛固酮通过刺激皮质集合管膜基底外侧面的Na+-K+ ATPase泵来增加钠重吸收和钾分泌。醛固酮还通过插入上皮钠通道(epithelial sodium channels)来增加膜腔侧(luminal side)的钠通透性。醛固酮作用的细胞机制将在第78章讨论。 | ||
醛固酮最重要的刺激因素如下:(1)细胞外钾浓度升高;(2)血管紧张素II(angiotensin II)水平升高,这通常发生在与钠和容量耗竭或低血压相关的条件下。与这些情况相关的醛固酮分泌增加会导致肾脏钠和水潴留,有助于恢复细胞外液容量和血压至正常水平。 | 醛固酮最重要的刺激因素如下:(1)细胞外钾浓度升高;(2)血管紧张素II(angiotensin II)水平升高,这通常发生在与钠和容量耗竭或低血压相关的条件下。与这些情况相关的醛固酮分泌增加会导致肾脏钠和水潴留,有助于恢复细胞外液容量和血压至正常水平。 | ||
| 第1,165行: | 第1,297行: | ||
# 血管紧张素 II 刺激醛固酮 (aldosterone) 分泌,从而增加钠的重吸收。 | # 血管紧张素 II 刺激醛固酮 (aldosterone) 分泌,从而增加钠的重吸收。 | ||
# 血管紧张素 II 收缩出球小动脉 (efferent arterioles),这对管周毛细血管 (peritubular capillary) 动力学产生两种效应,从而增加钠和水的重吸收。首先,出球小动脉收缩降低了管周毛细血管的静水压 (hydrostatic pressure),从而增加了净肾小管重吸收,尤其是近端小管 (proximal tubules) 的重吸收。其次,出球小动脉收缩通过减少肾血流量 (renal blood flow),提高了肾小球 (glomerulus) 的滤过分数 (filtration fraction),并增加了管周毛细血管中蛋白质的浓度和胶体渗透压 (colloid osmotic pressure)。这种机制还增加了管周毛细血管的重吸收力,并提高了肾小管对钠和水的重吸收。 | # 血管紧张素 II 收缩出球小动脉 (efferent arterioles),这对管周毛细血管 (peritubular capillary) 动力学产生两种效应,从而增加钠和水的重吸收。首先,出球小动脉收缩降低了管周毛细血管的静水压 (hydrostatic pressure),从而增加了净肾小管重吸收,尤其是近端小管 (proximal tubules) 的重吸收。其次,出球小动脉收缩通过减少肾血流量 (renal blood flow),提高了肾小球 (glomerulus) 的滤过分数 (filtration fraction),并增加了管周毛细血管中蛋白质的浓度和胶体渗透压 (colloid osmotic pressure)。这种机制还增加了管周毛细血管的重吸收力,并提高了肾小管对钠和水的重吸收。 | ||
# 血管紧张素 II 直接刺激近端小管、Henle 袢 (loops of Henle)、远端小管 (distal tubules) 和集合管 (collecting tubules) 中的钠重吸收。血管紧张素 II 的直接效应之一是刺激肾小管上皮细胞基底外侧膜 (basolateral membrane) 上的 Na | # 血管紧张素 II 直接刺激近端小管、Henle 袢 (loops of Henle)、远端小管 (distal tubules) 和集合管 (collecting tubules) 中的钠重吸收。血管紧张素 II 的直接效应之一是刺激肾小管上皮细胞基底外侧膜 (basolateral membrane) 上的 Na+-K+ ATP 酶泵 (ATPase pump)。第二个效应是刺激管腔膜 (luminal membrane) 中的钠-氢交换 (sodium-hydrogen exchange),尤其是在近端小管中。血管紧张素 II 的第三个效应是刺激基底外侧膜中的钠-碳酸氢盐共转运 (sodium-bicarbonate co-transport)(图 28-18)。 | ||
因此,血管紧张素 II 刺激了大多数肾小管节段中上皮细胞膜 (epithelial cell membrane) 的管腔和基底外侧表面的钠转运。血管紧张素 II 的这些多重作用在血管紧张素 II 水平升高时导致肾脏显著保留钠和水,并在允许身体适应钠摄入的广泛变化而不引起细胞外液量和血压的大幅变化中起关键作用,正如第 30 章所讨论的。 | 因此,血管紧张素 II 刺激了大多数肾小管节段中上皮细胞膜 (epithelial cell membrane) 的管腔和基底外侧表面的钠转运。血管紧张素 II 的这些多重作用在血管紧张素 II 水平升高时导致肾脏显著保留钠和水,并在允许身体适应钠摄入的广泛变化而不引起细胞外液量和血压的大幅变化中起关键作用,正如第 30 章所讨论的。 | ||
| 第1,175行: | 第1,307行: | ||
ADH与远端小管末端、集合小管和集合管中的特异性V_2受体结合,增加环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成并激活蛋白激酶(protein kinases)(图28-19)。这一作用反过来刺激一种称为水通道蛋白-2(aquaporin-2, AQP-2)的细胞内蛋白向细胞膜的管腔侧移动。AQP-2分子聚集在一起,通过胞吐作用(exocytosis)与细胞膜融合,形成允许水快速通过细胞扩散的水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们为水快速流出细胞提供了途径,尽管这些水通道蛋白不受ADH的调节。ADH水平的长期升高还通过刺激AQP-2基因转录来增加肾小管细胞中AQP-2蛋白的形成。当ADH浓度降低时,AQP-2分子被转运回细胞质,从而从管腔膜上移除水通道并降低水的通透性。ADH的这些作用将在第29章和第76章进一步讨论。 | ADH与远端小管末端、集合小管和集合管中的特异性V_2受体结合,增加环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成并激活蛋白激酶(protein kinases)(图28-19)。这一作用反过来刺激一种称为水通道蛋白-2(aquaporin-2, AQP-2)的细胞内蛋白向细胞膜的管腔侧移动。AQP-2分子聚集在一起,通过胞吐作用(exocytosis)与细胞膜融合,形成允许水快速通过细胞扩散的水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们为水快速流出细胞提供了途径,尽管这些水通道蛋白不受ADH的调节。ADH水平的长期升高还通过刺激AQP-2基因转录来增加肾小管细胞中AQP-2蛋白的形成。当ADH浓度降低时,AQP-2分子被转运回细胞质,从而从管腔膜上移除水通道并降低水的通透性。ADH的这些作用将在第29章和第76章进一步讨论。 | ||
图28-18 血管紧张素II(angiotensin II, Ang II)增加近端小管钠重吸收的直接作用。Ang II刺激管腔膜上的钠-氢交换(sodium-hydrogen exchange, NHE)和N a | 图28-18 血管紧张素II(angiotensin II, Ang II)增加近端小管钠重吸收的直接作用。Ang II刺激管腔膜上的钠-氢交换(sodium-hydrogen exchange, NHE)和N a+\boldsymbol-K+ ATPase转运体,以及基底外侧膜上的钠-碳酸氢盐共转运(sodium-bicarbonate co-transport)。Ang II的这些相同作用可能发生在肾小管的其他几个部分,包括髓袢(loop of Henle)、远端小管和集合小管。A T_1,血管紧张素II 1型受体(angiotensin II type I receptor)。 | ||
图28-19 精氨酸加压素(argine vasopressin, AVP)对远端小管末端、集合小管和集合管上皮细胞的作用机制。AVP与其\vee_2受体结合,后者与刺激性G蛋白(stimulatory G proteins, G_5)偶联,激活腺苷酸环化酶(adenylate cyclase, AC)并刺激环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成。这反过来激活蛋白激酶A(protein kinase A)和细胞内蛋白的磷酸化,导致水通道蛋白-2(aquaporin-2, AQP-2)向细胞膜的管腔侧移动。A Q P-2分子融合在一起形成水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们允许水流出细胞,尽管这些水通道蛋白似乎不受AVP的调节。 | 图28-19 精氨酸加压素(argine vasopressin, AVP)对远端小管末端、集合小管和集合管上皮细胞的作用机制。AVP与其\vee_2受体结合,后者与刺激性G蛋白(stimulatory G proteins, G_5)偶联,激活腺苷酸环化酶(adenylate cyclase, AC)并刺激环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成。这反过来激活蛋白激酶A(protein kinase A)和细胞内蛋白的磷酸化,导致水通道蛋白-2(aquaporin-2, AQP-2)向细胞膜的管腔侧移动。A Q P-2分子融合在一起形成水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们允许水流出细胞,尽管这些水通道蛋白似乎不受AVP的调节。 | ||
| 第1,197行: | 第1,329行: | ||
为了说明清除率原理,请考虑以下示例。如果通过肾脏的血浆每毫升含有1毫克某种物质,并且如果每分钟也有1毫克该物质排泄到尿液中,那么每分钟就有1毫升血浆被清除该物质。清除率是指单位时间内供应尿液中排泄物质量所需血浆的体积。用数学公式表示为: | 为了说明清除率原理,请考虑以下示例。如果通过肾脏的血浆每毫升含有1毫克某种物质,并且如果每分钟也有1毫克该物质排泄到尿液中,那么每分钟就有1毫升血浆被清除该物质。清除率是指单位时间内供应尿液中排泄物质量所需血浆的体积。用数学公式表示为: | ||
C_5×P_5=U_5×V | C_5×P_5=U_5×V | ||
其中 C_s 是物质 s 的清除率(clearance rate),P_s 是该物质的血浆浓度(plasma concentration),U_s 是该物质的尿液浓度(urine concentration),V 是尿流率(urine flow rate)。重新排列这个方程,清除率可以表示为: | 其中 C_s 是物质 s 的清除率(clearance rate),P_s 是该物质的血浆浓度(plasma concentration),U_s 是该物质的尿液浓度(urine concentration),V 是尿流率(urine flow rate)。重新排列这个方程,清除率可以表示为: | ||
C_s=\fracU_s×VP_s | C_s=\fracU_s×VP_s | ||
因此,物质的肾脏清除率(renal clearance)可以通过该物质的尿排泄率 (U_s×V) 除以其血浆浓度来计算。 | 因此,物质的肾脏清除率(renal clearance)可以通过该物质的尿排泄率 (U_s×V) 除以其血浆浓度来计算。 | ||
| 第1,216行: | 第1,344行: | ||
如果一种物质可以自由滤过(像水一样自由滤过)并且不被肾小管重吸收或分泌,那么该物质在尿液中的排泄率 (U_s×V) 等于肾脏对该物质的滤过率 (GFR×P_s)。因此: | 如果一种物质可以自由滤过(像水一样自由滤过)并且不被肾小管重吸收或分泌,那么该物质在尿液中的排泄率 (U_s×V) 等于肾脏对该物质的滤过率 (GFR×P_s)。因此: | ||
\sf G F R×\sf P_s=\sf U_s×\sf V | \sf G F R×\sf P_s=\sf U_s×\sf V | ||
因此,肾小球滤过率(GFR)可以通过该物质的清除率计算如下: | 因此,肾小球滤过率(GFR)可以通过该物质的清除率计算如下: | ||
\mathttG F R=\fracU_5×VP_5=C_2 | \mathttG F R=\fracU_5×VP_5=C_2 | ||
符合这些标准的物质是菊粉(inulin),一种分子量约为5200的多糖分子。菊粉在体内不产生,存在于某些植物的根部,必须通过静脉注射给患者以测量肾小球滤过率(GFR)。 | 符合这些标准的物质是菊粉(inulin),一种分子量约为5200的多糖分子。菊粉在体内不产生,存在于某些植物的根部,必须通过静脉注射给患者以测量肾小球滤过率(GFR)。 | ||
| 第1,247行: | 第1,371行: | ||
在某些情况下,收集患者的尿液以测量肌酐清除率(C_Cr)可能不切实际。然而,通过简单地测量血浆肌酐浓度(P_Cr),可以获得GFR变化的近似值,因为血浆肌酐浓度与GFR成反比: | 在某些情况下,收集患者的尿液以测量肌酐清除率(C_Cr)可能不切实际。然而,通过简单地测量血浆肌酐浓度(P_Cr),可以获得GFR变化的近似值,因为血浆肌酐浓度与GFR成反比: | ||
G F R\approxC_C r=\fracU_C r×\dotVP_C r | G F R\approxC_C r=\fracU_C r×\dotVP_C r | ||
图28-20 通过菊粉的肾脏清除率测量肾小球滤过率(GFR)。菊粉可自由通过肾小球毛细血管滤过,但不会被肾小管重吸收。P_inulin, 血浆菊粉浓度;U_inulin, 尿液菊粉浓度;\dot V_r 尿流率。 | 图28-20 通过菊粉的肾脏清除率测量肾小球滤过率(GFR)。菊粉可自由通过肾小球毛细血管滤过,但不会被肾小管重吸收。P_inulin, 血浆菊粉浓度;U_inulin, 尿液菊粉浓度;\dot V_r 尿流率。 | ||
| 第1,262行: | 第1,384行: | ||
理论上,如果一种物质完全从血浆中被清除,那么该物质的清除率等于总肾血浆流量(renal plasma flow, RPF)。换句话说,血液中输送到肾脏的该物质的量 \left(RPF×P_s\right) 将等于尿液中排泄的量 (U_s×\dotV) 。因此,RPF可以按以下公式计算: | 理论上,如果一种物质完全从血浆中被清除,那么该物质的清除率等于总肾血浆流量(renal plasma flow, RPF)。换句话说,血液中输送到肾脏的该物质的量 \left(RPF×P_s\right) 将等于尿液中排泄的量 (U_s×\dotV) 。因此,RPF可以按以下公式计算: | ||
R P F=\fracU_s×\dotVP_s=C_s | R P F=\fracU_s×\dotVP_s=C_s | ||
图28-21 当肌酐生成率保持不变时,肾小球滤过率(glomerular filtration rate, GFR)降低50%对血清肌酐浓度和肌酐排泄率的影响。PCreatinine,血浆肌酐浓度。 | 图28-21 当肌酐生成率保持不变时,肾小球滤过率(glomerular filtration rate, GFR)降低50%对血清肌酐浓度和肌酐排泄率的影响。PCreatinine,血浆肌酐浓度。 | ||
| 第1,284行: | 第1,404行: | ||
提取率(E_PAH)计算为肾动脉PAH(P_PAH)和肾静脉PAH(V_PAH)浓度之差除以肾动脉PAH浓度: | 提取率(E_PAH)计算为肾动脉PAH(P_PAH)和肾静脉PAH(V_PAH)浓度之差除以肾动脉PAH浓度: | ||
E_P A H=\fracP_P A H-V_P A HP_P A H | E_P A H=\fracP_P A H-V_P A HP_P A H | ||
可以通过总RPF和血细胞比容(hematocrit)(血液中红细胞的百分比)来计算通过肾脏的总血流量。如果血细胞比容为0.45,总RPF为650ml/min,则通过双肾的总血流量为650/(1\textrm--0.45),即1182ml/min。 | 可以通过总RPF和血细胞比容(hematocrit)(血液中红细胞的百分比)来计算通过肾脏的总血流量。如果血细胞比容为0.45,总RPF为650ml/min,则通过双肾的总血流量为650/(1\textrm--0.45),即1182ml/min。 | ||
| 第1,295行: | 第1,413行: | ||
要计算滤过分数(filtration fraction),即通过肾小球膜滤过的血浆分数,必须首先知道RPF(PAH清除率)和GFR(菊粉清除率)。如果RPF为650ml/min,GFR为125ml/min,则滤过分数(FF)计算如下: | 要计算滤过分数(filtration fraction),即通过肾小球膜滤过的血浆分数,必须首先知道RPF(PAH清除率)和GFR(菊粉清除率)。如果RPF为650ml/min,GFR为125ml/min,则滤过分数(FF)计算如下: | ||
F F=G F R/R P F=125/650=0.19 | F F=G F R/R P F=125/650=0.19 | ||
==== 通过肾脏清除率计算肾小管重吸收或分泌 ==== | ==== 通过肾脏清除率计算肾小管重吸收或分泌 ==== | ||
| 第1,361行: | 第1,476行: | ||
肾脏的最大浓缩能力决定了每天必须排出多少尿量以清除体内的代谢废物和摄入的电解质。一个正常的70-kg的人每天必须排出约600毫渗透压的溶质。如果最大尿液浓缩能力为1200mOsm/L,则必须排出的最小尿量,称为必需尿量,可以计算如下: | 肾脏的最大浓缩能力决定了每天必须排出多少尿量以清除体内的代谢废物和摄入的电解质。一个正常的70-kg的人每天必须排出约600毫渗透压的溶质。如果最大尿液浓缩能力为1200mOsm/L,则必须排出的最小尿量,称为必需尿量,可以计算如下: | ||
\frac600mOsm/day1200mOsm/L=0.5L/day | \frac600mOsm/day1200mOsm/L=0.5L/day | ||
这种尿液中的最小体积损失,加上皮肤、呼吸道和胃肠道的水分流失,在无法饮水时会导致脱水。 | 这种尿液中的最小体积损失,加上皮肤、呼吸道和胃肠道的水分流失,在无法饮水时会导致脱水。 | ||
| 第1,408行: | 第1,521行: | ||
<nowiki><html><body><table><tr></nowiki><nowiki><td rowspan="2"></nowiki>结构<nowiki></td></nowiki><nowiki><td rowspan="2"></nowiki>NaCl主动转运<nowiki></td></nowiki><nowiki><td colspan="3"></nowiki>渗透性<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>H20<nowiki></td></nowiki><nowiki><td></nowiki>NaCl<nowiki></td></nowiki><nowiki><td></nowiki>尿素<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>近端小管<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>薄壁降支<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>薄壁升支<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>厚壁升支<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>远端小管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>皮质集合小管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>髓质内层集合管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | <nowiki><html><body><table><tr></nowiki><nowiki><td rowspan="2"></nowiki>结构<nowiki></td></nowiki><nowiki><td rowspan="2"></nowiki>NaCl主动转运<nowiki></td></nowiki><nowiki><td colspan="3"></nowiki>渗透性<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>H20<nowiki></td></nowiki><nowiki><td></nowiki>NaCl<nowiki></td></nowiki><nowiki><td></nowiki>尿素<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>近端小管<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>薄壁降支<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>薄壁升支<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>厚壁升支<nowiki></td></nowiki><nowiki><td></nowiki>++<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>远端小管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>皮质集合小管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>髓质内层集合管<nowiki></td></nowiki><nowiki><td></nowiki>+<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki><td></nowiki>0<nowiki></td></nowiki><nowiki><td></nowiki>+ADH<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | ||
ADH, 抗利尿激素(antidiuretic hormone); NaCl, 氯化钠(sodium chloride); 0, 主动转运或渗透性的最低水平; | ADH, 抗利尿激素(antidiuretic hormone); NaCl, 氯化钠(sodium chloride); 0, 主动转运或渗透性的最低水平; +, 中等水平的主动转运或渗透性; ++ , 高水平的主动转运或渗透性; +A D H , 水或尿素的渗透性由ADH增加。 | ||
髓质间质。Henle袢薄壁升支有一些氯化钠的被动重吸收(passive reabsorption),该部分对水也基本上不渗透,进一步增加了肾髓质间质的高溶质浓度。 | 髓质间质。Henle袢薄壁升支有一些氯化钠的被动重吸收(passive reabsorption),该部分对水也基本上不渗透,进一步增加了肾髓质间质的高溶质浓度。 | ||
| 第1,512行: | 第1,625行: | ||
从血液中清除溶质的总量可以表示为渗透清除率(C_osm)。这是每分钟清除溶质的血浆体积,与计算单一物质的清除率相同: | 从血液中清除溶质的总量可以表示为渗透清除率(C_osm)。这是每分钟清除溶质的血浆体积,与计算单一物质的清除率相同: | ||
C_osm=\fracU_osm×\dotVP_osm | C_osm=\fracU_osm×\dotVP_osm | ||
其中U_osm是尿液渗透压,\dotV是尿流率,P_osm是血浆渗透压。例如,如果血浆渗透压为300mOsm/L,尿液渗透压为600mOsm/L,,尿流率为1ml/min \left(0.001L/min\right),则渗透排泄率为0.6 mOsm/min (600mOsm/L×0.001L/min)),渗透清除率为0.6mOsm/min除以300mOsm/L,即0.002L/min (2.0ml/min))。这意味着每分钟有2毫升血浆被清除溶质。 | 其中U_osm是尿液渗透压,\dotV是尿流率,P_osm是血浆渗透压。例如,如果血浆渗透压为300mOsm/L,尿液渗透压为600mOsm/L,,尿流率为1ml/min \left(0.001L/min\right),则渗透排泄率为0.6 mOsm/min (600mOsm/L×0.001L/min)),渗透清除率为0.6mOsm/min除以300mOsm/L,即0.002L/min (2.0ml/min))。这意味着每分钟有2毫升血浆被清除溶质。 | ||
| 第1,523行: | 第1,634行: | ||
自由水清除率(C_H2O)计算为水排泄(尿流率)和渗透清除率之间的差异: | 自由水清除率(C_H2O)计算为水排泄(尿流率)和渗透清除率之间的差异: | ||
C_H_20=V-C_0sm=V-\frac\left(U_o s m×\dotV\right)P_o s m | C_H_20=V-C_0sm=V-\frac\left(U_o s m×\dotV\right)P_o s m | ||
因此,自由水清除率(Free Water Clearance)代表了肾脏排出无溶质水的速率。当自由水清除率为正值时,肾脏正在排出多余的水分;当自由水清除率为负值时,肾脏正在从血液中移除多余的溶质,并保留水分。 | 因此,自由水清除率(Free Water Clearance)代表了肾脏排出无溶质水的速率。当自由水清除率为正值时,肾脏正在排出多余的水分;当自由水清除率为负值时,肾脏正在从血液中移除多余的溶质,并保留水分。 | ||
| 第1,558行: | 第1,667行: | ||
在大多数临床实验室中,血浆渗透压并不常规测量。然而,由于钠及其伴随的阴离子约占细胞外液溶质的94%,血浆渗透压(Posm)可以根据血浆钠浓度(PNa+)大致估算如下: | 在大多数临床实验室中,血浆渗透压并不常规测量。然而,由于钠及其伴随的阴离子约占细胞外液溶质的94%,血浆渗透压(Posm)可以根据血浆钠浓度(PNa+)大致估算如下: | ||
P_o s m=2.1×P_N a | P_o s m=2.1×P_N a+(m m o l/L) | ||
例如,当血浆钠浓度为 142mEq/L 时,根据此公式估算的血浆渗透压约为 298mOsm/L。为了更精确,尤其是在与肾脏疾病相关的情况下,通常会包括另外两种溶质(葡萄糖和尿素)的血浆浓度(单位为 mmol/L)的贡献: | 例如,当血浆钠浓度为 142mEq/L 时,根据此公式估算的血浆渗透压约为 298mOsm/L。为了更精确,尤其是在与肾脏疾病相关的情况下,通常会包括另外两种溶质(葡萄糖和尿素)的血浆浓度(单位为 mmol/L)的贡献: | ||
P_o s m=2×[P_N a | P_o s m=2×[P_N a+,m m o l/L]+[P_g l u c o s e,m m o l/L]+[P_u r e a,m m o l/L] | ||
这种血浆渗透压的估算通常与直接测量的结果相差在几个百分点以内。 | 这种血浆渗透压的估算通常与直接测量的结果相差在几个百分点以内。 | ||
| 第1,722行: | 第1,827行: | ||
\sf\sf\sf\sf\sf\beta -肾上腺素能刺激增加细胞对钾的摄取。儿茶酚胺分泌增加,尤其是肾上腺素,可以通过激活\upbeta_2 -肾上腺素能受体导致钾从细胞外液进入细胞内液。相反,使用\upbeta -肾上腺素能受体阻滞剂(如普萘洛尔)治疗高血压会导致钾从细胞内移出,并倾向于引起高钾血症。 | \sf\sf\sf\sf\sf\beta -肾上腺素能刺激增加细胞对钾的摄取。儿茶酚胺分泌增加,尤其是肾上腺素,可以通过激活\upbeta_2 -肾上腺素能受体导致钾从细胞外液进入细胞内液。相反,使用\upbeta -肾上腺素能受体阻滞剂(如普萘洛尔)治疗高血压会导致钾从细胞内移出,并倾向于引起高钾血症。 | ||
酸碱异常可以引起钾分布的改变。代谢性酸中毒(metabolic acidosis)会增加细胞外液钾浓度,部分原因是导致细胞内钾的丢失,而代谢性碱中毒(metabolic alkalosis)则会降低细胞外液钾浓度。虽然氢离子浓度对钾在细胞内分布的影响机制尚未完全阐明,但氢离子浓度增加的一个效应是降低Na | 酸碱异常可以引起钾分布的改变。代谢性酸中毒(metabolic acidosis)会增加细胞外液钾浓度,部分原因是导致细胞内钾的丢失,而代谢性碱中毒(metabolic alkalosis)则会降低细胞外液钾浓度。虽然氢离子浓度对钾在细胞内分布的影响机制尚未完全阐明,但氢离子浓度增加的一个效应是降低Na+-K+ ATPase泵的活性。这种降低反过来会减少细胞对钾的摄取,并提高细胞外液钾浓度。碱中毒则有相反的作用,使钾从细胞外液转移到细胞内,并倾向于引起低钾血症(hypokalemia)。 | ||
细胞溶解导致细胞外液钾浓度增加。当细胞被破坏时,细胞内的大量钾会释放到细胞外液中。如果大量组织被破坏,如严重的肌肉损伤或红细胞溶解,这种钾的释放会导致显著的高钾血症(hyperkalemia)。 | 细胞溶解导致细胞外液钾浓度增加。当细胞被破坏时,细胞内的大量钾会释放到细胞外液中。如果大量组织被破坏,如严重的肌肉损伤或红细胞溶解,这种钾的释放会导致显著的高钾血症(hyperkalemia)。 | ||
| 第1,750行: | 第1,855行: | ||
在远端小管和皮质集合管末端分泌钾的细胞称为主细胞(principal cells),它们构成了这些区域的大部分上皮细胞。图30-3展示了主细胞分泌钾的基本细胞机制。 | 在远端小管和皮质集合管末端分泌钾的细胞称为主细胞(principal cells),它们构成了这些区域的大部分上皮细胞。图30-3展示了主细胞分泌钾的基本细胞机制。 | ||
钾从血液进入管腔的分泌是一个两步过程,首先是通过基底外侧细胞膜上的Na | 钾从血液进入管腔的分泌是一个两步过程,首先是通过基底外侧细胞膜上的Na+-K+ ATP酶泵(ATPase pump)从间质(interstitium)摄取到细胞内。该泵将钠从细胞中移出到间质,同时将钾移入细胞内。 | ||
该过程的第二步是钾从细胞内被动扩散到管腔液(tubular fluid)中。Na | 该过程的第二步是钾从细胞内被动扩散到管腔液(tubular fluid)中。Na+-K+ ATP酶泵产生高细胞内钾浓度,这为钾从细胞被动扩散到管腔提供了驱动力。主细胞的管腔膜对钾具有高度通透性,因为有两种特殊的通道允许钾离子快速通过膜扩散:(1) 肾外髓钾通道(renal outer medullary potassium, ROMK channels),和 (2) 高电导、“大”钾通道(high-conductance, "big" potassium, BK channels)。这两种钾通道都是高效肾脏钾排泄所必需的,并且在高钾摄入期间它们在管腔膜中的丰度会增加。 | ||
==== 主细胞对钾分泌的调控 ==== | ==== 主细胞对钾分泌的调控 ==== | ||
控制远端小管和皮质集合管主细胞钾分泌的主要因素如下:(1) Na | 控制远端小管和皮质集合管主细胞钾分泌的主要因素如下:(1) Na+-K+ ATP酶泵的活性;(2) 从血液到管腔的钾分泌的电化学梯度(electrochemical gradient);以及 (3) 管腔膜对钾的通透性(permeability)。这三个钾分泌的决定因素又受到多种因素的调控,这些因素将在后面讨论。 | ||
==== 间质细胞(intercalated cells)可以重吸收或分泌钾 ==== | ==== 间质细胞(intercalated cells)可以重吸收或分泌钾 ==== | ||
在与严重钾耗竭相关的情况下,钾分泌会停止,并且在远端小管和集合管末端会发生钾的净重吸收(net reabsorption)。这种重吸收通过A型间质细胞(type A intercalated cells)发生。尽管这一重吸收过程尚未完全理解,但被认为参与其中的一种机制是位于管腔膜上的氢-钾ATP酶转运机制(hydrogen-potassium ATPase transport mechanism)(见第28章,图28- | 在与严重钾耗竭相关的情况下,钾分泌会停止,并且在远端小管和集合管末端会发生钾的净重吸收(net reabsorption)。这种重吸收通过A型间质细胞(type A intercalated cells)发生。尽管这一重吸收过程尚未完全理解,但被认为参与其中的一种机制是位于管腔膜上的氢-钾ATP酶转运机制(hydrogen-potassium ATPase transport mechanism)(见第28章,图28-13)。该转运体重吸收钾以交换分泌到管腔中的氢离子,然后钾通过基底外侧膜钾通道扩散到间质液中。这种间质细胞氢-钾ATP酶转运体的丰度在钾耗竭和低钾血症(hypokalemia)时增加,导致氢离子分泌增加和碱中毒(alkalosis)。然而,在正常情况下,间质细胞的钾重吸收在控制钾排泄中只起很小的作用。 | ||
当体液中的钾过量时,晚期远端小管和集合管中的B型闰细胞(intercalated cells)会主动将钾分泌到管腔中,其功能与A型细胞相反(参见第28章,图28-13)。钾通过基底外侧膜上的氢钾ATP酶转运体被泵入B型闰细胞,然后通过钾通道扩散到管腔中。 | 当体液中的钾过量时,晚期远端小管和集合管中的B型闰细胞(intercalated cells)会主动将钾分泌到管腔中,其功能与A型细胞相反(参见第28章,图28-13)。钾通过基底外侧膜上的氢钾ATP酶转运体被泵入B型闰细胞,然后通过钾通道扩散到管腔中。 | ||
| 第1,773行: | 第1,878行: | ||
'''饮食钾摄入增加和细胞外液钾浓度增加通过至少四种机制刺激钾分泌''': | '''饮食钾摄入增加和细胞外液钾浓度增加通过至少四种机制刺激钾分泌''': | ||
# 细胞外液钾浓度增加刺激Na | # 细胞外液钾浓度增加刺激Na+-K+ ATP酶泵,从而增加钾通过基底外侧膜的摄取。这种增加的钾摄取反过来增加了细胞内钾离子浓度,导致钾通过管腔膜扩散到小管中。 | ||
# 细胞外钾浓度增加增加了从肾间质液到上皮细胞内部的钾梯度,从而减少了钾离子从细胞内部通过基底外侧膜的反向泄漏。 | # 细胞外钾浓度增加增加了从肾间质液到上皮细胞内部的钾梯度,从而减少了钾离子从细胞内部通过基底外侧膜的反向泄漏。 | ||
# 钾摄入增加刺激钾通道的合成及其从细胞质到管腔膜的转运,从而增加了钾通过膜的扩散。 | # 钾摄入增加刺激钾通道的合成及其从细胞质到管腔膜的转运,从而增加了钾通过膜的扩散。 | ||
# 钾离子浓度的增加刺激肾上腺皮质分泌醛固酮(aldosterone),这进一步刺激钾离子的分泌,如下所述。 | # 钾离子浓度的增加刺激肾上腺皮质分泌醛固酮(aldosterone),这进一步刺激钾离子的分泌,如下所述。 | ||
'''醛固酮刺激钾离子分泌'''。醛固酮刺激远端小管和集合管(collecting ducts)的主细胞(principal cells)主动重吸收钠离子(见第28章)。这种效应是通过Na | '''醛固酮刺激钾离子分泌'''。醛固酮刺激远端小管和集合管(collecting ducts)的主细胞(principal cells)主动重吸收钠离子(见第28章)。这种效应是通过Na+-K+ ATP酶泵介导的,该泵将钠离子通过细胞的基底外侧膜(basolateral membrane)向外转运至肾间质液(renal interstitial fluid),同时将钾离子泵入细胞内。因此,醛固酮对控制主细胞分泌钾离子和重吸收钠离子的速率也有强大的影响。 | ||
醛固酮的第二个作用是增加管腔膜(luminal membrane)中钾离子通道的数量,从而提高其对钾离子的通透性,进一步增强醛固酮刺激钾离子分泌的效果。因此,醛固酮对增加钾离子排泄具有强大的作用,如图30-4所示。 | 醛固酮的第二个作用是增加管腔膜(luminal membrane)中钾离子通道的数量,从而提高其对钾离子的通透性,进一步增强醛固酮刺激钾离子分泌的效果。因此,醛固酮对增加钾离子排泄具有强大的作用,如图30-4所示。 | ||
| 第1,801行: | 第1,906行: | ||
醛固酮反馈系统在控制钾浓度中的特殊定量重要性如图30-8所示。在这个实验中,钾摄入量在两种情况下几乎增加了七倍:(1)在正常情况下;(2)在醛固酮反馈系统被阻断后,通过切除肾上腺并以固定速率输注醛固酮,使血浆醛固酮浓度保持在正常水平,但在钾摄入量变化时既不能增加也不能减少。 | 醛固酮反馈系统在控制钾浓度中的特殊定量重要性如图30-8所示。在这个实验中,钾摄入量在两种情况下几乎增加了七倍:(1)在正常情况下;(2)在醛固酮反馈系统被阻断后,通过切除肾上腺并以固定速率输注醛固酮,使血浆醛固酮浓度保持在正常水平,但在钾摄入量变化时既不能增加也不能减少。 | ||
'''图 30-9.''' 皮质集合管中的流速与钾分泌之间的关系以及钾摄入量变化的影响。注意,高钾饮食显著增强了增加管流速以增加钾分泌的效果。阴影条显示了大多数生理条件下的大致正常管流速。(数据来自Malnic G, Berliner RW, Giebisch G: Flow dependence of K | '''图 30-9.''' 皮质集合管中的流速与钾分泌之间的关系以及钾摄入量变化的影响。注意,高钾饮食显著增强了增加管流速以增加钾分泌的效果。阴影条显示了大多数生理条件下的大致正常管流速。(数据来自Malnic G, Berliner RW, Giebisch G: Flow dependence of K+ secretion in cortical distal tubes of the rat. Am J Physiol 256:F932, 1989.) | ||
注意,在正常动物中,钾摄入量增加七倍仅导致血浆钾浓度从4.2略微增加到4.3mEq/L。因此,当醛固酮反馈系统正常工作时,尽管钾摄入量发生大幅变化,钾浓度仍能得到精确控制。 | 注意,在正常动物中,钾摄入量增加七倍仅导致血浆钾浓度从4.2略微增加到4.3mEq/L。因此,当醛固酮反馈系统正常工作时,尽管钾摄入量发生大幅变化,钾浓度仍能得到精确控制。 | ||
| 第1,821行: | 第1,926行: | ||
增加的小管流量在钠摄入量变化期间对维持正常的钾排泄( potassium excretion )尤为重要。例如,在高钠摄入时,醛固酮( aldosterone )分泌减少,这本身会倾向于降低钾的分泌速率,从而减少尿中钾的排泄。然而,高钠摄入时伴随的远端小管高流量倾向于增加钾的分泌(图30-10)。因此,高钠摄入的两个效应——醛固酮分泌减少和小管流量增加——相互抵消,因此钾排泄几乎没有变化。同样,在低钠摄入时,由于醛固酮分泌增加和小管流量减少对钾分泌的抵消效应,钾排泄也几乎没有变化。 | 增加的小管流量在钠摄入量变化期间对维持正常的钾排泄( potassium excretion )尤为重要。例如,在高钠摄入时,醛固酮( aldosterone )分泌减少,这本身会倾向于降低钾的分泌速率,从而减少尿中钾的排泄。然而,高钠摄入时伴随的远端小管高流量倾向于增加钾的分泌(图30-10)。因此,高钠摄入的两个效应——醛固酮分泌减少和小管流量增加——相互抵消,因此钾排泄几乎没有变化。同样,在低钠摄入时,由于醛固酮分泌增加和小管流量减少对钾分泌的抵消效应,钾排泄也几乎没有变化。 | ||
急性酸中毒( acidosis )减少钾的分泌。细胞外液氢离子浓度( hydrogen ion concentration )的急性增加(酸中毒)会减少钾的分泌,而氢离子浓度的减少(碱中毒( alkalosis ))会增加钾的分泌。氢离子浓度增加抑制钾分泌的主要机制是通过降低Na | 急性酸中毒( acidosis )减少钾的分泌。细胞外液氢离子浓度( hydrogen ion concentration )的急性增加(酸中毒)会减少钾的分泌,而氢离子浓度的减少(碱中毒( alkalosis ))会增加钾的分泌。氢离子浓度增加抑制钾分泌的主要机制是通过降低Na+-K+ ATPase泵的活性。这种降低反过来减少了细胞内钾的浓度,并减少了钾通过管腔膜( luminal membrane )进入小管的被动扩散( passive diffusion )。酸中毒还可能减少管腔膜上的钾通道数量。 | ||
在持续数天的更长时间的酸中毒中,尿中钾的排泄会增加。这种效应的机制部分是由于慢性酸中毒抑制了近端小管( proximal tubule )对氯化钠和水的重吸收( reabsorption ),从而增加了远端小管的流量,进而刺激了钾的分泌。这种效应超过了氢离子对Na | 在持续数天的更长时间的酸中毒中,尿中钾的排泄会增加。这种效应的机制部分是由于慢性酸中毒抑制了近端小管( proximal tubule )对氯化钠和水的重吸收( reabsorption ),从而增加了远端小管的流量,进而刺激了钾的分泌。这种效应超过了氢离子对Na+-K+ ATPase泵的抑制作用。因此,慢性酸中毒导致钾的丢失,而急性酸中毒则导致钾排泄减少。 | ||
=== 高钾低钠饮食的益处 === | === 高钾低钠饮食的益处 === | ||
| 第2,080行: | 第2,185行: | ||
一旦液体和蛋白质从循环中丢失,肾脏的反应与其他与血浆容量减少相关的情况相似。也就是说,肾脏继续保留盐和水,直到血浆容量和动脉血压恢复到正常水平。在某些情况下,由于肝硬化中血管容量的增加,血浆容量实际上可能超过正常水平;门脉循环中的高压可以极大地扩张静脉,从而增加血管容量。 | 一旦液体和蛋白质从循环中丢失,肾脏的反应与其他与血浆容量减少相关的情况相似。也就是说,肾脏继续保留盐和水,直到血浆容量和动脉血压恢复到正常水平。在某些情况下,由于肝硬化中血管容量的增加,血浆容量实际上可能超过正常水平;门脉循环中的高压可以极大地扩张静脉,从而增加血管容量。 | ||
Curry JN, Yu ASL: Magnesium handling in the kidney. Adv Chronic Kidney Dis 25:236, 2018. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev 95:1, 2015. DuBose TD Jr: Regulation of potassium homeostasis in CKD. Adv Chronic Kidney Dis 24:305, 2017. Ellison DH, Felker GM: Diuretic treatment in heart failure. N Engl J Med 377:1964, 2017. Ferrè S, Hoenderop JG, Bindels RJ: Sensing mechanisms involved in | Curry JN, Yu ASL: Magnesium handling in the kidney. Adv Chronic Kidney Dis 25:236, 2018. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev 95:1, 2015. DuBose TD Jr: Regulation of potassium homeostasis in CKD. Adv Chronic Kidney Dis 24:305, 2017. Ellison DH, Felker GM: Diuretic treatment in heart failure. N Engl J Med 377:1964, 2017. Ferrè S, Hoenderop JG, Bindels RJ: Sensing mechanisms involved in Ca+++ and Mg++ homeostasis. Kidney Int 82:1157, 2012. Guyton AC: Blood pressure control—special role of the kidneys and body fluids. Science 252:1813, 1991. Hall JE: The kidney, hypertension, and obesity. Hypertension 41:625, 2003. | ||
Hall JE, do Carmo JM, da Silva AA, Wang Z, Hall ME: 肥胖、肾功能障碍和高血压:机制联系。Nature Reviews Nephrology 15: 367, 2019. Hall JE, Granger JP, do Carmo JM, 等: 高血压:生理学和病理生理学。Compr Physiol 2:2393, 2012. Hebert SC, Desir G, Giebisch G, Wang W: 肾脏钾通道的分子多样性和调控。Physiol Rev 85:319, 2005. Kamel KS, Schreiber M, Halperin ML: 肾脏钾生理学:整合肾脏对饮食钾耗竭的反应。Kidney Int 93:41, 2018. McDonough AA, Youn JH: 钾稳态:已知、未知和健康益处。Physiology (Bethesda) 32:100, 2017. Moe SM: 健康和肾脏疾病中的钙稳态。Compr Physiol 6:1781, 2016. Mullens W, Verbrugge FH, Nijst P, Tang WHW: 心力衰竭中的肾脏钠渴求:从病理生理学到治疗策略。Eur Heart J 38:1872, 2017. Palmer BF: 钾稳态的调控。Clin J Am Soc Nephrol 10:1050, 2015. Rossier BC, Baker ME, Studer RA: 上皮钠转运及其由醛固酮调控:我们内部环境的故事再探。Physiol Rev 95:297, 2015 Staruschenko A: 高钾的有益作用:肾脏基底外侧K+通道的贡献。Hypertension 71:1015, 2018. Whelton PK, Appel LJ, Sacco RL, 等: 钠、血压和心血管疾病:进一步支持美国心脏协会钠减少建议的证据。Circulation 126:2880, 2012. Young DB: 醛固酮在钾调控中的作用的定量分析。Am J Physiol 255:F811, 1988. | Hall JE, do Carmo JM, da Silva AA, Wang Z, Hall ME: 肥胖、肾功能障碍和高血压:机制联系。Nature Reviews Nephrology 15: 367, 2019. Hall JE, Granger JP, do Carmo JM, 等: 高血压:生理学和病理生理学。Compr Physiol 2:2393, 2012. Hebert SC, Desir G, Giebisch G, Wang W: 肾脏钾通道的分子多样性和调控。Physiol Rev 85:319, 2005. Kamel KS, Schreiber M, Halperin ML: 肾脏钾生理学:整合肾脏对饮食钾耗竭的反应。Kidney Int 93:41, 2018. McDonough AA, Youn JH: 钾稳态:已知、未知和健康益处。Physiology (Bethesda) 32:100, 2017. Moe SM: 健康和肾脏疾病中的钙稳态。Compr Physiol 6:1781, 2016. Mullens W, Verbrugge FH, Nijst P, Tang WHW: 心力衰竭中的肾脏钠渴求:从病理生理学到治疗策略。Eur Heart J 38:1872, 2017. Palmer BF: 钾稳态的调控。Clin J Am Soc Nephrol 10:1050, 2015. Rossier BC, Baker ME, Studer RA: 上皮钠转运及其由醛固酮调控:我们内部环境的故事再探。Physiol Rev 95:297, 2015 Staruschenko A: 高钾的有益作用:肾脏基底外侧K+通道的贡献。Hypertension 71:1015, 2018. Whelton PK, Appel LJ, Sacco RL, 等: 钠、血压和心血管疾病:进一步支持美国心脏协会钠减少建议的证据。Circulation 126:2880, 2012. Young DB: 醛固酮在钾调控中的作用的定量分析。Am J Physiol 255:F811, 1988. | ||
= 酸碱调节 = | = 酸碱调节 = | ||
氢离子\left(H | 氢离子\left(H+\right)的调节在某种程度上与体内其他离子的调节相似。例如,必须保持H+的摄入或产生与\Hat从体内的净排出之间的平衡,以实现稳态。而且,与其他离子一样,肾脏在调节\ H+从体内的排出中起着关键作用。然而,精确控制细胞外液\Hat浓度远不止肾脏简单排出H+。涉及血液、细胞和肺的多种酸碱缓冲机制对于维持细胞外和细胞内液中正常的H+浓度也至关重要。 | ||
在本章中,我们将探讨调节\Hat浓度的机制,特别强调肾脏\Hat分泌以及肾脏对碳酸氢根离子\left(HCO_3 | 在本章中,我们将探讨调节\Hat浓度的机制,特别强调肾脏\Hat分泌以及肾脏对碳酸氢根离子\left(HCO_3-\right)的重吸收、产生和排泄,这是体液中酸碱控制系统的关键组成部分之一。 | ||
== 氢离子浓度被精确调控 == | == 氢离子浓度被精确调控 == | ||
精确的H | 精确的H+调控至关重要,因为体内几乎所有酶系统的活性都受到H+浓度的影响。因此,H+浓度的变化几乎会改变所有细胞和身体功能。 | ||
与其他离子相比,体液中\Hat的浓度通常保持在较低水平。例如,细胞外液中的钠离子浓度(142mEq/L)大约是正常\ H | 与其他离子相比,体液中\Hat的浓度通常保持在较低水平。例如,细胞外液中的钠离子浓度(142mEq/L)大约是正常\ H+浓度的350万倍,而\ H+的平均浓度仅为\mathtt0.00004m E q/L。同样重要的是,细胞外液中\Hat浓度的正常变化范围仅为钠离子\left(Na+\right)浓度正常变化范围的百万分之一。因此,H+的精确调节强调了其对各种细胞功能的重要性。 | ||
=== 酸和碱——定义与意义 === | === 酸和碱——定义与意义 === | ||
氢离子是从氢原子中释放出的单个自由质子。含有氢原子且能在溶液中释放氢离子的分子被称为酸(acid)。例如,盐酸(HCl)在水中电离形成氢离子\left(H | 氢离子是从氢原子中释放出的单个自由质子。含有氢原子且能在溶液中释放氢离子的分子被称为酸(acid)。例如,盐酸(HCl)在水中电离形成氢离子\left(H+\right)和氯离子\left(Cl-\right)。同样,碳酸(H_2C O_3)在水中电离形成\Hat和碳酸氢根离子\left(HCO_3-\right)。 | ||
碱(base)是能够接受H | 碱(base)是能够接受H+的离子或分子。例如,HCO_3-是一种碱,因为它可以与\Hat结合形成H_2CO_3。同样,HPO_4=也是一种碱,因为它可以接受H+形成H_2PO_4-。体内的蛋白质也作为碱发挥作用,因为构成蛋白质的某些氨基酸带有净负电荷,能够轻易接受H+。红细胞中的血红蛋白和体内其他细胞中的蛋白质是体内最重要的碱之一。 | ||
术语“碱”和“碱金属”经常被同义使用。碱金属是由一种或多种碱金属(如钠、钾和锂)与高度碱性的离子(如羟基离子\left(OH | 术语“碱”和“碱金属”经常被同义使用。碱金属是由一种或多种碱金属(如钠、钾和锂)与高度碱性的离子(如羟基离子\left(OH-\right))结合形成的分子。这些分子的碱部分迅速与\Hat反应,将其从溶液中移除,因此是典型的碱。出于类似的原因,术语“碱中毒”(alkalosis)指的是体液中H+的过度移除,而\Hat的过度添加则被称为酸中毒(acidosis)。 | ||
强酸和弱酸,强碱和弱碱。强酸(strong acid),如HCl,迅速解离并在溶液中释放大量H | 强酸和弱酸,强碱和弱碱。强酸(strong acid),如HCl,迅速解离并在溶液中释放大量H+。弱酸(weak acid),如H_2CO_3,不太容易解离其离子,因此释放H+的能力较弱。强碱(strong base)是一种能够迅速且强烈地与H+反应并从溶液中快速移除H+的物质。典型的例子是OH-,它与\ H+反应形成水(H_2O)。典型的弱碱(weak base)是HCO_3-,因为它与\Hat的结合能力比OH-弱得多。参与正常酸碱调节的细胞外液中的大多数酸和碱都是弱酸和弱碱。我们讨论的最重要的酸和碱是碳酸(H_2C O_3)和HCO_3-碱。 | ||
正常体液中的 H | 正常体液中的 H+ 浓度和 pH 值以及酸中毒和碱中毒时的变化。血液中的 \ H+ 浓度通常维持在严格的范围内,正常值约为 0.00004 mEq/L (40nEq/L)。正常波动仅为约 3 到 5nEq/L,但在极端条件下,\ H+ 浓度可以从低至 10nEq/L 到高达 160 nEq/L 之间变化,而不会导致死亡。 | ||
由于 H | 由于 H+ 浓度通常较低,且这些较小的数值较为繁琐,习惯上使用 pH 单位以对数尺度表示 \Hat 浓度。pH 与实际 H+ 浓度的关系由以下公式表示(H+ 浓度 \left[H+\right] 以每升当量表示): | ||
p H=l o g\frac1\left[H | p H=l o g\frac1\left[H+\right]=-l o g\left[H+\right] | ||
例如,正常的 \left[H | 例如,正常的 \left[H+\right] 为 40nEq/L (0.00000004 Eq/L, )。因此,正常的 pH 如下: | ||
\beginarrayl lp H=-\log\left[0.00000004\right]\ p H=7.4\endarray | \beginarrayl lp H=-\log\left[0.00000004\right]\ p H=7.4\endarray | ||
从该公式可以看出,pH 与 \ H | 从该公式可以看出,pH 与 \ H+ 浓度呈反比关系;因此,低 pH 对应于高 \Hat 浓度,而高 pH 对应于低 H+ 浓度。 | ||
动脉血的正常 pH 为 7.4,而静脉血和组织间液的 pH 约为 7.35,这是因为从组织中释放的额外二氧化碳 (CO_2) 在这些液体中形成 H_2CO_3(表 31-1)。由于动脉血的正常 pH 为 7.4,当 pH 显著低于此值时,被认为存在酸血症(acidemia),而当 pH 高于 7.4 时,则被认为存在碱血症(alkalemia)。人类可以存活超过几小时的 pH 下限约为 6.8,上限约为 8.0。 | 动脉血的正常 pH 为 7.4,而静脉血和组织间液的 pH 约为 7.35,这是因为从组织中释放的额外二氧化碳 (CO_2) 在这些液体中形成 H_2CO_3(表 31-1)。由于动脉血的正常 pH 为 7.4,当 pH 显著低于此值时,被认为存在酸血症(acidemia),而当 pH 高于 7.4 时,则被认为存在碱血症(alkalemia)。人类可以存活超过几小时的 pH 下限约为 6.8,上限约为 8.0。 | ||
| 第2,127行: | 第2,228行: | ||
细胞内 pH 通常略低于血浆 pH,因为细胞代谢会产生酸,尤其是 H_2CO_3。根据细胞类型的不同,细胞内液的 pH 估计在 6.0 到 7.4 之间。组织缺氧和血流不足会导致酸积累和细胞内 pH 降低。术语酸中毒(acidosis)和碱中毒(alkalosis)分别描述了导致酸血症和碱血症的过程。 | 细胞内 pH 通常略低于血浆 pH,因为细胞代谢会产生酸,尤其是 H_2CO_3。根据细胞类型的不同,细胞内液的 pH 估计在 6.0 到 7.4 之间。组织缺氧和血流不足会导致酸积累和细胞内 pH 降低。术语酸中毒(acidosis)和碱中毒(alkalosis)分别描述了导致酸血症和碱血症的过程。 | ||
尿液的 pH 可以在 4.5 到 8.0 之间变化,具体取决于细胞外液的酸碱状态。正如后面所讨论的,肾脏通过以不同速率排泄酸或碱,在纠正细胞外液 H | 尿液的 pH 可以在 4.5 到 8.0 之间变化,具体取决于细胞外液的酸碱状态。正如后面所讨论的,肾脏通过以不同速率排泄酸或碱,在纠正细胞外液 H+ 浓度异常方面起着重要作用。 | ||
表 31-1 体液的 pH 和 H | 表 31-1 体液的 pH 和 H+ 浓度 | ||
markdown <nowiki><html><body><table><tr></nowiki><nowiki><td colspan="2"></nowiki>H+浓度(mEq/L) pH<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>细胞外液<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>动脉血<nowiki></td></nowiki><nowiki><td></nowiki>4.0x10-5 7.40<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>静脉血 4.5 × 10-5<nowiki></td></nowiki><nowiki><td></nowiki>7.35<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>间质液 4.5 x 10-5<nowiki></td></nowiki><nowiki><td></nowiki>7.35<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>细胞内液 1 x10-3 to 4×10-5<nowiki></td></nowiki><nowiki><td></nowiki>6.0-7.4<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>尿液 3 × 10-2 to 1 x 10-5<nowiki></td></nowiki><nowiki><td></nowiki>4.5-8.0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>胃酸 160<nowiki></td></nowiki><nowiki><td></nowiki>0.8<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | markdown <nowiki><html><body><table><tr></nowiki><nowiki><td colspan="2"></nowiki>H+浓度(mEq/L) pH<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>细胞外液<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>动脉血<nowiki></td></nowiki><nowiki><td></nowiki>4.0x10-5 7.40<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>静脉血 4.5 × 10-5<nowiki></td></nowiki><nowiki><td></nowiki>7.35<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>间质液 4.5 x 10-5<nowiki></td></nowiki><nowiki><td></nowiki>7.35<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>细胞内液 1 x10-3 to 4×10-5<nowiki></td></nowiki><nowiki><td></nowiki>6.0-7.4<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>尿液 3 × 10-2 to 1 x 10-5<nowiki></td></nowiki><nowiki><td></nowiki>4.5-8.0<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>胃酸 160<nowiki></td></nowiki><nowiki><td></nowiki>0.8<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | ||
一个极端的酸性体液例子是胃黏膜的壁细胞(oxyntic cells)分泌到胃中的HCl,如第65章所讨论的。这些细胞中的H | 一个极端的酸性体液例子是胃黏膜的壁细胞(oxyntic cells)分泌到胃中的HCl,如第65章所讨论的。这些细胞中的H+浓度大约是血液中氢离子浓度的400万倍,pH值为0.8。在本章的剩余部分,我们将讨论细胞外液\Hat浓度的调节。 | ||
== 防御\mathbbH | == 防御\mathbbH+浓度变化:缓冲系统、肺和肾脏 == | ||
三个主要系统调节体液中的\Hat浓度:(1) 体液中的化学酸碱缓冲系统,它们立即与酸或碱结合,以防止H | 三个主要系统调节体液中的\Hat浓度:(1) 体液中的化学酸碱缓冲系统,它们立即与酸或碱结合,以防止H+浓度的过度变化;(2) 呼吸中枢,调节细胞外液中CO_2(因此,H_2CO_3)的排出;(3) 肾脏,可以排泄酸性或碱性尿液,从而在酸中毒或碱中毒期间将细胞外液\Hat浓度调整回正常。 | ||
当\ H | 当\ H+浓度发生变化时,体液的缓冲系统在几秒钟内反应,以最小化这些变化。缓冲系统不会从体内消除\Hat或向体内添加H+,而只是将它们束缚住,直到可以重新建立平衡。 | ||
第二道防线,呼吸系统,在几分钟内起作用,以消除CO_2,因此,H_2CO_3从体内排出。 | 第二道防线,呼吸系统,在几分钟内起作用,以消除CO_2,因此,H_2CO_3从体内排出。 | ||
这两道防线防止H | 这两道防线防止H+浓度变化过大,直到反应较慢的第三道防线,肾脏,可以从体内消除多余的酸或碱。尽管肾脏与其他防御系统相比反应较慢,但在几小时到几天的时间内,它们是迄今为止最强大的酸碱调节系统。 | ||
=== 体液中的\Hat\HatH | === 体液中的\Hat\HatH+缓冲 === | ||
缓冲剂是任何可以可逆地结合\Hat的物质。缓冲反应的一般形式如下: | 缓冲剂是任何可以可逆地结合\Hat的物质。缓冲反应的一般形式如下: | ||
缓冲剂 +H | 缓冲剂 +H+\LongleftrightarrowH 缓冲剂 | ||
在这个例子中,一个自由的H | 在这个例子中,一个自由的H+与缓冲剂结合形成一个弱酸(H缓冲剂),它可以保持为未结合的分子,或者解离回缓冲剂和H+。当H+浓度增加时,反应被迫向右进行,只要有缓冲剂可用,更多的H+就会与缓冲剂结合。相反,当H+浓度降低时,反应向左移动,H+从缓冲剂中释放出来。通过这种方式,H+浓度的变化被最小化。 | ||
如果考虑到体液中H | 如果考虑到体液中H+的低浓度以及每天体内产生的相对大量的酸,体液缓冲系统的重要性就显而易见了。每天通过代谢摄入或产生的H+约为80mil当量,而体液中H+的浓度通常仅为0.00004mEq/L。如果没有缓冲作用,每天产生的酸和摄入的酸会导致体液H+浓度发生致命的变化。 | ||
酸碱缓冲系统的作用或许可以通过考虑细胞外液中数量上最重要的缓冲系统——碳酸氢盐缓冲系统来最好地解释。 | 酸碱缓冲系统的作用或许可以通过考虑细胞外液中数量上最重要的缓冲系统——碳酸氢盐缓冲系统来最好地解释。 | ||
| 第2,160行: | 第2,261行: | ||
H_2CO_3在体内通过CO_2与H_2O的反应形成: | H_2CO_3在体内通过CO_2与H_2O的反应形成: | ||
C O_2+H_2O\xrightarrow[]\DeltanhydraseH_2C O_3 | C O_2+H_2O\xrightarrow[]\DeltanhydraseH_2C O_3 | ||
该反应速度较慢,除非存在碳酸酐酶(carbonic anhydrase),否则形成的H_2CO_3量极少。这种酶在肺肺泡壁中特别丰富,CO_2在此处释放;碳酸酐酶也存在于肾小管的上皮细胞中,CO_2在此处与H_2O反应形成H_2CO_3。 | 该反应速度较慢,除非存在碳酸酐酶(carbonic anhydrase),否则形成的H_2CO_3量极少。这种酶在肺肺泡壁中特别丰富,CO_2在此处释放;碳酸酐酶也存在于肾小管的上皮细胞中,CO_2在此处与H_2O反应形成H_2CO_3。 | ||
H_2CO_3弱电离形成少量的H | H_2CO_3弱电离形成少量的H+和HCO_3-: | ||
H_2C O_3\longleftrightarrowH | H_2C O_3\longleftrightarrowH++H C O_3- | ||
该系统的第二个成分,碳酸氢盐,在细胞外液中主要以NaHCO_3的形式存在。NaHCO_3几乎完全电离形成HCO_3 | 该系统的第二个成分,碳酸氢盐,在细胞外液中主要以NaHCO_3的形式存在。NaHCO_3几乎完全电离形成HCO_3-和Na+,如下所示: | ||
N a H C O_3\longrightarrowN a | N a H C O_3\longrightarrowN a++H C O_3 | ||
现在,将整个系统结合起来,我们得到以下反应: | 现在,将整个系统结合起来,我们得到以下反应: | ||
C O_2+H_2O\LongleftrightarrowH_2C O_3\LongleftrightarrowH | C O_2+H_2O\LongleftrightarrowH_2C O_3\LongleftrightarrowH++\underbraceH C O_3_N a+ | ||
由于H_2CO_3的弱电离,H | 由于H_2CO_3的弱电离,H+的浓度极低。 | ||
当强酸如HCl加入碳酸氢盐缓冲溶液时,酸释放的H | 当强酸如HCl加入碳酸氢盐缓冲溶液时,酸释放的H+增加(HCl\toH++Cl-),并被HCO_3-缓冲: | ||
\uparrowH | \uparrowH++HCO_3-\toH_2CO_3\toCO_2+H_2O | ||
结果,更多的H_2CO_3形成,导致CO_2和H_2O的产生增加。从这些反应中可以看出,强酸HCl中的H | 结果,更多的H_2CO_3形成,导致CO_2和H_2O的产生增加。从这些反应中可以看出,强酸HCl中的H+与HCO_3-反应形成非常弱的酸H_2CO_3,后者又形成CO_2和H_2O。过量的CO_2极大地刺激了呼吸,从而从细胞外液中消除了CO_2。 | ||
当强碱,如氢氧化钠(NaOH),被添加到碳酸氢盐缓冲溶液中时,会发生相反的反应。 | 当强碱,如氢氧化钠(NaOH),被添加到碳酸氢盐缓冲溶液中时,会发生相反的反应。 | ||
N a O H+H_2C O_3\toN a H C O_3+H_2O | N a O H+H_2C O_3\toN a H C O_3+H_2O | ||
在这种情况下,NaOH中的OH | 在这种情况下,NaOH中的OH-与H_2CO_3结合形成额外的HCO_3-。因此,弱碱NaHCO_3取代了强碱NaOH。同时,H_2CO_3的浓度降低(因为它与NaOH反应),导致更多的CO_2与H_2O结合以取代H_2CO_3: | ||
\beginarrayc c cC O_2+H_2O\longrightarrowH_2C O_3\longrightarrow\uparrow H C O_3 | \beginarrayc c cC O_2+H_2O\longrightarrowH_2C O_3\longrightarrow\uparrow H C O_3-+H+&&\ &+&\ &&N a O H&N a\endarray | ||
因此,净结果是血液中的CO_2水平趋于下降,但血液中CO_2的减少抑制了呼吸并降低了CO_2的呼出速率。血液中HCO_3 | 因此,净结果是血液中的CO_2水平趋于下降,但血液中CO_2的减少抑制了呼吸并降低了CO_2的呼出速率。血液中HCO_3-浓度的上升通过增加肾脏对HCO_3-的排泄来补偿。 | ||
==== 碳酸氢盐缓冲系统的定量动力学 ==== | ==== 碳酸氢盐缓冲系统的定量动力学 ==== | ||
所有酸,包括H_2CO_3,都在一定程度上电离。从质量平衡的角度来看,\ H | 所有酸,包括H_2CO_3,都在一定程度上电离。从质量平衡的角度来看,\ H+和HCO_3-的浓度与H_2CO_3的浓度成正比: | ||
H_2C O_3\longleftrightarrow H | H_2C O_3\longleftrightarrow H++H C O_3 | ||
对于任何酸,酸相对于其解离离子的浓度由解离常数K | 对于任何酸,酸相对于其解离离子的浓度由解离常数K\prime定义。 | ||
K | K\prime=\fracH+× HCO_3-H_2CO_3 | ||
这个方程表明,在H_2CO_3溶液中,游离\ H | 这个方程表明,在H_2CO_3溶液中,游离\ H+的量等于 | ||
H | H+=K\prime×\fracH_2C O_3H C O_3- | ||
未解离的H_2CO_3的浓度不能在溶液中测量,因为它迅速解离成CO_2和H_2O或H | 未解离的H_2CO_3的浓度不能在溶液中测量,因为它迅速解离成CO_2和H_2O或H+和HCO_3-。然而,溶解在血液中的CO_2与未解离的H_2CO_3的量成正比。因此,方程2可以重写如下: | ||
\sf H | \sf H+=\sf K×\frac\sf C O_2\sf H C O_3- | ||
方程3的解离常数(K)仅为方程2的解离常数(K | 方程3的解离常数(K)仅为方程2的解离常数(K\prime)的约1/400,因为H_2CO_3与CO_2之间的比例比为1:400。 | ||
方程3是以溶液中溶解的CO_2总量表示的。然而,大多数临床实验室测量的是血液中的CO_2张力\left(PCO_2\right),而不是实际的CO_2量。幸运的是,血液中的CO_2量是Pco_2乘以CO_2的溶解度系数( solubility coefficient )的线性函数;在生理条件下,CO_2的溶解度系数在体温下为0.03mmol/mmHg。这意味着每测量到1 mm HgPCO_2,血液中就存在0.03毫摩尔的H_2CO_3。因此,方程3可以重写为 | 方程3是以溶液中溶解的CO_2总量表示的。然而,大多数临床实验室测量的是血液中的CO_2张力\left(PCO_2\right),而不是实际的CO_2量。幸运的是,血液中的CO_2量是Pco_2乘以CO_2的溶解度系数( solubility coefficient )的线性函数;在生理条件下,CO_2的溶解度系数在体温下为0.03mmol/mmHg。这意味着每测量到1 mm HgPCO_2,血液中就存在0.03毫摩尔的H_2CO_3。因此,方程3可以重写为 | ||
H | H+=K×\frac(0.03×P C O_2)HC O_3- | ||
Henderson-Hasselbalch方程。如前所述,通常用pH单位表示\H | Henderson-Hasselbalch方程。如前所述,通常用pH单位表示\H+浓度,而不是实际浓度。回想一下,pH=-logH+。 | ||
解离常数(pK)可以用类似的方式表示。 | 解离常数(pK)可以用类似的方式表示。 | ||
p K=-l o gK | p K=-l o gK | ||
因此,我们可以通过对该方程取负对数,将方程4中的\Hat浓度表示为pH单位,得到以下结果: | 因此,我们可以通过对该方程取负对数,将方程4中的\Hat浓度表示为pH单位,得到以下结果: | ||
-\logH | -\logH+=-\logp K-\log\frac(0.03×P c o_2)HC O_3- | ||
因此, | 因此, | ||
p H=p K-l o g\frac(0.03×P c o_2)H C O_3 | p H=p K-l o g\frac(0.03×P c o_2)H C O_3- | ||
为了避免使用负对数,我们可以改变对数的符号,并使用对数定律反转最后一项的分子和分母,得到以下结果: | 为了避免使用负对数,我们可以改变对数的符号,并使用对数定律反转最后一项的分子和分母,得到以下结果: | ||
p H=p K+10g\fracH C O_3 | p H=p K+10g\fracH C O_3-(0.03×P C O_2) | ||
对于碳酸氢盐缓冲系统,pK为6.1,方程7可以写成如下形式: | 对于碳酸氢盐缓冲系统,pK为6.1,方程7可以写成如下形式: | ||
肾脏控制着细胞外液中的HCO_3 | 肾脏控制着细胞外液中的HCO_3-浓度,而细胞外液中的P C O_2由呼吸速率控制。通过增加呼吸速率,肺部从血浆中去除CO_2,通过减少呼吸速率,肺部提高Pco_2。正常的生理酸碱稳态是肺和肾脏协调作用的结果,当这些控制机制中的一个或两个受损时,就会发生酸碱紊乱,从而改变细胞外液的HCO_3-浓度或Pco_2。 | ||
当酸碱平衡的紊乱是由于细胞外液HCO_3 | 当酸碱平衡的紊乱是由于细胞外液HCO_3-浓度的主要变化引起的,它们被称为代谢性酸碱紊乱。因此,由HCO_3-浓度主要降低引起的酸中毒称为代谢性酸中毒( metabolic acidosis ),而由HCO_3-浓度主要增加引起的碱中毒称为代谢性碱中毒( metabolic alkalosis )。由Pco_2增加引起的酸中毒称为呼吸性酸中毒( respiratory acidosis ),而由Pco_2减少引起的碱中毒称为呼吸性碱中毒( respiratory alkalosis )。 | ||
=== 碳酸氢盐缓冲系统滴定曲线 === | === 碳酸氢盐缓冲系统滴定曲线 === | ||
图31-1显示了当细胞外液中HCO_3 | 图31-1显示了当细胞外液中HCO_3-与CO_2的比例发生变化时,细胞外液pH的变化。当这两种组分的浓度相等时,方程式8的右侧部分变为1的对数,即等于0。因此,当缓冲系统的两种组分相等时,溶液的pH与碳酸氢盐缓冲系统的pK(6.1)相同。当向系统中加入碱时,部分溶解的CO_2会转化为HCO_3-,导致HCO_3-与CO_2的比例增加,从而使pH升高,这一点可以从Henderson-Hasselbalch方程中看出。当加入酸时,酸会被HCO_3-缓冲,HCO_3-随后转化为溶解的CO_2,导致HCO_3-与CO_2的比例降低,从而使细胞外液的pH下降。 | ||
=== 缓冲能力由缓冲组分的量和相对浓度决定 === | === 缓冲能力由缓冲组分的量和相对浓度决定 === | ||
从图31-1的滴定曲线中可以看出几个要点。首先,当每种组分(HCO_3 | 从图31-1的滴定曲线中可以看出几个要点。首先,当每种组分(HCO_3-和CO_2)占缓冲系统总浓度的50%时,系统的pH与pK相同。其次,缓冲系统在曲线的中心部分最为有效,此时pH接近系统的pK。这种现象意味着,当pH接近系统的pK时,向系统中加入任何给定量的酸或碱所引起的pH变化最小。缓冲系统在pK两侧1.0pH单位范围内仍然相当有效,对于碳酸氢盐缓冲系统来说,这一范围从pH约为5.1到7.1单位。超出这些范围,缓冲能力迅速减弱。当所有的CO_2都转化为HCO_3-,或者所有的HCO_3-都转化为CO_2时,系统将不再具有缓冲能力。 | ||
p H=6.1+l o g\fracH C O_3 | p H=6.1+l o g\fracH C O_3-0.03×P c o_2 | ||
方程式8是Henderson-Hasselbalch方程,通过它,如果已知HCO_3 | 方程式8是Henderson-Hasselbalch方程,通过它,如果已知HCO_3-的摩尔浓度和Pco_2,就可以计算出溶液的pH。 | ||
从Henderson-Hasselbalch方程可以看出,HCO_3 | 从Henderson-Hasselbalch方程可以看出,HCO_3-浓度的增加会导致pH升高,使酸碱平衡向碱中毒方向偏移。Pco_2的增加会导致pH降低,使酸碱平衡向酸中毒方向偏移。 | ||
Henderson-Hasselbalch方程不仅定义了细胞外液中正常pH调节和酸碱平衡的决定因素,还提供了对细胞外液中酸碱成分生理控制的深入理解。正如后面所讨论的,HCO_3 | Henderson-Hasselbalch方程不仅定义了细胞外液中正常pH调节和酸碱平衡的决定因素,还提供了对细胞外液中酸碱成分生理控制的深入理解。正如后面所讨论的,HCO_3-浓度主要由肾脏调节。 | ||
图31-1. 碳酸氢盐缓冲系统的滴定曲线,显示了当缓冲剂以H C O_3 | 图31-1. 碳酸氢盐缓冲系统的滴定曲线,显示了当缓冲剂以H C O_3-和C O_2(或H_2C O_3)形式的百分比改变时,细胞外液的pH值。 | ||
缓冲剂的绝对浓度也是决定系统缓冲能力的重要因素。当缓冲剂浓度较低时,只需向溶液中加入少量的酸或碱,pH值就会发生显著变化。 | 缓冲剂的绝对浓度也是决定系统缓冲能力的重要因素。当缓冲剂浓度较低时,只需向溶液中加入少量的酸或碱,pH值就会发生显著变化。 | ||
碳酸氢盐缓冲系统是最重要的细胞外缓冲系统。从图31-1所示的滴定曲线来看,人们可能不会认为碳酸氢盐缓冲系统很强大,原因有两个。首先,细胞外液的pH值约为7.4,而碳酸氢盐缓冲系统的pK为6.1,这意味着以HCO_3 | 碳酸氢盐缓冲系统是最重要的细胞外缓冲系统。从图31-1所示的滴定曲线来看,人们可能不会认为碳酸氢盐缓冲系统很强大,原因有两个。首先,细胞外液的pH值约为7.4,而碳酸氢盐缓冲系统的pK为6.1,这意味着以HCO_3-形式存在的碳酸氢盐缓冲系统大约是溶解的CO_2形式的20倍。因此,该系统在缓冲曲线的斜率较低的部分运行,缓冲能力较差。其次,碳酸氢盐系统的两个组成部分CO_2和HCO_3-的浓度并不高。 | ||
尽管有这些特点,碳酸氢盐缓冲系统是体内最强大的细胞外缓冲系统。这种看似矛盾的现象主要是由于缓冲系统的两个组成部分HCO_3 | 尽管有这些特点,碳酸氢盐缓冲系统是体内最强大的细胞外缓冲系统。这种看似矛盾的现象主要是由于缓冲系统的两个组成部分HCO_3-和CO_2分别由肾脏和肺调节,这一点将在后面讨论。由于这种调节作用,细胞外液的pH值可以通过肾脏对HCO_3-的移除和添加的相对速率以及肺对CO_2的移除速率来精确控制。 | ||
=== 磷酸盐缓冲系统 === | === 磷酸盐缓冲系统 === | ||
尽管磷酸盐缓冲系统不是主要的细胞外液缓冲系统,但它在缓冲肾小管液和细胞内液中起着重要作用。 | 尽管磷酸盐缓冲系统不是主要的细胞外液缓冲系统,但它在缓冲肾小管液和细胞内液中起着重要作用。 | ||
磷酸盐缓冲系统的主要组成部分是H_2PO_4 | 磷酸盐缓冲系统的主要组成部分是H_2PO_4-和HPO_4=。当向这两种物质的混合物中加入强酸如HCl时,氢被碱HPO_4=接受并转化为H_2P O_4-: | ||
H C l+N a_2H P O_4\toN a H_2P O_4+N a C l | H C l+N a_2H P O_4\toN a H_2P O_4+N a C l | ||
该反应的结果是强酸HCl被弱酸NaH_2PO_4所取代,pH值的下降被最小化。 | 该反应的结果是强酸HCl被弱酸NaH_2PO_4所取代,pH值的下降被最小化。 | ||
当向缓冲系统中加入强碱如NaOH时,OH | 当向缓冲系统中加入强碱如NaOH时,OH-被H_2PO_4-缓冲,形成额外的HPO_4=+H_2O: | ||
N a O H+N a H_2P O_4\toN a_2H P O_4+H_2O | N a O H+N a H_2P O_4\toN a_2H P O_4+H_2O | ||
在这种情况下,强碱NaOH被弱碱Na_2HPO_4所取代,导致pH值仅略有上升。 | 在这种情况下,强碱NaOH被弱碱Na_2HPO_4所取代,导致pH值仅略有上升。 | ||
| 第2,361行: | 第2,424行: | ||
=== 蛋白质是重要的细胞内缓冲剂 === | === 蛋白质是重要的细胞内缓冲剂 === | ||
蛋白质是体内最丰富的缓冲剂之一,因为它们的浓度很高,尤其是在细胞内。细胞的pH值虽然略低于细胞外液,但仍与细胞外液pH值的变化大致成比例变化。\Hat和HCO_3 | 蛋白质是体内最丰富的缓冲剂之一,因为它们的浓度很高,尤其是在细胞内。细胞的pH值虽然略低于细胞外液,但仍与细胞外液pH值的变化大致成比例变化。\Hat和HCO_3-会通过细胞膜轻微扩散,尽管这些离子需要几个小时才能与细胞外液达到平衡,除了在红细胞中发生的快速平衡。然而,CO_2可以迅速通过所有细胞膜扩散。碳酸氢盐缓冲系统成分的扩散导致细胞内液的pH值在细胞外液pH值发生变化时也会发生变化。因此,细胞内的缓冲系统有助于防止细胞外液pH值的变化,但可能需要几个小时才能达到最大效果。 | ||
在红细胞中,血红蛋白(Hb)是一种重要的缓冲剂,如下所示: | 在红细胞中,血红蛋白(Hb)是一种重要的缓冲剂,如下所示: | ||
H | H++Hb\overset\longrightarrow\longleftarrowHHb | ||
大约60%到70%的体液化学缓冲作用发生在细胞内,其中大部分缓冲作用来自细胞内蛋白质。然而,除了红细胞外,H | 大约60%到70%的体液化学缓冲作用发生在细胞内,其中大部分缓冲作用来自细胞内蛋白质。然而,除了红细胞外,H+和HCO_3-通过细胞膜的缓慢速率通常会延迟细胞内蛋白质缓冲细胞外酸碱异常的最大能力数小时。 | ||
除了细胞内蛋白质的高浓度外,另一个有助于其缓冲能力的因素是许多这些蛋白质系统的pK值与细胞内pH值相当接近。 | 除了细胞内蛋白质的高浓度外,另一个有助于其缓冲能力的因素是许多这些蛋白质系统的pK值与细胞内pH值相当接近。 | ||
=== 等氢离子原理:共同溶液中的所有缓冲剂都与相同的H | === 等氢离子原理:共同溶液中的所有缓冲剂都与相同的H+浓度处于平衡状态 === | ||
我们一直在讨论缓冲系统,仿佛它们在体液中独立运作。然而,它们实际上是一起工作的,因为H | 我们一直在讨论缓冲系统,仿佛它们在体液中独立运作。然而,它们实际上是一起工作的,因为H+是所有这些系统反应中的共同因素。因此,每当细胞外液中的\ H+浓度发生变化时,所有缓冲系统的平衡也会同时发生变化。这种现象被称为等氢离子原理(isohydric principle),并由以下公式说明: | ||
H | H+=K_1×\fracHA_1A_1=K_2×\fracHA_2A_2=K_3×\fracHA_3A_3 | ||
K_1,K_2,和K_3分别是三种酸-HA_1、HA_2、HA_3的解离常数(dissociation constants),而A_1,、A_2,、A_3是构成这三种缓冲系统碱基的自由负离子的浓度。 | K_1,K_2,和K_3分别是三种酸-HA_1、HA_2、HA_3的解离常数(dissociation constants),而A_1,、A_2,、A_3是构成这三种缓冲系统碱基的自由负离子的浓度。 | ||
这一原理的含义是,任何改变其中一个缓冲系统平衡的条件也会改变所有其他缓冲系统的平衡,因为缓冲系统实际上通过\ H | 这一原理的含义是,任何改变其中一个缓冲系统平衡的条件也会改变所有其他缓冲系统的平衡,因为缓冲系统实际上通过\ H+在它们之间的来回转移来相互缓冲。 | ||
== 酸碱平衡的呼吸调节 == | == 酸碱平衡的呼吸调节 == | ||
抵御酸碱紊乱的第二道防线是通过肺部控制细胞外液中的CO_2浓度。通气量的增加会从细胞外液中排出CO_2,通过质量作用(mass action)减少\ H | 抵御酸碱紊乱的第二道防线是通过肺部控制细胞外液中的CO_2浓度。通气量的增加会从细胞外液中排出CO_2,通过质量作用(mass action)减少\ H+的浓度。相反,通气量的减少会增加细胞外液中的CO_2和\Hat浓度。 | ||
=== 肺部的CO_2排出平衡代谢产生的CO_2 === | === 肺部的CO_2排出平衡代谢产生的CO_2 === | ||
| 第2,398行: | 第2,457行: | ||
图31-2. 肺泡通气速率增加或减少引起的细胞外液pH变化,表示为正常值的倍数。 | 图31-2. 肺泡通气速率增加或减少引起的细胞外液pH变化,表示为正常值的倍数。 | ||
==== 增加肺泡通气会降低细胞外液中的H | ==== 增加肺泡通气会降低细胞外液中的H+浓度并提高pH ==== | ||
如果CO_2的代谢生成保持恒定,影响细胞外液中PCO_2的唯一其他因素是肺泡通气(alveolar ventilation)速率。肺泡通气越高,Pco_2越低。如前所述,当CO_2浓度增加时,H_2CO_3浓度和H | 如果CO_2的代谢生成保持恒定,影响细胞外液中PCO_2的唯一其他因素是肺泡通气(alveolar ventilation)速率。肺泡通气越高,Pco_2越低。如前所述,当CO_2浓度增加时,H_2CO_3浓度和H+浓度也会增加,从而降低细胞外液的pH值。 | ||
图31-2显示了增加或减少肺泡通气速率引起的血液pH的近似变化。请注意,将肺泡通气增加到正常水平的两倍左右会使细胞外液的pH增加约0.23。如果正常肺泡通气下体液的pH为7.40,将通气速率加倍会使pH值增加到约7.63。相反,将肺泡通气减少到正常水平的四分之一会使pH值降低0.45。也就是说,如果正常肺泡通气下pH为7.4,将通气减少到正常水平的四分之一会使pH值降低到6.95。由于肺泡通气速率可以显著变化,从低至0到高达正常水平的15倍,人们可以很容易理解呼吸系统如何显著改变体液的pH值。 | 图31-2显示了增加或减少肺泡通气速率引起的血液pH的近似变化。请注意,将肺泡通气增加到正常水平的两倍左右会使细胞外液的pH增加约0.23。如果正常肺泡通气下体液的pH为7.40,将通气速率加倍会使pH值增加到约7.63。相反,将肺泡通气减少到正常水平的四分之一会使pH值降低0.45。也就是说,如果正常肺泡通气下pH为7.4,将通气减少到正常水平的四分之一会使pH值降低到6.95。由于肺泡通气速率可以显著变化,从低至0到高达正常水平的15倍,人们可以很容易理解呼吸系统如何显著改变体液的pH值。 | ||
==== 增加的H | ==== 增加的H+浓度刺激肺泡通气 ==== | ||
肺泡通气速率不仅通过改变体液的PCO_2来影响\ H | 肺泡通气速率不仅通过改变体液的PCO_2来影响\ H+浓度,而且\Hat浓度也会影响肺泡通气速率。因此,图31-3显示,当pH从正常值7.4下降到强酸性值7.0时,肺泡通气速率增加到正常水平的四到五倍。相反,血浆pH值上升到7.4以上会导致通气速率下降。与pH值升高相比,pH值降低(对应于\ H+浓度升高)时,每单位pH变化的通气速率变化要大得多。这是因为随着肺泡通气速率的降低,由于pH值升高(\Hat浓度降低),血液中氧气的添加量减少,血液中的氧分压\left(Po_2\right)也降低,从而刺激通气速率。因此,呼吸系统对pH值升高的补偿远不如对pH值显著降低的反应有效。 | ||
图31-3. 血液pH对肺泡通气速率的影响。 | 图31-3. 血液pH对肺泡通气速率的影响。 | ||
呼吸系统对H | 呼吸系统对H+浓度的反馈控制。由于增加的H+浓度刺激呼吸,而增加的肺泡通气降低H+浓度,呼吸系统充当了\ H+浓度的典型负反馈控制器: | ||
\beginarrayr l&\uparrow[H | \beginarrayr l&\uparrow[H+]\to\uparrowA l v e o l a r v e n t i l a t i o n\ &\Theta_:\ldots\ldots\ldots\ldots\downarrowP c o_2\uparrow\endarray | ||
也就是说,每当H | 也就是说,每当H+浓度增加到正常水平以上时,呼吸系统就会受到刺激,肺泡通气量增加。这种机制降低了细胞外液中的Pco_2,并使\Hat浓度恢复到正常水平。相反,如果\ H+浓度下降到正常水平以下,呼吸中枢就会受到抑制,肺泡通气量减少,\Hat浓度回升到正常水平。尽管碱中毒倾向于抑制呼吸中枢,但这种反应通常不如对代谢性酸中毒的反应强烈和可预测;与肺泡通气量减少相关的低氧血症最终会激活对氧气敏感的化学感受器,这些感受器倾向于刺激通气并限制对代谢性碱中毒的呼吸补偿。 | ||
==== 呼吸控制H | ==== 呼吸控制H+浓度的效率 ==== | ||
当呼吸系统外部的干扰改变了pH值时,呼吸控制无法将H | 当呼吸系统外部的干扰改变了pH值时,呼吸控制无法将H+浓度完全恢复到正常水平。通常,控制\Hat浓度的呼吸机制大约有50%到75%的有效性,对应于代谢性酸中毒的反馈增益为1到3。也就是说,如果通过向细胞外液中添加酸使pH突然下降,pH从7.4降至7.0,呼吸系统可以将pH恢复到大约7.2到7.3的值。这种反应在3到12分钟内发生。如前所述,代谢性碱中毒的呼吸反应受到与肺泡通气量减少相关的低氧血症的限制。 | ||
呼吸系统的缓冲能力。呼吸系统对酸碱平衡的调节是一种生理类型的缓冲系统,因为它作用迅速,并在缓慢反应的肾脏能够消除失衡之前,防止H | 呼吸系统的缓冲能力。呼吸系统对酸碱平衡的调节是一种生理类型的缓冲系统,因为它作用迅速,并在缓慢反应的肾脏能够消除失衡之前,防止H+浓度发生太大变化。总的来说,呼吸系统的整体缓冲能力是细胞外液中所有其他化学缓冲剂缓冲能力的一到两倍。也就是说,这种机制通常可以缓冲的酸或碱的量是化学缓冲剂的一到两倍。 | ||
肺功能受损可能导致呼吸性酸中毒。到目前为止,我们已经讨论了正常呼吸机制作为缓冲\ H | 肺功能受损可能导致呼吸性酸中毒。到目前为止,我们已经讨论了正常呼吸机制作为缓冲\ H+浓度变化的手段的作用。然而,呼吸异常也可能导致H+浓度的变化。例如,肺功能受损,如严重的肺气肿,会降低肺部消除CO_2的能力,导致细胞外液中CO_2的积累和呼吸性酸中毒的趋势。此外,对代谢性酸中毒的反应能力也会受损,因为通常通过增加通气量发生的Pco_2补偿性降低会被削弱。在这些情况下,肾脏代表了在细胞外液中的初始化学缓冲发生后,将pH恢复到正常水平的唯一剩余生理机制。 | ||
== 肾脏对酸碱平衡的控制 == | == 肾脏对酸碱平衡的控制 == | ||
肾脏通过排泄酸性或碱性尿液来控制酸碱平衡。排泄酸性尿液减少了细胞外液中的酸量,而排泄碱性尿液则从细胞外液中去除碱。 | 肾脏通过排泄酸性或碱性尿液来控制酸碱平衡。排泄酸性尿液减少了细胞外液中的酸量,而排泄碱性尿液则从细胞外液中去除碱。 | ||
肾脏排泄酸性或碱性尿液的总体机制如下。大量的HCO_3 | 肾脏排泄酸性或碱性尿液的总体机制如下。大量的HCO_3-不断被过滤到肾小管中,如果排泄到尿液中,就会从血液中移除碱。大量的\Hat也被肾小管上皮细胞分泌到肾小管腔中,从而从血液中移除酸。如果分泌的\Hat比过滤的HCO_3-多,细胞外液中的酸将会有净损失。相反,如果过滤的HCO_3-比分泌的\ H+多,碱将会有净损失。 | ||
每天,身体产生约80mEq的非挥发性酸(nonvolatile acids),主要来自蛋白质的代谢。这些酸被称为非挥发性酸,因为它们不是H_2CO_3,因此不能通过肺部排泄。从体内移除这些酸的主要机制是肾脏排泄。肾脏还必须防止尿液中碳酸氢盐的损失,这一任务在数量上比排泄非挥发性酸更为重要。每天,肾脏过滤约4320mEq的HCO_3 | 每天,身体产生约80mEq的非挥发性酸(nonvolatile acids),主要来自蛋白质的代谢。这些酸被称为非挥发性酸,因为它们不是H_2CO_3,因此不能通过肺部排泄。从体内移除这些酸的主要机制是肾脏排泄。肾脏还必须防止尿液中碳酸氢盐的损失,这一任务在数量上比排泄非挥发性酸更为重要。每天,肾脏过滤约4320mEq的HCO_3-(180L/天×24mEq/L));在正常情况下,几乎所有过滤的HCO_3-都会从肾小管中重吸收,从而保存细胞外液的主要缓冲系统。 | ||
正如后面所讨论的,HCO_3 | 正如后面所讨论的,HCO_3-的重吸收和\ H+的排泄都是通过肾小管分泌H+的过程完成的。因为HCO_3-必须与分泌的\Hat反应形成H_2CO_3才能被重吸收,所以每天必须分泌4320mEq的H+才能重吸收过滤的HCO_3-。然后,还需要额外分泌80mEq的\Hat以排出每天产生的非挥发性酸,总共每天分泌4400mEq的H+到肾小管液中。 | ||
当细胞外液中的\Hat浓度降低(碱中毒(alkalosis))时,肾脏通常会分泌较少的\ H | 当细胞外液中的\Hat浓度降低(碱中毒(alkalosis))时,肾脏通常会分泌较少的\ H+,并且无法重吸收所有过滤的HCO_3-,从而增加HCO_3-的排泄。由于HCO_3-通常在细胞外液中缓冲H+,这种HCO_3-的损失等同于向细胞外液中添加H+。因此,在碱中毒时,移除HCO_3-会使细胞外液中的H+浓度恢复到正常水平。 | ||
在酸中毒(acidosis)时,肾脏会分泌额外的\Hat,并且不会将HCO_3 | 在酸中毒(acidosis)时,肾脏会分泌额外的\Hat,并且不会将HCO_3-排泄到尿液中,而是重吸收所有过滤的HCO_3-并产生新的HCO_3-,这些新的HCO_3-会被重新添加到细胞外液中。这一作用使细胞外液中的H+浓度恢复到正常水平。 | ||
因此,肾脏通过三种基本机制调节细胞外液中的H | 因此,肾脏通过三种基本机制调节细胞外液中的H+浓度:(1) 分泌\because H+;(2) 重吸收过滤的H C O_3-;(3) 产生新的H C O_3-。所有这些过程都是通过相同的基本机制完成的,正如接下来的几节中所讨论的那样。 | ||
=== 肾小管对\Hat的分泌和HCO_3 | === 肾小管对\Hat的分泌和HCO_3-的重吸收 === | ||
氢离子(H | 氢离子(H+)的分泌和HCO_3-的重吸收几乎发生在肾小管的所有部分,除了Henle袢的降支和升支细段。图31-4总结了HCO_3-沿肾小管的重吸收情况。需要注意的是,每重吸收一个\cal H\cal C\cal O_3-,必须分泌一个H+。 | ||
大约80%到90%的HCO_3 | 大约80%到90%的HCO_3-重吸收(以及H+分泌)发生在近端小管,因此只有少量的HCO_3-流入远端小管和集合管。在Henle袢的粗升支,另外10%的滤过HCO_3-被重吸收,其余的重吸收发生在远端小管和集合管。如前所述,HCO_3-重吸收的机制也涉及肾小管分泌H+,但不同的肾小管段以不同的方式完成这一任务。 | ||
图31-4. 肾小管不同段对H C O_3 | 图31-4. 肾小管不同段对H C O_3-的重吸收。图中显示了各肾小管段吸收的滤过H C O_3-的百分比,以及在正常条件下每天重吸收的毫当量数。 | ||
==== 早期肾小管段通过次级主动转运分泌H | ==== 早期肾小管段通过次级主动转运分泌H+ ==== | ||
近端小管、Henle袢粗升支和远端小管早期的上皮细胞都通过钠-氢反向转运将H | 近端小管、Henle袢粗升支和远端小管早期的上皮细胞都通过钠-氢反向转运将H+分泌到肾小管液中,如图31-5所示。这种次级主动分泌\Hat与钠-氢交换蛋白在管腔膜上将Na+转运到细胞内相耦合,而\Hat逆浓度梯度分泌所需的能量来自于有利于Na+进入细胞的钠梯度。这一梯度由基底外侧膜上的钠-钾腺苷三磷酸酶(Na+-K+ ATPase)泵建立。大约95%的碳酸氢盐以这种方式被重吸收,肾小管每天需要分泌约4000mEq的\Hat。然而,这种机制只能建立约6.7的最低pH值;只有在集合小管和集合管中,肾小管液才会变得非常酸性,尿液的pH可低至约4.5。 | ||
图31-5展示了H | 图31-5展示了H+分泌过程如何实现HCO_3-的重吸收。分泌过程始于CO_2扩散进入肾小管细胞或在肾小管上皮细胞内通过代谢形成。在碳酸酐酶(carbonic anhydrase)的作用下,CO_2与H_2O结合形成H_2CO_3,随后解离为HCO_3-和H+。H+通过钠-氢反向转运(sodium-hydrogen countertransport)从细胞分泌到肾小管管腔中。也就是说,当Na+从肾小管管腔移动到细胞内时,它首先与细胞膜管腔侧的载体蛋白(carrier protein)结合;同时,细胞内的H+也与载体蛋白结合。Na+沿着由基底外侧膜上的Na+-K+ ATPase泵建立的浓度梯度进入细胞。Na+进入细胞的梯度为H+从细胞内部向肾小管管腔的相反方向移动提供了能量。 | ||
图31-5展示了以下细胞机制:(1) H | 图31-5展示了以下细胞机制:(1) H+主动分泌到肾小管中;(2) HCO_3-通过与H+结合形成H_2CO_3,随后解离为CO_2和H_2O,从而实现肾小管重吸收;(3) Na+通过与分泌的H+交换而重吸收。这种H+分泌模式发生在近端小管、Henle袢的厚升支和远端小管的早期部分。 | ||
细胞内生成的HCO_3 | 细胞内生成的HCO_3-(当H+从H_2CO_3解离时)随后沿着浓度梯度穿过基底外侧膜,进入肾间质液和肾小管周围毛细血管血液中。最终结果是,每分泌一个H+到肾小管管腔中,就有一个HCO_3-进入血液。 | ||
==== 滤过的HCO_3 | ==== 滤过的HCO_3-通过与肾小管中的H+相互作用而被重吸收 ==== | ||
碳酸氢根离子(bicarbonate ions)不易通过肾小管细胞的管腔膜;因此,肾小球滤过的HCO_3 | 碳酸氢根离子(bicarbonate ions)不易通过肾小管细胞的管腔膜;因此,肾小球滤过的HCO_3-不能直接被重吸收。相反,HCO_3-通过一个特殊过程被重吸收,即首先与H+结合形成H_2CO_3,最终转化为CO_2和H_2O,如图31-5所示。 | ||
HCO_3 | HCO_3-的重吸收(Reabsorption)是由肾小管中滤过的HCO_3-和肾小管细胞分泌的H+之间的反应启动的。形成的H_2CO_3随后解离为CO_2和H_2O。CO_2可以轻易穿过肾小管膜;因此,它立即扩散到肾小管细胞中,在碳酸酐酶(Carbonic Anhydrase)的作用下与H_2O重新结合,生成新的H_2CO_3分子。这个H_2CO_3解离形成HCO_3-和\Hat;然后HCO_3-通过基底外侧膜(Basolateral Membrane)扩散到间质液中,并被吸收到肾小管周围毛细血管血液中。HCO_3通过基底外侧膜的运输由两种机制促进:(1) 近端小管中的Na+–H C O_3-共转运(Co-transport);(2) 近端小管后段、Henle袢粗升支以及集合管和导管中的Cl-\cdotHCO_3-交换(Exchange)。 | ||
因此,每当肾小管上皮细胞中形成一个H | 因此,每当肾小管上皮细胞中形成一个H+时,也会形成一个H C O_3-并释放回血液中。这些反应的净效应是从肾小管中“重吸收”HCO_3-,尽管实际进入细胞外液的HCO_3-与滤入肾小管的HCO_3-并不相同。滤过的HCO_3-的重吸收不会导致\Hat的净分泌,因为分泌的\Hat与滤过的HCO_3-结合,因此不会被排泄。 | ||
H C O_3 | H C O_3-在肾小管中与H+滴定(Titrate)。在正常情况下,肾小管H+的分泌速率约为4400mEq/day,而HCO_3-的滤过速率约为4320 mEq/day。因此,进入肾小管的这两种离子的量几乎相等,它们相互结合形成CO_2和H_2O。因此,可以说HCO_3-和H+在肾小管中通常“滴定”彼此。 | ||
滴定过程并不完全精确,因为通常肾小管中会有少量的H | 滴定过程并不完全精确,因为通常肾小管中会有少量的H+过量,这些过量的\Hat (\approx80mEq/day)会通过尿液排出体外,以清除代谢产生的非挥发性酸(Nonvolatile Acids)。正如后面所讨论的,大多数H+并不是以游离H+的形式排泄,而是与其他尿液缓冲剂(Urinary Buffers)结合,尤其是磷酸盐(Phosphate)和氨(Ammonia)。 | ||
当尿液中的HCO_3 | 当尿液中的HCO_3-超过\Hat时,如在代谢性碱中毒(Metabolic Alkalosis)中发生的情况,过量的HCO_3-无法被重吸收。因此,过量的HCO_3-留在肾小管中,最终排泄到尿液中,这有助于纠正代谢性碱中毒。 | ||
在酸中毒(acidosis)时,H | 在酸中毒(acidosis)时,H+相对于HCO_3-过量,导致HCO_3-完全重吸收;过量的\Hat与尿液缓冲剂(urinary buffers)结合,特别是磷酸盐(phosphate)和氨(ammonia),最终以盐的形式排出。因此,肾脏纠正酸中毒或碱中毒(alkalosis)的基本机制是H+与HCO_3-的不完全滴定(incomplete titration),使其中一种进入尿液并从细胞外液(extracellular fluid)中移除。 | ||
==== 晚期远端小管和集合管插入细胞中H | ==== 晚期远端小管和集合管插入细胞中H+的初级主动分泌 ==== | ||
从远端小管(late distal tubules)开始并延续至小管系统的其余部分,小管上皮通过初级主动转运(primary active transport)分泌\Hat。这种转运的特性与近端小管(proximal tubule)、Henle袢(loop of Henle)和早期远端小管(early distal tubule)中讨论的不同。 | 从远端小管(late distal tubules)开始并延续至小管系统的其余部分,小管上皮通过初级主动转运(primary active transport)分泌\Hat。这种转运的特性与近端小管(proximal tubule)、Henle袢(loop of Henle)和早期远端小管(early distal tubule)中讨论的不同。 | ||
第28章讨论了初级主动H | 第28章讨论了初级主动H+分泌的机制,并在图31-6中展示。它发生在小管细胞的管腔膜(luminal membrane)上,H+通过特定的蛋白质直接转运,即氢转运ATP酶(hydrogen-transporting ATPase)和氢钾ATP酶转运体(hydrogen-potassiumATPase transporter)。泵送H+所需的能量来自ATP分解为二磷酸腺苷(adenosine diphosphate)。 | ||
图31-6. 通过晚期远端小管和集合管A型插入上皮细胞(type A intercalated epithelial cells)的管腔膜主动分泌H | 图31-6. 通过晚期远端小管和集合管A型插入上皮细胞(type A intercalated epithelial cells)的管腔膜主动分泌H+。A型细胞在管腔膜中含有氢-三磷酸腺苷酶(hydrogen–adenosine triphosphatase, ATPase)和氢钾ATP酶(hydrogen-potassium-ATPase),在酸中毒时分泌H+同时重吸收H C O_3-和K+。注意,每分泌一个H+就重吸收一个H C O_3-,并且一个\subset\l与H+一起被动分泌。 | ||
初级主动H | 初级主动H+分泌发生在称为A型插入细胞(type A intercalated cells)的特殊类型细胞中,这些细胞位于晚期远端小管和集合管中。这些细胞中的氢离子分泌分两步完成:(1) 细胞中溶解的CO_2与H_2O结合形成H_2CO_3;;(2) H_2CO_3随后解离为HCO_3-,后者被重吸收进入血液,以及H+,后者通过氢ATP酶和氢钾ATP酶转运体分泌到小管中。每分泌一个H+,就重吸收一个HCO_3-,类似于近端小管中的过程。主要区别在于H+通过主动\Hat泵穿过管腔膜,而不是像在肾单位(nephron)早期部分那样通过反向转运(counter-transport)进行。 | ||
尽管在远端小管(distal tubule)和集合管(collecting tubules)中分泌的H | 尽管在远端小管(distal tubule)和集合管(collecting tubules)中分泌的H+仅占总分泌H+的约5%,但这一机制在形成最大酸性尿液方面非常重要。在近端小管(proximal tubules)中,H+浓度只能增加约3到4倍,管腔液体的pH只能降低到约6.7,尽管这一肾单位(nephron)段分泌了大量的H+。然而,在集合管中,H+浓度可以增加多达900倍。这一机制将管腔液体的pH降低到约4.5,这是正常肾脏可以达到的pH下限。 | ||
==== 小管中过量的H | ==== 小管中过量的H+与磷酸盐和氨缓冲液结合生成“新”的\mathbfHCO_3- ==== | ||
当分泌的H | 当分泌的H+超过滤入管腔液体的HCO_3-时,只有一小部分过量的H+可以以离子形式\left(H+\right)在尿液中排泄。 | ||
这是因为尿液的最小pH约为4.5,对应的H | 这是因为尿液的最小pH约为4.5,对应的H+浓度为10-4.5mEq/L,即0.03mEq/L。因此,对于每升形成的尿液,最多只能排泄约0.03mEq的游离H+。如果要排泄每天代谢形成的80mEq非挥发性酸,如果H+在溶液中保持游离状态,则需要排泄约2667升尿液。 | ||
在尿液中排泄大量H | 在尿液中排泄大量H+(有时多达500mEq/day)主要通过将H+与管腔液体中的缓冲液结合来实现。最重要的缓冲液是磷酸盐缓冲液(phosphate buffer)和氨缓冲液(ammonia buffer)。其他弱缓冲系统,如尿酸(urate)和柠檬酸(citrate),则不那么重要。 | ||
当管腔液体中的H | 当管腔液体中的H+与HCO_3-滴定(titrated)时,这会导致每个分泌的H+重吸收一个HCO_3-,如前所述。然而,当管腔液体中存在过量的H+时,它会与HCO_3-以外的缓冲液结合,这会导致生成新的HCO_3-,这些HCO_3-也可以进入血液。因此,当细胞外液(extracellular fluid)中存在过量的H+时,肾脏不仅重吸收所有滤过的HCO_3-,还会生成新的HCO_3-,从而帮助补充酸中毒(acidosis)中从细胞外液丢失的HCO_3-。在接下来的两节中,我们将讨论磷酸盐和氨缓冲液如何促进生成新的HCO_3-。 | ||
==== 磷酸盐缓冲系统将过量的H | ==== 磷酸盐缓冲系统将过量的H+带入尿液并生成新的HCO_3- ==== | ||
磷酸盐缓冲系统由HPO_4 | 磷酸盐缓冲系统由HPO_4=组成。由于水通常比磷酸盐在肾小管中重吸收得更多,因此两者在管腔液体中都会浓缩。因此,尽管磷酸盐不是重要的细胞外液缓冲液,但它在管腔液体中作为缓冲液更为有效。 | ||
另一个使磷酸盐作为肾小管缓冲剂的重要因素是该系统的pK值约为6.8。在正常情况下,尿液呈微酸性,尿液的pH值接近磷酸盐缓冲系统的pK值。因此,在肾小管中,磷酸盐缓冲系统通常在其最有效的pH范围内发挥作用。 | 另一个使磷酸盐作为肾小管缓冲剂的重要因素是该系统的pK值约为6.8。在正常情况下,尿液呈微酸性,尿液的pH值接近磷酸盐缓冲系统的pK值。因此,在肾小管中,磷酸盐缓冲系统通常在其最有效的pH范围内发挥作用。 | ||
图31-7展示了\Hat与磷酸盐缓冲剂结合排泄的过程以及新的HCO_3 | 图31-7展示了\Hat与磷酸盐缓冲剂结合排泄的过程以及新的HCO_3-被添加到血液中的机制。\Hat分泌到肾小管的过程与之前描述的过程相同。只要肾小管液中有过量的HCO_3-,大多数分泌的\Hat就会与HCO_3-结合。然而,一旦所有的HCO_3-被重吸收并且不再与\ H+结合,任何过量的\Hat都可以与HPO_4=和其他肾小管缓冲剂结合。当\Hat与HPO_4=结合形成H_2PO_4-后,它可以以钠盐(NaH_2P O_4)的形式排泄,同时带走过量的\Hat。 | ||
图31-7. 通过过滤的磷酸盐(NaHP O_4)缓冲分泌的H | 图31-7. 通过过滤的磷酸盐(NaHP O_4)缓冲分泌的H+。注意,每当一个NaHP O_4与一个分泌的H+反应时,一个新的H C O_3-被返回到血液中。 | ||
在这个H | 在这个H+排泄的过程中,有一个重要的区别。在这种情况下,肾小管细胞中生成的HCO_3-进入管周血液,代表了血液中HCO_3-的净增加,而不仅仅是过滤的HCO_3-的替换。因此,每当一个分泌到肾小管腔的H+与H C O_3-以外的缓冲剂结合时,净效应是向血液中添加一个新的H C O_3-。这个过程展示了肾脏如何补充细胞外液中HCO3−储备的机制之一。 | ||
在正常情况下,大部分过滤的磷酸盐被重吸收,只有30到40 mEq/天的磷酸盐可用于缓冲H | 在正常情况下,大部分过滤的磷酸盐被重吸收,只有30到40 mEq/天的磷酸盐可用于缓冲H+。因此,在酸中毒时,肾小管液中过量H+的缓冲主要通过氨缓冲系统进行。 | ||
==== 通过氨缓冲系统排泄过量H | ==== 通过氨缓冲系统排泄过量H+并生成新的H C O_3- ==== | ||
图31-8. 近端肾小管细胞中铵离子\left(N H_4 | 图31-8. 近端肾小管细胞中铵离子\left(N H_4+\right)的产生和分泌。谷氨酰胺在细胞内代谢,产生N H_4+和H C O_3-。N H_4+通过N a+-N H_4+交换体分泌到管腔中。每代谢一个谷氨酰胺分子,会产生并分泌两个N H_4+,同时有两个H C O_3-返回到血液中。 | ||
图31-9. 集合管中氨(N H_3)对H | 图31-9. 集合管中氨(N H_3)对H+分泌的缓冲作用。N H_3扩散到管腔中,与分泌的H+反应形成N H_4+,随后被排泄。每排泄一个N H_4+,管状细胞中就会形成一个新的H C O_3-并返回血液。 | ||
管状液中的第二个缓冲系统在数量上比磷酸盐缓冲系统更为重要,它由氨(\left(NH_3\right))和铵离子((NH_4 | 管状液中的第二个缓冲系统在数量上比磷酸盐缓冲系统更为重要,它由氨(\left(NH_3\right))和铵离子((NH_4+))组成。铵离子由谷氨酰胺合成,谷氨酰胺主要来自肝脏中氨基酸的代谢。输送到肾脏的谷氨酰胺被转运到近端小管、Henle环的厚升支和远端小管的上皮细胞中(图31-8)。一旦进入细胞,每个谷氨酰胺分子在一系列反应中被代谢,最终形成两个NH_4+和两个HCO_3-。NH_4+通过一个逆向转运机制分泌到管腔中,以交换被重吸收的钠。HCO_3-与重吸收的Na+一起穿过基底外侧膜进入间质液,并被管周毛细血管吸收。因此,对于在近端小管中代谢的每个谷氨酰胺分子,两个NH_4+被分泌到尿液中,两个HCO_3-被重吸收到血液中。通过此过程生成的H C O_3-构成了新的H C O_3-。 | ||
在集合管中,NH_4 | 在集合管中,NH_4+通过不同的机制加入到管状液中(图31-9)。在这里,\ H+被管状膜主动分泌到管腔中,与NH_3结合形成NH_4+,随后被排泄。集合管对NH_3具有通透性,NH_3可以轻松扩散到管腔中。然而,这部分小管的管腔膜对NH_4+的通透性要低得多;因此,一旦\ H+与NH_3反应形成NH_4+,NH_4+就被困在管腔中并通过尿液排出。每排泄一个N H_4+,就会生成一个新的H C O_3-并加入到血液中。 | ||
慢性酸中毒增加N H_4 | 慢性酸中毒增加N H_4+排泄。肾氨-铵缓冲系统最重要的特征之一是它受到生理控制。细胞外液H+浓度的增加会刺激肾脏谷氨酰胺的代谢,从而增加NH_4+和新HCO_3-的形成,用于缓冲;H+浓度的降低则产生相反的效果。 | ||
在正常情况下,通过氨缓冲系统排出的\Hat量约占肾脏排泄的酸的50%和新生成的HCO_3 | 在正常情况下,通过氨缓冲系统排出的\Hat量约占肾脏排泄的酸的50%和新生成的HCO_3-的50%。然而,在慢性酸中毒(acidosis)的情况下,NH_4+的排泄率可增加至500 mEq/天。因此,在慢性酸中毒时,酸排泄的主要机制是NH_4+的排泄。这一过程也为慢性酸中毒期间生成新的碳酸氢盐提供了最重要的机制。 | ||
=== 量化肾脏的酸碱排泄 === | === 量化肾脏的酸碱排泄 === | ||
基于前面讨论的原理,我们可以量化肾脏对酸的净排泄或从血液中净增加或消除的HCO_3 | 基于前面讨论的原理,我们可以量化肾脏对酸的净排泄或从血液中净增加或消除的HCO_3-,如下所示。 | ||
碳酸氢盐排泄量计算为尿流量乘以尿中HCO_3 | 碳酸氢盐排泄量计算为尿流量乘以尿中HCO_3-浓度,表明肾脏从血液中去除HCO_3-的速度,这相当于向血液中添加H+。在碱中毒(alkalosis)时,HCO_3-的丢失有助于使血浆pH值恢复正常。 | ||
在任何给定时间,血液中新生成的H C O_3 | 在任何给定时间,血液中新生成的H C O_3-的量等于分泌到肾小管腔中与非碳酸氢盐尿缓冲剂结合的\ H+的量。如前所述,非碳酸氢盐尿缓冲剂的主要来源是NH_4+和磷酸盐。因此,通过测量NH_4+排泄量(尿流量乘以尿中NH_4+浓度)可以计算出添加到血液中的HCO_3-的一部分(以及通过NH_4+排泄的\Hat)。 | ||
尿液中排泄的其他非碳酸氢盐、非NH_4 | 尿液中排泄的其他非碳酸氢盐、非NH_4+缓冲剂通过测定称为可滴定酸(titratable acid)的值来测量。尿液中的可滴定酸量通过用强碱(如NaOH)滴定尿液至pH 7.4(正常血浆的pH和肾小球滤液的pH)来测量。这一滴定逆转了肾小管液被分泌的H+滴定时所发生的事件。因此,将尿液pH恢复到7.4所需的NaOH的毫当量数等于添加到肾小管液中与磷酸盐和其他有机缓冲剂结合的\ H+的毫当量数。可滴定酸测量不包括与NH_4+结合的H+,因为氨-铵反应的pK为9.2,用NaOH滴定至pH 7.4不会从NH_4+中去除\Hat。 | ||
因此,肾脏的净酸排泄可以如下评估: | 因此,肾脏的净酸排泄可以如下评估: | ||
净酸排泄 =NH_4 | 净酸排泄 =NH_4+ 排泄 + 尿可滴定酸 -HCO_3- 排泄 | ||
我们减去HCO_3 | 我们减去HCO_3-排泄的原因是HCO_3-的丢失相当于向血液中添加H+。为了维持酸碱平衡,净酸排泄必须等于体内非挥发性酸的产生量。 | ||
在酸中毒(acidosis)时,净酸排泄(net acid excretion)显著增加,尤其是由于NH_4 | 在酸中毒(acidosis)时,净酸排泄(net acid excretion)显著增加,尤其是由于NH_4+排泄增加,从而从血液中去除酸。净酸排泄也等于血液中净HCO_3-增加的速度。因此,在酸中毒时,随着更多的N H_4+和可滴定酸(titratable acid)被排泄,有净的H C O_3-被加回到血液中。 | ||
在碱中毒(alkalosis)时,可滴定酸和NH_4 | 在碱中毒(alkalosis)时,可滴定酸和NH_4+的排泄降至0,而HCO_3-的排泄增加。因此,在碱中毒时,存在负的净酸分泌(negative net acid secretion),这意味着血液中有净的HCO_3-丢失,这相当于向血液中添加\Hat,并且肾脏没有生成新的HCO_3-。 | ||
=== 肾小管\mathbbH | === 肾小管\mathbbH+分泌的调节 === | ||
如前所述,肾小管上皮细胞的H | 如前所述,肾小管上皮细胞的H+分泌对于HCO_3-的重吸收(reabsorption)和与可滴定酸形成相关的新HCO_3-的生成是必要的。因此,如果肾脏要有效地执行其在酸碱平衡(acid-base homeostasis)中的功能,H+分泌的速度必须仔细调节。在正常情况下,肾小管必须分泌至少足够的\Hat以重吸收几乎所有被滤过的HCO_3-,并且必须有足够的\Hat剩余以作为可滴定酸或NH_4+排泄,以清除体内每天代谢产生的非挥发性酸(nonvolatile acids)。 | ||
在碱中毒时,肾小管的\Hat分泌减少到一个太低以至于无法实现完全HCO_3 | 在碱中毒时,肾小管的\Hat分泌减少到一个太低以至于无法实现完全HCO_3-重吸收的水平,使肾脏能够增加HCO_3-的排泄。在碱中毒时,可滴定酸和氨不被排泄,因为没有多余的H+可用于与非碳酸氢盐缓冲剂(nonbicarbonate buffers)结合;因此,在碱中毒时没有新的HCO_3-被添加到血液中。 | ||
在酸中毒期间,肾小管的H | 在酸中毒期间,肾小管的H+分泌增加到足以重吸收所有被滤过的HCO_3-,并有足够的H+剩余以排泄大量的NH_4+和可滴定酸,从而为全身细胞外液(extracellular fluid)贡献大量的新HCO_3-。在酸中毒时,增加肾小管H+分泌的最重要刺激因素如下:(l)在呼吸性酸中毒(respiratory acidosis)时细胞外液的P C O_2增加;和(2)在呼吸性或代谢性酸中毒(metabolic acidosis)时细胞外液的H+浓度增加(pH降低)。 | ||
肾小管细胞直接响应血液中Pco_2的增加,如在呼吸性酸中毒时,H | 肾小管细胞直接响应血液中Pco_2的增加,如在呼吸性酸中毒时,H+分泌速度增加,如下所示。增加的Pco_2提高了肾小管细胞的Pco_2,导致肾小管细胞中H+的形成增加,这反过来又刺激了H+的分泌。刺激H+分泌的第二个因素是细胞外液H+浓度的增加(pH降低)。 | ||
表31-2 增加或减少肾小管H | 表31-2 增加或减少肾小管H+分泌和H C O_3\cdot重吸收的血浆或细胞外液因素 | ||
markdown | markdown | ||
| 第2,581行: | 第2,638行: | ||
==== 肾脏对酸中毒的纠正——增加H+排泄和向细胞外液添加HCO3- ==== | ==== 肾脏对酸中毒的纠正——增加H+排泄和向细胞外液添加HCO3- ==== | ||
既然我们已经描述了肾脏分泌H | 既然我们已经描述了肾脏分泌H+和重吸收HCO_3-的机制,我们现在可以解释当细胞外液的pH异常时,肾脏如何重新调整它。 | ||
参考方程式8,即Henderson-Hasselbalch方程,我们可以看到当细胞外液中HCO_3 | 参考方程式8,即Henderson-Hasselbalch方程,我们可以看到当细胞外液中HCO_3-与CO_2的比例下降时,会发生酸中毒(acidosis),从而导致pH值下降。如果这个比例因为HCO_3-的下降而降低,这种酸中毒被称为代谢性酸中毒(metabolic acidosis)。如果pH值因为PCO_2的升高而下降,这种酸中毒被称为呼吸性酸中毒(respiratory acidosis)。 | ||
==== 酸中毒降低肾小管液中H C O_3\bar-/H | ==== 酸中毒降低肾小管液中H C O_3\bar-/H+的比例 ==== | ||
呼吸性和代谢性酸中毒都会导致肾小管液中HCO_3 | 呼吸性和代谢性酸中毒都会导致肾小管液中HCO_3-/H+的比例下降。结果,肾小管中有过量的\Hat,导致HCO_3-的完全重吸收,并且仍然有额外的\ H+可以与尿液缓冲剂NH_4+和HPO_4=结合。因此,在酸中毒时,肾脏重吸收所有过滤的HCO_3-,并通过形成NH_4+和可滴定酸(titratable acid)贡献新的HCO_3-。 | ||
在代谢性酸中毒中,肾小管液中H | 在代谢性酸中毒中,肾小管液中H+相对于HCO_3-的过量主要是由于细胞外液中HCO_3-浓度的下降,从而导致HCO_3-的肾小球滤过减少。 | ||
在呼吸性酸中毒中,肾小管液中的过量\Hat主要是由于细胞外液中PCO_2的升高,这刺激了H | 在呼吸性酸中毒中,肾小管液中的过量\Hat主要是由于细胞外液中PCO_2的升高,这刺激了H+的分泌。 | ||
如前所述,在慢性酸中毒中,无论是呼吸性还是代谢性,NH_4 | 如前所述,在慢性酸中毒中,无论是呼吸性还是代谢性,NH_4+的生成都会增加,这进一步促进了\Hat的排泄和新的HCO_3-向细胞外液的添加。在严重的慢性酸中毒中,每天可以有多达500mEq/day的\Hat以NH_4+的形式排泄到尿液中;这种排泄反过来又贡献了多达500 mEq/day的新HCO_3-添加到血液中。 | ||
因此,在慢性酸中毒中,肾小管增加\Hat的分泌有助于消除体内过量的\Hat,并增加细胞外液中HCO_3 | 因此,在慢性酸中毒中,肾小管增加\Hat的分泌有助于消除体内过量的\Hat,并增加细胞外液中HCO_3-的量。这个过程增加了碳酸氢盐缓冲系统(bicarbonate buffer system)中的HCO_3-部分,根据Henderson-Hasselbalch方程,这有助于提高细胞外液的pH并纠正酸中毒。如果酸中毒是由代谢引起的,肺部的额外补偿会导致PCO_2的降低,也有助于纠正酸中毒。 | ||
表31-3 原发性酸碱紊乱的细胞外液特征a | 表31-3 原发性酸碱紊乱的细胞外液特征a | ||
| 第2,600行: | 第2,657行: | ||
html <nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>pH<nowiki></td></nowiki><nowiki><td></nowiki>H+<nowiki></td></nowiki><nowiki><td></nowiki>PCO2<nowiki></td></nowiki><nowiki><td></nowiki>HCO3-<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>正常<nowiki></td></nowiki><nowiki><td></nowiki>7.4<nowiki></td></nowiki><nowiki><td></nowiki>40 mEq/L<nowiki></td></nowiki><nowiki><td></nowiki>40mmHg<nowiki></td></nowiki><nowiki><td></nowiki>24 mEq/L<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>呼吸性酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>呼吸性碱中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>代谢性酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>一<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>一<nowiki></td></nowiki><nowiki><td></nowiki>↑个<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>代谢性碱中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | html <nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>pH<nowiki></td></nowiki><nowiki><td></nowiki>H+<nowiki></td></nowiki><nowiki><td></nowiki>PCO2<nowiki></td></nowiki><nowiki><td></nowiki>HCO3-<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>正常<nowiki></td></nowiki><nowiki><td></nowiki>7.4<nowiki></td></nowiki><nowiki><td></nowiki>40 mEq/L<nowiki></td></nowiki><nowiki><td></nowiki>40mmHg<nowiki></td></nowiki><nowiki><td></nowiki>24 mEq/L<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>呼吸性酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>呼吸性碱中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>代谢性酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>一<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>一<nowiki></td></nowiki><nowiki><td></nowiki>↑个<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>代谢性碱中毒<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki><td></nowiki>↑<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | ||
a主要事件由双箭头(↑↑或↓↓)表示。注意,呼吸性酸碱紊乱是由P C O_2的增加或减少引发的,而代谢性紊乱是由H C O_3 | a主要事件由双箭头(↑↑或↓↓)表示。注意,呼吸性酸碱紊乱是由P C O_2的增加或减少引发的,而代谢性紊乱是由H C O_3-的增加或减少引发的。 | ||
表31-3总结了与呼吸性和代谢性酸中毒以及呼吸性和代谢性碱中毒相关的细胞外液特征,这些内容将在下一节讨论。注意,在呼吸性酸中毒中,pH降低,细胞外液H | 表31-3总结了与呼吸性和代谢性酸中毒以及呼吸性和代谢性碱中毒相关的细胞外液特征,这些内容将在下一节讨论。注意,在呼吸性酸中毒中,pH降低,细胞外液H+浓度增加,PCO_2增加,这是酸中毒的初始原因。代偿反应是血浆H C O_3-的增加,这是由于肾脏向细胞外液添加了新的H C O_3-。HCO_3-的增加有助于抵消PCO_2的增加,从而使血浆pH恢复正常。 | ||
在代谢性酸中毒中,pH也下降,细胞外液\ H | 在代谢性酸中毒中,pH也下降,细胞外液\ H+浓度上升。然而,在这种情况下,主要异常是血浆HCO_3-的减少。主要的代偿包括增加通气率,从而减少P C O_2,以及肾脏代偿,通过向细胞外液添加新的H C O_3-,有助于最小化细胞外H C O_3-浓度的初始下降。 | ||
==== 碱中毒的肾脏纠正——减少H | ==== 碱中毒的肾脏纠正——减少H+的管状分泌和增加H C O_3-的排泄 ==== | ||
碱中毒的代偿反应基本上与酸中毒相反。在碱中毒中,细胞外液中HCO_3 | 碱中毒的代偿反应基本上与酸中毒相反。在碱中毒中,细胞外液中HCO_3-与CO_2的比率增加,导致pH上升(\ H+浓度下降),这可以从Henderson-Hasselbalch方程中看出。 | ||
==== 碱中毒增加肾小管液中H C O_3\bar-/H | ==== 碱中毒增加肾小管液中H C O_3\bar-/H+比率 ==== | ||
无论碱中毒是由代谢性还是呼吸性异常引起的,肾小管液中HCO_3 | 无论碱中毒是由代谢性还是呼吸性异常引起的,肾小管液中HCO_3-/H+的比率仍然增加。其净效应是HCO_3-的过量,无法从小管中重吸收,因此通过尿液排出。因此,在碱中毒中,HCO_3-通过肾脏排泄从细胞外液中移除,这与向细胞外液添加\Hat具有相同的效果。这个过程有助于使\Hat浓度和pH恢复正常。 | ||
表31-3显示了呼吸性和代谢性碱中毒的总体细胞外液特征。在呼吸性碱中毒中,细胞外液pH值升高,H | 表31-3显示了呼吸性和代谢性碱中毒的总体细胞外液特征。在呼吸性碱中毒中,细胞外液pH值升高,H+浓度降低。碱中毒的原因是过度通气导致的血浆P C O_2降低。Pco_2的降低进而导致肾小管H+分泌减少。因此,肾小管液中没有足够的\Hat与所有过滤的HCO_3-反应。因此,不能与H+反应的HCO_3-不会被重吸收,而是随尿液排出。这导致血浆HCO_3-浓度降低,从而纠正碱中毒。因此,呼吸性碱中毒中P C O_2原发性降低的补偿反应是血浆H C O_3-浓度降低,这是由于肾脏排泄H C O_3-增加所致。 | ||
在代谢性碱中毒中,血浆H | 在代谢性碱中毒中,血浆H+浓度也降低,pH值升高。然而,代谢性碱中毒的原因是细胞外液H C O_3-浓度升高。这种升高部分通过呼吸速率降低来补偿,呼吸速率降低会增加Pco_2,并帮助将细胞外液pH恢复到正常水平。此外,细胞外液中HCO_3-浓度的增加会增加HCO_3-的过滤负荷,这反过来又会导致肾小管液中分泌的H+不足以与HCO_3-反应。由于没有\Hat与之反应,肾小管液中的过量HCO_3-无法被重吸收,而是随尿液排出。在代谢性碱中毒中,主要的补偿反应是通气减少,这会增加P C O_2,并增加肾脏H C O_3-排泄,从而帮助补偿细胞外液H C O_3-浓度的初始升高。 | ||
== 酸碱平衡紊乱的临床原因 == | == 酸碱平衡紊乱的临床原因 == | ||
| 第2,628行: | 第2,685行: | ||
呼吸性碱中毒(respiratory alkalosis)是由肺部过度通气引起的。这种情况很少因身体病理状况而发生。然而,精神神经症(psychoneurosis)偶尔会增加呼吸,以至于一个人变得碱中毒。 | 呼吸性碱中毒(respiratory alkalosis)是由肺部过度通气引起的。这种情况很少因身体病理状况而发生。然而,精神神经症(psychoneurosis)偶尔会增加呼吸,以至于一个人变得碱中毒。 | ||
当一个人上升到高海拔时,会发生一种生理类型的呼吸性碱中毒。空气中低氧含量刺激呼吸,导致CO_2的丢失和轻度呼吸性碱中毒的发展。再次强调,主要的补偿手段是体液的化学缓冲剂和肾脏增加HCO_3 | 当一个人上升到高海拔时,会发生一种生理类型的呼吸性碱中毒。空气中低氧含量刺激呼吸,导致CO_2的丢失和轻度呼吸性碱中毒的发展。再次强调,主要的补偿手段是体液的化学缓冲剂和肾脏增加HCO_3-排泄的能力。 | ||
=== 代谢性酸中毒(metabolic acidosis)由细胞外液H C O_3-浓度降低引起 === | === 代谢性酸中毒(metabolic acidosis)由细胞外液H C O_3-浓度降低引起 === | ||
代谢性酸中毒这一术语指的是除了由体液中过量CO_2引起的所有其他类型的酸中毒。代谢性酸中毒可以由几个一般原因引起:(1) 肾脏未能正常排泄体内正常形成的代谢酸;(2) 体内形成过量的代谢酸;(3) 通过摄入或输注酸将代谢酸添加到体内;以及 (4) 从体液中丢失碱基,这与向体液中添加酸具有相同的效果。以下部分描述了一些导致代谢性酸中毒的具体情况。 | 代谢性酸中毒这一术语指的是除了由体液中过量CO_2引起的所有其他类型的酸中毒。代谢性酸中毒可以由几个一般原因引起:(1) 肾脏未能正常排泄体内正常形成的代谢酸;(2) 体内形成过量的代谢酸;(3) 通过摄入或输注酸将代谢酸添加到体内;以及 (4) 从体液中丢失碱基,这与向体液中添加酸具有相同的效果。以下部分描述了一些导致代谢性酸中毒的具体情况。 | ||
'''肾小管酸中毒(Renal Tubular Acidosis)'''。肾小管酸中毒是由于肾小管H | '''肾小管酸中毒(Renal Tubular Acidosis)'''。肾小管酸中毒是由于肾小管H+分泌、HCO_3-重吸收或两者缺陷引起的。这些疾病通常有两种类型:(1) 肾小管HCO_3-重吸收受损,导致HCO_3-在尿液中丢失;或 (2) 肾小管\Hat分泌机制无法建立正常的酸性尿液,导致排泄碱性尿液。在这些情况下,排泄的可滴定酸和NH_4+量不足,因此体液中有酸的净积累。肾小管酸中毒的一些原因包括慢性肾功能衰竭、醛固酮分泌不足(Addison病)以及几种损害肾小管功能的遗传性和获得性疾病,如Fanconi综合征(见第32章)。 | ||
'''腹泻(Diarrhea)'''。严重腹泻可能是代谢性酸中毒最常见的原因。这种酸中毒的原因是大量碳酸氢钠丢失到粪便中。胃肠道分泌物通常含有大量碳酸氢盐,腹泻导致HCO_3 | '''腹泻(Diarrhea)'''。严重腹泻可能是代谢性酸中毒最常见的原因。这种酸中毒的原因是大量碳酸氢钠丢失到粪便中。胃肠道分泌物通常含有大量碳酸氢盐,腹泻导致HCO_3-从体内丢失,这与尿液中丢失大量碳酸氢盐具有相同的效果。这种形式的代谢性酸中毒可能很严重,并可能导致死亡,尤其是在幼儿中。 | ||
'''呕吐肠道内容物(Vomiting of Intestinal Contents)'''。仅呕吐胃内容物会导致酸丢失和碱中毒倾向,因为胃分泌物是高度酸性的。然而,从胃肠道深处呕吐大量内容物会导致碳酸氢盐丢失,并以与腹泻引起酸中毒相同的方式导致代谢性酸中毒。 | '''呕吐肠道内容物(Vomiting of Intestinal Contents)'''。仅呕吐胃内容物会导致酸丢失和碱中毒倾向,因为胃分泌物是高度酸性的。然而,从胃肠道深处呕吐大量内容物会导致碳酸氢盐丢失,并以与腹泻引起酸中毒相同的方式导致代谢性酸中毒。 | ||
| 第2,646行: | 第2,703行: | ||
= 慢性肾功能衰竭(Chronic Renal Failure) = | = 慢性肾功能衰竭(Chronic Renal Failure) = | ||
当肾功能显著下降时,体液中未被肾脏排出的弱酸阴离子(anions of weak acids)会积聚。此外,肾小球滤过率(glomerular filtration rate)降低会减少磷酸盐(phosphates)和NH_4 | 当肾功能显著下降时,体液中未被肾脏排出的弱酸阴离子(anions of weak acids)会积聚。此外,肾小球滤过率(glomerular filtration rate)降低会减少磷酸盐(phosphates)和NH_4+的排泄,从而减少返回体液的HCO_3-量。因此,慢性肾功能衰竭可能与严重的代谢性酸中毒有关。 | ||
= 代谢性碱中毒(Metabolic Alkalosis)由细胞外液H C O_3-浓度增加引起 = | = 代谢性碱中毒(Metabolic Alkalosis)由细胞外液H C O_3-浓度增加引起 = | ||
HCO_3 | HCO_3-的过度滞留或\Hat的丢失会导致代谢性碱中毒。代谢性碱中毒远不如代谢性酸中毒常见,但以下部分描述了一些代谢性碱中毒的原因。 | ||
= 利尿剂的使用(Administration of Diuretics)(碳酸酐酶抑制剂除外) = | = 利尿剂的使用(Administration of Diuretics)(碳酸酐酶抑制剂除外) = | ||
所有利尿剂都会增加沿肾小管(tubules)的液体流动,通常会增加远端(distal)和集合管(collecting tubules)的流动。这种效应导致从肾单位(nephrons)的这些部分增加Na | 所有利尿剂都会增加沿肾小管(tubules)的液体流动,通常会增加远端(distal)和集合管(collecting tubules)的流动。这种效应导致从肾单位(nephrons)的这些部分增加Na+的重吸收(reabsorption)。因为这里的钠重吸收与\ H+分泌(secretion)耦合,增强的钠重吸收也会导致\Hat分泌增加和碳酸氢盐重吸收增加。与使用利尿剂相关的细胞外液(extracellular fluid)体积减少通常也与血管紧张素II(Ang II)和醛固酮(aldosterone)的形成增加有关,这两者都刺激\Hat分泌和HCO_3-重吸收。这些变化导致碱中毒的发展,其特征是细胞外液碳酸氢盐浓度增加。 | ||
= 醛固酮过量(Excess Aldosterone) = | = 醛固酮过量(Excess Aldosterone) = | ||
当肾上腺(adrenal glands)分泌大量醛固酮时,会出现轻度代谢性碱中毒。如前所述,醛固酮促进远端和集合管中Na | 当肾上腺(adrenal glands)分泌大量醛固酮时,会出现轻度代谢性碱中毒。如前所述,醛固酮促进远端和集合管中Na+的广泛重吸收,同时刺激集合管间细胞(intercalated cells)分泌\Hat和HCO_3-重吸收。这种H+分泌和HCO_3-重吸收的增加导致代谢性碱中毒。 | ||
胃内容物呕吐。仅呕吐胃内容物而不呕吐下消化道内容物,会导致胃黏膜分泌的HCl丢失。最终结果是细胞外液中的酸丢失,并发展为代谢性碱中毒(metabolic alkalosis)。这种类型的碱中毒尤其常见于因幽门括约肌肥大而导致幽门狭窄(hypertrophied pyloric sphincter muscles)的新生儿。 | 胃内容物呕吐。仅呕吐胃内容物而不呕吐下消化道内容物,会导致胃黏膜分泌的HCl丢失。最终结果是细胞外液中的酸丢失,并发展为代谢性碱中毒(metabolic alkalosis)。这种类型的碱中毒尤其常见于因幽门括约肌肥大而导致幽门狭窄(hypertrophied pyloric sphincter muscles)的新生儿。 | ||
| 第2,664行: | 第2,721行: | ||
酸中毒或碱中毒的最佳治疗方法是纠正导致异常的原因。这通常很困难,尤其是在导致肺功能受损或肾功能衰竭的慢性疾病中。在这些情况下,可以使用各种药物来中和细胞外液中过量的酸或碱。 | 酸中毒或碱中毒的最佳治疗方法是纠正导致异常的原因。这通常很困难,尤其是在导致肺功能受损或肾功能衰竭的慢性疾病中。在这些情况下,可以使用各种药物来中和细胞外液中过量的酸或碱。 | ||
为了中和过量的酸,可以口服大量碳酸氢钠。碳酸氢钠从胃肠道吸收进入血液,增加碳酸氢盐缓冲系统(bicarbonate buffer system)中的HCO_3 | 为了中和过量的酸,可以口服大量碳酸氢钠。碳酸氢钠从胃肠道吸收进入血液,增加碳酸氢盐缓冲系统(bicarbonate buffer system)中的HCO_3-部分,从而使pH趋向正常。碳酸氢钠也可以通过静脉注射,但由于这种治疗可能带来的生理危险,通常使用其他物质代替,如乳酸钠(sodium lactate)和葡萄糖酸钠(sodium gluconate)。这些分子中的乳酸和葡萄糖酸部分在体内代谢,留下细胞外液中的钠以碳酸氢钠的形式存在,从而使液体的pH趋向正常。 | ||
对于碱中毒的治疗,可以口服氯化铵(ammonium chloride)。当氯化铵被吸收进入血液后,氨部分被肝脏转化为尿素。该反应释放出HCl,HCl立即与体液中的缓冲剂反应,使H | 对于碱中毒的治疗,可以口服氯化铵(ammonium chloride)。当氯化铵被吸收进入血液后,氨部分被肝脏转化为尿素。该反应释放出HCl,HCl立即与体液中的缓冲剂反应,使H+浓度向酸性方向移动。氯化铵偶尔也会通过静脉注射,但由于NH_4+具有高度毒性,这种操作可能很危险。最合适的治疗方法是逆转碱中毒的根本原因。例如,如果代谢性碱中毒与细胞外液容量不足有关,但没有心力衰竭,通过输注等渗盐水溶液适当补充容量通常有助于纠正碱中毒。 | ||
=== 酸碱紊乱的临床测量和分析 === | === 酸碱紊乱的临床测量和分析 === | ||
酸碱紊乱的适当治疗需要正确的诊断。前面描述的简单酸碱紊乱可以通过分析动脉血样本的三个测量值来诊断:pH、血浆HCO_3 | 酸碱紊乱的适当治疗需要正确的诊断。前面描述的简单酸碱紊乱可以通过分析动脉血样本的三个测量值来诊断:pH、血浆HCO_3-浓度和Pco_2。 | ||
简单酸碱紊乱的诊断涉及几个步骤,如图31-10所示。通过检查pH,可以确定紊乱是酸中毒还是碱中毒。pH小于7.4表示酸中毒,而pH大于7.4表示碱中毒。 | 简单酸碱紊乱的诊断涉及几个步骤,如图31-10所示。通过检查pH,可以确定紊乱是酸中毒还是碱中毒。pH小于7.4表示酸中毒,而pH大于7.4表示碱中毒。 | ||
第二步是检查血浆中的Pco_2和HCO_3 | 第二步是检查血浆中的Pco_2和HCO_3-浓度。Pco_2的正常值约为40mmHg,而HCO_3-的正常值为24mEq/L。如果该紊乱被定性为酸中毒(acidosis)且血浆Pco_2升高,则酸中毒中必然存在呼吸成分。经过肾脏代偿后,呼吸性酸中毒(respiratory acidosis)中的血浆HCO_3-浓度往往会增加到高于正常水平。因此,单纯性呼吸性酸中毒的预期值将是血浆pH值降低、P C O_\mathcalD升高以及部分肾脏代偿后血浆H C O_3-浓度升高。 | ||
图31-10. 单纯性酸碱紊乱的分析。如果代偿反应与图中底部所示的有显著差异,则应怀疑存在混合性酸碱紊乱。 | 图31-10. 单纯性酸碱紊乱的分析。如果代偿反应与图中底部所示的有显著差异,则应怀疑存在混合性酸碱紊乱。 | ||
对于代谢性酸中毒(metabolic acidosis),血浆pH也会降低。然而,在代谢性酸中毒中,主要异常是血浆HCO_3 | 对于代谢性酸中毒(metabolic acidosis),血浆pH也会降低。然而,在代谢性酸中毒中,主要异常是血浆HCO_3-浓度降低。因此,如果低pH值与低HCO_3-浓度相关,则酸中毒中必然存在代谢成分。在单纯性代谢性酸中毒中,由于部分呼吸代偿,Pco_2会降低,这与呼吸性酸中毒中Pco_2升高形成对比。因此,在单纯性代谢性酸中毒中,预期会发现低p H、低血浆H C O_3-浓度以及部分呼吸代偿后P C O_2降低。 | ||
分类碱中毒(alkalosis)类型的步骤涉及相同的基本步骤。首先,碱中毒意味着血浆pH升高。如果pH升高与PCO_2降低相关,则碱中毒中必然存在呼吸成分。如果pH升高与HCO_3 | 分类碱中毒(alkalosis)类型的步骤涉及相同的基本步骤。首先,碱中毒意味着血浆pH升高。如果pH升高与PCO_2降低相关,则碱中毒中必然存在呼吸成分。如果pH升高与HCO_3-升高相关,则碱中毒中必然存在代谢成分。因此,在单纯性呼吸性碱中毒中,预期会发现pH值升高、P C O_\mathcalD降低以及血浆中H C O_3-浓度降低。在单纯性代谢性碱中毒中,预期会发现p H升高、血浆H C O_3-升高以及P C O_2升高。 | ||
=== 复杂的酸碱紊乱及酸碱诊断图的使用 === | === 复杂的酸碱紊乱及酸碱诊断图的使用 === | ||
在某些情况下,酸碱紊乱并不伴随适当的代偿反应。当这种情况发生时,这种异常被称为混合性酸碱紊乱(mixed acid-base disorder),这意味着酸碱紊乱有两个或更多的潜在原因。例如,pH值低的患者将被归类为酸中毒(acidotic)。如果紊乱是由代谢引起的,这也会伴随血浆HCO_3 | 在某些情况下,酸碱紊乱并不伴随适当的代偿反应。当这种情况发生时,这种异常被称为混合性酸碱紊乱(mixed acid-base disorder),这意味着酸碱紊乱有两个或更多的潜在原因。例如,pH值低的患者将被归类为酸中毒(acidotic)。如果紊乱是由代谢引起的,这也会伴随血浆HCO_3-浓度降低,并且在适当的呼吸代偿后,Pco_2也会降低。然而,如果低血浆pH和低HCO_3-浓度与升高的Pco_2相关,人们会怀疑酸中毒中存在呼吸成分以及代谢成分。因此,这种紊乱将被归类为混合性酸中毒(mixed acidosis)。例如,这种紊乱可能发生在因腹泻(代谢性酸中毒(metabolic acidosis))和肺气肿(呼吸性酸中毒(respiratory acidosis))导致胃肠道急性HCO_3-丢失的患者中。 | ||
图31-11. 显示动脉血pH、动脉血浆H C O_3,和P C O_2值的酸碱诺模图(acid-base nomogram)。中央的开放圆圈显示了正常人群酸碱状态的近似范围。诺模图中的阴影区域显示了由单纯代谢性和呼吸性紊乱引起的正常代偿的近似范围。对于落在阴影区域之外的值,应怀疑存在混合性酸碱紊乱。(改编自Cogan MG, Rector FC Jr: Acid-Base Disorders in the Kidney, 3rd ed. Philadelphia: WB Saunders, 1986.) | 图31-11. 显示动脉血pH、动脉血浆H C O_3,和P C O_2值的酸碱诺模图(acid-base nomogram)。中央的开放圆圈显示了正常人群酸碱状态的近似范围。诺模图中的阴影区域显示了由单纯代谢性和呼吸性紊乱引起的正常代偿的近似范围。对于落在阴影区域之外的值,应怀疑存在混合性酸碱紊乱。(改编自Cogan MG, Rector FC Jr: Acid-Base Disorders in the Kidney, 3rd ed. Philadelphia: WB Saunders, 1986.) | ||
诊断酸碱紊乱的一种便捷方法是使用酸碱诺模图(acid-base nomogram),如图31-11所示。该图可用于确定酸中毒或碱中毒的类型及其严重程度。在此酸碱图中,pH、HCO_3 | 诊断酸碱紊乱的一种便捷方法是使用酸碱诺模图(acid-base nomogram),如图31-11所示。该图可用于确定酸中毒或碱中毒的类型及其严重程度。在此酸碱图中,pH、HCO_3-浓度和PCO_2值根据Henderson-Hasselbalch方程相交。中央的开放圆圈显示了正常值以及仍可被视为正常范围内的偏差。图中的阴影区域显示了单纯代谢性和呼吸性紊乱的正常代偿的95%置信区间。 | ||
在使用此图时,必须假设已经有足够的时间进行完全代偿反应,原发性代谢性紊乱的呼吸代偿需要6至12小时,而原发性呼吸性紊乱的代谢代偿需要3至5天。如果某个值落在阴影区域内,这表明存在单纯的酸碱紊乱。相反,如果pH、碳酸氢盐或Pco_2的值落在阴影区域之外,这表明患者可能存在混合性酸碱紊乱。 | 在使用此图时,必须假设已经有足够的时间进行完全代偿反应,原发性代谢性紊乱的呼吸代偿需要6至12小时,而原发性呼吸性紊乱的代谢代偿需要3至5天。如果某个值落在阴影区域内,这表明存在单纯的酸碱紊乱。相反,如果pH、碳酸氢盐或Pco_2的值落在阴影区域之外,这表明患者可能存在混合性酸碱紊乱。 | ||
| 第2,692行: | 第2,749行: | ||
重要的是要认识到,落在阴影区域内的酸碱值并不总是意味着存在单纯的酸碱紊乱。在考虑到这一限制的情况下,酸碱图可以作为一种快速确定酸碱紊乱的具体类型和严重程度的手段。 | 重要的是要认识到,落在阴影区域内的酸碱值并不总是意味着存在单纯的酸碱紊乱。在考虑到这一限制的情况下,酸碱图可以作为一种快速确定酸碱紊乱的具体类型和严重程度的手段。 | ||
例如,假设一名患者的动脉血浆测得以下数值:pH,7.30;血浆HCO_3 | 例如,假设一名患者的动脉血浆测得以下数值:pH,7.30;血浆HCO_3-浓度,12.0mEq/L;血浆PCO_2,25mmHg。根据这些数值,可以通过图表发现,这代表了一种单纯性代谢性酸中毒(metabolic acidosis),并伴有适当的呼吸代偿,使Pco_2从正常值40mmHg降低至25mmHg。 | ||
第二个例子是一名患者的以下数值:pH,7.15;血浆HCO_3 | 第二个例子是一名患者的以下数值:pH,7.15;血浆HCO_3-浓度,17mEq/L;血浆Pco_2,50mmHg。在这个例子中,患者处于酸中毒状态,并且似乎存在代谢性成分,因为血浆HCO_3-浓度低于正常值24mEq/L。然而,通常会降低PCO_2的呼吸代偿并未出现,且PCO_2略高于正常值40mmHg。这一发现与混合性酸碱紊乱一致,包括代谢性酸中毒和呼吸性成分。 | ||
酸碱图(acid–base nomogram)是一种快速评估可能导致异常pH、PCO_2和血浆碳酸氢盐浓度的紊乱类型和严重程度的方法。在临床环境中,患者的病史和其他体格检查结果也为酸碱紊乱的原因和治疗提供了重要线索。 | 酸碱图(acid–base nomogram)是一种快速评估可能导致异常pH、PCO_2和血浆碳酸氢盐浓度的紊乱类型和严重程度的方法。在临床环境中,患者的病史和其他体格检查结果也为酸碱紊乱的原因和治疗提供了重要线索。 | ||
=== 使用阴离子间隙(anion gap)诊断酸碱紊乱 === | === 使用阴离子间隙(anion gap)诊断酸碱紊乱 === | ||
血浆中的阴离子和阳离子浓度必须相等以维持电中性。因此,血浆中并不存在真正的阴离子间隙。然而,临床实验室通常只测量某些阳离子和阴离子。通常测量的阳离子是Na | 血浆中的阴离子和阳离子浓度必须相等以维持电中性。因此,血浆中并不存在真正的阴离子间隙。然而,临床实验室通常只测量某些阳离子和阴离子。通常测量的阳离子是Na+,而阴离子通常是Cl-和HCO_3-。阴离子间隙——仅是一个诊断概念——是未测量阴离子与未测量阳离子之间的差值,其估算如下: | ||
\beginarrayr l血浆阴离子间隙=[Na | \beginarrayr l血浆阴离子间隙=[Na+]-[HCO_3-]-[Cl-]&\ =144-24-108=12mEq/L&\endarray | ||
如果未测量阴离子增加或未测量阳离子减少,阴离子间隙将增加。最重要的未测量阳离子包括钙、镁和钾,而主要的未测量阴离子是白蛋白、磷酸盐、硫酸盐和其他有机阴离子。通常,未测量阴离子超过未测量阳离子,阴离子间隙范围在8到16mEq/L之间。 | 如果未测量阴离子增加或未测量阳离子减少,阴离子间隙将增加。最重要的未测量阳离子包括钙、镁和钾,而主要的未测量阴离子是白蛋白、磷酸盐、硫酸盐和其他有机阴离子。通常,未测量阴离子超过未测量阳离子,阴离子间隙范围在8到16mEq/L之间。 | ||
| 第2,713行: | 第2,768行: | ||
<nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki>阴离子间隙增加(正常氯血症)<nowiki></td></nowiki><nowiki><td></nowiki>阴离子间隙正常(高氯血症)<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>糖尿病(酮症酸中毒)<nowiki></td></nowiki><nowiki><td></nowiki>腹泻<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>乳酸酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>肾小管酸中毒<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>慢性肾功能衰竭<nowiki></td></nowiki><nowiki><td></nowiki>碳酸酐酶抑制剂<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>阿司匹林(乙酰水杨酸)中毒<nowiki></td></nowiki><nowiki><td></nowiki>Addison病<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>甲醇中毒<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>乙二醇中毒<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>饥饿<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | <nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki>阴离子间隙增加(正常氯血症)<nowiki></td></nowiki><nowiki><td></nowiki>阴离子间隙正常(高氯血症)<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>糖尿病(酮症酸中毒)<nowiki></td></nowiki><nowiki><td></nowiki>腹泻<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>乳酸酸中毒<nowiki></td></nowiki><nowiki><td></nowiki>肾小管酸中毒<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>慢性肾功能衰竭<nowiki></td></nowiki><nowiki><td></nowiki>碳酸酐酶抑制剂<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>阿司匹林(乙酰水杨酸)中毒<nowiki></td></nowiki><nowiki><td></nowiki>Addison病<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>甲醇中毒<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>乙二醇中毒<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>饥饿<nowiki></td></nowiki><nowiki><td></nowiki><nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | ||
血浆阴离子间隙(plasma anion gap)主要用于诊断代谢性酸中毒(metabolic acidosis)的不同原因。在代谢性酸中毒中,血浆HCO_3 | 血浆阴离子间隙(plasma anion gap)主要用于诊断代谢性酸中毒(metabolic acidosis)的不同原因。在代谢性酸中毒中,血浆HCO_3-浓度降低。如果血浆钠浓度不变,阴离子Cl-或未测阴离子的浓度会增加以维持电中性。如果血浆Cl-的增加与血浆HCO_3-的下降成比例,阴离子间隙将保持正常。这通常被称为高氯性代谢性酸中毒(hyperchloremic metabolic acidosis)。 | ||
如果血浆HCO_3 | 如果血浆HCO_3-的下降不伴随Cl-的增加,则必须有未测阴离子水平的增加,从而导致计算的阴离子间隙增加。由过量非挥发性酸(除HCl外)如乳酸或酮酸引起的代谢性酸中毒与血浆阴离子间隙增加有关,因为HCO_3-的下降不与Cl-的等量增加相匹配。表31-4显示了一些与正常或增加的阴离子间隙相关的代谢性酸中毒的例子。通过计算阴离子间隙,可以缩小代谢性酸中毒的一些潜在原因。 | ||
Brown D, Wagner CA: Molecular mechanisms of acid-base sensing by the kidney. J Am Soc Nephrol 23:774, 2012. Curthoys NP, Moe OW: Proximal tubule function and response to acidosis. Clin J Am Soc Nephrol 9:1627, 2014. DeCoursey TE: Voltage-gated proton channels: molecular biology, physiology, and pathophysiology of the H(V) family. Physiol Rev 93:599, 2013. Hamm LL, Nakhoul N, Hering-Smith KS: Acid-base homeostasis. Clin J Am Soc Nephrol 10:2232, 2015. Kamel KS, Halperin ML: Acid-base problems in diabetic ketoacidosis. N Engl J Med 372:546, 2015. Kraut JA, Madias NE: Differential diagnosis of nongap metabolic acidosis: value of a systematic approach. Clin J Am Soc Nephrol 7:671, 2012. Kurtz I: Renal tubular acidosis: H+, /base and ammonia transport abnormalities and clinical syndromes. Adv Chronic Kidney Dis 25:334, 2018. Kurtz I: Molecular mechanisms and regulation of urinary acidification. Compr Physiol 4:1737, 2014. Nagami GT, Hamm LL: Regulation of acid-base balance in chronic kidney disease. Adv Chronic Kidney Dis 24:274, 2017. Palmer BF, Clegg DJ: Electrolyte and acid-base disturbances in patients with diabetes mellitus. N Engl J Med 373:548, 2015. Purkerson JM, Schwartz GJ: The role of carbonic anhydrases in renal physiology. Kidney Int 71:103, 2007. Roy A, Al-bataineh MM, Pastor-Soler NM: Collecting duct intercalated cell function and regulation. Clin J Am Soc Nephrol 10:305, 2015. Seifter JL: Integration of acid-base and electrolyte disorders. N Engl J Med 371:1821, 2014. Seifter JL, Chang HY: Extracellular acid-base balance and ion transport between body fluid compartments. Physiology (Bethesda) 32:367, 2017. Uduman J, Yee J: Pseudo-renal tubular acidosis: conditions mimicking renal tubular acidosis. Adv Chronic Kidney Dis 25:358, 2018. Vallés PG, Batlle D: Hypokalemic distal renal tubular acidosis. Adv Chronic Kidney Dis 25:303, 2018. Vandenberg RJ, Ryan RM: Mechanisms of glutamate transport. Physiol Rev 93:1621, 2013. Weiner ID, Verlander JW: Ammonia transporters and their role in acid-base balance. Physiol 97:465, 2017. | Brown D, Wagner CA: Molecular mechanisms of acid-base sensing by the kidney. J Am Soc Nephrol 23:774, 2012. Curthoys NP, Moe OW: Proximal tubule function and response to acidosis. Clin J Am Soc Nephrol 9:1627, 2014. DeCoursey TE: Voltage-gated proton channels: molecular biology, physiology, and pathophysiology of the H(V) family. Physiol Rev 93:599, 2013. Hamm LL, Nakhoul N, Hering-Smith KS: Acid-base homeostasis. Clin J Am Soc Nephrol 10:2232, 2015. Kamel KS, Halperin ML: Acid-base problems in diabetic ketoacidosis. N Engl J Med 372:546, 2015. Kraut JA, Madias NE: Differential diagnosis of nongap metabolic acidosis: value of a systematic approach. Clin J Am Soc Nephrol 7:671, 2012. Kurtz I: Renal tubular acidosis: H+, /base and ammonia transport abnormalities and clinical syndromes. Adv Chronic Kidney Dis 25:334, 2018. Kurtz I: Molecular mechanisms and regulation of urinary acidification. Compr Physiol 4:1737, 2014. Nagami GT, Hamm LL: Regulation of acid-base balance in chronic kidney disease. Adv Chronic Kidney Dis 24:274, 2017. Palmer BF, Clegg DJ: Electrolyte and acid-base disturbances in patients with diabetes mellitus. N Engl J Med 373:548, 2015. Purkerson JM, Schwartz GJ: The role of carbonic anhydrases in renal physiology. Kidney Int 71:103, 2007. Roy A, Al-bataineh MM, Pastor-Soler NM: Collecting duct intercalated cell function and regulation. Clin J Am Soc Nephrol 10:305, 2015. Seifter JL: Integration of acid-base and electrolyte disorders. N Engl J Med 371:1821, 2014. Seifter JL, Chang HY: Extracellular acid-base balance and ion transport between body fluid compartments. Physiology (Bethesda) 32:367, 2017. Uduman J, Yee J: Pseudo-renal tubular acidosis: conditions mimicking renal tubular acidosis. Adv Chronic Kidney Dis 25:358, 2018. Vallés PG, Batlle D: Hypokalemic distal renal tubular acidosis. Adv Chronic Kidney Dis 25:303, 2018. Vandenberg RJ, Ryan RM: Mechanisms of glutamate transport. Physiol Rev 93:1621, 2013. Weiner ID, Verlander JW: Ammonia transporters and their role in acid-base balance. Physiol 97:465, 2017. | ||
| 第2,748行: | 第2,803行: | ||
=== 碳酸酐酶抑制剂阻断碳酸氢钠重吸收 === | === 碳酸酐酶抑制剂阻断碳酸氢钠重吸收 === | ||
乙酰唑胺抑制碳酸酐酶(carbonic anhydrase),该酶对肾小管中碳酸氢根(HCO_3 | 乙酰唑胺抑制碳酸酐酶(carbonic anhydrase),该酶对肾小管中碳酸氢根(HCO_3-)的重吸收至关重要,如第31章所述。碳酸酐酶在近曲小管中尤其丰富,这是碳酸酐酶抑制剂的主要作用部位。一些碳酸酐酶也存在于其他小管细胞中,例如集合管的闰细胞(intercalated cells)。 | ||
表32-1 利尿剂的类别、作用机制及作用部位 | 表32-1 利尿剂的类别、作用机制及作用部位 | ||
| 第2,754行: | 第2,809行: | ||
<nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki>利尿剂类别(示例)<nowiki></td></nowiki><nowiki><td></nowiki>作用机制<nowiki></td></nowiki><nowiki><td></nowiki>作用部位<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>渗透性利尿剂(甘露醇)<nowiki></td></nowiki><nowiki><td></nowiki>通过增加小管液的渗透压抑制水和溶质的重吸收<nowiki></td></nowiki><nowiki><td></nowiki>主要作用于近曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>袢利尿剂(呋塞米、布美他尼)<nowiki></td></nowiki><nowiki><td></nowiki>抑制管腔膜上的Na+-K+-Cl-共转运<nowiki></td></nowiki><nowiki><td></nowiki>髓袢升支粗段<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>噻嗪类利尿剂(氢氯噻嗪、氯噻酮)<nowiki></td></nowiki><nowiki><td></nowiki>抑制管腔膜上的Na+-Cl-共转运<nowiki></td></nowiki><nowiki><td></nowiki>早期远曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>碳酸酐酶抑制剂(乙酰唑胺)<nowiki></td></nowiki><nowiki><td></nowiki>抑制H+分泌和HCO3-重吸收,从而减少Na+重吸收<nowiki></td></nowiki><nowiki><td></nowiki>主要作用于近曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>醛固酮拮抗剂(螺内酯、依普利酮)<nowiki></td></nowiki><nowiki><td></nowiki>抑制醛固酮对小管受体的作用,减少Na+重吸收,减少K+分泌<nowiki></td></nowiki><nowiki><td></nowiki>集合管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>钠通道阻滞剂(氨苯蝶啶、阿米洛利)<nowiki></td></nowiki><nowiki><td></nowiki>阻断Na+进入管腔膜的Na+通道,减少Na+重吸收,减少K+分泌<nowiki></td></nowiki><nowiki><td></nowiki>集合管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | <nowiki><html><body><table><tr></nowiki><nowiki><td></nowiki>利尿剂类别(示例)<nowiki></td></nowiki><nowiki><td></nowiki>作用机制<nowiki></td></nowiki><nowiki><td></nowiki>作用部位<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>渗透性利尿剂(甘露醇)<nowiki></td></nowiki><nowiki><td></nowiki>通过增加小管液的渗透压抑制水和溶质的重吸收<nowiki></td></nowiki><nowiki><td></nowiki>主要作用于近曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>袢利尿剂(呋塞米、布美他尼)<nowiki></td></nowiki><nowiki><td></nowiki>抑制管腔膜上的Na+-K+-Cl-共转运<nowiki></td></nowiki><nowiki><td></nowiki>髓袢升支粗段<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>噻嗪类利尿剂(氢氯噻嗪、氯噻酮)<nowiki></td></nowiki><nowiki><td></nowiki>抑制管腔膜上的Na+-Cl-共转运<nowiki></td></nowiki><nowiki><td></nowiki>早期远曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>碳酸酐酶抑制剂(乙酰唑胺)<nowiki></td></nowiki><nowiki><td></nowiki>抑制H+分泌和HCO3-重吸收,从而减少Na+重吸收<nowiki></td></nowiki><nowiki><td></nowiki>主要作用于近曲小管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>醛固酮拮抗剂(螺内酯、依普利酮)<nowiki></td></nowiki><nowiki><td></nowiki>抑制醛固酮对小管受体的作用,减少Na+重吸收,减少K+分泌<nowiki></td></nowiki><nowiki><td></nowiki>集合管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki><tr></nowiki><nowiki><td></nowiki>钠通道阻滞剂(氨苯蝶啶、阿米洛利)<nowiki></td></nowiki><nowiki><td></nowiki>阻断Na+进入管腔膜的Na+通道,减少Na+重吸收,减少K+分泌<nowiki></td></nowiki><nowiki><td></nowiki>集合管<nowiki></td></nowiki><nowiki></tr></nowiki><nowiki></table></nowiki><nowiki></body></nowiki><nowiki></html></nowiki> | ||
由于近曲小管中氢离子(H | 由于近曲小管中氢离子(H+)分泌和碳酸氢根(HCO_3-)重吸收通过管腔膜上的钠-氢离子反向转运机制(sodium-hydrogen ion counter-transport mechanism)与钠重吸收相耦合,减少碳酸氢根重吸收也会减少钠重吸收。钠和碳酸氢根从小管液中的重吸收被阻断,导致这些离子留在小管中并起到渗透性利尿剂的作用。可以预见的是,碳酸酐酶抑制剂的一个缺点是它们会导致一定程度的酸中毒,因为尿液中碳酸氢根的过度流失。 | ||
=== 盐皮质激素受体拮抗剂减少集合管中的钠重吸收和钾分泌 === | === 盐皮质激素受体拮抗剂减少集合管中的钠重吸收和钾分泌 === | ||
| 第2,762行: | 第2,817行: | ||
=== 钠通道阻滞剂减少集合管对钠的重吸收 === | === 钠通道阻滞剂减少集合管对钠的重吸收 === | ||
阿米洛利(Amiloride)和氨苯蝶啶(Triamterene)也抑制集合管对钠的重吸收和钾的分泌,其作用与螺内酯相似。然而,在细胞水平上,这些药物直接阻断钠进入集合管上皮细胞管腔膜(luminal membrane)钠通道(sodium channels)(见图28-12)。由于钠进入上皮细胞的减少,跨细胞基底外侧膜(basolateral membranes)的钠转运也减少,因此钠-钾-腺苷三磷酸酶泵(sodium-potassium-adenosine triphosphatase pump, Na | 阿米洛利(Amiloride)和氨苯蝶啶(Triamterene)也抑制集合管对钠的重吸收和钾的分泌,其作用与螺内酯相似。然而,在细胞水平上,这些药物直接阻断钠进入集合管上皮细胞管腔膜(luminal membrane)钠通道(sodium channels)(见图28-12)。由于钠进入上皮细胞的减少,跨细胞基底外侧膜(basolateral membranes)的钠转运也减少,因此钠-钾-腺苷三磷酸酶泵(sodium-potassium-adenosine triphosphatase pump, Na+-K+ ATPase pump)的活性降低。这种活性降低减少了钾向细胞内的转运,最终减少了钾向肾小管液的分泌。因此,钠通道阻滞剂也是保钾利尿剂(potassium-sparing diuretics),并降低了钾的尿排泄率。 | ||
== 肾脏疾病 == | == 肾脏疾病 == | ||
| 第2,928行: | 第2,983行: | ||
尿素和其他非蛋白氮(氮质血症)的增加。非蛋白氮包括尿素、尿酸、肌酐和一些不太重要的化合物。这些非蛋白氮通常是蛋白质代谢的终产物,必须从体内去除以确保细胞中蛋白质代谢的正常进行。在完全肾衰竭的1到2周内,这些非蛋白氮的浓度,特别是尿素的浓度,可以上升到正常水平的10倍。在CKD中,这些浓度的上升大致与肾小球滤过率(GFR)的下降程度成正比。因此,测量这些物质的浓度,特别是尿素和肌酐的浓度,为评估CKD的严重程度提供了重要手段。 | 尿素和其他非蛋白氮(氮质血症)的增加。非蛋白氮包括尿素、尿酸、肌酐和一些不太重要的化合物。这些非蛋白氮通常是蛋白质代谢的终产物,必须从体内去除以确保细胞中蛋白质代谢的正常进行。在完全肾衰竭的1到2周内,这些非蛋白氮的浓度,特别是尿素的浓度,可以上升到正常水平的10倍。在CKD中,这些浓度的上升大致与肾小球滤过率(GFR)的下降程度成正比。因此,测量这些物质的浓度,特别是尿素和肌酐的浓度,为评估CKD的严重程度提供了重要手段。 | ||
CKD中的酸中毒。每天,身体通常会产生比代谢碱多约50到80毫摩尔的代谢酸。因此,当肾脏功能衰竭时,酸会在体液中积累。体液的缓冲系统通常可以缓冲500到1000毫摩尔的酸,而不会导致细胞外液H | CKD中的酸中毒。每天,身体通常会产生比代谢碱多约50到80毫摩尔的代谢酸。因此,当肾脏功能衰竭时,酸会在体液中积累。体液的缓冲系统通常可以缓冲500到1000毫摩尔的酸,而不会导致细胞外液H+浓度的致命增加,骨骼中的磷酸盐化合物还可以额外缓冲几千毫摩尔的H+。然而,当这种缓冲能力耗尽时,血液pH值会急剧下降,如果pH值下降到约6.8以下,患者将陷入昏迷并死亡。 | ||
由促红细胞生成素分泌减少引起的慢性肾脏病贫血。严重CKD患者几乎总是会出现贫血。这种贫血的最重要原因是肾脏分泌的促红细胞生成素减少,促红细胞生成素刺激骨髓产生红细胞。如果肾脏严重受损,它们无法形成足够的促红细胞生成素,从而导致红细胞生成减少和随之而来的贫血。 | 由促红细胞生成素分泌减少引起的慢性肾脏病贫血。严重CKD患者几乎总是会出现贫血。这种贫血的最重要原因是肾脏分泌的促红细胞生成素减少,促红细胞生成素刺激骨髓产生红细胞。如果肾脏严重受损,它们无法形成足够的促红细胞生成素,从而导致红细胞生成减少和随之而来的贫血。 | ||
| 第3,012行: | 第3,067行: | ||
因此,溶质转移的最大速率最初发生在浓度梯度最大时(即透析开始时),随着浓度梯度的消散而减慢。在流动系统中,如血液透析中,血液和透析液流经人工肾,通过增加血液、透析液或两者的流速,可以减少浓度梯度的消散,并优化溶质通过膜的扩散。 | 因此,溶质转移的最大速率最初发生在浓度梯度最大时(即透析开始时),随着浓度梯度的消散而减慢。在流动系统中,如血液透析中,血液和透析液流经人工肾,通过增加血液、透析液或两者的流速,可以减少浓度梯度的消散,并优化溶质通过膜的扩散。 | ||
在人工肾的正常操作中,血液持续或间歇性地流回静脉。人工肾中任何时候的血液总量通常少于500毫升,流速可能为每分钟数百毫升,总扩散表面积在0.6至2. | 在人工肾的正常操作中,血液持续或间歇性地流回静脉。人工肾中任何时候的血液总量通常少于500毫升,流速可能为每分钟数百毫升,总扩散表面积在0.6至2.5m2之间。为了防止人工肾中血液凝固,当血液进入人工肾时,会向血液中注入少量肝素。除了溶质的扩散外,还可以通过施加静水压力迫使液体和溶质通过透析器的膜来产生溶质和水的质量转移;这种类型的过滤称为体积流或血液滤过。 | ||
==== 透析液 ==== | ==== 透析液 ==== | ||
2025年7月8日 (二) 11:10的版本
体液区室的调节:细胞外液和细胞内液;水肿
维持相对恒定的体液容量和稳定的组成对于内环境稳定(homeostasis)至关重要。临床医学中一些最常见和重要的问题源于维持体液相对恒定性的控制系统异常。在本章以及接下来的肾脏章节中,我们将讨论体液容量的整体调节、细胞外液的组成、酸碱平衡以及细胞外液和细胞内液之间液体交换的控制。
稳态条件下液体摄入和排出是平衡的
体液的相对恒定性是显著的,因为体液和溶质与外部环境以及不同体液区室之间存在持续的交换。例如,添加到体内的液体量变化很大,必须通过体内等量的水分排出仔细匹配,以防止体液容量增加或减少。
每日水分摄入
水分通过两种主要来源添加到体内:(1) 以液体或食物中的水分形式摄入,通常每天向体液中添加约2100ml;(2) 通过碳水化合物氧化在体内合成,每天添加约200ml。这些机制提供了每天约2300ml的总水分摄入量(表25-1)。然而,不同人群甚至同一个人在不同日期的水分摄入量差异很大,这取决于气候、习惯和体力活动水平。
每日体水损失
不显性失水(Insensible Water Loss)。一些水分损失无法精确调节。例如,人类通过呼吸道蒸发和皮肤扩散持续失水,在正常情况下,这两者合计每天失水约700ml。这种损失被称为不显性失水,因为我们没有意识地察觉到它,尽管它在所有活人中持续发生。
通过皮肤的不显性失水与出汗无关,即使在没有汗腺的人中也存在;通过皮肤扩散的平均失水量约为每天300至400ml。这种损失通过皮肤中充满胆固醇的角质层最小化,该层提供了防止过度扩散损失的屏障。当角质层被剥脱时,如大面积烧伤时,蒸发速率可增加多达10倍,达到每天3至5L。因此,烧伤患者必须给予大量液体,通常通过静脉注射,以平衡液体损失。
通过呼吸道的不显性失水通常平均每天约300至400ml。当空气进入呼吸道时,它会被水分饱和,达到约47mmHg的蒸气压,然后被排出。由于吸入空气的蒸气压通常低于47mmHg,水分会通过呼吸持续从肺部损失。在寒冷天气中,大气蒸气压降至接近0,随着温度降低,肺部水分损失更大。这一过程解释了寒冷天气中呼吸道干燥的感觉。
汗液中的体液流失。通过汗液流失的水量变化很大,取决于体力活动和环境温度。正常情况下,汗液量约为100ml/天,但在非常炎热的天气或剧烈运动期间,汗液中的体液流失偶尔会增加到1到2升/小时。如果不通过激活口渴机制增加摄入量,这种体液流失会迅速耗尽体液,如第29章所述。
粪便中的水分流失。正常情况下,粪便中仅流失少量水分(100ml/天)。在严重腹泻的人群中,这种流失可能增加到每天几升。因此,如果不在几天内纠正,严重腹泻可能危及生命。
肾脏的水分流失。体内剩余的水分流失发生在肾脏排泄的尿液中。多种机制控制尿液排泄速率。身体维持水分摄入和排出平衡以及体内大多数电解质摄入和排出平衡的最重要手段是通过控制肾脏排泄这些物质的速率。例如,脱水者的尿量可低至0.5L/天,而大量饮水者的尿量可高达20L/天。
| 摄入或排出 | 正常 | 长时间剧烈运动 |
|---|---|---|
| 摄入液体 | 2100 | ? |
| 代谢产生 | 200 | 200 |
| 总摄入量 | 2300 | ? |
| 不显性:皮肤 | 350 | 350 |
| 不显性:肺 | 350 | 650 |
| 汗液 | 100 | 5000 |
| 粪便 | 100 | 100 |
| 尿液 | 1400 | 500 |
| 总排出量 | 2300 | 6600 |
这种摄入量的变化也适用于体内大多数电解质,如钠、氯和钾。在某些人中,钠摄入量可能低至20mEq/天,而在其他人中,钠摄入量可能高达300到500 mEq/天。肾脏的任务是调整水和电解质的排泄速率,以精确匹配这些物质的摄入量,并补偿在某些疾病状态下发生的体液和电解质的过度流失。在第26章至第32章中,我们将讨论使肾脏能够执行这些非凡任务的机制。
体液分区
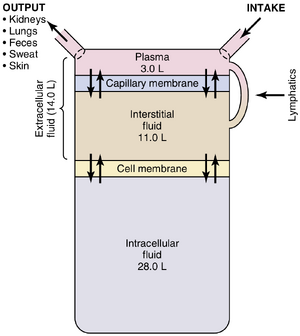
总体液主要分布在两个分区之间,即细胞外液(extracellular fluid)和细胞内液(intracellular fluid)(图25-1)。细胞外液分为组织间液和血浆(blood plasma)。
还有另一个小的体液分区,称为细胞跨液(transcellular fluid)。这个分区包括滑液、腹膜液、心包液和眼内液,以及脑脊液;它通常被认为是一种特殊类型的细胞外液,尽管在某些情况下其成分可能与血浆或组织间液显著不同。所有细胞跨液加起来约为1到2升。
在一名体重70公斤的成年男性中,总体水(total body water)约占体重的60%,即约42升。这一比例取决于年龄、性别和肥胖程度。随着年龄的增长,体液占总体重的比例逐渐下降。这种下降部分是由于衰老通常伴随着体脂比例的增加,从而降低了体内水分的比例。
由于女性通常比男性有更高的体脂比例,她们的总体水平均约占体重的50%。在早产儿和新生儿中,总体水占体重的70%至75%。因此,在讨论平均体液隔室时,我们应该意识到存在因年龄、性别和体脂比例而异的差异。
在许多其他国家,过去30年中平均体重(和脂肪量)迅速增加。在美国,20岁以上成年男性的平均体重估计约为88.8公斤(约196磅),成年女性为77.4公斤(约170磅)。因此,在本章及其他章节中讨论的关于平均体重70公斤男性的数据,在考虑大多数人的体液隔室时需要进行相应的调整。
细胞内液隔室
体内42升液体中约有28升位于数万亿个细胞内,统称为细胞内液(intracellular fluid)。因此,细胞内液约占“平均”人体重的40%。
每个细胞的液体含有其独特的成分混合物,但这些物质的浓度在不同细胞之间是相似的。事实上,细胞液体的组成非常相似,即使在不同的动物中,从最原始的微生物到人类都是如此。因此,所有不同细胞的细胞内液被视为一个大的液体隔室。
细胞外液隔室
所有位于细胞外的液体统称为细胞外液(extracellular fluid)。这些液体合计约占体重的20%,即在一名体重70公斤的男性中约为14升。细胞外液的两个最大隔室是间质液,占细胞外液的四分之三以上(11升),以及血浆(plasma),占细胞外液的近四分之一,约3升。血浆是血液的非细胞部分;它通过毛细血管膜的孔隙与间质液持续交换物质。这些孔隙对细胞外液中的几乎所有溶质都具有高度通透性,除了蛋白质。因此,细胞外液不断混合,所以血浆和间质液的组成大致相同,除了蛋白质,其在血浆中的浓度较高。
血容量
血液包含细胞外液(extracellular fluid)(血浆中的液体)和细胞内液(intracellular fluid)(红细胞中的液体)。然而,血液被认为是一个独立的液体隔室,因为它被包含在自己的腔室中,即循环系统。血容量在心血管动力学的控制中尤为重要。
成人的平均血容量约为体重的7%,或约5升。血液中约60%是血浆,40%是红细胞,但这些百分比在不同人群中可能会有很大差异,取决于性别、体重和其他因素。
血细胞比容(红细胞压积)。血细胞比容(hematocrit)是指血液中由红细胞组成的部分,通过将血液在血细胞比容管中离心直到细胞紧密堆积在管底来确定。由于离心机不能完全将红细胞堆积在一起,约3%至4%的血浆仍然被困在细胞之间,因此真实的血细胞比容仅为测量值的约96%。
在男性中,测量的血细胞比容通常约为0.40,而在女性中约为0.36。在严重贫血的患者中,血细胞比容可能低至0.10,这个值几乎不足以维持生命。相反,在某些情况下,患者会出现红细胞过度生成,导致红细胞增多症(polycythemia)。在这些患者中,血细胞比容可以上升到0.65。
细胞外液和细胞内液的组成
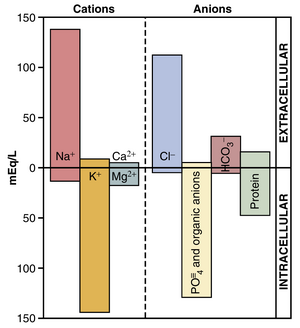
细胞外液(包括血浆和组织间液)和细胞内液的组成比较如图25-2、25-3和表25-2所示。
| 物质 | 血浆 (mOsm/L) | 间质液 (mOsm/L) | 细胞内液 (mOsm/L) |
| Na+ | 142 | 139 | 14 |
| K+ | 4.2 | 4.0 | 140 |
| Ca2+ | 1.3 | 1.2 | 0 |
| Mg2+ | 0.8 | 0.7 | 20 |
| CI- | 106 | 108 | 4 |
| HCO3- | 24 | 28.3 | 10 |
| HPO4-, H2PO4- | 2 | 2 | 11 |
| SO4- | 0.5 | 0.5 | 1 |
| 磷酸肌酸 | 45 | ||
| 肌肽 | 14 | ||
| 氨基酸 | 2 | 2 | 8 |
| 肌酸 | 0.2 | 0.2 | 6 |
| 乳酸 | 1.2 | 1.2 | 1.5 |
| 腺苷 | 5 | ||
| 三磷酸腺苷 己糖 | 3.7 | ||
| 单磷酸葡萄糖 | 5.6 | 5.6 | |
| 蛋白质 | 1.2 | 0.2 | 4 |
| 尿素 | 4 | 4 | 4 |
| 其他 | 4.8 | 3.9 | 10 |
| 总 mOsm/L 校正渗透压 | 299.8 | 300.8 | 301.2 |
| 活性 (mOsm/L) 总渗透压 | 282.0 | 281.0 | 281.0 |
| 37°C渗透压 (mm Hg) | 5441 | 5423 | 5423 |
血浆和组织间液的相似离子组成
由于血浆和组织间液仅由高度通透的毛细血管膜分隔,它们的离子组成相似。这两个隔室之间最重要的区别是血浆中蛋白质的浓度较高;因为毛细血管对血浆蛋白的通透性较低,所以在大多数组织中只有少量蛋白质渗漏到组织间隙中。
由于杜南效应(Donnan effect),阳离子在血浆中的浓度略高于间质液(约2%)。血浆蛋白带有净负电荷,因此倾向于结合钠和钾离子等阳离子,从而在血浆中与血浆蛋白一起保留额外的阳离子。相反,阴离子在间质液中的浓度略高于血浆,因为血浆蛋白的负电荷排斥带负电荷的阴离子。然而,在实际应用中,间质液和血浆中的离子浓度被认为是近似相等的。
再次参考图25-2,可以看到细胞外液(包括血浆和间质液)含有大量的钠和氯离子以及相当数量的碳酸氢根离子,但只有少量的钾、钙、镁、磷酸根和有机酸离子。细胞外液的组成通过各种机制(尤其是肾脏)进行精细调节,这将在后面讨论。这种调节使细胞能够持续浸泡在含有适当浓度电解质和营养物质的液体中,以实现最佳的细胞功能。
图25-4. 用于测量液体体积的指示剂稀释法。
细胞内液成分
细胞内液(Intracellular fluid)与细胞外液(Extracellular fluid)被细胞膜隔开,细胞膜对水具有高度通透性,但对体内大多数电解质不通透。与细胞外液相比,细胞内液仅含有少量的钠离子和氯离子,几乎不含钙离子。相反,细胞内液含有大量的钾离子和磷酸根离子,以及适量的镁离子和硫酸根离子,这些物质在细胞外液中的浓度都很低。此外,细胞中含有大量的蛋白质——几乎是血浆中的四倍。
体液腔室体积的测量——指示剂稀释原理
通过在腔室中放置指示剂物质,使其均匀分散在整个腔室的液体中,然后分析该物质的稀释程度,可以测量体内某个液体腔室的体积。图25-4展示了这种测量液体腔室体积的指示剂稀释方法。该方法基于质量守恒原理,即物质在液体腔室中分散后的总质量将与注入腔室的总质量相同。
在图25-4所示的例子中,注射器中含有少量染料或其他物质被注入腔室,该物质被允许在腔室中分散,直到在所有区域达到相同的浓度。然后取出含有分散物质的液体样本,并通过化学、光电或其他方法分析其浓度。如果该物质没有从腔室中泄漏出去,腔室中物质的总质量(体积B × 浓度B)将等于注入物质的总质量(体积A × 浓度A)。通过简单的方程重排,可以计算出腔室B的未知体积如下:
体积B = 体积A×浓度A / 浓度B
在进行此计算时,需要知道以下信息:(1) 注入腔室中的物质总量(方程的分子);(2) 物质分散后腔室中液体的浓度(方程的分母)。
例如,如果将1毫升含有10 mg/ml染料的溶液分散到腔室B中,并且腔室中的最终浓度为0.01mg/ml,则可以计算出腔室的未知体积如下:
体积B = 100ml
只要满足以下条件,该方法可用于测量体内几乎任何腔室的体积:(1) 指示剂均匀分散在整个腔室中;(2) 指示剂仅分散在被测量的腔室中;(3) 指示剂不被代谢或排泄。如果指示剂被代谢或排泄,则必须对体内指示剂的损失进行校正。可以使用多种物质来测量不同体液的体积。
特定体液腔室体积的测定
总体水量的测量。放射性水(氚)或重水(氘)可用于测量总体水量。这些形式的水在注入血液后几小时内与总体水混合,稀释原理可用于计算总体水量(表25-3)。另一种用于测量总体水的物质是安替比林(antipyrine),它具有很强的脂溶性,能迅速穿透细胞膜,并在细胞内和细胞外均匀分布。
| 体积 | 指示剂 |
|---|---|
| 总体水 | 重水,超重水, 安替比林 |
| 细胞外液 | 22Na,125I-碘他拉酸盐,硫代硫酸盐,菊粉 |
| 细胞内液 | (计算为总体水减去细胞外液体积) |
| 血浆体积 | 125I-白蛋白,伊文思蓝染料(T-1824) |
| 血液体积 | 51Cr标记的红细胞,或计算为血液体积=血浆体积/(1-血细胞比容) |
| 间质液 | 计算为细胞外液体积减去血浆体积 |
细胞外液体积的测量。细胞外液的体积可以使用几种物质来估计,这些物质分散在血浆和间质液中,但不轻易穿透细胞膜。这些物质包括放射性钠、放射性氯、放射性碘他拉酸盐、硫代硫酸盐离子和菊粉。当这些物质中的任何一种注入血液后,通常会在30到60分钟内几乎完全分散到细胞外液中。然而,其中一些物质,如放射性钠,可能会少量扩散到细胞内。因此,人们经常使用钠空间或菊粉空间来代替真正的细胞外液体积的测量。
细胞内体积的计算。细胞内体积无法直接测量。然而,可以通过以下方式计算:
细胞内体积 = 总体水 - 细胞外液体积
血浆体积的测量。血浆体积可以使用一种不易穿透毛细血管膜但在注射后仍留在血管系统中的物质来测量。最常用的测量血浆体积的物质之一是放射性碘标记的血清白蛋白(125I-白蛋白)或与血浆蛋白强烈结合的染料,如伊文思蓝染料(也称为T-1824)。
间质液体积的计算。间质液体积无法直接测量,但可以通过以下方式计算:
间质液体积 = 细胞外液体积 - 血浆体积
血液体积的测量。如果使用前面描述的方法测量血细胞比容(血液总体积中细胞所占的比例)和血浆体积,则可以使用以下公式计算血液体积:
血液总体积=血浆体积/1-血细胞比容
例如,如果血浆体积为3升,血细胞比容为0.40,则血液总体积计算5L.
另一种测量血容量的方法是向循环中注入标记有放射性物质的红细胞。这些红细胞在循环中混合后,可以测量混合血样的放射性,并使用指示剂稀释原理计算总血容量。一种可以用来标记红细胞的物质是放射性铬(51Cr),它与红细胞紧密结合。
细胞内液和细胞外液之间的液体交换和渗透平衡
在治疗重症患者时,一个常见的问题是维持细胞内液和/或细胞外液的充足液体。正如第16章和本章后面所讨论的,血浆和间质空间之间细胞外液的相对分布主要由毛细血管膜上的静水压和胶体渗透压的平衡决定。
相比之下,细胞内液和细胞外液之间的液体分布主要由较小溶质(尤其是钠、氯和其他电解质)通过细胞膜的渗透效应决定。这是因为细胞膜对水高度通透,但对即使是像钠和氯这样的小离子也相对不通透。因此,水迅速通过细胞膜移动,细胞内液与细胞外液保持等渗。
在下一节中,我们将讨论细胞内液和细胞外液体积之间的相互关系,以及可能导致这两个隔室之间液体转移的渗透因素。
渗透和渗透压的基本原理
渗透和渗透压的基本原理在第4章中已经介绍过。因此,我们在这里只回顾这些原理在体积调节中最重要的方面。
由于细胞膜对大多数溶质相对不通透,但对水高度通透(即它们是选择性通透的),每当细胞膜一侧的溶质浓度较高时,水就会通过膜向溶质浓度较高的区域扩散。因此,如果将氯化钠等溶质添加到细胞外液中,水会迅速从细胞通过细胞膜扩散到细胞外液中,直到膜两侧的水浓度相等。相反,如果从细胞外液中去除氯化钠等溶质,水会从细胞外液通过细胞膜扩散到细胞内。
渗透压和渗透浓度。溶液的渗透压浓度在表示为每千克水的渗透摩尔数时称为渗透压(osmolality);在表示为每升溶液的渗透摩尔数时称为渗透浓度(osmolarity)。在像体液这样的稀溶液中,这两个术语几乎可以互换使用,因为差异很小。临床上使用的大多数计算以及接下来几章中表达的计算都是基于渗透浓度(osmolarity)而不是渗透压(osmolality)。
溶液渗透压和渗透压的计算。利用范特霍夫定律(van't Hoff law),可以计算溶液的潜在渗透压(osmotic pressure),假设细胞膜对溶质(solute)是不可渗透的。例如,0.9% 氯化钠溶液的渗透压计算如下。0.9% 的溶液意味着每 100 毫升溶液中含有 0.9 克氯化钠,即 9g/L。由于氯化钠的分子量为 58.5g/mol_\cdot,因此溶液的摩尔浓度(molarity)为 9g/L 除以 58.5g/mol_,即约 0.154mol/L。由于每个氯化钠分子等于 2 个渗透摩尔(osmoles),因此溶液的渗透浓度(osmolarity)为 0.154×2,即 0.308Osm/L。因此,该溶液的渗透浓度为 308mOsm/L。因此,该溶液的潜在渗透压为 308mOsm/L×19.3mmHg/ mOsm/L,即 5944mmHg。
这个计算是一个近似值,因为钠离子和氯离子在溶液中由于离子间吸引力(interionic attraction)并不完全独立行为。可以通过使用称为渗透系数(osmotic coefficient)的校正因子来校正这些与范特霍夫定律预测的偏差。对于氯化钠,渗透系数约为 0.93。因此,0.9% 氯化钠溶液的实际渗透浓度为 308×0.93,即约 286 mOsm/L。出于实际原因,在确定生理溶液的渗透浓度和渗透压时,有时会忽略不同溶质的渗透系数。
体液的渗透浓度。回顾表 25-2,注意血浆、组织间液和细胞内液(intracellular fluid)中各种渗透活性物质的近似渗透浓度。组织间液和血浆的总渗透浓度约 80% 是由钠离子和氯离子贡献的,而对于细胞内液,几乎一半的渗透浓度是由钾离子贡献的,其余部分则由许多其他细胞内物质分担。
如表 25-2 所示,三个区室(compartments)的总渗透浓度均约为 300mOsm/L,其中血浆的渗透浓度比组织间液和细胞内液高约 1mOsm/L。血浆和组织间液之间的微小差异是由血浆蛋白的渗透效应引起的,这些蛋白在毛细血管中维持的压力比周围组织间隙高约 20mmHg,如第 16 章所述。
体液的校正渗透活性。表 25-2 的底部显示了血浆、组织间液和细胞内液的校正渗透活性(corrected osmolar activities)。这些校正的原因是阳离子和阴离子之间的离子间吸引力会导致溶解物质的渗透活性略有下降。
细胞内液和细胞外液之间的渗透平衡
细胞膜两侧可以产生高渗透压(high osmotic pressure),而细胞外液(extracellular fluid)中溶质浓度的相对较小变化即可导致这种高渗透压。如前所述,对于每一种不可渗透溶质(impermeant solute)(即不能透过细胞膜的溶质)的每毫渗透压摩尔浓度梯度,细胞膜两侧会产生约19.3mmHg的渗透压。如果细胞膜暴露在纯水中,且细胞内液(intracellular fluid)的渗透压为282 mOsm/L,则细胞膜两侧可能产生的潜在渗透压将超过5400mmHg。这表明,当细胞内液和细胞外液未达到渗透平衡时,可以驱动水穿过细胞膜的巨大力量。由于这些力量的作用,细胞外液中不可渗透溶质浓度的相对较小变化可能导致细胞体积的显著变化。
等渗(isotonic)、低渗(hypotonic)和高渗(hypertonic)液体。图25-5展示了细胞外液中不同浓度的不可渗透溶质对细胞体积的影响。如果将细胞置于渗透压为282mOsm/L的不可渗透溶质溶液中,细胞既不会收缩也不会膨胀,因为细胞内液和细胞外液中的水浓度相等,且溶质无法进入或离开细胞。这种溶液被称为等渗溶液,因为它既不会使细胞收缩也不会使细胞膨胀。等渗溶液的实例包括0.9%的氯化钠溶液或5%的葡萄糖溶液。这些溶液在临床医学中非常重要,因为它们可以注入血液中而不会破坏细胞内液和细胞外液之间的渗透平衡。
图25-5. 等渗(A)、高渗(B)和低渗(C)溶液对细胞体积的影响。
如果将细胞置于低渗溶液中(即不可渗透溶质浓度低于\phantom-\phantom+<282 mOsm/L),水将扩散进入细胞,导致细胞膨胀;水将继续扩散进入细胞,稀释细胞内液,同时浓缩细胞外液,直到两种溶液的渗透压大致相同。浓度低于0.9%的氯化钠溶液是低渗溶液,会导致细胞膨胀。
如果将细胞置于高渗溶液中(即不可渗透溶质浓度更高),水将从细胞流出进入细胞外液,浓缩细胞内液并稀释细胞外液。在这种情况下,细胞会收缩,直到两种浓度相等。浓度高于0.9%的氯化钠溶液是高渗溶液。
等渗(isosmotic)、高渗(hyperosmotic)和低渗(hypo-osmotic)液体 术语等渗、低渗和高渗指的是溶液是否会引起细胞体积的变化。溶液的渗透性取决于不可渗透溶质的浓度。然而,某些溶质可以透过细胞膜。渗透压与细胞相同的溶液被称为等渗溶液,无论溶质是否能穿透细胞膜。
术语高渗(hyperosmotic)和低渗(hypo-osmotic)分别指与正常细胞外液相比具有更高或更低渗透压的溶液,而不考虑溶质是否透过细胞膜。高度渗透的物质,如尿素,可以引起细胞内液和细胞外液之间液体体积的短暂变化,但只要有足够的时间,这些物质在两种体液中的浓度最终会变得相等,并且在稳态条件下对细胞内体积几乎没有影响。
细胞内液和细胞外液之间的渗透平衡迅速达到。液体跨细胞膜的转移发生得如此迅速,以至于这两种体液之间的任何渗透压差异通常会在几秒钟内或最多几分钟内得到纠正。水跨细胞膜的快速移动并不意味着在整个身体的细胞内和细胞外液之间在相同短的时间内发生完全平衡。这是因为液体通常通过肠道进入体内,并且必须通过血液输送到所有组织才能发生完全的渗透平衡。
图25-6. 在渗透平衡后向细胞外液添加等渗(A)、高渗(B)和低渗溶液(A)的效果。正常状态由实线表示,偏离正常的变化由阴影区域表示。每个图中细胞内和细胞外液体积显示在横坐标上,这些体液的渗透压显示在纵坐标上。
通常在饮水后约30分钟即可在全身达到渗透平衡。
异常状态下细胞外液和细胞内液的体积和渗透压
一些可以导致细胞外和细胞内体积显著变化的不同因素包括过量摄入或肾脏保留水分、脱水、静脉输注不同类型的溶液、从胃肠道丢失大量液体以及通过出汗或肾脏丢失异常量的液体。
如果记住以下基本原则,可以计算细胞内和细胞外液体体积的变化以及应实施的治疗类型:
- 水迅速穿过细胞膜;因此,细胞内液和细胞外液的渗透压几乎完全相等,除了在其中一个体液发生变化后的几分钟内。
- 细胞膜对许多溶质,如钠和氯,几乎完全不渗透;因此,除非溶质被添加到细胞外液或从细胞外液丢失,否则细胞外液或细胞内液中的渗透摩尔数通常保持相对恒定。
记住这些基本原则,我们可以分析不同异常液体条件对细胞外和细胞内液体体积和渗透压的影响。
向细胞外液添加盐水溶液的效果
如果将等渗盐水(Isotonic saline)加入细胞外液(extracellular fluid)中,细胞外液的渗透压(osmolarity)不会发生变化。主要效应是细胞外液体积的增加(图25-6A)。钠和氯离子主要保留在细胞外液中,因为细胞膜对氯化钠几乎是不通透的。
如果将高渗溶液(hypertonic solution)加入细胞外液中,细胞外液的渗透压会升高,导致水从细胞内渗透到细胞外(见图25-6B)。同样,几乎所有的氯化钠都保留在细胞外液中,液体从细胞内扩散到细胞外空间以达到渗透平衡。净效应是细胞外液体积增加(大于加入的液体体积)、细胞内液体积减少,以及两个区域的渗透压升高。
如果将低渗溶液(hypotonic solution)加入细胞外液中,细胞外液的渗透压会降低,部分细胞外水会扩散到细胞内,直到细胞内和细胞外区域的渗透压相同(见图25-6C)。加入低渗液体后,细胞内和细胞外体积都会增加,尽管细胞内体积增加得更多。
高渗盐水溶液输注后液体转移和渗透压的计算。我们可以计算输注不同溶液对细胞外液和细胞内液体积和渗透压的连续影响。例如,如果将2升3.0%的高渗氯化钠溶液输注到初始血浆渗透压为280mOsm/L的70公斤患者的细胞外液中,渗透平衡后细胞内和细胞外液的体积和渗透压是多少?
第一步是计算初始条件,包括每个区域的体积、浓度和总毫渗透压。假设细胞外液体积为体重的20%,细胞内液体积为体重的40%,可以计算出以下体积和浓度。
步骤1. 初始条件
<html><body><table><tr><td></td><td>体积(升)</td><td>浓度(mOsm/L)</td><td>总量(毫渗透压)</td></tr><tr><td>细胞外液</td><td>14</td><td>280</td><td>3920</td></tr><tr><td>细胞内液</td><td>28</td><td>280</td><td>7840</td></tr><tr><td>全身液体</td><td>42</td><td>280</td><td>11,760</td></tr></table></body></html>
接下来,我们计算2升3.0%氯化钠溶液中加入细胞外液的总毫渗透压。3.0%的溶液意味着每100毫升中有3.0克,或每升30克氯化钠。由于氯化钠的分子量约为58.5克/摩尔,这意味着每升溶液中有约0.5128摩尔的氯化钠。对于2升溶液,这将是1.0256摩尔的氯化钠。由于1摩尔的氯化钠约等于2渗透压(每摩尔氯化钠有两个渗透活性粒子),加入2升这种溶液的净效应是向细胞外液中加入2051毫渗透压的氯化钠。
在第二步中,我们计算了向细胞外液(extracellular fluid)中添加2051毫渗透压摩尔(milliosmoles)的氯化钠(sodium chloride)以及2升体积的瞬时效应。细胞内液(intracellular fluid)的浓度或体积不会发生变化,且不会达到渗透平衡(osmotic equilibrium)。然而,在细胞外液中,总溶质将增加2051毫渗透压摩尔,总量达到5971毫渗透压摩尔。由于细胞外液(extracellular compartment)现在有16升体积,浓度可以通过将5971毫渗透压摩尔除以16升来计算,得到约373mOsm/L的浓度。因此,在添加溶液后,以下值会立即出现。
渗透平衡(osmotic equilibrium)逐渐形成。在这种情况下,细胞内液和细胞外液的浓度将相等,并且可以通过将体内的总毫渗透压摩尔(13,811)除以总体积(现在为44升)来计算。此计算得出的浓度为313.9mOsm/L。因此,在渗透平衡后,所有体液(fluid compartments)将具有相同的浓度。假设没有溶质或水从体内流失,并且氯化钠没有进入或离开细胞,我们接下来计算细胞内液和细胞外液的体积。细胞内液体积通过将细胞内液中的总毫渗透压摩尔(7840)除以浓度(313.9mOsm/L)来计算,得到24.98升的体积。细胞外液体积通过将细胞外液中的总毫渗透压摩尔(5971)除以浓度(313.9mOsm/L)来计算,得到19.02升的体积。再次强调,这些计算基于假设添加到细胞外液中的氯化钠保留在那里,并且不会进入细胞。
在第三步中,我们计算了在几分钟后出现的体积和浓度。
第二步:添加2升3.0%氯化钠的瞬时效应
<html><body><table><tr><td></td><td>体积(升)</td><td>浓度(mOsm/L)</td><td>总量(毫渗透压摩尔)</td></tr><tr><td>细胞外液</td><td>16</td><td>373</td><td>5971</td></tr><tr><td>细胞内液</td><td>28</td><td>280</td><td>7840</td></tr><tr><td>总体液</td><td>44</td><td>未达到平衡</td><td>13,811</td></tr></table></body></html>
第三步:渗透平衡后添加2升3.0%氯化钠的效应
<html><body><table><tr><td></td><td>体积(升)</td><td>浓度(mOsm/L)</td><td>总量(毫渗透压摩尔)</td></tr><tr><td>细胞外液</td><td>19.02</td><td>313.9</td><td>5971</td></tr><tr><td>细胞内液</td><td>24.98</td><td>313.9</td><td>7840</td></tr><tr><td>总体液</td><td>44.0</td><td>313.9</td><td>13,811</td></tr></table></body></html>
因此,从这个例子中可以看出,添加2升高渗(hypertonic)氯化钠溶液会导致细胞外液体积增加超过5升,同时细胞内液体积减少近3升。
这种计算细胞内和细胞外液体体积和渗透压变化的方法几乎可以应用于任何液体体积调节的临床问题。读者应熟悉这些计算,因为理解细胞内和细胞外液体隔室之间渗透平衡的数学方面对于理解几乎所有体液异常及其治疗至关重要。
用于营养目的的葡萄糖和其他溶液
为了给无法摄入足够营养的人提供营养,通常会静脉注射几种类型的溶液。葡萄糖溶液被广泛使用;氨基酸和均质脂肪溶液的使用较少。当这些溶液被注射时,它们的渗透活性物质浓度通常被调整到接近等渗,或者注射速度足够慢,不会破坏体液的渗透平衡。
在葡萄糖或其他营养物质被代谢后,通常会留下多余的水分,特别是在摄入额外液体的情况下。通常,肾脏会以稀释尿液的形式排出这些液体。因此,最终结果只是向体内添加了营养物质。
一种接近等渗的5%葡萄糖溶液常用于治疗脱水。由于该溶液是等渗的,可以静脉注射而不会引起红细胞肿胀,就像注射纯水时会发生的那样。溶液中的葡萄糖迅速转运到细胞内并被代谢。因此,注射5%葡萄糖溶液会降低细胞外液的渗透压,从而有助于纠正与脱水相关的细胞外液渗透压升高。
液体体积调节的临床异常:低钠血症和高钠血症
临床医生评估患者液体状态的一个常用指标是血浆钠浓度。血浆渗透压通常不常规测量,但由于钠及其相关阴离子(主要是氯离子)占细胞外液溶质的90%以上,血浆钠浓度在许多情况下是血浆渗透压的合理指标。当血浆钠浓度比正常值(约142mEq/L)低几毫当量时,称为低钠血症。当血浆钠浓度高于正常值时,称为高钠血症。
低钠血症的原因:水分过多或钠丢失
血浆钠浓度降低可能是由于细胞外液钠的丢失或细胞外液水分的增加(表25-4)。钠的丢失通常会导致低钠血症和脱水,并与细胞外液体积减少相关。可能导致低钠血症的钠丢失情况包括腹泻和呕吐。过度使用抑制肾脏保钠能力的利尿剂以及某些类型的钠丢失性肾脏疾病也可能导致轻度低钠血症。Addison病是由于醛固酮激素分泌减少引起的,会损害肾脏重吸收钠的能力,可能导致轻度低钠血症。
低钠血症(hyponatremia)也可能与水分潴留过多有关,这会稀释细胞外液中的钠,这种情况被称为低钠血症性水过多(hyponatremia overhydration)。例如,抗利尿激素(antidiuretic hormone, ADH)分泌过多会增加肾小管对水的重吸收,从而导致低钠血症和水过多。
低钠血症导致细胞水肿
低钠血症引起的细胞体积快速变化会对组织和器官功能产生深远影响,尤其是大脑。例如,血浆钠浓度快速下降会导致脑细胞水肿和神经系统症状,包括头痛、恶心、嗜睡和定向障碍。如果血浆钠浓度迅速降至115至120mmol/L以下,脑肿胀可能导致癫痫、昏迷、永久性脑损伤和死亡。由于颅骨是刚性的,大脑体积增加超过约10%时,会被迫向下挤压到颈部(脑疝),这可能导致永久性脑损伤和死亡。
当低钠血症发展较慢,持续数天时,大脑和其他组织会通过将钠、氯、钾和有机溶质(如谷氨酸)从细胞转运到细胞外间隙来做出反应。这种反应减弱了水向细胞的渗透流动和组织肿胀(图25-7)。
然而,在缓慢发展的低钠血症期间,如果低钠血症纠正过快,细胞溶质的转运可能使大脑容易受到损伤。当过快添加高渗溶液以纠正低钠血症时,这种干预可能超过大脑重新捕获细胞丢失溶质的能力,并可能导致与脱髓鞘相关的神经元渗透性损伤,即神经髓鞘的丧失。这种渗透介导的神经元脱髓鞘可以通过将慢性低钠血症的纠正限制在24小时内少于10至12mmol/L,48小时内少于18mmol/L来避免。这种缓慢的纠正速度使大脑能够恢复因适应慢性低钠血症而从细胞中丢失的渗透物质。
表25-4 体液容量调节异常:低钠血症和高钠血症
<html><body><table><tr><td colspan="2">异常原因</td><td>血浆Na+浓度</td><td>细胞外液容量</td><td>细胞内液容量</td></tr><tr><td>低钠血症—脱水</td><td>肾上腺功能不全;利尿剂过度使用</td><td>↑</td><td>↑</td><td>↑</td></tr><tr><td>低钠血症—水过多</td><td>ADH分泌过多(SIADH);支气管源性肿瘤</td><td></td><td></td><td></td></tr><tr><td>高钠血症—脱水</td><td>尿崩症;过度出汗</td><td></td><td></td><td></td></tr><tr><td>高钠血症—水过多</td><td>库欣病;原发性醛固酮增多症</td><td></td><td></td><td></td></tr></table></body></html>
ADH, 抗利尿激素; SIADH, 抗利尿激素分泌异常综合征。
图25-7. 低钠血症(hyponatremia)期间的脑细胞体积调节。在急性低钠血症期间,由于N a+的丢失或\sf H_2\sf O的过量,H_2O会扩散进入细胞(1),导致脑组织肿胀(由虚线表示)。这一过程刺激了N a+、K+和有机溶质从细胞中运出(2),随后导致水从细胞中扩散出来(3)。在慢性低钠血症中,通过溶质从细胞中运出,脑肿胀得以减轻。
低钠血症是临床实践中最常见的电解质紊乱,可能发生在高达15%至25%的住院患者中。
高钠血症(hypernatremia)的原因:水分丢失或钠过量
血浆钠浓度增加,也会导致渗透压增加,可能是由于细胞外液中的水分丢失,使钠离子浓缩,或是细胞外液中钠过量。细胞外液中水分的原发性丢失会导致高钠血症和脱水。这种情况可能由于无法分泌ADH(抗利尿激素)而发生,ADH是肾脏保存水分所必需的。由于缺乏ADH,肾脏会排出大量稀释的尿液(一种称为中枢性尿崩症(central diabetes insipidus)的疾病),导致脱水和细胞外液中氯化钠浓度的增加。在某些类型的肾脏疾病中,肾脏无法对ADH作出反应,导致一种称为肾性尿崩症(nephrogenic diabetes insipidus)的疾病。与细胞外液体积减少相关的高钠血症的更常见原因是简单的脱水,这是由于水分摄入少于水分丢失,如在长时间剧烈运动期间出汗时可能发生的情况。
当细胞外液中添加过量的氯化钠时,也可能发生高钠血症。这通常会导致高钠血症-过度水合(hypernatremia-overhydration),因为过量的细胞外氯化钠通常也与肾脏至少保留一定量的水分有关。例如,过量的钠保留激素醛固酮(aldosterone)的分泌可能导致轻度的高钠血症和过度水合。高钠血症不更严重的原因是钠保留也会刺激ADH的分泌,并导致肾脏重新吸收更多的水分。
因此,在分析血浆钠浓度的异常并决定适当的治疗时,首先应确定异常是由钠的原发性丢失或增加引起,还是由水分的原发性丢失或增加引起。
高钠血症导致细胞收缩
高钠血症比低钠血症少见得多,严重症状通常仅在血浆钠浓度迅速且大幅度增加至158至160mmol/L以上时发生。高钠血症通常会促进强烈的口渴感并刺激ADH的分泌,这两者都可以防止血浆和细胞外液钠的大幅度增加,如第29章所述。然而,严重的高钠血症可能发生在下丘脑病变损害了患者的渴觉的患者中,在可能无法随时获得水分的婴儿中,在精神状态改变的老年患者中,或在尿崩症患者中。
高钠血症的纠正可以通过给予低渗氯化钠或葡萄糖溶液来实现。然而,对于血浆钠浓度长期升高的患者,应谨慎缓慢地纠正高钠血症,因为高钠血症也会激活保护细胞免受体积变化的防御机制。这些防御机制与低钠血症时发生的机制相反,包括增加细胞内钠和其他溶质浓度的机制。
水肿:组织中的过量液体
水肿指的是身体组织中存在过量液体。在许多情况下,水肿主要发生在细胞外液(extracellular fluid)隔室,但也可能涉及细胞内液(intracellular fluid)的积累。
细胞内水肿
有三种情况特别容易引起细胞内肿胀:(1) 低钠血症(hyponatremia),如前所述;(2) 组织代谢系统的抑制;(3) 细胞缺乏足够的营养。例如,当组织血流减少时,氧气和营养物质的输送也会减少。如果血流过低而无法维持正常的组织代谢,细胞膜离子泵会受到抑制,通常泄漏到细胞内部的钠离子无法再被泵出细胞。过量的细胞内钠离子随后导致水渗透到细胞内。有时,这一过程可以使组织区域的细胞内体积增加——甚至整个缺血腿的细胞内体积——达到正常的两到三倍。当这种细胞内体积增加发生时,通常是组织死亡的前兆。
细胞内水肿也可能发生在发炎的组织中。炎症通常会增加细胞膜的通透性,使钠和其他离子扩散到细胞内部,随后水渗透到细胞内。
细胞外水肿
细胞外水肿发生在过量液体在细胞外间隙积累时。细胞外水肿有两个主要原因:(1) 液体从血浆异常泄漏到毛细血管外的间质间隙;(2) 淋巴系统未能将液体从间质返回血液,通常称为淋巴水肿(lymphedema)。间质液积累的最常见临床原因是过度的毛细血管液体过滤。
增加毛细血管过滤的因素
为了理解过度毛细血管过滤的原因,回顾第16章讨论的毛细血管过滤的决定因素是有用的。数学上,毛细血管过滤率可以表示为:
过滤 \scriptstyle=K_f×\left(P_c-P_i f-\pi_c+\pi_i f\right)
其中 K_f 是毛细血管过滤系数(毛细血管的渗透性和表面积的乘积),P_c 是毛细血管静水压,P_if 是间质液静水压,\pi_c 是毛细血管血浆胶体渗透压,\pi_if 是间质液胶体渗透压。从这个方程可以看出,以下任何变化都可以增加毛细血管过滤率:
· 增加毛细血管过滤系数 · 增加毛细血管静水压 • 降低血浆胶体渗透压
淋巴水肿——淋巴管无法将液体和蛋白质返回血液
当淋巴功能因淋巴管阻塞或丧失而严重受损时,水肿可能变得特别严重,因为渗入间质(interstitium)的血浆蛋白无法通过其他方式被清除。蛋白质浓度的升高会增加间质液的胶体渗透压(colloid osmotic pressure),从而从毛细血管中抽出更多的液体。
淋巴结感染(例如由丝虫(filarial nematodes)(Wuchereria bancrofti)引起的感染)可能导致淋巴流动的阻塞特别严重。这些丝虫是微小的线状蠕虫,成虫生活在人类的淋巴系统中,并通过蚊子在人与人之间传播。感染丝虫的人可能会出现严重的淋巴水肿和象皮病(elephantiasis),男性可能会出现阴囊肿胀,称为鞘膜积液(hydrocele)。淋巴丝虫病(lymphatic filariasis)影响了亚洲、非洲、西太平洋以及加勒比和南美洲部分热带和亚热带地区80个国家的超过1.2亿人。
淋巴水肿也可能发生在某些类型的癌症患者中,或在进行淋巴管切除或阻塞的手术后。例如,在根治性乳房切除术(radical mastectomy)中,大量淋巴管被切除,这会阻碍蛋白质和液体从乳房和手臂区域的清除,导致组织间隙的水肿和肿胀。在这种手术后,一些淋巴管最终会重新生长;因此,间质水肿通常是暂时的。
细胞外水肿原因的总结
许多情况可以通过毛细血管异常渗漏液体或阻止淋巴系统将液体从间质返回循环系统,导致液体在间质间隙中积聚。以下是可能通过这两种异常引起细胞外水肿的部分情况列表:
I. 毛细血管压力增加 A. 肾脏过度保留盐和水
- 急性或慢性肾功能衰竭
- 盐皮质激素(mineralocorticoid)过多
B. 静脉高压和静脉收缩
- 心力衰竭
- 静脉阻塞
- 静脉泵功能衰竭 a) 肌肉麻痹 b) 身体部位固定 c) 静脉瓣膜功能衰竭
C. 小动脉阻力降低
- 身体过热
- 交感神经系统功能不全
- 血管扩张药物
II. 血浆蛋白减少 A. 尿液中蛋白质丢失(肾病综合征(nephrotic syndrome)) B. 皮肤剥脱区域蛋白质丢失
- 烧伤
- 伤口 C. 蛋白质生成不足
- 肝脏疾病(例如肝硬化(cirrhosis))
- 严重的蛋白质或热量营养不良
III. 毛细血管通透性增加 A. 引起组胺(histamine)和其他免疫产物释放的免疫反应 B. 毒素 C. 细菌感染 D. 维生素缺乏,尤其是维生素C E. 长期缺血 F. 烧伤
IV. 淋巴回流阻塞 A. 癌症 B. 感染(例如丝虫) C. 手术 D. 淋巴管先天性缺失或异常
心力衰竭引起的水肿
心力衰竭是水肿最严重和最常见的原因之一,这在第22章中已经讨论过。在心力衰竭中,心脏无法正常地将血液从静脉泵入动脉,导致静脉和毛细血管压力升高,从而引起毛细血管滤过增加。此外,动脉压力趋于下降,导致肾脏对盐和水的排泄减少,进而引起更多的水肿。同时,心力衰竭患者的肾脏血流量减少,这种血流量减少会刺激肾素(renin)的分泌,导致血管紧张素II(angiotensin II)和醛固酮(aldosterone)的生成增加,这两者都会进一步导致肾脏对盐和水的潴留。在晚期心力衰竭中,抗利尿激素(ADH)分泌增加会刺激肾小管对水的重吸收,导致低钠血症(hyponatremia)以及细胞内和细胞外水肿。因此,在未经治疗的心力衰竭患者中,所有这些因素共同作用可能导致严重的全身性水肿。
在左心衰竭但右心无明显衰竭的患者中,右心正常地将血液泵入肺部,但由于左心严重衰弱,血液无法轻易从肺静脉流入左心。因此,所有肺血管压力,包括肺毛细血管压力,都会远高于正常水平,导致严重且危及生命的肺水肿。如果不及时治疗,肺部液体积聚会迅速进展,可能在几小时内导致死亡。
肾脏排泄盐和水减少引起的水肿
添加到血液中的大部分氯化钠保留在细胞外液中,只有少量进入细胞内。因此,在肾脏疾病中,如果盐和水的尿液排泄受损,大量氯化钠和水会被添加到细胞外液中。这些盐和水大部分从血液渗漏到组织间隙,但一部分仍留在血液中。其主要影响如下:(1) 组织液体积广泛增加(细胞外水肿);(2) 由于血容量增加导致的高血压,如第19章所述。例如,在患有急性肾小球肾炎(acute glomerulonephritis)的儿童中,肾小球因炎症受损,无法过滤足够的液体,因此也会出现严重的细胞外液水肿;同时,通常还会伴随严重的高血压。
血浆蛋白减少引起的水肿
无法产生正常量的蛋白质或蛋白质从血浆中渗漏会导致血浆胶体渗透压下降。这会导致全身毛细血管滤过增加和细胞外水肿。
血浆蛋白浓度降低的最重要原因之一是某些肾脏疾病中蛋白质从尿液中丢失,这种情况被称为肾病综合征(nephrotic syndrome)。多种类型的肾脏疾病可能损害肾小球的膜,导致膜对血浆蛋白的通透性增加,并常常使大量蛋白质进入尿液。当这种丢失超过身体合成蛋白质的能力时,血浆蛋白浓度就会下降。当血浆蛋白浓度低于2.5g/100ml时,会出现严重的全身性水肿。
肝硬化( cirrhosis )是另一种降低血浆蛋白浓度的疾病。肝硬化意味着在肝脏实质细胞之间形成大量纤维组织。其中一个结果是这些细胞无法产生足够的血浆蛋白,导致血浆胶体渗透压降低,并伴随出现全身性水肿( generalized edema )。
肝硬化引起水肿的另一种方式是,肝纤维化有时会压迫腹腔门静脉引流血管,这些血管在返回体循环之前穿过肝脏。门静脉流出受阻会增加整个胃肠区域的毛细血管静水压,并进一步增加血浆向腹腔内区域的液体滤过。当这种情况发生时,血浆蛋白浓度降低和门静脉毛细血管高压的共同作用导致大量液体和蛋白质渗出到腹腔,这种情况被称为腹水( ascites )。
通常防止水肿的安全因素
尽管许多干扰因素可以引起水肿,但通常在严重异常时才会出现严重的水肿。异常必须严重的原因是,有三个主要的安全因素可以防止间质间隙中过多的液体积累:(1) 当间质液压力处于负压范围时,间质( interstitium )的低顺应性( compliance );(2) 淋巴流量增加10至50倍的能力;(3) 间质液蛋白浓度的冲刷( washdown ),随着毛细血管滤过的增加,间质液胶体渗透压降低。
由负压范围内间质低顺应性引起的安全因素
在第16章中,我们注意到身体疏松皮下组织中的间质液静水压略低于大气压,平均约为-3mmHg。这种轻微的负压有助于将组织保持在一起。图25-8显示了从动物研究中推断出的不同间质液压力和间质液体积之间的近似关系。请注意,在图25-8中,只要间质液压力处于负压范围内,间质液体积的微小变化就会导致间质液静水压的较大变化。因此,在负压范围内,组织的顺应性( compliance )(定义为每毫米Hg压力变化引起的体积变化)较低。
图25-8. 间质液静水压与间质液体积之间的关系,包括总体积、自由液体体积和凝胶液体体积,适用于皮肤等疏松组织。请注意,只有当间质液压力变为正时,才会出现大量的自由液体。(修改自Guyton AC, Granger HJ, Taylor AE: Interstitial fluid pressure. Physiol Rev 51:527, 1971。)
负压范围内组织的低顺应性如何作为防止水肿(edema)的安全因素?要回答这个问题,请回顾前面讨论过的毛细血管滤过的决定因素。当组织液静水压(interstitial fluid hydrostatic pressure)增加时,这种增加的压力倾向于阻止进一步的毛细血管滤过。因此,只要组织液静水压在负压范围内,组织液体积的少量增加就会导致组织液静水压相对较大的增加,从而阻止液体进一步滤入组织。
由于正常的组织液静水压为-3mmHg,组织液静水压必须增加约3mmHg,大量液体才会开始在组织中积聚。因此,防止水肿的安全因素是组织液压力变化约3mmHg。在正组织压范围内,由于组织顺应性的大幅增加,这种防止水肿的安全因素消失了。
组织凝胶在防止组织液积聚中的重要性。请注意,在图25-8中,在具有负组织液压力的正常组织中,几乎所有的组织液都处于凝胶形式。也就是说,液体被束缚在蛋白多糖(proteoglycan)网状结构中,因此几乎没有直径大于几百分之一微米的自由液体空间。凝胶的重要性在于,由于数万亿蛋白多糖细丝的阻碍,它阻止了液体在组织中轻易流动。此外,当组织液压力下降到非常负的值时,凝胶不会收缩很多,因为蛋白多糖细丝的网状结构提供了对压缩的弹性阻力。在负液体压力范围内,无论吸力仅为几毫米Hg负压还是10到20mmHg负压,组织液体积变化不大。换句话说,在负压范围内,组织的顺应性非常低。
相比之下,当组织液压力上升到正压范围时,组织中会大量积聚自由液体。在这个压力范围内,组织是顺应性的,允许大量液体积聚,而组织液静水压的增加相对较小。积聚的大部分额外液体是自由液体,因为它将蛋白多糖细丝的刷状堆推开。因此,液体可以自由地流过组织空间,因为它不是凝胶形式。当这种自由流动发生时,水肿被称为凹陷性水肿(pitting edema),因为可以用拇指按压组织区域并将液体推出该区域。当拇指移开时,皮肤上会留下一个凹陷几秒钟,直到液体从周围组织流回。这种类型的水肿与非凹陷性水肿(nonpitting edema)不同,后者发生在组织细胞肿胀而不是组织间隙肿胀时,或者当组织间隙中的液体与纤维蛋白原(fibrinogen)凝结时,使其无法在组织空间内自由移动。
蛋白多糖细丝作为细胞间隔物和在防止组织中液体快速流动中的重要性
蛋白聚糖(proteoglycan)细丝与细胞间隙中更大的胶原纤维(collagen fibrils)一起,充当细胞之间的间隔物。营养物质和离子不易通过细胞膜扩散;因此,如果细胞之间没有足够的间距,这些营养物质、电解质和细胞废物就无法在毛细血管和相距较远的细胞之间快速交换。
蛋白聚糖细丝还能防止液体在组织间隙中流动过于容易。如果没有蛋白聚糖细丝,一个人站立的简单动作就会导致大量组织间液从上半身流向下半身。当过多的液体积聚在组织间隙中时,如水肿(edema)时,这些额外的液体会形成大的通道,使液体容易通过组织间隙流动。因此,当腿部发生严重水肿时,通常只需抬高腿部即可减少水肿液。
尽管在紧密排列的蛋白聚糖细丝存在下,液体不易通过组织流动,但液体中的不同物质在组织中扩散的容易程度至少可以达到正常扩散的95%。因此,营养物质向细胞的正常扩散和废物从细胞的清除不会受到组织间隙中蛋白聚糖细丝的影响。
淋巴流动增加作为防止水肿的安全因素
淋巴系统(lymphatic system)的一个主要功能是将从毛细血管过滤到组织间隙中的液体和蛋白质返回到循环中。如果没有这种持续的过滤蛋白质和液体返回血液,血浆体积会迅速减少,并会发生组织间隙水肿。
淋巴管作为防止水肿的安全因素,因为当液体开始在组织中积聚时,淋巴流动可以增加10到50倍。这种增加的淋巴流动使淋巴管能够带走大量的液体和蛋白质,以应对毛细血管过滤的增加,防止组织间隙压力上升到正压范围。由淋巴流动增加引起的安全因素经计算约为7毫米汞柱(mm Hg)。
组织间隙液蛋白质的冲刷作为防止水肿的安全因素
随着越来越多的液体被过滤到组织间隙中,组织间隙液压力增加,导致淋巴流动增加。在大多数组织中,随着淋巴流动的增加,组织间隙的蛋白质浓度降低,因为带走的蛋白质比从毛细血管过滤出来的要多。这种现象的原因是毛细血管对蛋白质的渗透性相对淋巴管较低。因此,随着淋巴流动的增加,蛋白质被冲刷出组织间隙液。
由于蛋白质引起的组织间隙液胶体渗透压(colloid osmotic pressure)倾向于将液体从毛细血管中抽出,降低组织间隙液蛋白质会降低毛细血管的净过滤力,并倾向于防止液体的进一步积聚。这种效应的安全因素经计算约为7毫米汞柱(mm Hg)。
防止水肿的安全因素总结
将所有防止水肿的安全因素综合起来,我们发现以下几点:
- 由负压范围内组织顺应性(tissue compliance)低引起的安全因素约为3毫米汞柱(mm Hg)。
- 由淋巴流量增加引起的安全系数约为7毫米汞柱。
- 由间质空间蛋白质冲刷引起的安全系数约为7mmHg。
因此,抗水肿的总安全系数约为17mmHg。这意味着外周组织中的毛细血管压力理论上可以上升17mmHg,或大约为正常值的两倍,才会出现明显的水肿。
体内的潜在空间中的液体
一些潜在空间的例子包括胸膜腔、心包腔、腹膜腔和滑膜腔,包括关节腔和滑囊。几乎所有这些潜在空间的表面几乎相互接触,中间只有一层薄薄的液体,并且表面相互滑动。为了促进滑动,一种粘稠的蛋白质液体润滑了这些表面。
液体在毛细血管和潜在空间之间交换。潜在空间的表面膜通常不会对液体、电解质甚至蛋白质的通过提供显著阻力,这些物质在空间和周围组织的间质液之间相对容易地来回移动。因此,每个潜在空间实际上是一个大的组织空间。因此,与潜在空间相邻的毛细血管中的液体不仅扩散到间质液中,还扩散到潜在空间中。
淋巴管从潜在空间中排出蛋白质。由于毛细血管的渗漏,蛋白质在潜在空间中积聚,类似于全身间质空间中的蛋白质积聚。蛋白质必须通过淋巴管或其他通道被移除并返回到循环中。每个潜在空间都直接或间接地与淋巴管相连。在某些情况下,如胸膜腔和腹膜腔,大的淋巴管直接从腔体本身发出。
潜在空间中的水肿液体称为渗出液。
当水肿发生在与潜在空间相邻的皮下组织中时,水肿液体通常也会积聚在潜在空间中;这种液体称为渗出液。因此,淋巴阻塞或任何可能导致过度毛细血管滤过的多种异常都可以以与间质水肿相同的方式引起渗出液。腹腔特别容易积聚渗出液,在这种情况下,渗出液称为腹水。在严重的情况下,可以积聚20升或更多的腹水。
其他潜在空间,如胸膜腔、心包腔和关节腔,在全身性水肿存在时可能会严重肿胀。此外,任何一个腔体的损伤或局部感染通常会阻塞淋巴引流,导致腔体中的孤立性肿胀。
第39章详细讨论了胸膜腔中液体交换的动力学。这些动力学主要代表了所有其他潜在空间的情况。在非水肿状态下,大多数或所有潜在空间中的正常液体压力是负的,就像在松散的皮下组织中这种压力是负的(低于大气压)一样。例如,胸膜腔中的间质液静水压力通常约为-7到-8mmHg,关节腔中为-3到-5mmHg,心包腔中为-5到-6mmHg。
26-泌尿系统:肾脏的功能解剖与尿液形成
肾脏的多重功能
大多数人都熟悉肾脏的一个重要功能——清除体内摄入或代谢产生的废物。另一个尤为关键的功能是控制体液的体积和电解质组成。对于体内的水和几乎所有电解质,摄入(由于摄入或代谢产生)与排出(由于排泄或代谢消耗)之间的平衡主要由肾脏维持。肾脏的这种调节功能维持了细胞进行各种活动所需的稳定内部环境。
肾脏通过过滤血浆并根据身体的需要以不同的速率从滤液中移除物质来执行其最关键的功能。最终,肾脏通过将不需要的物质排泄到尿液中,同时将需要的物质返回血液,从而清除滤液(因此也是血液)中的不需要物质。
尽管本章及接下来的几章主要关注水、电解质和代谢废物的肾脏排泄控制,但肾脏还执行许多重要的稳态功能,包括以下内容:
- 排泄代谢废物和外来化学物质
- 调节水和电解质平衡
- 调节体液渗透压和电解质浓度
- 调节动脉血压
- 调节酸碱平衡
- 调节红细胞生成
- 激素的分泌、代谢和排泄
- 糖异生
代谢废物、外来化学物质、药物和激素代谢物的排泄。肾脏是消除体内不再需要的大多数代谢废物的主要途径。这些废物包括尿素(来自氨基酸代谢)、肌酐(来自肌肉肌酸)、尿酸(来自核酸)、血红蛋白分解的终产物(如胆红素)以及各种激素的代谢物。这些废物必须在产生后尽快从体内排出。肾脏还消除体内产生或摄入的大多数毒素和其他外来物质,如杀虫剂、药物和食品添加剂。
水和电解质平衡的调节。为了维持稳态,水和电解质的排泄必须与摄入精确匹配。如果摄入超过排泄,体内该物质的量将增加。如果摄入少于排泄,体内该物质的量将减少。尽管在各种与摄入或肾脏排泄改变相关的生理和病理生理条件下,水和电解质的暂时(或周期性)失衡可能发生,但维持生命依赖于水和电解质平衡的恢复。
水和许多电解质的摄入通常由一个人的饮食和饮水习惯决定,这要求肾脏调整其排泄率以匹配各种物质的摄入量。图26-1显示了肾脏对钠摄入量突然增加10倍(从低水平的30 mEq/天增加到高水平的300 mEq/天)的反应。在增加钠摄入量后的2到3天内,肾脏的排泄量也增加到约300 mEq/天,从而迅速重新建立摄入和输出之间的平衡。然而,在肾脏适应高钠摄入量的2到3天内,钠会有一定程度的积累,这会稍微增加细胞外液体积,并触发激素变化和其他代偿反应,这些信号会促使肾脏增加钠的排泄。
肾脏根据钠摄入量的变化来改变钠排泄的能力非常强大。实验研究表明,在许多人群中,钠摄入量可以增加到1500 mEq/天(超过正常水平的10倍)或减少到10 mEq/天(低于正常水平的0.1倍),而细胞外液体积或血浆钠浓度的变化相对较小。这种现象也适用于水和大多数其他电解质,如氯离子、钾离子、钙离子、氢离子、镁离子和磷酸根离子。在接下来的几章中,我们将讨论使肾脏能够执行这些惊人的稳态调节的具体机制。
图26-1. 钠摄入量增加10倍(从30到300 mEq/天)对尿钠排泄和细胞外液体积的影响。阴影区域表示净钠保留或净钠损失,由钠摄入量和钠排泄量之间的差异决定。
动脉压的调节。如第19章所述,肾脏通过排泄不同量的钠和水在长期调节动脉压中起主导作用。肾脏还通过分泌激素和血管活性因子或物质(如肾素)来参与短期动脉压的调节,这些物质会导致血管活性产物(如血管紧张素II)的形成。
酸碱平衡的调节。肾脏与肺和体液缓冲系统一起,通过排泄酸和调节体液缓冲储备来参与酸碱平衡的调节。肾脏是消除体内某些类型酸(如硫酸和磷酸)的唯一途径,这些酸是由蛋白质代谢产生的。
红细胞生成的调节。如第33章所述,肾脏分泌促红细胞生成素(erythropoietin),它刺激骨髓中的造血干细胞产生红细胞。肾脏分泌促红细胞生成素的一个重要刺激因素是缺氧。肾脏通常负责几乎所有分泌到循环中的促红细胞生成素。在患有严重肾脏疾病或已切除肾脏并接受血液透析的人群中,由于促红细胞生成素生成减少,会出现严重的贫血。
1,25-二羟基维生素\bf D_3生成的调节。肾脏通过在“1号”位置羟基化维生素D,产生1,25-二羟基维生素D_3(骨化三醇),这是维生素D的活性形式。骨化三醇对于骨骼中正常的钙沉积和胃肠道对钙的重吸收至关重要。如第80章所述,骨化三醇在钙和磷的调节中起着重要作用。
葡萄糖合成。在长时间禁食期间,肾脏从氨基酸和其他前体合成葡萄糖,这一过程称为糖异生(gluconeogenesis)。在长时间禁食期间,肾脏向血液中添加葡萄糖的能力与肝脏相当。
在慢性肾脏疾病或急性肾功能衰竭的情况下,这些稳态功能被破坏,体液容量和成分的严重异常迅速发生。在完全肾功能衰竭的情况下,除非采取临床干预措施(如血液透析)以至少部分恢复体液和电解质平衡,否则体内积累的钾、酸、液体和其他物质会在几天内导致死亡。
肾脏的生理解剖
肾脏和泌尿道的总体结构
两个肾脏位于腹部的后壁,腹膜腔外(图26-2)。成年人的每个肾脏重约150克,大约是一个紧握的拳头大小。每个肾脏的内侧有一个凹陷区域,称为肾门,肾动脉和静脉、淋巴管、神经供应和输尿管通过肾门,输尿管将最终尿液从肾脏输送到膀胱,尿液在膀胱中储存直到膀胱排空。肾脏被一层坚韧的纤维囊包围,保护其脆弱的内层结构。
如果将肾脏从上到下切开,可以看到两个主要区域:外层皮质和内层髓质。髓质被分为8到10个锥形组织块,称为肾锥体。每个锥体的基部起源于皮质和髓质之间的边界,终止于乳头,乳头突入肾盂的空间,肾盂是输尿管上端的漏斗状延续。肾盂的外缘分为开口的袋状结构,称为大盏,大盏向下延伸并分为小盏,小盏从每个乳头的肾小管收集尿液。盏、肾盂和输尿管的壁含有收缩元件,推动尿液流向膀胱,尿液在膀胱中储存直到排尿,本章稍后将讨论排尿。
肾脏的血液供应
流向两个肾脏的血流量通常约为心输出量的22%,即1100ml/min。肾动脉通过肾门进入肾脏,然后逐渐分支形成叶间动脉、弓状动脉、小叶间动脉(也称为放射状动脉)和入球小动脉,入球小动脉通向肾小球毛细血管,在那里大量的液体和溶质(除了血浆蛋白)被过滤以开始尿液形成(图26-3)。每个肾小球的毛细血管远端汇合形成出球小动脉,出球小动脉通向第二个毛细血管网络,即围绕肾小管的管周毛细血管。
图26-2. 肾脏和泌尿系统的总体结构。
肾循环的独特之处在于拥有两个毛细血管床,即肾小球毛细血管和管周毛细血管,它们串联排列并由出球小动脉分隔。这些小动脉有助于调节两组毛细血管中的静水压。肾小球毛细血管中的高静水压(约60 mmHg)导致快速的液体滤过,而管周毛细血管中的较低静水压(约13 mmHg)则允许快速的液体重吸收。通过调节入球和出球小动脉的阻力,肾脏可以调节肾小球和管周毛细血管中的静水压,从而改变肾小球滤过率、肾小管重吸收率或两者,以响应身体的稳态需求。
管周毛细血管汇入静脉系统的血管,这些血管与小动脉血管平行。静脉系统的血管逐渐形成小叶间静脉、弓状静脉、叶间静脉和肾静脉,肾静脉与肾动脉和输尿管一起离开肾脏。
肾单位是肾脏的功能单位
每个人的肾脏含有约800,000至1,000,000个肾单位,每个肾单位都能够形成尿液。肾脏无法再生新的肾单位。因此,随着肾损伤、疾病或正常老化,肾单位的数量逐渐减少。40岁以后,功能性肾单位的数量通常每10年减少约10%;因此,80岁时,许多人的功能性肾单位比40岁时少40%。这种损失不会危及生命,因为剩余肾单位的适应性变化使它们能够排出适量的水、电解质和废物,如第32章所述。
每个肾单位包含(1)一簇称为肾小球的肾小球毛细血管,大量液体从血液中滤过,以及(2)一条长管,滤过的液体在其流向肾盂的过程中转化为尿液(见图26-3)。
肾小球包含一个分支和吻合的肾小球毛细血管网络,与其他毛细血管相比,具有较高的静水压(约60 mmHg)。肾小球毛细血管被上皮细胞覆盖,整个肾小球被包裹在鲍曼囊中。
从肾小球毛细血管滤过的液体流入鲍曼囊,然后进入位于肾脏皮质的近端小管(图26-4)。从近端小管,液体流入亨利袢,亨利袢深入肾髓质。每个袢由一个降支和一个升支组成。降支和升支下端的壁非常薄,因此被称为亨利袢的薄段。在亨利袢的升支部分返回到皮质后,其壁变得非常厚;这部分被称为升支的厚段。
在厚升支的末端有一个短段,其壁内有一块特殊的上皮细胞斑块,称为致密斑(macula densa)。正如后面讨论的那样,致密斑在控制肾单位(nephron)功能中起着重要作用。在致密斑之后,液体进入远曲小管(distal tubule),远曲小管与近曲小管(proximal tubule)一样,位于肾皮质(renal cortex)中。远曲小管之后是连接小管(connecting tubule)和皮质集合小管(cortical collecting tubule),它们通向皮质集合管(cortical collecting duct)。8到10个皮质集合管的初始部分汇合形成一个更大的集合管,向下延伸进入髓质(medulla),成为髓质集合管(medullary collecting duct)。集合管逐渐合并形成更大的管道,最终通过肾乳头(renal papillae)的尖端排入肾盂(renal pelvis)。在每个肾脏中,大约有250个这样非常大的集合管,每个集合管从大约4000个肾单位收集尿液。
图26-3. 人类肾脏的切面,显示了供应肾脏血流的主要血管以及每个肾单位的微循环示意图。
图26-4. 肾单位的基本小管段。不同小管段的相对长度未按比例绘制。
肾单位结构的区域差异:皮质肾单位和近髓肾单位。尽管每个肾单位都具有前面描述的所有组成部分,但根据肾单位在肾脏质量中的深度,存在一些差异。肾小球(glomeruli)位于外皮质的肾单位称为皮质肾单位(cortical nephrons);它们的亨利袢(loops of Henle)较短,仅深入髓质一小段距离(图26-5)。
大约20%到30%的肾单位的肾小球位于靠近髓质的肾皮质深处,称为近髓肾单位(juxtamedullary nephrons)。这些肾单位的亨利袢较长,深入髓质,在某些情况下一直延伸到肾乳头的尖端。
供应近髓肾单位的血管结构也与供应皮质肾单位的血管结构不同。对于皮质肾单位,整个小管系统被广泛的管周毛细血管(peritubular capillaries)网络包围。对于近髓肾单位,长的出球小动脉(efferent arterioles)从肾小球延伸到外髓质,然后分化为特殊的管周毛细血管,称为直小血管(vasa recta),直小血管向下延伸进入髓质,与亨利袢并列。与亨利袢一样,直小血管返回皮质并排入皮质静脉(cortical veins)。髓质中的这种特殊毛细血管网络在浓缩尿的形成中起着至关重要的作用,这将在第29章中讨论。
排尿(MICTURITION)
排尿(micturition)是当膀胱充满时排空的过程。这个过程涉及两个主要步骤。首先,膀胱逐渐充满,直到其壁内的张力上升到阈值以上。这种张力引发第二个步骤,即一种称为排尿反射(micturition reflex)的神经反射,该反射排空膀胱,如果失败,至少会引起有意识的排尿欲望。尽管排尿反射是一种自主的脊髓反射,但它也可以被大脑皮层或脑干中的中枢抑制或促进。
图26-5. 血管与管状结构之间关系的示意图以及皮质肾单位和近髓肾单位之间的差异。
膀胱的生理解剖
图26-6中显示的膀胱是一个平滑肌腔室,由两个主要部分组成:(1) 体部(body),是膀胱的主要部分,尿液在此收集;(2) 颈部(neck),是体部的漏斗状延伸部分,向下和向前延伸进入泌尿生殖三角,并与尿道(urethra)连接。膀胱颈的下部由于其与尿道的关系,也被称为后尿道(posterior urethra)。
膀胱的平滑肌称为逼尿肌(detrusor muscle)。其肌纤维向各个方向延伸,当收缩时,可以将膀胱内的压力增加到40至60毫米汞柱。因此,逼尿肌的收缩是排空膀胱的主要步骤。逼尿肌的平滑肌细胞相互融合,因此存在从一个肌细胞到另一个肌细胞的低电阻电通路。因此,动作电位可以从一个肌细胞传播到下一个肌细胞,从而引起整个膀胱的同时收缩。
在膀胱的后壁上,紧靠膀胱颈上方,有一个小的三角形区域,称为三角区(trigone)。在三角区的最下顶点,膀胱颈开口进入后尿道,而两条输尿管(ureter)在三角区的最上角进入膀胱。三角区可以通过其粘膜(膀胱的内衬)是光滑的这一事实来识别,与剩余的膀胱粘膜形成褶皱形成皱襞(rugae)形成对比。
每条输尿管在进入膀胱时,斜向穿过逼尿肌,然后在膀胱粘膜下再经过1至2厘米,最后排入膀胱。
膀胱颈(后尿道)长2至3厘米,其壁由逼尿肌和大量弹性组织交织而成。该区域的肌肉称为内括约肌(internal sphincter)。其自然张力通常使膀胱颈和后尿道保持无尿状态,因此防止膀胱排空,直到膀胱主要部分的压力上升到临界阈值以上。
在后尿道之后,尿道穿过尿生殖膈(urogenital diaphragm),尿生殖膈包含一层称为膀胱外括约肌(external sphincter of the bladder)的肌肉。这块肌肉是随意骨骼肌(voluntary skeletal muscle),与膀胱体和膀胱颈的肌肉(完全由平滑肌(smooth muscle)组成)形成对比。外括约肌受神经系统的随意控制,可以用于有意识地阻止排尿,即使不自主控制试图排空膀胱时也是如此。
图26-6. 男性和女性的膀胱和尿道解剖。
图26-7. 膀胱的神经支配。
膀胱的神经支配。膀胱的主要神经供应是通过盆神经(pelvic nerves),盆神经通过骶丛(sacral plexus)与脊髓连接,主要与脊髓的S2和S3节段连接(图26-7)。盆神经中既有感觉神经纤维(sensory nerve fibers)也有运动神经纤维(motor nerve fibers)。感觉纤维检测膀胱壁的拉伸程度。来自后尿道的拉伸信号特别强烈,主要负责引发导致膀胱排空的反射。
通过盆神经传递的运动神经是副交感纤维(parasympathetic fibers)。这些纤维终止于位于膀胱壁内的神经节细胞(ganglion cells)。然后,短的节后神经(postganglionic nerves)支配逼尿肌(detrusor muscle)。
除了盆神经外,还有两种类型的神经支配对膀胱功能很重要。最重要的是通过阴部神经(pudendal nerve)传递到膀胱外括约肌的骨骼运动纤维(skeletal motor fibers)。这些纤维是体神经纤维(somatic nerve fibers),支配并控制括约肌的随意骨骼肌。此外,膀胱通过腹下神经(hypogastric nerves)从交感链(sympathetic chain)接收交感神经支配(sympathetic innervation),主要与脊髓的L2节段连接。这些交感纤维主要刺激血管,与膀胱收缩关系不大。一些感觉神经纤维也通过交感神经传递,可能在充盈感和某些情况下的疼痛感中起重要作用。
尿液从肾脏通过输尿管进入膀胱的运输
从膀胱排出的尿液与从集合管流出的液体成分基本相同。尿液在流经肾盏(renal calyces)和输尿管(ureters)到膀胱的过程中,其成分没有显著变化。
从集合管流入肾盏的尿液拉伸肾盏并增加其固有的起搏器活动(inherent pacemaker activity),从而引发蠕动收缩(peristaltic contractions),这些收缩扩散到肾盂(renal pelvis),然后沿着输尿管的长度向下传播,从而迫使尿液从肾盂流向膀胱。在成人中,输尿管通常长25至35厘米(10-14英寸)。
输尿管壁包含平滑肌,并受交感神经和副交感神经的支配,以及沿输尿管全长延伸的壁内神经元和神经纤维丛(intramural plexus of neurons and nerve fibers)的支配。与其他内脏平滑肌一样,输尿管的蠕动收缩通过副交感刺激增强,并通过交感刺激抑制。
输尿管通过膀胱三角区(trigone region)的逼尿肌(detrusor muscle)进入膀胱,如图26-6所示。正常情况下,输尿管在膀胱壁内斜行数厘米。膀胱壁内逼尿肌的正常张力倾向于压迫输尿管,从而在排尿(micturition)或膀胱受压时防止尿液从膀胱反流(reflux)。输尿管上的每个蠕动波都会增加输尿管内的压力,使通过膀胱壁的区域打开,允许尿液流入膀胱。
在某些人中,输尿管在膀胱壁内穿行的距离小于正常值,因此排尿时膀胱的收缩并不总是导致输尿管的完全闭塞。结果,膀胱中的一些尿液被推回输尿管,这种情况称为膀胱输尿管反流(vesicoureteral reflux)。这种反流可导致输尿管扩张,如果严重,可增加肾盏(renal calyces)和肾髓质(renal medulla)结构的压力,导致这些区域的损伤。
输尿管中的疼痛感觉和输尿管肾反射(ureterorenal reflex)。输尿管广泛分布有疼痛神经纤维。当输尿管被阻塞时(例如,由于输尿管结石),会发生强烈的反射性收缩,并伴有剧烈疼痛。此外,疼痛冲动会引起交感神经反射回到肾脏,使肾小动脉收缩,从而减少肾脏的尿液输出。这种效应称为输尿管肾反射(ureterorenal reflex),对于减少液体流入输尿管阻塞的肾脏的肾盂(pelvis)非常重要。
图26-8。正常的膀胱压力图(cystometrogram),还显示了由排尿反射引起的急性压力波(虚线尖峰)。
膀胱充盈和膀胱壁张力——膀胱压力图(cystometrogram)
图26-8显示了膀胱充盈时膀胱内压(intravesicular pressure)的近似变化。当膀胱中没有尿液时,膀胱内压约为0,但当收集到30至50毫升尿液时,压力上升到5至10厘米水柱。额外的尿液——200至300毫升——可以在压力仅有小幅上升的情况下收集;这种恒定的压力水平是由膀胱壁的内在张力(intrinsic tone)引起的。超过300至400毫升后,膀胱中收集更多尿液会导致压力迅速上升。
在膀胱充盈期间的张力压力变化上叠加了周期性的急性压力增加,这些压力增加持续几秒钟到超过1分钟。压力峰值可能仅上升几厘米水柱,也可能上升到超过100厘米水柱。这些压力峰值在膀胱压力图中称为排尿波(micturition waves),由排尿反射(micturition reflex)引起。
排尿反射(MICTURITION REFLEX)
再次参考图26-8,可以看到随着膀胱的充盈,许多叠加的排尿(urination)收缩开始出现,如虚线尖峰所示。这些是由膀胱壁中的感觉牵张受体(stretch receptors)引发的牵张反射(stretch reflex)的结果,尤其是在膀胱压力较高时,当后尿道(posterior urethra)开始充满尿液时,该区域的受体尤其活跃。来自膀胱牵张受体的感觉信号通过盆神经(pelvic nerves)传导到脊髓的骶段(sacral segments),然后通过副交感神经纤维(parasympathetic nerve fibers)反射性地返回到膀胱。
当膀胱仅部分充盈时,这些排尿收缩通常在一分钟后自发地放松,逼尿肌(detrusor muscles)停止收缩,压力回落到基线。随着膀胱继续充盈,排尿反射(micturition reflex)变得更加频繁,并导致逼尿肌更强的收缩。
一旦排尿反射开始,它是自我再生的。也就是说,膀胱的初始收缩激活了牵张受体,导致来自膀胱和后尿道的感觉冲动进一步增加,从而引起膀胱反射性收缩的进一步增强;因此,这个循环一次又一次地重复,直到膀胱达到强烈的收缩程度。然后,在几秒到超过一分钟之后,自我再生反射开始疲劳,排尿反射的再生循环停止,使膀胱得以放松。
因此,排尿反射是一个完整的循环,包括以下步骤:(1) 压力逐渐快速增加;(2) 持续压力期;(3) 压力回落到膀胱的基础张力(basal tone)。一旦排尿反射发生但未能成功排空膀胱,该反射的神经元素通常会保持抑制状态几分钟到1小时或更长时间,直到下一次排尿反射发生。随着膀胱越来越充盈,排尿反射发生得越来越频繁且更加强烈。
一旦排尿反射变得足够强大,它会引发另一个反射,该反射通过阴部神经(pudendal nerves)传递到外括约肌(external sphincter)以抑制其收缩。如果这种抑制作用在大脑中比对外括约肌的自主收缩信号更强,排尿就会发生。如果没有,排尿将不会发生,直到膀胱进一步充盈,排尿反射变得更加强大。
大脑对排尿的促进或抑制
排尿反射是一种自主脊髓反射(autonomic spinal cord reflex),但它可以被大脑中的中枢抑制或促进。这些中枢包括:(1) 脑干中的强促进和抑制中枢,主要位于脑桥(pons);(2) 位于大脑皮层(cerebral cortex)的多个中枢,主要是抑制性的,但可以变为兴奋性。
排尿反射是排尿的基本原因,但高级中枢通常对排尿施加最终控制,如下所示:
- 高级中枢保持排尿反射部分抑制,除非需要排尿。
- 高级中枢可以通过外括约肌的强直收缩(tonic contraction)来防止排尿,即使排尿反射发生,直到方便的时间出现。
- 当需要排尿时,皮层中枢可以促进骶部排尿中枢,帮助启动排尿反射,同时抑制尿道外括约肌,使排尿得以进行。
自主排尿通常以以下方式启动。首先,人自主收缩腹部肌肉,这会增加膀胱内的压力,使额外的尿液在压力下进入膀胱颈和后尿道,从而拉伸它们的壁。这一动作刺激了牵张感受器,激发了排尿反射,同时抑制了尿道外括约肌。通常,所有尿液都会被排空,膀胱内很少会留下超过5到10毫升的尿液。
排尿异常
感觉神经纤维破坏导致的膀胱无张力(Atonic Bladder)和尿失禁(Incontinence)。如果从膀胱到脊髓的感觉神经纤维被破坏,排尿反射收缩就无法发生,从而阻止了膀胱的牵张信号传递。当这种情况发生时,尽管从脊髓到膀胱的传出纤维完好无损,尽管大脑内的神经连接也完好无损,但人会失去对膀胱的控制。膀胱不会定期排空,而是会充满尿液并溢出,每次通过尿道滴出几滴尿液。这种情况被称为溢出性尿失禁(overflow incontinence)。
膀胱无张力的常见原因是脊髓骶部区域的挤压伤。某些疾病也可能导致进入脊髓的背根神经纤维受损。例如,梅毒(syphilis)可能导致背根神经纤维周围的收缩性纤维化,从而破坏它们。这种情况被称为脊髓痨(tabes dorsalis),由此导致的膀胱状况被称为脊髓痨性膀胱(tabetic bladder)。
骶部以上脊髓损伤导致的自动膀胱(Automatic Bladder)。如果脊髓在骶部以上受损,但骶部脊髓节段仍然完好,典型的排尿反射仍然可以发生。然而,它们不再受大脑控制。在脊髓损伤发生后的最初几天到几周内,由于脑干和大脑突然失去促进性冲动导致的脊髓休克状态,排尿反射会被抑制。然而,如果通过导尿定期排空膀胱以防止膀胱过度拉伸导致的损伤,排尿反射的兴奋性会逐渐增加,直到典型的排尿反射恢复;然后,膀胱会定期(但无预警地)排空。
大脑抑制信号缺失导致的非抑制性神经源性膀胱(Uninhibited Neurogenic Bladder)。另一种排尿异常是所谓的非抑制性神经源性膀胱,它导致频繁且相对不受控制的排尿。这种情况源于脊髓或脑干的部分损伤,中断了大部分抑制信号。因此,持续传递到脊髓的促进性冲动使骶部中枢非常兴奋,即使少量尿液也会引发无法控制的排尿反射,从而导致频繁排尿。
图26-9. 决定尿液成分的基本肾脏过程。某种物质的尿液排泄率等于该物质的滤过率减去其重吸收率,再加上其从管周毛细血管血液分泌到肾小管中的速率。
尿液的形成源于肾小球滤过、肾小管重吸收和肾小管分泌
不同物质在尿液中的排泄率代表了三个肾脏过程的总和,如图26-9所示:(1) 血液中物质的肾小球滤过;(2) 物质从肾小管重吸收回血液;(3) 物质从血液分泌到肾小管中,如下所示:
尿液排泄率 = 滤过率 − 重吸收率 + 分泌率
尿液的形成始于大量几乎不含蛋白质的液体从肾小球毛细血管滤过到鲍曼囊中。血浆中的大多数物质(除蛋白质外)都可以自由滤过,因此它们在鲍曼囊中的肾小球滤液中的浓度几乎与血浆中的浓度相同。当滤过的液体离开鲍曼囊并通过肾小管时,它会被水和特定溶质重吸收回血液或通过管周毛细血管分泌其他物质到肾小管中而改变。
图26-10显示了四种假设物质的肾脏处理方式。面板A中的物质被肾小球毛细血管自由滤过,但既不被重吸收也不被分泌。因此,其排泄率等于其滤过率。体内的某些废物,如肌酐,就是以这种方式由肾脏处理的,允许几乎所有的滤过物质被排泄。
图26-10. 四种假设物质的肾脏处理方式。A, 该物质被自由滤过但不被重吸收。B, 该物质被自由滤过,但部分滤过负荷被重吸收回血液。C, 该物质被自由滤过,但不会排泄到尿液中,因为所有滤过的物质都从肾小管重吸收回血液。D, 该物质被自由滤过且不被重吸收,但从管周毛细血管血液分泌到肾小管中。
在面板B中,该物质被自由滤过,但也部分从肾小管重吸收回血液。因此,尿液排泄率低于肾小球毛细血管的滤过率。在这种情况下,排泄率计算为滤过率减去重吸收率。这种模式对于体内的许多电解质(如钠离子和氯离子)是典型的。
在面板C中,该物质在肾小球毛细血管中被自由滤过,但不会排泄到尿液中,因为所有滤过的物质都从肾小管重吸收回血液。这种模式发生在血液中的一些营养物质(如氨基酸和葡萄糖)上,使它们能够在体液中得以保留。
D 图中的物质在肾小球毛细血管中自由过滤,且不被重吸收,但额外的量会从肾小管周围毛细血管血液中分泌到肾小管中。这种模式通常发生在有机酸和碱中,使它们能够迅速从血液中清除并以大量形式通过尿液排出。在这种情况下,排泄率计算为过滤率加上肾小管分泌率。
对于血浆中的每种物质,过滤、重吸收和分泌的组合是特定的。物质在尿液中的排泄率取决于这三种基本肾脏过程的相对速率。
不同物质的过滤、重吸收和分泌
一般来说,在尿液形成过程中,肾小管重吸收在数量上比肾小管分泌更为重要,但分泌在决定钾离子、氢离子和少数其他物质在尿液中的排泄量方面起着重要作用。大多数需要从血液中清除的物质,特别是代谢终产物,如尿素、肌酐、尿酸和尿酸盐,重吸收较差,因此以大量形式通过尿液排出。某些外来物质和药物也重吸收较差,但此外,它们还会从血液中分泌到肾小管中,因此它们的排泄率较高。相反,电解质,如钠离子、氯离子和碳酸氢根离子,重吸收较多,因此只有少量出现在尿液中。某些营养物质,如氨基酸和葡萄糖,完全从肾小管中重吸收,不会出现在尿液中,尽管它们被肾小球毛细血管大量过滤。
每个过程——肾小球过滤、肾小管重吸收和肾小管分泌——都根据身体的需要进行调节。例如,当体内钠过多时,钠的过滤率通常会略微增加,而过滤的钠的重吸收比例较小,导致尿液中钠的排泄增加。
对于大多数物质,过滤和重吸收的速率相对于排泄速率来说非常大。因此,即使过滤或重吸收的微小变化也可能导致肾脏排泄的较大变化。例如,如果肾小管重吸收保持不变,肾小球滤过率(GFR)仅增加 10%(从 180 到 198L/天)将使尿量增加 13 倍(从 1.5 到 19.5 L/天)。实际上,肾小球过滤和肾小管重吸收的变化通常以协调的方式作用,以产生肾脏排泄的必要变化。
为什么肾脏会过滤大量溶质然后重吸收?人们可能会质疑过滤如此大量的水和溶质然后重吸收大部分这些物质的智慧。高 GFR 的一个优势是它使肾脏能够迅速从体内清除主要依赖肾小球过滤进行排泄的废物。大多数废物被肾小管重吸收较差,因此依赖高 GFR 以有效从体内清除。
高肾小球滤过率(glomerular filtration rate, GFR)的第二个优势是它使得所有体液每天都能被肾脏多次过滤和处理。由于整个血浆容量仅为约3升,而GFR约为180L/天,因此整个血浆每天可以被过滤和处理约60次。这种高GFR使得肾脏能够精确且迅速地控制体液的容量和组成。
参考文献
参见第27至32章的参考文献。
27 肾小球滤过、肾血流量及其调控
肾小球滤过——尿液形成的第一步
尿液形成的第一步是通过肾小球毛细血管将大量液体过滤到鲍曼囊(Bowman’s capsule)中——每天几乎达到180升。尽管肾脏液体排泄率高度可变,取决于液体摄入量,但大部分滤液被重吸收,每天仅留下约1升液体被排出。肾小球滤过的高速率依赖于肾脏血流的高速率以及肾小球毛细血管膜的特殊性质。在本章中,我们将讨论决定肾小球滤过率(glomerular filtration rate, GFR)的物理力,以及调节GFR和肾血流量的生理机制。
肾小球滤液的组成
与大多数毛细血管一样,肾小球毛细血管对蛋白质相对不渗透,因此过滤的液体(称为肾小球滤液)基本上不含蛋白质,也不含细胞成分,包括红细胞。肾小球滤液中其他成分的浓度,包括大多数盐类和有机分子,与血浆中的浓度相似。这一普遍规律的例外包括一些低分子量物质,如钙和脂肪酸,它们由于部分与血浆蛋白结合而不被自由过滤。例如,几乎一半的血浆钙和大部分血浆脂肪酸与蛋白质结合,这些结合部分不会通过肾小球毛细血管被过滤。
肾小球滤过率约为肾血浆流量的20%
与其他毛细血管类似,肾小球毛细血管过滤液体的速率由以下因素决定:(1) 作用于毛细血管膜的静水压和胶体渗透压的平衡;(2) 毛细血管滤过系数(K_f),即毛细血管的渗透性和过滤表面积的乘积。由于肾小球静水压高且\operatornameK_\operatornamef*大,肾小球毛细血管的滤过速率远高于大多数其他毛细血管。在普通成年人中,GFR约为125ml/min.,或180L/day.。被过滤的肾血浆流量的比例(滤过分数)平均约为0.2,这意味着流经肾脏的血浆中约有20%通过肾小球毛细血管被过滤(图27-1)。滤过分数计算如下:
滤过分数 = GFR/肾血浆流量
肾小球毛细血管膜
肾小球毛细血管膜与其他毛细血管膜类似,但有三层(而不是通常的两层)主要结构:(1) 毛细血管的内皮(endothelium);(2) 基底膜(basement membrane);(3) 围绕毛细血管基底膜外表面的上皮细胞层(足细胞(podocytes))(图27-2)。这些层共同构成了滤过屏障(filtration barrier),尽管有三层结构,但其滤过的水和溶质量是普通毛细血管膜的数百倍。即使在这种高滤过率下,肾小球毛细血管膜通常也只滤过少量的血浆蛋白。
肾小球毛细血管膜的高滤过率部分归因于其特殊特性。毛细血管内皮上有数千个小孔,称为窗孔(fenestrae),类似于肝脏中的窗孔毛细血管,尽管比肝脏的窗孔小。尽管窗孔相对较大,但内皮细胞蛋白富含固定的负电荷,阻碍血浆蛋白的通过。
围绕内皮的是基底膜,它由胶原蛋白和蛋白多糖纤维组成的网状结构构成,具有较大的空间,允许大量水和小分子溶质通过。基底膜极大地阻碍了血浆蛋白的滤过,部分原因是与蛋白多糖相关的强负电荷。
肾小球膜的最后一部分是位于肾小球外表面的上皮细胞层(足细胞)。这些足细胞不是连续的,而是具有长足样突起(足突(pedicels)),环绕毛细血管的外表面(见图27-2)。足突之间由称为裂隙孔(slit pores)的间隙分隔,肾小球滤液通过这些间隙流动。上皮细胞也具有负电荷,进一步限制了血浆蛋白的滤过。因此,肾小球毛细血管壁的所有层都构成了血浆蛋白滤过的屏障,但允许水和血浆中的大多数溶质快速滤过。
图27-1. 总肾血浆流量(RPF)、肾小球滤过率(GFR)、肾小管重吸收(REAB)和尿流率的平均值。RPF等于肾血流量 × (1 − 血细胞比容)。注意,GFR平均约为RPF的20%,而尿流率不到GFR的1%。因此,正常情况下,超过99%的滤过液被重吸收。滤过分数为GFR/RPF。
图27-2. A,肾小球毛细血管的基本超微结构。B,肾小球毛细血管膜及其主要组成部分的横截面:毛细血管内皮、基底膜和上皮(足细胞)。
表27-1 基于分子量的肾小球毛细血管对物质的滤过性
markdown
溶质的过滤性与其大小成反比。肾小球毛细血管膜比大多数其他毛细血管更厚,但也更具多孔性,因此能以高速率过滤液体。尽管过滤速率很高,肾小球过滤屏障在决定哪些分子会被过滤时具有选择性,这取决于它们的大小和电荷。
表27-1列出了分子大小对不同分子过滤性的影响。过滤性为1.0意味着该物质像水一样自由过滤,而过滤性为0.75意味着该物质的过滤速率仅为水的75%。请注意,电解质如钠和小有机化合物如葡萄糖可以自由过滤。当分子的分子量接近白蛋白时,过滤性迅速下降,接近零。
带负电荷的大分子比带正电荷的相同分子大小的分子更难过滤。血浆蛋白白蛋白的分子直径仅为约6纳米,而肾小球膜的孔被认为约为8纳米(80埃)。然而,白蛋白由于其负电荷和肾小球毛细血管壁蛋白聚糖的负电荷产生的静电排斥而被限制过滤。
图27-3显示了电荷如何影响肾小球对不同分子量右旋糖酐的过滤。右旋糖酐是多糖,可以制造为中性分子或带有负电荷或正电荷。请注意,对于任何给定的分子半径,带正电荷的分子比带负电荷的分子更容易过滤。中性右旋糖酐也比相同分子量的带负电荷的右旋糖酐更容易过滤。这些过滤性差异的原因是基底膜和足细胞的负电荷提供了一种重要的限制带负电荷大分子(包括血浆蛋白)的手段。
图27-3. 右旋糖酐的分子半径和电荷对其在肾小球毛细血管中的过滤性的影响。值为1.0表示该物质像水一样自由过滤,而值为0表示它不被过滤。右旋糖酐是多糖,可以制造为中性分子或带有负电荷或正电荷,并具有不同的分子量。
微小病变性肾病(Minimal-Change Nephropathy)和肾小球对血浆蛋白通透性增加。在微小病变性肾病中,肾小球对血浆蛋白的通透性增加,尽管在标准光学显微镜下观察时它们可能看起来正常。然而,当用电子显微镜高倍放大观察时,肾小球通常显示扁平的足细胞(podocytes),其足突(foot processes)可能从肾小球基底膜(glomerular basement membrane)上脱离(足细胞消失,podocyte effacement)。
微小病变性肾病的原因尚不清楚,但可能至少部分与免疫反应和T细胞异常分泌细胞因子(cytokines)有关,这些细胞因子损伤足细胞并增加其对某些低分子量蛋白质(尤其是白蛋白,albumin)的通透性。这种增加的通透性使得蛋白质能够被肾小球毛细血管过滤并在尿液中排泄,这种情况称为蛋白尿(proteinuria)或白蛋白尿(albuminuria)。微小病变性肾病最常见于幼儿,但也可能发生在成人中,尤其是那些患有自身免疫性疾病(autoimmune disorders)的成人。
肾小球滤过率(Glomerular Filtration Rate, GFR)的决定因素
GFR由以下因素决定:(1) 跨肾小球膜的水静压(hydrostatic pressure)和胶体渗透压(colloid osmotic pressure)的总和,即净滤过压(net filtration pressure);(2) 肾小球滤过系数(glomerular \operatornameK_\operatornamef)。用数学表达式表示,GFR等于K_f和净滤过压的乘积:
图27-4. 导致肾小球毛细血管滤过的力的总结。所示值为健康人的估计值。
G F R=K_f×N e1 t filtration pressure
净滤过压表示促进或阻碍肾小球毛细血管滤过的水静压和胶体渗透压的总和(图27-4)。这些力包括:(1) 肾小球毛细血管内的水静压(肾小球水静压,P_G),促进滤过;(2) 肾小囊(Bowman’s capsule)外的水静压(\left(P_B\right)),阻碍滤过;(3) 肾小球毛细血管血浆蛋白的胶体渗透压(\left(\pi_G\right)),阻碍滤过;(4) 肾小囊内蛋白质的胶体渗透压((\uppi_B)),促进滤过。在正常情况下,肾小球滤液中的蛋白质浓度非常低,因此肾小囊液的胶体渗透压被认为是零。
因此,GFR可以表示为:
G F R=K_f×(P_G-P_B-\pi_G+\pi_B)
尽管GFR决定因素的正常值尚未在人类中直接测量,但已在狗和大鼠等动物中进行了估计。根据实验动物的结果,人类中促进和阻碍肾小球滤过的近似正常力被认为如下(见图27-4):
促进滤过的力(mm Hg)
肾小球水静压 60 肾小囊胶体渗透压 0 阻碍滤过的力(mm Hg)
Bowman囊静水压(Bowman's capsule hydrostatic pressure) 18 肾小球毛细血管胶体渗透压(Glomerular capillary colloid osmotic pressure) 32
因此,净滤过压(net filtration pressure) =60-18-32=+10mmHg。
这些值中的一些在不同生理条件下会发生显著变化,而另一些主要在疾病状态下发生改变,如后文所述。
肾小球毛细血管滤过系数增加会增加肾小球滤过率
K_f是肾小球毛细血管的水力传导性和表面积的乘积的度量。K_f不能直接测量,但可以通过将GFR除以净滤过压来实验估计:
K_f=G F R/N e tf l t r a t i o n p r e s s u r e
因为双肾的总GFR约为125 ml/min,净滤过压为10mmHg,所以正常K_f计算为约12.5ml/min每毫米Hg滤过压。当K_f以每100克肾脏重量表示时,平均约为4.2ml/min每毫米Hg,这一值约为身体其他大多数毛细血管系统的K_f的400倍。身体许多其他组织的平均K_f仅为约0.01 ml/min每毫米Hg/100g。肾小球毛细血管的高K_f有助于其快速的液体滤过率。
尽管增加K_f会提高GFR,减少K_f会降低GFR,但K_f的变化可能并不提供GFR正常日常调节的主要机制。然而,一些疾病通过减少功能性肾小球毛细血管的数量(从而减少滤过表面积)或通过增加肾小球毛细血管膜的厚度并降低其水力传导性来降低K_f。例如,慢性未控制的高血压可能通过增加肾小球毛细血管基底膜的厚度逐渐降低K_f,并最终严重损害毛细血管,导致毛细血管功能丧失。
增加Bowman囊静水压会降低肾小球滤过率
在实验动物中使用微管直接测量Bowman囊和近端小管不同点的静水压表明,人类Bowman囊压力的合理估计在正常情况下约为18mmHg。增加Bowman囊的静水压会降低GFR,而降低此压力会提高GFR。然而,Bowman囊压力的变化通常不作为调节GFR的主要手段。
在某些与尿路梗阻相关的病理状态下,Bowman囊压力可能会显著增加,导致GFR严重降低。例如,钙或尿酸的沉淀可能导致结石形成,结石通常卡在输尿管中,从而阻碍尿路流出并提高Bowman囊压力。这种情况会降低GFR,并最终可能导致肾积水(肾盂和肾盏的扩张和扩张),并可能损害甚至破坏肾脏,除非梗阻得到缓解。
图27-5. 血浆在流经肾小球毛细血管时胶体渗透压的增加。正常情况下,肾小球毛细血管中约五分之一的液体滤入鲍曼囊,从而使未被滤过的血浆蛋白浓缩。滤过分数(肾小球滤过率/肾血浆流量)的增加会加快血浆胶体渗透压沿肾小球毛细血管上升的速度;滤过分数的降低则会产生相反的效果。
肾小球毛细血管胶体渗透压的增加会降低肾小球滤过率
当血液从入球小动脉流经肾小球毛细血管到达出球小动脉时,血浆蛋白浓度增加约20%(图27-5)。这种增加的原因是毛细血管中约五分之一的液体滤入鲍曼囊,从而使未被滤过的肾小球血浆蛋白浓缩。假设进入肾小球毛细血管的血浆正常胶体渗透压为28mmHg,当血液到达毛细血管出球端时,该值通常上升到约36mmHg。因此,肾小球毛细血管血浆蛋白的平均胶体渗透压介于28和36mmHg之间,约为32mmHg。
影响肾小球毛细血管胶体渗透压的两个因素如下:(1) 动脉血浆胶体渗透压;(2) 肾小球毛细血管滤过的血浆比例(滤过分数)。增加动脉血浆胶体渗透压会提高肾小球毛细血管胶体渗透压,从而倾向于降低肾小球滤过率(GFR)。
增加滤过分数也会浓缩血浆蛋白并提高肾小球胶体渗透压(见图27-5)。由于滤过分数定义为肾小球滤过率除以肾血浆流量,因此可以通过提高肾小球滤过率或减少肾血浆流量来增加滤过分数。例如,在肾小球滤过率没有初始变化的情况下,肾血浆流量的减少会倾向于增加滤过分数,从而提高肾小球毛细血管胶体渗透压并倾向于降低肾小球滤过率。因此,肾血流量的变化可以独立于肾小球静水压的变化而影响肾小球滤过率。
随着肾血流量的增加,最初从肾小球毛细血管滤出的血浆比例较低,导致肾小球毛细血管胶体渗透压上升较慢,对肾小球滤过率的抑制作用较小。因此,即使在肾小球静水压恒定的情况下,肾小球血流量的增加倾向于提高肾小球滤过率,而肾小球血流量的减少则倾向于降低肾小球滤过率。
肾小球毛细血管静水压的增加会提高肾小球滤过率
在正常情况下,肾小球毛细血管静水压(glomerular capillary hydrostatic pressure)估计约为60mmHg。肾小球静水压的变化是生理调节肾小球滤过率(glomerular filtration rate, GFR)的主要手段。肾小球静水压的增加会提高GFR,而肾小球静水压的降低则会减少GFR。
肾小球静水压由三个变量决定,每个变量都受到生理控制:(1)动脉压(arterial pressure);(2)入球小动脉阻力(afferent arteriolar resistance);(3)出球小动脉阻力(efferent arteriolar resistance)。
动脉压的增加往往会提高肾小球静水压,从而增加GFR。然而,正如后面所讨论的,这种效应被自动调节机制所缓冲,这些机制在动脉压波动时维持相对恒定的肾小球压力。
入球小动脉阻力的增加会降低肾小球静水压并减少GFR(图27-6)。相反,入球小动脉的扩张会增加肾小球静水压和GFR。
出球小动脉的收缩增加了肾小球毛细血管流出的阻力。这种机制提高了肾小球静水压,并且只要出球阻力的增加不会过多减少肾血流量,GFR就会略有增加(见图27-6)。然而,由于出球小动脉的收缩也会减少肾血流量,随着出球小动脉阻力的增加,滤过分数(filtration fraction)和肾小球胶体渗透压(glomerular colloid osmotic pressure)也会增加。因此,如果出球小动脉的收缩严重(出球小动脉阻力增加超过约三倍),胶体渗透压的上升将超过由出球小动脉收缩引起的肾小球毛细血管静水压的增加。当这种情况发生时,滤过的净力实际上会减少,导致GFR的降低。
图27-6. 入球小动脉阻力'R_A, 上图)或出球小动脉阻力(R_E, 下图)对肾血流量、肾小球静水压(P_G)和肾小球滤过率(GFR)的影响。
图27-7. 入球小动脉阻力或出球小动脉阻力的变化对肾小球滤过率和肾血流量的影响。
因此,出球小动脉的收缩对GFR有双相效应(图27-7)。在中等程度的收缩下,GFR会略有增加,但在严重收缩时,GFR会减少。GFR最终减少的主要原因是:随着出球小动脉的收缩变得严重,以及血浆蛋白浓度的增加,由于Donnan效应,胶体渗透压会迅速非线性增加;蛋白浓度越高,由于与血浆蛋白结合的离子的相互作用,胶体渗透压上升得越快,这些离子也产生渗透效应,如第16章所讨论的。
表27-2 可能降低肾小球滤过率的因素
markdown
生理决定因素
a 决定因素的相反变化通常会增加GFR。A_P,系统动脉压;GFR,肾小球滤过率;K_f,肾小球滤过系数;P_B,鲍曼囊静水压;\pi_G,肾小球毛细血管胶体渗透压;P_G,肾小球毛细血管静水压;R_A,入球小动脉阻力;R_E,出球小动脉阻力。
总结来说,入球小动脉的收缩会降低GFR。然而,出球小动脉收缩的影响取决于收缩的严重程度;适度的出球小动脉收缩会增加GFR,但严重的出球小动脉收缩(阻力增加超过三倍)往往会降低GFR。
表27-2总结了可能降低GFR的因素。
肾血流量
在一个70公斤的男性中,通过双肾的总血流量约为1100毫升/分钟,约占心输出量的22%。考虑到双肾仅占总体重的约0.4%,可以明显看出,与其他器官相比,肾脏的血流量极高。
与其他组织一样,血流量为肾脏提供营养并清除废物。然而,肾脏的高血流量远远超过了这一需求。这种额外血流量的目的是为高肾小球滤过率提供足够的血浆,这对于精确调节体液体积和溶质浓度是必要的。正如预期的那样,调节肾血流量的机制与GFR的控制和肾脏的排泄功能密切相关。
图27-8. 狗肾脏中氧消耗与钠重吸收的关系。(来自Kramer K, Deetjen P: [Relation of renal oxygen consumption to blood supply and glomerular filtration during variations of blood pressure.] Pflugers Arch Physiol 271:782, 1960.)
肾血流量与氧消耗
以每克重量为基础,肾脏通常消耗氧气的速度是大脑的两倍,但血流量几乎是大脑的七倍。因此,输送到肾脏的氧气远远超过了它们的代谢需求,与大多数其他组织相比,动脉-静脉氧提取率相对较低。
肾脏消耗的氧气大部分与肾小管高活性的钠重吸收(active sodium reabsorption)有关。如果肾血流量(renal blood flow)和肾小球滤过率(glomerular filtration rate, GFR)降低,滤过的钠减少,重吸收的钠也减少,消耗的氧气也随之减少。因此,肾脏的耗氧量与肾小管钠重吸收成正比,而后者又与GFR和钠滤过率密切相关(图27-8)。如果肾小球滤过完全停止,肾脏的钠重吸收也会停止,耗氧量下降到正常水平的四分之一左右。这种残余的耗氧量反映了肾细胞的基本代谢需求。
肾血流量的决定因素
肾血流量(renal blood flow, RBF)由肾血管床的压力梯度(renal artery和renal vein的静水压差)除以总肾血管阻力决定:
肾动脉压力约等于体循环动脉压,肾静脉压力在大多数情况下平均为3到4 mmHg。与其他血管床一样,肾脏的总血管阻力由各个血管段的阻力之和决定,包括动脉、小动脉、毛细血管和静脉(表27-3)。
表27-3 正常肾脏循环中的近似压力和血管阻力
大部分肾血管阻力集中在三个主要血管段——小叶间动脉、入球小动脉和出球小动脉。这些血管的阻力由交感神经系统、各种激素和局部肾脏内部调控机制控制,这将在后面讨论。如果肾动脉和肾静脉压力保持不变,肾脏任何血管段的阻力增加都会减少肾血流量,而血管阻力降低则会增加肾血流量。
尽管动脉压的变化对肾血流量有一定影响,但肾脏有有效的机制在80到170 mmHg的动脉压范围内保持肾血流量和GFR相对恒定,这一过程称为自动调节(autoregulation)。这种自动调节能力通过肾脏固有的机制实现,这将在本章后面讨论。
肾髓质直小血管的血流量低于肾皮质血流量
肾脏的外部,即肾皮质(renal cortex),接收了肾脏的大部分血流。肾髓质(renal medulla)的血流仅占肾脏总血流的1%到2%。肾髓质的血流由肾小管周围毛细血管系统(peritubular capillary system)的一个特殊部分,即直小血管(vasa recta)供应。这些血管与Henle袢(loops of Henle)平行下降进入髓质,然后与Henle袢一起回环并返回到皮质,最后排入静脉系统。正如第29章所讨论的,直小血管在使肾脏形成浓缩尿液方面起着重要作用。
表27-4 影响肾小球滤过率(Glomerular Filtration Rate, GFR)的激素和自体活性物质(Autacoids)
<html><body><table><tr><td>激素或自体活性物质</td><td>对GFR的影响</td></tr><tr><td>去甲肾上腺素(Norepinephrine)</td><td></td></tr><tr><td>肾上腺素(Epinephrine)</td><td>一</td></tr><tr><td>内皮素(Endothelin)</td><td></td></tr><tr><td>血管紧张素II(Angiotensin II)</td><td>1 (防止下降)</td></tr><tr><td>内皮源性一氧化氮(Endothelial-derived nitric oxide)</td><td>↑</td></tr><tr><td>前列腺素(Prostaglandins)</td><td>↑</td></tr></table></body></html>
肾小球滤过和肾血流的生理控制
肾小球滤过率(GFR)最易变且受生理控制的决定因素是肾小球静水压(glomerular hydrostatic pressure)。这一变量又受到交感神经系统(sympathetic nervous system)、激素、自体活性物质(autacoids)(在肾脏中释放并局部作用的血管活性物质)以及其他肾脏固有的反馈控制的影响。
强烈的交感神经系统激活会降低肾小球滤过率
肾脏的所有血管,包括入球小动脉(afferent arterioles)和出球小动脉(efferent arterioles),都富含交感神经纤维。强烈的肾交感神经激活可以收缩肾小动脉,减少肾血流和GFR。中度或轻度的交感神经刺激对肾血流和GFR影响不大。例如,由于颈动脉窦压力感受器(carotid sinus baroreceptors)或心肺感受器(cardiopulmonary receptors)压力中度下降引起的交感神经系统反射激活对肾血流或GFR影响不大。然而,正如第28章所讨论的,即使是肾交感神经活动的轻度增加也可以刺激肾素(renin)释放并增加肾小管重吸收,导致钠和水排泄减少。
在持续几分钟到几小时的严重急性紊乱期间,如防御反应(defense reaction)、脑缺血(brain ischemia)或严重出血(severe hemorrhage)引起的紊乱,肾交感神经在降低GFR方面似乎最为重要。
激素和自体活性物质对肾循环的控制
如表27-4所总结的,几种激素和自体活性物质可以影响GFR和肾血流。
去甲肾上腺素(Norepinephrine)、肾上腺素(Epinephrine)和内皮素(Endothelin)收缩肾血管并降低肾小球滤过率。收缩入球小动脉和出球小动脉,导致GFR和肾血流减少的激素包括从肾上腺髓质(adrenal medulla)释放的去甲肾上腺素和肾上腺素。一般来说,这些激素的血浆水平与交感神经系统的活动平行;因此,除了在强烈激活交感神经系统的条件下,如严重出血,去甲肾上腺素和肾上腺素对肾血流动力学影响不大。
另一种血管收缩剂,内皮素(endothelin),是一种肽类物质,可由受损的肾脏血管内皮细胞以及其他组织释放。这种自体活性物质(autacoid)的生理作用尚未完全阐明。然而,当血管被切断时,内皮素可能有助于止血(hemostasis)(即减少失血),因为血管切断会损伤内皮并释放这种强效的血管收缩剂。在许多与血管损伤相关的疾病状态下,如妊娠毒血症(toxemia of pregnancy)、急性肾衰竭(acute renal failure)和慢性尿毒症(chronic uremia),血浆内皮素水平也会升高,并可能在某些病理生理条件下导致肾血管收缩和肾小球滤过率(GFR)下降。
在大多数生理条件下,血管紧张素II(Angiotensin II)优先收缩出球小动脉(efferent arterioles)。作为一种强效的肾血管收缩剂,血管紧张素II(Angiotensin II)可以被视为一种循环激素和局部产生的自体活性物质或旁分泌激素(paracrine hormone),因为它在肾脏和体循环中形成。血管紧张素II的受体几乎存在于肾脏的所有血管中。然而,在大多数与肾素-血管紧张素系统(renin-angiotensin system)激活相关的生理条件下,如低钠饮食或由于肾动脉狭窄导致的肾灌注压降低时,肾小球前血管,尤其是入球小动脉(afferent arterioles),似乎相对免受血管紧张素II介导的收缩影响。这种保护作用是由于血管扩张剂(vasodilators)的释放,特别是一氧化氮(nitric oxide)和前列腺素(prostaglandins),它们在这些血管中抵消了血管紧张素II的血管收缩作用。
然而,出球小动脉对血管紧张素II高度敏感。由于在大多数生理条件下,血管紧张素II优先收缩出球小动脉,因此血管紧张素II水平的升高会增加肾小球静水压(glomerular hydrostatic pressure),同时减少肾血流量(renal blood flow)。需要记住的是,血管紧张素II生成的增加通常发生在与动脉压降低或容量不足相关的条件下,这些条件往往会降低肾小球滤过率(GFR)。在这些情况下,血管紧张素II水平的升高通过收缩出球小动脉,有助于防止肾小球静水压和GFR的下降。然而,与此同时,出球小动脉收缩引起的肾血流量减少会导致通过管周毛细血管(peritubular capillaries)的血流量减少,这反过来又增加了钠和水的重吸收,如第28章所述。
因此,在低钠饮食或容量不足时,血管紧张素II水平的升高有助于维持GFR和代谢废物(如尿素和肌酐)的正常排泄,这些废物的排泄依赖于肾小球滤过。同时,血管紧张素II诱导的出球小动脉收缩增加了钠和水的肾小管重吸收,这有助于恢复血容量和血压。血管紧张素II在帮助自动调节GFR方面的作用将在本章后面详细讨论。
内皮源性一氧化氮降低肾血管阻力并增加肾小球滤过率。一种由全身血管内皮释放的自分泌物质(endothelial-derived nitric oxide)可以降低肾血管阻力。一氧化氮的基础水平对于维持肾脏的血管舒张和钠、水的正常排泄似乎很重要。因此,使用抑制一氧化氮生成的药物会增加肾血管阻力,降低肾小球滤过率(GFR)和尿钠排泄,最终导致高血压。在一些高血压患者或动脉粥样硬化患者中,血管内皮损伤和一氧化氮生成受损可能导致肾血管收缩增加和血压升高。
前列腺素和缓激肽降低肾血管阻力并倾向于增加肾小球滤过率。前列腺素(PGE2和PGI2)和缓激肽作为激素和自分泌物质,可引起血管舒张、增加肾血流量和增加肾小球滤过率。这些物质将在第17章讨论。虽然这些血管舒张剂在正常情况下对调节肾血流量或肾小球滤过率似乎并不重要,但它们可能会减弱交感神经或血管紧张素II的肾血管收缩作用,特别是它们对入球小动脉的收缩作用。
通过对抗入球小动脉的血管收缩,前列腺素有助于防止肾小球滤过率和肾血流量的过度降低。在应激条件下,如容量不足或手术后,使用抑制前列腺素合成的非甾体抗炎药(NSAIDs),如阿司匹林,可能会导致肾小球滤过率显著降低。
肾小球滤过率和肾血流量的自我调节
尽管动脉血压发生显著变化,但肾脏固有的反馈机制通常会使肾血流量和肾小球滤过率保持相对恒定。
图27-9。肾血流量和肾小球滤过率的自我调节,但在肾动脉压力变化期间尿流量的自我调节缺失。
这些机制在从体内取出的血液灌注的肾脏中仍然发挥作用,不受全身影响。这种肾小球滤过率和肾血流量的相对恒定性被称为自我调节(图27-9)。
在大多数组织中,除了肾脏,血流自我调节的主要功能是维持氧气和营养物质的正常输送,并清除代谢废物,尽管动脉压力发生变化。在肾脏中,正常血流量远高于这些功能所需的水平。肾脏自我调节的主要功能是维持相对恒定的肾小球滤过率,并允许精确控制肾脏对水和溶质的排泄。
尽管在人体日常活动中会发生相当大的动脉压波动,但GFR(肾小球滤过率,glomerular filtration rate)通常保持相对恒定。例如,动脉压降低至70至75mm Hg或升高至160至180mmHg通常只会使GFR变化不到10%。一般来说,肾血流量(renal blood flow)与GFR平行进行自我调节(autoregulation),但在某些条件下,GFR的自我调节更为有效。
肾小球滤过率自我调节在防止肾排泄极端变化中的重要性
尽管肾脏的自我调节机制并不完美,但它们确实防止了GFR和肾脏对水和溶质排泄的潜在大幅变化,这些变化在血压变化时可能会发生。通过考虑肾小球滤过、肾小管重吸收(tubular reabsorption)和肾排泄的相对量以及在没有自我调节机制时肾排泄的变化,可以理解自我调节的定量重要性。
正常情况下,GFR约为180升/天,肾小管重吸收为178.5L/天,留下1.5L/天的液体通过尿液排出。在没有自我调节的情况下,血压的较小增加(从100到125mmHg)会导致GFR类似的25%增加(从约180到225L/day)。如果肾小管重吸收保持在178.5L/天不变,尿流量将增加到46.5L/day(GFR与肾小管重吸收之间的差异)——尿液总量增加超过30倍。由于总血浆体积仅为约3升,这种变化将迅速耗尽血容量。
实际上,动脉压的变化通常对尿量的影响要小得多,原因有两个:(1) 肾脏的自我调节防止了GFR的大幅变化;(2) 肾小管中有额外的适应机制,当GFR上升时,这些机制会增加其重吸收率,这种现象称为肾小球-肾小管平衡(glomerulotubular balance)(在第28章讨论)。即使有这些特殊的控制机制,动脉压的变化仍然对水和钠的肾排泄有显著影响;这种效应称为压力利尿(pressure diuresis)或压力钠尿(pressure natriuresis),它在体液体积和动脉压的调节中至关重要,如第19章和第30章所述。
肾小管-肾小球反馈和肾小球滤过率的自我调节
肾脏有一种特殊的反馈机制,将致密斑(macula densa)处的氯化钠浓度变化与肾小动脉阻力的控制和GFR的自我调节联系起来。这种反馈有助于确保向远端小管(distal tubule)相对恒定的氯化钠输送,并有助于防止肾排泄的虚假波动。在许多情况下,这种反馈会平行地自我调节肾血流量和GFR。然而,由于这种机制特别针对稳定向远端小管的氯化钠输送,有时GFR的自我调节是以肾血流量的变化为代价的,如后文所述。在其他情况下,这种机制实际上可能会因肾小管氯化钠重吸收的初级变化而引起GFR的变化。
管球反馈机制(tubuloglomerular feedback mechanism)有两个共同作用以控制肾小球滤过率(GFR)的组成部分:(1)入球小动脉反馈机制(afferent arteriolar feedback mechanism);(2)出球小动脉反馈机制(efferent arteriolar feedback mechanism)。这些反馈机制依赖于近球复合体(juxtaglomerular complex)的特殊解剖结构(图27-10)。
近球复合体由远曲小管起始部分的致密斑细胞(macula densa cells)和入球、出球小动脉壁上的近球细胞(juxtaglomerular cells)组成。致密斑是远曲小管中与入球、出球小动脉紧密接触的特殊上皮细胞群。致密斑细胞含有高尔基体(Golgi apparatus),由朝向小动脉的细胞内分泌细胞器组成,表明这些细胞可能向小动脉分泌某种物质。
图27-10. 近球装置的结构,展示了其在控制肾单位功能中的可能反馈作用。
致密斑氯化钠减少导致入球小动脉扩张和肾素释放增加。致密斑细胞通过尚未完全理解的信号感知远曲小管中氯化钠输送的变化。实验研究表明,GFR降低会减慢Henle袢中的流速,导致输送到Henle袢升支的钠和氯离子百分比重吸收增加,从而降低致密斑细胞处的氯化钠浓度。氯化钠浓度的降低会启动来自致密斑的信号,该信号有两个作用(图27-11):(1)降低入球小动脉的血流阻力,从而提高肾小球静水压,帮助GFR恢复正常;(2)增加入球和出球小动脉近球细胞中肾素的释放,这些细胞是肾素的主要储存部位。从这些细胞释放的肾素随后作为酶发挥作用,增加血管紧张素I的形成,血管紧张素I被转化为血管紧张素II。最后,血管紧张素II收缩出球小动脉,从而提高肾小球静水压,帮助GFR恢复正常。
图27-11. 在肾动脉压降低期间,致密斑反馈机制用于自动调节肾小球静水压和肾小球滤过率(GFR)。
管球反馈机制的这两个组成部分,通过近球装置的特殊解剖结构共同作用,为入球和出球小动脉提供反馈信号,以便在动脉压变化期间有效自动调节GFR。当这两种机制共同作用时,即使动脉压在75至160mmHg之间大幅波动,GFR的变化也只有几个百分点。
在肾灌注不足期间,阻断血管紧张素II的形成进一步降低肾小球滤过率。
如前所述,当肾脏灌注压低于正常水平时,血管紧张素II(angiotensin II)对出球小动脉的优先收缩作用有助于防止肾小球静水压和肾小球滤过率(glomerular filtration rate, GFR)的严重下降。当肾动脉压低于正常水平时,使用阻断血管紧张素II生成的药物(如血管紧张素转换酶抑制剂,angiotensin-converting enzyme inhibitors)或阻断血管紧张素II作用的药物(如血管紧张素II受体拮抗剂,angiotensin II receptor antagonists)可能导致GFR的下降幅度比通常更大。因此,使用这些药物治疗因肾动脉狭窄(renal artery stenosis,肾动脉部分阻塞)引起的高血压患者时,一个重要并发症是GFR的严重下降,在某些情况下可能导致急性肾衰竭(acute renal failure)。然而,只要对患者进行监测以确保不会发生GFR的严重下降,血管紧张素II阻断药物仍然是许多高血压、充血性心力衰竭和其他疾病患者的重要治疗药物。
肾血流和肾小球滤过率的肌源性自动调节(MYOGENIC AUTOREGULATION OF RENAL BLOOD FLOW AND GLOMERULAR FILTRATION RATE)
另一种有助于维持相对恒定肾血流和GFR的机制是单个血管在动脉压升高时抵抗拉伸的能力,称为肌源性机制(myogenic mechanism)。对全身各处单个血管(尤其是小动脉)的研究表明,它们通过血管平滑肌的收缩来响应增加的壁张力或壁拉伸。血管壁的拉伸使得钙离子从细胞外液进入细胞的运动增加,从而通过第8章讨论的机制引起细胞收缩。这种收缩防止了血管的过度拉伸,同时通过增加血管阻力,有助于防止动脉压升高时肾血流和GFR的过度增加。
尽管肌源性机制可能在全身大多数小动脉中发挥作用,但一些生理学家对其在肾血流和GFR自动调节中的重要性提出了质疑,因为这种对压力敏感的机制无法直接检测肾血流或GFR本身的变化。另一方面,这种机制在保护肾脏免受高血压引起的损伤方面可能更为重要。在血压突然升高时,入球小动脉的肌源性收缩反应在几秒钟内发生,从而减弱了动脉压升高向肾小球毛细血管的传递。
高蛋白摄入和高血糖增加肾血流和肾小球滤过率。尽管在大多数情况下肾血流和GFR相对稳定,但在某些情况下这些变量会发生显著变化。例如,已知高蛋白摄入会增加肾血流和GFR。长期高蛋白饮食(如含有大量肉类的饮食)会导致GFR和肾血流的增加,部分原因是肾脏的生长。然而,在一个人摄入高蛋白餐后1到2小时内,GFR和肾血流也会增加20%到30%。
肾小球滤过率(glomerular filtration rate, GFR)增加的一个可能解释如下。高蛋白饮食会释放氨基酸进入血液,这些氨基酸在近端小管(proximal tubules)被重吸收。由于氨基酸和钠在近端小管通过共转运(cotransport)一起被重吸收,氨基酸重吸收的增加也会刺激钠的重吸收。钠重吸收的增加减少了到达致密斑(macula densa)的钠量(见图27-12),这引发了管球反馈(tubuloglomerular feedback)介导的入球小动脉(afferent arterioles)阻力下降,正如前面所讨论的。入球小动脉阻力的降低随后增加了肾血流量(renal blood flow)和GFR,使得钠的排泄维持在接近正常水平,同时增加了蛋白质代谢废物(如尿素)的排泄。
图27-12. 致密斑反馈在高蛋白饮食后介导肾小球滤过率(GFR)增加中的可能作用。
类似的机制也可能解释了在未控制的糖尿病(diabetes mellitus)患者中,血糖水平大幅升高时肾血流量和GFR显著增加的现象。因为葡萄糖与某些氨基酸一样,也在近端小管与钠一起被重吸收,葡萄糖输送到小管的增加导致它们与葡萄糖一起重吸收过量的钠。钠重吸收的增加反过来降低了致密斑处的氯化钠浓度,激活了管球反馈介导的入球小动脉扩张,随后增加了肾血流量和GFR。
这些例子表明,肾血流量和GFR本身并不是管球反馈机制控制的主要变量。该反馈的主要目的是确保氯化钠以恒定的速率输送到远端小管(distal tubule),在那里进行尿液的最终处理。因此,倾向于增加致密斑前小管部位氯化钠重吸收的干扰往往会引发肾血流量和GFR的增加,这有助于使远端氯化钠的输送恢复正常,从而维持钠和水排泄的正常速率(见图27-12)。
当近端小管重吸收减少时,会发生相反的事件序列。例如,当近端小管受损时(可能是由于重金属如汞中毒或大剂量药物如四环素类药物引起),它们重吸收氯化钠的能力下降。结果,大量的氯化钠被输送到远端小管,如果没有适当的补偿,会迅速导致过度的容量耗竭。其中一种重要的补偿反应似乎是在这些情况下,由于氯化钠输送到致密斑的增加而引发的管球反馈介导的肾血管收缩。这些例子再次证明了这种反馈机制的重要性,它确保远端小管接收到适当速率的氯化钠、其他小管液溶质和小管液体积的输送,以便这些物质以适当的量从尿液中排出。
表27-5 一些影响肾血流量(RBF)和肾小球滤过率(GFR)的条件
markdown
a指早期效应,在慢性高血糖、肥胖和高盐摄入可能导致的肾小球损伤发生之前。
影响肾血流量和肾小球滤过率的其他因素。出生时,GFR和肾血流量较低,大约在2岁后接近正常成人水平,在没有肾脏疾病的情况下,直到40岁左右保持相对恒定。此后,GFR每十年下降约5%至10%,尽管个体之间存在相当大的差异。GFR的下降与一氧化氮缺乏、氧化应激增加和功能性肾单位的丧失相吻合,这可能部分与血压升高、代谢紊乱和其他导致随年龄增长累积性肾小球损伤的因素有关。
男性的肾血流量和GFR高于女性,即使在校正体重后也是如此。然而,男性随着年龄增长GFR的下降速度比绝经前女性更快。尽管这些性别差异的机制尚未完全理解,但雌激素的有益作用和雄激素对肾脏的损害作用被认为是部分解释。表27-5总结了一些影响肾血流量和GFR调节的其他因素,在评估肾功能时应予以考虑。
28 肾小管重吸收和分泌
当肾小球滤液进入肾小管时,它依次流经肾小管的各个部分——近端小管、Henle袢、远端小管、集合小管和集合管——然后作为尿液排出。在此过程中,一些物质被选择性地从小管重吸收回血液,而其他物质则从血液分泌到小管腔中。最终,形成的尿液和尿液中的所有物质代表了三个基本肾脏过程的总和——肾小球滤过、小管重吸收和小管分泌:
尿排泄量 = 肾小球滤过 - 小管重吸收 + 小管分泌
对于许多物质,小管重吸收在决定最终尿排泄率方面比分泌起着更重要的作用。然而,小管分泌对尿液中出现的钾离子、氢离子和其他一些物质的量有显著贡献。
小管重吸收在数量上很大且高度选择性
表28-1显示了肾脏对几种物质的处理,这些物质在肾脏中自由滤过并以不同的速率重吸收。每种物质的滤过率计算如下:
滤过量 = 肾小球滤过率 × 血浆浓度
这个计算假设该物质是自由过滤的,并且不与血浆蛋白结合。例如,如果血浆葡萄糖浓度为 1g/L,每天过滤的葡萄糖量约为 180L/day×1g/L,即 180g/day。由于正常情况下几乎没有过滤的葡萄糖被排泄,因此葡萄糖的重吸收速率也是 180g/day。
从表28-1中可以立即看出两点。首先,对于许多物质来说,肾小球滤过和肾小管重吸收的过程在数量上相对于尿液排泄来说是很大的。因此,肾小球滤过或肾小管重吸收的微小变化可能会导致尿液排泄的较大变化。例如,如果肾小管重吸收减少 10%,从178.5降至160.7 L/day,而肾小球滤过率(GFR)保持不变,尿量将从1.5增加到 19.3L/ day(几乎增加了13倍)。实际上,肾小管重吸收和肾小球滤过的变化是密切协调的,以避免尿液排泄的大幅波动。
其次,与肾小球滤过相对非选择性(除了血浆蛋白或与其结合的物质外,血浆中的所有溶质都被过滤)不同,肾小管重吸收是高度选择性的。一些物质,如葡萄糖和氨基酸,几乎完全从肾小管中被重吸收,因此尿液排泄率基本上为零。血浆中的许多离子,如钠、氯和碳酸氢盐,也被高度重吸收,但它们的重吸收和尿液排泄速率是可变的,取决于身体的需求。相反,废物如尿素和肌酐从肾小管中重吸收较差,并以相对较大的量被排泄。
因此,通过控制对不同物质的重吸收,肾脏可以独立调节溶质的排泄,这种能力对于精确控制体液成分至关重要。在本章中,我们将讨论使肾脏能够以可变速率选择性重吸收或分泌不同物质的机制。
肾小管重吸收包括被动和主动机制
要使物质被重吸收,它必须首先被转运(1)穿过肾小管上皮膜进入肾间质液,然后(2)通过肾小管周围毛细血管膜回到血液中(图28-1)。因此,水和溶质的重吸收包括一系列转运步骤。通过肾小管上皮进入间质液的重吸收包括通过第4章中讨论的相同基本机制进行的主动或被动转运。例如,水和溶质可以通过细胞膜(跨细胞途径)或通过细胞连接之间的空间(旁细胞途径)转运。然后,在通过肾小管上皮细胞吸收进入间质液后,水和溶质通过肾小管周围毛细血管壁进入血液,这是由静水压和胶体渗透力介导的超滤(体积流动)。肾小管周围毛细血管的行为类似于大多数其他毛细血管的静脉端,因为存在一个净重吸收力,将液体和溶质从间质移动到血液中。
表 28-1 肾脏对不同物质的滤过、重吸收和排泄率
图 28-1 滤过的水和溶质从肾小管腔穿过肾小管上皮细胞,经过肾间质,回到血液中的重吸收过程。溶质通过细胞(跨细胞途径)通过被动扩散或主动运输,或通过细胞间(旁细胞途径)通过扩散运输。水通过渗透作用通过细胞和肾小管细胞之间运输。水和溶质从间质液进入肾小管周围毛细血管的运输通过超滤(体积流)发生。
主动运输 (Active Transport)
主动运输可以将溶质逆电化学梯度移动;这需要来自代谢的能量。直接与能量源(如三磷酸腺苷 (ATP) 的水解)耦合的运输称为初级主动运输 (primary active transport)。这种机制的一个例子是钠钾三磷酸腺苷酶 (ATPase) 泵(Na+-K+ ATPase 泵),它在肾小管的大部分区域发挥作用。间接与能量源(如离子梯度)耦合的运输称为次级主动运输 (secondary active transport)。肾小管对葡萄糖的重吸收是次级主动运输的一个例子。尽管溶质可以通过主动和/或被动机制被肾小管重吸收,但水总是通过渗透过程被动地穿过肾小管上皮膜被重吸收。
溶质可以通过上皮细胞或细胞间运输。肾小管细胞与其他上皮细胞一样,通过紧密连接 (tight junctions) 结合在一起。紧密连接后面的侧向细胞间隙 (lateral intercellular spaces) 将肾小管的上皮细胞分开。溶质可以通过跨细胞途径 (transcellular pathway) 穿过细胞重吸收或分泌,或通过旁细胞途径 (paracellular pathway) 穿过紧密连接和细胞间隙在细胞间运输。钠是一种通过两种途径移动的物质,尽管大部分钠通过跨细胞途径运输。在某些肾单位段,特别是近端小管,水也通过旁细胞途径重吸收,溶解在水中的物质,特别是钾、镁和氯离子,随着重吸收的液体在细胞间运输。
通过管状膜与ATPase水解相关的主要主动转运(primary active transport)。主要主动转运的特殊重要性在于它能够逆电化学梯度移动溶质。这种主动转运的能量来自于通过膜结合ATP酶(ATPase)水解ATP,ATP酶也是结合并移动溶质穿过细胞膜的载体机制的一个组成部分。已知肾脏中的主要主动转运体包括N a+-K+ ATP酶、氢ATP酶、氢钾ATP酶和钙ATP酶。
主要主动转运系统的一个很好的例子是钠离子跨近端小管膜的重吸收,如图28-2所示。在小管上皮细胞的基底外侧,细胞膜具有广泛的Na+-K+ ATP酶系统,该系统水解ATP并利用释放的能量将钠离子从细胞转运到间质中。同时,钾从间质转运到细胞内。这种离子泵的运作维持了细胞内低钠和高钾的浓度,并在细胞内产生了约-70毫伏的净负电荷。这种钠离子从细胞跨基底外侧膜主动泵出有利于钠离子从管腔膜被动扩散进入细胞,原因有二:(1) 由于细胞内钠浓度低((12mEq/L))而管腔液钠浓度高((140mEq/L)),存在有利于钠扩散进入细胞的浓度梯度;(2) 细胞内-70毫伏的负电位吸引管腔中的正钠离子进入细胞。
图28-2 钠离子通过小管上皮细胞主动转运的基本机制。钠钾泵将钠从细胞内部跨基底外侧膜转运出去,产生低细胞内钠浓度和负的细胞内电位。低细胞内钠浓度和负电位导致钠离子从管腔通过刷状缘扩散进入细胞。
Na+-K+ ATP酶的主动重吸收发生在小管的大部分区域。在肾单位的某些部分,还有额外的机制将大量钠离子移入细胞。在近端小管中,膜管腔侧(面向管腔的一侧)有广泛的刷状缘,使表面积增加了约20倍。还有载体蛋白在膜的管腔表面结合钠离子并在细胞内释放它们,提供钠通过膜进入细胞的易化扩散(facilitated diffusion)。这些钠载体蛋白对于其他物质(如葡萄糖和氨基酸)的次级主动转运(secondary active transport)也很重要,这将在后面讨论。
因此,钠离子从管腔重吸收回血液的净过程至少涉及三个步骤:
- 钠离子通过管腔膜(也称为顶膜)沿着由基底外侧膜上的Na+-K+ ATPase泵建立的电化学梯度扩散进入细胞。
- 钠离子通过基底外侧膜上的Na+-K+ ATPase泵逆着电化学梯度被转运。
- 钠、水和其他物质通过超滤从间质液被重吸收到管周毛细血管中,这是一个由静水压和胶体渗透压梯度驱动的被动过程。
通过管腔膜的次级主动重吸收。在次级主动转运中,两种或更多物质与特定的膜蛋白(载体分子)相互作用,并一起被转运穿过膜。当其中一种物质(例如钠)沿着其电化学梯度扩散时,释放的能量被用来驱动另一种物质(例如葡萄糖)逆着其电化学梯度转运。因此,次级主动转运不需要直接来自ATP或其他高能磷酸盐来源的能量。相反,能量的直接来源是另一种转运物质沿着其自身电化学梯度同时进行的易化扩散所释放的能量。
图28-3显示了近端小管中葡萄糖和氨基酸的次级主动转运。在这两种情况下,刷状缘中的特定载体蛋白同时与钠离子和氨基酸或葡萄糖分子结合。这些转运机制非常高效,几乎将所有葡萄糖和氨基酸从管腔中移除。进入细胞后,葡萄糖和氨基酸通过扩散穿过基底外侧膜,由细胞内高浓度的葡萄糖和氨基酸驱动,并由特定的转运蛋白促进。
钠葡萄糖共转运蛋白(SGLT2和SGLT1)位于近端小管细胞的刷状缘上,并逆着浓度梯度将葡萄糖携带到细胞质中,如前所述。大约90%的滤过葡萄糖由近端小管早期部分(S1段)的SGLT2重吸收,剩余的10%由近端小管后段(S3段)的SGLT1转运。在膜的基底外侧,葡萄糖在葡萄糖转运蛋白的帮助下从细胞扩散到间质空间——S1段中的GLUT2和近端小管后段(S3段)中的GLUT1。
尽管葡萄糖逆着化学梯度的转运不直接使用ATP,但葡萄糖的重吸收依赖于基底外侧膜中初级主动Na+ - K+ ATPase泵消耗的能量。由于该泵的活动,维持了钠通过管腔膜易化扩散的电化学梯度,正是钠向细胞内下坡扩散提供了葡萄糖逆着管腔膜上坡转运的能量。因此,葡萄糖的这种重吸收被称为次级主动转运,因为葡萄糖本身是逆着化学梯度重吸收的,但它是在钠的初级主动转运之后进行的。
图28-3 次级主动转运的机制。上方的细胞显示了葡萄糖和氨基酸与钠离子一起通过肾小管上皮细胞的顶膜侧进行共转运(co-transport),随后通过基底外侧膜进行易化扩散(facilitated diffusion)。下方的细胞显示了氢离子从细胞内部跨过顶膜进入肾小管腔的反向转运(counter-transport);钠离子顺电化学梯度进入细胞,基底外侧膜上的钠钾泵(sodium-potassium pump)建立了这一梯度,为氢离子从细胞内转运到肾小管腔提供了能量。ATP,三磷酸腺苷(Adenosine triphosphate);GLUT,葡萄糖转运蛋白(glucose transporter);NHE,钠氢交换体(sodium-hydrogen exchanger);SGLT,钠葡萄糖共转运蛋白(sodium-glucose co-transporter)。
另一个重要的点是,当重吸收过程中的至少一个步骤涉及初级或次级主动转运(primary or secondary active transport)时,即使重吸收过程中的其他步骤是被动的,也可以说该物质经历了主动转运(active transport)。对于葡萄糖的重吸收,次级主动转运发生在管腔膜(luminal membrane),但被动易化扩散发生在基底外侧膜(basolateral membrane),而通过整体流动(bulk flow)的被动摄取发生在管周毛细血管(peritubular capillaries)。
次级主动分泌进入肾小管。一些物质通过次级主动转运被分泌到肾小管中,这通常涉及该物质与钠离子的反向转运。在反向转运中,一种物质(例如钠离子)顺浓度梯度移动所释放的能量使第二种物质能够逆浓度梯度向相反方向移动。
图28-3中显示的反向转运的一个例子是氢离子的主动分泌与近端小管管腔膜中钠离子的重吸收相耦合。在这种情况下,钠离子进入细胞与氢离子从细胞中排出通过钠氢反向转运(sodium-hydrogen counter-transport)相耦合。这种转运由管腔膜刷状缘(brush border)中的一种特定蛋白质(钠氢交换体)介导。当钠离子被携带到细胞内部时,氢离子被迫向相反方向进入肾小管腔。初级和次级主动转运的基本原理在第4章中讨论。
胞饮作用(Pinocytosis)是蛋白质重吸收的主动转运机制。肾小管的一些部分,特别是近端小管,通过胞饮作用(一种内吞作用(endocytosis))重吸收大分子如蛋白质。在这个过程中,蛋白质附着在管腔膜的刷状缘上,然后这部分膜向内凹陷,直到完全掐断并形成一个含有蛋白质的囊泡(vesicle)。一旦进入细胞,蛋白质被消化成其组成的氨基酸,这些氨基酸通过基底外侧膜重吸收进入间质液。由于胞饮作用需要能量,因此它被认为是一种主动转运形式。
主动重吸收物质的转运最大值 (Transport Maximum for Substances That Are Actively Reabsorbed)
对于大多数主动重吸收或分泌的物质,溶质的转运速率存在一个上限,通常称为转运最大值 (transport maximum)。这一限制是由于当输送到肾小管的溶质量(称为肾小管负荷 (tubular load))超过参与转运过程的载体蛋白 (carrier proteins) 和特定酶 (specific enzymes) 的容量时,相关转运系统达到饱和所致。
近端小管 (proximal tubule) 中的葡萄糖转运系统是一个很好的例子。正常情况下,尿液中不会出现可测量的葡萄糖,因为几乎所有滤过的葡萄糖都在近端小管中被重吸收。然而,当滤过负荷超过肾小管重吸收葡萄糖的能力时,尿液中就会出现葡萄糖排泄。
在成年人体内,葡萄糖的转运最大值平均约为 375mg/min,而葡萄糖的滤过负荷仅为约 125mg/min(GFR × 血浆葡萄糖 =125ml/min×1mg/ml)。当 GFR 和/或血浆葡萄糖浓度大幅增加,导致葡萄糖的滤过负荷超过 375mg/min 时,多余的滤过葡萄糖将无法被重吸收,从而进入尿液。
图 28-4 显示了血浆葡萄糖浓度、葡萄糖滤过负荷、肾小管葡萄糖转运最大值以及尿液中葡萄糖丢失速率之间的关系。请注意,当血浆葡萄糖浓度为 100mg/100ml 且滤过负荷处于正常水平(125mg/min)时,尿液中不会出现葡萄糖丢失。然而,当血浆葡萄糖浓度上升到约 200mg/100ml 以上时,滤过负荷增加到约 250mg/min,尿液中开始出现少量葡萄糖。这一点被称为葡萄糖的阈值 (threshold for glucose)。需要注意的是,尿液中葡萄糖的出现(在阈值时)发生在达到转运最大值之前。阈值与转运最大值之间存在差异的一个原因是,并非所有肾单位 (nephrons) 对葡萄糖的转运最大值相同,因此一些肾单位在另一些肾单位达到其转运最大值之前就开始排泄葡萄糖。当所有肾单位都达到其重吸收葡萄糖的最大能力时,肾脏的整体转运最大值(通常约为 375 mg/min)才会达到。
图 28-4 葡萄糖滤过负荷、肾小管葡萄糖重吸收速率和尿液中葡萄糖排泄速率之间的关系。转运最大值是指葡萄糖从肾小管中重吸收的最大速率。葡萄糖的阈值是指尿液中首次开始出现葡萄糖时的葡萄糖滤过负荷。
健康人的血浆葡萄糖几乎不会高到导致尿液中葡萄糖排泄的程度,即使在进食后也是如此。然而,在未控制的糖尿病 (diabetes mellitus) 中,血浆葡萄糖浓度可能会上升到高水平,导致葡萄糖的滤过负荷超过转运最大值,从而引起尿液中葡萄糖排泄。以下是肾小管主动重吸收的一些重要物质的转运最大值:
markdown
主动分泌物质的转运最大值
主动分泌的物质也表现出转运最大值,如下所示:
第28章 肾小管重吸收和分泌
主动转运但不表现出转运最大值的物质
主动转运的溶质通常表现出转运最大值的原因是,随着管腔负荷的增加,转运载体系统会达到饱和。一些主动重吸收的物质不表现出转运最大值,因为它们的转运速率由其他因素决定,例如:
- 物质跨膜扩散的电化学梯度 (electrochemical gradient);
- 膜对物质的通透性 (permeability);
- 含有物质的液体在管腔内停留的时间。
这种类型的转运被称为梯度-时间转运 (gradient-time transport),因为转运速率取决于电化学梯度和物质在管腔内的停留时间,而后者又取决于管腔流速。
梯度-时间转运的一个例子是近端小管中的钠重吸收,其中基底外侧的Na+-K+ ATPase泵的最大转运能力通常远高于实际的净钠重吸收速率,因为大量从细胞转运出去的钠通过上皮细胞的连接处泄漏回管腔。这种回漏速率取决于:
- 紧密连接的通透性 (permeability);
- 间质物理力,这些力决定了从间质液到管周毛细血管的总体重吸收速率。
因此,近端小管中的钠转运主要遵循梯度-时间转运原则,而不是管腔最大转运特性。这意味着近端小管中钠的浓度越高,其重吸收速率越高。此外,管腔液体的流速越慢,从近端小管重吸收的钠的百分比越大。
在肾单位的更远端部分,上皮细胞的连接更紧密,转运的钠量更少。在这些节段中,钠重吸收表现出类似于其他主动转运物质的转运最大值。此外,某些激素(如醛固酮)可以增加这种转运最大值。
主要通过钠重吸收耦合的被动水重吸收
当溶质通过原发性或继发性主动转运(primary or secondary active transport)从肾小管中转运出去时,它们在肾小管内的浓度趋于降低,而在肾间质(renal interstitium)中的浓度则增加。这种现象产生了一个浓度差,导致水以与溶质转运相同的方向进行渗透(osmosis),从肾小管腔(tubular lumen)到肾间质。肾小管的一些部分,尤其是近端小管(proximal tubule),对水具有高度通透性,水的重吸收(water reabsorption)发生得如此迅速,以至于跨肾小管膜的溶质浓度梯度很小。
近端小管中水的渗透流(osmotic flow)大部分通过细胞膜上的水通道(aquaporins)以及上皮细胞之间的紧密连接(tight junctions)发生。如前所述,细胞之间的连接并不像其名称所暗示的那样紧密,而是允许水和小的离子进行显著的扩散(diffusion)。这种情况在近端小管中尤其明显,近端小管对水具有高通透性,对大多数离子(如钠、氯、钾、钙和镁)的通透性较小但仍然显著。
通过渗透作用穿过紧密连接的水也会携带一些溶质,这一过程称为溶剂拖曳(solvent drag)。此外,由于水、有机溶质和离子的重吸收与钠的重吸收(sodium reabsorption)相耦合,钠重吸收的变化显著影响水和许多其他溶质的重吸收。
在肾单位(nephron)的远端部分,从亨利氏袢(loop of Henle)开始并延伸到集合管(collecting tubule),紧密连接对水和溶质的通透性大大降低,上皮细胞的膜表面积也显著减少。因此,水不能轻易通过渗透作用穿过肾小管膜的紧密连接。然而,抗利尿激素(antidiuretic hormone, ADH)大大增加了远端小管和集合管的水通透性。
因此,只有当膜对水具有通透性时,水才能穿过肾小管上皮细胞,无论渗透梯度有多大。在近端小管和亨利氏袢的降支(descending loop of Henle),水通透性总是很高,水迅速被重吸收以达到与周围间质液的渗透平衡(osmotic equilibrium)。这种高通透性是由于水通道蛋白-1(aquaporin-1, AQP-1)在管腔膜(luminal membrane)和基底外侧膜(basolateral membrane)中的丰富表达。在亨利氏袢的升支(ascending loop of Henle),水通透性总是很低,因此尽管存在大的渗透梯度,几乎没有水被重吸收。在肾小管的最后部分——远端小管(distal tubule)、集合管和集合管(collecting ducts)——水通透性通过水通道蛋白发生,并且可以高或低,取决于ADH的存在与否。
氯、尿素和其他溶质通过被动扩散的重吸收
当钠通过肾小管上皮细胞重吸收时,由于电势的作用,氯离子等负离子会与钠一起被转运。也就是说,带正电荷的钠离子从管腔中转运出去,使管腔内部相对于间质液带负电,从而导致氯离子通过细胞旁路被动扩散。此外,当水通过渗透作用从肾小管中重吸收时,氯离子浓度梯度也会形成,从而进一步促进氯离子的重吸收,使管腔中的氯离子浓度增加(图28-5)。因此,钠的主动重吸收与氯的被动重吸收通过电势和氯离子浓度梯度紧密耦合。
图28-5 水、氯离子和尿素重吸收与钠重吸收耦合的机制。
氯离子也可以通过次级主动转运(secondary active transport)重吸收。氯离子重吸收的最重要的次级主动转运过程涉及氯离子与钠离子共同跨过管腔膜的共转运(co-transport)。
尿素也从肾小管中被动重吸收,但其程度远低于氯离子。当水从肾小管中重吸收时(通过与钠重吸收耦合的渗透作用),管腔中的尿素浓度增加(见图28-5)。这种增加形成了有利于尿素重吸收的浓度梯度。然而,尿素不像水那样容易渗透肾小管。在肾单位的某些部分,尤其是内髓集合管(inner medullary collecting duct),特定的尿素转运蛋白(urea transporters)促进了尿素的被动重吸收。然而,只有大约一半的尿素从肾小管中被重吸收,其余的尿素进入尿液,使肾脏能够排泄大量这种代谢废物。在哺乳动物中,超过90%的废物氮(主要由肝脏中的蛋白质代谢产生)通常以尿素的形式通过肾脏排泄。
另一种代谢废物——肌酐(creatinine),其分子比尿素更大,几乎无法渗透肾小管膜。因此,几乎没有任何被滤过的肌酐被重吸收,几乎所有被肾小球滤过的肌酐都通过尿液排出。
图28-6 近端小管的细胞超微结构和主要转运特性。近端小管重吸收约65%的滤过钠、氯离子、碳酸氢根和钾,以及几乎所有滤过的葡萄糖和氨基酸。近端小管还将有机酸、碱和氢离子分泌到管腔中。
肾单位不同部位的重吸收和分泌
在前面的章节中,我们讨论了水和溶质通过肾小管膜转运的基本原理。有了这些概括性的认识,我们现在可以讨论各个肾小管节段的不同特征,这些特征使它们能够执行特定的功能。我们将只讨论在数量上最重要的肾小管转运功能,特别是与钠、氯和水的重吸收相关的功能。在后续章节中,我们将讨论肾小管系统不同部位对其他物质的重吸收和分泌。
近端小管的重吸收
正常情况下,约65%的滤过钠和水以及略低比例的滤过氯在滤液到达Henle袢之前被近端小管重吸收。这些比例在不同的生理条件下可以增加或减少,如后文所述。
近端小管具有高容量的主动和被动重吸收能力。近端小管的高重吸收能力源于其特殊的细胞特征,如图28-6所示。近端小管上皮细胞具有高度的代谢活性,并拥有大量线粒体以支持强大的主动转运过程。此外,近端小管细胞在膜的腔面(顶端)具有广泛的刷状缘,以及广泛的细胞间和基底通道网络,所有这些共同提供了上皮腔面和基底外侧面的广泛膜表面积,以便快速转运钠离子和其他物质。
上皮刷状缘的广泛膜表面还富含蛋白质载体分子,这些分子通过共转运机制将大部分钠离子跨过腔面膜转运,并与多种有机营养物质(如氨基酸和葡萄糖)相连。额外的钠通过反向转运机制从肾小管腔进入细胞,这些机制在重吸收钠的同时将其他物质(尤其是氢离子)分泌到肾小管腔中。如第31章所述,将氢离子分泌到肾小管腔中是去除肾小管中碳酸氢根离子的重要步骤(通过将\Hat与HCO_3-结合形成H_2CO_3,然后解离为H_2O和CO_2)。
尽管Na+-K+ ATPase泵为整个近端小管中钠、氯和水的重吸收提供了主要动力,但在钠和氯通过近端小管膜早期和晚期部分的腔面转运机制上存在一些差异。
在近端小管(proximal tubule)的前半段,钠与葡萄糖、氨基酸和其他溶质一起通过共转运(co-transport)被重吸收。然而,在近端小管的后半段,几乎没有葡萄糖和氨基酸剩余可供重吸收。相反,钠现在主要与氯离子一起被重吸收。与近端小管前半段相比,近端小管后半段的氯离子浓度相对较高(约40 mEq/L),因为在近端小管前半段,当钠被重吸收时,它优先携带葡萄糖、碳酸氢盐和有机离子,留下一个氯离子浓度较高的溶液。在近端小管的后半段,较高的氯离子浓度有利于该离子从小管腔通过细胞间连接扩散到肾间质液中。少量的氯离子也可能通过近端小管细胞膜上的特定氯离子通道被重吸收。
近端小管中溶质浓度的变化。图28-7总结了近端小管中各种溶质浓度的变化。尽管小管液中的钠含量在近端小管中显著减少,但钠浓度(和总渗透压)保持相对恒定,因为近端小管的水通透性非常高,水的重吸收与钠的重吸收保持同步。某些有机溶质,如葡萄糖、氨基酸和碳酸氢盐,比水更强烈地被重吸收,它们的浓度在近端小管的长度上显著减少。其他渗透性较低且不被主动重吸收的有机溶质,如肌酐(creatinine),其浓度在近端小管中增加。由于近端小管对水的极高通透性,总溶质浓度(以渗透压反映)在整个近端小管中基本保持不变。
图28-7 近端小管中小管液中不同物质浓度相对于血浆和肾小球滤液中这些物质浓度的变化。值为1.0表示小管液中该物质的浓度与血浆中的浓度相同。低于1.0的值表示该物质比水更强烈地被重吸收,而高于1.0的值表示该物质被重吸收的程度低于水或被分泌到小管中。
近端小管对有机酸和碱的分泌。近端小管也是有机酸和碱(如胆汁盐、草酸盐、尿酸盐和儿茶酚胺)分泌的重要部位。这些物质中的许多是代谢的终产物,必须迅速从体内排出。这些物质分泌到近端小管中,加上肾小球毛细血管将其滤入近端小管,以及小管几乎完全不重吸收这些物质,所有这些因素共同促成了它们在尿液中的快速排泄。
除了代谢废物外,肾脏还将许多潜在有害的药物或毒素分泌到肾小管中,并迅速将这些物质从血液中清除。对于某些药物,如青霉素和水杨酸盐,肾脏的快速清除使得维持治疗有效药物浓度成为一个挑战。
另一种被近端小管快速分泌的化合物是对氨基马尿酸(para-aminohippuric acid, PAH)。PAH的分泌速度非常快,以至于普通人可以清除通过肾脏的血浆中约90%的PAH,并将其排泄到尿液中。因此,PAH清除率可以用来估计肾血浆流量(renal plasma flow, RPF),这一点将在后面讨论。
亨利袢中的溶质和水转运
亨利袢由三个功能不同的部分组成——细降支、细升支和粗升支。细降支和细升支,顾名思义,具有薄的上皮膜,没有刷状缘,线粒体较少,代谢活动水平极低(图28-8)。
图28-8 亨利袢细降支(上)和粗升支(下)的细胞超微结构和转运特性。亨利袢细降支对水具有高度通透性,对大多数溶质(包括尿素和钠)具有中等通透性,但线粒体较少,几乎没有或没有主动重吸收。亨利袢粗升支重吸收约25%的滤过钠、氯和钾负荷,以及大量的钙、碳酸氢盐和镁。该部分还将氢离子分泌到管腔中。
细降支对水具有高度通透性,对大多数溶质(包括尿素和钠)具有中等通透性。这部分肾单位的功能主要是允许物质通过其壁进行简单扩散。约20%的滤过水在亨利袢中被重吸收,几乎所有这些重吸收都发生在细降支。升支,包括细升支和粗升支,几乎对水不通透,这一特性对于浓缩尿液非常重要。
亨利袢的粗升支从升支的中部开始,具有厚上皮细胞,代谢活动高,能够主动重吸收钠、氯和钾(见图28-8)。约25%的滤过钠、氯和钾负荷在亨利袢中被重吸收,主要发生在粗升支。大量的其他离子,如钙、碳酸氢盐和镁,也在亨利袢的粗升支中被重吸收。细升支的重吸收能力远低于粗升支,而细降支几乎不重吸收这些溶质中的任何一种。
图28-9 Henle袢粗升支中钠、氯和钾的转运机制。基底外侧细胞膜上的N a+\boldsymbol-K+ ATPase泵维持细胞内低钠浓度和细胞内的负电位。管腔膜上的1-钠、2-氯、1-钾共转运体(co-transporter)利用钠沿电化学梯度扩散进入细胞所释放的势能,将这三个离子从管腔转运到细胞内。钠还通过钠-氢反向转运(sodium-hydrogen countertransport)进入管状细胞。管腔相对于间质液的正电荷(+8m V)迫使阳离子如Mg++和Ca+++通过细胞旁途径(paracellular pathway)从管腔扩散到间质液中。
Henle袢粗升支中溶质重吸收的一个重要组成部分是上皮细胞基底外侧膜上的Na+-K+ ATPase泵。与近端小管一样,Henle袢粗升支中其他溶质的重吸收与Na+-K+ ATPase泵的重吸收能力密切相关,该泵维持细胞内低钠浓度。细胞内低钠浓度反过来为钠从管腔液进入细胞提供了有利的梯度。在粗升支中,钠通过管腔膜的转运主要由1-钠、2-氯、1-钾共转运体(NKCC2)介导(图28-9)。管腔膜上的这种共转运蛋白利用钠顺浓度梯度扩散进入细胞所释放的势能,驱动钾逆浓度梯度重吸收进入细胞。
Henle袢粗升支是强效袢利尿剂(loop diuretics)呋塞米(furosemide)、依他尼酸(ethacrynic acid)和布美他尼(bumetanide)的作用部位,这些药物都抑制NKCC2共转运体的作用。这些利尿剂将在第32章讨论。粗升支的管腔细胞膜上还存在钠-氢反向转运机制,介导钠的重吸收和氢的分泌(见图28-9)。
由于管腔相对于间质液的轻微正电荷,粗升支中还存在显著的阳离子(如Mg++、Ca2+、Na+和K+)的细胞旁重吸收。尽管NKCC2共转运体将等量的阳离子和阴离子转运到细胞内,但钾离子会轻微泄漏回管腔,导致管腔内产生约+8毫伏的正电荷。这种正电荷迫使阳离子如Mg++和Ca2+从管腔通过细胞旁间隙扩散到间质液中。
Henle袢粗升支对水几乎是不通透的。因此,尽管大量溶质被重吸收,输送到该段的大部分水仍留在小管中。随着管腔液流向远端小管,粗升支中的管腔液变得非常稀释,这一特性在允许肾脏在不同条件下稀释或浓缩尿液方面非常重要,详见第29章。
远端小管
Henle袢升支的厚段排入远曲小管。远曲小管的起始部分形成致密斑(macula densa),这是一组紧密排列的上皮细胞,是肾小球旁复合体(juxtaglomerular complex)的一部分,并提供对同一肾单位内GFR和血流的反馈控制。
远曲小管的下一部分高度卷曲,具有与Henle袢升支厚段相似的许多重吸收特性。也就是说,它积极地重吸收大多数离子,包括钠、钾和氯,但对水和尿素几乎不渗透。因此,它被称为稀释段(diluting segment),因为它也稀释了小管液。
大约5%的过滤氯化钠负荷在远曲小管早期被重吸收。氯化钠共转运体(sodium-chloride co-transporter)将氯化钠从小管腔移动到细胞内,而Na+-K+ ATPase泵将钠从细胞跨过基底外侧膜(basolateral membrane)转运出去(图28-10)。氯通过基底外侧膜上的氯通道扩散出细胞进入肾间质液。
噻嗪类利尿剂(thiazide diuretics)广泛用于治疗高血压和心力衰竭等疾病,它们抑制氯化钠共转运体。
远曲小管后段和皮质集合管
远曲小管的后半部分和随后的皮质集合管具有相似的功能特性。在解剖学上,它们由两种不同的细胞类型组成,即主细胞(principal cells)和插入细胞(intercalated cells)(图28-11)。主细胞从管腔重吸收钠和水,并将钾离子分泌到管腔中。A型插入细胞重吸收钾离子并将氢离子分泌到小管腔中。
图28-10 远曲小管早期氯化钠转运机制。钠和氯通过被噻嗪类利尿剂抑制的共转运体从小管腔转运到细胞内。钠通过N a+\boldsymbol-K+ ATPase腺苷三磷酸酶泵出细胞,氯通过氯通道扩散到间质液中。
主细胞重吸收钠并分泌钾
主细胞对钠的重吸收和钾的分泌依赖于每个细胞基底外侧膜上的Na+-K+ ATPase泵的活性(图28-12)。该泵维持细胞内低钠浓度,因此有利于钠通过特殊通道扩散进入细胞。这些细胞将钾从血液分泌到小管腔中涉及两个步骤:(1)钾由于Na+-K+ ATPase泵的作用进入细胞,该泵维持细胞内高钾浓度;(2)一旦进入细胞,钾沿着其浓度梯度扩散穿过管腔膜进入小管液。
主细胞(principal cells)是保钾利尿剂(potassium-sparing diuretics)的主要作用部位,包括spironolactone、eplerenone、amiloride和triamterene。Spironolactone和eplerenone是盐皮质激素受体(mineralocorticoid receptor)拮抗剂,它们与醛固酮(aldosterone)竞争主细胞上的受体位点,从而抑制醛固酮对钠重吸收(sodium reabsorption)和钾分泌(potassium secretion)的刺激作用。Amiloride和triamterene是钠通道(sodium channel)阻滞剂,它们直接抑制钠进入管腔膜(luminal membrane)的钠通道,从而减少可以通过Na+-K+ ATP酶泵(ATPase pump)跨基底外侧膜(basolateral membrane)转运的钠量。这反过来又减少了钾向细胞内的转运,最终减少了钾向管腔液(tubular fluid)的分泌。因此,钠通道阻滞剂以及醛固酮拮抗剂都能减少尿钾排泄(urinary excretion of potassium),起到保钾利尿剂的作用。
图28-11 远端小管(distal tubule)早期和晚期以及集合管(collecting tubule)的细胞超微结构(ultrastructure)和转运特征。远端小管早期具有与Henle袢升支粗段(thick ascending loop of Henle)相同的许多特征,重吸收钠、氯、钙和镁,但对水和尿素几乎不通透。远端小管晚期和皮质集合管由两种不同的细胞类型组成,即主细胞和闰细胞(intercalated cells)。主细胞从管腔重吸收钠并向管腔分泌钾离子。A型闰细胞从管腔重吸收钾和碳酸氢根离子(bicarbonate ions)并向管腔分泌氢离子(hydrogen ions)。该小管段对水的重吸收由抗利尿激素(antidiuretic hormone)的浓度控制。
闰细胞可以分泌或重吸收氢离子、碳酸氢根离子和钾离子。闰细胞在酸碱调节(acid-base regulation)中起主要作用,占集合管和集合小管(collecting ducts)细胞的30%至40%。闰细胞有两种类型,A型和B型(图28-13)。A型闰细胞通过氢-ATP酶转运体(hydrogen-ATPase transporter)和氢-钾-ATP酶转运体(hydrogen-potassium-ATPase transporter)分泌氢离子。氢离子在该细胞中由碳酸酐酶(carbonic anhydrase)作用于水和二氧化碳生成碳酸(carbonic acid),然后碳酸解离成氢离子和碳酸氢根离子。氢离子随后被分泌到管腔中,每分泌一个氢离子,就有一个碳酸氢根离子可用于跨基底外侧膜重吸收。A型闰细胞在酸中毒(acidosis)时消除氢离子同时重吸收碳酸氢根离子方面尤为重要。
B型闰细胞(intercalated cells)的功能与A型细胞相反,在碱中毒(alkalosis)时向管腔分泌碳酸氢根(bicarbonate)并重吸收氢离子(hydrogen ions)。B型闰细胞的氢离子和碳酸氢根转运体(transporters)位于细胞膜的两侧,与A型细胞相反。B型细胞顶膜(apical membrane)上的氯-碳酸氢根反向转运体(chloride-bicarbonate counter-transporter)称为pendrin,与A型细胞的氯-碳酸氢根转运体不同。氢离子通过氢ATP酶(hydrogenATPase)从B型闰细胞的基底外侧膜(basolateral membrane)主动转运出细胞,碳酸氢根分泌到管腔中,从而在碱中毒时消除过多的血浆碳酸氢根。慢性代谢性碱中毒(chronic metabolic alkalosis)的诱导会增加B型闰细胞的数量,从而促进碳酸氢根的排泄增加,而酸中毒(acidosis)则会增加A型细胞的数量。
图28-12 远端小管(distal tubules)和皮质集合管(cortical collecting tubules)主细胞(principal cells)中钠-氯重吸收(sodium-chloride reabsorption)和钾分泌(potassium secretion)的机制。钠通过特殊通道进入细胞,并通过N a+\boldsymbol-K+ ATP酶泵(ATPase pump)转运出细胞。醛固酮拮抗剂(aldosterone antagonists)与醛固酮竞争细胞内的结合位点,从而抑制醛固酮刺激钠重吸收和钾分泌的作用。钠通道阻滞剂(sodium channel blockers)直接抑制钠进入钠通道。
关于这一机制的更详细讨论见第31章。如图28-13所示,闰细胞也可以重吸收或分泌钾离子。
远端小管和皮质集合管的功能特征可总结如下:
- 这两个节段的管状膜(tubular membranes)对尿素(urea)几乎完全不通透,类似于远端小管早期的稀释节段(diluting segment)。因此,进入这些节段的几乎所有尿素都会通过并进入集合管(collecting duct)随尿液排出,尽管在髓质集合管(medullary collecting ducts)中会发生一些尿素的重吸收。
- 远端小管和皮质集合管节段都重吸收钠离子,重吸收速率受激素(尤其是醛固酮)的调控。同时,这些节段从管周毛细血管血液(peritubular capillary blood)中分泌钾离子。
图28-13 集合管的A型和B型闰细胞。A型细胞的管腔膜(luminal membrane)含有氢ATP酶(hydrogen-ATPase)和氢钾ATP酶(hydrogen-potassium-ATPase),在酸中毒时分泌氢离子并重吸收碳酸氢根和钾离子。在B型细胞中,氢ATP酶和氢钾ATP酶转运体位于基底外侧膜,在碱中毒时重吸收氢离子并分泌碳酸氢根和钾离子。B型细胞顶膜上的氯-碳酸氢根反向转运体称为pendrin,与A型闰细胞的氯-碳酸氢根转运体不同。
进入管腔的过程,这一过程也受到醛固酮(aldosterone)和其他因素(如体液中钾离子浓度)的调控。
- 这些肾单位节段的A型间质细胞(intercalated cells)在酸中毒(acidosis)时可以通过主动的氢-ATP酶机制(hydrogen-ATPase mechanism)积极分泌氢离子。这一过程与近端小管(proximal tubule)通过次级主动分泌(secondary active secretion)分泌氢离子的过程不同,因为它能够逆着高达1000:1的浓度梯度分泌氢离子。这与近端小管通过次级主动分泌所能达到的相对较小的氢离子浓度梯度(4到10倍)形成对比。
图28-14 髓质集合管(medullary collecting duct)的细胞超微结构和转运特性。髓质集合管主动重吸收钠并分泌氢离子,并且对尿素(urea)具有通透性,尿素在这些管段中被重吸收。髓质集合管中水的重吸收受到抗利尿激素(antidiuretic hormone)浓度的调控。
在碱中毒(alkalosis)时,B型间质细胞分泌碳酸氢根(bicarbonate)并主动重吸收氢离子。因此,间质细胞在体液的酸碱平衡(acid-base regulation)中起着关键作用。
- 远端小管(late distal tubule)和皮质集合管(cortical collecting duct)对水的通透性受到ADH(也称为血管加压素(vasopressin))浓度的调控。在高水平的ADH作用下,这些管段对水具有通透性,但在缺乏ADH时,它们几乎对水不通透。这一特性为控制尿液的稀释或浓缩程度提供了重要的机制。
髓质集合管
尽管髓质集合管通常重吸收不到滤过水和钠的5%,但它们是处理尿液的最终部位,因此在决定最终尿液中的水和溶质输出方面起着关键作用。
集合管的上皮细胞形状接近立方体,表面光滑,线粒体(mitochondria)相对较少(图28-14)。该管段的特殊特性如下:
- 髓质集合管对水的通透性受到ADH水平的调控。在高水平的ADH作用下,水被积极重吸收到髓质间质(medullary interstitium)中,从而减少尿量并浓缩尿液中的大部分溶质。
- 与皮质集合管不同,髓质集合管对尿素具有通透性,并且有特殊的尿素转运蛋白(urea transporters)促进尿素穿过管腔膜(luminal membrane)和基底外侧膜(basolateral membrane)的扩散。因此,部分管腔中的尿素被重吸收到髓质间质中,有助于提高肾脏这一区域的渗透压(osmolality),并增强肾脏形成浓缩尿液的整体能力。这一主题将在第29章中讨论。
- 髓质集合管能够逆着较大的浓度梯度分泌氢离子,这与皮质集合管中的情况类似。因此,髓质集合管在调节酸碱平衡(acid-base balance)中也起着关键作用。
图 28-15 不同物质在肾小管系统不同点的平均浓度相对于血浆和肾小球滤液中该物质浓度的变化。值为1.0表示该物质在肾小管液中的浓度与血浆中的浓度相同。低于1.0的值表示该物质比水更强烈地被重吸收,而高于1.0的值表示该物质的重吸收程度低于水或被分泌到肾小管中。PAH,对氨基马尿酸。
不同溶质在不同肾小管段中的浓度总结
溶质是否会在肾小管液中浓缩取决于该溶质相对于水的重吸收程度。如果更大比例的水被重吸收,该物质会变得更加浓缩。如果更大比例的溶质被重吸收,该物质会变得更加稀释。
图28-15显示了不同肾小管段中几种物质的浓缩程度。该图中的所有值代表肾小管液浓度除以血浆中该物质的浓度。如果假设血浆中该物质的浓度是恒定的,肾小管液/血浆浓度比的任何变化都反映了肾小管液浓度的变化。
随着滤液沿着肾小管系统移动,如果水的重吸收多于溶质,或者溶质被净分泌到肾小管液中,浓度会逐渐升高到高于1.0。如果浓度比逐渐低于1.0,这意味着相对更多的溶质被重吸收。
图28-15顶部所示的物质,如肌酐,在尿液中高度浓缩。通常,这些物质是身体不需要的,肾脏已经适应了仅轻微重吸收它们或根本不重吸收,甚至将它们分泌到肾小管中,从而将大量物质排泄到尿液中。相反,图底部所示的物质,如葡萄糖和氨基酸,都被强烈重吸收。这些都是身体需要保存的物质,几乎没有任何一种会在尿液中丢失。
肾小管液/血浆菊粉浓度比可用于评估肾小管对水的重吸收。菊粉是一种用于测量肾小球滤过率(GFR)的多糖,不会被肾小管重吸收或分泌。因此,沿肾小管不同点的菊粉浓度变化反映了肾小管液中水量的变化。
例如,在近端小管末端,菊粉(inulin)的管状液/血浆浓度比上升到约3.0,表明管状液中的菊粉浓度是血浆和肾小球滤液中的三倍。由于菊粉不会从小管分泌或重吸收,管状液/血浆浓度比为3.0意味着只有三分之一被过滤的水保留在肾小管中,而三分之二的过滤水在液体通过近端小管时被重吸收。在集合管末端,管状液/血浆菊粉浓度比上升到约125(见图28-15),表明只有1/125的过滤水保留在小管中,超过99%的水被重吸收。
小管重吸收的调节
由于在小管重吸收和肾小球滤过之间保持精确平衡至关重要,因此有多个神经、激素和局部控制机制来调节小管重吸收,就像控制肾小球滤过一样。小管重吸收的一个重要特征是某些溶质的重吸收可以独立于其他溶质进行调节,特别是通过激素控制机制。
肾小球-小管平衡——小管负荷增加时重吸收率增加
控制小管重吸收的最基本机制之一是小管在响应小管负荷(小管流入量增加)时增加其重吸收率的内在能力。这种现象被称为肾小球-小管平衡(glomerulotubular balance)。例如,如果肾小球滤过率(GFR)从125增加到150毫升/分钟,近端小管重吸收的绝对速率也从约81毫升/分钟(GFR的65%)增加到约97.5毫升/分钟(GFR的65%)。因此,肾小球-小管平衡指的是,尽管近端小管中GFR的重吸收百分比保持相对恒定,约为65%,但随着滤过负荷的增加,总重吸收速率也会增加。
一定程度的肾小球-小管平衡也发生在其他小管段,特别是Henle袢。导致这种现象的确切机制尚不完全清楚,但可能部分是由于小管和周围肾间质中物理力的变化,如后面所讨论的。很明显,肾小球-小管平衡的机制可以独立于激素发生,并且可以在完全隔离的肾脏甚至完全隔离的近端小管段中证明。
肾小球-小管平衡有助于防止GFR增加时远端小管段的过载。肾小球-小管平衡作为另一道防线,缓冲了GFR自发变化对尿量的影响。(另一道防线,如前所述,包括肾脏自我调节机制,特别是小管-肾小球反馈,有助于防止GFR的大幅变化。)自我调节和肾小球-小管平衡机制共同作用,防止在动脉压力变化或其他干扰时远端小管中液体流量的大幅变化,否则会破坏钠和体积的稳态。
管周毛细血管和肾间质液的物理力
静水压(hydrostatic pressure)和胶体渗透压(colloid osmotic pressure)控制着肾小管周围毛细血管的重吸收(reabsorption)速率,正如它们控制肾小球毛细血管的滤过(filtration)一样。肾小管周围毛细血管重吸收的变化反过来会影响肾间质(renal interstitium)的静水压和胶体渗透压,并最终影响肾小管(renal tubules)对水和溶质(solutes)的重吸收。
物理力和重吸收速率的正常值。当肾小球滤过液(glomerular filtrate)通过肾小管时,正常情况下超过99%的水和大部分溶质被重吸收。液体和电解质(electrolytes)从肾小管重吸收到肾间质,再从那里进入肾小管周围毛细血管。肾小管周围毛细血管的正常重吸收速率约为124毫升/分钟(124 ml/min)。
肾小管周围毛细血管的重吸收可以按以下公式计算:
重吸收 =K_f× 净重吸收力
净重吸收力(net reabsorptive force)代表有利于或不利于肾小管周围毛细血管重吸收的静水压和胶体渗透压的总和。这些力包括:(1) 肾小管周围毛细血管内的静水压(peritubular hydrostatic pressure [P_c], ),它不利于重吸收;
图28-16 决定肾小管周围毛细血管液体重吸收的静水压和胶体渗透压的总结。所示数值为人类正常值的估计值。净重吸收压(net reabsorptive pressure)通常约为10毫米汞柱(10 mm Hg),导致液体和溶质在通过肾小管细胞运输时被重吸收到肾小管周围毛细血管中。ATP,三磷酸腺苷(Adenosine triphosphate);P_\subset 肾小管周围毛细血管静水压;P_if, 间质液静水压(interstitial fluid hydrostatic pressure);\pi_C, 肾小管周围毛细血管胶体渗透压;\pi_\parallel, 间质液胶体渗透压(interstitial fluid colloid osmotic pressure)。
(2) 毛细血管外肾间质的静水压 (P_if),它有利于重吸收;(3) 肾小管周围毛细血管血浆蛋白(plasma proteins)的胶体渗透压 (\pi_c),它有利于重吸收;以及 (4) 肾间质中蛋白质的胶体渗透压 (\pi_if),它不利于重吸收。
图28-16显示了促进和对抗管周重吸收的近似正常力量。由于正常的管周毛细血管压力平均约为13 mmHg,而肾间质液的静水压力平均为6mmHg,因此从管周毛细血管到间质液存在约7mmHg的正静水压力梯度,这对抗了液体的重吸收。这种对抗液体重吸收的力量被促进重吸收的胶体渗透压所抵消。促进重吸收的血浆胶体渗透压约为32mmHg,而对抗重吸收的间质胶体渗透压为15mmHg,导致净胶体渗透力约为17mmHg,促进重吸收。因此,从促进重吸收的净胶体渗透力(17mmHg)中减去对抗重吸收的净静水力量(7mmHg),得到约10mmHg的净重吸收力。这个值很高,类似于肾小球毛细血管中的值,但方向相反。
另一个促进管周毛细血管中液体高重吸收率的因素是由于高水力传导性和毛细血管的大表面积而产生的大过滤系数(K_f)。由于重吸收率通常约为124ml/ min,净重吸收压力为10mmHg,因此K_f通常约为12.4ml/min每毫米汞柱。
管周毛细血管物理力量的调节。直接影响管周毛细血管重吸收的两个决定因素是管周毛细血管的静水压力和胶体渗透压。管周毛细血管的静水压力受动脉压力和入球和出球小动脉的阻力影响如下:1. 动脉压力的增加倾向于提高管周毛细血管的静水压力并降低重吸收率。这种效应在一定程度上被维持相对恒定肾血流以及肾血管中相对恒定静水压力的自动调节机制所缓冲。2. 入球或出球小动脉阻力的增加降低了管周毛细血管的静水压力并倾向于增加重吸收率。尽管出球小动脉的收缩增加了肾小球毛细血管的静水压力,但它降低了管周毛细血管的静水压力。
管周毛细血管重吸收的第二个主要决定因素是这些毛细血管中血浆的胶体渗透压( colloid osmotic pressure );提高胶体渗透压会增加管周毛细血管的重吸收。管周毛细血管的胶体渗透压由以下因素决定:(1) 全身血浆胶体渗透压(增加全身血液中的血浆蛋白浓度会提高管周毛细血管的胶体渗透压,从而增加重吸收);以及(2) 滤过分数(filtration fraction)——滤过分数越高,通过肾小球滤过的血浆比例越大,因此剩余血浆中的蛋白质浓度越高。因此,增加滤过分数也会增加管周毛细血管的重吸收率。由于滤过分数定义为GFR(肾小球滤过率)/RPF(肾血浆流量)的比值,滤过分数的增加可能是由于GFR增加或RPF减少引起的。一些肾血管收缩剂,如血管紧张素II,通过减少RPF和增加滤过分数来增加管周毛细血管的重吸收,这一点将在后面讨论。
管周毛细血管的K_f变化也会影响重吸收率,因为K_f是毛细血管通透性和表面积的衡量指标。K_f的增加会提高重吸收,而K_f的降低会减少管周毛细血管的重吸收。在大多数生理条件下,K_f保持相对恒定。表28-2总结了可能影响管周毛细血管重吸收率的因素。
肾间质静水压和胶体渗透压。最终,管周毛细血管物理力的变化通过改变肾小管周围肾间质的物理力来影响肾小管的重吸收。例如,管周毛细血管膜上重吸收力的减少(由于管周毛细血管静水压增加或管周毛细血管胶体渗透压降低)会减少从间质到管周毛细血管的液体和溶质的摄取。这一作用反过来会提高肾间质液的静水压,并由于肾间质中蛋白质的稀释而降低间质液的胶体渗透压。这些变化随后会减少从肾小管到间质的液体净重吸收,尤其是在近端小管中。
\uparrowP_c\to\downarrow 重吸收 • \downarrowR_A\to\uparrowP_C • ↓ RE → ↑ Pc • ↑ 动脉压 \to\uparrowP_c \mathfrakR_\mathttC\to\uparrow 重吸收 • \uparrow\pi_A\to\uparrow\pi_C • \uparrowF F\to\uparrow\uppi_C \uparrowK_f\to\uparrow 重吸收
FF, 滤过分数; K_f, 管周毛细血管滤过系数; P_\subset 管周毛细血管静水压; \pi_A, 动脉血浆胶体渗透压; \pi_C, 管周毛细血管胶体渗透压; \sf R_\sf A 和 R_E, 分别为入球小动脉和出球小动脉阻力。
通过检查溶质和水被重吸收的途径,可以理解间质液静水压和胶体渗透压变化影响肾小管重吸收的机制(图28-17)。一旦溶质通过主动转运或被动扩散进入细胞间通道或肾间质,水就会通过渗透作用从肾小管腔进入间质。此外,一旦水和溶质进入间质空间,它们可以被扫入管周毛细血管或通过上皮连接扩散回肾小管腔。近端小管上皮细胞之间的所谓紧密连接实际上是漏的,因此大量的钠可以通过这些连接双向扩散。在管周毛细血管重吸收率正常较高的情况下,水和溶质的净运动是进入管周毛细血管,很少回漏到肾小管腔。然而,当管周毛细血管重吸收减少时,间质液静水压增加,更多的溶质和水倾向于回漏到肾小管腔,从而降低净重吸收率(见图28-17)。
当管周毛细血管重吸收增加到正常水平以上时,情况则相反。管周毛细血管重吸收的初始增加倾向于降低间质液静水压并提高间质液胶体渗透压。这两种力量都促进液体和溶质从肾小管腔移动到间质;因此,水和溶质回漏到肾小管腔的量减少,肾小管净重吸收增加。
因此,通过肾间质静水压和胶体渗透压的变化,管周毛细血管对水和溶质的摄取与从肾小管腔到间质的水和溶质的净重吸收紧密匹配。一般来说,增加管周毛细血管重吸收的力量也会增加肾小管的重吸收。相反,抑制管周毛细血管重吸收的血流动力学变化也会抑制肾小管对水和溶质的重吸收。
表28-2 影响管周毛细血管重吸收的因素 图28-17 正常情况下(上)和管周毛细血管重吸收减少时(下)近端小管和管周毛细血管的重吸收,后者由管周毛细血管静水压\left(P_\mathttC\right)增加或管周毛细血管胶体渗透压(\pi_c)降低引起。管周毛细血管重吸收减少反过来通过增加通过肾小管上皮细胞紧密连接回漏到肾小管腔的溶质和水量,特别是近端小管,减少溶质和水的净重吸收。
动脉压对尿量的影响——压力性钠尿和压力性利尿
即使是动脉压的轻微升高,也会导致钠和水的尿排泄显著增加,这种现象被称为压力性钠尿(pressure natriuresis)和压力性利尿(pressure diuresis)。由于第27章中描述的自我调节机制(autoregulatory mechanisms),在75到160mmHg的范围内增加动脉压通常对肾血流量(renal blood flow)和肾小球滤过率(GFR)的影响很小。确实发生的GFR轻微升高部分地促进了动脉压升高对尿量的影响。当GFR自我调节受损时,如肾脏疾病中常见的情况,动脉压的升高会导致GFR更大幅度的增加。
增加肾动脉压导致尿量增加的第二个效应是,它降低了肾小管重吸收的钠和水滤过负荷的百分比。尽管导致这一效应的机制尚未完全阐明,但它们包括一系列物理因素,以及旁分泌(paracrine)和激素效应。动脉压升高会导致肾小管周围毛细血管静水压(peritubular capillary hydrostatic pressure)轻微升高,尤其是在肾髓质(renal medulla)的直小血管(vasa recta)中,随后肾间质液静水压(renal interstitial fluid hydrostatic pressure)也会升高。如前所述,肾间质液静水压的升高增强了钠向肾小管腔的反向渗漏(backleak),从而减少了钠和水的净重吸收,并在肾动脉压升高时进一步增加了尿量。
导致压力性钠尿和压力性利尿的第三个因素是血管紧张素II(angiotensin II)生成减少。血管紧张素II本身会增加肾小管对钠的重吸收,并刺激醛固酮(aldosterone)分泌,从而进一步增加钠的重吸收。因此,当动脉压升高时,血管紧张素II生成减少有助于肾小管钠重吸收的减少。
可能导致压力性钠尿的第四个因素是钠转运蛋白(sodium transporter proteins)从肾小管顶膜(apical membranes)内化(internalization)到细胞质(cytoplasm)中,从而减少了可以跨细胞膜转运的钠量。动脉压升高的这一效应可能部分地由血管紧张素II生成减少和其他自体活性物质(autacoid)或旁分泌信号介导。
肾小管重吸收的激素调控
体液容量和溶质浓度的精确调节要求肾脏以不同的速率排泄不同的溶质和水,有时彼此独立。例如,当钾摄入量增加时,肾脏必须排泄更多的钾,同时维持钠和其他电解质的正常排泄。同样,当钠摄入量改变时,肾脏必须适当调整尿钠排泄,而不显著改变其他电解质的排泄。体内的几种激素为不同电解质和水的肾小管重吸收提供了这种特异性。表28-3总结了一些最重要的调节肾小管重吸收的激素、它们在肾小管上的主要作用部位,以及它们对溶质和水排泄的影响。其中一些激素将在第29章和第30章中更详细地讨论,但这里我们简要回顾它们在肾小管中的作用。
醛固酮(Aldosterone)刺激肾脏钠重吸收和钾分泌。由肾上腺皮质(adrenal cortex)的球状带(zona glomerulosa)细胞分泌的醛固酮,是肾小管(renal tubules)钠重吸收和钾、氢离子分泌的重要调节因子。醛固酮在肾小管的主要作用部位是皮质集合管(cortical collecting tubule)的主细胞(principal cells)。醛固酮通过刺激皮质集合管膜基底外侧面的Na+-K+ ATPase泵来增加钠重吸收和钾分泌。醛固酮还通过插入上皮钠通道(epithelial sodium channels)来增加膜腔侧(luminal side)的钠通透性。醛固酮作用的细胞机制将在第78章讨论。
醛固酮最重要的刺激因素如下:(1)细胞外钾浓度升高;(2)血管紧张素II(angiotensin II)水平升高,这通常发生在与钠和容量耗竭或低血压相关的条件下。与这些情况相关的醛固酮分泌增加会导致肾脏钠和水潴留,有助于恢复细胞外液容量和血压至正常水平。
当醛固酮缺乏时,如肾上腺破坏或功能障碍(Addison病)时,体内会出现明显的钠丢失和钾蓄积。相反,醛固酮分泌过多,如肾上腺肿瘤(Conn综合征)患者,会导致钠潴留和血浆钾浓度降低,部分原因是肾脏过度分泌钾。虽然只要存在最低水平的醛固酮,钠平衡的日常调节就可以维持,但无法适当调节醛固酮分泌会大大损害肾脏钾排泄和体液钾浓度的调节。因此,如第30章所述,醛固酮作为钾浓度的调节因子比钠浓度更为重要。
表28-3 调节肾小管重吸收的激素
<html><body><table><tr><td>激素</td><td>作用部位</td><td>效应</td></tr><tr><td>醛固酮</td><td>集合管和导管</td><td>↑NaCl、H2O重吸收;↑K+分泌;↑H+分泌</td></tr><tr><td>血管紧张素II</td><td>近端小管、髓袢升支粗段、远端小管、集合管</td><td>↑NaCl、H2O重吸收;↑H+分泌</td></tr><tr><td>抗利尿激素</td><td>远端小管/集合管和导管</td><td>↑H2O重吸收</td></tr><tr><td>心房利钠肽</td><td>远端小管/集合管和导管</td><td>↓NaCl重吸收</td></tr><tr><td>甲状旁腺激素</td><td>近端小管、髓袢升支粗段、远端小管</td><td>↓PO4-重吸收;↑Ca2+重吸收</td></tr></table></body></html>
血管紧张素 II (Angiotensin II) 增加钠和水的重吸收。血管紧张素 II 可能是体内最强大的钠保留激素 (sodium-retaining hormone)。正如第 19 章所讨论的,在低血压和/或低细胞外液量 (extracellular fluid volume) 的情况下,例如出血或由于过度出汗或严重腹泻导致体液中的盐和水丢失时,血管紧张素 II 的形成会增加。血管紧张素 II 的形成增加通过以下三种主要效应,帮助恢复血压和细胞外液量至正常水平:增加肾小管 (renal tubules) 对钠和水的重吸收。
- 血管紧张素 II 刺激醛固酮 (aldosterone) 分泌,从而增加钠的重吸收。
- 血管紧张素 II 收缩出球小动脉 (efferent arterioles),这对管周毛细血管 (peritubular capillary) 动力学产生两种效应,从而增加钠和水的重吸收。首先,出球小动脉收缩降低了管周毛细血管的静水压 (hydrostatic pressure),从而增加了净肾小管重吸收,尤其是近端小管 (proximal tubules) 的重吸收。其次,出球小动脉收缩通过减少肾血流量 (renal blood flow),提高了肾小球 (glomerulus) 的滤过分数 (filtration fraction),并增加了管周毛细血管中蛋白质的浓度和胶体渗透压 (colloid osmotic pressure)。这种机制还增加了管周毛细血管的重吸收力,并提高了肾小管对钠和水的重吸收。
- 血管紧张素 II 直接刺激近端小管、Henle 袢 (loops of Henle)、远端小管 (distal tubules) 和集合管 (collecting tubules) 中的钠重吸收。血管紧张素 II 的直接效应之一是刺激肾小管上皮细胞基底外侧膜 (basolateral membrane) 上的 Na+-K+ ATP 酶泵 (ATPase pump)。第二个效应是刺激管腔膜 (luminal membrane) 中的钠-氢交换 (sodium-hydrogen exchange),尤其是在近端小管中。血管紧张素 II 的第三个效应是刺激基底外侧膜中的钠-碳酸氢盐共转运 (sodium-bicarbonate co-transport)(图 28-18)。
因此,血管紧张素 II 刺激了大多数肾小管节段中上皮细胞膜 (epithelial cell membrane) 的管腔和基底外侧表面的钠转运。血管紧张素 II 的这些多重作用在血管紧张素 II 水平升高时导致肾脏显著保留钠和水,并在允许身体适应钠摄入的广泛变化而不引起细胞外液量和血压的大幅变化中起关键作用,正如第 30 章所讨论的。
在血管紧张素 II 增加肾小管钠重吸收的同时,其对出球小动脉的血管收缩作用 (vasoconstrictor effect) 也有助于维持代谢废物(如尿素 (urea) 和肌酐 (creatinine))的正常排泄,这些代谢废物的排泄主要依赖于足够的肾小球滤过率 (GFR)。因此,血管紧张素 II 的形成增加使肾脏能够保留钠和水,而不会导致代谢废物的滞留。
抗利尿激素(antidiuretic hormone, ADH)增加水的重吸收。ADH最重要的肾脏作用是增加远端小管(distal tubule)、集合小管(collecting tubule)和集合管(collecting duct)上皮细胞对水的通透性。这种效应有助于机体在脱水等情况下保存水分。在没有ADH的情况下,远端小管和集合管对水的通透性较低,导致肾脏排出大量稀释的尿液,这种情况称为尿崩症(diabetes insipidus)。因此,ADH的作用在控制尿液的稀释或浓缩程度方面起着关键作用,这一点将在第29章和第76章进一步讨论。
ADH与远端小管末端、集合小管和集合管中的特异性V_2受体结合,增加环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成并激活蛋白激酶(protein kinases)(图28-19)。这一作用反过来刺激一种称为水通道蛋白-2(aquaporin-2, AQP-2)的细胞内蛋白向细胞膜的管腔侧移动。AQP-2分子聚集在一起,通过胞吐作用(exocytosis)与细胞膜融合,形成允许水快速通过细胞扩散的水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们为水快速流出细胞提供了途径,尽管这些水通道蛋白不受ADH的调节。ADH水平的长期升高还通过刺激AQP-2基因转录来增加肾小管细胞中AQP-2蛋白的形成。当ADH浓度降低时,AQP-2分子被转运回细胞质,从而从管腔膜上移除水通道并降低水的通透性。ADH的这些作用将在第29章和第76章进一步讨论。
图28-18 血管紧张素II(angiotensin II, Ang II)增加近端小管钠重吸收的直接作用。Ang II刺激管腔膜上的钠-氢交换(sodium-hydrogen exchange, NHE)和N a+\boldsymbol-K+ ATPase转运体,以及基底外侧膜上的钠-碳酸氢盐共转运(sodium-bicarbonate co-transport)。Ang II的这些相同作用可能发生在肾小管的其他几个部分,包括髓袢(loop of Henle)、远端小管和集合小管。A T_1,血管紧张素II 1型受体(angiotensin II type I receptor)。
图28-19 精氨酸加压素(argine vasopressin, AVP)对远端小管末端、集合小管和集合管上皮细胞的作用机制。AVP与其\vee_2受体结合,后者与刺激性G蛋白(stimulatory G proteins, G_5)偶联,激活腺苷酸环化酶(adenylate cyclase, AC)并刺激环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的形成。这反过来激活蛋白激酶A(protein kinase A)和细胞内蛋白的磷酸化,导致水通道蛋白-2(aquaporin-2, AQP-2)向细胞膜的管腔侧移动。A Q P-2分子融合在一起形成水通道。在细胞膜的基底外侧还有其他水通道蛋白,AQP-3和AQP-4,它们允许水流出细胞,尽管这些水通道蛋白似乎不受AVP的调节。
心房钠尿肽(Atrial Natriuretic Peptide, ANP)减少钠和水的重吸收。当心房特定细胞因血浆容量扩张和心房血压升高而受到牵张时,它们会分泌一种称为心房钠尿肽(ANP)的肽类物质。该肽类物质水平的升高反过来直接抑制肾小管(renal tubules)对钠和水的重吸收,尤其是在集合管(collecting ducts)中。ANP还抑制肾素(renin)分泌,从而抑制血管紧张素II(angiotensin II)的形成,这反过来又减少了肾小管的重吸收。这种钠和水重吸收的减少增加了尿液的排泄,有助于使血容量恢复正常。
在充血性心力衰竭(congestive heart failure)中,由于心室泵血功能受损导致心房牵张,ANP水平显著升高。ANP水平的升高有助于减轻心力衰竭时钠和水的潴留。
甲状旁腺激素(Parathyroid Hormone)增加钙的重吸收。甲状旁腺激素是体内最重要的钙调节激素之一。它在肾脏中的主要作用是增加肾小管对钙的重吸收,尤其是在远曲小管(distal tubules)和连接小管(connecting tubules)中,连接小管是连接远曲小管和皮质集合管(cortical collecting duct)的肾小管节段。甲状旁腺激素还有其他作用,包括抑制近曲小管(proximal tubule)对磷酸盐的重吸收和刺激Henle袢(loop of Henle)对镁的重吸收,如第30章所述。
交感神经系统激活增加钠的重吸收
交感神经系统(sympathetic nervous system)的激活如果严重,可以通过收缩肾小动脉(renal arterioles)来减少钠和水的排泄,从而降低肾小球滤过率(GFR)。然而,即使是低水平的交感神经激活,也会通过增加近曲小管、Henle袢粗升支(thick ascending limb of the loop of Henle)以及可能更远端的肾小管部分对钠的重吸收来减少钠和水的排泄。这是通过激活肾小管上皮细胞上的α-肾上腺素能受体(\upalpha -adrenergic receptors)来实现的。
交感神经系统刺激还增加肾素释放和血管紧张素II的形成,这进一步增加了肾小管重吸收和减少肾脏对钠的排泄的总体效果。
使用清除率方法量化肾功能
不同物质从血浆中清除的速率提供了一种量化肾脏排泄各种物质有效性的有用方法(表28-4)。根据定义,某种物质的肾脏清除率(renal clearance)是指单位时间内肾脏完全清除该物质的血浆体积。
虽然没有完全清除某种物质的单一血浆体积,但肾脏清除率提供了一种量化肾脏排泄功能的有用方法。我们可以使用肾脏清除率来量化肾血流量(renal blood flow)、肾小球滤过率(GFR)、肾小管重吸收(tubular reabsorption)和肾小管分泌(tubular secretion)。
为了说明清除率原理,请考虑以下示例。如果通过肾脏的血浆每毫升含有1毫克某种物质,并且如果每分钟也有1毫克该物质排泄到尿液中,那么每分钟就有1毫升血浆被清除该物质。清除率是指单位时间内供应尿液中排泄物质量所需血浆的体积。用数学公式表示为:
C_5×P_5=U_5×V
其中 C_s 是物质 s 的清除率(clearance rate),P_s 是该物质的血浆浓度(plasma concentration),U_s 是该物质的尿液浓度(urine concentration),V 是尿流率(urine flow rate)。重新排列这个方程,清除率可以表示为:
C_s=\fracU_s×VP_s
因此,物质的肾脏清除率(renal clearance)可以通过该物质的尿排泄率 (U_s×V) 除以其血浆浓度来计算。
INULIN 清除率可用于估计肾小球滤过率(glomerular filtration rate)
如果一种物质可以自由滤过(像水一样自由滤过)并且不被肾小管重吸收或分泌,那么该物质在尿液中的排泄率 (U_s×V) 等于肾脏对该物质的滤过率 (GFR×P_s)。因此:
\sf G F R×\sf P_s=\sf U_s×\sf V
因此,肾小球滤过率(GFR)可以通过该物质的清除率计算如下:
\mathttG F R=\fracU_5×VP_5=C_2
符合这些标准的物质是菊粉(inulin),一种分子量约为5200的多糖分子。菊粉在体内不产生,存在于某些植物的根部,必须通过静脉注射给患者以测量肾小球滤过率(GFR)。
表28-4 使用清除率量化肾功能
<html><body><table><tr><td>术语</td><td>方程</td><td>单位</td></tr><tr><td>清除率</td><td>UsxV Ps</td><td>ml/min</td></tr><tr><td>肾小球滤过率</td><td>Uinulin xV GFR = Pinulin</td><td></td></tr><tr><td>清除率比值</td><td>Cs 清除率比值: Cinulin</td><td>无</td></tr><tr><td>有效肾血浆流量</td><td>UpAH x V ERPF = CpAH = PPAH</td><td>ml/min</td></tr><tr><td>肾血浆流量</td><td>(UPAH x V/PpAh) CPAH RPF: EPAH UPAHXV PPAH-VPAH</td><td>ml/min</td></tr><tr><td>肾血流量</td><td>RPF RBF= 1 - 血细胞比容</td><td>ml/min</td></tr><tr><td>排泄率</td><td>排泄率 = Us x V</td><td>mg/min, mmol/min, 或 mEq/min</td></tr><tr><td>重吸收率</td><td>= (GFRx Ps)- (U×v</td><td>重吸收率 = 滤过负荷 - 排泄率 mg/min, mmol/min, 或 mEq/min</td></tr><tr><td>分泌率</td><td>分泌率 =排泄率-滤过负荷</td><td>mg/min, mmol/min, 或 mEq/min</td></tr></table></body></html>
C_s, 物质 s 的清除率; E_P A H, PAH 提取率; ERPF, 有效肾血浆流量; GFR, 肾小球滤过率; P, 血浆浓度; PAH, 对氨基马尿酸; P_P A H, 肾动脉 PAH 浓度; RBF, 肾血流量; RPF, 肾血浆流量; S, 一种物质; U, 尿液浓度; \dot V_\prime 尿流率; V_P A H, 肾静脉 PAH 浓度。
图28-20展示了菊粉(inulin)的肾脏处理过程。在这个例子中,血浆浓度为1mg/ml_:,尿液浓度为125mg/ml_;,尿流率为1ml/min。因此,每分钟有125mg的菊粉进入尿液。然后,菊粉清除率(clearance)的计算方法是将菊粉的尿液排泄率除以血浆浓度,得到的结果为125ml/min。因此,流经肾脏的125毫升血浆必须被滤过,才能将出现在尿液中的菊粉输送出去。
菊粉并不是唯一可用于测定肾小球滤过率(glomerular filtration rate, GFR)的物质。临床上用于估计GFR的其他物质包括碘他拉酸(iothalamate)、铬乙二胺四乙酸(chromium ethylenediaminetetraacetic acid, EDTA)、胱抑素C_和肌酐(creatinine)。
肌酐清除率和血浆肌酐浓度可用于估计肾小球滤过率
肌酐是肌肉代谢的副产物,几乎完全通过肾小球滤过从体液中清除。因此,肌酐清除率也可用于评估GFR。由于测量肌酐清除率不需要对患者进行静脉注射,这种方法在临床上比菊粉清除率更广泛地用于估计GFR。然而,肌酐清除率并不是GFR的完美标志物,因为少量肌酐会被肾小管分泌,因此排泄的肌酐量略高于滤过量。在测量血浆肌酐时通常会有轻微误差,导致血浆肌酐浓度的高估;幸运的是,这两种误差往往会相互抵消。因此,肌酐清除率提供了GFR的合理估计。
在某些情况下,收集患者的尿液以测量肌酐清除率(C_Cr)可能不切实际。然而,通过简单地测量血浆肌酐浓度(P_Cr),可以获得GFR变化的近似值,因为血浆肌酐浓度与GFR成反比:
G F R\approxC_C r=\fracU_C r×\dotVP_C r
图28-20 通过菊粉的肾脏清除率测量肾小球滤过率(GFR)。菊粉可自由通过肾小球毛细血管滤过,但不会被肾小管重吸收。P_inulin, 血浆菊粉浓度;U_inulin, 尿液菊粉浓度;\dot V_r 尿流率。
如果GFR突然下降50%,肾脏将暂时只滤过和排泄一半的肌酐,导致肌酐在体液中积累并提高血浆浓度。血浆肌酐浓度将继续上升,直到肌酐的滤过负荷(P_Cr×GFR)和肌酐排泄(\operatornameU_\operatornameCr×\dotV)恢复正常,并且肌酐的产生和排泄之间重新建立平衡。当血浆肌酐水平增加到大约正常值的两倍时,这种反应将会发生,如图28-21所示。
如果肾小球滤过率(glomerular filtration rate, GFR)下降到正常值的四分之一,血浆肌酐(creatinine)水平将增加到正常值的四倍左右,而GFR下降到正常值的八分之一时,血浆肌酐水平将增加到正常值的八倍。因此,在稳态条件下,尽管GFR下降,肌酐的排泄率仍等于肌酐的生成率。然而,这种正常的肌酐排泄率是以血浆肌酐浓度升高为代价的,如图28-22所示。
对氨基马尿酸清除率可用于估算肾血浆流量
理论上,如果一种物质完全从血浆中被清除,那么该物质的清除率等于总肾血浆流量(renal plasma flow, RPF)。换句话说,血液中输送到肾脏的该物质的量 \left(RPF×P_s\right) 将等于尿液中排泄的量 (U_s×\dotV) 。因此,RPF可以按以下公式计算:
R P F=\fracU_s×\dotVP_s=C_s
图28-21 当肌酐生成率保持不变时,肾小球滤过率(glomerular filtration rate, GFR)降低50%对血清肌酐浓度和肌酐排泄率的影响。PCreatinine,血浆肌酐浓度。
图28-22 稳态条件下肾小球滤过率(glomerular filtration rate, GFR)与血浆肌酐浓度之间的近似关系。如果肌酐生成率保持不变,GFR降低50%将使血浆肌酐水平增加到正常值的两倍。
图28-23 通过对氨基马尿酸(para-aminohippuric acid, PAH)的肾清除率测量肾血浆流量。PAH自由通过肾小球毛细血管滤过,并从肾小管周围毛细血管血液分泌到肾小管腔中。肾动脉血浆中的PAH量大约等于尿液中排泄的PAH量。因此,可以通过PAH的清除率计算肾血浆流量。为了更准确,可以校正离开肾脏时仍留在血液中的PAH百分比。P_P A H, 动脉血浆PAH浓度;U_P A H, 尿液PAH浓度;\dotV, 尿液流速。
由于肾小球滤过率(GFR)仅占血浆总流量的约20%,因此一种完全从血浆中清除的物质必须通过肾小管分泌(secretion)以及肾小球滤过(glomerular filtration)来排泄(图28-23)。目前还没有已知的物质是完全由肾脏清除的。一种物质PAH,大约有90%从血浆中被清除。因此,PAH的清除率(clearance)可以用来近似估算肾血浆流量(RPF)。为了更准确,可以校正PAH离开肾脏时仍留在血液中的百分比。从血液中去除的PAH百分比称为PAH的提取率(extraction ratio),在正常肾脏中平均约为90%。在患病的肾脏中,由于受损的肾小管无法将PAH分泌到肾小管液中,这一提取率可能会降低。
RPF的计算可以通过以下例子来演示。假设PAH的血浆浓度为0.01mg/ml,尿液浓度为5.85mg/ml,尿流率为1ml/min。PAH的清除率可以通过尿中PAH排泄率(5.85 [mg/ml]×1[ml/min])除以血浆PAH浓度(0.01mg/ml)来计算。因此,PAH的清除率计算为585ml/min。
如果PAH的提取率为90%,则实际的RPF可以通过将585ml/min除以0.9来计算,得到650ml/min。因此,总RPF可以计算如下:
PAH清除率 总肾血浆流量 = PAH提取率
提取率(E_PAH)计算为肾动脉PAH(P_PAH)和肾静脉PAH(V_PAH)浓度之差除以肾动脉PAH浓度:
E_P A H=\fracP_P A H-V_P A HP_P A H
可以通过总RPF和血细胞比容(hematocrit)(血液中红细胞的百分比)来计算通过肾脏的总血流量。如果血细胞比容为0.45,总RPF为650ml/min,则通过双肾的总血流量为650/(1\textrm--0.45),即1182ml/min。
滤过分数由GFR除以RPF计算
要计算滤过分数(filtration fraction),即通过肾小球膜滤过的血浆分数,必须首先知道RPF(PAH清除率)和GFR(菊粉清除率)。如果RPF为650ml/min,GFR为125ml/min,则滤过分数(FF)计算如下:
F F=G F R/R P F=125/650=0.19
通过肾脏清除率计算肾小管重吸收或分泌
如果已知某物质的肾小球滤过率和肾脏排泄率,则可以计算该物质在肾小管中是净重吸收(net reabsorption)还是净分泌(net secretion)。例如,如果该物质的排泄率(U_s×\dotV)小于该物质的滤过负荷(GFR×P_s),则该物质一定有一部分从肾小管中被重吸收了。相反,如果该物质的排泄率大于其滤过负荷,则其在尿中出现的速率代表肾小球滤过率加上肾小管分泌率的总和。
以下示例展示了肾小管重吸收(renal tubular reabsorption)的计算。假设某患者的实验室检查结果如下:
- 尿流率(urine flow rate) =1ml/min
- 尿钠浓度(urine sodium concentration) \big(U_Na\big)=70m E q/L= 70\upmuEq/ml
- 血浆钠浓度(plasma sodium concentration) =140mEq/L=140 \upmuEq/ml
- 肾小球滤过率(glomerular filtration rate, GFR)(菊粉清除率(inulin clearance))=100ml/min
在此示例中,滤过的钠负荷(filtered sodium load)为 GFR×P_Na, 即 100ml/min×140\upmuEq/ml=14,000\upmuEq/min. 尿钠排泄(urinary sodium excretion)( U_Na× 尿流率)为 70\upmuEq/min 。因此,钠的肾小管重吸收(renal tubular reabsorption of sodium)为滤过负荷与尿排泄量之差,即 14,000\upmuEq/min-70\upmuEq/min=13,930\upmuEq/min 。
菊粉清除率与不同溶质清除率的比较。通过比较某物质的清除率与菊粉(测量GFR的金标准)的清除率,可以得出以下一般性结论:(1) 如果某物质的清除率等于菊粉的清除率,则该物质仅被滤过,未被重吸收或分泌;(2) 如果某物质的清除率低于菊粉清除率,则该物质必定被肾小管重吸收;(3) 如果某物质的清除率高于菊粉清除率,则该物质必定被肾小管分泌。以下是肾脏通常处理的一些物质的近似清除率:
<html><body><table><tr><td>物质</td><td>清除率(ml/min)</td></tr><tr><td>葡萄糖</td><td>0</td></tr><tr><td>钠</td><td>0.9</td></tr><tr><td>氯</td><td>1.3</td></tr><tr><td>钾</td><td>12.0</td></tr><tr><td>磷酸盐</td><td>25.0</td></tr><tr><td>菊粉</td><td>125.0</td></tr><tr><td>肌酐</td><td>140.0</td></tr></table></body></html>
29 尿液浓缩与稀释;细胞外液渗透压和钠浓度的调节
为了使身体细胞正常运作,它们必须浸泡在电解质浓度相对恒定的细胞外液(extracellular fluid)中。细胞外液中溶质的总浓度——以及因此的渗透压(osmolarity)——也必须精确调节,以防止细胞收缩或肿胀。渗透压由溶质(主要是氯化钠)的量除以细胞外液的体积决定。因此,在很大程度上,细胞外液渗透压和氯化钠浓度由细胞外水的量调节。总体水(total body water)由以下因素控制:(1) 液体摄入(fluid intake),由决定口渴的因素调节;(2) 肾脏水排泄(renal water excretion),由影响肾小球滤过(glomerular filtration)和肾小管重吸收(tubular reabsorption)的多种因素控制。
在本章中,我们将讨论以下内容:(1) 导致肾脏通过排泄稀释尿液来消除多余水分的机制;(2) 导致肾脏通过排泄浓缩尿液来保存水分的机制;(3) 控制细胞外液钠浓度和渗透压的肾脏反馈机制;(4) 决定水和盐摄入的口渴和盐食欲机制,这也有助于控制细胞外液体积、渗透压和钠浓度。
肾脏通过形成稀释尿液来排泄多余水分
正常的肾脏具有极大的能力,可以根据不同的挑战来改变尿液中溶质和水的相对比例。当体内水分过多,体液渗透压降低时,肾脏可以排出渗透压低至50mOsm/L的尿液,这一浓度仅为正常细胞外液渗透压的六分之一左右。相反,当体内水分不足,细胞外液渗透压升高时,肾脏可以排出渗透压高达1200至1400mOsm/L的高度浓缩尿液。同样重要的是,肾脏可以在不显著改变钠和钾等溶质排泄率的情况下,排出大量稀释尿液或少量浓缩尿液。这种独立于溶质排泄来调节水排泄的能力对生存至关重要,尤其是在液体摄入受限的情况下。
抗利尿激素(antidiuretic hormone, ADH)控制尿液浓度
人体有一个强大的反馈系统,通过独立于溶质排泄率来调节水的肾脏排泄,从而调节血浆渗透压和钠浓度。该反馈系统的主要效应器是抗利尿激素(antidiuretic hormone, ADH),也称为血管加压素(vasopressin)。
当体液渗透压升高超过正常水平(即体液中的溶质变得过于浓缩)时,垂体后叶会分泌更多的ADH,这会增加远端小管和集合管对水的通透性,如第28章所述。这种机制增加了水的重吸收并减少了尿量,但不会显著改变肾脏对溶质的排泄率。
当体内水分过多,细胞外液渗透压降低时,垂体后叶分泌的ADH减少,从而降低了远端小管和集合管对水的通透性,导致排出更多稀释的尿液。因此,ADH的分泌速率在很大程度上决定了肾脏是排出稀释尿液还是浓缩尿液。
肾脏排泄稀释尿液的机制
当体内水分大量过剩时,肾脏每天可以排出多达20L的稀释尿液,其浓度可低至50mOsm/L。肾脏通过继续重吸收溶质而不在肾单位的远端部分(包括远端小管和集合管)重吸收大量水分,来完成这一令人印象深刻的壮举。
图29-1. 一个人在摄入1升水后的水利尿(water diuresis)情况。注意,摄入水后,尿量增加,尿液渗透压降低,导致排出大量稀释尿液;然而,肾脏排出的溶质总量保持相对恒定。肾脏的这些反应防止了在过量摄入水时血浆渗透压显著下降。
图29-1显示了人类在摄入1升水后的大致肾脏反应。请注意,尿液量在摄入水后的45分钟内增加到正常值的约六倍。然而,由于形成的尿液变得稀释,尿液的渗透压从600降至约100mOsm/L,因此排出的溶质总量保持相对恒定。因此,在摄入过量水后,肾脏会排出体内的多余水分,但不会排出过量的溶质。
当肾小球滤液最初形成时,其渗透压与血浆的渗透压大致相同(300 mOsm/L)。为了排出多余的水分,滤液在通过肾小管时被稀释,因为溶质比水更多地被重吸收,如图29-2所示。然而,这种稀释仅发生在肾小管系统的某些部分,如下文所述。
近端小管中的小管液保持等渗。当液体流经近端小管时,溶质和水以相等的比例被重吸收,因此渗透压几乎没有变化。因此,近端小管液保持与血浆等渗,渗透压约为300mOsm/L。当液体流经Henle袢的降支时,水通过渗透作用被重吸收,小管液与肾髓质的周围间质液达到平衡,后者非常高渗——约为原始肾小球滤液渗透压的两到四倍。因此,当小管液流入内髓质时,其浓度增加。
图29-2. 当抗利尿激素(ADH)水平非常低时,稀释尿液的形成。请注意,在Henle袢的升支中,小管液变得非常稀释。在远端小管和集合小管中,当ADH水平非常低时,由于氯化钠的重吸收和水的重吸收失败,小管液进一步稀释。水的重吸收失败和溶质的持续重吸收导致大量稀释尿液的产生。(数值单位为毫渗透压每升。)
Henle袢升支中的小管液被稀释。在Henle袢的升支,特别是在厚段中,钠、钾和氯被大量重吸收。然而,即使存在大量的ADH,这部分小管段对水是不通透的。因此,当小管液流经Henle袢升支进入早期远端小管时,其渗透压逐渐降低至约100mOsm/L。因此,无论ADH是否存在,离开早期远端小管段的液体都是低渗的,其渗透压仅为血浆渗透压的三分之一左右。
远端小管和集合管中的小管液在缺乏ADH时进一步稀释。当早期远端小管中的稀释液进入晚期远端曲小管、皮质集合管和髓质集合管时,氯化钠会进一步被重吸收。在缺乏ADH的情况下,这部分小管对水也不通透,溶质的进一步重吸收导致小管液变得更加稀释,其渗透压降至低至50 mOsm/L。未能重吸收水以及持续重吸收溶质会导致大量稀释尿液的产生。
总结来说,形成稀释尿液的机制是在减少水重吸收的同时,继续从肾小管系统的远端部分重吸收溶质。在健康的肾脏中,无论ADH水平如何,离开Henle袢升支和早期远端小管的液体总是稀释的。在缺乏ADH的情况下,尿液在晚期远端小管和集合管中进一步稀释,并排出大量稀释尿液。
肾脏通过排出浓缩尿液来保存水分
肾脏形成浓缩尿液的能力对于包括人类在内的陆地哺乳动物的生存至关重要。水分通过多种途径不断从体内流失,包括通过肺部蒸发到呼出空气中、通过胃肠道以粪便形式排出、通过皮肤蒸发和排汗、以及通过肾脏排出尿液。需要摄入液体以匹配这种流失,但肾脏形成少量浓缩尿液的能力最大限度地减少了维持稳态所需的液体摄入量,这一功能在水资源短缺时尤为重要。
当体内水分不足时,肾脏通过继续排出溶质、增加水的重吸收并减少尿量来形成浓缩尿液。人类肾脏可以产生最大尿液浓度为1200至1400mOsm/L,是血浆渗透压的四到五倍。
一些沙漠动物,如澳大利亚跳鼠,可以将尿液浓缩至高达10,000 mOsm/L。这种能力使跳鼠能够在沙漠中生存而不需要饮水;通过摄入的食物和体内代谢食物产生的水分可以获得足够的水分。适应淡水环境的动物通常具有最小的尿液浓缩能力。例如,海狸只能将尿液浓缩至约500mOsm/L。
必需尿量
肾脏的最大浓缩能力决定了每天必须排出多少尿量以清除体内的代谢废物和摄入的电解质。一个正常的70-kg的人每天必须排出约600毫渗透压的溶质。如果最大尿液浓缩能力为1200mOsm/L,则必须排出的最小尿量,称为必需尿量,可以计算如下:
\frac600mOsm/day1200mOsm/L=0.5L/day
这种尿液中的最小体积损失,加上皮肤、呼吸道和胃肠道的水分流失,在无法饮水时会导致脱水。
人类肾脏将尿液浓缩至约1200mOsm/L的能力有限,这解释了为什么如果试图饮用海水会导致严重脱水。海洋中的氯化钠浓度平均约为3.0%至3.5%,渗透压约为1000至1200mOsm/L。饮用1升浓度为1200mOsm/L的海水将摄入1200毫渗透压的氯化钠。如果最大尿液浓缩能力为1200mOsm/L,则需要1.0升的尿量来排泄1200毫渗透压的氯化钠。那么为什么饮用海水会导致脱水呢?答案是肾脏还必须排泄其他溶质,尤其是尿素,当尿液达到最大浓缩时,尿素贡献约600mOsm/L。因此,肾脏可以排泄的氯化钠最大浓度约为600mOsm/L。因此,每摄入1升海水,需要1.5升的尿量来排出体内摄入的1200毫渗透压的氯化钠以及600毫渗透压的其他溶质(如尿素)。这将导致每摄入1升海水净流失0.5升液体,解释了饮用海水的海难受害者迅速脱水的原因。然而,海难受害者的宠物Australian hopping mouse可以毫无顾忌地饮用海水。
尿液比重
尿液比重在临床环境中常用于快速估计尿液溶质浓度。尿液越浓缩,尿液比重越高。在大多数情况下,尿液比重随尿液渗透压的增加而线性增加(图29-3)。然而,尿液比重是衡量给定体积尿液中溶质重量的指标,因此由溶质分子的数量和大小决定。相比之下,渗透压仅由给定体积中溶质分子的数量决定。
尿液比重通常以克/毫升(g/ml)表示,在人类中,正常范围为1.002至1.028g/ml,尿液渗透压每增加35至40\cdotmOsm/L,尿液比重增加0.001。当尿液中含有大量大分子(如葡萄糖、用于诊断的放射对比剂或某些抗生素)时,比重与渗透压之间的关系会发生变化。在这些情况下,尿液比重测量可能会错误地提示尿液高度浓缩,尽管尿液渗透压正常。
有试纸可用于测量近似的尿液比重,但大多数实验室使用折射计测量比重。
图29-3. 尿液比重与渗透压之间的关系。
排泄浓缩尿液需要高ADH水平和肾髓质高渗
排泄浓缩尿液需要高水平的抗利尿激素(ADH)和高渗的肾髓质。
形成浓缩尿液的基本要求是:(1) 高水平的抗利尿激素(ADH),它增加了远端小管和集合管对水的通透性,从而使这些管段能够积极地重吸收水;(2) 肾髓质间质液的高渗透压(osmolarity),这为在高水平ADH存在下发生水重吸收提供了必要的渗透梯度。
围绕集合管的肾髓质间质通常是高渗的(hyperosmotic),因此当ADH水平高时,水通过渗透作用穿过管壁进入肾间质;从那里,它被直小血管(vasa recta)带走回到血液中。因此,尿液浓缩能力受ADH水平和肾髓质高渗程度的限制。我们稍后会讨论控制ADH分泌的因素,但现在的问题是,肾髓质间质液如何变得高渗?这个过程涉及逆流倍增机制(countercurrent multiplier mechanism)的运作。
逆流倍增机制依赖于Henle袢(loop of Henle)和直小血管的特殊解剖排列,直小血管是肾髓质的特殊管周毛细血管(peritubular capillaries)。在人类中,约25%的肾单位是近髓肾单位(juxtamedullary nephrons),其Henle袢和直小血管深入髓质,然后返回皮质。一些Henle袢一直延伸到从髓质突出到肾盂的肾乳头尖端。与长Henle袢平行的是直小血管,它们也向下深入髓质,然后返回肾皮质。最后,集合管在尿液排出前通过高渗的肾髓质,也在逆流机制中起关键作用。
逆流倍增机制产生高渗的肾髓质间质
身体几乎所有部位的间质液的渗透压约为300mOsm/L,与血浆渗透压相似。(如第25章所讨论的,考虑到分子间吸引力的校正渗透活性约为282mOsm/L。)肾脏髓质间质液的渗透压要高得多,并且在髓质的骨盆尖端可能逐渐增加到约1200至1400mOsm/L。这意味着肾髓质间质积累了大量的溶质,远远超过水。一旦髓质中的高溶质浓度达到,它通过髓质中溶质和水的平衡流入和流出得以维持。
导致肾髓质溶质浓度积累的主要因素如下:
- 钠离子的主动转运(active transport)和钾、氯及其他离子的共转运(co-transport)从Henle袢升支粗段进入髓质间质
- 离子从集合管主动转运到髓质间质
- 尿素从髓质内层集合管通过易化扩散(facilitated diffusion)进入髓质间质
- 只有少量水从髓质小管扩散到髓质间质——远少于溶质重吸收到髓质间质的量
导致溶质被困在肾髓质中的Henle袢特性
Henle袢的转运特性总结在表29-1中,同时还包括近端小管(proximal tubules)、远端小管(distal tubules)、皮质集合小管(cortical collecting tubules)和髓质内层集合管(inner medullary collecting ducts)的特性。
髓质高渗透压的一个主要原因是钠的主动转运(active transport)以及钾、氯和其他离子从Henle袢厚壁升支向间质的共转运(co-transport)。这种泵能够在管腔和间质液之间建立约200-mOsm/L的浓度梯度。由于厚壁升支对水几乎不渗透,泵出的溶质不会伴随着水的渗透流进入间质。因此,钠和其他离子从厚壁升支的主动转运使得肾髓质间质中的溶质浓度超过水。
表29-1 小管特性总结-尿液浓缩
<html><body><table><tr><td rowspan="2">结构</td><td rowspan="2">NaCl主动转运</td><td colspan="3">渗透性</td></tr><tr><td>H20</td><td>NaCl</td><td>尿素</td></tr><tr><td>近端小管</td><td>++</td><td>++</td><td>+</td><td>+</td></tr><tr><td>薄壁降支</td><td>0</td><td>++</td><td>+</td><td>+</td></tr><tr><td>薄壁升支</td><td>0</td><td>0</td><td>+</td><td>+</td></tr><tr><td>厚壁升支</td><td>++</td><td>0</td><td>0</td><td>0</td></tr><tr><td>远端小管</td><td>+</td><td>+ADH</td><td>0</td><td>0</td></tr><tr><td>皮质集合小管</td><td>+</td><td>+ADH</td><td>0</td><td>0</td></tr><tr><td>髓质内层集合管</td><td>+</td><td>+ADH</td><td>0</td><td>+ADH</td></tr></table></body></html>
ADH, 抗利尿激素(antidiuretic hormone); NaCl, 氯化钠(sodium chloride); 0, 主动转运或渗透性的最低水平; +, 中等水平的主动转运或渗透性; ++ , 高水平的主动转运或渗透性; +A D H , 水或尿素的渗透性由ADH增加。
髓质间质。Henle袢薄壁升支有一些氯化钠的被动重吸收(passive reabsorption),该部分对水也基本上不渗透,进一步增加了肾髓质间质的高溶质浓度。
与升支相反,Henle袢的降支对水非常渗透,管腔液的渗透压迅速与肾髓质渗透压相等。因此,水从Henle袢的降支扩散到间质中,管腔液的渗透压随着流向Henle袢尖端而逐渐升高。
导致肾髓质高渗的步骤
考虑到Henle袢的这些特性,我们现在来讨论肾髓质如何变得高渗(视频29-1)。首先,假设Henle袢中充满了浓度为300mOsm/L的液体,这与离开近端小管(proximal tubule)的液体浓度相同(图29-4,步骤1)。接下来,Henle袢厚壁升支(thick ascending limb)的主动离子泵(active ion pump)降低了小管内的浓度,并提高了间质液的浓度;该泵在小管液和间质液之间建立了200-mOsm/L的浓度梯度(图29-4,步骤2)。梯度的极限约为200mOsm/L,因为当达到200 mOsm/L的浓度梯度时,离子通过旁细胞扩散(paracellular diffusion)回到小管中,最终与离子从小管腔中转运出去的速率达到平衡。
步骤3是,由于水从Henle袢降支(descending limb)渗透出去,降支中的小管液和间质液迅速达到渗透平衡。由于Henle袢厚壁升支持续将离子转运出去,间质液的渗透压维持在400mOsm/L。因此,仅靠厚壁升支主动转运氯化钠(sodium chloride),只能建立200-mOsm/L的浓度梯度,这远低于逆流倍增系统(countercurrent multiplier system)所达到的梯度。
步骤4是液体从近端小管流入Henle袢,这导致之前在降支中形成的高渗液体流入升支。一旦这些液体进入升支,更多的离子被泵入间质,而水则留在小管液中,直到建立200-mOsm/L的渗透梯度,间质液的渗透压上升到500mOsm/L(步骤5)。然后,降支中的液体再次与高渗的髓质间质液达到平衡(步骤6),并且当来自Henle袢降支的高渗小管液流入升支时,更多的溶质被持续泵出小管并沉积到髓质间质中。
这些步骤不断重复,最终效果是向髓质中添加越来越多的溶质,超过了水的量。随着时间的推移,这一过程逐渐将溶质困在髓质中,并放大了由Henle袢厚壁升支主动泵出离子所建立的浓度梯度,最终将间质液的渗透压提高到1200至1400 mOsm/L,如步骤7所示。
因此,Henle袢厚壁升支反复重吸收氯化钠,以及近端小管持续向Henle袢流入新的氯化钠,这一过程被称为逆流倍增(countercurrent multiplier)。从Henle袢升支重吸收的氯化钠不断添加到新到达的氯化钠中,从而“倍增”其在髓质间质中的浓度。
远端小管和集合管在排泄浓缩尿液中的作用
当小管液离开Henle袢并流入肾皮质的远端曲小管(distal convoluted tubule)时,液体是稀释的,渗透压仅为约100至
图29-4. Henle袢中的逆流倍增系统(countercurrent multiplier system)用于产生高渗的肾髓质。(数值单位为毫渗透压摩尔每升。)
图29-5. 当抗利尿激素(antidiuretic hormone, ADH)水平高时浓缩尿的形成。注意,离开Henle袢的液体是稀释的,但随着水从远端小管(distal tubules)和集合管(collecting tubules)中被吸收而变得浓缩。在ADH水平高的情况下,尿液的渗透压与肾髓质乳头间质液的渗透压大致相同,约为1200 mOsm/L。(数值单位为毫渗透压摩尔每升。)
140mOsm/L (图29-5)。早期远端小管进一步稀释了小管液,因为这一段与Henle袢的升支一样,主动将氯化钠从小管中转运出去,但对水的通透性相对较低。
当液体流入皮质集合管(cortical collecting tubule)时,水的重吸收量关键取决于血浆中ADH的浓度。在没有ADH的情况下,这一段几乎对水不通透,无法重吸收水,但继续重吸收溶质并进一步稀释尿液。当ADH浓度高时,皮质集合管对水的通透性显著增加,因此大量水从小管重吸收到皮质间质中,随后被快速流动的管周毛细血管带走。由于大量水被重吸收到皮质而不是肾髓质中,这有助于保持高渗的髓质间质液。
当小管液沿髓质集合管流动时,有更多的水从小管液重吸收到间质中,但与添加到皮质间质中的水量相比,总水量相对较小。重吸收的水被直小血管(vasa recta)带走进入静脉血。当ADH水平高时,集合管对水变得通透,因此集合管末端的液体与肾髓质间质液的渗透压基本相同——约为1200mOsm/L (见图29-4)。因此,通过尽可能多地重吸收水,肾脏形成高度浓缩的尿液,在尿液中排出正常量的溶质,同时将水重新添加到细胞外液中,补偿体内水分的不足。
尿素对高渗肾髓质间质和浓缩尿形成的贡献
当肾脏形成最大浓缩尿液时,尿素贡献了肾髓质间质渗透压的约40%至50% (500-600mOsm/L)。与氯化钠不同,尿素是被动从小管中重吸收的。当体内水分不足且血液中ADH浓度高时,大量尿素从髓质内层集合管被动重吸收到间质中。
尿素(urea)重吸收进入肾髓质(renal medulla)的机制如下。当水沿着Henle袢(loop of Henle)上升并进入远曲小管(distal tubule)和皮质集合管(cortical collecting tubule)时,由于这些节段对尿素不通透(impermeable),只有少量尿素被重吸收(见表29-1)。在高浓度ADH存在的情况下,水从皮质集合管迅速重吸收,由于尿素在该段小管中通透性较低,尿素浓度迅速升高。
当小管液流入内髓集合管(inner medullary collecting duct)时,更多的水被重吸收,导致小管液中尿素浓度进一步升高。内髓集合管小管液中高浓度的尿素促使尿素从小管扩散到肾间质液(renal interstitial fluid)中。这种扩散受到特异性尿素转运蛋白(urea transporter)UT-A1和UT-A3的极大促进。这些尿素转运蛋白被ADH激活,当ADH水平升高时,尿素从内髓集合管转运出的速度进一步加快。水和尿素同时从内髓集合管移出,维持了小管液中尿素的高浓度,最终也维持了尿液中尿素的高浓度,尽管尿素正在被重吸收。
尿素在尿液浓缩能力(urine-concentrating ability)中的基本作用可以从以下事实得到证明:摄入高蛋白饮食的人会产生大量尿素作为含氮废物(nitrogenous waste product),他们的尿液浓缩能力比蛋白质摄入和尿素生成量低的人要好得多。营养不良与髓质间质(medullary interstitium)中尿素浓度低和尿液浓缩能力显著受损有关。
从集合管到Henle袢的尿素再循环(Recirculation of Urea)有助于肾髓质高渗(Hyperosmotic Renal Medulla)
健康人通常排泄约20%至60%的滤过尿素负荷(filtered load of urea),具体取决于尿流率和水合状态(hydration state)。一般来说,尿素排泄率主要由以下因素决定:(1)血浆中尿素浓度;(2)肾小球滤过率(glomerular filtration rate, GFR);(3)肾小管尿素重吸收(renal tubular urea reabsorption)。在GFR大幅降低的肾病患者中,尽管GFR降低,血浆尿素浓度显著升高,使滤过尿素负荷和尿素排泄率恢复到正常水平(等于尿素生成率)。
图 29-6. 从髓质集合管吸收的尿素在间质液中的再循环。这种尿素扩散到Henle袢的细段,然后通过远曲小管,最后返回到集合管。尿素的再循环有助于将尿素困在肾髓质中,并促进肾髓质的高渗透压。从Henle袢的粗升支到髓质集合管的粗线表示这些节段对尿素的通透性较低。尿素转运蛋白UT-A1和UT-A3促进尿素从髓质集合管中扩散出来,而UT-A2则促进尿素扩散到Henle袢的细降支中。(数值单位为抗利尿期间每升尿素的毫渗透压,此时存在大量抗利尿激素。留在小管中的过滤尿素负荷的百分比在方框中表示。)
在近曲小管中,40%到50%的过滤尿素被重吸收,但即便如此,小管液中的尿素浓度仍然增加,因为尿素的通透性远不如水。当小管液流入Henle袢的细段时,尿素浓度继续上升,部分原因是水从Henle袢的降支中被重吸收,但也因为一些尿素从髓质间质分泌到Henle袢的细段中(图29-6)。尿素转运蛋白UT-A2促进了尿素被动分泌到Henle袢的细段中。
Henle袢的粗升支、远曲小管和皮质集合管对尿素的通透性较低,通常在这些小管节段中只有少量尿素被重吸收。当肾脏形成浓缩尿液且存在高水平抗利尿激素时,从远曲小管和皮质集合管中重吸收水分进一步提高了小管液中尿素的浓度。当这些尿素流入内髓质集合管时,高浓度的小管液尿素和尿素转运蛋白UT-A1和UT-A3导致尿素扩散到髓质间质中。进入髓质间质的尿素中,相当一部分最终扩散到Henle袢的细段中,然后通过Henle袢的升支、远曲小管和皮质集合管向上流动,再次返回到髓质集合管中。通过这种方式,尿素可以在排泄前多次循环通过这些小管系统的末端部分。每次循环都会增加尿素的浓度。
这种尿素再循环为形成高渗透压的肾髓质提供了额外的机制。由于尿素是肾脏必须排泄的最丰富的废物之一,这种在排泄前浓缩尿素的机制在水分供应不足时对体液的节约至关重要。
当体内水分过多时,尿流率增加,因此内髓质集合管中的尿素浓度降低,导致尿素向肾髓质间质的扩散减少。当体内水分过多时,抗利尿激素水平也会降低,这种降低反过来又减少了内髓质集合管对水和尿素的通透性,更多的尿素随尿液排出。
直小血管中的逆流交换维持肾髓质的高渗状态
血液必须流向肾髓质以满足肾脏这一部分细胞的代谢需求。如果没有特殊的髓质血流系统,由逆流倍增系统泵入肾髓质的溶质会迅速消散。
肾髓质血流的两个特殊特征有助于维持高溶质浓度:
- 髓质血流较低,占总肾血流的不到5%。这种缓慢的血流足以满足组织的代谢需求,但有助于减少髓质间质中溶质的流失。
- 直小血管作为逆流交换器,最大限度地减少溶质从髓质间质中被冲刷掉。
逆流交换机制的运作如下(图29-7)。血液通过直小血管在皮质和肾髓质边界处进入和离开髓质。直小血管与其他毛细血管一样,对血液中的溶质高度通透,除了血浆蛋白。当血液向髓质乳头方向下降时,它会逐渐变得更加浓缩,部分是由于溶质从间质进入,部分是由于水分进入间质。当血液到达直小血管的尖端时,其浓度约为1200mOsm/L,与髓质间质的浓度相同。当血液向皮质方向上升时,它会逐渐变得不那么浓缩,因为溶质扩散回髓质间质,而水分进入直小血管。
尽管大量的液体和溶质通过直小血管交换,但由于直小血管毛细血管的U形结构,肾髓质每一层次的间质液浓度几乎没有净稀释,这些毛细血管作为逆流交换器。因此,直小血管并不创造髓质的高渗状态,但它们确实防止了其消散。
血管的U形结构最大限度地减少了溶质从间质的流失,但并没有阻止液体和溶质通过通常的胶体渗透压和静水压进入血液,这些压力有利于这些毛细血管中的重吸收。在稳态条件下,直小血管仅带走从髓质小管吸收的溶质和水,逆流机制建立的高溶质浓度得以维持。
图29-7. 直小血管中的逆流交换。血浆沿直小血管降支流动时,由于水分从血液中扩散出去以及溶质从肾间质液扩散进入血液,变得更加高渗。在直小血管升支中,溶质扩散回间质液,水分扩散回直小血管。如果没有直小血管毛细血管的U形结构,大量的溶质将从肾髓质中流失。(数值单位为毫渗透压摩尔每升。)
髓质血流增加会降低尿液浓缩能力。某些血管扩张剂可以显著增加肾髓质血流,从而冲刷掉肾髓质中的部分溶质,降低最大尿液浓缩能力。动脉压的大幅增加也可能使肾髓质血流增加的程度超过肾脏其他区域,并倾向于冲刷掉高渗的间质,从而降低尿液浓缩能力。如前所述,肾脏的最大浓缩能力不仅取决于ADH的水平,还取决于肾髓质间质液的渗透压。即使ADH水平达到最大,如果髓质血流增加足以降低肾髓质的高渗性,尿液浓缩能力也会降低。
尿液浓缩机制及不同肾小管段渗透压变化的总结
当肾小管液流经肾单位的不同部分时,其渗透压和体积的变化如图29-8所示。
近端小管:约65%的滤过电解质在近端小管被重吸收。然而,近端小管膜对水具有高度通透性,因此每当溶质被重吸收时,水也会通过渗透作用扩散通过小管膜。水通过近端小管上皮的扩散受到水通道蛋白1(AQP-1)的辅助。因此,液体的渗透压与肾小球滤液大致相同,约为300 mOsm/L。
图29-8. 在高水平抗利尿激素(ADH)存在和不存在ADH的情况下,肾小管液流经不同肾小管段时渗透压的变化。(数值表示沿不同肾小管段流动的液体的近似体积,单位为毫升/分钟,或渗透压,单位为毫渗透压/升。)
Henle袢降支:当液体流经Henle袢降支时,水被吸收到髓质中。降支也含有AQP-1,对水具有高度通透性,但对氯化钠和尿素的通透性较低。因此,流经降支的液体的渗透压逐渐增加,直到几乎与周围间质液的渗透压相等,当ADH的血浆浓度较高时,间质液的渗透压约为1200 mOsm/L。
当由于ADH浓度低而形成稀释尿液时,髓质间质的渗透压低于1200 mOsm/L;因此,降支小管液的渗透压也变得不那么浓缩。这种浓度降低的部分原因是当ADH水平较低时,从集合管吸收到髓质间质的尿素较少,肾脏正在形成大量稀释的尿液。
Henle袢细段升支。Henle袢细段升支对水基本上是不通透的(impermeable),但会重吸收一些氯化钠。由于Henle袢降支中水分被移除,导致管腔液中氯化钠浓度很高,因此氯化钠会从细段升支被动扩散到髓质间质中。因此,随着氯化钠从肾小管中扩散出去,而水留在肾小管中,管腔液变得更加稀释。
从集合管吸收到髓质间质中的一些尿素也会扩散到升支中,从而将尿素返回到肾小管系统,并有助于防止其从肾髓质中被冲刷出去。这种尿素循环是导致肾髓质高渗的另一个机制。
Henle袢粗段升支。Henle袢粗段升支对水也几乎是不通透的,但大量的钠、氯、钾和其他离子会从肾小管主动转运到髓质间质中。因此,Henle袢粗段升支中的液体变得非常稀释,浓度下降到约140mOsm/L。
远曲小管早期。远曲小管早期具有与Henle袢粗段升支相似的性质,因此随着溶质被重吸收而水留在肾小管中,管腔液进一步稀释到约100mOsm/L。
远曲小管晚期和皮质集合管。在远曲小管晚期和皮质集合管中,液体的渗透压取决于ADH的水平。在ADH水平高时,这些肾小管对水高度通透,大量水被重吸收。然而,尿素在肾单位的这一部分并不十分通透,导致随着水的重吸收,尿素浓度增加。这一过程使得输送到远曲小管和集合管的大部分尿素进入内髓集合管,最终被重吸收或随尿液排出。在没有ADH的情况下,远曲小管晚期和皮质集合管中几乎没有水被重吸收;因此,由于这些节段中离子的持续主动重吸收,渗透压进一步降低。
内髓集合管。内髓集合管中液体的浓度还取决于以下因素:(1) ADH;以及(2) 由逆流机制建立的周围髓质间质的渗透压。在大量ADH存在的情况下,这些集合管对水高度通透,水从肾小管扩散到间质液中,直到达到渗透平衡,管腔液的浓度与肾髓质间质大致相同(1200-1400mOsm/L)。因此,当ADH水平高时,会产生少量浓缩的尿液。由于水的重吸收增加了管腔液中的尿素浓度,并且由于内髓集合管具有特定的尿素转运蛋白,极大地促进了扩散,集合管中高度浓缩的尿素大部分从管腔扩散到髓质间质中。尿素被吸收到肾髓质中,有助于髓质间质的高渗透压和肾脏的高浓缩能力。
从本次讨论中可能不明显看出几个重要的考虑点。首先,尽管氯化钠是导致髓质间质高渗(hyperosmolarity)的主要溶质之一,但在需要时,肾脏可以排出含有少量氯化钠的高度浓缩的尿液。在这种情况下,尿液的高渗性是由于其他溶质的高浓度,特别是尿素等废物。这种情况发生的一个条件是脱水伴随低钠摄入。正如第30章所讨论的,低钠摄入会刺激激素血管紧张素II(angiotensin II)和醛固酮(aldosterone)的形成,这两种激素共同导致肾小管对钠的强烈重吸收,同时留下尿素和其他溶质以维持高度浓缩的尿液。
其次,可以排出大量稀释的尿液而不增加钠的排泄。这一壮举是通过减少抗利尿激素(ADH)的分泌来实现的,这减少了远端肾小管段的水重吸收,而不会显著改变钠的重吸收。
最后,有一个由肾脏的最大浓缩能力和必须排出的溶质量决定的强制性尿量。因此,如果必须排出大量溶质,它们必须伴随着排出这些溶质所需的最少水量。例如,如果每天必须排出600毫渗透摩尔的溶质,如果最大尿液浓缩能力为1200 mOsm/L,则至少需要0.5升尿液。
量化肾脏尿液浓缩和稀释:自由水和渗透清除率
浓缩或稀释尿液的过程要求肾脏相对独立地排出水和溶质。当尿液稀释时,水的排出量超过溶质。相反,当尿液浓缩时,溶质的排出量超过水。
从血液中清除溶质的总量可以表示为渗透清除率(C_osm)。这是每分钟清除溶质的血浆体积,与计算单一物质的清除率相同:
C_osm=\fracU_osm×\dotVP_osm
其中U_osm是尿液渗透压,\dotV是尿流率,P_osm是血浆渗透压。例如,如果血浆渗透压为300mOsm/L,尿液渗透压为600mOsm/L,,尿流率为1ml/min \left(0.001L/min\right),则渗透排泄率为0.6 mOsm/min (600mOsm/L×0.001L/min)),渗透清除率为0.6mOsm/min除以300mOsm/L,即0.002L/min (2.0ml/min))。这意味着每分钟有2毫升血浆被清除溶质。
自由水清除率——溶质和水排出的相对速率
自由水清除率(C_H2O)计算为水排泄(尿流率)和渗透清除率之间的差异:
C_H_20=V-C_0sm=V-\frac\left(U_o s m×\dotV\right)P_o s m
因此,自由水清除率(Free Water Clearance)代表了肾脏排出无溶质水的速率。当自由水清除率为正值时,肾脏正在排出多余的水分;当自由水清除率为负值时,肾脏正在从血液中移除多余的溶质,并保留水分。
以前面讨论的例子为例,如果尿流率为1 ml/min,渗透清除率(osmolar clearance)为2ml/min,则自由水清除率为-1ml/min。这意味着肾脏并没有清除多余的水分,而是将水分返回到体循环中,这种情况通常发生在水分不足时。因此,当尿液渗透压大于血浆渗透压时,自由水清除率为负值,表明水分被保留。
当肾脏形成稀释尿液时(即尿液渗透压 < 血浆渗透压),自由水清除率将为正值,表明肾脏正在从血浆中移除多余的水分。因此,无溶质的水分,即自由水,正在从体内流失,当自由水清除率为正值时,血浆正在被浓缩。
尿液浓缩能力的障碍
肾脏适当浓缩或稀释尿液的能力受损可能由以下一种或多种异常引起:
- ADH(抗利尿激素)分泌不当。ADH分泌过多或过少都会导致肾脏水分排泄异常。
- 逆流机制受损。最大尿液浓缩能力需要高渗的髓质间质。无论ADH的量有多少,最大尿液浓缩能力都受限于髓质间质的高渗程度。
- 远端小管、集合小管和集合管对ADH的反应能力丧失。
ADH生成失败:中枢性尿崩症(Central Diabetes Insipidus)。无法从垂体后叶生成或释放ADH可能是由头部损伤或感染引起的,也可能是先天性的。由于在缺乏ADH的情况下,远端小管段无法重吸收水分,这种情况称为中枢性尿崩症,导致大量稀释尿液的生成,尿量可能超过15升/天。当体内水分过度流失时,本章稍后讨论的口渴机制会被激活;因此,只要患者摄入足够的水分,体液水分的大幅减少就不会发生。临床上观察到的这种病症的主要异常是大量稀释尿液。然而,如果水分摄入受限,例如在医院环境中液体摄入受限或患者昏迷(例如由于头部损伤),可能会迅速发生严重的脱水。
中枢性尿崩症的治疗是给予ADH的合成类似物去氨加压素(desmopressin),它选择性地作用于V_2受体,增加远端小管和集合小管的水分通透性。去氨加压素可以通过注射、鼻喷雾或口服给药,并迅速使尿量恢复正常。
肾脏对ADH无反应:肾性尿崩症(Nephrogenic Diabetes Insipidus)。在某些情况下,ADH水平正常或升高,但肾小管节段无法做出适当反应。这种情况被称为肾性尿崩症,因为异常存在于肾脏。这种异常可能是由于逆流机制未能形成高渗的肾髓质间质,或者远端小管和集合管对ADH无反应所致。无论哪种情况,都会形成大量稀释尿液,除非液体摄入量与尿量增加量相同,否则会导致脱水。
许多类型的肾脏疾病都会损害浓缩机制,尤其是那些损害肾髓质的疾病(详见第32章的进一步讨论)。此外,Henle袢功能受损,如使用抑制该节段电解质重吸收的利尿剂(如furosemide)时,也会损害尿液浓缩能力。此外,某些药物如锂(用于治疗躁郁症)和四环素类(用作抗生素)会损害远端肾单位节段对ADH的反应能力。
肾性尿崩症可以通过给予ADH的合成类似物去氨加压素(desmopressin)与中枢性尿崩症相鉴别。注射去氨加压素后2小时内尿量未迅速减少和尿渗透压未升高,强烈提示肾性尿崩症。肾性尿崩症的适当治疗是尽可能纠正潜在的肾脏疾病。低钠饮食和服用促进肾脏钠排泄的利尿剂(如噻嗪类利尿剂)也可以减轻高钠血症。
细胞外液渗透压和钠浓度的调控
细胞外液渗透压和钠浓度的调节密切相关,因为钠是细胞外液中含量最多的离子。血浆钠浓度通常在140至145 mEq/L的狭窄范围内调节,平均浓度约为142 mEq/L。渗透压平均约为300 mOsm/L(校正离子间吸引力后约为282 mOsm/L),很少变化超过±2%至3%。如第25章所述,这些变量必须精确控制,因为它们决定了细胞内和细胞外液之间的液体分布。
从血浆钠浓度估算血浆渗透压
在大多数临床实验室中,血浆渗透压并不常规测量。然而,由于钠及其伴随的阴离子约占细胞外液溶质的94%,血浆渗透压(Posm)可以根据血浆钠浓度(PNa+)大致估算如下:
P_o s m=2.1×P_N a+(m m o l/L)
例如,当血浆钠浓度为 142mEq/L 时,根据此公式估算的血浆渗透压约为 298mOsm/L。为了更精确,尤其是在与肾脏疾病相关的情况下,通常会包括另外两种溶质(葡萄糖和尿素)的血浆浓度(单位为 mmol/L)的贡献:
P_o s m=2×[P_N a+,m m o l/L]+[P_g l u c o s e,m m o l/L]+[P_u r e a,m m o l/L]
这种血浆渗透压的估算通常与直接测量的结果相差在几个百分点以内。
图 29-9. 渗透压感受器-抗利尿激素 (A D H) 反馈机制,用于调节细胞外液渗透压以应对水分不足。
正常情况下,钠离子及其伴随的阴离子(主要是碳酸氢根和氯离子)约占细胞外渗透压的 94%,而葡萄糖和尿素约占渗透压总量的 3% 到 5%。然而,由于尿素容易通过大多数细胞膜,因此在稳态条件下,它产生的有效渗透压很小。因此,细胞外液中的钠离子及其伴随的阴离子是决定跨细胞膜液体运动的主要因素。因此,我们可以同时讨论渗透压的控制和钠离子浓度的控制。
尽管有多种机制控制肾脏对钠和水的排泄,但有两个主要系统特别参与调节细胞外液的钠浓度和渗透压:(1) 渗透压感受器-ADH 系统;以及 (2) 口渴机制。
渗透压感受器-ADH 反馈系统
图 29-9 展示了渗透压感受器-ADH 反馈系统的基本组成部分,用于控制细胞外液的钠浓度和渗透压。当由于水分不足导致渗透压升高超过正常水平时,该反馈系统的运作如下:
- 细胞外液渗透压的增加(实际上意味着血浆钠浓度的增加)会导致位于下丘脑前部视上核附近的特殊神经细胞(称为渗透压感受器细胞)收缩。
- 渗透压感受器细胞的收缩导致它们放电,向视上核中的其他神经细胞发送神经信号,这些信号随后通过垂体柄传递到垂体后叶。
- 传导到垂体后叶的动作电位刺激 ADH 的释放,ADH 储存在神经末梢的分泌颗粒(或囊泡)中。
- ADH 进入血液并被运输到肾脏,在那里它增加了远端小管、皮质集合管和髓质集合管的水通透性。
- 远端肾单位水通透性的增加导致水的重吸收增加,并排出少量浓缩的尿液。
因此,水被保留,而钠和其他溶质继续通过尿液排出。这导致细胞外液中的溶质被稀释,从而纠正了最初过度浓缩的细胞外液。
当细胞外液变得过于稀释(低渗,hypo-osmotic)时,会发生相反的事件序列。例如,当摄入过多水分导致细胞外液渗透压降低时,抗利尿激素(ADH)的生成减少,肾小管对水的通透性降低,水的重吸收减少,从而形成大量稀释的尿液。这反过来会使体液浓缩,并使血浆渗透压恢复正常。
下丘脑视上核和室旁核中的ADH合成以及垂体后叶的ADH释放
图29-10显示了下丘脑和垂体腺的神经解剖结构,ADH在此处合成并释放。下丘脑包含两种大细胞(magnocellular)神经元,它们在下丘脑的视上核(supraoptic nuclei)和室旁核(paraventricular nuclei)中合成ADH,其中约六分之五在视上核中合成,约六分之一在室旁核中合成。这两个核团都有轴突延伸到垂体后叶。一旦ADH合成,它就会沿着神经元的轴突运输到其末端,终止于垂体后叶。当视上核和室旁核因渗透压升高或其他因素受到刺激时,神经冲动会传递到这些神经末梢,改变其膜通透性并增加钙离子内流。储存在神经末梢分泌颗粒(也称为囊泡,vesicles)中的ADH会因钙离子内流增加而释放。释放的ADH随后被垂体后叶的毛细血管血液带走,进入体循环。ADH对渗透压刺激的分泌反应非常迅速,因此血浆ADH水平可以在几分钟内增加数倍,从而为调节肾脏的水排泄提供了一种快速机制。
另一个在控制渗透压和ADH分泌中起重要作用的神经元区域位于第三脑室的前腹侧区域,称为A V3V区域。该区域的上部有一个称为穹窿下器官(subfornical organ)的结构,下部则有另一个称为终板血管器官(organum vasculosum of the lamina terminalis)的结构。在这两个器官之间是正中视前核(median preoptic nucleus),它与这两个器官以及视上核和脑干中的血压控制中心有多重神经连接。AV3V区域的损伤会导致ADH分泌、口渴、钠食欲和血压控制的多重缺陷。对该区域的电刺激或血管紧张素II(angiotensin II)的刺激可以增加ADH分泌、口渴和钠食欲。
图29-10. 下丘脑的神经解剖结构,抗利尿激素(ADH)在此处合成,以及垂体后叶,ADH在此处释放。
在AV3V区域和视上核附近,有一些神经元细胞会被细胞外液渗透压的微小增加所兴奋,因此这些神经元被称为渗透压感受器(osmoreceptors)。这些细胞向视上核发送神经信号以控制其放电和ADH的分泌。它们也可能在细胞外液渗透压升高时引发口渴。
穹窿下器官(subfornical organ)和终板血管器(organum vasculosum of the lamina terminalis)的血管供应缺乏典型的血脑屏障(blood-brain barrier),这种屏障通常会阻碍大多数离子从血液扩散到脑组织。这一特性使得离子和其他溶质能够在该区域的血液和局部组织液之间进行交换。因此,渗透压感受器(osmoreceptors)能够迅速对细胞外液(osmolarity)的变化作出反应,从而对ADH(抗利尿激素)的分泌和口渴感产生强有力的控制,这一点将在后面讨论。
图29-11. 血浆渗透压(osmolarity)升高或血容量(blood volume)减少对血浆(P)抗利尿激素(A D H)水平的影响,也称为精氨酸加压素(arginine vasopressin, AVP)。(修改自Dunn F L, Brennan T J, Nelson AE, et a/. The role of blood osmolality and volume in regulating vasopressin secretion in the rat. J Clin Invest 52[12]:3212, 1973.)
动脉压降低和/或血容量减少对ADH释放的刺激
ADH的释放还受到心血管反射(cardiovascular reflexes)的控制,这些反射对血压和/或血容量的降低作出反应,包括以下内容:(1) 动脉压力感受器反射(arterial baroreceptor reflexes);(2) 心肺反射(cardiopulmonary reflexes),这两者都在第18章中讨论。这些反射通路起源于循环系统的高压区域,如主动脉弓(aortic arch)和颈动脉窦(carotid sinus),以及低压区域,特别是心房(cardiac atria)。传入刺激由迷走神经(vagus nerve)和舌咽神经(glossopharyngeal nerve)传递,并在孤束核(nuclei of the tractus solitarius)中形成突触。从这些核发出的投射将信号传递到控制ADH合成和分泌的下丘脑核(hypothalamic nuclei)。
因此,除了渗透压升高外,还有两种刺激会增加ADH的分泌:(1) 动脉压降低;(2) 血容量减少。每当血压和血容量降低时,例如在出血期间,ADH分泌的增加会导致肾脏对液体的重吸收增加,从而帮助恢复血压和血容量至正常水平。
表29-2 抗利尿激素分泌的控制
<html><body><table><tr><td>增加ADH</td><td>减少ADH</td></tr><tr><td>↑血浆渗透压</td><td>↓血浆渗透压</td></tr><tr><td>↓血容量</td><td>↑血容量</td></tr><tr><td>↓血压</td><td>↑血压</td></tr><tr><td>恶心</td><td></td></tr><tr><td>缺氧</td><td></td></tr><tr><td>药物</td><td>药物</td></tr><tr><td>吗啡</td><td>酒精</td></tr><tr><td>尼古丁</td><td>可乐定(抗高血压药)</td></tr><tr><td>环磷酰胺</td><td>氟哌啶醇(多巴胺阻断剂)</td></tr></table></body></html>
渗透压和心血管反射在刺激ADH分泌中的定量重要性
如图29-11所示,有效血容量(effective blood volume)的减少或细胞外液(osmolarity)渗透压的增加会刺激抗利尿激素(ADH)的分泌。然而,ADH对渗透压微小变化的敏感性远高于对血容量相似百分比变化的敏感性。例如,血浆渗透压仅变化1%就足以增加ADH水平。相比之下,失血后,血浆ADH水平在血容量减少约10%之前不会有明显变化。随着血容量的进一步减少,ADH水平迅速增加。因此,在血容量严重减少的情况下,心血管反射在刺激ADH分泌中起主要作用。在单纯脱水期间,ADH分泌的日常调节主要通过血浆渗透压的变化来实现。然而,血容量和血压的下降会大大增强ADH对渗透压升高的反应。
其他刺激ADH分泌的因素
ADH分泌还可以通过中枢神经系统(central nervous system)的其他刺激以及各种药物和激素来增加或减少,如表29-2所示。例如,恶心是ADH释放的强效刺激,呕吐后ADH水平可能增加到正常水平的100倍。此外,尼古丁和吗啡等药物会刺激ADH释放,而酒精等药物则会抑制ADH释放。摄入酒精后出现的显著利尿作用部分是由于ADH释放的抑制。
口渴在控制细胞外液渗透压和钠浓度中的重要性
肾脏通过渗透压感受器-ADH反馈系统在水缺乏时尽量减少体液流失。然而,足够的液体摄入是必要的,以抵消通过出汗、呼吸和胃肠道发生的任何体液流失。液体摄入由口渴机制调节,该机制与渗透压感受器-ADH机制一起,精确控制细胞外液渗透压和钠浓度。
表29-3 口渴的控制
<html><body><table><tr><td>增加口渴</td><td>减少口渴</td></tr><tr><td>↑血浆渗透压</td><td>↓血浆渗透压</td></tr><tr><td>↓血容量</td><td>↑血容量</td></tr><tr><td>↓血压</td><td>↑血压</td></tr><tr><td>↑血管紧张素I</td><td>↓血管紧张素II</td></tr><tr><td>口干</td><td>胃扩张</td></tr></table></body></html>
许多刺激ADH分泌的因素也会增加口渴,口渴被定义为对水的有意识需求。
口渴的中枢神经系统中心
再次参考图29-10,促进ADH释放的第三脑室前腹壁区域也会刺激口渴。位于视前核前外侧的另一个小区域在受到电刺激时,会立即引发饮水行为,只要刺激持续,饮水行为就会继续。所有这些区域统称为口渴中枢(thirst center)。
口渴中枢的神经元对高渗盐溶液注射的反应是刺激饮水行为。这些细胞几乎可以肯定地作为渗透压感受器(osmoreceptors)来激活口渴机制,就像渗透压感受器刺激ADH释放一样。
第三脑室中脑脊液渗透压的增加对促进饮水具有基本相同的作用。位于AV3V区域下端脑室表面正下方的终板血管器官(organum vasculosum of the lamina terminalis)很可能密切参与了这一反应的介导。
口渴的刺激
表29-3总结了一些已知的口渴刺激。
- 最重要的刺激之一是细胞外液渗透压的增加,这会导致口渴中心细胞内脱水,从而刺激口渴感。这种反应的价值是显而易见的:它有助于稀释细胞外液并使渗透压恢复正常。
- 细胞外液容量和动脉压的降低也通过一条独立于血浆渗透压增加所刺激的途径来刺激口渴。
因此,失血导致的血液容量减少会刺激口渴,即使血浆渗透压可能没有变化。这种刺激可能是由于循环中心肺和全身动脉压力感受器的神经输入所致。
- 第三个重要的口渴刺激是血管紧张素II(angiotensin II)
动物研究表明,血管紧张素II作用于穹窿下器官(subfornical organ)和终板血管器官(organum vasculosum of the lamina terminalis)。这些区域位于血脑屏障之外,血管紧张素II等肽类物质可以扩散到组织中。由于血管紧张素II也由与低血容量和低血压相关的因素刺激,其对口渴的影响有助于恢复血容量和血压,同时血管紧张素II对肾脏的其他作用减少液体排泄。4. 口腔和食管黏膜的干燥可以引起口渴感。
因此,口渴的人在喝水后几乎立即会感到口渴缓解,即使水尚未从胃肠道吸收,尚未对细胞外液渗透压产生影响。
5. 胃肠道和咽部刺激影响口渴。
在食管开口通向外部、水永远不会被吸收到血液中的动物中,饮水后口渴会部分缓解,尽管这种缓解只是暂时的。此外,胃肠道扩张可能会部分缓解口渴;例如,简单地在胃中充气球可以缓解口渴。然而,通过胃肠道或咽部机制缓解口渴感是短暂的;只有当血浆渗透压和/或血容量恢复正常时,饮水的欲望才会完全得到满足。
动物和人类“计量”液体摄入的能力很重要,因为它可以防止过度水合。一个人喝水后,可能需要30到60分钟才能重新吸收并分布到全身。如果喝水后口渴感没有暂时缓解,这个人会继续喝越来越多的水,最终导致过度水合和体液过度稀释。实验研究一再表明,动物几乎准确地喝下使血浆渗透压和容量恢复正常所需的量。
饮水渗透压刺激的阈值
肾脏必须持续排泄一定量的水分,即使在脱水的人体中也是如此,以清除体内摄入或代谢产生的过量溶质。水分还通过肺部和胃肠道的蒸发以及皮肤的蒸发和出汗而流失。因此,人体总是存在脱水的倾向,导致细胞外液钠浓度和渗透压升高。
当钠浓度仅比正常值高出约2mEq/L时,口渴机制被激活,引发饮水欲望。这被称为饮水阈值。因此,即使血浆渗透压的微小升高,通常也会随之摄入水分,从而使细胞外液的渗透压和体积恢复到正常水平。通过这种方式,细胞外液的渗透压和钠浓度得以精确控制。
口渴和水分摄入的紊乱
如前所述,口渴增加发生在与尿量增加和细胞外液体积减少相关的各种医学疾病中,例如控制不佳的糖尿病或尿崩症。在这些情况下,增加的水分摄入是对血浆渗透压升高和/或细胞外液体积减少的补偿反应。多饮症(polydipsia),即过度口渴,偶尔会在没有已知生理刺激的情况下发生。例如,心因性多饮症(psychogenic polydipsia)可能由精神疾病如精神分裂症或强迫症引起,并可能导致严重的低钠血症。相反,无渴症(adipsia),即即使在高钠血症或体积减少的情况下也缺乏口渴感,虽然罕见,但通常是由于创伤、感染或手术导致的下丘脑口渴中枢损伤所致。部分口渴机制的缺陷,导致水分摄入不足(低渴症,hypodipsia),或无法获取液体的情况可能发生在中风患者、老年痴呆患者或危重患者中。在没有足够水分摄入的情况下,尽管抗利尿激素(ADH)水平大幅升高,仍会发生脱水和高钠血症。
渗透感受器-ADH与口渴机制的综合反应
在健康人体中,渗透感受器-ADH和口渴机制并行工作,以精确调节细胞外液的渗透压和钠浓度,尽管面临持续的脱水挑战。即使面对额外的挑战,如高盐摄入,这些反馈系统通常也能保持血浆渗透压的相对稳定。图29-12显示,只要ADH和口渴机制都正常运作,钠摄入量增加到正常值的六倍时,对血浆钠浓度的影响也很小。
当抗利尿激素(ADH)或口渴机制失效时,通常另一个机制仍能有效控制细胞外液渗透压和钠浓度,只要摄入足够的液体来平衡每日必需的尿量和由呼吸、出汗或胃肠道损失引起的水分流失。然而,如果ADH和口渴机制同时失效,血浆钠浓度和渗透压的控制就会很差。因此,当在阻断整个ADH-口渴系统后增加钠摄入量时,血浆钠浓度会发生相对较大的变化。在缺乏ADH-口渴机制的情况下,没有其他反馈机制能够充分调节血浆钠浓度和渗透压。
血管紧张素II和醛固酮在控制细胞外液渗透压和钠浓度中的作用
如第28章所述,血管紧张素II和醛固酮在调节肾小管对钠的重吸收中起着重要作用。当钠摄入量低时,这些激素水平的增加会刺激肾脏对钠的重吸收,并防止大量钠的流失,即使钠摄入量可能降至正常的10%。相反,当钠摄入量高时,这些激素的形成减少使肾脏能够排出大量的钠。
图29-12. 在正常条件下(红线)和抗利尿激素(A D H)及口渴反馈系统被阻断后(蓝线),钠摄入量大幅变化对狗细胞外液钠浓度的影响。注意,在缺乏这些反馈系统的情况下,细胞外液钠浓度的控制较差。(由David B. Young博士提供)
由于血管紧张素II和醛固酮在调节肾脏钠排泄中的重要性,人们可能会错误地推断它们在调节细胞外液钠浓度中也起主要作用。尽管这些激素增加了细胞外液中的钠量,但它们也通过增加与钠一起的水的重吸收来增加细胞外液体积。因此,除了在极端条件下,血管紧张素II和醛固酮对钠浓度的影响很小。
醛固酮在调节细胞外液钠浓度中的相对不重要性的实验如图29-13所示。该图显示了在两种情况下钠摄入量变化超过六倍对血浆钠浓度的影响:(1) 在正常情况下;(2) 在通过切除肾上腺并以恒定速率输注醛固酮阻断醛固酮反馈系统后,使血浆水平无法增加或减少。注意,当钠摄入量增加六倍时,血浆浓度在两种情况下仅变化约1%至2%。这一发现表明,即使没有功能性醛固酮反馈系统,血浆钠浓度也能得到良好调节。在阻断血管紧张素II形成后进行了相同类型的实验,结果相同。
图 29-13. 在正常条件下(红线)和醛固酮反馈系统被阻断后(蓝线),钠摄入量大幅变化对狗细胞外液钠浓度的影响。请注意,无论有无醛固酮反馈控制,钠浓度在这一广泛的钠摄入范围内都保持相对恒定。(由 David B. Young 博士提供)
血管紧张素 II 和醛固酮的变化对血浆钠浓度没有显著影响的原因主要有两个。首先,如前所述,血管紧张素 II 和醛固酮会增加肾小管对钠和水的重吸收,导致细胞外液体积和钠量的增加,但钠浓度的变化很小。其次,只要 ADH-口渴机制(ADH-thirst mechanism)正常运作,任何血浆钠浓度升高的趋势都会被增加的水摄入或血浆 ADH 分泌的增加所补偿,从而使细胞外液稀释回正常水平。在正常情况下,ADH-口渴系统远远超过了血管紧张素 II 和醛固酮系统对钠浓度的调节作用。即使在原发性醛固酮增多症患者中,尽管醛固酮水平极高,血浆钠浓度通常也仅比正常值高出约 3 至 5 mEq/L。
在极端情况下,如因肾上腺切除术导致醛固酮分泌完全丧失或 Addison 病(醛固酮分泌严重受损或完全缺乏)患者中,肾脏会大量丢失钠,这可能导致血浆钠浓度显著降低。其中一个原因是,钠的大量丢失最终会导致严重的容量不足和血压下降,从而通过心血管反射激活口渴机制。这种激活会导致血浆钠浓度的进一步稀释,尽管增加的水摄入有助于在这些情况下尽量减少体液容量的减少。
因此,在某些极端情况下,即使 ADH-口渴机制正常运作,血浆钠浓度也可能发生显著变化。即便如此,ADH-口渴机制仍然是体内控制细胞外液渗透压和钠浓度的最强大的反馈系统。
控制细胞外液钠浓度和体积的盐食欲机制(Salt-Appetite Mechanism)
维持正常的细胞外液体积和钠浓度需要钠排泄和钠摄入之间的平衡。目前,钠摄入量几乎总是超过维持稳态所需的量。事实上,在工业化文化中食用加工食品的人平均钠摄入量通常在 100 至 200 mEq/天之间,尽管人类在仅摄入 10 至 20 mEq/天的情况下仍能正常生存和运作。因此,大多数人摄入的钠远远超过了维持稳态所需的量,且有证据表明,我们通常的高钠摄入可能对心血管疾病(如高血压)的发生有贡献。
对盐的食欲(salt appetite)部分是由于动物和人类喜欢盐并食用它,无论他们是否缺乏盐。对盐的食欲也有一个调节成分,当体内存在钠缺乏时,有一种行为驱动力去获取盐。这种行为驱动力在草食动物中尤为重要,因为它们天然食用低钠饮食,但对盐的渴望在人类中也可能很重要,特别是在那些极度缺乏钠的人中,例如Addison病患者。在这种情况下,醛固酮(aldosterone)分泌不足,导致尿液中钠的过度流失,并导致细胞外液体积减少和钠浓度降低;这两种变化都会引发对盐的渴望。
一般来说,增加对盐的食欲的主要刺激是与钠缺乏和血容量减少或与循环不足相关的血压降低相关的刺激。
对盐的食欲的神经元机制类似于口渴机制。大脑AV3V区域的一些相同神经元中心似乎参与其中,因为该区域的病变经常同时影响动物的口渴和对盐的食欲。此外,由低血压或血容量减少引起的循环反射同时影响口渴和对盐的食欲。
30 钾、钙、磷酸盐和镁的肾脏调节;血容量和细胞外液容量控制的肾脏机制整合
细胞外液钾浓度和钾排泄的调节
细胞外液钾浓度通常调节在约4.2mEq/L,很少上升或下降超过\pm0.3mEq/L。这种精确的控制是必要的,因为许多细胞功能对细胞外液钾浓度的变化非常敏感。例如,血浆钾浓度仅增加3到4mEq/L就可能导致心律失常,更高的浓度可能导致心脏骤停或颤动。
调节细胞外钾浓度的一个特殊困难是,超过98%的全身钾存在于细胞内,只有2%存在于细胞外液中(图30-1)。对于一个70-kg的成年人,其细胞内液约为28升(体重的40%),细胞外液约为14升(体重的20%),细胞内约有3920mEq的钾,而细胞外液中只有约59mEq的钾。此外,一餐中的钾含量可能高达50mEq,每日摄入量通常在50到200mEq/day之间;因此,如果不能迅速清除细胞外液中的摄入钾,可能会导致危及生命的高钾血症(血浆钾浓度增加)。同样,如果没有迅速和适当的补偿反应,细胞外液中钾的少量损失可能会导致严重的低钾血症(血浆钾浓度低)。
维持钾摄入和排泄之间的平衡主要依赖于肾脏的排泄,因为粪便中排泄的钾量仅为钾摄入量的约5%到10%。因此,维持正常的钾平衡需要肾脏根据摄入量的广泛变化迅速而精确地调整其钾排泄,这对大多数其他电解质也是如此。
控制钾在细胞外和细胞内区室之间的分布也在钾稳态中起着重要作用。由于超过98%的全身钾存在于细胞内,它们可以作为高钾血症期间过量细胞外液钾的溢出场所,或在低钾血症期间作为钾的来源。因此,钾在细胞内和细胞外液区室之间的重新分布提供了对抗细胞外液钾浓度变化的第一道防线。
内部钾分布的调节
摄入富含钾的膳食后,如果摄入的钾不能迅速进入细胞,细胞外液钾浓度将上升到危险水平。例如,如果摄入的40 mEq钾(富含蔬菜和水果的膳食中的钾含量)全部留在细胞外液中,吸收到14升的细胞外液体积中,血浆钾浓度将增加约2.9 mEq/L。幸运的是,大部分摄入的钾会迅速进入细胞,直到肾脏能够排除多余的钾。在餐间,血浆钾浓度也几乎保持恒定,因为细胞释放钾以平衡肾脏排出的细胞外液钾。表30-1总结了一些可以影响钾在细胞内和细胞外液之间分布的因素。
图 30-1. 正常钾摄入量、体液中的钾分布以及钾的排出。
表30-1 可以改变细胞内和细胞外液之间钾分布的因素
<html><body><table><tr><td>使K+进入细胞的因素(降低细胞外[K+])</td><td>使K+离开细胞的因素(增加细胞外[K+])</td></tr><tr><td>胰岛素</td><td>胰岛素缺乏(糖尿病)</td></tr><tr><td>醛固酮</td><td>醛固酮缺乏(Addison病)</td></tr><tr><td>β-肾上腺素能刺激</td><td>β-肾上腺素能阻滞</td></tr><tr><td>碱中毒</td><td>酸中毒 细胞溶解 剧烈运动 细胞外液渗透压增加</td></tr></table></body></html>
胰岛素刺激钾进入细胞。胰岛素刺激许多组织中的钠-钾腺苷三磷酸酶(ATPase)活性,包括骨骼肌,从而将钾转运到细胞内。胰岛素在餐后增加细胞钾摄取方面非常重要。在胰岛素缺乏的糖尿病患者中,餐后血浆钾浓度的升高比正常人要大得多。然而,注射胰岛素可以帮助纠正高钾血症。
醛固酮增加钾进入细胞
钾摄入增加也会刺激醛固酮的分泌,从而增加细胞钾的摄取。醛固酮分泌过多(Conn综合征)几乎总是与低钾血症相关,部分原因是细胞外钾进入细胞内。相反,醛固酮生成不足的患者(Addison病)通常由于细胞外钾的积累以及肾脏对钾的保留而出现临床显著的高钾血症。
\sf\sf\sf\sf\sf\beta -肾上腺素能刺激增加细胞对钾的摄取。儿茶酚胺分泌增加,尤其是肾上腺素,可以通过激活\upbeta_2 -肾上腺素能受体导致钾从细胞外液进入细胞内液。相反,使用\upbeta -肾上腺素能受体阻滞剂(如普萘洛尔)治疗高血压会导致钾从细胞内移出,并倾向于引起高钾血症。
酸碱异常可以引起钾分布的改变。代谢性酸中毒(metabolic acidosis)会增加细胞外液钾浓度,部分原因是导致细胞内钾的丢失,而代谢性碱中毒(metabolic alkalosis)则会降低细胞外液钾浓度。虽然氢离子浓度对钾在细胞内分布的影响机制尚未完全阐明,但氢离子浓度增加的一个效应是降低Na+-K+ ATPase泵的活性。这种降低反过来会减少细胞对钾的摄取,并提高细胞外液钾浓度。碱中毒则有相反的作用,使钾从细胞外液转移到细胞内,并倾向于引起低钾血症(hypokalemia)。
细胞溶解导致细胞外液钾浓度增加。当细胞被破坏时,细胞内的大量钾会释放到细胞外液中。如果大量组织被破坏,如严重的肌肉损伤或红细胞溶解,这种钾的释放会导致显著的高钾血症(hyperkalemia)。
剧烈运动可通过从骨骼肌释放钾而引起高钾血症。在长时间运动期间,钾从骨骼肌释放到细胞外液中。通常高钾血症是轻微的,但在剧烈运动后可能具有临床意义,特别是在接受\upbeta -肾上腺素能阻滞剂治疗的患者或胰岛素缺乏的个体中。在极少数情况下,运动后的高钾血症可能严重到足以引起心脏毒性。
细胞外液渗透压增加导致钾从细胞向细胞外液重新分布。细胞外液渗透压增加会导致水从细胞中渗透流出。细胞脱水会增加细胞内钾浓度,从而促进钾从细胞中扩散出来,并增加细胞外液钾浓度。细胞外液渗透压降低则有相反的作用。
肾脏钾排泄概述
肾脏钾排泄由三个过程的总和决定:(1) 钾的滤过率(glomerular filtration rate [GFR]乘以血浆钾浓度);(2) 肾小管对钾的重吸收率;(3) 肾小管对钾的分泌率。肾小球毛细血管对钾的正常滤过率约为756 mEq/天(GFR为180 L/天,乘以血浆钾浓度4.2mEq/L)。由于之前讨论的GFR的自我调节机制以及血浆钾浓度调节的精确性,健康人的滤过率相对恒定。然而,在某些肾脏疾病中,GFR的严重下降可能导致严重的钾积累和高钾血症。
图 30-2. 肾小管中钾的重吸收和分泌部位。钾在近端小管和Henle袢升支被重吸收,因此只有约8%的滤过负荷被输送到远端小管。远端小管和集合管的主细胞分泌钾,增加了输送量,但间质细胞还会进行一些额外的重吸收;因此,每日排泄量约为肾小球毛细血管滤过的钾的12%。百分比表示滤过负荷在不同小管段中被重吸收或分泌的比例。
图30-2总结了正常条件下钾的肾小管处理。约65%的滤过钾在近端小管被重吸收。另外25%至30%的滤过钾在Henle袢中被重吸收,特别是在粗升支,钾与钠和氯一起被主动共转运。在近端小管和Henle袢中,滤过钾负荷的相对恒定部分被重吸收。这些段中钾重吸收的变化可以影响钾的排泄,但每日钾排泄的大部分变化并非由于近端小管或Henle袢中重吸收的变化。集合小管和集合管以可变速率重吸收钾,取决于钾的摄入量。
远端和集合小管中可变的钾分泌介导了大多数每日钾排泄的变化。调节钾排泄的最重要部位是远端小管和皮质集合小管的主细胞。在这些小管段中,钾有时可以被重吸收,有时可以被分泌,取决于身体的需要。在正常钾摄入量为100mEq/天的情况下,肾脏必须排泄约92 mEq/天(剩余的8mEq通过粪便排出)。约60 mEq/天的钾被分泌到远端和集合小管中,占排泄钾的大部分。
图 30-3. 远端和集合小管主细胞中钾分泌和钠重吸收的机制。BK,“大”钾通道;ENaC,上皮钠通道;ROMK,肾外髓钾通道。
在高钾摄入的情况下,所需的额外钾排泄几乎完全通过增加远端和集合小管中钾的分泌来实现。事实上,在那些摄入极高钾饮食的人中,钾的排泄速率可以超过肾小球滤液中的钾量,表明存在一种强大的钾分泌机制。
当钾摄入量低时,远端和集合小管中钾的分泌减少,导致尿钾排泄减少。肾单位远端段的间质细胞也会增加钾的重吸收,钾排泄量可以降至肾小球滤液中钾的1%以下(至<10mEq/day)。当钾摄入量低于此水平时,可能会出现严重的低钾血症。
因此,钾的日常排泄调节主要发生在远端小管和皮质集合管(cortical collecting tubules)的末端,在这里钾可以根据身体的需要被重吸收或分泌。在下一节中,我们将讨论钾分泌的基本机制以及调节这一过程的因素。
远端小管和皮质集合管的主细胞(principal cells)分泌钾
在远端小管和皮质集合管末端分泌钾的细胞称为主细胞(principal cells),它们构成了这些区域的大部分上皮细胞。图30-3展示了主细胞分泌钾的基本细胞机制。
钾从血液进入管腔的分泌是一个两步过程,首先是通过基底外侧细胞膜上的Na+-K+ ATP酶泵(ATPase pump)从间质(interstitium)摄取到细胞内。该泵将钠从细胞中移出到间质,同时将钾移入细胞内。
该过程的第二步是钾从细胞内被动扩散到管腔液(tubular fluid)中。Na+-K+ ATP酶泵产生高细胞内钾浓度,这为钾从细胞被动扩散到管腔提供了驱动力。主细胞的管腔膜对钾具有高度通透性,因为有两种特殊的通道允许钾离子快速通过膜扩散:(1) 肾外髓钾通道(renal outer medullary potassium, ROMK channels),和 (2) 高电导、“大”钾通道(high-conductance, "big" potassium, BK channels)。这两种钾通道都是高效肾脏钾排泄所必需的,并且在高钾摄入期间它们在管腔膜中的丰度会增加。
主细胞对钾分泌的调控
控制远端小管和皮质集合管主细胞钾分泌的主要因素如下:(1) Na+-K+ ATP酶泵的活性;(2) 从血液到管腔的钾分泌的电化学梯度(electrochemical gradient);以及 (3) 管腔膜对钾的通透性(permeability)。这三个钾分泌的决定因素又受到多种因素的调控,这些因素将在后面讨论。
间质细胞(intercalated cells)可以重吸收或分泌钾
在与严重钾耗竭相关的情况下,钾分泌会停止,并且在远端小管和集合管末端会发生钾的净重吸收(net reabsorption)。这种重吸收通过A型间质细胞(type A intercalated cells)发生。尽管这一重吸收过程尚未完全理解,但被认为参与其中的一种机制是位于管腔膜上的氢-钾ATP酶转运机制(hydrogen-potassium ATPase transport mechanism)(见第28章,图28-13)。该转运体重吸收钾以交换分泌到管腔中的氢离子,然后钾通过基底外侧膜钾通道扩散到间质液中。这种间质细胞氢-钾ATP酶转运体的丰度在钾耗竭和低钾血症(hypokalemia)时增加,导致氢离子分泌增加和碱中毒(alkalosis)。然而,在正常情况下,间质细胞的钾重吸收在控制钾排泄中只起很小的作用。
当体液中的钾过量时,晚期远端小管和集合管中的B型闰细胞(intercalated cells)会主动将钾分泌到管腔中,其功能与A型细胞相反(参见第28章,图28-13)。钾通过基底外侧膜上的氢钾ATP酶转运体被泵入B型闰细胞,然后通过钾通道扩散到管腔中。
图 30-4. 血浆醛固酮浓度(红线)和细胞外钾离子浓度(黑线)对尿钾排泄率的影响。这些因素刺激皮质集合管主细胞(principal cells)的钾分泌。(数据来自Young DB, Paulsen AW: Interrelated effects of aldosterone and plasma potassium on potassium excretion. Am J Physiol 244:F28, 1983.)
调节钾分泌的主要因素总结
由于钾排泄的正常调节主要是通过晚期远端小管和集合管主细胞的钾分泌变化实现的,因此在本章中我们讨论影响这些细胞分泌的主要因素。刺激主细胞钾分泌的最重要因素包括以下内容:(1)细胞外液钾浓度增加;(2)醛固酮增加;(3)管腔流速增加。
减少钾分泌的一个因素是氢离子浓度增加(酸中毒)。
细胞外液钾浓度增加刺激钾分泌。晚期远端小管和皮质集合管中的钾分泌速率直接受到细胞外液钾浓度增加的刺激,从而导致钾排泄增加,如图30-4所示。当细胞外液钾浓度上升到约4.1mEq/L以上时,这种效应尤为显著,略高于正常浓度。因此,血浆钾浓度增加是增加钾分泌和调节细胞外液钾离子浓度的重要机制之一。
饮食钾摄入增加和细胞外液钾浓度增加通过至少四种机制刺激钾分泌:
- 细胞外液钾浓度增加刺激Na+-K+ ATP酶泵,从而增加钾通过基底外侧膜的摄取。这种增加的钾摄取反过来增加了细胞内钾离子浓度,导致钾通过管腔膜扩散到小管中。
- 细胞外钾浓度增加增加了从肾间质液到上皮细胞内部的钾梯度,从而减少了钾离子从细胞内部通过基底外侧膜的反向泄漏。
- 钾摄入增加刺激钾通道的合成及其从细胞质到管腔膜的转运,从而增加了钾通过膜的扩散。
- 钾离子浓度的增加刺激肾上腺皮质分泌醛固酮(aldosterone),这进一步刺激钾离子的分泌,如下所述。
醛固酮刺激钾离子分泌。醛固酮刺激远端小管和集合管(collecting ducts)的主细胞(principal cells)主动重吸收钠离子(见第28章)。这种效应是通过Na+-K+ ATP酶泵介导的,该泵将钠离子通过细胞的基底外侧膜(basolateral membrane)向外转运至肾间质液(renal interstitial fluid),同时将钾离子泵入细胞内。因此,醛固酮对控制主细胞分泌钾离子和重吸收钠离子的速率也有强大的影响。
醛固酮的第二个作用是增加管腔膜(luminal membrane)中钾离子通道的数量,从而提高其对钾离子的通透性,进一步增强醛固酮刺激钾离子分泌的效果。因此,醛固酮对增加钾离子排泄具有强大的作用,如图30-4所示。
细胞外钾离子浓度增加刺激醛固酮分泌。在负反馈控制系统中,被控制的因子通常对控制器有反馈作用。在醛固酮-钾离子控制系统中,肾上腺分泌醛固酮的速率受到细胞外液钾离子浓度的强烈控制。图30-5显示,血浆钾离子浓度增加约3mEq/L可以使血浆醛固酮浓度从接近0增加到高达60 ng/100ml,这一浓度几乎是正常水平的10倍。
钾离子浓度刺激醛固酮分泌的效应是调节钾离子排泄的强大反馈系统的一部分,如图30-6所示。在这个反馈系统中,血浆钾离子浓度的增加刺激醛固酮分泌,从而增加血浆醛固酮浓度(模块1)。血浆醛固酮的增加随后导致肾脏钾离子排泄的显著增加(模块2)。钾离子排泄的增加又将细胞外液钾离子浓度降低回正常水平(循环3和模块4)。因此,当钾离子摄入增加时,这种反馈机制与细胞外钾离子浓度升高的直接效应协同作用,以提高钾离子排泄(图30-7)。
图30-5。细胞外液钾离子浓度对血浆醛固酮浓度的影响。注意,钾离子浓度的微小变化会引起醛固酮浓度的显著变化。
图30-6。醛固酮(A/d)控制细胞外液钾离子浓度的基本反馈机制。
阻断醛固酮反馈系统会严重损害钾的调节
在醛固酮分泌缺失的情况下,如Addison病患者,肾脏的钾分泌功能受损,从而导致细胞外液钾浓度升高到危险水平。相反,醛固酮分泌过多(原发性醛固酮增多症)会显著增加钾的分泌,导致肾脏钾丢失,从而引起低钾血症。
图 30-7. 高钾摄入增加钾排泄的主要机制。注意,血浆钾浓度升高直接增加皮质集合管的钾分泌,并通过提高血浆醛固酮浓度间接增加钾分泌。
图 30-8. 在正常条件下(红线)和醛固酮反馈被阻断后(蓝线),钾摄入量大幅变化对血浆钾浓度的影响。注意,在阻断醛固酮系统后,钾浓度的调节受到严重损害。(由Dr. David B. Young提供)
除了对肾脏钾分泌的刺激作用外,醛固酮还增加细胞对钾的摄取。这有助于强大的醛固酮-钾反馈系统,如前所述。
醛固酮反馈系统在控制钾浓度中的特殊定量重要性如图30-8所示。在这个实验中,钾摄入量在两种情况下几乎增加了七倍:(1)在正常情况下;(2)在醛固酮反馈系统被阻断后,通过切除肾上腺并以固定速率输注醛固酮,使血浆醛固酮浓度保持在正常水平,但在钾摄入量变化时既不能增加也不能减少。
图 30-9. 皮质集合管中的流速与钾分泌之间的关系以及钾摄入量变化的影响。注意,高钾饮食显著增强了增加管流速以增加钾分泌的效果。阴影条显示了大多数生理条件下的大致正常管流速。(数据来自Malnic G, Berliner RW, Giebisch G: Flow dependence of K+ secretion in cortical distal tubes of the rat. Am J Physiol 256:F932, 1989.)
注意,在正常动物中,钾摄入量增加七倍仅导致血浆钾浓度从4.2略微增加到4.3mEq/L。因此,当醛固酮反馈系统正常工作时,尽管钾摄入量发生大幅变化,钾浓度仍能得到精确控制。
当醛固酮反馈系统被阻断时,相同程度的钾摄入增加会导致血浆钾浓度显著升高,从3.8增加到接近4.7mEq/L。因此,当醛固酮反馈系统被阻断时,钾浓度的控制会受到严重损害。在醛固酮反馈系统功能不良的人群中,如原发性醛固酮增多症(醛固酮过多)或Addison病(醛固酮过少)患者,也会观察到类似的钾调节障碍。
远端小管流速增加刺激钾分泌 远端小管流速的增加,如发生在容量扩张、高钠摄入或某些利尿剂治疗时,会刺激钾分泌(图30-9)。相反,由钠耗竭引起的远端小管流速降低会减少钾分泌。
远端小管和集合管流速对钾分泌的影响受钾摄入的强烈影响。当钾摄入量高时,增加的小管流速对刺激钾分泌的作用比钾摄入量低时大得多(见图30-9)。
高流速对增加钾分泌主要有两种影响:
- 当钾分泌到小管液中时,管腔内的钾浓度增加,从而减少了钾跨管腔膜扩散的驱动力。随着小管流速的增加,分泌的钾不断被冲刷到小管中,最大限度地减少了小管钾浓度的上升,并增加了净钾分泌。
图 30-10. 高钠摄入对肾脏钾排泄的影响。注意,高钠饮食会降低血浆醛固酮,从而倾向于减少皮质集合管的钾分泌。然而,高钠饮食同时增加了皮质集合管的液体输送,这倾向于增加钾分泌。高钠饮食的相反效应相互抵消,因此钾排泄几乎没有变化。GFR,肾小球滤过率。
- 高小管流速还会增加管腔膜中高电导BK通道的数量。尽管BK通道通常是静息的,但它们会因流速的增加而被激活,从而大大增加钾跨管腔膜的电导。
增加的小管流量在钠摄入量变化期间对维持正常的钾排泄( potassium excretion )尤为重要。例如,在高钠摄入时,醛固酮( aldosterone )分泌减少,这本身会倾向于降低钾的分泌速率,从而减少尿中钾的排泄。然而,高钠摄入时伴随的远端小管高流量倾向于增加钾的分泌(图30-10)。因此,高钠摄入的两个效应——醛固酮分泌减少和小管流量增加——相互抵消,因此钾排泄几乎没有变化。同样,在低钠摄入时,由于醛固酮分泌增加和小管流量减少对钾分泌的抵消效应,钾排泄也几乎没有变化。
急性酸中毒( acidosis )减少钾的分泌。细胞外液氢离子浓度( hydrogen ion concentration )的急性增加(酸中毒)会减少钾的分泌,而氢离子浓度的减少(碱中毒( alkalosis ))会增加钾的分泌。氢离子浓度增加抑制钾分泌的主要机制是通过降低Na+-K+ ATPase泵的活性。这种降低反过来减少了细胞内钾的浓度,并减少了钾通过管腔膜( luminal membrane )进入小管的被动扩散( passive diffusion )。酸中毒还可能减少管腔膜上的钾通道数量。
在持续数天的更长时间的酸中毒中,尿中钾的排泄会增加。这种效应的机制部分是由于慢性酸中毒抑制了近端小管( proximal tubule )对氯化钠和水的重吸收( reabsorption ),从而增加了远端小管的流量,进而刺激了钾的分泌。这种效应超过了氢离子对Na+-K+ ATPase泵的抑制作用。因此,慢性酸中毒导致钾的丢失,而急性酸中毒则导致钾排泄减少。
高钾低钠饮食的益处
在人类历史的大部分时间里,与现代典型饮食相比,典型的饮食是低钠高钾的。在未经历工业化的孤立人群中,例如生活在巴西北部亚马逊地区的Yanomamo部落,钠的摄入量可能低至10至20 mmol/天,而钾的摄入量可能高达200 mmol/天。这种摄入量是由于他们食用大量水果和蔬菜且不含加工食品的饮食。食用这种饮食的人群通常不会经历与年龄相关的血压升高和心血管疾病。
随着工业化和加工食品消费的增加,这些食品通常含有高钠和低钾,钠的摄入量显著增加,而钾的摄入量显著减少。在大多数工业化国家,钾的平均摄入量仅为30至70 mmol/天,而钠的平均摄入量为140至180 mmol/天。
实验和临床研究表明,高钠低钾饮食会增加高血压及相关心血管和肾脏疾病的风险。然而,富含钾的饮食似乎能够抵御高钠饮食的不良影响,降低血压以及中风、冠状动脉疾病和肾脏疾病的风险。增加钾摄入的有益效果在与低钠饮食结合时尤为明显。
多个组织发布的饮食指南建议将氯化钠的膳食摄入量减少至约65至100 mmol/天(相当于1.5-2.3 g/天的钠或3.8-5.8 g/天的氯化钠),同时将健康成人的钾摄入量增加至120 mmol/天(4.7 g/天)。
肾脏钙排泄和细胞外钙离子浓度的调节
钙离子浓度的调节机制在第80章中详细讨论,同时还包括钙调节激素(parathyroid hormone, PTH)和降钙素(calcitonin)的内分泌学。因此,本章仅简要讨论钙离子的调节。
细胞外液钙离子浓度通常严格控制在正常水平的几个百分点内,即2.4 mEq/L。当钙离子浓度下降到低水平(低钙血症)时,神经和肌肉细胞的兴奋性显著增加,在极端情况下可能导致低钙性手足搐搦。这种情况以痉挛性骨骼肌收缩为特征。高钙血症(钙浓度增加)会抑制神经肌肉的兴奋性,并可能导致心律失常。
血浆中总钙的约50%(5 mEq/L)以离子形式存在,这是细胞膜上具有生物活性的形式。其余部分与血浆蛋白结合(约40%)或以非离子形式与磷酸盐和柠檬酸盐等阴离子复合(约10%)。
血浆氢离子浓度的变化会影响钙与血浆蛋白的结合。在酸中毒时,较少的钙与血浆蛋白结合。相反,在碱中毒时,更多的钙与血浆蛋白结合。因此,碱中毒患者更容易发生低钙性手足搐搦。
与体内的其他物质一样,钙的摄入必须与长期的钙净损失相平衡。然而,与钠和氯等离子不同,大部分钙的排泄发生在粪便中。通常的膳食钙摄入量约为1000 mg/天,其中约900 mg/天的钙通过粪便排泄。在某些情况下,粪便钙排泄可能超过钙的摄入,因为钙也可以分泌到肠腔中。因此,胃肠道以及影响肠道钙吸收和分泌的调节机制在钙稳态中起着重要作用,如第80章所述。
体内几乎所有的钙(99%)都储存在骨骼中,只有约0.1%在细胞外液中,1.0%在细胞内液和细胞器中。因此,骨骼作为钙的大型储存库,并在细胞外液钙浓度趋于下降时作为钙的来源。
骨骼摄取和释放钙的最重要调节因子之一是PTH。当细胞外液钙浓度低于正常水平时,甲状旁腺细胞膜上的钙感应受体(calcium-sensing receptors, CSRs)活性降低,促进PTH分泌增加。这种激素直接作用于骨骼,增加骨盐的重吸收(从骨骼中释放盐类),并将大量钙释放到细胞外液中,从而使钙水平恢复到正常水平。当钙离子浓度升高时,甲状旁腺细胞的CSR活性被刺激,导致PTH分泌减少,因此几乎不发生骨吸收;相反,多余的钙沉积在骨骼中。因此,钙离子浓度的日常调节在很大程度上是由PTH对骨吸收的影响介导的。
图 30-11. 由甲状旁腺激素(PTH)和维生素D介导的对血浆离子钙浓度降低的补偿反应。
然而,骨骼中的钙供应并不是无限的。因此,从长期来看,钙的摄入必须与胃肠道和肾脏的钙排泄相平衡。在这两个部位,钙重吸收的最重要调节因子是PTH,它通过三种主要效应调节血浆钙浓度:(1) 通过刺激骨吸收;(2) 通过刺激维生素D_\i的活化,从而增加肠道对钙的重吸收;(3) 通过增加肾小管对钙的重吸收(图30-11)。胃肠道钙重吸收和骨骼中钙交换的控制在其他地方讨论;本节其余部分将重点讨论控制肾脏钙排泄的机制。
肾脏对钙排泄的控制
钙在肾脏中被过滤和重吸收,但不被分泌。因此,肾脏钙排泄率的计算公式如下:
肾脏钙排泄 = 过滤的钙 − 重吸收的钙
血浆中只有约60%的钙是离子化的,40%与血浆蛋白结合,10%与磷酸盐等阴离子复合。因此,只有约60%的血浆钙在肾小球中被过滤。正常情况下,约99%的过滤钙被肾小管重吸收,只有约1%的过滤钙被排泄。约65%的过滤钙在近端小管中被重吸收,25%至30%在Henle袢中被重吸收,4%至9%在远端小管和集合管中被重吸收。这种重吸收模式与钠的重吸收模式相似。
图 30-12. 近端小管细胞中通过旁细胞途径和跨细胞途径重吸收钙的机制。
与其他离子一样,钙的排泄会根据身体的需要进行调整。随着钙摄入量的增加,肾脏钙排泄也会增加,尽管大部分增加的钙摄入量通过粪便排出。在钙缺乏的情况下,由于肾小管重吸收增强,肾脏的钙排泄减少。
近端小管钙重吸收
近端小管中的钙重吸收主要通过细胞旁途径(paracellular pathway)进行;钙溶解在水中,并随着重吸收的液体在细胞之间流动而被携带。只有约20%的近端小管钙重吸收通过跨细胞途径(transcellular pathway)进行,分为两个步骤:
- 钙从管腔通过电化学梯度扩散进入细胞,这是由于管腔中的钙浓度远高于上皮细胞质中的钙浓度,并且细胞内部相对于管腔带有负电荷。
- 钙通过钙-ATP酶泵(calcium-ATPase pump)和钠钙交换体(sodium-calcium counter-transporter)穿过基底外侧膜离开细胞(图30-12)。
这种主动转运的机制与近端小管和髓袢升支粗段(thick ascending limb)中的机制相似。它涉及通过钙通道穿过管腔膜的扩散,以及通过钙-ATP酶泵和钠钙交换机制穿过基底外侧膜的排出。在这一段以及Henle袢中,PTH(甲状旁腺激素)刺激钙的重吸收。维生素D(骨化三醇)和降钙素也刺激Henle袢升支粗段和远端小管中的钙重吸收,尽管这些激素在减少肾脏钙排泄方面的定量作用不如PTH重要。
小管钙重吸收的调节
肾小管钙重吸收的主要调节因子之一是PTH。PTH水平的增加刺激Henle袢升支粗段和远端小管中的钙重吸收,从而减少尿中钙的排泄。相反,PTH的减少通过减少Henle袢和远端小管中的重吸收促进钙的排泄。
细胞外液钙离子浓度的增加也直接刺激钙敏感受体(CSRs),从而抑制Henle袢升支粗段中的钙重吸收。相反,钙浓度的降低减少CSR的活性,并增加Henle袢升支粗段中的钙重吸收。
在近端小管中,钙重吸收通常与钠和水的重吸收平行,并且独立于PTH。因此,在细胞外液扩张或动脉压增加的情况下——这两种情况都会减少近端小管中钠和水的重吸收——钙重吸收也会减少,从而导致尿中钙排泄增加。相反,细胞外液减少或血压降低时,钙排泄减少主要是由于近端小管重吸收增加。
另一个影响钙重吸收的因素是血浆磷酸盐浓度。血浆磷酸盐的增加刺激PTH,从而增加肾小管对钙的重吸收,减少钙的排泄。血浆磷酸盐浓度降低时则发生相反的情况。
Henle袢和远端小管钙重吸收。在Henle袢中,钙重吸收仅限于粗升支。粗升支中约50%的钙重吸收通过细胞旁路(paracellular route)进行,这是由于管腔相对于间质液带有轻微正电荷,导致被动扩散。粗升支中剩余的50%钙重吸收通过跨细胞途径(transcellular pathway)进行,这一过程由PTH刺激。
钙重吸收还受到代谢性碱中毒(metabolic alkalosis)的刺激,并受到代谢性酸中毒(metabolic acidosis)的抑制。因此,酸中毒倾向于增加钙排泄,而碱中毒倾向于减少钙排泄。氢离子浓度对钙排泄的大部分影响源于远端小管中钙重吸收的变化。
表30-2总结了已知影响钙排泄的因素。
肾脏磷酸盐排泄的调节
在远端小管中,钙重吸收几乎完全通过细胞的主动转运进行。
肾脏的磷酸盐排泄主要通过溢出机制(overflow mechanism)控制,解释如下。肾小管对磷酸盐重吸收的正常最大转运量约为0.1mmol/min。当肾小球滤液中磷酸盐含量低于此值时,几乎所有滤过的磷酸盐都被重吸收。当磷酸盐含量超过此值时,多余的磷酸盐被排泄。因此,当细胞外液中磷酸盐浓度超过约0.8mM/L的阈值时,磷酸盐通常会开始溢出到尿液中,假设GFR为125ml/min,这给出了约0.1mmol/min的磷酸盐管负荷。由于大多数人通过乳制品和肉类摄入大量磷酸盐,磷酸盐浓度通常维持在1mM/L以上;在此水平下,磷酸盐会持续排泄到尿液中。
表30-2 改变肾脏钙排泄的因素 表30-3 总结了一些影响肾脏磷酸盐排泄的因素。
<html><body><table><tr><td>↓钙排泄</td><td>↑钙排泄</td></tr><tr><td>↑甲状旁腺激素</td><td>↓甲状旁腺激素</td></tr><tr><td>细胞外液体积</td><td>↑细胞外液体积</td></tr><tr><td>↓血压</td><td>↑血压</td></tr><tr><td>↑血浆磷酸盐浓度</td><td>↓血浆磷酸盐浓度</td></tr><tr><td>代谢性碱中毒</td><td>代谢性酸中毒</td></tr><tr><td>1,25-维生素D</td><td></td></tr></table></body></html>
近端小管通常重吸收75%至80%的滤过磷酸盐。远端小管重吸收约10%的滤过负荷,而Henle袢、集合小管和集合管中仅重吸收少量磷酸盐。约10%的滤过磷酸盐通过尿液排泄。
在近端小管中,磷酸盐重吸收主要通过跨细胞途径进行。磷酸盐通过钠-磷酸盐共转运体(sodium-phosphate cotransporter)从管腔进入细胞,并通过基底外侧膜离开细胞,这一过程尚不完全清楚,但可能涉及磷酸盐与阴离子交换的反向转运机制(counter-transport mechanism)。
在不同条件下,肾小管对磷酸盐的重吸收能力也会发生变化,从而影响磷酸盐的排泄。例如,长期低磷酸盐饮食可以增加磷酸盐的重吸收转运最大值,从而减少磷酸盐溢出到尿液中的趋势。
PTH(甲状旁腺激素)通过两种效应在调节磷酸盐浓度中起重要作用:(1) PTH促进骨吸收,从而从骨盐中释放大量磷酸盐到细胞外液中;(2) PTH减少顶端膜中钠-磷酸盐共转运体的数量,从而减少肾小管对磷酸盐的重吸收。因此,每当血浆PTH增加时,肾小管对磷酸盐的重吸收减少,更多的磷酸盐被排泄。磷酸盐、PTH和钙之间的这些相互关系在第80章中有更详细的讨论。
表30-3 影响肾磷酸盐排泄的因素
肾镁排泄和细胞外镁离子浓度的调节
人体中超过一半的镁储存在骨骼中。其余大部分位于细胞内,只有不到1%位于细胞外液中。尽管血浆总镁浓度约为1.8 mEq/L,但其中超过一半与血浆蛋白结合。因此,游离的镁离子浓度仅为约0.8 mEq/L。
正常的每日镁摄入量约为250至300 mg/天,但只有约一半的摄入量被胃肠道吸收。为了维持镁平衡,肾脏必须排泄这些被吸收的镁,约为每日镁摄入量的一半,即125至150 mg/天。肾脏通常排泄肾小球滤液中约10%至15%的镁。
在镁过量时,肾脏对镁的排泄可以显著增加,而在镁缺乏时,排泄量可以降至几乎为零。由于镁参与体内许多生化过程,包括许多酶的激活,因此其浓度必须受到严格调控。
镁排泄的调节主要通过改变肾小管的重吸收来实现。近端小管通常只重吸收约25%的滤过镁。主要的重吸收部位是Henle袢,约65%的滤过镁在此处被重吸收。只有少量(通常<5%)的滤过镁在远端小管和集合管中被重吸收。
调节镁重吸收的机制尚不十分清楚,但表30-4总结了一些影响肾镁排泄的因素。请注意,一些改变肾钙排泄的因素对镁排泄也有类似的影响。
肾机制对细胞外液控制的整合
细胞外液(extracellular fluid)体积主要由水和盐的摄入与排出之间的平衡决定。在许多情况下,盐和液体的摄入是由个人的习惯而非生理控制机制决定的。因此,细胞外液体积调节的负担通常落在肾脏上,肾脏必须调整其盐和水的排泄,以在稳态条件下与摄入相匹配。
表30-4 影响肾脏镁排泄的因素
<html><body><table><tr><td>镁排泄</td><td>↑镁排泄</td></tr><tr><td>↓细胞外Mg2+浓度</td><td>↑细胞外Mg2+浓度</td></tr><tr><td>↓细胞外Ca2+浓度</td><td>↑细胞外Ca2+浓度</td></tr><tr><td>↑甲状旁腺激素</td><td>↓甲状旁腺激素</td></tr><tr><td>↓细胞外液体积</td><td>↑细胞外液体积</td></tr><tr><td>代谢性碱中毒</td><td>代谢性酸中毒</td></tr></table></body></html>
在讨论细胞外液体积的调节时,我们考虑控制细胞外液中氯化钠含量的因素,因为细胞外液氯化钠含量的变化通常会引起细胞外液体积的平行变化,前提是抗利尿激素(antidiuretic hormone, ADH)-口渴机制在起作用。当ADH-口渴机制正常运作时,细胞外液氯化钠含量的变化通常伴随着细胞外水量的类似变化,因此渗透压和钠浓度的维持相对恒定。
在稳态条件下,钠的摄入和排泄是平衡的
在整体控制钠排泄(或大多数电解质的排泄)时,一个重要的考虑是,在稳态条件下,肾脏的排泄由摄入决定。为了维持生命,一个人必须在长期内几乎精确地排出摄入的钠量。因此,即使有导致肾功能发生重大变化的干扰,钠的摄入和排出之间的平衡通常也会在几天内恢复。
如果肾功能障碍不太严重,钠平衡可能主要通过肾脏内部的调整来实现,细胞外液体积或其他系统性调整的变化最小。然而,当肾脏受到严重干扰且肾脏内部的补偿机制耗尽时,通常会引发系统性调整,如血压、循环激素和交感神经系统活动的变化。
这些调整在整体稳态方面可能是代价高昂的,因为它们会引起全身的其他变化,从长远来看可能是有害的。例如,肾功能受损可能导致血压升高,这反过来又有助于维持正常的钠排泄。从长远来看,高血压可能会损害血管、心脏和其他器官。然而,这些补偿是必要的,因为液体和电解质摄入与排泄之间的持续不平衡会迅速导致电解质和液体的积累或流失,在几天内引起严重的心血管后果。因此,可以将肾脏功能异常引起的系统性调整视为一种必要的权衡,使电解质和液体的排泄与摄入重新平衡。
钠排泄通过改变肾小球滤过率或肾小管钠重吸收率来控制
影响钠和水排泄的两个变量是肾小球滤过率(glomerular filtration rate, GFR)和肾小管重吸收率:
排泄量 = 肾小球滤过量 − 肾小管重吸收量
正常情况下,GFR约为180L/day,肾小管重吸收量为178.5L/天,尿液排泄量为1.5L/天。因此,GFR或肾小管重吸收率的微小变化可能会导致肾脏排泄量的显著变化。例如,如果GFR增加5%(达到189 L/天),并且没有肾小管的补偿作用,尿液量将增加9 L/天;这种增加将迅速导致体液量的灾难性变化。同样,如果没有GFR的补偿性调节,肾小管重吸收率的微小变化也会导致尿量和钠排泄量的显著变化。肾小管重吸收率和GFR通常精确地平行调节,以便肾脏的排泄量能够与水和电解质的摄入量完全匹配。
即使存在改变GFR或肾小管重吸收率的干扰,尿排泄量的变化也会通过各种缓冲机制被最小化。例如,如果肾脏显著扩张血管,GFR增加(如某些药物或高热时可能发生的情况),这种情况会增加氯化钠向肾小管的输送,进而导致至少两种肾内补偿机制:(1)增加对大部分额外过滤的氯化钠的肾小管重吸收,称为肾小球-肾小管平衡(glomerulotubular balance);(2)致密斑反馈(macula densa feedback),其中增加向远端肾小管输送的氯化钠会导致入球小动脉收缩,并使GFR恢复正常。同样,近端肾小管或Henle袢的肾小管重吸收异常也会通过这些相同的肾内反馈机制得到部分补偿,如第27章所述。
由于这两种机制都不能完美地将远端氯化钠输送完全恢复到正常水平,GFR或肾小管重吸收率的变化可能会导致尿钠和水排泄量的显著变化。当这种情况发生时,其他反馈机制可能会发挥作用,例如血压变化和各种激素的变化;这些机制最终会使钠排泄量与钠摄入量相等。在接下来的几节中,我们将回顾这些机制如何共同作用以控制钠和水平衡,并在此过程中也控制细胞外液量。所有这些反馈机制通过改变GFR或肾小管重吸收率来控制肾脏对钠和水的排泄。
图 30-13. 动脉压对肾脏钠输出的急性和慢性影响(压力性钠尿)。注意,动脉压的慢性增加比急性增加时测得的钠输出增加要大得多。
压力性钠尿和压力性利尿在维持体内钠和液体平衡中的重要性
维持钠和体液平衡以及控制血容量和细胞外液容量的最基本和最强大的机制之一是血压对钠和水排泄的影响——分别是压力性钠尿(pressure natriuresis)和压力性利尿(pressure diuresis)机制。正如第19章所讨论的,这种反馈在长期血压调节中也起着主导作用。
图30-13显示了动脉压对尿钠排泄的影响。请注意,血压急性升高30至50mmHg会导致尿钠排泄量增加两到三倍。这种效应独立于交感神经系统或各种激素(如血管紧张素II (Ang II)、抗利尿激素(ADH)或醛固酮(aldosterone))活性的变化,因为压力性钠尿可以在脱离这些因素影响的离体肾脏中得以证明。随着血压的慢性升高,压力性钠尿的有效性大大增强,因为血压升高在短暂的延迟后也会抑制肾素(renin)的释放,从而减少Ang II和醛固酮的形成。如前所述,Ang II和醛固酮水平的降低会抑制肾小管对钠的重吸收,从而放大血压升高对增加钠和水排泄的直接作用。
压力性钠尿和利尿:调节体液容量和动脉压的肾-体液反馈的关键组成部分
血压升高导致尿量增加的效果是一个强大的反馈系统的一部分,该系统用于维持液体摄入和排出之间的平衡,如图30-14所示。这种机制与第19章讨论的动脉压控制机制相同。细胞外液容量、血容量、心输出量、动脉压和尿量都是这个基本反馈机制的不同部分,同时受到控制。
在钠和液体摄入变化期间,这种反馈机制有助于维持体液平衡,并最大限度地减少血容量、细胞外液容量和动脉压的变化,具体如下:
- 液体摄入量(假设钠伴随液体摄入)超过尿量会导致体内液体暂时积聚。
- 只要液体摄入量超过尿量,液体就会在血液和组织间隙中积聚,导致血容量和细胞外液容量平行增加。正如后面所讨论的,由于这种反馈的有效性,这些变量的实际增加通常很小。
- 血容量增加会提高平均循环充盈压(mean circulatory filling pressure)。
- 平均循环充盈压增加会提高静脉回流的压力梯度(pressure gradient for venous return)。
- 静脉回流压力梯度增加会提高心输出量(cardiac output)。
- 心输出量增加会提高动脉压。
- 动脉压增加通过压力性利尿增加尿量。正常压力性钠尿关系的陡峭性表明,只需要血压的轻微升高即可使尿排泄量增加数倍。
- 增加的液体排泄平衡了增加的摄入量,从而防止了液体的进一步积聚。
因此,肾-体液反馈机制(renal–body fluid feedback mechanism)在盐和水摄入增加时,防止体内盐和水持续积累。只要肾脏及各种神经和激素机制有效运作,盐和水摄入的大幅变化可以在血容量(blood volume)、细胞外液容量(extracellular fluid volume)、心输出量(cardiac output)和动脉压(arterial pressure)仅有微小变化的情况下得到调节。
图 30-14. 控制血容量、细胞外液容量和动脉压的基本肾-体液反馈机制。实线表示正向作用;虚线表示负向作用。
图 30-15. 每日液体摄入量变化对血容量的近似影响。注意,在正常每日液体摄入范围内,血容量保持相对恒定。
当液体摄入低于正常水平时,会发生相反的事件序列。在这种情况下,血容量和细胞外液容量有减少的趋势,动脉压也会降低。即使是血压的微小下降也会导致尿量的大幅减少,从而使体液平衡得以维持,同时血压、血容量或细胞外液容量的变化最小。图30-15展示了这种机制在防止血容量大幅变化方面的有效性,图中显示,尽管每日水和电解质摄入量变化很大,但血容量的变化几乎难以察觉,除非摄入量低到不足以弥补蒸发或其他不可避免的液体损失。
正如后面讨论的那样,除了肾内机制(intrarenal mechanisms)外,还有神经和激素系统可以在许多人不出现可测量的心输出量或动脉压升高的情况下,增加钠排泄以匹配增加的钠摄入。其他对“盐敏感”(salt-sensitive)的个体,即使钠摄入量适度增加,动脉压也会显著升高。长期高钠摄入(持续数年)可能导致高血压,即使最初对盐不敏感的人也可能如此。当血压确实升高时,压力性尿钠排泄(pressure natriuresis)提供了维持钠摄入和尿钠排泄之间平衡的关键手段。
血容量和细胞外液容量调节的有效性
通过研究图30-14,可以看出尽管每日液体摄入量发生极端变化,血容量仍几乎保持恒定的主要原因:(1) 血容量的微小变化会引起心输出量的显著变化;(2) 心输出量的微小变化会引起血压的大幅变化;(3) 血压的微小变化会引起尿量的大幅变化。这些因素共同作用,提供了有效的血容量反馈控制。
当因出血导致失血时,相同的控制机制也会发挥作用。在这种情况下,血压下降以及神经和激素因素(稍后讨论)会导致肾脏保留液体。同时,其他并行过程也会发生,以重建血液中的红细胞和血浆蛋白。如果红细胞体积仍然存在异常,例如当缺乏促红细胞生成素或其他刺激红细胞生成所需的因子时,血浆体积通常会弥补这一差异,尽管红细胞质量较低,但总体血容量基本上会恢复到正常水平。
图 30-16. 细胞外液体积与血容量之间的近似关系,显示在正常范围内几乎呈线性关系,但也显示了当细胞外液体积过多时,血容量不再继续增加的情况。当这种情况发生时,额外的细胞外液体积会存在于组织间隙中,导致水肿。
细胞外液在组织间隙和血管系统之间的分布
从图30-14可以看出,血容量和细胞外液体积通常是相互平行控制的。摄入的液体最初进入血液,但会迅速分布在组织间隙和血浆之间。因此,血容量和细胞外液体积通常是同时控制的。
然而,在某些情况下,细胞外液在组织间隙和血液之间的分布可能会有很大变化。正如第25章所讨论的,导致液体在组织间隙中积聚的主要因素包括以下几点:(1) 毛细血管静水压增加;(2) 血浆胶体渗透压降低;(3) 毛细血管通透性增加;(4) 淋巴管阻塞。在这些情况下,异常高比例的细胞外液会分布在组织间隙中。
图30-16显示了液体在组织间隙和血管系统之间的正常分布以及在水肿状态下的分布情况。当由于摄入过多液体或肾脏液体输出减少而导致少量液体在血液中积聚时,大约20%到30%的液体会留在血液中并增加血容量。其余的液体则分布在组织间隙中。当细胞外液体积上升到比正常值高出30%到50%以上时,几乎所有的额外液体都会进入组织间隙,而很少留在血液中。一旦组织间隙液压力从其正常的负值上升到正值,组织间隙就会变得顺应性增加,大量液体随后会涌入组织中,而组织间隙液压力不会进一步显著上升。换句话说,一旦组织变得高度顺应性,由于组织间隙液压力上升而抵消组织中液体积聚的抗水肿安全因素就会丧失。
因此,在正常情况下,间质间隙(interstitial spaces)充当了多余液体的溢出储存库,有时其体积会增加10至30升。这种情况会导致水肿(edema),如第25章所述,但它也充当了循环系统的重要溢出释放阀,保护心血管系统免受可能导致肺水肿(pulmonary edema)和心力衰竭(cardiac failure)的危险过载。
总结来说,细胞外液(extracellular fluid)体积和血容量(blood volume)通常同时受到控制,但间质和血液之间液体分布的定量取决于循环系统和间质间隙的物理特性,以及通过毛细血管膜(capillary membranes)的液体交换动力学。
神经和激素因素增强了肾-体液反馈控制的有效性
在第27章和第28章中,我们讨论了影响肾小球滤过率(GFR)和肾小管重吸收(tubular reabsorption)的神经和激素因素,从而影响肾脏对盐和水的排泄。这些神经和激素机制通常与压力性钠尿(pressure natriuresis)和压力性利尿(pressure diuresis)机制一起作用,使它们在最小化血容量、细胞外液体积和动脉压(arterial pressure)变化方面更加有效,这些变化是对日常挑战的响应。在许多情况下,神经和激素机制可以调节肾脏对钠和水的排泄,并在不显著改变血压的情况下维持摄入和排出之间的平衡。然而,肾功能异常或影响肾脏的各种神经和激素因素异常可能导致血压和体液体积的严重变化,如后文所述。
交感神经系统对肾脏排泄的控制:动脉压力感受器(arterial baroreceptor)和低压牵张感受器(low-pressure stretch receptor)反射
由于肾脏接受广泛的交感神经支配(sympathetic innervation),交感神经活动的变化可以改变肾脏对钠和水的排泄,在某些情况下还可以调节细胞外液体积。例如,当出血导致血容量减少时,肺血管和胸腔其他低压区域的压力下降,导致交感神经系统的反射性激活。这反过来增加了肾交感神经活动,从而减少钠和水的排泄:(1)肾小动脉收缩,如果交感神经激活严重,会降低肾小球滤过率(GFR);(2)增加肾小管对盐和水的重吸收;(3)刺激肾素(renin)释放并增加血管紧张素II(Ang II)和醛固酮(aldosterone)的形成,这两者进一步增加肾小管重吸收。如果血容量减少到足以降低全身动脉压,由于颈动脉窦(carotid sinus)和主动脉弓(aortic arch)中的动脉压力感受器牵张减少,交感神经系统会进一步激活。所有这些反射在急性情况(如出血)中快速恢复血容量方面起着重要作用。此外,反射性抑制肾交感神经活动可能有助于在摄入大量盐和水的餐后快速消除循环中的多余液体。
图 30-17. 过量的血管紧张素II(Ang II)形成或阻断Ang II形成对肾-压力-钠排泄曲线的影响。注意,高水平的Ang II形成会降低压力-钠排泄的斜率,使血压对钠摄入的变化非常敏感。阻断Ang II形成会使压力-钠排泄向较低的血压方向移动。
然而,过度和不适当的交感神经系统激活会导致一系列效应,包括增加肾素分泌、Ang II形成和肾钠重吸收,从而升高血压。事实上,在高血压患者中,尤其是与肥胖相关的高血压患者中,肾交感神经的消融通常会降低动脉血压。
血管紧张素II在控制肾排泄中的作用
体内最强大的钠排泄调节剂之一是Ang II。钠摄入的变化与Ang II形成的反向变化相关,这反过来又极大地有助于维持体内钠平衡。当钠摄入量高于正常水平时,肾素分泌和Ang II形成减少。由于Ang II具有增加肾小管钠重吸收的几种重要作用,如第28章所述,Ang II水平的降低会减少肾小管对钠和水的重吸收,从而增加肾对钠和水的排泄。最终结果是尽量减少细胞外液体积和动脉血压的上升,否则当钠摄入增加时会发生这种情况。
见图30-17。注意,当血管紧张素对钠排泄的控制完全正常时,压力-钠排泄曲线是陡峭的(正常曲线),表明当钠摄入增加时,可以在动脉血压变化最小的情况下实现钠排泄的增加。
相反,当Ang II水平不能因钠摄入增加而受到抑制时(高血管紧张素II曲线),如在一些高血压患者中,他们减少肾素分泌和Ang II形成的能力受损,压力-钠排泄曲线就不那么陡峭。因此,当钠摄入增加时,需要更大的动脉血压增加才能增加钠排泄并维持钠平衡。例如,在大多数人中,钠摄入增加10倍仅导致动脉血压增加几毫米汞柱,而在那些不能适当抑制Ang II形成以应对过量钠的受试者中,相同的钠摄入增加会导致血压上升多达50毫米汞柱。因此,当钠过量时无法抑制Ang II形成会降低压力-钠排泄的斜率,并使动脉血压对盐非常敏感,如第19章所述。
相反,当钠摄入量低于正常水平时,Ang II水平的增加会导致钠和水的滞留,并阻止动脉血压的下降,否则会发生这种情况。因此,肾素-血管紧张素系统活性的变化作为钠排泄的强大调节剂和压力-钠排泄机制的放大器,有助于维持稳定的血压和体液体积。
血管紧张素II在调节钠平衡和改变压力-钠排泄中的重要性。Ang II在调节钠平衡和使压力-钠排泄机制更有效的重要性如图19-13所示。
使用药物阻断Ang II的作用已被证明在临床上对于改善肾脏排泄盐和水的能力非常重要。当使用血管紧张素转换酶(ACE)抑制剂(见图19-13和图30-17)或Ang II受体拮抗剂阻断Ang II的形成时,肾脏压力-钠排泄曲线会向较低压力方向移动,这表明肾脏排泄钠的能力增强,因为现在可以在降低的动脉压力下维持正常的钠排泄水平。这种压力-钠排泄的移动为ACE抑制剂和Ang II受体拮抗剂在高血压患者中的长期降压作用提供了基础。
过量的Angiotensin II通常不会引起细胞外液体积的大幅增加,因为增加的动脉压力会抵消Angiotensin II介导的钠潴留。尽管Ang II是体内最强大的钠和水潴留激素之一,但只要不发生心力衰竭或肾衰竭,循环中Ang II的减少或增加对细胞外液体积或血容量都没有大的影响。这种现象的原因是,随着Ang II水平的大幅增加,如肾脏分泌肾素的肿瘤发生时,高水平的Ang II最初会导致肾脏对钠和水的潴留以及细胞外液体积的少量增加。这也引发了动脉压力的上升,迅速增加了肾脏对钠和水的输出,从而克服了Ang II的钠和水潴留效应,并在较高的血压下重新建立了钠的摄入和输出之间的平衡。相反,在使用ACE抑制剂或Ang II受体拮抗剂阻断Ang II形成后,最初会有钠和水的丢失,但血压的下降迅速抵消了这一效应,钠排泄再次恢复正常。
如果心脏功能减弱,或者存在潜在的心脏疾病,心脏的泵血能力可能不足以将动脉压力提高到足以克服高水平Ang II的钠潴留效应;在这些情况下,Ang II可能会导致大量的钠和水潴留,可能进展为充血性心力衰竭。在这些情况下,阻断Ang II的形成可能会缓解部分钠和水潴留,并减轻与心力衰竭相关的细胞外液体积的大幅扩张。
醛固酮在控制肾脏排泄中的作用
醛固酮增加钠的重吸收,尤其是在集合小管和集合管中。增加的钠重吸收也与增加的水重吸收和钾分泌有关。因此,醛固酮的净效应是使肾脏保留钠和水,并增加尿中钾的排泄。
醛固酮(aldosterone)在调节钠平衡中的作用与Ang II的作用密切相关。也就是说,当钠摄入量减少时,Ang II水平的升高会刺激醛固酮的分泌,从而减少尿钠排泄,进而维持钠平衡。相反,当钠摄入量高时,醛固酮生成的抑制会减少肾小管的重吸收,使肾脏能够排泄更多的钠。因此,醛固酮生成的变化也有助于压力性尿钠排泄机制(pressure natriuresis mechanism)在盐摄入量变化时维持钠平衡。
在醛固酮慢性过度分泌期间,随着动脉压的升高,肾脏会从钠潴留中“逃逸”。尽管醛固酮对钠重吸收有强大的作用,但当醛固酮生成过多时,如肾上腺肿瘤(Conn综合征)患者,肾脏的钠重吸收增加和钠排泄减少是暂时的。在钠和水潴留1至3天后,细胞外液量增加约10%至15%,同时动脉血压升高。当动脉压升高到一定程度时,肾脏会“逃逸”钠和水的潴留,尽管醛固酮水平持续升高,但此后会排泄与每日摄入量相等的钠量。这种逃逸的主要原因是动脉压升高时发生的压力性尿钠排泄和利尿作用(pressure natriuresis and diuresis)(见第78章,图78-3)。
在醛固酮分泌不足的肾上腺功能不全(Addison病)患者中,钠和水的排泄增加,细胞外液量减少,并倾向于低血压。在完全缺乏醛固酮的情况下,除非允许患者摄入大量盐和大量水以平衡增加的盐和水尿量,否则容量耗竭可能会很严重。
抗利尿激素(antidiuretic hormone, ADH)在控制肾脏水排泄中的作用
如第29章所述,ADH在使肾脏形成少量浓缩尿液的同时排泄正常量的盐方面起着重要作用。这种效应在缺水期间尤为重要,缺水会强烈提高血浆ADH水平,进而增加肾脏对水的重吸收,并有助于最大限度地减少细胞外液量和动脉压的下降,否则这些下降会发生。缺水24至48小时通常只会导致细胞外液量和动脉压的小幅下降。然而,如果用一种药物阻断ADH的作用,该药物拮抗ADH在远端小管和集合管中促进水重吸收的作用,同样的缺水期会导致细胞外液量和动脉压的大幅下降。相反,当细胞外液量过多时,ADH水平的降低会减少肾脏对水的重吸收,从而帮助身体排出多余的液量。
抗利尿激素(antidiuretic hormone, ADH)分泌过多通常仅引起细胞外液(extracellular fluid)容量的轻微增加,但会导致钠离子浓度的大幅下降。尽管ADH在调节细胞外液容量方面很重要,但过量的ADH很少引起动脉压(arterial pressure)或细胞外液容量的大幅增加。向动物体内输注大量ADH最初会引起肾脏对水的重吸收(retention),导致细胞外液容量增加10%至15%。随着动脉压因容量增加而升高,由于压力利尿(pressure diuresis)机制,大部分多余的容量会被排出。此外,血压升高还会引起压力性钠利尿(pressure natriuresis),导致细胞外液中的钠离子流失。在连续几天输注ADH后,血容量(blood volume)和细胞外液容量的增加不超过5%至10%,动脉压的升高也小于10mm Hg。对于不适当ADH综合征(inappropriate ADH syndrome)患者也是如此,他们的ADH水平可能升高数倍。
因此,高水平的ADH不会引起体液容量或动脉压的大幅增加,尽管高ADH水平会导致细胞外钠离子浓度的严重下降。原因是肾脏对水的重吸收增加稀释了细胞外钠离子,同时,血压的轻微升高通过压力性钠利尿机制导致钠离子从细胞外液经尿液流失。
对于因视上核(supraoptic nuclei)破坏而丧失ADH分泌能力的患者,尿量可能增加到正常的5至10倍。这种容量的增加几乎总是通过摄入足够的水来维持体液平衡而得到补偿。如果无法自由获取水,ADH分泌能力的丧失可能导致血容量和动脉压的显著下降。
心房钠尿肽(atrial natriuretic peptide, ANP)在控制肾脏排泄中的作用
到目前为止,我们主要讨论了钠和水潴留激素在控制细胞外液容量中的作用。然而,几种不同的钠尿激素(natriuretic hormones)也可能参与容量调节。其中最重要的是一种由心房肌纤维释放的肽类物质,称为心房钠尿肽(ANP)。释放这种肽的主要刺激是心房扩张,这可能是由于血容量过多引起的。一旦由心房释放,ANP进入循环并作用于肾脏,导致肾小球滤过率(glomerular filtration rate, GFR)的轻微增加、肾素(renin)分泌和血管紧张素II(Ang II)形成的减少,以及集合管(collecting ducts)对钠重吸收的减少。ANP的这些综合作用导致盐和水的排泄增加,从而有助于补偿过多的血容量。
ANP水平的变化有助于在各种干扰(如盐和水摄入增加)期间最小化血容量的变化。然而,ANP的过度产生甚至完全缺乏不会引起血容量的重大变化,因为这些效应可以通过血压的微小变化(通过压力性钠利尿机制)来克服。例如,输注大量ANP最初会增加盐和水的尿量,并导致血容量的轻微下降。在不到24小时内,这种效应会被血压的轻微下降所克服,使尿量恢复正常,尽管ANP仍然过量。
对钠摄入量变化的整合反应
在正常情况下,调节钠和液体排泄的不同控制系统的整合可以通过检查对饮食钠摄入量逐渐增加的内稳态反应来总结。如前所述,肾脏具有惊人的能力,能够将其盐和水的排泄与摄入量相匹配,摄入量可以从正常值的十分之一低至正常值的十倍高。
高钠摄入抑制抗钠尿系统并激活钠尿系统。随着钠摄入量的增加,钠的排泄最初略微滞后于摄入量。这种时间延迟导致累积钠平衡的少量增加,从而引起细胞外液体积的轻微增加。主要是细胞外液体积的这种轻微增加触发了体内增加钠排泄的各种机制。这些机制包括以下内容:
- 激活源自右心房和肺血管的牵张感受器的低压感受器反射。来自牵张感受器的信号传递到脑干,并在那里抑制肾脏的交感神经活动,以减少肾小管钠的重吸收。这种机制在盐和水摄入量大幅增加后的最初几小时或第一天最为重要。
- 抑制Ang II和醛固酮的形成,由动脉压增加和细胞外液体积扩张引起,通过消除Ang II和醛固酮增加钠重吸收的正常效应来减少肾小管钠的重吸收。
- 刺激钠尿系统,尤其是ANP,进一步促进钠排泄的增加。因此,钠尿系统的激活和钠及水保留系统的抑制相结合,导致钠摄入量增加时钠排泄的增加。当钠摄入量减少到正常水平以下时,会发生相反的变化。
- 由体积扩张引起的动脉压的轻微增加可能发生在钠摄入量大幅增加时,尤其是在盐敏感个体中;这种机制通过压力钠尿作用增加钠排泄。如前所述,如果神经、激素和肾内机制有效运作,即使在几天内钠摄入量大幅增加,也可能不会发生可测量的血压增加。然而,当高钠摄入量持续数月或数年时,肾脏可能会受损,排泄钠的效率降低,需要通过压力钠尿机制增加血压以维持钠平衡。
导致血容量和细胞外液体积大幅增加的条件
尽管有强大的调节机制使血容量和细胞外液体积保持相对恒定,但仍有一些异常情况可以导致这两个变量的大幅增加。几乎所有这种情况都是由循环异常引起的。
由心脏疾病引起的血容量和细胞外液体积增加
在充血性心力衰竭(congestive heart failure)患者中,血容量(blood volume)可能增加15%到20%,细胞外液(extracellular fluid)容量有时会增加200%或更多。这些增加的原因可以通过重新审视图30-14来理解。最初,心力衰竭会降低心输出量(cardiac output),从而降低动脉压(arterial pressure)。这种效应反过来激活了多种钠潴留系统(sodium-retaining systems),特别是肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)和交感神经系统(sympathetic nervous systems)。此外,低血压本身会导致肾脏保留盐和水。因此,肾脏保留容量以试图使动脉压和心输出量恢复正常。
如果心力衰竭不是太严重,血容量的增加通常可以使心输出量和动脉压几乎完全恢复正常,尽管细胞外液容量和血容量仍然增加以保持衰弱的心脏充分泵血。然而,如果心脏严重衰弱,动脉压可能无法增加到足以使尿量恢复正常。当这种情况发生时,肾脏会继续保留容量,直到严重的循环充血(circulatory congestion)发生,除非采取纠正措施,否则患者最终可能死于肺水肿(pulmonary edema)。
在心肌衰竭(myocardial failure)、心脏瓣膜病(heart valvular disease)和先天性心脏异常(congenital abnormalities of the heart)中,血容量增加作为一种重要的循环补偿(circulatory compensation),有助于使心输出量和血压恢复正常。这种补偿使得即使是衰弱的心脏也能维持生命所需的心输出量水平。
由血管容量增加引起的血容量增加
任何增加血管容量(vascular capacity)的情况也会导致血容量增加以填补这一额外的容量。血管容量的增加最初会降低平均循环充盈压(mean circulatory filling pressure)(见图30-14),从而导致心输出量和动脉压下降。血压的下降导致肾脏保留盐和水,直到血容量增加到足以填补额外的容量。
在怀孕期间,子宫、胎盘和女性身体其他扩大器官的血管容量增加通常会使血容量增加15%到25%。同样,在腿部有大静脉曲张(varicose veins)的患者中,这些静脉在罕见情况下可能容纳多达一升的额外血液,血容量会增加以填补额外的血管容量。在这些情况下,肾脏会保留盐和水,直到整个血管床被填满,使血压上升到足以平衡肾脏液体输出与每日液体摄入的水平。
导致细胞外液容量大幅增加但血容量正常或减少的情况
在某些情况下,细胞外液容量显著增加,但血容量保持正常甚至略有减少。这些情况通常是由液体和蛋白质渗漏到间质(interstitium)中引发的,这往往会减少血容量。肾脏对这些情况的反应类似于出血后的反应——即肾脏保留盐和水以试图使血容量恢复正常。然而,大部分额外的液体会渗漏到间质中,导致进一步的水肿(edema)。
肾病综合征(Nephrotic Syndrome)——尿中血浆蛋白丢失及肾脏钠潴留
导致细胞外水肿的一般机制在第25章中进行了回顾。水肿的一个重要临床原因是肾病综合征。在肾病综合征中,由于肾小球毛细血管通透性增加,大量蛋白质渗漏到滤液和尿液中。每天可能有30至50克的血浆蛋白通过尿液丢失,有时导致血浆蛋白浓度降至正常值的三分之一以下,并使血浆胶体渗透压降至低水平。这种效应导致全身毛细血管将大量液体过滤到各种组织中,进而引起水肿并减少血浆容量。
肾病综合征中的肾脏钠潴留通过多种机制发生,这些机制由血浆中的蛋白质和液体渗漏到组织间液激活,包括刺激各种钠潴留系统,如肾素-血管紧张素-醛固酮系统(RAAS)和交感神经系统。肾脏继续保留钠和水,直到血浆容量恢复到接近正常水平。然而,由于大量的钠和水潴留,血浆蛋白浓度进一步稀释,导致更多的液体渗漏到身体组织中。最终结果是肾脏大量保留液体,直到发生严重的细胞外水肿,除非采取措施恢复血浆蛋白。
肝硬化(Liver Cirrhosis)——肝脏血浆蛋白合成减少及肾脏钠潴留
在肝硬化中,血浆蛋白浓度的降低是由于肝细胞的破坏,从而降低了肝脏合成足够血浆蛋白的能力。肝硬化还与肝脏结构中的大量纤维组织有关,这些纤维组织极大地阻碍了门静脉血液通过肝脏的流动。这种阻碍反过来提高了整个门脉血管床的毛细血管压力,这也导致液体和蛋白质渗漏到腹腔中,这种情况称为腹水(ascites)。
一旦液体和蛋白质从循环中丢失,肾脏的反应与其他与血浆容量减少相关的情况相似。也就是说,肾脏继续保留盐和水,直到血浆容量和动脉血压恢复到正常水平。在某些情况下,由于肝硬化中血管容量的增加,血浆容量实际上可能超过正常水平;门脉循环中的高压可以极大地扩张静脉,从而增加血管容量。
Curry JN, Yu ASL: Magnesium handling in the kidney. Adv Chronic Kidney Dis 25:236, 2018. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev 95:1, 2015. DuBose TD Jr: Regulation of potassium homeostasis in CKD. Adv Chronic Kidney Dis 24:305, 2017. Ellison DH, Felker GM: Diuretic treatment in heart failure. N Engl J Med 377:1964, 2017. Ferrè S, Hoenderop JG, Bindels RJ: Sensing mechanisms involved in Ca+++ and Mg++ homeostasis. Kidney Int 82:1157, 2012. Guyton AC: Blood pressure control—special role of the kidneys and body fluids. Science 252:1813, 1991. Hall JE: The kidney, hypertension, and obesity. Hypertension 41:625, 2003.
Hall JE, do Carmo JM, da Silva AA, Wang Z, Hall ME: 肥胖、肾功能障碍和高血压:机制联系。Nature Reviews Nephrology 15: 367, 2019. Hall JE, Granger JP, do Carmo JM, 等: 高血压:生理学和病理生理学。Compr Physiol 2:2393, 2012. Hebert SC, Desir G, Giebisch G, Wang W: 肾脏钾通道的分子多样性和调控。Physiol Rev 85:319, 2005. Kamel KS, Schreiber M, Halperin ML: 肾脏钾生理学:整合肾脏对饮食钾耗竭的反应。Kidney Int 93:41, 2018. McDonough AA, Youn JH: 钾稳态:已知、未知和健康益处。Physiology (Bethesda) 32:100, 2017. Moe SM: 健康和肾脏疾病中的钙稳态。Compr Physiol 6:1781, 2016. Mullens W, Verbrugge FH, Nijst P, Tang WHW: 心力衰竭中的肾脏钠渴求:从病理生理学到治疗策略。Eur Heart J 38:1872, 2017. Palmer BF: 钾稳态的调控。Clin J Am Soc Nephrol 10:1050, 2015. Rossier BC, Baker ME, Studer RA: 上皮钠转运及其由醛固酮调控:我们内部环境的故事再探。Physiol Rev 95:297, 2015 Staruschenko A: 高钾的有益作用:肾脏基底外侧K+通道的贡献。Hypertension 71:1015, 2018. Whelton PK, Appel LJ, Sacco RL, 等: 钠、血压和心血管疾病:进一步支持美国心脏协会钠减少建议的证据。Circulation 126:2880, 2012. Young DB: 醛固酮在钾调控中的作用的定量分析。Am J Physiol 255:F811, 1988.
酸碱调节
氢离子\left(H+\right)的调节在某种程度上与体内其他离子的调节相似。例如,必须保持H+的摄入或产生与\Hat从体内的净排出之间的平衡,以实现稳态。而且,与其他离子一样,肾脏在调节\ H+从体内的排出中起着关键作用。然而,精确控制细胞外液\Hat浓度远不止肾脏简单排出H+。涉及血液、细胞和肺的多种酸碱缓冲机制对于维持细胞外和细胞内液中正常的H+浓度也至关重要。
在本章中,我们将探讨调节\Hat浓度的机制,特别强调肾脏\Hat分泌以及肾脏对碳酸氢根离子\left(HCO_3-\right)的重吸收、产生和排泄,这是体液中酸碱控制系统的关键组成部分之一。
氢离子浓度被精确调控
精确的H+调控至关重要,因为体内几乎所有酶系统的活性都受到H+浓度的影响。因此,H+浓度的变化几乎会改变所有细胞和身体功能。
与其他离子相比,体液中\Hat的浓度通常保持在较低水平。例如,细胞外液中的钠离子浓度(142mEq/L)大约是正常\ H+浓度的350万倍,而\ H+的平均浓度仅为\mathtt0.00004m E q/L。同样重要的是,细胞外液中\Hat浓度的正常变化范围仅为钠离子\left(Na+\right)浓度正常变化范围的百万分之一。因此,H+的精确调节强调了其对各种细胞功能的重要性。
酸和碱——定义与意义
氢离子是从氢原子中释放出的单个自由质子。含有氢原子且能在溶液中释放氢离子的分子被称为酸(acid)。例如,盐酸(HCl)在水中电离形成氢离子\left(H+\right)和氯离子\left(Cl-\right)。同样,碳酸(H_2C O_3)在水中电离形成\Hat和碳酸氢根离子\left(HCO_3-\right)。
碱(base)是能够接受H+的离子或分子。例如,HCO_3-是一种碱,因为它可以与\Hat结合形成H_2CO_3。同样,HPO_4=也是一种碱,因为它可以接受H+形成H_2PO_4-。体内的蛋白质也作为碱发挥作用,因为构成蛋白质的某些氨基酸带有净负电荷,能够轻易接受H+。红细胞中的血红蛋白和体内其他细胞中的蛋白质是体内最重要的碱之一。
术语“碱”和“碱金属”经常被同义使用。碱金属是由一种或多种碱金属(如钠、钾和锂)与高度碱性的离子(如羟基离子\left(OH-\right))结合形成的分子。这些分子的碱部分迅速与\Hat反应,将其从溶液中移除,因此是典型的碱。出于类似的原因,术语“碱中毒”(alkalosis)指的是体液中H+的过度移除,而\Hat的过度添加则被称为酸中毒(acidosis)。
强酸和弱酸,强碱和弱碱。强酸(strong acid),如HCl,迅速解离并在溶液中释放大量H+。弱酸(weak acid),如H_2CO_3,不太容易解离其离子,因此释放H+的能力较弱。强碱(strong base)是一种能够迅速且强烈地与H+反应并从溶液中快速移除H+的物质。典型的例子是OH-,它与\ H+反应形成水(H_2O)。典型的弱碱(weak base)是HCO_3-,因为它与\Hat的结合能力比OH-弱得多。参与正常酸碱调节的细胞外液中的大多数酸和碱都是弱酸和弱碱。我们讨论的最重要的酸和碱是碳酸(H_2C O_3)和HCO_3-碱。
正常体液中的 H+ 浓度和 pH 值以及酸中毒和碱中毒时的变化。血液中的 \ H+ 浓度通常维持在严格的范围内,正常值约为 0.00004 mEq/L (40nEq/L)。正常波动仅为约 3 到 5nEq/L,但在极端条件下,\ H+ 浓度可以从低至 10nEq/L 到高达 160 nEq/L 之间变化,而不会导致死亡。
由于 H+ 浓度通常较低,且这些较小的数值较为繁琐,习惯上使用 pH 单位以对数尺度表示 \Hat 浓度。pH 与实际 H+ 浓度的关系由以下公式表示(H+ 浓度 \left[H+\right] 以每升当量表示):
p H=l o g\frac1\left[H+\right]=-l o g\left[H+\right]
例如,正常的 \left[H+\right] 为 40nEq/L (0.00000004 Eq/L, )。因此,正常的 pH 如下:
\beginarrayl lp H=-\log\left[0.00000004\right]\ p H=7.4\endarray
从该公式可以看出,pH 与 \ H+ 浓度呈反比关系;因此,低 pH 对应于高 \Hat 浓度,而高 pH 对应于低 H+ 浓度。
动脉血的正常 pH 为 7.4,而静脉血和组织间液的 pH 约为 7.35,这是因为从组织中释放的额外二氧化碳 (CO_2) 在这些液体中形成 H_2CO_3(表 31-1)。由于动脉血的正常 pH 为 7.4,当 pH 显著低于此值时,被认为存在酸血症(acidemia),而当 pH 高于 7.4 时,则被认为存在碱血症(alkalemia)。人类可以存活超过几小时的 pH 下限约为 6.8,上限约为 8.0。
细胞内 pH 通常略低于血浆 pH,因为细胞代谢会产生酸,尤其是 H_2CO_3。根据细胞类型的不同,细胞内液的 pH 估计在 6.0 到 7.4 之间。组织缺氧和血流不足会导致酸积累和细胞内 pH 降低。术语酸中毒(acidosis)和碱中毒(alkalosis)分别描述了导致酸血症和碱血症的过程。
尿液的 pH 可以在 4.5 到 8.0 之间变化,具体取决于细胞外液的酸碱状态。正如后面所讨论的,肾脏通过以不同速率排泄酸或碱,在纠正细胞外液 H+ 浓度异常方面起着重要作用。
表 31-1 体液的 pH 和 H+ 浓度
markdown <html><body><table><tr><td colspan="2">H+浓度(mEq/L) pH</td></tr><tr><td>细胞外液</td><td></td></tr><tr><td>动脉血</td><td>4.0x10-5 7.40</td></tr><tr><td>静脉血 4.5 × 10-5</td><td>7.35</td></tr><tr><td>间质液 4.5 x 10-5</td><td>7.35</td></tr><tr><td>细胞内液 1 x10-3 to 4×10-5</td><td>6.0-7.4</td></tr><tr><td>尿液 3 × 10-2 to 1 x 10-5</td><td>4.5-8.0</td></tr><tr><td>胃酸 160</td><td>0.8</td></tr></table></body></html>
一个极端的酸性体液例子是胃黏膜的壁细胞(oxyntic cells)分泌到胃中的HCl,如第65章所讨论的。这些细胞中的H+浓度大约是血液中氢离子浓度的400万倍,pH值为0.8。在本章的剩余部分,我们将讨论细胞外液\Hat浓度的调节。
防御\mathbbH+浓度变化:缓冲系统、肺和肾脏
三个主要系统调节体液中的\Hat浓度:(1) 体液中的化学酸碱缓冲系统,它们立即与酸或碱结合,以防止H+浓度的过度变化;(2) 呼吸中枢,调节细胞外液中CO_2(因此,H_2CO_3)的排出;(3) 肾脏,可以排泄酸性或碱性尿液,从而在酸中毒或碱中毒期间将细胞外液\Hat浓度调整回正常。
当\ H+浓度发生变化时,体液的缓冲系统在几秒钟内反应,以最小化这些变化。缓冲系统不会从体内消除\Hat或向体内添加H+,而只是将它们束缚住,直到可以重新建立平衡。
第二道防线,呼吸系统,在几分钟内起作用,以消除CO_2,因此,H_2CO_3从体内排出。
这两道防线防止H+浓度变化过大,直到反应较慢的第三道防线,肾脏,可以从体内消除多余的酸或碱。尽管肾脏与其他防御系统相比反应较慢,但在几小时到几天的时间内,它们是迄今为止最强大的酸碱调节系统。
体液中的\Hat\HatH+缓冲
缓冲剂是任何可以可逆地结合\Hat的物质。缓冲反应的一般形式如下:
缓冲剂 +H+\LongleftrightarrowH 缓冲剂
在这个例子中,一个自由的H+与缓冲剂结合形成一个弱酸(H缓冲剂),它可以保持为未结合的分子,或者解离回缓冲剂和H+。当H+浓度增加时,反应被迫向右进行,只要有缓冲剂可用,更多的H+就会与缓冲剂结合。相反,当H+浓度降低时,反应向左移动,H+从缓冲剂中释放出来。通过这种方式,H+浓度的变化被最小化。
如果考虑到体液中H+的低浓度以及每天体内产生的相对大量的酸,体液缓冲系统的重要性就显而易见了。每天通过代谢摄入或产生的H+约为80mil当量,而体液中H+的浓度通常仅为0.00004mEq/L。如果没有缓冲作用,每天产生的酸和摄入的酸会导致体液H+浓度发生致命的变化。
酸碱缓冲系统的作用或许可以通过考虑细胞外液中数量上最重要的缓冲系统——碳酸氢盐缓冲系统来最好地解释。
碳酸氢盐缓冲系统
碳酸氢盐缓冲系统由含有两种成分的水溶液组成:(1) 一种弱酸,H_2CO_3;(2) 一种碳酸氢盐,如碳酸氢钠(NaHCO_3)。
H_2CO_3在体内通过CO_2与H_2O的反应形成:
C O_2+H_2O\xrightarrow[]\DeltanhydraseH_2C O_3
该反应速度较慢,除非存在碳酸酐酶(carbonic anhydrase),否则形成的H_2CO_3量极少。这种酶在肺肺泡壁中特别丰富,CO_2在此处释放;碳酸酐酶也存在于肾小管的上皮细胞中,CO_2在此处与H_2O反应形成H_2CO_3。
H_2CO_3弱电离形成少量的H+和HCO_3-:
H_2C O_3\longleftrightarrowH++H C O_3-
该系统的第二个成分,碳酸氢盐,在细胞外液中主要以NaHCO_3的形式存在。NaHCO_3几乎完全电离形成HCO_3-和Na+,如下所示:
N a H C O_3\longrightarrowN a++H C O_3
现在,将整个系统结合起来,我们得到以下反应:
C O_2+H_2O\LongleftrightarrowH_2C O_3\LongleftrightarrowH++\underbraceH C O_3_N a+
由于H_2CO_3的弱电离,H+的浓度极低。
当强酸如HCl加入碳酸氢盐缓冲溶液时,酸释放的H+增加(HCl\toH++Cl-),并被HCO_3-缓冲:
\uparrowH++HCO_3-\toH_2CO_3\toCO_2+H_2O
结果,更多的H_2CO_3形成,导致CO_2和H_2O的产生增加。从这些反应中可以看出,强酸HCl中的H+与HCO_3-反应形成非常弱的酸H_2CO_3,后者又形成CO_2和H_2O。过量的CO_2极大地刺激了呼吸,从而从细胞外液中消除了CO_2。
当强碱,如氢氧化钠(NaOH),被添加到碳酸氢盐缓冲溶液中时,会发生相反的反应。
N a O H+H_2C O_3\toN a H C O_3+H_2O
在这种情况下,NaOH中的OH-与H_2CO_3结合形成额外的HCO_3-。因此,弱碱NaHCO_3取代了强碱NaOH。同时,H_2CO_3的浓度降低(因为它与NaOH反应),导致更多的CO_2与H_2O结合以取代H_2CO_3:
\beginarrayc c cC O_2+H_2O\longrightarrowH_2C O_3\longrightarrow\uparrow H C O_3-+H+&&\ &+&\ &&N a O H&N a\endarray
因此,净结果是血液中的CO_2水平趋于下降,但血液中CO_2的减少抑制了呼吸并降低了CO_2的呼出速率。血液中HCO_3-浓度的上升通过增加肾脏对HCO_3-的排泄来补偿。
碳酸氢盐缓冲系统的定量动力学
所有酸,包括H_2CO_3,都在一定程度上电离。从质量平衡的角度来看,\ H+和HCO_3-的浓度与H_2CO_3的浓度成正比:
H_2C O_3\longleftrightarrow H++H C O_3
对于任何酸,酸相对于其解离离子的浓度由解离常数K\prime定义。
K\prime=\fracH+× HCO_3-H_2CO_3
这个方程表明,在H_2CO_3溶液中,游离\ H+的量等于
H+=K\prime×\fracH_2C O_3H C O_3-
未解离的H_2CO_3的浓度不能在溶液中测量,因为它迅速解离成CO_2和H_2O或H+和HCO_3-。然而,溶解在血液中的CO_2与未解离的H_2CO_3的量成正比。因此,方程2可以重写如下:
\sf H+=\sf K×\frac\sf C O_2\sf H C O_3-
方程3的解离常数(K)仅为方程2的解离常数(K\prime)的约1/400,因为H_2CO_3与CO_2之间的比例比为1:400。
方程3是以溶液中溶解的CO_2总量表示的。然而,大多数临床实验室测量的是血液中的CO_2张力\left(PCO_2\right),而不是实际的CO_2量。幸运的是,血液中的CO_2量是Pco_2乘以CO_2的溶解度系数( solubility coefficient )的线性函数;在生理条件下,CO_2的溶解度系数在体温下为0.03mmol/mmHg。这意味着每测量到1 mm HgPCO_2,血液中就存在0.03毫摩尔的H_2CO_3。因此,方程3可以重写为
H+=K×\frac(0.03×P C O_2)HC O_3-
Henderson-Hasselbalch方程。如前所述,通常用pH单位表示\H+浓度,而不是实际浓度。回想一下,pH=-logH+。
解离常数(pK)可以用类似的方式表示。
p K=-l o gK
因此,我们可以通过对该方程取负对数,将方程4中的\Hat浓度表示为pH单位,得到以下结果:
-\logH+=-\logp K-\log\frac(0.03×P c o_2)HC O_3-
因此,
p H=p K-l o g\frac(0.03×P c o_2)H C O_3-
为了避免使用负对数,我们可以改变对数的符号,并使用对数定律反转最后一项的分子和分母,得到以下结果:
p H=p K+10g\fracH C O_3-(0.03×P C O_2)
对于碳酸氢盐缓冲系统,pK为6.1,方程7可以写成如下形式:
肾脏控制着细胞外液中的HCO_3-浓度,而细胞外液中的P C O_2由呼吸速率控制。通过增加呼吸速率,肺部从血浆中去除CO_2,通过减少呼吸速率,肺部提高Pco_2。正常的生理酸碱稳态是肺和肾脏协调作用的结果,当这些控制机制中的一个或两个受损时,就会发生酸碱紊乱,从而改变细胞外液的HCO_3-浓度或Pco_2。
当酸碱平衡的紊乱是由于细胞外液HCO_3-浓度的主要变化引起的,它们被称为代谢性酸碱紊乱。因此,由HCO_3-浓度主要降低引起的酸中毒称为代谢性酸中毒( metabolic acidosis ),而由HCO_3-浓度主要增加引起的碱中毒称为代谢性碱中毒( metabolic alkalosis )。由Pco_2增加引起的酸中毒称为呼吸性酸中毒( respiratory acidosis ),而由Pco_2减少引起的碱中毒称为呼吸性碱中毒( respiratory alkalosis )。
碳酸氢盐缓冲系统滴定曲线
图31-1显示了当细胞外液中HCO_3-与CO_2的比例发生变化时,细胞外液pH的变化。当这两种组分的浓度相等时,方程式8的右侧部分变为1的对数,即等于0。因此,当缓冲系统的两种组分相等时,溶液的pH与碳酸氢盐缓冲系统的pK(6.1)相同。当向系统中加入碱时,部分溶解的CO_2会转化为HCO_3-,导致HCO_3-与CO_2的比例增加,从而使pH升高,这一点可以从Henderson-Hasselbalch方程中看出。当加入酸时,酸会被HCO_3-缓冲,HCO_3-随后转化为溶解的CO_2,导致HCO_3-与CO_2的比例降低,从而使细胞外液的pH下降。
缓冲能力由缓冲组分的量和相对浓度决定
从图31-1的滴定曲线中可以看出几个要点。首先,当每种组分(HCO_3-和CO_2)占缓冲系统总浓度的50%时,系统的pH与pK相同。其次,缓冲系统在曲线的中心部分最为有效,此时pH接近系统的pK。这种现象意味着,当pH接近系统的pK时,向系统中加入任何给定量的酸或碱所引起的pH变化最小。缓冲系统在pK两侧1.0pH单位范围内仍然相当有效,对于碳酸氢盐缓冲系统来说,这一范围从pH约为5.1到7.1单位。超出这些范围,缓冲能力迅速减弱。当所有的CO_2都转化为HCO_3-,或者所有的HCO_3-都转化为CO_2时,系统将不再具有缓冲能力。
p H=6.1+l o g\fracH C O_3-0.03×P c o_2
方程式8是Henderson-Hasselbalch方程,通过它,如果已知HCO_3-的摩尔浓度和Pco_2,就可以计算出溶液的pH。
从Henderson-Hasselbalch方程可以看出,HCO_3-浓度的增加会导致pH升高,使酸碱平衡向碱中毒方向偏移。Pco_2的增加会导致pH降低,使酸碱平衡向酸中毒方向偏移。
Henderson-Hasselbalch方程不仅定义了细胞外液中正常pH调节和酸碱平衡的决定因素,还提供了对细胞外液中酸碱成分生理控制的深入理解。正如后面所讨论的,HCO_3-浓度主要由肾脏调节。
图31-1. 碳酸氢盐缓冲系统的滴定曲线,显示了当缓冲剂以H C O_3-和C O_2(或H_2C O_3)形式的百分比改变时,细胞外液的pH值。
缓冲剂的绝对浓度也是决定系统缓冲能力的重要因素。当缓冲剂浓度较低时,只需向溶液中加入少量的酸或碱,pH值就会发生显著变化。
碳酸氢盐缓冲系统是最重要的细胞外缓冲系统。从图31-1所示的滴定曲线来看,人们可能不会认为碳酸氢盐缓冲系统很强大,原因有两个。首先,细胞外液的pH值约为7.4,而碳酸氢盐缓冲系统的pK为6.1,这意味着以HCO_3-形式存在的碳酸氢盐缓冲系统大约是溶解的CO_2形式的20倍。因此,该系统在缓冲曲线的斜率较低的部分运行,缓冲能力较差。其次,碳酸氢盐系统的两个组成部分CO_2和HCO_3-的浓度并不高。
尽管有这些特点,碳酸氢盐缓冲系统是体内最强大的细胞外缓冲系统。这种看似矛盾的现象主要是由于缓冲系统的两个组成部分HCO_3-和CO_2分别由肾脏和肺调节,这一点将在后面讨论。由于这种调节作用,细胞外液的pH值可以通过肾脏对HCO_3-的移除和添加的相对速率以及肺对CO_2的移除速率来精确控制。
磷酸盐缓冲系统
尽管磷酸盐缓冲系统不是主要的细胞外液缓冲系统,但它在缓冲肾小管液和细胞内液中起着重要作用。
磷酸盐缓冲系统的主要组成部分是H_2PO_4-和HPO_4=。当向这两种物质的混合物中加入强酸如HCl时,氢被碱HPO_4=接受并转化为H_2P O_4-:
H C l+N a_2H P O_4\toN a H_2P O_4+N a C l
该反应的结果是强酸HCl被弱酸NaH_2PO_4所取代,pH值的下降被最小化。
当向缓冲系统中加入强碱如NaOH时,OH-被H_2PO_4-缓冲,形成额外的HPO_4=+H_2O:
N a O H+N a H_2P O_4\toN a_2H P O_4+H_2O
在这种情况下,强碱NaOH被弱碱Na_2HPO_4所取代,导致pH值仅略有上升。
磷酸盐缓冲系统的pK值为6.8,与体液中正常的pH值7.4相差不大,这使得该系统能够在接近其最大缓冲能力的范围内工作。然而,它在细胞外液中的浓度较低,仅为碳酸氢盐缓冲液浓度的约8%。因此,磷酸盐系统在细胞外液中的总缓冲能力远低于碳酸氢盐缓冲系统。
与其在细胞外液中的次要作用相比,磷酸盐缓冲液在肾脏的管状液体中尤为重要,原因有二:(1) 磷酸盐通常在肾小管中高度浓缩,从而增加了磷酸盐系统的缓冲能力;(2) 肾小管液体的pH值通常比细胞外液低得多,这使得缓冲液的工作范围更接近系统的pK值(6.8)。
磷酸盐缓冲系统在缓冲细胞内液方面也很重要,因为细胞内液中磷酸盐的浓度比细胞外液高出许多倍。此外,细胞内液的pH值低于细胞外液,因此通常比细胞外液更接近磷酸盐缓冲系统的pK值。
蛋白质是重要的细胞内缓冲剂
蛋白质是体内最丰富的缓冲剂之一,因为它们的浓度很高,尤其是在细胞内。细胞的pH值虽然略低于细胞外液,但仍与细胞外液pH值的变化大致成比例变化。\Hat和HCO_3-会通过细胞膜轻微扩散,尽管这些离子需要几个小时才能与细胞外液达到平衡,除了在红细胞中发生的快速平衡。然而,CO_2可以迅速通过所有细胞膜扩散。碳酸氢盐缓冲系统成分的扩散导致细胞内液的pH值在细胞外液pH值发生变化时也会发生变化。因此,细胞内的缓冲系统有助于防止细胞外液pH值的变化,但可能需要几个小时才能达到最大效果。
在红细胞中,血红蛋白(Hb)是一种重要的缓冲剂,如下所示:
H++Hb\overset\longrightarrow\longleftarrowHHb
大约60%到70%的体液化学缓冲作用发生在细胞内,其中大部分缓冲作用来自细胞内蛋白质。然而,除了红细胞外,H+和HCO_3-通过细胞膜的缓慢速率通常会延迟细胞内蛋白质缓冲细胞外酸碱异常的最大能力数小时。
除了细胞内蛋白质的高浓度外,另一个有助于其缓冲能力的因素是许多这些蛋白质系统的pK值与细胞内pH值相当接近。
等氢离子原理:共同溶液中的所有缓冲剂都与相同的H+浓度处于平衡状态
我们一直在讨论缓冲系统,仿佛它们在体液中独立运作。然而,它们实际上是一起工作的,因为H+是所有这些系统反应中的共同因素。因此,每当细胞外液中的\ H+浓度发生变化时,所有缓冲系统的平衡也会同时发生变化。这种现象被称为等氢离子原理(isohydric principle),并由以下公式说明:
H+=K_1×\fracHA_1A_1=K_2×\fracHA_2A_2=K_3×\fracHA_3A_3
K_1,K_2,和K_3分别是三种酸-HA_1、HA_2、HA_3的解离常数(dissociation constants),而A_1,、A_2,、A_3是构成这三种缓冲系统碱基的自由负离子的浓度。
这一原理的含义是,任何改变其中一个缓冲系统平衡的条件也会改变所有其他缓冲系统的平衡,因为缓冲系统实际上通过\ H+在它们之间的来回转移来相互缓冲。
酸碱平衡的呼吸调节
抵御酸碱紊乱的第二道防线是通过肺部控制细胞外液中的CO_2浓度。通气量的增加会从细胞外液中排出CO_2,通过质量作用(mass action)减少\ H+的浓度。相反,通气量的减少会增加细胞外液中的CO_2和\Hat浓度。
肺部的CO_2排出平衡代谢产生的CO_2
CO_2在体内通过细胞内代谢过程不断形成。形成后,它从细胞扩散到间质液和血液中,流动的血液将其运输到肺部,在那里它扩散到肺泡中,然后通过肺通气转移到大气中。正常情况下,细胞外液中溶解的CO_2约为1.2mol/L,对应的Pco_2为40mmHg。
如果CO_2的代谢形成速率增加,细胞外液的Pco_2也会增加。相反,代谢速率的降低会降低PCO_2。如果肺通气速率增加,CO_2会从肺部排出,细胞外液中的Pco_2会降低。因此,肺通气速率或组织CO_2形成速率的变化可以改变细胞外液的PCO_2。
图31-2. 肺泡通气速率增加或减少引起的细胞外液pH变化,表示为正常值的倍数。
增加肺泡通气会降低细胞外液中的H+浓度并提高pH
如果CO_2的代谢生成保持恒定,影响细胞外液中PCO_2的唯一其他因素是肺泡通气(alveolar ventilation)速率。肺泡通气越高,Pco_2越低。如前所述,当CO_2浓度增加时,H_2CO_3浓度和H+浓度也会增加,从而降低细胞外液的pH值。
图31-2显示了增加或减少肺泡通气速率引起的血液pH的近似变化。请注意,将肺泡通气增加到正常水平的两倍左右会使细胞外液的pH增加约0.23。如果正常肺泡通气下体液的pH为7.40,将通气速率加倍会使pH值增加到约7.63。相反,将肺泡通气减少到正常水平的四分之一会使pH值降低0.45。也就是说,如果正常肺泡通气下pH为7.4,将通气减少到正常水平的四分之一会使pH值降低到6.95。由于肺泡通气速率可以显著变化,从低至0到高达正常水平的15倍,人们可以很容易理解呼吸系统如何显著改变体液的pH值。
增加的H+浓度刺激肺泡通气
肺泡通气速率不仅通过改变体液的PCO_2来影响\ H+浓度,而且\Hat浓度也会影响肺泡通气速率。因此,图31-3显示,当pH从正常值7.4下降到强酸性值7.0时,肺泡通气速率增加到正常水平的四到五倍。相反,血浆pH值上升到7.4以上会导致通气速率下降。与pH值升高相比,pH值降低(对应于\ H+浓度升高)时,每单位pH变化的通气速率变化要大得多。这是因为随着肺泡通气速率的降低,由于pH值升高(\Hat浓度降低),血液中氧气的添加量减少,血液中的氧分压\left(Po_2\right)也降低,从而刺激通气速率。因此,呼吸系统对pH值升高的补偿远不如对pH值显著降低的反应有效。
图31-3. 血液pH对肺泡通气速率的影响。
呼吸系统对H+浓度的反馈控制。由于增加的H+浓度刺激呼吸,而增加的肺泡通气降低H+浓度,呼吸系统充当了\ H+浓度的典型负反馈控制器:
\beginarrayr l&\uparrow[H+]\to\uparrowA l v e o l a r v e n t i l a t i o n\ &\Theta_:\ldots\ldots\ldots\ldots\downarrowP c o_2\uparrow\endarray
也就是说,每当H+浓度增加到正常水平以上时,呼吸系统就会受到刺激,肺泡通气量增加。这种机制降低了细胞外液中的Pco_2,并使\Hat浓度恢复到正常水平。相反,如果\ H+浓度下降到正常水平以下,呼吸中枢就会受到抑制,肺泡通气量减少,\Hat浓度回升到正常水平。尽管碱中毒倾向于抑制呼吸中枢,但这种反应通常不如对代谢性酸中毒的反应强烈和可预测;与肺泡通气量减少相关的低氧血症最终会激活对氧气敏感的化学感受器,这些感受器倾向于刺激通气并限制对代谢性碱中毒的呼吸补偿。
呼吸控制H+浓度的效率
当呼吸系统外部的干扰改变了pH值时,呼吸控制无法将H+浓度完全恢复到正常水平。通常,控制\Hat浓度的呼吸机制大约有50%到75%的有效性,对应于代谢性酸中毒的反馈增益为1到3。也就是说,如果通过向细胞外液中添加酸使pH突然下降,pH从7.4降至7.0,呼吸系统可以将pH恢复到大约7.2到7.3的值。这种反应在3到12分钟内发生。如前所述,代谢性碱中毒的呼吸反应受到与肺泡通气量减少相关的低氧血症的限制。
呼吸系统的缓冲能力。呼吸系统对酸碱平衡的调节是一种生理类型的缓冲系统,因为它作用迅速,并在缓慢反应的肾脏能够消除失衡之前,防止H+浓度发生太大变化。总的来说,呼吸系统的整体缓冲能力是细胞外液中所有其他化学缓冲剂缓冲能力的一到两倍。也就是说,这种机制通常可以缓冲的酸或碱的量是化学缓冲剂的一到两倍。
肺功能受损可能导致呼吸性酸中毒。到目前为止,我们已经讨论了正常呼吸机制作为缓冲\ H+浓度变化的手段的作用。然而,呼吸异常也可能导致H+浓度的变化。例如,肺功能受损,如严重的肺气肿,会降低肺部消除CO_2的能力,导致细胞外液中CO_2的积累和呼吸性酸中毒的趋势。此外,对代谢性酸中毒的反应能力也会受损,因为通常通过增加通气量发生的Pco_2补偿性降低会被削弱。在这些情况下,肾脏代表了在细胞外液中的初始化学缓冲发生后,将pH恢复到正常水平的唯一剩余生理机制。
肾脏对酸碱平衡的控制
肾脏通过排泄酸性或碱性尿液来控制酸碱平衡。排泄酸性尿液减少了细胞外液中的酸量,而排泄碱性尿液则从细胞外液中去除碱。
肾脏排泄酸性或碱性尿液的总体机制如下。大量的HCO_3-不断被过滤到肾小管中,如果排泄到尿液中,就会从血液中移除碱。大量的\Hat也被肾小管上皮细胞分泌到肾小管腔中,从而从血液中移除酸。如果分泌的\Hat比过滤的HCO_3-多,细胞外液中的酸将会有净损失。相反,如果过滤的HCO_3-比分泌的\ H+多,碱将会有净损失。
每天,身体产生约80mEq的非挥发性酸(nonvolatile acids),主要来自蛋白质的代谢。这些酸被称为非挥发性酸,因为它们不是H_2CO_3,因此不能通过肺部排泄。从体内移除这些酸的主要机制是肾脏排泄。肾脏还必须防止尿液中碳酸氢盐的损失,这一任务在数量上比排泄非挥发性酸更为重要。每天,肾脏过滤约4320mEq的HCO_3-(180L/天×24mEq/L));在正常情况下,几乎所有过滤的HCO_3-都会从肾小管中重吸收,从而保存细胞外液的主要缓冲系统。
正如后面所讨论的,HCO_3-的重吸收和\ H+的排泄都是通过肾小管分泌H+的过程完成的。因为HCO_3-必须与分泌的\Hat反应形成H_2CO_3才能被重吸收,所以每天必须分泌4320mEq的H+才能重吸收过滤的HCO_3-。然后,还需要额外分泌80mEq的\Hat以排出每天产生的非挥发性酸,总共每天分泌4400mEq的H+到肾小管液中。
当细胞外液中的\Hat浓度降低(碱中毒(alkalosis))时,肾脏通常会分泌较少的\ H+,并且无法重吸收所有过滤的HCO_3-,从而增加HCO_3-的排泄。由于HCO_3-通常在细胞外液中缓冲H+,这种HCO_3-的损失等同于向细胞外液中添加H+。因此,在碱中毒时,移除HCO_3-会使细胞外液中的H+浓度恢复到正常水平。
在酸中毒(acidosis)时,肾脏会分泌额外的\Hat,并且不会将HCO_3-排泄到尿液中,而是重吸收所有过滤的HCO_3-并产生新的HCO_3-,这些新的HCO_3-会被重新添加到细胞外液中。这一作用使细胞外液中的H+浓度恢复到正常水平。
因此,肾脏通过三种基本机制调节细胞外液中的H+浓度:(1) 分泌\because H+;(2) 重吸收过滤的H C O_3-;(3) 产生新的H C O_3-。所有这些过程都是通过相同的基本机制完成的,正如接下来的几节中所讨论的那样。
肾小管对\Hat的分泌和HCO_3-的重吸收
氢离子(H+)的分泌和HCO_3-的重吸收几乎发生在肾小管的所有部分,除了Henle袢的降支和升支细段。图31-4总结了HCO_3-沿肾小管的重吸收情况。需要注意的是,每重吸收一个\cal H\cal C\cal O_3-,必须分泌一个H+。
大约80%到90%的HCO_3-重吸收(以及H+分泌)发生在近端小管,因此只有少量的HCO_3-流入远端小管和集合管。在Henle袢的粗升支,另外10%的滤过HCO_3-被重吸收,其余的重吸收发生在远端小管和集合管。如前所述,HCO_3-重吸收的机制也涉及肾小管分泌H+,但不同的肾小管段以不同的方式完成这一任务。
图31-4. 肾小管不同段对H C O_3-的重吸收。图中显示了各肾小管段吸收的滤过H C O_3-的百分比,以及在正常条件下每天重吸收的毫当量数。
早期肾小管段通过次级主动转运分泌H+
近端小管、Henle袢粗升支和远端小管早期的上皮细胞都通过钠-氢反向转运将H+分泌到肾小管液中,如图31-5所示。这种次级主动分泌\Hat与钠-氢交换蛋白在管腔膜上将Na+转运到细胞内相耦合,而\Hat逆浓度梯度分泌所需的能量来自于有利于Na+进入细胞的钠梯度。这一梯度由基底外侧膜上的钠-钾腺苷三磷酸酶(Na+-K+ ATPase)泵建立。大约95%的碳酸氢盐以这种方式被重吸收,肾小管每天需要分泌约4000mEq的\Hat。然而,这种机制只能建立约6.7的最低pH值;只有在集合小管和集合管中,肾小管液才会变得非常酸性,尿液的pH可低至约4.5。
图31-5展示了H+分泌过程如何实现HCO_3-的重吸收。分泌过程始于CO_2扩散进入肾小管细胞或在肾小管上皮细胞内通过代谢形成。在碳酸酐酶(carbonic anhydrase)的作用下,CO_2与H_2O结合形成H_2CO_3,随后解离为HCO_3-和H+。H+通过钠-氢反向转运(sodium-hydrogen countertransport)从细胞分泌到肾小管管腔中。也就是说,当Na+从肾小管管腔移动到细胞内时,它首先与细胞膜管腔侧的载体蛋白(carrier protein)结合;同时,细胞内的H+也与载体蛋白结合。Na+沿着由基底外侧膜上的Na+-K+ ATPase泵建立的浓度梯度进入细胞。Na+进入细胞的梯度为H+从细胞内部向肾小管管腔的相反方向移动提供了能量。
图31-5展示了以下细胞机制:(1) H+主动分泌到肾小管中;(2) HCO_3-通过与H+结合形成H_2CO_3,随后解离为CO_2和H_2O,从而实现肾小管重吸收;(3) Na+通过与分泌的H+交换而重吸收。这种H+分泌模式发生在近端小管、Henle袢的厚升支和远端小管的早期部分。
细胞内生成的HCO_3-(当H+从H_2CO_3解离时)随后沿着浓度梯度穿过基底外侧膜,进入肾间质液和肾小管周围毛细血管血液中。最终结果是,每分泌一个H+到肾小管管腔中,就有一个HCO_3-进入血液。
滤过的HCO_3-通过与肾小管中的H+相互作用而被重吸收
碳酸氢根离子(bicarbonate ions)不易通过肾小管细胞的管腔膜;因此,肾小球滤过的HCO_3-不能直接被重吸收。相反,HCO_3-通过一个特殊过程被重吸收,即首先与H+结合形成H_2CO_3,最终转化为CO_2和H_2O,如图31-5所示。
HCO_3-的重吸收(Reabsorption)是由肾小管中滤过的HCO_3-和肾小管细胞分泌的H+之间的反应启动的。形成的H_2CO_3随后解离为CO_2和H_2O。CO_2可以轻易穿过肾小管膜;因此,它立即扩散到肾小管细胞中,在碳酸酐酶(Carbonic Anhydrase)的作用下与H_2O重新结合,生成新的H_2CO_3分子。这个H_2CO_3解离形成HCO_3-和\Hat;然后HCO_3-通过基底外侧膜(Basolateral Membrane)扩散到间质液中,并被吸收到肾小管周围毛细血管血液中。HCO_3通过基底外侧膜的运输由两种机制促进:(1) 近端小管中的Na+–H C O_3-共转运(Co-transport);(2) 近端小管后段、Henle袢粗升支以及集合管和导管中的Cl-\cdotHCO_3-交换(Exchange)。
因此,每当肾小管上皮细胞中形成一个H+时,也会形成一个H C O_3-并释放回血液中。这些反应的净效应是从肾小管中“重吸收”HCO_3-,尽管实际进入细胞外液的HCO_3-与滤入肾小管的HCO_3-并不相同。滤过的HCO_3-的重吸收不会导致\Hat的净分泌,因为分泌的\Hat与滤过的HCO_3-结合,因此不会被排泄。
H C O_3-在肾小管中与H+滴定(Titrate)。在正常情况下,肾小管H+的分泌速率约为4400mEq/day,而HCO_3-的滤过速率约为4320 mEq/day。因此,进入肾小管的这两种离子的量几乎相等,它们相互结合形成CO_2和H_2O。因此,可以说HCO_3-和H+在肾小管中通常“滴定”彼此。
滴定过程并不完全精确,因为通常肾小管中会有少量的H+过量,这些过量的\Hat (\approx80mEq/day)会通过尿液排出体外,以清除代谢产生的非挥发性酸(Nonvolatile Acids)。正如后面所讨论的,大多数H+并不是以游离H+的形式排泄,而是与其他尿液缓冲剂(Urinary Buffers)结合,尤其是磷酸盐(Phosphate)和氨(Ammonia)。
当尿液中的HCO_3-超过\Hat时,如在代谢性碱中毒(Metabolic Alkalosis)中发生的情况,过量的HCO_3-无法被重吸收。因此,过量的HCO_3-留在肾小管中,最终排泄到尿液中,这有助于纠正代谢性碱中毒。
在酸中毒(acidosis)时,H+相对于HCO_3-过量,导致HCO_3-完全重吸收;过量的\Hat与尿液缓冲剂(urinary buffers)结合,特别是磷酸盐(phosphate)和氨(ammonia),最终以盐的形式排出。因此,肾脏纠正酸中毒或碱中毒(alkalosis)的基本机制是H+与HCO_3-的不完全滴定(incomplete titration),使其中一种进入尿液并从细胞外液(extracellular fluid)中移除。
晚期远端小管和集合管插入细胞中H+的初级主动分泌
从远端小管(late distal tubules)开始并延续至小管系统的其余部分,小管上皮通过初级主动转运(primary active transport)分泌\Hat。这种转运的特性与近端小管(proximal tubule)、Henle袢(loop of Henle)和早期远端小管(early distal tubule)中讨论的不同。
第28章讨论了初级主动H+分泌的机制,并在图31-6中展示。它发生在小管细胞的管腔膜(luminal membrane)上,H+通过特定的蛋白质直接转运,即氢转运ATP酶(hydrogen-transporting ATPase)和氢钾ATP酶转运体(hydrogen-potassiumATPase transporter)。泵送H+所需的能量来自ATP分解为二磷酸腺苷(adenosine diphosphate)。
图31-6. 通过晚期远端小管和集合管A型插入上皮细胞(type A intercalated epithelial cells)的管腔膜主动分泌H+。A型细胞在管腔膜中含有氢-三磷酸腺苷酶(hydrogen–adenosine triphosphatase, ATPase)和氢钾ATP酶(hydrogen-potassium-ATPase),在酸中毒时分泌H+同时重吸收H C O_3-和K+。注意,每分泌一个H+就重吸收一个H C O_3-,并且一个\subset\l与H+一起被动分泌。
初级主动H+分泌发生在称为A型插入细胞(type A intercalated cells)的特殊类型细胞中,这些细胞位于晚期远端小管和集合管中。这些细胞中的氢离子分泌分两步完成:(1) 细胞中溶解的CO_2与H_2O结合形成H_2CO_3;;(2) H_2CO_3随后解离为HCO_3-,后者被重吸收进入血液,以及H+,后者通过氢ATP酶和氢钾ATP酶转运体分泌到小管中。每分泌一个H+,就重吸收一个HCO_3-,类似于近端小管中的过程。主要区别在于H+通过主动\Hat泵穿过管腔膜,而不是像在肾单位(nephron)早期部分那样通过反向转运(counter-transport)进行。
尽管在远端小管(distal tubule)和集合管(collecting tubules)中分泌的H+仅占总分泌H+的约5%,但这一机制在形成最大酸性尿液方面非常重要。在近端小管(proximal tubules)中,H+浓度只能增加约3到4倍,管腔液体的pH只能降低到约6.7,尽管这一肾单位(nephron)段分泌了大量的H+。然而,在集合管中,H+浓度可以增加多达900倍。这一机制将管腔液体的pH降低到约4.5,这是正常肾脏可以达到的pH下限。
小管中过量的H+与磷酸盐和氨缓冲液结合生成“新”的\mathbfHCO_3-
当分泌的H+超过滤入管腔液体的HCO_3-时,只有一小部分过量的H+可以以离子形式\left(H+\right)在尿液中排泄。
这是因为尿液的最小pH约为4.5,对应的H+浓度为10-4.5mEq/L,即0.03mEq/L。因此,对于每升形成的尿液,最多只能排泄约0.03mEq的游离H+。如果要排泄每天代谢形成的80mEq非挥发性酸,如果H+在溶液中保持游离状态,则需要排泄约2667升尿液。
在尿液中排泄大量H+(有时多达500mEq/day)主要通过将H+与管腔液体中的缓冲液结合来实现。最重要的缓冲液是磷酸盐缓冲液(phosphate buffer)和氨缓冲液(ammonia buffer)。其他弱缓冲系统,如尿酸(urate)和柠檬酸(citrate),则不那么重要。
当管腔液体中的H+与HCO_3-滴定(titrated)时,这会导致每个分泌的H+重吸收一个HCO_3-,如前所述。然而,当管腔液体中存在过量的H+时,它会与HCO_3-以外的缓冲液结合,这会导致生成新的HCO_3-,这些HCO_3-也可以进入血液。因此,当细胞外液(extracellular fluid)中存在过量的H+时,肾脏不仅重吸收所有滤过的HCO_3-,还会生成新的HCO_3-,从而帮助补充酸中毒(acidosis)中从细胞外液丢失的HCO_3-。在接下来的两节中,我们将讨论磷酸盐和氨缓冲液如何促进生成新的HCO_3-。
磷酸盐缓冲系统将过量的H+带入尿液并生成新的HCO_3-
磷酸盐缓冲系统由HPO_4=组成。由于水通常比磷酸盐在肾小管中重吸收得更多,因此两者在管腔液体中都会浓缩。因此,尽管磷酸盐不是重要的细胞外液缓冲液,但它在管腔液体中作为缓冲液更为有效。
另一个使磷酸盐作为肾小管缓冲剂的重要因素是该系统的pK值约为6.8。在正常情况下,尿液呈微酸性,尿液的pH值接近磷酸盐缓冲系统的pK值。因此,在肾小管中,磷酸盐缓冲系统通常在其最有效的pH范围内发挥作用。
图31-7展示了\Hat与磷酸盐缓冲剂结合排泄的过程以及新的HCO_3-被添加到血液中的机制。\Hat分泌到肾小管的过程与之前描述的过程相同。只要肾小管液中有过量的HCO_3-,大多数分泌的\Hat就会与HCO_3-结合。然而,一旦所有的HCO_3-被重吸收并且不再与\ H+结合,任何过量的\Hat都可以与HPO_4=和其他肾小管缓冲剂结合。当\Hat与HPO_4=结合形成H_2PO_4-后,它可以以钠盐(NaH_2P O_4)的形式排泄,同时带走过量的\Hat。
图31-7. 通过过滤的磷酸盐(NaHP O_4)缓冲分泌的H+。注意,每当一个NaHP O_4与一个分泌的H+反应时,一个新的H C O_3-被返回到血液中。
在这个H+排泄的过程中,有一个重要的区别。在这种情况下,肾小管细胞中生成的HCO_3-进入管周血液,代表了血液中HCO_3-的净增加,而不仅仅是过滤的HCO_3-的替换。因此,每当一个分泌到肾小管腔的H+与H C O_3-以外的缓冲剂结合时,净效应是向血液中添加一个新的H C O_3-。这个过程展示了肾脏如何补充细胞外液中HCO3−储备的机制之一。
在正常情况下,大部分过滤的磷酸盐被重吸收,只有30到40 mEq/天的磷酸盐可用于缓冲H+。因此,在酸中毒时,肾小管液中过量H+的缓冲主要通过氨缓冲系统进行。
通过氨缓冲系统排泄过量H+并生成新的H C O_3-
图31-8. 近端肾小管细胞中铵离子\left(N H_4+\right)的产生和分泌。谷氨酰胺在细胞内代谢,产生N H_4+和H C O_3-。N H_4+通过N a+-N H_4+交换体分泌到管腔中。每代谢一个谷氨酰胺分子,会产生并分泌两个N H_4+,同时有两个H C O_3-返回到血液中。
图31-9. 集合管中氨(N H_3)对H+分泌的缓冲作用。N H_3扩散到管腔中,与分泌的H+反应形成N H_4+,随后被排泄。每排泄一个N H_4+,管状细胞中就会形成一个新的H C O_3-并返回血液。
管状液中的第二个缓冲系统在数量上比磷酸盐缓冲系统更为重要,它由氨(\left(NH_3\right))和铵离子((NH_4+))组成。铵离子由谷氨酰胺合成,谷氨酰胺主要来自肝脏中氨基酸的代谢。输送到肾脏的谷氨酰胺被转运到近端小管、Henle环的厚升支和远端小管的上皮细胞中(图31-8)。一旦进入细胞,每个谷氨酰胺分子在一系列反应中被代谢,最终形成两个NH_4+和两个HCO_3-。NH_4+通过一个逆向转运机制分泌到管腔中,以交换被重吸收的钠。HCO_3-与重吸收的Na+一起穿过基底外侧膜进入间质液,并被管周毛细血管吸收。因此,对于在近端小管中代谢的每个谷氨酰胺分子,两个NH_4+被分泌到尿液中,两个HCO_3-被重吸收到血液中。通过此过程生成的H C O_3-构成了新的H C O_3-。
在集合管中,NH_4+通过不同的机制加入到管状液中(图31-9)。在这里,\ H+被管状膜主动分泌到管腔中,与NH_3结合形成NH_4+,随后被排泄。集合管对NH_3具有通透性,NH_3可以轻松扩散到管腔中。然而,这部分小管的管腔膜对NH_4+的通透性要低得多;因此,一旦\ H+与NH_3反应形成NH_4+,NH_4+就被困在管腔中并通过尿液排出。每排泄一个N H_4+,就会生成一个新的H C O_3-并加入到血液中。
慢性酸中毒增加N H_4+排泄。肾氨-铵缓冲系统最重要的特征之一是它受到生理控制。细胞外液H+浓度的增加会刺激肾脏谷氨酰胺的代谢,从而增加NH_4+和新HCO_3-的形成,用于缓冲;H+浓度的降低则产生相反的效果。
在正常情况下,通过氨缓冲系统排出的\Hat量约占肾脏排泄的酸的50%和新生成的HCO_3-的50%。然而,在慢性酸中毒(acidosis)的情况下,NH_4+的排泄率可增加至500 mEq/天。因此,在慢性酸中毒时,酸排泄的主要机制是NH_4+的排泄。这一过程也为慢性酸中毒期间生成新的碳酸氢盐提供了最重要的机制。
量化肾脏的酸碱排泄
基于前面讨论的原理,我们可以量化肾脏对酸的净排泄或从血液中净增加或消除的HCO_3-,如下所示。
碳酸氢盐排泄量计算为尿流量乘以尿中HCO_3-浓度,表明肾脏从血液中去除HCO_3-的速度,这相当于向血液中添加H+。在碱中毒(alkalosis)时,HCO_3-的丢失有助于使血浆pH值恢复正常。
在任何给定时间,血液中新生成的H C O_3-的量等于分泌到肾小管腔中与非碳酸氢盐尿缓冲剂结合的\ H+的量。如前所述,非碳酸氢盐尿缓冲剂的主要来源是NH_4+和磷酸盐。因此,通过测量NH_4+排泄量(尿流量乘以尿中NH_4+浓度)可以计算出添加到血液中的HCO_3-的一部分(以及通过NH_4+排泄的\Hat)。
尿液中排泄的其他非碳酸氢盐、非NH_4+缓冲剂通过测定称为可滴定酸(titratable acid)的值来测量。尿液中的可滴定酸量通过用强碱(如NaOH)滴定尿液至pH 7.4(正常血浆的pH和肾小球滤液的pH)来测量。这一滴定逆转了肾小管液被分泌的H+滴定时所发生的事件。因此,将尿液pH恢复到7.4所需的NaOH的毫当量数等于添加到肾小管液中与磷酸盐和其他有机缓冲剂结合的\ H+的毫当量数。可滴定酸测量不包括与NH_4+结合的H+,因为氨-铵反应的pK为9.2,用NaOH滴定至pH 7.4不会从NH_4+中去除\Hat。
因此,肾脏的净酸排泄可以如下评估:
净酸排泄 =NH_4+ 排泄 + 尿可滴定酸 -HCO_3- 排泄
我们减去HCO_3-排泄的原因是HCO_3-的丢失相当于向血液中添加H+。为了维持酸碱平衡,净酸排泄必须等于体内非挥发性酸的产生量。
在酸中毒(acidosis)时,净酸排泄(net acid excretion)显著增加,尤其是由于NH_4+排泄增加,从而从血液中去除酸。净酸排泄也等于血液中净HCO_3-增加的速度。因此,在酸中毒时,随着更多的N H_4+和可滴定酸(titratable acid)被排泄,有净的H C O_3-被加回到血液中。
在碱中毒(alkalosis)时,可滴定酸和NH_4+的排泄降至0,而HCO_3-的排泄增加。因此,在碱中毒时,存在负的净酸分泌(negative net acid secretion),这意味着血液中有净的HCO_3-丢失,这相当于向血液中添加\Hat,并且肾脏没有生成新的HCO_3-。
肾小管\mathbbH+分泌的调节
如前所述,肾小管上皮细胞的H+分泌对于HCO_3-的重吸收(reabsorption)和与可滴定酸形成相关的新HCO_3-的生成是必要的。因此,如果肾脏要有效地执行其在酸碱平衡(acid-base homeostasis)中的功能,H+分泌的速度必须仔细调节。在正常情况下,肾小管必须分泌至少足够的\Hat以重吸收几乎所有被滤过的HCO_3-,并且必须有足够的\Hat剩余以作为可滴定酸或NH_4+排泄,以清除体内每天代谢产生的非挥发性酸(nonvolatile acids)。
在碱中毒时,肾小管的\Hat分泌减少到一个太低以至于无法实现完全HCO_3-重吸收的水平,使肾脏能够增加HCO_3-的排泄。在碱中毒时,可滴定酸和氨不被排泄,因为没有多余的H+可用于与非碳酸氢盐缓冲剂(nonbicarbonate buffers)结合;因此,在碱中毒时没有新的HCO_3-被添加到血液中。
在酸中毒期间,肾小管的H+分泌增加到足以重吸收所有被滤过的HCO_3-,并有足够的H+剩余以排泄大量的NH_4+和可滴定酸,从而为全身细胞外液(extracellular fluid)贡献大量的新HCO_3-。在酸中毒时,增加肾小管H+分泌的最重要刺激因素如下:(l)在呼吸性酸中毒(respiratory acidosis)时细胞外液的P C O_2增加;和(2)在呼吸性或代谢性酸中毒(metabolic acidosis)时细胞外液的H+浓度增加(pH降低)。
肾小管细胞直接响应血液中Pco_2的增加,如在呼吸性酸中毒时,H+分泌速度增加,如下所示。增加的Pco_2提高了肾小管细胞的Pco_2,导致肾小管细胞中H+的形成增加,这反过来又刺激了H+的分泌。刺激H+分泌的第二个因素是细胞外液H+浓度的增加(pH降低)。
表31-2 增加或减少肾小管H+分泌和H C O_3\cdot重吸收的血浆或细胞外液因素
markdown
| 增加H+分泌和HCO3-重吸收 | 减少H+分泌和HCO3-重吸收 |
| ↑PCO2 | ↓PCO2 |
| ↑H+, ↓HCO3- | ↓H+, ↑HCO3- |
| ↓细胞外液体积 | ↑细胞外液体积 |
| ↑血管紧张素II | ↓血管紧张素II |
| ↑醛固酮 | ↓醛固酮 |
| 低钾血症 | 高钾血症 |
在某些病理生理条件下,醛固酮分泌过多是一个可以增加H+分泌的特殊因素。醛固酮通过刺激集合管和集合小管的A型间质细胞分泌H+。因此,醛固酮分泌过多,如Conn综合征患者,会增加H+分泌到管腔液中,从而增加HCO3-回收到血液中的量。这一作用通常会导致醛固酮分泌过多的患者出现碱中毒。
肾小管细胞通常通过减少H+分泌来应对H+浓度降低(碱中毒)。H+分泌减少是由于细胞外PCO2降低,如呼吸性碱中毒,或H+浓度降低,如呼吸性和代谢性碱中毒。
表31-2总结了影响H+分泌和HCO3-重吸收的主要因素。其中一些因素与酸碱平衡的调节没有直接关系。例如,H+分泌与Na+重吸收通过近端小管和Henle袢粗升支中的Na+-H+交换器耦合。因此,刺激Na+重吸收的因素,如细胞外液体积减少和血管紧张素II(Ang II)增加,也可能间接增加H+分泌和HCO3-重吸收。
细胞外液体积减少通过多种机制刺激肾小管钠重吸收并增加H+分泌和HCO3-重吸收,包括以下内容:(1)Ang II水平增加,直接刺激肾小管中的Na+-H+交换器活性;(2)醛固酮水平增加,刺激皮质集合管间质细胞的H+分泌。因此,细胞外液体积减少往往会导致由于H+分泌过多和HCO3-重吸收过多而引起的碱中毒。
血浆钾浓度的变化也会影响H+分泌,低钾血症刺激近端小管中的H+分泌,而高钾血症抑制H+分泌。血浆钾浓度降低往往会增加肾小管细胞中的H+浓度。这反过来又刺激H+分泌和HCO3-重吸收,导致碱中毒。高钾血症减少H+分泌和HCO3-重吸收,往往会导致酸中毒。
肾脏对酸中毒的纠正——增加H+排泄和向细胞外液添加HCO3-
既然我们已经描述了肾脏分泌H+和重吸收HCO_3-的机制,我们现在可以解释当细胞外液的pH异常时,肾脏如何重新调整它。
参考方程式8,即Henderson-Hasselbalch方程,我们可以看到当细胞外液中HCO_3-与CO_2的比例下降时,会发生酸中毒(acidosis),从而导致pH值下降。如果这个比例因为HCO_3-的下降而降低,这种酸中毒被称为代谢性酸中毒(metabolic acidosis)。如果pH值因为PCO_2的升高而下降,这种酸中毒被称为呼吸性酸中毒(respiratory acidosis)。
酸中毒降低肾小管液中H C O_3\bar-/H+的比例
呼吸性和代谢性酸中毒都会导致肾小管液中HCO_3-/H+的比例下降。结果,肾小管中有过量的\Hat,导致HCO_3-的完全重吸收,并且仍然有额外的\ H+可以与尿液缓冲剂NH_4+和HPO_4=结合。因此,在酸中毒时,肾脏重吸收所有过滤的HCO_3-,并通过形成NH_4+和可滴定酸(titratable acid)贡献新的HCO_3-。
在代谢性酸中毒中,肾小管液中H+相对于HCO_3-的过量主要是由于细胞外液中HCO_3-浓度的下降,从而导致HCO_3-的肾小球滤过减少。
在呼吸性酸中毒中,肾小管液中的过量\Hat主要是由于细胞外液中PCO_2的升高,这刺激了H+的分泌。
如前所述,在慢性酸中毒中,无论是呼吸性还是代谢性,NH_4+的生成都会增加,这进一步促进了\Hat的排泄和新的HCO_3-向细胞外液的添加。在严重的慢性酸中毒中,每天可以有多达500mEq/day的\Hat以NH_4+的形式排泄到尿液中;这种排泄反过来又贡献了多达500 mEq/day的新HCO_3-添加到血液中。
因此,在慢性酸中毒中,肾小管增加\Hat的分泌有助于消除体内过量的\Hat,并增加细胞外液中HCO_3-的量。这个过程增加了碳酸氢盐缓冲系统(bicarbonate buffer system)中的HCO_3-部分,根据Henderson-Hasselbalch方程,这有助于提高细胞外液的pH并纠正酸中毒。如果酸中毒是由代谢引起的,肺部的额外补偿会导致PCO_2的降低,也有助于纠正酸中毒。
表31-3 原发性酸碱紊乱的细胞外液特征a
html <html><body><table><tr><td></td><td>pH</td><td>H+</td><td>PCO2</td><td>HCO3-</td></tr><tr><td>正常</td><td>7.4</td><td>40 mEq/L</td><td>40mmHg</td><td>24 mEq/L</td></tr><tr><td>呼吸性酸中毒</td><td>↑</td><td>↑</td><td></td><td>↑</td></tr><tr><td>呼吸性碱中毒</td><td>↑</td><td></td><td>↑↑</td><td></td></tr><tr><td>代谢性酸中毒</td><td>一</td><td>↑</td><td>一</td><td>↑个</td></tr><tr><td>代谢性碱中毒</td><td>↑</td><td></td><td>↑</td><td>↑</td></tr></table></body></html>
a主要事件由双箭头(↑↑或↓↓)表示。注意,呼吸性酸碱紊乱是由P C O_2的增加或减少引发的,而代谢性紊乱是由H C O_3-的增加或减少引发的。
表31-3总结了与呼吸性和代谢性酸中毒以及呼吸性和代谢性碱中毒相关的细胞外液特征,这些内容将在下一节讨论。注意,在呼吸性酸中毒中,pH降低,细胞外液H+浓度增加,PCO_2增加,这是酸中毒的初始原因。代偿反应是血浆H C O_3-的增加,这是由于肾脏向细胞外液添加了新的H C O_3-。HCO_3-的增加有助于抵消PCO_2的增加,从而使血浆pH恢复正常。
在代谢性酸中毒中,pH也下降,细胞外液\ H+浓度上升。然而,在这种情况下,主要异常是血浆HCO_3-的减少。主要的代偿包括增加通气率,从而减少P C O_2,以及肾脏代偿,通过向细胞外液添加新的H C O_3-,有助于最小化细胞外H C O_3-浓度的初始下降。
碱中毒的肾脏纠正——减少H+的管状分泌和增加H C O_3-的排泄
碱中毒的代偿反应基本上与酸中毒相反。在碱中毒中,细胞外液中HCO_3-与CO_2的比率增加,导致pH上升(\ H+浓度下降),这可以从Henderson-Hasselbalch方程中看出。
碱中毒增加肾小管液中H C O_3\bar-/H+比率
无论碱中毒是由代谢性还是呼吸性异常引起的,肾小管液中HCO_3-/H+的比率仍然增加。其净效应是HCO_3-的过量,无法从小管中重吸收,因此通过尿液排出。因此,在碱中毒中,HCO_3-通过肾脏排泄从细胞外液中移除,这与向细胞外液添加\Hat具有相同的效果。这个过程有助于使\Hat浓度和pH恢复正常。
表31-3显示了呼吸性和代谢性碱中毒的总体细胞外液特征。在呼吸性碱中毒中,细胞外液pH值升高,H+浓度降低。碱中毒的原因是过度通气导致的血浆P C O_2降低。Pco_2的降低进而导致肾小管H+分泌减少。因此,肾小管液中没有足够的\Hat与所有过滤的HCO_3-反应。因此,不能与H+反应的HCO_3-不会被重吸收,而是随尿液排出。这导致血浆HCO_3-浓度降低,从而纠正碱中毒。因此,呼吸性碱中毒中P C O_2原发性降低的补偿反应是血浆H C O_3-浓度降低,这是由于肾脏排泄H C O_3-增加所致。
在代谢性碱中毒中,血浆H+浓度也降低,pH值升高。然而,代谢性碱中毒的原因是细胞外液H C O_3-浓度升高。这种升高部分通过呼吸速率降低来补偿,呼吸速率降低会增加Pco_2,并帮助将细胞外液pH恢复到正常水平。此外,细胞外液中HCO_3-浓度的增加会增加HCO_3-的过滤负荷,这反过来又会导致肾小管液中分泌的H+不足以与HCO_3-反应。由于没有\Hat与之反应,肾小管液中的过量HCO_3-无法被重吸收,而是随尿液排出。在代谢性碱中毒中,主要的补偿反应是通气减少,这会增加P C O_2,并增加肾脏H C O_3-排泄,从而帮助补偿细胞外液H C O_3-浓度的初始升高。
酸碱平衡紊乱的临床原因
呼吸性酸中毒由通气减少和P c o_2增加引起
从前面的讨论可以明显看出,任何降低肺通气速率的因素也会增加细胞外液的Pco_2。这会导致H_2CO_3和\Hat浓度增加,从而导致酸中毒。由于酸中毒是由呼吸异常引起的,因此称为呼吸性酸中毒。
呼吸性酸中毒可能由损害呼吸中枢或降低肺部排除CO_2能力的病理状况引起。例如,延髓呼吸中枢的损伤可能导致呼吸性酸中毒。此外,呼吸道通道的阻塞、肺炎、肺气肿或肺膜表面积减少,以及任何干扰血液和肺泡空气之间气体交换的因素,都可能导致呼吸性酸中毒。
在呼吸性酸中毒中,可用的补偿反应如下:(1) 体液的缓冲系统;(2) 肾脏,需要几天时间来补偿这种紊乱。
呼吸性碱中毒由通气增加和P c o_2减少引起
呼吸性碱中毒(respiratory alkalosis)是由肺部过度通气引起的。这种情况很少因身体病理状况而发生。然而,精神神经症(psychoneurosis)偶尔会增加呼吸,以至于一个人变得碱中毒。
当一个人上升到高海拔时,会发生一种生理类型的呼吸性碱中毒。空气中低氧含量刺激呼吸,导致CO_2的丢失和轻度呼吸性碱中毒的发展。再次强调,主要的补偿手段是体液的化学缓冲剂和肾脏增加HCO_3-排泄的能力。
代谢性酸中毒(metabolic acidosis)由细胞外液H C O_3-浓度降低引起
代谢性酸中毒这一术语指的是除了由体液中过量CO_2引起的所有其他类型的酸中毒。代谢性酸中毒可以由几个一般原因引起:(1) 肾脏未能正常排泄体内正常形成的代谢酸;(2) 体内形成过量的代谢酸;(3) 通过摄入或输注酸将代谢酸添加到体内;以及 (4) 从体液中丢失碱基,这与向体液中添加酸具有相同的效果。以下部分描述了一些导致代谢性酸中毒的具体情况。
肾小管酸中毒(Renal Tubular Acidosis)。肾小管酸中毒是由于肾小管H+分泌、HCO_3-重吸收或两者缺陷引起的。这些疾病通常有两种类型:(1) 肾小管HCO_3-重吸收受损,导致HCO_3-在尿液中丢失;或 (2) 肾小管\Hat分泌机制无法建立正常的酸性尿液,导致排泄碱性尿液。在这些情况下,排泄的可滴定酸和NH_4+量不足,因此体液中有酸的净积累。肾小管酸中毒的一些原因包括慢性肾功能衰竭、醛固酮分泌不足(Addison病)以及几种损害肾小管功能的遗传性和获得性疾病,如Fanconi综合征(见第32章)。
腹泻(Diarrhea)。严重腹泻可能是代谢性酸中毒最常见的原因。这种酸中毒的原因是大量碳酸氢钠丢失到粪便中。胃肠道分泌物通常含有大量碳酸氢盐,腹泻导致HCO_3-从体内丢失,这与尿液中丢失大量碳酸氢盐具有相同的效果。这种形式的代谢性酸中毒可能很严重,并可能导致死亡,尤其是在幼儿中。
呕吐肠道内容物(Vomiting of Intestinal Contents)。仅呕吐胃内容物会导致酸丢失和碱中毒倾向,因为胃分泌物是高度酸性的。然而,从胃肠道深处呕吐大量内容物会导致碳酸氢盐丢失,并以与腹泻引起酸中毒相同的方式导致代谢性酸中毒。
糖尿病(Diabetes Mellitus)
糖尿病是由于胰腺(pancreas)胰岛素(insulin)分泌不足(1型糖尿病)或胰岛素分泌不足以补偿对胰岛素作用敏感性下降(2型糖尿病)引起的。在缺乏足够胰岛素的情况下,葡萄糖(glucose)的正常代谢被阻止。相反,一些脂肪被分解为乙酰乙酸(acetoacetic acid),这种酸被组织代谢以代替葡萄糖提供能量。在严重的糖尿病中,血液乙酰乙酸水平会非常高,导致严重的代谢性酸中毒(metabolic acidosis)。为了补偿这种酸中毒,大量酸通过尿液排出——有时每天多达500 mmol。
酸的摄入(Ingestion of Acids)
在正常食物中很少摄入大量酸。然而,偶尔摄入某些酸性毒物会导致严重的代谢性酸中毒。这些物质包括一些乙酰水杨酸化合物(如阿司匹林)和甲醇(methyl alcohol),后者在代谢时形成甲酸(formic acid)。
慢性肾功能衰竭(Chronic Renal Failure)
当肾功能显著下降时,体液中未被肾脏排出的弱酸阴离子(anions of weak acids)会积聚。此外,肾小球滤过率(glomerular filtration rate)降低会减少磷酸盐(phosphates)和NH_4+的排泄,从而减少返回体液的HCO_3-量。因此,慢性肾功能衰竭可能与严重的代谢性酸中毒有关。
代谢性碱中毒(Metabolic Alkalosis)由细胞外液H C O_3-浓度增加引起
HCO_3-的过度滞留或\Hat的丢失会导致代谢性碱中毒。代谢性碱中毒远不如代谢性酸中毒常见,但以下部分描述了一些代谢性碱中毒的原因。
利尿剂的使用(Administration of Diuretics)(碳酸酐酶抑制剂除外)
所有利尿剂都会增加沿肾小管(tubules)的液体流动,通常会增加远端(distal)和集合管(collecting tubules)的流动。这种效应导致从肾单位(nephrons)的这些部分增加Na+的重吸收(reabsorption)。因为这里的钠重吸收与\ H+分泌(secretion)耦合,增强的钠重吸收也会导致\Hat分泌增加和碳酸氢盐重吸收增加。与使用利尿剂相关的细胞外液(extracellular fluid)体积减少通常也与血管紧张素II(Ang II)和醛固酮(aldosterone)的形成增加有关,这两者都刺激\Hat分泌和HCO_3-重吸收。这些变化导致碱中毒的发展,其特征是细胞外液碳酸氢盐浓度增加。
醛固酮过量(Excess Aldosterone)
当肾上腺(adrenal glands)分泌大量醛固酮时,会出现轻度代谢性碱中毒。如前所述,醛固酮促进远端和集合管中Na+的广泛重吸收,同时刺激集合管间细胞(intercalated cells)分泌\Hat和HCO_3-重吸收。这种H+分泌和HCO_3-重吸收的增加导致代谢性碱中毒。
胃内容物呕吐。仅呕吐胃内容物而不呕吐下消化道内容物,会导致胃黏膜分泌的HCl丢失。最终结果是细胞外液中的酸丢失,并发展为代谢性碱中毒(metabolic alkalosis)。这种类型的碱中毒尤其常见于因幽门括约肌肥大而导致幽门狭窄(hypertrophied pyloric sphincter muscles)的新生儿。
碱性药物摄入。代谢性碱中毒的一个常见原因是摄入碱性药物,如碳酸氢钠(sodium bicarbonate),用于治疗胃炎(gastritis)或消化性溃疡(peptic ulcer)。
酸中毒或碱中毒的治疗
酸中毒或碱中毒的最佳治疗方法是纠正导致异常的原因。这通常很困难,尤其是在导致肺功能受损或肾功能衰竭的慢性疾病中。在这些情况下,可以使用各种药物来中和细胞外液中过量的酸或碱。
为了中和过量的酸,可以口服大量碳酸氢钠。碳酸氢钠从胃肠道吸收进入血液,增加碳酸氢盐缓冲系统(bicarbonate buffer system)中的HCO_3-部分,从而使pH趋向正常。碳酸氢钠也可以通过静脉注射,但由于这种治疗可能带来的生理危险,通常使用其他物质代替,如乳酸钠(sodium lactate)和葡萄糖酸钠(sodium gluconate)。这些分子中的乳酸和葡萄糖酸部分在体内代谢,留下细胞外液中的钠以碳酸氢钠的形式存在,从而使液体的pH趋向正常。
对于碱中毒的治疗,可以口服氯化铵(ammonium chloride)。当氯化铵被吸收进入血液后,氨部分被肝脏转化为尿素。该反应释放出HCl,HCl立即与体液中的缓冲剂反应,使H+浓度向酸性方向移动。氯化铵偶尔也会通过静脉注射,但由于NH_4+具有高度毒性,这种操作可能很危险。最合适的治疗方法是逆转碱中毒的根本原因。例如,如果代谢性碱中毒与细胞外液容量不足有关,但没有心力衰竭,通过输注等渗盐水溶液适当补充容量通常有助于纠正碱中毒。
酸碱紊乱的临床测量和分析
酸碱紊乱的适当治疗需要正确的诊断。前面描述的简单酸碱紊乱可以通过分析动脉血样本的三个测量值来诊断:pH、血浆HCO_3-浓度和Pco_2。
简单酸碱紊乱的诊断涉及几个步骤,如图31-10所示。通过检查pH,可以确定紊乱是酸中毒还是碱中毒。pH小于7.4表示酸中毒,而pH大于7.4表示碱中毒。
第二步是检查血浆中的Pco_2和HCO_3-浓度。Pco_2的正常值约为40mmHg,而HCO_3-的正常值为24mEq/L。如果该紊乱被定性为酸中毒(acidosis)且血浆Pco_2升高,则酸中毒中必然存在呼吸成分。经过肾脏代偿后,呼吸性酸中毒(respiratory acidosis)中的血浆HCO_3-浓度往往会增加到高于正常水平。因此,单纯性呼吸性酸中毒的预期值将是血浆pH值降低、P C O_\mathcalD升高以及部分肾脏代偿后血浆H C O_3-浓度升高。
图31-10. 单纯性酸碱紊乱的分析。如果代偿反应与图中底部所示的有显著差异,则应怀疑存在混合性酸碱紊乱。
对于代谢性酸中毒(metabolic acidosis),血浆pH也会降低。然而,在代谢性酸中毒中,主要异常是血浆HCO_3-浓度降低。因此,如果低pH值与低HCO_3-浓度相关,则酸中毒中必然存在代谢成分。在单纯性代谢性酸中毒中,由于部分呼吸代偿,Pco_2会降低,这与呼吸性酸中毒中Pco_2升高形成对比。因此,在单纯性代谢性酸中毒中,预期会发现低p H、低血浆H C O_3-浓度以及部分呼吸代偿后P C O_2降低。
分类碱中毒(alkalosis)类型的步骤涉及相同的基本步骤。首先,碱中毒意味着血浆pH升高。如果pH升高与PCO_2降低相关,则碱中毒中必然存在呼吸成分。如果pH升高与HCO_3-升高相关,则碱中毒中必然存在代谢成分。因此,在单纯性呼吸性碱中毒中,预期会发现pH值升高、P C O_\mathcalD降低以及血浆中H C O_3-浓度降低。在单纯性代谢性碱中毒中,预期会发现p H升高、血浆H C O_3-升高以及P C O_2升高。
复杂的酸碱紊乱及酸碱诊断图的使用
在某些情况下,酸碱紊乱并不伴随适当的代偿反应。当这种情况发生时,这种异常被称为混合性酸碱紊乱(mixed acid-base disorder),这意味着酸碱紊乱有两个或更多的潜在原因。例如,pH值低的患者将被归类为酸中毒(acidotic)。如果紊乱是由代谢引起的,这也会伴随血浆HCO_3-浓度降低,并且在适当的呼吸代偿后,Pco_2也会降低。然而,如果低血浆pH和低HCO_3-浓度与升高的Pco_2相关,人们会怀疑酸中毒中存在呼吸成分以及代谢成分。因此,这种紊乱将被归类为混合性酸中毒(mixed acidosis)。例如,这种紊乱可能发生在因腹泻(代谢性酸中毒(metabolic acidosis))和肺气肿(呼吸性酸中毒(respiratory acidosis))导致胃肠道急性HCO_3-丢失的患者中。
图31-11. 显示动脉血pH、动脉血浆H C O_3,和P C O_2值的酸碱诺模图(acid-base nomogram)。中央的开放圆圈显示了正常人群酸碱状态的近似范围。诺模图中的阴影区域显示了由单纯代谢性和呼吸性紊乱引起的正常代偿的近似范围。对于落在阴影区域之外的值,应怀疑存在混合性酸碱紊乱。(改编自Cogan MG, Rector FC Jr: Acid-Base Disorders in the Kidney, 3rd ed. Philadelphia: WB Saunders, 1986.)
诊断酸碱紊乱的一种便捷方法是使用酸碱诺模图(acid-base nomogram),如图31-11所示。该图可用于确定酸中毒或碱中毒的类型及其严重程度。在此酸碱图中,pH、HCO_3-浓度和PCO_2值根据Henderson-Hasselbalch方程相交。中央的开放圆圈显示了正常值以及仍可被视为正常范围内的偏差。图中的阴影区域显示了单纯代谢性和呼吸性紊乱的正常代偿的95%置信区间。
在使用此图时,必须假设已经有足够的时间进行完全代偿反应,原发性代谢性紊乱的呼吸代偿需要6至12小时,而原发性呼吸性紊乱的代谢代偿需要3至5天。如果某个值落在阴影区域内,这表明存在单纯的酸碱紊乱。相反,如果pH、碳酸氢盐或Pco_2的值落在阴影区域之外,这表明患者可能存在混合性酸碱紊乱。
重要的是要认识到,落在阴影区域内的酸碱值并不总是意味着存在单纯的酸碱紊乱。在考虑到这一限制的情况下,酸碱图可以作为一种快速确定酸碱紊乱的具体类型和严重程度的手段。
例如,假设一名患者的动脉血浆测得以下数值:pH,7.30;血浆HCO_3-浓度,12.0mEq/L;血浆PCO_2,25mmHg。根据这些数值,可以通过图表发现,这代表了一种单纯性代谢性酸中毒(metabolic acidosis),并伴有适当的呼吸代偿,使Pco_2从正常值40mmHg降低至25mmHg。
第二个例子是一名患者的以下数值:pH,7.15;血浆HCO_3-浓度,17mEq/L;血浆Pco_2,50mmHg。在这个例子中,患者处于酸中毒状态,并且似乎存在代谢性成分,因为血浆HCO_3-浓度低于正常值24mEq/L。然而,通常会降低PCO_2的呼吸代偿并未出现,且PCO_2略高于正常值40mmHg。这一发现与混合性酸碱紊乱一致,包括代谢性酸中毒和呼吸性成分。
酸碱图(acid–base nomogram)是一种快速评估可能导致异常pH、PCO_2和血浆碳酸氢盐浓度的紊乱类型和严重程度的方法。在临床环境中,患者的病史和其他体格检查结果也为酸碱紊乱的原因和治疗提供了重要线索。
使用阴离子间隙(anion gap)诊断酸碱紊乱
血浆中的阴离子和阳离子浓度必须相等以维持电中性。因此,血浆中并不存在真正的阴离子间隙。然而,临床实验室通常只测量某些阳离子和阴离子。通常测量的阳离子是Na+,而阴离子通常是Cl-和HCO_3-。阴离子间隙——仅是一个诊断概念——是未测量阴离子与未测量阳离子之间的差值,其估算如下:
\beginarrayr l血浆阴离子间隙=[Na+]-[HCO_3-]-[Cl-]&\ =144-24-108=12mEq/L&\endarray
如果未测量阴离子增加或未测量阳离子减少,阴离子间隙将增加。最重要的未测量阳离子包括钙、镁和钾,而主要的未测量阴离子是白蛋白、磷酸盐、硫酸盐和其他有机阴离子。通常,未测量阴离子超过未测量阳离子,阴离子间隙范围在8到16mEq/L之间。
表31-4 与正常或增加血浆阴离子间隙相关的代谢性酸中毒
<html><body><table><tr><td>阴离子间隙增加(正常氯血症)</td><td>阴离子间隙正常(高氯血症)</td></tr><tr><td>糖尿病(酮症酸中毒)</td><td>腹泻</td></tr><tr><td>乳酸酸中毒</td><td>肾小管酸中毒</td></tr><tr><td>慢性肾功能衰竭</td><td>碳酸酐酶抑制剂</td></tr><tr><td>阿司匹林(乙酰水杨酸)中毒</td><td>Addison病</td></tr><tr><td>甲醇中毒</td><td></td></tr><tr><td>乙二醇中毒</td><td></td></tr><tr><td>饥饿</td><td></td></tr></table></body></html>
血浆阴离子间隙(plasma anion gap)主要用于诊断代谢性酸中毒(metabolic acidosis)的不同原因。在代谢性酸中毒中,血浆HCO_3-浓度降低。如果血浆钠浓度不变,阴离子Cl-或未测阴离子的浓度会增加以维持电中性。如果血浆Cl-的增加与血浆HCO_3-的下降成比例,阴离子间隙将保持正常。这通常被称为高氯性代谢性酸中毒(hyperchloremic metabolic acidosis)。
如果血浆HCO_3-的下降不伴随Cl-的增加,则必须有未测阴离子水平的增加,从而导致计算的阴离子间隙增加。由过量非挥发性酸(除HCl外)如乳酸或酮酸引起的代谢性酸中毒与血浆阴离子间隙增加有关,因为HCO_3-的下降不与Cl-的等量增加相匹配。表31-4显示了一些与正常或增加的阴离子间隙相关的代谢性酸中毒的例子。通过计算阴离子间隙,可以缩小代谢性酸中毒的一些潜在原因。
Brown D, Wagner CA: Molecular mechanisms of acid-base sensing by the kidney. J Am Soc Nephrol 23:774, 2012. Curthoys NP, Moe OW: Proximal tubule function and response to acidosis. Clin J Am Soc Nephrol 9:1627, 2014. DeCoursey TE: Voltage-gated proton channels: molecular biology, physiology, and pathophysiology of the H(V) family. Physiol Rev 93:599, 2013. Hamm LL, Nakhoul N, Hering-Smith KS: Acid-base homeostasis. Clin J Am Soc Nephrol 10:2232, 2015. Kamel KS, Halperin ML: Acid-base problems in diabetic ketoacidosis. N Engl J Med 372:546, 2015. Kraut JA, Madias NE: Differential diagnosis of nongap metabolic acidosis: value of a systematic approach. Clin J Am Soc Nephrol 7:671, 2012. Kurtz I: Renal tubular acidosis: H+, /base and ammonia transport abnormalities and clinical syndromes. Adv Chronic Kidney Dis 25:334, 2018. Kurtz I: Molecular mechanisms and regulation of urinary acidification. Compr Physiol 4:1737, 2014. Nagami GT, Hamm LL: Regulation of acid-base balance in chronic kidney disease. Adv Chronic Kidney Dis 24:274, 2017. Palmer BF, Clegg DJ: Electrolyte and acid-base disturbances in patients with diabetes mellitus. N Engl J Med 373:548, 2015. Purkerson JM, Schwartz GJ: The role of carbonic anhydrases in renal physiology. Kidney Int 71:103, 2007. Roy A, Al-bataineh MM, Pastor-Soler NM: Collecting duct intercalated cell function and regulation. Clin J Am Soc Nephrol 10:305, 2015. Seifter JL: Integration of acid-base and electrolyte disorders. N Engl J Med 371:1821, 2014. Seifter JL, Chang HY: Extracellular acid-base balance and ion transport between body fluid compartments. Physiology (Bethesda) 32:367, 2017. Uduman J, Yee J: Pseudo-renal tubular acidosis: conditions mimicking renal tubular acidosis. Adv Chronic Kidney Dis 25:358, 2018. Vallés PG, Batlle D: Hypokalemic distal renal tubular acidosis. Adv Chronic Kidney Dis 25:303, 2018. Vandenberg RJ, Ryan RM: Mechanisms of glutamate transport. Physiol Rev 93:1621, 2013. Weiner ID, Verlander JW: Ammonia transporters and their role in acid-base balance. Physiol 97:465, 2017.
利尿剂与肾脏疾病
利尿剂及其作用机制
利尿剂(diuretics)顾名思义会增加尿量的排出速率。大多数利尿剂还会增加溶质(尤其是钠和氯)的尿排泄。事实上,临床上使用的大多数利尿剂都是通过减少肾小管钠重吸收来发挥作用的,这会导致钠尿(natriuresis,即钠排出增加),进而引起利尿(diuresis,即水排出增加)。也就是说,在大多数情况下,水排泄增加是继发于肾小管钠重吸收抑制的,因为留在肾小管中的钠会通过渗透作用减少水的重吸收。由于许多溶质(如钾、氯、镁和钙)的肾小管重吸收也受到钠重吸收的间接影响,因此许多利尿剂也会增加这些溶质的肾排泄。
利尿剂最常见的临床用途是减少细胞外液(extracellular fluid)容量,尤其是在与水肿(edema)和高血压(hypertension)相关的疾病中。正如第25章所讨论的,体内钠的丢失主要会减少细胞外液容量;因此,利尿剂通常用于细胞外液容量增加的临床情况。
一些利尿剂在给药后几分钟内就能使尿量增加20倍以上。然而,由于细胞外液容量减少引发的代偿机制激活,大多数利尿剂对盐和水肾排泄的影响会在几天内减弱(图32-1)。例如,细胞外液容量减少可能会降低动脉压(arterial pressure)和肾小球滤过率(glomerular filtration rate, GFR),并增加肾素(renin)分泌和血管紧张素II(angiotensin II, Ang II)的形成;所有这些反应最终会抵消利尿剂对尿量的慢性影响。因此,在稳态下,尿量变得与摄入量相等,但只有在动脉压和细胞外液容量降低后,才能缓解最初促使使用利尿剂的高血压或水肿。
临床上可用的许多利尿剂具有不同的作用机制,因此会抑制肾单位(nephron)不同部位的肾小管重吸收。
表32-1显示了利尿剂的一般类别、作用机制及其肾小管作用部位。
渗透性利尿剂通过增加肾小管液的渗透压来减少水的重吸收
将某些物质(如尿素(urea)、甘露醇(mannitol)和蔗糖(sucrose))注入血液中,这些物质会被肾小球毛细血管过滤,但不易被肾小管重吸收,从而导致肾小管中渗透活性分子浓度显著增加。这些溶质的渗透压(osmotic pressure)会减少水的重吸收,将大量肾小管液冲入尿液中。
在某些与过量溶质相关的疾病中,也会形成大量尿液,这些溶质未能从肾小管液中重吸收。例如,当糖尿病患者的血糖浓度升高到高水平时,肾小管中过滤的葡萄糖负荷增加,超过了其重吸收葡萄糖的能力(即超过了其葡萄糖的转运最大值)。当血浆葡萄糖浓度超过约250mg/dl时,肾小管几乎不会重吸收多余的葡萄糖;相反,多余的葡萄糖留在肾小管中,作为渗透性利尿剂,增加了尿液的流速。因此,未控制的糖尿病的一个标志是多尿(频繁排尿),这是由于脱水、细胞外液渗透压增加和口渴机制的激活而导致的液体摄入量高(多饮)所平衡的。
环利尿剂减少Henle袢厚升支的钠-氯-钾重吸收
Furosemide、ethacrynic acid和bumetanide是强效利尿剂,通过阻断位于上皮细胞腔膜上的1-钠、2-氯、1-钾共转运体(参见图28-9),减少Henle袢厚升支的重吸收。这些环利尿剂是临床上使用的最强效的利尿剂之一。
通过阻断Henle袢腔膜上的钠-氯-钾共转运,环利尿剂增加了钠、氯、钾和其他电解质以及水的尿液排出量,原因有二:(1)它们大大增加了输送到肾单位远端部分的溶质量,这些溶质作为渗透剂阻止水的重吸收;(2)它们通过减少Henle袢向髓质间质的离子吸收,破坏了逆流倍增系统,从而降低了髓质间质液的渗透压。因此,环利尿剂损害了肾脏浓缩或稀释尿液的能力。尿液稀释能力受损是因为Henle袢中钠和氯的重吸收被抑制,导致这些离子的排泄增加,同时水的排泄也增加。尿液浓缩能力受损是因为这些离子在肾髓质间质液中的浓度降低,从而降低了肾髓质的渗透压。因此,集合管中液体的重吸收减少,肾脏的最大浓缩能力也大大降低。此外,肾髓质间质液渗透压的降低减少了Henle袢降支中水的重吸收。由于这些多重效应,20%到30%的肾小球滤液可能被输送到尿液中,导致在急性情况下,尿液排出量在至少几分钟内达到正常值的25倍。
图32-1. 利尿剂给药期间的钠排泄和细胞外液体积。钠排泄的立即增加伴随着细胞外液体积的减少。如果钠摄入量保持不变,补偿机制最终将使钠排泄恢复到等于钠摄入量,从而重新建立钠平衡。
噻嗪类利尿剂抑制早期远曲小管中的氯化钠重吸收
噻嗪类衍生物,如氯噻嗪,主要作用于早期远曲小管,阻断管腔膜上的钠-氯共转运体(sodium-chloride co-transporter)(见图28-10)。在有利条件下,这些药物可能导致最多5%到10%的肾小球滤过液进入尿液,这大约相当于远曲小管正常重吸收的钠量。
碳酸酐酶抑制剂阻断碳酸氢钠重吸收
乙酰唑胺抑制碳酸酐酶(carbonic anhydrase),该酶对肾小管中碳酸氢根(HCO_3-)的重吸收至关重要,如第31章所述。碳酸酐酶在近曲小管中尤其丰富,这是碳酸酐酶抑制剂的主要作用部位。一些碳酸酐酶也存在于其他小管细胞中,例如集合管的闰细胞(intercalated cells)。
表32-1 利尿剂的类别、作用机制及作用部位
<html><body><table><tr><td>利尿剂类别(示例)</td><td>作用机制</td><td>作用部位</td></tr><tr><td>渗透性利尿剂(甘露醇)</td><td>通过增加小管液的渗透压抑制水和溶质的重吸收</td><td>主要作用于近曲小管</td></tr><tr><td>袢利尿剂(呋塞米、布美他尼)</td><td>抑制管腔膜上的Na+-K+-Cl-共转运</td><td>髓袢升支粗段</td></tr><tr><td>噻嗪类利尿剂(氢氯噻嗪、氯噻酮)</td><td>抑制管腔膜上的Na+-Cl-共转运</td><td>早期远曲小管</td></tr><tr><td>碳酸酐酶抑制剂(乙酰唑胺)</td><td>抑制H+分泌和HCO3-重吸收,从而减少Na+重吸收</td><td>主要作用于近曲小管</td></tr><tr><td>醛固酮拮抗剂(螺内酯、依普利酮)</td><td>抑制醛固酮对小管受体的作用,减少Na+重吸收,减少K+分泌</td><td>集合管</td></tr><tr><td>钠通道阻滞剂(氨苯蝶啶、阿米洛利)</td><td>阻断Na+进入管腔膜的Na+通道,减少Na+重吸收,减少K+分泌</td><td>集合管</td></tr></table></body></html>
由于近曲小管中氢离子(H+)分泌和碳酸氢根(HCO_3-)重吸收通过管腔膜上的钠-氢离子反向转运机制(sodium-hydrogen ion counter-transport mechanism)与钠重吸收相耦合,减少碳酸氢根重吸收也会减少钠重吸收。钠和碳酸氢根从小管液中的重吸收被阻断,导致这些离子留在小管中并起到渗透性利尿剂的作用。可以预见的是,碳酸酐酶抑制剂的一个缺点是它们会导致一定程度的酸中毒,因为尿液中碳酸氢根的过度流失。
盐皮质激素受体拮抗剂减少集合管中的钠重吸收和钾分泌
螺内酯(Spironolactone)和依普利酮(Eplerenone)是盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonists),它们与醛固酮(aldosterone)竞争集合管(collecting tubule)和集合管上皮细胞(collecting duct epithelial cells)上的受体结合位点,因此可以减少这些肾小管节段对钠的重吸收和钾的分泌(见图28-12)。其结果是,钠留在肾小管中并作为渗透性利尿剂(osmotic diuretic)发挥作用,导致水和钠的排泄增加。由于这些药物还阻断了醛固酮促进肾小管分泌钾的作用,因此它们减少了钾的排泄。
盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonists)还会导致钾从细胞内转移到细胞外液(extracellular fluid)。在某些情况下,这种转移会导致细胞外液钾浓度过度升高。因此,螺内酯和其他盐皮质激素受体拮抗剂被称为保钾利尿剂(potassium-sparing diuretics)。许多其他利尿剂会导致尿液中钾的流失,而盐皮质激素受体拮抗剂则能避免钾的流失。
钠通道阻滞剂减少集合管对钠的重吸收
阿米洛利(Amiloride)和氨苯蝶啶(Triamterene)也抑制集合管对钠的重吸收和钾的分泌,其作用与螺内酯相似。然而,在细胞水平上,这些药物直接阻断钠进入集合管上皮细胞管腔膜(luminal membrane)钠通道(sodium channels)(见图28-12)。由于钠进入上皮细胞的减少,跨细胞基底外侧膜(basolateral membranes)的钠转运也减少,因此钠-钾-腺苷三磷酸酶泵(sodium-potassium-adenosine triphosphatase pump, Na+-K+ ATPase pump)的活性降低。这种活性降低减少了钾向细胞内的转运,最终减少了钾向肾小管液的分泌。因此,钠通道阻滞剂也是保钾利尿剂(potassium-sparing diuretics),并降低了钾的尿排泄率。
肾脏疾病
肾脏疾病是全世界许多国家最重要的死亡和致残原因之一。例如,2018年,美国估计有超过14%的成年人,即超过3000万人患有慢性肾脏病(chronic kidney disease),还有数百万人患有急性肾损伤(acute renal injury)或较轻形式的肾功能障碍(kidney dysfunction)。
严重的肾脏疾病可分为两大类:
- 急性肾损伤(acute kidney injury, AKI),即在几天内肾功能突然丧失。急性肾衰竭(acute renal failure)一词通常用于严重的急性肾损伤,在这种情况下,肾脏可能突然完全或几乎完全停止工作,需要肾脏替代治疗(renal replacement therapy),如透析(dialysis),本章稍后将讨论。在某些情况下,AKI患者最终可能恢复接近正常的肾功能。
- 慢性肾脏病(chronic kidney disease, CKD),即越来越多的肾单位(nephrons)功能逐渐丧失,导致整体肾功能逐渐下降。
在这两大类中,有许多特定的肾脏疾病可以影响肾脏的血管、肾小球(glomeruli)、肾小管(tubules)、肾间质(renal interstitium)以及肾脏外的尿路部分,包括输尿管(ureters)和膀胱(bladder)。在本章中,我们将讨论一些较为重要的肾脏疾病中发生的特定生理异常。
急性肾损伤(ACUTE KIDNEY INJURY, AKI)
AKI的原因通常分为三大类:
- 由于肾脏血液供应减少导致的AKI。这种情况通常被称为肾前性AKI(prerenal AKI),以反映起源于肾脏外的异常。例如,肾前性AKI可能是由于心力衰竭导致心输出量减少和低血压,或与血容量减少和低血压相关的疾病,如严重出血。
- 由于肾脏本身的异常导致的肾性AKI(intrarenal AKI),包括影响血管、肾小球或肾小管的异常。
- 由于从肾盏到膀胱出口的任何部位的尿路收集系统阻塞导致的肾后性AKI(postrenal AKI)。肾脏外尿路阻塞的最常见原因是肾结石,由钙、尿酸或胱氨酸的沉淀引起。
在一些重要的AKI原因中,如败血症(sepsis),肾前性(例如,血压降低)和肾性(内皮和肾小管损伤)异常可能同时发生。
由于肾脏血流减少导致的肾前性急性肾损伤(PRERENAL ACUTE KIDNEY INJURY CAUSED BY DECREASED BLOOD FLOW TO THE KIDNEY)
肾脏通常接受丰富的血液供应,约为1100ml/min,约占心输出量的20%至25%。肾脏高血流量的主要目的是为有效调节体液容量和溶质浓度所需的高肾小球滤过率(glomerular filtration rate, GFR)提供足够的血浆。因此,肾血流量减少通常伴随着GFR减少和水及溶质的尿量减少。因此,急性减少肾脏血流量的情况通常会导致少尿(oliguria),即尿量低于水和溶质的摄入水平。这种情况会导致水和溶质在体液中积累。如果肾血流量显著减少,可能会发生尿量完全停止,这种情况被称为无尿(anuria)。
只要肾血流量不低于正常值的约20%至25%,如果在肾细胞发生损伤之前纠正了缺血的原因,急性肾损伤(acute kidney injury, AKI)通常可以逆转。与某些组织不同,肾脏在肾细胞发生重大损伤之前能够承受相对较大的血流量减少。这种现象的原因是,随着肾血流量的减少,肾小球滤过率(glomerular filtration rate, GFR)和肾小球滤过的氯化钠量(以及水和其它电解质的滤过率)也会减少。这减少了肾小管必须重吸收的氯化钠量,而肾小管重吸收过程消耗了正常肾脏的大部分能量和氧气。因此,随着肾血流量和GFR的下降,肾脏的氧气消耗也会减少。当GFR接近零时,肾脏的氧气消耗接近肾小管细胞在不重吸收钠时维持生存所需的速率。当血流量低于这一基础需求时(通常低于正常肾血流量的20%至25%),肾细胞会缺氧,如果肾血流量进一步减少且持续时间较长,将导致肾细胞(尤其是肾小管上皮细胞)的损伤甚至死亡。
如果肾前性急性肾损伤(prerenal AKI)的原因未得到纠正,且肾脏缺血持续数小时以上,这种类型的肾衰竭可能会发展为肾性急性肾损伤(intrarenal AKI),这一点将在后文讨论。肾血流量的急性减少是住院患者(尤其是那些遭受严重创伤的患者)发生急性肾损伤的常见原因。表32-2列出了一些导致肾血流量减少和肾前性急性肾损伤的常见原因。
由肾脏异常引起的肾性急性肾损伤
起源于肾脏并突然减少尿量的异常情况属于肾性急性肾损伤(intrarenal AKI)的范畴。这类急性肾损伤可进一步分为以下几类:(1) 损伤肾小球毛细血管或其他小肾血管的情况;(2) 损伤肾小管上皮细胞的情况;(3) 导致肾间质损伤的情况。这种分类方式基于损伤的主要部位,但由于肾血管系统和肾小管系统在功能上相互依赖,肾血管的损伤可能导致肾小管损伤,而原发性肾小管损伤也可能导致肾血管损伤。表32-3列出了一些肾性急性肾损伤的原因。
表32-2 肾前性急性肾损伤的一些原因
<html><body><table><tr><td>血管内容量减少 出血(如创伤、手术、产后、胃肠道出血)</td></tr><tr><td>腹泻或呕吐</td></tr><tr><td>烧伤 心力衰竭</td></tr><tr><td>心肌梗死</td></tr><tr><td>瓣膜损伤 外周血管扩张及随之而来的低血压</td></tr><tr><td>过敏性休克</td></tr><tr><td>麻醉</td></tr><tr><td>败血症、严重感染</td></tr><tr><td>原发性肾血流动力学异常 肾动脉狭窄、栓塞或肾动脉或静脉血栓形成</td></tr></table></body></html>
表32-3 肾性急性肾损伤的一些原因
markdown <html><body><table><tr><td>小血管和/或肾小球损伤 血管炎(结节性多动脉炎)</td></tr><tr><td>胆固醇栓塞</td></tr><tr><td>恶性高血压</td></tr><tr><td>急性肾小球肾炎</td></tr><tr><td>肾小管上皮损伤(肾小管坏死) 缺血导致的急性肾小管坏死</td></tr><tr><td>毒素导致的急性肾小管坏死(例如,重金属、乙二醇、杀虫剂、毒蘑菇、四氯化碳)</td></tr><tr><td>肾间质损伤</td></tr><tr><td>急性肾盂肾炎 急性过敏性间质性肾炎</td></tr></table></body></html>
由肾小球肾炎引起的急性肾损伤
急性肾小球肾炎是一种通常由异常免疫反应引起的肾内急性肾损伤(acute kidney injury, AKI),这种免疫反应会损害肾小球。在大约95%的患者中,肾小球的损伤发生在身体其他部位感染后的1到3周内,通常由某些类型的A组β链球菌引起。感染可能是链球菌性咽炎、链球菌性扁桃体炎,甚至是皮肤的链球菌感染。损害肾脏的并不是感染本身,而是在几周内,随着针对链球菌抗原的抗体的产生,抗体和抗原相互反应形成不溶性免疫复合物,这些复合物被捕获在肾小球中,尤其是肾小球的基底膜部分。
一旦免疫复合物沉积在肾小球中,许多肾小球细胞开始增殖,但主要是位于内皮和上皮之间的系膜细胞。此外,大量的白细胞被捕获在肾小球中。许多肾小球被这种炎症反应阻塞,而那些未被阻塞的肾小球通常变得过度通透,导致蛋白质和红细胞从肾小球毛细血管的血液中渗漏到肾小球滤液中。在严重的情况下,肾脏功能完全或几乎完全停止。
肾小球的急性炎症通常在大约2周内消退,大多数患者在接下来的几周到几个月内肾脏功能几乎恢复正常。然而,有时许多肾小球被破坏到无法修复的程度,在一小部分患者中,肾功能逐渐恶化,导致慢性肾脏病(chronic kidney disease, CKD),如本章后续部分所述。
肾小管坏死作为急性肾损伤的原因
肾内急性肾衰竭的另一个原因是肾小管坏死,这意味着肾小管上皮细胞的破坏。肾小管坏死的一些常见原因如下:(1)严重的缺血和肾小管上皮细胞的氧气和营养供应不足;(2)破坏肾小管上皮细胞的毒物、毒素或药物。
严重肾缺血引起的急性肾小管坏死
严重的肾脏缺血可能由循环休克或其他严重损害肾脏血液供应的紊乱引起。如果缺血严重到足以严重影响肾小管上皮细胞的营养和氧气供应,并且如果这种损伤持续时间较长,上皮细胞可能会受到损伤或最终破坏。当这种损伤发生时,肾小管细胞会脱落并堵塞许多肾单位,导致被堵塞的肾单位没有尿液输出;即使肾血流恢复到正常水平,只要肾小管仍然堵塞,受影响的肾单位通常也无法排泄尿液。肾小管上皮细胞缺血损伤的最常见原因是与循环休克相关的急性肾损伤(AKI)的肾前性原因,如本章前面所讨论的。
毒素或药物引起的急性肾小管坏死
有许多肾脏毒物和药物可以损害肾小管上皮细胞并导致急性肾损伤(AKI)。这些物质包括四氯化碳、重金属(如汞和铅)、乙二醇(防冻剂的主要成分)、各种杀虫剂、一些用作抗生素的药物(如四环素)以及用于治疗某些癌症的顺铂。这些物质中的每一种都对肾小管上皮细胞具有特定的毒性作用,导致许多细胞死亡。结果,上皮细胞从基底膜上脱落并堵塞肾小管。在某些情况下,基底膜也会被破坏。如果基底膜保持完整,新的肾小管上皮细胞可以沿着膜表面生长,因此肾小管可能在10到20天内自我修复。
下尿路异常引起的肾后性急性肾损伤
下尿路的多种异常可以完全或部分阻塞尿流,从而导致急性肾损伤(AKI),即使肾脏的血液供应和其他功能最初是正常的。如果只有一个肾脏的尿液输出减少,体液成分不会发生重大变化,因为对侧肾脏可以增加其尿液输出,以维持相对正常的细胞外电解质和溶质水平,以及正常的细胞外液体积。对于这种类型的肾损伤,如果问题的根本原因在几小时内得到纠正,正常的肾功能可以恢复。然而,持续数天或数周的慢性尿路梗阻可能导致不可逆的肾损伤。肾后性急性肾损伤的一些原因包括:(1)由大结石或血块引起的双侧输尿管或肾盂梗阻;(2)膀胱梗阻;(3)尿道梗阻。
急性肾损伤的生理效应
AKI(急性肾损伤)的一个主要生理效应是水分、代谢废物和电解质在血液和细胞外液中的滞留。这可能导致水和盐的过载,进而引发水肿和高血压。然而,钾的过度滞留对AKI患者来说往往是一个更严重的威胁,因为血浆钾浓度(高钾血症)超过8mEq/L(仅为正常值的两倍)可能是致命的。由于肾脏也无法排出足够的氢离子,AKI患者可能会出现代谢性酸中毒,这本身可能是致命的,或者会加重高钾血症。
在最严重的AKI病例中,会出现完全无尿。除非肾功能恢复或使用人工肾脏清除体内过多的滞留水分、电解质和代谢废物,否则患者将在8到14天内死亡。尿量减少的其他影响以及人工肾脏治疗将在下一节中与CKD(慢性肾脏病)相关的内容中讨论。
表32-4 慢性肾脏病的一些病因
慢性肾脏病通常与功能性肾单位的不可逆性丧失相关
C K D通常被定义为持续至少3个月的肾脏损伤或肾功能下降。CKD通常与大量功能性肾单位的进行性和不可逆性丧失相关。在功能性肾单位数量下降到正常值的70%到75%以下之前,通常不会出现严重的临床症状。事实上,直到功能性肾单位数量下降到正常值的20%到25%以下时,大多数电解质的血液浓度和体液量仍能保持相对正常。
表32-4列出了一些导致CKD的最重要病因。一般来说,CKD与AKI一样,可能由于血管、肾小球、肾小管、肾间质和下尿路的疾病而发生。尽管导致CKD的疾病种类繁多,但最终结果基本相同——功能性肾单位数量的减少。
慢性肾脏病导致终末期肾病的恶性循环
在某些情况下,肾脏的初始损伤会导致肾功能进行性恶化和肾单位的进一步丧失,直到患者必须接受透析治疗或移植功能性肾脏才能生存。这种情况被称为终末期肾病(ESRD)。
图32-2. 显示了原发性肾脏疾病可能发生的恶性循环。由于疾病导致的肾单位(nephrons)丧失可能会增加存活肾小球毛细血管中的压力和流量,这反过来可能最终也会损伤这些正常的毛细血管,从而导致进行性硬化(sclerosis)并最终丧失这些肾小球。
实验研究表明,手术切除大部分肾脏最初会导致剩余肾单位的适应性变化,这些变化导致存活肾单位的血流量增加、肾小球滤过率(GFR)增加以及尿量增加。导致这些变化的确切机制尚不完全清楚,但涉及肥大(hypertrophy)(存活肾单位的各种结构的生长)以及功能性变化,这些变化降低了存活肾单位的血管阻力和肾小管重吸收。这些适应性变化使得即使肾脏质量减少到正常的20%至25%,人体仍能排出正常量的水和溶质。然而,在几年的时间内,这些肾脏适应性变化可能会导致剩余肾单位的进一步损伤,特别是这些肾单位的肾小球。
这种进行性损伤可能部分与剩余肾小球压力或拉伸增加有关,这是由于传入小动脉(afferent arterioles)的功能性血管扩张或血压升高所致。小动脉和肾小球的长期压力和拉伸增加被认为会导致这些血管的损伤和硬化(正常组织被结缔组织替代)。这些硬化性病变最终可能使肾小球消失,导致肾功能进一步下降,剩余肾单位的进一步适应性变化,以及最终导致终末期肾病(ESRD)的缓慢进展的恶性循环(图32-2)。减缓这种肾功能进行性丧失的最有效方法是降低动脉压和肾小球静水压,特别是通过使用血管紧张素转换酶(ACE)抑制剂或Ang II受体拮抗剂等药物。
表32-5 终末期肾病(ESRD)的最常见原因
<html><body><table><tr><td>原因</td><td>ESRD患者总数(%)</td></tr><tr><td>糖尿病</td><td>45</td></tr><tr><td>高血压</td><td>27</td></tr><tr><td>肾小球肾炎</td><td>8</td></tr><tr><td>多囊肾病</td><td>2</td></tr><tr><td>其他,未知</td><td>18</td></tr></table></body></html>
表32-5列出了ESRD的最常见原因。在20世纪80年代初,各种形式的肾小球肾炎被认为是ESRD最常见的起始原因。最近,糖尿病和高血压已被认为是ESRD的主要原因,两者合计占所有ESRD的70%以上。
过度体重增加(obesity)似乎是导致ESRD(终末期肾病)的两个主要原因——糖尿病和高血压的最重要风险因素。正如第79章所讨论的,与肥胖密切相关的2型糖尿病占所有糖尿病病例的90%以上。体重过度增加也是原发性高血压(essential hypertension)的主要原因,占成年人患高血压风险的65%至75%。除了通过糖尿病和高血压导致肾脏损伤外,肥胖可能对已有肾脏疾病的患者产生叠加或协同效应,进一步恶化肾功能。
肾血管损伤作为慢性肾脏病的原因
许多类型的血管病变可导致肾缺血和肾组织死亡。最常见的病变包括:(1) 较大肾动脉的动脉粥样硬化(atherosclerosis),伴随血管的进行性硬化性狭窄;(2) 一条或多条大动脉的纤维肌性增生(fibromuscular hyperplasia),同样导致血管闭塞;(3) 由小动脉、微动脉和肾小球的硬化性病变引起的肾硬化(nephrosclerosis)。
大动脉的动脉粥样硬化或增生性病变通常对一侧肾脏的影响大于另一侧,因此导致单侧肾功能下降。正如第19章所讨论的,当一侧肾动脉狭窄而另一侧肾动脉仍正常时,常会发生高血压,这种情况类似于所谓的“两肾Goldblatt高血压”。
良性肾硬化(benign nephrosclerosis)是最常见的肾脏疾病形式,在60岁以上死亡者的尸检中,约70%的人至少有一定程度的这种病变。这种类型的血管病变发生在较小的叶间动脉和肾脏的入球小动脉中。据信,这种病变始于血浆通过这些血管内膜的渗漏。这种渗漏导致血管中层形成纤维蛋白样沉积,随后血管壁逐渐增厚,最终导致血管狭窄,在某些情况下甚至闭塞。由于较小的肾动脉之间几乎没有侧支循环,一条或多条血管的闭塞会导致相应数量的肾单位(nephron)破坏。因此,大部分肾组织被少量纤维组织取代。当肾小球发生硬化时,这种损伤被称为肾小球硬化(glomerulosclerosis)。
图32-3. 年龄对功能性肾小球数量的影响
肾硬化和肾小球硬化在大多数人40岁后都会有一定程度的发生,导致每10年功能性肾单位数量减少约10%(图32-3)。这种肾小球和整体肾单位功能的丧失反映为肾血流量和肾小球滤过率(GFR)的逐渐下降。即使在健康人群中,没有潜在高血压或糖尿病的情况下,80岁时肾血浆流量和GFR也可能下降40%至50%。
高血压或糖尿病的同时存在会显著增加肾硬化(nephrosclerosis)和肾小球硬化(glomerulosclerosis)的发生频率和严重程度。因此,与严重高血压相关的良性肾硬化(benign nephrosclerosis)可导致快速进展的恶性肾硬化(malignant nephrosclerosis)。恶性肾硬化的特征性组织学改变包括小动脉内大量纤维素样沉积(fibrinoid deposits)和血管进行性增厚,受累肾单位(nephrons)发生严重缺血。由于未知的原因,恶性肾硬化和严重肾小球硬化的发病率在黑人中显著高于同年龄段、高血压或糖尿病严重程度相似的白人。
肾小球损伤作为慢性肾脏病的原因——肾小球肾炎(glomerulonephritis)
慢性肾小球肾炎可由多种引起肾脏肾小球毛细血管袢炎症和损伤的疾病引起。与急性肾小球肾炎不同,慢性肾小球肾炎是一种缓慢进展的疾病,常导致不可逆的肾功能衰竭。它可能是原发性肾脏疾病,继发于急性肾小球肾炎,也可能是继发于系统性疾病的肾脏损害,如系统性红斑狼疮(systemic lupus erythematosus)。
在大多数情况下,慢性肾小球肾炎始于肾小球膜中沉淀的抗原-抗体复合物的积累。与急性肾小球肾炎不同,链球菌感染仅占慢性肾小球肾炎患者的一小部分。肾小球膜中抗原-抗体复合物的积累引起炎症、膜进行性增厚,最终纤维组织侵入肾小球。在疾病后期,由于肾小球丛中滤过毛细血管数量减少和肾小球膜增厚,肾小球毛细血管滤过系数大大降低。在疾病的最后阶段,许多肾小球被纤维组织取代,无法滤过液体。
肾间质损伤作为慢性肾脏病的原因——间质性肾炎(interstitial nephritis)
肾间质的原发性或继发性疾病称为间质性肾炎。一般来说,这种情况可由血管、肾小球或肾小管损伤引起,这些损伤破坏了个别肾单位,也可能涉及毒物、药物和细菌感染对肾间质的原发性损伤。
由细菌感染引起的肾间质损伤称为肾盂肾炎(pyelonephritis)。感染可由不同类型的细菌引起,但尤其常见于来自泌尿道粪便污染的Escherichia coli。这些细菌要么通过血流到达肾脏,要么更常见的是通过输尿管从下尿路上升到肾脏。
尽管正常的膀胱能够迅速清除细菌,但有两种常见的临床情况可能会干扰细菌从膀胱的正常排出:(1) 膀胱无法完全排空,导致膀胱内残留尿液;(2) 尿液流出受阻。当膀胱清除细菌的能力受损时,细菌会繁殖,膀胱会发炎,这种情况称为膀胱炎(cystitis)。一旦发生膀胱炎,它可能局限于膀胱而不上升到肾脏,或者在某些人中,由于排尿时尿液被推入一侧或双侧输尿管的病理情况,细菌可能到达肾盂。这种情况称为膀胱输尿管反流(vesicoureteral reflux),是由于排尿时膀胱壁未能封闭输尿管所致;结果,部分尿液被推向肾脏,携带的细菌可以到达肾盂和肾髓质,在那里它们可以引发与肾盂肾炎(pyelonephritis)相关的感染和炎症。
肾盂肾炎始于肾髓质,因此通常对髓质功能的影响比对皮质的影响更大,至少在初始阶段是如此。由于髓质的主要功能之一是为浓缩尿液提供逆流机制,肾盂肾炎患者通常明显受损的尿液浓缩能力。
在长期肾盂肾炎的情况下,细菌侵入肾脏不仅会导致肾髓质间质损伤,还会导致肾小管、肾小球和肾脏其他结构的进行性损伤。因此,大量功能性肾组织丧失,可能发展为慢性肾脏病(chronic kidney disease, CKD)。
肾病综合征(NEPHROTIC SYNDROME)—尿液中蛋白质的排泄
肾病综合征以大量血浆蛋白丢失到尿液中为特征,许多肾病患者会出现这种情况。在某些情况下,这种综合征的发生没有其他主要肾功能异常的证据,但它通常与一定程度的慢性肾脏病(CKD)相关。
尿液中蛋白质丢失的原因通常是肾小球膜通透性增加。因此,任何增加该膜通透性的疾病都可能导致肾病综合征。这些疾病包括以下内容:(1) 慢性肾小球肾炎(chronic glomerulonephritis),主要影响肾小球,通常会导致肾小球膜通透性大大增加;(2) 淀粉样变性(amyloidosis),由血管壁中异常类蛋白物质的沉积引起,严重损害肾小球的基底膜;(3) 微小病变肾病综合征(minimal-change nephrotic syndrome),与肾小球毛细血管膜无明显异常相关,无法通过光学显微镜检测到。如第27章所述,微小病变肾病与异常的免疫反应和T细胞分泌的细胞因子增加有关,这些细胞因子导致足细胞损伤和对低分子量蛋白质(如白蛋白)的通透性增加。
微小病变性肾病(Minimal-change nephropathy)可以发生在成人中,但更常见于2至6岁的儿童。肾小球毛细血管膜通透性增加偶尔会导致每天多达40克的血浆蛋白流失到尿液中,这对幼儿来说是极端的量。因此,儿童的血浆蛋白浓度常常下降到2g/dl以下,胶体渗透压从正常值28mmHg下降到10mmHg以下。由于血浆中胶体渗透压低,大量液体从全身毛细血管渗漏到大多数组织中,导致严重的水肿,如第25章所述。
慢性肾脏病中的肾单位功能
功能性肾单位的丧失要求存活的肾单位排泄更多的水和溶质。可以合理地推测,功能性肾单位数量的减少会降低肾小球滤过率(GFR),也会导致水和溶质的肾脏排泄显著减少。然而,失去了75%到80%肾单位的患者仍然能够排泄正常量的水和电解质,而不会在体液中严重积累液体或大多数电解质。然而,肾单位数量的进一步减少会导致电解质和液体潴留,当肾单位数量下降到正常的5%到10%时,通常会导致死亡。
图32-4. 当肌酐生成率保持不变时,肾小球滤过率(GFR)降低50%对血清肌酐浓度和肌酐排泄率的影响。
与电解质不同,许多代谢废物,如尿素和肌酐,几乎与破坏的肾单位数量成比例地积累。原因是像肌酐和尿素这样的物质在很大程度上依赖于肾小球滤过来排泄,并且它们不像电解质那样被重吸收。例如,肌酐根本不被重吸收,排泄率大约等于其滤过率(忽略分泌的少量):
肌酐滤过率 =G FR× 血浆肌酐浓度 = 肌酐排泄率
因此,如果GFR降低,肌酐排泄率也会暂时降低,导致肌酐在体液中的积累,并提高血浆浓度,直到肌酐排泄率恢复正常——即肌酐在体内生成的速率(图32-4)。因此,在稳态条件下,尽管GFR降低,肌酐排泄率仍等于肌酐生成率;然而,这种正常的肌酐排泄率是以血浆肌酐浓度升高为代价的,如图32-4中的曲线A所示。
图32-5. 慢性肾衰竭中不同类型溶质的适应性变化模式。曲线A显示了血浆中如肌酐和尿素等被过滤且重吸收较少的溶质浓度的近似变化。曲线B显示了如磷酸盐、尿酸和氢离子等溶质的近似浓度。曲线C显示了如钠和氯等溶质的近似浓度。
一些溶质,如磷酸盐、尿酸和氢离子,通常在GFR(肾小球滤过率)降至正常值的20%到30%之前保持在接近正常范围内。此后,这些物质的血浆浓度上升,但上升幅度与GFR下降不成比例,如图32-5中的曲线B所示。随着GFR的下降,这些溶质的血浆浓度保持相对恒定,这是通过在肾小球毛细血管过滤的溶质中逐渐增加排泄比例来实现的;这通过降低肾小管重吸收率或增加肾小管分泌率来实现。
对于钠和氯离子,即使在GFR严重下降的情况下,它们的血浆浓度也几乎保持不变(见图32-5中的曲线C)。这种维持是通过大幅减少这些电解质的肾小管重吸收来实现的。
例如,当功能性肾单位损失75%时,每个存活的肾单位必须排泄四倍于正常条件下的钠和四倍于正常条件下的液体量(表32-6)。这种适应性部分是由于血管和肾小球的肥大导致每个存活肾单位的血流量增加和GFR增加,以及导致血管扩张的功能性变化。即使总GFR大幅下降,通过降低肾小管对水和溶质的重吸收率,仍然可以维持正常的肾脏排泄率。
表32-6 肾脏疾病中的总肾脏排泄和每个肾单位的排泄
<html><body><table><tr><td></td><td>正常</td><td>肾单位损失75%</td></tr><tr><td>肾单位数量</td><td>2,000,000</td><td>500,000</td></tr><tr><td>总肾小球滤过率 (GFR; ml/min)</td><td>125</td><td>40</td></tr><tr><td>单个肾单位GFR (nl/min)</td><td>62.5</td><td>80</td></tr><tr><td>所有肾单位排泄的液体量 (ml/min)</td><td>1.5</td><td>1.5</td></tr><tr><td>每个肾单位排泄的液体量 (nl/min)</td><td>0.75</td><td>3.0</td></tr></table></body></html>
图32-6. 功能性肾单位减少的患者中低渗尿的发展。
等渗尿(Isosthenuria)——肾脏无法浓缩或稀释尿液。在患病肾脏的剩余肾单位(nephron)中,肾小管流速加快的一个重要影响是肾小管失去了完全浓缩或稀释尿液的能力。肾脏的浓缩能力受损主要是由于以下原因:(1) 肾小管液通过集合管(collecting ducts)的快速流动阻碍了足够的水分重吸收;(2) 通过亨利袢(loop of Henle)和集合管的快速流动阻碍了逆流机制(countercurrent mechanism)有效运作以浓缩髓质间质液(medullary interstitial fluid)中的溶质。因此,随着越来越多的肾单位被破坏,肾脏的最大浓缩能力下降,尿液渗透压(osmolarity)和比重(specific gravity)接近肾小球滤过液(glomerular filtrate)的渗透压和比重,如图32-6所示。
当肾单位数量显著减少时,肾脏的稀释机制也会受损,因为液体快速通过亨利袢以及尿素等溶质的高负荷导致肾单位这一部分的肾小管液中溶质浓度相对较高。因此,肾脏的稀释能力受损,尿液的最低渗透压和比重接近肾小球滤过液的水平。由于在慢性肾脏病(CKD)中,浓缩机制比稀释机制受损更严重,因此一项重要的肾功能临床测试是确定在限制饮水12小时或更长时间后,肾脏浓缩尿液的能力如何。
图32-7. 肾功能衰竭对细胞外液成分的影响。NPN,非蛋白氮(Nonprotein nitrogens)。
肾功能衰竭对体液的影响——尿毒症(Uremia)
慢性肾脏病(CKD)对体液的影响取决于以下因素:(1) 水和食物摄入量;(2) 肾功能受损的程度。假设一个完全肾功能衰竭的人继续摄入相同量的水和食物,细胞外液中不同物质的浓度会发生变化,如图32-7所示。重要的影响包括:(1) 由于水和盐的潴留导致全身性水肿(generalized edema);(2) 由于肾脏无法排出体内正常的酸性产物而导致酸中毒(acidosis);(3) 由于身体无法排出蛋白质的代谢终产物,导致非蛋白氮(nonprotein nitrogens)——尤其是尿素(urea)、肌酐(creatinine)和尿酸(uric acid)——浓度升高;(4) 肾脏排泄的其他物质浓度升高,包括酚类(phenols)、硫酸盐(sulfates)、磷酸盐(phosphates)、钾(potassium)和胍类碱(guanidine bases)。由于体液中尿素浓度升高,这种整体状况被称为尿毒症(uremia)。
慢性肾脏病中的水潴留和水肿发展
如果在急性肾损伤(acute kidney injury)开始后立即限制水的摄入,总体液含量可能只会轻微增加。如果不限制液体摄入,并且患者根据正常的口渴机制饮水,体液会迅速增加。
只要盐和液体摄入不过量,慢性肾脏病(CKD)中的液体积累在肾功能下降到正常水平的25%或更低之前可能不会很严重。正如之前讨论的,原因是存活的肾单位会排出更多的盐和水。即使是发生的小量液体潴留,加上通常在缺血性肾脏病中增加的肾素分泌和血管紧张素II(Ang II)形成,也常常会导致严重的高血压。当肾功能降低到需要透析来维持生命时,几乎不可避免地会出现高血压。
在许多这类患者中,通过严格限制盐摄入或通过透析去除细胞外液可以控制高血压。一些患者即使在透析去除过量钠后仍持续存在高血压。在这类患者中,去除缺血肾脏通常可以纠正高血压(只要通过透析防止液体潴留),因为去除了过量肾素分泌和随后增加的Ang II形成的来源。
尿素和其他非蛋白氮(氮质血症)的增加。非蛋白氮包括尿素、尿酸、肌酐和一些不太重要的化合物。这些非蛋白氮通常是蛋白质代谢的终产物,必须从体内去除以确保细胞中蛋白质代谢的正常进行。在完全肾衰竭的1到2周内,这些非蛋白氮的浓度,特别是尿素的浓度,可以上升到正常水平的10倍。在CKD中,这些浓度的上升大致与肾小球滤过率(GFR)的下降程度成正比。因此,测量这些物质的浓度,特别是尿素和肌酐的浓度,为评估CKD的严重程度提供了重要手段。
CKD中的酸中毒。每天,身体通常会产生比代谢碱多约50到80毫摩尔的代谢酸。因此,当肾脏功能衰竭时,酸会在体液中积累。体液的缓冲系统通常可以缓冲500到1000毫摩尔的酸,而不会导致细胞外液H+浓度的致命增加,骨骼中的磷酸盐化合物还可以额外缓冲几千毫摩尔的H+。然而,当这种缓冲能力耗尽时,血液pH值会急剧下降,如果pH值下降到约6.8以下,患者将陷入昏迷并死亡。
由促红细胞生成素分泌减少引起的慢性肾脏病贫血。严重CKD患者几乎总是会出现贫血。这种贫血的最重要原因是肾脏分泌的促红细胞生成素减少,促红细胞生成素刺激骨髓产生红细胞。如果肾脏严重受损,它们无法形成足够的促红细胞生成素,从而导致红细胞生成减少和随之而来的贫血。
然而,自1989年以来,重组促红细胞生成素的可用性为治疗慢性肾衰竭患者的贫血提供了一种手段。
慢性肾脏病中的骨软化症由活性维生素D生成减少和肾脏磷酸盐滞留引起
长期慢性肾脏病(CKD)也会导致骨软化症(osteomalacia),这是一种骨骼部分被吸收,因而变得极度脆弱的情况。骨软化症的一个重要原因是维生素D必须经过两个阶段的转化过程,首先在肝脏,然后在肾脏,转化为1,25-二羟基胆钙化醇(1,25-dihydroxycholecalciferol),才能促进肠道对钙的吸收。因此,肾脏的严重损伤会大大降低活性维生素D的血液浓度,从而减少肠道对钙的吸收和骨骼对钙的利用。
CKD中骨骼脱矿质(osteomalacia)的另一个重要原因是由于肾小球滤过率(GFR)降低导致的血清磷酸盐浓度升高。血清磷酸盐水平的升高增加了磷酸盐与血浆中钙的结合,从而降低了血浆中离子钙的浓度,进而刺激甲状旁腺激素(parathyroid hormone)的分泌。这种继发性甲状旁腺功能亢进(secondary hyperparathyroidism)会刺激骨骼释放钙,导致进一步的骨骼脱矿质。
高血压与肾脏疾病
正如本章前面所讨论的,高血压会加剧肾小球和肾脏血管的损伤,是终末期肾病(ESRD)的主要原因。肾功能异常也会导致高血压,如第19章所述。因此,在某些情况下,高血压与肾脏疾病之间的关系可能会形成一个恶性循环——原发性肾脏损伤导致血压升高,进而对肾脏造成进一步损伤并进一步升高血压,直到发展为ESRD。
并非所有类型的肾脏疾病都会导致高血压,因为肾脏某些部位的损伤会导致尿毒症(uremia)而不伴有高血压。然而,某些类型的肾脏损伤特别容易引起高血压。以下部分提供了与高血压或非高血压效应相关的肾脏疾病分类。
降低肾脏排泄钠和水能力的肾脏病变促进高血压
降低肾脏排泄钠和水能力的肾脏病变几乎总是会导致高血压。因此,降低GFR或增加肾小管重吸收的病变通常会导致不同程度的高血压。一些可能导致高血压的特定类型肾脏异常如下:
- 肾血管阻力增加,从而减少肾血流量和GFR。例如,肾动脉狭窄引起的高血压。
- 肾小球毛细血管滤过系数降低,从而减少GFR。例如,慢性肾小球肾炎(chronic glomerulonephritis)会导致肾小球毛细血管膜炎症和增厚,从而降低肾小球毛细血管滤过系数。
- 肾小管钠重吸收过多。例如,醛固酮(aldosterone)分泌过多引起的高血压,这主要增加了皮质集合管(cortical collecting tubules)对钠的重吸收。
一旦高血压(hypertension)发展起来,肾脏对钠和水的排泄会恢复正常,因为高动脉压会导致压力性钠尿(pressure natriuresis)和压力性利尿(pressure diuresis),因此钠和水的摄入和排出再次达到平衡。即使肾血管阻力大幅增加或肾小球毛细血管系数下降,在动脉血压升高后,肾小球滤过率(GFR)仍可能恢复到接近正常水平。同样,当肾小管重吸收增加时,如醛固酮(aldosterone)分泌过多时,尿排泄率最初会降低,但随着动脉压升高而恢复正常。因此,在高血压发展后,除了高血压本身外,可能没有明显的钠和水排泄受损的迹象。正如第19章所解释的,在升高的动脉压下钠和水的正常排泄意味着压力性钠尿和压力性利尿已被重置到更高的动脉压。
由局部肾损伤和肾素(renin)分泌增加引起的高血压。如果肾脏的一部分缺血,而其余部分没有缺血,例如当一条肾动脉严重收缩时,缺血的肾组织会分泌大量肾素。这种分泌导致血管紧张素II(Ang II)的形成增加,从而可能导致高血压。正如第19章所讨论的,导致这种高血压的最可能的事件顺序如下:(1)缺血的肾组织排泄的水和盐少于正常量;(2)缺血肾脏分泌的肾素以及随后增加的Ang II形成影响非缺血的肾组织,导致其也保留盐和水;(3)过量的盐和水以通常的方式导致高血压。
当由于肾脏特定部分的动脉硬化或血管损伤导致一个或两个肾脏的局部区域缺血时,可能会发生类似类型的高血压。当这种情况发生时,缺血的肾单位(nephrons)排泄的盐和水较少,但分泌的肾素较多,这导致Ang II形成增加。高水平的Ang II然后损害周围其他正常肾单位排泄钠和水的能力。结果,高血压发展起来,这恢复了肾脏对钠和水的整体排泄,因此盐和水的摄入和排出之间的平衡得以维持,但以高血压为代价。
导致整个肾单位丧失的肾脏疾病会导致慢性肾脏病(chronic kidney disease)但可能不会引起高血压
大量肾单位(whole nephrons)的丧失,例如一个肾脏和另一个肾脏的部分丧失,如果肾组织的丧失足够大,几乎总是会导致慢性肾脏病(chronic kidney disease, CKD)。如果剩余的肾单位是正常的,并且盐摄入量不过量,这种情况可能不会引起临床上显著的高血压。这是因为即使血压轻微升高,也会提高肾小球滤过率(glomerular filtration rate, GFR)并减少存活肾单位中的肾小管钠重吸收(tubular sodium reabsorption),从而促进足够的尿液中的水和盐排泄,即使只有少数肾单位保持完整。然而,如果施加额外的压力,例如摄入大量盐分,这种类型的异常患者可能会变得严重高血压。在这种情况下,肾脏无法在正常血压下用剩余的少量功能肾单位清除足够的盐分。在稳态条件下,血压升高可以恢复盐和水的排泄,以匹配盐和水的摄入。
有效治疗高血压需要通过增加肾小球滤过率或减少肾小管重吸收来增强肾脏排泄盐和水的能力,以便在较低的血压下维持盐和水摄入与肾脏排泄之间的平衡。这种效果可以通过阻断导致肾脏保留盐和水的神经和激素信号作用的药物(例如,\upbeta -肾上腺素能阻滞剂、Ang II受体拮抗剂或ACE抑制剂)、通过扩张肾脏血管并增加肾小球滤过率的药物(例如,钙通道阻滞剂)或通过直接抑制肾小管重吸收盐和水的利尿药物来实现。
特定肾小管疾病
在第28章中,我们讨论了几种负责运输不同物质穿过肾小管上皮膜的机制。在第3章中,我们还指出,每种细胞酶和每种载体蛋白都是在细胞核中相应基因的响应下形成的。如果任何所需的基因恰好缺失或异常,肾小管可能会缺乏适当的载体蛋白之一或肾小管上皮细胞溶质运输所需的酶之一。在其他情况下,酶或载体蛋白产生过多。因此,许多遗传性肾小管疾病是由于个别物质或物质组通过肾小管膜的异常运输而发生的。此外,毒素或缺血对肾小管上皮膜的损伤可能导致重要的肾小管疾病。
肾性糖尿(renal glycosuria)——肾脏重吸收葡萄糖的失败。在肾性糖尿中,血糖浓度可能是正常的,但肾小管重吸收葡萄糖的运输机制大大受限或缺失。因此,尽管血糖水平正常,每天仍有大量葡萄糖进入尿液。由于糖尿病(diabetes mellitus)也与尿液中葡萄糖的存在有关,因此在诊断糖尿病之前,必须排除相对良性的肾性糖尿。
氨基酸尿症(Aminoaciduria)——肾脏无法重吸收氨基酸。一些氨基酸共享相互转运系统进行重吸收,而其他氨基酸则有各自独特的转运系统。在极少数情况下,一种称为广泛性氨基酸尿症的情况是由于所有氨基酸的重吸收不足所致。更常见的是,特定载体系统的缺陷可能导致以下情况:(1) 必需性胱氨酸尿症(essential cystinuria),其中大量胱氨酸未能被重吸收,并常在尿液中结晶形成肾结石;(2) 单纯性甘氨酸尿症(simple glycinuria),其中甘氨酸未能被重吸收;或 (3) β-氨基异丁酸尿症(beta-aminoisobutyricaciduria),这种情况在大约 5% 的人群中出现,但显然没有重大的临床意义。
肾性低磷血症(Renal Hypophosphatemia)——肾脏无法重吸收磷酸盐。在肾性低磷血症中,当体液中磷酸盐浓度极低时,肾小管无法重吸收足够大的磷酸盐离子。这种情况通常不会立即引起严重的异常,因为细胞外液的磷酸盐浓度可以在不引起主要细胞功能障碍的情况下大幅波动。然而,长期的低磷酸盐水平会导致骨骼钙化减少,从而引发佝偻病。这种类型的佝偻病对维生素D治疗无效,与第80章中讨论的常见类型佝偻病的快速反应形成对比。
肾小管酸中毒(Renal Tubular Acidosis)——肾小管分泌氢离子减少。在肾小管酸中毒中,肾小管无法分泌足够量的氢离子。结果,大量碳酸氢钠持续从尿液中丢失。这种丢失导致持续的代谢性酸中毒状态,如第31章所述。这种类型的肾脏异常可能由遗传性疾病引起,也可能由于肾小管广泛损伤而发生。
肾性尿崩症(Nephrogenic Diabetes Insipidus)——肾脏对抗利尿激素无反应。有时,肾小管对抗利尿激素无反应,导致大量稀释尿液排出。只要患者有充足的水分供应,这种情况很少会引起严重困难。然而,当没有足够的水分供应时,患者会迅速脱水。
Fanconi综合征(Fanconi Syndrome)——肾小管的广泛性重吸收缺陷。Fanconi综合征通常与几乎所有氨基酸、葡萄糖和磷酸盐的尿排泄增加有关。在严重病例中,还会观察到其他表现,例如:(1) 无法重吸收碳酸氢钠,导致代谢性酸中毒;(2) 钾和有时钙的排泄增加;以及 (3) 肾性尿崩症。
Fanconi综合征有多种原因,这是由于肾小管细胞广泛性无法转运各种物质所致。其中一些原因包括:(1) 细胞转运机制的遗传缺陷;(2) 损伤肾小管上皮细胞的毒素或药物;以及 (3) 由于缺血导致的肾小管细胞损伤。在由肾小管损伤引起的Fanconi综合征中,近端小管细胞尤其受到影响,因为这些细胞重吸收和分泌许多可能导致损伤的药物和毒素。
Bartter综合征——Henle袢中钠、氯和钾的重吸收减少
Bartter综合征是一组罕见的肾脏疾病,由影响1-钠、2-氯、1-钾共转运体功能的突变或Henle袢升支粗段管腔膜钾通道或基底外侧膜氯通道的缺陷引起。目前已发现至少五种通常以常染色体隐性遗传方式遗传的突变会导致Bartter综合征。这些疾病导致肾脏排泄水、钠、氯、钾和钙增加。盐和水的丢失导致轻度容量不足,从而激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)。由于Henle袢重吸收功能受损,醛固酮增加和远端小管流量增加刺激集合管分泌钾和氢,导致低钾血症(hypokalemia)和代谢性碱中毒(metabolic alkalosis)。
Gitelman综合征——远端小管中氯化钠重吸收减少
Gitelman综合征是一种常染色体隐性遗传疾病,影响远端小管中对噻嗪类敏感的氯化钠共转运体。Gitelman综合征患者具有与Bartter综合征患者相似的一些特征——盐和水丢失、轻度容量不足以及肾素-血管紧张素-醛固酮系统的激活,尽管这些异常在Gitelman综合征患者中通常较轻。
由于目前无法纠正Bartter或Gitelman综合征中的小管缺陷,治疗通常集中在补充氯化钠和钾的丢失。一些研究表明,使用非甾体抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)阻断前列腺素合成以及使用醛固酮拮抗剂(如螺内酯)可能有助于纠正低钾血症。
Liddle综合征——钠重吸收增加
Liddle综合征是一种罕见的常染色体显性遗传疾病,由远端小管和集合管中对阿米洛利敏感的上皮钠通道(epithelial sodium channel, ENaC)的各种突变引起。这些突变导致ENaC过度活跃,从而增加钠和水的重吸收,导致高血压和代谢性碱中毒,类似于醛固酮过度分泌(原发性醛固酮增多症)引起的变化。
然而,Liddle综合征患者存在钠潴留和肾素分泌减少以及血管紧张素II水平降低,这反过来又减少了肾上腺分泌醛固酮。幸运的是,Liddle综合征可以通过使用利尿剂阿米洛利治疗,该药物可阻断ENaC的过度活性。
通过移植或人工肾透析治疗肾衰竭
急性或慢性肾功能严重丧失是危及生命的,需要清除有毒废物并将体液容量和成分恢复到正常水平。这可以通过肾移植或人工肾透析来实现。目前,美国有超过70万患者正在接受某种形式的终末期肾病(end-stage renal disease, ESRD)治疗。
将单个供体肾脏成功移植给终末期肾病(ESRD)患者,可以恢复肾功能至足以维持体液和电解质基本正常稳态的水平。美国每年大约进行19,000例肾移植手术,但超过100,000名患者在等待肾移植。接受肾移植的患者通常比依赖透析的患者寿命更长,健康问题更少。几乎所有患者都需要维持免疫抑制治疗(immunosuppressive therapy),以帮助预防急性排斥反应和移植肾的丧失。抑制免疫系统的药物副作用包括增加感染和某些癌症的风险,尽管随着时间的推移通常可以减少免疫抑制治疗的剂量,从而大大降低这些风险。
在美国,超过475,000名患有不可逆性肾衰竭或完全肾切除的患者正在通过人工肾(artificial kidney)进行长期透析维持。透析也用于某些类型的急性肾损伤(AKI),以帮助患者渡过难关,直到肾脏恢复功能。如果肾功能丧失是不可逆的,则有必要长期进行透析以维持生命。由于透析不能维持完全正常的体液成分,也不能替代肾脏执行的所有多种功能,因此使用人工肾维持的患者健康状况通常仍然明显受损。
透析的基本原理
人工肾的基本原理是让血液通过由薄膜分隔的微小血液通道。薄膜的另一侧是透析液(dialyzing fluid),血液中的有害物质通过扩散进入其中。
图32-8显示了一种人工肾的组成部分,其中血液持续流经两层赛璐玢(cellophane)薄膜之间;薄膜外侧是透析液。赛璐玢具有足够的孔隙,允许血浆成分(除血浆蛋白外)双向扩散——从血浆进入透析液或从透析液返回血浆。如果某种物质在血浆中的浓度高于透析液,则该物质将从血浆净转移到透析液中。
溶质跨透析膜移动的速率取决于以下因素:(1)两种溶液之间溶质的浓度梯度;(2)膜对溶质的通透性;(3)膜的表面积;以及(4)血液和液体与膜接触的时间长度。
表32-7 透析液与正常和尿毒症血浆的比较
markdown
因此,溶质转移的最大速率最初发生在浓度梯度最大时(即透析开始时),随着浓度梯度的消散而减慢。在流动系统中,如血液透析中,血液和透析液流经人工肾,通过增加血液、透析液或两者的流速,可以减少浓度梯度的消散,并优化溶质通过膜的扩散。
在人工肾的正常操作中,血液持续或间歇性地流回静脉。人工肾中任何时候的血液总量通常少于500毫升,流速可能为每分钟数百毫升,总扩散表面积在0.6至2.5m2之间。为了防止人工肾中血液凝固,当血液进入人工肾时,会向血液中注入少量肝素。除了溶质的扩散外,还可以通过施加静水压力迫使液体和溶质通过透析器的膜来产生溶质和水的质量转移;这种类型的过滤称为体积流或血液滤过。
透析液
表32-7比较了典型透析液中的成分与正常血浆和尿毒症血浆中的成分。请注意,透析液中的离子和其他物质的浓度与正常血浆或尿毒症血浆中的浓度不同。相反,它们被调整到透析过程中通过膜引起适当的水和溶质移动所需的水平。
请注意,透析液中没有磷酸盐、尿素、尿酸、硫酸盐或肌酐;然而,这些物质在尿毒症血液中浓度很高。因此,当尿毒症患者接受透析时,这些物质会大量流失到透析液中。
图32-8. 人工肾透析的原理。
人工肾的有效性可以用每分钟清除不同物质的血浆量来表示,正如第28章所讨论的,这是表达肾脏自身功能有效性以清除体内不需要物质的主要方式。大多数人工肾可以以每分钟100到225毫升的速度清除血浆中的尿素,这表明至少对于尿素的排泄,人工肾的功能速度大约是两颗正常肾脏的两倍,正常肾脏的尿素清除率仅为每分钟70毫升。然而,人工肾每天仅使用4到6小时,每周三次。因此,当人工肾替代正常肾脏时,总体血浆清除率仍然受到相当大的限制。此外,重要的是要记住,人工肾不能替代肾脏的一些其他功能,例如分泌促红细胞生成素,这是红细胞生成所必需的。
