第三十二章 肝脏的转运和代谢功能
学习目标
完成本章学习后,应能够回答以下问题:
- 肝脏的主要代谢功能有哪些?
- 肝脏如何参与解毒过程?它排泄哪些类型的代谢产物?
- 肝脏的主要细胞类型有哪些?这些细胞如何组织以实现器官功能?
- 胆汁在何处形成、储存和分泌?其主要成分有哪些?
- 肝脏如何参与全身氨代谢?
- 临床上有哪些评估肝功能的方法?
肝脏及其功能概述
肝脏是位于腹腔内的多叶大型器官,其功能与胃肠系统密切相关。作为大多数吸收营养物质的首个处理场所,肝脏分泌的胆汁酸(如第30章所述)在膳食脂质吸收中起关键作用。此外,肝脏作为代谢中枢,通过将代谢废物和异生物质(xenobiotics)转化为可排泄形式,在清除这些物质方面具有重要作用。肝脏储存或生产机体所需的多种物质,如葡萄糖、氨基酸和血浆蛋白(plasma proteins)。肝脏的关键功能可分为三个领域:(1)全身代谢的参与;(2)解毒作用;(3)蛋白结合/脂溶性废物的排泄。本章将讨论支持这些功能的肝脏与胆道系统的结构和分子特征及其调控机制。尽管肝脏对维持全身生化稳态具有核心作用,但所有基础反应的完整讨论超出本章范围,我们将主要聚焦与胃肠生理相关的肝功能。
肝脏的代谢功能
肝细胞(hepatocytes)参与主要营养物质——碳水化合物、脂类和蛋白质的代谢。因此,肝脏通过糖异生作用(gluconeogenesis)(将其他糖类转化为葡萄糖)在葡萄糖代谢中发挥重要作用。肝脏还在葡萄糖过剩时(如餐后)将其以糖原(glycogen)形式储存,并在需要时将储存的葡萄糖释放入血液。这一过程被称为"肝脏的葡萄糖缓冲功能"。当肝功能受损时,摄入碳水化合物后血糖浓度可能异常升高;反之,在餐间可能出现低血糖(hypoglycemia)。
肝细胞也参与脂类代谢。它们是脂肪酸氧化代谢酶的丰富来源,这些酶负责为身体其他功能提供能量。肝细胞还将碳水化合物代谢产物转化为可储存于脂肪组织的脂类,并合成大量脂蛋白(lipoproteins)、胆固醇和磷脂(phospholipids)。此外,肝细胞将大部分合成的胆固醇转化为胆汁酸,本章后续将对此进行更详细讨论。
肝脏在蛋白质代谢中同样起着至关重要的作用。肝脏合成非必需氨基酸(nonessential amino acids)(参见第30章),这些氨基酸无需通过饮食补充;同时通过氨基酸的相互转化和脱氨作用(deamination)使其产物进入生物合成途径以合成碳水化合物。除免疫球蛋白(immunoglobulins)外,肝脏几乎合成了血浆中存在的所有蛋白质,尤其是决定血浆胶体渗透压的白蛋白(albumin),以及大多数重要的凝血因子(clotting factors)。肝病患者可能因低白蛋白血症(hypoalbuminemia)继发外周水肿,并易出现出血性疾病。最后,肝脏是处理蛋白质分解代谢产生氨(ammonia)的关键场所,通过将氨转化为尿素(urea)并由肾脏排泄完成这一过程。该过程的细节将在本章后续部分讨论。
肝脏与解毒作用
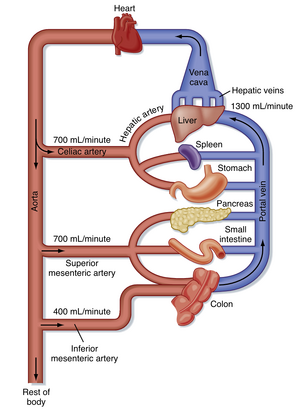
肝脏既作为守门人限制有毒物质进入血液循环,又作为废物处理系统清除体内其他部位产生的潜在有毒代谢产物,并将其转化为可排泄的化学形式。肝脏能够实现这些功能,部分归功于其独特的血液供应方式。与所有其他器官不同,到达肝脏的大部分血液本质上是静脉血,通过门静脉(portal vein)从肠道输送而来(图32.1)。因此,肝脏的战略性位置使其能够同时接收吸收的营养物质和潜在有害的吸收分子(如药物和细菌毒素)。根据肝细胞对这些分子的提取效率和首过代谢(first-pass metabolism)的程度,被吸收物质可能极少或完全无法进入体循环。这也是为什么并非所有药物通过口服给药都能在血液中达到治疗浓度的主要原因。
肝脏通过两个层次清除和代谢/解毒来自门脉循环的物质。第一层次是物理性清除。进入肝脏的血液在巨噬细胞系细胞(称为库普弗细胞(Kupffer cells))间渗透。这些细胞具有吞噬功能,可清除门脉血液中的颗粒物质,包括正常生理条件下可能从结肠进入血液的细菌。
第二层次是生化性防御。肝细胞具有多种酶系,可修饰内源性和外源性毒素,使产物通常更易溶于水且不易被肠道重吸收。相关代谢反应大致分为两类:I相反应(由细胞色素P-450酶(cytochrome P-450 enzymes)催化的氧化、羟基化等反应)后接II相反应——将产物与葡萄糖醛酸、硫酸盐、氨基酸或谷胱甘肽等分子结合以促进排泄。这些反应的产物随后排入胆汁或返回血液,最终经肾脏排出。
肝脏在排泄中的作用
如肾脏章节所述,肾脏在水溶性分解产物的排泄中起重要作用。但只有相对较小的水溶性分解产物可通过肾小球滤过排出。而较大的水溶性分解产物、与血浆蛋白结合的分子(包括亲脂性代谢物与外源性物质(xenobiotics))、类固醇激素和重金属等无法通过肾小球滤过。这些物质若蓄积将产生潜在危害,因此需要肝脏通过胆汁排泄的机制。
肝细胞通过基底外侧膜的一系列转运蛋白高亲和力摄取这些物质,随后通过微粒体和胞质溶胶进行代谢(表32.1)。最终,待排泄物质通过另一组转运蛋白穿过肝细胞的胆小管膜排出。胆汁的特性使其能够溶解亲脂性物质,这些物质随后可排入肠道并通过粪便排出体外。
| 名称 | 基底外侧膜 | 胆小管膜 | 底物/功能 |
|---|---|---|---|
| 钠/牛磺胆酸协同转运多肽 (NTCP) | 是 | 否 | 结合胆汁酸的摄取 |
| 有机阴离子转运多肽 (OATP) | 是 | 否 | 胆汁酸和外源性物质的摄取 |
| 胆盐输出泵 (BSEP) | 否 | 是 | 结合胆汁酸的分泌 |
| 多药耐药蛋白 3 (MDR3) | 否 | 是 | 磷脂酰胆碱的分泌 |
| 多药耐药蛋白 1 (MDR1) | 否 | 是 | 阳离子外源性物质的分泌 |
| ATP结合盒转运体 G5/G8 (ABCG5/ABCG8) | 否 | 是 | 胆固醇的分泌 |
| 胆小管多特异性有机阴离子转运蛋白 (cMOAT) / 多药耐药相关蛋白 2 (MRP2) | 否 | 是 | 硫酸石胆酸和结合胆红素的分泌 |
肝脏与胆管系统的结构特征
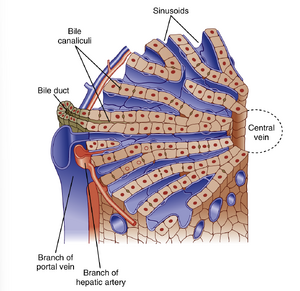
肝细胞(肝脏的主要细胞类型)以吻合索形式排列形成板层结构,周围有大量血液循环(图32.2)。肝脏接受的血流量远超其质量比例,确保肝细胞获得充足的氧气和营养物质。静息状态下,肝细胞70%以上的血液供应来自门静脉(餐后可达90%以上)。
构成肝脏实质的肝细胞板由一系列血窦(sinusoids)供血。这些低阻力腔隙由门静脉(portal vein)和肝动脉(hepatic artery)的分支共同灌注。血窦与供应其他器官的毛细血管不同:在空腹状态下,许多血窦处于塌陷状态,但餐后随着门静脉血流量增加(此时吸收的营养物质被转运至肝脏),更多血窦可被逐渐募集。血窦腔的低阻力特性意味着肝脏血流量可显著增加而不伴随压力升高。最终血液汇入肝静脉的中央分支。
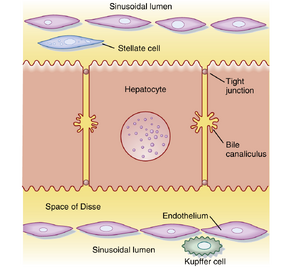
从衬覆血窦壁的内皮细胞(图32.3)来看,血窦也表现出特殊性:肝血窦内皮细胞具有称为窗孔(fenestrations)的特化开口,其孔径足以让白蛋白(albumin)大小的分子通过;同时缺乏基底膜(basement membrane)这一潜在的扩散屏障。这些特征使白蛋白结合物质能够接触并最终被肝细胞摄取。血窦内还含有库普弗细胞(Kupffer cells)。
在血窦内皮下方、将内皮与肝细胞分隔开的是一层疏松结缔组织——窦周隙(Disse间隙)。正常生理状态下,该结构即使对白蛋白大小的分子也几乎不构成扩散阻力。窦周隙还是另一种重要肝细胞——星状细胞(stellate cells)的所在地。星状细胞不仅是类视黄醇(retinoids)的储存场所,还可分泌肝细胞的关键生长因子;在病理状态下,星状细胞被激活后能合成大量胶原,导致肝功能障碍。
临床要点
某些病毒感染或酒精等毒性物质过度暴露会导致肝细胞死亡,并激活肝星状细胞(hepatic stellate cells)。这些细胞合成过量胶原蛋白,形成组织学上可见的纤维化(fibrosis)。若损伤持续存在,纤维化最终将发展为不可逆状态,即肝硬化(cirrhosis)。纤维化瘢痕区域会挤压肝实质,从而降低肝脏的合成、代谢和排泄能力。纤维化团块压迫肝窦(sinusoids),阻碍其在餐后(postprandial)门静脉血流量增加时的扩张。慢性肝损伤患者可能因血白蛋白水平降低而出现水肿,继而发展为腹水(ascites)。最终,血液中毒素蓄积可导致黄疸、瘙痒和神经系统并发症。若肝功能恶化超过临界水平,唯一有效的治疗方法是肝移植。
临床视角
若肝脏循环(特别是肝窦)因纤维化受压,肝脏将失去在餐后血流量增加时维持压力稳定的代偿能力。由于肝窦窗孔(fenestrations)的存在,白蛋白会从循环系统逸出,富含白蛋白的液体从肝脏表面渗出至腹腔,超过淋巴引流的代偿能力。这种现象称为腹水(ascites),表现为肝病患者腹围显著增大。随着肝内压力升高,新生的侧支血管试图绕过阻塞部位以缓解门静脉高压(portal hypertension)。部分侧支血管通向腹部结构,因其管壁薄弱易发生破裂。典型病例是食管高压侧支血管的形成,可发展为静脉曲张(varices)并破裂出血。食管腔出血极难控制,属于急危重症。即使未发生出血,侧支血管的形成也会绕过肝脏残余的代谢功能,导致血氨等毒素水平升高,引发全身性不良影响。
临床视角
肝炎可由五种不同的病毒引起(分别标记为A至E型),这些病毒会导致炎症和坏死,可能进展为肝硬化。甲型和戊型肝炎在大多数患者中表现为自限性急性感染,通过粪-口途径传播。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)通过肠道外途径传播(丁型肝炎病毒需与HBV共感染才能复制),通常导致慢性疾病并增加肝细胞癌风险。多年来,HBV和HCV感染者的预后一直不容乐观——HBV仍是肝脏相关死亡的首要原因,而HCV则是肝移植最常见的适应症。然而,随着对病毒生命周期的深入了解,这些感染的治疗方法近年发生了革命性变化。HBV感染可通过疫苗接种预防,并可通过聚乙二醇干扰素等抗病毒药物控制。目前,通过多种抑制病毒复制不同阶段的新型口服药物,HCV感染已可治愈。
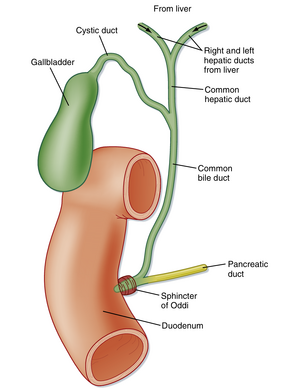
肝细胞(hepatocytes)同时也是胆道系统的起源。尽管肝细胞被认为是具有基底外侧膜和顶膜的典型上皮细胞,但其细胞极性分布与胃肠道单层柱状上皮存在差异。在肝脏中,肝细胞的顶膜仅占据细胞膜的一小部分区域,相邻细胞的顶膜相互对合形成细胞间通道——胆小管(canaliculus)(见图32.3)。胆小管的功能是引流肝脏产生的胆汁,最终汇入由典型柱状上皮细胞(cholangiocytes)构成的胆小管(biliary ductules)。这些胆小管最终汇合成左右肝管(right and left hepatic ducts),使胆汁得以排出肝脏。左右肝管进一步形成肝总管(common hepatic duct),根据压力梯度关系,胆汁可通过胆囊管(cystic duct)流入胆囊,或通过胆总管(common bile duct)进入肠道(图32.4)。
肝脏组织结构中另一个具有临床意义的特征需要特别强调。肝静脉、肝动脉和胆管的分支在所谓"门管三联(hepatic triad)"中平行走行。最靠近三联管的肝细胞称为门静脉周围(periportal)或"1区"细胞,具有最丰富的氧气和营养供应。相反,最靠近肝静脉分支的肝细胞称为中央静脉周围(pericentral)或"3区"细胞。后者细胞对缺血更为敏感,而前者则更容易受到氧化损伤。因此,活检中损伤细胞的位置可为特定肝损伤病例的病因提供线索。正常情况下,1区细胞的解毒功能最为活跃,但在肝脏疾病发生时,2区(1区与3区之间的过渡区)和3区细胞可被逐步激活。相反,3区细胞被认为是胆汁酸合成最活跃的区域。
胆汁的形成与分泌
胆汁是肝脏的排泄液,在脂质消化中发挥重要作用。胆汁形成始于肝细胞,其通过顶端膜主动将溶质转运至胆小管。胆汁是一种胶束溶液,其中主要溶质为胆汁酸、磷脂酰胆碱和胆固醇,三者比例约为10:3:1。这些溶质的分泌驱动水和电解质通过连接相邻肝细胞的紧密连接进行伴随性移动,从而形成胆小管胆汁。
大部分胆汁流动由肝细胞顶端膜上通过ATP酶转运蛋白(称为胆汁盐输出泵,BSEP;见表32.1)介导的胆汁酸分泌所驱动。当形成的液体流经胆小管时(形成肝胆汁),其成分可被进一步调整;在胆囊储存期间(形成胆囊胆汁)仍会继续调整。最终,胆汁成为浓缩的生物去污剂溶液,可在肠腔水环境中帮助脂质消化产物的溶解,从而提高脂质向吸收性上皮表面转移的速率。它也可作为代谢废物排出体外的载体。
细胞水平
虽然罕见,但多种表现为渐进性胆汁淤积的家族性综合征使我们深入了解了将胆汁成分输送至胆小管的转运蛋白分子特性。例如,II型进行性家族性肝内胆汁淤积(PFIC II)已被定位为BSEP基因突变,该突变导致胆汁中几乎完全缺乏胆汁酸。此类患者会出现胆汁淤积,但即使存在胆管损伤证据也极少。另一方面,进行性家族性肝内胆汁淤积III型(PFIC III)是更具侵袭性的疾病,其胆汁淤积伴随循环中γ-谷氨酰转肽酶(γ-glutamyl transpeptidase)的早期升高。分子病因是导致多药耐药蛋白3(MDR3)表达缺失的突变。当缺乏该转运蛋白时,磷脂酰胆碱无法进入胆汁,这揭示了该脂质在保护胆管细胞免受胆汁酸损伤中的重要性——因为若无磷脂酰胆碱,混合胶束将无法形成。
胆汁酸合成
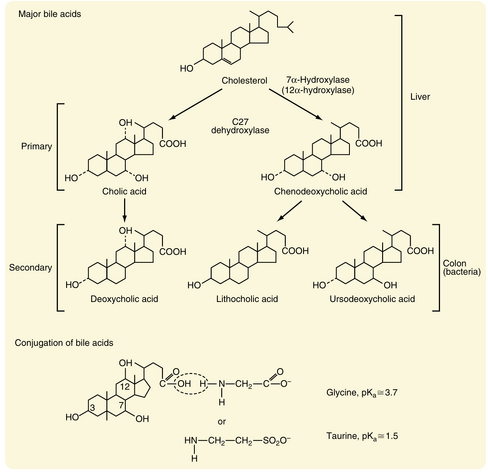
胆汁酸(bile acids)是肝细胞将胆固醇代谢的最终产物。胆固醇通过一系列酶的选择性代谢形成胆汁酸(图32.5)。初始且限速的步骤是由胆固醇7α-羟化酶(cholesterol 7α-hydroxylase)在类固醇核的7号位添加羟基。该反应产物的侧链随后被缩短,并通过C27脱羟酶(C27 dehydroxylase)添加羧酸基团,生成鹅脱氧胆酸(chenodeoxycholic acid)——一种二羟基胆汁酸。或者,该产物在12号位进一步羟化后,经C27脱羟酶作用生成胆酸(cholic acid)——一种三羟基胆汁酸。胆汁酸合成可上调或下调,这取决于机体的需求(图32.6)。例如,若流向肝脏的血液中胆汁酸水平降低,其合成可增加至10倍。相反,摄入胆汁酸会显著抑制肝细胞新胆汁酸的合成。这些胆汁酸合成变化的机制与相关酶的表达改变有关。胆汁酸激活肝细胞中的多种细胞表面受体和核受体,最终激活调控酶丰度的特定转录因子。
鹅脱氧胆酸和胆酸被定义为初级胆汁酸(primary bile acids),因为它们由肝细胞合成(见图32.5)。然而,两者均可在结肠腔被细菌酶代谢,分别生成熊脱氧胆酸(ursodeoxycholic acid)和脱氧胆酸(deoxycholic acid)。鹅脱氧胆酸还可被细菌酶转化为石胆酸(lithocholic acid),后者具有相对细胞毒性。这些细菌代谢产物的总和称为次级胆汁酸(secondary bile acids)。在肝细胞中,初级和次级胆汁酸还会发生另一项重要生化修饰(见图32.5)。这些分子与甘氨酸(glycine)或牛磺酸(taurine)结合,显著降低其pKa。结果是结合型胆汁酸在小肠腔pH环境下几乎完全离子化,因而无法被动穿越细胞膜。因此,结合型胆汁酸会保留在肠腔中,直至通过顶端钠依赖性胆盐转运体(asbt)在回肠末端被主动吸收。未参与该吸收步骤的结合型胆汁酸在结肠被细菌酶解离,产生的非结合型因不带电荷可通过结肠上皮被动重吸收。
胆汁酸肝肠循环的肝脏机制
胆汁酸通过其去污剂特性协助脂质的消化和吸收,因此需要大量此类分子以实现膳食脂质的溶解。通过肠肝循环(enterohepatic circulation),主动重吸收的结合型胆汁酸经门静脉血液返回肝细胞,在此处被基底外侧转运体(basolateral transporters)(可能为Na+依赖型或非依赖型,参见表32.1)高效摄取。类似地,在结肠解离的胆汁酸也会返回肝细胞,经重新结合后分泌入胆汁。通过这种方式形成了循环中的初级和次级胆汁酸池(primary and secondary bile acids),而每日合成量仅等于逃脱重吸收并随粪便排出的少量部分(约10%/天,或200-400mg)(图32.7)。唯一例外是石胆酸(lithocholic acid),其在肝细胞中优先发生硫酸化而非与甘氨酸或牛磺酸结合。大部分硫酸结合物在每次进食后排出体外,因为它们不是顶端钠依赖性胆酸转运体(asbt)的底物,从而避免了潜在毒性分子的蓄积。
关于胆汁酸在全身胆固醇稳态中的作用需要特别说明。体内胆固醇池反映其每日合成量及饮食摄取的低效部分,并与排出量保持平衡(图32.8)。在健康状态下,胆固醇仅能通过胆汁排出,其存在两种形式:原型分子或转化为胆汁酸后的代谢产物。尽管存在肠肝循环,后者仍占每日排泄胆固醇总量的三分之一。因此,治疗高胆固醇血症的策略之一是阻断肠肝循环,从而促使胆固醇向胆汁酸的转化增加,最终通过粪便排出胆汁酸。
图32.6 胆汁酸合成与分泌速率的关系。正常情况下胆汁酸分泌速率平均为30g/24小时,而合成速率平均为0.5g/24小时。垂直和水平虚线分别表示胆汁酸分泌与合成的正常范围。分泌增加(通过胆汁酸喂养模拟)会提高胆汁酸经门静脉血液返回肝脏的速率,从而对合成产生负反馈抑制。相反,肠肝循环的中断(如回肠切除后)可使合成速率增加至正常值的10倍以上。(From Carey MC, Cahalane MJ. In: Arias IM, Jakoby WB, Popper H, Schachter D, Shafritz DS. The Liver: Biology and Pathobiology. 2nd ed. New York: Raven Press; 1988.)
图32.7 不同体液池及肠肝循环中胆汁酸的相对含量。绿色线条的宽度表示相对含量。该图显示大部分胆汁酸池循环于肝脏、胆囊和小肠之间,而非全身循环。
• 图32.8 健康成人每日胆固醇平衡状态
其他胆汁成分
如前所述,胆汁还含有胆固醇和磷脂酰胆碱(phosphatidylcholine)。胆固醇跨胆小管膜的转运至少部分由一种异二聚体介导,该异二聚体由我们在第30章讨论过的主动转运蛋白ABC G5和ABC G8组成(见表32.1),这些转运蛋白参与小肠上皮细胞的胆固醇外排。磷脂酰胆碱来源于胆小管膜的内小叶,通过另一个ABC家族转运蛋白——多药耐药蛋白3(multidrug resistance protein 3,MDR3)特异性地"翻转"跨膜运输。此外,由于由胆汁酸、磷脂酰胆碱和胆固醇组成的混合微胶粒具有渗透活性,且连接相邻肝细胞的紧密连接相对疏松,水分和其他血浆溶质(如Ca++、葡萄糖、谷胱甘肽、氨基酸和尿素)会被吸入胆小管腔,其浓度基本接近血浆水平(图32.9)。最后,水溶性的结合胆红素(conjugated bilirubin),以及由内源性代谢物和外源性物质形成的多种有机阴离子和阳离子,也会通过肝细胞顶膜分泌进入胆汁。
小胆管中的胆汁修饰
排列于胆小管壁的胆管细胞(cholangiocytes)具有特化的胆汁成分调节功能(图32.10)。通过特异性转运蛋白,可回收利用的溶质(如葡萄糖和氨基酸)被重新吸收。胆汁中的氯离子与HCO3-进行交换,从而使胆汁呈弱碱性,降低Ca++沉淀的风险。谷胱甘肽在胆管细胞表面被γ-谷氨酰转肽酶分解为组成氨基酸后被重吸收。进食后,在促胰液素(secretin)等激素作用下,该部位的胆汁会被稀释——这些激素能增加HCO3-分泌,并刺激水通道蛋白(aquaporin)插入胆管细胞顶膜。因此在餐后时期,当需要胆汁酸协助脂质同化时,胆汁流量随之增加。
• 图32.9 溶质进入胆汁的途径(改编自Barrett KE. Gastrointestinal Physiology. New York: McGraw-Hill; 2006.)
胆囊的作用
最后,胆汁进入胆管并被输送至肠道。然而,在餐间期,由于Oddi括约肌收缩导致流出受阻,因此胆汁被重新导向胆囊。胆囊是由高阻力(resistance)上皮细胞构成的肌性囊状结构。在胆囊储存期间,钠离子通过主动吸收与质子交换,而作为主要阴离子的胆汁酸因体积过大无法通过胆囊上皮紧密连接(图32.11),这使得胆汁逐渐浓缩。尽管胆汁酸浓度可升高10倍以上,但由于单个混合胶束仅作为一个渗透活性颗粒存在,胆汁仍保持等渗性。因浓缩而产生的额外胆汁酸单体立即被整合入现有混合胶束中,这在一定程度上也降低了胆固醇从胆汁中沉淀的风险。然而,许多成年人的胆汁中胆固醇处于过饱和状态,其沉淀通常被抗成核蛋白的存在所抑制。胆汁的长期储存会增加成核发生的几率,这为"不应跳过早餐"提供了有力依据,或许也解释了为何胆结石疾病在人类中相对普遍。
胆囊通过同时松弛Oddi括约肌和收缩围绕胆囊上皮的平滑肌(图32.12)来分泌胆汁,这一过程的关键调节介质是胆囊收缩素。此外,内在神经反射和迷走神经通路也参与调控胆囊收缩性,其中部分通路本身也受到胆囊收缩素与迷走神经传入结合能力的激活。最终结果是浓缩的胆汁团被排入十二指肠腔,其中所含的混合胶束可协助脂质吸收。当不再需要时,胆汁酸被重新吸收并再次进入肠肝循环。而胆汁的其他成分大多随粪便排出体外,从而实现其从体内的排泄。
• 图32.10 胆管细胞分泌富含碱性液体和回收有用物质的主要转运过程。AQP,水通道蛋白(aquaporin);CFTR,囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator);GGT,γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase);GLUT1,葡萄糖转运蛋白1(glucose transporter 1);NBC,钠/碳酸氢盐协同转运蛋白(sodium/bicarbonate cotransporter);NHE1,钠/氢交换体1(sodium/hydrogen exchanger 1);NKCC1,钠/钾/2氯协同转运蛋白1(sodium/potassium/2 chloride cotransporter 1);SGLT-1,钠-葡萄糖协同转运蛋白1(sodium-glucose cotransporter 1)。
• 图32.11 胆囊储存期间胆汁浓缩的机制。AQP\cal{1},水通道蛋白1(aquaporin 1);BA^{-},胆汁酸阴离子(bile acid anion);NHE,钠/氢交换体(sodium/hydrogen exchanger);
临床相关
人类异常容易患胆结石(gallstones),这是由沉淀的胆汁成分在胆囊或胆道其他部位积聚形成的。胆结石主要由胆固醇或Ca++-胆红素盐构成(分别称为胆固醇结石与色素结石)。其重要性在于其容易阻塞胆汁流动,从而导致疼痛、对高脂饮食耐受性差、胆汁成分潴留,以及(若未及时治疗)肝损伤。在易感个体中,通常防止饱和胆汁成核的机制存在缺陷或被破坏,此时微小晶体形成并可能发展为胆结石。人类胆汁的胆固醇含量常处于过饱和状态,这会增加结石形成风险,尤其在长时间禁食期间。胆固醇胆结石在肥胖中年女性中尤为常见,特别是经产妇。这种高发率至少部分归因于雌激素具有增强肝脏胆固醇分泌的能力。在严重胆结石病例中,可通过外科手术切除胆囊,通常采用腹腔镜(laparoscopically)完成。对于嵌顿在胆道的小型胆结石,有时可通过内镜经Oddi括约肌插入小圈套器进行内镜下取石。
肝脏对胆红素(bilirubin)的形成与排泄
肝脏在胆红素排泄中也具有重要作用,胆红素是血红素(heme)的代谢产物,对机体具有潜在毒性。
• 图 32.12 胆囊收缩和胆汁分泌的神经体液调控。该通路还涉及Oddi括约肌的松弛以允许胆汁流入十二指肠。ACh,乙酰胆碱;CCK,胆囊收缩素;NO,一氧化氮;VIP,血管活性肠肽。
胆红素是一种抗氧化剂,同时也是清除衰老红细胞血红蛋白释放过量血红素的重要途径。事实上,红细胞贡献了80%的胆红素产量,其余来自其他组织的含血红素蛋白。胆红素可穿越血脑屏障,若水平过高会导致继发于神经元死亡的脑功能障碍,并激活星形胶质细胞和小胶质细胞;若未及时治疗可能致命。胆红素及其代谢产物还具有重要的显色作用,赋予胆汁、粪便颜色,并在较小程度上影响尿液颜色。同理,当肝脏疾病导致胆红素在循环中积聚时,就会引发黄疸(jaundice)这一常见症状,即皮肤和结膜黄染。
胆红素(bilirubin)由血红素通过两阶段反应在网状内皮系统的吞噬细胞(包括库普弗细胞和脾脏细胞)中合成(图32.13)。这些细胞中的血红素加氧酶(heme oxygenase)从血红素分子中释放铁并产生绿色的胆绿素(biliverdin)。随后,胆绿素可被还原形成黄色的胆红素。由于胆红素在中性pH条件下几乎不溶于水溶液,它通过与白蛋白结合在血液中运输。当该复合物到达肝脏时,会进入迪塞间隙(space of Disse),在此处胆红素通过有机阴离子转运多肽(OATP)转运体(见表32.1)被选择性摄取进入肝细胞的基底侧膜。
在微粒体区室中,胆红素与一或两个葡萄糖醛酸分子结合以增强其水溶性。该反应由尿苷5'-二磷酸(UDP)葡萄糖醛酸转移酶(UGT)催化。此酶在出生后合成缓慢,这解释了为什么轻度黄疸在新生儿中相对常见。随后,胆红素结合物通过位于胆小管膜的多药耐药相关蛋白(MRP2)分泌进入胆汁。值得注意的是,结合型胆红素无法从肠道被重吸收,从而确保其能被排出。然而,胆红素穿过肝细胞的转运(以及从血液中的初始摄取)效率相对较低,因此即使在正常条件下,血浆中也会存在部分结合型和非结合型胆红素。两者均以与白蛋白结合的形式循环,但结合型结合较松散,因此可进入尿液。
• 图32.13 血红素转化为胆红素。虚线框内的反应发生在网状内皮系统的细胞中。
在结肠中,胆红素结合物被细菌酶解结合,释放的胆红素经细菌代谢产生尿胆素原(urobilinogen)(可被重吸收)以及尿胆素(urobilins)和粪胆素(stercobilins)(被排出)。被吸收的尿胆素原可再次被肝细胞摄取并重新结合,从而使该分子获得再次排出的机会。
血浆胆红素的测定及其结合状态的评估是诊断肝脏疾病的重要工具。非结合型胆红素(几乎完全与白蛋白结合且无法通过尿液排出)的存在反映UGT缺失(或婴儿期该酶成熟的正常暂时性延迟)或血红素突然过量超出结合机制的负荷能力(如输血反应或Rh血型不合新生儿的情况)。另一方面,结合型胆红素血症的特征是尿液中存在胆红素(使尿液呈深色),这提示介导胆红素单葡萄糖醛酸苷/双葡萄糖醛酸苷分泌至胆小管的转运体存在遗传缺陷,或可能由胆结石阻塞引起的胆汁流动受阻所致。这两种情况下,胆红素结合物在肝脏中形成,但由于无法排出,会反流入血浆并通过尿液排泄。
细胞层面
克里格勒-纳贾尔综合征(Crigler-Najjar syndrome)是一种与肝细胞酶UGT(尿苷二磷酸葡萄糖醛酸转移酶)突变相关的疾病。在I型克里格勒-纳贾尔综合征中,先天性错义突变导致该酶完全缺失;而II型患者则存在较温和的突变,使UGT水平降至正常个体的约10%。因此,在不同严重程度下,该综合征会损害肝细胞生成结合胆红素的能力。未结合胆红素反流入循环系统并与白蛋白结合,若浓度急剧升高可能造成神经损伤风险。目前I型患者的唯一有效治疗方法是肝移植,但基因治疗可能在近期成为有前景的选择。II型患者有时可通过蓝光(blue light)有效治疗,该疗法将循环中的未结合胆红素转化为水溶性更高的形式,从而减弱其与白蛋白的结合能力,最终通过尿液排出。
肝脏对氨的处理
氨(NH₃)是一种中性小分子代谢物,来源于蛋白质分解代谢和细菌活动,具有极强的膜通透性。肝脏是防止循环系统中氨蓄积的关键器官,因氨对中枢神经系统具有毒性。肝脏通过尿素循环(urea cycle,亦称Krebs-Henseleit循环,见图32.14)将氨转化为尿素排出体外。肝脏是人体唯一能将氨转化为尿素的组织。
氨主要有两个来源:约50%由结肠细菌的脲酶产生。由于结肠腔通常呈弱酸性,部分氨会转化为铵离子(NH₄⁺),使其无法透过结肠上皮而被随粪便排出。但剩余氨仍可被动穿过结肠上皮,经门脉循环转运至肝脏。另一主要来源(约40%)是肾脏(见第37章)。少量氨(约10%)来自肝内氨基酸脱氨基作用、肌细胞代谢过程以及衰老红细胞释放的谷氨酰胺。
健康成人氨处理的"总量平衡"(mass balance)见图32.15。如前所述,氨作为中性小分子无需特定转运蛋白即可透过细胞膜,但某些膜蛋白(包括特定水通道蛋白)可转运氨。无论通过何种机制,氨的理化性质使其能被肝细胞高效地从门脉和体循环中摄取,随后进入尿素循环转化为尿素(见图32.14)。尿素作为中性小分子易被肾小球滤过,约50%滤过的尿素经肾小管重吸收后最终通过尿液排出(见第37章)。进入结肠的尿素或被排出,或被肠道细菌代谢为氨,这些氨可被重新吸收或排出体外。
• 图32.14 尿素循环
• 图32.15 健康状态下的氨稳态
若肝脏的代谢能力急性受损,可能迅速引发昏迷和死亡。在慢性肝病中,患者可能经历精神功能的渐进性衰退,这反映了氨和其他无法被肝脏清除的毒素的共同作用,这种病理状态称为肝性脑病(hepatic encephalopathy)。肝病患者出现意识模糊、痴呆并最终发展为昏迷,提示疾病已显著进展,若未及时治疗,这些症状可能致命。
肝功能临床评估
鉴于肝脏对维持稳态的重要性,肝功能检测是临床诊断的主要手段。此类检测目标包括:(1)评估肝细胞是否受损或功能障碍;(2)判断胆汁排泄是否受阻;(3)评价胆管细胞是否受损或功能障碍。肝功能检测也用于监测治疗效果或肝移植后的排斥反应。不过并非所有检测都直接测量功能。尽管如此,因其与肝脏生理的关联,仍需简要讨论这些检测方法。
肝细胞损伤检测依赖于该细胞类型的特异性标志物。例如当肝细胞因炎症或感染引发坏死时,会释放丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)等酶类。这些参与氨基酸相互转化的酶易在血清中检测,提示肝细胞损伤,但AST也可能来自心脏等其他组织损伤。另两项检测针对胆道系统损伤:碱性磷酸酶(alkaline phosphatase)表达于胆小管膜,其血浆浓度升高提示胆汁流动局部受阻;γ-谷氨酰转肽酶(GGT)水平升高则提示胆管细胞损伤。
循环或尿液中胆红素的测定也能反映肝功能。此外,肝脏其他特征性分泌产物的检测也可用于肝病诊断。临床上最常见的是血清白蛋白和凝血指标——凝血酶原时间(prothrombin time)的检测。若这些检测结果异常,结合其他临床表现,可确立肝病诊断。慢性肝病患者需定期监测血糖和血氨水平。最后,影像学检查以及经皮获取的肝实质活检组织学检查,对疑似或确诊肝病患者的评估和监测也至关重要。
