第二十五章 呼吸的调节
学习目标
完成本章学习后,学生应能回答以下问题:
- 通气是如何由中枢神经系统控制的?
- 中枢和外周化学感受器如何为通气调节提供反馈?
- 化学感受器与肺机械感受器在呼吸调节中的异同点是什么?
- 运动或高海拔暴露等环境如何改变呼吸驱动?
- 阻塞性睡眠呼吸暂停与中枢性睡眠呼吸暂停有何区别?
人类无需思考即可呼吸,并能主动调整呼吸模式甚至屏息。通气控制包括脑干呼吸中枢产生的节律性呼吸及其调节。节律性呼吸模式可根据全身感受器和高级脑中枢的输入信号进行调整。从机械角度看,呼吸的目标是使做功最小化;从生理角度看,则是维持和调节动脉血氧分压和二氧化碳分压。呼吸的另一目标是通过调节PaCO2来维持酸碱平衡。自主呼吸始于出生。在子宫内,胎盘(而非肺)是胎儿气体交换的器官,其微绒毛与母体子宫循环相互嵌合,胎儿氧分压的运输和二氧化碳分压的清除通过母体循环的被动扩散实现。
通气控制概述
呼吸调节的主要调控部位包括:(1) 呼吸控制中心(respiratory control center),(2) 中枢化学感受器(central chemoreceptors),(3) 外周化学感受器(peripheral chemoreceptors),以及(4) 肺机械感受器/感觉神经(pulmonary mechanoreceptors/sensory nerves)。呼吸控制中心位于脑干的延髓(medulla oblongata),由多个产生和调节基本呼吸节律的核团组成。该中心包含两个主要部分:(1) 通气模式发生器(ventilatory pattern generator),负责设定节律模式;(2) 整合器(integrator),负责控制模式的生成、处理来自高位脑中枢和化学感受器的输入信号,并调节通气模式的速率和幅度。整合器的输入信号源自高位脑中枢,包括大脑皮层、下丘脑、杏仁核所在的边缘系统以及小脑。
中枢化学感受器(central chemoreceptors)位于中枢神经系统内,紧贴延髓腹外侧表面下方。这些感受器可检测脑干组织间液中PaCO2和pH的变化,并据此调节通气活动。外周化学感受器(peripheral chemoreceptors)分布于主动脉弓的特定细胞群(主动脉体,aortic bodies)以及颈内、外动脉分叉处(颈动脉体,carotid bodies)。这些外周感受器可感知动脉血中的PaO2、PaCO2和pH变化,通过迷走神经和舌咽神经的分支——颈动脉窦神经(carotid sinus nerves),将信息反馈至延髓的整合器核团。肺机械感受器和感觉神经的激活(由肺扩张、气道刺激物或局部介质释放引发)可调节通气模式。
呼吸控制中心对脊髓前角运动神经元的综合输出信号控制呼吸肌活动,这一输出决定了呼吸的自动节律模式。位于脊髓颈段的运动神经元通过膈神经(phrenic nerves)调控膈肌活动,而位于胸段的运动神经元则控制肋间肌(intercostal muscles)和辅助呼吸肌。
与自主呼吸(automatic respiration)不同,随意呼吸(voluntary respiration)绕过了延髓中的呼吸控制中心(respiratory control center)。控制随意呼吸的神经活动起源于运动皮层(motor cortex),信号通过皮质脊髓束(corticospinal tracts)直接传递到脊髓中的运动神经元。支配呼吸肌的运动神经元是整合通气随意控制(皮质脊髓束)和自主控制(腹外侧束)的最后部位。这些肌肉的随意控制与自主影响在脊髓运动神经元水平存在竞争,这种竞争可通过屏气行为得到验证:屏气开始时,随意控制主导脊髓运动神经元;但随着屏气持续,自主通气控制最终会压倒随意努力,限制屏气持续时间。运动神经元也支配上气道肌肉。这些神经元位于延髓内靠近呼吸控制中心的区域,通过颅神经(cranial nerves)支配上气道肌肉。当被激活时,它们在吸气开始时扩张咽部和大气道。
对二氧化碳的反应
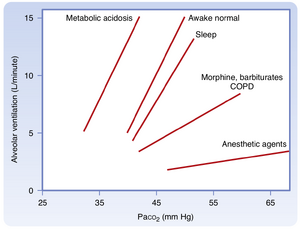
通气还受到动脉血中PaCO2、PaO2和pH的调节。其中PaCO2是最重要的调节因子。呼吸频率和深度均受控制以维持PaCO2接近40mmHg。正常清醒个体中,当PaCO2达到并超过40mmHg时,通气量呈线性增加(图25.1)。过度通气和抑制呼吸中枢的药物会降低对PaCO2变化的通气驱动(ventilatory drive)或反应,这些药物同时减弱对CO2和O2的通气反应,包括阿片类药物、苯二氮䓬类药物、巴比妥类药物和麻醉剂。在这些情况下,刺激不足以激活支配呼吸肌的运动神经元。睡眠期间该反应也会被抑制。此外,当呼吸功增加时(如慢性阻塞性肺疾病患者),对PaCO2变化的通气反应也会减弱,这主要是由于通气机械受限导致呼吸中枢的神经输出对促进通气的效果降低。
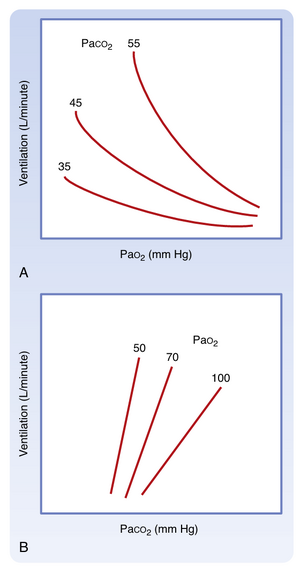
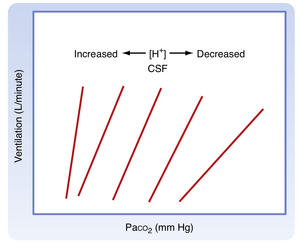
PaCO₂的变化由中枢和外周化学感受器感知,这些感受器将信息传递至延髓呼吸中枢。呼吸控制中枢随即调节每分通气量,从而将PaCO₂维持在正常范围内。当PaO₂正常时,PaCO₂每升高1 mm Hg,通气量约增加3升/分钟。若同时存在低PaO₂,机体对PaCO₂升高的通气反应会进一步增强(图25.2A)。
在低PaO₂状态下,任一给定PaCO₂水平对应的通气量均增大,且PaCO₂单位增量引发的通气增强效应更为显著。每分通气量随吸入CO₂浓度变化的斜率被称为二氧化碳通气反应,该指标用于评估机体对CO₂的敏感性。需重点指出:低氧状态会放大这种反应关系(见图25.2B)。
低氧反应增强的机制源于外周化学感受器对PaO₂与PaCO₂的感应途径不同。因此当高碳酸血症(CO₂升高)和低氧血症(O₂降低)共存时(二者并存常称为窒息),它们对化学感受器输出信号及最终通气刺激产生加和作用。
通气调控:细节解析
呼吸控制中枢
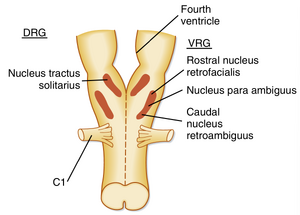
当实验性横断延髓与脑桥之间的脑组织时,周期性呼吸仍能维持,这表明呼吸的固有节律性起源于延髓。虽然尚未发现延髓中存在单一的"起搏器"神经元群,但延髓内两个不同的核团参与呼吸模式的生成(图25.3)。其一是背侧呼吸组(dorsal respiratory group, DRG),由孤束核(nucleus tractus solitarius)细胞组成,位于延髓背内侧区域。DRG细胞接收来自第IX和第X对脑神经的传入信号,这些信号源自气道和肺部,构成该传入信号在颅内的首个处理站。
第二组延髓细胞是腹侧呼吸组(ventral respiratory group, VRG),位于延髓腹外侧区域。VRG由三个细胞群组成:头端的面后核(nucleus retrofacialis)、尾端的疑后核(nucleus retroambiguus)以及疑旁核(nucleus para-ambiguus)。VRG同时包含吸气神经元和呼气神经元。面后核及疑后核尾端细胞在呼气时激活,而疑后核头端细胞在吸气时激活。疑旁核的吸气与呼气神经元通过迷走神经支配喉部和咽部肌肉。这些区域细胞的放电活动可兴奋某些细胞并抑制其他细胞。
呼吸控制中枢层面的调控
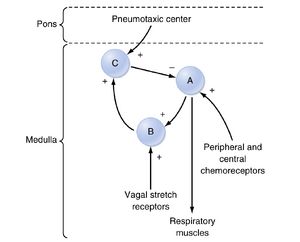
在呼吸控制中枢层面,吸气和呼气包含三个阶段:一个吸气相和两个呼气相(图25.4)。吸气起始于孤束核(nucleus tractus solitarius)、疑后核(nucleus retroambiguus)和疑旁核(nucleus para-ambiguus)细胞放电的突然增加,随后在整个吸气过程中放电频率呈现稳定的斜坡式上升。这种放电模式导致自主呼吸期间呼吸肌的渐进性收缩。在吸气结束时,"关闭开关(off-switch)"事件引发神经元放电显著减少,此时呼气开始。
在呼气初期(呼气相I),吸气神经元放电会出现反常性增加,通过增强吸气肌张力和呼气神经元放电来减缓呼气相。这种吸气神经元放电在呼气相II期间逐渐减弱并停止。尽管背侧呼吸组(DRG)和腹侧呼吸组(VRG)中的多种神经元都参与通气调控,但每种细胞类型似乎具有特定功能。例如,赫-伯反射(Hering-Breuer reflex)是一种吸气抑制性反射,其信号来源于气道平滑肌内的牵张感受器传入纤维。肺扩张增强会刺激这些牵张感受器,并通过激活与吸气肌控制"关闭开关"阶段相关的神经元导致提前呼气。因此,节律性呼吸依赖于来自DRG的持续(紧张性)吸气驱动,以及来自大脑皮层、丘脑、颅神经和脊髓上行感觉通路的间断(时相性)呼气驱动。
中枢化学感受器
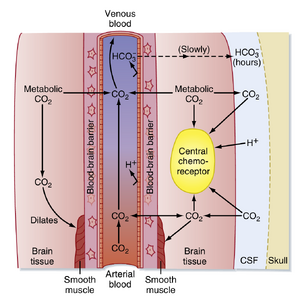
化学感受器(chemoreceptor)是指能够响应周围血液或其他体液化学成分变化的感受器。中枢化学感受器是位于延髓腹外侧表面的特化细胞。这些感受器对周围细胞外液的pH值变化敏感。由于该细胞外液与脑脊液(CSF)直接接触,CSF的pH值变化会通过作用于这些化学感受器来影响通气活动。
CSF是血浆的超滤液,由脉络丛持续分泌并被蛛网膜颗粒重吸收。由于CSF与脑组织细胞外液相接触,其成分受周围区域细胞代谢活动和血液成分的影响。尽管CSF来源于血浆,但由于两者之间存在血脑屏障(图25.5),其成分并不完全相同。血脑屏障由内皮细胞、平滑肌以及软脑膜和蛛网膜构成,可调节离子在血液与CSF之间的移动。此外,脉络丛也通过主动转运离子进出CSF来调控其离子组成。血脑屏障对H⁺和HCO₃⁻离子的通透性较低,但对CO₂具有高度通透性。因此,CSF中的Pco₂与动脉血Pco₂保持平行。CO₂也作为代谢产物由脑细胞产生。因此,CSF中的Pco₂通常比动脉血高数毫米汞柱(mmHg),导致其pH值(7.33)较血浆(表25.1)略偏酸性。
| 参数 | 脑脊液 | 动脉血 |
|---|---|---|
| pH | 7.33 | 7.40 |
| PCO2 | 44mmHg | 40mmHg |
| HCO3- | 22mEq/L | 24mEq/L |
外周化学感受器
颈动脉体和主动脉体是外周化学感受器(peripheral chemoreceptors),可响应血浆溶解氧分压(PaO2,非血液总氧含量)、PaO2和pH的变化,并向中枢呼吸控制中心传递传入信息。外周化学感受器是唯一能响应PaO2变化的化学感受器,同时负责约40%由PaCO2变化引起的通气反应。这些化学感受器是高度血管化的小型结构,由富含线粒体和内质网的I型(球状)细胞组成,胞质内含多种神经递质(如多巴胺、乙酰胆碱、去甲肾上腺素和神经肽)的突触囊泡。传入神经纤维与I型细胞形成突触,通过颈动脉窦神经(颈动脉体)和迷走神经(主动脉体)将信息传递至脑干。I型细胞是感知PaO2、PaCO2和pH的主要细胞,即使PaO2轻微降低也会增强化学感受器放电频率,从而促进呼吸。当PaO2降至75 mmHg以下时,该反应尤为显著。因此,通气活动通过外周和中枢化学感受器对动脉血及CSF pH变化的响应进行调控(图25.6)。
细胞水平
Henderson-Hasselbalch方程式描述了CSF pH与碳酸氢根浓度及PCO2的关系:
pH = pK + log[HCO3-]/α×PCO2
其中α为溶解度系数(solubility coefficient,0.03 mmol/L 每 mmHg),pK是碳酸解离常数的负对数(6.1)。亨德森-哈塞尔巴尔赫方程表明,在任一给定的[HCO3-]下,脑脊液PCO2的增加都会导致脑脊液pH值降低。pH值的降低会刺激中枢化学感受器(central chemoreceptors),从而增强通气。因此,血液中的CO2通过影响脑脊液pH值来调节通气。由此产生的过度通气会降低PaCO2,从而降低脑脊液的PCO2,使脑脊液pH值恢复正常。此外,脑动脉扩张伴随PaCO2的升高而出现,这会促进CO2向脑脊液扩散。相反,在任一给定的PaCO2下,脑脊液[HCO3-]的升高会导致脑脊液pH值升高。
由pH改变引起的PaCO2变化会激活稳态机制,使pH恢复至正常值。血脑屏障通过调节脑脊液的离子组成和HCO3-来调控脑脊液pH值。然而,脑脊液[HCO3-]的这些变化需要数小时缓慢完成,而脑脊液PCO2的变化可在数分钟内发生。因此,对脑脊液pH值变化的代偿需要数小时才能完全形成。
肺机械感受器(Pulmonary Mechanoreceptors)
胸壁与肺反射(Chest Wall and Lung Reflexes)
若干源自胸壁和肺的反射会影响通气和呼吸模式(表25.2)。赫林-布鲁尔吸气抑制反射(Hering-Breuer inspiratory-inhibitory reflex)由肺容积增加触发,尤其是伴随通气频率和潮气量同时增加时。这种牵张反射通过迷走神经纤维介导,被激活时可通过刺激延髓的关闭神经元(off-switch neurons)使吸气终止。该反射在平静呼吸时不活跃,在新生儿中似乎最为重要。用冷水刺激鼻部或面部感受器会引发潜水反射(diving reflex)。当该反射被激活时,会出现呼吸暂停(apnea)和心动过缓(bradycardia)。此反射可防止个体在溺水初期吸入水分。鼻部感受器的激活负责喷嚏反射(sneeze reflex)。
呼吸道反射(Reflexes in the Respiratory Tract) 25.2
IN THE CLINIC
想象一下从纽约市飞往丹佛。纽约的气压约为760\mathrm{mm}\ H_{9},而在科罗拉多州丹佛周边山区气压为600 mm Hg。在海平面,动脉血氧分压(PaO₂)约为95\mathrm{mm} \mathsf{H g},而肺泡氧分压(PAO₂)根据肺泡气方程(alveolar air equation;见第23章)计算为[(760-47)\times0.21]-[40/0.8]=100\mathsf{m m H g}。若肺泡-动脉氧分压差(AaDO₂)为5\mathsf{m m}\mathsf{H g},则PaO₂=100\mathsf{m m}\mathsf{H g}-5\mathsf{m m}\mathsf{H g}=95\mathsf{m m}\mathsf{H g}。在脑脊液(CSF)中,pH约为7.33,动脉血二氧化碳分压(PaCO₂)为44\mathrm{mm}\ H_{9}(PaCO₂加上脑细胞代谢产生的CO₂),碳酸氢根(HCO₃⁻)浓度约为22\mathrm{mEq/L}。
抵达丹佛时,吸入氧分压(PIO₂)急剧下降:PIO₂=(600-47)\times0.21=116\mathsf{m m H g}。肺泡氧分压和动脉血氧分压也随之降低:PAO₂=116-(40/0.8)=66\mathsf{m m H g},PaO₂=61\mathsf{m m}\mathsf{H g}(假设AaDO₂未改变)。动脉血氧分压的降低刺激外周化学感受器,从而增加通气量。通气量增加会降低PaCO₂并升高动脉血pH。这种通气量的增加通过提高PAO₂来减轻低氧血症。例如,假设肺泡二氧化碳分压(PACO₂)降至30\mathrm{mm} Hg,则PAO₂=[(600-47)\times0.21]-[30/0.8]=78\mathsf{m m H g},PAO₂增加了12 mm Hg。
PaCO₂的降低也导致脑脊液中二氧化碳分压(PCO₂)下降。由于HCO₃⁻浓度未改变,脑脊液pH升高。这种pH升高会减弱中枢化学感受器的放电频率,减少其对通气驱动的贡献。在接下来的12至36小时内,随着血脑屏障中的酸碱转运蛋白降低HCO₃⁻浓度,脑脊液中的HCO₃⁻浓度逐渐下降。结果,脑脊液pH逐渐恢复正常,中枢化学感受器放电频率增加,分钟通气量进一步升高。与此同时,肾脏逐渐排泄血浆中的HCO₃⁻,使得动脉血pH逐渐恢复正常。随着动脉血pH恢复正常(升高的动脉血pH会抑制外周化学感受器),外周化学感受器的刺激进一步增强。
最终,在抵达高海拔地区36小时内,分钟通气量显著增加。这种延迟反应比低氧血症对通气的即时效应更强。通气量的进一步增加同时源于中枢和外周化学感受器的刺激。因此,36小时后,动脉血pH和脑脊液pH均接近正常值;分钟通气量增加,PaO₂降低,PaCO₂也降低。
感觉受体与反射
位于气管支气管树中的三种主要类型感觉受体可响应多种不同刺激,这些响应会导致肺机械特性的改变、呼吸模式的调整及呼吸症状的产生。吸入的粉尘、有害气体和香烟烟雾会刺激气管和大气道中的刺激受体(irritant receptors),这些受体通过有髓鞘的迷走神经传入纤维传递信息。刺激这些受体会导致气道阻力增加、反射性呼吸暂停和咳嗽。这些受体也被称为快速适应肺牵张受体(rapidly adapting pulmonary stretch receptors)。慢适应肺牵张受体(slowly adapting pulmonary stretch receptors)对机械刺激产生响应,并在肺膨胀时被激活。它们也通过有髓鞘的迷走神经传入纤维传递信息。慢性阻塞性肺疾病(COPD)患者肺容积的增加会刺激这些肺牵张受体,并延迟下一次吸气努力的开始。这解释了患者为何会出现缓慢而持久的呼气努力,该机制对最小化动态呼气气道压缩至关重要。
你返回家中。当你在纽约降落时,\mathsf{P i o}_{2}恢复到正常值,对通气的低氧刺激被消除。\mathsf{P a o}_{2}恢复正常值,外周化学感受器(chemoreceptor)对通气的刺激作用减弱。这导致动脉[CO2]向正常值升高,进而引起脑脊液(CSF)[CO2]的增加。由于CSF中[\mathsf{H C O}_{3}{}^{-}]减少且通气增强,这种增加与CSF的pH值降低相关。在接下来的12至36小时内,血脑屏障中的酸碱转运体将{\mathsf{H C O}}_{3}{\mathrm{^{-}}}转运回CSF,CSF的pH值逐渐恢复正常。类似地,随着{\mathsf{P a c o}}_{2}升高(因动脉[\mathsf{H C O}_{3}{}^{-}]下降),血液pH值降低。这会刺激外周化学感受器,使分钟通气量维持增强状态。在接下来的12至36小时内,肾脏对[\mathsf{H C O}_{3}{}^{-}]的排泄增加(参见第36章),动脉pH值恢复正常,分钟通气量也回归正常水平。
吸入反射(aspiration reflex)或鼻吸反射(sniff reflex)可通过刺激鼻咽和咽部的机械受体(mechanoreceptors)引发。这是一种短暂而强烈的吸气动作,可将物质从鼻咽部带到咽部,以便吞咽或咳出。负责鼻吸反射的机械受体在吞咽过程中也起重要作用,通过抑制呼吸并引起喉部闭合。由于解剖学原因,只有新生儿能够同时进行呼吸和吞咽,这使得营养摄入更为迅速。
喉部包含浅表和深层受体。浅表受体的激活会导致呼吸暂停、咳嗽和呼气运动,从而保护下呼吸道免受异物吸入。深层受体位于喉部骨骼肌中,与其他骨骼肌类似,它们控制肌纤维的激活。
运动
运动能力取决于心血管和呼吸系统增加组织氧(O₂)输送及清除体内二氧化碳(CO₂)的能力。运动开始时通气量立即增加,且分钟通气量的增加与运动中伴随的O₂消耗量和CO₂生成量的增加高度匹配(图25.7)。在低至中等强度运动中,通气量与CO₂生成量和O₂消耗量呈线性相关(见图25.7)。在最大强度运动时,体能良好者能达到4升/分钟的O₂消耗量及120升/分钟的分钟通气量,这几乎是静息水平的15倍。
运动的显著特征在于血气参数无显著变化。除最大强度运动外,运动中动脉血二氧化碳分压(Paco₂)和动脉血氧分压(Pao₂)的变化极小。中等强度运动期间,动脉pH值仍维持在正常范围内。剧烈运动时,由于无氧代谢导致肌肉释放乳酸,动脉pH值开始下降。这种动脉pH值的降低会刺激通气量出现与运动强度不成比例的增加。持续代谢性(乳酸)酸中毒开始出现的运动强度称为无氧阈(见图25.7)。
呼吸控制异常
通气模式的改变可能由原发性和继发性原因引起。在睡眠期间,约三分之一的健康个体会出现短暂的呼吸暂停或通气不足,这些事件对PaO2或PaCO2没有显著影响。此类呼吸暂停通常持续不到10秒,发生于慢波睡眠和快速眼动(rapid eye movement, REM)睡眠的较浅阶段。在睡眠呼吸暂停综合征中,呼吸暂停持续时间异常延长,并改变PaO2和PaCO2。睡眠呼吸暂停主要分为两类(图25.8)。
第一类为阻塞性睡眠呼吸暂停(obstructive sleep apnea, OSA),是最常见的睡眠呼吸暂停综合征,发生于吸气时上气道(通常为下咽部)闭合。尽管该过程与打鼾时发生的情况类似,但其更为严重,因为它会阻塞气道并导致气流停止。
第二类睡眠呼吸暂停综合征是中枢性睡眠呼吸暂停。这种类型的呼吸暂停发生于呼吸运动神经元的通气驱动减弱时。中枢性睡眠呼吸暂停患者每晚会出现反复的呼吸暂停发作,期间无任何呼吸努力(见图25.8)。中枢性睡眠呼吸暂停患者的二氧化碳潴留和低氧血症程度较OSA患者轻,但当中枢性睡眠呼吸暂停反复发作且严重时,可出现相同并发症(如红细胞增多症)。
• 图25.8 睡眠呼吸暂停的两种主要类型。A. 阻塞性睡眠呼吸暂停,随着CO2水平升高,胸膜压力波动增大,表明由于上气道阻塞导致气流阻力极高;B. 中枢性睡眠呼吸暂停的特征是无呼吸努力,表现为胸膜压力无波动。
临床视角
OSA患者的临床病史非常相似。配偶通常报告患者存在打鼾现象。鼾声逐渐变大后突然停止,此时患者仍持续进行强烈的呼吸努力(见图25.8)。随后患者觉醒,再次入睡,整夜重复该过程。OSA患者觉醒是由于动脉低氧血症和二氧化碳潴留刺激外周及中枢化学感受器所致。在下次呼吸暂停事件发生前,呼吸会短暂恢复。OSA患者每夜可发生数百次此类事件,导致睡眠中断。OSA的并发症包括睡眠剥夺、红细胞增多症、右心衰竭(肺源性心脏病)以及继发于反复低氧事件的肺动脉高压。OSA常见于肥胖患者,以及下咽部顺应性过高、上气道水肿和上气道结构异常的患者。
• 图25.9 在陈-施呼吸(Cheyne-Stokes breathing)中,潮气量(tidal volume)以及由此产生的动脉血气水平呈现周期性增强与减弱。通常,陈-施呼吸是血管运动不稳定的标志,尤其是低心输出量的表现。P a c o_{2}, 动脉二氧化碳分压;P a o_{2}, 动脉氧分压。
陈-施通气(Cheyne-Stokes ventilation)是另一种异常呼吸模式,其特征是潮气量和通气频率的周期性变化(图25.9)。在呼吸暂停期后,潮气量和呼吸频率经过数次呼吸逐渐增加,随后又逐渐降低直至再次出现呼吸暂停。这种不规则呼吸模式可见于某些中枢神经系统疾病、颅脑外伤和颅内压增高的个体。健康人在高海拔睡眠时偶尔也会出现。陈-施呼吸的机制尚不清楚,在某些个体中,似乎与脑部血流缓慢相关,表现为通气努力对\mathrm{Pco}_{2}变化的过度反应与反应不足交替出现。
临床知识
中枢性肺泡低通气(central alveolar hypoventilation)(即Ondine’s curse)是一种罕见疾病,其特点是自主呼吸正常但自动呼吸调控异常。这是中枢性睡眠呼吸暂停综合征中最严重的一种。因此,患者只要保持清醒就能正常呼吸,但入睡后即出现危险。对于这些患者,机械通气或近年采用的双侧膈肌起搏(类似于心脏起搏器)可挽救生命。
• 图25.10 几种呼吸模式。A、正常呼吸频率为每分钟12至20次。B、当不同肺受体(主要是牵张受体)的感觉传入被阻断时,每个呼吸周期延长且潮气量增加,但肺泡通气量未显著改变。C、当同时阻断来自大脑皮层和丘脑的传入信号及迷走神经传导时,会出现持续数秒的吸气活动,随后被短暂呼气中断(长吸呼吸,apneusis)。
长吸呼吸(apneustic breathing)是另一种异常呼吸模式,其特征是持续的吸气期被短暂的呼气期分隔(图25.10C)。这种通气模式的机制似乎是吸气抑制活动的丧失,导致吸气驱动增强。该模式偶见于中枢神经系统损伤的个体。
婴儿猝死综合征(sudden infant death syndrome,SIDS)是围产期后第一年婴儿最常见的死亡原因。虽然SIDS的病因尚不明确,但通气调控异常(尤其是对CO2反应性的异常)被认为与之相关。让婴儿采取仰卧位睡眠(可减少CO2重复呼吸的可能)已显著降低了该综合征的死亡率(但尚未完全消除)。
关键点
- 通气调控(ventilatory control)由呼吸控制中枢、中枢化学感受器、外周化学感受器和肺机械感受器/感觉神经组成。PaCO2是影响通气的主要因素。
