第十章 性别分配
所有有性繁殖生物都必须决定如何将资源分配给雄性和雌性繁殖。这涵盖了不同繁殖系统类型下的一系列相关问题。在雌雄异体(dioecious)物种(如鸟类和哺乳动物)中,个体终身为单一性别,核心问题在于应生产雄性还是雌性子代?在顺序性雌雄同体(sequential hermaphrodites)(或性别转换者)中(如许多珊瑚礁鱼类),个体生命早期以一种性别功能活动,随后转换为另一性别,问题在于应先成为何种性别以及何时转换性别?在子代性别由环境决定(环境性别决定,environmental sex determination)的物种(如某些虾类和鱼类)中,问题在于何种信号应决定性别以及如何决定?
传统观点认为性别分配是否出现有趣现象取决于性别决定方式(专栏10.1)。对于具有遗传性别决定(genetic sex determination)的物种(如鸟类或哺乳动物),学界曾假设性别决定是随机的,且无法被亲代控制。这一观点得到家禽(如鸡)选择实验的支持——尽管雌性偏倚的性别比例会带来巨大经济效益,但实验未能使子代性别比例偏离雌雄均等。相比之下,单倍二倍体(haplodiploidy)和环境性别决定等机制允许对子代性别进行更多控制,因此可能出现偏向儿子或女儿的性别分配模式。例如,在单倍二倍体物种(如蚂蚁、蜜蜂和黄蜂)中,雌性可通过是否使卵受精来根据局部条件调整子代性别(专栏10.1)。
然而过去40年间,这一图景发生了巨大转变。研究发现,包括鸟类和哺乳动物在内的众多生物都能以提升自身适合度的方式操纵子代性别。事实上,性别分配研究已成为行为生态学(behavioural ecology)中最富成果的领域之一,揭示了自然选择如何塑造行为。要理解性别分配的有趣模式,首先需要解释为何对雄性和雌性的均等投资是零模型(null model)。
专栏10.1 性别决定(Sex Determination)
个体的性别可由性染色体、环境决定,甚至在其生命周期中发生改变(Bull, 1983)。
在具有遗传(染色体)性别决定(genetic (chromosomal) sex determination)的物种(如鸟类或哺乳动物)中,性别取决于个体是否具有两条同型性染色体(同型配子,homogametic)或两条异型性染色体(异型配子,heterogametic)。哺乳动物中,雌性为同型配子(XX),雄性为异型配子(XY)。因此,所有卵子携带X染色体,性别取决于卵子是被X精子还是Y精子受精。鸟类中,雌性为异型配子(ZW),雄性为同型配子(ZZ)。因此,所有精子携带Z染色体,性别取决于卵子携带Z或W染色体。因此,雌性若要控制子代性别,需偏向接受X或Y精子(哺乳动物),或产生W或Z卵子(鸟类)。
图 B10.1.1 爬行动物的温度依赖性性别决定(temperature dependent sex determination)。许多爬行动物的性别由发育期间的温度决定。例如,(a)锦箱龟(Terrapene ornate)和(b)绿海龟(Chelonia mydas)在低温孵化时产生雄性,高温孵化时产生雌性。其他物种如(c)澳大利亚淡水鳄(Crocodylus johnstoni)呈现相反模式,较高温度下产生雄性。最后,极端温度(高温和低温)可能优先产生单一性别,如(d)皱褶蜥(Chlamydosaurus kingii),中间温度产生两性,极端温度仅产生雌性。照片(a)© Fred Janzen;(b)© Annette Broderick;(c)和(d)© Ruchira Somaweera。
图 B10.1.2 温度依赖性性别决定爬行动物性别比对孵化温度的响应示例。不同线条代表不同物种。引自Bull(1980)。
在单倍二倍体(haplodiploid)物种中,如ants、bees、wasps和某些beetles,性别由卵是否受精决定。受精卵为二倍体并发育为雌性,而未受精卵为单倍体并发育为雄性。这使雌性能通过是否使卵受精来控制后代的性别。在某些wasp物种中,观察者甚至能在产卵时确定卵的性别,因为雌性在给这个卵受精时会有一个可见的停顿。
在具有环境性别决定(environmental sex determination)的物种中,环境的某些特征如温度或日照时长决定性别。这存在于包括某些turtles、crocodiles、shrimps和worms的一系列物种中。例如,在turtles中,雄性在相对低温下产生,而雌性在相对高温下产生。相反,许多lizards和crocodiles表现出相反模式,雄性在相对高温下产生(图B10.1.2)。
Fisher的均等投资理论
如果一个雄性能为数十个雌性的卵受精,为何不产生例如1雄:20雌的性别比?采用这种比例时,种群的繁殖成功率将高于1:1比例,因为会有更多卵可供受精。然而在自然界中,性别比通常非常接近1:1,即使雄性除了为雌性受精外无所作为。正如我们在第1章所见,性状的适应价值不应被视为"为了种群利益",而是"为了个体利益"或更精确地说"为了控制该性状的基因利益"。Darwin曾困惑为何1:1性别比会被选择,但R.A. Fisher(1930)给出了明确答案。
假设一个种群每20个雌性对应1个雄性。每个雄性的预期繁殖成功率是雌性的20倍(因为每个雄性平均有20个配偶),因此只生育儿子的亲代预计拥有的孙代数量是主要生育雌性子代的亲代的近20倍。因此,雌性偏倚的性别比在进化上不稳定,因为导致亲代的子代性别比偏向雄性的基因会迅速扩散,性别比将逐渐向高于初始1:20比例的雄性方向偏移。但反过来设想,如果雄性数量是雌性的20倍,只生育雌性的亲代将具有优势。由于每个卵只需一个精子受精,每20个雄性中仅有一个能贡献基因给任意个体后代;因此雌性的平均繁殖成功率是雄性的20倍。故雄性偏倚的性别比也不稳定。结论是:稀有性别总具有优势,因此专注于生育稀有性别的亲代将被选择偏好。只有当性别比恰好为1:1时,雄性和雌性的预期成功率相等,种群性别比才稳定。即使微小偏倚也会使稀有性别受益:在51雌:49雄的种群中,若每个雌性有一个后代,平均雄性拥有51/49个后代。无论父权主要由单一雄性获得还是平均分配,该平均值均成立。
检验Fisher理论的一种方法是将性别比从1:1扰动后观察其是否向该点回归。Alexandra Basolo(1994)利用Xiphorus maculatus的独特性别决定机制完成了该实验。该物种的性别由具有三个性别等位基因的单基因座决定,存在三种雌性(WX、WY、XX)和两种雄性(YY、XY)基因型。她证明当改变等位基因相对频率以建立偏倚性别比的种群时,选择如预测般偏好稀有性别,并迅速将性别比恢复至1:1(图10.1)。
上述关于性别比应为1:1的论点可通过资源投入重新表述以完善。前文隐含假设生育雄性和雌性成本相等。但如果雄性成本是雌性的两倍(例如因其体型更大且发育中需要两倍食物),当性别比1:1时,雄性的平均后代数与雌性相同。但因其成本翻倍,雄性对亲代是低效投资:通过雄性获得的每个孙代的成本是通过雌性的两倍。因此,此时亲代应专注于生育雌性。随着性别比向雌性偏倚,雄性的预期繁殖成功率将上升,直至雌雄比为2:1时,平均雄性的后代数是雌性的两倍。此时每单位投资在雄性和雌性上的回报相等:雄性成本翻倍但回报也翻倍。这意味着当两性成本不同时,进化稳定策略是亲代对两性均等投资而非生育等量后代。Bob Metcalf(1980)对两种wasp(Polistes metricus和P_{\mathbf{\delta}} variatus)性别比的研究可说明该点:前者雌性体型小于雄性,后者两性体型相近。如预测,P_{\mathbf{\delta}} metricus的种群性别比存在偏倚而P. variatus无偏倚,但两物种的投资比均为1:1。
图10.1 南方platyfish的性别比演化。当性别比偏离雌雄数量相等时,其迅速回归该点。扰动方向为雌性偏倚(a)或雄性偏倚(b)。不同线条代表不同重复实验。引自Basalo(1994)。经University of Chicago Press许可转载。
亲属互作时的性别分配
Fisher理论假设亲属个体不发生合作或竞争互作。若发生此类互作,则个体可能被选择偏倚子代性别比以减少亲属竞争或增加合作(框10.2)。
局部资源竞争
Anne Clark(1978)发现非洲婴猴Galago crassicaudatus的子代投资比偏向雄性。她指出这可用该物种的生活史解释。与多数哺乳动物类似,雌性Galago扩散距离小于雄性,常与母亲及其他雌性竞争母亲领地内的树胶和果树等丰富食物资源。这种局部资源竞争(LRC)降低了其作为后代的价值:极端情况下,仅一个雌性后代能在家园附近的食物资源中存活,因此对其他雌性后代的投资将被浪费。在灵长类中,这种后代性别比例的适应性调整程度存在极大争议,因为数据变异性强,且有人认为染色体(遗传)性别决定机制限制了鸟类和哺乳类等类群对后代性别比例的控制。
框10.2 亲属互作时的性别比
雌性适合度等于其通过雌雄子代获得的适合度之和,由下式给出:
适合度 = (生育雌性子代数 × 每个雌性子代适合度) + (生育雄性子代数 × 每个雄性子代适合度)
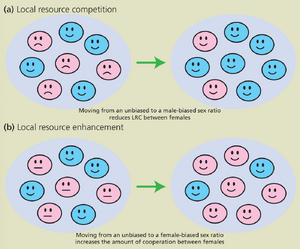
考虑这样一种情况:雌性后代为资源竞争,导致每个雌性后代的平均适合度(fitness)随雌性后代数量的增加而降低。这种局部资源竞争(Local Resource Competition, LRC)会偏向雄性性别比例,以减少雌性后代间的竞争,从而提高每个雌性后代的适合度(图 B10.2.1a)。随着性别比例愈发偏向雄性,每个雄性获得的平均配偶数量将减少,从而降低产生雄性后代的适合度收益。进化稳定(ES)性别比例将是这两种力量相互抵消的平衡点。
相反,若雌性后代间存在合作,则雌性后代的平均适合度随其数量增加而上升。这种局部资源增强(Local Resource Enhancement)会偏向雌性性别比例,以促进雌性间的合作,从而提高每个雌性后代的适合度(图 B10.2.1b)。随着性别比例愈发偏向雌性,每个雄性获得的平均配偶数量将增加,从而提高产生雄性后代的适合度收益。进化稳定性别比例将是这两种力量相互抵消的平衡点。
图 10.2 雌性、两性或雄性为扩散性别的灵长类物种出生时的性别比例。性别比例偏向扩散性别。引自 Silk 和 Brown (2008)。照片为 Joan Silk 拍摄的黑猩猩。
Joan Silk 和 Gillian Brown (2008) 对 102 种灵长类物种数据的综合研究表明,这一预测得到支持,但效应较弱:扩散性别为雄性的物种中性别比例仅略微偏向约 53% 雄性,扩散性别为雌性的物种中则偏向约 55% 雌性(图 10.2)。在 LRC 可能更极端的物种中观察到更大的偏向性。例如,行军蚁 Eciton burchelli 的新群体仅通过旧群体分裂为两个集群形成,一个由旧蚁后领导,另一个由其某个雌性后代领导。姐妹间争夺领导权的竞争可解释为何群体产生 6 只雌性和 3000 只雄性,生殖个体中雄性比例达约 99.8%(Franks & Holldobler, 1987)。
局部资源竞争也可解释物种内或种群内的性别比例变异。William Brown 和 Laurent Keller (2000) 发现窄头蚁 Formica exsecta 的群体倾向于仅产生雄性或雌性生殖个体(图 10.3),且这种“分裂性别比例”无法用第 13 章将讨论的亲缘不对称变异的常见解释说明。他们认为原因在于群体间 LRC 程度的差异,这源于蚁后数量的变异。在该物种中,蚁后的扩散常受限,新交配的蚁后被招募回亲本群体,最终可能携带工蚁扩散至附近建立新群体。在蚁后数量较多或资源可用性较低的群体中,LRC 更强,因此产生新蚁后的相对收益降低。Brown、Keller 及其同事通过检验群体生殖个体性别比例如何随蚁后数量及生态变量变化,验证了这一预测。支持其假说的是,他们发现当群体包含更多蚁后时(图 10.3),以及资源(如针叶树上产蜜蚜虫)可用性较低时,群体产生更高比例的雄性。进一步地,他们通过实验验证这些观点,表明移除蚁后或增加食物资源(在巢穴放置金枪鱼和蜂蜜)均导致群体产生更高比例的雌性生殖个体(Kümmerli et al., 2005; Brown & Keller, 2006)。
图 10.3 窄头蚁 Formica exsecta 中产生雌性(浅蓝)或雄性(深蓝)生殖个体的群体内蚁后数量分布。蚁后较少的群体产生雌性,而蚁后较多的群体产生雄性。引自 Brown 和 Keller (2000)。照片由 Rolf Kümmerli 拍摄。
局部配偶竞争
Bill Hamilton (1967) 注意到,许多性别比例极度偏向雌性的昆虫和螨类物种,其生活史中雄性兄弟常为配偶(多为姐妹)相互竞争。他将此解释为 LRC 的特殊情况,称为“局部配偶竞争(Local Mate Competition, LMC)”。LMC 导致雌性偏向性别比例的确切原因在 1970-1980 年代争议不断,但现公认其由两个因素引起(Taylor, 1981)。首先,假设两个雄性仅有一次交配机会且竞争同一雌性,则仅一个能成功交配,从母亲视角看其中一个被“浪费”。此极端案例说明:当雄性竞争配偶时,其对母亲的价值降低。因此,母亲应使投资比例偏向雌性。其次,若雄性可与姐妹近亲交配,则雌性偏向性别比例能通过提供更多配偶(雌性)给雄性带来额外收益,因此母亲产生的雌性比例越高,每个雄性的价值越大。
Hamilton 理论预测的偏向程度取决于局部配偶竞争的强度。考虑完全近亲交配的极端情况:母亲“确信”所有雌性后代将被其雄性后代受精。此时最佳性别比例是仅产生足够受精雌性的雄性,因为其他雄性将被浪费。这与早期1:1性比理论的关键区别在于,此时种群其他部分的雌雄比例不再重要。子代中的雌性偏向比例不会让其他亲代通过专注生产雄性后代获得优势。Hamilton注意到,在近亲交配概率高的物种中,每个子代往往只产生一个或少量雄性。支持该预测的例子是胎生螨Acarophenox,其子代为1个雄性和最多20个雌性。雄性在母体内与姐妹交配,并在出生前死亡。
Fig. 10.4 寄生蜂Nasonia vitripennis的性比调节。当更多雌蜂在斑块产卵时,会产生雌性偏向程度较低的性比。引自Werren (1983)。照片由Michael Clark提供。
Hamilton进一步提出,若个体能评估其后代可能经历的局域配偶竞争(local mate competition, LMC)程度,则应相应调整子代性比。具体而言,若N个母体在同一个斑块产卵,且交配仅发生在这些子代间(随后仅有雌性扩散),则演化稳定(evolutionarily stable, ES)性比(雄性比例)为(N-1)/2N。该模型预测性比将随N值变化:当N较大时接近0.5(符合Fisher理论),随着N减小而逐渐偏向雌性。极端情况下,当N=1时,预测性比为0,即母体仅需产生足够雄性使女儿受精。
Jack Werren (1983)用寄生蜂Nasonia vitripennis验证了这一预测。该物种将卵产于蝇类(如Sarcophaga bullata)的蛹内。该物种中,有翅雌蜂与无翅雄蜂在其发育的寄主蛹内/上/附近交配,随后仅有雌蜂扩散。因此,当单一雌蜂寄生斑块内蛹时,其女儿将全部由其儿子受精,正如预测其卵块的性比高度偏向雌性(雄性仅占8.7%)。当更多雌蜂在斑块产卵时,LMC程度降低,雌蜂应产下雌性偏向程度较低的性比。Werren在实验室实验中观察到这一模式:当更多母体在斑块产卵时,个体会产生雌性偏向程度较低的性比(Fig. 10.4)。
近年来,分子方法(微卫星标记)被用于验证该模式是否存在于自然种群。Max Burton-Chellew等(2008)对鸟类巢穴中蝇蛹内羽化的蜂群进行基因分型,重建母体基因型以确定每个巢内的产卵母体数量,并将其与羽化蜂群的性比关联。他们发现了与Werren高度一致的模式:当更多雌蜂在寄主蛹产卵时,子代性比的雌性偏向程度降低。
Fig. 10.5 寄生蜂N. vitripennis的性比调节机制。雌蜂通过感知先前寄生宿主和其他雌蜂的存在(照片显示用于追踪个体行为的红眼突变体),产生雌性偏向程度较低的性比。引自Shuker and West (2004)。照片© David Shuker与Stuart West。
我们应预期动物行为的精确度?LMC研究为解答该问题提供了独特视角,因其理论能对个体行为做出相对清晰的预测。首要因素是处理环境信息的能力。在LMC背景下,关键问题是个体如何评估斑块内产卵雌蜂数量(即LMC程度)。Shuker and West (2004)在N. vitripennis中发现,性比调节既依赖其他雌蜂存在的直接信号,也依赖其他雌蜂产卵的间接信号。通过使用切除产卵器的雌蜂和眼色突变体,他们分离了这两个因素:性比随斑块内雌蜂数量增加而发生的变化,主要源自其他雌蜂产卵的间接信号(Fig. 10.5)。这表明个体行为会因到达斑块的时间顺序和产卵进程产生差异。这种"如何"(近因)问题的解答有助于理解"为何"(终因)问题。
另一影响行为精确度的因素是环境变异。Allen Herre (1987)研究13种榕小蜂(在榕果内产卵发育)的LMC时发现:虽然所有物种都调节性比,但调节程度存在种间差异——自然种群中产卵雌蜂数量变异越大的物种,性比调节幅度越大。这完美印证了"更高环境变异选择更高行为变异"的普遍原则。
局域资源增强
亲属间不仅存在竞争,也可能合作。在许多合作繁殖脊椎动物中,某一性别后代更可能留群协助亲代抚育后代。例如塞舌尔莺雌性更常充当帮手,而非洲野犬和红顶啄木鸟则雄性更常协助。许多学者认为这类物种的种群性比应偏向帮手性别(Box 10.1)。但Ido Pen与Franjo Weissing (2000)指出该预测仅适用于简单情形,实际根据生活史细节可能预测任何方向的性比偏移。这凸显了数学模型的优势——迫使潜在假设显性化,并揭示语言论证可能存在的误导性。他们证明的明确预测是:缺少帮手的群体应多产帮手性别,已有帮手的群体应产另一性别。该预测已在多个物种中得到支持,例如非洲野犬中,帮手较少的群体产63%雄性的偏雄性窝,而帮手较多的群体产64%雌性的偏雌性窝(Creel et al. 1998)。
鸟类和哺乳动物中最引人注目的性别比调节案例来自塞舌尔莺,该物种同时存在局域资源增强和局域资源竞争。该物种的繁殖对可在同一领地维持长达九年,每年产一胎,雌性后代常通过领地防御、筑巢、孵卵和育雏等行为留在出生领地协助。Jan Komdeur及其同事发现协助的收益强烈依赖于领地质量。在昆虫猎物密度高的优质领地,拥有协助者具有优势(局域资源增强);相反,在昆虫猎物密度低的劣质领地,食物竞争的加剧使拥有协助者转为劣势(局域资源竞争)。令人惊叹的是,Komdeur等发现雌鸟能据此精确调节子代性别比:在优质领地产下90%雌性,在劣质领地产下80%雄性(图10.6)。
除观察数据外,Komdeur等还进行了将莺类迁至新岛屿的实验。从劣质领地迁至优质领地的繁殖对,其子代性别比从90%雄性转变为85%雌性;而原优质领地迁至新优质领地的个体则持续产下80%雌性。此外在优质领地,拥有1-2个协助者具有优势,但食物和繁殖竞争的加剧使超过两个协助者转为劣势。与此一致,优质领地的繁殖对在无协助者或一个协助者时产下85%雌性,当已有两个及以上协助者时转为产下93%雄性。实验也验证了这点——当从拥有两个协助者的优质领地移除一个协助者后,繁殖对的子代性别比从100%雄性转变为83%雌性。
图 10.6 塞舌尔莺(Acrocephalus sechellensis)的性别比例调节。(a) 1993年、(b) 1994年和(c) 1995年不同质量领地内的后代性别比(雄性比例)。母亲在高质量领地生产雌性后代,在低质量领地生产雄性后代。(d) 1995年数据进一步区分了巢内已有1个(实心圆)或多个(空心圆)协助者的情况。当母亲已拥有多个协助者时,无论领地质量如何都会生产雄性后代。数据来自Komdeur等(1997)。转载获自然出版集团许可。照片© Martijn Hammers。
Komdeur的研究成果首次发表时产生了巨大影响,颠覆了"鸟类等脊椎动物无法操控后代性别比"的传统认知。此外,最新研究表明该模式不能仅用差异性死亡率(differential mortality)解释。该物种雌性通常产1枚卵,但当被转移到空置的高质量领地时,雌性会间隔1天产下2枚卵。Komdeur等(2002)发现第二枚卵与第一枚卵存在同等程度的极端性别比偏倚。鉴于第二枚卵仅比第一枚晚产1天,这种性别比偏倚不可能是排卵后机制(如性别选择性卵子重吸收或错误性别卵的抛弃)导致。因此这表明性别控制涉及某些排卵前机制,例如偏向所需性染色体(Z或W;见框10.1)的分离过程。更普遍而言,这强调我们应始终检验性别比偏倚模式是否能用"差异性死亡率"这一替代假说解释,例如某一性别个体需要更多资源,因而在发育过程中(尤其是环境相对恶劣时)更易死亡。
某些物种(如橡实啄木鸟(Melanerpes formicivorus)和壮丽细尾鹩莺(Malurus cyaneus)的后代性别比不随群体中协助者数量变化。如何解释这种种间差异?Ashleigh Griffin及其同事提出:在性别比调节收益较低的物种中,性别比调节程度可能较弱。若协助者实际提供的帮助很少,则缺乏协助者的群体优先生产协助性别的后代收益甚微。他们通过对11个物种的元分析(meta-analysis)(框10.3)验证该假说,发现在协助者收益较低的物种中性别比调节水平也较低(图10.7;Griffin等,2005)。在协助者收益可忽略的物种中未观察到性别比调节。
图 10.7 性别比调节程度与协助者存在所提供收益的相关性。更正向的调节程度表示在缺乏协助者的斑块中更倾向于生产帮助行为更多的性别后代。跨物种的显著正相关表明,在协助者带来更大适合度收益的物种中性别比调节更明显。数据点代表:(1) 笑翠鸟(Dacelo novaeguineae)、(2) 群织雀(Philetairus socius)、(3) 哈里斯鹰(Parabuteo unicinctus)、(4) 橡实啄木鸟、(5) 绿林戴胜(Phoeniculus purpureus)、(6) 西蓝鸲(Sialia mexicana)、(7) 高山旱獭(Marmota marmota)、(8) 红顶啄木鸟(Picoides borealis)、(9) 铃矿鸟(Manorina melanophrys)、(10) 塞舌尔莺和(11) 非洲野犬(Lycaon pictus)。Griffin等(2005)。转载获芝加哥大学出版社许可。照片© Andrew Young。
框 10.3 元分析/荟萃分析(Meta-Analysis)
本书所述多数比较研究中,我们探讨的是两个变量是否在物种间存在相关性。例如第2章探讨灵长类性别二态性是否与交配系统相关(图2.6)。但在某些情况下,关键问题不是变量是否相关,而是跨物种是否存在一致模式。元分析为此提供了方法工具,并正成为本书讨论各领域中日益重要的研究方法(Arnqvist & Wooster, 1995)。
为了说明元分析(meta-analysis)的有用性,假设我们关注雌性哺乳动物是否能根据母体状况调整后代性别比(sex ratio),如Trivers和Willard(1973)最初提出的,或者基因性别决定是否限制了这种能力。假设已收集了八个物种的数据:两项研究显示母体状况与后代性别比呈显著正相关,符合Trivers和Willard的预测,即状况更好的雌性更可能产下雄性后代;一项研究显示母体状况与后代性别比呈显著负相关,与预测方向相反;其余五项研究未显示显著相关性。
对此数据的一个可能结论是:Trivers和Hare的假说不被支持,阳性结果可能只是偶然出现。然而,这种结论忽略了非显著结果的方向性信息,并隐含假设所有研究质量等同且样本量相同。这可能导致错误结论。例如,若两项阳性结果来自150个体的大样本研究,而其他研究仅使用10个体的小样本,则大样本研究(均为阳性)应在最终结论中占更大权重,因为它们更可能反映"正确"结果。此外,若所有非显著结果均呈正向趋势,则实际上有七项研究支持预测方向,仅一项不支持。此时数据呈现一致性模式,非显著结果可能源于小样本量。综上,对样本量和方向性的深入分析将改变结论,转而支持Trivers和Willard假说。
元分析正是为解决样本量与方向性问题而发展。首先,它不仅统计研究是否显著,还使用效应量(effect size)的标准度量——相关系数r(其中r^{2}表示数据中解释的方差比例,此处即母体状况解释的性别比方差比例)。其次,它对大样本研究赋予更高权重。对真实有蹄类数据的元分析显示,尽管存在变异,但结果一致支持Trivers和Willard假说(Sheldon & West, 2004)。元分析不仅能检验一致性模式,还为探究物种间关系强度的变异提供方法。例如,Trivers和Willard假说支持的跨物种差异是否因其非普适性导致(类似分析见图10.7)?此外,近期发展的方法允许此类"比较元分析"考虑物种非独立数据点的特性(Hadfield & Nakagawa, 2010),如第2章所述。
变化环境下的性别分配
母体的状况
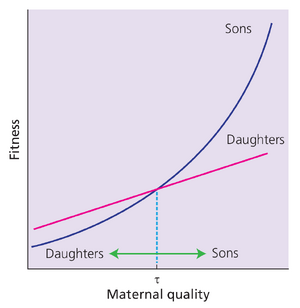
Robert Trivers和Dan Willard(1973)提出个体会根据环境条件调整后代性别。他们设想哺乳动物种群满足三个假设:(1)状况更好的雌性拥有更多繁殖资源,产下更优质后代;(2)更优质后代成长为更优质成体;(3)雄性从优质成体状态中获得更大的适合度收益。他们认为第三个假设在雄性配偶竞争激烈时成立,此时最高质量雄性获得不成比例的配偶份额(如许多一雄多雌哺乳动物,第7章)。这些假设的推论是:若将后代适合度与母体质量作图,雄性的适合度增长斜率高于雌性(图10.8)。Trivers和Willard据此提出,相对低质量的母亲将被选择产雌性后代,而高质量母亲产雄性后代。
Tim Clutton-Brock及其同事(Clutton-Brock et al., 1984)通过红鹿测试了这一预测,其中雌性个体的生理状态由其社会等级(dominance hierarchy)决定。他们发现雌性按预测方向调整了后代性别比,从低社会等级雌性的47%雄性后代比例提升至高社会等级雌性的61%。此外,他们还验证了Trivers和Willard假设的前提条件:(1) 高社会等级雌性产下更重(更优质)的后代;(2) 更重的后代会成长为体型更大、质量更高的成体;(3) 雄性从成体体型增长中获益更大。个体质量的提升对雄性更为重要,因为红鹿实行一夫多妻制(polygynous),雄性在发情期通过争斗保卫雌性群体(harems),导致体型更大、状态更好的雄性获得更高的交配成功率。总体而言,他们证明了这些效应的综合后果:母亲的等级对其儿子终身繁殖成功率(lifetime reproductive success)的影响显著大于对女儿的影响(图10.9)。
配偶吸引力(Mate attractiveness)
Trivers和Willard假说在偶蹄目(ungulates)中的应用存在争议,实证支持结果不一。然而更明确的证据来自其他领域。Ben Sheldon及其团队证明,相同逻辑可解释因配偶质量或吸引力导致的性别比变异。在蓝山雀(blue tits)中,雄性头顶具有紫外线反射斑块(UV patch),这似乎是质量的可靠信号(第7、14章)。Sheldon等人(1999)发现,与UV斑更亮的雄性交配的雌性会产下更高比例的雄性后代(图10.10)。他们认为雌性应如此调节后代性别比,因为高质量配偶通过传递优良基因或提供更优质的父本抚育(paternal care)可产下更优质后代,而雄性会从质量提升中获益更多。该思路与经典Trivers和Willard(1973)假说(图10.8)高度相似,仅将x轴上的影响因素从母体状态替换为配偶质量。Sheldon团队还通过实验验证了结果:当使用防晒剂阻隔UV信号时,雌性后代的占比上升。尽管这些结果最初存在争议,但观测与实验模式已在三个不同欧洲种群中被重复验证。
图10.9 红鹿中,儿子(实心圆与实线)的终身繁殖成功率(LRS)随母亲社会等级提升的增速快于女儿(空心圆与虚线)。引自Clutton-Brock et al. (1984)。照片© Alison Morris。
图10.10 与UV斑(冠羽)更亮的雄性交配的雌性蓝山雀产下更高比例的雄性后代。引自Griffith et al. (2003)。照片© Joseph Tobias。
环境性别决定(Environmental sex determination)
在某些动植物物种中,后代的性别由胚胎发育所处的环境决定。这种现象被称为环境性别决定(Environmental Sex Determination, ESD)。例如,在许多龟类中,相对低温环境下发育出雄性个体,而相对高温环境下发育出雌性个体(专题10.1)。Ric Charnov和Jim Bull(1977)提出,类似Trivers和Willard假说的形式可以解释ESD的发生及其模式。他们的观点是:个体发育所处的环境可能对雄性和雌性产生不同的适合度(fitness)后果。例如,假设在"良好"环境中发育对雄性具有更大的适合度收益,而恶劣环境仅产生略低于平均水平的雌性或极差的雄性,良好环境则产生略高于平均的雌性或极优秀的雄性。这种情况下,自然选择会倾向于在良好环境中发育为雄性,在恶劣环境中发育为雌性。这一思路与经典的Trivers和Willard(1973)假说(如图10.8所示)非常相似,只不过用某些环境因子替代了母体条件作为x轴上影响后代适合度的因素。
龟类和许多其他爬行动物中ESD的成因仍不明确,甚至被称为"进化谜题"(参见讨论主题)。然而,对Charnov和Bull假说的明确支持来自对Gammarus duebeni的研究——这种广盐性端足类甲壳动物广泛分布于北大西洋两岸的温带沿海沼泽和河口生境。早前已知该物种具有温度响应的ESD,幼体在长日照光周期下更易发育为雄性,短日照下则发育为雌性(Bulnheim, 1967)。这种ESD模式导致雄性和雌性在不同季节产出:雄性相对更早出现在繁殖季初期,雌性则更晚出现。其主要后果是:到下一个繁殖季时,雌雄个体拥有不同的生长期限,最终体型出现差异。具体而言,较早出生的幼体主要为雄性,使其拥有更长的生长期,因此繁殖季期间雄性体型大于雌性。若雄性从体型获得的适合度收益大于雌性,则这种ESD模式会被自然选择保留。Jennie McCabe和Ali Dunn(1997)通过研究野外条件下体型的影响验证了这一假说。他们发现,虽然体型较大的雌性产卵更多,但体型较大的雄性在获得配偶方面更成功,且获得的配偶体型更大从而产卵更多(图10.11)。综合所有因素时,体型对雄性的适合度影响显著更大。
性别转换
性别转换(sex change)指个体成熟时为某一性别,后期转换为另一性别的现象,见于多种鱼类、无脊椎动物和植物(图10.12)。Ghiselin(1969)提出,若个体的适合度随年龄或体型变化,且这种关系在雌雄间存在差异,则性别转换会受自然选择青睐。此时,个体会先成熟为适合度随年龄增长较慢的性别(第一性别),待年龄较大时转换为另一性别(第二性别)。该思路与经典的Trivers和Willard(1973)假说(如图10.8所示)高度相似,只是用年龄或体型替代了母体条件作为x轴上影响后代适合度的因素。如专题10.4所述,性别转换的特殊性在于,它是少数能对种群性比(sex ratio)做出有效预测的Trivers-Willard假说应用案例之一。
在许多珊瑚礁鱼类中,会发生雌性先熟(protogynous)的性别转变。Robert Warner及其同事认为,这种现象出现在那些交配系统导致雄性交配成功率被最年长、体型最大的个体垄断的物种中。例如,在蓝头濑鱼 Thalassoma bifasciatum 中,雄性会建立领地供雌性前来产卵(Warner et al., 1975)。雌性选择与体型最大的终期阶段雄性交配。这导致了巨大的体型优势,大型雄性每天产卵超过40次,而小型个体每天不足两次(Warner et al., 1975)。此外,个体能够根据社会条件以惊人精确的时机进行性别转变。若珊瑚礁上最大的雄性被移除,次大的个体(雌性)将改变性别并变为色彩鲜艳的雄性。刺激此类社会性性别转变的线索尚存争议,可能涉及行为、视觉或化学信号。
若雄性体型对繁殖成功率影响甚微,性别转变也可能倾向于相反方向——从雄性变为雌性(protandry)。在这种情况下,个体在体型较小时作为雄性可能繁殖效果最佳,因为它能与部分体型较大、繁殖力最强的雌性交配。从雄性转变为雌性的鱼类案例是海葵鱼(小丑鱼)Amphiprion akallopisos,它们栖息于印度洋的珊瑚礁。该物种与海葵存在密切共生关系,由于通常只有足够空间供两条鱼共生于同一海葵,它们以配对形式生活。实际上,栖息地迫使它们形成单配制。配对繁殖成功率更多受限于雌性产卵能力而非雄性产精能力,因此体型较大的个体作为雌性时更具优势。与濑鱼类似,其性别转变受社会调控。若移除雌性,雄性将与更小的个体配对,随后自身转变性别并产卵,而新来者则行使雄性功能(Fricke & Fricke, 1977)。
图10.11 虾类 Gammarus duebeni 的体型与适合度。(a) 体型更大的雌性 产卵更多。 (b) 体型更大的雄性 更可能成功交配。 (c) 大型雄性会与大型雌性交配。 (d) 当综合考量体型 带来的所有影响时, 雄性的相对适合度 随体型增长的速度 快于雌性 (交配对的照片中, 雄性为体型较大的个体)。引自McCabe 和Dunn(1997)。照片© Alison Dunn。
图10.12 性别转变者。性别转变可能从雌性到雄性,如(a)蓝头濑鱼(终期阶段雄性);或从雄性到雌性,如(b)小丑鱼 Amphiprion percula;(c)常见履螺 Crepidula fornicata(交配堆叠的照片中,底部最大个体为雌性,顶部较小个体为雄性);以及(d)Pandalid虾。(a)照片© Kenneth Clifton;(b)照片© Peter Buston;(c)照片© Rachel Collin;(d)照片© David Shale/naturepl.com
框10.4 种群性比、性别转变与性腺
如本章案例所示,性别分配理论常能明确预测个体何时应根据环境条件调节其后代性比。相比之下,当发生此类兼性性比调节时,理论在预测和解释整体种群或繁殖性比变异方面成效甚微。原因在于种群性比通常被认为依赖于鲜为人知的生物学细节,例如雄性与雌性生活史特征,以及其他行为(如窝卵数)是否也存在条件性调节(Frank 1987, 1990)。事实上,对该问题缺乏认知是性别分配领域最常见的误解之一。Ric Charnov和Jim Bull(1989)指出,该问题的主要例外存在于性别转变动物中——这些物种的性比应偏向于个体初始成熟时的性别(即第一性别)。
考虑一种原雌性(protogynous)物种的情况:个体首先成熟为雌性,随着年龄增长(体型增大)转变为雄性。此时,雄性的相对适合度(fitness)随年龄增长的速度比雌性更快。由于所有后代都有双亲,雄性和雌性对下一代的遗传贡献必须相等。因此必然满足:
Nm Wm = Nf Wf
其中N_m和N_f分别代表成熟雄性和雌性的数量,W_m和W_f表示雄性和雌性的平均适合度。假设个体在性别转变时的适合度与雌性相等,且雄性适合度随年龄增长更快(这正是该方向性别转变被选择的原因!),则意味着W_m>W_f(图B10.4.1)。因此,为使公式B10.4.1成立,必须有N_m<N_f。这表明雌性数量将多于雄性,导致性别比例偏向雌性。对于原雄性(protandrous)物种可进行相反的预测,即性别比例将偏向雄性。
图B10.4.1 雌性向雄性的性别转变。雄性相对适合度随年龄增长的速度快于雌性。因此,个体被选择为首先成熟为雌性,并在年龄τ时转变为雄性。注意与图10.8的相似性。
对121种性别转变动物的研究数据支持了这一预测,涵盖鱼类、甲壳类、软体动物、棘皮动物和环节动物等多个类群(图B10.4.2)。原雌性物种的种群性别比例显著偏向雌性,而原雄性物种则显著偏向雄性。此外,无论将物种作为独立数据点还是通过系统发育校正的独立比较,这两类群间的差异均显著。
Philip Molloy等人(2007)对116种鱼类的研究显示,雄性性腺(gonad)相对大小与性别转变的发生存在相关性。具体而言,原雌性物种雄性的睾丸(testes)相对小于非性别转变物种(图B10.4.3)。这种策略间的共变关系可通过交配系统(mating system)同时影响性别转变和精子竞争(sperm competition)来解释。在雄性可垄断(monopolize)雌性的物种中,选择压力有利于原雌性性别转变,同时也降低了繁殖期雄性间的竞争强度,从而减弱了增大睾丸的收益(第7章)。相反,在雄性无法垄断雌性的物种中,性别转变不会被选择,而繁殖期的雄性间精子竞争将达到最大强度,导致增大睾丸的收益提升。
图B10.4.2 性别转变物种的种群性别比例分布:(a)原雌性;(b)原雄性。种群性别比例倾向于偏向初始性别。引自Allsop和West(2004)。
图B10.4.3 配子投资(gametic investment)与性别转变发生的相关性。与原非性别转变物种相比,原雌性物种雌性性腺大小相似但睾丸更小。引自Molloy等(2007)。
自私的性别比例扭曲者
本书始终假设个体的行为旨在最大化其适合度。然而,若某个基因(gene)能通过牺牲个体或其他基因的利益来增加自身传递概率,则可能被选择。此类自私遗传元件(selfish genetic elements)中最典型的例子是性别比例扭曲者(sex ratio distorters)。
在某些果蝇物种中观察到,当预期为费舍尔式(Fisherian)50%雄性后代时,特定雄性的后代往往以雌性为主。这种偏差是由决定性别的染色体上的性比扭曲因子(sex ratio distorter)引起的(Jaenike, 2001)。果蝇与哺乳动物具有相似的遗传性别决定机制:性染色体为X或Y,携带不同染色体(XY)的个体发育为雄性,携带两个X的个体发育为雌性(YY不可能出现,因为雌性总是提供一个X)。性比偏斜由减数分裂驱动X基因(meiotic driving X genes)导致,这些基因通过某种机制使携带Y的精子死亡,导致X染色体在后代中的频率出现非孟德尔式(non-Mendelian)增加。Y染色体驱动现象也已被发现,导致特定雄性主要产生儿子。
为何这类性比扭曲因子并非十分普遍?阻止性比扭曲因子扩散的主要因素是基因组其余部分会被选择来抑制它们。以X驱动因子扩散导致种群性比偏雌为例:由于费舍尔式选择(Fisherian selection)偏好中性性比,携带X驱动因子的个体适合度会降低,因为它们会产出更常见的性别。因此,若其他位点的突变体能抑制驱动因子并恢复种群更正常的性比,则该突变体将受到选择优势。Egbert Leigh(1971)指出,这导致基因组其余部分联合形成"基因议会(parliament of genes)"来抑制性比扭曲因子。目前已发现大量抑制因子(suppressors)可对抗X和Y驱动因子,使性比回归更均衡状态(Burt & Trivers, 2006)。事实上,性比无偏的果蝇物种间杂交常显示它们携带性比扭曲因子,只是因同时存在抑制因子而被掩盖。
Greg Hurst及其同事对东南亚和波利尼西亚的琉璃蛱蝶(Hypolimnas bolina)种群的研究,展示了性比扭曲抑制因子能多快扩散的惊人案例。波利尼西亚的该蝴蝶种群携带沃尔巴克氏体(Wolbachia)属细菌,这些细菌导致雄性死亡并引发偏雌性比(Charlat et al., 2005)。该细菌仅通过卵子进行母系传递,因此雄性对其而言是相对的“死胡同”。在H. bolina等幼虫群居发育的物种中,雄性杀灭(male killing)具有选择优势,因为雄性死亡可释放资源供其姐妹(可能携带遗传相同细菌)利用(Hurst, 1991)。因此,细菌中导致雄性杀灭的基因会扩散,因为雄性死亡会增加该基因其他拷贝的传递。这种"亲属选择(kin selection)"概念将在第11章详细讨论。
相比之下,该蝴蝶东南亚种群虽也携带Wolbachia,却未发生雄性杀灭。Hornett et al.(2006)通过将波利尼西亚与东南亚(菲律宾和泰国)蝴蝶进行多代杂交组合(产生不同遗传背景与Wolbachia来源的组合),验证这种跨物种差异是否由雄性杀灭抑制因子解释。他们发现宿主蝴蝶的遗传背景起关键作用——波利尼西亚和东南亚的Wolbachia在波利尼西亚遗传背景中均引发雄性杀灭,但在东南亚背景中则否。杂交实验数据表明,这种差异源于东南亚种群中某个单基因抑制了Wolbachia的雄性杀灭。近年数据表明该抑制因子正如理论预测,已在东南亚快速扩散并开始进入波利尼西亚。例如在波利尼西亚的Upolu岛,抑制因子流行率从2001年的约0%升至2005-2006年的约100%,仅经历8-10代(Charlat et al., 2007)。
总结
关于性别分配(sex allocation)为何偏离所有个体均等投资两性的平衡状态,存在两个主要假说。首先,若亲属间存在相互作用,偏向性比(biased sex ratios)可能被选择以降低亲属间竞争或增强亲属间合作。其次,若不同性别从环境变异中获益程度不同,则可通过条件性调整性别分配来利用这种差异。这可通过调整后代性比(offspring sex ratio)、环境性别决定(environmental sex determination)或性别转换(sex change)实现。第13章将讨论社会性物种中性别分配冲突的具体案例。
性别分配研究多聚焦于膜翅目昆虫(hymenopteran insects)——蚂蚁、蜜蜂与黄蜂。因其单双倍体遗传系统(haplodiploid genetics)为控制后代性别提供了明确机制:卵子是否受精决定性别——雄性由未受精卵(单倍体)发育,雌性由受精卵(双倍体)发育。然而,在鸟类和哺乳动物等脊椎动物类群中,条件性调整后代性比的证据正迅速积累,此前学界普遍认为染色体性别决定系统(chromosomal sex determination)会限制这种调整能力。此类物种调整后代性比的具体机制仍是未解之谜。
延伸阅读
Hamilton(1967)的论文是行为生态学领域的奠基之作。它证明简单数学模型可用于预测动物行为模式,并能通过跨物种比较或观察个体在不同条件下的行为差异进行验证。尽管这种研究方式已成为当今行为生态学研究的常规方法,但应铭记其革命性意义:当时人们难以想象,几行简单数学公式竟能推导出关于生物行为模式的可检验预测。
Charnov(1982)的著作从概念层面统一了性别分配研究领域。West(2009)的专著系统综述了该领域的理论与实证文献,并探讨性别分配研究如何揭示行为生态学中的更广泛议题。Hardy(2002)的著作详细介绍了研究性别分配所需的实践方法,涵盖从不同生物类群操作到数据分析的全流程。Munday等(2006)综述了动物性别转换策略的多样性。Burt与Trivers(2006)系统回顾了包括性比扭曲因子(sex ratio distorters)在内的各类遗传冲突的自然史。
Badyaev等(2001)关于新引入家朱雀(Carpodacus mexicanus)种群的数据,惊人地展示了选择压力如何快速导致同种不同种群间性比调整模式的差异。Charnov与Hannah(2002)利用长达30年的北蝗虾(Pandalidae)商业捕捞数据,证明个体会根据当地种群年龄结构调整性别转换策略,但其感知年龄结构的生理或社会机制仍完全未知。Burley(1981)首次提出配偶吸引力应影响性比选择。她在斑胸草雀(Poephila guttata)研究中发现惊人结果:雄性佩戴的彩色塑料脚环通过影响其吸引力,导致雌性相应调整后代性比。
讨论议题
- 在蜜蜂中,新蜂群通过分蜂(colony fission)形成:工蜂群分裂为两个群体,一个由原巢新育王蜂领导,另一个由旧王蜂带领。此时生殖个体的性比是否会出现偏斜?若会,原因为何?
- 为何疟原虫及相关血液寄生虫的有性生殖阶段常出现雌性偏斜性比(参见Read等,1995;Reece等,2008)?
- 在寄生蜂N. vitripennis中,斑块上雌蜂数量增加导致的后代性比变化,主要源于其他雌蜂产卵的存在,其次才是其他雌蜂个体的存在(图10.5)。这种机制为何被选择保留?如何验证你的假说?
- 性别分配常被视为行为生态学最成功的研究领域之一。试讨论该领域理论与数据高度吻合的潜在原因。
- 讨论Trivers-Willard假说有蹄类动物中的支持程度(参见Hewison & Gaillard,1999;Cameron,2004;Sheldon & West,2004)。
- Joan Roughgarden(2004)认为传统达尔文进化理论难以解释性别转换等交配系统。你是否认同?
- 讨论爬行动物的温度依赖性性别决定是否是一个“进化之谜”(见 Shine,1999 年;Janzen & Phillips, 2006;Warner & Shine,2008年)。
- 讨论如何使用荟萃分析来测试是否有选择性的结果报告(Palmer,1999 年;Simmons 等人,1999b)
