第三十四章 肾小管沿途的水、溶质转运:小管功能
学习目标
完成本章学习后,学生应能回答以下问题:
- 尿液生成涉及哪三个基本过程?
- "正常"尿液的组成成分是什么?
- 肾小管重吸收氯化钠(NaCl)的转运机制有哪些?这些机制沿肾小管分布在哪些部位?
- 近端小管中水分重吸收如何与NaCl重吸收"耦联"?
- 为什么Henle袢升支粗段能重吸收溶质但不重吸收水分?
- 有机阴离子和阳离子分泌涉及哪些转运机制?这些转运过程的生理意义是什么?
- 什么是肾小球-小管平衡(glomerulotubular balance)?其生理重要性何在?
- 调节肾脏NaCl和水分重吸收的主要激素有哪些?每种激素在肾小管的作用部位是哪里?
- 什么是醛固酮悖论(aldosterone paradox)?
尿液的形成包含三个基本过程:(1) 肾小球的血浆超滤作用,(2) 超滤液中水分和溶质的重吸收,以及(3)特定溶质向小管液的分泌。尽管人类肾小球每天滤过的无蛋白液体量女性为115-180升/天、男性为130-200升/天,但最终尿液中通常只排泄不到1%的滤过水和氯化钠(NaCl)以及不同比例的其他溶质(表34.1)。通过重吸收和分泌过程,肾小管决定了尿液的体积和组成(表34.2),从而使肾脏能够精确调控细胞内外液体的容量、渗透压、成分和pH值。肾小管细胞膜上的转运蛋白介导了肾脏对溶质和水的重吸收与分泌。人类约有5%-10%的基因编码转运蛋白,而转运蛋白的遗传性和获得性缺陷是许多肾脏疾病的病因(表34.3)。此外,众多转运蛋白是重要的药物靶点。本章将讨论NaCl和水分的重吸收、有机阴离子和阳离子的转运、参与溶质和水转运的转运蛋白,以及调节NaCl转运的部分因素和激素。关于酸碱转运、K⁺、Ca²⁺和无机磷酸盐(Pi)转运及其调控的细节详见第35至37章。
溶质和水的肾小管重吸收
上皮细胞溶质和水转运的一般原理已在第二章讨论。
从数量上看,NaCl 和水的重吸收是肾单位(nephron)的主要功能。肾小管每天重吸收约 25,000mEq 的 Na+ 和 179 升水(见表 34.1)。此外,许多其他重要溶质的肾脏转运都直接或间接与 Na+ 的重吸收相关联。以下各节将介绍每个肾小管节段的 NaCl 和水转运过程及其受激素和其他因素的调控。
近端小管(proximal tubule)
近端小管重吸收约 67% 的水、Na+、Cl-、K+ 以及肾小球(glomerulus)滤过的大部分其他溶质。此外,近端小管几乎完全重吸收肾小球滤过的所有葡萄糖、蛋白质和氨基酸,以及大部分 HCO3-。近端小管重吸收的关键是基底外侧膜上的 Na+,K+-ATPase。所有物质(包括水)的重吸收都以某种方式与 Na+,K+-ATPase 的运作相关联。
| 物质 (Substance) | 计量单位 (Measure) | 滤过量a (Filtered) | 排泄量 (Excreted) | 重吸收量 (Reabsorbed) | 滤过负荷重吸收率 (% Filtered Load Reabsorbed) |
|---|---|---|---|---|---|
| 水 (Water) | 升/天 (L/day) | 180 | 1.5 | 178.5 | 99.2 |
| Na⁺ | 毫当量/天 (mEq/day) | 25,200 | 150 | 25,050 | 99.4 |
| K⁺ | 毫当量/天 (mEq/day) | 720 | 100 | 620 | 86.1 |
| Ca⁺⁺ | 毫当量/天 (mEq/day) | 540 | 10 | 530 | 98.2 |
| HCO₃⁻ | 毫当量/天 (mEq/day) | 4,320 | 2 | 4,318 | 99.9以上 |
| Cl⁻ | 毫当量/天 (mEq/day) | 18,000 | 150 | 17,850 | 99.2 |
| 葡萄糖 (Glucose) | 毫摩尔/天 (mmol/day) | 800 | 0 | 800 | 100.0 |
| 尿素 (Urea) | 克/天 (g/day) | 56 | 28 | 28 | 50.0 |
| a任何物质的滤过量可通过超滤液中该物质浓度乘以肾小球滤过率(GFR)计算。例如,Na+ 的滤过量计算为超滤液 [Na+](140 mEq/L)× GFR(180 L/day)=25200 mEq/day。 | |||||
| 物质 (Substance) | 浓度 (Concentration) |
|---|---|
| Na⁺ (钠离子) | 50–130 毫当量/升 (mEq/L) |
| K⁺ (钾离子) | 20–70 毫当量/升 (mEq/L) |
| 铵离子 (NH₄⁺) | 30–50 毫当量/升 (mEq/L) |
| Ca⁺⁺ (钙离子) | 5–12 毫当量/升 (mEq/L) |
| Mg⁺⁺ (镁离子) | 2–18 毫当量/升 (mEq/L) |
| Cl⁻ (氯离子) | 50–130 毫当量/升 (mEq/L) |
| 无机磷酸盐 (Pi) | 20–40 毫当量/升 (mEq/L) |
| 尿素 (Urea) | 200–400 毫摩尔/升 (mmol/L) |
| 肌酐 (Creatinine) | 6–20 毫摩尔/升 (mmol/L) |
| pH (酸碱度) | 5.0–7.0 |
| 渗透压 (Osmolality) | 500–800 毫渗摩尔/千克水 (mOsm/kg H₂O) |
| 葡萄糖 (Glucose) | 0 |
| 氨基酸 (Amino acids) | 0 |
| 蛋白质 (Protein) | 0 |
| 血液 (Blood) | 0 |
| 酮体 (Ketones) | 0 |
| 白细胞 (Leukocytes) | 0 |
| 胆红素 (Bilirubin) | 0 |
| 健康状态下尿液的成分和体积可能差异很大。表中数值代表平均范围。正常水排泄量通常在0.5-1.5升/天之间。数据来源:Valtin HV. Renal Physiology. 2nd ed. Boston: Little, Brown; 1983. | |
Na+ 重吸收
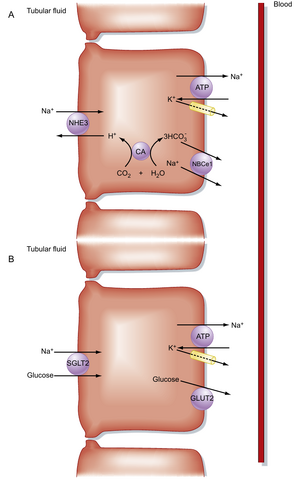
Na+在近端小管(proximal tubule)前半段和后半段通过不同机制被重吸收。在近端小管前半段,Na+主要与碳酸氢根(HCO3-)及其他溶质(如葡萄糖、氨基酸、Pi、乳酸)共同被重吸收。而在后半段,Na+主要与Cl-共同被重吸收。这种差异源于近端小管前半段与后半段Na+转运系统的不同,以及这两个部位小管液成分的差异。从绝对值来看,近端小管前半段重吸收的Na+显著多于后半段。
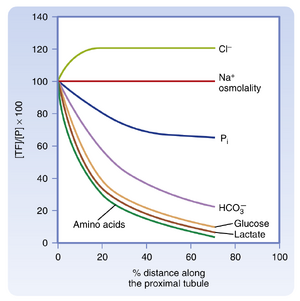
在近端小管前半段,细胞对Na+的摄取与H+或有机溶质(包括葡萄糖)相偶联(图34.1)。特定的转运蛋白介导Na+跨顶膜进入细胞。例如,Na+/H+反向转运体NHE3(见图34.1A)将Na+的进入与H+的排出相偶联。H+分泌导致碳酸氢钠(NaHCO3)的重吸收(见第37章)。Na+还可通过多种同向转运机制进入近端小管细胞,包括Na+/葡萄糖(SGLT2)、Na+/氨基酸、Na+/Pi和Na+/乳酸(见图34.1B)。与Na+共同进入细胞的葡萄糖和其他有机溶质通过被动转运机制(如GLUT2,一种被动葡萄糖转运体)跨基底外侧膜离开细胞。任何通过顶膜进入细胞的Na+都将通过Na+,K+-ATP酶离开细胞进入血液。因此,近端小管前半段对Na+的重吸收与HCO3-及多种有机分子的重吸收相偶联,这会在近端小管形成跨上皮负电压,为Cl-的细胞旁路重吸收提供驱动力。包括葡萄糖和乳酸在内的许多有机分子的重吸收非常高效,它们在近端小管前半段几乎被完全从管腔液中清除(图34.2)。近端小管对NaHCO3和Na+-有机溶质的重吸收建立了跨小管渗透梯度(即浸泡细胞基底外侧面的间质液渗透压比小管液渗透压高数mOsm/L),这为水通过渗透作用的被动重吸收提供驱动力。由于近端小管前半段对水的重吸收量超过Cl-,小管液中的[Cl-]浓度沿近端小管长度逐渐升高(见图34.2)。
目前已发现超过300个溶质转运体基因,组成SLC(溶质载体)基因家族。 AD:常染色体显性(autosomal dominant);AR:常染色体隐性(autosomal recessive);ENaC:上皮钠通道;TAL:髓袢升支粗段;XLR:X连锁隐性遗传。 改编自Nachman RH, Glassock RJ. NephSAP. 2010;9(3).
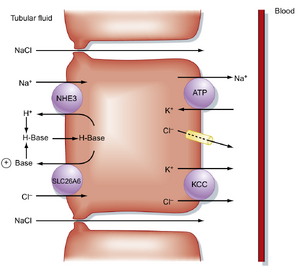
在近端小管(proximal tubule)后半段,Na+的重吸收主要通过跨细胞和旁细胞途径与Cl-的重吸收相伴进行(图34.3)。Na+主要伴随Cl-而非有机溶质或HCO3-作为伴随阴离子被重吸收,原因有二:其一,近端小管后半段的Na+转运机制与前半段不同;其二,流入后半段的小管液中含有极少量葡萄糖或氨基酸。此外,由于近端小管前半段优先重吸收Na+与HCO3-及有机溶质,导致小管液中Cl-浓度高达140 mEq/L,这促进了Cl-与Na+的共同重吸收。
临床视角
范可尼综合征(Fanconi syndrome)是一种遗传性或获得性肾脏疾病,源于近端小管重吸收HCO₃⁻、磷酸盐(Pi)、氨基酸、葡萄糖和低分子量蛋白质的功能受损。由于下游肾单位无法重吸收这些溶质和蛋白质,该综合征会导致尿中HCO₃⁻、氨基酸、葡萄糖、Pi和低分子量蛋白质的排泄增加。
近端小管后半段跨细胞Na+重吸收的机制如图34.3所示。Na+主要通过Na+/H+逆向转运体(NHE3)与一个或多个Cl- -碱基逆向转运体(如SLC26A6)的并联运作穿过管腔膜进入细胞。由于分泌的H+和碱基在管腔液中结合并重新进入细胞,Na+/H+和Cl- -碱基逆向转运体的运作等同于将NaCl从管腔液摄入细胞。Na+通过Na+,K+ -ATP酶离开细胞,Cl-则通过基底外侧膜的K+/Cl-同向转运体(KCC)和Cl-通道离开细胞进入血液。
部分NaCl也通过细胞旁途径在近端小管后半段被重吸收。细胞旁路NaCl重吸收的发生是由于近端小管前半段管腔液中[Cl-]升高形成了浓度梯度(管腔140 mEq/L,间质105 mEq/L)。该浓度梯度促使Cl-通过紧密连接从管腔向细胞侧间隙扩散。带负电荷的Cl-移动导致管腔液相对血液呈正电性。这种正向跨上皮电压促使带正电的Na+通过紧密连接从管腔液向血液扩散。因此在近端小管后半段,部分Na+和Cl-通过被动扩散经紧密连接被重吸收。
综上,近端小管中Na+和Cl-的重吸收通过细胞旁路和跨细胞两种途径进行。肾小球每天滤过的NaCl约有67%在近端小管被重吸收。其中三分之二通过跨细胞途径转运,剩余三分之一通过细胞旁路转运(表34.4)。
水的重吸收
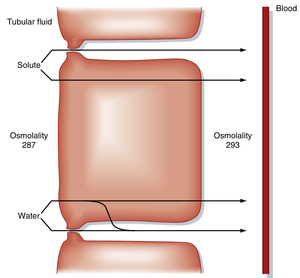
近端小管重吸收了67%的滤过水(表34.5)。水重吸收的驱动力是通过溶质(如NaCl、Na+-葡萄糖)重吸收建立的跨小管渗透梯度。Na+与有机溶质、HCO3-和Cl-从管腔液向侧向细胞间隙的重吸收,降低了管腔液的渗透压并提高了侧向细胞间隙的渗透压。这些转运过程建立的跨近端小管渗透梯度仅有数mOsm/L(图34.4)。由于近端小管对水具有高度通透性(主要归因于顶膜和基底膜上水通道蛋白(aquaporin water channels,AQP1)的表达),水通过渗透作用跨细胞重吸收。此外,近端小管的紧密连接也具有透水性,因此部分水也通过近端小管细胞间的细胞旁途径重吸收。
液体和溶质在侧向细胞间隙的积聚会增加该区域的静水压。升高的静水压将液体和溶质推入毛细血管。因此,近端小管的水重吸收跟随溶质重吸收进行。重吸收的液体相对于血浆呈轻微高渗。然而这种渗透压差异非常微小,通常认为近端小管的重吸收是等渗的(即滤过的溶质和水中均有约67%被重吸收)。实际上,近端小管起始端与末端管腔液的渗透压差异极小。水通过渗透作用流经近端小管的重要后果是:部分溶质(尤其是K+和Ca++)会被重吸收液裹挟,从而通过溶剂拖曳(solvent drag)过程被重吸收(见图34.4)。
几乎所有有机溶质、Cl-和其他离子以及水的重吸收都与Na+重吸收偶联。因此Na+重吸收的变化会影响近端小管对水和其他溶质的重吸收。这一点将在后文(特别是第35章)讨论,在容量不足时尤为重要——此时近端小管Na+重吸收的增加会伴随HCO3-重吸收的平行增加,可能导致代谢性碱中毒(即容量收缩性碱中毒)。
蛋白质重吸收
肾小球滤过的蛋白质在近端小管被重吸收。如前所述,肽类激素、小分子蛋白质以及少量大分子蛋白质(如白蛋白)可被肾小球滤过。总体而言,只有少量蛋白质能穿过肾小球进入鲍曼囊(即肾小球超滤液中的蛋白质浓度仅为≈40 mg/L)。但由于肾小球滤过率(GFR)极高,每日滤过的蛋白质总量仍然显著:
滤过蛋白量 = GFR × 超滤液中[蛋白质]
滤过蛋白量 = 180 L/天 × 40 mg/L = 7200 mg/天 或 7.2 g/天
被滤过的蛋白质在近端小管通过内吞作用(endocytosis)被重吸收,可以是完整蛋白质形式,也可以先被近端小管细胞表面的酶部分降解。一旦蛋白质和肽段进入细胞内,酶将其消化为组成氨基酸,随后这些氨基酸通过基底侧膜的转运蛋白离开细胞,重新返回血液。正常情况下,该机制几乎能重吸收所有被滤过的蛋白质,因此尿液基本不含蛋白质。然而由于该机制易达到饱和,滤过蛋白增加会导致蛋白尿(proteinuria)(尿液中出现蛋白质)。肾小球滤过屏障对蛋白质的通透性破坏会增加蛋白质滤过量并引发蛋白尿,这在肾脏疾病中常见。
有机阴离子和有机阳离子的分泌
近端小管细胞还能将有机阴离子和有机阳离子分泌至小管液中。近端小管分泌有机阴离子和阳离子在调节异生物质(如多种抗生素、利尿剂、他汀类药物、抗病毒药物、抗肿瘤药物、免疫抑制剂、神经递质和非甾体抗炎药[NSAIDs])以及内源性和外源性毒性化合物的血浆水平中起关键作用。近端小管分泌的许多有机阴离子和阳离子(见Boxes 34.1和34.2)是循环于血浆中的代谢终产物。这些有机化合物大多与血浆蛋白结合,因此不易被滤过。
因此仅有一小部分这些潜在毒性物质通过单纯的滤过作用排出体外。因此,有机阴离子和阳离子(包括来自管周毛细血管的多种毒素)向小管液的分泌过程,促进了这些化合物从进入肾脏的血浆中被清除。由此可见,这些物质通过滤过和分泌两种途径从血浆中移除。值得注意的是,当疾病导致肾功能下降时,有机阴离子和阳离子的尿液排泄会严重减少,可能导致外源性物质血浆浓度升高以及有机阴/阳离子的潜在毒性蓄积。
近端小管分泌的部分有机阴离子 • BOX 34.1
内源性阴离子:
cAMP、cGMP 胆汁盐 马尿酸盐 草酸盐 前列腺素:PGE2、PGF2α尿酸盐 维生素:抗坏血酸、叶酸
药物:
乙酰唑胺 阿昔洛韦 阿莫西林 卡托普利 氯噻嗪 呋塞米 氯沙坦 青霉素 丙磺舒 水杨酸(阿司匹林) 氢氯噻嗪 辛伐他汀 布美他尼 非甾体抗炎药(NSAIDs):吲哚美辛
cAMP,环磷酸腺苷;cGMP,环磷酸鸟苷。
近端小管分泌的部分有机阳离子 • BOX 34.2
内源性:
肌酐 多巴胺 肾上腺素 去甲肾上腺素
药物:
阿托品 异丙肾上腺素 西咪替丁 吗啡 奎宁 阿米洛利 普鲁卡因胺
细胞水平
被称为水通道蛋白(aquaporins,AQPs)的水通道介导水在多个肾单位节段的跨细胞重吸收。迄今已鉴定出13种水通道蛋白。根据通透特性,AQP家族可分为两类:一类(aquaporins)对水具有通透性(AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8、AQP11和AQP12);另一类(aquaglyceroporins)对水和小分子溶质(尤其是甘油)具有通透性(AQP3、AQP7、AQP9、AQP10)。水通道蛋白在细胞质膜中形成四聚体,每个亚基构成一个水通道。
在肾脏中,AQP1表达于近端小管的顶膜和基底外侧膜,以及Henle袢降支细段的某些部分。通过基因敲除小鼠AQP1的研究,突显了AQP1在肾水重吸收中的重要性:这些小鼠表现出尿量增加(多尿症)和尿液浓缩能力降低。此外,缺乏AQP1的小鼠近端小管对水的渗透性通透能力较正常小鼠低五倍。AQP7和AQP8也在近端小管表达。
AQP2表达于集合管主细胞的顶膜,其在膜中的丰度受精氨酸加压素(arginine vasopressin,AVP)调节(见第35章)。AQP3和AQP4表达于集合管主细胞的基底外侧膜,缺乏这些AQP(即AQP3和AQP4基因敲除小鼠)的小鼠存在尿液浓缩功能缺陷(见第35章)。
细胞水平
近端小管对蛋白质的内吞作用由顶端膜蛋白介导,这些蛋白能特异性结合小管液中的蛋白质和肽类。这些被称为多配体内吞受体的受体可结合多种肽类和蛋白质,从而介导其内吞作用。Megalin和cubilin介导近端小管的蛋白质和肽类内吞作用。两者均为糖蛋白,其中megalin属于低密度脂蛋白受体基因家族。
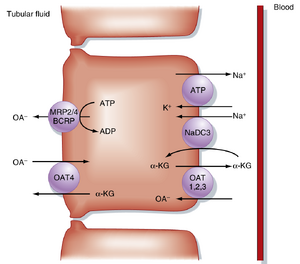
图34.5展示了近端小管中有机阴离子(organic anion,OA⁻)跨膜转运的机制。这些分泌途径具有最大转运速率、低特异性(即能转运多种OA⁻),负责分泌框34.1所列的OA⁻。OA⁻通过基底外侧膜上的多个OA⁻/α-酮戊二酸(α-KG)逆向转运体(包括OAT1、OAT2和OAT3),以α-KG交换的方式逆化学梯度进入细胞。α-KG在细胞内通过谷氨酸代谢和基底外侧膜上的Na⁺/α-KG同向转运体(即Na⁺/二羧酸转运体[NaDC3])积累。因此,OA⁻逆电化学梯度进入细胞的过程与α-KG顺其化学梯度(由Na⁺/α-KG同向转运机制产生)出细胞相偶联。OA⁻通过管腔膜进入小管液的过程由多药耐药蛋白2和4(MRP2/4)及乳腺癌耐药蛋白1(BCRP)介导,这些蛋白的运作需要腺苷三磷酸(ATP)。最新研究表明,OAT4介导近端小管对嘌呤分解代谢终产物——有机阴离子尿酸盐的重吸收(见图34.5)。
临床视角
尿液分析是检测肾脏疾病的重要常规工具。完整的尿液分析包括肉眼观察、显微镜检查和生化评估。具体通过肉眼观察尿液、显微镜检查尿沉渣、以及使用试纸试剂条进行尿液成分的生化评估。试纸检测成本低廉且快速(即<5分钟),可检测尿液pH值和多种物质的存在(如胆红素、血液、葡萄糖、酮体、蛋白质)。尿液中存在微量蛋白质属于正常现象,尤其是浓缩尿液中。尿液蛋白质主要有两个来源:(1)超过近端小管重吸收能力的滤过量;(2)Henle袢粗升支合成的Tamm-Horsfall糖蛋白的合成与分泌。由于蛋白质重吸收机制位于粗升支"上游"(即近端小管),分泌的Tamm-Horsfall糖蛋白会出现在尿液中。超过微量水平的蛋白尿通常提示肾脏疾病。
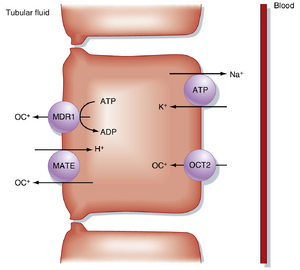
图34.6展示了近端小管中有机阳离子(organic cation,OC+)的跨膜转运机制。近端小管分泌的有机阳离子包括外源性物质(如降糖药二甲双胍、抗病毒药拉米夫定、抗癌药奥沙利铂)以及多巴胺、肾上腺素、组胺、去甲肾上腺素等重要单胺类神经递质。有机阳离子主要通过基底侧膜的有机阳离子转运蛋白2(organic cation transporter 2,OCT2)进入细胞。基底侧膜的细胞负性跨膜电位差是驱动有机阳离子摄取的主要动力。
有机阳离子通过管腔膜进入小管液的转运过程是分泌过程的限速步骤,主要由电中性多药及毒素外排转运蛋白(multidrug and toxin extrusion transporters,MATEs)和MDR1(亦称P-糖蛋白)介导,其中MDR1的运作需要ATP供能。这些转运机制具有非特异性,多种有机阳离子通常通过同一转运通路竞争分泌。
临床意义
由于许多有机阴离子竞争相同的分泌通路,当一种转运阴离子的血浆浓度升高时,常会抑制其他阴离子的分泌。例如,输注对氨基马尿酸(p-aminohippuric acid,PAH)可抑制近端小管对青霉素的分泌。由于肾脏负责青霉素的清除,对接受青霉素治疗的患者输注PAH会减少青霉素排泄,从而延长其生物半衰期。在二战期间青霉素短缺时,曾通过联合使用马尿酸类物质以延长青霉素的疗效。
近端小管的有机阳离子分泌也存在类似竞争现象。当一种转运阳离子的血浆浓度升高时,会抑制其他竞争性阳离子的分泌。例如,用于治疗胃溃疡的组胺H_2拮抗剂西咪替丁通过近端小管的有机阳离子转运机制分泌。若对接受普鲁卡因胺(治疗心律失常的有机阳离子药物)治疗的患者使用西咪替丁,两者会因竞争同一分泌通路而导致分泌减少。因此,联合使用竞争同一通路的阳离子药物时,可使两者的血药浓度显著高于单独用药时的水平,可能引发药物毒性。
亨利氏袢
亨利氏袢重吸收约25%滤过的NaCl和15%滤过的水。NaCl的重吸收发生在袢的薄壁升支和厚壁升支,而降支薄壁段不参与NaCl重吸收。与之相反,由AQP1水通道介导的水重吸收仅发生于降支薄壁段,而升支对水不通透。此外,二价阳离子(如Ca2+和Mg2+)及HCO3-也在亨利氏袢中被重吸收(详见第36和37章)。
薄升支通过被动机制重吸收NaCl。降支细段对水(而非NaCl)的重吸收作用,会使进入升支细段的管腔液中[NaCl]升高。随着富含NaCl的液体向皮质方向移动,NaCl会顺着从管腔液指向间质的浓度梯度,通过薄升支从管腔扩散到髓质间质液中(详见第35章)。
厚升支溶质重吸收的关键要素是基底外侧膜中的Na+,K+-ATP酶(图34.7)。与近端小管(proximal tubule)的重吸收机制类似,厚升支对所有溶质的重吸收都与Na+,K+-ATP酶活性相关。该转运体维持着细胞内低[Na+],从而为Na+从管腔液进入细胞提供了有利的化学梯度。Na+通过顶膜(apical membrane)进入细胞的运动由1Na+/1K+/2Cl-同向转运体(NKCC2)介导,该转运体将1个Na+与1个K+和2个Cl-的移动相偶联。利用Na+和Cl-顺浓度梯度移动释放的势能,该同向转运体驱动K+逆浓度梯度进入细胞。
顶膜质膜中的K+通道(ROMK和Maxi-K)对厚升支的NaCl重吸收具有重要作用。这些K+通道允许通过1Na+/1K+/2Cl-同向转运体进入细胞的K+重新循环回管腔液。由于管腔液中[K+]相对较低,K+的再循环是维持1Na+/1K+/2Cl-同向转运体持续运作的必要条件。
顶膜中的Na+/H+逆向转运体(NHE3)也介导厚升支的Na+重吸收和H+分泌(HCO3-重吸收)(另见第37章)。顶膜Na+/H+逆向转运体的运作导致细胞以H+交换的形式摄取Na+。细胞内H+的产生会形成HCO3-,后者通过基底外侧膜的Cl-/HCO3-逆向转运体(AE2)离开细胞。Na+通过Na+,K+-ATP酶跨越基底外侧膜离开细胞,而K+和Cl-则通过基底外侧膜上的独立路径(即K+通道、Cl-通道和K+/Cl-同向转运体)离开细胞。
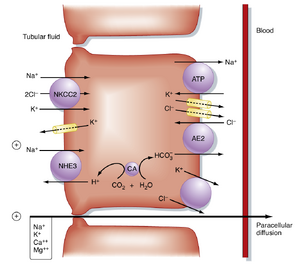
粗升支两侧的电压对于多种阳离子的重吸收至关重要。由于顶膜和基底外侧膜转运蛋白的独特分布,小管液相对于血液呈正电位。以下两点尤为重要:(1) 粗升支对氯化钠(NaCl)转运的增加会增强管腔正电压的幅度;(2) 该电压是多种阳离子(包括钠离子(Na⁺)、钾离子(K⁺)、镁离子(Mg²⁺)和钙离子(Ca²⁺))通过细胞旁途径(paracellular pathway)重吸收的重要驱动力(见图34.7)。紧密连接蛋白claudin-16的功能缺失突变会减少粗升支对Mg²⁺和Ca²⁺的重吸收(即使在存在管腔正跨上皮电压的情况下),这一观察结果凸显了细胞旁途径在溶质重吸收中的重要性。
总结而言,粗升支对NaCl的重吸收通过跨细胞和细胞旁两种途径实现:50%的NaCl重吸收为跨细胞途径,50%为细胞旁途径。由于缺乏水通道蛋白(AQPs),粗升支不重吸收水分,因此NaCl及其他溶质的重吸收使小管液渗透压降至150 mOsm/kg H₂O以下。由于亨利袢粗升支产生的液体相对于血浆呈低渗状态,该节段及其相邻的远曲小管(下文将讨论)常被统称为"稀释段"。
远曲小管与集合管(Distal Tubule and Collecting Duct)
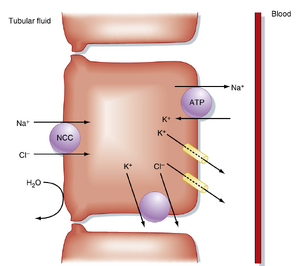
远端小管(distal tubule)和集合管(collecting duct)重吸收约8%的滤过NaCl,分泌不同量的K⁺和H⁺,并重吸收不同量的水(≈8%-17%)。远端小管的起始段(早期远端小管)重吸收Na⁺、Cl⁻和Ca²⁺,且对水不通透(图34.8)。NaCl通过顶端膜进入细胞由Na⁺/Cl⁻同向转运体(NCC)介导(见图34.8)。Na⁺通过Na⁺,K⁺-ATP酶的作用离开细胞,Cl⁻则通过Cl⁻通道和K⁺/Cl⁻同向转运体(KCC4)扩散离开细胞。因此,小管液的稀释过程开始于髓袢升支粗段,并持续于远端小管的早期节段。
细胞水平
如第2章所述,上皮细胞通过顶端表面的紧密连接(zonula occludens)相互连接。目前已鉴定出多种构成紧密连接的蛋白质,包括跨膜蛋白(如occludin和claudins)——它们连接相邻细胞膜上的同源分子,以及胞质连接蛋白(如ZO-1、ZO-2和ZO-3)——它们将跨膜蛋白与细胞骨架相连。在这些连接蛋白中,claudins似乎是决定紧密连接通透特性的主要因素。例如,claudin-16和claudin-19是Henle袢升支粗段紧密连接对二价阳离子通透性的关键决定因子。人类claudin-16和claudin-19的突变会导致家族性低镁血症(familial hypomagnesemia,即血浆[Mg⁺⁺]降低)伴高钙尿症(hypercalciuria)和肾钙质沉着症(nephrocalcinosis)。Claudin-2对水具有通透性,可能负责近端小管的细胞旁水重吸收。Claudin-4控制紧密连接对Na⁺的通透性,而claudin-15决定紧密连接对阳离子或阴离子的通透性。因此,不同肾单位节段紧密连接的通透特性至少部分由该节段细胞表达的特定claudins决定。
细胞水平
巴特综合征(Bartter syndrome)是一组以低钾血症、代谢性碱中毒和高醛固酮血症为特征的常染色体隐性遗传疾病(见表34.3)。编码顶膜1Na+/1K+/2Cl−同向转运体(NKCC2)、顶膜K+通道(ROMK)或基底膜Cl-通道(ClCNKB)的基因发生失活突变时,会降低厚壁升支对NaCl和K+的重吸收,从而导致低钾血症(即血浆[K+]降低)和细胞外液容量(ECFV)减少。ECFV的下降会刺激醛固酮分泌,进而促进远端小管和集合管对NaCl的重吸收与H+的分泌。
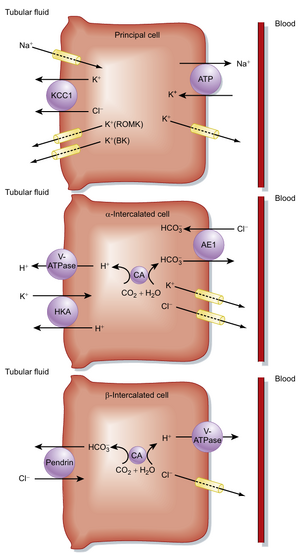
远端小管末段(late distal tubule)和集合管由三种细胞类型构成:主细胞(principal cells)和两种类型的闰细胞(intercalated cells)。如图34.9所示,主细胞重吸收NaCl和水,并分泌K+。这些细胞的Na+重吸收和K+分泌都依赖于基底侧膜上Na+,K+-ATP酶的活性。通过维持细胞内低[Na+],Na+,K+-ATP酶为Na+从管腔液进入细胞提供了有利的化学梯度。由于Na+通过顶端膜的上皮钠选择性通道(ENaCs)扩散进入细胞,细胞内的负电压促进了Na+的进入,随后Na+通过基底侧膜的Na+,K+-ATP酶离开细胞进入血液。Na+的重吸收在远端小管末段和集合管产生管腔负电压,这为Cl-的细胞旁路重吸收提供了驱动力。
闰细胞分泌H+或HCO3-,在酸碱稳态中起重要作用(见第37章)。α-闰细胞(见图34.9,中间)分泌H+并重吸收HCO3-和K+,因此在调节酸碱平衡(见第37章)和K+平衡(见第36章)中具有重要作用。α-闰细胞通过顶端质膜上的H+,K+-ATP酶(HKA)重吸收K+。相比之下,β-闰细胞(见图34.9,底部)分泌HCO3-并重吸收H+和Cl-。氯离子通过顶端膜的Cl-/HCO3-反向转运体(pendrin, SLC26A4)进入β-闰细胞,并通过基底侧膜的Cl-通道离开细胞。β-闰细胞还重吸收NaCl,该过程涉及pendrin与顶端膜Na+/HCO3-/2Cl-反向转运体(NDCBE)的协同作用。这种NaCl重吸收机制可被噻嗪类利尿剂抑制(详见第37章)。
在远端小管末段和集合管的主细胞中,有不同量的水被重吸收。这些节段的水重吸收由位于顶端质膜的AVP调控的AQP2水通道,以及主细胞基底侧膜的AQP3和AQP4介导。在AVP存在时,水被重吸收;相反,缺乏AVP时,远端小管末段和集合管几乎不重吸收水(见第35章)。
主细胞通过两个步骤将K+从血液分泌到管腔液中(见图34.9,顶部):首先,基底侧膜通过Na+,K+-ATP酶介导K+的摄取。第二,K+通过被动扩散离开细胞。由于主细胞(principal cells)内[K+]较高(≈150 mEq/L)而小管液[K+]较低(≈10 mEq/L),K+顺浓度梯度通过顶膜(apical membrane)的K+通道(ROMK和BK)扩散进入小管液。虽然这些细胞内的负电位有利于K+在胞内滞留,但跨顶膜的电化学梯度促进K+从细胞分泌到小管液中(参见第36章)。与此相反,α细胞对K+的重吸收由位于顶膜的H+/K+-ATP酶(HKA)介导(见图34.9,中央)。因此,这些远端肾单位节段通过独立调控的机制同时具有分泌和重吸收K+的能力,这与大多数肾单位节段普遍倾向于重吸收Na+的特性形成对比。
NaCl和水的重吸收调节
从数量上看,血管紧张素II(angiotensin II)、醛固酮(aldosterone)、儿茶酚胺(catecholamines)、利钠肽(natriuretic peptides)和尿鸟苷素(uroguanylin)是调节NaCl重吸收(从而影响尿中NaCl排泄)的最重要激素(表34.6)。不过,其他激素(包括多巴胺和肾上腺髓质素)、Starling力以及肾小球-小管平衡现象也会影响NaCl重吸收。AVP是唯一直接调节肾脏水排泄量的主要激素。
血管紧张素II对近端小管NaCl和水的等渗重吸收具有强效刺激作用。它还能刺激髓袢升支粗段(thick ascending limb of Henle's loop)、远曲小管远端(late distal tubule)和集合管(collecting duct)的Na+重吸收。ECFV(细胞外液容量)下降会激活肾素-血管紧张素-醛固酮系统(详见第35章),从而提高血浆中血管紧张素II的浓度。
醛固酮由肾上腺皮质球状带细胞合成,能刺激亨利袢升支粗段、远曲小管后段和集合管对NaCl的重吸收。其对NaCl重吸收的主要作用体现在远曲小管后段和集合管(统称为醛固酮敏感性远端肾单位(aldosterone-sensitive distal nephron,ASDN)[详见第35、37章])。醛固酮通过以下四种机制增强这些节段主细胞(principal cells)的NaCl重吸收:
- 增加基底侧膜Na+,K+-ATP酶的数量;
- 增加顶膜钠通道(ENaC)的表达;
- 升高Sgk1(血清糖皮质激素刺激激酶,见分子专栏)水平,进而增加顶膜ENaC的表达;
- 激活CAP1(通道激活蛋白酶,亦称prostatin)——一种通过蛋白水解直接激活ENaC的丝氨酸蛋白酶。
这些机制共同增强了顶膜对Na+的摄取,并促进Na+从细胞内转运至血液。Na+重吸收的增加使远曲小管后段和集合管产生跨上皮腔侧负电压。该负电压为Cl-通过紧密连接(tight junctions)的重吸收提供电化学驱动力。醛固酮还刺激ASDN分泌K+。
高钾血症(hyperkalemia)和低血容量(hypovolemia)(即通过肾素-血管紧张素系统(RAS)激活后血管紧张素II增加导致的细胞外液容量减少)可促进醛固酮分泌。低钾血症(hypokalemia)和利钠肽(natriuretic peptides)则抑制其分泌(详见下文)。醛固酮通过刺激集合管NaCl重吸收,间接增强该肾单位节段的水重吸收。
醛固酮悖论(Aldosterone Paradox):如前所述,醛固酮(aldosterone)可刺激集合管对NaCl的重吸收和K+的分泌。尽管细胞外液容量(ECFV)减少(即低血容量,参见第35章)和高钾血症(参见第36章)均会升高醛固酮水平,但在这两种情况下肾脏的生理反应存在差异。在ECFV耗竭的情况下,肾脏减少NaCl排泄以恢复ECFV,而K+排泄不伴随变化。相比之下,在高钾血症期间,肾脏增加K+排泄以使血浆[K+]恢复正常,但NaCl排泄不伴随变化。这种现象——醛固酮对尿Na+和K+排泄的表观独立效应——被称为醛固酮悖论(aldosterone paradox)。
该悖论可通过以下观察解释:ECFV耗竭通过激活肾素-血管紧张素系统(RAS)增加醛固酮释放,而高钾血症直接刺激肾上腺释放醛固酮,无需激活RAS。因此,两种情况下醛固酮均升高,但血管紧张素II(angiotensin II)水平仅在ECFV耗竭时升高,而在高钾血症时不升高。正是醛固酮和血管紧张素II对转运过程的差异调节解释了这一悖论。
对ECFV减少的整合生理反应如表34.7所示。在低血容量状态下,血管紧张素II刺激近端小管和远端小管前段对NaCl的重吸收。醛固酮则刺激集合管主细胞(principal cells)中ENaC介导的Na+重吸收。同时,血管紧张素II通过ROMK抑制K+分泌,从而防止K+排泄增加(尽管醛固酮水平升高通常会促进K+分泌)。此外,血管紧张素II对近端小管NaCl和水重吸收的刺激作用还减少了NaCl和液体向集合管的输送,进一步抑制该节段的K+分泌(详见第36章)。
对高钾血症的相应整合生理反应如表34.6所示。在高钾血症期间,醛固酮刺激集合管主细胞中ROMK介导的K+分泌,从而增加尿Na+排泄。尿Na+排泄无变化的原因是:在血管紧张素II未升高的情况下,远端小管前段NCC介导的Na+重吸收减少,这一效应抵消了醛固酮对集合管ENaC的刺激作用。
a除醛固酮外,所有激素均在数分钟内起效。醛固酮对NaCl重吸收的作用延迟1小时,数天后达到最大效应。 ANP, 心房钠尿肽;BNP, 脑钠尿肽;BP, 血压;CD, 集合管;DT, 远曲小管;ECFV, 细胞外液容量;[K⁺]ₚ, 血浆K⁺浓度;Posm, 血浆渗透压;PT, 近曲小管;TAL, 髓袢升支粗段。
CD, 集合管;ENaC, 上皮钠选择性通道。
心房钠尿肽(ANP)和脑钠尿肽(BNP)抑制NaCl和水的重吸收。心房分泌的ANP和心室分泌的BNP均受ECFV增加和心肌壁压力升高的刺激。ANP和BNP通过降低外周总阻力和增强NaCl与水的尿排泄来降低血压,主要通过增加肾血流量(RBF)和肾小球滤过率(GFR)实现。这些利钠肽扩张入球小动脉并收缩出球小动脉,从而提高GFR和NaCl的滤过量,进而增加NaCl排泄(具体机制参见后文肾小管球平衡的讨论)。此外,RBF的增加会降低髓质间质中NaCl的浓度,从而减少髓袢升支细段对NaCl的被动重吸收(该节段NaCl重吸收的详细机制参见前文)。ANP和BNP还抑制集合管髓质部分的NaCl重吸收,并抑制AVP介导的集合管水重吸收。此外,ANP和BNP也减少垂体后叶AVP的分泌。这些作用通过激活膜结合型鸟苷酸环化酶受体实现,该受体可提高细胞内第二信使环磷酸鸟苷(cGMP)的水平。ANP的利钠和利尿作用强于BNP。
Urodilatin and ANP are encoded by the same gene and have similar amino acid sequences. Urodilatin is a 32–amino acid hormone that differs from ANP by the addition of four amino acids to the amino terminus. Urodilatin is secreted by the distal tubule and collecting duct and is not present in the systemic circulation; thus urodilatin influences only the function of the kidneys. Secretion of urodilatin is stimu lated by a rise in blood pressure and an increase in ECFV. It inhibits NaCl and water reabsorption across the medullary portion of the collecting duct. Urodilatin is a more potent natriuretic and diuretic hormone than ANP because some of the ANP that enters the kidneys in blood is degraded by a neutral endopeptidase that has no corresponding effect on urodilatin.
在细胞水平
Sgk1(血清糖皮质激素刺激激酶)是一种丝氨酸/苏氨酸激酶,通过调节肾脏对NaCl和K+的排泄,在维持NaCl和K+稳态中起重要作用。对Sgk1基因敲除小鼠的研究表明,该激酶是动物在严重NaCl限制和K+负荷条件下存活所必需的。NaCl限制和K+负荷会升高血浆[醛固酮]水平,从而快速(数分钟内)增加Sgk1蛋白表达及其磷酸化。磷酸化的Sgk1通过两种机制增强集合管中ENaC介导的Na+重吸收:一是增加主细胞顶质膜中ENaC的数量;二是提高基底外侧膜中Na+,K+-ATP酶泵的数量。磷酸化的Sgk1抑制Nedd4-2(一种泛素连接酶),后者可对ENaC亚基进行单泛素化修饰,从而靶向这些亚基使其通过内吞作用从质膜移除,最终在溶酶体中降解。Sgk1对Nedd4-2的抑制作用降低了ENaC的单泛素化水平,进而减少内吞过程并增加膜通道数量。Sgk1诱导K+通道(ROMK)从细胞内池向质膜转位,从而增强主细胞ROMK介导的K+分泌。Sgk1的这些效应先于醛固酮刺激引起的ENaC、ROMK和Na+,K+-ATP酶数量增加(此过程需时超过4小时),后者最终导致集合管对NaCl和K+转运的二次延迟性增强。Sgk1的激活多态性会引起血压升高,推测机制是增强集合管对NaCl的重吸收,从而增加ECFV并升高血压。
临床视角
利德尔综合征( Liddle syndrome )是一种罕见的遗传性疾病,其特征为继发于细胞外液容量(ECFV)增加的高血压(hypertension)。该病由上皮钠通道(epithelial sodium channel, ENaC)的β或γ亚基发生激活突变引起。这些突变会增加主细胞顶膜上的钠通道数量,从而增加钠的重吸收量。在利德尔综合征中,肾脏钠重吸收速率异常升高,导致ECFV增加和高血压。
假性醛固酮减少症(pseudohypoaldosteronism, PHA)存在两种不同形式(即肾脏以醛固酮水平低时的方式重吸收NaCl;然而在PHA中,醛固酮水平是升高的)。常染色体隐性遗传形式由ENaC的α、β或γ亚基失活突变引起。常染色体显性遗传形式的病因是盐皮质激素受体发生失活突变。假性醛固酮减少症的特征包括:钠排泄增加、ECFV减少、高钾血症和低血压。
对于某些ECFV扩张和血压升高的患者,可使用血管紧张素转换酶(angiotensin-converting enzyme, ACE)抑制剂(如卡托普利Captopril、依那普利Enalapril、赖诺普利Lisinopril)进行治疗,以降低体液容量和血压。ACE抑制剂通过阻断血管紧张素I向血管紧张素II的降解,从而降低血浆血管紧张素II水平。血浆血管紧张素II浓度的下降会产生三种效应:
- 肾单位(尤其是近端小管)对NaCl和水的重吸收减少
- 醛固酮分泌下降,从而降低髓袢升支粗段、远曲小管和集合管对NaCl的重吸收
- 由于血管紧张素是强效血管收缩剂,其浓度降低可使全身小动脉舒张,从而降低动脉血压
ACE还可降解血管舒张激素缓激肽(bradykinin),因此ACE抑制剂会增加这种血管舒张激素的浓度。通过促进肾脏NaCl和水排泄,以及降低总外周阻力,ACE抑制剂可减少ECFV并降低动脉血压。
尿鸟苷素(uroguanylin)与鸟苷素(guanylin),肠道神经内分泌细胞在口服NaCl后分泌这两种激素。它们通过激活膜结合型鸟苷酸环化酶受体(增加细胞内[cGMP]),抑制肾脏对NaCl和水的重吸收。这些肠道来源激素的参与可解释:为何肾脏对口服NaCl负荷产生的利钠反应比静脉输注时更显著。
儿茶酚胺可刺激NaCl重吸收。交感神经末梢释放的去甲肾上腺素(norepinephrine)和肾上腺髓质分泌的肾上腺素(epinephrine)能刺激近端小管、髓袢升支粗段、远曲小管和集合管对NaCl和水的重吸收。当ECFV正常时交感神经不活跃,但当ECFV下降(如出血后)时,交感神经活性升高会显著增强这四个肾单位节段对NaCl和水的重吸收。
多巴胺是一种儿茶酚胺,由肾脏中的多巴胺能神经释放,也可由近端小管(proximal tubule)细胞合成。多巴胺的作用与去甲肾上腺素(norepinephrine)和肾上腺素(epinephrine)相反。细胞外液容量(ECFV)增加会刺激多巴胺分泌,其分泌直接抑制近端小管对NaCl和水的重吸收。
肾上腺髓质素(adrenomedullin)是由肾脏等多种器官产生的52氨基酸的肽类激素。它能显著促进利尿和尿钠排泄,其分泌在充血性心力衰竭和高血压时被激活。肾上腺髓质素对肾脏的主要作用是增加肾小球滤过率(GFR)和肾血流量(RBF),从而间接刺激NaCl和水的排泄(参见前文关于ANP和BNP的讨论)。
精氨酸加压素(arginine vasopressin, AVP)是调节肾脏水重吸收最重要的激素(见第35章)。该激素由垂体后叶分泌,响应血浆渗透压升高(≥1%)或ECFV减少(稳态值下降>5%-10%)。AVP可增加集合管对水的通透性,由于集合管壁两侧存在的渗透压梯度(见第35章),它能促进集合管对水的重吸收。AVP对尿NaCl排泄的影响甚微。
Starling力调节近端小管对NaCl和水的重吸收。如前所述,Na⁺、Cl⁻、HCO₃⁻、氨基酸、葡萄糖和水被转运至近端小管细胞间隙。该间隙与管周毛细血管之间的Starling力促使重吸收液进入毛细血管。作用于管周毛细血管壁的Starling力包括:管周毛细血管静水压(Pₚc)与侧向细胞间隙静水压(Pᵢ),以及管周毛细血管胶体渗透压(πₚc)与侧向细胞间隙胶体渗透压(πᵢ)。因此,Na⁺从管腔液转运至侧向细胞间隙所引起的水重吸收会受到Starling力的调节。具体公式如下:
公式34.2:J = Kf[(Pi-Ppc)+(πpc-πi)]
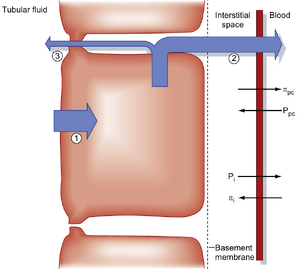
式中J为液体流动量(正值表示液体从细胞间隙流向血液)。促进物质从间质进入管周毛细血管的Starling力为πpc和Pi(图34.10)。相反的Starling力为πᵢ和Pₚc。正常情况下,Starling力的总和有利于溶质和水从间质进入毛细血管。然而,部分进入侧向细胞间隙的溶质和液体会反流回近端小管腔。Starling力对髓袢(loop of Henle)、远端小管和集合管的转运无显著影响,因为这些节段对水的通透性低于近端小管。
多种因素可改变近端小管周围管周毛细血管的斯塔林力。例如,出球小动脉的扩张会增加P_pc;而出球小动脉的收缩会降低它。P_pc的升高通过增加NaCl和水通过紧密连接的回漏来抑制溶质和水的重吸收,而P_pc的降低则通过减少紧密连接的回漏来刺激重吸收。
管周毛细血管胶体渗透压(π_pc)部分由肾小球超滤液(glomerular ultrafiltrate)的生成速率决定。例如,假设入球小动脉的血浆流量恒定,当超滤液生成减少(即GFR降低)时,进入出球小动脉和管周毛细血管的血浆中蛋白质浓度会降低。因此,π_pc降低。故π_pc与滤过分数\left(FF=GFR\right/肾血浆流量[RPF])呈正相关。在RPF恒定的情况下,因GFR降低导致的FF下降会减少π_pc。这反过来会增加NaCl和水从细胞侧间隙向小管液的回流,从而减少近端小管对溶质和水的净重吸收。FF的升高则产生相反效应。
Starling 力在调节近端小管对溶质和水的重吸收中的重要性被肾小球小管 (G-T) 平衡现象所低估。GFR 的自发变化显着改变了过滤液中 Na 的过滤量(过滤后的 Na = GFR × [Na ])。如果不快速调整 Na 重吸收来抵消 Na 滤过的变化,尿液中 Na 的排泄就会波动很大,扰乱身体的 Na 平衡,从而改变 ECFV 和血压(更多细节见第 35 章)。然而,由于 GT 平衡现象,当 ECFV 不严重时,GFR 的自发变化不会改变尿液中 Na 排泄或 Na 平衡。当身体 Na 平衡正常(即 ECFV 正常)时,GT平衡是指 Na 和水的重吸收与 GFR 和 Na 量的增加成正比。因此,尽管 GFR 发生变化,但恒定比例的 Na 和水从近端肾小管被重新吸收。GT 平衡的最终结果是减少 ECFV 正常时 GFR 变化对尿液中排泄的 Na 和水量的影响。
两个机制负责 GT 平衡。一个与肾小管周围毛细血管和外侧 cel 间隙之间的渗透压和静水压差(即 Starling 力)有关。例如,GFR 的增加(在恒定的 RPF 下)使肾小球毛细血管血浆中的蛋白质浓度高于正常水平。这种富含蛋白质的血浆离开肾小球毛细血管,流经传出小动脉,进入肾小管周围毛细血管。πpc 的增加增加了溶质和 f luid 从外侧细胞间隙进入肾小管周围毛细血管的运动。这个动作增加了近端小管对净溶质和水的吸附。
负责 GT 平衡的第二种机制是由葡萄糖和氨基酸过滤量的增加启动的。如前所述,近端小管前半部分 Na 的重吸收与葡萄糖和氨基酸的重吸收耦合。因此,Na 重吸收率部分取决于 glu cose 和氨基酸的过滤量。随着 GFR 和葡萄糖和氨基酸的过滤量增加,Na 和水的重吸收也会增加。
除了 GT 平衡之外,另一种机制还最大限度地减少了 Na 过滤量的变化。如第 33 章所述,GFR 的增加(以及由肾小球过滤的 Na 量的增加)激活了肾小管小球反馈机制。此作将 GFR 和 Na 的过滤恢复为正常值。因此,GFR 的自发变化(例如,由姿势和血压的变化引起)仅在几分钟内增加过滤的 Na 量。GT 平衡的基础机制维持尿 Na 排泄恒定,从而维持 Na 稳态(以及 ECFV 和血压),直到 GFR 恢复正常。
关键点
- 肾单位的四个主要部分(近端小管(proximal tubule)、Henle's loop、远端小管(distal tubule)和集合管(collecting duct))通过选择性重吸收溶质和水以及分泌某些溶质的过程,决定尿液的成分和体积。
- 肾小管对肾小球滤过物质的重吸收使肾脏能够保留必需物质,并通过调节其重吸收程度来维持它们在血浆中的水平。Na+、Cl-、其他阴离子、有机阴离子和阳离子与水的重吸收是肾单位的主要功能。每天约有25,200mEq的Na+和179L的水被重吸收。近端小管细胞重吸收67%的肾小球超滤液,Henle's loop的细胞重吸收约25%的滤过NaCl和约15%的滤过水。肾单位的远端部分(远端小管和集合管系统)的重吸收能力较有限。然而,尽管近端小管重吸收了最大比例的滤过溶质和水(即67%),尿液成分和体积的最终调节以及激素与其他因素的主要调控作用主要发生在远端小管和集合管。
- 物质从血液分泌至小管液是排泄多种代谢副产物的途径,也是清除体内外源性有机阴离子、阳离子(如药物)和毒素的方式。许多有机阴离子和阳离子与血浆蛋白结合,因此无法被滤过。因此分泌是它们在尿液中排泄的主要途径。
- 多种激素(包括血管紧张素II(angiotensin II)、醛固酮(aldosterone)、AVP、ANP、BNP、尿扩张素(urodilatin)、尿鸟苷素(uroguanylin)、鸟苷素(guanylin)和多巴胺(dopamine))、交感神经和Starling力共同调节肾脏对NaCl的重吸收。AVP是调节水重吸收的主要激素。
37 肾脏在酸碱平衡调节中的作用
学习目标
完成本章学习后,学生应能够回答以下问题:
- HCO3-如何作为缓冲剂发挥作用,为什么它是细胞外液的重要缓冲剂?
- 食物代谢如何产生酸和碱,饮食成分对全身酸碱平衡有何影响?
- 挥发性酸和非挥发性酸之间的区别是什么,什么是净内源性酸产生(NEAP)?
- 肾脏和肺如何参与全身酸碱平衡的调节,什么是肾脏净酸排泄(RNAE)?
- 为什么肾脏排泄酸需要尿液缓冲剂?
- 肾单位各段中 H+ 转运的机制是什么,这些机制如何被调节?
- 肾单位各段如何参与过滤的 HCO3 的重吸收过程?
- 肾脏如何产生新的 HCO3?
- 肾脏如何产生铵,其排泄如何促进肾脏的酸排泄?
- 身体防御酸碱平衡变化的主要机制是什么?
- 单纯代谢性和呼吸性酸碱紊乱之间的区别是什么,如何通过动脉血气测量来区分它们?
体液中 H+ 的浓度与其他离子相比较低。例如,Na+ 的浓度约为 H+ 的300万倍([Na+]=140m E q/L;[H+]=40n E q/L)。由于体液中 [H+] 较低,通常用负对数或 pH 表示。
几乎所有细胞、组织和器官的生理过程都对pH敏感。事实上,生命无法在细胞外液(extracellular fluid, ECF)pH范围6.8至7.8(H+浓度为160-16nEq/L)之外存在。正常情况下,ECF的pH维持在7.35至7.45之间。细胞内液(intracellular fluid, ICF)的pH略低(7.1–7.2),但也受到严格调控。
每天,酸和碱通过饮食摄入。此外,细胞代谢产生许多对体液pH有影响的物质。如果没有适当的机制来处理这些日常的酸碱负荷并维持酸碱平衡,许多生命必需的过程将无法进行。本章将回顾全身酸碱平衡的维持。虽然重点在于肾脏在这一过程中的作用,但也考虑了肺和肝脏的作用。此外,还介绍了饮食和细胞代谢对酸碱平衡的影响。最后,讨论了酸碱平衡紊乱,主要是为了说明相关的生理过程。在本章中,酸被定义为任何向体液中添加H+的物质,而碱被定义为从体液中去除H+的物质。
HCO3-缓冲系统
碳酸氢根(bicarbonate, HCO3-)是ECF的重要缓冲物质。在正常血浆中,[HCO3-]为23至25mEq/L,体积为14L(以70公斤个体为例),ECF可以缓冲350mEq的H+。HCO3-缓冲系统与身体的其他缓冲系统(如磷酸盐)不同,因为它受到肺和肾脏的共同调节。通过以下反应可以更好地理解这一点:
CO2+H2O↔H2CO3↔H+ + HCO3-
如所示,第一个反应(CO2的水合/脱水)是限速步骤。这个通常较慢的反应在碳酸酐酶存在下大大加速。第二个反应,H2CO3电离为H+和HCO3-,几乎是瞬间完成的。
Henderson-Hasselbalch方程用于量化CO2和HCO3-的变化如何影响pH:
pH = pKH + log[HCO3-]/αPCO2
或
pH = 6.1 + log[HCO3-]/0.03PCO2
在这些方程中,CO2的量由CO2的分压(PCO2)及其在溶液中的溶解度(α)决定。对于37°C的血浆,α的值为0.03。此外,pK\prime是方程37.1中反应的总解离常数的负对数,对于37°C的血浆,其值为6.1。或者,HCO3-和CO2对[H+]的关系可以如下确定:
[H+]= 24×PCO2/[HCO3-]
通过检查方程37.3和37.4可以看出,当[HCO3-]或PCO2发生变化时,pH和[H+]也会发生变化。由于[HCO3-]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于PCO2变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。这些紊乱将在后续章节中详细讨论。肾脏主要负责调节ECF中的[HCO3-],而肺则控制PCO2。
酸碱平衡概述
人类的饮食中含有许多酸性或碱性的成分。此外,细胞代谢也会产生酸和碱。最后,每天通常会有碱通过粪便排出。正如后面所述,尽管这些过程依赖于饮食,但其净效应是向体液中添加酸。为了维持酸碱平衡,酸的排泄速率必须与其添加速率相等。如果酸的添加超过排泄,就会导致酸中毒。相反,如果酸的排泄超过添加,就会导致碱中毒。
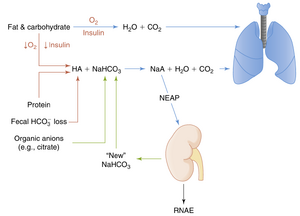
如图37.1所示,饮食中的主要成分是碳水化合物和脂肪。当组织灌注充足、O2可供组织使用且胰岛素水平正常时,碳水化合物和脂肪会代谢为CO2和H2O。每天通过这一过程会产生15到20摩尔的CO2。通常,这一大量的CO2会通过肺有效地从体内排出。因此,这种代谢产生的CO2对酸碱平衡没有影响。CO2通常被称为挥发性酸,因为它有潜力在与H2O水合后生成H+(见方程37.1)。不直接来自CO2水合的酸称为非挥发性酸(例如乳酸)。
其他膳食成分的细胞代谢也会对酸碱平衡产生影响。例如,含硫氨基酸如半胱氨酸和甲硫氨酸在代谢时会产生硫酸,而赖氨酸、精氨酸和组氨酸的代谢则会产生盐酸。这部分非挥发性酸负荷的一部分通过天冬氨酸和谷氨酸的代谢产生的HCO3-来抵消。平均而言,膳食氨基酸的代谢会产生净的非挥发性酸。某些有机阴离子(如柠檬酸(citrate))的代谢会产生HCO3-,这在一定程度上抵消了非挥发性酸的产生。总体而言,在摄入含肉饮食的个体中,酸的生成超过了HCO3-的生成。相比之下,素食饮食产生的非挥发性酸较少。除了代谢产生的酸和碱外,摄入的食物中也含有酸和碱。例如,摄入食物中的磷酸盐(H2PO4-)会增加膳食酸负荷。最后,在消化过程中,部分HCO3-通常会随粪便排出。这种损失相当于向体内添加了非挥发性酸。在摄入含肉饮食的个体中,膳食摄入、细胞代谢和粪便中HCO3-的损失导致每天向体内添加约0.7至1.0mEq/kg体重的非挥发性酸(大多数成年人每天50-100mEq)。这种酸被称为净内源性酸生成(net endogenous acid production, NEAP),会导致体内HCO3-的等量损失,必须进行补充。
临床相关
当胰岛素水平正常时,碳水化合物和脂肪会完全代谢为CO2+H2O。然而,如果胰岛素水平异常低(如糖尿病()),细胞代谢会导致几种有机酮酸(organic ketoacids)的产生(例如,脂肪酸代谢产生的β -羟基丁酸(β -hydroxybutyric acid)和乙酰乙酸(acetoacetic acid))。
在缺乏足够的O2(缺氧)的情况下,细胞的厌氧代谢()也会导致有机酸(如乳酸)的产生,而不是CO2+ H2O。这种情况在正常个体进行剧烈运动时经常发生。组织灌注不良(如心输出量减少时)也会导致细胞的厌氧代谢,从而导致酸中毒(acidosis)。在这些情况下,有机酸会积累,体液的pH值下降(酸中毒)。治疗(例如,在糖尿病的情况下给予胰岛素)或改善组织灌注(例如,在组织灌注不良的情况下)会导致这些有机酸代谢为CO2+ H2O,这会消耗H+,从而有助于纠正酸碱紊乱。
非挥发性酸不会在全身循环,而是立即被ECF中的HCO3-中和。这一中和过程产生了强酸的Na+盐,并从细胞外液(ECF)中移除了HCO3-。因此,HCO3-最大限度地减少了这些强酸对ECF的pH的影响。如前所述,ECF中大约含有350mEq的HCO3-。如果这些HCO3-没有得到补充,每天产生的非挥发性酸(\approx70mEq/天)将在5天内耗尽ECF中的HCO3-。为了维持酸碱平衡,肾脏必须补充因中和非挥发性酸而损失的HCO3-,这一过程称为肾脏净酸排泄(RNAE)。
肾脏的净酸排泄
在稳态条件下,NEAP必须等于RNAE以维持酸碱平衡。尽管NEAP在个体之间以及同一个体在不同天之间有所变化,但它并不受调节。相反,肾脏通过调节RNAE来匹配NEAP,并在此过程中补充因中和非挥发性酸而损失的HCO3-(新的HCO3-)。此外,肾脏还必须防止HCO3-在尿液中的丢失。后一项任务在数量上更为重要,因为HCO3-的滤过负荷约为4320mEq/day(24mEq/L×180L/day=4320mEq/day),而平衡NEAP仅需要50到100mEq/天。
滤过的HCO3-的重吸收和酸的排泄都是通过肾单位的H+分泌来完成的。因此,在一天内,肾单位必须向肾小管液中分泌大约4390mEq的H+。大部分分泌的H+用于重吸收滤过的HCO3-负荷。只有50到100mEq的H+,相当于NEAP的量,被排泄到尿液中。由于这种酸的排泄,尿液通常是酸性的。
肾脏不能排泄比pH4.0到4.5更酸的尿液。即使在pH为4.0时,也只能排泄0.1mEq/L的H+。因此,为了排泄足够的酸,肾脏通过尿液缓冲剂如磷酸盐(Pi)来排泄H+。尿液中的其他成分也可以作为缓冲剂(例如肌酐),尽管它们的作用不如Pi重要。这些尿液缓冲剂统称为可滴定酸(titratable acid)。这一术语来源于实验室中定量这些缓冲剂的方法。通常,向尿液样本中加入碱(OH−)以将其pH滴定至血浆的pH(即7.4)。加入的碱量等于这些尿液缓冲剂所滴定的H+量,称为可滴定酸。
H+作为可滴定酸(titratable acid)的排泄不足以平衡NEAP。肾脏通过合成和排泄铵离子来维持酸碱平衡,这是另一个重要的机制。本章后面将更详细地讨论这一过程所涉及的机制。关于肾脏对酸碱平衡的调节,尿液中每排泄一个NH4+,就会有一个HCO3-返回到体循环中,从而补充在非挥发性酸中和过程中丢失的HCO3-。因此,NH4+的产生和排泄,就像可滴定酸的排泄一样,相当于肾脏排泄酸。
简而言之,肾脏通过重吸收过滤的HCO3-并排泄与NEAP等量的酸来维持酸碱稳态。这一过程可以量化如下:
RNAE = (UNH4×V)+(UTA×V)-(UHCO3×V)
其中 (UNH4×V)和(UTA×V)分别是NH4+和可滴定酸(TA)的排泄速率(mEq/day),而(UHCO3×V)是尿液中丢失的HCO3-量(相当于向体内添加H+)。再次强调,维持酸碱平衡意味着净酸排泄必须等于非挥发性酸的产生。在大多数情况下,尿液中排泄的HCO3-非常少。因此,净酸排泄基本上反映了可滴定酸和NH4+的排泄。从数量上看,可滴定酸约占RNAE的三分之一,而NH4+占三分之二。
[疑问:NH4+在滴定过程中应该也会消耗对应的OH-吧?为什么要算在可滴定酸之外呢?]
肾单位沿途的HCO3-重吸收
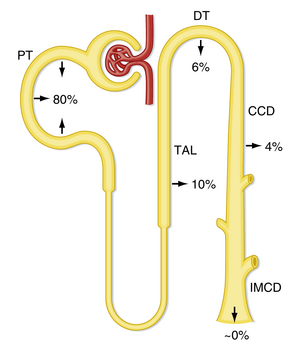
如公式37.7所示,当尿液中排泄的HCO3-很少或没有时,净酸排泄达到最大值。事实上,在大多数情况下,尿液中出现的HCO3-非常少。由于HCO3-在肾小球自由过滤,每天大约有4320mEq被输送到肾单位并被重吸收。图37.2总结了每个肾单位段对过滤的HCO3-重吸收的贡献。
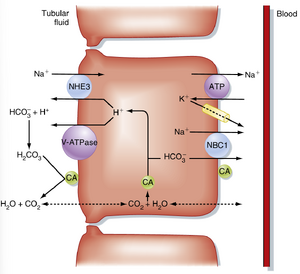
近端小管重吸收了滤过的HCO3-的最大部分。图37.3总结了涉及的主要转运过程。H+通过Na+/H+反向转运体和H+ -ATPase(V型)分泌到细胞的顶膜。Na+/H+反向转运体(NHE3)是H+分泌的主要途径(约占HCO3-重吸收的三分之二),并利用管腔到细胞的[Na+]梯度来驱动这一过程(即H+的次级主动分泌)。在细胞内,H+和HCO3-在碳酸酐酶(CA-II)催化的反应中产生。H+被分泌到管腔液中,而HCO3-通过基底外侧膜离开细胞并返回到管周血液中。HCO3-通过基底外侧膜离开细胞的过程与其他离子耦合。大多数HCO3-通过一个将Na+与HCO3-外流耦合的同向转运体(碳酸氢钠同向转运体,NBC1)离开细胞。一些HCO3-通过其他转运体离开细胞,但它们不如Na+/HCO3-同向转运体重要。如图37.3所示,碳酸酐酶(CA-IV)也存在于细胞的刷状缘和基底外侧膜中。刷状缘酶催化管腔液中的H2CO3脱水,而位于基底外侧膜的酶则促进HCO3-离开细胞。CO2进出细胞的运动通过AQP1进行,AQP1位于管腔和基底外侧膜。
Henle袢厚升支(TAL)重吸收HCO3-的细胞机制与近端小管非常相似。H+通过Na+/H+反向转运体和H+ -ATPase分泌。与近端小管一样,Na+/H+反向转运体(NHE3)是H+分泌的主要途径。HCO3-离开细胞涉及Na+/ HCO3-同向转运体(NBC1)和Cl-/HCO3-反向转运体(阴离子交换体,AE-2)。一些HCO3-也可能通过基底外侧膜中的Cl-通道离开细胞。
远端小管和集合管重吸收了近端小管和Henle袢未能重吸收的少量HCO3-。图37.4显示了位于这些节段中的间质细胞的H+/HCO3-转运的细胞机制(另见第34章)。
一种类型的闰细胞分泌H+(重吸收HCO3-),被称为A-或α-闰细胞。在这种细胞内,H+和HCO3-通过CO2的水合作用产生;该反应由碳酸酐酶(CA-II)催化。H+通过两种机制分泌到管腔液中。第一种机制涉及顶膜上的H+-ATPase(V型)。第二种机制通过H+-K+-ATPase将H+的分泌与K+的重吸收耦合,这种ATPase类似于在胃和结肠中发现的HKα1和HKα2。HCO3-通过基底膜上的Cl-/HCO3-反向转运体(AE-1)与Cl-交换,离开细胞并进入管周毛细血管血液。
第二种类型的闰细胞将HCO3-而不是H+分泌到管腔液中(也称为B或β-闰细胞)。在这些细胞中,H+-ATPase(V型)位于基底膜上,而Cl-/HCO3-反向转运体位于顶膜上(见图37.4)。
然而,顶膜上的Cl-/HCO3-反向转运体与H+分泌闰细胞基底膜上的不同,已被鉴定为pendrin。在代谢性碱中毒期间,当肾脏必须排泄过量的HCO3-时,HCO3-分泌闰细胞的活性增加。然而,在大多数情况下(例如,摄入含肉饮食),H+的分泌在这些节段中占主导地位。
集合管细胞的顶膜对H+的渗透性不高,因此管腔液的pH值可以变得相当酸性。实际上,沿着肾单位的最酸性管腔液(pH=4.0-4.5)是在这里产生的。相比之下,近端小管对H+和HCO3-的渗透性要高得多,该节段中的管腔液pH仅降至6.5。正如后面所解释的,集合管降低管腔液pH的能力对于排泄尿液可滴定酸和NH4+至关重要。
H+分泌的调节
许多因素影响H+的分泌,从而影响肾单位细胞对过滤的HCO3-的重吸收。从生理学角度来看,调节肾单位H+分泌的主要因素是全身酸碱平衡的变化。因此,酸中毒刺激RNAE,而碱中毒期间RNAE减少。
在细胞水平
肾脏细胞表达监测酸碱状态的受体,因此在调节肾小管中的H⁺和HCO3-转运体中起关键作用(图37.5)。例如,一种G蛋白偶联的H+受体(GPCR–GPR4)已被定位到集合管。细胞外液中[H+]的增加激活该受体,刺激H+的分泌。同样在集合管中,分泌HCO3-的闰细胞(B-或β -ICs)表达一种基底外侧的胰岛素相关受体(IRR),它是一种酪氨酸激酶。该受体被ECF中[HCO3-]的增加激活,并刺激细胞分泌HCO3-。一种由细胞内HCO3-调节的可溶性腺苷酸环化酶(sAC)似乎也在调节集合管的H+分泌中起作用。在近端小管中,基底外侧膜的受体酪氨酸激酶(ErbB1和ErbB2)感知ECF中P C O2的变化。P C O2的增加激活这些受体,导致血管紧张素II的生成,后者通过AT-1A受体从管腔侧作用,刺激H+分泌/HCO3-重吸收。同样在近端小管中,非受体酪氨酸激酶(Pyk2)感知细胞内[H+]的变化。当细胞内[H+]的增加激活该激酶时,H+分泌/H dCO_3-重吸收被刺激。最后,几种离子通道(例如,肾外髓质K+通道[ROMK])的门控受到ECF或细胞内液(ICF)pH变化的影响。这些通道也有可能作为细胞酸碱传感器。
• 图37.4 远端小管和集合管闰细胞重吸收和分泌HCO3-的细胞机制。仅显示了主要的H+和HCO3-转运体。A T P, 三磷酸腺苷;C A_i,碳酸酐酶;H K A,H+ f+-K+ -ATP酶。
肾脏对酸碱平衡变化的反应包括膜上转运体活性和/或数量的即时变化,以及转运体合成的长期变化。例如,在代谢性酸中毒时,H+分泌通过多种机制被刺激,具体取决于肾小管的不同节段。首先,酸中毒时细胞内pH的降低将产生更有利的细胞到管腔液的H+梯度,从而使H+跨顶膜的分泌在能量上更为有利。其次,pH的降低可能导致转运蛋白的变构变化,从而改变其动力学。最后,转运体可能从细胞内囊泡转运到膜上。在长期酸中毒的情况下,转运体的丰度增加,这可能是通过适当转运体基因的转录增加或转运体mRNA的翻译增加实现的。
• 图37.5 细胞H+和HCO3-传感器的 示例。ATP,三磷酸腺苷;C A M P,环磷酸腺苷;G P C R,\textcircled7蛋白偶联受体;IRR,胰岛素受体相关受体;Pyk2,非受体酪氨酸激酶;sAC,可溶性腺苷酸环化酶。(改编自:Levin LR, Buck J. Annu Rev Physiol; 2015;77:347。)
在细胞水平
在近端小管中,代谢性酸中毒增加了N a+/H+反向转运体(NHE3)的转运动力学,并增加了N a+/H+反向转运体、H+-ATP酶以及基底外侧N a+/3HCO3-同向转运体(NBCe1)在顶膜的表达。在集合管中,酸中毒导致H+-ATP酶通过胞吐作用插入到间质细胞的顶膜中。长期酸中毒会增加近端小管(NHE3和NBCe1)和集合管间质细胞中关键酸碱转运体的丰度(H+-ATP酶和AE1)。最后,酸中毒会减少在HCO3-分泌型间质细胞中Cl-/HCO3-反向转运体pendrin的表达。
尽管上述一些效应可能直接归因于酸中毒,但许多细胞H+转运的变化是由激素或其他因素介导的。已知的三种介导肾脏对酸中毒反应的介质是内皮素、皮质醇和血管紧张素II。内皮素(ET-1)由内皮细胞和近端小管细胞产生。在酸中毒时,ET-1的分泌增强。在近端小管中,ET-1刺激Na+/H+反向转运体的磷酸化并随后插入到顶膜中,以及Na+/3HCO3-同向转运体插入到基底外侧膜中。ET-1也可能在其他肾单位节段中介导对酸中毒的反应。酸中毒还刺激肾上腺皮质分泌糖皮质激素皮质醇。皮质醇增加了近端小管中Na+/H+反向转运体和Na+/3HCO3-同向转运体的丰度。血管紧张素II在近端小管细胞中响应酸中毒而产生。它被分泌到管腔液中,在那里与血管紧张素I受体结合,从而刺激近端小管的H+分泌/HCO3-重吸收。皮质醇和血管紧张素II还刺激近端小管产生和分泌NH4+,这将在后面描述,是肾脏对酸中毒反应的重要组成部分。
酸中毒还刺激甲状旁腺激素(PTH)的分泌。PTH抑制近端小管对磷酸盐(Pi)的重吸收(见第36章)。通过这种方式,更多的Pi被输送到远端肾单位,在那里它作为尿液缓冲剂,从而增加了肾脏排泄可滴定酸的能力。
肾脏对碱中毒的反应尚未得到充分表征。RNAE减少是由于尿中HCO3-排泄增加以及可滴定酸和NH4+排泄减少。调节这种反应的因素尚未得到充分表征。
其他不一定与维持酸碱平衡相关的因素也可能影响肾单位(nephron)细胞分泌H+。由于肾单位中一个重要的H+转运体是Na+/H+反向转运体(antiporter),因此改变Na+重吸收的因素会间接影响H+的分泌。例如,在容量收缩(负Na+平衡)时,肾单位对Na+的重吸收增加(见第35章),包括通过Na+/H+反向转运体重吸收Na+。结果,H+的分泌增强。这是通过几种机制实现的。一种机制涉及由容量收缩激活的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system)。如前所述,血管紧张素II(angiotensin II)作用于近端小管,刺激顶端膜(apical membrane)的Na+/H+反向转运体以及基底外侧膜的Na+/3HCO3-同向转运体(symporter)。在较小程度上,血管紧张素II刺激亨利袢(Henle’s loop)的粗升支(thick ascending limb, TAL)和远端小管(distal tubule)早期部分的H+分泌,这一过程也由Na+/H+反向转运体介导。醛固酮(aldosterone)对远端小管和集合管(collecting duct)的主要作用是刺激主细胞(principal cells)重吸收Na+(见第34章)。然而,它也刺激这些节段中的闰细胞(intercalated cells)分泌H+。这种效应既有间接的,也有直接的。通过刺激主细胞重吸收Na+,醛固酮使跨上皮电压(transepithelial voltage)超极化(hyperpolarize)(即管腔(lumen)变得更负)。这种跨上皮电压的变化随后促进了闰细胞分泌H+。除了这种间接效应外,醛固酮(和血管紧张素II)还直接作用于闰细胞,通过H+ -ATPase和H+,K+ -ATPase刺激H+分泌。
细胞外液(extracellular fluid, ECF)容量(ECFV)收缩增强H+分泌(HCO3-重吸收)的另一种机制是通过改变管周毛细血管(peritubular capillary)的Starling力(Starling forces)。如第34章和第35章所述,ECFV收缩改变了管周毛细血管的Starling力,从而增强了近端小管的整体重吸收。随着这种增强的重吸收,更多的滤过负荷(filtered load)的HCO3-被重吸收。
钾平衡(potassium balance)影响近端小管分泌H+。低钾血症(hypokalemia)刺激H+分泌,而高钾血症(hyperkalemia)抑制H+分泌。据认为,K+诱导的细胞内pH变化至少部分导致了这种效应。低钾血症使细胞酸化,因为细胞内K+与H+交换,而高钾血症使细胞碱化,因为细胞内H+与K+交换。低钾血症还刺激集合管分泌H+。这是由于闰细胞中H+,K+ -ATPase的表达增加所致。
新HCO3-的形成
如前所述,重吸收滤过的HCO3-(碳酸氢根)对于最大化RNAE(净酸排泄)至关重要。然而,仅靠HCO3-的重吸收并不能补充代谢过程中产生的非挥发性酸中和过程中丢失的HCO3-。为了维持酸碱平衡,肾脏必须用新的HCO3-来替代这些丢失的HCO3-。新的HCO3-的生成通过可滴定酸的排泄以及NH4+(铵离子)的合成和排泄来实现。
图37.6展示了由于可滴定酸排泄而产生新的HCO3-的过程。由于近端小管和Henle袢对HCO3-的重吸收,到达远端小管和集合管的液体通常含有很少的HCO3-。因此,当H+(氢离子)被分泌时,它将与非\cdotHCO3-缓冲剂(主要是P_i,\ell\cdot(磷酸盐))结合,并以可滴定酸的形式排泄。由于H+是由CO2(二氧化碳)水合作用在细胞内产生的,因此也会产生一个HCO3-。
• 图37.6 H+与非\cdotHCO3-尿缓冲剂(可滴定酸)排泄的一般机制。主要的尿缓冲剂是磷酸盐(H P O_42-)。图中展示了一个H+(氢离子)分泌的间质细胞。为简化起见,仅展示了H+ -ATPase(氢离子-钾离子ATP酶)。\HatH+通过H+,K+ -ATPase的分泌也会滴定管腔缓冲剂。ATP,三磷酸腺苷;CA,碳酸酐酶。
• 图37.7 肾单位对N H_4+的产生、转运和排泄。谷氨酰胺在近端小管中代谢为N H_4+和HCO3-。N H_4+被分泌到管腔中,而HCO3-进入血液。分泌的N H_4+在Henle袢(主要是粗升支)中被重吸收,并在髓质间质中积累。N H_3(氨)通过rhesus糖蛋白由集合管分泌,H+的分泌将N H_4+捕获在管腔中。每排泄一个N H_4+分子,就会有一个“新的”HCO3-分子被添加到ECF(细胞外液)中。C A,碳酸酐酶。
这个HCO3-作为新的HCO3-返回到ECF。如前所述,Pi(磷酸盐)的排泄在酸中毒时增加。然而,即使有更多的Pi可用于形成可滴定酸,这种反应仍不足以生成所需量的新的HCO3-。剩余的新的HCO3-生成是通过NH4+的生成和排泄来实现的。
NH4+由肾脏产生,其合成和随后的排泄为ECF添加了HCO3-。重要的是,这一过程会根据身体的酸碱需求进行调节。
NH4+ 通过谷氨酰胺的代谢在肾脏中产生。肾脏主要代谢谷氨酰胺,排出 NH4+,并向体内添加 HCO3-。然而,通过这一过程形成新的 HCO3- 取决于肾脏将 NH4+ 排泄到尿液中的能力。如果 NH4+ 未被排泄到尿液中,而是进入体循环,它会被肝脏转化为尿素。这一转化过程会产生 H+,随后被 HCO3- 缓冲。因此,由肾脏生成的 NH4+ 转化为尿素会消耗 HCO3-,并抵消了通过肾脏合成和排泄 NH4+ 形成 HCO3- 的过程。然而,正常情况下,肾脏会将 NH4+ 排泄到尿液中,从而产生新的 HCO3-。
肾脏排泄 NH4+ 的过程是复杂的。图 37.7 展示了这一过程的关键特征。NH4+ 在近端小管细胞中由谷氨酰胺产生,这一过程称为氨生成(ammoniagenesis)。每个谷氨酰胺分子产生两个 NH4+ 分子和二价阴离子 2-氧代戊二酸(2-oxoglutarate2−)。该阴离子的代谢最终提供两个 HCO3- 分子。HCO3- 通过基底外侧膜离开细胞,并作为新的 HCO3- 进入管周血液。NH4+ 通过顶膜离开细胞,进入小管液。NH4+ 分泌到小管液中的主要机制涉及 Na+/H+ 反向转运体,NH4+ 替代 H+。此外,一些 NH_3 可以扩散出细胞进入小管液,在那里被质子化为 NH4+。
近端小管分泌的大部分 NH4+ 被 Henle 袢重吸收。TAL(厚升支)是 NH4+ 重吸收的主要部位,NH4+ 替代 K+ 结合到 1Na+/1K+/2Cl- 同向转运体上。此外,该节段的管腔正跨上皮电压驱动 NH4+ 的旁细胞重吸收。
被 Henle 袢 TAL 重吸收的 NH4+ 在髓质间质中积累。随后,它被集合管分泌到小管液中。
集合管细胞表达两种 NH_3 膜转运蛋白,称为 Rhesus (Rh) 糖蛋白(RhBG 和 RhCG)。RhBG 存在于 H+ 分泌的间细胞和主细胞的基底外侧膜中,而 RhCG 存在于这些细胞的顶膜和基底外侧膜中。如图 37.7 所示,NH_3 通过集合管转运,这一过程传统上称为非离子扩散。分泌的 NH_3 由于间细胞分泌的 H+ 而在小管腔中被质子化。由于顶膜对 NH4+ 的通透性较低,它被有效地困在小管腔中,这一过程传统上称为扩散捕获。
集合管(collecting duct)分泌的H+对于NH4+的排泄至关重要。如果集合管的H+分泌受到抑制,Henle袢(TAL)重吸收的NH4+将无法通过尿液排出。相反,NH4+会返回到体循环中,如前所述,它会被肝脏转化为尿素,并在此过程中消耗HCO3-。因此,近端小管(proximal tubule)细胞在谷氨酰胺代谢过程中会产生新的HCO3-。然而,只有当NH4+被排出时(即防止肝脏将NH4+转化为尿素),整个过程才算完成。最终,每排出尿液中的一个NH4+,就会有一个新的HCO3-返回到体循环中。因此,尿液中的NH4+排泄量可以作为近端小管谷氨酰胺代谢的标志物。
临床意义
评估肾脏的NH4+排泄通常是通过间接方法进行的,因为尿液中N H_4+的测定并不常规进行。例如,考虑代谢性酸中毒(metabolic acidosis)的情况,此时肾脏的适当反应是增加净酸排泄。因此,尿液中几乎不会出现HCO3-,尿液呈酸性,且N H_4+排泄量会增加。为了评估这一点,特别是N H_4+的排泄量,可以通过测量尿液中的N a+、K+和Cl-浓度来计算“尿净电荷”或“尿阴离子间隙”:
U r i n e a n i o n g a p=\left(\left[N a+\right]+\left[K+\right]\right)-\left[C l-\right]
在代谢性酸中毒期间,尿阴离子间隙的概念假设尿液中的主要阳离子是N a+、K+和NH4+,而主要阴离子是Cl-(尿液p H<6.5时,几乎不存在HCO3-)。电中性原则指出,尿液中的阳离子和阴离子的总和应相等。因此,当未测定的阳离子N H_4+被排泄时,尿阴离子间隙将产生负值。需要注意的是,实际上并不存在阴离子间隙——阳离子和阴离子的数量是相等的。计算出的阴离子间隙仅反映了所测定的参数,而NH4+通常不被测定。事实上,尿阴离子间隙的缺失或正值的存在表明肾脏在N H_4+的产生和排泄方面存在缺陷。
肾脏NH4+系统的一个重要特征是它受到全身酸碱平衡的调节。如前所述,酸中毒时皮质醇水平升高,近端小管腔内的血管紧张素II分泌也增加。皮质醇和血管紧张素II都刺激氨生成(即从谷氨酰胺生成NH4+)。在全身酸中毒期间,近端小管细胞中负责谷氨酰胺代谢的酶被激活。这涉及新酶的合成,并且需要几天时间才能完全适应。随着这些酶水平的增加,NH4+的生成增加,从而增强了新的HCO3-的产生。相反,碱中毒时谷氨酰胺代谢减少。酸中毒还增加了集合管中RhBG和RhCG的丰度,因此分泌NH4+的能力也增强。
对酸碱紊乱的反应
ECF(细胞外液)的pH维持在一个非常狭窄的范围内(7.35-7.45)。通过检查方程37.3可以看出,当[HCO3-]或PCO2发生变化时,ECF的pH会发生变化。如前所述,由于ECF中[HCO3-]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于PCO2变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。肾脏主要负责调节[HCO3-],而肺则调节PCO2。
当酸碱紊乱发生时,身体使用几种机制来防御ECF pH的变化。这些防御机制并不能纠正酸碱紊乱,而只是最小化紊乱引起的pH变化。将血液pH恢复到正常值需要纠正导致酸碱紊乱的根本过程。身体有三种一般机制来防御酸碱紊乱引起的体液pH变化:(1)细胞外和细胞内缓冲,(2)通过改变肺的通气速率来调整血液PCO2,(3)调整RNAE(净酸排泄)。
细胞外和细胞内缓冲
防御酸碱紊乱的第一道防线是细胞外和细胞内缓冲。细胞外缓冲的反应几乎是瞬时的,而细胞内缓冲的反应较慢,可能需要几分钟。
由于向体液中添加非挥发性酸或碱而引起的代谢紊乱在细胞外和细胞内都被缓冲。HCO3-缓冲系统是主要的ECF缓冲系统。当向体液中添加非挥发性酸(或从体内丢失碱)时,HCO3-在中和酸负荷的过程中被消耗,ECF的[HCO3-]减少。相反,当向体液中添加非挥发性碱(或从体内丢失酸)时,H+被消耗,导致更多的HCO3-从H2CO3的解离中产生。因此,[HCO3-]增加。
尽管HCO3-缓冲系统是主要的细胞外液(ECF)缓冲系统,Pi和血浆蛋白也提供了额外的细胞外缓冲作用。HCO3-、P_i和血浆蛋白的缓冲过程共同作用,约占非挥发性酸负荷缓冲的50%和非挥发性碱负荷缓冲的70%。在这两种情况下,剩余的缓冲作用发生在细胞内。细胞内缓冲涉及H+进入细胞(在非挥发性酸缓冲期间)或H+离开细胞(在非挥发性碱缓冲期间)。H+在细胞内被HCO3-、Pi和蛋白质上的组氨酸基团滴定。
• 图37.8 通气速率对肺泡P C O2及动脉血P C O2的影响。
骨骼是细胞外缓冲的另一个来源。然而,在酸中毒时,骨骼的缓冲作用会导致其脱矿质化。
当发生呼吸性酸碱紊乱时,体液的pH会因PCO2的变化而改变。几乎所有呼吸性酸碱紊乱的缓冲作用都发生在细胞内。当PCO2升高(呼吸性酸中毒)时,CO2进入细胞,与H2O结合形成H2CO3。H2CO3随后解离为H+和HCO3-。部分H+被细胞蛋白缓冲,而HCO3-离开细胞并提高ECF中的[HCO3-]。当PCO2降低(呼吸性碱中毒)时,这一过程会逆转。在这种情况下,PCO2的降低使水合反应(H2O+CO2H2CO3)向左移动。结果,解离反应(H2CO3OH++HCO3-)也向左移动,从而降低ECF中的[HCO3-]。
呼吸代偿
肺是抵御酸碱紊乱的第二道防线。正如Henderson-Hasselbalch方程(见公式37.2)所示,PCO2的变化会改变血液的pH:升高会降低pH,而降低会增加pH。
通气速率决定了PCO2。通气增加会降低PCO2,而通气减少则会增加PCO2(图37.8)。血液中的PCO2和pH是通气速率的重要调节因素。位于脑干(延髓腹侧表面)和外周(颈动脉体和主动脉体)的化学感受器感知PCO2和[H+]的变化,并相应地调整通气速率。因此,当代谢性酸中毒发生时,[H+]的升高(pH降低)会刺激通气速率。相反,在代谢性碱中毒期间,[H+]的降低(pH升高)会减少通气速率。在最大程度的过度通气时,PCO2可以降低到大约10mmHg。由于缺氧是通气的强效刺激因素,而缺氧也会随着通气不足而发展,因此PCO2可以增加的程度是有限的。在正常个体中,通气不足不能使PCO2超过60mmHg。对代谢性酸碱紊乱的呼吸反应可能在几分钟内启动,但可能需要几个小时才能完成。
肾脏代偿
对抗酸碱紊乱的第三道也是最后一道防线涉及肾脏。响应血浆pH和PCO2的变化,肾脏会适当调整RNAE(净酸排泄)的排泄。肾脏反应可能需要几天时间才能完成,因为增加近端小管酶(参与NH4+生成)的合成和活性需要数小时到数天的时间。在酸中毒([H+]或PCO2增加)的情况下,肾单位的H+分泌受到刺激,并且所有过滤的HCO3-负荷都被重吸收。可滴定酸排泄增加,NH4+的生成和排泄也受到刺激,因此RNAE增加(图37.9)。在净酸排泄过程中生成的新HCO3-被添加到体内,血浆[HCO3-]增加。
当存在代谢性碱中毒([H+]降低)时,HCO3-的过滤负荷增加(血浆[HCO3-]升高)。在呼吸性碱中毒(PCO2降低)时,血浆[HCO3-]降低,因此过滤负荷减少。在这两种情况下,肾单位的H+分泌受到抑制。结果,HCO3-排泄增加。同时,可滴定酸和NH4+的排泄减少。因此,RNAE减少,HCO3-出现在尿液中。此外,一些HCO3-通过远端小管和集合管的HCO3-分泌性间质细胞分泌到尿液中。随着HCO3-排泄的增加,血浆[HCO3-]降低。
临床实践
胃内容物从体内流失(例如呕吐、鼻胃管抽吸)会导致继发性代谢性碱中毒,这是由于HCl的流失所致。如果胃液流失严重,会发生ECFV(细胞外液容量)收缩。在这种情况下,肾脏无法排泄足够量的HCO3-来代偿代谢性碱中毒。肾脏无法排泄HCO3-的原因是,为了纠正ECFV收缩,需要减少N a+的排泄。如前所述(详见第35章),肾脏对容量收缩的反应是降低肾小球滤过率,从而减少HCO3-的滤过负荷,并增加肾单位对N a+的重吸收。由于大量的N a+重吸收是通过N a+/H+反向转运体进行的,这导致近端小管增加H+分泌(HCO3-重吸收)。在这种情况下,所有滤过的HCO3-都会被重吸收,甚至可能增强新的HCO3-生成。后一种反应的发生是因为醛固酮(在容量收缩时其水平升高)不仅刺激远端N a+的重吸收,还刺激间质细胞的H+分泌。这种H+分泌的刺激通过增加可滴定酸和NH4+排泄来生成新的HCO3-。因此,在胃内容物流失的个体中,通常会出现代谢性碱中毒和反常的酸性尿液。只有在恢复正常血容量时,碱中毒才能得到纠正。
• 图37.9 肾单位对酸中毒的反应。CCD,皮质集合管;D T, 远端小管;IMCD,内髓集合管;P_\mathfrakp 磷酸盐;P T, 近端小管;P T H, 甲状旁腺激素;Rhbg & Ṙhcg,恒河猴糖蛋白;R N A E, 肾脏净酸排泄;T A_: 可滴定酸;T A L, 粗升支;\dotV, 尿流率。
简单酸碱紊乱的特征 37.1
<html><body><table><tr><td>紊乱</td><td>血浆pH</td><td>主要改变</td><td>防御机制</td></tr><tr><td>代谢性酸中毒</td><td></td><td>↓ECF [HCO]</td><td>ICF和ECF缓冲 过度通气 (↓Pco2) ↑RNAE</td></tr><tr><td>代谢性碱中毒</td><td></td><td>↑ECF [HCO]</td><td>ICF和ECF缓冲 通气不足 (↑Pco2) ↓RNAE</td></tr><tr><td>呼吸性酸中毒</td><td></td><td>↑PcO2</td><td>ICF缓冲 ↑RNAE</td></tr><tr><td>呼吸性碱中毒</td><td></td><td>↓PcO2</td><td>ICF缓冲 ↓RNAE</td></tr></table></body></html>
ECF,细胞外液;I C F, 细胞内液;RNAE,肾脏净酸排泄
简单酸碱紊乱
表37.1总结了各种简单酸碱紊乱的主要改变及其随后的代偿或防御机制。在所有酸碱紊乱中,代偿反应并不能纠正潜在的紊乱,而只是减少了pH变化的幅度。纠正酸碱紊乱需要治疗其病因。
酸碱紊乱的类型
代谢性酸中毒
代谢性酸中毒的特征是细胞外液(ECF)中[HCO3-]和pH的降低。它可以通过向体内添加非挥发性酸(如糖尿病酮症酸中毒)、非挥发性碱的丢失(如由腹泻引起的HCO3-丢失)或肾脏未能排出可滴定酸和NH4+(如肾功能衰竭)而发展。如前所述,H+的缓冲发生在ECF和细胞内液(ICF)中。当pH下降时,呼吸中枢受到刺激,通气速率增加(呼吸代偿)。
最后,在代谢性酸中毒中,净酸排泄量(RNAE)增加。这是通过从尿液中排出所有HCO3-(增强过滤的HCO3-的重吸收)以及通过增加可滴定酸和NH4+的排泄(增强新的HCO3)的产生)来实现的。如果引发酸碱紊乱的过程得到纠正,增强的RNAE最终将使pH和[HCO3-]恢复正常。在pH纠正后,通气速率也会恢复正常。
临床中的应用
当非挥发性酸被添加到体液中时,如糖尿病酮症酸中毒,[H+]增加(pH降低),[HCO3-]减少。此外,与非挥发性酸相关的阴离子浓度增加。这种阴离子浓度的变化提供了一种方便的方法,通过计算所谓的阴离子间隙来分析代谢性酸中毒的原因。阴离子间隙代表主要ECF阳离子\left(N a+\right)与主要ECF阴离子(Cl-和HCO3-)之间的差异:
在正常情况下,阴离子间隙范围为8至16mEq/L。重要的是要认识到阴离子间隙实际上并不存在。所有阳离子都由阴离子平衡。这个间隙仅仅反映了测量的参数。实际上:
A n i o n g a p=\left[N a+\right]-\left(\left[C l-\right]+\left[HCO3-\right]\right)
\beginarrayr l&\left[N a+\right]+\left[U n m e a s u r e d c a t i o n s\right]\ &\quad=\left[C l-\right]+\left[HCO3-\right]+\left[U n m e a s u r e d a n i o n s\right]\endarray
如果非挥发性酸的阴离子是Cl-,阴离子间隙将是正常的(即[HCO3-]的减少与[Cl-]的增加相匹配)。与腹泻或肾小管酸中毒(即肾脏H+分泌缺陷)相关的代谢性酸中毒具有正常的阴离子间隙。相反,如果非挥发性酸的阴离子不是Cl-(如乳酸,β -羟基丁酸),阴离子间隙将增加(即[HCO3-]的减少不与\left[\bigcirc\right]-]的增加相匹配,而是与未测量阴离子浓度的增加相匹配)。在代谢性酸中毒相关的酮症酸中毒(如糖尿病)中,阴离子间隙增加,伴有肾功能衰竭、乳酸酸中毒或摄入毒素或某些药物(如大量阿司匹林)。因此,计算阴离子间隙是临床环境中识别代谢性酸中毒病因的有用方法。
白蛋白(albumin)是一种带负电荷的大分子,它对“未测定的阴离子”有相当大的贡献。因此,对于血清[白蛋白]异常的患者,必须调整阴离子间隙(anion gap)。血清[白蛋白]每变化19/dL,阴离子间隙需要同方向调整2.5mEq/L。
代谢性碱中毒(Metabolic Alkalosis)
代谢性碱中毒的特征是细胞外液(ECF)中[HCO3-]和pH的增加。它可以通过向体内添加非挥发性碱(例如,摄入抗酸剂)、由于容量收缩(例如,出血)或更常见的是由于非挥发性酸的丢失(例如,由于长期呕吐导致的胃HCl丢失)而发生。缓冲作用主要发生在细胞外液(ECF),在细胞内液(ICF)中程度较轻。pH的增加抑制了呼吸中枢,从而降低了通气率,因此PCO2升高(呼吸代偿)。
肾脏对代谢性碱中毒的代偿反应是通过减少肾单位沿途的重吸收来增加HCO3-的排泄。通常这种情况发生得相当迅速(几分钟到几小时)且有效。只要初始酸碱紊乱的根本原因得到纠正,肾脏排泄HCO3-的增加最终会使pH和[HCO3-]恢复正常。当pH得到纠正时,通气率也会恢复正常。
呼吸性酸中毒(Respiratory Acidosis)
呼吸性酸中毒的特征是PCO2升高和细胞外液(ECF)pH降低。它是由于肺泡气体交换减少所致,原因可能是通气不足(例如,药物引起的呼吸中枢抑制)或气体扩散受损(例如,肺水肿,如心血管和肺部疾病中发生的情况)。与代谢性紊乱不同,呼吸性酸中毒期间的缓冲作用几乎完全发生在细胞内液(ICF)中。PCO2的增加和pH的降低刺激了肾单位对HCO3-的重吸收以及可滴定酸和NH4+的排泄(肾脏代偿)。这些反应共同增加了RNAE并生成了新的HCO3-。肾脏的代偿反应需要几天时间才能发生。因此,呼吸性酸碱紊乱通常分为急性和慢性阶段。在急性阶段,肾脏代偿反应的时间不足,身体依靠细胞内液(ICF)缓冲来最小化pH的变化。在慢性阶段,肾脏代偿发生。纠正基础疾病后,PCO2恢复正常,RNAE降至初始水平。
呼吸性碱中毒(Respiratory Alkalosis)
呼吸性碱中毒(Respiratory alkalosis)的特征是PCO2降低和ECF(细胞外液)pH升高。它通常是由于肺部气体交换增加引起的,通常由呼吸中枢受到刺激(例如通过药物或中枢神经系统疾病)导致的通气增加引起。过度通气(Hyperventilation)也发生在高海拔地区,以及由于焦虑、疼痛或恐惧引起。缓冲作用主要发生在ICF(细胞内液)区室。与呼吸性酸中毒一样,呼吸性碱中毒也有急性和慢性阶段,反映了肾脏代偿所需的时间。呼吸性碱中毒的急性阶段反映了细胞内缓冲作用,而慢性阶段反映了肾脏代偿。在肾脏代偿过程中,升高的pH和降低的PCO2抑制了肾单位对HCO3-的重吸收,并减少了可滴定酸和NH4+的排泄。由于这些效应,RNAE(净酸排泄量)减少。纠正基础疾病后,PCO2恢复正常,肾脏的酸排泄量也随之恢复到初始水平。
酸碱紊乱的分析
酸碱紊乱的分析旨在确定基础病因,以便启动适当的治疗。患者的病史和相关体格检查通常为酸碱紊乱的性质和起源提供有价值的线索。此外,通常需要分析动脉血样本。如果系统地进行分析,这种分析是直接的。例如,考虑以下数据:通过这些值或任何其他值集所代表的酸碱紊乱可以使用以下三步法确定:
- 检查pH。当首先考虑pH时,基础紊乱可以分类为酸中毒或碱中毒。身体的防御机制本身无法纠正酸碱紊乱。因此,即使防御机制完全运作,pH的变化也表明了酸碱紊乱。在提供的例子中,pH为7.35表明酸中毒。
37.2 伴有代偿的简单酸碱紊乱
- 代谢性与呼吸性紊乱的鉴别。简单的酸碱紊乱要么是代谢性的,要么是呼吸性的。为了确定存在哪种紊乱,临床医生接下来必须检查ECF(细胞外液)中的[HCO3-](碳酸氢根离子浓度)和PCO2(二氧化碳分压)。如前所述,酸中毒可能是由于[HCO3-]的降低(代谢性)或PCO2的升高(呼吸性)引起的。相反,碱中毒可能是由于ECF中[HCO3-]的升高(代谢性)或PCO2的降低(呼吸性)引起的。对于提供的例子,ECF中的[HCO3-]从正常值(正常值为24mEq/L)降低,PCO2也从正常值(正常值为40mmHg)降低。因此,这种紊乱必须是代谢性酸中毒;它不可能是呼吸性酸中毒,因为PCO2降低了。
- 代偿反应的分析。代谢性紊乱会导致通气量的代偿性变化,从而影响PCO2,而呼吸性紊乱则会导致RNAE(肾净酸排泄)的代偿性变化,从而影响ECF中的[HCO3-](表37.2)。在适当代偿的代谢性酸中毒中,PCO2降低,而在代偿性代谢性碱中毒中,PCO2升高。在呼吸性酸中毒中,代偿导致[HCO3-]升高。
相反,ECF中的[HCO3-]在呼吸性碱中毒中会降低。在这个例子中,PCO2从正常值降低,且降低的幅度(ECF中[HCO3-]降低8mEq/L,PCO2降低10mmHg)符合预期(见表37.2)。因此,这种酸碱紊乱是一种伴有适当呼吸代偿的单纯代谢性酸中毒。
混合性酸碱紊乱反映了酸碱失衡存在两种或更多潜在原因。例如,考虑以下数据:
当遵循三步法时,可以明显看出这种紊乱是一种酸中毒,既有代谢性成分(ECF中[HCO3-]<24mEq/L),也有呼吸性成分(PCO2>40mmHg)。因此,这种紊乱是混合性的。混合性酸碱紊乱可能发生在例如有慢性肺病(如肺气肿,即慢性呼吸性酸中毒)病史并发展为急性胃肠道疾病(如腹泻)的个体中。因为腹泻液中含有HCO3-,其从体内的丢失会导致代谢性酸中毒的发生。
当患者的PCO2和ECF中的[HCO3-]值异常但pH正常时,也提示存在混合性酸碱紊乱。这种情况可能发生在摄入了大量阿司匹林的患者中。水杨酸(阿司匹林中的活性成分)会引起代谢性酸中毒,同时刺激呼吸中枢,导致过度通气和呼吸性碱中毒。因此,患者的ECF中[HCO3-]降低,PCO2也降低。(注意:PCO2低于代谢性酸中毒的正常呼吸代偿水平。)
关键概念
- 肾脏通过排泄与代谢产生的非挥发性酸和饮食中摄入的酸量相等的酸来维持酸碱平衡(称为肾脏净酸排泄 [RNAE])。肾脏还通过重吸收几乎所有在肾小球滤过的 HCO3- 来防止 HCO3- 在尿液中的丢失。滤过的 HCO3- 的重吸收和酸的排泄都是通过肾小管分泌 H+ 来完成的。肾脏以可滴定酸(主要是 P_i,\ell\cdot)和 NH4+ 的形式排泄酸。可滴定酸和 NH4+ 的排泄都会生成新的 HCO3-,从而补充在非挥发性酸中和过程中丢失的细胞外液(ECF)中的 HCO3-。
- 人体通过三道防线来最小化酸碱紊乱对体液 pH 的影响:(1)细胞外液(ECF)和细胞内液(ICF)缓冲,(2)呼吸代偿,(3)肾脏代偿。
- 代谢性酸碱紊乱是由于细胞外液(ECF)中 [HCO3-] 的初始改变引起的,这种改变又源于体内酸的增加或碱的丢失。在代谢性酸中毒的情况下,肺通气增加,从而降低 PCO2。肺对代谢性酸碱紊乱的反应在几分钟内发生。RNAE 也会增加,但这需要几天时间。ECF 中 [HCO3-] 的增加会导致碱中毒。这会迅速(几分钟到几小时)减少肺通气,从而升高 PCO2 作为代偿反应。RNAE 也会减少,但这需要几天时间。
- 呼吸性酸碱紊乱是由于 PCO2 的初始改变引起的。PCO2 的升高会导致酸中毒,肾脏通过增加 RNAE 来应对。相反,PCO2 的降低会导致碱中毒,RNAE 也会减少。肾脏对呼吸性酸碱紊乱的反应需要几小时到几天的时间。
