第二十章 癌
大约五分之一的人会死于癌症,但这并不是我们专门用一章来探讨这种疾病的原因。癌细胞破坏了构成多细胞生物体的最基本细胞行为规则,并且它们会利用各种机会来达到这一目的。这些违反规则的行为虽然往往是悲剧性的,但却有助于揭示正常的规则,以及它们是如何运作的。因此,癌症研究有助于阐明细胞生物学的基本原理——尤其是细胞信号传导(第15章)、细胞周期和细胞生长(第17章)、细胞凋亡(第18章)以及组织结构的控制(第19章和第22章)。当然,随着对这些正常过程的深入了解,我们也将对癌症有更深入的理解,并找到更好的治疗方法。
在本章中,我们首先探讨癌症是什么,并从细胞的角度描述癌症的自然史。然后,我们将讨论导致细胞癌变的分子变化。本章的最后,我们将探讨如何通过加深对癌症分子基础的理解来改进癌症的预防和治疗方法。
癌症是一种微进化过程
动物的身体就像一个社会或生态系统,其个体成员是细胞,它们通过细胞分裂进行繁殖,并自行组织成称为组织的协作体。然而,这个生态系统非常特殊,因为自我牺牲——而非适者生存——才是规则。最终,动物体内所有体细胞谱系都致力于支持生殖细胞,而只有生殖细胞才有机会继续生存(详见第21章)。由于体细胞的基因组与产生精子或卵子的生殖细胞谱系的基因组相同,因此体细胞通过自我牺牲来帮助繁殖自身基因的副本。
与细菌或酵母等独立生存的细胞竞争生存不同,多细胞生物的细胞必须致力于合作。为了协调自身行为,细胞会发送、接收并解读一组复杂的细胞外信号,这些信号充当社会控制,指导细胞如何行动(第15章将对此进行讨论)。因此,每个细胞通常都会根据生物体自身的需要,以符合社会责任的方式行事——静息、生长、分裂、分化或死亡。
破坏这种和谐的分子扰动意味着多细胞社会将面临危机。在一个拥有超过1017个细胞的人体中,数十亿个细胞每天都会发生突变,这可能会扰乱社会控制。最危险的是,突变可能会赋予一个细胞选择优势,使其生长和分裂略有活力,并且比邻近细胞更容易存活。通过这种方式,一个突变细胞可以成为一个不断生长的突变克隆体的起源。随着时间的推移,在体细胞群体中反复发生的突变、竞争和自然选择会导致情况每况愈下,危及多细胞生物的未来。这些是癌症的基本要素:它是一种疾病,单个突变细胞克隆开始以牺牲邻近细胞为代价而繁荣发展。最终——随着该克隆进化、转移——他将摧毁整个细胞社会(电影20.1)。
本节中,我们将癌症的发展视为一种微观进化过程,该过程在人体内某一细胞亚群中发生于人的生命周期内。正如我们将要看到的,这一过程依赖于数十亿年来驱动地球生物进化的相同原则:突变与自然选择。
癌细胞绕过正常增殖控制并侵占其他组织
癌细胞具有两大遗传特性:(1)它们无视正常的细胞生长与分裂限制进行繁殖;(2)它们会侵入并占据通常属于其他细胞的领域。正是这两种特性的结合使得癌症尤为危险。一个异常细胞若经历连续且异常的增殖循环,失控地增生,便会形成肿瘤(tumor)或赘生物/新生物(neoplasm)——字面意为"新的生长物"。然而,只要这些肿瘤细胞尚未具备侵袭能力,该肿瘤便被称为良性肿瘤(benign)。对于大多数此类肿瘤,通过局部切除或摧毁肿块通常可实现彻底治愈。
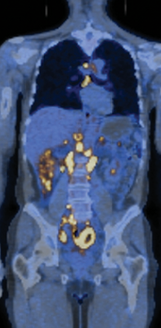
只有当肿瘤是恶性的(malignant),即其细胞获得了侵袭周围组织的能力时,才被视为真正的癌症。侵袭性是癌细胞的一个基本特征。这使得它们能够脱离原发部位,进入血液或淋巴管,并在身体其他部位形成被称为转移灶(metastases)的继发性肿瘤(图20-1)。通常,癌症扩散得越广泛,就越难以根除。正是这些转移灶通过导致重要器官功能衰竭,通常成为癌症患者死亡的原因。
图 20-1 转移。恶性肿瘤通常会导致转移,使癌症难以根除。这张融合图像显示的是一位转移性非霍奇金淋巴瘤 (NHL) 患者的全身扫描图。背景图像由 CT(计算机 X 射线断层扫描)扫描获得。叠加在此图像上的 PET(正电子发射断层扫描)扫描显示了肿瘤组织(黄色),该组织通过其对放射性标记的氟脱氧葡萄糖 (FDG) 的异常高摄取率被发现。高 FDG 摄取率发生在葡萄糖摄取和代谢异常活跃的细胞中,这是癌细胞的特征(见图 20-18)。腹部的黄色斑点揭示了多处转移灶。
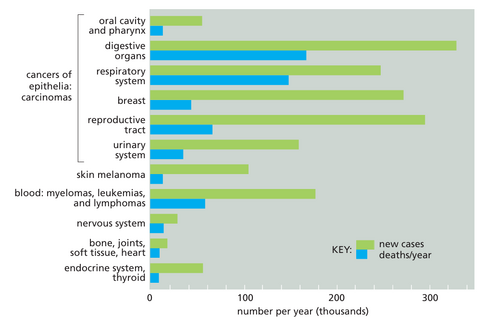
传统上,癌症是根据其起源的组织和细胞类型进行分类的。癌(Carcinoma)是指起源于上皮细胞的癌症,它们是迄今为止人类最常见的癌症,约占所有癌症的 85% 。成年人中,通过增殖和死亡实现的正常细胞更新主要发生在上皮组织,而经历最多细胞分裂周期的细胞类型积累致癌所需多重突变的概率最大。此外,上皮组织最易暴露于各种有利于癌症发展的物理和化学损伤中。图 20-2 显示了美国诊断出的癌症类型及其发病率和死亡率。继癌之后,最常见的癌症类型包括各种骨髓瘤(myelomas)、白血病(leukemias)和淋巴瘤(lymphomas),这些源自白细胞及其前体(造血细胞)。起源于结缔组织或肌肉细胞的肉瘤(Sarcomas)以及源自神经系统细胞的癌症则较为罕见。
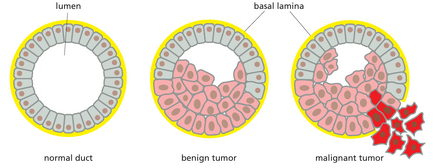
与恶性肿瘤的命名体系相对应,存在一组相关的良性肿瘤命名:例如,腺瘤是一种具有腺体结构的良性上皮肿瘤;其对应的恶性肿瘤类型为腺癌(图20-3)。
大多数癌症具有反映其起源的特征。例如,源自皮肤角质形成细胞干细胞的基底细胞癌,其细胞通常持续合成细胞角蛋白中间丝;而源自皮肤色素细胞的黑色素瘤细胞,则往往(并非总是)继续制造色素颗粒。一般而言,起源于不同细胞类型的癌症是截然不同的疾病。以皮肤基底细胞癌为例,它们仅具有局部侵袭性且很少转移,而黑色素瘤可能恶性程度更高并常形成转移灶。基底细胞癌通过手术或局部放疗即可治愈,而恶性黑色素瘤一旦广泛转移,往往致命。
稍后我们将看到,还有一种更新、更不同的癌症分类方法,它跨越了传统的原发部位分类法:现在我们可以根据使特定肿瘤细胞癌变的突变来对多种癌症进行分类。本章最后一节将展示这些信息如何对治疗方案的设计与选择起到关键作用。
大多数癌症源于单个异常细胞
即使癌症已经发生转移,我们通常仍可追溯其根源至某个特定器官中的单个原发肿瘤。原发肿瘤被认为是由最初经历某种可遗传变化的单个细胞通过分裂而产生的。随后,该细胞的部分后代中积累了更多变化,使它们能够比邻近细胞生长更快、分裂更多且通常存活更久。
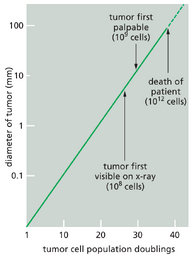
当首次被发现时,一个典型的人类癌症通常已经发展了多年,并已包含十亿个或更多的癌细胞(图20-4)。肿瘤通常还包含多种其他细胞类型和相关的细胞外基质,称为肿瘤间质。例如,在癌相关的支持性结缔组织中,除了免疫细胞和血管内皮细胞外,还会存在成纤维细胞。我们如何确定癌细胞是单个异常细胞的克隆后代?
证明克隆起源的一种方法是对肿瘤细胞染色体进行分子分析。例如,在几乎所有慢性髓系白血病(CML)患者中,我们可以通过特定的染色体异常区分白血病白细胞与个体的正常细胞:即所谓的费城染色体,这是由 9 号和 22 号染色体长臂之间的易位形成的(图 20-5)。当对易位位点的 DNA 进行克隆和测序时,发现所有白血病细胞中易位片段的断裂和重接位点在特定个体内完全一致,但在不同个体间存在细微差异(相差几百至几千个碱基对)。这个结果当且仅当每个个体的癌症都源于单个细胞发生的独特事故时,才符合预期。(后续我们将看到这种特殊易位如何通过创建编码促进细胞增殖蛋白的新型杂交基因来推动 CML 的发展。)
来自多种不同类型癌症的大量其他证据都指向同一结论:大多数癌症起源于单个异常细胞。
癌细胞含有体细胞突变
如果一个异常细胞要发展成肿瘤,它必须将其异常性传递给后代:这种畸变必须是可遗传的。因此,癌细胞克隆的发展依赖于基因变化。肿瘤细胞含有体细胞突变:它们的 DNA 序列中存在一个或多个可检测的共享异常,使其区别于肿瘤周围的正常细胞,正如刚才描述的慢性髓性白血病(CML)例子所示。(这些突变被称为体细胞突变,因为它们发生在体细胞中,而非生殖细胞系。)癌症也受到表观遗传变化的驱动——这些持久、可遗传的基因表达变化源于染色质结构的修饰,而非细胞 DNA 序列的改变。但改变 DNA 序列的体细胞突变似乎是一个基本且普遍的特征,从这个意义上说,癌症是一种遗传性疾病。
导致基因变化的因素往往会诱发癌症的发展。因此,癌变(癌症的产生)可与诱变(DNA 序列变化的产生)相关联。这种关联在两类外部因素中尤为明显:(1)化学致癌物(通常引起核苷酸序列的简单变化),以及(2)辐射,如 X 射线(通常导致染色体断裂和易位)或紫外线(UV)光(引起特定 DNA 碱基改变)。
正如预期的那样,遗传了某种 DNA 修复机制缺陷的人,其细胞会以较高速度积累突变,因此患癌症的风险增加。例如,患有色素性干皮病的人,其修复紫外线引起的 DNA 损伤的系统存在缺陷,他们患皮肤癌的发病率大大增加。总体而言,遗传突变被认为在所有癌症中占 5-10%的比例,而体细胞突变和表观遗传变化则更为普遍。
单一突变不足以将正常细胞转变为癌细胞
据估计,一个普通体型的人类体内约有 3.7 × 1013 个细胞(不包括细菌),在典型生命周期中会发生 1016 次细胞分裂。这种细胞增殖主要发生在上皮组织和造血系统,并通过细胞死亡保持平衡以维持正常的组织稳态。即使在无诱变剂的环境中,突变仍会以每个细胞分裂约三次的自发频率发生,相当于每个基因每次细胞分裂约 10-6 次突变。这一不可避免的误差率由 DNA 复制与修复精度的根本限制所决定(参见第 253-254 页)。这意味着,在典型生命周期中,人体每个基因都会在体内经历约 1010 次独立突变。由此产生的突变细胞中,将有大量细胞在调控生长分裂的基因中积累有害突变,导致细胞违背正常更替规则。考虑到人类这样大型生物体内不可避免的巨量突变,癌症问题看似不应纠结于为何发生,而应探究其为何如此罕见。
图 20-5 导致慢性粒细胞白血病的 9 号与 22 号染色体易位。顶部显示的是 9 号和 22 号染色体的正常结构。当它们在指定位置发生相互易位时,结果形成底部所示的异常染色体对。其中较小的异常染色体 (22q^{-}) 被称为费城染色体,得名于首次记录该异常的城市。
如果单个基因的突变足以将典型的健康细胞转化为癌细胞,我们就不可能成为可存活的生物体。多项证据表明,癌症的发生通常需要在一个单细胞衍生的谱系中,积累大量独立且罕见的遗传和表观遗传意外事件。其中一个证据来自对癌症发病率随年龄变化的流行病学研究(图20-6)。如果癌症由单一突变引起,且每年发生概率固定,那么在任何年龄段患上癌症的几率应与年龄无关。事实上,大多数癌症类型的发病率随年龄增长而急剧上升——这符合癌症是由细胞谱系中一系列突变的渐进性随机积累所引起的预期。然而值得注意的是,癌症发病率在极高龄人群中显著下降。对此现象的一种解释是,细胞增殖减少(八旬老人干细胞功能衰退的典型特征)降低了突变发生的机会。
正如后文所述,这些将累积突变数量与癌症发展相关联的间接论证,现已通过对个体癌症患者肿瘤细胞基因组进行系统性测序并汇编其包含的突变而得到证实。
许多癌症通过随机遗传变异的连续循环及自然选择逐步发展而成
对于那些已知具有特定外部诱因的癌症,疾病通常在接触致病因素很久之后才会显现。例如,肺癌的发病率往往在重度吸烟数十年后才开始急剧上升(图20-7)。同样,广岛和长崎遭受强辐射暴露的人群中,白血病发病率直到原子弹爆炸约五年后才出现显著增长。而有限期接触工业致癌物的工人,通常要在暴露10年、20年甚至更久之后,才会出现职业特征性癌症。在这漫长的潜伏期内,潜在癌细胞经历了一系列变化,这种情况同样适用于那些初始基因损伤没有明显外部诱因的癌症。
癌症的发展需要细胞内多个不同基因逐渐积累突变,这一事实有助于解释众所周知的肿瘤进展现象,即最初轻微的细胞行为异常逐渐演变为全面发展的癌症(图20-8)。
在进展的每个阶段,某些单个细胞会获得额外的突变或表观遗传变化,使其比邻近细胞更具选择优势,从而更能在恶劣环境中茁壮成长——这种肿瘤内部环境可能缺氧、营养匮乏,并受到周围正常组织形成的天然生长屏障限制。肿瘤细胞数量越多,至少有一个细胞发生有利于其生存的变异几率就越高。因此,随着肿瘤生长,进展速度加快。适应能力最强的细胞后代持续分裂,最终在发展中的病灶内形成优势克隆群 (图20-9)。因此,肿瘤进展包含大量随机因素且通常历时多年,这或许是大多数人最终死于非癌症原因的重要解释。
图 20-6 癌症患病率与年龄的关系。图中绘制了 2000 年监测、流行病学和最终结果(SEER)9 个癌症登记处女性恶性癌症患病率随年龄变化的情况。癌症患病率随年龄增长急剧上升。若仅需单次突变即可引发癌症,且突变在任何时间点发生概率均等,则各年龄段癌症患病率应保持一致。(数据来源:G. Harding 等人,《癌症》118 卷 1371-1386 页,2012 年,doi 10.1002/cncr:26376)
图20-7 吸烟与肺癌。20世纪初开始的吸烟量大幅增长(蓝线)导致约20年滞后周期后肺癌死亡人数急剧上升(红线)。由于吸烟量在1980年达到峰值,经过类似滞后周期后,目前肺癌死亡人数呈下降趋势。(数据来源:美国疾病控制与预防中心国家卫生统计中心,2017年)
正如动植物进化过程中常出现物种分化一样,癌细胞谱系也会发生某种分化:原始癌细胞可多样化产生许多遗传特性各异的亚克隆细胞群。这些亚克隆可能共存于同一肿瘤组织块中;也可能迁移并殖民于适合各自特性的不同微环境,在那里定居、增殖并作为独立演化的转移灶发展。随着每个肿瘤内部不断产生新突变,不同亚克隆可能获得生长优势并占据主导地位,但很快又会被其他亚克隆超越或被自身的次级亚克隆淘汰。大多数肿瘤中存在的高度遗传多样性是导致癌症难以根治的主要因素之一,这也凸显了尽早检测肿瘤的重要性。
遗传不稳定性可导致癌症急剧演化
如果癌细胞仅通过单个有害突变的逐渐积累而进化,那么从癌前病变转变为转移性癌症的时间尺度对于特定癌症类型应该是可预测的。然而事实并非如此。正如物种进化一样,癌症进化可能经历长时间无明显变化,随后突然产生新的表型。癌症进化的"大爆炸"理论认为,除了逐渐的诱变和对最适细胞的筛选外,周期性的灾难性基因组破坏可以促进癌细胞向恶性发展的快速演进。
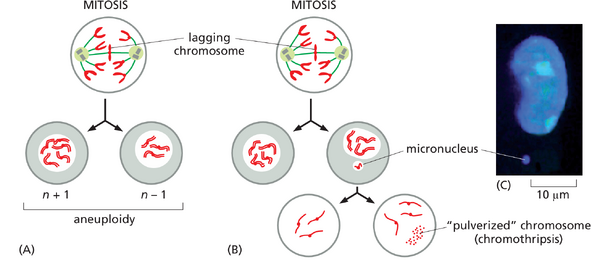
与正常分裂细胞不同,大多数人类癌细胞以异常快速的速度积累遗传变化,被称为具有遗传不稳定性。这种不稳定性通过加速肿瘤进展过程提供了选择优势——使得后续能够积累许多额外的突变,而这对癌症的发生是必需的。然而,这种不稳定的程度及其分子根源在不同癌症类型和不同个体之间,无论是在严重性还是性质上,都存在差异。在某些情况下,癌细胞的核型——即有丝分裂时染色体组的形态——是正常或接近正常的,但在个别基因中检测到许多点突变,这表明通常纠正 DNA 序列复制或维护错误的修复机制出现了故障。然而,常见的情况是,癌细胞的核型严重紊乱,伴随着许多染色体断裂和重排,导致基因组部分区域的缺失、重复和扩增(图 20-10)。这种高度破坏的基因组表明发生了灾难性事件,很可能是由于有丝分裂过程中染色体复制或分离的缺陷所致。例如,许多癌细胞的一个共同特征是未能正确将所有染色体附着到有丝分裂纺锤体上,这可能导致染色体断裂或非整倍性,即个别染色体的增加或丢失。 更为显著的是,有丝分裂缺陷还可能导致单个染色体被隔离在子细胞的"微核"中,这种情况极易引发大规模 DNA 损伤和染色体重排,这一现象被称为"染色体碎裂chromothripsis"(图 20-11)。
图20-9 肿瘤进展过程中的克隆演化。本示意图展示肿瘤通过多轮突变与增殖发展形成完全恶性癌细胞克隆的过程。每个阶段中,单个细胞发生增强增殖能力或降低死亡率的突变,使其后代成为肿瘤中的优势克隆。各克隆群的增殖通过扩大可能发生额外突变的细胞群体,加速肿瘤进展的下一阶段发生。此处描绘的最终步骤是突破基底膜的侵袭——转移的初始阶段。实际上,根据肿瘤类型不同,可能涉及超过三个发展阶段,且往往伴随遗传学与表观遗传学改变的共同作用。未在图中展示的是,随时间推移,肿瘤内常会涌现多种竞争性亚克隆。正如后续将讨论的,这种异质性使癌症治疗变得复杂。
图 20-8 展示了子宫颈上皮癌发展进程的各个阶段。病理学家采用标准化术语对在此类组织切片中观察到的病变类型进行分类。(A)在复层鳞状上皮中,分裂细胞仅限于基底层。(B)在这张低度上皮内瘤变的图像(右半部分)中,分裂细胞可见于上皮下三分之一区域;表层细胞仍呈扁平状并显示分化迹象。(C)在高度上皮内瘤变中,所有上皮层的细胞均呈现增殖状态并表现出异常分化。(D)当细胞突破或破坏上皮下方的基底层,侵入下方结缔组织时,真正的恶性肿瘤开始形成。(由 Andrew J. Connolly 提供。)
图 20-10 显示不同类型遗传不稳定性的结肠癌染色体组(核型)。(A) 典型癌症的核型显示染色体数量和结构存在大量显著异常。细胞间也可能存在相当大的变异(未显示)。(B) 具有稳定染色体组且染色体异常较少的肿瘤核型;这些肿瘤中的遗传异常大多不可见,由 DNA 修复缺陷造成。本图中所有染色体均按图 4-11 方法染色,每条人类染色体的 DNA 均采用不同组合的荧光染料标记。(由 Wael AbdelRahman 和 Paul Edwards 提供。)
从进化角度看,这一切都不足为奇:任何能增加基因功能随机变化概率(这些变化可在细胞代际间遗传且不致过于有害)的因素,都可能加速细胞克隆向恶性方向的演化,从而使该特性在肿瘤进展过程中被筛选出来。基因组不稳定性很可能也导致了单个肿瘤内常见癌细胞异质性的形成。通过引发多重异常核型、染色体错误分离、非整倍体——以及更罕见的染色体碎裂——这些机制如同洗牌般重组遗传信息,使得癌细胞能够尝试多种不同表型,并让不同克隆在群体中共存。
某些癌症可能潜藏少量干细胞群
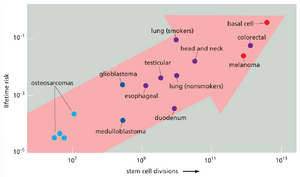
自我更新的组织,即细胞分裂在生命过程中持续进行的组织,是绝大多数人类癌症的滋生地。这些组织包括表皮(皮肤的外上皮层)、消化道和生殖道的上皮内衬,以及生成血细胞的骨髓(参见第22章)。每一次细胞分裂周期都伴随着突变的机会,而环境因素可能极大地放大这种突变。因此,特定组织中细胞分裂的频率与癌症发病率之间存在强烈的相关性(图20-12)。
在几乎所有增殖组织中,细胞更新依赖于干细胞的存在——这些干细胞通过分裂产生不再分裂的终末分化细胞。这就形成了基因完全相同、谱系密切关联但处于不同分化状态的细胞混合体。许多肿瘤同样呈现出由不同分化状态细胞群体构成的特征。将肿瘤发展过程与干细胞来源组织的正常稳态进行比较,或许能帮助我们更好地理解某些癌症的起源,以及为何部分肿瘤对治疗具有如此强的抵抗性。
要理解其含义,思考正常干细胞系统的运作方式会有所帮助。当正常干细胞分裂时,每个子细胞都面临选择——它可以继续保持为干细胞,也可以选择走向分化之路。保持干细胞特性的子细胞留在原位,为未来生成更多细胞。而选择分化的子细胞通常会经历几轮细胞增殖(作为所谓的过渡放大细胞),但随后停止分裂,最终分化并更替(可能通过凋亡死亡,其物质被回收利用,或从体内脱落)。因此,干细胞的数量往往远少于那些注定要终末分化的细胞。然而,尽管干细胞数量稀少、分布分散且通常分裂相对缓慢,它们却长期承担着维持组织完整性的全部责任。在健康机体中,反馈调控机制会通过调整细胞命运选择、细胞增殖与细胞死亡的平衡,对任何偏离正常细胞数量的情况进行修正。
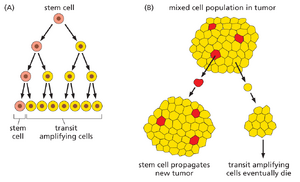
在癌症发展过程中,突变可能以多种方式颠覆正常的细胞分化程序;例如,导致过渡扩增细胞过度增殖,或抑制其终末分化或死亡。然而更为隐蔽的是那些导致癌症干细胞生成的突变。某些肿瘤似乎表现出这种病因:它们由具有自我更新能力的稀有癌症干细胞,以及数量远多于前者的分裂中过渡扩增细胞组成——这些过渡扩增细胞虽源自癌症干细胞,但自我更新能力有限(图20-13)。
癌症干细胞存在的证据来源于实验,其中将癌症中的单个细胞植入小鼠体内,测试其能否产生新肿瘤。半个多世纪以来已知,随机选取的肿瘤细胞以此方式测试时,通常仅有很小的概率——通常远低于 1% ——能生成新肿瘤。这本身并不证明肿瘤细胞具有异质性:如同撒在贫瘠土地上的种子,每个细胞可能仅有微小机会找到存活和生长的地点。然而,现代细胞分选技术显示,表达通常在干细胞表面发现的标记物的癌细胞亚群,其形成新肿瘤的能力显著增强。此外,新肿瘤由表达干细胞标记物和不表达标记物的细胞混合组成,所有这些细胞均源自同一表达标记物的创始细胞。癌症干细胞现象,无论其基础如何,意味着即使肿瘤细胞在遗传上相似,它们在表型上也可能多样化。 一种能清除某种状态下肿瘤细胞的治疗方法,常会放过其他构成威胁的存活细胞。例如,放疗或细胞毒性药物可能会选择性杀死快速分裂的细胞,将肿瘤体积缩减至近乎为零,却放过少数缓慢分裂的细胞,这些细胞最终会导致疾病复发。这大大增加了癌症治疗的难度,也是为何最初看似成功的治疗往往以复发和失望告终的部分原因。
癌症生长通常具有一组共同特征
显然,要形成癌症,细胞在进化过程中必须获得一系列异常特性——即一套颠覆性的新技能。不同癌症需要这些特性的不同组合。然而,所有癌症都具备某些共同特征。这些决定性特性通常与其他特征(如遗传不稳定性)相结合,助长这些异常细胞的产生和繁衍。癌细胞普遍具有的关键属性包括以下几点:
- 导致细胞生长和分裂速度超过死亡速度的稳态失衡
- 绕过细胞增殖的正常限制
- 逃避细胞死亡信号
- 细胞代谢的改变
- 操纵组织环境以支持细胞存活并规避有害免疫反应
- 细胞逃离其原生组织并在异位增殖(转移)
下文我们将更详细地讨论这些关键特征。在本章下一节中,我们将探讨构成癌细胞这些特性及其他特性的突变与分子机制。
癌细胞表现出生长与稳态控制的改变
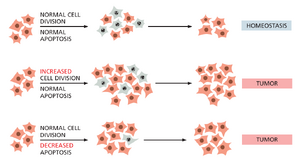
变异性和庞大的细胞群体数量为突变的发生提供了机会,但癌症发展的驱动力必须来自于突变细胞所具备的某种选择优势。最明显的是,突变或表观遗传变化可以通过提高细胞克隆的增殖速率,或使其在正常细胞停止增殖或死亡时仍能继续增殖,从而赋予这种优势。许多类型癌细胞最重要的特性之一是,在正常细胞会凋亡的情况下,它们却未能经历凋亡(图20-14)。
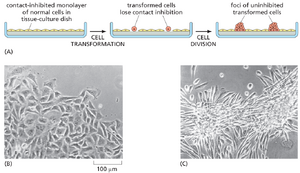
能够在培养中生长的癌细胞或人工改造以包含癌症中常见突变类型的培养细胞,通常表现出转化表型。它们在形态、运动性、对培养基中生长因子的反应,以及最典型的是对培养皿表面和彼此接触的反应方式上均表现出异常。大多数正常细胞除非附着于表面否则不会分裂,而转化细胞即使在悬浮状态下也常会分裂。更普遍地说,转化细胞不再需要正常细胞所需的所有来自周围环境的积极信号。此外,转化细胞无法识别某些负面影响。例如,当培养达到汇合(细胞相互接触)时,正常细胞的运动和分裂会受到抑制,而转化细胞即使在汇合后仍继续运动和分裂,因此在培养皿中层层堆积(图20-15)。
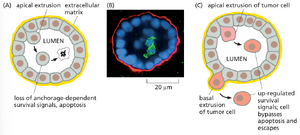
癌细胞在其自然环境中——即嵌入组织内部时——同样行为异常。例如,肠道上皮的正常细胞通过不断的分裂与死亡实现更新换代,却能通过将老化或受损细胞无缝排出至肠腔的方式维持屏障功能。这些细胞一旦脱离基质及相关的生存信号,便会通过细胞凋亡走向死亡。而癌变细胞通过颠覆正常的死亡信号,即便被排出上皮层仍可能存活。但由于细胞排出的正常方向是朝向肠腔,它们终究会被排泄通道清除。不过,癌症进展过程中筛选出的某些突变能够改变排出方向,从而使肿瘤细胞突破基底膜侵袭周围组织, 可能导致转移。 (图 20-16)。
总之,通过违背"何处生存、何时死亡"的正常规则,癌细胞既逃避了生长抑制,又获得了繁荣增殖的新机遇。
人类癌细胞突破细胞增殖的内在限制
许多正常人类细胞在培养中受刺激增殖时,其分裂次数存在内在限制:经过特定次数的群体倍增后(例如人类成纤维细胞为25-50次),它们会永久停止分裂。这种细胞分裂计数机制被称为复制性细胞衰老,通常取决于染色体末端端粒的逐渐缩短——这一过程最终会改变其结构(第17章将讨论)。如第5章所述,端粒 DNA 在 S 期的复制依赖于端粒酶,这种酶能维持特殊的端粒 DNA 序列,促进形成保护染色体末端的蛋白质帽结构。由于许多增殖中的人类细胞(干细胞除外)缺乏端粒酶,其端粒会随着每次分裂而缩短,保护帽逐渐退化,产生 DNA 损伤信号——因为未受保护的染色体末端类似于双链断裂。最终,改变的染色体末端会引发永久性细胞周期停滞或导致细胞死亡。
人类癌细胞通过两种方式之一规避复制性细胞衰老。最常见的是,它们在增殖过程中重新激活端粒酶基因,使端粒不再缩短或脱帽;或者,它们可以激活一种基于同源重组 DNA 修复机制的途径来延长染色体末端(称为 ALT)。无论采用哪种策略,结果都是癌细胞在正常细胞因端粒侵蚀而停止增殖的条件下仍能持续分裂。
癌细胞具有异常规避死亡信号的能力
一个大型多细胞生物需要强大的安全机制来防范受损和异常细胞带来的麻烦。这些机制至关重要,因为如前所述,大量突变细胞将不可避免地产生。通常情况下,内部紊乱会在故障细胞中引发危险信号,激活保护措施以逆转并治愈这种紊乱,或者如果失败,则激活导致细胞通过凋亡死亡的决策(参见第18章)。为了生存,癌细胞需要通过突变来规避或突破这些旨在清除缺陷细胞的防御机制。
癌细胞通常含有驱动细胞进入异常状态的突变,此时代谢过程可能失衡,必需细胞成分可能以比例失调的方式产生。这类细胞稳态机制无法应对所受干扰的状态,通常被笼统地称为细胞应激状态。例如,在癌症发展过程中常见染色体断裂及其他形式的 DNA 损伤,这反映了癌细胞表现出的遗传不稳定性。因此,为了无限生存和分裂,潜在的癌细胞必须积累使正常安全机制失效的变化,否则这些机制会促使应激细胞通过凋亡方式自杀。
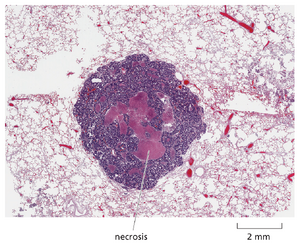
虽然癌细胞倾向于逃避凋亡,但这并不意味着它们很少死亡。相反,在大型实体瘤内部,细胞死亡往往大规模发生:生存条件恶劣,癌细胞之间为争夺氧气和养分展开激烈竞争。这些细胞大多通过另一种称为坏死(图20-17)的细胞死亡机制走向死亡。
肿瘤的生长是因为细胞增殖速度超过了细胞死亡速度,但通常仅以微弱优势。因此,肿瘤体积翻倍所需的时间可能远长于肿瘤细胞的细胞周期时间。
癌细胞的糖代谢发生改变
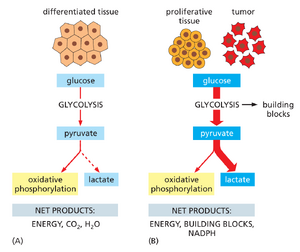
在氧气充足的情况下,大多数成体组织中的分化细胞会将摄入的葡萄糖中几乎所有的碳完全氧化为 CO2 ,最终由肺部作为废物排出。不断生长的肿瘤需要大量营养物质来提供构建新大分子的基础材料。相应地,大多数肿瘤在代谢上更类似于发育中的胚胎,而非正常成人组织。肿瘤细胞贪婪地消耗葡萄糖,从血液中摄取葡萄糖的速率可达邻近正常细胞的100倍之多。此外,这些被摄入的葡萄糖中只有一小部分通过线粒体氧化磷酸化,这通常能高效生产 ATP。相反,葡萄糖中碳原子的代谢被重新调整,以支持合成蛋白质、核酸和脂质所需的原材料生产,从而促进细胞增殖(图 20-18)。换言之,尽管糖酵解是一种比氧化磷酸化效率低得多的 ATP 生产方式,但在缺氧环境中的癌细胞中,它可以持续不断地进行,并且具有产生丰富细胞构建模块的关键附加益处。
肿瘤细胞即使在氧气充足的情况下也倾向于弱化氧化磷酸化,同时大量摄取葡萄糖,这种特性对许多癌细胞的快速增殖至关重要,被称为瓦博格效应——因奥托·瓦博格在二十世纪初首次发现此现象而得名。正是这种异常高的葡萄糖摄取能力,使得肿瘤能够在全身扫描中被选择性成像(见图20-1),从而为监测癌症进展及治疗反应提供了一种方法。
肿瘤微环境影响癌症发展
虽然肿瘤中的癌细胞携带有危险突变且通常明显异常,但肿瘤中的其他细胞——尤其是支持性结缔组织或间质中的细胞——绝非被动的旁观者。肿瘤的发展依赖于癌细胞与肿瘤间质之间的双向通讯,正如上皮器官的正常发育依赖于上皮细胞与间质细胞之间的通讯(第22章将讨论)。
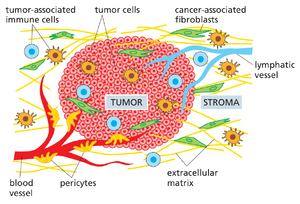
基质为肿瘤提供了结构框架。就正常结缔组织而言,基质由成纤维细胞、炎性白细胞以及形成血管和淋巴管内皮细胞及其伴随的平滑肌细胞构成(图20-19)。随着癌瘤的发展,癌细胞通过分泌信号蛋白改变基质细胞行为,并通过蛋白水解酶修饰细胞外基质,从而诱导基质发生变化。反过来,基质细胞通过分泌刺激癌细胞生长分裂的信号蛋白以及进一步重塑细胞外基质的蛋白酶,作用于肿瘤细胞。如此,肿瘤与其基质共同演化,犹如杂草与其入侵的生态系统,肿瘤可能变得依赖于其特定的基质细胞。利用小鼠进行的实验表明,某些移植的癌瘤的生长依赖于肿瘤相关成纤维细胞,而正常成纤维细胞则无法满足需求。
癌细胞与基质中的免疫系统细胞存在复杂的相互作用,这些免疫细胞若识别出肿瘤为异常组织则具有摧毁肿瘤的潜力,但也能通过提供刺激癌细胞增殖的信号来促进肿瘤生长。肿瘤至少能以两种方式操纵免疫系统为己所用:首先,肿瘤可能引发类似正常组织损伤时的炎症反应,这有助于其获取生存和生长所需的基质。因此,肿瘤常被比作无法愈合的伤口,引发包括附近血管通透性增加(允许信号分子自由进出血管)、细胞外基质沉积等相同反应。肿瘤还会刺激新血管形成(该过程称为血管生成),随着肿瘤体积增大内部出现缺氧时,血管生成能促进其存活。其次同样重要的是,肿瘤通过阻断可能导致其毁灭的白细胞活化,建立起免疫抑制微环境。 克服肿瘤抑制免疫反应能力的策略最近已成为癌症治疗中的有力工具,这些策略将在本章最后一节详细阐述。
癌细胞必须在异质环境中生存与增殖
为了致命,癌细胞通常需要通过一种称为转移的过程在体内新部位扩散并增殖。这是癌症最致命且最不为人知的方面,导致了 90% 的癌症相关死亡。癌细胞通过全身扩散,使得无论是手术还是局部放疗都几乎无法根除。转移本身是一个多步骤过程:癌细胞首先必须侵入局部组织和血管,通过循环系统移动,离开血管,然后在远处部位建立新的细胞群落(图20-20)。每个环节都极为复杂,其中涉及的大多数分子机制尚未明确,但最终步骤——远处部位的定植——是整个过程的限速环节。
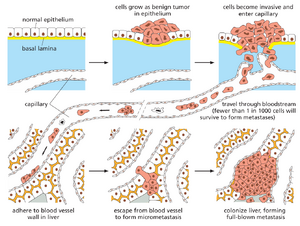
癌细胞若要变得恶性,必须摆脱那些约束正常细胞、使其保持在适当位置并防止侵入邻近组织的限制。因此,侵袭性是恶性肿瘤的一个决定性特征,这些肿瘤呈现出无序的生长模式和参差不齐的边界,并向周围组织延伸(例如,参见图20-8)。尽管其背后的分子变化尚未完全明了,但侵袭性几乎肯定需要破坏那些通常将细胞束缚在适当邻居和细胞外基质上的粘附机制。
转移过程的下一步——在远处器官建立集落——始于进入循环系统:侵袭性癌细胞必须穿透血管或淋巴管壁。淋巴管比血管更大且管壁更脆弱,允许癌细胞以小团块形式进入;这些团块随后可能被困在淋巴结中,形成淋巴结转移。相比之下,进入血管的癌细胞则以单个或极少数小簇形式存在。借助根据细胞表面特性分选细胞的现代技术,现已能够在癌症患者的血液样本中检测到这些循环肿瘤细胞(CTCs),尽管它们仅占血细胞总数的极小部分。值得注意的是,在小鼠模型中,CTC 团块形成转移的比率显著高于单个 CTC。据推测,上皮源性癌细胞之间的相互粘附有助于克服死亡信号并抑制细胞凋亡。
进入淋巴管或血液的癌细胞中,仅有极少数能成功脱出、在新部位定居,并在那里存活增殖成为转移灶的奠基者。要探究转移过程中哪个后续环节对癌细胞构成最大障碍,可用荧光染料或绿色荧光蛋白(GFP)标记细胞,将其注射入小鼠血液后追踪其命运(参见影片 20.4)。此类实验表明,无论源自易转移或非转移性肿瘤,多数细胞都能在循环系统中存活,滞留于微小血管并渗入周围组织。部分细胞在进入异体组织后立即死亡;另一些虽能成功侵入异质环境却无法增殖。另一些细胞分裂数次后便停止,形成包含十个至数千个细胞的小型转移灶。极少数能形成完全发展的转移瘤。实验表明,成功完成这一壮举的细胞不足千分之一,甚至可能是百万分之一。定植的最后一步似乎最为艰难:正如维京人在格陵兰荒凉海岸登陆时的遭遇,迁移的细胞可能无法在陌生环境中存活,或只能短暂繁衍形成一个小型群落——即微小转移灶——随后便消亡(参见影片20.5)。
许多癌症在形成转移灶前就被发现,通过清除原发肿瘤即可治愈。但偶尔会有未被发现的远处微小转移灶潜伏多年,直到原发肿瘤被切除很久后,才突然生长形成大型继发性肿瘤而显露踪迹。
摘要
癌细胞,顾名思义,是在违背正常调控的情况下生长和增殖(即具有肿瘤性),并获得侵袭周围组织并在远处器官定植的能力(即具有恶性)。通过形成继发性肿瘤或转移灶,它们变得难以通过手术或局部放疗根除。癌症被认为起源于单个经历了初始突变的细胞,但该细胞的后代必须经历许多进一步的变化才能癌变。肿瘤进展通常需要多年时间,反映了类似达尔文进化过程的作用,其中体细胞经历突变和表观遗传变化,伴随着自然选择以及偶尔爆发的基因组混乱,从而产生异质性。
癌细胞在演化、增殖和扩散过程中获得多种特殊属性。其突变基因组使它们能够无视正常严格控制细胞增殖的信号而生长分裂。作为肿瘤进展演化过程的一部分,癌细胞获得了诸多额外异常特征,包括:永久停止细胞分裂或响应细胞应激及 DNA 损伤而诱导凋亡的控制机制缺陷,以及阻止细胞偏离其正常位置的常规机制缺陷。所有这些变化增强了癌细胞在原始组织中生存、生长和分裂的能力,进而发生转移,在异质环境中建立新的病灶。肿瘤的演化还取决于肿瘤微环境中存在的其他细胞——统称为基质细胞,这些细胞被癌症吸引并受其操纵。
由于需要许多改变才能赋予这一系列非社会性行为,大多数癌细胞在遗传和/或表观遗传上不稳定并不令人意外。这种不稳定性被认为是在能够产生肿瘤的异常细胞克隆中被选择的,因为它极大地加速了肿瘤进展所需的进一步遗传和表观遗传变化的积累。
癌症关键基因:发现方式与功能解析
正如我们所知,癌症依赖于体细胞中可遗传变化的积累;也就是说,这些变化会通过细胞传递给其后代。要在分子层面理解这一点,我们需要识别出相关的突变和表观遗传改变,并揭示它们如何导致癌细胞行为。找到相关细胞通常较为容易;它们受到自然选择的青睐,并通过形成肿瘤而引起注意。但是,我们如何在癌细胞的所有其他基因中识别出那些经历了促癌变化的基因呢?典型的癌症依赖于一整套突变和表观遗传变化,这些变化在两位不同患者中从未完全相同,尽管某些肿瘤类型之间存在共性。此外,一个给定的癌细胞还会包含大量体细胞突变,这些突变是其遗传不稳定性的偶然副产品——即所谓的“乘客”而非“驱动”突变,并且很难将这些偶然变化与关键变化区分开来。
从那些在疾病中具有因果作用的变化中区分出来。尽管存在这些困难,过去40年间,许多在人类癌症中反复发生改变的基因已被识别。我们暂且将这些基因称为癌症关键基因,意指所有其改变可能促成癌症发生或演化的基因。
在本节中,我们将首先讨论如何识别癌症关键基因。随后我们将审视它们的功能及其在赋予癌细胞本章第一部分所述特性中所起的作用。最后,我们将以结肠癌作为扩展案例结束本节,展示癌症关键基因中的一系列变化如何使肿瘤从一种不良行为模式演变为更恶劣的另一种模式。
功能获得性与功能缺失性癌症突变的识别传统上需要不同的方法
癌症关键基因根据其风险源于基因产物活性过高或过低,被划分为两大类。第一类基因中,功能获得性突变可驱动细胞癌变,称为原癌基因;其突变型、过度活跃或过度表达的形式则称为癌基因。第二类基因中,功能丧失性突变可能促成癌症,称为抑癌基因。无论哪种情况,突变都可能直接导致癌症(如使本不应增殖的细胞异常增殖),或间接导致癌症;例如,通过引发遗传或表观遗传不稳定性,从而加速其他直接刺激肿瘤生长的遗传变化的发生。那些因改变而导致基因组不稳定性的基因,构成了癌症关键基因的一个亚类,有时被称为基因组维护基因genome maintenance genes。
正如我们将要看到的,癌基因和抑癌基因的突变在促进癌症发展方面可能产生相似效果;例如,细胞增殖信号的过度产生可能源于任何一种突变。因此,从癌细胞的角度来看,癌基因与抑癌基因——以及影响它们的突变——实为一体两面。然而,导致这两类基因被发现的研究技术却截然不同。
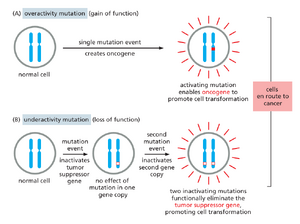
原癌基因单拷贝突变转化为癌基因时,会对细胞产生显性的促生长效应(图 20-21A)。因此,我们可以通过将癌基因添加到合适的测试细胞或实验动物基因组中(例如通过 DNA 转染或病毒载体转导)时产生的效应来识别它。相反,对于抑癌基因而言,由突变产生的致癌等位基因通常是隐性的:通常(但并非总是)需要移除或灭活二倍体体细胞中的两个正常基因副本才能观察到效应(图 20-21B)。这为采用不同的实验方法提供了依据,即专注于发现癌细胞中缺失的内容。
我们首先讨论几类癌症关键基因的实例以阐明基本原理。这些案例的选择也基于其历史重要性:导致它们被发现的实验——在不同时期通过不同方法——标志着癌症认知历程的转折点。
逆转录病毒引领了癌基因的鉴定
人类癌症遗传原因的探索走过了一条曲折的道路,始于对肿瘤病毒研究提供的线索。尽管病毒仅与少数人类癌症有关,但一组感染动物的病毒为研究癌症提供了关键的早期工具。
首个被证实与癌症相关的动物病毒之一是在 100 多年前于鸡体内发现的,当时一种导致结缔组织肿瘤(即肉瘤)的传染源被确认为病毒——劳斯肉瘤病毒。与之后发现的所有其他 RNA 肿瘤病毒一样,它属于逆转录病毒。当它感染细胞时,其 RNA 基因组通过逆转录过程被复制成 DNA,并插入宿主基因组中,可在其中持续存在并被后续细胞世代遗传。劳斯肉瘤病毒插入的 DNA 中有某种物质使宿主细胞癌变,但这究竟是什么呢?答案令人意外。原来是一段对病毒自身生存或繁殖并非必需的 DNA;相反,它是一个“乘客”,一个名为 Src 的基因,是病毒在其传播过程中获取的。Src 基因与所有脊椎动物基因组中都存在的一个基因——c-Src 基因——明显相似但不完全相同,后者编码一种蛋白酪氨酸激酶。 c-Src 显然是被逆转录病毒意外地从先前感染宿主细胞的基因组中获取,并在此过程中发生突变成为致癌基因( v - Src)。
在这项诺贝尔奖获奖成果之后,涌现出大量关于其他逆转录病毒携带的致癌基因的发现,这些病毒会导致非人类动物罹患癌症。每一个这样的致癌基因都被证实与正常脊椎动物基因组中的原癌基因相对应。与 Src 的情况类似,这些其他致癌基因通常在结构或表达水平上与其正常对应基因存在差异。
但这与典型的人类癌症有何关联?在那些癌症中,逆转录病毒并未被确认发挥作用。在一项旨在识别人类致癌基因的实验中,研究人员从人类肿瘤细胞中提取 DNA,将其分割成片段,并引入培养的小鼠细胞中。培养皿中开始偶尔出现异常增殖的细胞集落,这些细胞展现出转化表型,其生长速度超过培养皿中未转化的细胞,并层层堆积(见图 20-15)。每个集落都是一个克隆,源自单个细胞,该细胞整合了驱动癌性行为的 DNA 片段。经分离和测序后,这些 DNA 片段被发现含有一个人类版本的基因,该基因此前已在研究一种导致大鼠肿瘤的逆转录病毒时为人所知——一种名为 v - Ras 的致癌基因。这一新发现的致癌基因显然是由正常人类基因突变而来,属于一小类名为 Ras 的原癌基因家族。20 世纪 80 年代初,人类肿瘤细胞与动物肿瘤病毒中同一致癌基因的发现令人震惊。 癌症由少数关键癌症基因突变引起的这一观点,彻底改变了我们对癌症分子生物学的理解。
如第 15 章所述,正常的 Ras 蛋白是单体 GTP 酶,协助将信号从细胞表面受体传递至细胞内部(参见影片 15.7)。从人类肿瘤中分离出的 Ras 致癌基因含有位点突变,这些突变会产生过度活跃的 Ras 蛋白,使其无法通过水解结合的 GTP 为 GDP 来自行关闭。由于这种突变导致蛋白质过度活跃,其效应呈显性;即细胞的两个基因副本中只需一个发生改变即可产生影响。在所有人类癌症中,约 30% 存在三种人类 Ras 家族成员中某一种的突变。因此,Ras 基因成为所有关键癌症基因中最为重要的成员之一。
癌症中突变的基因可通过多种方式变得过度活跃
图 20-22 总结了原癌基因转变为癌基因的几种机制。(1)DNA 序列的微小变化,如点突变或缺失,若发生在蛋白质编码区内可能产生过度活跃的蛋白质,若发生在基因调控区域则可能导致蛋白质过量表达。(2)基因扩增事件(例如由 DNA 复制错误引起)可能产生额外的基因拷贝,从而导致蛋白质过量生成。(3)染色体重排——涉及 DNA 螺旋的断裂与重连——可能改变蛋白质编码区域形成过度活跃的融合蛋白,或改变基因调控区域导致正常蛋白质的过度表达。
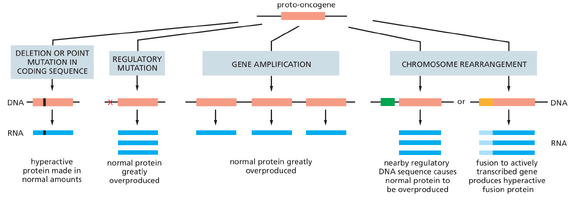
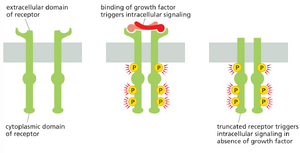
例如,表皮生长因子(EGF)这种胞外信号蛋白的受体,可通过缺失部分胞外结构域的突变而被激活,导致其在缺乏 EGF 的情况下仍保持活性(图 20-23)。这种突变的 EGF 受体因此会产生不当的刺激信号,就像故障的门铃即使无人按动也会自鸣。此类突变常见于最常见的人类脑肿瘤——胶质母细胞瘤中。
再举一例,Myc 蛋白在细胞核内促进细胞生长与分裂(参见第 17 章),其正常形式的过量产生通常会导致癌症。某些情况下,该基因会发生扩增,即 DNA 复制错误导致单个细胞内产生大量基因拷贝。或者点突变可使这种通常快速更新的蛋白质变得稳定。更常见的是,过量生产似乎源于作用于该基因的调控元件发生变化。例如,染色体易位可能错误地将强效基因调控序列与 Myc 蛋白编码序列相邻,从而产生异常大量的 Myc mRNA。因此,在伯基特淋巴瘤中,易位使 Myc 基因受控于通常驱动 B 淋巴细胞中抗体基因表达的序列,导致突变 B 细胞过度增殖并形成肿瘤。不同的特异性染色体易位在其他癌症中也较为常见。
对罕见遗传性癌症综合征的研究首次鉴定出抑癌基因
识别癌细胞基因组中失活的基因需要不同于寻找过度活跃基因的策略:例如,无法通过细胞转化实验来识别根本不存在的东西。导致首个抑癌基因发现的关键洞见来自于对一种罕见人类癌症——视网膜母细胞瘤的研究,这种癌症源于视网膜细胞,仅需极少数突变即可转化为癌变状态。正如生物学中常见的那样,这一发现始于对特殊案例的考察,但最终揭示了一个具有广泛重要性的基因。
视网膜母细胞瘤多发于儿童期,肿瘤由未成熟视网膜中的神经前体细胞发展而来。约每两万名儿童中有一名患病。该疾病分为遗传性和非遗传性两种形式。遗传性病例通常双眼独立出现多个肿瘤;而非遗传性病例仅单眼受累,且通常只有一个肿瘤。少数视网膜母细胞瘤患者可见染色体核型异常,表现为13号染色体特定区带的缺失——若该缺失被遗传,将显著增加患病风险。在部分非遗传性患者的肿瘤细胞中也发现了相同区域的缺失,这表明该癌症是由该关键基因位点的缺失所引发。
通过定位这一染色体缺失的位置,科学家得以识别出 Rb 基因。随后发现,患有遗传性该疾病的患者在每一个体细胞中,其 Rb 基因的一个拷贝存在缺失或功能丧失突变。这些细胞虽具有癌变倾向,但只要保留一个完好的基因拷贝就不会癌变。而癌变的视网膜细胞由于体细胞事件消除了先前完好拷贝的功能,导致 Rb 基因的两个拷贝均存在缺陷。
相比之下,在非遗传性该疾病患者中,非癌变细胞的 Rb 基因两个拷贝均无缺陷,而癌变细胞的两个拷贝则均出现缺陷。这类非遗传性视网膜母细胞瘤极为罕见,因为它们需要两个独立事件在同一视网膜细胞谱系中使两条染色体上的相同基因失活(图 20-24)。
在几种常见的散发性癌症中, Rb 基因同样缺失,包括肺癌、乳腺癌和膀胱癌。这些更为常见的癌症是由一系列比视网膜母细胞瘤更为复杂的遗传变化引发的,且发病时间通常较晚。但在所有这些癌症中, Rb 功能的丧失似乎常常是向恶性进展的关键一步。
该 Rb 基因编码的 Rb 蛋白,是体内几乎所有细胞周期的一种普遍调节因子(见图 17-59)。它作为细胞分裂周期进程的主要制动器之一,其缺失可能导致细胞不适当地进入细胞周期,这一点我们将在后面讨论。
图 20-24 导致视网膜母细胞瘤的遗传机制。在遗传性病例中,体内所有细胞都缺失两个正常功能性抑癌基因副本中的一个,而肿瘤则源于某个细胞克隆,其中剩余的副本因体细胞事件(突变或表观遗传沉默)而丢失或失活。在非遗传性病例中,所有细胞最初均含有该基因的两个功能性副本,肿瘤的发生是由于两个体细胞事件巧合地发生在同一细胞系中,导致两个副本均丢失或失活。
遗传与表观遗传机制均可导致抑癌基因失活
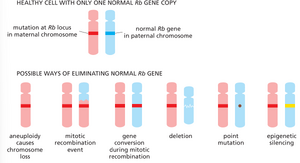
遗传与表观遗传机制均可导致抑癌基因失活对于抑癌基因而言,其失活状态才是危险的。这种失活可通过多种方式发生,不同的异常组合可导致两个基因拷贝同时被消除或功能受损。例如,第一个拷贝可能因染色体微小缺失而丢失,或因 DNA 复制过程中的随机错误导致点突变失活;第二个拷贝则更常通过非特异性机制被清除——这种机制易发生于向癌症发展且已出现基因组不稳定的细胞中。例如,携带剩余正常拷贝的染色体可能在细胞分裂过程中丢失(见图 20-11),或由于染色体分离错误受损;亦或正常基因及其邻近遗传物质可能通过有丝分裂重组事件或伴随的基因转换被突变版本取代(参见 305-306 页)。表观遗传改变则为抑癌基因的永久性失活提供了另一重要途径。 最常见的情况是,其启动子中 CG 序列的 C 核苷酸可能以可遗传的方式发生甲基化,这能在细胞及其所有后代中不可逆地使该基因沉默(参见第 435-436 页)。图 20-25以 Rb 基因为例,总结了通过 DNA 序列或表观遗传变化导致抑癌基因剩余完好拷贝功能丧失的各种途径。
癌细胞基因组的系统测序彻底改变了我们对这种疾病的理解
我们上述所描述的方法揭示了一组以零散方式被识别的癌症关键基因。与此同时,癌细胞基因组的其余部分仍处于未知之中:那里潜藏着多少其他突变、属于何种类型、出现在哪些癌症种类中、频率如何、个体间差异多大以及带来什么后果,都是未解之谜。随着人类基因组的测序完成和 DNA 测序技术的巨大进步(见图 8-44),现在我们已经能够一览全貌——全面审视癌细胞基因组。这彻底改变了我们对这种疾病的理解。
癌细胞基因组可通过多种不同方式进行系统性扫描。最极端的方法——虽然成本最高但已不再令人望而却步——是对肿瘤进行全基因组测序。更经济的方式是仅关注人类基因组中约 21,000 个编码蛋白质的基因(即外显子组),寻找癌细胞 DNA 中导致产物氨基酸序列改变或阻碍其合成的突变(图 20-26)。此外,DNA 测序还能检测基因组中发生缺失或重复的区域,揭示拷贝数变异及染色体增减(非整倍性)。基因组扫描还可检测表观遗传变化,揭示 DNA 甲基化模式的改变或伴随转录沉默或激活而不影响 DNA 序列的其他变化。通过系统性 RNA 测序,可分析 mRNA(见图 7-5)及调控性非编码 RNA 水平,从而揭示基因表达水平的变化。 最后,为了通过检测已知关键癌症基因的蛋白质产物来直接测量其表达,可以利用质谱技术对肿瘤细胞裂解液进行定量分析。这些方法涉及将癌细胞与正常对照组进行比较——理想情况下,对照组应来自同一组织且同一患者的非癌细胞。
通过美国国立卫生研究院协调的"癌症基因组图谱"联盟,上述高通量方法的组合已应用于涵盖 33 种癌症类型的超过 10,000 个肿瘤样本。其他国际性免费资源,如 COSMIC(癌症体细胞突变目录),正在持续汇编新的癌症数据。正如我们下文将讨论的,这些大规模项目重要地揭示了癌症基因组中存在哪些类型的变异、不同癌症类型之间及内部哪些基因或通路发生改变,以及肿瘤内癌细胞的异质性有多大,以及疾病进展和治疗过程中改变模式随时间演变的特点。
图 20-26 癌基因与抑癌基因中发现的 DNA 序列变化类型对比。本图中,改变氨基酸的突变用蓝色箭头标示,而截断多肽链的突变则用黄色箭头标示。(A)如此例所示(产生磷酸肌醇 3-激酶亚基的 PIK3CA 基因),癌基因突变可通过基因错义突变中反复出现的相同核苷酸变化来识别。(B)如此例所示( Rb 基因),抑癌基因中以产生终止密码子中断蛋白质合成的错义突变为主。需注意蛋白质编码序列中仅少数可能突变具有激活作用,而失活可能是错义、无义和移码突变的结果。(改编自 B. Vogelstein 等人,《科学》339 卷 1546-1558 页,2013 年。)
许多癌症具有高度紊乱的基因组
癌症基因组分析首先揭示了癌细胞中大规模遗传破坏的程度。这在癌症类型之间以及不同癌症患者之间差异巨大,无论是严重程度还是性质特征。如前所述(见第 1169 页),染色体核型可能看似正常,但由于修复机制失效——这些机制通常负责纠正 DNA 序列复制或维护过程中的错误——导致单个基因中存在大量点突变。然而,核型常常极度紊乱,伴随着许多染色体断裂、重排以及完全混乱的染色体序列,这表明 DNA 发生了广泛断裂后随机重组(如染色体碎裂现象;见图 20-11)。从这些变化模式可以推断,在肿瘤进化过程中破坏性事件反复发生,遗传紊乱呈渐进性加剧。
许多人类癌症的一个共同特征是染色体非整倍性——即染色体核型从正常数目(46 条)发生改变。一项针对超过 10,000 个癌症基因组的染色体水平增益或缺失的研究显示,大多数癌症类型都具有特征性的染色体异常模式,不同臂或整条染色体以不同频率发生改变。在许多情况下,由于细胞分裂完全失败,整套染色体被复制或四倍化,产生多倍体细胞,随后经历额外的染色体增益和丢失。几乎 90% 的被调查癌症都显示出某种程度的非整倍性。图 20-27 展示了部分数据,呈现了特定肿瘤类型,每种类型都显示出独特的非整倍性模式。例如,虽然 74% 的甲状腺癌显示出正常核型,但仅有不到 5% 的胶质母细胞瘤和宫颈癌肿瘤拥有正常染色体数目。尽管非整倍性程度通常是癌症类别的特征,但异质性也同样明显。 例如,胶质母细胞瘤的一个亚型以7号染色体增益和10号染色体缺失为特征,但这种缺陷组合并非在所有病例中都存在,表明存在多种基因组紊乱途径,可导致不同的癌症亚型。
癌症基因组研究还揭示了导致基因组紊乱的根本缺陷。例如,在卵巢癌中,染色体断裂、易位和缺失极为常见,这些异常与同源重组修复 DNA 双链断裂所需基因(尤其是 Brca1 和 Brca2)的高频突变和表观遗传沉默密切相关(参见第 300-301 页)。另一方面,在部分子宫内膜癌中,则发现大量点突变遍布基因组,这可能是由 DNA 复制过程中校对所需酶类突变所致(参见第 267-269 页)。由此可见,不同癌症及其亚型具有高度可变的突变率,范围从某些儿科癌症每个外显子组仅一个碱基替换,到诱变剂诱导的恶性肿瘤(如肺癌和黑色素瘤)每个外显子组数千个突变不等。
表观遗传与染色质改变助推多数癌症发生
迄今为止,我们主要关注的是直接促成癌症特征的癌症关键基因突变。然而,对癌症发生同样重要的是表观遗传上改变基因表达而不改变 DNA 序列的变化。如前所述,增加如 Rb 等基因启动子区域的 DNA 甲基化可永久沉默该基因。此外,可逆的共价修饰如甲基化和乙酰化也发生在将 DNA 包装成染色质的组蛋白上。这些组蛋白标记通过改变染色质的构象及其对转录因子和染色质重塑复合物等调控因子的可及性来调节基因表达(参见第七章)。大规模基因组测序项目的一个重要发现是,大约 50% 的人类癌症在染色质蛋白中存在突变,这包括那些负责添加、移除或识别组蛋白和 DNA 上共价标记的酶的突变。许多由此产生的缺陷有可能导致可遗传的表观遗传变化,这些变化调节基因表达并促进肿瘤发生。
图 20-27 不同肿瘤类型中非整倍体的普遍性。每种肿瘤类型检测到的染色体臂总数绘制于 X 轴。正常核型中的染色体臂数量已标注。同时展示了基因组倍性状态(黑色表示未倍增,蓝色表示一次基因组倍增,红色表示两次或更多次基因组倍增)。各肿瘤类型中拥有相应染色体臂数量的肿瘤样本数通过 Y 轴上条形长度表示。需注意,某些肿瘤类型的样本主要呈现正常核型,而其他肿瘤类型的样本则因广泛存在的非整倍体现象表现出染色体臂数量急剧增加的极端异质性。(改编自 A.M. Taylor 等人,《癌细胞》33:676-689, 2018。)
通常,遗传和表观遗传变化共同作用导致癌症(图 20-28)。在某些情况下,表观遗传变化先于特征性的致癌突变,甚至可能引发这些突变,例如当负责修复 DNA 损伤的基因因表观遗传沉默而增加突变率时。在其他情况下,DNA 序列的意外变化可能破坏染色质和表观遗传调控。一个例子是编码异柠檬酸脱氢酶(IDH)的基因发生功能获得性突变,已知这是包括胶质瘤、白血病和其他肿瘤在内的多种癌症中常见的起始事件。突变的 IDH 产生高水平的代谢物 2-羟基戊二酸,该物质抑制 DNA 去甲基化酶。因此,IDH 突变细胞中的 DNA 在基因组随机位点出现超甲基化。正如 DNA 突变一样,那些在生长或生存方面提供选择优势的表观遗传变化将使受影响的细胞及其后代得以持续存在并积累更多变化,从而促进癌症进展。
突变 IDH 对 DNA 超甲基化的间接影响揭示了另一个重要观点:代谢条件会影响染色质状态,进而可能影响基因表达。值得注意的是,只有少数具有异常 DNA 甲基化的癌症可由潜在的遗传事件解释。这些观察结果表明,环境条件本身可能并不具有诱变性,但可以作为表观遗传变化的来源。许多 DNA 和组蛋白修饰酶需要代谢物作为辅因子,这为已知的人类癌症风险因素(如饮食和炎症)与癌症发展之间提供了潜在联系。
除了调控单个基因的表达外,表观遗传变化还能对染色质状态产生更全局性的影响,从而调控决定细胞行为程序的基因网络。例如,由表观遗传标记决定的不同基因表达模式,可能限制细胞启动凋亡的能力,或阻止其退出细胞周期并发生分化。癌症中存在此类变化的证据来源于对罕见儿童脑肿瘤的研究——这些肿瘤缺乏体细胞突变,却表现出异常的 DNA 甲基化谱。
必须牢记的是,由表观遗传调控导致的基因激活与沉默模式改变,是细胞分化的正常特征。通过精确的发育程序,同一基因组得以产生并维持多种不同细胞类型(参见第21章)。因此,与癌细胞的其他特性一样,表观遗传变化并非新的生物学现象,而是对现有细胞机制的颠覆。
数百种人类基因与癌症发生相关
在目前已识别的数十亿个癌细胞体细胞突变中,我们如何发现哪些是癌症的驱动因素,即疾病发展中的致病因子?显然,大多数突变仅仅是乘客突变——由于基因不稳定性,这些突变恰好与驱动突变发生在同一细胞中,但与癌症的发展无关。一个判断标准是发生频率。影响疾病相关基因的驱动突变会在许多患有特定类型癌症的不同个体中反复出现。相反,不赋予癌细胞选择性优势的乘客突变可能只会罕见地出现。
通过汇编不同类型癌症的基因组序列数据(每种癌症都有其特定的一组已识别驱动突变),我们可以建立一个被强烈怀疑至少对一种肿瘤类型至关重要的癌症关键基因的全面的目录。目前估计这类基因总数约为 300 个,约占人类基因组基因数量的 1% 。这些癌症关键基因惊人地多样化,揭示了机制上意想不到的广度。虽然部分新发现的癌症基因编码了可能预期会在癌细胞中发生突变的经典信号传导和细胞周期蛋白,但其他基因则归属于新颖且有时令人惊讶的类别。这些功能涵盖代谢、染色质生物学、RNA 剪接、蛋白质稳态和细胞分化等多个方面。显然,在任何组织中,这些过程的改变都可能促使细胞演化出第 1172 页所列的癌变特性。
图20-28 表观遗传与遗传机制可协同促进癌症的演变。基因突变和环境因素(如代谢状态)均可导致表观遗传变化。如图所示,这些表观遗传变化反过来会加速遗传及进一步表观遗传变化的积累——通过改变基因表达的方式促进癌细胞增殖,并在细胞克隆中遗传,从而加快癌症进展的进程。
显然,导致癌症的分子变化是复杂的。然而,正如我们现在所要说明的,这种复杂性并不像最初看起来那么令人生畏。
少数关键通路的紊乱常见于多种癌症
某些基因,如 Rb 和 Ras ,在多种癌症及不同类型癌症病例中频繁发生突变。像 Rb 和 Ras 这类基因参与癌症发生并不令人意外,鉴于我们已了解其正常功能:它们调控细胞分裂与生长的基本过程。但即便是这些常见元凶,在个体病例中的占比也远低于半数。在众多癌症案例中,当例如 Rb 保持完整或 Ras 未发生突变时,这些过程的调控机制究竟出现了什么问题?其他数百个癌症关键基因的突变在疾病发展中扮演着怎样的角色?随着对人类基因组中基因正常功能认知的不断深入,我们越来越容易从已收录的驱动突变中发现规律,并为这些问题提供简明的解答。
为了阐明所揭示的模式类型,以致命疾病胶质母细胞瘤——人类最常见脑癌为例。对 91 名患者肿瘤细胞基因组的分析共识别出至少 79 个在多个个体中发生突变的基因。这些基因中大多数正常功能已知或可推测,因此能够将其归类至特定生化或调控通路。其中三个功能组别尤为突出,涵盖了 21 个高频突变基因。第一组由 Rb 通路基因构成(即 Rb 本身及其直接调控基因 Rb ),该通路主导细胞分裂周期的启动;第二组包含与 Ras 处于同一调控子网络的基因——以其三个核心组分命名为 RTK/Ras/PI3 激酶通路,负责将细胞生长与分裂信号从胞外传递至胞内;第三组由调控应激反应与 DNA 损伤修复的通路基因组成——即 p53 通路。 关于这些通路,我们将在下文进一步阐述。
在 91 例胶质母细胞瘤中, 74% 所有三种通路均存在可识别的突变。若进一步追溯这些通路上游,并纳入所有已知和未知的依赖组件,这一比例几乎必定更高。换言之,几乎在每一例胶质母细胞瘤中,都存在破坏三种基本调控机制的突变:细胞生长调控、细胞分裂调控,以及应激与 DNA 损伤应答调控。
值得注意的是,在任何特定的肿瘤细胞克隆中,每个通路中通常只有一个基因发生突变。显然,对肿瘤进化而言,关键在于控制机制的破坏,而非实现这一破坏的遗传手段。例如,在某个肿瘤细胞的 Rb 基因本身未发生突变的个体中,通常会在 Rb 通路的其他组分中发现突变,从而产生相似的生物学效应。这表明,若某通路已因其他位置的突变而失活,则该通路中的突变体不会受到进一步的选择压力。
类似模式在其他类型癌症中亦有体现。例如,在对主要类型卵巢癌的大量样本调查中,发现 67% 的个体具有 Rb 通路突变, 45% 在 Ras/PI3 激酶通路中(定义比胶质母细胞瘤研究中的更狭义),以及超过 96% 在 p53 通路中。考虑到分析中未包含的其他通路成分,似乎这种癌症的大多数病例也都有突变破坏了相同的三种控制机制,导致细胞生长失调、细胞增殖失调以及对压力和 DNA 损伤的异常忽视。
图 20-29 导致肿瘤发生的三大主要细胞通路。此处列出的具体案例将在本章详述。由 Rb 控制的细胞周期事件详见第 17 章。
似乎这三种基本控制在几乎所有类型的癌症中都以某种方式被颠覆。然而,由于特化组织可能依赖不同的机制将环境信号传递至核心控制机制,这些控制在不同类型的癌症中可通过不同的方式被颠覆。事实上,在细胞发育和组织维持过程中进行通信的所有主要信号通路中(第15、21和22章讨论),几乎都能找到驱动突变的例子。
图 20-29 概括了刚刚描述的三种核心通路,将其简称为细胞周期、细胞增殖和细胞存活。我们先前已讨论过 Rb 蛋白(参见第 1182-1183 页),并用整个章节(第 17 章)专门阐述了细胞周期调控机制。接下来将回顾图 20-29 中另外两条调控通路的重要细节。
PI3 激酶/Akt/mTOR 通路的突变驱动癌细胞生长
细胞增殖不仅仅是细胞周期的推进过程,还需要协调的细胞生长——这涉及复杂的合成代谢过程,通过该过程细胞能从小分子前体合成所有必需的大分子(图20-30)。因此,癌症的发生不仅依赖于细胞周期进程约束的缺失,还取决于细胞生长调控机制的紊乱。
RTK/Ras 激活的下游,PI3 激酶/Akt/mTOR 细胞内信号通路对细胞生长调控至关重要。如第 15 章所述,包括胰岛素和胰岛素样生长因子在内的多种细胞外信号蛋白通常激活此通路。然而,在癌细胞中,该通路因突变而被激活,使得细胞能在缺乏此类信号的情况下生长。如图 20-30B 所示,由此导致的 Akt 和 mTOR 蛋白激酶的异常激活不仅刺激蛋白质合成,还显著增加葡萄糖摄取以及细胞质中用于脂质合成的乙酰辅酶 A 的生成。
PI3K/Akt/mTOR 通路的异常激活通常出现在肿瘤进展早期,这有助于解释肿瘤细胞中观察到的糖酵解速率异常升高现象——即如前所述(见图 20-18)的瓦博格效应。根据我们之前的讨论可以预期,癌症可通过多种不同方式激活该通路。例如,生长因子受体可能发生异常激活,如图 20-23 所示。癌症中同样常见的是磷酸酶与张力蛋白同源物(PTEN)磷酸酶的缺失,该酶正常情况下起抑制该通路的作用。PTEN 通过使磷脂酰肌醇 3,4,5-三磷酸去磷酸化来抑制 PI3K/Akt/mTOR 通路 \left[\mathrm{PI}(3,4,5)\mathrm{P}_3\right]
图 20-30 细胞增殖似乎需要两类信号。(A)为成功增殖,大多数正常细胞既需要驱动细胞周期进程的胞外信号(此处显示为蓝色有丝分裂原),也需要驱动细胞生长的胞外信号(此处显示为红色生长因子)。有丝分裂原如何通过 Rb 通路激活信号传导以驱动细胞进入周期,详见图 17-59。(B)展示通过激活 Akt 和 mTOR 驱动细胞生长的信号系统示意图,该系统极大刺激葡萄糖摄取与利用,包括将线粒体中糖代谢中间产物产生的过量柠檬酸转化为胞质脂质合成和新膜生成所需的乙酰辅酶 A。如图所示,蛋白质合成亦随之增强。该信号系统在肿瘤进展早期即异常激活。TCA 循环指三羧酸循环(柠檬酸循环)。
PI3 激酶生成的分子(见第 920 页)。PTEN 在肿瘤中常见突变。
p53 通路突变使癌细胞在应激和 DNA 损伤条件下仍能存活并增殖
癌细胞必须打破控制细胞生长和分裂的正常规则,这一点显而易见:这正是癌症定义的一部分。但为何癌细胞在应对压力和 DNA 损伤时也表现异常,这一点却不那么明显,然而这几乎是一个普遍特征。位于这一反应核心的基因—— p53 基因,在所有癌症病例中约有 50% 发生突变,这一比例高于任何其他已知的关键癌症基因。当我们将与 p53 功能密切相关的其他基因一并考虑时,发现大多数癌症病例在 p53 通路中存在突变。为什么会这样?要回答这个问题,我们首先必须考虑这一通路的正常功能。
与 Rb 蛋白不同,在正常情况下,体内大多数细胞所含的 p53 蛋白非常少:尽管该蛋白会被合成,但会迅速降解。基因的两个拷贝均被删除或失活的小鼠,除了一个共同特征——普遍在 10 月龄前罹患癌症外,通常在所有方面都表现正常。这些观察结果表明,p53 的功能仅在特殊情况下才需要。事实上,细胞会在一系列条件下提高 p53 蛋白的浓度,这些条件只有一个明显的共同点:从细胞的角度来看,它们都是病理性的,使细胞面临死亡或严重损伤的风险。这些条件包括 DNA 损伤、
图 20-31 p53 肿瘤抑制因子的作用模式。p53 蛋白是一种细胞应激传感器。响应于过度增殖信号、DNA 损伤、缺氧、端粒缩短以及其他多种应激因素,细胞内的 p53 水平会上升。如图所示,这可能导致细胞周期停滞,使细胞得以调整并存活;也可能触发细胞通过凋亡自杀;或引起细胞衰老——一种不可逆的细胞周期停滞,阻止受损细胞分裂。
这使细胞面临基因组错误的风险;端粒丢失或缩短,同样危及基因组完整性;缺氧使细胞无法获得维持线粒体呼吸所需的氧气;渗透压应激导致细胞肿胀或萎缩;氧化应激则产生危险水平的高活性自由基。
能够激活 p53 通路的另一种应激形式似乎出现在调控信号过于强烈或不协调时——这种信号驱使细胞突破正常界限进入危险区域,导致其调控与协调机制崩溃,犹如超速运转的发动机。例如当 Myc 癌基因过度表达至致癌水平时,p53 浓度就会升高。
所有这些情况都要求采取极端行动,可能表现为两种形式之一:细胞可以阻止分裂周期的任何进一步进展,以便腾出时间修复或从病理状态中恢复;或者它可以接受自己必须死亡,并以最小化对机体损害的方式结束生命。从这个角度来看,理想的死亡方式是凋亡。在凋亡过程中,细胞被邻近细胞吞噬,其内含物被高效地回收利用。而不良的死亡方式则是坏死。在坏死过程中,细胞破裂或解体,其内含物泄漏到细胞外空间,引发炎症反应。
因此,p53 通路如同一种天线,能够感知多种危险状况的存在,并在检测到任何异常时触发相应行动——要么暂时或永久地阻止细胞周期,要么通过细胞凋亡促使细胞自杀(图 20-31)。这些反应旨在防止异常细胞增殖。癌细胞确实普遍存在异常,其存活和增殖因此依赖于 p53 通路的失活。若 p53 通路在癌细胞中保持活跃,它们将会被阻止或死亡(视频 20.6)。例如,如果 p53 通路功能正常,具有未修复 DNA 损伤的细胞将停止分裂或死亡;它无法增殖。
p53 蛋白主要通过作为转录调节因子发挥作用(参见影片 17.8)。事实上,在人类肿瘤中观察到的 p53 最常见突变位于其 DNA 结合域,这些突变削弱了 p53 与其 DNA 靶序列结合的能力。如第 17 章所述,p53 蛋白对细胞周期的抑制作用至少部分是通过诱导 p21 的转录实现的,该基因编码的蛋白质能够结合并抑制细胞周期进程所需的细胞周期蛋白依赖性激酶(Cdk)复合物。通过阻断这些 Cdk 复合物的激酶活性,p21 蛋白阻止细胞进入 S 期并复制其 DNA。
p53 诱导细胞凋亡的机制包括刺激多种促凋亡基因的表达,如第 18 章所述。
利用小鼠的研究有助于界定癌症关键基因的功能
基因在癌症中作用的最终验证必须来自对完整成熟生物体的研究。实验研究中最受青睐的生物体是小鼠。为了探索候选癌基因或抑癌基因的功能
图 20-32 使用发光报告基因监测小鼠肿瘤生长与转移。通过基因工程技术改造小鼠,使其前列腺中 PTEN 抑癌基因的两个拷贝均能失活,同时在前列腺特异性激活一个经改造能产生萤火虫来源荧光素酶的基因。向小鼠血液注射荧光素(荧光素酶的底物分子)后,前列腺细胞会发光,可通过活体生物发光检测观察到,如左侧 67 天龄小鼠所示。缺乏 PTEN 磷酸酶的细胞含有升量的 Akt 激活剂𝑃。 1 ( 3 , 4 , 5 ) 𝑃 3 P1(3,4,5)P 3 ,这导致前列腺细胞异常增殖,并随时间推移逐渐形成癌症。通过这种方式,可以在同一动物体内追踪长达一年的转移过程。在这些实验中,光强度与前列腺细胞后代的数量成正比,从浅蓝逐渐增强至绿色、黄色,再到红色表示。(改编自 C.-P. Liao 等人,《癌症研究》67:7525-7533, 2007。经美国癌症研究协会许可使用。)
通过基因操作,可以培育出过度表达特定基因的转基因小鼠或缺失该基因的敲除小鼠。利用第八章所述技术,可以设计出仅在特定细胞群中错误表达或删除基因的小鼠,或者能够在选定时间点随意开启基因表达的小鼠,甚至两者兼备,以观察肿瘤是否及如何形成。此外,为实时追踪活体小鼠体内肿瘤的每日生长情况,可通过基因标记使目标细胞表达荧光或发光报告基因而变得可见(图20-32)。通过这些方法,人们能够逐步阐明每个癌症关键基因在癌症发生或进展过程中所起的作用。
例如,转基因小鼠研究证实,单一癌基因通常不足以使正常细胞转变为癌细胞。因此,在经基因改造表达 Myc 或 Ras 致癌转基因的小鼠中,部分表达该癌基因的组织可能出现细胞增殖增强现象,随着时间的推移,偶有细胞会经历进一步变化而发展成癌症。然而,大多数表达癌基因的细胞并不会形成癌症。但从整体动物角度来看,这种遗传性癌基因构成严重威胁,因为它极大提高了机体某处发生癌症的风险。同时表达 Myc 和 Ras 两种癌基因的小鼠,其癌症发生时间更早、发病率远高于仅表达单一基因的小鼠(图 20-33);但需注意的是,这些癌症仍以分散、孤立的肿瘤形式起源于非癌组织之中。
图 20-33 转基因小鼠中的癌基因协同作用。图表展示了三种转基因小鼠品系的肿瘤发生率,分别为携带 Myc 癌基因、携带 Ras 癌基因以及同时携带两种癌基因的小鼠。在这些实验中,首先培育了两个转基因小鼠品系:一个品系通过将原癌基因 Myc 与小鼠乳腺肿瘤病毒调控 DNA 融合(从而在乳腺组织中驱动 Myc 过表达),插入了该构建的癌基因拷贝;另一个品系则在相同调控元件控制下插入了 Ras 癌基因拷贝。两个品系小鼠的肿瘤发生率均显著高于正常水平,且多发生于乳腺或唾液腺。通过杂交这两个品系获得同时携带两种癌基因的小鼠,这些杂交后代肿瘤发生率进一步提高,远超过两种癌基因单独作用时的发生率之和。然而,肿瘤仅延迟发生,且仅出现在两种基因表达组织中少数细胞中。 除了这两种癌基因外,显然还需要进一步的偶然变化才能导致癌症的发展(引自 E. Sinn 等人,《细胞》49:465-475, 1987 年)。
因此,即使是表达这两种癌基因的细胞也必须经历进一步随机产生的变化才能癌变。这强烈表明肿瘤发生需要多重突变,正如之前讨论的大量其他证据所支持的那样。使用抑癌基因缺失小鼠进行的实验也得出了类似结论。
癌症在进展过程中变得越来越具有异质性
尽管研究癌症驱动基因在体内的功能与相互作用十分有用,但人类癌症的小鼠模型存在重要局限性。小鼠肿瘤体积小,形成周期仅需数月甚至数日,而人类肿瘤可能达到小鼠体型或更大,且通常已生长数十年。通过观察染色组织切片的简单组织学分析可见,某些肿瘤包含明显不同的区域——虽均属癌变组织,但因遗传或表观遗传差异呈现不同形态:癌细胞群体具有异质性。显然,在最初的癌细胞克隆中,产生了赋予选择性优势(如加速生长)的额外突变,从而形成多样化亚克隆。如今,癌症基因组分析能力使我们能更深入探究这一过程。通过比较肿瘤不同区域及其转移灶的样本,揭示出达尔文进化的经典图景——这一过程虽以月或年而非百万年为时间尺度,却遵循着同样的自然选择法则。
研究肿瘤异质性发展的一种方法利用了在体外培养的人类细胞,即“类器官”(详见第 22 章)。与先前描述的适应了人工二维生活方式的永生化癌细胞系不同(见图 20-15),类器官是在更接近生理条件的三维基质中由成体干细胞培养而成。在这种环境中,单个干细胞能够增殖并分化成自组织结构,模拟来源器官的简化微型版本,具有真实的微观解剖特征。一项研究应用这种类器官系统来考察结直肠癌个体肿瘤内的遗传异质性(图 20-34A)。研究人员从肿瘤不同区域及邻近正常组织中分离出单个细胞培养类器官。基因组分析揭示了每个类器官的详细突变模式,这些模式指示了它们之间的亲缘关系,并据此可绘制出家族树。 源自同一肿瘤部位的类器官相似度最高,且均携带相同的致癌突变簇——这些突变源于进化树主干上的共同祖细胞,对应着肿瘤生长的早期阶段。
显然,癌细胞在不断突变、增殖、竞争、进化并多样化的过程中,不断开拓新的生态位并应对治疗手段(图 20-34B)。当它们转移并殖民新领域时,多样化进程会加速,因为这些新环境带来了新的选择压力。进化过程持续越久,就越难用同一张网捕获并消灭所有癌细胞。
结直肠癌通过一系列可见变化的缓慢演进
在本章开头,我们了解到大多数癌症都是由单个异常细胞逐渐发展而来,通过一系列独立的遗传和表观遗传变化的积累,从良性肿瘤进展为恶性肿瘤。我们已经从分子层面讨论了其中一些变化的本质,并了解了它们如何促成癌变行为。现在我们将更深入地研究一种常见的人类癌症,以此为例阐释并拓展我们已介绍的一些普遍原理和分子机制。我们以结直肠癌作为研究范例。
图 20-34 癌症如何以一系列亚克隆形式进展。(A)利用类器官进行癌症分析。从人类结直肠肿瘤的四个不同区域(颜色编码)以及附近健康组织(未显示)中分离出单个细胞,随后利用这些细胞培育类器官,从而获得大量分析材料。通过 DNA 测序确定每个类器官的突变情况,这些数据进而构建出系统发育树,揭示了原始肿瘤中突变发生的顺序。(B)描绘了驱动突变如何被认为在长时间内导致癌症进展,最终形成足够大的增殖细胞克隆而被检测为肿瘤。数据显示,驱动突变仅在长期存在的细胞亚克隆背景下罕见发生,这些亚克隆持续积累乘客突变却未获得生长优势。(A,改编自 C.J. Kuo 和 C. Curtis,《自然》556:441-442, 2016,经 Springer Nature 许可使用;B,改编自 S. Nik-zainal 等人,《细胞》149:994-1007, 2012。) 本文依据知识共享署名许可协议条款发布。
结直肠癌起源于结肠(大肠)和直肠(肠道末端)的上皮组织。该组织的结构与第22章(第1281-1282页)讨论的小肠组织大体相似。无论是小肠还是大肠,其上皮组织都以极快的速度更新,约需一周时间即可基本完成整个上皮层的更替。这两个区域的组织更新都依赖于位于上皮深层凹陷处(称为肠隐窝)的干细胞。如第22章所述,目前对维持干细胞功能、调控上皮正常结构与更替的信号机制已有了较为深入的认识。大多数结直肠癌的肿瘤进展过程,正是始于破坏这些信号通路的基因突变(参见影片20.7)。
结直肠癌较为常见,目前在美国每年导致近 6 万人死亡,约占癌症总死亡人数的 10% 。与大多数癌症类似,这类癌症通常直到晚年才被确诊(90%发生在 55 岁之后)。然而,通过结肠镜(一种用于观察结肠和直肠内部的光纤设备)对正常成年人进行常规检查时,常会发现肠道上皮存在小型良性肿瘤或腺瘤,表现为称为息肉的组织突起。这些腺瘤性息肉被认为是
| 表20-1 结直肠癌细胞中检测到的部分遗传异常 | |||
| 基因 | 类别 | 受影响通路 | 人类结肠癌(%) |
| K-Ras 基因 | 癌基因 | 受体酪氨酸激酶信号传导 | 40 |
| β-连环蛋白¹ | 癌基因 | Wnt 信号通路 | 5–10 |
| 腺瘤性结肠息肉病基因¹ | 肿瘤抑制因子 | Wnt 信号通路 | >80% |
| p53 | 肿瘤抑制因子 | 应激反应与 DNA 损伤应答 | 60 |
| TGFβ受体 II² | 肿瘤抑制因子 | TGFβ信号传导 | 10 |
| Smad4² | 肿瘤抑制因子 | TGFβ信号通路 | 30 |
| MLH1 及其他 DNA 错配修复基因(常因 DNA 甲基化而沉默) | 肿瘤抑制因子(维持遗传稳定性) | DNA 错配修复 | 15 |
1.2 带有相同上标数字的基因作用于同一通路,因此在个体癌症中仅有一个组分发生突变。
这些是大肠癌中大部分癌症的前体。由于疾病进展通常非常缓慢,通常存在约10年的时间窗口,在此期间缓慢生长的肿瘤可被检测到但尚未恶变。因此,当人们在五十多岁时接受结肠镜检查并通过结肠镜(一种快速简便的操作)切除息肉后,结直肠癌的发病率会大幅降低:根据某些研究,其发病率不到未筛查情况下的四分之一。
在直径小于1厘米的息肉显微切片中,上皮细胞及其排列通常呈现近乎正常状态。息肉越大,越可能包含形态异常且排列紊乱的细胞。有时单个息肉内可区分出两个或多个明显区域,其中某个区域的细胞相对正常,而其他区域的细胞则明显癌变,仿佛是由腺瘤细胞原始克隆中突变产生的亚克隆。疾病后期阶段,少数息肉中的部分肿瘤细胞会获得侵袭性:首先突破上皮基底层,继而穿透包裹肠道的肌层,最终通过淋巴管转移至淋巴结,或经血管转移至肝、肺及其他器官。
少数关键基因损伤常见于大部分结直肠癌病例
哪些突变随时间积累导致这一系列事件发生?在目前已发现的与结直肠癌相关的基因中,有三个突变频率最高:原癌基因 K (Ras 基因家族成员),约占 40% 的病例; p53 ,约占 60% 的病例;以及抑癌基因 Apc (下文将讨论),超过 80% 的病例。其他基因在较少结肠癌病例中起作用,部分列于表 20-1。
Apc 的作用最初是通过研究某些家族发现的,这些家族表现出一种罕见的遗传性结直肠癌易感性,称为家族性腺瘤性息肉病(FAP)。在此综合征中,数百至数千个息肉沿结肠生长(图 20-35)。这些息肉最初
图 20-35 家族性腺瘤性息肉病患者结肠与正常结肠对比。(A)正常结肠壁呈平缓起伏但表面光滑。(B)息肉病结肠完全被数百个突出息肉覆盖,肉眼观察每个息肉形似微型花椰菜。(由 Mark Arends 提供。)
通常在成年早期出现,若不予以切除,几乎总有一个或多个会发展为恶性肿瘤;从首次发现息肉到确诊癌症的平均时间为 12 年。该病可追溯至抑癌基因 Apc (以该综合征命名)的缺失或失活。患有家族性腺瘤性息肉病(FAP)的个体,其所有细胞中的一个 Apc 基因拷贝均存在失活性突变或缺失,且在肿瘤中表现出杂合性丢失,这意味着即使是在良性息肉中,两个基因拷贝也已丢失或失活。大多数结直肠癌患者并非遗传性疾病所致。然而,在超过 80% 的病例中,其癌细胞(而非正常细胞)通过个体生命周期中获得的突变,使 Apc 基因的两个拷贝均失活。因此,通过类似于我们讨论视网膜母细胞瘤时所涉及的途径, Apc 基因的突变被确认为结直肠癌的核心因素之一。
APC 蛋白是 Wnt 信号通路(第 15 章讨论)的一个抑制性组分。它与 \beta -连环蛋白(Wnt 通路的另一组分)结合,并协助诱导该蛋白降解。通过这种方式抑制 \beta -连环蛋白,APC 阻止其定位到细胞核——在核内它会作为转录调节因子驱动细胞增殖并维持干细胞状态(见图 15-61)。APC 的缺失导致游离 \beta -连环蛋白过量,进而引发干细胞群体的不受控扩增。这会造成肠道隐窝数量和尺寸的急剧增加(见图 22-4)。
当对一批结直肠肿瘤中的 \beta -连环蛋白基因进行测序时,发现许多不存在 Apc 突变的肿瘤反而存在 \beta -连环蛋白的激活突变。因此,Wnt 信号通路的过度活化才是引发此类癌症的关键,而非该通路包含的某个特定癌基因或抑癌基因。
既然如此,为何 Apc 基因尤其成为结直肠癌中最常见的罪魁祸首?APC 蛋白体积庞大,不仅与 \beta -连环蛋白相互作用,还与包括微管在内的多种其他细胞组分产生联系。APC 的缺失似乎会增加有丝分裂纺锤体缺陷的频率,导致细胞分裂时出现染色体异常。这种独立且额外的促癌效应或许能解释为何 Apc 突变在结直肠癌的成因中如此突出。
部分结直肠癌存在 DNA 错配修复缺陷
除了与 Apc 突变相关的遗传性疾病(FAP)外,还存在第二种更为常见的结肠癌遗传易感性,其发展过程与我们描述的 FAP 有所不同。这种更为常见的状况被称为遗传性非息肉病性结直肠癌(HNPCC),或称林奇综合征,其结肠癌风险增加,但结直肠息肉(腺瘤)的数量并未增多。此外,这些癌细胞异常之处在于它们具有正常(或近乎正常)的核型。相比之下,非 HNPCC 个体中的大多数结直肠肿瘤具有明显的染色体异常,包括多重易位、缺失及其他畸变,且染色体数量远超正常水平(参见图 20-10)。
导致遗传性非息肉病性结直肠癌(HNPCC)患者易患结直肠癌的突变,发生在编码 DNA 错配修复系统核心组件的若干基因之一。这些基因在结构和功能上与细菌及酵母中的 MutL 和 MutS 基因同源(参见图 5-20)。由于仅有两个基因拷贝中的一个存在缺陷,修复系统仍能清除个体细胞中不可避免的 DNA 复制错误。然而,如前所述,这些个体面临风险,因为剩余正常基因拷贝的意外丢失或失活会立即使自发突变率提高百倍甚至更多(详见
第五章)。这些基因不稳定的细胞随后可加速经历突变和自然选择的标准进程,促使细胞克隆向恶性肿瘤发展。
这种特定类型的基因不稳定性会在染色体中产生不可见的变化——最显著的是单个核苷酸的改变以及单核苷酸和双核苷酸重复序列(如 AAAA...或 CACACA...)的短扩增和收缩。一旦识别出 HNPCC 个体的缺陷,便发现约 15% 的无遗传易感突变人群中发生的结直肠癌存在错配修复基因的表观遗传沉默或突变。
因此,许多结直肠癌中发现的基因不稳定性至少可通过两种方式获得。大多数癌症表现出一种导致染色体明显改变的形式,而其他癌症的不稳定性发生在更小的尺度上,反映了 DNA 错配修复的缺陷。事实上,许多癌变要么显示染色体不稳定性,要么存在错配修复缺陷——但很少两者兼具。这些发现清楚地表明,基因不稳定性并非恶性行为的偶然副产品,而是一个促成因素——且癌细胞可通过多种方式获得这种不稳定性。
肿瘤进展的步骤常可与特定突变相关联
这些已识别的结直肠癌关键基因—— K 、 p53 、 Apc 及其他基因——以何种顺序发生突变?它们各自对癌细胞非社会性行为有何贡献?答案并非唯一,因为结直肠癌可通过多种途径发生:例如在某些病例中,首发性突变可能位于 DNA 错配修复基因;而在其他病例中,则可能出现在调控细胞增殖的基因上。此外,如前所述,诸如遗传不稳定性或异常增殖倾向等普遍特征,可通过不同基因的突变以多种方式产生。
然而,某些突变组合在结直肠癌中尤为常见,并且按照特定顺序发生。因此,在大多数情况下,使 Apc 基因失活的突变似乎是最早或至少是非常早期的步骤,因为它们在小型良性息肉和大型恶性肿瘤中检测到的高频率相同。导致遗传和表观遗传不稳定的变化可能也在肿瘤进展早期出现,因为这些变化是驱动后续步骤所必需的。
在 K -Ras 基因中发生的激活突变出现较晚,因为它们在小型息肉中罕见,但在显示细胞分化和组织学模式紊乱的较大息肉中却很常见。
失活突变在 p53 中被认为出现得更晚,因为它们在息肉中罕见,但在癌中常见(图 20-36)。我们已经看到, p53 功能的丧失使癌细胞能够承受压力并避免凋亡和细胞周期停滞。此外, p53 的缺失与癌基因(如 Ras )的高度激活有关。小鼠实验表明,初始低水平的癌基因
图20-36 结直肠癌发展过程中遗传变化的典型顺序建议。这个过于简化的示意图提供了突变与肿瘤发展关系的一般概念。但通常还涉及许多其他突变,并且不同的结肠癌可能通过不同的突变序列(和/或表观遗传变化)进展。
激活可能导致肿瘤缓慢生长,即使 p53 功能正常:毕竟像 Ras 这样的基因是正常生长调控机制的一部分,适度激活对细胞不会造成压力,也不会引发 p53 蛋白的作用。然而,肿瘤从缓慢生长进展为快速恶性增长,涉及癌基因激活超出正常生理限度达到更高、更具压力的水平。如果 p53 蛋白存在且功能正常,这应导致细胞周期停滞或死亡。只有失去 p53 功能,携带过度活跃癌基因的癌细胞才能存活并进展。
我们刚刚描述的步骤只是整体情况的一部分。需要强调的是,每种结直肠癌病例都有其独特性,具有各自详细的突变组合,即使是常见的突变,其发生顺序也可能各不相同。
导致肿瘤细胞转移的变化在很大程度上仍是个谜
或许我们对癌症理解中最显著的空白在于侵袭性和转移性(见图20-20)。在结直肠癌多步骤进展首次被描述超过25年后,尚未发现具有转移性疾病特征性相关的基因突变。迄今为止,即使是大规模的基因组测序工作也未能揭示足以解释癌细胞从原发肿瘤逃逸、扩散并在远处组织定植的重复性突变。一种可能性是,转移可能由改变基因表达模式的表观遗传变化启动。这些变化可能使癌细胞在没有进一步遗传改变的情况下获得新特性,从而重新编程其行为以促进侵袭性和运动性,或产生癌症干细胞。重要的是,细胞编程和行为的变化在细胞分化过程中的多种情境下通常是正常运作的。 与转移最为相关的例子是上皮-间质转化(EMT),这是一个高度调控但尚未被充分理解的过程,它使上皮细胞失去其特有的极性和粘附性,转而呈现间质表型,包括增强的迁移行为。EMT 程序在胚胎发生的多个阶段以及伤口愈合过程中发挥作用,其在癌细胞中的激活可以解释它们如何从原发肿瘤逃逸并侵入新组织。然而,EMT 不太可能解释主要谜团:即播散细胞如何在新组织的微环境中获得生存能力,面对其中陌生的生长因子和细胞外基质成分组合。由于 EMT 程序(如同几乎所有细胞分化程序)涉及基因表达的变化,它不会改变 DNA 序列,因此通过测序转移癌细胞的基因组无法检测到这一过程。
对肿瘤发生多个阶段和多样特征的观察表明,癌细胞并非发明了新的生物学现象,而是在不恰当的时间和地点利用了现有的机制和通路。正如我们将在本章最后一节讨论的那样,更好地理解正常的底层细胞生物学,以及癌症中颠覆这些生物学过程的分子变化,将为癌症治疗提供有前景的研究方向。
摘要
癌细胞分子分析揭示了两类癌症关键基因:癌基因与抑癌基因。这些基因中的一部分会因遗传和表观遗传意外的共同作用而发生改变,从而驱动肿瘤进展。许多癌症关键基因编码社会调控通路的组成部分,这些通路调控细胞的生长、分裂、分化或死亡时机。此外,一类肿瘤抑制因子可归类为基因组维护基因,因其正常功能是协助维持基因组完整性。
p53 通路的失活——这种现象见于几乎所有人类癌症——使得基因受损的细胞能够逃避凋亡并持续增殖。
Rb 通路的失合同样常见于多数人类癌症,这彰显了每条通路在保护机体抵御癌症方面的重要性。更广泛而言,癌细胞基因组的大规模测序表明,癌症的发生需要获得三种正常调控——即细胞周期、细胞增殖和细胞存活通路——的可遗传性紊乱。
癌细胞基因组的测序表明,除儿童期癌症外,多数癌症在漫长的肿瘤进展过程中会积累多个驱动突变,以及数量更为庞大但无实质影响的乘客突变。相同研究方法揭示了随着肿瘤发展,细胞亚克隆如何产生与消亡。因此,肿瘤内部存在异质性细胞群,其中某些被称为癌症干细胞的亚群比其他细胞危险得多。
我们常能将肿瘤进展阶段与激活特定癌基因、失活特定抑癌基因的突变相关联,结肠癌便是典型例证。但不同癌症类型甚至同种癌症的不同个体中,突变表现组合与表观遗传变化各不相同,这反映了这些遗传变异产生的随机性。然而,相同变异模式的反复出现表明,突破人体抗癌防御体系的途径实则有限。不过,对于癌症最终也是最致命阶段——转移的分子机制,科学界仍知之甚少。
癌症防治:现状与未来
我们可以运用日益增长的癌症分子生物学知识,在三个层面加强对该疾病的攻势:预防、诊断和治疗。预防总胜于治疗,事实上许多癌症是可以预防的,尤其是通过戒烟。高灵敏度分子检测技术为更早、更精确的诊断带来新机遇,旨在检测尚处于微小未转移阶段的原发肿瘤。如我们在结直肠息肉案例中所见,早期发现的癌症通常可以通过手术或放疗及时根除。然而,在未来许多年里,全面发展的恶性疾病仍将普遍存在,癌症治疗的需求将持续存在。
本节首先探讨癌症的可预防病因,继而分析分子层面的认知进展如何开始改变疾病治疗格局。
流行病学揭示多数癌症病例可预防
无论环境如何,某种不可降低的癌症基础发病率是预期之中的。正如第五章所讨论的,突变永远无法完全避免,因为它们是 DNA 复制和修复准确性存在根本性局限的必然结果。如果一个人能活得足够长,其体内至少有一个细胞最终会积累足够导致癌症发生的一系列突变,这是不可避免的。
然而,环境因素似乎在决定癌症风险中起着重要作用。这一点通过比较不同国家的癌症发病率得到了最清晰的证明:几乎每一种在某个国家常见的癌症,在另一个国家其发病率要低得多。由于移民群体往往会采纳其新居住国典型的癌症发病模式,这些差异被认为主要归因于环境因素而非遗传因素(图 20-37A)。根据美国癌症协会汇编的流行病学研究,估计至少有 45% 的癌症死亡可归因于可改变的风险因素,这表明超过一半的癌症本可避免(图 20-37B)。
| 原因 | 死亡(占总数的百分比) | 美国死亡人数(2018年) | 可能减少的估计(百分比) |
| 所有风险因素 | 45% | 265,150 | 50% |
| 香烟烟雾 | 29% | 169,180 | 75% |
| 超重 | 6.6% | 38,230 | 50% |
| 饮食 | 4.9% | 28,630 | 50% |
| 酒精 | 4.0% | 23,510 | 50% |
| 病毒 | 2.7% | 16,100 | 100% |
| 缺乏运动 | 2.2% | 12,800 | 85% |
| 紫外线辐射 | 1.5% | 8,750 | 50% |
图 20-37 癌症发病率与环境影响因素相关。(A)这张世界地图显示了特定人群从一个地区迁移至另一地区时,癌症发病率上升(红色箭头)或下降(蓝色箭头)的情况。此类观察结果表明环境因素(包括饮食)在决定癌症风险方面的重要性。(B)环境与生活方式对美国癌症影响的部分估计数据。表格显示了美国每年可归因于各因素的死亡人数,以及通过预防可能消除的死亡人数预估百分比。(B,数据来源:F. Islami 等,《CA 临床癌症杂志》68:31-54, 2018;以及 G.A. Colditz 等,《科学转化医学》4:127rv4, 2012。)
遗憾的是,不同类型的癌症具有不同的环境风险因素,一个群体即便避开了某种危险,通常也会面临另一种。然而,这并非不可避免。存在一些人类亚群,他们的生活方式显著降低了特定年龄段的总体癌症死亡率。在目前美国和欧洲的条件下,大约每五人中就有一人将死于癌症。但在犹他州严格遵守教规的摩门教徒中——他们远离酒精、咖啡、香烟、毒品和不安全性行为——其癌症发病率仅为同家族非实践成员或普通美国人的大约一半。
尽管对人类群体的此类观察表明癌症通常可以避免,但在大多数情况下——吸烟是一个显著例外——很难精确指出造成这些巨大群体差异的具体环境因素,或确定它们的作用机制。不过,目前已识别出几类重要的环境致癌风险因素(图 20-37B)。但还存在许多其他影响因素——包括环境中的化学物质、体内循环的激素,以及我们使组织遭受的刺激、感染和损伤——这些因素同样重要,并通过其他方式促使疾病发展。
灵敏检测法可识别那些损害 DNA 的致癌物质
许多截然不同的化学物质在被喂食给实验动物或反复涂抹于其皮肤上时具有致癌性。例如,一系列芳香烃及其衍生物,如芳香胺、亚硝胺以及像芥子气这样的烷化剂。尽管这些化学致癌物结构各异,但其中很大一部分至少有一个共同特性——它们会引发突变。在一个常见的致突变性测试(艾姆斯试验)中,将致癌物与从大鼠肝细胞制备的活化提取物混合(以模拟完整动物体内发生的生化过程)。然后将该混合物加入特殊设计的测试细菌培养物中,并测量细菌突变率。通过这种快速便捷的细菌检测方法判定为致突变的大多数化合物,在哺乳动物细胞测试中也会引起突变或染色体畸变。
图 20-38 部分已知致癌物。(A)致癌物活化过程。许多化学致癌物需经肝脏代谢转化激活后,才能通过与 DNA(标为橙色)反应引发突变。图示为黄曲霉毒素 B1,这是一种由霉菌(黄曲霉)产生的毒素,常见于潮湿热带条件下储存的谷物和花生中。黄曲霉毒素是热带地区肝癌的重要致病因素。(B)不同致癌物引发不同癌症类型。(B,数据来源:医学研究所,《癌症与环境:基因-环境相互作用》,华盛顿特区:国家学术出版社,2002 年。)
其中一些致癌物直接作用于 DNA。但通常来说,化学性质相对惰性的致癌物更具效力;这些化学物质只有在经过肝脏代谢过程(由一组称为细胞色素 P-450 氧化酶的细胞内酶催化)转化为更具反应性的分子后,才会产生破坏作用。这些酶通常有助于将摄入的毒素转化为无害且易于排泄的化合物。不幸的是,它们对某些化学物质的活性会产生高度致突变的产物。以此方式激活的致癌物包括苯并[a]芘(一种存在于煤焦油、烟草烟雾中的致癌多环芳烃)以及真菌毒素黄曲霉毒素 B1(图 20-38)。
百分之五十的癌症可通过改变生活方式预防
烟草烟雾是当今世界上最重要的致癌物质。尽管已识别出许多其他风险因素,但似乎没有任何一个因素导致的癌症死亡人数能与烟草烟雾相提并论。人们有时认为,癌症的主要环境原因源于高度工业化的生活方式——污染加剧、食品添加剂使用增加等等——但支持这一观点的证据甚少。这种想法可能部分源于对工业中使用的一些高致癌物质的识别,如2-萘胺和石棉。然而,除了吸烟导致的癌症增加外,过去半个世纪中,大多数常见人类癌症的年龄调整死亡率基本保持不变,甚至在某些情况下显著下降(图20-39)。
已知具有显著致癌性的因素大多并非现代社会所特有。根据某些检测方法,目前已知效力最强的致癌物是黄曲霉毒素 B1(见图 20-38)。这种由天然污染热带花生等食物的真菌产生的毒素,是非洲和亚洲肝癌的重要致病因素。
除烟草外,化学毒素和诱变剂作为癌症诱因的重要性低于人类行为相关因素。例如,当前美国近四分之三的成年人与三分之一的儿童及青少年存在超重或肥胖问题。体重超标、酒精摄入、不良饮食和缺乏运动这四项风险因素的叠加,现已导致女性癌症病例占比达到最高,在男性中仅次于吸烟。据估算,多达
图 20-39 美国 1930-2018 年经年龄调整的癌症死亡率。图中绘制了(A)女性和(B)男性经调整至美国人口年龄分布的选定死亡率数据。注意两性肺癌死亡率的急剧上升与吸烟模式相符,而胃癌死亡率的下降被认为与幽门螺杆菌感染率降低有关。近期其他癌症死亡率的下降可能归因于检测和治疗手段的进步。对数据进行年龄调整是必要的,以抵消人们平均寿命延长导致的癌症发病率必然上升的影响。(改编自美国癌症协会《2021 年癌症事实与数据》。亚特兰大:美国癌症协会有限公司。数据来源:1930-1959 年美国死亡率卷宗、1960-2016 年美国死亡率数据,国家卫生统计中心,疾病控制与预防中心。注:由于 1970 年前编码限制,子宫数据包含子宫颈和子宫体合并统计。经美国癌症协会许可使用。)
作为 50% 的所有癌症可以通过改变可识别的生活方式来避免(见图 20-37B)。
病毒和其他感染在人类癌症中占有显著比例
人类癌症虽不具传染性,但仍有相当一部分癌症直接或间接与病毒感染有关,较少情况下与细菌或寄生虫感染相关。这类感染约占全球癌症的 15% ,且在发展中国家更为常见。其相关证据部分来源于癌症患者体内的病毒检测,部分来自流行病学研究。例如,子宫颈癌与乳头瘤病毒感染相关,而在乙型肝炎病毒感染常见的地区(非洲和东南亚),肝癌极为普遍。全球已有 1.7 亿人感染的丙型肝炎病毒,其慢性感染也与肝癌发生明确相关。
如表 20-2 所示,主要元凶是 DNA 病毒。DNA 肿瘤病毒通过最直接的途径——干扰细胞周期和凋亡的控制——引发癌症。要理解这类病毒致癌机制,有必要回顾病毒的生命历程。许多 DNA 病毒利用宿主细胞的 DNA 复制机制来复制自身基因组。然而,为在单个宿主细胞内产生大量传染性病毒颗粒,DNA 病毒必须劫持这套机制并强力驱动它,突破 DNA 复制的正常限制,这个过程通常会导致宿主细胞死亡。多数 DNA 病毒仅以此方式繁殖。但部分病毒还有第二种选择:它们可以让基因组作为安静守序的"乘客"在宿主细胞内传播,在常规细胞分裂周期中与宿主细胞 DNA 同步复制(或整合进宿主基因组,或以染色体外质粒形式存在)。 这些病毒会根据情况在两种生存模式间切换,长期保持潜伏且无害状态,但偶尔会在某些细胞中大量增殖,这一过程会杀死宿主细胞并产生大量传染性颗粒。
这两种情况都不会使宿主细胞转变为癌性特征,这样做也不符合病毒的利益。但对于具有潜伏期的病毒,可能会发生意外,过早激活某些病毒蛋白,这些蛋白
| 表20-2 与人类癌症相关的病毒 | ||
| 病毒 | 相关癌症 | 高发区域 |
| DNA 病毒 | ||
| 乳头瘤病毒科 | ||
| 乳头瘤病毒(多种不同毒株) | 疣(良性) | 全球范围 |
| 乳头瘤病毒(多种不同毒株) | 子宫颈癌 | 全球范围内 |
| 嗜肝 DNA 病毒科 | ||
| 乙型肝炎病毒 | 肝癌(肝细胞癌) | 东南亚、热带非洲 |
| 疱疹病毒科 | ||
| 爱泼斯坦-巴尔病毒 | 伯基特淋巴瘤(B 淋巴细胞癌) | 西非、巴布亚新几内亚 |
| 爱泼斯坦-巴尔病毒 | 鼻咽癌 | 中国南方,格陵兰岛 |
| 人类疱疹病毒8型 | 卡波西肉瘤 | 非洲中南部 |
| RNA 病毒 | ||
| 逆转录病毒科 | ||
| 人类 T 细胞白血病病毒 I 型(HTLV-1) | 成人 T 细胞白血病/淋巴瘤 | 日本,西印度群岛 |
| 人类免疫缺陷病毒(HIV,艾滋病病毒) | 卡波西肉瘤(通过人类疱疹病毒8型传播) | 中非和南非 |
| 黄病毒科 | ||
| 丙型肝炎病毒 | 肝癌(肝细胞癌) | 全球范围 |
| 对于所有这些病毒,感染人数远多于发展为癌症的人数:病毒必须与其他因素共同作用。正如文中所述,不同病毒以不同方式促进癌症的发生。 | ||
病毒通常会利用其复制阶段使病毒 DNA 独立于细胞周期进行复制。如下文所述的人乳头瘤病毒案例,这类意外事件可能激活宿主细胞自身的持续增殖,从而导致癌症。
通过接种人乳头瘤病毒疫苗可以预防子宫颈癌。
乳头瘤病毒是 DNA 肿瘤病毒的典型代表。它们导致人类疣的形成,并且作为子宫颈癌的病因尤为重要:这是全球范围内女性第二常见的癌症,约占所有人类癌症的 6% 。人类乳头瘤病毒(HPVs)感染宫颈上皮细胞,并在基底细胞层以染色体外质粒的形式保持潜伏状态,与染色体同步复制。在外层上皮组织中,随着这些细胞的后代开始分化并最终从表面脱落,病毒通过切换到复制阶段产生感染性病毒颗粒。正常情况下,此处细胞分裂应停止,但病毒干扰了这种细胞周期停滞,因此
图 20-40 某些乳头瘤病毒如何引发子宫颈癌的机制示意图。乳头瘤病毒拥有约 8000 个核苷酸对的双链环状 DNA 染色体。这些染色体通常以质粒形式(红色圆圈)稳定存在于上皮基底层细胞中,其复制受到调控以与宿主染色体保持同步。(A)正常情况下,只有当病毒在外层上皮组织中按程序产生感染性子代时,才会干扰宿主细胞周期,这一过程相对无害。(B)罕见意外可能导致此类质粒片段整合到宿主染色体中,从而改变病毒基因在上皮基底层细胞中的微环境。这会破坏病毒基因表达的正常调控。某些病毒蛋白(命名为 E6 和 E7)的失控产生会干扰基底层细胞的细胞分裂调控,进而促使癌症发生(下图所示)。
以便复制其自身的基因组。通常,这种影响仅限于细胞外层且相对无害,如疣。然而,偶尔遗传意外会导致编码阻止细胞周期停滞蛋白质的病毒基因整合到宿主染色体中,并在上皮干细胞所在的基底层活跃(见图22-6)。这可能导致癌症,病毒基因充当癌基因(图20-40)。
从初始感染到侵袭性癌症的整个过程进展缓慢,需要多年时间。它包括一个漫长的中间阶段,此时受影响的宫颈上皮区域明显紊乱,但细胞尚未开始侵入下方的结缔组织——这种现象称为上皮内瘤变。许多此类病变会自行消退。此外,在此阶段,通过破坏或手术切除异常组织仍易于治愈该病症。幸运的是,通过刮取宫颈表面细胞样本并在显微镜下观察(巴氏涂片技术)可以检测到此类病变的存在。
更令人欣喜的是,现已研发出一种能够有效预防相关人乳头瘤病毒株感染的疫苗。若在女孩青春期前、即尚未开始性行为时接种,该疫苗已被证实能显著降低其罹患宫颈癌的风险。鉴于该病毒通过性接触传播,目前建议对青少年男女进行常规接种。多个国家已启动大规模免疫计划。
传染性病原体可通过多种途径诱发癌症
在乳头瘤病毒中,主要起致病作用的病毒基因被称为 E6 和 E7。这些病毒癌基因的蛋白质产物与多种宿主细胞蛋白相互作用,但特别值得注意的是,它们会结合宿主细胞的两个关键肿瘤抑制蛋白,使两者失去功能,从而允许细胞以不受控制的方式复制其 DNA 并进行分裂。其中一种宿主蛋白是 Rb;另一种是 p53。其他 DNA 肿瘤病毒采用类似机制抑制 Rb 和 p53,这突显了改变细胞周期控制通路和细胞存活通路对于细胞逃脱正常增殖限制的核心重要性,正如我们先前讨论的那样。
在其他癌症中,病毒具有间接促癌作用。例如,乙型和丙型肝炎病毒通过引发慢性炎症(肝炎)促进肝癌发展,这种炎症刺激肝脏大量细胞分裂,最终促使肿瘤细胞演化。在艾滋病中,人类免疫缺陷病毒(HIV)通过破坏免疫系统,导致原本罕见的卡波西肉瘤发生——这使得具有直接致癌作用的人类疱疹病毒(HHV-8)得以继发感染。寄生虫和细菌引起的慢性感染同样可通过引发严重炎症促进某些癌症发展。例如,导致胃溃疡的幽门螺杆菌慢性感染被认为是胃癌的主要诱因;过去半个世纪胃癌发病率的显著下降(见图 20-39)与幽门螺杆菌感染率降低呈现相关性。
A) 良性增生或疣
寻找癌症治愈方法虽艰难但并非无望
寻找癌症疗法虽艰难却非无望。治愈癌症的难度堪比清除杂草,癌细胞可通过手术切除或用有毒化学物质或辐射摧毁,但难以彻底根除每一个癌细胞。手术很少能找出所有转移灶,而杀死癌细胞的治疗方法通常对正常细胞也有毒性。此外,与正常细胞不同,癌细胞能快速突变,常会对所用毒剂和辐射产生耐药性。
尽管存在这些困难,针对某些曾经高度致命的癌症——包括霍奇金淋巴瘤、睾丸癌、绒毛膜癌以及某些白血病和其他儿童癌症——已经找到了使用抗癌药物(单独或联合其他疗法)的有效治愈方法。即使对于目前似乎无法治愈的癌症类型,也有延长生命或至少缓解痛苦的疗法。但对于那些仍造成巨大痛苦和众多死亡的最常见癌症,我们有多大希望能做得更好并找到治愈方法呢?
传统疗法利用癌细胞中的遗传不稳定性及细胞周期检查点应答缺失
抗癌疗法需要利用癌细胞区别于正常细胞的某些分子特性。其中一种特性是基因不稳定性,这反映了染色体维持、细胞周期检查点和/或 DNA 修复方面的缺陷。值得注意的是,尽管最初开发这些治疗方法的科学家并不知晓,但最广泛应用的癌症疗法似乎正是通过利用这些异常来发挥作用。电离辐射和大多数抗癌药物会损伤 DNA 或干扰有丝分裂中的染色体分离,它们优先杀死癌细胞,因为癌细胞存活于损伤的能力较弱。例如,经辐射处理的正常细胞会暂停其细胞周期,直到修复 DNA 损伤,这得益于第 17 章讨论的细胞周期检查点反应。由于癌细胞通常存在检查点反应缺陷,它们在辐射后可能继续分裂,结果几天后因基因损伤未修复而死亡。更普遍地说,大多数癌细胞在生理上紊乱到了应激程度:它们生活在危险之中。 尽管肿瘤细胞已经进化到对轻微的 DNA 损伤异常耐受,但它们对辐射和 DNA 损伤药物可能造成的更严重损伤却极为敏感。遗传损伤的微小增加足以打破增殖与死亡之间的平衡。然而不幸的是,DNA 损伤疗法通常会对消化系统、骨髓和黏膜中正常且快速分裂的细胞造成严重的副作用。此外,这些治疗方法本身具有致癌性,可能导致继发性癌症。
此外,虽然癌细胞中存在的分子异常通常增强了它们对细胞毒性药物的敏感性,但也可能增加其耐药性。例如,正常细胞在 DNA 损伤时可能通过 p53 介导的应激反应发生凋亡,而癌细胞由于缺乏 p53 可能逃避免疫性死亡。不同癌症对细胞毒性治疗的敏感性差异很大,有些对某种药物有反应,有些则对另一种药物有反应,这可能反映了特定癌症在 DNA 修复过程、细胞周期检查点及凋亡控制方面存在的特定缺陷类型。
新药通过靶向特定突变选择性杀死癌细胞
放疗和传统细胞毒性药物的选择性较弱:它们不仅伤害癌细胞,也会损伤正常细胞,且安全边际狭窄。由于剂量往往无法提高到足以杀死所有癌细胞的程度,
这将导致患者死亡,而可实现的治愈性治疗通常需要多种细胞毒性药物的联合使用。副作用可能严重且难以忍受。我们如何才能做得更好?
理想的治疗方法是与癌细胞中存在的某种病变结合时具有细胞致死性,但对不存在这种病变的细胞无害。这种治疗方法被称为合成致死(源自合成一词的本意,即“组合在一起”):它仅在与癌症特异性突变合作时才会杀死细胞。随着我们越来越能够精确定位癌细胞中使其与正常邻近细胞不同的特定分子改变,这类精准靶向治疗的新机遇正逐渐显现。我们以一些已投入实践的新治疗方法为例结束本章。
PARP 抑制剂可杀死携带 Brca1 或 Brca2 基因缺陷的癌细胞
正如我们所强调的,癌细胞的基因不稳定性使其既危险又脆弱——危险在于它们进化与增殖的能力增强,脆弱则是因为治疗若引发更极端的基因紊乱,便可能将其推过生存临界点导致死亡。在某些癌症中,基因不稳定性源于正常细胞依赖的众多 DNA 修复与维护机制中某一环节的明确缺陷。此时,针对性地阻断 DNA 修复机制中互补环节的药物,可造成如此严重的基因损伤,以致癌细胞死亡。
第五章中讨论的 DNA 维护机制详细研究揭示出惊人的表面冗余性。因此,敲除特定 DNA 修复途径通常比预期造成的损害要小,因为存在替代修复途径。例如,当复制叉遇到模板链上的单链断裂时,可能会形成停滞的 DNA 复制叉,但细胞可以通过直接修复这些单链断裂来避免灾难性后果;若此方法失效,还可通过同源重组修复断裂的复制叉(见图 5-49)。假设某种癌细胞因获得突变而导致遗传不稳定,该突变降低了其通过同源重组修复断裂复制叉的能力。那么,是否可以通过使用抑制单链断裂修复的药物来治疗这种癌症,从而大幅增加断裂复制叉的数量,最终根除癌细胞?这种药物治疗对正常细胞可能相对无害,但对癌细胞可能是致命的。
该策略似乎能有效杀死至少一类癌细胞——那些 Brca1 或 Brca2 抑癌基因的两个拷贝均失活的癌细胞。如第五章所述,Brca2 是一种辅助蛋白,在通过同源重组修复 DNA 双链断裂过程中与 Rad51 蛋白(人类中的 RecA 类似物)相互作用。Brca1 是这一修复过程中同样必需的另一种蛋白。与 Rb 类似,Brca1 和 Brca2 基因最初是作为使人类易患癌症的突变被发现的——具体而言,主要是乳腺癌和卵巢癌(尽管与 Rb 不同,它们似乎只与这类癌症中的一小部分有关)。遗传了一个 Brca1 或 Brca2 突变拷贝的个体会发展出使同一基因第二个拷贝失活的肿瘤,这可能是因为这种变化使细胞遗传不稳定并加速肿瘤进展。
虽然 Brca1 和 Brca2 是修复 DNA 双链断裂所必需的,但单链断裂则由其他机制修复,涉及一种名为 PARP(聚 ADP-核糖聚合酶)的酶。对 DNA 修复基本机制的这项理解带来了一个惊人发现:阻断 PARP 活性的药物能以极高的选择性杀死 Brca 缺陷细胞。与此同时,PARP 抑制对正常细胞影响甚微;事实上,经基因改造缺乏 PARP1(参与 DNA 修复的主要 PARP 家族成员)的小鼠在实验室条件下仍保持健康。这一结果表明,
图 20-41 如何利用肿瘤的遗传不稳定性进行癌症治疗。如第五章所述,DNA 序列的维持对生命至关重要,因此细胞进化出了多种修复 DNA 损伤和减少 DNA 复制错误的途径。如图所示,当 DNA 复制叉遇到 DNA 模板链断裂时会停滞。在此例中,正常细胞拥有两种不同的修复途径(途径 1 和途径 2)来帮助避免这一问题。因此,它们不会因使用阻断修复途径 1 的药物而受损。但由于肿瘤细胞在进化过程中选择了修复途径 2 的失活,同样的药物治疗却能杀死肿瘤细胞。
在本例所依据的实际案例中,修复途径 1(需要文中讨论的 PARP 蛋白)的功能是在移动的复制叉遇到之前,清除 DNA 单链上持续存在的意外断裂。途径 2 是依赖于重组的修复过程(需要 Brca2 和 Brca1 蛋白),用于修复图 5-49 中所示的停滞复制叉。PARP 抑制剂常用于治疗具有 Brca2 或 Brca1 抑癌基因缺陷的癌症。
虽然需要 PARP 的修复途径提供了对抗 DNA 链持续断裂的第一道防线,但这些断裂在正常细胞中可通过遗传重组途径高效修复。相比之下,因 Brca1 或 Brca2 缺失而获得遗传不稳定性的肿瘤细胞则失去了这第二道防线,因此它们对 PARP 抑制剂具有独特的敏感性(图 20-41)。
PARP 抑制剂已取得一些显著成果,使许多 Brca 基因缺陷患者的肿瘤消退,并延缓了疾病进展,且副作用相对较少。这些药物似乎也适用于其他导致细胞同源重组机制缺陷的突变癌症——这在癌症病例中虽占比不大,但具有重要意义。
PARP 抑制疗法体现了癌症治疗中理性且高度靶向的新型策略,这类方法正逐渐成为可能。结合下文将讨论的其他新疗法,它为治疗多种其他癌症带来了巨大希望。
小分子药物可被设计用于抑制特定致癌蛋白
治疗癌症的一个明显策略是使用专门设计用于阻断癌基因产生蛋白质功能的药物来攻击表达该癌基因的肿瘤。但这样的治疗如何避免伤害那些依赖于癌基因进化前原癌基因功能的正常细胞?又为何药物会杀死癌细胞而非仅仅使其镇静?答案或许在于癌基因依赖现象。一旦癌细胞经历了致癌突变,往往会进一步发生突变、表观遗传改变或生理适应,使其依赖于初始癌基因的过度活跃,正如吸毒者对高剂量毒品的依赖。阻断致癌蛋白的活性可能因此杀死癌细胞,而不会对其正常邻居造成显著伤害。通过这种方式已取得了一些显著成功。
如前所述,慢性髓系白血病(CML)通常与特定的染色体易位相关,表现为费城染色体(见图 20-5)。这种现象源于两条特定基因 Abl 和 Bcr 所在位置的染色体断裂与重接。这两个基因的融合形成了一个名为 Bcr-Abl 的杂合基因,该基因编码一种嵌合蛋白,由 Bcr 的 N 端片段与 Abl 的 C 端部分连接而成(图 20-42)。Abl 是一种参与细胞信号传导的酪氨酸激酶。Bcr 片段替代 Abl 正常 N 端后使其过度活跃,从而刺激含有该基因的造血前体细胞异常增殖,并阻止这些细胞通过凋亡死亡——而正常情况下许多细胞会经历这一过程。最终,过量白细胞在血液中积聚,导致慢性髓系白血病的发生。
嵌合 Bcr-Abl 蛋白是治疗干预的明确靶点。在寻找能够抑制酪氨酸激酶活性的合成药物分子过程中,科学家发现了一种名为伊马替尼(商品名格列卫)的化合物,可有效阻断 BcrAbl 活性(图 20-43)。当该药物首次用于慢性粒细胞白血病患者时,几乎
图 20-42 慢性粒细胞白血病患者体内 Abl 原癌基因向癌基因的转化过程。该染色体易位将 22 号染色体上的 Bcr 基因与 9 号染色体的 Abl 基因连接,从而形成费城染色体(参见图 20-5)。由此产生的融合蛋白包含 Bcr 蛋白的 N 端与 Abl 酪氨酸蛋白激酶的 C 端结合,导致 Abl 激酶结构域异常激活,进而驱动骨髓中造血细胞克隆的过度增殖。
图 20-43 伊马替尼(格列卫)如何阻断 Bcr-Abl 蛋白活性并抑制慢性粒细胞白血病。(A) 伊马替尼位于 Bcr-Abl 酪氨酸激酶结构域的 ATP 结合口袋中,从而阻止 Bcr-Abl 将 ATP 中的磷酸基团转移至底物蛋白的酪氨酸残基上。这阻断了细胞增殖和存活的信号传导。(B) 通过 X 射线晶体学测定的伊马替尼(蓝色实体)与 Abl 蛋白酪氨酸激酶结构域(带状图)复合物的结构。(C) 该药物的化学结构。可口服给药;存在副作用,但通常耐受性良好。(B, 来自 T. Schindler 等人,《科学》289:1938-1942, 2000。经 AAAS 许可使用。PDB 代码:3K5V)
所有患者均显示出显著反应,费城染色体阳性细胞在超过 80% 的患者中明显消失。这种反应似乎相对持久:经过多年持续治疗,许多患者并未进展至疾病晚期——尽管在治疗初期,每年出现伊马替尼耐药性癌症的概率约为 5% 。
对于已经进展到更急性阶段,即进入所谓“母细胞危象”的髓性白血病患者来说,治疗效果并不理想。在这个阶段,基因不稳定性已经形成,疾病进展速度显著加快。这些患者最初会显现治疗反应,但随后会复发,因为癌细胞对伊马替尼产生了耐药性。这种耐药性通常与 Bcr-Abl 基因中编码激酶结构域的部分发生二次突变有关,这些突变破坏了伊马替尼与 Bcr-Abl 激酶结合的能力。目前已经开发出第二代抑制剂,能有效对抗一系列伊马替尼耐药突变体。通过将一种或多种这类新型抑制剂与伊马替尼作为初始治疗联合使用,慢性髓性白血病——至少在慢性(早期)阶段——似乎正朝着可治愈疾病的方向迈进。
尽管存在耐药性的复杂性,伊马替尼的非凡成功足以阐明一个重要原则:一旦我们精确理解了癌症中发生的基因病变,就能开始设计有效的理性治疗方法来应对。这一成功案例推动了针对其他致癌蛋白激酶的小分子抑制剂的研发,并利用它们精准攻击相应的癌细胞。越来越多的此类药物正在开发中,其中包括靶向 EGF 受体的分子——目前已被批准
图 20-44 Ras-MAP 激酶信号通路中的部分抗癌药物及靶点。该通路由多种受体酪氨酸激酶(RTKs)激活,包括 EGF 受体(参见图 15-48 和 15-50)。Raf 激酶抑制剂包含多种特异性靶向致癌蛋白 B-Raf 的药物。按照惯例,抗体类药物以"单抗"(mab)结尾,而小分子药物以"尼布"(nib)结尾。(改编自 R. Vogelstein 等人,《科学》339 卷 1546-1558 页,2013 年)
用于治疗某些肺癌,以及专门针对黑色素瘤中 B-Raf 致癌蛋白的药物。
蛋白激酶相对容易被小分子(如伊马替尼)抑制,许多制药公司正在生产多种激酶抑制剂,希望它们能有效治疗某些类型的癌症。许多癌症并不存在蛋白激酶的致癌突变。但大多数肿瘤含有异常激活的信号通路,有望在该通路的某个环节找到靶点(参见视频20.8)。例如,图20-44展示了当前正在测试的针对癌症中常见激活通路的某些抗癌药物及药物靶点。
通过增强免疫反应可能治愈多种癌症
癌症与免疫系统存在复杂互动,其各组分有时可能助长也可能抑制肿瘤发展。但一个多世纪以来,癌症研究者一直梦想能以可控且高效的方式利用我们的免疫系统来消灭癌细胞,就像清除病原微生物那样。终于有迹象表明,这个梦想或许有一天能够实现,至少对某些类型的癌症是如此。
从概念上讲,最简单的免疫疗法类型是向患者注射靶向癌细胞的抗体。这种方法已取得一定成功。例如,约 25% 的乳腺癌会异常高表达 Her2(人类表皮生长因子受体 2)蛋白——这是一种与 EGF 受体相关的受体酪氨酸激酶,在乳腺上皮正常发育过程中发挥作用。名为曲妥珠单抗(商品名赫赛汀)的单克隆抗体能结合 Her2 并抑制其功能,可减缓过度表达 Her2 的人类乳腺癌生长,现已成为这类癌症的标准疗法(见图 20-44)。另一种相关方法利用抗体向癌细胞递送毒素。针对特定癌细胞表面高表达而正常细胞缺乏的蛋白质抗体,可与毒素结合,从而杀死抗体所结合的细胞。
当前大量研究热点聚焦于另一种基于 T 淋巴细胞的新型免疫疗法。正如
图 20-45 免疫系统识别肿瘤特异性抗原。由于体细胞突变,肿瘤细胞会产生多种不同的突变蛋白。如第 24 章所述,这些蛋白质的肽段将作为新抗原呈现在肿瘤细胞表面,并有可能激活 T 细胞反应以杀死该细胞(参见图 24-42)。
如第 24 章详述,细胞毒性 T 细胞能够杀死表面呈现外源肽抗原的宿主细胞。由于这些肽通常源自入侵病原体,该反应有助于终止感染。当前挑战在于寻找方法,以类似效率与特异性招募细胞毒性 T 细胞攻击癌细胞——前提是癌细胞表达肿瘤特异性抗原。需注意的是,通过对迄今确定的数千个肿瘤基因组序列分析,我们已知典型癌细胞含有约 50 种发生氨基酸序列改变的突变蛋白,其中绝大多数为先前所述的乘客突变(参见第 1186 页)。无论是乘客突变还是驱动突变引发的氨基酸变化,都有可能产生能被 T 细胞识别为异物的细胞表面新抗原,从而导致癌细胞死亡(图 20-45)。然而,由于细胞毒性 T 细胞会杀死受感染的宿主细胞,其活性受到严格调控以确保处于安全范围内。 此外,癌细胞通常缺乏病原体感染细胞中存在的某些成分,这些成分对于启动强烈的 T 细胞反应至关重要。因此,肿瘤反应性 T 细胞数量极少,而增加其数量的疗法正处于免疫治疗的前沿。
增强 T 细胞对癌细胞反应的一种方法是,从患者血液中采集其自身的 T 细胞,扩增具有抗癌活性的细胞群,然后将其重新输回患者体内。这种方法通过引入大量已能识别携带癌症特异性抗原肿瘤细胞的 T 细胞,在转移性黑色素瘤患者中显示出显著疗效,完全缓解率高达 20% 。在这一策略的更精细变体中,患者的 T 细胞可在扩增前进行基因改造,这一过程称为嵌合抗原受体 T 细胞(CAR T)疗法(参见影片 20.9)。经过改造的 CAR T 细胞不仅能识别患者的肿瘤特异性抗原,还具备共刺激活性以增强 T 细胞反应。该疗法对某些血癌极为有效,但不幸的是,由于免疫系统过度激活,也会引发严重副作用。
免疫抑制是癌症免疫疗法面临的主要障碍
如果癌细胞的新抗原被识别为外来物,为何免疫系统不能更有效地在初期清除癌症?如前所述(参见第 1175-1176 页),癌细胞通过操纵其周围的基质(包括免疫细胞)来创造一个既促进肿瘤生长又抑制免疫反应的微环境。对肿瘤如何逃避免疫破坏的研究揭示了关键的免疫抑制机制——癌细胞表面表达一种或多种蛋白质,这些蛋白质与包括活化 T 细胞在内的多种免疫细胞上的抑制性受体结合。因此,即使细胞毒性 T 细胞识别出肿瘤抗原,它们也无法杀死肿瘤细胞。T 细胞表面表达的抑制性受体是免疫检查点的一部分,在感染期间防止过度、组织损伤性免疫反应中发挥重要的正常功能。但在癌症背景下,免疫
图 20-46 免疫系统如何与癌症相互作用。(A)克服肿瘤免疫抑制微环境的抗体疗法。癌细胞通常通过在表面表达与 T 细胞抑制性受体结合的蛋白质来保护自身免受免疫攻击。如图所示示例中,癌细胞表达 PDL1,该蛋白与 T 细胞上的 PD1 受体结合并干扰 T 细胞活化。这使得肿瘤易受释放 T 细胞攻击的抗体影响。(B)树突状细胞通过从肿瘤获取肿瘤细胞抗原并在淋巴结中呈递(如图所示),在激活 T 细胞过程中起关键作用,而某些癌症已进化出干扰此过程的机制(未显示)。
检查点机制可能阻止个体杀死威胁其生存的癌细胞。
为了克服免疫抑制环境并提供强烈的 T 细胞激活信号,一种前景广阔的新型抗癌疗法致力于开发免疫检查点抑制剂,例如能够阻止肿瘤细胞与 T 细胞上抑制性受体结合的抗体。如图 20-46A 所示,通过抗体靶向抑制性受体或其配体,可以释放对癌细胞的免疫攻击。重要的是,多种新抗原被识别为外来物质,使得癌细胞无法通过单个新抗原的突变丢失来逃避免疫攻击,从而让肿瘤难以对抗体治疗产生耐药性。相当一部分转移性黑色素瘤患者在反复注射与 PD1(程序性细胞死亡蛋白 1)或其配体 PDL1(存在于癌细胞表面)结合的单克隆抗体后,出现了显著疗效,其癌症得以缓解数年之久。遗憾的是,该治疗方法对患有同类癌症的其他患者并未奏效。
关于为何免疫疗法对部分患者有效而对另一些无效的重要线索,源自本章第二部分所述的对癌症基因组的广泛分析。肿瘤样本的一个偶然特性是,它们不仅包含癌细胞,还包括相关的基质细胞,如成纤维细胞、内皮细胞及各种免疫细胞。由于每种细胞类型都表达一组特征性的 RNA,因此可以评估肿瘤中每种细胞类型的存在和比例,包括 T 细胞。对数千种不同肿瘤的免疫细胞谱进行比较后,发现了有趣的相关性。例如,正如人们可能预测的那样,与基因组突变较少的癌症相比,基因组含有大量点突变的癌症通常拥有更高比例的 T 细胞,这可能是由于新抗原的增加。反过来,这种肿瘤特征与使用免疫检查点抑制剂治疗后更好的治疗效果相关。
某些癌症似乎通过阻止 T 细胞最初渗入肿瘤来避免免疫破坏。这一现象的细胞基础尚不明确,是当前重要的研究领域。已知 T 细胞的激活需要其与称为树突状细胞的抗原呈递细胞发生物理性相互作用。树突状细胞具有高度迁移性,能在感染部位摄取病原体或其产物,并将其输送至淋巴系统。
淋巴结或其他淋巴器官中的树突状细胞捕获这些抗原,并将其呈递给 T 细胞。在癌症情况下,树突状细胞会将新抗原呈递给 T 细胞,使 T 细胞能够追踪并摧毁表达这些抗原的癌细胞(图 20-46B)。某些癌细胞通过阻止树突状细胞与其相互作用及获取新抗原,来抑制这一过程。
这些观察结果说明了免疫系统如何受到多层次的调控,以及癌细胞如何被选择以利用这些调控机制。重要的是,对这些现象背后的细胞生物学机制进行研究,不仅有助于开发新的癌症治疗方法,还将教会我们系统运作的基本原理,正如第24章所述。
癌症对疗法产生耐药性
高期望必须与严峻的现实相调和。我们已经看到,基因不稳定性可能成为癌症疗法可利用的弱点,但与此同时,它也可能使癌细胞以惊人的速度进化出对治疗药物的抗药性,从而使根除疾病变得更加困难。这一点甚至适用于那些针对基因不稳定性本身的药物。因此,PARP 抑制剂能够有效缓解病情,但从长远来看,疾病通常会复发。例如,Brca 缺陷型癌症有时会通过对受影响的 Brca 基因进行二次突变来恢复其功能,从而对 PARP 抑制剂产生抗药性。到那时,癌症已经失控,可能为时已晚,无法通过额外治疗来影响疾病的进程。
癌症对抗癌药物产生耐药性的策略多种多样。通常,初始药物治疗会使肿瘤体积显著缩小,所有可检测到的肿瘤细胞似乎都已消失。但数月或数年后,癌症会以改变后的形态复发,并对原本疗效显著的药物产生耐药性。这种情况下,初始药物治疗显然未能彻底清除原始肿瘤细胞群中的微小部分细胞。这些细胞可能因携带保护性突变或表观遗传变化而逃过一死,亦或仅仅是因为藏匿于受保护的环境中。更隐蔽的是,表型独特的肿瘤细胞亚群可能发挥着癌症干细胞的作用。这些存活细胞通过持续增殖最终使癌症再生,并在此过程中进一步发生突变和进化。联合疗法——即同时使用两种合适药物靶向相同癌细胞——原则上应能极大帮助解决这类问题。
然而,在某些情况下,暴露于某种抗癌药物的细胞不仅会对该药物产生耐药性,还会对从未接触过的其他药物产生耐药性。这种多药耐药现象通常与基因组中一个名为 Mdr1 或 Abcb1 基因所在区域的扩增有关。该基因编码一种质膜结合的 ABC 转运蛋白超家族(第 11 章将讨论)的 ATP 酶,能够将亲脂性药物泵出细胞(参见视频 11.5)。癌细胞过度产生这种蛋白质(或其家族其他成员)会阻止多种细胞毒性药物在细胞内的积累,从而使细胞对这些药物不敏感。
在晚期转移性癌症与治疗专家之间的拉锯战中,按照现行医疗实践,癌症通常最终会获胜。但情况必须如此吗?正如我们下文将探讨的,有理由认为通过同时使用多种武器攻击癌症——而非逐一使用每种手段直至其失效——我们很有可能取得更好的疗效。
如今我们已具备设计个性化联合疗法的技术手段
现今,早期发现的癌症通常可通过手术、放疗或药物治愈。然而对于大多数已广泛进展和转移的癌症,治愈仍常常难以实现。如前所述的治疗方案
虽能带来宝贵的缓解期,但迟早往往会面临复发。
尽管如此,针对某些类型的晚期癌症,目前正在开发结合多种策略的治疗方法;例如,将化疗和放疗与免疫疗法相结合。理想情况下,联合用药的选择应针对个体患者量身定制。癌症的演变本质上是一个随机过程,且每个个体都有所不同,但现代基因组分析方法使我们能够详尽地分析肿瘤活检细胞,从而发现特定病例中哪些关键癌症基因受到影响。诚然,这并非易事:个体内的肿瘤细胞具有异质性,并非所有细胞都含有相同的基因损伤。然而,随着对癌症演变途径理解的加深,以及从众多不同病例中积累的经验,我们应能做出关于最佳治疗方案的明智决策。
组织取样技术、基因组学及生物统计学的进步使得直接表征人类原发性肿瘤成为可能。然而,这些分析并未考虑全身系统的影响。癌症治疗领域的进展还源于疾病模型的精细化发展——这些模型既能用于探究肿瘤生长与转移的影响因素,也可用于检验治疗反应。其中一种方法是通过基因工程技术改造小鼠,使其携带特定组合的人类基因突变(见图 20-33)。第二种手段是人体肿瘤异种移植模型:将人类癌细胞移植到免疫缺陷小鼠体内(皮下或癌源器官部位),这类小鼠不会排斥人类细胞。而绕过小鼠模型的第三种方法,是利用患者来源的健康组织和肿瘤组织在三维培养体系中培育类器官(见图 20-34A)。这些系统为患者特异性药物测试及个体化治疗方案制定提供了有力支撑。
从患者的角度看,癌症研究的进展速度可能显得令人沮丧地缓慢。每种新药都必须在临床中进行测试,先检验安全性再验证有效性,才能获准普遍使用。若药物需与其他药物联合使用,联合疗法也必须经历同样漫长的过程。严格的伦理规范制约着试验的开展,这意味着试验需要时间——通常需要数年之久。但朝着正确方向系统迈出的缓慢而谨慎的步伐,终将带来重大突破。虽然任重道远,但我们讨论过的实例已提供了原理验证和乐观的依据。
通过癌症研究,我们获得了关于正常细胞分子生物学的绝大部分认知。如今,我们正越来越多地发现如何将这些知识运用于对抗癌症本身的战役中。
摘要
我们对癌症细胞生物学的日益深入理解,已经开始催生出更有效的预防、诊断和治疗这些疾病的方法。通过利用癌细胞区别于正常细胞的特性——包括癌细胞对致癌蛋白的依赖及其 DNA 修复机制中的缺陷——可以设计出优先摧毁癌细胞的抗癌疗法。现有充分证据表明,随着对正常细胞调控机制及其在特定癌症中如何被颠覆的精确理解,我们终将能够研制出通过攻击癌细胞增殖和存活所必需的关键分子来精准杀灭癌症的药物。此外,通过复杂的免疫学方法治疗癌症最近也取得了重大进展。而且,随着我们能够更准确地测定任何特定肿瘤细胞中发生改变的基因,我们开始能够为每位患者量身定制更精准的治疗方案。
多细胞生物的发育
每个多细胞生物,无论是动物还是植物,其生命都始于单个细胞——一个受精卵或合子。在发育过程中,这个细胞不断分裂,产生许多不同类型的细胞,最终排列成极其复杂且精确的模式。发育细胞生物学的目标是理解指导这一惊人转变的细胞和分子机制(视频21.1)。
植物和动物有着截然不同的生活方式,并采用不同的发育策略。在本章中,我们主要关注动物。动物发育的三个基本过程是:(1)细胞增殖,即从一个细胞产生许多细胞;(2)细胞特化或分化,使细胞获得不同的特性和功能;(3)形态发生,即细胞重新排列形成结构化的组织和器官(图21-1)。
受精卵的发育始于多轮细胞分裂,产生大量可特化为不同功能的细胞群。在发育的每个后续阶段,细胞都面临有限的选择,使其发育路径不断分叉,反映出大量连续决策过程。正如我们人生中的抉择,细胞的选择基于其内在状态——这主要反映其历史经历——以及来自其他细胞特别是邻近细胞的即时影响。要理解发育过程,我们需要了解每个选择如何受控、如何依赖于先前的决策。更重要的是,我们需要理解决策如何影响细胞的化学特性与行为方式,以及细胞行为如何协同作用最终决定机体的结构与功能。
随着细胞特化,它们不仅改变自身的生物化学特性,还改变形态及与其他细胞和细胞外基质的连接方式。它们通过移动和重组构建出人体复杂的架构,包括所有精确构造且尺寸明确的组织和器官。要理解这种形态发生的过程,我们需要同时考虑细胞间的机械相互作用和生物化学相互作用。
乍看之下,人们不会期望蠕虫、跳蚤、雄鹰和巨型乌贼由相同的发育机制产生,就如同不会假设制鞋与造飞机采用相同方法。然而令人惊讶的是,研究发现发育的基础机制在所有动物中本质上是一致的——不仅在所有脊椎动物中,在所有无脊椎动物中也是如此。可识别相似、进化相关的分子
图21-1 多细胞生物发育所需的三个基本细胞过程
图 21-2 同源蛋白通常具有保守功能。(A)无眼蛋白(亦称 Pax6)调控果蝇眼睛发育。在野生型果蝇中(上排),无眼/Pax6 基因在发育中的眼部表达,并指导形成右侧扫描电镜图像所示的眼睛结构。该基因在腿部错误表达(下排)会导致腿前体细胞(B)(参见图 7-38)或翅前体细胞(C)形成眼组织。乌贼同源 Pax6 蛋白在果蝇发育腿部错误表达时会产生相同效果(D)。(果蝇图像由 Katy Ong 和 Justin Kumar 提供;电镜图像引自 S.I. Tomarev 等,《美国国家科学院院刊》94 卷 2421-2426 页。1997 年版权归美国国家科学院所有,经美国国家科学院许可使用。)
定义特化的动物细胞类型,标记不同身体区域的差异,并协助构建动物体型模式。同源蛋白在不同物种中常发挥相同作用且功能可互换。例如,人工在果蝇体内表达的小鼠或鱿鱼蛋白,能够执行与该果蝇自身版本蛋白相同的功能(图21-2)。基于机制的内在统一性,发育生物学家在系统理解动物发育方面取得了重大进展。
本章首先概述动物发育过程中的若干基本机制,重点探讨那些研究最深入且能引发细胞差异的机制。随后依次讨论:胚胎细胞如何分化形成空间模式、发育事件的时间调控机制、细胞行为变化如何驱动形态发生,以及动物体型大小的调节方式。
发育概述
动物通过摄食其他生物生存。因此,尽管存在显著多样性,从蠕虫、软体动物到昆虫和脊椎动物等形态各异的动物,都共享与这种生存方式密切相关的基本解剖特征。表皮细胞构成保护性外层;肠道细胞吸收摄入食物中的营养;肌肉细胞实现向食物源移动;神经元和感觉细胞则调控行为。这些不同类型的细胞被组织成组织和器官,形成覆盖体表的皮肤层、用于摄食的口腔以及负责消化的内部肠道管道——肌肉、神经及其他组织分布于皮肤与肠道之间的空间。许多动物具有明确的身体轴线:前后轴(口与脑部居前,肛门居后)、背腹轴(背部向上,腹部向下)以及左右轴。本节将探讨动物基本体型构建的核心机制,以及这种细胞类型多样性是如何形成的。
保守机制构建动物核心组织体系
动物共有的解剖特征通过保守的机制发育而成。受精后,合子通常会迅速分裂或卵裂,形成许多称为卵裂球的小细胞。在此卵裂阶段,尚不能自主获取营养的胚胎并不生长。这一发育步骤最初完全由母体沉积在卵子中的物质驱动和控制。
图 21-3 以青蛙为例展示的早期发育阶段。(A) 受精卵分裂产生大量
胚胎基因组在很大程度上保持休眠状态,直至母源 mRNA 和蛋白质被耗尽或突然降解的转折点。随后胚胎基因组被激活——即我们后续将讨论的母源-合子转换——细胞相互粘附形成囊胚,通常呈现为实心或中空充满液体的细胞团。
即使在胚胎发生的这些早期阶段,遗传程序已然启动,催生出基本组织类型。一种称为原肠胚形成(源自希腊语 gaster,意为“腹部”)的复杂细胞重排过程,很快将囊胚转化为包含原始内部肠道的多层结构(图 21-3)。囊胚的部分细胞保留在外层,形成外胚层,这些细胞将发育成表皮和神经系统;其他细胞内陷形成内胚层,未来将形成肠道管及其附属器官,如肺、胰腺和肝脏。在大多数动物中,另一群细胞迁移至外胚层与内胚层之间的空隙,形成中胚层,这些细胞将发育成肌肉、结缔组织、血液、肾脏以及其他多种组织成分。进一步的细胞运动及伴随的细胞分化过程,不断塑造并完善着胚胎的结构架构。
原肠胚形成过程中形成的外胚层、中胚层和内胚层构成了早期胚胎的三个胚层。这一初始划分是确定发育过程中将出现的众多细胞命运的第一步。许多后续的发育转化将产生结构精细的器官。但在原肠胚形成阶段以微型规模建立的基本身体蓝图和轴线会一直保留到成年期,此时生物体的体积可能增长数十亿倍(参见影片21.2)。
细胞的发育潜能逐渐受限
随着身体结构的精细化,谱系内的单个细胞——即特定增殖母细胞的后代——其发育潜能变得越来越受限。在囊胚阶段,细胞通常具有全能性或多能性,即有能力分化形成成人身体的所有或几乎所有细胞类型。随着原肠胚形成的进行,这种多能性逐渐丧失:例如位于内胚层的细胞
形成上皮层的囊胚细胞通常围绕一个空腔排列。在原肠胚形成过程中,部分细胞内陷形成中胚层(绿色)和内胚层(黄色)。外胚层细胞(蓝色)则保留在外侧。(B)通过两栖动物胚胎躯干的横截面展示了基本的动物体结构规划:外侧为外胚层,内部为内胚层形成的管状结构,中胚层夹在两者之间。内胚层构成了从口腔到肛门的肠道上皮内衬,不仅发育出咽、食管、胃和肠道,还形成许多相关结构。例如唾液腺、肝脏、胰腺、气管和肺部都源自消化道壁,逐渐发育成分支管状系统并开口于肠道或咽部。内胚层仅形成这些结构的上皮组成部分——如肠道内衬和胰腺分泌细胞,而支撑性的肌肉与纤维成分则源于中胚层。
中胚层发育为结缔组织——最初形成胚胎中称为间充质的疏松细胞网,最终形成软骨、骨骼和纤维组织,包括真皮(皮肤的内层)。中胚层还形成肌肉、整个血管系统——包括心脏、血管和血细胞——以及肾脏和生殖腺的小管、导管和支持组织。脊索由中胚层形成,作为未来脊柱的核心,并作为协调周围组织发育的信号源。
外胚层将形成表皮(皮肤的外上皮层)和表皮附属器,如毛发、汗腺和乳腺。它还将发育成整个神经系统,包括中枢和周围神经系统,不仅包括神经元和神经胶质细胞,还包括鼻、耳、眼和其他感觉器官的感觉细胞。(B,引自 T. Mohun 等人,《细胞》22:9–15, 1980。)
例如,能够产生将排列在肠道内或形成肠道衍生器官(如肝脏或胰腺)的细胞类型,但它不再具有形成中胚层衍生结构(如骨骼、心脏或肾脏)的潜力。这样的细胞被称为已决定走向内胚层命运。因此,细胞决定开始得早,并随着细胞逐步经历一系列程序化的中间状态——在每一步都受到其基因组、历史以及与邻近细胞相互作用的引导——而逐渐缩小选择范围。当细胞经历终末分化,形成成年体内高度特化的细胞类型之一时,这一过程达到极限(图21-4)。成年体内一些保持分裂能力的细胞类型也保留了一定程度的多能性,尽管选择范围通常较窄。这些成体干细胞将在第22章讨论。
细胞记忆是细胞决策的基础
发育过程中丰富且极其复杂的成果背后,是细胞记忆在起作用(参见第435页)。细胞表达的基因及其行为方式既取决于细胞的过去,也受当前环境的影响。我们体内的细胞——肌肉细胞、神经元、皮肤细胞、肠道细胞等——能够保持其特化特征,主要因为它们保留了祖先在发育过程中接收的细胞外信号记录,而非持续从周围环境获取此类指令。尽管表型差异巨大,几乎所有细胞都保留着与受精卵中相同的完整基因组。它们的差异反而源于差异基因表达,这可能导致特定细胞程序的稳定遗传。我们在前几章讨论了基因调控、细胞记忆、细胞分裂、细胞信号传导和细胞运动的分子机制。本章将探讨这些基本过程如何协同作用,使发育中的动物实现自我组装。
几种模式生物对理解发育过程至关重要
动物共有的解剖特征在进化过程中经历了诸多极端变化。因此,物种间的差异在我们人类眼中通常比相似之处更为显著。但在分子机制及所涉及特定大分子的层面上,情况恰恰相反:所有动物之间的相似性既深刻又广泛。经过超过五亿年的进化分化,所有动物都保留着明显相似的基因和蛋白质组合,这些基因和蛋白质负责构建它们的身体蓝图,并形成特化的细胞和器官。
这种惊人的进化保守性并非通过对动物多样性的广泛调查发现,而是通过对少数实验便利物种——即第一章讨论的模式生物——的深入研究而揭示。对于动物发育生物学而言,最重要的模式生物包括果蝇黑腹果蝇 、非洲爪蟾光滑爪蟾 、线虫秀丽隐杆线虫 、小鼠家鼠以及斑马鱼斑马鱼 。在探讨发育机制时,我们将主要从这几种物种中选取案例,同时谨记它们仅代表了动物生命树的一部分。
调控 DNA 似乎是造成动物物种间差异的主要原因
尽管许多发育机制具有保守性,但它们最终产生的动物却可能截然不同。这些差异主要源于关键发育控制基因活性的变异。如第七章所述,多细胞生物中每个基因都关联着数千个核苷酸的非编码 DNA,其中包含调控元件。这些
图 21-4 从卵裂球到终末分化细胞谱系的演变过程。随着发育的推进,细胞变得越来越特化。卵裂球具有分化产生大多数或全部细胞类型的潜能。在信号分子和基因调控因子的作用下,细胞命运逐渐受限,最终分化为高度特化的细胞类型,例如分泌胰岛素激素的胰腺 \beta 细胞。
图 21-5 调控 DNA 决定发育过程中的基因表达模式。肌肉细胞与皮肤细胞拥有相同的基因组,但由于这些细胞表达不同的转录调控因子(这些因子会与基因调控元件结合),导致不同基因被激活。例如,皮肤细胞中的转录调控因子识别基因 1 的调控元件并激活该基因,而肌肉细胞中则存在另一组调控因子,它们结合并激活基因 3。激活基因 2 表达的转录调控因子同时存在于这两种细胞类型中。
调控元件根据特定细胞中存在的转录调节因子和染色质结构,决定基因产物何时、何地以及以多强的程度表达(图 21-5)。因此,进化过程中调控 DNA 序列的改变,即使编码 DNA 未发生任何变化,也可能改变基因调控网络的逻辑并影响发育结果。
如第四章所述,当我们比较不同动物物种的基因组时,发现进化对编码 DNA 和调控 DNA 的改变程度各不相同。编码 DNA 可能相当保守,但非编码调控 DNA 通常保守性要低得多。调控 DNA 的变化似乎是造成不同动物类群间显著差异的主要原因(参见第 239 页)。我们可以将保守编码序列的蛋白质产物视为通用分子零件工具箱,而调控 DNA 则是组装说明书:通过不同的指令,同一套零件工具箱可用来构建各种不同的身体结构。我们稍后将重新讨论这一重要概念。
少量保守的细胞间信号通路协调空间模式形成
发育动物的空间模式形成要求细胞根据其在胚胎中的位置产生差异,这意味着细胞必须对其他细胞(尤其是邻近细胞)产生的细胞外信号作出反应。在最常见的空间模式形成方式中,一组细胞最初具有相同的发育潜能,随后来自该群体外部细胞的信号诱导其中一个或多个成员改变其特性。这一过程被称为诱导信号传导。通常,诱导信号在时间和空间上受到限制,因此只有能够响应的细胞子集——即靠近信号源的细胞——才会呈现诱导特性(图21-6)。部分诱导信号依赖于细胞间直接接触;另一些则作用于更长距离,通过细胞外介质中扩散的分子或经由血液运输的分子进行介导(参见图15-2)。
动物发育中已知的大多数诱导事件由少数高度保守的信号通路控制,包括转化生长因子- \beta (TGF- \beta )、Wnt、Hedgehog、Notch 以及受体酪氨酸激酶(RTK)通路(详见第 15 章)。发育细胞用于细胞间通讯的有限信号词汇的发现,已成为发育生物学的一大简化特征。
通过组合调控与细胞记忆,简单信号可生成复杂模式
少量信号通路如何能产生如此多样的细胞类型与模式?这主要依靠几种机制。首先,激活信号通路产生的效应取决于细胞先前的经历
图21-6 诱导性信号传导。表达细胞外信号分子的灰色细胞引导邻近蓝色细胞形成新的细胞命运。
图 21-7 对相同诱导信号产生不同应答的两种机制。(A)通过细胞记忆,先前的信号(或其他事件)可留下持久痕迹,改变对当前信号的响应(参见图 7-56)。记忆痕迹在此以细胞核着色表示。(B)在组合信号传导中,信号效应取决于同时接收的其他信号是否存在。
应答细胞:过往影响会留下持久印记,记录在细胞染色质状态以及细胞内转录调节因子和 RNA 分子的选择中。这种细胞记忆使具有不同历史的细胞能够对相同信号作出不同响应(图 21-7A)。其次,细胞对特定信号的应答取决于其同时接收的其他信号(图 21-7B)。因此,不同信号组合可产生多种多样的应答反应。
除了这两种机制外,信号通路的某些组成部分,如配体或受体,是由在进化过程中经历复制并随后功能分化的基因编码的。这些高度同源的基因随后可在不同细胞类型中表达,从而引导不同的信号传导结果。例如,Notch 信号在一个组织中可能由 Notch1 介导,在另一个组织中则由 Notch4 介导,每个同源物诱导不同靶基因的转录。因此,相同的少数信号通路可以在不同时间和地点重复使用并产生不同结果,从而形成无限复杂的模式。
形态发生素是可扩散的诱导信号,能产生梯度效应
信号分子通常控制简单的"是-否"选择——高浓度时产生一种结果,低浓度或缺失时产生另一种结果。然而在其他情况下,反应呈现更精细的梯度变化:例如高浓度信号分子可能引导细胞进入一种发育途径,中等浓度引导进入另一种途径,而低浓度则引导进入第三种发育途径。
产生信号分子不同浓度的一种常见方式是分子从局部信号源扩散出去,形成浓度梯度。距离信号源不同位置的细胞会根据其所接触的信号浓度,被驱动表现出多种不同的行为方式(图21-8)。以这种方式在整个细胞区域形成模式的信号分子被称为形态发生素。在最简单的情况下,特化的细胞群以稳定速率产生形态发生素,随后该物质在扩散过程中逐渐降解。扩散速度与
图 21-8 梯度形成与解读机制。通过局部产生的诱导剂——形态发生素——从源点向外扩散形成浓度梯度。不同的形态发生素浓度(或不同暴露时长)会在响应细胞中诱导不同的基因表达模式和细胞命运。扩散传输仅能在短距离内形成陡峭梯度,形态发生素通常作用于 1\mathrm{mm} 或更短距离范围内。
形态发生素的半衰期将共同决定其形成梯度的范围和陡峭程度(图21-9)。
随后,邻近细胞根据其接触到的信号量——通过细胞表面受体的结合来检测——解读自身与形态发生素源的距离。这些受体完成信号转导后,只有当形态发生素浓度超过特定阈值时,靶基因才会开始转录;低于此阈值的低浓度则不会激活靶基因。通过这种方式,梯度信号可转化为基因活性的多个离散开关式变化。因此,单个分泌蛋白结合扩散的物理特性及细胞解读信息的能力,能够在细胞区域内产生多种不同的命运走向。
这种简单机制可以通过多种方式进行调整。例如,细胞表面受体可能捕获扩散中的形态发生素,使其被内吞并降解,从而缩短其有效半衰期。或者,形态发生素可能与细胞外基质中的分子(如硫酸乙酰肝素蛋白聚糖,第19章将讨论)结合,从而大幅降低其扩散速率。
侧向抑制可产生不同细胞类型的模式
形态发生素梯度及其他类型的诱导信号利用胚胎中现有的不对称性来创造进一步的不对称性和细胞间差异:从一开始,某些细胞就特化为产生形态发生素,从而对另一类对其敏感的细胞施加模式。但如果没有明确的初始不对称性呢?在最初完全相同的细胞群中,能否自发形成规则模式?
答案是肯定的。这种全新模式形成的基本原理在于正反馈机制:细胞能够通过信号交换,使得不同位置细胞间任何微小的初始差异自我放大,从而推动细胞走向不同的命运。这一机制在最典型的侧向抑制现象中得到了清晰体现——这种细胞间相互作用迫使相邻细胞产生分化,进而形成精细的不同细胞类型图案。
图 21-9 通过扩散建立信号梯度。每张图显示在原点以恒定速率产生的形态发生素信号分子浓度。在所有情况下,该分子在从源点扩散的同时会发生降解,这些图表基于分子沿空间两个轴向扩散的假设计算得出(例如从上皮组织中的源点径向扩散)。(A) 假设从时间 0 开始产生形态发生素,分子半衰期为 170 分钟,并以有效扩散常数 D = 1\mu \mathrm{m}^2\mathrm{sec}^{-1} (相当于细胞外组织中典型小蛋白分子的扩散能力)进行扩散时的浓度分布。红线展示了形态发生素积累过程中六个连续阶段,其浓度随距离源点的增加呈指数衰减。图 B 和 C 展示了系统特性的简单变化如何改变 160 分钟时间点的梯度分布。(B) 形态发生素扩散常数增加三倍(蓝线)会扩大其作用范围,但会降低源点附近的浓度。(C) 形态发生素半衰期增加三倍(绿线)会提高其在整片组织中的浓度。 形态发生素的作用不仅取决于其在某个关键时刻的浓度,还取决于每个靶细胞如何随时间整合其反应。(由 Patrick Müller 提供。)
设想一对起始状态相似的相邻细胞。每个细胞既能产生也能响应某种信号分子 \mathbf{X} ,并遵循一个附加规则:细胞接收到的信号越强,其自身产生的信号就越弱(图 21-10)。若一个细胞产生更多 \mathbf{X} ,另一个则被迫减少产生,例如通过降低编码 X 的基因转录。这形成了一个正反馈循环,倾向于放大两个相邻细胞间的任何初始差异。这种差异可能源于当前或过去外部因素施加的偏向,也可能仅来自自发的随机波动或“噪音”——这是细胞遗传控制回路不可避免的特性(第七章将讨论)。无论哪种情况,侧向抑制意味着,如果细胞 1 产生稍多的 X,它将导致细胞 2 产生更少;由于细胞 2 产生较少的 X,它对细胞 1 的抑制减弱,从而使得细胞 1 中 X 的产量进一步上升;如此循环,直至达到一个稳定状态,其中细胞 1 大量产生 X,而细胞 2 产生极少。 结果是这两个细胞被驱动沿着不同的分化路径发展。
在几乎所有组织中,都需要不同细胞类型的平衡混合与分布。侧向抑制提供了一种生成这种混合的常见方式。正如我们将看到的,侧向抑制通常通过细胞间接触经由 Notch 信号通路进行信号交换来介导,通过使表达一组基因的单个细胞引导其紧邻细胞表达另一组基因,从而驱动细胞多样化,这正是我们所描述的方式(另见图 15-60)。
不对称细胞分裂也能产生多样性
细胞分化并不总是依赖于细胞外信号:在某些情况下,细胞天生就不同,这是由于不对称细胞分裂的结果,即母细胞中存在的某些重要分子在两个子细胞之间不均等分配。这种有丝分裂期间的不对称遗传确保了两个子细胞以不同方式发育(图21-11)。尽管子细胞也可能在分裂后由于先前讨论的外源性诱导信号而变得不对称,但这里的机制是分裂细胞固有的。内在的不对称分裂是早期发育的一个常见特征。受精卵可能已经拥有内部模式,而这个大细胞的分裂将不同的命运决定因子分离到不同的卵裂球中。我们将在后面看到,不对称分裂在后期发育过程以及干细胞中也发挥作用(参见第22章)。
图 21-10 通过侧向抑制与正反馈产生不对称性的机制。本例中,两个相互作用细胞各自产生物质 X,该物质通过侧向抑制效应抑制对方细胞的 X 生成。某个细胞内 X 的增加会引发正反馈,促使该细胞进一步增加 X 产量,同时减少相邻细胞的 X 产量。这种加速不稳定性可能导致两个细胞产生根本性差异。最终,系统会稳定于两种对立稳态中的一种。这种稳态选择代表了一种记忆形式:最初引导选择方向的微小影响无需持续存在即可维持该状态。
图 21-11 使子代细胞差异化的两种方式。子代细胞可通过以下两种途径获得不同命运:(A) 通过细胞质分子差异性遗传的内在不对称分裂,或(B) 通过对称分裂后仅向其中一个子代细胞传递信号。
图21-12 通过连续诱导实现模式形成。从少量细胞出发,通过一系列诱导相互作用可产生多种细胞类型。
初始模式在小范围细胞群中建立,并随着胚胎生长通过连续诱导逐步精细化
调控胚胎细胞空间模式的信号通常作用于短距离,并支配相对简单的选择。例如,形态发生素通常作用于 1\mathrm{mm} 的范围内——这是扩散的有效作用距离——并指导其作用的细胞在若干发育选项间做出选择。然而最终发育形成的器官远比这更为庞大和复杂。
随着器官通过细胞增殖而生长,其初始模式的精细化过程可解释为:通过一系列连续相互作用,在最初简略的草图基础上不断增添更精细的细节。例如,当发育组织中出现两种细胞类型时,其中一种可产生信号,诱导邻近细胞亚群分化为第三种类型。这种第三类细胞又可反向信号传导至附近另两种细胞,从而产生第四和第五种细胞类型,依此类推(图21-12)。
这种生成渐进复杂模式的策略称为连续诱导。发育动物的身体蓝图最初以微型形式勾勒雏形后,正是主要通过连续诱导作用,随着发育进程不断增添越来越精细的细节。
发育生物学为疾病研究和组织维持提供重要见解
对动物发育理解的快速进展已成为生物学领域的重大成功案例之一,并具有重要的实际意义。约 2 - 5% 的人类婴儿出生时存在解剖结构异常,如心脏畸形、肢体短缺、腭裂或脊柱裂。发育生物学的进步帮助我们理解这些缺陷是如何产生的,即便目前尚无法预防或治愈大多数此类疾病。
从实践角度来看,虽不那么显而易见却更为重要的是,发育生物学也为理解成体细胞与组织的运作机制提供了洞见。发育过程并非止于出生,而是贯穿生命始终,伴随着组织的维持与修复。细胞生长与分裂、细胞间信号传导、细胞记忆、细胞粘附以及细胞运动等基本机制,不仅参与胚胎发育,同样作用于成体组织的维护与修复。正如我们在第20章所见,这些机制也是肿瘤细胞中主要被扰乱的机制。
胚胎比成体更为简单,使我们能更轻松地分析这些基础过程。例如,对早期果蝇胚胎的研究对发现多个保守信号通路(包括 Wnt、Hedgehog 和 Notch 通路)至关重要。这些研究不仅揭示了这些通路在维持正常人体组织中的核心作用,还为再生医学中调控这些通路奠定了基础。最终,它们为抗击癌症及其他疾病的疗法确定了靶点并提供了合理的作用机制。
在第22章中,我们将探讨这些核心发育机制及其他机制如何在正常成体中运作,特别是在通过干细胞持续更新的组织中——包括肠道、皮肤和造血系统。但现在,我们必须更仔细地观察早期胚胎如何生成其特化细胞的空间模式,从构建成体蓝图的变化过程开始。
摘要
动物发育是一个奇妙的自我组装过程,其中胚胎最初相似的细胞逐渐彼此分化,并自组织成日益复杂的结构。这一过程始于单个大细胞——受精卵,它通过分裂形成囊胚,囊胚经历原肠运动产生胚胎的三个胚层:外胚层、中胚层和内胚层。随着发育的继续,细胞根据其位置和彼此间的相互作用变得越来越特化,最终形成成体中的某种分化细胞类型。
发育中的细胞差异以多种方式产生,并需在空间上得到恰当协调。一种常见策略是,群体内初始相似的细胞通过暴露于来自外部信号源的不同浓度诱导信号或形态发生素而变得不同。邻近细胞亦可通过侧向抑制产生差异,即某个细胞向其邻近细胞发出信号,阻止它们走向相同的命运。这些细胞间相互作用由少数高度保守的信号通路介导,这些通路在不同生物体及发育过程中的不同时期被反复利用。然而,并非所有细胞多样化都源于细胞间相互作用:子细胞可能因不对称细胞分裂而天生不同。
转录和染色质结构的调控因子结合到调控 DNA 上,决定每个细胞的命运。体型差异在很大程度上似乎源于与每个基因相关的调控 DNA 的差异。这种 DNA 在定义发育的时序程序中起着核心作用,根据前一发育阶段每个细胞中存在的基因表达模式,在特定时间和地点激活基因。
发育过程在少数模式生物中得到了最深入的研究。但由此识别出的大多数基因和机制在所有动物中都被使用,并在不同发育阶段反复出现。因此,从蠕虫、果蝇、鱼类、青蛙和小鼠中获得的认识深刻影响了我们对人类胚胎学和成体组织维持的理解,以及这些过程中的异常如何导致先天缺陷和癌症。
模式形成机制
一个发育中的多细胞生物必须在几乎无法区分的细胞区域内创建不同的细胞命运,并以空间有序的方式完成这一任务,从而形成功能性组织。一些早期显微镜学家曾设想人体的整个形态和结构已以"小人"的形式存在于精子中——即一个微型人类,受精后这个小人只需生长即可形成完整尺寸的人体。我们现在知道这种观点是错误的,发育实际上是从简单到复杂的渐进过程,通过动物解剖结构的逐步精细化实现。要了解空间模式化和细胞决定的全过程如何启动,我们必须回到卵子和早期胚胎的阶段。
不同动物采用不同机制建立其初级极化轴
令人惊讶的是,动物发育的最初阶段是变异最大的阶段,即便在同一门类内也是如此。以青蛙、鸡和哺乳动物为例,尽管它们后期发育方式相似,但产生的卵子在大小和结构上截然不同,并且它们以不同的细胞分裂序列开启发育历程。
细胞分裂与特化同样存在巨大差异。同样地,身体主轴形成的时间和方式也存在很大变化。然而,胚胎的这种极化通常在原肠胚形成开始之前就已显现——这是空间模式形成的第一步。
必须建立两个主轴。前后轴(A-P 轴)确定未来头部和尾部的位置,背腹轴(D-V 轴)则确定未来的背部和腹部。对于呈现双侧不对称性的物种,建立额外的左右轴(L-R 轴)也至关重要。最后,许多动物的卵具有动物-植物极轴(A-V 轴),这一轴线在成体中并不明显,但能通过原肠胚运动界定哪些部分将形成内部结构,哪些将保持外部特征。(这个奇特的名称源自一个世纪前,与蔬菜毫无关联。)
在动物多样性的一个极端,卵子呈球面对称,其轴向仅在胚胎发生过程中才得以确立。小鼠便是一例,其卵子中几乎看不出明显的极性。相应地,最初几次细胞分裂产生的卵裂球似乎完全相同,且具有显著的适应能力。若将早期小鼠胚胎一分为二,便能产生一对同卵双胞胎——由单个细胞发育成两个完整、正常的个体。类似地,若用针刺毁双细胞期小鼠胚胎中的一个细胞,并将剩余的“半胚胎”植入代孕母鼠子宫发育,多数情况下仍能诞生出完全正常的小鼠。
在另一个极端,卵子具有不对称结构,这种结构本身就决定了身体未来的轴线。大多数物种都是这种情况,包括我们稍后将看到的果蝇等昆虫。其他生物则处于两者之间的某个状态。例如,非洲爪蟾的卵子在受精前就具有明确界定的 A-V 轴:靠近顶部的原核定义了动物极,而朝向底部的大量卵黄(胚胎的食物供应,最终将被纳入肠道)则定义了植物极。几种类型的 mRNA 分子已经定位在卵子的植物极细胞质中,并在那里产生它们的蛋白质产物。受精后,这些 mRNA 和蛋白质在胚胎中下部和中部的细胞中发挥作用,赋予细胞其特化特征。
非洲爪蟾胚胎的背腹轴形成由受精触发。精子仅能在动物极区域进入,其进入点处,精子中心体形成微管星体。微管细胞骨架的重组导致卵子外部皮层相对于细胞质中央核心发生旋转,使得皮层动物极略微偏向一侧(图21-13)。皮层旋转
图 21-13 蛙卵及其不对称性。(A)受精前的非洲爪蟾卵侧视图。(B)卵内分子沿动物-植物极轴的不对称分布,以及受精如何激活背腹不对称性。未受精卵中植物极定位的 VegT 蛋白定义了信号源的植物极位置,这些信号将诱导内胚层和中胚层形成。精子进入引发微管细胞骨架重组,触发卵皮质(数微米厚的表层)相对于卵核心旋转约 30 度。皮质旋转将包括 Wnt11 mRNA 在内的 Wnt 信号组分重新定位至未来背侧,从而建立胚胎的背腹轴。(A,由 Tony Mills 提供。)
重新定位信号分子并启动一系列事件,这些事件将组织身体的背腹轴。(胚胎的前后轴稍后在原肠胚形成过程中才会变得清晰。)这种通过信号提示在胚胎中建立新轴的一般过程被称为对称性破缺。
尽管不同动物物种采用多种机制来确立其整体结构,但进化结果却相对保守:头部与尾部、背部与腹部、内脏与皮肤均得以区分。似乎无论胚胎运用何种策略,总能成功打破初始对称性,建立起基本的身体蓝图。
果蝇研究揭示了发育背后的多种遗传调控机制
正是果蝇,而非其他任何生物,为我们理解基因如何调控早期发育提供了关键线索。数十年的研究最终汇聚成一项大规模遗传筛选,聚焦于早期胚胎,寻找破坏其形态模式的突变。这揭示了一组关键发育基因,它们通过相对少量的调控通路发挥作用。这些基因的发现及后续功能分析堪称科学杰作,对整个生物学领域产生了革命性影响,其发现者也因此荣获诺贝尔奖。通过这种方式揭示的调控机制中,部分在果蝇与脊椎动物间具有保守性,部分则不然。但该实验方法的逻辑及其揭示的遗传调控总体策略,彻底改变了我们对多细胞发育的整体认知。
要理解果蝇早期发育机制如何运作,需注意其发育过程中的一个特点。与其他昆虫卵类似但不同于大多数脊椎动物,果蝇卵——形似黄瓜——在发育初期会经历极其快速的核分裂而不伴随细胞分裂,在共同细胞质(即合胞体)中产生多个细胞核。随后这些细胞核迁移至细胞皮层,形成称为合胞体胚层的结构。当产生约6000个细胞核后,质膜在核间向内折叠并将其分隔成独立细胞,从而将合胞体胚层转化为细胞性胚层(图21-14)。
我们将看到,果蝇胚胎的初始模式形成依赖于在合胞体阶段通过细胞质扩散的分子,这些分子在卵子分裂成独立细胞之前,对快速分裂的细胞核中的基因发挥作用。在此阶段,无需通常形式的细胞间信号传递;合胞体囊胚层的相邻区域可以通过在巨大多核细胞的细胞质中移动的转录调节因子进行通信。
卵内沉积的基因产物调控早期果蝇胚胎的轴向形成
与大多数昆虫一样,果蝇未来身体的主要轴线在受精前就已确定,这是通过发育中的卵子(即卵母细胞)与卵巢中包围它的母体体细胞之间复杂的信号交换完成的。
图21-14 果蝇卵从受精到细胞囊胚阶段的发育过程。
图 21-15 Bicoid 蛋白梯度。(A) Bicoid mRNA 在卵子发生过程中沉积于前极。(B)局部翻译后通过扩散形成 Bicoid 蛋白梯度。(C)来自 Bicoid 纯合突变母体胚胎中缺失的 Bicoid 蛋白梯度。(A 和 B 由 Stephen Small 提供。)
这些信号可归类为母体效应,因为其源自母体基因组而非受精卵基因组。在受精前,未来胚胎的前后轴和背腹轴通过卵极性基因系统得以确立,这些系统在卵母细胞中形成 mRNA 或蛋白质标志物。受精后,每个标志物作为信标,提供引导周围区域发育过程的定位信号。
卵极性基因的本质源于对胚胎模式发生改变的突变体研究。其中一些突变导致胚胎极性紊乱;例如,某突变使身体两端都形成尾端结构,而缺失头端结构。这一特定突变有助于识别组织胚胎前端的标志物——Bicoid 蛋白。在受精前,Bicoid mRNA 分子沉积并定位于卵的前端。受精后,这些 mRNA 被翻译产生 Bicoid 蛋白。该蛋白作为一种细胞内形态发生素和转录调节因子,从其源点扩散开来,在合胞体细胞质内形成浓度梯度,最高浓度位于胚胎头部(图 21-15)。Bicoid 沿前后轴的不同浓度通过直接调控合胞体 blastoderm 细胞核中的基因转录,帮助决定不同的细胞命运(详见第 7 章讨论)。
还有三种卵极性基因系统对合胞体核进行模式构建;其中两个沿前后轴作用,一个沿背腹轴作用。它们与 Bicoid 基因群共同作用,方式大致相似,其基因产物标记出身体区域的三个基本分区——头部与后部,
图 21-16 果蝇中四种卵极性梯度系统的组织方式。Bicoid mRNA 编码一种转录激活因子,决定头部和胸部区域。Nanos 是一种翻译抑制因子,调控腹部的形成。定位的 Nanos mRNA 也会在胚胎后端形成生殖细胞时被纳入其中,Nanos 蛋白对生殖系发育至关重要。Toll 和 Torso 是遍布膜上的受体蛋白,但仅通过局部暴露于细胞外配体 Spaetzle(Toll 的配体)和 Trunk(Torso 的配体),在着色所示位点被激活。Toll 活性决定中胚层,而 Torso 活性则决定头尾末端结构的形成。
背侧与腹侧、内胚层与中胚层和外胚层——以及第四个同样对动物体型结构至关重要的划分:生殖细胞与体细胞的区别(图21-16)。
卵极性基因首先作用于基因系统层级中,逐步定义更详细的身体部位模式。接下来几页,我们将从沿前后轴模式化发育中的果蝇胚胎和幼虫的分子机制开始,再探讨沿背腹轴的模式化过程。
三组基因控制果蝇沿前后轴的分节
昆虫的身体沿其前后轴被划分为一系列体节。这些体节是同一主题的变奏重复:每一节都形成高度特化的结构,但都遵循相似的基本构建方案(图21-17)。在早期胚胎中,由卵极性基因沿前后轴建立的转录调节因子梯度是体节形成的序曲。这些调节因子启动分节基因的有序转录,通过精确调控基因表达模式来界定各个体节的边界和基本布局。分节基因在胚胎细胞亚群中表达,其产物是胚胎自身基因组对胚胎发育的首批贡献之一;因此被称为合子效应基因,以区别于更早起作用的母体效应基因。分节基因的突变可能改变体节的数量或其基本内部结构。
根据突变表型,分割基因可分为三类(图 21-18)。尽管三类基因的功能在时间上存在重叠,但将其视为按序作用更为便捷。最先表达的是一组至少包含六个间隙基因,其产物标记出胚胎头尾轴的粗略分区。间隙基因突变会导致相邻体节群缺失:例如 Krüppel 突变体幼虫缺失八个体节。随后表达的是八对规则基因,这些基因的突变
图 21-17 果蝇体节的形成过程。(A) 3 小时胚胎(侧视图)处于囊胚期,虽不可见分节结构,但可绘制命运图谱显示未来分节区域(彩色标注)。(B) 10 小时时所有体节清晰可辨(T1:第一胸节;A1:第一腹节)。参见视频 21.3。(C) 果蝇幼虫体节及其与胚胎区域的对应关系。(D) 果蝇成体体节及其与胚胎区域的对应关系。
图 21-18 影响卵极性基因和三类分节基因突变的表型示例。每种情况下,正常幼虫(左侧)绿色阴影区域在突变体(右侧)中被删除或被未受影响区域的镜像复制所替代。(改编自 C. Nüsslein-Volhard 和 E. Wieschaus,《自然》287:795-801, 1980。)
导致一系列影响交替体节的缺失,使胚胎仅保留正常数量一半的体节;尽管所有突变体都呈现这种两节周期性,但它们在具体模式上存在差异。最后,至少有10个节极性基因,其突变会产生正常数量的体节,但每个体节的部分区域被删除,并由其余全部或部分体节的镜像复制所替代。
各类分节突变体的表型表明,分节基因形成了一个协同系统,将胚胎沿前后轴逐步细分为越来越小的区域,每个区域通过不同的基因表达模式加以区分。分子遗传学有助于揭示这一系统的工作机制。
基因调控相互作用的层级细分果蝇胚胎
与 Bicoid 类似,大多数分节基因编码转录调节因子。通过比较正常与突变胚胎中的基因表达,可以解读这些基因受卵极基因调控的方式及其相互之间以及对其他基因的作用。利用适当探针检测 RNA 转录本或其蛋白质产物,可观察到基因以变化模式开启和关闭。这些模式揭示了形态均一的胚胎内部通过卵极基因网络产生的丰富空间信息。通过比较不同突变体中的这些模式,人们得以开始辨识整个基因控制系统的逻辑规则。
卵极性基因的产物为早期胚胎提供了全局位置信号(见图 21-16)。正如我们所知,Bicoid 蛋白作为形态发生素,在前后轴不同位置激活不同的基因组合:某些间隙基因仅在高浓度 Bicoid 区域被激活,而其他基因则在 Bicoid 浓度较低区域表达。虽然仅有六个间隙基因,但通过表达区域的重叠组合及其在各自域内的浓度差异,为前后轴上的每个细胞提供了丰富多样的位置身份标识。当间隙基因产物通过相互抑制表达完成位置精确定位后,它们形成了第二层级的位置信号系统,这些信号在更局部范围内调控胚胎图式的精细结构。通过如第 7 章讨论的配对规则基因 Even-skipped 所展现的组合效应(参见 423-424 页),间隙基因控制着配对规则基因的表达。配对规则基因进而划分出
图 21-19 果蝇胚胎前后轴模式形成的调控层次。卵极性基因定义了前后轴,并启动了三组基因(间隙基因、配对规则基因和体节极性基因)的表达,从而创建体节。每个体节的身份由 Hox 基因(稍后讨论)指定,其表达受卵极性基因和分节基因的共同输入调控。照片展示了各类基因代表性样本的 mRNA 表达模式。(由 Stephen Small 提供。)
这些重复的细胞群随后将形成体节,并相互协作,同时与间隙基因协同作用,建立起节段极性基因表达的规则周期性模式,这些基因定义了每个独立体节的内部结构模式(图21-19)。
节段极性基因中的大部分子集编码两种信号通路的组成成分——Wnt 通路和 Hedgehog 通路,包括分泌型信号蛋白 Wingless(Wnt 家族首个被命名的成员)和 Hedgehog。(Hedgehog 通路最初通过果蝇体节研究被发现,其名称源于 Hedgehog 突变体胚胎表面棘刺状的外观。)Wingless 和 Hedgehog 在不同细胞带中合成,这些细胞带在每个体节内充当信号中心。这两种蛋白质在调节邻近细胞中 Engrailed 等基因表达的同时,相互维持对方的表达(图 21-20)。通过这种方式,一系列连续诱导在每个体节内形成了精细的基因表达模式。
图 21-20 Hedgehog 与 Wingless 表达的相互维持机制。Engrailed 是一种转录调节因子(蓝色),驱动 Hedgehog 的表达。Hedgehog 编码分泌蛋白(红色),激活邻近细胞的信号通路,从而促使这些细胞表达 Wingless 基因。反过来,Wingless 编码分泌蛋白(绿色),作用于表达 Wingless 细胞的邻近细胞,维持其 Engrailed 的表达。随后 Engrailed 维持 Hedgehog 的表达,形成完整循环。如图所示,该网络沿果蝇前-后轴重复出现。(基于 S. DiNardo 等人,《当代遗传学与发育观点》4:529-534, 1994。)
卵极性基因、间隙基因和配对规则基因建立瞬时模式,该模式由体节极性基因和 Hox 基因记忆
间隙基因和对规则基因在受精后的最初几小时内被激活。它们的 mRNA 产物最初出现的模式仅大致接近最终图案;随后,在短时间内,这种模糊的初始模式会自行调整成一个规则、清晰定义的条纹系统。但这一模式本身并不稳定且短暂:随着胚胎经历原肠胚形成及后续发育,该模式逐渐瓦解。然而,这些基因的作用通过诱导某些体节极性基因以及另一类称为 Hox 基因(稍后讨论)的表达,传递了其表达模式的持久记忆。经过一段由细胞间相互作用介导的模式精细化过程后,这些新模式基因的表达模式得以稳定,提供位置标签,用以维持幼虫和成虫果蝇的体节组织结构。
片段极性基因 Engrailed 提供了一个很好的例证。其 RNA 转录物在细胞囊胚层中形成 14 条带状结构,每条带宽约一个细胞。这些条纹紧邻另一个片段极性基因 Wingless 的类似表达条纹前方。随着发育胚胎中细胞持续分裂和移动,表达 Wingless 的细胞与表达 Engrailed 的细胞之间的信号传导维持着它们表达的狭窄条纹(见图 21-20)。这种相互作用触发了一个稳定的 Engrailed 表达模式,该模式将在果蝇整个生命周期中持续存在,远早于诱导和细化该模式的信号消失之后。胚胎、幼虫和成虫的体节边界都将形成于每个 Engrailed 条纹的后缘(图 21-21)。
除了调控体节极性基因外,配对规则基因的产物还与间隙基因产物协同作用,诱导另一组基因——Hox 基因(见图 21-19)的精确定位激活。正是 Hox 基因首先定义并永久区分各个体节。在下一节中,我们将详细研究这些重要基因;我们将看到这一作用在包括人类在内的众多动物中都具有关键意义。
Hox 基因永久塑造前后轴模式
随着动物发育的推进,身体结构变得越来越复杂。但无论在哪个物种、哪个组织层面,我们反复发现复杂结构都是通过重复几个基本主题并加以变异而形成的。因此,肌肉细胞或成纤维细胞等基本分化细胞类型的子集会在不同部位重复出现,并组织成肌肉或肌腱等组织。模式形成机制在实施方式和位置上的微妙变异决定了牙齿或指趾等结构的构建方式,从而产生臼齿与门齿、手指与拇指及脚趾的差异。
无论我们在何处观察到这种调制性重复现象,都可以将发育生物学家的问题分解为两类:给定类别中所有对象共有的基本构建机制是什么?以及该机制如何被修饰以产生不同动物中观察到的变异?昆虫体节为此提供了绝佳范例。至此我们已概述了单个体节原基的构建方式,以及每个体节内细胞如何彼此分化。现在我们将探讨一个体节如何被决定或特化为不同于其他体节。
对该问题的初步解答出现在80多年前,随着果蝇中一系列突变体的发现,这些突变导致成虫组织结构出现奇异紊乱。例如在触足突变体中,腿部从头部触角位置生长而出;而在双胸突变体中,本应是小平衡棒的部位却出现了额外一对翅膀的部分结构(图21-22)。这些突变将身体部位转化为其他位置应有的结构,并且
图 21-21 分节极性基因 Engrailed 的表达模式。图示为 10 小时胚胎及成虫(制备时已去除翅膀)中 Engrailed 基因的表达模式。该模式通过构建果蝇品系呈现:将 Engrailed 基因的调控序列与报告基因 LacZ 的编码序列连接,通过针对 LacZ 的免疫组化产生的棕色产物(10 小时胚胎)或 LacZ 催化反应生成的蓝色产物(成虫)进行组织化学检测。值得注意的是,Engrailed 的表达模式标记了体节边界,且一旦确立便在整个生命周期中持续保持。(由 Tom Kornberg 提供。)
图 21-22 同源异型突变。超双胸基因(Ultrabithorax,简称 Ubx)是双胸基因复合体(一种 Hox 基因簇)中的三个基因之一。Ubx 负责第二胸节(具翅胸节)与第三胸节(具平衡棒胸节)之间的所有差异。(A 和 B)Ubx 功能缺失突变将具平衡棒的胸节(A)转化为具翅胸节,导致果蝇出现四翅表型(B)。(C)在第二胸节中 Ubx 功能获得性突变将该具翅胸节转化为具平衡棒胸节,导致果蝇无翅。(A 由加州理工学院档案馆提供;C 由 L.S. Shashidhara 提供。)
这些突变被称为同源异型突变(源自希腊语 homotos,意为“相似”),因为其转化发生在具有明显相似通用类型的结构之间,将一种附肢或体节转变为另一种。最终研究发现,整套同源异型选择基因(即 Hox 基因)能够永久性指定动物所有体节的前后轴特征。这些基因作为多基因家族成员彼此相关。
果蝇体内有八个 Hox 基因,它们分别位于被称为双胸复合体和触角足复合体的两个基因簇中。双胸复合体中的基因控制着身体腹部和胸节之间的差异,而触角足复合体中的基因则调控胸部与头节的分化。与其他物种的比较表明,这些基因基本上存在于所有动物体内,包括人类。这些比较还揭示,触角足复合体和双胸复合体实际上是一个完整实体——即 Hox 复合体——被分割的两部分,该复合体在果蝇进化过程中发生分裂,其成员通过协同作用实现对身体从头到尾发育模式的调控。
Hox 基因的产物——Hox 蛋白——是转录调节因子,均包含一个高度保守的、由 60 个氨基酸组成的 DNA 结合同源结构域(参见第 404 页)。编码同源结构域的 DNA 序列被称为"同源框",Hox 复合体正是通过缩写这一术语得名。虽然存在许多含同源框的基因,但只有位于 Hox 复合体中的基因才被称为 Hox 基因。
Hox 蛋白赋予每个体节独特性
Hox 蛋白可视为每个体节细胞所携带的分子地址标签:这些标签赋予各区域细胞位置值,即根据细胞位置不同而具有的内在特性。若发育中的果蝇体节地址标签被改变,该体节会表现出仿佛位于其他位置的行为;若胚胎中所有 Hox 基因被删除,幼虫的身体节段将全部趋于相同。
粗略地说,每个 Hox 基因通常在其突变或缺失会导致发育异常的区域表达。每个 Hox 蛋白如何赋予体节永久身份?需知 Hox 蛋白作为转录调节因子,能够结合基因调控 DNA;每种 Hox 蛋白会激活或抑制不同的靶基因组合。数百个基因受此类 Hox 调控影响,包括控制细胞间信号传导、转录调控、细胞极性、细胞粘附、细胞骨架功能、细胞生长与细胞死亡的基因,这些机制共同赋予每个体节独特的 Hox 依赖性特征。
Hox 基因的表达遵循其在基因簇中的排列顺序
那么 Hox 基因自身的表达是如何调控的呢?果蝇八个 Hox 基因的编码序列散布在数量庞大的调控 DNA 中,这些 DNA 包含结合位点用于
图 21-23 Hox 复合体基因表达模式与其染色体位置对比。(A)果蝇胚胎在所谓胚带收缩阶段的示意图,约为受精后 10 小时,此时发育中的体轴自身折叠。(B)通过原位杂交技术,使用不同标记探针对此阶段胚胎进行染色,以不同颜色检测不同 Hox 基因的 mRNA 产物。(C)照片中的空间分布模式与染色体复合体两个分区中的基因序列基本对应,仅存在微小偏差。(B 图由 William McGinnis 提供,改编自 D. Kosman 等人《科学》305:846, 2004。经美国科学促进会许可。)
卵极性基因和分节基因的产物,从而充当所有这些转录调控因子所提供的详细空间信息的解释器。最终结果是特定的一组 Hox 基因沿着前后体轴在特定区域进行转录。
Hox 基因的表达模式展现出显著的规律性,暗示存在额外的调控形式。无论是在触足复合体还是双胸复合体中,基因沿染色体的排列顺序几乎完全对应着它们沿身体前后轴表达的顺序(图 21-23)。这提示某种基因激活过程——可能依赖于染色质结构沿 Hox 复合体的传递,按照染色体上的顺序逐个启动 Hox 基因。细胞中表达的"最末端"Hox 基因通常占据主导地位,抑制"前端"基因的表达与活性,并决定体节特征。这些现象背后的基因调控机制尚未完全阐明,但其影响深远。我们将看到,Hox 复合体中基因表达的序列组织是在动物进化过程中高度保守的基本特征。
Trithorax 和 Polycomb 组蛋白通过调控 Hox 表达来维持位置信息的永久记录
Hox 复合体中基因表达的空间模式由发育早期作用的信号设定,但其影响持久不衰。尽管随着发育进程,表达模式会经历复杂调整,但 Hox 模式为每个细胞及其所有后代烙上了永久印记——记录该细胞在早期胚胎中所处的头尾轴向位置。通过这种方式,每个体节的细胞都保持着沿身体头尾轴位置的记忆,这种记忆不仅决定了幼虫体节的特定身份,也主导着成年果蝇各结构的节段特异性。
两种分子机制确保细胞记住其位置信息。一种来自 Hox 基因本身:许多 Hox 蛋白能自动激活自身基因的转录,从而帮助这些基因无限期保持开启状态。另一个关键输入来自两组大型互补蛋白——Trithorax 组蛋白和 Polycomb 组蛋白,它们通过在 Hox 复合物的染色质上留下胚胎激活或抑制状态的可遗传印记来实现记忆功能。这些是染色质结构的关键通用调节因子,对细胞记忆至关重要:若 Trithorax 或 Polycomb 组蛋白的基因存在缺陷,Hox 基因的表达模式最初能正确建立,但随着细胞分裂和胚胎发育,这种模式无法得到正确维持。
这两组调节因子以相反方式发挥作用。Trithorax 组蛋白对于在细胞中维持 Hox 基因的转录是必需的,当这些
图 21-24 Polycomb 群基因的作用。(A)野生型果蝇胚胎的暗场显微镜照片。(B)来自缺乏 Extra sex combs(Esc)基因母体的该基因缺陷突变型胚胎照片。该基因属于 Polycomb 群。几乎所有体节都转化为类似最末端腹节 A8 的结构。突变体中,最初大致正常的同源异型选择基因表达模式变得不稳定,导致这些基因很快沿整个体轴全面激活。(摘自 G. Struhl,《自然》293:36-41,1981 年由自然出版集团出版。经 SNCSC 许可复制。)
转录功能已经启动。相比之下,多梳群蛋白形成稳定复合体,结合到 Hox 复合体的染色质上,并在那些尚未激活 Hox 基因的细胞中维持抑制状态(图 21-24)。虽然最初因对果蝇 Hox 基因的影响而被发现,但多梳和三胸群蛋白是染色质结构的通用调节因子,控制着植物和动物中许多基因的表达。关于染色质如何存储发育细胞记忆的讨论详见第 4 章和第 7 章。
背腹信号基因创建转录调节因子 Dorsal 的梯度
现在我们转向果蝇胚胎第二条主要轴的图式形成。与刚才讨论的沿前-后轴的图式形成类似,沿背腹(D-V)轴的图式形成始于卵中界定该轴的母源基因产物(参见图 21-16),随后通过合子基因产物进一步细分胚胎中的背腹轴。
最初,由母体体细胞在胚胎未来腹侧区域下方产生的一种蛋白质,导致卵膜腹侧局部激活一种名为 Toll 的跨膜受体。(有趣的是,果蝇 Toll 与脊椎动物 Toll 样蛋白同样参与先天性免疫反应,详见第 24 章讨论。)Toll 的局部激活调控了 Dorsal 的分布,这是一种转录调节因子,属于第 15 章讨论的 \mathrm{NF}\kappa \mathrm{B} 家族。Dorsal 受 Toll 调控的活性,类似于 \mathrm{NF}\kappa \mathrm{B} ,依赖于 Dorsal 蛋白从细胞质(在此以非活性形式存在)向细胞核(在此调节基因表达)的转运(见图 15-63)。在新产下的卵中,Dorsal mRNA 和蛋白质均均匀分布于细胞质内。当合胞体囊胚层中的细胞核迁移至胚胎表面后,但在细胞化之前(见图 21-14),腹侧 Toll 受体的激活引发了 Dorsal 蛋白的显著重新分布。 在背侧,该蛋白质保留在细胞质中,但在腹侧则集中于细胞核内,两者之间存在平滑的核定位梯度(图21-25)。
图 21-25 囊胚层细胞核中 Dorsal 蛋白的浓度梯度。在野生型果蝇胚胎中,该蛋白质存在于背侧细胞质而缺失于背侧细胞核;垂直方向上,其在细胞质中减少并在细胞核中富集。在 Toll 通路被全面激活而非仅限于腹侧的突变体中,Dorsal 蛋白在所有区域均集中于细胞核,导致胚胎腹侧化。相反,在 Toll 信号通路失活的突变体中,Dorsal 蛋白在所有区域均滞留于细胞质而缺失于细胞核,导致胚胎背侧化。(引自 S. Roth 等人,《细胞》59:1189-1202, 1989。经爱思唯尔许可使用。)
类似于 Bicoid 在 A-P 轴上的作用,Dorsal 蛋白沿 D-V 轴充当形态发生素。一旦进入细胞核,Dorsal 蛋白会根据其浓度开启或关闭不同基因组的表达。每个响应基因的表达取决于其调控 DNA——特别是该 DNA 所含的 Dorsal 及其他转录调节因子结合位点的数量和亲和力。通过这种方式,调控 DNA 解读由核内 Dorsal 蛋白梯度提供的位置信号,从而界定出独特的 D-V 系列区域——贯穿胚胎全长的互补细胞带。在最腹侧(核内 Dorsal 蛋白浓度最高处),它会启动例如 Twist 基因的表达,该基因主导中胚层命运;而在最背侧(核内 Dorsal 蛋白浓度最低处),细胞则启动名为 Decapentaplegic 的基因表达。 而在一个中间区域,背侧蛋白的核浓度高到足以抑制 Dpp ,但又低到无法激活 Twist 时,细胞会启动另一组基因,包括一个名为短原肠形成蛋白(Sog)的基因(图 21-26A)。
由背侧蛋白直接调控的基因产物继而产生更多局部信号,这些信号沿背腹轴定义了更精细的亚分区。这些信号在细胞化后发挥作用,以传统细胞外可扩散蛋白的形式存在。特别是, Dpp 编码一种分泌型 \mathrm{TGF}\beta 家族蛋白,它在胚胎背部形成局部形态发生素梯度。在 Dpp 腹侧产生的 Sog 编码另一种分泌蛋白,通过结合并阻止 Dpp 激活其受体,作为 Dpp 蛋白的拮抗剂。这两种信号蛋白的对向扩散梯度形成了陡峭的 Dpp 活性梯度:最高的 Dpp 活性水平与其他特定因子共同作用,最终发育出最背部的组织——
图 21-26 形态发生素梯度如何指导果蝇胚胎背腹轴的模式形成过程。(A)最初,Dorsal 蛋白梯度定义了三个广泛的基因表达区域,此处通过三个代表性基因的表达来标示:Dpp , Sog,以及Twist。(B)稍后阶段,表达Dpp和Sog的细胞分别分泌信号蛋白Dpp(一个 TGF)\beta家人)以及Sog(一种拮抗剂Dpp随后,这两种蛋白质扩散并相互作用(并与某些其他因子共同作用),形成了所示的背腹(D-V)区域。
胚外膜。中等水平的 Dpp 活性导致背侧表皮发育;而在表达 Sog 的细胞中缺乏 Dpp 活性则允许神经源性外胚层发育,该结构将形成神经系统(图 21-26B)。
诱导相互作用的分级体系细分脊椎动物胚胎
果蝇发育的分子遗传学分析揭示了转录调控因子与信号通路级联如何逐级细分胚胎。这种渐进式图式精细化原理适用于所有动物胚胎(包括脊椎动物)的发育过程。值得注意的是,这种保守性不仅限于图式形成的总体策略,还延伸至许多相关分子。
如前所述,脊椎动物发育的最早阶段具有惊人的变异性,即使在近缘物种间也是如此,甚至很难准确说明早期果蝇胚胎的前后轴和背腹轴与早期青蛙或小鼠胚胎的对应关系如何。然而我们将看到,在这种进化可塑性的展示中,早期发育的某些特征实际上高度保守。后期发育阶段同样如此,其保守程度往往令人惊叹。从我们自身的解剖结构来看,人类显然是鸟类和鱼类的近亲。但通过分子机制观察,我们发现与果蝇和蠕虫也存在亲缘关系。
在接下来的篇幅中,我们将讨论信号分子与转录调节因子如何通过相互作用塑造脊椎动物胚胎的发育模式。我们首先以两栖动物为例,以非洲爪蟾为模型探讨胚胎轴的形成与模式建立。本章前文已对此主题有所涉及,此处我们将延续这一脉络,并与果蝇发育进行对比分析。
如前所述,青蛙胚胎轴及三个胚层的起源可追溯至囊胚阶段(见图 21-3A)。通过标记单个囊胚细胞,我们可以追踪细胞经历的所有分裂、转化与迁移过程,观察它们最终形成的结构及其来源。外胚层、中胚层和内胚层的前体细胞沿囊胚的动物-植物极轴有序排列:内胚层源自最靠近植物极的囊胚细胞,外胚层源自最靠近动物极的细胞,而中胚层则来源于中间区域的细胞。在这些区域内,细胞根据其在后期胚胎背腹轴上的位置具有不同的命运走向:外胚层中,表皮前体细胞位于腹侧,未来神经元则分布于背侧;中胚层中,脊索、肌肉、肾脏和血液的前体细胞按背腹方向依次排列。所有这些可通过命运图谱来呈现,该图谱揭示了后期各类细胞分别源自早期胚胎的哪些区域(图 21-27)。命运图谱向我们提出了核心问题:位于不同位置的细胞是如何被引导向各自特定命运发展的? 我们已经解释了母源因子如何在发育中的蛙卵中确定其动物-植物轴,以及受精引发的皮层旋转如何确定背腹轴的定向(见图21-13)。但是,轴的建立如何进一步导致胚胎细分为未来的身体部分呢?
答案是母源基因产物导致在胚胎的植物侧和背侧形成信号中心。特别是背侧信号中心在发育生物学史上占有特殊地位。二十世纪初的实验发现,这是一小簇具有非凡特性的细胞:当这些细胞被移植到相对位置时,它们能引发邻近组织的彻底重组,导致形成第二个完整的身体轴(图21-28)。这个被称为"组织者"的信号中心的发现,开创性地揭示了建立脊椎动物身体框架的诱导相互作用链。
图21-27 青蛙胚胎的囊胚命运图谱。内胚层来源于最靠近植物极的卵裂球(黄色),外胚层来源于最靠近动物极的卵裂球(蓝色),而中胚层则来源于中间区域的卵裂球(绿色),这些细胞也会贡献于内胚层和外胚层的形成。不同类型的细胞源于背腹轴上的不同位置。
图 21-28 组织者诱导次级轴的形成。通过将取自另一同期胚胎背部特定区域(称为组织者区)的一小簇细胞移植到两栖动物胚胎中,移植体发出的信号会调控宿主胚胎邻近细胞的行为,导致连体双胞胎的形成。参见视频 21.4。[改编自 J. Holtfreter 与 V. Hamburger,载于《发育分析》(B.H. Willier, P.A. Weiss 与 V. Hamburger 编),第 290-296 页,费城:桑德斯出版社,1955 年。]
与果蝇合胞体胚胎不同,受精的蛙卵经历常规的卵裂分裂,形成由数千个细胞组成的胚胎。因此,胚胎的模式形成必须通过细胞间扩散的胞外信号分子来介导,而非通过合胞体细胞质中移动的转录调节因子。不足为奇的是,如今已知组织者是分泌信号的主要来源。正如我们将要看到的,这不仅包括结合并激活跨膜受体的配体(参见第15章),还包括抑制这些配体活性的分泌蛋白。
分泌信号蛋白之间的竞争塑造了脊椎动物胚胎轴的模式
沿动物-植物极(A-V)轴模式化青蛙胚胎的信号分子属于 \mathrm{TGF\beta} 家族:它们由植物极的信号中心分泌,并沿 A-V 轴形成浓度梯度。这些 Nodal 蛋白的作用范围相对较短:最靠近植物极的细胞暴露于高水平信号,通过启动促进内胚层发育的基因作出响应;距离较远的细胞则暴露于较低水平,激活促进中胚层形成的基因。产生 Nodal 的植物极细胞同时产生第二种扩散更快的蛋白质 Lefty,该蛋白可拮抗 Nodal。动物极区域 Lefty 与 Nodal 的高比例使 Lefty 能够阻断 Nodal 信号传导,导致该处细胞发育为外胚层(图 21-29A)。因此,Nodal 的中程激活作用与 Lefty 的长程抑制作用相结合,沿 A-V 轴建立了内胚层、中胚层和外胚层这三个胚层的祖细胞分布模式。
青蛙采用一种略有相关的策略,沿着胚胎的背腹轴细分胚层区域。它依赖于对骨形态发生蛋白 (BMPs;属于另一个 TGF-β家族亚类成员)的模式化抑制,这些蛋白在整个胚胎中分泌。背侧信号系统通过分泌包括乔丁蛋白和诺金蛋白在内的多种蛋白质发挥作用,当这些蛋白质自身浓度较高时,会阻断 BMP 信号传导。通过这种方式,乔丁和诺金形成了 BMP 的背腹梯度,背侧活性低而腹侧活性高(图 21-29B)。经历高水平 BMP 信号传导的外胚层细胞被推向表皮命运,而几乎或完全没有 BMP 信号传导的细胞则保持神经特性。值得注意的是,这种通过 BMP 家族信号与可扩散抑制剂的对抗梯度来模式化背腹轴的策略,与果蝇中所采用的策略相似,且实际使用的特定分子具有同源性。
图 21-29 Nodal 与骨形态发生蛋白(BMP)信号如何调控胚胎轴向模式。Nodal 及其拮抗剂 Lefty 塑造动物-植物轴向模式,而 BMP 及其拮抗剂 Chordin 与 Noggin 则调控背腹轴向模式。(A)在动物极区域,Nodal 水平相对于 Lefty 较低,Lefty 阻遏 Nodal 与其受体结合。在植物极区域,Nodal 过量表达导致其信号通路激活。(B)沿背腹轴方向,BMP 广泛存在但 Chordin 与 Noggin 集中于背侧,通过结合 BMP 阻遏其与受体相互作用。图示底部展示了 Nodal 与 BMP 活性模式的最终空间分布。
了解指定脊椎动物体内三个胚层及各种组织类型的信号后,便可在培养皿中重现这一分化过程。例如,取自胚胎动物极区域的蛙细胞,若通过暴露于中等浓度 Nodal 信号和高浓度 BMP 信号改变其原有发育路径,便会分化为血液(一种腹侧中胚层组织)。同样地,通过将小鼠或人类胚胎干细胞在培养环境中暴露于适当的信号分子组合,也能诱导其生成特定细胞类型。如此,通过对动物发育研究获得的洞见,可用于再生医学所需细胞类型的制备,我们将在下一章讨论这一点。
Hox 基因控制脊椎动物前后轴发育
果蝇与脊椎动物之间发育机制的保守性远不止于背腹侧信号系统。Hox 基因几乎存在于所有被研究的动物物种中,且通常以类似昆虫 Hox 基因复合体的形式成簇存在。例如,小鼠和人类拥有四个这样的复合体——分别称为 HoxA、HoxB、HoxC 和 HoxD 复合体——每个位于不同的染色体上。通过序列比对可以识别每个复合体中单个基因与果蝇 Hox 基因家族特定成员的对应关系。事实上,哺乳动物的 Hox 基因在果蝇体内能部分替代相应果蝇 Hox 基因的功能。大致而言,哺乳动物的四个 Hox 复合体各自都相当于一个完整的昆虫 Hox 复合体(即触足复合体加双胸复合体)(图 21-30)。
每个脊椎动物 Hox 复合体中的基因排列顺序与昆虫 Hox 复合体基本相同,这表明所有四个脊椎动物复合体都起源于脊椎动物和昆虫共同祖先中存在的单一原始复合体的复制,并保留了其基本组织结构。最具说服力的是,每个脊椎动物 Hox 复合体的成员沿着胚胎轴线从头到尾依次表达,正如在果蝇中所见。与果蝇类似,脊椎动物 Hox 基因的表达模式通常与脊椎动物的体节相对应。这种对应关系在后脑区域尤为明显(见图 21-30),该区域的节段被称为菱脑节。
脊椎动物 Hox 基因的产物——Hox 蛋白,负责指定控制后脑、颈部和躯干(以及身体其他某些部位)前后轴向模式的位置值。与果蝇相似,当后部 Hox
图 21-30 昆虫与哺乳动物 Hox 基因复合体对比及其与身体区域的关系。果蝇触角足复合体和双胸复合体基因按染色体顺序展示于首行(参见图 21-23)。四个哺乳动物 Hox 复合体的对应基因同样按染色体顺序排列于下方。通过上方和下方动物示意图中的颜色简化展示了基因在果蝇与哺乳动物体内的表达区域,呈现出显著平行性。但具体表达模式会随发育阶段变化,且不同哺乳动物 Hox 复合体间存在细微差异。此外,许多标注为前部区域表达的基因也会在后部区域表达,与更靠后的 Hox 基因表达域存在重叠。
这些复合体被认为经历了如下演化过程:首先,在蠕虫、果蝇和脊椎动物的某个共同祖先中,一个原始的同源异型选择基因经过多次复制,形成了一连串串联排列的此类基因——即祖代的 Hox 复合体。在果蝇谱系中,这个单一复合体分裂成了独立的 Antennapedia 复合体和 Bithorax 复合体。与此同时,在向哺乳动物演化的谱系中,整个复合体经历了多次复制,形成了四个 Hox 复合体。这种平行演化并非完美无缺,因为显然有些基因被复制而其他基因则丢失了。自复合体分化以来,还有一些基因被征用服务于不同目的(顶行括号内的基因)。(基于威廉·麦金尼斯提供的示意图。)
若将基因人为表达于前部区域,它能将前部组织转化为后部特性。相反,后部 Hox 基因的缺失会使它们通常表达的后部组织呈现前部特征(图 21-31)。由于四个 Hox 基因簇中基因功能存在重叠,小鼠 Hox 突变体中观察到的转化现象并不像果蝇中那样直接明了,且往往是不完全的。尽管如此,显然果蝇和小鼠使用基本相同的分子机制,在至少一部分前-后轴线上赋予连续区域以个体特征。
某些转录调节因子能激活定义细胞类型或构建完整器官的程序
正如存在指定身体特定区域身份的单个基因,也存在一些基因,其产物可作为特定细胞类型乃至特定器官发育的触发器,启动并协调所需的整个复杂基因表达程序。MyoD 即为一例
图 21-31 Hox 基因对小鼠前后轴模式的控制。(A 和 B)正常小鼠(野生型)具有约 65 块椎骨,其结构根据沿身体轴线的位置而不同:7 块颈椎(颈部)、13 块胸椎(带肋骨)、6 块腰椎(B 图中黄色星号标注区域)、4 块骶椎(B 图中红色星号标注区域)以及约 35 块尾椎(尾部)。A 图展示侧视图,B 图展示背视图;为清晰起见,两图中均移除了四肢。(C)HoxA10 基因通常在腰椎区域表达(与其同源基因 HoxC10 和 HoxD10 共同作用);本实验中该基因被人为地在发育椎体组织中全轴表达。其结果是,颈椎和胸椎全部转化为无肋骨的腰椎特征。(D)相反,当同时敲除 HoxA10、HoxC10 和 HoxD10 基因时,本应具有腰椎或骶椎特征的椎骨会转而呈现带肋骨的胸椎特征。(A 和 C 图源自 M. Carapuco 等,《基因与发育》19:2116-2121, 2005,经冷泉港实验室出版社许可使用;B 和 D 图源自 D.M. Wellik 和 M.R. Capecchi,《科学》301:363-367, 2003。) 经美国科学促进会许可。)
我们在第 7 章中遇到的转录调节因子家族。这些蛋白质驱动细胞分化为肌肉细胞,表达肌肉特异性肌动蛋白和肌球蛋白,以及肌肉细胞所需的所有其他特殊细胞骨架、代谢和膜蛋白。类似地,Achaete/Scute 家族的转录调节因子成员驱动细胞成为神经祖细胞。在这两个例子中,这些蛋白质都属于螺旋-环-螺旋(HLH)类转录调节因子(见第 405 页),其他几种诱导特定细胞类型分化的蛋白质也是如此。这些主转录调节因子通过结合基因组中的多个不同调控位点,从而控制大量下游靶基因的表达,发挥其强大的分化诱导活性。在一个经过充分研究的案例中,即 Achaete/Scute 家族成员 Atonal 同源物 1(Atoh1)的研究表明,其在小鼠基因组中的直接靶基因数量超过 600 个。 然而,值得注意的是,即便是如此强大的细胞分化驱动因子,其作用效果也可能因作用细胞的具体环境和历史背景而有天壤之别:例如,Atoh1 在大脑中驱动特定类型神经元的分化,在内耳中促进感觉毛细胞的生成,并在肠道内壁推动分泌细胞的形成。
编码转录调节因子的其他基因能够驱动构成整个器官的多种细胞类型的形成与组装。一个著名的例子是转录调节因子 Eyeless(见图 21-2)。当该基因在果蝇腿部前体细胞群中被人工表达时,腿部会发育出结构完整的类眼器官,其中各种眼细胞类型排列正确;反之,若缺失 Eyeless 基因,则会导致果蝇失去眼睛。此外,脊椎动物中 Eyeless 的同源基因 Pax6 缺失同样会造成眼部结构缺失——携带 Pax6 突变的人类会表现出先天性无虹膜症(图 21-32)。类似的器官选择蛋白也存在于前肠、心脏、胰腺等其他器官中。它们都是主导转录调节因子,直接调控数百个靶基因,这些基因的产物进而特化并构建相应器官的不同组成部分。然而,如同 Atoh1 的例子所示,这些调节因子通常需要与特定搭档蛋白协同作用才能发挥特异性效应,而这些搭档蛋白仅在其早期发育过程中经过适当预处理的细胞中表达。
Notch 介导的侧向抑制机制优化细胞间距模式
在基本体型结构建立和器官前体生成之后,还需要经历许多模式精细化的步骤,才能实现组织和器官中终末分化细胞的成熟模式。侧向
图 21-32 Pax6 蛋白(在果蝇中亦称为无眼蛋白)控制多种动物物种光感受器官的发育。携带 Pax6 基因突变的果蝇或人类会缺失正常动物所具有的某些眼部结构。[果蝇图片由 Katy Ong 提供;人类图片引自 N.L. Washington 等,《公共科学图书馆·生物学》7(11):e1000247, 2009 年。]
抑制(参见图 21-10)通过 Notch 信号传导介导,对于所有动物各类组织中的细胞多样化及精细模式形成都至关重要。
某些组织需要在其范围内均匀分布特定类型的细胞,比如感觉细胞、分泌细胞或干细胞。果蝇感觉刚毛的发育就是一个很好的例子,这些刚毛最容易在果蝇背部观察到,但也存在于其大多数其他暴露表面。每一个感觉刚毛都是一个微型感觉器官,由一个感觉神经元和少量支持细胞组成。有些刚毛对化学刺激作出反应,而另一些则对机械刺激作出反应,但它们的构造方式相似(图21-33)。
先前提到的原神经基因 Achaete 和 Scute 标记了表皮细胞簇,这些细胞簇中将形成刚毛,但具体哪些细胞形成刚毛则取决于它们之间的竞争性相互作用。每个细胞簇内的信号传导会选择单一细胞——称为感觉器官前体细胞——作为刚毛的祖细胞。通过侧向抑制(见图 21-10),祖细胞与周围细胞区分开来,这一过程由 Notch 信号通路介导。当细胞簇中某个细胞表面的跨膜受体 Notch 与邻近细胞上的跨膜配体 Delta 结合时,会产生信号,抑制该细胞分化为感觉器官前体,并同时抑制其自身 Delta 的产生。最初,簇中的所有细胞都表达 Notch 和 Delta,并相互抑制分化。
图 21-33 果蝇机械感觉刚毛。(A) 左侧展示了刚毛四个细胞的谱系——均为单一感觉器官前体细胞的后代。感觉器官前体细胞一旦确定,便通过短暂的分裂周期程序产生这组细胞。在每一代子细胞中,侧向抑制机制再次运作,促使新生细胞走向不同命运:其中一个最终子细胞将分化为神经元;另一个形成刚毛杆;其余则分化为各类支持细胞。(B) 利用无意义基因荧光报告系统(粉红色)观察到的蛹表皮中感觉器官前体细胞的分布。(C) 成年果蝇胸部刚毛的排列模式。(B 和 C 由 François Schweisguth 提供。)
图 21-34 侧向抑制。(A)仅以两个相互作用细胞为例说明 Notch 介导的竞争性侧向抑制基本机制。灰色显示的蛋白质或效应线表示失活状态。(B)相同过程在更大细胞区域中的运作结果。最初,该区域内所有细胞均等效,通过 Delta-Notch 相互作用发出信号,阻止相邻细胞特化为感觉器官前体细胞。当某个细胞产生略强于邻细胞的 Delta 信号时,这种平衡抑制被打破:该细胞通过更强烈地抑制邻近细胞,使自身更坚定地朝向感觉器官前体命运发展。随着邻近细胞分化能力丧失,它们抑制其他细胞分化的能力也随之减弱。因此,侧向抑制使相邻细胞走向不同命运。虽然该相互作用被认为主要依赖于细胞间接触,但感觉器官前体细胞也能向超过一个细胞直径距离的细胞传递抑制信号;例如通过伸出长突起接触远端细胞。
然而,逐渐地,微小的信号差异会形成一个正反馈循环:产生稍强 Delta 信号的细胞既抑制邻近细胞分化,又减少其 Delta 蛋白的生成。这引发了一场竞争,最终单个感觉器官前体细胞胜出,向紧邻细胞发出强烈的抑制信号,自身却不接收此类反馈信号(图 21-34)。
感觉器官前体细胞会经历短暂的进一步分裂程序,生成构成最终刚毛的细胞群(参见图 21-33)。Notch 信号在该程序的连续阶段反复作用,推动感觉器官前体细胞的后代沿不同路径分化,并赋予它们各自特化的命运。但这一过程还需结合其他机制,这些机制能够影响由侧向抑制介导的竞争结果。正如我们将要讨论的,在感觉刚毛发育过程中,不对称定位于分裂细胞内部的 Determinants(细胞命运决定因子)正扮演着这样的角色。
细胞命运决定因子可被不对称遗传
细胞分化并不总是依赖于细胞外信号:在某些情况下,子细胞天生就存在差异,这是由于内在的不对称细胞分裂造成的,在此过程中,某些重要的分子集合在它们之间被不均等地分配。这种不对称分离的分子(或分子集合)随后通过直接或间接改变接收到它的子细胞内的基因表达模式,成为决定细胞命运的关键因素(见图 21-11)。分子不对称分离的一个典型例子发生在早期青蛙胚胎中:VegT RNA 特异性地定位于受精卵的植物极区域。经过卵裂分裂后,只有植物极细胞会继承 VegT RNA。
不对称分裂通常发生在发育初期,但在某些后期阶段也会出现。以成年果蝇刚毛为例(见图21-33),感觉器官前体细胞会经历一次
不对称细胞分裂产生两个子细胞:一个将生成外毛和套细胞,另一个则生成内神经元和鞘细胞。每种命运由一种名为 Numb 的蛋白质的差异遗传所决定,该蛋白质影响子细胞间基于 Notch 介导的侧向抑制决策。Numb 是一种抑制 Notch 信号传导的胞质蛋白,其在感觉器官前体细胞中的存在指定了“内部”前体细胞的命运。在此细胞分裂前,Numb 均匀分布于细胞皮层。随着有丝分裂纺锤体的形成,Numb 从靠近一个纺锤体极的皮层区域移位,限制其仅定位于另一极相邻的皮层区域(图 21-35)。这种限制依赖于第 16 章所述的 Par 蛋白复合物的极化活性(另见图 16-76)。当胞质分裂完成时,Numb 仅存在于两个子细胞中的一个,并在该细胞内抑制 Notch 信号传导——从而作为一种不对称分离的命运决定因子发挥作用。
Numb 在果蝇神经干细胞谱系的不对称分裂中以类似方式运作,产生大量且比例平衡的神经元和胶质细胞。神经祖细胞的不对称分裂也驱动脊椎动物大脑皮层中的神经发生。在这两种情况下,Notch 信号决定了更偏向祖细胞特性与更偏向分化命运之间的差异。
调控 DNA 的进化解释了许多形态差异
在前几节中,我们已经看到动物含有相同的基本细胞类型,具有相似的基因集合,并共享许多模式形成的分子机制。但如何将这些观点与我们在蠕虫、果蝇、青蛙和小鼠等形态各异的动物身体结构中观察到的根本差异相协调?我们先前曾概括性地断言,这些差异通常似乎反映了控制保守发育调控蛋白基本组的调控 DNA 差异。现在我们将更仔细地审视相关证据。
当我们比较具有相似基本身体构造的动物物种时——例如不同的脊椎动物,如鱼类、鸟类和哺乳动物——我们发现对应基因可能拥有相似的调控元件组合,这些元件在不同动物中具有保守性且可识别为同源结构。这一规律同样适用于不同种类的线虫或昆虫间的比较。然而,当我们将脊椎动物的调控区域与蠕虫或果蝇的调控区域进行比较时,很难发现任何此类相似性。蛋白质编码序列具有明显的相似性,但对应的调控 DNA 序列却显得截然不同,这表明身体构造的差异主要反映了调控 DNA 的差异。尽管蛋白质本身的变异也起作用,但即使蛋白质相同,调控 DNA 的差异已足以产生截然不同的组织和身体结构。
目前尚无法追溯导致动物惊人多样性的所有遗传步骤。它们的谱系已经分化了数亿年
图 21-35 不对称细胞分裂在果蝇刚毛谱系中产生不同的子细胞命运。(A)果蝇蛹内一个分裂中的感觉器官前体细胞图像。最初,Numb 蛋白(粉红色)均匀分布在细胞皮层周围,但在分裂中期会聚集到细胞一侧。细胞核 DNA 被染成蓝色。分裂导致 Numb 仅被分配到两个子细胞中的一个。(B)在这对子细胞中,不对称遗传的 Numb(未显示)阻止了左侧子细胞中的 Notch 信号传导;Notch 活性仅限于右侧子细胞,如 Notch 靶基因 Enhancer of Split m8 的报告基因(绿色)所示,该基因在细胞核(染成蓝色)中呈现为斑点状。(A 图来自 J.A. Knoblich, Nat. Rev. Mol. Cell Biol. 11:849-860, 2010;B 图由 François Schweisguth 提供)
经过数年的演变,大多数情况下发生了太多变化,以至于我们无法断言某一特征是由某一突变所致。然而,对于更近期的进化事件,情况则更为清晰。对形态各异的近缘动物种群和植物种群的研究表明,调控 DNA 的特定变化能够引发显著的发育效应。
一个被深入研究的例子是三刺鱼形态的多样性。海洋中的三刺鱼从其骨盆骨骼延伸出尖锐的刺棘,这些刺棘被认为有助于保护它们免受海洋中软口鱼类捕食者的侵害。约一万年前末次冰期结束后,部分海洋三刺鱼迁居到新形成的淡水溪流和湖泊中,这些水域通常缺乏此类捕食者。许多淡水三刺鱼种群在进化过程中逐渐失去了骨盆刺棘。这种不同形态的发展反映了对名为 Pitx1 的转录调节因子表达控制的差异。海洋三刺鱼在后肢芽细胞(这些细胞将发育成骨盆刺棘)中表达 Pitx1 基因,而淡水三刺鱼由于 Pitx1 基因位点的变化失去了这种表达。这些变化并不位于编码序列中,而是各自缺失了一小段调控 DNA 区块,这些区块专门控制骨盆细胞中的 Pitx1 表达(图 21-36)。
Pitx1 蛋白在鱼体其他部位具有重要功能,例如在颌部和垂体,这些功能必须保留。编码 Pitx1 蛋白的 DNA 序列,以及负责在这些其他身体部位实现组织特异性 Pitx1 表达的调控 DNA,在海鱼和淡水鱼中均得以保留。骨盆发育的进化
图 21-36 刺鱼形态多样性由调控元件变化引起。(A-D) 海生种群(A)具有骨盆棘刺,而某些淡水种群(C)则缺失。相应地,Pitx1 在海鱼(B)骨盆区域表达,在淡水鱼(D)中不表达。(E) 淡水种群骨盆区域缺乏表达是由于调控缺失移除了骨盆特异性增强子序列;这些缺失在不同种群中独立发生且长度各异。Pitx1 的编码序列及其他增强子和表达位点在海水与淡水刺鱼中均保守。(A-D,由 Michael D. Shapiro 提供)
图 21-37 移动遗传元件的插入促进了现代玉米的形成。现今的玉米植株最初由一种名为类蜀黍的野生植物(A)选育而来。这种野生祖先结有多个果穗,内含细小坚硬的种子。(B)相比之下,现代玉米结穗较少——但穗中含有大量饱满甜美的籽粒。在种子发育相关基因调控区域插入的移动遗传元件推动了这一演变。图中两种植物按相同比例绘制;为简化示意图,未展示叶片部分。
棘鱼案例揭示了我们在第七章(见图 7-31)讨论的调控 DNA 元件的模块化特性如何实现身体不同部位的独立演化——即使多个身体部位的形成依赖于相同的蛋白质。
在植物近期的进化过程中,其结构变化可通过类似调控 DNA 变化的方式进行追溯。农业领域的一个重要例证是:经过约一万年美洲原住民对自然遗传变异的选择,这类变化构成了野生类蜀黍植物与其现代后代玉米之间显著差异的主要成因(图 21-37)。
摘要
果蝇一直是研究动物发育遗传学的首要模式生物。其胚胎模式由称为卵极基因的母体效应基因产物启动,这些基因通过建立卵子和早期胚胎中转录调节因子的梯度分布发挥作用。例如沿前后轴(A-P 轴)分布的 Bicoid 蛋白梯度,有助于启动间隙基因、配对规则基因和分节极性基因的有序表达。这三类分节基因通过层级式相互作用,在胚胎特定区域选择性表达,将最初均匀的细胞场沿 A-P 轴逐步细分为一系列规则重复的模块化单元——体节。
叠加在每一体节重复出现的基因表达模式之上,Hox 基因的序列表达模式赋予每个体节不同的身份特征。这些基因成簇排列在复合体中,其序列顺序与它们沿身体前后轴线的表达顺序相一致。
尽管 Hox 基因的表达始于胚胎阶段,但其后续维持依赖于 Polycomb 和 Trithorax 组染色质结合蛋白的作用。这些蛋白分别在 Hox 复合体染色质上留下胚胎期抑制或激活状态的可遗传印记。与果蝇同源的 Hox 复合体几乎存在于所有动物类型中,协助塑造身体的前后轴线模式。
信号梯度同样沿背腹轴建立。最初,Toll 信号通路形成 Dorsal 蛋白的核梯度,进而诱导 TGFβ家族蛋白 Dpp 及其拮抗剂 Sog 的细胞外信号梯度。由此形成的 Dpp 活性梯度有助于精确分配背腹轴不同位置细胞的特性差异。
在非洲爪蟾中,卵子的极性和精子进入位点确立了胚胎轴。由 TGFβ家族蛋白 Nodal 产生的梯度沿动物-植物轴诱导不同命运,而分别与果蝇 Dpp 和 Sog 同源的 BMP 和 Chordin 蛋白则控制背-腹轴的模式形成。
转录调节因子控制特定细胞类型的形成。MyoD 家族成员驱动肌肉细胞决定过程,协调所需的多种组分,而 Achaete/Scute 转录调节因子则控制神经命运。其他编码这类主转录调节因子的基因能够调控整个器官的形成。例如,Eyeless 基因在果蝇中既是生成眼结构所必需的,也足以实现该功能。
为了精化此类器官内的解剖模式,细胞通过可扩散的诱导信号和短程机制进行局部互动。通常,细胞通过侧向抑制相互竞争。这一过程导致一个细胞中 Notch 信号通路的激活及其邻近细胞的抑制,从而产生两种不同的细胞类型。不对称细胞分裂——即子细胞从母细胞继承不同的分子决定因子——为组织精细多样的细胞类型提供了另一种方式。
来自近期进化事件的证据表明,解剖结构变化主要受调控 DNA 序列变化的驱动,这些序列决定了发育基因的表达时空。尽管类似原理可能适用,但关于身体结构显著多样性在更长时间尺度上的演化机制,目前仍 largely 未知。
发育时序
发育事件在数分钟、数小时、数天、数周、数月甚至数年内逐步展开,每个生物体都遵循其自身严格的时间表。先前描述的诱导作用级联反应和转录调控事件需要时间,因为信号需要传递,转录调节因子需要合成并结合 DNA 以激活或抑制其靶基因。由基因表达变化引起的细胞大小、形状和组织结构的改变同样需要时间。所有这些事件都需要精确的时间参数,包括顺序(事件发生的序列)、间隔(事件之间的时间)以及在某些情况下的节律(事件的重复周期)。因此,每个发育过程必须以适当的速度进行,经过进化调整以适应胚胎内或环境中其他过程的时间安排。时间控制是发育生物学中一个引人入胜但却是最未被充分理解的难题。
分子寿命在发育时序中起着关键作用
发育过程虽复杂,却由简单步骤累积而成。首要挑战在于理解这些步骤的时间维度:例如,启动或关闭基因表达需要多长时间?这不同于拨动电灯开关——其中存在时间延迟。首先,合成 mRNA 分子需要时间:RNA 聚合酶需沿基因全长行进,初级 RNA 转录本需经历剪接等加工过程,最终形成的 mRNA 必须从细胞核输出并运抵翻译位点。这些步骤共同构成了单个分子的"孕育时间"。其次,单个 mRNA 分子积累至完全有效浓度也需要时间;正如第 15 章所述,这种积累时间取决于分子的平均寿命——分子存续时间越长,其最终浓度越高,达到该浓度所需时间也越长。 在接下来的步骤中,也会出现类似的延迟,即 mRNA 被翻译成蛋白质的过程:每个蛋白质分子的合成都涉及一个孕育延迟,而达到有效蛋白质浓度则涉及一个积累延迟,这取决于每个蛋白质折叠成其三维结构所需的时间及其产生后的寿命。整个基因切换过程的时间是 mRNA 和蛋白质分子的孕育延迟与积累延迟(基本上是分子寿命)的总和。有些反直觉的是,决定切换时间的主要是这些延迟的总长度,而不是分子合成速率(每秒合成的分子数量)。
同样的加法原则适用于基因开关的长级联过程,其中基因 A 激活基因 B ,基因 B 激活基因 C ,依此类推。该原则也适用于其他情况,例如信号通路中一个蛋白质直接调控下一个蛋白质的激活。在所有这些情况下,分子寿命以及孕育延迟在决定发育速度方面起着关键作用。mRNA 和蛋白质分子的寿命差异极大,从几分钟或几小时到数天甚至更长,这解释了发育事件节奏的许多方面。
然而,基因开关延迟并非发育时序的全部决定因素。发育过程还涉及多种其他类型的延迟,这些都对时序调控起着重要作用。染色质结构重塑需要时间完成,诱导信号需要时间在细胞场中扩散(参见图21-9),细胞在空间中的迁移与重组同样需要时间。尽管如此,基因开关的时序仍在发育时序中扮演着基础性角色——这一点通过控制脊椎动物体轴分节的基因表达振荡器得到了尤为清晰而显著的诠释。
基因表达振荡器作为时钟调控脊椎动物分节过程
所有脊椎动物的主体轴都具有重复的周期性结构,这体现在颈部、躯干和尾部的椎骨序列、肋骨以及节段性肌肉中。这些节段性结构源自胚胎中线两侧呈长板状分布的中胚层。该中胚层板会规律性地分裂成一系列独立的块状结构,即体节——这些由裂隙分隔的细胞群(图 21-38A)。与我们先前讨论过的果蝇胚胎同时形成的体节不同,脊椎动物的体节是按顺序形成的。体节以双边对称的形式,按照从头部向尾部的固定节律依次形成。根据不同物种,最终形成的体节数量从不足 40 个(如青蛙或斑马鱼)到超过 300 个(如蛇类)不等。
形成体节的细胞产生于中胚层板最后端、最不成熟的区域,称为前体节中胚层。这是一个增殖区,随着新细胞的不断生成,该区域会向尾部方向推移,不断延伸
图 21-38 鸡胚胎中的体节形成过程。(A)孵化 40 小时的鸡胚胎明场图像。(B)前体节中胚层基因表达的时间振荡如何转化为已形成体节中基因表达的空间交替模式。在前体节中胚层的后部区域,每个细胞以 90 分钟为周期进行振荡。随着细胞成熟并脱离前体节区域,其振荡逐渐减缓直至停止,最终停留在临界时刻所处的周期相位所决定的状态。通过这种方式,基因表达的时间振荡形成了空间上的交替模式。(视频 21.5)(A 图源自 Y.J. Jiang 等人,《当代生物学》8:R868-R871, 1998。经爱思唯尔许可使用。)
胚胎(图 21-38B)。随着前体节中胚层向尾部移动,它留下了一串由细胞组成的体节轨迹,这些细胞在从前体节区域前端出现时聚集成块。前体节中胚层的特殊特性由成纤维细胞生长因子(FGF)和 Wnt 信号的组合维持,这些信号由胚胎尾端的信号中心产生,而这些信号的范围似乎定义了可以形成体节的区域。体节以时钟般的节奏出现,但究竟是什么决定了这一过程的节律呢?
在预定被分节的前体节中胚层后部,某些基因的表达随时间呈现振荡现象。这种振荡可在含有单个基因荧光报告胚胎的延时摄影中观察到。每个振荡周期会形成一对新的体节,而在振荡无法发生的突变体中,体节分割遭到破坏:细胞虽仍可能延迟分裂成独立的簇群,但分裂方式杂乱无章且不规则。这种控制规律性分割的基因表达振荡器被称为分节时钟。一个完整振荡周期的时长因物种而异:斑马鱼为30分钟,鸡为90分钟,小鼠为120分钟,人类则为300分钟。
当细胞从前体中胚层分化出来形成体节时——换言之,当它们摆脱了 FGF 和 Wnt 信号的影响时——它们的振荡基因表达便停止了。根据离开前体区域时振荡周期的相位,一些细胞停滞在一种状态,另一些则停滞在另一种状态。通过这种方式,前体中胚层中基因表达的时间振荡在成熟中胚层中留下了空间周期性的基因表达模式。这进而通过影响细胞间粘附模式,决定了组织如何分裂成物理上独立的块状结构。
分割时钟是如何工作的?首个被发现的体节振荡器基因是 Hes 基因,它们编码抑制性转录调节因子。除了调控其他基因外,Hes 基因的产物还能直接调控自身表达,形成一个简单的负反馈循环。Hes 基因的自我调节被认为是体节时钟振荡的基本发生器。尽管不同物种中这一机制经过各种方式的修饰,但其基本原理似乎是保守的。当关键 Hes 基因被转录时,Hes 蛋白数量逐渐积累,直至足以阻断 Hes 基因的转录。随后蛋白质合成停止,随着蛋白质降解,转录得以重新开始;如此周而复始(图 21-39)。决定每个体节大小的振荡周期取决于反馈环中的延迟时间。根据先前讨论的原理,这一延迟等于 Hes mRNA 和蛋白质分子的合成延迟与积累延迟(即分子寿命)之和。 数学模型(参见第8章)使我们能够将这些基本分子参数与分割时钟的周期时间联系起来:初步近似下,周期时长等于负反馈回路总延迟的两倍,因此也就是所有发生延迟之和的两倍
图 21-39 延迟负反馈导致基因表达振荡。(A) 单个基因编码能抑制自身表达的转录调节因子,可表现为振荡器。要实现振荡,反馈回路中必须存在一个(或多个)延迟,且 mRNA 和蛋白质的寿命(构成延迟因素)必须短于总延迟时间。总延迟时间决定了振荡周期。据认为,基于斑马鱼中一对冗余作用基因 Her1 和 Her7(或小鼠中的对应基因 Her7)的此类反馈回路,是控制体节形成的分节时钟的起搏器。(B) 使用适用于斑马鱼该基因的反馈回路参数粗略估算得出的 Her1 和 Her7 mRNA 及蛋白质预测振荡曲线。浓度以每个细胞中的分子数计量。预测周期与观测周期接近,在斑马鱼中每个体节的形成周期为 30 分钟。
在循环的每一步中。此外,通过实验操作改变这些参数之一(例如,改变 Hes 内含子的大小以干扰 mRNA 处理时间)会导致对体节形成周期的预期影响。
上述反馈回路是细胞内的,前体节中胚层中的每个细胞即使培养在培养皿中也能自行产生振荡。然而,单细胞水平的这些振荡有些混乱且不精确,反映了基因表达控制本质上具有噪声和随机性,正如第七章所讨论的。需要一种机制来使前体节中胚层中所有将形成特定体节的细胞保持同步振荡。这在一定程度上是通过 Notch 信号通路进行的细胞间通讯实现的。在此背景下,Notch 信号并不像侧向抑制那样驱动相邻细胞产生差异,而是恰恰相反:它使它们保持一致。在 Notch 信号失效的突变体中,包括 Delta 或 Notch 本身有缺陷的突变体,细胞会失去同步性,体节分割再次被破坏。这导致脊柱的严重畸形——单细胞水平基因表达的噪声时间控制后果的惊人展示,在脊椎动物整体结构中得到了放大体现。
细胞内在的定时机制可导致不同的细胞命运
尽管细胞间的信号传递在推动发育进程中起着至关重要的作用,但这并不意味着细胞总是需要来自其他细胞的信号来促使它们在发育过程中改变特性。其中一些变化是细胞固有的(如第15章讨论的生物钟的滴答声),并依赖于细胞内发育程序,这些程序即使在细胞脱离正常环境时也能运作。
最典型的例子是神经母细胞的发育,这些是果蝇中枢神经系统的干细胞。这些细胞经历一系列不对称分裂,以产生不同类型的神经元和胶质细胞,其分裂顺序和时间始终一致。每个神经母细胞通过一个时间依赖性的发育程序,产生出多种命运不同的子细胞。随着神经母细胞按照既定的分裂计划进行,它通过依次表达一系列不同的转录调节因子来改变其内部状态。例如,大多数胚胎神经母细胞按固定顺序依次表达转录调节因子 Hunchback、Kruppel、Pdm 和 Castor(图 21-40)。当神经母细胞分裂时,此时表达的转录调节因子会被其子细胞继承并维持;因此,分化出的神经细胞根据其出生时间被赋予不同的特性。
当神经母细胞从胚胎中取出并在培养中维持,与其正常环境隔离时,它们会经历与留在胚胎中时几乎相同的固定发育程序。此外,即使细胞分裂被阻断,许多神经母细胞的转变仍会发生。这些神经母细胞似乎拥有一个内置计时器,决定每种转录调节因子何时表达,且该计时器能在细胞周期进程缺失的情况下持续运行。这种时间调控的分子基础尚不完全清楚。由于涉及交叉调控的转录级联反应,它可能依赖于基因切换所需的时间,如前所述,但也可能与染色质结构和基因组组织的缓慢渐进变化有关,这些变化同样能够衡量胚胎内时间的流逝。
时序机制能够协调细胞命运与组织的空间结构。例如,在哺乳动物大脑皮层的发育过程中,祖细胞中有序表达的不同转录因子通过分裂产生神经元和胶质细胞,进而依次生成特定类型的神经细胞。新生神经元随后迁移至其适当位置。
图 21-40 果蝇胚胎中神经命运的时间模式。每个神经母细胞通过不对称分裂实现自我更新,并产生一个称为神经节母细胞的子细胞。该神经节母细胞随后会分裂产生一对终末分化的神经元或胶质细胞。神经元和胶质细胞的类型由母体神经母细胞中表达的转录调节因子决定,这些因子随后被其神经节母细胞子代继承。每个神经母细胞在其谱系进展过程中会依次表达 Hunchback、Kruppel、Pdm 和 Castor 等转录调节因子。在表达其中一种调节因子并进行数次分裂后,神经母细胞会转换其基因表达模式,表达更新的基因组合,这些基因将传递给其子细胞,使它们相应地分化为特定细胞类型。(改编自 B.J. Pearson 与 C.Q. Doe,《自然》425:624-628, 2003。)
图 21-41 神经基因的时序表达驱动大脑的分层结构组织。(A)哺乳动物大脑皮层中的许多神经元和胶质细胞源自共同祖细胞,这些祖细胞在皮层神经上皮内表面增殖,产生连续世代的神经元(此处以蓝色、绿色、橙色和黑色表示)。发育中的神经元沿放射状胶质细胞延伸的突起向外迁移,这些胶质细胞同样源自相同祖细胞。最早生成的神经元停留在其诞生位置,而较晚生成的神经元则越过它们定居于更外围区域。因此,连续世代的神经元占据皮层不同层次,并根据其出生时间具有不同的内在特性。(B)荧光显微图像显示哺乳动物大脑皮层中通过不同转录因子抗体标记(蓝、绿、白、红)的兴奋性神经元分层结构。神经细胞类型由其祖细胞中转录因子表达的时序序列决定,因此出生顺序既规定了分化神经元的命运也决定了其定位。(源自 I. Holguera 与 C.) Desplan,《科学》362 卷:176-180 页,2018 年。)
在发育中的皮层,最终占据成年大脑的不同层次。因此,占据同一层次的所有神经元都在同一时间窗口形成,并具有共同的命运(图21-41)。
细胞很少通过计数细胞分裂来计时其发育过程
许多特化细胞来源于增殖性祖细胞,这些祖细胞在有限次数的分裂后停止增殖并最终分化。在这种情况下,人们很容易推测细胞分裂周期充当了细胞内计时器,以控制细胞分化的时机。细胞周期如同滴答作响的时钟,设定其他发育进程的节奏,基因表达的成熟变化依赖于细胞周期的推进。然而,多数证据表明这一诱人观点并不正确。尽管存在细胞随每次分裂改变成熟状态且这种变化依赖于细胞分裂的实例,但这并非普遍规律。正如我们在果蝇胚胎神经母细胞中看到的,发育中的动物细胞即使在被人工阻断分裂时,也常能按照正常的成熟与分化时间表进行;当然会出现某些异常,毕竟单个未分裂细胞无法同时向两种方向分化。但大多数发育中的细胞似乎无需细胞分裂即可改变其发育状态。 发育调控基因能够开启或关闭细胞分裂周期机制,正是这些基因的动态变化而非细胞周期本身决定了发育的节奏。
微小 RNA 可调控发育进程转变
由于遗传筛选能有效追踪参与几乎所有生物学过程的基因,研究人员利用该方法寻找改变发育时序的突变。此类筛选在线虫中得以实施
图 21-42 秀丽隐杆线虫的细胞谱系。(A)成虫部分主要组织(参见图 1-42)。(B)通过精密分析每次细胞分裂后各子细胞的命运,绘制出从单细胞受精卵到成虫 959 个细胞的完整细胞谱系。每条垂直线代表一个细胞,分支点反映细胞分裂。标注显示谱系中构成 A 图所示组织的细胞。(A 和 B,由 D.H. Hall 惠赠,线虫图谱源自 https://www.wormatlas.org/celllineages.html。)
秀丽隐杆线虫(图21-42)。这种微小生物遵循着惊人精确且可预测的发育程序,其细节已被极其详尽地描述,以至于可以绘制出体内每个细胞的确切谱系。每个细胞分裂的时间与地点,以及其各子细胞的命运,在个体间具有高度一致性。
描述秀丽隐杆线虫正常发育的谱系图的一大优势在于,可以精确观察到突变体中发育程序如何被改变。通过线虫的遗传筛选,发现了以特别显著方式扰乱发育时序的突变:在这些所谓的异时性突变体中,幼虫特定发育阶段的细胞会表现出其他发育阶段幼虫细胞的特征,或成虫细胞持续分裂如同幼虫细胞(图21-43)。
遗传分析显示,异时基因的产物以级联形式依次作用,构成调控级联。出乎意料的是,位于各自级联顶端的两个基因——Lin4 和 Let7——被发现编码的并非蛋白质,而是微 RNA(miRNA),即一种短小的、非编码的调控性 RNA 分子,长度为 21 或 22 个核苷酸。这些 miRNA 通过与来自其他异时基因的 mRNA 分子非编码区中的互补序列结合,从而抑制其翻译并促进其降解,如第七章所述。Lin4 miRNA 结合到异时基因 Lin14 产生的 mRNA 的 3'非翻译区,而 Lin14 本身促进早期幼虫细胞行为。因此,发育调控下 Lin4 水平的增加通过逐渐降低 Lin14 蛋白水平,控制着从早期到晚期幼虫细胞行为的转变。类似地,Let7 miRNA 水平的增加通过调控另一个名为 Lin41 的靶基因,以相似方式控制从幼虫晚期到成虫的转变过程。事实上,Lin4 和 Let7 是在任何动物中首次被描述的 miRNA:正是通过对秀丽隐杆线虫的发育遗传学研究才揭示了这一点。 正是在秀丽隐杆线虫中,发现了这类分子对动物基因调控的重要性。
图 21-43 秀丽隐杆线虫 Lin14 基因的异时性突变。图中仅显示了众多受影响细胞系中某一谱系的变化。Lin14 基因的功能缺失(隐性)突变会导致幼虫晚期特有的细胞分裂与分化模式提前出现,使得个体过早进入终末状态且细胞数量异常减少。功能获得(显性)突变则产生相反效应,促使细胞重复执行第一幼虫期特有的分裂模式,持续经历多达五至六次蜕皮周期。Lin14 功能获得性突变可能源于 Lin4 miRNA 结合位点的改变,使 Lin14 蛋白免受下调调控。黑色 X 表示程序性细胞死亡。绿色线条代表含有 DNA 结合蛋白 Lin14 的细胞,红色线条代表不含有该蛋白的细胞。(改编自 V. Ambros 与 H.R. Horvitz,《科学》226:409-416, 1984;以及 P. Arasu 等,《基因与发展》5:1825-1833, 1991。)
细胞与细胞核大小关系调控合子基因表达的开始
正如我们之前讨论的,许多基因产物由母体沉积在卵子中,使得发育的第一步能在受精后立即启动。然而,母源供给最终会耗尽,合子便开始产生自身的基因产物。这种母源-合子转换(MZT)在大多数生物中会延迟相当长时间后发生,标志着胚胎自身基因组从母源大分子手中基本接管发育控制权的时间窗口(图 21-44)。
母源合子转换(MZT)发生在大多数物种原肠胚形成前不久,此时快速且同步的卵裂分裂被较慢且更常规的细胞周期所取代。在这一转变过程中,成千上万的基因从先前沉默的合子基因组启动转录,许多母源基因产物从胚胎中被清除。在包括青蛙、鱼类和果蝇在内的多个物种中,最早被转录的一些合子基因包含特定的 miRNA,这些 miRNA 靶向母源 mRNA 进行翻译抑制和降解。在此,miRNA 再次通过阻断和移除定义早期发育阶段的 mRNA 来锐化发育转变。
MZT 的时机是如何被控制的?其中一个触发因素似乎是核质比。许多动物胚胎在发育的最初阶段并不生长或改变体积。相反,快速的 DNA 复制和有丝分裂将受精卵转化为数千个更小的细胞。在这些卵裂分裂过程中,胚胎中的细胞质总量保持不变,但胚胎中的细胞核数量呈指数增长,从而增加了 DNA 与细胞质的比例。引人注目的是,含有单倍体的胚胎
图 21-44 斑马鱼胚胎中的母源-合子转换。母源 mRNA 由母体沉积到卵子中并驱动早期发育。这些 mRNA 在胚胎发生的不同阶段(包括囊胚和原肠胚阶段)被降解,但在母源-合子转换(MZT)时发生相对突然的变化。在此之前,胚胎(合子)基因组处于转录失活状态;之后,合子基因开始转录。在斑马鱼胚胎中,合子基因组在 512 细胞阶段开始被激活。
每个细胞中 DNA 含量减半的胚胎,其母源-合子转换(MZT)的发生时间比正常二倍体胚胎晚一个细胞周期。根据一种模型,核质比可能是通过母源提供的转录抑制因子与不断增加的核 DNA 量之间的滴定作用来测量的。在卵裂分裂过程中,抑制因子的总量保持不变,但每个基因组所对应的抑制因子量会随着每一轮 DNA 合成而减半,直至达到阈值,从而使合子基因组开始转录激活。组蛋白作为母源蛋白,是这种抑制因子的候选者之一,其浓度在多种生物中调控 MZT 的时机。另有证据表明,某些母源提供的转录调节因子在积累到足以激活其靶基因的阈值后,会触发 MZT。不同物种可能依赖其中一种或两种机制来适时激活合子基因组。
激素信号协调发育转变的时机
迄今为止,我们重点讨论了在胚胎不同部位或分子控制机制的特定子系统中局部独立运作的计时机制。进化已将这些基本独立的过程调整至适宜速率,以满足生物体整体需求。然而在某些情况下,这还不够:需要全局协调信号。当身体需要根据环境相关信号进行全面改变时尤其如此。例如昆虫或两栖动物经历变态——从幼虫到成虫的转变——几乎每个身体部位都会发生转化。变态时机取决于外部因素(如食物供应),这决定了动物何时达到合适体型。所有身体变化都必须在正确时间同步触发,尽管它们发生在相距甚远的部位。此类协调由激素——遍布全身的信号分子——实现。
两栖动物的变态过程提供了一个引人注目的例证。在这一发育转变期间,它们从水生生活过渡到陆生生活。幼虫特有的器官如鳃和尾巴逐渐消失,而成体特有的器官如四肢则开始形成。这一剧烈变化由甲状腺产生的甲状腺激素触发。若摘除甲状腺或阻断甲状腺激素的作用,尽管生长仍在继续,变态过程却不会发生,最终形成巨型蝌蚪。相反,实验者若给蝌蚪注射一剂甲状腺激素,则可提前引发其变态过程。
甲状腺激素通过血管系统分布至全身,通过与细胞内核激素受体结合来诱导接收细胞发生变化,这些受体调控着数百种基因。然而,这并不意味着所有靶组织对激素的反应方式相同:器官不仅在甲状腺激素受体水平及局部调节活性激素量的细胞外蛋白水平上存在差异,而且在响应的基因集合上也各不相同。甲状腺激素促使肢体肌肉生长,同时导致尾部肌肉消亡。反应时机亦有所不同;例如,腿部在循环激素浓度极低时便早期形成,但诱导尾部吸收则需要高水平的激素。
甲状腺激素的激增引发变态过程,但其激增时机如何被调控?一种机制依赖于激素合成与甲状腺大小的关联,而甲状腺大小反映了蝌蚪的体型。只有当腺体达到特定大小时,才能产生足够的甲状腺激素来启动变态。然而,除营养外,环境信号也发挥作用:温度和光照等条件由神经系统感知,该系统调控另一层激素(神经激素)的分泌,这些激素进而刺激甲状腺激素的分泌。因此,蝌蚪的内在因素(如体型)与环境因素共同决定了变态开始的时间。
环境信号决定开花时间
环境控制发育时机的另一个显著例子是植物的开花过程。开花涉及植物茎尖生长点——顶端分生组织细胞行为的转变。在常规营养生长阶段,这些细胞表现为干细胞特性,持续不断地分化出新叶和茎秆节段。而在开花过程中,分生组织细胞转而构建花的各个组成部分:包括承载花粉的萼片与花瓣、产生雄配子的雄蕊,以及容纳雌配子的子房。
为了准确掌握转换时机,植物必须综合考虑过去与现在的环境条件。对许多植物而言,日照长度是重要线索。为感知这一点,植物运用其生物钟——一种内源性的 24 小时基因表达节律——仅在一天中适宜时段有光照时生成开花信号。生物钟本身受光照影响,植物实际上是通过生物钟来对比历史与当前的光照条件。这些现象背后的遗传电路关键组成部分已被识别,包括作为光受体的光敏色素和隐花色素(详见第 15 章)。通过维管系统从叶片传递至茎尖分生组织的开花信号,依赖于名为开花位点 T(FT)基因的产物。
但只有当植物处于先前长期寒冷暴露后的感受态时,该信号才会触发开花。许多植物需要经历冬季才能开花——这一过程称为春化作用。数周或数月的低温会逐渐降低一个名为开花位点 C(Flc)的关键基因的表达水平。Flc 编码一种转录抑制因子,可抑制开花启动因子 Ft 的表达。
春化作用如何关闭 Flc 以解除开花阻滞?该效应涉及至少三种长链非编码 RNA,包括一种与 Flc 基因重叠的反义转录本 Coolair,其在低温条件下产生(图 21-45)。通过与包括 Polycomb 家族蛋白在内的冷诱导染色质修饰因子协同作用,Coolair 协调 Flc 染色质转换为沉默状态(第四和第七章将详细讨论)。沉默程度取决于寒冷暴露的持续时间,使植物能够区分偶然的寒夜与整个冬季。
对染色质的影响是持久的,即使天气转暖,这种影响也会持续多轮细胞分裂。因此,春化作用形成了
图 21-45 拟南芥开花的时间调控。当植物未经冬季低温生长时,Flc 基因处于活跃状态并阻止开花。长期低温暴露导致产生与 Flc 基因重叠的非编码 RNA Coolair。Coolair 诱导长期染色质变化,从而关闭 Flc。这些变化在低温期结束后持续存在,使得植物在较长日照促进开花时能够开花。
对 Flc 产生的持续阻断,使得当日照足够长时能够产生 Ft 信号。
影响 Flc 表达调控的突变会改变开花时间,从而影响植物在特定气候条件下繁茂生长的能力。因此,控制开花转换的整个调控系统对农业至关重要,尤其是在气候快速变化的时代。
春化作用的例子揭示了染色质修饰在发育时序调控中的一个普遍原理。植物通过染色质的变化来记录其经历的持续低温环境。或许在其他生物体——无论是动物还是植物——中,染色质结构的缓慢渐进变化,为那些需要数日、数周、数月甚至数年时间缓慢展开的神秘发育过程提供了长期计时机制。这类染色质计时器可能是胚胎中最重要的生物钟之一,但迄今为止我们对它们的了解仍非常有限。
摘要
发育时序在多个层面受到调控。基因的开启或关闭需要时间,这一时间延迟取决于所涉及分子的寿命,而分子寿命差异巨大。基因调控级联反应伴随着一系列延迟。反馈回路可导致基因表达的时间性振荡,这些振荡可能用于生成空间周期性结构。例如,在脊椎动物体节形成过程中,Hes 基因的表达呈现振荡,每个振荡周期会形成一对新的体节。Hes 基因编码的转录抑制蛋白能反馈作用于自身基因的表达。这种负反馈产生的振荡周期反映了自调节基因开关回路中的延迟。这种"分节时钟"的振荡周期控制着体节的大小。相邻细胞间的 Notch 信号传导使它们的振荡同步:当 Notch 信号传导失效时,由于各细胞内部时钟的遗传噪声,细胞间逐渐失去同步性,导致脊柱的节段性结构遭到破坏。
时机并不总是依赖于细胞间的相互作用;许多发育中的动物细胞拥有内在的发育程序,即便在培养的孤立细胞中也能展开。例如,果蝇胚胎中的成神经细胞会经历一系列不对称分裂的程序,每次分裂都以可预测的顺序和时间,通过基因开关事件的级联反应,产生不同的神经细胞类型。对脊椎动物和无脊椎动物的研究表明,这类程序很少受细胞分裂时间的支配,即使细胞分裂被阻断,程序仍可展开。在关键时刻产生的微 RNA 通过阻断翻译并促进特定 mRNA 集的降解,来锐化发育转变。其中一个例子是母源-合子转换,此时胚胎基因组的转录开始。这一事件的启动既涉及合子核倍增对母源抑制因子的稀释作用,也涉及母源转录激活因子随时间累积的过程。 发育时间的全局协调是通过激素实现的,这些激素在生物体内传播并作用于细胞:例如,当蝌蚪成长时,甲状腺激素水平激增,触发其变态为青蛙。发育时间的环境控制在植物中尤为显著,揭示了长期作用的分子计时器的存在。以春化作用为例,持续的低温诱导染色质发生变化,记录冬季的进程,从而确保仅在春季开花。染色质结构的缓慢渐进变化很可能在动物发育的长期编程中也扮演着重要计时器的角色。
形态发生
细胞在特定时间分化为不同类型固然重要,但这仅是动物发育的一个方面。同样关键的是细胞经历的运动和变形过程,这些过程使细胞组装成组织与器官。
具有特定形状和尺寸。这些物理形态作为细胞命运程序的核心输出,对每个器官的生理功能至关重要。与发育时序类似,形态发生("形态生成")过程相较于导致细胞类型特化的差异基因表达和诱导信号传导过程,其理解程度仍显不足。细胞运动可被明确描述,而协调这些运动的分子机制正在逐步破译。
在第十九章中,我们了解了细胞如何通过粘附形成上皮片层,或通过细胞外基质包裹自身以构成结缔组织。我们还探讨了组织的基本特征(如上皮细胞的极性)如何源自单个细胞的特性。本节将重点讨论动物发育过程中细胞的动态重排如何塑造胚胎及身体所有独立器官与附属结构的形态。
少数细胞行为是形态发生的基础。细胞能够改变形状,而协调的形状变化可以将上皮片弯曲成管状或空心球体。细胞能够相对于邻近细胞重新排列,导致组织伸长、收缩或增厚。通过伸展并保持与同伴的连接,特化的细胞群可以形成不断生长的管状网络,如血液或淋巴管系统。单个细胞也能从邻近细胞中脱离出来,形成物理上独立的群体,然后沿着特定路径在胚胎中迁移。群体迁移,如原肠胚形成过程中发生的迁移,能够改变胚胎的整体拓扑结构。所有这些过程的基础是物理力的变化,这些力改变了细胞形状和细胞接触——无论是与其他细胞还是与细胞外基质的接触。我们首先考虑这些力是如何产生的。
作用于细胞的物理力不平衡驱动形态发生
尽管细胞具有生命,但它遵循着与非生命物体相同的物理法则。细胞和组织拥有特定的力学特性,其形态反映了作用于它们的力量。在静止状态下,细胞处于力学平衡中,所有力量相互抵消。形态发生则意味着这种平衡的转变,因为新的力量以定向方式产生。这些有序的力变随后在更广范围内展开作用。例如,肌球蛋白运动蛋白对肌动蛋白细胞骨架的活动可能改变细胞形态,进而影响其与邻近细胞的相互作用,从而塑造组织的形状。这类协调变化最终雕琢出完整的器官和动物躯体。
虽然像肌动蛋白和肌球蛋白这样的蛋白质在细胞内产生力量,但另一些则负责感知所施加的力。这类被称为机械传导器的蛋白质,会响应机械刺激启动细胞内信号传导,正如第 15 章所述分子响应化学信号触发信号通路一样。 \alpha - Catenin 和 Talin 是机械传导器,它们与细胞黏附分子的胞质尾部结合(参见第 19 章);这些分子在邻近细胞施加的张力作用下展开,这种构象变化发送生化信号,既能引发细胞力学的快速响应,也能对基因表达产生长期影响。Piezo(见第 660 页)是一种跨细胞膜的机械敏感离子通道;它响应剪切应力或质膜拉伸而打开,通过离子传递进而启动信号级联反应。通过这些机械敏感分子,细胞和组织能够解读其所处的物理环境并作出相应反应。
张力和黏附决定上皮细胞层内的细胞排列方式
在许多组织中发现的二维上皮片层是阐释形态发生原理的一个简单系统。跨动物物种观察,稳定的上皮片层展现出高度一致的细胞形态分布模式,其中大多数细胞
图 21-46 上皮组织中细胞形态的规则分布。(A) 非洲爪蟾早期胚胎细胞膜的荧光显微图像显示,大多数上皮细胞呈现六边形轮廓,具有六个相邻细胞,在细胞相接处形成三向连接点。(B) 水面上的二维肥皂泡"筏"展现出类似的组织结构。(C) 细胞间接触的长度和几何形状由相抗衡的作用机制决定。每个细胞内皮层肌动球蛋白细胞骨架的收缩网络倾向于使细胞分离,而由钙黏蛋白等分子介导的粘附作用则倾向于使细胞表面保持连接。(A 图由 Saranyarajan Varadarajan 和 Ann Miller 提供;B 图来自 Shebeko/Shutterstock。)
细胞在其顶端表面呈现六边形轮廓(图 21-46A)。这种排列方式由细胞的力学特性及其与邻近细胞的连接决定,这些连接主要通过粘附连接实现(参见第 19 章)。质膜邻近连接处下方的肌动球蛋白环收缩性会在每个细胞内产生皮层张力,倾向于将细胞从邻近细胞中拉开。然而,这种力被细胞间粘附所抵消,该粘附由连接处内的钙粘蛋白等分子介导。这些内向和外向力之间的平衡形成了可预测的细胞构型,可通过数学模型进行模拟,类似于肥皂泡等无机实体的堆积排列(图 21-46B 和 C)。尽管气泡中平衡表面张力最小化与接触界面的物理机制与塑造细胞的机制大相径庭,但代表排列能量最小化的数学解却具有相似性。
细胞粘附分子模式的变化迫使细胞形成新排列
组织的形态最终由基因表达模式决定,这些模式产生的分子会改变表达它们的细胞的物理特性。影响这些特性的重要基因类别编码了细胞表面展示的黏附分子。通过改变其表面分子,细胞可以打破旧的附着并建立新的连接。例如,组织中某一区域的细胞可能发展出使其相互凝聚的表面特性,并与拥有不同表面分子的邻近细胞群分离。钙黏蛋白及其他在发育动物不同组织中差异表达的细胞间黏附蛋白发挥着重要作用。在第19章中,我们了解到选择性细胞间黏附足以驱动从胚胎分离的细胞按同类聚集(见图19-7);使用结合钙黏蛋白的抗体处理会干扰这一过程。 各种钙黏蛋白基因表达的变化与胚胎发生过程中细胞间不同结合模式密切相关,例如在原肠胚形成、神经管形成和体节发生过程中所观察到的那样。钙黏蛋白还控制上皮片层和细胞簇的形成与解离(参见视频19.1)。最后,由于黏附分子不仅将细胞相互粘合,还为细胞内肌动蛋白丝提供锚定点,细胞-细胞黏附位点会影响发育组织中张力和细胞运动。
排斥性相互作用有助于维持组织边界
不同类型的钙黏蛋白使不同细胞能够选择性黏附:表达特定钙黏蛋白的细胞会最大化与表达相同钙黏蛋白细胞的接触,从而与其他细胞分离,形成特定的组织边界。细胞混合也可通过另一种方式被抑制并形成维持边界:不同类型细胞
图 21-47 通过排斥作用进行整理。鸡胚后脑分割中的 Ephrin-Eph 信号传导。每对菱脑节(后脑中的节段)与一个鳃弓(一种改良的鳃原基)相关联,该对节段向鳃弓发送神经支配。菱脑节通过表达不同的 Vox 基因(见图 21-30)而彼此区分。在表达 EphrinB2 的菱脑节 R4 细胞与表达 EphA4 的菱脑节 R5 细胞之间的界面处,表面张力的差异导致相互排斥(红色条),形成清晰的边界。
有时,它们会主动相互排斥。第 15 章讨论的 Eph 受体和 ephrins 的双向激活常常介导这种排斥作用,在不同细胞群之间的界面上发挥作用,防止群体混合,并排斥不适宜的入侵者。Ephrin-Eph 信号传导在之前讨论的脊椎动物胚胎体节边界处运作(见图 21-38)。通过调节皮层肌动球蛋白细胞骨架,ephrin-Eph 信号传导被认为能诱导细胞间皮层张力的差异,从而减少细胞间接触的力量。另一个例子是在菱形脑中,这是发育中脊椎动物大脑的分段区域。相邻的菱形脑表达互补的 ephrins 和 Eph 受体组合,这使得相邻菱形脑中的细胞严格隔离,它们之间的边界清晰明确(图 21-47)。
图 21-48 间充质细胞迁移导致的会聚延伸。(A) 细胞群体形成片状伪足,试图相互爬行。片状伪足运动沿共同轴线排列,由平面极性信号控制(稍后讨论),导致会聚延伸。(B-G) 斑马鱼原肠胚形成过程中背侧中胚层的会聚延伸模式,分别为受精后 8.8 小时(B,E)、9.3 小时(C,F)和 11.3 小时(D,G)。将发育成脊索的细胞标记为绿色,将发育成体节和肌肉的细胞标记为蓝色。脊索和体节区域从记录开始时就空间分离(B,E),但其边界最初几乎不可见,稍后才变得明显。会聚作用使脊索区域在最后时间点(D,G)缩小至约两个细胞宽度。(A, 改编自 J. Shih 和 R. Keller, 《发育》116:901-914, 1992. 经生物学家公司许可;B-G, 改编自 N.S. Glickman 等, 《发育》130:873-887, 2003. 经生物学家公司许可。)
相似细胞群能实现显著的集体重组
由钙粘蛋白介导的细胞分选和由 ephrin-Eph 介导的排斥作用,展示了细胞表面特性的差异如何驱动组织排列,导致表达不同基因组的细胞相互分离。然而,完全相似的细胞群也能经历显著的重排。许多动物胚胎通过这种称为汇聚延伸的过程延伸其主要体轴。当一群细胞协调地向特定边界移动,并在此过程中相互穿插时,就会发生汇聚延伸。这导致组织沿一个轴变窄(汇聚)并沿另一个轴伸长(延伸)。组织形状的整体变化源于细胞位移,而非单个细胞形状的改变,且很大程度上是相关细胞群自主完成的。一个显著的例证是,当从青蛙胚胎适当区域分离出的小型方形组织碎片在培养中独立存在时,它们会自发地变窄和伸长,就像在发育中的动物体内一样。
汇聚延伸是一种常见的运动方式,能够延长多种器官,尽管其背后的细胞行为可能有所不同。例如,在青蛙原肠胚形成过程中,表面上皮某一区域的细胞在迁移至胚胎内部时会失去上皮特性。这些松散连接的细胞,称为间充质细胞,会形成基于肌动蛋白的片状伪足,这些伪足定向排列,使细胞在向胚胎中线汇聚时相互爬行并交错嵌合(图21-48)。相反,当果蝇胚胎延伸其前后轴时,相关细胞仍保持上皮特性。这些细胞维持紧密的粘附连接,但通过沿一个轴收缩细胞连接同时在另一轴延伸连接,实现细胞间插排列(图21-49;另见图19-15)。连接的重塑涉及由局部肌球蛋白活性产生的差异收缩张力。 在这两种情况下,无论是间充质迁移还是上皮连接重塑,细胞行为的协调都依赖于能够产生平面细胞极性的信号通路,我们将在接下来讨论。
平面细胞极性引导胚胎内细胞行为的方向
正如指南针能帮助我们在景观中定位方向,进行形态发生运动的细胞也必须具备一套系统,以相对于动物体的不同轴线来定向自身。我们在第19章中讨论了所有
图 21-49 通过上皮连接重排实现的会聚延伸。(A)展示了果蝇胚胎表皮在 9 分钟内的荧光图像,(B)中的示意图标注了特定细胞及细胞连接(参见视频 21.6)。与其他上皮组织类似,大多数细胞初始呈六边形,其连接由三个相邻细胞共享。为沿前后轴延伸组织,部分背腹向连接(绿色)收缩,形成短暂的五边形或四边形细胞排列,此时一个连接由四个相邻细胞共享。随后沿前后轴形成新连接(蓝色),该连接现由两个先前未接触的细胞共享,并分离了两个原先相接触的细胞。这种平面极性化的连接收缩与延伸过程在整个表皮同步发生,在维持上皮完整性的同时使组织变窄并延伸。(图像由 Huapeng Yu 和 Jennifer Zallen 提供。)
图 21-50 平面细胞极性。(A)果蝇翅膀上的翼毛。翅膀上皮中的每个细胞在其顶端形成一个小而尖的突起或“毛发”,所有毛发都朝向同一方向,即翅膀的尖端。这反映了每个细胞结构中的平面极性。(B)小鼠内耳中的感觉毛细胞同样具有明确的平面极性,表现为其表面上定向排列的静纤毛(充满肌动蛋白的突起)模式。声音的检测依赖于毛细胞正确且协调的定向。(C)果蝇中编码非经典钙黏蛋白的 Flamingo 基因突变,破坏了翅膀中的平面细胞极性模式。(D)小鼠中同源 Flamingo 基因的突变使耳朵中毛细胞的平面极性向量方向随机化。突变小鼠因此失聪。(E)显微照片显示 Flamingo(绿色)在果蝇蛹翅膀中的定位,与每个细胞生长的毛发(红色)的关系。 (F) 图示平面极化定位:Flamingo 蛋白定位于每个上皮细胞的一侧,而另一种平面极性调节蛋白 Frizzled 则定位于相对一侧,毛发将由此形成。(A 和 C,摘自 J. Chae 等人,《发育》126:5421-5429, 1999,经生物学家公司许可;B 和 D,摘自 J.A. Curtin 等人,《当代生物学》13:1129-1133, 2003,经爱思唯尔许可;E,由 Paul Adler 提供。)
上皮细胞具有顶-基极性,但许多上皮组织的细胞还表现出垂直于该轴的额外极性:这些细胞排列方式犹如表面标注了方向箭头,全部指向上皮平面内的同一方向。这种极性被称为平面细胞极性。以果蝇翅膀为例,每个上皮细胞表面都有称为翼毛的微小不对称突起,所有翼毛均指向翅膀尖端。类似地,在脊椎动物内耳中,每个机械感受性毛细胞顶端质膜上都有精确定向的不对称纤毛束——这些充满肌动蛋白的杆状突起称为静纤毛,作为声音及重力等力的探测器。向特定方向倾斜纤毛束会使膜离子通道打开,从而激活细胞电信号;反向倾斜则产生相反效果。要使耳朵正常运作,毛细胞必须
必须正确定向。平面细胞极性在呼吸道中也至关重要,每个纤毛细胞必须调整其纤毛的摆动方向,以便将黏液向上清扫,远离肺部。
必须正确定向。平面细胞极性在呼吸道中也至关重要,每个纤毛细胞必须调整其纤毛的摆动方向,以便将黏液向上清扫,远离肺部。通过对果蝇中毛发方向异常的突变体进行筛选,已识别出一组控制多种组织中平面细胞极性的基因。其中一些基因编码 Wnt 信号通路的组成部分,另一些则编码跨膜蛋白,如钙粘蛋白超家族的特殊成员,这些蛋白通过相邻细胞间的连接相互作用。与影响跨膜蛋白定位的细胞内蛋白共同作用,沿细胞顶面定义了两个互补且互斥的区域,以此施加一种极化影响,这种影响在细胞间传播,导致整个上皮组织的极化。基本上相同的蛋白质系统控制着脊椎动物的平面细胞极性;缺乏果蝇平面极性基因同源物的小鼠表现出多种缺陷,包括内耳中毛细胞方向错误,从而导致耳聋(图 21-50)。
上皮组织在发育过程中可弯曲形成管状结构
会聚延伸是二维形态发生的一个例子。当细胞需要脱离组织平面并形成三维结构时,它们会采取额外的细胞行为。普遍的囊胚形成过程涉及未来的内胚层和/或中胚层细胞迁移至胚胎内部,这通常由囊胚上皮的局部弯曲启动。类似的弯曲能使扁平上皮片层形成生物管状结构,包括脊索动物特有的神经管,尽管如图21-51所示,还存在其他形成管状结构的途径。
组织可以通过一种广泛应用的细胞行为——顶端收缩而发生弯曲,这种现象发生在细胞利用肌球蛋白运动蛋白收缩锚定在其顶端表面附近粘附连接处的肌动蛋白纤维束时。这些纤维束的缩短导致上皮细胞在顶端变窄,使细胞从柱状转变为独特的楔形或瓶状。由于细胞通过粘附连接相互连接,一组细胞的协调收缩可导致整个片层弯曲甚至卷曲成管状(图 21-52)。发生顶端收缩的细胞群由模式基因的局部表达所选定,这些基因触发收缩性肌动球蛋白网络的活动。在果蝇胚胎中,腹侧限制性转录调节因子 Twist(图 21-26)控制预定中胚层细胞中的肌球蛋白行为,随后通过形成临时管状内陷完成原肠胚形成。在脊椎动物胚胎中,Sonic hedgehog(Shh)和 BMP 的模式
图21-51 参与管状结构形成的细胞行为。折叠形成神经管,出芽是肺和气管形成的基础,索状中空化发生于哺乳动物唾液腺形成过程中,细胞中空化参与气管末端细胞管的形成,而细胞组装则生成心脏发育最早期阶段出现的心管。
图 21-52 上皮片弯曲形成管道的过程。通过粘附连接在细胞间相连的顶端肌动蛋白束收缩,导致上皮细胞在其顶端变窄。根据发生收缩的细胞数量和排列方式,内陷的上皮可以保持与原片的连接,或者卷曲成独立的管道或空心球体。(A)示意图显示沿上皮片某一轴向的顶端收缩如何促使片层形成管道。(B)通过扫描电子显微镜观察的 2 天鸡胚胎躯干横截面,展示了通过(A)图所示过程形成神经管的情况。脊椎动物的神经管最终发育为大脑和脊髓。(B,由 Jean-Paul Revel 提供。)
信号传导诱导三个铰链点处的顶端收缩,从而将神经板转变为闭合的神经管。
上皮与间充质之间的相互作用生成分支管状结构
胚胎在需要大面积表面以执行排泄、营养吸收及气体交换等功能时,常会发育出分支状管状结构。肺脏便是其中一例。它们起源于从前肠底部生长出的上皮芽,这些芽体穿透邻近的间充质形成支气管树——随着不断延伸而反复分支的管道系统,最终在人体内形成约 1700 万条分支。构成血管内壁的内皮细胞侵入同一间充质,由此形成紧密贴邻的气道与血管系统,这正是肺内气体交换所需的结构(图 21-53)。这一完整的分支形态发生过程依赖于生长中的上皮芽与间充质之间双向传递的信号。小鼠遗传学研究表明,成纤维细胞生长因子(FGF)蛋白及其受体酪氨酸激酶在这些信号传导过程中起核心作用。FGF 信号在发育过程中具有多种功能,尤其在发育上皮与间充质之间发生的众多相互作用中尤为重要。
在肺发育过程中,FGF10 在靠近生长中的上皮管尖端的间充质细胞簇中表达,其受体则在侵入的上皮细胞内表达。在 FGF10 缺陷型突变小鼠中,肺上皮的原基虽能形成,却无法从间充质中生长出来形成分支状的支气管树。相反,将浸泡过 FGF10 的微小珠子置于培养的胚胎肺上皮附近,会诱导上皮形成芽体并向珠子方向生长。显然,上皮细胞只有在 FGF10 的诱导下才会进入间充质。
图21-53 通过成人支气管树铸型显示的肺部气道。不同颜色的树脂被注入支气管树的不同大分支中。(詹姆斯·卡瓦利尼/科学源。)
图 21-54 肺的分支形态发生。FGF10 与音猬因子如何诱导支气管树芽体的生长与分支机制示意图。该系统中还表达许多其他信号分子(如 BMP4),所示分支机制仅为多种可能性之一。如图所示,FGF10 蛋白在生长中的上皮管尖端附近的间充质细胞簇中表达,其受体则表达于上皮细胞本身。音猬因子信号沿相反方向传递——从芽体顶端的上皮细胞返回至间充质。基因表达模式及其时序特征表明,音猬因子信号可能用于抑制最靠近芽体生长尖端的间充质细胞中 FGF10 的表达,从而将分泌 FGF10 的细胞簇分割为两个独立集群,进而促使芽体分叉形成两个分支。
但是,是什么让肺部不断生长的上皮管在侵入间充质时反复分支呢?这依赖于一种 Sonic hedgehog 信号,该信号以相反方向传递,从芽尖的上皮细胞返回至间充质,在那里它抑制 FGF10 的产生以促进分支,如图 21-54 所示。在缺乏 Sonic hedgehog 的小鼠中,肺上皮虽能生长和分化,但形成的却是囊状结构而非管状分支树。
FGF 同样是昆虫气体交换系统形成中的主要信号,该系统由一系列称为气管和微气管的细小充气通道构成。这些通道起源于覆盖体表的表皮,向内延伸侵入下层组织,过程中不断分支并变细(图 21-55)。FGF 作用于前进中气管尖端的细胞,促使它们伸出丝状伪足并向 FGF 信号源迁移。由于尖端细胞始终与气管上皮的其余部分相连,它们产生的拉力使气管得以伸长。
最初,果蝇胚胎中 FGF 的产生模式由先前讨论过的 D-V(背腹)和 A-P(前后)模式系统所定义。然而,在发育的后期阶段,FGF 的表达由称为缺氧诱导因子(HIFs)的转录调节因子诱导,这些因子在缺氧(低氧水平)条件下被激活。通过这种方式,缺氧刺激形成越来越细、分支更广泛的气管,直到氧气供应充足到足以停止这一过程。
细胞外基质也影响组织形态
到目前为止,我们仅关注了形态发生过程中由细胞产生的力。然而,我们绝不能忽视器官的另一个重要组成部分:细胞外基质。正如第19章详述,这种不溶性分子网络存在于大多数动物组织中,而一种称为基底层的特殊基质位于所有上皮片层之下。细胞外基质为形态发生的细胞迁移事件提供了基质,这一点我们稍后将讨论。此外,基质的机械刚度可以通过改变细胞产生力时所面对的阻力,为器官形态的塑造提供指导性信号。在哺乳动物唾液腺的分支形态发生过程中,
图 21-55 果蝇气道分支形态发生。(A) 果蝇胚胎气管系统。(B) 周围细胞产生的 FGF(果蝇中由 Branchless 基因编码)向气管上皮发出信号并激活其 FGF 受体,导致丝状伪足形成和管腔延伸。[A 图源自 G. Manning 与 M.A. Krasnow,收录于《黑腹果蝇的发育》(A. Martinez-Arias 与 M. Bates 编)第 1 卷第 609-685 页。纽约:冷泉港实验室出版社,1993 年。经冷泉港实验室出版社许可使用。]
例如,生长芽周围的基底层会被基质降解酶穿孔。这种基质的局部软化促使上皮优先向更柔韧的区域生长。因此,细胞外阻力的变化以及动态的细胞内力量可产生驱动形态发生事件的力不平衡。
细胞迁移受环境信号引导
细胞的诞生地往往远离其在体内的最终位置。例如,我们的骨骼肌源自体节中的肌细胞前体(即成肌细胞),这些细胞从体节迁移至四肢及其他区域。迁移细胞遵循的路径及其定植位置的选择,决定了体内肌肉的最终分布模式。胚胎结缔组织构成了成肌细胞迁移的框架,这些组织提供了引导成肌细胞分布的关键信号。无论来自哪个体节,迁移至前肢芽的成肌细胞将形成适合前肢的肌肉模式,而迁移至后肢芽的成肌细胞则会形成适合后肢的模式。正是结缔组织提供了这种模式形成的信息。
当一个迁移细胞穿越胚胎组织时,它会不断伸出表面突起探测周围环境,通过其特定的细胞表面受体蛋白组合来检测对其特别敏感的线索。这些受体在细胞内与皮层肌动蛋白和肌球蛋白细胞骨架相连,推动细胞前进(参见第16章)。某些细胞外基质分子,如纤连蛋白,提供粘附位点协助细胞推进;而其他分子,如硫酸软骨素蛋白聚糖,则会抑制运动并阻止迁移。迁移路径上的非迁移细胞表面同样可能存在吸引性或排斥性大分子;有些细胞甚至可能伸出丝状伪毛以宣告自身的存在。
除了通用的黏附分子外,迁移细胞还能通过特定化学或机械信号引导,这些信号由专门的受体感知。在众多影响因素中,有几个尤为关键。特别是,多种迁移细胞受到趋化作用的引导,该过程依赖于一种称为 CXCR4 的 G 蛋白偶联受体,该受体被细胞外配体 CXCL12 激活。表达这种受体的细胞能够沿着 CXCL12 标记的路径移动(图 21-56)。向 CXCL12 源头的趋化作用在引导淋巴细胞和各种其他白细胞的迁移、发育中大脑神经元的迁移以及进入肢体的成肌细胞的迁移中起着重要作用。
图 21-56 CXCL12 引导生殖细胞迁移。斑马鱼生殖细胞会迁移至表达 CXCL12 的区域。随着 CXCL12 表达位点的变化,细胞循着 CXCL12 轨迹被引导至发育后期形成性腺的区域。(A)在 4 体节期,生殖细胞从靠近中线位置向表达 CXCL12 的侧部区域移动。(B)当 CXCL12 表达范围收缩时,生殖细胞被引导至更靠后的位置,即性腺发育处。
图 21-57 通过局部泡状突起的定向迁移。(A)生殖细胞通过细胞前缘称为"泡状突起"的凸起结构迁移,该处质膜局部脱离下方的肌动蛋白皮层并向外凸出(参见图 16-18)。(B)凸起的持续存在位置倾向于 CXCL12 浓度更高的区域。因此,生殖细胞沿着 CXCL12 浓度梯度迁移。注意这种细胞迁移形式不同于基于肌动蛋白富集的片状伪足的迁移方式(参见图 21-18 和图 21-59)。
芽体;原始生殖细胞在向发育中的性腺移动过程中;以及癌细胞转移时的迁移方式。
对原始生殖细胞迁移的详细研究表明,CXCL12 信号传导并非直接诱导细胞迁移,而是用于控制其方向。在缺乏 CXCL12 信号传导的情况下,生殖细胞仍表现出与细胞迁移相关的膜泡形成,但形成泡状突起的细胞前端位置是随机选择的(图 21-57),迁移更类似于随机游走;若 CXCL12 信号传导完整,则面向 CXCL12 源头的细胞侧面更频繁形成泡状突起,从而实现定向迁移。
迁移细胞的分布取决于生存因子
迁移细胞的最终分布不仅取决于它们选择的路径,还取决于它们是否能在迁徙过程中存活并在目的地环境中繁衍生息。特定位点会提供特定类型迁移细胞存活所需的生存因子。
在脊椎动物胚胎中,最重要的迁移细胞群之一是神经嵴细胞。它们起源于外胚层中将要形成表皮的区域与将要形成中枢神经系统的区域之间的边界地带。当神经外胚层卷曲形成神经管时,神经嵴细胞从这一边界区域的表皮层脱离,开始其漫长的迁移之旅(参见图19-8和影片21.7)。这些细胞最终定居于多个部位,并分化出令人惊异的多种细胞类型。部分细胞将分化为周围神经系统的神经元和胶质细胞——不仅存在于靠近脊髓的感觉神经节中,还会经过更长距离的迁移后定居于肠壁。另一些细胞将构成面部的骨骼组织;还有一些则会驻留在皮肤中,特化为色素细胞。
通过研究色素沉着缺陷的动物,科学家们识别出一种对神经嵴细胞存活至关重要的信号通路。许多自然发生的突变小鼠,在其通常为黑色的毛发上出现白斑,这些突变是由于编码一种名为干细胞因子的分泌肽的基因存在缺陷所致。干细胞因子由迁移路径上的组织产生,作为迁移中神经嵴细胞的生存因子。在干细胞因子或其受体——一种名为 Kit 的跨膜酪氨酸激酶——存在缺陷的动物中,许多迁移中的神经嵴细胞会通过凋亡死亡。结果,突变个体出现无色素(白化)的皮肤斑块(图 21-58)。干细胞因子同样是其他类型迁移细胞的重要生存信号,包括
图 21-58 Kit 基因突变的影响。婴儿与小鼠均携带功能缺失型突变杂合子,导致其体内 Kit 基因产物(即干细胞因子 SCF 的受体)仅存正常量的一半。两者均出现色素沉着缺陷,因为色素细胞的生存依赖于 SCF。(由 R.A. Fleischman 提供,摘自 R.A. Fleischman 等人,《美国国家科学院院刊》88:10885-10889, 1991。)
原始生殖细胞和血细胞前体。完全缺乏干细胞因子或 Kit 的小鼠会不育,并最终因贫血而死亡。
细胞以群体迁移方式实现大规模形态发生运动
除了单独移动外,细胞还能以群体形式迁移,彼此保持联系并展现出与独立迁移细胞不同的协调行为。这些运动被称为集体细胞迁移,它们根据细胞组织方式的不同分为多种形式。例如,神经嵴细胞进行链式迁移,细胞像溪流般排成队列依次跟随(图 21-59A)。尽管它们之间的关联较为松散,但细胞间的接触对于沿着由 CXCL12 等趋化因子确定的路径定向迁移至关重要。虽然单个神经嵴细胞对此信号反应较弱,但首尾相接的细胞接触会在群体内诱导极性,从而驱动迁移链中每个细胞前缘的突起形成。
斑马鱼的发育过程为第二种集体细胞运动形式——集群迁移(图 21-59B)提供了良好范例。这类迁移发生于具有凝聚性的细胞群中,这些细胞通常源自间充质,群体中的先导细胞展现出最显著的伪足伸展行为。在斑马鱼胚胎中,一个称为侧线原基的细胞簇从耳后位置开始迁移,穿越躯干肌肉组织向尾部移动。迁移中的原基细胞持续分裂,部分细胞在移动过程中被滞留并形成感觉结构。特定迁移路径由预先形成的 CXCL12 蛋白条纹布局,但有趣的是这种配体并未以梯度形式表达。相反,细胞簇自身会生成局部梯度——先导细胞与跟随细胞均表达 CXCR4 受体,但跟随细胞还额外表达一种称为 CXCL7 的非功能性 CXCL12 受体,该受体如同"吸收池"般削弱集群后部的 CXCL12 信号效应,最终在细胞簇内部形成引导迁移方向的差异化信号传导。
整个上皮组织可以以第三种集体迁移形式移动,称为片层迁移(见图 21-59C)。在此过程中,细胞群保持强粘附性和顶基极性;位于片层前缘的细胞伸出强健的伪足探索环境,而跟随细胞则形成短小的基底伪足,这些伪足同样朝向迁移方向。集体片层迁移能够融合相邻上皮组织,填补发育过程中形成的间隙,这在果蝇和秀丽隐杆线虫胚胎发育末期或伤口愈合过程中可见。它还能通过双侧原基融合形成单一器官,例如哺乳动物腭部的形成过程。有趣的是,上皮迁移可在没有自由前缘的情况下发生,如发育中果蝇卵室球形上皮所示。这种情况下,由定向基底伪足驱动的集体上皮迁移促使整个组织进行多轮旋转,这是塑造成熟卵形的必要过程。细胞向哺乳动物肠绒毛顶端的迁移,
图 21-59 集体细胞迁移。细胞突起以红色显示。(A)进行链式迁移的细胞仅松散连接,但与前方细胞的瞬时接触会使后方细胞的突起(红色)极化,促进共享运动轨迹。(B)簇状迁移涉及成群的黏附细胞,其中少数"先导"细胞向移动方向延伸突起。(C)在片层迁移中,大群紧密黏附的上皮细胞协调一致地共同移动,通常具有自由边缘,该处细胞呈现部分间充质形态,并产生引导迁移的强健突起。在领先边缘后方的细胞中也可见较小的定向突起。
维持肠道稳态(参见图22-4)似乎也涉及连续上皮片层的类似运动。
摘要
动物组织通过细胞形态、排列或位置的显著变化塑造而成。这些变化源于细胞受力平衡的改变,通常由调控肌动球蛋白收缩性或细胞粘附性的基因表达所触发。表面具有相似粘附分子的细胞会相互粘附,并倾向于与具有不同表面特性的其他细胞群分离。选择性细胞间粘附通常由钙粘蛋白介导;排斥作用则常由 Ephrin-Eph 信号传导驱动。在组织内部,细胞能够重新排列自身以驱动会聚延伸运动,从而导致组织沿体轴方向伸长。许多运动通过平面极性信号通路进行协调,该通路还负责在各种类型上皮组织中正确定向细胞。上皮管道的形成方式多样,最简单的是由于顶端表面收缩导致上皮片段卷曲并夹断而形成。 精细分支的管状结构,如肺的气道,是通过上皮芽与它侵入的间充质之间的双向信号传导产生的,这一过程称为分支形态发生。分支及其他形态发生事件受细胞外基质和细胞内部变化的调控。长距离迁移的细胞,如神经嵴细胞,会脱离原有的邻近细胞,穿越胚胎定居新位置。许多迁移细胞,包括原始生殖细胞,依赖受体 CXCR4 及其配体 CXCL12 的趋化性引导。相互连接的细胞群也能迁移,其中领路细胞和跟随细胞表现出不同的行为。这种集体细胞迁移实现了大规模的组织塑造。
生长
发育中最基本的一个方面,我们对其了解却出奇地少——那就是动物或器官的大小是如何决定的。例如,为什么我们人类会长得比老鼠大得多?所有哺乳动物都是从大小相似的卵细胞发育而来,但成年后,最小(如鼩鼱)与最大(如蓝鲸)之间的体重差异可达一亿倍。即便在同一物种内,体型也可能差异巨大;例如,大丹犬的体重可能超过吉娃娃的40倍(图21-60)。除了遗传因素,环境也起着作用——一条被放归野外的金鱼可能比养在家用水族箱里的同类大上10倍。
器官或生物体的大小由三个变量决定:细胞数量、细胞大小以及每个细胞的细胞外物质数量。尺寸差异可能源于这些因素中任意一项的变化(图21-61)。例如,比较小鼠与人类时,我们发现差异主要在于细胞数量——人类细胞数量约为小鼠的3000倍,对应体重也约为3000倍。另一方面,野生与栽培食用植物物种的体型差异则主要源于细胞大小的不同。
图21-61 器官大小的决定因素。组织可通过调节细胞生长、增殖、死亡或这些过程的组合来控制尺寸。细胞外基质沉积同样发挥作用,尤其在骨与软骨等动物组织以及植物中尤为显著。
图 21-60 同一物种的个体可能存在显著体型差异。吉娃娃体重为 2-5 公斤,而大丹犬体重可达 45-90 公斤。(由 Deanne Fitzmaurice 提供。)
因此,挑战在于理解细胞数量、细胞大小以及细胞外基质产生的调控机制。首先,我们需要识别驱动或抑制生长的信号。接着,我们必须揭示这些信号本身是如何被调控的。在某些情况下,器官的生长由发育程序决定,这些程序并不监测结构已达到的尺寸。而在其他情况下,器官或整个身体的生长是通过稳态机制控制的,即使在面临剧烈干扰时也能达到“目标尺寸”。这表明发育中的结构通过局部或全身信号以某种方式感知自身大小,并利用这一信息来调节其生长或萎缩。
一些经典的移植实验很好地展示了控制策略的多样性。若将多个胎儿胸腺移植至发育中的小鼠体内,每个胸腺都会生长至其特有的成体大小。相反,若移植多个胎儿脾脏,则每个脾脏最终都会小于正常尺寸,但它们的总合会达到一个成体脾脏的大小。由此可见,胸腺的生长受个体器官内在的局部机制调控,而脾脏的生长则由感知全身脾脏组织总量的系统性反馈机制控制;这两种机制的具体原理目前均属未知。身体部位的大小和比例往往取决于尺寸测量反馈控制与细胞内程序的组合作用,同时也受到营养和栖息地等环境因素的影响。
细胞增殖、死亡与大小决定器官及生物体尺寸
秀丽隐杆线虫展示了体型差异如何产生。正如我们之前讨论的,同一性别的每个个体都通过几乎完全相同的细胞分裂和细胞死亡序列生成,因此拥有完全相同数量的体细胞——成年雌雄同体个体中为959个(见图21-42)。在雌雄同体发育过程中,超过1000次细胞分裂产生了1090个体细胞,但其中131个细胞经历了程序性细胞死亡。因此,对细胞分裂和细胞死亡的精确调控决定了线虫体内最终的体细胞数量。
秀丽隐杆线虫仅需 3 天便能生成所有成体体细胞,此后细胞分裂仅发生在生殖系中。然而这种蠕虫仍持续生长,在性成熟后的 2-3 周生命期内体积翻倍。这种增长源于体细胞生长:虽然细胞不再分裂,但仍持续进行多轮 DNA 合成;基因组的这种内复制使细胞变为多倍体。与所有生物体相同,细胞大小与其倍性(即所含基因组拷贝数)成正比:倍性翻倍会使细胞体积大致加倍。因此,蠕虫的最终体型由程序性细胞分裂和死亡共同决定,同时通过对倍性变化的调控来实现单个细胞尺寸的调节。
基因组的内复制作为增大细胞体积的一种方式,并非秀丽隐杆线虫所独有,而是在许多动物的特定组织中以一种发育调控的方式发生。在一个极端例子中,支配软体动物海兔大面积区域的神经元可能包含比二倍体细胞多出数十万倍的基因组拷贝,并且直径可增长至 1\mathrm{mm} (图21-62)。
图 21-62 海蛞蝓的巨型神经元具有高度多倍体特性。(A) 软体动物加州海兔(学名 Aplysia californica),因其化学感应触角竖立如耳常被称作海兔,体重可超过 2\mathrm{kg} 。加州海兔中枢神经系统包含称为神经节的神经细胞体集群。(B) 解剖后的腹神经节内含 R2 等巨型神经元,这些细胞通过内复制机制产生 \sim 300,000 份二倍体基因组副本,被认为是自然界中发现的最大体细胞。加州海兔及其巨型神经元为单细胞层面的生理学、生物化学和基因组学研究提供了可能,成为研究神经回路如何控制行为的理想模型。(A 和 B 图由 Lynne Fieber 与 Michael Schmale 提供。)
倍性变化也可能在新物种进化过程中出现,从而推动整个动物体型的变化。非洲爪蟾拥有四倍体基因组,其体重约为二倍体近亲热带爪蟾的两倍(图21-63)。这两个物种在生物体、细胞和亚细胞层面均表现出显著的大小比例关系:体型较小的青蛙拥有更小的细胞,而较小的细胞又含有更小的细胞核。与动物界相似,植物界也存在细胞大小随倍性增加而增大的现象(图21-64)。这一效应已被应用于农业育种中以培育大型作物:我们日常消费的主要果蔬大多属于多倍体。
细胞大小的变化通常源于细胞周期的改变
尽管理解器官和生物体大小如何确定是基础性的,但细胞大小本身如何设定和维持仍是一个未解之谜。如第 17 章所述,细胞大小的增加(生长)通常与细胞周期进程(分裂)相协调,以维持细胞大小的稳态。然而,细胞可以解耦这两个过程,例如在卵细胞生长期间,其体积显著增大却不复制基因组或分裂。受精后,这一现象发生逆转,当多轮 DNA 复制和细胞分裂在没有生长的情况下进行,形成许多小细胞。
内复制通过基因组再复制来扩大体细胞,是细胞周期的另一种变异形式。尽管 S 期照常进行,
图 21-64 倍性对细胞大小与器官尺寸的影响。从细菌到人类的所有生物体中,细胞大小与倍性(每个细胞中基因组的拷贝数)成正比。这通过(A-D)拟南芥花和(E)蝾螈示例说明。每种情况下,上图显示特定组织中的细胞[拟南芥的花瓣,蝾螈的前肾小管];下图展示宏观解剖结构——拟南芥的花,蝾螈的全身。对于拟南芥花而言,细胞增大导致器官尺寸增加。相反,蝾螈及其单个器官无论倍性如何都能达到正常标准尺寸,因为较大的细胞尺寸通过细胞数量减少得到补偿。这表明该物种中生物体或器官的尺寸并非简单地通过计算细胞分裂次数或细胞数量来控制;尺寸必须在总细胞质量的层面上以某种方式被调控。[A-D 图源自 C. Breuer 等,《植物细胞》19:3655-3668, 2007,经美国植物生物学家协会许可使用;E 图改编自 G. Fankhauser,收录于《发育分析》(B.H. Willer 等编)第 126-150 页] 费城:桑德斯出版社,1955年。
有丝分裂周期蛋白水平过低,无法诱导 M 期,多倍体细胞通常完全停止分裂,进入后分裂状态。在缺乏细胞分裂的情况下,额外的 DNA 复制轮次导致细胞体积增大。在某些组织中,如肝脏和心肌,DNA 复制后伴随核分裂,但无胞质分裂,通过称为核内有丝分裂的过程形成具有多个细胞核的多倍体细胞。无论是否发生核分裂,倍性增加均伴随细胞生长,并有助于组织功能。例如,哺乳动物胎盘的滋养层细胞经历八轮核内复制,产生对形成母胎间组织屏障至关重要的巨细胞。
多倍体如何增大细胞体积?一种观点认为,基因拷贝数的增加通过产生更多基因产物来提升生物合成能力。然而,在所有物种中均观察到基因组大小与细胞尺寸呈显著正相关,且与编码蛋白质的基因组比例无关。例如,尽管所有脊椎动物具有相似数量的编码基因,但蝾螈蝾螈的二倍体基因组大小是人类基因组的 10 倍(包含 10 倍以上的非编码 DNA)。值得注意的是,蝾螈细胞也比人类细胞大 10 倍。基因组大小与细胞尺寸之间比例关系的分子基础,仍是生物学中众多未解之谜之一。
动物与器官具备评估和调节总细胞质量的能力
动物或器官的大小取决于细胞大小和细胞数量,即总细胞质量。值得注意的是,许多动物和器官能够以某种方式评估其总细胞质量并对其进行调节,这为我们先前在生长控制一般原则介绍中强调的反馈控制机制提供了证据。与秀丽隐杆线虫不同,在这些情况下,若人为增大或减小细胞体积,细胞数量会相应调整以维持相同的总细胞质量。这一点早已通过蝾螈实验得到完美印证——通过改变动物倍性可操纵细胞大小。如图 21-64E 所示,不同倍性的蝾螈最终体型相同,但细胞数量差异巨大。例如五倍体蝾螈的单个细胞体积约为单倍体蝾螈的五倍,但细胞数量仅为其五分之一。这种缩放效应不仅作用于整体躯体,同样体现在各个器官中。五倍体蝾螈拥有与二倍体同类相同大小的大脑,但神经元数量显著减少且结构简化。
果蝇的成虫盘为稳态尺寸调控提供了另一个引人注目的例证。这些盘状上皮囊在幼虫期通过细胞增殖生长,并在蛹期形成成年蝇的器官与肢体(图21-65)。实验主要针对翅成虫盘开展。通过突变细胞周期调控机制中的组件,可以加速或减缓盘中细胞的分裂速率。值得注意的是,这类突变分别会导致异常小细胞数量过多或异常大细胞数量减少,但成年翅膀的尺寸(面积)和图案却几乎保持不变。由此可见,
图 21-65 果蝇翅成虫盘的生长过程。A-C 组图示展示了经过变态后形成成虫翅膀和背侧胸部的细胞位置。(A) 最初, \sim 30 细胞在胚胎的第二胸节被指定为翅膀和背侧胸部的先驱细胞。这些细胞在幼虫期的 4 天内快速分裂。(B) 变态前的幼虫体内,这些细胞组织成一个简单的袋状上皮器官——翅成虫盘,其中包含 \sim 30,000 个细胞,直径为 \sim 400 \mu \mathrm{m} 。其他成虫盘(未显示)则发育成果蝇大部分其他外部结构。(C) 最终形成的成虫翅膀长度为 \sim 2.25 毫米。(D, E) 形态发生素 Dpp 在翅成虫盘中央呈条带状表达(绿色),向边缘扩散并影响盘的生长及细胞命运。若在幼虫发育后期移除成虫盘中的 Dpp 表达,翅成虫盘及最终形成的翅膀会按比例缩小。(D 和 E 图源自 S. Matsuda 与 M. Affolter,eLife 6:e22319, 2017,doi 10.7554/eLife.22319。)
该盘状结构并非通过计算细胞分裂次数以产生固定数量的细胞来确定。相反,必然存在一种调控机制,在盘状结构总细胞量达到适当值时停止生长,从而确保后续发育形成的成虫翅膀形态正常。更值得注意的是,若将幼龄盘状结构甚至其碎片从正常环境中取出,移植到成虫雌性腹腔这种允许生长的环境中,它们仍会生长至正常大小后停止。显然,调控器官尺寸的机制内在于盘状结构本身。
关于生物体或器官如何评估总细胞量或监测自身生长,我们知之甚少。然而,我们正逐步理解某些信号分子——它们响应传递已达成尺寸信息的神秘信号,从而驱动或抑制生长过程。
多种细胞外信号刺激或抑制生长
要形成具有正确形态和比例的器官,组织内的细胞增殖与细胞生长必须协调一致。虽然部分调控通过生长调节激素系统性进行(稍后讨论),但也存在组织自我调控生长的有趣案例。果蝇翅成虫盘的研究揭示了这一机制的可能实现方式(见图 21-65),其中 \mathrm{TGFB} 家族成员 Dpp 发挥着关键作用。我们此前曾提及 Dpp 作为形态发生素参与果蝇胚胎背腹轴模式构建;在成虫盘中,它通过类似机制从盘体中央的狭窄条带扩散,根据距离差异指定不同细胞命运。实验表明,这种中心源发出的 Dpp 梯度同时影响组织尺寸——可能是因为盘体生长导致远离信号源的细胞接受较低水平的 Dpp 信号(见图 21-65D 和 E)。将组织生长与模式形成相耦合,可确保器官尺寸变化时细胞分化和分布也发生相应调整。
并非所有调节生长的细胞外信号都促进生长;有些通过促进细胞死亡或抑制细胞生长、细胞分裂或两者兼而有之来抑制生长。肌肉生长抑制素是另一个 \mathrm{TGFB} 家族成员,专门抑制成肌细胞的生长和增殖——这些前体细胞融合形成骨骼肌中巨大、多核的细胞。在这种情况下,组织自身产生信号,因此随着肌肉形成增多,肌肉生长抑制素水平上升,最终关闭肌肉生长。当肌肉生长抑制素基因被删除时,可以观察到这种简单的器官大小反馈机制的重要性:突变小鼠的肌肉会长到正常大小的数倍。值得注意的是,两种很久以前为获得大肌肉而培育的牛品种,其肌肉生长抑制素基因均发生突变,某犬种也是如此(图21-66)。
Hippo 通路传递调节生长的机械信号
在许多组织中,器官生长由一种称为 Hippo 通路的内细胞信号系统调控。该通路最初在果蝇中发现,但也存在于脊椎动物中。其名称源于当
(A) 野生型
(B) 肌肉生长抑制素突变体
图 21-66 肌肉生长抑制素限制肌肉生长。(A) 标准型惠比特犬与(B) 缺乏肌肉生长抑制素的壮硕型惠比特犬。(A 图由 Bianca Grueneberg/Getty Images 提供;B 图©2020 Stuart Isett,版权所有。)
该通路处于非激活状态时,野生型动物中的 Hippo 信号通过促进细胞死亡(通过阻断凋亡抑制剂)和抑制细胞周期进程(通过抑制细胞周期基因 Cyclin E 的表达)来抑制生长。果蝇中该通路的部分组分如图 21-67 所示。对 Hippo 抑制异常抵抗的动物器官可生长至巨大尺寸(图 21-68)。
与许多涉及信号分子与专用受体结合的信号通路不同,Hippo 通路似乎主要受机械力和细胞结构调控。细胞-细胞接触、细胞-基质接触、细胞骨架张力以及细胞的顶基极性均可影响 Hippo 激活。通过这种机制,组织能感知环境中的物理和化学信号,并相应调节自身生长。
激素协调全身生长
我们已经了解到一些信号如何作为激素在全身范围内调节动物的整体发育。其中一些激素负责调控生长。例如,在哺乳动物中,生长激素(GH)由垂体分泌进入血液,并刺激全身生长:GH 分泌过多会导致垂体性巨人症,而过少则会导致侏儒症(图 21-69)。GH 水平较低的垂体性侏儒症患者,其身体和器官均按比例缩小,与软骨发育不全性侏儒症形成对比,后者的四肢通常因编码 PGF 受体的基因发生突变而异常短小,这种突变会干扰正常的软骨和骨骼发育(图 21-60)。
生长激素主要通过刺激肝脏及其他器官产生胰岛素样生长因子 1(IGF1)来促进生长,该因子在多数组织中主要作为局部信号发挥作用。IGF1 及其相关因子是强效的生长促进剂,能根据细胞类型不同,增强细胞存活、细胞生长、细胞增殖或这些效应的某种组合。大型犬种如大丹犬因其体内高水平的 IGF1 而体型巨大,而迷你犬种如吉娃娃则 IGF1 水平较低(参见图 21-60)。
值得注意的是,所有物种中营养状况对生长速度与程度的调控都起着根本性作用。在动物体内,这一调控通过高度保守的激素信号网络实现,
图 21-68 克服 Hippo 抑制可增大器官尺寸。(A)当小鼠肝脏中过表达 Yap 时,Hippo 信号通路无法抑制其活性,导致过度生长。(B)当果蝇眼睛表达无法被 Hippo 信号磷酸化抑制的 Yorkie/Yap 蛋白时,同样会出现过度生长现象。(A 图改编自 J. Dong 等,《细胞》130:1120-1133, 2007,经爱思唯尔许可使用;B 图由 Jung Kim 提供。)
脊椎动物与无脊椎动物。遗传实验,尤其是在果蝇中的研究,已开始揭示这些调控机制的运作逻辑,并指出它们如何与诸如 Hippo 信号通路等其他机制协同作用,共同决定最终体型。
生长持续时间影响生物体大小
除生长速率外,生物体的最终大小还取决于生长持续的时间。某些动物在生命周期中存在明确的允许生长阶段,这类物种被称为具有确定性生长特性。人类的生长期在青春期结束时终止,而许多昆虫的生长则随着变态发育的开始而停止。这两种情况都是由激素释放触发的,这些激素促使生物体向性成熟过渡。此后,细胞增殖仅限于通过成体干细胞的作用维持组织稳态(参见第 22 章),尽管脂肪细胞等特定细胞仍可继续显著生长。激素释放的时机受多种因素影响,其中营养状况和幼体体型为设定最终体型提供了重要参数。
其他物种表现出无限生长特性,只要环境条件适宜,它们一生都能持续增大体型。龙虾和许多鱼类是常见例子,但无限生长现象广泛存在于生命树的多个分支中。植物通过名为分生组织(参见第 19 章)的特殊区域进行细胞增殖,同样展现出有限与无限两种生长模式。巨杉及其他红杉树属于后者例证,而前者包括为追求最大化和同步果实产量而选育的农作物。包括番茄在内的某些物种,同时存在有限生长和无限生长品种。决定一个生物体终止生长点,却让近缘物种终生持续生长的机制至今仍未可知。
摘要
动物物种及其器官的大小差异巨大,主要取决于细胞的大小和数量,这两者分别通过细胞生长和细胞分裂得以增加。细胞数量则通过细胞死亡——主要是凋亡——而减少。谜团在于,单个细胞内关于生长、分裂和死亡的决策是如何被调控和协调,以形成成年动物特有的最终体型。
某些信号如生长因子、有丝分裂原和存活因子在器官中发挥作用以刺激生长,而其他信号分子则起相反作用。这些信号在发育模式程序的控制下被部署,并影响细胞周期或凋亡机制,从而产生组织特异性的生长结果。许多动物和器官能够评估自身的总细胞质量并进行调节,即使在人为改变细胞生长或数量的情况下,也能达到一致的目标大小。补偿机制尚不明确,但已发现确保器官不会超过特定大小的信号通路。
尽管这些信号大多在局部作用以塑造器官和附肢的大小,但另一些则作为激素调节动物整体的生长。营养物质可通过刺激全身激素信号的释放来调控生长。生命中可以生长的时期也受激素控制。最终生物体的大小反映了上述所有机制的综合输出。
1米
图 21-70 软骨发育不全。这种侏儒症见于委拉斯开兹的画作中,每 10,000 至 100,000 名新生儿中有一例发生;超过 59% 的病例源于基因组中同一位置的突变,对应 FGF 受体 FGFR3 中的第 380 位氨基酸(跨膜结构域中的一个甘氨酸)。该突变为显性遗传,几乎所有病例均由新的、独立发生的突变引起,表明该特定基因组位点的突变率异常高。FGF 信号传导缺陷通过干扰发育中长骨的软骨生长而导致侏儒症。(图片艺术收藏/Alamy Stock Photo。)
问题
哪些说法是正确的?解释原因。
21-1 在早期卵裂阶段,当胚胎尚不能自行摄食时,发育进程完全由母体沉积在卵子中的物质驱动和控制。
21-2 由于后期许多发育转变会形成结构精细的器官,原肠胚形成阶段建立的体型结构与成体的体型结构几乎不存在相似性。
21-3 随着发育的推进,谱系中的单个细胞能够分化产生的细胞类型范围变得越来越受限。
21-4 在胚胎发育的不同阶段,相同的信号被不同细胞反复利用,却产生不同的生物学结果。
21-5 发育相关基因编码区的变化是造成物种间差异的主要原因。
21-6 细胞周期如同设定发育进程节奏的时钟,基因表达的成熟变化依赖于细胞周期的推进。
讨论下列问题。
21-7 说出动物发育过程中三个基本过程,并用一句话描述每个过程。
21-8 说出原肠胚形成过程中早期胚胎的三个胚层,并列出每个胚层在成体中形成的主要结构。
21-9 在果蝇早期胚胎中,似乎不需要通常形式的细胞间信号传导;相反,转录调节因子和 mRNA 分子在细胞核之间自由移动。这怎么可能呢?
21-10 形态发生素在发育过程中起着关键作用,形成浓度梯度以告知细胞它们的位置和行为方式。检查图 Q21-1 中旗帜所代表的简单图案。你认为哪些可以由单一形态发生素的梯度形成?哪些需要两种形态发生素的梯度?假设这些图案存在于细胞层中,解释形态发生素如何创建这些图案。
图 Q21-1 三个国家的国旗(问题 21-10)。(左图,railway fx/Shutterstock;中图,Creative Photo Corner/Shutterstock;右图,Derek Brumby/Shutterstock)
21-11 在线虫中,两个相邻细胞通常会分化为锚定细胞(AC)和腹侧子宫前体细胞(VU),但具体哪个细胞成为 AC、哪个成为 VU 完全是随机的。这两个细胞有同等机会选择任一种命运,但总是选择相反的命运。Lin12 基因的突变会改变这些命运。在过度活跃的 Lin12 突变体中,两个细胞都变成 VU 细胞;而在失活的 Lin12 突变体中,两个细胞都变成 AC。因此,Lin12 在决策过程中起着核心作用。在遗传嵌合体中,若一个前体细胞具有过度活跃的 Lin12,另一个前体细胞具有失活的 Lin12,那么携带过度活跃 Lin12 基因的细胞总是成为 VU 细胞,而携带失活 Lin12 基因的细胞总是成为 AC。假设一个细胞发出信号,另一个细胞接收信号,请解释这些结果如何表明 Lin12 基因编码的蛋白质是接收信号所必需的。并对野生型线虫中这两个前体细胞的命运通常如何决定提出建议。
21-12 早在研究发育的初期就已明确,卵中含有某些“形态发生”物质,这些物质被不对称地分配到发育中胚胎的细胞内。一项针对海鞘胚胎的研究考察了内胚层碱性磷酸酶,该酶可通过组织化学染色法显现。用细胞松弛素 B 处理胚胎会停止细胞分裂,但不会阻止碱性磷酸酶在适当时机的表达。用放线菌素 D 处理(该药物能阻断转录)并未干扰碱性磷酸酶的表达。而用嘌呤霉素处理(该药物能阻断翻译)则消除了碱性磷酸酶的表达。导致碱性磷酸酶产生的形态发生物质可能具有何种性质?
21-13 小鼠的 HoxA3 和 HoxD3 基因是旁系同源基因,它们位于各自 Hox 基因簇中的等效位置,并且在蛋白质编码序列上具有约 50% 的相似性。HoxA3 基因缺陷的小鼠在咽部组织方面存在缺陷,而 HoxD3 基因缺陷的小鼠则在轴骨架上表现出不足,这表明这两个旁系同源基因的功能截然不同。因此,当发现用正常的 HoxA3 基因替换有缺陷的 HoxD3 基因能够纠正缺陷,以及用正常的 HoxD3 基因替换突变的 HoxA3 基因的互逆实验也取得相同效果时,这一结果令人惊讶。然而,被置换的任一基因都无法履行其正常功能;也就是说,位于 HoxD3 位点上的正常 HoxA3 基因无法纠正由 HoxA3 位点上突变 HoxA3 基因引起的缺陷。HoxD3 基因的情况也是如此。如果 HoxA3 和 HoxD3 基因是等效的,你认为它们如何在发育过程中扮演如此不同的角色?你认为它们为何无法在新位置执行正常功能?
21-14 脊椎动物胚胎中体节的分割被认为依赖于 Hes7 基因表达的振荡。数学模型解释了这一现象。
这些振荡现象与不稳定 Hes7 蛋白的生产延迟有关,该蛋白作为转录调节因子关闭自身表达。一旦 Hes7 蛋白衰变(半衰期约 20 分钟),其转录便会恢复。为验证此模型,您决定通过移除小鼠 Hes7 基因中的一个、两个或全部三个内含子来缩短总延迟时间。为何预期内含子移除会减少延迟?若模型正确,您预测振荡时间及体节形成将发生何种变化?
21-15 驱动脊椎动物体节形成的振荡时钟包含三个关键组分:Her7(一种自身合成的不稳定抑制因子)、Delta(一种跨膜信号分子)和 Notch(Delta 的跨膜受体)。Notch 被相邻细胞上的 Delta 结合后,会激活 Notch 信号通路,进而启动 Her7 的转录。正常情况下,这一系统能精确运作,形成边界清晰的体节(图 Q21-2A)。然而在缺失 Delta 的情况下,只有前五个体节正常形成,其余体节边界模糊(图 Q21-2B)。若后期补充 Delta 脉冲,在 Delta 存在的区域体节形成会恢复正常(图 Q21-2C)。图 Q21-2D 展示了时钟各组分之间的连接及其在相邻细胞中的相互作用机制。在缺乏 Delta 的情况下,细胞为何会失去同步性?
图 Q21-2 斑马鱼胚胎中的体节形成(问题 21-15)。(A) 具有正常体节的野生型胚胎。(B) 缺乏 Delta 蛋白的胚胎中的体节形成。方括号标示最初形成时外观正常的体节区域。(C) 缺乏 Delta 蛋白但在其右侧方括号所示时间点接受 Delta 表达脉冲的胚胎中的体节形成。(D) 相邻细胞中振荡时钟组件间的相互作用。(改编自 C. Soza-Ried 等人,《发育》141:1780-1786, 2014。经生物学家公司许可转载。)
是什么让 Delta 的存在使得邻近细胞保持同步振荡?
21-16 细胞外蛋白因子 Decapentaplegic(Dpp)对果蝇翅膀的正常发育至关重要(图 Q21-3A)。它通常沿着前后边界在翅膀中部狭窄条纹区表达。Dpp 缺陷的果蝇会形成发育不全的“翅膀”(图 Q21-3B)。若将基因额外拷贝置于翅膀前部或后部活性启动子控制下,会在 Dpp 表达部位产生由外观正常细胞组成的大块翅膀组织(图 Q21-3C 和 D)。Dpp 是刺激细胞分裂、细胞生长还是两者兼有?你是如何判断的?
图 Q21-3 Dpp 表达对果蝇翅膀发育的影响(问题 21-16)。(A)正常 Dpp 表达。(B)无 Dpp 表达。(C)额外前部 Dpp 表达。(D)额外后部 Dpp 表达。(摘自 M. Zecca 等人,《发育》121:2265-2278, 1995。经生物学家公司许可使用。)
参考文献
通用
巴雷西 MJ 与吉尔伯特 SF(2019)《发育生物学》第 12 版,马萨诸塞州桑德兰:Sinauer Associates 出版社。 卡罗尔 SB(2006)《无尽之形最美:进化发育生物学新科学》,纽约:诺顿出版社。 沃林福德 JD(2019)《我们都是发育生物学家》,《发育细胞》50(2): 132-137。 沃尔珀特 L、蒂克尔 C 与马丁内斯-阿里亚斯 A(2019)《发育原理》第 6 版,牛津:牛津大学出版社。
发展概述
发展概述 Gurdon JB (2013) 卵与核:争夺主导权的斗争(诺贝尔奖演讲)。Angew. Chem. Int. Ed. Engl. 52, 13890-13899。 Istrail S & Davidson EH (2005) 基因组顺式调控编码的逻辑功能。Proc. Natl. Acad. Sci. USA 102, 4954-4959。 Levine M (2010) 动物发育与进化中的转录增强子。Curr. Biol. 20, R754-R763。 Lewis J (2008) 从信号到模式:发育生物学中的空间、时间与数学。Science 322, 399-403。 Meinhardt H & Gierer A (2000) 通过局部自激活和侧向抑制形成的模式。Bioessays 22, 753-760。 Rogers KW & Schier AF (2011) 形态发生素梯度:从生成到解读。Annu. Rev. Cell Dev. Biol. 27, 377-407。 Shubin N, Tabin C & Carroll S (2009) 深度同源性与进化新特征的起源。Nature 457, 818-823。
模式形成机制
安德烈·G 与杜布尔·D(2014)快照:Hox 基因调控。《细胞》156 卷,856-856.e1。 陈亚非、马克斯·M·E、琼斯·F·C...金斯利·D·M(2010)通过反复删除 Pitx1 增强子实现刺鱼骨盆退化的适应性进化。《科学》327 卷,302-305。 戴维斯·R·L、温特劳布·H 与拉萨尔·A·B(1987)单次转染 cDNA 的表达使成纤维细胞转化为成肌细胞。《细胞》51 卷,987-1000。 德·罗伯特斯·E·M(2006)斯佩曼组织者与两栖动物胚胎的自我调控。《自然综述分子细胞生物学》4 卷,296-302。 德里弗·W 与纽斯莱因-沃尔哈德·C(1988)果蝇胚胎中 bicoid 蛋白的梯度分布。《细胞》54 卷,83-93。 哈尔德·G、卡拉埃茨·P 与格林·W·J(1995)通过定向表达 eyeless 基因在果蝇中诱导异位眼形成。《科学》267 卷,1788-1792。 耶格尔·J(2011)间隙基因网络。《细胞与分子生命科学》68 卷,243-274。 克诺布利希·J·A(2010)不对称细胞分裂:最新进展及其对肿瘤生物学的意义。《自然综述分子细胞生物学》11 卷,849-860。 兰德·A·D(2013)细胞如何感知自身位置。《科学》339 卷,923-927。 劳伦斯·P·A(1992)《果蝇的诞生:动物设计的遗传学》。 牛津:Wiley-Blackwell 出版社 Lewis EB(1978)《果蝇体节发育的基因复合体调控》。《自然》276 卷,565-570 页。Muller P, Rogers KW, Jordan BM... Schier AF(2012)《Nodal 与 Lefty 蛋白差异扩散性构成反应-扩散图式系统》。《科学》336 卷,721-724 页。Nüsslein-Volhard C 与 Wieschaus E(1980)《影响果蝇体节数量与极性的突变研究》。《自然》287 卷,795-801 页。Schuettengruber B, Bourbon HM, Di Croce L 与 Cavalli G(2017)《多梳蛋白与三胸蛋白的基因组调控:七十年研究历程》。《细胞》171 卷,34-57 页。Sjoqvist M 与 Andersson ER(2019)《言传不如身教:细胞命运侧向控制的 Notch 机制》。《发育生物学》447(1)期,58-70 页。von Dassow G, Meir E, Munro EM 与 Odell GM(2000)《体节极性网络是稳健的发育模块》。《自然》406 卷,188-192 页。
发育时序调控
发育时序 Brown DD & Cai L (2007) 两栖动物变态发育。《发育生物学》306, 20-33. Giraldez AJ, Mishima Y, Rihel J... Schier AF (2006) 斑马鱼 MiR-430 促进母源 mRNA 的去腺苷化与清除。《科学》312, 75-79. Herrera I & Desplan C (2018) 神经元在时空维度上的特化。《科学》362, 176-180. Hubaud A & Pourquie O (2014) 脊椎动物体节发生的信号动力学。《自然综述·分子细胞生物学》15, 709-721. Isshiki T, Pearson B, Holbrook S & Doe CO (2001) 果蝇神经母细胞顺序表达转录因子以指定其后代神经元的时间身份。《细胞》106, 511-521. Jukam D, Shariati SAM & Skotheim JM (2017) 脊椎动物合子基因组激活。《发育细胞》42, 316-332. Lee RC, Feinbaum RL & Ambros V (1993) 线虫异时性基因 lin-4 编码与 lin-14 反义互补的小 RNA。《细胞》75, 843-854. Oates AC (2020) 边缘等待:分割时钟中的细胞自主性与信号延迟。《当前遗传学与发育观点》63, 61-70. Song J, Irwin J & Dean C (2013) 铭记冬季 prolonged 寒冷。《当代生物学》23, R807-R811. Wightman B, Ha I & Ruvkun G (1993) 通过 lin-4 对异时基因 lin-14 的转录后调控介导了秀丽隐杆线虫的时间模式形成。《细胞》75 卷,855-862 页。
形态发生
形态发生 Bussmann J & Raz E (2015) 斑马鱼发育中趋化因子引导的细胞迁移与运动。EMBO 杂志。34, 1309-1318。 Butler MT & Wallingford JB (2017) 发育与疾病中的平面细胞极性。自然综述:分子细胞生物学。18, 375-388。 Glimour D, Rembold M & Leptin M (2017) 从形态发生素到形态发生再回归。自然。541, 311-320。 Goodwin K & Nelson CM (2020) 分支形态发生。发育。147, dev184499。 Lecuit T & Lenne PF (2007) 细胞表面力学与细胞形态、组织模式及形态发生的调控。自然综述:分子细胞生物学。8, 633-644。 Le Douarin NM & Kalcheim C (1999) 神经嵴,第二版。剑桥:剑桥大学出版社。 Solnica-Krezel L & Sepich DS (2012) 原肠胚形成:胚层的形成与塑造。细胞与发育生物学年度评论。28, 687-717。 Takeichi M (2011) 动物组织的自组织:钙黏蛋白介导的过程。发育细胞。21, 24-26。 Te Boekhorst V, Preziosi L & Friedl P (2016) 体内与计算机模拟中细胞迁移的可塑性。细胞与发育生物学年度评论。32, 491-526。 Weak-Shannon E & Hardin J (2014) 自上而下的细胞相互作用。自然。15, 34-48。
生长
生长与器官尺寸调控相关文献:Andersen DS, Colombani J & Leopold P (2013) 器官生长的协调:来自昆虫世界的原理与未解之谜。《细胞生物学趋势》23, 336-344。Conlon I & Raff M (1999) 动物发育中的尺寸控制。《细胞》96, 235-244。Hariharan IK & Bilder D (2006) 果蝇抑癌基因对成虫盘生长的调控。《遗传学年评》40, 335-361。Ovrebo JI & Edgar BA (2018) 多倍体在组织稳态与再生中的作用。《发育》145, dev156034。Penzo-Mendez AI & Stanger BZ (2015) 哺乳动物器官尺寸调控。《冷泉港生物学视角》7, a019240。Restrepo S, Zartman JJ & Basler K (2014) 形态发生素 DPP 对模式形成与生长的协调。《当代生物学》24, R245-R255。Zheng Y & Pan D (2019) 发育与疾病中的 Hippo 信号通路。《发育细胞》50, 264-282。
组织稳态与再生中的干细胞
细胞最初作为自由生活的个体演化而来,这样的细胞至今仍主导着地球及其海洋。然而对人类而言,最重要的细胞是多细胞共同体中专化的成员。这些细胞丧失了独立生存所需的特性,却获得了服务于整个机体需求的特殊功能。尽管共享同一基因组,它们在结构、化学特性和行为方式上展现出惊人的多样性。人体内已有命名的细胞类型超过200种,它们相互协作形成多种组织,进而组成执行广泛功能的器官。要理解这些细胞,仅靠培养皿中的分析远远不够:我们更需要了解它们在其自然栖息地——完整人体内如何生存、工作与消亡。
在第七章和第二十一章中,我们探讨了胚胎中各类细胞如何分化形成差异,以及细胞记忆和邻近细胞信号如何使它们在此后保持这种差异。第十九章讨论了细胞通过分子装置相互连接、利用细胞外基质支撑组织器官,从而实现多细胞组织自组装的机制。但成年机体并非静止不变:它处于动态平衡结构中,新细胞不断诞生、分化并死亡。稳态机制维持着恰当平衡,使得尽管新旧细胞持续更替,组织结构仍得以保持。
在本章中,我们重点探讨贯穿生命始终的这些稳态过程。通过这一探讨,我们将展示分化细胞类型的多样性,特别关注干细胞在许多成人组织中所起的作用——这些未分化细胞专门负责在需要持续更新或组织修复再生时大量需求的情况下,提供新的分化细胞供应。我们将看到许多成人组织具有持续自我更新与修复的能力,而其他组织则不具备这种特性,这种情况下,失去的细胞将永久缺失,导致耳聋、失明、痴呆等疾病。我们将讨论干细胞如何在自我更新的组织中维持存在,以及其子细胞命运如何被决定。随后我们将描述某些动物物种再生完整肢体或器官的非凡能力,其中一个极端案例甚至能从单个干细胞再生生物体的全部组织。 在本章的最后一节,我们讨论了如何人工生成和操控干细胞,这引发了一个当前干细胞技术热潮背后的实际问题:我们如何利用对细胞分化和组织更新过程的理解来改进自然,修复那些迄今为止似乎无法治愈的与疾病和人体衰老相关的损伤和退化?
干细胞与组织稳态
干细胞与组织稳态在自我更新的成体组织中,细胞不断诞生、分化并死亡。这种细胞的“流动”可类比于河流中水的流动:河流日复一日看似相同,但随着水流向下游,水
第22章
本章内容
干细胞与组织稳态
干细胞命运与自我更新的调控
再生与修复
细胞重编程与多能干细胞
图22-1 组织稳态与河流的类比。在自我更新的成体组织中,由细胞分裂"上游"持续产生的新细胞流与"下游"不断丢失的分化细胞,共同维持着组织的动态平衡。
正如河流中的水永不重复(图22-1),自我更新组织的特征性结构虽细胞群体持续更替却得以保持——分化细胞在"下游"流失,干细胞在"上游"生成新细胞。因此,这类组织中的干细胞必须兼具自我复制和分化产生特定细胞的能力,以支撑生物体的整个生命周期。若无干细胞,这些组织器官将因无法跟上细胞自然更替的节奏而快速衰竭。事实上,干细胞功能缺陷正因如此会成为疾病与衰老的诱因。
在本节第一部分,我们将以两种上皮组织——肠道内壁和皮肤外表面为例,定义干细胞的基本特性。接着探讨如何通过细胞谱系追踪识别组织中的干细胞,或在血细胞的情况下,通过细胞移植研究进行识别。最后讨论那些在没有干细胞的情况下仍能自我维持的组织。
干细胞的定义在于其自我更新和产生分化细胞的能力。
许多成体组织,特别是那些细胞更新率高的组织,含有组织特异性干细胞(也称为成体干细胞)。这些组织各自拥有独特的干细胞群体,能够产生该组织特有的分化细胞,而非其他组织的细胞。每种组织的干细胞都有其独特的发育历程,不一定与其他组织的干细胞共享分子特征。
然而,所有干细胞都具有两个基本特性:(1) 它们能够在整个生物体生命周期内自我补充为干细胞——这一过程称为自我更新;(2) 它们还能产生分化细胞。因此,当干细胞分裂时,每个子细胞都面临选择:既可保持干细胞状态,也可启动分化进程(图22-2)。
干细胞通常不直接产生分化细胞;相反,它们会生成一种中间细胞类型,这种细胞虽已确定分化方向但仍持续增殖,从而产生更多数量的分化细胞。这些细胞被称为祖细胞;它们也被称为过渡扩增细胞,因为其分裂作用在于扩增分化细胞的数量。
图22-2 干细胞的定义特征。当干细胞分裂时,每个子细胞要么通过自我更新过程保持干细胞状态,要么在经历数次分裂后进入分化程序。自我更新过程维持着组织中干细胞池的稳定。
图22-3 干细胞、祖细胞与分化细胞的层级关系。除自我更新外,组织特异性干细胞通常会产生祖细胞(过渡扩增细胞),这些细胞在有限次数的分裂后终末分化。干细胞和祖细胞可以是单能或多能的,这取决于它们仅产生一种还是多种类型的分化细胞。
这些中间细胞最终源自每次干细胞分裂(图22-3)。与干细胞不同,这些中间细胞仅经历有限次数的分裂便会分化。当细胞抵达分化路径终点且不再分裂时,即达到终末分化状态。当成年干细胞或祖细胞产生多种分化细胞类型时,称为多能性;若仅产生一种分化细胞类型,则称为单能性(参见图22-3)。
我们现在考虑两种上皮组织,以说明这些不同类别的细胞如何在自我更新的成体组织中组织——肠道内壁和皮肤外层。在这两种情况下,干细胞在组织的一个表面持续产生过渡扩增的祖细胞,而终末分化细胞则从相对表面丢失——在我们的河流类比中,分别对应上游和下游。
小肠上皮内衬通过隐窝中的细胞增殖不断更新
小肠内衬(及肠道大多数其他区域)是单层上皮,仅一个细胞厚。肠上皮覆盖着伸入肠腔的绒毛表面,并衬里着下陷至下层结缔组织的隐窝(图22-4)。分裂细胞,包括干细胞和祖细胞,仅限于隐窝,而终末分化细胞则如稳定溪流般从隐窝涌出至绒毛。主要有四种类型的分化细胞——一种吸收型和三种分泌型(图22-5)。
- 吸收细胞(又称刷状缘细胞或肠上皮细胞)是上皮组织中的主要细胞类型,其暴露表面密布微绒毛。它们的功能是从肠腔吸收营养物质。为此,这些细胞还产生水解酶,执行食物细胞外消化的最终步骤。
- 杯状细胞向肠腔分泌黏液;这种黏液形成保护层覆盖在上皮表面。
- 潘氏细胞构成先天性免疫防御系统的一部分(详见第 24 章),能分泌杀菌蛋白质;同时分泌维持干细胞群所需的 Wnt 信号蛋白(详见第 15 章)。
- 肠内分泌细胞具有超过15种亚型,可分泌血清素和肽类激素。这些激素作用于肠壁神经元及其他细胞类型,调控肠道及其他组织细胞的生长、增殖与消化活动。
肠道内腔
如同在传送带上,吸收细胞、杯状细胞和肠内分泌细胞从它们在隐窝中的诞生地出发,通过在上皮细胞层平面上的滑动运动向上移动,覆盖绒毛表面。从隐窝出现后的3-4天内(小鼠体内),这些分化细胞抵达绒毛顶端,随后被排入肠道内腔(参见影片20.7)。隐窝中的潘氏细胞数量较少且迁移模式不同,它们驻留在隐窝底部,虽然更新速度较慢,但仍持续更替,可存活数周后才经历细胞凋亡并被邻近细胞吞噬。
产生肠道上皮的干细胞位于隐窝基部上方,散布在潘氏细胞之间。这些干细胞之所以能被识别,是因为只有它们表达一种名为 Lgr5 的特殊 G 蛋白偶联受体,该受体可作为干细胞群体的特异性标记。当干细胞分裂时(在小鼠肠道中约每 24 小时分裂一次),部分后代细胞会定向分化,成为向上迁移的过渡扩增祖细胞,而其他细胞则通过自我更新过程保持干细胞状态。这些干细胞具有多能性,能够产生上皮中所有分化的细胞类型。
表皮干细胞在体表维持着自我更新、防水的上皮屏障
表皮干细胞在体表维持自我更新、防水、上皮屏障的功能。干细胞系统根据组织不同以多种方式组织。例如,身体的外上皮覆盖层——表皮,持续进行更新,但与肠上皮不同,它是多层或分层的。干细胞位于基底层,分裂中的过渡扩增祖细胞也位于此。一旦祖细胞停止分裂,它们便离开基底层向外移动至暴露表面,经历
图 22-4 肠道上皮内衬的更新过程。(A) 小肠内衬上皮细胞更替与增殖模式。干细胞(红色)位于隐窝基部,散布于不分裂的分化细胞(潘氏细胞)之间。干细胞后代主要从隐窝向上迁移至绒毛;经过数次快速分裂后停止分裂并分化——部分细胞在隐窝内即完成分化,多数细胞在离开隐窝时分化。与其他不分裂的分化细胞相同,潘氏细胞通过干细胞后代持续更新,但它们会向下迁移至隐窝基部并在该处存活数周。(B) 小肠部分内衬切片的显微图像,显示隐窝和绒毛结构。注意所有由干细胞产生的分化细胞类型混合存在,主要包括吸收细胞,其间散布着黏液分泌型杯状细胞(红色染色)。
图22-5展示了小肠上皮内衬中发现的四种主要分化细胞类型。所有细胞均以肠腔朝上的方向排列。粗橙色箭头指示每种细胞类型物质分泌或吸收的方向。这些细胞均由位于隐窝底部附近未分化的多能干细胞生成(参见图22-4)。吸收性(刷状缘)细胞在数量上以约10:1或更高的比例超过其他上皮细胞类型。其顶面微绒毛使表面积增加30倍,不仅用于营养物质的输入,还为执行细胞外消化最后阶段的酶提供锚定位点——将小肽和二糖分解成可跨细胞膜运输的单体。杯状细胞分泌黏液,是分泌性细胞类型中最常见的一种。潘氏细胞分泌(伴随某些生长因子)隐窝素——属于防御素家族的杀菌蛋白质。肠内分泌细胞的不同亚型向肠壁(继而进入血液)分泌血清素和肽类激素。 胆囊收缩素是一种由肠内分泌细胞在肠道内营养物质存在时释放的激素。它与附近感觉神经末梢上的受体结合,促使胰腺释放消化酶和胆囊排出胆汁;同时向大脑发出信号,在进食足够后停止饥饿感。(吸收细胞和杯状细胞,Don W. Fawcett/Science Source;潘氏细胞和肠内分泌细胞,摘自 R.V. Krstic《人体组织学图解百科全书》。柏林:Springer-Verlag,1964 年。经 Springer Nature 许可使用。)
它们在此过程中逐渐完成终末分化,最终形成无生命的鳞屑,这些鳞屑最终会从皮肤表面脱落(图22-6)。
尽管表皮的结构与肠上皮大相径庭,但许多基本法则却相通。干细胞通过组织特定区域的信号得以维持,在表皮中这一区域是基底层及其下方的结缔组织。那些注定要分化的干细胞后代,在经历数次分裂后成为过渡扩增细胞。
图22-6 表皮的多层结构。表皮构成皮肤的外层覆盖,形成一道自我修复且持续更新的防水屏障。其下方是相对较厚的结缔组织层,包含富含胶原蛋白的坚韧真皮(皮革即由此制成)。表皮细胞被称为角质形成细胞,因为它们特有的分化活动是合成角蛋白中间丝蛋白,赋予表皮韧性。这些细胞在不同层次间改变外观与特性,经历规律的程序性终末分化。最内层附着于下方基膜的细胞称为基底细胞,通常只有这些细胞进行分裂:基底细胞群包含相对少量的干细胞及由其衍生的较多过渡扩增祖细胞。基底细胞上方是数层较大的棘细胞。 棘细胞层之外是薄而染色深的颗粒细胞层,这里的细胞紧密连接形成防水屏障;这标志着内部代谢活跃层与表皮最外层之间的界限,最外层由细胞内细胞器已消失的死细胞构成。这些最外层细胞退化为扁平鳞片状,即角质鳞屑,内部充满紧密堆积的角蛋白,最终从皮肤表面脱落。从细胞离开基底层到从表面脱落的时间为一到两周,具体取决于身体部位和物种。
细胞在基底层中分化前。此外,尽管各自作用不同,但调控肠道干细胞系统的大多数信号通路也参与调节表皮干细胞系统。
细胞谱系追踪揭示干细胞及其后代的位置
在成人组织中,干细胞通常稀少且难以通过常规组织切片识别,除非存在如 Lgr5 这样的干细胞特异性标记。重组 DNA 技术提供了一种通用而强大的方法,通过细胞谱系追踪技术,在任何更新组织中识别干细胞及其后代。该方法利用转基因动物在少数细胞中创建可见的遗传标记,随着时间的推移,这些标记会产生分布广泛且易于区分的后代细胞克隆,如图 22-7 和图 22-8 所示。此方法无需预先知晓组织是否含有干细胞。若存在干细胞,它们将被随机标记并形成包含干细胞及分化细胞的持久克隆谱系(见图 22-7B);分裂的前体细胞同样会被随机标记并产生标记克隆,但这些克隆最终都会消失(见图 22-7C)。对克隆的分析不仅能揭示是否存在干细胞,还能
图 22-7 使用遗传标记的克隆分析。(A) 含有两个转基因的转基因动物可用于驱动少量细胞中易于检测且可遗传的标记表达。第一个转基因编码标记基因,例如编码绿色荧光蛋白(GFP)的基因。然而,该 GFP 转基因的表达(此处以绿色显示)被两侧带有 LoxP 位点(粉红色;参见图 5-66)的阻断序列(红色)所阻止。第二个转基因 CreERT2(棕色)编码一种称为 CreERT 的嵌合型 Cre 重组酶,该酶由与雌激素受体蛋白连接的 Cre 重组酶组成;只有当其结合人工雌激素类似物他莫昔芬(红色球体)时,该酶才具有重组酶活性。添加他莫昔芬会导致重组事件,从而移除阻断 DNA 序列。结果,GFP 标记得以表达。由于阻断 DNA 已从基因组中永久移除,该标记在发生重组事件的细胞的所有后代中持续表达。 使用低剂量的诱导分子他莫昔芬,可以在少数分布稀疏的细胞中随机激活标记,从而产生可区分的克隆。(B)若重组事件发生在干细胞中,将标记一个克隆谱系,随着标记干细胞的自我更新和分化细胞的生产,该标记会随时间持续存在。(C)若重组事件发生在非干细胞中,随着标记细胞分化并最终丢失,标记将随时间逐渐消失。
图 22-8 小肠中表达 Lgr5 的干细胞及其后代。此处对图 22-7 所示的基本方法进行了修改,以标记单个肠道干细胞并追踪其后代的命运。Lgr5 基因编码 G 蛋白偶联跨膜受体家族成员,并特异性表达于隐窝基底附近的干细胞中。本实验中,利用 Lgr5 启动子驱动 CreERT2 表达,低剂量他莫昔芬处理使得个别干细胞表达标记蛋白 LacZ(而非 GFP)。这些细胞及其所有后代随后可通过蓝色组织化学染色检测。图中所有蓝色细胞均源自单个表达 Lgr5 的干细胞。60 天后,可见该细胞的蓝色后代几乎遍布整个绒毛顶端。这些后代可被证实包含所有类型的分化细胞,以及在隐窝基底持续存在的 Lgr5 表达细胞。这证明表达 Lgr5 的细胞是多能干细胞。(改编自 N. Barker 等人,《自然》449:1003-1007,2007 年由自然出版集团出版。经 SNCSC 许可复制。)
不仅在于干细胞的存在,还在于它们的位置以及它们是单能还是多能。
如果已知某个基因在特定组织的干细胞中特异性表达,比如小鼠肠道中的 Lgr5 基因,就可以采用更有针对性的方法进行细胞谱系追踪。这种情况下,可以利用该基因的启动子使遗传标记仅在干细胞中表达。正是这类实验最初证实了小鼠肠上皮中表达 Lgr5 的细胞是干细胞,并且是多能性的(见图 22-8)。
静止干细胞难以通过谱系追踪识别
上述谱系追踪方法假设组织中的干细胞在活跃分裂,产生自我更新或分化的子细胞。然而,一些成体干细胞处于静止状态,作为需要时的“储备库”:它们很少分裂甚至不分裂,除非受到如组织损伤等刺激诱导。在这些情况下,可能需要额外的时间或刺激才能通过谱系追踪揭示干细胞的存在。
以人类骨骼肌为例,它由多核肌细胞(肌纤维)构成,这些细胞在发育过程中通过终末分化的成肌细胞融合形成。人类在成年期通常不会生成新的骨骼肌,但在需要肌肉生长或修复时仍具备这种能力。能够作为成肌细胞的细胞以小型、扁平且不分裂的状态保留下来,紧贴成熟肌纤维并包裹在基底层鞘内(图22-9)。当肌肉受损或受到生长刺激时,这些卫星细胞会被激活增殖,其后代可与现有肌纤维融合实现修复。
图 22-9 卫星细胞对骨骼肌纤维的修复过程。(A)标本采用针对肌肉钙黏蛋白(M-cadherin)的抗体(红色)染色,该蛋白同时存在于卫星细胞和肌纤维上,并在两者膜接触部位富集。肌纤维细胞核呈绿色,卫星细胞核呈蓝色。(B)示意图展示卫星细胞通过增殖与融合修复受损肌纤维的过程。(A 图由 Terence Partridge 提供。)
受损肌肉的修复或促进肌肉生长。因此卫星细胞或其特定亚群是成年骨骼肌的干细胞,通常保持静止状态备用,在需要时可作为自我更新的终末分化成肌细胞来源。
通过卫星细胞进行的肌肉修复过程在所能达到的效果上是有限的。例如,在某种形式的肌营养不良症中,细胞骨架蛋白肌营养不良蛋白的遗传缺陷会缓慢但持续地损害已分化的骨骼肌细胞。结果,卫星细胞增殖以修复受损的肌纤维。但这种再生反应无法跟上损伤的速度,最终结缔组织取代了肌纤维,阻断了任何进一步修复的可能性。类似的修复能力下降也导致了老年人中逐渐出现的肌肉衰弱现象。
造血干细胞可通过移植来识别
识别成体组织中干细胞的另一种方法是通过细胞移植。该技术最初用于鉴定造血(血液生成)系统的干细胞,这是成年哺乳动物体内最复杂的干细胞系统。造血干细胞既能生成红细胞(erythrocytes)也能产生白细胞(leukocytes),它们位于成年个体的骨髓中,并在此处生成血小板。白细胞包含多种类型,包括可离开血流发育为巨噬细胞的单核细胞——这类细胞存在于大多数器官中。当动物暴露于大剂量 X 射线时,骨髓中的造血细胞大多会被摧毁,导致动物因无法生成新血细胞而在数日内死亡。但若移植来自同品系健康供体小鼠骨髓的细胞,则该动物可获救。
| 表22-1 血细胞类型 | ||
| 细胞类型 | 主要功能 | 人类血液中的典型浓度(细胞/升) |
| 红细胞(红血球) | 向组织输送氧气并带走二氧化碳 | 5 × 10¹² |
| 白细胞(白血球) | ||
| 粒细胞 | ||
| 中性粒细胞(多形核白细胞) | 吞噬并杀灭入侵的细菌 | 5 × 10^9 |
| 嗜酸性粒细胞 | 消灭较大寄生虫并调节过敏性炎症反应 | 2 × 10^8 |
| 嗜碱性粒细胞 | 在某些免疫反应中释放组胺(某些物种中还包括血清素) | 4 × 10^7 |
| 单核细胞 | 成为组织巨噬细胞,负责吞噬并消化入侵的微生物、异物以及受损衰老细胞;部分还会分化为树突状细胞 | 4 × 10^8 |
| 淋巴细胞 | ||
| B 细胞 | 制造并分泌抗体 | 约0.3×10^9 |
| T 细胞 | 杀死病毒感染的细胞并调节其他白细胞的活动 | 约2 × 10^9 |
| 自然杀伤(NK)细胞 | 杀死病毒感染的细胞及某些肿瘤细胞 | 1 × 10^8 |
| 血小板(源自骨髓中巨核细胞的细胞碎片) | 启动血液凝固过程 | 3 × 10¹¹ |
| 人体含有约5升血液,占体重的7%。红细胞约占该体积的45%,白细胞约占1%,其余为液态血浆。 | ||
在这些细胞中,有些能够定植于受辐射宿主体内,并永久性地为其重新装备造血组织(图22-10)。此类实验证明,骨髓包含完整的造血干细胞系统,并使科学家得以分离出相关干细胞,发现区分它们的分子特征。
为此,从小鼠骨髓中提取的细胞会根据其细胞表面抗原进行分选(使用荧光激活细胞分选仪),并将不同组分输注到经辐射处理的小鼠体内。若某一组分能挽救这些受辐射小鼠,则其中必定含有造血干细胞。通过这种方式,研究揭示了造血干细胞具有特定的细胞表面蛋白组合,且通过适当的细胞分选,可以获得几乎纯净的干细胞制剂。这些干细胞仅占小鼠骨髓细胞群体的极小部分——大约每5万至10万个细胞中仅有1个;但这已足够。值得注意的是,将单个此类细胞注入造血功能缺陷的宿主小鼠体内,便足以重建其整个造血系统,生成全套血细胞类型及新的干细胞。这一点及谱系追踪实验证实,单个造血干细胞具有多能性,能够自我更新并产生所有类型的血细胞。
血液中含有大量多种类型的已分化细胞(见表 22-1),其中许多可在标准染色的人血涂片中观察到(图 22-11)。红细胞具有同质性,它们停留在血管内,负责运输氧气 2 O 2 与 C O 2 一氧化碳 2 与血红蛋白结合。相比之下,白细胞在形态和功能上具有异质性,必须穿过小血管壁进入组织才能发挥作用。终末分化的
X 射线照射会中止血细胞生成,若不进行进一步治疗,小鼠将会死亡
图22-10 通过骨髓细胞输注拯救受辐射小鼠。人类白血病治疗中采用基本相似的流程,即在放疗或化疗后通过骨髓移植进行治疗。小鼠得以存活;注入的干细胞定植于其造血组织,持续生成新的血细胞
由于血细胞寿命相对较短且需在动物整个生命周期中持续生成,造血干细胞必须每日产生大量分化细胞。但它们并非直接生成终末细胞,而是通过持续产生大量过渡扩增祖细胞——这些定向前体细胞在骨髓中经历多次分裂后才最终完成终末分化。
然而,干细胞并非直接从多能干细胞状态跃迁至定向分化的特定路径,而是经历多次细胞分裂,通过一系列步骤逐步限制其发育选择(图 22-12)。第一步通常是通过两种多能性过渡扩增祖细胞,决定向髓系或淋巴系命运分化。其中一种能产生大量各类髓系细胞,包括血液粒细胞(中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)、单核细胞(巨噬细胞和树突状细胞的前体)、红细胞以及巨核细胞(驻留骨髓并通过出芽方式产生血小板的细胞)(视频 22.1)。另一种多能祖细胞则产生大量不同类型的淋巴系细胞,包括适应性免疫系统的 B 淋巴细胞和 T 淋巴细胞,以及先天性免疫系统中类淋巴细胞特性的自然杀伤(NK)细胞(详见第 24 章)。 进一步的承诺步骤最终导致祖细胞仅专一于产生一种细胞类型,尽管这一最终承诺步骤远在细胞停止增殖并终末分化之前就已发生。骨髓内外产生的多种信号分子控制着造血细胞及其已定向后代在骨髓中的存活、增殖和路径承诺,从而调控每种分化血细胞最终产生的数量。
图 22-12 小鼠与人类造血过程的简化示意图。多能造血干细胞通常分裂频率较低,既可生成更多具有自我更新能力的多能干细胞,也可形成多能祖细胞,后者能够分化产生血液和免疫系统中的所有细胞。祖细胞分裂次数有限,需经历多个逐步过渡的中间阶段才能发育为完全分化的细胞。随着不断分裂,祖细胞能产生的细胞类型范围逐渐专一化,正如该细胞谱系图的分支结构所示。在成年哺乳动物中,图示所有细胞主要于骨髓中发育——除 T 淋巴细胞(如图所示在胸腺中发育)以及巨噬细胞和部分树突状细胞(由循环血液中的单核细胞发育而来)之外。需注意,并非所有干细胞都通过完全相同的序列产生完全一致的后代细胞模式。
在这一层级造血系统中,唯有干细胞能在个体生命周期内自我更新,单次干细胞分裂可产生成千上万至数百万的分化后代。这解释了为何干细胞数量仅占骨髓造血细胞总数的极小部分。维持干细胞低分裂频率具有重要优势——若仅靠其自身分裂来满足终末分化血细胞的高需求,将导致快速的复制性细胞衰老与干细胞库枯竭,引发严重后果。此外,干细胞分裂次数越少,细胞积累危险突变的风险越低,这些突变会持续存在于变异克隆中;如第20章所述,此类克隆在造血系统中尤为危险,因为相对较少的突变就是以诱发血细胞癌。
某些组织的维持无需依赖干细胞
某些类型的细胞即使完全分化后仍能分裂,无需借助干细胞即可实现更新与再生。分泌胰岛素的胰腺 \beta 细胞便是一例。其更新模式具有特殊重要性,因为自身免疫攻击导致这类细胞缺失正是 1 型(青少年发病型)糖尿病的成因,而随年龄增长和肥胖出现的功能衰退也是 2 型(成人发病型)糖尿病的重要诱因。这类 \beta 细胞通常聚集在称为朗格汉斯岛的细胞群中。这些胰岛似乎并不含有干细胞,但新的 \beta 细胞却在胰岛内持续生成。与此前所述的谱系追踪研究相似,实验表明该细胞群的更新通常通过已分化的胰岛素分泌性 \beta 细胞的简单分裂实现。
另一种能够通过完全分化细胞的简单分裂进行更新的组织是肝脏。肝脏中的主要细胞类型是肝细胞,这是一种执行肝脏多种代谢功能的大型细胞。肝细胞通常存活一年或更长时间,并以极慢的速度分裂。强大的稳态机制通过调节细胞增殖速率和细胞死亡速率,维持肝脏正常体积并在受损时恢复其大小。若通过手术大量移除肝细胞或通过四氯化碳中毒致其死亡,会观察到显著效应:在任一种损伤发生后的第一天左右,存活肝细胞中会出现细胞分裂浪潮,迅速替代丢失的组织。例如,若移除大鼠三分之二的肝脏,通过肝细胞增殖可在约两周内再生出接近正常体积的肝脏。
胰腺和肝脏同样含有少量干细胞群,这些细胞可作为备用机制在更极端情况下被激活以产生分化细胞类型。
应对损伤时,某些分化细胞可逆转为祖细胞,部分祖细胞可逆转为干细胞
尽管从干细胞到祖细胞再到分化细胞的路径通常是单向的,但在某些情况下,损伤可以逆转这一方向。一个显著的例子发生在哺乳动物有髓神经被切断时:切断处远端的轴突会退化,而已经分化的髓鞘形成施万细胞(参见图11-35)会去分化形成增殖中的施万祖细胞。这些祖细胞有助于引导再生的轴突回到其原始目标,并重新髓鞘化轴突以完成再生过程。
类似地,在某些组织中,当干细胞丢失时,已承诺分化的祖细胞可以重编程以恢复为干细胞。例如,在小鼠和果蝇的睾丸中,精原细胞通常遵循从干细胞到增殖祖细胞的单向发育路径,这些祖细胞经历减数分裂最终分化为精子。如果干细胞因自然或实验原因丢失,有丝分裂增殖的祖细胞
细胞能够重新编程并逆转为干细胞。更普遍地说,这一过程可能有助于干细胞群体的长期维持,使得单个干细胞的寿命可以短于生物体的寿命。不幸的是,癌细胞也常常获得类似干细胞的特性,使它们能够无限自我更新(第20章将讨论)。
某些组织缺乏干细胞且不可再生
某些缺乏干细胞的成人组织无法再生。通过比较鼻腔中的嗅觉上皮、内耳的听觉上皮以及视网膜的感光上皮,可以明显看出不同组织再生能力的显著差异,这些组织在更新能力上表现出惊人的区别。嗅觉上皮含有一群干细胞,这些干细胞分化出的细胞寿命有限且持续更新。但与之前讨论的表皮不同,这些分化的嗅觉细胞是神经元;它们的细胞体位于嗅觉上皮中,并将轴突延伸回大脑的嗅球。因此,这种上皮的更新涉及持续产生新的轴突,这些轴突必须导航回大脑中的特定位置,并在那里形成新的突触。
相比之下,至少在哺乳动物中,听觉上皮和视网膜感光上皮缺乏干细胞,其感觉受体细胞——耳朵中的感觉毛细胞和视网膜中的光感受器——是不可替代的。如果这些细胞遭到破坏——无论是由于过度暴露于巨大噪音、直视激光束,还是疾病或衰老过程中的退行性变化——这种损失将是永久性的。
我们将在本章后续部分再次讨论组织再生。
摘要
许多成体组织,特别是那些细胞更新率高的组织,如肠黏膜、皮肤表皮和血液,通过干细胞持续更新以维持生物体整个生命过程中的组织稳态。干细胞的定义特征在于其既能自我更新,又能通过快速分裂的过渡放大祖细胞产生终末分化细胞。这些特性可通过谱系追踪或移植实验得到验证。组织特异性干细胞(或称成体干细胞)的分化潜能有限,仅能产生特定组织中的一种或多种细胞类型。
在小肠的单层衬里中,多能干细胞位于每个隐窝的基部附近,它们在此自我更新并产生分裂中的定向祖细胞。这些祖细胞大多向上流动,在到达绒毛时最终分化为三种主要肠道细胞类型之一;其他祖细胞则向相反方向移动,成为潘氏细胞,这些细胞留在隐窝基部,帮助维持干细胞。其他具有自我更新能力的上皮组织,如表皮,具有多层(复层)结构,干细胞及其分化后代以不同方式排列,但遵循相似的基本原理。
造血系统是最复杂的哺乳动物干细胞系统;所有红细胞和多种白细胞均源自成体骨髓中的一种共同的多能造血干细胞,该细胞缓慢分裂并产生多能及单能祖细胞(过渡扩增细胞)。这些祖细胞快速分裂,每天分化形成大量不同类型的终末分化细胞。在其他组织如骨骼肌中,干细胞处于静息状态,仅在需要组织生长或修复时才进行分裂与分化。成体组织的更新与修复并非总是依赖干细胞;例如在胰腺和肝脏中,已分化细胞可终生分裂以替代缺失细胞,维持组织稳态。某些情况下,分化细胞可逆转为祖细胞,而祖细胞也能
逆转为干细胞。相反地,成年哺乳动物耳部和眼部的某些感觉上皮不可再生;其感觉细胞不会更新——一旦缺失,将永久丧失。
干细胞命运与自我更新的调控
成体干细胞在更新组织中维持组织稳态,这归功于它们既能自我更新,又能在生物体整个生命周期内产生分化细胞的能力。这些细胞如何长期保持其干细胞特性?它们的子细胞又是如何在自我更新和分化承诺之间做出选择的?尽管维持干细胞群体对于自我更新组织至关重要,但必须控制干细胞的增殖,因为未分化细胞的失控产生是癌症的一个标志(第20章将讨论)。在本节中,我们将探讨使干细胞在产生分化细胞的同时保持自身特性并控制其增殖的机制。
干细胞微环境维持干细胞的自我更新能力
干细胞的身份与自我更新依赖于其环境中的细胞外信号,这些信号既促进其增殖,又抑制其向分化方向发展的倾向。在许多组织中,干细胞栖息于一个被称为干细胞巢的特殊微环境,此处信号分子浓度较高(图22-13)。干细胞与支持巢的细胞保持紧密的物理接触,这些细胞不仅产生信号,还提供了一个局部的特殊环境。在此环境之外,信号分子的浓度不足以维持干细胞的自我更新,因此它们的子代细胞便会走向分化。
干细胞微环境的存在最初是通过一项实验推断出来的,该实验将骨髓细胞移植到接受过高剂量 X 射线照射的小鼠体内(见图 22-10)。未经预先辐照处理时,移植细胞无法重建造血功能,这表明必须先清除宿主体内的造血干细胞,移植的干细胞才能成功定植于宿主骨髓。这个假想的、由宿主或供体造血干细胞占据的特殊"位置"被称为干细胞微环境。由于骨髓的复杂性及干细胞在其中极为稀少,该微环境的具体位置直到多年后才得以明确——免疫荧光显微镜技术和细胞标记物的运用证实,骨髓血窦表面很可能是干细胞微环境的所在位置。
干细胞微环境中提供的自我更新信号的分子性质因物种和组织而异,但这些信号通常属于 Wingless(Wnt)、Hedgehog(Hh)或转化生长因子(TGF)家族的分泌性信号蛋白(详见第 15 章)。其他微环境信号则是依赖于干细胞与支持细胞直接接触的细胞表面蛋白。哺乳动物肠隐窝提供了一个经过充分研究的范例(参见
图22-13 干细胞微环境。干细胞仅在特定的微环境中进行自我更新,该环境为其提供必要的信号分子。这些信号分子可由微环境支持细胞提供,或通过能够富集信号分子的特殊细胞外基质传递。微环境空间可能极为微小——在某些情况下,紧邻微环境的干细胞具有自我更新能力,而仅一个细胞直径之隔的细胞则丧失此能力。
图 22-14 单个表达 Lgr5 的细胞在无细胞基质中培养形成微型肠道的发生过程。(A)示意图及(B)发育中类器官的相差显微照片。起始细胞首先分裂形成小囊或囊泡。该囊泡中随机有一个或多个细胞分化为潘氏细胞(蓝色)。潘氏细胞分泌 Wnt 蛋白,刺激邻近细胞的干细胞自我更新并维持 Lgr5 表达(黄色);除了产生更多干细胞外,干细胞还产生能分化为全部肠道上皮细胞类型的祖细胞。(C)示意图显示潘氏细胞来源的 Wnt 信号如何帮助组织发育中的隐窝:除了使隐窝中邻近细胞保持干细胞状态的增殖外,这些信号还激活由接触细胞膜结合的 ephrin 和 Eph 蛋白介导的排斥性相互作用(第 15 章讨论)。这些相互作用导致分裂的隐窝细胞类型(表达 Wnt 诱导的 EphB)与非分裂的终末分化绒毛细胞类型(表达 ephrinB)发生分离。 在许多组织中,通过 ephrin-Eph 结合相互作用的细胞在接触时会彼此排斥(见图 15-52 或图 21-47)。(改编自 T. Sato 和 H. Clevers,《科学》340:1190-1194, 2013。经 AAAS 许可。)
图 22-4 展示了小肠隐窝中干细胞微环境的构成。我们之前了解到,产生肠道上皮所有终末分化细胞的干细胞表达细胞表面受体蛋白 Lgr5,并位于隐窝基部上方,与潘氏细胞交错分布。潘氏细胞通过两种方式协助形成干细胞微环境:它们分泌 Wnt 蛋白,在短距离内作用于干细胞以促进其自我更新;同时在其表面表达 Delta(一种信号受体 Notch 的配体),直接激活接触的干细胞上的 Notch,从而抑制细胞分化——这是侧向抑制的一个实例(见图 15-59)。
值得注意的是,单个表达 Lgr5 的干细胞嵌入无细胞的细胞外基质中,能够在培养皿中增殖并形成微小的肠道样结构——类器官,其中包含肠道组织中通常存在的所有细胞类型,包括干细胞。图 22-14 展示了这一过程,并概述了建立隐窝干细胞微环境的关键信号事件,在此微环境中产生的不同细胞类型会自组织成微型绒毛,从而形成三维类器官结构。
微环境大小可决定干细胞数量
每个肠道隐窝中,干细胞微环境由15个潘氏细胞构成,仅能容纳有限数量的干细胞。当干细胞分裂时,哪个子细胞被挤出巢穴是随机事件;这些细胞因无法获得维持干细胞特性所需的信号,注定会走向分化。在大多数研究过自我更新与分化承诺平衡问题的其他干细胞系统中,似乎也存在类似的运作机制。
秀丽隐杆线虫的生殖细胞谱系提供了一个视觉上引人注目的例子(图22-15)。在该系统中,干细胞被维持在一个
图 22-15 秀丽隐杆线虫性腺的干细胞微环境。(A)荧光显微图像显示秀丽隐杆线虫性腺部分细胞核(蓝色)。远端尖端细胞的细胞核呈红色。(B)同一组织染色显示远端尖端细胞的细胞质和突起为红色,分化后的生殖细胞为绿色。远端尖端细胞的突起跨越多个干细胞直径,通过 Notch 信号传导维持干细胞特性。那些脱离远端尖端细胞突起范围的细胞启动减数分裂,并开始分化程序,最终形成卵子或精子。(由 Judith Kimble 和 Sarah Crittenden 提供。)
由一种称为远端尖端细胞的大型体细胞形成的微环境,该细胞形成细长的细胞突起。位于远端尖端细胞表面的 Notch 配体向干细胞上的 Notch 发出信号,以维持其干细胞特性。如同在肠道隐窝中,干细胞在微环境中进行自我更新增殖,直到部分后代被推离远端尖端细胞突起的范围,结果它们开始分化。这样,处于不同分化阶段的细胞源源不断地从远端尖端细胞和干细胞处移开,仿佛在传送带上,逐步成为终末分化的生殖细胞——卵子或精子。
然而,生态位大小并非控制干细胞数量的唯一方式——不对称干细胞分裂是另一种方式,正如我们现在要讨论的。
不对称干细胞分裂可维持干细胞数量
正如先前所述,当干细胞分裂时,两个子细胞必须在保持干细胞状态与走向分化之间做出选择。这两种命运之间的平衡对组织稳态至关重要,因为过度的自我更新会导致干细胞过多,而过度分化则会耗尽干细胞库。我们刚刚讨论了干细胞生态位的大小如何帮助控制干细胞数量。不对称干细胞分裂是此类调控的另一种机制。
在不对称干细胞分裂中,分裂干细胞内部的过程导致一种或多种重要分子的偏向性遗传,从而影响两个子细胞的命运。例如,两个子细胞中可能只有一个继承了维持干细胞特性所需的细胞命运决定因子,致使另一个子细胞走向分化(图 22-16A)。每次这样的不对称干细胞分裂都会产生一个干细胞和一个定向分化的细胞;因此,无论干细胞经历多少次分裂,其数量都保持不变。而在对称干细胞分裂中,两个子细胞都继承了这类细胞命运决定因子并保持干细胞状态,从而扩大了干细胞库(图 22-16B)。
如图22-16所示,在不对称干细胞分裂前,细胞发生极化,细胞命运决定因子集中于细胞一侧。随后细胞通过调整有丝分裂纺锤体的位置来定向分裂平面,确保仅有一个子细胞继承该命运决定因子。
干细胞分裂面方向的另一种影响子代细胞命运的方式是决定它们相对于干细胞的位置。
图 22-16 不对称与对称的干细胞分裂。(A)在此示意图的不对称干细胞分裂中,维持干细胞特性的细胞命运决定因子(红色)定位于细胞一侧的皮层。细胞分裂时,仅一个子细胞继承该决定因子并保持干细胞特性,而另一个子细胞则走向分化,经过若干祖细胞分裂后(未显示)完成分化。(B)在所示的对称干细胞分裂中,两个子细胞均继承此类决定因子并保持干细胞特性。
图 22-17 果蝇睾丸中分裂的生殖系干细胞的分裂平面如何决定哪个子细胞保持与微环境的接触。(A)微环境由一群体细胞组成,生殖系干细胞围绕该微环境呈环状排列。当干细胞分裂时,其有丝分裂纺锤体垂直于微环境定向,因此只有一个子细胞保持与微环境的接触并维持干细胞特性;另一个子细胞失去与微环境细胞的接触,从而无法获得自我更新信号,进而走向分化。(B)光学显微照片显示围绕微环境的生殖系干细胞及一个正在分裂的干细胞,其有丝分裂纺锤体垂直于微环境定向。这些干细胞经过基因工程改造,可表达荧光标记的微管蛋白。(B,引自 Y.M. Yamashita 等人,《科学》301 卷,1547-1550 页,2003 年;经美国科学促进会许可使用。)
生态位,使得生态位被不对称地继承。例如,在果蝇睾丸中,生殖系干细胞将其纺锤体定向垂直于支持生态位的细胞:结果,当干细胞分裂时,一个子细胞保持附着在生态位上并采取干细胞命运,而另一个子细胞则被移离生态位,在那里它被剥夺了自我更新信号,因此承诺分化(图22-17)。
在许多对称的干细胞分裂中,子细胞独立且随机地选择它们的命运
正如我们所知,不对称干细胞分裂提供了一种直接的方式,在自我更新的成体组织中维持干细胞数量同时生成分化细胞。然而,这种方式使组织适应变化条件(如营养供应的波动或应对组织损伤)的空间极为有限。在许多自我更新的成体组织中,干细胞分裂模式会发生变化以适应这些改变的条件。类似的适应性变化也发生在组织发育过程中:例如,发育早期小鼠的神经和表皮干细胞主要通过对称分裂来扩大干细胞池,以支持快速生长的器官;然而在发育后期,这些干细胞会转向更多的不对称细胞分裂,以产生更多分化细胞(参见图22-16)。
在许多更新组织中,包括肠道上皮,干细胞采取了一种更为灵活的策略。在这些情况下,干细胞进行分裂时采取对称方式,每个子细胞独立于其姐妹细胞,自主选择是保持干细胞状态(自我更新)还是走向分化。在这种独立选择机制中,有时两个子细胞会做出相同选择,有时则做出相反选择。每个细胞的选择可能是随机的(概率性的),如同抛硬币一般,或者受到子细胞所处环境的影响(图22-18)。与不对称分裂策略相比,独立选择机制具有灵活性,允许局部和更广泛的环境因素根据需要调节概率平衡——在需要更多干细胞时(如生长或损伤修复过程中常见的情况)倾向于干细胞选项,或在分化细胞缺失时倾向于分化方向。
小鼠小肠中的谱系追踪实验显示,一些干细胞谱系会消失,而另一些则会扩张并持续存在,这与干细胞分裂产生的子细胞随机做出选择的情况相符(见图22-18)。
干细胞功能衰退导致组织老化
尽管成体干细胞具有维持组织稳态的卓越能力,但这种能力往往会随时间减弱,从而导致组织老化。以造血干细胞为例,通过连续移植实验可以证明这种衰退现象。在这些实验中,干细胞从供体小鼠移植到同一近交系经辐照处理的宿主小鼠体内。
图 22-18 干细胞分裂的两个子代如何选择命运的独立选择机制。该机制的结果比对称性干细胞分裂更具变异性。选择可能由子代所处的局部环境决定(图示左侧),也可能完全随机(图示右侧)。当每个子代随机做出选择,且各自保持干细胞状态或定向分化的概率为 50% 时,例如在第一次分裂时存在 25% 的概率两个子代都将定向分化,导致克隆最终消失。或者,在此次或后续分裂中,多数子代可能选择保持干细胞状态,形成持续存在并扩增的克隆。借助数学工具,可以基于这种随机性假设预测单个干细胞在任何给定时间产生的克隆大小概率分布。肠道及其他组织的观察结果符合这种随机独立选择策略。
供体细胞在宿主小鼠的造血系统中重新定植后(见图22-10),将宿主的造血干细胞移植到新的受辐照宿主中,这一过程反复进行。经过多轮移植后,干细胞逐渐失去在新宿主体内重建造血系统的能力,这表明干细胞随年龄发生变化,显然在多次分裂后经历了复制性细胞衰老。
为了研究造血干细胞微环境的支持功能是否也随年龄下降,将来自年轻或年老供体小鼠的造血干细胞移植到受辐照的年轻或年老宿主小鼠体内。通过比较这四类实验(年轻至年轻、年轻至年老、年老至年轻、年老至年老——图 22-19A)的结果表明,年轻干细胞
图 22-19 区分细胞自主因素与环境因素对造血干细胞功能随衰老衰退的影响的方法。(A)将年轻或年老的供体造血干细胞移植至年轻或年老的宿主体内,从而评估干细胞功能。通过四组对比可揭示干细胞自身衰老与环境或微环境衰老对干细胞功能衰退的贡献。(B)在联体共生实验中,动物通过共享循环系统相连。其中一个动物的细胞将暴露于另一个动物的全身环境中。通过比较异龄配对(年轻与年老)与同龄配对(年轻与年轻、年老与年老)中年轻或年老伴侣的细胞功能,可揭示自主干细胞衰老与循环因子或干细胞微环境在干细胞功能衰退中的作用。[基于 M.A. Goodell 与 T.A. Rando 的研究,《科学》350(6265):1199-1204, 2015, doi 10.1126/science.aab3388.]
特定微环境无法挽救老化的造血干细胞,而老化的干细胞微环境却能够支持年轻的造血干细胞,这表明微环境的变化并非导致造血功能随年龄衰退的原因,至少在老鼠中如此。
研究干细胞在衰老中功能的一种更普遍方法是异种共生,即连接两只不同年龄小鼠的循环系统——年轻与年轻、年轻与年老或年老与年老(图 22-19B)。这种三向比较提供了一种确定不同因素对干细胞功能随衰老衰退的贡献方式:干细胞本身、干细胞微环境以及血液中的循环因子。例如,有来自此类研究的证据表明,老年小鼠的循环因子可减少年轻小鼠大脑海马区的神经发生,损害其学习和记忆能力,模拟了正常小鼠大脑在衰老过程中发生的衰退。相反,其他研究发现,年轻小鼠的循环因子可以恢复老年小鼠的骨骼肌干细胞功能,并能对抗包括肝脏、胰腺、骨骼和心脏在内的组织中的年龄相关功能障碍。导致组织衰老或再生的血液成分可能包括对干细胞有直接作用的分子,而这些循环因子的鉴定是一个活跃的研究领域。
摘要
每个干细胞微环境中都存在多种细胞外信号,使得组织特异性干细胞能够在生物体整个生命周期中维持成体组织稳态。这些信号调控着干细胞自我更新的时机与位置,以及其子细胞向分化方向发展的进程。单个干细胞选择自我更新或定向分化的决策受到精密调控,以确保组织维持足够数量的干细胞并产生适量终末分化细胞。在某些情况下,通过不对称干细胞分裂——每次分裂产生一个干细胞和一个分化细胞——来实现这种平衡。而在另一些情况下,干细胞进行对称分裂,两个子细胞独立选择自我更新或定向分化,这种选择既可能是随机的,也可能是响应局部环境信号的结果。成体干细胞自我更新及产生终末分化细胞的能力随时间推移逐渐衰退,这正是导致组织衰老的重要因素。
再生与修复
正如我们所知,人体许多组织不仅能够自我更新,还具备自我修复能力,这主要归功于干细胞及其行为调控的反馈机制,以维持组织稳态。然而,这些天然修复机制存在局限性。例如,在阿尔茨海默病中,人类大脑多数区域的神经细胞死亡后无法再生。同样,心脏病发作时因缺氧死亡的心肌细胞,会被瘢痕组织替代而非新的心肌细胞。
某些动物的再生能力远超人类,能够再生整个器官,比如截肢后完整复原的肢体。在无脊椎动物中,有些物种甚至能从单个体细胞再生出身体的所有组织。这些现象燃起了希望:或许能通过人工手段诱导人类细胞实现类似的修复与再生奇迹,以替代阿尔茨海默病或帕金森病患者体内死亡的神经细胞、1 型糖尿病中缺失的分泌胰岛素的 \beta β细胞、心脏病发作时死亡的心肌细胞等等。随着我们对再生基础细胞生物学的深入了解,这些曾经只是梦想的目标正逐渐变得触手可及。
本节首先列举某些动物物种非凡的再生能力实例,以此说明理论上的可能性。接着我们将探讨如何通过利用成人组织中各类干细胞的特性,来优化人体的自然修复机制并治疗疾病。
图 22-20 地中海涡虫(Schmidtea mediterranea)。(A) 外部视图。(B) 使用三种不同抗体进行的免疫染色,揭示了内部解剖结构。(A,由 A. Sánchez Alvarado 提供;B,引自 A. Sánchez Alvarado,BMC 生物学杂志 10:88,2012 年。经作者许可。)
涡虫体内含有能够再生完整新躯体的干细胞
施密特地中海涡虫是一种小型淡水扁虫,或称真涡虫,完全成长时体长约一厘米(图22-20)。它具有表皮、肠道、大脑、一对原始眼、外周神经系统、肌肉组织以及排泄和生殖器官——这些是其他动物常见的大多数基本身体部位,尽管按照脊椎动物的标准都相对简单,并由大约20至25种不同的分化细胞类型构成。一个多世纪以来,像施密特地中海涡虫这样的真涡虫因其非凡的再生能力而令生物学家着迷:从身体几乎任何部位取下的微小组织碎片都能生长并再生出一个完整的新个体。这一特性伴随着另一种特性:当动物饥饿时,它会通过减少细胞数量而变得越来越小,同时保持基本正常的身体比例。这种行为被称为逆生长,可持续至动物体积缩小至完全体型的二十分之一。一旦获得食物,它又能重新长回完整大小。逆生长与生长的循环可以无限重复,而不会影响生存或繁殖能力。
这种行为的基础是细胞持续更新的过程。除了不分裂的分化细胞外,还存在一群被称为新生细胞的小型未分化分裂细胞。新生细胞约占体内细胞的 20% ,并广泛分布其中;通过细胞分裂,它们作为干细胞产生新的分化细胞。与此同时,分化细胞通过凋亡不断死亡,使其残骸被邻近细胞吞噬和消化(详见第 18 章)。通过这种细胞自噬,死亡细胞的成分可以被高效回收利用。无论动物处于饱食还是饥饿状态,细胞分裂与细胞死亡及自噬始终保持着动态平衡。在饥饿条件下,平衡倾向于细胞死亡和自噬;而在营养充足时,则倾向于细胞生长和分裂。
高剂量的 X 射线会中止所有细胞分裂,阻止细胞更新并破坏再生能力,导致几周后死亡。然而,通过注射一个从未受辐射供体分离出的单一新胚细胞(图 22-21),可以挽救该动物。在部分案例中,注入的细胞分裂形成克隆后代,最终重新填充整个身体,产生一个健康的再生个体,其拥有看似完整的终末分化细胞类型以及分裂中的新胚细胞。关于头尾身份的位置信息梯度由沿虫体肌肉细胞持续表达,并指导神经母细胞的适当发育。遗传标记证明,分化细胞均源自注入的单一新胚细胞,这表明至少部分新胚细胞是具有全能性的干细胞,因为它们能够分化成各种细胞类型。
图 22-21 单个体细胞再生为涡虫的过程。(A)成体中分裂细胞(新生细胞;蓝色)的分布情况。辐射会阻断所有细胞分裂并阻止再生。(B)将单个未受辐射的新生细胞注入受辐射动物体内后,该细胞能够增殖并重建所有组织。最终形成完全由该单细胞后代构成的完整个体,且具备正常再生能力。沿虫体分布的肌肉细胞持续表达关于头尾身份识别的梯度信息,并指导神经母细胞分化。(改编自 E.M. Tanaka 与 P.W. Reddien,《发育细胞》21 卷 172-185 页,2011 年。)
这些细胞能够分化形成构成扁形虫身体的所有细胞类型,包括像它们自身一样的新生细胞。
某些脊椎动物能再生完整的肢体与器官
人们或许认为,这种再生能力仅为小型、简单、原始动物所独有。然而,某些脊椎动物,尤其是鱼类和两栖类,也展现出非凡的再生能力。例如蝾螈(包括水螈和墨西哥钝口螈),不仅能再生被截肢体的全部或部分,还能再生许多其他身体部位,包括脑组织和脊髓(图22-22)。在肢体再生过程中,截肢处会形成芽基——一种类似于胚胎肢芽的小芽状结构。相邻表皮细胞的快速侧向迁移有助于封闭伤口部位。深层芽基细胞主要来源于残肢中高度增殖的活化干细胞和祖细胞。尽管这些细胞看起来相似,但它们保留着源组织的记忆及足够的位置信息,使其能够分化成适当的细胞类型,并形成具有正确图案的肢体或肢体被截部分的替代结构。这一再生过程宛如胚胎肢体发育的重演。 如同在发育的肢体中,所有必需的细胞行为都由上层表皮、向内生长的神经、增殖的谱系限制性干细胞、以及过渡扩增祖细胞及其分化细胞所产生的细胞间信号精心协调
图 22-22 蝾螈肢体再生过程。(A) 延时序列显示了肱骨中段截肢后的再生阶段。该序列涵盖了伤口愈合、残端干细胞与祖细胞在芽基形成过程中的激活增殖,以及各类肢体细胞分化的全过程。(B) 早期芽基示意图。(A 图由 Susan Bryant 和 David Gardiner 提供。)
后代细胞。其中涉及的大多数信号通路与肢体发育过程中使用的通路相同,包括由 Hedgehog、Wnt 和 FGF 家族成员激活的通路。
为何蝾螈能再生如此多的身体部位而哺乳动物却不能,这仍是一个深奥的未解之谜。
干细胞可临床用于替代缺失的造血细胞或皮肤细胞
在本章前面部分,我们了解到可以通过对小鼠进行辐射以清除其造血干细胞和祖细胞,随后通过输注新的干细胞来挽救其生命,这些干细胞会重新填充骨髓并恢复血细胞生成(见图22-10)。同样地,患有某些类型白血病或淋巴瘤的人类个体,在接受辐射或化学治疗以摧毁癌细胞及剩余造血组织后,可通过输注健康的非癌变造血干细胞获得救治。在理想情况下,可以在清除患者自身造血组织前,从其样本中分选出干细胞;治疗后再将这些干细胞回输,从而避免免疫排斥问题。
干细胞应用的另一个例子是修复大面积烧伤后的皮肤。通过培养烧伤患者未受损区域的细胞,经过漫长而复杂的程序,可以生成足够数量的表皮干细胞,以重新覆盖受损的体表。
神经干细胞可在培养环境中进行操作,并用于重建病变的中枢神经系统
脊椎动物的中枢神经系统(CNS)是体内最复杂的组织,与表皮组织截然相反。然而,鱼类和两栖动物在被切除部分大脑、脊髓和眼睛后能够再生这些器官的大部分。但在成年哺乳动物中,这些组织的自我修复能力极为有限,能够生成新神经元的干细胞难以寻觅——如此难以发现,以至于多年来人们认为它们根本不存在。
不过我们现在知道,能够生成神经元、胶质细胞或两者兼有的神经干细胞确实存在于成年哺乳动物大脑的某些区域,如图 22-23 所示,这些干细胞可生成小鼠嗅球中的神经元。在成年小鼠和人类大脑中,海马体(一个专门负责学习和记忆的区域)的神经元也在持续更新。在这里,成年大脑功能的可塑性与特定神经元亚群的更替相关:这类神经元每天约产生 1400 个新细胞,相当于每年约 0#的细胞更新率。
在某些鸣禽的大脑中观察到更为显著的神经元更替现象。这些鸟类每年会有大量神经元死亡,并被新生神经元替代,这一过程是鸟类为每个新繁殖季节完善其鸣唱技巧的重要组成部分。
脑神经干细胞可在培养环境中进行研究。例如,从成年或胎儿哺乳动物大脑的自我更新区域提取组织碎片,经解离后在特定条件下培养,会形成悬浮的"神经球"——由神经干细胞及其神经元与胶质细胞后代混合组成的细胞团。这些神经球可传代培养多代,其细胞可随时提取并植入完整动物的大脑,在那里它们将分化为成熟的神经元和胶质细胞。
通过略微调整培养条件,在培养基中添加恰当的生长因子组合,神经干细胞可在培养皿中以分散细胞形式生长,并被诱导增殖为几乎纯净的干细胞群体,而不伴随分化子代细胞。进一步改变培养条件后,这些细胞可随时被诱导分化形成
图 22-23 成年小鼠大脑中神经元的持续生成。从上方观察大脑剖面图,显示前脑室管膜区域——神经干细胞的聚集地。这些细胞持续产生迁移至嗅球的子代细胞,并在该处最终分化为神经元。嗅球内神经元的持续更新机制,可能与鼻腔嗅上皮向嗅球投射的嗅觉受体神经元的更新存在某种关联。在成年小鼠和人类中,海马体(未显示)同样存在持续的神经元更替现象,该区域专门负责学习与记忆功能。(改编自 B. Barres, Cell 97:667-670, 1999。)
根据培养基的成分,可能是神经元和胶质细胞的混合物(图22-24),或者仅仅是这两类细胞中的一种。
根据培养基的成分,可能是神经元和胶质细胞的混合物(图22-24),或者仅仅是这两类细胞中的一种。神经干细胞,无论是通过上述方法获得还是来自本章最后一节描述的多能干细胞,都可以移植到成年大脑中。一旦移植,它们展现出非凡的能力,能够调整自身行为以适应新的位置。例如,来自小鼠海马体的干细胞,当植入小鼠嗅球前体细胞的迁移路径时(见图22-23),会产生神经元,这些神经元能够正确融入嗅球。神经干细胞及其后代在动物体内适应新环境的能力,为中枢神经系统疾病或损伤的治疗提供了应用前景。
摘要
动物的再生能力各不相同。极端情况下,涡虫扁形动物拥有支持所有细胞类型持续更新的干细胞(成体干细胞),几乎任何微小身体碎片甚至单个成体干细胞都能再生出完整的虫体。蝾螈能在截肢后再生四肢及其他大型身体部位,但再生细胞仍受来源限制:再生组织中的肌肉细胞源自肌肉组织,表皮细胞源自表皮组织,以此类推。哺乳动物的再生能力较为有限。然而,通过利用干细胞生物学,我们正逐渐突破伤口愈合的自然限制。神经系统特定区域含有终身维持神经元生成的干细胞。这些神经干细胞可从原位或胎儿大脑中获取,经体外培养后移植至大脑其他区域,能够生成适应新位置的神经元。
细胞重编程与多能干细胞
当细胞从哺乳动物体内的一个位置移植到另一个位置,或是从体内取出并在培养中维持时,它们大体上仍忠于其起源。每种特化细胞都对其发育历程有所记忆,似乎命运已定。虽然确实会发生一些有限的转变,并且正如我们所知,某些干细胞能够生成多种分化的细胞类型,但可能性是受限的。每种成体干细胞都服务于特定类型组织的更新,而成体中自我更新的干细胞到分化细胞的整个模式惊人地稳定。在基础分子层面上,这些细胞类型和细胞状态之间的稳定差异的本质是什么?是否存在方法可以超越这些限制?
图 22-24 神经干细胞。图示从胎儿脑组织或胚胎干细胞出发,经由神经球(A)阶段,最终获得纯化的神经干细胞培养物(B)的步骤。这些干细胞既可无限增殖维持原态,也可通过培养基调整诱导其分化(C)为神经元(红色)和胶质细胞(绿色)。具有相同特性的神经干细胞亦可通过类似步骤从胚胎干细胞(ES)或诱导多能干细胞(iPS)中获取(本章后续将展开讨论)。(显微照片源自 L. Conti 等人,《PLoS 生物学》3:e283, 2008。经作者授权使用。)
细胞记忆机制如何运作?又是什么力量促使细胞从一种状态彻底转变为另一种截然不同的状态?
我们已在第七章从宏观角度探讨过这些根本性问题。此处我们将结合干细胞生物学领域进行更深入的分析——该领域近年来在细胞分化状态认知与操控方面取得了革命性突破。随着研究的深入,这些进展必将为医学应用开辟重要途径。
细胞核通过移植至异源细胞质可实现重编程
若无法通过改变环境来转换特化细胞的基本特性,我们能否以更直接且彻底的方式干预其内部机制来实现这一目标?一种极端的方法是将细胞核移植至另一种大型细胞的细胞质中。倘若决定并维持特定细胞类型的因子存在于细胞质内,那么被移植的细胞核应当会转变其基因表达模式,以与宿主细胞保持一致。在第七章中,我们描述了一项利用非洲爪蟾进行的著名实验。该实验中,分化细胞的细胞核(取自蝌蚪肠壁细胞)被用于替换卵母细胞的细胞核(一种停滞在第一次减数分裂前期的卵细胞前体,处于受精准备状态)。在部分案例中,由此形成的杂交细胞最终发育成了完全正常的青蛙(参见图 7-2A)。 这成为了发育生物学核心原理的关键证据:细胞核,即便是已分化细胞的核,也包含完整的基因组,能够支持生物体所有正常细胞类型的发育。同时,该实验表明细胞质因子确实能重编程细胞核:卵母细胞质能将肠道细胞核逆转为早期胚胎状态,使其随后逐步经历基因表达的变化模式,最终发育成完整的成年生物体。
然而,整个故事并非如此简单。首先,这类实验中的重编程并不完美。例如,当移植的细胞核取自肠道细胞时,即使在最终动物的肌肉细胞中,也发现通常仅肠道特有的基因持续表达。其次,实验仅在有限比例的情况下成功,且成功率随着供体动物成熟度的增加而越来越低:若细胞核来自成年青蛙的分化细胞,则需进行大量移植才能获得一次成功。
核移植同样可在哺乳动物中进行,并产生基本相似的结果。例如,从成年绵羊乳腺中取出的分化细胞核移植到去核的绵羊卵细胞中,能够支持发育出一只外观正常的绵羊——即著名的多利。同样,成功率很低:需要进行多次移植才能获得这样一个个体。
移植核的重编程涉及染色质的剧烈变化
在一个典型的完全分化细胞中,似乎存在维持基因表达模式的机制,这些机制不易被细胞质因子所覆盖。一个明显的可能性是,成年细胞中基因表达模式的稳定性可能至少部分依赖于染色质的自我延续性修饰,正如第四章所讨论的(见图 4-44)。如第七章所述,哺乳动物中的 X 染色体失活现象为此类表观遗传控制提供了一个清晰的例证。每个雌性细胞中存在两条 X 染色体,暴露于相同的化学环境,但一条保持活跃,另一条则以凝聚的失活状态代代相传;细胞质因子无法解释这种差异,这必然反映了
个体染色体固有的机制。在基因组的其他区域,染色质层面的调控也与其他形式的调节相结合,共同控制每个基因的表达。基因可以被完全关闭,或持续开启,或保持在一种不稳定状态,以便根据环境变化迅速开启或关闭。
移植到卵母细胞中的细胞核重编程过程涉及染色质的显著变化。细胞核膨胀,体积增大 50 倍,染色体随之解凝;DNA 和组蛋白的甲基化模式发生全面改变;连接组蛋白 H1(连接相邻核小体的组蛋白)被卵母细胞和早期胚胎特有的变异形式所取代,而原有的组蛋白 H3 类型在许多位点也被独特的异构体替换。显然,卵细胞含有能够重置细胞核染色质状态的因子,清除染色质上旧的组蛋白修饰并施加新的修饰。通过这种方式重编程后,基因组再次具备启动胚胎发育并产生全系列分化细胞类型的能力。
胚胎干细胞(ES 细胞)能生成身体的任何部分
受精卵,或通过核移植产生的等效细胞,是一种非凡的存在:它能孕育出一个全新的多细胞个体,这意味着它能分化出每一种正常的特化细胞类型,甚至包括用于繁衍下一代的卵子或精子细胞。处于这种状态的细胞被称为全能细胞;而能产生大多数细胞类型但非全部者,则称为多能细胞。然而,这样的全能或多能细胞并非干细胞,因为它们不具备自我更新能力,而是致力于逐步分化的程序。若将其作为研究和利用多能细胞的唯一起点,这项工作将需要持续供应新鲜的受精卵或进行新的核移植操作——这对实验动物的研究而言颇为不便,对人类实际应用更是不可接受。
然而,大自然在此处对科学家们展现出了意想不到的慷慨。我们能够提取处于囊胚阶段的小鼠早期胚胎,通过细胞培养技术从中获得一类名为胚胎干细胞(ES 细胞)的干细胞。这些 ES 细胞源自早期胚胎的内细胞团(即形成胚胎主体而非胚外结构的细胞群),它们具有非凡特性:在适宜的培养条件下,这些细胞不仅能无限增殖,还能保持不受限制的发育潜能。其唯一局限在于无法形成胎盘等胚外组织。因此,它们被归类为多能性干细胞而非全能性干细胞。但这只是微小限制——若将 ES 细胞重新植入囊胚,它们会融入胚胎并分化成体内所有组织和细胞类型,完美整合到所处位置,呈现出正常细胞在该部位应有的特性与行为(图 22-25)。 它们甚至能产生生殖细胞,从而繁衍出新一代动物。
图 22-25 ES 细胞的生产与多能性。ES 细胞源自早期胚胎的内细胞团(ICM)。将 ICM 细胞转移至含有适宜培养基的培养皿中,在此它们转化为 ES 细胞,并能在未分化状态下无限增殖。这些 ES 细胞可在任何时间点——如经基因操作后——被注射回发育中的囊胚。在囊胚内,它们融入内细胞团,参与形成结构良好的嵌合体动物,该动物由普通细胞与 ES 源细胞混合构成。ES 源细胞能分化为体内任何细胞类型,包括生殖细胞,由此可培育出不再呈嵌合特征的新一代小鼠,其所有细胞均继承了一半来自培养 ES 细胞系的基因。
胚胎干细胞使我们能够在细胞培养与完整有机体之间架起桥梁:在细胞培养中,我们可以运用强大的基因转化与筛选技术;而在完整有机体中,我们能探索这些基因操作如何影响发育与生理过程。因此,胚胎干细胞为哺乳动物高效基因工程开辟了道路,引发了对哺乳动物分子与发育生物学认知的革命。
具有类似小鼠胚胎干细胞特性的细胞,不仅可从早期人类胚胎和人类胎儿生殖细胞中获取,甚至——正如我们稍后将阐述的——还能从成年哺乳动物组织中的已分化细胞中衍生出来。通过这种方式,人们可以获得潜在取之不竭的多能细胞供应。通过在培养过程中精心选择培养条件,这些细胞能够被操控产生大量几乎任何类型的分化细胞,从而为众多实际应用铺平道路。但在探讨这些应用之前,我们需先理解其背后的生物学基础。
一组核心转录调控因子界定并维持着胚胎干细胞状态
是什么赋予了胚胎干细胞及相关类型的多能干细胞其非凡的发育潜能?它们又能告诉我们哪些关于干细胞特性、分化承诺以及分化状态稳定性的基本机制?
对于某些胚胎干细胞(ES 细胞)特性而言,答案十分明确。例如,ES 细胞的一个核心特征在于必须规避复制性细胞衰老。如第 17 章所述,这恰恰是成纤维细胞及多种增殖性体细胞的宿命:这类细胞的分裂次数存在上限,至少部分归因于其缺乏端粒酶活性,导致端粒随着每次分裂周期逐渐缩短,最终引发永久性细胞周期停滞。相比之下,ES 细胞表达高水平活性端粒酶,使其能够逃避复制性细胞衰老,实现无限增殖。这一特性与其他发育受限型干细胞(如成年肠道干细胞)共有,后者同样能持续进行数百至数千次细胞周期分裂。
更深层次的问题在于解释胚胎干细胞(ES 细胞)中整个复杂的基因表达模式是如何被组织和维持的。作为第一步,可以寻找在 ES 细胞或早期胚胎中相应多能细胞中特异性表达的基因。这种方法识别出相对较少的候选 ES 关键基因;也就是说,这些基因似乎以某种方式对 ES 细胞的独特特性至关重要。例如,一个名为 Oct4 的基因仅在 ES 细胞及完整生物体中相关类别的细胞中特异性表达——具体而言,在生殖细胞谱系以及内细胞团及其前体细胞中。Oct4 编码一种转录调节因子。当它从 ES 细胞中缺失时,这些细胞会失去其 ES 细胞特性;而当它在胚胎中缺失时,本应分化为内细胞团的细胞会转向胚外分化途径,导致胚胎发育中止。
成纤维细胞可通过重编程产生诱导多能干细胞(iPS 细胞)
在第七章中,我们了解到,如果人工表达主肌肉特异性转录调节因子 MyoD,成纤维细胞及其他某些细胞类型可被诱导改变特性并分化为肌肉细胞。那么,是否可以通过强制表达如 Oct4 等对胚胎干细胞(ES 细胞)至关重要的基因,采用相同技术将成纤维细胞及其他细胞类型转化为 ES 细胞呢?为解决这一问题,研究人员用携带预期能产生此类效果的基因的逆转录病毒载体转染小鼠成纤维细胞。通过这种方式共测试了 24 个候选的 ES 细胞关键基因。单独使用任一基因均无法实现转化,但特定组合下它们能够做到。2006 年,首批突破性实验将所需基因精简至核心的四个。
基因,它们全部编码转录调节因子——Oct4、Sox2、Klf4 和 Myc,简称 OSKM 因子。当这些因子共同表达时,能够重编程小鼠成纤维细胞,永久性地将其转变为与胚胎干细胞(ES 细胞)极为相似的细胞(图 22-26)。通过这种方式产生的类 ES 细胞被称为诱导多能干细胞,或 iPS 细胞。与 ES 细胞一样,iPS 细胞能在培养中无限分裂,并且当被植入小鼠囊胚时,它们能参与形成一个结构完整的嵌合体动物。在此动物体内,它们能促进任何组织的发育,并能转化为任何分化的细胞类型,包括功能性生殖细胞,从而培育出新一代小鼠(参见图 22-25)。
iPS 细胞现已可从成人体细胞中获取,包括除成纤维细胞外的多种分化细胞类型。多种方法可用于驱动转化因子 OSKM 的表达,其中包括在重编程细胞中不留外源 DNA 痕迹的技术。原始转录调控因子组合的变体可推动转化过程,不同特化细胞类型对此有略微不同的需求。例如,虽然 Myc 的过表达能提高过程效率,但事实证明并非绝对必要。且分化细胞类型可能在其正常表型中已表达部分所需因子。例如,毛囊中的某些细胞已表达 Sox2、Klf4 和 Myc;要将它们转化为 iPS 细胞,只需人工强制其表达 Oct4 即可。
重编程涉及基因控制系统的重大变革
将分化细胞转化为 iPS 细胞,并非如同启动某个可预测、精密设计的机械开关那般简单。在接受 OSKM 因子的细胞中,仅有极少数能真正转变为 iPS 细胞——在最初实验中成功率仅为数千分之一,即便采用更先进的技术改进后,成功者仍属凤毛麟角。实际上,原始实验的成功依赖于巧妙的筛选策略,以精准识别那些发生转化的稀有细胞(图 22-27)。
通过 OSKM 因子转化为 iPS 状态不仅效率低下且过程缓慢:成纤维细胞从引入转化因子到开始表达 iPS 细胞特征性标志物需要 10 天或更长时间。这表明该转化过程涉及一系列漫长的级联变化。这些变化已被广泛研究,它们既影响单个基因的表达,也影响染色质的状态。时间进程如图 22-28 所示。该过程始于 Myc 诱导的细胞增殖和染色质结构松弛,这促进了其他三种转录调节因子与基因组中数百个不同位点的结合。在这些位点中的大部分,Oct4、Sox2 和 Klf4 会协同结合。结合位点包括内源性 Oct4、Sox2 和 Klf4 基因本身,最终形成如前所述的正反馈循环,使这些基因的表达自我维持(见图 22-26)。但自我诱导
图 22-26 使用 OSKM 因子将成纤维细胞重编程为 iPS 细胞
如图所示,转录调控蛋白 Oct4、Sox2 和 Klf4(OSK 因子)会诱导自身及彼此间的合成(灰色阴影标注)。这形成了一个自我维持的反馈回路,有助于将细胞维持在类胚胎干细胞状态,即使在所有实验添加的 OSKM 起始因子被移除后仍能持续。Myc 过表达通过所示机制加速重编程过程的早期阶段(参见图 17-59)。稳定的重编程还涉及 Nanog 基因的永久性诱导表达,该基因编码另一种转录调控因子(参见图 7-10)。(改编自 J. Kim 等人,《细胞》132 卷:1049-1061 页,2008 年)
该实验利用了一个在所有细胞中都存在但通常仅在胚胎干细胞(ES)和早期胚胎细胞中表达的基因(Fbx15),尽管这些细胞并不依赖该基因存活。G418 是一种氨基糖苷类抗生素,能阻断细菌和真核细胞中的蛋白质合成。研究人员对一种成纤维细胞系进行基因改造,使其携带一个受 Fbx15 调控序列控制的基因,该基因能产生降解 G418 的酶。当人工表达 OSKM 因子于该细胞系时,一小部分细胞会发生状态转变并激活 Fbx15 调控序列,从而启动抗 G418 基因的表达。将 G418 加入培养基后,唯有这些细胞能够存活并增殖。经检测,这些细胞表现出诱导多能干细胞(iPS 细胞)的特性。
图 22-28 成纤维细胞重编程为 iPS 细胞过程中伴随的主要事件概览。OSKM 因子表达会引发持续数天至数周的一系列变化。重编程始于体细胞标志物的下调表达。随后出现间质-上皮转化的形态学特征(参见第 1197 页),该过程部分由细胞黏附与信号蛋白表达变化驱动。早期多能性标志物被诱导后,Nanog 和 Oct4 等多能性基因开始表达。与此同时,随着端粒酶被激活及细胞周期基因的调控,细胞获得永生特性,从而实现干细胞自我更新。当细胞激活内源性多能性基因并不再依赖 OSKM 因子时,稳定的重编程便在此时段完成。值得注意的是,绝大多数表达 OSKM 因子的成纤维细胞未能下调体细胞标志物并激活多能性基因,因此未能转化为 iPS 细胞。(改编自 M. Stadtfeld 等人,《细胞·干细胞》2:230-240, 2008,经爱思唯尔授权使用。)
Oct4、Sox2 和 Klf4 的作用仅是细胞转化过程中的一小部分。这三个核心因子激活部分靶基因并抑制其他基因,产生级联效应,从全局到各个层面重组基因调控系统,改变组蛋白修饰模式、DNA 甲基化状态和染色质压缩程度,以及无数蛋白质和非编码 RNA 的表达。在这一复杂过程结束时,最终形成的 iPS 细胞不再依赖于引发变化的 OSKM 人工因子:它已进入稳定、自我维持的协同基因表达状态,能够通过自身内源基因副本自主产生 OSKM 因子(以及多能干细胞所需的所有其他关键成分)。
通过实验性调控染色质修饰因子可提升重编程效率
早期 iPS 细胞研究中效率低下与转化缓慢的现象表明,这些实验存在阻碍分化状态向 iPS 状态转变的屏障,而克服这些屏障可能是一个艰难且很大程度上依赖偶然性的过程。这或许有助于解释为何实验结果往往多变,即便初始分化细胞在基因型和表型上完全一致,所产生的各 iPS 细胞系间仍存在显著差异。只有部分候选 iPS 细胞系能通过所有多能性测试。此外,在分子层面上,即使经过全面验证的 iPS 细胞系之间也存在差异:尽管它们共享许多特征,但在基因表达模式的细节上——例如 DNA 甲基化模式——仍有所不同。
克服这些困难对于提升我们对多细胞生物中细胞特化如何被控制和组织的理解至关重要;它也将促进许多医学进步。因此,针对重编程过程正在进行深入研究。其中一种方法旨在更清晰地揭示染色质结构在真核生物基因调控中所扮演的角色。
通过对核移植的讨论,我们可以预期,任何分化细胞的重编程都需要对特定基因相关的染色质结构进行根本而广泛的改变。不仅观察到了这些变化,大量实验还表明,通过改变影响染色质结构的蛋白质活性,可以显著提高重编程过程的效率。图 22-29 分类列举了某些经调控后可增强成纤维细胞向 iPS 细胞转化的因子;其中前三行所列的染色质重塑因子、组蛋白修饰因子及组蛋白变体,尤其以对染色质中核小体组织产生深远影响而著称(第四章已作讨论)。
图22-29 已观察到可提升重编程效率的因素。此处重点强调那些能够改变染色质状态的因素,其中前三行所列因素具有最直接的影响。上箭头表示当指定因子的活性增强时重编程效率提高;下箭头表示当指定因子的活性降低时重编程效率提高。例如,组蛋白乙酰转移酶活性增强与组蛋白去乙酰化酶活性增强会产生相反效果,这与其生化活性预期一致(参见第206页)。需注意组蛋白伴侣同样影响编程效率,其作用可能是正向或负向的,具体取决于组装入染色质的组蛋白变体类型。
胚胎干细胞与诱导多能干细胞可被引导生成特定成体细胞类型甚至类器官
我们可以将胚胎发育视为细胞在从受精卵到终末分化的道路上所面临的一系列选择。即便在培养环境中经历了漫长的停留,胚胎干细胞(ES 细胞)或诱导多能干细胞(iPS 细胞)及其后代仍能识别发育路径中每个分支的信号,并作出与正常早期胚胎细胞相同的反应。然而,若将 ES 或 iPS 细胞直接植入发育后期胚胎或成体组织中,它们无法接收到正确的信号序列;其分化过程便会失控,往往形成称为畸胎瘤的肿瘤,其中包含与植入部位不相符的多种细胞类型(图 22-30)。
通过在培养过程中将 ES 或 iPS 细胞暴露于适当序列的生长因子及其他信号蛋白,并精确控制递送时机,可以引导这些细胞沿着近似正常发育路径的方向分化,最终转化为标准化的、已分化的成体细胞类型(图 22-31 及视频 22.2)。这一过程虽需反复试验,但目前已成功实现多种小鼠和人类分化细胞类型的转化,包括人类多巴胺能神经元及胰岛素分泌 \beta 细胞——这两种细胞分别缺失于帕金森病与 1 型糖尿病患者体内。
值得注意的是,在适宜条件下,小鼠或人类的 ES 细胞、iPS 细胞及其后代能够在培养体系中增殖、分化并自组装形成微型三维器官,即类器官,其组织结构与真实器官高度相似。图 22-32 展示了一个早期惊人案例:人类 ES 细胞成功发育出眼类器官结构。
小鼠和人类的胚胎干细胞(ES)及诱导多能干细胞(iPS),以及由它们衍生的祖细胞,已被用于形成模拟多种发育器官的类器官,其中包括人类大脑的重要部分——这可以说是地球上最复杂精密的构造。这类类器官为研究器官发育提供了强大的培养皿模型,使人们能够识别和研究相关基因,并以在完整生物体中无法实现的方式探索细胞间相互作用的作用。我们之前讨论过一个显著的例证:单个多能肠道干细胞在适当的培养条件下能够形成复杂的肠道类器官(见图 22-14)。
一种特化类型的细胞可被强制直接转分化成另一种类型
我们刚刚描述的路径,即通过转化为 iPS 细胞从一种分化细胞转变为另一种分化细胞,似乎绕了不必要的弯路。我们能否直接将分化细胞类型 A 转化为分化细胞类型 B,而无需回溯到多能干细胞?多年来,已知在少数特殊情况下可以实现这种转分化,
图 22-30 畸胎瘤。这些肿瘤包含来自每个胚胎胚层(内胚层、中胚层和外胚层,包括此处可见的毛发和牙齿)的组织。这些肿瘤通常是良性的,当将 ES 或 iPS 细胞注射到免疫相容的成年动物体内时可能形成,这证明了这些干细胞的多能性。(由曹宣促提供。)
图 22-31 小鼠或人类 ES 或 iPS 细胞在培养中分化为特定细胞的过程。ES 和 iPS 细胞以单层贴壁培养时可无限保持多能性。若将其解离并形成称为拟胚体的聚集体,则会启动细胞特化进程。通过在不同因子添加的培养基中培养拟胚体细胞,可引导其向多种方向分化。值得注意的是,与小鼠相比,从人多能干细胞获得分化细胞所需时间显著延长,这反映了人类发育速率远慢于小鼠。(基于 B. Fuchs 和 J.A. Segre 发表于《细胞》100:143-155, 2000 的研究。)
例如通过强制表达 MyoD 可将成纤维细胞转化为骨骼肌细胞(参见第 428 页)。但如今,随着对 ES 和 iPS 细胞研究的深入,已发现更多实现此类转化的方法,包括将成纤维细胞转化为神经元、肝细胞和肠上皮细胞等广泛类型。
一个具有特殊医学意义的优雅例子来自心脏研究。通过强制表达适当的转录因子组合
图 22-32 培养的人类胚胎干细胞可形成三维类器官。(A)示意图显示,在适当条件下,小鼠或人类多能干细胞及其培养后代能够增殖、分化并自组装成三维眼状结构(视杯),该结构包含多层视网膜,其组织结构与正常眼发育过程中体内形成的视网膜相似。(B)人类胚胎干细胞在培养中形成的视杯荧光显微图像。该结构包含发育中的视网膜(绿色染色),具有多层神经细胞,以及下方的色素上皮层(顶端表面红色染色)。所有细胞核均呈蓝色染色。(A 图改编自 M. Eiraku 和 Y. Sasai,《当前神经生物学观点》22:768-777, 2012;B 图来自 T. Nakano 等,《细胞干细胞》10:771-785, 2012。经爱思唯尔许可使用。)
调控因子——并非 Oct4、Sox2、Klf4 和 Myc,而是 Gata4、Mef2c 与 Tbx5——能够直接将心脏成纤维细胞转化为心肌细胞。这一过程已在活体小鼠中通过逆转录病毒载体实现,当携带转基因的载体直接注入心肌组织时,转化效率极高。尽管成纤维细胞仅占心脏组织体积的一小部分,但在正常心脏中其数量超过心肌细胞,且在心肌细胞已死亡的区域大量存活。因此,在典型的非致命性心脏病发作中,当心肌细胞因缺氧死亡时,成纤维细胞会增殖并产生胶原性细胞外基质,用纤维瘢痕替代失去的肌肉组织。这是一种效果欠佳的修复方式。 通过强制心脏中适当因子的表达,如上所述,已证明至少在老鼠身上,能够超越自然,通过心脏成纤维细胞的转分化再生失去的心肌。虽然将这项技术应用于人类心脏病治疗仍前路漫长,但它揭示了未来可能的前景——不仅针对这一医学难题,还包括许多其他疾病。
尽管将这项技术应用于人类心脏病治疗仍前路漫长,但它揭示了未来可能的前景——不仅针对这一医学难题,还包括许多其他疾病。
ES 和 iPS 细胞在药物发现和疾病分析中也大有可为
围绕 ES 和 iPS 细胞以及转分化技术的大部分兴奋点,源于利用人工生成细胞进行组织修复的前景。这开始让人觉得,几乎任何类型的组织都可能被替换,从而治疗以往除器官移植外无法治愈的退行性疾病。该领域的研究进展迅速,但仍有许多困难需要克服。
随着 iPS 细胞和直接转分化技术的出现,至少在理论上,器官移植面临的一个主要障碍——免疫排斥问题——已被克服。胚胎干细胞(ES 细胞)由于通常来源于无关捐赠者的早期胚胎,其基因永远不会与接受细胞移植者的细胞完全一致。因此,移植的细胞及其后代容易遭受免疫系统的排斥。相比之下,iPS 细胞和转分化细胞都可以从个体自身组织的小样本中生成,当移植回同一个体时,理应能避免免疫攻击。
然而,通过细胞和类器官移植进行组织修复并非胚胎干细胞、诱导多能干细胞及转分化细胞的唯一应用领域:还存在其他更具即时价值的方法。特别值得一提的是,这些细胞可用于在培养中生成大量、同质化的任意选定类型的特化细胞群体,这些细胞既能用于疾病机制的研究,也能用于寻找针对特定细胞缺陷的新药物(图22-33)。
当疾病由遗传因素引起时,可以从患者体内提取诱导多能干细胞(iPS 细胞),利用这些细胞产生功能异常的特异性细胞类型,以此研究功能障碍的发生机制,并筛选可能有助于纠正该状况的药物。蒂莫西综合征便是一个例证。这种罕见遗传病因特定类型 \mathrm{Ca^{2 + }} 通道的基因突变导致危及生命的心律严重紊乱(以及其他多种异常)。为探究其病理机制,研究人员从患者皮肤成纤维细胞中培育出 iPS 细胞,并诱导其分化为心肌细胞。与正常对照组以相同方式制备的心肌细胞相比,这些细胞表现出不规则的心肌收缩以及可被详细表征的 \mathrm{Ca^{2 + }} 内流和电活动异常模式。基于这些发现,开发体外检测方法以筛选可能纠正心肌细胞异常行为的药物仅剩一步之遥。
即使在病因不明的遗传性疾病中,诱导多能干细胞(iPS 细胞)也有助于理解病情。例如,脑类器官的研究就展示了其应用价值。
图 22-33 iPS 细胞在药物发现及遗传性疾病分析与治疗中的应用。图表左侧展示了如何利用遗传性疾病患者来源的 iPS 细胞生成分化细胞,进而分析疾病机制并发现治疗药物。右侧则说明了如何在 iPS 细胞中修复基因缺陷,随后诱导其定向分化并安全移植回个体体内,避免免疫排斥风险。(改编自 D.A. Robinton 和 G.Q. Daley,《自然》481:295-305,经 SNCSC 许可转载)
利用来自患有小头畸形个体的 iPS 细胞生成,该病症以大脑生长和发育严重受阻为特征。对这些发育中的大脑类器官的仔细分析显示,此例小头畸形似乎是由于大脑祖细胞增殖与分化过早停止所致,导致分化出的大脑细胞数量异常稀少。
摘要
在成年哺乳动物体内,各种类型的组织特异性干细胞高度特化,每种仅能产生有限范围的分化细胞类型。细胞在胚胎发育过程中被限定于特定的分化路径。一种强制回归多能或全能状态的方法是通过核移植:将分化细胞的细胞核注入去核卵母细胞中,其细胞质能将注入细胞核的基因组重编程至近似早期胚胎状态。这使得被注入的卵母细胞能够发育成一个完整的新个体。基因组回归此状态涉及染色质结构和 DNA 甲基化在基因组范围内的根本性改变。
值得注意的是,从早期哺乳动物胚胎内细胞团提取的细胞能够在培养中无限期保持多能性状态。当将这些胚胎干细胞(ES 细胞)移植回宿主早期胚胎时,它们能够分化成任何组织类型的细胞,包括生殖系。ES 细胞在小鼠遗传工程领域具有不可估量的价值。通过强制表达关键转录调控因子组合,可以从成体分化细胞(如成纤维细胞)中培育出具有相似特性的诱导多能干细胞(iPS 细胞)。类似方法还可用于直接将已分化的成体细胞从一种特化类型重编程为另一种类型。理论上,从成人个体细胞培育出的 iPS 细胞可用于该个体自身的组织修复,从而避免免疫排斥问题。更直接地,iPS 细胞提供了特化细胞的来源,可用于体外分析影响人类细胞的突变效应,并筛选治疗遗传性疾病的药物。 胚胎干细胞(ES)和诱导多能干细胞(iPS)及其后代均能在培养中形成微小器官(类器官),这为人类发育与疾病研究提供了强有力的模型。
问题
哪些陈述是正确的?请解释原因。
22-1 在小鼠小肠中,隐窝内的干细胞通过不对称分裂来维持构成隐窝和绒毛的细胞群体;每次分裂后,一个子细胞保持为干细胞,另一个则开始快速分裂以产生分化的后代。
22-2 所有组织中的干细胞都是相同的。
22-3 每个能够再生的组织都是由特定于该组织的干细胞群体进行更新的。
22-4 尽管小鼠会持续更换其嗅球中的神经元,鸣禽为每个交配季节优化歌声时会替换大量神经元,但人类不具备更换大脑中神经元的能力。
讨论以下问题。
22-5 在 20 世纪 50 年代,科学家们给大鼠喂食 \mathrm{^3H} -胸苷,以标记正在合成 DNA 的细胞,并随后追踪标记细胞长达一年的命运。他们在不同组织中发现了三种细胞标记模式。某些组织如中枢神经系统和视网膜的神经元细胞未被标记。相比之下,肌肉、肾脏和肝脏各自显示出少量保留标记的细胞,这些细胞显然未进一步分裂或丢失。最后,诸如舌头和食道的鳞状上皮细胞中有相当数量的细胞被标记,12 小时内可见放射性核对;然而,标记细胞随时间推移而消失。如果标记细胞是由干细胞产生的,您预计会看到这三种标记模式中的哪一种?请解释您的答案。
22-6 在任何特定时间,小鼠的单个肠隐窝大约包含 15 个干细胞和 10 个潘氏细胞。细胞分裂大约每天发生一次,分裂后的子细胞只有在保持与潘氏细胞接触的情况下才能维持干细胞特性。这种对潘氏细胞接触的持续竞争提出了隐窝可能随时间推移变成单克隆的可能性;也就是说,某一时间点的隐窝细胞可能仅源自早期存在的 15 个干细胞中的一个。为了验证这种可能性,研究人员使用所谓的"彩点标记",该标记在激活后会在隐窝干细胞中表达三种荧光蛋白之一。随后通过观察不同时期的隐窝,检测其是否包含多种颜色或仅单一颜色的细胞(图 Q22-1)。隐窝是否会随时间变成单克隆?如何判断?
22-7 胰腺中新 \beta 细胞的起源——是来自干细胞还是已有的 \beta 细胞——直到最近才通过谱系追踪技术得以解决。研究人员设计了转基因小鼠,使其在胰岛素启动子(仅活跃于 \beta 细胞)控制下表达他莫昔芬激活型 Cre 重组酶。通过这些小鼠,科学家能通过添加他莫昔芬移除 DNA 的抑制片段,从而表达可用组织化学染色检测的人胎盘碱性磷酸酶(HPAP)。在一次性给予他莫昔芬使幼鼠中约 30% 的 \beta 细胞转化为表达 HPAP 的细胞后,研究人员追踪了标记 \beta 细胞占比一年,期间胰腺中 \beta 细胞总数增长了 6.5 倍。若新 \beta 细胞源自干细胞,你认为 \beta 细胞比例将如何随时间变化?若新 \beta 细胞源自现有 \beta 细胞呢? 图 Q22-2 的结果支持哪种假设?
22-8 最早用于检测造血干细胞的实验方法之一利用了它们在重度辐照小鼠脾脏中形成集落的能力。通过改变移植骨髓细胞的数量,研究人员发现脾脏集落数量与剂量呈线性关系,且曲线通过原点,
图 Q22-2 不同年龄小鼠胰岛中标记 \beta 细胞的百分比(问题 22-7)。所有小鼠在 6-8 周龄时注射一次他莫昔芬脉冲,随后在不同时间点对其胰腺细胞进行 HPAP 染色。误差棒代表各时间点所有分析动物的标准差。(改编自 Y. Dor 等人《自然》429:41-46, 2004,图 2)
这表明单个细胞能够形成独立集落。然而,由于集落形成率相对于移植细胞数量较为罕见,可能存在由两个或更多未分散细胞团块作为实际起始源的情况。
一篇经典论文通过利用辐射产生的罕见、细胞学上可见的基因组重排解决了这一问题。受体小鼠首先接受辐射以清除骨髓细胞,随后在移植后再次接受辐射,从而在移植细胞群体中产生罕见的基因组重排。之后通过筛选脾脏集落来寻找携带基因组重排的集落。你认为这个实验如何区分单细胞定植与细胞团块定植?
22-9 利用针对细胞表面靶标的抗体组合纯化造血干细胞是可行的。通过去除表达特定谱系表面标志物(如 B 细胞、粒细胞、髓系单核细胞和 T 细胞)的细胞,研究人员获得了富含干细胞的细胞群体。他们通过阳性筛选表达疑似干细胞表面标志物的细胞,进一步富集了这群假定干细胞。图 Q22-3 显示了这些假定干细胞与未分选骨髓细胞在辐照小鼠体内形成脾脏集落的情况。考虑到仅有约十分之一的细胞能定植于脾脏,这些结果是否支持富集群体主要由造血干细胞组成的观点?需要哪些额外信息才能确信富集细胞是真正的干细胞?骨髓细胞中造血干细胞的比例是多少?
图 Q22-3 经干细胞富集的细胞与未分选骨髓细胞形成的脾脏集落(问题 22-9)。
22-10 诱导多能干细胞(iPS 细胞)的生成最初是通过使用逆转录病毒载体将 OSKM(Oct4、Sox2、Klf4 和 Myc)这组转录调控因子导入细胞实现的。成纤维细胞重编程的效率通常较低 (0.01%) ,部分原因是需要大量逆转录病毒整合才能实现重编程,而每次整合事件都伴随着不适当地破坏或激活关键基因的风险。您认为还可以通过哪些其他方式或形式来递送 OSKM 转录调控因子,以避免这些问题?
22-11 为验证血液中是否存在影响小鼠中枢神经系统神经发生的因子,您采用连体共生技术——即将两个个体的循环系统相连——来观测海马齿状回神经源性微环境的变化。如图 Q22-4A 所示,您将两只年轻小鼠、两只老年小鼠或一老一幼两只小鼠的循环系统相连。五周后,使用双皮质素(Dcx)抗体对齿状回切片进行染色(该标记物可识别新生神经元),并统计新生神经元数量,结果汇总于图 Q22-4B 和 C。年轻-年轻连体组与老年-老年连体组的结果与单独饲养的年轻或老年小鼠无异。这些结果是否支持血液因子影响海马齿状回神经发生的观点?请说明理由。在一老一幼的连体实验中,哪只小鼠(若存在受益方)会获益?
图 Q22-4 异种共生对小鼠海马齿状回新生神经元数量的影响(问题 22-11)。(A) 成对小鼠间的循环系统连接(异种共生)。(B) 年轻小鼠与年轻小鼠配对(同龄共生)或年轻小鼠与老年小鼠配对(异龄共生)中的 Dcx 阳性细胞(新生神经元)。(C) 老年小鼠与老年小鼠配对(同龄共生)或老年小鼠与年轻小鼠配对(异龄共生)中的 Dcx 阳性细胞。同龄共生指同年龄小鼠间的异种共生;异龄共生指不同年龄小鼠间的异种共生。星号表示结果的统计学显著性:*表示 P< 0.05 预期该结果在 20 次重复中偶然发生的概率小于 1 次;**表示 < 0.01 预期该结果在 100 次重复中偶然发生的概率小于 1 次。
参考文献
通用
Gurdon JB 与 Melton DA (2008) 细胞核重编程。《科学》322, 1811-1815。He S、Nakada D 与 Morrison SJ (2009) 干细胞更新的机制。《细胞发育生物学年评》25, 377-406。Karagiannis P、Takahashi K、Saito M...Osafune K (2019) 诱导多能干细胞及其在人类疾病与发育模型中的应用。《生理学评论》99, 79-114。Morrison SJ 与 Spradling AC (2008) 干细胞与微环境:促进终生干细胞维持的机制。《细胞》132, 598-611。
干细胞与组织稳态
干细胞与组织稳态 Barker N, van Es JH, Kuipers J. . . Clevers H (2007) 通过标记基因 Lgr5 鉴定小肠和结肠中的干细胞。《自然》449, 1003-1007. Baron CS & van Oudenaarden A (2019) 利用遗传谱系追踪揭示发育和再生过程中的细胞关系。《自然综述·分子细胞生物学》20, 753-765. Blanpain C & Fuchs E (2014) 上皮干细胞在组织再生中的可塑性。《科学》344, 1242281. Morrison SJ, Uchida N & Weissman IL (1995) 造血干细胞的生物学特性。《细胞发育生物学年度评论》11, 35-70. Taub R (2004) 肝脏再生:从神话到机制。《自然综述·分子细胞生物学》5, 836-847.
干细胞命运与自我更新的调控
干细胞命运与自我更新的调控 Crane GM, Jeffery E & Morrison SJ (2017) 成体造血干细胞微环境。《免疫学综述》17(9), 573-590。Goodeil MA & Rando TA (2015) 干细胞与健康衰老。《科学》350, 1199-1204。Losick VP, Morris LX, Fox DT & Spradling A (2011) 果蝇干细胞微环境:十年发现揭示干细胞调控的统一观点。《发育细胞》21, 159-171。Sato T, Van Es JH, Snippert HJ... Clevers H (2011) 潘氏细胞构成肠道隐窝中 Lgr5 干细胞的微环境。《自然》469, 415-418。Sunchu B & Cabernard C (2020) 不对称细胞分裂的原理与机制。《发育》147(13), dev167650。
Venkei ZG & Yamashita Y (2018) 不对称干细胞分裂的新兴机制。《细胞生物学杂志》217(11), 3785-3795。Yoshida S (2019) 哺乳动物生精干细胞的异质性、动态性和随机性。《发育生物学当前议题》135, 245-285。
再生与修复
再生与修复 Brockes JP & Kumar A (2008) 动物再生的比较研究。《细胞与发育生物学年度评论》24, 525-549。 Tanaka EM (2016) 附肢再生的分子与细胞调控机制。《细胞》165(7), 1598-1608。 Tanaka EM & Reddien PW (2011) 动物再生的细胞基础。《发育细胞》21, 172-185。 Wagner DE, Wang IE & Reddien PW (2011) 克隆形成性新胚细胞是多能成体干细胞,支撑涡虫再生。《科学》332, 811-816。
细胞重编程与多能干细胞
细胞重编程与多能干细胞 Apostolou E & Hochedlinger K (2013) 细胞重编程过程中的染色质动态。《自然》502, 462-471。Fox IJ, Daley GQ, Goldman SA... Trucco M (2014) 干细胞疗法。利用分化多能干细胞作为替代疗法治疗疾病。《科学》345, 1247391。Hochedlinger K & Jaenisch R (2015) 诱导多能性与表观遗传重编程。《冷泉港生物学展望》7, 4019448。Inoue H, Nagata N, Kurokawa H & Yamanaka S (2014) iPS 细胞:未来医学的游戏规则改变者。《EMBO 杂志》33, 409-417。Radzisheuskaya A & Silver JCR (2014) 所有道路都通向 Oct4 吗?诱导多能性的新兴概念。《细胞生物学趋势》24, 275-284。Sasai Y, Eiraku M & Suga H (2012) 三维体外器官发生:自组织干细胞。《发育》139, 4111-4121。Takahashi K & Yamanaka S (2006) 通过限定因子从小鼠胚胎和成体成纤维细胞培养物中诱导多能干细胞。《细胞》126, 663-676。Theunissen TW & Jaenisch R (2014) 诱导多能性的分子控制。《细胞干细胞》14, 720-734。
