第三十四章 肾小管沿途的水、溶质转运:小管功能
学习目标
完成本章学习后,学生应能回答以下问题:
- 尿液生成涉及哪三个基本过程?
- "正常"尿液的组成成分是什么?
- 肾小管重吸收氯化钠(NaCl)的转运机制有哪些?这些机制沿肾小管分布在哪些部位?
- 近端小管中水分重吸收如何与NaCl重吸收"耦联"?
- 为什么Henle袢升支粗段能重吸收溶质但不重吸收水分?
- 有机阴离子和阳离子分泌涉及哪些转运机制?这些转运过程的生理意义是什么?
- 什么是肾小球-小管平衡(glomerulotubular balance)?其生理重要性何在?
- 调节肾脏NaCl和水分重吸收的主要激素有哪些?每种激素在肾小管的作用部位是哪里?
- 什么是醛固酮悖论(aldosterone paradox)?
尿液的形成包含三个基本过程:(1) 肾小球的血浆超滤作用,(2) 超滤液中水分和溶质的重吸收,以及(3)特定溶质向小管液的分泌。尽管人类肾小球每天滤过的无蛋白液体量女性为115-180升/天、男性为130-200升/天,但最终尿液中通常只排泄不到1%的滤过水和氯化钠(NaCl)以及不同比例的其他溶质(表34.1)。通过重吸收和分泌过程,肾小管决定了尿液的体积和组成(表34.2),从而使肾脏能够精确调控细胞内外液体的容量、渗透压、成分和pH值。肾小管细胞膜上的转运蛋白介导了肾脏对溶质和水的重吸收与分泌。人类约有5%-10%的基因编码转运蛋白,而转运蛋白的遗传性和获得性缺陷是许多肾脏疾病的病因(表34.3)。此外,众多转运蛋白是重要的药物靶点。本章将讨论NaCl和水分的重吸收、有机阴离子和阳离子的转运、参与溶质和水转运的转运蛋白,以及调节NaCl转运的部分因素和激素。关于酸碱转运、K⁺、Ca²⁺和无机磷酸盐(Pi)转运及其调控的细节详见第35至37章。
溶质和水的肾小管重吸收
上皮细胞溶质和水转运的一般原理已在第二章讨论。
从数量上看,NaCl 和水的重吸收是肾单位(nephron)的主要功能。肾小管每天重吸收约 25,000mEq 的 Na+ 和 179 升水(见表 34.1)。此外,许多其他重要溶质的肾脏转运都直接或间接与 Na+ 的重吸收相关联。以下各节将介绍每个肾小管节段的 NaCl 和水转运过程及其受激素和其他因素的调控。
近端小管(proximal tubule)
近端小管重吸收约 67% 的水、Na+、Cl-、K+ 以及肾小球(glomerulus)滤过的大部分其他溶质。此外,近端小管几乎完全重吸收肾小球滤过的所有葡萄糖、蛋白质和氨基酸,以及大部分 HCO3-。近端小管重吸收的关键是基底外侧膜上的 Na+,K+-ATPase。所有物质(包括水)的重吸收都以某种方式与 Na+,K+-ATPase 的运作相关联。
| 物质 (Substance) | 计量单位 (Measure) | 滤过量a (Filtered) | 排泄量 (Excreted) | 重吸收量 (Reabsorbed) | 滤过负荷重吸收率 (% Filtered Load Reabsorbed) |
|---|---|---|---|---|---|
| 水 (Water) | 升/天 (L/day) | 180 | 1.5 | 178.5 | 99.2 |
| Na⁺ | 毫当量/天 (mEq/day) | 25,200 | 150 | 25,050 | 99.4 |
| K⁺ | 毫当量/天 (mEq/day) | 720 | 100 | 620 | 86.1 |
| Ca⁺⁺ | 毫当量/天 (mEq/day) | 540 | 10 | 530 | 98.2 |
| HCO₃⁻ | 毫当量/天 (mEq/day) | 4,320 | 2 | 4,318 | 99.9以上 |
| Cl⁻ | 毫当量/天 (mEq/day) | 18,000 | 150 | 17,850 | 99.2 |
| 葡萄糖 (Glucose) | 毫摩尔/天 (mmol/day) | 800 | 0 | 800 | 100.0 |
| 尿素 (Urea) | 克/天 (g/day) | 56 | 28 | 28 | 50.0 |
| a任何物质的滤过量可通过超滤液中该物质浓度乘以肾小球滤过率(GFR)计算。例如,Na+ 的滤过量计算为超滤液 [Na+](140 mEq/L)× GFR(180 L/day)=25200 mEq/day。 | |||||
| 物质 (Substance) | 浓度 (Concentration) |
|---|---|
| Na⁺ (钠离子) | 50–130 毫当量/升 (mEq/L) |
| K⁺ (钾离子) | 20–70 毫当量/升 (mEq/L) |
| 铵离子 (NH₄⁺) | 30–50 毫当量/升 (mEq/L) |
| Ca⁺⁺ (钙离子) | 5–12 毫当量/升 (mEq/L) |
| Mg⁺⁺ (镁离子) | 2–18 毫当量/升 (mEq/L) |
| Cl⁻ (氯离子) | 50–130 毫当量/升 (mEq/L) |
| 无机磷酸盐 (Pi) | 20–40 毫当量/升 (mEq/L) |
| 尿素 (Urea) | 200–400 毫摩尔/升 (mmol/L) |
| 肌酐 (Creatinine) | 6–20 毫摩尔/升 (mmol/L) |
| pH (酸碱度) | 5.0–7.0 |
| 渗透压 (Osmolality) | 500–800 毫渗摩尔/千克水 (mOsm/kg H₂O) |
| 葡萄糖 (Glucose) | 0 |
| 氨基酸 (Amino acids) | 0 |
| 蛋白质 (Protein) | 0 |
| 血液 (Blood) | 0 |
| 酮体 (Ketones) | 0 |
| 白细胞 (Leukocytes) | 0 |
| 胆红素 (Bilirubin) | 0 |
| 健康状态下尿液的成分和体积可能差异很大。表中数值代表平均范围。正常水排泄量通常在0.5-1.5升/天之间。数据来源:Valtin HV. Renal Physiology. 2nd ed. Boston: Little, Brown; 1983. | |
Na+ 重吸收
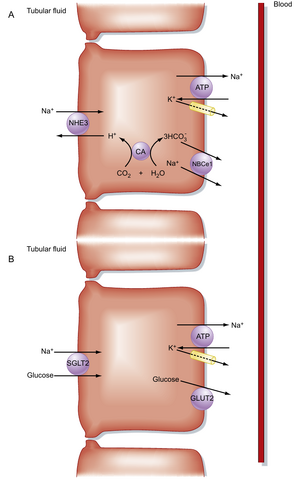
Na+在近端小管(proximal tubule)前半段和后半段通过不同机制被重吸收。在近端小管前半段,Na+主要与碳酸氢根(HCO3-)及其他溶质(如葡萄糖、氨基酸、Pi、乳酸)共同被重吸收。而在后半段,Na+主要与Cl-共同被重吸收。这种差异源于近端小管前半段与后半段Na+转运系统的不同,以及这两个部位小管液成分的差异。从绝对值来看,近端小管前半段重吸收的Na+显著多于后半段。
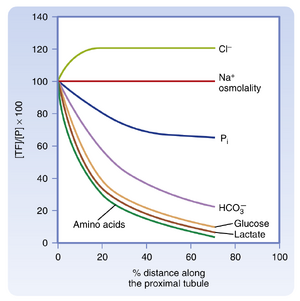
在近端小管前半段,细胞对Na+的摄取与H+或有机溶质(包括葡萄糖)相偶联(图34.1)。特定的转运蛋白介导Na+跨顶膜进入细胞。例如,Na+/H+反向转运体NHE3(见图34.1A)将Na+的进入与H+的排出相偶联。H+分泌导致碳酸氢钠(NaHCO3)的重吸收(见第37章)。Na+还可通过多种同向转运机制进入近端小管细胞,包括Na+/葡萄糖(SGLT2)、Na+/氨基酸、Na+/Pi和Na+/乳酸(见图34.1B)。与Na+共同进入细胞的葡萄糖和其他有机溶质通过被动转运机制(如GLUT2,一种被动葡萄糖转运体)跨基底外侧膜离开细胞。任何通过顶膜进入细胞的Na+都将通过Na+,K+-ATP酶离开细胞进入血液。因此,近端小管前半段对Na+的重吸收与HCO3-及多种有机分子的重吸收相偶联,这会在近端小管形成跨上皮负电压,为Cl-的细胞旁路重吸收提供驱动力。包括葡萄糖和乳酸在内的许多有机分子的重吸收非常高效,它们在近端小管前半段几乎被完全从管腔液中清除(图34.2)。近端小管对NaHCO3和Na+-有机溶质的重吸收建立了跨小管渗透梯度(即浸泡细胞基底外侧面的间质液渗透压比小管液渗透压高数mOsm/L),这为水通过渗透作用的被动重吸收提供驱动力。由于近端小管前半段对水的重吸收量超过Cl-,小管液中的[Cl-]浓度沿近端小管长度逐渐升高(见图34.2)。
目前已发现超过300个溶质转运体基因,组成SLC(溶质载体)基因家族。 AD:常染色体显性(autosomal dominant);AR:常染色体隐性(autosomal recessive);ENaC:上皮钠通道;TAL:髓袢升支粗段;XLR:X连锁隐性遗传。 改编自Nachman RH, Glassock RJ. NephSAP. 2010;9(3).
在近端小管(proximal tubule)后半段,Na+的重吸收主要通过跨细胞和旁细胞途径与Cl-的重吸收相伴进行(图34.3)。Na+主要伴随Cl-而非有机溶质或HCO3-作为伴随阴离子被重吸收,原因有二:其一,近端小管后半段的Na+转运机制与前半段不同;其二,流入后半段的小管液中含有极少量葡萄糖或氨基酸。此外,由于近端小管前半段优先重吸收Na+与HCO3-及有机溶质,导致小管液中Cl-浓度高达140 mEq/L,这促进了Cl-与Na+的共同重吸收。
临床视角
范可尼综合征(Fanconi syndrome)是一种遗传性或获得性肾脏疾病,源于近端小管重吸收HCO₃⁻、磷酸盐(Pi)、氨基酸、葡萄糖和低分子量蛋白质的功能受损。由于下游肾单位无法重吸收这些溶质和蛋白质,该综合征会导致尿中HCO₃⁻、氨基酸、葡萄糖、Pi和低分子量蛋白质的排泄增加。
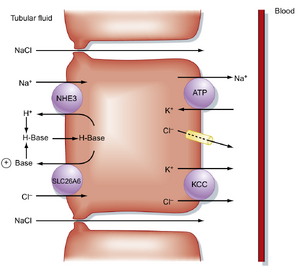
近端小管后半段跨细胞Na+重吸收的机制如图34.3所示。Na+主要通过Na+/H+逆向转运体(NHE3)与一个或多个Cl- -碱基逆向转运体(如SLC26A6)的并联运作穿过管腔膜进入细胞。由于分泌的H+和碱基在管腔液中结合并重新进入细胞,Na+/H+和Cl- -碱基逆向转运体的运作等同于将NaCl从管腔液摄入细胞。Na+通过Na+,K+ -ATP酶离开细胞,Cl-则通过基底外侧膜的K+/Cl-同向转运体(KCC)和Cl-通道离开细胞进入血液。
部分NaCl也通过细胞旁途径在近端小管后半段被重吸收。细胞旁路NaCl重吸收的发生是由于近端小管前半段管腔液中[Cl-]升高形成了浓度梯度(管腔140 mEq/L,间质105 mEq/L)。该浓度梯度促使Cl-通过紧密连接从管腔向细胞侧间隙扩散。带负电荷的Cl-移动导致管腔液相对血液呈正电性。这种正向跨上皮电压促使带正电的Na+通过紧密连接从管腔液向血液扩散。因此在近端小管后半段,部分Na+和Cl-通过被动扩散经紧密连接被重吸收。
综上,近端小管中Na+和Cl-的重吸收通过细胞旁路和跨细胞两种途径进行。肾小球每天滤过的NaCl约有67%在近端小管被重吸收。其中三分之二通过跨细胞途径转运,剩余三分之一通过细胞旁路转运(表34.4)。
水的重吸收
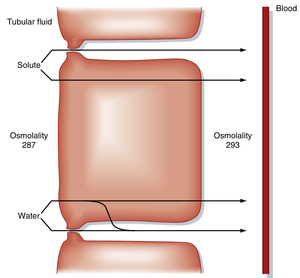
近端小管重吸收了67%的滤过水(表34.5)。水重吸收的驱动力是通过溶质(如NaCl、Na+-葡萄糖)重吸收建立的跨小管渗透梯度。Na+与有机溶质、HCO3-和Cl-从管腔液向侧向细胞间隙的重吸收,降低了管腔液的渗透压并提高了侧向细胞间隙的渗透压。这些转运过程建立的跨近端小管渗透梯度仅有数mOsm/L(图34.4)。由于近端小管对水具有高度通透性(主要归因于顶膜和基底膜上水通道蛋白(aquaporin water channels,AQP1)的表达),水通过渗透作用跨细胞重吸收。此外,近端小管的紧密连接也具有透水性,因此部分水也通过近端小管细胞间的细胞旁途径重吸收。
液体和溶质在侧向细胞间隙的积聚会增加该区域的静水压。升高的静水压将液体和溶质推入毛细血管。因此,近端小管的水重吸收跟随溶质重吸收进行。重吸收的液体相对于血浆呈轻微高渗。然而这种渗透压差异非常微小,通常认为近端小管的重吸收是等渗的(即滤过的溶质和水中均有约67%被重吸收)。实际上,近端小管起始端与末端管腔液的渗透压差异极小。水通过渗透作用流经近端小管的重要后果是:部分溶质(尤其是K+和Ca++)会被重吸收液裹挟,从而通过溶剂拖曳(solvent drag)过程被重吸收(见图34.4)。
几乎所有有机溶质、Cl-和其他离子以及水的重吸收都与Na+重吸收偶联。因此Na+重吸收的变化会影响近端小管对水和其他溶质的重吸收。这一点将在后文(特别是第35章)讨论,在容量不足时尤为重要——此时近端小管Na+重吸收的增加会伴随HCO3-重吸收的平行增加,可能导致代谢性碱中毒(即容量收缩性碱中毒)。
蛋白质重吸收
肾小球滤过的蛋白质在近端小管被重吸收。如前所述,肽类激素、小分子蛋白质以及少量大分子蛋白质(如白蛋白)可被肾小球滤过。总体而言,只有少量蛋白质能穿过肾小球进入鲍曼囊(即肾小球超滤液中的蛋白质浓度仅为≈40 mg/L)。但由于肾小球滤过率(GFR)极高,每日滤过的蛋白质总量仍然显著:
滤过蛋白量 = GFR × 超滤液中[蛋白质]
滤过蛋白量 = 180 L/天 × 40 mg/L = 7200 mg/天 或 7.2 g/天
被滤过的蛋白质在近端小管通过内吞作用(endocytosis)被重吸收,可以是完整蛋白质形式,也可以先被近端小管细胞表面的酶部分降解。一旦蛋白质和肽段进入细胞内,酶将其消化为组成氨基酸,随后这些氨基酸通过基底侧膜的转运蛋白离开细胞,重新返回血液。正常情况下,该机制几乎能重吸收所有被滤过的蛋白质,因此尿液基本不含蛋白质。然而由于该机制易达到饱和,滤过蛋白增加会导致蛋白尿(proteinuria)(尿液中出现蛋白质)。肾小球滤过屏障对蛋白质的通透性破坏会增加蛋白质滤过量并引发蛋白尿,这在肾脏疾病中常见。
有机阴离子和有机阳离子的分泌
近端小管细胞还能将有机阴离子和有机阳离子分泌至小管液中。近端小管分泌有机阴离子和阳离子在调节异生物质(如多种抗生素、利尿剂、他汀类药物、抗病毒药物、抗肿瘤药物、免疫抑制剂、神经递质和非甾体抗炎药[NSAIDs])以及内源性和外源性毒性化合物的血浆水平中起关键作用。近端小管分泌的许多有机阴离子和阳离子(见Boxes 34.1和34.2)是循环于血浆中的代谢终产物。这些有机化合物大多与血浆蛋白结合,因此不易被滤过。
因此仅有一小部分这些潜在毒性物质通过单纯的滤过作用排出体外。因此,有机阴离子和阳离子(包括来自管周毛细血管的多种毒素)向小管液的分泌过程,促进了这些化合物从进入肾脏的血浆中被清除。由此可见,这些物质通过滤过和分泌两种途径从血浆中移除。值得注意的是,当疾病导致肾功能下降时,有机阴离子和阳离子的尿液排泄会严重减少,可能导致外源性物质血浆浓度升高以及有机阴/阳离子的潜在毒性蓄积。
近端小管分泌的部分有机阴离子 • BOX 34.1
内源性阴离子:
cAMP、cGMP 胆汁盐 马尿酸盐 草酸盐 前列腺素:PGE2、PGF2α尿酸盐 维生素:抗坏血酸、叶酸
药物:
乙酰唑胺 阿昔洛韦 阿莫西林 卡托普利 氯噻嗪 呋塞米 氯沙坦 青霉素 丙磺舒 水杨酸(阿司匹林) 氢氯噻嗪 辛伐他汀 布美他尼 非甾体抗炎药(NSAIDs):吲哚美辛
cAMP,环磷酸腺苷;cGMP,环磷酸鸟苷。
近端小管分泌的部分有机阳离子 • BOX 34.2
内源性:
肌酐 多巴胺 肾上腺素 去甲肾上腺素
药物:
阿托品 异丙肾上腺素 西咪替丁 吗啡 奎宁 阿米洛利 普鲁卡因胺
细胞水平
被称为水通道蛋白(aquaporins,AQPs)的水通道介导水在多个肾单位节段的跨细胞重吸收。迄今已鉴定出13种水通道蛋白。根据通透特性,AQP家族可分为两类:一类(aquaporins)对水具有通透性(AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8、AQP11和AQP12);另一类(aquaglyceroporins)对水和小分子溶质(尤其是甘油)具有通透性(AQP3、AQP7、AQP9、AQP10)。水通道蛋白在细胞质膜中形成四聚体,每个亚基构成一个水通道。
在肾脏中,AQP1表达于近端小管的顶膜和基底外侧膜,以及Henle袢降支细段的某些部分。通过基因敲除小鼠AQP1的研究,突显了AQP1在肾水重吸收中的重要性:这些小鼠表现出尿量增加(多尿症)和尿液浓缩能力降低。此外,缺乏AQP1的小鼠近端小管对水的渗透性通透能力较正常小鼠低五倍。AQP7和AQP8也在近端小管表达。
AQP2表达于集合管主细胞的顶膜,其在膜中的丰度受精氨酸加压素(arginine vasopressin,AVP)调节(见第35章)。AQP3和AQP4表达于集合管主细胞的基底外侧膜,缺乏这些AQP(即AQP3和AQP4基因敲除小鼠)的小鼠存在尿液浓缩功能缺陷(见第35章)。
细胞水平
近端小管对蛋白质的内吞作用由顶端膜蛋白介导,这些蛋白能特异性结合小管液中的蛋白质和肽类。这些被称为多配体内吞受体的受体可结合多种肽类和蛋白质,从而介导其内吞作用。Megalin和cubilin介导近端小管的蛋白质和肽类内吞作用。两者均为糖蛋白,其中megalin属于低密度脂蛋白受体基因家族。
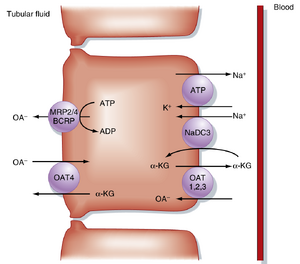
图34.5展示了近端小管中有机阴离子(organic anion,OA⁻)跨膜转运的机制。这些分泌途径具有最大转运速率、低特异性(即能转运多种OA⁻),负责分泌框34.1所列的OA⁻。OA⁻通过基底外侧膜上的多个OA⁻/α-酮戊二酸(α-KG)逆向转运体(包括OAT1、OAT2和OAT3),以α-KG交换的方式逆化学梯度进入细胞。α-KG在细胞内通过谷氨酸代谢和基底外侧膜上的Na⁺/α-KG同向转运体(即Na⁺/二羧酸转运体[NaDC3])积累。因此,OA⁻逆电化学梯度进入细胞的过程与α-KG顺其化学梯度(由Na⁺/α-KG同向转运机制产生)出细胞相偶联。OA⁻通过管腔膜进入小管液的过程由多药耐药蛋白2和4(MRP2/4)及乳腺癌耐药蛋白1(BCRP)介导,这些蛋白的运作需要腺苷三磷酸(ATP)。最新研究表明,OAT4介导近端小管对嘌呤分解代谢终产物——有机阴离子尿酸盐的重吸收(见图34.5)。
临床视角
尿液分析是检测肾脏疾病的重要常规工具。完整的尿液分析包括肉眼观察、显微镜检查和生化评估。具体通过肉眼观察尿液、显微镜检查尿沉渣、以及使用试纸试剂条进行尿液成分的生化评估。试纸检测成本低廉且快速(即<5分钟),可检测尿液pH值和多种物质的存在(如胆红素、血液、葡萄糖、酮体、蛋白质)。尿液中存在微量蛋白质属于正常现象,尤其是浓缩尿液中。尿液蛋白质主要有两个来源:(1)超过近端小管重吸收能力的滤过量;(2)Henle袢粗升支合成的Tamm-Horsfall糖蛋白的合成与分泌。由于蛋白质重吸收机制位于粗升支"上游"(即近端小管),分泌的Tamm-Horsfall糖蛋白会出现在尿液中。超过微量水平的蛋白尿通常提示肾脏疾病。
• 图34.6 近端小管的有机阳离子(OC⁺)分泌过程。OC⁺主要通过OCT2穿过基底外侧膜进入细胞。OC⁺逆化学浓度梯度进入细胞的驱动力是细胞内的负电位差。OC⁺通过电中性多药及毒素转运体(MATE1和MATE2-K)以及与H⁺交换的方式离开细胞顶膜,此外还通过需要ATP的多药耐药蛋白(MDR1)完成转运。
图34.6展示了近端小管中有机阳离子(organic cation,OC+)的跨膜转运机制。近端小管分泌的有机阳离子包括外源性物质(如降糖药二甲双胍、抗病毒药拉米夫定、抗癌药奥沙利铂)以及多巴胺、肾上腺素、组胺、去甲肾上腺素等重要单胺类神经递质。有机阳离子主要通过基底侧膜的有机阳离子转运蛋白2(organic cation transporter 2,OCT2)进入细胞。基底侧膜的细胞负性跨膜电位差是驱动有机阳离子摄取的主要动力。
有机阳离子通过管腔膜进入小管液的转运过程是分泌过程的限速步骤,主要由电中性多药及毒素外排转运蛋白(multidrug and toxin extrusion transporters,MATEs)和MDR1(亦称P-糖蛋白)介导,其中MDR1的运作需要ATP供能。这些转运机制具有非特异性,多种有机阳离子通常通过同一转运通路竞争分泌。
临床意义
由于许多有机阴离子竞争相同的分泌通路,当一种转运阴离子的血浆浓度升高时,常会抑制其他阴离子的分泌。例如,输注对氨基马尿酸(p-aminohippuric acid,PAH)可抑制近端小管对青霉素的分泌。由于肾脏负责青霉素的清除,对接受青霉素治疗的患者输注PAH会减少青霉素排泄,从而延长其生物半衰期。在二战期间青霉素短缺时,曾通过联合使用马尿酸类物质以延长青霉素的疗效。
近端小管的有机阳离子分泌也存在类似竞争现象。当一种转运阳离子的血浆浓度升高时,会抑制其他竞争性阳离子的分泌。例如,用于治疗胃溃疡的组胺H_2拮抗剂西咪替丁通过近端小管的有机阳离子转运机制分泌。若对接受普鲁卡因胺(治疗心律失常的有机阳离子药物)治疗的患者使用西咪替丁,两者会因竞争同一分泌通路而导致分泌减少。因此,联合使用竞争同一通路的阳离子药物时,可使两者的血药浓度显著高于单独用药时的水平,可能引发药物毒性。
亨利氏袢
亨利氏袢重吸收约25%滤过的NaCl和15%滤过的水。NaCl的重吸收发生在袢的薄壁升支和厚壁升支,而降支薄壁段不参与NaCl重吸收。与之相反,由AQP1水通道介导的水重吸收仅发生于降支薄壁段,而升支对水不通透。此外,二价阳离子(如Ca2+和Mg2+)及HCO3-也在亨利氏袢中被重吸收(详见第36和37章)。
薄升支(thin ascending limb)通过被动机制重吸收NaCl。降支细段(descending thin limb)对水(而非NaCl)的重吸收作用,会使进入升支细段的管腔液中[NaCl]升高。随着富含NaCl的液体向皮质方向移动,NaCl会顺着从管腔液指向间质的浓度梯度,通过薄升支从管腔扩散到髓质间质液中(详见第35章)。
厚升支(thick ascending limb)溶质重吸收的关键要素是基底外侧膜(basolateral membrane)中的Na+,K+-ATP酶(图34.7)。与近端小管(proximal tubule)的重吸收机制类似,厚升支对所有溶质的重吸收都与Na+,K+-ATP酶活性相关。该转运体维持着细胞内低[Na+],从而为Na+从管腔液进入细胞提供了有利的化学梯度。Na+通过顶膜(apical membrane)进入细胞的运动由1Na+/1K+/2Cl-同向转运体(NKCC2)介导,该转运体将1个Na+与1个K+和2个Cl-的移动相偶联。利用Na+和Cl-顺浓度梯度移动释放的势能,该同向转运体驱动K+逆浓度梯度进入细胞。
顶膜质膜中的K+通道(ROMK和Maxi-K)对厚升支的NaCl重吸收具有重要作用。这些K+通道允许通过1Na+/1K+/2Cl-同向转运体进入细胞的K+重新循环回管腔液。由于管腔液中[K+]相对较低,K+的再循环是维持1Na+/1K+/2Cl-同向转运体持续运作的必要条件。
顶膜中的Na+/H+逆向转运体(NHE3)也介导厚升支的Na+重吸收和H+分泌(HCO_3-重吸收)(另见第37章)。顶膜Na+/H+逆向转运体的运作导致细胞以H+交换的形式摄取Na+。细胞内H+的产生会形成HCO3-,后者通过基底外侧膜的Cl-/HCO_3-逆向转运体(AE2)离开细胞。Na+通过Na+,K+-ATP酶跨越基底外侧膜离开细胞,而K+和Cl-则通过基底外侧膜上的独立路径(即K+通道、Cl-通道和K+/Cl-同向转运体)离开细胞。
粗升支(thick ascending limb)两侧的电压对于多种阳离子的重吸收至关重要。由于顶膜和基底外侧膜转运蛋白的独特分布,小管液相对于血液呈正电位。以下两点尤为重要:(1) 粗升支对氯化钠(NaCl)转运的增加会增强管腔正电压的幅度;(2) 该电压是多种阳离子(包括钠离子(Na⁺)、钾离子(K⁺)、镁离子(Mg²⁺)和钙离子(Ca²⁺))通过细胞旁途径(paracellular pathway)重吸收的重要驱动力(见图34.7)。紧密连接蛋白claudin-16的功能缺失突变会减少粗升支对Mg²⁺和Ca²⁺的重吸收(即使在存在管腔正跨上皮电压的情况下),这一观察结果凸显了细胞旁途径在溶质重吸收中的重要性。
• 图34.7 亨利袢粗升支对NaCl重吸收的转运机制。管腔正电压在驱动阳离子被动性细胞旁路重吸收中起主要作用。由于顶膜主要对K⁺具有导电性,其膜电位比基底外侧膜更负(基底外侧膜对K⁺和Cl⁻均具有导电性),从而形成管腔正跨上皮电位。顶膜K⁺通道(ROMK)、顶膜1Na⁺/1K⁺/2Cl⁻同向转运体(NKCC2)或基底外侧Cl⁻通道(ClCNKB)的突变会导致Bartter综合征(参见Bartter综合征的临床框)。CA表示碳酸酐酶(Carbonic anhydrase)。
总结而言,粗升支对NaCl的重吸收通过跨细胞和细胞旁两种途径实现:50%的NaCl重吸收为跨细胞途径,50%为细胞旁途径。由于缺乏水通道蛋白(AQPs),粗升支不重吸收水分,因此NaCl及其他溶质的重吸收使小管液渗透压降至150 mOsm/kg H₂O以下。由于亨利袢粗升支产生的液体相对于血浆呈低渗状态,该节段及其相邻的远曲小管(下文将讨论)常被统称为"稀释段"。
远曲小管与集合管(Distal Tubule and Collecting Duct)
远端小管(distal tubule)和集合管(collecting duct)重吸收约8%的滤过NaCl,分泌不同量的K⁺和H⁺,并重吸收不同量的水(≈8%-17%)。远端小管的起始段(早期远端小管)重吸收Na⁺、Cl⁻和Ca²⁺,且对水不通透(图34.8)。NaCl通过顶端膜进入细胞由Na⁺/Cl⁻同向转运体(NCC)介导(见图34.8)。Na⁺通过Na⁺,K⁺-ATP酶的作用离开细胞,Cl⁻则通过Cl⁻通道和K⁺/Cl⁻同向转运体(KCC4)扩散离开细胞。因此,小管液的稀释过程开始于髓袢升支粗段(thick ascending limb),并持续于远端小管的早期节段。
细胞水平(AT THE CELLULAR LEVEL)
如第2章所述,上皮细胞通过顶端表面的紧密连接(tight junctions,zonula occludens)相互连接。目前已鉴定出多种构成紧密连接的蛋白质,包括跨膜蛋白(如occludin和claudins)——它们连接相邻细胞膜上的同源分子,以及胞质连接蛋白(如ZO-1、ZO-2和ZO-3)——它们将跨膜蛋白与细胞骨架相连。在这些连接蛋白中,claudins似乎是决定紧密连接通透特性的主要因素。例如,claudin-16和claudin-19是Henle袢升支粗段紧密连接对二价阳离子通透性的关键决定因子。人类claudin-16和claudin-19的突变会导致家族性低镁血症(familial hypomagnesemia,即血浆[Mg⁺⁺]降低)伴高钙尿症(hypercalciuria,尿中Ca⁺⁺增加)和肾钙质沉着症(nephrocalcinosis,肾脏钙化)。Claudin-2对水具有通透性,可能负责近端小管的细胞旁水重吸收(paracellular water reabsorption)。Claudin-4控制紧密连接对Na⁺的通透性,而claudin-15决定紧密连接对阳离子或阴离子的通透性。因此,不同肾单位节段紧密连接的通透特性至少部分由该节段细胞表达的特定claudins决定。
• 图34.8 远端小管早期节段NaCl重吸收的转运机制。该节段对水不通透。顶端膜NaCl同向转运体(NCC)的突变会导致Gitelman综合征。
细胞水平(AT THE CELLULAR LEVEL)
巴特综合征(Bartter syndrome)是一组以低钾血症(hypokalemia)、代谢性碱中毒(metabolic alkalosis)和高醛固酮血症(hyperaldosteronism)为特征的常染色体隐性遗传疾病(见表34.3)。编码顶膜1Na+/1K+/2Cl−同向转运体(NKCC2)、顶膜K+通道(ROMK)或基底膜Cl-通道(ClCNKB)的基因发生失活突变时,会降低厚壁升支(thick ascending limb)对NaCl和K+的重吸收,从而导致低钾血症(即血浆[K+]降低)和细胞外液容量(ECFV)减少。ECFV的下降会刺激醛固酮分泌,进而促进远端小管(distal tubule)和集合管(collecting duct)对NaCl的重吸收与\Join+的分泌。
远端小管末段(late distal tubule)和集合管由三种细胞类型构成:主细胞(principal cells)和两种类型的闰细胞(intercalated cells)。如图34.9所示,主细胞重吸收NaCl和水,并分泌K+。这些细胞的Na+重吸收和K+分泌都依赖于基底侧膜上Na+,K+-ATP酶的活性。通过维持细胞内低[Na+],Na+,K+-ATP酶为Na+从管腔液进入细胞提供了有利的化学梯度。由于Na+通过顶端膜的上皮钠选择性通道(ENaCs)扩散进入细胞,细胞内的负电压促进了Na+的进入,随后Na+通过基底侧膜的Na+,K+-ATP酶离开细胞进入血液。Na+的重吸收在远端小管末段和集合管产生管腔负电压,这为Cl-的细胞旁路重吸收提供了驱动力。
闰细胞分泌H+或HCO3-,在酸碱稳态中起重要作用(见第37章)。α-闰细胞(见图34.9,中间)分泌H+并重吸收HCO3-和K+,因此在调节酸碱平衡(见第37章)和K+平衡(见第36章)中具有重要作用。α-闰细胞通过顶端质膜上的H+,K+-ATP酶(HKA)重吸收K+。相比之下,β-闰细胞(见图34.9,底部)分泌HCO3-并重吸收H+和Cl-。氯离子通过顶端膜的Cl-/HCO_3-反向转运体(pendrin, SLC26A4)进入β-闰细胞,并通过基底侧膜的Cl-通道离开细胞。β-闰细胞还重吸收NaCl,该过程涉及pendrin与顶端膜Na+/HCO_3-/2Cl-反向转运体(NDCBE)的协同作用。这种NaCl重吸收机制可被噻嗪类利尿剂抑制(详见第37章)。
在远端小管末段和集合管的主细胞中,有不同量的水被重吸收。这些节段的水重吸收由位于顶端质膜的AVP调控的AQP2水通道,以及主细胞基底侧膜的AQP3和AQP4介导。在AVP存在时,水被重吸收;相反,缺乏AVP时,远端小管末段和集合管几乎不重吸收水(见第35章)。
主细胞通过两个步骤将K+从血液分泌到管腔液中(见图34.9,顶部):首先,基底侧膜通过Na+,K+-ATP酶介导K+的摄取。
NaCl和水的重吸收调节
从数量上看,血管紧张素II(angiotensin II)、醛固酮(aldosterone)、儿茶酚胺(catecholamines)、利钠肽(natriuretic peptides)和尿鸟苷素(uroguanylin)是调节NaCl重吸收(从而影响尿中NaCl排泄)的最重要激素(表34.6)。不过,其他激素(包括多巴胺和肾上腺髓质素)、Starling力以及肾小球-小管平衡现象也会影响NaCl重吸收。AVP是唯一直接调节肾脏水排泄量的主要激素。
血管紧张素II对近端小管NaCl和水的等渗重吸收具有强效刺激作用。它还能刺激髓袢升支粗段(thick ascending limb of Henle's loop)、远曲小管远端(late distal tubule)和集合管(collecting duct)的Na+重吸收。ECFV(细胞外液容量)下降会激活肾素-血管紧张素-醛固酮系统(详见第35章),从而提高血浆中血管紧张素II的浓度。
第二,K+通过被动扩散离开细胞。由于主细胞(principal cells)内[K+]较高(≈150 mEq/L)而小管液[K+]较低(≈10 mEq/L),K+顺浓度梯度通过顶膜(apical membrane)的K+通道(ROMK和BK)扩散进入小管液。虽然这些细胞内的负电位有利于K+在胞内滞留,但跨顶膜的电化学梯度促进K+从细胞分泌到小管液中(参见第36章)。与此相反,α细胞对K+的重吸收由位于顶膜的H+/K+-ATP酶(HKA)介导(见图34.9,中央)。因此,这些远端肾单位节段通过独立调控的机制同时具有分泌和重吸收K+的能力,这与大多数肾单位节段普遍倾向于重吸收Na+的特性形成对比。
醛固酮的生理作用机制
醛固酮(aldosterone)由肾上腺皮质球状带细胞合成,能刺激亨利袢升支粗段(thick ascending limb of Henle’s loop)、远曲小管后段(late distal tubule)和集合管(collecting duct)对NaCl的重吸收。其对NaCl重吸收的主要作用体现在远曲小管后段和集合管(统称为醛固酮敏感性远端肾单位(aldosterone-sensitive distal nephron,ASDN)[详见第35、37章])。醛固酮通过以下四种机制增强这些节段主细胞(principal cells)的NaCl重吸收:
- 增加基底侧膜Na+,K+-ATP酶的数量;
- 增加顶膜钠通道(ENaC)的表达;
- 升高Sgk1(血清糖皮质激素刺激激酶,见分子专栏)水平,进而增加顶膜ENaC的表达;
- 激活CAP1(通道激活蛋白酶,亦称prostatin)——一种通过蛋白水解直接激活ENaC的丝氨酸蛋白酶。
这些机制共同增强了顶膜对Na+的摄取,并促进Na+从细胞内转运至血液。Na+重吸收的增加使远曲小管后段和集合管产生跨上皮腔侧负电压。该负电压为Cl-通过紧密连接(tight junctions)的重吸收提供电化学驱动力。醛固酮还刺激ASDN分泌K+。
高钾血症(hyperkalemia)和低血容量(hypovolemia)(即通过肾素-血管紧张素系统(RAS)激活后血管紧张素II增加导致的细胞外液容量减少)可促进醛固酮分泌。低钾血症(hypokalemia)和利钠肽(natriuretic peptides)则抑制其分泌(详见下文)。醛固酮通过刺激集合管NaCl重吸收,间接增强该肾单位节段的水重吸收。
图34.9 远曲小管后段和集合管主细胞、α-间细胞(α-intercalated cells)及β-间细胞(β-intercalated cells)的转运通路。CA:碳酸酐酶(carbonic anhydrase)。主细胞重吸收Na+并分泌K+,K+通过两种钾通道(ROMK和BK)及K+/Cl-同向转运体(KCC1)分泌。α-间细胞分泌H+并重吸收HCO3-和K+,β-间细胞分泌HCO3-并重吸收H+和Cl-。
【注:原文中"\Join+"疑似为排版错误,可能应为H+,此处保留原文符号】
醛固酮悖论(Aldosterone Paradox)
如前所述,醛固酮(aldosterone)可刺激集合管对NaCl的重吸收和K+的分泌。尽管细胞外液容量(ECFV)减少(即低血容量,参见第35章)和高钾血症(参见第36章)均会升高醛固酮水平,但在这两种情况下肾脏的生理反应存在差异。在ECFV耗竭的情况下,肾脏减少NaCl排泄以恢复ECFV,而K+排泄不伴随变化。相比之下,在高钾血症期间,肾脏增加K+排泄以使血浆[K+]恢复正常,但NaCl排泄不伴随变化。这种现象——醛固酮对尿Na+和K+排泄的表观独立效应——被称为醛固酮悖论(aldosterone paradox)。
该悖论可通过以下观察解释:ECFV耗竭通过激活肾素-血管紧张素系统(RAS)增加醛固酮释放,而高钾血症直接刺激肾上腺释放醛固酮,无需激活RAS。因此,两种情况下醛固酮均升高,但血管紧张素II(angiotensin II)水平仅在ECFV耗竭时升高,而在高钾血症时不升高。正是醛固酮和血管紧张素II对转运过程的差异调节解释了这一悖论。
对ECFV减少的整合生理反应如表34.7所示。在低血容量状态下,血管紧张素II刺激近端小管和远端小管前段对NaCl的重吸收。醛固酮则刺激集合管主细胞(principal cells)中ENaC介导的Na+重吸收。同时,血管紧张素II通过ROMK抑制K+分泌,从而防止K+排泄增加(尽管醛固酮水平升高通常会促进K+分泌)。此外,血管紧张素II对近端小管NaCl和水重吸收的刺激作用还减少了NaCl和液体向集合管的输送,进一步抑制该节段的K+分泌(详见第36章)。
对高钾血症的相应整合生理反应如表34.6所示。在高钾血症期间,醛固酮刺激集合管主细胞中ROMK介导的K+分泌,从而增加尿Na+排泄。尿Na+排泄无变化的原因是:在血管紧张素II未升高的情况下,远端小管前段NCC介导的Na+重吸收减少,这一效应抵消了醛固酮对集合管ENaC的刺激作用。
34.6 调节NaCl与水重吸收的激素
激素对肾小管转运的调节作用
a除醛固酮外,所有激素均在数分钟内起效。醛固酮对NaCl重吸收的作用延迟1小时,数天后达到最大效应。 ANP, 心房钠尿肽;BNP, 脑钠尿肽;BP, 血压;CD, 集合管;DT, 远曲小管;ECFV, 细胞外液容量;[K⁺]ₚ, 血浆K⁺浓度;Posm, 血浆渗透压;PT, 近曲小管;TAL, 髓袢升支粗段。
醛固酮悖论 34.7
CD, 集合管;ENaC, 上皮钠选择性通道。
心房钠尿肽(ANP)和脑钠尿肽(BNP)抑制NaCl和水的重吸收。心房分泌ANP和心室分泌BNP均受ECFV增加和心肌壁压力升高的刺激。ANP和BNP通过降低外周总阻力和增强NaCl与水的尿排泄来降低血压,主要通过增加肾血流量(RBF)和肾小球滤过率(GFR)实现。这些利钠肽扩张入球小动脉并收缩出球小动脉,从而提高GFR和NaCl的滤过量,进而增加NaCl排泄(具体机制参见后文肾小管球平衡的讨论)。此外,RBF的增加会降低髓质间质中NaCl的浓度,从而减少髓袢升支细段对NaCl的被动重吸收(该节段NaCl重吸收的详细机制参见前文)。ANP和BNP还抑制集合管髓质部分的NaCl重吸收,并抑制AVP介导的集合管水重吸收。此外,ANP和BNP也减少垂体后叶AVP的分泌。这些作用通过激活膜结合型鸟苷酸环化酶受体实现,该受体可提高细胞内第二信使环磷酸鸟苷(cGMP)的水平。ANP的利钠和利尿作用强于BNP。
在细胞水平
Sgk1(血清糖皮质激素刺激激酶)是一种丝氨酸/苏氨酸激酶,通过调节肾脏对NaCl和K+的排泄,在维持NaCl和K+稳态中起重要作用。对Sgk1基因敲除小鼠的研究表明,该激酶是动物在严重NaCl限制和K+负荷条件下存活所必需的。NaCl限制和K+负荷会升高血浆[醛固酮]水平,从而快速(数分钟内)增加Sgk1蛋白表达及其磷酸化。磷酸化的Sgk1通过两种机制增强集合管中ENaC介导的Na+重吸收:一是增加主细胞顶质膜中ENaC的数量;二是提高基底外侧膜中Na+,K+-ATP酶泵的数量。磷酸化的Sgk1抑制Nedd4-2(一种泛素连接酶),后者可对ENaC亚基进行单泛素化修饰,从而靶向这些亚基使其通过内吞作用从质膜移除,最终在溶酶体中降解。Sgk1对Nedd4-2的抑制作用降低了ENaC的单泛素化水平,进而减少内吞过程并增加膜通道数量。Sgk1诱导K+通道(ROMK)从细胞内池向质膜转位,从而增强主细胞ROMK介导的K+分泌。Sgk1的这些效应先于醛固酮刺激引起的ENaC、ROMK和Na+,K+-ATP酶数量增加(此过程需时超过4小时),后者最终导致集合管对NaCl和K+转运的二次延迟性增强。Sgk1的激活多态性会引起血压升高,推测机制是增强集合管对NaCl的重吸收,从而增加ECFV并升高血压。
临床视角
利德尔综合征(Liddle syndrome)
利德尔综合征是一种罕见的遗传性疾病,其特征为继发于细胞外液容量(ECFV)增加的高血压(hypertension)。该病由上皮钠通道(epithelial sodium channel, ENaC)的β或γ亚基发生激活突变引起。这些突变会增加主细胞顶膜上的钠通道数量,从而增加钠的重吸收量。在利德尔综合征中,肾脏钠重吸收速率异常升高,导致ECFV增加和高血压。
假性醛固酮减少症(pseudohypoaldosteronism, PHA)存在两种不同形式(即肾脏以醛固酮水平低时的方式重吸收NaCl;然而在PHA中,醛固酮水平是升高的)。常染色体隐性遗传形式由ENaC的α、β或γ亚基失活突变引起。常染色体显性遗传形式的病因是盐皮质激素受体发生失活突变。假性醛固酮减少症的特征包括:钠排泄增加、ECFV减少、高钾血症和低血压。
对于某些ECFV扩张和血压升高的患者,可使用血管紧张素转换酶(angiotensin-converting enzyme, ACE)抑制剂(如Captopril、Enalapril、Lisinopril)进行治疗,以降低体液容量和血压。ACE抑制剂通过阻断血管紧张素I向血管紧张素II的降解,从而降低血浆血管紧张素II水平。血浆血管紧张素II浓度的下降会产生三种效应:
- 肾单位(尤其是近端小管)对NaCl和水的重吸收减少
- 醛固酮分泌下降,从而降低髓袢升支粗段、远曲小管和集合管对NaCl的重吸收
- 由于血管紧张素是强效血管收缩剂,其浓度降低可使全身小动脉舒张,从而降低动脉血压
ACE还可降解血管舒张激素缓激肽(bradykinin),因此ACE抑制剂会增加这种血管舒张激素的浓度。通过促进肾脏NaCl和水排泄,以及降低总外周阻力,ACE抑制剂可减少ECFV并降低动脉血压。
尿鸟苷素(uroguanylin)与鸟苷素(guanylin)
肠道神经内分泌细胞在口服NaCl后分泌这两种激素。它们通过激活膜结合型鸟苷酸环化酶受体(增加细胞内[cGMP]),抑制肾脏对NaCl和水的重吸收。这些肠道来源激素的参与可解释:为何肾脏对口服NaCl负荷产生的利钠反应比静脉输注时更显著。
儿茶酚胺(catecholamines)
儿茶酚胺可刺激NaCl重吸收。交感神经末梢释放的去甲肾上腺素(norepinephrine)和肾上腺髓质分泌的肾上腺素(epinephrine)能刺激近端小管、髓袢升支粗段、远曲小管和集合管对NaCl和水的重吸收。当ECFV正常时交感神经不活跃,但当ECFV下降(如出血后)时,交感神经活性升高会显著增强这四个肾单位节段对NaCl和水的重吸收。
动物生理学教材翻译
多巴胺(dopamine)是一种儿茶酚胺,由肾脏中的多巴胺能神经释放,也可由近端小管(proximal tubule)细胞合成。多巴胺的作用与去甲肾上腺素(norepinephrine)和肾上腺素(epinephrine)相反。细胞外液容量(ECFV)增加会刺激多巴胺分泌,其分泌直接抑制近端小管对NaCl和水的重吸收。
肾上腺髓质素(adrenomedullin)是由肾脏等多种器官产生的52氨基酸肽类激素。它能显著促进利尿和尿钠排泄,其分泌在充血性心力衰竭和高血压时被激活。肾上腺髓质素对肾脏的主要作用是增加肾小球滤过率(GFR)和肾血流量(RBF),从而间接刺激NaCl和水的排泄(参见前文关于ANP和BNP的讨论)。
精氨酸加压素(arginine vasopressin, AVP)是调节肾脏水重吸收最重要的激素(见第35章)。该激素由垂体后叶分泌,响应血浆渗透压升高(≥1%)或ECFV减少(稳态值下降>5%-10%)。AVP可增加集合管对水的通透性,由于集合管壁两侧存在的渗透压梯度(见第35章),它能促进集合管对水的重吸收。AVP对尿NaCl排泄的影响甚微。
Starling力调节近端小管对NaCl和水的重吸收。如前所述,Na⁺、Cl⁻、HCO₃⁻、氨基酸、葡萄糖和水被转运至近端小管细胞间隙。该间隙与管周毛细血管之间的Starling力促使重吸收液进入毛细血管。作用于管周毛细血管壁的Starling力包括:管周毛细血管静水压(Pₚc)与侧向细胞间隙静水压(Pᵢ),以及管周毛细血管胶体渗透压(πₚc)与侧向细胞间隙胶体渗透压(πᵢ)。因此,Na⁺从管腔液转运至侧向细胞间隙所引起的水重吸收会受到Starling力的调节。具体公式如下:
公式34.2
J=K_f\left[\left(Pi-P_pc\right)+\sigma\left(\pi_pc-\pi_i\right)\right]
式中J为液体流动量(正值表示液体从细胞间隙流向血液)。促进物质从间质进入管周毛细血管的Starling力为πₚc和Pᵢ(图34.10)。相反的Starling力为πᵢ和Pₚc。正常情况下,Starling力的总和有利于溶质和水从间质进入毛细血管。然而,部分进入侧向细胞间隙的溶质和液体会反流回近端小管腔。Starling力对髓袢(loop of Henle)、远端小管和集合管的转运无显著影响,因为这些节段对水的通透性低于近端小管。
• 图34.10 斯塔林力调节近端小管溶质和水的重吸收。(1) 溶质和水通过顶膜被重吸收。随后这些溶质和水穿过侧面细胞膜。部分溶质和水重新进入小管液(3),其余进入间质空间并流入毛细血管(2)。箭头宽度与通过路径1至3移动的溶质和水含量成正比。毛细血管壁的斯塔林力决定了通过路径2与路径3的液体量。顶膜上的转运机制决定了进入细胞的溶质和水含量(路径1)。P_j, 间质静水压;P_pc, 管周毛细血管静水压;\pi_i, 间质液胶体渗透压;\pi_pc, 管周毛细血管胶体渗透压。毛细血管壁上的细箭头表示各力作用下水的移动方向。
多种因素可改变近端小管周围管周毛细血管的斯塔林力。例如,出球小动脉的扩张会增加P_pc;而出球小动脉的收缩会降低它。P_pc的升高通过增加NaCl和水通过紧密连接的回漏来抑制溶质和水的重吸收,而P_pc的降低则通过减少紧密连接的回漏来刺激重吸收。
管周毛细血管胶体渗透压(\pi_pc)部分由肾小球超滤液(glomerular ultrafiltrate)的生成速率决定。例如,假设入球小动脉的血浆流量恒定,当超滤液生成减少(即GFR降低)时,进入出球小动脉和管周毛细血管的血浆中蛋白质浓度会降低。因此,\pi_pc降低。故\pi_pc与滤过分数\left(FF=GFR\right/肾血浆流量[RPF])呈正相关。在RPF恒定的情况下,因GFR降低导致的FF下降会减少\pi_pc。这反过来会增加NaCl和水从细胞侧间隙向小管液的回流,从而减少近端小管对溶质和水的净重吸收。FF的升高则产生相反效应。
关键点
- 球管平衡(G-T balance)的机制确保当ECFV正常时,GFR的自发性变化不会显著改变尿液中Na+和水的排泄量。
- Starling forces通过调节管周毛细血管与细胞侧间隙(lateral intercellular space)之间的胶体渗透压(\pi_pc)和静水压差,影响近端小管对溶质和水的重吸收。
- 近端小管前半段对Na+的重吸收与葡萄糖和氨基酸的滤过量相关,因此GFR升高会增加这些溶质的滤过量,进而增强Na+和水的重吸收。
- 管球反馈(tubuloglomerular feedback)机制通过快速调节GFR,减少Na+滤过量的短期波动,从而维持Na+稳态。
- G-T平衡与管球反馈协同作用,在ECFV正常时稳定体液容量和血压。
肾单位的功能性解剖与生理
- 肾单位的四个主要部分(近端小管(proximal tubule)、Henle's loop、远端小管(distal tubule)和集合管(collecting duct))通过选择性重吸收溶质和水以及分泌某些溶质的过程,决定尿液的成分和体积。肾小管对肾小球滤过物质的重吸收使肾脏能够保留必需物质,并通过调节其重吸收程度来维持它们在血浆中的水平。Na+、Cl-、其他阴离子、有机阴离子和阳离子与水的重吸收是肾单位的主要功能。每天约有25,200~mEq的Na+和179~L的水被重吸收。近端小管细胞重吸收67%的肾小球超滤液,Henle's loop的细胞重吸收约25%的滤过NaCl和约15%的滤过水。肾单位的远端部分(远端小管和集合管系统)的重吸收能力较有限。然而,尽管近端小管重吸收了最大比例的滤过溶质和水(即67%),尿液成分和体积的最终调节以及激素与其他因素的主要调控作用主要发生在远端小管和集合管。
- 物质从血液分泌至小管液是排泄多种代谢副产物的途径,也是清除体内外源性有机阴离子、阳离子(如药物)和毒素的方式。许多有机阴离子和阳离子与血浆蛋白结合,因此无法被滤过。因此分泌是它们在尿液中排泄的主要途径。
- 多种激素(包括血管紧张素II(angiotensin II)、醛固酮(aldosterone)、AVP、ANP、BNP、尿扩张素(urodilatin)、尿鸟苷素(uroguanylin)、鸟苷素(guanylin)和多巴胺(dopamine))、交感神经和Starling力共同调节肾脏对NaCl的重吸收。AVP是调节水重吸收的主要激素。
35 体液渗透压与容量的调控
学习目标
完成本章后,学生应能回答以下问题:
- 为何水平衡变化会改变细胞外液(ECF)的[Na+]?
- 精氨酸加压素(AVP)的分泌如何受体液渗透压、血容量和全身血压变化的调控?
- AVP作用于集合管时伴随哪些细胞事件?这些事件如何增加该肾单位节段的水通透性?
- Henle's loop在产生稀释尿和浓缩尿过程中有何作用?
- 髓质间质液的成分是什么?它如何促进尿液浓缩?
- 直小血管(vasa recta)在尿液稀释和浓缩过程中有何作用?
- 如何量化肾脏的稀释和浓缩能力?
- 为何Na+平衡变化会改变细胞外液容量?
- 有效循环容量(effective circulating volume)是什么?Na+平衡如何影响它?它又如何影响肾脏的Na+排泄?
- 哪些机制调控有效循环容量?
- 改变肾脏Na+排泄的主要信号是什么?
- 细胞外液体积的变化如何影响不同肾单位节段中的Na+转运,以及这些变化如何调节肾脏的Na+排泄?
- 哪些机制导致水肿形成,肾脏在此过程中起什么作用?
体液渗透压是人体生理学中受到高度调控的参数之一。肾脏分别通过调节水分和NaCl的排泄来控制体液的渗透压和体积。本章将讨论水分和NaCl排泄的肾脏机制。第2章已回顾了不同体液分区的组成和体积。
体液渗透压的调控:尿液浓缩与稀释
如第2章所述,水约占健康成年人体重的60%。水分分布于两个主要区室——细胞内液(ICF)和细胞外液(ECF),由于水通道蛋白(如Aqp1)使细胞膜对水具有通透性,这两个区室处于渗透平衡状态。体内水分的主要来源是液态食物和含液体成分的固体食物的经口摄入,水也产生于摄入食物的代谢过程(如碳水化合物代谢)。在疾病状态下,静脉输液是重要的水分补充途径。
肾脏负责调节水平衡,且在大多数情况下是体内水分排出的主要途径(表35.1)。水分也会通过胃肠道丢失。正常情况下粪便失水量较少(约100毫升/天),但在腹泻时显著增加(如霍乱时可达20升/天)。呕吐也会导致胃肠道失水。汗液生成是主动的水分和电解质排出过程。通过肾脏、胃肠道和汗腺的水分丢失称为显性失水,因为这些过程可被人体感知。其他水分排出途径包括皮肤细胞和呼吸道的蒸发,这些统称为隐性失水,因其过程不易被察觉。在高温环境、运动时或发热状态下,出汗和隐性失水量会显著增加(表35.2)。
尽管出汗、排便以及肺部和皮肤蒸发导致的水分丢失会因环境条件或疾病状态而变化,但这些途径的水分丢失不可调控。相比之下,肾脏的水分排泄受到严格调控以维持水平衡。维持水平衡需要水分摄入与丢失精确匹配。若摄入超过丢失,则存在正水平衡;反之若摄入低于丢失,则存在负水平衡(稳态平衡详见第2章)。
35.1 水平衡的调节
当摄水量减少或水分过度流失时,肾脏通过生成低容量、高渗(相对于血浆)的浓缩尿来保存水分。反之,当摄水量较高时,则会产生大量低渗尿。健康个体的尿液渗透压(urine osmolality,U_osm)可在约50至1200mOsm/kgH_2O之间变化,相应的尿量范围约为每日18升至\bar0.5~升。重要的是,肾脏能够独立于总溶质(如Na+、K+、尿素等)的排泄来调节水的排泄(图35.1)。这种独立调节水排泄的能力对生存至关重要,因为它可以在不影响肾脏其他稳态功能的前提下实现水平衡。
需要明确的是,水平衡紊乱表现为体液渗透压的改变,通常通过血浆渗透压(plasma osmolality,P_osm)的变化来检测。由于血浆渗透压的主要决定因子是Na+(及其伴随阴离子Cl-和HCO_3~.~),这些紊乱也会导致血浆或血清[Na+]的变化(图35.2)。临床上最常见的体液电解质紊乱之一即是血清[Na+]的异常。当发现个体血清[Na+]异常时,常被误认为是Na+平衡问题。然而,这类问题通常与水平衡相关,而非Na+平衡。如后文所述,Na+平衡的改变会导致细胞外液容量(ECFV)而非其渗透压的变化。
室温(23°C)下成人的水获取与流失途径
a液体摄入量可能因社会文化因素存在显著个体差异
图35.1 血浆抗利尿激素(AVP)水平与尿液渗透压、尿流率及总溶质排泄量的关系。Max:最大值;Min:最小值。(引自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
T3A5B.L2E 环境温度与运动对成人水流失与摄入的影响
| 正常温度 | 炎热天气a | 长时间剧烈运动a | |
| 水分流失 | |||
| 不感流失(Insensible loss) | |||
| 皮肤 | 350 | 350 | 350 |
| 肺 | 350 | 250 | 650 |
| 汗液 | 100 | 1400 | 5000 |
| 粪便 | 100 | 100 | 100 |
| 尿液a | 1600 | 1200 | 500 |
| 总流失量 | 2500 | 3300 | 6600 |
a在炎热天气和长时间剧烈运动期间,通过增加水分摄入维持水平衡。仅靠肾脏减少水分排出不足以维持水平衡。
肾脏通过排泄1升低渗尿液(hypoosmotic urine)排出水分,使容量恢复至14\textiota,并使[N a+]和渗透压恢复正常。
当个体饮水时,肾脏排泄高渗尿液(hyperosmotic urine),使容量恢复至14\perp,并使[N a+]和渗透压恢复正常。 • 图35.2 对水平衡变化的反应。图示为在70公斤个体ECF中增减1升水的影响。正水平衡:(1)增加1升水使ECFV升高并降低其渗透压,[Na+]也降低(低钠血症);(2)正常肾脏反应是排泄1升低渗尿液;(3)通过肾脏排水,ECFV、渗透压和\left[N a+\right]恢复正常。负水平衡:(4)ECF流失1升水使其容量减少、渗透压升高,[Na+]也升高(高钠血症);(5)肾脏通过排泄少量高渗尿液来保存水分;(6)通过口渴刺激饮水和肾脏保水,ECF容量、渗透压及[Na+]恢复正常。方框大小表示ECF相对容量。(From Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
临床视角
在临床中,低渗状态(血浆渗透压降低)会使水分进入细胞,导致细胞肿胀(见第2章)。低渗状态相关症状主要与脑细胞肿胀有关,例如P_o s m快速下降可影响神经功能,导致恶心、不适、头痛、意识模糊、嗜睡、癫痫发作和昏迷。当P_o s m升高(即高渗状态)时,细胞会失水。高渗状态的症状也以神经系统为主,包括嗜睡、乏力、癫痫发作、昏迷甚至死亡。
体液渗透压改变相关的临床症状
与体液渗透压变化相关的临床症状因变化速度而异。快速发生的渗透压变化(即数小时内)相对于逐渐发生的变化(即数天至数周内)耐受性较差。事实上,长期(数周至数月)发生体液渗透压改变的个体可能完全无症状。这反映了神经元通过补偿机制随时间推移最大限度地减少细胞体积变化。例如,细胞通过清除细胞内渗透颗粒(osmoles)应对低渗状态,同时生成新的细胞内渗透颗粒应对高渗状态(参见第2章)。
下文将讨论肾脏排泄低渗(稀释)或高渗(浓缩)尿液的机制,并阐述精氨酸加压素(arginine vasopressin, AVP)分泌的调控及其在调节肾脏排水功能中的核心作用(另见第41章)。
精氨酸加压素
精氨酸加压素(arginine vasopressin, AVP)是一种九肽(nonapeptide),在下丘脑视上核(supraoptic nucleus, SON)和室旁核(paraventricular nucleus, PVN)合成。AVP通过加压素(vasopressin, V)受体发挥作用。多个肾单位节段表达2型受体(V₂),该受体介导肾脏调节尿量和渗透压的能力。当血浆AVP水平降低时,大量尿液被排出(利尿效应),且尿液渗透压低于血浆(即稀释尿);当血浆AVP水平升高时,少量尿液被排出(抗利尿效应),且尿液渗透压高于血浆(即浓缩尿)。因此,AVP也被称为抗利尿激素(antidiuretic hormone, ADH)。
神经垂体分泌AVP受多种因素影响。生理条件下,AVP分泌受两大机制调控:渗透压性(血浆渗透压变化)和血流动力学性(血压或血容量变化)。其他影响AVP分泌的因素包括恶心、急性低血糖、血管紧张素II(刺激作用)和心房利钠肽(抑制作用)。多种药物和娱乐性药物可影响AVP分泌,例如尼古丁刺激分泌,而乙醇和止吐药抑制分泌。
• 图35.3 下丘脑与垂体解剖结构(正中矢状切面)显示AVP分泌通路。同时展示了调控AVP分泌的相关通路。来自压力感受器的传入纤维通过迷走神经和舌咽神经传导。插图为下丘脑与垂体结构的放大示意图。
AT THE CELLULAR LEVEL
AVP分泌的渗透压调控
体液渗透压的变化在调节AVP分泌中起最重要的作用。位于下丘脑终极板血管器(organum vasculosum of the lamina terminalis, OVLT)的特化神经元——渗透压感受器(osmoreceptors),可感知275至295 mOsm/kg H₂O正常范围内的渗透压变化。这些渗透压感受细胞通过有效溶质(如Na⁺及其阴离子)浓度的微小变化来感知体液渗透压的改变,而对无效溶质(如尿素和葡萄糖)无反应(参见第1章)。
有效溶质指那些缓慢或完全不能穿透细胞的物质,从而形成渗透梯度导致水跨细胞膜外流。当有效血浆渗透压(张力)升高时,渗透压感受细胞的皱缩会激活膜非选择性阳离子通道,产生内向电流使细胞去极化。随后,OVLT神经元中由渗透压触发的动作电位通过突触将电活动传递至视上核(SON)和室旁核(PVN)的下游效应神经元,最终引发AVP释放。相反,当有效血浆渗透压降低时,AVP的合成和分泌被抑制。由于AVP在血浆中迅速降解,其循环水平可在数分钟内降至零。最新数据显示,决定渗透压感受器活性的因素是细胞膜牵张而非细胞体积。
哺乳动物的渗透压刺激由瞬时受体电位香草素(transient receptor potential vanilloid, TRPV)阳离子通道家族介导,包括TRPV1、TRPV2和TRPV4。这些通道通过细胞膜牵张激活,并在低渗状态下介导渗透压感受器的失活。目前尚不清楚高渗状态下响应细胞皱缩的牵张失活阳离子通道(stretch-inactivated cationic channels)的分子介质。
渗透压感受器(osmoreceptors)的激活与抑制成分通过协同作用形成阈值(threshold)或调定点(set point)。图35.4A展示了血浆渗透压(plasma osmolality)变化对循环中AVP水平的影响。该关系的斜率十分陡峭,反映了系统的敏感性。调定点指AVP分泌开始增加时对应的血浆渗透压值,低于此值时几乎不释放AVP。由于遗传因素对系统调定和敏感性的影响,不同个体中AVP达到最低有效浓度和最高有效浓度时对应的有效血浆渗透压绝对值存在显著差异。但AVP释放的平均调定点对应血浆渗透压为280mOsmol/kgH_2O,通常仅需升高2%至4%即可达到最大抗利尿效果。健康个体的调定点相对稳定,但妊娠、月经周期、雌激素水平升高或血压/血容量显著下降时可使其降低。妊娠期间调定点偏移的机制可能与某些激素(如松弛素(relaxin)和绒毛膜促性腺激素(chorionic gonadotropin))水平升高有关。
• 图35.4 AVP分泌的渗透压和血流动力学(非渗透压)调控。A、血浆渗透压变化(血容量和血压恒定)对血浆AVP水平的影响;B、血容量或血压变化(血浆渗透压恒定)对血浆AVP水平的影响;C、渗透压刺激与血容量/血压刺激对血浆AVP水平的交互作用
血流动力学(非渗透压)对AVP分泌的调控
在循环系统中
血容量或血压下降也会刺激AVP分泌。负责这一反应的感受器同时位于循环系统的低压侧(左心房和大肺血管)和高压侧(主动脉弓和颈动脉窦)。由于低压感受器位于循环系统的高顺应性侧(即静脉侧),且大部分血液存在于静脉侧,这些低压感受器可被视为对整体血管容量作出反应。高压感受器则对动脉压作出反应。两组感受器都对所在结构壁的牵张敏感(如心心房和主动脉弓),因此被称为压力感受器(baroreceptors)。
来自这些感受器的信号通过迷走神经和舌咽神经的传入纤维传递至脑干(延髓的孤束核),这是调节心率和血压中枢的一部分(另见第18章)。信号随后从脑干中继至下丘脑视上核和室旁核的AVP分泌细胞。压力感受器系统的敏感性低于中枢渗透压感受器,需要血容量或血压下降5%到10%才能刺激AVP分泌。这一机制如图35.4B所示。
多种物质已显示通过影响血压来改变AVP分泌。包括缓激肽(bradykinin)和组胺(histamine)——它们降低血压从而刺激AVP分泌,以及去甲肾上腺素(norepinephrine)——其升高血压并抑制AVP分泌。
血容量和血压的变化也会影响对体液渗透压变化的反应(见图35.4C)。当血容量或血压下降时,调定点会向更低渗透压值偏移,且相关曲线的斜率变得更陡峭。从个体生存角度来看,这意味着面临循环衰竭时,肾脏将继续保留水分,即使这样做会降低体液的渗透压。当血容量或血压升高时,则发生相反情况:调定点向更高渗透压值偏移,曲线斜率降低。
临床应用
垂体后叶AVP释放不足会导致大量稀释尿的排泄(多尿症)。为补偿水分丢失,个体必须摄入大量水分(烦渴)以维持体液渗透压恒定。若个体被限制饮水,体液将变为高渗状态。这种情况称为中枢性(垂体性)尿崩症(central diabetes insipidus, CDI)。该病可遗传,但较为罕见。CDI更常见于头部创伤后以及脑肿瘤或感染时。CDI患者的尿液浓缩缺陷可通过外源性AVP给药纠正。
遗传性(常染色体显性)CDI由AVP基因不同区域的突变引起(即AVP、copeptin和神经垂体素)。人类胎盘产生的半胱氨酸氨肽酶可降解AVP。某些女性因血管加压素酶水平过高而导致尿崩症。相关多尿症状可通过合成AVP类似物去氨加压素(desmopressin, DDAVP)治疗。
抗利尿激素分泌异常综合征(SIADH)
抗利尿激素分泌异常综合征(Syndrome of Inappropriate AVP (ADH) Secretion,SIADH)是一种相对常见的临床问题,其特征是血浆AVP水平升高超出根据体液渗透压、血容量或血压预期的范围——因此称为"不适当"的AVP(ADH)分泌。AVP在肾脏集合管的作用导致水通道(见下文)的募集,从而增强AVP刺激肾脏水潴留的效应。SIADH患者会潴留水分,其体液逐渐变为低渗状态。此外,基于体液低渗状态,其尿液呈现超出预期的高渗性。SIADH可由药物、中枢神经系统感染或肿瘤、肺部疾病或肺癌引发。这些病理状态通过改变AVP分泌细胞的神经输入来刺激AVP分泌,或直接分泌AVP(如小细胞癌)。药物相关性SIADH日益常见,可能与多种非处方药和处方药相关,包括质子泵抑制剂(proton pump inhibitors)、非甾体抗炎药、抗抑郁药、抗惊厥药、抗精神病药和抗肿瘤药。AVP受体拮抗剂通过与\vee_\mathtt1A和V_2受体结合,诱导水利尿(aquaresis),用于治疗SIADH及其他由AVP依赖性肾脏水潴留引起的病症(如充血性心力衰竭和肝硬化)。
AVP对肾脏的作用
AVP对肾脏的主要作用是通过增加远端小管后段和集合管对水的通透性,促进肾小管液中水的重吸收。此外,AVP还显著增加集合管髓质段对尿素(urea)的通透性。最后,AVP可刺激亨利袢(Henle’s loop)升支粗段、远端小管和集合管对NaCl的重吸收。
在缺乏AVP的情况下,位于远端小管后段及集合管的主细胞(principal cells,参见第34章)顶膜对水的通透性较低。这反映了以下事实:在AVP缺失时,这些细胞的顶膜仅含有少量水通道(aquaporins),因为这些通道储存在细胞内。因此,缺乏AVP时,这些肾单位节段几乎不重吸收水分。当AVP与主细胞基底外侧膜上的V_2受体结合后,会促使水通道蛋白(AQP2)募集到顶膜,使水从管腔进入细胞。随后,这些水通过基底外侧膜的AQP3和AQP4水通道(因其固有通透性)离开细胞。因此,在AVP存在时,水从肾小管中被重吸收。
细胞水平机制(AT THE CELLULAR LEVEL)
水通道蛋白的调节机制
编码V₂受体的基因位于X染色体,其表达的371个氨基酸蛋白质属于具有七个跨膜结构域并与异源三聚体G蛋白偶联的受体家族。如图35.5所示,精氨酸加压素(AVP)与基底侧膜上的受体结合会激活腺苷酸环化酶。细胞内环磷酸腺苷(cAMP, cyclic adenosine monophosphate)水平升高可激活蛋白激酶A(PKA, protein kinase A),导致AQP2水通道磷酸化,并通过激活cAMP反应元件(CRE, cAMP-response element)增强AQP2基因的转录。
含有磷酸化AQP2的胞内囊泡在分子马达动力蛋白的驱动下沿微管向顶膜移动。当接近顶膜时,SNARE蛋白与含AQP2的囊泡相互作用,促进其与质膜融合。AQP2嵌入膜后,在渗透压梯度(管腔渗透压 < 细胞渗透压)驱动下允许水分子进入细胞。随后水分通过基底侧膜上组成型表达的AQP3和AQP4水通道排出细胞。当V₂受体未被AVP占据时,AQP2水通道通过网格蛋白介导的内吞作用从顶膜移除,从而使顶膜对水不通透。被内吞的AQP2分子可储存于胞内囊泡(血浆AVP水平升高时可重新插入顶膜)或被降解。
AVP还调控AQP2和AQP3的长期表达。长期大量摄入水分(如精神性烦渴)会减少主细胞中AQP2和AQP3的数量,导致限水时无法最大程度浓缩尿液。反之,限水状态可增加主细胞中AQP2和AQP3的表达,促进最大尿浓缩。
在伴有尿液浓缩稀释功能障碍的病理状态下,AQP2(有时包括AQP3)的表达会发生改变。尿浓缩能力受损的情况(如高钙血症、低钾血症)中AQP2表达降低,而水潴留状态(如充血性心力衰竭、肝硬化、妊娠)中AQP2表达增加。
AVP还通过增加髓质内层集合管末段对尿素的通透性,促进尿素重吸收,从而提高髓质间质液渗透压(这是实现最大尿浓缩的必要条件)。该段上皮细胞表达两种尿素转运体(UT, urea transporter):顶膜定位的UT-A1和基底侧膜定位的UT-A3。AVP通过cAMP/PKA信号级联上调UT-A1和UT-A3表达。此外,肾髓质间质液渗透压升高(通过磷脂酶C/蛋白激酶C(PKC, protein kinase C)通路)也可增强UT-A1和UT-A3表达,从而提高该段对尿素的通透性。
【注】原文中"heterotrimeric proteins"的符号显示异常,根据上下文判断应为"G proteins",此处译为"G蛋白";"SNAREs"为专业术语保持原文不译。
• 图35.5 精氨酸加压素(AVP)通过V_2受体对远曲小管末端和集合管主细胞(principal cell)的作用机制。详见正文。AC,腺苷酸环化酶;AP2,水通道蛋白2基因;AQP2,水通道蛋白2;cAMP,环磷酸腺苷;CRE,cAMP反应元件;CREB-\cdot P,磷酸化cAMP反应元件结合蛋白;P,磷酸化蛋白。(改编自Brown D, Nielsen S. The cell biology of vasopressin action. In: Brenner BM, ed. The Kidney. 7th ed. Philadelphia: Saunders; 2004.)
AVP还刺激Henle袢升支粗段、远曲小管和集合管皮质段的NaCl重吸收。这种Na+重吸收的增加与三种Na+转运体数量的增加相关:Na+/K+/2Cl-同向转运体(Henle袢升支粗段)、Na+/Cl-同向转运体(远曲小管)以及Na+通道ENaC(远曲小管末端和集合管)。对升支粗段NaCl转运的刺激作用有助于维持髓质高渗状态,这对集合管髓质段的水分重吸收至关重要(见下文)。
临床聚焦
当集合管对AVP无法产生正常反应时,尿液无法达到最大浓缩度,导致多尿和烦渴。该临床病症称为肾性尿崩症(nephrogenic diabetes insipidus, NDI),以区别于中枢性尿崩症。NDI可由多种全身性疾病引起,少数为遗传性。获得性NDI由集合管AQP2表达减少所致,AQP2表达降低会损害低钾血症(hypokalemia)、锂摄入(约35%双相情感障碍患者长期服用锂制剂会出现不同程度的NDI)、尿路梗阻、低蛋白饮食和高钙血症等情况下的尿液浓缩能力。AVP V_2受体AVPR2基因或AQP2基因的突变会导致遗传性NDI。约90%的遗传性病例由AVPR2基因突变引起,其余10%由AQP2基因突变导致。由于AVPR2基因位于\textsfX染色体上,其突变会导致X连锁NDI。AQP2基因位于12号染色体,其突变可导致常染色体隐性遗传型NDI,极少数情况下导致常染色体显性遗传型NDI。AQP2通道在细胞膜上以同源四聚体形式发挥作用。导致隐性NDI的突变会影响AQP2基因中与同源四聚体水通道孔形成相关的区域。杂合携带者可同时产生正常和缺陷型AQP2单体。由于缺陷型AQP2单体会滞留在内质网中,水通道仅由正常单体形成,因此携带者无症状。与此相反,导致显性NDI的突变会影响AQP2基因中与翻译后修饰(如AQP2磷酸化)相关的区域,而非水通道孔区域。
抗利尿激素不适当分泌综合征(NSIAD)
AVPR2基因的功能获得性(gain-of-function)突变会导致肾源性抗利尿不适当综合征(nephrogenic syndrome of inappropriate antidiuresis, NSIAD)。在这种X染色体连锁的疾病中,V_2受体处于持续性激活状态。患者的实验室检查结果与SIADH相似,包括血浆渗透压降低、低钠血症(血浆[Na+]降低)以及尿液浓缩程度超过体液渗透压降低的预期水平。然而,与SIADH不同(SIADH患者循环中AVP水平升高并导致肾脏水潴留),这些患者的血浆AVP水平无法检测到。
口渴
口渴感知受血浆渗透压、血容量或血压变化的影响。血浆渗透压升高以及血容量或血压下降会增强口渴感。在这些刺激中,高渗透压的作用更强——仅升高2%至3%即可引发强烈的饮水欲望,而血容量丢失或血压下降需达到10%至15%才能产生同等程度的口渴反应。
如前所述,AVP分泌存在由基因决定的阈值(即当体液渗透压超过该值时,AVP分泌增加)。类似地,触发口渴感也存在基因决定的阈值。然而,口渴阈值高于AVP分泌阈值。平均而言,AVP分泌阈值约为280mOsm/kg\ H_2O,而口渴阈值约为295mOsm/kg\ H_2O。由于这种差异,当AVP分泌接近最大时(对应体液渗透压水平),口渴感才会被激活。
调节水摄入的中枢(口渴中枢)位于下丘脑,与调节AVP分泌的区域相同。但目前尚不确定是否由同一细胞执行这两种功能。实际上,与AVP分泌调节类似,口渴反应仅对有效溶质(如NaCl)产生应答。关于血容量或血压下降引发口渴反应的神经通路所知更少,但推测其与调节AVP分泌的血容量和压力相关通路相同。血管紧张素II(angiotensin II)通过作用于口渴中枢的细胞也能诱发口渴感。由于血容量和血压下降时血管紧张素II水平会升高,这种效应有助于通过稳态反应恢复并维持体液于正常容量。
通过饮水行为即可缓解口渴感,甚至在胃肠道吸收足量水分以纠正血浆渗透压之前就会发生。值得注意的是,冷水缓解口渴感的效果更显著。这一反应可能涉及口咽部和上胃肠道的受体。但通过这些受体缓解口渴感的作用短暂,只有血浆渗透压、血容量或血压恢复正常时,口渴感才会完全消失。
显然,AVP(精氨酸加压素)和口渴系统协同工作以维持水稳态。血浆渗透压升高会引发饮水行为,并通过AVP在肾脏的作用促进水分重吸收。相反,当血浆渗透压降低时,口渴感被抑制,且在缺乏AVP的情况下,肾脏水分排泄增加。当液体摄入由文化和社会因素而非口渴驱动时,维持正常体液渗透压完全依赖肾脏的排水能力。本章后续章节将详细讨论肾脏实现这一功能的机制。
临床相关知识
在可获得充足水分的情况下,口渴机制能预防高渗状态的发生。该机制可解释中枢性尿崩症(CDI)和肾性尿崩症(NDI)患者多尿引发的烦渴(polydipsia)现象。多数个体即使没有口渴感也会摄入水/饮料。正常情况下,肾脏可通过排泄高达18升/天的尿液来处理这些过量水分。然而在某些情况下,尤其是短时间内摄入的水量可能超过肾脏的排泄能力,此时体液将呈现低渗状态。
马拉松长跑是水分摄入超过肾脏排泄能力的典型案例。一项针对波士顿马拉松参赛者的研究发现,13%的跑者在比赛中出现低钠血症。b 这反映部分跑者为保持"良好水合状态"而在比赛中过量摄入水或其他低渗饮料的普遍做法。此外,运动中肌糖原和甘油三酯代谢也会产生水分。由于比赛中水分摄入量和内生水量超过肾脏排泄量与汗液流失量的总和,跑者出现正水平衡,最终导致低钠血症。部分参赛者的低钠血症严重到足以引发神经系统症状。
肾脏的最大排水能力取决于溶质排泄量,而后者又受食物摄入量影响。例如,当尿液达到最大稀释度(Uosm=50mOsm/kg H2O)时,仅当溶质排泄速率为900mmol/天时才能实现18升/天的最大尿量:
\beginarrayrU_\circs m=S O|U t ee x c r e t i o n/V o l u m ee x c r e t e d\ \Gamma50m O s m/k g H_2O=900m m o l/18L\endarray
若溶质排泄减少(如老年人因进食减少常见的情况),最大尿量将相应降低。例如当溶质排泄仅为400mmol/天时,在Uosm=50mOsm/kg H2O条件下最大尿量仅能达到8升/天。因此食物摄入减少的个体排水能力会下降。
bAlmond CS, et al. Hyponatremia among runners in the Boston Marathon. N Engl J Med; 2005;352:1150-1556.
肾脏稀释与浓缩尿液的机制
如前所述,水的排泄与溶质的排泄是分开调节的。要实现这一点,肾脏必须能够排出相对于体液呈低渗(hypoosmotic)或高渗(hyperosmotic)的尿液。这种排出不同渗透浓度尿液的能力,要求肾单位某段能将溶质与水分离。如第34章所述,近端小管的溶质重吸收会导致相应比例的水分重吸收。因此,溶质和水在肾单位的这一部分并未分离。此外,无论肾脏排出稀释尿还是浓缩尿,近端小管的水与溶质重吸收之间都保持这种比例关系。因此,近端小管重吸收了大部分滤过的溶质和水分,但并未产生稀释或浓缩的小管液。亨利袢(loop of Henle),尤其是厚壁升支(thick ascending limb),是溶质与水分离的主要部位。因此,稀释尿和浓缩尿的排出都需要亨利袢的正常功能。
• 图35.6 存在精氨酸加压素(+AVP)和不存在(−AVP)时肾单位各段小管液的渗透浓度。详见正文。(改编自Sands JM等. Urine concentration and dilution. 见: Taal MW等主编. Brenner and Rector's The Kidney. 第9版. Philadelphia: Saunders; 2012.)
低渗尿的排泄相对容易理解。肾单位只需从小管液中重吸收溶质,同时阻止水的重吸收。如前所述(后续将更详细描述),溶质重吸收而不伴随水重吸收的现象发生在亨利袢升支。在适当条件下(即缺乏AVP时),远曲小管和集合管也通过重吸收溶质但不重吸收水分来稀释小管液。
高渗尿(即尿液浓缩)的排泄更为复杂,本质上是将水从小管液中移除而不带走溶质。由于水的移动是被动的,由渗透梯度驱动,肾脏必须建立一个高渗区室,使水分能通过渗透作用从管腔液中被重吸收而不伴随溶质。实现这一功能的高渗区室是肾髓质间质。亨利袢对生成高渗的髓质间质至关重要。一旦建立,这个高渗区室驱动水从集合管重吸收,从而实现尿液浓缩。
图35.6总结了在AVP存在和缺失时,肾单位各点的小管液渗透浓度。需注意:从近端小管进入亨利袢的小管液与血浆等渗,且无论AVP是否存在均是如此;此外,无论AVP是否存在,离开厚壁升支的小管液相对于血浆呈低渗。在AVP缺失时,沿集合管的小管液渗透浓度相对于血浆呈低渗;而在AVP存在时,其渗透浓度逐渐升高(即从皮质到内髓质)形成高渗。
髓质高渗状态的建立与维持
自1940年代以来,髓质高渗状态的建立与维持一直是研究课题,目前模型仍不完善。尽管普遍认为外髓部通过称为逆流倍增机制(countercurrent multiplication)的主动过程参与渗透梯度的形成,但内髓部梯度的来源仍未完全明确。需要说明的是,当前模型仍需完善,此处介绍该模型是因为其体现了该过程的一些基本概念。
逆流倍增机制涉及亨氏袢(Henle’s loop)升支向周围髓质间质主动重吸收溶质(主要为NaCl)而不伴随水的重吸收。这会降低小管液的渗透压,同时提高该处间质的渗透压。间质渗透压的升高进而促使水从亨氏袢降支重吸收,从而增加该段小管液的渗透压。因此,在亨氏袢的任意位置,升支内液体的渗透压均低于相邻降支内的液体。这种渗透压差异被称为单一效应(single effect)。由于降支(液体流向髓质)与升支(液体流出髓质)中液体呈逆流方向流动,这种单一效应可被放大,最终形成髓质间质内的渗透梯度:肾乳头尖端的渗透压可达1200mOsm/kgH_2O,而皮髓交界处仅为300mOsm/kgH_2O。
图35.7示意了尿液稀释与浓缩的过程。这些过程基于三个关键概念:
- 尿液浓缩依赖于集合管(collecting duct)中AVP介导的水分重吸收。
- 亨氏袢升支对NaCl的重吸收稀释了小管液,同时使髓质间质中形成高[NaCl](肾乳头尖端可达600mmol/L),后者驱动集合管中水分的重吸收。
- 尿素在髓质间质中积累(高达600mmol/L),这使得肾脏能够排出具有相同高尿素浓度的尿液。这种机制允许大量尿素以相对较少的水分排出。首先需要理解当抗利尿激素(AVP)水平低下或缺如时,肾脏如何排出稀释尿液(水利尿或水排泄)。以下编号对应图35.7A中的圈注数字:
- 从近端小管进入Henle袢降支细段的液体与血浆等渗。这反映了近端小管溶质和水的重吸收本质上是等渗的(参见第34章)。(注:水通过AQP1从近端小管各段被重吸收)
- 水从Henle袢降支细段被重吸收。大部分水在外髓质被重吸收,从而限制进入内髓质最深部间质的含水量,维持该区域的高渗状态。(注:水通过AQP1被重吸收)
- 在内髓质,降支细段的末端部分和整个升支细段对水不通透。(注:此处不表达AQP1)这些相同的肾单位节段表达Cl-通道CLCN1,介导Cl-的重吸收,Na+则通过细胞旁途径随之移动。这种不伴随水重吸收的NaCl被动重吸收过程启动了小管液的稀释。
- Henle袢升支粗段同样对水不通透,并主动从小管液重吸收NaCl,从而进一步稀释液体(参见第34章)。此处的稀释作用如此显著,使得该节段常被称为肾脏的稀释段。离开升支粗段的液体相对于血浆呈低渗(见图35.6)。
- 远曲小管和集合管的皮质部分主动重吸收NaCl。在缺乏AVP时,这些节段对水不通透(即细胞顶膜不含AQP2)。因此当AVP缺如或水平低下时(如血浆渗透压降低),由于NaCl在无水重吸收的情况下被重吸收,小管液渗透压进一步降低。在此状态下,离开集合管皮质部的液体相对于血浆呈低渗(见图35.6)。
- 髓质集合管主动重吸收NaCl。即使缺乏AVP,该节段仍具有轻微水通透性,部分水被重吸收。
- 尿液渗透压可低至约50mOsm/kgH_2O,且含有低浓度NaCl。每日尿量最高可达18升,约为肾小球滤过率(GFR)的10%。
接下来将讨论当血浆渗透压和血浆AVP水平升高时,肾脏如何排出浓缩尿液(抗利尿)。以下编号对应图35.7B中的圈注数字:
1–4. 这些步骤与稀释尿的生成过程相似。理解浓缩尿如何生成的一个关键点是认识到:虽然Henle袢(loop of Henle)的升支细段和粗段对NaCl的重吸收稀释了小管液,但被重吸收的NaCl在髓质间质中积累并提高了该区域的渗透压。髓质间质中NaCl的积累对于生成高渗于血浆的尿液至关重要,因为它为髓质集合管(medullary collecting duct)的水分重吸收提供了渗透驱动力。如前所述,AVP通过刺激Henle袢粗升支的NaCl重吸收,在髓质集合管向该区域添加水分(这可能导致渗透梯度消散)时维持髓质间质渗透梯度。
- 由于Henle袢升支对NaCl的重吸收,到达集合管的小管液相对于周围间质液呈低渗状态。因此,在集合管两侧建立了渗透梯度。当存在AVP时(AVP通过将AQP2插入细胞顶膜,增加远曲小管(distal tubule)后段和集合管的水通透性),水分从管腔扩散出去,小管液渗透压升高。这种水分从集合管腔扩散出去的过程启动了尿液浓缩机制。远曲小管和集合管皮质段小管液能达到的最大渗透压约为290mOsm/kgH_2O(即与血浆相同),这与肾脏皮质内间质液和血浆的渗透压一致。
- 当小管液向髓质深部下行时,水分继续从集合管重吸收,使小管液渗透压在乳头尖端处升高至1200mOsm/kgH_2\dotO。
A
Antidiuresis • 图35.7 参与尿液稀释与浓缩的肾单位节段示意图。显示近髓肾单位(juxtamedullary nephrons)的Henle袢。A,稀释尿(水利尿)排泄机制。AVP缺失时集合管对水基本不通透。注意在水利尿状态下,由于直小血管(vasa recta)血流量增加和部分尿素进入髓质集合管,髓质间质的渗透压会降低。B,浓缩尿(抗利尿)排泄机制。血浆AVP水平达峰值,集合管对水高度通透。此状态下髓质间质渗透梯度最大。详见正文。
- 当AVP水平升高时生成的尿液渗透压为1200mOsm/kgH_2O,含有高浓度尿素和其他未被重吸收的溶质。此状态下尿量可低至0.5\:L/天。
髓质间质组织
通过比较上述两种生理状态,可以明显看出:相对恒定量的低渗小管液被输送至肾单位对AVP敏感的部分(远曲小管后段和集合管)。此时血浆AVP水平决定了这些节段对水的重吸收量。当AVP水平较低时,这些节段重吸收的水量相对较少,从而排出大量低渗尿液(可达滤过水量的10%)。当AVP水平较高时,这些相同节段重吸收大量水分,仅排出少量高渗尿液(<滤过水量的1%)。在抗利尿状态(antidiuresis)下,大部分水分在远曲小管、集合管皮质部及外髓部被重吸收。因此,仅有少量液体到达内髓部集合管并被重吸收。这种沿集合管全长分布的水分重吸收模式(即皮质部 > 外髓部 > 内髓部)通过最小化进入内髓部的水量,维持了内髓部高渗的间质环境。
髓质间质组织
如前所述,肾脏髓质间质液在尿液浓缩过程中具有关键作用。间质液的渗透压为髓袢降支细段和集合管的水分重吸收提供驱动力。髓质间质液的主要溶质是NaCl和尿素,但这些溶质的浓度在整个髓质并非均匀分布(即存在从皮质到肾乳头的梯度)。其他溶质(如NH_4+和K+)也会在髓质间质中积聚,但含量最高的溶质仍是NaCl和尿素。为简化讨论,本节假设NaCl和尿素是唯一的溶质。
如图35.8所示,NaCl和尿素在肾髓质积聚,内髓部乳头尖端的间质液最高渗透浓度可达1200mOsm/kgH_2O,其中约600mOsm/kgH_2O来自NaCl(300mmol/L),另600mOsm/kgH_2O来自尿素(600mmol/L)。NaCl梯度的建立在外髓部与内髓部交界处基本完成。
髓质中的NaCl浓度梯度来源于逆流倍增(countercurrent multiplication)过程中髓质肾单位节段重吸收的NaCl积累。在此过程中最重要的结构是髓袢升支。髓质间质内的尿素积累机制更为复杂,在排泄高渗尿液(即抗利尿状态)时最为有效。当产生稀释尿液时(尤其是长期持续状态),髓质间质的渗透压会下降(见图35.7A)。这种渗透压降低几乎完全由尿素浓度下降所引起,反映了直小血管(后文讨论)的冲刷作用,以及尿素从间质向集合管髓质部分管腔液的扩散——即使在没有AVP的情况下,该段对尿素也具有通透性。(注:集合管的皮质部和外髓部对尿素通透性较低,而内髓部由于存在尿素转运蛋白UT-A1和UT-A3,其通透性相对较高,这些转运蛋白的表达受AVP上调。)部分被重吸收的尿素通过尿素转运蛋白UT-A2分泌至髓袢降支细段,另一部分则通过UT-B转运蛋白进入直小血管。分泌至髓袢降支细段的尿素随后被"截留"在肾单位内,直到再次到达髓质集合管时重新进入髓质间质。因此,尿素在间质和肾单位之间形成循环。这种尿素再循环过程促进了髓质间质中尿素的积累,使其在乳头尖端浓度可达600mmol/L。
• 图35.8 髓质间质梯度主要由NaCl和尿素构成。图中NaCl和尿素的浓度反映抗利尿状态(即排泄高渗尿液)时的水平。详见正文。(改编自Sands JM等. Urine concentration and dilution. 见: Taal MW等编. Brenner and Rector’s The Kidney. 第9版. Philadelphia: Elsevier; 2012.)
髓质高渗状态的维持机制
如前所述,高渗髓质(hyperosmotic medulla)对于浓缩集合管中的小管液至关重要。由于集合管的水分重吸收由髓质间质建立的渗透梯度驱动,尿液渗透浓度永远无法超过乳头区间质液的浓度。因此,任何降低髓质间质渗透浓度的病理状态都会损害肾脏最大程度浓缩尿液的能力。髓质间质中的尿素(urea)对尿液总渗透浓度有贡献。然而,由于内髓集合管(inner medullary collecting duct)对尿素具有高通透性(尤其是在AVP存在时),尿素无法驱动该肾单位节段的水分重吸收。相反,小管液和髓质间质中的尿素会达到平衡,最终排出少量含高浓度尿素的尿液。真正负责从髓质集合管重吸收水分,从而浓缩尿液中非尿素溶质(如NH_4+盐、K+盐、肌酐(creatinine))的是髓质间质中的NaCl浓度。
直小血管(Vasa Recta)的功能
直小血管(vasa recta)是为髓质供血的毛细血管网,对溶质和水分具有高通透性。与髓袢(loop of Henle)类似,直小血管在髓质内形成平行排列的U型袢(参见第33章)。直小血管不仅为髓质内的肾单位节段提供营养和氧气,更重要的是能够清除这些肾单位节段持续向髓质间质添加的过量水分和溶质。直小血管维持髓质间质梯度的能力具有血流依赖性:直小血管血流量显著增加会削弱髓质梯度(即导致髓质间质渗透分子被"冲刷");而血流量减少则会降低向髓质肾单位节段的氧输送。由于盐类和其他溶质的转运需要氧气和ATP,髓质血流量减少会降低髓质肾单位节段的溶质转运能力,最终导致髓质间质渗透梯度无法维持。
总之,肾脏维持着从皮髓交界处到内髓顶端的渗透梯度。皮质组织与血浆等渗,而内髓顶端呈高渗状态。该梯度在抗利尿时变得陡峭,在利尿时幅度降低。最新研究聚焦于肾脏功能结构的精细解析,包括三维重建和数学建模,以期更全面地理解肾单位节段的通透特性及其三维排列如何协同作用,生成并维持尿液浓缩所需的渗透梯度。
肾脏稀释与浓缩功能的评估
肾脏水处理能力的评估包括尿液渗透浓度和尿量测定。尿液渗透浓度范围为50至1200mOsm/kgH_2O,对应尿量范围为18~L~/天至最低0.5 L/天。这些范围并非固定值,存在个体差异并可受疾病进程影响。
肾脏稀释与浓缩尿液的能力
肾脏稀释或浓缩尿液的能力需要溶质与水分的分离(即逆流倍增系统的单一效应)。这种溶质与水分的分离实质上产生了"无溶质"的水量。当尿液被稀释时,无溶质水(solute-free water)从体内排出;当尿液被浓缩时,无溶质水则返回体内(即被保留)。
最大排泄无溶质水的条件(约18L/天)
要实现肾脏最大程度排泄无溶质水(即18L/day),必须满足以下条件:
- 必须缺乏精氨酸加压素(AVP):若无AVP,集合管无法重吸收大量水分
- 负责分离溶质与水分的肾小管结构(即稀释小管液的功能)必须正常运作。在AVP缺失时,以下肾单位节段可稀释肾小管液:
- 髓袢细升支(ascending thin limb of Henle's loop)
- 髓袢粗升支(thick ascending limb of Henle's loop)
- 远曲小管
- 集合管 由于高转运速率,髓袢粗升支在溶质与水分分离过程中具有最重要的定量意义。
- 必须有足够量的小管液输送至上述肾单位部位:任何减少输送量的因素(如肾小球滤过率降低或近端小管重吸收增强)都会削弱最大排泄无溶质水的能力
最大保水条件(6-8L/天)
肾脏要实现最大程度保水,必须满足以下要求:
- 足够量的小管液必须输送至负责溶质分离的肾单位节段:其中最重要的是髓袢粗升支。小管液向髓袢的输送量取决于肾小球滤过率和近端小管重吸收
- 肾单位节段对NaCl的重吸收必须正常:此处最重要的节段仍然是髓袢粗升支
- 必须存在高渗的髓质间质:间质液渗透压的维持依赖于:
- 髓袢对NaCl的重吸收(条件1和2)
- 尿素的有效蓄积(尿素蓄积又取决于充足的膳食蛋白质摄入)
- 必须存在最大浓度的AVP,且集合管对AVP需保持正常反应
细胞外液容量的调控与肾脏NaCl排泄的调节
细胞外液(ECF)的主要溶质是Na+盐类(见第2章)。其中,NaCl含量最为丰富。由于NaCl也是ECF渗透压的主要决定因素,通常认为Na+平衡的改变会扰乱ECF渗透压。然而在正常情况下,这种情况并不会发生,因为抗利尿激素(AVP)系统和口渴机制能将体液渗透压维持在一个非常狭窄的范围内(前文已讨论)。如图35.9所示,向ECF中添加或移除NaCl会改变其容量,而不会改变[Na+](比较初始状态与最终状态)。例如,向ECF中添加NaCl(不伴随水分)会提高该腔室的[Na+]和渗透压(由于ECF与细胞内液(ICF)的渗透平衡作用,ICF渗透压也会升高)。作为响应,AVP分泌和口渴机制被激活,从而导致水分摄入增加且肾脏水分流失减少。这使血浆渗透压(以及血清[Na+])恢复到初始值,但此时ECF容量已增加。当ECF丢失NaCl时则发生相反的过程。ECF容量(ECFV)的变化可通过测量体重来监测,因为1\textrmL的ECF相当于1kg的体重。
肾脏是机体排泄NaCl的主要途径。每日Na+总丢失量中仅有约10%通过非肾途径(如汗液和粪便)排出。因此,肾脏在调节ECFV中至关重要。正常情况下,肾脏通过调整NaCl排泄量使其与饮食摄入量相匹配,从而维持ECFV恒定(称为正常血容量状态,euvolemia)。若摄入量超过排泄量,ECFV会升高至正常水平以上(容量扩张);反之,若排泄量超过摄入量则会发生容量收缩。
• 图35.9 Na+平衡改变对ECFV的影响。(1)向ECF中添加NaCl(不伴随水分)会增加[Na+]和渗透压。(2)ECF渗透压升高刺激神经垂体分泌AVP,后者作用于肾脏以保留水分。(3)肾脏水分排泄减少与水分摄入共同作用,使血浆渗透压和血浆[Na+]恢复正常。但此时ECF容量已增加1升。(4)从ECF中移除NaCl(不伴随水分)会降低血浆[Na+]和渗透压。(5)ECF渗透压下降抑制AVP分泌。血浆AVP水平降低导致肾脏排泄水分。(6)肾脏水分排泄增加使血浆[Na+]和渗透压恢复正常。但此时ECF容量已减少1升。如图所示,由于AVP系统高效维持体液渗透压正常,Na+平衡的变化会通过改变ECFV实现调节。(改编自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
有效循环容量的概念
如第2章所述,细胞外液(ECF)可分为两个部分:血管内(血浆)和血管外(组织间液)。钠平衡(Na+ balance)——进而影响ECF容量(ECFV)——涉及一个复杂的传感器和效应信号系统,这些信号主要作用于肾脏以调节NaCl排泄。血浆容量决定血管容量、血压和心输出量。由于该系统的核心传感器位于血管系统的大血管中,因此血管容量、血压和心输出量的变化是调节肾脏NaCl排泄的主要因素(后文讨论)。在健康个体中,ECFV的变化会导致血管容量、血压和心输出量的变化。ECFV减少会导致血管容量、血压和心输出量降低;反之,ECFV增加则会导致血管容量、血压和心输出量升高。这些心血管参数变化的程度取决于ECF收缩或扩张的程度以及心血管反射机制的有效性(参见第18和19章)。当个体处于负钠平衡(negative Na+ balance)时,ECF收缩,肾脏NaCl排泄减少;反之,在正钠平衡(positive Na+ balance)时,ECF扩张,肾脏NaCl排泄增加(即尿钠排泄【natriuresis】)。
典型饮食每天约含140mEq的Na+(相当于8~g的NaCl),因此尿液中Na+的排泄量也约为140mEq/天。然而,肾脏能在很大范围内调节Na+的排泄。当个体采用低盐饮食时,排泄率可低至10 mEq/天;反之,当摄入高盐饮食时,肾脏可将排泄率提高至超过1000~mEq/天。这些Na+排泄的变化发生时,机体ECFV和Na+含量仅发生轻微改变。
肾脏对NaCl摄入量突然变化的反应通常需要数小时至数天,具体时间取决于变化的幅度。在此过渡期内,Na+的摄入与排泄不会像稳态时那样匹配。因此,个体会经历正钠平衡(摄入>排泄)或负钠平衡(摄入<排泄)。然而,在过渡期结束时,新的稳态会建立,摄入与排泄再次相等。
本节重点讨论控制ECFV的受体,并解释作用于肾脏以调节NaCl排泄的各种信号。此外,还将考虑肾单位节段对这些信号的反应。
然而,在某些病理状态下(如充血性心力衰竭、肝硬化),肾脏对Na+的处理与细胞外液量(ECFV)不相关。矛盾的是,此时ECFV增加而肾脏对NaCl的排泄减少。要解释这两种病理状态下肾脏对Na+的处理机制,必须理解有效循环容量(effective circulating volume, ECV)的概念。与ECFV不同,ECV并非可测量的独立体液分区。有效循环容量指血管系统中实际灌注组织的有效细胞外液部分。更具体地说,ECV反映了血管系统内容量感受器(后文讨论)的活动状态。
临床视角
充血性心力衰竭患者常表现为ECF容量增加,具体表现为血浆容量增加和肺(肺水肿)及外周组织(全身性水肿)间质液积聚。这种过量的ECFV是肾脏滞留NaCl和水分的结果。尽管ECFV增加,但肾脏仍持续滞留NaCl的反应看似矛盾。这些患者由于心输出量降低、低血压或毛细血管液体渗漏至间质区,虽然ECF总量增加,但实际有效循环容量(ECV)却降低。因此,血管系统中的感受器会像在ECFV减少时一样做出反应,促使肾脏滞留NaCl和水分。
在健康个体中,ECV与ECFV呈正相关,由血管系统(动脉和静脉)容量、动脉血压及心输出量共同决定。但需注意,在某些疾病状态下这种关系并不成立。本章后续章节将重点探讨健康成人ECFV与肾脏NaCl排泄的关系。
容量感知系统
容量感受器被称为血管容量受体或压力感受器(baroreceptors),因其能对所在结构(如血管或心房心室)壁的压力性牵张产生反应。
低压心肺循环中的容量感受器
位于左右心房、右心室和大型肺血管壁内的压力感受器可感知这些结构的扩张(详见第18、19章)。由于循环系统低压侧具有高顺应性,这些感受器主要反映血管系统的"充盈度"。这些压力感受器通过舌咽神经和迷走神经(第IX和X对脑神经)的传入纤维向脑干发送信号。感受器活动可同时调节交感神经输出和精氨酸加压素(AVP)分泌。例如,肺血管和心房充盈度降低会增强交感神经活动并刺激AVP分泌;反之,这些结构的扩张则会抑制交感神经活动。通常需要至少5%的血容量和压力变化才能激活这些反应。
心脏心房的附加调节机制
心脏心房拥有一个与调控肾脏NaCl排泄相关的附加机制。心房肌细胞合成并储存一种肽类激素——心房钠尿肽(atrial natriuretic peptide, ANP)。当心房扩张时,ANP被释放,并通过本章后续描述的机制降低血压并增加肾脏对NaCl和水的排泄。心脏心室也产生一种钠尿肽——脑钠尿肽(brain natriuretic peptide, BNP),其命名源于它最初从脑部分离。与ANP类似,BNP也会因心室扩张而从肌细胞中释放,其作用与ANP相似。
高压动脉循环的容量感受器
循环系统的动脉侧也存在压力感受器(baroreceptors),位于主动脉弓、颈动脉窦和肾入球小动脉的管壁中。主动脉弓和颈动脉压力感受器通过舌咽神经和迷走神经的传入纤维向脑干发送信号,以改变交感神经输出和抗利尿激素(AVP)分泌。血压降低会增强交感神经活性和AVP分泌,而血压升高则会抑制交感神经活性(并激活副交感神经活性)。高压压力感受器的敏感性与血管系统低压侧的感受器相似。
肾脏的球旁器(juxtaglomerular apparatus, JGA)(见第33章),尤其是入球小动脉,可直接对压力变化作出反应。如果入球小动脉的灌注压降低,球旁细胞会释放肾素(renin)。相反,当灌注压升高时,肾素分泌被抑制。如本章后续所述,肾素决定了血管紧张素II和醛固酮的血浆水平,两者均会减少肾脏的NaCl排泄。
临床指南
肾动脉狭窄(如动脉粥样硬化斑块所致)会降低肾脏灌注压,从而刺激JGA入球小动脉分泌肾素。肾素会促进强效血管收缩剂血管紧张素II的生成,后者作用于全身血管的动脉,升高全身血压。血压升高会被对侧肾脏(即无肾动脉狭窄的肾脏)的JGA感知,从而抑制该肾脏的肾素分泌。此外,血管紧张素II水平升高也会通过负反馈抑制对侧肾脏的肾素分泌。肾动脉狭窄患者的治疗策略包括使用血管紧张素II受体阻滞剂、血管紧张素转换酶抑制剂,或通过手术修复肾动脉狭窄。
容量感受器信号
当血管容量感受器检测到细胞外液容量(ECFV)变化时,它们会向肾脏发送信号以调节NaCl和水的排泄。因此,当ECF扩张时,肾脏的NaCl和水排泄增加;反之,当ECF收缩时,其排泄减少。连接容量感受器与肾脏的信号包括神经和激素途径,总结见方框35.1。
调控肾脏NaCl和水排泄的信号 • 方框35.1
↓肾交感神经(活性:NaCl排泄)
肾小球滤过率(GFR) 肾素分泌 沿肾单位\uparrowNa+重吸收
↓肾素-血管紧张素-醛固酮(分泌:NaCl排泄)
肾素-血管紧张素-醛固酮系统
肾素是一种天冬氨酸蛋白酶,可启动级联反应生成血管紧张素II——一种能升高血压和ECFV的强效血管收缩剂。表达肾素的细胞位于肾小球入口处的入球小动脉壁,因此被称为近球细胞(JG细胞)。肾素的合成和分泌受肾压力感受器、β-肾上腺素能受体和致密斑调控:
- 肾压力感受器:入球小动脉作为高压压力感受器发挥作用。当肾脏灌注压降低时,肾素分泌被激活;反之,灌注压升高则抑制肾素释放。
- β-肾上腺素能受体:来自肾主神经的交感神经纤维密集支配入球小动脉。激活β-肾上腺素能受体可刺激肾素分泌。
血管紧张素II对肾单位各段的Na⁺重吸收具有刺激作用
醛固酮主要刺激远端小管和集合管的Na⁺重吸收,对亨利袢升支粗段的作用较弱 血管紧张素II刺激抗利尿激素(AVP)分泌
利钠肽:ANP、BNP与尿扩张素(分泌效应:促进NaCl排泄)
肾小球滤过率(GFR) 肾素分泌 醛固酮分泌(通过血管紧张素II间接作用及直接作用于肾上腺) 集合管对NaCl和水的重吸收 AVP分泌,并抑制AVP对远端小管和集合管的作用
抗利尿激素(AVP)(分泌效应:减少H₂O排泄)
增加远端小管和集合管对H₂O的重吸收
肾交感神经
如第33章所述,交感神经纤维支配肾小球入球及出球小动脉,以及肾单位细胞。ECF容量减少会激活低压力和高压力血管压力感受器,导致交感神经活动增强(包括支配肾脏的神经纤维)。这种刺激会产生以下效应:
- 入球与出球小动脉收缩(由α-肾上腺素能受体介导)。入球小动脉的血管收缩作用更显著,可降低肾小球毛细血管腔内的静水压,从而减少GFR。GFR降低会减少Na⁺滤过量。
- 激活近球细胞分泌肾素(由β-肾上腺素能受体介导)。后文将详述,肾素最终会升高血管紧张素II和醛固酮的循环水平,二者均可刺激肾单位重吸收Na⁺。
- 直接激活肾单位各段对NaCl的重吸收(由α-肾上腺素能受体介导)。由于近端小管重吸收的Na⁺量最大,因此交感神经活动增强对该节段的定量效应最为显著。
综上,肾交感神经活动增强可减少NaCl排泄,这种适应性反应有助于ECFV恢复正常。当ECF扩张时,肾交感神经活动减弱,上述效应通常发生逆转。
在细胞水平
成年肾脏仅含有少量近球细胞(JG cells),这些细胞在稳态期间能产生足量肾素以维持血压、体液和电解质平衡。相比之下,低血压、脱水或钠缺乏等威胁稳态的情况需要更高水平的肾素来恢复血压及水电解质平衡。这种对肾素的更高需求通过募集肾小动脉沿途的额外细胞来生产肾素得以满足。这些被募集的细胞来源于完成肾脏形态发生后的肾素祖细胞,这些祖细胞已分化为小动脉平滑肌细胞。被募集的平滑肌细胞发生去分化,重新获得产生肾素的能力。
肾素的合成与分泌由细胞内[Ca²⁺]的降低所刺激——这与大多数分泌细胞的反应相反(通常分泌由细胞内[Ca²⁺]升高触发)。相反,增加细胞内[Ca²⁺]的信号会抑制肾素分泌。肾素的分泌与释放主要受cAMP通路调控。与G蛋白α亚基偶联的β-肾上腺素能受体,以及JG细胞特异的腺苷酸环化酶V和VI,对JG细胞中cAMP的生成至关重要。cAMP的有效浓度是腺苷酸环化酶正向活性与钙调蛋白激活的磷酸二酯酶1C(calcium calmodulin-activated phosphodiesterase 1C)降解活性共同作用的结果。急性升高细胞内[Ca²⁺]可通过抑制腺苷酸环化酶活性和增强磷酸二酯酶活性来降低净cAMP生成。
细胞外[Ca²⁺]通过钙敏感受体(CaSR)影响细胞内[Ca²⁺]。急性刺激CaSR会导致cAMP水平显著下降并抑制肾素释放。相反,慢性CaSR刺激会引起肾素水平升高。这些效应的具体亚细胞机制是当前研究的热点领域。
肾素-血管紧张素-醛固酮系统的调控机制
入球小动脉的牵张、血管紧张素-II(angiotensin-II)和内皮素(endothelin)通过增加细胞内\left[Ca++\right]浓度来抑制肾素分泌。交感神经活动对肾素分泌的刺激作用由去甲肾上腺素介导,后者通过\upbeta-肾上腺素能受体增加细胞内cAMP水平。前列腺素E_2同样通过提升JG细胞cAMP水平刺激肾素分泌。利钠肽(natriuretic peptides)和一氧化氮(NO)则通过增加细胞内环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)抑制肾素分泌。
致密斑(macula densa)对肾素分泌的调控机制复杂,涉及多种旁分泌因子,包括ATP、腺苷和前列腺素E_2(详见第33章)。
图35.10概括了肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)的核心组成。肾素本身不具生理功能,仅作为蛋白水解酶发挥作用。其底物是肝脏产生的循环蛋白——血管紧张素原(angiotensinogen)。肾素将血管紧张素原切割为10个氨基酸的肽段——血管紧张素I(angiotensin I)。血管紧张素I同样无已知生理功能,随后被血管内皮细胞表面存在的血管紧张素转化酶(angiotensin-converting enzyme, ACE)切割为8个氨基酸的肽段——血管紧张素II。肺和肾内皮细胞是血管紧张素I转化为血管紧张素II的重要场所。ACE还可降解强效血管舒张剂缓激肽(bradykinin)。血管紧张素II具有以下重要生理功能:
- 刺激肾上腺皮质分泌醛固酮
- 引起小动脉血管收缩,升高血压
- 刺激抗利尿激素(AVP)分泌和口渴反应
- 增强近端小管、髓袢升支粗段、远端小管和集合管对NaCl的重吸收。其中近端小管的作用最为显著
血管紧张素II是醛固酮(由肾上腺皮质球状带细胞分泌的主要盐皮质激素)的重要促泌素。远端小管后段和集合管通过表达盐皮质激素受体(mineralocorticoid receptor)及\mathbf11\upbeta-羟类固醇脱氢酶2(11β-hydroxysteroid dehydrogenase 2),以及髓袢升支粗段和远端小管前段(程度较轻)赋予对醛固酮的敏感性。醛固酮与盐皮质激素受体结合,而该酶通过代谢另一类激素——糖皮质激素(glucocorticoids)来提升醛固酮的特异性,防止糖皮质激素占据盐皮质激素受体。
• 图35.10 肾素-血管紧张素-醛固酮系统(RAAS)核心组分的示意图。RAAS激活可减少肾脏Na+和水的排泄。注:血管紧张素I通过所有血管内皮细胞表面存在的血管紧张素转化酶转化为血管紧张素II。如图所示,肺内皮细胞在此转化过程中起重要作用。详见正文。
醛固酮的肾脏作用
醛固酮在肾脏中具有多种效应(另见第34、36和37章)。关于细胞外液容量(ECFV)的调节,醛固酮可刺激NaCl的重吸收。它通过增加主细胞顶膜中上皮钠通道(ENaC)的数量和活性来促进Na+的进入。细胞基底外侧膜的Na+外排由Na+,K+ -ATP酶介导,其数量也受醛固酮上调。因此,醛固酮可增加远端肾单位对肾小管液中NaCl的重吸收,而醛固酮水平降低则会减少NaCl的重吸收量。
如框35.1所述,ECFV收缩时肾素-血管紧张素-醛固酮系统(RAAS)被激活,导致肾脏NaCl排泄减少。ECFV扩张则会抑制RAAS,从而增加肾脏NaCl的排泄。
临床意义
肾上腺皮质疾病可改变醛固酮水平,从而损害肾脏维持Na+平衡和正常血容量(euvolemia)的能力。当醛固酮分泌减少(低醛固酮血症)时,主要由醛固酮敏感远端肾单位介导的NaCl重吸收降低,导致尿液中NaCl丢失。若尿NaCl丢失量超过饮食摄入量,则会出现Na+负平衡并导致ECFV减少。为应对ECFV收缩,交感神经张力增加,导致肾素、血管紧张素II和精氨酸加压素(AVP)水平升高。醛固酮分泌增加(高醛固酮血症)则产生相反效应:醛固酮敏感远端肾单位对NaCl的重吸收增加,排泄减少,导致ECFV扩张。这些效应会降低交感神经张力及肾素、血管紧张素II和AVP水平。后文将提到,此时心房钠尿肽(ANP)和脑钠尿肽(BNP)水平会升高。
利钠肽(Natriuretic Peptides)
多种内源性物质可作用于肾脏以增加NaCl排泄(见第34章)。目前对心脏和肾脏产生的利钠肽机制研究最为深入,以下将重点讨论。
心脏产生两种利钠肽:心房钠尿肽(ANP)由心房肌细胞合成并储存,脑钠尿肽(BNP)由心室肌细胞合成并储存。在容量扩张或心力衰竭导致心脏扩张时,两种肽类均会分泌。BNP和ANP可舒张血管平滑肌张力,并促进肾脏NaCl和水排泄。尿扩张素(urodilatin)是肾脏产生的利钠肽,可促进肾脏NaCl排泄。利钠肽通过以下机制拮抗RAAS对肾脏NaCl和水排泄的调节作用:
- 通过扩张入球小动脉和收缩出球小动脉,增加肾小球滤过率(GFR)及滤过的NaCl量;
- 抑制入球小动脉分泌肾素;
- 抑制醛固酮分泌:(a)间接通过减少肾素分泌,从而降低血管紧张素II诱导的醛固酮水平;(b)直接抑制肾上腺皮质球状带细胞的醛固酮分泌。
抑制集合管的NaCl重吸收
这一作用也部分由醛固酮水平降低引起。然而,利钠肽(natriuretic peptides)会增加cGMP,后者可抑制髓质集合管细胞顶膜(apical membrane)的阳离子通道,从而减少NaCl的重吸收。
抑制垂体后叶分泌AVP及其对集合管的作用
这些效应会减少集合管对水的重吸收,从而增加尿中水的排泄。
利钠肽的净效应是通过肾脏增加NaCl和水的排泄。
精氨酸加压素(Arginine Vasopressin)
如前所述,ECF容量减少会刺激垂体后叶分泌AVP。AVP水平升高可减少肾脏水分排泄,从而重建正常血容量(euvolemia)。
正常血容量状态下NaCl排泄的调控
维持Na⁺平衡(即正常血容量)需要精确平衡摄入量与排泄量。如前所述,肾脏是Na⁺排泄的主要途径。因此,在血容量正常的个体中,每日尿Na⁺排泄量等于Na⁺摄入量。
在限盐(即低盐饮食)条件下,尿液中几乎不出现Na⁺。相反,在摄入大量盐的个体中,肾脏Na⁺排泄量可超过1000 mEq/天。肾脏调整Na⁺排泄的时间进程(数小时至数天)取决于盐摄入量变化的幅度。与小幅度的盐摄入变化相比,适应大幅度的盐摄入变化需要更长时间。
图35.11显示了Na⁺沿肾单位转运的基本特征。肾小球滤过的Na⁺大部分(67%)由近端小管(proximal tubule)重吸收。另有25%由髓袢升支粗段(thick ascending limb)重吸收,剩余部分由远曲小管(distal tubule)和集合管重吸收。
• 图35.11 肾单位节段性Na⁺重吸收。各肾单位节段重吸收的Na⁺滤过负荷百分比已标注。CD:皮质集合管(cortical collecting duct);DT:远曲小管(distal tubule);PT:近端小管(proximal tubule);TAL:升支粗段(thick ascending limb)。
正常成人每日Na⁺滤过量(负荷)约为25,000 mEq/天:
#公式35.1
\beginarrayr l &Na+=(GFR)×(Plasma[Na+])\\ &=(180L/day)×(140mEq/L)\\ &=25,200mEq/day \endarray
维持恒定输送至远曲小管的 NaCl 的机制
在典型饮食条件下,仅有不到 1% 的滤过量通过尿液排出(约 140mEq/天)。由于 Na+ 的滤过量极大,肾单位对其重吸收的微小变化即可显著影响 Na+ 平衡,从而影响细胞外液容量(ECFV)。例如,若 Na+ 排泄量从滤过量的 1% 增至 3%,则意味着每日额外损失约 500~mEq 的 Na+。由于细胞外液的 [Na+] 为 140~mEq/L,这种 Na+ 损失将导致细胞外液容量减少超过 3L(即水的排泄会伴随 Na+ 的损失以维持体液渗透压恒定:500~mEq/天 \div 140~mEq/L = 3.6~L/天 的体液损失)。对于一个 70kg 的个体,这种体液损失相当于细胞外液容量减少 26%。
在正常血容量的个体中,位于亨利袢(Henle loop)远端的肾单位节段(远曲小管和集合管)是调节 Na+ 重吸收以维持排泄量与饮食摄入量相适应的主要部位。然而,这并不意味着其他肾单位节段不参与此过程。由于远曲小管和集合管的重吸收能力有限,其他肾单位节段(即近曲小管和亨利袢)必须重吸收大部分滤过的 Na+。在正常血容量状态下,肾单位对 Na+ 的处理分为两个连续阶段:
- 近曲小管和亨利袢对 Na+ 的处理:将滤过 Na+ 量的相对恒定部分输送至远曲小管。这些肾单位节段的联合作用重吸收了约 92% 的滤过 Na+,并将 8% 输送至远曲小管。
- 远曲小管和集合管对 Na+ 的处理:最终通过尿液排出的 Na+ 量等于饮食摄入的 Na+ 量。
维持 NaCl 恒定输送至远曲小管的机制
多种机制共同维持 Na+ 恒定输送至远曲小管的起始端。这些机制包括肾小球滤过率(GFR)的自身调节(从而调节滤过的 Na+ 量)、肾小球-小管平衡(glomerulotubular balance),以及亨利袢对 Na+ 重吸收的负荷依赖性(load dependency)。
肾小球滤过率的自身调节(见第33章)可在较宽的灌注压范围内维持相对恒定的滤过率。由于滤过率恒定,滤过的 Na+ 量也保持恒定。
尽管存在 GFR 的自身调节,仍可能出现微小波动。若这些变化未通过调整肾单位的 Na+ 重吸收进行补偿,Na+ 排泄量将发生显著改变。幸运的是,在正常血容量状态下(尤其是近曲小管),Na+ 重吸收会随 GFR 的变化而同步调整。这种现象称为肾小球-小管平衡。因此,若 GFR 增加,近曲小管重吸收的 Na+ 量也会增加;反之亦然(详见第34章)。
远端小管和集合管NaCl重吸收的调节
当Na+输送量恒定时,主要通过醛固酮敏感的远端肾单位(aldosterone-sensitive distal nephron)对Na+重吸收进行微小调整,足以平衡排泄与摄入。醛固酮是Na+重吸收(因而也是NaCl排泄)的主要调节因子。当醛固酮水平升高时,这些节段的Na+重吸收增加(\mathbf\nabla\primeN\mathbfa\dag排泄减少)。当醛固酮水平降低时,Na+重吸收减少(NaCl排泄增加)。其他因素(如血管紧张素II、利钠肽)也被证明可改变Na+重吸收,但它们在正常血容量(euvolemia)状态下的作用尚不明确。
只要膳食盐摄入量的变化较小,上述机制即可维持正常血容量。然而,这些机制无法有效处理Na+摄入量的显著变化,导致细胞外液容量(ECFV)扩张或收缩。在极端情况下,其他因素会作用于肾脏以调整Na+排泄,从而重建正常血容量状态。
容量扩张期间NaCl排泄的调控
在ECFV扩张期间,高压和低压血管容量感受器向肾脏发送信号以增加NaCl和水的排泄。这些信号包括:
- 肾交感神经活动降低。
- 心脏分泌的ANP和BNP以及肾脏分泌的尿扩张素(urodilatin)释放减少。
- 抑制神经垂体分泌AVP及其在集合管的作用。
- 肾素分泌减少,进而减少血管紧张素II的生成。
- 由于血管紧张素II水平降低和利钠肽水平升高,醛固酮分泌减少。
肾单位对这些信号的整合反应如图35.12所示。对ECFV扩张的总体反应可分为三类(编号与图35.12中圈注对应):
- 肾小球滤过率(GFR)增加。GFR的增加主要源于交感神经活动降低。交感神经纤维支配肾小球的入球和出球小动脉,并控制其直径。交感神经活动降低导致小动脉扩张和肾血浆流量(RPF)增加。由于入球小动脉的效应似乎更显著,肾小球毛细血管内静水压升高,从而增加GFR。由于RPF的增加幅度大于GFR,滤过分数(filtration fraction,GFR/RPF)降低。利钠肽也通过扩张入球小动脉和收缩出球小动脉来增加GFR。因此,ECFV扩张时升高的利钠肽水平促进了这一反应。随着GFR的增加,Na+的滤过负荷也增加。
- 近端小管(proximal tubule)和亨利袢(loop of Henle)对Na+的重吸收减少。多种机制共同导致近端小管对Na+的重吸收降低。由于支配该肾单位节段的交感神经纤维(sympathetic nerve fibers)激活会刺激近端小管Na+重吸收,因此ECF扩张引起的交感神经活动减弱会降低Na+重吸收。此外,血管紧张素II(angiotensin II)可直接刺激近端小管的Na+重吸收。由于在此状态下血管紧张素II水平也降低,近端小管的Na+重吸收随之减少。近端小管两侧的Starling力也发生改变:肾小球毛细血管静水压升高会增加管周毛细血管(peritubular capillaries)的静水压。同时,滤过分数(filtration fraction)降低会减小管周毛细血管胶体渗透压(oncotic pressure)。这些毛细血管Starling力(即静水压和胶体渗透压)的改变会减少侧细胞间隙(lateral intercellular space)对溶质(如NaCl)和水的吸收,从而降低肾小管对NaCl的重吸收(该机制的完整描述参见第34章)。近端小管的滤过负荷(filtered load)增加和NaCl重吸收减少,导致更多NaCl被输送至亨利袢。由于交感神经激活、血管紧张素II和醛固酮(aldosterone)均可刺激亨利袢升支粗段(thick ascending limb)的NaCl重吸收,ECF扩张引起的神经活动减弱以及血管紧张素II和醛固酮水平降低,会减少升支粗段对NaCl的重吸收。因此,被输送至远端小管(distal tubule)的滤过负荷比例增加。
• 图35.12 ECF扩张的整合反应。数字对应正文中反应机制的描述。ANP:心房利钠肽(atrial natriuretic peptide);BNP:脑利钠肽(brain natriuretic peptide);GFR:肾小球滤过率(glomerular filtration rate);P_Na+:血浆[Na+];R:Na+的肾小管重吸收;U_Na+\dotV:Na+排泄率。
- 远端小管和集合管(collecting duct)对Na+的重吸收减少。如前所述,输送至远端小管的Na+量超过正常血容量状态(即输送至远端小管的Na+量与ECF扩张程度成正比)。增加的Na+负荷超过了远端小管和集合管的重吸收能力。由于血管紧张素II和醛固酮水平降低,以及利钠肽(natriuretic peptides)水平升高,NaCl的重吸收也受到抑制。
对细胞外液容量扩张反应的最终环节——水排泄增加
随着钠离子(Na+)排泄增加,血浆渗透压开始下降。这会减少精氨酸加压素(AVP)的分泌。此外,升高的钠尿肽(natriuretic peptide)水平也会抑制AVP分泌。钠尿肽还可抑制AVP对集合管的作用。这些效应共同减少集合管对水的重吸收,从而增加肾脏的水排泄。钠离子和水的排泄是协同进行的;正常血容量得以恢复,体液渗透压也回归正常水平。这种反应的时间进程(数小时至数天)取决于细胞外液容量(ECFV)扩张的程度以及持续的钠离子和水摄入量。若ECFV扩张程度较小,相关机制通常可在24小时内恢复正常血容量;若扩张程度较大,则可能需要数天时间。
总结而言,肾脏对ECFV扩张的反应涉及整个肾单位的协同作用:(1)滤过的钠离子量增加;(2)近端小管和髓袢对钠离子的重吸收减少(在此情况下不会发生肾小球-小管平衡);(3)远曲小管和集合管对钠离子的重吸收因醛固酮水平降低而减少;(4)滤过钠离子的更大比例被排泄,从而恢复正常血容量。
• 图35.13 对ECFV收缩的整合反应。数字对应文中描述的响应步骤。ANP 心房钠尿肽;BNP 脑钠尿肽;GFR 肾小球滤过率;P_Na+ 血浆[Na+];R 肾小管对Na+的重吸收;U_Na+\dotV,Na+排泄率。
容量收缩期间NaCl排泄的调控
在ECFV收缩期间,高/低压血管容量感受器向肾脏发出信号以减少NaCl和水的排泄,从而恢复正常血容量。这些信号包括:
- 肾交感神经活动增强
- 肾素分泌增加(导致血管紧张素II和醛固酮水平升高)
- 心脏分泌的ANP/BNP和肾脏分泌的尿扩张素受到抑制
- 神经垂体AVP分泌被激活
下文将描述肾单位对这些信号的整合反应(见图35.13)。编号与图中对应:
- 肾小球滤过率(GFR)下降。由于肾交感神经活动增强,入球和出球小动脉发生收缩。由于入球小动脉的收缩效应更显著,肾小球毛细血管静水压下降,导致GFR降低。
由于肾血浆流量(RPF)的下降幅度大于GFR,滤过分数(filtration fraction)增加。GFR的降低减少了钠离子的滤过量。
关键概念
- 体液渗透浓度(osmolality)的调节(即稳态平衡)要求机体摄入的水量必须与丢失量完全匹配。水分通过显性(sensible)和非显性(insensible)机制从体内丢失。肾脏通过垂体后叶分泌的AVP调控水分排泄。当AVP水平升高时,尿量减少且尿液呈高渗状态。当AVP水平降低时,尿量增加且渗透浓度下降。
- 近端小管(proximal tubule)和Henle袢(loop of Henle)对Na+的重吸收增加。多种机制增强了近端小管的Na+重吸收。例如,交感神经活性增强和血管紧张素II水平升高可直接刺激Na+重吸收。肾小球毛细血管内静水压的降低也减少了管周毛细血管的静水压。此外,如前所述,滤过分数(filtration fraction)的增加会提高管周胶体渗透压(oncotic pressure)。这些毛细血管Starling力的改变促进液体从细胞侧间隙(lateral intercellular space)进入毛细血管,从而增强近端小管对NaCl和水的重吸收(该机制的完整描述参见第34章)。交感神经活性增强以及血管紧张素II和醛固酮水平升高可刺激髓袢升支粗段(thick ascending limb)对Na+的重吸收。
- 远曲小管(distal tubule)和集合管(collecting duct)的Na+重吸收增强。由于滤过减少以及近端小管和Henle袢重吸收增加,输送至醛固酮敏感性远端肾单位(aldosterone-sensitive distal nephron)的少量Na+几乎被完全重吸收。尽管交感神经活性和血管紧张素II水平升高也可能参与此反应,但醛固酮水平升高进一步增强了对该节段Na+重吸收的刺激。
最后,远曲小管后段和集合管对水的重吸收因AVP而增强,其水平通过低压力和高压力血管容量感受器(low- and high-pressure vascular volume sensors)以及血管紧张素II的激活而升高。结果导致水排泄减少。由于肾脏以同等比例保留水和Na+,正常血容量(euvolemia)得以重建,体液渗透浓度恢复正常。重建正常血容量所需的时间(数小时至数天)和程度取决于ECF收缩的幅度、Na+和水的摄入量(肠内或肠外)以及持续的Na+和水的丢失量(显性和非显性)。
简而言之,肾单位对ECFV收缩的应答涉及所有节段的协同作用:(1)滤过的Na+量减少;(2)近端小管和Henle袢的Na+重吸收增强(GFR降低而近端重吸收增加,因此在此情况下不发生肾小球-小管平衡(glomerulotubular balance));(3)输送至醛固酮敏感性远端肾单位的Na+量减少,同时该节段对Na+和水的重吸收增强,从而几乎完全消除尿中Na+和水的排泄。
关键概念
- 体液渗透浓度(osmolality)的调节(即稳态平衡)要求机体摄入的水量必须与丢失量完全匹配。水分通过显性(sensible)和非显性(insensible)机制从体内丢失。肾脏通过垂体后叶分泌的AVP调控水分排泄。当AVP水平升高时,尿量减少且尿液呈高渗状态。当AVP水平降低时,尿量增加且渗透浓度下降。
36 钾、钙和磷的稳态
学习目标
完成本章学习后,学生应能回答以下问题:
- 机体如何维持钾(K⁺)稳态?
- K⁺在机体各腔室中的分布如何?这种分布为何重要?
- 调节血浆K⁺水平的激素和因子有哪些?这种调节为何重要?
- 不同肾单位节段如何转运K⁺?决定尿钾排泄量的机制是什么?
- 为何远端小管和集合管在调节K⁺排泄中起重要作用?
- 血浆K⁺水平、醛固酮、血管加压素、小管液流速和酸碱平衡如何影响K⁺排泄?
- 钙(Ca²⁺)和无机磷酸盐(Pi)的生理重要性是什么?
- 机体如何维持Ca²⁺和Pi的稳态?
- 肾脏、胃肠道和骨骼在维持血浆Ca²⁺和Pi水平中起什么作用?
- 调节血浆Ca²⁺和Pi水平的激素和因子有哪些?
- 沿肾单位进行Ca²⁺和Pi重吸收的细胞机制是什么?
- 哪些激素调节肾脏对Ca²⁺和Pi的排泄?
- 钙敏感受体(calcium-sensing receptor)的作用是什么?
- Ca²⁺和Pi稳态的常见临床紊乱有哪些?
- 肾脏在维生素D代谢中的作用是什么?
- 袢利尿剂和噻嗪类利尿剂对Ca²⁺排泄有何影响?
- 慢性饮食钾缺乏对血压有何影响?
- 慢性全身性钾耗竭对肾功能有何影响?
K⁺稳态
- 水平衡紊乱会改变体液渗透压。由于Na⁺及其伴随阴离子是细胞外液(ECF)渗透压的主要决定因素,水平衡紊乱表现为ECF [Na⁺]的变化。正水平衡(摄入>排泄)导致低钠血症(hyponatremia)并降低体液渗透压。负水平衡(摄入<排泄)导致高钠血症(hypernatremia)并升高体液渗透压。
- ECF容量(ECFV)由该腔室内的Na⁺总量决定。为维持正常ECFV(即正常血容量,euvolemia),Na⁺排泄必须与Na⁺摄入相匹配。肾脏是调节体内NaCl排泄的主要器官。主要位于血管系统的容量感受器(volume sensors)监测容量和压力。当ECFV扩张时,神经和激素信号会增加肾脏对NaCl和水的排泄,从而恢复正常血容量。当ECFV收缩时,神经和激素信号会减少肾脏Na⁺和水的排泄,使正常血容量得以恢复。交感神经系统、肾素-血管紧张素-醛固酮系统(RAAS)和利钠肽(natriuretic peptides)是维持稳态Na⁺平衡系统的重要组成部分。
钾离子(K+)是体内含量最丰富的阳离子。体内绝大部分的钾离子(98%)位于细胞内,其浓度([K+])为150mEq/L。仅有2%的钾离子存在于细胞外液(extracellular fluid, ECF)中,浓度约为4~mEq/L。细胞膜两侧巨大的钾离子浓度梯度(\approx146mEq/L)由Na+,K+-ATP酶维持。这种浓度梯度对维持细胞膜电位差至关重要,它直接影响神经和肌细胞的兴奋性,以及心肌、骨骼肌和平滑肌细胞的收缩功能(图36.1)。
骨骼肌是体内最大的单一钾离子储存库。在成年人体内,骨骼肌中的钾离子含量约为所有细胞外腔室总和的225倍。此外,由于骨骼肌细胞含有大量Na+、K+-ATP酶泵和K+通道,其具备极强的钾离子交换能力。尽管膳食钾摄入量存在显著波动,但细胞内液(intracellular fluid, ICF)和ECF中的[K+]仍能保持高度稳定。当ECF中的[K+]超过5.0mEq/L时称为高钾血症(hyperkalemia);反之,当ECF中的[K+]低于3.5mEq/L时则称为低钾血症(hypokalemia)。低钾血症发生时,骨骼肌细胞会释放钾离子以维持ECF中的[K+],从而导致全身钾离子总量减少。
临床知识
钾水平通常通过静脉血样本测定。传统上使用凝血后的血清进行检测,但现在更多采用肝素抗凝的血浆进行测量。血清钾水平通常比血浆高0.2~0.4mEq/L。不当的采血技术会影响检测结果:体力活动后ECF中的钾水平会升高(见后文),因此应在静息数分钟后采血;采血过程中或采血后的红细胞溶血会释放钾至血浆中,导致样本中[K+]假性升高。为防止溶血,必须使用经认证的专用针头、采血管和管接头,并选择大静脉(如肘静脉)进行穿刺,避免握拳动作和长时间使用止血带。
假性高钾血症(pseudohyperkalemia)指采血管中钾浓度>5mmol/L而患者实际血钾水平正常的情况。除导致假性高钾血症外,检测误差还可能掩盖真实存在的低钾血症。
临床关联
低钾血症(hypokalemia)可能发生于长期使用利尿剂、滥用泻药、呕吐、进食障碍或腹泻性疾病患者。Gitelman综合征(远端肾小管细胞顶膜Na+/Cl-协同转运体的遗传缺陷)也可引起低钾血症(详见第34章)。高钾血症(hyperkalemia)可见于肾功能衰竭患者,或作为血管紧张素转换酶(ACE)抑制剂和保钾利尿剂在潜在肾病患者(肾脏排钾能力下降)中的副作用,亦可见于糖尿病患者(细胞内钾转移能力下降)。
临床关联
心律失常可由高钾血症和低钾血症引发。心电图(ECG;图36.2)(另见第16章)可监测心脏电活动,是快速判断血浆[K+]变化是否影响心脏功能的可靠方法。高钾血症的首个征象是ECG出现高尖T波。血浆[K+]进一步升高会延长PR间期、压低ST段并增宽ECG的QRS波群。当血浆[K+]接近10 mEq/L时,P波消失,QRS波群增宽,ECG呈正弦波形,心室出现纤维性颤动(即心肌纤维快速、无协调性收缩)。低钾血症会延长QT间期,导致T波倒置和ECG的ST段压低。
从胃肠道(GI)吸收的K+在数分钟内进入ECF(图36.3)。若正常饮食摄入的K+(约33 mEq)全部存留于ECF腔室(14 L),则血浆[K+]将升高2.4 mEq/L(33 mEq加入14 L ECF中):
#公式36.1
33mEq/14L=2.4mEq/L
• 图36.1 血浆[K+]变化对骨骼肌静息膜电位的影响。高钾血症使膜电位负值减小,通过使快Na+通道失活(该通道负责动作电位的去极化时相)而降低兴奋性。低钾血症使膜电位超极化,从而降低兴奋性,因为需要更强的刺激才能使膜电位去极化达到阈电位。"静息"表示"正常"静息膜电位。"正常阈值"表示膜阈电位。
• 图36.2 不同血浆[K+]患者的心电图。详见正文。(改编自Barker LR, Burton JR, Zieve PD. Principles of Ambulatory Medicine. 5th ed. Baltimore: Williams & Wilkins; 1999.)
钾离子(K+)的快速(数秒至数分钟)细胞内摄取对于预防危及生命的高钾血症(hyperkalemia)至关重要。肾脏对K+的排泄相对缓慢(数小时)。维持全身K+浓度恒定需要胃肠道(GI tract)吸收的几乎所有K+最终通过肾脏排出。结肠负责剩余的小部分K+排泄,对于终末期肾病(end-stage kidney disease)患者,结肠可能增加粪便中K+的排泄量。
血浆[\sf K+]的调节
包括肾上腺素(epinephrine)、胰岛素(insulin)和醛固酮(aldosterone)在内的多种激素通过刺激骨骼肌、肝脏、骨骼和红细胞中的Na+,K+ -ATPase以及Na+/K+/2Cl-和Na+/C l-共转运体,增加这些细胞对K+的摄取(见Box 36.1;图36.3)。K+摄取的急性刺激(即几分钟内)是由现有Na+,K+ -ATPase以及Na+/K+/2Cl-和Na+/C l-共转运体活性增加介导的,而K+摄取的慢性增加(即几小时到几天内)则是由Na+,K+ -ATPase数量的增加介导的。胃肠道吸收K+后血浆[K+]的升高会刺激胰腺分泌胰岛素、肾上腺皮质释放醛固酮以及肾上腺髓质分泌肾上腺素(见图36.3)。相反,血浆[K+]的降低会抑制这些激素的释放。胰岛素和肾上腺素在几分钟内发挥作用,而醛固酮则需要大约一小时才能刺激细胞摄取K+。
• 图36.3 K+稳态概述。血浆中胰岛素、肾上腺素或醛固酮的增加会刺激K+进入细胞并降低血浆[K+],而这些激素血浆浓度的下降则会产生相反的效果并增加血浆[K+]。体内K+的量由肾脏决定。当饮食摄入量和尿量(加上胃肠道的输出量)相等时,个体处于K+平衡状态。肾脏对K+的排泄受血浆[K+]、醛固酮和精氨酸加压素(AVP)的调节。
生理性:保持血浆[K+]恒定
肾上腺素 胰岛素 醛固酮
病理性:使血浆[K+]偏离正常
酸碱平衡紊乱 血浆渗透压 细胞溶解 剧烈运动
诱发高钾血症的药物
膳食K+补充剂 ACE抑制剂 K+ -保钾利尿剂 肝素
肾上腺素
儿茶酚胺通过激活\upalpha-和\upbeta_2 -肾上腺素能受体影响K+在细胞膜上的分布。\upalpha -肾上腺素能受体的刺激会释放K+,尤其是在肝脏中,而\upbeta_2 -肾上腺素能受体的刺激则会促进细胞摄取K+。
例如,运动后\upbeta_2 -肾上腺素能受体的激活对预防高钾血症很重要。如果患者在摄入富含K+的餐食前接受了\upbeta\mathbf\cdot -肾上腺素能受体拮抗剂(如普萘洛尔)的预处理,血浆[K+]的升高会更大。此外,应激(如心肌缺血)期间肾上腺素的释放可以迅速降低血浆[K+]。
胰岛素
胰岛素是摄入膳食K+后促使K+进入细胞的最重要激素。胰岛素和葡萄糖输注可用于纠正危及生命的高钾血症。在糖尿病患者(即胰岛素缺乏)中,摄入富含K+的膳食后血浆[K+]的升高幅度大于健康人。在慢性肾病患者中,尽管胰岛素刺激的葡萄糖进入细胞的能力受损,但胰岛素刺激K+进入细胞的能力仍然保留。
醛固酮
醛固酮与儿茶酚胺和胰岛素一样,也促进K+进入细胞。醛固酮水平升高(如原发性醛固酮增多症)会导致低钾血症,而醛固酮水平下降(如Addison病)会导致高钾血症。正如后面讨论的以及图36.3所示,醛固酮还刺激尿液中K+的排泄。因此,醛固酮通过作用于K+进入细胞的摄取和改变尿液中K+的排泄来改变血浆[K+]。
血浆[K+]的变化
当K+的量(无论是肠内来源的,如膳食或胃肠道出血,还是肠外来源的,如静脉注射或溶血)超过细胞内摄取和肾脏排泄K+的能力时,通常会发生高钾血症(见框36.1)。当细胞内K+摄取和肾脏K+丢失超过K+摄入(膳食或静脉注射)时,通常会发生低钾血症(见框36.1)。在某些情况下(见后文),仅ECF和ICF之间K+分布的变化就可能导致血浆[K+]的急性且具有临床意义的紊乱。
酸碱平衡
代谢性酸中毒会增加血浆[K+],而代谢性碱中毒会降低血浆[K+]。呼吸性碱中毒会导致低钾血症。相比之下,呼吸性酸中毒对血浆[K+]几乎没有影响。由无机酸(如HCl、H_2SO_4)引起的代谢性酸中毒比由有机酸(如乳酸、乙酸、酮酸)积累引起的同等酸中毒更能增加血浆[K+]。降低的pH(即增加的\left[H+\right])促进H+进入细胞,同时K+从细胞中移出以维持电中性。酸中毒的这种效应部分是由于酸中毒抑制了细胞内积累K+的转运蛋白,包括Na+,K+ -ATP酶和Na+/K+/2Cl-共转运蛋白。此外,H+进入细胞的过程也发生在细胞缓冲ECF中[H+]变化时(见第37章)。当H+跨细胞膜移动时,K+向相反方向移动,因此阳离子在细胞膜上既没有增加也没有减少。代谢性碱中毒具有相反的效果;血浆[K+]随着K+进入细胞和H+离开细胞而降低。
尽管有机酸会导致代谢性酸中毒(metabolic acidosis),但它们不会引起显著的高钾血症(hyperkalemia)。对于有机酸引起高钾血症能力降低的原因,有两种解释。首先,有机阴离子可能与H+一起进入细胞,从而消除了跨膜K+-H+交换的需要。其次,有机阴离子可能刺激胰岛素分泌,从而将K+移入细胞。这种移动可能抵消酸中毒的直接效应,后者会将K+移出细胞。
血浆渗透压(Plasma Osmolality)
血浆的渗透压(osmolality)也会影响K+在细胞膜两侧的分布。细胞外液(ECF)渗透压的增加会促进细胞释放K+,从而增加细胞外K+的浓度。血浆渗透压每增加10mOsm/kgH_2O,血浆K+浓度可能增加0.4到0.8mEq/L。在不使用胰岛素的糖尿病患者中,血浆K+浓度通常升高,部分原因是缺乏胰岛素,部分原因是血浆[葡萄糖]的增加(即从正常值\approx100\:mg/\bardL增加到某些情况下高达s\approx1200mg/dL),这会增加血浆渗透压。低渗透压则具有相反的作用。与渗透压变化相关的血浆K+浓度的变化与细胞体积的变化有关。例如,随着血浆渗透压的增加,由于跨膜渗透梯度的存在,水会离开细胞(见第1章)。水会离开细胞,直到细胞内渗透压与细胞外液相等。这种水的流失会使细胞收缩,并导致细胞内K+浓度上升。细胞内K+浓度的上升为K+从细胞中流出提供了驱动力。这一过程会增加血浆K+浓度。血浆渗透压的下降则具有相反的效果。
细胞溶解(Cell Lysis)
细胞溶解会导致高钾血症,因为细胞内K+被释放到细胞外液中。严重的创伤(如烧伤)、肿瘤溶解(即化疗或自然过程导致的肿瘤细胞破坏)和横纹肌溶解(即骨骼肌细胞的破坏)会破坏细胞,并将K+和其他细胞内容物释放到细胞外液中。
运动(Exercise)
在高强度运动或体力消耗期间,骨骼肌中的重复动作电位导致肌肉细胞中的K+流失,随后在血浆和间质液(ECF腔室)之间重新分布。由于骨骼肌含有体内主要的K+池,血浆K+水平可能增加到8mEq/L,并且在运动期间可能维持这一水平。体能训练或锻炼通过增加骨骼肌细胞中Na,K-ATPase泵的数量来减少运动引起的高钾血症。运动停止后,恢复中的肌肉细胞通过Na,K-ATPase介导的K+摄取重新获得丢失的K+,随后在几分钟内血浆K+水平恢复正常,这可能会先出现K+水平的暂时性下降和短暂的低钾血症。运动期间K+水平的变化伴随着肌肉细胞体积的变化。收缩的肌肉细胞在失去K+时会膨胀。运动停止后,水迅速从肌肉细胞移动到间质空间,然后缓慢重新分布到血管内空间。然而,K+的移动似乎对控制肌肉细胞体积并不重要。
• 图 36.4~K+ 沿肾单位的转运。K+的排泄取决于远端小管和集合管末段对K+转运的速率和方向。百分比表示每个肾单位段重吸收或分泌的过滤K+的量。箭头表示转运方向。左图,饮食中K+缺乏。排泄的K+量等于过滤负荷的1%。右图,正常和增加的饮食K+摄入。排泄的K+量等于过滤负荷的15%至80%。CCD,皮质集合管;D T,远端小管;/N C D,内髓集合管;P T,近端小管;T A L,厚升支。
肾脏的K+排泄
肾脏在维持K+平衡中起主要作用。如图36.3所示,肾脏排泄了从饮食中摄入的90%至95%的K+。即使摄入量增加多达10倍,排泄量也等于摄入量。尿液排泄和饮食摄入之间的这种平衡强调了肾脏在维持K+稳态中的重要性。尽管每天有少量K+通过粪便和汗液流失(约5%-10%的饮食摄入K+),除了严重腹泻期间,这一量基本上是恒定的,不受调节,因此相对于肾脏排泄的K+来说不那么重要。远端小管(DT)和集合管系统的细胞将K+从血液分泌到管腔液是决定尿K+排泄的关键因素(图36.4)。
由于K+不与血浆蛋白结合,它可以在肾小球自由滤过,并且几乎完全在近端小管(通过旁细胞途径,与Na+和水成比例)和Henle袢升支(此处跨细胞的K+转运由顶膜Na+/K+/2Cl-共转运体介导)被重吸收。K+的重吸收部分与K+的摄入量无关。尿液中K+的排泄主要来源于沿醛固酮敏感的远端肾单位(ASDN)的分泌,该单位包括远端小管(DT)的最后部分、连接小管和皮质集合管(CCD)。饮食中K+摄入量的增加会促进K+的分泌(见图36.4,右图)。相反,低K+饮食会激活沿ASDN的K+重吸收(见图36.4,左图)。
临床意义
运动引起的血浆[K+]变化通常不会产生症状,并在休息几分钟后恢复正常。然而,剧烈运动可能导致危及生命的高钾血症,尤其是在以下个体中:(1) 患有影响胰岛素、肾上腺素(一种\upbeta -肾上腺素能激动剂)或醛固酮释放的内分泌疾病;(2) 排泄K+的能力受损(例如,肾功能衰竭);或(3) 服用某些药物,如\upbeta_\upnu -肾上腺素能阻滞剂。例如,在剧烈运动期间,服用\upbeta_1 -肾上腺素能受体拮抗剂治疗高血压的个体,血浆[|K+]可能增加至少2至4mEq/L。心脏在运动停止时也可能面临K+水平的急剧下降(见前文)。这种下降似乎与心脏复极受损有关,可能诱发心律失常和心源性猝死,尤其是在已有低钾血症、缺血性心脏病、心力衰竭、室性心律失常或遗传性或获得性长QT综合征的个体中。
在患有终末期肾病的个体中,肾脏无法排泄摄入的K+,导致血浆[K+]升高。由此产生的高钾血症(hyperkalemia)会降低静息膜电位(resting membrane potential)(即电压变得不那么负)。膜电位的降低通过使快速N a+通道失活来减少神经元、心脏细胞和肌肉细胞的兴奋性,这些通道对于动作电位(action potential)的去极化阶段至关重要(见图36.1)。血浆[K+]的急剧升高可能导致心脏骤停和死亡。相反,在使用利尿剂的患者中,尿液中K+的排泄量通常超过饮食中K+的摄入量。因此,K+平衡为负值,导致低钾血症(hypokalemia)的发生。细胞外[K+]的下降会使静息细胞膜超极化(hyperpolarizes)(即电压变得更负),并降低神经元、心脏细胞和肌肉细胞的兴奋性。严重的低钾血症可能导致心律失常、瘫痪和死亡。低钾血症还可能损害肾脏浓缩尿液的能力,并刺激肾脏产生N H_4+,从而影响酸碱平衡(见第37章)。因此,维持细胞内高[K+]、细胞外低[K+]以及跨细胞膜的高[K+]梯度对于细胞功能至关重要。
远端小管(DT)和集合管(CCD)中主细胞(Principal Cells)和闰细胞(Intercalated Cells)的K+转运的细胞机制
图36.5A展示了主细胞(principal cells)分泌K+的细胞机制。K+从血液分泌到管腔的过程分为两步:(1) K+通过Na+,K+ -ATPase从血液跨过基底外侧膜(basolateral membrane)进入细胞;(2) K+通过肾外髓K+通道(renal outer medullary K+ channel, ROMK)和大K+通道(Big K+ channel, BK)从细胞进入管腔液。顶膜(apical membrane)上的K+/Cl-共转运体(cotransporter, KCC1)也参与K+的分泌。Na+,K+ -ATPase在细胞内建立了高K+浓度,为K+通过K+通道跨过顶膜提供了化学驱动力。尽管基底外侧膜上也存在K+通道,K+优先通过顶膜离开细胞并进入管腔液。K+选择这一途径的原因有两个:首先,顶膜两侧的K+电化学梯度有利于其顺梯度进入管腔液;其次,顶膜对K+的通透性高于基底外侧膜。因此,K+优先通过顶膜扩散进入管腔液。K+通过K+/Cl-共转运体跨过顶膜的分泌是由细胞与管腔液之间K+的有利浓度梯度驱动的。控制主细胞在远端小管(distal tubule, DT)和皮质集合管(cortical collecting duct, CCD)中K+分泌速率的三个主要因素包括:(1) Na+,K+ -ATPase的活性;(2) K+跨过顶膜运动的驱动力(K+通道的电化学梯度和K+/Cl-共转运体的化学浓度梯度);(3) 顶膜K+通道对K+的通透性。在DT和CCD中,\upalpha -间细胞(\upalpha -intercalated cells)通过位于顶膜的H+,K+ -ATPase(HKA)转运机制重吸收K+(见图36.5B)。该转运体介导K+跨过顶膜进入细胞,同时排出H+。K+从间细胞进入血液的过程由K+通道介导。K+的重吸收在低K+饮食时被激活。
• 图36.5 远端小管(DT)和皮质集合管(CCD)末段中主细胞(A)和\upalpha -间细胞(B)分泌K+的细胞机制。\upalpha -间细胞的基底外侧膜中Na+,K+ -ATPase的含量非常低(未显示)。K+缺乏通过刺激H+,K+ -ATPase(HKA)增加\upalpha -间细胞对K+的重吸收。A E1,阴离子交换体1;C A,碳酸酐酶。
DT和CCD中的K+排泄
K+ 的排泄由 ASDN(aldosterone-sensitive distal nephron,醛固酮敏感性远端肾单位)决定,其影响因素包括血浆 [K+]、Na+ 的输送和管腔液流量(即 K+ 感知)、醛固酮、精氨酸加压素(arginine vasopressin, AVP)、糖皮质激素水平以及酸碱状态。
血浆 [K+]
血浆 [K+] 是 DT(distal tubule,远端小管)和 CCD(cortical collecting duct,皮质集合管)分泌 K+ 的重要决定因素。高钾血症(hyperkalemia)在几分钟内通过多种机制刺激 K+ 的分泌。首先,高钾血症刺激 Na+ , K+ -ATPase,从而增加 K+ 通过基底外侧膜的摄取。这种摄取提高了细胞内 [K+],并增加了 K+ 通过顶膜排出的电化学驱动力。其次,高钾血症还增加了顶膜对 K+ 的通透性。第三,高钾血症刺激肾上腺皮质分泌醛固酮,正如后文所述,醛固酮与血浆 [K+] 协同作用,刺激 K+ 的分泌。第四,高钾血症还增加了管腔液的流速,正如后文所述,这会刺激 DT 和 CCD 分泌 K+。
低钾血症(hypokalemia)通过与高钾血症相反的作用减少 K+ 的分泌。因此,低钾血症抑制 Na+ , K+ -ATPase,降低 K+ 通过顶膜排出的电化学驱动力,减少顶膜对 K+ 的通透性,并降低血浆醛固酮水平。
在细胞水平
ROMK是主细胞顶膜上的主要通道,介导组成性(与流量刺激相对)的K+分泌。ROMK在生理条件下具有低电导和高开放概率。此外,\mathttC a++激活的BK通道也在顶膜上表达。BK通道具有较大的单通道电导,在基础状态下处于静息状态,并在前述的流量增加条件下介导K+分泌。有趣的是,敲除编码ROMK通道的KCNJ1基因会导致肾脏增加NaCl和K+的排泄,从而导致ECFV减少和低钾血症。尽管这一效应有些令人困惑,但需要注意的是,ROMK也在Henle袢粗升支(TAL)的顶膜上表达,在那里它在K+跨顶膜的再循环中起着非常重要的作用,这一效应对N a+/K+/2C F共转运体的运作至关重要。在没有ROMK的情况下,TAL对NaCl的重吸收减少,导致尿液中NaCl的丢失。TAL对NaCl重吸收的减少也降低了正跨上皮管腔电压,这是该肾单位段重吸收K+的驱动力。因此,TAL对旁细胞K+重吸收的减少增加了尿液中K+的排泄,即使由于缺乏ROMK通道,皮质集合管无法分泌正常量的K+。然而,即使在ROMK敲除小鼠中,CCD仍然通过主细胞顶膜上表达的流量和\mathttC a++依赖的BK通道分泌K+。
临床相关
慢性低钾血症([K+]<3.5 mEq/L)可能发生在接受利尿剂治疗、滥用泻药、严重呕吐或腹泻、进行鼻胃抽吸或患有醛固酮增多症的患者中。低钾血症的发生是因为肾脏K+排泄超过了饮食中K+的摄入。呕吐、鼻胃抽吸、利尿剂和腹泻都会减少ECF体积,进而刺激醛固酮的分泌(见第35章)。由于醛固酮刺激肾脏排泄K+,其作用有助于低钾血症的发展。低钾性肾病是一种慢性疾病,患者体内K+总量减少,其特征是体积减少和醛固酮增多症。它通常是一种进展性慢性肾脏疾病,可能导致终末期肾病。
慢性高钾血症([K+]>5.0m E q/L)最常见于尿流量减少、血浆醛固酮水平低和肾病患者,其中肾小球滤过率(GFR)低于正常值的20%。在这些个体中,高钾血症的发生是因为肾脏K+排泄低于饮食中K+的摄入。较少见的高钾血症原因发生在胰岛素或醛固酮分泌不足的人或由无机酸引起的代谢性酸中毒的人中。
N a+输送和管状液流量(肾上皮细胞的K+感知)
K+ 的分泌是由增加的 Na+ 输送和管状液体流向 ASDN(aldosterone-sensitive distal nephron,醛固酮敏感性远端肾单位)所诱导的。这一效应始于远端小管(distal tubule, DT)的早期部分,其中 Na+ 的转运由噻嗪类敏感的 Na+/C l- 共转运体(cotransporter)驱动。增加的 K+ 血浆浓度由位于 DT 早期段基底外侧膜上的 K+ 传感器 Kir 4.1/5.1 通道检测到(图 36.6A)。Kir 4.1/5.1 对增加的 K+ 血浆浓度的感知启动了一个信号级联反应,该反应使 Na+/C l- 共转运体去磷酸化并抑制其活性。Na+/C l- 共转运体的抑制导致更多的 Na+ 输送和管状液体流向 ASDN,从而增加肾脏的 K+ 排泄。摄入减少和 K+ 血浆浓度降低会激活 DT 早期的 Na+/C l- 共转运体,并通过减少 Na+ 输送和流向 ASDN 来限制 K+ 的分泌(图 36.6B)。
• 图 36.6 上皮 K+ 感知的机制。A, 增加的 K+ 血浆浓度由 DT 早期部分的 K i r4.1/5.1 通道检测到,这些通道使 NCC(Na+/C l- 共转运体)失活,导致更多的 N a+ 输送到醛固酮敏感性远端肾单位(ASDN),增加管状液体流动和肾脏对 N a+ 和 K+ 的排泄。B, 降低的 K+ 血浆浓度激活 WNK 通路,该通路使 NCC(Na+/C l- 共转运体)磷酸化并激活,从而刺激 N a+ 的吸收并减少 N a+ 输送到 ASDN,减少管状液体流动和肾脏对 N a+ 和 K+ 的排泄。ASDN, 醛固酮敏感性远端肾单位;CCD, 皮质集合管;DT, 远端小管。
肾小管液流量的增加(例如,使用利尿剂治疗、ECF扩张)会在几分钟内刺激K+的分泌,而由出血、严重呕吐或腹泻引起的ECF收缩则会减少ASDN对K+的分泌。随着饮食中K+摄入量的增加,肾小管液流量的增加对刺激K+分泌的效果更为显著。流量的增加会使主细胞中的初级纤毛弯曲,从而激活多囊蛋白(PKD)1/PKD2 Ca++传导通道复合物。这使得更多的Ca++进入主细胞,并增加细胞内\left[Ca++\right]。\left[Ca++\right]的增加激活了顶膜上的BK K+通道,从而增强了K+从细胞向肾小管液的分泌。随着流量的增加,例如在使用利尿剂后或由于ECF的增加,肾小管液中的[Na+]也会增加。[Na+]的增加促进了Na+通过ASDN细胞顶膜的进入,从而降低了细胞内部的负膜电位。细胞膜电位的去极化增加了电化学驱动力,促进了K+通过顶膜向肾小管液的分泌。此外,Na+进入细胞的增加激活了基底外侧膜上的Na+,K+ -ATP酶,从而增加了K+通过基底外侧膜的摄取,进而提高了细胞内[K+]。需要注意的是,在水利尿期间流量的增加对K+的排泄没有显著影响,这很可能是因为在水利尿期间,肾小管液中的[Na+]不会随着流量的增加而增加。
• 图36.7 醛固酮对远端小管末端和集合管主细胞分泌K+的影响。数字指的是文中讨论的醛固酮的五种作用。
临床意义
自农业革命以来,人类的饮食从高钾(K+)低钠(N a+)转变为低钾(K+)高钠(N a+)饮食。成年人适宜的钾(K+)摄入量建议通常在90至100 mEq/天(3500-4000 mg/天)之间。在全球范围内的分析中,钾(K+)摄入量(通过成年人尿钾排泄量估算)比推荐摄入量低40%至50%。低钾(K+)饮食与心血管不良事件风险增加相关,包括高血压和低钾性肾病。低钾(K+)饮食会增加远曲小管(DT)中钠(N a+)/氯(Cl-)共转运体的活性。这在生理学上是合理的,因为通过钠(N a+)/氯(Cl-)共转运体增加钠的重吸收,减少了钠(N a+)向下游分泌钾(K+)的肾单位节段的输送,从而有助于保留钾(K+)。低钾(K+)饮食通过减少肾脏的钠(N a+)排泄,与盐敏感性高血压的发病机制有关。在钾(K+)缺乏时,肾脏保留钾(K+)和钠(N a+)的反应可能是由于早期人类可能同时面临饮食中钾(K+)和钠(N a+)的缺乏。在当今饮食中钠(N a+)摄入量高而钾(K+)摄入量低的情况下,肾脏保留钾(K+)和钠(N a+)的反应可能导致盐敏感性高血压。
醛固酮(Aldosterone)
长期升高(≥24小时)的血浆醛固酮水平增强了ASDN(醛固酮敏感远端肾单位)主细胞的K+分泌(图36.7):(1) 通过增加基底外侧膜上的Na+,K+ -ATPase数量;(2) 通过增加顶膜上的上皮钠通道(ENaC)的表达;(3) 通过提高SGK1(血清糖皮质激素刺激激酶)水平,这也增加了顶膜上Na+ (ENaC)通道的表达并激活K+通道;(4) 通过刺激CAP1(通道激活蛋白酶,也称为prostatin),直接激活ENaC;(5) 通过刺激顶膜对K+的通透性。醛固酮通过增加膜上K+通道的数量来增加顶膜对K+的通透性。然而,参与这一反应的细胞机制尚不完全清楚。Na+,K+ -ATPase表达的增加促进了K+通过基底外侧膜进入细胞的摄取,从而提高了细胞内[K+]。Na+通道数量和活性的增加增强了Na+从管腔液进入细胞的量,这一效应使顶膜电压去极化。顶膜的去极化和细胞内[K+]的增加增强了K+从细胞分泌到管腔液的电化学驱动力。总的来说,这些作用增加了K+通过基底外侧膜进入细胞的摄取,并增强了K+通过顶膜从细胞的排出。醛固酮的分泌在高钾血症和血管紧张素II(在肾素-血管紧张素系统激活后)的作用下增加。醛固酮的分泌在低钾血症和心脏释放的利钠肽作用下减少。
• 图36.8 AVP和尿流率对ASDN分泌K+的相反影响。K+分泌在尿流率增加时被刺激,而在AVP水平下降时减少。相反,K+分泌在尿流率减少时减少,而在AVP水平上升时增加。由于流率和AVP的影响相互抵消,净K+分泌不受水利尿或抗利尿剂的影响。AVP,精氨酸加压素;CCD,皮质集合管;D T, 远端小管。
尽管醛固酮水平的急性(几小时内)增加增强了Na+,K+ -ATPase的活性,但K+的排泄并不会立即增加。这种延迟是由于醛固酮对Na+重吸收和管腔流量的影响。醛固酮刺激的Na+和水重吸收减少了管腔流量,从而减少了K+的分泌(稍后将详细讨论)。然而,长期刺激Na+重吸收会增加ECF(细胞外液)体积,从而使管腔流量恢复正常。这些作用使醛固酮对ASDN的直接刺激效应能够增强K+的排泄。
AVP
尽管AVP(抗利尿激素)不影响尿中K+的排泄,但这种激素通过ASDN(远端肾单位)促进K+的分泌(图36.8)。AVP通过刺激主细胞顶膜的Na+摄取,增加了K+跨顶膜外出的电化学驱动力。Na+摄取的增加降低了跨顶膜的电势差(即细胞内部变得不那么负)。尽管有这种效应,AVP并不改变这些肾单位段的K+分泌。这与AVP对管腔液流动的影响有关。AVP通过刺激水的重吸收减少了管腔液的流动。管腔液流动的减少反过来又减少了K+的分泌(稍后解释)。管腔液流动减少的抑制作用抵消了AVP对K+跨顶膜外出的电化学驱动力的刺激作用(见图36.8)。如果AVP没有增加有利于K+分泌的电化学梯度,随着AVP水平的增加和尿流率的减少,尿中K+的排泄将会下降。因此,K+平衡将随着水平衡的变化而变化。因此,AVP对K+跨顶膜外出的电化学驱动力和肾小管流动的影响使得尿中K+的排泄在水排泄大幅波动的情况下保持恒定。
糖皮质激素
糖皮质激素增加尿中K+的排泄。这种效应部分是通过增加GFR(肾小球滤过率)来介导的,GFR的增加提高了尿流率,这是K+排泄的强有力刺激因素,同时通过刺激SGK1活性(见前文)来实现。
如前所述,尿中K+的排泄速率通常由激素水平、酸碱平衡或肾小管液流动速率的同时变化决定(表36.1)。流动的强大效应常常增强或抵消ASDN对激素和酸碱平衡变化的反应。这种相互作用在高钾血症的情况下是有益的,因为流动的增加增强了K+的排泄,从而恢复了K+的稳态。然而,这种相互作用也可能是有害的,例如在代谢性碱中毒的情况下,流动和酸碱状态的变化会改变K+的稳态。
酸碱状态
急性(几分钟到几小时内)和慢性(几天内)的酸碱紊乱对ASDN的K+处理和肾脏K+排泄都有复杂的影响。代谢性酸中毒对肾脏K+排泄的影响是时间依赖性的。如图36.9所示,急性酸血症(即血浆pH低于正常)通过两种机制减少K+的分泌:(1)抑制Na+,K+ -ATP酶,从而降低细胞内[K+]和K+跨顶膜外出的电化学驱动力;(2)通过降低顶膜对K+的通透性。急性碱血症(即血浆pH高于正常)具有相反的效果,增加K+的分泌。
A36B.L1E 激素和其他因素对肾脏K+稳态的影响及其对血浆[K+]的影响
ASDN,醛固酮敏感性远端肾单位。改编自Field MJ等。见:Narins R,编。《肾脏学教科书:体液和电解质代谢的临床紊乱》。第5版。纽约:McGraw-Hill;1994年。
• 图36.9 代谢性酸中毒对K+排泄的急性与慢性影响。详见正文。ECV,有效循环血量。
慢性酸血症促进肾脏K+排泄,导致K+负平衡(见图36.9)。这是因为慢性代谢性酸中毒通过抑制近端小管中的Na+,K+ -ATP酶,减少了水和溶质(如NaCl)的重吸收。因此,肾小管液流量在ASDN中增加。近端小管对水和NaCl重吸收的抑制也减少了ECF容量,从而刺激醛固酮的分泌。此外,由无机酸引起的慢性酸中毒增加了血浆[K+],这进一步刺激了醛固酮的分泌。肾小管液流量、血浆[K+]和醛固酮水平的升高抵消了酸中毒对细胞[K+]和顶膜通透性的影响,K+分泌增加。因此,代谢性酸中毒可能抑制或刺激K+的排泄,这取决于紊乱的持续时间。如前所述,急性代谢性碱中毒刺激K+的排泄。慢性代谢性碱中毒,尤其是与ECF收缩相关时,由于醛固酮水平的增加,显著增加了肾脏K+的排泄。
酸血症(acidemia)和碱血症(alkalemia)对K+排泄的方向性影响在呼吸性酸碱紊乱中与代谢性紊乱相似,但呼吸性紊乱对K+排泄的影响通常小于代谢性酸碱紊乱。由过度通气引起的急性呼吸性碱中毒(acute respiratory alkalosis)与\upalpha-肾上腺素能刺激相关,这种刺激通过抑制细胞内K+的摄取来增加血浆[K+]。急性呼吸性碱中毒是临床中常见的酸碱紊乱,常见于胸痛、焦虑、药物、低氧血症和感染等情况。慢性呼吸性碱中毒通常会增加肾脏K+的排泄并降低血浆[K+]。
在细胞水平
最近阐明了饮食中K+含量和酸碱状态通过ASDN(aldosterone-sensitive distal nephron)早期段调节K+分泌的细胞机制。K+摄入增加通过多种机制增加K+的分泌。高钾血症(hyperkalemia)增加了主细胞(principal cells)顶膜(apical plasma membrane)上ROMK通道的活性。此外,高钾血症抑制了近端小管(proximal tubule)对NaCl和水的重吸收,从而增加了ASDN的流速,这是K+分泌的强有力刺激(图36.6)。高钾血症还增加了醛固酮(aldosterone)水平,醛固酮通过三种机制增加K+的分泌。首先,醛固酮增加了顶膜上K+通道的数量。其次,醛固酮通过增加基底外侧膜(basolateral membrane)上N a+,K+-ATPase泵的数量,刺激K+的摄取,从而增强了驱动K+跨顶膜分泌的电化学梯度。第三,醛固酮增加了N a+跨顶膜的运动,使顶膜电压去极化,从而增加了电化学梯度,促进了K+的分泌。低K+饮食通过增加酪氨酸激酶(tyrosine kinase)的活性显著减少了ASDN对K+的分泌,酪氨酸激酶导致ROMK通道从顶膜内吞,从而减少了K+的分泌。伴有酸血症的代谢性酸中毒(metabolic acidosis)通过抑制ROMK通道的活性减少了K+的分泌,而伴有碱血症的代谢性碱中毒(metabolic alkalosis)则通过增强ROMK通道的活性刺激了K+的分泌。
钙和无机磷酸盐稳态概述
Ca++和无机磷酸盐(Pi)a是多价离子,承担着许多复杂而重要的功能。Ca++是酶促反应的辅因子,也是许多信号通路中的第二信使,对稳态至关重要。Pi是代谢过程中必不可少的物质,包括三磷酸腺苷(ATP)的形成,并且它是核苷酸、核苷和磷脂的重要组成部分。蛋白质的磷酸化是细胞信号传导的重要机制,Pi是细胞、血浆和尿液中的重要缓冲物质。Ca++和Pi是细胞外基质、软骨、牙齿和骨骼的关键元素。
肾脏通过排泄胃肠道吸收的Ca++和Pi的量来调节全身的Ca++和Pi(正常的骨重塑不会导致Ca++和Pi的净增加或从骨骼中释放)。如果血浆中的Ca++和Pi浓度显著下降,肠道吸收、骨吸收(即从骨骼中丢失Ca++和Pi)以及肾小管重吸收会增加,从而使血浆中的Ca++和Pi浓度恢复到正常水平。在生长和怀孕期间,肠道吸收超过尿液排泄,这些离子会在新形成的胎儿组织和骨骼中积累。相反,骨骼疾病(如骨质疏松症)或瘦体重的下降会增加尿液中的Ca++和Pi丢失,而肠道吸收没有变化。这些情况会导致体内Ca++和Pi的净丢失。最后,在慢性肾功能衰竭期间,Pi会在体内积累,因为Pi的肠道吸收超过尿液排泄,导致Pi在体内积累和骨重塑(参见“临床讨论”中关于终末期肾病的讨论)。
这段简短的介绍揭示了肾脏与胃肠道和骨骼共同作用,在维持血浆Ca++和Pi水平以及Ca++和Pi稳态方面起着重要作用(参见第40章)。因此,本章的这一部分将讨论肾脏对Ca++和Pi的处理,重点介绍调节尿液排泄的激素和因素。
钙
Ca++在细胞过程中扮演重要角色,包括骨骼形成、细胞分裂和生长、止血、激素-反应偶联以及电刺激-反应偶联(例如肌肉收缩、神经递质释放)。近99%的Ca++储存在骨骼和牙齿中,约1%存在于细胞内液(ICF)中,0.1%存在于细胞外液(ECF)中。血浆中总\left[Ca++\right]为10mg/dL (2.5~mM或5~mEq/L),其浓度通常维持在非常狭窄的范围内。血浆中约50%的Ca++是离子化的(即游离的),40%与血浆蛋白(主要是白蛋白)结合,10%与几种阴离子形成复合物,包括PO_43-、HCO3-、柠檬酸和SO_42-(图36.10)。血浆的pH会影响这种分布(图36.11)。测量的总血浆\left[Ca++\right]并不能反映生理上相关的离子化\left[Ca++\right]。酸血症会增加离子化\left[Ca++\right],而以与蛋白质结合的Ca++为代价,而碱血症则通过增加与蛋白质结合的Ca++来减少离子化\left[Ca++\right]。碱血症患者容易发生强直性痉挛(强直性肌肉痉挛),而酸血症患者即使血浆总Ca++水平降低,也不容易发生强直性痉挛。代谢性酸中毒患者中[H+]的增加导致更多的H+与血浆蛋白、PO_43-、HCO3-、柠檬酸和SO_42-结合,从而取代Ca++。这种取代增加了血浆中离子化的\left[Ca++\right]。在碱血症中,血浆的[H+]减少。一些H+离子从血浆蛋白、PO_43-、HCO3-、柠檬酸和SO_42-中解离,以交换Ca++,从而减少离子化的\left[Ca++\right]。血浆白蛋白浓度也影响\left[Ca++\right]。低白蛋白血症会降低总\left[Ca++\right],可能无法准确反映离子化的\left[Ca++\right],而高白蛋白血症对总\left[Ca++\right]有相反的影响。在临床实践中,普遍认为血清白蛋白浓度每下降1g/dL (10~g/L),总\left[Ca++\right]下降0.8~mg/dL (0.2mmol/L)。
• 图36.10 血浆中\mathttC a++的分布。(来自Koeppen BM, Stanton BA. Renal Physiology. 第5版. 费城: Elsevier; 2013.)
• 图36.11 pH对血浆[C a++]的影响。(来自Koeppen BM, Stanton BA. Renal Physiology. 第5版. 费城: Elsevier; 2013.)
低离子化\left[Ca++\right]会增加神经和肌肉细胞的兴奋性,并可能导致低钙血症性手足搐搦。与低钙血症相关的手足搐搦发生的原因是低钙血症导致阈值电位向更负的值移动(即更接近静息膜电位)(图36.12)。升高的离子化\left[Ca++\right]可能会降低神经肌肉的兴奋性或导致心律失常、嗜睡、定向障碍甚至死亡。高钙血症的这种效应发生的原因是升高的离子化\left[Ca++\right]导致阈值电位向较不负的值移动(即远离静息膜电位)。\left[Ca++\right]在一个非常狭窄的范围内被调节,主要由甲状旁腺激素(PTH)和维生素D的活性代谢物骨化三醇(1,25-二羟基维生素\mathbfD_3)调节。
细胞内Ca++被隔离在内质网和线粒体中,或与蛋白质结合。因此,细胞内离子化\left[Ca++\right]非常低(\approx100nM)。细胞膜两侧\left[Ca++\right]的大浓度梯度由所有细胞中的Ca++-ATPase泵(PMCa1b)和一些细胞中的3Na+/Ca++交换器(NCX1)维持。
钙稳态概述
Ca++稳态取决于:(1)从胃肠道吸收的Ca++,(2)Ca++在骨骼和细胞外液(ECF)之间的分布,以及(3)肾脏对Ca++排泄的调节。全身Ca++含量由从胃肠道吸收的Ca++量和肾脏排泄的Ca++量决定(图36.13)。胃肠道通过一种主动的载体介导的转运机制吸收Ca++,这种机制受到肾脏近曲小管产生的骨化三醇的刺激。从胃肠道净吸收的Ca++约为200mg/day,但当骨化三醇水平升高时,可以增加到600mg/day。肾脏每日排泄的Ca++量等于胃肠道吸收的量(200~mg/day),并且与肠道吸收同步变化。因此,Ca++平衡得以维持,因为平均饮食中摄入的Ca++量1000mg/day等于粪便中丢失的量\langle800mg/day加上尿液中排泄的量(200~mg/day)。
Ca++在骨骼和细胞外液(ECF)之间的分布调控由甲状旁腺激素(PTH)和骨化三醇(calcitriol)介导(见图36.13)。PTH由甲状旁腺分泌,以响应血浆\left[Ca++\right]的降低(即低钙血症)。PTH通过以下方式增加血浆\left[Ca++\right]:(1) 刺激骨吸收,(2) 增加肾脏远曲小管(DT)对Ca++的重吸收,以及(3) 刺激骨化三醇的产生,骨化三醇进而增加胃肠道(GI)对Ca++的吸收。肾脏中骨化三醇的产生由低钙血症和低磷血症刺激。骨化三醇主要通过刺激胃肠道对Ca++的吸收来增加血浆\left[Ca++\right]。它还通过增加肾脏中Ca++结合和转运蛋白的表达来增强肾脏对Ca++的重吸收(具体细节将在后面讨论)。血浆Ca++是钙感应受体(\mathbfCaSR)的激动剂,\mathbfCaSR表达在参与Ca++稳态的细胞表面:分泌PTH的甲状旁腺细胞、分泌降钙素的甲状腺细胞、产生骨化三醇的近曲小管细胞和TAL细胞(将在后面讨论)。\mathbfCaSR被离子化\left[Ca++\right]的增加激活,抑制甲状旁腺释放PTH和近曲小管产生骨化三醇。\mathbfCaSR激活的净效应是减少肾脏对Ca++的重吸收、降低血浆\left[Ca++\right]以及减弱PTH介导的磷酸尿效应(减少肾脏Pi的排泄)。\mathbfCaSR通过立即响应血浆\left[Ca++\right]的微小变化,在稳态血浆\left[Ca++\right]中起主要作用。降钙素由甲状腺C细胞(滤泡旁细胞)分泌,其分泌由高钙血症刺激。降钙素主要通过刺激骨形成(即Ca++在骨中的沉积)来降低血浆\left[Ca++\right]。尽管降钙素在低等脊椎动物的Ca++稳态中起重要作用,但在人类的Ca++稳态中仅起次要作用,因此不再进一步讨论。
• 图36.12 \mathbbC\ a++对神经和肌肉兴奋性的影响。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
• 图36.13 \mathttC a++稳态的概述。P T H, 甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
临床意义
降低甲状旁腺激素(PTH)水平的情况(例如,因腺瘤切除甲状旁腺后导致的甲状旁腺功能减退)会降低血浆中的\left[C a++\right],这可能导致低钙性手足抽搐(间歇性肌肉收缩)。在严重情况下,低钙性手足抽搐可能因窒息导致死亡。高钙血症可能引发致命的心律失常并降低神经肌肉的兴奋性。临床上,高钙血症最常见的原因是原发性甲状旁腺功能亢进和恶性肿瘤。原发性甲状旁腺功能亢进是由于甲状旁腺良性肿瘤过度分泌PTH所致。相比之下,恶性肿瘤如癌会分泌一种类似PTH的激素,称为甲状旁腺激素相关肽(PTHrP)。PTH和PTHrP水平的升高会导致高钙血症和高钙尿症(尿钙排泄增加)。
沿肾单位的钙转运
可用于肾小球滤过的Ca++包括离子化部分和与阴离子结合的Ca++。因此,血浆中约60%的Ca++可用于肾小球滤过。正常情况下,滤过的Ca++中有99%被肾单位重吸收(图36.14)。近端小管重吸收约50%至60%的滤过Ca++。另外15%在Henle袢(主要是TAL的皮质部分)重吸收,约10%至15%由远曲小管(DT)重吸收,不到1%由集合管重吸收。约1%(200毫克/天)通过尿液排出。这部分等于胃肠道每天净吸收的量。
近端小管对Ca++的重吸收主要通过细胞旁途径进行。这种被动的细胞旁重吸收由近端小管后半段的管腔正跨上皮电压和有利的Ca++浓度梯度驱动,这两者都是由近端小管前半段的跨细胞Na+和水重吸收建立的(见第34章)。
• 图36.14 沿肾单位的\mathttC a++转运概述。百分比表示每个节段重吸收的滤过\mathttC a++的量。CCD,皮质集合管;D T, 远曲小管;IMCD,内髓集合管;P T, 近端小管;T A L,厚升支。
Henle袢对Ca++的重吸收也主要通过细胞旁途径进行。与近端小管类似,TAL中的Ca++和Na+重吸收是平行的。这些过程之所以平行,是因为Ca++通过细胞旁途径被动重吸收,而Na+重吸收产生了管腔正电压。袢利尿剂抑制Henle袢TAL的Na+重吸收,从而降低管腔正电压的幅度(见第34章)。这一作用反过来抑制了通过细胞旁途径的Ca++重吸收。因此,袢利尿剂可用于增加高钙血症患者的肾脏Ca++排泄。
在细胞水平
紧密连接蛋白claudin-16(CLDN16)的突变会降低细胞旁途径对\mathttC a++和M g++的通透性,从而减少\mathttC a++和M g++在Henle袢粗升支(TAL)中通过紧密连接的扩散性重吸收。家族性低镁高钙尿症是由claudin-16的突变引起的,claudin-16是TAL细胞中紧密连接的组成部分。这种疾病的特征是由于TAL中细胞旁途径对这些离子的被动重吸收减少,导致\mathttC a++和M g++的排泄增加。受影响的个体尿液中\mathttC a++水平较高,可能导致肾结石(nephrolithiasis)的形成。
在远曲小管(DT)中,由于管腔内的电压相对于血液为负电性,Ca++的重吸收完全是主动的,因为Ca++是逆其电化学梯度被重吸收的(图36.15)。因此,DT对Ca++的重吸收完全是跨细胞的。Ca++通过Ca++通透性离子通道(TRPV5)穿过顶膜进入细胞。在细胞内,Ca++与calbindinD28K结合。calbindin-\mathbfC\mathbfa++复合物携带Ca++穿过细胞,并将其递送到基底外侧膜,在那里主要通过3Na+/1Ca++反向转运体(NCX1)将Ca++排出细胞;然而,质膜Ca++ -ATPase同工酶1b(PMCA1b)也可能参与其中。尿液中Na+和Ca++的排泄通常呈平行变化。然而,这些离子的排泄并不总是平行变化,因为DT对Ca++和Na+的重吸收是独立且差异调节的。例如,噻嗪类利尿剂抑制DT对Na+的重吸收,但刺激该节段对Ca++的重吸收。因此,噻嗪类利尿剂的净效应是增加尿液中Na+的排泄并减少尿液中Ca++的排泄。由于噻嗪类利尿剂减少了尿液中Ca++的排泄,它们常被用于减少产生含Ca++肾结石的个体的尿钙排泄。
• 图 36.15 远端小管重吸收 \mathttC a++ 的细胞机制。\mathttC a++ 仅通过细胞途径重吸收。\mathttC a++ 通过一种 C a++ 通透性离子通道 (T R P V5) 穿过顶膜进入细胞。在细胞内,\mathttC a++ 与钙结合蛋白(calbindin- \cdotD_28K)结合,\mathbbC\ a++ -钙结合蛋白复合物扩散穿过细胞,将 \mathttC a++ 递送至基底外侧膜。\mathttC a++ 主要通过 3(或 4)N a+/C a++ 反向转运体 (N C X1) 以及 C a++-H+ -ATP 酶(PMCa1b)穿过基底外侧膜转运。Claudin 8 (CLDN8) 是一种紧密连接蛋白,对 C a++ 不通透,从而防止 \mathttC a++ 通过紧密连接反向扩散到管腔中,管腔相对于细胞的血侧是电负性的。CB,Calbindin- \cdotD_28K。
尿钙排泄的调节
多种激素和因素影响尿中 Ca++ 的排泄。PTH 发挥最强的调控作用(表 36.2)。PTH 刺激肾脏对 Ca++ 的重吸收(即抑制肾脏 Ca++ 的排泄)。尽管 PTH 抑制 Na+ 和水的重吸收,从而抑制近端小管对 Ca++ 的重吸收,但它刺激 Henle 袢的 TAL 和 DT 对 Ca++ 的重吸收。因此,PTH 的净效应是增强肾脏对 Ca++ 的重吸收。
血浆 \left[Ca++\right] 的变化也调节尿中 Ca++ 的排泄,高钙血症增加排泄,低钙血症减少排泄。高钙血症通过以下方式增加尿中 Ca++ 的排泄:(1)减少近端小管对 Ca++ 的重吸收(由于间质液 \left[Ca++\right] 增加导致旁细胞重吸收减少);(2)通过激活位于这些细胞基底外侧膜的 CaSR 抑制 Henle 袢 TAL 对 Ca++ 的重吸收(Na+ 重吸收减少,从而降低管腔正电位的幅度);(3)通过降低 PTH 水平抑制 DT 对 Ca++ 的重吸收。因此,尿中 Ca++ 的排泄增加。低钙血症对尿中 Ca++ 的排泄有相反的影响,主要是通过增加近端小管和 TAL 对 Ca++ 的重吸收。Calcitriol 增强 DT 对 Ca++ 的重吸收,但其效果不如 PTH。
影响肾脏Ca++排泄的因素有多种。血浆[Pi]的增加(例如,由于饮食中Pi负荷增加或肾功能下降引起)通过降低血浆离子化\left[Ca++\right]并随后刺激PTH分泌来抑制肾脏Ca++排泄。血浆[Pi]的下降(例如,由于饮食中Pi缺乏引起)则具有相反的效果(注:在肾功能正常的情况下,饮食中Pi摄入量在七倍范围内的变化对血浆\left[Pi\right]没有影响)。TAL中表达的CaSR直接增加肾脏Ca++排泄以响应血浆离子化\left[Ca++\right]的升高(如前所述)。相反,血浆\left[Ca++\right]的下降会导致TAL对Ca++的吸收增加,并相应地减少尿中Ca++的排泄。血浆\left[Ca++\right]对TAL中CaSR的直接影响与PTH并行作用,PTH通过调节DT对Ca++的吸收并控制尿中Ca++排泄以维持其稳态。ECF(细胞外液)体积的变化主要通过影响近端小管对Na+和水的重吸收来改变Ca++排泄。ECF收缩会增加近端小管对Na+和水的重吸收,从而增强Ca++的重吸收。因此,尿中Ca++排泄减少。ECF扩张则具有相反的效果。酸血症会增加Ca++排泄,而碱血症则会减少排泄。pH对Ca++重吸收的调节主要发生在DT。碱中毒会刺激顶端膜Ca++通道(TRPV5),从而增加Ca++重吸收。相反,酸中毒会抑制同一通道,从而减少Ca++重吸收。如前所述,袢利尿剂抑制TAL对Ca++的重吸收,而噻嗪类利尿剂则刺激DT对Ca++的重吸收。
aPTH抑制近端小管对C a++的重吸收,但刺激TAL(厚升支)和远端小管的重吸收。总体而言,净效应是增加C a++的重吸收,从而减少尿中\mathttC a++的排泄。CaSR,钙感受受体;P T H_i,甲状旁腺激素;P T H r P,甲状旁腺激素相关肽;TAL,厚升支。改编自Mount DB, Yu A. 无机溶质的运输:钠、氯、钾、镁、钙和磷酸盐。见:Brenner BM, 编. Brenner和Rector的肾脏学。第8版。费城:Saunders;2008。
临床相关
CaSR基因编码的突变会导致\mathttC a++稳态的紊乱。家族性低尿钙性高钙血症(FHH)是由CaSR基因失活突变引起的单倍体不足状态。高钙血症是由于\mathttC a++调节的PTH分泌改变(即\mathttC a++调节的PTH分泌的设定点发生偏移)所致,使得在任何血浆\left[Ca++\right]水平下PTH水平都升高,并且不受高钙血症的抑制。由于PTH水平升高和CaSR对肾脏\mathttC a++运输的调节缺陷,TAL和DT中\mathttC a++重吸收增强,导致低尿钙。常染色体显性低甲状旁腺功能减退症是由CaSR基因的激活突变引起的。CaSR的激活改变了\mathttC a++调节的PTH分泌的设定点,使得在任何血浆\left[C a++\right]水平下PTH水平都降低。PTH水平降低和CaSR调节的肾脏\mathttC a++运输缺陷导致高尿钙。CaSR通过WNK(无K=赖氨酸)激酶信号通路激活DT早期段的噻嗪类敏感的N a+/C l-共转运体(见第34章)。N a+/C l-共转运体的激活减少了\mathbbC\ a++的重吸收,导致高尿钙。共转运体的失活增加了C a++的重吸收,高尿钙得以缓解。因此,CaSR的激活增加了N a+/C l-共转运体的活性,导致NaCl重吸收增加,肾脏\mathttC a++排泄加剧,以及高尿钙。
磷酸盐
Pi是许多重要细胞组分的重要组成部分,包括DNA、RNA、ATP、核苷酸、核苷、磷脂和代谢途径的中间产物。与Ca++一样,它是骨骼的主要成分。其在血浆中的浓度是骨形成和吸收的重要决定因素。此外,尿中的Pi是维持酸碱平衡的重要缓冲剂(即它是许多可滴定酸之一)(见第37章)。大约85%的Pi位于骨骼和牙齿中,14%位于细胞内液(ICF)中,1%位于细胞外液(ECF)中。正常血浆[Pi]为3至4~mg/dL(1-1.5mM)。血浆Pi以离子化形式存在(45%)、复合形式存在(30%)或与蛋白质结合(25%)。Pi缺乏会导致肌肉无力、横纹肌溶解和骨矿化减少,从而导致儿童佝偻病和成人骨软化症。
磷酸盐稳态概述
Pi(磷酸盐)的稳态依赖于:(1) 胃肠道(GI tract)对Pi的吸收,(2) Pi在骨骼和细胞外液(ECF)之间的分布,以及(3) 肾脏对Pi排泄的调节(见图36.16)。
全身Pi水平由胃肠道吸收的Pi量和肾脏排泄的Pi量决定。胃肠道对Pi的吸收通过主动和被动机制进行;随着膳食中Pi的增加,Pi的吸收也随之增加,并且这一过程受到骨化三醇(calcitriol)的刺激。尽管成年人每日Pi摄入量在800至1500毫克之间波动,但在稳态下,肾脏通过尿液排泄与胃肠道吸收的Pi量相等的Pi,从而维持全身Pi平衡的恒定(正常的骨骼重塑不会导致骨骼中Pi的净增加或释放)。相比之下,在生长期间,Pi会在体内积累。肾脏对Pi的排泄是身体调节Pi平衡和稳态的主要机制。
• 图36.16 P_i稳态的概述。P T H,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 第5版. 费城: Elsevier; 2013.)
血浆中的[Pi](磷酸盐浓度)由甲状旁腺激素(PTH)、骨化三醇和成纤维细胞生长因子-23(FGF-23)调控。PTH从骨骼中释放Pi(见图36.16)。肾脏对Pi的排泄由PTH增加,而骨化三醇则抑制这一过程。
维持血浆中的[Pi]对于最佳的Ca++(钙离子)- Pi复合物形成至关重要,这是骨骼矿化所必需的,同时避免了Ca++–P_i在血管和其他软组织中的沉积。血浆[Pi]的升高直接刺激PTH的合成和释放,并降低离子化的\left[Ca++\right],后者通过与钙敏感受体(CaSR)的相互作用刺激PTH的释放。PTH通过抑制近端小管对Pi的重吸收来增强尿液中Pi的排泄。高磷血症还会减少近端小管对骨化三醇的产生,从而导致胃肠道对Pi吸收的减少。PTH的增加和骨化三醇的减少都会降低血浆中的[Pi]。
磷酸盐在肾单位中的转运
图36.17总结了肾单位各段对Pi的转运。近端小管重吸收了肾小球滤过的Pi的80%;亨利氏袢、远端小管(DT)和皮质集合管(CCD)重吸收的Pi量可以忽略不计。因此,大约20%的肾小球毛细血管滤过的Pi通过尿液排出。
Pi 在近端小管的重吸收是通过跨细胞途径进行的(图 36.18)。Pi 通过近端小管顶膜上的两种 Na+/Pi 共转运体(IIa 和 IIc)被摄取。Na+/Pi IIa 转运 3 个 Na+ 和一个二价 Pi (HPO_42-),并将正电荷带入细胞内。Na+/Pi IIc 转运 2 个 Na+ 和一个单价 Pi \left(H_2PO_4\right),并且是电中性的。Pi 通过基底外侧膜上的一个尚未被表征的 Pi -无机阴离子反向转运体离开细胞。
• 图 36.17 P_i 沿肾单位的转运。P_i 主要由近端小管重吸收。百分比表示每个肾单位段重吸收的滤过 P_i 的量。大约 20% 的滤过 P_i 被排泄。CCD,皮质集合管;D T_:,远端小管;IMCD,内髓集合管;P T_:,近端小管;T A L,粗升支。
成纤维细胞生长因子 23 (FGF-23) 增加肾脏 Pi 的排泄,从而有助于调节血浆 [Pi](见图 36.16)。FGF-23 由骨细胞和成骨细胞分泌,并抑制近端小管对 Pi 的重吸收和骨化三醇的产生。FGF-23 的分泌受到持续高磷血症、PTH 和骨化三醇的刺激。FGF23 基因的激活突变会导致低磷血症、低血浆骨化三醇和佝偻病/骨软化症,而失活突变则会导致高磷血症、高骨化三醇水平和软组织钙化。
• 图 36.18 近端小管 P_i 重吸收的细胞机制。顶膜转运途径包含两种 N a+/P_i 同向转运体,一种转运 3 个 N a+ 对应一个 Pi(I I a),另一种转运 2 个 N a+ 对应一个 Pi(I I C)。P_i 通过未知机制穿过基底外侧膜离开细胞。A T P,三磷酸腺苷。
临床相关
在终末期肾病患者中,肾脏无法排泄磷(Pi)。由于消化道(\textcircled7 tract)持续吸收P_i,P_i在体内积累,血浆中的P_i浓度上升。过量的P_i与\mathbbC\ a++形成复合物,降低了血浆中的离子化\left[Ca++\right]浓度。P_i的积累还会减少骨化三醇(calcitriol)的产生。这一反应减少了消化道对\mathttC a++的吸收,进一步降低了血浆中的\left[Ca++\right]浓度。血浆\left[Ca++\right]的降低增加了甲状旁腺激素(PTH)的分泌和骨骼中\mathttC a++的释放。这些作用导致肾性骨营养不良(即骨吸收增加,纤维组织替代骨组织,使骨骼更容易发生骨折)。
在终末期肾病期间,慢性甲状旁腺功能亢进(即由于血浆P_i升高导致的PTH水平升高)可能导致转移性钙化,其中\mathttC a++和P_i在动脉、软组织和内脏中沉淀。\mathbbC\ a++和P_i在心脏中的沉积可能导致心肌衰竭。预防和治疗甲状旁腺功能亢进及P_i潴留的措施包括低P_i饮食和在饮食中使用“磷酸盐结合剂”(即一种形成不溶性P_i盐的物质,从而使P_i无法从消化道吸收)。此外,还会开具骨化三醇补充剂以抑制PTH的释放。
尿磷排泄的调节
多种激素和因素调节尿中Pi的排泄(表36.3和图36.19)。血浆Pi浓度升高会降低\left[Ca++\right]浓度,从而增加PTH水平,进而增加肾脏对Pi的排泄。PTH通过抑制近端小管对Pi的重吸收来增加Pi的排泄。PTH通过刺激近端小管细胞刷状缘膜上的Na+/Pi共转运体的内吞移除来减少Pi的重吸收。血浆Pi浓度升高还会增加FGF-23的水平,FGF-23抑制近端小管对Pi的重吸收和骨化三醇的产生。血浆Pi浓度升高直接抑制骨化三醇的产生,从而减少肠道对Pi的重吸收。饮食中的Pi摄入也通过不依赖于PTH水平变化的机制调节Pi的排泄。Pi负荷增加会增加排泄,而Pi耗竭则会减少排泄。饮食中Pi摄入的变化通过改变近端小管顶膜上Na+/Pi IIa和IIc共转运体的转运速率和数量来调节Pi的转运。
影响近端小管Pi重吸收的激素和因素总结 36.3
FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。
• 图36.19 对血浆[Pi]升高的反应。FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。虚线表示负反馈。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
细胞外液(ECF)体积影响Pi的排泄。ECF扩张通过以下方式增强Pi的排泄:(1)增加肾小球滤过率(GFR),从而增加Pi的滤过量;(2)减少Na+/P_i耦合重吸收,从而减少ECF体积;(3)降低血浆\left[Ca++\right],从而增加PTH,PTH抑制近端小管对Pi的重吸收。酸碱平衡也影响Pi的排泄。慢性酸血症增加Pi的排泄,而慢性碱血症则减少其排泄。酸碱状态的影响,类似于PTH的作用,是通过改变顶膜上Na+/Pi共转运体的表达来介导的。代谢性酸中毒增加糖皮质激素的分泌,糖皮质激素抑制近端小管对Pi的重吸收,并增加肾脏对Pi的排泄。这种抑制作用,加上酸中毒对近端小管Pi重吸收的直接影响,使得远曲小管(DT)和集合管能够分泌更多的H+作为可滴定酸,并生成更多的HCO3-,因为Pi是重要的尿液缓冲剂。生长激素减少Pi的排泄。
临床相关
Klotho在肾脏的早期远曲小管(DT)中高度表达。Klotho基因敲除小鼠表现出类似于慢性肾脏病(CKD)的表型,包括软组织钙化、高磷血症和血浆FGF-23水平升高。Klotho以膜结合和可溶性蛋白的形式存在。膜结合形式是FGF-23的共受体,因此Klotho促进肾脏对P_i的排泄,并降低血清中骨化三醇的水平。可溶性循环Klotho影响离子转运、Wnt信号传导和FGF-23依赖的PTH合成,并抑制肾素-血管紧张素轴。Klotho可能是CKD的生物标志物,其缺乏可能促进CKD的发展。此外,实验数据还表明,Klotho治疗可能减缓CKD的进展。
甲状旁腺激素和骨化三醇对\mathbbCa++和\sf P_i稳态的综合综述
如图36.20所示,PTH(甲状旁腺激素)调节Ca++和Pi的稳态。低钙血症是PTH分泌的主要刺激因素。PTH引起骨吸收,增加尿中Pi的排泄,减少尿中Ca++的排泄,并刺激骨化三醇的产生,骨化三醇则促进肠道对Ca++和Pi的吸收。由于骨、胃肠道和肾脏对Pi的处理变化趋于平衡,PTH增加了血浆\left[Ca++\right],而对血浆[Pi]的影响较小。总体而言,PTH水平因低钙血症而升高,使血浆\left[Ca++\right]恢复正常。高钙血症则产生相反的效果。
骨化三醇在Ca++和Pi的稳态中起重要作用(图36.21)。骨化三醇的净效应是增加血浆\left[Ca++\right]和[Pi]。因此,骨化三醇产生的主要刺激因素是低钙血症和低磷血症。骨化三醇的主要作用是刺激胃肠道对Ca++和Pi的吸收。在较小程度上,骨化三醇与PTH共同作用,减少肾脏对Ca++的排泄。在Ca++缺乏的饮食中,骨化三醇可能增强PTH的骨吸收效应,从而从骨中释放Ca++和Pi。
临床相关
在缺乏糖皮质激素的情况下(例如,Addison病),P_i的排泄受到抑制,肾脏排泄可滴定酸和生成新的H C O_3-的能力也下降。生长激素增加近端小管对P_i的重吸收。因此,儿童处于P_i的正平衡状态,血浆[Pi]高于成人,而升高的[Pi]对骨形成和生长至关重要。
• 图36.20 对血浆\left[Ca++\right]下降的反应。虚线表示负反馈。FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
• 图36.21 维生素D代谢及其对C a++和P_i稳态的影响。低钙血症(通过PTH)和低磷血症是肾脏中骨化二醇代谢为骨化三醇的主要刺激因素。骨化三醇的净效应是增加血浆\left[C a++\right]和[Pi]。P T H,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
关键概念
- K+的稳态由肾脏维持,肾脏调整K+的排泄以匹配饮食中的K+摄入,胰岛素、肾上腺素、醛固酮、AVP和糖皮质激素则调节K+在细胞内液(ICF)和细胞外液(ECF)之间的分布以及肾脏对K+的排泄。其他条件,如细胞溶解、运动、酸碱平衡和血浆渗透压的变化,也会影响K+的稳态和血浆[K+]。
- 肾脏对 K+ 的排泄取决于DT(远端小管)和CCD(皮质集合管)对 K+ 的转运速率和方向。这些肾小管段对 K+ 的分泌受血浆 [K+]、醛固酮和AVP(抗利尿激素)的调节。肾小管液流量和酸碱平衡的变化会改变肾脏对 K+ 的排泄。在 K+ 缺乏状态下,DT和CCD会抑制 K+ 的分泌并增加其重吸收。
- 肾脏与胃肠道和骨骼共同调节血浆 \left[Ca++\right] 和 [Pi]。4. 血浆 \left[Ca++\right] 受PTH(甲状旁腺激素)和骨化三醇的调节。降钙素在人类中不是主要的调节激素。肾脏对 Ca++ 的排泄受PTH、血浆 \left[Ca++\right] 和骨化三醇的调节,并受酸碱状态、ECF(细胞外液)容量和血浆 Pi 变化的影响。5. Ca++ 的重吸收由PTH和骨化三醇在TAL(髓袢升支粗段)和DT中作用以及血浆 \left[Ca++\right] 升高所刺激。6. 血浆 [Pi] 受PTH、FGF-23(成纤维细胞生长因子23)和骨化三醇的调节。Pi 的排泄受PTH、FGF-23、膳食 Pi 和生长激素的调节,并受酸碱失调、ECF扩张和糖皮质激素的影响。
37 肾脏在酸碱平衡调节中的作用
学习目标
完成本章学习后,学生应能够回答以下问题:
- H C O_3- 如何作为缓冲剂发挥作用,为什么它是细胞外液的重要缓冲剂?
- 食物代谢如何产生酸和碱,饮食成分对全身酸碱平衡有何影响?
- 挥发性酸和非挥发性酸之间的区别是什么,什么是净内源性酸产生(NEAP)?
- 肾脏和肺如何参与全身酸碱平衡的调节,什么是肾脏净酸排泄(RNAE)?
- 为什么肾脏排泄酸需要尿液缓冲剂?
- 肾单位各段中 H+ 转运的机制是什么,这些机制如何被调节?
- 肾单位各段如何参与过滤的 H C O_3! 的重吸收过程?
- 肾脏如何产生新的 H C O_3\boldsymbol?
- 肾脏如何产生铵,其排泄如何促进肾脏的酸排泄?
- 身体防御酸碱平衡变化的主要机制是什么?
- 单纯代谢性和呼吸性酸碱紊乱之间的区别是什么,如何通过动脉血气测量来区分它们?
体液中 H+ 的浓度与其他离子相比较低。例如,Na+ 的浓度约为 H+ 的300万倍([Na+]=140m E q/L;[H+]=40n E q/L)。由于体液中 [H+] 较低,通常用负对数或 pH 表示。
几乎所有细胞、组织和器官的生理过程都对pH敏感。事实上,生命无法在细胞外液(extracellular fluid, ECF)pH范围6.8至7.8(H+浓度为160-16~nEq/L)之外存在。正常情况下,ECF的pH维持在7.35至7.45之间。细胞内液(intracellular fluid, ICF)的pH略低(7.1–7.2),但也受到严格调控。
每天,酸和碱通过饮食摄入。此外,细胞代谢产生许多对体液pH有影响的物质。如果没有适当的机制来处理这些日常的酸碱负荷并维持酸碱平衡,许多生命必需的过程将无法进行。本章将回顾全身酸碱平衡的维持。虽然重点在于肾脏在这一过程中的作用,但也考虑了肺和肝脏的作用。此外,还介绍了饮食和细胞代谢对酸碱平衡的影响。最后,讨论了酸碱平衡紊乱,主要是为了说明相关的生理过程。在本章中,酸被定义为任何向体液中添加H+的物质,而碱被定义为从体液中去除H+的物质。
H C O_3-缓冲系统
碳酸氢根(bicarbonate, HCO_3-)是ECF的重要缓冲物质。在正常血浆中,[HCO_3-]为23至25~mEq/L,体积为14~L~(以70公斤个体为例),ECF可以缓冲350~mEq的H+。HCO3-缓冲系统与身体的其他缓冲系统(如磷酸盐)不同,因为它受到肺和肾脏的共同调节。通过以下反应可以更好地理解这一点:
方程 37.1
CO_2+H_2O\leftrightarrowH_2CO_3\leftrightarrowH++HCO_3-
如所示,第一个反应(CO_2的水合/脱水)是限速步骤。这个通常较慢的反应在碳酸酐酶存在下大大加速。第二个反应,H_2CO_3电离为H+和HCO3-,几乎是瞬间完成的。
• 图 37.1 酸碱平衡概述。肺和肾脏共同作用以维持酸碱平衡。肺排出CO_2(挥发性酸),肾脏排出酸(肾脏净酸排泄 [renal net acid excretion, RNAE]),其量等于净内源性酸产生(net endogenous acid production, NEAP),反映了饮食摄入、细胞代谢以及体内酸碱的损失(如粪便中的H C O_3-损失)。详见正文。(摘自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
Henderson-Hasselbalch方程用于量化CO_2和HCO3-的变化如何影响pH:
方程 37.2
pH=pKH+\log\frac\left[HCO_3-\right]oPCO_2
或
方程 37.3
pH=6.1+\log\frac\left[HCO_3-\right]0.03PCO_2
在这些方程中,CO_2的量由CO_2的分压(Pco_2)及其在溶液中的溶解度(\upalpha)决定。对于37°C的血浆,\upalpha的值为0.03。此外,pK\prime是方程37.1中反应的总解离常数的负对数,对于37°C的血浆,其值为6.1。或者,HCO3-和CO_2对[H+]的关系可以如下确定:
方程 37.4
\left[H+\right]=\frac24×PCO_2\left[HCO_3-\right]
通过检查方程37.3和37.4可以看出,当[HCO_3-]或Pco_2发生变化时,pH和[H+]也会发生变化。由于[HCO_3-]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于Pco_2变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。这些紊乱将在后续章节中详细讨论。肾脏主要负责调节ECF中的[HCO_3-],而肺则控制Pco_2。
酸碱平衡概述
人类的饮食中含有许多酸性或碱性的成分。此外,细胞代谢也会产生酸和碱。最后,每天通常会有碱通过粪便排出。正如后面所述,尽管这些过程依赖于饮食,但其净效应是向体液中添加酸。为了维持酸碱平衡,酸的排泄速率必须与其添加速率相等。如果酸的添加超过排泄,就会导致酸中毒。相反,如果酸的排泄超过添加,就会导致碱中毒。
如图37.1所示,饮食中的主要成分是碳水化合物和脂肪。当组织灌注充足、O_2可供组织使用且胰岛素水平正常时,碳水化合物和脂肪会代谢为CO_2和_H_2O。每天通过这一过程会产生15到20摩尔的CO_2。通常,这一大量的CO_2会通过肺有效地从体内排出。因此,这种代谢产生的CO_2对酸碱平衡没有影响。CO_2通常被称为挥发性酸,因为它有潜力在与_H_2O水合后生成H+(见方程37.1)。不直接来自CO_2水合的酸称为非挥发性酸(例如乳酸)。
其他膳食成分的细胞代谢也会对酸碱平衡产生影响。例如,含硫氨基酸(sulfur-containing amino acids)如半胱氨酸(cysteine)和甲硫氨酸(methionine)在代谢时会产生硫酸,而赖氨酸(lysine)、精氨酸(arginine)和组氨酸(histidine)的代谢则会产生盐酸。这部分非挥发性酸(nonvolatile acid)负荷的一部分通过天冬氨酸(aspartate)和谷氨酸(glutamate)的代谢产生的HCO3-来抵消。平均而言,膳食氨基酸的代谢会产生净的非挥发性酸。某些有机阴离子(organic anions)(如柠檬酸(citrate))的代谢会产生HCO3-,这在一定程度上抵消了非挥发性酸的产生。总体而言,在摄入含肉饮食的个体中,酸的生成超过了HCO3-的生成。相比之下,素食饮食产生的非挥发性酸较少。除了代谢产生的酸和碱外,摄入的食物中也含有酸和碱。例如,摄入食物中的磷酸盐(H_2PO_4-)会增加膳食酸负荷。最后,在消化过程中,部分HCO3-通常会随粪便排出。这种损失相当于向体内添加了非挥发性酸。在摄入含肉饮食的个体中,膳食摄入、细胞代谢和粪便中HCO3-的损失导致每天向体内添加约0.7至1.0mEq/kg体重的非挥发性酸(大多数成年人每天50-100mEq)。这种酸被称为净内源性酸生成(net endogenous acid production, NEAP),会导致体内HCO3-的等量损失,必须进行补充。
临床相关
当胰岛素水平正常时,碳水化合物和脂肪会完全代谢为CO_2+\ H_2O。然而,如果胰岛素水平异常低(如糖尿病(diabetes mellitus)),细胞代谢会导致几种有机酮酸(organic ketoacids)的产生(例如,脂肪酸代谢产生的\upbeta -羟基丁酸(\upbeta -hydroxybutyric acid)和乙酰乙酸(acetoacetic acid))。
在缺乏足够的O_2(缺氧(hypoxia))的情况下,细胞的厌氧代谢(anaerobic metabolism)也会导致有机酸(如乳酸(lactic acid))的产生,而不是CO_2+\ H_2O。这种情况在正常个体进行剧烈运动时经常发生。组织灌注不良(如心输出量减少时)也会导致细胞的厌氧代谢,从而导致酸中毒(acidosis)。在这些情况下,有机酸会积累,体液的pH值下降(酸中毒)。治疗(例如,在糖尿病的情况下给予胰岛素)或改善组织灌注(例如,在组织灌注不良的情况下)会导致这些有机酸代谢为CO_2+\ H_2O,这会消耗\Join+,从而有助于纠正酸碱紊乱。
非挥发性酸不会在全身循环,而是立即被ECF中的HCO3-中和。
公式 37.5
H_2SO_4+2NaHCO_3\leftrightarrowNa_2SO_4+2CO_2+2H_2O
公式 37.6
HCl+NaHCO_3\leftrightarrowNaCl+CO_2+H_2O
这一中和过程产生了强酸的Na+盐,并从细胞外液(ECF)中移除了HCO3-。因此,HCO3-最大限度地减少了这些强酸对ECF的pH的影响。如前所述,ECF中大约含有350~mEq的HCO3-。如果这些HCO3-没有得到补充,每天产生的非挥发性酸(\approx70mEq/天)将在5天内耗尽ECF中的HCO3-。为了维持酸碱平衡,肾脏必须补充因中和非挥发性酸而损失的HCO3-,这一过程称为肾脏净酸排泄(RNAE)。
肾脏的净酸排泄
在稳态条件下,NEAP必须等于RNAE以维持酸碱平衡。尽管NEAP在个体之间以及同一个体在不同天之间有所变化,但它并不受调节。相反,肾脏通过调节RNAE来匹配NEAP,并在此过程中补充因中和非挥发性酸而损失的HCO3-(新的\mathbfHCO_3-\dagger)。此外,肾脏还必须防止HCO3-在尿液中的丢失。后一项任务在数量上更为重要,因为HCO3-的滤过负荷约为4320mEq/day(24~mEq/L×180~L/day=4320~mEq/day),而平衡NEAP仅需要50到100~mEq/\Omega天。
滤过的HCO3-的重吸收和酸的排泄都是通过肾单位的H+分泌来完成的。因此,在一天内,肾单位必须向肾小管液中分泌大约4390mEq的H+。大部分分泌的H+用于重吸收滤过的HCO3-负荷。只有50到100~mEq的H+,相当于NEAP的量,被排泄到尿液中。由于这种酸的排泄,尿液通常是酸性的。
肾脏不能排泄比pH4.0到4.5更酸的尿液。即使在pH为4.0时,也只能排泄0.1mEq/L的H+。因此,为了排泄足够的酸,肾脏通过尿液缓冲剂如磷酸盐(Pi)来排泄H+。尿液中的其他成分也可以作为缓冲剂(例如肌酐),尽管它们的作用不如Pi重要。这些尿液缓冲剂统称为可滴定酸。这一术语来源于实验室中定量这些缓冲剂的方法。通常,向尿液样本中加入碱(OH−)以将其pH滴定至血浆的pH(即7.4)。加入的碱量等于这些尿液缓冲剂所滴定的H+量,称为可滴定酸。
H+作为可滴定酸(titratable acid)的排泄不足以平衡NEAP(非挥发性酸净产量)。肾脏通过合成和排泄铵离子\left(\mathbfNH_4~+~\right)来维持酸碱平衡,这是另一个重要的机制。本章后面将更详细地讨论这一过程所涉及的机制。关于肾脏对酸碱平衡的调节,尿液中每排泄一个NH_4+,就会有一个HCO3-返回到体循环中,从而补充在非挥发性酸中和过程中丢失的HCO3-。因此,NH_4+的产生和排泄,就像可滴定酸的排泄一样,相当于肾脏排泄酸。
简而言之,肾脏通过重吸收过滤的HCO3-并排泄与NEAP等量的酸来维持酸碱稳态。这一过程可以量化如下:
公式 37.7
RNAE=\Bigg(U_NH_4+×\dotV\Bigg)+\Bigg(U_TA×\dotV\Bigg)-\Bigg(U_HCO_3-×\dotV\Bigg)
其中\left(U_NH++\dotV\right)和(U_TA+\dotV)分别是NH_4+和可滴定酸(TA)的排泄速率(mEq/day),而(U_.HCO_3-+V)是尿液中丢失的HCO3-量(相当于向体内添加H+)。再次强调,维持酸碱平衡意味着净酸排泄必须等于非挥发性酸的产生。在大多数情况下,尿液中排泄的HCO3-非常少。因此,净酸排泄基本上反映了可滴定酸和NH_4+的排泄。从数量上看,可滴定酸约占RNAE的三分之一,而NH_4+占三分之二。
沿肾单位的H C O_3-重吸收
如公式37.7所示,当尿液中排泄的HCO3-很少或没有时,净酸排泄达到最大值。事实上,在大多数情况下,尿液中出现的HCO3-非常少。由于HCO3-在肾小球自由过滤,每天大约有4320mEq被输送到肾单位并被重吸收。图37.2总结了每个肾单位段对过滤的HCO3-重吸收的贡献。
• 图37.2 H C O_3-的节段重吸收。图中显示了肾单位各段对过滤的H C O_3-重吸收的比例。通常情况下,过滤的H C O_3-全部被重吸收,尿液中几乎没有或没有H C O_3-出现。CCD,皮质集合管;D T,远端小管;IMCD,内髓集合管;P T,近端小管;T A L,厚升支。
近端小管重吸收了滤过的HCO3-的最大部分。图37.3总结了涉及的主要转运过程。H+通过Na+/H+反向转运体和H+ -ATPase(V型)分泌到细胞的顶膜。Na+/H+反向转运体(NHE3)是H+分泌的主要途径(约占HCO3-重吸收的三分之二),并利用管腔到细胞的[Na+]梯度来驱动这一过程(即H+的次级主动分泌)。在细胞内,H+和HCO3-在碳酸酐酶(CA-II)催化的反应中产生。H+被分泌到管腔液中,而HCO3-通过基底外侧膜离开细胞并返回到管周血液中。HCO3-通过基底外侧膜离开细胞的过程与其他离子耦合。大多数HCO3-通过一个将Na+与HCO3-外流耦合的同向转运体(碳酸氢钠同向转运体,NBC1)离开细胞。一些HCO3-通过其他转运体离开细胞,但它们不如Na+/H C O_3-同向转运体重要。如图37.3所示,碳酸酐酶(CA-IV)也存在于细胞的刷状缘和基底外侧膜中。刷状缘酶催化管腔液中的H_2CO_3脱水,而位于基底外侧膜的酶则促进HCO3-离开细胞。CO_2进出细胞的运动通过AQP1进行,AQP1位于管腔和基底外侧膜。
• 图37.3 近端小管细胞重吸收滤过的H C O_3-的细胞机制。仅显示了主要的H+和H C O_3-转运体。ATP,三磷酸腺苷;CA,碳酸酐酶。
Henle袢厚升支(TAL)重吸收HCO3-的细胞机制与近端小管非常相似。H+通过Na+/H+反向转运体和H+ -ATPase分泌。与近端小管一样,Na+/H+反向转运体(NHE3)是H+分泌的主要途径。HCO3-离开细胞涉及Na+/ HCO3-同向转运体(NBC1)和Cl-/H C O_3-反向转运体(阴离子交换体,AE-2)。一些HCO_3-也可能通过基底外侧膜中的Cl-通道离开细胞。
远端小管和集合管重吸收了近端小管和Henle袢未能重吸收的少量HCO3-。图37.4显示了位于这些节段中的间质细胞的H+/H C O_3-转运的细胞机制(另见第34章)。
一种类型的闰细胞分泌H+(重吸收HCO_3-),被称为A-或\upalpha-闰细胞。在这种细胞内,H+和HCO3-通过CO_2的水合作用产生;该反应由碳酸酐酶(CA-II)催化。H+通过两种机制分泌到管腔液中。第一种机制涉及顶膜上的H+-ATPase(V型)。第二种机制通过H+-K+-ATPase将H+的分泌与K+的重吸收耦合,这种ATPase类似于在胃和结肠中发现的HK\upalpha1和HK\alpha2。HCO3-通过基底膜上的Cl-/H C O_3-反向转运体(AE-1)与Cl-交换,离开细胞并进入管周毛细血管血液。
第二种类型的闰细胞将HCO3-而不是H+分泌到管腔液中(也称为B\cdot或\upbeta-闰细胞)。在这些细胞中,H+-ATPase(V型)位于基底膜上,而Cl-/H C O_3-反向转运体位于顶膜上(见图37.4)。
然而,顶膜上的Cl-/H C O_3-反向转运体与H+分泌闰细胞基底膜上的不同,已被鉴定为pendrin。在代谢性碱中毒期间,当肾脏必须排泄过量的HCO3-时,HCO3-分泌闰细胞的活性增加。然而,在大多数情况下(例如,摄入含肉饮食),H+的分泌在这些节段中占主导地位。
集合管细胞的顶膜对H+的渗透性不高,因此管腔液的pH值可以变得相当酸性。实际上,沿着肾单位的最酸性管腔液(pH=4.0-4.5)是在这里产生的。相比之下,近端小管对H+和HCO3-的渗透性要高得多,该节段中的管腔液pH仅降至6.5。正如后面所解释的,集合管降低管腔液pH的能力对于排泄尿液可滴定酸和NH_4+至关重要。
H+分泌的调节
许多因素影响H+的分泌,从而影响肾单位细胞对过滤的HCO3-的重吸收。从生理学角度来看,调节肾单位H+分泌的主要因素是全身酸碱平衡的变化。因此,酸中毒刺激RNAE,而碱中毒期间RNAE减少。
在细胞水平
肾脏细胞表达监测酸碱状态的受体,因此在调节肾小管中的H⁺和H C O_3-转运体中起关键作用(图37.5)。例如,一种G蛋白偶联的\Join+受体(GPCR–GPR4)已被定位到集合管。细胞外液(ECF)中[H+]的增加激活该受体,刺激\Join+的分泌。同样在集合管中,分泌H C O_3-的闰细胞(B-或\upbeta -ICs)表达一种基底外侧的胰岛素相关受体(IRR),它是一种酪氨酸激酶。该受体被ECF中[HCO_3-]的增加激活,并刺激细胞分泌H C O_3-。一种由细胞内H C O_3-调节的可溶性腺苷酸环化酶(sAC)似乎也在调节集合管的H+分泌中起作用。在近端小管中,基底外侧膜的受体酪氨酸激酶(ErbB1和ErbB2)感知ECF中P C O_2的变化。P C O_2的增加激活这些受体,导致血管紧张素II的生成,后者通过AT-1A受体从管腔侧作用,刺激H+分泌/H C O_3-重吸收。同样在近端小管中,非受体酪氨酸激酶(Pyk2)感知细胞内[H+]的变化。当细胞内[H+]的增加激活该激酶时,\Join+分泌/H dCO_3-重吸收被刺激。最后,几种离子通道(例如,肾外髓质K+通道[ROMK])的门控受到ECF或细胞内液(ICF)pH变化的影响。这些通道也有可能作为细胞酸碱传感器。
• 图37.4 远端小管和集合管闰细胞重吸收和分泌H C O_3-的细胞机制。仅显示了主要的H+和H C O_3-转运体。A T P, 三磷酸腺苷;C A_i,碳酸酐酶;H K A,\Join+ f+-K+ -ATP酶。
肾脏对酸碱平衡变化的反应包括膜上转运体活性和/或数量的即时变化,以及转运体合成的长期变化。例如,在代谢性酸中毒时,H+分泌通过多种机制被刺激,具体取决于肾小管的不同节段。首先,酸中毒时细胞内pH的降低将产生更有利的细胞到管腔液的H+梯度,从而使H+跨顶膜的分泌在能量上更为有利。其次,pH的降低可能导致转运蛋白的变构变化,从而改变其动力学。最后,转运体可能从细胞内囊泡转运到膜上。在长期酸中毒的情况下,转运体的丰度增加,这可能是通过适当转运体基因的转录增加或转运体mRNA的翻译增加实现的。
• 图37.5 细胞\Join+和H C O_3-传感器的示例。ATP,三磷酸腺苷;C A M P,环磷酸腺苷;G P C R,\textcircled7蛋白偶联受体;IRR,胰岛素受体相关受体;Pyk2,非受体酪氨酸激酶;sAC,可溶性腺苷酸环化酶。(改编自:Levin LR, Buck J. Annu Rev Physiol; 2015;77:347。)
在细胞水平
在近端小管中,代谢性酸中毒增加了N a+/H+反向转运体(NHE3)的转运动力学,并增加了N a+/H+反向转运体、\Join+-ATP酶以及基底外侧N a+/3H C O_3-同向转运体(NBCe1)在顶膜的表达。在集合管中,酸中毒导致\Join+-ATP酶通过胞吐作用插入到间质细胞的顶膜中。长期酸中毒会增加近端小管(NHE3和NBCe1)和集合管间质细胞中关键酸碱转运体的丰度(\mathbbH+-ATP酶和AE1)。最后,酸中毒会减少在H C O_3-分泌型间质细胞中Cl-/H C O_3-反向转运体pendrin的表达。
尽管上述一些效应可能直接归因于酸中毒,但许多细胞H+转运的变化是由激素或其他因素介导的。已知的三种介导肾脏对酸中毒反应的介质是内皮素、皮质醇和血管紧张素II。内皮素(ET-1)由内皮细胞和近端小管细胞产生。在酸中毒时,ET-1的分泌增强。在近端小管中,ET-1刺激Na+/H+反向转运体的磷酸化并随后插入到顶膜中,以及Na+/3HCO_3-同向转运体插入到基底外侧膜中。ET-1也可能在其他肾单位节段中介导对酸中毒的反应。酸中毒还刺激肾上腺皮质分泌糖皮质激素皮质醇。皮质醇增加了近端小管中Na+/H+反向转运体和Na+/3HCO3-同向转运体的丰度。血管紧张素II在近端小管细胞中响应酸中毒而产生。它被分泌到管腔液中,在那里与血管紧张素I受体结合,从而刺激近端小管的H+分泌/HCO3-重吸收。皮质醇和血管紧张素II还刺激近端小管产生和分泌NH_4+,这将在后面描述,是肾脏对酸中毒反应的重要组成部分。
酸中毒还刺激甲状旁腺激素(PTH)的分泌。PTH抑制近端小管对磷酸盐(Pi)的重吸收(见第36章)。通过这种方式,更多的Pi被输送到远端肾单位,在那里它作为尿液缓冲剂,从而增加了肾脏排泄可滴定酸的能力。
肾脏对碱中毒的反应尚未得到充分表征。RNAE减少是由于尿中HCO3-排泄增加以及可滴定酸和NH_4+排泄减少。调节这种反应的因素尚未得到充分表征。
其他不一定与维持酸碱平衡相关的因素也可能影响肾单位(nephron)细胞分泌H+。由于肾单位中一个重要的H+转运体是Na+/H+反向转运体(antiporter),因此改变Na+重吸收的因素会间接影响H+的分泌。例如,在容量收缩(负Na+平衡)时,肾单位对Na+的重吸收增加(见第35章),包括通过Na+/H+反向转运体重吸收Na+。结果,H+的分泌增强。这是通过几种机制实现的。一种机制涉及由容量收缩激活的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system)。如前所述,血管紧张素II(angiotensin II)作用于近端小管,刺激顶端膜(apical membrane)的Na+/H+反向转运体以及基底外侧膜(basolateral membrane)的Na+/3HCO_3-同向转运体(symporter)。在较小程度上,血管紧张素II刺激亨利袢(Henle’s loop)的粗升支(thick ascending limb, TAL)和远端小管(distal tubule)早期部分的H+分泌,这一过程也由Na+/H+反向转运体介导。醛固酮(aldosterone)对远端小管和集合管(collecting duct)的主要作用是刺激主细胞(principal cells)重吸收Na+(见第34章)。然而,它也刺激这些节段中的闰细胞(intercalated cells)分泌H+。这种效应既有间接的,也有直接的。通过刺激主细胞重吸收Na+,醛固酮使跨上皮电压(transepithelial voltage)超极化(hyperpolarize)(即管腔(lumen)变得更负)。这种跨上皮电压的变化随后促进了闰细胞分泌H+。除了这种间接效应外,醛固酮(和血管紧张素II)还直接作用于闰细胞,通过H+ -ATPase和H+,K+ -ATPase刺激H+分泌。
细胞外液(extracellular fluid, ECF)容量(ECFV)收缩增强H+分泌(HCO_3-重吸收)的另一种机制是通过改变管周毛细血管(peritubular capillary)的Starling力(Starling forces)。如第34章和第35章所述,ECFV收缩改变了管周毛细血管的Starling力,从而增强了近端小管的整体重吸收。随着这种增强的重吸收,更多的滤过负荷(filtered load)的HCO3-被重吸收。
钾平衡(potassium balance)影响近端小管分泌H+。低钾血症(hypokalemia)刺激H+分泌,而高钾血症(hyperkalemia)抑制H+分泌。据认为,K+诱导的细胞内pH变化至少部分导致了这种效应。低钾血症使细胞酸化,因为细胞内K+与H+交换,而高钾血症使细胞碱化,因为细胞内H+与K+交换。低钾血症还刺激集合管分泌H+。这是由于闰细胞中H+,K+ -ATPase的表达增加所致。
新H C O_3-的形成
如前所述,重吸收滤过的HCO3-(碳酸氢根)对于最大化RNAE(净酸排泄)至关重要。然而,仅靠HCO3-的重吸收并不能补充代谢过程中产生的非挥发性酸中和过程中丢失的HCO3-。为了维持酸碱平衡,肾脏必须用新的HCO3-来替代这些丢失的HCO3-。新的HCO3-的生成通过可滴定酸的排泄以及NH_4+(铵离子)的合成和排泄来实现。
图37.6展示了由于可滴定酸排泄而产生新的HCO3-的过程。由于近端小管和Henle袢对HCO3-的重吸收,到达远端小管和集合管的液体通常含有很少的HCO3-。因此,当H+(氢离子)被分泌时,它将与非\cdotHCO_3-缓冲剂(主要是P_i,\ell\cdot(磷酸盐))结合,并以可滴定酸的形式排泄。由于H+是由CO_2(二氧化碳)水合作用在细胞内产生的,因此也会产生一个HCO3-。
• 图37.6 H+与非\cdotHCO_3-尿缓冲剂(可滴定酸)排泄的一般机制。主要的尿缓冲剂是磷酸盐(H P O_42-)。图中展示了一个\Join+(氢离子)分泌的间质细胞。为简化起见,仅展示了\Join+ -ATPase(氢离子-钾离子ATP酶)。\HatH+通过H+,K+ -ATPase的分泌也会滴定管腔缓冲剂。ATP,三磷酸腺苷;CA,碳酸酐酶。
• 图37.7 肾单位对N H_4+的产生、转运和排泄。谷氨酰胺在近端小管中代谢为N H_4+和H C O_3-。N H_4+被分泌到管腔中,而H C O_3-进入血液。分泌的N H_4+在Henle袢(主要是粗升支)中被重吸收,并在髓质间质中积累。N H_3(氨)通过rhesus糖蛋白由集合管分泌,\Join+的分泌将N H_4+捕获在管腔中。每排泄一个N H_4+分子,就会有一个“新的”H C O_3-分子被添加到ECF(细胞外液)中。C A,碳酸酐酶。
这个HCO3-作为新的HCO3-返回到ECF。如前所述,Pi(磷酸盐)的排泄在酸中毒时增加。然而,即使有更多的Pi可用于形成可滴定酸,这种反应仍不足以生成所需量的新的HCO3-。剩余的新的HCO3-生成是通过NH_4+的生成和排泄来实现的。
NH_4+由肾脏产生,其合成和随后的排泄为ECF添加了HCO3-。重要的是,这一过程会根据身体的酸碱需求进行调节。
NH_4+ 通过谷氨酰胺的代谢在肾脏中产生。肾脏主要代谢谷氨酰胺,排出 NH_4+,并向体内添加 HCO3-。然而,通过这一过程形成新的 HCO3- 取决于肾脏将 NH_4+ 排泄到尿液中的能力。如果 NH_4+ 未被排泄到尿液中,而是进入体循环,它会被肝脏转化为尿素。这一转化过程会产生 H+,随后被 HCO3- 缓冲。因此,由肾脏生成的 NH_4+ 转化为尿素会消耗 HCO3-,并抵消了通过肾脏合成和排泄 NH_4+ 形成 HCO3- 的过程。然而,正常情况下,肾脏会将 NH_4+ 排泄到尿液中,从而产生新的 HCO3-。
肾脏排泄 NH_4+ 的过程是复杂的。图 37.7 展示了这一过程的关键特征。NH_4+ 在近端小管细胞中由谷氨酰胺产生,这一过程称为氨生成(ammoniagenesis)。每个谷氨酰胺分子产生两个 NH_4+ 分子和二价阴离子 2-氧代戊二酸(2-oxoglutarate2−)。该阴离子的代谢最终提供两个 HCO3- 分子。HCO3- 通过基底外侧膜离开细胞,并作为新的 HCO3- 进入管周血液。NH_4+ 通过顶膜离开细胞,进入小管液。NH_4+ 分泌到小管液中的主要机制涉及 Na+/H+ 反向转运体,NH_4+ 替代 H+。此外,一些 NH_3 可以扩散出细胞进入小管液,在那里被质子化为 NH_4+。
近端小管分泌的大部分 NH_4+ 被 Henle 袢重吸收。TAL(厚升支)是 NH_4+ 重吸收的主要部位,NH_4+ 替代 K+ 结合到 1Na+/1K+/2Cl- 同向转运体上。此外,该节段的管腔正跨上皮电压驱动 NH_4+ 的旁细胞重吸收。
被 Henle 袢 TAL 重吸收的 NH_4+ 在髓质间质中积累。随后,它被集合管分泌到小管液中。
集合管细胞表达两种 NH_3 膜转运蛋白,称为 Rhesus (Rh) 糖蛋白(RhBG 和 RhCG)。RhBG 存在于 H+ 分泌的间细胞和主细胞的基底外侧膜中,而 RhCG 存在于这些细胞的顶膜和基底外侧膜中。如图 37.7 所示,NH_3 通过集合管转运,这一过程传统上称为非离子扩散。分泌的 NH_3 由于间细胞分泌的 H+ 而在小管腔中被质子化。由于顶膜对 NH_4+ 的通透性较低,它被有效地困在小管腔中,这一过程传统上称为扩散捕获。
集合管(collecting duct)分泌的H+对于NH_4+的排泄至关重要。如果集合管的H+分泌受到抑制,Henle袢(TAL)重吸收的NH_4+将无法通过尿液排出。相反,NH_4+会返回到体循环中,如前所述,它会被肝脏转化为尿素,并在此过程中消耗HCO3-。因此,近端小管(proximal tubule)细胞在谷氨酰胺代谢过程中会产生新的HCO3-。然而,只有当NH_4+被排出时(即防止肝脏将NH_4+转化为尿素),整个过程才算完成。最终,每排出尿液中的一个NH_4+,就会有一个新的HCO3-返回到体循环中。因此,尿液中的NH_4+排泄量可以作为近端小管谷氨酰胺代谢的标志物。
临床意义
评估肾脏的NH_4+排泄通常是通过间接方法进行的,因为尿液中N H_4+的测定并不常规进行。例如,考虑代谢性酸中毒(metabolic acidosis)的情况,此时肾脏的适当反应是增加净酸排泄。因此,尿液中几乎不会出现H C O_3-,尿液呈酸性,且N H_4+排泄量会增加。为了评估这一点,特别是N H_4+的排泄量,可以通过测量尿液中的N a+、K+和Cl-浓度来计算“尿净电荷”或“尿阴离子间隙”:
U r i n e a n i o n g a p=\left(\left[N a+\right]+\left[K+\right]\right)-\left[C l-\right]
在代谢性酸中毒期间,尿阴离子间隙的概念假设尿液中的主要阳离子是N a+、K+和NH_4+,而主要阴离子是Cl-(尿液p H<6.5时,几乎不存在H C O_3-)。电中性原则指出,尿液中的阳离子和阴离子的总和应相等。因此,当未测定的阳离子N H_4+被排泄时,尿阴离子间隙将产生负值。需要注意的是,实际上并不存在阴离子间隙——阳离子和阴离子的数量是相等的。计算出的阴离子间隙仅反映了所测定的参数,而NH_4+通常不被测定。事实上,尿阴离子间隙的缺失或正值的存在表明肾脏在N H_4+的产生和排泄方面存在缺陷。
肾脏NH_4+系统的一个重要特征是它受到全身酸碱平衡的调节。如前所述,酸中毒时皮质醇水平升高,近端小管腔内的血管紧张素II分泌也增加。皮质醇和血管紧张素II都刺激氨生成(即从谷氨酰胺生成NH_4+)。在全身酸中毒期间,近端小管细胞中负责谷氨酰胺代谢的酶被激活。这涉及新酶的合成,并且需要几天时间才能完全适应。随着这些酶水平的增加,NH_4+的生成增加,从而增强了新的HCO3-的产生。相反,碱中毒时谷氨酰胺代谢减少。酸中毒还增加了集合管中RhBG和RhCG的丰度,因此分泌NH_4+的能力也增强。
对酸碱紊乱的反应
ECF(细胞外液)的pH维持在一个非常狭窄的范围内(7.35-7.45)。通过检查方程37.3可以看出,当[HCO_3-]或Pco_2发生变化时,ECF的pH会发生变化。如前所述,由于ECF中[HCO_3-]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于Pco_2变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。肾脏主要负责调节[HCO_3-],而肺则调节Pco_2。
当酸碱紊乱发生时,身体使用几种机制来防御ECF pH的变化。这些防御机制并不能纠正酸碱紊乱,而只是最小化紊乱引起的pH变化。将血液pH恢复到正常值需要纠正导致酸碱紊乱的根本过程。身体有三种一般机制来防御酸碱紊乱引起的体液pH变化:(1)细胞外和细胞内缓冲,(2)通过改变肺的通气速率来调整血液Pco_2,(3)调整RNAE(净酸排泄)。
细胞外和细胞内缓冲
防御酸碱紊乱的第一道防线是细胞外和细胞内缓冲。细胞外缓冲的反应几乎是瞬时的,而细胞内缓冲的反应较慢,可能需要几分钟。
由于向体液中添加非挥发性酸或碱而引起的代谢紊乱在细胞外和细胞内都被缓冲。HCO3-缓冲系统是主要的ECF缓冲系统。当向体液中添加非挥发性酸(或从体内丢失碱)时,HCO3-在中和酸负荷的过程中被消耗,ECF的[HCO_3-]减少。相反,当向体液中添加非挥发性碱(或从体内丢失酸)时,H+被消耗,导致更多的HCO3-从H_2CO_3的解离中产生。因此,[HCO_3-]增加。
尽管HCO_3-缓冲系统是主要的细胞外液(ECF)缓冲系统,Pi和血浆蛋白也提供了额外的细胞外缓冲作用。HCO_3-、P_i和血浆蛋白的缓冲过程共同作用,约占非挥发性酸负荷缓冲的50%和非挥发性碱负荷缓冲的70%。在这两种情况下,剩余的缓冲作用发生在细胞内。细胞内缓冲涉及H+进入细胞(在非挥发性酸缓冲期间)或H+离开细胞(在非挥发性碱缓冲期间)。H+在细胞内被HCO3-、Pi和蛋白质上的组氨酸基团滴定。
• 图37.8 通气速率对肺泡P C O_2及动脉血P C O_2的影响。
骨骼是细胞外缓冲的另一个来源。然而,在酸中毒时,骨骼的缓冲作用会导致其脱矿质化。
当发生呼吸性酸碱紊乱时,体液的pH会因Pco_2的变化而改变。几乎所有呼吸性酸碱紊乱的缓冲作用都发生在细胞内。当Pco_2升高(呼吸性酸中毒)时,CO_2进入细胞,与_H_2O结合形成H_2CO_3。H_2CO_3随后解离为H+和HCO3-。部分H+被细胞蛋白缓冲,而HCO3-离开细胞并提高ECF中的[HCO_3-]。当Pco_2降低(呼吸性碱中毒)时,这一过程会逆转。在这种情况下,Pco_2的降低使水合反应(H_2O+CO_2H_2CO_3)向左移动。结果,解离反应(H_2CO_3OH++HCO_3-)也向左移动,从而降低ECF中的[HCO_3-]。
呼吸代偿
肺是抵御酸碱紊乱的第二道防线。正如Henderson-Hasselbalch方程(见公式37.2)所示,Pco_2的变化会改变血液的pH:升高会降低pH,而降低会增加pH。
通气速率决定了Pco_2。通气增加会降低Pco_2,而通气减少则会增加Pco_2(图37.8)。血液中的Pco_2和pH是通气速率的重要调节因素。位于脑干(延髓腹侧表面)和外周(颈动脉体和主动脉体)的化学感受器感知Pco_2和[H+]的变化,并相应地调整通气速率。因此,当代谢性酸中毒发生时,[H+]的升高(pH降低)会刺激通气速率。相反,在代谢性碱中毒期间,[H+]的降低(pH升高)会减少通气速率。在最大程度的过度通气时,Pco_2可以降低到大约10mmHg。由于缺氧是通气的强效刺激因素,而缺氧也会随着通气不足而发展,因此Pco_2可以增加的程度是有限的。在正常个体中,通气不足不能使Pco_2超过60mmHg。对代谢性酸碱紊乱的呼吸反应可能在几分钟内启动,但可能需要几个小时才能完成。
肾脏代偿
对抗酸碱紊乱的第三道也是最后一道防线涉及肾脏。响应血浆pH和Pco_2的变化,肾脏会适当调整RNAE(净酸排泄)的排泄。肾脏反应可能需要几天时间才能完成,因为增加近端小管酶(参与NH_4+生成)的合成和活性需要数小时到数天的时间。在酸中毒([H+]或Pco_2增加)的情况下,肾单位的H+分泌受到刺激,并且所有过滤的HCO3-负荷都被重吸收。可滴定酸排泄增加,NH_4+的生成和排泄也受到刺激,因此RNAE增加(图37.9)。在净酸排泄过程中生成的新HCO3-被添加到体内,血浆[HCO_3-]增加。
当存在代谢性碱中毒([H+]降低)时,HCO3-的过滤负荷增加(血浆[HCO_3-]升高)。在呼吸性碱中毒(Pco_2降低)时,血浆[HCO_3-]降低,因此过滤负荷减少。在这两种情况下,肾单位的H+分泌受到抑制。结果,HCO3-排泄增加。同时,可滴定酸和NH_4+的排泄减少。因此,RNAE减少,HCO3-出现在尿液中。此外,一些HCO3-通过远端小管和集合管的HCO3-分泌性间质细胞分泌到尿液中。随着HCO3-排泄的增加,血浆[HCO_3-]降低。
临床实践
胃内容物从体内流失(例如呕吐、鼻胃管抽吸)会导致继发性代谢性碱中毒,这是由于HCl的流失所致。如果胃液流失严重,会发生ECFV(细胞外液容量)收缩。在这种情况下,肾脏无法排泄足够量的H C O_3-来代偿代谢性碱中毒。肾脏无法排泄H C O_3-的原因是,为了纠正ECFV收缩,需要减少N a+的排泄。如前所述(详见第35章),肾脏对容量收缩的反应是降低肾小球滤过率,从而减少H C O_3-的滤过负荷,并增加肾单位对N a+的重吸收。由于大量的N a+重吸收是通过N a+/H+反向转运体进行的,这导致近端小管增加\Join+分泌(HCO_3-重吸收)。在这种情况下,所有滤过的H C O_3-都会被重吸收,甚至可能增强新的H C O_3-生成。后一种反应的发生是因为醛固酮(在容量收缩时其水平升高)不仅刺激远端N a+的重吸收,还刺激间质细胞的H+分泌。这种\Join+分泌的刺激通过增加可滴定酸和NH_4+排泄来生成新的H C O_3-。因此,在胃内容物流失的个体中,通常会出现代谢性碱中毒和反常的酸性尿液。只有在恢复正常血容量时,碱中毒才能得到纠正。
• 图37.9 肾单位对酸中毒的反应。CCD,皮质集合管;D T, 远端小管;IMCD,内髓集合管;P_\mathfrakp 磷酸盐;P T, 近端小管;P T H, 甲状旁腺激素;Rhbg & Ṙhcg,恒河猴糖蛋白;R N A E, 肾脏净酸排泄;T A_: 可滴定酸;T A L, 粗升支;\dotV, 尿流率。
简单酸碱紊乱的特征 37.1
<html><body><table><tr><td>紊乱</td><td>血浆pH</td><td>主要改变</td><td>防御机制</td></tr><tr><td>代谢性酸中毒</td><td></td><td>↓ECF [HCO]</td><td>ICF和ECF缓冲 过度通气 (↓Pco2) ↑RNAE</td></tr><tr><td>代谢性碱中毒</td><td></td><td>↑ECF [HCO]</td><td>ICF和ECF缓冲 通气不足 (↑Pco2) ↓RNAE</td></tr><tr><td>呼吸性酸中毒</td><td></td><td>↑PcO2</td><td>ICF缓冲 ↑RNAE</td></tr><tr><td>呼吸性碱中毒</td><td></td><td>↓PcO2</td><td>ICF缓冲 ↓RNAE</td></tr></table></body></html>
ECF,细胞外液;I C F, 细胞内液;RNAE,肾脏净酸排泄
简单酸碱紊乱
表37.1总结了各种简单酸碱紊乱的主要改变及其随后的代偿或防御机制。在所有酸碱紊乱中,代偿反应并不能纠正潜在的紊乱,而只是减少了pH变化的幅度。纠正酸碱紊乱需要治疗其病因。
酸碱紊乱的类型
代谢性酸中毒
代谢性酸中毒的特征是细胞外液(ECF)中[HCO_3-]和pH的降低。它可以通过向体内添加非挥发性酸(如糖尿病酮症酸中毒)、非挥发性碱的丢失(如由腹泻引起的HCO3-丢失)或肾脏未能排出可滴定酸和NH_4+(如肾功能衰竭)而发展。如前所述,H+的缓冲发生在ECF和细胞内液(ICF)中。当pH下降时,呼吸中枢受到刺激,通气速率增加(呼吸代偿)。
最后,在代谢性酸中毒中,净酸排泄量(RNAE)增加。这是通过从尿液中排出所有HCO3-(增强过滤的HCO3-的重吸收)以及通过增加可滴定酸和NH_4+的排泄(增强新的HCO_3~)的产生)来实现的。如果引发酸碱紊乱的过程得到纠正,增强的RNAE最终将使pH和[HCO_3-]恢复正常。在pH纠正后,通气速率也会恢复正常。
临床中的应用
当非挥发性酸被添加到体液中时,如糖尿病酮症酸中毒,[H+]增加(pH降低),[H C O_3-]减少。此外,与非挥发性酸相关的阴离子浓度增加。这种阴离子浓度的变化提供了一种方便的方法,通过计算所谓的阴离子间隙来分析代谢性酸中毒的原因。阴离子间隙代表主要ECF阳离子\left(N a+\right)与主要ECF阴离子(Cl-和H C O_3-)之间的差异:
在正常情况下,阴离子间隙范围为8至16mEq/L。重要的是要认识到阴离子间隙实际上并不存在。所有阳离子都由阴离子平衡。这个间隙仅仅反映了测量的参数。实际上:
A n i o n g a p=\left[N a+\right]-\left(\left[C l-\right]+\left[H C O_3-\right]\right)
\beginarrayr l&\left[N a+\right]+\left[U n m e a s u r e d c a t i o n s\right]\ &\quad=\left[C l-\right]+\left[H C O_3-\right]+\left[U n m e a s u r e d a n i o n s\right]\endarray
如果非挥发性酸的阴离子是Cl-,阴离子间隙将是正常的(即[H C O_3-]的减少与[Cl-]的增加相匹配)。与腹泻或肾小管酸中毒(即肾脏\Join+分泌缺陷)相关的代谢性酸中毒具有正常的阴离子间隙。相反,如果非挥发性酸的阴离子不是Cl-(如乳酸,\upbeta -羟基丁酸),阴离子间隙将增加(即[H C O_3-]的减少不与\left[\bigcirc\right]-]的增加相匹配,而是与未测量阴离子浓度的增加相匹配)。在代谢性酸中毒相关的酮症酸中毒(如糖尿病)中,阴离子间隙增加,伴有肾功能衰竭、乳酸酸中毒或摄入毒素或某些药物(如大量阿司匹林)。因此,计算阴离子间隙是临床环境中识别代谢性酸中毒病因的有用方法。
白蛋白(albumin)是一种带负电荷的大分子,它对“未测定的阴离子”有相当大的贡献。因此,对于血清[白蛋白]异常的患者,必须调整阴离子间隙(anion gap)。血清[白蛋白]每变化19/dL,阴离子间隙需要同方向调整2.5mEq/L。
代谢性碱中毒(Metabolic Alkalosis)
代谢性碱中毒的特征是细胞外液(ECF)中[HCO_3-]和pH的增加。它可以通过向体内添加非挥发性碱(例如,摄入抗酸剂)、由于容量收缩(例如,出血)或更常见的是由于非挥发性酸的丢失(例如,由于长期呕吐导致的胃HCl丢失)而发生。缓冲作用主要发生在细胞外液(ECF),在细胞内液(ICF)中程度较轻。pH的增加抑制了呼吸中枢,从而降低了通气率,因此Pco_2升高(呼吸代偿)。
肾脏对代谢性碱中毒的代偿反应是通过减少沿肾单位的重吸收来增加HCO3-的排泄。通常这种情况发生得相当迅速(几分钟到几小时)且有效。只要初始酸碱紊乱的根本原因得到纠正,肾脏排泄HCO3-的增加最终会使pH和[HCO_3-]恢复正常。当pH得到纠正时,通气率也会恢复正常。
呼吸性酸中毒(Respiratory Acidosis)
呼吸性酸中毒的特征是Pco_2升高和细胞外液(ECF)pH降低。它是由于肺泡气体交换减少所致,原因可能是通气不足(例如,药物引起的呼吸中枢抑制)或气体扩散受损(例如,肺水肿,如心血管和肺部疾病中发生的情况)。与代谢性紊乱不同,呼吸性酸中毒期间的缓冲作用几乎完全发生在细胞内液(ICF)中。Pco_2的增加和pH的降低刺激了肾单位对HCO3-的重吸收以及可滴定酸和NH_4+的排泄(肾脏代偿)。这些反应共同增加了RNAE并生成了新的HCO3-。肾脏的代偿反应需要几天时间才能发生。因此,呼吸性酸碱紊乱通常分为急性和慢性阶段。在急性阶段,肾脏代偿反应的时间不足,身体依靠细胞内液(ICF)缓冲来最小化pH的变化。在慢性阶段,肾脏代偿发生。纠正基础疾病后,Pco_2恢复正常,RNAE降至初始水平。
呼吸性碱中毒(Respiratory Alkalosis)
呼吸性碱中毒(Respiratory alkalosis)的特征是Pco_2降低和ECF(细胞外液)pH升高。它通常是由于肺部气体交换增加引起的,通常由呼吸中枢受到刺激(例如通过药物或中枢神经系统疾病)导致的通气增加引起。过度通气(Hyperventilation)也发生在高海拔地区,以及由于焦虑、疼痛或恐惧引起。缓冲作用主要发生在ICF(细胞内液)区室。与呼吸性酸中毒一样,呼吸性碱中毒也有急性和慢性阶段,反映了肾脏代偿所需的时间。呼吸性碱中毒的急性阶段反映了细胞内缓冲作用,而慢性阶段反映了肾脏代偿。在肾脏代偿过程中,升高的pH和降低的Pco_2抑制了肾单位对HCO3-的重吸收,并减少了可滴定酸和NH_4+的排泄。由于这些效应,RNAE(净酸排泄量)减少。纠正基础疾病后,Pco_2恢复正常,肾脏的酸排泄量也随之恢复到初始水平。
酸碱紊乱的分析
酸碱紊乱的分析旨在确定基础病因,以便启动适当的治疗。患者的病史和相关体格检查通常为酸碱紊乱的性质和起源提供有价值的线索。此外,通常需要分析动脉血样本。如果系统地进行分析,这种分析是直接的。例如,考虑以下数据:通过这些值或任何其他值集所代表的酸碱紊乱可以使用以下三步法确定:
- 检查pH。当首先考虑pH时,基础紊乱可以分类为酸中毒或碱中毒。身体的防御机制本身无法纠正酸碱紊乱。因此,即使防御机制完全运作,pH的变化也表明了酸碱紊乱。在提供的例子中,pH为7.35表明酸中毒。
37.2 伴有代偿的简单酸碱紊乱
- 代谢性与呼吸性紊乱的鉴别。简单的酸碱紊乱要么是代谢性的,要么是呼吸性的。为了确定存在哪种紊乱,临床医生接下来必须检查ECF(细胞外液)中的[HCO_3-](碳酸氢根离子浓度)和Pco_2(二氧化碳分压)。如前所述,酸中毒可能是由于[HCO_3-]的降低(代谢性)或Pco_2的升高(呼吸性)引起的。相反,碱中毒可能是由于ECF中[HCO_3-]的升高(代谢性)或Pco_2的降低(呼吸性)引起的。对于提供的例子,ECF中的[HCO_3-]从正常值(正常值为24mEq/L)降低,Pco_2也从正常值(正常值为40mmHg)降低。因此,这种紊乱必须是代谢性酸中毒;它不可能是呼吸性酸中毒,因为Pco_2降低了。
- 代偿反应的分析。代谢性紊乱会导致通气量的代偿性变化,从而影响Pco_2,而呼吸性紊乱则会导致RNAE(肾净酸排泄)的代偿性变化,从而影响ECF中的[HCO_3-](表37.2)。在适当代偿的代谢性酸中毒中,Pco_2降低,而在代偿性代谢性碱中毒中,Pco_2升高。在呼吸性酸中毒中,代偿导致[HCO_3-]升高。
相反,ECF中的[HCO_3-]在呼吸性碱中毒中会降低。在这个例子中,Pco_2从正常值降低,且降低的幅度(ECF中[HCO_3-]降低8mEq/L,Pco_2降低10mmHg)符合预期(见表37.2)。因此,这种酸碱紊乱是一种伴有适当呼吸代偿的单纯代谢性酸中毒。
混合性酸碱紊乱反映了酸碱失衡存在两种或更多潜在原因。例如,考虑以下数据:
当遵循三步法时,可以明显看出这种紊乱是一种酸中毒,既有代谢性成分(ECF中[HCO_3-]<24mEq/L),也有呼吸性成分(Pco_2>40mmHg)。因此,这种紊乱是混合性的。混合性酸碱紊乱可能发生在例如有慢性肺病(如肺气肿,即慢性呼吸性酸中毒)病史并发展为急性胃肠道疾病(如腹泻)的个体中。因为腹泻液中含有HCO3-,其从体内的丢失会导致代谢性酸中毒的发生。
当患者的Pco_2和ECF中的[HCO_3-]值异常但pH正常时,也提示存在混合性酸碱紊乱。这种情况可能发生在摄入了大量阿司匹林的患者中。水杨酸(阿司匹林中的活性成分)会引起代谢性酸中毒,同时刺激呼吸中枢,导致过度通气和呼吸性碱中毒。因此,患者的ECF中[HCO_3-]降低,Pco_2也降低。(注意:Pco_2低于代谢性酸中毒的正常呼吸代偿水平。)
关键概念
- 肾脏通过排泄与代谢产生的非挥发性酸和饮食中摄入的酸量相等的酸来维持酸碱平衡(称为肾脏净酸排泄 [RNAE])。肾脏还通过重吸收几乎所有在肾小球滤过的 HCO3- 来防止 HCO3- 在尿液中的丢失。滤过的 HCO3- 的重吸收和酸的排泄都是通过肾小管分泌 H+ 来完成的。肾脏以可滴定酸(主要是 P_i,\ell\cdot)和 NH_4+ 的形式排泄酸。可滴定酸和 NH_4+ 的排泄都会生成新的 HCO3-,从而补充在非挥发性酸中和过程中丢失的细胞外液(ECF)中的 HCO3-。
- 人体通过三道防线来最小化酸碱紊乱对体液 pH 的影响:(1)细胞外液(ECF)和细胞内液(ICF)缓冲,(2)呼吸代偿,(3)肾脏代偿。
- 代谢性酸碱紊乱是由于细胞外液(ECF)中 [HCO_3-] 的初始改变引起的,这种改变又源于体内酸的增加或碱的丢失。在代谢性酸中毒的情况下,肺通气增加,从而降低 Pco_2。肺对代谢性酸碱紊乱的反应在几分钟内发生。RNAE 也会增加,但这需要几天时间。ECF 中 [HCO_3-] 的增加会导致碱中毒。这会迅速(几分钟到几小时)减少肺通气,从而升高 Pco_2 作为代偿反应。RNAE 也会减少,但这需要几天时间。
- 呼吸性酸碱紊乱是由于 Pco_2 的初始改变引起的。Pco_2 的升高会导致酸中毒,肾脏通过增加 RNAE 来应对。相反,Pco_2 的降低会导致碱中毒,RNAE 也会减少。肾脏对呼吸性酸碱紊乱的反应需要几小时到几天的时间。
