第七单元 呼吸
第三十八章 肺通气
呼吸的主要功能是为组织提供氧气并排出二氧化碳。呼吸的四个主要组成部分如下:(1) 肺通气(pulmonary ventilation),即大气与肺泡之间的空气进出;(2) 氧气(O2)和二氧化碳(CO2)在肺泡与血液之间的扩散;(3) 氧气和二氧化碳在血液和体液中与身体组织细胞之间的运输;(4) 通气及其他呼吸方面的调节。本章讨论肺通气;随后的五章将涵盖其他呼吸功能以及特殊呼吸异常的生理学。
肺通气的力学
引起肺扩张和收缩的肌肉
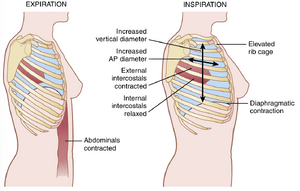
肺可以通过两种方式扩张和收缩:(1) 通过膈肌(diaphragm)的上下运动来延长或缩短胸腔;(2) 通过肋骨的抬高或降低来增加或减少胸腔的前后径。图38-1展示了这两种方法。
正常的安静呼吸几乎完全由膈肌的运动完成。在吸气时,膈肌的收缩将肺的下表面向下拉。然后,在呼气时,膈肌简单地放松,肺、胸壁和腹部结构的弹性回缩力压缩肺部并排出空气。然而,在剧烈呼吸时,弹性力不足以引起必要的快速呼气,因此主要通过腹部肌肉的收缩来获得额外的力量,腹部肌肉将腹部内容物向上推压膈肌底部,从而压缩肺部。
扩张肺部的第二种方法是抬高肋骨。抬高肋骨扩张肺部是因为在自然休息位置时,肋骨向下倾斜,如图38-1左侧所示,从而使胸骨向后朝向脊柱。然而,当肋骨被抬高时,肋骨几乎直接向前突出,因此胸骨也向前移动,远离脊柱,使胸腔的前后厚度在最大吸气时比呼气时大约增加20%。因此,所有抬高胸腔的肌肉都被归类为吸气肌,而压低胸腔的肌肉则被归类为呼气肌。
抬高肋骨的最重要肌肉是肋间外肌(external intercostals),但其他辅助肌肉包括:(1) 胸锁乳突肌(sternocleidomastoid muscles),它们向上提起胸骨;(2) 前锯肌(anterior serrati),它们提起多根肋骨;(3) 斜角肌(scaleni),它们提起前两根肋骨。
在呼气时压低肋骨的肌肉主要包括:(1) 腹直肌(abdominal recti),它们在将腹部内容物向上压缩膈肌的同时,对下肋骨产生强大的下拉作用;(2) 肋间内肌(internal intercostals)。
图38-1还展示了外部和内部肋间肌(intercostals)如何作用以引起吸气和呼气的机制。在左侧,呼气期间的肋骨向下倾斜,外部肋间肌向前和向下伸长。当它们收缩时,它们将上肋骨相对于下肋骨向前拉动,这会在肋骨上产生杠杆作用,使其向上抬起,从而引起吸气。内部肋间肌以相反的方式起作用,作为呼气肌,因为它们在肋骨之间的角度相反,并产生相反的杠杆作用。
导致空气进出肺部的压力
参见视频38-1。肺是一种弹性结构,像气球一样塌陷,并在没有力量保持其膨胀时通过气管排出所有空气。此外,除了在肺门处从纵隔(胸腔的中部)悬挂外,肺与胸壁之间没有连接。相反,肺“漂浮”在胸腔中,周围有一层薄薄的胸膜液,润滑肺在腔内的运动。此外,淋巴通道持续吸出多余液体,维持肺胸膜的脏层表面和胸腔壁层胸膜表面之间的轻微吸力。因此,肺部被固定在胸壁上,就像被粘在那里一样,但它们润滑良好,可以在胸部扩张和收缩时自由滑动。
胸膜压力及其在呼吸期间的变化。胸膜压力是肺胸膜和胸壁胸膜之间薄层空间中的液体压力。这种压力通常是轻微的吸力,意味着轻微的负压。吸气开始时正常的胸膜压力约为-5厘米水柱(cm H2O.),这是保持肺部开放到其静息水平所需的吸力量。在正常吸气期间,胸腔的扩张以更大的力量向外拉动肺部,并产生更多的负压,平均约为\beginarrayr-7.5cmH2O.\endarray。
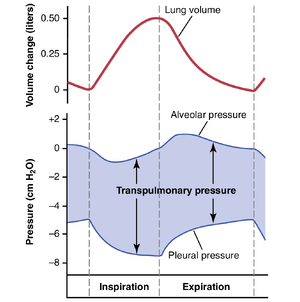
胸膜压力与肺容积变化之间的关系如图38-2所示;下图显示了吸气期间胸膜压力从-5到-7.5cmH2O的负性增加,上图显示了肺容积增加0.5升。然后,在呼气期间,这些事件基本上被逆转。
肺泡压力(Alveolar Pressure)——肺肺泡内的气压。当声门打开且没有空气流入或流出肺部时,呼吸树的所有部分(一直到肺泡)的压力都等于大气压,大气压被认为是气道中的零参考压力,即0cmH2O压力。为了在吸气期间使空气流入肺泡,肺泡内的压力必须下降到略低于大气压的值(低于0)。图38-2中的第二条曲线(标记为“肺泡压力”)表明,在正常吸气期间,肺泡压力下降到约-1cmH2O。这种轻微的负压足以在正常安静吸气所需的2秒内将0.5升空气吸入肺部。
在呼气期间,肺泡压力上升到约+1 cm H2O,,这会在2到3秒的呼气期间将0.5升吸入的空气排出肺部。
跨肺压(Transpulmonary Pressure)——肺泡压力和胸膜压力之间的差异。请注意,在图38-2中,跨肺压是肺泡内压力和肺外表面(胸膜压力)之间的压力差;它是衡量肺部弹性力的指标,这些弹性力在每次呼吸时倾向于使肺部塌陷,称为回缩压力(recoil pressure)。
图38-3 健康人的顺应性图。该图显示了跨肺压(肺泡压力减去胸膜压力)变化期间肺容积的变化。
肺的顺应性(Compliance of the Lungs)
肺部在每单位跨肺压增加时扩张的程度(如果有足够的时间达到平衡)称为肺顺应性(lung compliance)。正常成年人双肺的总顺应性平均约为200ml空气/cmH2O跨肺压。也就是说,每次跨肺压增加1cmH2O,,10到20秒后,肺容积将扩张200ml。
肺的顺应性(compliance)图
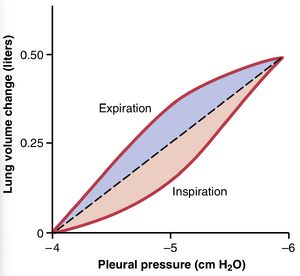
图38-3是一个将肺容积变化与胸膜压(pleural pressure)变化相关联的示意图,而胸膜压的变化又会改变跨肺压(transpulmonary pressure)。请注意,吸气和呼气的关系是不同的。每条曲线都是通过逐步改变胸膜压并让肺容积在连续步骤之间达到稳定水平来记录的。这两条曲线分别称为吸气顺应性曲线和呼气顺应性曲线,整个图称为肺的顺应性图。
顺应性图的特征由肺的弹性力(elastic forces)决定。这些力可以分为两部分:(1) 肺组织的弹性力;(2) 由肺泡内壁和其他肺气腔内衬液体的表面张力(surface tension)引起的弹性力。
肺组织的弹性力主要由交织在肺实质中的弹性蛋白(elastin)和胶原纤维(collagen fibers)决定。在塌陷的肺中,这些纤维处于弹性收缩和弯曲状态;当肺扩张时,纤维被拉伸并伸直,从而伸长并施加更大的弹性力。
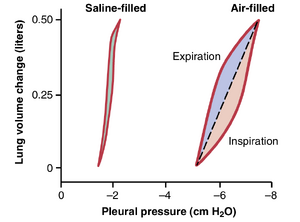
由表面张力引起的弹性力则复杂得多。表面张力的重要性如图38-4所示,该图比较了肺在充满生理盐水和充满空气时的顺应性图。当肺充满空气时,肺泡液体和肺泡内的空气之间存在界面。在充满生理盐水的肺中,没有气液界面,因此不存在表面张力效应;只有组织弹性力在充满生理盐水的肺中起作用。
请注意,扩张充满空气的肺所需的跨胸膜压(transpleural pressure)大约是扩张充满生理盐水的肺所需压力的三倍。因此,可以得出结论,导致充满空气的肺塌陷的组织弹性力仅占肺总弹性力的约三分之一,而肺泡中的气液表面张力则占约三分之二。
当肺泡液体中不存在称为表面活性物质(surfactant)的物质时,肺的气液表面张力弹性力也会显著增加。
表面活性物质、表面张力与肺泡塌陷
表面张力原理 当水与空气形成表面时,水表面的水分子之间具有特别强的吸引力。因此,水表面总是试图收缩。这就是使雨滴保持完整的原因——雨滴整个表面周围有一层紧密的收缩性水分子膜。现在,让我们反转这些原理,看看肺泡内表面会发生什么。在这里,水表面也试图收缩。这倾向于迫使空气通过支气管从肺泡中排出,并在此过程中导致肺泡试图塌陷。净效应是导致整个肺的弹性收缩力,称为表面张力弹性力。
表面活性剂及其对表面张力的影响。表面活性剂(surfactant)是水中的一种表面激活剂(surface-active agent),这意味着它能显著降低水的表面张力。它由特殊的分泌表面活性剂的上皮细胞分泌,这些细胞被称为II型肺泡上皮细胞(type II alveolar epithelial cells),约占肺泡表面积的10%。这些细胞呈颗粒状,含有脂质包涵体,这些包涵体被分泌到肺泡中的表面活性剂中。
表面活性剂是由几种磷脂(phospholipids)、蛋白质和离子组成的复杂混合物。最重要的成分是磷脂二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine)、表面活性剂载脂蛋白(surfactant apoproteins)和钙离子。二棕榈酰磷脂酰胆碱和几种不太重要的磷脂负责降低表面张力。它们通过不均匀地溶解在肺泡表面的液体中来执行这一功能。相反,分子的一部分溶解,而其余部分则分布在肺泡中的水表面上。该表面的表面张力为纯水表面的十二分之一到二分之一。
从数量上看,不同水溶液的表面张力大约如下:纯水,72达因/厘米;没有表面活性剂的正常肺泡内衬液体,50达因/厘米;含有正常量表面活性剂的正常肺泡内衬液体,5到30达因/厘米。
由表面张力引起的闭塞肺泡内的压力。如果从肺泡通向肺部的气道被阻塞,肺泡中的表面张力会导致肺泡塌陷。这种塌陷在肺泡内产生正压,试图将空气推出。肺泡中通过这种方式产生的压力可以通过以下公式计算:
压力 = (2×表面张力)/肺泡半径
对于一个半径约为100微米并衬有正常表面活性剂的平均大小肺泡,计算得出的压力约为4cmH2O压力(3mmHg)。如果肺泡内衬有纯水且没有任何表面活性剂,则计算得出的压力约为18cmH2O压力——是前者的4.5倍。因此,可以看出表面活性剂在降低肺泡表面张力方面的重要性,从而也减少了呼吸肌扩张肺部所需的努力。
由表面张力引起的压力与肺泡半径成反比。从前面的公式可以看出,肺泡越小,由表面张力引起的肺泡压力越大。因此,当肺泡的半径是正常半径的一半(50微米而不是100微米)时,前面提到的压力会加倍。这种现象在早产儿中尤为重要,许多早产儿的肺泡半径不到成人的25%。此外,表面活性剂通常在妊娠第六到第七个月之间才开始分泌到肺泡中,在某些情况下甚至更晚。因此,许多早产儿在出生时肺泡中几乎没有或没有表面活性剂,他们的肺部极易塌陷,有时是正常成人的六到八倍。这种情况会导致新生儿呼吸窘迫综合征(respiratory distress syndrome of the newborn)。如果不采取强有力的措施,尤其是正确应用持续正压通气,这种情况是致命的。
胸廓对肺扩张性的影响
到目前为止,我们仅讨论了肺的扩张性,而没有考虑胸廓的影响。胸廓具有其自身的弹性和粘性特性,即使胸腔内没有肺,扩张胸廓仍然需要肌肉的努力。
胸廓和肺的总顺应性
整个肺系统(肺和胸廓一起)的顺应性(compliance)是在完全放松或瘫痪的受试者扩张肺时测量的。为了测量顺应性,空气被逐渐压入肺部,同时记录肺压和肺容积。为了扩张这个整个肺系统,与从胸廓中取出的相同肺相比,几乎需要两倍的压力。因此,肺-胸廓系统的顺应性几乎正好是单独肺的一半——肺-胸廓系统的顺应性为110ml/cm H2O,而单独肺的顺应性为200ml/cmH2O。此外,当肺扩张到高容积或压缩到低容积时,胸廓的限制变得极为明显。当接近这些极限时,肺-胸廓系统的顺应性可能不到单独肺的20%。
呼吸功
我们已经指出,在正常安静呼吸期间,所有呼吸肌的收缩都发生在吸气过程中;呼气几乎完全是由肺和胸廓的弹性回缩引起的被动过程。因此,在静息条件下,呼吸肌通常只执行“功”以引起吸气,而不引起呼气。
吸气功可以分为三个部分:(1) 扩张肺以对抗肺和胸廓弹性力所需的功,称为顺应性功(compliance work)或弹性功(elastic work);(2) 克服肺和胸壁结构的粘性所需的功,称为组织阻力功(tissue resistance work);(3) 克服气道阻力以使空气进入肺所需的功,称为气道阻力功(airway resistance work)。
呼吸所需的能量
在正常安静呼吸期间,身体消耗的总能量中只有3%到5%用于肺通气。然而,在剧烈运动期间,所需的能量可以增加多达50倍,特别是如果个体有任何程度的气道阻力增加或肺顺应性降低。因此,能够进行的运动强度的主要限制之一是个体为呼吸过程提供足够肌肉能量的能力。
肺容积和容量
记录肺容积变化——肺量测定法
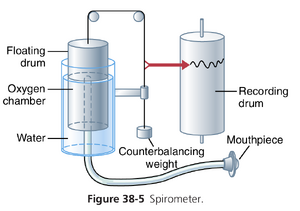
通过记录进出肺部的空气容积变化来研究肺通气,这种方法称为肺量测定法(spirometry)。图38-5展示了一个典型的基本肺量计。它由一个倒置在水室上的鼓组成,鼓通过一个重量平衡。鼓内装有呼吸气体,通常是空气或氧气;一根管子将口腔与气体室连接起来。当个体向气体室呼吸时,鼓会上升和下降,并作出适当的记录。
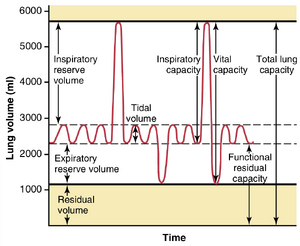
图38-6显示了一个呼吸描记图,指示了在不同呼吸条件下肺容积的变化。为了便于描述肺通气(ventilation)的过程,图中的肺内空气被细分为四个容积(volumes)和四个容量(capacities),这些数值是一个年轻成年男性的平均值。表38-1总结了健康男性和女性的平均肺容积和容量。
表38-1 健康年轻成年男性和女性的平均肺容积和容量
肺容积
图38-6列出了四个肺容积,当它们相加时,等于肺可以扩张到的最大容积。显示的肺容积是成年男性的平均值,但肺容积因体能、年龄、身高、性别和其他因素(如居住海拔)而有很大差异。这些肺容积的意义如下:
- 潮气量(tidal volume)是每次正常呼吸时吸入或呼出的空气量;在平均健康男性中约为500毫升。
- 吸气储备量(inspiratory reserve volume)是在正常潮气量之外,当人用力吸气时可以额外吸入的空气量;通常约为3000毫升。
- 呼气储备量(expiratory reserve volume)是在正常呼气结束后,通过用力呼气可以额外呼出的最大空气量;在男性中通常约为1100毫升。
- 残气量(residual volume)是在最用力呼气后仍留在肺中的空气量;平均约为1200毫升。
肺容量
在描述肺循环中的事件时,有时考虑两个或多个容积的组合是有用的。这些组合称为肺容量。在图38-6的右侧列出了重要的肺容量,可以描述如下:
- 吸气容量(inspiratory capacity)等于潮气量加上吸气储备量。这个容量是一个人可以从正常呼气水平开始,将肺扩张到最大量时吸入的空气量(约3500毫升)。
- 功能残气量(functional residual capacity)等于呼气储备量(expiratory reserve volume)加上残气量(residual volume)。这个容量是指在正常呼气结束时留在肺部的空气量(~2300ml)。
- 肺活量(vital capacity)等于吸气储备量(inspiratory reserve volume)加上潮气量(tidal volume)加上呼气储备量(expiratory reserve volume)。这个容量是指一个人在首先将肺部充满到最大程度,然后尽可能呼气到最大程度时,可以从肺部排出的最大空气量((~4600ml))。
- 肺总量(total lung capacity)是指肺部在最大努力下可以扩张到的最大体积((~5800ml));它等于肺活量(vital capacity)加上残气量(residual volume)。
大多数肺容量和肺活量在女性中通常比男性少约20%到30%,并且在体型较大和运动员中比在体型较小和虚弱的人中更大。
肺功能研究中使用的缩写和符号
肺活量测定(spirometry)只是肺科医生日常使用的众多测量程序之一。许多这些程序严重依赖于数学计算。为了简化这些计算以及肺功能数据的呈现,一些缩写和符号已经标准化。表38-2中列出了其中一些更重要的符号。使用这些符号,我们在这里展示了一些简单的代数方程,显示了肺容量和肺活量之间的一些相互关系;学生应该思考并验证这些相互关系。
VC = IRV + VT + ERV
VC = IC + ERV
TLC = IC + FRC
FRC = ERV + RV
表38-2 肺功能的缩写和符号
功能残气量、残气量和肺总量的测定——氦稀释法
功能残气量 (Functional residual capacity, FRC) 是指每次正常呼气结束时残留在肺内的气体量,对肺功能非常重要。由于在某些类型的肺部疾病中,其值会发生显著变化,因此通常需要测量这一容量。肺活量计不能直接用于测量 FRC,因为残留在肺内的气体无法呼入肺活量计,而这一容量约占 FRC 的一半。为了测量 FRC,肺活量计必须以间接方式使用,通常通过氦稀释法进行,如下所述。
一个已知体积的肺活量计(肺量计)中充满了已知浓度的氦气混合空气。在从肺活量计呼吸之前,受试者正常呼气。在这次呼气结束时,肺中剩余的体积等于功能残气量(FRC)。此时,受试者立即开始从肺活量计呼吸,肺活量计中的气体与肺中的气体混合。结果,氦气被FRC气体稀释,FRC的体积可以根据氦气的稀释程度,使用以下公式计算:
FRC = (CiHe/CfHe - 1)ViSpir
其中F R C是功能残气量(functional residual capacity),C iH e是肺活量计中氦气的初始浓度,C fH e是肺活量计中氦气的最终浓度,V iS p i r是肺活量计的初始体积。
一旦确定了FRC,就可以通过从FRC中减去通过正常肺活量测定法测量的呼气储备量(expiratory reserve volume, ERV)来确定残气量(residual volume, RV)。此外,可以通过将吸气量(inspiratory capacity, IC)加到FRC上来确定总肺容量(total lung capacity, TLC)。即:
R V=F R C-E R V
和
T L C=F R C+I C
每分钟通气量等于呼吸频率乘以潮气量
每分钟通气量(minute respiratory volume)是每分钟进入呼吸通道的新空气总量,等于潮气量(tidal volume)乘以每分钟呼吸频率(respiratory rate)。正常潮气量约为500毫升,正常呼吸频率约为12次/分钟。因此,每分钟通气量平均约为6升/分钟。一个人可以在每分钟通气量低至1.5~L/min、呼吸频率仅为2至4次/分钟的情况下存活很短的时间。
呼吸频率偶尔会上升到40至50次/分钟,潮气量可以变得与肺活量(vital capacity)一样大,年轻男性约为4600ml。这可以使每分钟通气量超过200L/min,或超过正常值的30倍。大多数人无法维持超过这些值的一半到三分之二超过1分钟。
肺泡通气
肺通气的最终重要性是不断更新肺部气体交换区域的空气,那里的空气靠近肺的血液。这些区域包括肺泡(alveoli)、肺泡囊(alveolar sacs)、肺泡管(alveolar ducts)和细呼吸道支气管( respiratory bronchioles)。新空气到达这些区域的速度称为肺泡通气。
死腔及其对肺泡通气的影响
人呼吸的部分空气从未到达气体交换区域,而只是填充了呼吸通道,如鼻子、咽部和气管,这些地方不发生气体交换。这部分空气被称为死腔空气(dead space air),因为它对气体交换没有用处。
在呼气时,死腔中的空气首先被呼出,然后肺泡中的空气才到达大气。因此,死腔对从肺部排出呼气气体非常不利。
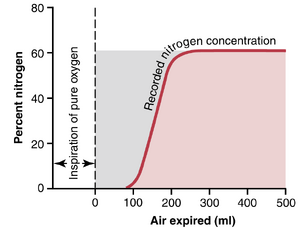
死腔容积的测量。测量死腔容积(dead space volume)的一种简单方法如图38-7所示。在进行此测量时,受试者突然深吸一口100%的O2,这将用纯O2填充整个死腔。一些氧气也会与肺泡(alveolar)空气混合,但不会完全取代这些空气。然后,受试者通过快速记录的氮气计呼气,记录结果如图所示。呼出的第一部分空气来自呼吸道(airway)的死腔区域,那里的空气已被O2完全取代。因此,在记录的早期部分,只出现O2,氮气浓度为0。然后,当肺泡空气开始到达氮气计时,氮气浓度迅速上升,因为含有大量氮气的肺泡空气开始与死腔空气混合。在呼出更多空气后,所有死腔空气都已从气道中排出,只剩下肺泡空气。因此,记录的氮气浓度达到一个平台水平,等于其在肺泡中的浓度,如图右侧所示。灰色区域代表不含氮气的空气,是死腔空气容积的度量。为了精确量化,使用以下公式:
VD = 灰色面积 × VE /(粉色区域+灰色区域)
其中,VD是死腔空气,VE是呼出空气的总体积。
例如,假设图中的灰色区域为30平方厘米,粉色区域为70平方厘米,呼出的总体积为500毫升。死腔容积为150ml。
正常死腔容积。年轻男性的正常死腔空气约为150毫升。死腔空气随年龄略有增加。
解剖死腔与生理死腔。刚才描述的测量死腔的方法测量的是呼吸系统中除肺泡及其密切相关的气体交换区域之外的所有空间的体积;这个空间被称为解剖死腔(anatomical dead space)。有时,由于邻近肺毛细血管的血流缺失或不足,一些肺泡是无功能的或仅部分功能。因此,这些肺泡也必须被视为死腔。当将肺泡死腔包括在死腔的总测量中时,这被称为生理死腔(physiological dead space),以区别于解剖死腔。在肺健康的人中,解剖死腔和生理死腔几乎相等,因为所有肺泡在正常肺中都是功能性的,但在某些肺部肺泡部分功能或非功能的人中,生理死腔的体积可能是解剖死腔的10倍,或1到2升。这些问题在第40章关于肺气体交换和第43章关于某些肺部疾病的讨论中进一步讨论。
肺泡通气率
每分钟肺泡通气量是每分钟进入肺泡和邻近气体交换区域的新空气的总量。它等于呼吸频率乘以每次呼吸进入这些区域的新空气量:
·VA = Freq ×(VT - VD)
其中·VA是每分钟肺泡通气量,Freq是每分钟呼吸频率,Vt是潮气量(tidal volume),Vd是生理死腔体积。
因此,在正常潮气量为500ml,正常死腔为150ml,呼吸频率为12次/分钟的情况下,肺泡通气量等于12×(500-150),即4200 ml/min。
肺泡通气量是决定肺泡中氧气和二氧化碳浓度的主要因素之一。因此,在接下来的关于呼吸系统的章节中,几乎所有关于气体交换的讨论都集中在肺泡通气量上。
呼吸道功能
气管、支气管和细支气管
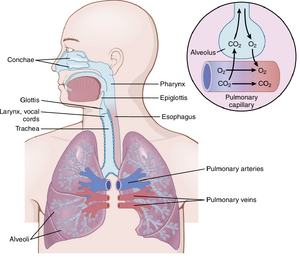
图38-8突出了呼吸道。空气通过气管、支气管和细支气管分布到肺部。
呼吸道中最重要的一项挑战是保持其开放并允许空气轻松进出肺泡。为了防止气管塌陷,多个软骨环围绕气管延伸约五分之六。在支气管壁中,较少范围的弯曲软骨板也保持了一定程度的刚性,同时允许足够的运动以使肺部扩张和收缩。这些板在后代的支气管中逐渐减少,在细支气管中消失,细支气管的直径通常小于1.5毫米。细支气管不会因为其壁的刚性而防止塌陷。相反,它们主要通过扩展肺泡的相同跨肺压来保持扩张。也就是说,随着肺泡的扩大,细支气管也会扩大,但程度较小。
支气管和细支气管的肌性壁。在气管和支气管中未被软骨板占据的所有区域,壁主要由平滑肌组成。此外,细支气管的壁几乎完全由平滑肌构成,除了最末端的细支气管,称为呼吸性细支气管,它主要由肺上皮和下方的纤维组织以及少量平滑肌纤维组成。许多肺部阻塞性疾病是由于较小的支气管和较大的细支气管狭窄引起的,通常是由于平滑肌的过度收缩。
支气管树中的气流阻力。在正常呼吸条件下,空气通过呼吸道非常容易,从肺泡到大气压的梯度小于1cmH2O就足以引起足够的空气流动以进行平静呼吸。最大的气流阻力不是发生在终末细支气管的微小气道中,而是发生在靠近气管的一些较大的细支气管和支气管中。这种高阻力的原因是,与大约65,000个平行的终末细支气管相比,这些较大的支气管相对较少,每个终末细支气管只需通过极少量空气。
在某些疾病情况下,较小的细支气管在决定气流阻力方面起着更大的作用,因为它们尺寸小且容易被以下因素阻塞:(1) 壁内的肌肉收缩;(2) 壁内的水肿;或(3) 细支气管腔内积聚的黏液。
细支气管肌肉的神经和局部控制——交感神经对细支气管的扩张。交感神经纤维对细支气管的直接控制相对较弱,因为很少有这些纤维穿透到肺的中央部分。然而,支气管树非常容易受到由肾上腺髓质交感神经刺激释放到血液中的去甲肾上腺素和肾上腺素的影响。这两种激素,尤其是肾上腺素,由于其对β-肾上腺素能受体的更强刺激,会导致支气管树的扩张。
副交感神经对细支气管的收缩。一些来自迷走神经的副交感神经纤维穿透肺实质。这些神经分泌乙酰胆碱,当被激活时,会引起细支气管的轻度到中度收缩。当疾病过程如哮喘已经引起一些细支气管收缩时,叠加的副交感神经刺激通常会加重病情。当这种情况发生时,使用阻断乙酰胆碱作用的药物,如阿托品,有时可以放松呼吸道,足以缓解阻塞。
有时,副交感神经也会被起源于肺的反射激活。大多数这些反射始于呼吸道上皮膜的刺激,由有害气体、灰尘、香烟烟雾或支气管感染引发。此外,当微栓子阻塞小肺动脉时,通常会发生细支气管收缩反射。
局部分泌因子可能导致细支气管收缩。肺部形成的几种物质通常具有引起细支气管收缩的活性。其中最重要的两种是组胺(histamine)和过敏性慢反应物质(slow reactive substance of anaphylaxis)。这两种物质在过敏反应期间由肥大细胞释放到肺组织中,尤其是由空气中的花粉引起的过敏反应。因此,它们在过敏性哮喘中引起气道阻塞方面起关键作用;过敏性慢反应物质尤其如此。
引起气道副交感神经收缩反射的刺激物——烟雾、灰尘、二氧化硫以及烟雾中的一些酸性成分——也可能直接作用于肺组织,引发局部的非神经性反应,从而导致气道阻塞性收缩。
呼吸道黏液层和纤毛清除作用
从鼻子到终末细支气管的所有呼吸道都被一层黏液覆盖,使整个表面保持湿润。黏液部分由呼吸道上皮中的单个杯状细胞分泌,部分由黏膜下的小腺体分泌。除了保持表面湿润外,黏液还能捕获吸入空气中的小颗粒,并防止这些颗粒到达肺泡。黏液通过以下方式从呼吸道中清除。
从鼻子到终末细支气管的整个呼吸道表面都覆盖着纤毛上皮,每个上皮细胞上约有200根纤毛。这些纤毛以每秒10到20次的频率持续摆动,其机制在第2章中已解释,且其“动力冲程”的方向始终朝向咽部。也就是说,肺部的纤毛向上摆动,而鼻子中的纤毛向下摆动。这种持续摆动使黏液层以每分钟几毫米的速度缓慢流向咽部。然后,黏液及其捕获的颗粒被吞咽或咳出体外。
咳嗽反射
支气管和气管对轻微触碰非常敏感,微量的异物或其他刺激物即可引发咳嗽反射。喉部和气管隆突(气管分叉为支气管的部位)特别敏感,终末细支气管甚至肺泡对腐蚀性化学刺激物(如二氧化硫气体或氯气)也很敏感。传入神经冲动主要通过迷走神经从呼吸道传递到延髓。在那里,延髓的神经元回路触发了一系列自动事件,导致以下效应。
- 快速吸入多达2.5升的空气。
- 会厌关闭,声带紧闭以将空气困在肺内。
- 腹肌强力收缩,推动膈肌,同时其他呼气肌(如肋间内肌)也强力收缩。因此,肺内压力迅速上升,可达100mmHg或更高。
- 声带和会厌突然大幅打开,使肺内高压下的空气迅速向外喷出。有时,空气以每小时75到100英里的速度被排出。
重要的是,肺部的强烈压缩通过使非软骨部分向内凹陷而导致支气管和气管塌陷,因此爆炸的空气实际上通过支气管和气管的缝隙排出。快速流动的空气通常会带走存在于支气管或气管中的任何异物。
喷嚏反射 (Sneeze Reflex)
喷嚏反射与咳嗽反射非常相似,只不过它适用于鼻腔通道而不是下呼吸道。喷嚏反射的起始刺激是鼻腔通道的刺激;传入冲动通过第五脑神经传递到延髓,在那里触发反射。发生一系列与咳嗽反射相似的反应,但悬雍垂被压低,因此大量空气迅速通过鼻子,从而帮助清除鼻腔中的异物。
鼻子的正常呼吸功能
当空气通过鼻子时,鼻腔执行三种不同的正常呼吸功能:(1) 空气通过鼻甲和鼻中隔的广泛表面被加热,总面积约为160平方厘米(见图38-8);(2) 空气几乎完全被加湿,甚至在它通过鼻子之前;(3) 空气被部分过滤。这些功能合称为上呼吸道通道的空气调节功能。通常,吸入空气的温度在到达气管之前会上升到接近体温的1\circF以内,并且水蒸气饱和度在2%到3%以内。当一个人通过管子直接向气管呼吸空气时(如通过气管切开术),下肺的冷却和特别是干燥效应可能导致严重的肺部结痂和感染。
鼻子的过滤功能。鼻孔入口处的毛发对于过滤大颗粒非常重要。然而,更重要的是通过湍流沉淀去除颗粒。也就是说,通过鼻腔通道的空气会撞击许多阻碍物——鼻甲(也称为鼻甲,因为它们引起空气的湍流)、鼻隔膜和咽壁。每次空气撞击这些阻碍物之一时,它必须改变其运动方向。悬浮在空气中的颗粒,其质量和动量远大于空气,不能像空气那样迅速改变其运动方向。因此,它们继续向前运动,撞击阻碍物的表面,并被黏液层捕获,然后通过纤毛运输到咽部被吞咽。
呼吸道通道中捕获的颗粒大小。鼻腔湍流机制去除空气中的颗粒非常有效,以至于几乎没有直径大于6微米的颗粒通过鼻子进入肺部。这个尺寸比红细胞还要小。
在剩余的颗粒中,许多直径在1到5微米之间的颗粒由于重力沉淀作用而沉降在较小的细支气管中。例如,煤矿工人中常见的终末细支气管疾病就是由于沉降的尘埃颗粒引起的。一些更小的颗粒(直径小于1微米)会扩散到肺泡壁上并附着在肺泡液中。然而,许多直径小于0.5微米的颗粒仍然悬浮在肺泡空气中,并通过呼气排出。例如,香烟烟雾的颗粒大约为0.3微米。几乎所有这些颗粒在到达肺泡之前都不会在呼吸道中沉淀。不幸的是,其中多达三分之一的颗粒通过扩散过程在肺泡中沉淀,其余的则保持悬浮状态并通过呼气排出。
许多被困在肺泡中的颗粒会被肺泡巨噬细胞清除,如第34章所述,其他颗粒则会被肺淋巴系统带走。过量的颗粒会导致肺泡间隔中纤维组织的生长,从而导致永久性残疾。
发声
发声不仅涉及呼吸系统,还涉及以下内容:(1) 大脑皮层中的特定语言神经控制中心,如第58章所述;(2) 大脑的呼吸控制中心;以及(3) 口腔和鼻腔的发音和共鸣结构。发声由两个机械功能组成:(1) 发声(phonation),由喉部实现;(2) 发音(articulation),由口腔结构实现。
发声。如图38-9A所示,喉部特别适合作为振动器。振动元件是声带(vocal folds),通常称为声带(vocal cords)。声带从喉部的侧壁向声门中心突出;它们由喉部的几个特定肌肉拉伸和定位。
图38-9B显示了通过喉镜观察声门时看到的声带。在正常呼吸时,声带是张开的,以便空气轻松通过。在发声时,声带会靠拢,使它们之间的空气通过时产生振动。振动的音调主要由声带的拉伸程度决定,但也取决于声带彼此靠近的紧密程度以及它们边缘的质量。图38-9A显示了去除粘膜上皮衬里后声带的解剖视图。每个声带内部都有一个强韧的弹性韧带,称为声韧带(vocal ligament)。这个韧带在前方附着于大的甲状软骨(thyroid cartilage),这是从颈部前表面向前突出的软骨,称为喉结(Adam’s apple)。在后方,声韧带附着于两个杓状软骨(arytenoid cartilages)的声带突。甲状软骨和杓状软骨从下方与另一个软骨(图38-9中未显示)——环状软骨(cricoid cartilage)相连。
声带可以通过甲状软骨(thyroid cartilage)的前旋或杓状软骨(arytenoid cartilages)的后旋来拉伸,这些动作由从甲状软骨和杓状软骨延伸到环状软骨(cricoid cartilage)的肌肉激活。位于声带外侧、声韧带(vocal ligaments)旁的甲杓肌(thyroarytenoid muscles)可以将杓状软骨拉向甲状软骨,从而使声带松弛。此外,这些肌肉在声带中的部分可以改变声带边缘的形状和质量,使其变尖以发出高音,或变钝以发出低音。
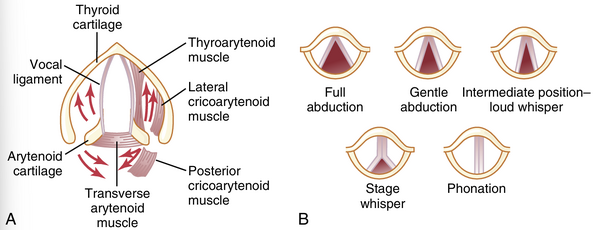
另外几组小的喉部肌肉位于杓状软骨和环状软骨之间,可以使这些软骨向内或向外旋转,或将它们的基部拉近或分开,从而形成声带的各种配置,如图38-9B所示。
发音和共鸣。发音的三个主要器官是嘴唇、舌头和软腭。我们不需要在这里详细讨论它们,因为我们都熟悉它们在说话和其他发声时的运动。
共鸣器包括口腔、鼻腔及相关的鼻窦、咽部,甚至胸腔。同样,我们对这些结构的共鸣特性也很熟悉。例如,当一个人患有严重感冒,阻塞了通往这些共鸣器的气道时,声音质量的变化就展示了鼻腔共鸣器的功能。
第三十九章 肺循环、肺水肿和胸膜液
肺有两个循环系统,一个是高压、低流量的循环系统,另一个是低压、高流量的循环系统。高压、低流量的循环系统为气管、支气管树(包括终末细支气管)、肺的支持组织以及肺动脉和肺静脉的外膜(外膜)提供体循环动脉血。支气管动脉是胸主动脉的分支,以略低于主动脉压力的压力提供大部分体循环动脉血。
低压、高流量的循环系统将来自身体各部分的静脉血输送到肺泡毛细血管,在那里加入氧气并去除二氧化碳(CO2)。肺动脉从右心室接收血液,其动脉分支将血液输送到肺泡毛细血管进行气体交换,然后肺静脉将血液返回到左心房,由左心室泵入体循环。
在本章中,我们将讨论肺循环在肺部气体交换中的重要特殊方面。
肺循环系统的生理解剖
肺血管。肺动脉仅延伸至右心室顶端5厘米处,然后分为左右两支,分别向两肺供血。
肺动脉的壁厚约为主动脉的三分之一。肺动脉的分支较短,且所有肺动脉,甚至较小的动脉和小动脉,其直径都比相应的体循环动脉大。这一特点,加上血管壁薄且易扩张的特性,使得肺动脉树具有较大的顺应性(compliance),平均约为7ml/mmHg,与整个体循环动脉树的顺应性相似。这种高顺应性使得肺动脉能够容纳右心室的每搏输出量。
肺静脉与肺动脉一样,也较短。它们直接将血液排入左心房。
支气管血管(Bronchial Vessels)。血液还通过起源于体循环的小支气管动脉流向肺部,占心输出总量的1%至2%。与肺动脉中部分脱氧的血液不同,支气管动脉血液是含氧血液。它为肺的支持组织供血,包括结缔组织、间隔以及大小支气管。在支气管和动脉血液流经支持组织后,它们排入肺静脉并进入左心房,而不是返回右心房。因此,左心房和左心室的输出量比右心室的输出量大约多1%至2%。
淋巴管(Lymphatics)。淋巴管存在于肺的所有支持组织中,始于终末细支气管周围的结缔组织间隙,经过肺门,然后主要进入右胸淋巴导管。进入肺泡的颗粒物质部分由这些淋巴管清除,从肺毛细血管渗漏的血浆蛋白也从肺组织中清除,从而有助于预防肺水肿。
肺循环系统中的压力
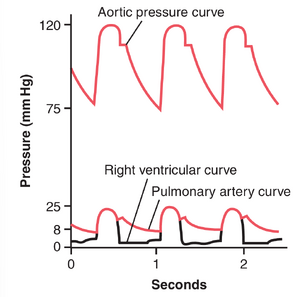
右心室压力。图39-1的下部显示了右心室和肺动脉的压力脉搏曲线。这些曲线与图中上部显示的更高的主动脉压力曲线形成对比。右心室的正常收缩压平均约为25mm Hg,舒张压平均约为0至1mm Hg,仅为左心室压力的五分之一。
肺动脉压力。在收缩期,肺动脉的压力基本上与右心室的压力相等,如图39-1所示。然而,在收缩末期肺动脉瓣关闭后,心室压力急剧下降,而肺动脉压力则随着血液流经肺部而缓慢下降。
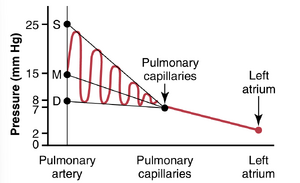
如图39-2所示,人类正常的肺动脉收缩压平均约为25mmHg,肺动脉舒张压约为8mmHg,平均肺动脉压为15mmHg。
肺毛细血管压力。如图39-2所示,平均肺毛细血管压力约为7mmHg。这种低毛细血管压力的重要性将在本章后面详细讨论,涉及肺毛细血管的液体交换功能。
左心房和肺静脉压力。在仰卧位的人中,左心房和主要肺静脉的平均压力约为2mmHg,范围从低至1mmHg到高达5mmHg。通常无法使用直接测量设备测量某人的左心房压力,因为很难将导管通过心脏腔室插入左心房。然而,通过测量所谓的肺楔压,可以以中等精度估计左心房压力。这是通过首先将导管插入外周静脉到右心房,然后通过心脏右侧和肺动脉插入肺动脉的一个小分支,最后推动导管直到它紧密楔入小分支来测量的。
通过导管测量的压力称为“楔压wedge pressure”,约为5mmHg。由于在小楔入的动脉中所有血流都已停止,并且由于延伸超过该动脉的血管与肺毛细血管直接连接,因此该楔压通常仅比左心房压力高2到3mmHg。当左心房压力升高到高值时,肺楔压也会升高。因此,楔压测量可用于估计充血性心力衰竭患者的肺毛细血管压力和左心房压力的变化。
肺的血容量
肺的血容量约为450ml,约占整个循环系统总血容量的9%。大约70ml的肺血容量在肺毛细血管中;其余部分大致平均分布在肺动脉和肺静脉之间。
肺作为血液储存库。在各种生理和病理条件下,肺中的血液量可以从正常的一半变化到正常的两倍。例如,当一个人用力吹气以至于在肺部产生高压时,例如吹喇叭时,多达250ml的血液可以从肺循环系统排出到体循环中。此外,由于出血导致的体循环血液损失可以通过血液从肺部自动转移到体循环血管中得到部分补偿。
心脏病理可能导致血液从体循环转向肺循环。心脏左侧衰竭,或由于二尖瓣狭窄或二尖瓣反流导致通过二尖瓣的血流阻力增加,会导致血液在肺循环中淤积,有时会使肺血容量增加多达100%,并导致肺血管压力大幅增加。由于体循环的容量大约是肺循环的九倍,血液从一个系统转移到另一个系统对肺循环影响很大,但对体循环通常只有轻微的影响。
肺部的血流及其分布
通过肺部的血流基本上等于心输出量。因此,控制心输出量的因素——主要是外周因素,如第20章所讨论的——也控制着肺部的血流。在大多数情况下,肺血管表现为可扩张的管道,随着压力增加而扩张,随着压力降低而收缩。为了使血液充分氧合,血液必须分布到肺泡氧合最好的肺段。这种分布通过以下机制实现。
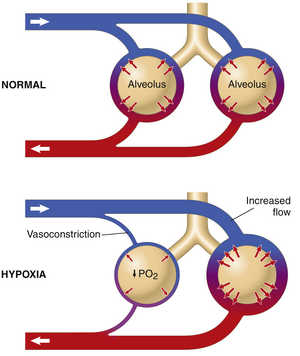
肺泡氧分压降低会减少局部肺泡血流并调节肺血流分布。当肺泡空气中的O2浓度低于正常水平,特别是低于正常水平的70%时(即<73mmHgPO2),邻近的血管会收缩(图39-3),在极低的O2水平下,血管阻力可能增加五倍以上。这种效应与体循环血管的效应相反,体循环血管在低O2水平下会扩张而不是收缩。尽管缺氧时促进肺血管收缩的机制尚未完全理解,但低O2浓度可能具有以下效应:(1) 刺激血管收缩物质(如内皮素或活性氧)的释放或增加对其的敏感性;或(2) 减少肺组织中血管扩张剂(如一氧化氮)的释放。
一些研究表明,缺氧可能通过抑制肺血管平滑肌细胞膜上的氧敏感钾离子通道直接诱导血管收缩。在氧分压低的情况下,这些通道被阻断,导致细胞膜去极化并激活钙通道,引起钙离子内流。钙离子浓度的升高随后导致小动脉和小动脉的收缩。
图39-4. 直立休息状态下(红色曲线)和运动状态下(蓝色曲线)肺部不同水平的血流情况。注意,当人处于休息状态时,肺部顶部的血流非常低;大部分血流通过肺底部。
由于低O2浓度导致的肺血管阻力增加具有重要的功能,即将血流分配到最有效的地方。也就是说,如果某些肺泡通气不良且O2浓度低,局部血管会收缩。这种收缩导致血液流经其他通气较好的肺部区域,从而提供了一个自动控制系统,根据肺泡O2压力按比例分配血流到肺部区域。
肺部静水压力梯度对区域肺血流的影响
在第15章中,我们指出,站立时脚部的血压可能比心脏水平的血压高出90mmHg。这种差异是由静水压力引起的,即血液本身在血管中的重量。同样的效应,但程度较轻,也发生在肺部。在直立的成年人中,肺部的最低点通常比最高点低约30cm,这代表了23mmHg的压力差异,其中约15mmHg在心脏以上,8mmHg在心脏以下。也就是说,站立时肺部最上部分的肺动脉压比心脏水平的肺动脉压低约15mmHg,而肺部最低部分的压力则高约8mmHg。
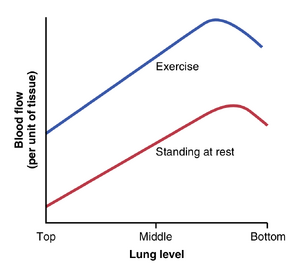
这种压力差异对通过肺部不同区域的血流有深远的影响。这种效应由图39-4中的下曲线展示,该曲线描绘了直立状态下肺部不同水平的每单位肺组织的血流。注意,在站立休息时,肺部顶部的血流很少,但底部的血流大约是顶部的五倍。为了帮助解释这些差异,肺部通常被描述为分为三个区域,如图39-5所示。在每个区域中,血流的模式都大不相同。
肺血流的区域1、2和3
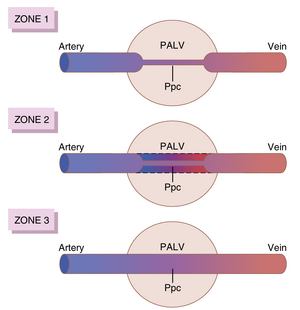
肺泡壁中的毛细血管(capillaries)被其内部的血压扩张,但同时也受到外部肺泡气压的压缩。因此,当肺泡气压大于毛细血管血压时,毛细血管关闭,血流停止。在不同的正常和病理肺条件下,可能会发现以下三种可能的肺血流区域(模式):
- 区域1:在整个心动周期中均无血流,因为该区域肺部的局部肺泡毛细血管压力在任何心动周期内均未超过肺泡气压。
- 区域2:仅在肺动脉压力峰值时出现间歇性血流,因为此时收缩压大于肺泡气压,但舒张压小于肺泡气压。
- 区域3:持续血流,因为在整个心动周期中,肺泡毛细血管压力始终大于肺泡气压。
正常情况下,肺部仅有区域2和区域3的血流——区域2(间歇性血流)位于肺尖部,区域3(持续血流)位于所有较低区域。例如,当一个人处于直立位时,肺尖部的肺动脉压力比心脏水平低约15mmHg。因此,肺尖部的收缩压仅为10mmHg(心脏水平的25mmHg减去15mmHg的静水压差)。这10mmHg的肺尖部血压大于0的肺泡气压,因此在心脏收缩期,血液流经肺尖部的毛细血管。相反,在舒张期,心脏水平的8mmHg舒张压不足以推动血液克服15mmHg的静水压梯度,导致舒张期毛细血管血流停止。因此,肺尖部的血流是间歇性的,收缩期有血流而舒张期无血流;这被称为区域2血流。在正常肺中,区域2血流从心脏中部水平上方约10~cm处开始,并延伸至肺顶部。
在肺的下部区域,从心脏水平上方约10~cm处一直到肺底部,肺动脉压力在收缩期和舒张期均保持大于0的肺泡气压。因此,肺泡毛细血管中发生持续血流,即区域3血流。此外,当一个人平躺时,肺的任何部分都不会比心脏水平高出几厘米。在这种情况下,正常人的血流完全为区域3血流,包括肺尖部。
区域1血流仅在异常条件下发生。区域1血流(Zone 1 blood flow)意味着在心动周期的任何时刻都没有血流,这种情况发生在肺动脉收缩压过低或肺泡压过高以致无法允许血流通过时。例如,如果一个直立的人在正压通气下呼吸,使得肺泡内气压至少比正常高10mmHg,但肺动脉收缩压正常,那么可以预期在肺尖部会出现区域1血流——即没有血流。另一种出现区域1血流的情况是直立的人的肺动脉收缩压极低,例如在严重失血后可能发生。
运动增加肺部所有部位的血流。再次参考图39-4,可以看到在运动期间肺部所有部位的血流都会增加。血流增加的一个主要原因是运动期间肺血管压力上升得足够多,将肺尖部的血流模式从区域2转变为区域3。
剧烈运动期间增加的心输出量通常由肺循环适应,而不会显著增加肺动脉压
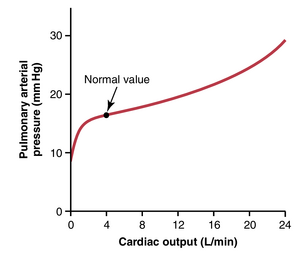
在剧烈运动期间,通过肺部的血流可能增加四到七倍。这种额外的血流通过三种方式在肺部得到适应:(1) 通过增加开放的毛细血管数量,有时多达三倍;(2) 通过扩张所有毛细血管并将通过每个毛细血管的流速增加超过两倍;(3) 通过增加肺动脉压。通常,前两种变化大大降低了肺血管阻力,以至于即使在最大运动期间,肺动脉压也几乎不上升。这种效应如图39-6所示。
肺部在运动期间适应大幅增加的血流而不增加肺动脉压的能力,节省了右心室的能量。这种能力还防止了肺毛细血管压的显著上升和肺水肿的发展。
左心房压因左侧心力衰竭而上升时的肺循环功能
健康人的左心房压几乎不会超过+6mmHg,即使在最剧烈的运动期间也是如此。左心房压的这些微小变化对肺循环功能几乎没有影响,因为这仅仅是扩张了肺小静脉并打开了更多的毛细血管,使得血液继续以几乎相同的顺畅度从肺动脉流出。
当心脏左侧衰竭时,血液开始在左心房(Left Atrium)中积聚。结果,左心房压力有时会从正常的1到5mmHg上升到高达40到50mmHg。心房压力的初始上升,最高约7mmHg,对肺循环功能影响不大。然而,当左心房压力上升到超过7或8 mmHg时,左心房压力的进一步增加几乎同样大幅度地增加肺动脉压力,从而增加右心的负荷。左心房压力超过7或8mmHg的任何增加几乎同样大幅度地增加毛细血管压力。当左心房压力上升到超过30mm Hg时,导致毛细血管压力类似增加,肺水肿(Pulmonary Edema)可能会发生,这将在本章后面讨论。
肺毛细血管动力学
肺泡空气和肺毛细血管血液之间的气体交换将在下一章讨论。然而,这里需要注意的是,肺泡壁上有如此多的毛细血管,以至于在大多数地方,毛细血管几乎彼此并排接触。因此,常有人说毛细血管血液在肺泡壁中以“流动片”而非单个毛细血管的形式流动。
肺毛细血管压力。尽管尚未报道肺毛细血管压力的直接测量结果,但间接估计表明其正常平均值约为7mmHg。这个值可能几乎正确,因为平均左心房压力约为2mmHg,而平均肺动脉压力仅为15mmHg,因此平均肺毛细血管压力必须位于这两个值之间。
血液在肺毛细血管中停留的时间。从所有肺毛细血管总横截面积的组织学研究可以计算出,当心输出量正常时,血液通过肺毛细血管大约需要0.8秒。当心输出量增加时,这个时间可以缩短到0.3秒。如果不是因为通常情况下塌陷的额外毛细血管开放以容纳增加的血液流量,缩短的时间会更大。因此,在仅几分之一秒内,通过肺泡毛细血管的血液就会氧合并失去多余的二氧化碳。
肺毛细血管液体交换和肺间质液体动力学
肺毛细血管膜上的液体交换动力学在性质上与周围组织相同。然而,在数量上存在重要差异,如下:
- 肺毛细血管压力低,约为7 mmHg,相比之下,许多周围组织的功能性毛细血管压力约为17mmHg。
- 肺间质液体压力略低于周围皮下组织的间质液体压力(该压力通过两种方式测量——通过插入肺间质的微管测量,得到的值约为-5 mmHg,以及通过测量从肺泡吸收液体的压力,得到的值约为-8 mmHg.。)
- 肺间质液的胶体渗透压约为14mmHg,相比之下,大多数外周组织的胶体渗透压不到该值的一半。
- 肺泡壁非常薄,覆盖肺泡表面的肺泡上皮非常脆弱,以至于任何大于肺泡气压的间质正压力(>0mmHg)都可以使其破裂,从而导致液体从间质间隙流入肺泡。现在让我们看看这些定量差异如何影响肺液动力学。
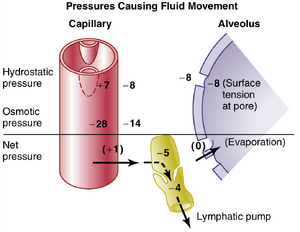
间质液压力与肺内其他压力之间的关系。图39-7显示了肺毛细血管、肺泡和引流毛细血管与肺泡之间间质间隙的淋巴毛细血管。注意毛细血管膜上的力的平衡,如下所示:
<html><body><table><tr><td>mmHg 导致液体从毛细血管向外移动并进入肺间质的力:</td></tr><tr><td>毛细血管压力 7</td></tr><tr><td>间质液胶体渗透压 14</td></tr><tr><td>负间质液压力 8</td></tr><tr><td>总向外力 29</td></tr><tr><td>导致液体吸收进入毛细血管的力:</td></tr><tr><td>血浆胶体渗透压 28</td></tr><tr><td>总向内力 28</td></tr></table></body></html>
因此,正常的向外力略大于向内力,提供了肺毛细血管膜上的平均滤过压力,可以计算为+29-28 mm H g=+1 mm Hg。
这种滤过压力导致液体从肺毛细血管持续轻微流入间质间隙,除了少量在肺泡中蒸发的液体外,这些液体通过肺淋巴系统被泵回循环系统。
负肺间质压力及保持肺泡干燥的机制。在正常情况下,是什么阻止肺泡充满液体?肺毛细血管和肺淋巴系统通常在间质间隙中维持轻微的负压;每当肺泡中出现额外的液体时,它会被机械地通过肺泡上皮细胞之间的小开口吸入肺间质。多余的液体随后通过肺淋巴管被带走。因此,在正常情况下,肺泡保持“干燥”,除了少量液体从上皮渗出到肺泡的内衬表面以保持其湿润。
肺水肿
肺水肿的发生方式与身体其他部位的水肿相同。任何增加肺毛细血管液体滤过或阻碍肺淋巴功能并导致肺间质液压力从负值范围上升到正值范围的因素,都会导致肺间质和肺泡充满自由液体。
肺水肿最常见的原因如下:
- 左心衰竭或二尖瓣疾病,导致肺静脉压力和肺毛细血管压力大幅增加,进而使间质和肺泡充满液体
- 由感染(如肺炎)或吸入有害物质(如氯气或二氧化硫)引起的肺毛细血管膜损伤
这些机制中的每一种都会导致血浆蛋白和液体迅速从毛细血管渗漏到肺间质和肺泡中。
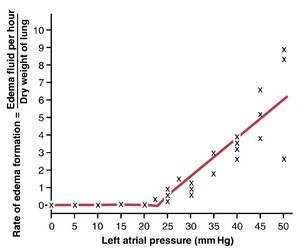
肺水肿的安全因素。动物实验表明,肺毛细血管压力通常必须上升到至少等于毛细血管内血浆的胶体渗透压时,才会发生显著的肺水肿。举例来说,图39-8显示了不同水平的左心房压力如何增加犬肺水肿形成的速率。请记住,每次左心房压力上升到较高值时,肺毛细血管压力会上升到比左心房压力高1到2mmHg的水平。在这些实验中,一旦左心房压力上升到23mmHg以上(导致肺毛细血管压力上升到25mmHg以上),液体就开始在肺部积聚。随着毛细血管压力的进一步增加,这种液体积聚的速度甚至更快。在这些实验中,血浆胶体渗透压等于这个25mmHg的临界压力水平。因此,对于正常人来说,其血浆胶体渗透压为28mm Hg,可以预测肺毛细血管压力必须从正常的7mmHg上升到超过28mmHg才会引起显著的肺水肿,从而提供了一个21mmHg的急性肺水肿安全因素。
慢性情况下的安全因素。当肺毛细血管压力长期保持升高(至少2周)时,肺部对肺水肿的抵抗力会进一步增强,因为淋巴管会显著扩张,增加了它们从间质空间带走液体的能力,可能增加了10倍。因此,在患有慢性二尖瓣狭窄的患者中,测量到的肺毛细血管压力为40到45mmHg,但并未发生致命的肺水肿。
急性肺水肿患者的死亡速度。当肺毛细血管压力(pulmonary capillary pressure)即使轻微上升到安全系数水平以上时,致死性肺水肿可能在数小时内发生,如果毛细血管压力上升到安全系数水平以上25至30mmHg,甚至可能在20至30分钟内发生。因此,在急性左心衰竭(acute left-sided heart failure)中,肺毛细血管压力偶尔会上升到50mmHg,由于急性肺水肿,死亡可能在不到30分钟内发生。
胸腔中的液体
在正常呼吸过程中,当肺部扩张和收缩时,它们在胸腔内来回滑动。为了促进这种运动,壁层胸膜(parietal pleura)和脏层胸膜(visceral pleura)之间有一层薄薄的黏液样液体。
图39-9显示了胸膜腔内液体交换的动态。胸膜是一种多孔的、间充质的、浆液性的膜,通过它,少量的间质液(interstitial fluid)不断渗出到胸膜腔中。这些液体携带组织蛋白,使胸膜液具有黏液样特性,这使得移动的肺部能够极其容易地滑动。
图39-9. 胸膜腔内液体交换的动态。
每个胸腔内的液体总量通常很少——只有几毫升。每当液体的量超过仅仅足以在胸腔内开始流动时,多余的液体就会被淋巴管泵走,这些淋巴管直接从胸腔开口进入以下部位:(1)纵隔(mediastinum);(2)膈肌(diaphragm)的上表面;以及(3)壁层胸膜的侧面。因此,胸膜腔——壁层胸膜和脏层胸膜之间的空间——被称为潜在空间(potential space),因为它通常非常狭窄,以至于它不是一个明显的物理空间。
胸膜液中的负压。肺部的外部总是需要一个负力来保持肺部的扩张。这种力由正常胸膜腔中的负压提供。这种负压的基本原因是淋巴管从空间中泵出液体,这也是身体大多数组织空间中发现负压的基础。由于肺部的正常塌陷倾向约为-4mmHg,胸膜液压力必须始终至少为-4mmHg以保持肺部扩张。实际测量表明,压力通常约为-7mmHg,这比肺部的塌陷压力负几毫米汞柱。因此,胸膜液压力的负性使正常肺部紧贴在胸腔的壁层胸膜上,除了一层极薄的黏液样液体作为润滑剂。
胸腔积液——大量游离液体积聚在胸膜腔
胸腔积液类似于组织中的水肿液,可以称为胸膜腔水肿。积液的原因与其他组织水肿的原因相同(在第25章讨论),包括以下几点:(1) 胸膜腔淋巴引流阻塞;(2) 心力衰竭,导致外周和肺毛细血管压力过高,导致液体过度渗出到胸膜腔;(3) 血浆胶体渗透压显著降低,从而导致液体过度渗出;(4) 感染或任何其他导致胸膜腔表面炎症的原因,这会增加毛细血管膜的通透性,使血浆蛋白和液体迅速进入胸膜腔。
Guyton AC, Lindsey AW: Effect of elevated left atrial pressure and decreased plasma protein concentration on the development of pulmonary edema. Circ Res 7:649, 1959. Hughes M, West JB: Gravity is the major factor determining the distribution of blood flow in the human lung. J Appl Physiol 104:1531, 2008. Jaitovich A, Jourd’heuil D: A Brief overview of nitric oxide and reactive oxygen species signaling in hypoxia-induced pulmonary hypertension. Adv Exp Med Biol 967:71, 2017. Lumb AB, Slinger P: Hypoxic pulmonary vasoconstriction: physiology and anesthetic implications. Anesthesiology 122:932, 2015. Parker JC: Hydraulic conductance of lung endothelial phenotypes and Starling safety factors against edema. Am J Physiol Lung Cell Mol Physiol 292:L378, 2007. Stickland MK, Lindinger MI, Olfert IM, Heigenhauser GJ, Hopkins SR: Pulmonary gas exchange and acid-base balance during exercise. Compr Physiol 3:693, 2013. Suresh K, Shimoda LA: Lung circulation. Compr Physiol 6:897, 2018. Sylvester JT, Shimoda LA, Aaronson PI, Ward JP: Hypoxic pulmonary vasoconstriction. Physiol Rev 92:367, 2012. Tabima DM, Philip JL, Chesler NC: Right ventricular-pulmonary vascular interactions. Physiology (Bethesda) 32:346, 2017. Townsley MI: Structure and composition of pulmonary arteries, capillaries, and veins. Compr Physiol 2:675, 2012. Zielinska-Krawczyk M, Krenke R, Grabczak EM, Light RW: Pleural manometry-historical background, rationale for use and methods of measurement. Respir Med 136:21, 2018.
第四十章 气体交换原理;氧气和二氧化碳通过呼吸膜的扩散
当肺泡被新鲜空气通气后,呼吸的下一步是氧气(O2)从肺泡扩散到肺血液中,以及二氧化碳(CO2)向相反方向扩散,从血液进入肺泡。扩散过程仅仅是分子通过呼吸膜和相邻液体的随机运动。然而,在呼吸生理学中,我们不仅关注扩散发生的基本机制,还关注其发生的速率,这是一个更为复杂的问题,需要对扩散和气体交换的物理学有更深入的理解。
气体扩散和气体分压的物理学
气体扩散的分子基础
呼吸生理学中关注的所有气体都是简单分子,它们可以通过扩散自由地在彼此之间移动。对于溶解在体液和组织中的气体也是如此。
要发生扩散,必须有能量来源。这个能量来源由分子的动能提供。除了绝对零度外,所有物质的所有分子都在不断运动。对于没有物理附着在其他分子上的自由分子来说,这意味着它们以高速直线运动,直到撞击其他分子。然后它们会以新的方向弹开,并继续移动,直到再次撞击其他分子。通过这种方式,分子在彼此之间快速且随机地移动。
气体在一个方向上的净扩散——浓度梯度的影响。如果一个气体室或溶液在室的一端有高浓度的特定气体,而在另一端有低浓度,如图40-1所示,气体将从高浓度区域向低浓度区域发生净扩散。原因很明显。在室的A端有更多的分子向B端扩散,而在相反方向扩散的分子要少得多。因此,两个方向的扩散速率成比例地不同,如图中箭头的长度所示。
气体混合物中的气体压力——单个气体的分压
压力是由运动分子对表面的多次撞击引起的。因此,作用于呼吸道和肺泡表面的气体压力与任何给定时刻撞击该表面的所有气体分子的撞击力总和成正比。这意味着压力与气体分子的浓度成正比。
在呼吸生理学中,我们处理的是气体混合物,主要是氧气、氮气和二氧化碳。每种气体的扩散速率与仅由该气体引起的压力成正比,这称为该气体的分压。分压的概念可以解释如下。
考虑空气,其组成大约为79%的氮气和21%的氧气。在海平面,这种混合物的总压力平均为760mmHg。从前面对压力分子基础的描述中可以清楚地看出,每种气体对总压力的贡献与其浓度成正比。因此,760 mm Hg中的79%是由氮气引起的(600mmHg)),21%是由O2引起的(160mmHg))。因此,混合物中氮气的分压为600mmHg,O2的分压为160mmHg,总压力为760mmHg,即各个分压的总和。混合物中单个气体的分压用符号PO2、PCO2;、PN2、Phe等表示。
溶解在水和组织中的气体压力
溶解在水或身体组织中的气体也会产生压力,因为溶解的气体分子在随机运动并具有动能。此外,当溶解在液体中的气体遇到表面(如细胞膜)时,它会以与气相中的气体相同的方式施加其自身的分压(partial pressure)。溶解在液体中的各种气体的分压与气相中的分压相同,即PO2, o2,CO2,P N2, Phe等。
决定液体中溶解气体分压的因素。液体中气体的分压不仅由其浓度决定,还由气体的溶解度系数(solubility coefficient)决定。也就是说,某些类型的分子(尤其是CO2)在物理或化学上被水分子吸引,而其他类型的分子则被排斥。当分子被吸引时,更多的分子可以溶解在液体中而不会在溶液中积累过高的分压。相反,对于被排斥的分子,即使溶解的分子较少,也会产生较高的分压。这些关系由以下公式表示,即亨利定律(Henry’s law):
图40-1. 氧气从腔室一端扩散到另一端。箭头长度的差异表示净扩散。
分压 = 溶解气体浓度/溶解系数
当分压以大气压(1大气压[1 atm]等于760mmHg)表示,浓度以每单位体积水中溶解的气体体积表示时,重要呼吸气体在体温下的溶解度系数如下:
氧气 0.024
二氧化碳 0.57
一氧化碳 0.018
氮气 0.012
氦气 0.008
从列表中可以看出,CO2的溶解度是O2的20倍以上。因此,对于给定的浓度,CO2的分压不到O2分压的二十分之一(5%)。
肺泡中气相与肺血中溶解相之间的气体扩散。肺泡呼吸气体混合物中每种气体的分压倾向于将该气体的分子推入肺泡毛细血管的血液中。相反,已经溶解在血液中的相同气体分子在血液中随机弹跳,其中一些弹跳的分子会逃逸回肺泡。它们逃逸的速率与它们在血液中的分压成正比。
但是,气体将向哪个方向发生净扩散(net diffusion)呢?答案是,净扩散由两个分压(partial pressure)之间的差异决定。如果气体在肺泡中的气相分压更高(通常氧气就是这种情况),那么更多的分子将向血液中扩散,而不是向相反方向扩散。相反,如果气体在血液中的溶解状态分压更高(通常二氧化碳(CO2)就是这种情况),那么净扩散将朝向肺泡中的气相发生。
水蒸气压
当未加湿的空气被吸入呼吸道时,水会立即从这些通道的表面蒸发,使空气湿润。这是因为水分子与不同的溶解气体分子一样,会不断从水表面逃逸到气相中。水分子通过表面逃逸所施加的分压称为水蒸气压(vapor pressure of water)。在正常体温37℃(98.6℉)下,水蒸气压为47mmHg。因此,一旦气体混合物完全湿润——即与水平衡——气体混合物中的水蒸气分压为47mmHg。这个分压与其他分压一样,被表示为PH2O。
水蒸气压完全取决于水的温度。温度越高,分子的动能活动越强,因此水分子从水表面逃逸到气相的可能性越大。例如,0℃时的水蒸气压为5mmHg,而在100℃时为760mmHg。最重要的数值是体温下的水蒸气压,即47mmHg。这个值在我们后续的讨论中会多次出现。
压力差导致气体通过液体的净扩散
从前面的讨论中可以清楚地看出,当气体在一个区域的分压高于另一个区域时,净扩散将从高压区域向低压区域发生。例如,回到图40-1,可以很容易地看到,高压区域的分子由于数量更多,随机移动到低压区域的机会比试图向相反方向移动的分子更大。然而,确实有一些分子会从低压区域随机反弹到高压区域。因此,气体从高压区域向低压区域的净扩散等于向前方向反弹的分子数减去向相反方向反弹的分子数,这与两个区域之间的气体分压差成正比,简称为引起扩散的压力差。
量化液体中的净扩散速率。除了压力差之外,还有其他几个因素会影响气体在液体中的扩散速率:(1) 气体在液体中的溶解度(solubility);(2) 液体的横截面积(cross-sectional area);(3) 气体必须扩散的距离;(4) 气体的分子量(molecular weight);(5) 液体的温度。在人体中,温度保持相对恒定,通常不需要考虑。
气体的溶解度越大,在给定的分压差下可用于扩散的分子数量就越多。扩散路径的横截面积越大,扩散的分子总数就越多。相反,分子必须扩散的距离越长,分子扩散整个距离所需的时间就越长。最后,分子的运动速度越快(与分子量的平方根成反比),气体的扩散速率就越大。所有这些因素可以用一个公式表示,如下所示:
D ∝ (ΔP×A×S)/ d × √MW
其中,D 表示扩散速率,Δ P 表示扩散路径两端的分压差,A 表示路径的横截面积,S 表示气体的溶解度,d 表示扩散距离,MW 表示气体的分子量。
从该公式可以明显看出,气体的特性决定了公式中的两个因素——溶解度(solubility)和分子量(molecular weight)。这两个因素共同决定了气体的扩散系数,该系数与 S/\sqrtMW 成正比;也就是说,在相同分压水平下,不同气体的相对扩散速率与其扩散系数成正比。假设 O2 的扩散系数为 1,体液中对呼吸重要的不同气体的相对扩散系数如下:
氧气 1
二氧化碳 20.3
一氧化碳 0.81
氮气 0.81
氦气 0.95
气体通过组织的扩散
对呼吸重要的气体都高度溶于脂质,因此也高度溶于细胞膜。由于这一特性,气体在组织中运动的主要限制因素是气体通过组织水扩散的速率,而不是通过细胞膜的速率。因此,气体通过组织(包括呼吸膜)的扩散几乎等同于气体在水中的扩散,如前述列表所示。
表 40-1 呼吸气体进入和离开肺部时的分压(单位为 m mH g.)和组成(百分比)
<html><body><table><tr><td></td><td>Atmo- spheric Air</td><td>Humidi- fiedAir</td><td>Alveolar Air</td><td>Expired Air</td></tr><tr><td>N2</td><td>597 (78.62)</td><td>563.4 (74.09)</td><td>569 (74.9)</td><td>566 (74.5)</td></tr><tr><td>02</td><td>159 (20.84)</td><td>149.3 (19.67)</td><td>104 (13.6)</td><td>120 (15.7)</td></tr><tr><td>CO2</td><td>0.3 (0.04)</td><td>0.3 (0.04)</td><td>40 (5.3)</td><td>27 (3.6)</td></tr><tr><td>H20O</td><td>3.7 (0.50)</td><td>47 (6.20)</td><td>47 (6.2)</td><td>47 (6.2)</td></tr><tr><td>Total</td><td>760 (100)</td><td>760 (100)</td><td>760 (100)</td><td>760 (100)</td></tr></table></body></html>
a在海平面。
图 40-2. 肺泡中气体通过连续呼吸的呼出过程。
肺泡空气和大气空气的组成不同
肺泡空气的气体浓度与大气空气不同(表40-1)。造成这种差异的原因有几个。首先,每次呼吸时,肺泡空气仅部分被大气空气替换。其次,O2 不断从肺泡空气中被吸收进入肺血液。第三,CO2 不断从肺血液中扩散进入肺泡。第四,进入呼吸道的大气空气在到达肺泡之前就已经被加湿了。
空气在呼吸道中被加湿
表40-1显示,大气空气几乎完全由氮气和O2组成;通常几乎不含CO2,水蒸气也很少。然而,一旦大气空气进入呼吸道,它就会接触到覆盖在呼吸道表面的液体。甚至在空气进入肺泡之前,它就已经几乎完全被加湿了。
在正常体温37℃下,水蒸气的分压为47mmHg,因此这也是肺泡空气中水蒸气的分压。由于肺泡中的总压力不能超过大气压力(海平面为760mmHg),这些水蒸气只是稀释了吸入空气中的其他气体。表40-1还显示,空气的加湿使海平面上的氧气分压从大气空气中的平均159mmHg稀释到加湿空气中的149mm Hg,氮气分压从597稀释到563mmHg。
肺泡空气被大气空气缓慢更新。在第38章中,我们指出,肺的平均功能残气量(正常呼气结束时肺中剩余的空气量)在男性中约为2300ml。然而,每次正常吸气时只有350ml的新鲜空气进入肺泡,同时呼出相同量的旧肺泡空气。因此,每次呼吸时被新大气空气替换的肺泡空气量仅为总量的七分之一,因此需要多次呼吸才能交换大部分肺泡空气。图40-2显示了肺泡空气的这种缓慢更新速率。在图的第一个肺泡中,肺泡中存在过量的气体,但请注意,即使在16次呼吸结束时,过量的气体仍未完全从肺泡中移除。
图40-3以图形方式展示了肺泡中过量气体被移除的速率,显示在正常肺泡通气情况下,约一半的气体在17秒内被移除。当一个人的肺泡通气速率仅为正常的一半时,一半的气体在34秒内被移除,而当通气速率为正常的两倍时,约8秒内移除一半。
图40-3. 肺泡中过量气体的移除速率
肺泡空气的缓慢替换有助于稳定呼吸控制。肺泡空气的缓慢替换在防止血液中气体浓度的突然变化方面尤为重要。这使得呼吸控制机制比原本更加稳定,并有助于在呼吸暂时中断时防止组织氧合、组织CO2浓度和组织pH的过度增加和减少。
肺泡中的氧气浓度和分压
氧气不断从肺泡被吸收到肺部的血液中,同时新的O2不断从大气中被吸入肺泡。O2被吸收得越快,其在肺泡中的浓度就越低;反之,新的O2从大气中被吸入肺泡的速度越快,其浓度就越高。因此,肺泡中的O2浓度及其分压由以下因素控制:(1) O2被吸收到血液中的速率;(2) 通过通气过程进入肺部的新O2的速率。
图40-4显示了肺泡通气和O2吸收速率对肺泡PO2的影响。一条曲线表示O2以250 ml/min的速率被吸收,另一条曲线表示以1000ml/ min的速率被吸收。在正常通气速率为4.2L/min和O2消耗量为250ml/min的情况下,图40-4中的正常操作点是点A。该图还显示,当每分钟吸收1000ml的O2时(如在中度运动期间),肺泡通气速率必须增加四倍,以将肺泡PO2维持在正常值104mmHg。
图40-4还显示,只要人在海平面压力下呼吸正常大气空气,即使肺泡通气量极度增加,肺泡PO2也永远不会超过149mmHg,因为149mmHg是在该压力下湿润空气中的最大PO2。如果人呼吸的气体中O2的分压高于149mmHg,在高通气速率下,肺泡PO2可以接近这些更高的压力。
图40-4. 肺泡通气对肺泡氧分压(PO2)的影响,显示两种氧气吸收速率——250 ml/min和1000ml/ min。点A是正常操作点。
图40-5. 肺泡通气对肺泡二氧化碳分压(P\mathbbCO2)的影响,显示两种二氧化碳排泄速率——800 ml/min和200 ml/min。点A是正常操作点。
肺泡中的 o2浓度和分压
二氧化碳在体内不断形成,然后通过血液运输到肺泡;通过通气不断从肺泡中排出。图40-5显示了肺泡通气量和两种二氧化碳排出率(200和800毫升/分钟)对肺泡二氧化碳分压(PCO2)的影响。一条曲线代表正常的二氧化碳排出率(200毫升/分钟)。在正常的肺泡通气量(4.2升/分钟)下,肺泡PCO2的操作点位于图40-5中的点A(即40毫米汞柱)。
从图40-5中还可以看出另外两个事实。首先,肺泡CO2与二氧化碳排出率成正比增加,如曲线的四倍升高所示(当每分钟排出800毫升二氧化碳时)。其次,肺泡CO2与肺泡通气量成反比下降。因此,肺泡中氧气和二氧化碳的浓度和分压由两种气体的吸收或排出率以及肺泡通气量决定。
图40-6。正常呼出气中氧气和二氧化碳分压PO2和P\left(O2\right)在不同部分的变化。
图40-7。呼吸单位。
呼出气是死腔空气和肺泡空气的混合物
呼出气的总体组成由以下因素决定:(1) 呼出气中死腔空气的量;(2) 肺泡空气的量。图40-6显示了在呼气过程中呼出气中氧气和二氧化碳分压的逐渐变化。呼出气的第一部分是来自呼吸道死腔的空气,是典型的湿润空气,如表40-1所示。然后,越来越多的肺泡空气与死腔空气混合,直到所有死腔空气最终被排出,呼气结束时只有肺泡空气被呼出。因此,收集肺泡空气进行研究的方法是在用力呼气排出所有死腔空气后,收集呼出气的最后一部分样本。
图40-8。A,肺泡壁中毛细血管的表面视图。B,肺泡壁及其血管供应的横截面视图。(A,来自MaloneyJE,Castle BL:青蛙肺中毛细血管和小血管的压力-直径关系。Respir Physiol 7:150, 1969。)
正常的呼出气,包含死腔空气和肺泡空气,其气体浓度和分压大约如表40-1所示(即浓度介于肺泡空气和湿润大气空气之间)。
气体通过呼吸膜的扩散
呼吸单位
图40-7展示了呼吸单位(也称为呼吸小叶),它由呼吸性细支气管、肺泡管、肺泡前庭和肺泡组成。两肺中大约有3亿个肺泡,每个肺泡的平均直径约为0.2毫米。肺泡壁非常薄,肺泡之间是一个几乎实心的相互连接的毛细血管网络,如图40-8所示。由于毛细血管丛的广泛性,肺泡壁中的血流被描述为一片流动的血液。因此,很明显,肺泡气体与肺毛细血管中的血液非常接近。此外,肺泡空气与肺血液之间的气体交换发生在所有肺终末部分的膜上,而不仅仅是在肺泡中。所有这些膜统称为呼吸膜,也称为肺膜。
图40-9。肺泡呼吸膜的超微结构,横截面显示。
呼吸膜
图40-9展示了呼吸膜的超微结构,左侧为横截面图,右侧为红细胞。它还展示了O2从肺泡扩散到红细胞以及CO2向相反方向扩散的过程。请注意呼吸膜的以下不同层次:
- 一层含有表面活性剂的液体,覆盖肺泡并降低肺泡液体的表面张力
- 肺泡上皮,由薄的上皮细胞组成
- 上皮基底膜
- 肺泡上皮与毛细血管膜之间的薄间隙
- 毛细血管基底膜,在许多地方与肺泡上皮基底膜融合
- 毛细血管内皮膜
尽管层次众多,但在某些区域,呼吸膜的总厚度仅为0.2微米,平均约为0.6微米,除了有细胞核的地方。根据组织学研究,健康男性的呼吸膜总表面积估计约为70平方米,相当于一个25×30英尺房间的地板面积。在任何给定时刻,肺毛细血管中的血液总量为60至140毫升。现在,想象一下这么少量的血液散布在整个25×30英尺的地板表面上,就很容易理解O2和CO2的呼吸交换速度有多快。
肺毛细血管的平均直径仅为约5微米,这意味着红细胞必须挤过它们。红细胞膜通常接触毛细血管壁,因此O2和CO2在肺泡和红细胞之间扩散时不需要通过大量的血浆。这也增加了扩散的速度。
影响气体通过呼吸膜扩散速率的因素
参考之前关于气体在水中扩散的讨论,我们可以将相同的原理应用于气体通过呼吸膜的扩散。因此,决定气体通过膜的速度的因素如下:(1) 膜的厚度;(2) 膜的表面积;(3) 气体在膜物质中的扩散系数;(4) 膜两侧气体的分压差。
呼吸膜的厚度有时会增加——例如,由于膜间质空间和肺泡中的水肿液——因此,呼吸气体不仅需要通过膜扩散,还需要通过这些液体扩散。此外,一些肺部疾病会导致肺纤维化,这可能会增加呼吸膜某些部分的厚度。由于通过膜的扩散速率与膜的厚度成反比,任何使厚度增加到正常值的两到三倍以上的因素都会显著干扰正常的气体呼吸交换。
许多情况会大大减少呼吸膜的表面积。例如,切除整个肺会使总表面积减少到正常值的一半。此外,在肺气肿中,许多肺泡会融合,许多肺泡壁会溶解。因此,新的肺泡腔比原来的肺泡大得多,但由于肺泡壁的丧失,呼吸膜的总表面积通常会减少多达五倍。当总表面积减少到正常值的三分之一到四分之一时,即使在静息状态下,通过膜的气体交换也会受到显著阻碍,而在竞技运动和其他剧烈运动期间,即使肺部表面积的轻微减少也会对气体呼吸交换造成严重损害。
每种气体通过呼吸膜的扩散系数取决于气体在膜中的溶解度,并且与气体分子量的平方根成反比。由于之前解释的原因,呼吸膜中的扩散速率几乎与水中完全相同。因此,在给定的压力差下,CO2 的扩散速度约为 O2 的20倍。氧气的扩散速度约为氮气的两倍。
呼吸膜两侧的压力差是肺泡中气体的分压与肺毛细血管血液中气体的分压之间的差异。因此,这两个压力之间的差异是气体分子通过膜移动的净趋势的度量。
当肺泡中气体的分压大于血液中气体的压力时,如 O2 的情况,会发生从肺泡到血液的净扩散。当血液中气体的压力大于肺泡中的分压时,如 C O2 的情况,会发生从血液到肺泡的净扩散。
呼吸膜的扩散能力
呼吸膜在肺泡和肺血液之间交换气体的能力通过呼吸膜的扩散容量(diffusing capacity)来定量表达,扩散容量定义为在1 mmHg分压差下每分钟通过膜扩散的气体体积。前面讨论的所有影响通过呼吸膜扩散的因素都会影响这种扩散容量。
氧气的扩散容量。在平均年轻男性中,静息状态下O2的扩散容量平均为21 ml/min每mmHg。从功能上讲,这意味着什么?在正常安静呼吸期间,呼吸膜两侧的平均O2压差约为11mmHg。将此压力乘以扩散容量(11×21),得出每分钟通过呼吸膜扩散的氧气总量约为230ml,这等于静息状态下身体使用O2的速率。
运动期间氧气扩散容量的增加
在剧烈运动或其他大大增加肺血流量和肺泡通气量的条件下,O2的扩散容量增加到静息状态下扩散容量的约三倍。这种增加是由几个因素引起的,包括:(1) 许多先前休眠的肺毛细血管的开放或已经开放的毛细血管的额外扩张,从而增加了O2可以扩散进入的血液表面积;(2) 肺泡的通气与肺泡毛细血管的血液灌注之间更好的匹配,称为通气-灌注比(ventilation-perfusion ratio),本章后面会解释。因此,在运动期间,血液的氧合不仅通过增加的肺泡通气增加,还通过呼吸膜更大的扩散容量将O2运输到血液中而增加。
图40-10。静息条件和运动期间正常肺中一氧化碳、氧气和二氧化碳的扩散容量。
二氧化碳的扩散容量。CO2的扩散容量从未被测量过,因为CO2通过呼吸膜扩散得非常快,以至于肺血液中的平均PCO2与肺泡中的PCO2没有太大差异——平均差异小于1mmHg。使用目前可用的技术,这种差异太小而无法测量。
然而,对其他气体扩散的测量表明,扩散能力与特定气体的扩散系数成正比。由于CO2的扩散系数略高于O2的20倍,因此可以预期在静息条件下CO2的扩散能力约为400至450ml/min每mmHg,在运动期间约为1200至1300ml/ min每mm Hg。图40-10比较了静息和运动期间一氧化碳、O2和CO2的测量或计算扩散能力,显示了CO2的极高扩散能力以及运动对这些气体扩散能力的影响。
扩散能力的测量——一氧化碳法
O2的扩散能力可以通过以下测量计算得出:(1) 肺泡PO2;(2) 肺毛细血管血液中的PO2;以及(3) 血液摄取O2的速率。然而,测量肺毛细血管血液中的PO2非常困难且不精确,因此除了实验目的外,通过这种直接方法测量氧气扩散能力并不实际。
为了避免直接测量氧气扩散能力时遇到的困难,生理学家通常测量一氧化碳(CO)的扩散能力,然后从中计算O2的扩散能力。CO方法的原理如下:将少量CO吸入肺泡,并通过适当的肺泡空气样本测量CO在肺泡中的分压。由于血红蛋白与CO结合得非常迅速,血液中的CO压力几乎为零,因此其压力没有时间积累。因此,CO在呼吸膜两侧的压力差等于其在肺泡空气样本中的分压。然后,通过测量短时间内吸收的CO体积并将其除以肺泡CO分压,可以准确确定CO的扩散能力。
要将CO扩散能力转换为O2扩散能力,需将该值乘以1.23的因子,因为O2的扩散系数是CO的1.23倍。因此,健康年轻男性在静息状态下的平均CO扩散能力为每mm Hg 17ml/min,而O2的扩散能力是此值的1.23倍,即每mm Hg 21ml/min。
通气-灌注比对肺泡气体浓度的影响
在本章的前面部分,我们了解到两个因素决定了肺泡中的PO2和PCO2:(1) 肺泡通气(alveolar ventilation)的速率;以及(2) O2和CO2通过呼吸膜(respiratory membrane)的转移速率。这一讨论假设所有肺泡的通气是均等的,并且每个肺泡的毛细血管血流也是相同的。然而,即使在正常情况下,尤其是在许多肺部疾病中,肺部的某些区域通气良好但几乎没有血流,而其他区域可能有良好的血流但通气很少或没有。在这两种情况下,通过呼吸膜的气体交换都会受到严重影响,尽管总通气和总肺血流正常,但通气和血流流向肺部的不同部分,患者可能会遭受严重的呼吸窘迫(respiratory distress)。因此,为了帮助我们理解肺泡通气和肺泡血流不平衡时的呼吸交换,发展出了一个高度量化的概念。这个概念被称为通气-灌注比(ventilation-perfusion ratio)。
从量化的角度来看,通气-灌注比表示为·VA/·Q。当·VA(肺泡通气)对于给定的肺泡是正常的,并且·Q(血流)对于同一肺泡也是正常的时,通气-灌注比(·VA/·Q)也被认为是正常的。当通气(·VA)为零时,但肺泡仍有灌注(·Q),·VA/·Q为零。或者,在另一个极端情况下,当有足够的通气(·VA)但没有灌注(·Q)时,比率·VA/·Q为无穷大。在比率为零或无穷大的情况下,受影响肺泡的呼吸膜没有气体交换。因此,让我们解释这两种极端情况的呼吸后果。
当·vA/·Q等于零时的肺泡氧气和二氧化碳分压。当·VA/·Q等于零时——即没有任何肺泡通气——肺泡中的空气与血液中的O2和CO2达到平衡,因为这些气体在血液和肺泡空气之间扩散。由于灌注毛细血管的血液是从体循环返回肺部的静脉血,肺泡气体与这种血液中的气体达到平衡。在第41章中,我们描述了正常静脉血(\overlineV)的PO2为40mmHg,PCO2为45mmHg。因此,这些也是在有血流但没有通气的肺泡中这两种气体的正常分压。
图 40-11. 正常氧分压 (P02) – 二氧化碳分压 (P\mathbbC\mathbbO2) 通气-灌注 (·VA/·Q) 比值 (PO2- PCO2, , (·VA/·Q) 图。
当 ·vA/·Q 等于无穷大时的肺泡氧和二氧化碳分压
当 ·VA/·Q 等于无穷大时,对肺泡气体分压的影响与 ·VA/·Q 等于零时的影响完全不同,因为此时没有毛细血管血流将 O2 带走或将 CO2 带到肺泡。因此,肺泡气体不会与静脉血达到平衡,而是肺泡空气变得与湿润的吸入空气相等。也就是说,吸入的空气不会向血液失去 O2,也不会从血液中获得 CO2。此外,由于正常吸入的湿润空气的 PO2 为 149mmHg,PCO2 为 0mmHg,这些将是肺泡中这两种气体的分压。
当 ·vA/·Q 正常时的气体交换和肺泡分压
当肺泡通气正常且肺泡毛细血管血流(肺泡灌注)正常时,通过呼吸膜的 O2 和 CO2 交换几乎是最佳的,肺泡 PO2 通常为 104mmHg,介于吸入空气 (149mmHg) 和静脉血 (40mmHg) 之间。同样,肺泡 PCO2 介于两个极端之间;通常为 40mm Hg,与静脉血中的 45mmHg 和吸入空气中的 0mm Hg 形成对比。因此,在正常情况下,肺泡空气的 PO2 平均为 104mmHg,PCO2 平均为 40mmHg。
PO2-PCO2,·VA/·Q 图
前几节中提出的概念以图形形式显示在图 40-11 中,称为 PO2. - PCO2; , ·VA/\breveQ 图。图中的曲线代表了在静脉血中气体压力正常且人在海平面压力下呼吸空气时,H+·VA/·Q 等于零和 ·VA/·Q 等于无穷大之间的所有可能的 PO2 和 PCO2 组合。因此,点 ·VA·/·Q 是当 ·VA/·Q 等于零时的 PO2 和 PCO2 的图。在这一点上,PO2 为 40mmHg,PCO2 为 45mmHg,这是正常静脉血中的值。
在曲线的另一端,当·VA/·Q等于无穷大时,点I代表吸入的空气,显示PO2为149 mmHg,而PCO2为零。曲线上还绘制了一个点,代表当·VA/·Q正常时的正常肺泡空气。在这一点上,PO2为104mmHg,PCO2为40 mmHg。
生理性分流的概念(当·VA/·Q低于正常时)
每当·VA/·Q低于正常时,通气不足以提供通过肺泡毛细血管流动的血液所需的O2。因此,通过肺毛细血管的一部分静脉血未能被氧合。这部分血液被称为分流血。此外,一些额外的血液通过支气管血管而不是肺泡毛细血管流动,通常约占心输出量的2%;这部分血液也是未氧合的分流血。
每分钟分流血液的总量称为生理性分流。生理性分流在临床肺功能实验室中通过分析混合静脉血和动脉血中的O2浓度以及同时测量心输出量来测量。根据这些值,可以通过以下公式计算生理性分流:
\frac·QP S·QT=\fracC iO2-C aO2C iO2-C\overlinevO2
其中,·QPS是每分钟的生理性分流血流量,·QT是每分钟的心输出量,CiO2是如果存在“理想”通气-灌注比时动脉血中的氧浓度,CaO2是测量的动脉血中的氧浓度,C\overlinevO2是测量的混合静脉血中的氧浓度。
生理性分流越大,通过肺部时未能被氧合的血液量就越多。
当·VA/·Q大于正常时的生理性死腔概念
当某些肺泡的通气量很大但肺泡血流较低时,肺泡中可用的氧气量远远超过流动血液能从肺泡中带走的氧气量。因此,这些肺泡的通气被称为浪费的。呼吸道的解剖死腔区域的通气也是浪费的。这两种浪费通气的总和称为生理性死腔。该空间在临床肺功能实验室中通过进行适当的血液和呼气气体测量并使用以下公式(称为玻尔公式)来测量:
\frac·VDp h y s·VT=\fracP aC O2-P\bareC O2PaC O2
其中 ·VDphys 是生理死腔(physiological dead space),·VT 是潮气量(tidal volume),PaCO2 是动脉血中 CO2 的分压(partial pressure),P\overlineeCO2 是整个呼出气中 CO2 的平均分压(average partial pressure)。
当生理死腔较大时,大部分通气工作是无效的,因为大量通气空气从未到达血液。
通气-血流比异常
在正常肺的上部和下部,通气-血流比(·vA/·Q)异常。在直立位的健康人中,肺上部的肺毛细血管血流和肺泡通气都比下部少;然而,血流的减少比通气的减少更为显著。因此,在肺的顶部,·VA/·Q 是理想值的2.5倍,这导致该区域出现中等程度的生理死腔。
在另一个极端,即肺的底部,通气相对于血流略少,\barVA/·Q 低至理想值的0.6倍。在该区域,一小部分血液未能正常氧合,这代表了生理分流(physiological shunt)。
在这两个极端情况下,通气和血流的不平等略微降低了肺交换 O2 和 CO2 的效率。然而,在运动期间,肺上部的血流显著增加,因此生理死腔大大减少,气体交换的效率接近最佳状态。
慢性阻塞性肺疾病中的异常 ·VA/·Q
大多数长期吸烟的人会发展出不同程度的支气管阻塞;其中许多人最终会发展出严重的肺泡气体滞留,导致肺气肿(emphysema)。肺气肿反过来导致许多肺泡壁被破坏。因此,吸烟者会出现两种异常,导致 ·VA/·Q 异常。首先,由于许多小支气管被阻塞,阻塞远端的肺泡无法通气,导致 ·VA/·Q 接近零。其次,在肺泡壁主要被破坏但仍存在肺泡通气的区域,由于血流不足无法运输气体,大部分通气是无效的。
因此,在慢性阻塞性肺疾病中,肺的某些区域表现出严重的生理分流,而其他区域表现出严重的生理死腔。这两种情况都极大地降低了肺作为气体交换器官的效率,有时将其效率降低至正常的十分之一。事实上,这种情况是当今肺功能障碍的最常见原因。
第41章 血液和组织液中氧气和二氧化碳的运输
一旦氧气(O2)从肺泡扩散到肺血液中,它几乎完全与血红蛋白结合被运输到组织毛细血管。红细胞中血红蛋白的存在使得血液能够运输比溶解在血液水中的O2形式多30到100倍的O2。
在身体的组织细胞中,O2与各种食物反应形成大量的二氧化碳(CO2)。这些CO2进入组织毛细血管并被运输回肺部。二氧化碳,像O2一样,也与血液中的化学物质结合,使CO2的运输量增加15到20倍。
本章定性和定量地介绍了血液和组织液中O2和CO2运输的物理和化学原理。
氧气从肺部到身体组织的运输
在第40章中,我们指出气体可以通过扩散从一个点移动到另一个点,并且这种移动的原因总是从第一个点到下一个点的分压差。因此,O2从肺泡扩散到肺毛细血管血液中,因为肺泡中的氧分压(PO2)大于肺毛细血管血液中的PO2。在身体的其他组织中,毛细血管血液中的PO2高于组织中的PO2,导致O2扩散到周围的细胞中。
相反,当O2在细胞中代谢形成CO2时,细胞内二氧化碳分压(PCO2)上升,导致CO2扩散到组织毛细血管中。血液流到肺部后,CO2从血液中扩散到肺泡中,因为肺毛细血管血液中的PCO2大于肺泡中的PCO2。因此,血液中O2和CO2的运输依赖于扩散和血液流动。我们现在定量地考虑这些效应的因素。
氧气从肺泡到肺毛细血管血液的扩散
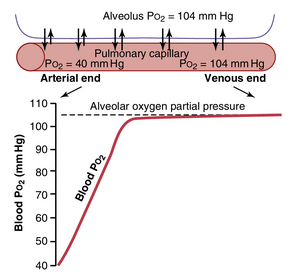
图41-1的上部显示了一个与肺毛细血管相邻的肺泡,展示了肺泡空气和肺血液之间O2的扩散。肺泡中气态O2的PO2平均为104mmHg,而进入肺毛细血管动脉端的静脉血液的PO2平均仅为40mmHg,因为大量O2在通过外周组织时被从血液中移除。因此,导致O2扩散到肺毛细血管的初始压力差为104-40mmHg,即64mmHg。在图的底部图表中,曲线显示了血液通过毛细血管时PO2的快速上升;血液PO2在血液通过毛细血管的三分之一距离时几乎上升到肺泡空气的水平,达到几乎104 mmHg。
运动期间肺血液对氧气的摄取。在剧烈运动期间,人体的氧气需求量可能达到正常水平的20倍。此外,由于运动期间心输出量增加,血液在肺毛细血管中停留的时间可能减少到正常时间的一半以下。然而,由于氧气通过肺膜扩散的安全系数很高,血液在离开肺毛细血管时仍然几乎完全饱和了O2。这可以通过以下原因解释。
首先,在第40章中,我们指出运动期间O2的扩散能力几乎增加了三倍。这主要是由于参与扩散的毛细血管表面积增加,以及肺部上部的通气-灌注比更接近理想状态。
其次,请注意图41-1中的曲线,在非运动条件下,血液在通过肺毛细血管的三分之一时几乎已经饱和了O2,而在剩余的三分之二时间内,通常只有很少的额外O2进入血液。也就是说,血液在肺毛细血管中停留的时间通常是完全氧合所需时间的三倍。因此,在运动期间,即使血液在毛细血管中暴露的时间缩短,血液仍然可以几乎完全氧合。
动脉血液中的氧气运输
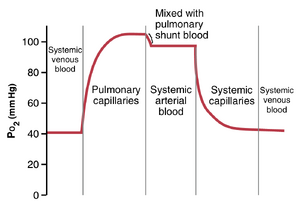
从肺部进入左心房的血液中,约98%刚刚通过肺泡毛细血管,并氧合至PO2约为104 mm Hg。另外2%的血液从主动脉通过支气管循环,主要供应肺的深层组织,并未暴露于肺空气中。这种血流称为分流血流(shunt flow),意味着血液绕过了气体交换区域。在离开肺部时,分流血液的PO2大约与正常体循环静脉血液相同——约为40 mmHg。当这种血液在肺静脉中与来自肺泡毛细血管的氧合血液混合时,这种所谓的静脉混合(venous admixture)会导致进入左心并泵入主动脉的血液的PO2降至约95mmHg。这些血液PO2在循环系统不同点的变化如图41-2所示。
氧气从外周毛细血管向组织液的扩散
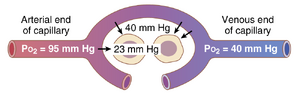
当动脉血到达外周组织时,毛细血管中的PO2仍为95mmHg。然而,如图41-3所示,围绕组织细胞的间质液中的PO2平均仅为40mmHg。因此,存在一个较大的初始压力差,导致O2从毛细血管血液迅速扩散到组织中——速度如此之快,以至于毛细血管中的PO2几乎下降到与间质中的40-mmHg压力相等。因此,离开组织毛细血管并进入体静脉的血液中的PO2也约为40mmHg。
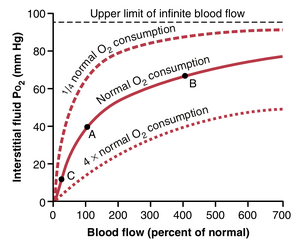
增加血流量会提高间质液中的PO2。如果通过特定组织的血流量增加,更多的O2被输送到组织中,组织的PO2也会相应升高。这种效应如图41-4所示。请注意,血流量增加到正常的400%时,PO2从40mmHg(图中的A点)增加到66mmHg(图中的B点)。然而,即使血流量达到最大,PO2的上限也只能达到95mm Hg,因为这是动脉血中的O2压力。相反,如果通过组织的血流量减少,组织的PO2也会降低,如图中的C点所示。
增加组织代谢会降低间质液中的PO2。如果细胞在代谢中使用的O2比正常情况更多,间质液中的PO2会降低。图41-4也展示了这种效应,当细胞氧气消耗增加时,间质液中的PO2降低;当消耗减少时,PO2增加。
总之,组织的PO2由以下两个因素的平衡决定:(1) 血液中O2向组织的输送速率,以及(2) 组织对O2的消耗速率。
氧气从外周毛细血管向组织细胞的扩散
氧气总是被细胞使用。因此,外周组织中的细胞内PO2(氧分压)始终低于外周毛细血管中的PO2。此外,在许多情况下,毛细血管和细胞之间存在相当大的物理距离。因此,正常的细胞内PO2范围从低至5mmHg到高达40mmHg,平均值为23 mmHg(通过实验动物的直接测量得出)。由于细胞中使用氧气的化学过程通常只需要1到3mmHg的O2压力,因此即使是这种低至23mmHg的细胞内PO2也足够,并提供了很大的安全系数。
二氧化碳从外周组织细胞扩散到毛细血管以及从肺毛细血管扩散到肺泡
当细胞使用O2时,几乎所有的O2都会转化为CO2,这种转化增加了细胞内PCO2(二氧化碳分压);由于组织细胞PCO2的升高,CO2从细胞扩散到毛细血管,然后由血液携带到肺部。在肺部,CO2从肺毛细血管扩散到肺泡并被呼出。
因此,在气体运输链的每个点上,CO2的扩散方向与O2的扩散方向完全相反。然而,CO2和O2的扩散之间有一个主要区别——CO2的扩散速度大约是O2的20倍。因此,在每种情况下,引起CO2扩散所需的压力差远小于引起O2扩散所需的压力差。CO2的压力大致如下:
- 细胞内PCO2,46mmHg;间质PCO2,45 mmHg。因此,如图41-5所示,只有1mmHg的压力差。
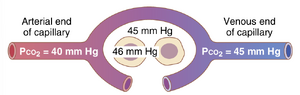
- 进入组织的动脉血PCO2,40 mm Hg;离开组织的静脉血PCO2,45mmHg。因此,如图41-5所示,组织毛细血管血液几乎完全与间质PCO2的45mmHg达到平衡。
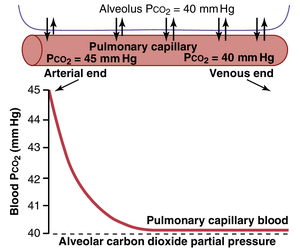
- 进入肺毛细血管动脉端的血液的PCO2为45 mm Hg;肺泡空气的PCO2为40mmHg。因此,仅5mmHg的压力差就足以使所有需要的CO2从肺毛细血管扩散到肺泡中。此外,如图41-6所示,肺毛细血管血液的PCO2在通过毛细血管约三分之一距离之前,几乎完全降至与肺泡PCO2相等的40mmHg。这与之前观察到的O2扩散效应相同,只是方向相反。
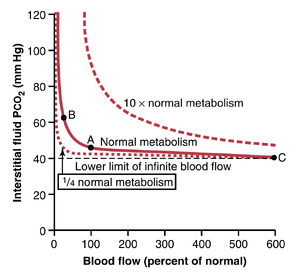
组织代谢和组织血流速率对间质CO2的影响。组织毛细血管血流和组织代谢以与它们对组织PO2的影响完全相反的方式影响PCO2。图41-7显示了这些影响,如下所示:
- 血流从正常(点A)减少到正常值的四分之一(点B)会使外周组织的PCO2从正常值45mmHg升高到60mmHg。相反,将血流增加到正常值的六倍(点C)会使间质PCO2从正常值45降至41mm Hg,几乎等于进入组织毛细血管的动脉血液中的PCO2(40 mmHg)。
- 还要注意,组织代谢速率增加10倍会显著升高所有血流速率下的间质液PCO2,而将代谢降低到正常值的四分之一会使间质液PCO2降至约41mmHg,接近动脉血液的40mmHg。
血红蛋白在氧运输中的作用
正常情况下,从肺部运输到组织的氧气中,约97%与红细胞中的血红蛋白化学结合。剩余的3%以溶解状态存在于血浆和血细胞的水中。因此,在正常情况下,氧气几乎完全由血红蛋白运输到组织。
O2与血红蛋白的可逆结合
血红蛋白的化学在第33章中介绍,我们指出O2分子与血红蛋白的血红素部分松散且可逆地结合。当PO2高时,如在肺毛细血管中,O2与血红蛋白结合,但当PO2低时,如在组织毛细血管中,O2从血红蛋白中释放。这是几乎所有O2从肺部运输到组织的基础。
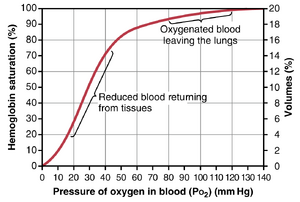
氧-血红蛋白解离曲线。图41-8显示了O2-血红蛋白解离曲线,该曲线表明随着血液PO2的增加,与O2结合的血红蛋白百分比逐渐增加,称为血红蛋白的饱和度(percent saturation of hemoglobin)。由于离开肺部并进入体循环动脉的血液通常具有约95mmHg的PO2,从解离曲线可以看出,体循环动脉血的O2饱和度通常平均为97%。相反,在从外周组织返回的正常静脉血中,PO2约为40mmHg,血红蛋白的饱和度平均为75%。
血液中血红蛋白能结合的最大氧气量。正常人的血液中每100ml血液含有约15克血红蛋白,每克血红蛋白最多可以结合1.34ml的O2(当血红蛋白化学纯时为1.39ml,但如高铁血红蛋白等杂质会降低这一数值)。因此,15乘以1.34等于20.1,这意味着如果血红蛋白饱和度为100%,则100ml血液中的15克血红蛋白总共可以结合约20ml的O2。这通常表示为20体积百分比。正常人的O2-血红蛋白解离曲线也可以用O2的体积百分比表示,如图41-8中最右侧的刻度所示,而不是血红蛋白的饱和度百分比。
当体循环动脉血流经组织时从血红蛋白释放的氧气量。正常体循环动脉血中与血红蛋白结合的O2总量,饱和度为97%,约为19.4ml/100ml血液,如图41-9所示。在通过组织毛细血管时,这一量平均减少到14.4ml(PO2为40mmHg,血红蛋白饱和度为75%)。因此,在正常情况下,每100毫升血液流经组织时,约有5毫升的O2从肺部运输到组织。
在剧烈运动期间,氧气的运输显著增加。在剧烈运动时,肌肉细胞以高速率消耗 O2,在极端情况下,这可能导致肌肉间质液的 PO2 从正常的 40mmHg 下降到低至 15mmHg。在这种低压下,每 100ml 血液中只有 4.4ml 的 O2 与血红蛋白结合,如图 41-9 所示。因此,19.4-4.4ml,即 15ml,是每 100ml 血液流经组织时实际输送到组织的 O2 量,这意味着每单位体积血液中输送的 O2 量是正常情况下的三倍。需要注意的是,训练有素的马拉松运动员的心输出量可以增加到正常水平的六到七倍。因此,将心输出量的增加(6 到 7 倍)与每单位体积血液中 O2 运输的增加(3 倍)相乘,可以得到输送到组织的 O2 量增加了 20 倍。我们将在本章后面看到,其他几个因素也有助于在运动期间将 O2 输送到肌肉中,因此即使在非常剧烈的运动中,肌肉组织的 PO2 通常也只会略微低于正常水平。
利用系数 (Utilization Coefficient)。血液在流经组织毛细血管时释放其 O2 的百分比称为利用系数。正常值约为 25%,正如前面的讨论所表明的那样——即 25% 的氧合血红蛋白将其 O2 释放给组织。在剧烈运动期间,全身的利用系数可以增加到 75% 到 85%。在血流极慢或代谢率极高的局部组织区域,记录到的利用系数接近 100%——即几乎所有的 O2 都释放给了组织。
血红蛋白“缓冲”组织的PO2
尽管血红蛋白对于将 O2 输送到组织是必要的,但它还执行另一项对生命至关重要的功能。这就是它作为组织氧缓冲系统的功能。也就是说,血液中的血红蛋白主要负责稳定组织中的 PO2,这可以解释如下。
血红蛋白帮助维持组织中几乎恒定的 PO2。在基础条件下,组织需要从每 100ml 流经组织毛细血管的血液中获取约 5ml 的 O2。参考图 41-9 中的 O2 - 血红蛋白解离曲线,注意要使每 100ml 血液中释放正常的 5ml O2,PO2 必须下降到约 40mmHg。因此,组织的 PO2 通常不能超过这个 40mmHg 的水平,因为如果超过,组织所需的 O2 量将不会从血红蛋白中释放出来。通过这种方式,血红蛋白通常将组织中的 PO2 上限设定在约 40mmHg。
相反,在剧烈运动期间,必须从血红蛋白向组织输送额外的O2(多达正常值的20倍)。然而,由于(1)解离曲线的陡峭斜率,以及(2)由PO2降低引起的组织血流增加,这种额外的O2输送可以在组织PO2几乎没有进一步降低的情况下实现。也就是说,PO2的极小下降会导致大量额外的O2从血红蛋白中释放出来。因此,血液中的血红蛋白自动以大约15到40mmHg之间的压力向组织输送O2。
当大气中的氧气浓度显著变化时,血红蛋白的缓冲效应仍然保持组织PO2几乎恒定。肺泡中的正常PO2约为104mmHg,但当一个人登山或乘坐飞机上升时,PO2很容易下降到不到这个值的一半。相反,当一个人进入压缩空气的区域,如深海或加压舱室时,PO2可能会上升到这个水平的10倍。即便如此,组织PO2变化很小。
从图41-8中的氧-血红蛋白解离曲线可以看出,当肺泡PO2降低到60mmHg时,动脉血红蛋白仍然有89%的O2饱和度——仅比正常饱和度97%低8%。此外,组织仍然从每100ml流经组织的血液中移除约5ml的O2。为了移除这些O2,静脉血的PO2下降到35mm Hg——仅比正常值40mmHg低5mmHg。因此,尽管肺泡PO2从104下降到60mmHg,组织PO2几乎没有变化。
相反,当肺泡PO2上升到500 mm Hg时,血红蛋白的最大O2饱和度永远不会超过100%,这仅比正常水平97%高3%。只有少量额外的O2溶解在血液的液体中,这将在后面讨论。然后,当血液流经组织毛细血管并向组织失去几毫升的O2时,这会使毛细血管血液的PO2降低到仅比正常40mmHg高几毫升的值。因此,肺泡O2的水平可能会有很大变化——从60到超过500mmHgPO2-——而外周组织中的PO2与正常值相比变化不超过几毫升,这很好地展示了血液血红蛋白系统的组织“氧气缓冲”功能。
影响氧-血红蛋白解离曲线的因素——它们对氧气运输的重要性
图41-8和图41-9中的O2-血红蛋白解离曲线是针对正常平均血液的。然而,有几个因素可以使解离曲线向一个方向或另一个方向移动,如图41-10所示。该图显示,当血液变得略微酸性时,pH从正常值7.4降至7.2,O2-血红蛋白解离曲线平均向右移动约15%。相反,当pH从正常的7.4增加到7.6时,曲线向左移动相似的距离。
除了pH变化外,还有其他几个已知可以使曲线移动的因素。其中三个使曲线向右移动的因素是:(1) CO2浓度增加;(2) 血液温度升高;(3) 2,3-二磷酸甘油酸(2,3-biphosphoglycerate, BPG)增加,这是一种在不同代谢条件下血液中以不同浓度存在的代谢重要磷酸化合物。
当 o2和H+使氧-血红蛋白解离曲线移动时,组织氧输送增加——波尔效应(Bohr Effect)
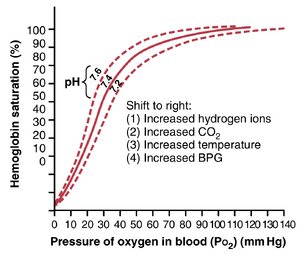
血液中CO2和H+水平增加导致氧-血红蛋白解离曲线向右移动,这通过增强组织中O2的释放和肺部血液的氧合产生显著影响。这被称为波尔效应(Bohr effect),其解释如下。当血液流经组织时,CO2从组织细胞扩散到血液中。这种扩散增加了血液中的PCO2,进而提高了血液中的H2CO3(碳酸)和H+浓度。这些效应使O2-血红蛋白解离曲线向右和向下移动,如图41-10所示,迫使O2从血红蛋白中释放出来,从而向组织输送更多的O2。
在肺部则发生完全相反的效果,CO2从血液扩散到肺泡中。这种扩散降低了血液中的PCO2和H+浓度,使O2-血红蛋白解离曲线向左和向上移动。因此,在任何给定的肺泡PO2下,与血红蛋白结合的O2量显著增加,从而允许更多的O2输送到组织。
BPG导致氧-血红蛋白解离曲线向右移动的效果
血液中正常的BPG(2,3-二磷酸甘油酸)总是使O2-血红蛋白解离曲线略微向右移动。在持续数小时以上的缺氧条件下,血液中的BPG量显著增加,从而使O2-血红蛋白解离曲线进一步向右移动。这种移动导致O2在组织中的释放压力比没有这种BPG增加时高出10mmHg。因此,在某些条件下,BPG机制对于适应缺氧(特别是由组织血流不良引起的缺氧)非常重要。
运动期间氧-血红蛋白解离曲线的右移
在运动期间,几个因素使解离曲线显著向右移动,从而向活跃的运动肌纤维输送额外的O2。运动中的肌肉反过来释放大量的CO2;这些以及肌肉释放的其他几种酸增加了肌肉毛细血管血液中的\ H+浓度。此外,肌肉的温度通常上升2\circ到3℃:,这可以进一步增加O2向肌纤维的输送。所有这些因素共同作用,使肌肉毛细血管血液中的氧-血红蛋白解离曲线显著向右移动。这种曲线的右移迫使O2在PO2水平高达40mmHg时从血液中的血红蛋白释放到肌肉中,即使70%的O2已经从血红蛋白中移除。然后,在肺部,这种移动发生在相反的方向,允许从肺泡中摄取额外的O2。
细胞的氧代谢利用
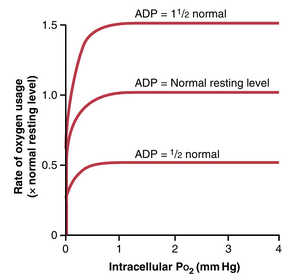
细胞内PO2对氧利用速率的影响。细胞内仅需要极低的O2压力即可进行正常的细胞内化学反应。这种现象的原因是细胞的呼吸酶系统(在第68章讨论)已被配置为当细胞PO2超过1mmHg时,O2的可用性不再是化学反应速率的限制因素。相反,主要的限制因素是细胞内二磷酸腺苷(ADP)的浓度。这种效应在图41-11中得到了展示,该图显示了细胞内PO2与不同ADP浓度下的O2利用速率之间的关系。请注意,每当细胞内PO2高于1mmHg时,O2利用速率对于细胞中任何给定的ADP浓度都变得恒定。相反,当ADP浓度改变时,O2利用速率与ADP浓度的变化成比例地变化。
如第3章所述,当细胞中使用三磷酸腺苷(ATP)提供能量时,它被转化为ADP。ADP浓度的增加增加了O2的代谢利用,因为它与各种细胞营养物质结合,释放能量将ADP重新转化为ATP。在正常操作条件下,细胞的O2利用速率最终由细胞内的能量消耗速率控制——即由ATP形成ADP的速率控制。
毛细血管到细胞的扩散距离对氧利用的影响。组织细胞通常距离毛细血管不超过50微米,O2通常可以足够迅速地从毛细血管扩散到细胞,以满足代谢所需的所有O2量。然而,偶尔细胞会位于离毛细血管较远的位置,O2向这些细胞的扩散速率可能变得非常低,以至于细胞内PO2下降到维持最大细胞内代谢所需的临界水平以下。因此,在这些条件下,细胞的O2利用受到扩散限制,不再由细胞内形成的ADP量决定。然而,这种情况几乎不会发生,除非在病理状态下。
血流对氧代谢利用的影响。每分钟可用于任何特定组织的O2总量由以下两个因素决定:(1)每100ml血液中可运输到组织的O2量,以及(2)血流速率。如果血流速率降至零,可用O2的量也会降至零。因此,有时通过组织的血流速率可能非常低,以至于组织PO2下降到细胞内代谢所需的临界1mmHg以下。在这些条件下,组织的O2利用速率受到血流限制。然而,无论是扩散限制还是血流限制的氧状态都不能持续很长时间,因为细胞接收到的O2少于维持细胞生命所需的量。
氧在溶解状态下的运输
在正常动脉PO2为95mmHg时,每100ml血液中的水溶解了约0.29ml的O2,当血液的PO2下降到组织毛细血管中的正常40mmHg时,只有0.12ml的O2仍然溶解。换句话说,每100ml动脉血流通常以溶解状态向组织运输0.17ml的O2。这个值与红细胞血红蛋白运输的近5ml的O2相比。因此,以溶解状态运输到组织的O2量通常很少,仅占总量的约3%,而血红蛋白运输的占97%。
在剧烈运动时,当血红蛋白向组织释放的O2增加3倍时,以溶解状态运输的O2的相对量下降到仅为1.5%。然而,如果一个人在肺泡PO2水平非常高的情况下呼吸O2,以溶解状态运输的O2量可能会大大增加,有时甚至会导致组织中O2的严重过量,从而引发所谓的O2中毒。这种情况通常会导致脑部抽搐甚至死亡,正如第45章中详细讨论的关于深海潜水员高压呼吸O2的情况。
血红蛋白与一氧化碳的结合——O2的置换
一氧化碳(CO)与血红蛋白分子上的结合点与O2相同;因此,它可以置换血红蛋白中的O2,降低血液的O2携带能力。此外,它与血红蛋白的结合强度约为O2的250倍,这可以通过图41-12中的CO-血红蛋白解离曲线来证明。这条曲线几乎与O2-血红蛋白解离曲线相同,只是横坐标上显示的CO分压水平是图41-8中O2-血红蛋白解离曲线的%50。因此,肺泡中仅0.4mmHg的CO分压(正常肺泡O2的50%,即100 mm\ HgPO2)就足以使CO与O2竞争结合血红蛋白,导致血液中50%的血红蛋白与CO结合而不是与O2结合。因此,仅0.6mmHg的CO分压(空气中体积浓度<千分之一)就可能是致命的。
尽管在CO中毒时血液中的O2含量大大降低,但血液的PO2可能是正常的。这种情况使得暴露于CO特别危险,因为血液呈鲜红色,并且没有明显的低氧血症迹象,如指尖或嘴唇发紫(发绀)。此外,PO2没有降低,通常因缺乏O2(通常反映为低PO2)而刺激呼吸频率增加的反馈机制也不存在。由于大脑是最先受到缺氧影响的器官之一,患者可能在意识到危险之前就已经迷失方向并失去意识。
严重CO中毒的患者可以通过给予纯O2来治疗,因为高肺泡压力的O2可以迅速置换与血红蛋白结合的CO。同时给予5%CO2也对患者有益,因为这强烈刺激呼吸中枢,增加肺泡通气并减少肺泡中的CO。通过强化的O2和CO2治疗,CO从血液中清除的速度可以比没有治疗时快10倍。
血液中CO2的运输
血液中 CO2 的运输远不如 O2 的运输那样成问题,因为即使在最异常的条件下,CO2 通常也能以比 O2 多得多的量进行运输。然而,血液中 CO2 的含量与体液的酸碱平衡(acid-base balance)有很大关系,这将在第31章中讨论。在正常静息条件下,平均每100毫升血液中有4毫升的 CO2 从组织运输到肺部。
CO2 运输的化学形式
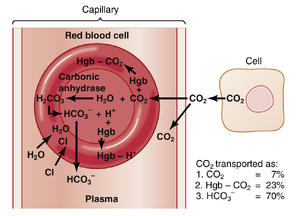
CO2 运输的过程始于 CO2 以溶解的分子形式从组织细胞中扩散出来。进入组织毛细血管后,CO2 引发了一系列几乎瞬间发生的物理和化学反应,如图41-13所示,这些反应对 CO2 的运输至关重要。
CO2 以溶解状态的运输
一小部分 CO2 以溶解状态运输到肺部。回顾一下,静脉血的 PCO2 为 45mmHg,而动脉血的 PCO2 为 40mmHg。
在 45mmHg 下,血液中溶解的 CO2 量约为 2.7ml/dl(2.7体积百分比)。在 40mmHg 下,溶解的 CO2 量约为 2.4ml,相差 0.3ml。因此,每100毫升血液中仅有约 0.3ml 的 CO2 以溶解形式运输。这大约占正常情况下所有运输的 CO2 的 7%。
CO2 以碳酸氢根离子形式的运输
碳酸酐酶(Carbonic Anhydrase)催化红细胞中 CO2 与水的反应。血液中溶解的 CO2 与水反应生成碳酸。如果没有红细胞内一种称为碳酸酐酶的酶,这一反应将发生得太慢而不重要。碳酸酐酶催化 CO2 与水的反应,并将其反应速率加快约5000倍。因此,与血浆中需要数秒或数分钟才能发生反应不同,红细胞中的反应发生得如此迅速,以至于在不到一秒的时间内几乎达到完全平衡。这种现象使得大量的 CO2 在血液离开组织毛细血管之前就能与红细胞中的水发生反应。
碳酸分解为碳酸氢根离子和氢离子。在红细胞中形成的碳酸 (H2CO3) 在另一瞬间分解为 H+ 和碳酸氢根离子 H+ 和 HCO3- )。大多数 \ H+ 离子随后与红细胞中的血红蛋白结合,因为血红蛋白是一种强大的酸碱缓冲剂。反过来,许多 HCO3- 离子从红细胞扩散到血浆中,而氯离子则扩散到红细胞中以取代它们的位置。这种扩散之所以可能,是因为红细胞膜中存在一种特殊的碳酸氢根-氯离子载体蛋白,它以高速将这两种离子向相反方向运输。因此,静脉红细胞中的氯离子含量高于动脉红细胞中的含量,这种现象称为氯离子转移 chloride shift。
在碳酸酐酶的作用下,红细胞中 CO2 与水的可逆结合约占从组织运输到肺部的 CO2 的 70%。因此,这种运输 CO2 的方式是最重要的。事实上,当给动物施用碳酸酐酶抑制剂(如乙酰唑胺)以阻断红细胞中碳酸酐酶的作用时,从组织运输的 CO2 变得非常差,以至于组织中的 PCO2 可能上升到 80mmHg,而不是正常的 45mmHg。
CO2 与血红蛋白和血浆蛋白结合运输——氨基甲酰血红蛋白Carbaminohemoglobin。除了与水反应外,CO2 还直接与血红蛋白分子的胺基反应,形成氨基甲酰血红蛋白 (CO2H g b)。CO2 和血红蛋白的这种结合是一种可逆反应,形成的键较松散,因此 CO2 很容易释放到肺泡中,因为肺泡中的 PCO2 低于肺毛细血管中的 PCO2。
图 41-15 当 PO2 为 100 或 40mm Hg 时的二氧化碳解离曲线部分。箭头表示 Haldane 效应对二氧化碳运输的影响。
少量 CO2 也以同样的方式与组织毛细血管中的血浆蛋白反应。这种反应对 CO2 的运输影响较小,因为血液中这些蛋白的数量仅为血红蛋白数量的四分之一。
通过与血红蛋白和血浆蛋白结合形成氨基甲酸(carbamino),从外周组织运输到肺部的CO2量约占运输总量的30%——即正常情况下,每100ml血液中约含1.5ml的CO2。然而,由于该反应比CO2在红细胞(red blood cells)内与水的反应慢得多,因此在正常情况下,这种氨基甲酸机制运输的CO2量是否超过总量的20%是值得怀疑的。
二氧化碳解离曲线
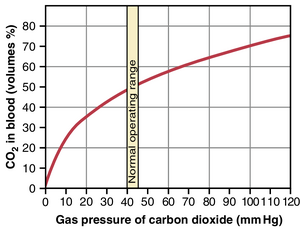
图41-14所示的曲线,即CO2解离曲线(CO2 dissociation curve),描绘了血液中所有形式的CO2总量对PCO2的依赖性。请注意,正常血液的PCO2在动脉血(arterial blood)中为40mmHg,在静脉血(venous blood)中为45mmHg。还要注意,血液中所有不同形式的CO2的正常浓度约为50体积百分比(volume percent),但在CO2从组织运输到肺部的正常过程中,只有4体积百分比的CO2被交换。也就是说,当血液流经组织时,CO2浓度上升到约52体积百分比,而当血液流经肺部时,CO2浓度下降到约48体积百分比。
当氧气与血红蛋白结合时,CO2被释放(Haldane效应)以增加CO2的运输
在本章的前面部分,我们注意到血液中CO2的增加会导致O2从血红蛋白中解离(Bohr效应),这是增加O2运输的一个重要因素。反之亦然——O2与血红蛋白的结合往往会将CO2从血液中解离出来。这种效应称为Haldane效应,在促进CO2运输方面,其重要性远远超过Bohr效应在促进O2运输方面的作用。
Haldane效应的产生是由于一个简单的事实:O2在肺部与血红蛋白结合会使血红蛋白变得更酸性。这通过两种方式将CO2从血液中解离并进入肺泡(alveoli)。首先,酸性更强的血红蛋白与CO2结合形成氨基甲酸血红蛋白的倾向降低,从而将血液中以氨基甲酸形式存在的大部分CO2解离出来。其次,血红蛋白酸度的增加还导致其释放过量的H+,与HCO3-结合形成碳酸,然后碳酸分解为水和CO2,CO2从血液中释放到肺泡中,最后进入空气。
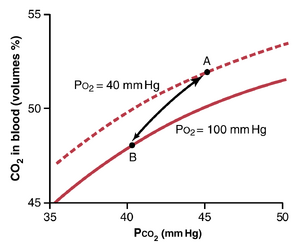
图41-15定量展示了Haldane效应(Haldane effect)在CO2从组织运输到肺中的重要性。该图展示了两条CO2解离曲线(dissociation curve)的一小部分:(1)当PO2为100mm Hg时,这是肺毛细血管中的情况;(2)当PO2为40mmHg时,这是组织毛细血管中的情况。点A显示,组织中正常的PCO2为45mmHg,导致52体积百分比的CO2与血液结合。进入肺后,PCO2降至40mmHg,PO2升至100mm Hg。如果CO2解离曲线没有因Haldane效应而移动,血液中的CO2含量只会降至50体积百分比,这意味着仅损失2体积百分比的CO2。然而,肺中PO2的增加使CO2解离曲线从图中的上曲线降至下曲线,因此CO2含量降至48体积百分比(点B)。这表示额外损失了2体积百分比的CO2。因此,Haldane效应使肺中从血液释放的C O2量大约翻倍,并使组织中吸收的C O2量大约翻倍。
CO2运输过程中血液酸度的变化
当CO2进入外周组织的血液时,形成的碳酸会降低血液的pH。然而,这种酸与血液中的酸碱缓冲剂(acid-base buffer)反应,阻止H+浓度大幅上升(以及pH大幅下降)。通常,动脉血的pH约为7.41,当血液在组织毛细血管中吸收CO2时,pH降至静脉血的约7.37。换句话说,发生了0.04单位的pH变化。当CO2从肺中的血液释放时,情况相反,pH再次升至动脉血的7.41。在剧烈运动或其他高代谢活动条件下,或当组织血流缓慢时,组织血液(以及组织本身)中的pH下降可能高达0.50,约为正常值的12倍,从而导致显著的组织酸中毒(tissue acidosis)。
呼吸交换率(RESPIRATORY EXCHANGE RATIO)
细心的学生会注意到,正常情况下,每100ml血液从肺运输到组织的O2约为5ml,而从组织运输到肺的CO2约为4ml。因此,在正常静息条件下,从肺排出的CO2量仅为肺吸收的O2量的约82%。[译者注:即呼吸商]CO2输出量与O2摄取量的比率称为呼吸交换率(respiratory exchange ratio, R)。即:
R = 二氧化碳输出速率/氧气摄取速率
R值在不同的代谢条件下会发生变化。当一个人仅使用碳水化合物进行身体代谢时,R值会上升到1.00。相反,当一个人仅使用脂肪作为代谢能量时,R值会降至0.7。这种差异的原因是,当O2与碳水化合物代谢时,每消耗一个O2分子就会形成一个CO2分子;而当O2与脂肪反应时,大部分O2会与脂肪中的氢原子结合形成水,而不是CO2。换句话说,当脂肪代谢时,组织中的化学反应呼吸商(respiratory quotient)约为0.70,而不是1.00。(组织呼吸商在第72章中讨论。)对于一个正常饮食、摄入平均量碳水化合物、脂肪和蛋白质的人来说,R的平均值被认为是0.825。
第42章 呼吸的调节
神经系统通常会调整肺泡通气(alveolar ventilation)的速率,以几乎完全满足身体的需求,因此即使在剧烈运动和大多数其他类型的呼吸压力下,动脉血中的氧分压和二氧化碳分压也几乎不会改变。本章描述了这种神经源性系统在调节呼吸中的功能。
呼吸中枢
呼吸中枢(respiratory center)由几组神经元组成,这些神经元位于脑干的延髓(medulla oblongata)和脑桥(pons)的两侧,如图42-1所示。它分为三个主要的神经元集合:(1) 背侧呼吸群(dorsal respiratory group),位于延髓的背侧部分,主要引起吸气;(2) 腹侧呼吸群(ventral respiratory group),位于延髓的腹外侧部分,主要引起呼气;(3) 呼吸调节中枢(pneumotaxic center),位于脑桥上部的背侧,主要控制呼吸的速率和深度。
背侧呼吸群神经元控制吸气和呼吸节律
背侧呼吸群神经元在呼吸控制中起着基础性作用,并延伸至延髓的大部分长度。其大多数神经元位于孤束核(NTS)中,尽管延髓邻近网状结构中的其他神经元也在呼吸控制中发挥重要作用。NTS是迷走神经()和舌咽神经的感觉终止点,这些神经将来自以下部位的感觉信号传递到呼吸中枢:(1) 外周化学感受器(peripheral chemoreceptors);(2) 压力感受器(baroreceptors);(3) 肝脏、胰腺和胃肠道多个部位的感受器;(4) 肺部的几种类型的感受器。
来自背侧呼吸群的节律性吸气放电。呼吸的基本节律主要由背侧呼吸群(dorsal respiratory group)的神经元产生。即使所有进入延髓的外周神经都被切断,并且脑干在延髓上下被横断,这组神经元仍然会发出重复的吸气神经元动作电位(action potentials)爆发。这些重复放电的基本原因尚不清楚。在原始动物中,已经发现了一些神经网络,其中一组神经元的活动会兴奋第二组神经元,而第二组神经元反过来又会抑制第一组神经元。然后,经过一段时间后,这种机制会重复进行,持续整个动物的生命周期。类似的神经元网络也存在于人类中,完全位于延髓内;它可能不仅涉及背侧呼吸群,还包括延髓的邻近区域,并负责呼吸的基本节律。
吸气“斜坡”信号。传递到吸气肌肉(主要是膈肌)的神经信号并不是瞬间的动作电位爆发。相反,它在正常呼吸中开始时较弱,并以斜坡方式稳步增加约2秒。然后,它在大约接下来的3秒内突然停止,这关闭了膈肌的兴奋,并允许肺和胸壁的弹性回缩引起呼气。接着,吸气信号再次开始,进入另一个周期;这个周期一次又一次地重复,呼气在中间发生。因此,吸气信号是一个斜坡信号。斜坡的明显优势是它在吸气期间使肺容量稳步增加,而不是引起吸气性喘息。
吸气斜坡的两个特性受到控制,如下:
- 控制斜坡信号的增加速率,以便在剧烈呼吸时,斜坡迅速增加,从而迅速填充肺部。
- 控制斜坡突然停止的极限点,这是控制呼吸速率的常用方法。也就是说,斜坡停止得越早,吸气的持续时间越短。这种方法也缩短了呼气的持续时间。因此,呼吸频率增加。
图42-1. 呼吸中枢的组织
呼吸调节中枢限制吸气持续时间并增加呼吸频率
位于上脑桥臂旁核(nucleus parabrachialis)背侧的呼吸调节中枢(pneumotaxic center)向吸气区域传递信号。该中枢的主要作用是控制吸气斜坡的“关闭”点,从而控制肺循环中填充阶段的持续时间。当呼吸调节信号强时,吸气可能仅持续0.5秒,因此肺部仅略微填充;当呼吸调节信号弱时,吸气可能持续5秒或更长时间,从而使肺部填充更多的空气。
呼吸调节中枢(pneumotaxic center)的主要功能是限制吸气(inspiration),这会产生增加呼吸频率的次级效应,因为限制吸气也会缩短呼气(expiration)和每次呼吸的整个周期。强烈的呼吸调节信号可以将呼吸频率增加到每分钟30到40次,而微弱的呼吸调节信号可能将呼吸频率降低到每分钟仅3到5次。
腹侧呼吸神经元群(ventral respiratory group of neurons)——在吸气和呼气中均起作用
位于延髓(medulla)两侧,大约在背侧呼吸神经元群(dorsal respiratory group of neurons)前外侧5毫米处的是腹侧呼吸神经元群,其头端位于疑核(nucleus ambiguus),尾端位于后疑核(nucleus retroambiguus)。该神经元群的功能在几个重要方面与背侧呼吸神经元群不同:
- 在正常安静呼吸期间,腹侧呼吸神经元群的神经元几乎完全处于不活动状态。因此,正常安静呼吸仅由来自背侧呼吸神经元群的重复吸气信号引起,这些信号主要传递到膈肌(diaphragm),而呼气则由肺和胸廓的弹性回缩(elastic recoil)引起。
- 腹侧呼吸神经元似乎不参与控制呼吸的基本节律性振荡(rhythmical oscillation)。
- 当增加肺通气(pulmonary ventilation)的呼吸驱动(respiratory drive)变得比正常更大时,呼吸信号会从背侧呼吸区域的基本振荡机制溢出到腹侧呼吸神经元。因此,腹侧呼吸区域也会提供额外的呼吸驱动。
- 对腹侧神经元群中少数神经元的电刺激会引起吸气,而对其他神经元的刺激则会引起呼气。因此,这些神经元对吸气和呼气都有贡献。它们在非常强烈的呼气期间向腹部肌肉提供强大的呼气信号方面尤其重要。因此,当需要高水平肺通气时,特别是在剧烈运动期间,该区域或多或少作为超速驱动(overdrive)机制运作。
肺充气信号限制吸气——Hering-Breuer充气反射(Hering-Breuer inflation reflex)
除了完全在脑干(brain stem)内运作的中枢神经系统(central nervous system)呼吸控制机制外,来自肺的感觉神经信号也有助于控制呼吸。最重要的是,位于整个肺的支气管(bronchi)和细支气管(bronchioles)壁的肌肉部分中的牵张感受器(stretch receptors)在肺过度扩张时通过迷走神经(vagi)将信号传递到背侧呼吸神经元群。这些信号以与来自呼吸调节中枢的信号非常相似的方式影响吸气;也就是说,当肺过度充气时,牵张感受器会激活适当的反馈反应,从而“关闭”吸气斜坡(inspiratory ramp)并因此停止进一步吸气。这种机制称为Hering-Breuer充气反射。与来自呼吸调节中枢的信号一样,这种反射也会增加呼吸频率。
在人类中,Hering-Breuer反射可能直到潮气量(tidal volume)增加到正常的三倍以上(>~1.5L/呼吸)时才会被激活。因此,这种反射似乎主要是一种防止肺过度充气的保护机制,而不是正常通气控制的重要因素。
整体呼吸中枢活动的控制
到目前为止,我们已经讨论了引起吸气和呼气的基本机制,但了解如何增加或减少呼吸控制信号的强度以适应身体的通气需求也很重要。例如,在剧烈运动期间,氧气(O2)的使用和二氧化碳(CO2)的生成速率通常会增加到正常水平的20倍,这需要肺通气的相应增加。本章剩余部分的主要目的是讨论根据身体的呼吸需求对通气的这种控制。
呼吸的化学控制
呼吸的最终目标是维持组织中O2、CO2和H+的适当浓度。因此,幸运的是,呼吸活动对这些物质的变化高度敏感。
血液中过量的CO2或过量的H+主要直接作用于呼吸中枢,导致吸气和呼气运动信号对呼吸肌的强度大大增加。相比之下,氧气在控制呼吸时对大脑呼吸中枢没有主要的直接影响。相反,它几乎完全作用于位于颈动脉体和主动脉体的外周化学感受器(peripheral chemoreceptors),这些化学感受器又将适当的神经信号传递到呼吸中枢以控制呼吸。
CO2和H+对呼吸中枢活动的直接控制
位于延髓腹侧表面下方的呼吸中枢的化学敏感区。我们主要讨论了呼吸中枢的三个区域——背侧呼吸神经元群(dorsal respiratory group)、腹侧呼吸神经元群(ventral respiratory group)和呼吸调节中枢(pneumotaxic center)。据信,这些区域都不会直接受到血液中CO2或H+浓度变化的影响。相反,另一个神经元区域,即化学敏感区(chemosensitive area),如图42-2所示,位于延髓腹侧表面下方仅0.2毫米处,双侧分布。该区域对血液中PCO2或H+浓度的变化高度敏感,并反过来兴奋呼吸中枢的其他部分。
H+对化学敏感神经元的兴奋可能是主要的刺激。化学敏感区中的感觉神经元特别容易被H+兴奋;事实上,据信H+可能是这些神经元唯一重要的直接刺激。然而,H+离子不容易穿过血脑屏障(blood-brain barrier)。因此,血液中H+浓度的变化对化学敏感神经元的刺激作用远不如血液中CO2的变化,尽管据信CO2通过改变H+浓度间接刺激这些神经元,如下一节所述。
图42-2. 位于延髓腹侧表面下方仅几分之一毫米的双侧化学敏感区(chemosensitive area)对脑干吸气区(inspiratory area)的刺激。还需注意的是,H+刺激化学敏感区,但体液中的二氧化碳(CO2)产生了大部分\Join+。
o2间接刺激化学敏感神经元(chemosensitive neurons)。尽管CO2对化学敏感区神经元的直接刺激作用很小,但它具有强大的间接作用。它是通过与组织中的水反应生成碳酸来实现这一作用的,碳酸解离为H+和HCO3-;H+随后对呼吸产生强烈的直接刺激作用。这些反应如图42-2所示。
为什么血液中的CO2比血液中的H+对化学敏感神经元的刺激作用更强?答案是血脑屏障(blood-brain barrier)对H+的通透性很低,但CO2几乎可以像屏障不存在一样通过。因此,每当血液中的PCO2增加时,延髓间质液(interstitial fluid)和脑脊液(cerebrospinal fluid)中的PCO2也会增加。在这两种体液中,CO2立即与水反应生成新的\ H+。因此,矛盾的是,当血液中CO2浓度增加时,延髓呼吸化学敏感感觉区(respiratory chemosensitive sensory area)释放的H+比血液中H+浓度增加时更多。因此,血液中CO2的变化对呼吸中枢(respiratory center)活动的增强作用非常强,这一点我们将在后面定量讨论。
o2在最初1到2天后的刺激作用减弱。在血液中CO2最初增加的几小时内,CO2对呼吸中枢的兴奋作用很强,但在接下来的1到2天内逐渐减弱,降至初始作用的约五分之一。这种下降的部分原因是肾脏在CO2最初增加\ H+浓度后,重新调整循环血液中的H+浓度,使其恢复正常。肾脏通过增加血液中的HCO3-来实现这一调整,HCO3-与血液和脑脊液中的H+结合,降低其浓度。但更重要的是,在几小时内,HCO3-也会缓慢扩散通过血脑屏障和血脑脊液屏障,并直接与呼吸神经元附近的H+结合,从而将H+恢复到接近正常水平。因此,血液中CO2浓度的变化对控制呼吸驱动(respiratory drive)具有强烈的急性作用,但在几天适应后仅具有微弱的慢性作用。
图42-3. 动脉血CO2增加和动脉pH降低(H+浓度增加)对肺泡通气率(alveolar ventilation rate)的影响。
血液 CO2 和 H+ 浓度对肺泡通气量的定量影响。图42-3定量显示了血液 PCO2 和血液 pH(这是 H+ 浓度的逆对数测量)对肺泡通气量的近似影响。特别要注意的是,在正常范围内(35至75 mmHg),PCO2 的增加导致通气量的显著增加,这表明 CO2 变化在控制呼吸中的巨大作用。相比之下,在正常血液 pH 范围(7.3至7.5)内,呼吸的变化不到 10%。
O2 的变化对呼吸中枢控制的直接影响很小。O2 浓度的变化几乎对呼吸中枢本身没有直接影响,不会改变呼吸驱动——尽管 O2 变化确实有间接影响,通过外周化学感受器(peripheral chemoreceptors)起作用,如下一节所述。
我们在第41章中了解到,血红蛋白-氧缓冲系统几乎总是向组织输送正常量的 O2,即使肺 PO2 从低至 60mmHg 变化到高达 1000mmHg。因此,除特殊情况外,尽管肺通气量从略低于正常的一半到高达正常值的20倍或更多,仍能实现足够的 O2 输送。这对 CO2 来说并非如此,因为血液和组织 PCO2 与肺通气速率成反比变化;因此,动物进化的过程使 CO2 成为呼吸的主要控制者,而不是 O2。
图42-4. 颈动脉体和主动脉体外周化学感受器对呼吸的控制。
然而,对于那些因缺乏 O2 而使组织陷入困境的特殊情况,身体有一个位于大脑呼吸中枢之外的外周化学感受器中的特殊呼吸控制机制。当血液 O2 过低(主要低于 PO2 70mmHg)时,该机制会响应,如下一节所述。
外周化学感受器系统——氧气在呼吸控制中的作用
除了呼吸中枢本身对呼吸活动的控制外,还有另一种机制可用于控制呼吸。这种机制是外周化学感受器系统,如图42-4所示。特殊的神经化学感受器(chemoreceptors)位于大脑外的几个区域。它们对血液中 O2 的变化特别敏感,尽管它们也对 CO2 和 H+ 浓度的变化有较小的反应。化学感受器将神经信号传递到大脑的呼吸中枢,以帮助调节呼吸活动。
大多数化学感受器(chemoreceptors)位于颈动脉体(carotid bodies)。然而,也有一些位于主动脉体(aortic bodies),如图42-4下部所示,极少数则位于胸部和腹部区域的其他动脉附近。
颈动脉体位于颈总动脉(common carotid arteries)分叉处的两侧。它们的传入神经纤维通过Hering神经传递到舌咽神经(glossopharyngeal nerves),然后到达延髓(dorsal respiratory area of the medulla)。主动脉体位于主动脉弓(arch of the aorta)附近;它们的传入神经纤维通过迷走神经(vagi)传递,同样到达延髓的呼吸区。
图42-5. 动脉PO2对颈动脉体冲动频率的影响。
每个化学感受器体都有其特殊的血液供应,通过一条小动脉直接从邻近的动脉干获得。通过这些感受器体的血流量非常大,每分钟是其自身重量的20倍。因此,从流动的血液中去除的O2百分比几乎为零,这意味着化学感受器始终暴露于动脉血而非静脉血中,它们的PO2值是动脉PO2值。
动脉氧分压降低刺激化学感受器。当动脉血中的氧浓度低于正常水平时,化学感受器会受到强烈刺激。这一效应在图42-5中得到了展示,图中显示了不同水平的动脉PO2对颈动脉体神经冲动传递速率的影响。请注意,冲动频率对动脉PO2在60mmHg到30mmHg范围内的变化特别敏感,这一范围内血红蛋白的氧饱和度迅速下降。
O2缺乏刺激化学感受器的基本机制。低PO2如何刺激颈动脉体和主动脉体中的神经末梢的确切机制尚不完全清楚。然而,这些感受器体具有多种高度特异性的腺样细胞,称为球细胞(glomus cells),它们直接或间接与神经末梢形成突触。目前的证据表明,这些球细胞作为化学感受器发挥作用,然后刺激神经末梢(图42-6)。球细胞具有对O2敏感的钾通道,当血液PO2显著降低时,这些通道会失活。这种失活导致细胞去极化,进而打开电压门控钙通道并增加细胞内钙离子浓度。钙离子数量的增加刺激神经递质的释放,激活传入神经元,向中枢神经系统发送信号并刺激呼吸。尽管早期研究表明多巴胺或乙酰胆碱可能是主要的神经递质,但最近的研究表明,在缺氧期间,三磷酸腺苷(adenosine triphosphate, ATP)可能是颈动脉体球细胞释放的关键兴奋性神经递质。
图42-6. 颈动脉体球细胞氧感应。当PO2降低到约60mmH g以下时,钾通道关闭,导致细胞去极化(Depolarization),钙通道打开,细胞质钙离子浓度增加。这会刺激递质释放(三磷酸腺苷[ATP]可能是最重要的),激活传入纤维,向中枢神经系统(CNS)发送信号并刺激呼吸。低PO2影响钾通道活动的机制尚不清楚。ΔVm,膜电压变化。
增加的 o2和H+浓度刺激化学感受器(Chemoreceptors)。CO2或H+浓度的增加也会兴奋化学感受器,从而间接增加呼吸活动。然而,这两种因素在呼吸中枢的直接作用比通过化学感受器介导的作用要强得多(大约强七倍)。然而,CO2的外周和中枢作用之间存在一个差异——通过外周化学感受器的刺激发生速度是中枢刺激的五倍,因此外周化学感受器在运动开始时增加对CO2的快速反应可能特别重要。
当动脉 o2和H+浓度保持正常时,低动脉PO2刺激肺泡通气的效果
图42-7显示了当PCO2和\ H+浓度保持在正常水平时,低动脉PO2对肺泡通气的影响。换句话说,在该图中,只有由低O2对化学感受器引起的通气驱动是活跃的。图42-7显示,只要动脉PO2保持在100mmHg以上,对通气几乎没有影响。然而,当压力低于100mmHg,时,当动脉PO2降至60mmHg时,通气量大约增加一倍,并且在非常低的PO2值时可以增加多达五倍。在这些条件下,低动脉PO2显然非常强烈地驱动通气过程。
图42-7. 下方的红色曲线显示了不同水平的动脉PO2对肺泡通气的影响,显示当PO2从正常水平的100mmH g降至20m m Hg时,通气量增加了6倍。上方的绿线显示,在本研究的测量过程中,动脉CO2保持在恒定水平;pH也保持恒定。
由于在PO2值大于60至80mmHg时,缺氧对通气的影响较小,因此在海平面健康人群中,PCO2和H+反应主要负责调节通气。
长期呼吸低O2会进一步刺激呼吸——“适应”现象
登山者发现,当他们缓慢攀登高山时,即用几天而不是几个小时的时间,他们的呼吸会更深,因此能够承受比快速攀登时低得多的氧气浓度。这种现象被称为习服(acclimatization)。
习服的原因在于,在2到3天内,脑干中的呼吸中枢对PCO2和H+变化的敏感性降低了约80%。因此,通常抑制呼吸增加的过量CO2排出不会发生,低O2可以驱动呼吸系统达到比急性条件下高得多的肺泡通气水平。与急性暴露于低O2后通气量可能增加70%不同,在低O2条件下2到3天后,肺泡通气量通常会增加400%到500%,这极大地帮助登山者获得额外的O2。
图42-8. 综合图表展示了CO2、PO2和pH对肺泡通气的相互影响。(数据来自Cunningham DJC, Lloyd BB: The Regulation of Human Respiration. Oxford: Blackwell Scientific, 1963.)
CO2、pH和PO2对肺泡通气的综合影响
图42-8快速概述了PO2、PCO2和pH共同影响肺泡通气的方式。要理解此图,首先观察四条红色曲线。这些曲线是在不同的动脉PO2水平下记录的——40、50、60和100mmHg。对于每条曲线,PCO2从较低水平变化到较高水平。因此,这组红色曲线代表了肺泡PCO2和PO2对通气的综合影响。
现在观察绿色曲线。红色曲线是在血液pH为7.4时测量的,而绿色曲线是在pH为7.3时测量的。我们现在有两组曲线,代表了在两种不同pH值下PCO2和PO2对通气的综合影响。其他曲线组会在更高pH时向右移动,在更低pH时向左移动。因此,使用此图,可以预测大多数肺泡PCO2、肺泡PO2和动脉pH组合下的肺泡通气水平。
运动期间的呼吸调节
在剧烈运动期间,O2消耗和CO2生成可以增加多达20倍。然而,在健康的运动员中,如图42-9所示,肺泡通气量通常几乎与氧气代谢的增加水平完全同步增加。动脉PO2、PCO2和pH几乎保持完全正常。
在尝试分析运动期间通气量增加的原因时,人们倾向于将这种通气量的增加归因于血液中CO2和H+的增加,以及血液中O2的减少。然而,对动脉PCO2:、pH和PO2的测量表明,这些值在运动期间都没有显著变化,因此它们都没有变得异常到足以像在剧烈运动期间观察到的那样强烈地刺激呼吸。那么,是什么导致了运动期间的强烈通气呢?至少有一个效应似乎是主要的。大脑在向运动肌肉传递运动冲动时,被认为同时向脑干传递侧支冲动以兴奋呼吸中枢。这一作用类似于运动期间脑干血管运动中枢的刺激,导致动脉压力同时增加。
图42-9. 中度和剧烈运动对耗氧量和通气率的影响。(来自Gray JS: Pulmonary Ventilation and Its Physiological Regulation. Springfield, IL: Charles C Thomas, 1950.)
实际上,当一个人开始运动时,通气量的总增加量中的很大一部分在运动开始时立即开始,在任何血液化学物质有时间改变之前。很可能,呼吸增加的大部分是由于神经源性信号直接传递到脑干呼吸中枢,同时信号传递到身体肌肉以引起肌肉收缩。
运动期间化学和神经因素在控制呼吸中的相互关系。当一个人运动时,直接的神经信号可能以几乎适当的量刺激呼吸中枢,以提供运动所需的额外O2并排出额外的CO2。然而,偶尔神经呼吸控制信号可能过强或过弱。化学因素在实现呼吸的最终调整中起着重要作用,以尽可能保持体液中的O2、CO2和H+浓度接近正常。
这个过程在图42-10中展示。下部的曲线显示了在1分钟运动期间肺泡通气量(alveolar ventilation)的变化,而上部的曲线显示了动脉PCO2的变化。注意,在运动开始时,肺泡通气量几乎立即增加,而动脉PCO2并没有初始的增加。事实上,通气量的增加通常足够大,以至于最初它实际上使动脉PCO2降低到正常水平以下,如图所示。通气量在血液CO2积累之前增加的原因可能是大脑在运动开始时提供了“预期性”的呼吸刺激,导致额外的肺泡通气量,即使在没有必要的情况下。然而,在30到40秒后,从活跃肌肉释放到血液中的CO2量大约与通气量的增加速率相匹配,动脉PCO2基本恢复到正常水平,即使运动仍在继续。这在图42-10中1分钟运动结束时显示。
图42-10. 在1分钟运动期间和运动结束后肺泡通气量(下部曲线)和动脉CO2(上部曲线)的变化。(数据来自Bainton CR:速度与坡度以及颤抖对狗在主动运动期间通气量的影响。J Appl Physiol 33:778, 1972。)
图42-11以另一种方式总结了运动期间呼吸的控制,这次更加定量。该图的下部曲线显示了在身体处于休息状态(即不运动)时不同水平的动脉PCO2对肺泡通气量的影响。上部曲线显示了在剧烈运动期间由呼吸中枢的神经驱动引起的通气曲线的近似偏移。两条曲线上指示的点显示了首先在休息状态下,然后在运动状态下的动脉PCO2。注意,在两种情况下,PCO2都处于正常水平的40mmHg。换句话说,神经因素使曲线向上偏移约20倍,因此通气量几乎与CO2释放速率相匹配,从而保持动脉PCO2接近其正常值。图42-11的上部曲线还显示,如果在运动期间动脉PCO2确实从其正常值40mmHg变化,它在PCO2值大于40mmHg时对通气量有额外的刺激作用,而在PCO2值小于40mmHg时有抑制作用。
运动期间通气的神经控制可能部分是一种学习反应。许多实验表明,大脑在运动期间偏移通气反应曲线的能力,如图42-1l所示,至少部分是一种学习反应。也就是说,随着反复的运动,大脑逐渐能够提供保持血液PCO2在正常水平所需的适当信号。此外,有理由相信,即使是大脑皮层也参与了这种学习,因为仅阻断皮层的实验也会阻断学习反应。
图42-11. 运动员在最大运动量下肺泡CO2-通气反应曲线向远高于正常水平移动的近似效果。这种移动被认为是由神经源性因素引起的,几乎恰好使动脉CO2在静息状态和剧烈运动期间维持在正常水平40mmH g。
图42-12. Cheyne-Stokes呼吸,显示肺血中CO2的变化(红线)和呼吸中枢液体中CO2的延迟变化(蓝线)。
影响呼吸的其他因素
气道中刺激感受器(irritant receptors)的作用。气管、支气管和细支气管的上皮分布有称为肺刺激感受器的感觉神经末梢,这些感受器受到多种因素的刺激。如第40章所述,这些感受器引发咳嗽和打喷嚏。它们也可能在患有哮喘和肺气肿等疾病的人中引起支气管收缩。
肺J感受器(J receptors)的功能。在肺泡壁中,靠近肺毛细血管的位置描述了一些感觉神经末梢,因此得名J感受器。当肺毛细血管充血或肺水肿发生时(如充血性心力衰竭),这些感受器尤其受到刺激。尽管J感受器的功能尚不明确,但它们的兴奋可能使人感到呼吸困难(dyspnea)。
脑水肿抑制呼吸中枢。呼吸中枢的活动可能因脑震荡引起的急性脑水肿而受到抑制甚至失活。例如,头部可能撞击到某个固体物体,随后受损的脑组织肿胀,压迫颅骨内的脑动脉,从而部分阻断脑部血液供应。
有时,脑水肿引起的呼吸抑制可以通过静脉注射高渗溶液(如高浓度甘露醇溶液)暂时缓解。这些溶液通过渗透作用去除部分脑部液体,从而减轻颅内压,有时在几分钟内恢复呼吸。
麻醉剂和麻醉药过量。呼吸抑制和呼吸暂停的最常见原因可能是麻醉剂或麻醉药过量。例如,戊巴比妥钠对呼吸中枢的抑制作用比许多其他麻醉剂(如氟烷)更强。曾经,吗啡被用作麻醉剂,但现在仅作为麻醉剂的辅助药物使用,因为它对呼吸中枢有很强的抑制作用,而对大脑皮层的麻醉能力较弱。
由于它们能够引起呼吸抑制,阿片类药物在全球范围内导致了大量致命的药物过量事件。在美国,2017年约有70,000人死于药物过量,主要是由于呼吸暂停。
周期性呼吸(Periodic Breathing)。一种称为周期性呼吸的呼吸异常发生在多种疾病情况下。患者会短暂地深呼吸一段时间,然后轻微呼吸或完全不呼吸一段时间,如此循环往复。一种类型的周期性呼吸,即Cheyne-Stokes呼吸,其特征是呼吸缓慢增强和减弱,大约每40到60秒发生一次,如图42-12所示。
Cheyne-Stokes呼吸的基本机制。Cheyne-Stokes呼吸的基本原因如下。当一个人过度呼吸时,从肺血中排出过多的CO2,同时增加血液中的O2,需要几秒钟的时间才能使改变的肺血被运输到大脑并抑制过度的通气。到那时,患者已经过度通气了几秒钟。因此,当过度通气的血液最终到达大脑呼吸中枢时,中枢会被过度抑制,此时相反的循环开始——即肺泡中的CO2增加,O2减少。同样,大脑需要几秒钟才能对这些新的变化做出反应。当大脑做出反应时,患者再次用力呼吸,循环重复。
Cheyne-Stokes呼吸的基本原因发生在每个人身上。然而,在正常情况下,这种机制被高度抑制。也就是说,血液和呼吸中枢控制区域的液体中含有大量的溶解和化学结合的CO2和O2。因此,在正常情况下,肺不能在几秒钟内积累足够的额外CO2或充分降低O2以引起周期性呼吸的下一个循环。然而,在两种不同的情况下,抑制因素可以被克服,Cheyne-Stokes呼吸确实会发生:
- 当血液从肺部运输到大脑的延迟时间较长时,肺泡中CO2和O2的变化可以持续比平常更多秒。在这种情况下,肺泡和肺血对这些气体的储存能力被超过;然后,再过几秒钟,周期性呼吸驱动变得极端,Cheyne-Stokes呼吸开始。这种类型的Cheyne-Stokes呼吸经常发生在严重心力衰竭的患者中,因为血流缓慢,从而延迟了血液气体从肺部到大脑的运输。在慢性心力衰竭患者中,Cheyne-Stokes呼吸有时会断断续续地发生数月。
- Cheyne-Stokes呼吸的第二个原因是呼吸控制区域的负反馈增益(negative feedback gain)增加,这意味着血液中CO2或O2的变化会导致通气量的变化比正常情况下大得多。例如,当PCO2上升3mmHg时,通气量通常会增加2到3倍,但在这种情况下,同样的3-mmHg上升可能会导致通气量增加10到20倍。现在,大脑的周期性呼吸反馈倾向足够强,可以在没有肺和大脑之间额外血流延迟的情况下引起Cheyne-Stokes呼吸。这种类型的Cheyne-Stokes呼吸主要发生在脑呼吸中枢受损的患者中。脑损伤通常会完全关闭呼吸驱动几秒钟,然后血液中CO2的额外强烈增加会以极大的力量重新启动呼吸驱动。这种类型的Cheyne-Stokes呼吸通常是脑功能障碍导致死亡的前兆。
图42-12显示了Cheyne-Stokes呼吸期间肺和呼吸中枢PCO2变化的典型记录。请注意,肺血液中的PCO2变化先于呼吸神经元中的PCO2变化。然而,呼吸的深度与大脑中的PCO2相对应,而不是与发生通气的肺血液中的PCO2相对应。
睡眠呼吸暂停(Sleep Apnea)
术语“呼吸暂停(apnea)”指的是没有自发性呼吸。在正常睡眠期间偶尔会发生呼吸暂停,但在患有睡眠呼吸暂停的人中,呼吸暂停的频率和持续时间大大增加,呼吸暂停发作持续10秒或更长时间,每晚发生300到500次。睡眠呼吸暂停可能由上呼吸道阻塞引起,尤其是咽部,或者由中枢神经系统呼吸驱动受损引起。
阻塞性睡眠呼吸暂停(Obstructive Sleep Apnea)是由上呼吸道阻塞引起的。咽部肌肉通常在吸气时保持这个通道开放,以便空气流入肺部。在睡眠期间,这些肌肉通常会放松,但气道通道仍然保持开放,以允许足够的气流。有些人有特别狭窄的通道,睡眠期间这些肌肉的放松会导致咽部完全关闭,从而使空气无法流入肺部。
在患有睡眠呼吸暂停的人中,入睡后不久会出现大声打鼾和呼吸困难。打鼾持续进行,通常变得更响,然后被一段长时间的静默期打断,期间没有呼吸(呼吸暂停)。这些呼吸暂停期导致PO2显著下降和PCO2显著上升,这极大地刺激了呼吸。这种刺激反过来导致突然的呼吸尝试,从而引起大声的鼻息和喘息,随后是打鼾和反复的呼吸暂停发作。呼吸暂停和呼吸困难期在夜间重复数百次,导致睡眠断断续续且不安稳。因此,睡眠呼吸暂停患者通常白天过度嗜睡,以及其他疾病,包括交感神经活动增加、心率加快、肺和全身性高血压,以及心血管疾病风险大大增加。
阻塞性睡眠呼吸暂停(obstructive sleep apnea)通常发生在年龄较大、肥胖的人群中,这些人的咽部软组织脂肪沉积增加,或由于颈部脂肪过多导致咽部受压。在少数个体中,睡眠呼吸暂停可能与鼻塞、舌头过大、扁桃体肥大或某些形状的腭部有关,这些情况会大大增加吸气时空气流入肺部的阻力。阻塞性睡眠呼吸暂停最常见的治疗方法包括:(1)手术切除咽喉后部多余的脂肪组织(称为悬雍垂腭咽成形术(uvulopalatopharyngoplasty))、切除肥大的扁桃体或腺样体,或在气管上开一个口(气管切开术(tracheostomy)),以便在睡眠期间绕过阻塞的气道;(2)使用持续气道正压通气(continuous positive airway pressure, CPAP)进行鼻腔通气。
当呼吸肌的神经驱动暂时消失时,就会发生"中枢性"睡眠呼吸暂停(central sleep apnea)。在少数患有睡眠呼吸暂停的人中,中枢神经系统对通气肌的驱动会暂时停止。可能导致睡眠期间通气驱动停止的疾病包括中枢呼吸中枢受损或呼吸神经肌肉装置异常。受中枢性睡眠呼吸暂停影响的患者即使在清醒时也可能出现通气减少,尽管他们完全有能力进行正常的自主呼吸。在睡眠期间,他们的呼吸障碍通常会加重,导致呼吸暂停发作更频繁,从而降低PO2并增加PCO2,直到达到最终刺激呼吸的临界水平。这些短暂的呼吸不稳定会导致睡眠不安稳,并产生与阻塞性睡眠呼吸暂停患者相似的临床特征。
在大多数患者中,中枢性睡眠呼吸暂停的原因尚不清楚,尽管呼吸驱动的不稳定可能是由中风或其他使大脑呼吸中枢对CO2和H+的刺激作用反应减弱的疾病引起的。患有这种疾病的患者对即使是小剂量的镇静剂或麻醉剂也极为敏感,这些药物会进一步降低呼吸中枢对CO2刺激作用的反应性。刺激呼吸中枢的药物有时可能有所帮助,但通常需要在夜间使用CPAP进行通气。
在某些情况下,睡眠呼吸暂停可能是由阻塞性和中枢性机制共同引起的。据估计,这种"混合型"睡眠呼吸暂停约占所有睡眠呼吸暂停病例的15%,而单纯的"中枢性"睡眠呼吸暂停占不到1%的病例。睡眠呼吸暂停最常见的原因是上呼吸道阻塞。
呼吸的自主控制
到目前为止,我们主要讨论了控制呼吸的非自主系统(involuntary system)。然而,我们都知道,呼吸可以在短时间内被自主控制(voluntarily controlled),一个人可以过度通气(hyperventilate)或通气不足(hypoventilate)到血液中PCO2、pH和PO2发生严重紊乱的程度。事实上,据报道,在静态休息条件下(并且在尝试前不使用纯氧进行过度通气),自主屏气(apnea)的持续时间世界纪录为11分54秒。在尝试屏气前使用纯氧进行过度通气并排出大量CO2,使得个人能够在水下屏气超过24分钟。超精英的屏气选手能够抑制呼吸冲动,使氧饱和度降至约50%,而意识丧失限制了屏气的持续时间。
Guyenet PG, Bayliss DA, Stornetta RL, 等: 质子检测和retrotrapezoid核的呼吸调节。J Physiol 594:1529, 2016. Guyenet PG, Bayliss DA: 呼吸和C O2稳态的神经控制。Neuron 87:946, 2015. Hilaire G, Pasaro R: 成年哺乳动物呼吸节律的产生和控制。News Physiol Sci 18:23, 2003. Hoiland RL, Fisher JA, Ainslie PN: 动脉二氧化碳对脑循环的调节。Compr Physiol 9:1101, 2019. Hoiland RL, Howe CA, Coombs GB, Ainslie PN: 高海拔下的通气和脑血管调节与整合。Clin Auton Res 28:423, 2018. Javaheri S, Barbe F, Campos-Rodriguez F, Dempsey JA, 等. 睡眠呼吸暂停:类型、机制和临床心血管后果。J Am Coll Cardiol 69:841, 2017. Nurse CA, Piskuric NA: 哺乳动物颈动脉体化学感受器的信号处理。Semin Cell Dev Biol 24:22, 2013. Plataki M, Sands SA, Malhotra A: 化学反射控制改变的临床后果。Respir Physiol Neurobiol 189:354, 2013. Prabhakar NR, Semenza GL: 氧感知和稳态。Physiology (Bethesda) 30:340, 2015. Ramirez JM, Doi A, Garcia AJ 3rd, 等: 呼吸的细胞构建模块。Compr Physiol 2:2683, 2012. Stuth EA, Stucke AG, Zuperku EJ: 麻醉剂、镇静剂和阿片类药物对通气控制的影响。Compr Physiol 2:2281, 2012. Veasey SC, Rosen IM: 成人阻塞性睡眠呼吸暂停。N Engl J Med 380:1442, 2019. Wilson RJ, Teppema LJ: 中枢和外周呼吸化学反射的整合。Compr Physiol 6:1005, 2016.
呼吸功能不全——病理生理学、诊断、氧疗
大多数呼吸系统疾病的诊断和治疗在很大程度上依赖于对呼吸和气体交换的基本生理原理的理解。一些呼吸系统疾病是由于通气不足引起的。其他疾病则是由于肺膜扩散异常或肺部与组织之间气体运输异常引起的。这些疾病的治疗方法通常完全不同,因此仅仅做出“呼吸功能不全”的诊断是不够的。
研究呼吸异常的有用方法
在前几章中,我们讨论了几种研究呼吸异常的方法,包括测量肺活量(vital capacity)、潮气量(tidal air)、功能残气量(functional residual capacity)、死腔(dead space)、生理性分流(physiologic shunt)和生理性死腔(physiological dead space)。这些测量只是临床肺生理学家工具库的一部分。这里还描述了一些其他工具。
血液气体和血液pH的研究
在所有肺功能测试中,最基本的是测定血液中氧分压\left(PO2\right)、二氧化碳分压(CO2)和pH。通常需要快速进行这些测量,以帮助确定急性呼吸窘迫或急性酸碱平衡异常的治疗方案。以下简单快速的方法可以在几分钟内完成这些测量,仅需几滴血液。
血液pH的测定。血液pH使用化学实验室常用的玻璃pH电极进行测量。然而,用于此目的的电极是微型化的。玻璃电极产生的电压是pH的直接测量值,通常直接从电压表刻度读取,或记录在图表上。
血液 o2的测定。玻璃电极pH计也可用于测定血液CO2。当弱碳酸氢钠溶液暴露于CO2气体时,CO2溶解在溶液中,直到达到平衡状态。在这种平衡状态下,溶液的pH是CO2和碳酸氢根离子\left(HCO3-\right)浓度的函数,符合第31章解释的Henderson-Hasselbalch方程:
p H=6.1+l o g\fracH C O3-C O2
当使用玻璃电极测量血液中的CO2时,微型玻璃电极被一层薄塑料膜包围。已知浓度的碳酸氢钠溶液位于电极和塑料膜之间的空间。然后将血液灌注到塑料膜的外表面,使CO2从血液扩散到碳酸氢钠溶液中。仅需一滴左右的血液。接下来,通过玻璃电极测量pH,并使用之前提供的公式计算CO2。
血液\scriptstylePO2的测定。液体中O2的浓度可以通过一种称为极谱法(polarography)的技术进行测量。电流在小负电极和溶液之间流动。如果电极的电压与溶液的电压相差超过-0.6伏特,O2将沉积在电极上。此外,通过电极的电流速率将与O2的浓度(因此也与PO2)成正比。在实践中,使用表面积约为1平方毫米的负铂电极,该电极与血液之间由一层薄塑料膜隔开,该膜允许O2扩散,但不允许蛋白质或其他会"毒害"电极的物质扩散。
通常,测量pH\cdot、CO2和PO2的三种设备都集成在同一台仪器中,并且所有这些测量都可以在短短一分钟内使用一滴血样完成。因此,可以在床边几乎实时监测血液气体水平和pH的变化。
最大呼气流量(maximum expiratory flow)的测量
在许多呼吸系统疾病中,特别是在哮喘(asthma)中,呼气时的气流阻力变得特别大,有时会导致严重的呼吸困难。这种情况引出了最大呼气流量(maximum expiratory flow)的概念,其定义如下:当一个人用力呼气时,呼气气流会达到一个最大流量,即使再增加额外的力量,流量也无法再增加。这就是最大呼气流量(maximum expiratory flow)。当肺部充满大量空气时,最大呼气流量(maximum expiratory flow)要比肺部几乎排空时大得多。这些原理可以通过参考图43-1来理解。
图43-1A显示了由于胸腔压缩而对肺泡(alveoli)和气道(air passageways)外部施加增加压力的效果。箭头表示相同的压力压缩了肺泡(alveoli)和细支气管(bronchioles)的外部。因此,这种压力不仅将空气从肺泡(alveoli)推向细支气管(bronchioles),同时也倾向于使细支气管(bronchioles)塌陷,从而阻碍空气向外流动。一旦细支气管(bronchioles)几乎完全塌陷,进一步的呼气力量仍然可以大大增加肺泡(alveoli)压力,但它也会同等程度地增加细支气管(bronchioles)的塌陷程度和气道阻力(airway resistance),从而阻止流量的进一步增加。因此,超过一定程度的呼气力量后,就达到了最大呼气流量(maximum expiratory flow)。
图43\ –1B显示了不同程度的肺塌陷(以及细支气管(bronchioles)塌陷)对最大呼气流量(maximum expiratory flow)的影响。
图43-1. A, 最大呼气努力时呼吸道的塌陷,这种效应限制了呼气流量。B, 肺容积对最大呼气气流的影响,显示随着肺容积变小,最大呼气气流逐渐减少。
该部分记录的曲线显示了健康人在尽可能多地吸入空气后,以最大呼气努力呼气直到无法再增加呼气速率时,所有肺容积水平下的最大呼气流量(maximum expiratory flow)。注意,这个人迅速达到了超过400L/min的最大呼气气流。然而,无论这个人施加多少额外的呼气努力,这仍然是他或她能够达到的最大流量。
还要注意的是,随着肺容积变小,最大呼气流量也会减少。这一现象的主要原因是,在扩张的肺中,支气管和细支气管部分通过肺结构元素对其外部的弹性拉力保持开放。然而,随着肺变小,这些结构松弛,使得支气管和细支气管更容易被外部胸腔压力压塌,从而逐渐降低最大呼气流量。
最大呼气流量-容积曲线的异常。图43-2显示了正常的最大呼气流量-容积曲线,以及两种类型的肺部疾病记录的额外流量-容积曲线:肺收缩和部分气道阻塞。请注意,收缩的肺的总肺容量(TLC, total lung capacity)和残气量(RV, residual volume)都减少了。此外,由于肺无法扩张到正常的最大容积,即使有最大的呼气努力,最大呼气流量也无法上升到与正常曲线相等的水平。肺收缩疾病包括肺纤维化疾病,如肺结核和硅肺病,以及限制胸腔的疾病,如脊柱后凸、脊柱侧凸和纤维性胸膜炎。
在气道阻塞的疾病中,通常呼气比吸气困难得多,因为呼气所需的额外正压大大增加了气道的闭合倾向。相比之下,吸气期间产生的额外负胸膜压实际上在扩张肺泡的同时“拉开”了气道。因此,空气容易进入肺部,但随后被困在肺部。经过数月或数年的时间,这种效应增加了TLC和RV,如图43-2中的绿色曲线所示。此外,由于气道的阻塞,以及它们比正常气道更容易塌陷,最大呼气流量大大降低。
图43-2. 两种呼吸异常——肺收缩和气道阻塞——对最大呼气流量-容积曲线的影响。RV, 残气量; TLC, 总肺容量。
导致严重气道阻塞的典型疾病是哮喘。严重的阻塞也发生在肺气肿的某些阶段。
用力呼气肺活量和用力呼气量
另一个有用的临床肺功能测试,也是容易进行的,是在肺活量计上记录用力呼气肺活量(FVC, forced expiratory vital capacity)。图43-3A显示了正常肺的人的记录,图43-3B显示了部分气道阻塞的人的记录。在进行FVC操作时,人首先最大程度地吸气到TLC,然后以最大的呼气努力尽可能快速和完全地呼气到肺活量计中。肺容积记录的下坡总距离代表FVC,如图所示。
现在,研究一下(1)正常肺和(2)部分气道阻塞的两条记录之间的差异。FVC(用力肺活量)的总容量变化没有太大差异,表明两个人的基本肺容量只有中等程度的差异。然而,这两个人每秒能够呼出的空气量存在显著差异,尤其是在第一秒内。因此,通常会将记录的第一秒用力呼气量(FEV1)与正常值进行比较。在正常人(见图43-3A)中,第一秒内呼出的FVC百分比除以总FVC\left(FEV1/FVC%\right)为80%。然而,请注意在图43-3B中,气道阻塞时,该值降至仅47%。在严重气道阻塞的患者中,如急性哮喘时常见的情况,该值可降至20%以下。
图43-3. 健康人(A)和部分气道阻塞患者(B)在用力肺活量操作期间的记录。(容量刻度上的“零”表示残气量。)F E V1,第一秒用力呼气量;FVC,用力肺活量。
特定肺部异常的病理生理学
慢性肺气肿
肺气肿(pulmonary emphysema)一词字面意思是肺部空气过多。然而,该术语通常用于描述由多年吸烟引起的复杂的阻塞性和破坏性肺部过程。它是由以下肺部主要病理生理变化引起的:
- 慢性感染,由吸入烟雾或其他刺激支气管和细支气管的物质引起。慢性感染严重扰乱了气道的正常保护机制,包括呼吸道上皮纤毛的部分麻痹,这是由尼古丁引起的。结果,黏液无法轻易从气道中排出。此外,过量的黏液分泌被刺激,进一步加剧了病情。肺泡巨噬细胞也受到抑制,因此它们在对抗感染方面变得不那么有效。
- 感染、过量黏液和细支气管上皮的炎性水肿共同导致许多较小气道的慢性阻塞。
- 气道阻塞使得呼气特别困难,从而导致肺泡内空气滞留并过度扩张。这种效应与肺部感染相结合,导致多达50%至80%的肺泡壁显著破坏。因此,肺气肿的最终表现如图43-4(顶部)和43-5所示。
慢性肺气肿的生理效应是可变的,取决于疾病的严重程度以及细支气管阻塞与肺实质破坏的相对程度。不同的异常包括以下内容:
- 细支气管阻塞增加了气道阻力,导致呼吸功显著增加。患者在呼气时尤其难以将空气通过细支气管,因为肺外部的压缩力不仅压缩了肺泡,还压缩了细支气管,这进一步增加了它们在呼气时的阻力。
- 肺泡壁的显著丧失大大降低了肺的扩散能力(diffusing capacity)。这降低了肺部为血液供氧和从血液中去除CO2的能力。
- 阻塞过程在肺部的某些部分通常比其他部分严重得多,因此肺部的某些部分通气良好,而其他部分通气不良。这种情况通常会导致极其异常的通气-灌注比(ventilation-perfusion ratios),在某些部分·VA/·Q非常低(生理性分流(physiological shunt)),导致血液通气不良,而在其他部分Δ\barVA/Δ\barQ非常高(生理性死腔(physiological dead space)),导致通气浪费,这两种效应在同一肺中同时发生。
图43-4. 肺气肿肺(上)与正常肺(下)的对比,显示肺气肿中广泛的肺泡破坏。(由Patricia Delaney和威斯康星医学院解剖学系提供,密尔沃基,威斯康星州。)
- 大部分肺泡壁的丧失也减少了血液可以通过的肺毛细血管数量。结果,肺血管阻力通常显著增加,导致肺动脉高压(pulmonary hypertension),进而使右心负荷过重,并经常导致右心衰竭(right-sided heart failure)。
慢性肺气肿通常在许多年内缓慢进展。由于许多肺泡的通气不足加上肺泡壁的丧失,低氧血症(hypoxia)和高碳酸血症(hypercapnia)都会发生。所有这些效应的最终结果是严重、持久、毁灭性的空气饥饿感,这种状况可以持续多年,直到低氧血症和高碳酸血症导致死亡——这是吸烟付出的高昂代价。
肺炎——肺泡中的炎症和液体
肺炎(pneumonia)一词包括任何肺部炎症状况,其中部分或全部肺泡充满液体和血细胞,如图43-5所示。一种常见的肺炎类型是细菌性肺炎(bacterial pneumonia),最常由肺炎球菌(pneumococci)引起。这种疾病始于肺泡感染;肺膜发炎并变得高度多孔,以至于液体甚至红细胞和白细胞从血液中渗入肺泡。因此,受感染的肺泡逐渐充满液体和细胞,感染通过细菌或病毒从肺泡到肺泡的扩展而传播。最终,肺部的大面积区域,有时是整个肺叶甚至整个肺,变得“实变(consolidated)”,这意味着它们充满了液体和细胞碎片。
在肺炎患者中,肺的气体交换功能在疾病的不同阶段会下降。在早期阶段,肺炎过程可能仅局限于一侧肺,肺泡通气减少,而通过肺的血流继续正常。这种情况会导致两种主要的肺部异常:(1) 呼吸膜总可用表面积减少;(2) 通气-灌注比降低。这两种效应都会导致低氧血症(血液中O2低)和高碳酸血症(血液中CO2高)。
图43-5. 肺炎和肺气肿中肺泡的变化。
图43-6显示了肺炎中通气-灌注比降低的影响。通过通气肺的血液O2饱和度为97%,而通过未通气肺的血液饱和度约为60%。因此,左心泵入主动脉的血液平均饱和度仅为约78%,远低于正常水平。
肺不张——肺泡的塌陷
肺不张(Atelectasis)是指肺泡的塌陷。它可以发生在肺的局部区域或整个肺。肺不张的常见原因包括:(1) 气道的完全阻塞;(2) 肺泡内液体缺乏表面活性物质(surfactant)。
气道阻塞导致肺塌陷。气道阻塞型肺不张通常由以下原因引起:(1) 许多小支气管被黏液阻塞;或(2) 主支气管被大块黏液栓或某些固体物体(如肿瘤)阻塞。阻塞后滞留的空气会在几分钟到几小时内被肺毛细血管中的血液吸收。如果肺组织足够柔韧,这将导致肺泡的简单塌陷。然而,如果肺因纤维化组织而僵硬且无法塌陷,肺泡内空气的吸收会在肺泡内产生非常负的压力,从而将液体从肺毛细血管中抽出进入肺泡,导致肺泡完全充满水肿液。当整个肺发生肺不张时,几乎总是会发生这种情况,这种情况称为肺的大面积塌陷。
图43-7显示了整个肺大面积塌陷(肺不张)对整体肺功能的影响。肺组织的塌陷不仅阻塞了肺泡,还几乎总是增加了通过塌陷肺的肺血管的血流阻力。这种阻力的增加部分是由于肺塌陷,随着肺体积的减少,血管被压缩和折叠。此外,塌陷肺泡中的缺氧会导致额外的血管收缩,如第39章所述。
图43-6. 肺炎对肺动脉、左右肺静脉和主动脉中氧气( O2)饱和度百分比的影响。
由于血管收缩,通过肺不张(atelectasis)的肺部的血流大大减少。幸运的是,大部分血液被引导通过通气的肺部,因此得到了良好的氧合。在图43-7所示的情况下,六分之五的血液通过通气良好的肺部,只有六分之一通过未通气的肺部。结果,总体通气-灌注比(ventilation-perfusion ratio)仅受到中等程度的影响,因此尽管整个肺部的通气完全丧失,主动脉血液的氧饱和度(oxygen saturation)仅轻微下降。
缺乏“表面活性物质(surfactant)”作为肺塌陷的原因
第38章讨论了肺泡中表面活性物质的分泌和功能。表面活性物质由特殊的肺泡上皮细胞分泌到覆盖肺泡内表面的液体中。表面活性物质反过来将肺泡内的表面张力(surface tension)降低2到10倍,这在正常情况下对防止肺泡塌陷起着重要作用。然而,在某些情况下,如常发生在早产儿中的透明膜病(hyaline membrane disease)(也称为呼吸窘迫综合征(respiratory distress syndrome)),肺泡分泌的表面活性物质数量大大减少,导致肺泡液体的表面张力比正常情况高出数倍。这种表面活性物质的缺乏导致这些婴儿的肺部严重倾向于塌陷或被液体填充。正如第38章所解释的,当大部分肺部发生肺不张时,许多这些婴儿会因窒息而死亡。
图43-7. 肺不张对主动脉血氧饱和度(oxygen saturation)的影响。
哮喘(ASTHMA)——细支气管(bronchioles)平滑肌的痉挛性收缩
哮喘的特征是细支气管平滑肌的痉挛性收缩,这使细支气管部分阻塞并导致极度呼吸困难。哮喘的患病率一直在上升,影响了美国所有人口的7%到8%,在某些群体中,如非西班牙裔黑人,患病率甚至更高。世界卫生组织估计,全球有超过2.35亿人患有哮喘,尽管有些估计认为哮喘的患病率高达3.39亿人。
哮喘的常见原因是细支气管对空气中的外来物质的收缩性过敏。在约70%的30岁以下患者中,哮喘是由过敏性过敏引起的,尤其是对植物花粉的过敏。在老年人中,原因几乎总是对空气中非过敏性刺激物的过敏,如烟雾中的刺激物。
典型的过敏体质者往往会形成异常大量的免疫球蛋白E (immunoglobulin E, IgE) 抗体,这些抗体在与最初导致它们产生的特定抗原反应时会引起过敏反应,如第35章所述。在哮喘患者中,这些抗体主要附着在肺间质中的肥大细胞上,这些肥大细胞与细支气管和小支气管紧密相连。当哮喘患者吸入对其敏感的花粉(即已产生IgE抗体的花粉)时,花粉会与肥大细胞上的抗体反应,导致肥大细胞释放多种不同的物质。其中包括:(1) 组胺 (histamine);(2) 过敏性慢反应物质 (slow-reacting substance of anaphylaxis)(由白三烯 (leukotrienes) 组成);(3) 嗜酸性粒细胞趋化因子 (eosinophilic chemotactic factor);(4) 缓激肽 (bradykinin)。所有这些因素的联合作用,尤其是过敏性慢反应物质,会导致以下结果:(1) 小支气管壁局部水肿,以及向细支气管腔内分泌粘稠黏液;(2) 细支气管平滑肌痉挛。因此,气道阻力显著增加。
正如本章前面所讨论的,在哮喘患者中,由于呼气时细支气管外部受到压缩导致细支气管塌陷,细支气管直径在呼气时的缩小比吸气时更为明显。由于哮喘患者的细支气管已经部分阻塞,外部压力导致的进一步阻塞在呼气时会造成特别严重的梗阻。也就是说,哮喘患者通常可以充分吸气,但在呼气时却非常困难。临床测量显示:(1) 最大呼气速率显著降低;(2) 定时呼气量减少。此外,所有这些因素共同导致呼吸困难(dyspnea),即本章后面将讨论的“空气饥饿感”。
在急性哮喘发作期间,由于难以将空气从肺部排出,肺的功能残气量 (functional residual capacity) 和残气量 (residual volume) 会显著增加。此外,经过数年时间,胸廓会永久性扩大,形成所谓的桶状胸 (barrel chest),同时功能残气量和肺残气量也会永久性增加。
结核病 (TUBERCULOSIS)
在结核病中,结核杆菌 (tubercle bacilli) 会在肺部引起一种特殊的组织反应,包括:(1) 巨噬细胞 (macrophages) 侵入受感染的组织;(2) 通过纤维组织“隔离”病灶,形成所谓的结核结节 (tubercle)。这种隔离过程有助于限制结核杆菌在肺部的进一步传播,因此是防止感染扩散的保护机制的一部分。然而,在约3%的结核病患者中,如果疾病未得到治疗,隔离过程会失败,结核杆菌会扩散到整个肺部,通常会导致肺组织的极度破坏,并形成大的脓肿腔。
因此,肺结核在其晚期阶段表现为肺部多处纤维化,以及功能性肺组织总量的减少。这些效应导致以下结果:(1) 呼吸肌的“工作”增加以引起肺通气,同时肺活量和呼吸能力降低;(2) 呼吸膜总面积减少且呼吸膜厚度增加,导致肺扩散能力逐渐减弱;(3) 肺部通气-灌注比例异常,进一步降低 O2 和 CO2 的整体肺扩散。
缺氧与氧疗
本章前几节讨论的几乎所有情况都可能导致全身严重的细胞缺氧。有时 O2 疗法非常有价值,有时价值中等,而在其他时候几乎没有任何价值。因此,了解不同类型的缺氧非常重要,然后我们可以讨论氧疗的生理学原理。以下是缺氧原因的详细分类:
- 由于外部原因导致的肺部血液氧合不足 a. 大气中 O2 不足 b. 通气不足(神经肌肉疾病)
- 肺部疾病 a. 由于气道阻力增加或肺顺应性降低引起的通气不足 b. 肺泡通气-灌注比例异常(包括生理死腔增加或生理分流增加) c. 呼吸膜扩散能力减弱
- 静脉到动脉的分流(右到左心脏分流)
- 血液向组织输送 O2 不足 a. 贫血或异常血红蛋白 b. 全身循环不足 c. 局部循环不足(外周、脑部、冠状动脉) d. 组织水肿
- 组织利用 O2 的能力不足 a. 细胞氧化酶中毒 b. 由于毒性、维生素缺乏或其他因素导致细胞利用氧的代谢能力减弱
这种缺氧类型的分类主要从本章前面的讨论中显而易见。只有一种类型的缺氧需要进一步阐述——由于身体组织细胞利用 O2 的能力不足引起的缺氧。
组织利用氧气的能力不足。组织无法利用 O2 的典型原因是氰化物中毒,其中氰化物阻断了细胞色素氧化酶的作用,以至于即使有充足的氧气,组织也无法利用 O2。此外,某些组织细胞氧化酶的缺乏或组织氧化系统中其他元素的缺乏也可能导致这种类型的缺氧。一个特殊的例子是脚气病,由于维生素 B 缺乏,组织利用氧气和形成 CO2 的几个重要步骤受到影响。
缺氧对身体的影响。如果缺氧足够严重,可能导致全身细胞死亡,但在较轻的情况下,它主要导致 (1) 精神活动抑制,有时最终导致昏迷,以及 (2) 肌肉工作能力降低。这些效应在第 44 章中与高海拔生理学相关时进行了具体讨论。
不同类型缺氧中的氧气疗法
O2 可以通过以下方式给予:(1) 将患者的头部置于含有 O2 强化的空气的“帐篷”中;(2) 让患者通过面罩呼吸纯 O2 或高浓度的 O2;(3) 通过鼻内管给予 O2。
回顾不同类型缺氧的基本生理学原理,可以很容易地决定何时 O2 疗法会有价值,以及如果有价值,其价值有多大。
在大气性缺氧(atmospheric hypoxia)中,O2 疗法可以完全纠正吸入气体中 O2 水平的下降,因此提供 100% 的有效治疗。
在通气不足性缺氧(hypoventilation hypoxia)中,呼吸 100% O2 的人每次呼吸可以将五倍于正常空气的 O2 送入肺泡。因此,在这种情况下,O2 疗法也非常有益。然而,这种 O2 疗法对由通气不足引起的血液中 CO2 过多没有帮助。
图 43-8. 肺水肿中肺毛细血管血液对氧气的吸收,有和没有氧气帐篷疗法的情况。
在由肺泡膜扩散障碍引起的缺氧中,结果与通气不足性缺氧基本相同,因为 O2 疗法可以将肺泡中的 PO2 从正常值约 100mm Hg 提高到高达 600mmHg。这一作用将氧气从肺泡扩散到血液的 O2 压力梯度从正常值 60mmHg 提高到高达 560mmHg,增加了超过 800%。O2 疗法在扩散性缺氧中的这种高度有益效果在图 43-8 中得到了展示,图中显示,这位肺水肿患者的肺血液吸收 O2 的速度是没有治疗时的三到四倍。
在由贫血、异常血红蛋白运输 O2、循环不足或生理性分流引起的缺氧中,O2 疗法的价值要小得多,因为肺泡中已经有正常的 O2。相反,问题在于将氧气从肺部运输到组织的一个或多个机制存在缺陷。即便如此,当肺泡 O2 增加到最大值时,血液中可以以溶解状态运输少量额外的 O2,约为 7% 到 30%,尽管血红蛋白运输的量几乎没有变化。这少量的额外 O2 可能是生死攸关的。
在由组织使用 O2 不足引起的不同类型缺氧中,肺部吸收 O2 或将其运输到组织的过程没有异常。相反,组织代谢酶系统只是无法使用输送的 O2。因此,O2 疗法没有可测量的益处。
紫绀(Cyanosis)
术语发绀(cyanosis)指的是皮肤发蓝;其原因是皮肤血管中脱氧血红蛋白(deoxygenated hemoglobin)含量过高,尤其是在毛细血管中。这种脱氧血红蛋白呈深蓝紫色,透过皮肤显现出来。
一般来说,当每100毫升动脉血中含有超过5克脱氧血红蛋白时,就会出现明显的发绀。贫血(anemia)患者几乎不会出现发绀,因为100毫升动脉血中没有足够的血红蛋白来达到5克脱氧血红蛋白。相反,在红细胞增多症(polycythemia vera)等红细胞过多的患者中,由于有大量血红蛋白可以脱氧,即使在正常情况下也经常会出现发绀。
高碳酸血症(HYPERCAPNIA)——体液中的二氧化碳过多
乍一想,人们可能会怀疑任何导致缺氧(hypoxia)的呼吸状况也会导致高碳酸血症(hypercapnia)。然而,高碳酸血症通常只在缺氧是由通气不足(hypoventilation)或循环不足(circulatory deficiency)引起时才会与缺氧同时发生,原因如下。
由空气中氧气过少、血红蛋白过少或氧化酶(oxidative enzymes)中毒引起的缺氧仅涉及氧气的可用性或组织对氧气的利用。因此,很容易理解高碳酸血症与这些类型的缺氧无关。
在由肺膜或组织扩散不良引起的缺氧中,通常不会同时出现严重的高碳酸血症,因为二氧化碳的扩散速度是氧气的20倍。如果确实开始出现高碳酸血症,这会立即刺激肺通气,从而纠正高碳酸血症,但不一定能纠正缺氧。
相反,在由通气不足引起的缺氧中,肺泡与大气之间的二氧化碳转移与氧气转移一样受到影响。因此,高碳酸血症与缺氧同时发生。在循环不足的情况下,血流减少会降低二氧化碳从组织中的清除,导致组织高碳酸血症和组织缺氧。然而,血液对二氧化碳的运输能力是氧气的三倍以上,因此由此产生的组织高碳酸血症远低于组织缺氧。
当肺泡二氧化碳分压(PCO2)上升到约60至75毫米汞柱(mmHg)以上时,一个原本正常的人会尽可能地快速和深呼吸,空气饥饿(air hunger),也称为呼吸困难(dyspnea),会变得严重。
如果二氧化碳分压上升到80至100毫米汞柱,人会变得昏昏欲睡,有时甚至半昏迷。当二氧化碳分压上升到120至150毫米汞柱时,可能会导致麻醉和死亡。在这些较高的二氧化碳分压水平下,过量的二氧化碳开始抑制呼吸而不是刺激呼吸,从而导致恶性循环:(1)更多的二氧化碳,(2)呼吸进一步减少,(3)然后更多的二氧化碳,依此类推——迅速导致呼吸死亡。
呼吸困难(DYSPNEA)
呼吸困难指的是由于无法充分通气以满足空气需求而导致的精神痛苦。一个常见的同义词是空气饥饿(air hunger)。
至少有三个因素常常导致呼吸困难(dyspnea)的发生:(1) 体液中的呼吸气体异常,特别是高碳酸血症(hypercapnia),以及程度较轻的低氧血症(hypoxia);(2) 呼吸肌为提供足够的通气所必须完成的工作量;(3) 心理状态。
当体液中CO2过度积累时,人会感到特别呼吸困难。然而,有时体液中CO2和O2的水平都是正常的,但为了达到呼吸气体的正常水平,人必须用力呼吸。在这些情况下,呼吸肌的强力活动常常会让人感到呼吸困难。
大多数人在仅进行1到2分钟的自主屏气(apnea)后就会感到严重的呼吸困难。然而,如第42章所讨论的,尽管体液中CO2积累和O2水平非常低,有些人可以通过训练抑制呼吸冲动超过10分钟。
最后,即使一个人的呼吸功能以及体液中的CO2和O2水平正常,由于心理状态的异常,也可能会感到呼吸困难。这种情况被称为神经性呼吸困难(neurogenic dyspnea)或情绪性呼吸困难(emotional dyspnea)。例如,几乎任何人在瞬间想到呼吸的动作时,可能会因为轻微的呼吸困难感而突然开始比平常更深地呼吸。对于那些心理上害怕无法获得足够空气的人来说,这种感觉会大大增强,比如进入一个小或拥挤的房间时。
人工呼吸
复苏器。有许多类型的呼吸复苏器可用,每种都有其独特的操作原理。图43-9A中所示的复苏器由一个O2或空气的供应罐、一个用于施加间歇正压的机制(有些机器还包括负压),以及一个适合患者面部的面罩或用于连接设备的插管组成。这个装置在复苏器的正压周期中通过面罩或插管将空气强制送入患者的肺部,然后在周期的其余时间通常允许空气被动地从肺部流出。
早期的复苏器由于过度的正压常常导致肺部损伤。它们的使用曾一度受到极大的谴责。然而,现在的复苏器具有可调节的正压限制,通常设置为12到15cm H2O压力用于正常肺部,但对于非顺应性肺部有时会设置得更高。
坦克呼吸机(“铁肺”)
图43-9B展示了坦克呼吸机,患者的身体位于坦克内部,头部通过一个柔软但气密的项圈伸出。在坦克的末端,与患者头部相对的位置,一个由电机驱动的皮革隔膜来回移动,其移动幅度足以使坦克内部压力升高和降低。当皮革隔膜向内移动时,身体周围产生正压,导致呼气;当隔膜向外移动时,负压导致吸气。呼吸机上的检查阀控制正压和负压。通常,这些压力被调整为使导致吸气的负压降至-10到-20cmH2O,而正压升至0到+5cmH2O。
图43-9. A, 复苏器。B, 坦克呼吸机。
随着现代医学中更先进的机械通气设备的发展,坦克呼吸机的使用在现代医学中已基本过时,这些设备通过正压将空气推入气道。
复苏器和坦克呼吸机对静脉回流的影响
当复苏器通过正压将空气强制送入肺部,或当坦克呼吸机降低患者身体周围的压力时,肺内压力变得高于身体其他部位的压力。外周静脉向胸部和心脏的血流受阻。因此,使用复苏器或坦克呼吸机时过高的压力可能会减少心输出量,有时甚至达到致命水平。例如,持续暴露于超过30毫米汞柱的肺内正压超过几分钟,可能会因静脉回流不足而导致死亡。**
