第二章 神经元内的信号传递
神经系统能迅速响应感官刺激。例如,一条5天大的斑马鱼幼体能在3毫秒内开始对代表潜在威胁的水流脉冲作出反应,并在12毫秒内完全改变其运动方向,从而逃离潜在威胁(图2-1)。这种逃避行为依赖于感觉神经元对机械力的检测、通过中间神经元将感觉信息传递至运动神经元,以及相应肌肉的协调收缩或放松,所有这些过程均在数毫秒内完成。由于此类逃避行为(如躲避捕食者,见视频2-1)对动物生存至关重要,神经元通信速度经历了强烈的进化选择。
如第一章所述,神经系统利用电信号在神经元内部传递信息。单个神经元是神经系统的基本单位,它们基于膜电位的变化接收、整合、传播和传递信号(图1-18)。典型的脊椎动物神经元通过树突和细胞体以突触电位的形态接收来自突触前伙伴的输入。神经元将这些突触电位沿着通往轴突起始段的路径进行整合,动作电位在此处产生。动作电位沿轴突传播至神经元的突触前末端,引发神经递质释放。随后,神经递质与突触后目标神经元上的受体结合,产生突触电位,从而完成一轮完整的神经元通信循环。
在本章及第三章中,我们将探讨神经元通信的基本机制,重点关注三个关键步骤:(1)动作电位的产生与传播,(2)突触前神经元释放神经递质,以及(3)突触后神经元接收神经递质。在深入这些关键步骤之前,我们将首先研究神经元作为具有复杂胞质延伸的大型细胞以及电信号传导者的特殊细胞特性。理解这些特性对我们研究神经元通信至关重要。本章前四节还作为对本教材中使用的分子与细胞生物学基本概念和术语的介绍或复习。

图 2-1 斑马鱼幼体的快速逃避反应。左下角管道喷出水脉冲时斑马鱼幼体逃避行为的延时图像。星号(*)标示刺激开始后 3 毫秒(ms)首次可检测到的反应,此反应在本图所示帧中难以察觉但在视频片段中清晰可见。(引自 Liu KS & Fetcho JR [1999] Neuron 23:325-335,经 Elsevier Inc.许可使用)
神经元的细胞生物学特性与电生理特性
神经元是动物体内最大的细胞。例如,支配脚趾的感觉神经元胞体位于约腰部水平的背根神经节中,但其外周分支延伸至脚趾,而中枢轴突则向上延伸至脑干(图1-21);因此,对于高个子的人来说,这个感觉神经元的跨度约为 2m ,而对于长颈鹿则为 5m 。许多神经元拥有复杂的树突树。例如,小脑浦肯野细胞(图1-11)的树突树拥有数百个分支,并能接收来自多达20万个突触前伙伴的突触输入。轴突或树突的表面积和体积通常比胞体大几个数量级。这种独特的结构,加上以特定模式装饰这一结构的信号分子,使得电信号能够长距离快速传递,并允许单个神经元整合来自众多细胞的信息。
为了使神经元能够启动、整合、传播和传递电信号,它们必须持续合成蛋白质并将其输送到适当的亚细胞区室。因此,神经元内部存在两种通信方式:一是通过 RNA、蛋白质和细胞器沿其长突起的运输,将这些组分送达细胞的正确部位;二是通过电信号沿这些突起的移动。这两种方式可分别比作通过邮件寄送包裹(传递实体物品)和发送短信或电子邮件(仅传递信息)。两者对神经系统功能都至关重要,但依赖的机制截然不同。在接下来的章节中,我们将从神经元的基本分子和细胞生物学入手,研究这些机制。
2.1 神经元遵循分子生物学的中心法则和细胞内囊泡运输的规则
神经元中的大分子合成遵循分子生物学的中心法则,即信息从 DNA 流向 RNA 再流向蛋白质(图 2-2 左)。基因作为携带特定 RNA 和蛋白质合成指令的遗传基质,位于细胞核内的 DNA 分子上。DNA 是由脱氧核糖核苷酸构成的长双链结构,每个核苷酸包含脱氧核糖、磷酸基团以及四种含氮碱基之一:腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)或胸腺嘧啶(T)。转录过程中,RNA 聚合酶以 DNA 为模板合成单链 RNA(由含核糖的核苷酸组成,其中尿嘧啶[U]替代了 T);基因中作为 RNA 合成模板的部分称为转录单元。基因转录产生的信使 RNA(前体 mRNA)通过其特定的核糖核苷酸序列携带信息,该序列与转录单元的脱氧核苷酸序列相对应。前体 mRNA 需经历一系列 RNA 加工步骤。 这些过程包括加帽(在 RNA 的 5 端添加一个修饰的鸟苷核苷酸)、RNA 剪接(去除不编码蛋白质的 RNA 序列,即内含子,并将剩余序列即外显子连接起来)、多聚腺苷酸化(在 RNA 的 3 端添加一长串腺苷核苷酸序列),以及偶尔发生的 RNA 编辑(一种改变特定 RNA 序列的调控事件)。最终形成的成熟信使 RNA(mRNA)从细胞核输出到细胞质,在蛋白质合成(翻译)过程中被核糖体解码。mRNA 序列中的信息决定了新合成的多肽(蛋白质)的氨基酸序列。
除 mRNA 外,细胞还转录多种不编码蛋白质的 RNA。这些 RNA 包括对翻译过程至关重要的核糖体 RNA(rRNA)和转运 RNA(tRNA),以及统称为非编码 RNA 的其他多种 RNA。其中在细胞质中发挥作用的一类非编码 RNA 是微小 RNA(microRNA);这些短链(21-26 个核苷酸)RNA 通过触发 具有互补序列的mRNA 降解和抑制其翻译来调控蛋白质的产生。其他非编码 RNA 在细胞核中扮演多种角色以调控基因表达。

图 2-2 分子生物学中心法则与细胞内囊泡运输的示意性总结。左侧,细胞核内双链 DNA 作为转录模板生成前体 mRNA,随着核苷酸在 3 端不断添加而延长。前体 mRNA 经过 5 端加帽、剪接去除内含子并连接外显子、 3 端多聚腺苷酸化等加工过程形成成熟 mRNA,随后被输出至细胞质。编码胞质蛋白和核蛋白(紫色)的 mRNA 在胞质游离核糖体上进行翻译(左侧分支);编码分泌蛋白(蓝色)或跨膜蛋白(绿色)的 mRNA 则与内质网(ER)结合的核糖体上进行翻译。右下角显示,跨膜蛋白和分泌蛋白在合成并跨内质网膜转运后,通过囊泡出芽方式离开内质网,经一系列囊泡融合与出芽步骤穿越高尔基体,最终运输至质膜。囊泡与质膜融合(胞吐作用)导致分泌蛋白释放到细胞外空间,同时将跨膜蛋白递送至质膜。 右上角,细胞外蛋白质(红色)或质膜上的跨膜蛋白质可通过质膜出芽形成囊泡(内吞作用)进入早期内体。其内容物可通过胞吐作用回收至质膜,或递送至晚期内体和溶酶体进行降解。内体与高尔基体之间还存在双向运输。大部分细胞内囊泡运输是沿着微管细胞骨架,利用分子马达进行的;我们将在2.3节讨论这些内容。
翻译发生在两个不同的位置之一,具体取决于真核细胞中蛋白质产物的目的地。定位于细胞质和细胞核的蛋白质在细胞质中的游离核糖体上合成,而 destined for export from the cell(分泌蛋白)或跨越膜脂双层的蛋白质(跨膜蛋白)则在与内质网(ER)——一个膜包围的区室网络(图 2-2,左)——相关联的核糖体上合成。
对于大多数分泌蛋白和定位于质膜的跨膜蛋白而言,其全部或部分序列在翻译过程中会跨过内质网膜进行转运。完全翻译后的蛋白质随后经历一系列通过细胞内囊泡的运输步骤,这些囊泡是细胞质中由膜包裹的小型细胞器。分泌蛋白和跨膜蛋白通过从内质网膜出芽形成囊泡离开内质网,并经由一系列囊泡融合与出芽事件穿过高尔基体。最终,携带这些蛋白质的囊泡通过称为胞吐作用的过程与质膜融合,使得分泌蛋白被释放到细胞外空间,而跨膜蛋白则被递送至质膜(图2-2,右下角)。
除了胞吐作用外,神经元(与许多其他细胞一样)还采用一种称为胞吞作用的过程,使细胞能够从细胞外空间回收液体和蛋白质,或从细胞质膜回收跨膜蛋白。胞吞产物首先被运送至早期内体,这是一种膜包裹的细胞器,负责携带新摄入的物质和新内化的跨膜蛋白。来自早期内体的蛋白质既可通过胞吐作用循环回质膜,也可被转运至晚期内体和溶酶体——这些细胞器含有用于蛋白质降解的酶(图2-2右上角)。在第三章中,我们将结合突触前神经递质释放和突触后神经递质受体调控的具体实例,深入研究胞吐作用和胞吞作用。
在遵循中心法则和细胞内囊泡运输规则的同时,神经元还具有特殊性质以适应其庞大的体积以及轴突或树突末梢与细胞体(胞体)之间的遥远距离。我们可以提出一个简单的问题:特定蛋白质,如神经递质受体或与突触前膜相关的蛋白质,是如何到达树突末梢或轴突终末的?这个“简单”问题的答案相当复杂,我们远未获得完整的解答。原则上,相应的 mRNA 可以在指导蛋白质合成之前被运输到最终目的地。或者,蛋白质可以在胞体处合成,然后通过被动扩散或主动运输方式抵达其最终位置。 对于跨膜蛋白而言,其递送途径可分为以下三种:(1) 携带该蛋白的细胞内囊泡可在胞体处与质膜融合,随后跨膜蛋白通过质膜扩散至目标位置;(2) 囊泡可沿树突或轴突运输,最终在目标位置与质膜融合;(3) 蛋白可先靶向至某个区室(轴突或树突)的质膜,再通过内吞作用转运至最终目的地,这一过程称为跨细胞运输。每种合成与运输机制均已被实验证实。这些机制的相对普遍性既取决于蛋白质类型,也取决于其靶向的神经元区室类型。我们将在后续两节中详细研究其中部分机制。
2.2 虽然部分树突和轴突蛋白由局部 mRNA 合成,但大多数蛋白质仍从胞体主动运输而来
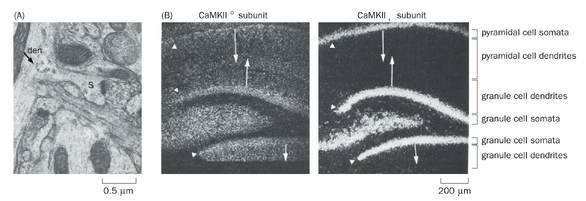
大量证据表明,编码特定蛋白质的 mRNA 被定向运输至树突分支,并在那里指导局部蛋白质合成。电子显微镜研究揭示了树突中存在多聚核糖体(核糖体簇),表明 mRNA 在此处进行翻译(图 2-3A)。原位杂交技术能够确定 mRNA 在原生组织中的分布(第 14.12 节),该技术已识别出树突中存在的特定 mRNA(图 2-3B)。这些定位于树突的 mRNA 编码多种已知在树突及突触后位点发挥功能的蛋白质,例如钙调蛋白依赖性蛋白激酶 II(CaMKII)的α亚基(图 2-3B,左图)、细胞骨架成分如肌动蛋白和微管相关蛋白 2(MAP2),以及神经递质受体。本章后续及第三章将再次讨论这些蛋白质中的许多成员。得益于高通量方法(如从树突区室分离 mRNA 进行 RNA 测序的技术,第 14.12 节),近年来树突定位 mRNA 的清单已大幅扩展。
除了多核糖体和 mRNA 外,在远端树突中也观察到了类似内质网和高尔基体的膜细胞器,这使得局部合成的跨膜蛋白和分泌蛋白能够像在胞体中一样经历分泌途径(图 2-2)。最后,通过多种体外实验制备,已直接证明了树突中的局部翻译过程。
树突中的局部蛋白质合成解决了几个问题:它减轻了长距离运输的成本,将特定蛋白质的生产空间聚焦于所需之处,并且,或许最有趣的是,允许蛋白质生产在树突树的特定区域受到调控。正如后续章节将讨论的,这种树突中的局部蛋白质合成能够快速响应突触信号而改变蛋白质翻译;这些局部合成的蛋白质进而帮助修饰突触信号,可能导致树突和突触的区域性重塑以响应突触活动。尽管与树突蛋白质合成相比研究较少,局部蛋白质合成在发育中和成熟的轴突中也有观察到。发育中轴突的局部蛋白质合成产物可能在轴突导向中扮演重要角色,这一过程我们将在第5章和第7章中详细研究。
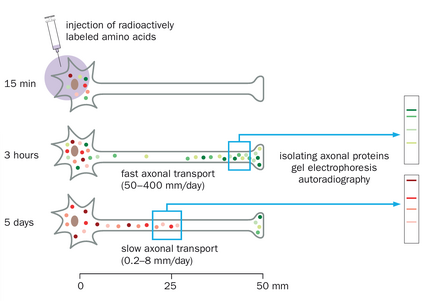
即便是对于已知在树突中合成的蛋白质,其 mRNA 亦通常在胞体中更为丰富(图 2-3B,左图),这表明它们也在胞体中合成。对于大多数蛋白质而言,mRNA 似乎主要存在于胞体(图 2-3B,右图)。那么这些蛋白质是如何到达它们在树突和轴突中的最终目的地呢?这一问题主要在轴突中得到了探索,因为实验上相对容易将远端轴突与细胞体分离。例如,可以将放射性标记的氨基酸注射到含有感觉或运动神经元胞体的区域,这些神经元的长轴突延伸至远处。注射后不同时间以及距离胞体不同位置处,可以从轴突中分离出含有这些放射性标记氨基酸的新合成蛋白质,并通过凝胶电泳等生化方法分析以确定其身份(图 2-4)。这些研究根据蛋白质在轴突中出现速度的不同,识别出了两大类蛋白质。快速组分以每天 50- 400mm 的速度运输 (0.6 - 5μm / s) ;这主要包括跨膜蛋白和分泌蛋白。 慢速组分以每天 0.2- 8mm 的速度移动;主要包括胞质蛋白和细胞骨架成分。这两种模式分别被称为快速轴突运输和慢速轴突运输。除了从细胞体到轴突末梢的顺向运输外,一些蛋白质(如通过内吞作用摄取的蛋白质)会以逆向运输方式从轴突末梢返回细胞体;逆向运输的速度与快速顺向轴突运输的速度相似。
是什么机制导致了轴突运输的不同模式?理论研究表明,轴突内的被动扩散速度过慢,甚至无法解释慢速轴突运输,这表明所有这些运输模式都是主动过程。尽管研究较少,但蛋白质和 mRNA 进入树突的运输可能也利用了类似的主动过程。为了理解主动运输的机制,并理解为何某些蛋白质被运输至树突而其他至轴突,我们需要考察神经元的细胞骨架组织。
2.3 细胞骨架构成神经元极性的基础并指导细胞内运输
与所有真核细胞一样,神经元依赖两种主要的细胞骨架元素来维持结构完整性和运动性——丝状肌动蛋白(F-肌动蛋白,亦称微丝)和微管。F-肌动蛋白由两条平行的肌动蛋白聚合物螺旋链构成,而微管是由 13 条平行原纤维组成的空心圆柱体,这些原纤维由 α 和 β 微管蛋白亚基构成(图 2-5)。大多数细胞还具有中间纤维,这类细胞骨架聚合物的直径介于 F-肌动蛋白( ~ 7 nm )和微管( ~ 25 nm )之间。脊椎动物神经元中最主要的中间纤维是神经丝,它们集中分布于轴突中,可增强细胞骨架的稳定性。
F-肌动蛋白和微管都是极性丝状结构,具有性质截然不同的正端和负端。与所有细胞一样,F-肌动蛋白主要集中于质膜附近。这包括成熟神经元中沿轴突和树突过程的质膜、突触前末梢和突触后树突棘,以及发育中神经元轴突和树突的生长锥。肌动蛋白亚基被添加到靠近质膜的 F-肌动蛋白正端,使得肌动蛋白聚合能够引起膜突起,负责细胞的形态动态和运动性。然而,F-肌动蛋白并不介导沿树突或轴突过程的远距离运输。微管占据轴突和树突过程的中心,因此是神经过程中发生远距离运输的细胞骨架要素。在大多数非神经元细胞中,较动态的微管正端指向外围,而较稳定的负端则位于细胞中心,锚定在微管组织中心。 神经元中的微管取向更为复杂,这有助于区分树突和轴突。
如第一章所述,信息通常从树突流向轴突。在拉蒙-卡哈尔最初提出该理论一个多世纪后,现有研究对神经元极性的细胞生物学基础——轴突与树突的区别——有深入理解。与信息接收相关的亚细胞结构和蛋白质,如神经递质受体,通常定位于树突。相反,与信息传递相关的结构和蛋白质,如突触小泡,则定位于轴突。这些过程主要通过神经元的不对称细胞骨架组织实现,该组织使得运动蛋白——将 ATP 水解产生的能量转化为沿细胞骨架聚合物移动的动力——能够将特定货物运输至特定目的地。

图 2-5 丝状肌动蛋白(F-actin)和微管是两种主要的细胞骨架成分。(A)F-actin 示意图,由两条螺旋链组成,重复单元为 37~nm 。(B)微管示意图。左图, α -和 β -微管蛋白异二聚体组装成纵向原纤维;右图,微管由 13 条平行原纤维构成管状结构,具有中空管腔(横截面如上所示)。(改编自 Alberts B, Johnson A, Lewis J 等[2015]《细胞分子生物学》热销版,Garland Science 出版)
微管在轴突和树突中的取向不同。在轴突中,微管以平行阵列排列,其正端指向远离细胞体、朝向轴突末端的方向,遵循"正端向外"的规则。然而,树突中的微管群体是混合的:在近端树突中,正端向外和负端向外的微管群体大致相当(图 2-6A)。迄今为止,这一规则适用于所有在培养和体内检查过的脊椎动物神经元。如第 1.7 节所述,大多数无脊椎动物神经元具有单一神经突从细胞体伸出,随后分出树突和轴突分支。线虫和果蝇中的某些感觉神经元具有明显的轴突和树突突起(类似于脊椎动物中的双极神经元)。在迄今检查过的无脊椎动物双极神经元中,树突似乎主要具有负端向外的微管,而轴突则具有正端向外的微管。因此,尽管细节可能有所不同,脊椎动物和无脊椎动物神经元都遵循树突和轴突在微管取向上存在差异的原则。
两种马达蛋白沿微管运输货物:(1) 胞质动力蛋白和(2) 一个称为驱动蛋白的大家族。动力蛋白是负向运动蛋白,因此它将货物从轴突末端运回细胞体。大多数驱动蛋白是正向运动蛋白,因此将货物从细胞体运输至轴突末端(图 2-6B)。在脊椎动物的树突中,动力蛋白和驱动蛋白均可介导双向运输,原因是存在两种极性的微管。用于树突局部蛋白质合成的 mRNA 以 mRNA-蛋白质复合物形式,通过动力蛋白和多种驱动蛋白在微管上进行运输(图 2-6A)。
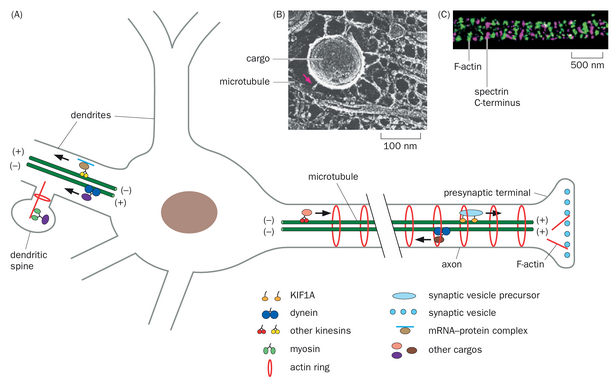
动力蛋白和驱动蛋白具有特定的蛋白质将它们与特定货物连接起来,一些驱动蛋白可能直接与货物结合。例如,突触小泡前体通过直接与一种名为 KIF1A 的特定驱动蛋白结合(图 2-6A),从细胞体运输至轴突末端。某些类型的驱动蛋白在轴突中高度富集,而其他驱动蛋白则能将货物运输至轴突和树突,从而提高了货物被递送到特定神经元区室的特异性。微管细胞骨架的不对称组织以及特定的马达蛋白-货物相互作用共同建立并维持神经元极性。其他促成神经元极性的因素包括轴突起始段对胞质蛋白和膜蛋白的扩散屏障。在第 7 章中,我们将探讨发育中的神经元如何启动极性。
体外运动研究表明,驱动蛋白和细胞质动力蛋白介导快速轴突运输。驱动蛋白可沿微管以约 2 μ m / s 的速度移动(见框2-1;视频2-2),其速度范围与快速顺向轴突运输相当(图2-4)。最新研究表明,驱动蛋白也介导慢速顺向轴突运输。然而,慢速运输的特点是运输间歇(货物被运输的时段)之间的停顿时间更长,而快速轴突运输则具有更长的运输时段和更短的停顿时间。在短暂的运输时段中,慢速运输达到的速度可与快速轴突运输相媲美。
框2-1:驱动蛋白是如何被发现的?
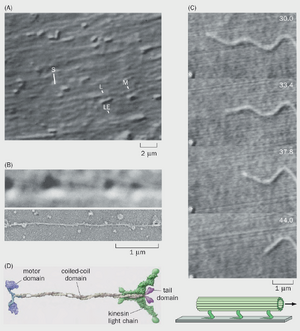
图 2-7 首个驱动蛋白的发现。(A) 完整鱿鱼巨大轴突片段的视频增强微分干涉对比(VE-DIC)显微图像显示,水平线性元件(LE,即微管)与轴突平行排列。在视频记录中,可见许多小型(S)、中型(M)和大型(L)细胞器沿线元件移动。(B) 上图:沿疑似单一运输细丝水平移动的细胞器的 VE-DIC 图像(取自挤压出的鱿鱼轴浆);下图:VE-DIC 研究后拍摄的同一视野电子显微图像,证实存在单根微管。光学显微镜下运输细丝的表观直径因衍射效应被放大至真实直径的约 10 倍 (25~nm) 。(C) 上图:向右移动的单根微管在玻片上的延时影像(右上角时间单位为秒),该玻片在ATP存在下固定有纯化自鱿鱼轴浆的可溶性组分。左下角标有星号的物体作为固定标记。底部示意图展示了从鱿鱼轴浆中提取的假定运动蛋白附着于玻璃和微管上的情况。多个同向排列的运动蛋白通过 ATP 水解导致微管相对于玻璃移动。(D)鱿鱼巨轴突中驱动蛋白的分子结构。 生物学的突破往往源于运用新技术和恰当的实验准备来解决重要而未解的问题。驱动蛋白的发现过程展示了这些要素的结合如何推动新发现。20 世纪 80 年代初,视频增强微分干涉对比(VE-DIC)显微镜的发明使得无需染色即可观察活体组织中的亚细胞器。当应用于鱿鱼巨大轴突——一种直径可达 1mm 的特殊轴突(我们将在本章后面研究动作电位时再次遇到这种轴突)时,VE-DIC 显微镜揭示了细胞器沿着轴突内部质膜下的丝状结构移动(图 2-7A)。此外,在轴突细胞质(轴质)被挤出后,同样观察到细胞器沿着无轴突膜包裹的轴质中的丝状结构移动。
挤出轴浆支持细胞器运动的能力为多种实验操作打开了大门。例如,研究人员可通过稀释轴浆来追踪细胞器沿单根纤维随时间移动的轨迹并测量其速度(视频2-2)。研究发现小细胞器的运输速度约为 2μm / s ,与通过追踪放射性标记蛋白在脊椎动物神经元体内测得的快速轴突运输速度处于同一量级(图 2-4)。研究人员可通过向轴质中添加化学物质或药物来研究其对细胞器运动的影响。当时已知基于肌动蛋白的马达蛋白肌球蛋白利用 ATP 水解为沿 F-肌动蛋白的运动提供动力,因此研究者测试了轴突运输是否同样需要 ATP 水解。他们发现当轴质中的 ATP 耗尽或加入不可水解的 ATP 类似物时,运动性被阻断,这表明细胞器沿轴质细丝的运动确实依赖于 ATP 水解。最后,通过使用 VE-DIC 显微镜对单根运输细丝进行运动性研究后,对同一细丝的电子显微镜分析(图 2-7B)提供了确凿证据:支撑细胞器运动的单根细丝正是单个微管。
这些研究表明,存在利用 ATP 水解产生的能量来驱动鱿鱼轴浆中细胞器运动的马达蛋白。实际上,正如微管能够支持细胞器移动一样,从鱿鱼巨大轴突中提取的含有假定马达蛋白的可溶性轴浆组分,在玻璃上固定后,也能在 ATP 存在的情况下促使单个微管移动(图 2-7C)。通过这一功能性实验,对鱿鱼轴浆进行生化纯化,鉴定出了一个能够在玻璃上支持微管运动的蛋白质复合物。从牛和鸡脑中纯化出的类似蛋白质复合物也展现出相同能力。该蛋白质家族的成员被命名为驱动蛋白(kinesin,源自希腊语 kinein,意为“移动”)。
我们现在知道,驱动蛋白是在所有真核生物中进化上保守的分子马达。最初从鱿鱼轴浆中纯化出的驱动蛋白复合体属于特定的驱动蛋白亚家族,由两条重链和两条轻链组成。每条重链具有一个 N 端球状结构域,该结构域包含微管结合位点和 ATP 酶;一个长的卷曲螺旋结构域,介导两条重链的二聚化;以及一个 C 端结构域,用于结合轻链和货物(图 2-7D)。生物化学和生物物理学研究揭示了驱动蛋白沿微管移动的详细机制(视频 2-3)。每个哺乳动物基因组约有 45 个编码不同驱动蛋白的基因,其中许多在神经元中表达,负责将不同货物运输至神经元的特定亚细胞区室(图 2-6)。人类驱动蛋白及相关蛋白(及动力蛋白)的突变是多种神经系统疾病的基础,突显了它们对人类健康的重要性。
微管是树突主干和轴突中不可或缺的结构组成部分,可被视为神经元中介导长距离运输的高速公路。然而,树突棘和突触前末梢通常不存在微管。当货物在近似目的地(如树突远端段)离开微管高速公路后,F-肌动蛋白利用庞大的肌球蛋白家族作为分子马达引导局部运输(图 2-6)。我们将在第 8.1 节中研究肌动蛋白与肌球蛋白相互作用在肌肉收缩背景下产生运动的机制。
利用超分辨率荧光显微镜(详见第 14.17 节)对轴突膜上的肌动蛋白细胞骨架进行检测发现,F-肌动蛋白以周期性环状结构分布,这些环状结构与血影蛋白网络相关联——血影蛋白是一种与质膜相连的细胞骨架成分(图 2-6C)。这些肌动蛋白环的周期约为 190-200 纳米,恰好低于传统衍射极限光学显微镜的分辨率,导致其直至最近才被发现。尽管在树突中及树突棘颈部亦发现肌动蛋白环的存在,但其出现频率远低于轴突。这些肌动蛋白环及其相关的血影蛋白网络可能为长轴突提供稳定性,并调控轴突直径。
总之,膜蛋白(与细胞内囊泡相关)以及定位于树突或轴突的胞质蛋白,通过与特定运动蛋白的相互作用被运送到目的地,这使得它们能够沿着微管进行长距离运输,有时则沿肌动蛋白丝进行局部移动。尽管我们已经掌握了运输规则的概要,但对于许多问题仍缺乏完整答案:运动蛋白与货物的选择是如何实现的?货物的装载和卸载是如何调控的?暂停与运行之间的转换受什么调节?为何某些运动蛋白更倾向于轴突?这些问题的答案将揭示每个神经元区室如何获得独特的专用蛋白质组合以执行其功能,从而不仅丰富我们对神经元细胞生物学的理解,还深化对神经元生理学和功能的认识。
2.4 通道和转运蛋白以被动或主动方式跨神经元膜运输溶质
我们迄今研究的机制关注于细胞内蛋白质和细胞器如何移动,但尚未涉及细胞外分子或离子如何通过质膜进入细胞。这需要一种不同类型的跨脂质双层的运输方式。质膜的脂质双层及细胞内囊泡的膜对大多数离子和可溶于水环境(如胞质溶胶或细胞外环境)的极性分子是不通透的。脂质双层作为重要的区隔边界,划分了细胞和细胞内细胞器,如内质网、高尔基体和突触囊泡。无机离子和水溶性分子——包括营养物质、代谢物和神经递质,统称为溶质——不易扩散穿过脂质双层,因此需要特定的运输机制来实现跨膜运输。跨脂质双层的运输对许多神经元功能至关重要,例如电信号传导。
特殊的跨膜蛋白负责在神经元及其他细胞的膜间运输溶质。这些膜运输蛋白可分为两大类:通道和转运体。通道具有水性孔道,当开放时允许特定溶质直接通过。本章后续部分将探讨离子通道,每种通道都允许一种或多种特定离子选择性通过。转运体则拥有两个独立门控,交替开闭,使溶质能从膜的一侧移动至另一侧(图 2-8A)。通常,溶质通过开放通道的速度远快于通过转运体。
通道和转运蛋白通常在特定条件下支持溶质单向跨膜净移动。不带电溶质从浓度较高一侧向浓度较低一侧移动,即顺其化学梯度方向。带电溶质(如离子)的跨膜移动会产生电势差,形成跨膜电化学梯度。这种结合化学梯度与电势梯度的电化学梯度决定了溶质净移动的方向与强度(图 2-9)。当电化学梯度与化学梯度同向时,二者共同强化溶质的驱动传输(图 2-9 中);而当两者方向相反时,其效应会部分(图 2-9 右)或完全抵消。溶质顺电化学梯度运输无需外部能量介入,称为被动运输(图 2-8A)。
某些转运蛋白能够利用外部能量,逆着溶质的电化学梯度(从低到高)将其跨膜运输;这一过程称为主动运输(图 2-8B)。主动运输的能量可来源于以下途径:(1)化学反应:最常见的形式是 ATP 水解,此时转运蛋白作为 ATP 酶,利用 ATP 水解产生的化学能用于驱动蛋白质的构象变化。(2)光:能量来源于光子吸收。由化学反应或光驱动的转运蛋白也称为泵。我们将在第 13 章讨论视觉进化背景下的光驱动泵。(3)偶联运输:当转运蛋白同时移动多种溶质时,从某些溶质顺梯度运输中获得的能量可用于将其他溶质逆另一梯度运输。偶联转运蛋白(也称为共转运蛋白)可分为两种类型:将溶质沿同一方向移动的称为同向转运蛋白,而将溶质沿相反方向移动的称为反向转运蛋白或交换蛋白(图 2-10;视频 2.4)。(与共转运蛋白类似,仅运输单一类型物质的转运蛋白也称为单向转运蛋白。)在下一节中,我们将遇到 ATP 驱动泵和共转运蛋白的具体例子,它们在建立跨质膜的不同离子的电化学梯度中发挥关键作用,这构成了神经元电信号传导的基础。

图 2-8 通道蛋白与转运蛋白介导被动和主动运输。(A)通道蛋白具有水性孔道,当通道开启时允许溶质直接通过;而转运蛋白则通过至少两个闸门的顺序开合来实现溶质跨膜转运。在无能量输入的情况下,溶质沿着电化学梯度(图 2-9)通过通道和转运蛋白移动,这称为被动运输。(B)转运蛋白也能利用能量介导主动运输,使溶质逆电化学梯度移动。(改编自 Alberts B, Johnson A, Lewis J 等[2015]《细胞分子生物学》第 6 版,Garland Science 出版社)

图 2-9 带电溶质(如离子)的电化学梯度。当膜两侧无电势差时,仅化学梯度决定离子移动方向,即从高浓度向低浓度移动(左图)。当膜两侧存在电势差时,化学梯度与电学梯度共同作用,决定离子移动方向及作用力大小。电化学梯度的这两个分量可能同向作用(中图)或反向作用(右图)。箭头粗细象征驱动离子移动的作用力大小。(改编自 Alberts B, Johnson A, Lewis J 等[2015]《细胞分子生物学》第六版,加兰科学出版社。)
2.5 神经元在静息状态下因跨质膜离子梯度和差异离子通透性而呈现极化
神经元以及其他可兴奋细胞(如肌肉细胞等能产生动作电位的细胞)中的电信号依赖于跨质膜的电势差。细胞内部与细胞外环境之间的这种电势差称为细胞的膜电位。我们可以通过将微电极插入细胞直接测量膜电位,这一过程称为细胞内记录。用于细胞内记录的微电极通常由玻璃制成,尖端极细并填充导电盐溶液,以便与细胞内部建立电接触;电极的另一端通过导线连接到放大器和示波器(具体参见图14-34及第14.20-14.21节关于不同的记录神经元活动的方法)。神经元在静息状态下的膜电位(静息电位)通常在 - 50 至 - 80 毫伏之间 (mV) ,具体取决于细胞类型(图2-11)。因此,神经元膜是极化的。细胞内电位向负值减小的方向变化称为去极化。细胞内电位向负值增大的方向变化称为超极化。

图 2-10 三种主动运输方式。主动转运蛋白可以是 ATP 驱动泵,利用 ATP 水解产生的能量逆电化学梯度运输溶质(左);光驱动泵,通过吸收光子获取能量(中);或偶联转运蛋白,借助第二种溶质顺其电化学梯度运输时释放的能量。偶联转运蛋白根据两种溶质运动方向相同或相反分为同向转运体和反向转运体。最右侧示意图总结了不同溶质的电化学梯度,符号数量越多表示电化学梯度越高。向下灰色箭头表示黄色圆圈所代表溶质的电化学梯度。(改编自 Alberts B, Johnson A, Lewis J 等人[2015]《细胞分子生物学》第六版,加兰科学出版社)

图 2-11 测量神经元的静息电位。(A)记录神经元静息状态下膜电位的示意图。示波器测量地线(细胞外环境中的电势)与电极尖端之间的电压差(V,单位为毫伏)。(B)在电极尖端插入细胞前,V 为零。插入后,V 下降至 -75 mV ,即我们模型神经元的静息电位。
神经元之所以呈现极化状态,原因在于:(1)细胞内与细胞外环境中的离子浓度存在差异;(2)质膜对三种主要离子的通透性各不相同(后续将了解到,通透性取决于传导特定离子的开放离子通道数量;当离子通道开放时,膜对一种或多种离子具有通透性;离子可双向流动,净通量由该离子的电化学梯度决定)。典型神经元中,细胞外空间的钠离子 (Na+) 和氯离子 (Cl- ) 浓度较胞质溶胶高出 10 至 20 倍,而细胞内钾离子 (K+) 浓度则比细胞外环境高 30 倍(图 2-12A),尽管这些数值会因神经元类型和动物种类而异。在神经元静息状态下,质膜对 Na+ 和 Cl- 的通透性较低,而对 K+ 具有相对较高的通透性。 (也就是说, K+ 比 Na+ 或 Cl- 更容易穿过神经元膜。)除了这两种阳离子(带正电荷的离子,如 K+ 和 Na+ )和一种阴离子(带负电荷的离子,如 Cl- )之外,还有一些有机阴离子在细胞内富集,但神经元膜通常对这些有机阴离子不通透。

图 2-12 静息电位的离子基础。(A)数字表示哺乳动物神经元内外 K+ 、 Na+ 和 Cl- 的典型浓度,单位为毫摩尔每升 (mM) 。在静息状态下,细胞膜对 K+ 具有通透性(箭头表示沿电化学梯度方向),但对 Na+ 和 Cl- 的通透性较低(虚线箭头)。静息膜电位主要由驱动 K+ 外向的化学梯度与驱动 K+ 内向的电学梯度之间的平衡决定。细胞膜两侧的 + 和 - 符号表明细胞内电势比细胞外环境更负。(B)左图显示, Na+ - K+ ATP 酶利用 ATP 水解产生的能量,每循环一次逆电化学梯度向外转运三个 Na+ 离子,向内转运两个 K+ 离子。 Na+ - K+ ATP 酶的活性通过抵消 Na+ 和 K+ 跨静息膜的泄漏,维持 Na+ 和 K+ 的细胞内浓度,从而保持静息电位。 是的, K+ - Cl- 共转运蛋白利用 K+ 沿其电化学梯度向下移动时释放的能量,将 Cl- 逆其电化学梯度向上移动,有助于维持跨膜的 Cl- 浓度梯度。
神经元膜两侧的离子浓度通过主动运输维持,主要由一种称为Na+ -K+ ATP 酶的转运蛋白负责。这种离子泵利用 ATP 水解产生的能量,将 Na+ 向外泵出, K+ 向内泵入,逆着各自的电化学梯度(图 2-12B;视频 2-5),从而维持这两种重要离子在静息膜两侧的浓度差异。据估计,神经元能量的三分之一或更多被 Na+ - K+ ATP 酶消耗,这既凸显了该特定泵的重要性,也表明了维持 Na+ 和 K+ 浓度梯度的重要性。 Cl- 梯度则由多种共转运体维持,例如耦合 K+ 与 Cl- 外排的 K+ - Cl- 同向转运体(图 2-12B)。
要理解化学梯度和膜电位如何影响离子移动,我们首先设想一种假设情况:膜仅对 K+ 具有通透性。(这种情况在胶质细胞中相当适用。)膜两侧的浓度差异导致 K+ 沿着其化学梯度向外扩散。然而,随着 K+ 向外流动,细胞内区域带负电性增强,从而增大了膜两侧的电势差。由于 K+ 带正电荷,这会阻碍 K+ 进一步向外扩散。最终,化学力和电力将达到 K+ 的平衡电位E。 K ′ EK ′ 膜电位达到电力和化学力相互平衡的状态,此时没有净离子流。EK EK 遵循能斯特方程:
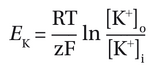
其中[K+]o和[K+]i分别为细胞外和细胞内 K+ 浓度,R 和 F 分别是气体常数和法拉第常数,T 是绝对温度(单位开尔文), Z 是离子 (+1 的价数(对于 K+ 而言),ln 是自然对数函数。在室温下,表达式 RT / F 约为 25mV. 。利用我们模型神经元的 K+ 浓度差(图 2-12A),我们可以计算出Ek约为 -85mV,相对于静息电位略有超极化。
能斯特方程也可用于确定 Cl- 和 Na+ 的平衡电位。利用我们模型神经元跨膜浓度差(图 2-12A),可计算出 E_Cl = - 79mV 和 E_Na = +58mV 。需注意,尽管 Cl- 的化学梯度与 K+ 相反,但由于带有负电荷 (z = - 1) ,其平衡电位与 K+ 相近。 Na+ 的正平衡电位意味着若细胞膜仅对 Na+ 通透,则细胞内膜电位将相对于细胞外环境呈正电性。我们将在本章后续研究动作电位的离子基础时看到这一现象的重要性。
实际上,大多数神经元的静息电位略低于 K+ 平衡电位,因为膜对 Na+ 和 Cl- 也具有一定通透性。当膜同时对多种离子具有通透性时,静息膜电位Vm Vm 在平衡状态下(即无净离子流动时),可通过 Goldman-Hodgkin-Katz(GHK)方程计算:
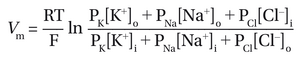
其中 PK,PNa,PCl分别是其透过性。本质上,GHK 方程表明,每种离子对静息电位的贡献是独立的,其权重取决于静息膜对该离子的渗透性。
由于膜电位通常与任何单一离子的平衡电位不完全相同,存在一种力推动每种离子进入或离开细胞。这被称为该离子的驱动力,它等于膜电位与该离子平衡电位之间的差值。如果膜仅对 K+ 具有渗透性(即 P_Na = 0 ,P_Cl = 0 ),那么Vm = EK 根据 GHK 方程; K+ 的驱动力将为 0,净电流为零,尽管 K+ 具有高渗透性。然而,PNa、PCl都不为0。由于 Cl- 的平衡电位通常非常接近静息电位, Cl- 在静息状态下因驱动力小而流动较小。另一方面, Na+ 的驱动力非常大,因为化学梯度和电学梯度均有利于其进入细胞。尽管 P 较小, Na+ 仍会沿着其电化学梯度向内渗漏 。这将使膜电位略微高于EK ,形成驱动力并导致 K+ 向外泄漏。如果不加以阻止,这些泄漏电流会逐渐降低细胞内 K+ 浓度并增加细胞内 Na+ 浓度;然而,它们通过 Na+ - K+ ATPase 的主动运输得到平衡,该酶泵出 Na+ 并泵入 K+ (图 2-12B)。因此, Na+ - K+ ATPase 维持细胞内 K+ 和 Na+ 的浓度,从而稳定神经元的静息电位。
2.6 神经元质膜可用电路术语描述
虽然离子无法自行穿过神经元质膜的脂质双层,但细胞内和细胞外环境均为支持离子运动的水溶液。我们可以使用描述电路的术语——即包含至少一条闭合电流通路的电子元件互连系统——来模拟神经元的功能。本节将介绍电路的基本组件和规则,这对后续章节中讨论神经元信号传递至关重要。
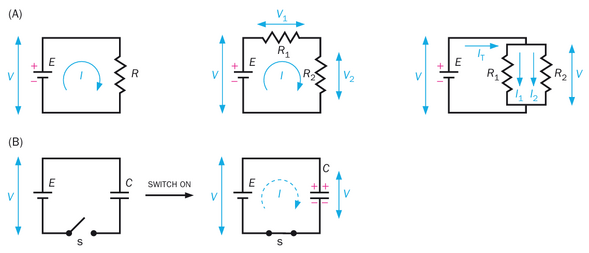
最简单的电路由两个电气元件组成:电池和电阻器。电池在其两个端子之间维持恒定的电压(电势差),从而提供能量源。电阻器实现电阻(即阻碍电流通过),并在电流通过时在其两个端子间产生电压(图 2-13A,左)。通过电阻器的电流(I,单位时间内电荷的流动)遵循欧姆定律:
I = V/R
其中, V 是电阻器两端的电压, R 是电阻器的电阻值。由于假设连接电池和电阻器的导线电阻为零,电阻器两端的电压与电池两端的电压相同。 I 、 V 和 R 的单位分别为安培(A)、伏特(V)和欧姆(Ω)。
当两个电阻器串联时(图 2-13A,中),通过每个电阻器的电流相同;两个电阻器两端的电压是各电阻器两端电压之和,即 V=V 1 +V 2 ;而组合电阻为 R=R 1 +R 2 在电生理学中,一个等效但更广泛使用的电阻衡量指标是电导(g),它是电阻的倒数: g = 1 / R 。因此,当两个电阻串联时,1/g=1/g 1 +1/g 2; 换言之,电导减小。当两个电阻并联时(图 2-13A,右侧),每个电阻两端的电压相同;总电流等于通过每个电阻的电流之和,即I = I1 + I2 ;组合电阻遵循公式 1 / 𝑅 = 1 / 𝑅 1 + 1 / 𝑅 2 1/R=1/R 1 +1/R 2 ,而总电导可计算为𝑔 = 𝑔 1 + 𝑔 2 g=g 1 +g 2 换言之,并联电阻的电导会增加。电导的单位是西门子(S)。根据电导的定义,欧姆定律也可以表示为:
I = gV
I = gV
需要注意的是,电阻器同时也是电流的导体,这两个术语根据上下文可以互换使用;高电阻的电阻器是较差的导体,而低电阻的电阻器则是良好的导体。
现在我们可以将这些简单的电路与我们目前所学的神经元知识联系起来。脂质双层是一种绝缘体,即电阻无限大的电阻器,因为它不允许电流通过。正如第2.5节所述,质膜并非完美绝缘体——即使在静息状态下,离子也能通过特定通道泄漏穿过膜。这些离子通道可被建模为并联的电流路径,每条路径包含一个具有特定电阻的电阻器和一个电池,该电池的电压相当于离子的平衡电位,插入跨膜电位之间。我们将在第2.7节详细讨论这一模型。在研究第2.8节中电信号沿神经纤维(树突和轴突)的传播时,我们还会遇到串联连接的电阻器。
另一个重要的电气元件是电容器,它由两个被绝缘体隔开的平行导体组成。电容器是一种电荷存储装置,因为它不允许电流通过绝缘体。质膜的脂双层结构,连同细胞外和细胞内环境,是电容器的绝佳实例。在一个由电池和电容器组成的简单电路中(图 2-13B),当开关闭合时,电流从电池流向电容器,直到电容器充电至与电池电压相等。正电荷在一个导体上积累,而负电荷在另一个导体上积累;这就是电荷存储的方式。电容(C),即电容器存储电荷的能力,定义为 C = Q / V ,其中 Q 是电容器两端电压为 V 时存储的电荷量。电容的单位是法拉(F),电荷的单位是库仑(C)。当两个电容器串联时,组合电容(C)遵循公式 1/C=1/C1 +1/C2 当两个电容器并联时,C = C1 + C2。
理论上,当电路没有电阻时(图 2-13B),开关闭合时电容器会瞬间充电。实际上,电路总是存在一定电阻。在包含电阻器和电容器的电路(RC 电路)中,开关闭合后,流经电阻器和电容器的电流会随时间变化。电阻与电容的乘积的量纲为时间,被称为时间常数(记为τ)。时间常数定义了电容器(如质膜)响应外部信号(如电流突然变化,这可能是由通道开放引起的)随时间充电或放电的速度。时间常数越大,电容器充电所需时间越长,电信号随时间分布越分散。
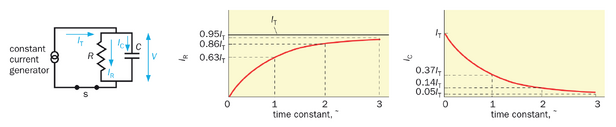
让我们通过分析一个并联的 R - C 电路来阐明时间常数这一重要概念(关于该主题的定量分析请参见框2-2)。在此电路中,电阻器与电容器并联连接至恒定电流源(图2-14左)。当开关闭合后,虽然电流总和 (I_T) 保持恒定,但流经电阻器的电流 (I_R) 和电阻器两端的电压 (V = I_RR) 会随时间增加(图2-14中),而流过电容器的电流 (I_C) 则随时间递减(图2-14右)。直观来看,这是因为电容器的作用是储存电荷,其两端电压需待电荷积累后才能改变——这个过程需要时间,且在并联路径中, R 和 C 两端的电压必须相同。时间常数 τ 作为时间 (x) 轴上的单位,定义了电信号随时间变化的快慢程度。电压在时间等于一个、两个或三个时间常数时分别达到峰值 63% 86% 和 95% (图2-14中图;推导这些值的方法参见专栏2-2)。
并联 R - C 电路在神经生物学中应用广泛,因为它能很好地描述神经元质膜的特性。离子通道起到电阻器的作用,而脂质双层与细胞外和细胞内环境共同构成电容器,以离子在膜表面聚集的形式储存电荷。虽然单位面积的膜电容基本保持恒定 (~ 1μ F / cm2) ,但膜电阻会随膜电位和时间发生显著变化。接下来我们将运用这些概念来研究离子跨神经元质膜的流动。
框 2-2:深入探讨并联 R-C 电路
在2.6节中我们曾遇到并联 R - C 电路(图2-14)。对于具有微分方程背景的学生,本节将推导这些电路的时间动态特性。
当并联电路连接到恒流源时(图2-14左侧开关闭合后),电流会随时间从电容器路径重新分配到电阻路径,但它们的总和保持不变。同时,电阻和电容器两端的电压均相等。因此,我们有 I_R(t) = I_T - I_C(t) = I_T - dQ / dt = I_T - CdV / dt = I_T - RCd_R(t) / dt. 。解此微分方程可得:
\beginarrayrl & I_R(t) = I_T\Big(1 - e-\fractRC\Big)\\ & V(t) = I_TR\Big(1 - e-\fractRC\Big)\\ & I_C(t) = I_Te-\fractRC \endarray
第一和第三个函数在图2-14的中部和右侧面板中以图形表示。例如, I_R(t) 增加到 63% (1 - e- 1) 86% (1 - e- 2) ,以及 95% (1 - e- 3) 的I。 T I T 有时相当于一个、两个和三个时间常数。
请注意,我们将并联的 R - C 电路连接到恒流源而非电池,因为这能更好地模拟神经元膜在电信号传递过程中的情况;输入可以模拟为恒流源的瞬时供应(离子通道的开启和关闭),而膜电位则随着离子通道的开启和关闭而持续变化。如果我们将并联的 R - C 电路连接到恒定电压的电池上,电容器会瞬间充电,使电路简化为仅含电阻的电路,如图 2-13A 所示。
2.7 电路模型可用于分析离子跨神经胶质细胞和神经元质膜的流动
在介绍了电路基础之后,我们通过两个例子来说明这些电路模型如何帮助我们理解电流跨膜流动。
首先假设膜仅对 K+ 具有通透性,这是对胶质细胞的良好近似。这相当于一个由两条并联路径组成的电路:一条 K+ 导电路径和一条膜电容路径(图 2-15A)。膜电容路径用电容器 (C_m) 表示。 K+ 导电路径

图 2-15 神经元质膜电路模型。(A)在简化模型中,膜仅对 K+ 具有通透性,质膜由两条平行路径组成:一条膜电容 (C_m) 路径和一条 K+ 路径。电阻器的电阻由电导的倒数表示,1 / 𝑔 K 一/克 K 该路径还配备了一个与 K+(E_K) 的平衡电位相对应的电池。由于 K+ 的平衡电位在细胞内为负值,因此电池的正极位于细胞外一侧。Vm Vm 膜电位。在静息状态下,由于没有净电流流动,Vm = EK Vm =易 K (B)在更为贴近实际的神经元模型中,质膜可被模拟为四条并联路径:一条用于膜电容,另外三条分别对应 K+ 、 Cl- 和 Na+ 。箭头标示了各路径内电流的方向,这些方向依据每种离子的平衡电位及图 2-12 中我们模型神经元的静息电位而定。需注意,尽管 Cl- 离子向内流动(因静息电位较我们模型神经元中 Cl- 的平衡电位更不具负电性),但 Cl- 所携带的电流却显示为向外流动;这是因为电路图惯例上将电流表示为正电荷的流动。因此,带负电离子(如 Cl- )所承载的电流被标示为与实际离子移动方向相反。(B,改编自 Hodgkin AL 与 Huxley AF [1952] J Physiol 117:500-544。)

有两个电气元件,一个电阻器和一个代表 K+ 平衡电位的电池。由于电阻是电导的倒数,电阻器用1表示。 / 𝑔 K 一/克 K ,其中𝑔 K g K 是 K+ 路径的电导。与膜电位串联的电池象征着驱动 K+ 沿此路径移动的电化学梯度。我们可以确定膜电位V。 m Vm 从 K+ 路径出发,作为电阻两端电压(I)的总和 K / 𝑔 K I K /克 K 根据欧姆定律,以及EK EK 在静息状态下, K+ 的流入与流出达到平衡,即 I_K = 0 。因此,Vm = EK + Vm =易 K + 也就是说,静息膜电位与 K+ 的平衡电位相同。
现在让我们考虑一个更贴近实际的神经元情况,其中细胞膜除了对 K+ 具有通透性外,还对 Cl- 和 Na+ 也具有通透性。我们可以在图 2-15A 的基础上增加两条平行路径,一条用于 Cl- ,另一条用于 Na+ (图 2-15B)。接下来,我们将展示V如何... m Vm 可以根据每种离子的电导和平衡电位来确定。在这个并联电路中,每条路径上的电压均为V。 m Vm 因此,我们得到三个方程:
\beginarrayrV_m = \fracI_Kg_K +E_K\\ V_m = \fracI_Clg_Cl +E_Cl\\ V_m = \fracI_Nag_Na +E_Na \endarray \tag1
根据这三个方程,我们有Vm ( 𝑔 K + 𝑔 C l + 𝑔 N a ) = EK 𝑔 K + E C l 𝑔 C l + E N a 𝑔 N a + 我 K + 我 C l + 我 N a Vm (g K +g 氯 +g 钠 )=EK g K +E 氯 g 氯 +E 钠 g 钠 +我 K 我 氯 我 钠 在静息状态下,穿过膜的净电流应为零。由于膜电位恒定,电容支路中的电流也为零。因此,
I_K + I_Cl + I_Na = 0 \tag4
因此,Vm Vm 可以推导为
V_m = \fracE_Kg_K + E_Clg_Cl + E_Nag_Nag_K + g_Cl + g_Na
其中, g 和 E 分别代表每种离子的电导和平衡电位。这实际上是第 2.5 节介绍的 Goldman-Hodgkin-Katz 方程的电路模型等效形式。然而,这个公式更为实用,因为电导和平衡电位比渗透性及第 2.5 节公式中使用的绝对离子浓度更容易通过实验测定。需要注意的是,电导和渗透性都用于描述离子跨质膜流动的难易程度,常可互换使用,但存在细微差别。渗透性是膜的内在特性,反映开放通道的数量(我们将在后续内容中详述),无论待传导的离子是否存在
其值都不会改变;而电导不仅取决于渗透性,还取决于离子的存在与否。
一旦我们确定了Vm Vm 我们还可以确定每条并联路径中的电流:
\beginarrayrI_K = g_K(V_m - E_K)\\ I_Cl = g_Cl(V_m - E_Cl)\\ I_Na = g_Na(V_m - E_Na) \endarray
请注意,括号中的数值代表每种离子的驱动力,其定义见第2.5节。因此,每种离子所携带的电流是该离子电导与其驱动力的乘积。正如我们将在本章后面学到的,𝑔 N a g 钠 和𝑔 K g K 膜电位变化作为函数,这种电压依赖性构成了动作电位产生的基础。我们将在第三章进一步了解到,突触传递是通过突触后膜电导响应突触前末梢神经递质释放的变化而介导的。
2.8 神经元的被动电学特性:电信号随时间演变并随距离衰减
在介绍了静息电位的离子基础以及神经元质膜的电回路模型之后,我们现在准备探讨电信号传导中的两个关键主题:神经元如何响应电刺激以及电信号如何在神经元内部传播。我们从一个理想化的神经元纤维(树突或轴突)实验观察开始,该实验总结了不同制备条件下的真实实验结果,并近似模拟了神经元树突的特性。在此实验中,一根连接电流源的电极被插入神经元纤维,使得实验者可以指令其向神经元纤维“注入”电流。我们称此电极为刺激电极。紧邻刺激电极插入膜内的是一个记录电极 (a) ,该电极连接放大器和示波器,以便记录由刺激电极注入电流所引起的膜电位变化。 另外两个记录电极 (b 和 c) 被沿着纤维以不同距离插入,远离刺激电极,以记录远端位置的膜电位(图 2-16A;视频 2-6)。
我们首先以矩形脉冲的形式注入一个小的去极化电流(即向神经元注入正电荷)(图 2-16B,左)。注入的电流将通过电极穿过膜并沿着纤维内部流动。我们观察到,在电流脉冲开始时,记录电极 a 处的膜电位逐渐去极化,并在电流脉冲结束时逐渐恢复到静息电位 (t_2) 。在更远的位置,电极 b 和 c 记录的膜电位也表现出类似的逐渐变化。然而,膜电位变化的幅度大大减小(图 2-16B,中和右)。
我们使用纤维的电路模型(图 2-16C)来解释这些结果。膜的每一段都可以建模为一个并联 R - C 电路(图 2-15B),其中图 2-15 中所有离子的膜电导合并为 𝑅。 m R m ,静息膜电位如同电池 E r E r ,以及膜电容为𝐶 m C m 过程的不同部分可以被建模为并联电路,通过纤维内部沿纵向轴离子移动的内部(或轴向)电阻相连接。离子在较大的细胞外环境中流动更为自由;因此,细胞外电阻通常被近似为零。
让我们考虑第一个观察结果:膜电位在响应阶跃电流脉冲时逐渐变化,这一点在电流注入点的记录中已经显而易见。除了引起跨膜离子流动(用I表示)之外, R I R 在电路图中,部分注入电流通过电容路径流动,为膜电容 (I_C) 充电。正如第2.6节所讨论的,

图 2-16 理想化实验中观察到的神经元被动电学特性。(A)实验制备示意图。刺激电极以矩形电流脉冲形式提供电信号源。三个记录电极以不同距离插入神经纤维。(B)当刺激电极发出矩形去极化脉冲时(左),三个记录电极位点的膜电位变化如图所示(右)。虚线表示时间( 𝑡 1 (t 1 和𝑡 2 t 2 与当前脉冲的起始和终止对齐。三个膜电位图的 y 轴具有相同的比例尺。两个特性显而易见:(1)膜电位变化对矩形电流脉冲的响应是渐进的;(2)膜电位变化的幅度和速度随距离衰减。(C)神经元纤维的电路模型。每个膜段近似为一个并联的 R - C 电路,包含一个膜电容𝐶。 m C m 膜电阻 (R_r) 整合了 K+ 、 Cl- 和 Na- (C);一层膜;以及代表静息膜电位的电池 (E_r) 。这些部分通过内部电阻(电阻为𝑅)相互连接。 r R r ),反映了神经元纤维内部或轴向的电阻;外部流体的电阻近似为零。电流注入通过开关(s)瞬时将细胞内一侧与恒定电流源连接来模拟。箭头指示由电流源注入正电荷所引起的电流方向,包括流入电阻分支 (I_R) 和跨膜电容分支 (I_C) 的电流,以及在神经元纤维内部流动的电流 (I_r) 。(改编自 Katz B [1966]《神经、肌肉与突触》,麦格劳-希尔出版社。)
我 R I R 遵循指数曲线,其乘积为𝑅 m 𝐶 m R m C m 作为时间常数(图2-14),膜电位的变化也是如此。时间常数越小,膜电位对电流注入的响应变化越快。这个实验揭示了神经元电信号传递的一个普遍特性。由于膜电容的存在,即使电流注入恒定,电信号也会随时间演变,其乘积𝑅 m 𝐶 m R m C m 作为这些时间动态的关键参数。这一特性限制了电信号的时间分辨率,但也为时间整合提供了可能:当两个独立信号在短时间内相继传递时,它们可能不会被解析为独立信号,而是被检测为一个整合信号。我们将在第三章关于树突整合突触输入的背景下进一步讨论这一点。
现在转向我们的第二个观察:膜电位变化的幅度随着距离电流注入点的增加而减小。假设电极 a 处对电流注入的最大膜电位变化为V。 0 V 0 这种膜电位变化沿纤维的传播由轴向电流承载,由于沿途通过膜电导持续泄漏电流,该电流逐渐减弱。一个简单的理解方式是进一步简化图 2-16C 中的电路,仅考虑导电路径(图 2-17A)。(这种简化相当于

图 2-17 展示神经元纤维上电信号衰减的电路模型。(A)在图 2-16C 的简化模型中,象征静息电位的电池被省略,因为此处仅考虑膜电位相对于静息电位的变化;电容器也被省略,因为仅考虑膜电位的峰值变化。在位置 C 处的电流注入引起峰值膜电位变化V 0 V 0 除了穿过膜 (I_m) 外,注入电流的一部分还会沿着神经纤维内部向两个方向扩散,形成内部电流 (I_i) (此处仅显示向右扩散的情况)。在此过程中,电流I的强度会... i I i 由于漏泄跨膜电流 (I_m) ,膜电位逐渐减小,这通过箭头长度的递减来象征。(B) 膜电位的变化沿纤维呈指数衰减曲线递减。 x 轴单位是神经元纤维的长度常数。在 1× 、 2× 和 3× 长度常数处的膜电位值分别为 0.37 V 0 0.37V 0 , 0.14 维 0 0.14伏 0 ,以及0.05 伏 0 0.05伏 0 分别。(改编自 Katz B [1966]《神经、肌肉与突触》。麦格劳·希尔出版社。)
(考虑到膜电容充电后膜电位变化的峰值幅度。)轴向电流 (I_i) 的幅度逐渐减小,因为部分电流由于膜电导而泄漏到外部。距离电极 a 为 x 处的膜电位变化 V(x) 由以下公式给出:
V(x) = V_0e-\fracx\sqrtdR_m / AR_i
其中𝑅 m R m 是单位膜面积的膜电阻,𝑅 i R i 是神经元胞浆单位体积的内部(轴向)电阻,而 d 是纤维的直径。该方程表示电信号随距离呈指数衰减(图 2-17B),类似于我们在第 2.6 节和专栏 2-2 中讨论的 R - C 电路中电流随时间指数衰减的情况。
术语𝑑 𝑅 m / 𝐴 𝑅 𝑖 dR m /AR i 被称为长度常数或空间常数(记为 \lambda )。它以长度单位表示;一个长度常数对应于膜电位变化的峰值幅度衰减至原始峰值幅度的 1 / e ,即约 37% 的距离。具体来说,在我们理想化的实验(图 2-16A)中,电极 b 和 c 的位置被选择为距离电极 a 1.5 和 3 个长度常数。长度常数越长,电信号在衰减到原始值的给定比例之前能够传输的距离就越远。如公式所示,长度常数随着膜电阻或神经元纤维直径的增加而增加。这是因为如果𝑅 m R m 随着电阻增加,更多电流将沿轴向路径流动(因为电流与电阻成反比), \lambda 将随之增大;同理,若电阻 i R i 随着纤维直径的增加(实质上相当于并联了更多电阻,从而降低了总电阻),通过𝑅的电流将会增大 m R m 因此增加了 \lambda 。实际上,动物进化出了多种策略来增加电信号传播的距离,例如增大纤维直径(如乌贼的巨大轴突)或提高单位膜电阻(如髓鞘形成);我们将在第2.13节更详细地讨论这些策略。
电信号的时间扩散及其随距离的衰减通常被称为神经元的被动电特性(与主动特性相对,我们将在下一节开始研究)。它们也被称为神经纤维的电缆特性,类似于跨洋电缆使用绝缘体将内部导体与外部的导电海水隔开来传输电信号。时间常数,表征了
表2-1:轴突、树突和肌肉细胞的时间与长度常数
<table><tbody><tr><td>纤维</td><td>直径(微米)</td><td>长度常数(毫米)</td><td>时间常数(毫秒)</td></tr><tr><td>乌贼巨大轴突</td><td>500</td><td>5</td><td>0.7</td></tr><tr><td>龙虾神经</td><td>75</td><td>2.5</td><td>2</td></tr><tr><td>青蛙肌肉 a</td><td>75</td><td>2</td><td>24</td></tr><tr><td>哺乳动物皮层锥体神经元的顶树突 b</td><td>3</td><td>1</td><td>~20</td></tr></tbody></table>
a 数据来自 Katz B(1966)《神经、肌肉与突触》。麦格劳-希尔出版社。长度常数在较大细胞外容积中测得。b 数据来自 Stuart G、Spruston N 和 Hausser M(1999)《树突》。牛津大学出版社。
电信号的时间传播特性和表征跨距离衰减的长度常数是神经元的两个关键被动电学特性。表2-1列出了在神经生理学史上具有重要地位的各种实验制备中测得的神经元和肌肉的时间常数与长度常数。我们将在后续章节中了解这些具体的实验制备方法。
2.9 神经元的主动电学特性:去极化超过阈值产生动作电位
从表2-1可以明显看出,若神经元仅具备被动特性,电信号将在传输过程中显著衰减。即使在直径很大的纤维中,长度常数最多也只有几毫米。这意味着信号仅传输几毫米就会衰减至原幅值的 37% 。那么电信号如何能在更远距离上实现保真传播?具体来说,信号如何可靠地通过人类运动神经元传输约一米的距离以控制脚趾肌肉?
要回答这个问题,让我们继续使用图 2-16A 中的装置进行理想化实验。通过刺激电极,我们向神经元纤维(这次是轴突,见图 2-18 顶部)注入不同大小和方向的阶跃电流脉冲。我们首先注入负电流,使膜电位超极化。由电极 a (图 2-18 底部)测量的膜电位变化幅度与注入的负电流大小成正比。如果我们改变符号,向轴突注入正电流,会发现膜电位去极化而非超极化。只要注入的正电流量较小,去极化程度同样与注入的正电流大小成正比。然而,当注入电流超过一定强度时,膜电位会出现更大且短暂的高幅上升。

图 2-18 去极化超过阈值导致动作电位产生。采用图 2-16A 所示的实验装置,通过刺激电极施加一系列矩形电流脉冲(顶部)。电极 a 记录到的相应膜电位变化显示在底部。 x 轴单位为 1 毫秒。无论是超极化脉冲还是前两个去极化脉冲(电流脉冲 1-4),膜电位变化均遵循电流脉冲的符号规律,且其幅度与电流脉冲幅度成正比。对于第五个电流脉冲,膜电位变化变得不稳定且在不同试验中存在差异(如多条曲线所示)。偶尔刺激会导致极大的去极化——即动作电位。而第六个电流脉冲始终会引发相同幅度的动作电位。(改编自 Katz B [1966]《神经、肌肉与突触》,麦格劳·希尔出版社。)
在部分试验中,电流注入达到一定强度时才会产生。超过该电流注入强度后,每个电流脉冲都会不可避免地引起膜电位的大幅瞬时升高,这被称为动作电位或峰电位。其产生机制是:当注入特定强度的正电流时,膜电位去极化超过特定水平——即阈值(参见视频2-6)。能够引发神经元产生动作电位的刺激称为超阈值刺激,而不能引发的则称为亚阈值刺激。
请注意,动作电位的大小一旦达到阈值,便不会随去极化程度的增加而改变。此外,若电极 a 记录到一个动作电位,图 2-16A 中的电极 b 和 c 也会记录到幅度与波形相似的动作电位。换言之,动作电位的传播几乎没有衰减。与第 2.8 节讨论的电信号被动扩散不同,动作电位是神经元的一种主动电特性。正如我们将在本章后续内容中了解到的,神经元的主动电特性源于离子电导的电压依赖性变化。
并非所有神经元都会发放动作电位:有些神经元即便在轴突中也仅使用分级电位来传递电信号。根据先前对长度常数的讨论,这类神经元必然具有较短的轴突;我们将在第四章脊椎动物视网膜中看到此类神经元的实例。还需注意的是,主动电特性并非轴突独有:某些神经元的树突同样表现出主动特性;我们将在第三章详细讨论这些特性。
动作电位是如何产生的?它们又是如何沿轴突传播的?本章下一部分我们将重点探讨神经元信号传递中的这些基本问题。
电信号如何从神经元胞体传播至轴突末梢?
在本章的这一部分,我们将沿着发现之路,追溯导致我们当前理解动作电位产生与传播机制的历程。这些研究不仅解答了神经元通信中的一个关键问题——电信号如何从神经元胞体传播至轴突末梢,还确立了离子通道的概念,并揭示了离子通道发挥作用的具体机制。
2.10 动作电位由去极化诱导的内向电流触发
动作电位的离子基础发现,是科学突破如何源于新方法、模式生物和分析工具引入的绝佳例证。枪乌贼属(Loligo)拥有直径可达 1mm 的巨大轴突,其尺寸远超邻近轴突(图 2-19A)或典型哺乳动物神经元的轴突。这种巨大轴突能极速传导动作电位,并控制乌贼的喷水推进系统,使其得以迅速逃离危险。巨大轴突的粗直径还使研究人员能够插入电极,比以往更精确地测量动作电位(图 2-19B)。在此类测量过程中,发现动作电位上升期的膜电位远超零值(图 2-19C),这表明动作电位并非由膜短暂破裂导致膜电位归零所致——这一观点在此前测量中被广泛接受。
在动作电位的峰值,观察到膜电位接近 Na+ 平衡电位。(回顾图2-12中我们的模型神经元 E_Na = +0.8mV 。)这一发现表明膜具有优先性

图 2-19 利用乌贼巨轴突研究动作电位。(A)乌贼巨轴突横截面的电子显微照片,展示其大直径(本样本为 ~ 180 μm ),与邻近轴突(例如 * 所指轴突)形成对比。(B)插入直径接近 1 mm 的乌贼巨轴突的电极照片。(C)通过细胞内电极记录的乌贼巨轴突动作电位。(A,由 Kay Cooper 和 Roger Hanlon 提供;B,引自 Hodgkin AL & Keyes RD [1956] - Physiol 131:592-616;C,引自 Hodgkin AL & Huxley AF [1939] Nature 144:710-711。经 Springer Nature 许可使用。)

图2-20 验证动作电位上升相由 Na+ 通量引起的假说。当正常细胞外液(海水,红色轨迹)被替换为 33% 海水与 67% 等渗葡萄糖溶液时(因此细胞外 Na+ 浓度或[ N a + ] 0 [钠 + ] 0 被 67% 蓝色轨迹所示减少。重新施加海水(绿色轨迹)后,动作电位的幅度和速度得以恢复。(改编自 Hodgkin, A. & Katz B [1949] J Physiol 108:37-77。)
在动作电位峰值时对 Na+ 具有通透性,且内向的 Na+ 流负责动作电位的上升相。为验证这一假设,系统性地降低了细胞外 Na+ 浓度。若 Na+ 确实负责动作电位的上升相,根据能斯特方程可预测:随着细胞外 Na+ 浓度的降低,动作电位的幅度会减小。实验结果确实如此(图2-20)。
但细胞膜如何变得对 Na+ 具有通透性?一个重要的概念突破是认识到去极化可诱导膜对 Na+ 的通透性增加,而 Na+ 的内流又导致进一步去极化。这种自我强化过程(正反馈循环)能够解释动作电位上升相期间观察到的膜电位快速变化。
2.11 Na+ 与 K+ 电导的顺序性电压依赖性变化是动作电位的形成机制
为了测试去极化是否能使轴突膜对 Na+ 更具通透性,定量测量在模拟动作电位条件下跨膜离子流动至关重要。然而,跨膜离子流会改变膜电位,而膜电位的变化又可能影响离子的通透性,从而使离子流动的测量变得复杂。为此引入了电压钳技术这一新方法,以简化对电压变化引起的离子流动的测量(图2-21)。电压钳通过比较细胞内膜电位与实验者设定的指令电压,自动生成反馈电流注入细胞,使细胞内膜电位迅速调整至指令电压值。在通常以指令电压阶跃变化形式进行的初始刺激后,通过记录维持膜电位于特定值所需注入的电流量,即可测量由膜电位变化引起的跨膜离子流。
利用电压钳技术,艾伦·霍奇金和安德鲁·赫胥黎在1950年左右进行了一系列经典实验,以确定动作电位的离子基础。通过使乌贼巨大轴突经历去极化电压,他们得以剖析构成动作电位基础的离子流组成。重要的是,将膜电位保持恒定值消除了电容电流(即响应膜电位变化而充电的电流)。
电压变化,相当于I c I c 在图 2-16C 中,以便他们能够测量跨膜的离子电流(相当于I) R I R 在图 2-16C 中观察它们随时间的变化。例如,一个去极化步骤产生了初始的内向电流,随后是外向电流(图 2-22,绿色轨迹)。(根据电生理学惯例,内向电流是阳离子净流入细胞或阴离子净流出细胞;外向电流则相反。)当细胞外的钠被胆碱(一种带有与钠相似电荷但无法穿透膜的有机离子)替代时,内向电流被消除(图 2-22,蓝色轨迹)。这一发现表明初始内向电流确实是由钠内流引起的。因此,通过比较两种条件下的差异可以计算出钠电流(图 2-22,红色轨迹)。其他证据表明,在胆碱替代的情况下,剩余电流是由外向钾通量引起的。
电压钳技术还允许在一系列不同电压下系统性地测量 Na+ 和 K+ 的电导。如第2.7节所述,电导是通过膜的电流与驱动力(即膜电位与平衡电位之差)的比值。因此, Na+ 和 K+ 的电导可由下式给出:
\beginarrayrg_Na = \fracI_NaV_m - E_Na\\ g_K = \fracI_KV_m - E_K \endarray
其中I N a I 钠 和I K I K 图2-22中测量的 Na+ 和 K+ 电流,Vm Vm 膜电位为,而E N a E 钠 和 EK EK Na+ 和 K+ 的平衡电位。通过改变 Vm Vm (等于V) C M D V 命令提示符 通过电压钳实验测量电流,霍奇金和赫胥黎得以实验性地测定𝑔 N a g 钠 和𝑔 K g K 在不同膜电位下,他们发现 Na+ 和 K+ 的电导均随细胞内膜电位去极化而增强,且这些电导变化随时间演变(图2-23)。
霍奇金和赫胥黎从这些实验中得出了几个关键发现。首先,他们证实动作电位的上升相是由 Na+ 的流入引起的,并确定 Na+ 的流入是由于膜去极化导致 Na+ 电导迅速增加所致。其次,在初始去极化引起的增加之后,尽管去极化持续, Na+ 电导总会减少(图 2-23A),这解释了 Na+ 电流的下降相(图 2-22,红色轨迹)。这被称为 Na+ 电导的失活。第三,去极化还导致 K+ 电导增加,引起 K+ 外流。重要的是, K+ 电导的变化滞后于 Na+ 电导的变化(图 2-23B)。第四, Na+ 和 K+ 电导似乎彼此独立,但都依赖于膜电位。 早在膜运输的分子机制被揭示之前,这些发现就为现代离子通道概念——即作为跨膜蛋白质对特定离子具有选择通透性(第2.4节)——奠定了基础。特别是在乌贼巨轴突中,存在对特定离子具有选择通透性的通道

图2-21 电压钳技术示意图。通过插入乌贼巨轴突的蓝色导线测量膜电位 (V_m) ,并与轴突外的接地导线作对比。随后将其与实验人员设定的指令电压 (V_CMD) 作为两个不同输入信号,共同接入电压钳反馈放大器(大三角形符号)。两电压之间的差值 (V_CMD - V_m) 会生成反馈电流作为放大器输出,该电流通过第二根注入导线(红色)导入轴突。当V C M D = 维 m V 命令提示符 =Vm ,不存在反馈电流。在电压V发生阶跃变化时, C M D V 命令提示符 反馈电流迅速改变Vm Vm 到新的V C M D V 命令提示符 (在微秒内)。因此,电压钳使实验者能够控制Vm Vm 所研究的轴突部分,并同时测量维持V所需的反馈电流量 m Vm 至V的值 C M D V 命令提示符 ;该反馈电流的大小等于流经轴突膜的电流(平行红色箭头所示)。反馈电流的方向可正可反(即红色箭头可反向),具体取决于V的相对值。 m Vm 和V C M D V 命令 .

图 2-22 通过电压钳实验分离 Na+ 和 K+ 电流。顶部,对乌贼巨轴突施加了 56mV 的电压阶跃增加。中部,通过测定需向轴突注入多少电流以维持轴突膜电位于实验者设定的指令电压( +56mV 阶跃),测量了去极化电压阶跃下单位面积轴突膜的离子流动。绿色轨迹显示生理条件下的电流流动:初始内向电流(轨迹向下部分)后跟随外向电流(轨迹向上部分)。虚线标示零净电流。蓝色轨迹显示外部 Na+ 大部分被无法跨膜的胆碱 + 替代条件下的电流流动;此轨迹仅显示 K+ 电流。底部,红色轨迹代表推导出的 Na+ 电流,即绿色与蓝色轨迹之差。改编自 Hodgkin AL & Huxley AF [1952] J Physiol 116:449-472。

图 2-23 电压依赖性 Na+ 和 K+ 电导变化。 Na+ (A)和 K+ (B)电导(y 轴,单位为毫西门子每平方厘米)在从静息电位进行去极化电压阶跃后随时间变化。进行了一系列测量,每次测量在不同幅度的电压阶跃后进行(每条轨迹上标注)。随时间推移, Na+ 电导先增加后减少,而 K+ 电导仅增加,但比 Na+ 电导的初始上升更缓慢。更大的电压阶跃导致两种电导更快速地上升。(改编自 Hodgkin AL & Huxley AF [1952] J Physiol 116:449-472。)
Na+ 或 K+ 允许这些离子通过膜流动。当轴突去极化时,这些离子通道的电导增加。这些通道现在被称为电压门控离子通道,因为它们的电导随膜电位的变化而改变。
总而言之,动作电位可通过 Na+ 与 K+ 电导性的连续变化来解释(图2-24;视频2-7),我们现在知道这些变化是由电压门控 Na+ 和 K+ 通道的开启与关闭引起的。在静息状态下,电压门控 Na+ 和 K+ 通道均处于关闭状态。(另一组 K+ 通道负责静息时的 K+ 通透性。)在动作电位的上升阶段,当膜去极化时,电压门控 Na+ 通道的开启允许 Na+ 沿其电化学梯度流入细胞。去极化还会导致 K+ 外流增加(通过静息 K+ 通道),因为新的、较小的电梯度产生的力量在抵消化学梯度产生的力量方面效果减弱。当 Na+ 内流超过 K+ 外流时,神经元便超过了触发动作电位的阈值。(对于大多数可兴奋细胞,阈值比静息电位高 10 - 20mV 。)进一步去极化会导致更多电压门控 Na+ 通道开启,从而引起进一步去极化。 这种正反馈循环产生了动作电位的快速上升阶段。
在下降阶段, Na+ 通道在初始开放后失活,阻止了进一步的 Na+ 内流。同时,电压门控 K+ 通道打开,允许更多的 K+ 外流。这两个事件共同构成了动作电位的下降阶段,使神经元能够重新极化至静息电位,并为下一个动作电位做好准备(图2-24)。实际上,根据

图 2-24 动作电位离子基础概述。(A)动作电位示意图,参照静息电位及 Na+ 与 K+ 的平衡电位。(鱿鱼巨大轴突的 K+ 平衡电位和静息电位相较于图 2-12 中的模型神经元更为去极化。)(B)动作电位期间 Na+ 与 K+ 电导的连续变化(根据图 2-23 数据计算得出)。两图共享同一 X 轴。上升相由 Na+ 电导增加引起,导致 Na+ 内流。下降相则归因于 Na+ 电导失活(终止 Na+ 内流)及 K+ 电导增加(引发 K+ 外流)。上升相与下降相的转换发生在上升相达到 Na+ 平衡电位之前。 下降阶段会超过静息电位并接近 K+ 平衡电位,随后膜电位逐渐恢复到略高于 K+ 平衡电位的静息状态(详见第 2.5 节)。(改编自 Hodgkin AL & Huxley AF [1952] J Physiol 117:500-544。)
通过电压钳实验的测量,霍奇金和赫胥黎建立了一个定量重现动作电位动态特性及其多种性质的模型(详见第14.30节)。重要的是,最初在乌贼巨轴突中发现的动作电位离子基础,适用于包括人类在内的大多数动物界的神经元及其他可兴奋细胞。
2.12 动作电位具有全或无特性、自我再生特性,并沿轴突单向传播
霍奇金-赫胥黎模型令人满意地解释了动作电位的若干特性,这些特性确保了信息从胞体到轴突末梢的忠实传递。
首先,动作电位是全或无的。当刺激引起的神经元膜去极化低于阈值时,动作电位不会发生。当去极化超过阈值时,动作电位的波形由 Na+ 和 K+ 电导变化的时机以及细胞内外 Na+ 和 K+ 的相对浓度决定,这些对于任何特定神经元来说大多保持恒定。(动作电位期间 Na+ 的内流和 K+ 的外流导致细胞内 Na+ 和 K+ 浓度的变化非常微小,细胞外的变化则更小。)在初步近似中,动作电位对任何超阈值刺激都呈现相同的形式。
其次,动作电位具有再生性——它们在传播过程中幅度不会衰减。假设动作电位发生在轴突的某个特定位置。上升期会产生显著的膜去极化,这种去极化沿轴突向下传播,使相邻区域达到阈值,进而又对其下游相邻区域产生相同作用,如此类推(图2-25)。通过这种方式,动作电位以相似的形式持续且忠实地沿着轴突向其末端传播。
第三,动作电位在轴突中单向传播,从细胞体向轴突末端行进。当动作电位发生在轴突的某一位置(例如图 2-25 中的位置 A)时,理论上,去极化不仅会沿着轴突向下传播至轴突末端(位置 B),也会向上传播至细胞体(位置 Z)。然而, K+ 通道的延迟激活与 Na+ 通道的失活相结合,在动作电位刚发生后形成了一段不应期,在此期间无法再次引发动作电位。由于动作电位通常起始于轴突起始段,并在到达 A 之前经过 Z,因此另一个动作电位无法立即从 A 反向传播至 Z。这一不应期确保了动作电位通常仅从细胞体沿轴突向末端传播,而不会反向进行。
在大多数投射神经元中,其轴突与远处的目标神经元形成突触连接,动作电位首先在轴突起始段产生,该区域单位膜面积的电压门控 Na+ 通道密度最高;这种高通道密度降低了动作电位启动的阈值。轴突起始段是整合去极化和超极化信号的关键部位。

图 2-25 动作电位传播示意图。此图展示了动作电位沿轴突传导时的电信号事件快照。波前位于 A 点,此处电压门控 Na+ 通道打开并使膜去极化。轴突内 A 点的正电荷扩散至 B 点,将在该处引发超过阈值的去极化。因此,下一时刻波前将抵达 B 点。波前刚经过的 Z 点正处于不应期,此时 K+ 通道的延迟激活与 Na+ 通道的失活共同阻止动作电位由 A 向 Z 反向传播。红色与蓝色箭头分别表示 Na+ 内流与 K+ 外流。弯曲箭头代表因 Na+ 内流形成的左右回路电流。下方电荷标识表示轴突不同区段的膜电位。
来自树突和细胞体的突触电位;这一整合过程将在第3.24节进一步讨论。动作电位一旦启动,便会单向沿着轴突向其末端传播。然而,在启动点,动作电位原则上可以双向传播;实际上,在某些哺乳动物神经元中,动作电位可以逆向传播至树突,这些树突与轴突一样,含有电压门控的 Na+ 和 K+ 通道。在实验者电刺激轴突或其末梢的人工情境下,动作电位可以从轴突末梢向细胞体逆向传播,产生所谓的逆向峰电位,这些峰电位可在细胞体处记录到。然而,在体内生理条件下尚未发现逆向峰电位的发生。
总而言之,这三种特性使得动作电位成为将信息从神经元胞体可靠地远距离传递至轴突末梢的理想方式。但由于动作电位遵循“全或无”原则,其大小无法编码刺激信息。相反,信息通常通过动作电位的频率(单位时间内动作电位的数量)或响应刺激的时序进行编码(参见第1.8节)。脉冲频率受不应期限制。某些神经元,如哺乳动物皮层中的快速放电抑制性神经元,每秒可发放高达 1000Hz 次脉冲,即每毫秒产生一次动作电位;这些动作电位之间的间隔短于许多神经元的不应期。这需要特化离子通道,使动作电位能快速复极化,并在下一个动作电位到来前完成不应期。 因此,离子通道特性(如 Na+ 通道失活和 K+ 通道延迟开启)在进化过程中被选择以确保动作电位的单向传播,而具有高放电率的神经元则采用具有快速动力学的特殊离子通道。广泛的可能放电率范围扩展了单个神经元的信息编码能力。
2.13 动作电位在直径较大的轴突和有髓鞘轴突中传播更快
动作电位的传播速度并非所有神经元类型都相同,而是取决于轴突的特性。这是因为去极化沿轴突传播的速度由轴突的电缆特性决定。回到我们神经元膜的电路模型(图 2-16C 和图 2-17A),可以看到该速度取决于膜电位变化对膜电容充电的快慢,以及向前流动与泄漏到细胞外环境的电流相对分布。若其他特性相同,这些数值将是轴突直径的函数:轴突直径越大,轴突的轴向电阻越低,向前流动的电流比例越大。这一点可以从长度常数λ的公式推导得出,该常数等于𝑑 𝑅 m / 4 𝑅 𝑖 dR m 四 R i (第2.8节)。因此,直径 (d) 越大,长度常数就越大,去极化就能在超阈值水平传播得更远,从而在更远的部位产生下一个动作电位。这就是为什么鱿鱼和其他一些动物进化出了直径巨大的巨轴突,以实现快速的逃避行为。
原则上,增加𝑅 m R m (单位面积的膜电阻)也能增加长度常数。然而,增加𝑅 m R m 同时增加了时间常数(等于𝑅) m 𝐶 m R m C m ;第2.8节)需要沿途对膜进行充电,这会减慢动作电位的传播。一种补偿方法是同时减小𝐶。 m C m 膜电容。实际上,这正是轴突髓鞘化的原理。许多脊椎动物的轴突被髓鞘包裹,髓鞘由胶质细胞的胞质延伸层构成——在外周神经系统(PNS)中是施万细胞,在中枢神经系统(CNS)中是少突胶质细胞。一些大型无脊椎动物的轴突也具有髓鞘(参见第 13.7 节)。胶质细胞的胞质延伸多次缠绕轴突,大部分胞质被挤压出延伸部分并移向胞体,形成由紧密排列的胶质细胞膜组成的致密髓鞘。

图 2-26 轴突髓鞘化提升动作电位传导速度。(A)脊髓轴突横截面的电子显微照片,显示少突胶质细胞膜包裹轴突。中央为单个被髓鞘包裹的轴突。(B)大鼠视神经的荧光显微图像,通过免疫染色技术可视化三种蛋白质(免疫染色方法详见第 14.12 节)。 Na+ 通道(绿色)高度聚集于郎飞氏结中心区域。 K+ 通道(蓝色)分布于郎飞氏结外周。其间存在名为 Caspr 的跨膜蛋白(红色),协助调控结区通道分布。(C)动作电位在郎飞氏结间跳跃传导示意图。当动作电位在左侧郎飞氏结产生后,正电荷迅速向右流动至相邻结区。这是因为髓鞘包裹使得结间膜具备低电容特性(减少充电需求)和高电阻特性(仅允许少量电流泄漏,如虚线箭头所示)。 正电荷到达右侧节点引起快速去极化,超过阈值后在该处重新产生动作电位。红色箭头表示电流方向,该电流因左侧节点 Na+ 内流而形成回路。为简化起见,左侧节点向左传播去极化所形成的回路未予显示。(A 图由 Cedric Raine 提供。B 图改编自 Rasband MN & Shrager P [2000] J Physiol 525:63-73。)
膜(图 2-26A)。从电路角度而言,致密髓鞘相当于多个串联电阻,使得总膜电阻𝑅 T R T 等价于 𝑛 𝑅 m nR m 其中, n 表示胶质膜的层数。然而,在串联连接中,总电容 𝐶 T C T 等价于 C_m / n (回顾第2.6节可知,两个串联电容器的总电容遵循 1 / 𝐶 T = 1 / 𝐶 1 + 1 / 𝐶 2 1/𝐶 T =1/C 1 +1/摄氏度 2 ;六个相同电容器串联时的总电容遵循公式 1 / 𝐶 T = 𝑛 / 𝐶 1 一/丙 T =n/C 1 或 C_T = C / n )。因此,髓鞘化极大地增加了膜电阻,从而增加了长度常数,而不会增加时间常数(因为乘积𝑅 T 𝐶 T R T C T 与原始𝑅相比保持不变 m 𝐶 m R m C m 这意味着,一旦轴突上的特定位置产生动作电位,去极化会传播至较远距离,从而引发动作电位的远端再生。
尽管髓鞘增加了膜电阻,仍有少量电流从有髓轴突中泄漏。因此,具有规律间隔(通常相隔 200μm 至 2mm )的郎飞结至关重要,这些节点的轴突表面暴露于细胞外离子环境,并富含高密度的电压门控 Na+ 和 K+ 通道(图 2-26B)。由于这些通道的活动,去极化电流在节点间快速传播,而动作电位仅在郎飞结处“更新”(图 2-26C)。因此,有髓轴突中的动作电位从一个节点跳跃至另一个节点。这被称为跳跃传导(源自拉丁语 saltare,意为“跳跃”),与无髓轴突中的连续传播形成对比(图 2-25)。
髓鞘化显著提高了动作电位的传导速度和高频放电能力。在有髓鞘轴突中,动作电位的传播速度可达 120m / s ,而无髓鞘轴突仅为 < 2m / s 。尽管无髓鞘轴突通常直径较小(见专栏 2-3),但仅凭直径差异无法解释传导速度的巨大差距。跳跃式传导还能节约能量——由于除朗飞结外几乎不存在跨膜电流, Na+ - K+ ATP 酶泵出 Na+ 和泵入 K+ 的需求大幅降低。鉴于髓鞘对脊椎动物(包括人类)轴突正常传导至关重要,髓鞘异常会导致多种重大神经系统疾病,如多发性硬化症和夏科-马里-图斯病(详见专栏 2-3)。
2.14 膜片钳记录技术能够研究单个离子通道的电流流动
对乌贼巨轴突动作电位的研究揭示了存在专门的 Na+ 和 K+ 离子通道。这一观点后来得到特异性阻断 Na+ 或 K+ 通道的毒素特性研究证实。最著名的
专栏2-3:健康与疾病中的轴突-胶质细胞相互作用
轴突髓鞘化是胶质细胞与神经元之间密切互动的一个显著例证。在中枢神经系统的白质中,每个少突胶质细胞通常会伸出数个突起,为多个轴突形成髓鞘(图 1-9)。而在周围神经系统中,每个施万细胞通常专门包裹单个轴突的一段。在发育过程及成体重髓鞘化期间,少突胶质细胞和施万细胞的突起如螺旋般多次缠绕轴突,并挤压突起层间的细胞质,从而形成髓鞘(图 2-27A)。
轴突与胶质细胞以多种方式相互作用。例如,如第六章将讨论的,体感系统包含不同类型的感受神经元,这些神经元具有特征性的轴突直径、髓鞘化程度及动作电位传导速度。髓鞘的厚度与轴突大小相匹配。支配肌肉并提供快速运动反馈调节的感觉神经元拥有大直径轴突、较厚的髓鞘,并能更快地传导动作电位。感知触觉的感觉神经元则具有中等轴突直径和传导速度。许多感知温度和疼痛的感觉神经元无髓鞘,传导动作电位较慢。尽管如此,这些无髓鞘轴突仍与雷马克施万细胞相关联,后者的细胞质延伸至单个轴突之间形成雷马克束(图 2-27B)。在此,胶质细胞的作用仅是隔离单个轴突,而非支持跳跃传导。
是什么决定了轴突是否应该被髓鞘化,以及如果应该,其程度如何?这些问题在周围神经系统中已得到解答。一种名为 III 型神经调节蛋白-1(Nrg1-III)的轴突细胞表面蛋白起着关键作用:表达高水平 Nrg1-III 的轴突与厚的髓鞘相关联,表达中等水平 Nrg1-III 的轴突则被薄髓鞘化,而表达低水平 Nrg1-III 的轴突则与雷马克束相关联(图 2-27B)。Nrg1-III 作用于雪旺细胞上的 erbB 受体复合物,指导它们的分化,包括髓鞘相关蛋白的表达和轴突的螺旋包裹。Nrg1/erbB 信号传导对于少突胶质细胞的髓鞘化并非必需,这表明中枢神经系统中存在替代性的轴突-胶质细胞信号。雪旺细胞和少突胶质细胞也向轴突发出信号,为其健康和完整性提供长期支持。
髓鞘形成对人类健康的重要性,通过众多脱髓鞘疾病得以凸显。这类疾病中,髓鞘受损导致郎飞结间电阻降低,并破坏结区离子通道的有序排列(图2-26)。这会减慢甚至阻断动作电位的传导,引发感觉、运动和认知功能缺损。脱髓鞘疾病可由多种因素引起,包括攻击胶质细胞的自身免疫反应,以及髓鞘功能必需蛋白的基因突变。
最常见的中枢神经系统脱髓鞘疾病是多发性硬化症(MS),这是一种成人发病的炎症介导性疾病,全球每 3000 人中就有 1 人患病。MS 的典型特征包括免疫细胞破坏髓鞘导致白质中形成炎性斑块。多数 MS 患者始于复发缓解型阶段,期间患者会在伴有神经系统症状的炎症性脱髓鞘与症状缓解期之间循环往复。

图 2-27 雪旺细胞对轴突的包裹及其受神经调节蛋白信号调控的示意图。(A)示意图展示雪旺细胞包裹轴突的连续步骤:形成螺旋状延伸,并在质膜层间压缩细胞质以形成髓鞘。(B)上部分:大直径轴突表达最高水平的三型神经调节蛋白-1(NRG1-III),指导形成较厚的髓鞘。中间部分:中等直径轴突表达中等水平的 NRG1-III,指导形成较薄的髓鞘。下部分:小直径无髓鞘轴突表达最低水平的 NRG1-III,指导其与雷马克雪旺细胞相互作用,形成雷马克束。(改编自 NavEKA & Salzer JL [2006] Curr Opin Neurobiol 16:492-500。经 Elsevier Inc.许可使用。)
框2-3:续
髓鞘再生与恢复。随后的阶段以持续的神经系统症状和进行性恶化为特征,这一过程通常不可逆转。尽管异常免疫反应明显起着主要作用,但多发性硬化的病因大多仍不明确。某些基因变异(如主要组织相容性位点)会带来风险,但环境因素似乎起着重要作用。得益于近期开发的抑制中枢神经系统髓鞘免疫破坏的药物,如今首次确诊多发性硬化患者的生命预后远优于几十年前。
与多发性硬化症(MS)相比,人们对周围神经系统(PNS)脱髓鞘疾病的机制了解更为深入,因为许多此类疾病是由特定基因的遗传突变引起的。夏科-玛丽-图斯病(CMT)(由 J. M. 夏科、P. 玛丽和 H. H. 图斯于 1886 年首次描述)是最常见的 PNS 遗传性疾病,每 2500 人中就有一人受影响。CMT 患者表现出随年龄增长而加重的感觉和/或运动缺陷,且呈长度依赖性(即远端肢体症状最为严重)。数十种不同基因的遗传变异导致了症状相似的各种 CMT 类型。部分 CMT 相关基因作用于雪旺细胞。例如,最常见的 CMT 类型(CMT1A)源于染色体片段的重复,导致外周髓鞘蛋白 22(PMP22)过度表达。CMT1B 则由编码髓鞘蛋白零(MPZ)的基因突变引起。PMP22 和 MPZ 均为跨膜蛋白,在雪旺细胞中大量表达,并参与紧密髓鞘的形成。 CMT1X 是由编码间隙连接通道(框 3-5)的基因突变引起的,该通道在施万细胞中表达,通过建立髓鞘膜间的捷径,可促进分子从核周区域向髓鞘内层的运输。部分 CMT 基因在轴突中发挥作用,编码多种蛋白质,如神经丝蛋白及参与线粒体融合和蛋白质翻译的蛋白。对这些 CMT 基因的研究有助于我们理解髓鞘形成的正常生物学过程以及脱髓鞘疾病的发病机制。
神经生物学的基础研究与神经系统疾病的研究能够极大地相互促进。在本书中,我们将多次遇到这种协同作用的例子,并在专注于脑部疾病的第12章中详细探讨其中的许多案例。
河豚毒素(TTX)(图 2-28)是一种强效阻断多种动物电压门控 Na+ 通道的毒素,被广泛用于实验性抑制神经元放电。例如在乌贼巨轴突记录中,施加 TTX 可模拟原始霍奇金-赫胥黎实验(图 2-22)中用胆碱+替代 Na+ 的效果。其他药物如四乙铵(TEA)能选择性阻断电压门控 K+ 通道。使用这些药物的实验为存在特异性离子通道提供了证据。
对离子通道存在的直接支持及单个通道特性的表征,源于 20 世纪 70 年代末一项名为膜片钳记录技术的重要创新(详见第 14.21 节及专栏 14-3)。该技术最初形式现称为细胞贴附式记录——通过使用尖端带有微小开口的玻璃电极(称为膜片电极),与完整细胞质膜上的微小区域形成高阻抗密封。这种高阻抗密封被称为吉欧密封,因其电阻超过 109 欧姆,从而有效阻隔电极与细胞外液之间的离子流动。在进行膜片钳记录时,实验人员可对膜片电极施加电压钳制,该电压对应于电极下方微小膜片的细胞外电位。通过该微小膜片(有时仅含单个离子通道)的离子流可被独立解析和研究(图 2-29A)。
例如,当对培养的大鼠肌肉细胞应用细胞贴附式膜片钳技术时,单个通道的开启和关闭可作为离散事件被检测到。当单个通道响应膜片去极化而开启时,会产生一个大小为 - 1.6 皮安(图 2-29B 中圈出)的单位内向电流。将数百条此类单通道记录轨迹进行时间上的叠加与平均后,重建出了一个类似于霍奇金-赫胥黎电压钳记录的“宏观” Na+ 电流集合,具有特征性的电压依赖性开启及随后的失活过程(图 2-30B,底部;与图 2-22 底部轨迹对比)。因此,该实验揭示了 Na+ 电导在单分子水平上电压依赖性变化的生物物理基础:每个电压门控 Na+ 通道以离散状态存在,即开启或关闭,并伴随随机转换;单个通道处于开放状态的时间比例

图 2-28 河豚中的河豚毒素(TTX)。河豚(上图)体内共生的细菌会产生河豚毒素(TTX,下图),这是日本料理中的珍馐,需精心烹制。TTX 是多种生物电压门控 Na+ 通道的高效阻断剂。(图片由 Brocken Inaglory/维基百科提供。)

图 2-29 利用膜片钳技术研究单个 \mathttNa+ 通道的离子流动。(A)细胞贴附式膜片钳可记录肌肉膜小片区域的离子流动。该配置类似于图 2-21 所示的电压钳示意图。膜片钳微电极具有双重功能:测量电极电压V p V p 并通过反馈电路注入电流,使得V p V p 与指令电压 (V_CMD) 相匹配。为了使得V p V p 以匹配V C M D V 指令 可通过电流监测器测量的 CMD,等同于流经贴片吸管下离子通道的电流 (I_p) 。(B)作为对施加于贴片吸管(顶部)的去极化步骤 (V_p) 的响应,电流会穿过贴片( 我 p (我 p ,中间)。展示了九次独立电流测量的轨迹。 Na+ 通道开放表现为向下的矩形步进(例如,第一、第二和第四条轨迹上的圆圈标记),这是因为带正电的 Na+ 离子离开记录移液管并流入细胞。300次测量的平均值 I p 300I p 底部轨迹类似于通过传统电压钳测得的宏观 Na+ 电流,包括电压依赖性的激活与失活过程。在这些记录中,移液管溶液中加入了 K+ 通道阻断剂,以阻断可能存在于膜片上的 K+ 通道的离子流动。(改编自 Sigworth FJ 与 Neher E [1980]《自然》287:447-449。经 Springer Nature 许可使用。)
是开放的并且能够传导电流——即通道的开放概率——会因去极化而暂时增加。
请注意,在实验中每个通道的开放呈现类似方波的形态,这意味着通道通常直接从非传导(关闭)状态转变为传导(开放)状态,而不经过中间状态。还需注意,尽管单个通道会突然完成从关闭到开放的转变,但并非所有通道都在膜电位改变后立即开放,并且它们随后会通过明显的失活过程迅速关闭。实际上, Na+ 和 K+ 通道在去极化诱导的开放概率延迟上的差异,解释了动作电位期间 Na+ 和 K+ 电导上升的时间差异(图 2-24B)。
通常,特定离子通过神经元膜片所携带的电流 (I) 可以通过以下公式从单通道特性中确定:
I = NP_oγ (V_m - E)
其中 N 表示存在的通道总数,𝑃 o P o 单个通道的开放概率为Vm Vm 膜电位为, E 是该离子的平衡电位(因此 V_m - E 是驱动力),而 γ 是单通道电导。与我们第2.7节学到的电流与驱动力之间的关系相比,我们发现乘积 NP_oγ 等同于宏观电导 g 。因此,跨神经元膜的离子电导是(1)膜上存在的通道数量,(2)每个通道的开放概率,以及(3)单通道电导的乘积。如前所述,开放概率𝑃 o P o 是膜电位和时间的函数,而单通道电导 γ 则是通道蛋白的一种物理属性,可随其离子环境的变化而改变。
2.15 离子通道编码基因的克隆使得研究其结构-功能关系成为可能
随着分子生物学革命在 20 世纪 80 年代扩展至神经科学领域,离子通道作为独立蛋白质的分子结构在编码特定离子通道的基因被克隆后得以确定。能够克隆一个基因需要以下一种或多种方法:(1) 纯化相应蛋白质,利用其氨基酸序列推断其核苷酸序列,并设计探针筛选 cDNA 文库(由克隆的 cDNAs 或互补 DNAs 组成,这些是从特定组织提取的 mRNA 模板合成而来),(2) 识别基因产物存在缺陷的突变体,并运用分子遗传学技术追踪致病基因,或(3) 在宿主细胞中表达候选基因产物(通过 cDNA 文库的分区表达),并利用功能测定来确认基因产物的存在。如果蛋白质来源丰富,

图 2-30 电压门控 N\mathbfa+ 与 K+ 通道的一级结构。(A)电压门控 N\mathbfa+ 通道由四个重复模块构成。每个模块包含六个螺旋跨膜段(TMs),其中第四 TM(红色)带有带正电荷的氨基酸,在电压感应中起关键作用。孔道环及相邻的第五和第六 TM 共同构成离子传导孔(绿色)。该结构最初源自电鳗的电压门控 N\mathbfa+ 通道(参见 Noda M, Shimizu S, Tanabe T 等人[1984]《自然》312:121-127)。(B)电压门控 K+ 通道蛋白类似于电压门控 N\mathbfa+ 通道四个重复模块中的一个;注意第四 TM 中带正电荷的氨基酸及第五与第六 TM 之间的孔道环。四个此类亚基构成功能性通道。该结构最初通过对果蝇 Shaker 基因进行定位克隆后鉴定的 K+ 通道得出(参见 Papazian DM, Schwarz TL, Tempel BL 等人[1987]《科学》237:749-753 及 Tempel BL, Papazian DM, Schwarz TL 等人[1987]《科学》237:770-775)。(源自 Yu FH 与 Catterall WA[2004]《科学信号传导》253:re15) 经美国科学促进会许可;改编自 Sato 等人[2001]《自然》409:1047。
并且拥有功能性检测方法(如高亲和力配体)来检测生化组分中该蛋白质的存在,蛋白质纯化途径便成为可能;事实上,正是这一途径促成了首批 Na+ 通道的克隆。
电压门控 Na+ 通道蛋白最初是从电鳗(Electrophorus electricus)中纯化出来的,其发电器官密集分布着 Na+ 通道。(电鳗利用发电器官通过大电流电击猎物。)从纯化的电鳗 Na+ 通道蛋白中获得的肽序列被用于识别编码这些蛋白的 cDNA,随后电鳗 cDNA 被用于鉴定包括哺乳动物在内的其他生物中的同源基因,从而确定了它们的完整氨基酸序列。这些研究揭示了一个高度保守的一级结构(图 2-30A):从无脊椎动物到哺乳动物的动物体内,电压门控 Na+ 通道均由四个重复模块组成,每个模块包含六个跨膜段。这种结构保守性解释了为何如 TTX 等毒素能阻断整个动物界的 Na+ 通道。第四个跨膜段,称为 S4,含有许多带正电荷的氨基酸,被假设为检测通道门控电压变化的传感器。 位于第五和第六跨膜段(S5 与 S6)之间的疏水性氨基酸序列在膜内形成了一个额外的孔道环。正如我们将在 2.16 节详细了解到的那样,孔道环、S5 和 S6 共同构成了离子传导的中心孔道。
尽管电压门控 Na+ 通道的研究得益于电器官,但缺乏类似富集的 K+ 通道来源以及 K+ 通道的整体异质性使得它们难以采用类似的生化方法进行研究。幸运的是,对果蝇(Drosophila melanogaster)的遗传学研究为克隆编码 K+ 通道的基因提供了替代策略。一种名为“Shaker”的果蝇突变体——之所以如此命名,是因为突变果蝇在乙醚麻醉下会抖动腿部——在肌肉和神经元中表现出快速瞬态 K+ 电流的缺陷,以及动作电位复极化的缺陷。这些发现导致了一种假设,即 Shaker 突变果蝇中的 K+ 通道被破坏。对 Shaker 基因座对应 DNA 的位置克隆(详见第 14.6 节)识别出了第一个电压门控 K+ 通道(图 2-30B)。有趣的是,这种 K+ 通道蛋白类似于 Na+ 通道四个重复模块中的一个;正如每个
在这些模块中,它拥有六个跨膜段,包括带正电荷的 S4 和孔道环。后续研究表明,四个这样的多肽(亚基)共同构成一个功能性的 K+ 通道。
离子通道的克隆促进了结构与功能研究,这些研究探索了通道特性背后的分子机制。其中一种特性是电压门控通道的失活,这有助于动作电位的复极化阶段。通过强制不应期(第 2.10 和 2.11 节),动作电位得以单向传播。20 世纪 70 年代的生物物理学研究提出了一个球链失活模型,该模型假设通道蛋白的一个胞质部分(球体)通过多肽链与通道其余部分相连,在离子通道打开后阻塞通道孔。进一步假设认为,去极化不仅打开通道,还导致带电氨基酸移动,形成一个带负电荷的内部通道孔,这将促进带正电荷球体的结合(图 2-31A)。
这种球链模型在电压门控 Shaker 通道中得到了优雅的验证,该通道的失活机制与电压门控通道相似。通过采用名为体外诱变的分子生物学技术改变克隆 Shaker 基因的 DNA 序列,研究人员能够表达经过特定氨基酸序列删除、插入或替换的 Shaker 蛋白。这项工作揭示了 Shaker 通道胞质 N 端结构域对快速失活至关重要。删除该结构域中一段氨基酸序列后,突变通道在去极化诱导通道开放后无法实现快速失活。而补充含有胞质域前 20 个氨基酸的多肽就足以恢复该功能。

图 2-31 电压门控离子通道失活的分子机制。(A)电压门控 Na+ 通道失活的球链模型。去极化使通道开放,同时移动带电氨基酸,导致通道内孔带更多负电荷,形成与带正电的胞质结构域部分(即球体)的结合位点。球体与内孔结合使通道失活。(B)Shaker K+ 通道(ShB 亚型)的诱变研究支持球链模型。在膜片钳实验中,野生型 ShB 通道(上图)在初始去极化诱导开放后失活,并在持续 -50 mV 去极化状态下保持关闭。当 ShB 中 6-46 位氨基酸被删除时(中图),通道呈现缺陷性失活,去极化后仍保持开放。通过提供由胞质结构域前 20 个氨基酸组成的可溶性球肽(下图),可纠正突变通道的失活缺陷。 (C) 与野生型通道(第四列)相比,从连接球体与通道其余部分的链中删除 15、9 和 7 个氨基酸(分别为前三列)会缩短通道平均开放时间。而在该链上增加 41 个氨基酸(复制第 31-71 位氨基酸,第五列)则会延长通道平均开放时间。(A 图改编自 Armstrong CM 与 Bezanilla F [1977] J Gen Physiol 70:567-590;B 图和 C 图改编自 Hoshi T、Zagotta WN 与 Aldrich RW [1990] Science 250:563-538 以及 Zagotta WN、Hoshi T 与 Aldrich RW [1990] Science 250:568-571。)
恢复该突变 K+ 通道的失活状态(图 2-31B)。因此,前 20 个氨基酸对应球状结构域。正如球链模型所预测的,前 20 个氨基酸中的几个带正电荷氨基酸对失活过程至关重要。此外,缩短链长——即前 20 个氨基酸与通道其余部分之间的多肽连接段——会使通道在失活前开放时间缩短,而延长链长则会增加通道保持开放状态的持续时间(图 2-31C)。这些数据表明,链的长度决定了球状结构域寻找开放通道的"搜索"时间。这个例子展示了结合分子生物学和电生理学理解离子通道功能机制的巨大潜力。
2.16 结构研究揭示离子通道特性的原子基础
离子通道是卓越的分子机器。电压门控 K+ 通道每秒可传导多达 106K+ 个离子,接近 K+ 的扩散速率,同时对 K+ 保持高度选择性:该通道传导 Na+ 离子的数量比 K+ 离子少 ~ 10,000 倍。通道的传导和离子选择性核心在于孔环结构(图 2-31B)。体外诱变研究表明,孔环中的突变会改变离子选择性。随后利用 X 射线晶体学进行的原子分辨率结构研究揭示了离子传导与选择性的详细机制。
K+ 通道孔环的氨基酸残基从细菌到人类高度保守。因此,细菌 K+ 通道 KcsA 的晶体结构——首个在原子分辨率上确定结构的离子通道——揭示了 K+ 传导与选择性的机制,这些机制可能具有普遍性。KcsA 通道虽非电压门控,却与电压门控 K+ 通道的部分结构相似:四个 KcsA 亚基各含仅两个跨膜螺旋(相当于电压门控 K+ 通道亚基的跨膜段 S5 和 S6)及位于两者之间的孔环,其中部分形成孔螺旋(图 2-32A)。从侧面看,该通道呈圆锥形。

图 2-32 KcsA(一种细菌 K+ 通道)的原子结构。(A)从细胞外侧面观察 KcsA 通道。四个亚基(不同颜色表示)各由两个跨膜螺旋和一个较短的孔道螺旋(黄色亚基中标示部分)构成。一个绿色 K+ 离子正在穿过中央孔道。(B)从侧面看,KcsA 通道呈锥形漏斗状。水相通道从细胞内侧延伸至脂质双层中部的中央空腔。图中显示三个 K+ 离子,一个位于空腔内,两个位于上方的选择性过滤器中。灰色阴影表示从侧面观察的通道蛋白。在此侧视图中可见四个孔道螺旋中的两个,其带负电的羧基末端朝向空腔,以稳定带正电的 K+ 离子。(C)选择性过滤器的原子结构。主多肽链羰基的氧原子(红点)在选择性过滤器内形成四个 K+ 结合位点。 在每个结合位点, K+ 离子被八个氧原子包围,正如水合的 K+ 离子在底部所示空腔中被水分子中的八个氧原子包围一样。这种模拟使得 K+ (而非较小的 Na+ )的传导在能量上更为有利,从而提供了一种离子选择性的机制。(A 和 B 部分,摘自 Doyle DA, Cabral JM, Pfuetzner RA 等人[1998]《科学》280:69-77,经美国科学促进会许可使用。C 部分,改编自 Zhou Y, Morais-Cabral JH, Kaufman A 等人[2001]《自然》414:43-48,经施普林格·自然许可使用。)
漏斗状结构(图 2-32B),其通道中央有一个空腔,用于容纳水合 K+ 离子。(溶液中的离子,包括 K+ 和 Na+ ,通常以水合形式存在。)四个孔螺旋的负电性羧基末端朝向空腔,稳定经过的 K+ 离子。当通道开放时,细胞内水合 K+ 可自由进入空腔。在空腔与细胞外侧之间是选择性过滤器, K+ 离子以脱水形式通过此处。这是通过 K+ 与主多肽链上对应 K+ 通道最保守氨基酸的负电性羰基相互作用实现的。这些紧密的羰基相互作用模拟并替代了溶液中 K+ 离子周围的水分子,完美匹配 K+ 离子的尺寸但不适合较小的 Na+ 离子。这解释了 K+ 通道高度离子选择性的特性及 K+ 通过开放通道传导的有利能量学(图 2-32C;视频 2-8)。 在选择性过滤器中, K+ 有四个可能的位置,通常由两个 K+ 离子交替占据。当通道开放且存在驱动力(电化学梯度)时,两个 K+ 离子之间的排斥力促使 K+ 快速通过选择性过滤器。
继对 KcsA K+ 通道的开创性研究之后,许多离子通道(见框 2-4)的结构,包括真核电压门控 K+ 和 Na+ 通道(图 2-33),已通过 X 射线晶体学以及近年来的冷冻电子显微镜(cryo-EM)技术得以解析。电压门控 K+ 和 Na+ 通道的整体结构彼此相似,反映了它们在一级结构上的共性(图 2-30)。 K+ 通道的四个亚基以及 Na+ 通道的重复单元各自在其外围拥有一个电压感应域(由跨膜段 S1-S4 构成),并在通道中心设有一个孔道域(由 S5、孔道环和 S6 组成)。在这两种情况下,一个单元的电压感应域会扣紧相邻单元的孔道域(图 2-33A、B)。富含正电荷氨基酸的 S4 段(图 2-30)感知去极化后,会使电压感应域在脂质双层内移动,从而引发构象变化。

图 2-33 电压门控 K+ 与 Na+ 通道的结构。(A)通过 X 射线晶体学测定的大鼠电压门控 K+ 通道跨膜段组织示意图,从细胞外侧观察。该结构呈现四重对称性,反映了构成通道的四个相同亚基。每个亚基(以独特颜色标示)具有六个跨膜段。S1-S4 段构成电压感应域(VSD),而 S5、孔道环和 S6 段构成孔道域。这两个结构域通过 S4-S5 连接体相连。需注意,一个亚基的 VSD 会扣合在相邻亚基的孔道域上——例如红色亚基的 S4 最接近蓝色亚基的 S5。(B)人体骨骼肌特异性电压门控 Na+
与辅助亚基 β 1 复合的通道结构,通过冷冻电镜技术解析。从 N 端到 C 端的四个重复单元分别以灰色、黄色、绿色和青色表示,其中 β 1 的跨膜区段呈金色,第三与第四重复单元间的连接区域为橙色。跨膜区段的排布方式与电压门控 K+ 通道相似。(C)图 B 同一结构的侧视图,仅显示两个重复单元的孔道区段(S5、孔环、S6)。紫色圆点标示出不对称的渗透路径。(A 图改编自 Long SB, Campbell EB & MacKinnon R (2005) Science 309:903-908,经 AAAS 许可使用;B、C 图改编自 Pan X, Li Z, Zhou Q 等(2018) Science 362:eaav5486,经 AAAS 许可使用。)
孔道结构域发生构象变化,导致离子传导孔道开启。电压感应域与不同单元孔道域之间的紧密相互作用,促进了孔道域响应膜电位变化的协同构象改变。
与由四个相同亚基组成的电压门控 K+ 通道的四重对称性不同,电压门控 Na+ 通道中的电压感应域和离子渗透路径排列是不对称的(图 2-33B、C),这反映了该通道由四个同源但非相同的重复单元构成。此外,在 K+ 通道中, K+ 离子以脱水形式通过选择性过滤器,而在 Na+ 通道(以及结构相似的 Ca2 + 通道;框 2-4)中,离子则以水合形式通过选择性过滤器。离子选择性不仅由主链的羰基决定,还由 Na+ 和 Ca2 + 通道选择性过滤器中的特定氨基酸侧链共同决定,而不像 K+ 通道那样完全由后者决定。
自20世纪50年代动作电位的离子基础被发现以来,研究人员在阐明这种最基本神经元通信形式的机制方面取得了长足进展。
框2-4:功能多样的离子通道
我们在动作电位背景下讨论的电压门控 Na+ 和 K+ 通道只是众多离子通道中的两种。人类基因组中有超过 230 个基因编码离子通道(表 2-2)。离子通道通常根据其传导的离子类型和门控机制进行分类。许多离子通道具有序列相似性,反映了它们共同的进化历史(详见第 13.8 节)。图 2-34 展示了 143 个结构相关离子通道的系统发育树,这些通道与电压门控 Na+ 和 K+ 通道属于同一超家族。所有 143 个通道都具有共同孔道结构,包含两个跨膜螺旋(2TMs)和一个孔环。除两个 K+ 通道亚家族外,其余均采用与电压门控 Na+ 和 K+ 通道相似的 6TM 单元(图 2-30)。
表2-2:人类基因组中编码离子通道的基因数量
<table><tbody><tr><td>通道类型</td><td>基因数量</td></tr><tr><td>钾离子通道</td><td>78</td></tr><tr><td>电压门控钾离子通道</td><td>40</td></tr><tr><td>内向整流钾离子通道</td><td>15</td></tr><tr><td>双孔域钾离子通道</td><td>15</td></tr><tr><td>钙/钠激活钾离子通道</td><td>8</td></tr><tr><td>钠/钙离子通道</td><td>29</td></tr><tr><td>电压门控钠离子通道</td><td>9</td></tr><tr><td>电压门控钙离子通道</td><td>10</td></tr><tr><td>其他钙离子和钠离子通道</td><td>10</td></tr><tr><td>TRP 通道</td><td>28</td></tr><tr><td>环核苷酸门控和 HCN 通道</td><td>10</td></tr><tr><td>氯离子通道</td><td>10+</td></tr><tr><td>神经递质门控通道</td><td>70</td></tr><tr><td>其他配体门控通道</td><td>11</td></tr><tr><td>压电通道</td><td>2</td></tr></tbody></table>
根据药理学指南数据库([www.guideto](http://www.guideto)pharmacology.org)整理。关于上述通道的系统发育树参见图 2-34(位于 Cl- 通道行上方)。人类基因组还编码 11 种水通道蛋白(水通道)和 24 种在相邻细胞间形成间隙连接的通道(见框 3-5),此处未予收录。缩写说明:TRP,瞬时受体电位;HCN,超极化激活的环核苷酸门控。
\mathbfK+ 通道构成了最多样化的通道家族,由至少 78 个基因编码,其中许多基因具有可变剪接异构体。不同通道亚基的混合搭配形成异源多聚体通道,也进一步增加了通道的多样性。 K+ 通道在可兴奋细胞的多种功能中扮演重要角色,确立了诸如静息电位、动作电位启动后复极化的动力学特性以及起搏细胞的自发节律性放电等特性(图 2-35A)。部分 K+ 通道通过去极化激活,具有多样化的激活和失活动力学特性,适应不同放电频率的神经元类型。部分 K+ 通道则通过细胞内 Ca2 + 浓度升高或 ATP 浓度下降而激活,使细胞能够根据[ C a 2 + ] i [钙 2+ ] i 或能量水平。内向整流通道亚家族的成员在膜电位比E更超极化时优先传导内向电流。 K EK 并且在膜电位比E更去极化时允许最小的外向电流 K EK 这是因为在去极化条件下,内向整流通道被带正电的多胺和镁离子从细胞内侧面阻断。除其他功能外,内向整流通道有助于将静息电位维持在接近钾平衡电位的水平。 K EK 并且是代谢型神经递质受体调节的主要底物(详见第3章讨论)。 K+ 通道也存在于许多非兴奋性细胞中。例如, K+ 通道是神经胶质细胞中主要的离子通道。
与 K+ 通道类似, Cl- 通道通常稳定静息膜电位,因为EK EK 和 E C l E 氯离子 两者都接近静息电位。 Cl- 通道在不同细胞类型中也扮演着多样化的角色,通常涉及细胞内囊泡。 Cl-
(续)

框2-4:续
图 2-34 143 种离子通道的系统发育树。该树根据 143 种结构相关离子通道保守孔区氨基酸序列的相似性构建,对应表 2-2 所列离子通道的子集;与此超家族无序列相似性的通道(如 Cl- 通道和神经递质门控通道)未包含在内。比例尺表示树上 0.05 单位距离对应序列中每个位点的氨基酸替换数。背景色区分离子通道家族:蓝色为电压门控 Na+ (Na_γ) 和 Ca2 + (Ca_γ) 通道;绿色为瞬时受体电位(TRP)及相关通道,包括双孔通道(TPC);红色为多数 K+ 通道,含
通道由异质蛋白质家族构成,其结构不同于阳离子通道。其中一个特定家族包含由两个亚基组成的通道,每个亚基拥有18个膜嵌入螺旋和一个离子传导孔。实际上,这些 Cl- 通道与细菌 Cl- / H- 交换器属于同一家族,这表明离子通道和转运蛋白可以共享结构上的相似性。新的 Cl- 通道仍在不断被发现中。
电压门控 Ca2 + 通道构成了可兴奋细胞中另一个重要的蛋白质家族。其一级结构与电压门控 Na+ 通道相似,具有四个重复模块,每个模块包含六个跨膜螺旋。不同的电压门控 Ca2 + 通道在激活阈值、单通道电导和失活速度上存在差异。神经元通常维持极低的细胞内 Ca2 + 浓度,这是 >10,000 倍的内向整流 K+ 通道 (K_H) Ca2 + 依赖性 K+ 通道 (K_ca) 电压门控 K+ 通道的前九个亚家族 (K_v1 - 9) 以及双孔域 K+ 通道 (K_2p) 橙色部分,环核苷酸门控(CNG)通道,包括结构相关的超极化激活环核苷酸门控(HCN)通道和电压门控 K+ 通道的最后三个亚家族 (K_10 - 12) ,这些通道含有一个环核苷酸结合域。围绕系统树的示意图展示了通道蛋白的膜拓扑结构,孔环部分以深灰色阴影标示。 红色六边形内的 R 代表具有环核苷酸或结合结构域的胞质结构域。(摘自 Yu FH 与 Cattarell WA [2004]《科学》S74, 1253:re15。经美国科学促进会许可。)
低于细胞外浓度,这会产生极高的E c a E 钙 大约 +120mV 电压门控通道的开放导致去极化,这是由于 Ca2 + 在化学和电学梯度共同驱动下的内流。实际上,某些神经元和心肌细胞中的动作电位是由电压门控 Ca2 + 通道而非电压门控 Na+ 通道介导的。正如我们将在后续章节中了解到的,电压门控 Ca2 + 通道在轴突末梢调节神经递质释放中扮演重要角色。它们对于肌肉的兴奋-收缩偶联、某些哺乳动物神经元的树突整合、塑造如节律性爆发放电(图 2-35B)等放电模式,以及响应神经元活动调节基因表达和神经元分化也至关重要。其他 Ca2 + 通道存在于内部 Ca2 + 储存器的膜上,并由细胞内信使门控。

框2-4:续
图 2-35 参与神经元节律性簇状放电的离子通道。(A) 海洋软体动物起搏细胞(无需输入即可产生节律性输出的神经元)的细胞内记录,显示周期性的动作电位簇发放。重复的动作电位导致细胞内 [Ca2+] 累积升高,从而激活 Ca2 + 依赖性 K+ 通道,促使簇发放后出现超极化。随着 [Ca2+] 在簇间期逐渐降低,更多 Ca2 + 依赖性 K+ 通道关闭,使膜电位升高直至达到新一轮动作电位簇的阈值。(B) 猫丘脑神经元切片在无 TTX(上)和有 TTX(下)情况下的细胞内记录。TTX 阻断了动作电位发放但未影响节律性膜电位变化,表明
而 K+ 、 Cl- 、 Na+ 和 Ca2 + 通道因其离子选择性而得名,但有些通道对它们传导的离子并不那么具有选择性。例如,大多数 TRP 通道(以创始成员瞬时受体电位命名,这是一种对果蝇视觉转导至关重要的蛋白质)和 CNG 通道(即环核苷酸门控通道)是非选择性阳离子通道,这意味着它们对 Na+ 、 K+ ,有时还有 Ca2 + 具有通透性。因为在静息状态下, Na+ 的驱动力通常大于 K+ ,非选择性阳离子通道的开放导致更多的 Na+ 内流而非 K+ 外流,从而产生净去极化。正如我们将在第 4 章和第 6 章中了解到的,CNG 通道和 TRP 通道在感觉神经元中扮演重要角色,将环境刺激——包括光、气味分子、信息素、温度以及有害化学物质——转化为膜电位变化。TRP 通道还在果蝇和秀丽隐杆线虫的机械感觉中发挥作用。 HCN 通道(超极化激活环核苷酸门控通道)由超极化(通常低于 - 55 mV )和环核苷酸激活,在结构上与 CNG 通道相关。由于 HCN 通道传导阳离子,从而在超极化时使细胞去极化,因此它们对神经元的节律性放电和心脏跳动尤为重要(图 2-35B)。
人类基因组中至少有 70 个基因编码由神经递质门控的离子通道(表 2-2);这些通道与电压门控通道分属不同基因家族,且不参与后者的功能。进一步分析显示,节律性膜电位变化主要是低阈值电压门控通道、电压门控通道与 HCN 通道相互作用的结果。去极化会打开通道并产生尖峰。通道的失活和通道的开启导致超极化,进而激活 HCN 通道。HCN 通道的开放引起去极化,直至达到通道的下一个尖峰阈值。若无 TTX 存在,尖峰会使神经元去极化超过电压门控通道的阈值,导致爆发性放电。(A 图源自 Smith SJ & Thompson SH [1987] J Physiol 382:425-428;B 图源自 McCormick DA & Huguenard JR [1992] J Neurophysiol 68:1384-1400。)
图2-34。许多神经递质门控通道是非选择性阳离子通道,因此它们的开放会使突触后神经元去极化并引起兴奋。某些神经递质门控通道对 Cl- 具有选择性;它们的开放通常介导对突触后神经元的抑制。我们将在第三章更详细地研究这些神经递质门控离子通道的结构和功能。
自 21 世纪初人类基因组测序完成以来,我们仍在不断发现新的离子通道。例如,正如我们将在第六章讨论的,由机械力门控的离子通道介导听觉和触觉。在哺乳动物中,机械敏感通道的分子性质仍在深入研究,因为它们似乎不属于本文讨论的离子通道家族。例如,介导触觉的部分机械敏感通道属于一个进化上保守的蛋白质家族——Piezo 家族,其每个亚基含有 >30 个跨膜片段,且序列与其他已知离子通道无相似性。我们预计未来离子通道列表(表 2-2)还将有更多补充。
最后,许多人类离子通道的突变会导致或增加对多种神经系统疾病的易感性,包括癫痫(见框12-4)、精神分裂症、自闭症(第12.24节)、偏头痛以及异常疼痛敏感性。仅在电压门控通道中就发现了超过1000种致病突变。这些发现凸显了离子通道在人类健康中的重要性。
总结
神经元是极其巨大的细胞。它们采用特殊的细胞生物学特性来支持其树突和轴突,这些结构的表面积和体积通常比其细胞体大几个数量级。mRNA、核糖体和分泌途径组分存在于树突中(轴突中也有少量),以便合成胞质和膜蛋白。
在局部进行处理。细胞器和胞体合成的蛋白质通过特定的微管马达被主动运输至轴突和树突。轴突微管统一朝向,其正端朝外。在脊椎动物神经元中,树突同时拥有正端朝外和负端朝外的微管。轴突与树突中微管极性的差异对于指导特定货物至适当的亚细胞区域至关重要。驱动蛋白主要是正端导向的微管马达,介导轴突运输,将膜蛋白(通过细胞内囊泡)和胞质蛋白从胞体运送至轴突末端。动力蛋白和负端导向的驱动蛋白则介导从轴突末端返回胞体的逆向运输。驱动蛋白和动力蛋白也在树突内运输货物。微管沿着树突和轴突过程的中心延伸,而 F-肌动蛋白富集于外周,能在货物离开微管“高速公路”后,通过基于肌球蛋白的运输帮助它们到达最终目的地。
可兴奋细胞中的电信号传导依赖于脂质双层的特性以及质膜上转运体和离子通道的活动。主动转运体,如 Na+ - K+ ATP 酶,利用能量逆电化学梯度将离子跨膜运输;这些转运体维持着质膜两侧的离子浓度差异。在大多数神经元和肌肉细胞中,与细胞外环境相比,细胞内区域 K+ 浓度高,而 Na+ Ca2 + 和 Cl- 浓度低。由于静息状态下膜对 K+ 的通透性高于其他任何离子,静息膜电位接近 K+ 的平衡电位。
神经元质膜可被有效描述为一个并联电路,其中每种离子的电导路径代表通过特定通道的离子流动,而电容路径则代表脂质双层。电信号,如膜电位响应电流注入的变化,会随时间演变。当电信号沿神经纤维被动传播时,沿途的泄漏膜电导会导致信号随距离衰减。为了可靠地将电信号长距离传播,轴突利用动作电位等主动特性。
动作电位由超阈值去极化产生。去极化首先开启电压门控 Na+ 通道,导致进一步去极化并形成快速上升相。动作电位的下降相则是由 Na+ 通道的失活及电压门控 K+ 通道的延迟开启所引起。这一序列确保动作电位呈现全或无特性,成为沿轴突从胞体向末梢单向传播的再生性事件。通过运用过去几十年发展的重要技术手段,如膜片钳记录、分子克隆和原子结构分析等研究揭示:离子通道如何以精确选择性传导离子、通道开启如何受电压调控、失活机制如何发生,以及单个离子通道特性如何响应膜电位变化形成宏观电流的分子与机制基础。
离子通道具有多种功能。我们将在后续章节中更详细地研究这些功能,从下一章的核心主题开始:突触前末梢的神经递质释放和突触后特化区的神经递质接收。