配位化学
这部分内容是我自己整理的,如有错误,请予以指正 ——Moxi
各配位数的配合物
1. 一、二、三配位化合物
这类低配位化合物形成的主导因素主要是大体积的配体。
1.1 一配位化合物
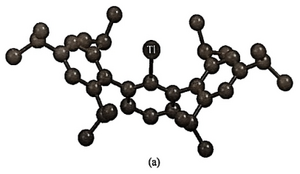
在凝聚相(固体和液体)配合物中,配位数为1的很少见;在溶液中尝试制备仅含一个配体的物种几乎是徒劳的,因为溶剂分子会参与配位导致更高的配位数。Tl(I)和In(I)有配位数为1的金属有机化合物,配体为2,6-Trip2C6H3,因为其庞大的配体阻止了配合物二聚偶联形成金属键。(图2-1)
图2-2中的大体积氟化三氮戊二烯基配体可形成单配位的Tl(I)配合物,Tl被夹在两个苯环之间,阻止了其他配体的配位,结构分析和计算结果表明,该配合物的中心金属原子Tl(I)与芳环π电子之间的相互作用非常弱。
Ga[C(SiMe)3]为气态时,为单核单配位化合物。
1.2 二配位化合物
自21世纪以来,许多配位数是2的化合物被报道。这些化合物为配位不饱和化合物。其表明这些金属具有空的配位点。但由于其他配体本身性质的影响,该位点在动力学上也受到不同程度的封闭。配体较小时受中心原子排布影响,配体均匀分布成直线型。配体较大时二配位化合物的几何形状受配体制约。主要影响因素为空间位阻效应,刚体配体和金属间配位键。
1.2.1 配体均匀排布
最典型的二配位化合物是[Ag(NH3)2]+,其中Ag+为d10组态,按照VSEPR分析,应为线型分子,与实际情况相符。其中心原子排布为d0或d10,电子均匀排布。所以配体均匀排布成直线型。其他类似线型配合物还有[CuCl2]、Hg(CN)2、[Au(CN)2]。
1.2.2 空间位阻效应
[Et3PAuTi(CO)6]也是一种线形分子。该配体通过金原子与过渡金属钛配位,形成一个直接的Au-Ti键,其中磷原子与金形成稳定的Au-P键。Au倾向于形成Au-Au键,但在本体系中金的其中一个配体为六羰基钛,其庞大的体积阻挡了金原子之间形成Au-Au键,所以该配体的影响因素为空间位阻效应。
图1-3 [Et3PAuTi(CO)6]
1.2.3 刚性配体
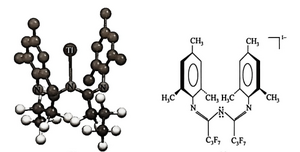
β-二酮亚胺[{N(SiMe3)C(Ph)}2CH]-是一个nacnac类配体,它的螯合强制主族金属Tl(I)形成二配位非直线型几何结构。其二齿螯合加强了该配合物的稳定性,其刚性配体为主导因素。
图2-4 铊的β-二酮亚胺配合物
1.2.4 金属间配位键
金属间配位键是通过一个金属中心(路易斯碱)向另一金属中心(路易斯酸)提供孤对电子形成的定向、部分共价性作用。其形需要满足一定条件,对于两金属中心来说,他们需处于显著不同的氧化态或配位环境,驱动分子内电荷转移(如Zn→Fe或Cd→Ni电子迁移);对于配体来说,配体空间效应需限制金属间距,形成稳定短键。
如一种含有Fe-Fe配位键的二配位分子的配体为[(η⁵-C₅H₅)Fe(CO)₂]-,受体为[Fe{C6H-2,6-(C6H6-2,4,6-iPr3)2-3,5-iPr2}]。这为制备二配位过渡金属配合物提供了全新的策略。
图2-5 含有Fe-Fe配位键的低配位数分子1
1.3 三配位化合物
三配位化合物比较常见,比如sp2与sp3杂化分别能形成平面三角形和三角锥形结构,如[HgI3]-,[SnCl3]-等等。
如果从空间位阻角度分析,三配位化合物以d10组态Au(I)和Cu(I)离子为主,采用庞大的配体,如大空间位阻的烷基、芳基、酰胺基、烷氧基和硫醇基,来保证金属不被其他基团攻击,从而限制配位数。第一过渡系所有金属元素,以及5族,6族,8族,9族的重过渡金属元素所形成的三配位化合物部有近平面三角的结构。一种典型的受空间位阻影响的配合物是[Au(PPh3)3]+。由于离子为d10组态没有未成对电子,不存在晶体场稳定化能对几何构型的偏好,因此其空间构型主要由空间位阻决定。P(Ph3)为大位阻配体,倾向于互相远离,形成了配离子的平面三角形结构。
图2-6 庞大的配体限制了配位数
2 四配位化合物
四配位是常见的配位, 包括平面正方形和四面体两种构型。一般非过渡元素的四配位化合物都是四面体构型。这是因为采取四面体空间排列, 配体间能尽量远离, 静电排斥作用最小,能量最低。但当由强场配体配位时, 形成平面正方形的CFSE会更高。当然,如果有两对多余的孤对电子时,也能形成平面正方形构型, 此时, 两对电子分别位于平面的上下方, 比如XeF4。
过渡金属的四配位化合物既有四面体形, 也有平面正方形, 究竟采用哪种构型需考虑下列两种因素的影响:
(1) 配体之间的相互静电排斥作用;
(2) 配位场稳定化能的影响。
2.1 四面体形(Td)
这种结构常见于中心原子为d0,d10或高自旋d5,d6构型的化合物。这些情况下的电子均匀分布在每个d轨道内,呈现球对称,故符合VSEPR模型,是最简单的四面体构型。
d0:TiCl4,VO43-,MnO4-
d1:VCl4
d10:Ni(CO)4,[Cu(py)4]+
d5:MnCl42- (Cl-为弱场配体,Mn2+保持高自旋,五个单电子均匀排布)
d6:FeCl42- (Cl-为弱场配体,Fe2+保持高自旋,六个单电子近似均匀排布)
d7:CoCl42- (Cl-为弱场配体,且体积较大,配体间的排斥作用占据主导)
d8:NiCl42- (Cl-为弱场配体,且体积较大,配体间的排斥作用占据主导)
2.2 平面四边形(D4h)
这种结构常见于中心离子为强场配体配位的d8,d9组态配合物,这样形成平面正方形场时的能量最低。常见的有PtCl2(NH3)2、[PtCl4]2-、[Ni(CN)4]2-。
当配体为某些刚性多齿配体时,也能形成平面四边形结构。1,2-二硫烯类分子可以形成图3-1中给出的几种Ni的配合物。2
图2-1 1,2-二硫烯类分子与Ni的配合物
类似的多齿配体还有PNP或NNN配体,其中的三个P,N原子在同一平面内与中心离子配位,形成Pd(PNP)CH3或(NNN)PdCl等配合物(图3-2)3
图2-2 几种三齿配体形成的配合物
3 五配位化合物
配位数为5的配合物包括三角双锥、四方锥和平面五边形构型。其中平面五边形最为罕见。目前已知的有主族元素中的[XeF5]-和[IF5]-;许多过渡金属也存在五配位情况。三角双锥和四方锥构型之间的能量差很小,因而这些分子表现出构型流变行为。
3.1三角双锥构型和四方锥构型
三角双锥是最常见的,符合VSEPR模型,配体间排斥最小。
四方锥较为少见,包括两类,一类是八面体构型的一条杂化轨道容纳了孤对电子形成的,一类中心原子没有孤对电子,前者也符合VSEPR模型,后者作为主族无孤对电子的 AB5体系,自身在真空下应为三角双锥构型,四方锥构型应该是受到其他分子/离子的影响所致
图3-1 三角双锥构型和四方锥构型
事实上,两种构型的能量相差不大,因此,有时两者能同时存在,相互流变。Fe(CO)5和PF5分别在13C NMR 和19F NMR谱中只存在一个峰,这表明配合物可迅速从一种构型异构为另一种构型,配体在三角双锥和四方锥构型两种不同的环境中同时存在。
3.2 平面五边型
平面五边型是较为少见。有主族元素中的[XeF5]-和[IF5]-。它们两对孤对电子占据了轴向轨道。
4 六配位化合物
六配位是最为常见的配位数,常见的构型为八面体和三棱柱。对于非八面体的六配合物可能会出现几种畸变类型
4.1 八面体形
八面体构型是最常见的构型之一,d0-d10组态过渡元素均能形成,在此不做过多叙述。
4.2 四方畸变
四方畸变是Jahn-Taller效应的结果,电子在简并轨道中的不对称占据导致分子几何构型发生畸变,以降低分子对称性和轨道简并度,使体系能量进一步下降。(图5-1)
当dz2轨道上占据一对电子时,产生伸长八面体,两个反式键拉长,另四个赤道平面的键缩短,如晶态CuF2;
当dx2-y2轨道上占据一对电子时,产生压缩八面体,两个反式键缩短,而其他四个键拉长,如K2CuF4。
图4-1 Jahn-Taller效应
4.3 三角畸变
八面体以三角形平面伸长或缩短会产生三棱柱或反三棱柱构型。他们的相对转角为60度(图5-2a、b)。ThI2晶体中存在由三角棱柱和三角反棱柱构成的层状结构。
三棱柱构型的顶部和底面三角面重叠。许多三棱柱构型的配合物中含有3个双齿配体,例如二硫代羧酸根和草酸根离子。它们将顶部与底部的三角面连接在一起(图5-2c)
反三棱柱构型的顶部和底面三角面交叉。Fe(III)与合适的配体可以形成反三棱柱构型(图5-2f)
图4-2 (a)三棱柱 (b)反三棱柱 (c)Re[S2C2(C6H5)2]3 (d)三棱柱形的ReS6配位中心 (e)一六齿配体 (f)包含(e)中配体的Fe(III)配合物 (g)反三棱柱形的配位中心
5 七配位化合物
七配位化合物有3种可能的构型,分别为五角双锥、加冠三棱柱和加冠八面体(图6-1),七配位化合物没有一种像八面体或四面体那样标准的绝对优势构型,其最终采取五角双锥、加冠三棱柱还是加冠八面体,是金属中心的电子结构和配体的空间位阻相互竞争、协同作用的结果。
在中心离子周围的七个配位原子所构成的几何体远比其它配位形式所构成的几何体对称性要差得多。这些低对称性结构要比其它几何体更易发生畸变, 在溶液中极易发生分子内重排。所以其配位化合物很少。
图5-1 七配位的可能结构4
5.1 加冠三棱柱
在加冠的构型中,第七个配体直接加到主体构型的一个面上,同时键角做出必要的调整以容纳该配体。这三种构型均为实验结果,配体的空间需要决定了七配位化合物的构型。前文曾介绍过一个七配位化合物,即图1-1中的钛-金配合物[Et3PAuTi(CO)6],含有二配位的金和七配位的钛,钛的配位环境近似为加冠三棱柱,金原子加冠在与钛结合的四个碳原子所构成的平面上。另一种简单的例子是[NbF7]2-(图6-2),第七个氟加在棱柱的矩形面上。
图5-2 [NbF7]2-结构
5.2 五角双锥
主族和过渡金属元素均可形成五角双锥配合物,如IF7、[ZrF₇]³⁻、[HfF₇]³⁻、[NbOF6]3-、[UO2F5]3-。这些配合物中心离子的电子组态在五角双锥场中的CFSE很弱或为零(如d⁰的I7+、Zr⁴⁺、Hf⁴⁺、Nb5+、U6+;d¹⁰的La³⁺、Zn²⁺)。它们没有强烈的电子偏好,因此结构主要受配体空间位阻等外部因素支配,往往采取对称性相对较高、配体排斥力分布均匀的五角双锥构型。
一些合适的多齿配体能够在同一平面内与中心离子五配位,比如图6-3中的铁(I)配合物4。
图5-3 一种铁(I)配合物的结构
5.3 加冠八面体
三溴四羰基钨酸根离子[W(CO)4Br3]-(图6-4)是最典型的加冠八面体配合物5。
图5-4 [W(CO)4Br3]-的结构
其他的配合物还有Mo(CO)3(PEt3)2Cl2,Mo(CO)3(PMe2Ph)2Br2等,这些配合物的共性是具有3个较大配体和4个较小配体。同时,Mo2+,W2+均为d4组态,且配体为Cl-,Br-弱场配体,因此,作为高自旋d4组态的中心离子,其在八面体场中能获得更高的CFSE(-6Dq),当配位数增加到七时,它们会尽可能保留一个近似八面体的结构,因为将一个帽子加到八面体的一个面上是对八面体破坏最小的方式,能最大程度地保留原有的CFSE。
6 八配位化合物
八配位和八配位以上的配合物都是高配位化合物。一般而言, 形成高配位化合物须具备以下条件:
(1)中心金属离子体积较大, 而配体要小, 以减小空间位阻;
(2)中心金属离子的d电子数一般较少, 一方面可获得较多的配位场稳定化能, 另一方面也能减少d电子与配体电子间的排斥作用;
(3)中心金属离子的氧化数较高;
(4)配体电负性大, 变形性小。
综上,高配位的化合物,其中心离子通常是d0-d2组态的第二、三过渡系列的离子以及镧系锕系离子,且氧化态一般大于三。
在高配位化学中,传统定性描述(如“四方反棱柱”、“双帽三棱柱”)高度模糊且主观。同一结构(如石榴石中的碱土金属配位环境)常被不同作者用对称性和几何差异巨大的多面体(立方体、四方反棱柱、十二面体)来描述,导致混乱。随着晶体结构数据库的扩张,采用连续形状测量方法量化实际结构与理想多面体之间的偏差成为可能。CShM方法随之诞生,这种方法通过计算实际原子位置与理想多面体顶点位置的最小均方偏差,归一化后得到一个数值 SQ(P):
SQ(P)=0代表完全吻合理想形状。
SQ(P)值越大意味着偏差越大。
CShM方法能处理对称性低、形状不规则的结构,并可分析结构是否处于两个理想多面体之间的最小畸变互变路径上。因此,分析高配位化合物结构常采用这种方法。
八配位的理想多面体有11种(图7-1),对于每一对理想多面体,计算它们的CShM值,即SA(B) 和 SB(A)。这个值量化了这两个结构的差异程度。通过比较所有结构之间的CShM值(表7-1),可以揭示他们之间的关系:
图6-1 八配位的理想多面体
表6-1 理想多面体结构之间的CShM值6
从图6-2表示的距离矩阵中可以发现这些结构在距离上聚集成三个集群:
(1)低能区包括正十二面体、四方反棱柱、双帽三棱柱,这些结构配体间排斥小,d轨道成键效率高。是配位化合物中最常见的区域。
(2)中区包括立方体、三角化四面体,这些结构对称性高,但在配位化合物中因排斥较大而不如低能区稳定。
(3)孤立区包括六角双锥、旋转二棱柱、拉长三角双锥、七角锥、八边形,这些结构与其他多面体都很远,几何独特,非常罕见,通常需要特殊配体场或拓扑才能稳定
通过对CSD中500多个八配位过渡金属配合物的统计分析,研究人员揭示了清晰的规律6。
6.1 中心离子电子构型
中心离子为d⁰, d¹, d²组态的配合物主要集中在低能区,尤其沿四方反棱柱-正十二面体互变路径分布,这是因为这些组态d轨道部分占据,存在晶体场稳定化能。当配体以特定几何排布时,会分裂金属的d轨道能级(图7-2),电子填入较低能级。
图6-2 不同多面体结构的d轨道杂化情况
中心离子为d¹⁰组态的配合物显著不同,近半数沿正方体-四方反棱柱路径分布,26%为六角双锥,几乎没有十二面体。这是因为d¹⁰电子云球对称,无晶体场稳定化能的驱动力。其几何构型完全由配体的空间位阻主导。
6.2 配体的空间拓扑效应
不同的配体诱导形成不同的结构:
| 配体类型 | 典型配体 | 诱导的几何构型 | 原因 |
| 小咬角双齿配体 | 硝酸根、二硫代氨基甲酸根 | 十二面体 | 小咬角完美匹配DD中较短的棱边。 |
| 正常咬角双齿配体 | β-二酮、草酸根 | 四方反棱柱 或 DD-SAPR中间体 | 咬角适中,适配性广。 |
| 三足配体 | 拓扑如 7a-7b | 十二面体为主,立方体次之 | 三足对称性与DD或CU的部分面匹配。 |
| 四齿大环配体 | 酞菁、卟啉 | 近似四方反棱柱 | 两个平面型配体交错排列,自然形成SAPR。 |
| 六齿冠醚 | O₆-冠醚 | 六角双锥 | 冠醚提供赤道面六个给体,两个轴向配体完成HBPY。 |
| 八齿穴状配体 | [2.2.2]穴醚 | 立方体 | 配体的C₃对称性和扭曲构象适配立方几何。 |
表6-2 不同配体的空间拓扑效应
7 九配位化合物
九配位化合物主要有两种结构,三帽三角棱柱和单帽四方反棱柱。简单的例子有水蓝色络合体[Sc(H2O)9]3+,[Y(H2O)9]3+,以及[La(H2O)9]3+,[TcH9]2-和[ReH9]2-。(图8-1)
图7-1 [ReH9]2-的结构
7.1 三帽三棱柱
该构型由三棱柱的每个矩形面中心垂直添加一个配体形成,整体对称性较低,但能有效减少配体间的空间排斥。典型代表是ReH9²⁻离子:中心Re原子位于三棱柱中心,9个氢原子分别占据三棱柱的顶点和三帽位置。三帽三棱柱形成的核心驱动力是最大化配体距离,降低空间排斥。适用于大半径中心离子(如镧系、早期过渡金属:La3+,Re3+)。研究表明,这种构型在热力学上较为稳定,符合价层电子对互斥理论对高配位数体系的预测(《无机化学》,Gary L.Mieseler等著)。
7.2 单帽四方反棱柱
该构型以四方反棱柱为基础,在其中一个四元环面中心额外添加一个配体。例如,[Sm(EDTA)(H2O)3]配合物中,中心金属离子与EDTA六齿配体和三个水分子配位,形成单帽四方反棱柱结构。这种构型的对称性略高于三帽三棱柱,常见于大半径离子与多齿配体的体系中。
图7-2 [Sm(EDTA)(H2O)3]配合物的结构
九配位化合物的稳定性较差。对于许多金属离子(尤其是过渡金属和镧系元素),6或8配位是稳定的全充满配置,形成九配位意味着“超配位”,需要将额外的配体强行塞入配位球,导致其内部静电阻力较大。同时键长拉长,键能减弱,配体与金属中心的结合变得不那么牢固。在拥挤的九配位环境中,任何一个配体的解离都会为周围配体的重排和进一步解离创造空间和机会,引发连锁反应,导致配体迅速、协同地丢失。
8 十-十六配位化合物
配位数高于9的化合物极为罕见,通常涉及大体积金属离子、小体积配体和促进高配位的特殊配体结构的组合。包括以下值得注意的例子:6
十二配位配合物[Hf(BH4)4]展示了小多齿配体是如何促进更高的配位数的。如图所示,[Hf(BH4)4] 具有反立方八面体结构,其中BH4-作为三齿配体,BH3占据反立方八面体三角形面的单位。
图8-1 [Hf(BH4)4]的结构
十二配位配合物[Ce(NO3)6]2-,其中的硝酸根构成了一个二十面体构型,如图9-2所示。结构中的硝酸盐以双叶形方式结合Ce中心,形成八面体阵列,如图9-3所示。
图8-2 [Ce(NO3)6]2-的结构
图8-3 硝酸盐以双叶形方式结合Ce中心,形成八面体阵列
十六配位配合物[CoB16]−,拥有迄今为止观测到的最高的配位数。其结构见图9-4所示。配位几何构型是一个反八棱柱,该构型可视为含一个B16-“分子鼓”包含Co中心。B16-“分子鼓”由团簇键连接在一起。
图8-4 十六配位配合物[CoB16]−的结构
