第十三章 内膜系统运输
每个细胞都必须进食,与周围的世界交流,并对其环境的变化做出快速反应。为了帮助完成这些任务,细胞根据需要不断调整其质膜和内部隔室的组成。真核细胞使用复杂的内膜系统来添加和去除细胞表面蛋白,例如受体、离子通道和转运蛋白(图 13-1)。通过胞吐作用过程,分泌途径将新合成的蛋白质、碳水化合物和脂质输送到质膜或细胞外空间。通过内吞作用的相反过程,细胞吸收质膜和细胞外空间的成分,并将它们输送到称为内体的内部隔室。
通过内吞作用输送到内体的蛋白质、营养物质、脂质和受体被分类并循环到质膜或输送到溶酶体,在那里它们被分解成构建块并运输到胞质溶胶中,用于各种生物合成过程。溶酶体还通过称为自噬的过程分解和回收细胞内大分子。该途径将部分胞质溶胶或整个细胞器吞噬到新组装的出血隔室中,然后与溶酶体融合以输送其内容物进行降解。在发育过程中,细胞在分化和适应新的生理任务时,经常使用自噬来重塑其细胞质。
沿分泌和内吞途径的每个膜封闭隔室的内部空间或管腔在拓扑学上等同于细胞外部。这意味着蛋白质可以通过许多膜封闭的运输容器从一个隔室的腔移动到另一个隔室的腔,而无需穿过膜(图 13-2)。这些容器是由膜从隔室出芽形成的,要么是小的球形囊泡,要么是较大的不规则囊泡,要么是小管。我们将使用术语运输囊泡来应用于这些容器的所有形式。
运输囊泡不断从一个膜室中萌芽并与另一个膜室融合,携带膜成分和可溶性管腔分子,它们被称为货物。这种囊泡交通高度组织化定向路线,允许细胞分泌、食用和重塑其质膜和细胞器(图 13-3)。分泌途径从内质网 (ER) 向外通向高尔基体和细胞表面,侧向通向内体,而内吞途径从质膜向内通向内。在每种情况下,修复途径都会将膜和选定的蛋白质带回起始隔室,以平衡隔室之间的物质流动。
为了执行其功能,从隔室出芽的每个运输囊泡都必须是选择性的。它必须只吸收适当的分子,并且必须只与适当的靶膜融合。例如,将货物从 ER 运送到 ER 的高尔基体的囊泡必须排除大多数要留在 ER 中的其他蛋白质,并且它必须仅与 Golgi 体融合,而不与任何其他细胞器融合。本章开始时,我们考虑了所有囊泡运输基础的出芽和融合的分子机制。然后,我们讨论了一个基本问题,即面对这种运输,细胞如何维持其隔室之间的分子和功能差异。最后,我们在追踪连接这些细胞器的途径时考虑了高尔基体、分泌囊泡、内体和溶酶体的功能。
膜转运和隔室身份的机制
囊泡转运介导 10 个或更多化学不同的膜封闭隔室之间的成分持续交换,这些隔室共同构成分泌和内吞途径。在本节中,我们将讨论运输囊泡如何形成,它们如何将货物集中在其中,以及它们如何选择性地将其内容物输送到另一个隔间。当一层特殊的蛋白质外壳组装在膜室的胞质表面的某个区域时,运输就开始了。涂层用于从膜和隔室腔中收集特定的货物成分,以运送到另一个部门。外套在额外的蛋白质的帮助下,将膜塑造成从原始隔室发芽的运输囊泡。这些囊泡选择性地停靠在适当的目的地膜上,然后与它融合以运送货物。
尽管膜封闭隔室之间不断交换成分,但每个隔室都保持其分子标志物的特殊身份,例如蛋白质或特异性脂质,这些标志物显示在膜的胞质表面。细胞通过严格控制包装到离开的运输囊泡中的膜成分来实现这一点。隔室的身份标记通过招募适当的外套作为传出流量的指导线索,并用于传入流量,以确保运输囊泡仅与正确的隔室融合。无论如何,这些膜标志物中的许多都存在于多个区室中,正是标志物分子的特定组合赋予了每个区室其分子地址。
包被囊泡有多种类型
大多数运输囊泡从膜的特殊包被区域形成。它们以包被的囊泡形式发芽,这些囊泡有一个独特的蛋白质笼覆盖着它们的胞质表面。在囊泡与靶膜融合之前,它们会脱落外套,以便囊泡和目标隔室的膜表面可以直接相互作用并融合。
涂层执行两个主要功能,这些功能反映在一个常见的两层结构中。首先,内涂层将特定的膜蛋白集中在一个专门的斑块中,然后产生囊泡膜。通过这种方式,内层为反式端口选择合适的膜分子。其次,外涂层组装成一个弯曲的篮状晶格,使膜片变形,从而形成囊泡。
有四种特征明确的包被囊泡类型,按其主要外壳蛋白区分:网格蛋白包被、COPI 包被、COPII 包被和逆转运复合体包被(图 13-4)。每种类型用于不同的传输步骤(图 13–5)。网格蛋白包被的囊泡介导源自高尔基体、内体和质膜的转运。COPI 包被和 COPII 包被的囊泡分别介导源自高尔基体池和 ER 的转运。逆转录体在运输囊泡上形成外套以进行内体到高尔基体的逆向转运。然而,包被的囊泡的种类及其功能比这个简短的列表所暗示的要多得多。正如我们稍后讨论的那样,有几种类型的网格蛋白包被的囊泡,每种类型专门用于不同的运输步骤,并且 COPI 包被和 COPII 包被的囊泡可能同样多样化。我们首先讨论网格蛋白包被的囊泡,因为它们提供了囊泡如何形成的一个很好的例子。
网格蛋白涂层的组装驱动囊泡形成
网格蛋白包被的囊泡的主要蛋白质成分是网格蛋白,它形成外壳的外层。网格蛋白由一个大亚基(重链)和一个小亚基(轻链)组成。三条重链和三条轻链组装成一个称为 triskelion 的三足结构(图 13-6A 和 B)。网格蛋白三边形在膜的胞质表面上组装成一个由六边形和五边形组成的篮状框架。网格蛋白组装诱导涂层芽的形成(在质膜上时称为涂层凹坑),最终掐断成为网格蛋白涂层的囊泡(图 13-7)。在适当的条件下,分离的三重体自发地自组装成试管中的典型多面体笼,甚至在没有这些篮子通常包围的膜囊泡的情况下(图 13-6C 和 D)。因此,网格蛋白三叉戟决定了网格蛋白笼的几何形状(图 13-6E)。
衔接蛋白将货物选择到网格蛋白包被的囊泡中
衔接蛋白是网格蛋白包被囊泡中的另一种主要外壳成分,形成外壳的离散内层,位于网格蛋白笼和膜的胞质表面之间。它们与捕获囊泡内可溶性货物分子的各种跨膜蛋白货物和跨膜受体结合,即所谓的货物受体。接头蛋白还与网格蛋白结合并将其募集到膜表面,在那里组装和弯曲膜。通过这种方式,由衔接蛋白选择的特定跨膜和可溶性货物集被包装到新形成的网格蛋白包被的运输囊泡中(图 13-8)。
衔接蛋白在膜上的组装受到严格控制,部分原因是衔接蛋白与膜、跨膜货物和外壳的其他成分的协同相互作用。衔接蛋白 AP2 是一个广为人知的例子。当它与特定的磷酸化磷脂酰肌醇脂质(一种磷酸肌醇)结合时,AP2 获得不同的构象,暴露出膜中货物受体的结合位点。同时与转运蛋白受体和脂质头基团的结合大大增强了 AP2 与膜的结合(图 13-9)。结合后,AP2 诱导膜弯曲,这使得附近其他 AP2 蛋白结合的可能性更大。然后,AP2 外壳层的协同组装通过网格蛋白结合进一步扩增,从而导致运输囊泡的形成和出芽。
这里有几种类型的衔接蛋白。特征最好的,如 AP2,有四个不同的蛋白质亚基;其他是单链蛋白。许多衔接蛋白与磷酸肌醇结合。正如我们接下来将看到的,不同类型的磷酸肌醇位于不同的膜区室中,是该区室身份的分子标志物之一。每种类型的衔接蛋白对跨膜货物和货物受体具有特异性,它们共享显示在膜胞质侧的特定氨基酸序列基序。由于不同的衔接蛋白对磷酸肌醇的类型和它们识别的序列基序具有不同的特异性,因此每种类型的衔接蛋白仅在部分膜上指导网格蛋白包被的囊泡的组装。
磷酸肌醇标记膜区域和细胞器
尽管肌醇磷脂通常占膜中总磷脂的 10% 以下,但它们具有重要的调节功能。它们可以在肌醇糖头基的 3'、4' 和 5' 位置经历快速的磷酸化和去磷酸化循环,以产生各种类型的磷酸肌醇(磷脂酰肌醇磷酸酯,或 PIP)。磷脂酰肌醇 (PI) 和 PIP 的相互转化是高度区室化的:内吞和分泌途径中的不同细胞器具有不同的 PI 和 PIP 激酶以及 PIP 磷酸酶集(图 13-10)。这些酶的分布、调节和局部平衡决定了磷脂酰肌醇的稳态分布。因此,PIP 的分布因器官而异,并且常在从一个区域到另一个区域的连续膜内存在差异,从而定义专门的膜结构域。
参与囊泡运输不同步骤的许多蛋白质包含与特定 PIP 的头部基团高度特异性结合的结构域,从而将一种磷酸化形式与另一种磷酸化形式区分开来(参见图 13-10)。因此,PI 和 PIP 激酶以及 PIP 磷酸酶的局部控制可用于快速控制蛋白质与膜或膜结构域的结合。特定类型的 PIP 的产生募集包含匹配的 PIP 结合结构域的蛋白质。然后,PIP 结合蛋白有助于调节囊泡形成和控制囊泡转运的其他步骤(图 13-11)。相同的策略被广泛用于响应细胞外信号将特异性细胞内信号转导蛋白募集到质膜(在第 15 章中讨论)。
膜弯曲蛋白有助于在囊泡形成过程中使膜变形
尽管囊泡出芽在细胞的不同位置相似,但每个细胞膜都构成了其特殊的挑战。例如,质膜相对平坦和坚硬,这要归功于其富含胆固醇的脂质成分和潜在的富含肌动蛋白的皮层。因此,仅由网格蛋白外壳组装产生的力不足以从膜中塑造和夹住囊泡。其他膜弯曲和产生力的蛋白质参与该过程的每个阶段。包含新月形结构域(称为 BAR 结构域)的膜弯曲蛋白与下面的膜结合并施加其形状,通过与脂质头基团的静电相互作用(图 13-12;另见图 10-40)。其中一些蛋白质还包含两亲性螺旋,这些螺旋在作为楔形插入膜的细胞质小叶后诱导膜弯曲。BAR 结构域 蛋白产生的弯曲膜被认为有助于 AP2 成核形成网格蛋白包被的芽。
其他 BAR 结构域蛋白在塑造出芽的颈部很重要,其中稳定急剧的膜弯曲是必不可少的。这些 BAR 结构域蛋白,以及帮助成核的网格蛋白机制一起,刺激肌动蛋白丝的局部组装(图 13-13)。不断增长的 f ilaments 推动出芽囊泡周围的膜,并进一步帮助将其推离膜。
细胞质蛋白调节包被囊泡的夹断和脱壳
随着网格蛋白包被的芽生长,可溶性细胞质蛋白(包括 dyna min)聚集在芽的颈部,最终掐掉膜以释放完全形成的网格蛋白包被的囊泡(图 13-14)。Dynamin 包含一个磷酸肌醇结合结构域和一个 GTP 酶结构域,前者将蛋白质拴在膜上,后者调节囊泡从膜上夹出的速度。捏断过程使芽颈处膜的两个小叶靠近并密封形成的囊泡(见图 13-2)。为了执行这项任务,动力蛋白组装体在颈部周围形成一个环,然后在水解其结合的 GTP 时发生构象变化。这将动力环与芽颈处的底层膜一起收缩。此外,dynamin 可以募集脂质修饰酶,这些酶会改变芽颈部局部的脂质组成,以促进膜融合。
一旦从膜中释放出来,囊泡就会迅速失去其网格蛋白涂层,因为共包装到网格蛋白包被的囊泡中的因子会引发导致涂层分解的反应。囊泡中的磷酸肌醇磷酸酶会消耗与外套衔接蛋白结合的磷酸肌醇。此外,另一种囊泡蛋白生auxilin激活 hsp70 伴侣蛋白的 ATP 酶(参见图 6-80),该蛋白利用 ATP 水解的能量剥落网格蛋白外壳。然而,外套的释放不能过早发生,因此额外的控制机制必须以某种方式防止网格蛋白在形成完整的囊泡之前被去除。
单体 GTP 酶控制包衣组装
到目前为止,我们已经讨论了质膜上的网格蛋白包被的囊泡,以说明包衣形成、膜出芽和脱衣的几个原理。COPI 涂层、COPII 涂层、逆转录体涂层和其他类型的网格蛋白涂层的形成原理相似,但在许多重要方面有所不同。一个关键的区别是细胞用于确定何时何地开始外壳形成的机制。虽然 PIP 的本地生产在调节网格蛋白包被在质膜和高尔基体上的组装中起着重要作用,但包被募集 GTP 酶控制 COPI 包被在高尔基体上ER 膜上的 COPII 包被,以及内体上的逆转录体和网格蛋白包被的组装。
外壳募集 GTP 酶Coat-recruitment GTPases是单体 GTP 酶家族的成员。它包括 ARF 蛋白,它负责在高尔基体膜上组装 COPI 和网格蛋白涂层,Sar1 蛋白,它对应于在 ER 膜上组装 COPII 涂层,以及 Rab7,它启动内体膜上逆转录体外壳的组装。如第 3 章所述,GTP 结合蛋白调节真核细胞中的许多过程。他们充当分子开关,在 GTP 结合的活性状态和 GDP 结合的非活性状态之间切换。两类蛋白质调节切换:鸟嘌呤核苷酸交换因子 (GEF) 通过催化 GDP 与 GTP 的交换来激活蛋白质,而 GTP 酶激活蛋白 (GAP) 通过触发结合的 GTP 水解为 GDP 来灭活蛋白质(参见图 3-68 和 15-7)。
外壳募集 GTP 酶通常在细胞溶胶中以高浓度存在,处于无活性的 GDP 结合状态。当 COPII 包被的囊泡从 ER 膜中出芽时,嵌入 ER 膜中的特异性 Sar1 GEF 与胞质 Sar1 结合,导致 Sar1 释放其 GDP。由于 GTP 浓度远高于GDP,Sar1以释放GDP就结合了GTP。.在其 GTP 结合状态下,Sar1 蛋白暴露出一个两亲性螺旋,该螺旋插入 ER脂质双层的细胞质小叶中。紧密结合的 Sar1 现在将衔接子外壳蛋白亚基募集到 ER 膜上以启动出芽(图 13-15)。其他 GEF 和外壳募集 GTP 酶在其他膜上以类似的方式运作(电影 13.2)。一些小的单体 GTP 酶使用两亲性螺旋,而另一些则使用附着的脂质将它们锚定在膜上。因此,位于不同隔室中的 GEF 是重要的空间线索,控制不同涂层募集 GTP 酶被激活的位置,以启动不同类型运输囊泡的形成。
涂层募集 GTP 酶参与涂层分解
与质膜上的网格蛋白涂层囊泡一样,一旦运输囊泡从起始囊泡中出芽,其他类型的涂层也必须分解。如果不拆卸外套,囊泡膜就无法与其目标隔室的囊泡膜融合,包被的囊泡将永久积聚在细胞中,无处可去。因此,出芽囊泡包含仅在囊泡完全形成后才启动外壳分解的蛋白质。这种从包套形成到包被分解的关键转变是由包套募集 GTP 酶触发的。结合的 GTP 与 GDP 的水解导致 GTP 酶改变其共形性,使其疏水尾部从膜中弹出,导致囊泡的外壳分解。因此,外套募集 GTP 酶水解 GTP 的速率决定了其相关外套保持组装的时间长度。COPII 包被加速 Sar1 的 GTP 水解,只有当芽形成的速度比定时拆卸更快时,才会产生完全形成的囊泡;否则,将在囊泡夹掉之前触发解体,并且该过程将不得不重新开始,也许在更合适的时间和地点。一旦囊泡被夹掉,GTP 水解就会释放 Sar1,但密封的外壳通过许多协同相互作用得到充分稳定,包括与膜中的货物受体结合,它可以留在囊泡上,直到囊泡到达靶膜。在那里,激酶磷酸化外壳蛋白,从而完成外壳拆卸并为囊泡进行融合做好准备。
相比之下,网格蛋白包被和 COPI 包被的囊泡在捏掉后很快就会脱落外套。对于 COPI 包被的囊泡,囊泡膜的曲率是开始脱壳的触发因素。在组装时被募集到 COPI 涂层的 ARF GAP 可感应脂质堆积密度。当膜的曲率接近运输囊泡的曲率时,ARF GAP 被激活。然后它刺激 ARF 水解其 GTP,导致涂层分解。
运输囊泡的形状和大小多种多样
需要通过细胞运输的货物类型在大小、形状和拓扑结构上各不相同。运输囊泡的形态形态同样可以多种多样,以适应它们携带的货物。例如,胶原蛋白在 ER 中组装为 300 nm 长的坚硬前胶原杆,然后从细胞中分泌出来,最终嵌入细胞外基质中(在第 19 章中讨论)。前胶原杆不适合通常携带较小货物的直径为 60 至 80 nm 的 COPII 囊泡。为了规避这个问题,前胶原转运蛋白分子与 ER 中的跨膜包装蛋白结合,后者控制 COPII 涂层组分的组装(图 13-16)。这些事件被认为推动了容纳超大货物的更大 COPII 囊泡的局部组装。编码此类包装蛋白的基因的人类突变会导致胶原蛋白缺陷,并产生严重后果,例如骨骼异常和其他发育缺陷。类似的机制必须调节分泌其他大分子复合物所需的囊泡的大小,包括将脂质运输出细胞的脂蛋白颗粒。
小球形运输囊泡的另一种变体是膜小管。小管的表面积体积比小泡或它们形成的较大细胞器高。因此,与可溶性货物蛋白相比,它们的膜蛋白相对丰富。正如我们稍后讨论的那样,小管的这种特性是内体中蛋白质分选的重要特征。逆转运体外壳专门用于将膜蛋白从内体转运到高尔基体,优先驱动管状运输囊泡的形成(图 13-4)。
Rab 蛋白将运输囊泡引导至其靶膜
为了确保囊泡运输的有序流动,运输囊泡必须高度准确识别要与之融合的正确靶膜。由于细胞质中膜系统的多样性和拥挤性,囊泡在找到正确的靶膜之前可能会遇到许多潜在的靶膜。确保靶向的特异性,因为所有运输囊泡都显示根据其来源和货物类型识别它们的表面标志物,而 tar get 膜显示识别适当标志物的互补受体。两种类型的标志物依次起作用,以确保囊泡靶向的特异性。首先,Rab 蛋白将囊泡引导至正确的靶膜上的特定位置。其次,SNARE 蛋白能够融合脂质双层。
与前面讨论的外壳募集 GTP 酶一样(参见图 13-15),Rab 蛋白也是单体 GTP 酶。Rab 亚家族在哺乳动物细胞中拥有 60 多个已知成员,是单体 GTP 酶亚家族中最大的一个。每个 Rab 蛋白都与分泌或内吞途径的一个或多个膜封闭细胞器相关,并且每个细胞器的胞质表面都至少有一个 Rab 蛋白(表 13-1)。在货物在细胞器之间移动的不同类型的运输囊泡上也发现了不同的 Rab 蛋白。它们在这些膜系统上的选择性分布使 Rab 蛋白成为识别每种类型的运输囊泡和靶膜以引导囊泡运输的理想分子标志物。
Rab 蛋白在膜和胞质溶胶之间循环,并调节蛋白质复合物在膜上的可逆组装。在 GDP 结合状态下,它们处于无活性状态,并与另一种蛋白质(GDP 解离抑制剂,或 GDI)结合,使它们可溶于胞质溶胶中。膜结合的 Rab GEF 通过催化 GDP 与 GTP 的交换来激活 Rab 蛋白。一旦处于 GTP 结合状态,Rab 蛋白的脂质锚定就会插入膜中,Rab 在膜中与一组称为 Rab 效应子的多种蛋白质结合(图 13-17)。GTP 水解速率决定了活性 Rab 的浓度,因此决定了其效应子在膜上的浓度。
当囊泡的特定组分(通常是外壳组分)募集 Rab GEF 时,Rab 蛋白在转运囊泡上被激活。Rab 蛋白激活有几个后果。首先,Rab 蛋白本身是一种特定的分子线索,可以通过位于靶膜上的tethering proteins来识别。栓系蛋白tethering proteins通常是蛋白质复合物,通常包含线状结构域,这些结构域充当“钓鱼线”,能够捕获最远 200 nm 外的囊泡。其次,Rab 蛋白可以与运动蛋白相互作用,运动蛋白是常见的 Rab 效应器,它们沿着肌动蛋白丝或微管推动囊泡到达其靶膜。第三,Rab 蛋白可以募集一个 Rab 效应子,该效应子选择性地结合靶膜上的蛋白质,例如位于靶膜上的 SNARE 蛋白。通过这些机制中的一种或多种,在运输囊泡上选择性激活的 Rab 蛋白引导并停靠在正确的靶膜上。一些 Rab 蛋白,例如前面讨论的 Rab7,也起着外壳募集 GTP 酶的作用,随着细胞器的成熟而启动新的出芽事件,我们将讨论。
Rab 蛋白创建并改变细胞器的身份
除了作用于囊泡外,Rab 蛋白还在细胞器膜上发挥作用。与囊泡一样,细胞器上的特异性 Rab GEF 催化 Rab 蛋白激活并插入膜表面。活化的 Rab 蛋白募集的许多效应蛋白通过直接控制传入和传出的运输囊泡来帮助赋予细胞器其身份。这些效应子包括前面提到的栓系蛋白、介导进入囊泡的膜融合的 SNARE 以及产生或修饰特定磷酸肌醇的酶。
Rab 蛋白及其效应子在细胞器膜上的组装可以是协作的,并导致形成大的、特殊的膜斑块,这些斑块定义了该细胞器的身份。例如,内体膜上的活性 Rab5 募集了最初激活 Rab5 的相同 Rab5 GEF 的更多拷贝。这刺激了更多的 Rab5 募集到同一位点。同时,活性 Rab5 激活 PI 3 激酶,该激酶将 PI 局部转化为 PI(3)P,进而结合一些 Rab 效应子,包括栓系蛋白并稳定其局部膜附着(图 13-18)。这种类型的正反馈极大地放大了组装过程,并有助于在连续的细胞器膜内建立功能不同的膜结构域。
| Rab蛋白 | 细胞器 |
|---|---|
| Rab1 | ER,高尔基 |
| Rab2 | 顺面高尔基 |
| Rab3A | 突触小泡,分泌囊泡 |
| Rab4/Rab11 | 再循环内体 |
| Rab5 | 早期内体,质膜,网格蛋白包被囊泡 |
| Rab6 | 反面和中间高尔基体 |
| Rab7 | 晚期内体 |
| Rab8 | 纤毛 |
| Rab9 | 晚期内体,反面高尔基体 |
人们认为,不同的 Rab 蛋白及其效应子有助于创建多个专门的膜结构域,每个结构域都实现一组特定的功能。T hus,虽然 Rab5 相关膜斑块接收来自质膜的进入内吞囊泡,但同一内体中不同的 Rab11 和 Rab4 相关斑块组织了回收囊泡的出芽,这些囊泡将蛋白质从内体返回到质膜。正如我们已经讨论过的,内体膜上的 Rab7 充当逆转运体的外壳募集 GTP 酶,启动用于高尔基体的运输囊泡的形成。
一种 Rab 蛋白可以被不同的 Rab 蛋白取代,这可以改变其相关细胞器的身份。这是通过一种 Rab 蛋白选择性募集和激活另一种 Rab 蛋白来实现的,该蛋白的效应子包括使第一个 Rab 蛋白失活,从而分解其相关膜片的蛋白质。这种顺序作用的 Rab 蛋白的有序募集称为 Rab 级联反应(图 13-19)。例如,随着时间的推移,内体膜上的 Rab5 相关膜贴片被 Rab7 相关膜贴片取代。这会将以 Rab5 为标记的早期内体转化为以 Rab7 为标记的晚期内体。由于 Rab7 募集的 Rab 效应子集与 Rab5 募集的 Rab 效应子集不同,因此此变化对隔室进行重新编程,包括传入和传出的 traf f ic,并将细胞器从质膜重新定位到细胞内部。早期内体中包含的所有尚未回收到质膜的货物现在是晚期内体的一部分。这个过程也称为内体成熟。Rab 相关膜贴片的自扩增性质使内体成熟过程是单向且不可逆的。
SNARE 介导膜融合
一旦运输囊泡从其原始隔室出芽并脱落外套,膜融合允许它在目的地卸货。膜融合需要使两个膜的脂质双层彼此相距 1.5 nm 以内,以便它们可以合并。当膜如此接近时,脂质可以从一个双层流到另一个双层。对于这种紧密的方法,必须将水从膜的亲水表面排出,这一过程在能量上非常不利,需要专门的融合蛋白来克服这种能量障碍。我们已经讨论了在夹断网格蛋白包被的囊泡期间将膜挤压在一起的相关任务中的作用(参见图 13-14)。
SNARE 蛋白(也称为 SNAREs)催化囊泡运输中的膜融合反应。动物细胞中至少有 35 种不同的 SNARE,每个 SNARE 都与分泌性或胞内途径中的特定细胞器相关。这些跨膜蛋白以互补集的形式存在,v-SNARE 通常存在于囊泡膜上,而 t-SNARE 通常存在于靶膜上(参见图 13-17)。v-SNARE 是单个多肽链,而 t-SNARE 通常由三种蛋白质组成。v-SNARE 和 t-SNARE 具有特征性的螺旋结构域,这些结构域在孤立时大多是非结构化的。当 v-SNARE 与 t-SNARE 相互作用时,一个拉链的螺旋结构域与另一个拉链的螺旋结构域形成一个非常稳定的四螺旋束。得到的反式 SNARE 复合物将两个膜锁定在一起。所有不同 SNARE 组合的生化膜融合试验表明 v- 和 t-SNARE 配对具有高度特异性。因此,SNARE 有助于确保囊泡仅与其正确的靶膜融合,从而在运输过程中提供额外的特异性层。
反式 SNARE 复合物的极高稳定性意味着它从最初的非结构化 v 和 t-SNARE 组装在能量上是有利的。利用这种能量将膜表面拉在一起,同时从界面中挤出水分子以启动脂质双层融合(图 13-20)。当含有纯化的 v-SNARE 的脂质体与包含互补 t-SNARE 的脂质体混合时,它们的膜会融合,尽管速度很慢。在细胞中,与 v-SNARE 和 t-SNARE 对相互作用的因子会大大加速融合,以精确对齐它们,以便它们可以启动拉链。融合并不总是在 v-SNARE 和 t-SNARE 配对后立即进行。正如我们稍后讨论的那样,在调节胞吐作用的过程中,反式 SNARE 复合体的最后一部分的拉链被延迟,直到分泌被特定的细胞外信号触发。
相互作用的 SNARE 需要被撬开才能再次发挥作用
在 SNARE 蛋白参与膜融合后,高度稳定的反式 SNARE 复合物必须在 SNARE 介导新一轮运输之前分解。一种称为 NSF 的关键蛋白质在 mem branes 和胞质溶胶之间循环并催化分解过程。NSF 是 AAA 蛋白家族的六聚体 ATP 酶(参见图 6-88),它利用 ATP 水解的能量来解开成对的 SNARE 蛋白的螺旋结构域之间的紧密相互作用(图 13-21)。拆卸后,SNARE 蛋白可以再次利用其组装获得的能量来驱动另一个融合反应。因此,SNARE 介导的聚变反应的能量最终来自 NSF 消耗的 ATP 以将它们撬开。在目标隔室分解反式 SNARE 复合物后,v-SNARE 被选择性地检索并返回到其起始隔室,以便它们可以在新形成的运输囊泡中重复使用。这种选择性检索路径(稍后讨论)对于在面对持续的传出流量时维护每个区间的身份至关重要。
其他过程中的膜融合也很重要。精子和卵子的质膜在受精时融合,成肌细胞在发育为骨骼肌时融合,人类胎盘的上皮细胞融合为巨大的合胞体。类似的,ER和线粒体动态地融合和分裂。所有的细胞膜融合都需要特定的蛋白质。
病毒编码细胞进入所需的特殊膜融合蛋白
当病毒膜与细胞膜融合时,包膜病毒具有基于脂质双层的包膜,进入它们感染的细胞(在第 5 章和第 23 章中讨论)。例如,导致 AIDS 的人类免疫缺陷病毒 (HIV) 等病毒与细胞表面受体结合,然后与靶细胞的质膜融合(图 13-22)。这种融合事件允许核衣壳内的病毒核酸进入胞质溶胶,在那里进行复制。其他病毒,如流感病毒,首先通过受体介导的内吞作用进入细胞(稍后讨论),然后被递送到内体;内体中的低 pH 值激活病毒包膜中的融合蛋白,该融合蛋白催化病毒膜和内体膜的融合,将病毒核酸释放到胞质溶胶中。在导致 COVID-19 的严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 的情况下,融合反应需要裂解病毒表面蛋白的宿主蛋白酶以激活其融合活性。
病毒融合蛋白催化的膜融合反应已得到很好的理解。与 SNARE 介导的融合(涉及两个膜中的蛋白质)不同,病毒融合通常只需要病毒蛋白。这些病毒融合蛋白在适当的环境中展开,并将部分疏水贴片插入宿主膜。然后,融合蛋白发生压实,使两个膜靠拢,以类似于 SNARE 介导的融合的反应驱动它们的融合。
总结
在真核细胞中,特定膜成分从一个膜封闭隔室定向和选择性转运到另一个隔室,从而维持了这些隔室之间的差异。运输囊泡可以是球状、管状或不规则形状的,从供体膜的特殊涂层区域发芽。涂层的组装有助于收集特定的膜和可溶性货物分子以进行运输并驱动囊泡的形成。
有各种类型的包衣囊泡。网格蛋白包被的囊泡介导从质膜、内体和反式高尔基体网络的转运。COPI 包被和 COPII 包被的囊泡介导高尔基体膜囊之间以及 ER 与高尔基体之间的运输。逆转运体在内体膜上形成一层外套,用于转运到高尔基体。外套具有常见的两层结构:由衔接蛋白形成的内层捕获特定的货物分子以包装到囊泡中,外层形成笼并帮助膜变形为囊泡。在囊泡与其适当的靶膜融合之前,涂层脱落。
膜运输的特异性是由几种类型的分子标志物介导的,这些分子标志物决定了运输囊泡的来源和货物的运输地点。特异性磷酸肌醇的局部合成产生结合位点,触发网格蛋白包衣组装和囊泡出芽。此外,外壳募集 GTP 酶(包括 Sar1 和 ARF 蛋白)调节外壳组装和拆卸。Rab 蛋白是一大类 GTP 酶,在转运囊泡和靶膜上发挥作用,以控制膜转运的特异性。活性 Rab 蛋白募集 Rab 效应子,例如沿肌动蛋白丝或微管运输囊泡的运动蛋白,以及有助于确保囊泡仅将其内容物输送到适当的靶膜的丝状束缚蛋白。有助于确定细胞器身份的专用膜结构域可以通过 Rab 蛋白及其效应子的组装和拆卸以动态方式生成和改变。转运囊泡上的互补 v-SNARE 蛋白和靶膜上的互补 t-SNARE 蛋白形成稳定的反式 SNARE 复合物,强迫膜接近以融合。
从内质网通过高尔基体运输
如第 12 章所述,新合成的蛋白质从胞质溶胶穿过内质网 (ER) 膜进入分泌途径。这些蛋白质在通过从 ER 到高尔基体,从高尔基体到细胞表面和其他地方的一系列隔室时被连续修饰。从一个隔室转移到下一个隔室涉及前向和后向运输路径之间的微妙平衡。一些运输囊泡选择货物分子并将它们移动到通路的下一个部分,而另一些则检索逃逸的蛋白质并将它们返回到它们正常运作的前一个隔室。因此,从 ER 到细胞表面的途径由许多分选步骤组成,这些步骤不断选择膜和可溶性管腔蛋白进行包装和运输。
在本节中,我们主要关注高尔基体(也称为高尔基复合体)。它是碳水化合物合成的主要场所,也是从内质网运送到它的产品的分拣和修补站。细胞在高尔基体中产生许多多糖,包括植物细胞壁的果胶和半纤维素以及动物细胞外基质的大部分糖胺聚糖(在第 19 章中讨论)。高尔基体还构建寡糖链并将其连接到 ER 发送给它的许多蛋白质和脂质上。其中一些寡糖用作标签,将携带它们的特定蛋白质引导到囊泡中,然后转运到内体,最终递送到溶酶体。但是,大多数蛋白质和脂质一旦在高尔基体中获得适当的寡糖,就会以其他方式被识别为靶向进入细胞表面和其他目的地的运输囊泡。
蛋白质在 COPII 包被的运输囊泡中离开内质网
为了开始它们沿着分泌途径的旅程,已经进入内质网并运往高尔基体或更高尔基体以外的蛋白质首先被包装到 COPII 包被的运输囊泡中。这些囊泡从 ER 的特殊区域(称为 ER 出口位点)出芽,其膜缺乏结合的核糖体。大多数动物细胞的 ER 出口位点分散在整个 ER 网络中。
进入离开ER的囊泡可能是一个选择性过程,也可能是组成型的。许多跨膜蛋白被主动募集到这种囊泡中,在那里它们变得浓缩。这些跨膜蛋白在其胞质表面显示 COPII 内涂层的衔接蛋白识别的出口(转运)信号(图 13-23)。ER 腔中的可溶性转运蛋白具有出口信号,这些信号被其中一些跨膜蛋白识别,这些蛋白充当转运受体。这些受体在将货物输送到高尔基体后被回收回 ER。没有出口信号的蛋白质也可以进入转运囊泡,包括通常在 ER 中起作用的蛋白质分子(所谓的 ER 驻留蛋白)。这些驻留蛋白缓慢地从 ER 中泄漏出来,需要修复途径将它们从高尔基体中带回来。不同的货物蛋白以截然不同的速率和效率进入运输囊泡。这些差异可能是由于它们的折叠和寡聚化效率和动力学,以及它们与货物受体和 COPII 涂层结合的能力不同。
ER的退出步骤是一个主要检查点,在该检查点上对细胞分泌或显示在其表面的蛋白质进行质量控制,正如我们在第12章中讨论的那样。目前尚不清楚将可溶性蛋白质直接从 ER 中转运到高尔基体及更远处的出口信号。一些跨膜蛋白作为货物受体,将一些分泌蛋白包装到 COPII 包被的囊泡中,是与分泌蛋白的寡糖结合的凝集素。一中这样的凝集素,结合两种分泌的凝血因子的甘露糖(V和VIII),从而打包这些蛋白,缺乏该蛋白导致凝血障碍。
只有正确折叠和组装的蛋白质才能离开 ER
要从 ER 中出来,蛋白质必须正确折叠,如果它们是多蛋白复合物的亚基,则需要完全组装。那些错误折叠或未完全组装的细胞瞬时保留在 ER 中,在那里它们与 BiP 或钙联蛋白(第 6 章讨论)结合。伴侣可能会掩盖出口信号或以某种方式将蛋白质锚定在 ER 中。这种失败的蛋白质最终被转运回胞质溶胶中,在那里它们被蛋白酶体降解(在第 6 章和第 12 章中讨论)。该质量控制步骤可防止错误折叠或错误组装的蛋白质继续转运,这可能会干扰正常蛋白质的功能。这样的失败出奇地普遍。例如,T 细胞受体(在第 24 章中讨论)和乙酰胆碱受体(在第 11 章中讨论)的大多数新合成的亚基通常会在未到达它们发挥作用的细胞表面时被降解。因此,细胞必须产生大量过量的一些蛋白质分子,以产生少数能够折叠、组装和正常运作的蛋白质分子。
然而,有时严格的质量控制机制也存在缺点。导致囊性纤维化(一种常见的遗传性疾病)的主要突变导致产生对 Cl 转运很重要的质膜蛋白的略微错误折叠形式。尽管如果突变蛋白到达质膜,它的功能几乎会正常,但它被保留在 ER 中,然后被胞质蛋白酶体降解。因此,这种毁灭性的疾病不是因为突变使蛋白质失活,而是因为潜在的活性蛋白质在到达质膜之前就被丢弃了。
囊泡管簇介导从 ER 到高尔基体的运输
运输囊泡从 ER 出口部位出芽并脱落外套后,它们开始相互融合。来自同一隔室的膜的融合称为同型融合,以区别于异型融合,其中来自一个隔室的膜与不同隔室的膜融合。与异型融合一样,同型融合需要一组配对的SNARE。在这种情况下,相互作用是对称的,两个膜都携带vSNARE和tSNARE。
当 ER 衍生的囊泡相互融合时形成的结构称为囊泡管簇vesicular tubular clusters,因为它们在电子显微镜下具有复杂的外观(图 13-25A)。这些簇构成了一个独立于 ER 的部分,并且缺乏许多在 ER 中起作用的蛋白质。它们不断生成,并用作运输容器,将材料从 ER 运送到高尔基体。簇沿着微管快速移动到与之融合的高尔基体(图 13-25B 和电影 13.3)。
一旦囊泡管状簇形成,他们就开始出芽自己的运输囊泡。与从 ER 中出芽的 COPII 包被的囊泡不同,这些囊泡是 COPI 包被的(参见图 13-25B)。COPI 包被的囊泡的独特之处在于,构成内层和外层的成分被募集为预组装复合物,称为 coatomer。它们作为回收途径发挥作用,带回逃逸的内质网驻留蛋白,以及参与内质网出芽和囊泡融合反应的转运受体和SNARE等蛋白。这个检索过程展示了调节涂层组装反应的精细控制机械。COPI 涂层组装在 COPII 涂层脱落后几秒钟开始;外套组件中的这个开关是如何控制的仍然是一个谜。
当囊泡小管 Clus ters 向高尔基体移动时,取回(或逆行)运输继续进行。因此,簇不断成熟,随着选定的蛋白质返回 ER,它们的组成逐渐改变。在囊泡管状囊团输送货物后,继续从高尔基体取回。
ER 的检索途径使用分选信号
将逃逸的蛋白质返回 ER 的检索途径取决于 ER 回收信号。例如,驻留 ER 膜蛋白包含直接与 COPI 包被结合的信号,因此被包装到 COPI 包被的运输囊泡中,以便逆行递送到 ER。这种类型的最特征的修复信号由两个赖氨酸组成,然后是位于 ER 膜蛋白最末端的任意两个其他氨基酸。它被称为 KKXX 序列,基于单字母氨基酸代码。大多数在 ER 和高尔基体界面上起作用的膜蛋白,包括 v-SNARE 和 t-SNARE 以及一些货物受体,都使用这种修复途径返回 ER。
可溶性 ER 驻留蛋白,如 BiP,在其 C 端也包含一个短的 ER 回收信号,但它不同:它由 Lys-Asp-Glu-Leu 或类似序列组成。如果通过基因工程从 BiP 中去除这个信号(称为 KDEL 序列),则蛋白质会慢慢从细胞中分泌出来。如果信号被转移到正常分泌的蛋白质上,蛋白质现在会有效地返回到 ER,在那里积累。与可以直接与 COPI 外壳相互作用的 ER 膜蛋白上的检索信号不同,可溶性 ER 驻留蛋白必须与专门的受体蛋白结合,例如 KDEL 受体——一种与 KDEL 序列结合的多通道转膜蛋白,并将显示它的任何蛋白质包装到 COPI 包被的逆行运输囊泡中(图 13-26)。
KDEL 受体通过在 ER 和高尔基体之间循环,选择性地将蛋白质与高尔基体中的 KDEL 序列结合并在 ER 中释放它们来完成这项任务。这两个区室中受体和 KDEL 序列之间的亲和力明显不同,这是由于高尔基体的 pH 值较低,而高尔基体的 pH 值由 H+ 泵调节。KDEL 受体中的关键组氨酸在高尔基体的低 pH 环境中被质子化,强烈有利于其与 KDEL 序列的相互作用。正如我们稍后讨论的那样,pH 敏感的蛋白质-蛋白质相互作用构成了细胞中许多蛋白质分选步骤的基础。
许多蛋白质选择性地保留在它们发挥作用的隔室中
KDEL 修复途径仅部分解释了 ER 驻留蛋白如何维持在 ER 中。如前所述,表达转基因 ER 驻留蛋白的细胞(已从实验中去除 KDEL 序列)分泌这些蛋白质。但分泌速度比正常的分泌蛋白慢得多。似乎独立于其 KDEL 信号的机制通常会保留 ER 驻留蛋白,并且只有那些逃避这种保留机制的蛋白质才会被捕获并通过 KDEL 受体返回。
一种建议的保留机制是 ER 驻留蛋白彼此结合,从而形成太大而无法有效进入运输囊泡的复合物。由于 ER 驻留蛋白以非常高的浓度(估计为毫摩尔)存在于 ER 中,因此相对低亲和力的相互作用足以保留此类复合物中的大多数蛋白质。在同一隔室中起作用的蛋白质聚集是部门用来组织和保留其驻留蛋白质的一般机制。例如,一起发挥作用的高尔基体酶也相互结合,从而被限制进入离开高尔基体的运输囊泡。
高尔基体由一系列有序的隔室组成
因为它可以通过银染选择性地可视化,所以高尔基体是早期光学显微镜学家描述的最早的细胞器之一。它由一组扁平的、用膜封闭的隔间组成,称为蓄水池cisternae,有点像一堆皮塔饼面包。每个高尔基体堆栈通常由 4 到 6 个蓄水池组成(图 13-27),尽管一些单细胞鞭毛虫可以有 20 多个。在动物细胞中,相应池之间的管状连接连接了许多堆栈,从而形成一个单一的复合体,通常位于细胞核附近并靠近中心体(图 13-28A)。这种定位取决于微管。如果微管通过实验解聚,高尔基体会重组成单独的堆栈,这些堆栈遍布整个细胞质,靠近 ER 出口位点。一些细胞,包括大多数植物细胞,有数百个单独的高尔基体堆栈,通常位于内质网出口处。
在它们通过高尔基体的过程中,许多转运的分子经历了一系列有序的共价修饰。每个高尔基体堆栈都有两个不同的面:顺面(或入口面)和反面(或出口面)。顺式面和反式面都与特殊隔室密切相关,每个隔室都由相互连接的管状和脑状结构网络组成:分别是顺式高尔基体网络 (CGN) 和反式高尔基体网络 (TGN)。CGN 是从 ER 到达的融合囊泡管簇的集合。蛋白质和脂质进入顺式高尔基体网络并从反式高尔基体网络退出,进入细胞表面或其他隔室。这两个网络对于蛋白质分选都很重要:进入 CGN 的蛋白质可以在高尔基体中继续移动或返回到 ER。同样,从 TGN 中流出的蛋白质继续前进,并根据其下一个目的地进行分类:内体、分泌囊泡或细胞表面。它们也可以返回到较早的区间。一些膜布兰蛋白保留在高尔基体发挥作用的部分。
如第 12 章所述,单一种类的 N-连接寡糖整块连接到内质网中的许多蛋白质上,然后在原蛋白仍在内质网中时被修剪。修剪反应产生的寡糖中间体用于帮助蛋白质折叠,并帮助将错误折叠的蛋白质转运到胞质溶胶中,以便在蛋白酶体中降解。因此,它们在控制从 ER 中流出的蛋白质质量方面发挥着重要作用。一旦这些 ER 功能得到满足,细胞就会重新利用寡糖来实现新功能。这从高尔基体开始,它产生成熟蛋白质中可见的异质寡聚骑乘结构。到达 CGN 后,蛋白质进入第一个高尔基体加工区室(顺式高尔基体池)。然后它们移动到下一个隔室(内侧池),最后移动到跨式池,在那里完成糖基化。经水箱的管腔被认为与 TGN 连续,TGN 是将蛋白质分离到不同的运输包中并运送到下一个目的地的地方。寡糖加工步骤在高尔基体中以有序的顺序进行,每个蓄水池都包含一种特征性的加工酶混合物。当蛋白质在堆栈中从一个池移动到另一个池时,它们在连续的阶段中被修饰,因此堆栈形成一个多级处理单元。
研究人员通过将参与加工 N-连接寡糖的酶定位在细胞器的不同区域,通过细胞器的物理分级和用抗体标记电子显微镜切片中的酶,发现了高尔基体的顺式、内侧和反式细分之间的功能差异(图 13-29)。去除甘露糖和添加乙酰葡糖胺发生在顺面和中顺面,半乳糖和唾液酸添加发生在反面和中反面。
寡糖链在高尔基体中加工
ER 腔充满可溶性驻留蛋白和酶,而高尔基体中的驻留蛋白都是膜结合的。例如,所有高尔基体糖苷酶和糖基转移酶都是单跨膜蛋白,其中许多蛋白以多酶复合物形式组织。
两大类 N-连接寡糖,复合型寡糖和高甘露糖寡糖,都连接到哺乳动物糖蛋白上。有时,两种类型都连接到同一多肽链(在不同的地方)。当修剪 ER 中添加的原始 N-连接寡糖并进一步添加糖时,会产生复合型寡糖;相比之下,高甘露糖寡糖被修剪,但在高尔基体中没有添加新的糖(图 13-31)。唾液酸具有特殊的重要性,因为它们带有负电荷。给定的寡糖是保持高甘露糖还是经过加工,很大程度上取决于它在蛋白质中的位置。如果寡糖可以被高尔基体中的加工酶接近,则它很可能转化为复杂形式;如果由于糖分紧紧地粘附在蛋白质表面而无法接近,则它很可能保持高甘露糖形式。生成复杂寡糖链的过程遵循图 13-32 中所示的高度有序途径。
除了大多数细胞共享的寡糖加工的这些共同点之外,在高尔基体中进行的碳水化合物修饰的产物非常复杂,并产生了一个称为糖生物学的研究领域。例如,人类基因组编码数百种不同的高尔基体糖基转移酶和许多糖苷酶。这些酶在不同细胞类型之间以及发育过程中的不同时间表达不同,导致给定蛋白质或脂质在不同的细胞类型和不同的分化阶段出现多种糖基化形式。修饰的复杂性不仅限于 N-连接寡糖,还发生在 O-连接糖上,正如我们接下来讨论的那样。
蛋白多糖组装在高尔基体中
除了 N-连接寡糖的改变外,许多蛋白质在从 ER 到最终目的地的途中穿过高尔基体池时,还会以其他方式在高尔基体中进行修饰。一些蛋白质在丝氨酸和苏氨酸添加了糖,有时还在羟脯氨酸和羟赖氨酸上(如胶原蛋白)。这种 O 连接的甘油糖共糖基化(图 13-33)与 N-连接的寡糖链的延伸一样,由一系列糖基转移酶催化,这些酶利用高尔基体腔中的糖-核苷酸将糖添加到蛋白质中,一次一个。通常,首先添加 N-乙酰半乳糖胺,然后添加数量可变的额外糖,从几个到 10 个或更多不等。
高尔基体对粘蛋白、粘液分泌物中的糖蛋白和蛋白多糖核心蛋白赋予最重的 O-连接糖基化,它对其进行修饰以产生蛋白多糖。如第 19 章所述,此过程涉及将一条或多条糖胺聚糖链(由重复的二糖单元组成的长而无支链的聚合物;参见图 19-35)聚合到核心蛋白上的丝氨酸上。许多蛋白聚糖被分泌并成为细胞外基质的组成部分,而其他蛋白聚糖则保持锚定在质膜的细胞外表面。还有一些形成粘稠物质的主要成分,例如分泌的粘液在许多上皮细胞表面形成保护涂层。
掺入糖胺聚糖中的糖在这些聚合物制成后立即在高尔基体中被严重硫酸化,从而增加了它们特征性大负电荷的一大部分。蛋白质中的一些酪氨酸在离开高尔基体前不久也会被硫酸化。在这两种情况下,硫酸化都依赖于硫酸盐供体 3'-磷酸腺苷-5'-磷酸硫酸盐 (PAPS)(图 13-34),它从胞质溶胶转运到反面高尔基体网络的腔中。
糖基化的目的是什么?
寡糖的构建与其他大分子(如 DNA、RNA 和蛋白质)的合成之间有重要区别。核酸和蛋白质是使用相同的酶或一组酶通过一系列重复的相同步骤从模板中复制的,而复杂的碳水化合物在每个步骤中都需要不同的酶。每种酶的产物都被认为是该系列中下一种酶的专有底物。糖蛋白的大量性和进化成合成它们的复杂途径强调,糖蛋白和鞘脂上的寡糖具有非常重要的功能。一大类人类遗传疾病被称为先天性糖基化疾病,是由参与蛋白质和脂质聚糖修饰的单个酶的遗传突变引起的。
例如,N-连接糖基化在所有真核生物中都普遍存在,包括酵母。N-连接寡糖也以非常相似的形式存在于古细菌细胞壁蛋白中,这表明它们合成所需的整个机制在进化上是古老的。N-连接糖基化以两种方式促进蛋白质折叠。首先,它在使折叠中间体更易溶解方面起着直接作用,从而防止它们聚集。其次,N-连接寡糖的连续修饰建立了一个“糖密码”,标志着蛋白质折叠的进展。该糖密码被 ER 中的伴侣和凝集素用于指导蛋白质折叠和降解(在第 12 章中讨论),并被其他引导 ER 到高尔基体运输的凝集素使用。正如我们稍后讨论的那样,寡糖也参与反式高尔基体网络中的蛋白质分选。
由于糖链的柔韧性有限,即使是从糖蛋白表面突出的小 N-连接寡糖(图 13-35)也会限制其他大分子接近蛋白质表面。以这种方式,例如,寡糖的存在往往会使糖蛋白更耐蛋白水解酶的消化。可能是细胞表面蛋白上的寡糖最初为祖先细胞提供了保护层;与刚性细菌细胞壁相比,这种糖衣的优点是它让细胞可以自由地改变形状和移动。
此后,糖链也被调整为其他用途。例如,肺和肠道细胞的粘液外套可以防止许多病原体。凝集素在细胞外空间对糖链的识别在许多发育过程和细胞间识别中很重要:例如,选凝素是跨膜凝集素,在血细胞迁移过程中在细胞间粘附中发挥作用,如第 19 章所述。寡糖的存在可能会改变蛋白质的抗原和功能特性,使糖基化成为生产制药用蛋白质的重要因素。
糖基化也可以发挥重要的调节作用。例如,通过细胞表面信号转导受体 Notch 进行信号转导是决定细胞发育命运的重要因素(在第 21 章中讨论)。Notch 是一种跨膜蛋白,通过向一些丝氨酸、苏氨酸和羟赖氨酸添加单个岩藻糖而进行 O 糖基化。一些细胞类型表达一种额外的糖基转移酶,该酶向高尔基体中的每个岩藻糖中添加 N-乙酰葡糖胺。这种添加改变了 Notch 对激活它的细胞表面信号蛋白的特异性。
通过高尔基体的运输通过多种机制发生
为了发挥作用,高尔基体必须保持其极化的多池结构,同时促进大量不同分子的运输。很可能使用了多种机制来通过高尔基体池运输货物分子,同时有效地保留高尔基体驻留蛋白。一种机制涉及运输容器中的货物从一个隔间移动到另一个隔间,同时回收任何逃脱的驻留蛋白,使用不同运输囊泡(图 13-36A)。这种囊泡转运机制在概念上类似于蛋白质和脂质从 ER 转运到高尔基体的方式,只是仅使用 COPI 包被的囊泡。尽管向前和向后移动的囊泡都似乎带有 COPI 包被,但包被可能包含不同的衔接蛋白,这些接头蛋白赋予货物分子包装选择性。
货物通过高尔基体的另一种方式涉及膜囊成熟机制。根据这一观点,当囊泡状肾小管簇从 ER 到达并与含有高尔基体驻留蛋白和酶的运输囊泡融合时,新的顺式膜囊不断形成。当顺式池内的货物被修饰时,酶离开运输囊泡,这些囊泡将与新到达的囊泡管簇融合。同时,膜囊接受含有来自后来高尔基体膜囊的酶的运输囊泡,将其转化为内侧膜囊。通过这种方式,装满货物的蓄水池通过高尔基体堆栈,而高尔基体驻留蛋白的不同亚群在 COPI 包被的囊泡中从晚期到早期蓄水池向后移动(图 13-36B)。当蓄水池最终向前移动成为反式高尔基体网络的一部分时,各种类型的涂层囊泡从它身上发芽,直到这个网络消失,取而代之的是紧随其后的成熟蓄水池。同时,其他运输囊泡不断从后高尔基体隔室中取回膜并将其返回到反式高尔基体网络。
根据细胞的类型和需要运输的货物分子的性质,这两种机制的各个方面可能在不同程度上得到使用。每个高尔基体水池的中心可能存在一个稳定的持久蓄水池核心,而边缘的区域可能会不断成熟,可能利用改变其身份的 Rab 级联。随着膜囊的成熟部分的形成,它们可能会通过同型融合机制断裂并与下游顺式融合,带走大的货物分子,如前胶原杆和脂蛋白颗粒。此外,COPI 包被的囊泡可能会向前运输小货物,并将逃逸的高尔基体酶回收到适当的上游水池。
高尔基体基质蛋白有助于组织堆栈
如前所述,高尔基体的独特结构取决于微管细胞骨架和细胞质高尔基体基质蛋白。高尔基体重组和堆叠蛋白(称为 GRASP)在相邻的蓄水池之间形成支架,并赋予高尔基体堆栈结构完整性。其他基质蛋白(称为golgins)形成长系绳,由坚硬的卷曲螺旋结构域和散布的铰链区域组成。golgins形成一片触手森林,可以从高尔基体堆栈表面延伸 100-400 纳米。golgin家族的不同成员位于高尔基体堆栈的不同区域,并包含结合不同 Rab 蛋白的位点。由于来自不同位置的运输囊泡具有其特征性的 Rab 蛋白,因此golgin被认为起着tethers的作用,选择运输囊泡加入高尔基体堆栈的哪一部分(图 13-37)。
当细胞准备分裂时,有丝分裂蛋白激酶磷酸化高尔基体基质蛋白,导致高尔基体片段化并分散在整个胞质溶胶中。然后,高尔基体片段均匀分布到两个子细胞,其中基质蛋白被去磷酸化,导致高尔基体堆栈的重组。同样,在细胞凋亡过程中,半胱天冬酶对高尔基体的蛋白水解 cleav age(在第 18 章中讨论)导致高尔基体碎片化。
总结
在 ER 中正确折叠和组装的蛋白质被包装到 COPII 包被的运输囊泡中,这些囊泡从 ER 膜上夹下来。此后不久,囊状囊状菌脱落外套并相互融合形成囊泡状管状簇。在动物细胞中,这些簇随后沿着微管轨道移动到高尔基体,在那里它们彼此融合形成顺式高尔基体网络。任何从 ER 逸出的常驻 ER 蛋白都通过 COPI 包被囊泡中的逆行运输从囊泡肾小管和高尔基体返回那里。
与 ER 不同,高尔基体包含许多糖核苷酸,糖基转移酶在脂质和蛋白质分子通过高尔基体时使用这些核苷酸对脂质和蛋白质分子进行糖基化。在 ER 中添加到蛋白质中的 N-连接寡糖上的甘露糖通常最初被去除,然后进一步添加糖。此外,高尔基体是发生 O-连接糖基化的位点,也是糖胺聚糖链添加到核心蛋白形成蛋白聚糖的位点。蛋白聚糖中糖的硫酸化和蛋白质上选定的酪氨酸的硫酸化也发生在晚期高尔基体区室中。
高尔基体修饰它从 ER 接收到的许多蛋白质和脂质,然后将它们分配到质膜、内体和秘密囊泡。高尔基体是一种极化细胞器,由一堆或多堆圆盘状水箱组成。每个堆栈组织为一系列至少三个功能不同的隔室,称为顺式、内侧和中间脑池。顺式蓄水池和反式蓄水池分别连接到特殊的分拣站,分别称为顺式高尔基体网络和反式高尔基体网络。蛋白质和脂质沿顺式到反式方向穿过高尔基体堆栈。这种运动可能是通过囊泡运输、顺式脑池在堆栈中不断迁移时逐渐成熟或这两种机制结合发生的。从晚期到早期水池的持续逆行囊泡运输使酶集中在需要它们的水池中。成品新蛋白最终来到反面高尔基体网络,在此处打包分配。
从反式高尔基体网络到细胞外部和内体的运输
通过高尔基体池后,到达反式高尔基体网络 (TGN) 的货物分子被分类并包装成运输囊泡,前往不同的目的地。运往细胞表面的运输囊泡通常以不规则形状的小管形式稳定地离开 TGN。这些囊泡中的膜蛋白和脂质为细胞的质膜提供新的成分,而囊泡内的可溶性蛋白则分泌到细胞外间隙。囊泡与质膜的融合称为胞吐作用。例如,这是细胞分泌细胞外基质的大部分蛋白聚糖和糖蛋白的途径,如第 19 章所述。
所有细胞都需要这种组成型分泌途径,该途径持续运作 (Movie 13.5)。然而,专门的分泌细胞有第二种分泌途径,可溶性蛋白质和其他物质在这个途径中最初储存在分泌囊泡中,随后通过胞吐分泌到细胞外。这是调节性分泌途径,主要存在于专门根据需要快速分泌产物(如激素、神经递质或消化酶)的细胞中。
TGN 的第三个主要目的地是内体。在溶酶体腔中起作用的水解酶首先通过这条途径到达内体,内体逐渐成熟为溶酶体(稍后讨论)。TGN 中溶酶体水解酶蛋白的分选机制特别容易理解,并提供了 TGN 中的货物分子如何在不同类型的运输囊泡中分离的一个例子。在本节中,我们考虑了高尔基体在这三种途径之间对蛋白质进行分类中的作用,并比较了组成型和调节性分泌的机制。
许多蛋白质和脂质自动从反式高尔基体网络携带到细胞表面
能够调节分泌的细胞在离开 TGN 之前必须至少分离出三类蛋白质——那些发往溶酶体(通过内体)、那些发往分泌囊泡的蛋白质,以及那些注定要立即递送到细胞表面的蛋白质(图 13-38)。需要特定信号才能将分泌蛋白引导到分泌囊泡中,将溶酶体蛋白引导到不同的特殊转运囊泡中。非选择性组成型分泌途径将大多数其他蛋白质直接转运到细胞表面。因为进入该通路不需要特定的信号,所以它也被称为默认途径。因此,在非极化细胞(例如白细胞或成纤维细胞)中,高尔基体腔中的任何蛋白质似乎都会通过构成途径自动携带到细胞表面,除非它被特异性地返回到 ER,作为驻留蛋白质保留在高尔基体本身中, 或选择通向受调节分泌或内体的途径。在极化细胞中,不同的产物必须输送到细胞表面的不同区域,我们将看到选项更加复杂。
甘露糖 6-磷酸受体在反式高尔基体网络中对溶酶体水解酶进行分类
最容易理解的 TGN 货物分子分选机制在溶酶体水解酶上起作用。溶酶体是膜封闭的细胞器,含有大约 40 种水解酶,负责消化输送在那里的所有大分子。因此,溶酶体是蛋白质、核酸、脂质甚至整个细胞器降解和再循环的主要场所。溶酶体的功能和通向该细胞器的各种运输途径将在后面考虑。现在,我们讨论选择性打包的途径:TGN 处的溶酶体水解酶进入运往内体的运输囊泡。离开 TGN 进入内体的囊泡掺入溶酶体 蛋白,并排除许多其他蛋白质。
如何在 TGN 中以所需的准确度识别和选择溶酶体水解酶?在动物细胞中,它们携带甘露糖 6-磷酸 (M6P) 基团形式的独特标记物,当它们通过顺式高尔基体网络的内腔时,这些基团被专门添加到这些可溶酶体酶的 N-连接寡糖中(图 13-39)。存在于 TGN 中的跨膜 M6P 受体蛋白识别 M6P 基团并与膜腔侧的溶酶体水解酶和胞质侧组装网格蛋白外壳的衔接蛋白结合。通过这种方式,接收器有助于将水解酶包装成网格蛋白包被的囊泡,这些囊泡从 TGN 发芽并将其内容物输送到早期内体。
M6P 受体蛋白在 TGN 管腔中 pH 6.5-6.7 与 M6P 结合,并在 pH 6 处释放,即内体管腔中的 pH 值。因此,在受体递送后,溶酶体水解酶与 M6P 接收器解离,M6P 接收器被回收到从内体发芽的运输囊泡中。这些囊泡包被有逆转运体retromer,逆转运体是一种专门用于内体到 TGN 转运的外壳蛋白复合物,它将受体返回给 TGN 以供重复使用(图 13-40)。
任一方向的运输都需要 M6P 受体的胞质侧尾部发出信号,将该蛋白质引导至内体或返回 TGN。网格蛋白外壳的衔接蛋白在 TGN 处识别尾部,而逆转录酶在内体处识别它。细胞器特异性标志物(如内体上的 Rab7 和 PI(3)P)确保了同一受体在不同 mem branes 的不同外壳上的组装。M6P 受体的再循环类似于前面讨论的 KDEL 受体的再循环,尽管它在介导转运的包被囊泡的类型上有所不同。
不是所有用 M6P 标记的水解酶分子都到达溶酶体。一些逃避反式高尔基体网络中的正常包装过程,并通过组成型分泌途径运输到细胞表面,在那里它们被分泌到细胞外液中。然而,一些 M6P 受体也绕道到质膜,在那里它们重新捕获逃逸的溶酶体水解酶,并通过受体介导的内吞作用(稍后讨论)通过早期和晚期内体将它们返回到溶酶体。由于溶酶体水解酶需要酸性环境才能工作,因此它们对细胞外液(通常具有 7.4 的中性 pH 值)几乎没有伤害。
对于分离溶酶体水解酶并将其调度到内体工作的分选系统,M6P 基团必须仅添加到高尔基体中适当的糖蛋白中。这需要负责添加 M6P 的高尔基体酶特异性识别水解酶。由于所有糖蛋白都以相同的 N-连接寡糖链离开 ER,因此将 M6P 单元添加到寡糖中的信号必须位于每个水解酶的多肽链中的某个位置。基因工程实验表明,识别信号是每个 pro-tein 表面的一簇相邻氨基酸,称为信号片段(图 13-41)。由于大多数溶酶体水解酶含有多个寡糖,因此它们获得许多 M6P 基团,为 M6P 受体提供高亲和力信号。
磷酸转移酶缺陷导致人类溶酶体贮积病
影响一种或多种溶酶体水解酶的遗传缺陷会导致大量人类溶酶体贮积病。缺陷导致未消化的底物在溶酶体中积累,具有严重的病理后果,最常见于神经系统。在大多数情况下,编码单个溶酶体水解酶的结构基因存在突变。这发生在 Hurler 病中,例如,分解某些类型的糖胺聚糖链所需的酶有缺陷或缺失。然而,最严重的溶酶体贮积病是一种非常罕见的遗传性代谢性代谢病,称为包涵体细胞病(I 细胞病)。在这种情况下,许多细胞类型的溶酶体中几乎缺少所有的水解酶,它们未消化的底物在这些溶酶体中积累,从而在细胞中形成大的包涵体。随之而来的病理很复杂,影响所有器官系统、骨骼完整性和智力发育;个体很少能活超过 6 或 7 年。
I 细胞病是由单个基因缺陷引起的,并且与大多数遗传酶缺陷一样,它是隐性的;也就是说,它只发生在有两个缺陷基因拷贝的个体中。在患有 I 细胞疾病的个体中,溶酶体遗漏的所有水解酶都在血液中发现:因为它们未能在高尔基体中正确分类,因此它们被分泌而不是转运到溶酶体。错误分选可追溯到 GlcNAc 磷酸转移酶有缺陷或缺失。由于溶酶体酶在顺式高尔基体网络中未被磷酸化,因此 M6P 受体不会将它们分离到 TGN 中适当的运输囊泡中。相反,溶酶体水解酶被带到细胞表面并分泌。
在 I 细胞疾病中,某些细胞类型(例如肝细胞)中的溶酶体包含溶酶体酶的正常补体,这意味着还有另一种将水解酶引导至溶酶体的途径,某些细胞类型使用,但其他细胞类型不使用。替代分选受体在这些 M6P 非依赖性通路中发挥作用。同样,所有细胞中的 M6P 非依赖性通路将溶酶体的膜蛋白从 TGN 分选到晚期内体,因此这些蛋白质在 I 细胞疾病中是正常的。
分泌囊泡 来自反式高尔基体网络的芽
专门用于按需快速分泌其某些产品的细胞,将这些产品浓缩并储存在分泌囊泡中(通常称为致密核心分泌颗粒,因为在电子显微镜下观察时它们具有致密的核心)。正如我们所讨论的(参见图 13-38),分泌囊泡由 TGN 形成,它们响应特定信号通过胞吐作用将其内容物释放到细胞外部。分泌的产物可以是小分子(如组胺或神经肽)或蛋白质(如激素或消化酶)。
用于分泌性囊泡的蛋白质(称为分泌蛋白)通过涉及分泌蛋白选择性聚集的机制在 TGN 中包装成适当的囊泡。聚集的电子致密材料团块可以通过电子显微镜在 TGN 的管腔中检测到。将分泌蛋白直接进入此类聚集体的信号尚不明确,并且可能非常多样化。当编码分泌蛋白的基因在通常不制造蛋白质的分泌细胞中人工表达时,外源蛋白被适当包装到分泌囊泡中。这一观察表明,尽管单个细胞表达和包装在分泌囊泡中的蛋白质不同,但它们包含共同的分选信号,即使蛋白质在通常不产生它们的细胞中表达,这些信号也能正常工作。
目前尚不清楚分泌蛋白的聚集体是如何分离成分泌囊泡的。分泌囊泡的膜中具有独特的蛋白质,其中一些可能作为 TGN 中聚集蛋白的受体。然而,聚集体太大了,对于分泌蛋白的每个分子来说,无法与其自身的货物受体结合,就像溶酶体酶的运输一样。相反,聚集体可能会导致包含货物受体的膜区域在聚集体周围拉紧,从而将其封闭在出芽的囊泡内。

最初,离开 TGN 的分泌囊泡膜仅松散地包裹在聚集的分泌蛋白簇周围。从逻辑上讲,这些未成熟的分泌囊泡类似于从高尔基体堆栈中掐下来的扩张的反式高尔基体池。随着未成熟的分泌囊泡成熟,网格蛋白包被的运输囊泡从中萌芽并返回 TGN(图 13-42)。这种回收过程不仅将高尔基体成分返回到高尔基体,而且还用于浓缩分泌囊泡的内容物。分泌蛋白从 ER 通过高尔基体池转运到成熟分泌囊泡过程中所有检索途径的总和导致净浓度增加 200 至 400 倍。
未成熟的分泌囊泡也相互融合,由于囊泡膜中 V 型 ATP 酶浓度的增加,管腔逐渐变得更加酸性。管腔的酸化进一步将分泌蛋白聚集体浓缩在囊泡内,其多余的膜现已被回收回 TGN。由于最终成熟的分泌囊泡如此密集地充满了内容物,因此分泌细胞可以在触发时通过胞吐作用迅速排出大量物质(图 13-43)。
分泌蛋白的前体在分泌囊泡浓度的形成过程中进行蛋白水解加工
随着分泌囊泡的成熟,分泌蛋白并不是分泌蛋白经历的唯一过程。许多蛋白质激素和小的 神经肽,以及许多分泌的水解酶,都是作为无活性前体合成的。蛋白水解对于从这些前体蛋白中释放活性分子是必要的。裂解发生在分泌囊泡中,有时发生在分泌后的细胞外液中。此外,许多前体 pro teins 带着 N 末端前肽离开 ER,该前肽仅在分泌途径的后期被切割以产生成熟蛋白。这些蛋白质最初合成为pre-pro蛋白,当蛋白质进入粗面 ER 时,ER 信号肽(有时称为前肽)会更早地被切割掉(参见图 12-18)。在其他情况下,肽信号转导分子被制成 polyprotein,其中包含相同氨基酸序列的多个拷贝。在更复杂的情况下,各种肽信号分子被合成为单个多蛋白的一部分,该多蛋白充当多个终产物的前体,这些终产物分别从初始多肽链上切割下来。相同的多蛋白可以以多种方式加工,以在不同细胞类型中产生不同的肽(图 13-44)。
为什么蛋白水解加工在分泌途径中如此常见?以这种方式产生的一些肽,例如脑啡肽(具有吗啡样活性的五个氨基酸神经肽),无疑在其成熟形式中太短,无法共翻译转运到 ER 腔或包含打包的必须信号。此外,对于分泌的水解酶——或任何其他在细胞内活性可能有害的蛋白质——延迟蛋白质的激活,直到它到达分泌囊泡或直到它被分泌出来后,有一个明显的优势:延迟可以防止蛋白质在合成它的细胞内过早地起作用。
分泌囊泡在质膜附近等待,直到发出释放其内容物的信号
一旦加载,分泌囊泡必须到达分泌部位,在某些细胞中,分泌部位远离 TGN。神经细胞是最极端的例子。分泌蛋白,例如肽神经递质(神经肽),将从轴突末端的神经末梢释放出来,并被制造并包装成细胞体内的分泌囊泡。然后它们沿着轴突行进到神经末梢,神经末梢可能在一米或更远的地方。如第 16 章所述,运动蛋白沿着轴突微管推动囊泡,其一致的方向将囊泡引导到正确的方向。微管还将运输囊泡引导至细胞表面以进行组成型胞吐作用。
而含有组成型释放材料的运输囊泡一旦到达质膜就会与质膜融合,而调节途径中的分泌囊泡在膜上等待,直到细胞接收到囊泡分泌其货物的信号。该信号可以是神经电冲动(动作电位)或细胞外信号分子,例如激素。在任何一种情况下,它都会导致胞质溶胶中游离 Ca 2+ 浓度的瞬时增加,这是分泌囊泡融合的触发因素。
为了快速胞吐作用,突触囊泡在突触前质膜提前预备好
神经细胞(和一些内分泌细胞)包含两种类型的分泌囊泡。与所有分泌细胞一样,这些细胞以标准方式将蛋白质和神经肽包装在致密的有芯分泌囊泡中,以便通过受调节的分泌途径释放。然而,此外,它们使用另一类特殊的微小(直径 ∼50 nm)分泌囊泡,称为突触囊泡。这些囊泡储存小的神经递质分子,例如乙酰胆碱、谷氨酸、甘氨酸和 γ-氨基丁酸 (GABA),正如我们在第 11 章中讨论的那样,它们介导从神经细胞到化学突触处靶细胞的快速信号传导。当动作电位到达神经末梢时,它会导致 Ca2+ 通过电压门控 Ca2+ 通道流入,从而触发突触小泡与质膜融合并将其内容物释放到细胞外间隙(参见图 11-38)。一些神经元每秒发射超过 1000 次,每次都会释放神经递质。

递质释放的速度(仅用几毫秒)表明介导融合反应的蛋白质不会经历复杂的多步骤重排。相反,在囊泡对接在突触前质膜后,它们会经历一个准备过程,为快速融合做好准备。在准备状态下,SNARE 部分配对,但它们的螺旋没有完全缠绕成融合所需的最终四螺旋束(图 13-45)。称为 complexin 的蛋白质将 SNARE 复合物冻结在这种亚稳态下。复合物施加的暂停由另一种蛋白synaptotagmin突触结合蛋白释放,该蛋白包含 Ca2+ 结合结构域。胞质 Ca2+ 的增加触发突触结合蛋白与 SNARE 结合,从而分裂复合物蛋白。当 SNARE 束完全拉链时,融合孔打开,神经递质被释放。在典型的突触中,只有少量对接的囊泡被启动并准备好进行胞吐作用。一次只使用一小部分引物囊泡可以使每个突触快速连续地一遍又一遍地发射。每次发射时,新的突触囊泡会对接并准备好取代那些已经融合并释放其内容物的突触囊泡。
突触小泡在胞吐作用后可以在局部回收
为了使神经末梢快速、反复地反应,突触小泡在放电后需要非常迅速地补充。这是通过突触前质膜中突触小泡的局部再循环来实现的。在这个过程中,synaptic 囊泡的膜成分通过内吞作用从表面去除,几乎与胞吐作用添加它们的速度一样快。同样,突触小泡新制造的膜成分最初通过组成性分泌途径输送到质膜,然后通过内吞作用回收。突触小泡的膜成分包括专门用于从胞质溶胶中摄取神经递质的转运蛋白,其中合成了介导快速突触信号传导的小分子神经传递体(图 13-47)。大多数内吞囊泡立即充满神经递质,成为突触囊泡。一旦充满神经递质,突触小泡就可以再次使用(参见图 13-46)。
分泌囊泡膜成分迅速从质膜中去除
当分泌囊泡与质膜融合时,其内容物通过胞吐作用从细胞中排出,其膜成为质膜的一部分。虽然这应该会增加质膜的表面积,但它只是短暂的,因为等量的膜通过内吞作用从表面去除的速度几乎与胞吐添加膜的速度一样快,这一过程让人想起后面讨论的内吞-外吞循环。从质膜内吞的分泌囊泡膜的蛋白质要么被回收,要么被穿梭到溶酶体,通过后面讨论的机制进行降解。临时添加到质膜上的分泌囊泡膜的数量可能是巨大的:在胰腺腺泡细胞中,释放消化酶以输送到肠腔,当细胞受到刺激分泌时,大约 900 μm2 的囊泡膜入顶端质膜(其面积仅为 30 μm2)。
因此,膜交通的控制在维持细胞各种膜的组成方面起着重要作用。为了将分泌和内吞途径中的每个膜封闭隔室保持恒定大小,需要精确调节膜向外和向内流动之间的平衡。然而,要使细胞生长,正向流动需要大于逆向流动,这样膜的面积才能增加。为了使细胞保持恒定大小,正向流和逆行流必须相等。我们对协调这些流动的机制仍然知之甚少。
一些调节性胞吐作用事件用于扩大质膜
调节性胞吐作用的一项重要任务是在出现此类需要时输送更多的膜以扩大细胞质膜的表面积。一个典型的例子是在果蝇胚胎的细胞化过程中发生的质膜扩张,它最初是一个合胞体 — 一个包含大约 6000 个细胞核的细胞,被单个质膜包围(参见图 21-14)。在数十分钟内,胚胎被转化为相同数量的细胞。这种细胞化过程需要大量的新质膜,这些质膜是通过精心编排的细胞质囊泡融合而添加的,最终形成包围独立细胞的质膜。当其他动物细胞或植物细胞在胞质分裂过程中分裂时,需要类似的囊泡融合事件来扩大质膜(在第 17 章中讨论)。许多动物细胞,尤其是那些受到机械应力的动物细胞,经常会在其质膜中经历小破裂。在一个被认为涉及同型囊泡-囊泡融合和胞吐的非凡过程中,从当地可用的内膜资源,比如溶酶体,迅速形成了一个暂时的细胞补丁。除了提供防止泄漏的紧急屏障外,该补片还降低了受伤区域的膜张力,使双层能够重新流在一起,以恢复连续性并密封穿刺。介导膜布赖修复的囊泡的融合和胞吐作用是由 Ca2+ 的突然增加触发的,Ca2+ 在细胞外空间中丰富,一旦质膜被刺破,就会冲入细胞。图 13-48 显示了调节胞吐作用导致质膜扩张的四个示例。
极化细胞 将蛋白质从反式高尔基体网络引导到质膜的适当结构域
组织中的大多数细胞都是极化的,具有两个或多个分子和功能不同的质膜结构域。这就提出了一个普遍的问题,即如何组织从高尔基体递送的膜,以维持一个细胞表面结构域和另一个细胞表面结构域之间的差异。例如,典型的上层细胞具有顶端结构域,该结构域面向内腔或外部世界,并且通常具有特殊特征,例如纤毛或微绒毛的刷状边界。它还有一个基底外侧结构域,覆盖细胞的其余部分。两个结构域由一圈紧密连接隔开(参见图 19-20),这可以防止蛋白质和脂质在两个结构域之间扩散,从而维持两个结构域之间的差异。
不同的蛋白质亚群从细胞的顶端和基底外侧表面分泌。例如,肠道内壁的上皮细胞在其顶端表面分泌消化酶和粘液,在其基底外侧表面分泌基底层的成分。这种细胞必须有办法将携带不同货物的囊泡引导到不同的质膜结构域。发往不同结构域的蛋白质从 ER 一起移动,直到到达 TGN,在那里它们被分离并以分泌或运输囊泡的形式调度到适当的质膜结构域(图 13-49)。这些途径被称为极化分泌的直接途径,因为运往顶端和基底外侧域的货物直接运送到那里。
大多数上皮细胞的顶端质膜富含鞘糖脂,有助于保护这个暴露的表面免受损伤;例如,特别是来自肠道或胃等部位的消化酶和低 pH 值。同样,通过糖基磷脂酰肌醇 (GPI) 锚点连接到脂质双层的质膜蛋白主要存在于顶端质膜中。如果使用重组 DNA 技术将 GPI 锚连接到通常被递送到基底外侧表面的蛋白质上,则该蛋白质被递送到细胞顶端。人们认为GPI 锚定蛋白之所以指向顶膜,是因为它们与 TGN 膜中形成的脂筏中的鞘糖脂结合。如第 10 章所述,当鞘糖脂和胆固醇分子自缔合时,脂质筏会在 TGN 和质膜中形成(参见图 10-13)。在选择了一组独特的货物分子后,筏子然后从 TGN 发芽进入运往顶端质膜的运输囊泡。
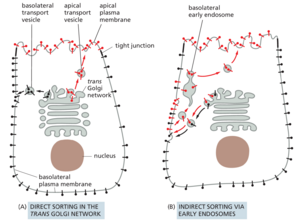
虽然分泌蛋白和 GPI 锚定蛋白依赖于直接途径,但膜蛋白有时可以使用间接途径到达适当的膜表面(参见图 13-49B)。在这条路线中,顶端和基底货物在从 TGN 到基底外侧膜的运输囊泡中一起移动。不属于质膜该区域的膜蛋白通过内吞作用被回收,并通过早期内体转运到正确的区域。注定要递送到基底膜的膜蛋白在其胞质尾部包含分选信号。当存在于适当的结构环境中时,这些信号被外壳蛋白识别,外壳蛋白将它们包装到 TGN 中适当的运输囊泡中。在 TGN 中识别的相同基底信号也在早期内体中发挥作用,在蛋白质被内吞后将其重定向回基底外侧质膜。直接和间接递送的组合确保顶端和基底外侧膜保持其独特的身份。
总结
离开 TGN 的运输囊泡将其内容物带到两个主要目的地之一:用于胞吐作用的质膜或最终输送到溶酶体的内体。囊泡从 TGN 到质膜的转运进一步分为组成型途径或调节途径。蛋白质遵循组成型途径,除非它们被转移到其他途径或保留在高尔基体 appara tus 中。在极化细胞中,从 TGN 到质膜的转运途径选择性地发挥作用,以确保不同的膜蛋白组、分泌的 pro teins 和脂质被递送到质膜的不同结构域。调节通路仅在专门的分泌细胞和神经元中起作用。用于调节分泌的分子储存在分泌囊泡或突触囊泡中,在接收到适当的信号之前,它们不会与质膜融合以释放其内容物。含有用于从 TGN 分泌芽的蛋白质的分泌囊泡。分泌蛋白在分泌囊泡的形成和成熟过程中变得浓缩。突触囊泡局限于神经细胞和一些内分泌细胞,由内吞囊泡和内体形成,它们介导神经细胞轴突末梢小分子神经递质的调节分泌。新合成的溶酶体蛋白通过网格蛋白包被的运输囊泡从 TGN 输送到内体,然后进入溶酶体。溶酶体水解酶含有 N-连接的寡糖,这些寡糖在顺式高尔基体网络中以独特的方式进行共价修饰,因此它们的甘露糖被磷酰化。这些甘露糖 6-磷酸 (M6P) 基团被反式高尔基体网络中的 M6P 受体蛋白识别,该受体蛋白分离水解酶并帮助它们包装成出芽的运输囊泡,将其内容物输送到内膜一些。M6P 受体在反式高尔基体网络和内体之间来回穿梭。内体中的低 pH 值和从 M6P 基团中去除磷酸盐导致溶酶体水解酶与这些受体解离,使水解酶的转运是单向的。单独的运输系统使用网格蛋白包被的囊泡将驻留的溶酶体膜蛋白从反式高尔基体网络递送到内体。
从质膜运输到细胞中:内吞作用
从细胞表面向内引出的途径从内吞作用过程开始,细胞通过内吞作用吸收质膜成分、液体、溶质、大分子和颗粒物质。内吞货物包括受体-配体复合物、一系列营养物质及其载体、细胞外基质成分、细胞碎片、细菌、病毒,在特殊情况下,甚至包括其他细胞。通过内吞作用,细胞调节其质膜的组成,以响应不断变化的细胞外条件。
在内吞作用中,要摄入的物质逐渐被质膜的一小部分包围,质膜首先内陷,然后被夹住,形成含有摄入物质或颗粒的内吞囊泡。大多数真核细胞不断形成内吞囊泡,这一过程称为胞饮作用(“细胞饮水”);此外,一些特化细胞包含按需吸收大颗粒的专用途径,这一过程称为吞噬作用(“细胞吃噬”)。内吞囊泡通过多种机制在质膜上形成,这些机制在使用的分子机制和该机制的调节方式上有所不同。
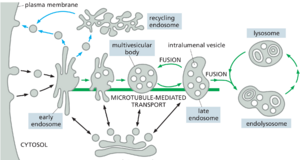
一旦在质膜上产生,大多数内吞囊泡就会与一个共同的接收室融合,即早期内体early endosome,内化的货物在这里被分类:一些货物分子直接或通过回收内体recycling endosome返回质膜,而其他货物分子则随着早期内体通过·称为内体成熟的过程转变为晚期内体而保留(图 13-50)。这个转化过程改变了内体膜的蛋白质组成,内体的斑块内陷包裹在内体中,形成称为intralumenal vesicles的细胞器,而内体本身从细胞外围移动到靠近细胞核的位置。随着内体的成熟,它不再将物质回收到质膜中。相反,晚期内体彼此融合并与溶酶体融合形成内溶酶体endolysosomes,降解其内容物。
内体成熟的每个阶段(从早期内体到内溶酶体)都通过双向囊泡转运途径与 TGN 相连。这些途径允许将新合成的物质(例如来自 ER 的溶酶体酶)插入,并将成分(例如 M6P 受体)回收回分泌途径的早期部分。我们稍后讨论了细胞如何使用和控制内吞运输的各种特征。
胞饮囊泡从质膜中的包被凹坑形成
几乎所有的真核细胞都以小的胞吞(内吞)囊泡的形式不断摄取其质膜的一部分。在这种胞饮作用过程中,质膜布的内化速率因细胞类型而异,但通常高得惊人。例如,巨噬细胞每小时摄入自身体积液体的 25%。这意味着它必须每分钟摄入 3% 的质膜,或在大约半小时内摄入 100%。成纤维细胞以稍低的速度内吞(每分钟 1% 的质膜),而一些变形虫摄入质膜的速度甚至更快。因为细胞的表面积和体积在这个过程中保持不变,所以很明显,通过内吞作用去除的相同数量的膜正在通过胞吐作用的相反过程添加到细胞表面。从这个意义上说,内吞作用和胞吐作用是相互关联的过程,可以认为构成内吞-胞吐循环。胞吐作用和内吞作用之间的耦合在以高膜周转为特征的特殊结构(例如神经末梢)中尤为严格。
循环的内吞部分通常从网格蛋白包被的凹坑开始。这些特化区域通常占质膜总面积的 2% 左右。网格蛋白包被的凹坑的寿命很短:在形成后的一分钟左右,它会内陷到细胞中并掐断,形成网格蛋白包被的囊泡(图 13-51)。每分钟约有 2500 个网格蛋白包被的囊泡从培养的成纤维细胞的质膜上夹出。包被的囊泡甚至比包被的凹坑更短暂:在形成后的几秒钟内,它们就会脱落外套并与早期内体融合。
并非所有的膜内陷和胞饮囊泡都包被网格蛋白
除了网格蛋白包被的凹坑和囊泡外,细胞还可以形成其他类型的胞饮囊泡和膜内陷。大多数这些不依赖网格蛋白的膜内陷缺乏了解,介导分子未完全鉴定。最了解的非网格蛋白内陷称为caveolae,最初观察到的是形成血管内皮细胞的突出特征。
小窝,有时在电子显微镜下显示为深内陷的烧瓶型,存在于大多数脊椎动物细胞类型的质膜中(图 13-52)。小窝中的主要结构蛋白是窖蛋白caveolins,这是一个不常见的整合膜蛋白家族,每个蛋白都从胞质侧将疏水环插入膜中,但不延伸到膜上。在胞质一侧,窖蛋白与 cavin 蛋白的大蛋白复合物结合,这被认为可以稳定膜曲率。小窝特别富含胆固醇、鞘糖脂和糖基磷脂酰基质醇 (GPI) 锚定膜蛋白,可能代表质膜中的一种脂筏(参见图 10-13)。
与网格蛋白包被和 COPI 包被或 COPII 包被的囊泡相比,小窝通常是静态结构,可以作为额外质膜的储存库。人们认为,受剪切力动态变化的细胞,例如动脉的内皮细胞,利用这个储存库为其质膜提供更大的拉伸弹性。这是通过响应机械力快速拆卸 cavin 蛋白支架来实现的,从而允许下面的膜暂时增加细胞的表面积。快速改变膜表面积的能力被认为对于适应流向大脑不同部位的血流的动态变化很重要。
还有另外两种已知的内吞途径,它们都不使用网格蛋白。巨胞饮作用Macropinocytosis是质膜从细胞中突出并将周围细胞外液的一部分吞噬成 macropinosome的过程。这是在特定条件下将液体带入细胞的非选择性过程。在吞噬作用phagocytosis中,质膜被引导包裹在要吞噬的颗粒周围,直到它与自身融合,导致细胞内出现封闭的吞噬。这两个过程都利用了肌动蛋白聚合在质膜之下,用于介导吞噬大颗粒或大量流体所需的大规模膜变形。大型胞饮小体和吞噬体都注定要与溶酶体融合,它们的内部内容物从而可以降解。当我们考虑溶酶体的功能时将讨论这些降解途径。
细胞利用受体介导的内吞作用输入选定的细胞外大分子
在大多数动物细胞中,网格蛋白包被的凹坑和囊泡为从细胞外液中吸收特定大分子提供了有效的途径。在这个称为受体介导的内吞作用的过程中,大分子与互补的跨膜受体蛋白结合,这些蛋白在包被的凹坑中积累,然后作为网格蛋白包被囊泡中的受体-大分子复合物进入细胞(参见图 13-51)。由于配体被受体选择性捕获,因此受体介导的内吞作用提供了一种选择性浓缩机制,可将特定配体的内吞效率提高一百倍以上。通过这种方式,即使是细胞外 f luid 的微量成分也可以被有效地大量吸收。一个特别广为人知且生理上重要的例子是哺乳动物细胞用于输入胆固醇的过程。
许多动物细胞通过受体介导的内吞吸收胆固醇,并以这种方式获得制造新膜所需的大部分胆固醇。如果摄取受阻,胆固醇会在血液中积累,并可能导致动脉粥样硬化斑块、脂质和纤维组织沉积在血管(动脉)壁中形成,这些沉积物会阻塞动脉血流,从而导致中风和心脏病发作。事实上是一项对动脉粥样硬化遗传易感性的人类的研究,首次揭示了受体介导的内吞作用机制。
大多数胆固醇以脂质蛋白质颗粒的形式在血液中以胆固醇酯的形式运输,称为低密度脂蛋白 (LDL),从结构上讲,它类似于带有三酰基甘油、游离胆固醇和胆固醇酯核心的脂滴。液滴由载脂蛋白 B 的单个分子稳定,载脂蛋白 B 是一种包裹在 LDL 颗粒周围的非常大的蛋白质(图 13-53)。当细胞需要胆固醇进行膜合成时,它会在 ER 制造用于 LDL 的跨膜受体蛋白并将其运输到质膜。一旦进入质膜,LDL 受体就会扩散,直到其细胞质尾部的内吞作用信号与衔接蛋白 AP2 结合,之后 AP2 的构象通过与质膜上的 PI(4,5)P2 结合而局部解锁。这AP2 与内吞信号结合的两步机制(参见图 13-9)为该过程提供了效率和选择性。然后 AP2 募集网格蛋白以启动内吞作用。
由于包被的凹坑不断被夹断以形成包被的囊泡,因此与包被凹坑中的 LDL 受体结合的任何 LDL 颗粒都会迅速内化在包被的囊泡中。在脱落网格蛋白外套后,囊泡将其内容物输送到早期内体。一旦 LDL 和 LDL 受体遇到早期内体中的低 pH 值,LDL 就会从其受体中释放出来,并通过晚期内体输送到溶酶体。在那里,低密度脂蛋白部分中的胆固醇酯被水解为游离胆固醇,现在可以被细胞用于新的膜合成(电影 13.7)。如果细胞中积累了过多的游离胆固醇,细胞会同时关闭内源性胆固醇的合成(图 12-64),并通过关闭 LDL 受体的合成来减少外源性胆固醇的摄入。
胆固醇摄取的调节途径在遗传编码 LDL 受体的缺陷基因的个体中被破坏。由此产生的高水平血液胆固醇使这些人容易过早发展为动脉粥样硬化,如果他们没有接受他汀类药物等降低血液胆固醇水平的药物治疗,许多人会在冠状动脉疾病引起的心脏病发作中早逝。在某些情况下,受体完全缺乏。在其他情况下,受体存在缺陷——要么在 LDL 的细胞外结合位点,要么在网格蛋白包被的凹坑中 AP2 衔接蛋白的细胞内结合位点。在后一种情况下,存在正常数量的 LDL 受体,但它们未能定位在网格蛋白包被的凹坑中。尽管 LDL 与这些突变细胞的表面结合,但它没有被内化,直接证明了网格蛋白包被的凹坑对受体介导的胆固醇内吞作用的重要性。
已知超过 25 种不同的受体参与不同类型分子的受体介导的内吞作用。它们显然都使用网格蛋白依赖性内化途径,并通过其细胞质尾部与网格蛋白外壳中的衔接蛋白结合的信号引导进入网格蛋白包被的凹坑。这些受体中的许多,如 LDL 受体,无论它们是否结合其特定配体,都会进入包被的凹坑。其他基因在与特定配体结合时优先进入,这表明它们需要配体诱导的构象变化才能激活引导它们进入凹坑的信号序列。由于大多数质膜蛋白无法集中在网格蛋白包被的凹坑中,因此凹坑充当分子过滤器,优先收集某些质膜蛋白(受体)而不是其他蛋白。
同时暴露于不同标记配体的培养细胞的电子显微镜表明,多种受体可以聚集在同一个网格蛋白包被的凹坑中,而其他一些受体聚集在不同的网格蛋白包被的凹坑中。一个网格蛋白包被的凹坑的质膜可以容纳 100 多种各种受体。
从早期内体中回收特异性蛋白质并返回质膜
早期内体是内吞途径中的主要分选站,就像顺式和反式高尔基体网络在分泌途径中发挥此功能一样。在早期内体的弱酸性环境中,许多内化受体蛋白改变其构象并释放其配体,正如已经讨论过的 M6P 受体。那些在早期内体中从受体解离的内吞配体通常注定要递送到溶酶体,在那里它们要么被降解并回收成构建单元,要么被细胞直接利用(例如刚刚讨论的胆固醇)。然而,其他一些 endocy tosed 配体仍然与它们的受体结合,从而共享受体的命运。
在早期内体中,LDL 受体与其配体 LDL 解离,并被回收回质膜再利用,留下排出的 LDL运输至溶酶体。回收运输囊泡从从早期内体延伸的长而窄的小管中萌芽(图 13-55)。这些小管的几何形状可能有助于分选过程:因为小管有一个大的膜面积,包围着一个小体积,所以膜蛋白相对于可溶性蛋白质富集。运输囊泡将 LDL 受体直接返回到质膜。
转铁蛋白受体遵循与 LDL 受体相似的回收途径,但与 LDL 受体不同的是,它也回收其配体。转铁蛋白是一种在血液中携带铁的可溶性蛋白质。细胞表面转铁蛋白受体通过受体介导的内切 tosis 将转铁蛋白及其结合的铁输送到早期内体。内体中的低 pH 值会诱导转铁蛋白释放其结合的铁,但不含铁的转铁蛋白本身(称为脱铁蛋白)仍与其受体结合。受体-载铁蛋白复合物进入早期内体的肾小管延伸部分,并从那里循环回质膜。当载铁蛋白恢复到细胞外液的中性 pH 值时,它与受体解离,从而释放出来吸收更多的铁并再次开始循环。因此,转铁蛋白在细胞外液和早期内体之间来回穿梭,避开溶酶体并将铁输送到细胞内部,以满足细胞生长和增殖的需要。
回收内体调节质膜组成
内吞受体的命运——以及任何仍然与它们结合的配体——的命运根据受体的特定类型而变化。正如我们所讨论的,大多数受体被回收并返回到它们来自的同一质膜结构域;一些进入质膜的不同结构域,从而介导转胞吞作用;而一些留在内体系统中并进展到溶酶体,在那里它们被降解,正如我们接下来讨论的那样。极化上皮细胞表面的受体可以通过转胞吞作用将特定大分子从一个细胞外空间转移到另一个细胞外空间。例如,新生儿通过肠道上皮运输抗体(有助于保护其免受感染)从母乳中获取抗体。肠道管腔是酸性的,在这种低 pH 值下,牛奶中的抗体与肠道上皮细胞顶端(吸收性)表面的特异性受体结合。受体-抗体复合物通过网格蛋白包被的凹坑和囊泡内化,并递送到早期内体。复合物保持完整,并在从早期内体萌芽的运输囊泡中回收,随后与质膜的基底外侧结构域融合。当暴露于沐浴细胞基底外侧表面的细胞外液的中性 pH 值时,抗体会从其受体上解离并最终进入婴儿的血液。从早期内体回到血浆膜的转胞吞途径不是直接的。受体首先从早期内体移动到回收内体。不同受体从早期内体开始遵循的多种途径意味着,除了其配体和
