第二十一章 有性生殖:从配子到果实
在十七世纪末发现植物有性生殖之前,人们认为种子是由一种类似于芽形成的无性营养过程产生的。十八世纪中叶,花粉在受精中的作用得到了实验证明,到十九世纪末,植物生命周期的主要特征已经确定。植物和动物有性生殖之间最显著的区别是植物生命周期中存在两个完全独立的单倍体个体,称为雄配子体和雌配子体。严格地说,花的雄蕊和心皮是产生孢子的结构,而不是有性结构。花中产生的孢子发育成雄配子体和雌配子体,即植物生命周期的真正有性阶段(见第 1 章)。
我们从产生配子的雄配子体和雌配子体的发育开始讨论。作为固着生物,植物依靠重力和风或昆虫等媒介进行授粉和受精。正如我们将看到的,植物在这个过程中并不是完全被动的:它们已经进化出了复杂的解剖和生化机制,以确保异交。与动物一样,达尔文进化论涉及自然选择和性选择。植物的性选择不是像动物那样通过雄性的视觉展示来实现的,而是由雄配子体之间的竞争来实现的,以到达雌配子体并使胚珠内的卵子受精。这个过程的最后一步是种子和果实的发育——保护和滋养胚胎的结构,并将其输送到合适的基质上,使其发芽并建立为新的幼苗。
21.1 雄性和雌性配子体世代的发育
植物生命周期与动物生命周期有根本区别,因为它包含两个独立的多细胞世代,即二倍体 (2N) 孢子体世代和单倍体 (1N) 配子体世代(见第 1 章;有关植物二倍体进化的讨论,见 WEB 主题 21.1)。植物生命周期中存在两个遗传上不同的多细胞阶段,称为世代交替。世代交替发生在花的两个生殖“场所”——雄蕊(雄蕊群或“雄性场所”)和心皮(雌蕊群或“雌性场所”)。
由于世代交替,植物和动物生命周期在减数分裂的结果上存在关键差异。在动物中,减数分裂产生的单倍体细胞直接分化为配子——精子或卵子。相反,植物中减数分裂产生的单倍体细胞分化为孢子——小孢子(雄性)或大孢子(雌性)(图 21.1)(有关减数分裂的综述,请参阅第 3 章)。孢子是由减数分裂形成的细胞,它们发育成称为配子体世代的单独多细胞世代,而不是像动物那样直接分化成配子。具体而言,小孢子和大孢子经历有丝分裂,分别产生称为雄配子体(或微配子体)和雌配子体(或大配子体)的单倍体个体。雄配子体在雄蕊的花药中形成,而雌配子体在胚珠或未成熟种子内发育,胚珠或未成熟种子包含在心皮的中空基部内,称为子房(见图 21.1)。植物生命周期中存在单倍体多细胞配子体世代意味着植物中的配子是由有丝分裂而不是减数分裂产生的。也就是说,成熟的雄性和雌性配子体中的特化细胞进行有丝分裂以产生 1N 配子——精子和卵细胞。雄性和雌性配子最终参与合子,其中一个精子细胞与一个卵细胞融合。精子细胞受精后,卵细胞转变为 2N 合子,即未来胚胎的第一个细胞(见图 21.1 和第 22 章)。
除了雌雄配子之间的合子现象外,被子植物的胚囊内还发生了一种独特的配子体细胞融合:第二个精子细胞与雌配子体的二倍体中央细胞(本身是两个单倍体极核融合的结果)融合,产生三倍体初级胚乳细胞,该细胞继续形成种子的营养胚乳组织。开花植物特有的受精过程中两个精子细胞的参与被称为双重受精。这两个细胞融合过程之所以可能,是因为参与的细胞(精子、卵子和中央细胞)与植物体内所有其他细胞不同,缺乏真正的细胞壁,这会阻止膜融合。
除了有助于被子植物的进化成功之外,某些农作物的双受精,特别是在中东新月沃地发展起来的大种子谷物,在人类文明的早期崛起中发挥了关键作用。早期小麦品种的种子因其富含碳水化合物的胚乳组织而受到狩猎采集者的珍视。在中东种植小麦种子最终导致了从狩猎采集到农业的重大转变。
21.2 雄蕊中雄配子的形成
雄配子体形成于花的雄蕊中。通常,雄蕊由细丝连接在四个小孢子囊(或花粉囊)组成的花药上,小孢子囊成对排列(图 21.2A)。每对小孢子囊由一个围绕着维管束的无菌组织中心区域相互隔开。
小孢子囊发育的确切顺序因物种而异。在拟南芥中,成熟的花药含有花粉母细胞,即进行减数分裂的细胞,被四个体细胞层包围:表皮、药室内壁、中间层和绒毡层,绒毡层是一种支持孢子发生组织发育的营养转移组织。这些层最初来自花分生组织的三层(L1、L2 和 L3)(见第 20 章)。L1 层成为表皮,L2 层产生孢原细胞以及内部周围层,如图 21.2B 所示。包含孢原细胞的中心区域称为locule。
花粉粒的形成分为两个连续阶段
花粉粒是开花植物的雄配子体。其发育在时间上分为两个连续阶段:小孢子发生和小配子发生。在小孢子发生过程中,花药室中的孢子发生细胞分化为花粉母细胞(也称为小孢子母细胞),这些母细胞是经过减数分裂产生小孢子的二倍体细胞(图 21.3A)。减数分裂过程的最终结果是四分体单倍体小孢子在细胞壁处连接在一起,细胞壁主要由胼胝质(一种 (1,3)-β-葡聚糖多糖)组成(见第 2 章)。绒毡层,一层围绕花药的分泌细胞,分泌水解酶-胼胝质酶callase和其他细胞壁降解酶到子房,部分消化细胞壁并将四分体分离成单个小孢子(见图 21.3A)。在一些昆虫授粉的物种中,花粉通常以tetrads形式散落,如 common heather(Calluna vulgaris),或以较大的组合形式散落,称为polyads,或以更大的花粉块和花粉块形式散落,后者将所有花粉聚集在花药中,如许多兰花物种(参见 WEB 主题 21.2)。一旦小孢子在花药室内形成,小配子体发育的小孢子发生阶段就完成了。
第二阶段是小配子发生,即雄配子的形成。在小配子发生过程中,单倍体小孢子有丝分裂发育成成熟的雄配子体,由营养细胞(或管细胞)和两个精子细胞组成(图 21.3B)。在第一次有丝分裂之前,小孢子会大幅膨胀,这一过程与大液泡的形成有关。与此同时,小孢子核从液泡迁移到细胞的另一侧,从而形成极化小孢子。极化小孢子随后经历高度不对称的细胞分裂(花粉有丝分裂 I),产生一个大的营养细胞和一个小的生殖细胞(或雄性生殖细胞)。在许多物种中,这种不对称有丝分裂导致细胞质的急剧分裂,将所有质体排除在生殖细胞之外。因此,质体基因组通常通过母系遗传。
请注意,生殖细胞面向细胞壁一侧的质膜与小配子体的外膜共享。因此,生殖细胞最初仍附着在小孢子细胞壁上,并被半球形的胼胝质壁包裹,将生殖细胞与营养细胞分开。然而,最终,胼胝质层会分解,生殖细胞会从外部小配子体质膜上脱落。然后,生殖细胞迁移到花粉粒的中心,形成独特的解剖结构:细胞内的细胞(双细胞阶段)。
在成熟过程中,花粉粒积累碳水化合物和/或脂质储备,以支持快速发芽和花粉管生长所需的活性代谢。在此阶段,花粉发育可以采取两种途径之一。许多被子植物科(例如,茄科、兰科、蔷薇科)释放双细胞花粉:花粉在双细胞阶段脱水并通过花药壁开裂(打开)从花药中释放出来。花粉粒授粉并发芽后,生殖细胞便会分裂,在生长的花粉管内产生两个精子细胞(花粉有丝分裂 II)。在其他科(例如十字花科、禾本科)中,生殖细胞在花药内进行花粉有丝分裂 II,并释放出三细胞花粉。在这两种情况下,两个精子的产生都标志着小配子发生的结束。与生殖细胞一样,两个精子细胞被包裹在营养细胞或花粉管细胞内,缺乏适当的细胞壁,使它们能够在双受精过程中与卵子或中央细胞融合。
根据物种的不同,绒毡层细胞可能留在子房室的边缘(如拟南芥中的情况),也可能变成变形虫状并迁移到子房室中,与发育中的小孢子混合在一起。在这两种情况下,绒毡层细胞都发挥分泌功能,最终经历程序性细胞死亡(见第 23 章),将其内容物释放到子房室中。由于绒毡层细胞在为发育中的花粉粒提供酶、营养物质和细胞壁成分方面起着重要作用,因此绒毡层缺陷通常会导致花粉发育异常和育性下降。虽然雄性不育通常是自然界中的有害特性,但通过在绒毡层中表达细胞毒性蛋白来产生雄性不育植物的能力在农业中对于生产杂交种子(例如油菜)非常有用。
多层花粉细胞壁非常复杂
花粉粒细胞壁的外表面表现出各种雕塑特征,在花粉从一朵花转移到另一朵花的过程中发挥着重要的生态作用(图 21.4A)。然而,同样复杂的是多个内层,它们提供了迷宫般的内部空间,脂质和蛋白质可以沉积其中(图 21.4B)。
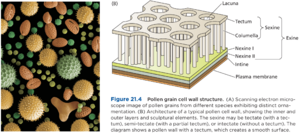
花粉细胞壁的形成始于减数分裂后的小孢子。短暂的胼胝质壁是小孢子沉积在细胞表面的几层中的第一层。接下来是primexine(sexine的前身)、nexine,最后是intine。(请注意,由于小孢子是这些层的来源,因此最内层是最后沉积的。)
主要由多糖组成的primexine充当模板,引导孢粉素sporopollenin的积累,孢粉素是exine或outer layer的主要结构成分,exine包括nexine and sexine。当小孢子仍处于四分体状态时,早期exine由小孢子自身合成和分泌的孢粉素前体组装而成。然而,一旦最外层的胼胝质壁溶解并且小孢子从四分体中释放出来,大多数孢粉素前体由绒毡层提供。intine, or inner layer主要由纤维素和果胶组成。
拟南芥的最新研究表明,孢粉素聚合物由酚和脂肪酸衍生的成分组成,这些成分以共价键连接,类似于木质素和木栓质。此外,大多数花粉粒壁包括外壁较薄或缺失的区域(图 21.5A 和 B)。外壁上的这些间隙(花粉壁变薄)称为 apertures or pores,使花粉管能够在花粉粒在相容的柱头上发芽时从花粉粒中伸出。这些孔不包含外壁,而是以水凝胶的形式充满果胶,似乎有助于花粉管的出现。这些孔的数量和分布因物种而异,并受遗传控制。例如,在拟南芥中,基因 INAPERTURATE POLLEN1 的突变或过度表达分别会导致完全没有孔或出现多余的孔(图 21.5C 和 D)。虽然花粉壁孔曾被认为是花粉管出现所必需的,但至少在拟南芥中,花粉管偶尔会在没有孔的情况下突破外壁(图 21.5E)。
孔的数量和外壁雕刻图案是被子植物科、属和物种的特征。光滑的花粉与风媒授粉有关,例如橡树 (Quercus) 和禾草 (玉米 [corn; Zea mays]),而由昆虫、鸟类和哺乳动物授粉的植物往往具有高度雕刻的图案,由刺、钩或粘性线状突起组成,使花粉能够粘附在觅食的传粉者身上。由于孢粉素不易腐烂,花粉在化石记录中表现良好,外壁独特的表面图案可用于识别当时存在的物种,以及提示早期气候条件。在柱头干燥的物种(见第 21.4 节)中,如拟南芥,绒毡层还会用tryphine覆盖花粉粒,是一种粘性黏合层,覆盖外壁层。tryphine富含蛋白质、脂肪酸、蜡和其他碳氢化合物。
21.3 雌配子体在胚珠中的发育
在被子植物中,胚珠位于雌蕊群的子房内,雌蕊群是心皮的统称。胚珠是大孢子发生和大配子体发生的场所。当雌配子(卵细胞)与精子细胞受精后,胚胎发生起始,而胚珠发育成种子。同时,子房增大并变成果实。我们将在本章后面讨论受精和果实发育。
胚珠原基出现在一种称为胎座placenta的特殊子房组织中。胎座组织的位置因植物群而异,包括边缘胎座、周壁胎座、轴胎座、基胎座和自由中心胎座类型(参见 WEB 主题 21.3)。子房中的胎座类型决定了种子在果实内的位置和排列。
拟南芥雌蕊是研究胚珠发育的重要模型系统
拟南芥的雌蕊群与十字花科的许多成员一样,由两个融合的心皮组成,称为valves,由称为隔膜的中间隔板隔开(图 21.6)。瓣的边缘和隔膜在称为裂片的组织带处连接,该组织在干果开裂(分裂)中起重要作用,使种子得以分散。每个心皮在隔膜的两侧都有两条胎盘组织带。
胚珠原基首先沿胎盘出现,呈圆锥形突起,尖端圆润(图 21.7)。在原基发育的早期阶段,内部已经可以区分出三个区域:基部的近端区域,产生柄状的珠柄(图 21.7 中蓝色部分);远端或micropylar区域位于尖端,产生珠心,减数分裂在此发生(图 21.7 中粉红色部分);中心区域称为合点,产生珠被,即胚珠的外层(图 21.7 中黄色部分)。由于原始珠心尺寸大、细胞核大、细胞质致密,因此将分化为大孢子母细胞的细胞在原始珠心内清晰可见。
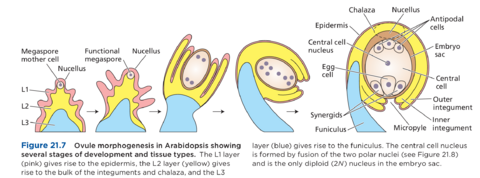
通常有两层珠被:内珠被和外珠被。内珠被在位于珠心顶端后面一段距离处形成一个脊,随后是外珠被层(见图 21.7)。两层珠被继续在珠心上生长,最终在珠孔周围形成一个孔。同时,珠柄略微弯曲,导致胚珠向内弯曲至隔膜。这样,珠孔就更接近transmitting tract,是隔膜内的一种特殊组织,花粉管在授粉过程中通过传递道生长。我们将在第 21.4 节中更详细地讨论传递道的功能。
绝大多数被子植物都表现出蓼型胚囊发育
雌配子体或胚囊的发育比雄配子体的发育更复杂、更多样化。根据一种分类方案,被子植物中有 15 多种不同的胚囊发育模式,成熟的胚囊有 4 到 12 个以上的细胞。最常见的模式最早在蓼属植物(“knotweed”)中描述,因此被称为蓼属植物类型的胚囊。蓼属植物类型的胚囊在成熟时有 8 个细胞(有时称为 3+2+3)。我们接下来讨论这种类型的胚囊发育;与蓼属植物类型的发育的偏差在 WEB 主题 21.4 中描述。
功能性大孢子经历一系列自由核有丝分裂,然后细胞化。珠心产生大孢子母细胞,该细胞经历减数分裂产生大孢子。
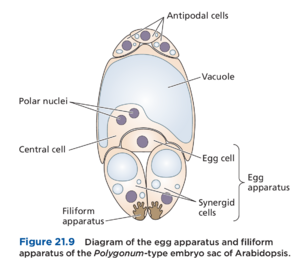
在蓼属植物类型的胚囊中,二倍体大孢子母细胞的减数分裂产生四个单倍体大孢子(图 21.8)。三个大孢子(通常是珠孔端的大孢子)随后会经历程序性细胞死亡,只留下一个有功能的大孢子。功能性大孢子随后会经历三轮自由核有丝分裂(即母细胞有功能无功能大孢子胚囊形成一个八核的未成熟胚囊,其中四个细胞核迁移至合点极,另外四个迁移至珠孔极。每个极的三个细胞核发生细胞化,但不形成细胞壁。合点极的三个细胞称为反足细胞,而胚囊珠孔端的三个细胞称为卵器,由中间的一个卵细胞(与精子细胞结合形成受精卵的雌配子)和两个助细胞组成。剩下的两个细胞核称为极核,它们向胚囊的中央区域迁移,中央区域也包含一个大液泡。细胞质和两个极核在它们周围产生质膜,从而形成一个大的双核中心细胞。请注意,两个极核可以保持分离,直到雄配子排入胚囊,或者它们可以在受精前融合形成二倍体 (2N) 次级核。完全细胞化的胚囊由七个细胞和七个或八个细胞核组成,代表成熟的雌配子体或胚囊。
蓼属类型的胚囊有许多变种。例如,睡莲目(包括睡莲)以及月见草科(柳叶菜科)的成员中没有反足细胞。因此,这两个植物群在成熟时只有四核胚囊。在许多其他物种中,包括拟南芥,反足细胞在受精前退化,而在禾本科 (Poaceae) 成员中,反足细胞可以增殖。鉴于反足细胞在成熟胚囊中的存在情况各不相同,它们在胚囊发育过程中的功能仍未确定。
卵器包括一个称为丝状器filiform apparatus的结构,位于每个助细胞的珠孔端(图 21.9)。丝状器由卷曲的增厚细胞壁组成,增加了质膜表面积。如第 21.4 节所述,助细胞参与花粉管吸引的最后阶段、花粉管内容物排入胚囊和配子融合。Plumbago 属和 Plumbagella 属的胚囊是这一原则的例外,因为它们在成熟时缺乏助细胞。
在双受精过程中,卵细胞与花粉管排出的一个精子细胞融合,而中央细胞与另一个精子细胞融合。虽然双受精一词意味着卵细胞和中央细胞都作为雌配子发挥作用,但只有受精卵会继续发育成胚胎。因此,中央细胞不被认为是真正的配子。在拟南芥中,中央细胞的两个极核在与精子细胞融合之前融合形成单个二倍体核(见图 21.8)。根据胚囊的类型,极核的数量可能从月见草属植物的一个到Peperomia植物的八个或更多不等。在蓼属植物型胚囊的双受精过程中,一个精子细胞与卵子融合产生二倍体 2N 合子,另一个精子细胞与中央细胞融合产生三倍体 (3N) 初级胚乳细胞,该细胞进行有丝分裂,产生种子的营养胚乳。由于不同类型的胚囊含有不同数量的极核,胚乳的倍性水平从月见草的 2N 到Peperomia的 15N 不等。
21.4 开花植物的授粉和受精
被子植物的授粉是将花粉粒从雄蕊(花的产生小孢子的结构)的花药转移到心皮(花的大孢子产生结构)的柱头的过程(见图 21.1)。在某些物种中,例如拟南芥和水稻,生殖典型通常通过自花授粉或自交进行,即花粉和柱头来自同一个体。
在其他物种中,异花授粉或杂交是常态——父本和母本是独立的孢子体。 许多物种可以通过自花授粉或异花授粉繁殖;其他物种(稍后讨论)具有促进异花授粉的各种机制,甚至可能无法通过自花授粉繁殖。 在异花授粉过程中,花粉可能会传播很长的距离才能落在合适的柱头上。 通常,花粉粒大量产生,通过风、昆虫、鸟类和哺乳动物传播。 花粉粒作为运输精子细胞的载体的进化使得种子植物(裸子植物和被子植物)的繁殖不依赖于水介质。由于授粉对植物及其授粉者都有利,因此许多动物与植物共同进化以促进这一过程。
成功的授粉取决于几个因素,包括环境温度、时间和相容花朵柱头的接受性。许多花粉粒在前往柱头的途中可以耐受干燥和高温。然而,一些花粉粒,如番茄花粉粒,会被高温损坏。了解一些花粉粒如何耐受高温将有助于确保我们在全球气候变化下的食物供应。
配子期包括从花粉落地和花粉管生长到精子和卵子融合的所有内容
雌配子受到卵巢组织的良好保护,免受环境影响。因此,为了到达未受精的卵子,精子细胞必须通过从柱头长出的花粉管穿过花柱进入胚珠。从花粉沉积在柱头上到精子细胞被输送到胚囊的发育阶段称为生殖的原配阶段。在与其他被子植物相似的拟南芥雌蕊(或雌蕊)中,这个过程可分为六个步骤(图 21.10)。
请注意,在拟南芥中,与许多被子植物一样,花柱是实心的,花粉管通过传递组织的质外体侵入性生长。具有中空花柱的花(例如,百合、紫花苜蓿、兰花)具有所谓的花柱管。在这些物种中,传递组织排列在花柱管的内表面上,花粉管沿着管表面生长到子房。精子细胞从花粉管排出后,发生双受精:一个精子与卵细胞结合产生受精卵,第二个精子与中央细胞融合形成三倍体初生胚乳细胞。正如我们接下来要讨论的,在配子期的六个步骤中,两个精子细胞能否成功传递到两个雌配子(卵子和中央细胞)取决于花粉管、雌蕊和雌配子体之间的广泛相互作用和交流。如图 21.10C 所示,被子植物的花粉管生长速度约为每小时 10 微米至每小时 20,000 微米(20 毫米)以上,平均比裸子植物花粉管的生长速度快 100 倍左右。单个植物的花粉粒可以具有不同的花粉管生长率,这种现象被认为构成了雄性竞争(例如,在木槿和栎属物种以及拟南芥中),应该被认为是一种达尔文性选择的植物中的等价物。
花粉粒在相容花朵上的粘附和水合取决于花粉和柱头表面之间的识别
被子植物的繁殖具有高度选择性。柱头的表面可以区分不同的花粉粒,接受来自适当物种的花粉粒,并拒绝来自无关物种的其他花粉粒。当花粉落在相容的柱头上时,由于花粉蛋白和脂质以及柱头表面蛋白之间的生物物理和化学相互作用,花粉粒会物理地粘附在柱头细胞上,称为papillae。一般而言,花粉粒对其他科植物柱头的粘附效果较差。
花有湿柱头和干柱头。湿柱头的表面细胞释放出水、蛋白质、脂质和多糖的粘稠混合物;干柱头的表面细胞(例如十字花科植物的柱头)被细胞壁、角质层和蛋白质膜覆盖(图 21.11)。花粉粒在湿柱头上通过吸收分泌的水分而默认水合(例如,烟草和兰花)。相比之下,干柱头上的水合过程受到严格调控。落在干柱头上后,花粉外皮中的脂质和蛋白质会流出到柱头表面并与乳头细胞中的物质混合形成“foot”,这种结构将花粉粒牢固地附着在乳头细胞的尖端(见图 21.11B 和 C)。在此过程中,花粉foot中的脂质被认为会重新组织,形成毛细管系统,水和离子可以通过该系统从柱头流向花粉粒。这种机制显然允许花粉粒在干燥的柱头上完成水合这一矛盾的壮举。值得注意的是,烟草植物的雌蕊,其柱头被基因切除,只要有外源脂质(包括橄榄油)供应,柱头仍然可以支持花粉发芽和受精。这些实验表明脂质界面对于体内花粉发芽的早期步骤至关重要。
为了进一步支持脂质在花粉水合中的作用,具有长链脂质代谢缺陷的拟南芥突变体会产生没有花粉外壳的花粉,并且这些花粉粒无法在柱头上水合。可以通过高湿度或将脂质应用于柱头来挽救这一缺陷,这两种方法都可以使花粉粒水合并形成花粉管。
Ca2+ 触发的花粉粒极化先于花粉管形成
在水合过程中,花粉粒被生理激活。 Ca2+ 流入营养细胞会触发细胞骨架的重组,并导致细胞在生理和结构上极化。 拟南芥花粉粒中游离 Ca2+ 的实时成像表明,水合后不久,未来发芽位点的细胞质 Ca2+ 浓度就会增加,并且一直保持升高直到花粉管出现。肌动蛋白微丝和分泌囊泡都聚集在发芽孔或孔径下方,而营养核和精子细胞则迁移到发芽的花粉管中。除了水和 Ca2+,硼酸也是花粉体外萌发所必需的。如第 7 章所述,硼酸是植物中必需的微量营养素。其主要功能之一是交联细胞壁中的小果胶多糖鼠李半乳糖醛酸 II(见第 2 章)。与其在细胞壁组装中的作用一致,硼既是绒毡层(分泌多糖和其他物质以正确组装小孢子细胞壁)所必需的,也是花粉粒萌发所必需的。柱头也已知能提供多种促进花粉萌发的因素,但这些因素似乎是物种特异性的。
花粉管通过尖端生长而生长
在柱头上发芽后,拟南芥花粉管穿过乳突细胞蜡质角质层的缝隙,进入乳突细胞壁(见图 21.11C)。在它们向胚珠移动的过程中,所有物种的花粉管都通过尖端生长而生长,而细胞壁前体的胞吐作用仅在尖端处促进花粉管生长(见第 1 章)。如前所述(见图 21.10C),一些开花植物(例如紫露草、黄花菜、玉米)的花粉管生长速度极快,体内生长速度约为每秒 6 µm。
(相比之下,根毛的尖端生长速度仅为每秒约 10 至 40 nm。)这些速度使花粉管成为自然界中生长最快的细胞之一。值得注意的是,单个花粉管的长度可达 40 厘米,就像玉米花粉管穿过一束丝线(玉米心皮的花柱)时一样。考虑到许多被子植物都有坚实的花柱,而且花粉管的生长是通过侵入性破坏传输道内的细胞壁进行的(见图 21.6),如此快速的花粉管生长速度就更加令人印象深刻了。生长中的花粉管通过形成大的液泡和胼胝质栓塞将细胞质、两个精子核和营养核限制在生长顶端区域后方几百微米的区域,这些液泡和胼胝质栓塞会封闭花粉管的后部,最终导致花粉管死亡(图 21.12)。花粉管的顶端有一个区域称为透明区,大多数大型细胞器(如淀粉体、细胞核、大多数内质网和线粒体)都被排除在该区域之外(图 21.13A)。在最靠近尖端的区域,这种尺寸排除现象更加严格,只有携带细胞壁前体的小分泌囊泡存在。这些囊泡聚集在尖端下方,发生胞吞和胞吞作用,并且经常以倒锥形排列,或在切片中呈三角形(图 21.13B)。
透明区形成的分子基础尚不清楚,但它与尖端肌动蛋白索的破坏或重组有关。肌动蛋白微丝动力学(见第 1 章)驱动细胞质流动,遵循“反向喷泉”流动(图 21.13C)。细胞器沿着花粉管柄上的肌动蛋白纤维移动,但这些纤维在透明区分解成小的、短命的细丝。因此,透明区的流动被打乱,分泌囊泡和小细胞器在该区域的运动类似于无序的布朗运动。花粉管和其他尖端生长细胞如何建立和维持其极性仍然是植物发育中的一个基本问题。绝大多数证据表明,生长尖端的离子梯度参与其中。例如,由于尖端集中的 Ca2+ 和 pH 梯度,以及氯化物 (Cl–) 的倒置梯度,生长中的花粉管尖端发生极化(图 21.14)。这些细胞质梯度可以达到近
外壁
内壁
微丝
内质
高尔基体
含有细胞壁前体的囊泡,在管尖端与质膜融合
胼胝栓
线粒体
营养细胞
精子细胞
内吞囊泡
回收过量的
质膜
图 21.12 花粉管通过尖端生长伸长。
细胞质通过大液泡和胼胝隔板集中在管的生长区域。 (R. L.
Jones 等人,2013 年。《植物的分子生命》。纽约:
Wiley-Blackwell。)
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 636
TZ7E 21.12
有性生殖:从配子到果实 637
图片由 N. Moreno 提供,J. Feijo 提供
含有细胞壁前体的囊泡
图 21.13 正在生长的花粉管的透明区。
(A) 百合花粉伸长透明区(白色虚线)的光显微照片。 (B) 百合花粉透明区的电子显微照片,显示了尖端最末端的众多小囊泡(两条线内)的锥体。 (C) 透明区超微结构成分图。如图所示,含有前体的细胞质囊泡与管尖端的质膜融合,即“透明区”不太清楚,但包含
高尔基体、F-肌动蛋白丝和大量小囊泡。
箭头表示中心轴两侧细胞质流动的环状。 (B 源自 S. A. Lancelle 等人,1997 年。
Protoplasma 196:21–33;C 源自 A. Y. Cheung 等人,2010 年。Proc.
Natl. Acad. Sci. USA 107:16390–16395。)
TZ7E 21.13
Plant Physiology 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-25-22
10 pmol.cm3-s–1
图 21.14 烟草花粉管显示细胞质 Ca2+、pH/H+、
Cl– 浓度梯度,用荧光探针成像的短肌动蛋白丝,以及质膜 H+-AT
Pase NtAHA1。浓度梯度用颜色编码,从红色(高)到蓝色(低)。酸性尖端对应于分泌囊泡区域,透明区对应于 Ca2+ 和酸性梯度。支持细胞器流动的长肌动蛋白丝始于这些离子梯度的基底边缘。尖端的细胞外 H+ 通量模式与质膜 H+-ATPase NtAHA1 的缺失相关。插图显示了拟南芥花粉管中类似的 pH/H+ 模式。图像显示了拟南芥花粉管中细胞质 pH 梯度、细胞外 H+ 通量和表达较多的质子泵(AHA6 和 AHA8)的定位。不仅这些泵的定位与细胞外通量(存在 = 流出,不存在 = 流入)以及随之而来的花粉管内 pH 值(流出 = 较高 pH 值,流入 = 较低 pH 值)相关,而且在双突变体 aha6/aha8 中,花粉管受损,种子结实率大大降低。 (根据 E.
Michard 等人 2017 年。植物生理学 173:91-111,部分基于 T. Gutermuth 等人 2013 年。植物细胞 25:
4525-4543 和 E. Michard 等人 2008 年。性别。植物繁殖 21:169-181。)
浓度
浓度
21_Taiz7e-Ch21.indd 637
插图来自 D. Hoffmann 等人 2020 年。
Nat. Comm. 11:2395。CC BY 4.0
4/29/22 10:27 AM
TZ7E 21.14
638 第 21 章
浓度在仅 10 到 20 µm 的距离内达到数量级(例如,Ca2+ 从尖端的 > 3 μM 变为尖端下方的 ~0.25 μM)。Ca2+ 梯度与尖端中肌动蛋白微丝的分布和细胞器分类密切相关(见图 21.13C)。pH 梯度形成的分子机制(尖端内通常为 0.5 到 1.0 pH 单位)被认为涉及从尖端排除 H+ 泵送质膜 ATPase(见第 8 章)(见图 21.14)。由于该区域没有质膜 H+-ATPase,质子流入使尖端正下方的细胞质酸化(见图 21.14)。据推测,其他离子梯度也是由花粉管尖端的离子通道差异定位或排除而形成的。实验室实验表明,许多物种的花粉管尖端中所有这些离子的浓度都会振荡。虽然尚不清楚这些振荡是否也发生在野外,但离子振荡的周期性与花粉管生长率的振荡相关,这一事实让人想起在根毛尖端观察到的离子振荡与根毛生长之间的相关性。 Ca2+ 振荡也与受精前花粉管和助细胞之间的相互作用有关。已知与离子浓度变化(特别是 Ca2+、H+ 和 Cl–)相关的电变化和化学变化在细胞信号传导、细胞骨架动力学、膜运输和胞吐中发挥作用,所有这些都与维持花粉管极性和生长有关。
受体样激酶被认为可以调节 ROP1 GTPase 开关,这是尖端生长的主要调节器。为了调节各种细胞中的尖端生长,植物使用一种高度保守的机制,该机制基于小 GTPase(将 GTP 水解为 GDP 的酶)的极性定位。这些调节性 GTPase 是分子开关,可以在活性、GTP 结合
G 蛋白-GDP
(非活性)
G 蛋白-GTP
信号转导
图 21.15 GEF 激活 GTPase 的图表。
鸟嘌呤核苷酸交换因子 (GEF) 和 GTPase 活化蛋白 (GAP) 调节小
GTPase (ROPS) 的活性,后者在
花粉管
中充当分子开关。
形式和非活性、GDP 结合形式(图 21.15)。
当调节性 GTPase 处于活性形式时,它会触发下游信号转导途径(参见第 4 章)。从活性形式转换回非活性形式由 GTPase 本身催化,GTPase 本身将结合的 GTP 水解为 GDP。 GTPase 开关由其他影响 GDP-GTP 交换或 GTP 水解速率的蛋白质操作。鸟嘌呤核苷酸交换因子 (GEF) 通过用 GTP 替换 GDP 来激活失活的 GTPase,而 GTPase 活化蛋白 (GAP) 通过促进 GT 来灭活 GTPaseP 水解。
调节植物尖端生长和极性细胞扩张的 GTPase 属于一个独特的小 GTPase 家族,称为 ROP(Rho 样 GTPase)。拟南芥有 11 种不同的 ROP 基因,其中 7 种在花粉中表达。其中一种产生蛋白质 ROP1-GTPase,该蛋白质仅存在于生长花粉管尖端的质膜中,是尖端生长的调节剂。ROP1 活性可分别由 GEF 和 GAP 打开和关闭,但 ROP1 帮助限制花粉管生长到尖端的机制尚不完全清楚。Ca2+ 信号传导和肌动蛋白细胞骨架重组受 ROP1 调节,但其他与 ROP1 特异性相互作用的蛋白质可能发挥重要作用。一组称为 RIC(ROP 相互作用的 CRIB 基序含蛋白)的蛋白质就是这种情况。当在拟南芥中过度表达时,RIC3 和 RIC4 会改变花粉管极性和胞吐作用。进一步的研究表明,RIC4 促进肌动蛋白丝的形成并诱导胞吐小泡在尖端的积累。根毛发育研究也有证据表明,GEF 本身是由涉及受体样激酶 (RLK) 的信号传导机制激活的,这些激酶由拟南芥基因组中的一个大基因家族编码。一个 RLK 亚家族包括 CrRLK1s(长春花受体样激酶 1),也称为 FERONIA 样 RLK。 (FERONIA 是拟南芥中克隆的第一个成员,在胚囊中表达。)两种这样的激酶 ANXUR 1 和 2 在花粉中表达,当它们发生突变时,花粉管会自发破裂(WEB 主题 21.5)并且无法到达胚珠。这些 RLK 受一个称为 RALF(快速碱化因子)的大肽家族调控。特定的 RALF 与特定的 RLK 结合,触发下游机制(包括与 ROP1 信号通路的相互作用),据信这些机制可以调节尖端生长。雌蕊中花粉管尖端的生长受物理和化学线索的引导。为了成功受精,花粉管必须找到通往胚珠珠孔的路。事实上,花粉管之间经常存在竞争,以期最先到达珠孔,从而成为使卵子受精的花粉管。 在许多物种中,到达子房的花粉管数量超过可用的胚珠数量,这强化了这样一种观点,即更快的花粉管生长速度应该会提高雄性的生殖适应性,从而受到达尔文定义的性选择的影响。 对不同物种中这种雄性竞争的遗传分析提供了性选择确实发生的证据。 在某些物种中,例如橡树,雌蕊的子房包含多个胚珠,但只有其中一个受精产生种子。这是因为只有一条花粉管能够成功到达子房。在其他物种中,例如拟南芥,传输道的直径较窄(如下所述)提供了物理约束,限制了可以进入子房的花粉管总数。人们提出了两种主要模型来解释花粉管如何向胚珠生长:机械假说和化学向性假说。在机械假说中,雌蕊结构决定了花粉管的路径,花粉管沿着一条狭窄的传输道通向胚珠(见图 21.10A)。柱头和花柱的传输道在空间上将花粉管生长限制在正确的路径上,在拟南芥的情况下,限制了可以走这条路径的花粉管的数量。这种空间限制也可以由分泌分子介导。例如,在向胚珠生长的过程中,花粉管与传递道细胞外基质的成分紧密接触(或者在具有中空花柱的物种的情况下,如百合和兰花,与来自传递组织细胞的分泌物紧密接触)。细胞外基质不仅提供支持花粉管代谢活动的营养物质,而且还提供其他被认为具有粘附特性的分子,这些分子有助于确定花粉管生长的空间限制。例如,在百合中,一种小的分泌蛋白——柱头/花柱富含半胱氨酸的粘附素 (SCA),一种脂质转移蛋白——由传递道表皮分泌,表皮排列在中空花柱上,参与花粉管沿传递道的生长和粘附。尽管实验证据支持机械假说作为花粉管在大部分花柱中的运动的解释,但它并不能解释花粉管必须急转弯才能接近并进入珠孔。
根据化学趋化假说,花粉管通过遵循称为化学势的分子线索梯度被引导向胚珠ctants。在所有动物物种和早期陆生植物(例如苔藓)中,精子细胞通过一种称为趋化性的过程向卵细胞游动:精子能够解码化学引诱剂的浓度梯度并跟随它到达其最浓缩的来源。例如,蕨类植物的精子细胞被认为是通过苹果酸的浓度梯度被含有卵子的颈卵器吸引的。已知有一种类似的机制可以引导花粉管生长,但由于花粉管生长而不是游动,因此该过程被称为趋化性,这种现象也在真菌菌丝和神经元生长中观察到。已经鉴定出几种在花粉管引导中起作用的分子,主要是从体外和半体内测定(参见下一小节)。值得注意的是,机械机制和化学趋化机制并不相互排斥,它们既可以通过互补性发挥作用,即化学趋化性只涉及沿途机械机制缺失的区域,也可以通过冗余性发挥作用,即两种机制协同工作以确保成功受精。此外,虽然花粉管生长的早期阶段受传递道中的孢子体细胞调控,但拟南芥的遗传分析和 Torenia
fournieri 的体外引导实验(将在下一小节中讨论)支持以下观点:来自雌配子体的化学信号在花粉管向珠孔生长的最后阶段也发挥着关键作用。
花柱组织可能使花粉管向胚囊生长。花粉管要从柱头移动到子房,必须通过花柱生长。人们已经开发出各种实验方法来确定引导花粉管向胚珠生长的机制。例如,早期研究表明,解剖的 Gasteria verrucosa 未受精胚珠能够在体外吸引花粉管。最近,Torenia fournieri(唇形目成员,包括薰衣草和丁香)的独特解剖特征使其成为研究花粉管对雌配子体产生的引诱剂的反应的首选模型系统(图 21.16A)。在种子植物中,胚珠被包裹在一层或多层孢子体组织(称为珠被)中,珠被代表未来的种皮。裸子植物的种子通常被包裹在单层珠被中,而被子植物的胚珠通常被双层珠被包裹。大多数被子植物的珠被不能轻易去除以进入胚囊,但在 T. fournieri 和其他一些物种中,胚囊自然地从珠孔中伸出,导致卵细胞、两个助细胞和大约一半的中央细胞位于胚珠外部,在那里可以在光学显微镜下观察到它们(图 21.16B 和 C)。当 T. fournieri 的胚珠从胎座中切除时,裸露的胚囊直接暴露在培养基中。实验表明,当切除的 T. fournieri 胚珠与在营养培养基上发芽的花粉管共培养时,花粉管对胚珠的吸引力很小。然而,如果 T. fournieri 花粉粒首先在活柱头上发芽,然后从花柱的切端伸入营养培养基,花粉管向胚囊珠孔端生长的趋势就会大大增加(图 21.16D-F)。这种研究花粉管吸引的系统也已适用于拟南芥。在拟南芥和蓝花楸中进行的实验得出了这样的假设:花粉管和花柱之间的相互作用决定了花粉管(即使其能够)对来自胚囊的线索作出反应并向珠孔生长。然而,这一原则似乎并不适用于所有植物。在某些物种(例如百合、Gasteria)中,花粉管被胚珠吸引的能力可能是自主发展的,而不是通过与柱头的相互作用。花粉管在发芽或从柱头传递到子房的过程中,基因表达会发生重大变化。© blickwinkel/Alamy Stock Photo在百合和 Gasteria 中,这种发育变化可能在建立感知雌蕊引导机制所需的传感和传导机制方面发挥作用。
助细胞释放化学引诱剂,引导花粉管生长到珠孔
在 T. fournieri 中检测到的第一个花粉管引诱剂的细胞来源是通过激光消融胚囊的特定细胞来确定的。只有当两个助细胞(而不是卵子或中央细胞)被杀死时,花粉管才会无法向胚珠生长。这些花粉管化学引诱剂nts 现已被鉴定为富含半胱氨酸的多肽,恰当地称为 LURE,它们可以吸引体外生长的花粉管。LURE 与防御素有关,防御素是一组在动物和植物中发现的抗菌蛋白。图 21.16 使用切除的 Torenia fournieri 胚珠研究花柱对花粉管定向生长的影响。 (A) T. fournieri 的花。 (B) T. fournieri 胚囊 (ES) 从切除的胚珠 (OV) 的珠孔区域延伸。 (C) 裸胚囊的放大视图,显示中央细胞 (CC)、卵细胞 (EC) 和一个
B–F 来自 T. Higayashiyama 等人。 1998.
植物细胞 10: 2019–2031
两个助细胞 (SY) 及其丝状装置 (FA)。
(D) 胚珠位于授粉花柱附近。 (E) 暗视野图像
显示花粉管向胚珠生长。 (F) 显微照片
显示花粉管 (PT) 已到达胚珠 (OV) 中裸胚囊的珠孔端。
21_Taiz7e-Ch21.indd 640
4/29/22 10:27 AM
TZ7E 21.16
有性生殖:从配子到果实 641
植物。 Torenia 的各种 LURE 似乎以物种特异性的方式起作用。拟南芥中也发现了 LURE 样蛋白,表达拟南芥 LURE 的 T. fournieri 胚珠优先吸引拟南芥花粉管,反之亦然。已证实 LURE 可与两种特定受体结合,即受体激酶 PRK6 和受体样激酶 MDIS1-MIK1 和 MDIS1-MIK2。然而,拟南芥中所有七个 LURE 基因的突变对生育力没有影响,而它们的两个已知受体的突变仅产生边际影响。因此,LURE 似乎不是体内花粉趋化性的严格必需条件,这表明存在其他冗余机制。这一发现促成了第二类富含半胱氨酸的多肽的发现,这种多肽被命名为 XIUQIU(发音为“shiy-chou”),它源于中国传统绣花丝球,在舞蹈庆典中用作爱情的象征。XIUQIU 多肽对体外花粉管的吸引作用几乎与 LURE 一样强,但与 LURE 一样,XIUQIU 无效突变体保留了其生育能力。鉴于受精在植物生命周期中的关键作用,系统中似乎已经建立了大量的冗余也就不足为奇了。然而,LURE 和 XIUQUI 的功能似乎并不相同。对花粉管竞争实验的详细分析表明,XIUQIU 对物种不具特异性,而 LURE 可以促进物种特异性授粉。在花粉管竞争实验中,植物用拟南芥和近亲 A. lyrate 的花粉混合物授粉,结果表明 XIUQIU 对物种不具特异性,而 LURE 可以促进物种特异性授粉。这种现象称为不协调,由查尔斯·达尔文详细描述,它强制物种隔离,即使密切相关物种的花粉管可以发芽并向胚珠生长。有关引导花粉管生长的其他潜在信号剂的简要概述,请参阅 WEB 主题 21.6。双受精发生在三个不同的阶段。当花粉管感知到助细胞分泌的化学引诱剂时,它会穿过微孔生长,穿透胚囊,进入其中一个助细胞。在拟南芥中,卵囊的珠孔端被丝状器增厚的壁阻塞,从而形成花粉管穿透的屏障。因此,拟南芥花粉管不会在珠孔处进入助细胞,而是在助细胞附近缓慢生长一小时,直到找到合适的穿透位点。一旦进入助细胞,花粉管就会停止生长,尖端破裂释放出两个精子细胞,助细胞退化。对用细胞浆 Ca2+ 浓度报告基因标记的花粉管和助细胞的研究表明,当花粉管接近受体助细胞时,两者都会经历一系列 Ca2+ 脉冲。这表明 Ca2+ 振荡是花粉管和助细胞之间信号机制的一部分,该机制导致受体助细胞穿透和花粉管破裂。受体样激酶 FERONIA 可能参与了这一过程,因为在 feronia 突变体植物中,胚囊显示出改变的 Ca2+ 振荡模式,并且在花粉管进入 feronia 突变体胚囊的助细胞后,花粉管尖端不仅不会破裂,而且会继续在胚囊内生长、卷曲并偶尔离开胚珠。基于荧光标记精子细胞的实时成像,拟南芥中的精子细胞行为可分为三个阶段(图 21.17)。首先,花粉管进入助细胞后几秒钟内破裂,引发受体助细胞退化。其次,两个精子细胞在卵细胞和中央细胞之间的边界区域保持静止约 7 分钟。第三,两个精子细胞lls 开始沿着胚囊移动;一个精子与卵子融合,另一个与中央细胞融合,完成双受精。使用不同颜色的细胞标记的实验表明,拟南芥的两个同构(形态相同)的精子细胞随机地使卵细胞或对足细胞受精
中央细胞
中央细胞
营养核
精子细胞
1. 花粉管破裂并排出。精子细胞从花粉管迅速进入雌配子体。在花粉管开始排出后,受体助细胞很可能立即分解。 2. 两个精子细胞停留在卵细胞和中央细胞之间的边界区域数分钟。 3. 一个精子细胞与卵细胞融合,另一个与中央细胞融合,它们的细胞核向目标配子细胞核移动。
图 21.17 拟南芥双受精过程中的精子细胞行为可分为三个阶段。
21_Taiz7e-Ch21.indd 641
4/29/22 10:27 AM
642 第 21 章
中央细胞。虽然被子植物的精子细胞通常是同形的,但有些物种是二态的,精子细胞有两种不同的形态,决定了精子细胞将与哪个雌配子体细胞融合。例如,在 Plumbago zeylanica 中,较大的精子细胞含有大量线粒体,优先与中央细胞融合,而较小的精子细胞富含质体,与卵细胞融合。在受精的最后步骤中,已经进化出各种故障安全机制,以确保正确的配子融合发生(参见 WEB 主题 21.7)。有证据表明,排出的精子细胞与卵子和中央细胞交换额外的信号,为它们融合做好准备。配子融合本身似乎主要由特定的融合蛋白 HAPLESS2 (HAP2) 介导,这是一种古老的蛋白质,最初是在植物中发现的,但后来被证明对大多数生物体的配子融合至关重要,真菌和脊椎动物除外。 HAP2 也被许多病原体(包括疟原虫(疟疾)、弓形虫和病毒(例如风疹、登革热))利用来促进与靶细胞的融合。在拟南芥中,HAP2 在精子细胞中表达,是与卵细胞融合所必需的,这一过程还涉及富含半胱氨酸的蛋白质 EC1。
当精子细胞到达卵细胞时,卵细胞会释放 EC1。然后精子细胞对 EC1 作出反应,将 HAP2 分泌到其表面,使融合得以进行。与这种机制一致,缺乏 HAP2 的突变精子细胞无法与卵子或中央细胞融合。
21.5 自交与异交
大多数被子植物(超过 85%)是雌雄同体的,其中约一半能够自交。根据一种假设,能够自交的物种在长距离传播后更有可能定居(即“归化”)。与此规则相一致的是,自交能力与全球归化的程度呈正相关。
然而,自交也与近交衰退有关,这可能是许多开花植物进化出促进异交的机制的原因。异交增加了遗传多样性,从而提高了适应不同环境条件的能力。被子植物用来防止自交的最常见机制是花粉自交不亲和性,我们将在本节后面讨论。花的形态或发育时间的某些特征也促进了异花授粉,例如,当双性花或雌雄同株植物的雄蕊和雌蕊在不同时间成熟时。最后,雄性不育(功能性雌性)个体的产生可防止自花授粉并促进植物的异花授粉。雌雄同株和雌雄同株物种已经进化出确保异花授粉的花的特征。植物学家在发现植物的性别后,最初认为雌雄同株的花都必须自花授粉。因此,当十八世纪末有人证明,在大多数情况下,花的形态是为了吸引昆虫传粉者而优化的,并且这些传粉者促进了异花授粉而不是自花授粉时,人们感到惊讶。已确定花朵形态的时间和空间特征可防止雌雄同株和雌雄同株物种自花授粉。在雌雄同株中,雄蕊和雌蕊在不同时间成熟。雌雄同株有两种类型:雄蕊先熟和雌蕊先熟。在雄蕊先熟的花中,雄蕊先于雌蕊成熟,而在雌蕊先熟的花中,雌蕊先于雄蕊成熟(图 21.18A)。因此,雄蕊先熟的花在发育早期起“雄花”的作用,在发育后期起“雌花”的作用。ent;
在雌蕊先熟的花中,模式则相反。由于野生种群中的个体在任何给定时间都处于不同的发育阶段,因此每个雌蕊总会有花粉,反之亦然。
促进异交的另一个花特征是异柱花柱。在异柱花种中,同一种群中存在两种或三种形态类型的花,称为形态。花形态的雌蕊和雄蕊的长度不同。在一种形态中,雄蕊短而雌蕊长,而在第二种形态中则相反(图 21.18B)。两种形态中雄蕊和雌蕊的长度适合由不同的传粉者或同一传粉者的不同身体部位授粉,从而促进异交。形态表型在遗传上也与一种独特的自交不亲和性有关,即一种形态的花粉不能使同一形态的另一朵花受精。
细胞质雄性不育 (CMS) 发生在野生环境中,在农业中具有重要用途。雄性不育——无法产生功能性花粉——在植物中广泛存在,并有效地阻止了自花授粉。雄性不育通常是母系遗传的,由线粒体基因组中的功能获得突变引起,因此被称为细胞质雄性不育 (CMS)。CMS 已在各种作物中得到广泛研究,并被用于育种计划。
大多数类型的 CMS 突变都是由线粒体染色体重排引起的,从而产生具有新功能的嵌合基因。植物线粒体基因组
很大,大小不一,并且倾向于在特定区域发生重组(参见第 3 章和第 13 章)。线粒体基因组重排可导致两个不同的线粒体序列融合,有时
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 642
有性生殖:从配子到果实 643
(A) 雌雄异花
花粉释放
雄蕊先熟
柱头可授性
柱头可授性
雌蕊先熟
(B) 异花柱
长花柱形态
花粉释放
短花柱形态
图 21.18 促进异花杂交的花的形态适应。(A) 雌雄异花。在雄蕊先熟的花中,
花药中的花粉释放发生在柱头可授性
之前(柱头开放表明)。在雌蕊先熟的花中,
柱头可授性先于花粉释放。(B)异柱花柱。
产生两种解剖学上不同类型的花:
长柱花柱型和短柱花柱型。由于不相容
反应,这两种类型可以相互授粉
但不能自花授粉。
产生一种新的功能基因。虽然迄今为止分离出的 CMS 突变没有两个是相同的,但当在花药中表达时,所有突变似乎都会抑制线粒体功能,导致产生活性氧 (ROS) 和 ROS 介导的程序性细胞死亡。有关水稻 CMS 的分子机制及其逆转的讨论,请参阅 WEB TOPIC 21.8。雄性不育是农作物中最受追捧的特征之一,其中杂种优势或杂种优势对产量至关重要(例如玉米和油菜)(见第 3 章)。显示杂种优势的杂交种子必须每季从两个遗传上不同的自交系杂交中重新产生。生产杂交种子的主要实际问题是防止自花授粉,因为自花授粉会导致非杂交种子。如果没有雄性不育性,就必须手动去雄以阻止自花授粉,这是一个费力的过程。细胞消融术已被广泛用于产生各种作物(例如油菜)的雄性不育品种。在这种技术中,花药或花粉发育所依赖的组织(例如绒毡层)特异的基因启动子用于驱动细胞毒性蛋白(如 RNA 酶)的表达。这些细胞毒性蛋白会特异性地杀死目标细胞或组织,使成年植物雄性不育。这些品种与产生花粉的植物交替播种,产生具有所需表型的杂交种子。自交不亲和性 (SI) 是被子植物进行异花授粉的主要机制。
花的形态和细胞质雄性不育性促进了一些物种的异花授粉。然而,在大多数自交从未发生的雌雄同株物种中,异花授粉严格由一种称为自交不亲和性 (SI) 的自/非自识别机制强制执行。SI 系统在开花植物中独立进化了好几次,产生了各种各样的机制。SI 创造了一种阻止自花授粉的生化屏障,通常是通过杀死同一个体产生的花粉粒或花粉管,同时允许同一物种的另一个个体授粉。
区分自花和非自花的能力是多细胞和微生物物种普遍存在的一项基本功能。例如,在脊椎动物中,识别非自身是免疫系统的主要功能,它依赖于一组称为主要组织相容性复合体 (MHC) 的基因,其中 MHC 基因座的等位基因变异或多态性有助于自我/非自我识别。在植物中,有性生殖过程中的自我/非自我识别由自交不亲和基因座 S(自交不亲和性)介导,它指导自花粉的识别和拒绝。MHC 和 S 基因座在确定自我和非自我识别方面的功能相似性长期以来一直激发有关动物和植物之间进化同源性的提议。然而,植物自交不亲和性的第一个分子机制的发现表明,它们在各个方面都与动物完全不同。S 基因座是一组基因,它们在花药和花粉粒(雄性)或雌蕊(雌性)中表达。花粉和雌蕊决定基因作为单个分离单位遗传,具有许多等位基因。这种基因复合体的等位基因变体称为 S 单倍型。单倍型是染色体上相邻基因座上一起遗传的等位基因的任何组合。两种不同的遗传机制控制着
自交不亲和性
在柱头授粉和花柱和子房内花粉管生长的过程中,SI 基因等位基因表达的蛋白质决定了雌蕊细胞将花粉或
花粉管视为自体还是非自体。如果花粉粒(或花粉管)的细胞携带与雌蕊 S 单倍型相同的等位基因,
则花粉被视为自体,并发生不亲和反应,导致花粉管发育中止。但是,如果
花粉粒(或花粉管)表达的 S 单倍型等位基因与雌蕊的等位基因不同,则花粉被视为非自体,从而允许授粉、花粉管生长和受精继续进行。
通过对许多物种的 SI 过程进行显微镜观察,人们早期将 SI 机制分为两大类,根据受精停滞的阶段进行分类。在一组科(例如十字花科、禾本科)中,花粉粒在非常早期的阶段就被阻断,有时甚至在水合之前就被阻断,无法发芽。在第二组科(例如茄科、蔷薇科)中,花粉粒在柱头上正常发芽,但花粉管在通往胚珠的途中死亡。这两种类型的 SI 反映了两种非常不同的遗传机制(图 21.19)。在孢子体自交不亲和 (SSI) 中,花粉粒的不亲和表型由花粉亲本的二倍体基因组决定,或者更准确地说,由支持花粉形成的孢子体组织——花药的绒毡层决定。二倍体绒毡层将其 S 单倍型的两个副本产生的蛋白质沉积在 SSI 物种的花粉表面上。因此,即使每个单倍体花粉粒在其基因组中仅携带一个 S 单倍型,其不亲和表型也反映了其亲本携带的两个 S 单倍型。柱头也是孢子体的,因此是二倍体,并且还含有来自两种不同 S 单倍型的蛋白质。如果花粉亲本的 S 单倍型之一与受体植物柱头上的 S 单倍型之一匹配,则会发生排斥。由于 SSI 蛋白在接触柱头后立即发生反应,因此 SSI 反应通常会在花粉粒吸水或发芽之前阻止花粉粒。但是,如果将未发芽的 SSI 花粉从不相容的柱头上取下并放置在相容的柱头上,它将恢复。在配子体自交不亲和 (GSI) 中,花粉的不相容表型由以下因素决定:(A) 孢子体自交不亲和 (SSI)
(B) 配子体自交不亲和 (GSI)
花粉管
图 21.19 配子体和孢子体自交不亲和性的比较。 (A) 孢子体自交不亲和性 (SSI)。只有当亲本二倍体基因型与雌性亲本不匹配时,花粉管才会生长。 (B) 配子体自交不亲和性 (GSI)。只有当单倍体基因型与雌性 S 基因座不匹配时,花粉管才会生长。
TZ7E 21.19
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-06-21
花粉自身(单倍体)基因型。在这种情况下,如果花粉粒的单个 S 单倍型与雌蕊中的任一 S 单倍型匹配,就会发生排斥。GSI 反应通常会在花粉管生长到花柱的一部分后阻止花粉管发育。这是因为在雌蕊中引发不相容反应的蛋白质并不像在 SSI 中那样存在于花粉细胞壁中。相反,蛋白质 m必须首先由花粉粒的单倍体基因组合成,然后必须积累足够的量以在花柱内引发 GSI。与通常会阻止花粉发芽的 SSI 相比,GSI 作用较晚,导致花粉管死亡。特定物种中存在的自交不亲和反应类型已被证明与生殖发育的其他方面相关。例如,SSI 通常与干燥柱头有关,而 GSI 在具有湿柱头的物种中更常见。因此,SSI 花粉必须从柱头获得水分,然后花粉管才能出现,而 GSI 花粉一旦落在柱头上就会变得水合并具有代谢活性。 4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 644
有性生殖:从配子到果实 645
尽管存在这些差异,但两种类型的 SI 中相容花粉的发芽速度同样快。尽管如此,这些解剖特征与 SI 类型之间的相关性可能表明两种主要类型的 SI 在被子植物进化早期就出现了分化。
十字花科孢子体 SI 系统由 S 位点编码的受体和配体介导。迄今为止,唯一在分子水平上被表征的 SSI 系统是十字花科系统。在十字花科中,S 基因座的两个高度多态性基因(即具有许多不同等位基因的基因)参与 SI 反应(图 21.20)。雄性 S 决定子是位于花粉外壳中的富含半胱氨酸的蛋白质,被称为 S 基因座富含半胱氨酸的蛋白质 (SCR)。尽管 SCR 在二倍体绒毡层和单倍体花粉粒中均有表达,但只有绒毡层产生的 SCR 才是自交不亲和反应所必需的。由于绒毡层是孢子体组织,因此十字花科的 SI 系统被视为孢子体。雌蕊 S 决定簇是一种丝氨酸/苏氨酸受体激酶,称为 S 位点受体激酶 (SRK),位于柱头细胞的质膜上。SRK 在不同的 S 单倍型之间变化很大,这与参与自我识别的蛋白质预期一致。
在微配子发生过程中,二倍体绒毡层分泌各种蛋白质,包括两种类型的 SCR(二倍体基因组的每个 S 单倍型各一种),它们被整合到花粉粒细胞壁的外壁中。授粉后,SCR 扩散到柱头表面并穿透乳头细胞壁,直到到达质膜。
由于柱头是二倍体,乳头细胞质膜也含有两种类型的 SRK,柱头中的每个 S 单倍型各一种。每个 SRK 仅识别并结合由相同 S 位点单倍型编码的同源 SCR。当发生这种情况时,SCR 与 SRK 的结合会导致受体的自身磷酸化。SRK 受体的磷酸化随后启动信号级联,迅速抑制通常促进花粉水合和发芽的功能。例如,分泌所需的花粉活化化合物或蛋白质可能成为降解的目标。即使花粉外壳中代表的两个 S 单倍型(作为 SCR)中只有一个存在于柱头基因组中,也会发生 SSI 反应。细胞毒性 S-RNases 和 F-box 蛋白决定配子体自交不亲和性 (GSI) 配子体自交不亲和性 (GSI) 是开花植物中更普遍的自交不亲和性形式,被认为是在 SSI 之前进化而来的。 和 SSI 一样,GSI 由单个多等位基因位点控制 SCR1 和 SCR2 与各自的受体结合,阻止发芽 S1S2 花粉 自交不亲和 SCR3 和 SCR4 没有特定的受体,因此不会阻止发芽。 SCR3 配体
SCR4 配体
S3S4 花粉
等位基因决定因素
图 21.20 十字花科孢子体 SI 系统
涉及受体-配体相互作用和柱头表皮表面“自体”花粉的识别。在孢子体 SI 系统中,花粉的 SI 表型由其形成的花药的 SI 表型决定。 因此,花粉和雌蕊表达两种不同 SI 等位基因的基因产物(花粉壁中的点)。
该图显示了自交亲和 S1S3 杂合子的柱头乳头细胞上具有不同单倍体类型(S1S2 和 S3S4)的两个花粉粒。每个花粉粒的 S 位点富含半胱氨酸的蛋白 (SCR) 配体位于花粉外壁或花粉外层,当花粉粒落在柱头上时,会输送到表皮表面。图中的柱头乳头细胞表达 SRK1 和
TZ7E 21.20
SRK2 受体。花粉粒的 S1 和 S2 配体均与 S1S2 柱头细胞表面的各自受体结合并激活,从而触发信号级联,导致水合、发芽和花粉管生长受到抑制。相反,来自表达 SRK1 的植物的花粉粒的 S3 和 S4 配体S3 或 S4 单倍体
类型均不能结合并激活 SRK 受体,从而使花粉管生长得以进行。
植物生理学 7/E Taiz/Zeiger
牛津大学出版社/Sinauer Associates
莫拉莱斯工作室日期 2-1-22
(S 基因座)含有两个紧密相连的基因,它们编码花粉表达的雄性决定因素和雌蕊表达的雌性决定因素。在茄科、玄参科和蔷薇科中,花粉决定簇由编码 F-box 蛋白 SLF/SFB 的基因决定(SLF 和 SFB 表示在不同物种中发现的相同蛋白),该蛋白参与通过泛素化途径靶向降解蛋白质(参见第 4 章)。雌蕊决定簇由细胞毒性 S-核糖核酸酶 (S-RNase) 基因决定,该基因在花柱传递道中特异性表达并分泌到细胞外空间 1. 来自二倍体花柱传递道的 S-RNase 进入单倍体花粉管。花粉管生长的地方(图 21.21A)。只要单倍体花粉的 S 决定簇与二倍体花粉中表达的两个 S 决定簇之一匹配,就会发生花粉管排斥。
我们对 GSI 机制理解的一个关键进展是发现 2. SCFSLF 复合物中产生的 S-RNases 仅泛素化和降解非自身 S-RNases。
花粉管
SCFSLF 复合物
RNA 降解
4. SCFSLF 复合物
泛素化和降解两种非自身 S-RNases。
自交花粉管
3. 自身 S-RNases 可以自由降解细胞 RNA。
5. RNA 不降解,允许花粉管生长。
异花粉管
苹果特有
SI-RNAse 蛋白的分布
TZ7E 21.21
图 21.21 配子体自交不亲和性 (GSI) 的 RNase 降解模型。(A) (左) 自交花粉管。
由于花粉是单倍体,其 SCFSLF 复合物仅识别和降解由二倍体传递道产生的非自 S-RNase。 因此,剩余的自 S-RNase 可以自由降解细胞 RNA。 (右) 异花粉管。 在异花授粉过程中,花粉管 SCFSLF 复合物识别并降解两种非自 S-RNase,从而消除毒性并允许花粉管生长。 (B) 苹果花柱中的 SI-RNAses 免疫标记,苹果是蔷薇科的一员。
左图显示苹果雌蕊的显微切片。
植物生理学 7/E Taiz/Zeiger
牛津大学出版社/Sinauer Associates
莫拉莱斯工作室日期 4-18-22
来自 A. C. Certal 等人。1999。
性别。植物繁殖。12:94–98
假彩色图像是通过合并使用荧光标记抗体获得的荧光图像(顶部中心)和宽视野显微镜图像(底部中心)生成的。绿色表示苹果特异性
SI-RNAase 蛋白的分布。SI 蛋白在花粉和花粉管生长的地方积累,从外部柱头细胞
(st),到传递组织 (tt),而在皮层组织 (ct) 和表皮中看不到。右图显示 SI 蛋白在细胞壁和细胞间隙中的积累。花粉管在细胞间隙中生长时吸收了这些蛋白质。
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 646
有性生殖:从配子到果实 647
无论花粉决定因素是否与雌蕊决定因素相匹配,传递道都可以被吸收到花粉管的细胞溶胶中。换句话说,雌蕊的 S-RNase 与花粉的 S 决定簇之间的识别发生在花粉管内,导致只有自身 S-RNase 具有细胞毒性。这一观察结果与花粉决定簇 SLF/SFB 是细胞内蛋白相一致。作为 F-box 蛋白,SLF/SFB 是 E3 连接酶复合物 SCF 的组成部分,后者通过泛素-26S 蛋白酶体依赖性途径参与蛋白质降解。SLF/SFB 的功能表明了一种模型,其中花粉管 SCFSLF 蛋白对非自身 S-RNase 的识别导致花粉管中非自身 S-RNase 的泛素化和降解(图 21.21B)。 SCFSLF 降解非自身 S-RNase 可防止 RNase 细胞毒性并使花粉管继续生长。然而,在自花粉的情况下,SCFSLF 蛋白复合物无法与从传递道吸收的 S-RNase 结合。因此,S-RNase 不会降解并消化花粉管营养细胞的 RNA,导致细胞死亡。
该模型解释了 GSI 的某些方面,但并非全部。
例如,S-RNase 在管细胞液泡中的隔离似乎在保护免受细胞毒性方面发挥重要作用。在不相容反应期间,液泡膜的分解可能引发管细胞的程序性细胞死亡。
描述了 GSI 的一种更简单的分子机制罂粟 (Papaver rhoeas) 中的 ibed(参见网络主题 21.9)。
21.6 无融合生殖:通过种子进行无性繁殖
在某些物种中,胚胎不是通过减数分裂和受精产生的,而是由胚珠中的体细胞二倍体细胞直接分化为合子,因此在遗传上与母本相同。这种通过种子进行的无性或克隆繁殖称为无融合生殖,以这种方式产生的植物称为无融合生殖。已知无融合生殖发生在大约 0.1% 的被子植物中,包括 40 多个被子植物科中的单子叶植物和真双子叶植物。常见的例子包括柑橘属、芒果、蒲公英、黑莓、海棠和饲料草黍。各种类型的无融合生殖在
WEB 主题 21.10 中进行了描述。
无融合生殖不是进化的死胡同
由于其克隆性质,无融合生殖曾被视为进化的死胡同,在遗传上与有性生殖截然不同。这一假设基于这样的假设:无融合生殖代表不可逆的系统发育分支点,必然会导致谱系灭绝。这种观点现已被系统发育分析所取代,这些分析表明,无融合生殖不仅广泛分布于早期和晚期分支谱系中,而且也是可逆的。也就是说,曾经是无融合生殖的谱系有时会恢复到专性有性生殖。在少数情况下,环境压力已被证明会诱导从有性生殖转变为无融合生殖。
无融合生殖的遗传控制基于控制珠心和大配子体正常发育的相同基因的改变表达。
由于绝大多数无融合生殖基因型都是多倍体,因此有人提出,无融合生殖的进化可能有助于至少某些多倍体物种的适应性。
阐明无融合生殖的机制可能为植物育种者提供改良作物的重要新工具。我们许多产量最高的作物,如玉米,都是利用杂种优势现象而开发的杂交品种。
如前所述,杂交植物不能纯种繁殖,也不能通过种子繁殖。因此,必须通过重复原始杂交来每季生成杂交种子。但是,如果将无融合生殖引入 F1 杂种,杂交植物可以克隆地产生种子,从而避免 F2 代杂种优势丧失的问题。通过用适当的基因转化 F1 杂种来诱导无融合生殖的方法的发展为大大加速未来作物改良的进展提供了令人兴奋的可能性。
21.7 胚乳发育
从生态和农业的角度来看,植物生命周期始于种子,也终于种子。我们现在来了解被子植物胚珠在双受精后的故事,并观察它如何转变为成熟的种子。胚乳是由双受精产生的初生胚乳核的有丝分裂发育而成的。被子植物的胚乳发育有三种类型:核型、细胞型和胚轴型。其中,核型是最常见的,已在谷物和拟南芥种子中进行了广泛的研究,正如我们在本节中讨论的那样。(有关其他胚乳类型的描述,请参阅 WEB 主题 21.11。)在种子形态发生过程中,胚乳为发育中的胚胎提供营养。在某些物种中,有足够的胚乳剩余来为发芽的幼苗提供营养。在拟南芥和许多其他物种中,胚乳在胚胎发生过程中几乎完全被重新吸收(溶解和吸收),支持早期幼苗生长的储备储存在胚胎的子叶中(图 21.22)。豆科植物的肉质子叶高度专门用于储存食物(见第 17 章)。在
21_Taiz7e-Ch21.indd 647
4/29/22 10:27 AM
648 第 21 章
周围
珠孔
珠被
合点珠孔
图 21.22 拟南芥种子结构。 (A) 拟南芥种子图,胚胎处于鱼雷发育阶段。 (B) 与 (A) 相同阶段的拟南芥种子染色切片的光显微照片。 胚胎嵌入成熟的胚乳组织中。 种子被种皮覆盖,种皮来自胚珠的内、外珠被
珠被
合点珠孔
组织。 (C) 成熟种子。 胚乳大部分已被重新吸收,胚胎填满种子。子叶含有储存的储备,可在发芽后支持幼苗早期生长。(A 源自 I. Debeaujon 等人,2003 年。植物细胞 15:2514-2531。)谷类和其他草类,胚乳在种子发育过程中持续存在,并成为储存淀粉和蛋白质的主要场所(图 21.23)。调动这些储备进行翻译胚乳进入胚胎的最后功能是胚乳在幼苗成熟后经历程序性细胞死亡之前的最终功能。
在具有核型胚乳的种子中,发育分为两个阶段:多核细胞期和细胞期。在双受精后,胚乳细胞核经历几轮有丝分裂,没有细胞质分裂,形成多核多核细胞。
在因物种而异的特定时间,多核细胞在每个细胞核周围沉积细胞壁,并逐渐经历细胞化。
TZ7E 21.22
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
拟南芥胚乳多核细胞的细胞化从珠孔区进展到合点区
图 21.24 显示了拟南芥胚乳多核细胞发育的几个阶段。由中央细胞与其中一个精子细胞融合而产生的初生胚乳核经历了一系列八次有丝分裂,没有细胞质分裂,导致产生约 200 个细胞核,大部分位于大型中央细胞的边缘。在球形胚阶段,拟南芥的胚乳腔细胞有三个区域,随着种子的生长,这些区域变得截然不同:围绕胚的珠孔胚乳、中央腔中的外围胚乳和合点胚乳。
种皮和果皮
胚乳:
糊粉层
淀粉胚乳
胚芽鞘
胚根
授粉后几天
图 21.23 谷物种子结构,以小麦(Triticum aestivum)为例。(A) 种子表面视图,显示胚相对于胚乳的位置。 (B) 种子纵向切片。 (C) 胚的发育。
(A 和 B 源自 W. Troll。1937 年。Vergleichende Morphologie der
hoheren Pflanzen,Gebruder Borntrager,柏林; M 之后的 C。
科塞加尔等人。 2007. 胚乳:植物细胞专着,卷
8.奥尔森,O.-A. [编辑],第 57-71 页。施普林格:柏林、海德堡。)
B 和 C 来自 I. Debeaujon 等人。 2003. Plant Ce l 15: 2514–2531
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 648
有性生殖:从配子到果实 649
多核细胞
外周
珠孔
外周胚乳
珠孔
微管
多核细胞的结节
持久
多核细胞胚乳
细胞化胚乳
合点胚乳
图 21.24 拟南芥胚乳多核细胞的发育。(A–D) 初生胚乳核经历自由核分裂,产生的核迁移到多核细胞中央细胞的外围。 (E–G) 胚乳多核细胞的细胞化始于珠孔糊粉状胚乳区,并进展至合点区。除了外围薄薄的一层胚乳(糊粉层)外,其余部分在发育过程中被正在生长的胚胎重新吸收。(O.-A. Olsen 著,2004 年。植物细胞 16:S214–S227。)
TZ7E 21.24
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-19-21
拟南芥多核胚乳的细胞化始于珠孔胚乳区,并进展至合点区(见图 21.24E 和 F)。该过程始于胚胎发生的球状阶段,此时,多核细胞被组织成间距均匀的细胞核,并通过微管的径向阵列将其固定在位(图 21.25A 和 B)。
微型成膜体(见第 1 章)与相邻的细胞核等距组装,然后通过将管状膜融合成多孔片而产生细胞板(图 21.25C)。最后阶段是细胞板的一侧与亲本质膜融合(图 21.25D)。相邻的核质域之间形成壁,但不在域和胚囊的中央腔之间形成壁,从而形成开放的细胞,由于其管状性质,这些细胞被称为肺泡细胞。随后,肺泡细胞向内分裂,导致外周细胞层形成横壁,使肺泡内层连同上层残留的胞质细胞质向内移向中央腔,直到最终中央液泡消失,整个胚乳细胞化(见图 21.24E 和 F)。
21_Taiz7e-Ch21.indd 649
与谷类植物不同,谷类植物中大部分胚乳仍留在成熟种子中,1 而在拟南芥中,细胞胚乳在胚生长过程中被大量消耗。 成熟时,胚充满整个种子,成熟种子中仅存一层胚乳(见图 21.22C 和 21.24G)。如第 17 章所述,持久胚乳层(有时称为糊粉层,类似于谷物)有助于拟南芥和其他小种子物种的外壳休眠,并且其细胞壁的分解是完成发芽所必需的。谷物的胚乳细胞向心发育
在谷物中,胚乳在胚胎发生过程中不会被消耗,因此它占据了成熟种子的很大一部分体积(见图 21.23)。
在谷物胚乳发育过程中,三倍体初生胚乳核经历一系列
1 谷物从技术上讲是果实而不是种子,因为它们被融合的种皮包裹,其中包括种皮和果壁(见第 17 章)。
4/29/22 10:27 AM
650 第 21 章
(A) 概述
外围
微孔
(B) 核质
(C) 横壁形成,
早期
细胞质
微管
微型隔膜体
图 21.25 拟南芥外围胚乳的横壁形成。(A) 细胞化开始于胚胎发生的球状阶段。 (B) 共生体由放射状微管组织成核质域。
(D) 横壁形成,
后期
细胞板
(C) 微型隔膜体在相邻域之间的边界形成。 (D) 囊泡融合形成横壁。 (M.
S. Otegui 著。2007 年。《胚乳:植物细胞专著》,第 8 卷。
Olsen, O.-A. [编辑],第 159-178 页。Springer:柏林,海德堡。)
有丝分裂没有胞质分裂,细胞核
迁移到中央细胞的边缘,中央细胞也
包含一个大的中央液泡(图 21.26A-D)。与拟南芥共生细胞一样,每个细胞核都被放射状排列的微管包围(图 21.26E)。
相邻细胞核之间最初形成垂周壁,形成管状肺泡细胞,其开口端指向中央液泡(图 21.26F)。然后,泡状核经历一个或多个平周有丝分裂,随后发生胞质分裂,产生子细胞。子细胞的最内层仍为泡状结构,并继续平周分裂,直到细胞分化完成(图 TZ7E 21.25 21.26G 和 H)。
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-06-21
淀粉胚乳组织最重要的前体是胚乳细胞分化完成时存在的文件内部细胞(见图 21.26H)。在此阶段之后不久,细胞会进一步分裂,分裂平面现在的方向是随机的,因此细胞文件模式很快就会消失。淀粉胚乳细胞的第二个来源是糊粉层的周层分裂产生的内子细胞。这些细胞重新分化成为淀粉胚乳的外层。微管胚乳发育和胚胎发生可以独立发生虽然胚胎发生和胚乳形成在种子中同时发生且非常接近,但这两个过程并非必然耦合。例如,在体细胞胚胎发生过程中,
胚胎发生可以在营养组织中进行,而无需
在落地生根和伽蓝菜中,
它们可以繁殖
外围
(E)(F)(G)(H)
垂周细胞壁
周周细胞壁
图 21.26 谷类胚乳多核细胞的发育。(A–D)
三倍体胚乳细胞核位于中央细胞的基底细胞质中。经过一系列自由核分裂后,细胞核迁移到大型多核细胞的外围。(E–H)谷类多核细胞胚乳的细胞化。 (O.-A.
Olsen 著。2004 年。植物细胞 16:S214–S227。)
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 650
有性生殖:从配子到果实 651
通过在叶缘产生小植株而无性繁殖
(图 21.27A)。体细胞胚胎也可以通过组织培养实验生成,这是许多生物技术实验室的常规程序(图 21.27B)。
一旦启动,通过组织培养产生的体细胞胚胎就会经历与正常胚胎相同的发育阶段(参见第 22 章),并且可以长成正常植物,表明营养培养基可以在体外胚胎发生过程中替代营养胚乳。尽管有这种明显的
Patrice78500/Wikimedia/CC BY-SA 3.0
来自 P. P. Kumar 和 C. S. Loh。2012 年。在植物生物技术和农业中。A. Altman 和
P. M. Hasegawa,(编辑),第 131-138 页。Academic 出版社:阿姆斯特丹。照片由 Wendy Shu 拍摄
图 21.27 无性胚胎发生的例子。
TZ7E 21.27
(A)在 Kalanchoe 中,小胚胎(有时称为
繁殖体)从叶子的边缘分化出来。它们
最终从叶子上掉下来,开始在地上生长为发芽的种子。(B)体细胞胚胎可以在许多物种的组织培养中产生,使用幼嫩的组织
或花药。这些外植体首先受到强烈的渗透、激素或温度冲击,然后在恢复培养基中生长为愈伤组织或悬浮细胞。一些细胞簇随后呈现“卵状”命运,并开始重现所有形态合子胚胎发生的网络步骤。在这里,可以看到一个心形阶段的胚胎从未分化细胞的愈伤组织中发出。
植物生理学 7/E Taiz/Zeiger
牛津大学出版社/Sinauer Associates
莫拉莱斯工作室日期 4-25-22
合子胚胎发生的形态学重演,体细胞胚胎是通过不同的过程形成的。例如,它们不是从单细胞合子发育而来的,而是从小细胞群发育而来的,体细胞胚胎通常比合子胚胎大。胚乳也可以独立于胚胎发育。种子中胚乳的自主发育似乎受到部分遗传控制。在拟南芥中,三个受精无关种子 (FIS) 基因 (FIS1、FIS2 和 FIS3) 中的任何一个基因发生突变,都会在没有双受精和胚胎形成的情况下触发自主胚乳发育。2 然而,突变胚乳永远不会细胞化,无论是由于二倍体而不是三倍体还是其他原因。鉴于种皮 (种皮) 和果实 (长角果) 也在 fis 突变体中形成,胚乳、种皮和子房壁的发育似乎是协调的。控制胚乳发育的许多基因都是差异表达的母本或父本基因。动物育种者数千年来一直知道亲本效应。例如,如果父本是马,则将驴与马杂交,产生骡子;如果母本是马,则产生骡子。亲本效应被定义为取决于遗传特征的亲本性别的表型。亲本效应的一个子集是由印记基因表达引起的。这种遗传印记可能是在植物和动物中对选择压力的反应而进化而来的(参见 WEB 主题 21.12)。对单个基因印记的首次展示之一是对玉米粒颜色遗传的研究。结果表明,玉米粒是纯色还是呈现紫色斑驳取决于控制斑驳的 R 等位基因是来自母本还是父本。这些研究和后续研究表明,来自雌性和雄性亲本的两组染色体虽然包含相同的基因,但其发育效应不同。因此,遗传印记是母系和父系染色体上的等位基因被差异“标记”以确保受精后亲本特异性表达的过程。
我们现在知道,基因组印记涉及以化学修饰形式从配子向后代传递表观遗传信息(“标记”)。
2FIS1 基因最初是在突变的拟南芥植物中作为母系效应发现的,称为 medea。FIS1 编码与 MEDEA 基因相同的蛋白质。蛋白质 FIS1、FIS2 和 FIS3 是 Polycomb 组蛋白质,在组蛋白甲基化中起作用(见第 21.7 节)。 FIS3 基因也称为受精独立胚乳 1 (FIE1)。
21_Taiz7e-Ch21.indd 651
4/29/22 10:27 AM
652 第 21 章
DNA 或其相关蛋白质(例如组蛋白)通过甲基化或乙酰化(参见第 3 章)表达。因此,一小部分基因(称为印迹基因)仅从二倍体细胞中的两条染色体中的一条表达。相反,基因组中的大多数基因都是非印迹的,这意味着来自父母双方的等位基因表达相同。
由于印记而由母体表达而由父体沉默的基因称为母体表达基因 (MEG),而由父体表达而由母体沉默的基因称为父体表达基因 (PEG)。对拟南芥和其他物种(包括单子叶植物)的研究表明,在开花植物中,有性印记基因的表达几乎完全局限于胚乳组织。大多数差异表达基因都是母体表达基因(一项研究发现 100-165 个 MEG 对比 10-43 个 PEG)。MEG 在胚乳中的作用的进化意义在于母本控制着正在发育的植物胚胎的营养。虽然印记主要影响胚乳的发育,但胚胎也表达一些印记基因。我们对植物亲本印记的理解依赖于对有限数量的基因突变的研究,即母本表达的 FIS1、FIS2 和 FLOWERING WAGENIGEN (FWA) 基因座,以及父本表达的 PHERES1 (PHE1) 基因。
WEB TOPIC 21.13 介绍了胚乳发育和细胞增殖的遗传调控的可能方案。
淀粉胚乳和糊粉层的细胞遵循不同的发育途径。
许多物种的种子以蛋白质和油脂的形式储存储备,而谷物的胚乳则储存大量淀粉。淀粉胚乳是一种独特的组织,是一种c
占谷物胚乳的大部分(见图 21.23)。谷物的淀粉胚乳还含有储存蛋白,这些蛋白沉积在蛋白质储存液泡中。
核内复制——即染色体复制而不进行有丝分裂,导致高 DNA 含量和多倍体(见第 1 章)——似乎在淀粉胚乳发育中起着重要作用。例如,在玉米中,多达五轮的核内复制可能导致每个细胞核的 DNA 含量为 96C——即单倍体细胞核中存在的数量(含量)的 96 倍。核内复制在储备沉积期间开始,DNA 的积累阻止了进一步的核或细胞分裂。细胞的典型大小似乎受到细胞核中 DNA 数量限制。因此,
核内复制使植物和其他生物的某些细胞能够膨胀到比正常体积更大的体积,从而最大限度地提高它们储存食物储备(例如,胚乳,最高可达 96C)或分泌化合物(例如,叶毛,最高可达 16C)的能力。
谷物的淀粉质胚乳在成熟时会因程序性细胞死亡而死亡,这一事件与
乙烯信号通路有关。在萎缩的玉米突变体 en2 中,过量产生乙烯,胚乳细胞死亡会加速。
如第 17 章所述,糊粉层(胚乳的最外层)在幼苗早期生长过程中发挥作用,通过产生 α-淀粉酶、蛋白酶和其他水解酶来动员淀粉胚乳中的淀粉和储存蛋白质储备,以响应胚产生的赤霉素。玉米和小麦有一层糊粉层细胞,水稻有一层到几层,大麦有三层。在谷物中,糊粉层是胚乳中唯一可能变成色素的部分。遗传学研究已经确定了两个在调节糊粉层分化方面起核心作用的基因(参见 WEB 主题 21.14)。 21.8 种皮的发育
种皮是种子的外部保护层,是胚胎植物抵御不利环境因素(包括非生物和生物)的第一道防线。然而,如第 17 章所述,种皮还可以调节休眠,确保在发芽开始之前外部条件有利于生长。受精后,种皮在 2 至 3 周内与母体衍生的胚珠珠被细胞分化(图 21.28)。受精后最初几天,外珠被的两层细胞和内珠被的所有三层细胞都会经历一段急剧的生长期,包括细胞分裂和扩增。由此产生的五个细胞层会经历四种不同的命运之一。最内层的细胞来自胚珠内皮,合成原花青素类黄酮化合物,也称为缩合单宁(见网络附录 4),这些化合物在受精后的第一周内积聚在内皮细胞的中央液泡中,随后被氧化,使分化细胞(称为色素细胞层)和整个种皮呈现棕色。相比之下,其他两个内珠被层的细胞似乎没有进一步分化,经历早期程序性细胞死亡,并在种子发育过程中被压碎(见图 21.28C)。种皮发育似乎受胚乳的调控。种皮来自胚珠的珠被,因此是母体孢子体组织。种皮
生长和分化由受精开始
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 652
有性生殖:从配子到果实 653
所有照片来自 G. Haughn 和 A. Chaudhury。
2005. Trends Plant Sci。10:472–477
整粒种子
图 21.28 受精后,胚珠珠被
发育成拟南芥种皮。
显示了整粒种子的几个种子发育阶段(左)
和正在发育的种皮的细节(右)。
(A) 受精前。 (B) 受精后十天。各层细胞几乎已分化为各种特殊细胞类型,包括内皮细胞(5)、栅栏细胞(2)和表皮细胞(1)。实线箭头表示质外体中的粘液。虚线箭头表示栅栏细胞的次生细胞壁。(C)15 天(种子成熟期)。除表皮外,所有五层细胞均已死亡并被挤压在一起,表皮的形状由厚厚的富含纤维素的次生细胞壁(称为小柱)维持。Al,胚乳糊粉层;Em,胚;En,胚乳;Es,胚囊;Ii,内珠被;Oi,外珠被。1 和 2 表示外珠被的两个细胞层;3-5 是内珠被的三个细胞层。并且通常与种子正在生长的胚胎和胚乳的发育协调进行,
ich 代表下一代孢子体。
因为种皮包裹着种子,所以其表面积的增长必须与
胚和胚乳的生长相协调,种子才能达到成熟大小。
如果种皮无法扩大,种子大小就会减小。
TZ7E 21.28
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
种皮的发育似乎直接取决于
胚乳。在野生型拟南芥与仅产生一个精子细胞(因此只能与一个雌配子融合)的突变体杂交中,只有中央细胞受精的种子产生正常的种皮,而只有卵细胞受精的种子则不产生种皮,这表明种皮的发育取决于胚乳的发育,而不是胚胎的发育。种皮发育需要胚乳的原因是,受精后,合成多种激素的胚乳会向胚珠的外部组织提供生长素,从而触发种皮的发育。在受精之前,种皮发育基因似乎受到 POLYCOMB 抑制复合物 2 (PRC2-) 介导的组蛋白三甲基化的表观遗传抑制(参见第 2.7 节脚注 2),而胚乳产生的生长素可消除这种抑制。透明种皮 2 (TTG2) 基因提供了种皮如何调节种子大小的一个例子。TTG2 正向调节原花青素(一种在种皮中产生的植物防御化合物)的生物合成和种皮扩张。因此,功能丧失的 ttg2 突变体具有较小的种子,大概是因为胚胎和胚乳在发育过程中受到种皮的机械约束。相反,HAIKU 基因突变导致多核胚乳生长受限。胚乳生长的这种缺陷也会影响正在发育的种皮的生长,从而限制正在扩展的种皮中的细胞伸长。这表明,正在生长的胚乳调节着种皮发育开始后胚珠珠被细胞伸长的程度。
21.9 种子成熟和耐干燥性
种子发育的最后阶段称为成熟,伴随着水分蒸发而产生干燥种子,这是许多植物物种发芽前静止状态的先决条件。对于许多物种来说,成熟还包括获得耐干燥性。耐干燥性通常与种子寿命相关,种子寿命是指种子在干燥状态下长时间保持活力的能力。
“正统种子”一词用于表示那些能够耐受低至 5% 水分含量的干燥的种子,并且可以根据物种的不同在干燥状态下储存不同的时间。
常见的正统种子包括谷物、豆类和拟南芥。寿命最长的正统种子是 2000 年历史的犹太枣椰子 (Phoenix
21_Taiz7e-Ch21.indd 653
4/29/22 10:27 AM
654 Chapter 21
dactylifera) 种子,于 2005 年成功发芽。相反,顽固种子是从植物中释放出来的,水分含量相对较高,代谢活跃。与正统种子不同,顽固种子在进一步脱水后会变质,无法在储存中存活。芒果和鳄梨就是顽固种子的植物例子。在大多数物种中,种子灌浆和耐干燥性阶段是重叠的。耐干燥性和种子寿命的发育时间与达到成熟大小和种子散播的关系因物种而异。对于大多数物种来说,耐干燥性是在种子灌浆期间获得的。随后,在晚期成熟过程中,种子逐渐获得寿命,即在干燥状态下长时间存活的能力。例如,图 21.29A 显示了苜蓿 (Medicago truncatula) 种子生长和发育的四个阶段(胚胎发生、种子灌浆、晚期成熟和豆荚脱落)。授粉后 10 天内胚胎发生,此后种子开始饱满,这由种子干重的增加表明。同时,种子的含水量下降(图 21.29B)。
耐干燥性获得开始于授粉后约 24 天,与种子饱满阶段和脱水阶段重叠。从授粉后 28 天开始,种子逐渐获得长寿(图 21.29C)。
新鲜收获的种子在授粉后约 16 天获得发芽能力,授粉后 22 至 32 天,完全发芽能力增加到 50%,此后由于休眠期的开始,发芽能力下降到 10%cy(图 21.29D)(种子休眠在第 17 章中讨论)。但是,可以通过干贮 6 个月(后熟)来克服这种休眠,之后完全成熟的种子会在 24 小时内发芽。
获得耐干燥性涉及许多代谢途径
对于正统种子,种子干燥不仅仅涉及种子的物理干燥。它与影响多种生理过程的不同基因表达和代谢模式有关,包括
12 16 24 28 32 36 40 44
含水量
(g H2O/g dw)( )
耐干燥性(%)( )
发芽 50% 的时间(d)( )
种子填充
晚熟
来自 J. Verdier 等人。
2013. Plant Physiol.
163: 757–774.
授粉后天数 (DAP)
干重
(mg) ( )
(P50, d) ( )
图 21.29 苜蓿种子成熟过程中的代谢和生理变化。种子发育分为四个主要阶段:
胚胎发生、种子灌浆、晚期成熟和豆荚脱落。 (A) 种子发育的时间过程。 (B) 水分含量和干重 (dw) 变化。 误差线表示平均值的 ± 标准误差。 (C) 获得耐干燥性,以快速干燥至 43% 相对湿度后的发芽率来衡量,以及寿命,以在 75% 相对湿度和 35°C 的储存条件下将活力降低至 50% 所需的时间来确定。 (D) 发芽速度或休眠的变化,以 50% 的种子在 20°C 下完成发芽所需的时间来确定。 ABS,脱落;MS,成熟种子。 (J. Verdier 等人 2013 年。
Plant Physiol. 163: 757–774。CC BY 4.0)
TZ7E 21.29
Plant Physiology 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 654
有性生殖:从配子到果实 655
休眠、后熟和发芽。在正统种子的中后期胚胎发生过程中,当种子脱落酸 (ABA) 含量最高时(见第 18 章),多种代谢过程被激活,有助于获得耐干燥性。在拟南芥中,超过 6900 个基因(约占基因组的三分之一)的表达模式在此期间发生变化。这些变化包括代谢过程(例如,二糖和寡糖的积累、储存蛋白和晚期胚胎发生丰富的 [LEA] 蛋白的合成)、应激防御机制的激活(例如,小热休克蛋白 [smHSP] 的合成、抗氧化防御的激活)以及细胞物理结构和密度的改变。在获得耐干燥性的过程中,胚胎细胞获得玻璃态。干燥会严重损害膜和其他细胞成分(见第 24 章)。成熟种子每干重仅含 0.1 g 水,水势在 -350 至 -50 MPa 之间。当种子开始脱水时,胚胎会积累糖和一组特定的蛋白质。这些分子群被认为相互作用产生玻璃态。一般来说,玻璃被定义为一种无定形、亚稳态,类似于固体、易碎的材料,但保留了液体状态的无序性和物理特性。生物玻璃是粘稠度很高的液体,分子扩散速率非常低,因此只能参与有限的化学反应。由于蔗糖、棉子糖和水苏糖等非还原糖在种子成熟的后期积累,因此最初假设它们是细胞玻璃形成的主要原因。然而,糖玻璃的物理性质与干燥胚胎的物理性质有显著不同,这导致了这样的假设:蛋白质,特别是 LEA 蛋白质,是种子玻璃形成所必需的。 LEA 蛋白和非还原糖与种子耐干燥性有关
晚期胚胎发生丰富 (LEA) 蛋白是小型、亲水性、大量无序且热稳定的蛋白质,它们在成熟中后期和营养组织中合成,以响应渗透胁迫。它们被认为具有一系列针对干燥的保护功能,效率各不相同,包括离子结合、抗氧化活性、水合缓冲以及膜和蛋白质稳定。自从 LEA 蛋白于 20 世纪 80 年代初在棉花种子中首次被描述以来,相关蛋白质已在其他植物物种的种子和花粉粒以及细菌、蓝藻和一些无脊椎动物中被鉴定出来,并且 LEA 蛋白已被证明可以提高转基因酵母的渗透耐受性。 “复活植物”(例如 Craterostigma plantagineum)在极端干燥条件下生存的能力与 LEA 蛋白在营养器官中的积累有关。
此外,LEA 蛋白可能在响应中发挥作用冷冻和盐胁迫,这两者都涉及细胞脱水(见第 15 章)。
大多数 LEA 蛋白表现出偏向性的氨基酸组成,导致高亲水性,它们与一组称为脱水蛋白的蛋白质有关。LEA 蛋白的一个关键特征是它们能够与蔗糖形成氢键。由于糖在种子成熟过程中积累,因此人们认为 LEA 蛋白与蔗糖和其他二糖和寡糖相互作用,形成干燥耐受所需的玻璃态(见 WEB 主题 21.15)。
脱落酸在种子成熟中起着关键作用
对 ABA 不敏感的 M. truncatula 突变体的种子无法产生干燥耐受性,因此难以生长。 ABA 促进 LEA 蛋白、储存蛋白和脂质的合成,正如对许多物种的培养胚胎的生理和遗传研究表明的那样。缺乏 ABA 的突变体无法积累这些蛋白质。此外,ABA 处理可以在营养组织中诱导一些 LEA 蛋白或相关家族成员的合成。这些结果表明,在种子成熟过程中,许多 LEA 蛋白的合成受到 ABA 的控制。正如我们在第 4 章中讨论的那样,ABA 通过直接或间接激活转录因子网络来诱导细胞代谢的变化。特别是,ABSCISIC ACID INSENSITIVE3 (ABI3) 通过与 bZIP 转录因子(如 ABI5)相互作用来诱导储存蛋白和 LEA 蛋白的合成。对 M.
truncatula 种子基因调控网络的分析表明,ABI5 基因在调控网络中占据中心位置,与 LEA 和耐干燥基因高度相关。因此,
ABI3 和 ABI5 以及其他几个基因是种子特异性 ABA 信号通路的核心组成部分,该通路调节干燥状态下的存活率。
外衣休眠与长期种子活力相关
许多草本植物和园艺蔬菜的种子,如洋葱、秋葵和大豆,在储存条件下只能存活 1 至 2 年。其他种子,如黄瓜和芹菜的种子,可存活长达 5 年。
1879 年,W. J. Beal 发起了一项持续时间最长的种子寿命实验,他将 20 种不同物种的种子埋在东兰辛密歇根农学院附近的沙质山顶上,装在未封盖的瓶子里。经过 120 年(2000 年),只有一种,毛蕊花(Verbascum blattaria),仍然具有活力,瓶中的 50 颗种子中有一半发芽了。2021 年,又挖出了一个瓶子,对种子进行了活力测试;截至 2021 年撰写本文时,只有 11 颗种子发芽了。然而,142 年绝不是种子的最大寿命。例如,美人蕉 (Canna compacta) 的种子显然可以存活至少 600 年,而经证实现存最古老的种子是印度莲 (Nelumbo nucifera) 的种子,已有近 1300 年的历史,而一颗枣椰子 (Phoenix dactylifera) 种子被发现埋藏在以色列的马萨达,已有惊人的 2000 年的历史。这两个物种的种皮具有高度不透水性,这表明种皮强加的休眠与长期活力有关。然而,许多寿命较短的正统种子可以在低温种子库条件下长期储存。 21.10 果实的发育和成熟
真正的果实只存在于开花植物中。
事实上,果实是被子植物的一个决定性特征,
因为 angio 在希腊语中的意思是“容器”或“容器”,
sperm 的意思是“种子”。
早白垩世化石中出现了各种各样的果实类型,包括坚果、肉质核果和浆果。
果实通常来自含有成熟子房的种子;
子房衍生的果实通常被称为植物果实。
植物果实的例子有桃子、西红柿和拟南芥角果。
然而,果实也可以从各种非子房组织发育而来,在这些情况下,它们被称为附果(或假果)。
草莓就是附果的一个例子。草莓的肉质部分实际上是子房的托花,而真正的果实是嵌在该组织中的干燥瘦果。
果实是种子传播单位,可根据多种特征和各种形式进行分组。 番茄、香蕉和葡萄在植物学上被定义为浆果,其中种子嵌在肉质块中,而桃、李和杏被归类为核果,其中种子被包裹在石质内果皮中。 苹果和梨是仁果,其中可食用的组织来自一种称为托杯的附属结构,即萼片、花瓣和有时雄蕊的融合基部。水果也可以定义为简单的,具有成熟的单个或复合子房,如榛子、拟南芥和番茄。或者,它们可能是聚合的,其中花具有多个不连接在一起的心皮,如覆盆子。最后,它们可能是多花的,其中果实由一簇花形成,每朵花产生一个果实,如菠萝。图 21.30 显示了肉质和干果类型的一些示例。值得注意的是,即使在一个植物科中,也可以发现各种各样的果实类型,包括肉质果实,如浆果、梨果和核果,以及干果,如瘦果、蒴果和蓇葖果。果实类型的这种发育可塑性可能反映了种子保护和传播方式的快速进化适应。植物激素生长素和赤霉酸 (GA) 调节坐果和单性结实。在大多数被子植物中,如果未受精,花器官就会衰老和死亡。将花组织转变为正在生长的果实的发育转换取决于柱头的授粉或胚珠的受精。这种发育转换也称为坐果。这种坐果诱导的机制在进化上是保守的,并且已在拟南芥中进行了研究(参见 WEB 主题 21.16)。根据其成分和水分含量,它们可以是干的也可以是肉质的。一些干果,例如大豆豆荚,会裂开以释放种子,因此会开裂。其他干果,如枫树的翅果和蒲公英的扁果,不经历这个过程,并且不开裂。我们最熟悉的肉质果实不开裂,出现在树莓花托(小果)树莓果实托杯梨果实图 21.30 三种水果及其花:豌豆、树莓和梨。 21_Taiz7e-Ch21.indd 656
4/29/22 10:27 AM
有性生殖:从配子到果实 657
仅 1 个瘦果受精
所有瘦果受精
没有瘦果受精
没有瘦果受精 + 生长素
来自 R. Aloni。2021. 维管分化和植物激素。Springer Nature,Cham,瑞士,第 174 页。由 R. Aloni 提供
图 21.31 Nitsch 1950 年对草莓果实发育的实验。(A) 从左到右:通过去除除单个瘦果以外的所有瘦果而产生的小果肉;完全受精和增大的果实;由于去除了所有瘦果而未能发育出果肉的果实;以及由于外源施用生长素而仍然扩大形成果肉的无瘦果果实。 (B) 选择性去除草莓花中的大部分受精子房导致由两个剩余的瘦果(黑色箭头)诱导的两个独立的微型“肉质红色果实”的发育。
(C) 聚集在诱导瘦果(白色和黑色箭头)下方的五个独立的“微小红色果实”。
TZ7E 21.31
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-25-22
番茄、草莓和其他被子植物。从历史上看,草莓一直是研究果实结实的模型。
草莓果实由一个花托组成,其表面散布着大约 200 个含有种子的子房(瘦果),这使得瘦果(真正的果实)易于进行实验操作。1950 年,Nitsch 证明,去除瘦果会阻止花托发育成果实。然而,在花托上施用生长素可以替代瘦果并刺激花托增大(图 21.31)。这个简单的实验表明,瘦果是刺激花托发育的生长素的来源。这次和后来的实验表明,种子在成功受精后会产生植物激素生长素和 GA,并且这些植物激素的产生或外源应用是促进果实结实和随后果实增大所必需的。调节坐果的分子机制主要在拟南芥和番茄中进行研究,它们拥有丰富的分子遗传工具。在番茄和茄子中,转基因植物中生长素生物合成基因 iaaM 或生长素受体基因生长素抗性运输抑制剂 1 (TIR1) 的过度表达足以诱导无籽果实的发育。这种不依赖受精的果实被称为单性结实果实(图 21.32)。编码生长素反应抑制剂(例如生长素反应因子 (ARF))的基因突变也会导致单性结实。例如,拟南芥 arf8 突变体可以在没有受精的情况下发育出细长的角果。在番茄中,ARF7、ARF8 或 IAA9 的转基因敲除导致单性结实(见图 21.32),表明这三个基因可能在不产生生长素时正常抑制结实。
B. 爱尔兰(USDA-ARS)分类学参考集练习
图 21.32 单性结实pic 果实与受精果实的比较。 (A) 野生有籽香蕉 (Musa
acuminata banksia) 的果实。 (B) 驯化的单性结实香蕉果实。 (C) 受精诱导的野生型番茄果实‘Monalbo’品种。 (D) 单性结实的‘Monalbo’果实
来自 M. Goetz 等人。2007 年。植物生理学。145: 351–366。CC BY 4.0
含有异常 arf8 突变转基因。 (E) 将‘Monalbo’野生型果实切成两半;子房充满了果肉和种子。 (F) 将单性结实的‘Monalbo’果实切成两半,以显示无籽的内果皮。
21_Taiz7e-Ch21.indd 657
4/29/22 10:27 AM
658 第 21 章
类似地,DELLA 蛋白抑制 GA 反应。当 GA 产生时,GA–GID1(GIBBERELLIN INSEN
SITIVE DWARF 1)受体复合物靶向 DELLA 蛋白进行蛋白酶体介导的降解,以激活下游过程,包括坐果。在拟南芥中,五重 della 突变体表现出强烈的单性结实。携带 DELLA 点突变的番茄 procera 突变体和沉默 DELLA 的转基因番茄植物也会发育出单性结实果实。有效的受精或授粉通常对果实发育至关重要。诱导单性结实有可能提高果实产量,特别是当授粉和受精受到不利环境条件或缺乏传粉者的负面影响时。单性结实还可以通过生产供人类食用的无籽果实来提高果实质量。对单性结实分子遗传机制的研究正在揭示基因编辑和工程的候选靶基因,以便在不使用激素的情况下生产单性结实果实。特定的转录因子调节开裂区的发育。成熟后,开裂的果实会自发打开以释放种子。拟南芥干燥的开裂果实是研究果实开裂的模型。在拟南芥中,雌蕊来自花朵中心两个心皮的融合,统称为雌蕊。拟南芥雌蕊由两个子房壁或果皮(也称为瓣膜)、一个中央
瓣膜、一个隔膜和瓣膜边缘组成(图 21.33A)。
受精后,瓣膜边缘分化为
来自 G. B. Seymour 等人,2013 年。Annu. Rev. Plant Biol. 64: 219–241
开裂区
分离
开裂区
分离
图 21.33 开裂区的结构和调节。(A) 拟南芥雌蕊的假彩色扫描电子显微照片,显示柱头、花柱、瓣膜、
瓣膜和瓣膜边缘。 (B) 雌蕊子房区横切面图,显示隔膜和种子以及开裂区的两层。内果皮层 b 位于内表面表皮层的内部,木质化并有助于荚果破碎的张力机制。 (C) 拟南芥开裂区 (DZ) 的横截面图。分离层和木质化层用不同的颜色表示。 (D) 调节开裂区形成的转录因子网络摘要。四种主要转录因子在瓣膜边缘和直接开裂区形成处表达。 SHATTERPROOF1 和 SHATTERPROOF2 (SHP1,2) 冗余上调 INDEHISCENT (IND) 和 ALCATRAZ (ALC)。 shp 和 ind 突变体的果实缺乏木质化层和分离层,完全不开裂,而 alc 突变体的分离层仅有缺陷。另外两个转录因子 FRUITFULL (FUL) 和 REPLUMLESS (RPL) 分别在裂片和裂片中起作用,将开裂区基因的表达限制在裂片边缘。此外,FUL(在裂片中)激活 miR172,它是 APETALA2 (AP2) 的阻遏物,可抑制其在开裂区的 SHP。 (B 源自 J. R. Dinneny 和 M. F.
Yanofsky。2004 年。BioEssays 27:42–49;C 和 D 源自 P. Ballester
和 C. Ferrándiz。2017 年。Curr. Opin. Plant Biol. 35:68–75。)
4/29/22 10:27 AM
有性生殖:从配子到果实 659
开裂区由木质化层和分离层组成(图 21.33B 和 C)。分离层包含由细胞外基质弱结合在一起的小细胞;成熟时,木质化层和相邻组织中的弹簧状张力会沿着分离层裂开果实,导致瓣膜在荚果破碎过程中与果肉分离。
在拟南芥中,裂区形态发生和分化受在裂片边缘表达的四种转录因子调控(图 21.33D)。两个 MADS 盒基因 SHATTERPROOF1 (SHP1)和 SHP2 冗余地激活两个碱性螺旋-环-螺旋 (bHLH) 转录因子基因 IN DEHISCENT (IND) 和 ALCATRAZ (ALC)。IND 和 ALC 分别促进木质化层和分离层的形成。由于 FRUITFULL (FUL) 和 REPLUMLESS (RPL) 分别在瓣膜和瓣膜中起作用,这四个基因的表达被限制在开裂区(见图 21.33D)。花同源基因 APETALA2 (AP2) 也通过抑制开裂区转录因子 SHP 和 IND 以及瓣膜因子 RPL 来限制开裂区和瓣膜的扩张。同时,FUL 通过激活 miR172 来阻止 AP2 在瓣膜中的表达,miR172 在转录后负向调节 AP2。NAC 次级壁增厚促进因子 1 (NST1) 和 NST3 都是 NAC 转录因子,它们作用于 IND 下游以调节木质素和纤维素合成基因。在豆科植物(例如大豆)和油菜籽等种子作物中,果实不开裂(抗荚果裂性)是防止产量大幅下降的关键农艺性状。大豆和油菜籽品种已开展了抗荚果裂性的定量遗传学方法和形态学表征。在大豆中,NAC 转录因子(由刘忠池提供)SHATTERING1-5(SHAT1-5)通过促进位于缝合线附近瓣膜边缘的纤维帽细胞过度木质化来增强抗荚果裂性,从而防止荚果分裂。番茄是研究肉质果实发育的重要模型系统。肉质果实的果皮通常分为三层:外果皮(皮)、中果皮(中间层)和内果皮(最内层)(图 21.34)。果实柔软的可食用部分通常是中果皮。在桃子、开心果和其他核果中,硬化的内果皮被称为果核或果核。果核为种子提供了物理屏障,以保护种子免受病原体和食草动物的侵害。对果核发育过程中基因表达的分析表明,在桃子果核和拟南芥果皮的木质化过程中会诱导类似的调控基因。我们对肉质果实发育的了解大部分来自对番茄 (Solanum lycopersicum) 的研究,番茄是茄科 (Sola
naceae) 的一员 (图 21.35A)。番茄的果实和拟南芥一样,是由心皮融合而成,种子附着在胎座上。然而,与拟南芥果实不同,番茄果实不开裂,心皮保持完全融合。在肉质果实中,细胞分裂通常会伴随大量细胞扩张 (图 21.35B)。在某些番茄品种中,果皮细胞直径可能达到 0.5 毫米。大约 30 个数量性状基因座 (QTL) 已被证明可控制番茄果实大小,并且这些 QTL 的几个基因已被克隆。特定基因座 (Fw2) 编码植物特异性和果实特异性蛋白质,该蛋白质调节果实中的细胞分裂,因此影响果实大小。另外两个基因座 FASCIATED 和 LOCULE NUMBER 分别是 CLV3 和 WUS 的番茄同源物,控制子房数量和果实大小。
图 21.34 肉质果实组织分化示例。
21_Taiz7e-Ch21.indd 659
(A) 正在发育的覆盆子小核果的横截面。增厚的内果皮(核)中的木质素被染成红色。(B) 桃子果实的图画,展示了内果皮内的三个组织层和一颗种子。
(B 为刘忠池绘制。)
2022 年 4 月 29 日上午 10:27
660 第 21 章
现代番茄的驯化涉及果实重量、形状和颜色以及植物结构的显着变化。 控制这些特征的基因的识别,加上 CRISPR-Cas9 技术的出现,使得直接从其野生近缘种 Solanum pimpinellifolium 进行番茄“驯化”成为可能。 S. pimpinellifolium 中的四到六个基因座,包括 SELF-PRUNING、FAS CIATED、Fw2.2 和 OVATE,被同时编辑以改善开花时间、增加果实大小和形状、优化枝条结构和增加果实番茄红素积累,同时保留野生物种的多基因抗病和耐盐性状。
如此快速的基于 CRISPR-Cas9 的野生亲属性状改良预示着设计师水果可能很快就会出现在我们的水果篮中。
肉质果实经历成熟
细胞分裂
细胞扩张
花后天数
来自 G. B. Seymour 等人。
2013. Annu. Rev. Plant Biol.
64: 219–241
图 21.35 番茄果实生长。 (A) 微型番茄发育阶段的照片。 (B) 开花后 2、4、8 和 24 天番茄果皮横截面的光学显微镜图像。
肉质果实的成熟是指使它们具有吸引力(对人类和其他动物)并可供食用的变化。 这些变化通常包括颜色发展、软化、淀粉水解、糖积累、产生香气化合物以及有机酸和酚类化合物,包括单宁。干果不会经历真正的成熟过程,许多控制干果开裂的相同基因家族似乎已被招募到肉质果实成熟的新功能中。由于水果在农业中的重要性及其健康益处,绝大多数关于水果成熟的研究都集中在可食用水果上。番茄是研究水果成熟的既定模型,因为它已被证明非常适合成熟机制的生化、分子和遗传研究。
TZ7E 21.35
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
成熟涉及水果颜色的变化
水果从绿色成熟到各种颜色,包括红色、橙色、黄色、紫色和蓝色。所涉及的色素不仅影响水果的视觉吸引力,还影响其味道和香气,并且已知对人类有健康益处。水果通常含有多种色素,包括绿色叶绿素;黄色、橙色和红色类胡萝卜素;红色、蓝色和紫色花青素;以及黄色类黄酮。成熟开始时绿色色素的损失是由于叶绿素的降解和叶绿体转化为有色体,而有色体是类胡萝卜素积累的场所(见第 1 章)。类胡萝卜素是番茄果实呈红色的原因。在番茄成熟过程中,类胡萝卜素的浓度会增加 10 到 14 倍,主要是由于深红色色素番茄红素的积累。果实成熟涉及类胡萝卜素的活性生物合成,其化学前体在质体中合成。第一个关键步骤是通过酶类植物红素合酶形成无色分子植物红素。在番茄中,植物红素随后通过一系列进一步的反应转化为红色色素番茄红素。转基因番茄实验表明,沉默植物红素合酶基因可阻止番茄红素的形成(图 21.36)。
花青素是造成某些浆果呈蓝色和紫色以及草莓呈红色的色素(图 21.37)。花青素是通过苯丙素途径产生的;也就是说,它们来源于氨基酸苯丙氨酸。苯丙素是植物中一些最重要的次生代谢产物。它们不仅影响了水果特有的颜色和风味,还会导致一些不良特性,例如通过多酚氧化酶对酚类化合物进行酶促氧化,导致水果组织褐变。
© brozova/istock
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 660
有性生殖:从配子到果实 661
来自 R. G. Fray 和 D. Grierson。1993 年。
Plant Mol. Biol. 22: 589–602
图 21.36 番茄红素合酶在番茄果皮中番茄红素的产生中发挥作用。左边的番茄是野生型红色成熟果实。右边的番茄的八氢番茄红素合酶基因表达水平降低,因此无法积累红色色素番茄红素。
果实软化涉及许多细胞壁降解酶的协同作用
TZ7E 21.36
果实软化涉及果实细胞壁的变化。在大多数肉质果实中,细胞壁由半刚性的纤维素微纤维复合物组成 - 被认为由木葡聚糖网络束缚 - 嵌入凝胶状果胶基质中。在番茄中,超过 50 个与细胞壁结构相关的基因在成熟过程中表现出表达变化,表明在成熟过程中与细胞壁重塑相关的一系列高度复杂的事件。
转基因植物实验表明,没有一种细胞壁降解酶可以解释番茄或其他水果软化的所有方面。看来,质地变化是由一系列细胞壁降解酶的协同作用引起的,而一系列与质地相关的基因赋予了不同水果独特的融化、酥脆或粉状质地。然而,即使在番茄中,每种酶对水果质地的确切贡献仍然知之甚少。影响水分流失的水果角质层变化也会影响质地和保质期。味道和风味反映了酸、糖、香气和其他化合物的变化。图片由刘忠池提供。图 21.37 水果成熟过程中色素形成的例子。 (A) 蓝莓在成熟过程中积累了十几种不同的花青素,包括锦葵花素、飞燕草素、矮牵牛素、矢车菊素和芍药素糖苷,这些糖苷赋予蓝莓深紫色。 (B) 以天竺葵素为基础的花青素使草莓果实呈现红色。
人类食用的大多数肉质水果都会发生变化使它们在成熟时特别可口的化学变化。这些化学变化包括糖和酸的变化、香气化合物的释放以及难吃代谢物的减少。人类选择更可口的水果的一个例子是选择黄瓜以抵抗苦味。野生黄瓜产生葫芦素,三萜类化合物,赋予食草动物驱赶的苦味。两种 bHLH 转录因子 BL(苦叶)和 BT(苦果)分别促进叶子和果实中的葫芦素 C (CuC) 生物合成;它们调节苦味 (Bi) 的表达,Bi 编码葫芦二烯醇合酶,这是 CuC 生物合成的第一步。栽培的无苦味黄瓜品种被发现具有 Bi 或 Bt 突变。 Bi 的缺失会导致整株植物失去苦味,而减少 Bt 表达的 DNA 变体只会消除果实中的苦味。在无苦味黄瓜中发现的 Bi 和 Bt 的 DNA 变体揭示了人类在驯化过程中对这些基因的选择。在许多水果中,淀粉在成熟开始时转化为葡萄糖和果糖,柠檬酸和苹果酸也非常丰富。然而,虽然糖和酸对味道至关重要,但挥发性物质才是真正决定水果独特风味的物质。风味挥发性物质来自多种化合物。一些最详细的研究是在番茄中进行的。他们表明,在番茄产生的 400 多种挥发性物质中,只有少数对风味有积极影响。番茄中最重要的风味挥发物
来自脂肪酸的分解代谢,例如亚油酸(己醛)和亚麻酸(顺式-3-己烯醛、顺式-3-己烯醇、反式-2-己烯醛)通过脂氧合酶活性。
其他重要的挥发物,包括 2- 和 3-甲基丁醛、3-甲基丁醇、
苯乙醛、2-苯基乙醇和
水杨酸甲酯,来自
必需氨基酸亮氨酸、异亮氨酸和苯丙氨酸。第三类挥发物是脱辅基类胡萝卜素,
它们是通过类胡萝卜素的氧化裂解而获得的。
脱辅基类胡萝卜素,例如
β-大马酮,在番茄、
苹果和葡萄中很重要。
挥发性物质的产生与成熟过程密切相关,但这些事件的调控机制尚不明确。它可能由一些在成熟过程中表达发生改变的转录因子控制。乙烯与成熟之间的因果关系在转基因和突变番茄中得到证实。乙烯长期以来被认为是一种可以加速许多可食用水果成熟的激素。然而,乙烯是水果成熟所必需的,这一明确证据是通过实验提供的,在这些实验中,通过抑制 ACC 合酶 (ACS) 或 ACC 氧化酶 (ACO) 的表达来阻断乙烯的生物合成。 ACS 和 ACO 分别是乙烯合成倒数第二步和最后一步所涉及的酶(见第 4 章)。该途径中的这两个步骤通常受到严格调控。使用反义 RNA 构建体沉默编码这两种酶的基因可抑制转基因番茄的成熟(图 21.38)。外源乙烯可恢复转基因番茄果实的正常成熟。番茄永不成熟突变的分析进一步证明了果实成熟需要乙烯。顾名思义,这种突变完全阻止了番茄果实的成熟。(A)ACC 合酶分子分析表明,永不成熟表型是由乙烯受体突变引起的,这种突变使受体无法结合乙烯。这些结果,加上抑制乙烯生物合成会阻碍成熟的论证,为乙烯在果实成熟中的作用提供了明确的证据。
除了乙烯之外,其他植物激素在控制成熟方面的作用还不太清楚,尽管已知生长素、脱落酸和赤霉素对这一重要的发育过程有影响。
跃变型和非跃变型水果对乙烯的反应不同
肉质水果传统上被分为两类,其定义是在成熟开始时是否存在称为跃变型的特征呼吸上升。跃变型水果表现出这种呼吸增加,并且在呼吸上升之前或同时出现乙烯产量激增(图 21.39)。苹果、香蕉、鳄梨和番茄是跃变型水果的例子。相反,柑橘类水果、草莓和葡萄等水果的呼吸作用和乙烯生成变化并不大,因此被称为非跃变型水果。
(B)ACC 氧化酶
空气 +C2H4摘自 P. Oe ler 等人,1991 年。Science 254:437–439
图 21.38 ACC 合酶 (A) 和 ACC 氧化酶 (B) 的反义沉默可抑制成熟和衰老
(C)。(A) 表达 ACS2 (ACC SYNTHASE2) 反义基因的果实,以及对照(野生型)。请注意,在空气中,反义果实不会成熟,但在 70 天后会衰老(黄色);通过添加外部乙烯 (C2H4) 可以恢复成熟。 (B) ACO1 (ACC OXIDASE) 反义基因仅抑制乙烯合成约 95%:果实成熟,但过熟和变质大大减少。 (C) 此外,与非转基因植物(左)相比,ACO1 反义植物(右)的叶片衰老延迟。
B 和 C 来自 D. Grierson。2013。在《果实成熟的分子生物学和生物化学》中。Seymour,G. B. 等人(编辑),第 43-73 页。Wiley-Blackwe l:纽约
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 662
有性生殖:从配子到果实 663
细胞分裂
相对变化
细胞扩张
开花后天数
乙烯和
呼吸
类胡萝卜素
图 21.39 番茄果实的生长发育与乙烯和成熟的影响有关。跃变型果实表现出呼吸作用和乙烯产量的典型增加,这标志着成熟的开始。(J. J. Giovannoni 于 2004 年出版的《植物细胞》第 16 卷:S170–S180 页)
在具有跃变型果实的植物中,乙烯生产系统有两种,具体取决于发育阶段:
● 在系统 1 中,乙烯在未成熟的跃变型果实中起作用,通过负反馈抑制其自身的生物合成。
● 在系统 2 中,乙烯在成熟的跃变型果实和某些物种的衰老花瓣中发生,乙烯刺激其自身的生物合成。
TZ7E 21.39
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-1-22
系统 2 中乙烯生物合成的正反馈回路确保成熟开始后整个果实均匀成熟。
当成熟的跃变型果实用乙烯处理时,跃变期的开始和与成熟相关的变化会加速。 相反,当未成熟的跃变型果实用乙烯处理时,呼吸速率会随着乙烯浓度的增加而逐渐增加,但这种处理不会触发内源乙烯的产生或诱导成熟。 对非跃变型果实(如柑橘、草莓和葡萄)进行乙烯处理不会导致呼吸增加,并且不是成熟所必需的。然而,成熟抑制剂可以改变某些物种的成熟特征,例如柑橘的颜色增强。虽然跃变型和非跃变型水果之间的区别是一种有用的概括,但一些非跃变型水果也可能对乙烯作出反应;例如,柑橘类水果对外源乙烯的反应是脱绿。事实上,跃变型和非跃变型水果之间的区别可能没有以前想象的那么明显,有些物种根据品种的不同表现出不同的行为。例如,甜瓜(Cucumis melo)可以是跃变型或非跃变型,具体取决于品种。人们对非跃变型水果成熟过程的分子控制知之甚少。草莓长期以来一直被用作研究非跃变型果实成熟的模型系统。越来越多的证据表明,植物激素脱落酸和蔗糖协同作用,促进草莓果实成熟。相反,生长素会抑制草莓果实成熟,尽管我们之前看到,生长素最初是果实结实和果实增大所必需的。成熟过程受转录调控。无色不成熟 David McIntyre 21_Taiz7e-Ch21.indd 663 G. B. Seymour 提供,诺丁汉大学 图 21.40 在番茄突变体成熟抑制剂 (rin) 和无色不成熟 (Cnr) 中,突变会阻止正常成熟。番茄中几种罕见的自发单基因突变体表现出异常成熟或完全取消这一过程。它们包括成熟抑制剂 (rin)、不成熟 (nor)(未显示)和无色不成熟 (Cnr)(图 21.40)。rin 基因座编码一种称为 MADS-RIN 的 SEPALLATA 类 MADS 盒转录因子,该因子在成熟开始时被诱导。nor 基因座编码 NAC 转录因子 NAC-NOR,Cnr 基因座编码 SQUA MOSA 启动子结合蛋白样 (SPL) 家族转录因子 SPL-CNR。这三个突变体缺乏成熟表明这些基因在控制番茄成熟方面发挥着重要作用。 MADS-RIN 与 ACC 合酶基因的启动子相互作用,表明 MADS-RIN 调节乙烯生物合成(见第 20 章)。MADS-RIN 还与许多成熟相关基因的调控区结合,指导t
ly 控制它们的表达(图 21.41)。这些基因包括参与细胞壁代谢、类胡萝卜素形成和香气化合物生物合成的基因。
4/29/22 10:27 AM
664 第 21 章
根据 G. B. Seymour 等人 2013 年。Annu. Rev. Plant Biol.
64: 219–241;图片由 Don Grierson 和 Kevin Davies 提供
NOR CNR RIN
* 在干裂果实中也发现直系同源物的基因
图 21.41 番茄成熟的主要已知调节因子。
带有虚线轮廓的蓝色矩形是转录因子;红色标签是在干裂果实中也发现直系同源物的基因。下游效应子以白色框显示。 RIN 与其他基因之间的实线表示激活,而虚线表示可能激活。AP2 和 CNR 之间的红色虚线表示抑制。(G. B. Seymour 等人,2003 年。Annu. Rev. Plant Biol. 64: 219–241 之后。)
TZ7E 21.41
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
半个世纪前发现的 rin 突变是由 MADS-RIN 与其邻近基因 MACROCALYX (MC)(也是 MADS 盒基因)之间的缺失引起的。最近发现,由此产生的融合蛋白是一种获得功能的抑制蛋白,而不是之前认为的有缺陷的激活蛋白。
采用 CRISPR-CAS9 产生真正的 RIN 敲除。值得注意的是,产生的 RIN-KO 突变体仍然表现出与成熟相关的过程,从乙烯产生到番茄红素积累,尽管水平有所降低。这一结果表明,RIN 在番茄成熟中的作用可能需要重新评估。自从克隆出 rin、nor 和 Cnr 突变背后的基因以来,已经描述了大量编码成熟所需转录因子的其他基因。这些基因参与了调控网络,下游效应子促进乙烯生物合成和与成熟相关的生化变化(见图 21.41)。研究成熟的分子机制可以有商业应用
阐明乙烯在跃变型果实成熟中的作用已导致许多实际应用,旨在均匀成熟或延迟成熟。例如,香蕉串在它们仍然绿色和坚硬时被采摘,这有助于它们在从中美洲和南美洲的田野到世界各地的最终目的地的旅途中存活下来。将未成熟的果实串从串中切下,用杀菌剂处理,装进纸箱,然后运往海外。到达目的地后,将香蕉放置在恒温室中,并用少量乙烯气体处理以开始成熟。这反映了自然成熟过程,但确保了不同成熟阶段的水果将同时开始成熟,使其更容易上市。对于苹果等水果,可通过受控气氛(即约 2.5% 氧气和 2.5% 二氧化碳)储存和冷藏来延迟成熟,从而延长作物的上市期。在番茄的优良品种中,rin 突变被广泛用于杂合形式,以减缓成熟速度并延长保质期。使用 rin 突变体的一个主要缺点是它会延迟成熟的所有方面,因此水果的风味、香气和其他与质量相关的化合物通常水平不理想。更有效的方法是针对单个成熟过程,例如减缓软化以延长保质期,而不会对颜色和风味产生不利影响。随着番茄基因组序列的获取,识别控制水果品质各个方面的复杂性状背后的基因变得更加容易,这一目标正在成为现实。还可以控制水果的营养质量。例如,花青素和类胡萝卜素一样,被认为可以预防心脏病和某些癌症,因为它们是强抗氧化剂,可以清除过量的有害 ROS。水果中的花青素水平可以通过转基因方法进行控制,甚至可以在番茄果肉中引入高浓度的这些化合物,而这些化合物通常不会出现(图 21.42)。对水果发育其他方面(例如挥发性物质的产生)的分子决定因素的深入了解,可能会提供其他改善水果质量的机会。
图 21.42 可以通过过度表达控制金鱼草(Antirrhinum)中这些化合物生物合成的转录因子来诱导番茄中的花青素产生。
感谢 Andy Davis、John Innes Centre
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 664
有性生殖:从配子到果实 665
植物表现出世代交替,其中二倍体
往往占主导地位,但单倍体产生配子。
通过以下方式鼓励遗传多样性异交是植物的一大优势,因为风或昆虫等媒介可以促进异交,而近交则通过植物中的主动预防机制而最小化。新的二倍体世代在种子或果实中发育,成熟后对传播种子的媒介具有吸引力。
21.1 雄性和雌性配子体世代的发展
■ 植物经历二倍体和单倍体世代以产生配子并繁殖(图 21.1)。
■ 二倍体使个体能够掩盖有害的隐性等位基因,并使种群表现出更大的遗传多样性。
21.2 雄蕊中雄配子的形成
■ 花粉形成分为两个阶段:首先是小孢子发生,然后是小配子发生(图 21.3)。
■ 在花粉室中,二倍体花粉母细胞减数分裂产生小孢子,小孢子被营养绒毡层包围(图 21.2、21.3)。
■ 花粉细胞壁复杂,有多层,用于储存营养和散播花粉(图 21.4、21.5)。
21.3 胚珠中雌配子体的发育
■ 卵子在雌配子体(胚囊)中首先通过大孢子发生形成,然后通过大配子体发生形成(图 21.7、21.8)。
■ 大多数被子植物表现出蓼型大配子体发育,其中二倍体母细胞的减数分裂产生四个未成熟的单倍体大配子体,其中只有一个经历大配子体发生。
■ 巨配子发生始于三次有丝分裂,没有细胞质分裂,然后是细胞分化(图 21.9)。
21.4 开花植物的授粉和受精
■ 花粉被送到柱头后,精子细胞通过新长出的花粉管到达雌配子体(图 20.10、21.11)。
■ 除非花粉和柱头之间有识别,否则花粉管不会形成(图 21.11)。
■ 花粉管通过尖端生长而生长(图 21.12–21.14)。
■ 尖端聚焦离子浓度梯度和 GTPase 开关对于控制花粉管细胞扩张的极性至关重要(图 21.15)。
■ 花粉管生长的路径由雌蕊和大配子体的物理和化学信号决定。
■ 一旦花粉管到达胚珠,就会释放出两个精子,使卵子和中央细胞受精(图 21.17)。
21.5 自交与异交
■ 雌雄同株和雌雄同株物种的异交由雌雄异体和异花柱保证(图 21.18)。
■ 细胞质雄性不育减少了自花授粉。
■ 自交不亲和性 (SI) 在生物化学上阻止了被子植物的自花授粉(图 21.19)。
■ 孢子体的 SI 反应需要表达两个高度可变的 S 位点基因,而配子体的 SI 则由细胞毒性 S-RNases 和 F-box 蛋白介导(图 21.20、21.21)。
21.6 无融合生殖:无性生殖
■无融合生殖,即二倍体细胞的克隆生殖,
可能有助于多倍体物种的适应性。
■能够诱导无融合生殖将减少农作物杂种活力的丧失。
21.7 胚乳发育
■受精后,为胚胎提供营养的二倍体胚乳变成多核,使其成为多核细胞(图 21.24、21.25)。
■ 拟南芥中多核胚乳的细胞化从珠孔区向合点区进行,而谷类胚乳的细胞化向心进行(图 21.25,
■ 胚乳发育主要受母体表达基因(MEG)控制,而不是受母体表达基因控制。
21.8 种皮发育
■ 种皮来自母体珠被,但其发育受胚乳调控(图 21.28)。
21.9 种子成熟和耐干燥性
■ 种子灌浆和耐干燥性的获得在大多数物种中重叠(图 21.29)。
■ LEA 蛋白有助于耐干燥性的获得,它与非还原糖形成氢键,使胚胎细胞能够
获得玻璃状状态,使其比单纯脱水的细胞更稳定。
(续)
21_Taiz7e-Ch21.indd 665
4/29/22 10:27 AM
666 第 21 章
摘要(续)
■LEA 蛋白的合成受脱落酸控制。
■不透水的种皮和低温可以增加种子寿命,否则种子寿命在不同物种之间差异很大。
21.10 果实发育和成熟
■果实是种子传播单位,要么来自雌蕊并包含种子,要么来自附属花组织(图 21.30)。
■果实起始是由胚珠的受精和柱头的授粉引发的。这种发育转换,也称为坐果,可以由生长素和 GA 诱导(图 21.31)。
网络材料
■诱导单性结实(无需受精即可发育果实)可以提高果实的质量和产量(图 21.32)。
■开裂果实通过荚果破碎释放种子。适当的形态开裂区的同源性和分化依赖于转录因子和 miRNA 网络(图 21.33)。
■ 肉质果实经历成熟,包括颜色变化、高度协调的果实软化和其他变化(图 21.34–21.37)。
■ 酸、糖和挥发物决定了成熟和未成熟肉质果实的味道。
■ 乙烯加速成熟,特别是在跃变型果实中(图 21.38、21.39)。
■ 对成熟过程的机制理解具有商业应用(图 21.42)。
■ 网络主题 21.1 进化有利于植物生命周期中的二倍体 讨论了二倍体相对于单倍体的可能选择优势。
■ WEB 主题 21.2 兰花,授粉欺骗的冠军 几种兰花的花朵已经进化到模仿雌蜂,刺激雄蜂进行假交配。
■ WEB 主题 21.3 果实胎座类型
图中显示了果实中各种胎座类型。
■ WEB 主题 21.4 配子体发育的变化 与蓼型胎座发育的偏差。描述了单孢子、双孢子和四孢子胚囊的特征。
■ WEB 主题 21.5 ANXUR 1 和 2 是尖端生长所需的 FERONIA 类 RLK
具有缺陷的 Anxur 1 和 2 基因的花粉粒在发芽后立即破裂。
■ WEB 主题 21.6 参与花粉管引导的其他信号分子 拟南芥突变体胚珠合成 ACC 缺陷,无法吸引花粉管。
■ WEB 主题 21.7 故障安全机制确保正确受精 各种机制已经进化以确保被子植物受精的稳健性。
■ WEB 主题 21.8 水稻细胞质不育的分子机制 细胞质雄性不育 (CMS) 的分子机制已在“野败”或 CMS-WA 水稻系统中得到阐明。
■ WEB 主题 21.9 罂粟 (Papaver rhoeas) 中 GSI 的分子机制 虽然比茄科、玄参科和蔷薇科中的 GSI 机制更简单,但当转移到拟南芥中时,罂粟 GSI 机制赋予了拟南芥自交不亲和性。
■ WEB 主题 21.10 各种类型的无融合生殖
描述了孢子体和配子体无融合生殖的机制。
■ WEB 主题 21.11 三种胚乳发育类型 胚乳发育分为三个基本类别:核、细胞和
■ WEB 主题 21.12 表观遗传印记的进化 表观遗传印记可能是为了响应植物和动物中类似的选择压力而进化的。
■ WEB 主题 21.13 FIS 蛋白和胚乳发育 胚乳发育在受精后受到 FIS 蛋白的抑制,FIS 蛋白甲基化和去甲基化胚乳中的 DNA 和组蛋白。
■ WEB 主题 21.14 调节糊粉层分化的基因 DEK1 和 CR4 这两个基因与谷物糊粉层分化有关。
■ WEB 主题 21.15 LEA 蛋白在
耐干燥性中的作用 LEA 蛋白的一个子集
与耐干燥性有关
■ WEB 主题 21.16 果实类型和例子
列出了常见的果实类型
和例子。
如需更多学习帮助,请访问 oup.com/he/taiz7e。
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 666
有性生殖:从配子到果实 667
推荐阅读
Angelovici, R., Galili, G., Fernie, A. R., 和 Fait, A. (2010) 种子
干燥:成熟和发芽之间的桥梁。
Trends Plant Sci. 15:201-208。
Batista, R. 和 Köhler, C. (2020) 植物中的基因组印记——重新审视现有模型。Genes Dev. 34:24-36。
Dinneny, J. R. 和 Yanofsky, M. F. (2005) 绘制线条和边界:拟南芥开裂果实的图案化方式。
BioEssays 27:42-49。
Doucet, J.、Lee, H. K. 和 Goring, D. R. (2016) 花粉接受或拒绝:两种途径的故事。Trends Plant Sci.
20:1058-1067。
Gehring, M. (2013) 基因组印记:来自植物的见解。
Annu. Rev. Genet. 47: 187–208。
Hater, F.、Nakel, T. 和 Groß-Hardt, R. (2020) 生殖
多任务处理:雌配子体。Annu. Rev. Plant Biol.
71: 517–546。
Higashiyama, T. 和 Takeuchi, H. (2015) 花粉管引导的机制和关键分子。Annu. Rev. Plant Biol.
66: 393–413。
Johnson, M. A.、Harper, J. F. 和 Palanivelu, R. (2019) 成果丰硕的
旅程:花粉管从发芽到受精的导航。Annu. Rev. Plant Biol.
70: 809–837。
Klee, H. J. 和 Giovannoni, J. J. (2011) 番茄果实成熟和品质属性的遗传学和控制。Annu. Rev Genet.
45: 41–59。
Knapp, S. (2002) 从烟草到番茄:茄科果实多样性的系统发育视角。J. Exp. Bot. 53: 2001–2022。
Knapp, S. 和 Litt, A. (2013) 果实——被子植物的创新。
在《果实成熟的分子生物学和生物化学》中,
G. B. Seymour、G. A. Tucker、M. Poole 和 J. J. Giovannoni 编,Wiley-Blackwell,牛津,英国,第 206 页。
Li, J. 和 Berger, F. (2012) 胚乳:人类的食物和科学发现的素材。新植物学 195:290-305。
Li, J.、Cocker, J. M.、Wright, J.、Webster, M. A.、McMullan, M.、
Dyer, S.、Swarbreck, D.、Caccamo, M.、van Oosterhout, C. 和
Gilmartin, P. M. (2016) 报春花中 S 基因座超基因的遗传结构和进化。自然植物 2:16188。
Li, N., Xu, R., 和 Li, Y. (2019) 植物种子大小控制的分子网络。植物生物学年鉴 70:435–463。
Manning, K., Tor, M., Poole, M., Hong, Y., Thompson, A. J., King,
G. J., Giovannoni, J. J., 和 Seymour, G. B. (2006) 编码 SBP-box 转录因子的基因中自然发生的表观遗传突变抑制了番茄果实成熟。自然遗传学
38:948–952。
McCann, M., 和 Rose, J. (2010) 构建植物细胞壁的蓝图。植物生理学153: 365。
21_Taiz7e-Ch21.indd 667
Michard, E.、Simon, A. A.、Tavares, B.、Wudick, M. M. 和 Feijó,
J.A. (2016) 离子信号传导:花粉管顶端细胞生长和形态发生的关键。植物生理学。
173: 91–111。
Nasrallah, J. B. (2011) 十字花科的自交不亲和性。在《植物遗传学和基因组学:作物和模型》第 9 卷:十字花科的遗传学和基因组学,R. Schmidt 和 I. Bancroft 编辑,Springer,柏林,第 389–412 页。
Rodrigues, J. C. M.、Luo, M.、Berger, F. 和 Koltunow, A. M. G.
(2010) Polycomb 组基因在被子植物有性和无性种子发育中的作用。《性。植物繁殖》
23: 123–133。
Rudall, P. J. (2021) 种子植物胚珠的进化和模式。《生物评论》
96: 943-960。
Seymour, G. B.、Østergaard, L.、Chapman, N. H.、Knapp, S. 和
Martin, C. (2013) 果实发育和成熟。《植物生物学年鉴》
64: 209–241。
番茄基因组联盟。 (2012) 番茄基因组序列为肉质果实进化提供了见解。《自然》485:635-641。
Tonnabel, J., David, P., Janicke, T., Lehner, A., Mollet, J.-C.,
Pannell, J. R., 和 Dufay, M. (2021) 植物交配后性选择的范围。《生态学趋势》36:556-567。
Twell, D. (2010) 雄配子体发育。在:《植物发育生物学——生物技术观点》,第 1 卷,E. C. Pua 和 M. R. Davey 编辑,Springer-Verlag,柏林,
第 225-244 页。
Vrebalov, J.、Ruezinsky, D.、Padmanabhan, V.、White, R.、Medrano,
D.、Drake, R.、Schuch, W. 和 Giovannoni, J. (2002) A MADS
番茄成熟时果实成熟所必需的 box 基因
抑制剂 (rin) 位点。科学 296:343–346。
Wilkinson, J. Q.、Lanahan, M. B.、Yen, H.-C.、Giovannoni, J. J. 和
Klee, H. J. (1995) 信号的乙烯诱导成分
由Never-ripe编码的转导。科学 270:1807–1809。
Yang, W.-C.、Shi, D.-Q. 和 Chen, Y.-H.。 (2010) 女
开花植物安努配子体的发育。 Rev. Plant
Biol. 61: 89–108.
Zhong, S., Fei, Z., Chen, Y.-R., Zheng, Y., Huang, M., Vrebalov, J.,
McQuinn, R., Gapper, N., Liu, B., Xiang, J., et al. (2013) 番茄果实发育的单碱基分辨率甲基化组揭示了与成熟相关的表观基因组修饰。Nat.
Biotechnol. 31: 154–159.
Zhong, S., Liu, M., Wang, Z., Huang, Q., Hou, S., Xu, Y., Ge,
Z., Song, Z., Huang, J., Qiu, X., Shi, Y., Xiao, J., Liu, P., Guo,
Y. L., Dong, J., Dresselhaus, T., Gu, H., and Qu, L. J. (2019)
富含半胱氨酸的肽促进拟南芥种间遗传隔离。Science 364: eaau9564。
4/29/22 10:27 AM
21_Taiz7e-Ch21.indd 668
4/29/22 10:27 AM
胚胎发生:植物结构的起源
陆生植物包括一个名为
胚胎植物的单系群——制造胚胎的植物。它们与水生藻类姐妹的区别在于,它们能够在卵细胞与精子细胞受精后发育出多细胞孢子体。不同植物群中,受精卵(受精卵细胞)的命运差异很大。例如,在苔藓等非维管陆生植物(苔藓植物)中,受精卵经历有丝分裂,产生多细胞二倍体孢子体,其大部分营养依赖于配子体(其附着于配子体)(有关概述,请参阅第 1 章)。苔藓孢子体的细胞分化和发育程度最低,产生相对简单的茎和荚膜,缺乏真正的维管组织。相比之下,在维管植物(气管植物)中,合子分裂产生二倍体孢子体,其独立于产生它的配子体而生活。此外,维管植物孢子体的细胞分化为三种主要组织类型——真皮、地面和维管组织,这些组织进一步分化为各种细胞和组织类型,构成营养和生殖结构的主要器官系统。在种子植物(种子植物,包括裸子植物和被子植物)中,胚胎发生终止于休眠(或静止)种子的形成。苔藓植物和非种子植物的类似休眠阶段是单倍体孢子,它代表了生命周期配子体阶段的开始。鉴于主要研究重点是开花植物,以及种子植物对粮食生产的巨大重要性,我们对种子植物的胚胎发生的了解远远多于非种子植物。因此,本章重点介绍种子植物的胚胎发生,重点是被子植物。然而,应该记住,种子植物的胚胎发生大约在 3.2 亿年前进化,它源自一个更古老的过程,该过程自大约 4.5 亿年前陆生植物起源以来就一直存在。在种子植物中,胚胎发生将单细胞合子转变为成熟种子内包含的复杂多细胞个体。因此,胚胎发生提供了许多发育过程的例子,植物的基本结构就是通过这些过程建立起来的,包括形态的形成(形态发生)、功能性组织结构的形成(器官发生)以及细胞分化以产生解剖学和功能上不同的组织(组织发生)。植物基本结构的一个基本特征是在茎尖和根尖处存在顶端分生组织,这是维持不确定的营养生长模式的关键(见第 18 章)。胚胎的发育还具有复杂的生理变化,使胚胎能够承受长时间的代谢活动减少(休眠),并识别和响应环境信号,这些信号向植物发出恢复生长(发芽)的信号(见第 17 章)。我们的主要重点是被子植物的胚胎发生,被子植物是农业和生态主导性方面最重要的种子植物群。
22.1 单子叶植物和真双子叶植物的胚胎发生
我们首先比较被子植物的两个主要群体,即单子叶植物和真双子叶植物的胚胎发生,分别以玉米(玉米;Zea mays)和拟南芥为代表。接下来,我们考虑指导胚胎复杂生长和分化模式的信号,包括位置依赖性线索的重要性。我们通过讨论将位置依赖性线索转化为有组织的生长模式的分子和遗传机制来结束对植物胚胎发生的调查。可以在 WEB ESSAY 18.1 中找到植物胚胎发生历史的概述。
单子叶植物和真双子叶植物的胚胎发生不同,但也有共同的特征。
解剖学比较揭示了不同种子植物群之间胚胎发生模式的差异,例如单子叶植物和真双子叶植物之间的差异以及非开花裸子植物和开花被子植物之间的差异。被子植物胚胎发生在具有两个子叶(胚叶)的真双子叶植物中比在具有一个子叶的单子叶植物中更可预测。裸子植物的胚胎发生比真双子叶植物或单子叶植物更难以预测,来自同一裸子植物物种的胚胎能够表现出一系列子叶数目。但重要的是,胚胎发生的核心要素在几乎所有种子植物物种中都是共同的,可能反映了共同的发育过程。在开花植物中,拟南芥(真双子叶植物)和玉米(单子叶植物)提供了两种胚胎发生的例子,它们在细节上有所不同,但在主要生长轴的建立方面具有某些基本特征。在这两个物种中,发育和生理事件都遵循相同的顺序。在两者中,组织和器官都以类似的方式建立。然而,单子叶植物和真双子叶植物的胚胎发生之间也存在重大差异。例如,拟南芥的茎尖分生组织在胚胎发生过程中处于非活动状态,而玉米在胚胎发生过程中会形成几片小叶子。此外,虽然拟南芥是一类植物的代表,其中胚胎细胞分裂似乎受到严格控制,并且在个体之间几乎保持不变,但玉米表现出一种表面上不太有序的细胞分裂模式。因此,玉米和拟南芥代表了胚胎发育光谱的两端,从相对复杂和较难预测到相对简单和更可预测。
我们在这里简要描述了玉米胚胎发生,并详细描述了拟南芥胚胎发生,关于后者人们对此了解较多。
玉米胚胎发生 禾本科(Poaceae 或 Gramineae)是一个庞大且几乎无处不在的禾本科,玉米是该科的一员,代表了一类特殊的单子叶植物,根据一种解释,单片子叶似乎在功能上被划分为o 两种结构,盾片和胚芽鞘。盾片是一种吸收器官,在发芽过程中从胚乳中吸收糖分,而胚芽鞘形成管状鞘,保护新生的初生叶免受土壤的机械损伤。产生这些特殊单子叶结构的细胞分裂模式必然比形成大多数真双子叶植物的两个子叶所需的细胞分裂模式更复杂,但更可预测。尽管细胞分裂模式缺乏明显的规律性,但仍可以用六个形态学定义的发育阶段来描述玉米的胚胎发生(图 22.1):1. 合子阶段。此阶段始于单倍体卵子和精子融合形成受精卵(图 22.1 中未显示)(见第 21 章)。受精卵经历极化生长,然后进行不对称横向分裂,形成一个小的顶端细胞和一个细长的基细胞(见图 22.1A)。
2. 球状阶段。在顶端细胞和基细胞形成后,一系列可变的细胞分裂形成一个多层球状胚胎,由胚胎本体和较大的多细胞胚柄组成(见图 22.1B)。
3. 过渡阶段。在早期过渡阶段,胚的内侧出现盾片(相对于未来的种皮)。到后期过渡阶段,未来的茎尖分生组织在胚胎的外侧明显可见,相对于未来的种皮。(图 22.1 中未显示过渡阶段。)
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 670
胚胎发生:植物结构的起源 671
来自 D. Sosso 等人。2012 年。J. Exp. Bot。
63:5843–5857/CC BY-NC 2.0/UK
顶端细胞
球状胚
胚芽鞘
胚芽鞘叶
胚芽鞘
基底细胞
胚根
胚根
胚根
图 22.1 玉米胚胎发生的阶段。(A)合子阶段。 (B) 球状阶段。(C) 胚芽鞘阶段。(D) 叶原基阶段。(E) 成熟阶段。 (过渡阶段,
4. 胚芽鞘阶段。此阶段的标志是形成独特的胚芽鞘、盾片、茎尖分生组织、根尖分生组织、胚根(胚根)和胚根鞘,胚根鞘是覆盖胚根尖端的保护鞘(见图 22.1C)。
5. 叶原基阶段。茎尖分生组织在胚芽鞘内开始长出几片叶子(见图 22.1D)。
6. 成熟阶段。在胚胎发生的最后阶段(见图 22.1E),成熟相关基因的表达先于休眠的开始。
TZ7E 22.01
拟南芥胚胎发生 拟南芥植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
胚胎相对较小,由极少量细胞组成,这是拟南芥所属十字花科(卷心菜科)的共同特征。也许由于这种“极简主义”的胚胎发生方式,个体之间在细胞分裂的模式和时间上几乎没有差异。这种有序的细胞分裂模式使我们能够详细研究胚胎发生过程中发生的事件及其调控。拟南芥的胚胎发生分为五个主要阶段,每个阶段都与胚胎的形状有关:
1. 合子阶段。二倍体生命周期的第一阶段始于单倍体卵子和精子融合形成单细胞合子。与玉米一样,该细胞的极化生长,随后是不对称的横向分裂,产生一个小的顶端细胞和一个细长的基细胞(图 22.2A)。
22_Taiz7e-Ch22.indd 671
球状胚芽鞘阶段与胚芽鞘阶段之间的过渡,未显示。)
玉米胚的纵向切片用过碘酸-希夫试剂染色。
2.球状阶段。顶端细胞经历一系列分裂(图 22.2B-D),产生一个球形的八细胞(八分之一)球状胚,表现出径向对称性(见图 22.2C)。额外的细胞分裂增加了球状胚中的细胞数量(见图 22.2D)并产生了外层,即原表皮,后来成为表皮。在下一个细胞分裂周期中,内细胞再次分裂以产生内维管束和外基本组织前体,从而完成细胞层径向模式的建立。随着球状胚的生长,芽和根分生组织在两端开始。
3. 心脏阶段。当胚胎生长时,未来芽顶端分生组织的两侧发生两个区域的集中细胞分裂,形成两个子叶,使胚胎具有双侧对称性(图 22.2E 和 F)。
4. 鱼雷阶段。细胞伸长和细胞分化过程发生在整个胚胎轴上。子叶近轴组织和远轴组织之间的明显区别变得明显(图 22.2G)。在s
阶段,胚胎弯曲以填充种子腔。
5. 成熟阶段。在胚胎发生结束时,
胚胎和种子失水并在进入休眠状态时变得
代谢不活跃(第 17 章讨论)。储存化合物在成熟阶段在细胞中积累(图 22.2H)。
拟南芥和玉米的胚胎发生比较表明胚胎大小、形状、细胞数量和分裂模式存在差异。尽管存在这些差异,
4/29/22 10:29 AM
672 第 22 章
顶端细胞
基底细胞
图 22.2 拟南芥胚胎发生阶段的特点是细胞分裂的精确模式。
(A) 合子第一次分裂后的单细胞胚胎,
形成顶端细胞和基底细胞。 (B) 两细胞胚胎。
来自 M. A. L. West 和
J. J. Harada。1993. Plant
Cel 5: 1361–1369
茎尖
(C) 八细胞胚胎。(D) 中球状阶段胚胎,已发育出独特的原表层(表面层)。(E) 早期
心形阶段胚胎。(F) 晚期心形阶段胚胎。
(G) 鱼雷阶段胚胎。(H) 成熟胚胎。
出现了几个可以推广到所有种子植物的共同主题。也许其中最基本的与极性有关。从单细胞合子开始,胚胎逐渐沿着两条轴极化:顶端-基轴,位于胚芽和根的尖端之间,以及垂直于顶端-基轴的径向轴,从植物中心向外延伸(图 22.3)。在
TZ7E 22.02
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
顶端-基部
图 22.3 幼苗沿两个轴排列。
在纵向横截面(左)中,顶端-基轴
延伸于胚根和芽的尖端之间。
在横截面(右)中,径向轴从中心延伸到表面,横跨维管组织、基底组织和表皮组织。接下来的章节中,我们将考虑这些轴是如何建立的,并讨论特定的分子过程如何指导它们的发育。
22.2 顶端-基底极性的建立
我们对顶端-基底极性的大部分讨论都集中在拟南芥上,它不仅是分子和遗传研究的有力模型,而且在其胚胎发育的早期阶段也表现出简单且高度定型的细胞分裂。通过观察这种简单模式的变化,我们可以更容易地识别影响胚胎发育的生理和遗传因素。图 22.4 提供了拟南芥最早细胞分裂的图形示意图,为下面的讨论提供了方便的指南。 (有关更简单的藻类合子极性建立的讨论,请参阅
WEB 主题 22.1。)
顶端-基部极性在胚胎发生早期建立
种子植物的一个特征是极性,其中组织和器官排列成高度
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 672
胚胎发生:植物结构的起源 673
极核
胚囊
晚期球状
透镜状
过渡
垂体
子叶
主根
早期球状
晚期心脏
图 22.4 拟南芥胚胎发生过程中的模式形成。一系列连续阶段展示了幼胚中的特定细胞如何形成幼苗特定的解剖学特征。克隆相关的细胞群(可以追溯到共同祖先的细胞)用不同的颜色表示。在合子不对称分裂之后,较小的顶端子细胞分裂形成一个八细胞胚胎,由两层组成,每层四个细胞。上层产生静止中心和中央根冠芽顶端分生组织和大部分侧翼子叶原基。下层产生下胚轴和一些子叶、胚根和根顶端分生组织的上部细胞。基底子细胞产生一列细胞,构成胚柄。胚柄的最上部细胞变成垂体,它是胚胎的一部分。垂体分裂形成静止中心和形成根冠的初始细胞。(根据 T. Laux 等人 2004 年。植物细胞 16:S190–S202。)
TZ7E 22.04
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 3-4-22
沿着从茎顶端分生组织延伸到根顶端分生组织的轴线保持保守顺序。这种顶端-基底轴的早期表现在受精卵本身中,受精卵伸长约三倍,并就其细胞内组成而言发生极化。受精卵的顶端细胞质密集,而基端则含有较大的中央液泡。受精卵分裂时,细胞质密度的差异就会显现出来不对称地产生短的、细胞质致密的顶端细胞和较长的、液泡化的基底细胞(见图 22.1A、22.2A 和 22.4)。
第一次细胞分裂是胚胎发生的关键步骤,因为它决定了植物的极轴。 在许多(但不是全部)开花植物中都观察到了类似的不对称分裂。 在拟南芥中,具有顶端核和基底液泡的合子的极性反映了受精前卵细胞的极性。 直观地,人们可能会由此得出结论,胚胎的极性是从未受精的卵细胞直接遗传的,但事实并非如此。 相反,卵细胞极性在精子细胞受精后会破坏,随后会重新建立。
可使用活体成像研究合子极化
通过对转基因拟南芥株系进行活体成像,研究了合子极化过程,其中某些细胞结构被荧光标记(图 22.5)。极化在受精后不久即可观察到,与合子伸长紧密相关,涉及细胞骨架、细胞核和液泡在细胞两端的不同分区。
合子分裂产生的两个细胞不仅大小不同,而且其后续发育命运也不同。几乎整个胚胎,以及最终的成熟植物,都来自较小的顶端细胞,该细胞首先经历两次纵向分裂,然后经历一组横向分裂(产生与顶端-基底轴成直角的新细胞壁)以产生
4/29/22 10:29 AM
674 第 22 章
胚柄 1 细胞胚胎 受精 顶端-基底 横向 伸长 纺锤体 成膜体
图 22.5 拟南芥早期胚胎发育过程中细胞骨架动力学的活细胞成像。
(A) 拟南芥合子在花的子房中发育的示意图。 (B) 卵细胞(最左边的图像)、受精后不久的受精卵(时间 00:00)以及受精卵发育到第一次分裂的连续阶段的延时荧光显微镜图像系列。微管以绿色荧光标记,周围的胚珠细胞以洋红色自发荧光标记。数字表示从第一帧开始的时间(小时:分钟)。受精后,受精卵收缩,皮质微管变为各向同性(即随机)取向。然后,受精卵在其顶端凸起,形成一圈横向取向的微管。然后,这个凸起会一直生长,直到合子长到最大尺寸。在细胞核(白色箭头)的位置形成一个微管前期带(PPB)(见第 1 章),并发生有丝分裂。(C)插图总结了(B)中的各个阶段。MT,微管;PPB,前期带。(根据 Y. Kimata 等人 2016 年。美国国家科学院院刊 113:14157–14162。)
TZ7E 22.05
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
八细胞(八分之一)球形胚胎(见图 22.1B、22.2C 和 22.4)。
基底细胞的发育潜力更有限。一系列横向分裂产生丝状柄,将胚胎附着在母体植物的维管系统上。只有最上面的分裂产物,即垂体,才会被纳入成熟胚胎。通过进一步的细胞分裂,垂体形成根尖分生组织的重要部分,包括小柱和相关的根冠组织,以及静止中心(见图 22.4),我们在第 18 章中详细讨论过。在组成八分球形胚胎的细胞中,除了位置之外,几乎没有什么可以区分上层和下层细胞的外观。全部八个
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 674
胚胎发生:植物结构的起源 675
周周分裂
顶端-基底
图 22.6 周周和背斜细胞分裂。
周周分裂产生与组织表面平行的新细胞壁,从而有助于建立新的层。背斜分裂产生垂直于组织表面的新细胞壁,从而增加层内的细胞数量。然后细胞周周分裂(新细胞壁平行于组织表面形成)(图 22.6)形成称为原皮层的新细胞层,最终形成表皮。随着胚胎体积的增大,原胚层细胞开始向外分裂(新细胞壁垂直于组织表面形成),以增加这一单细胞厚组织的面积。到早期球状阶段,上层和下层细胞命运之间的明显区别开始显现(见图 22.4):
● 顶端区域源自m 顶端四重细胞形成子叶和茎尖分生组织。
● 中间区域来自基部四重细胞,形成下胚轴(胚茎)、根和根分生组织的顶端区域。
TZ7E 22.06
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 12-27-21
● 垂体来自胚柄最上层细胞,形成根分生组织的其余部分。
从单个顶端细胞进展到具有多个组织层的年轻球形胚胎的有序事件序列需要几次定向细胞分裂。控制这些细胞分裂平面的“规则”是什么?支撑这些分裂平面的细胞机制是什么?对早期拟南芥胚胎形状和分裂平面的分析得出了这样的假设:细胞在使两个子细胞之间新的横壁的表面积最小化的平面上分裂。使用三维显微成像和计算分析对这一假设进行了测试,结果表明,最小表面积规则确实适用于前三轮分裂(1 → 2、2 → 4 和 4 → 8 个细胞)(图 22.7)。然而,在第四轮分裂(8 → 16 个细胞)时,模式突然发生变化。图 22.7 中的顶部图像显示了八细胞拟南芥胚胎中的四个细胞。如果细胞按照最小表面积规则分裂,它们会在
22_Taiz7e-Ch22.indd 675
8 细胞胚胎
径向轴
反斜
16 细胞胚胎
不对称分裂
(偏离
最小表面积)
16 细胞胚胎
默认对称分裂(最小
表面积)
图 22.7 拟南芥胚胎细胞分裂的方向。顶部显示的是八细胞胚胎的四个细胞。每个细胞都可以通过细胞中心对称分裂(反斜),遵循最小
表面积规则并产生两个体积相等的细胞(右下)。或者,在生长素等调控因素的影响下,每个细胞可以不对称分裂(周向分裂),偏离最小表面积规则,并产生外细胞层和内细胞层(左下)。 (S. Yoshida 等人 2014 年。Dev. Cell 29:75–87。)
TZ7E 22.07
Plant Physiology 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio Date 3-4-22
每个细胞中心的背斜面,从而产生两个体积相等的子细胞。 由此产生的假设球状胚胎(图 22.7 中的右下侧)将仅由一层大致相等体积的径向排列的胚胎细胞组成。 然而,这并不是正常的 16 细胞拟南芥胚胎的样子。
相反,八细胞胚胎的细胞在平周方向不对称地(即偏离中心)形成横壁,从而产生由两个不同细胞层组成的 16 细胞胚胎。请注意,在这种情况下,两个子细胞的体积不同,并且违反了横壁的最小表面积规则。不对称分裂产生的子细胞在成熟植物中通常具有不同的发育命运。在这种情况下,外细胞层或原表皮会发育成表皮,而内细胞会形成基底和维管组织。胚胎细胞分裂的前三轮的对称模式遵循最小表面积规则,可以被认为是默认途径。这就提出了一个问题:为什么胚胎在第四轮分裂中偏离了这条
4/29/22 10:29 AM
676 第 22 章
途径。据推测,某种遗传决定的机制介入改变了这种模式。正如我们将在本章后面看到的那样,激素生长素在早期胚胎发生过程中转变为不对称细胞分裂时起着信号分子的作用。(有关更简单的藻类合子极性建立的讨论,请参阅 WEB 主题 22.1。)
22.3 指导胚胎发生的机制
拟南芥早期胚胎发生过程中细胞分裂的可重复模式可能表明,固定的细胞分裂序列对于这一发育阶段至关重要。细胞分裂模式的绝对一致性意味着胚胎内单个细胞的命运在发育的早期就已固定或确定;一旦它们的命运确定,这些细胞就会致力于固定的发展程序。这种依赖于谱系的机制可以比作根据自包含的指令从一组标准部件组装一个结构。
组成型
转座子
GUS 基因(失活)
GUS 基因(活性)
由于转座子的存在而失活
由于转座子的切除,GUS 基因偶尔、随机地激活
早期
转录、转录slation
尽管在动物发育过程中已记录了许多谱系依赖机制的例子,但仅凭这种类型的模型还不足以解释植物胚胎发生的几个一般特征。
首先,假设类似的机制在控制植物物种的胚胎发育方面起作用,谱系依赖机制很难与许多其他植物物种(包括水稻,甚至是拟南芥的近亲)在胚胎发生过程中通常看到的更可变的细胞分裂模式相协调。
其次,即使对于拟南芥,也可以通过使用灵敏的命运映射技术跟踪单个细胞的命运,看到正常胚胎发生过程中细胞分裂行为的一些有限变化(图 22.8)。最后,可以考虑某些拟南芥突变体提供的极端例子,这些突变体具有明显不同的细胞分裂模式,但仍保留形成基本胚胎结构的能力(图 22.9)。植物发育程序似乎在细胞分裂模式变化方面具有一定程度的稳健性。从这个角度来看,或多或少可预测的图 22.8 特定胚胎细胞的命运并非严格确定的。该分析追踪了幼胚中单个细胞的命运。上图显示了一个人工基因,该基因会组成性表达 GUS 报告基因,但被转座子的存在所阻断。随机切除转座子会激活单个细胞中的 GUS 基因表达,为该细胞及其后代提供可遗传的标记。发生这些切除事件的胚胎会产生具有 GUS 表达扇区的幼苗。在下图中,来自此类实验的幼苗根据其 GUS 表达扇区的位置和范围被分为几类(标记为 A-F)。这些扇区均来自幼胚中的单个细胞,与左侧的幼苗图对齐显示。虽然某些类别(例如 E 和 F)中的扇区相似且可能来自胚胎中位置相似的细胞,但它们的端点存在差异。例如,E 类中扇区的顶端与 D 类中某些扇区的底端重叠。其他类别扇区的端点也存在类似的变化。这种变异性与
严格依赖于谱系的细胞命运决定机制不一致
,但更容易通过响应位置依赖性线索反馈的机制来解释。(B. Scheres 等人,1994 年。
发展 120:2475-2487。)
早期胚胎单细胞衍生的扇区
GUS 表达的位置
不同的拟南芥幼苗
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 676
胚胎发生:植物结构的起源 677
野生型拟南芥
纯合 fass 突变体
所有照片来自 J. Traas 等人。
1995. Nature 375: 676–677
拟南芥中观察到的细胞分裂模式可能仅仅反映了其胚胎的小尺寸,这对早期细胞分裂的极性和可能位置设置了物理限制。因此,植物胚胎发生似乎涉及多种机制,包括那些不完全依赖于固定细胞分裂序列的机制。
图 22.9 额外的细胞分裂不会阻止基本径向模式元素的建立。FASS 基因突变的拟南芥植物无法在分裂的任何阶段在细胞中形成前期微管带。携带这种突变的植物在细胞分裂和扩张平面上高度不规则,因此严重变形。然而,它们继续在正确的位置产生可识别的组织和器官。虽然这些突变植物产生的器官和组织非常异常,但放射状的组织模式仍然很明显。(顶部)野生型拟南芥:(A)早期球状阶段胚胎;(B)从顶部看到的幼苗;(C)根的横截面。(底部)与 fass 突变纯合的拟南芥的可比阶段:(D)早期胚胎发生;(E)从顶部看到的突变幼苗;(F)突变根的横截面,显示细胞的随机方向,但组织顺序几乎是野生型的:外表皮层覆盖多细胞皮层,皮层又围绕着维管柱。2. 单个细胞必须具有评估其相对于位置线索的位置的方法。 3. 细胞必须能够以适当的方式对位置提示作出反应。
细胞间信号传导过程在指导位置依赖性发育中起着关键作用
TZ7E 22.09
鉴于胚胎的形态发生可以适应细胞分裂的不同模式,依赖于位置依赖机制的发育过程会阻止我的细胞命运似乎可能发挥重要作用。这种机制将通过调节细胞的行为来发挥作用,这种调节方式反映了细胞在发育胚胎中的位置,而不是它们的谱系(祖先)。这种机制可以解释等效形式如何通过不同的细胞分裂模式产生。这种位置依赖性决定过程可以预期具有三种一般的功能元素:
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
1. 必须有线索来表示发育结构内的独特位置。
22_Taiz7e-Ch22.indd 677
这些基本要求将注意力集中在信号传导过程运作的细胞环境中。信号在空间和时间上的传播如何受到细胞的物理构成及其与周围组织的关系的影响?诸如膜和细胞壁之类的物理特征是否仅仅代表了细胞间通讯的障碍,还是它们是使信号输出能够响应额外输入而受到调节的机制不可或缺的一部分?在下一小节中,我们将考虑几个例子,这些例子说明了遗传定义的信号传导过程如何促进胚胎发育。早期胚胎发育过程中的细胞间通讯可能受胞间连丝的调节。 可能以类似于社会群体中的个体的方式,发育中的胚胎中的单个细胞显示出一系列功能,这些功能可用于在发育过程中启用、限制和转换信息。 4/29/22 10:29 AM
678 第 22 章 早期心脏 晚期心脏 中期鱼雷报告蛋白 中间 GFP 报告蛋白 报告蛋白 M N O P Q R
图 22.10 细胞间蛋白质运动在发育过程中发生变化的潜力。 图像显示不同年龄胚胎中小(B、H、N)、中间(C、I、O)和大(D、J、P)GFP 报告蛋白的分布(早期心脏,A-F;晚期心脏,G-L;中期鱼雷,M-R)。所有
构建体均从 STM 启动子转录,该启动子在胚胎相对较小的区域产生转录本,如原位杂交 (A、G、M) 或与非扩散性 GUS (E、K、Q) 或 ER–GFP 报告基因 (F、L、R) 融合所示。
小蛋白质似乎在胚胎发生的所有阶段都很容易移动 (B、H、N),但较大蛋白质的移动性较低,并且在较老的胚胎中受到更多限制 (C 和
D、I 和 J、O 和 P)。箭头表示胚柄细胞中的细胞核 (C) 和下胚轴中 STM 启动子的异位表达 (L、P–R)。箭头表示根。缩写:
c,子叶;h,下胚轴;r,根。
TZ7E 22.10
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
通信。早期胚胎的一个显着方面是细胞壁对某些大分子类别的细胞间运动的影响相对较小。对完整植物的研究表明,大型人工染料和荧光标记的蛋白质分子可以在整个胚胎中从一个细胞移动到另一个细胞(图 22.10),可能是通过胞间连丝提供的细胞质桥。随着发育的进展,这些分子的运动变得更加尺寸受限和空间受限,这表明胞间连丝调节的信息流对于后期发育阶段变得更加重要,也许可以实现区域化的组织发生模式。矛盾的是,在发育的这些早期阶段,某些类别的相对较小的分子(包括广泛使用的植物激素生长素)的运动似乎受到更多限制。正如我们将看到的,这种受调节的细胞间分子运动在各种发育过程中起着至关重要的作用,包括胚胎轴向结构的建立。突变体分析已经确定了对胚胎组织至关重要的信号传导过程基因。已经分析了各种类型的突变体,以深入了解有助于建立胚胎基本极性的过程。其中许多过程会影响可能有助于信号转导某些方面的蛋白质。拟南芥突变体的遗传分析已经确定了发育可行胚胎所需的基因。图 22.11 中显示的所有胚胎都已停滞并将在图中所示的阶段流产,远早于心脏
来自 I. Kim 等人。2005 年。美国国家科学院院刊 102:11945-11950。© 2005 年美国国家科学院。A、G 和 M 来自 J. A. Long 和 M. K. Barton。1998。发展 125:3027-3035
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 678
胚胎发生:植物结构的起源 679
图 22.11 代表性胚胎致死拟南芥突变体。每个面板显示了胚胎致死突变体的停滞阶段左上角。HSN4 参与组氨酸生物合成。TTN10 参与有丝分裂 DNA 复制起始。EMB3001 有助于蛋白水解途径。
TZ7E 22.11
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
阶段。虽然在这种胚胎致死突变体中观察到的缺陷表明突变基因是胚胎发生的生存力或进展所必需的,但不能断定该基因直接参与调节发育过程。事实上,许多影响发育的突变都是间接的,要么通过改变细胞结构,要么通过修改基本代谢功能所需基因的表达。
通过筛选有缺陷的幼苗,已经分离出几种在胚胎模式形成中起作用的基因。
与胚胎致死突变体不同,幼苗缺陷突变体能够发育成成熟的种子并发芽,这表明基本代谢活动相对完整。然而,这类突变体在发芽并在幼苗阶段进行检查时表现出异常组织。在这些突变体中,正常的顶端-基部模式被破坏,因此缺少茎尖分生组织、根尖分生组织或两者。这些功能丧失突变体中出现的缺陷性质表明,相应的基因是建立正常顶端基部极性所必需的(图 22.12)。这些基因中的几个的克隆使人们对它们的分子功能有了更深入的了解,总结如下。由于我们在此的讨论重点是突变体的形态,因此我们使用其同名突变体的名称来识别每个基因(参见第 3 章中有关基因名称和命名系统的讨论)。
来自 D. Meinke 等人,2008 年。Trends Plant Sci. 13: 483–491
● GURKE (GK)(见图 22.12C),因突变体的形状类似黄瓜而得名,其中子叶和茎尖分生组织减少或缺失,编码乙酰辅酶 A 羧化酶。
由于乙酰辅酶 A 羧化酶是极长链脂肪酸 (VLCFA) 和鞘脂正确合成所必需的,这些分子或它们的衍生物似乎对胚胎顶端部分的正确模式化至关重要。
● MONOPTEROS (MP)(见图 22.12B 和 C)是正常形成根和下胚轴等基部元素以及维管组织所必需的,它编码生长素反应因子 (ARF)。ARF 调节对生长素的反应基因表达,突变体的缺陷可以被认为是由于未能正确响应生长素而引起的。
● FACKEL (FK)(见图 22.12C)最初被认为是下胚轴形成所必需的。
突变体表现出复杂的模式形成缺陷,包括畸形的子叶、短的下胚轴和根,以及通常多个芽和根分生组织。FK 编码一种固醇 C-14 还原酶,表明固醇对于胚胎发生过程中的模式形成至关重要。
● GNOM (GN)(见图 22.12C)编码一种鸟嘌呤核苷酸交换因子 (GEF),该因子在内膜运输中起作用。这种 GEF 是生长素定向运输所必需的,因为它有助于 PIN 生长素流出蛋白在膜中的极性分布。因此,突变对胚胎发育的影响部分是由于生长素无法正确分布。
这一小群突变体突出了特定信号传导过程对胚胎发生的潜在重要性。虽然还不清楚 GK 和 FK 突变如何导致特征性胚胎模式缺陷,但这两个基因编码的蛋白质的预测生化活性与某种形式的脂质介导信号传导的破坏一致。
同样,GN 和 MP 都可以与信号传导过程相关联,两者都以生长素为特征。鉴于
4/29/22 10:29 AM
680 第 22 章
(A) 野生型与 gnom 突变体
(B) 野生型与 monopteros 突变体
来自 U. Mayer 等人。1993。发展 117:149-162
(C) 突变类型示意图
来自 T. Berleth 和 G. Juergens。
1993. 发展 118:575–587
GNOM 基因控制
顶端-基部极性
MONOPTEROS 基因控制
主根的形成
monopteros
图 22.12 从拟南芥幼苗缺陷突变体表型中鉴定出对拟南芥胚胎发生至关重要的基因。此处对比了突变幼苗的发育与同一发育阶段的野生型幼苗的发育。(A)GNOM 基因有助于建立顶端-基部极性。
右侧显示的是 gnom 突变纯合植物。
(B)MONOPTEROS 基因是基部模式形成和
主根形成所必需的。一株单叶枯病突变纯合植物(右侧)具有下胚轴、正常的茎尖分生组织和子叶,但缺乏主根。(C)四个缺失的示意图etion 突变体类型。在每一对中,左侧野生型植物的方框区域在右侧突变体中缺失。 (C 源自 U. Mayer 等人,1991 年。Nature 353:402–407。)
TZ7E 22.12
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
丰富的生长素依赖性反应背景信息,我们接下来更详细地考虑生长素的重要性以及 GN 和 MP 的具体作用,包括它们如何促进生长素依赖性建立发育胚胎的顶端-基底轴。
22.4 胚胎发生过程中的生长素信号传导
如第 4 章和第 18 章所述,生长素激素协调植物的许多生长和发育过程,并在胚胎发生过程中产生深远的影响。生长素和生长素信号传导活动的分布都已使用荧光报告构建体进行映射,这些构建体可以报告活性生长素的存在(基于 DII 域的报告子,例如 DII-VENUS)或响应生长素的转录激活(基于 DR5 启动子的报告子)。使用这些工具,可以清楚地看到,在整个胚胎发生过程中,细胞显示出动态的生长素积累和反应模式(图 22.13)。在双细胞阶段,顶端细胞表现出比基底细胞更活跃的生长素反应,而在球状阶段,垂体和胚胎下部区域的细胞表现出更高水平的生长素活性。事实上,胚胎发生的许多阶段,如胚根(胚根)的形成、子叶的形成和维管组织的分化,都与局部生长素活性的增加密切相关。
生长素积累的空间模式调节关键的发育事件
遗传学研究已证实,局部生长素积累的增加与它们相关的发育事件有因果关系。抑制生长素生物合成(由于生物合成基因缺陷)或生长素反应(由于受体缺陷、不可降解的 Aux/IAA 抑制剂或 ARF 缺陷)的基因突变专门阻止与局部生长素活性增加相关的胚胎发育阶段。
这些突变体的表型包括无法产生根或子叶以及无法正确指定维管组织和基本组织。如果生长素积累的空间模式为胚胎中的模式提供了模板,那么哪些过程决定了生长素积累的位置?
生长素积累的空间模式源于局部生物合成和运输的结合。负责生长素生物合成的基因在特定细胞中表达,这些细胞成为生长素来源。然而,这些细胞并不是唯一表现出生长素信号活性的细胞,这种差异可以通过胚胎内的极性生长素运输来解释。例如,拟南芥的 pin1 突变体缺乏生长素的极性运输,在胚胎发育过程中经常表现出异常,例如融合的子叶(图 22.14),这与生长素运输在胚胎发育过程中的作用一致。PIN 蛋白起着生长素流出的作用
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 680
胚胎发生:植物结构的起源 681
2 细胞阶段
球状胚胎
早期心脏阶段
图 22.13 PIN1 依赖的生长素 (IAA) 在胚胎发生早期阶段的运动。箭头表示从 PIN1 蛋白的不对称分布和 DR5 生长素反应报告基因的活性推断出的生长素运动。蓝色区域表示生长素浓度最高的细胞;棕色阴影表示维管柱。激素合成产生的生长素最大值产生梯度,然后通过 PIN1 的极性取向得到强化。
(A)野生型拟南芥
TZ7E 22.13
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 12-27-21
(B)突变体 pin1-1 拟南芥
A 和 B 来自 C. Liu 等人1993.
Plant Ce l 5: 621–630
图 22.14 生长素在胚胎发育中发挥作用的证据。 (A) 野生型拟南芥胚胎。 (B) pin1-1 突变体拟南芥胚胎。请注意,由于体外生长素运输的化学抑制和 PIN 基因突变导致生长素运输中断,导致子叶分离失败。
TZ7E 22.14
22_Taiz7e-Ch22.indd 681
Plant Physiology 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio Date 4-18-22
载体(见第 4 章),在拟南芥胚胎中显著表达。它们位于运输细胞基端的质膜上(与生长素运输的化学渗透模型一致),表明生长素运输的路径明确,从生物合成位点到作用位点。因此,生长素充当移动的细胞间信号,控制胚胎的形态发生。注意目标细胞对生长素的反应因细胞在胚胎中的位置而明显不同。因此,胚胎顶端域中的细胞通过启动子叶来响应生长素,而基底域中的细胞通过形成胚根来响应。
GNOM 蛋白建立了 PIN 生长素流出蛋白的极性分布
PIN 蛋白是限速生长素转运蛋白,它们对极化膜域的不对称靶向决定了生长素转运的路径。PIN 蛋白定位的动态性质的核心是它们通过囊泡通过以 GNOM 蛋白存在为特征的内膜区进行运输。 GNOM 蛋白建立了生长素流出蛋白的极性分布,毫不奇怪,gnom 突变体具有严重的发育缺陷(见图 22.12A 和 C)。通过使用生长素运输抑制剂,可以模仿或表型复制 gnom 突变体表型的许多方面,这与 GNOM 是正常生长素运输所必需的这一观点一致。
当对 GNOM 基因进行测序时,发现其预测的蛋白质类似于鸟嘌呤核苷酸交换因子 (GEF)。GEF 促进囊泡的细胞内运动,囊泡将特定蛋白质运送到细胞内的目标位置。通过实验证明 GNOM 的 GEF 活性是 PIN 蛋白极化定位所必需的,这解释了 GNOM 如何促进极性生长素运输。GNOM 的突变会破坏 PIN 蛋白的正常极化分布。在用布雷菲德菌素 A(一种 GEF 活性抑制剂)处理的细胞中观察到 PIN 定位中断,但在含有布雷菲德菌素 A 无法结合的改变形式的 GNOM 的细胞中没有观察到这种情况。gnom 突变体中胚胎发育模式的改变反映了 PIN 活性的中断,这一观点得到了直接破坏编码 PIN 蛋白的基因所导致的类似发育缺陷的支持。MONOPTEROS 编码一种由生长素激活的转录因子MONOPTEROS 基因的克隆(见图 22.12B 和 C)表明,它编码一种称为生长素反应因子 (ARF) 的蛋白质家族的成员,表明它参与了生长素依赖性过程。在存在生长素的情况下,ARF 调节参与生长素反应的特定基因的转录。在没有生长素的情况下,这些蛋白质的活性通过与特定阻遏物(称为 Aux/IAA 蛋白)的物理关联而受到抑制。当生长素触发这些阻遏物的靶向降解时,就会发生生长素依赖性反应,从而使 ARF 能够控制其目标基因(参见第 4 章)。有几条证据支持 MONOPTEROS 至少介导一部分生长素反应的观点。 monopteros 突变体胚胎不仅缺乏下胚轴和胚根(见图 22.12B 和 C),而且在血管模式方面也存在缺陷,类似于人为干扰生长素水平或运动时观察到的缺陷,这表明 MONOPTEROS 很可能调节指导生长素依赖性血管发育的基因。单独的遗传研究证实,MONOPTEROS 活性受生长素调节。这些研究集中于 bodenlos (bdl) 突变体,它与 monopteros 突变体一样,缺乏胚胎的基底区域。这种相似性表明这两个基因可能在功能上相关。BDL 的分子克隆表明它编码了许多 Aux/IAA 抑制蛋白之一。正常形式的 BDL 与 MONOPTEROS 结合以抑制 MONOPTEROS 活性,但这种抑制可以通过生长素诱导的 BDL 降解来缓解。生化研究表明,突变形式的 BDL 对生长素诱导的降解具有抗性,因此会继续与 MONOPTEROS 结合,抑制其活性并产生与 monopteros 相似的表型。
原基
垂体
透镜状
综上所述,GNOM 和 MONOPTEROS 可以被视为更复杂机制的一部分,通过该机制,生长素的运动及其引起的反应有助于引导顶端-基底轴的建立。
该机制的总体输出是激活一组基因,这些基因触发各种模式元素或细胞类型的建立。使用突变体进行的分子遗传学研究结合全基因组转录分析,已经确定了几个这样的靶基因。鉴于生长素作用的位置依赖性,可以预期,由该途径激活的基因将根据细胞的环境而变化。这些基因包含多种功能,包括转录因子TARGET OF MONOPTEROS 7 (TMO7),它可以从一个细胞移动到另一个细胞并有助于根的形成,以及维管组织形成的调节剂TMO5,我们将在本章后面讨论。
22.5 Radial 胚胎发生过程中的模式化
除了发育胚胎沿顶端-基底轴分布的细胞和组织之间的区别外,还可以看到沿垂直于顶端-基底轴的径向轴的差异,从内部延伸到表面。在拟南芥中,沿径向轴的组织分化首先在球形胚中观察到(图 22.15),其中周周分裂将胚分成
早期球形
1. 表皮/侧根冠初始细胞
2. 表皮
3. 侧根冠
4. 皮层/内皮层初始细胞和子细胞
6. 内皮层
7. 维管柱和初始细胞
8. 中柱和初始细胞
9. 静止中心
10. 柱柱和垂体
晚期球形
晚期心脏
横截面
晚期心脏
图 22.15 拟南芥胚胎发生过程中径向模式事件序列总结。纵向切片中显示的五个连续胚胎阶段说明了不同组织的起源,从原胚层(左)的划定开始,到维管组织的形成结束(右)。请注意,组织的数量是如何通过初始细胞的作用而增加的。最右边显示了晚期心脏阶段胚胎基底部分的横截面图(横截面的水平由其左侧纵向切片中的线显示)。(根据 T. Laux 等人 2004 年。植物细胞 16:S190–S202。)
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 682
胚胎发生:植物结构的起源 683
三个径向定义的区域。最外层细胞形成一层单细胞厚的表面层,称为原皮层,最终分化为表皮。在此层之下的细胞后来会变成基本组织,而基本组织又会分化为皮层(维管系统和表皮之间的基本组织),在根和下胚轴中,则是内皮层(一层木栓化细胞,限制水和离子通过质外体进出中柱;见第 6 章)。最中心的区域是原形成层,它产生维管组织,包括根的中柱鞘。正如我们在胚胎的顶端-基部模式中所看到的,精确定义的细胞分裂序列似乎对基本的放射状模式并不是必不可少的。在相关物种中可以看到与径向图案形成相关的细胞分裂模式的显著变化,并且基本图案元素仍然可以在细胞分裂模式紊乱的突变体中建立,这表明位置依赖机制发挥了重要作用。在以下小节中,我们将讨论解决这些机制性质的实验,为分子遗传分析的实用性提供更多示例。有关细胞分裂物理方面的进一步讨论,请参见 WEB ESSAY 18.1。表皮在径向图案的边缘提供了界面和边界胚胎径向轴的一个明显而独特的方面是由原皮提供的,原皮是一种可以通过其表面位置唯一定义的组织,最终产生表皮,表皮是介导植物与外界之间通讯的关键组织。原胚层细胞起源于胚胎早期,具有一组暴露的细胞壁,理论上,这些细胞壁可以促进与外部环境的信号交换,或者在信号在胚胎内从一个细胞移动到另一个细胞时充当边界。无论哪种情况,原胚层都会表现出与内部细胞层不同的独特特性,从而为径向(A)野生型提供潜在线索。来自 M. Abe 等人,2003 年。发展 130:635–643(B)atml1/pdf2 突变体模式。例如,柑橘类植物的研究表明,从最早的合子阶段到成熟期,胚胎表面都存在角质层,这表明原胚层细胞壁形成了通信边界。一些研究还表明,表皮可以作为更多内层生长的物理约束。遗传学研究帮助我们了解了导致表皮独特特征的过程。例如,已确定两个基因,拟南芥分生层 1 (ATML1) 和原皮因子 2 (PDF2),在促进表层细胞的表皮身份方面具有重要作用。这两个基因都编码同源结构域转录因子,并在胚胎发生的早期阶段在胚胎的外细胞中表达。这种表达对于建立正常的表皮身份似乎是必要的,因为功能丧失的突变植物具有异常的表皮,其中细胞表现出通常与叶肉细胞相关的特征(图 22.16)。相反,异位(在研究表明,在内部组织中(例如,在错误的位置)表达 ATML1 会诱导异常的表皮特征。总之,这些结果表明 ATML1 和相关的 PDF2 可能通过促进介导表皮特征发育的下游基因的活性来发挥作用。
维管柱的原形成层前体位于径向轴的中心
很容易想象,发育中的胚胎中心的独特几何特性将为沿径向轴的组织模式化提供进一步的潜在位置线索,而维管柱的维管组织最终将占据最中心的位置。遗传和发育分析表明,这个过程是渐进的,周周分裂首先沿径向轴产生额外的细胞层,然后通过特定基因网络的活动形成特定的命运。例如,拟南芥
22_Taiz7e-Ch22.indd 683
图 22.16 ATML1 和 PDF2 是
正常表皮建立所必需的。
野生型植物 (A) 和双 atml1/
pdf2 突变体 (B) 的比较表明,突变体的表层与野生型植物的叶肉相似(A 中部分暴露)。
4/29/22 10:29 AM
684 第 22 章
(A) 野生型
原韧皮部
筛管分子
(B) wol 突变体
来自 A. P. Mahonen 等人。2000 年。
基因开发。 14: 2938–2943 © 2000,
Cold Spring Harbor Laboratory Press
原生木质部
图 22.17 拟南芥木腿 (WOL) 基因编码的细胞分裂素受体是正常韧皮部发育所必需的。 野生型 (A) 和 wol (B) 突变根的比较表明,wol 中缺乏韧皮部元素,同时细胞层数明显减少。
TZ7E 22.17
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
缺乏木腿 (WOL) 基因的突变体无法进行关键的细胞分裂,而细胞分裂通常会产生木质部和韧皮部的前体(图 22.17)。这种缺陷导致形成包含木质部但不包含韧皮部的维管系统。
WOL(也称为细胞分裂素反应 1 [CRE1])编码几种相关的细胞分裂素受体之一,表明这种激素参与了放射状模式元素的建立(见第 4 章)。然而,这些缺陷可以通过 fass(即通过制造 wol/fass 双突变体)来挽救(通过改变第二个因子来逆转表型),这会导致额外的细胞分裂轮次。因此,wol 中韧皮部的缺失似乎仅仅反映了适当定位的前体细胞层的缺失,而不是无法指定韧皮部细胞身份。对细胞分裂的关键作用以及形成维管组织模式的足够数量的细胞的理解也来自对 MONOPTEROS 5 (TMO5) 基因的 TARGET OF MONOPTEROS 的研究。该基因由前面讨论过的生长素依赖性转录因子 MONOPTEROS 激活,因此代表局部生长素输出。TMO5 仅在球形胚胎中心的维管前体细胞中表达并编码转录因子。 TMO5 与第二个转录因子 LONESOME HIGHWAY (LHW) 形成异二聚体。这两个转录因子一起过度表达会诱导额外的周壁分裂,而任一因子的突变都会导致周壁分裂减少,这表明这些因子是维管组织细胞分裂的关键调节因子(图 22.18)。通过滴定 TMO5 和 LHW 的水平,研究人员可以控制维管组织中的细胞层数,这导致发现维管元素(木质部和韧皮部)的数量与组织中的细胞总数成比例。例如,只有正常细胞文件数量一半的突变体(在背斜和周壁上产生)只产生一个韧皮部极而不是两个。当突变体具有过量的细胞文件时,会产生多个(两个以上)韧皮部极。一旦 TMO5 和 LHW 被生长素激活,它们就会通过局部促进第二种植物激素细胞分裂素的合成而起作用。因此,这两种植物激素之间的相互作用决定了维管组织的大小,从而决定了其组成和结构。
皮层和内胚层细胞的分化涉及转录因子的细胞间运动
内胚层和皮层组织的发育提供了一个经典的例子,说明如何通过相邻层之间传递的基因活性来调节放射状图案形成过程。两个拟南芥基因,SCARECROW (SCR) 和 SHORT ROOT (SHR),都是皮层和内胚层细胞层正常形成所必需的。这两个基因编码的蛋白质序列相似,因此它们属于 GRAS 转录因子家族,该家族的名称源自第一个已知成员rs、赤霉素不敏感基因 (GAI)、GA1–3 抑制基因 (RGA) 和 SCR。
SCR 或 SHR 活性降低的突变体无法进行一轮细胞分裂,从而无法产生两层,这两层后来分化为独立的皮层和内皮层。任一基因的突变都会阻止产生这些独立层的细胞分裂(图 22.19)。在 scr 突变体中,剩下的单层表现出内皮层和皮层的特征,这表明突变体仍然能够表达这些特征,但无法将它们分离成离散的层。fass 能够恢复更正常的生长模式,这支持了这种解释。
fass 似乎可以弥补 scr 的分裂缺陷,就像它拯救了 wol 一样,从而提供了单独的层,可以在其中表达不同的内胚层和皮层特征。
突变体 shr 不仅表现出与 scr 类似的细胞分裂缺陷,而且无法阐述内胚层的典型细胞特征。shr 中单个未分裂的层缺乏内胚层特征,例如
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 684
胚胎发生:植物结构的起源 685
所有照片来自 B. De Rybel 等人。
2013。Dev. Ce l 24: 426–437
pRPS5A-TMO5
pRPS5A-TMO5
pRPS5A-LHW
pRPS5A-TMO5
pRPS5A-LHW
pRPS5A-TMO5
韧皮部极
内皮层
内皮层
图 22.18 TMO5 和 LHW 控制拟南芥根部中木质部和韧皮部细胞文件在所有维度上的数量。 (A 和 B) 野生型 (A) 和 tmo5 tmo5 like1 (t5l1) 双突变体 (B) 成熟胚的横截面。虚线内的区域是维管组织,突变体中的维管组织较小。 (C 和 D) 野生型 (C) 和 tmo5/t5l1 突变体 (D) 的胚后根分生组织的横截面显示,后者的维管细胞 (周围内皮层中的细胞用内皮层星号标记) 和韧皮部极 (箭头) 较少。 (E–G) 野生型 (E)、pRPS5A-TMO5(过表达 TMO5 的品系 (F))和 pRPS5A-LHW、pRPS5A-TMO5(过表达 LHW 和 TMO5 的品系 (G))的根分生组织的横截面。 与野生型相比,双过表达品系具有更多的细胞文件和平周分裂。 由平周分裂产生的细胞对的示例用轮廓和箭头表示。 内皮层细胞用星号标记。凯氏带,而是显示出通常仅限于皮层的基因活动。 SHR 基因活性明显需要指定内胚层特征,这令人费解,因为 SHR mRNA 的表达通常仅限于更内部的原维管组织。 (A) 野生型 TZ7E 22.18 植物生理学 7/E Taiz/Zeiger OUP/Sinauer Associates Morales Studio 日期 4-18-22 内胚层 涉及使用荧光标记蛋白的更详细分析已经解决了这一悖论,表明尽管 SHR mRNA 局限于维管柱,但其翻译产物并非如此。
SHR 蛋白能够移动到相邻的更多
(B) 突变体
图 22.19 正常和突变体径向根模式的比较显示了特定基因的空间定义功能。(A) 野生型根。 (B) 三个拟南芥突变体的缺陷径向根
22_Taiz7e-Ch22.indd 685
木腿 (wol)
内皮层
稻草人 (scr)
短根 (shr)
模式:木腿 (wol)、
稻草人 (scr) 和短根 (shr)。 (K. Nakajima 和
P. N. Benfey 著。2002 年。植物细胞 14:S265–S276。)
4/29/22 10:29 AM
686 第 22 章
(A)野生型根
SHR mRNA 表达
内皮层
(C)野生型根
SCR mRNA 表达
A、C 和 D 来自 Y. Helariutta 等人。
2000 年。细胞 101:555–567
(B)野生型根
SHR 蛋白表达
(D)shr 突变根
SCR mRNA 表达
内皮层
细胞层
静止中心
TZ7E 22.20
外层通过胞间连丝,在那里它具有多种活性,包括促进 SCR 转录增强。在 SCR mRNA 翻译之后,SHR 与 SCR 蛋白形成异二聚体,以增强与内胚层发育程序相关的基因的转录(图 22.20)。SHR 蛋白对皮层和内胚层细胞分化的贡献提供了一个清晰的例子,说明特定转录因子的功能可能取决于它们在细胞层之间的移动。
图 22.20 简短来自 K. Nakajima 等人。2001 年。自然 413:307-311
拟南芥中的 ROOT(SHR)和 SCARECROW(SCR)基因在根发育过程中控制组织模式。在这里,SHR 和 SCR 的 mRNA 或蛋白质已通过共聚焦激光扫描显微镜定位。(A 和 B)SHR 表达。 (A) 在根系早期发育过程中,SHR 启动子活性仅限于中柱(使用 SHR 启动子绿色荧光蛋白 [GFP] 融合可视化)。(B) SHR 蛋白显示出独特的定位模式,其中包括 c中柱和相邻内皮细胞的细胞核(使用 SHR 启动子 + 编码区 + GFP 融合进行可视化)。(C 和 D)SCR 表达(使用 SCR 启动子-GFP 融合进行监测)。(C)在野生型根中,SCR 在静止中心、内皮层和皮质-内皮层初始细胞(CEI)中转录。它不存在于皮层、维管柱或表皮中。(D)SCR 的表达在 shr 突变根中显着降低,并且仅出现在具有内皮层和皮层特征的异常细胞层中。幼苗生长停滞,表明这一步骤在植物发育中至关重要。根的形成涉及 MONOPTEROS 和
其他生长素调节的转录因子
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
22.6 根和
茎顶端分生组织的形成
胚胎发生最重要的结果可以说是成熟胚胎两端顶端分生组织的形成。这些茎和根顶端分生组织是维持茎和根系统营养生长的初始细胞的家园。两种顶端分生组织中的任何一种都无法启动,这会导致
正如我们在本章前面所看到的,缺乏
胚根的突变体(例如,monopteros [mp] 和 bodenlos
[bdl])有助于阐明生长素在根形成中的作用。对受
MONOPTEROS 调控的基因的分析导致了移动转录因子 TMO7 和维管组织调节因子 TMO5(本章前面讨论过)的发现,但单独使用其中任何一个都不足以指定根。事实上,基因分析已经确定了另外两个由生长素激活的转录因子,它们似乎负责胚根的形成。这两个转录因子属于 AP2/乙烯反应因子类,由 PLETHORA 1 (PLT1) 和 PLETHORA 2 (PLT2) 基因编码。两者均在球形胚胎下半部分的胚胎中被激活(图 22.21)。突变体中的 MP 和 NPH4 依赖生长素表达; MP 和 NPH4
促进 PLT 的表达
初始细胞
PLT 诱导 SCR 和 SHR 的表达
PLT、SCR 和 SHR 的组合指导静止中心的形成并诱导 WOX5 的表达
图 22.21 根部细胞身份指定模型。 (A) MONOPTEROS (MP) 和 NONPHOTOTROPIC HYPOCOTYL
4 (NPH4) 基因的早期生长素依赖性表达。 MONOPTEROS 和 NPH4 促进基底域中的 PLETH
ORA (PLT) 表达。 (B) PLT 促进 SCARECROW (SCR) 和 SHORT ROOT
(SHR) 的表达。 (C) PLT、SCR 和 SHR 基因表达的组合指示位于中心的细胞成为静止中心,并诱导 WOX5 的表达,这有助于维持周围的初始细胞。虚线表示的区域包含初始细胞。(根据 M. Aida 等人 2004 年。Cell 119:109-120。)PLT 基因被破坏的细胞无法形成胚胎根。相反,PLT 在球状胚胎上半部分(或其他胚胎后组织)的异位表达足以在这些位置形成新根。总之,这些实验支持一种模型,其中生长素激活胚胎下半部分的一组基因(包括 PLT 基因),指示这些细胞采用根身份。 TZ7E 22.21
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 3-4-22
22_Taiz7e-Ch22.indd 687
芽形成需要 HD-ZIP III、SHOOT
MERISTEMLESS 和 WUSCHEL 基因
另一组转录因子在球状胚的上半部分被激活,它似乎介导整个芽域或芽顶端分生组织的建立。例如,属于 HD-ZIP III 类的一个小家族相关转录因子的成员在球状胚的上半部分中特异性表达。
这些 HD-ZIP III 基因在胚胎上半部分的表达是胚胎中茎尖分生组织形成所必需的,也是营养生长期间叶片的近轴-远轴极性所必需的(见第 18 章)。当在胚胎下半部分异位表达时,这些因子之一 PHABULOSA (PHB) 能够触发第二个茎域的形成(图 22.22C)。这与在胚胎上半部分人工表达 PLT 蛋白时发生的情况相反(图 22.22B),这表明 HD-ZIP III 和 PLT 转录因子起拮抗作用。事实上,进一步的实验表明 HD-ZIP III 因子抑制了 PLT 基因的表达(图 22.22A)。茎无分生 (STM) 或
WUSCHEL (WUS) 基因突变,ch 编码转录因子,导致胚胎茎尖分生组织的丢失。虽然这两个转录因子单独在其他组织中异位表达时都不能触发新茎尖分生组织的形成,但它们结合起来可以。STM 和 WUS 都在幼胚的顶端域中表达,似乎两者都是分生组织形成所必需的。由于这种相互作用,胚胎茎尖分生组织的位置可以通过两个基因表达重叠的区域精确定义。植物可以在多种类型的细胞中启动胚胎发生在本章中,我们讨论了胚胎发生,重点关注了种子发育的熟悉背景。然而,正如引言中指出的,胚胎发生过程在进化上比种子发育更古老,因为它也发生在非种子维管植物中,例如蕨类植物和马尾草。即使在种子植物中,除了合子之外,还有多种其他细胞能够进行胚胎发生(图 22.23)。这些过程包括无性胚胎发生的自然形式,例如无融合生殖(来自胚珠内细胞的无性胚胎发生 - 即未成熟的种子)以及来自叶缘的体细胞胚胎发生(例如,在 Kalanchoe 中)(参见第 21 章)。在这两种情况下,受精卵以外的细胞
都被遗传编程为
经历胚胎发生,并可以形成
抑制的胚胎
4/29/22 10:29 AM
688 第 22 章
HD-ZIP III
摘自 Z. R. Smith 和 J. A. Long。
2010. Nature 464: 423–427
miR165/166
图 22.22 拟南芥胚胎中芽和根顶端分生组织的起始。
体细胞
TZ7E 22.22
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
小孢子
体细胞
图 22.23 植物胚胎的多种来源。
除了受精卵,许多不同的细胞都可以产生植物胚胎。这里展示的例子是胚珠中的体细胞、胚柄细胞、小孢子和培养的体细胞。(T. Radoeva 和 D. Weijers 著,2014 年。Trends Plant Sci. 19: 709–716。)
(A)调节器如何控制 16 细胞拟南芥胚胎中芽和根顶端分生组织的起始的模型。显示了胚胎的三维横截面,其中每种细胞类型都用不同的颜色标记。胚胎的上层产生芽域,下层产生根域。该模型的核心是 HD-Zip III(顶层)和 PLT(下层)转录因子之间的相互抑制相互作用,它们会抑制彼此的表达。此外,PLT 表达受 BODENLOS [BDL] 和 TOPLESS [TPL] 控制,而下层的 microRNA miR165/166 会限制 HDZip III mRNA 向顶层的积累。HD-ZIP III 促进芽的形成,而 PLT 促进根的形成。(B)左图:在芽中过表达 PLT 蛋白的幼苗会在那里形成根分生组织,而不是芽分生组织。右图:左侧面板中方框区域的放大图显示了平衡石的存在,这是典型的根部特征。 (C) 在胚胎下层过度表达 HD-Zip III 的幼苗会发育出第二个芽域。 (A 源自 J. Palovaara 等人,2016 年。Annu. Rev. Cell Dev. Biol. 32: 47–75。)通常在形态上(几乎)与有性合子衍生的胚胎没有区别。胚胎发生也可以人工诱导。例如,人工体细胞胚胎发生,即在激素处理后诱导胚胎从愈伤组织形成,通常用于植物繁殖。同样,小孢子暴露于诸如热等压力下会导致某些植物物种形成胚胎。最后,替代胚胎发生可以发生在种子内。胚柄细胞是受精卵第一次细胞分裂产生的基底细胞的后代,通常在几轮细胞分裂后处于静止状态。然而,如果胚胎受损,胚柄细胞可以恢复分裂并形成第二个胚胎。因此,只要有正确的触发因素,许多类型的植物细胞都可以形成胚胎,证明了植物细胞巨大的发育潜力。
来自 C. Galinha 等人,2007 年。
Nature 449: 1053–1057
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 688
胚胎发生:植物结构的起源 689
植物孢子体的产生始于启动胚胎发生的受精事件。受控的细胞分裂产生胚胎的极轴和双侧对称性。移动和位置信号都起着形态发生调节器的作用。这些调节机制的扩展集在胚后生长过程中对植物器官的进一步发育起作用。胚后植物保留分生组织(初始细胞生态位),它们是未分化细胞分裂的场所,以提供塑性或适应性生长。22.1 单子叶植物和真双子叶植物的胚胎发生
■ 单子叶植物和真双子叶植物的胚胎发生不同,但也有共同的特征。
■ 玉米(单子叶植物)和拟南芥(真双子叶植物)代表了胚胎发育的两个极端,从相对复杂和较难预测到相对简单和较易预测。
22.2 顶端-基部极性的建立
■ 在种子植物中,顶端-基部极性在胚胎发生早期就已建立(图
22.1–22.5)。
22.3 指导胚胎发生的机制
■ 决定细胞命运的位置依赖性机制指导胚胎发生(图 22.8)。
网络材料
■ 拟南芥突变体表明,除了固定的细胞分裂序列之外,某些过程必须指导径向图案的形成(图 22.9)。
■ 细胞间蛋白质运动的潜力在发育过程中发生变化(图 22.10)。
■ 胚胎致死和幼苗缺陷突变体的筛选揭示了对正常拟南芥胚胎发生至关重要的基因(图 22.11、22.12)。
22.4 胚胎发生过程中的生长素信号传导
■ 生长素可能在胚胎发生过程中起到移动化学信号的作用(图 22.13、22.14)。
22.5 胚胎发生过程中的放射状图案
■ 放射状图案引导组织层的形成(图 22.15)。
■ 两个拟南芥基因建立了正常的表皮身份(图 22.16)。
■ 不同的基因建立了内部组织,包括脉管系统和皮层(图 22.17–22.20)。
22.6 根和芽顶端分生组织的形成
■ 在胚胎发生过程中,芽和根顶端分生组织的起始由 HD-Zip III 和 PLT 转录因子的相互抑制相互作用控制(图 22.21、22.22)。
■ 植物胚胎可来自各种类型的细胞(图 22.23)。
■ 网络主题 22.1 墨角藻合子的极性
多种外部梯度可使最初无极性的细胞生长极化。
有关更多学习辅助,请访问 oup.com/he/taiz7e。
推荐阅读
Aichinger, E.、Kornet, N.、Friedrich, T. 和 Laux, T. (2012) 植物干细胞生态位。Annu. Rev. Plant Biol. 63:615–636。
Barlow, P. W. (1994) 植物顶端分生组织中结构初始细胞的进化。J. Theor. Biol. 169:163–217。
Dresselhaus, T. 和 Jürgens G. (2021) 被子植物的比较胚胎发生:胚胎细胞谱系的激活和模式化。Annu. Rev. Plant Biol. 72:641–676。
Esau, K. (1965) 植物解剖学,第二版。Wiley,纽约。
Hudson, A. (2005) 植物分生组织:细胞命运的移动介质。
Curr. Biol. 15:R803–R805。
Jenik, P. D. 和 Barton, M. K. (2005) 涌动与毁灭:生长素在植物胚胎发生中的作用。发展 132:3577–3585。
22_Taiz7e-Ch22.indd 689
Laux, T.、Wurschum, T. 和 Breuninger, H. (2004) 胚胎模式形成的遗传调控。植物细胞 16 (补充):S190–S202。
Maule, A. J.、Benitez-Alfonso, Y. 和 Faulkner, C. (2011)
胞间连丝 - 具有姿态的膜隧道。Curr. Opin.
Plant Biol. 14:683–690。
Miyashima, S.、Sebastian, J.、Lee, J.-Y。和 Helariutta, Y. (2013)
植物维管发育过程中的干细胞功能。EMBO J.
32: 218–193。
Palovaara, J.、de Zeeuw, T. 和 Weijers, D. (2016) 植物胚胎中的组织和器官起始:一切的第一次。Annu. Rev. Cell Dev. Biol. 32: 47–75。
4/29/22 10:29 AM
690 第 22 章
Poethig, R. S. (1997) 开花植物的叶形态发生。
Plant Cell 9: 1077–1087。
Radoeva, T.、Vaddepalli, P.、Zhang, Z. 和 Weijers, D.
(2019) 植物早期胚胎发生的进化、起始和多样性。Dev. Cell 50: 533–543。
Raghavan, V. (1986) 被子植物的胚胎发生。剑桥大学出版社,英国剑桥。
Sachs, T. (1991) 植物的细胞极性和组织模式。Development 113 (Supplement 1): 83–93。
Scheres, B.、Wolkenfelt, H.、Willemsen, V.、Terlouw, M.、Lawson, E.、
Dean, C. 和 Weisbeek, P. (1994) 拟南芥初生根和根分生组织初始细胞的胚胎起源。
Development 120: 2475–2487。
Scheres, B. (2013) 生根植物发育。Development
140: 939–941。
Silk, W. K. (1984) 发育的定量描述。
Annu. Rev. Plant Physiol. 35: 479–518。
Sparks, E., Wachsman, G., 和 Benfey, P. N. (2013)
植物发育中的时空信号传导。Nat. Rev.
Genet. 14: 631–644。
Steeves, T. A., 和 Sussex, I. M. (1989) 植物发育模式。剑桥大学出版社,英国剑桥。
4/29/22 10:29 AM
22_Taiz7e-Ch22.indd 690
植物衰老和
发育细胞死亡
每年秋天,生活在温带气候中的人们都会欣赏到落叶树落叶前壮观的色彩变化。秋天的树叶变黄、
橙色或红色,从树枝上掉下来,这是由于日照时间变短和气温降低所致,这会引发两个相关的
发育过程:衰老和脱落(图 23.1)。
衰老是最后一个发育阶段,最终衰老是细胞、器官或生物体随年龄增长而发生的分解和退化过程,受环境因素与遗传调控的发育程序相互作用控制。坏死虽然与衰老有一定相似之处,但通常被定义为非程序性细胞死亡,直接由物理损伤、毒物(如除草剂或病原体释放的毒素)或非生理条件(如温度或缺氧)引起。脱落是指发生在叶片、花部和果实基部的细胞层分离,使细胞层容易脱落而不会对植物造成损害。在植物中,细胞水平的衰老涉及遗传编码和主动控制的细胞自杀,也称为程序性细胞死亡 (PCD)。 PCD 是特定细胞类型或组织正常发育的内在组成部分,也可由非生物和生物胁迫引发(图 23.2)。
不同形式的 PCD 在发育、免疫和对环境的反应中起着至关重要的作用。
器官衰老(整个叶子、树枝、花朵或果实的衰老)发生在营养和生殖发育的各个阶段,通常包括衰老器官的脱落。器官衰老对植物适应性的重要性在叶片衰老中很容易看出。在一年生植物中,叶片衰老是一种分解和释放生长阶段积累的营养物质并将其重新定位到下一代种子中的方式。在树木中,叶片衰老期间分解的营养物质被重新定位并储存在茎或根中,为下一季做准备。
其他器官(例如花瓣)的衰老在
WEB 主题 23.1 中描述。
schankz/Shutterstock
4/29/22 9:58 AM
23_Taiz7e-Ch23.indd 691
692 第 23 章
Chuck Savage/Getty Images
TZ7E 23.01
Plant Physiology 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio Date 04-18-22
毛状体发育
叶片衰老
退化
过敏反应
(抗病性)
胚乳,
导管元素
通气组织
图 23.2 程序性细胞死亡 (PCD) 是植物生命周期的正常组成部分,发生在广泛的发育过程
以及对环境信号和病原体的反应中。经历 PCD 的细胞和组织在此处以黄色突出显示。
图 23.1 弗吉尼亚州蓝岭公园大道沿线的秋色。几种落叶树种(例如山茱萸、红枫、糖枫和酢浆草)的组合产生了各种各样的色调。
整株植物衰老,即整株植物衰老和死亡,与动物的衰老不同,而且变化更大。例如,单个植物的寿命可能从一些沙漠一年生植物的几周到狐尾松的 4600 年不等。克隆多年生植物可以活得更长。由于存在不断分裂的顶端分生组织,植物可能永远存活,但所有顶端分生茎最终都会衰竭,植物死亡。
本章首先简要概述了植物细胞死亡的特征和机制。然后,我们介绍了 PCD 的各种形式,包括与衰老相关的细胞死亡,并讨论了关键过程自噬如何参与植物细胞死亡。接下来,我们转向器官水平的衰老,重点关注叶片衰老和脱落,并描述叶片衰老过程中有序退化的机制及其受发育和环境信号的调控。最后,我们讨论了控制两种不同类型的全植物衰老的因素:单果衰老和多果衰老。
