5羟色胺受体-3
17.1 简介
5-HT3 受体是一种阳离子选择性配体门控离子通道,其结构和功能与其他六类 5-HT 受体不同,后者是 G 蛋白偶联受体。5-HT3 受体是 Cys-loop 和五聚体配体门控离子通道 (pLGIC) 家族的成员,与其他 pLGIC 一样,主要位于神经系统中,但也存在于其他组织中。5-HT3 受体在大脑中发挥作用,尤其是在涉及呕吐反射的区域,并且对于胃肠道中的信息传递很重要,它们在那里调节肠道运动、分泌和蠕动。 5-HT3 受体功能可受多种化合物调节,包括麻醉剂、阿片类药物和酒精。5-HT3 受体系统内的紊乱可能导致一系列神经、胃肠道和免疫系统疾病。
17.2 亚基多样性
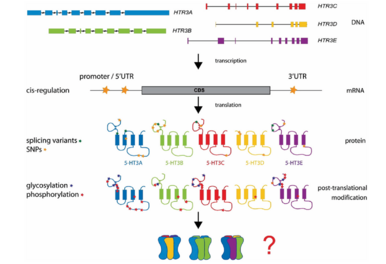
通过对小鼠神经母细胞瘤 (NCB20) cDNA 文库进行功能筛选,分离出第一个编码 5-HT3 受体亚基的 cDNA 克隆,即小鼠 5-HT3A 受体亚基。随后,从人类、豚鼠、雪貂和狗等多种物种中克隆出直系同源 5-HT3A 受体亚基的全长 cDNA。与五聚体配体门控离子通道不同,5-HT3A 亚基可以很容易地形成功能性同聚体。这表明它们可能进化得很古老,但无脊椎动物中缺乏 5-HT3 受体同源物表明它们至少比某些其他 Cys 环受体(例如乙酰胆碱和 GABA 受体)进化得更晚。早期的观察表明 5-HT3 受体群体并不完全相同(兔结节神经节中 5-HT3A 受体和天然 5-HT3 受体之间的不同电导率)。1999 年,发现了第二个亚基,即 5-HT3B 亚基。该亚基与 5-HT3A 亚基共表达产生的功能性受体具有更接近某些天然受体的特性。此后,人们又发现了其他三个亚基(5-HT3C、5-HT3D 和 5-HT3E;见图 17.1),并且这些蛋白质的基因现已证明存在于一系列物种中,尽管啮齿动物中没有。
异源受体的化学计量仍不清楚,尽管至少一个 5-HT3A 亚基的存在似乎是异源受体组装的必需条件。原子力显微镜研究表明 5-HT3AB受体具有 BABBA 排列,但其他研究表明存在AA 界面;因此可能出现两个(或可能更多)亚基排列。 5-HT3C、5-HT3D 和 5-HT3E 亚基在功能性受体中的排列和数量尚未确定,尽管存在许多可能性(图 17.1)。5-HT3 受体亚基的库因许多不同的同工型和启动子、可变剪接、单核苷酸多态性 (SNP) 和翻译后修饰而进一步增加。
17.3 结构
每个 5-HT3 受体亚基都有一个大的细胞外结构域 (ECD),其中有六个环 (A–F) 构成结合位点,一个跨膜结构域 (TMD) 由四个跨膜 α 螺旋 (M1–M4) 组成,以及一个位于 M3 和 M4 之间的细胞内结构域 (ICD),其中包含两个外周螺旋 MX 和 MA(图 17.2A、B)。 5-HT3 受体的第一个高分辨率结构是小鼠 5-HT3A 同型五聚体的 X 射线结构。此后,已获得了具有和不具有正构配体的 5-HT3A 受体的结构 (图 17.2C) 以及各种变构调节剂。这些结构中的离子通道孔显示出各种尺寸(图 17.2D),可能反映了不同的状态(例如,开放、关闭、预开放)和/或使用了不同的制备程序(例如,脂质双层盘中的受体显示出比使用去污剂溶解的受体解析的结构更浓缩和紧密的结构)。
17.3.1 胞外结构域
ECD 包含激动剂结合位点,该位点位于两个相邻亚基的界面处,由一个(主要)亚基的三个环(A-C)和来自相邻亚基,或互补亚基的三个 β 链(称为环 D-F)形成。一系列研究已经确定了对这些环中的结合口袋有贡献的关键残基。在环 A 中,序列 128AsnGluPhe130 的替换会改变受体功能,其中 Glu129 与激动剂 5-HT 的羟基形成氢键。环 B 对修饰非常敏感,许多残基的替换会消融ng 功能,表明环 B 是一种具有广泛氢键网络的强制性刚性结构。
环 B 色氨酸残基起着特别关键的作用,因为它与 5-HT 的伯胺形成阳离子-π 相互作用。环 C 在确定各种配体的物种特异性方面很重要,环的多个区域都很重要。环 C 和环 D 都为“芳香盒”(位于所有 Cys 环受体结合口袋中的 4/5 个芳香残基)贡献了一个色氨酸,环 D 也为结合位点贡献了一个精氨酸。许多环 E 残基和至少三个环 F 残基已被证明有助于受体结合/或功能,并且另一个环(环 G)中的残基也已被证明有助于某些物种中某些配体的结合。
17.3.2 跨膜结构域
每个 5-HT3 受体亚基的 TMD 的四个 α-螺旋通过 M1 和 M2(细胞内)以及 M2 和 M3(细胞外)之间的短环和 M3 和 M4 之间的长环连接。M2 α-螺旋排列在离子孔内,中央为亮氨酸 (L9'),M1–M2 环谷氨酸 (E-1) 形成封闭结构中通道孔的最窄点(图 17.2D 和 17.3)。M1' 和 M3 围绕 M2 螺旋形成一个环,研究表明这些螺旋有助于通道功能。例如,M1 中保守的脯氨酸对于激活至关重要,当该脯氨酸被丙氨酸、甘氨酸或亮氨酸取代时,受体会表达但无法发挥作用(Dang 等人,2000 年)。然而,用反式-3-甲基脯氨酸、哌可酸或亮氨酸取代会产生类似于野生型受体的活性通道。这些残基和脯氨酸之间的共同点是缺乏氢键供体活性;因此数据表明这是通道门控的关键元素,可能是因为 M1 的这个区域的二级结构具有灵活性。最后,M4 螺旋在 M1/M3 之外形成一个外环,将 TMD 的其余部分与脂质双层隔开。研究表明,改变这个螺旋可以改变通道功能,表明 M4 不仅仅是一个结构成分,而且参与受体功能。
17.3.3 细胞内结构域
ICD 由大型 M3–M4 细胞内环形成,包括 MX 和 MAα-螺旋。该区域在运输中发挥作用,也调节通道功能,尽管缺失研究表明 ICD 并非必需,因为 5-HT3A 受体亚基 ICD 可以被GLIC 的七肽 M3–M4 接头取代并保留功能 (Jansen 等人,2008)。5-HT3A 受体 ICD 可以作为一个单独的结构域发挥作用,正如研究表明的那样,它被添加到 GLIC,导致细胞内伴侣 RIC-3 改变功能。ICD 结构细节很少,这可能是因为——像 nACh 受体一样(Bondarenko 等人,2022 年)——它大多是非结构化的,但MA 螺旋有助于在膜水平下方形成开口(所谓的门户),为离子提供进出受体孔的横向路径(Kelley 等人,2003 年)。这些不仅仅是被动孔径,因为阻断 MA 螺旋的相对运动会影响通道电导(Stuebler 和 Jansen,2020 年)。排列在这些门户上的残基也有助于电导:当 5-HT3A 亚基 MA 残基被 5-HT3B 亚基中的残基替换时,单通道电导增加到异源 5-HT3AB 受体的电导(Kelley 等人,2003 年)。
17.4 生理作用和表达
5-HT3 受体位于许多大脑区域,包括海马、内嗅皮质、额叶皮质、扣带皮层、背角神经节、杏仁核、伏隔核、黑质和腹侧被盖区 (Barnes 等人,2009)。脑干中的背迷走神经复合体是呕吐反射的关键,包含后区和孤束核,具有最高的受体水平,这与 5-HT3 受体拮抗剂的强效止吐特性一致。
中枢神经系统中的 5-HT3 受体激活可以调节多种神经递质的释放,包括多巴胺、胆囊收缩素、GABA、P 物质和乙酰胆碱。在大鼠脑中,5-HT3 受体由海马 CA1 区和齿状回以及大脑皮层 I 层的抑制性中间神经元亚群表达。这些中间神经元的突触前 5-HT3 受体激活可能导致足够的 Ca2+ 进入,从而影响 GABA 释放,并导致 GABAA 受体介导的自发抑制性突触后电流 (sIPSC) 频率增加。
突触前 5-HT3 受体还促进谷氨酸释放到背迷走神经节前神经元、孤束核和后区神经元上。突触后 5-HT3 受体激活有助于在一系列位置进行快速兴奋性突触传递,包括大鼠外侧(但不是基底外侧)杏仁核、孤束核、雪貂视觉皮层和含有胆囊收缩素和血管活性肠肽的大鼠新皮质 GABA 能中间神经元。事实上,5-HT3 受体通常与胆囊收缩素以及 CB1 大麻素受体共定位:大鼠端脑、前嗅核、皮质、海马、齿状回和杏仁核中表达 5-HT3A 受体亚基的约一半神经元也表达 CB1 转录本,而表达 5-HT3A/CB1 的神经元也含有 GABA。
5-HT3 受体长期以来被认为在呕吐反应中发挥作用,因此它们参与胃肠道的信息传递也就不足为奇了。在肠神经系统中,它们调节肠道运动和蠕动。它们还在泌尿道中发挥重要作用,小鼠中组成性活性高敏性 5-HT3 受体的表达会导致兴奋毒性神经元细胞死亡,从而导致致命的尿路疾病。
功能和表达研究表明,5-HT3 受体 mRNA 和/或蛋白质存在于许多非神经元组织中,包括外周和感觉神经节、脾脏、结肠、小肠和肾脏。此外,据报道,该受体在免疫细胞中表达,例如单核细胞、软骨细胞、T 细胞、滑膜组织和血小板。
17.5 生物物理特性
17.5.1 受体激活
5-HT3 受体介导快速激活、脱敏内向电流。在卵母细胞中表达的 5-HT3A 受体对 5-HT 的 EC50 为 1-4 µM,5-HT3AC、5-HT3AD 和 5-HT3AE 受体也是如此,而 5-HT3AB 受体的 EC50 大约高出三倍 (Price 等人,2017)。结构数据表明,结合位点上的环 C 闭合(图 17.4)是激动剂结合后的第一个构象变化之一(如在其他 pLGIC 中一样),并且这种变化通过 ECD/TMD 界面(涉及 β1–β2 和 β8–β9 环、β10 链和 M2–M3 接头)通过蛋白质传导至 M2。比较开放和封闭结构时,可以看到不同的孔径,孔径最小的是 L9' 和 E-1'(图 17.2 和 17.3)。TMD 的其他区域也经历了构象变化:M1 螺旋从封闭构象向外移动到开放构象,而 M3 保持更稳定,尽管 M3 的顶部向 p 弯曲ore;M4 向上移动了几乎一个螺旋转角的高度,同时 M4-MA 边界处的 α 螺旋松动(比较 MA 中 R416 的相同高度与 M4 中 Y441 的移动;图 17.4)。
图 17.4
通过比较开放(蓝色,6DG8)和闭合(紫色,6BE1)结构,显示了受体激活后 5-HT3 受体的移动。左上:从顶部看到的细胞外结构域,显示环 C 的移动(箭头)。左下:跨膜结构域的自上而下视图显示 MX 螺旋和 M2-M3 环(用 * 表示)的移动,以及 M4 角度的变化。右图:单个亚基,显示 MX 和 M4 的移动(注意残基 Y441 的不同相对位置)。灰色框表示脂质双层。插图:从细胞外端看到的孔衬 M2 螺旋,显示 L9’ (L260) 的运动。
272 离子通道教科书第二卷
17.5.2 离子和离子选择性
5-HT3 受体孔是一个相对非选择性的阳离子通道。电流主要由 Na+ 和 K+ 离子携带,尽管二价和小有机阳离子也是可渗透的。
5-HT3A 受体对单价和二价阳离子的渗透性几乎相同(PCa/
PCs = 1.0 – 1.4;尽管 5-HT3AB 受体具有较低的 Ca2+ 渗透性(PCa/PCs = 0.6)。
离子选择性主要由 -1' 谷氨酸残基介导,而三重突变受体在 -1' 处插入脯氨酸,以及替换 E-1'A 和 V13'T
导致阴离子可渗透的 5-HT3A 受体。后续研究表明,
只需替换两个残基(E-1'A、S19'R)即可反转离子选择性(图
17.3),而仅 E-1'A 会导致非选择性通道。
17.5.3 单通道电导
5-HT3A 受体的单通道电导较低:值0.4–0.76 pS 的电导率(Gunthorpe 等人,2000 年;Kelley 等人,2003 年)。M2 区中存在 Lys 最初被认为是一种可能的解释,但此处的替换表明情况并非如此(Gunthorpe 等人,2000 年)。后续研究表明,低电导率是由于位于 M3–M4 环的 MA 螺旋中的 Arg 残基造成的(Kelley 等人,2003 年)。这些数据解释了 5-HT3AB 受体的较高电导率,因为这些 Arg 残基被 5-HT3B 亚基中的中性或带负电荷的残基取代。
17.5.4 通道门
5-HT3 受体通道的激活门位于 M2 的中心,与通道门控的“疏水带”模型一致;疏水带是 M2 中心的一个区域,直径小于 3.5 Å,距离约为 8 Å。这里面向孔的残基是疏水性的(V13' 和 L9'),使其在封闭构象下有效地阻止离子通过。与此假设一致的数据包括 5-HT3A 受体中的 V13' 残基被苏氨酸或丝氨酸取代,这会导致激动剂效力增加和/或自发通道开放,以及 L9' 被一系列氨基酸取代,这会影响激动剂效力和脱敏率。
17.6 药理学
17.6.1 5-HT3 受体激动剂
5-HT3 受体激动剂与正构配体结合位点结合(图 17.5)。它们共同具有一个碱性胺、一个芳香环、一个疏水基团和两个氢键受体。活性化合物包括 2-甲基-5-HT、苯双胍和间氯苯双胍。这些激动剂是相对较小的化合物,可使 C 环闭合在结合位点上,从而启动门控过程。
17.6.2 5-HT3 受体拮抗剂
5-HT3 受体竞争性拮抗剂与正构(激动剂)结合位点结合,通常比激动剂大;它们需要芳香部分、碱性部分和中间氢键受体。大多数拮抗剂具有刚性芳香或杂芳环系统、碱性胺和与芳香系统共面的羰基(或等排体等效物)。与激动剂药效团相比,芳香族和胺基之间的距离略长。带电胺基上只能容纳较小的取代基,例如甲基。许多 5-HT3 受体的强效拮抗剂具有杂环,最有效的化合物含有芳香族六元环。吗啡和可卡因是用于表征 5-HT3 受体的首批拮抗剂,后来开发了更具选择性和效力的 5-HT3 拮抗剂。其他通道的拮抗剂也可能通过结合 5-HT3 受体孔起作用。最初被认为是相对特异性的 GABAA 受体非竞争性抑制剂的苦味毒素可阻断 5-HT3 受体通道;苦味毒素(苦味毒素的活性成分)的结合定位于 M2 的 6' 位置。结构上与苦味毒素相似的化合物,如银杏内酯和白果内酯,作用类似。y. 阻断电压门控钙通道的地尔硫卓也阻断了 5-HT3 受体孔,并在同源受体的 7' 和/或 12' 残基附近起作用。吗啡及其类似物美多奈以及抗疟药奎宁和甲氟喹也可能通过结合孔发挥抑制作用,这突出了这些药物中的许多具有共同的机制,以及这些化合物中的许多表现出的混杂性。
17.6.3 5-HT3 受体调节剂
有许多变构调节剂会影响 5-HT3 受体功能,包括 n-醇、麻醉剂、抗抑郁药、大麻素、阿片类药物、类固醇和天然化合物;这些可以抑制或增强受体活性,许多还可以调节其他
图 17.5
5-HT3 受体药物结合位点。图中显示了激动剂、拮抗剂和调节剂的结合位点。
司琼包括昂丹司琼、格拉司琼、托烷司琼、贝美司琼、多拉司琼和帕洛诺司琼。转载自 Pharmacology and Therapeutics, 128/1, Walstab, Rappold, Niesler, 5-HT3 受体:在疾病中的作用和药物靶点, 146–169, 版权所有 2010, 经 Elsevier 许可。
274 离子通道教科书第二卷
Cys-loop 受体,尽管并不总是在同一个方向(参见 Davies,
2011; Walstab 等人, 2010 的评论)。这些化合物的特定结合位点大多尚未得到证实,尽管有些可能结合在 TMD 顶部的亚基间结合腔中。这些化合物的作用主要在 5-HT3A 受体上进行研究,尽管酒精和吸入麻醉剂会降低 5-HT3AB 受体的效力,而依托咪酯、丙泊酚和戊巴比妥对 5-HT3A 和 5-HT3AB 受体的作用相似。脂质也可以调节受体,这些将在下一节中更详细地讨论。
17.7 调节
5-HT3 受体可以通过在 ICD 中确定的激酶共识位点处进行磷酸化进行翻译后修饰。虽然在豚鼠 5-HT3 受体的 S409 处的假定蛋白激酶 A (PKA) 位点观察到磷酸化,但大多数研究都是间接的。 PKA 的激活加速了小鼠神经母细胞瘤和 HEK-293 细胞中 5-HT3 受体的脱敏,而蛋白激酶 C (PKC) 的激活剂则增加了 5-HT 激活电流的幅度。出乎意料的是,假定的 PKC 位点的点突变并未影响突变受体对 PKC 增强的敏感性,5-HT 引发的反应增强可能是由于受体聚集的 F-肌动蛋白的结构重排导致受体细胞表面表达增加所致,这一结论与 5-HT3A 受体与富含 F-肌动蛋白的膜域共定位的观察结果一致。由于神经递质的释放可以通过肌动蛋白依赖性机制进行调节,而 5-HT3A 受体可以调节神经递质的释放,因此 PKC 增强 5-HT3 受体功能似乎可能在调节 5-HT3 受体传递的有效性方面发挥作用。与其他 pLGIC(Thompson 和 Baenziger,2020)一样,5-HT3 受体活性也受膜脂环境的调节:胆固醇耗尽的细胞中 5-HT 诱发的电流减少,脂质部分,特别是与 M4 相邻的胆固醇分子,可能会稳定使用脂质纳米盘确定的受体结构中观察到的紧密堆积构象(Zhang 等人,2021 年)。与基于洗涤剂的结构相比,这些结构具有压缩的 TMD,并且由于 TMD α 螺旋倾斜度更大,因此开放通道更宽。这种脂质调节尚未得到广泛探索,但可以解释一些意外的数据,例如,5-HT3 受体 M4 突变 (Y441A) 在卵母细胞中表达时导致受体无功能,但在具有不同膜组成的 HEK 细胞中表达时则不会 (Crnjar 等人,2021)。
17.8 细胞生物学
Vogel 团队的优雅研究跟踪了 5-HT3 受体从“出生”到“死亡”的过程 (Ilegems 等人,2004)。在内质网 (ER) 和高尔基体中形成的 5-HT3A 受体以囊泡状结构沿微管运输到质膜。它们聚集在特定的亚细胞位点,这些位点可以通过 F-肌动蛋白 275 解聚来破坏。这些聚集体已在包括神经元在内的一系列细胞中得到确认,这与介导快速突触神经传递所需的精确解剖位置一致。激动剂与细胞表面 5-HT3 受体的相互作用可导致其内化和破坏或再循环。其他亚基的研究较少,但 5-HT3B 受体亚基单独表达时无法离开 ER,这可能解释了为什么这些亚基不能形成功能性同源受体。ER 保留至少部分归因于 CRAR 保留基序构成 M1–M2 细胞内环路的一部分 (Boyd 等人,
2003)。与 5-HT3A 亚基共表达可能屏蔽该 ER 保留基序,从而允许
异源 5-HT3AB 受体到达细胞表面。有证据表明
5-HT3B 亚基迫使优先表达异源 5-HT3 受体,因为
5-HT3A 和 5-HT3B 亚基在 tsA-201 细胞中的共表达并不表明存在同源 5-HT3A 受体。
人类 5-HT3A 亚基在 N 端 ECD 结构域中有四个一致序列 N-糖基化位点,并且所有位点都可以进行 N-糖基化。 N-糖基化对于 ER 输出、细胞表面表达和放射性配体结合至关重要,尽管受体成熟后无需保留配体结合位点 (Boyd 等人,2003)。
四个 N-糖基化位点中的三个在一系列物种 (N104、
N170 和 N186) 之间是保守的,并且似乎至关重要,而残基 28 处的 N-糖基化位点不太重要,在啮齿动物中确实不存在。
BiP、钙联蛋白和 RIC-3 已被鉴定为与 5-HT3 受体相关的 ER 伴侣蛋白,并且可能促进正确折叠、寡聚化、翻译后修饰和/或从 ER 输出 (Boyd 等人,2003)。 RIC-3 是研究最为广泛的一种,但它的作用取决于亚基、来源物种和表达系统。例如,转染的哺乳动物细胞中人类 5-HT3A 受体的表达因 RIC-3 而增强,但它会抑制 5-HT3AB 和小鼠 5-HT3A 受体的表达。这种明显的差异可能是由于其他蛋白质会影响 5-HT3 受体的表达。例如,环丝氨酸蛋白酶 A 通过整合肽酰脯氨酰异构酶活性促进细胞膜中 5-HT3A 受体的表达,并且可能还有一系列其他尚未确定的蛋白质可以改变 5-HT3 受体的表达。 17.9 通道病和治疗潜力
研究表明,5-HT3 受体功能障碍与一系列神经和胃肠道疾病有关(Niesler,2011;Walstab 等人,2010)。在患有双相情感障碍 (BPAD) 和精神分裂症的患者中发现了一些 SNP,这些疾病与涉及 11 号染色体上含有
HTR3A 基因的区域的细胞遗传学异常有关。在精神分裂症患者中发现了两种 SNP(R344H 和 P391R),
并且发现 BPAD 与 5-HT3A
亚基中的 P16S 突变有显著关联,报告构建体表明该突变体可以调节表达水平。
HTR3A 基因中的其他 SNP 导致 A33T 和 M257I 亚基变体,这两种变体都与细胞表面表达水平降低有关。在 5-HT3B 亚基中,对一种非常常见的 SNP Y129S 进行了广泛的研究,该 SNP 与女性的 BPAD 和重度抑郁症有关(Krzywkowski 等,2008 年)。Y129S 变体是一种功能获得性突变,因为与含有野生型 5-HT3B 亚基的异源受体相比,5-HT3AB(Y129S) 受体对 5-HT 的最大反应增加,脱敏和失活动力学降低,平均通道开放时间增加了七倍。对于由野生型 5-HT3A、野生型 5-HT3B 和
5-HT3B(Y129S) 亚基混合物组装而成的受体,中间效应显而易见,这表明杂合子和纯合子个体中通过 5-HT3AB 受体的信号传导受到该 SNP 的改变。
对最近发现的 HTR3C、HTR3D 和 HTR3E 基因的研究也表明可能与疾病有关,因为这些亚基与许多临床状况有关,包括化疗引起的恶心和呕吐 (CINV)、肠易激综合征 (IBS)、抑郁症和精神疾病 (Fakhfouri 等人,2019 年;
Walstab 等人,2010 年)。例如,5-HT3C 亚基 (N163K) 中的 SNP 与 IBS 相关,表达研究表明它会导致受体密度增加。
表达增加也与 HTR3E 基因的 3UTR 中的 SNP 有关,
该基因抑制微 RNA 的结合,也与 IBS 有关,
5-HT3 受体拮抗剂是有效的止吐药,最初用于放射治疗和
CINV,但现在也被广泛用作更普遍的呕吐治疗方法 (Sanger and
Andrews 2018)。常用药物包括昂丹司琼、格拉司琼和帕洛诺司琼,
统称为司琼。帕洛诺司琼是最有效的,结构数据显示,它的刚性和与结合位点中捕获的水分子的相互作用都有助于它与正构位点的高亲和力结合(图 17.2;
Zarkadas 等人,2020 年)。研究表明,多种其他疾病都有可能用 5-HT3 受体选择性药物治疗,包括抑郁症反应、精神分裂症、药物戒断、成瘾、瘙痒、呕吐、偏头痛、慢性心痛、贪食症和神经现象(如焦虑、精神病、伤害感受和认知功能)(例如,Fakhfouri 等人,2019 年;Sanger 和 Andrews,2018 年)。免疫细胞中 5-HT3 受体的鉴定也表明 5-HT3 受体可能在免疫过程和炎症中发挥作用,包括动脉粥样硬化、肌腱病和纤维肌痛。
279
18
GABAA 受体
Trevor G. Smart 和 Martin Mortensen
18.1 简介
为了实现连贯和受控的兴奋性大脑活动,并最终实现行为,中枢神经系统依靠神经元抑制来限制和塑造神经元兴奋性的程度。在中枢神经系统 (CNS) 中,抑制主要由普遍存在的抑制性神经递质 GABA 介导,GABA 可增加细胞膜电导率并电分流兴奋性活动。这会产生两个后果:使细胞膜超极化以降低动作电位激发的可能性;增加膜电导率以降低(分流)兴奋性突触电位,防止突破尖峰激发阈值。为了启动抑制,GABA 会迅速激活离子型 GABAA 受体 (GABAAR),无论是短暂的还是持续的,从而实现跨膜 Cl- 通量。它还会激活代谢型 GABAB 受体,后者通过 G 蛋白激活向众多下游效应器发出信号。在这里,我们重点关注 GABAAR 家族(Olsen 和 Sieghart,2009 年;Sieghart 和 Sperk,2002 年)。 GABAAR 属于五聚体配体门控离子通道家族(以前称为 Cys-loop 受体家族),其中包括烟碱乙酰胆碱受体、3 型 5-羟色胺受体、甘氨酸受体、Zn2+ 激活阳离子通道、来自紫色黏菌 (GLIC) 和菊欧文氏菌 (ELIC) 的细菌同源物,以及来自秀丽隐杆线虫的谷氨酸激活 Cl- 通道(Corringer 等人,2012 年)。 18.2 受体亚基多样性和结构
对于 GABAAR,已鉴定出八个离散亚基家族:α1–6、β1–3、γ1–3、δ、ε、π、
ө 和 ρ1–3,共 19 个亚基 (Sigel and Steinmann, 2012)。这为受体组成提供了内在的多样性,理论上,这种多样性可能非常广泛,但实际上,神经元中表达的天然受体亚基组装体要少得多 (Olsen and Sieghart, 2009)。其中最突出的是含有 αβγ 和 αβδ
亚基的受体,它们填充抑制性突触和突触外域,以及不太常见的 αβ 同工型 (Olsen and Sieghart, 2009) 和含有 ρ
亚基的受体。 GABAAR 的性质受到特定亚基的强烈影响。因此,就其功能特性而言,根据它们是否包含 α1–3 和 α5 亚基,或 α4 和 α6 亚基,将它们分为不同的簇。此外,β 亚基的存在对于在细胞表面表达 GABAAR 是必不可少的。
使用 X 射线晶体学和低温电子显微镜 (cryo-EM) 对原型抑制性突触受体(由 α1β1-3γ2 亚基组成)进行分析,可以实现近原子级分辨率的 GABAAR 结构(Laverty 等人,2019 年;Phulera 等人,2018 年;Kim 等人,2020 年;Kim 和 Hibbs,2021 年)。这些结构证实了五聚体中两个 α、两个 β 和一个 γ 亚基的化学计量基本一致,且亚基位置大多已确定。当从突触后膜平面上方观察 αβγ 受体并逆时针读取时,这种排列为 β–α–β–α–γ(图 18.1)。胞外结构域 (ECD) 和离子通道前庭包含受体的大部分残基(~60%),排列成两个反向平行的 β 链内片和外片阵列。跨膜结构域 (TMD;~20% 的残基) 容纳离子通道、受体激活和脱敏门以及离子选择性过滤器,它们由五个亚基中的每一个亚基的 α 螺旋簇束形成(图 18.1)。细胞内结构域(ICD;~20% 残基)在结构上仍未得到充分解析,是受体磷酸化和与受体相关分子相互作用的位点。GABAAR 的其他显著结构特征包括一条通过 ECD 和 TMD 的中央连续离子传导通路,在到达 ICD 之前穿过通道激活和脱敏门;位于 ECD 底部的 Cys 环,虽然并非存在于所有五聚体配体门控离子通道中,但在将神经递质结合与离子通道激活进行沟通方面起着至关重要的作用(Miller 和 Smart,2010 年)。
18.3 受体运输和聚集
突触 GABAAR 聚集在抑制性突触处,这需要受体相关分子(图 18.2)在细胞表面附近提供支架/锚定支持ace 膜。受体簇是动态的,通过翻译后修饰
GABAAR 和/或其支架,可以调节受体表达水平和运输,从而影响功能和可塑性 (Luscher 等人,2011;Araud 等人,2010)。
Gephyrin 是一种自组装支架蛋白,通过锚定和聚集
蛋白质,为甘氨酸能
和 GABA 能突触提供有序的信号突触后密度框架。它通过形成将受体亚基连接到细胞骨架的晶格结构来固定抑制性突触处的 GABAAR (Tyagarajan 和 Fritschy,
281 GABAA 受体
2010)。因此,它是定位抑制性突触的可靠标记。 GABAAR α1–3 亚基直接与 gephyrin 结合 (Tretter 等人,2008),这合理地解释了为什么某些 GABAAR 聚集在突触处 (图 18.3),而其他 GABAAR 则不聚集,例如 α4βδ。此外,α5 亚基可以与另一种细胞骨架支架分子 radixin 连接,这使得 α5βγ 受体能够定位在突触外,只有在 α5 受体-radixin 连接断开后才会扩散到突触中。其他几种蛋白质也可以与 GABAAR 结合,包括 GABAAR 相关蛋白 (GABARAP)、Plic-1 和 Huntingtin 相关蛋白 1 (HAP-1)。这些蛋白质通过与 GABAAR 亚基的 ICD 相互作用来调节 GABAAR 的表面稳定性和运输(Luscher 等人,2011 年)(图 18.2)。另一种将 GABAAR 锚定在抑制性突触上的分子是由跨膜 GABAAR 调节性脂肪瘤融合伴侣样蛋白 3/4 (GARHLs) 提供的,它充当 GABAAR 的辅助蛋白,直接与细胞膜中 γ2 亚基的 TMD 和填充抑制性突触的跨突触结构分子神经连接蛋白-2 结合(图 18.3)。对于突触外 GABAAR,对其结合伴侣(如果有的话)的了解很少。唯一的例外是 α5-GABAAR,它与根蛋白连接以减缓其在细胞膜中的扩散。细胞粘附分子神经塑性蛋白-65 也与抑制性突触中的 α1 和 α2 亚基共定位,但不与 α3 亚基共定位。它还与 GABAAR 结构中的 α5 亚基相互作用。(A)象形图显示典型 GABAAR 亚基的模块化结构,包括细胞外结构域 (ECD)、跨膜结构域 (TMD;跨膜 α 螺旋,1-4) 和细胞内结构域 (ICD)。氨基酸连接区显示为蓝线。(B)从侧面观察的人类 α1β3γ2 突触型 GABAAR 五聚体结构。α 亚基为绿色,β 为红色,γ 为黄色。ICD 的结构未知,除 M1-M2 连接子外未显示。(C)并列的 β-α 亚基显示包含 GABA 结合位点。 β 亚基的环 C 以星号 (*) 为中心标记。 (D) 上图:从突触前释放的 GABA 分子的角度来看 GABAAR。离子通道是每个亚基的 M2 排列的中央孔。下图:与图 A 中的视图相同,但移除了 ECD,露出了 TMD。结构基于蛋白质数据库结构 6I53。
282 离子通道教科书第 II 卷
突触外域,表明它可能以亚型特异性方式锚定受体。
尽管 GABAAR 表现出以亚基依赖的方式定位到突触和突触外域的偏好(图 18.3),但它们在膜平面上也是横向移动的,这是补充抑制性突触受体的重要途径(Thomas 等人,2005 年)。
蛋白质与 GABAAR 的相互作用也受蛋白激酶的磷酸化调节,这些蛋白激酶靶向受体亚基及其相关分子,以调节受体的运输、组装和细胞表面稳定性。在 α4、β1-3 和 γ2 亚基的 ICD 中已确定了 GABAAR 的丝氨酸/苏氨酸和酪氨酸激酶磷酸化的一致位点(图 18.2 和 18.3)(Brandon 等人,2002 年)。通过磷酸化调节 GABAAR 运输是确定细胞表面受体数量以及突触和紧张性抑制程度的重要途径。考虑到受体的细胞表面分布,一致的观点是,由 α1-3βγ 亚基组成的 GABAAR 主要填充抑制性突触,而突触外区将容纳 α4βδ 或 α6βδ、α5βγ 和 αβ 同工型(图 18.3)。它们在表面膜中的横向移动性意味着 αβγ 受体也将存在于突触外区。相反,较少的 α4βγ 和 α6βγ 受体也可以是
图 18.2
GABAAR ICD 相互作用蛋白的结合位点。显示了
GABAAR α、β 和 γ 亚基的 ICD 一级序列的选定片段。这些说明了为受体亚基的蛋白激酶磷酸化和对 GABAAR 相互作用蛋白至关重要的结合基序而确定的共识序列。
PK(A-C),蛋白激酶;CaMKII,Ca2+/钙调蛋白激酶 II;TyrK,酪氨酸激酶;CaN,钙调神经磷酸酶;
GABARAP,GABAAR 相关蛋白;GODZ,高尔基特异性 DHHC(Asp-His-His-Cys)锌指蛋白;
BIG 2,布雷菲德菌素-A 抑制的 GDP/GTP 交换因子 2;AP2,网格蛋白衔接蛋白 2;Plic-1,将整合素相关蛋白与细胞骨架-1 连接在一起的蛋白质。(改编自 Luscher 等人,2011 年。)
283 个 GABAA 受体
存在于选定的抑制性突触中。总体而言,虽然很难准确确定突触和突触外位置的 GABAAR 亚型的相对权重,但一般来说,αβγ 受体在突触位点占主导地位,而 αβδ 位于突触外位点。除了 GABAAR 亚型在细胞水平上的表达不同之外,整个中枢神经系统和神经发育过程中的亚基表达模式也存在显著差异,尤其是 α 亚基 (Pirker 等人,2000;Hortnagl 等人,2013)。
18.4 受体激活和 GABA 结合位点
GABA 门控离子通道的主要目的是将 GABA 结合过程快速转化为离子通道开放。GABA 在受体上的两个位点结合,这两个位点由相邻的 β 和 α 亚基之间的界面定义。这些结合位点涉及称为结合环的 ECD
结构,其中已鉴定出六个(表示为 A–F),其中三个形成位点的主要“面”(P 或 +)(环 A–C,在 β 亚基上),其余三个(D–F)构成由
图 18.3
GABAergic 抑制性突触提供的互补面(C 或 –)。示意图显示了 GABA 突触和突触外膜的主要元素。GABA 在主要由
α1-3βγ 亚基组成的突触处释放(蓝色羽流)到 GABAAR 上。突触外受体将包括 α4 或 α6βδ 和 αβ 亚基组合(框)。对于
α5βγ(和其他 αβγ)受体(虚线框),突触外和突触位置都很明显。 α4、β 和 γ 亚基上标有磷酸化 (Phos) 的位点。绿色箭头表示受体进出细胞膜以及细胞膜内部的运输路线。GARLHs、GABAAR 调节性脂肪瘤 HMGIC 融合伴侣样 3 和 4 辅助亚基。锚定突触前和突触后结构的分子是神经连接蛋白和神经连接蛋白。
284 离子通道教科书第 II 卷
相邻 α 亚基(图 18.4A)(Miller 和 Smart,2010 年)。这些环内的突变残基会显著影响 GABA 的效力和受体的激活状态,环 A、D 和 E 的一些突变使 GABAAR 能够在没有 GABA 的情况下自发激活。低温电子显微镜结构显示,正构 GABA 结合位点由芳香族残基的“盒状结构”形成,这些芳香族残基协调 GABA 分子的位置,参与阳离子-π、H 键、静电和盐桥形成,并与并列残基结合。GABA/激动剂与正构位点结合后,环 C 向受体界面闭合,从而固定结合的激动剂分子。这先于亚基 ECD 的逆时针旋转和 GABA 结合 β-α 亚基界面的压缩,从而导致离子通道中的激活门打开。相比之下,对于结合竞争性拮抗剂,特别是占据神经递质结合位点的大体积拮抗剂,例如 bicuculline,环 C 会远离受体,并且不会发生 ECD 旋转或 β-α 界面压缩,从而导致受体无法激活。
虽然我们缺乏“开放、激活” GABAAR 的精确高分辨率结构细节,但与其他配体门控离子通道结构的比较表明,GABA 结合环的耦合会产生构象变化,从而实现受体激活,从而打开通道。这涉及受体 ECD 和 TMD 之间的关键接口。在这里,ECD 的环 2、7 和 9 可能与 TMD 的 pre-M1 区域和 M2-M3 接头相互作用,从而实现通道打开(图 18.4B)。这种由 ECD 和 TMD 界面形成的支撑受体操作的功能性连接依赖于疏水和静电相互作用。对于抑制性突触处的 αβγ 亚基 GABAAR,它们将被突触前释放的 GABA 激活,达到毫摩尔浓度,从而引起短暂的突触抑制 (Farrant 和 Nusser,2005)。然而,在突触外区,GABAAR(例如 αβδ 亚基)将暴露于低得多的(纳摩尔)GABA 浓度,从而导致持续的紧张性抑制 (Brickley 和 Mody,2012)。
图 18.4
GABAAR 正位点结合环和用于激活的结构域。(A)并列的 β 和 α GABAAR 亚基的部分细胞外结构域。以分离格式显示界面及其主(P,+)侧和互补(C,-)侧,其中显示反向平行 β 片层阵列和六个神经递质结合环(A–C 和 D–F),以及结合的 GABA 分子。(B) GABAAR 的 ECD 和 TMD 之间的界面区域对于配体结合后的激活至关重要。这包括 ECD 的环 2、7 和 9;以及 TMD 的 pre-M1 接头和 M2–M3 接头区域。星号 (*) 表示表征这些五聚体受体的 Cys-Cys 桥。
285 GABAA 受体
18.5 离子通道域:传导和离子选择
GABA 离子通道由五个 M2 α-螺旋组成的环形成,每个受体亚基贡献一个螺旋(图 18.1D)。组成离子通道的残基用数字撇号表示。通道以通道细胞内末端保守的精氨酸残基(指定为 0’)为起点,向外部门户延伸,大约在 20’–22’ 处。这种表示法便于比较五聚体配体门控离子通道家族(Miller and Smart,2010)。GABA 离子通道中间附近 9’ 处有一个收缩,由疏水残基(亮氨酸、缬氨酸)的同心环形成,形成激活门。GABA 诱导的通道开放将涉及 M2 α 螺旋向 M1 和 M3 向外收缩,从而加宽 9’ 亮氨酸(环)激活门以促进阴离子通量。GABA 离子通道的电导是恒定的,配体门控离子通道家族的其他成员也具有这一特征。对于 αβγ 和 αβδ 受体,单通道电导率约为 28-30 pS。相比之下,对于 αβ 异聚体,单通道电导率降低约 50% 至 12-16 pS。亚电导状态(~50% 的主状态)也观察到,但总体而言,对于大多数 GABAAR 来说,与主通道电导状态相比,这些事件相对罕见。
通道两端都有带电残基环(谷氨酸、精氨酸),它们共同在确定 GABA 通道中的离子选择性方面发挥关键作用(Keramidas 等人,2004 年;Nemecz 等人,2016 年)。GABAAR 离子通道对阴离子具有选择性,在生理条件下,PCl>PHCO3 约五倍,可实现对 Cl– 和 HCO3– 的渗透性 (P)。离子选择最初被认为发生在离子通道深处 2’ 至 -2’ 处,其中脯氨酸残基 (-2’) 和丙氨酸残基 (-1’) 起着关键作用,该区域总体呈现正电性。然而,阴离子选择也可能发生在离子渗透途径的更早阶段,例如 TM2 中的 13’(苏氨酸残基),甚至更早发生在构成 ECD 一部分的通道外部前庭。近细胞内的离子选择性过滤器还覆盖了离子通道中的收缩,这归因于由疏水残基组成的“脱敏门”(Gielen 等人,2015 年),当 GABAAR 持续激活时,该门会关闭。受体的这种封闭状态经常在原子级低温电子显微镜结构中表现出来(Laverty 等,2019),这表明它很可能是一种动力学稳定状态。
18.6 GABAAR 的生物物理特性:
亚基组成的影响
GABAAR 的生物物理特性取决于其亚基组成。
从生理学上讲,对 GABA 的敏感性,以及受体失活(GABA 解离后通道关闭)和脱敏(GABA 持续结合时通道关闭)的程度都因组装成 αβγ GABAAR 的 α 亚基异构体而异(图 18.5)。评估 GABA 引起受体激活的效力可发现三组:
含有 α6 亚基的受体对 GABA 的敏感性最高,其次是 α1、α4 和 α5 亚基的敏感性中等;含有 α2 和 α3 亚基的受体敏感性最低 (Mortensen 等人,2011)(图 18.5A)。受体 β 亚基表现出高度同源性,即便如此,含有 β3 亚基的 αβγ 受体大约是
286 离子通道教科书第二卷
图 18.5
突触和突触外 GABAAR 的特性。 (A) GABA 效力的“卷尺”象形图(定义为 EC50;n,纳;μ,微;m,毫摩尔)可激活一系列突触型和突触外型
GABAAR。 (B) GABAAR 生物物理特性象形图。卷尺显示由 αβγ 亚基组成的突触型受体的 GABA 电流激活(从 10% 到 90% 最大电流,顶部)、失活(GABA 解离,中间)和脱敏(GABA 结合闭合状态,底部)的时间常数 (τ)。 (C)
0.1(橙色)、1(红色)和 100 µM(蓝色)GABA 快速应用于表达 αxβ3γ2 GABAA 受体的 HEK293 细胞,激活全细胞 GABA 电流曲线。注意不同的脱敏和失活曲线。
(Currents 改编自 Mortensen 等人,2011 年。)
287 个 GABAA 受体
对 GABA 的敏感性比含 β1 或 β2 亚基的受体高五倍(图
18.5A)。对于突触外含 δ 亚基的 GABAAR,或仅 αβ 二异聚体组合,GABA 效力也取决于 α 亚基的身份,其中α6 受体(α6βxδ、α6βx)对 GABA 的敏感性最高,其次是 α4 和 α1 受体,α3 受体敏感性最低,其中 X = 1–3。α 亚基还影响 GABAAR 激活、失活和脱敏的动力学参数。对于激活,α1 和 α2 亚基受体通常以亚毫秒速度快速,而 α4 和 α6 受体需要 1–2 毫秒,α3 和 α5 受体在 2 到 10 毫秒之间激活(图 18.5B)。反映 GABA 解离的失活率
总是比激活慢一个数量级,其中 α4 和 α5 亚基受体失活最快,其次是包含 α1 和 α2 亚基的中间组,α3 和 α6 失活最慢
(图 18.55B)。进入脱敏状态是 GABAAR 的一个常见特征。
通常,脱敏率最好用两个指数时间常数来描述
,其中包含 α1、α2 或 α4 亚基的受体脱敏最快,其次是 α3
和 α6 亚基受体,α5 亚基受体脱敏最慢
(图 18.5B)。
18.7 GABAAR 的调节
许多配体具有当前或潜在的治疗价值,它们可以从一系列离散的结合位点调节 GABAAR,包括直接作用于神经递质结合位点或通过结合到一个或多个变构位点进行。受体上的三个主要地理结合位点类别可以区分为:ECD、TMD 和“离子通道”。这些类别并不相互排斥,区分结合位点残基和信号转导途径通常并非易事。
18.7.1 ECD 界面结合位点:激动剂
神经递质结合位点是界面结合位点的典型例子,位于 β 和 α 亚基之间(图 18.6A)。这是许多 GABA 激动剂的作用位点。对于突触型 αβγ 受体,GABA、蝇蕈醇和异戊酸酯是完全激动剂(具有相似的相对宏观效力,均为 1),其效力顺序为蝇蕈醇 > GABA > 异戊酸酯。其他激动剂可分为几类部分激动剂,具有不同的效力和宏观效力。例如,THIP 和异哌啶酸的效力低于 GABA,与 GABA 相比,相对宏观效力约为 0.8。哌啶-4-磺酸和咪唑乙酸的相对效力约为 0.4,效力与 GABA 相似或降低。非常弱的部分激动剂以 Thio-4-PIOL 和 4-PIOL 为代表,效力较低,相对效力较低,为 0.01 – 0.05。 18.7.2 界面结合位点:拮抗剂
竞争性拮抗剂(如 bicuculline 和 gabazine)均与 GABAAR 上的 GABA(正位)位点结合。然而,这两种拮抗剂都会抑制由神经类固醇(例如,alphaxolone)或巴比妥类药物(例如,戊巴比妥)引发的 GABAAR 活性,这些药物与不同于 GABA 位点的位点结合。由于这些拮抗剂不竞争类固醇和巴比妥类药物位点,因此它们能够进行变构抑制(称为负变位调节剂),这表明它们不仅仅是通过与 GABA 竞争来阻断正位结合位点。
18.7.3 界面结合位点:正变构调节剂
五聚体 αβγ GABAAR 包含五个亚基-亚基界面;其中四个因并列的亚基配对而不同(两个 β-α;α-β、β-γ 和
α-γ 各一个;图 18.6A)。α-γ 界面很重要,因为苯二氮卓类 (BDZ) 在此处结合,增强受体功能但无法激活受体。考虑到 BDZ 位点的界面位置,γ 亚基是 GABAAR 对
BDZ 敏感性的关键要求也就不足为奇了。然而,也依赖于存在的 α 亚基的类型,α1–3 和 α5 显示 BDZ 敏感性,而 α4 和 α6 亚基受体
图 18.6
GABAAR 配体结合位点。 (A) αβγ 突触 GABAAR 的平面图,显示 GABA 和苯二氮卓类药物 (BDZ;箭头) 的 ECD 界面结合位点。 (B) 神经类固醇、巴比妥类药物 (barbs)、丙泊酚和依托咪酯的 TMD 界面结合位点的平面图。 ECD 已被移除。 (C) TMD 和离子通道
结合和转导残基。 左图描绘了 TMD M2 α-螺旋的平面图。 亚基用红色 (β)、绿色 (α) 和黄色 (γ) 进行颜色编码。 选定的离子通道残基显示在单个 β–α 界面上。这些
残基映射到右面板示意图中显示的 β 和 α 亚基 M2 片段(基于蛋白质数据库结构 6I53 和 6DW0,并使用素数符号)。元素也用颜色编码:O,红色;
N,深蓝色。右面板:影响药物和离子调节的残基在此处以粗体红色表示,并通过红线链接到离子/配体面板。这些残基以各种方式形成结合或配位位点的一部分,
和/或参与信号转导。
289 GABAA 受体
不。这是因为 BDZ 敏感性取决于 α 亚基 1-3 和 5(α1 中的 H101)ECD 中的组氨酸残基,该残基被 α4 和 α6 中的精氨酸取代。结合地西泮的 Cryo-EM
GABAAR 结构不仅表明在 α+/γ– 界面处结合,而且在每个 β+/α– 界面处都存在于 TMD 中,并且在 γ+/β– 界面处与 TMD 中的巴比妥类结合位点重叠(Masiulis 等人,2019 年;Kim 等人,2020 年)。
这些其他位点的功能后果还有待观察,但可能涉及稳定受体蛋白的结构组织。
18.7.4 界面结合位点:非 GABA 结合界面
GABA 不结合的另一个界面位于 α 和 β 亚基 (α+β–) 之间,我们对此知之甚少。对众多化合物的筛选已确定了一种抗焦虑吡唑喹啉基化合物 CGS9895,它可作为 α+/γ– BDZ 位点的拮抗剂,也可作为变构调节剂,通过结合 α+β– 界面增强 GABA 电流。
CGS9895 的结构类似物也在此位点起作用,鉴于界面的特殊性质,可以预测由占据此位点引发的调节可能取决于 β 亚基和 α 亚基的身份。事实上,据报道,α6β2/3γ2 受体特异性调节剂通过与 α6+β– 界面结合,优于 α1–5β2/3γ2 受体。
这一发现表明,作用于 α+β– 界面的药物原则上能够调节 αβ、αβγ 和 αβδ 受体(即主要的突触型和突触外型 GABAAR),而不会引起直接受体激活。因此,它们的治疗范围将超过 BDZ,后者需要包含 γ 亚基(以及 α 和 β 亚基)才能进行功能调节。
18.7.5 跨膜结构域结合位点:亚基内和界面
GABAAR 上另一个被药物靶向的主要区域是 TMD。正是在这里,
几类吸入和静脉麻醉剂、巴比妥类药物和内源性调节性神经类固醇分子有其结合位点(图 18.6B)(Hosie 等人,
2006 年;Yamakura 等人,2001 年;Kim 等人,2020 年)。
α1β2/3γ2 GABAAR 的低温电子显微镜结构表明,对于苯巴比妥(巴比妥类药物),
在两个 TMD 界面处明显存在结合:α+/β– 和 γ+/β–,但在 β+/α– 界面处不存在结合,
这与结构功能研究之前认为的不一样(Kim 等人,2020 年)。巴比妥类药物特有的巴比妥酸基团位于相邻亚基的 M3 和 M1 α-螺旋之间,导致巴比妥类药物分子在 M2 中 15' 的水平上结合,在 M1 形成的口袋内,位于 M2-M3 连接体正下方,该区域对于受体激活非常重要。TMD 附近的分子与 BDZ 不同,不仅能增强受体功能,而且还能在没有 GABA 的情况下直接激活。传统上,这两种效应被认为是通过两个不同的结合位点进行的,但现在显然一个位点可以介导这两种效应。为了找到麻醉剂结合位点,首先使用了 Cys 环受体的细菌同源物 GLIC(Corringer 等人,2012 年)。麻醉剂丙泊酚或地氟烷原位结合的 GLIC 晶体结构表明麻醉剂的结合位点位于单个亚基内(亚基内)。对于 GABAAR,附着在丙泊酚上的二氮杂环丙烷光标记物可识别 β 亚基离子通道中的残基,该残基距离 GLIC 中的丙泊酚结合位点以及之前在 GABAAR 中发现的另一种麻醉剂阿齐托咪酯的光标记结合位点相当远。使用结合丙泊酚或依托咪酯的低温电子显微镜结构揭示了 TMD 中的共享结合位点(Kim and Hibbs,2021),但仅在 β+/α– 界面处。这些麻醉剂在任一界面的结合都是相同的,依托咪酯的苯环与 β 亚基中的 N265 并列,水平为 15' - 已知会影响麻醉活性的残基。
在 TMD 深处,靠近细胞膜内叶,是大脑中内源性神经类固醇分子的结合位点,这些分子可以增强、直接激活并抑制 GABAAR 功能。使用 X 射线晶体学和光标记,发现四氢脱氧皮质酮和别孕酮(均为 GABAAR 的正变构调节剂)在 β+/α- 界面结合。神经甾体将相邻亚基的 M3 和
M1 α-螺旋与 β 亚基 F301 和 α 亚基 Q241 形成 H-键 (Laverty 等人,2017;Miller 等人,2017)。对于抑制 GABAAR 功能的抑制性神经甾体,例如
孕烯醇酮硫酸盐,在受体 TMD 中初步确定了一个离散位点,涉及 M3 和 M4 α-螺旋 (Laverty 等人,2017)。
18.7.6 跨膜结合位点:Ion 通道孔
药物作用于 GABAAR 的第三个主要区域涉及离子通道孔(图
18.6C)。在这里,可以很容易地识别出排列在离子通道腔内的残基,这些残基可以结合配体和离子。
在 β 亚基中,组氨酸残基 (17’) 是 Zn2+ 的主要配位位点。这种二价阳离子可作为 GABAAR 的受体亚型选择性抑制剂,有效且可逆地抑制 αβ、αβδ 受体功能(纳摩尔-低微摩尔浓度),优于
αβγ 同工型(>300 μM)。这种组氨酸的突变会显著降低 Zn2+ 的效力,但要完全消除 Zn2+ 的敏感性,则需要在 α+β– 亚基界面的 ECD 中突变额外的残基(α1 亚基中的 E147 和 H141,以及 β 亚基中的 E182)(Hosie 等人,2003 年)。αβγ 受体对 Zn2+ 抑制的敏感性降低是由于用缺乏 Zn2+ 结合残基的 γ 亚基(β–α–β–α–β)替换 αβ 二异聚体(β–α–β–α–β)中的 β 亚基所致。
质子将调节 GABAAR,根据受体亚基组成引起电流的增强和抑制(Krishek 等人,1996 年)。对 Zn2+ 抑制很重要的组氨酸残基也在 GABAAR 的质子敏感性中起着关键作用,尽管其他残基,尤其是 β 亚基的 M2-M3 连接体和 ECD 中的残基,也很重要。
进一步进入通道,β2/3 亚基中的另一个关键残基是 15' 处的天冬酰胺 (N)(图 18.6C)。它被 β1 中的丝氨酸取代,这足以消除几种治疗和实验药物对 GABAAR 的调节:洛雷克唑(抗惊厥药)、甲基 6,7-二甲氧基-4-乙基-β-咔啉(DMCM,一种苯二氮卓类负变构调节剂)、依托咪酯(麻醉剂)、呋塞米(利尿剂)和甲芬那酸(抗炎药)。 15’残基的重要性在于它不易从通道腔中获取,当受体含有 β2 或 β3 亚基,但不含有 β1 亚基时,洛雷克唑可增强 αβγ GABAAR 的功能(Wingrove 等人,1994 年)。将 15' 天冬酰胺插入 β1 可使 αβ1γ 受体对洛雷克唑敏感,这也是 DMCM 的一个特点,DMCM 被认为与苯二氮卓位点 α+γ– 亚基界面结合,但很明显其调节受 β2/3 中 N290 的影响。利尿剂呋塞米也表现出依赖于 15'N 的 β 亚基选择性,尽管 GABAAR 中其他地方的残基(例如 M1 中的残基)对其调节作用很重要。这五种药物中的另一个成员甲芬那酸是 GABAAR 的调节剂,它也依赖于 15'N,导致 α1β2/3γ 和 α1β2/3 受体增强,但抑制 α1β1 受体。最后,麻醉药依托咪酯是 GABAAR 的增效剂,同样显示出对 β2/3 受体的偏好。用 15'N 取代 β3 可降低依托咪酯直接诱导的电流及其对 αβ3γ2 受体的 GABA 调节作用。
在缺乏结构背景的情况下,从这些观察中自然产生的问题是 β2/3 亚基中的 15' 天冬酰胺是否构成通用结合位点的一部分或代表信号转导的关键区域。比较甲芬那酸、依托咪酯和洛雷克唑的化学结构表明,它们的疏水性和电负性部分可以以最小能量构象重叠,这与共享相似的结合位点一致。然而,其他证据反对单一结合位点。用阿齐托咪酯进行光标记以及低温电子显微镜数据表明,麻醉剂与 GABAAR 上的 β+/α- 界面位点结合。此外,呋喃酰胺严重依赖于 M1 中的其他残基,并显示出对含有 α6 亚基的受体的偏好。总体而言,证据表明 15' 天冬酰胺不太可能形成结合位点的一部分,并且可能参与转导途径。深入 GABA 离子通道孔,朝向内部门户,揭示了所有 GABAAR α 亚基中保守的其他关键残基,即 6' 处的苏氨酸和 2' 处的缬氨酸(图 18.6C)。这些残基在倍半萜类惊厥剂苦味毒素对 GABAAR 的非竞争性混合拮抗作用中起重要作用,并且很可能在某些其他配体(例如叔丁基双环磷硫酯 (TBPS))中起重要作用。α1β2/3γ2 受体的低温电子显微镜结构显示苦味毒素位于离子通道中,结合在 9' 激活门之外的 6' 至 2' 区域内,位于离子通道深处。这
反映了一种典型的离子通道阻断机制,它也位于脱敏门附近(Gielen 等人,2015 年),当该门关闭时,可能会损害苦味毒素的结合。
仔细检查苦味毒素的通道位置发现,其异丙烯基
接近 9' 亮氨酸环,环外氧原子与 6' 环残基形成 H 键(Masiulis 等人,2019 年)。苦味毒素当通道关闭时,也会被“困”在离子通道中。然而,苦味毒素的抑制方式比简单的开放通道阻滞更复杂,有几项研究提出了异位抑制作用。未来的结构研究无疑将阐明这一问题和其他结合位点争论。
18.8 结论
各种亚基和 GABAAR 同工酶,其生理特性具有内在差异,提供了一个多样化的信号平台,可影响单个神经元和神经网络的活动模式。通过在神经元细胞表面膜的关键点表达受体,以及通过控制其亚基组成来改变受体生理,可以对兴奋性进行精确控制。这些不同的受体同工酶如何在单个细胞内发挥作用,以及它们的相对重要性,仍然是一项难以解决的任务。拥有更多特定药剂将会大有裨益。GABAAR 对多种药物敏感,其中一些确实表现出受体亚型选择性。研究 GABAAR 的另一种方法是开发光化学配体。此类分析工具可用于探索受体激活对暴露于光子的膜域的影响。主要地,光敏配体的构象可以通过光相互改变,可以快速影响受体功能。此外,非活性 GABA 分子可以通过光“释放”,以绘制 GABAAR 密度和沿神经元过程的聚类。总体而言,鉴于 GABAAR 的治疗组合,开发针对特定受体异构体的选择性配体显然是一个值得称赞的目标。甘氨酸受体
Josip Ivica 和 Lucia Sivilotti
19.1 简介
甘氨酸在 20 世纪 60 年代首次被确定为哺乳动物中枢神经系统的抑制性递质。后来发现甘氨酸对通过 NMDA 型谷氨酸离子通道进行的谷氨酸能兴奋性信号传导也很重要,这种通道需要谷氨酸和甘氨酸才能激活(见第 16 章)。本章重点介绍抑制性甘氨酸受体 (GlyR)。这些受体对士的宁敏感,具有阴离子通透性,属于五聚体配体门控离子通道 (pLGIC) 超家族,该家族包括 GABA 受体 (GABAR)、肌肉烟碱乙酰胆碱受体 (nAChR) 和 3 型血清素受体 (5-HT3R)(分别参见第 18、15 和 17 章)。GlyR 在神经系统的尾部区域尤其重要,尤其是脊髓和脑干。在人类中,在甘氨酸突触处发现的蛋白质的可遗传突变,特别是 GlyR 亚基,会导致惊吓病/过度惊吓症,这是一种非常罕见的神经系统疾病。 19.2 亚基多样性和基本结构组织
GlyR 是从哺乳动物脑中分离出的第一个 pLGIC,这直接导致了形成成人突触受体的亚基基因的克隆:α1 和 β。小鼠中已知有五个 GlyR 亚基基因,α1–α4 和 β(GLRA1-4 和 GLRB;图 19.1a)。在人和大鼠中,一个亚基 α4 可能是假基因,因为跨膜螺旋 4(M4;图 19.1b)中有一个终止密码子。不同 α 亚基之间的序列相似性较高 (~85%),尤其是 α1 和 α3 之间、α2 和 α4 之间以及同一亚基的不同物种之间,但 α 亚基和 β 之间的相似性较低 (~60%;对于
M2,参见图 19.1c)。
额外的多样性来自可变剪接。一个值得注意的例子是在 β1–
β2 环中(位于胞外域底部;图 19.1d),其中 α2A 具有 VT,而
α2B 在位置 58–59 具有 IA。这些残基与 α1 中的 IA 51–52 对齐,它们对信号转导很重要:在 α1 中,A52S 导致功能丧失通道病(痉挛小鼠;Ryan 等人,1994 年)。第二个值得注意的剪接位点位于 M3 和 M4 之间的细胞内环中,其中已知 α1 和 α3 的长变体和短变体,分别相差 8 个和 15 个氨基酸。长变体和短变体转录本和亚基的相对丰度取决于物种,但它们的功能意义尚不清楚。在异源表达中,α 亚基非常有效地形成功能性同源受体,而 β 单独不能形成功能性 GlyR(Bormann 等人,1993 年)。如果 α β
图 19.1
(a) 小鼠 α 和 β GlyR 亚基基因的系统发育图。(b) GlyR 五聚体的组织,显示亚基界面处的激动剂结合位点(示意图为深蓝色椭圆;+ 和 – 分别表示主侧和互补侧)和跨膜螺旋,M2 排列在孔内。 (c)M2 螺旋和 M2–M3 环的序列比对(保守残基用方框括起来)。M2 编号遵循 pLGIC 惯例,高度保守的 L 位于 M2 中间的 9′(α1 基质中的 261ure 亚基)。
-2′ 至 2′ 残基位于开放通道的最窄部分,2′ G(蓝色)是同源 α1 GlyR 电导率的决定因素。红色残基显示最早表征的惊吓病
α1 突变的位置。(d)斑马鱼 α1 GlyR 在脱位静息状态下的低温电子显微镜结构(蛋白质数据库:6PXD)。
右侧面板显示单个亚基,其中注释了链、环和跨膜螺旋。该结构来自长 M3-M4 环被短三肽接头替换的构造。(e)ECD 结构显示激动剂结合位点的位置(深蓝色椭圆形)。为了显示清晰,两个亚基之间的距离比在受体中的距离更远。请注意,β2 和 β6 链也称为环 D 和
E。扩展面板显示甘氨酸和牛磺酸与斑马鱼 α1 GlyR 结合(蛋白质数据库:6PM6 和
6PM2;残基编号与成熟亚基相同,两个 α 亚基之间没有额外的间距;Yu 等人,2021 年)。
297 甘氨酸受体
需要异源 GlyR,建议转染过量的 β DNA 构建体
以减少 α 同源体的污染。
从天然哺乳动物组织中提取的异源 GlyR 的结构证据
显示 4 α 到 1 β 亚基的化学计量(Zhu 和 Gouaux,2021 年)。
19.2.1 结构组织
已经解析了几种同源 GlyR 结构,包括斑马鱼 α1
GlyR(Du 等人,2015 年;Kumar 等人,2020 年;Yu 等人,2021 年)和人类 α3 GlyR(Huang 等人,2015 年)的结构。这些结构显示出常见的 pLGIC 特征(图 19.1d)。N 端胞外结构域 (ECD) 由十条通过环连接的 β 链组成,β 链 6 和 7 之间有高度保守的 Cys 环。激动剂结合位点位于 ECD 亚基界面(图 19.1b、e),当从 ECD 上方观察通道时,亚基中的主 (+) 侧位于口袋的逆时针方向。对结合位点有贡献的最重要的片段是 (+) 侧环 B 和 C 以及 (–) 侧链 β2 和 β6 (也称为环 D 和 E;图 19.1d)。结合口袋附近的其他残基可能稳定其形状。当受体未结合(apo)或与竞争性拮抗剂士的宁结合(与激动剂/正构位点结合,但保持其处于扩张状态)时,受体在静息状态下分解。与激动剂(有或没有调节剂)结合的 GlyR 的结构可以是闭合的(预开放或脱敏)或开放的(Du 等人,2015 年;Huang 等人,2017 年;Kumar 等人,2020 年;Yu 等人,2021 年)。 ECD 后面是跨膜结构域的四个螺旋(M1–M4;
图 19.1b、d):M2 在 α 亚基中高度保守,对通透性和电导性的影响最大,因为它排列在孔内(图 19.1b、c;参见第 19.5 节)。
在 M2 的中间,我们发现了 α 和 β 亚基中的典型 pLGIC Leu 残基(为了便于跨亚基比较,M2 残基从细胞内到细胞外侧编号 - 在这个素数编号系统中,所有 pLGIC 中的中间 Leu 都是 9′)。
在静止闭合状态下,不同亚基的 M2 螺旋大致平行,并且通道由疏水残基 9′–13′ 形成的激活门保持关闭,就像在其他 pLGIC 中一样。 M2 螺旋倾斜,其顶部向外以打开孔,并在脱敏通道中保持倾斜,其中孔由更深的 M2 残基保持关闭。跨膜螺旋之间的环很短,除了 M3-M4 环(约 80 个残基),它构成了细胞内结构域 (ICD)。该域主要是内在无序的,其结构在很大程度上尚未解决。ICD 对于突触定位很重要,因为它介导 GlyR 与支架蛋白 gephyrin 的相互作用,后者与 β 亚基的 M3-M4 环结合(Meyer 等人,1995 年),它也是 GlyR 通过磷酸化调节的底物。ICD 的急剧缩短(在为结构工作而设计的构造中很常见)增强了通道门控(Ivica 等人,2021 年)。 19.3 生理作用
GlyR 在视网膜和成人中枢神经系统(脊髓、脑干、延髓)的尾部区域最为丰富,它们在这些区域参与脊髓运动反射、呼吸节律调节和感觉处理,尤其是在脊髓和听觉通路中。
胚胎神经元主要表达 α2 GlyR 亚基,可能作为突触外同源受体。它们被周围的甘氨酸或牛磺酸激活会导致去极化(由于胚胎中枢神经系统中细胞内氯化物含量高),因此导致 Ca+2 进入,这可能对突触成熟很重要(Kneussel 和 Betz,2000 年)。
在成人中,突触后 GlyR 主要是 α1β 异聚体,介导快速抑制电流,这种电流通常比 GABA 能电流更快。
在大鼠旋转在脊髓中,转换发生在出生后两周 (Malosio 等人,1991;Singer 等人,1998),此时 α2 同源体独特的较高电导率和较慢动力学被 α1β 异源体 GlyR 的较小振幅和较短开口所取代 (图 19.2a;Takahashi 等人,1992)。α3 的水平在出生后也会增加,但该亚基的丰富程度仍低于 α1,并且其独特之处在于其在脊髓灰质的浅层(尤其是层 II)中的离散定位,其中甘氨酸能传递控制疼痛处理,并且 α3 可能在炎症引起的痛觉变化中发挥作用 (Harvey 等人,2004)。在成人中枢神经系统中,一些 α 同源 GlyR 存在于突触前末端,例如 Held 萼 (Hruskova 等人,2012;Turecek 和 Trussell,2001)。
β 是 GlyR 亚基中表达最广泛的,即使在几乎没有或没有 α 的情况下也是如此。其原因尚不清楚,因为 β 同源物不起作用 (Bormann 等人,1993)。
在发育过程中,突触前末端通常会释放甘氨酸和
GABA,每种都作用于自己的受体。在由此产生的混合突触事件群中,可以通过其更快的动力学和对低浓度拮抗剂士的宁的敏感性来识别甘氨酸能事件 (Jonas 等人,1998)。甘氨酸和 GABA 共同释放的另一种形式出现在听觉通路中,其中甘氨酸能抑制电流的衰减比 GlyR 通道失活更快,这是因为甘氨酸和 GABA 共同释放,两者都作用于 GlyR(Lu 等人,2008 年)。添加 GABA(GlyR 的弱部分激动剂)可使宏观电流对甘氨酸的响应比对单独甘氨酸的响应更快(并且略小)(图 19.2b)。
在比较单通道和突触事件的动力学时,检查记录条件很重要,因为高细胞内氯离子会减慢 GlyR 或 GABAR 失活。高氯离子通常用于细胞内溶液中以增加全细胞记录中的信号幅度,但它不是生理性的,因为在完整的成年神经元中,细胞内氯离子处于低毫摩尔范围内。通过将细胞内氯离子从 10 mM 增加到 130 mM(与细胞外氯离子浓度相似),甘氨酸能 gic 电流的衰减速度减慢了约两倍(Pitt 等人,2008 年)。
图 19.2
(a)GlyR 特性随发育而变化。3-10 μM 甘氨酸在胚胎第 20 天(左图)和出生后第 22 天(右图)大鼠脊髓神经元外向外贴片中引起的单通道电流。
请注意胚胎脊髓神经元记录中的较大振幅和较长的开口(来自 Takahashi 等人,1992 年)。(b)部分激动剂 GABA 的共同应用加速了大鼠梯形体内侧核外向外贴片中通过 1 毫秒激动剂应用引起的甘氨酸能电流的衰减。
记录是在存在 GABA 拮抗剂 SR-95531(20 μM)的情况下进行的。由甘氨酸和 GABA 的组合引起的电流(红色轨迹)具有较小的峰值和更快的失活(当响应缩放到峰值时更清晰,右图)(来自 Lu 等人,2008 年。)
299 甘氨酸受体
19.4 门控
含有 α1 亚基的 GlyR 异构体已被证明是单通道动力学的理想选择,旨在测量激动剂功效并通过将机制直接拟合到数据来定量了解通道激活。 GlyRs 具有相对较高的电导率,这为通道开放提供了良好的信噪比,高浓度的甘氨酸不会阻塞开放的 GlyR 孔(而激动剂在 nAChR 中会阻塞),因此可以直接从通道最大开放概率估计功效,而无需校正阻塞。
图 19.3a 显示了 α1β 异源 GlyRs 单通道活性的另一个有利于动力学分析的特性,即其对激动剂浓度的强烈依赖性。在低甘氨酸浓度下,开放很短,并且单独发生或以少数开放的群体发生。这些群体称为“爆发”,发生在激动剂结合时(在未结合的 GlyRs 中开放概率可以忽略不计)。爆发之间的关闭间隔
图 19.3
GlyR 单通道动力学。 (a 和 b) 甘氨酸或牛磺酸引起的细胞附着 α1β GlyR 单通道活性的浓度依赖性。记录来自转染了 α1 和 β GlyR 亚基的 HEK293,标称保持电位 +100 mV,向上打开。 (c) 使用 Hill 方程拟合的 (a) 和 (b) 中记录的开放概率浓度曲线。 (d) 详细的“翻转”激活机制,拟合单通道甘氨酸数据的 α1β GlyR,每个步骤的速率常数和平衡常数值。速率常数的单位为 s–1 或 M–1s–1。灰色箭头表示无法估计速率常数的步骤。 (e) 绘制的能量图图 19.3a 中显示了 GlyRs 完全结合到三个甘氨酸 (红色) 或牛磺酸 (蓝色) 分子上时的速率和平衡常数值 (面板底部),这些 GlyRs 处于开放状态。(数据来自 Burzomato 等人,2004 年和 Lape 等人,2008 年。)
300 离子通道教科书第二卷
开放反映了通道重新结合激动剂所需的时间,随着激动剂浓度的增加,开放时间会变短。然后爆发合并成开放簇,这些簇由较长的、脱敏的关闭时间隔离,并代表单个通道分子的活性。在图 19.3a 中,簇可以从 30 µM 开始定义,它们的开放概率在约 300 µM 时达到最大值(参见图 19.3c 中的浓度-开放概率曲线)。对于甘氨酸,该最大值较高(96%),甘氨酸是一种完全激动剂,结合后可使通道保持开放或脱敏。牛磺酸也会产生类似的行为,但牛磺酸是一种部分激动剂,其最大簇开放概率要低得多,为 54%(图 19.3b、c)。
随着更多激动剂分子结合,GlyR 的开放效果会更佳。当五个可能的结合位点中有三个被占用时,α1 同源通道和 α1β 异源通道的开放概率最大。GlyR 激活的详细描述由“翻转”机制给出(图 19.3d;Burzomato 等人,2004 年),其中一组额外的关闭前开放中间状态(“翻转”F 状态)将静止状态和开放状态联系起来,并且与激动剂的结合亲和力高于静止状态。进入中间状态是决定激动剂功效的重要因素:与甘氨酸相比,牛磺酸的功效较低,这是因为其驱动通道进入这些中间状态的能力较差(Lape 等人,2008 年)。在图 19.3e 的能量图中,这通过屏障高度(活化能)和两种激动剂与不同功能状态的平衡位置(水平条的水平)来显示。一旦达到中间状态,两种激动剂的打开能量屏障就相当相似,如与甘氨酸或牛磺酸完全结合的 GlyR 的速率和平衡常数值所示:两种激动剂之间的主要区别在于翻转的正向平衡常数值。斑马鱼 GlyR 中描述了中间状态的可能结构(Yu 等人,2021 年;Ivica 等人,2022 年):在高浓度的完全激动剂甘氨酸和氨基甲磺酸盐存在下,单粒子低温电子显微镜仅检测到两种通道状态(开放或脱敏,如单通道记录中所示),但在存在部分激动剂(如牛磺酸或 GABA)的情况下,激动剂结合的 GlyR 填充了一个额外的结构类,其中结合位点已紧固到激动剂上,但通道仍然关闭。这可能对应于部分激动剂引起的开口簇内的关闭时间(见图 19.3b 和 19.4b)。在 GlyR 中,使用图 19.3d 中的详细方案拟合单通道记录表明翻转状态很短(小于 10 µs),但这种非常短暂的状态可能只是打开前几个中间体中的最后一个,并且这些中间体的寿命更长(正如它们在结构工作中的可检测性所表明的那样),但动力学分析将其与静止关闭状态归为一类。
在其他 GlyR 亚型和其他 pLGIC(如 ELIC、nACh、5-HT3 和 GABAA 受体)中也发现了预打开中间体的证据。
19.5 离子渗透性和电导率
GlyR 对氯离子和碳酸氢根阴离子具有渗透性,并且对阴离子的选择性高于阳离子。在培养的脊髓神经元(可能是异源的)的 GlyR 中,钾与氯离子的通透性比率低于 0.05(Bormann,1987)。通透性顺序为 SCN– > NO3
– > I– > Br– > Cl– > F–,该顺序遵循水合阴离子尺寸减小的顺序。在测量 GlyR 电导率时(使用一种渗透性阴离子),该顺序与通透性顺序相反,Cl– >
Br– > I– >NO3
– > SCN–,这表明渗透性阴离子可能在两个结合位点结合在通道中(Bormann 等人,1987)。请注意,当渗透性离子浓度高时,它们在孔中的结合会减慢通道动力学(参见第 19.3 节)。透过 GlyRs 的最大有机阴离子是醋酸盐,表明孔径约为 5.2 Å
(Bormann 等人,1987 年)。在对称氯化物中,GlyR 电导是氯化物浓度的双曲线函数,在 108 mM 氯化物时电导率达到半最大值,仅在高于生理氯化物细胞外水平的浓度下达到最大值(Bormann 等人,1987 年)。与其他 pLGIC 一样,主要的电导决定因素位于 M2 螺旋中,细胞外前庭也有一定的贡献。最窄的 p开放通道孔的艺术是 M2 螺旋从 -2′ 到 2′ 的延伸(图 19.1c)。请注意,开放的 GlyR 孔的结构一直存在争议。早期的结构过于“开放”,可能只有在脂质存在下对 GlyR 进行成像时才能获得生理相关的开放孔结构(而不是“开放”结构)(Yu 等人,2021 年)。单个 GlyR 通道的一个关键特征是同源和异源受体的电导率不同,同源体的电导率要大得多,例如 145 mM 对称氯化物中的 86-111 pS,而异源体的 ~50 pS(Bormann 等人,1993 年)。这源于 α 和 β 的 M2 差异(图 19.1c)。在同源 GlyR 中,α2 和 α3 的主电导率略高(分别为 111 和 105 pS,而 α1 为 86
pS),这是因为 2′ M2 中的残基存在差异(分别为 Ala 和 Gly;图 19.1c;
Bormann 等人,1993 年)。
GlyR 单通道开口显示多个亚电导。由于尚不清楚的原因,亚电导在同源通道和由外向外记录中最为常见,而在异源 GlyR 的细胞贴附记录中则很少见(Bormann 等人,1987 年;Bormann 等人,1993 年;Beato 等人,2004 年;Burzomato 等人,2004 年)
19.6 药理学
GlyR 的药理学相对简单,没有主要作用于 GlyR 的药物用于治疗。
最好的 GlyR 激动剂是神经递质本身,即甘氨酸,它是所有同工型的完全激动剂,当通道未脱敏时,其最大开放概率接近 100%。几种小氨基酸也是 GlyR 激动剂。氨基甲烷磺酸盐、L-丙氨酸、L-丝氨酸和β-丙氨酸的功效较高,但在较大分子中急剧下降,而牛磺酸和GABA是部分激动剂,这由它们在簇内较低的最大开放概率和明显的关闭时间可以看出(图19.4b,c)。
GlyR的界面(正构)结合口袋具有典型的pLGIC特征,包括芳香盒。图19.1e显示了从上方观察的斑马鱼同源GlyR结构中甘氨酸和牛磺酸的结合姿势,突出显示了主要(+)亚基的环B和C以及互补(-)亚基中的β链2(环D)和6(环E)的贡献(Yu等人,2021年)。该图与 α3 GlyR 结构 (Huang 等人,2017) 非常相似,激动剂和受体之间存在氢键和阳离子-π 相互作用网络。激动剂中一致的一个特征是保守的 β2/环 D Arg(图 19.1e 中的 R65)的侧链与激动剂分子的带负电荷部分之间的离子键。
302 离子通道教科书第 II 卷
区分因药理学而含有不同形式 α 亚基的受体并不简单。在 GlyR 亚型中,不同激动剂的效力等级顺序差异不足以帮助受体分类。激动剂对不同 GlyR 的功效存在一些差异(参见人类和斑马鱼 α1 或 α2 的 2A/2B 剪接变体),但这些似乎在激动剂之间相似,并且是
图 19.4
GlyR 激动剂及其功效。 (a) 在 10 mM 甘氨酸存在下,人类 α1 GlyR 的细胞附着单通道记录显示了如何选择簇。 (b) 由 100 mM β-丙氨酸、牛磺酸和 GABA 激活的人类 α1 GlyR 的代表性单通道电流。 在 +100 mV 下从转染的 HEK293 细胞记录电流,开口向上。 (c) 箱线图显示不同激动剂对人类 α1 GlyR 引起的最大开放概率(每个簇一个点)。方框显示 25-75 百分位数;黑线
代表中位数,晶须 5-95 百分位数。(数据来自 Ivica 等人,2021 年。)
303 甘氨酸受体
可能是由于通道异构体的一般开放倾向不同(即其变构常数;Ivica 等人,2021 年;Miller 等人,2004 年)。
重要的注意事项:许多市售的氨基酸激动剂被甘氨酸污染,即使是最高纯度的,如果必须使用高浓度的激动剂,则应进一步纯化。
经典的竞争性拮抗剂士的宁具有很强的效力(亲和力低于 20 nM)并且
对 GlyR 具有选择性,而对其他通道则没有用处,但它在对 GlyR 进行分类时同样没有用处。
苦味毒素(苦味素和苦味毒素的等摩尔混合物)与 GlyRs 的孔道结合,在阻断同源 GlyRs 方面比阻断异源 GlyRs 更有效(对 EC50 浓度的甘氨酸的阻断效果约为 20 倍),因此可用于检查异源表达工作中异源组装是否完成。α2 对孔道阻断剂氰基苯基三硼酸盐具有相对的抵抗力,但含有该亚基的 GlyRs 的缓慢动力学可能更具特色。GlyR 活性可以通过多种药物进行调节,其中一些是内源性的(例如锌、细胞外 pH 和大麻素)。锌的调节作用已被深入研究,可能具有生理重要性。纳摩尔锌浓度增强亚最大 GlyR 反应,但微摩尔锌浓度抑制 GlyR,尤其是含有 α1 的 GlyR。ECD 中锌的抑制和增强位点不同,并且已鉴定出传递锌作用的其他残基 (Miller 等,2008)。尽管在啮齿动物模型中使用先导化合物取得了有希望的结果 (Huang 等,2017),但 GlyR 正向变构调节剂作为镇痛药的潜力尚未实现。与其他 pLGIC 一样,GlyR 受乙醇和全身麻醉剂(吸入或静脉注射)的调节,这些麻醉剂在跨膜结构域结合,但 GlyR 不太可能是这些药物作用的主要靶标。抗寄生虫药物伊维菌素也与 GlyR 的跨膜结构域结合:它既增强了甘氨酸的作用,又或多或少不可逆地激活了 GlyR 本身。
19.7 运输、聚集和调节
有效的突触传递需要通道聚集在精确的突触后位置。对于 GlyR,此过程需要微管相关蛋白 gephyrin 的存在(Dumoulin 等人,2009 年),它将 β 亚基的细胞内环与突触后细胞骨架连接起来。Gephyrin 分子相互作用,形成 GlyR 的亚突触结合位点的六边形晶格(Meyer 等人,1995 年)。
同源 α GlyR 在膜中扩散得更快,因为它们无法与 gephyrin 结合 (Meier 等人,2001)。Gephyrin 还可以通过与在内质网中组装的通道结合来增强 GlyR 向膜的运输 (Maas 等人,2006)。
磷酸化共识序列位于 GlyR 的 M3–M4 细胞内环中。例如,α1 亚基具有蛋白激酶 C (PKC) 共识位点,并且在其长同工型中也具有蛋白激酶 A (PKA) 位点。功能的增强和抑制都归因于磷酸化,这取决于受体的来源(重组或天然),其亚基组成和磷酸化可能在炎症引起的伤害感受变化中发挥作用(Harvey 等人,2004 年)。β 亚基磷酸化可能抑制 GlyR-gephyrin 相互作用,从而增加受体扩散并降低突触后密度(Specht 等人,2011 年)。
19.8 通道病和疾病
GlyR 因导致人类通道病过度惊吓症(惊吓病)的遗传突变数量而引人注目。这种罕见疾病仅影响全球数百名患者,但惊吓突变的多个位置、其分子表型以及小鼠品系中惊吓疾病的存在,使人们早期了解了不同 pLGIC 域的功能。
遗传性严重惊吓过度症 (OMIM #149400) 通常在出生时开始,表现为全身僵硬和对无害感官刺激(轻拍患者的鼻子)的夸张运动反应。僵硬在生命早期逐渐消退,但过度惊吓反应持续存在,随后出现间歇性僵硬,通常导致跌倒。这种疾病的典型形式是常染色体显性遗传,与神经发育问题无关,对苯二氮卓类药物氯硝西泮治疗有反应。惊跳过度症与 GLRA1 基因的关联很快被第一个惊跳突变的识别所取代,即 α1 亚基中 M2 中 19′ 处的错义突变 (Shiang 等,1993)。在重组 GlyRs 中,这种突变 R271L 或 Q(编号与成熟蛋白质相同,没有信号肽,图 19.1c 中 M2 比对中的红色残基)导致复杂的功能丧失,单通道电导率降低,并出现典型的分子“惊跳表型”。后者包括甘氨酸效力的降低和部分激动剂功效的严重丧失,并强烈表明通道门控受损。此后不久,M2–M3 环路中的其他惊吓突变(24′ K276E 和 27′ Y279C;图 19.1c)被发现,它们不会改变电导率,但在产生“惊吓表型”方面与 R271L/Q 相似,并确定 M2-M3 环路是超家族中信号转导的关键区域(Lewis 等人,1998 年;Lynch 等人,1997 年)。二十多年的研究并未彻底解决这一问题,也未证实大多数惊厥病突变发生在 α1 中,但也有一些突变发生在 β(GLRB)和其他对甘氨酸能突触很重要的蛋白质中,例如神经元甘氨酸转运蛋白 GlyT2 (SCLC6A5)或支架蛋白,例如 gephyrin(GPHN)和 collybistin(ARHGEF9)。
迄今为止已知的 45 种 GLRA1 错义突变中,约有一半是常染色体显性突变(主要是跨膜结构域中的突变)。七个 GLRA1 错义突变中除一个外均为常染色体显性突变。β 中的错义突变以隐性模式遗传。总体而言,隐性遗传(或复合杂合性)是最常见的模式,并且是无义突变或 GlyR 亚基(α (13) 或 β (11))缺失以及其他甘氨酸蛋白突变的规则。
隐性遗传突变通常具有“延长表型”,伴随惊吓反应出现发育迟缓和发作性呼吸暂停。目前尚不清楚患者表型的这种差异是由于分子表型的差异还是由于隐性遗传与父母的血缘关系之间的关联。
当惊吓突变在重组 GlyR 中表达时,大多数错义突变
会导致功能丧失,在全细胞记录中,这会导致甘氨酸的效力降低,并且对部分激动剂的最大反应相对于甘氨酸降低,尽管
少数突变会导致功能获得和自发 GlyR 通道开放。
305 甘氨酸受体
在与突触相关的条件下研究的突变体相对较少,其中甘氨酸达到 2.2-3.5 mM 浓度(Beato,2008)。
图 19.5a、b 中的示例显示惊吓突变 α1K276E(M2-M3 环中的位置 24′;
参见图 19.1c)降低了异源 GlyR 的甘氨酸最大开放概率。
突变体中甘氨酸引起的簇看起来像部分激动剂的簇,最大开放概率约为 45%,不到野生型的一半,并且在甘氨酸浓度高得多时达到。当在准突触条件下用压电步进器将甘氨酸应用于外向外贴片时(图 19.5c),突变体中的电流响应比野生型受体上升慢,衰减快(注意,野生型 GlyR 的激活非常快,以至于电流上升的速率反映了溶液交换,而不是受体激活,即使快速交换约为 0.15-0.2 毫秒)。图 19.5c 中的轨迹已归一化为其峰值,并未显示此惊吓突变的更重要的影响,即它使突触电流峰值降低了约 99%(这是根据从单通道数据和突触处甘氨酸浓度时间过程数据获得的激活机制计算得出的;Lape 等人,2012 年)。
19.9 结论
GlyR 具有阴离子渗透性,其激活会在突触处产生抑制作用,在那里它们被支架蛋白 gephyrin 聚集。GlyR 在人类治疗方面仍未得到充分开发,但其高电导性和具有不同功效的激动剂的可用性使其成为研究通道激活和单分子电生理学激动剂功效基础的有用主题,并将这项工作与结构研究结合起来。这样的工作可以帮助我们理解所有的 pLGIC。
图 19.5
M2–M3 环路中的惊吓突变对 GlyR 功能的影响,(a) 大鼠 K276Eα1β GlyR 由甘氨酸激活的细胞附着单通道记录。(b) 来自 (a) 记录的 K276Eα1β GlyR 的开放概率-浓度曲线;注意最大开放概率和甘氨酸效力的明显下降。(c) 30 mM 甘氨酸脉冲引起来自表达野生型 α1(虚线)或 α1 K276E 突变体(实线)的 HEK 293 细胞的外向外贴片的内向电流的示例;至少五个反应的平均值(来自 Lape 等人,2012 年。)
酸敏感离子通道
Yangyu Wu 和 Cecilia M. Canessa
20.1 简介
酸敏感离子通道 (ASIC) 是质子激活的离子型受体,属于上皮 Na 通道/退化蛋白 (ENaC/DEG) 离子通道家族。该类的所有成员都具有共同的蛋白质结构,由三个相同或同源的成孔亚基组成。尽管结构非常相似,但 DEG/ENaC 通道在功能作用和激活方式上存在显着差异;一些是组成性活性的(ENaC),而另一些则由质子(ASIC)、肽(FaNaCh)、激素(PPK23 和 PPK29 对果蝇的信息素作出反应)、渗透压(果蝇的水味)、机械力(秀丽隐杆线虫的触觉受体)控制,在更多情况下,激动剂尚不清楚。哺乳动物基因组中有四个 ASIC 基因,ACCN1–ACCN4。通过差异剪接,四个基因 ACCN1–ACCN4 产生七种不同的蛋白质。ASIC1a 和 ASIC1b 是 ACCN2 基因的剪接变体。同样,ASIC2a 和 ASIC2b 是 ACCN1 的剪接形式(图 20.1)。 ASIC2a 的同源三聚体形成质子激活通道,而 ASIC2b 的同源三聚体只有当 ASIC2b 与其他亚基结合形成异源通道时才会形成质子激活通道。ACCN3 基因的剪接产生两种异构体,它们在远端细胞内羧基末端有所不同;所有三种 ASIC3 蛋白都产生具有相同功能特性的通道。ACCN4 的产物是亚基 ASIC4,当以同源三聚体形式表达时,它不会产生质子激活电流。
20.2 组织分布
ASIC 通道介导的质子激活电流的功能性表达大部分局限于神经元和神经胶质细胞。中枢神经系统表达除 ASIC1b 之外的所有 ASIC 转录本,ASIC1b 仅存在于外周神经元中。最
图 20.1
(A) ACCN 基因及其在人类染色体中的定位。ASIC 蛋白及其剪接异构体用方块表示的跨膜结构域表示:TM1 和 TM2。数字是剪接外显子的氨基酸位置。 (B) 同源人 ASIC1a 电流迹线的代表性示例,由从基线 pH 7.4 施加的外部 pH 浓度从 6.7 到 5.0 引起,以计算通道激活的表观质子亲和力 (pH50a)。pH 6.0 引起的电流,同时调节溶液的质子浓度从 7.4 以小步 (0.1 pH 单位) 增加到 7.0,以计算通道稳态脱敏的表观质子亲和力 (pH50sssd)。 (C) hASIC1a、hASIC2a 和 mASIC3 同源通道的表观 pH50a 和 pH50ssd 图。 311 酸敏感离子通道 脑中丰富的亚基是 ASIC1a,它在脑的大多数区域形成同源通道,但也与 ASIC2a 结合形成异源通道。 ASIC1a 似乎对大脑中 H+ 介导电流的表达至关重要,因为当小鼠体内的 ASIC1a 失活时,这些电流就会消失(Wemmie 等人,2002 年)。在一些外周组织中发现了少量的 ASIC 转录本或蛋白质,但在神经系统之外尚未检测到强大的功能活性。神经系统外表达的例子有肺中的 ASIC3 以及骨骼中的 ASIC1、ASIC2 和 ASIC3。
外周神经元以高丰度表达所有 ASIC 亚型;任何给定的神经元都包含几种类型的 ASIC 亚基,它们以各种组合相关联,从而产生具有不同特性和药理反应的多种通道。
这种表达模式表明 ASIC 参与检测各种感觉模式,例如,ASIC1 和 ASIC3 的激活会引起疼痛。
在神经元中,ASIC 主要位于细胞表面,而不是细胞内的细胞器中。在质膜上,通道分布在胞体、轴突和树突上,
包括突触后密度。ASIC2 还位于形成皮肤中机械敏感结构(如迈斯纳小体和帕西尼氏体)和毛囊中的特殊神经末梢中。ASIC 在大脑结构和神经元内的广泛表达模式(覆盖了质膜的大部分区域)与检测神经元周围质子浓度增加的功能作用相一致,而它在皮肤特殊结构中的存在表明其具有处理各种感觉模式(如伤害感受和机械感受)的其他作用。
20.3 功能
迄今为止,几乎每种类型的神经元,无论其位置(大脑、脊髓、背根神经节)或特化(兴奋性、抑制性、交感神经或感觉受体),都表达至少一种类型的 ASIC 蛋白。然而,质子诱发电流的大小因神经系统结构而异,在某些感觉神经元中最大。ASIC 在中枢和周围神经系统中几乎无处不在,并且在脊椎动物和无脊椎动物中具有高度的序列保守性 - 跨越数百万年的进化距离 - 强调了这些通道在神经系统中的重要性。然而,尽管近年来取得了重大进展,但许多 ASIC 通道的生物学功能仍然大多未知。迄今为止,尚未报道与 ASIC 突变相关的遗传疾病。目前对 ASIC 生理和病理作用的理解主要来自对 ASIC1a、ASIC2a/b 或 ASIC3 基因失活小鼠表现型的研究。相比之下,关于直接激活中枢神经系统 (CNS) 中的 ASIC 的后果的信息很少,这在很大程度上是由于改变大脑选定区域的外部 pH 值的技术困难。
另一个困难在于获得中枢神经系统微区外部 pH 值的精确空间和时间测量值。尽管 H+ 选择性微电极的灵敏度和时间分辨率有所提高,但这仍然是一个挑战。与高频范围的神经元活动相比,H+ 选择性微电极的大尺寸、侵入性和相对较低的时间响应都是缺点。pH 敏感荧光指示剂可能具有一些优势,但目前它们需要大型和复杂的检测应用paratus 不易适应哺乳动物大脑的体内测量。
312 离子通道教科书第二卷
所有 ASIC 基因敲除小鼠都表现出正常的大体形态、生育能力,没有明显的异常行为,除非在特定环境下进行检查,以发现细微的缺陷。
在小鼠中首次对 ASIC1a 进行基因失活,结果显示敲除小鼠 (ASIC1–/–) 所有大脑结构中的质子诱发电流均缺失或明显减少,证实 ASIC1a 是大脑中形成同源和异源 ASIC 通道的主要亚基。有证据表明 ASIC 调节突触可塑性,包括长期增强 (LTP) 和长期抑制 (LTD)。在 ASIC1–/– 小鼠中,高频刺激期间的兴奋电位和 NMDA 受体激活均降低。此外,ASIC1–/– 动物表现出海马依赖性空间学习、小脑依赖性眨眼和杏仁核依赖性恐惧条件反射方面的缺陷。
然而,这些发现中的一些受到了一些研究小组的挑战,这些研究小组产生了 ASIC1a 脑特异性失活的小鼠。ASIC 功能的复杂性可能是由于兴奋性和抑制性神经元中分布和功能的不同、ASIC 亚基组成和不同脑结构中调节伙伴的表达水平的变化造成的。需要进一步研究来阐明 ASIC 在调节突触可塑性方面仍然存在争议和难以捉摸的作用。
ASIC 与退化蛋白的结构非常相似,其中一些是参与线虫 C. elegans 机械转导的离子通道,这表明 ASIC 中的至少一些成员也可能在脊椎动物中传递机械刺激。早期研究报告称 ASIC2–/– 小鼠的触觉和压力感受器反射异常;然而,原始研究尚未重现。然而,ASIC2–/– 小鼠并不正常;在早期,它们表现出增强的视网膜电图,随着年龄的增长,视网膜会退化,这表明 ASIC2 和 ASIC3 可能是视杆光传导的负调节剂,并可能在维持视网膜完整性方面发挥保护作用。
在外周神经元中研究 ASIC 比在中枢神经系统中研究挑战较少,因为感觉神经元终端可接触酸性溶液、炎症剂或机械刺激。疼痛感受器暴露于酸性溶液和珊瑚蛇的蛇毒会产生严重且持久的疼痛,这种疼痛源于 ASIC1a 的持续激活。 20.4 激动剂、调节剂和抑制剂
20.4.1 激动剂和调节剂
ASIC 由外部质子激活,但问题是额外的
内源性刺激是否也能控制这些通道。有几条证据支持这种可能性。首先意识到 ENaC/DEG 超家族的一些成员
是神经肽激活的离子型受体。FMRF 酰胺 Na 通道 (FaNaCh) 是
几种蜗牛神经元中由神经肽 FMRF 酰胺激活的离子通道。
另一种肽门控通道是来自淡水水螅
的水螅 Na 通道 (HyNac),由神经肽水螅-RF 酰胺 I 和 II 门控。
与哺乳动物 ASIC 相关的证据来自德克萨斯珊瑚蛇 (Micrurus tener tener) 毒素的分离,这种蛇的咬伤会产生剧烈疼痛 (Bohlen 等人,2011)。这种毒素名为 MitTx-α/β,由两种不同的多肽组成:一种 Kunitz 样蛋白 (MitTx-α) 和一种磷脂酶-A2 样蛋白 (MitTx-β)。当一起使用时,它们是 ASIC 通道的强效激活剂。随后,对小分子化学库进行了筛选,目的是找到替代分子来打开 ASIC 通道。通过筛选富含碱性基团的化合物库,这些化合物能够与质子传感器的负电荷结合,从而分离出具有胍基和杂环的分子,例如 2-胍-4-甲基喹唑啉 (GMQ),它们在 pH 值为中性时激活小鼠 ASIC3 (Yu 等人,2010 年)。
在肽类中也发现了 ASIC 电流增强剂。神经肽 FMRFamide (Ph-Met-Arg-Phe-amide) 虽然对软体动物通道 FANaCh 具有特异性,但也与 ASIC1、ASIC2 和 ASIC3 (EC50 ~30 µM) 结合,从而增加了峰值电流的幅度,减缓了通道脱敏的速度,并在质子和肽持续存在的情况下诱导持续电流 (Askwith 等人,2000 年)。
FMRF 酰胺在无脊椎动物的神经系统中含量丰富,它是一种神经递质和神经调节剂,但它在脊椎动物中不表达。三种哺乳动物 FMRF 酰胺相关肽以低效力调节 ASIC:神经肽 FF、神经肽 AF 和神经肽 SF。在所有情况下,这些神经肽都会与闭合状态结合并减缓脱敏动力学。大强啡肽阿片肽是 ASIC1a 最有效的内源性调节剂(EC50 ~26 nM)。它将 pH50ssd 移向更酸性的范围,从而能够在通常诱导脱敏的 pH 值下实现质子介导的 ASIC1a 激活。结合位点已定位到酸性口袋,这也对应于 PcTx1 结合位点,与观察到的这两种肽的竞争一致。外部应用的二价阳离子也会调节 ASIC 电流。Zn2+ 增加了同源 ASIC2a、异源 ASIC2a/ASIC1a 和 ASIC2a/ASIC3 通道对 H+ 的表观亲和力。 Zn2+ 增强 ASIC2a 电流可能与谷氨酸能突触有关,谷氨酸能突触中含有神经递质的囊泡具有高浓度的 Zn2+ 和 H+。Zn2+ 和 H+ 同时释放到突触间隙中会使 Zn2+ 浓度从 0.5 µM 升高到大约 ~200 µM,这足以增加 ASIC2a 电流:Zn2+ 在 ASIC2 上的 EC50 估计为 ~120 µM。Zn2+ 赋予的质子亲和力增强可能与此有关,因为 ASIC2a 通道在 CNS 中很丰富,但对质子的敏感性较低。ASIC 还受内源性促炎因子(如花生四烯酸)的调节,这些因子通过改变 pH 和内向电流之间的关系使通道对质子敏感。缺血组织释放花生四烯酸和乳酸,这也会增强 ASIC
电流,因此,缺血中质子的作用会因额外的存在而放大
表 20.1
打开或增强 ASIC 活性的分子
激活剂/
调节剂 目标 IC50 类型 参考
MitTx-α/β ASIC1a 9.4 nM 蛇毒素 Bohlen 等人,2011
ASIC1b 230 nM
ASIC3 830 nM
GMQ ASIC3 1 mM 2-胍-4-甲基喹唑啉 Yu 等人,2010
FMRFamide ASIC3 50 µM 神经肽 Askwith 等人,2000
大强啡肽 ASIC1a 33 µM 内源性阿片类药物 Sherwood 等人, 2009
RFRP-1/2 ASIC1 ASIC3
Zn2+ ASIC2a 120 µM 二价阳离子 Baron 等人,2001
ASIC2a+1a 111 µM
花生四烯酸 ASIC1 ND 内源性脂质 Smith 等人,2007
精胺 ASIC1 内源性多胺 Babini 等人,2002
314 离子通道教科书第二卷
内源性因素导致 ASIC 在高于 pH50a 预期的 pH 值时激活。
20.4.2 抑制剂
最成功的 ASIC 强效抑制剂来源是在毒液中发现的。
Psalmotoxin 1 (PcTtx1) 是从狼蛛 Psalmopoeus cambridgei 的毒液中分离出来的,
最初被鉴定为 ASIC1a 同源通道的高选择性和强效抑制剂 (Escoubas 等人,2000)。PcTtx1 是一种由 40 个氨基酸组成的肽,具有胱氨酸结
和三链反向平行 β 片层结构,定义了离子通道门控调节剂家族。PcTx1 增加了对 H+ 的表观亲和力,并将哺乳动物 ASIC1a 的脱敏
曲线从 pH 7.19 移至 7.40,导致中性 pH 下的脱敏
,从而对 pH 的进一步降低失去反应。鞘内注射 PcTx1 可在啮齿动物急性疼痛模型中产生镇痛作用,这表明抑制中枢神经系统中的 ASIC1a 可能成为减轻慢性疼痛的新途径 (Mazzuca 等人,
2007)。微摩尔范围内的高浓度 PcTx1 可以打开并减缓 ASIC1a 的脱敏速度。与鸡 ASIC1a 结合的 PcTx1 共结晶揭示了两种不同的孔开放构象:一种是在 pH 7.25 下获得的,另一种是在 pH 5.5 下获得的 (Baconguis 等人,2012;Dawson 等人,2012)。
Hi1a 是富含二硫键的蜘蛛毒液肽,包含两个同源抑制剂胱氨酸结结构域(相当于两个由几个氨基酸连接起来的 PcTx1 肽)。
Hi1a 以 pH 独立且缓慢可逆的方式部分抑制 ASIC1a。
给大鼠脑室内单次低剂量 Hi1a 可显著抑制 ASIC1a。
表 20.2
ASIC 抑制剂;亚基特异性多肽和小分子抑制 ASIC 电流
具有各种效力
抑制剂靶标 IC50 类型参考
PcTx1 ASIC1a 2 nM 肽毒素 Escoubas 等人,2000
APETx2 ASIC3 63 nM 肽毒素 Diochot 等人,2004
Mambalgin 1 和 2 ASIC1a 55 nM 肽毒素 Diochot 等人,2012
ASIC1a+2a 246 nM
ASIC1a+2b 61 nM
ASIC1b 192 nM
ASIC1a+1b 72 nM
Hi1a ASIC1a 0.52 nM 蜘蛛肽 Chassagnon 等人,2017
A-317567 ASIC1 2 µM Dubé 等人al., 2005
ASIC2 29 µM
ASIC3 9.5 µM
Diminazene ASIC1a, ASIC1b 2.4/0.3 µM 抗原生动物 Chen et al., 2010
萘莫司他甲磺酸盐 ASIC1a 13.5 µM Ugawa et al., 2007
ASIC2a 70 µM
ASIC3 2.5 µM
氟比洛芬 ASIC1a 350 µM NSAID Voilley et al., 2001
水杨酸 ASIC3 260 µM NSAID
双氯芬酸 ASIC3 92 µM NSAID
NSAID,非甾体抗炎药。
315 酸敏感离子通道
即使在闭塞后 8 小时给药,也能减少因大脑中动脉闭塞引起的梗塞面积(Chassagnon 等人,2017 年)。
APETx2 是一种来自海葵 Anthopleura elegantissima 的毒素,可抑制同源和异源 ASIC3 通道(Diochot et al.,2004)。APETx2 是一种由 42 个氨基酸组成的肽,具有三个二硫键,结构类似于其他抑制性海葵毒素,靶向电压门控 Na+ 和 K+ 通道。APETx2 已用于在啮齿动物术后疼痛模型中诱导镇痛,其中来自局部细胞炎症的质子可能激活 ASIC3。
Mambalgins(mambalgin-1 和 mambalgin-2)是从黑曼巴蛇毒液中分离出的 57 个残基的三指毒素,其产生的镇痛作用与吗啡一样强(IC50 ~123 nM)。它们是门控修饰剂,可降低外周和中枢神经元的质子敏感性,抑制同源 ASIC1a 和由 ASIC1 和 ASIC2 形成的异源通道 (Diochot 等人,2012)。无论毒素是通过中枢还是外周给药,Mambalgins 都能对急性和慢性炎症疼痛产生强效镇痛作用。与 mambalgin-1 结合的人类 ASIC1a 的低温电子显微镜 (cryo-EM) 结构显示,一种毒素以闭合构象与通道的每个亚基结合 (图 20.3) (Sun 等人,2020)。
20.5 生物物理特性
20.5.1 结构和门控
通过解决 ASIC1a 在各种功能状态下的结构,对 ASIC 质子介导门控机制的阐明已经取得进展。 ASIC1a 在闭合状态下的第一个结构揭示了亚基的结构和通道的三聚体组成(Jasti 等人,2007 年)。亚基的形状与拳头的形状相似;每个子域都被分配到手的一个元素,如图 20.2 所示。两个跨膜结构域 TM1 和 TM2 形成离子通路,其中包括关闭门和选择性过滤器。TM2 在该通道家族的所有成员中具有高度保守的序列,表现出一种不寻常的结构:螺旋中间未缠绕的 α 转角将 TM2 分成两个段 - 上方的 TM2a 与同一亚基的 TM1 接触,而下方的 TM2b 将接触转移到相邻的 TM1。最近,通过对 cASIC1 在静息和脱敏状态下的单粒子低温电子显微镜 (Yoder 等人,2020) 解析了 TM1 附近氨基末端片段的结构。该片段形成一个环,进入并填充 TM1 和 TM2 之间的宽阔空间。它们一起形成下孔,解释了为什么高度保守的 H28G29 残基在 ASIC1 和 ENaC/degenerin 家族的其他通道的离子渗透和动力学中起着如此重要的作用。ENaC 中相应残基 G29 的突变降低了开放概率并导致 1 型假性低醛固酮血症 (Gründer 等人,1997),而 ASIC1a 和 ASIC2 环中的各种残基会改变离子选择性和动力学 (Chen 等人,2021)。相反,羧基末端对于功能或表达而言并非必不可少,因为大部分羧基末端都可以被删除而不会产生任何明显后果;由于内在灵活性,其结构仍然未知。
胞外结构域 (ECD) 具有高度保守的带负电荷残基,分布在各个子结构域中。拇指 (Asp346、Asp350、Glu354)、手指 (Glu236、
Glu238、Glu239、Glu243、Asp260) 和手掌 (Glu178、Glu220、Asp408) 结构域共同形成一个酸性口袋。拇指和手指中羧酸盐对之间的氢键:
Asp238/Asp350、Glu239/Asp346 和 Glu220/Asp408 表明这些残基可能构成“质子传感器”,即质子结合触发配体介导的门控过程的初始构象变化的位点。尽管这些相互作用很重要,但上述残基可以用中性氨基酸取代,而不会消除质子门控。因此,假定的质子传感器的身份和位置仍然难以捉摸。
ASIC 的表观 pH50a 因亚基组成而异。这不是由于质子传感器亲和力的巨大差异,而是由于将构象变化从传感器传递到跨膜结构域孔隙的元素(Chen 等人,2020 年)。同源 ASIC1a 通道对
图 20.2
单个 ASIC 亚基结构域的卡通表示。α-螺旋显示为圆柱体,
β-链显示为箭头,线圈结构显示为线。酸性口袋中的四个带负电荷的残基以圆圈显示:拇指 α5 螺旋中的 D346 和 D350 以及手指域环中的 D238 和 E239。卡通描绘了扩展构象中的酸性口袋。在脱敏状态下锁定通道的重要残基(L415 和 N416)显示在 β11-β12 接头中。一个延伸的环,称为 GAS 带,
将 TM2 分成两个段(TM2a 和 TM2b),并将孔分成上部和下部。从 V16 到 L39,
N 端折叠成一个折返环进入下部孔,其中 S23 至 H28 残基排列在整个下部渗透途径中。HG 基序是高度保守,在确定离子选择性和动力学方面具有重要功能。H28 的侧链面向孔腔并在 GAS 带下方形成收缩。羧基末端未出现在任何当前可用的结构中。编号对应于人类 ASIC1a。
317 酸敏感离子通道
质子(pH50A 从 7.0 到 6.8),而最不敏感的是同源 ASIC2a(pH50A
从 4.0 到 5.0),ASIC2b 和 ASIC4 对质子没有反应。
ASIC1 的封闭、高 pH 脱敏(稳态脱敏)、低 pH 脱敏和开放构象的结构如图 20.3 所示。通过比较四种主要功能构象中的结构,可以重建
图 20.3
cASIC 在封闭、开放和脱敏构象下的结构以及毒素结合位点。封闭 cASICI(蛋白质数据库:6VTL)(Yoder 等人,2020 年)、开放(蛋白质数据库:4NTW)(Baconguis 等人,2014 年)、稳态脱敏 (SSD) pH 7.0(蛋白质数据库:6VTK)(Yoder 等人,2020 年)和脱敏低 pH(pH 6.5)(蛋白质数据库:4NYK)的带状表示。封闭和脱敏 pH 7.0 是单粒子重建的低温电子显微镜结构。孔结构在封闭(pH 8.0)和 SSD
pH 7.0 构象中几乎相同。Pctx-1 与酸性口袋结合,诱导 SSD 构象,而 MamBa-1 毒素
结合在拇指上,将通道锁定在封闭的非活动状态。开放结构 pH 6.8 与 MitTxα/β 复合获得,MitTxα/β 从每个亚基的拇指顶部到拇指下端结合。
开放构象表现出下掌的扩张和跨膜域的加宽,从而消除了 GAS 带上方的门控收缩并打开了孔。在开放通道的晶体结构中,折返环未解决。所有毒素都以橙色丝带表示,它们在通道上的结合位点用虚线框划定。
318 离子通道教科书第二卷
质子诱导门控机制的一些事件。静息状态下最相关的特征是拇指区域远离手掌,酸性口袋扩大,孔被关闭门关闭——由 TM2a 螺旋的残基 D434I435G436G437 形成的跨膜区域变窄。质子浓度高于基线时,拇指移到手掌附近,手指使酸性口袋塌陷。当拇指的运动受到半胱氨酸键形成的限制时,质子无法诱导电流,这表明拇指的位移和酸性口袋的塌陷是打开孔所需的构象变化。质子化并驱动这种构象变化的残基的身份和位置尚未确定。拇指的位移会引发 ECD 的构象变化,这种变化会向下传播,导致下掌扩张,TM1 和 TM2 虹膜式旋转,从而打开门,增加孔径,并使离子渗透。开放构象中的单一可用结构与 MitTx 一起被捕获,这不仅会打开通道,还会减缓通道的脱敏。开放构象的特征是开放的孔、塌陷的酸性口袋和下掌域的扩张。
20.5.2 脱敏
所有配体门控阳离子通道都表现出一定程度的脱敏,以保护神经元免受长时间去极化的影响。脱敏通过 (1) 稳态脱敏 (SSD)、(2) 峰值电流衰减速率和 (3) 脱敏恢复动力学影响 ASIC 电流的大小和时间过程。
SSD 是一种电静默过程,其中浓度太低而无法有效打开孔隙的质子(pH 范围为 7.4 至 7.0)会诱导 ECD 构象变化,从而使通道无法对激活刺激作出反应。要完全恢复到静止状态,通道必须重新暴露在 pH 7.4 下至少 30 秒,这表明构象变化比质子解离所需的时间慢得多。
静止状态对 SSD 高度敏感,并且由于 pH50SSD 值接近 CNS 的基线 pH,因此小的或缓慢的酸化往往会使 ASIC1 沉默而不是激活。
但是,各种因素都会调节 ASIC 的 pH50SSD;例如,Ca2+ 或其他二价阳离子浓度的增加会使 pH50SSD 转移到更酸的范围,而 Ca2+ 的减少则会产生相反的效果。带正电荷的有机分子,如多胺(Babini 等人,2002 年)和神经肽大强啡肽(32 个残基中有 8 个带正电荷)(Sherwood 等人,2009 年)将 pH50SSD 移位约 0.2 个 pH 单位,进入更酸性的范围。从机制上讲,这些分子与 ASIC 表面的结合屏蔽了 H+结合位点阻碍 H+ 诱导的构象变化,从而导致 SSD。多胺主要存在于细胞质中,但它们由缺血神经元释放到间质空间中,大强啡肽 (~1-7 nM) 的浓度在损伤后升高;因此,这些分子在 CNS 中的浓度足以调节体内 ASIC 反应。
在高质子浓度下,会发生从开放状态脱敏;在质子存在的情况下,它驱动峰值电流衰减回零水平。这归因于开放构象的低稳定性,导致孔迅速返回到关闭状态,而 β11-β12 接头的重排阻止了重新打开。接头作为阀门或离合器,将 ECD 与孔分离。孔的关闭压缩了接头,迫使接头残基 L415 和 N416 旋转 180°,将孔锁定在闭合构象中 (Yoder 等人,2018)。
如果刺激序列由短暂的酸脉冲组成,约 10 毫秒,短于 τD 所需的时间,即脱敏时间常数 (~770 毫秒),则人类 ASIC1 会从开放状态避免脱敏。如果脉冲很短,通道会通过失活 (从开放状态解开 H+ 的结合) 而不是脱敏 (与 H+ 结合的封闭状态) 来关闭。这些观察结果表明,长时间的刺激会使 ASIC1 沉默,但如果刺激以高频率施加,通道仍会保持响应,这是中枢神经系统神经元活动的特征。
脱敏构象的主要特征(无论是 SSD 还是从开放状态脱敏)是孔关闭、酸性口袋塌陷以及 β11–β12 连接体中 L415 和 N416 的翻转。当质子被洗出时,通道从脱敏中恢复,从而缓慢返回到静息状态。
20.5.3 离子选择性
ASIC1 的激活导致膜去极化,因为主要钠离子的流入会进入暴露于细胞外 pH 短暂下降的神经元。ASIC1a 离子选择性序列为 Li+~Na+ > K+ > Cs+。它还渗透含氮阳离子,包括 NH4+ 和胍基。最初,报道了高 Ca2+ 通透性,但此后几项研究表明,人类和啮齿动物 ASIC1a 中的 PNa/PCa 比率≥20。激活 ASIC1a 后观察到的细胞内 Ca2+ 增加可能是由于膜去极化和 Ca2+ 通透性途径的二次激活而间接导致的。广泛的电生理测量和诱变表明,ENaC(与 ASIC 最密切相关的通道)仅允许 Li+、Na+ 和 H+ 通过,而不允许 K+ 或更大的阳离子通过。对应于 ENaC 的 GAS 带的片段已被提议作为最有可能的选择性过滤器候选者,而过滤器的大小是 ENaC 选择性的主要决定因素。然而,目前还无法在分子水平上进行验证,因为目前可用的单个 ENaC 结构的 TM 域分辨率很低,并且唯一处于开放构象的 ASIC 结构 (cASIC1-MitTx) 缺少形成孔的三个元素之一:折返环。折返环由来自氨基末端 (V17 至 L40) 的氨基酸组成,这些氨基酸折叠成两个短螺旋片段,由包含 H28G29 的转角隔开;该环从胞质侧进入孔并排列在离子通路的整个下部 (图 20.2 和 20.3)。
在 cASIC1-MitTx 的开放构象中,GAS 带使开放孔的收缩最窄,该开放孔由半径为 3.6 Å 的 G443 羰基氧环定义。该尺寸可以容纳水合 Na+,但不能容纳水合 K+。在闭合构象中,无论是静止构象还是脱敏构象,闭合门都会关闭孔隙;在它下面,GAS 带保持与开放构象相同的半径。包含折返环的静止和脱敏结构表明,闭合孔中最小的收缩是由 GAS 带正下方的 H28 造成的。His 侧链向离子通路的腔倾斜,将半径减小到 2.1-2.6 Å。三个 His 环而不是 GAS 带是否定义了开放状态下的最小收缩尚未确定。开放构象中 hASIC1a 的计算建模预测 GAS 带和 H28 环收缩的半径相似,表明两者可能在决定离子渗透方面发挥作用 (Chen et al., 2021)。最终答案有待解决开放构象下完整孔的结构。
除了选择性过滤器的大小外,其他因素(例如静电负电位和离子结合位点)也可能影响离子渗透和选择性。电生理学和结构证据支持以下观点:ENaC 和 ASIC 的离子选择性遵循屏障机制,其中选择性是主要通过基于水合离子大小的离子鉴别来实现。
320 离子通道教科书第二卷
20.6 观点
自 Krishtal 和 Pidoplichko (1980) 首次描述哺乳动物神经元中的质子诱发电流以来,几乎过了二十年才确定了介导这种电流的分子的身份 (Waldmann 等人,1997)。此后,快速的发现步伐导致在理解 ASIC 通道的生物物理特性和结构方面取得了巨大进展;特别是,由于 X 射线晶体学和低温电子显微镜单粒子重建,通道结构的清晰图像已经出现。分子结构领域的剩余挑战是解决开放构象中完整孔的结构,以了解离子渗透和选择性。鉴于 ENaC/Degenerin 成员之间的结构相似性,离子传导的基础可以扩展到该家族的其他通道。
众多的生物物理和结构发展与阐明 ASIC 生理作用的进展甚微形成鲜明对比。迄今为止,仅检测到由 ASIC 介导的非常小的突触后电流,这表明对突触传递的贡献很小。在体内,这些电流可能被大脑中表达但在实验测定中不存在的小调节分子放大。该领域的进步将需要开发新技术,以高空间和时间精度在选定的 CNS 结构中输送质子,同时监测功能效应,最好是在有意识的动物中。同样重要的是寻找 ASIC 的其他内源性激动剂。
尽管人们预测这些分子应该在大脑中普遍表达,以匹配 ASIC 在大多数 CNS 结构中的广泛分布,但寻找此类分子仍然困难重重。
有趣的是,ASIC 表现出的生物物理特性与密切相关的脊椎动物物种有显著差异。例如,hASIC3 不会重现小鼠和大鼠 ASIC3 对质子的反应。目前,尚不清楚这些差异是否反映了对物种特定内部条件(温度、基线 pH、内源性调节剂)的特定生理适应,还是仅仅是实验室实验的好奇心,没有生理重要性。
在努力揭示 ASIC 功能的过程中,值得考虑的是,一些 ASIC 也可能以不同于离子通道的方式工作。毫无疑问,质子在体外激活 ASIC,而体内产生严重酸中毒的病理条件可能会门控大脑中的 ASIC,但通过尚未设想的方式门控这些通道仍然是可行的。尽管关于神经系统中 ASIC 的生理学仍有很多需要学习的地方。近年来,发现改变 ASIC 活性的分子和富有洞察力的结构功能研究表明,该领域正在朝着详细了解的方向发展,这对于设计针对 ASIC 离子通道家族的治疗干预措施是必不可少的。 21
ENaC 通道
Mike Althaus、Diego Alvarez de la Rosa 和 Martin Fronius
21.1 简介
上皮钠通道 (ENaC) 是一种组成性活性 Na+ 选择性离子通道,属于退化蛋白 (DEG)/ENaC 超家族蛋白的一部分。ENaC 仅存在于脊椎动物中,其主要功能是控制 Na+,从而控制电解质和水的稳态。此外,ENaC 蛋白还参与机械传感过程。由于其组成性活性,ENaC 功能受到多种细胞机制和细胞外刺激的严格调节。ENaC 活性失衡与严重的人类疾病有关,包括高血压、肾脏和呼吸系统疾病。本章重点介绍了 ENaC 在健康和疾病中的作用,阐述了控制 ENaC 功能的调节机制,并总结了最近对通道结构的见解。
21.2 生理作用
ENaC 最容易理解的生理作用与其在上皮细胞中的存在和功能有关,在上皮细胞中,它与 Na+/
K+-ATPase 一起介导跨上皮 Na+ 吸收。跨上皮 Na+ 吸收产生渗透梯度,驱动跨上皮水通量(图 21.1)。因此,ENaC 对于维持全身和局部环境中的 Na+ 和水稳态至关重要,正如使用青蛙皮肤上皮的早期研究(Koefoed-Johnsen 和 Ussing,1958)所证明的那样。 ENaC 的分子身份是由 Canessa 及其同事克隆出形成三聚体离子通道的三个亚基(α、β 和
γ)而揭示的(Canessa 等人,1994 年)。除了 ENaC 之外,ENaC 亚基在离子转运上皮中(图 21.1)表达,在非上皮细胞中表达,而这些细胞的功能尚未完全建立。
21.2.1 上皮细胞中的 ENaC
在醛固酮敏感的远端肾上皮(远曲小管和皮质集合管)中,ENaC 介导的 Na+ 和水重吸收使膳食 Na+ 摄入量与其排泄率相匹配,从而调节全身 Na+ 稳态和液体量。其功能
图 21.1
ENaC 在上皮和非上皮组织和细胞中的生理作用。(a)在上皮和非上皮细胞和组织中检测到 ENaC 功能。(b)ENaC 在 Na+ 吸收上皮中的功能。 ENaC 介导的跨上皮 Na+ 重吸收与 Na+/K+-ATPase 协同产生渗透梯度,以驱动水流过上皮细胞。 (c) 在非上皮细胞中,可能存在除 αβγ- 或 δβγ-ENaC 以外的 ENaC 亚基组合。 ENaC 介导的 Na+ 内流被认为会导致膜电位 (∆Vm) 去极化,从而影响电压敏感蛋白,例如电压门控 Ca2+ 通道。 另一种可能性是,细胞内 Na+ 浓度的变化 ([Na+]i
) 可能会干扰“Na+ 敏感”分子
并影响其活性。
325 ENaC 通道
这里对于驱动 H+ 和 K+ 分泌也很重要 (Alvarez de la Rosa 等人,2013)。通过这些过程调节的体液量决定了心脏输出量,以维持和调节血压(Rossier,2014)。同样,远端结肠上皮中的 ENaC 有助于 Na+ 吸收和体液量调节(Nakamura 等人,2018)。肺部缺乏 α-ENaC 亚基的转基因小鼠在出生后不久就会死亡,原因是新生儿肺液体清除功能缺陷(Hummler 等人,1996)。这表明 ENaC 在平衡覆盖肺泡上皮的液体量以促进呼吸气体扩散方面的重要性。在气道中,ENaC 调节气道表面液体层的体积和粘度(Hollenhorst 等人,2011),以促进粘膜纤毛清除和先天免疫防御。在唾液腺或汗腺等外分泌腺的上皮中,ENaC 可防止分泌过程中过量的 Na+ 和水分流失。在女性生殖道中,ENaC 通过维持液体环境来促进受精,从而在生育中发挥作用 (Hanukoglu 和 Hanukoglu,2016),在膀胱上皮中,ENaC 有助于膀胱容量的感觉,从而调节启动排尿的传入通路 (Araki 等人,2004)。ENaC 还位于味蕾中的味觉受体细胞中,并参与啮齿动物对食物 Na+ 和食欲咸味的检测 (Chandrashekar 等人,2010)。在这里,该通道的亚基组成可能与典型的 ENaC 不同,它们对人类咸味的贡献尚不清楚。 21.2.2 非上皮组织和细胞中的 ENaC
ENaC 已在血管系统中检测到,特别是在内皮细胞 (EC) 和血管平滑肌细胞 (VSMC) 中,它调节血管阻力和血压。
在 EC 中,ENaC 决定血管扩张剂一氧化氮的机械性能和产生 (Warnock 等人,2014)。机械性能影响小血管和毛细血管的顺应性,从而影响外周血管阻力。在 VSMC 中,ENaC 蛋白感知膜拉伸并启动肌源性收缩 (Warnock 等人,2014)。
在下丘脑中,ENaC 似乎参与了血管加压素的释放 (Tasker 等人,2020)。 ENaC 表达也在皮质和海马的神经元中检测到(Giraldez 等人,2013 年),表明其在调节神经元兴奋性和突触传递方面具有潜在作用。
在感觉神经末梢中检测到了 ENaC 蛋白。在压力感受器中,ENaC 介导启动压力感受器反射的传入输入(Drummond 等人,1998 年)。在皮肤的感觉神经末梢中,ENaC 参与触觉和疼痛感(Geffeney 和 Goodman,2012 年)。
ENaC 在免疫系统的树突状细胞中表达,并通过以盐敏感的方式影响促炎细胞因子的产生来介导免疫反应(Barbaro 等人,2017 年)。
21.3 亚基多样性和基本结构组织
ENaC 有四个单独的亚基 (α、β、γ 和 δ),分别由基因
SCNN1A、SCNN1B、SCNN1G 和 SCNN1D 编码。虽然 SCNN1D 仅存在于总鳍鱼和四足脊椎动物中(鼠科除外),但 SCNN1A、
SCNN1B 和 SCNN1G 存在于大多数脊椎动物中(辐鳍鱼除外)
(Wichmann 和 Althaus, 2020)。异源三聚体人类
326 离子通道教科书第二卷
αβγ-ENaC 的低温电子显微镜衍生结构显示出逆时针 α–γ–β 方向 (Noreng 等人,2018)(图
21.2a)。除了αβγ-ENaCs之外,δβγ-ENaCs还形成功能性离子通道(图参见 21.2b),它们持续产生比 αβγ-ENaC 更大的电流。同源 α-ENaC 或 δ-ENaC (图 21.2b) 产生的电流比异源三聚体 ENaC (Canessa 等人,1994;Waldmann 等人,1995) 小一百倍,并且此类同源 ENaC 的生理功能尚不清楚。在人类中,已鉴定出两种含有短 (1) 或长 (2) N 端的 δ-ENaC 亚基剪接变体 (Giraldez 等人,2007)。这些同工型形成功能性 δ1βγ-ENaC 和 δ2βγ-ENaC,具有相似的生物物理特性,但膜插入率不同 (Wesch 等人,2012)。所有四个 ENaC 亚基都具有共同的结构组织(图 21.2c),具有短的
细胞内 N 端和 C 端、两个跨膜区和一个大的细胞外环。
缺乏有关细胞内 N 端和 C 端的结构信息。
每个 ENaC 亚基的细胞外环类似于由“手腕”、“手掌”、“关节”、“手指”和“拇指”结构域形成的握紧的手,握着“一团 β 片层”(Noreng 等人,2018 年)(图 21.2c)。
手掌结构域主要由 β 片层形成,并允许与相邻亚基相互作用。
关节、手指和拇指结构域包含 α 螺旋,在 ENaC 门控中起重要作用。关节结构域与相邻亚基的指结构域相互作用,从而形成可能有助于稳定异源三聚体蛋白质的“领圈”(Noreng 等人,2018 年)。
一个关键的调节位点是位于每个亚基内指结构域和拇指结构域界面的蛋白水解抑制门控缓解 (GRIP) 结构域(Noreng 等人,2018 年)(图 21.3b)。α-ENaC 和 γ-ENaC GRIP 结构域含有抑制肽,这些肽两侧是蛋白酶裂解位点,使 ENaC 保持低开放概率 (PO) 状态(Noreng 等人,2018 年、2020 年)。细胞内和细胞外蛋白酶去除这些肽会增加 ENaC PO。有趣的是,β-ENaC GRIP 结构域不包含蛋白酶裂解位点 (Noreng 等人,2018)。
图 21.2
基本结构组织和 ENaC 亚基多样性。 (a) 人类 αβγ-ENaC 的低温电子显微镜衍生结构的插图和表面表示(蛋白质数据库:6BQN)。 (b) 四个 ENaC 亚基 (α、β、γ 和 δ) 可以以不同的组合组装成功能性 ENaC。 (c) 单个 ENaC 亚基(此处为人类 α-ENaC)的结构组织。 N 端和 C 端的结构尚未解析。 TM1/TM2,跨膜结构域(黄色)。细胞外部分类似于一只握紧的手,握着一个“β 片层球”(洋红色)。 “手掌”域显示为绿色,“关节”显示为红色,“手指”显示为浅蓝色,“拇指”显示为深蓝色。
327 ENaC 通道
ENaC 是一种糖基化蛋白。在人类 ENaC 中,α 亚基和 γ 亚基中存在三个 N 连接糖基化位点,而 β 亚基包含六个糖基化位点 (Noreng 等人,2018)。δ-ENaC 亚基内的糖基化位点数量未知。糖基化对于适当的通道成熟和运输非常重要(参见第 21.8 节)。此外,细胞外肽聚糖可以与细胞外基质形成束缚,从而促进人类 αβγ-ENaC 通过机械刺激(例如层流剪切应力)激活(Knoepp 等人,2020 年)。
21.4 门控
ENaC 是一种组成性活性离子通道(图 21.3a)。目前尚无关于开放状态 ENaC 的结构信息,因此无法就 ENaC 门控机制得出明确的结论。通道的打开/关闭可能是运动的结果
图 21.3
ENaC 门控。(a)在 –100
mV 下记录的 Xenopus laevis αβγ-ENaC 的代表性细胞附着膜片钳轨迹。 (单通道轨迹是 L. Wichmann、K. S. Vowinkel、A. Perniss、I. Manzini 和 M. Althaus 在 2018 年发表的“δ 亚基并入上皮钠通道 (ENaC) 会在 Xenopus laevis 中产生蛋白酶抗性 ENaC”,J Biol Chem 293(18):6647–58 中发表的数据的一部分。)(b) 人类 αβγ-ENaC 胞外结构域的结构(蛋白质数据库:6WTH)。每个亚基的 GRIP 结构域显示为表面模型。α 和 γ-GRIP 结构域内的抑制性 P1 肽以黄色显示。(c) 来自双电极电压钳实验的代表性电流轨迹,显示在 Xenopus 卵母细胞中表达的人类 αβγ-ENaC 的钠自抑制。从低浓度(1 mM)到高浓度(90 mM)的快速切换会触发快速内向电流,然后下降到较低的平台期。(d)人类 αβγ-ENaC 细胞外结构域(蛋白质数据库:6WTH),其中 α-ENaC 亚基酸性裂隙的 β6–β7 环以红色显示。
同一亚基的 α2-螺旋以黄色显示。阳离子(可能是 Na+)也以紫色表示在结构中。
328 离子通道教科书第二卷
第二跨膜结构域可能位于孔内。第二跨膜结构域内丝氨酸的突变支持了这一点结构域(人类 ENaC 中的 αS549、βS520 和 γS529)在 DEG/ENaC 家族成员中是保守的,被称为“退化位点”。用半胱氨酸替换 β-ENaC 亚基中的丝氨酸并将通道暴露于烷化剂(例如甲硫基磺酸盐)可将人类 ENaC 锁定在开放状态(PO = 1)(Haerteis 等人,2009 年)。ENaC 门控受细胞外和细胞内结构域的影响。ENaC α 和 γ 亚基的 GRIP 结构域包含四条 β 片层链(P1-P4)(Noreng 等人,2020 年)。 P1 含有将通道锁定在低 PO 状态的抑制肽,此类 ENaC 被描述为“近静默通道”(Caldwell 等人,2004 年)(图 21.3b)。抑制肽两侧是蛋白酶切割位点。在高尔基体网络中的 ENaC 成熟过程中,蛋白酶弗林蛋白酶切割 α 亚基两次,从而去除其抑制性 P1 肽,而 γ 亚基仅被切割一次。此类弗林蛋白酶处理的 ENaC 具有中等 PO。当膜定位 ENaC 的 γ-ENaC 亚基被细胞外蛋白酶(例如前列腺素)进一步裂解时,γ-ENaC 亚基的抑制肽被去除,从而进一步增加 ENaC PO (Kleyman and Eaton, 2020)。总体而言,蛋白水解成熟状态决定了 ENaC PO,这可能导致在天然组织中的膜片钳实验中观察到的 ENaC PO 变化(Palmer and Frindt, 1988)。钠自抑制 (SSI) 描述了对高细胞外 Na+ 浓度的 ENaC PO 的快速抑制。建议将 ENaC 介导的 Na+ 吸收与肾脏远端肾单位中细胞外 Na+ 浓度的波动相匹配(Kleyman and Eaton, 2020)。 SSI 最早是在青蛙皮肤制剂中观察到的,
其中顶端细胞外 Na+ 浓度的增加会诱发瞬时电流
并迅速下降至较低水平(Fuchs 等人,1977 年)。在表达 αβγ-ENaC 的 Xenopus 卵母细胞中也观察到了类似的现象。高细胞外 Na+ 浓度会触发
内向电流,由于 SSI,该电流会迅速下降至较低水平(图 21.3c)。触发该机制的假定 Na+ 结合位点可能位于 α-ENaC 亚基的指关节和指状结构域之间的“酸性裂隙”中(Noreng 等人,2020 年)。该裂隙(位于关节域和指域之间)β6–β7 环内的酸性残基(EQND 基序)提供了一个阳离子结合位点,可能介导细胞外 Na+ 离子降低 ENaC PO(Kashlan 等人,2015 年;Noreng 等人,2018 年;Wichmann 等人,2019 年)(图 21.3b)。在 Xenopus
laevis δ-ENaC 中发现了类似的酸性裂隙(Wichmann 等人,2019 年),但它在哺乳动物 δ-ENaC 中并不保守,这可能解释了哺乳动物 δ-ENaC 直系同源物的 SSI 降低(Wichmann 等人,2019 年)。 SSI 被质子拮抗,从而导致在酸性细胞外 pH 条件下活化 αβγ-ENaCs (Collier 和 Snyder,2009) 和 δβγ-ENaCs (Wichmann 等人,2019)。
SSI 和 GRIP 结构域的蛋白水解加工相互影响。人类 αβγ-ENaC 的结构表明,α-ENaC 亚基中 GRIP 结构域的 P3 链稳定了 α2 螺旋和 β6–β7 环之间的相互作用,该环包含该亚基的假定 Na+ 结合位点 (Noreng 等人,2020)(图 21.3b)。在弗林蛋白酶切割后去除抑制性 P1 肽后,这种稳定性可能会消失,这可能解释了 α-ENaC 亚基蛋白水解加工后 SSI 降低的原因 (Noreng 等人,2020 年)。GRIP 结构域的 SSI 和蛋白水解加工如何与通道的打开/关闭相关联尚不清楚。然而,相邻亚基的手掌和拇指结构域之间的亚基间相互作用似乎对 ENaC 门控很重要,并且可能将酸性裂隙和 GRIP 结构域的结构变化传递到通道孔。在 ENaC 329 ENaC 通道亚基之间引入不同长度的交联剂表明亚基间距离会影响 ENaC PO (Collier 等人,2014 年)。总体而言,似乎一系列构象变化涉及 GRIP 结构域的灵活性、酸性裂隙内的阳离子相互作用以及手掌-拇指界面处的亚基间相互作用,这些变化都与 ENaC 门控有关。
除了细胞外结构域外,细胞内结构域也影响 ENaC 门控。保守的组氨酸-甘氨酸 (HG) 基序位于细胞内 N 端,这些残基的突变会影响 ENaC PO,包括导致 1 型假性低醛固酮血症的突变(Grunder 等人,1997 年)。 ENaC N 端的结构信息尚不清楚,但鸡 ASIC1 的低温电子显微镜衍生结构显示,这种密切相关的离子通道的 N 端形成一个“折返环”,延伸到孔内,从而可能影响 ASIC 门控(Yoder 和 Gouaux,2020)。
是否有类似的机制可以解释细胞内 N 端对 ENaC 门控的贡献,目前尚不清楚。
21.5 离子通透性
ENaC 对 Na+ 离子具有高度选择性,αβγ-ENaC 的 Na+/K+ 通透性比率 >100:1 (Kellenberger 等人,1999 年),δβγ-ENaC 的 Na+/K+ 通透性比率 >50:1(Waldmann 等人,1995 年)。低钾通透性可能是为了防止由于组成性 ENaC 活性而导致的大量钾泄漏出细胞而进化的(Yang 和 Palmer,2018 年)。脊椎动物中 αβγ-ENaCs 的单通道 Na+ 电导率 (GNa+) 始终为 5 pS,而 δβγ-ENaCs 的 GNa+ 变化较大 (5-12 pS)。αβγ-ENaCs 对 Li+ 离子的渗透性比 Na+ 离子强 (Li+/Na+ 渗透性比 2:1;Canessa 等人,1994),而人类 δβγ-ENaCs 对锂离子的渗透性较差 (Li+/Na+ 渗透性比 1:1.6;Waldmann 等人,1995)。尽管如此,ENaC 对小阳离子 (Li+/Na+) 的渗透性表明离子选择性主要通过离子大小区分来实现。 ENaC 结构中的选择性过滤器尚未解决(Noreng 等人,2018 年),但诱变研究表明,它很可能是由每个亚基的第二个跨膜结构域内保守的 G/SxS 基序形成的(Kellenberger 和 Schild,2002 年)。
人类 α-ENaC 亚基中该 G/SxS 基序(S589A/C/D)内的第二个丝氨酸的替换增加了 ENaC 对较大的单价(K+、Rb+、Cs+)和二价(Ca2+)阳离子的通透性,这表明该残基可能有助于形成尺寸排阻过滤器(Kellenberger 等人,1999 年)。 是否有其他机制导致 ENaC 的高 Na+/K+ 通透性比率仍不清楚。
21.6 ENaC 的药理学
ENaC 在肾脏 Na+ 重吸收和 K+ 和 H+ 排泄中的重要作用使通道调节剂成为纠正细胞外体积和矿物质稳态缺陷的重要工具 (Alvarez de la Rosa 等人,2013)。此外,它在肺中的作用,包括控制气道粘液流动性和肺泡水转运 (Schoenberger 和 Althaus,2013),扩大了其作为治疗药物靶点的潜力。ENaC 的典型抑制剂是阿米洛利,一种吡嗪胍衍生物,最初被开发为 K+ 保留利尿剂,拮抗肾脏中的醛固酮作用 (Kleyman 和 Cragoe,1988)。
除了临床应用外,阿米洛利在定义 ENaC 的生理作用方面发挥了重要作用,并允许对通道亚基进行分子克隆(Canessa 等人,1994 年)。
阿米洛利阻断典型 ENaC 的 IC50 ≈100 nM(Canessa 等人,1994 年),这比其对其他 Na+ 转运蛋白(如 Na+/H+ 交换蛋白或 Na+/Ca2+ 反向转运蛋白)的亲和力低得多(IC50 在 μM 范围内;Kleyman 和 Cragoe,1988 年)。由于其胍基部分,阿米洛利是一种弱碱。在生理 pH 下,阿米洛利是单价阳离子。阿米洛利对 ENaC 的阻断取决于 pH 和膜电位,超极化会增加通道阻断。此外,阿米洛利阻断受渗透阳离子(Na+ 和 Li+)的细胞外浓度调节,这与孔阻断剂的作用一致。阿米洛利可能与由三个亚基形成的孔的外部开口结合,靠近选择性过滤器(G/SxS 基序)。在该模型中,吡嗪环位于残基 αSer583/βGly525/γGly537,而胍基部分占据选择性过滤器道的外部开口(Kashlan 和 Kleyman,2011)。由于缺乏开放状态的 ENaC 结构,因此无法对阿米洛利结合进行更详细的分析。对阿米洛利结构-功能关系的系统分析导致了具有更高 ENaC 亲和力的第二代抑制剂的开发,包括苯扎米勒和苯那米勒 (Kleyman and Cragoe, 1988),它们主要在研究应用中作为阿米洛利的更有效替代品。第三代高亲和力 ENaC 阻滞剂已经开发出来,主要是由于 ENaC 可能作为治疗囊性纤维化和其他肺部疾病的药物靶点,以及阿米洛利在这种情况下由于药物清除速度快而表现不佳 (Moore and Tarran, 2018)。 有报道称,阿米洛利衍生物具有更高的亲和力,并且在肺上皮中吸收减少 (Hirsh et al., 2008)。基于与阿米洛利化学上无关的吡嗪基季胺的化合物的开发也产生了新型高亲和力 ENaC 阻滞剂,这些阻滞剂可能具有改进的药代动力学特性 (Alvarez de la
Rosa 等人,2013)。已经提出了 δβγ-ENaC 通道的选择性抑制剂,但它们通常缺乏足够的特异性和选择性而无法使用 (Giraldez 等人,2012)。
21.7 ENaC 的调节
严格控制 ENaC 活性对于全身和组织稳态至关重要。
调节机制可以由激素启动,最重要的是醛固酮rone,在细胞外容量和血压调节以及电解质稳态中起关键作用(Rossier 等人,2015 年)。其他激素调节 ENaC 活性,包括加压素、心房利钠肽 (ANP)、胰岛素和内皮素 (Rotin 和 Staub,2021 年)。旁分泌信号(如 ATP)已被证明可通过 P2Y 受体调节 ENaC(Deetjen 等人,2000 年)。从分子角度来看,ENaC 调节在多个层面上发挥作用(图 21.4),其机制影响 PO、膜中活性通道的数量(N)或两者。这些机制以组织特异性方式运作(Rotin 和 Staub,2021 年)。 ENaC 调节包括通过 Na+ 或机械力等细胞外因素快速控制门控(第 21.4 节;最近由 Kleyman 和 Eaton,2020 年审查;Kleyman 等人,2018 年)。此外,通道 PO 通过蛋白水解加工在较长时间内增加(第 21.4 节)。多种蛋白酶对 ENaC 的调节已在培养细胞中得到充分证实,但其在体内的作用更难分离。有新证据表明前列腺素控制肺和结肠中的 ENaC,而其他蛋白酶(如激肽释放酶)在体内作用的证据尚缺乏(Kleyman 和 Eaton,2020 年)。重要的是,ENaC 蛋白水解加工增加与激素刺激有关 (Frindt 和 Palmer,2015;Zheng 等人,2011)。此外,多项研究已将人尿中异常蛋白酶活性与肾病综合征期间 ENaC 活化增加联系起来 (Kleyman 和 Eaton,2020)。
图 21.4
ENaC 调节。调节 ENaC PO、门控和膜丰度的主要调节机制示意图。新合成的 ENaC 可以直接从 ER (1) 或通过高尔基体 (2) 输送到质膜,在那里获得成熟的糖基化并进行蛋白水解加工。质膜输送可以是组成性的,也可以是由储存的囊泡池 (3) 调节的,这个过程由加压素和胰岛素信号诱导。质膜 ENaC 受剪切应力、细胞外 Na+ 浓度和进一步的蛋白水解加工调节。ENaC 质膜稳定性受
可逆泛素化调节。泛素标记内吞通道 (4)。单、多或多泛素化
调节通道循环到膜 (5) 或在溶酶体中降解 (6)。醛固酮和糖皮质激素调节 ENaC 亚基和调节因子的转录,包括 SGK1 和
miRNA 等蛋白质。SGK1 负向调节 ENaC 泛素化,可能还影响正向运输和 PO。
缩写:CAP,通道激活蛋白酶;DUB,去泛素化酶;GR,糖皮质激素受体;InsR,胰岛素受体;MR,盐皮质激素受体; Nedd4-2,神经前体细胞表达的下调 4-2;P2Y,代谢型嘌呤能受体;SGK1,血清和糖皮质激素诱导的激酶 1;Ub,泛素;V2R,加压素受体 2。
332 离子通道教科书第二卷
ENaC PO 也受磷脂酰肌醇调节,例如磷脂酰肌醇 4,5-二磷酸 (PIP2) 和磷脂酰肌醇 3,4,5-三磷酸 (PIP3) (Kleyman 和 Eaton,2020 年)。PIP2 似乎是维持基础 ENaC 活性所必需的。嘌呤能 P2Y 受体的刺激会激活磷脂酶 C,进而水解 PIP2,导致 ENaC 活性降低 (Deetjen 等人,2000)。醛固酮刺激会通过激活磷脂酰肌醇-3-激酶急剧增加膜 PIP3 水平,从而增加 ENaC 活性 (Blazer-Yost 等人,1999)。磷脂酰肌醇是通过直接关联还是间接作用来调节 ENaC 尚不确定,但有证据支持 PIP2 与 ENaC 胞质结构域中的碱性残基直接结合 (Archer 等人,2020)。翻译后修饰对于控制 ENaC 活性很重要,会影响 PO 和 N。这些包括泛素化,这对于控制质膜上的 ENaC 稳定性至关重要(第 21.8 节)、磷酸化和棕榈酰化(Rotin 和 Staub,2021 年)。激活 ENaC 的激素,例如醛固酮或胰岛素,会增加 β 和 γ-ENaC 亚基 COOH 末端 S/T 和 Y 残基的亚基磷酸化(Shimkets、Lifton 和 Canessa,1998 年)。已证明几种激酶可直接磷酸化 ENaC,包括 PKC、酪蛋白激酶 II 以及血清和糖皮质激素诱导的激酶 1 (SGK1)。然而,大多数调节性磷酸化过程似乎会间接影响通道活性和运输(Rotin 和 Staub,2021 年)。除了 SGK1 之外,这些还包括代谢传感器 AMP 活化蛋白激酶 (AMPK),没有赖氨酸/K 激酶 (WNK) 或 mTORC2 (Rotin and Staub, 2021)。β 和 γ-ENaC 亚基的棕榈酰化已被证实 (Mukherjee et al., 2017),但这种修饰在体内的作用仍不清楚.
21.8 ENaC 的细胞生物学:生物发生、运输和周转
主要的生理 ENaC 调节剂,激素醛固酮,通过盐皮质激素受体 (MR) 发挥其功能,MR 是转录因子的核受体家族的成员。然而,ENaC 亚基表达不协调,并且醛固酮对亚基 mRNA 和蛋白质丰度的影响具有高度的组织特异性 (Masilamani 等人,1999)。醛固酮在电解质平衡方面的主要靶细胞,远端肾单位/集合管的主要细胞,在醛固酮刺激后,α 亚基表达增加,但 β 亚基或 γ-ENaC 亚基表达没有增加,同时通道表面丰度急剧增加 (Masilamani 等人,1999)。已鉴定出参与调节 ENaC 运输的醛固酮诱导蛋白,
最重要的是 SGK1 (Chen 等人,1999)。这与人类先天性高血压中 ENaC 细胞表面丰度失调的发现 (Firsov 等人,1996) 一起,
引起了人们对研究 ENaC 生物合成和运输的极大兴趣,这已得到广泛研究(有关最近的综述,请参阅 Ware 等人,2020),特别是在肾上皮细胞中。通道亚基在粗面内质网 (ER) 处合成,
以允许膜插入 (Canessa、Merillat 和 Rossier,1994) 和亚基组装。
所有 ENaC 亚基都是 N-糖基化的。虽然 ENaC 糖基化似乎对功能并非必不可少 (Canessa 等人,1994),并且核心糖基化的未成熟亚基
可以到达质膜,但已证明成熟的糖基化可能代表膜中的主要传导通道池 (Frindt 等人,2016)。
一旦合成,ENaC 就会离开 ER,并通过高尔基体从储存的囊泡池中输送到上皮细胞的顶端膜,该过程可以由 cAMP/PKA 信号传导 (Ware 等人,2020) 或来自循环途径调节,
这可能解释了文献中报道的 ENaC 递送动力学的不同 (Ware 等人,2020)(图 21.4)。有证据表明醛固酮促进大鼠肾脏的顶端输送 (Frindt 等人,2016)。这项研究还表明,不同组合的通道遵循不同的 ER 出口途径,ENaC 异三聚体遵循典型的高尔基体途径,其中包括蛋白水解加工。该模型可以解释早期报告三个 ENaC 亚基的协调和非协调运输的差异。 ENaC 质膜停留时间受网格蛋白介导的内吞作用控制(Shimkets 等人,1997),该作用由 Nedd4-2 对 NH2 末端的 K 残基进行亚基泛素化所促进,Nedd4-2 是一种泛素连接酶,可与 COOH 末端的 PY 基序相互作用(Staub 等人,1997)(图 21.4)。PY 基序在 ENaC 调节中的重要性得到认可,因为它们在 Liddle 综合征中发生改变(Shimkets 等人,1994),并且由于在质膜中积累而产生通道活性增加(Firsov 等人,1996)。多泛素化引导 ENaC 进行溶酶体降解,而单泛素化和多泛素化控制其内吞作用 (Ware et al., 2020)。ENaC 的乙酰化降低了其泛素化,从而稳定了通道 (Butler, Staruschenko, and Snyder, 2015)。SGK1 是一种醛固酮诱导的激酶 (Chen et al., 1999),它通过磷酸化 Nedd4-2、使其失活并阻止 ENaC 泛素化来控制 ENaC 活性,从而稳定膜中的通道 (Debonneville et al., 2001)。然而,最近从大鼠肾脏获得的证据表明,刺激正向运输可能是醛固酮作用的关键调节步骤 (Frindt et al., 2020)。 SGK1 代表激素调节的 ENaC 运输的汇聚点,包括其在胰岛素和加压素的影响中的作用 (Rotin and Staub, 2021)。通道内吞后,ENaC 可以被引导至溶酶体降解或回收回质膜,这取决于去泛素化酶 (DUB) 去除泛素标签 (图 21.4) 以及与多聚体蛋白质回收复合物的相互作用 (Ware et al., 2020)。DUB 本身已被证明是醛固酮的靶标 (Fakitsas et al., 2007),因此 ENaC 分类很可能受激素控制。 ENaC 的内吞和运输可能受到其他蛋白质的修饰,而这些蛋白质又被认为至少部分地受醛固酮调节的 microRNA 表达的控制(Edinger 等人,2014 年)。有证据表明,肾小管中 ENaC 运输存在节段特异性激素控制(Nesterov 等人,2016 年)。人们对非上皮组织中 ENaC 的运输和调节知之甚少,尤其是在血管内皮和平滑肌细胞中。ENaC 似乎是调节血管 t 的重要因素一个,但其在内皮细胞中的一些特性和可变的亚基组成表明存在不同的调节途径 (Warnock 等人,2014)。
21.9 通道病和疾病
ENaC 通道病包括功能获得和功能丧失,并与 ENaC 亚基基因突变或参与 ENaC 调节的细胞信号通路改变有关。特征最明显的 ENaC 通道病与肾功能受损和血压调节有关。
血压升高 (高血压) 与 ENaC 活性增加 (功能获得) 有关 (Pavlov 和 Staruschenko,2017)。一种常染色体显性遗传的高血压,称为 Liddle 综合征,是由 β-/γ-ENaC 编码基因的功能获得突变引起的(Shimkets 等人,1994 年)。这些突变破坏了 PY 基序并导致通道在膜中长时间存在(参见第 21.8 节),从而导致体液含量和心输出量增加。除了 PY 基序突变外,还发现 α-、β- 或 γ-ENaC 中的几种单核苷酸多态性与高血压有关,但影响 ENaC 功能的潜在机制尚不清楚(Hanukoglu 和 Hanukoglu,2016 年)。导致功能丧失的 ENaC 亚基基因突变与肾性盐耗和低血压(低血压)有关。由此产生的疾病被称为假性低醛固酮血症 (PHA1),由编码 α-、β- 和 γ-ENaC 亚基的基因内的常染色体隐性突变组成 (Hanukoglu 和 Hanukoglu,2016)。
除了因肾脏盐和水丢失导致的低血压外,PHA 1 患者还表现出呼吸道症状、汗腺和唾液腺功能改变以及生育能力受损 (Hanukoglu 和 Hanukoglu,2016)。
囊性纤维化 (CF) 通常由囊性纤维化跨膜传导调节器 (CFTR) 基因的功能丧失突变引起,其特征是气道中离子和水稳态受损,导致粘稠的黏液覆盖上皮。这会影响黏液纤毛清除,导致慢性感染和肺功能逐渐下降。在具有 CF 样症状但 CFTR 功能正常的一组患者中,发现了 ENaC 编码基因的功能获得性突变 (Azad 等人,2009),并由于气道上皮 Na+ 和水重吸收增加而导致 CF 样表型。
肺水肿的特征是肺血管外腔积液过多,从而损害血液氧合。ENaC 功能降低与肺水肿的形成有关,这是由于肺泡气腔 Na+ 和水重吸收受损所致 (Hummler 等人,1996)。这可能是由缺氧 (例如在高海拔地区) 或血红素水平升高 (例如在急性呼吸窘迫综合征期间) 引起的。
虽然缺氧似乎在转录水平上降低了 ENaC 的功能(Hollenhorst、
Richter 和 Fronius,2011),但血红素直接与通道相互作用并降低 PO(Wang、
Publicover 和 Gu,2009)。COVID-19 患者因 ENaC 活性降低而出现的肺水肿可能是感染 Sars-CoV-2 病毒的结果。病毒刺突蛋白中的序列与 α ENaC 的
GRIP 结构域中的弗林蛋白酶切割位点相同(Anand 等人,2020 年),这暗示了这一点。
最近的证据表明 ENaC 是癌症进展的一个促成因素(Liu 等人,2016 年)。在乳腺癌中,ENaC 表达的减少与细胞增殖率增加有关,这是更恶性表型的特征 (Ware et al., 2021)。
21.10 结论
ENaC 的分子克隆定义了一个新的离子通道家族 (DEG/ENaC),并迅速导致鉴定出对血压和电解质稳态有深远影响的遗传性人类突变。从那时起,人们对该通道的结构、表达、调节和病理生理作用有了很大的了解。当前和未来的挑战包括更好地定义 ENaC 在非上皮组织中的作用以及不同亚基组合对通道病理生理的可能贡献。为此,需要更深入地表征 ENaC 复杂的调节网络,以及改进的组织特异性药理学工具来控制通道。最后,关于 ENaC 结构,特别是跨膜和细胞内结构域,仍然存在一些重要问题。
22
TRPC 通道
Jin Bin Tian 和 Michael X. Zhu
22.1 简介
TRP 通道因其与果蝇 TRP(Montell 等,2002)同源而得名,这种蛋白质之所以如此命名,是因为其突变会导致瞬时受体电位(trp)表型,从而损害昆虫的光传导。术语“受体电位”描述了动物对光刺激的光反应,使用视网膜电图测量。trp 突变体在视网膜电图上缺乏持续相(图 22.1A)。在 TRP 同源物中,TRP 典型(或 TRPC)是指那些与原型果蝇 TRP 具有高序列同源性的 TRP 蛋白(整体氨基酸序列同一性约为 35%),在昆虫中有三种异构体(TRP、TRP 样和 TRPγ),在哺乳动物中有七种异构体(TRPC1-C7)(图 22.1B)。在人类中,TRPC2 是一种假基因。编码这些蛋白质的基因都是在 1989 年至 1999 年的十年间发现的。1989 年,果蝇 trp 基因首次通过遗传方法的定位克隆分离出来(Montell 和 Rubin,1989 年),随后在 1992 年通过筛选 cDNA 表达文库发现了与 TRP 具有高度同源性的钙调蛋白结合蛋白 TRP-like。这一早期的功能研究表明,TRP 和 TRP-like 均可介导昆虫感光细胞中的光诱导电流,从而确定了它们在昆虫视觉中的基本作用。然而,哺乳动物的 TRPC 通常不参与光传导,尽管它们都是基于使用果蝇 TRP 和 TRP-like 序列的同源性筛选而克隆出来的(Zhu 等人,1996 年)。离子通道教科书第二卷 TRPC 通道
22.2 生理作用
果蝇 TRP 和 TRP 样通道不直接由光激活。相反,
它们由 Gq 蛋白下游激活,该蛋白对昆虫感光细胞中
视紫红质的光激活作出反应。Gq 蛋白与磷脂酶 C (PLCβ) 的 β 同工酶偶联,后者又分解质膜上的磷脂酰肌醇 4,5-二磷酸
(PIP2),产生两种第二信使 - 肌醇 1,4,5-三磷酸 (IP3) 和二酰甘油 (DAG) - 质子 (H+) 作为副产物 (Huang 等人,
2010)。研究表明,PIP2 及其前体 PIP 和 PI 的减少以及通道细胞质侧的局部酸化对于果蝇感光细胞中天然 TRP 和 TRP 样物质的激活非常重要 (Huang 等人,2010)。
同样,哺乳动物 TRPC 也在 PLC 通路下游被激活,
包括 Gq/11–PLCβ 和受体酪氨酸激酶–PLCγ 通路。这些通路
广泛存在于所有哺乳动物细胞中,负责 IP3 诱发的 Ca2+ 动员
图 22.1
关于 TRPC 的一般背景。(A) 图表描绘了通过视网膜电图测量的野生型和 trp 突变果蝇的受体电位。轨迹下方的括号表示光照。 (B) 系统发育树显示了三种果蝇 (Dm) 和七种鼠 (Mm) TRPC 蛋白之间的关系。 (C) TRPC4α 的结构组织和一些关键调节位点。标记了锚蛋白样重复序列 (ANK)、跨膜片段 (蓝色框) 和钙调蛋白 (CaM) 结合位点 (红色圆圈)。 EWKFAR 表示 TRP 基序。 VTTRL 表示 NHERF 结合域。 仅针对 TRPC5 报告了所示部分特征的实验证据。 –,负调节; ±,正调节和负调节。 有关更多详细信息,请参阅 Tian 等人 (2014) 和 Wang 等人 (2020)。 339 来自内质网 (ER) 库的 TRPC 通道。有趣的是,内质网释放 Ca2+ 总是会诱导 Ca2+ 流入细胞。这个过程被称为电容性 Ca2+ 内流或钙池操纵的 Ca2+ 内流 (Putney, 1986)。当果蝇 TRP 首次被发现时,其在 PLC 下游的激活和 Ca2+ 通透性引起了人们的注意,这导致了这样的假设:其哺乳动物同源物可能是钙池操纵的 Ca2+ 内流的分子基础,这推动了在 TRPC 研究早期寻找哺乳动物物种中 TRP 同源物的主要动力,并对这些同源物进行功能表征,使其成为钙池操纵通道 (Birnbaumer 等人,1996)。然而,这些通道并不像特征最明显的天然钙库操纵通道(即 Ca2+ 释放激活 Ca2+ (CRAC) 通道)那样表现出高 Ca2+ 选择性和非常小的单位电导。相反,TRPC 通道是阳离子非选择性的,不仅对 Ca2+ 具有极好的渗透性,而且对 Na+ 和 K+ 也具有极好的渗透性,并且它们显示出从 14 pS 到 ~70 pS 的单通道电导。这个难题直到 2006 年才得到解决,当时 ORAI 蛋白被发现形成 CRAC 通道,这些通道通过 STIM 的结合而打开,STIM 是一种将 Ca2+ 库耗竭信号传递到质膜定位的 ORAI 通道的反式内质网膜蛋白(Prakriya 等人,2006 年;另见第 25 章)。有趣的是,有证据表明 STIM 也直接与至少一些 TRPC 同工型相互作用。这可能是 TRPC 通道的库操纵激活的基础,尽管
电流在离子选择性和电导性方面与 ORAI 通道不同。值得注意的是,天然之前已经报道过具有与 TRPC 通道类似的单一电导的钙库操作非选择性电流,这意味着存在多个钙库操作的 Ca2+ 进入途径;一些由 ORAI 编码,一些由 TRPC 编码 (Wang et al, 2020)。
所有 TRPC 通道也可以被视为受体操作通道,因为它们的激活是在刺激 PLC 功能的受体下游进行的。本质上,ER Ca2+ 库耗竭是由于 IP3 介导的 Ca2+ 动员导致 PLC 激活的必然结果;因此,当初始触发因素是受体激动剂时,并不总是能够区分 TRPC 的激活是由库耗竭还是 PLC 通路的其他成分引起的,这代表了诱导 TRPC 电流的最可靠方法。在更严格的条件下,当在没有受体激活的情况下诱发钙库耗竭时,ORAI 通道可能通过功能或物理相互作用与 TRPC 合作,使 TRPC“看起来”是由钙库操作的,尽管在 STIM 直接激活 TRPC 的情况下,ORAI 不发挥作用。目前,对于 TRPC 通道是否以及如何由 Ca2+ 钙库耗竭激活仍无共识。无论是否由钙库操作,受体操作的 TRPC 通道激活都会将 Na+ 和 Ca2+ 带入细胞,分别导致膜去极化和细胞质 Ca2+ 浓度 ([Ca2+]c) 升高。这些也代表了这些通道的主要生理作用。大量研究表明 TRPC 通道参与各种生理和病理生理环境、不同细胞类型和器官。这些功能涵盖神经传递、神经退化、心脏收缩、心律失常、肥大、内皮细胞通透性、血管扩张剂释放、细胞迁移、血管生成和动脉粥样硬化形成、平滑肌收缩和增殖以及癌症生长和转移。不同的功能可能源于不同细胞类型中 TRPC 亚型表达的差异、各个 TRPC 通道产生的 Na+ 和 Ca2+ 信号的时空模式以及特定 TRPC 亚型与其蛋白质伙伴之间可能存在的独特蛋白质-蛋白质相互作用 (Jeon 等人,2021 年)。 340 离子通道教科书第二卷
22.3 亚基多样性和基本结构组织
根据序列同源性,哺乳动物 TRPC 细分为四组:TRPC1、
TRPC2、TRPC3/C6/C7 和 TRPC4/C5。后两组成员之间分别有大约 75% 和 65% 的氨基酸同一性。所有 TRPC 成员在其羧基 (C) 末端都含有一个绝对保守的序列 EWKFAR,称为 TRP 结构域
(图 22.1C)。它们在氨基 (N) 末端也有锚蛋白样重复序列,在 C 末端还有另一个保守基序,即钙调蛋白 (CaM) 和 IP3 受体结合 (CIRB) 位点
(Zhang 等人,2001 年)。此外,单个 TRPC 亚型还与多种其他蛋白质相互作用,例如 Homer、Junctate、NHERF 和 STIM1 (Wang 等人,2020)(图 22.1C)。
与其他 TRP 通道一样,TRPC 形成由相同或相关亚基组成的四聚体(图 22.2A)。每个 TRPC 亚基由六个跨膜片段(S1-S6)组成,N 端和 C 端均位于细胞质侧(图 22.2B)。S1-S4 片段称为电压感应类结构域。它们与 S5-S6 孔结构域的域交换排列类似于其他 TRP 通道和电压门控 K+ (Kv) 通道。离子传导孔由 S5 和
S6 以及四个原体的对称排列中的中间孔 (P) 环形成。
S6 的 C 端部分形成的四螺旋束代表几乎所有低温电子显微镜 TRPC 结构中最窄的部分或通道门。所涉及的氨基酸是来自高度保守序列
VLLNMLIAMXNXSXQ 的异亮氨酸 (I)、天冬酰胺 (N) 和谷氨酰胺 (Q)。然而,在某些结构中,最受限制的路径是由 L654 和 I658 (在 TRPC3 中) 或 L723、I727 和 F731 (在 TRPC6 中) 形成的 (Fan et al., 2018; Bai et al.,
2020),它们分别位于常见的 I、N 和 Q 之前的一个残基。对于选择性过滤器,最窄部分具有保守的甘氨酸,它位于上部入口处谷氨酸(TRPC3 中的 E618 和 TRPC6 中的 E687)或天冬酰胺(TRPC4 中的 N580 和 TRPC5 中的 N584)下方三个残基。已证明 TRPC3-E618 和 TRPC5-N584 都对通道的 Ca2+ 通透性至关重要(参见 Wang 等人,2020 年的评论)。在细胞质侧,四个锚蛋白样重复序列构成外围,它围绕由远端 C 端 α 螺旋(称为 CH2)形成的螺旋束。CH2 是
图 22.2
TRPC4/C5 通道的结构特征。(A)组装四聚体通道图。对于细胞质区域,仅显示两个亚基。注意en CH1 和 CH2 螺旋。TRP 折返区(在图 B 中标记)和 CH1 之间的无序区域用红色链突出显示。包含 CH1 部分和无序区域的 CIRB 基序用椭圆形阴影表示。(B)单个亚基的主要结构特征。圆柱体突出显示跨膜结构域(S1-S6)、氨基(N)和羧基(C)末端结构域中的 α-螺旋。AR1-AR4 表示锚蛋白样重复,H1-H7 表示 N 端的螺旋-环-螺旋结构域。大多数 TRP 通道中都存在 TRP 螺旋或 TRP 结构域。(C)带状图 封闭的小鼠 TRPC4 通道单个亚基的侧视图。341 个 TRPC 通道通过跨越相邻原体的短环连接到 CH1。这样,CH2 就面对同一原体的锚蛋白重复序列(图 22.2A)。四个交叉,加上由四个原体中的各个 CH2 结构域组成的长螺旋束,有助于稳定四聚体结构。CH1 是一个比 CH2 更近端的长 C 端 α 螺旋,它与包含保守 TRP 结构域的螺旋反向平行。TRP 螺旋位于膜的正下方,通过 TRP 折返环与 CH1 相连,后接包含 CIRB 位点的无序区域(图 22.2A、C)。该区域完全暴露在膜-细胞质界面,多个 TRPC 相互作用蛋白可以进入通道进行功能调节。CH1 与 TRP 螺旋被相邻原体的 N 端连接螺旋隔开。 TRP 螺旋与 S6 跨膜片段的 C 端侧相连,可直接影响门控(图 22.2C)。胞质侧的这种整体结构与 TRPM 和 NOMPC 相似。
与 TRPM 和 TRPA1 相同的是,阳离子结合位点由 S2 最后两个螺旋圈中的两个残基(TRPC4 的 E417、Q420;TRPC5 的 E418、E421)和 S3 开始两个圈中的另外两个残基(TRPC4 的 N435、D438;TRPC5 的 N436、D439)协调。在 TRPC4 和 C5 中,钠离子或钙离子与此位置结合(图 22.3),而在 TRPM 和 TRPA1 中,该位置由 Ca2+ 占据,并参与促进和抑制(至少对于 TRPA1)通道功能(Zhao 等人,
图 22.3
TRPA、TRPC 和 TRPM 中的常见 Ca2+ 结合位点。 (A) TRPA1、TRPM4、TRPM8 和 TRPC4/C5 中发现的保守 Ca2+ 结合位点的结构细节。在 TRPC4/C5 中,阳离子可以是 Na+ 或 Ca2+。S2 和 S3 分别描绘了第二和第三个跨膜螺旋。虽然这里没有描绘,但 TRPC4/C5 中显示的紧密相邻的 TRP 螺旋也存在于其他 TRP 通道中。 (B) 氨基酸序列小鼠 TRPA1、TRPM2/M4/M5/M8 和 TRPC1-C7 的 S2–S3 区域的对齐,显示除 TRPC1 外,参与 Ca2+ 结合的关键残基(红色框)的保守性。数字表示 TRPA1 中的位置。替换(灰色背景上的蓝色字母)表明该结合位点在 TRPC1 中被破坏。
342 离子通道教科书第二卷
2020)。然而,该位点以何种方式参与 Na+ 依赖性或 Ca2+ 依赖性的 TRPC 通道调节仍有待确定。最近的低温电子显微镜结构强调了该位点的功能重要性,显示其参与与某些 TRPC 抑制剂的结合(Bai 等人,2020 年)。 22.4 门控
尽管最近的低温电子显微镜 TRPC 结构提供了有关门控位置和门控方式的线索,这些线索基于结构差异、配体结合位点位置以及与其他相关通道的比较,但 TRPC 通道的门控方式仍不清楚。人们普遍认为 TRPC 通道在 PLC 刺激的下游被激活。PLC 通路的至少三种成分与 TRPC 通道门控有关:PIP2、IP3 和 DAG。其中,IP3 可能通过激活 IP3 受体间接发挥作用,然后 IP3 受体在保守的 CIRB 位点与 TRPC 发生物理相互作用。然而,CIRB 基序在低温电子显微镜结构中基本上是无序的,而且距离前面描述的 S6 门也相当远,因此很难知道 IP3 受体结合如何影响门控。对于 PIP2,据报道,在 TRPC6 的低温电子显微镜结构中,S4 和 S4-S5 连接子之间有一个假定的磷脂结合位点(Bai 等人,2020 年),该位点部分与 TRPC6 拮抗剂 BTDM 的结合位点重叠(Song 等人,2021 年)。这是否代表 PIP2 结合位点还有待确定,尽管在 TRPV1 中,磷酸肌醇和香草酸也与相似区域结合。对于 DAG,最近有报道称 TRPC5 的假定结合位点位于跨膜区外层,楔入孔螺旋和相邻原体的 S6 段之间(Song 等人,2021 年)。该区域包含一个保守的甘氨酸,位于选择性过滤器后面er,可通过亚基连接开窗进入,并且已被证明对 TRPC3 中的 DAG 结合至关重要(Lichtenegger 等人,2018 年)。有趣的是,合成的 TRPC6 激动剂 AM-0883 也结合在等效口袋中(Bai 等人,2020 年)。该化合物与孔螺旋上的 F675 和 W680 以及相邻亚基 S6 上的 Tyr705、
Val706 和 Val710 相互作用。在所有这些情况下,DAG 或其合成类似物 OAG 或 AM-0883 似乎从细胞外侧获得进入,但通过 PIP2 水解内源性产生的 DAG 应该首先出现在质膜的内叶中。因此,这是否代表了由 PLC 信号产生的内源性 DAG 作用的真实位点,以及它是否在所有 TRPC 通道中都保守,值得进一步研究。Ca2+ 是 PLC 信号通路的一部分,由 IP3 受体介导的 ER Ca2+ 释放和 Ca2+ 通过质膜 Ca2+ 通透性通道(包括 TRPC 通道本身)进入所致,也与 TRPC 通道门控有关(Wang 等人,2020 年)。这些包括刺激和抑制作用,可以通过钙离子直接作用于通道或通过其他 Ca2+ 结合蛋白(例如钙调蛋白和 PLCδ1)发生(Thakur 等人,2016 年)。基于 TRPA1、TRPC 和 TRPM 中 S2 和 S3 之间阳离子结合位点的保守性,以及许多 TRPC 拮抗剂占据同一区域的发现,与该位点的结合可能代表 Ca2+ 对 TRP 通道门控的共同机制(Zhao 等,2020;Song 等,2021)。可能底物与该位点结合引起的构象变化的作用类似于电压对电压门控通道构象的影响,导致 S4-S5 连接子发生变化以及 S6 四螺旋束旋转和移位以打开下门。从这个意义上说,电压门控通道的电压感应域和 TRP 通道的电压感应样域可能确实在通道门控中共享一个共同的保守机制。然而,包含 S2-S3 阳离子结合位点的电压感应样结构域门控每个 TRPC 亚型的详细机制仍有待阐明。
除了第二信使外,许多蛋白质也与 TRPC 通道的激活有关。这些包括 STIM1,一种 ER 跨膜蛋白,可感知储存耗尽;异三聚体 G 蛋白的 Gαi/o 亚基;以及 SESTD1,一种包含 SEC14 样脂质结合域和两个频谱蛋白域的蛋白质,在 Ca2+ 存在下与 PIP 和 PIP2 结合。有趣的是,Gαi/o 和 SESTD1 都与先前描述的 CIRB 基序结合,该基序也与钙调蛋白和 IP3 受体结合,并且在低温电子显微镜结构中大多无序。另一方面,STIM1 可以通过 TRPC C 末端的两个保守天冬氨酸/谷氨酸 (TRPC1 的 D639、D640;TRPC4 的 E648、E649) 与 STIM1 C 末端的两个赖氨酸残基之间的静电相互作用与 TRPC 结合。TRPC 中的这些残基位于 TRP 螺旋和 TRP 折返的边界处,非常靠近 CIRB 基序的无序部分 (Wang et al., 2020)(图 22.1C)。值得注意的是,使用不包含 C 末端赖氨酸的重组 STIM1-Orai1 激活区 (SOAR),Asanov 等人。 (2015) 成功激活了切除的内外贴片中的 TRPC1、C4 和 C5 的单通道电流,但没有激活 C3 和 C6。结合单分子荧光成像,这些研究人员还证明一个 TRP 四聚体需要两个 SOAR 分子,而四个钙调蛋白分子则拮抗了该活性。目前尚不清楚 SOAR 片段究竟在哪里结合以及它如何门控 TRPC 通道。TRPC 的其他门控机制包括溶血磷脂、氧化还原状态变化、花生四烯酸及其代谢物 20-HETE、一氧化氮、机械刺激和冷却温度。有关这些调节的详细信息,请参阅以前的评论文章(Tian 等,2014;Wang 等,2020)。在大多数情况下,除了TRPC5被一氧化氮的s-亚硝化位点外,这种调节的结构基础仍然缺乏,而且关于这种调节是直接的还是间接的还存在争议。
22.5离子通透性
所有同源TRPC都是非选择性阳离子通道,可以渗透Ca2+和相关的二价阳离子。事实上,对Sr2+、Ba2+和Mn2+的渗透性已用于评估表达系统中的TRPC通道活性。基于反转电位测量的报道的离子选择性值差异很大。TRPC的PCa2+/PNa+(或Cs+)比率已总结为~1到10,排序为TRPC5>C6>C7>C2>C3>C4>C1(Gees等人,2010年)。目前还没有关于 Ca2+ 电流分数测量的报道TRPC 的调节。在生理条件下,TRPC 传导的主要离子是 Na+。TRPC 介导的总阳离子流入 (INa+ + ICa2+) 导致去极化,在可兴奋细胞中可激活电压门控 Na+ 和 Ca2+ 通道。
TRPC3 介导的 Na+ 流入也已证明可以触发 Na+/Ca2+ 交换器 (NCX) 的“反向模式”,挤出 Na+ 以换取 Ca2+ 进入,从而间接增强 Ca2+ 信号 (Eder 等人,2005)。TRPC 通道可能通过增加局部 [Na+]c 来促进或改变其他 Na+ 依赖性转运活动。
344 离子通道教科书第二卷
然而,已证明通过 TRPC1 的 Ca2+ 流入可激活唾液腺和血管平滑肌细胞中的大电导 Ca2+ 激活 K+ (BK) 通道,导致超极化而不是去极化。已证明 TRPC1 和 BK 之间存在物理关联,表明这种耦合是局部的和有效的 (Kwan 等人 2009)。因此,尽管 TRPC 激活的直接局部效应是去极化的 Na+ 和 Ca2+ 流入,这取决于与其他蛋白质的关联,但全局 TRPC 激活可导致去极化或超极化。显然,TRPC 通道不仅是 [Ca2+]c 变化的介质,也是膜电位的关键调节器。在可兴奋细胞中,尽管主要 Ca2+ 进入途径似乎依赖于电压门控 Ca2+ 通道 (VGCC),该通道在 TRPC 介导的膜去极化作用下激活,但 Ca2+ 通过 TRPC 通道流入可能具有特殊的功能意义。例如,TRPC3 选择性过滤器 E633Q 的突变破坏了其 Ca2+ 通透性,但不影响心房肌细胞中的单价电导或其与 L 型 VGCC 的功能耦合,但它完全消除了 TRPC3 依赖性和钙调神经磷酸酶介导的活化 T 细胞核因子 (NFAT) 的核易位 (Poteser 等人,2011)。
22.6 药理学
过去对 TRPC 通道的研究因缺乏特异性激动剂和拮抗剂而受到阻碍。直到最近,只有非特异性阻滞剂(例如 SKF96365、2-氨基乙氧基二苯基硼酸盐 (2-APB) 和氟芬那酸)可用于评估 TRPC 通道在天然系统中的参与。这些药物无法区分不同的 TRPC,并且在所用的浓度下它们还具有许多非 TRPC 靶标。随着学术实验室和制药行业最近开发出新的小分子选择性 TRPC 通道激动剂和拮抗剂,这种情况在过去几年中得到了显着改善。有关当前 TRPC 小分子探针的全面讨论,读者可以参考 Wang 等人 (2020) 的评论文章。一般来说,所有新的 TRPC 探针都表现出 TRPC1/4/5 和 TRPC3/6/7 亚组之间的相对选择性。其中一些甚至专门针对 TRPC5,而不是密切相关的 TRPC4,或者在 TRPC3/6/7 亚组成员中表现出对特定 TRPC 异构体的偏好。然而,选择性信息应谨慎对待,因为大多数药物尚未彻底测试其脱靶效应。此外,目前,由于缺乏针对异源系统中这种 TRPC 异构体的特定检测方法,因此没有针对 TRPC1 的特定药物。在大多数筛选试验中,TRPC1 与 TRPC4 一起以 TRPC1-C4 异源复合物的形式进行测试。
22.7 调节
TRPC 通道调节的一些方面在门控部分中介绍。在这里,我们讨论影响这些通道活性的调节作用。第一个是磷酸化。 PKA、PKC 和 PKG 不同程度地抑制 TRPC3/6/7,
345 TRPC 通道
并且一些已识别的位点在三个通道之间是保守的,并且可以在 PKA 和 PKG 之间重叠。还表明 PKC 可以通过刺激 PKG 来抑制这些通道。对于其他 TRPC,PKC 的抑制也很常见。然而,PKC 激活了天然异源 TRPC1/C5 通道。PKA 和非受体酪氨酸激酶 Src 家族成员(例如 Fyn)也被证明可以调节某些 TRPC 通道的运输。磷酸化也可能影响 TRPC 与其伴侣蛋白的相互作用。有关 TRPC 磷酸化和其他翻译后修饰的更多详细信息,请参阅 Tian 等人(2014 年)和 Liu 等人(2020 年)。
TRPC4/C5 与其他 TRPC 同工型的区别在于对 Gi/o 蛋白的依赖。对于 TRPC4,Gi/o 是受体操作通道门控所必需的,其中 Gq/11–PLC 通路只能非常微弱地刺激该通道。但是,如果 Gi/o 被激活,TRPC4 就会经历强烈的激活,可能是由 Gαi/o–GTP 通过直接结合 CIRB 位点介导的 (Jeon 等人,2012)。在这种情况下,甚至 Gq/11–PLCβ 也不再是必要的,尽管它仍然可以通过加速功能来促进该过程TRPC4 和 PLCδ1 之间的传统偶联,PLCδ1 是一种仅由 Ca2+ 激活的 PLC 同工型,
对于 Gi/o 依赖的 TRPC4 激活至关重要 (Thakur 等人,2016 年,2020 年)。相比之下,
TRPC5 可以由 Gq/11 或 Gi/o 激活,并且不完全依赖于 PLCδ1
(Thakur 等人,2016 年)。
阳离子以不同的方式影响各种 TRPC 通道的活性。除了
Ca2+、H+ (pH)、镧系元素 (La3+ 和 Gd3+)、Na+、Mg2+ 和 Hg2+ 也会对 TRPC4/
C5 产生影响。虽然强烈的细胞外酸中毒通常会抑制 TRPC 通道,但轻度酸中毒
会增强 TRPC4/C5 活性。细胞外质子的这些双重作用在镧系元素中也很明显,它们在浓度范围为 10 至 300 µM 时增强 TRPC4/C5 活化。值得注意的是,当通道活性相对较弱时,质子和镧系元素都只会增强 TRPC4/C5。当通道被其他刺激强烈激活时,它们就会变成抑制性的。这种抑制可以通过 H+ 和镧系元素对降低通道单位电导的影响来解释。增强效应是由于通道开放概率的增加,并且依赖于孔环中的谷氨酸残基。有趣的是,细胞外质子和镧系元素具有相同的谷氨酸残基,以实现其增强作用。此外,H+ 还通过促进 Ca2+ 激活 PLCδ1 来促进从细胞内激活 TRPC4(Thakur 等人,2020 年)。由于 H+ 是 PLC 介导的 PIP2 水解的副产物 (Huang 等人,2010) ,而 Ca2+ 则来自 IP3 介导的 ER Ca2+ 动员,通过充当 PLCδ1 的产物和激活剂,Ca2+ 和 H+ 有助于维持支持 PLCδ1 自我传播激活的正反馈回路。由于 Ca2+ 从内部储存中很快耗尽,与 TRPC4 的耦合介导 Ca2+ 从细胞外空间流入并增加 PLCδ1 分解 PIP2 的质膜附近的 [Ca2+]c,TRPC4 的额外募集进一步维持了反馈回路,从而实现了 PLCδ1 和 TRPC4 的强健和持久的激活 (Thakur 等人,2020)(图 22.4)。虽然在 Na+ 和 Cs+ 两种溶液中均检测到了 TRPC4/C5 电流,但有些情况下 Na+ 溶液中的电流非常小,而在切换到 Cs+ 溶液时电流会明显变大 (Jeon 等,2012)。这表明 Na+ 对 TRPC4/C5 具有抑制作用,与两种单价阳离子之间的选择性差异无关,因为这种差异非常小(如果有的话)。当通道通过受体刺激被强烈激活时,Na+ 的抑制作用并不明显 (Thakur 等,2016),这表明 Na+ 敏感状态代表激活较弱的 TRPC4/C5 通道。然而,这种抑制的机制仍有待阐明。汞化合物可有效激活 TRPC4/C5,但不激活其他 TRPC。 TRPC5 孔环中的两个半胱氨酸残基被鉴定为一氧化氮和硫氧还蛋白
346 离子通道教科书第二卷
传感,被证明对汞刺激至关重要。汞效应不能被 Cd2+、Ni2+ 和 Zn2+ 模仿。有人提出,TRPC4/C5 可能是汞化合物对神经发育产生细胞毒性作用的原因 (Xu 等人,2012)。
TRPC 的电流-电压 (I-V) 关系在 -120 至 +100 mV 范围内不是线性的,表明电导率的变化依赖于电压 (图 22.5)。这些变化至少有三个原因。一个是二价离子 Ca2+ 和 Mg2+ 的阻断。发现 Mg2+ 阻滞可解释 TRPC5 电流 I-V 曲线上 +10 和 +40 mV 之间不寻常的“平坦”区段或负斜率。位于 S6 跨膜螺旋末端的 Asp633 被证明可介导通过 TRPC5 的细胞质 Mg2+ 外向电流阻滞。该残基还影响 TRPC5 在负电位下的单位电导 (Obukhov 和 Nowycky,2005)。同样,回肠肌细胞中天然 TRPC 样电流 (mICAT) 的单位电流幅度也因细胞外 Mg2+ 和 Ca2+ 而降低 (Dresviannikov 等人,2006),类似于细胞外质子和镧系元素的幅度。很少有研究检查过 TRPC 通道的固有电压依赖性。由于电流在较长时间内非常不稳定,因此通常使用重复电压斜坡或固定电位下的无间隙记录来检测它们。
由于斜坡通常非常快(<0.5 秒)并从负电位运行到正电位,因此获得的 I-V 曲线可能与真实稳态 I-V 关系有相当大的偏差。
尽管如此,TRPC4 和 C5 的 I-V 关系通常会根据激活程度从 U 形或 V 形(或平坦)变为负电位下的线性(图 22.5A)。
使用从正电位到负电位的缓慢(6 秒)电压斜坡,可以计算电导-电压曲线的负向偏移在激活天然
FIGURE 22.4
G 蛋白信号激活 TRPC4 通道的机制。响应同时激活 Gq/11 偶联受体和 Gi/o 偶联受体的激动剂,受体操作的 TRPC4 通道激活的关键因素示意图。浅黄色和浅粉色圆圈分别突出显示传播的 H+ 和 Ca2+ 信号,它们通过正反馈机制支持持续的 PLCδ1 激活,这可以通过刺激 Gq/11–PLCβ 来启动。传播的 PLCδ1 激活需要同时通过 Gαi/o–GTP 激活 Gi/o,以支持强大的 TRPC4 激活。红色箭头表示基于蛋白质的调节;蓝色箭头表示由离子和小的可扩散信使调节。±,表示(PIP2 和 Ca2+)对
TRPC4 激活的影响可以是积极的,也可以是消极的。
347 TRPC 通道
受体激动剂或 GTPγS 细胞内透析在回肠肌细胞中产生 TRPC 样电流
(Dresviannikov 等人,2006),表明电压依赖性向生理电位的负移构成了 TRPC 激活的一部分。
异多聚化也会影响电压依赖性。这已在 TRPC1–C4 和 C1–C5 异聚通道中得到证实,当激活时,它们具有比同聚 TRPC4 和 C5 通道更强的向外整流和在负电位下约七倍小的单位电导
(Strübing 等人,2001)。同聚 TRPC 的测量单位电导在 25 至 130 pS 范围内变化很大。同一通道在不同电压下的值可能会有所不同(Obukhov 和 Nowycky,2005)。
然而,TRPC1-C5异聚体的单位电导率在电位-20至-70 mV之间确定为~5 pS(Strübing等人,2001)。
最后,TRPC向质膜的运输也可以调节。Ca2+流入和/或受体刺激已被证明可以促进囊泡向质膜的运输,因此,隔离在囊泡膜中的TRPC被带到质膜,导致通道密度和功能增加。触发TRPC运输的Ca2+流入可能由不同的通道介导,例如,ORAI介导的Ca2+进入已被证明可以提供局部Ca2+信号以增强TRPC1插入培养的人唾液腺细胞的质膜(Cheng等人,2011)。
增强 TRPC 通道运输的其他机制包括涉及 PKA、酪氨酸激酶、PI3 激酶和半胱氨酸氧化的途径 (Wang 等人,2020)。
22.8 通道病和疾病
据报道,大量错义 TRPC6 突变 (~30),主要是功能获得性突变,但也有一些功能丧失突变,与家族性局灶性节段性
图 22.5
TRPC4 (A) 和 TRPC6 (B) 激活期间的电流-电压 (I-V) 关系。 (A) 在卡巴胆碱 (5 µM) 刺激过程中,在共表达 TRPC4β 和 M2 毒蕈碱受体的 HEK293 细胞中,电压从 +100 mV 上升至 -100 mV 引起的全细胞电流。标出了应用激动剂后的时间点(以秒为单位)。注意负电位下的 I-V 曲线,它从 V 形变为
随时间呈线性。 (B) 与图 A 类似,但细胞共表达 TRPC6 和 M5 毒蕈碱受体,并且
刺激物为卡巴胆碱 (30 µM)。与图 A 相比,I-V 曲线形状的变化不那么明显,但趋势相似。
348 离子通道教科书第 II 卷
肾小球硬化症 (FSGS)。这些突变影响 TRPC6 功能的不同方面,
表达和运输可能会或可能不会损害通道的离子传导。
最终结果是 TRPC6 失调,导致肾脏中的细胞死亡或足细胞骨架紊乱,从而导致裂孔隔膜破坏和蛋白尿。
据报道,患有遗传性小脑共济失调的小鼠中发生了功能获得性 TRPC3 突变 (T635A)。对于 TRPC4,研究发现,具有错义单核苷酸多态性 (SNP) I957V 的糖尿病患者发生心肌梗死的风险较低。TRPC 启动子和内含子区域的 SNP 也与疾病有关,包括癌症。有关 TRPC 通道病的更详细综述,请参见 Liu 等人 (2020)。
22.9 结论
作为与原型果蝇 TRP 通道最密切相关的通道,哺乳动物 TRPC 因其参与库和受体操作的 Ca2+ 进入和膜电位调节而受到广泛研究,这些调节是在 G 蛋白偶联受体和受体酪氨酸激酶的配体刺激后激活 PLC 通路的下游进行的。虽然所有 TRPC 都可以被 DAG 直接激活,但 TRPC4 和 TRPC5 也对 Gi/o 蛋白有反应。PIP2 的分解和 Ca2+ 和 H+ 信号的产生有助于通道激活。所有 TRPC 通道都是 Ca2+ 可渗透的,但负向的内向电流电位主要由 Na+ 携带,引起膜去极化和/或促进 Na+ 依赖性转运活动。这些功能与 Ca2+ 进入和/或膜电位变化有关,这些变化由 PLC 通路下游激活的 TRPC 通道介导。影响 TRPC 通道相对响应水平的多种因素的存在表明,这些通道可能充当不同输入信号的巧合检测器,通过这些检测器微调靶细胞的输出。最近,无配体和配体结合 TRPC 通道的高分辨率低温电子显微镜结构揭示了 TRPC 通道组装和结构组织的详细信息,以及门控和配体相互作用的关键调节位点。TRPC 的药理学正在改进,再加上遗传学研究,预计将大大提高我们对 TRPC 通道的生理功能及其对疾病的贡献的理解。 23
TRPM 通道
David D. McKemy
23.1 简介
TRPM 通道是瞬时受体电位离子通道家族中遗传和功能各异的亚家族,由八个成员组成(图 23.1)。
这些通道之间很少有共同的特征,但有些具有显著的功能相似性(Huang 等人,2020 年)。例如,TRPM2、TRPM6 和 TRPM7 在已知离子通道中是独一无二的,因为它们的 C 端也含有酶活性蛋白结构域。此外,TRPM6 和 TRPM7 在功能上彼此相似,TRPM4 和 TRPM5 也是如此,但这些配对的每个成员之间的不同表达谱导致生理作用显着不同。
TRPM1(也称为黑素瘤)是第一个被识别的 TRPM,被认为是转移性黑色素瘤的标志物。 TRPM2 具有独特的 nudix 水解酶结构域,该结构域与 ADP 焦磷酸酶 NUDT9 同源,可作为腺嘌呤核苷酸激活通道的结合位点。TRPM3 是一种神秘的通道,因为它具有几种可变剪接变体。TRPM4 和 TRPM5 是 TRP 通道家族中仅有的仅对单价阳离子有选择性且不渗透 Ca2+ 的成员。然而,两者都由细胞内 Ca2+ 激活,作为细胞 Ca2+ 水平升高下游的转导通道。与 TRPM2 一样,TRPM6 和 TRPM7 具有离子通道和酶结构域,在这种情况下是结构类似于 PKA 的非典型蛋白激酶。这些通道似乎充当细胞内 Mg2+ 水平的传感器,对一般 Mg2+ 稳态很重要。 TRPM8 最早是在前列腺中发现的,它被认为是一种雄激素反应通道,但该通道主要用作周围神经系统中的低温传感器。因此,TRPM 通道是一系列不同的离子通道,在许多细胞过程中起着关键作用。下文将介绍每个通道的要点,并将它们置于每种蛋白质之间的分子和结构差异的背景下,并描述目前已知的基本细胞功能。23.2 TRPM1 TRPM1 是 TRP 离子通道 TRPM 亚家族的创始成员,最初在筛选与黑色素瘤转移有关的基因时被命名为“melastatin”(Duncan 等人,1998 年)。在该筛选中,发现 TRPM1 在高度转移性细胞变体中被强烈下调,这与随后对黑色素细胞肿瘤表达模式的分析一致,其中 TRPM1 表达与黑色素瘤转移、黑色素细胞肿瘤进展和黑色素瘤厚度呈负相关。因此,TRPM1 的表达可作为黑色素瘤转移进展的标志。除了黑色素细胞外,TRPM1 转录本也在小鼠眼中发现(Duncan 等人,1998 年),特别是在视网膜双极 ON 细胞中,最近的证据表明它介导调节视网膜双极 ON 细胞活性的阳离子电流(Morgans 等人,2009 年)。 TRPM1
TRPM3
TRPM6
TRPM7
TRPM4
TRPM5
TRPM2
TRPM8
TRPM
通道
图 23.1
基于氨基酸水平同源性的 TRPM 通道系统发育树。
353 个 TRPM 通道
23.2.1 分子结构
值得注意的是,作为 TRPM 通道亚家族的创始成员,在小鼠 B16 细胞中鉴定的初始 tran 脚本仅编码一种 542 个氨基酸的蛋白质,该蛋白质缺乏跨膜结构域和假定的通道孔区(Duncan 等人,1998 年)。
然而,随后在视网膜中鉴定的人类克隆编码了一种 1533 个氨基酸的蛋白质,具有六个预测的跨膜结构域,并且与 TRP 家族的其他通道具有同源性(图 23.2)。全长 cDNA 编码 1516 至 1643 个残基蛋白
表明较短的 melastatin cDNA 代表全长异构体的氨基 (N) 末端剪接变体。事实上,几个 spl已经鉴定出 TRPM1 的几种变体。
例如,一种短的 N 端变体直接与全长通道相互作用并抑制其易位到质膜,从而抑制通道功能。
除了黑素细胞和视网膜表达外,TRPM1 也在脑和心脏组织中检测到,尽管水平非常低。TRPM1 基因还编码一种称为 miR-211 的 microRNA,它也在皮肤和视网膜中表达,并被认为可以调节这些组织的功能。
23.2.2 细胞功能
值得注意的是,尽管自在黑素细胞中发现 TRPM1 以来进行了多年的研究,但该通道在黑素瘤发展中的作用仍不清楚。在 TRPM1 启动子区内,鉴定出小眼转录因子 (MITF) 的结合位点,MITF 是一种螺旋-环-螺旋亮氨酸拉链转录因子。这一发现很重要,因为 MITF 已被证明可以调节多种黑素细胞特异性基因的表达,包括 TRPM1 (Miller 等人,2004)。在异位表达此 miRNA 的黑素瘤细胞系中,许多预测的 miR-211 靶标的表达减少,而 MITF 是 miR-211 表达所必需的,这表明存在潜在的肿瘤抑制机制。在研究 TRPM1 对黑素细胞功能的影响时,一个重要的混淆因素是缺乏稳健的动物模型,因为啮齿动物没有黑素细胞。在人类中,黑素细胞在称为“黑素体”的细胞器中产生黑色素,然后转移到角质形成细胞,在那里保护细胞免受紫外线损伤。激活黑皮质素-1受体(MC1R),一种Gαs蛋白偶联受体,调节产生黑色素所需蛋白质的合成,这一过程由MITF表达介导,表明TRPM1参与其中。TRPM1表达与黑色素含量相关,通过代谢型谷氨酸受体亚型6(mGluR6)的信号传导和黑色素细胞中Ca2+信号的变化调节黑色素含量。此外,抑制细胞TRPM1表达可降低黑色素细胞中的黑色素含量,表明该通道在正常的黑色素细胞功能中发挥作用并调节色素沉着。在视网膜中,光感受器与ON和OFF双极细胞形成突触,后者将视觉对比度传递给神经节细胞。ON细胞检测光强度的增加,并在光感受器超极化后去极化,从而降低响应光而发生的谷氨酸释放率。 ON 双极细胞反应由 mGluR6 介导,当 mGluR6 被激活时,它会与 Go 类三聚体 G 蛋白偶联,后者会调节这些细胞中的去极化电流。虽然这种途径得到了广泛的认可,但负责去极化电流的通道的身份尚不清楚。在通过 mGluR6 表达分离的视网膜细胞中发现了 TRPM1 表达,功能证据表明 mGluR6 依赖性电流很可能是 TRP 通道,支持 TRPM1 通道在 ON 双极细胞的光诱发反应中发挥作用。这一假设已通过对 TRPM1–/– 小鼠的分析得到证实 (Morgans 等人,2009)。视网膜电图 354 离子通道教科书第 II 卷
图 23.2
定位到 TRPM 通道的一般结构。每个通道有多达四个 TRPM 同源结构域
(TRPM-D) 以及 TRP (TD) 和卷曲螺旋结构域 (CC)。TRPM1 通道对 G 蛋白
Gαo 敏感。TRPM2 通道在 C 端 (NUDT9) 包含一个酶促 nudix 同源结构域,类似于
TRPM6 和 TRPM7 中的 A-激酶结构域,前者包含几个 ATP(未显示)和钒酸盐
结合结构域 (DV)。TRPM3 和 TRPM4 通道包含 Ca2+/钙调蛋白结合结构域 (CaM)。几乎所有
通道都直接对 PIP2 敏感,或者由于 PIP2 裂解而敏感。对 TRPM1–/– 小鼠的 355 TRPM 通道分析发现,与双极细胞反应相关的 b 波被消除,但这些动物保留了正常的 a 波。此外,TRPM1–/– 小鼠视网膜切片中 ON 双极细胞的全细胞膜片钳记录发现光诱发反应被消除。这些结果和其他结果确定 TRPM1 是哺乳动物视网膜中的视觉转导通道。
23.3 TRPM2
TRPM 亚家族某些成员的一个显着特征是,除了具有离子渗透通道域外,它们还具有具有酶功能的细胞内区域。TRPM2 就是这样一种多功能蛋白质,因为它是一种非选择性阳离子通道,但其 C 端也有一个酶结构域,这对于通道的门控很重要(Sumoza-Toledo 和 Penner,2011)。此外,TRPM2 通道在多种不同类型的细胞中发挥着重要作用,包括胰腺 β 细胞、免疫细胞、内皮细胞、神经元细胞和心脏细胞,支持从胰岛素释放到细胞因子产生、细胞运动到细胞死亡等一系列功能。
与其他 TRPM 不同,TRPM2 通道表现出电压依赖性很小,具有线性电流-电压关系,在 0 mV 时反转(Perraud 等人,2001)。TRPM2 对于这些细胞中的 Ca2+ 流入至关重要,并且位于细胞内溶酶体,在那里它充当 Ca2+ 释放通道。最后,TRPM2 被认为是与氧化应激相关的疾病(例如炎症和神经退行性)的一个有趣靶点,因为它被活性氧(ROS)激活,例如过氧化氢。
23.3.1 分子结构
TRPM2 是几个蛋白质结构已被解析的 TRPM 通道之一(Huang 等人,2020 年;Yu 等人,2021 年)。 TRPM2 在 TRPM 通道中是独一无二的,因为它与 TRPM6 和 TRPM7(分别参见第 23.7 和 23.8 节)一样,被认为是一种“通道酶”,因为它的 C 端含有一个 NUDT9 腺苷二磷酸核糖 (ADPR) 焦磷酸酶结构域(nudix 样同源结构域),该结构域有 >300 个氨基酸(图 23.2)(Perraud 等人,2001 年)。人类 TRPM2 基因编码一种由 1503 个氨基酸组成的蛋白质,由六个跨膜结构域和包含 NUDT9 结构域的 C 端组成。此外,N 端有四个 TRPM 同源结构域 (MHD) 和一个钙调蛋白结合 IQ 样结构域,以及第六个跨膜结构域和 NUDT9 结构域之间的特征性 TRP 盒和卷曲螺旋区域。
已鉴定出几种剪接变体,与 TRPM1 类似,仅含有对应于 N 端的残基的截短形式被认为对脑、骨髓和血管等组织中的 TRPM2 通道活性具有显性负作用。其他变体包括 N 端和 C 端均缺少残基的变体,这些变体已证明对通道功能有指导意义。具体而言,N 端变体的通道功能被消除,缺少 20 个氨基酸,对应于 IQ 样钙调蛋白结合位点以及两个 PxxP 蛋白质-蛋白质相互作用基序。然而,这些区域内单个残基的突变对通道功能没有影响,表明它们单独对于 TRPM2 激活是可有可无的。 C 端剪接变体缺少 NUDT9 域内的 34 个残基,因此已被证明对 ADPR 不敏感,但对 H2O2 反应正常。然而,与 N 端变体一样,没有显示任何特定残基对于 ADPR 诱导的门控是必需的,这导致人们推测删除的序列代表稳定该区域的间隔片段。最后,虽然 ADPR 是一种激动剂,但其水解不是通道门控所必需的。
23.3.2 细胞功能
TRPM2 通道由 ADPR、环状 ADPR、烟酰胺二核苷酸 (NAD+) 和 ROS(如 H2O2 和其他产生活性氧和氮物质的物质)激活;TRPM2 通道激活需要 Ca2+ (McHugh 等人,2003)。该通道
既能通过质膜流入 Ca2+,又能作为溶酶体中的 Ca2+ 释放通道。此外,TRPM2 需要磷脂磷脂酰肌醇-4,5-二磷酸 (PIP2) 的存在。根据激活 TRPM2 的激动剂概况,该通道
被认为在与氧化应激相关的细胞死亡中起着重要作用。例如,TRPM2 的表达使异源细胞对 H2O2 敏感,从而导致与细胞内 Ca2+ 增加相关的细胞死亡。此外,TRPM2
表达的下调显着降低了几种细胞系中氧化应激诱导的细胞死亡。在胰腺 β 细胞中,H2O2 和变性毒素诱导 TRPM2 介导的溶酶体 Ca2+ 释放
,从而诱导细胞凋亡。然而,TRPM2–/– 小鼠的血糖水平较高,这与整个动物和细胞水平上葡萄糖刺激的胰岛素分泌受损有关,也表明 TRPM2 在糖尿病中可能发挥作用。
此外,氧化应激在神经退化中至关重要,TRPM2 通道在大脑中表达最为强烈,与阿尔茨海默病和帕金森病以及肌萎缩侧索硬化症有关。Ca2+ 兴奋毒性在与阿尔茨海默病相关的神经病理学中起着关键作用,并且已经证明 H2O2 诱导的皮质和基底神经节神经元中的 Ca2+ 进入涉及 TRPM2 通道。
与 TRPM2 与氧化应激之间的联系一致,ADPR 也是由聚 ADPR 糖基水解酶 (PARG) 分解 ADPR 聚合物而产生的,PARG 是一种因 DNA 损伤而活性增加的酶。因此,该通道在这些过程中起着关键作用,将成为未来急需研究的目标。
23.4 TRPM3
TRPM3 是 TRPM 亚家族中了解最少的成员之一,因为该基因编码至少 23 种剪接变体,因此由于对生理相关异构体的不确定性,在通道功能研究中造成了歧义。此外,TRPM3 的内源性激活剂尚未阐明,但该通道由神经类固醇孕烯醇酮硫酸盐 (PS) 激活,这使得人们能够表征各种细胞类型中的通道表达和功能。TRPM3 表达已在包括大脑(齿状回;脉络丛)在内的一系列不同组织以及垂体、胰腺、卵巢、睾丸、感觉神经节和脊髓中检测到。然而,该通道的功能相关性在胰腺 β 细胞、原发性感觉神经元、视网膜和各种癌症中最为明显。 23.4.1 分子结构
与其他 TRPM 通道一样,TRPM3 具有六个跨膜结构域、一个 C 端卷曲螺旋区以及位于通道 N 端的 TRPM 同源结构域
357 TRPM 通道
(图 23.2)。此外,N 端还存在两个钙调蛋白结合位点,
并且已证明钙调蛋白可以与含有这些序列的异源蛋白结合,表明通道受 Ca2+ 调节(见下文)。与大多数 TRPM 通道一样,有一个 PIP2 结合位点与 N 端钙调蛋白结构域相互作用。
TRPM3 基因非常大(小鼠中为 850 kb),内含子将前几个外显子分开,跨越超过 250 kb 的 DNA 序列。因此,TRPM3 编码了数量最多的 TRP 通道剪接变体,呈现出具有不同功能域和门控特性的不同通道群,这并不令人惊讶。在大多数情况下,这些变体主要来自转录本 5 区以及假定的孔域中的可变剪接。例如,对应于外显子 2 的编码序列仅在人类的一个假定转录本中发现。几种剪接变体改变了通道假定孔附近的序列,并且已经发现,在通道外显子 24 的两个小鼠变体中,阳离子通透性受到影响,这些变体仅在孔区域有所不同。在大多数研究中,TRPM3α2 是首选变体,在孔区域内缺少 12 个氨基酸残基,但对二价阳离子具有高度渗透性。 TRPM3 基因的另一个定义特征是,与 TRPM1(见前文)一样,microRNA
miR-204 位于小鼠序列的内含子 8 中。miR-204 是眼部研究最广泛的 miRNA 之一,已知在人类视网膜色素上皮中具有生理作用,尽管其确切作用尚不清楚。
23.4.2 细胞功能
迄今为止,对 TRPM3 通道功能的分析(无论测试哪种变体)发现,当异源表达时,该通道具有组成活性,并且可渗透二价阳离子,例如 Ca2+ 和 Mg2+。TRPM3 通道也被钆和镧离子以及 2-氨基乙氧基二苯硼酸盐 (2-APB)(IP3 受体、池操纵通道 (SOC) 和几个 TRP 通道的抑制剂)阻断。该孔还可渗透锰,高渗溶液可阻断通道活性,低渗溶液可增强通道活性,这表明肾脏中的 TRPM3 通道参与渗透调节。许多研究表明,胰腺 β 细胞和 INS-1 细胞系中的 PS 可激活 TRPM3 通道,这两种细胞类型均已证实可表达 PS 敏感通道。事实上,与 TRPM3 相关的大多数功能数据均基于 PS 激活的细胞电流。硝苯地平(一种电压门控 Ca2+ 通道的二氢吡啶抑制剂)也可激活 TRPM3。相反,胆固醇和甲芬那酸可阻断 TRPM3 通道,罗格列酮和曲格列酮(两种过氧化物酶体增殖激活受体 (PPARg) 激动剂)以及多种柑橘类水果黄烷酮也可阻断 TRPM3 通道。这些激动剂和拮抗剂在确定 TRPM3 在生理学中的潜在作用方面发挥了重要作用。在胰腺细胞中,PS 增强了葡萄糖诱导的胰岛胰岛素分泌,这种作用被甲芬那酸阻断。与这些数据一致,PS 增加了这些细胞中的细胞内 Ca2+,这种细胞效应也被甲芬那酸阻断,甲芬那酸在改变经典的 KATP 依赖性途径方面无效,从而表明 TRPM3 通道独立于葡萄糖介导的胰岛素分泌发挥作用。有人提出,胰腺中 TRPM3 的激活会导致足够的去极化,从而 L 型 Ca2+ 通道打开并改变细胞内 Ca2+ 的水平,从而诱导基因表达的变化,可能是通过 Raf 和 ERK 蛋白激酶途径和增加锌指转录因子 Egr-1 的产生。然而,缺乏 TRPM3 的小鼠表现出正常的静息血糖水平,胰岛素释放也正常,这表明该通道在葡萄糖稳态中起着次要作用 (Vriens 等人,2011)。
在神经组织中,TRPM3 在少突胶质细胞中表达,通道的激活会导致细胞内 Ca2+ 增加,这表明涉及髓鞘形成。同样,PS 被发现通过增强浦肯野细胞突触中的谷氨酸释放来调节发育中神经系统中谷氨酸能突触的形成。然而,神经元表达的 TRPM3 最典型作用是在背根和三叉神经节的小直径神经元中,在那里它被证明可以介导小鼠对 PS 的厌恶反应 (Vriens 等人,2011)。TRPM3 通道被热量激活,缺乏 TRPM3 的小鼠表现出避免有害热量的缺陷,以及与炎症相关的热过敏症的发展。TRPM3 在眼中的表达也很强劲,在视网膜色素上皮、虹膜和视网膜中检测到。同样,PS 敏感性用于显示视网膜神经节细胞中的功能性 TRPM3 通道,尽管迄今为止,尚未报告缺乏 TRPM3 通道的小鼠在视觉处理方面存在缺陷。然而,在人类中发现的 TRPM3 点突变与高压性青光眼和常染色体显性白内障有关。
23.5 TRPM4
在 TRPM 亚家族中,TRPM4(以及 TRPM5)的独特之处在于该通道不通透 Ca2+。然而,Ca2+ 是通道功能的主要调节器,因为它可以通过细胞内 Ca2+ 的增加来门控。事实上,即使该通道不允许 Ca2+ 直接进入,其活性也与钙池操纵的 Ca2+ 进入 (SOCE) 密切相关,因为 Na+ 通过 TRPM4 进入会使膜去极化,从而降低 Ca2+ 通过 ORAI1/STIM1 复合物进入的驱动力。 SOCE 与多种细胞功能有关,包括与许多癌症相关的功能。TRPM4 的另一个特点是该通道似乎普遍表达,并且由于其通过增加的细胞内 Ca2+ 激活,该通道在 Ca2+ 依赖性过程中起着重要的调节作用,例如心脏功能和脑动脉收缩、胰岛素分泌、吸气神经元活动、免疫反应和角化障碍。
23.5.1 分子结构
TRPM4 通道在结构上与 TRPM5 最为密切相关(氨基酸水平上约 40% 同源),但与所描述的其他 TRPM 通道一样,TRPM4 基因确实编码了几种剪接变体,其中 TRPM4b 被认为是主要的通道变体,并且是研究的主要转录本(图 23.2)。人类和小鼠
TRPM4b 基因分别编码 1214 和 1213 个氨基酸的蛋白质,与 TRPM 亚家族的其他成员一样,TRPM4 在 N 端包含四个 TRPM 同源域,在 C 端包含一个卷曲螺旋域,并且在 N 端和 C 端均包含假定的钙调蛋白结合位点。TRPM4 还包含已知彼此相互作用的基序,包括两个 ATP 结合盒 (ABC) 转运蛋白样基序,
以及四个位于近距离的 Walker 核苷酸结合域 (NBD)(Ullrich 等人,2005 年)。最后,TRPM4 通道具有 PIP2 结合位点,与赋予通道对磷酸肌醇敏感性的 pleckstrin 同源性 (PH) 域同源 (Autzen 等人,2018)。
如所述,TRPM4 在许多组织中相当普遍地表达,包括通过 Northern 印迹分析检测到的胰腺、骨骼肌、心脏、肝脏、肾脏、胎盘、结肠、肺、胸腺、脾脏、前列腺和小肠中来自人体组织的 mRNA 表达 (Launay 等人,2004)。细胞内 Ca2+ 在大多数生理反应中起着重要作用,因此受到许多细胞元素的强烈调节。因此,在这些组织中,TRPM4 通道充当细胞内 Ca2+ 的传感器。尽管 Ca2+ 结合位点的确切位置尚未确定,但据认为它位于前四个跨膜域中,因此构成 Ca2+ 激活的非选择性阳离子通道 (NSCCa)。TRPM4 通道激活使 Na+ 进入细胞,通过改变细胞膜电位改变 Ca2+ 和其他离子的驱动力。具体而言,已证明 TRPM4 会影响各种细胞离子传导的活性,例如电压门控和非电压门控 Ca2+ 通道。TRPM4 和 TRPM5 的通道功能对磷酸肌醇 PIP2 非常敏感。切除的膜片和细胞内操作中的 PIP2 耗竭会降低通道活性,而应用外源性 PIP2 可以逆转这种影响。切除的膜片中的两个通道均由 Ca2+ 激活,但它们的 Ca2+ 敏感性会随着时间的推移而降低。这种脱敏可以通过应用 PIP2 来逆转。与 TRPM5 通道相比,TRPM4 对 PIP2 更敏感,这种磷酸肌醇的水平会改变 Ca2+ 敏感性并改变每个通道的电压敏感性。
23.5.2 细胞功能
TRPM4 在心脏的几种细胞类型中表达,包括 sin心房结起搏细胞、心室和心房肌细胞。在肥大大鼠模型中,心室肌细胞中 TRPM4 表达增加,与通道表达和细胞电容的相关性一致,后者是肥大的标志。与肥大相关的心律失常涉及钙激活瞬时内向电流 (Iti),负责延迟后去极化和早期后去极化,并且有人提出 TRPM4 通道可能参与其中。在免疫系统中,TRPM4 似乎通过防止 T 淋巴细胞和树突状细胞中的 Ca2+ 超载来减轻免疫反应 (Barbet 等人,2008)。在 TRPM4 缺陷小鼠中,树突状细胞在受到细菌感染刺激后无法迁移到淋巴器官。 TRPM4 还与炎症和过敏反应有关,因为 TRPM4 缺陷小鼠的肥大细胞活化增加,以及炎症期间肥大细胞迁移减少。因此,TRPM4 通道在与炎症和其他疾病相关的免疫反应中起着关键作用。与许多 TRP 离子通道一样,TRPM4 在角质形成细胞中表达,据报道,通道中的错义突变会导致过度活跃和细胞内钙增加,这与一种进行性对称性红斑角化病有关(Wang 等人,2019 年)。同样,胰腺 β 细胞在葡萄糖刺激下释放胰岛素依赖于细胞内 Ca2+ 的升高。TRPM4 通道在 β 细胞中表达,研究表明,如果抑制 TRPM4 通道活性,永生化 β 细胞系中葡萄糖刺激的胰岛素释放就会减少。然而,在
TRPM4 缺陷小鼠中,体内和体外葡萄糖和胰岛素稳态均正常,
这使该通道在胰腺中的作用受到质疑。这些结果和其他结果表明
TRPM4 参与了许多细胞过程,其表达多样性阻碍了对该通道作用的解释。
23.6 TRPM5
TRPM5 与 TRPM4 一样,是一种 Ca2+ 激活阳离子通道,对单价离子有选择性,
且
不渗透二价阳离子。然而,与 TRPM4 不同,TRPM5 表达仅限于
360 离子通道教科书第 II 卷
少数组织,因此其在生理学中的作用同样受到限制。TRPM5 在舌头、小肠和胃以及胰腺
β 细胞中含量较高,它似乎与胰岛素一起定位。 TRPM5 通道活性受电压、质膜磷酸肌醇、酸度和温度的强烈调节,是苦味、甜味和鲜味传导所必需的。此外,缺乏 TRPM5 的小鼠表现出葡萄糖稳态受损。因此,与 TRPM4 一样,TRPM5 通道介导调节可兴奋细胞的去极化电流,但生理反应更明确。
23.6.1 分子结构
TRPM5 最初是在筛选与 TRPM1 同源的基因时发现的,在人类中编码 1165 个氨基酸的蛋白质,在小鼠中编码 1158 个氨基酸的稍小的肽(图 23.2)。迄今为止,仅鉴定和研究了 TRPM5 的单个功能性转录本,并且从结构上讲,TRPM5 不包含 TRPM4 中发现的许多不同基序。例如,TRPM5 缺乏 ABC 转运蛋白样基序,并且仅具有一个 Walker B 位点,该位点位于通道中 ATP 无法进入的区域(Ullrich 等人,2005 年)。这些序列差异等同于功能,因为 TRPM4 对十钒酸盐阻断敏感,大概是通过 ABC 基序,而 TRPM5 活性不受影响。对于 TRPM4 和 TRPM5,直接比较每个通道的 Ca2+ 敏感性发现 TRPM5 在比 TRPM4 低得多的 Ca2+ 浓度下被激活,但当在切除的膜贴片中进行研究时,这两个通道都强烈脱敏。TRPM5 显示出多模态 Ca2+ 敏感性,在低 Ca2+ 浓度下激活需要膜去极化,而通道的电压依赖性在高 Ca2+ 浓度下基本上是线性的。 TRPM5 通道对 Ca2+ 结合蛋白钙调蛋白的调节不敏感,但使用 PIP2 等磷酸肌醇可降低脱敏作用,表明调节通道功能的细胞内事件存在协调性(Liu 和 Liman,2003 年)。TRPM5 在味觉细胞中得到最广泛的研究,它在 G 蛋白偶联受体和 PLC 介导的肌醇三磷酸 (IP3) 产生的下游被激活,肌醇三磷酸 (IP3) 是由 PIP2 的裂解产生的,从而暗示负反馈抑制通路调节通道功能。
23.6.2 细胞功能
TRPM5 在味觉受体细胞中表达强劲,并与苦味、甜味和鲜味味觉的 G 蛋白偶联受体以及味觉传导所必需的基因(包括 G 蛋白)共表达gustducin 和 PLCβ2(Perez 等人,2002 年)。当发现 TRPM5–/– 小鼠对这些味觉模式不敏感,但仍能检测到酸味和咸味的味觉物质时,TRPM5 在味觉中的作用就被确立了(Zhang 等人,2003 年)。
从机制上讲,TRPM5 是味觉受体激活的下游靶标,这导致 PLC 的激活和 PIP2 水解为二酰甘油 (DAG) 和 IP3,后者通过 IP3 受体诱导 Ca2+ 从细胞内储存中释放。
如前所述,Ca2+ 直接门控 TRPM5 通道,当细胞内 Ca2+ 被缓冲或 IP3 受体被抑制时,味觉诱发的反应会被阻断(Liu 和 Liman,2003 年)。
如前所述,与 TRPM4 相比,TRPM5 的表达范围较小,但与 TRPM4 一样,它存在于胰岛中,主要存在于含有胰岛素的细胞中,表明它在分泌胰岛素的 β 细胞中表达 (Colsoul 等人,2010)。β 细胞表达 Ca2+ 敏感的非选择性阳离子通道,这种电流在 TRPM5–/– 小鼠中显著降低,表明 TRPM5 通道在葡萄糖诱导刺激条件下有助于 β 细胞的电活动。与这些细胞数据一致,从 TRPM5–/– 小鼠获得的胰岛表现出葡萄糖诱导的胰岛素释放缺陷,这些动物在葡萄糖耐量测试中表现不佳,血浆胰岛素水平较低。最后,TRPM5 还在肠道中表达,这种细胞是一种化学感应细胞,可释放激素,如胰高血糖素样肽 1 (GLP-1)。该通道以及通常与味觉细胞相关的其他分子存在于一组肠道单刷细胞和十二指肠腺内分泌细胞中,这表明该通道可能用于检测肠腔内的化学物质。在 2 型糖尿病模型中,TRPM5 表达与血糖浓度呈负相关,小鼠十二指肠中表达 TRPM5 的肠内分泌细胞也表达 β-内啡肽和其他肽,这些肽可能在高血糖或高渗条件下对调节肠道功能具有局部作用。 23.7 TRPM6
与 TRPM4/TRPM5 一样,通道 TRPM6 和 TRPM7 密切相关,TRPM7
普遍表达,而 TRPM6 表达仅限于肠道和肾脏。这些通道的独特之处还在于它们在 C 端具有激酶结构域,这使得它们像 TRPM2 一样成为多功能通道或通道酶。
从生理学上讲,TRPM6 和 TRPM7 对镁稳态至关重要,前者的遗传缺陷是导致低镁血症和继发性低钙血症 (HSH) 的根本原因,这是一种常染色体隐性遗传疾病,其特征是血清镁含量低 (Walder 等人,2002)。因此,TRPM6 通道具有明确的生理作用,但它们如何调节镁水平以及在没有 TRPM7 的情况下它们是否形成功能性通道的潜在机制尚不清楚。尽管存在这些相似之处,但这两个通道似乎在生理上并不相互补偿。
23.7.1 分子结构
TRPM6 编码一种蛋白质,在人类中有 2022 个氨基酸,在小鼠中有 2028 个残基,
与 TRPM7 有 50% 的同源性(图 23.2),最初是在筛选与延伸因子激酶 2 同源的转录本时克隆出来的。在结构上,TRPM6 与其他 TRPM 通道有许多相似之处,但如前所述,其 C 端包含一个 A-激酶结构域,据报道可形成同四聚体和异四聚体通道,后者与 TRPM7 形成。事实上,TRPM7 表达的普遍性表明 TRPM6 在与 TRPM7 寡聚化时可能形成功能性通道,
后者被认为是通道运输到质膜所必需的。
然而,TRPM6 的寡聚化仍存在争议,有证据表明,当每个通道单独表达时,与 TRPM6 和 TRPM7 同时表达时相比,通道特性(即电导、离子渗透和药理敏感性)有所不同(Li 等人,2006 年)。TRPM6 电流强烈向外整流,少量电流通过主要由 Mg2+ 或 Ca2+ 组成的负膜电位,但该通道也渗透一系列阳离子,几乎没有证据表明单价阳离子通过孔进行传导。 23.7.2 细胞功能
由于该通道在肾脏和肠道中相对独特的表达,以及
其与 HSH 的联系,对 TRPM6 在细胞水平上功能的大部分了解
362 离子通道教科书第 II 卷
来自对 Mg2+ 稳态的分析。Mg2+ 对能量代谢至关重要,Mg2+ 平衡的任何缺陷都会影响许多生理过程。Mg2+ 浓度受肠道和肾脏排泄以及骨骼的饮食吸收调节。
患有 HSH 的个体 Mg2+ 和 Ca2+ 水平都较低,这是由于肠道对 Mg2+ 吸收不良和肾脏排泄改变而导致的,但可以通过补充 Mg2+ 轻松治疗。HSH 的基因位点被定位到 TRPM6,并显示该通道的功能丧失突变是导致这种疾病的原因(Walder 等人,2002 年)。TRPM6 通道受表皮生长因子受体 (EGFR) 等受体调节,其激活导致 TRPM6 通道易位到肾细胞膜。与其在 Mg2+ 稳态中的作用一致,TRPM6 被证明在肾远曲小管的顶端膜以及小肠的刷状缘膜上表达。通道功能受细胞内 Mg2+ 水平调节,并通过细胞外酸化增强。已证明 TRPM6 上的 A-激酶结构域对通道活性并非必需,但似乎在调节通道功能方面发挥调节作用。该通道可以自我磷酸化,并增加 TRPM7 通道中的磷酸盐掺入。然而,该通道被 RACK1 抑制,RACK1 是活化 C-激酶 1 的受体,在自我磷酸化时与 TRPM6 的 A-激酶结构域相互作用。同样,雌激素受体活性抑制因子 (REA) 也与该区域结合并以激酶依赖性方式抑制通道功能。自我磷酸化调节 Mg2+ 抑制 TRPM6 通道功能的能力,从而包含一种反馈抑制机制以防止 Mg2+ 过载。 23.8 TRPM7
如前所述,TRPM7 通道与 TRPM6 密切相关,但其组织分布更广泛,并且与多种细胞功能有关,包括 Mg2+ 稳态、细胞死亡、增殖、神经元退化和细胞周期。
此外,可能由于这种表达多样性,对 TRPM7 通道功能进行了更多的研究。小鼠中 TRPM7 的缺失会导致胚胎致死,这进一步证明了该通道的普遍重要性。当细胞内 Mg2+ 浓度骤降并置于酸性环境中时,TRPM7 通道会增强,而当细胞内 PIP2 水平以 PLC 依赖的方式降低时,通道功能会减弱。
23.8.1 分子结构
TRPM7 基因编码人类的 1865 个氨基酸的蛋白质,以及小鼠的 1863 个残基的稍小的蛋白质(图 23.2)(Runnels 等人,2001 年)。如前所述,
TRPM7 与 TRPM6 高度同源(这两种蛋白质之间的序列同一性为 49%–52%),并且包含与 TRPM6 大致相同的分子结构,包括
C 末端 A-激酶结构域。TRPM7 是一种普遍表达的蛋白质,甚至在胚胎干细胞中也能发现其表达,并且是胚胎发育所必需的。此外,
迄今为止,在所检查的每种细胞类型中都记录了原生 TRPM7 电流。
TRPM7 通道具有强烈的向外整流性,主要对二价阳离子具有渗透性,例如 Zn2+、Ni2+、Mg2+、Ca2+ 和 Mn2+,按此顺序,但在正常生理条件下通常会受到抑制 (Ryazanova 等人,2010)。然而,当细胞内二价阳离子浓度降低时,TRPM7 通道活性会增加,主要传导 K+ 和 Na+ 电流。此外,生理浓度的 Mg2+ 结合核苷(例如 Mg-ATP)可作为 Mg2+ 的来源,据报道也会抑制 TRPM7 通道。TRPM7 的晶体结构表明,部分水合的 Mg2+ 离子位于通道孔的中心 (Duan 等人,2018)。与 TRPM6 一样,TRPM7 通道也对 pH 敏感,在这种情况下,随着细胞外环境酸化,质子增加会导致主要由单价阳离子组成的内向电流增加。
23.8.2 细胞功能
由于其普遍表达,有大量数据检查 TRPM7 在各种细胞和组织类型中的功能,但这些研究受到 TRPM7 缺陷小鼠的胚胎致死率的阻碍(Jin 等人,2008 年)。此外,仅缺乏 TRPM7 激酶结构域的小鼠也是胚胎致死的,但补充 Mg2+ 可以恢复这些小鼠胚胎干细胞的活力,这表明 Mg2+ 稳态作为死亡的根本原因的重要性。然而,从胸腺细胞中删除 TRPM7 不会改变 Mg2+ 稳态,但会阻止这些细胞的发育。此外,在成年小鼠中诱导 TRPM7 缺失未导致可观察到的表型,表明其在发育中的作用对于生存力至关重要 (Jin et al., 2012)。事实上,TRPM7 功能与多种组织中的细胞存活有关,包括肥大细胞、血管平滑肌、肝细胞和各种癌症。激酶结构域是否参与通道门控仍存在争议,因为激酶结构域的失活突变不会影响门控。此外,表达激酶死突变的小鼠ant 不表现出发育或 Mg2+ 稳态表型
(Kaitsuka 等人,2014)。话虽如此,TRPM7 已被证明可以磷酸化多种底物,并且体内表达截短的激酶结构域确实会影响 Mg2+ 稳态 (Ryazanova 等人,2010),这表明激酶结构域可以调节通道功能。TRPM7 与 Mg2+ 的相关性至关重要,因为这种离子在发育和细胞活力方面具有多种功能。TRPM7 的全面敲除对小鼠来说是胚胎致死的,而心脏细胞中的细胞特异性缺失会改变心脏发育 (Jin 等人,2008,2012)。 23.9 TRPM8
TRPM8 通道在序列上与 TRPM2 最为接近,但缺少位于后者 C 端的酶结构域。TRPM8 最初是在癌性前列腺上皮细胞中上调基因的筛选中发现的,但后来被发现是薄荷醇(薄荷中的清凉成分)的受体。与薄荷醇引起的冷生理感觉一致,TRPM8 通道也对温度敏感,当温度降至 26°C 以下时直接受到门控(McKemy 等人,2002 年)。因此,TRPM8 属于 TRP 通道类,可作为周围神经系统的温度检测器。TRPM8 可介导无害的冷感知和有害的冷感知,增强受伤或患病后对冷的反应,并且对于神经性疼痛和炎症性疼痛条件下的镇痛方面至关重要。此外,TRPM8 在几种恶性细胞类型中发挥着尚未明确的作用,并且在控制体温调节反应方面至关重要。
364 离子通道教科书第二卷
23.9.1 分子结构
与其他 TRPM 通道类似,TRPM8 具有六个跨膜结构域以及 C 末端区域中的特征 TRP 和卷曲螺旋结构域(图 23.2)。据报道,C 末端的卷曲螺旋结构域对于四聚体组装和通道运输是必需的(Diver 等人,2019 年)。TRPM8 被几种冷却化合物激活,包括薄荷醇和 icilin,并且已经确定了通道中对每种激动剂都很重要的区域。 Icilin 激活 TRPM8 的方式需要同时增加细胞内 Ca2+,而薄荷醇或冷门控通道则不需要这种要求。Icilin 的作用定位于第二和第三 TM 之间的连接区域,其中残基 N799、D802 和 G805 被证明是关键的。然而,Ca2+ 和 icilin 如何相互作用以门控 TRPM8 尚不清楚。TRPM8 通道活性的关键调节剂是磷酸肌醇 PIP2,它已被证明是 TRPM8 通道功能的必需物质。TRPM8 通道适应长时间刺激的方式需要外部 Ca2+ 的存在,切除后的膜片中的通道活性迅速减弱,但可以通过通道细胞质表面的外源性 PIP2 的存在来恢复(Rohacs 等人,2005 年)。 PLC 的激活也会导致通道适应,这表明 Ca2+ 通过 TRPM8 孔进入可激活 Ca2+ 敏感的 PLCδ 同工型,从而裂解 PIP2,从而使 TRPM8 通道适应。此外,已提出 TRPM8 的 TRP 结构域附近的 C 末端近端区域的残基与 PIP2 相互作用。寒冷门控 TRPM8 通道的潜在机制仍未解决,所有热敏感的 TRP 通道也是如此。TRPM8 通道对电压敏感度较弱,并表现出特征性的外向整流。这种电压敏感性以及 TRP 通道和电压门控 K+ 通道之间的拓扑相似性表明温度和电压激活可能存在关联。然而,最接近的 TRPM8 同源物 TRPM2 具有与 TRPM8 相同的参与冷门控的假定带电残基模式,但不对温度或电压敏感。此外,有证据表明,温度、激动剂和电压依赖性门控是独立的过程,因为已经确定了每种门控的不同激活域,这表明一种门控机制的影响以变构方式作用于另一种门控机制。最后,纯化的 TRPM8 通道已重建为平面脂质双层,并被证明可被寒冷激活,这是该通道直接受温度门控的最有力证据。
23.9.2 细胞功能
在感觉神经节中,TRPM8 在 <15% 的小直径(~20 μm)感觉神经元中表达,与神经元培养中显示对冷和薄荷醇敏感的神经元比例一致。从生物物理角度来看,冷和薄荷醇诱发的 TRPM8 电流具有与天然细胞中记录的电导惊人的相似特性,包括离子选择性、薄荷醇效力和电压依赖性。更值得注意的是,TRPM8 电流也会因温度下降而诱发,激活温度阈值约为 26°C,而当温度降至 8°C 时,活性会增强。有趣的是,温度范围广泛,既包括无害的低温(~30°C–15°C),也包括有害的低温(<15°C)。
此外,许多模拟寒冷的化合物可激活 TRPM8 通道,并在啮齿动物静脉注射时引起特征性颤抖或“湿狗”抖动,这一过程需要 TRPM8 通道和神经元。同样,已鉴定出许多拮抗剂,并显示可在小鼠中引起剧烈的低温反应,这可能是由于抑制了冷感应传入神经。同样,TRPM8 在棕色脂肪组织 (BAT) 中功能性存在,并通过薄荷醇刺激棕色脂肪细胞,上调 UCP1 表达,这是一种产热调节剂。
薄荷醇和冷却通常用作局部镇痛剂,从而表明激活 TRPM8 可能导致疼痛缓解。局部应用冷或冷却化合物可产生由 TRPM8 表达传入神经介导的暂时性镇痛效果。
在神经性疼痛的啮齿动物模型中,在首先用冷或冷却化合物(如 icilin)治疗的动物中,对机械或热刺激的反应性爪缩回潜伏期显著减弱。镇痛持续超过 20-30 分钟,之后动物恢复其过敏性,类似于施加冷刺激之前,并且与未用冷或冷却化合物预先处理的动物的过敏性水平相同。只有适度的冷却和低剂量的冷却化合物才能产生镇痛作用,并且依赖于 TRPM8 通道和神经元。这些数据表明 TRPM8 介导由低温和冷却化合物提供的镇痛作用,这表明适度激活 TRPM8 传入神经可以作为促进疼痛缓解的内源性机制。
除了神经元热感应外,TRPM8 还发挥其他生物学作用。除了在正常前列腺中表达外,TRPM8 还表达于其他非前列腺肿瘤,如乳腺、结肠、肺和皮肤,以及膀胱和男性生殖道 (Tsavaler 等,2001)。在胃底和由于食用冷食引起的胃肠道平滑肌收缩而导致的冷却中发现了 TRPM8 转录本,这导致胃排空时间短暂。这些数据和其他数据强烈表明,TRPM8 可能在外周神经系统之外具有多种生物学功能。
致谢
这项工作得到了美国国立卫生研究院 (NS106888 和 NS0118852) 资助。
TRPV 通道
Tamara Rosenbaum
24.1 简介
瞬时受体电位香草酸 (TRPV) 通道由一个蛋白质亚家族组成,该亚家族有六个成员 (TRPV1–TRPV6),它们形成具有不同阳离子选择性的四聚体。这些通道是多模态的,因为它们由多种机制控制,并作为昆虫的湿度和机械传感器;线虫的化学和机械传感器;以及脊椎动物几种器官的温度、化学和渗透传感器。正如将要讨论的,它们的重要性体现在它们在生理学中发挥的多种作用上。
24.2 生理作用
24.2.1 TRPV1
瞬时受体电位香草酸 1 (TRPV1) 是 TRP 离子通道家族中一个被广泛研究的成员。它主要由感觉神经节(如背根 (DRG) 和三叉神经节 (TG))内的小直径神经元表达。TRPV1 是多模态的,对各种刺激有反应,包括有害热量 (>43°C)、小化学激动剂和动物肽毒素(表 24.1)(Caterina 和 Julius,2001)。此外,细胞外质子激活 TRPV1,由于它们在组织损伤、缺血和炎症期间释放,因此它们通过激活 TRPV1 在产生疼痛方面发挥重要作用。质子还会通过辣椒素和热量使通道激活敏感。尽管质子通过增强通道门控作为 TRPV1 激活的内源性正调节剂,但也已证明它们抑制通过开放通道的渗透(Lee 和 Zheng,2015)。 TRPV1 对生物体内的炎症介质作出反应,并在与疼痛和炎症相关的信号通路中发挥重要作用,因为它的激活是导致疼痛感知的首批分子事件之一。因此,TRPV1 已成为止痛疗法的有希望的目标 (Lee and Zheng, 2015)。
尽管如此,必须注意的是,尽管 TRPV1 的作用在神经元细胞中得到了更好的探索,但该通道也参与非神经元组织的生理学。例如,TRPV1 在呼吸道功能中起着重要作用,慢性咳嗽患者对辣椒素的敏感性更高,气道中的通道表达水平也更高 (Emir, 2017)。在平滑肌和内皮细胞中,TRPV1 也有表达,并被认为有助于慢性缺氧诱导的血管控制 (Du et al., 2019)。
TRPV1 也在角膜中表达角质形成细胞,这些细胞维持皮肤免疫反应的完整性。多项研究表明,TRPV1 在人类表皮角质形成细胞中表达,虽然尚未报道在这些细胞中直接测量 TRPV1 电流,但已观察到培养的人类表皮角质形成细胞在酸化和辣椒素(并被辣椒素阻断)的作用下 Ca2+ 水平增加。此外,响应皮肤中的 ATP 释放而引起的表皮增殖也被辣椒素阻断,这导致人们提出 TRPV1 和嘌呤能受体参与低 pH 促进的皮肤增殖(Denda 等人,2001 年)。
24.2.2 TRPV2
感觉神经元中的 TRPV2 由温度变化(>52°C)激活,充当脂质和大麻素受体,并对机械和渗透刺激作出反应。 TRPV2 在几种细胞类型中表达,特别是在细胞内膜(即内体)中表达(Shibasaki,2016 年)。
该通道存在于大脑中,表明它可能与自主神经调节(即食欲和心血管调节)、小脑、视网膜以及三叉神经和背根神经节有关。在骨骼肌和心肌以及胃神经元中,TRPV2 对拉伸和剪切应力以及张力过低作出反应。在肌细胞闰盘中,TRPV2 可能充当拉伸激活通道,在心肌细胞机械刺激期间在心脏中发挥重要作用。TRPV2 缺陷小鼠的心肌细胞在电刺激期间表现出 Ca2+ 处理缺陷和收缩反应降低、存活率降低和心脏收缩力严重下降(Falcón 等人,2019 年)。
TRPV2 在 Aδ 和 Aβ 纤维中的表达表明其在检测有害化学刺激和传导高热痛方面具有伤害性作用,其表达水平在神经损伤后上调。另一方面,在某些细胞中,当以拉伸依赖性方式激活时,该通道会调节轴突生长。它也在上皮和先天免疫细胞、胃和星形胶质细胞中表达(Emir,2017)。 371 TRPV 通道 表 24.1 TRPV 通道的激动剂和拮抗剂 通道 激动剂 拮抗剂 TRPV1 内源性产生的 LPA LTB4 OLDA 20-HEPE CPA 18:1 AEA 5(S)-HPETE 12(S)-HEPE 15-(S)-HPETE 9-HODE 13-HODE 18:1 NOE/OEA N-acylsalsolinols 前列腺素 精胺 催产素 NAE OAG PEA NADA 2-AG NAT RAOAEPA RvE1 RvD2 腺苷 毒胡萝卜素 育亨宾 α-菠菜甾醇 外源性产生的 辣椒素 RTX THCV 香叶醇 Olvanil Phar 吴茱萸碱 大麻二酚 樟脑 大蒜素 丁香酚 胡椒碱 姜酚 姜油酮 姜烯酚 香茅醇 水杨酸BrP-LPA DkTx RhTx BmP01 VaTx1-3 2-APB 辣椒素 JNJ17203212 SB-705498 AMG9810 SB-366791 A-425619 SB-452533 JYL1421 ABT-102 SB-782443 AMG517 DD161515 AG489 AG505 APHC1 APHC3 HCRG21) 5-碘RTX TRPV2 外源产生的大麻二酚 2-APB THC DPBA 丙苯舒 曲尼司特 (SKF96365) TRPV3 内源性 FPP ETYA IPP PI(4,5)P2 17R-RvD1 外源产生的樟脑 百里酚 香芹酚 丁香酚 香芹酚 香兰素 柠檬醛2-APB THCV Δ(9)-THC DPBA 大麻二酚 薄荷醇(鼠) 醋酸香香 2-APB DPTHF GRC 15133 GRC 17173 TRPV4 内源产生 DMAPP 5,6-EET 14,15-EET AA N-花生四烯酰牛磺酸 AEA 3+ Gd 3+ La 外源产生4α-PDD 4α-LPDD 4α-PD PMA THCV BAA 芹菜素 丁子香酚 PDDHV RN-1747 GSK1016790A 大麻二酚 大麻二酚 柠檬醛恶嗪素 A Onydecalin A Aintennol Butamben RN-1734 RN-9893 GSK205 HC-067047 GSK3527497 GSK2798745 SiNP克罗米通 哌啶-苯并咪唑
(续)
372 离子通道教科书 第二卷 通道激动剂 拮抗剂 TRPV5 内源性产生 OAG PI(4,5)P2 β-葡萄糖醛酸酶 Klotho 2+ Mg tTG 2+ 2+ 2+ 2+ 2+ Pb = Cu > Zn > Co > Fe 80K-H 蛋白 外源性产生 益康唑 咪康唑 THCV ZINC9155420 ZINC17988990 TH-1177 TRPV6 内源性产生 PI(4,5)P2) 1,25[OH]2D3 2+ Mg 3+ Gd 2-APB 外源性产生 益康唑 咪康唑 Xestospongin C ZINC9155420 TH-1177 他莫昔芬 THCV Soricidin 来源:Holzer 和Izzo(2014)和Blair等人。 (2019)。缩写:三叉神经节 (TG)、背根神经节 (DRG)、5-(S)-过氧氢二十碳四烯酸 (5(S)-HPETE)、12-(S)-羟基二十碳五烯酸 (12(S)-HEPE)、15-(S)-过氧氢二十碳四烯酸 [15-(S)-HPETE]、白三烯 B4 (LTB4)、20-羟基二十碳五烯酸 (20-HEPE)、9-羟基十八碳二烯酸 (9-HODE)、13-羟基十八碳二烯酸 (13-HODE)、N-花生四烯酰牛磺酸 (NAT)、溶血磷脂酸 (LPA)、N-油酰乙醇胺 (18:1 NOE 或 OEA)、棕榈酰乙醇酰胺(PEA)、N-花生四烯酰多巴胺(NADA)、2-花生四烯酰甘油(2-AG)、N-油酰多巴胺(OLDA)、花生四烯乙醇胺(AEA)、N-酰基乙醇胺(NAE)、硫化氢(H S)、环状磷脂酸2(CPA 18:1)、1-油酰-2-乙酰基-sn-甘油(OAG)、树脂毒素(RTX)、Δ9-四氢大麻酚(THCV)、Δ(9)-四氢大麻酚(Δ(9)-THC)、Psalmopoeus cambridgei 的香草毒素(VaTx1-3)、双结毒素(DkTx)、1-溴-3(S)-羟基-4-(棕榈酰氧基)丁基膦酸酯 (BrP-LPA)、2-氨基乙氧基二苯基硼酸酯 (2-APB)、蓖麻油酸 (RA)、油酸 (OA)、二十碳五烯酸 (EPA)、resolvin E1 (RvE1)、resolvin D2 (RvD2)、Heteractis crispa RG 21 (HCRG21)、(-)-反式-Δ9-四氢大麻酚 (THC)、苯基硼酸酯 (DPBA)、法呢基焦磷酸酯 (FPP)、5,8,11,14-二十碳四烯酸 (ETYA)、二苯基硼酸酐 (DPBA)、异戊烯基焦磷酸酯 (IPP)、磷脂酰肌醇 4,5-二磷酸酯 (PI(4,5)P2)、17(R)-resolvin D1 (17R-RvD1)、2、 2-二苯基四氢呋喃 (DPTHF)、二甲基烯丙基焦磷酸酯 (DMAPP)、5,6-环氧二十碳三烯酸 (5,6-EET)、14,15-环氧二十碳三烯酸 (14, 15-EET)、花生四烯酸 (AA)、4α-佛波醇 12,13-二癸酸酯 (4α-PDD)、4α-卢米佛波醇二癸酸酯 (4α-LPDD)、4α-佛波醇单酯 (4α-PD)、佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA)、2-佛波醇 12,13-二癸酸酯 20-高香草酸酯 (PDDHV)、穿心莲内酯 A (BAA)、二氧化硅纳米颗粒 (SiNP)、1-油酰乙酰-sn-甘油 (OAG)、组织转谷氨酰胺酶 (tTG)、 1,25-二羟基维生素 D3 (1,25[OH]2D3)。表 24.1(续)TRPV 通道激动剂和拮抗剂
373 个 TRPV 通道
24.2.3 TRPV3
TRPV3 通道参与温暖感觉和疼痛,主要在皮肤中表达,但也在鼻腔、腭、毛囊、舌头、结肠和感觉神经节中的其他上皮以及大脑、脊髓和睾丸中表达。该通道表现出使用依赖性和滞后温度依赖性激活,因为初始激活需要 50°C 以上的温度,然后可以通过较低的温度(约 30°C)打开(Nilius 等人,2014 年)。 TRPV3 已被确定为治疗瘙痒和其他皮肤病的关键分子,因为它参与皮肤屏障的形成和功能、毛发发育以及包括疼痛在内的皮肤感觉。TRPV3 偶联信号传导机制参与表皮角质形成细胞的皮肤痛觉,因为 TRPV3 的过度表达还伴随着前列腺素 E2 (PGE2) 释放增加,从而激活相邻的感觉传入神经。此外,角质形成细胞中 TRPV3 的激活会导致 ATP 和一氧化氮的释放,这也会影响疼痛状态 (Nilius 等人,2014)。 TRPV3 在伤害感受中的作用的支持证据还来自消退素的作用,这些分子与抗炎和抗伤害感受作用有关,例如 17(R)-消退素 D1,它通过影响其电压依赖性和降低其活性来抑制该通道。
24.2.4 TRPV4
TRPV4 是一种多模态蛋白,在 27°C 左右的温度、低渗条件、机械应力和某些化合物 (Liedtke, 2005; Nilius 等人, 2007) 下激活,具有普遍表达 (Rosenbaum 等人, 2020)。
来自细胞外环境的 Ca2+ 流入与内皮功能极为相关,TRPV4 是参与这一过程的分子之一。
在血管内皮细胞中,它有助于内源性大麻素对血管张力和血压调节以及葡萄糖和氧气供应的放松作用。
TRPV4 的机械传导作用在视网膜中的 Müller 细胞、神经节细胞体细胞树突和小胶质细胞中非常重要,并且该通道已被强调为青光眼中的分子效应器。
在呼吸系统中,TRPV4 存在于几种类型的细胞中,它维持渗透压的稳态并将各种刺激整合到 Ca2+ 信号中,调节主肺动脉的松弛和肺循环的血管收缩。其功能可以改变肺壁的完整性,影响慢性哮喘的严重程度,并在用于治疗呼吸衰竭的呼吸机的机械力引起的肺损伤中发挥重要作用。
在肾脏中,TRPV4 存在于远曲小管中不表现出顶端水渗透性且可以形成跨细胞渗透梯度的区域。在粗升支中,可能发生细胞肿胀,从而激活 TRPV4,通过改变肾脏中的水分泌来调节渗透平衡。TRPV4 在肾元中表达,这些区域不透水,允许在盐摄入量增加的情况下检测渗透刺激和调节血压 (Emir, 2017)。在对骨骼稳态很重要的成骨细胞以及软骨细胞中,TRPV4 表达是机械转导所必需的。 TRPV4 还有助于皮肤稳态,它能保护皮肤屏障、调节毛囊生长,并参与某些病理中的免疫和瘙痒反应 (Emir, 2017)。
374 离子通道教科书第二卷
24.2.5 TRPV5 和 TRPV6
在 TRP 通道中,TRPV6(以前称为 CaT1 和 ECaC2)与 TRPV5(以前称为 ECaC1)保持最高的同源性,尽管前者存在于更广泛的细胞中。
这两个通道也不同于其他成员香草酸亚家族的一个新特征是它们
不由配体激活或对热敏感,它们对 1,25-二羟基维生素 D3 有反应,
并且它们位于 Ca2+ 转运上皮的顶端膜。因此,这些
通道在调节高等生物血液 Ca2+ 水平方面起着关键作用,
稍后将讨论。
TRPV5 对全身 Ca2+ 稳态很重要,因为它充当肾脏中 Ca2+ 重吸收的微调中心蛋白。TRPV5 基因缺失的小鼠
表现出与活性 Ca2+ 重吸收减少相关的表型,例如小梁骨和皮质骨厚度减少,骨形态紊乱,肠道 Ca2+ 吸收增加,这是肾脏 Ca2+ 重吸收受损的补偿机制的结果 (Emir, 2017)。
TRPV5 主要在肾脏的远曲小管和连接小管中表达,而 TRPV6 则存在于肠道、肾脏和外分泌组织中。因此,TRPV5 参与确定尿液 Ca2+ 排泄水平,TRPV6 参与肠道 Ca2+ 吸收,但也可能有助于肾小管系统某些部分的跨细胞 Ca2+ 转运。TRPV6 还参与 Ca+ 依赖性精子成熟,其功能障碍会导致精子活力和生育能力下降 (Yelshanskaya 等人,2021 年)。 24.3 亚基多样性和基本结构组织
与电压门控离子通道超家族的其他成员类似,TRPV 通道是由包含细胞内 N 端和 C 端、六个跨膜螺旋 (S1–S6) 和一个孔区 (S5–P–S6) 的单体组成的四聚体。作为电压门控钾 (Kv) 通道的远亲,这些蛋白质包含一个 S1–S4 区域,该区域被视为电压传感器样域 (VSLD)。S5 和 S6 从该域延伸出来并与相邻单体的 VSLD 相互作用,形成四聚体孔。选择性过滤器由 S5 和 S6 之间的环和螺旋形成,
TRPV1、TRPV2 和 TRPV4 通道表现出由 S5 和孔螺旋之间具有 15-25 个残基的非结构化环区域形成的孔塔。已经证明
S5-S6 区域经历构象变化导致孔打开
并且温度门控和配体门控似乎都会导致 S6 中该激活门区域发生相同的构象变化(Cao,2020;Gao 等,2016)。
TRPV 通道单体含有六个 N 端锚蛋白重复序列,形成一个称为锚蛋白重复域 (ARD) 的区域,通常每个重复序列由 33 个残基组成(图 24.1)。它们参与亚基-亚基相互作用,可以结合调节其活性的分子(如大蒜素)。 N 端区域包含具有螺旋-转角-螺旋基序的 N 连接子和位于 S1 之前的螺旋。通过 ARD 与相邻单体的 β 片层区域(由来自 N 连接子的两个 β 片层和来自 C 端的一个 β 片层组成)的接触,可以实现亚基间相互作用。
C 端区域包含 TRP 结构域,这是一种与膜平行的弯曲 α 螺旋,位于 S1-S4 束中。该螺旋转换成环和 β 链,并与相邻亚基的一些锚蛋白重复序列相互作用。与 Kv 通道的 C 端相比,TRP 通道中的这种排列是独一无二的,因为在 Kv 中,它与 S6 片段连续,并且不与 N 端相互作用。 S4–S5 连接子在调节通道门控方面处于特殊位置,因为它与 S1–S4 束、TRP 和相邻单体的孔域相互作用。域交换的孔域需要 S5 和 S6,它们产生中央孔和细胞内门。
24.4 温度和配体的门控
热感受器是对温度变化作出反应的外周传入纤维。这种反应的分子基础是热 TRP 通道。在 TRP 通道中,有九个成员被强调为对哺乳动物细胞的温度敏感(热 TRP):TRPV1–4、TRPM2 和 TRPM3 对高温(包括有害热量)作出反应;TRPM8 和 TRPC5 对寒冷作出反应,TRPA1 对寒冷或高温(取决于物种)作出反应。
ThermoTRP 不仅表现出对几种激动剂结合敏感的多模态激活,而且它们还共享激活剂,这些激活剂可作为这些蛋白质的非特异性激动剂。它们还通过共价修饰细胞内半胱氨酸表现出激活作用,导致孔隙打开(即 TRPV1 和 TRPA1),并且在没有其他刺激的情况下发生,构成与孔隙打开耦合的变构机制,目前尚不清楚。在典型的电压门控离子通道中,电压感应区域(带电荷 z),通常是 S4,通过由跨质膜的电位差 (V) 产生的电场发生位移。虽然 thermoTRP 通道s 显示电压
图 24.1
TRPV 通道的结构。对于所有 TRPV 通道,N 端和 C 端分别包含六个锚蛋白重复序列
和一个 TRP 盒(右)。通过低温电子显微镜 (cryo-EM) 解析的 TRPV1 亚基结构(蛋白质数据库 ID
7LQY,松鼠 TRPV1 apo,左)。该图显示了细胞内的 N 端和 C 端、跨膜结构域
(S1–S6),其中 S1–S4 区域是弱电压感应类结构域(红色),孔区域形成于
S5–P–S6 之间(蓝色)。(使用 BioRender.com 创建。)
376 离子通道教科书第二卷
激活依赖性,与电压门控离子通道(如 Kv 通道)(9–13 eo)相比,z 的值相当低(~1 eo)。它们的 S4 缺乏重复基序 (R/
KXXR/K;其中 X 是疏水残基)。thermoTRP 通道中电压门控的可能机制涉及这些蛋白质 S4 中发现的芳香残基的部分电荷在电场中的移动,或选择性过滤器附近带电残基的移动 (Zheng, 2013)。thermoTRP 和 Kv 通道门控之间的其他差异包括导致热或冷激活和电压依赖性开放的机制相互作用。虽然最初有人提出相同的构象转变(具有较大的焓 pic [∆H] 和熵变化 [∆S])是由温度和电压引导的,但现在人们更普遍地认为温度和电压影响不同的构象变化,这些变化可能通过变构机制耦合。 ThermoTRP 可以直接通过温度变化进行门控,这意味着它们可以吸收热量并将其转化为具有大焓 (∆H) 的构象变化。随着温度的升高,通道的开放概率会随着热量的吸收而不断变化 (Yao 等人,2010)。这种作为温度函数的开放概率的增加可以通过温度系数或 Q10 来量化,该参数的值越高,表示与开放概率变化相关的焓变化越大。Q10 描述了 10°C 温度 (T) 变化产生的电流幅度 (I) 的倍数变化,如下所示:
Q
T T
10
2
1
10
2 1
= æ
è
ç ö
ø
÷
( ) - I
I (24.1)
可以用相同的形式描述由配体结合或电压等其他刺激引起的门控。
通道开放可以在没有刺激的情况下发生(Co–O2 转换),而热吸收则通过 Co–C1 转换发生,由平衡常数 K(T) 控制。温度激活的简单变构模型是
转换 C1–O3 导致通道的温度依赖性开放,并且通道开放通过变构因子 D 增加到 DL0。因此,在存在温度刺激的情况下,开放概率增加到
377 TRPV 通道
DL
DL
0
1+ 0
(24.2)
发生这种情况的原因是,一般来说,虽然 L0 可能非常小,但 D 是一个非常大的数字。
当 D 为大数时,开放概率可能非常接近 1。
对于温度活化,平衡常数 K(T) 由 C0–C1 跃迁的正向和反向速率常数的商给出:
k
k
exp
exp
H T S RT
H T S RT
1
1
1
1
1
1 1
1 -
- - ( )
-
- - ( ) = ×
×
± ±
-
± -
±
q
q
D D
D D
/
/ (24.3)
在此方程中,θ i
对应于 0 K 时的扩散限制速率常数,Hi
± 和 Si
±
是活化焓和熵,R 是气体常数,T 是温度(单位:开尔文)。
对于该变构模型,稳态开放概率与温度的关系由以下公式给出:
p T
L K DL
K L K T DL ( ) = + ( )
+ + + ( )
0 0
0 0 1
T
(24.4)
其中 K(T) 是温度相关的平衡常数,L0 是温度无关的通道开放平衡常数。
如果我们假设只有 K(T) 是温度相关的平衡常数,并且它代表由温度变化推动的特定构象变化,则公式 24.1 设想开放概率变化的陡度与转变所需的热量 (∆H) 有关,∆S 决定了转变发生的温度范围。此外,D 是温度敏感转换和孔模块之间的变构耦合因子值,也有助于确定激活曲线的陡度。
通道是通过温度升高还是降低激活取决于 K(T) 转换中熵和焓变化的符号:如果 ∆H 和 ∆S >0,则该通道是热激活通道,但如果 ∆H 和 ∆S <0,则它将被低温激活(Islas,2017)。可以包含其他模块,以便它们与温度传感模块(即电压敏感性)相互作用,以获得更复杂的变构模型。
对于 TRPV1,通过热量重复激活会导致温度依赖性失活过程,这构成了不可逆转换,建议将其作为由于在吸收热量时通道蛋白的一个或多个区域部分或完全展开。结果特别表明,在重复刺激下电流幅度的降低伴随着通道对温度的敏感性的大幅变化,该敏感性由 ΔH 的表观活化决定。当通道受到重复热刺激时,观察到与开放相关的 ΔH 减少。重要的是,如果通道中存在辣椒素,这种对热量的失活或脱敏状态会保留下来(图 24.2a、b)。虽然热量可以被通道的几个区域吸收并导致其开放,但一些区域可以通过类似于部分多肽变性的机制吸收热量,导致通道的表观活化焓降低。这些转变将使这些蛋白质吸收或将热量转化为构象变化的效率降低,并且在打开后,它们将不可逆地进入失活状态(Sánchez Moreno 等人,2018 年)。
TRP 通道中的配体依赖性激活在 TRPV1 中得到了更广泛的研究。
辣椒素与由 S3、S4 和部分 S5 跨膜 α 螺旋中的残基以及哺乳动物通道中的 S4-S5 接头构成的香草素结合口袋 (VBP) 结合。辣椒素以“头朝下”的方向与 VBP 结合,将 S4-S5 接头稳定在允许 S6 门处于开放构象的位置(Cao,2020 年)。
在 TRPV1 中,已证明其外表面的一个位点可结合钠离子并修改其门控,使其能够被可能造成损害的温度激活。TRPV1
通道包含外部钠结合位点,这些位点必须被占用,以便通道
可以在生理温度下保持关闭状态,从而调整其响应(Jara-Oseguera 等人,2016 年)。
24.5 离子通透性和药理学
大多数 TRPV 都是非选择性阳离子通道,可渗透单价和二价阳离子(即 K+、Na+ 和 Ca2+),TRPV5 和 TRPV6 除外(见下文)。对于大多数 TRP 通道,
没有统一的选择性过滤序列(如通常在 K+ 通道中观察到的序列),并且它们表现出直径从 3.2 到 10.6 Å 的选择性过滤器。
TRP 通道的离子选择性由可渗透阳离子与动态选择性过滤器的相互作用能决定。四个天冬氨酸残基形成一个带负电的环,以吸引和协调阳离子。此外,一些选择性过滤器残基的主链羰基氧原子面向 TRPV 通道的孔隙,据推测可以协调阳离子。值得注意的是,与辣椒素激活相比,溶血磷脂酸 (LPA) 对 TRPV1 的门控产生了具有较大单通道电导率的开放状态(图 24.2c、d),而选择性没有变化。因此,这种不同完全激动剂以高概率打开通道的现象(即辣椒素和 LPA)可以产生不同的开放状态。这意味着 LPA 可以更有效地产生动作电位,而表达 TRPV1 的神经元可以更有效地产生疼痛 (Canul-Sánchez 等人,2018 年;Nieto Posadas 等人,2011 年)。
TRPV2、TRPV3 和 TRPV4 也是非选择性阳离子通道,允许单价和二价阳离子渗透,对 Ca2+ 具有高选择性和强外向整流 (Owsianik 等人,2006 年)。TRPV4 之所以脱颖而出,是因为它具有直径最宽的选择性过滤器 (~10.6 Å),完全水合的阳离子可以渗透,同时当 Ca2+ 作为电荷载体并通过渗透变化激活时,它也允许其具有较大的电导率 (~280–310 pS) (Cao,2020 年)。 TRPV4 充当内向或外向整流器,具体取决于 Ca2+ 是否存在。
TRPV5 和 TRPV6 通道的生物物理特性与其他 TRP 通道不同,因为它们对 Ca2+ 表现出非常高的渗透性(PCa/PNa >100:1)。去除细胞外二价阳离子会导致单价离子渗透。在 TRPV6 中,Mg2+ 充当渗透性孔阻滞剂,影响其强大的内向整流。
由于这两个通道可以在负膜电位下将 Ca2+ 转运到细胞中,因此这允许在生理膜电位下大量钙渗透(Owsianik 等人,2006 年)。
379 TRPV 通道
如前所述,TRPV 通道大多是多模态的,由包括外源性和内源性物质在内的几种分子激活和抑制,这些分子总结在表 24.1 中(Holzer 和 Izzo,2014 年;Blair 等人,2019 年)。
24.6 调节
TRPV1 的活性受磷脂酰肌醇-4,5-二磷酸 (PIP2) 调节,事实上,这种磷脂激活除 TRPV3 之外的所有 TRPV 通道(Gamper 和 Rohacs,2012 年)。
TRPV1 中几个关键残基的磷酸化导致对两种化学物质的敏感性增加钙调和热刺激。蛋白激酶 C (PKC)、PKA、钙调蛋白 (CaM) 依赖性激酶和 Src 激酶可增加 TRPV1 活性,但钙调磷酸酶介导的
图 24.2
温度和 LPA 对 TRPV1 的激活。 (a) 表达 TRPV1 通道的内外贴片,其中对温度斜坡的响应的激活 (上升) 部分显示为 60 mV;49.7°C 是最高温度。峰值电流和激活斜率会随着每个后续斜坡激活电流而降低。在 150 s 时,所有 TRPV1 电流都已丢失。 (b) 在 59°C 的较高温度下,在达到最高温度之前的上升斜坡期间也观察到电流损失,并且在此较高温度下后续响应非常降低。 (c) 在辣椒素存在和 (d) LPA 存在的情况下对 TRPV1 (+60 mV) 进行单通道记录。在 LPA 存在的情况下,单通道电流幅度增加。(面板 (a) 和
(b) 取自 Sánchez-Moreno 等人,2018 年,根据知识共享署名许可证
(CC BY 4.0)。)
380 离子通道教科书第二卷
相同位点的去磷酸化导致 TRPV1 脱敏,变得难以激活(Yao 等人,2005 年)。
TRPV2 的功能也可以通过 PKA 或 PI3-激酶的磷酸化/去磷酸化或 Ca2+ 的脱敏来快速调节。已确定此通道的 C 端片段中存在 Ca2+ 依赖性 CaM 结合位点,而膜中 PIP2 的消耗会导致 TRPV2 以 Ca2+ 依赖性方式脱敏。
在 TRPV3 中,PIP2 水解导致电流增强,这是由于电压依赖性打开的转变以及热激活阈值的明显降低。因此,PIP2 水平的降低以及 PKC 的激活会导致皮肤炎症或热痛觉过敏,这是由于 TRPV3 活性增加及其对温暖温度的敏感化。该通道通过重复的配体刺激而敏感,细胞外和细胞内 Ca2+ 水平的变化在此过程中起着重要作用,它们导致 TRPV3 在正电位下缓慢激活,在负电位下强烈失活。具体而言,TRPV3 的这种敏化依赖于与孔环中的残基结合并可被 CaM 消除的细胞外 Ca2+ 的减少。
PIP2 是 TRPV4 的内源性活性调节剂,可通过温度、渗透压变化和 5,6-环氧二十碳三烯酸 (5,6-EET;花生四烯酸代谢的产物) 激活 (Nilius 等人,2007)。PIP2 还调节 TRPV5 和 TRPV6 的组成活性,如下所示。虽然快速脱敏是通过 CaM 的结合发生的,但 PIP2 与 TRPV5 的相互作用对于通道开放至关重要。对于 TRPV5,直接与通道结合的激活剂可能会在 PIP2 激活期间变构增强电导率和/或减少 CaM 诱导的脱敏。相反,通道抑制剂可能通过以下方式起作用:(1) 直接阻断 PIP2 结合,(2) 变构限制 PIP2 诱导的构象变化,(3) 通过在孔中结合来阻断离子流和/或 (4) 增加 CaM 依赖性脱敏。
PIP2 还被证明是 TRPV6 功能所必需的,并且在平面脂质双层中,它直接与该通道相互作用。最近,这种磷脂与 TRPV6 内部 S5 螺旋和 C 端的阳离子残基的相互作用被认为是 PIP2 激活通道所必需的。TRPV5 和 TRPV6 也表现出失活和电流衰减,这是 Ca2+ 依赖性反馈调节机制,部分由 Ca2+ 依赖性 CaM 与通道孔底部的结合控制。
24.7 生物发生、运输和周转
TRPV1 可以以糖基化和非糖基化形式表达。S5 跨膜螺旋和孔环之间的细胞外连接处的 N604 残基会受到 N 连接的糖基化,但该位点的糖基化对于蛋白质的正确折叠和靶向质膜并非必不可少。尽管如此,它对于 cap saicin 调节(即脱敏)和通透性很重要。
在 TRPV4 中,与成孔环相邻的残基 N651 是影响运输的 N 连接的糖基化位点。对于 TRPV5,Klotho 蛋白切割 N 连接的寡糖链(在第一和第二个跨膜片段之间的细胞外环内的残基 N358 处)并将通道捕获在肾脏的顶端质膜中。
首次发现,TRPV2 的 TRP 通道可转位至质膜,这是通过刺激胰岛素生长因子 (IGF)-1 受体实现的,这导致质膜中 TRPV2 水平升高。PI 3-激酶的活性被证明是 TRPV2 和 TRPV1 转位至血浆的关键膜。
此外,PI 3-激酶下游的蛋白激酶C和Src激酶促进蛋白质磷酸化,这是激素诱导TRPV1胞吐的重要步骤。此外,位于核周高尔基体和内质网的蛋白质RGA或基因激活蛋白与TRPV2的N末端相互作用,其过表达会增加细胞表面水平,并可能在内质网和高尔基体区室中TRPV2的早期生物合成和运输中发挥作用(Ferrandiz-Huertas等人,2014年)。
TRPV1 与突触结合蛋白(一种参与 Ca2+ 依赖性胞吐的分子)相互作用,并与 snapin 和微管蛋白二聚体以及聚合微管相互作用,从而允许 TRPV1 四聚化并保留 TRPV1 在膜中的功能。微管的分解导致受体自聚集和部分活性丧失,以及干扰 TRPV1 的囊泡运输。
另一种蛋白质 Cdk5 积极控制 TRPV1 膜转运并促进 TRPV1 在炎症后体内的顺向转运,调节热敏感性并减少辣椒素引起的初级感觉神经元钙内流。
E3-泛素连接酶 Myc 结合蛋白 2 (MYCBP2) 也通过抑制 P38MAPK 信号传导来调节 TRPV1 内化,由于 TRPV1 内化减少,MYCBP2 缺陷 DRG 中的受体运输发生改变,而辣椒素诱导的脱敏在这些细胞中不存在 (Ambudkar, 2007)。
TRPV1 还被证明与 sigma-1 受体相互作用,sigma-1 受体是一种受孕酮拮抗的伴侣分子。这种相互作用调节质膜中的 TRPV1 表达水平 (图 24.3) 以及动物实验模型中的疼痛反应 (Ortíz-Rentería 等人,2018)。
PACSIN 蛋白还与动力蛋白、突触蛋白 1 和 N-WASP 结合,并调节突触囊泡运输和内吞作用。对于 TRPV4,已知 PACSIN 3 的 C 端 SH3 结构域与离子通道的 N 端富含脯氨酸的结构域相互作用,从而增加其细胞表面表达。微管相关蛋白 7 (MAP7) 与 TRPV4 的 C 端相互作用也会增加该离子通道的细胞表面表达,并且 MAP7 还会与肌动蛋白微丝相互作用,促进上皮极性并在细胞形状发生变化时增加 TRPV4 向细胞表面的运输。控制 TRPV4 水平和插入细胞表面的蛋白质-蛋白质相互作用包括与网状相关蛋白 OS-9 的相互作用,OS-9 与 TRPV4 的 N 端尾部相互作用,通过与 TRPV4 的单体和未成熟变体结合,促进正确折叠和四聚体的形成,并保护通道免受过早泛素化和相关降解。赖氨酸缺乏蛋白激酶 (WNK) 家族也影响 TRPV4 的生理学:WNK4 和 WNK1 通过降低其在质膜中的表达来下调 TRPV4 的功能,突出了这些 WNK 在 TRPV4 向细胞表面运输中的作用 (Ferrandiz-Huertas 等人,2014)。Rab 家族的小 G 蛋白,如 Rab11,也参与将 TRPV5 和 TRPV6 运输到质膜。最后,TRPV5 和 TRPV6 与 S-100–
膜联蛋白 2 复合物相互作用,后者也与膜脂质结合。
这些通道剪接变体的表达会影响它们的寡聚化和运输。例如,研究表明,TRPV4 的一些剪接变体在其 N 端(即 ARD)上表现出缺失。对这些剪接变体的研究有助于确定 TRPV4 的生物合成依赖于核心糖基化,并且 ARD 是通道寡聚化所必需的,当没有寡聚化时,通道会保留在内质网中(Ferrandiz-Huertas 等人,2014 年)。
382 离子通道教科书第二卷
24.8 通道病
大多数已报道的 TRPV 通道病与 TRPV4 有关(见下文)。然而,有人提出 TRPV1 变体(Thr612Met 和 Asn394del)与恶性高热症 (MH) 有关,恶性高热症是一种由不受控制的肌肉钙释放引起的疾病,这种疾病是由于卤化吸入麻醉剂引发的肌浆网 (SR) Ca2+- 释放机制异常而引起的。TRPV4 的突变和功能障碍与多种疾病密切相关。例如,TRPV4 的 N 端 (ARD) 突变与遗传疾病有关,例如 2C 型夏科-马里-图斯病。获得功能突变 (TRPV4-P19S) 可导致
Ca2+ 通过通道的进入增加,并导致 MMP-1(间质胶原酶)等分子的过度分泌,从而导致慢性阻塞性肺病。
TRPV4 通道中的其他突变会导致几种类型的发展,如图所示图 24.4 (Nilius and Owsianik, 2010; Rosenbaum et al., 2020)。
图 24.3
TRPV1 通道的运输途径。以下显示了三种主要途径:(1) 通过神经生长因子 (NGF) 的作用将 TrkA 与 TRPV1 敏化连接起来的信号通路。该通路由 TrkA 的 Y760 位点的自身磷酸化启动,随后激活 Src 和 PI 3-激酶,
在残基 Y200 处磷酸化 TRPV1。(2) 突触小泡也可以储存 TRP 通道,然后通过 SNARE 复合物将其递送到细胞表面。(3) TRPV1 通道可以由伴侣 sigma-1 受体 (Sig-1R) 正向调节,这种相互作用上调了质膜中的 TRPV1 蛋白水平。
(使用 BioRender.com 创建。)
383 TRPV 通道
图 24.4
TRPV4 通道病。(顶部)TRPV4 通道可遗传突变体的概念图。CDSMA,先天性远端脊髓肌萎缩;SPSMA,肩胛腓骨脊髓肌萎缩;CMT2C,夏科-马里-图思病 2C 型;BO3,常染色体显性骨骼发育不良短脊椎病 3 型;SMDK,Kozlowski 型脊椎干骺端发育不良;SEDM-PM2,Maroteaux 假 Morquio 型脊椎干骺端发育不良 2 型;PD,副脊柱发育不良;MD,变性发育不良,与胎儿运动不能 (FA) 合并; FDAB,
家族性指关节病短指症。(底部)TRPV4 通道结构中突变的定位。
S,替换;D,缺失;I/Du,插入/重复;ARD,锚蛋白重复域;OS-9,骨肉瘤 9;
MAP7,微管相关蛋白 7。(使用 BioRender.com 创建。)
384 离子通道教科书第二卷
对于 TRPV5 和 TRPV6,已发现功能改变会导致诸如乳碱综合征、肾结石病、骨质疏松症、维生素 D 缺乏症和佝偻病等疾病(Nilius 和 Owsianik,2010 年)。
24.9 结论
几个 TRPV 通道控制 Ca2+ 稳态并参与多种生理和病理生理功能。关于这些离子通道作用的大部分信息来自转基因动物模型的使用。然而,要完全了解它们在多种组织和器官中的功能,仍需要开展大量工作。
这些通道表现出复杂的门控机制,需要进一步研究
揭示不同配体和温度对这些离子通道进行门控的细节。
例如,由于蛋白质受热变性高度依赖于温度,通过极性和疏水相互作用的扰动,通道结构某些区域的部分变性可能是温度门控 TRP 通道中温度门控机制的一部分。
致谢
我感谢 Itzel Llorente 制作图表,并感谢 León D. Islas 的建议和校对。这项工作得到了 Dirección General de Asuntos 的支持
个人学术 (DGAPA) – Programa de Apoyo a Proyectos de Investigación
创新技术 (PAPIIT) 拨款 IN200720,国家科学委员会
Tecnología (CONACyT) 授予 A1-S-8760 和 Secretaría de Educación, Ciencia, Tecnología
墨西哥政府创新基金 SECTEI/208/2019。
商店自营 CRAC 频道
穆拉利·普拉克里亚
25.1 简介
Ca2+ 释放激活的 Ca2+ (CRAC) 通道是一种普遍存在的动员机制
许多动物细胞中存在 Ca2+ 信号。一旦激活,Ca2+ 通过 CRAC 通道流入会驱动多种细胞功能,包括酶激活、基因表达、趋化性和神经胶质递质释放。从生理学上讲,CRAC 通道通过细胞内 Ca2+ 库的消耗而激活,这种消耗发生在细胞表面受体的下游,与肌醇三磷酸 (IP3) 的产生相结合,从而引发库操纵的 Ca2+ 内流 (SOCE)(图 25.1)。临床研究表明,CRAC 通道基因突变会导致严重的免疫缺陷、肌肉无力以及皮肤和牙齿异常 (1)。此外,动物研究表明,越来越多的可能疾病,包括过敏、癌症、自身免疫和神经退行性疾病,都与 SOCE 活性的丧失或增加有关 (2),凸显了这些通道对人类健康和疾病的潜在重要性。离子通道教科书第二卷 钙库操纵 CRAC 通道
SOCE 的早期研究依赖于细胞质 Ca2+ 指示剂染料来检查 Ca2+ 通量 (3)。
这些研究得益于 thapsigargin 的发现,这是一种植物碱,是内质网 (ER) 膜中 SERCA(肌/内质网 Ca2+-ATPase)泵的强效抑制剂。Thapsigargin 允许研究人员直接消耗细胞内 Ca2+ 库而不刺激表面受体,从而消除了受体刺激导致的信号传导的无数混杂效应 (3)。
在这些早期研究之后进行的电生理学研究描述了 sto 的生物物理和功能特征T 淋巴细胞和肥大细胞中的再操作电流(4、5)。这些细胞中的 Ca2+ 电流被称为 CRAC 电流,表现出高 Ca2+ 选择性,可以根据其低单位电导率和对大单价阳离子的低渗透性与其他 Ca2+ 选择性通道区分开来(在参考文献 2 中进行了综述)。然而,尽管早期对 CRAC 电流进行了表征,但 CRAC 通道的分子身份以及将 ER Ca2+ 库耗竭与其激活联系起来的机制几十年来仍然未知。在 2005 年将基质相互作用分子 1 (STIM1) 鉴定为 ER Ca2+ 传感器和 2006 年将 ORAI1 鉴定为原型 CRAC 通道蛋白(6、7)之后,这种情况发生了巨大变化(图 25.1)。我们现在知道
CRAC 通道是通过 ER Ca2+ 传感器 STIM1 和
STIM2 与 CRAC 通道 ORAI 蛋白的结合而激活的(图 25.1)。STIM1 和 ORAI1 可以在异源表达系统中完全
重建 SOCE,满足这些蛋白质对 SOCE 的必要性和
充分性。
图 25.1
钙库操纵的钙内流。许多细胞中细胞表面 G 蛋白偶联受体 (GPCR) 或受体酪氨酸激酶 (RTK) 的刺激会导致可扩散信使肌醇三磷酸 (IP3) 的产生。
ER Ca2+ 传感器 STIM1 可以感知 IP3 对细胞内 Ca2+ 库的消耗。激活的 STIM1 分子
迁移到 ER-质膜连接处并聚集在那里。在其延伸形式中,STIM1 二聚体与 ORAI1 通道结合并控制 ORAI1 通道。通过 ORAI1 产生的 Ca2+ 流入驱动一系列细胞效应功能。
389 库操作 CRAC 通道
25.2 CRAC 通道的生物物理特性
早在鉴定出 STIM 和 ORAI 蛋白之前,Cahalan、Penner 和 Lewis 团队数十年的开创性电生理学研究已经揭示了 CRAC 通道的许多重要生物物理和药理学特征。
电生理记录显示,CRAC 电流在 ER Ca2+ 库耗尽后的几秒钟内缓慢激活(图 25.2A),并相应地在库重新填充时缓慢失活(关闭)。激活-失活的速度主要由 STIM1 激活或其逆转的动力学决定,速率受 STIM1 在 ER-质膜连接处的迁移和积累(或其逆转)限制。
从生物物理角度来看,CRAC 通道因其非常高的 Ca2+ 选择性 (PCa/PNa >1000) 和内向整流电流-电压关系 (图 25.2A) 以及非常低的电导率而广为人知,在没有细胞外二价阳离子的情况下,估计 Ca2+ 仅为 ~10-30 fS,Na+ 仅为 ~1 pS (2)。有趣的是,高 Ca2+ 选择性仅在含 Ca2+ 的溶液中表现出来。CRAC 通道在无二价溶液中很容易传导各种小的单价离子 (Na+、Li+ 和 K+)(例如,图 25.2B),这表明高 Ca2+ 选择性不是 CRAC 通道孔的固有特征,而是由于离子-孔相互作用而产生的。微摩尔浓度的 Ca2+ (Ki ~20 µM at –100 mV) 对单价电流的阻断清楚地揭示了这一点。单个 Ca2+ 离子的占据似乎足以阻断大的单价电导,并且,正如孔内结合位点所预期的那样,Ca2+ 阻断是电压依赖性的 (2)。CRAC 通道对包括 Cs+ (PCs/PNa <0.1) 在内的大单价阳离子也几乎不具有渗透性 (图 25.2B),这是由于孔的尺寸相对较窄,限制了较大离子的电扩散。这些通道对常见的 CaV 或 Na+ 通道抑制剂不敏感,但被咪唑抗真菌剂、亚微摩尔浓度的镧系元素抑制,
图 25.2
CRAC 电流的电生理特征。 (A) 表达外源性 ORAI1 和 STIM1 的 HEK293 细胞中 CRAC 电流激活的时间过程。在 t = 0 s 时全细胞闯入后,BAPTA 从记录电极透析到细胞中,随着 ER Ca2+ 库的耗尽,CRAC 电流缓慢激活。电流的电流-电压关系(蓝色轨迹)显示出向内整流曲线,具有极正(> +60 mV)的反转电位,这表明 CRAC 通道具有高 Ca2+ 选择性。(B)在没有细胞外二价离子的情况下(在无二价 [DVF] 溶液中),CRAC 通道很容易传导大的 Na+ 电流。 DVF 电流的电流-电压关系(右,绿色轨迹)显示向内整流曲线,反转电位约为 +50 mV,表明记录吸量管中存在的 Cs+ 离子的渗透性较低。
390 离子通道教科书第二卷
以及小分子 2-APB、BTP2 和 CM4620 等(2)。总体而言,高 Ca2+ 选择性、低电导率和对镧系元素的高灵敏度是识别和区分 CRAC 电流的有用标准m 天然细胞中的其他通道。
25.3 STIM1 是 ER Ca2+ 传感器,用于激活 CRAC 通道
STIM1 首次在筛选与前 B 淋巴细胞结合的分子时被发现。
初步研究表明 STIM1 在肿瘤生长中发挥作用,但直到 2005 年,才通过 RNAi 筛选 SOCE 抑制剂证明了 Ca2+ 信号传导的明确作用(6、8)。人类 STIM1 是一种 77 KDa 单程 ER 膜蛋白,具有包含信号肽的腔内 N 端结构域和胞质溶胶中的大 C 端结构域(图 25.3A)。它包含几个对其功能至关重要的结构域,包括 N 端的无菌 α 基序 (SAM) 和两个 EF 手(图 25.3A)和三个卷曲螺旋结构域、一个 Ser/Pro 富集区和一个 C 端的 Lys 富集区。果蝇只有一个 STIM 基因,而哺乳动物有两个密切相关的基因,STIM1 和
STIM2,它们的 C 端区域有显著差异。在静息细胞中,STIM1 主要位于 ER 主体中。ER Ca2+ 库耗竭触发 Ca2+ 从
图 25.3
STIM1 和 ORAI1 的拓扑组织。(A)STIM1 及其关键功能域的拓扑表示。这些结构域包括 Sig,信号肽;SAM,无菌 α 基序;TM,跨膜结构域;
CC,卷曲螺旋结构域; CAD,CRAC 激活域;ID,STIM1 的失活域;S/P,富含丝氨酸脯氨酸的结构域;K-rich,富含赖氨酸的结构域。(B)ORAI1 单个亚基的示意图。STIM1 结合域以红色阴影表示。标记的关键残基包括人类疾病位点 R91;谷氨酸选择性过滤器 E106;通道门残基 F99;以及位于孔口外部的酸性残基 D110、D112 和 D114。
391 库操作 CRAC 通道
腔内 EF 手,最终导致 STIM1 从本体 ER 重新分布到靠近质膜的点状区域 (2)。 EF 手性 STIM1 突变体具有受损的 Ca2+ 结合形成点状结构并独立于 ER Ca2+ 库耗竭而激活 CRAC 通道 (6, 8);这些突变体中 Ca2+ 结合的缺失基本上诱使分子做出反应,就好像库耗竭了一样。以这种方式,N 端 Ca2+ 结合的变化通过一系列构象变化和与 Orai1 C 端的相互作用与 SOCE 启动相耦合。因此,STIM1 在 CRAC 通道的激活过程中发挥了两个关键作用:它感知 ER Ca2+ 库的耗竭,以及将库耗竭信号传达给质膜中的 CRAC 通道以触发其开放(图 25.1)。 25.4 ORAI1 是原型 CRAC 通道蛋白
2006 年,使用 RNAi 筛选和连锁分析确定了一个患有遗传性免疫缺陷的人类家族中的 ORAI 蛋白 (ORAI1-3) (7、9、10)。ORAI1 是研究最深入的成员,是一种广泛表达的 33 kDa 细胞表面蛋白,具有四个预测的跨膜结构域、细胞内 N 和 C 末端 (图 25.3B),并且与其他先前确定的离子通道没有显著的序列同源性。在 HEK293 或其他异源细胞中,ORAI1 与 STIM1 一起过表达会引起大电流,其生物物理特征与天然 CRAC 通道一致。这些电流还具有 CRAC 电流的核心特征,例如 Ca2+ 阻断 Na+ 电流和对 2-APB 和 La3+ 阻断的敏感性。 ORAI1 第一个跨膜结构域 (E106D) 中高度保守的酸性残基的突变(图 25.3B)显著降低了 CRAC 通道的 Ca2+ 选择性,并改变了与孔密切相关的多种特性,包括 La3+ 阻断、Ca2+ 阻断的电压依赖性和 Cs+ 渗透性 (9-
11)。哺乳动物细胞表达另外两种密切相关的同源物 ORAI2 和 ORAI3,它们的主要区别在于 C 末端和 3-4 环。这三种同工型在 HEK293 细胞中与 STIM1 共表达时,在产生钙池操纵的 Ca2+ 内流方面发挥着类似的作用,并且在哺乳动物组织中广泛表达(详见 (2))。然而,ORAI1 仍然是研究最深入的 CRAC 通道蛋白,并且似乎是大多数细胞中介导 SOCE 的主要异构体,与人类疾病密切相关(1、2)。相比之下,目前尚无直接的遗传证据表明 ORAI2 或 ORAI3 通道在任何细胞类型中对病理学起作用。
25.5 STIM1 的激活:寡聚化和重新分布到 ER-质膜连接
如前所述,STIM 蛋白通过 Ca2+ 解离——与腔内域中的 EF 手结合来响应 ER Ca2+ 库内容的变化。腔内 EF-手域的 Ca2+ 解离常数为 ~500 µM,这与已知存在于 ER 腔中的 Ca2+ 浓度范围一致。与 STIM1 的 EF 手(~500 µM)相比,STIM2 的 Ca2+ 结合亲和力较低(在
(2) 中进行了综述)。从结构研究来看,分离的腔内结构域片段,我们现在知道
Ca2+ 从 N 端 EF 手上解离会触发腔内结构域的展开和聚集,从而导致二聚体和高阶多聚体的出现
392 离子通道教科书第二卷
(12)。STIM1 寡聚化过程是通道激活过程的早期步骤,发生在 STIM1 重新分布到质膜之前,并作为关键的上游激活开关,可展开通道激活过程的所有后续步骤(在 (2) 中进行了综述)。
一旦 ER 库耗尽,就会释放一种分子内自抑制制动器,使 STIM1 在 ER Ca2+ 库充足的细胞中保持静止状态,从而触发 STIM1 激活 (12, 13)。这种制动器是由 STIM1 的 CC1 结构域与催化 CRAC 活化结构域 (CAD) 相互作用形成的,这导致 CAD 在 STIM1 C 末端的折叠三级结构内隔离 (13)。腔内 EF–SAM 结构域的二聚化是此过程中的关键事件,通过将 CC1 结构域包装在一起释放抑制钳,迫使 CAD 向外并远离 ER 膜。在这种扩展形式中,CAD 能够伸出并与质膜中的 ORAI 通道相互作用以触发 ORAI1 活化(图 25.1)。一旦被激活,STIM1 最显着的特征之一是它从静息细胞中储存充足的 ER 主体重新分布到质膜,在那里它在 ER 和质膜之间的连接点处积聚成离散的点状。 STIM1 在质膜上的积累表现出与 ICRAC 激活相同的对 ER Ca2+ 浓度的依赖性,并且比 ICRAC 的发展早约 10 秒,这与通道激活需要 STIM1 和 ORAI 亚基之间局部相互作用的观点一致(在 (2) 中进行了综述)。有趣的是,截断 STIM1 最末端 C 端的碱性区域会减弱截断的 STIM1 向外周位点的重新分布,而不会影响 STIM1 寡聚化(2, 13),这表明该多碱基结构域对于 STIM1 与质膜的相互作用很重要。由于在秀丽隐杆线虫或果蝇 STIM 蛋白中未发现多碱基尾部,因此它很可能是一种脊椎动物适应性,有助于 STIM1 迁移到质膜并有效门控 ORAI 通道。此外,现在越来越清楚的是,除了 STIM1 之外,ER-质膜连接还具有大量其他分子,这些分子具有专门的功能,旨在促进和稳定大量信号分子,包括参与脂质交换的蛋白质、衔接蛋白(如延伸突触结合蛋白 (E-syts))和离子通道 (2、12、13)。
25.6 STIM1 直接与 ORAI1 结合
CRAC 通道在操作上被定义为库操作通道。该特征的机制基础涉及 ER Ca2+ 传感器 STIM1 与 ORAI1 的直接结合,从而导致 CRAC 通道激活。 ORAI1 激活所需的 STIM1 区域包含第二和第三个卷曲螺旋 (CC) 结构域,被称为 CRAC 激活结构域 (CAD)、STIM1–ORAI1 激活区域 (SOAR) 或 Ccb9 (2) (图 25.3A)。该结构域的结构表明,它与主要功能域(CC2 和 CC3)形成二聚体,采用 R 形配置,形成发夹结构(2、14)。该二聚体模块是否代表 CAD 的活性状态结构以及它与静息状态配置有何不同,目前仍存在争议。在 ORAI1 中,STIM1 的主要相互作用位点是细胞内 C 端(图 25.3B)。在这里,点突变(L273S 和 L276D)完全破坏了 ORAI1–STIM1 相互作用。有趣的是,使用纯化组分系统的研究也表明 STIM1 可以与 ORAI1 N 端片段结合 (2)。然而,N 端缺失突变保留了显著水平的全长 STIM1-ORAI1 结合,然而,这些突变会消除 SOCE 和 ICRAC。一些模型提出了两个结合位点的模块化作用,其中 C 端位点介导 STIM1 结合,而 N 端位点被认为调节通道门控。然而,假定的 N 端 STIM1 结合位点(但不是 C 端位点)的突变也会在缺乏 STIM1 的情况下独立消除获得功能 (GOF) ORAI1 突变体中的电流 (15)。因此,N 端是通道功能的一个方面所必需的,与 STIM1 结合中的任何作用无关。目前尚不清楚 N 端是否真的在全长蛋白质中含有 STIM1 结合位点。
25.7 孔结构和门控
在鉴定出 ORAI1 后不久,半胱氨酸扫描分析表明,在四个跨膜结构域中,只有第一个跨膜结构域 (TM1) 形成孔,而面向孔的关键残基包括谷氨酸选择活性过滤器(E106)、疏水残基(V102、F99 和 L95)和孔底部的碱性 R91(16)。随后对果蝇 Orai 晶体结构的阐明证实了这些发现,并揭示了一个具有众多有趣结构基序的非凡通道结构(17)(图 25.4A)。
结构显示 ORAI 孔分为三个区域:外孔中的酸性区域、疏水中心区域和内孔中的碱性区域(图 25.4B)。孔的宽外前庭包含 18 个天冬氨酸残基(每个亚基上的 D110/D112/D114),并在孔入口处形成选择性过滤器(E106)的谷氨酸残基环附近急剧变窄(图 25.4B)。外前庭和选择性过滤器中的这些负电荷对于吸引阳离子到外部口和通过将离子引入孔隙(18)来增强渗透性非常重要,其中 E106 直接形成高亲和力 Ca2+ 结合位点,控制通道的高 Ca2+ 选择性。
孔隙的中心部分由三个疏水残基环(V102、F99 和 L95)排列(图 25.4B),其中外部两个残基 V102 和 F99 起疏水门的作用(19, 20)。V102 或 F99 突变为极性更强的残基会增强孔隙水合,导致通道泄漏(19, 20)。电生理分析和分子动力学 (MD) 模拟表明,孔径的打开是由
图 25.4
Orai 通道的结构。 (A) 果蝇 ORAI 通道的晶体结构 (17)。从细胞外侧看到的 dORAI 横截面视图,显示围绕中心轴排列的六聚体 ORAI 复合物。
TM1 螺旋 (蓝色) 形成孔。右图显示整个通道复合物的侧视图,其中主要的 STIM1 结合域以橙色显示。 (B) ORAI 孔的结构。两个 TM1 域中的孔衬残基显示氨基酸侧链伸入孔内。通道孔有三个主要结构区域,包括酸性区域、疏水区域和碱性区域。残基编号对应于果蝇 ORAI,人类 ORAI1 的相应残基显示在括号中。
伸入细胞质的 ORAI TM1 延伸螺旋以青色突出显示。
394 离子通道教科书第二卷
孔螺旋将 F99 残基移离孔轴(图 25.4B)。此运动
使孔溶解并降低疏水拉伸中的整体能量屏障以允许离子传导(20)。从计算研究中,我们知道 F99 的方向与孔水化紧密相关(15)。当 F99 面向孔时,疏水拉伸会排斥水,而当 F99 移开时,孔水化会增加。通过这种方式,F99 和
V102 经过精心设计,可以调节孔中的润湿-脱湿转变以控制
离子渗透。最近,组成性活性突变体 H206A dOrai(H134A ORAI1;蛋白质数据库 ID:6BBF)的 3.3 Å 低温电子显微镜结构已被解析,令人满意的是,该结构的开放通道配置与之前的功能研究非常吻合。在半胱氨酸可及性实验中发现的所有对孔有贡献的氨基酸(hORAI1 R91、L95、G98、F99、V102 和 E106)在 dOrai 结构中也观察到了这一点(图 25.4B)。新结构还显示 V102–F99 疏水延伸略有加宽,再次证实了这些残基在控制孔开放方面的关键作用。 25.8 STIM 和 ORAI 蛋白的组织分布
在哺乳动物中,STIM 和 ORAI 蛋白广泛表达,一般可视为普遍存在的蛋白质,尽管特定异构体的表达水平在不同组织之间有所不同。从 mRNA 表达分析中,我们知道
STIM1 和 STIM2 存在于骨骼肌、脑、心脏、肺、胰腺和肝脏中。
功能研究表明,ORAI1 和 STIM1 是淋巴细胞、肥大细胞、B 细胞、巨噬细胞、中性粒细胞和
小胶质细胞中钙离子库操纵钙内流的关键介质,并且已使用包括 mRNA 和蛋白质分析在内的多种方法证明了这些蛋白质在这些组织中的表达(有关调节免疫细胞功能的离子通道的进一步描述,请参阅第 III 卷第 7 章)。 STIM2 在脑中的表达
在海马和小脑等结构中尤为突出,并且 STIM 蛋白功能的多样性通过可变剪接进一步增加。
ORAI1 转录本和蛋白质表达也在脑中得到描述,尽管
ORAI2 和某种程度上的 ORAI3 的水平实质上更高(Allen Brain Atlas)。
同一细胞中多种 ORAI 亚型的重叠表达似乎是一个反复出现的主题,并且已在包括 T c 在内的多种类型的细胞中得到描述细胞、巨噬细胞和海马神经元。这提出了是否存在异多聚体通道的问题。有趣的是,ORAI2 的缺失反而增强了各种组织中的 SOCE,表明各种 ORAI 亚型的作用并不简单,并且 CRAC 通道的亚基组成可能对 SOCE 产生深远的影响。阐明不同 Orai 亚型在特定细胞类型中的确切作用有望成为未来研究的重要领域。
25.9 CRAC 通道的生理功能
鉴于 ORAI 和 STIM 蛋白的广泛组织分布,预计 CRAC 通道在不同器官系统中将发挥许多特定作用,这一观点得到了基因敲除研究和具有突变 STIM/ORAI 基因的人类患者的证实。
395 池操纵 CRAC 通道
一种众所周知的生理作用是产生持久的 [Ca2+]i
升高,这对于许多细胞中的 Ca2+ 依赖性基因转录、运动、细胞因子产生和
细胞增殖至关重要。对人类患者的几项研究表明,严重的
免疫缺陷是由 CRAC 通道突变引起的,这些突变使其失活
(1)。这些细胞中 CRAC 通道功能的废除导致
Ca2+ 升高的消除,而 NFAT 是一种重要且广泛表达的转录因子,参与细胞因子基因表达。以下部分描述了一些众所周知的 CRAC 通道在某些细胞类型和组织中的作用列表,尽管这些列表非常简短。
25.9.1 T 细胞
作为 T 细胞中 Ca2+ 流入的主要途径,CRAC 通道调节多种 T 细胞效应功能,包括抗原刺激的细胞因子产生、克隆扩增和细胞溶解 (1)(有关调节免疫细胞功能的 CRAC 通道的更详细描述,请参阅第 III 卷第 7 章)。这些效应功能主要通过激活钙调磷酸酶和 NFAT 以及依赖于这些介质的细胞因子的下游诱导来介导,其中包括 IL-6、IFNγ 和 TNFα 等关键促炎细胞因子以及 MCP1 等趋化因子。CRAC 通道还通过充当停止信号 (1、21、22) 来调节 T 细胞的运动性,进而调节它们与抗原呈递细胞 (APC) 的相互作用。 SOCE 调节的 CRAC 控制的其他途径包括 NF-κB、AMPK、ERK1/2 和 CREB 的激活,它们以不同的方式在抗原刺激后形成 T 细胞反应。然而,值得注意的是,T 细胞功能的几个重要方面不受 CRAC 通道调节。这些包括胸腺内的 T 细胞发育和正向和负向选择、T 细胞迁移以及与 Ca2+ 信号传导无关的细胞因子的增殖。CRAC 通道对特定 T 细胞功能的选择性控制对人类免疫和 CRAC 通道阻滞剂的开发具有临床意义。
25.9.2 血小板
除了 T 细胞外,CRAC 通道还是激动剂诱发的血小板中 Ca2+ 进入的主要 Ca2+ 流入途径 (23)。 STIM1 和 ORAI1 缺陷小鼠表现出激动剂刺激的血小板 SOCE 受损和血栓形成受损,导致受伤后出血时间轻微增加。STIM1-/- 小鼠明显免受动脉血栓形成和缺血性脑梗塞的影响,而 ORAI1 缺陷小鼠表现出对各种血栓形成的抵抗力,包括肺血栓栓塞、动脉血栓形成和缺血性脑梗塞 (23)。这些发现表明血小板中的 CRAC 通道是脑血管血栓形成的关键介质,从而提出了阻断通道功能可能有利于治疗这种疾病的可能性。 25.9.3 骨骼肌
除了免疫表型外,人类和小鼠的遗传学研究还揭示了骨骼肌功能和发育的缺陷(24、25)。缺乏 STIM1 的小鼠骨骼肌中没有 SOCE,并且这种表型伴随着在重复刺激期间肌肉快速疲劳的明显倾向(24)。有趣的是,与非兴奋性细胞不同,STIM1 和 ORAI1 蛋白似乎在静息条件下在骨骼肌的三联体连接处预先定位在彼此靠近的位置,从而允许在储存耗竭期间实现极快且有效的跨肌膜 Ca2+ 内流(25)。在最广泛接受的模型中,CRAC 通道并不直接调节肌肉的节拍收缩性,而是在快速重复收缩事件期间维持储存补充所必需的。 ORAI1 缺陷小鼠的 CRAC 通道功能丧失会导致疲劳加速,与这一作用一致。这可能与人类患者在失去 CRAC 通道时出现的极度肌肉无力直接相关。无功能 CRAC 通道突变。
除了加速疲劳之外,患有 ORAI1 和 STIM1 突变的人的虚弱也可能是由于肌肉发育缺陷导致快肌纤维丢失所致。
25.9.4 神经系统
近年来,CRAC 通道在大脑中的作用越来越受到关注。
一项研究发现,选择性删除前脑兴奋性神经元中的 ORAI1 会导致突触可塑性和认知学习受损,其机制需要树突棘中 ORAI1 介导的 Ca2+ 信号传导 (26)。STIM1 也与调节短期可塑性有关。特别是,STIM1 的一种短同工酶,称为 STIM1B,在包括海马在内的许多大脑区域都有高度表达,似乎对高频刺激引起的突触促进至关重要 (27)。在星形胶质细胞中,星形胶质细胞 ORAI 通道是 Ca2+ 进入的关键途径,可调节神经胶质递质释放以调节海马回路 (28)。其他研究还表明,SOCE 和 ORAI-STIM 介导的 Ca2+ 流入在背角神经元兴奋性中起着至关重要的作用,这对神经性疼痛有影响 (29),这提出了针对中枢神经系统中的 ORAI1 通道可能为缓解慢性疼痛提供新途径的可能性。
25.9.5 细胞增殖和癌症
在从平滑肌细胞到神经干细胞的多种细胞类型中,由 STIM 和 ORAI 形成的 CRAC 通道对细胞增殖很重要。通过基因或药物抑制 CRAC 通道功能会通过抑制 NFAT 信号来降低细胞增殖,而 NFAT 信号在驱动许多细胞增殖方面起着关键作用。这种表型对多种类型的癌症具有病理学意义,包括乳腺癌、宫颈癌和胶质母细胞瘤。此外,通过 RNA 干扰对 ORAI1 或 STIM1 进行药物阻断或敲低可降低小鼠的肿瘤转移,而人类研究表明,STIM1 水平相对升高的女性情况更糟 (30)。乳腺癌中 Ca2+ 信号传导改变的机制仍不确定,但可能模仿在重塑组织状态中常见的增殖状态,例如肺损伤后或细胞培养中发现的增殖状态。总之,这些研究确立了 CRAC 通道在不同疾病过程中的关键作用,并为在许多层面上理解分子生理学提供了强大的动力。
25.10 结论
STIM 和 ORAI 蛋白家族的鉴定使我们对 CRAC 通道生理学和功能的理解有了显著的进步。具体来说,我们现在有一个坚实的机制框架来理解 CRAC 通道是如何通过细胞内 Ca2+ 库的耗尽而被激活的,并且我们知道了参与离子渗透和选择性的关键结构元素。然而,仍有许多尚未解决的问题。一个问题是 STIM1 结合导致 ORAI1 孔打开的机制。如前所述,现在已有封闭和开放通道的结构,STIM1 激活的许多关键步骤已被详细描述,最近的研究开始剖析门控过程中发生的构象变化。因此,我们可以期待未来几年解决有关 CRAC 通道门控结构机制的剩余问题,包括 STIM1-ORAI1 结合的结构基础以及这种结合如何传导至门控的打开。另一个未知数与“其他” ORAI 和 STIM 蛋白的机制和功能有关:ORAI2、ORAI3 和 STIM2。由于动物和人类的遗传证据严重缺乏,目前对这些非典型 CRAC 通道蛋白的研究受到限制。然而,最近的证据揭示了这些蛋白质与典型 CRAC 通道的行为之间存在着令人着迷的差异,包括但不限于不依赖于储存的调节、对 SOCE 的贡献、蛋白质的亚细胞定位和调节。特定敲除和/或转基因小鼠等遗传工具的开发应该为提供有关这些研究较少的异构体的生理作用的新信息打开大门。最后,尽管在开发针对 CRAC 通道的小分子药物方面已经取得了一些进展,但大多数 CRAC 通道抑制剂的机制和靶点尚不清楚。最近在解决 CRAC 通道蛋白晶体结构方面取得的突破应该会影响基于结构的药物设计,并有望提供具有治疗潜力的新一代 CRAC 通道阻滞剂。
致谢
我感谢实验室成员以及许多同事和朋友多年来激发讨论。我特别感谢 Priscilla Yeung 和 Megumi Yamashita 对 CR 的见解AC 通道门控和生理学,以及生成图表的帮助。本章所述工作由美国国立卫生研究院资助。
26
压电通道
Jörg Grandl 和 Bailong Xiao
26.1 简介
2010 年,Bertrand Coste 在结合 siRNA 敲除、机械细胞压痕和膜片钳电生理学的筛选中确定了 Piezo1 和 Piezo2 蛋白是机械激活阳离子通道的新成分 (Coste 等人,2010)(见图 26.1)。
发现的通道在几个方面都很不寻常:Piezo 非常大,每个亚基约有 2500 个氨基酸,这与已知的力门控通道小得多的尺寸相反; Piezos 控制阳离子携带的电流,这对于哺乳动物力门控通道来说是一种新奇事物,意味着它们可以介导兴奋信号;并且 Piezos 在不同组织中表现出广泛的表达,这立即表明了广泛的生理作用。后续研究通过显示纯化的 Piezo1 在重建为人工双层膜后足以介导阳离子电流、确定 Piezo1 的同源三聚体低温电子显微镜 (cryo-EM) 结构(包含中心离子传导孔)以及功能性地识别成孔域(Coste 等人,2012 年;Ge 等人,2015 年),牢固地证实了 Piezo 蛋白是真正的成孔亚基。如今,人们已经了解了很多有关 Piezo 功能和生理学的知识:革命性的低温电子显微镜能够捕捉到 Piezos 的美丽结构,它总共有 114 个跨膜 (TM) 螺旋(每个亚基有 38 个 TM),这表明它具有独特的激活机制;功能研究表明,Piezo1 可以高灵敏度(~1.4 mN/m)感知膜张力,这是其他力门控通道无法比拟的(第 1 卷,第 4 章);对其他模型生物的研究表明,Piezo 并不局限于哺乳动物,在拟南芥中也有发现。
图 26.1
Piezos 的发现。(A)“拉伸”装置示意图,其中通过膜片吸管用高速压力钳将负吸力施加到细胞附着的
贴片上,仅刺激贴片圆顶内包含的通道(顶部)。 Piezo1 峰值电流幅度最初随着压力的增加而上升,然后达到饱和状态(中间)。压力-响应关系可以用 S 形函数拟合,以测量压力灵敏度(底部)。(B)“戳刺”装置示意图,描绘了在全细胞记录过程中钝探针(通常是火抛光玻璃吸管)引起的细胞变形,从而激活了整个细胞中的大量通道(顶部)。Piezo1 电流幅度随着位移步骤的增加而增加,从探针与细胞膜首次接触后几微米开始。从这些实验中,可以生成电流-位移曲线。通常,电流在细胞破裂之前不会达到稳定状态(底部)。(C)电压阶跃协议,每个步骤中只有一个“戳刺”位移(左)。来自单个细胞的电流家族说明了通道失活的电压依赖性,在正电压下衰减时间严重减慢(中间)。从峰值电流幅度绘制的 I-V 曲线显示反转电位接近 0 mV,表明非选择性阳离子电导(右)。(转载自 Jörg Grandl,2017 年,“触摸、张力和转导:压电离子通道的功能和调节”,Trends Biochem Sci
42(1):57–71。经许可。)
403 压电通道
拟南芥、果蝇、秀丽隐杆线虫和斑马鱼。然而,最大的进展是在揭示依赖于压电的众多有时出乎意料的生理机制,以及可能使它们能够作为多功能机械转导通道发挥作用的独特结构特征方面取得的。总而言之,这些进步与 2021 年诺贝尔生理学或医学奖的共同获得者 Ardem Patapoutian 一起获得了荣誉,他发现了 Piezos。然而,关于 Piezo 的药理学、调节和细胞生物学的知识仍然存在相对较大空白。同样,与 Piezos 相关的病理学已被确定,但在机制层面上仍未得到充分理解。因此,我们章节中描述 Piezo 生理学、结构和功能的部分能够描绘出一幅相当详细的图景,而关于 Piezo 药理学、调节、细胞生物学和疾病的部分只是勾勒出尚待完成的工作。
26.2 生理作用
Piezo 是完全专门的机械传感器——除了机械力之外,没有任何内源性分子或物理刺激能够牢固地激活 Piezo1 或 Piezo2。人类
PIEZO1 和 PIEZO2 基因位于 16 和 18 号染色体上,分别编码 2521 和
2752 个氨基酸。这种对单一刺激模式的专注极大地促进了nd 加快研究以揭示 Piezo 生理学,因为基因表达数据直接指向相应细胞和组织中的力感应功能(Murthy 等人,2017 年)。因此,消除背根神经节 (DRG) 神经元中 Piezo2 的表达会导致对轻机械触摸的检测出现特定缺陷,但不会导致热反应出现缺陷,这些反应也是由这些神经元介导的(Ranade 等人,2014 年)。同样,已经证明在 Merkel 细胞(轻触)、迷走神经(气道伸展和肺膨胀)、膀胱尿路上皮和支配感觉神经元(膀胱控制)和本体感受神经元(肌肉拉伸)中表达的 Piezo2 具有特殊的机械传导功能(Nonomura 等人,2017 年;Woo 等人,2015 年)。虽然 Piezo2 不会介导急性机械疼痛反应,但它会导致炎症条件下的机械性异常性疼痛或触觉疼痛 (Szczot 等,2018)。
此外,Piezo1 和 Piezo2 的表达模式基本不重叠,导致生理功能的明显划分:Piezo2 主要局限于神经组织,而 Piezo1 则广泛表达。在心血管系统中,它感知剪切应力、血管流动和器官拉伸,以调节血管发育、血压、动脉重塑、血细胞体积和心脏功能。在骨骼系统中,它在成骨细胞中表达并调节机械负荷依赖性骨形成和重塑。在免疫系统中,它调节先天性和适应性免疫。在消化系统中,它参与肠道蠕动和结肠炎以及压力诱发的胰腺炎(Murthy 等人,2017 年)。已知的例外是结节和岩部感觉神经节,这两个通道都参与感知血压和压力感受器反射,以及肠道肠嗜铬细胞,它们介导血清素的释放。这种表达分离的遗传调控目前尚不清楚,Piezo1 和 Piezo2 的功能几乎相同,而它们的力敏感性和响应动力学似乎难以区分——只有 Piezo2(快速)和 Piezo1(慢速)的失活动力学明显不同——这几乎没有留下什么线索。尽管它们的作用通常是分开的,但 Piezo1 和 Piezo2 的体内功能似乎可以互换。例如,Piezo1 异位表达到初级体感神经元中可敏感化并挽救 Piezo2 依赖的触觉和本体感觉反应,但出乎意料地抑制而不是引起机械疼痛。
26.3 亚基多样性和基本结构组织
哺乳动物 Piezos 是大型跨膜蛋白,与已知离子通道无序列同源性。例如,小鼠 Piezo1 和 Piezo2 分别具有 2547 个和 2822 个氨基酸,并且共享约 42% 的序列同源性。Piezo1 和 Piezo2 基因的可变剪接已被证明以细胞特异性方式发生,并且可以产生具有改变的离子渗透和门控动力学的通道。例如,Piezo1 具有剪接变体 Piezo1.1,该变体在小鼠和人类细胞类型和组织中均有广泛表达。值得注意的是,Piezo2 以细胞类型依赖的方式在小鼠和人类感觉神经元中广泛剪接。有趣的是,在 Piezo1 和 Piezo2 中都发现了包含关键侧向插入门的保守域的替代剪接,这表明 Piezo 通道家族具有共同且进化保守的调节机制。这些 Piezo 剪接变体在机械敏感性、单位电导、离子选择性和失活动力学方面有所不同。因此,它们可能极大地扩展和微调 Piezo1 和 Piezo2 的功能和生理多样性。然而,尚未详细探索功能变异、剪接调节和生理后果的全部范围。例如,剪接变体的生理意义仍有待使用小鼠遗传学模型确定。通过确定全长小鼠 Piezo1 (2547 个残基)(蛋白质数据库:5Z10、6B3R、7128)、全长小鼠 Piezo2 (2822 个残基)(蛋白质数据库:6KG7)和小鼠 Piezo1.1 变体 (2524 个残基)(蛋白质数据库:6LQI)的低温电子显微镜结构,我们对复杂 Piezo 通道的结构-功能关系的理解发生了范式转变(Wang 等人,2019 年;Guo 和 MacKinnon,2017 年;Saotome 等人,2018 年;Zhao 等人,2018 年)。所有这些结构都表明 Piezos 形成了同源三聚体结构,细胞外视图类似于三叶螺旋桨(图 26.2)。三个高度弯曲的叶片从中央离子传导孔模块螺旋出来,顶部有一个细胞外帽,其结构来自小鼠 Piezo1(蛋白质数据库:4RAX)和单个秀丽隐杆线虫 Piezo 同源物(蛋白质数据库: 4PKE)也通过 X 射线晶体学独立确定(图 26.2A-C)。Piezo2 的结构具有完全解析的 38 TM 拓扑结构,而在 Piezo1 和 Piezo1.1 中,38 个 TM 中只有最后 26 个 TM 未解析。因此,Piezo1/2 原体采用了显著的 38 TM 拓扑结构,包括 N 端叶片、C 端孔模块以及连接梁和锚域(图 26.2D)。叶片由 36 个 TM 螺旋 (TM1-36) 组成,其中每四个具有前一个膜平行两亲螺旋的 TM 折叠成一个重复的结构单元,称为 TM 螺旋单元 (THU) 或压电重复 (图 26.2D、E)。TM37 和 TM38 分别称为外螺旋 (OH) 和内螺旋 (IH)。C 端 OH-Cap-IH-CTD 区域与细胞外帽 (或 C 端细胞外结构域 [CED]) 和细胞内 C 端结构域 (CTD) 一起三聚化形成中央孔模块,其中三个 IH 包围跨膜孔 (图 26.2F)。此外,9 纳米长的细胞内梁从 TM28 延伸到中央孔模块的底部,与 CTD 和楔入 THU9 和 OH-IH 对之间空间的锚定域形成分层界面,随后是关键功能域,包括中央塞、侧塞、闩锁、扣环和未解决的无序 405 Piezo 通道
图 26.2
Piezos 的同源三聚体结构和 38 TM 拓扑组织。 (A–C) 所示 Piezo2 模型的视图,其中主要结构域已着色和标记。 在图 B 中,标记了由三个叶片的高度弯曲跨膜区域形成的纳米碗结构的中平面开口直径、深度、表面积 (Abowl) 和投影面积 (Aproj)。当叶片完全变成平面时,假设的最大 Aproj 为 700 nm2。在灰色框中,从封闭通道过渡到开放通道时张力 (γ) 引起的自由能变化由自由能方程描述。张力灵敏度由投影面积 (∆Aproj) 的变化决定,该变化可能达到最大值 250 nm2。 (D) Piezo2 原体的 38 TM 拓扑模型。虚线表示未解析区域。 (E) Piezo2 原体的结构模型。 (F) 带状图显示 OH–Cap–
IH–CTD 构成的孔模块以及锚、侧塞、闩锁和梁域。中央溶剂可及途径用程序 HOLE 生成的虚线网格标记(孔半径:红色 < 1 Å < 绿色 < 2 Å < 紫色)。标记了细胞外前庭 (EV)、膜前庭 (MV) 和细胞内前庭 (IV)。IH 形成的收缩部位充当上 TM 门和下 TM 门。
细胞质收缩颈部可能不是主要的离子传导途径。 (G) 三个侧门户 (虚线圆角矩形) 的顶视图,位于图 F 中箭头所示的解剖位置。
衬在侧门户、侧塞和闩锁上的 Piezo1 残基被着色和标记。将九个标记残基集体突变为带正电的赖氨酸残基,可将 Piezo1 从阳离子选择性通道转变为阴离子选择性通道。 (改编自 Bailong Xiao,2021 年,《机械敏感型 Piezo 通道的结构设计和机械门控机制》,Trends Biochem Sci 46(6):472–488。经许可。)
406 离子通道教科书第 II 卷
位于 TM28 (THU7) 和 TM29 (THU8) 之间最大的细胞内环中的区域
(图 26.2D、E)。
Piezo1/2 结构的一个显著特征是,它们的三个叶片的 TM 区域
采用高度弯曲和非平面的配置,这可能是由
每个 THU 前面的膜平行螺旋形成的细胞内螺旋层促成的。基于 Piezo2 的完整结构,总共 114 个 TM 的三个叶片形成了一个纳米碗结构,中平面开口直径为 24 nm,深度为 9 nm,产生 700 nm2 的中平面碗表面积和 450 nm2 的投影平面面积,当 Piezo2 假设变为完全平面时,这可能导致最大平面膜面积膨胀 ~250 nm2(图 26.2B)。Piezo1/2 结构的纳米碗形状可能会使驻留膜急剧弯曲。事实上,当重组成小脂质体时,Piezo1 蛋白会局部变形脂质双层,尽管通道以由内向外的方向插入以采用脂质体的膜曲率(Lin 等人,2019 年)。这种不寻常的纳米碗状 Piezo 通道膜系统结构可能成为赋予 Piezo 通道精致机械敏感性的独特结构基础 (Haselwandter 和 MacKinnon, 2018)。
Piezo 通道复合物中拥有惊人的 114 个 TM 结构域,因此nels 是具有最多 TM 结构域的膜蛋白。尽管小鼠 Piezo1 和 Piezo2 在组织表达、生理功能和生物物理特性方面存在差异,但它们具有非常相似的整体架构、38 个 TM 拓扑组织和关键结构域,这表明它们可能具有整体相似的机械控制机制,用于介导体内机械转导功能。
26.4 门控
在机械刺激下,Piezos 会迅速激活(<1 毫秒)。多项研究表明,Piezo1 直接受膜张力控制,灵敏度高(~1.4 mN/m)(Lewis 和 Grandl,2015 年)。详细机制尚不清楚,但可能依赖于极大且异常弯曲的叶片结构对局部膜曲率的感知和转导。极端的 Piezo 曲率会引起膜的局部弯曲,
据推测,这对于其高张力敏感性至关重要 (Haselwandter
和 MacKinnon,2018)。
在持续的机械刺激下,Piezo 通过通道内在机制失活,而去极化会减慢这一过程。失活可能是生理上需要的,以保护细胞免受持续的 Piezo 激活和随后的钙过载,因为 Piezo 灵敏度 (~1.4 mN/m) 与细胞中的静息膜张力 (1-2 mN/m) 相当 (Opsahl 和 Webb,1994)。与 Piezo2 (τ ~10 ms) 相比,Piezo1 失活较慢 (τ ~30 ms),并且正电压越大,失活速度越慢。存在两种动力学上不同的失活状态,并且从失活中恢复的过程同样依赖于电压(在更正的电位下较慢),并且与 Piezo2 相比,Piezo1 中的速度较慢(Lewis 等人,2017 年;Wu 等人,2017 年)。失活的一个新兴特性是它调节 Piezos 的整体机械灵敏度,并赋予通道作为重复刺激的频率过滤器的能力。失活本身通过多种机制进行调节,包括电压、pH、温度、二价离子、渗透膨胀等物理因素,以及可变剪接、蛋白质相互作用、膜脂质组成和 G 蛋白偶联途径等细胞过程。失活的结构决定因素已定位到帽结构域和内孔螺旋内的单个残基,而帽和叶片之间的静电相互作用以及帽内的构象变化已被证明是门控发生所必需的(Zheng 等人,2019 年)。去除机械刺激会导致失活,同样,Piezo1 和 Piezo2 之间的动力学不同,即电压依赖性。总之,膜张力引起的 Piezo 门控可以用四状态马尔可夫模型准确描述。除了膜张力激活外,还提出了用于 Piezos 的系绳门控机制,并且膜组成已成为门控的重要调节器。 26.5 离子通透性
Piezos 是非选择性阳离子通道,在生理相关离子条件下,其单位电导率约为 30 pS(Piezo1)
和 22 pS(Piezo2)。由三个 IH(TM38)形成的中央渗透途径横跨整个膜。
Piezo2 结构具有完全密封的跨膜孔,该孔在
Piezo1 结构中扩张,表明存在能够实现力诱导门控的跨膜门(图 26.2F)。然而,定义这个中央孔的入口和出口点更加复杂:细胞外离子可以通过帽进入,尽管除了结构腔之外,没有支持该途径存在的功能数据,或者通过帽下方的侧孔进入,尽管可能阻碍这些孔的叶片中细胞外环的电子密度目前尚未解决。研究表明,离子从孔进入细胞也是通过三个侧孔和三个侧门进入的,这些侧门由所谓的侧塞控制,侧塞跟随光束(图 26.2G)(Geng 等人,2020 年)。将侧门内壁的九个残基集体突变为带正电的赖氨酸残基,将 Piezo1 从阳离子选择性通道转变为阴离子选择性通道。侧向插头可能通过拟议的插头和闩锁机制协同移动,以全有或全无的方式门控通道,其中力诱导的叶片梁结构构象变化可能导致物理上拔掉侧向插头门。令人兴奋的是,剪接变体 Piezo1.1 和突变体缺乏侧向插头,导致单位电导增加(~44 pS),钙渗透性略有降低,机械敏感性增强。更重要的是,相同的剪接变体 Piezo2.1 在质量上反映了这些结构和功能特征。离子是否也可能流过垂直通道中央收缩颈部在底部具有中央塞子,这需要额外的结构和功能证据。
26.6 药理学
作为一种新型、独特且复杂的离子通道,目前对
Piezo 通道的药理学研究仍然很差,缺乏高效力和特异性。Piezo1 和 Piezo2
介导的电流可以被非特异性阻断剂阻断,包括聚阳离子钌红 (RR)、钆 (Gd3+) 和肽毒素 GsMTx-4。已知 RR 和 Gd3+ 可以阻断许多 TRP 通道,而 GsMTx-4 还可以抑制其他机械敏感通道,例如双孔钾通道。RR 可作为小鼠
Piezo1/2 的孔阻断剂,但不能作为果蝇 Piezo 的孔阻断剂,并且 RR 敏感性的物种差异由细胞外帽结构域决定。锚定域中的残基 E2133 和 Piezo1 侧门中的残基 E2495 和 E2496 除了确定单位电导率外,还被证明对 RR 阻塞至关重要。此功能在 Piezo2 中得到保留,此处由等效残基 E2126、E2769 和 E2770 保留。Piezo1 和 Piezo2 离子传导途径中 RR 的确切结合位点仍有待从结构上确定。GsMTx-4 是 Piezo1 的门控调节剂,它通过在压力门控曲线中产生约 30 mmHg 的右移来调节,可能是通过调节局部膜张力来实现的。有人提出,GsMTx4 在无应力膜中占据较小的表面积,但会更深地渗透到膜中,在对膜施加张力时部分放松外单层,从而降低作用于 Piezo1 通道的有效刺激幅度。
通过高通量筛选诱导 Piezo 依赖性 Ca2+ 反应的化合物,鉴定出三种 Piezo1 化学激活剂,包括疏水性 Yoda1(最大水溶性约为 30 μM)和亲水性 Jedi1 和 Jedi2(最大水溶性高达 2 mM)。Yoda1 可激活小鼠和人类 Piezo1,表观 EC50 分别约为 17 μM 和 27 μM,但不会激活 Piezo2。 Jedi1 和 Jedi2 特异性激活 Piezo1 但不激活 Piezo2,EC50 分别约为
200 μM 和 158 μM。Yoda1 和 Jedi1/2 均可直接与叶片区域中的 Piezo1 结合,从而通过独立机制稳定其开放状态。Jedi 诱导的 Piezo1 激活需要 TM15–16 和 TM19–20 之间的细胞外环路,
以及梁近端的两个亮氨酸残基 L1342 和 L1345,这表明中央孔存在长距离变构门控。与 Jedi1 和 Jedi2 相比,Yoda1 具有相对更高的效力和更强劲的 Ca2+ 反应,使其成为一种广泛使用的工具化合物,用于通过 Ca2+ 成像检测各种细胞类型中 Piezo1 的功能性表达。 Yoda1 衍生物 Dooku1 可作为竞争性拮抗剂,阻断 Yoda1 诱导的
Piezo1 Ca2+ 反应,其表观 IC50 约为 1 μM,表明两种分子
竞争同一结合位点。
26.7 调节
与 Piezo 膜系统独特的纳米碗结构一致,据报道,Piezo 通道的性质受膜脂质(包括磷酸肌醇和胆固醇)组成的调节。在 Piezo1 结构中以及在分子动力学模拟中,已发现充满脂质密度的口袋。Piezo 活性也可能受到膜硬度的影响。气孔素样蛋白 3 (STOML3) 的共表达增强了 Piezo1 和
Piezo2 的机械激活。有人提出,STOML3 结合并募集胆固醇以形成脂质筏,从而导致膜硬度增加。通过在细胞培养物中添加不同的膳食脂肪酸,研究发现,七叶酸(一种增加膜硬度的饱和脂肪酸)抑制了 Piezo1 的活化,而多不饱和脂肪酸 (PUFA) 通过降低膜硬度来调节通道失活。
值得注意的是,在某些细胞类型(例如内皮细胞、肾上皮细胞和干细胞)中,内源性 Piezo1 介导的电流显示出显着减慢的失活动力学。
409 Piezo 通道
有人提出,内源性鞘磷脂酶 SMPD3 通过在内皮细胞中产生神经酰胺来减缓 Piezo1 失活。
可以通过改变不同细胞类型中的细胞骨架蛋白(包括肌动蛋白、动力蛋白和细丝蛋白 A)来调节 Piezo 活性,这些蛋白可能间接影响膜硬度、张力或曲率。例如,用肌动蛋白聚合抑制剂细胞松弛素 D 处理细胞可抑制 Piezo1 介导的机械激活电流。另一方面,在渗透性膨胀期间测量时,Piezo1 和 Piezo2 的活性增加,这可能导致静息膜张力增加。
已鉴定出 Piezo1 和 Piezo2 的其他功能相互作用蛋白,包括抑制蛋白质一些蛋白,如多囊蛋白-2、pericentrin、SERCA、Mtmr2 和膜联蛋白 A6,以及增强蛋白,如前面提到的 STOML3 和 TMEM150C/
Tentonin3。其中一些,如 Mtmr2、STOML3 和 TMEM150C,似乎通过影响膜特性间接影响 Piezo 通道活性。另一方面,SERCA2 通过结合连接孔模块和机械转导模块的连接区域直接抑制 Piezo1。
26.8 细胞生物学
Piezo 通道的生物发生、运输和周转在很大程度上仍未得到探索。
虽然大部分研究都集中在位于质膜上的 Piezo 通道上,但很大一部分 Piezo 蛋白实际上存在于细胞内膜系统中,包括内质网 (ER) 和核膜。有趣的是,一项研究表明,机械拉伸可导致 Piezo1 介导的钙从 ER 中释放,导致 H3K9 三甲基化 (H3K9me3) 快速丧失、异染色质减少和核软化,从而保护 DNA 免受机械应力损伤。Piezo1 表达的变化与各种疾病状况有关,包括骨质疏松症、心肌病、神经胶质瘤、胃癌、结肠癌、膀胱癌和前列腺癌。Piezo1 机械传感器与机械敏感细胞和器官所经历的机械力之间的正反馈关系已在多种生物环境中得到证实,其中机械负荷导致 Piezo1 表达和激活增加。例如,在神经胶质瘤组织中,机械力激活 Piezo1 会上调细胞外基质并使组织变硬,进而提高 Piezo1 表达以促进神经胶质瘤的侵袭性。当在跑步机上锻炼时,小鼠的成骨细胞中 Piezo1 的表达和激活增加。这种机械负荷引起的 Piezo1 变化反过来又增强了成骨作用和骨形成。相反,机械卸载(例如后肢悬吊或微重力治疗)或 Piezo1 机械传感器的丧失(例如成骨细胞特异性敲除)会导致成骨作用受损和骨质流失。此外,心肌细胞中 Piezo1 的自主上调会导致细胞和动物模型以及人类患者的心肌病,这可能会改变机械应力条件。虽然钙可能通过激活 Ca2+ 依赖性分子(如 CaMKII 和 NFAT)发挥关键作用,但机械力依赖性 Piezo1 表达遗传调控的详细机制仍有待充分解决。
410 离子通道教科书第二卷
26.9 通道病和疾病
截至今天,多项研究已将八种人类疾病与 Piezo1 和 Piezo2 中的 60 多种基因突变联系起来(Murthy 等人,2017 年):Piezo1 中大约 40 种不同的单点突变与结直肠腺瘤性息肉病、脱水性遗传性口红细胞增多症、全身淋巴发育不良和溶血性贫血有关。
矛盾的是,症状似乎存在重叠,因为一些脱水遗传性口形红细胞增多症患者也患有全身淋巴发育不良,尤其是在围产期,而全身淋巴发育不良患者的红细胞偶尔会出现口形红细胞。同样,包括远端关节挛缩症 5 型、戈登综合征、马登-沃克综合征和小眼畸形在内的一系列疾病与 Piezo2 中的大约 20 个单点突变有关。患者均表现出先天性关节挛缩或关节僵硬异常,但可以通过其他特定症状来区分。许多疾病与已知的 Piezos 生理功能没有明显关系。虽然大多数突变对 Piezo 功能的影响尚不清楚,但迄今为止研究的少数突变明显影响了 Piezo 失活。例如,患有遗传性干性红细胞增多症的个体的失活速度减慢,并出现年龄性铁过载。令人惊讶的是,三分之一的非洲裔个体存在与血浆铁升高相关的相对温和的突变(Ma 等人,2018 年)。尽管如此,我们对这些疾病及其潜在机制的理解仍然有限。有效敲除 Piezo2 的人类在本体感觉和辨别性触觉方面存在严重缺陷,在皮肤发炎后无法产生敏感和对触摸的疼痛反应,并且经常报告膀胱功能受损(Szczot 等人,2018 年)。所有这些诊断都反映在小鼠基因消融研究中观察到的表型中。除了遗传学研究外,Piezo1 蛋白的水平在几种人类疾病条件下也存在异常,
例如增生性瘢痕形成、骨质疏松症、癌症和肥厚性心肌病,这暗示着 Piezo1 在伤口愈合、维持健康骨骼结构方面发挥着作用,细胞增殖和心脏功能。
26.10 结论
自 2010 年发现 Piezo 通道家族以来,Piezo 通道的病理生理作用不仅在各种动物物种中得到证实,而且在人类中也几乎在机械转导过程的所有方面得到证实。与此同时,结构功能表征揭示了独特的结构特征和优雅的门控机制,使 Piezo 通道能够形成复杂的机械转导机制,从而有效地将机械力转化为细胞信号。
尽管研究取得了显著进展,但仍有许多悬而未决的问题有待解决,例如,Piezo 通道如何利用其通道特性来精确确定涉及机械转导的各种病理生理过程。鉴于压电膜系统标志性的纳米碗结构和所提出的门控机制,了解在存在和不存在细胞骨架的情况下脂质环境中压电通道的动态门控机制至关重要。压电通道的表达控制、生物发生、运输和周转在很大程度上仍未得到探索。最后但并非最不重要的是,基于对压电通道的分子机制和疾病相关性的深入了解,艰巨但最终的目标可能是开发用于治疗疾病的新型疗法,例如 Piezo2 介导的触觉疼痛。 27
瑞安诺丁受体
Jean-Pierre Benitah、Laetitia Pereira、Liheng Yin、Jean-Jacques Mercadier、Marine Gandon-Renard、Almudena Val-Blasco、Romain Perrier 和 Ana Maria Gomez
27.1 简介
瑞安诺丁受体 (RyR) 是已知最大的通道(超过 2.2 MDa)。RyR 具有较大的电导率以及单价和二价阳离子选择性,在生理上可作为 Ca2+ 释放通道。它位于内部细胞器肌网/内质网的膜上,激活后会将 Ca2+ 释放到细胞溶胶中。它于 1985 年在兔骨骼肌和心肌的肌浆网 (SR) 制剂中被发现,其与从植物 Ryania speciosa 中提取的生物碱毒素 ryanodine 具有强的 Ca2+ 依赖性结合,该毒素不可逆地与开放的 RyR 结合,因此得名 (Pessah、Waterhouse 和 Casida 1985)。哺乳动物中有三种 RyR 同工型:RyR1,主要存在于骨骼肌中;RyR2,主要存在于心脏和大脑中;和 RyR3,在平滑肌、大脑和慢骨骼肌中更普遍但表达水平较低。RyR 是同源四聚体;每个单体包含约 5000 个氨基酸,在面向胞质的小 C 端附近有六个跨膜结构域,以及一个大的胞质中心和 N 端结构域,它们在电子显微照片中可见为致密结构,称为“脚”(图 27.1)。由于尺寸较大,RyR 难以结晶,但最近的研究已经允许可视化 3D 结构并通过低温电子显微镜和 X 射线解析部分结构,主要是来自 RyR1,尽管 RyR2 也取得了一些进展。
离子通道教科书第二卷
27.2 生理作用
RyR 在可兴奋细胞中表达,其生理功能是释放足够的 Ca2+ 将电信号(动作电位)转化为功能性结果(收缩或分泌,取决于细胞类型)。在肌肉细胞中,RyR 是兴奋-收缩偶联机制的关键元素,而在其他可兴奋细胞(如神经元和分泌细胞(例如胰岛的嗜铬细胞和 β 细胞)中,RyR 是兴奋-分泌偶联的关键,可启动胞吐作用以释放神经递质或激素。除了这些生理功能外,RyR 还可以参与通过兴奋-转录偶联激活的基因转录和表达的调节(有关综述,请参阅 Bers 2008)。RyR 通过 Ca2+ 诱导的 Ca2+ 释放机制由 Ca2+ 激活。少量 Ca2+ 通过电压敏感的 Ca2+ 通道进入可激活 RyR,而 RyR 又通过从 SR 释放 Ca2+ 显着放大该信号。然而,在骨骼肌中,RyR1 可以在没有 Ca2+ 的情况下打开。事实上,骨骼 L 型 Ca2+ 通道 (Cav1.1) 的打开与 RyR1 的打开直接相关。Cav1.1 电压传感器构象的变化通过直接蛋白质-蛋白质相互作用传递到 RyR1。在心脏和骨骼肌中,RyR 主要分布在 SR 膜上,位于 T 管内陷处的肌膜电压依赖性 L 型 Ca2+ 通道 (LTCC) 正前方,是二联体 (心脏) 或三联体 (骨骼肌) 的一部分 (图 27.1 骨骼纤维和心肌中钙释放单元 (CRU) 的位置和形态。 (A) 在成人骨骼肌纤维中,Ca2+ 释放单元 (CRU,空箭头指向) 位于在肌节 A 带和 I 带过渡区附近,在 Z 线的两侧。线粒体 (M) 存在时位于 CRU 附近,更靠近 Z 线。插图:在骨骼纤维中,CRU 被称为三联体,因为它们由三个元素组成,一个中央横管 (TT),两侧是肌质网 (SR) 的两个末端池。在薄片中,在更高的放大倍数下,可以看到横跨 TT 和 SR 膜之间间隙的电子密度(小黑箭头指向)。(B)在成年心肌细胞中,CRU(空箭头指向)位于肌节的 I 带中,大致与 Z 线相对应。线粒体 (M) 体型较大,颜色较深,排列在肌原纤维之间的纵列中。插图:CRU 被称为二元组,因为它们是由 TT 结合而成,TT 具有宽轮廓,SR 末端池狭窄而平坦,环绕着 TT。在更高的放大倍数下,RyR 可见为电子密度(称为脚,尖尖的小黑箭头),位于 TT 和 SR 膜之间的连接间隙中。比例尺:面板 A 和 B,1 µm;插图,0.2 µm。(图片由意大利基耶蒂佩斯卡拉 G. d’Annunzio 大学的 L. Pietrangelo 和 F. Protasi 提供。)
415 Ryanodine 受体
27.1)。这种特定的空间组织使 RyR 对收缩的启动至关重要。在心脏中,去极化后,LTCC(Cav1.2)的开放会产生少量的 Ca2+ 内流,不足以产生心肌细胞收缩。然而,这种 Ca2+ 内流激活了 RyR2s。结果,RyR2s 大量释放储存在 SR 中的 Ca2+ 到细胞质中。这种 RyR2 介导的 Ca2+ 释放与动作电位同步,并发生在心室细胞的所有 T 小管-SR 连接处。RyR2s 释放的 Ca2+ 量很大(约 10 µM),导致细胞溶胶中 Ca2+ 浓度增加,足以通过 Ca2+ 与肌丝结合产生心肌细胞收缩。这种放大过程由 A. Fabiato 和 F. Fabiato 首次描述,被称为 Ca2+ 诱导的 Ca2+ 释放。心脏收缩的强度取决于 RyR2 在兴奋-收缩偶联过程中释放的 Ca2+ 量,并与通过 LTCC 的 Ca2+ 流入幅度和 SR 内可用的 Ca2+ 量(也称为 SR Ca2+ 负荷)直接相关。在其他心肌细胞中,例如起搏器细胞,RyR2 也参与动作电位的产生,从而调节自律性(Lakatta 和 DiFrancesco 2009)。RyR 是多分子复合物,支撑多种参与调节心脏收缩的调节蛋白,例如钙调蛋白 (CaM)、Ca2+/CaM 激酶 II (CaMKII)、蛋白激酶 A (PKA)、FK506 结合蛋白 (FKBP12.6)、sorcin、juncttin、triadin 和钙调蛋白。 RyRs 的这种调节将在后面描述。
27.3 亚基多样性和基本结构组织
RyR 是一种同源四聚体,四个相同亚基的疏水片段形成中央 Ca2+ 孔。三种蛋白质 RyR1、RyR2 和 RyR3 共享约 70% 的同一性。编码每种异构体的基因是在 1989 年至 1990 年间确定的。在人类中,它们位于染色体 19q13.2 上,跨 104 个外显子 (RyR1),染色体 1q43 上,跨 10 个外显子 (RyR2),以及染色体 15q13.3-14 上,跨 103 个外显子 (RyR3)。
单粒子电子显微镜提供了该通道的最佳分辨率结构,其分辨率为 3.8 Å,可显示兔和猪 RyR1 的约 70%(Yan 等人,2015 年;Zalk 等人,2015 年;Efremov 等人,2015 年)。RyR2 结构的部分也已结晶并叠加在 RyR1 结构上,以深入了解 RyR2 结构。如图 27.2A 所示,RyR 的侧视图呈蘑菇状,其茎位于 SR 膜中,且具有较大的细胞质部分。EF 手是假定的 Ca2+ 结合位点。顶视图呈方形(图 27.2C)。C 端结构域(六个跨膜结构域)形成孔,与电压门控通道有相似之处。细胞质调节部分有三个核心螺线管(长螺旋结构域),两个位于中央结构域,一个位于 N 端结构域。图 27.2E、F 中还显示了示意图,每个部分使用不同的颜色代码。
磷酸化热点位于重复 3-4(它包含相当于 2808 和 2814 的位点,这是 RyR2 中研究最多的位点)。这些丝氨酸由 PKA 和 CaMKII 磷酸化(参见第 27.6 节)。最近的研究表明,PKA 的催化亚基包含 RyR2 的整个重复 3-4,它非常灵活。
CaMKII 在 S2814 等效位点的磷酸化暴露了 S2808,而 S2808 变得更易于被 PKA 磷酸化 (Haji-Ghassemi、Yuchi 和 Van Petegem 2019),因此
416 教科书 I在 Channels Volume II 上
显示磷酸化热点中的这些位点不是独立的。FKBP12
和 12.6 kDa(也称为 Calstabin 1/2)与螺线管(螺旋结构域)1 和 2(在图 27.2C、D 中以黄色标记)之间的 RyR 结合,稳定其闭合状态。氨基酸 3500-3600 附近是与钙调蛋白结合的区域,钙调蛋白也通过稳定其闭合状态与通道门控相互作用。
图 27.2
RyR 结构。(A)四聚体 RyR1 与 FKBP12 复合的结构侧视图。(B)一个 RyR1 原体中域组织的示意图。 (C) 分辨率为 5.0 Å 的 RyR1,其中一个原聚体根据模型中指定的域进行分段,颜色如下:蓝色,N 端域;青色,SPRY1、SPRY2 和
SPRY3;鲑鱼色,钳位区域(RY12 重复)和磷酸化域(RY34 重复);黄色,FKBP12;绿色,
桥螺线管支架;红色,核心螺线管;橙色,跨膜和 C 端域;紫色,假定的 Ca2+ 结合域 (EF)。(D) 两个单体的示意图,颜色代码与面板 C 中的颜色代码相同。
B-sol,桥螺线管;C-sol,核心螺线管;N-sol,N 端螺线管。(E) 一个 RyR 原聚体的一级结构
及其每个区域的位置。 (F) 一个 RyR 原体的分子密度侧面图,颜色代码与图 E 相同。为清楚起见,省略了 α-螺线管 2 和重复 3-4 结构域。为了使面板之间等效:面板 A 和 B 中的 NTD 细分为面板 C 和 D 中的 NTD-A、B 和 N-sol,面板 E 中的 AB 域加 α-solenoid1。SPRY 在所有面板中的名称相同,面板 F 中的重复 1-4 在 D 中命名为 R1-4,在 B 中命名为 P1 和 P2。B 中的 HD1 和 HD2 对应于面板 D 中的 B-sol 和面板 F 中的 α-solenoid 2。面板 B 中的 Central 对应于面板 D 中的 C-sol 和面板 F 中的 α-solenoid 1。面板 B 和 D 中的 CTD 是面板 F 中的 C 端域。(面板 A 和 B 来自 Yan 等人 2015 年;面板 C 和 D 来自 Zalk 等人 2015 年;面板 E 和 F 来自 Efremov 等人 2015 年。)
417 瑞安诺定受体
27.4 门控和离子通透性
诱变分析、低温电子显微镜和分子动力学模拟表明,跨膜孔的整体结构类似于电压门控 Na+ 或 K+ 通道。前四个跨膜螺旋 (S1-S4) 形成一个紧凑的束,称为伪电压传感器域,而每个原体的最后两个螺旋 (S5 和 S6) 形成孔域,S6 螺旋排列在离子传导途径上,半渗透性孔螺旋形成通道的管腔口,类似于 K+ 和 Na+ 通道的选择性过滤器 (Meissner 2017)。RyR 通道传导单价和二价阳离子,同时由于其孔的净电荷为负而排斥阴离子。事实上,选择性过滤器上每个原体上的 GGGIGDE 基序对于有效的离子渗透至关重要。因此,RyR 通道具有阳离子选择性,对单价阳离子(250 mM K+ 作为导电离子时约为 800
pS)和二价阳离子(50 mM Ca2+ 时约为 150 pS)均具有异常大的离子电导率,同时保持二价阳离子与单价阳离子的适度选择性(PCa/PK ∼7)。
单价和二价阳离子之间的这种适度选择性具有以下相对特异性:K+ > Rb+ > Na+ ≈ Cs+ > Li+,对二价阳离子具有类似的选择性(Ba2+ ≈
Sr2+ ≈ Ca2+ > Mg2+),这对于 Ca2+ 通道来说是不寻常的。相比之下,LTCC 在单价和二价阳离子之间显示出更高的区分度(PCa/PK >20)。
Ca2+ 选择性明显不足可能与其高电导率有关。与高选择性 K+、Na+ 和 Ca2+ 通道相比,RyR 的一个独特渗透特征是,Ca2+ 离子在转位过程中几乎完全水合,第一溶剂化壳完好无损,这导致 RyR 的离子选择性较弱 (Zhang et al. 2020)。事实上,跨膜孔区域足够宽,可以让水合阳离子渗透,从而促进较大的离子电导率。然而,阳离子之间的选择性主要通过电荷-空间竞争实现,因为与 K+ 相比,Ca2+ 可以在最小的空间中容纳最多的电荷并表现出更高的亲和力(溶液中 Ca2+ 的存在显着降低了 K+ 的渗透性)。另一个特点是 RyR 的选择性过滤器具有高度动态性;其构象在状态转变过程中发生变化。选择性过滤器的移动特性将允许所有小于选择性过滤器的柔性孔径的阳离子在激活时通过,从而使 RyR 成为广谱阳离子传导通道。RyR 通道相对较差的 Ca2+ 选择性确实具有重要的生理意义。值得注意的是,RyR 必须介导其自身的 K+ 逆流,以最大限度地减少 SR Ca2+ 释放期间膜电位的形成,否则会迅速阻碍进一步的 rCa2+ 释放。
27.5 药理学
已描述了许多用于实验和治疗调节 RyRs 的药理学药物(有关综述,请参阅 Dulhunty 等人,2017 年)。在这些药物中,咖啡因、瑞安诺丁和丁卡因通常用于实验评估 RyRs 在 SR Ca2+ 释放中的作用和功能。咖啡因通过降低 Ca2+ 激活的阈值来调节 RyRs。持续接触咖啡因会使 RyRs 保持开放状态,从而引起储存在 SR 中的 Ca2+ 突然释放,同时阻止 SR Ca2+ 填充。因此,咖啡因会清空 SR,从而可以估计 SR Ca2+ 含量。至于瑞安诺丁,其结合具有高度特异性,但依赖于浓度。它在低浓度(纳摩尔)下锁定开放的通道,使其保持在较低的亚电导状态,但在高浓度(毫摩尔范围)下完全关闭它们。RyR1 和 RyR2 的开创性分析提出了四个结合位点,其亲和力逐渐降低,作用相反。较高的亲和力(1-4 nM)激活,而最低的亲和力(2-4 µM)抑制它,位点之间具有负协同作用(Pessah 和 Zimanyi 1991)。与高亲和力位点的结合降低了单通道电导,同时增加了开放概率。RyR2 中的跨膜位点 Q4863(相当于 RyR1 中的 Q4933)在瑞安诺丁结合中很重要(Wang 等人,2003 年;Ranatunga 等人,2007 年)。一旦与瑞安诺定结合,
通道就会对 Ca2+、Mg2+ 和 ATP 失去敏感性。瑞安诺定还以放射性标记形式 ([3H] 瑞安诺定) 用于量化 RyR 并研究其结构和功能。[3H] 瑞安诺定结合分析也用于评估通道对 Ca2+ 的依赖性。
由于瑞安诺定仅与开放通道结合,因此结合取决于
通道的开放概率,而这高度依赖于 [Ca2+]。
丁卡因是一种麻醉剂,可通过保持 RyR 处于关闭状态来抑制 RyR。
几种能够调节 RyR 的药理化合物也被认为是具有巨大潜力的治疗剂,可预防与 SR Ca2+ 释放改变相关的心脏功能障碍、心律失常或肥大。其中,氟卡尼是一种 I 类抗心律失常药物(Na+ 通道阻滞剂),也已被鉴定为 RyRs 抑制剂,其利用 RyR 通道整合到平面磷脂双层中。氟卡尼阻断 RyRs 的开放状态,从而防止心律失常事件背后的舒张期 Ca2+ 释放增加(Kryshtal 等人,2021 年)。此外,丹曲林已被证明可以抑制 RyR1,并作为骨骼肌松弛剂用于治疗恶性高热(Zhao 等人,2001 年)。在心肌细胞中,丹曲林通过增强钙调蛋白与 RyR2 的结合亲和力来抑制 RyR2,从而降低促心律失常的舒张期 Ca2+ 释放(以火花和波来衡量),尤其是在儿茶酚胺能多形性室性心动过速 (CPVT) 中,使其成为一种有前途的抗心律失常治疗剂。另一种用于减少 SR Ca2+ 泄漏以防止心律失常的策略是使用 JTV519(或 K201)稳定 RyR2 与 FKBP12.6 的结合。JTV519 是一种 1,4 苯并硫氮杂卓衍生物,可防止 FKBP12.6 从 RyR2 解离,从而减少 SR Ca2+ 泄漏。有研究表明,JTV519 通过恢复正常的 RyR2 域间相互作用来稳定 RyR2(Yamamoto 等人,2008 年)。当前的研究工作针对能够稳定 RyR 闭合状态的分子,这些分子可能有助于治疗神经肌肉疾病和心血管疾病,例如心律失常性遗传或后天性疾病和心力衰竭。
27.6 调节
RyR 是一种受 SR 膜两侧(胞浆和腔内)多种因素调节的通道,例如离子、分子、蛋白质和翻译后修饰。主要的 RyR 调节剂是 Ca2+,它可以激活它,但也可以在较高浓度下抑制它。在存在 ATP 的情况下,Ca2+ 可在浓度低于 10 µM 时激活通道,在浓度高于 100 µM 时抑制通道(见图 27.3)(Gyorke 和 Gyorke 1998)。人们已经认识到 RyR2 在胞浆部分含有高亲和力的 Ca2+ 结合位点,可激活该位点(Ikemoto 和 Yamamoto 2002),其中 E3987(对应于 RyR1 中的 E4032 和 RyR3 中的 E3885)很重要(Li 和 Chen 2001)。因此,在胞浆侧,Ca2+ 是生理激活剂(尽管 RyR1 可以在没有 Ca2+ 的情况下通过 Cav1.1 直接激活而打开)。其他离子,如Mg2+,与Ca2+结合到相同的位点,但无法激活它,从而降低RyR活性。在调节RyR的分子中,有核苷酸,其中ATP是最活跃的,在微摩尔Ca2+浓度存在下增强其活性,RyR1比RyR2更敏感(Laver 2006),而ATP本身是一种r 激活剂,如 [Ca2+] <50 nM 所示。由于细胞中的大多数 ATP 与 Mg2+ 结合,因此 MgATP 而不是
游离 ATP 可能是 RyR 通道上的生理效应物,其对 RyR1 的影响比对 RyR2 的影响更明显。
活性氧和抗氧化酶调节兴奋-收缩偶联,特别是通过它们对 RyRs 的影响。慢性氧化激活 RyR2,这会增加 SR Ca2+ 泄漏并减少 SR Ca2+ 负荷 (Terentyev 等人,2008)。一氧化氮 (NO) 通过亚硝化许多丝氨酸残基来调节 RyR2 的活性。
增加 NO 合酶 (NOS) 活性有利于 RyR2 亚硝化,从而增加 SR Ca2+ 泄漏 (Carnicer 等人,2012)。相反,NOS 缺失的小鼠表现出 RyR2 开放概率和火花频率降低,与 SR Ca2+ 负荷增加有关(Wang 等,2010 年)。
除了离子、其他分子及其氧化还原和亚硝基化类似物外,RyR 通道还受几种相关蛋白的调节,这些蛋白的功能是调节 SR 膜两侧通道的通透性和对 Ca2+ 的敏感性。
在胞质侧,这些蛋白质包括 CaM、sorcin、FKBP12 和 FKBP12.6 以及参与四聚体磷酸化/去磷酸化平衡的激酶和磷酸酶,四聚体在其功能中起重要作用。
图 27.3
RyR 单通道电流和 Ca2+ 敏感性。(A)不同胞质 [Ca2+] 对 RyR2 活性的影响。
在 40 mV 保持电位下,由 Ca2+ 和 ATP 激活的单通道电流(向上偏转),有(左)和没有(右)Mg2+。trans 室含有 20 µM Ca2+。(B)RyR2 开放概率对细胞质 [Ca2+] 依赖性的平均数据。(C)增加管腔 [Ca2+] 对通道活性的影响。在将管腔 [Ca2+] 从 20 µM 增加到 5 mM 之前和之后,在 40 mV 下记录通道。关闭的水平用破折号标记。cis 室含有 3 mM Na 2ATP 和 1 µM 游离 [Ca2+]。(D)在 –40 和 +40 mV 下,相对开放概率 (Po) 与管腔 [Ca2+] 的关系的平均数据。 (摘自 Gyorke 和 Gyorke 1998。)
420 离子通道教科书第 II 卷
每个 RyR 单体都以高亲和力结合一个 CaM 分子,而不管与其结合的 Ca2+ 离子数量(1 到 4),尽管高 [Ca2+] 有利于结合。CaM 结合的效果是 RyR Ca2+ 依赖性激活的改变,导致通道开放抑制。这有利于舒张期间通道关闭(Meissner 2017)。在收缩期间,[Ca2+] 的增加导致四个 Ca2+ 离子与 CaM 结合,从而导致 CaMKII 激活,即使由于 CaMKII 自身磷酸化导致 [Ca2+] 减少,这种激活仍可能持续。Sorcin 是一种 22 kDa 蛋白质,可与 RyR 和 LTCC 结合。当 [Ca2+] 增加时,它调节 RyR 开放并与通道相互作用,从而促进其关闭 (Farrell 等人,2003)。
在 RyR 调节蛋白中,FKBP 起着重要作用。在心肌细胞中,
两种 FKBP 亚型结合并调节 RyR2 功能:12 kDa 的 FKBP12 和
12.6 kDa 的 FKBP12.6。与 FKBP12 相比,FKBP12.6 的丰度要低得多,但对 RyR2 的亲和力要高得多 (Zissimopoulos 等人,2012)。然而,每种亚型的相对重要性和作用机制仍有争议。人们普遍认为,FKBP12.6 促进收缩期 RyR2 通道之间的耦合门控 (Marx 等人,2000) 并使 RyR2 处于关闭状态,从而限制舒张期 SR Ca2+ 释放 (Gellen 等人,2008)。由于舒张期 SR Ca2+ 释放可能因 NCX 介导的去极化电流激活而导致心律失常,因此有人提出 FKBP12.6 具有抗心律失常特性。事实上,通过 JTV519 促进 FKBP12.6–RyR2 结合可防止心脏杂合 FKBP12.6 KO 小鼠 (FKBP12.6 KO+/– 小鼠) 中观察到的应激性心律失常和猝死 (Wehrens 等人,2004)。 FKBP12 在心脏中的作用尚不清楚。FKBP12 似乎会促进 RyR2 引发心律失常,而 FKBP12.6 会抑制这种作用 (Galfre 等人,2012)。在骨骼肌细胞中,FKBP 12 和 12.6 两种同工型也会表达,但与心肌细胞相比,FKBP12 对 RyR1 的亲和力比 FKBP12.6 高得多。
如前所述,RyR 磷酸化状态(磷酸化-去磷酸化平衡)在 RyR2 功能中起着重要作用,这是由多种激酶 (PKA、CaMKII)、磷酸酶 (PP1、PP2A) 和磷酸二酯酶 (PDE4D) 的协同作用引起的,这些激酶通过锚定蛋白与通道相连。 RyR2 的三个主要磷酸化位点是 S2808、S2814 和 S2030。随着磷酸化的增加,RyR2 开放概率总体增加,导致交感神经刺激期间 SR Ca2+ 释放增加。分析方法试图为每个磷酸化位点分配特定的激酶和磷酸酶,以及对通道功能有特定的影响。这导致了相当多的争议,尽管现在似乎已经达成共识,即 Ser2814 过度磷酸化参与了舒张期 SR Ca2+ 泄漏,而这种泄漏是导致在几种病理条件下观察到的心律失常的原因 (Camors 和 Valdivia 2014)。如前所述,各种激酶对给定磷酸化位点的特异性受到质疑,现在对每个单独位点的磷酸化对 RyR2 功能的影响有了更全面的看法,这些位点之间的协同程度各不相同。在这种情况下,最近对优先表达蛋白激酶 SPEG 的横纹肌磷酸化的 Ser2367 残基的描述特别令人感兴趣 (Campbell 等人,2020 年)。与 PKA 和 CaMKII 介导的增加 RyR2 活性的磷酸化不同,Ser2367 位点的 SPEG 磷酸化会降低 RyR2 介导的 SR Ca2+ 释放。因此,各种磷酸化对 RyR2 功能的影响不仅是激酶和磷酸酶之间微妙平衡的结果,而且是有利于和减轻 SR Ca2+ 释放的激酶和磷酸酶之间的微妙平衡的结果。RyR 也在腔内侧受到调节。与胞浆侧相反,Ca2+ 以剂量依赖性方式激活 RyR(图 27.3)。一些膜包埋蛋白(连接蛋白、三聚体)或 SR 腔内的蛋白质控制游离 [Ca2+](钙结合蛋白,富含组氨酸的 Ca2+ 结合蛋白),调节 RyR 通道内口的 Ca2+ 敏感性(Gyorke 和 Terentyev 2008)。此外,三聚体在 LTCC-RyR 连接的结构和功能完整性以及 SR Ca2+ 释放中起着重要作用(Chopra 和 Knollmann 2013)。
27.7 细胞生物学(生物发生、运输、周转)
与大多数蛋白质一样,瑞诺丁受体在细胞溶胶中合成,然后被定位到最终目的地。 RyRs 的表达需要转录因子结合,例如,特异性蛋白 1 与 RyR1 和 RyR2 启动子的结合是其表达所必需的 (Schmoelzl 等人,1996 年;Mackrill,2010 年)。RyR1 的组织特异性表达是由基因第一个内含子介导的非肌肉细胞中的转录抑制引起的 (Schmoelzl 等人,1996 年)。RyR2 的表达也受神经元昼夜节律的调节,因为其表达受 BMAL1 增加,受 mCRY1 抑制 (Pfeffer 等人,2009 年)。三种 RyR 同工型主要存在于内质网和肌质网 (ER/SR) 膜上,但也可以存在于质膜、分泌囊泡和内体上。然而,人们对 RyRs 如何靶向 ER/SR 知之甚少。研究表明,RyR1 的第一个跨膜结构域提供了强大的 ER 保留信号,足以使 RyR1 靶向 ER(Meur 等人,2007 年),但 RyR 在连接 SR 处定位的特定信号尚不清楚。在幼鼠中,研究表明 RyRs 的半衰期约为 8 天,而随着年龄的增长,半衰期会增加,从而降低骨骼肌中的 RyR 周转率(Ferrington、Krainev 和 Bigelow,1998 年;Denniss、Dulhunty 和 Beard,2018 年)。
27.8 通道病和疾病
迄今为止,已发现 300 多种 RyR 基因突变,并与不同的病理有关。在 RyR1 中,大多数突变与危及生命的肌病有关,而 RyR2 同工型中的 200 多个突变与心脏病有关。至于 RyR3,由于其表达水平低,因此知之甚少,然而,最近它与阿尔茨海默病和一些高血压和糖尿病病例有关。
至于 RyR1 相关肌病,恶性高热 (MH) 是一种常染色体显性药物遗传病,表现为麻醉或肌肉松弛剂引起的体温突然升高和肌肉僵硬。与 MH 相关的第一个已发现的 RyR1 人类突变是 R614C (Hogan 等人,1992 年)。MH 中的 RyR1 突变会导致 SR Ca2+ 释放增加和细胞内 Ca2+ 超载,从而导致 Ca2+ 与肌丝结合增强,从而导致细胞收缩失调。它通常表现为肌肉僵硬,从而导致体温升高的代谢亢进状态。唯一获批的 MH 治疗方法是丹曲林。另一种与 RyR1 相关的疾病是中央核病 (CCD),这是一种先天性肌病 (I4898T、G4890R、
R4892W、G4898R、A4905V),通常在儿童时期发展,通常表现为肌肉无力和运动发育迟缓 (Ogasawara 和 Nishino 2021)。典型的发现包括线粒体的减少或缺失、肌原纤维紊乱程度不一以及中央核区域缺乏氧化和糖酵解酶活性。虽然对 RyR1 突变的病理生理机制尚无共识,但它有人认为,去极化和 RyR1 之间的耦合发生了改变,因此改变了 Ca2+ 释放,导致 [Ca2+]i 减少和肌肉收缩缺陷。然而,RyR1 突变导致病理的具体机制仍不清楚。鉴于 RyR2 在兴奋-收缩耦合中的基本作用,RyR2 的功能障碍会导致或多或少严重的心脏功能障碍。RyR2 中的特定突变会导致病理情况,尤其是在压力条件下。在这方面,CPVT 是一种遗传性通道病,在运动或情绪压力的背景下导致儿童和年轻人晕厥和猝死。到目前为止,已经在 RyR2 基因 (CPVT1) 中发现了 150 多种与 CPVT 相关的变体。自 Priori 等人首次报道 CPVT 患者中存在一系列 RyR2 突变以来,大多数突变都位于三个“热点”,即 N 端结构域(残基 44-466)(32%)、中央结构域(残基 2246-2534)(30%)和 C 端结构域(残基 3778-4959)(38%)。在 CPVT 中发现的大多数 RyR2 突变都被归类为功能获得,尽管很少有突变显示功能丧失改变。获得功能突变会增加心室肌细胞的舒张期 SR Ca2+ 漏出,尤其是在应激条件下,这可以通过基本 Ca2+ 释放事件的频率或数量增加来检测,例如 Ca2+ 火花并通过 Na+–Ca2+ 交换器诱发 DAD(延迟后去极化),从而触发动作电位。对来自具有不同 RyR2 突变的小鼠的心肌细胞的分析发现突变通道中存在几种改变,这些改变被认为是致心律失常的机制。迄今为止,这些改变包括细胞质或腔内 Ca2+ 敏感性增加 (Fernandez-Velasco 等人,2009 年)、FKBP12.6 解结合 (Lehnart 等人,2008 年)、N 端和中心域之间的拉链-解拉链相互作用改变 (Uchinoumi 等人,2010 年)、磷酸化后 CaM 相互作用降低 (Xu 等人,2010 年) 或与 junctophilin 2 结合不稳定 (Yin 等人,2021 年)。表 27.1 总结了不同 RyR2 CPVT 突变的发现。获得功能突变显示舒张期 SR Ca2+ 释放事件增加,例如 Ca2+ 火花或波,在交感神经刺激条件下触发 Ca2+
波和 DAD(图 27.4)。
虽然大多数 CPVT1 突变都是获得功能的,但也已证实存在功能丧失突变,例如 HEK293 细胞系中的 RyR2L433P 和 HEK293 细胞系和转基因小鼠模型中的 RyR2A4860G,从而使 CPVT 中的心律失常机制变得复杂。对 A4860G 敲入小鼠心室心肌细胞中 RyR2A4860G 突变的功能研究揭示了一种新机制,即突变降低了收缩期间 Ca2+ 释放的峰值,逐渐使 SR 中 Ca2+ 超载,进而导致 Ca2+ 释放的随机爆发延长,激活电生性 Na+–Ca2+ 交换活性并引发早期后去极化 (EAD) (Zhao 等人 2015 年)(图 27.4)。
大多数 CPVT 研究都集中在心室,尽管 CPVT 患者中心动过缓很常见。因此,新的研究已转向起搏细胞或浦肯野纤维作为了解 CPVT 的新枢纽。从这个意义上讲,RYR2R4496C 突变与起搏细胞中 β-肾上腺素能刺激下舒张期 Ca2+ 火花和 Ca2+ 波的高发生率有关,β-肾上腺素能刺激可释放 SR Ca2+,从而引起动作电位生成暂停 (Neco 等人,2012 年)。同样,在从 RyR2R420Q 敲入小鼠解剖的起搏组织中观察到心律减慢和舒张期 SR Ca2+ 泄漏增多。
在这种情况下,舒张期 SR 中 Ca2+ 泄漏增加部分失活了 L 型 Ca2+ 通道,该通道也参与了自律性,从而减慢了动作电位生成速度 (Wang 等人,2017 年)。
423 瑞安诺定受体
表 27.1
一些 RyR2 CPVT 突变的主要发现
突变位置模型发现/机制参考
HEK293 ↑舒张期细胞质 Ca2+ 释放
[Ca2+]
Domingo 等人 2015
小鼠通过干扰耦合时钟起搏器导致心动过缓
Wang 等人 2017
R420Q N-T hiPS-CM ISO 无效,↑
心律失常,↑舒张期 [Ca2+]
Novak 等人 2015
小鼠,hiPS-CM ↑ Ca2+ 火花持续时间,中断
JPH2 与 RyR2 的结合,超微结构
改变(较小的 RyR2 簇
和加宽的 jSR),
↑ NT-核心螺线管相互作用
Yin 等人2021
HEK293 ↓ 对通道激活的敏感性 Thomas 等人 2004
HL-lr
、HEK293 ↑ SOICR 倾向 Jiang 等人 2005
L433P N-T ↓ Ca2+ 释放终止阈值和 ↑ 分数释放
Tang 等人 2012
小鼠 ↑ 心房肌细胞舒张期 SR Ca2+ 泄漏
Shan 等人 2012
酵母破坏 RyR2 N 端自缔合
Seidel 等人 2015
HL-1、HEK293 ↑ SOICR 倾向 Jiang 等人 2006
HEK293FKBP12.6 从
RyR2 分离
Wehrens 等人 2008
↓ FKBP12.6 亚基结合 Lehnart 等人 2008
↓ RyR2 域间相互作用,↓
CaM 结合,↑ 自发性 Ca2+
泄漏
Xu 等人 2010
↑ 心房肌细胞舒张期 SR Ca2+ 泄漏和 ↓ FKBP12.6 从 RyR2 分离
Shan 等人 2012
R2474S Ctr 小鼠 ↑ SR Ca2+ 泄漏,↑ Ca2+ 交替和
Ca2+ 波 ↑ 心房心律失常
Xie 等人2013
↑ 自发性 Ca2+ 漏出、DAD、
触发活动和 Ca2+ 火花
频率 → 通过 ↑ CaM
与 RyR2
结合进行校正
Fukuda 等人 2014
运动训练 ↓ CPVT 中的室性
心动过速通过 ↓
CaMKII 依赖性
RyR2 磷酸化
Manotheepan 等人2016
↑ 细胞质 RyR2 Ca2+ 敏感性
和 ↑ 交感神经刺激后的促心律失常事件
Danielsen 等人,2018
HL-1 ↑ Ca2+ 释放和 RyR2:FKBP12.6
解离
George、Higgs 和 Lai
2008
↑ 低 [Ca2+] 下的 RyR2 活性,Jiang 等人,2002
HEK293 RyR2:FKBP12.6 解离 Wehrens 等人 2008
(续)
424 离子通道教科书第二卷
突变位置模型发现/机制参考
↑ RyR2 腔内 Ca2+ 活化,↓
SOICR 阈值
Jiang 等人2004
小鼠心脏在咖啡因和/或肾上腺素刺激下易发生室性心动过速 (VT) 和室颤 (VF)
Cerrone 等人 2005;
Cerrone 等人 2007
异常 Ca2+ 瞬变,
RyR2:FKBP12.6 相互作用不参与
Liu 等人 2006
↑ 舒张期自发性 Ca2+ 释放,由于 Ca2+ 敏感性增加
Fernandez-Velasco 等人
2009
↑ RyR2 泄漏 ↓SR Ca2+ 负荷和 ↓Ca2+ 波阈值。β-AR 刺激 → ↑SR Ca2+ 负荷和 ↑Ca2+ 波
Kashimura 等人2010
↑ 浦肯野细胞在细胞内 Ca2+ 处理中的异常
Kang 等人,2010
His-Purkinje 系统局部激活心律失常
Herron 等人 2010
在没有 β-AR 刺激的情况下,Na* 依赖性 SRCa2+ 过载↑
引发心律失常
Sedej 等人 2010
R4497C /
M496C
C-T RyR2 中 CaMKII 的过度表达
R4496CT+/- 敲入小鼠→
改变细胞内 Ca2+ 处理
和↑死亡率
Dybkova 等人2011
CaMKII 抑制 ↓ 儿茶酚胺诱导体内持续性室性心动过速,
小鼠 ↓ 触发活动和 ↓ ISO 诱导的瞬时内向电流
体外,机制上由 ↑ SR Ca2+
泄漏和 ↓ SERCA 激活
Liu 等人 2011
↓ 舒张期间 ↓ lcsi 和 SR Ca2+ 耗竭引起的 SAN 自动性
Neco 等人 2012
突变的 RyR2 在静息时功能正常,但在强烈的 β-AR 刺激下显示 ↑ CRV
Chen 等人2012
↑ RyR2 活性、↑ Ca2spark 和 ↑
Ca2 波
Savio-Galmberti 和
Knollmann 2015
浦肯野细胞的 [Na+] 过量 →↑
在比心室更低的压力水平下触发活动和
心律失常
Willis 等人2016
肌细胞
由于 SR Ca2+ 泄漏增加而导致正性肌力反应降低,这是由于 RyR2 R4496C 通道失活后恢复速度加快
Ferrantini 等人,2015
(续)
表 27.1(续)
一些 RyR2 CPVT 突变的主要发现
425 Ryanodine 受体
有力证据将 RyR2 突变与 CPVT1 联系起来,但有趣的是,最近有报道称 RyR2 中罕见的突变与其他心脏病理有关。例如,在患有肌节突变阴性肥厚型心肌病的患者中发现了 RyR2P1124L 突变。 Valdivia 及其同事表明,RyR2P1124L 突变是一种细胞质功能丧失和管腔功能获得突变,可触发舒张期 Ca2+ 释放和心律失常,并诱导心脏收缩力下降,从而导致肥大表型 (Alvarado 等人,2019)。
此外,据报道,另一种遗传性心律失常,心律失常性右心室心肌病 (ARVC),也称为心律失常性心肌病 (ACM),与 RyR2 突变有关 (Te Riele 等人,2015)。然而,RyR2 突变是否导致 ARVC 存在争议,因为在 ARVC 中识别 RyR2 突变可能反映临床误诊 (Roux-Buisson 等人,2014)。
除了 RyR2 突变导致的特定通道病外,其他以结构变化和 Ca2+ 处理不当为特征的心血管疾病也表现出 RyR2 结构或功能的改变,例如心力衰竭 (HF)。HF 与 RyR2 的磷酸化和氧化还原修饰增强有关,导致舒张期 Ca2+ 漏出增加,从而导致心律失常(表 27.1)。在 HF 进展过程中,适应不良的慢性 β-肾上腺素能激活会导致 RyR2 的翻译后变化,从而诱导 Ca2+ 处理失调,以及随后的心脏收缩力改变、心律失常事件和心力衰竭。普遍的共识是,在 HF 期间,RyR2 位点被 PKA(小鼠中的 Ser 2808 和 Ser 2030)和 CaMKII(小鼠中的 Ser2808 和 Ser2814)过度磷酸化,后者参与促进 Ca2+ 泄漏和 DAD。此外,氧化
还会影响 RyR2 亚基间相互作用,改变其功能并增加舒张期间 SR
Ca2+ 释放(Val-Blasco 等人,2021 年)。此外,相同的翻译后
突变位置n 模型发现/机制参考
选择性沉默突变体 RYR2
R4496C mRNA 可降低 ISO 诱导的 DAD 和触发的
活动、肾上腺素能介导的
VT、超微结构异常
和线粒体异常
Bongianino 等人,2017
HEK.293、HL-1 ↓ RyR2 由腔内 Ca2+ 激活,
和 =RyR2 由细胞质
Ca2+ 激活
Jiang 等人,2007
A4860Q C-T HEK293 ↑ SOICR 阈值 Jones 等人,2008
小鼠收缩期间 ↓Ca2+ 瞬时峰值,
逐渐使 SR 超载,
激活电生 Na+– Ca2+
交换器并触发 EAD
Zhao 等人,2015a
缩写: N 端 (N-T)、中枢 (Ctr)、C 端结构域 (C-T)、异丙肾上腺素 (ISO)、库超载诱导钙释放 (SOICR)、肌浆网 (SR)、β-肾上腺素 (β-AR)、钙调蛋白 (CaM)、延迟后去极化 (DAD)、早期后去极化 (EAD)、Ca2+/钙调蛋白激酶 II (CaMKII)、室性心动过速 (VT)、心室颤动 (VF)、肌浆网钙 ATP 酶 (SERCA)、窦房结 (SAN)、L 型钙电流 (ICaL)、Ca2+ 释放变异性 (CRV)、连接蛋白 2 (JPH2)、连接性肌浆网 (jSR)。表 27.1(续)
一些 RyR2 CPVT 突变的主要发现
426 离子通道教科书第 II 卷
RyR2 的修饰与心房颤动 (AF) 有关,心房颤动是最常见的心律失常形式。在阵发性 AF 中,RyR2 蛋白水平上调,
导致 SR Ca2+ 泄漏增加,而在慢性 AF 中,RyR2 的过度活跃是由 CaMKII 和 PKA 磷酸化增加介导的 (Heijman 等人,2014)。
除了肌肉之外,RyR 功能障碍还与一些神经系统疾病有关
如阿尔茨海默病、帕金森病和低灌注痴呆症 (Abu Omar 等人,2018)。
图 27.4
RyR2 修饰导致心脏 Ca2+ 处理不当。(A 和 B)CPVT1 中的功能获得性突变。
在舒张期,RyR2 突变有利于以小 Ca2+ 火花形式增加自发性 Ca2+ 泄漏(A)。
在 β-肾上腺素能刺激下,产生 Ca2+ 波,通过 Na+–Ca2+
交换器 (NCX) 激活 Ca2+ 挤出,使膜去极化,产生延迟后去极化 (DAD) (B),这些延迟后去极化是致心律失常的。(C 和 D)CPVT1 中的功能丧失突变。在功能丧失突变中,舒张期 Ca2+ 泄漏减少,这逐渐使 SR 中的 Ca2+ 超载(C),这在 β-肾上腺素能刺激下得到增强,从而在舒张期触发自发性 Ca2+ 波。收缩期 Ca2+ 瞬变减少可诱导更少的 ICa 失活和早期后去极化 (EAD) (D)。(E 和 F) RyR2 的转录后修饰。在心力衰竭中,由于交感神经紧张增强而导致的 RyR2 过度磷酸化和其他翻译后修饰增加了 RyR2 开放概率。这导致 SR Ca2+ 泄漏和 Ca2+ 波增强,尽管由于 SERCA2a 功能下降导致 SR Ca2+ 负荷下降,从而导致 DAD。此外,延长动作电位持续时间的其他离子电流的改变也会促进 EAD。
427 瑞诺丁受体
27.9 结论
瑞诺丁受体是最大的离子通道,位于肌浆网或内质网膜中。尽管它们的离子选择性较差,但它们仍可作为 Ca2+ 释放通道发挥作用,尽管它们与电压门控通道相似,但它们的开放是由 Ca2+ 或位于骨骼肌纤维肌膜中的 L 型电压通道的直接开放触发的。它们是激活心脏和骨骼肌收缩、控制动脉张力和激活分泌细胞和神经元分泌的关键元素。它们作为多种蛋白质的支架,调节其功能,并可通过多种翻译后修饰进行调节,例如磷酸化、氧化和亚硝化。这些调节机制的改变或基因突变与许多病理状态有关。因此,当前的研究正致力于寻找这些通道的药理调节剂,这些调节剂可以稳定关闭状态,而不会干扰动作电位刺激期间的开放,这对细胞功能至关重要。 28
质子通道
Emily R. Liman 和 I. Scott Ramsey
28.1 简介
细胞内 pH (pHi) 的控制是生物化学的基础,跨膜质子运动在大多数(如果不是所有)细胞中都受到精确调节。后生动物中 H+ 选择性通道的例子包括电压门控质子通道 HVCN1 (Hv1) 和最近发现的耳蝶呤 (OTOP) 蛋白家族。质子通道必须在一组独特的化学和生物物理约束下运行,H+ 转移和选择性的专门机制似乎在 Hv1 和 OTOP 蛋白中独立进化。在生理条件下(pH 7.4 或 400 nM [H+]),质子的浓度比外部浓度低约 0.4 百万倍细胞外 Na+(~140 mM),这意味着由 Hv1 和 OTOP 通道介导的 H+ 电流(与本书中的大多数其他通道处于同一数量级)如果在与生理重要无机离子(即 100 mM H+ 或 pH 1.0)相似的浓度下测量,预计会非常大。与直觉相反,Hv1 和 OTOP 通道也具有极好的质子选择性,并且至少 Hv1 通道似乎利用非常规类型的氢键链和/或水线机制进行质子转移。由于生物物理特性的差异,Hv1 和 OTOP 通道通常支持相反方向的稳态质子通量:Hv1 通道主要介导质子流出,而 OTOP 通道则根据异构体介导流入或双向通量。从细胞内 pH (pHi
) 控制的角度来看,质子通量的方向至关重要:通过 Hv1 向外的 H+ 电流将使细胞质碱化并有助于从酸性负荷中恢复,而向内的 H+ 电流将使细胞酸化并可能在局部或整体上显著改变 pHi。pHi
的变化可能对生化稳态和细胞信号传导产生重要影响。例如,H+ 与多效性第二信使离子 Ca2+ 竞争与酸性侧链的结合,因此降低 pHi
(即增加质子浓度)将提高细胞内游离(即未结合)Ca2+ ([Ca2+]i
) 的浓度。膜电位决定了所有其他离子和电解质运动的驱动力,也由向内(去极化)和向外 H+ 电流(超极化)相互控制。尽管改变质子电流的大小和方向对细胞的影响可能无处不在,但我们对质子通道生理学的了解可能仍处于起步阶段。尽管已经报道了 Hv1 和 OTOP 通道的实验和模型结构,但迄今为止,由于一系列不寻常的限制,破译 OTOP 和 Hv1 通道中 H+ 渗透、离子选择性和门控机制的结构基础的努力一直受到阻碍。H+ 的低电子密度使其无法通过用于实验确定离子通道结构的主流技术(X 射线晶体学和低温电子显微镜 [cyro-EM])看到。其他有前景的方法,如核磁共振 (NMR)、拉曼和时间分辨傅里叶变换红外光谱,尚未适应在电压钳电生理学中典型的近生理条件(即,膜双层中稀疏堆积的蛋白质,两侧是完整的离子浓度梯度)下使用,这可能会混淆将原子级构象变化与测量的通道活动相关联的努力。
命运的另一个残酷转折是,质子当量 H+、H3O+ 和 OH- 共享相同的能斯特平衡电位(即 EH+),这严重限制了传统电生理学方法在同名 H+ 通道中区分载流离子身份的效用。 H+ 在水溶液中具有异常高的迁移率(质子扩散速度比 K+ 快约 5 倍,比 Tris 或其他常用 pH 缓冲分子 1 快约 12 倍),这归因于 Grotthuss 型质子转移(Cukierman,2006),这意味着 H+ 选择性通道携带的电流很容易超过 pH 缓冲液在通道开放时准确控制 pHi 和 pHo 的能力。在对 H+ 通道进行电压钳实验期间,pH 梯度(ΔpH = pHo – pHi)的控制不完全直接挑战了实验者控制离子运动驱动力的能力,从而准确测量电流幅度和电流反转电位。上述和其他限制阻碍了该领域的进展,Hv1 和 OTOP 通道中 H+ 传导和选择性的结构基础仍然不明。因此,激动人心的科学挑战等待着质子通道机制的勇敢研究者。
28.2 OTOP 通道简介
类耳蝶呤蛋白家族在进化上很古老,其成员存在于从秀丽隐杆线虫到人类的不同后生动物中(Hughes 等人,2008 年)。耳蝶呤 1 基因突变的小鼠(Otop1)缺乏碳酸钙基耳石,而耳石是检测头部加速度和重力所必需的,因此得名:o̱tós(耳朵)和 pétrā(石头)(Hurle 等人,2003 年)。OTOP 蛋白家族成员形成离子通道的第一个证据来自对酸味受体的识别(Tu 等人,2018 年)。候选味觉受体的异源表达表明,脊椎动物和无脊椎动物的 OTOP 通道都足以形成新的质子选择性电导 (Tu et al., 2018)。几个 OTOP 通道的结构很快就被解析了y cryo-EM(Chen 等人,2019 年;Saotome 等人,2019 年)。作为离子通道超家族的相对较新的成员,OTOP 通道领域的进展迅速,本综述中可能不会描述最新的发现。
28.2.1 OTOP1 在前庭和味觉系统中的生理作用
随后证明由 OTOP1 介导的 H+ 电流首先在小鼠味觉细胞的膜片钳记录中描述,这些细胞传递酸味(Chang 等人,2010 年;
Bushman 等人,2015 年)。这些实验确定了 OTOP 通道的一些基本特性,例如细胞外 Zn2+ 的抑制和电压依赖性门控的缺失。后者立即将酸味细胞中的 H+ 电流与 Hv1(哺乳动物中唯一已知的其他质子选择性通道)携带的电流区分开来,并表明它们是由一种新型膜蛋白携带的,这种膜蛋白也起到酸味受体的作用。Otop1 突变小鼠和斑马鱼的前庭功能障碍被分别描述(Hurle 等人,2003 年;Hughes 等人,2004 年;Sollner 等人,2004 年)。耳石是基于碳酸钙的结构,可将机械力转化为前庭“毛”细胞中的电反应(Hurle 等人,2003 年)。在小鼠中,Otop1 基因产物在两种前庭结构(椭圆囊和球囊)上皮的支持细胞中表达,携带 Otop1(tlt 或 mlg)突变的小鼠无法在强迫游泳任务中自行翻身(Hurle 等人,2003 年)。OTOP1 质子通道如何参与耳石的形成尚不清楚。尽管小鼠(Mm)OTOP1 中的突变最初被认为会扰乱嘌呤能信号传导(Hughes 等人,2007 年),但现在看来 OTOP1 在调节 pH 以促进生物矿化方面发挥作用的可能性更大。鉴于其在前庭系统中的既定作用,当 Otop1 在富含酸味细胞的基因的差异 RNAseq 筛选中被鉴定出来,并且 Mm OTOP1 蛋白被发现表现出质子通道活性并可能作为酸味受体发挥作用时,人们感到很惊讶 (Tu et al., 2018)。Mm 或 Hs OTOP1 的表达足以在异源细胞中产生强大的酸诱发 H+ 电流,而降低或破坏 OTOP1 通道功能的突变会导致天然酸味受体细胞质子电流减少 (Tu et al., 2018; Teng et al., 2019)。随后对 Otop1–/– 小鼠的研究表明,Mm OTOP1 通道是味觉受体细胞、味觉神经纤维和味觉脑区测量的对酸刺激反应所必需的(Teng 等人,2019 年;Zhang 等人,2019 年)。然而,Otop1–/– 小鼠对摄入酸的行为厌恶似乎没有改变,这表明 OTOP1 可能是参与感知口腔酸的几种分子之一;其他假定的受体/离子通道的身份仍然未知。 28.2.2 OTOP 通道的基因结构、亚基多样性和结构
耳蝶呤基因家族,也称为耳蝶呤结构域蛋白 (ODP) 基因
家族,从秀丽隐杆线虫到人类高度保守 (Hughes 等人,2008)(图 28.1A)。
在大多数脊椎动物中,三个基因 (Otop1、Otop2 和 Otop3) 编码大约 600 个氨基酸 (aa) 蛋白,与其他离子通道或转运蛋白没有已知的相似性。小鼠
434 离子通道教科书第二卷
Otop2 和 Otop3 位于 11 号染色体 (人类为 17) 上的串联阵列中,而
Otop1 位于 5 号染色体 (人类为 4)。无脊椎动物的 OTOP 通道直系同源物已被指定为未知功能域 270 (DUM270) 家族。果蝇和其他节肢动物中有三个已知的 OTOP/DUM270 基因,但它们并不是这三个脊椎动物基因的直接同源物。同样,编码 OTOP 样蛋白的八个秀丽隐杆线虫基因显然自脊椎动物和节肢动物的最后一个共同祖先以来就发生了分化,这表明祖先基因组可能包含一个 OTOP 样基因 (Hughes 等人,2008)。氨基酸序列同一性在跨膜片段 5、6、11 和 12 中最高,所有 OTOP 样蛋白都含有一个称为 Phe-Tyr-Arg (FYR) 盒的 C 端基序。所有三种脊椎动物 OTOP 蛋白和一组无脊椎动物 OTOP 蛋白均已被证明可作为质子通道发挥作用(图 28.1B、C),并且
其他物种直系同源物似乎也可能发挥类似作用(Tu 等人,2018 年)。
2019 年,斑马鱼 (Dr)、鸡 (Gg) 和非洲爪蟾 (Xl) OTOP 蛋白的结构以近原子分辨率被报道(Dr OTOP1 [蛋白质数据库:6NF4] 和 Gg OTOP3 [蛋白质数据库:6NF6] 分别为 3.0 Å 和 3.3 Å,Xl OTOP3
[蛋白质数据库:6O84] 为 3.7 Å)(Chen 等人,2019 年;Saotome 等人,2019 年),并显示通道为长方体状同型二聚体,尺寸约为 70 Å 50 Å 50 Å,具有细胞质
N 和 C 末端。每个原聚体中的 12 个 α 螺旋片段可以进一步划分分成两束六个跨膜 (TM) 螺旋 (TM 1-6 和 TM 7-12),每束
形成同源桶状结构,称为“N”和“C”结构域。二聚体 OTOP 通道复合物的四级
结构是伪四聚体,总共包含
24 个 TM 螺旋,如电压门控 Na+、K+ 和 Ca2+ 通道 (VGC)(图 28.2 A、B)。
与 VGC 不同,OTOP 通道复合物的中心轴被胆固醇
或胆固醇样脂质占据,因此似乎不太可能形成离子通透性
孔 (Saotome 等人,2019 年)。分子动力学 (MD) 模拟表明,水分子可以侵入其他暴露于溶剂的腔体,这可能导致
图 28.1
Otopetrin 基因家族编码质子选择性离子通道。 (A) 代表性 OTOP 蛋白的系统发育树。一个祖先 Otop 基因可能产生了现存的 Otop 基因,该基因在进化过程中经历了多次独立扩展。 (B) 由 Xenopus
卵母细胞中表达的每个小鼠 OTOP 通道介导的电流,响应于降低细胞外 pH 值而引起。 (C) HEK-293 细胞中表达的 Mm
OTOP1 的电流-电压关系响应于变化的细胞外 pH 值,如图所示。电流反转电位 (Erev) 偏移 ~59 mV/ΔpH,类似于 Nernst 方程对质子选择性离子通道的预测偏移。
435 质子通道
质子渗透途径的形成 (Saotome 等人,2019)。每个 N 和 C 结构域
包含一个假定的孔,第三个孔位于 N 和 C 结构域之间的亚基内界面(图 28.2B)。亚基间界面在 OTOP 蛋白中保守性较差,因此似乎不太可能需要共享 H+ 通道功能。然而,位于亚基间界面的色氨酸残基(Dr OTOP1 中的 W394 和 W398)是二聚体形成所必需的,突变会破坏二聚化
或质膜靶向(Saotome 等人,2019)。
28.2.3 OTOP 通道的离子选择性、药理学和门控
鼠 OTOP 通道的功能特性已被详细描述。 Mm
OTOP1 对 H+ 的选择性比 Na+ 更高:PH
+/PNa+ >105
,这是根据 H+ 和 Na+ 浓度变化时电流反转电位 (Erev) 的变化确定的 (Tu
et al., 2018)。与更丰富的单价阳离子相比,OTOP1 对 H+ 的精确选择性引起了这样的假设:OTOP 通道(如后面讨论的 Hv1)可能对质子渗透具有完美的选择性(即特异性)。
图 28.2
OTOP1 的结构和离子渗透机制。 (A) OTOP1 包含 12 个跨膜螺旋,
排列在具有结构相似性的两个域中。 (B) Dr OTOP1(蛋白质数据库:6NF4)的结构,
显示该通道组装为二聚体,具有伪四聚体化学计量。中央孔隙充满脂质,因此不太可能渗透离子。相反,已确定三种可能的渗透途径,这些途径在 MD 模拟中大多是水合的。一种位于 N 和 C 域的中心,第三种位于亚基内界面(N 和 C 域之间)。(C)N 和 C 域内的假定孔隙具有几个共同的特征,包括存在带电残基,疏水性 NPY 三联体可能阻碍闭合状态下的离子传导。 (D) Mm OTOP1 的 N 和 C 结构域中带电残基的突变表明,带负电的残基 E219(Dr OTOP1 中的 E215)和 E433(Dr OTOP1 中的 E429)对于通道功能或组装是必不可少的,而带正电的残基 K149(Dr OTOP1 中的 R145)和 R586(Dr OTOP1 中的 R572)是可有可无的。C 结构域中的双突变体挽救了通道功能,这与 E433 和 R586 之间形成盐桥一致。
436 离子通道教科书第二卷
虽然目前尚不清楚离子选择性的机制和离子渗透途径的位置,但 OTOP 通道结构确实提供了一些提示。仔细检查 N 和 C 域中暴露于溶剂的前庭,发现存在裂缝,这些裂缝向膜中部变窄,显然阻止了水穿过膜。因此,N 和 C 裂缝可能允许本体中的 H+ 进入选择性过滤区域,类似于 Hv1 的报道(见下文)。在 OTOP 通道中,溶剂进入的中央收缩位于保存完好的 Gln-Asn-Tyr (QNY) 三联体附近(图 28.2C),N 或 C 域三联体的突变会消除质子电流(Chen 等人,2019 年;Saotome 等人,2019 年)。在 QNY 三联体的细胞外,两个假定的孔都含有酸性和碱性残基,可能有助于质子传导和/或稳定蛋白质结构。实验证据有力地支持了 C 域盐桥的存在:保守酸性残基的电荷反转 Glu → Arg 突变(Mm OTOP1 中的 E433)消除了 H+ 电流,但当假定的反电荷
相互突变为 Glu (R586E) 时,电流随后恢复 (Saotome 等,2019)。然而,N 域中保守的 Glu 和 Lys 残基的突变没有表现出类似的功能互补,表明 N 和 C 域裂缝之间存在功能不对称 (Saotome 等,2019) (图 28.2D)。位于亚基内裂缝中的高度保守的带电和极性残基的电荷中和突变也会破坏 H+ 电流 (Saotome
等,2019)。尽管 OTOP 中的保守残基是通道功能所必需的,但尚不清楚突变是否会破坏门控或离子渗透,并且机械因果关系
仍有待确定。酸味细胞中的天然质子电流和异源表达的 OTOP 通道电流被细胞外 Zn2+ 抑制 (Chang 等人,2010;Tu 等人,2018)。正如预期的那样,对于由可电离侧链形成的离散 Zn2+ 结合位点 (De La Rosa 等人,2018),ZnCl2 对 OTOP 通道的抑制具有强烈的 pH 依赖性,在酸性细胞外 pH (pHo) 下表现出较低的 (毫摩尔) 效力,而在碱性 pHo 下表现出较高的 (近微摩尔) 效力 (Bushman 等人,2015;Teng 等人,2019)。与 Hv1 (Ramsey 等人,2006 年;De La Rosa 等人,2018 年;Qiu 等人,2016 年) 不同,OTOP 蛋白中构成假定 Zn2+-
结合位点的残基尚未确定。
OTOP 通道的门控机制仍然很大程度上未知,但最近的证据表明,一些通道是酸激活的 (Teng 等人,2022 年)。值得注意的是,小鼠 OTOP1 和 OTOP3
在 pHo 5.5 和 6.0 之间表现出电导率的急剧增加,而 OTOP2 电流
可以在广泛的 pHo 范围内引发,包括对碱性 pH 的反应 (图 28.1B)。
OTOP1 和 OTOP3 通道(而非 OTOP2 通道)受质子正向门控,这一假设得到了进一步证实,因为观察到,在酸性刺激下,OTOP1 和 OTOP3 电流(而非 OTOP2 电流)的激活动力学是 pH 依赖性的。流入 OTOP 通道后积累的细胞内质子是否能够调节 OTOP 通道的门控尚不清楚,并且可能因不同亚型而异。一项研究表明,在持续酸性刺激期间,表达 OTOP1 的味觉细胞中质子电流的衰减率与电流幅度密切相关(Bushman 等人,2015 年)。然而,了解改变的驱动力对 H+
进入的相对贡献以及 pHi
变化对各种 OTOP 通道中电流衰减动力学(即通过脱敏 [Chen
et al., 2019] 或失活)的影响需要进一步研究。
28.2.4 OTOP 通道分布和相关疾病
OTOP 通道在多种组织和细胞类型中表达(Tu et al., 2018),
它们可以特异性和快速地跨细胞膜运输质子。
437 质子通道
OTOP1:除了味觉和前庭系统外,Mm OTOP1 在棕色脂肪组织中高度表达,而在白色脂肪组织中表达水平较低(Tu et al., 2018)。
有趣的是,Otop1 基因表达在肥胖小鼠的白色脂肪组织中上调,并可防止脂肪组织炎症 (Wang 等人,2014)。OTOP1 质子通道活性如何或是否有助于脂肪组织生理学尚不清楚。棕色脂肪组织通过参与无用的线粒体循环产生热量,其中通常为 ATP 合成提供动力的质子积累通过线粒体质子通道 UCP1 分流。因此,OTOP1 的 pH 调节可能对棕色脂肪生理学有重要意义。尽管乳腺和肾上腺、子宫和肥大细胞中的 Otop1 表达水平高到中等,但 OTOP 通道在这些组织中的作用仍未得到研究 (Tu 等人,2018)。 OTOP2 和 OTOP3:Otop2 基因表达已在嗅球、胃和结肠中检测到(Tu 等人,2018 年)。在人类结肠中,Otop2 基因表达存在于共表达钙敏感氯离子通道 BEST4 和饱腹肽尿鸟苷素的一组细胞中(Parikh 等人,2019 年)。表达 OTOP2 的细胞在结直肠肿瘤和炎症性肠综合征中被耗尽,这表明 OTOP2 可能对结直肠疾病有保护作用(Parikh 等人,2019 年)。与这种可能性一致,Otop2 基因被证明受 p53 控制并抑制体外癌细胞增殖(Qu 等人,2019 年)。 OTOP2 蛋白在鸡子宫中表达,
它可能在生物矿化和蛋壳形成中发挥作用 (Sah et al., 2018)。Otop3 基因在表皮和胃肠道中表达;有趣的是,较高的表达水平似乎是结肠癌疾病进展的特征之一 (Yang et al., 2019)。
无脊椎动物 OTOP 通道的分布和功能才刚刚开始被描述。最近的两份报告表明,在果蝇 (Dm) 中,OTOP 样通道 (OtopLa) 参与味觉系统的酸感知 (Ganguly 等人,2021;Mi 等人,2021),而在海胆中,OTOP 通道参与生物矿化,类似于其在脊椎动物内耳中的作用 (Chang 等人,2021)。OTOP 通道在不同物种和其他组织中的作用仍有待发现,但基于对它们的少数研究系统,可以预期它们在酸感知、pH 稳态和生物矿化中发挥重要作用。 28.3 Hv1 通道介绍
在识别编码 Hv1 蛋白的基因之前,已在多种细胞类型(包括蜗牛神经元、肺泡上皮细胞和中性粒细胞)中测量了电压门控质子电流(DeCoursey,2003 年)。2006 年,基于与其他电压传感器 (VS) 域含蛋白的序列相似性,在人类、小鼠和海鞘 (Ci) 基因组中识别了编码 Hv1(Ramsey 等人,2006 年)和 VSOP(Sasaki 等人,2006 年)的基因(Ramsey 等人,2006 年;Sasaki 等人,2006 年)。随后采用了标准化命名法 (HVCN1),但我们更喜欢 Hv1,因为它与这个历史性的 VGC 命名法 (即 Kv1.2) 有明显的关系。尽管在 Hv1 被鉴定之前已经提出了其他候选电压门控 H+ 通道蛋白,但目前的共识是 Hv1 仍然是唯一真实的哺乳动物电压门控 H+ 通道蛋白 (Decoursey, 2012)。
哺乳动物 Hv1 蛋白的异源表达足以重建天然质子选择性和电压依赖性和 pH 依赖性电导 (GvH+) 的标志性生物物理特性 (Ramsey 等人,2006)。小鼠 Hvcn1 等位基因的靶向破坏会消除 Hv1 蛋白表达和 GvH+,表明 Hv1 也是必需的。与早期报告一致(DeCoursey,2003),Hv1 蛋白和 mRNA 在人类和小鼠免疫细胞和组织中高度表达(Ramsey 等人,2006)。最近的研究表明,Hv1 表达更为广泛,现在包括哺乳动物小胶质细胞、乳腺癌细胞系、胰腺 β 细胞、精子和其他细胞(Wu 等人,2012;Pang 等人,2020;Lishko 等人,2010;Decoursey,2012;Bare 等人,2020)。
28.3.1 Hv1 通道的生理作用
Hv1 通道在大多数真核细胞中的主要生理作用是从细胞质中流出酸当量(DeCoursey,2003,2012)。这是电压和 pH 依赖性门控之间的特征耦合的直接结果,导致通道主要在 H+ 运动的驱动力向外定向时打开(Cherny 等人,1995 年;DeCoursey,2003 年)。Hv1 通道最容易理解的作用可能是在吞噬性白细胞的“呼吸爆发”期间,其中持续、高水平的活性氧 (ROS) 产生具有杀菌作用。NADPH 氧化酶产生的 ROS 导致 pHi 急剧下降,随后 pHi 的正常化需要 H+ 通过 Zn2+ 敏感的质子通道流出(DeCoursey,2003 年)。正如预期的那样,如果 Hv1 通道
活性支持 NADPH 氧化酶活性,则 Hv1 缺陷小鼠表现出较低的 ROS 产生和
细菌杀灭率降低 (Ramsey 等人,2009 年;Okochi 等人,2009 年;El Chemaly 等人,2010 年)。
在脑内驻留的小胶质细胞中,Hv1 通道增强小鼠脑缺血和神经毒性模型中的炎症反应 (Wu 等人,2012 年;Tian 等人,2016 年)。小胶质细胞
功能类似于外周巨噬细胞,Hv1 增强神经毒性的作用与其促进 NADPH 氧化酶依赖性 ROS 产生的作用一致 (Wu 等人,2012 年;Tian 等人,2016 年;Ramsey 等人,2009 年)。尽管 GvH+ 的关键生物物理特性
最早是在气道上皮细胞中描述的(DeCoursey,2003),但 Hv1 在肺中的作用仍然知之甚少。最近,培养的支气管上皮细胞的细胞外碱化被证明可以以 Zn2+ 依赖的方式改变 pHi
并有效
阻止 SARS-CoV-2 复制(Davis 等人,2021 年),这表明调节肺中的 Hv1 活性可能对病毒和非病毒炎症性气道疾病都有治疗作用。
新兴证据表明 Hv1 在控制 Ca2+ 信号传导中发挥作用。例如,
H+ 电流降低了 Ca2+ 进入的驱动力并调节中性粒细胞化学趋化性(El Chemaly 等人,2010 年)。在精子中,Hv1 通道导致 pHi
碱化,这是过度活跃和受精所必需的(Lishko 和 Kirichok,2010 年)。Hv1 也是胰腺 β 细胞 Ca2+ 依赖性葡萄糖依赖性胰岛素分泌所必需的,而靶向缺失会导致啮齿动物高血糖症(Pang 等人,2020 年)。
最近对原生生物、真菌、珊瑚和软体动物的 Hv 通道的研究显示出与哺乳动物对应物的有趣差异s 表明这些生物体生理学中具有特殊作用,但这项工作超出了本综述的范围。总之,Hv1 通道广泛存在于真核细胞中,Hv1 似乎对控制 pHi、膜电位和 Ca2+ 信号传导至关重要,但未来的发现可能会扩大依赖 Hv1 通道的生理过程的范围。
28.3.2 Hv1 结构
Hv1 由单个基因编码,Hv1 足以重建 GvH+ 的大多数生物物理特征,这表明辅助蛋白或其他辅因子不是 H+ 通道活性所必需的(Sasaki 等人,2006 年;Ramsey 等人,2006 年)。人类 (Hs) Hv1 的长度为 273
aa:~100 aa 的 N 端结构未知,中间 ~120 aa 形成一个
规范的 VS 结构域,该结构域和功能与 VGC 和电压敏感磷酸酶 (VSP) 中的结构域和功能同源(图 28.3A、B),C 端卷曲螺旋
(CC) 基序自结合以成核通道的二聚四级结构。Hv1
蛋白缺乏 VGC 的典型孔结构域,并且如后所述,质子会渗透通过 VS。
图 28.3
VS 结构域蛋白中 S4 螺旋片段的氨基酸序列比对。 (A) 亚硝化弧菌 DSM 7299 钠通道 (Ab Nav;
ADG92959)、Hs Kv1.2 (NP_004965)、Dm Shaker (CAA29917)、Ci VSP (BAD98733) 和 Hs Hv1 (NP_115745) 的 S3 和 S4 螺旋中氨基酸的多重序列比对显示保守残基和 S1-S4 螺旋的位置 (彩色框);L 是 VGC 中的 S4-S5 连接螺旋或 Hv1 中的假定 S4-CC 连接子,灰色框表示在 mHv1cc 嵌合体中交换的残基 (蛋白质数据库:3WKV)。对角线数字表示 Hs Hv1 中的氨基酸位置。带电和极性残基被着色,保守的 S4 门控电荷在 S4 下方突出显示。 (B) 假定的静止状态 (Hv1 F;
Randolph 等人,2016) 和激活状态 (Hv1 J) Hv1 VS 域模型结构被叠加以说明 S4 位置的差异。 (C) 从 Hv1 J MD 轨迹拍摄的快照显示水分子深入渗透到 Hv1 VS 中央缝隙中。 在图 B 和 C 中,螺旋显示为彩色丝带,选定的侧链以甘草表示显示并标记。
440 离子通道教科书第二卷
尽管生化研究表明功能性 Hv1 通道最有可能形成同型二聚体四级结构 (Koch 等人,2008 年;Lee 等人,2008 年;Tombola 等人,2008 年),但结构研究尚未完全解决亚基间界面的结构 (Li 等人,2015 年)。CC 截断 (Hv1-ΔC) 减弱二聚化但不损害功能,这表明 Hv1 通道可以作为单体发挥作用 (Koch 等人,2008 年;Lee 等人,2008 年;Tombola 等人,2008 年)。然而,Hv1-ΔC 蛋白在蛋白脂质体中确实会二聚化(Kd ≈ 3 µM)(Li 等,2015),并且也可能在细胞膜中自缔合,这增加了 Hv1-ΔC 二聚体占通常归因于单体通道的部分或全部 H+ 电流的可能性(Koch 等,2008;Gonzalez 等,2010;Qiu 等,2013;Gonzalez 等,2013;Chamberlin 等,2014;Carmona 等,2018;Tombola 等,2008,Musset 等,2010)。尽管全长(二聚体)Hv1 蛋白的高分辨率结构仍然难以捉摸,但实验确定的 VS(蛋白质数据库:3WKV、5OQK)和 CC 结构域
(蛋白质数据库:3A2A、3VMX、3VMY、3VYI、3VN0)结构代表了一个起点。
针对包含 VSP(S2–S3 环;图 28.3A)序列和来自不相关蛋白质(GCN4;蛋白质数据库:3WKV)的 CC 的嵌合蛋白,已解析出唯一的 X 射线结构(蛋白质数据库:3WKV)(Takeshita 等人,2014 年);还报道了 NMR 确定的推定 Hv1 VS 结构集合(蛋白质数据库:5OQK)(Bayrhuber 等人,2019 年)。然而,这些结构的生理相关性尚未牢固确立,某些特征(即位于无溶剂口袋内的功能关键可电离侧链)难以与实验证据相一致;因此需要进一步研究以阐明体内蛋白质构象。
分子建模、MD 模拟、诱变和电压钳电生理学的结合推动了理解 Hv1 机制结构基础的大部分进展。大多数计算机模拟 Hv1 VS 域模型结构
基于相关的 VGC 或 VSP 结构(图 28.3B、C)(Ramsey 等人,2010 年;Li 等人,2015 年;
Geragotelis 等人,2020 年;Randolph 等人,2016 年;De La Rosa 等人,2018 年),但计算机模拟模型缺少 N 端 ~100 aa,因此必然不完整。长时间尺度模拟(Geragotelis 等人,2020 年)以及基于模型结构的假设的实验测试,即使在没有明确的实验结构的情况下也应该有助于推动进展结构。一个令人鼓舞的趋势是开发了可以先验预测实验结果的 Hv1 模型 (De La Rosa 等人,2018)。
尽管目前缺乏万无一失的结构支持,但一系列证据支持 Hv1 通道的关键结构特征:(1) Hv1 包含一个沙漏形的溶剂可及中央裂缝,该裂缝在 VS 静息状态(即关闭的 H+ 通道)和激活状态(即开放的 H+ 通道)构象中,最狭窄的地方是 S1 Asp(Hs Hv1 中的 D112)和 S2 Phe(Hs Hv1 中的 F150)附近 (Ramsey 等人,2010;Kulleperuma 等人,2013;Geragotelis 等人,2020)(图 28.3B)。 (2)D112 和一个或多个 S4 Arg(Hs Hv1 中的 R208/R2 和或
R211/R3)侧链,以及蛋白质相关水分子,是 Hv1 通道特有的精细 H+ 选择性所必需的(Musset 等,2011;Berger 和 Isacoff,2011;Randolph 等,2016)。 (3)与 OTOP(见前文)相反,保守可电离残基的中和突变对电压依赖性门控有很大影响,但不会消除 Hv1 通道中的电流(Musset 等,2011;Berger 和 Isacoff,2011;Ramsey 等,2010)。总体而言,现有数据似乎与 Hv1 中充满溶剂的中央裂缝介导 H+
转移的假设最为一致,但细节仍有待积极研究和辩论(Bennett 和 Ramsey,2017 年;DeCoursey,2017 年)。
441 质子通道
28.3.3 Hv1 通道门控
与 VGC 一样,Hv1 电流激活的幅度和动力学强烈依赖于电压,但 Hv1 通道往往相对较慢地打开(激活时间常数
τ ACT,通常在 Hs Hv1 的数百毫秒范围内)(Vargas 等人,2012 年;DeCoursey,2003 年;Cherny 等人,1995 年;Ramsey 等人,2006 年;Sasaki 等人,2006 年)(图 28.4A)。
此外,与其他 VGC 一样,Hv1 会产生瞬态“门控电流”,这种电流与三个高度保守的 S4 Arg“门控电荷”残基(Hs Hv1 中的 R208–R211)在跨膜电场中的移动有关(Vargas 等人,2012 年;De
La Rosa 和 Ramsey,2018 年;Carmona 等人,2018 年)(图 28.5D)。 S4 门控电荷和预测的酸性“反电荷”残基处的中和突变通常会导致 POPEN-V 向预期方向移动,这表明与 VGC 一样,Hv1 中的 S4 门控电荷链很可能形成具有反电荷侧链的状态依赖性盐桥,这些侧链被组织成细胞外和细胞内的库仑网络 (De La Rosa 等人,2018 年;Randolph 等人,2016 年;Ramsey 等人,2010 年;Geragotelis 等人,2020 年;Vargas 等人,2012 年)。
与 VS 结构和功能高度同源的假设一致,R1H 突变也会在 Hv1 和 VGC 中产生类似的静息态 H+ 电流(图 28.5A-C)(Randolph 等人,2016 年)。
Hv1 还表现出大多数其他 VS 结构域蛋白所不具备的功能和结构特性。首先,Hv1 不同寻常之处在于在 R4 位置(Hs Hv1 中的 N214;图 28.3A)缺少碱性侧链;在此引入 Arg 或 Lys 会产生突变通道,这些通道会产生较小的外向电流(ISTEP),但会保留在野生型 (WT) Hv1 中看到的强大的内向瞬时“尾”电流(ITAIL)(Ramsey 等人,2010 年;Randolph 等人,2016 年;Sakata 等人,2010 年)(图 28.4A)。 Hv1
N214R/K 突变通道的行为已被解释为反映了引入的 Arg 或 Lys 相关的阳离子电荷对 H+ 渗透途径的电压依赖性阻断,
这表明 VGC 和 VSP 中的 R4 有助于防止 H+ 通过处于活化态构象的 VS“泄漏” (Randolph 等人,2016)。在 Hs Hv1 R1H 的背景下,
N214R 选择性地消除了固有的活化态 H+ 电流,而不会影响
静息态电流(图 28.5B、C)(Randolph 等人,2016)。因此,N214 侧链
可能位于 Hv1 VS 活化状态构象中 F150 和疏水收缩附近(图 28.3C)(Randolph 等人,2016 年)。
Hv1 通道的一个定义特征是它们对 pH 梯度变化的敏感性
(ΔpH = pHo – pHi
),这会导致沿电压轴的表观开放概率 (POPEN) 曲线位置发生剧烈(~40 mV/pH 单位)偏移(图 28.4B、D)(Cherny
等人,1995 年;Ramsey 等人,2006 年;Sasaki 等人,2006 年;Ramsey 等人,2010 年;De La Rosa 和
Ramsey,2018 年)。有趣的是,pHi
酸化产生的 VTHR 偏移量与 pHo 酸化相同,但方向相反,这导致人们假设 pH 梯度(ΔpH = pHo – pHi
),而不是绝对细胞内或细胞外 pH,是 Hv1 门控的关键能量决定因素(Cherny 等人,1995 年;DeCoursey,2003 年)。或者,单独的 pHi
和 pHo 传感器可以变构调节常见的电压敏感转变,而明显的 ΔpH 依赖性是 s 的新兴特性系统 (Rangel-Yescas
et al., 2021)。pH 依赖性的门控电荷运动变化 (图 28.5F) 表明 ΔpH
敏感性是 Hv1 VS 域所固有的 (De La Rosa 和 Ramsey, 2018),但对候选 pH 感应残基的中和诱变筛选表明 pHo 敏感性在突变的 Hv1 通道中完好无损 (图 28.4D) (Ramsey 等人,2010)。VGC 和 VSP 中 Hv1 样
ΔpH 敏感性的缺失 (Vargas 等人,2012) 仍然是个谜。
442 离子通道教科书第二卷
尽管 Hv1 中潜在的 pH 感应机制仍不太清楚,但最近的研究反映了对这一基本谜团的理解取得了进展。
细胞外 Zn2+ 和 H+ 均作为 Hv1 中电压依赖性门控的变构调节剂起作用,但它们对 POPEN-V 的位置具有相反的影响,并且在酸性 pHo 下 Zn2+ 效力较低,这表明 Zn2+ 和 H+ 可能竞争一个共同的结合位点 (Cherny and DeCoursey, 1999; De La Rosa et al., 2018, DeCoursey, 2003)。中和 Hs Hv1 中的两个细胞外 His 残基 (H140 和 H193;图 28.3A) 足以消除 Hv1 门控的强效 Zn2+ 依赖性调节,但 H140A-H193A 通道与 WT Hv1 一样,强烈依赖 pHo (Ramsey et al., 2006, De La Rosa et al., 2018)。
显然,形成细胞外 pH 传感器需要其他残基,而最近发现造礁珊瑚中的 Hv1 直系同源物表现出降低的 pHo 敏感性
(Rangel-Yescas 等人,2021 年)表明,可以更好地理解假定的细胞外 pH 传感器是如何构建的。假定的细胞内 pH 传感器的性质同样受到 Hs Hv1 H168A 中报道的 pHi 敏感性降低的启发,这
受到了蜗牛 (Helisoma trivolvis, Ht) Hv1 序列差异的启发 (Cherny 等人,2018 年)。
图 28.4
WT 和突变 Hv1 通道中电压和 pH 依赖的离子电流门控。 (A) 在对称 pH 6.5 下,通过连续 10 mV 去极化诱发表达 Hs Hv1 的 HEK-293 细胞中的全细胞电流。
施加电压步骤 (ISTEP) 结束时的稳态电流与连续电压步骤 (ITAIL) 后在 -80 mV 处测量的瞬态内向“尾”电流不同。 (B) 在 pHo 7.5 (蓝色)、6.5 (黑色) 或 5.5 (红色) 下测量的电流激活 (ISTEP,空心符号;-ITAIL,
实心符号) 偏移 ~40 mV/pH 单位。 (C) 激活 Hv1 通道的表观阈值 (VTHR) 经验性地确定为足以引起大于背景 (红色轨迹) 的尾电流 (插图中放大) 的最小去极化。
“选择性过滤器”残基 D112 的中和不会阻止离子传导,但电流幅度
小于 WT Hv1。(D)候选 pH 感应残基被中和的突变通道保留了
对 pHo 变化的
WT 样敏感性。(面板 A 和 B 中的数据来自 Ramsey 等人,2006 年,有
更改。C 和 D 中的数据来自 Ramsey 等人,2010 年,有更改。)
443 质子通道
不幸的是,将 Hs Hv1 中的 H168 移植到 Ht Hv1 中的等效位置
未能恢复人类通道的 pHi 敏感性,表明 pHi 感应机制的其他决定因素仍有待确定(Cherny 等人,2018 年)。综合起来,现有数据表明,Hv1 中假设的 pHi
和 pHo 传感器
不太可能是单质子的 H+ 结合位点,而可能是由含有“离域”质子的
可电离侧链网络形成。
28.3.4 Hv1 中的离子渗透性和选择性
与 OTOP 通道一样,天然和表达的 Hv1 通道似乎对 H+ 的选择性强于其他单价阳离子(DeCoursey,2003 年;Ramsey 等人,2006 年;Sasaki 等人,2006 年;Musset 等人,2011 年;Berger 和 Isacoff,2011 年)。关于质子选择性,目前已提出了两种相互竞争(但并不互相排斥)的假设:(1)蛋白质内的“水线”通过 Grotthuss 型 H+ 跳跃机制为 H+ 迁移通过 VS 域(图 28.3C)创建了一条“水性”途径,该机制不需要明确电离侧链(Ramsey 等人,2010 年;Randolph 等人,2016 年;Bennett 和 Ramsey,2017 年)。
(2)渗透质子通过连续的“穿梭”穿过中央缝隙收缩
图 28.5
Hv1 通道中的静息态和门控电流。(A)Hs Hv1 中的 R205H(R1H)在负电位下产生静息态电流,而 WT Hv1 中没有观察到这种电流。 (B) 将 N214R 掺入 R205H 的背景中会消除 WT Hv1 中看到的固有激活状态电流,但不会改变静息状态电流。 (C)
R205H(灰色圆圈)和 R205-N214R(半实圆圈)的 ISTEP-V 关系表明,R205H 表现出双整流,而 R205-N214R 是纯内向整流器。 (D) 双突变体中的瞬态“开启”门控电流,表现出外向电流阻断(N214R)和快速激活动力学(W207A)以及在电压步进至一定电位范围后,在 +100 mV 处重新测量;门控电流的积分产生门控电荷 (QON)。 (E) 归一化的 QON–V 和 ITAIL–V 关系表明,门控电荷运动和通道开放在电压轴上是分开的。 (F) 将 pHo 从 5.5(红色符号)更改为 6.5(黑色符号)会使 QON–V(圆圈)和 ITAIL–V(方块)关系的平均中点移动 ~40 mV/pH 单位(虚线)。 (图 A–C 中的数据来自 Randolph 等人,2016 年。图 D–F 中的数据来自 De La Rosa 和 Ramsey,2018 年,并进行了更改。)
444 离子通道教科书第二卷
在保守的 S1 Asp(Hs Hv1 中的 D112;图 28.3A)处进行电离/去离子化循环(Musset 等人,2011 年;Dudev 等人,2015 年;DeCoursey,2017 年)。支持和反对每个假设的直接论据已在其他地方总结(Bennett 和 Ramsey,2017 年;DeCoursey,2017 年)。简而言之,这两种机制在理论上都是 H+ 特异性的,因为质子运动需要形成氢键(H 键),并且只有质子才能通过 H 键重排进行转移。 OTOP 结构中不存在连续的水合离子移动途径(见前文),这表明尽管它们的序列和结构不同,但类似的机制可能在起作用。
对假设 2 的实验检验表明,Hv1 中可电离侧链的中和突变未能按预期消除测量电流(图 28.4C),这表明 H+ 转移的替代(即“水性”)机制是更简洁的数据解释(Ramsey 等人,2010 年)。随后表明,H+ 选择性(但不是 ΔpH 敏感性;图 28.4D;Ramsey 等人,2010 年)在 D112 突变 Hs Hv1 通道中受到侵蚀,表明该残基是 Hv1“选择性过滤器”结构的一部分(Musset 等人,2011 年)。与 WT Hv1 通道不同,D112X 突变体对阴离子具有渗透性,这增加了 OH–(而不是 H+)和/或其他阴离子携带测量电流的可能性(Musset 等人,2011 年)。不幸的是,这一假设很难使用电压钳方法进一步检验,因为各种 H+ 等效电荷载体(即 H+、OH– 和 H3O+)都具有相同的能斯特平衡电位。与所有可用实验数据一致的一种简约解释是,D112 突变体与 WT Hv1 通道一样,保留了在水线中介导 H+ 转移的能力;然而,与 WT 通道不同,D112X 突变体还允许溶液离子(如 Cl–
(以及潜在的 OH– 和/或 H3O+))通过改变的中央缝隙结构扩散(Bennett 和 Ramsey,2017 年)。如果 (a) 水取代了突变的 Asp 侧链,并且 (b) D112 在体内具有足够低的 pKa,以至于它几乎总是阴离子并且静电排斥进入中央缝隙的阴离子,从而去除该静电屏障使阴离子渗透,则通过突变的 Hv1 孔进行非选择性扩散是有意义的。 D185 位于 D112 附近,在 Hv1 VS 域中选择性保守(图 28.3C),中和作用显然不会像 D112 突变体那样削弱 H+ 选择性(Musset 等人,2011 年),这表明尽管突变导致结构差异,但水性机制可能具有足够的可塑性以支持快速和选择性的质子转移,这与实验数据一致,表明 Hv1 中的各种中和突变仍然具有功能性(图 28.4D)(Ramsey 等人,2010 年)。考虑到 Hv1 蛋白质结构的热波动可以在皮秒时间尺度上产生电子结构的动态变化(其中 H 键断裂和重新形成,但比电压依赖性门控事件快几个数量级),因此,有理由假设 WT Hv1 可能利用一组分子相似但电子不同的水结构进行 H+ 转移。
几个研究小组已经使用间接(即电流波动分析)方法估计了电压门控 H+ 通道 (γH
+) 的单位电导;尽管报告的 γH
+
值不同,但研究一致认为,单位 H+ 电流是已知通道中最小的电流之一(Cherny 等人,2003 年)。无法直接测量单通道电流的原因在于,即使在完整细胞的电压钳实验中通常会导致实验失败的 pH 值(即 pH 4.0 或 [H+] = 0.1 mM),与大多数 VGC 中用于单通道记录的条件相比,渗透离子的浓度仍然相对较小。考虑到“通用溶剂”中 H+ 的奇特化学性质,推测大自然可能已经进化出独特而具体的 H+ 选择性跨膜转移机制,而我们对其他离子通道机制的现有知识对此知之甚少,这很有趣。
445 质子通道
28.3.5 Hv1 药理学
Zn2+ 是已知的最佳配体Hv1 通道。如前所述,细胞外
ZnCl2 导致表观 POPEN-V 关系向正电压方向发生浓度和 pHo 依赖性转变;在 pHo 为中性时,Zn2+ 效力较高(微摩尔)(Cherny 和
DeCoursey,1999 年;Ramsey 等人,2006 年;De La Rosa 等人,2018 年)。在 Hs Hv1 H140A-H193 中,Zn2+ 效力降低约 3 个数量级至低毫摩尔范围(Ramsey 等人,2006 年)。结合的 Zn2+ 很可能也与至少一个酸性侧链(即 E119
或 D185)和一个水氧原子配体(De La Rosa 等人,2018 年)。例如,Zn2+ 效力在 E119A 中降低,在 E119H 中增强,并且与 E119H-H140A-H193A 中的 WT Hv1 相似,
这表明 (a) E119 处于与 Zn2+ 相互作用的理想位置,并且 (b) 替代二价金属配位几何结构(即在 E119H 中)显然也能够以高表观亲和力结合
Zn2+。
Zn2+ 结合改变 Hv1 中电压依赖性门控的机制仍未完全了解。已知表观 Zn2+ 效力受细胞外 (E119、D123、H140、D185 和 H193) 和细胞内 (E153) 残基突变的调节 (De La Rosa 等人,2018 年;Ramsey 等人,2006 年;Qiu 等人,2016 年);C 端截断产生额外的动力学复杂性,目前尚不完全清楚 (Musset、Smith 等人,2010 年),表明 Hv1 中存在长程变构偶联机制。与 ΔpH 变化类似,细胞内 Zn2+ 导致 POPEN-V 关系向与细胞外 Zn2+ 相反的方向 (负向,使其成为正变构调节剂或 PAM) 移动 (Cherny 和 DeCoursey,1999 年)。关于细胞内 Zn2+ 效应的结构基础知之甚少。最近有报道称,白蛋白可作为 Hv1 PAM 发挥作用 (Zhao, Dai, et al., 2021),而 PAM 可能有助于阐明结构,与白蛋白竞争的选择性配体可能有效地作为 NAM 发挥作用。
除了细胞外 Zn2+ 外,Hv1 NAM 还包括几种小有机分子,其中一些似乎模仿 Arg 的胍离子结合并阻断 Hv1 孔 (Hong et al., 2014; Geragotelis et al., 2020; Zhao, Hong, et al., 2021) 和肽毒素 Corza-6 (C6) (Zhao et al., 2018)。鉴于 Hv1 可能参与人类疾病相关病理,人们对开发强效、Hv1 选择性和药物样 NAM 有着浓厚的兴趣。然而,Hv1 与其他 VS 结构域蛋白之间的结构和功能相似性表明有必要谨慎行事。总之,在我们知道 Hv1 配体是否能够发挥其作为神经炎症、哮喘和其他主要人类疾病的治疗剂的潜力之前,还有很多工作要做。
28.3.6 Hv1 调节
一项研究报告称,T29 处 Hs
Hv1 的蛋白激酶 A (PKA) 依赖性磷酸化会导致 VTHR 发生负向转变,并增加活化动力学速度 (Musset、Capasso 等人,2010 年)。由于 Hv1 N 端的结构仍然未知,T29 磷酸化调节门控的机制仍然未知。尽管如此,由 T29 磷酸化 (Musset, Capasso, et al., 2010)、细胞内酸化(和/或细胞外碱化)(Cherny et al., 1995; DeCoursey, 2003) 或细胞外白蛋白 (Zhao,
Dai, et al., 2021) 引起的表观 POPEN-V 关系的负向转变可被视为 Hv1 通道调节的生理相关机制,因为它们可能会增加细胞静息膜电位下的通道活性。未来研究将确定 pHi 和 pHo 传感的结构基础以及配体结合和电压传感器激活之间的变构机制,这将有助于了解体内控制 Hv1 通道活性的机制。
446 离子通道教科书第二卷
29
P2X 受体
Kate Dunning 和 Thomas Grutter
29.1 简介
P2X 受体是三聚体配体门控离子通道 (LGIC) 家族,在被细胞外 ATP 激活后形成非选择性阳离子通透孔。与其他 LGIC(如 cys-loop 或离子型谷氨酸受体家族)相比,P2X 受体的历史相对较短,嘌呤能信号的概念最早由 Burnstock 在 20 世纪 70 年代提出,而它们的分子鉴定直到 20 世纪 90 年代才出现(North,2002 年)。
很快,P2X 家族的所有七个成员 P2X1–P2X7 都在哺乳动物中被鉴定出来。P2X 受体也存在于其他真核生物中,包括无脊椎动物和变形虫,如盘基网柄菌。在第一次克隆 15 年后,获得了 P2X 成员的 X 射线结构,揭示了独特的分子结构(Kawate 等人,2009 年)。尽管在氨基酸序列和结构方面有一定程度的相似性,但这些亚型的功能特征、药理学和生理作用差异很大,并且在本章中可以看到。
29.2 生理作用
由于 P2X 受体在细胞中的分布范围很广,因此其生理作用也多种多样,并且因亚型和细胞定位的不同而不同。
P2X 受体最深入研究的生理作用之一是神经调节。例如,P2X2、P2X4 和 P2X7 与下丘脑大细胞神经元的神经调节过程有关。通过无数的细胞信号传导过程,突触外 P2X 受体被 ATP 激活,导致 Ca2+ 流入,进而导致磷脂酰肌醇 3-激酶的激活(图 29.1)。细胞外 ATP 有多种来源,包括神经胶质细胞释放的 ATP。对于星形胶质细胞,已提出了多种机制,包括通过离子通道(例如阴离子通道和连接蛋白)的参与,以囊泡和非囊泡形式释放 ATP(Boué-Grabot 和 Pankratov,2017 年)。这一系列事件的总体结果是促进 AMPA 受体插入突触后树突棘。因此,这种 P2X 依赖性调节网络可增强突触强度(Boué-Grabot 和 Pankratov,2017 年)。与 Ca2+ 信号传导相关的另一个生理作用是 P2X1 在平滑肌细胞收缩中的作用,其激活会导致钙快速内流和膜去极化(Ralevic,2012 年)。在这些条件下,电压门控 Ca2+ 通道
被激活,进一步增加细胞内钙含量,最终导致钙调蛋白依赖性肌球蛋白轻链激酶的动员,肌球蛋白轻链激酶是肌肉收缩所需的肌球蛋白-肌动蛋白棘轮机制的关键组成部分。
最近,P2X4 在角质形成细胞衍生的机械感觉转导中的作用已被阐明 (Moehring 等人,2018)。角质形成细胞是位于表皮最外层的皮肤细胞,经证实在机械刺激后会释放 ATP,从而导致附近神经元上 P2X4 受体的随后激活,并将无害和有害的触摸传递到脊髓。
图 29.1
P2X 受体的神经调节。突触前来源的去甲肾上腺素 (NA) 和谷氨酸的释放
会导致星形胶质细胞中肌醇 1,4,5-三磷酸 (IP3) 介导的 Ca2+ 释放,随后被
mGluR (谷氨酸) 和 α1-肾上腺素 (NA) 受体识别。反过来,这会触发神经胶质细胞释放 ATP,ATP 作用于突触后树突棘中的
P2X 受体,导致钙流入,激活磷脂酰肌醇 3-激酶 (PI3K) 并随后促进突触后 AMPA 插入。 (根据 Khakh 和 North,2012 年复制。版权所有 2012,经 Elsevier 许可。部分图片使用 Servier Medical Art 中的图片绘制。Servier 的 Servier Medical Art 已获得 Creative Commons Attribution 3.0 未移植许可证的许可。https://creativecommons.org/licenses/by/3.0/。)451 P2X 受体29.3 亚基多样性和基本结构组织就多聚体组织而言,七种 P2X 亚型因所讨论的特定亚型而异(North,2002 年)。例如,P2X6 是唯一无法在重组条件下形成同源三聚体结构的变体,需要与 P2X2 或 P2X4 进行异聚化才能实现功能性表达。研究表明,许多异源 P2X 受体
也能够在异源系统中形成,但在天然组织中,P2X1/5 和 P2X2/3
是最有说服力的证据 (Saul 等人,2013)。
尽管许多使用互补生化、荧光和显微镜技术的研究提供了关键的结构见解,但 P2X 结构组织的最终确认是在 2009 年第一个晶体结构的解析之后,即在 apo 状态下截短的斑马鱼 P2X4 构建体 (Kawate 等人,2009)。
在这一里程碑式壮举之后的十年中,一系列 P2X 结构已被解析,从而可以深入了解几种亚型的结构细节,这些亚型处于不同的变位构象状态,并与激动剂、拮抗剂和调节剂复合。
这些结构证实了三聚体的结构,由三个高度交织的单体单元以杯状排列形成(图 29.2A)。N 端和 C 端位于细胞内,在 ATP 结合的开放状态下,通过三个单体之间广泛的域交换相互作用形成细胞质帽。这种 beta 片层结构被认为可以稳定开放状态,有效地将其锁定到位。相反,在 apo 状态下似乎不存在该帽:在人类 P2X3(hP2X3)的 apo 结构中未观察到该域,表明这些区域在静息状态下是无序的。与这些末端相连的是两个跨膜 (TM) 螺旋结构域,称为 TM1 和 TM2。离子传导孔由 TM2 螺旋排列来自三个亚基。最后,连接 TM1 和 TM2 的胞外域是一个广泛的结构,由各种二硫键固定,具有 ATP 结合位点,位于两个单体的界面处,形成“下颚”状结构(图 29.2A)。每个单体亚基本身都被比作一只跳跃的海豚,鳍足、头部和背鳍位于细胞外域,而跨膜域则代表尾鳍(图 29.2B)。
这种结构在 P2X 家族成员中大部分都保持高度相似,除了由于氨基酸序列变化而导致的细微结构差异,从而产生改变或独特的药理学结合口袋。这方面的例子包括 ATP 结合位点本身,以及在 P2X7 的细胞外域中发现的独特变构结合位点。与该通用架构最显著的差异是 P2X7 亚型,其低温电子显微镜结构揭示了细胞内结构域内的许多关键差异(图 29.2C)(McCarthy 等人,2019 年)。虽然与 hP2X3 类似,胞质帽在开放状态结构中可见,但它在 apo 状态下也可见,因此似乎作为该亚型中的永久结构支架存在。在这个帽子里,存在一个由 18 个富含半胱氨酸残基的氨基酸组成的独特基序,称为 Ccys 锚。Ccys 锚具有至少六个棕榈酰化残基,其棕榈酰基延伸到膜双层中,将胞质帽锚定到位,这种机制被认为是 P2X7 非脱敏行为的起源。 P2X7 亚型的最后一个主要结构差异在于其细长的 C 末端结构域,该结构域形成独特折叠的“压舱”结构域,悬挂在细胞质帽下方。在压舱折叠内,尚未鉴定出结构同源物,存在两个结合基序:双核锌位点和 GDP 结合位点(图 29.2C)。压舱物的生理作用仍有待阐明,无疑将成为未来研究的重点。
452 离子通道教科书第二卷
29.4 门控
激动剂的应用引起的电流在 P2X 亚型之间有所不同(图 29.3A)。为了解释这些差异,有人假设 P2X 受体能够以动态、可逆的方式进入多种变构构象状态(图 29.3B)。已经通过多种技术在分子水平上广泛研究了从静止的 apo 状态到 ATP 结合开放状态的门控转换。将封闭的 apo 状态的解析结构与 ATP 结合开放状态的解析结构进行比较,也极大地促进了从封闭到开放通道状态的转换中涉及的分子运动的推断。这些运动可以大致通过四步描述
图 29.2
P2X 受体的结构。 (A) hP2X3 (Mansoor 等人,2016) 的晶体结构,其三聚体形式
处于 ATP 结合开放状态。ATP 在其结合位点以红色球体显示。蛋白质数据库:5SVK。 (B)
hP2X3 的单体亚基处于 apo 封闭状态,根据跳跃的海豚类比进行标记。两个跨膜结构域 TM1 和 TM2 也被标记。(C)全长 rP2X7 的低温电子显微镜解析结构(McCarthy 等人,2019),此处显示为 apo 闭合状态。Ccys 锚内的棕榈酰基团显示为红色棒。虚线矩形内显示了压载区域的放大图像,其中可见 GDP 分子和两个 Zn2+ 离子。蛋白质数据库:6U9V。灰线表示膜双层外(外)和内(内)小叶的边界。
453 P2X 受体
机制(Chataigneau 等人,2013):(1)ATP 的结合诱导结合“颚”的收紧,使相邻亚基的头部结构域和背鳍接近; (2) 颌闭合导致背鳍向上运动;(3) 背鳍运动反过来又导致下身 β 片层向外弯曲;以及
图 29.3
P2X 受体的门控。(A) 表达 rP2X2 (左)、
rP2X3 (中) 或 rP2X7 (右) 受体的 HEK293 细胞的全细胞电生理学痕迹,用激动剂 (P2X2 和 P2X3 的情况下为 100 µM ATP,
P2X7 的情况下为 10 µM BzATP) 刺激。请注意,较长时间应用 ATP (例如 20 秒) 会导致 P2X2 脱敏,并促进/敏化 P2X7 电流。 (B) P2X 门控循环,以 hP2X3 的晶体结构表示,处于 apo、静息状态(蓝色;蛋白质数据库:5SVJ)、ATP 结合开放状态(黄色;蛋白质数据库:5SVK)和 ATP 结合脱敏状态(绿色;蛋白质数据库:5SVL)(Mansoor 等人,2016 年)。ATP 结合后(显示为红色球体),门控过程开始:构象变化导致阳离子通透性孔的打开以及细胞质帽的形成。从这种开放状态,某些亚型可能达到脱敏状态,尽管存在结合 ATP,但通道仍处于关闭状态。这些变构构象状态之间的循环是动态的。
454 离子通道教科书第二卷
(4) 与 TM 域耦合,下体的这种向外弯曲导致 TM 螺旋以被描述为“虹膜”状的运动旋转,导致打开约 5 Å 的离子通透性孔。这种运动级联发生在毫秒时间尺度上,并且是所有 P2X 受体所共有的。根据所讨论的亚型,激活所需的 ATP 浓度从纳摩尔到毫摩尔不等。 2016 年,hP2X3 在开放状态下的结构被解析,其中
可见的细胞内结构域比以前更多,这表明
细胞质帽的形成也发生在门控过程期间或之后不久(Mansoor 等人,2016 年)。对精确的分子运动和帽形成动力学的进一步研究将使我们能够更全面地了解 P2X 门控循环。
除了在关闭和打开通道状态之间的门控转换之外,几种
亚型变体能够进入第三种变构构象状态,即脱敏
状态,在此状态下,尽管 ATP 持续固定,但通道仍处于关闭状态。脱敏作用在亚型变体之间差异很大,P2X1 和 P2X3 表现出快速脱敏动力学(不到一秒内),而 P2X2 和 P2X4 脱敏速度要慢得多(几十秒)(North,2002)。与此形成鲜明对比的是,P2X7 亚型表现出相反的行为,以“敏化”或促进的形式 - 胆固醇依赖性、ATP 诱发电流的逐渐增加(Robinson 等人,2014 年)。图 29.3A 显示了 P2X2、P2X3 和 P2X7 亚型的代表性轨迹,说明了它们对激动剂的反应差异。 29.5 离子通透性
P2X 受体是非选择性阳离子通道,允许 Na+ 和 Ca2+ 进入细胞,并允许 K+ 沿其电化学梯度流出 (Samways 等人,2014)。已知 P2X5 亚型除了阳离子外,还对氯离子具有通透性(人类 P2X5 [hP2X5] 中 Cl– 对 Na+ 的相对通透性 PCl–/PNa+ = 0.5)。
在关闭状态下,hP2X3 的通道门由 Ile-323、Val-326 和 Thr-330 形成,它们形成的收缩太窄,无法让水合 Na+ 通过 (Mansoor 等人,2016)(图 29.4A)。然而,在开放状态下,由于 Ile-323 和 Val-326 向外旋转,这种收缩消失,从而形成一条连续的离子传导通路,该通路足够宽(~3 Å),允许部分水合阳离子通过(图 29.4B)。Thr-330 占据传导通路中最窄的点,在离子选择性过滤器中起关键作用。在大鼠 P2X2 (rP2X2)的同源位点处将该残基突变为赖氨酸,可将离子选择性从阳离子转换为阴离子(Browne 等人,2011 年)。然而,尽管 hP2X5 在这个同源位置上具有丙氨酸残基,但它显示出显著的 Cl- 渗透性。因此,对阳离子偏好的分子基础尚未完全了解。这些离子通过位于跨膜域上方的三个孔洞以横向方式进入通道,然后沿开放通道的三重对称轴向下传输(图 29.4B)。 hP2X3 的结构(胞质帽可见)提供了有关离子渗透途径的更多信息,表明三重对称轴正下方的通道口太窄,无法让离子进入细胞溶胶。
相反,这最有可能通过位于胞质帽正上方的三个胞质孔洞发生(Mansoor 等人,2016)(图 29.4B)。
除了较小的金属阳离子通透性外,一些 P2X 受体(P2X2、P2X4 和
P2X7)还可通透较大尺寸的有机阳离子,包括 N-甲基-D-葡糖胺 (NMDG+)、亚精胺和荧光有机染料(如 YO-PRO-1)。就 P2X7 而言,
455 P2X 受体
这种大分子通透性延伸至分子量小于 900 Da 的阳离子和阴离子物种,在不同细胞类型和实验条件之间观察到高度可变性(Ugur 和 Ugur,2019 年)。这种特性是 P2X7 所独有的,
被定义为所谓的 P2X7“大孔”。P2X 大分子通透性背后的分子机制仍然难以捉摸,在文献中存在很大争议(Peverini 等人,2018 年)。长期以来,关于这种大阳离子流起源的首选假设是进一步的变构构象状态,其特征是 P2X 孔逐渐扩张。这主要得到了电生理学实验的支持,这些实验表明g 大阳离子的渗透性随时间逐渐增加。然而,Li 等人(2015 年)的一项重要研究表明,这种渗透性的逐渐变化可能是人为的,是由于在双离子实验条件下发生了离子耗竭效应。这项研究和其他研究已经确定,一些较大的有机阳离子(如 NMDG+ 和亚精胺)的流动可能与小金属阳离子在相同的毫秒时间尺度上发生,但由于显著的构象和方向限制,其流动速率会降低(Harkat 等人,2017 年)。
另一个历史上著名的假设假设了次级“附属”通道的参与。在这种情况下,较小的物种(如金属阳离子)将通过 P2X 孔,而较大分子量的物种将通过与 P2X 功能耦合的次级通道。这种情景在 P2X7 大孔的情况下尤其有吸引力,其开放通道直径为 5 Å,似乎与渗透大孔的大分子量物种高度不相容。尽管 Pannexin-1 最初被确定为候选者,但后续文献对其含义提出了质疑(Kaczmarek-Hájek 等人,2012 年)。最近使用截短形式的熊猫 P2X7 受体重组成脂质体的研究也证明,376 Da 的阳离子染料 YO-PRO-1 能够通过内在的 P2X7 孔(Karasawa 等人,2017 年)。然而,对于大于此的分子,渗透途径仍不清楚,尽管有人提出了离子通道/爬行酶的 anoctamin 家族的作用(Kopp 等人,2019 年;Dunning 等人,2021 年)。这个问题无疑将继续成为 P2X 研究的重点。
图 29.4
P2X 受体的离子渗透。 (A) apo 闭合状态下 hP2X3 的晶体结构(蛋白质数据库:5SVJ)。 (B) ATP 结合开放状态下 hP2X3 的晶体结构(蛋白质数据库:5SVK)。标出了孔衬残基 Ile-323、Val-326 和 Thr-330;细胞外和细胞内开窗;帽;以及推定的离子路径。图中显示了蛋白质的表面,亚基以浅蓝色显示,其中一个亚基以深蓝色突出显示。
456 离子通道教科书第二卷
29.6 药理学
P2X 受体的内源性激动剂是细胞外 ATP,其 EC50 值因亚型而异 (Coddou 等人,2011)。这些值的范围从 P2X1 和 P2X3 的几百纳摩尔到 P2X2 和 P2X4 的微摩尔。与其他 P2X 亚型形成鲜明对比的是,P2X7 需要异常高浓度的 ATP 才能激活(毫摩尔范围)。最近解析的大鼠 P2X7 结构为这种差异提供了一种可能的解释,即通往 ATP 结合位点的溶剂可及入口要窄得多 (McCarthy 等人,2019)。这种受限的进入
可能对 ATP 的进入施加限制,进而可能影响 ATP 结合。
2,3-O-(4-苯甲酰苯甲酰)-ATP (BzATP) 是一种 ATP 类似物,由于其效力增强而经常用于研究 P2X7
(Donnelly-Roberts 等人,2009 年)。许多其他 ATP 类似物在不同亚型中具有不同的活性。例如,使用 α,β-meATP
可以区分快速脱敏亚型 P2X1 和 P2X3(其中它具有很强的效力),以及
其余亚型变体对这种 ATP 类似物基本不敏感(Coddou 等人,2011 年)。为了保持其独特的激动剂药理学,P2X7 还具有通过核苷酸辅因子 NAD+ 激活的特性(就小鼠 P2X7 而言),甚至通过脂多糖和淀粉样蛋白-β (Di Virgilio 等人,2018) 等非核苷酸激动剂激活的特性。
就拮抗剂而言,存在多种 P2X 拮抗剂,既有竞争性的也有非竞争性的,其功效不同,并且根据所讨论的亚型具有不同的选择性。一些常见的拮抗剂包括苏拉明(一种多磺化尿素衍生物);
PPADS(一种吡咯烷二磺酸);和 TNP-ATP(一种竞争性拮抗剂)(Syed 和 Kennedy,2012 年)。工业环境中还开发了几种合成拮抗剂,目的是提供更大的亚型选择性和效力。鉴于其强大的治疗潜力,许多此类化合物都以 P2X7 亚型为目标。其中一些化合物已与 P2X7 形成复合物结晶,并显示出独特的变构结合口袋 (Karasawa and Kawate, 2016)。变构调节剂在不同的 P2X 亚型之间也存在很大差异。例如 Zn2+,它正向调节 P2X2-5 反应,同时在 P2X1 和 P2X7 亚型中充当负调节剂 (Coddou et al., 2011)。其他 P2X 活性调节剂包括小金属阳离子(如 Cd2+ 和 Cu2+)、质子、伊维菌素 (P2X4, 7) 和脂质(如磷脂酰肌醇) (Coddou et al., 2011)。除了亚型之间的药理学差异外,P2X7 的药理学甚至在直系同源物之间也存在差异
– KN-62,f例如,是人类和小鼠 P2X7 的强效拮抗剂,但对大鼠对应物无效(Donnelly-Roberts 等人,2009 年)。
29.7 调节
许多不同的机制干预 P2X 受体功能的调节(图 29.5),通常对每种亚型都有特异性。
翻译后修饰代表了一种这样的调节机制。例如,P2X1 N 端结构域中蛋白激酶 C (PKC) 位点的磷酸化已被证明对通道功能具有调节作用,改变电流幅度和脱敏的时间过程(Kaczmarek-Hájek 等人,2012 年)。该 PKC 位点
高度保守,并且该域内的磷酸化已被证明可以调节
457 P2X 受体
P2X2 受体脱敏 (Boué-Grabot 等人,2000)。棕榈酰化是另一种翻译后修饰,对 P2X7 的功能调节尤为重要。
细胞内 Ccys 锚含有至少六个易受棕榈酰化影响的残基。
对经历棕榈酰化或去除基序的残基进行丙氨酸诱变
表明,该区域内的棕榈酰化是 P2X7 非脱敏行为的关键决定因素 (Robinson 等人,2014;McCarthy 等人,2019)。有人提出,这些棕榈酰基团(在低温电子显微镜结构中可以看到它们延伸到膜中)有助于将细胞质帽锁定到位,从而为开放通道状态提供稳定性(McCarthy 等人,2019 年)。
P2X 受体与各种蛋白质伙伴之间的许多相互作用也已被确定具有调节重要性。已经证明 P2X 受体与 cys-loop 家族的其他 LGIC(包括烟碱、GABA 和 5HT3)之间存在功能性串扰(Kaczmarek-Hájek 等人,2012 年)。P2X7 具有大量相互作用蛋白,其中许多通过其细长的 C 端相互作用,该 C 端含有大量结合域。已鉴定出 50 多种相互作用蛋白,其中相当一部分参与免疫反应,包括 CD14、MyD88 和 NLRP3 (Kopp 等,2019)。还描述了与 pannexin-1 半通道、Ca2+ 激活氯离子通道的 anoctamin 家族和钙调蛋白的功能性相互作用 (Kopp 等,2019;Dunning 等,2021)。
P2X 调节的最后一个重要来源是细胞膜元素,包括磷脂和胆固醇。磷脂酰肌醇 (PIPn) 是膜中存在的阴离子磷脂,已知可正向调节所有亚型中的 P2X 活性,但 P2X5 除外,P2X5 没有观察到任何影响 (Bernier 等,2013)。虽然有证据表明 PIPn 直接与 P2X C 末端的多碱基结构域结合,但一些亚型(如 P2X3)被认为以间接方式受到 PIPn 的调控。
P2X1、2、3、4 和 7 存在于脂质筏级分中,脂质筏级分是细胞膜内的微环境,富含胆固醇 (Murrell-Lagnado, 2017)。胆固醇同样被证明可以调节 P2X 行为,尽管这种调节的性质取决于所讨论的亚型。虽然 P2X2、3 和 4 已被证明对胆固醇的去除基本不敏感,但 P2X1 却受到胆固醇去除的抑制,电流减少高达 90% (Murrell-Lagnado, 2017)。这种调节是间接的,是通过胆固醇和肌动蛋白细胞骨架之间的相互作用而不是 P2X1 本身发生的。
相反,胆固醇对 P2X7 亚型有抑制作用,在胆固醇耗尽的情况下,由于开放通道概率的增加,表现出极大的增强电流和显着的敏化加速(Dunning 等人,2021 年)。
图 29.5
P2X 受体的功能调节。ATP 门控 P2X 受体受不同机制调节。详情请参阅正文。
