Taiz的WEB TOPIC
WEB TOPIC 1.1 模式生物
植物是一组多样化的生物,对各种环境具有不同的适应能力。因此,一些植物具有使它们易于在实验室中生长和研究的特性。正如小鼠和大鼠被用作哺乳动物生物学的实验动物一样,植物生理学中也有一些实验室植物最常使用。那些具有生长和繁殖特性且易于在实验室中使用的物种称为模式生物. 它们通常是小型、耐寒的生物,世代时间短,基因组小。不同的模式生物用于研究植物生理学的不同方面,因为没有一种植物表现出使植物有趣的各种适应性。基因测序正在迅速发展,目前可在网站Phytozome上找到有关几种模式植物生物和作物物种的遗传信息的良好资源。下表列出了一些植物模型以及使它们变得有趣且有用的模型系统的功能。
| 学名 | 中文正式名 | 常用名 | 作为模式生物的原因 |
|---|---|---|---|
| Arabidopsis thaliana | 拟南芥 | Mouse-ear cress /Thale cress | 基因组小,易于培养,自体受精 |
| Brachypodium distachyon | Purple false brome | 基因组小,体型小,自体受精,禾本科 | |
| Chlamydomonas reinhardtii | Green alga | 单细胞藻类,纤毛 | |
| Citrullus lanatus | watermelon | ||
| Lotus japonicus | Miyakogusa | 固氮,与Medicago的共生关系不同 | |
| Medicago truncatula | Barrel cover | 固氮,和Lotus的共生关系不同,基因组和体系小 | |
| Oryza sativa
Oryza glaberrima |
Asian rice
African rice |
单子叶作物,50%人口的主食 | |
| Picea abies | Norway spruce | 针叶树,作为体细胞胚胎发生的研究,最大的基因组之一19800Mb | |
| Populus trichocarpa | Western balsam poplar | 木本,造纸业中重要 | |
| Physcomitrella (Physcomitrium) patens | moss | 非维管植物,研究顶端生长和细胞极性 | |
| Selaginella moellendorffii | Spike moss | 最小的基因组之一100Mb,石松类 | |
| Solanum lycoperiscum | tomato | 作物 | |
| Triticum aestivum | bread wheat | 六倍体单子叶作物 | |
| Zea mays | Maize | 作物中最大的基因组2.3Gb |
WEB TOPIC 1.2 植物分类与进化
自亚里士多德时代(公元前 384-322 年)以来,生物学家一直在寻求对生物进行分类。许多早期的植物分类,如亚里士多德的学生 Theophrastus(公元前 371-287 年)在《植物史》和 Dioscorides(公元 40-90 年)在《药材学》( De Materia Medica)中按名称、大小、常见的位置和有用性对植物进行分类,尤其是它们的医疗用途。事实上,《本草》作为药理学和植物知识的来源已有 1500 多年的历史,是在黑暗时代从未“丢失”的为数不多的科学论文之一。文艺复兴时期出现了一个分水岭,当时人们放弃了对植物的使用作为分类手段。1583 年,安德烈亚·切萨尔皮诺 (1524-1603) 发表了他的De Plantis Libri XVI(植物十六本书),使用植物形态学、植物的形态和结构作为分类手段。特别是,Cesalpino 使用了水果和种子的形态。当 Mathias de l'Obel(1538-1616 年)发表Icones Stirpium(植物图像,1591 年)和 Kaspar Bauhin(1560-1624 年)发表Pinax Theatri Botanici(植物图解博览会)时,出现了基于“自然亲和力”对植物进行分类的进一步尝试, 1596, 有超过 6000 种不同的植物)。他们的许多植物群都是今天使用的。
随着越来越多的植物被了解和描述,识别植物或植物键的方法变得可取。Adam Zaluziansky (1558) 为药用植物开发了二分法,其中可以通过一系列非此即彼的选择(即大种子与小种子,锯齿状边缘叶与光滑边缘叶)来识别植物–1613) 在他的Methodus Herbariae(1592)。理查德·沃勒(Richard Waller,1660-1715 年)在数年间(1689-1713 年)向伦敦皇家学会提交了一个二分法钥匙,作为识别所有植物的视觉指南,并保存了本指南的水彩插图手稿在皇家学会图书馆。这些被认为是“人工系统”,其目的是易于识别。所有植物的第一个广泛的书面二分法密钥是对让·巴蒂斯特·德·拉马克 (Jean Baptist de Lamarck) (1744-1829) Flore Françoise (1778)的补充。
在拉马克工作之前的几年里,分类的尝试是基于“物种的固定性”的概念进行的(即,有固定数量的物种,揭示它们的顺序所需要做的就是充分描述和分组它们) . 这是约翰·雷(1627-1705)和卡罗勒斯·林奈(1707-1778)的植物和动物分类系统、分类学的哲学(和宗教)基础的一部分。林奈引入了二项式命名法,有机体可以通过两个名称来识别,它们的属和种。直到那时,植物和动物都是通过描述其识别特征的短语来识别的。现在命名生物的这种分类上层结构或分类单元包括属和种,作为八个分类单元命名层次结构中的底部两个分类单元:域、王国、门(部门)、类、目、科、属和种。
拉马克是进化论的早期支持者,即物种的属性不是固定的,而是可以随着时间而改变或进化的。从阿尔弗雷德·罗素·华莱士 (Alfred Russell Wallace) (1823-1913) 和查尔斯·达尔文 (Charles Darwin) (1809-1882) 的遗传与修饰和自然选择的概念,到遗传的遗传基础,揭示了这种变化发生的机制一直是现代生物学的核心胜利,不断变化的基因组的性质,以及表观遗传学的最新发现。现在分类的目标是显示进化关系。
当前的分类系统是基于进化共享的特征;具有共同特征的生物可能具有具有该特征的共同祖先。随着我们对生物体的了解越来越多,可以使用更多的特征进行比较。自切萨尔皮诺时代以来,用于分类的特征或特征一直是形态学的。但是通过 DNA 序列分析,描述生物体的特征数量以天文数字的速度增加,因为基因组的差异可以比其编码的形态特征更精细地分析。
共享特征之间的关系可以用分支图来描述。教科书中的图 1.1 显示了重要的植物进化特征的分支图。它显示了一棵祖先树,其中树上的分支或进化枝包括一组物种,这些物种通过进化变化产生的共享特征相关联,共享衍生特征。该物种与较早祖先共享的那些特征称为共享原始特征。例如,当植物发展出在陆地上定居的能力时,这些适应性是陆地植物的共同衍生特征。它们还与绿藻具有共同的原始特征,即具有叶绿素a和b的叶绿体. 网络图 1.2.A 还显示了植物如何融入更普遍的生物进化枝图。
网页图 1.2.A.生物体的三个领域的分支图,细菌、古生菌和真核生物(Woese 等人,1990),显示了植物适合进化方案的位置。包括已知发生的内共生事件。(由康涅狄格大学分子与细胞生物学系 J. Peter Gogarten 博士提供)。所有生物的共同祖先首先产生了细菌以及古细菌和真核生物的共同祖先。古生菌是真核生物谱系的分支。真核生物的共同祖先获得线粒体内共生体(一种 α-变形杆菌样细胞)。一组被称为原生生物的异质真核生物从导致植物、真菌和动物的谱系中分支出来。真菌和动物的共同祖先形成一个分支,然后分化为真菌和动物谱系。植物、绿藻、红藻和蓝藻的共同祖先获得了叶绿体内共生体(一种蓝细菌)。绿藻、红藻和绿藻的三个谱系分道扬镳。各种原生生物谱系通过绿藻或红藻内共生体获得叶绿体。最早的绿藻分支(Green Algae I)发散。绿藻(Green Algae II,Characeae,Coleochaetales)的后期分支出现分歧。剩余的血统导致植物。Characeae, Coleochaetales) 发散。剩余的血统导致植物。Characeae, Coleochaetales) 发散。剩余的血统导致植物。
真核生物包括真核生物,其细胞含有真正的细胞核。包括蓝细菌在内的细菌或真细菌缺乏真正的细胞核,因此是原核生物。古细菌或古细菌也是原核生物,但它们与细菌不同。除了形态和生化差异外,它们还经常适应极端环境,例如硫磺温泉或盐池。系统发育研究表明,在细菌与共同祖先分离后,古细菌和真核生物分裂。因此,古细菌和真核生物代表姐妹群体。古细菌和真核生物之间的这种更密切的关系反映在它们相似的启动子结构和 RNA 聚合酶、组蛋白的存在以及许多其他特征上。
真菌以前被归类为失去叶绿体的类藻类植物。然而,如 Web 图 1.2.A 中的分支图所示,真菌和动物在叶绿体出现之前就从真核生物谱系中分支出来了。因此,它们与动物的关系比与植物的关系更密切。真菌是异养的;也就是说,它们的食物依赖于其他生物,它们通过从外部环境中吸收无机离子和有机分子来满足其营养需求。大多数真菌物种是丝状的,并具有由几丁质制成的细胞壁,与昆虫外骨骼中发现的物质相同。
系统发育树
有趣的是,遗传差异通常表现为双向分支或二分法——在一个基因或一组基因的两种不同形式之间进行选择。这产生了分支的进化系统发育树。系统发育树,就像用于识别的二分键一样,是人工的。像二分键一样,它们对于传达有机体之间的某些关系非常有用。网络图 1.2.B 显示了植物界最近的系统发育树。
Web 图 1.2.B 植物界 的系统发育树,横轴为大致时间尺度。修改自:Palmer、JD 等人。2004. 生命之树:概述和一些观点。是。J.博特。91, 1437–1445。(由布卢明顿印第安纳大学生物系 Jeffrey D. Palmer 博士提供。)
苔藓植物很小(高度很少超过 4 厘米),非常简单的陆生植物,并且就物种数量和总种群而言最不丰富。苔藓植物似乎不属于维管植物的直接进化路线。相反,它们似乎构成了一个单独的次要分支。苔藓植物包括苔藓、地钱和金鱼草。这些小植物适应陆地生活,但在有性阶段其生命周期依赖于水(参见教科书的图 1.2)。水促进受精,配子融合产生二倍体合子。. 苔藓植物既没有真根也没有真叶,它们缺乏维管系统,并且它们不产生用于结构支撑的硬组织。缺乏这些对陆地生长很重要的结构极大地限制了苔藓植物的潜在大小,与藻类不同,苔藓植物是陆生植物而不是水生植物。
蕨类植物是最大的带孢子维管植物群。与苔藓植物相比,蕨类植物具有真正的根、叶和维管组织,它们产生硬组织来支撑。这些建筑特征使蕨类植物能够长到小树的大小。尽管蕨类植物比苔藓植物更能适应陆地生命的干燥条件,但它们仍然依赖水作为精子向卵子移动的介质。在其生命周期的关键阶段,这种对水的依赖将蕨类植物的生态范围限制在相对潮湿的栖息地。
最成功的陆生植物是种子植物。种子植物已经能够适应各种各样的栖息地。在种子内部受到保护和滋养的胚胎能够在干旱等不利的生长条件下以休眠状态存活。种子传播也有利于胚胎远离亲本植物的传播。
种子植物的另一个重要特征是它们的受精方式。种子植物的受精是通过风或昆虫介导的花粉(雄性的产生配子的结构)转移到雌性的雌性结构(雌蕊)而实现的。授粉独立于外部水,在陆地环境中具有明显优势。许多种子植物产生大量的木质组织,使它们能够长到非凡的高度。种子植物的这些特征促成了它们的成功并解释了它们的广泛范围。
种子植物有两类:裸子植物(来自希腊语,意为“裸种子”)和被子植物(希腊语意为“容器种子”,或容器中的种子)。裸子植物是不太先进的类型。已知约 700 种裸子植物。最大的裸子植物群是针叶树(“cone-bearers”),其中包括松树、冷杉、云杉和红木等商业上重要的林木。
存在两种类型的球果:产生花粉的雄性球果和带有胚珠的雌性球果。胚珠位于称为锥鳞的特殊结构的表面上。在风媒授粉后,精子通过花粉管到达卵子,受精卵发育成胚胎。成熟后,在早期发育过程中被压住的锥形鳞片相互分离,使裸露的种子落到地上。
被子植物是一种更先进的种子植物,在大约 1 亿年前的白垩纪时期首次大量出现。今天,它们主宰着这片土地,轻松击败了它们的表亲裸子植物。已知大约有 250,000 种物种,但还有更多的物种有待鉴定。被子植物的主要创新是花;因此它们被称为开花植物。被子植物和裸子植物之间还有其他解剖学差异,但没有一个比繁殖方式更重要和更深远。
WEB TOPIC 1.3 花卉解剖学和被子植物生命周期
在开花植物中,二倍体孢子体是迄今为止最大和最显着的一代(参见教科书图 1.2)。它产生茎、叶、根和花。花会产生不同大小的孢子(称为异孢子),这些孢子会保留在花中。
花由几个叶状结构组成,这些结构附着在茎的一个特殊区域,称为花托(Web 图 1.3.A)。萼片和花瓣最像叶子。花瓣的主要功能是吸引昆虫作为传粉媒介,这也是它们经常艳丽和色彩鲜艳的原因。雄蕊是雄性的性结构,雌蕊是雌性的性结构。雄蕊由称为花丝的狭窄茎和称为花药的腔室结构组成。花药含有产生花粉粒的组织。雌蕊由一个或多个联合的心皮;雌蕊,或在某些花中是一圈雌蕊,有时被称为雌蕊。雌蕊由柱头(授粉过程中花粉着落的尖端)、花柱(细长的结构)和子房组成。子房,雌蕊的中空基部,完全包围一个或多个胚珠。每个胚珠依次包含一个胚囊,即产生雌配子的结构,即卵子。
Web 图 1.3.A 被子植物理想化花的示意图。
花内雌配子体的产生
在胚珠内,雌性大孢子体在大孢子囊内产生大孢子母细胞。大孢子母细胞减数分裂产生四个单倍体大孢子,其中三个退化。幸存者发育成巨配子体或胚囊。胚囊含有八个单倍体细胞核,是雌配子体。它包含卵子、卵子的两个附属细胞、助细胞、两个极核和三个反足细胞。
花内雄性配子体的产生
在花药内部,雄性小孢子体在小孢子囊内形成小孢子母细胞。小孢子母细胞减数分裂产生单倍体小配子体或花粉粒,即雄性配子体。花粉粒包含两个细胞,一个管状细胞和一个生殖细胞。较大的管状细胞包围着生殖细胞。花粉管是管细胞的延伸。
花粉粒转移到柱头上。如果花粉相容,则含有两个精子的花粉管会长到胚囊的基部。如果花粉不相容,则管将不会形成或仅部分生长。许多植物物种不能自我授粉,因为它们具有不相容的花粉。当花粉管到达胚囊时,生殖细胞分裂并产生两个精子细胞。精子进入两个助细胞之一,然后退化并释放两个精子。一个与两个极核融合形成三倍体胚乳。另一个与鸡蛋融合。这是双重受精的过程。
受精卵的第一个分裂是极地分裂,建立植物的纵轴。顶部细胞产生胚胎,底部细胞产生胚柄。胚柄分裂几次,成为吸收胚乳营养的器官。
经过几轮分裂,胚胎变成球状。在真双子叶植物中,随后是两个裂片的延伸,最终形成子叶。这个早期的分叶期被称为心脏期,因为胚胎的形状像心脏。随着子叶的生长,出现了茎尖、下胚轴和根尖。在这个阶段,胚胎的形状像鱼雷,因此被称为鱼雷阶段。最终,子叶在形成种皮的外皮组织内卷曲,主要填满种子。
种子传播是通过各种物理手段和动物吃水果然后排便来完成的。瘦果(蒲公英、蓟)等水果可使种子随风散播。核果(樱桃、李子)等水果可以让种子通过动物传播。
WEB TOPIC 1.3 核进出口所涉及的核孔和蛋白质
毛孔
核孔复合物 (NPC) 充当跨越核膜的两个膜的超分子筛。构成孔的蛋白质称为核孔蛋白。呈八边形对称的平行环位于核膜的内膜和外膜附近(Web 图 1.4.A)。各种核孔蛋白形成其他结构,例如核环、细胞质细丝和核篮。小代谢物通过 NPC 自由扩散,但大蛋白和 RNA 的流动是有选择性的。根据最近的模型,选择性来自水孔内的非结构化核孔蛋白的网状结构。为了将这个网状结构穿透进出细胞核,大分子必须与特定的载体蛋白结合,例如核转运蛋白。
Web 图 1.4.A 核孔复合体
进出口所涉及的蛋白质
已经确定了核输入和输出所需的三种蛋白质:Ran,一种小 GTP 酶,以及穿过核孔的载体蛋白,称为核转运蛋白(输入蛋白、输出蛋白和转运蛋白)。尽管植物和动物都共享这种运输途径,但植物输入蛋白比动物输入蛋白识别更广泛的核定位信号。
蛋白质进出细胞核的模型如图 1.4.B 所示。该模型的重要特征是不带货物的importin作为与Ran-GTP的复合物离开细胞核,而带货物的importin单独进入细胞核。
Web 图 1.4.B 蛋白质输入细胞核的机制。(根据 Lodish 等人,2004 年。)
对于从细胞质穿过核包膜的输入,特定的核转运蛋白在膜的细胞质侧识别它们的货物(通常带有核定位序列或 NLS),那里有低水平的 Ran-GTP。与核孔复合物的结合和核转运蛋白-货物复合物在其上的易位是由核转运蛋白介导的。一旦进入核质(核膜内的区域),Ran-GTP 就会与核转运蛋白-货物复合物结合并刺激货物的释放。核转运蛋白及其相关的 Ran-GTP 通过核孔转运回细胞质,在此 Ran 的 GTP 水解为 GDP,Ran-GDP 与核转运蛋白解离,使核转运蛋白可用于另一轮运输. 因此,在导入过程中,
对于出口,会发生类似的易位过程,但出口核转运蛋白与其货物的亲和力因其与 Ran 的结合而增加。一些核转运蛋白可以双向操作,即进出口,但它们在不同的方向上携带不同的货物。它们甚至可以携带某些小 RNA(例如 tRNA),而不仅仅是蛋白质,而是使用不同的识别途径(不是 NLS)来结合这种货物。
WEB TOPIC 1.4用于将蛋白质分类到目的地的蛋白质信号
蛋白质的共翻译和翻译后分选信号
细胞器 信号功能 蛋白质信号序列 信号受体
急诊室 蛋白质的共翻译插入 6-12 AA 的 N 末端疏水结构域 信号识别粒子
急诊室 维持 ER 中的蛋白质 C-末端 Lys-Asp-Glu-Leu HDEL-受体或 ERD2
高尔基体 维持高尔基体中的跨膜蛋白 跨膜结构域 未知
液泡 将内膜蛋白靶向液泡 N端Asn-Pro-Ile-Arg BP80 或 VSR-At1
液泡 将内膜蛋白靶向液泡 C-末端具有疏水性延伸 RMR(用于受体同源性跨膜环 H2 结构域)
过氧化物酶体 蛋白质的翻译后插入 C-末端 Ser-Lys-Leu SKL受体
线粒体 蛋白质的翻译后插入 两亲(螺旋,一侧带正电荷,另一侧带负电荷)序列 外膜转运蛋白——TOM22/TIM 17 复合物
叶绿体 蛋白质的翻译后插入 没有一致序列 外膜转运蛋白——TOC159 和其他多肽
叶绿体 在 ER 中共翻译插入,然后在粘附位点转移到叶绿体 用于 ER 靶向的 N 末端疏水结构域,与叶绿体结合的未知结构域(例如:碳酸酐酶 1) 叶绿体中的ER信号识别系统和未知系统
核 将转录因子、组蛋白和其他蛋白质靶向细胞核 示例:
导入:Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val
导出:Leu-Ala-Leu-Lys-Leu-Ala-Gly-Leu-Asp-Ile 核孔的重要成分
WEB TOPIC 1.6 SNARE、Rabs 和外壳蛋白介导囊泡形成、裂变和融合
一类特殊的靶向识别蛋白,称为SNARE(网络图 1.9.A)和Rabs(网络图 1.9.B),参与囊泡和小管的选择性融合和裂变,充当内膜系统隔室之间的转运蛋白. 发现不同的 SNARE 和 Rab 与不同的膜系统相关。穿梭囊泡上的 SNARE,称为 v-SNARE,与靶膜上的 SNARE 结合,称为 t-SNARE。植物中的SNARE基因比动物多得多,它们可能不仅在膜融合中起作用,而且在膜-膜锚定中起作用。Rabs 是小的 GTP 结合蛋白(参见Web 图 1.9.A) 为过程提供能量和方向性。大多数内膜的细胞质小叶上还有一个重要的蛋白质 ATPase,一旦发生融合,它参与破坏 v-和 t-SNARE 之间的键(参见网络图 1.9.B)。
Web 图 1.6.A 囊泡靶向由互补 SNARE 介导。包被的囊泡首先从具有囊泡特异性 v-SNARE 的供体细胞器中萌芽。然后将囊泡靶向显示互补 t-SNARE 的受体膜。涂层从囊泡中释放出来,使囊泡与受体膜上的 t-SNARE 对接。对接后,囊泡与膜融合。(图由密西沙加多伦多大学的 Danton H. O'Day 提供,来自他的网站“ Vesicle Traffic: COPs, SNARES & Other Things ”。)
网页图 1.6.B Rab-GTP酶驱动囊泡的形成、运输和融合。Rab 被特定的鸟嘌呤核苷酸交换因子(GEF,在图中显示为鸟嘌呤核苷酸释放蛋白 [步骤 1])激活,并被 GTP 酶激活蛋白(GAP,图中未显示,但在步骤 6 中显示)灭活。Rab-GDP 与供体细胞器膜上的鸟嘌呤核苷酸交换蛋白或 GEF 结合,导致 GDP 与 GTP 交换(步骤 1)。然后,Rab-GTP 通过暴露的脂质尾部附着在供体膜上(步骤 2)。v-SNARE 和外壳蛋白(未显示)在同一位点积聚,导致囊泡形成(步骤 3),并且囊泡迁移到目标细胞器(步骤 4)。释放涂层后(未显示),囊泡与受体细胞器膜上的互补 t-SNARE 对接(步骤 5)。与 Rab 结合的 GTP 水解为 GDP(步骤 6),将 Rab-GDP 释放到细胞质中,然后再循环到供体细胞器(步骤 7)。囊泡与其受体膜融合(步骤 8)。(图由密西沙加多伦多大学的 Danton H. O'Day 提供。)
WEB TOPIC 1.7 ER 出口站点 (ERES) 和高尔基体相互连接
ER 出口站点和高尔基体作为一个单元移动
蛋白质从 ER 到高尔基体的运动称为顺行运输,它是由 ER 外壳蛋白 (COPII) 介导的,该蛋白在 ER 出芽的部位积聚以形成靶向高尔基体的小管或囊泡。发生这种从 ER 退出的位置称为 ER 退出位点 (ERES),它是 ER 中的一个特殊蛋白质结构域,在动物细胞中,它远离位于细胞核旁边的 1 到 8 个高尔基体。然而,在高度空泡化的植物细胞中,ERES 仍然与运动的高尔基体密切相关。电影 A 展示了数百个单独的高尔基体堆栈在与 ER 和细胞骨架轨迹相关联时移动。绿色荧光蛋白 (GFP) 标记 ER 和高尔基体,因为 GFP 报告受体 (ERD2) 的分布,该受体在 ER 和高尔基体之间循环。蛋白质从高尔基体循环回 ER 称为逆行运输,由高尔基体外壳蛋白 (COPI) 介导。留在 ER 中的蛋白质,即所谓的 ER 驻留蛋白,通过 COPII 短暂离开 ER,但被与末端四个氨基酸序列(KDEL 或 HDEL)结合的循环受体 (ERD2) 识别。为了维持 ER 和高尔基体之间的这种有效运动,这些细胞器在植物中一起追踪。
电影 1 ERES 与高尔基体一起移动,因为它们流过细胞(延时面板,图 1.7.A 和电影 B)。在植物中,由于它们非常靠近,因此很少观察到穿过 ER 和高尔基体之间空间的 COPII 囊泡。COPII 囊泡的快速生产和消耗可能会促进 ER 和高尔基体之间的物理连接。
图 1.7 . 电影 2 中的延时面板
电影 2 COPII 区域由 SAR 1 显示,这是一种参与 ER 向高尔基体转运的 Rab 蛋白。高尔基体和 ER 与 ERD 2 一起显示。显示了电影的延时面板。
当然,电影 2 中显示的协同运动表明高尔基体和 ER 之间存在管状连接,或者存在某种将结构保持在一起的蛋白质支架。这些不是相互排斥的选择。这种蛋白质支架的存在可以从植物高尔基体的早期显微照片中推断出来,因为它们被排除区域包围,排除了其他细胞器,包括无处不在的细胞质核糖体。最近的研究表明,称为golgins的支架蛋白存在于植物中。这些要么是反式的-膜蛋白或与位于高尔基体内的脂质锚定的 GTP 结合蛋白结合的蛋白。这些支架蛋白具有大的扩展结构域,可以使囊泡在靶膜附近积聚并稳定。据推测,类似的蛋白质参与了水池之间的连接,但它们尚未被描述。脑池间元素,在电子显微镜下可见带有某些污点的小结构杆出现在最横池之间,并且可能在高尔基体成熟的横面上起到支架作用。
WEB TOPIC 1.8 植物细胞中的特化液泡
在许多有色花朵和生殖组织(如水果)中,颜色是由花青素产生的,花青素是液泡中的色素。不同的花青素、液泡的不同 pH 值(许多花青素的颜色对 pH 值敏感),或者同一细胞内有一些有色素的和一些无色素的液泡,都可以产生各种深浅不一的颜色,这是细胞内液泡分化的情况。这可以在红芙蓉的花瓣细胞中看到,其中一个液泡是红色的,一个液泡是透明的。
Web 图 1.8 .芙蓉花细胞内的液泡分化。在单个细胞内,同时出现红色和白色(透明)液泡。(来自格里芬。)
液泡非常动态。在电影 1 中,可以看到液泡膜相互移动,相互融合,形成跨液泡链,并环绕其他细胞器。3D 重建显示了跨液泡链如何连接细胞的不同区域,以及皮层增厚如何被液泡膜、液泡膜包裹。
液泡是植物储存的终点,因此是含有种子中蛋白质的细胞器,用于人类营养。从 Web 表 1.8.A 中可以看出,这些“蛋白质体”或种子蛋白质储存液泡中的一些直接来自 ER,而另一些则来自高尔基体。
液泡也是甘蔗和甜菜中蔗糖储存的场所,它们专门吸收和储存大量的蔗糖,这些蔗糖是从叶绿体中产生的磷酸丙糖在细胞质中合成的。
液泡是植物乳胶的主要成分,由植物乳汁制成(参见教科书图 1.36)。在橡胶树中,液泡储存天然橡胶聚合物。在罂粟中,液泡储存吗啡喃生物碱,包括吗啡。
储存的天然功能也可以转化为防御。如此高浓度的储存草酸可以浓缩在液泡中,它可以从溶液中析出并形成液泡状晶体或针晶(参见教科书图 23.7)。这些针状晶体会损害食用含有它们的植物叶子的动物的消化道。动物学会不吃它们,从而保护植物免受食草动物的侵害。
在模式植物拟南芥中,诸如干表皮细胞之类的营养组织具有源自内质网并随其移动的体,但含有水解酶,例如β-葡萄糖苷酶。它们被称为 ER 体,但可以归类为溶胞室,其中液泡是主要成员。这些梭形体被认为具有防御草食性的功能,因为裂解酶会导致消化问题。
表 10.8.A
液泡细胞器 尺寸 功能 外貌
种子蛋白储存液泡 - ER 衍生 球形,直径 1 μm 储存白蛋白 电子显微照片中的电子密度
种子蛋白质储存液泡 - 源自高尔基体 直径大于 1 μm 储存凝集素和谷蛋白 电子显微照片中的电子密度
多泡体 0.3 微米直径 晚期内体和溶酶体,ESCRT 通路的一部分 球形,有小 50 nm 的腔内囊泡,有时附有共同扩张的小管
中央大液泡 直径 10 μm 及更大,多叶 溶质的储存,水的运输以保持膨胀 电子显微照片中的电子透明,有时有液泡内包裹体
外周小液泡和液泡前体 直径 0.2– 0.5 μm 裂解蛋白的储存;溶酶体 电子显微照片中的电子透明
管状空泡 横向直径 1 μm,长数 μm 与中央大液泡相同 仅见于活细胞和速冻细胞。传统的固定方式会破坏它们
自噬泡 围绕胞质溶胶区域的小管网络 自噬的胞质溶胶分解 腔内细胞器和细胞质成分
WEB TOPIC 1.9 定向细胞器运动和细胞质流
细胞质流动是大多数高等植物细胞的基本特征。有一些高等植物细胞不会流动,例如休眠种子组织中的细胞。事实上,在较小的、非空泡的分生组织细胞中,流动速率比在较大细胞中的要慢。尽管流化是大多数植物细胞的基本特征,但其功能和机制仍是研究的活跃领域。然而,很明显,大多数流与肌动蛋白丝网络相关,如电影 1 所示。肌动蛋白网络遍布植物细胞的细胞质,沿它的运动由植物肌球蛋白之一肌球蛋白 XI 驱动。
球状细胞器流:油体、高尔基体、过氧化物酶体、烟草和拟南芥中的线粒体
油体和肌动蛋白:油体小而呈球形。因为它们是由油制成的,它们比水更能弯曲光线(即,它们具有更高的折射率,因此可以用常规显微镜识别)。在那些基于细胞器不同折射率的显微镜形式中,例如相差显微镜,它们很容易被看到。它们沿着细胞内的细胞质链移动,有时可以看到它们以相反的方向相互通过,这清楚地表明它们不是由细胞质的大量流动携带的,而是独立机动的,可能是由肌球蛋白驱动的。在电影 1 中,您可以看到沿着细胞内的丝状肌动蛋白追踪的油体(用重要的染料尼罗红染色)。
Golgi:如关于 Golgi 和 ER 出口站点的 Web WEB TOPIC 1.7 所示,Golgi 以可变速率流动,最大约 2 微米/秒,同时它们连接到 ER。这可以在电影 2 中看到,这是用绿色荧光蛋白 (GFP) 标记的高尔基体和 ER 的时间推移,ERD2 是 ER 和高尔基体之间的 HDEL 回收受体。这是来自瞬时表达 GFP-ERD2 的烟叶。请注意,一些高尔基体保持静止。移动与静止的高尔基体的功能尚不清楚,但一种假设是,作为高尔基体流,它们会像泡泡棒一样释放囊泡。然后囊泡独立地移动到它们与质膜融合的部位。
高尔基体的外观也略有不同,具体取决于它是用靶向顺侧或反侧的荧光融合蛋白标记的。电影 3 和 4 来自拟南芥的稳定转化品系,可通过拟南芥生物资源中心获得。电影 3 显示了与 Memb12 融合的 YFP 标记的高尔基体流,Memb12 是一种顺式蛋白。电影 4 显示了用 YFP 与反式蛋白Got1 融合标记的高尔基体流。Golgi-Got1 电影展示了流式 Golgi 的 3D 分布。
过氧化物酶体:过氧化物酶体的流动速度与高尔基体的流速大致相同,如图 5 所示。显示了过氧化物酶体在各种组织中的运动:叶柄、根部和根毛。有关过氧化物酶体运动的更多电影和分析,请参阅电影 9(叶绿体)。过氧化物酶体有时会产生称为过氧化物的长小管,这些小管通常“引导”流动粒子,如电影 6 所示。过氧化物的功能是未知的。与高尔基体一样,过氧化物酶体也可以是静止的。有时,静止的过氧化物酶体与叶绿体有关,它们可能紧密相连以接收光氧化产物。
线粒体:线粒体也以与高尔基体和过氧化物酶体大致相同的速率流动——平均约 2 微米/秒。同样,它们在下胚轴的表皮细胞中的运动存在相当多的变化,电影 7。还显示了表皮细胞中非流动线粒体的 3D 分布。根据组织的不同,线粒体也表现出大量的分支、融合和裂变。正如您在电影 7 的第二部分中看到的那样,分支的线粒体在多个裂变位点分裂。其中一些会在它们停止时发生,也许这种束缚有助于它们分裂,就像在酵母细胞中一样。
如电影 8、ERD2 电影和叶绿体电影中所示,ER 快速流动,在流动时重塑和重塑自身。ER 在这里用 GFP 标记,在其羧基末端具有 ER 保留信号 KDEL。在拟南芥中,下胚轴 ER 也具有与之相关的梭形“ER 体”(但不是大多数其他植物),这可能是植物细胞裂解室的一部分。ER 网在表皮毛状体和气孔的保卫细胞中相当密集。ER在转基因本氏烟草的叶肉细胞中的叶绿体周围形成重塑网络细胞。因为 ER 与核包膜共同扩展(NE 实际上是 ER 的一个子域),所以核包膜很容易在表达腔 ER 标记的细胞的 3D 重建中看到(参见表皮毛状体和保卫细胞重建)。
叶绿体水植物中的叶绿体流,如电影 9 的第一部分所示。由于叶绿体大且可见,这通常是生物学学生唯一能看到的流。然而,在其他植物和组织中,叶绿体的移动并不多,而且许多似乎受到束缚,而其他细胞器,如 ER 则在它们周围流动。其他可以流动,但似乎与细胞器分开移动,例如过氧化物酶体。这部电影比较了拟南芥下胚轴中过氧化物酶体与叶绿体的流动速率。
植物细胞对光也有特殊的环境反应,包括叶绿体向表皮细胞侧面的移动,以避免高光水平,如电影 10 所示。
WEB TOPIC 1.10 植物中的微管运动和微管介导的运动
皮质微管
植物细胞皮层中的微管网络通过“跑步”移动(即,从负端失去聚合物,同时以相似的速度和增长的正端获得它们)。电影 1 显示了拟南芥下胚轴表皮细胞中皮质微管的动力学。因为很难看到单个微管的两端,所以进行了一项实验以表明微管的物理易位没有发生,而是聚合物被添加到一端并从另一端减去。在实验中,荧光微管蛋白被光漂白成一条线。如果小管通过易位移动,光漂白区域会很快消失。相反,它会随着时间的推移而维持,证明跑步会导致微管运动。
电影 1 微管
因为大多数高等植物没有中心体和相关的动物细胞微管组织中心,它们沿着膜——质膜和核膜——启动微管。有时这发生在其他微管的侧面。这种受控的聚合和解聚在许多微管相关蛋白或 MAP 的帮助下发生。
通过有丝分裂重组微管和 MAP
Web 图 1.10.A 显示了微管(红色)的组织以及它们的驱动蛋白马达(浅绿色)相关的 MAP(蓝色)如何参与它们在整个细胞周期中的重组。
Web 图 1.10.A从左到右,从上到下阅读。MAP(蓝色)标有它们的常用首字母缩略词(在图的文本中定义),并显示它们相对于微管、前期带、纺锤体和成膜体的位置。还显示了驱动蛋白(绿色)的位置。细胞核显示为中央多色球体,直到核膜破裂,然后显示单个染色体。
微管和细胞质流
微管也可以作为其他细胞器动力学的束缚点。最近的研究表明,当线粒体和高尔基体等细胞器移动时,它们会在穿过微管的地方停下来。微管可以与这些细胞器相互作用,使这些细胞器能够彼此建立短暂或更持久的膜结合,即所谓的膜接触位点。
WEB TOPIC 2.1质体基因组的遗传模式
植物线粒体和质体中的大部分 DNA 都存在于可能包含多个基因组拷贝的线性分子中。这些拷贝相互连接并且可以高度分枝,类似于灌木或树木(Oldenburg and Bendich 1998, 2004),这与核染色体更简单、不分枝的结构不同(Web 图 2.1.A)
在植物中,质体通常仅从两个亲本中的一个继承(单亲遗传)。在具有母系质体遗传的物种中,由于雄性配子体(花粉)的形成方式,父系质体被排除在外。花粉形成涉及小配子体的两个有丝分裂分裂。第一次分裂产生一个营养细胞,产生花粉管,然后产生一个小得多的生殖细胞,随后产生两个精子细胞。在第一次分裂期间,质体被排除在生殖细胞之外,因此被排除在雄性种系之外。因此,受精卵从雌性巨配子体的卵中获得所有质体,导致质体基因的母系遗传(Mogensen 1996)。
花旗松( Pseudotsuga menziesii)和油松(Pinus tabulaeformis )等针叶树质体的父系遗传机制),稍微复杂一些,也不太容易理解。在许多裸子植物中,产生两个精子核的第二次有丝分裂发生在花粉管进入雌性配子体时。富含质体的父系细胞质和一些线粒体紧贴进入卵细胞的精子核。在受精时,卵核被母体线粒体包围,但母体质体位于卵细胞的外围。在精子和卵核融合并形成合子后,细胞化以这样一种方式进行,即新的细胞壁将所有母体质体和大部分父系线粒体排除在胚胎之外(Mogensen 1996;Guo et al. 2005)。
Web 图 2.1.A线粒体和质体基因组的复杂结构。每张照片都显示了一个包含多个连接的细胞器基因组的单个分支 DNA 分子。(A) 地钱Marchantia polymorpha的乙锭染色线粒体DNA 显微照片。(B) 同一分子的线条图。186 kb 比例尺显示了一个基因组的大小。(C) 玉米多基因组叶绿体 DNA 的显微照片,在琼脂糖中伸展。10 µm 比例尺相当于 30 kb 的 DNA 序列,约为基因组总长度 (154 kb) 的 20%。(A 和 B 来自 Oldenburg 和 Bendich 1998;C 来自 Oldenburg 和 Bendich 2004。)
WEB TOPIC 2.2重组作图和基因克隆:概述
使用辐射或化学物质进行的诱变会在基因组中随机诱导核苷酸变化,但不会留下易于检测的标记,例如转座子或 T-DNA 插入物。有几种方法可以将突变映射到染色体并最终克隆包含突变的基因。Web 图 2.2.A显示了一种称为基于地图的克隆的方法。这种方法利用了同一物种的两个密切相关但略有不同的变种之间 DNA 序列的微小差异。在拟南芥中,这样的品种被称为生态型。Columbia 和 Landsberg erecta是拟南芥基因定位最常用生态型的两个例子。两种生态型或个体之间不同的纯合基因座称为多态性 序列并可作为遗传标记。例如,一个基因的两个等位基因可以作为遗传标记,但即使是生态型之间差异很小的非基因区域也可以作为染色体上的标记。如果许多此类多态性序列的位置已知,则新突变的位置可以基于与一个或多个已知标记的紧密遗传连锁定位在遗传图谱上。一旦确定了图谱位置,就在突变体中对该位置周围的区域进行测序,并与野生型的序列进行比较。我们将首先描述分析映射群体的一般方法,然后解释确定每个标记的分子身份所需的分子工具。
基于图谱的克隆涉及对图谱群体的筛选
让我们假设在来自哥伦比亚生态型 (Col) 的个体中发现了隐性突变。绘制突变基因的第一步是将其与来自不同生态型的个体杂交——让我们假设在我们的示例中,直立兰茨贝格( L er)——这样后代(F 1代)在每个基因位点都是杂合的,包括感兴趣的突变。然后这些后代将被允许自我,从而产生 F 2代。鉴于我们示例中突变的隐性性质,F 1代的所有个体都将具有野生型表型,但在 F 2四分之一的后代会因突变表型而分离。此外,由于 F 1减数分裂期间的交叉, F 2代中的染色体将包含来自 Col 和 L er的DNA 的不同组合。例如,标记 A 可能来自 Col,标记 B 和 C 来自 L er,等等(参见Web 图 2.2.A)。请记住,感兴趣的基因必须位于 Col 染色体片段上,并且由于其隐性性质,突变表型仅在携带感兴趣基因的片段是纯合子时才可见,我们可以排除所有不显示的植物Col 的纯合性和突变表型。分析的下一步是确定可能靠近未知基因的标记(Col 或 L er )的来源。由于拟南芥有 5 条染色体,最初可以从 10 个多态性标记开始,每个染色体臂一个,并测试这些标记中的哪些始终与突变表型分离。在我们的示例中,我们已经将搜索范围缩小到一条染色体。现在我们必须看看感兴趣的基因在染色体上的什么位置。例如,如果在 F 2的几十个人中如果没有植物显示突变表型是标记 A 的纯合 Col 基因型,我们可以假设突变与标记 A 没有密切联系,我们现在可以继续测试相同植物的标记 B。在某些时候,我们期望找到标记和突变表型之间的联系。通过确定大多数突变个体对于来自 Col 生态型的给定标记是纯合子和突变表型。这意味着在我们原来的 Col 亲本中发生突变的基因必须接近这个标记。如果我们从每个染色体臂的标记开始分析(在拟南芥的情况下,有五个染色体),我们可以轻松地从作图种群中筛选个体,以寻找突变表型与十个标记之一(每个染色体臂一个)之间的联系。在实践中,寻找紧密连锁标记的最佳方法是排除与突变基因座不紧密连锁的任何标记。在我们的Web 图 2.2.A示例中,只有个体 2 到 4 将被分析(因为个体 1 是杂合子并且不能是表型突变)。个体 2 将帮助我们排除标记 A 周围的区域,个体 3 将排除标记 B 以北(上方)任何地方的更大区域,而个体 4 将排除标记 C 以南(下方)的区域。所以唯一没有排除的区域在这个例子中是标记 B 和 C 之间的区域。
标记可以通过使用分子指纹分析来区分
上面您学习了如何建立一个映射群体并分析来自一个映射群体的数据,但是您如何实际筛选每个个体的标记分子身份?首先,请记住,突变等位基因只能位于最初来自诱变 Col 亲本的染色体片段上,并且映射的目标是找到一个在物理上接近突变基因并与之分离的基因标记。这样的标记必须在 Col 染色体上,但不能在 L er染色体上。为了找到与突变共分离的 Col 标记,从具有突变表型的 F 2个体和父母(Col 和 L er)。检测 Col 和 L er之间多态性的一种简单方法是首先通过 PCR 扩增 DNA 以获得特定标记,此处为标记 A,然后使用限制性内切酶在该标记处通过仅切割其中一个来区分 Col 和 L er两个 PCR 产物。这种技术被称为切割扩增多态性序列分析,或简称CAPS分析。在我们的示例中,切割导致 Col 衍生的 DNA 中出现两条较小的条带,但来自 L er的 DNA 中只有一条较大的条带。这是因为在本例中用于 CAPS 分析的酶识别了存在于 Col 标记 A 但不存在于 L er标记 A 中的序列。如果 F 2植物是 Col 标记 A 的纯合子,它应该只显示两个较小的条带。同样,如果植物对于 L er标记 A 是纯合的,它应该只显示一个更大的条带。然而,如果植物在标记 A 处是杂合的,我们应该期望看到所有三个条带,因为这两个染色体都在该植物中在标记 A 的基因座处出现。
精细映射最终可以导致突变的分子身份
如果我们想更接近感兴趣的基因,我们将不得不使用更多聚集在候选区域周围的标记——在我们的例子中,在标记 B 和 C 之间。然后,我们将确定与这些标记中的一个或两个的紧密连锁,直到连锁足够近,可以对两个标记之间的区域进行测序并从分子上识别突变。使用拟南芥信息资源 (TAIR) 在线提供的全基因组序列信息,我们可以检查我们刚刚映射突变的 DNA 片段中 Col 的野生型序列。然后我们所要做的就是将突变体中相同 DNA 片段的序列与野生型的序列进行比较,并检查 DNA 序列中是否确实存在可以解释表型变化的差异。如果有区别,我们仍然需要证明野生型 DNA 可以恢复突变植物的正常表型。为此,我们将用野生型序列转化突变体并观察下一代的表型。如果表型恢复为野生型,我们将有充分的证据证明我们的突变体的突变表型实际上是由于我们绘制的被破坏的基因造成的。
Web 图 2.2 .一种基于图谱的拟南芥 克隆方法(详见正文)。
WEB TOPIC 2.3转座子标记
另一种克隆基因和了解突变体基因功能的有效方法是在称为转座子标记的技术中使用转座子(网络图 2.3.A)。正如我们在正文第 2 章中所讨论的(参见图 2.2),转座因子可以在转座酶激活后改变它们的基因组位置,从而导致转座因子。如果激活的转座子插入到基因的编码或调控序列中,阅读框的破坏会导致基因功能的丧失。因此转座子可以是诱变的。被已知序列的转座子破坏的基因比仅由单个核苷酸变化产生的突变体更容易定位(如 Web WEB TOPIC 2.2 中所述)。为了在诱变实验中系统地使用转座子,将具有非活性或非自主转座子的遗传系与含有活性或自主 转座子的系杂交. 携带转录转座酶的自主转座子的后代可以调动非自主转座子。重新激活的转座子现在可以自由地随机插入基因组内的新序列中,从而导致后代发生突变。如果突变是由非自主转座子拷贝引起的,那么如果能将自主元件分离出来,则突变在后代中将是稳定的。由于转座子仅在染色体的一个副本上发现(可以说它是半合子的),因此可以选择不携带活性转座子但具有非自主元件突变的后代。然后可以筛选来自下一代的数百甚至数千个人以寻找新的感兴趣的突变。使标记方法如此强大的原因是可以相对容易地在筛选群体中识别新的转座子破坏基因。由于用于标记方法的转座子序列是已知的,因此可以合成与转座子匹配的引物。使用反向 PCR,可以识别与突变诱导转座子相邻的区域(参见网络图 2.3.A)。
Web 图 2.3 .一种用于基因识别的转座子标记方法(详见正文)。
WEB TOPIC 2.4微阵列技术
所有微阵列技术都使用固体支持物,例如载玻片,在其上点样代表给定物种的单个基因的 DNA 序列,这些序列代表给定物种的单个基因。这样的阵列可以容纳数千个点,所有这些点都可以在一个实验中一起研究,与文中提到的经典方法相比,大大提高了基因分析的吞吐量。从给定组织中提取的 RNA 首先通过逆转录转化为提取物中代表的每个 RNA 分子的更稳定的 DNA 拷贝(cDNA)(网络 图 2.4.A)。然后用荧光染料标记 cDNA 混合物,以便在程序后期对其进行可视化。标记后,将 cDNA 混合物应用于微阵列。
每个单链 cDNA 结合(杂交)其在微阵列上的相应(互补)DNA 点,该点代表在原始组织提取物中产生相应 mRNA 的基因。例如,如果组织提取物中存在来自基因X的 mRNA ,则其 cDNA 将与微阵列上代表基因X的位点结合。然而,如果在组织取样时基因Y未表达,则没有 cDNA 与微阵列上代表基因Y的 DNA 点结合,该点将保持空白。杂交后,使用激光束扫描微阵列,该激光束可以检测应用于 cDNA 的荧光标记。在我们的例子中,基因X的位置将在激光扫描中亮起,而基因Y的点不会。
有几种类型的微阵列技术。虽然有些类型在单个微阵列上分析两个 mRNA 样本(例如,来自处理过的植物和对照植物)(使用“双色标记”;参见网络图 2.4.A),但其他类型使用两个单独的微阵列比较两个样本. 自从最初应用于基因表达分析以来,微阵列技术也已适应许多其他用途,从诊断群体中个体的基因型到确定基因或基因间区域的表观遗传状态。
Web 图 2.4.A 双色标记是一种微阵列技术,可用于比较不同个体或不同条件下的基因表达。
WEB TOPIC 2.5农杆菌转化
根癌农杆菌的转化需要植物和细菌之间的多重、连续的相互作用。当细菌感知到散发出化学乙酰丁香酮的受伤植物时,转化过程就开始了。通常这种化学物质起到抗菌剂的作用,但农杆菌已经进化为使用它作为信号来检测可能被感染的受伤植物。在激活其 T-DNA 后,农杆菌篡夺植物信号转导途径,最终进入植物细胞核并将 T-DNA 插入植物基因组。Web 图 2.5.A中的方框中给出了有关此过程的详细信息。
Web 图 2.5 .农杆菌 感染植物细胞过程中的详细信号转导途径。
WEB TOPIC 3.1计算毛细上升
我们在教科书的第 86 页上了解到,内聚力、粘附力和表面张力的水特性会导致毛细现象,即水在毛细管中向上移动一小段距离。管半径越小,毛细上升越高。可以使用以下公式计算水将移动多远:
其中毛细上升和半径均以米表示。
对于半径为 25 µm 的木质部容器,毛细上升约为 0.6 m。这个距离太小了,对于水运到高大的树木来说意义不大。
细胞壁等纤维材料可以像灯芯一样通过毛细作用从附近的木质部吸水。这种毛细作用确保直接暴露在空气中的细胞壁表面(例如叶肉中的细胞壁表面)保持湿润且不会变干。由于细胞壁毛细血管的半径很小,大约为 10 m –8,因此可以在细胞壁蒸发表面下方的水中产生非常大的物理力。
WEB TOPIC 3.2计算扩散的半衰期
扩散在短距离内很快,但在长距离内非常缓慢
根据 Fick 定律,可以得出物质扩散特定距离所需时间的表达式。如果定义了所有溶质分子都集中在起始位置的条件(参见教科书图 3.8A),那么浓度前沿会远离起始位置,如教科书图 3.8B 中稍后的时间点所示。随着物质远离起点扩散,浓度梯度变得不那么陡峭(Δ c s减小),因此净运动变得更慢。
物质在距起点的任何给定距离处达到起点浓度的二分之一 ( t c = ½) 所需的时间由以下等式给出:
其中K是常数,D s是扩散系数。上式表明物质扩散给定距离所需的时间与该距离的平方成正比。让我们考虑两个数值例子。首先,一个小分子在一个典型的细胞中扩散需要多长时间?葡萄糖等小分子的扩散系数约为 10 –9 m 2 s –1,细胞长度可能为 50 µm。因此,对于这个例子:
该计算表明小分子在细胞维度上迅速扩散。更远距离的扩散呢?计算同一物质移动 1 m 距离所需的时间(例如,玉米叶的长度),我们发现:
这个值比玉米植物的寿命高出几个数量级,而玉米植物的寿命只有几个月。这表明溶液中的扩散可以在细胞维度内有效,但对于长距离的质量传输来说太慢了。正如您将在本书第 4 章中了解到的那样,扩散作为水蒸气从叶子中流失的驱动力非常重要,因为空气中分子的扩散系数远大于水溶液中的扩散系数。
WEB TOPIC 3.3水势成分的替代约定
计划进一步研究植物水分关系的学生应注意,文中定义的水势成分有时会被赋予不同的名称和符号。特别是,方程
(教科书公式 3.5)通常被以下等效公式代替:
在这个替代约定中,P与Ψ p相同。它是溶液的静水压力,可能是正的,如在膨胀细胞中,或负的,如木质部的水。符号 π 称为渗透压,是Ψ s的负值。即,π 为正值,Ψ s为负值。“渗透压”是物理化学家、动物学家和许多其他人用来表示溶解的溶质对水的自由能的影响的术语。大多数物理和化学手册使用术语“渗透压”和符号 π。上式中 π 前面的负号说明了水势的降低 ( Ψw ) 通过溶解的溶质。因此Ψ s = –π。Hammel 和 Scholander (1976) 给出了对渗透压的历史和物理意义的一个非常有趣的(虽然有点不合常规)的说明。
不幸的是,一些作者混合了Ψ s和 π 的约定,导致对符号 π 的含义产生不必要的混淆。因此,π 有时被错误地称为渗透势而不是渗透压,它既可以用作正量,也可以用作负量。
关于基质势,通常用符号t表示。
WEB TOPIC 3.4温度和水势
不同温度下 的RT值和不同溶质浓度溶液的Ψ s值列于下表 3.4.A 中。对于解离成两个或多个粒子的离子溶质,c s必须乘以解离粒子的数量,以说明溶解粒子数量的增加。这不适用于由酸或碱解离释放的 H +或 OH –离子,因为这些离子有助于溶剂而不是稀释溶剂。
网络表 3.4.A
WEB TOPIC 3.5活细胞中是否存在负膨胀压力?
理解植物水分关系的一个具有挑战性的方面是植物体内发生的巨大压力范围,包括正压力和负压力。负压(或张力)取决于水的内聚强度以及木质化细胞壁抵抗变形的强度,在水通过木质部的运输中起着重要作用。正压取决于质膜的半透性和原代细胞壁的弹性,出现在所有水合活植物细胞中,但在筛管和保卫细胞中可能特别大。通常假定活的植物细胞只有正压(例如,教科书图 3.11)。然而,似乎没有理由不能在活植物细胞的细胞质内也出现负压。
当细胞在空气中失去水分时,膨压下降,溶质浓度增加。在膨压损失点(Ψ p = 0),细胞液中的静水压力等于大气压力,这意味着没有净力施加在细胞壁上。如果水继续从细胞中流失,则细胞质内的压力会降至大气压力以下,从而导致力不平衡,从而使细胞壁坍塌。活细胞在干燥时的变形称为细胞硬化。请注意,质膜在整个干燥过程中被压在细胞壁上(即不发生质壁分离),因为细胞质中的静水压力仍然大于质外体中的静水压力(另见教科书图 3.10)。
在上述活细胞中,细胞水势在膨胀损失点以下的降低与细胞体积减小时溶质浓度的增加相平衡。因此,不会产生真正的“负面”压力。相比之下,木质部导管具有抵抗变形的刚性细胞壁,使其能够承受负压而不会内爆。这就提出了当水从具有厚壁或嵌入刚性细胞基质(例如,木质部薄壁组织)的活细胞中丢失时会发生什么的问题。这些细胞可能会抵抗变形并因此产生负膨胀压力吗?
重要的是要强调这是一个有争议的领域,这在很大程度上是由于缺乏对细胞内负膨胀压力的直接测量(Tyree 1976)。然而,在审查负膨胀压力的证据之前,有必要考虑一下活细胞中这种负压的发展可能会产生什么生理影响。负膨胀的主要结果是它允许硬壁细胞降低水势而不发生细胞体积或渗透浓度的重大变化。因为细胞硬化可能会对细胞壁和/或细胞膜造成物理损伤,而细胞体积减少导致的高浓度溶质可能会对细胞膜和蛋白质的构象产生不利影响,
我们现在扭转这个局面,问在活细胞中产生负膨胀压力是否有任何不利因素?在木质部,与负压相关的主要问题是气蚀;这也可能是活细胞的一个问题吗?植物空化的主要机制是空气播种(参见教科书第 4 章),这反映了在水中重新形成气隙的可能性(通过均质或非均质成核)极低的事实(Pickard 1983)。在空气播种中,空气通过细胞壁被吸入,然后它“成核”转变为气相。为了在经历负压的活细胞中进行空气播种,必须将空气拉过细胞壁的非常小的孔。虽然人们可以想象会发生这种情况,
与活细胞产生负压的能力相关的其他成本包括产生刚性细胞壁的代谢成本,以及木质壁可能对生理功能造成的任何限制。此外,通过产生负压来避免因干燥引起的细胞损伤的策略可能会对细胞大小施加限制。细胞承受塌陷(并因此产生负压)的强度与细胞大小成反比。
植物负膨压的证据有限,部分反映了很少有研究人员对这个问题投入太多关注的事实。具有柔性(未木质化)细胞壁的活细胞在干燥时相对容易变形,因此似乎不支持负压。然而,对破坏细胞壁所需的力的测量表明,具有厚壁的活细胞可以承受 1.0 MPa 范围内的力(Oertli et al. 1990)。对适应极冷温度的组织进行目视检查也为阴性膨胀提供了间接证据。例如,冷冻射线薄壁细胞通常不会表现出明显的变形,尽管细胞外冰具有非常强的干燥作用(低水势)。
总之,负膨胀压力仍然是植物水分关系的一个有趣但研究很少的领域。虽然它似乎不会在像叶肉这样容易变形的细胞中形成,但它存在于具有木质化细胞壁或细胞嵌入木质化组织基质中的活细胞中(例如,木头内的活细胞)不能排除。负膨胀压力在防止与严重干燥相关的机械和渗透损伤方面的潜在好处使得该WEB TOPIC值得进一步研究。
WEB TOPIC 3.6测量水势
植物科学家已经付出了相当大的努力来设计准确可靠的方法来评估植物的水分状况。此处描述了四种广泛用于测量Ψ、Ψ s和Ψ p 的仪器:干湿计、压力室、低温渗透压计和压力探头。
湿度计(Ψ测量)
干湿法(前缀“psychro-”来自希腊词psychein,“冷却”)是基于水的蒸气压随着水势降低而降低的事实。干湿计测量溶液或植物样品的水蒸气压力,其原理是水从表面蒸发冷却表面。
Web 图 3.6.A 图解说明使用等压干湿法测量植物组织的水势。
John Boyer 和他的同事(Boyer 和 Knipling 1965)广泛使用了 一种称为等压干湿法的干湿测量技术,并在Web 图 3.6.A中进行了说明。研究人员通过将一块密封的组织放置在一个包含温度传感器(在本例中为热电偶)的小室内与已知溶质浓度(已知Ψ s因此已知Ψ )的标准溶液的小液滴接触来进行测量)。如果组织的水势低于水滴的水势,水就会从水滴中蒸发,通过空气扩散,并被组织吸收。水的这种轻微蒸发使液滴冷却。组织和液滴之间的水势差越大,水转移速率越高,因此液滴越冷。如果标准溶液的水势低于待测样品的水势,水将从组织扩散到液滴,导致液滴升温。测量已知Ψ的几种溶液的液滴温度变化,可以计算液滴和组织之间水的净运动为零的溶液的水势(Web 图 3.6.B) 表示液滴和组织具有相同的水势。
网页图 3.6.B
湿度计可用于测量切除和完整植物组织的水势。此外,该方法可用于测量溶液的Ψ s。这对植物组织特别有用。例如,用干湿计测量组织的Ψ,然后将组织压碎,用同一仪器测量表达的细胞液的Ψ s值。通过结合这两种测量,研究人员可以估计在组织被压碎之前存在于细胞中的膨胀压力 ( Ψ p = Ψ – Ψ s )。
这种方法的一个主要困难是测量对温度波动的极端敏感性。例如,0.01°C 的温度变化对应于约 0.1 MPa 的水势变化。因此,干湿计必须在恒温条件下运行。因此,该方法主要用于实验室环境。湿度测量技术有很多变化。感兴趣的读者应该参考 Brown 和 Van Haveren 1972、Slavik 1974 和 Boyer 1995。
压力室(Ψ测量)
估计大块组织(例如叶子和小枝条)的水势的相对快速的方法是使用压力室。这种方法是由都柏林三一学院的亨利·迪克森在 20 世纪初开创的,但直到斯克里普斯海洋研究所的 P. Scholander 和同事改进了仪器设计并展示了它的实际用途,它才得到广泛使用(Scholander 等人,1965 年)。
在这种技术中,要测量的器官从植物中切除,部分密封在压力室中(Web 图 3.6.C)。切除前,木质部中的水柱处于张力状态。当水柱因器官切除而破裂时(即,其张力得到缓解,允许其Ψ p上升到零),水通过渗透从木质部迅速拉入周围的活细胞。因此,切割表面显得暗淡干燥。为了进行测量,研究人员用压缩气体对腔室加压,直到活细胞和木质部导管之间的水分布恢复到其初始的切除前状态。这可以通过观察水何时返回到可以在切割表面中看到的木质部管道的开口端来直观地检测到。使水回到其初始分布所需的压力称为平衡压力,并且很容易通过切割表面外观的变化来检测,当达到该压力时,切割表面会变得潮湿和发亮。
Web 图 3.6.C 压力室法测量植物水势。左图显示了密封在腔室中的射流,该腔室可以用压缩气体加压。右图显示了三个时间点木质部内的水柱状态: (A) 木质部未切割且处于负压或张力下。(B) 芽被切割,导致水拉回组织,远离切割表面,以响应木质部的张力。(C) 腔室加压,将木质部汁液带回切割表面。
压力室通常被描述为测量木质部张力的工具。然而,这仅适用于在非蒸腾的叶子或枝条上进行的测量(例如,先前已封装在塑料袋中的叶子或枝条)。当没有蒸腾作用时,叶细胞的水势和木质部的水势就会达到平衡。在这种非蒸腾枝上测得的平衡压力与木质部中的压力 ( Ψ p ) 大小相等但符号相反。因为我们的非蒸腾叶片的水势等于木质部的水势,所以可以通过将Ψ p和Ψ s相加来计算叶子的水势木质部,前提是采集木质部汁液样本以测定Ψ s。幸运的是,与典型的木质部正午张力( Ψ p为 –1 到 –2 MPa )相比,木质部的Ψ s通常较小(> –0.1 MPa )。因此,经常省略对木质部汁液 的Ψ s的校正。
蒸腾叶的平衡压力测量更难以解释。水从木质部流向叶子的事实意味着必须存在水势差异。当蒸腾的叶子或枝条被切断时,木质部的张力立即得到缓解,水分被吸入叶细胞,直到木质部和叶细胞的水势达到平衡。因为叶细胞的总体积远大于木质部汁液的体积,所以这种平衡水势将严重偏向叶的水势。因此,对这种叶子或枝条上的平衡压力的任何测量都将产生一个近似于叶子的水势的值,而不是木质部的张力。(确切地说,必须添加Ψs到平衡压力的负值以获得叶片水势。)可以通过比较覆盖的平衡压力(即,非蒸腾)与未覆盖(蒸腾)的叶子。
压力室测量提供了一种快速准确地测量叶片水势的方法。因为压力室方法不需要精密仪器或温度控制,它已在现场条件下广泛使用(Tyree 和 Hammel 1972)。有关压力室的理论和操作的更完整描述,请参见 Boyer,1995。
低温渗透压计(Ψ s测量)
低温渗透压计通过测量溶液的冰点来测量溶液的渗透势 。溶液具有依数性质,这些性质共同取决于溶解颗粒的数量,而不取决于溶质的性质。例如,溶质会降低溶液的蒸气压,提高其沸点并降低其凝固点。溶质的具体性质无关紧要。溶液的依数性质之一是随着溶质浓度的增加,凝固点降低。例如,每千克水含有 1 mol 溶质的溶液的冰点为 –1.86°C,而纯水的冰点为 0°C。
可以使用各种仪器来测量溶液的冰点降低(两个例子,参见 Prager 和 Bowman 1963,以及 Bearce 和 Kohl 1970)。使用低温渗透压计,将小至 1 纳升 (10 –9 L) 的溶液样品置于位于显微镜温控台上的油介质中(Web 图 3.6.D)。非常小的样本量可以测量来自单个细胞的汁液,并允许与载物台进行快速热平衡。为防止蒸发,研究人员将样品悬浮在银板(银具有高导热性)中的充油孔中。载物台的温度迅速降低到大约 –30° C,这导致样品冻结。然后非常缓慢地升高温度,并通过显微镜观察样品中的熔化过程。当样品中最后一个冰晶融化时,记录台的温度(注意熔点和冰点相同)。从冰点降低计算溶质浓度很简单;并由溶质浓度 ( c s ) Ψ s计算为–RTc s。该技术已用于测量从单个细胞中提取的液滴(Malone 和 Tomos 1992)。
Web 图 3.6.D 低温 渗透压计通过测量溶液的冰点降低来测量总溶解溶质的浓度。(A) 非常小的液体样品被加载到显微镜的温度控制阶段。(B) 当温度迅速降低时,样品过冷并冻结。(C) 缓慢加热舞台导致样品解冻。最后一个冰晶融化的温度提供了样品熔点的量度。
压力探头(Ψ p测量)
如果一个细胞像西瓜甚至葡萄那么大,那么测量它的静水压力将是一项相对容易的任务。然而,由于植物细胞的体积小,直接测量膨压的方法的发展一直很缓慢。使用微压计,宾夕法尼亚大学的 Paul Green 开发了第一个直接测量植物细胞膨胀压力的方法(Green 和 Stanton 1967)。在这种技术中,将一端密封的充气玻璃管插入电池中(Web 图 3.6.E)。电池中的高压压缩了捕获的气体,从体积的变化可以很容易地根据理想气体定律(压力 × 体积 = 常数)计算电池的压力。这种方法仅适用于体积相对较大的细胞,例如丝状绿藻Nitella 的巨细胞。对于较小的细胞,细胞液流失到玻璃管中足以使细胞放气,这会产生人为的低压。
Web 图 3.6.E 使用微压计(压力探针)来测量细胞膨胀压力。Nitella细胞(特别大——直径约 100 毫米,长数厘米)用于这些测量。(在格林 1968 之后。)
对于体积比Nitella 小几个数量级的高等植物细胞,Ernest Steudle、Ulrich Zimmermann 和他们在德国的同事开发了一种更复杂的设备,即压力探头(Husken 等人,1978 年)。该仪器类似于微型注射器(Web 图 3.6.F)。将玻璃微毛细管拉至细点并插入细胞中。微毛细管充满硅油,这是一种相对不可压缩的流体,在显微镜下很容易与细胞液区分开来。当微毛细管的尖端首次插入细胞时,由于该区域的初始低压,细胞液开始流入毛细管。研究人员可以在显微镜下观察树液的这种运动,并通过推动装置的柱塞来抵消它,从而建立压力。以这种方式,油和细胞液之间的边界可以被推回微毛细管的尖端。当边界返回到尖端并保持在恒定位置时,细胞的初始体积恢复,细胞内的压力与毛细管中的压力完全平衡。该压力由设备中的压力传感器测量。因此,可以直接测量单个电池的静水压力。
Web 图 3.6.F 最简单的压力探头示意图(未按比例)。与Web 图 3.6.E中所示的方法相比,这种方法的主要优点是细胞体积受到的干扰最小。对于高等植物典型的微小细胞而言,最小的干扰非常重要,其中即使损失几皮升 (10 –12 L) 的液体也可以显着降低膨胀压力。
该方法已用于测量各种植物物种的切除组织和完整组织的细胞中的Ψ p和其他水关系参数(Steudle 1993)。这种方法的主要限制是某些细胞太小而无法测量。此外,一些细胞在被毛细管刺伤后往往会泄漏,而另一些细胞会堵塞毛细管的尖端,从而阻止有效的测量。压力探头也适用于测量木质部Ψ p的正值和负值(Heydt 和 Steudle 1991)。然而,空化的技术问题(参见教科书第 4 章)限制了通过这种技术 测量负Ψ p 。
WEB TOPIC 3.7衬质势
在讨论土壤、种子和细胞壁时,人们经常会发现Ψ的另一个组成部分:基质势 ( Ψ m )。当水以一个或两个分子厚、吸附在相对干燥的土壤颗粒、细胞壁和其他材料的表面上时,基质势用于说明水的自由能减少。基质势并不代表作用于水的新力,因为理论上可以通过对Ψ s和Ψ p的影响来解释表面相互作用的影响(参见 Passioura 1980;Nobel 1999)。然而,在干燥材料中,这种表面相互作用效应通常不容易分解为Ψp和Ψ s成分在干燥材料中,因此它们经常聚集在一起并指定为基质势。
将Ψ m添加到Ψ s和Ψ p的独立测量值以得出总水势 通常是无效的。对于水合细胞和细胞壁内的水尤其如此,其中基质效应要么可以忽略不计,要么可以通过Ψ p的减少来解释。例如,叶片蒸发表面处的细胞壁微毛细血管所保持的水中负压,见第 10 页。91 的教科书,有时被描述为墙矩阵势。在Ψ p、Ψ s和Ψ的定义中考虑这种物理效应时,需要注意避免不一致米(Passioura 1980)。
WEB TOPIC 3.8枯萎和质壁分离
质壁分离是植物细胞质因失水而与细胞壁分离。它不太可能在自然界发生,除非在恶劣的条件下。在实验室中,通过将植物细胞浸入强盐水或含糖溶液中来诱导质壁分离,从而通过渗透作用损失水分。
如果将洋葱表皮组织浸入硝酸钙溶液中,细胞通过渗透作用迅速失水,细胞原生质收缩(Web 图 3.8.A)。这是因为钙离子和硝酸根离子自由地渗透细胞壁并遇到选择性渗透的质膜。细胞中心的大液泡最初含有一种渗透压比膜另一侧的硝酸钙溶液低得多的稀溶液。液泡因此失去水分并变小。细胞膜和细胞壁之间的空间扩大,质膜和其中的原生质收缩到细胞中心。由于质膜-细胞壁附着点,细胞质链延伸到细胞壁。除非将它们从盐或糖溶液中迅速转移到水中,否则纤溶细胞会死亡。
Web 图 3.8.A加入硝酸钙后洋葱表皮细胞的质壁分离。叶绿体和液泡都变得不均匀。在收缩的原生质和相邻细胞之间保留有细胞质链。(由汉堡大学 Peter v. Sengbusch 博士提供。)
WEB TOPIC 3.9了解水力传导率
考虑一个初始水势为 –0.2 MPa 的电池,浸没在纯水中。从这些信息我们知道水会流入细胞,驱动力是ΔΨ = 0.2 MPa,但初始运动速率是多少?该速率取决于膜对水的渗透性,该属性通常称为膜的水力传导率( Lp )(参见教科书图 3.13)。
驱动力、膜渗透性和流速由以下等式相关:
流量=驱动力×导水率
水力传导率表示水在膜上移动的难易程度,单位时间内每单位驱动力(例如,m 3 m –2 s –1 MPa –1或 ms –1 MPa –1 )。水力传导率越大,流量越大。在教科书图 3.13 中,膜的水力传导率为 10 –6 ms –1 MPa –1。然后可以从以下等式计算 传输(流量)速率(J v ):
其中J v是每单位膜面积和每单位时间穿过膜的水量(m 3 m –2 s –1或等效地,ms –1)。请注意,这个方程假设膜是理想的——也就是说,溶质迁移可以忽略不计,而水的迁移对跨膜的ΔΨ s和ΔΨ p同样敏感。非理想膜需要一个更复杂的方程,分别说明由ΔΨ s和ΔΨ p引起的水流(Nobel 1999)。
在我们的示例中,J v的值为 0.2 × 10 –6 ms –1。请注意,J v具有速度的物理意义。我们可以通过将J v乘以细胞的表面积 来计算体积术语 (m 3 s –1 )的流速。
结果值是水运的初始速率。随着水的吸收,细胞Ψ增加,驱动力 ( ΔΨ ) 减小。因此,水运会随着时间的推移而减慢。正如教科书第 94-95 页所阐述的那样,该比率以指数方式接近零(参见 Dainty 1976)。
WEB TOPIC 4.1灌溉
几乎只要人们从事农业,人们就使用灌溉为农作物提供水源。在亚利桑那州南部严酷炎热的沙漠中,史前霍霍卡姆美洲原住民社区挖掘了广泛的灌溉渠网络,将附近盐河的水引到他们的农作物上。因此,他们的社会在原本会灭亡的地方蓬勃发展。航拍照片揭示了这些古老运河的位置,这些运河沿袭了许多与当今遍布亚利桑那州凤凰城地区的混凝土内衬水道相同的路线。
在被称为“文明摇篮”的美索不达米亚底格里斯河和幼发拉底河谷(现代伊拉克和叙利亚),灌溉农作物产生了类似的结果。当灌溉的田地被“盐渍化”时,文明可能已经衰落——由于劣质水源不断地向土壤中添加盐分而变得毫无用处。古代秘鲁的印加人也实行广泛的灌溉,包括一些创新方法,包括高架床和从地下供水。
今天在世界农业中实行的灌溉遵循与古代相同的一般原则。水是昂贵的,因此必须尽可能有效地使用。如果使用地表水,则必须建造和维护水坝和水道。如果从地面抽水,则必须消耗能量将其提升到地面。
或许令人惊讶的是,在水到达田间植物之前,就遇到了用水效率低下的大部分问题。湖泊的蒸发、运河的渗漏、运河中生长的水草的蒸腾以及田间施肥不均等只是灌溉专家面临的一些问题。如果 50% 的可用水被输送到它所支持的作物的根区,则该系统被认为是有效的。
已经开发了多种方法来将水输送到田间。如果土地可以适当分级和倾斜,则可以在植物行之间放置具有非常轻微下坡坡度的犁沟。然后在上坡端施加水并使其流过犁沟。一些水被浪费了,因为在上坡端的土壤在足够的水被输送到田地中间之前就已经饱和了。水也可能在下坡末端“积水”。
越来越多地使用水平流域灌溉来克服这些问题。大型盆地通过激光定向机械平整到 10 到 20 毫米以内。如果土壤在整个盆地中具有均匀的渗透性,则这种平整可以使水均匀地施用。如果土地无法平整或施用的水量很少,则通常使用洒水器。然而,洒水器不仅需要能量来泵送和加压水,而且它们还会产生蒸发过度的小水滴。此外,如果水质不好,洒水会使盐分直接沉积在叶子上,从而伤害植物。在某些情况下,晚上洒水可以防止大部分伤害,因为含盐的水滴不会蒸发得那么快。
一些粘土含量非常高的土壤在湿润时会膨胀,在干燥时会收缩和开裂。当它们变湿时,它们往往会变得密封,并且水进入非常缓慢。对于这些开裂的粘土,已经开发了一种称为浪涌灌溉的技术。水非常迅速地供应到田间,以便在土壤膨胀和裂缝消失之前,它可以顺着裂缝流下并进入根区。
近年来,一种称为滴灌(也称为滴灌或微灌)的技术) 已在世界某些地区投入使用。水通过塑料管直接泵送到植物的底部,并以刚好满足植物需要的缓慢速度通过发射器排出。这种方法非常有效,但也非常昂贵,并且需要对硬件进行勤勉的维护以保持系统正常工作。例如,发射器往往会被矿物质沉积物和微生物产生的粘液堵塞。必须定期用酸或消毒剂冲洗系统。到目前为止,滴灌主要用于高价值作物,其质量(和价格)在很大程度上取决于可靠的水供应。在这种情况下,滴灌的利润将支付额外的成本。
随着滴灌等极其高效的灌溉系统的出现,人们可以将更多的注意力转移到作物本身对水的低效利用以及植物用水效率的可能改进上。植物中水的生理学是一个令人兴奋的研究领域,因为许多问题有待解决。例如,粮食作物在开花时对干旱最敏感,此时非常年轻的胚胎流产会导致植物不育。解决这些问题将使农艺师即使不依靠灌溉也能确保粮食产量可靠。
WEB TOPIC 4.2土壤的物理性质
土壤导水率是土壤水势的函数。电导率测量水通过土壤的难易程度。随着含水量(以及水势)的降低,水力传导率急剧下降(Web 图 4.2.A,注意对数刻度)。
网页图 4.2.A 土壤水力传导率是土壤水势的函数。电导率测量水通过土壤的难易程度。随着土壤干燥,电导率的降低主要是由于空气进入土壤以取代水。随着空气进入,土壤颗粒之间的水流路径变得更小、更曲折,流动变得更加困难。这条曲线的整体形状代表了许多土壤,但特定土壤的形状可能会受到其颗粒大小分布和有机质含量的影响。田间容量是土壤能够抵抗重力的水量。永久萎蔫点是植物即使在夜间也不能恢复膨压的土壤水势值,
随着土壤干燥,电导率的降低主要是由于空气进入土壤以取代水。随着空气进入,土壤颗粒之间的水流路径变得更小、更曲折,流动变得更加困难。
这条曲线的整体形状代表了许多土壤,但特定土壤的形状可能会受到其颗粒大小分布和有机质含量的影响。
田间容量(在曲线上标记)是土壤能够抵抗重力的最大水量。永久萎蔫点(在曲线上标记)是植物即使在没有蒸腾作用的夜间也不能恢复膨压的土壤水势值。
WEB TOPIC 4.3计算木质部和活细胞中的水运动速度
让我们首先注意到水沿着树干向上流动的速度取决于树木的类型和木质部的蒸腾需求。对于具有宽血管(半径为 100 至 200 µm)的树木,测得的峰值速度为 16 至 45 mh –1(4 至 13 mm s –1)。具有较小血管(半径为 25 至 75 µm)的树具有较低的峰值速度,从 1 至 6 mh –1(0.3 至 1.7 mm s –1)。对于我们的计算,我们将使用 4 mm s –1作为木质部传输速度和 40 µm 作为容器半径的数字。对于如此狭窄的容器来说,这是一个很高的速度,因此它往往会夸大支持木质部中的水流所需的压力梯度。
Poiseuille 方程的一个版本(参见教科书方程 4.2)可用于估计以该速度(4 × 10 –3 ms –1 ) 移动水通过半径为( r ) 40 微米。通过将教科书公式 4.2 除以木质部容器的横截面积 (π r 2 ),我们发现传输速率 ( J v , in ms –1 ) 由以下公式给出:
将木质部汁液的粘度设为水的粘度(10 –3 Pa s),我们发现所需的压力梯度为 2 × 10 4 Pa m –1(或 0.02 MPa m –1)。这是克服当水以 4 mm s –1的速率通过理想容器时产生的粘性阻力所需的压力梯度。真实的容器具有不规则的内壁表面和收缩,例如在容器元件相遇的点处的穿孔板。管胞的直径更小,壁有凹坑,对水流的阻力更大。与理想管道的这种偏差将增加摩擦阻力,高于泊肃叶方程计算的值,但由于我们选择了一个较低的容器半径值,我们估计的 0.02 MPa m –1应该在真实树木中发现的压力梯度的正确范围内.
现在让我们将该值 (0.02 MPa m –1 ) 与使水以相同速度通过一层活细胞所需的驱动力进行比较。在这个例子中,我们将忽略质外体途径中的水运动,并关注水从一个细胞到另一个细胞的运动,每次都穿过质膜。正如我们在教科书第 3 章中所描述的,水流过膜的速度 ( J v ) 取决于膜的水力传导率 ( Lp ) 和跨膜的水势差 ( ΔΨ w ):
高等植物细胞的Lp值较高,约为 4 × 10 –7 ms –1 MPa –1。因此,要使水以 4 × 10 –3 ms –1的速度穿过膜,需要10 4 MPa的驱动力 (Δ Ψ w ) (4 × 10 –3 ms –1除以 4 × 10 –7 ms –1兆帕–1 )。这是使水流过单个膜所需的驱动力。要通过细胞,水必须至少穿过两层膜,因此穿过一个细胞的总驱动力为 2 × 10 4兆帕。如果我们估计细胞长度为 100 µm(10 –4 m,一个大方的估计),那么水以 4 mm s –1的速度穿过一层细胞所需的水势梯度将为 2 × 10 4 MPa 除以 10 –4 m,或 2 × 10 8 MPa m –1。这是一个巨大的驱动力,它说明流过木质部的水流比流过细胞膜的水流效率更高。比较这两种驱动力(对于开放血管和细胞运输),我们看到这两种途径显示出 10 10倍的差异。这确实是一个巨大的差异。
WEB TOPIC 4.4叶蒸腾和水蒸气梯度
叶片的蒸腾取决于两个主要因素:叶片空气空间与外部空气之间的水蒸气浓度差异,以及该路径的扩散阻力 ( r )。这种蒸腾作用的概念类似于电路中的电子流动。实际上,电气模拟通常用作叶片中水蒸气损失的模型。
在这个类比中,阻力与通路的每个部分相关。主要是气孔处的阻力(rs)和叶片表面未搅动的空气层(rb )(所谓的边界层)造成的阻力。蒸腾速率 ( E , in mol m –2 s –1 ) 可能与扩散阻力 ( r , in sm –1 ) 相关,公式如下:
网络方程 4.4.1
让我们更详细地研究 Web 公式 4.4.1 中的因素。水蒸气浓度的差异表示为c wv (leaf) – c wv (air)。(有时使用蒸气压代替浓度,差值称为水蒸气 压差。水蒸气压 ( p wv ) 以千帕 (kPa) 为单位测量,与水蒸气浓度成正比(Web 表 4.4.A),其中c wv (leaf)是叶片内部的水蒸气浓度,c wv (air)是叶片外部空气的水蒸气浓度,均以摩尔每立方米 (mol m –3)。电阻 ( r ) 是电导的倒数;也就是说,电阻 = 1/电导。因此,高电阻与低电导相同。在某些情况下,用电阻表示这个值优于用电导表示,因为可以将串联电阻相加以计算总电阻,如上述等式,而类似的串联电导计算更复杂。在叶片中,总阻力主要是由于气孔所施加的扩散限制,但水汽损失路径的其他部分,例如边界层(我们将很快讨论),可能对r有很大贡献。
蒸气压和浓度相等;在我们的分析中,我们将使用后者。大量空气的水蒸气浓度 ( c wv (air) ) 可以很容易地测量,但叶子的水蒸气浓度 ( c wv (leaf)) 更难评估。我们可以通过假设叶片中的空气空间与细胞壁表面接近水势平衡来估计它。这种近似并不严格正确,因为水正在从这些表面扩散开来。然而,它引入的误差很小,因为对蒸汽损失的主要阻力是在气孔处。此外,叶子内部的空气空间体积小,而水分蒸发的湿表面相对较大。松针的空气空间体积约为总叶体积的 5%,玉米叶为 10%,大麦叶为 30%,烟叶为 40%。水分蒸发的内表面积可能是外叶面积的 7 至 30 倍。这种表面积与体积的高比率使得叶片内的蒸汽快速平衡。
假设平衡,我们可以计算叶片空气空间中的水蒸气浓度,如果我们知道: (1) 叶片的水势(与蒸发水的壁面的水势相同) ,和(2)叶片温度。让我们以水势为 –1.0 MPa 的叶子为例。为了达到蒸汽平衡,水从细胞壁表面蒸发,直到叶片内部空气的水势等于叶片的水势。空气的水势由下式给出:
网络方程 4.4.2
其中R是气体常数,T是温度(以开氏度为单位),V – w是液态水的偏摩尔体积,RH是空气的相对湿度。相对湿度是水蒸气浓度,表示为饱和水蒸气浓度c wv(sat.)的分数:
网络方程 4.4.3
RH在 0 和 1 之间变化;RH乘以 100 是相对湿度百分比。
Web 表 4.4.A 显示了作为水势函数的RH值,由 Web 公式 4.4.2 计算得出。该表显示,当水势处于生理范围内时,活叶的空气空间必须具有高RH ,接近 1 (100%) 的值。此外,相对湿度为例如 0.5 (50%) 的外部空气具有非常低的水势。
Web 表 4.4.A 注:这些数据适用于 20°C。 a使用 Web 公式 4.4.2 计算, RT / V w的值为 135 MPa 。
要从RH转换为c wv,我们需要知道c wv(sat.)。饱和水蒸气浓度强烈依赖于温度。随着空气温度的升高,空气的持水能力急剧增加,(Web 图 4.4.A)。在 10 到 35°C 的范围内,空气温度每升高 12°C,饱和空气中的水蒸气浓度就会增加一倍。这是一个重要的观察。如果我们的水势为 –1.0 MPa 的叶子突然从 20°C 升温到 32°C,则叶子空气空间中的相对湿度突然从 99.3% 下降到近 50%。RH的下降是因为空气的持水能力c wv (sat.),双打。由于RH下降,水会在空气空间中蒸发,直到RH恢复到 99.3% 的值,空气再次与叶片处于水势平衡状态。由于这种温度变化,c wv(leaf)(叶空气空间的水蒸气浓度)从 0.95 增加到 1.87 mol m -3,这使得浓度差变得更陡峭,从而推动了水的扩散损失。叶子。因此,叶温是蒸腾速率的重要决定因素。
Web 图 4.4.A 饱和空气中的水蒸气浓度与气温的关系。
教科书表 4.1 说明了RH、c wv和水势如何在蒸腾路径中的各个点发生变化。我们看到,c wv沿着从细胞壁表面到叶外大量空气的路径的每一步都减小。请记住,相对湿度可以沿着这条路径的一部分增加,因为外部气温可能低于叶子的温度。要记住的要点是(1)叶片水分流失的驱动力是绝对浓度差(c wv的差异,而不是RH的差异),以及(2)这种差异取决于叶片温度。
WEB TOPIC 5.1必需矿物质缺乏的症状
韦德贝瑞,加州大学洛杉矶分校
介绍
视觉营养缺乏症状可以成为评估植物营养状况的非常强大的诊断工具。然而,人们应该记住,给定的个体视觉症状很少足以对植物的营养状况做出明确的诊断。许多典型的缺乏症症状,如尖端烧伤、萎黄和坏死,都与一种以上的矿物质缺乏症以及其他压力有关,这些压力本身不能诊断任何特定的营养压力。然而,它们的检测对于评估营养状况非常有用。除了对形态和光谱症状的实际观察之外,了解这些症状的位置和时间是任何营养状况评估的关键方面。植物不会孤立生长,它们是整体环境的一部分,因此它们对影响养分供应的环境变化作出反应。此外,植物确实会影响其环境,并可能导致环境变化,进而影响植物的营养状况。
视觉症状的来源
盐度、病原体和空气污染等压力会诱发其特有的一组视觉症状。通常,这些症状与营养缺乏的症状非常相似。病原体通常会导致静脉内萎黄症,空气污染和盐分压力会导致尖端烧伤。尽管起初这些症状的总体外观可能与营养缺乏症状相似,但它们在细节和/或整体发育模式上确实不同。病理症状通常可以通过其在受影响植物种群中的分布与营养症状区分开来。如果植物处于营养胁迫下,相同环境中给定类型和年龄的所有植物往往会同时出现相似的症状。然而,如果压力是病理的结果,
环境协会
植物在其正常的生长周期中会从土壤中去除大量的养分,并且由于这一过程会发生许多长期的环境变化。对土壤的影响远远超出直接去除或消耗养分的范围。在养分吸收过程中,植物-土壤系统必须保持电荷平衡。电荷平衡通常通过植物排泄质子和/或氢氧根离子来代替吸收的营养阳离子或阴离子来实现。例如,当植物用氨施肥时,它们以铵阳离子的形式获得大部分氮,而不是从通常的硝酸根阴离子中获得。因为硝酸盐是植物大量使用的唯一阴离子,这种变化的最终结果是,在正常的养分吸收过程中,质子的排泄量将远远超过氢氧根离子的排泄量。在生长旺盛的植物的情况下,排出的质子量可以大到足以将土壤的 pH 值降低几个 pH 单位。如此大的土壤 pH 值变化可能对许多土壤过程产生重大影响,例如土壤结构、养分有效性和养分流失。对土壤的直接影响可能有利于某些植物,尤其是喜欢酸的植物,因为它往往会使铁更容易获得。然而,从长远来看,降低土壤 pH 值可能对植物有害,因为养分的可用性会发生变化。较低的土壤 pH 值将使微量营养素更容易从土壤剖面中浸出,最终导致 Cu 和 Zn 等营养素的缺乏。此外,当土壤的 pH 值远低于 pH 5 时,
植物通常被认为与环境相比是被动的。然而,这并不总是一个有效的假设;因为有许多植物明显地以一种倾向于使某些营养素更容易获得的方式操纵它们的环境。例如,铁在许多农业地区是一种限制性养分,但它占平均土壤的 3% 左右,如果可用的话,将远远超过平均植物的需求。一些植物积极排泄质子,由此产生的 pH 值降低会增加铁在其环境中的溶解度。此外,其他植物分泌的植物铁素能螯合土壤铁,使其成为植物更容易获得的形式(见教科书第 372 页)。
症状发展的途径
乍一看,13 种已知必需矿物质营养素的缺乏症状的区分似乎相对简单。但这样的假设是不正确的。事实上,缺乏症的症状相当复杂,因为每种营养素都有许多不同的生物学功能,并且每种功能可能与广泛的环境参数有一组独立的相互作用。此外,这些症状的表现因急性或慢性缺乏症而异。当快速生长的植物突然无法获得某种营养物质时,就会发生急性缺乏症。当养分供应有限但持续供应不足,不足以满足植物的生长需求时,就会发生 慢性缺乏症。
教科书中描述的大多数经典缺乏症状都是急性缺乏的特征。低度、慢性缺陷的最常见症状是叶片呈深绿色,生长发育迟缓或缓慢。通常,大多数已发表的缺陷症状描述来自在温室或生长室中进行的实验,植物在水培法或营养完全可用的培养基中生长。在这些条件下,养分在存在时很容易获得,但是当养分耗尽时,植物会突然面临严重的缺乏。因此,水培研究有利于急性缺陷的发展。
在旨在研究微量营养素缺乏症状的实验中,微量营养素通常从营养液中省略。微量营养素通常存在于种子中或作为环境中的污染物存在,因此足够大小的植物会耗尽这些微量营养素并发展出特征性的急性缺乏系统。当大量营养素缺乏症状时寻求时,从合适大小的快速生长的植物中突然去除大量营养素。或者,植物最初可以一次性提供足够有限量生长的养分。由于快速生长的植物持续需要相对大量的大量营养素,可用的营养素将迅速耗尽,导致急性缺乏。
在自然系统中,植物会遇到许多程度和类型的压力,这些压力会导致随着时间的推移出现不同类型的症状。也许自然环境中最常见的养分缺乏是由于土壤风化过程以低速率不断更新的有限养分供应的情况。在这种情况下,有限的营养供应会导致慢性营养缺乏症状。
营养迁移对症状发展的影响
植物中养分流动性和植物生长速率之间的相互作用可能是影响出现的缺乏症状的类型和位置的主要因素。对于流动性很强的养分,如氮和钾,缺乏症状主要出现在较老和成熟的叶子上。这是因为这些养分在营养胁迫期间从老叶优先转移到植物生长区域附近的新叶。此外,根系新获得的流动养分也优先转移到新叶和生长区域。因此,在压力期间,老叶和成熟叶会耗尽可移动的养分,而新叶则保持在更有利的养分状态。
钙、硼、铁等流动性极弱的营养素缺乏症状的典型定位与流动性营养素相反;这些缺乏症状首先表现在生长区域和新叶中,而老叶则保持良好的营养状态。(这假设这些植物开始时有足够的营养,但随着它们的发育而耗尽了营养)。在由于营养以外的原因(例如光线不足)而生长非常缓慢的植物中,在这些条件下,通常限制营养的供应可能足以使植物缓慢发育,甚至可能没有症状。这种类型的发育很可能发生在弱移动养分的情况下,因为老叶中多余的养分最终会被调动起来供应新发育的组织。相比之下,具有类似供应且快速生长的植物将在活跃生长的组织(例如叶边缘和植物的生长区域)中出现严重缺陷。一个典型的例子是生菜等蔬菜缺钙,症状出现在叶缘(尖端烧伤)和分生组织附近的生长区域。莴苣的最大生长速度通常受钙向生长组织的内部转移速度的限制,而不是受土壤中有限的养分供应限制。一个典型的例子是生菜等蔬菜缺钙,症状出现在叶缘(尖端烧伤)和分生组织附近的生长区域。莴苣的最大生长速度通常受钙向生长组织的内部转移速度的限制,而不是受土壤中有限的养分供应限制。一个典型的例子是生菜等蔬菜缺钙,症状出现在叶缘(尖端烧伤)和分生组织附近的生长区域。莴苣的最大生长速度通常受钙向生长组织的内部转移速度的限制,而不是受土壤中有限的养分供应限制。
当硫和镁等适度流动的养分成为系统的限制养分时,通常会在整个植物上看到缺乏症状。然而,生长速度和养分利用率会对症状出现的部位产生相当大的影响。如果养分供应与生长速度相比是微不足道的,则较老的组织会出现症状,但如果养分供应与生长速度相比非常低,或者养分完全耗尽,则年轻的组织首先会变得缺乏。
植物竞争和诱发缺陷
当观察到的症状是营养缺乏的直接结果时,纠正所需的行动相对简单。然而,症状通常是与其他环境因素相互作用的结果,这些因素限制了症状所表达的营养素的可用性。典型的例子是环境中重金属过量引起的缺铁。Cu、Zn Cr 和 Ni 等过渡金属与 Fe 竞争植物吸收。吸收竞争并非特定于铁和重金属,而是适用于所有化学性质相似且具有相似吸收机制的矿物质营养素。例如,如果 Cu 或 Zn 的可用性相对低于 Fe 的可用性,那么某些其他金属(例如 Ni 或 Cr)的浓度过高会导致其中一种营养素的缺乏,而不是 Fe。在宏量营养素的情况下,过量的镁会与钾竞争吸收,并可能导致钾缺乏。蛇纹石土壤的贫瘠是这种竞争的结果,这些土壤的高镁会导致钙缺乏。低 pH 值土壤的毒性是基本营养缺乏的另一个例子。低 pH 值对土壤养分有双重影响:它增强了阳离子的浸出,降低了它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。在宏量营养素的情况下,过量的镁会与钾竞争吸收,并可能导致钾缺乏。蛇纹石土壤的贫瘠是这种竞争的结果,这些土壤的高镁会导致钙缺乏。低 pH 值土壤的毒性是基本营养缺乏的另一个例子。低 pH 值对土壤养分有双重影响:它增强了阳离子的浸出,降低了它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。在宏量营养素的情况下,过量的镁会与钾竞争吸收,并可能导致钾缺乏。蛇纹石土壤的贫瘠是这种竞争的结果,这些土壤的高镁会导致钙缺乏。低 pH 值土壤的毒性是基本营养缺乏的另一个例子。低 pH 值对土壤养分有双重影响:它增强了阳离子的浸出,降低了它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。蛇纹石土壤的贫瘠是这种竞争的结果,这些土壤的高镁会导致钙缺乏。低 pH 值土壤的毒性是基本营养缺乏的另一个例子。低 pH 值对土壤养分有双重影响:它增强了阳离子的浸出,降低了它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。蛇纹石土壤的贫瘠是这种竞争的结果,这些土壤的高镁会导致钙缺乏。低 pH 值土壤的毒性是基本营养缺乏的另一个例子。低 pH 值对土壤养分有双重影响:它增强了阳离子的浸出,降低了它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。减少它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。减少它们在土壤中的可用性,并且土壤中相对丰富的质子与 Ca 和其他阳离子竞争吸收。因此,营养缺乏可以由许多不同的机制引起,这些机制通常协同工作以限制营养的可用性。
营养需求和使用效率
尽管同一物种的所有植物对养分胁迫的反应相似,但相似物种的植物通常会在养分利用效率方面表现出显着差异。这是由于生长速率、根系分布、发育阶段以及养分吸收和利用效率的差异造成的。这意味着在任何给定的位置,一个物种的植物可能会变得营养缺乏,而在它们旁边生长在相同环境中的另一个物种的植物可能不会表现出任何缺乏症状。
生长速度也会影响营养状况。当养分供应在现有环境条件下几乎不足以生长时,许多植物会调整其生长速度以匹配可用养分供应所支持的速度,而不会表现出典型的视觉缺陷症状。
农业系统与自然系统的不同之处在于,农作物的选择主要是为了在低胁迫条件下快速生长。这种快速的生长速度导致这些植物对养分的需求很高,并且除非提供补充肥料,否则养分缺乏的发生率更高。农作物表现出严重的营养压力迹象并不罕见,而生长在同一地区的本地植物几乎没有或没有营养压力的迹象。在农业系统中,慢性缺乏症状主要发生在施肥很少或有限的作物中。当引入具有更高养分需求的新作物,或为生产快速生长的农作物而种植生产力较低的土地时,最常出现急性养分缺乏症状。
营养状况的均匀性
在压力期间,并非植物的所有组织都处于相同的营养状态。同一植物上的叶子暴露于不同的环境条件(如光照)或不同年龄的叶子可能在营养状况上有很大差异。矿物质养分大部分由根部获得并在整个植物中转移。植物任何部分到根部的距离都会影响养分的有效性,特别是在流动性较差的养分的情况下。在从营养缺乏中恢复的植物中,根和导电组织首先恢复。例如,在从缺铁中恢复的情况下,通常会看到静脉重新变绿,而静脉间组织仍然褪绿和缺铁。
为了保持快速、最佳的生长,所有植物组织都必须具有良好的营养状态。尽管植物的多种营养素可能略低,但一次只有一种营养素会限制整体生长。然而,如果这种限制性营养素的供应稍微增加,那么由此产生的增长增长将增加对所有其他营养素的需求,而另一种营养素(可用性次之最低)将成为限制性营养素。
其他诊断工具
尽管视觉诊断症状是快速评估植物营养状况的非常有价值的工具,但它们只是可用工具中的一部分。其他主要工具包括显微镜研究、光谱分析以及组织和土壤分析。这些方法的精度、速度和预测未来营养状况的能力各不相同。由于植物生长与环境之间的密切相互作用,所有对未来营养状况的预测都必须假设环境在该时间范围内将如何变化。
视觉诊断症状的主要优点是它们很容易获得并提供对营养状况的即时评估。它们的主要缺点是直到对产量、生长和发育产生重大影响后才会出现视觉症状。
组织分析具有营养特异性,但相对较慢;在确定营养状况之前,必须对组织进行取样、处理和分析。对选定植物组织的矿物质养分含量的分析,与临界水平值(大多数作物都可用,参见教科书图 5.4)进行比较时,可用于评估取样时的植物养分状况置信度高,可外推以预测收获时的养分状况。土壤分析类似于组织分析,但评估的是土壤的潜在供应能力,而不是植物养分状态。植物分析提供有关植物需要什么的信息,而土壤分析提供有关养分供应状况的信息。
营养状况的光谱分析仍处于起步阶段,目前主要用于全球资源清单和专业研究。微观研究在观察养分胁迫的生理方面最有价值,而不是在整株植物或作物的基础上评估植物养分状态。
症状描述
发现任何一片叶子甚至一株植物都表现出特定缺陷的全部症状是不寻常的。因此,非常希望了解单个症状的外观,因为它们可能以多种可能的组合出现在单个植物上。以下用于描述缺陷症状的大多数术语都是不言自明的;然而,一些在营养缺乏领域具有独特的意义。例如,褪绿这个词,这是由于叶绿素损失而导致叶子变黄的通用术语,如果没有进一步的限定,则不能使用,因为可能存在整体萎黄病,如缺氮,叶脉,如缺铁,或边缘,如缺钙。另一个经常用于描述缺乏症状的术语是坏死,它是棕色死亡组织的总称。这种症状也可以以多种形式出现,就像褪绿症状一样。
许多植物的营养缺乏症状是相似的,但由于植物及其环境中存在的巨大多样性,存在一系列症状表现。由于它们的平行脉,草和其他单子叶植物通常将萎黄病的影响显示为一系列条纹,而不是双子叶植物中常见的网状脉间萎黄病。另一个主要区别是,在双子叶植物中发现的边缘坏死或褪绿通常表现为单子叶植物的尖端烧伤。
网络图 5.1.A-M 显示了番茄中大量营养素和微量营养素的缺乏症状。
镁。缺镁叶片(网络图 5.1.A) 表现出晚期静脉内萎黄,在高度失绿的组织中出现坏死。在其高级形式中,镁缺乏可能在表面上类似于钾缺乏。在镁缺乏的情况下,症状通常始于静脉间组织中出现斑驳的褪绿区域。与其他叶组织相比,脉间叶片组织倾向于按比例扩大,产生凸起的皱褶表面,皱褶顶部逐渐从褪绿组织变为坏死组织。在一些植物中,如芸苔属(即芥菜科,包括西兰花、球芽甘蓝、卷心菜、花椰菜、羽衣甘蓝、羽衣甘蓝、大头菜、芥末、油菜、大头菜和萝卜),橙色、黄色和紫色也可能发展。
Web 图 5.1.A 番茄缺镁症状。(爱泼斯坦和布鲁姆 2004)
锰。这些叶子(网络图 5.1.B)显示在锰供应有限的情况下出现了轻微的脉间萎黄症。缺锰引起的萎黄症的早期阶段与缺铁有些相似。它们从幼叶的轻度萎黄和成熟叶的网状脉开始,特别是当它们通过透射光观察时。随着压力的增加,叶子呈现出灰色的金属光泽,并沿着叶脉形成黑色的雀斑和坏死区域。叶子的上表面也可能出现紫色光泽。燕麦、小麦和大麦等谷物极易缺锰。它们会出现轻微的萎黄病以及灰色斑点,这些斑点会拉长并合并,最终整个叶子都会枯萎死亡。
Web 图 5.1.B 番茄缺锰症状。(爱泼斯坦和布鲁姆 2004)
钼。这些叶子(网络图 5.1.C) 显示一些斑驳的斑点以及一些静脉间萎黄。缺钼的早期症状是全身萎黄,与缺氮症状相似,但叶片背面通常没有微红色。这是由于在硝酸盐还原过程中需要钼,而硝酸盐需要在被植物同化之前被还原(参见教科书第 13 章)。因此,钼缺乏的最初症状实际上是氮缺乏的症状。然而,钼在植物内还具有其他代谢功能,因此即使在可用的氮减少的情况下也会出现缺乏症状。在花椰菜的情况下,新叶的叶片未能发育,导致特征性的鞭尾外观。在许多植物中,在严重缺乏的情况下,叶片向上呈杯状,斑驳的斑点发展成大的脉间褪绿区。在高浓度下,钼具有非常明显的毒性症状,即叶子变成非常鲜艳的橙色。
Web 图 5.1.C 番茄缺钼症状。(爱泼斯坦和布鲁姆 2004)
氮。褪绿症状(网络图 5.1.D) 这片叶子显示的原因是缺氮。在叶脉和叶柄上也可以看到淡红色的铸件。在缺氮条件下,较老的成熟叶片逐渐从其正常的特征性绿色外观变为更淡的绿色。随着缺乏症的进展,这些较老的叶子变成均匀的黄色(褪绿)。在极度缺乏的情况下,叶子接近黄白色。植物顶部的幼叶保持绿色但颜色较淡,并且尺寸趋于变小。缺氮植物的分枝减少,导致植物短而细长。缺氮变黄在包括叶脉在内的整个叶子上是均匀的。然而,在某些情况下,静脉间坏死取代了许多植物中常见的萎黄病。在一些植物中,叶子的下面和/或叶柄和中脉会出现微红色或紫色的痕迹。在某些植物中,这种颜色可能非常明亮。随着缺乏症的进展,较老的叶子在轻度水分胁迫下也表现出更多的枯萎倾向,并且比平时更早衰老。将缺乏的植物恢复到施用的氮是立即(数天)且引人注目的。
Web 图 5.1.D 番茄缺氮症状。(爱泼斯坦和布鲁姆 2004)
磷。这些缺磷的叶子(网络图 5.1.E) 显示一些坏死点。通常,缺磷症状不是很明显,因此难以识别。一个主要的视觉症状是植物矮小或发育不良。与在类似环境条件下但没有缺磷的其他植物相比,缺磷植物的发育非常缓慢。磷缺乏植物经常被误认为是无胁迫但更年轻的植物。一些品种,如番茄、莴苣、玉米和芸苔属植物的茎、叶柄和叶子的下侧会出现明显的紫色。在严重缺乏的情况下,叶子也有呈现蓝灰色光泽的趋势。在非常严重缺乏条件下的老叶中,可能会形成棕色的叶网状脉纹。
Web 图 5.1.E 番茄缺磷症状。(爱泼斯坦和布鲁姆 2004)
硫。这片叶子(网络图 5.1.F)显示出总体的整体萎黄,但仍保留一些绿色。叶脉和叶柄呈现出非常明显的淡红色。缺硫的视觉症状与缺氮时的萎黄病非常相似。然而,在缺硫情况下,整个植物(包括幼叶)的泛黄更加均匀。通常在叶子和叶柄下面发现的微红色具有更粉红色的色调,并且比缺氮时的颜色要少得多。晚期缺硫时,沿叶柄常出现褐色病斑和/或坏死斑,叶片趋向于变得更加直立且经常扭曲和变脆。
Web 图 5.1.F 番茄缺硫症状。(爱泼斯坦和布鲁姆 2004)
锌。这片叶子(网络图 5.1.G)显示了一个晚期的静脉间坏死病例。在缺锌的早期,幼叶变黄,成熟叶的脉间上表面出现凹坑。Guttation(参见教科书图 4.5)也很普遍。随着缺铁的进展,这些症状发展为严重的静脉间坏死,但主要静脉保持绿色,就像恢复缺铁的症状一样。在许多植物中,尤其是树木,叶子变得非常小,节间缩短,产生类似玫瑰花结的外观。
Web 图 5.1.G 番茄缺锌症状。(爱泼斯坦和布鲁姆 2004)
硼。这些缺硼的叶子(网络图 5.1.H)表现出轻微的一般萎黄病。植物对硼的耐受性变化很大,以至于具有高硼需求的植物生长所需的硼浓度可能对对硼敏感的植物有毒。硼在大多数植物韧皮部的运输很差,除了那些利用复合糖(如山梨糖醇)作为运输代谢物的植物。在最近的一项研究中(参见 Brown 等人,1999 年),被设计用于合成山梨糖醇的烟草植物被证明具有增加的硼迁移率,并且可以更好地耐受土壤中的硼缺乏。
Web 图 5.1.H 番茄缺硼症状。(爱泼斯坦和布鲁姆 2004)
在硼流动性差的植物中,缺硼会导致生长区域的分生组织坏死,从而导致顶端优势的丧失和莲座状结构的发展。这些缺乏症状与缺钙引起的症状相似。在硼易于在韧皮部运输的植物中,缺乏症状局限于成熟组织,类似于氮和钾的缺乏症状。茎的髓和表皮都可能受到影响,通常会导致茎中空或粗糙,并在果实上出现坏死斑。叶片出现明显的褶皱,叶柄变暗和噼啪作响,通常从叶片中渗出糖浆状物质。叶子异常脆,容易折断。还,
钙。这些缺钙的叶子(网络图 5.1.I) 显示叶片基部周围出现坏死。钙的极低迁移率是决定植物缺钙症状表现的主要因素。缺钙的典型症状包括番茄开花末端腐烂(番茄果实末端部分燃烧)、生菜尖端灼伤、芹菜黑心和许多植物的生长区域死亡。所有这些症状都在快速生长的区域显示软死坏死组织,这通常与钙向组织的易位不良有关,而不是与外部钙供应不足有关。钙供应不足的生长非常缓慢的植物可能会从较老的叶子中重新转移足够的钙来维持生长,而叶子只有轻微的萎黄。这最终导致叶子的边缘比叶子的其余部分生长得更慢,导致叶子向下杯形。这种症状通常会发展到叶柄发育但叶子没有发育的程度,在每个叶柄的顶部只留下一点黑色的坏死组织。长期缺钙的植物比未受胁迫的植物更容易枯萎。
Web 图 5.1.I 番茄缺钙症状。(爱泼斯坦和布鲁姆 2004)
氯化物。这些叶子(网络图 5.1.J) 形状异常,有明显的脉间萎黄。植物在其组织中需要相对较高的氯浓度。氯在土壤中含量非常丰富,在盐碱地区达到高浓度,但在内陆高度淋失的地区可能缺乏。缺氯最常见的症状是萎黄和嫩叶萎蔫。萎黄病发生在叶片脉间区域的光滑平坦的凹陷处。在更高级的情况下,成熟叶子的上侧通常会出现特征性的烫金现象。植物通常对氯化物具有耐受性,但鳄梨、核果和葡萄藤等一些物种对氯敏感,即使在土壤中氯化物浓度较低的情况下也会表现出毒性。
Web 图 5.1.J 番茄缺氯症状。(爱泼斯坦和布鲁姆 2004)
铜。这些缺铜的叶子(网络图 5.1.K)是卷曲的,它们的叶柄向下弯曲。铜缺乏可能表现为轻微的整体萎黄以及幼叶膨胀的永久性丧失。最近成熟的叶子显示出网状的绿色脉络,区域漂白成灰白色。有些叶子会出现凹陷的坏死点,并有向下弯曲的趋势。长期缺铜的树木会形成玫瑰花状生长。叶小而褪绿,有斑点状坏死。
Web 图 5.1.K 番茄缺铜症状。(爱泼斯坦和布鲁姆 2004)
铁。这些缺铁的叶子(网络图 5.1.L) 在叶子的基部表现出强烈的萎黄病,并带有一些绿色的网。缺铁最常见的症状是从最年轻的叶子的脉间萎黄开始,演变成整体萎黄,最后以完全白化的叶子结束。漂白区域通常会出现坏死斑。直到叶子几乎完全变白,它们会在应用铁后恢复。在恢复阶段,静脉首先恢复,如亮绿色所示。在铁回收过程中观察到的这种明显的静脉重新变绿可能是所有经典植物营养中最容易识别的症状。由于铁的流动性低,缺铁症状首先出现在最年轻的叶子上。缺铁与钙质土壤和厌氧条件密切相关,
图 5.1.L 番茄缺铁症状。(爱泼斯坦和布鲁姆 2004)
钾。这些叶子中的一些(网络图 5.1.M)显示边缘坏死(尖端烧伤),其他处于更严重缺乏状态的叶子显示在主脉之间的脉间空间坏死以及脉间萎黄。这组症状非常具有钾缺乏症状的特征。
Web 图 5.1.M 番茄缺钾症状。(爱泼斯坦和布鲁姆 2004)
钾缺乏的发作通常以边缘萎黄病为特征,在最近成熟的叶子上进展为干燥的革质棕褐色焦斑。随后随着应力的增加,从叶缘向中脉进展的叶脉间焦化和/或坏死增加。随着缺乏症的进展,大部分叶脉区域坏死,叶脉保持绿色,叶片趋于卷曲和起皱。在一些植物如豆类和马铃薯中,缺乏的最初症状是叶片出现白色斑点或雀斑。与缺氮相反,即使给植物补钾,缺钾时也会出现不可逆的萎黄病。因为钾在植物内的流动性很大,所以只有在极度缺乏的情况下才会在幼叶上出现症状。在钠的存在下可以大大缓解钾缺乏症,但由此产生的富含钠的植物比高钾植物多汁。在一些植物中,超过 90% 的所需钾可以用钠代替,而不会减少生长。
有关植物营养缺乏症状的更多图片,请访问IPM 图片网站。
WEB TOPIC 5.2观察地下的根
研究土壤表面以下的根系生长需要一种直接观察根系的方法。早在 1873 年,德国植物学家朱利叶斯·冯·萨克斯 (Julius von Sachs) 就通过使用带有一面玻璃墙的简单的土壤填充盒子来研究根系。从那时起,研究土壤中根系生长的设施变得更加复杂。已经建造了带有地下室的大型实验室,用于观察根系生长,并允许在植物地上部分暴露于自然田间条件时分析根系生长(Klepper 和 Kaspar 1994)。这些实验室被称为rhizotrons(来自希腊语rhizos,意思是“根”和tron,意思是“用于研究的设备”)。
在根瘤菌中,根系生长在排列在地下通道的玻璃壁室中。玻璃墙上的网格线表示土壤深度。自然生长条件下的根部形态(根部大小和分布)的细节可以通过安装在根室玻璃壁附近的专门设计的显微镜进行观察。此外,可以通过延时摄影测量一段时间内根系的生长情况。
由于 rhizotrons 的建造和维护成本很高,它们已在很大程度上被 minirhizotrons 或根潜望镜所取代。Minirhizotrons 是以前以一定角度埋在待观察植物附近的土壤中的透明塑料管。将光学设备(例如带有放大镜的倾斜镜或微型摄像机)插入管中,以监测沿其表面生长的根部(Web 图 5.2.A)。该设备提供有关大块土壤中的生根密度以及根系生长和物候学的信息。植物生理学家将这些信息与土壤中养分和水分含量的变化结合起来,通过土壤剖面评估根系活动。
Web 图 5.2.A 安装在燕麦幼苗附近的 minirhizotron 绘图。在透明塑料管内滑动的金属管由翼形螺钉固定。金属管包含用于观察沿塑料管表面生长的根的光学器件。刻在塑料管表面上的深色网格有助于定位金属管。光学包括透镜、镜子和灯。许多现代配置使用微型电视摄像机而不是镜头来获取图像。
WEB TOPIC 6.1将膜电位与多个离子在膜上的分布联系起来:Goldman 方程
许多不同的离子同时渗透活细胞的膜;因此,任何单一离子物种的能斯特势很少能描述膜的扩散势。相反,所有离子对跨膜扩散电位的贡献由 Goldman 方程描述:
该方程将跨膜的驻留离子梯度与产生的扩散电势联系起来。P K +、P Na +和P Cl -分别代表 K +、 Na +和 Cl -的膜渗透率。尽管该方程应包括所有通过膜的离子的项,但 K +、Na +和 Cl -在植物细胞中具有最大的膜渗透性和最高浓度,因此在方程中占主导地位。
如果人们想象一个膜只能透过一种离子,比如 K +,那么P Cl -和P Na +都等于 0,那么 Goldman 方程和 Nernst 方程之间的关系(参见教科书第 147 页)就可以形象化了。在这些条件下,Goldman 方程简化为 K +的 Nernst 方程。虽然生物膜永远不会只渗透单一离子物质,但人造膜可以接近这种情况,并用于制造 pH 电极和其他离子选择性电极。
WEB TOPIC 6.2植物细胞中的膜片钳研究
在植物生理学中使用膜片钳方法正在生成有关植物膜特性的信息,这超出了其他技术的范围。使用细胞内电极进行的常规电生理研究(参见教科书图 6.3)对于测量植物细胞的膜电位和其他电特性很有价值,但这些方法对离子泵和单离子通道的表征有局限性。另一方面,膜片钳非常适合该目的(Hedrich 和 Schroeder 1989;Miedema 和 Assmann,1998)。
在细胞电位的常规细胞内记录过程中,细胞被玻璃微量移液管电极刺穿,电极尖端位于细胞内部,通常位于液泡中。对于膜片钳实验,首先通过用适当的细胞壁酶处理将细胞壁消化掉,从而产生裸露的原生质体。然后将玻璃微量移液器的尖端与原生质体的质膜接触,并轻轻抽吸以促进微量移液器和膜之间形成紧密密封(Web 图 6.2.A 和 6.2.B)。
Web 图 6.2 . 贴在大麦糊粉细胞原生质体表面的贴片吸管的显微照片。(照片由 J. Schroeder 和 D. Bush 提供。)
Web 图 6.2.B 全细胞和膜贴片配置图。
当达到紧密密封时,调查员可以使用多种选择。进一步的抽吸可以去除由移液管尖端中的开口界定的膜部分,使细胞内部暴露于微量移液管溶液(因此可以通过微量移液管将不同的溶液引入细胞中)。在这种配置中,测得的电流反映了通过整个细胞质膜的主动和被动离子通量携带的所有电荷的总和(参见Web 图 6.2.B)。
将电极从电池中拉出会产生一个膜贴片,该膜贴片同时暴露在移液管溶液和沐浴介质中(参见Web 图 6.2.B)。由于膜贴片仅包含几个通道,因此这种配置可以研究由单个离子通道的打开和关闭引起的电流突变(Web 图 6.2.C,第 3 部分)。值得注意的是,这种技术足够灵敏,可以检测单个蛋白质分子的构象变化。
由于原生质体是球形的,它们的体积很容易测量,并且它们与其他细胞没有电连接,便于计算每单位膜面积的电荷通量。膜片钳的其他优点是能够区分质膜和液泡膜上的电事件,以及控制胞质溶胶和沐浴介质组成的可能性。
许多关于植物膜的膜片钳研究都是用保卫细胞进行的。Web 图 6.2.C显示了通过在受控膜电位(电压钳位)下测量电流获得的一些结果。全细胞电流如图 6.2.C 第 1 部分所示,使用的溶液中 K +是可渗透膜的主要离子。最初,膜电位保持在接近 K +平衡电位。然后向原生质体施加电压脉冲(在这种情况下约为 3 s 长)(如图右侧所示),电流(以皮安为单位)随时间变化(记录仪器的向上偏转表示正电荷搬出牢房)。在这种情况下,电流不会在电压变化后立即变为新的稳定值。
Web 图 6.2.C整个细胞和保卫细胞原生质体的单个 K +选择性通道中 的 K +电流记录。(1)当膜电位被钳制在不同的值时,在全细胞配置中记录的K +电流(参见Web 图 6.2.B )。向上偏转显示向外的电流;向下偏转显示向内的电流。K +浓度在移液管和细胞质中为 105 m M ,在细胞外的沐浴液中为11 m M。(2) 同一实验的数据绘制为 I/V(电流/电压)曲线,在添加 Ba 2+之前和之后,Ba 2+是一种阻断 K +的离子渠道。(3)通过膜贴片中单个通道的向内 K +电流。(来自 Schroeder 等人,1987 年。)
电压变化后电流的逐渐增加反映了响应膜电位的通道数量增加。以这种方式响应的通道称为电压门控通道。通常,通道的门控(打开和关闭)独立于其离子选择性进行控制,离子选择性对于特定类型的通道蛋白通常是恒定的。相同的数据在网络图 6.2.C第 2 部分中绘制为 I/V(电流/电压)曲线。同样,电流不以简单的方式取决于 K +扩散的驱动力(即电位与 K +的偏差平衡电位)。外向电流仅在高于 –40 mV 的正电势下被激活,而向内电流仅在负于约 –100 mV 的电势下被激活。这种激活反映了具有不同特性的单个通道蛋白的门控。
可以显示向内和向外的电流具有不同的单通道电导(电流穿过膜的能力)和不同的响应时间,并且它们受到各种激活剂和抑制剂的不同影响。现在已知,向内和向外的电流由两种不同的 K +通道携带,如各自基因的克隆和表达所证明的(Maathuis 等人,1997;Schachtman,2000)。外向整流通道仅在膜电位有利于 K +向外扩散时打开,而向内整流通道仅在膜电位有利于 K +向内扩散时打开. 由于每种类型的通道都有自己的调节机制,因此细胞可以独立控制向内和向外扩散的速率。
有关 K +通道的其他信息可以从对单个通道可见的孤立膜片中的电流研究中获得(参见Web 图 6.2.C,第 3 部分)。当保持在恒定电压下时,这些贴片显示电流水平的突然跳跃,因为单个 K +通道打开和关闭。这种行为只出现在膜通道中,从不存在于离子泵或载体中,因为通道的单个构象变化可以允许数十万个离子穿过膜,而泵或载体的构象变化只能传输一个,或几个,分子或离子。有关钾通道的更多信息,请参阅 Web Essay 6.1。
膜片钳研究还表明,门控通道可以根据门在响应长时间刺激时保持打开多长时间来区分。保卫细胞质膜上有两种类型的阴离子通道:快速激活(R 型)和缓慢激活(S 型)。R 型通道响应电压刺激非常迅速地打开和关闭;S 型通道在刺激期间保持打开状态。在液泡膜中也发现了快速和慢速通道,它们被称为快速液泡 (FV)或慢速液泡 (SV ) 通道。
WEB TOPIC 6.3化学渗透作用
英国诺贝尔奖获得者彼得·米切尔(Peter Mitchell)创造了化学渗透这一术语来解释质子通过选择性渗透膜的电化学势梯度与细胞工作性能之间的耦合(Harold 1986)。在植物中,质子梯度在跨质膜和液泡膜的转运中发挥作用,并在叶绿体和线粒体的内膜上驱动转运和 ATP 合成。质子沿其电和化学梯度的通过可以与细胞功耦合,因为自由能的变化是负的。这个过程可以用以下等式表示:
式中,ΔμH +为电化学势的质子梯度,F为法拉第常数,ΔE为膜电位,R为气体常数,T为绝对温度,上标“i”和“o”指分别位于细胞或其他膜封闭隔室的内部和外部。
Mitchell 引入了术语“质子动力”(Δ p),用于表示细胞隔室内外质子之间的电化学势差μ H +。用电势单位表示Δp很方便,我们可以通过将上述等式两边除以法拉第常数F来表示,法拉第常数 F 将单位更改为毫伏:
由于 pH = –log[H + ],术语 log([H + ] i /[H + ] o ) 简化为 –(pH i – pH o )。如果 ΔpH 定义为 pH i – pH o,则质子动力的一般表达式为:
在 25°C 时,2.3 RT/F = 59 mV,并将该值代入上述表达式,得到最常用的质子动力方程:
其中Δp以毫伏表示。
让我们考虑一个细胞沐浴在 1 m M K Cl 和 1 m M蔗糖溶液中的例子。H + -ATP酶的质子泵浦导致–120 mV的膜电位和2个pH单位的细胞内外之间的pH差。因此,根据前面的等式,
使用这个Δp,细胞可以吸收 多少 K +?由于钾带正电,而跨细胞膜的膜电位差在内部为负,钾将通过离子通道被 Δ p的电分量(等于 –120 mV)吸收。使用 Nernst 方程(参见教科书第 147 页),我们可以计算出1 m M的外部 K +浓度和 –120 mV 的 Δ E值将与 100 m M的内部 K +浓度平衡。因此,如果使用Δp的电分量,电池可以产生 100 倍的 K +跨膜梯度。
质子动力也可用于逆浓度梯度吸收蔗糖,通常通过质子-蔗糖同向转运体。因为蔗糖与质子共转运,所以电化学电位梯度的两个分量(在我们的例子中为–238 mV)都可以用于蔗糖的吸收(Harold 1986)。在平衡时,(见教科书方程 6.4 和 6.5)Δ μ H +将等于F Δ p;因此我们可以计算出 1 m M的外部蔗糖浓度和 –238 mV 的Δp将与 10 M的内部蔗糖浓度平衡. 然而,在现实生活中,这样的浓度梯度是不存在的:蔗糖会扩散回细胞外,在达到某些临界浓度后,膜上的调节机制会抑制同向转运体的功能。
WEB TOPIC 6.4多转运系统的动力学分析
对K m值的研究表明,载体介导的转运具有反馈抑制作用(参见本网站第 2 章),使细胞能够在广泛的外部浓度范围内保持稳定的细胞质离子浓度。例如,大麦根系中高亲和力K +载体的表观K m值随着植物对K +的需求而变化。缺乏 K +的大麦植物具有高亲和力的K m值,范围为 0.02 到 0.03 m M,而受精良好的植物的K m值高 4 到 5 倍(网络图 6.4.A)。正如教科书第 6 章所解释的,K m的增加反映了载体对 K +的亲和力的降低(Epstein 1972)。
Web 图 6.4.A 钾向大麦根部的转运显示了两个不同的阶段。钾吸收的双相动力学,在该图中通过在 1 m M左右的尺度变化来强调,表明存在不同类型的钾运输系统。K m值为 0.02 至 0.03 m M的高亲和力转运系统归因于同向转运体的主动转运;低亲和力系统(可能显示也可能不显示饱和)归因于通过 K +通道的扩散。(爱泼斯坦 1972 年之后。)
表观K m的变化可能反映了基因家族不同成员的表达,它们的基因产物从而使细胞需要与环境离子条件相匹配(Schachtman 2000;Maser 等人 2001)。如果植物的调整仅仅是向质膜添加更多的转运蛋白,那么V max会发生变化,而K m不会发生变化。这不是观察到的 K +。然而,已经挨饿然后再补充硫酸盐或磷酸盐的植物通常会通过增加V max来响应。随着内部硫酸盐和磷酸盐水平的恢复,V max随着过量载体从膜中去除,它们的吸收值下降到通常的值(Glass 1983)。
WEB TOPIC 6.5植物中的 ABC 转运蛋白
ATP 结合盒 (ABC) 转运蛋白是由 ATP 水解直接激活的一大类主动转运蛋白的成员。最初在微生物和动物细胞中发现的 ABC 转运蛋白能够直接利用 ATP 水解的能量将有机分子(尤其是大阴离子分子)泵过膜。与 P 型 H + -ATP 合酶一样,ABC 转运蛋白在催化过程中形成磷酸化中间体,因此它们被钒酸盐抑制。
已经从各种植物中克隆了许多 ABC 转运蛋白基因 (Sanchez-Fernandez et al. 2001)。ABC 蛋白质的基因可通过预测的蛋白质结构识别,该结构由两个结构单元中的每个拷贝一个或两个拷贝、一个跨膜结构域(穿过膜数次)和一个核苷酸结合折叠组成,该折叠包含一个特征特征序列(Sanders 和 Bethke 2000)。跨膜结构域为溶质转运提供了途径,并决定了转运蛋白的分子特异性。
已发现一种 ABC 转运蛋白在烟草细胞的质膜上分泌抗真菌萜烯。更常见的是,ABC 转运蛋白存在于液泡膜中,它们有时被称为谷胱甘肽共轭泵或 GS-X 泵,因为它们经常转运与谷胱甘肽共价连接的分子。谷胱甘肽 (GS) 是一种三肽 (Glu-Cys-Gly),可作为重要的细胞抗氧化分子(分子结构见教科书第 369 页)。植物细胞的液泡 GS-X 泵在除草剂解毒、防止氧化损伤、色素积累和抗菌化合物的储存中发挥作用。
称为谷胱甘肽转移酶 (GST) 的酶家族负责将谷胱甘肽连接到要运输的分子上。GS 共轭的常见化学决定因素是与吸电子基团相邻的碳-碳双键 (CH 2 = CH-Z) (Talalay et al. 1998)。含有这种决定因素的化合物包括花青素(参见教科书图 6.13)、IAA(吲哚乙酸或生长素)和各种酚类化合物。由谷胱甘肽合成的称为植物螯合素的金属结合多肽也通过 GS-X 泵与其螯合的重金属一起被转运到植物液泡中(Salt 和 Rauser 1995)。
WEB TOPIC 6.6分离液泡和膜泡的运输研究
正如对分离的类囊体膜的研究导致阐明光合作用的电子转移反应(参见教科书第 7 章)一样,分离具有功能能力的液泡和质膜的技术的发展使科学家能够在体外研究这些膜的转运反应(Sze 1985;Jahn 等人 2001)。使用分离的膜囊泡研究运输避免了新陈代谢的干扰。由于囊泡的内容物可以相当容易地交换,因此可以更好地确定膜每一侧的溶质浓度。已使用两种类型的制剂:完整液泡和分离的质膜或液泡囊泡。
从原生质体中分离完整的液泡
当通过细胞壁的酶消化制备的原生质体通过在含有合适的渗透溶质(如甘露醇)的培养基中孵育而保持在质壁分离状态时,可以小心地裂解质膜而不会通过温和的渗透冲击破坏液泡膜(Pantoja 和 Smith 2002)。然后可以通过蔗糖密度梯度离心纯化通过这种处理释放的完整液泡。完整的液泡(连同污染的细胞碎片)在含有浓度梯度的蔗糖(或另一种合适的溶质)的试管中进行离心。因为完整的液泡倾向于排除溶质,所以它们在密度梯度上沉积到比其他细胞器和膜更轻的密度。以这种方式可以获得高度纯化的完整液泡的制剂。
从细胞匀浆中分离液泡膜
或者,液泡膜和质膜可以纯化为小膜囊泡。当组织在研钵和杵中研磨或在搅拌器中均质时,各种膜的碎片往往会密封形成直径小于 1 µm 的小囊泡。由于液泡膜中蛋白质与脂质的比例较低,液泡膜囊泡通常具有相对较低的密度,并且可以通过密度梯度离心将它们与其他细胞膜分离(Kawamura 等人,2000)。
从细胞匀浆中分离质膜
质膜囊泡可以通过在葡聚糖和聚乙二醇溶液的混合物中进行相分配来纯化(Larsson 等,1987)。这种混合物分成两相,并且由于它们的表面特性,质膜倾向于在上相中积累,而细胞内膜倾向于保留在下相中。
组织均质化通常会产生不同方向的囊泡混合物(右侧向外和由内向外的囊泡)。在质膜囊泡的情况下,相分配选择右侧向外的囊泡,因此由于酶的催化位点面向囊泡内部,因此对 ATP 几乎没有反应性。如果将去污剂添加到这样的制剂中,ATP 会穿透囊泡并被水解,但由于囊泡不再密封,因此没有观察到运输。
一种低剂量的去污剂 (Brij 58) 不会使膜渗漏,但据称会导致它们反转它们的方向 (Johansson et al. 1995)。显然,这种去污剂积聚在脂质双层的内半部分,使其膨胀并将囊泡内外翻转。由于酶的催化位点现在面向外部溶液,在这种去污剂的存在下,囊泡通过产生 pH 值和膜电位梯度来响应 ATP。
测量膜泡中的运输
放射性同位素可用于监测各种溶质向膜囊泡的转运。囊泡与标记的溶质一起孵育不同时间,然后通过快速过滤分离,并在闪烁计数器中测量它们的放射性。已经开发了其他方法来测量由质子泵产生的 pH 梯度和膜电位。一种这样的方法使用荧光弱碱,例如 9-氨基吖啶 (9-AA) 或奎纳克林,它们在不带电的情况下是脂溶性的,很容易扩散穿过膜并进入囊泡。在酸化的囊泡内,氨基被质子化,将带电形式的分子困在里面(Web 图 6.6.A)。当染料分子在囊泡内积聚时,它们会形成二聚体和其他聚集体,导致它们的荧光降低,这种现象称为荧光猝灭。因此,人们可以通过在一种称为荧光分光光度计的仪器中测量荧光猝灭率来研究 ATP 驱动的质子跨囊泡膜的转运。
Web 图 6.6.A通过荧光猝灭法 测量 H +泵浦。反应示意图。在存在 ATP 驱动的 pH 梯度的情况下,质子化(带电)形式的荧光弱碱,例如 9-AA,会在囊泡内积聚。由于 9-AA 的二聚化引起的自猝灭,9-AA 在囊泡内的积累导致悬浮液的总荧光降低。
如网络图 6.6.B所示,将 ATP 添加到从质膜或液泡膜分离的膜囊泡中会导致荧光快速降低(淬灭)。当质子从囊泡中漏出的速率等于质子进入囊泡的速率时,就达到了稳定状态。短杆菌肽是一种在膜上诱导非特异性孔洞的化合物,它会迅速消散 pH 梯度,如荧光恢复所示。其他分子探针,例如氧杂酚染料,与脂质膜结合并随着电势的变化显示出荧光的变化,可以以类似的方式用于研究 ATP 驱动的膜电势。
Web 图 6.6.B 典型荧光猝灭实验的结果,显示加入 ATP 后荧光减弱,而当使用形成通道的离子载体短杆菌肽消散 ΔpH 时,荧光恢复,这会在膜中产生非特异性孔.
尽管已经证明很难对膜囊泡中的 pH 值和电位梯度进行绝对测量,但这种类型的研究对于相对测量以及定义各种运输系统的能源和活化剂和抑制剂敏感性非常有用 (Sze 1985) . 结合其他实验技术,对膜囊泡的研究为植物细胞中的运输提供了许多见解。
WEB TOPIC 7.1分光光度法原理
我们对光合作用装置的大部分了解都是通过光谱学来学习的——也就是说,测量光和分子的相互作用。分光光度法是光谱学的一个重要分支,专注于测量技术。在这里,我们将研究四个WEB TOPIC:比尔定律、吸光度的测量、作用光谱和差异光谱。
比尔定律
关于任何分子种类的一个重要信息是它的存在量。浓度的定量测量是生物科学的基石之一。在为测量浓度而设计的所有方法中,迄今为止应用最广泛的是吸收分光光度法。在该技术中,测量样品在特定波长下吸收的光量,并通过与适当的标准或参考数据进行比较来确定样品的浓度。最有用的光吸收量度是吸光度 ( A ),通常也称为光密度 (OD)(Web 图 7.1.A)。吸光度定义为A = log I 0 / I其中,I 0是入射到样品上的光强度, I是样品透射的光强度。
Web 图 7.1.A 吸光度的定义。强度为I 0的单色入射光束穿过包含在长度为 ( l ) 的比色皿中的样品。部分光被样品中的发色团吸收,发出的 光强度为I。
样品的吸光度可以通过比尔定律与吸收物质的浓度相关:
A = ε cl
其中c是浓度,通常以摩尔每升测量;l为光路长度,通常为1cm;ε 是比例常数,称为摩尔消光系数,单位为升/摩尔/厘米。ε 的值是被测量的特定化合物和波长的函数。叶绿素的 ε 值通常约为 100,000 L mol –1 cm –1。当复杂混合物的多于一种成分在给定波长处吸收时,由于单个成分的吸光度通常是相加的。
分光光度计
吸光度由称为分光光度计的仪器测量(网络图 7.1.B)。分光光度计的基本部件包括光源、波长选择装置(如单色仪或滤光片)、样品室、光检测器和读出装置,通常还包括计算机,用于存储和分析光谱数据。光谱。最有用的机器扫描入射到样品上的光的波长,并产生作为输出的吸光度与波长的光谱,例如教科书图 7.7 中所示的光谱。
Web 图 7.1.B 分光光度计示意图。该仪器由光源、包含棱镜等波长选择装置的单色仪、样品架、光电探测器和记录仪或计算机组成。单色仪的输出波长可以通过棱镜的旋转来改变;吸光度与波长的关系图称为光谱。
行动光谱
作用光谱的使用对于我们目前对光合作用的理解的发展至关重要。作用光谱是观察到的生物效应幅度随波长变化的图表。由作用光谱测量的影响的例子是氧气释放(Web 图 7.1.C)和由于光敏色素作用引起的激素生长反应(参见教科书的第 16 章)。通常,作用光谱可以识别导致特定光诱导现象的发色团。作用光谱有助于发现 O 2进化光合生物中存在两种光系统。
Web 图 7.1.C 作用光谱与吸收光谱的对比。吸收光谱的测量如图 7.1.B 所示. 通过绘制对光(例如氧气释放)的响应作为波长的函数来测量作用光谱。如果用于获得吸收光谱的颜料与引起响应的颜料相同,则吸收光谱和作用光谱将匹配。在此处显示的示例中,析氧的作用光谱与完整叶绿体的吸收光谱非常匹配,表明叶绿素的光吸收介导了析氧。在类胡萝卜素吸收区域发现差异,从 450 到 550 nm,表明从类胡萝卜素到叶绿素的能量转移不如叶绿素之间的能量转移有效。
TW Engelmann 在 1800 年代后期测量了一些最初的作用光谱(网络图 7.1.D)。恩格尔曼使用棱镜将阳光分散成一道彩虹,让彩虹落在水生藻丝上。将一群寻求O 2的细菌引入系统中。细菌聚集在产生最多 O 2的细丝区域. 这些是被叶绿素强烈吸收的蓝光和红光照射的区域。今天,作用光谱可以在房间大小的光谱仪中测量,科学家进入一个巨大的单色仪,并将样品放置在房间的大面积单色光中进行照射。但实验的原理与恩格曼的实验相同。
Web 图 7.1.D TW Engelmann 的作用谱测量示意图。Engelmann 将光谱投射到丝状绿藻Spirogyra的螺旋叶绿体上,并观察到引入系统的寻氧细菌收集在叶绿素色素吸收的光谱区域。该作用光谱首次表明辅助色素吸收的光在驱动光合作用方面的有效性。
差异光谱
光合作用研究中的一项重要技术是光诱导差异光谱法,它测量吸光度的变化(Web 图 7.1.E)。在该技术中,通常称为光化光的强光用于照亮样品,而暗光束用于测量样品在光化光束波长以外的波长处的吸光度。以这种方式获得了差异光谱,其代表了由光化光照射引起的样品吸收光谱的变化。光照后消失的吸收带显示为负峰;光照时出现的新条带显示为正峰。差异光谱为参与光合作用光反应的分子物种的身份提供了重要线索。P700(一种吸收波长为 700 nm 光的叶绿素,参见教科书图 7.19)光氧化的差异光谱示于Web 图 7.1.F(柯 1973)。
Web 图 7.1.E 差分光谱原理。我们通过观察当打开光化灯时样品中测量光 λ 1的吸光度随时间的变化来测量差异光谱。光化光 λ 2在样品中引起化学变化,从而改变其吸收光谱。阻挡滤光片是防止散射光化光进入检测器所必需的。向上和向下箭头分别表示光化灯打开和关闭的时间。光化光引起的吸光度变化,ΔA, 可以是正数也可以是负数。通常,一次测量一个波长。通过在许多不同波长处重复测量来建立差异光谱。
Web 图 7.1.F P700 光氧化的明暗差光谱,如Web 图 7.1.E所示测量。在 430 和 700 nm 处吸收(漂白)的减少是由于 P700 的吸收损失。在 450 nm 附近和 730 nm 以上观察到的增加是由于 P700 +(氧化 P700)的吸收。(柯 1973 之后。)
通过使用特殊的闪光技术,可以记录闪光激发后给定时间的差异光谱。闪光激发后在不同时间记录的多个差异光谱可用于测量反应中心光子激发后的化学反应动力学。这些技术可以具有非凡的时间分辨率,在某些情况下不到一皮秒(10-12秒),并为了解光合能量存储过程中的最早事件提供了深刻的见解。
WEB TOPIC 7.1
叶绿素和其他光合色素的分布
WEB TOPIC 7.3量子产率
分子放弃其激发能量(或“衰变”)的过程 的量子产率(Φ )是通过该途径衰变的受激分子的比例(Clayton 1971, 1980)。在数学上,一个过程(例如光化学)的量子产率定义如下:
特定过程的Φ 值范围可以从 0(如果该过程从未参与激发态的衰减)到 1.0(如果该过程总是使激发态失活)。所有可能过程的量子产率之和为 1.0。
功能性叶绿体在昏暗光照条件下,光化学的量子产率约为0.95,荧光的量子产率在0.05或更低,其他过程的量子产率可以忽略不计。因此,绝大多数被激发的叶绿素分子会导致光化学。
可以非常准确地测量 光合作用产物(例如 O 2 )形成的量子产率。在这种情况下,量子产率大大低于光化学的值,因为在任何 O 2分子形成之前必须发生几个光化学事件。对于 O 2生产,测得的最大量子产率约为 0.1,这意味着每个释放的 O 2分子吸收 10 个量子。量子产率的倒数称为量子要求。O 2的最小量子要求因此,进化大约是 10(参见教科书图 7.11)。光吸收的定量测量和光中所含能量的命运对于理解光合作用至关重要。
WEB TOPIC 7.4光对细胞色素氧化的拮抗作用
令人费解的红色下降(参见教科书中的图 7.12)和增强效果(参见教科书的第 179 页)由荷兰的 Louis Duysens 进行的实验解释(Duysens 等人,1961 年)。他认为两个光化学事件是造成增强效应的原因。一个光化学事件产生氧化,而另一个产生还原。叶绿体含有细胞色素,即在光合作用中充当中间电子载体的含铁蛋白质(参见教科书图 7.19)。Duysens 发现,当用长波长光照射红藻样本时,细胞色素大部分被氧化。如果还存在较短波长的光,则效果会部分逆转(Web 图 7.4.A)。这些拮抗作用可以通过涉及两种光化学事件的机制来解释:一种倾向于氧化细胞色素,另一种倾向于减少它(Hill and Bendall 1960)。
Web 图 7.4.A 光对细胞色素氧化的拮抗作用。远红光在氧化叶绿体中的细胞色素f方面非常有效。如果还存在绿光,则一些细胞色素会减少。这两种波长具有相反的效果——因此称为“拮抗剂”。该实验是对光合作用中存在两种光化学系统的最清楚的证明之一:一种减少细胞色素,另一种氧化细胞色素。这个特殊的实验是用红藻完成的,其中光系统 II(参见教科书图 7.13)最好由绿光驱动,而光系统 I 最好由远红光驱动。(根据 Duysens 等人,1961 年。)
我们现在知道,在光谱的红色区域,一种称为光系统 I ( PS-I ) 的光反应优先吸收波长大于 680 nm 的远红光,而第二种称为光系统 II ( PS -II ),能很好地吸收 680 nm 的红光,远红光的驱动效果很差。这种波长依赖性解释了增强效应和红滴效应。光系统之间的另一个区别是光系统 I 产生强还原剂,能够还原 NADP +, 和弱氧化剂。光系统 II 产生一种非常强的氧化剂,能够氧化水,并且是一种比光系统 I 产生的还原剂更弱的还原剂。光系统 II 的这种还原剂重新还原了光系统 I 产生的氧化剂(参见教科书图 7.14),这解释了拮抗作用。影响。
WEB TOPIC 7.5两个细菌反应中心的结构
1984 年,Hartmut Michel、Johann Deisenhofer、Robert Huber 和慕尼黑的同事从紫色光合细菌绿红假单胞菌 中解出了反应中心的三维结构(Deisenhofer 和 Michel 1989)。这一具有里程碑意义的成就于 1988 年获得了诺贝尔奖,它是首次对完整膜蛋白进行高分辨率 X 射线结构测定,并首次对反应中心复合物进行结构测定。其结构如图 7.5.A 所示。
Web 图 7.5.A 紫色细菌Rhodopseudo-monas viridis 反应中心的结构,通过 X 射线晶体学解析。膜内的 11 个管代表跨膜蛋白螺旋。叶绿素类色素以浅绿色显示;紧密结合的含铁细胞色素的血红素基团在图的顶部以深灰色显示。C(细胞色素亚基)指向周质或细胞外;H亚基与细胞的细胞质接触。醌和细胞色素参与与细菌叶绿素的电子转移反应。(由 J. Richardson 提供。)
复合物的蛋白质部分由四个独立的多肽组成。其中两个,称为 L 和 M(用于轻质量和中等质量)结合复合物的所有细菌叶绿素、醌和类胡萝卜素辅助因子。该结构具有关于垂直于膜平面的轴的双重对称性,暗示反应中心的二聚体性质。L 和 M 肽的 10 个跨膜部分(各 5 个)排列成 α 螺旋,膜内部几乎没有带电荷的氨基酸残基。H(重)蛋白具有单个跨膜螺旋并且主要定位于膜的细胞质侧。C ( cytochrome)亚基位于周质区域(细菌质膜和外膜之间的区域)。颜料和醌(电子受体)的几何排列如图 7.5.B所示,去除了蛋白质。在另一种紫色光合细菌球形红杆菌的反应中心也发现了类似的排列,只是不存在 C 亚基。
Web 图 7.5.B 细菌反应中心色素和其他辅基的几何排列:细菌叶绿素(BChl);细菌脱镁叶绿素 (BPh),一种叶绿素分子,其中镁原子已被两个氢原子取代;和Q A和Q B,第一和第二醌受体。该图中已删除细胞色素血红素组;如果存在,它们将位于顶部。顶部的两个细菌叶绿素 (P870) 是在反应中心内与光发生反应的“特殊对”。电子转移序列从特殊对开始,沿着图的右侧向下延伸到细菌脱镁叶绿素。接下来,电子转移到 Q A然后到 Q B. 所描绘的分子之间的距离及其在反应中心对称平面内的角度已被精确确定,从而可以非常详细地分析反应中心中光子和电子的路径。
其中两个细菌叶绿素分子彼此密切接触,被称为特殊对。这种二聚体的存在是根据磁共振研究预测的,它是复合物的光活性部分。一个电子沿着复合物右侧的电子载体序列从这个二聚体转移。对这些结构的详细分析,以及对众多突变体的分析,揭示了所有反应中心进行的能量储存过程中涉及的许多原理。
细菌反应中心的结构被认为在许多方面与来自析氧生物的光系统 II 中发现的相似,尤其是在链的电子受体部分(参见教科书图 7.23)。构成细菌反应中心核心的蛋白质在序列上与它们的光系统 II 对应物相对相似,这意味着进化相关性。
WEB TOPIC 7.6中点电位和氧化还原反应
氧化还原反应、中点电势及其与热力学定律的关系在本网站的第 2 章中进行了讨论。这些概念对于我们讨论从 H 2 O 到 NADP +的电子流(参见教科书图 7.21)以及不同电子载体之间的相互作用很有用。
中点电位 ( E m ) 是化合物从其他化合物中获取电子的趋势的量度。大的正中点电位意味着该化合物是一种强氧化剂;较大的负值意味着该化合物是一种强还原剂(在这两种情况下都相对于标准氢电极)。
平衡常数可以很容易地从中点电位预测,就像自由能与平衡常数相关(参见教科书附录方程 A1.15)。许多化学和生化反应的中点电位已被测量并制成表格。教科书图 7.19 中 Z 方案的y轴显示了电子载流子的中点电位,负值高于正值。这种选择使自发的反应(释放自由能)在图表上显得“下坡”。
了解各种电子载体的中点电位对于在任何生化电子传输系统(例如在叶绿体或线粒体中发现的那些)中建立电子流动途径非常重要。研究人员通常通过进行氧化还原滴定来进行这种测量(Dutton 1978)。他们通常通过添加少量氧化剂或还原剂来调整或平衡样品在特定的氧化还原电位。氧化还原介质,必须包括允许样品和测量系统电极之间快速平衡的小分子,以确保在进行测量时系统处于平衡状态。在各种氧化还原电位下进行了几次测量。样品在包含铂和参比电极的特殊池中搅拌,并添加化学氧化剂和还原剂以调节氧化还原电位,用电压表读取(Web 图 7.6.A)。
网页图 7.6.A
我们可以通过跟踪样品在每个电位下的特定特性(通常是吸光度)来测量氧化还原反应的程度。在Web 图 7.6.B所示的示例中,化合物的还原形式具有随着化合物被氧化而降低的吸光度。将每个电位下还原形式的分数与氧化还原电位作图,中点电位 ( E m ) 确定为化合物半氧化半还原时的电位(Web 图 7.6.C)。
网页图 7.6.B
网页图 7.6.C
WEB TOPIC 7.7氧气进化
光合水氧化的化学机制尚不清楚,尽管有大量关于该过程的间接证据。如果将一个适应暗的光合膜样品暴露在一系列非常短暂、强烈的闪光中,就会观察到一种特征性的氧气产生模式。前两次闪蒸时产生的氧气很少或不产生,第三次闪蒸时释放出最多的氧气,此后每隔四次闪蒸一次,直到最终每次闪蒸的产率下降到一个恒定值。Pierre Joliot 在 1960 年代首次观察到这一非凡的结果。
由 Kok 及其同事提出的解释这些观察结果的示意图模型已被广泛接受(Kok 等人,1970 年)。这种水的光氧化模型,称为S 状态 机制,由一系列称为 S 0到 S 4的五种状态组成,它们依次代表水氧化酶系统或放氧复合物的更多氧化形式(网页图 7.7.A)。指示灯闪烁将系统从一个 S 状态推进到下一个状态,直到达到状态 S 4。状态 S 4在没有进一步光输入的情况下产生 O 2并将系统返回到 S 0. 偶尔,一个中心在闪光激发时不会进入下一个 S 状态,不太常见的是,一个中心被一次闪光激活两次。这些未命中和双重命中导致通过暗适应实现的同步丢失,氧气产量最终衰减到一个恒定值。在达到此稳定状态后,复合物处于 S 0到 S 3状态中的任何状态的概率相同(S 4不稳定且仅短暂出现),并且 O 2的产率变得恒定。状态S 2和 S 3在黑暗中衰变,但只能追溯到 S 1, 在黑暗中是稳定的。因此,在适应黑暗后,大约四分之三的放氧复合物似乎处于 S 1状态,四分之一处于 S 0状态。这种状态分布解释了为什么在对暗适应叶绿体进行一系列闪光的第三次之后观察到 O 2的最大产量。
网页图 7.7.A
这种 S 态机制解释了观察到的 O 2释放模式,但不能解释 S 态的化学性质或是否形成任何部分氧化的中间体,例如 H 2 O 2。通过测量质子释放模式(参见教科书公式 7.8)获得了更多信息,因为 S 状态随着闪光而前进。除氧外,氢离子也是水氧化的产物。质子的释放与O 2的释放不严格耦合。
WEB TOPIC 7.8光系统 I
PS-I 反应中心由多蛋白复合物组成。反应中心叶绿素 P700 和大约 100 个核心天线叶绿素与两种蛋白质 PsaA 和 PsaB 结合,分子量范围为 66 至 70 kDa (Golbeck 1992; Krauss et al. 1993, 1996; Chitnis 1996; Jordan et al. . 2001)。PS-I 反应中心复合物已从几种生物中分离出来,发现含有 66 至 70 kDa 的蛋白质,以及数量不定的 4 至 25 kDa 范围内的较小蛋白质(参见教科书图 7.27)。这些蛋白质中的一些用作可溶性电子载体质体蓝蛋白和铁氧还蛋白的结合位点。其他一些蛋白质的功能还不是很清楚。一个 8 kDa 的蛋白质包含一些结合的铁硫中心,它们在光系统 I 中充当早期电子受体。
在它们的还原形式中,在光系统 I 的受体区域起作用的电子载体都是极强的还原剂。这些减少的物种非常不稳定,因此难以识别。有证据表明,这些早期受体之一是叶绿素分子,另一个是醌类叶绿醌,也称为维生素 K 1 (Nugent 1996)。
其他电子受体包括一系列三种膜相关的铁硫蛋白,或结合的铁氧还蛋白,也称为Fe-S 中心 Fe-S X、Fe-S A和 Fe-S B。Fe-S 中心 Fe-S X是 P700 结合蛋白的一部分;Fe-S A和 Fe-S B中心位于一个 8 kDa 的蛋白质上,该蛋白质是 PS-I 反应中心复合体的一部分。电子通过中心 Fe-S A和 Fe-S B转移到铁氧还蛋白,一种小的水溶性铁硫蛋白。膜相关的黄素蛋白铁氧还蛋白-NADP 还原酶(FNR) 可降低 NADP +到 NADPH,从而完成了从水的氧化开始的非循环电子传输序列(Karplus 等人,1991)。
PSII 和 PSI 之间的电子传输由质体氢醌、细胞色素b 6 f复合物和质体蓝素介导(参见教科书图 7.26)。细胞色素b 6 f复合物包含两种b型血红素和一种c型血红素(Web 图 7.8.A)
Web 图 7.8.A b型和c型细胞色素 的辅基结构。原血红素基团(也称为原卟啉 IX)存在于b型细胞色素中,血红素c基团存在于c型细胞色素中。血红素c基团通过硫醚键与蛋白质中的两个半胱氨酸残基共价连接到蛋白质上;原血红素基团不与蛋白质共价连接。Fe 离子在还原的细胞色素中处于 2 +氧化态,在氧化的细胞色素中处于 3 +氧化态。
PS-I 中电子载流子的组织模型如图 7.8.B 所示。P700 二聚体位于结构的底部,两个对称臂从 P700 辐射出来(Malkin 和 Niyogi 2000)。每个臂包括一个辅助叶绿素a和另一个叶绿素分子,暂定为 A 0。其他结构包括 Fe-S 中心 F X和另外两个 Fe-S 中心 F 1和 F 2。载体之间的距离如右图所示。
Web 图 7.8.B PS-I 中电子载流子组织的模型。(来自 Schubert 等人,1997 年。)
PS-I 反应中心似乎与厌氧绿硫细菌和日光杆菌中的反应中心有一些功能相似性。这些细菌含有低电位 Fe-S 中心作为早期电子受体,并且可能能够进行铁氧还蛋白介导的 NAD +还原,类似于光系统 I 的 NADP +还原功能。几乎可以肯定,这些复合物和光系统 I 之间存在进化关系产氧生物。
WEB TOPIC 7.9ATP合酶
合成 ATP 的化学机制尚未详细了解。然而,现在有大量证据支持一种机制,首先由 Paul Boyer 提出,其中主要的能量需求步骤是从酶中释放结合的 ATP (Boyer 1993, 1997)。也有人提出,在催化过程中,大部分 CF 1配合物围绕由 γ 亚基组成的轴承旋转(Noji 等人,1997)。γ 子单元可以像凸轮轴一样,交替旋转 α 和 α 子单元(参见 Web WEB TOPIC 12.4)。然后将构象运动的能量转化为磷酸酐键能(Junge et al. 1997)。
类囊体 ATP 合酶有两个片段:CF 0是跨膜片段,CF 1是气孔表面的亲水片段(参见教科书图 7.30)。CF 0将质子从叶绿体腔转移到酶的催化部分(参见教科书图 7.31),CF 1催化 ADP 和无机磷酸盐转化为 ATP。
叶绿体 ATP 合酶有九个不同的亚基。CF 1由两个大亚基 α 和 β 以及三个较小的亚基 γ、δ 和 ε 组成。每个CF 1 分子具有三个拷贝的α和β亚基以及一个拷贝的γ、δ和ε亚基。α和β亚基结合ADP和磷酸盐,催化ADP磷酸化为ATP。
对线粒体 ATP 合酶的研究增加了我们对 ATP 合酶如何工作的理解。正如 Paul Boyer 在 1997 年提出的,ATP 合成是通过结合变化机制进行的(Web 图 7.9.A)。根据该模型,质子梯度的能量用于从酶的催化结合侧释放紧密结合的 ATP。如图 7.9.A 所示,CF 1具有三个核苷酸结合位点,L、T 和 O。假定 ADP 和无机磷酸盐首先与 O 位点结合,然后移动到 L 位点。T 位点结合 ATP。当质子通过 CF 0通道从管腔移动到基质区域时,能量被释放,CF 1的 γ 亚基旋转。旋转导致三个核苷酸结合位点的构象发生变化,这些位点相互转换,从而改变位点对核苷酸的亲和力。随着 T 位点转变为 O 位点,ATP 被释放,另一个循环开始。直接观察 CF 1的 γ 亚基的旋转为结合变化机制提供了强有力的实验支持 (Yasuda et al. 2001)。
Web 图 7.9.A Boyer 的绑定变化机制模型。α 和 β 亚基构成三个核苷酸结合位点:O,为 ADP 和无机磷酸盐提供早期结合位点,L,ADP 和无机磷酸盐从 O 迁移后与之结合,T,与 ATP 紧密结合。质子从叶绿体腔移动到基质所产生的能量驱动 CF 1的 γ 亚基的旋转,以及结合位点的相互转换和 ATP 分子的释放。(取自 Malkin 和 Niyogi 2000,继 Cross 和 Duncan 1996 之后。)
WEB TOPIC 7.10一些除草剂的作用方式
一种主要类型的除草剂——大约一半的商业上重要的化合物——通过中断光合电子流起作用(Ashton 和 Crafts 1981)。Web 图 7.10.A显示了其中两种化合物的化学结构。已发现许多这些试剂的精确作用位点位于光系统 I 的还原侧(例如,百草枯)或位于两个光系统之间的电子传输链中的醌受体复合物(例如,在敌草隆) (网络图 7.10.B)。
Web 图 7.10.A 在现代农业中广泛使用除草剂来杀死不需要的植物。已经开发了许多不同类别的除草剂,它们通过阻断氨基酸、类胡萝卜素或脂质生物合成或通过破坏细胞分裂而起作用。了解除草剂的作用方式一直是研究植物代谢的重要工具,并促进了它们在不同农业实践中的应用(Ashton 和 Crafts 1981)。此处显示了两种阻断光合电子流的除草剂的化学结构。DCMU 也称为敌草隆。百草枯因其在大麻作物上的使用而声名狼藉。
Web 图 7.10.B 除草剂的作用位点。许多除草剂,如 DCMU,通过竞争通常由 Q B占据的质体醌的结合位点来阻断光系统 II 的醌受体处的电子流动。其他除草剂,如百草枯,通过接受来自光系统 I 早期受体的电子,然后与氧气反应形成超氧化物 O 2 -,这种物质对叶绿体成分,尤其是脂质非常有害。
百草枯的作用是在结合的铁氧还蛋白受体和 NADP 之间截取电子,然后将氧还原为超氧化物( O 2 – )。超氧化物是一种自由基,它与叶绿体中的多种分子发生非特异性反应,导致叶绿体活性迅速丧失。细胞膜中的脂质分子特别敏感。
作用于醌受体复合物的除草剂与质体醌竞争Q B结合位点。如果存在除草剂,它会取代氧化形式的质体醌并占据醌受体的特异性结合位点,该位点被认为位于 D1 除草剂结合蛋白上。除草剂不能接受电子,因此电子不能离开第一个醌受体Q A。因此,除草剂的结合有效地阻断了电子流动并抑制了光合作用。许多以这种方式起作用的除草剂还抑制具有醌型电子受体复合物的光合细菌中的电子流动(Trebst 1986)。
近年来,在单一除草剂连续使用数年的地区,出现了普通杂草抗除草剂生物型。这些生物型对某些类别的除草剂的抗性可能比非抗性植物高几个数量级。在一些情况下,抗性因素可追溯到 D1 蛋白中的单个氨基酸取代。这种变化,可能是在肽的醌(和除草剂)结合区域,降低了除草剂的结合亲和力,使其效果大大降低。
通过对 PS-II 反应中心的蛋白质进行细微的改变来微调农作物对除草剂的敏感性的可能性引起了农业化学工业的极大兴趣。通过生物技术,现在可以制造一种对特定除草剂具有抗性的农作物,然后可以将其用于控制不具有抗性的不良植物。这种方法的成功将取决于是否可以控制抗除草剂突变的不良副作用以及杂草通过自然选择或基因转移获得抗性的速度。因此,这是一场科学与进化变化之间的竞赛(Dover and Croft 1986;Chase et al. 1998)。
一种补充方法是通过基因工程将针对某些害虫(例如昆虫)的抗性因子插入植物中。然后植物自己产生有毒物种,消除对杀虫剂的需要。
WEB TOPIC 7.11叶绿素生物合成
在叶绿素生物合成的第一阶段,氨基酸谷氨酸转化为 5-氨基乙酰丙酸 (ALA)(网络图 7.11.A)。这种反应是不寻常的,因为它涉及一个共价中间体,其中谷氨酸连接到一个转移 RNA 分子上。这是生物化学中极少数例子之一,其中 tRNA 用于蛋白质合成以外的过程。然后将两个 ALA 分子缩合形成胆色素原 (PBG),最终在叶绿素中形成吡咯环。下一阶段是由四个 PBG 分子组装卟啉结构。该阶段由六个不同的酶促步骤组成,以产物原卟啉 IX 结束。
Web 图 7.11.A 叶绿素的生物合成途径。该途径从谷氨酸开始,谷氨酸转化为 5-氨基乙酰丙酸 (ALA)。两个 ALA 分子缩合形成胆色素原 (PBG)。四个 PBG 分子连接形成原卟啉 IX。然后插入镁 (Mg),环 E 的光依赖性环化、环 D 的还原和植物醇尾的附着完成了该过程。此图中省略了该过程中的许多步骤。
到目前为止,所有生物合成步骤对于叶绿素和血红素的合成都是相同的(参见教科书图 7.25 和 7.26)。但这里的路径分支,分子的命运取决于插入卟啉中心的金属。如果镁被一种叫做镁螯合酶的酶插入,那么就会发生将分子转化为叶绿素所需的额外步骤;如果插入铁,该物种最终会变成血红素。
叶绿素生物合成途径的下一阶段是通过环化一个丙酸侧链形成原叶绿素,形成第五环(环 E)。该途径涉及使用 NADPH 还原环 D 中的双键之一。该过程由被子植物中的光驱动,并由一种称为原叶绿素氧化还原酶 (POR) 的酶进行。非产氧光合细菌在没有光的情况下使用一组完全不同的酶进行这种反应。蓝藻、藻类、低等植物和裸子植物既包含光依赖性 POR 途径,也包含光非依赖性途径。在完全黑暗中生长的被子植物幼苗缺乏叶绿素,因为 POR 酶需要光照。这些黄化植物在光照下会迅速变绿。叶绿素生物合成途径的最后一步是附着植物醇尾,它由一种称为叶绿素合成酶的酶催化(Malkin 和 Nyogi 2000)。
阐明叶绿素和相关色素的生物合成途径是一项艰巨的任务,部分原因是许多酶的含量很低。最近,遗传分析已被用于阐明这些过程的许多方面(Suzuki et al. 1997, Armstrong and Apel 1998)。
WEB TOPIC 8.1 CO 2泵
有氧光合作用总是利用 rubisco 作为核心酶,参与将无机碳掺入有机化合物的骨架中。然而,
1.目前大气中 CO 2的浓度不会使羧化酶活性饱和,并且
2.与羧化酶活性竞争的加氧酶活性是酶的内在功能。
这些特征可以帮助我们想象为什么许多产生 O 2的生物体包含用于固定无机碳的浓缩机制。这些机制主动运输 HCO 3 –、CO 2和/或 H +以增加 rubisco 活性位点的 CO 2浓度和 CO 2 /O 2比率,从而有利于羧化酶活性。在大多数陆生植物中,CO 2富集机制是 C 4光合作用和景天酸代谢 (CAM)。虽然存在于水生植物中,但 CO 2和 HCO 3 -质膜上的泵在原核蓝细菌和真核藻类中得到了最广泛的研究。
为响应水环境中无机碳浓度的变化,许多光合生物诱导了浓缩 CO 2的机制,因此有利于 rubisco 的羧化反应(Ogawa 和 Kaplan 1987;Giordano 等人 2005)。尽管当用于给培养基充气的空气从 5% CO 2切换到 0.03% CO 2时,蓝细菌和藻类会表现出光呼吸症状(生长迟缓、早熟),但这些生物体迅速发展出浓缩无机碳的能力,因此它们不会更长的光呼吸。在蓝藻中,两种细胞组合对于无机碳的浓度是必不可少的:
1.位于质膜和类囊体膜上的转运蛋白,以及
2.羧基体,其中大部分rubisco和碳酸酐酶都存在。
Web 图 8.1.A 蓝藻 CO 2浓缩机制。位于质膜(紫色框)和类囊体膜(蓝色框)中的转运蛋白将 HCO 3 -和 CO 2泵入蓝藻的胞质溶胶和类囊体。对流出的扩散阻力和 HCO 3的内部梯度-将无机碳驱动到羧基体。羧基体碳酸酐酶催化 HCO 3 -和 CO 2的相互转化,从而增加 rubisco 周围的 CO 2浓度,促进核酮糖 1,5-二磷酸的羧化。
羧基体是一种独特的微体,被蛋白质外壳包围,包含大部分细胞 rubisco,与类囊体膜不同。在大气 CO 2含量低的情况下,蓝细菌分别使用与质膜和类囊体膜相关的HCO 3和CO 2泵在胞质溶胶中积累无机碳。HCO 3 –从胞质溶胶扩散到羧基体中,一旦进入隔室,碳酸酐酶将 HCO 3 –转化为 CO 2以进行 rubisco 反应。
简而言之,无机碳从环境流向 rubisco 附近需要:(1)HCO 3 -在细胞质中的积累;(2) 将其转运至含有 rubisco 的羧基体;(3)通过羧基体碳酸酐酶将 HCO 3 –转化为 CO 2 (Badger and Price 2003)。rubisco 周围CO 2的协同富集最终抑制了 1,5-二磷酸核酮糖的氧化,从而消除了对光呼吸的需要。
WEB TOPIC 8.2如何阐明卡尔文-本森循环
卡尔文循环的阐明是梅尔文卡尔文和他的同事在 1950 年代进行的一系列优雅实验的结果,并因此在 1961 年获得了诺贝尔奖。他们使用单细胞真核绿藻小球藻的悬浮液来追踪循环的路径。碳。卡尔文循环也称为还原戊糖磷酸循环,以区分光合循环和氧化戊糖磷酸途径(见教科书第 12 章),它与氧化戊糖磷酸途径共享几种酶。卡尔文循环的另一个名称是光合碳还原循环。
为了阐明这个循环,研究人员首先将藻类细胞暴露在恒定的光照和 CO 2条件下,以建立稳态光合作用。接下来,他们在短时间内添加放射性14 CO 2以标记循环的中间体。然后他们通过将悬浮液浸入沸腾的酒精中杀死细胞并灭活它们的酶。他们将14 C 标记的化合物彼此分离,并通过它们在二维纸色谱图上的位置来识别它们(网络图 8.2.A)。
Web 图 8.2.A放射自显影图显示了暴露于14 CO 2后 藻类小球藻中碳化合物的标记。图中显示的时间间隔表示暴露于放射性标记的时间。在指定的时间间隔,通过将内容物浸入沸腾的醇中来终止反应。然后通过纸色谱分离细胞匀浆中的标记化合物。3-磷酸甘油酸 (PGA) 在较短暴露时间后的重标记表明它是 Calvin(还原性戊糖磷酸)循环的第一个稳定中间体。(在 Bassham 1965 之后。)
以这种方式,3-磷酸甘油酸和各种糖磷酸盐被鉴定为碳固定的中间体。通过将细胞暴露于14 CO 2的时间逐渐缩短,Calvin 的小组能够将 3-磷酸甘油酸识别为第一个稳定的中间体。因此,其他标记的糖磷酸盐必须来自随后的 3-磷酸甘油酸还原(Bassham 1965)。
为了推断碳的路径,有必要确定每种标记糖中14 C 的分布。在短暂暴露于14 CO 2后,分离出各个中间体并进行化学降解,从而可以确定每个碳原子中14 C 的量。结果表明,3-磷酸甘油酸最初主要标记在羧基上。这一发现表明最初的 CO 2受体是一种双碳化合物,它促使人们对这种化合物进行了漫长而徒劳的搜索。
随后发现戊糖一磷酸和戊糖二磷酸(核酮糖)参与循环,提出了最初的CO 2受体是五碳化合物的可能性。这一概念上的突破迅速导致了将 1,5-二磷酸核酮糖确定为 CO 2受体并形成了完整的循环。循环的操作解释了其他中间体的14 C-标记模式。
为了最终证明存在代谢途径,有必要证明假定的酶催化试管中提出的反应。理想情况下,这些酶反应的速率(体外)应等于或超过在完整细胞(体内)中观察到的速率。然而,这一证据只能用于支持提议的途径。未能在体外证明反应并不能证明反应没有发生。
卡尔文循环的所有反应都已在体外得到证实。除了一个例外,酶活性的体外速率远远超过观察到的最大光合作用速率。那个例外是rubisco,当在空气中的CO 2和O 2水平下进行测定时,它显示出的体外活性几乎不足以解释观察到的空气中的光合作用速率。尽管通过提供适当的激活条件在增加活性方面取得了很大进展,但研究人员仍在争论 rubisco 是否是光合作用的限速步骤(Lorimer 1981)。
WEB TOPIC 8.3Rubisco:一种用于研究结构和功能的模型酶
除了一些原核生物固定的碳外,地球上固定的大部分碳都是经过卡尔文循环处理的。rubisco(卡尔文循环的羧化酶)的浓度通常很高。例如,它占植物叶片总蛋白质的50%以上,在叶绿体内的浓度极高(约0.2 g/ml)。
Rubisco 以两种功能相似的形式出现,具有不同的结构、分布和 O 2敏感性。产氧光养生物(蓝细菌,高等植物的叶绿体)和许多光合细菌含有一种酶,(I 型),由八个大 (L) 催化亚基(每个约 55 kDa)和八个小 (S) 亚基组成(每个约 14 kDa),得到完整蛋白质的分子量约为 560 kDa (L 8 S 8 )。I 型的 8 个 L 亚基排列成一个八聚体核心,周围有两层四个 S 亚基,每一层位于分子的相对两侧(Web 图 8.3.A)。
Web 图 8.3.A 高等植物叶绿体中 rubisco 结构的模型。Rubisco 由 8 个大 (L) 和 8 个小 (S) 亚基组成,排列为 4 个二聚体。小亚基以红色显示(仅看到四个小亚基),大亚基以蓝色和绿色显示,以显示二聚体的边界。(来自 Malkin 和 Niyogi 2000。)
rubisco 的 II 型存在于一些光合紫色无硫细菌中,它由两个 L 亚基组成,每个 L 亚基为 50 kDa。真核藻类甲藻也使用变形菌祖先的二聚酶。最近在缺乏卡尔文循环的光合绿色硫细菌中发现了一种缺乏催化活性的类rubisco酶。证据表明,该酶可能在硫氧化中发挥作用,为光合电子传递链提供电子。基因组序列显示,rubisco 样蛋白也存在于某些异养细菌中。
酶特异性
除了羧化反应外,rubisco 还与 O 2反应,导致光呼吸作用,这是一种明显浪费的反应,会降低碳结合到有机化合物中的效率(参见教科书第 8 章)。由于 CO 2和 O 2是 rubisco 的竞争底物,1,5-二磷酸核酮糖的 2,3-烯二醇中间体的羧化(参见教科书图 8.4)取决于环境比率 CO 2 / O 2(参见网络WEB TOPIC8.5)和酶的内在特征(即特异性因子φσ)。
当 CO 2和 O 2作为底物竞争 rubisco 时,羧化速率和氧化速率分别由 Web 方程 8.3.1 和 8.3.2 给出。
网络公式 8.3.1
网络公式 8.3.2
式中K c : CO 2的米氏常数;K o : O 2的米氏常数;V c : 羧化的最大速度;和V o:氧合的最大速度。
在此基础上,rubisco 催化的羧化与氧化的比例为
其中特异性因子 (φ) 表示 rubisco 的两种竞争底物之间的区别。显然,较高的 φ 值表明对 CO 2的特异性更高。
特异性因子 φ 的范围从 50(蓝细菌)到 80(C 3和 C 4植物)在 rubisco 的形式 I 中,但在形式 II 中下降到大约 10(紫色光合细菌)。对 rubisco 的特性影响特异性因子的方式进行更详细的分析表明,K c(羧化)是变异的主要原因,但也发现 了K o(氧化)和V c / V o的变化。
生物合成和组装
编码 rubisco 的小 ( rbcS ) 和大 ( rbcL ) 亚基的基因对自养细胞的功能至关重要。与基因表达和蛋白质生物合成发生在同一个细胞区室(胞质溶胶)中的原核生物相比,大多数真核生物的 rubisco 是通过多个生化过程的协调作用组装而成的,这可能需要多个细胞区室的参与。植物核(Metaphyte)和绿藻(Chlorophyte )中rbcS表达的光介导调节) 在胞质核糖体上产生前体多肽。穿过叶绿体包膜的易位去除了 N 末端质体靶向肽,并在叶绿体基质中释放成熟形式。另一方面,植物和绿藻的叶绿体基因组编码rbcL,因此大亚基的生物合成完全发生在叶绿体核糖体上。rubisco 从其组成亚基的组装发生在叶绿体中。
并非所有的光合生物都具有相同的 rubisco 基因。编码大型和小型 rubisco 亚基的基因存在于棕色(色藻)和红色(红藻)藻类的叶绿体中。另一方面,甲藻缺乏rbcS,因为它们的叶绿体中只有酶的 II 型,更重要的是,rbcL完全存在于核基因组中。
一些光合真核生物的核 DNA 中编码叶绿体蛋白的基因还有另一个有趣的特征。植物和绿藻的rbcS基因编码仅包含一个成熟蛋白质拷贝的前体,但原生生物纤细眼虫的rbcS和甲藻的核rbcL编码的多肽分别包含成熟蛋白质的 8 个和 3 个拷贝蛋白质。这些前体在叶绿体包膜处的后续蛋白水解加工确保了功能酶在基质中的组装。
调节蛋白质折叠的特殊蛋白质有助于在使用 ATP 的过程中形成 L 8 S 8类型的 rubisco。这些称为伴侣蛋白的蛋白质可修饰靶蛋白的非共价相互作用并产生酶的活性构象。几种不同的伴侣蛋白促进两个亚基的组装。
WEB TOPIC 8.4陆地植物光合作用的能量需求
卡尔文-本森循环有效利用能源
需要由 ATP 和 NADPH 提供的恒定能量输入来保持 Calvin-Benson 循环功能以固定 CO 2。在 Calvin-Benson 循环的羧化和还原阶段形成磷酸丙糖需要在光照下在叶绿体的类囊体膜中产生能量 (ATP) 和还原当量 (NADPH)。
3 CO 2 + 3 核酮糖 1,5-二磷酸 + 3 H 2 O + 6 NADPH + 6 H + + 6 ATP →
6 磷酸丙糖 + 6 NADP + + 6 ADP + 6 P i
在稳态光合作用下,形成的六分之一磷酸丙糖离开卡尔文-本森循环,用于淀粉和蔗糖的净合成,而其余六分之五用于补充核酮糖 1,5-二磷酸。再生阶段需要额外的 ATP 来形成主要的 CO 2 -受体。
5 个磷酸丙糖 + 3 个 ATP → 3 个 1,5-二磷酸核酮糖 + 3 个 ADP
因此,卡尔文-本森循环的一整圈利用 9 个 ATP 和 6 个 NADPH 将三个 CO 2固定成一个磷酸丙糖(网络图 8.4.A)。总之,通过卡尔文-本森循环固定成碳水化合物的每个 CO 2分子消耗 2 分子 NADPH 和 3 分子 ATP;即,ATP:NADPH 的比例为3:2/CO 2光同化。
Web 图 8.4.A 卡尔文-本森循环运行的能量需求
在此基础上,我们可以通过比较从 CO 2合成碳水化合物所消耗的能量与 NADPH 氧化和 ATP 水解所 消耗的能量来计算 Calvin-Benson 循环的效率。为此,必须考虑以下几点:
一摩尔己糖完全氧化成CO 2(燃烧)释放的能量等于相反合成所需的最小能量[C 6 H 12 O 6 + O 2 → CO 2 + H 2 O ΔG ° = 2,804 kJ]。
在 12 摩尔 NADPH [NADPH + 1 / 2 O 2 + H + → NADP + + H 2 O Δ G°的氧化过程中,由 6 摩尔 CO 2合成 1 摩尔 6-磷酸己糖果糖消耗 3,126 kJ = –217 kJ/mole] 和 522 kJ 水解 18 摩尔 ATP [ATP + H 2 O → ADP + P i ΔG° = –29 kJ/mole];即 [(12 摩尔 NADPH × 217 kJ/摩尔) + (18 摩尔 ATP × 29 kJ/摩尔) = –3,648 kJ]。
因此,卡尔文-本森循环的热力学效率约为。75% [(2,804/3,648) × 100]。对这些计算的进一步检查表明,CO 2向碳水化合物的转化主要是一个还原过程,因为所需的大部分能量来自 NADPH。12 摩尔 NADPH 的氧化释放 2,604 kJ,而 18 摩尔 ATP 的水解提供 522 kJ;因此,卡尔文-本森循环中使用的总能量的 83% [(2,604/3,126) × 100] 来自还原剂 NADPH。
植物只能利用光合有效辐射(波长范围为 400 至 700 nm 的光)。在此基础上,如果我们知道入射光的能量含量和光合作用过程的最小量子需求(固定每摩尔 CO 2吸收的量子摩尔数;参见教科书第 7 章) ,我们就可以计算出光合作用的最大总热力学效率。 . 在卡尔文-本森循环中固定一摩尔 CO 2使用两摩尔 NADPH 和三摩尔 ATP。最低量子要求通常计算为每 2 摩尔 NADPH 和 ATP 各有 8 个光子(最低量子要求是每个电子有 2 个光量子,然后用 8 个光量子来驱动水的氧化:2 H 2 O → O2 + 4 H + + 4 e – )。需要额外的光量子来驱动循环电子流以产生固定CO 2所需的第三个ATP 。680 nm 的红光每摩尔光子含有 175 kJ。因此,将 6 摩尔 CO 2还原为 1 摩尔己糖所需的最小光能约为 6 × 9 × 175 kJ = 9,450 kJ。假设合成一摩尔己糖至少需要 2,804 kJ,光合作用的最大总热力学效率约为光合有效辐射的 29.7% [(2,804/9,450) × 100]。
因此,当热力学估计依赖于底物提供的能量时,CO 2 的光合作用同化的理论效率为90%,但当计算依赖于来自入射光的能量时,则下降到几乎 30%。这种差异表明大部分光能在 ATP 和 NADPH 的产生中通过光反应而不是在卡尔文-本森循环的运行过程中损失。
然而,在田间正常生长条件下,植物的性能实际上远低于这些理论值。一般而言,植物的发育阶段和环境因素(如水、矿质养分、温度)共同倾向于降低光合作用的产量。大多数作物(例如马铃薯、大豆、小麦、稻米和玉米)的转化效率通常在 0.1% 到 0.4% 之间。对于得克萨斯州和夏威夷州的甘蔗,在最佳条件下可以实现近乎全年的活跃生长,其价值接近 2%。
C 4和 CAM 循环比 Calvin-Benson 循环具有更高的能量需求
C 4循环。热力学告诉我们,必须努力建立和维持代谢物的每一个梯度。该原理也适用于C 4循环中CO 2浓度梯度的操作。根据所涉及的反应的总和(参见教科书表 8.4),我们计算出 NADP-苹果酸酶在束鞘细胞中的作用 [苹果酸 + NADP + → 丙酮酸 + NADPH + CO 2 ](反应 4)平衡了叶肉细胞中的苹果酸脱氢酶用于还原草酰乙酸 [草酰乙酸 + NADPH → 苹果酸 + NADP + ](反应 2)。另一方面,初级CO 2的再生-受体,磷酸烯醇丙酮酸,在叶肉细胞中消耗两个额外的 ATP 分子来驱动两个 endergonic 反应——由丙酮酸 - 磷酸二激酶 [丙酮酸 + P i + ATP → 磷酸烯醇丙酮酸 + AMP + 焦磷酸] 和腺苷酸激酶 [AMP + ATP → 2 ADP] 催化](网络图 8.4.B)。这些反应通过焦磷酸酶[焦磷酸盐 + H 2 O → 2 磷酸盐] 催化焦磷酸盐水解为无机磷酸盐得到补充。
Web 图 8.4.B进行 C 4光合作用所需的补充能量
总之,通过C 4光合作用固定成碳水化合物的每一个CO 2分子利用了两个NADPH分子和五个ATP分子;即 ATP:NADPH 的比例为 5:2/CO 2光同化。
由于这种更高的能量需求,在非光呼吸条件(高 CO 2和低 O 2 )下进行光合作用的C 4植物每 CO 2比 C 3叶需要更多的光量子。在正常空气中,C 3植物的量子需求随影响光合作用和光呼吸平衡的因素而变化,例如温度。相比之下,由于避免光呼吸的内置机制,C 4植物的量子需求在不同的环境条件下保持相对恒定(参见教科书图 9.16)。
凸轮循环。两分子 NADH 用于在两分子 CO 2 的夜间固定中还原草酰乙酸,但在两分子 CO 2的昼夜释放中产生两分子 NADH,以运行 Calvin-Benson 循环。也就是说,PEPCase 对两个还原吡啶核苷酸分子的夜间利用与苹果酸酶在白天形成的相似量相匹配。
另一方面,需要额外的能量来从丙酮酸(苹果酸昼夜脱羧过程中形成的三碳化合物,四碳化合物)中建立足够水平的磷酸烯醇丙酮酸(CO 2的夜间主要受体)(参见教科书)图 8.13)。白天,两个丙酮酸分子通过糖异生将一个己糖部分结合到淀粉中(网络图 8.4.C)。两个分子的 NADH 和七个当量的 ATP 用于将两个分子的丙酮酸昼夜转化为淀粉(Web 表 8.4.A)。在晚上,从一分子己糖(来自淀粉)夜间形成两分子磷酸烯醇丙酮酸产生两分子 NADH 和两分子 ATP,但在从淀粉形成果糖-1,6-二磷酸时消耗了两分子 ATP .
Web 图 8.4.C CAM 工厂运行所需的补充能源
网络表 8.4.A
昼夜糖异生
2 丙酮酸+ 6 ATP + 2 NADH → 葡萄糖 6-磷酸 + 6 ADP + 5 Pi + 2 NAD +
葡萄糖 6-磷酸 ↔ 葡萄糖 1-磷酸
葡萄糖 1-磷酸 + ATP → ADP-葡萄糖 + 焦磷酸焦
磷酸 → 2 磷酸
ADP-葡萄糖 → [淀粉] + ADP
NET:2 丙酮酸+ 7 ATP + 2 NADH → [淀粉] + 7 ADP + 7 磷酸盐 + 2 NAD +
____________________
磷酸烯醇丙酮酸[淀粉]的夜间形成→ 麦芽糖 → 葡萄糖
葡萄糖 + ATP → 葡萄糖 1-磷酸 + ADP
葡萄糖 1-磷酸 ↔ 葡萄糖 6- 磷酸 ↔ 果糖 6-磷酸
果糖 6-磷酸 + ATP → 果糖 1,6-二磷酸 + ADP
果糖 1,6-二磷酸 → 2 磷酸丙糖
2 磷酸丙糖 + 2 磷酸 + 2 NAD + → 2 1,3-二磷酸甘油酸 + 2 NADH
2 1,3-二磷酸甘油酸 + 2 ADP → 2 3-磷酸甘油酸 + 2 ATP
2 3-磷酸甘油酸 → 2 2-PGA
2 2-PGA → 2 磷酸烯醇丙酮酸
NET:淀粉+ 2 NAD + + 2 磷酸 → 2 磷酸烯醇丙酮酸+ 2 NADH
____________________
昼夜丙酮酸净转化为夜间磷酸烯醇丙酮酸
2 丙酮酸+ 7 ATP → 2 磷酸烯醇丙酮酸+ 7 ADP + 5 磷酸
总之,在 CAM 光合作用中使用 3.5 分子 ATP 补充了利用 2 分子 NADPH 和 3 分子 ATP通过卡尔文-本森循环将固定在碳水化合物中的每个 CO 2分子同化。
WEB TOPIC 8.5 Rubisco 激活酶
Rubisco 催化 CO 2与 1,5-二磷酸核酮糖的烯二醇形式的 C-2 结合,随后裂解不稳定的中间体,产生两个 3-磷酸甘油酸分子(参见 Web WEB TOPIC 8.3 和教科书图 8.4)将非活性形式的 rubisco 转化为活性状态,这是羧化和氧化反应所需的,需要特定赖氨酸残基(在菠菜中,Lys-201)的氨甲酰化(Web 图 8.5.A)。由于 CO 2 –分子与赖氨酸残基结合,酶获得了为辅因子 Mg 2+提供结合位点的阴离子残基三联体(在菠菜中,另外两个残基是 Asp-203 和 Glu-204)。在这个阶段,核酮糖-1,5-二磷酸的掺入导致rubisco的构象变化,这使得酶可以将糖二磷酸从溶剂中分离出来,并在与CO 2或O 2分子结合后开始催化循环. 然而,核酮糖-1,5-二磷酸与未氨甲酰化酶分子的紧密结合将平衡置换为死端复合物rubisco-ribulose-1,5-二磷酸,因此反应速率迅速下降直至最终停止。这个问题是如何解决的?
Web 图 8.5 . rubisco 激活酶 对 rubisco 的调节。rubisco (E) 与调节剂的组合或相互作用将酶分布在不同的状态(黄色框)。特定赖氨酸残基 (E-NH 2 ) 的非质子化形式与 CO 2反应释放质子并形成由辅因子 Mg 2+ (E-NH-CO 2 ) 稳定的氨基甲酸酯 (E-NH-CO 2 - ) – . Mg 2+ )。在这个阶段(蓝色框),rubisco 具有催化能力,从而结合 1,5-二磷酸核酮糖 (RuBP) 产生三元复合物 (E-NH-CO 2 – . Mg 2+. RuBP),其中后者转化为烯二醇形式。这需要在活性位点结合 CO 2或 O 2以分别产生羧化或氧化产物。1,5-二磷酸核酮糖对游离rubisco (E-NH 3+ ) 的高亲和力产生了死端复合物(E-NH 3+ .RuBP),从而将上述平衡置换为催化无能状态。Rubisco-activase (RA) 与二元复合物非共价相互作用,促进核酮糖 1,5-二磷酸(红色框)的释放,释放酶以进行下一个氨甲酰化循环。该过程需要同时水解 ATP。
遗传、生理和生化研究的结合为长期的 rubisco 激活之谜提供了解决方案。在体内,拟南芥的一些突变体缺乏光介导的rubisco活化,只能在高浓度CO 2下生长。令人惊讶的是,该突变并未削弱酶对体外CO 2和Mg 2+调节的反应。这些相互矛盾的结果导致发现了一种蛋白质,rubisco-activase,它将核酮糖-1,5-二磷酸与去氨甲酰化的活性位点解偶联,从而促进 CO 2和 Mg 2+的进入用于酶的氨甲酰化。这一过程的重要性在于,rubisco 激活酶增强 rubisco 催化能力的速率与 ATP 的水解有关(水解 50 个 ATP 分子 / 激活 1 个 rubisco 位点)。由于共同前 mRNA 的差异剪接,在几个物种中发现的两种 rubisco 激活酶同工型(42 和 46 kDa)在 C 末端区域不同。两种异构体都催化 rubisco 的活化和 ATP 的水解,但对于这两种活性,较小的异构体比较大的异构体具有更高的能力。研究表明,用胰蛋白酶消化天然 rubisco 激活酶或通过定点诱变修饰其一级结构不会在刺激 rubisco 和ATP 的水解(Esau 等人 1996,Kallis 等人 2000)。更重要的是,在 rubisco 激活酶 C 区的一些残基的缺失使 rubisco 活化率加倍,而对 ATP 水解的影响很小。
激活酶对 Rubisco 的激活需要两种蛋白质的相互识别。来自烟草(茄科)的 Rubisco 激活酶不能激活来自菠菜或衣藻(非茄科)的 Rubisco,同样,来自菠菜或衣藻的 Rubisco 激活酶也不能激活来自烟草的 Rubisco 。然而,在红衣藻大亚基表面上的一些残基的取代将特异性从非茄科转变为茄科红衣藻激活酶(Ott 等人,2000)。这些实验强调了特定氨基酸对蛋白质-蛋白质相互作用的贡献,并为从随后的激活过程中分离出来的识别步骤提供了实验证据。
WEB TOPIC 8.6 硫氧还蛋白
硫氧还蛋白是具有催化活性的二硫基团的 12 kDa 蛋白质,存在于大多数(如果不是所有)生物体中。硫氧还蛋白具有一个具有两个氧化还原活性半胱氨酸残基的活性位点 (-Trp-Cys-Gly-Pro-Cys-)。活性位点位于基序的第一个 α 螺旋上,该基序由三个侧翼 α 螺旋和一个四链 β 折叠组成,已在几种氧化还原活性蛋白中鉴定(网络图 8.6.A)。
Web 图 8.6.A 硫氧还蛋白 2,来自鱼腥藻。显示了蛋白质的 α-β-α 拓扑结构。(MOE,Chemical Computing Group, Inc. 的分子操作环境)
每种硫氧还蛋白的氧化形式包含一个二硫键 (-SS-) 桥,该桥通过还原的铁氧还蛋白或 NADPH 还原到巯基 (-SH) 水平(参见教科书图 8.6)。硫氧还蛋白的还原形式是还原蛋白质分子内(链内)二硫键的极好催化剂,这些二硫键只能被其他主要的细胞巯基还原剂谷胱甘肽或谷氧还蛋白缓慢还原。还原后,硫氧还蛋白特异性靶向酶的二硫键会导致催化活性发生显着变化(通常增加)。首先观察到激活光合作用酶,硫氧还蛋白现在已知在许多细胞类型中发挥广泛的调节作用。
尽管在细菌和动物中仅检测到一种硫氧还蛋白,但光合细胞中存在三种特征明确的变体。三者中的两个(m和f)位于叶绿体中,可以根据目标酶的一级结构和特异性相互区分,这一特征导致了它们的发现。这两种叶绿体硫氧还蛋白被来自激发的叶绿素的电子通过铁氧还蛋白和铁氧还蛋白-硫氧还蛋白还原酶 (FTR) 还原,FTR 是一种具有催化活性二硫基团的铁硫酶。
除了激活卡尔文循环的酶外,铁氧还蛋白-硫氧还蛋白系统还激活其他叶绿体过程的酶。因此,硫氧还蛋白通过 NADP-苹果酸脱氢酶、脂肪酸生物合成、类囊体结合的 ATP 合酶(偶联因子)和叶绿体 mRNA 的 5' 非翻译区的激活蛋白分别激活C 4循环、光磷酸化和 mRNA 翻译. 已经表明,除了在 C 4植物中的作用外,硫氧还蛋白连接的 NADP-苹果酸脱氢酶在 C 3植物处于一个循环过程中,将叶绿体中合成的苹果酸转运到胞质溶胶中,在胞质溶胶中产生 NADH。在这种氧化过程中形成的草酰乙酸被转运回叶绿体,以通过特定的逆向转运体交换苹果酸。
叶绿体还含有一种酶,6-磷酸葡萄糖脱氢酶,它是氧化戊糖磷酸循环的主要调节酶(见教科书第 12 章),其功能与光合作用酶相反:它在被硫氧还蛋白还原时失活。通过降低这种酶的活性,光抑制了用于分解碳水化合物的氧化戊糖磷酸途径的运作(见教科书第 12 章)。因此,叶绿体使用硫氧还蛋白将光与通过两个主要相反碳途径的碳流控制联系起来(Scheibe 1990;Buchanan 1992;Schürmann 和 Jacquot 2000)。
受硫氧还蛋白调节的酶显示出不同程度的特异性。与卡尔文循环相关的酶、1,6-二磷酸果糖磷酸酶、1,7-二磷酸景天酮糖磷酸酶、5-磷酸核酮糖激酶、NADP-3-磷酸甘油醛脱氢酶和 rubisco 活化酶,优先被硫氧还蛋白f激活. 一种酶,ATP 合酶,在光磷酸化中催化 ATP 的合成(参见 Web WEB TOPIC 7.9),它被两种叶绿体硫氧还蛋白激活。
硫氧还蛋白m可有效激活 NADP-苹果酸脱氢酶(一种 C 4光合碳循环和 C 3氧化还原穿梭酶),并使 6-磷酸葡萄糖脱氢酶失活。已发现“ m ”或细菌类型的硫氧还蛋白调节其他依赖光的叶绿体过程,例如mRNA的翻译。
植物具有第三类硫氧还蛋白,即h型——位于细胞质、内质网和线粒体中,在黄素蛋白酶 NADP-硫氧还蛋白还原酶 (NTR) 催化的反应中被 NADPH 还原:
目前正在几个植物系统中研究 硫氧还蛋白h的功能,包括种子、韧皮部和花粉。在谷物中,已发现它可促进谷物萌发早期胚乳中碳和氮的动员。硫氧还蛋白h的作用似乎是 (1) 通过减少主要的种子贮藏蛋白,从而增强它们对蛋白酶的敏感性,(2) 通过激活一种新发现的钙连接蛋白酶(硫钙素),和 (3) 通过中和(通过还原它们的链内二硫键)是抑制淀粉降解酶的低分子量蛋白质。
通过基因失活的研究,硫氧还蛋白h已被确定为花粉自交不亲和性发展的必要条件,并且是韧皮部的重要组成部分。硫氧还蛋白,再次与 NADP 相关,也被发现在动物细胞中广泛发挥作用,从转录到免疫反应的发展再到胚胎发生。
硫氧还蛋白的这些生化和分子研究已导致在技术和医学中的可能应用。硫氧还蛋白可用于通过降低过敏性和增加消化率来改善食品。正在进行的研究揭示了硫氧还蛋白在诊断和监测某些人类疾病、中和毒液神经毒素和参与炎症反应的因素以及提高器官移植成功率方面的潜在用途。硫氧还蛋白就是将基础研究中学到的原理应用于当代社会问题的一个例子。
WEB TOPIC 8.7 C 2氧化光合碳循环的运行
支持 C 2氧化光合碳循环的证据来自几种类型的实验。C. Somerville 和 WL Ogren使用缺乏磷酸乙醇酸磷酸酶(教科书表 8.2 中催化反应 2 的酶)的突变拟南芥植物证明,在有利于光呼吸的条件下,来自14 CO 2的放射性在 2-磷酸乙醇酸中积累(高浓度的 O 2,低浓度CO 2浓度),但不是在非光呼吸条件下(低 O 2,高 CO 2)。此外,体内乙醇酸的合成依赖于O 2并被CO 2抑制正如rubisco在周期中的主要角色所预期的那样,以竞争的方式进行。
几项研究表明,与卡尔文循环一样,C 2氧化光合碳循环的酶在体外以高于体内光呼吸速率的速率催化所有提出的反应。此外,参与的酶定位于叶绿体(rubisco、磷酸乙醇酸磷酸酶、甘油酸激酶)、过氧化物酶体(乙醇酸氧化酶、过氧化氢酶、羟基丙酮酸还原酶和两种氨基转移酶)和线粒体(甘氨酸脱羧酶和丝氨酸羟甲基转移酶)(见教科书表 8.2)(Hatch 和 Osmond 1976;Tolbert 1981)。
WEB TOPIC 8.8 二氧化碳:一些重要的物理化学性质
了解 CO 2固定的机制需要了解 CO 2的物理和化学性质,尤其是与它与水的相互作用相关的那些。溶解在水中的任何气体的量与其溶液上方的分压( P gas)(亨利定律)及其本生吸收系数(α )成正比。本生吸收系数是一体积水在 1 个大气压下吸收的气体体积,它与温度有关,随温度升高而减小。
因此,气体的溶解度随着温度的升高而降低。因此,对于给定的温度,
其中V 0是标准温度和压力下理想气体的标准体积(V 0 = 22.4 L mol –1)。
我们可以通过将气体的摩尔分数乘以总压力来计算气体的分压。气体的摩尔分数是其部分体积除以所有存在的气体的总体积。因此,空气中CO 2和O 2的摩尔分数分别为0.0345%和20.95%。在海平面,大气压力约为0.1 MPa,因此CO 2和O 2的分压分别为3.4 × 10 –5和2.1 × 10 –2 MPa。
根据这些值和α值,CO 2和 O 2的相应溶液浓度可以通过上面给出的等式计算。下表列出了这些浓度在不同温度下的值。
这些值对羧化作用有相当大的限制。作为一种羧化酶,rubisco 必须能够在其可用的 CO 2浓度相当低的情况下有效运行。Rubisco 在光呼吸中也起到加氧酶的作用,因此 O 2的溶液浓度也很重要。
由于本生吸收系数α(CO 2 ) 和α(O 2 ) 的温度依赖性不同,这两种气体的浓度随温度而变化,使得CO 2与O 2的比率随着温度升高而降低。这种效应在生物学上很重要,因为随着温度的升高,rubisco 催化的羧化与氧化的比例降低,光呼吸与光合作用的比例因此增加。
Web 表 8.8.A作为温度函数的 CO 2和 O 2溶解度。
严格地说,将大气中的 CO 2掺入溶液中包括两个反应:
增溶CO 2 (gas) → CO 2 (aq)
和水合CO 2 (aq) + H 2 O → H 2 CO 3,K = 2 × 10 –3。
H 2 CO 3相对于CO 2 (aq) 的低比例以及难以通过实验区分这些物种导致将它们的浓度集中在亨利定律中。可以使用 Lewis 和 Wallace (1998) 开发的计算机程序获得对海洋和淡水中无机碳形态的进一步描述。
WEB TOPIC 8.9 C 4代谢的三种变化
基本 C 4途径 有三种变体(网络图 8.9.A)。变化的主要区别在于输送到束鞘细胞(苹果酸或天冬氨酸)中的 C 4酸和脱羧方式。
Web 图 8.9.A C 4光合碳循环 的三种变体。这些变体的主要区别在于 (1) 转运到束鞘细胞中的四碳酸(苹果酸或天冬氨酸)的性质和返回叶肉细胞的三碳酸(丙酮酸或丙氨酸)的性质和 (2) 性质在束鞘细胞中催化脱羧步骤的酶。这三种变体以催化脱羧反应的酶命名。每个变体的代表包括玉米、马唐、甘蔗、高粱(NADP苹果酸酶);藜麦,小米(NAD苹果酸酶);几内亚草(磷酸烯醇丙酮酸羧激酶)。
这些变异以催化各自脱羧反应的酶命名:叶绿体中发现的 NADP 依赖性苹果酸酶 (NADP-ME);线粒体中的 NAD 依赖性苹果酸酶 (NAD-ME);和胞质溶胶中的磷酸烯醇丙酮酸羧激酶 (PEP-CK)。文中的讨论追溯了 NADP-ME 类型的碳路径,例如甘蔗或玉米。
碳路径
由 PEP 羧化酶催化的初级羧化反应在所有三种变体中都很常见,发生在叶肉细胞的胞质溶胶中,并使用 HCO 3 -而不是 CO 2作为底物(参见教科书表 8.4,反应 1)。在 NADP-ME 变体中,NADPH 使用 NADP-苹果酸脱氢酶将叶肉叶绿体中的草酰乙酸迅速还原为苹果酸(参见教科书表 8.4,反应 2)。形成的苹果酸进入束鞘细胞的叶绿体并发生氧化脱羧(见教科书表 8.4,反应 4),产生丙酮酸。束鞘细胞内释放的CO 2通过卡尔文循环转化为碳水化合物。
残留的 C 3酸以丙酮酸的形式运回叶肉,并在叶肉叶绿体中转化为磷酸烯醇式丙酮酸(参见教科书表 8.4,反应 7)。该反应发生在所有三种 C 4变体的叶肉叶绿体中。然后循环再次开始,磷酸烯醇丙酮酸羧化生成草酰乙酸(Gutierrez et al. 1974)。
在所有三种 C 4变体的叶肉叶绿体中定位的另一个过程是将 3-磷酸甘油酸还原为磷酸丙糖,这发生在 C 3叶绿体中的卡尔文循环中。相反,所有 C 4变体都从束鞘中输出 3-磷酸甘油酸以减少叶肉叶绿体。还原后,磷酸丙糖被转运回束鞘叶绿体,用于在那里进行卡尔文循环。
束鞘和叶肉叶绿体之间卡尔文循环显着分裂的一个可能原因是限制束鞘中的电子传递活动和氧气释放,从而避免有利于光呼吸的氧气水平(Bowyer 和 Leegood 1997)。C 4途径代谢物的运输伴随着质子和其他离子物质的运动,以维持 pH 值和电荷平衡。
WEB TOPIC 10.10 单细胞 C 4光合作用
在 1960 年代阐明光合作用的 C 4途径之后的许多年里,Kranz 型叶解剖学与 C 4光合作用同义。在 2000 年代初期,在缺乏克兰兹解剖结构的陆地植物中发现了 C 4光合作用,揭示了 C 4碳固定机制的多样性比以前认为的要大得多(Edwards 等人,2004 年)。两种植物,一种生长在中亚(Borszczowia aralocaspica)和另外两种种从安纳托利亚向东到巴基斯坦(Bienertia cycloptera和B. sinuspersici),进行了完整的 C 4单个chlorenchyma 细胞中的光合作用(Sage 2002;Edwards 等人 2004)(参见教科书图 8.12B)。此外,大量证据表明C 4光合作用也在被子植物之外进化。一些海洋大型藻类和重要的光合自养海洋原生生物(硅藻)也在单个细胞中 进行 C 4光合作用(Edwards et al. 2004)。
陆地单细胞 C 4光合作用
Borszczowia aralocaspica和Bienertia cycloptera (均为藜科)由于酶和叶绿体在同一细胞的两个区域之间分布不均匀,可以在单个细胞内进行 C 4光合作用。两种亚洲植物的这一特性使细胞能够将 CO 2集中在 rubisco 周围,从而最大限度地减少 C 2氧化碳循环(参见教科书图 8.12B)。
在Borszczowia叶子中,叶绿素自发荧光的共聚焦显微镜显示靠近维管束的叶绿体形成致密的一层,而与大气接触的叶表面附近的叶绿体较少。此外,胞质酶 PEPCase 的合成和细胞两端的二态叶绿体的发育伴随着Borszczowia子叶中绿色组织的形成。维管系统近端的叶绿体具有发育良好的颗粒,含有rubisco,并储存淀粉,而位于远端的叶绿体颗粒减少,含有丙酮酸-磷酸二激酶,缺乏淀粉。
大气 CO 2的同化发生在绿壁组织细胞中,其中细胞溶质 PEPCase 催化 HCO 3 -结合到磷酸烯醇丙酮酸中,形成草酰乙酸,即苹果酸的前体。四碳酸扩散穿过没有细胞器的细胞质区域,到达靠近血管系统的细胞区域。在位于血管区域的线粒体中,NAD-苹果酸酶将苹果酸脱羧,释放 CO 2和丙酮酸并产生 NADH(参见教科书表 8.4,反应 4)。CO 2被 rubisco 和线粒体周围叶绿体中的 Calvin-Benson 循环捕获。形成的丙酮酸扩散回与大气接触的区域,在那里叶绿体丙酮酸-磷酸二激酶将丙酮酸转化为磷酸烯醇式丙酮酸。因此,这些特定细胞在细胞内模拟经典 C 4 Kranz 解剖学的扩散路径,将细胞器定位为一种适应性反应,以确保rubisco 周围 的高浓度 CO 2 。
海洋单细胞 C 4光合作用
硅藻是丰富的单细胞藻类,存在于海洋和内陆水域,占海洋初级生产力的 40%。HCO 3 –在海水中的浓度很高(约 2 m M),但这种形式的无机碳不能用作 rubisco 的底物。为了克服碳固定速率的这种限制,许多真核浮游植物物种已经进化出依赖能量的机制来浓缩 CO 2。用海洋硅藻Thalassiosira weissflogii进行的短期放射性同位素标记实验揭示了 CO 2的初始掺入转化为四碳酸,随后将碳转移到 3-磷酸甘油酸和糖中。此外,PEPCase 的特异性抑制剂(即 3,3-二氯-2-二羟基膦酰基甲基-2-丙烯酸酯)可将适应低 CO 2 (10 μ M ) 的Thalassiosira weissflogii细胞的光合作用抑制超过 90%。然而,随后 CO 2增加到 150 μM或 O 2减少到 80 μM会使光合作用恢复到控制水平(Reinfelder 等人,2004 年)。
我们对硅藻对无机碳的吸收和同化的理解在Thalassiosira pseudonana和Phaeodactylum tricornutum的全基因组序列发表后取得了显着进展。在这些基因组中寻找参与碳水化合物途径的酶,确定了可能参与类 C 4光合作用的基因;即,PEPCase、丙酮酸-磷酸二激酶和磷酸烯醇丙酮酸羧激酶(Armbrust 等人 2004;Kroth 等人 2008)。C 4循环的各种酶的多达五种不同的异构体被认为分布在质体、线粒体和胞质溶胶之间。虽然 PEPCase 最初羧化的亚细胞定位仍不清楚,但硅藻中的 C4途径取决于线粒体中 CO 2的脱羧释放与叶绿体中 Rubisco 对 CO 2的利用的空间分离。
WEB TOPIC 8.11叶绿体磷酸盐转运蛋白
叶绿体是叶细胞内的代谢动力。它们不仅是碳、氮和硫同化的主要场所,而且还与其他植物细胞区室共享代谢途径——例如光呼吸碳循环。代谢物和离子与胞质溶胶的持续交换对于发挥这些作用是必要的。在所有维管植物中,质体都被一个限制极性分子非特异性扩散的包膜包围。因此,一对同心膜调节基质内部和胞质溶胶之间的代谢物交换(Neuhaus 和 Wagner 2000)。尽管在外膜中表征了许多底物特异性的成孔蛋白,但内膜被认为是细胞质和叶绿体之间的主要渗透屏障。
叶绿体转运蛋白统称为磷酸盐转运蛋白,催化正磷酸盐与磷酸丙糖、磷酸戊糖和磷酸己糖的严格 1:1 反向交换(逆向转运)(Weber 2004;Weber et al. 2005)。拟南芥基因组包含六个基因,编码四类功能性质体磷酸转运蛋白(Web 表 8.11.A):磷酸丙糖/磷酸转运蛋白 (TPT) 和磷酸烯醇丙酮酸/磷酸转运蛋白 (PPT) 的单拷贝;葡萄糖 6-磷酸/磷酸转运蛋白 (GPT) 和木酮糖 5-磷酸/磷酸转运蛋白 (XPT) 各有两个拷贝。
易位器 MATDB 条目 运输的化合物
TPT TPT (At5g46110) 磷酸丙糖,3-磷酸甘油酸酯
PPT PPT1 (At5g54800), PPT2 (At3g01550) 磷酸烯醇丙酮酸,2-磷酸甘油酸
GPT GPT1 (At5g33320)、GPT2 (At1g61800) 6-磷酸葡萄糖、磷酸丙糖
XPT (At5g17630) 5-磷酸木酮糖、磷酸丙糖
Web 表 8.11.A质体磷酸盐转运 蛋白
磷酸丙糖/磷酸盐转运蛋白和植物中的碳分配
由卡尔文循环以光合作用产生的 ATP 和 NADPH 为代价产生的磷酸丙糖通过叶绿体包膜流向细胞质。反过来,生物合成过程中释放到细胞质中的正磷酸盐被转运回叶绿体,以补充维持 CO 2同化所需的 ATP和光合电子传递。磷酸丙糖的流出和正磷酸盐的流入都是由一个由两个相同亚基组成的二聚体驱动的——叶绿体 TPT。这种膜蛋白作为一个反端口系统发挥作用,将磷酸化的(主要是三碳,但也承认五碳或六碳化合物)交换为正磷酸盐。因此,叶绿体 TPT 输出固定碳用于蔗糖的胞质合成,蔗糖是分配给异养植物器官的主要产物,用于进一步代谢或转化为储存产物(例如淀粉、果聚糖)。因此,叶绿体 TPT 代表了碳输出的昼夜路径。
叶绿体 TPT 缺陷的突变体依靠不同的途径将光同化物从叶绿体转移到胞质溶胶,从而弥补 TPT 活性的不足。因此,该转运蛋白的敲除突变增加了最近固定的碳分配到临时淀粉中,随后淀粉在光照下降解,随后中性糖输出到细胞质中。另一方面,同时敲除叶绿体 TPT 和淀粉合成会严重损害植物生长。
磷酸烯醇丙酮酸/磷酸盐转运蛋白对叶绿体代谢至关重要
内叶绿体膜中的 PPT 还将所有植物的基质代谢与周围的细胞质联系起来。NADP-苹果酸酶类型的C 4植物(例如,玉米)(参见网络WEB TOPIC8.9)在活跃的光合作用下在束鞘细胞中产生丙酮酸。这种三碳化合物返回叶肉细胞,通过叶绿体定位的丙酮酸磷酸二激酶转化为磷酸烯醇丙酮酸(网络图 8.11.A)。随后,磷酸烯醇丙酮酸从基质流到胞质溶胶,通过 PEPCase 进行初级碳固定。为了确保该循环的正常运作,磷酸烯醇丙酮酸的高速率流出,叶肉叶绿体的包膜带有 PPT,它同时驱动叶绿体吸收正磷酸盐以恢复失去的磷。
Web 图 8.11.A磷酸烯醇式丙酮酸在 NAD-苹果酸酶类型 的 C 4植物的叶肉叶绿体中的动员。由束鞘细胞中的苹果酸酶 (ME) 产生的丙酮酸流向叶肉细胞,通过位于叶绿体基质处的丙酮酸-磷酸二激酶 (PPDK) 转化为磷酸烯醇式丙酮酸 (PEP)。PEP 通过磷酸烯醇丙酮酸/磷酸转运蛋白 (PPT) 流出至胞质溶胶,恢复了磷酸烯醇丙酮酸羧化酶 (PEPCase) 初级碳固定所需的 HCO 3-受体。CA:碳酸酐酶;NADP-MD:NADP依赖性苹果酸脱氢酶。
另一方面,苹果酸酶型的CAM植物在白天将苹果酸在夜间积累。同样,两个连续的过程解释了磷酸烯醇丙酮酸的产生,它是 CO 2的主要受体。首先,苹果酸脱羧形成的丙酮酸进入叶绿体基质,在丙酮酸-磷酸二激酶的催化下转化为磷酸烯醇式丙酮酸。其次,磷酸烯醇丙酮酸离开叶绿体以通过 PPT 交换正磷酸盐。
关于PPT在C 3植物或C 4植物的非绿色组织中的功能的知识很少。显然,磷酸烯醇丙酮酸的摄取而非输出是 PPT 在这些组织中的主要功能。叶绿体和大多数非绿色质体缺乏磷酸甘油变位酶和烯醇化酶,因此不能将 3-磷酸甘油酸转化为磷酸烯醇丙酮酸。然而,磷酸烯醇丙酮酸与 4-磷酸赤藓糖(一种戊糖-磷酸途径的中间体)结合,可通过莽草酸途径合成芳香族化合物(网络图 8.11.B)。因此,通过 PPT 向基质提供胞质磷酸烯醇式丙酮酸对于类黄酮、木质素、生物碱的生物合成是必不可少的。
Web 图 8.11.B C 3植物叶绿体中磷酸烯醇式丙酮酸的动员。在活跃的光合作用下,TPT 为细胞质提供碳骨架,用于磷酸烯醇式丙酮酸的生物合成。在释放正磷酸盐后,细胞溶质磷酸烯醇丙酮酸的摄取,在基质中与 4-磷酸赤藓糖结合,触发 3-脱氧-D-阿拉伯-庚酮酸 7-磷酸 (DHAP) 的形成。DHAP 是一种生物合成莽草酸 5-磷酸盐的支架,它反过来启动了通往芳香族氨基酸酪氨酸和苯丙氨酸的途径,它们是类黄酮、木质素和生物碱的前体。
葡萄糖 6-磷酸盐/磷酸盐转运蛋白在非绿色组织中发挥作用,对植物发育至关重要
拟南芥的基因组包含两个旁系同源 GPT 基因,AtGPT1和AtGPT2,显然,它们在非绿色组织的质体中用于输入葡萄糖 6-磷酸。两个在GPT1基因中插入 T-DNA 的转基因品系不仅表现出花粉和胚珠发育受损,而且在纯合状态下也是致命的。不同的是, GPT2基因的破坏对生长和发育没有影响。基于严重的配子发生缺陷,转运蛋白 AtGPT1 将 6-磷酸葡萄糖输入非绿色质体似乎对花粉的成熟和雌性配子体的发育至关重要。
木酮糖 5-磷酸盐/磷酸盐转运蛋白
XPT 构成磷酸盐转运蛋白的第四个亚家族,其表现出 与 GPT 相似的底物特异性,但缺乏转运葡萄糖 6-磷酸盐的能力。在拟南芥中,缺乏胞质转酮醇酶和转醛缩酶会在磷酸戊糖阶段停止胞质氧化戊糖磷酸途径(Kruger 和 von Schaewen 2003)。在这种情况下,XPT 的推定功能是为基质戊糖磷酸途径提供以木酮糖 5-磷酸形式存在的胞质五碳骨架,特别是在需要将其从胞质溶胶中去除的条件下。
WEB TOPIC 8.12 CAM植物的光呼吸
许多陆生植物适应了缺水的炎热和干旱地区,受到全日照的严重影响,特别是干旱和高温。为避免高速率的水分蒸腾,这些物种的气孔在炎热的白天时紧密关闭,并在夜间空气相对凉爽和潮湿时与周围的大气进行大部分气体交换。另一方面,光合作用的重要过程,其中CO 2结合到碳水化合物中,发生在白天。为了应对大气 CO 2缺乏有效的昼夜流入,这些物种进化出不同的光合作用机制,称为“景天酸代谢”(CAM)。这种不寻常的过程发生在单叶细胞中,其中大气 CO 2的吸收和随后的同化涉及三个隔室:细胞质、液泡和叶绿体。一般来说,CAM植物常见于暴露于白天高温和低相对湿度的沙漠多肉植物 (例如仙人掌科)中,或常见于由于其空中生长习性而在潮湿条件下暴露于生理干旱的热带森林附生植物(凤梨科)中。值得注意的是,CAM 也存在于水生物种() 在世界范围内发现 CO 2的昼夜限制的沼泽和浅水栖息地。
在凉爽的夜间时间,开放的气孔促进吸收大气中的 CO 2 ,CO 2扩散到细胞胞质溶胶中,产生 HCO 3 -(参见教科书第 8 章)。在这个阶段,磷酸烯醇丙酮酸羧化酶 (PEPCase) 催化 HCO 3 -结合到磷酸烯醇丙酮酸中,产生草酰乙酸和相关的四碳有机酸(尤其是苹果酸),它们在液泡中积聚。在一天中的炎热时段,陆地 CAM 植物的气孔关闭特性减少了水分流失,但会导致内部 CO 2短缺。为了克服这一缺陷,液泡将苹果酸释放到细胞质中,在那里脱羧酶、NADP-苹果酸酶或 PEP-羧激酶的作用产生丙酮酸和 CO 2。在叶绿体的基质内,Rubisco 将释放的 CO 2结合到 3-磷酸甘油酸中,它与通过光磷酸化在光下合成的 ATP 和 NADPH 协同作用,引发一系列 Benson-Calvin 循环反应,从而导致淀粉的积累。苹果酸的夜间形成和储存的时间分离,以及质体淀粉的昼夜脱羧和伴随的积累,在 24 小时的光周期过程中进行。在这个时间基础上,CAM 由四个代谢阶段组成,其中包括 C 的调节4 (PEPCase) 和 C 3 (Rubisco) 羧化在相同的细胞环境中(网络图 8.11.A)。夜间通过 PEPCase 吸收大气中的 CO 2形成 C 4酸(第一阶段)和苹果酸的昼夜脱羧导致 CO 2内部浓度升高(第三阶段),在早期散布着净 CO 2吸收的过渡期早上(第二阶段)和下午晚些时候(第四阶段),此时 PEPCase 和 Rubisco 介导的羧化有助于 CO 2的同化。在这种昼夜节律中,CO 2的比例晚上通过 PEPCase 或白天通过 Rubisco 摄取受以下因素控制:
气孔功能
有机酸和储存碳水化合物含量的波动
参与初级 (PEPCase) 和二级 (Rubisco) 羧化以及有机酸脱羧的酶的活性(例如苹果酸酶或 PEP-羧激酶)
Web 图 8.12.A CAM 昼夜节律。代谢物通量[大气CO 2、液泡苹果酸、糖动员形成PEP]和酶活性[PEPCase、Rubisco]在CAM的四个主要时间阶段[I、II、III、IV]上显示。阶段 I 包括夜间 PEPCase 驱动的大气 CO 2吸收和苹果酸积累。阶段 II 是过渡阶段,其中由于 PEPCase 介导和 Rubisco 介导的 CO 2固定,CO 2吸收加速爆发。在昼夜阶段 III 中,大气 CO 2的吸收减少,液泡苹果酸的脱羧作用产生了 CO 2的基质浓度需要通过 Benson-Calvin 循环进行 Rubisco 介导的 CO 2固定。第四阶段可能包括由 Rubisco 直接固定的 CO 2吸收。
在昼夜第三阶段,封闭的气孔阻止了与外部大气的气体交换,但光合作用和其他重要过程仍在继续。在这个阶段,由于活跃的 Benson-Calvin 循环,CO 2的内部水平急剧下降;然而,这种下降被线粒体呼吸所抵消。气孔的关闭也导致叶细胞中O 2的积累,因为光合O 2进化的速率高于线粒体呼吸和其他消耗O 2的反应。在这个阶段,Rubisco 的加氧酶活性激活光呼吸循环,Benson-Calvin 循环通过该循环回收 75% 的碳转化为乙醇酸盐,其余 25% 以 CO 2的形式释放线粒体甘氨酸脱羧酶复合物(见教科书第 8 章)。因此,封闭的气孔提供了一种适应性优势,可最大限度地减少因蒸腾作用而从叶片中流失的水分,并保持基质 CO 2的浓度足以进行碳同化。然而,O 2的同时积累是一个主要的不良后果,因为作为一种强氧化剂,O 2会与其他分子发生反应并产生有害的自由基(例如,超氧化物、氢氧根离子),这可能会引发对 DNA、蛋白质、和脂质(见教科书第 7 章)。
在这种情况下,光呼吸通过消耗基质和过氧化物酶体 O 2 有助于减轻 O 2积累的不良后果。在单轮光呼吸循环中释放一摩尔 CO 2需要连续利用:(a)两摩尔 O 2通过叶绿体基质中 Rubisco 的加氧酶活性(参见教科书图 8.8,反应 2.1),和( b) 1 摩尔 O 2用于乙醇酸氧化酶和过氧化氢酶在过氧化物酶体小氧循环中的协同作用(参见教科书图 8.8,反应 2.3 和 2.4)。由 1,5-二磷酸核酮糖 {2 Ribulose-1,5-bisphosphate + 3 O 2 + H 2驱动的光呼吸循环O + ATP → 3 3-磷酸甘油酸 + CO 2 + 2 P i + ADP}比使用碳水化合物 {C 6 H 12 O 6 (例如葡萄糖) + 6 O 2 → 6 CO 2 +的线粒体呼吸需要更多的 O 2 6 H 2 O}。因此,每摩尔 CO 2 分别消耗 3 对 1摩尔O 2释放。因此很明显,CAM 光呼吸在第三阶段的有益结果不仅包括避免由于形成乙醇酸盐而导致的碳损失,而且还包括由于去除活性氧物质而导致的氧化应激的改善。这种氧化应激的缓解被认为是 CAM 发展的主要驱动力。
WEB TOPIC 8.13 淀粉架构
淀粉是一种半结晶生物聚合物,储存在许多植物位置,例如叶子、谷物、块茎和根部。大量研究得出这样的观点,即这种多糖的结构可以在四个不同的层次上最好地可视化:分子、薄片、块状和颗粒。虽然淀粉几乎完全由葡萄糖分子组成,但颗粒的组成、形状和大小取决于植物来源。
淀粉颗粒中的支链淀粉和直链淀粉紧密包裹
颗粒物质的主要部分,大约 98-99%,是由直链淀粉和支链淀粉这两种成分组成的复杂均聚物(网络图 8.13.A)。α-D-葡糖基单元在通过α-D-1,4糖苷键连接的长直链中缔合,其中α-D-1,6糖苷键形成为分支点。α-D-1,6 糖苷键对总键的贡献在直链淀粉中极低(小于 1%),而在支链淀粉中则适度广泛(约5-6%),分别产生基本上直链和支链的均聚物。相对延伸的支链淀粉具有比具有紧凑形状的直链淀粉(是世界上最大的分子之一,约10^6 个葡萄糖单位)更低的分子量(500-20,000个葡萄糖单位)。
由于直链淀粉 (10-20%) 和支链淀粉 (80-90%) 的含量不同,天然淀粉的来源差异很大。但更重要的是,直链淀粉与支链淀粉的比例决定了支链淀粉在称为淀粉颗粒的超分子复合物中规则的半结晶阵列的结构(网络图 8.13.B)。在叶绿体和淀粉体中,直链淀粉和支链淀粉以相对致密的球形颗粒(直径 0.1 至 > 50 μm)排列,其形状和大小各不相同。
Web 图 8.13.B 淀粉颗粒的同心层。豌豆种子淀粉碘染色切片的光学显微镜。由于其开放结构,碘主要与直链淀粉成分反应。(来自 Ridout 等人,2003 年。)
当通过光学显微镜观察时,大多数颗粒呈现出同心壳,这些壳源自由交替的半结晶层和无定形层组成的内部层状结构(Web 图 8.13.C)。
Web 图 8.13.C 淀粉颗粒的组织水平。淀粉颗粒由四个层次的组织构成:支链淀粉分子簇(0.1-1 nm)、薄片(~10 nm)、块状(20-250 nm)和整个颗粒(> 1μm)。支链淀粉分子紧密堆积在一起形成双螺旋簇。结晶薄片是由散布在无定形区域的支链淀粉双螺旋结合而成。小块是几个结晶无定形薄片有序聚集成轴比为 3:1 的不对称结构(称为“正常小块”)。直链淀粉和其他物质(例如,水、脂质)会干扰小块的规则形成,从而引入“缺陷”(称为“有缺陷的小块”)。
尽管 Nägeli 在 1858 年提出有组织的淀粉单元被组织较少的材料包围并结合在一起,但 Badenhuizen 在 1937 年首先描述了由嵌入无定形材料中的结晶单元组成的结构。这些难以被酶分解的淀粉单元导致了当前的“ blocklet ”概念”(最初称为“blöckchen Strüktur”)(Buleon 等人,1998 年)。Blocklet 是介于大分子和大淀粉颗粒组织之间的超分子结构(图 3)。切片淀粉的透射电子显微镜图像的重建揭示了直径为 20 至 500 nm 的大致椭圆形区域。这些特殊结构是由块内交替的半结晶和无定形支链淀粉薄片的叠加产生的。小块由半结晶薄片组成,半结晶薄片由支链淀粉分子簇形成,无定形薄片包含低支链分子,如直链淀粉和脂质。通常,一些支链淀粉分子组装松散,扰乱了半结晶阵列并导致无定形环中的“缺陷”。这两个“正常”和“有缺陷”的小块簇在淀粉颗粒的径向生长中一个接一个有规律地出现,产生两种不同的结构:异质壳和均质壳。因此,支链淀粉分子在 Blocklet 的结构中发挥着重要作用,其中其他成分调节整个淀粉颗粒的强度和柔韧性(Tang 等人,2006 年)。早期对淀粉颗粒的研究发现,结晶度较低的部分比结晶度较高的部分更容易被酶消化。淀粉对酶促攻击的不同反应清楚地表明,半结晶壳的结构调节水解酶的催化能力。在淀粉颗粒的径向生长中,有规律地依次出现,产生两种不同的形态:异质壳和均质壳。因此,支链淀粉分子在 Blocklet 的结构中发挥着重要作用,其中其他成分调节整个淀粉颗粒的强度和柔韧性(Tang 等人,2006 年)。早期对淀粉颗粒的研究发现,结晶度较低的部分比结晶度较高的部分更容易被酶消化。淀粉对酶促攻击的不同反应清楚地表明,半结晶壳的结构调节水解酶的催化能力。在淀粉颗粒的径向生长中,有规律地依次出现,产生两种不同的形态:异质壳和均质壳。因此,支链淀粉分子在 Blocklet 的结构中发挥着重要作用,其中其他成分调节整个淀粉颗粒的强度和柔韧性(Tang 等人,2006 年)。早期对淀粉颗粒的研究发现,结晶度较低的部分比结晶度较高的部分更容易被酶消化。淀粉对酶促攻击的不同反应清楚地表明,半结晶壳的结构调节水解酶的催化能力。支链淀粉分子在 Blocklet 的结构中起主要作用,其中其他成分调节整个淀粉颗粒的强度和柔韧性(Tang 等人,2006 年)。早期对淀粉颗粒的研究发现,结晶度较低的部分比结晶度较高的部分更容易被酶消化。淀粉对酶促攻击的不同反应清楚地表明,半结晶壳的结构调节水解酶的催化能力。支链淀粉分子在 Blocklet 的结构中起主要作用,其中其他成分调节整个淀粉颗粒的强度和柔韧性(Tang 等人,2006 年)。早期对淀粉颗粒的研究发现,结晶度较低的部分比结晶度较高的部分更容易被酶消化。淀粉对酶促攻击的不同反应清楚地表明,半结晶壳的结构调节水解酶的催化能力。
近年来,可以定位特定酶的方法表明,淀粉颗粒通常与用于构建淀粉颗粒复杂结构的生物合成酶和用于分解多糖的降解酶相关。与淀粉颗粒相关的蛋白质可分为两类,表面结合蛋白和内部颗粒相关蛋白。表面结合的蛋白质和淀粉颗粒之间的小程度结合有助于通过用蛋白酶(例如嗜热菌蛋白酶、蛋白酶 K)消化或在水性缓冲液中进行大量洗涤来进行分离。相反,去除内部颗粒相关蛋白需要苛刻的条件(例如,十二烷基硫酸钠)。
在淀粉的昼夜积累中,直链淀粉的生物合成主要归因于完全在颗粒基质中发现的颗粒结合的淀粉合酶。当酶缺乏多糖环境时观察到的低活性表明淀粉合酶需要淀粉颗粒具有活性。同样,颗粒表面对于某些参与淀粉夜间分解的酶的催化能力至关重要。例如,质体淀粉磷酸化酶不能使用完整的淀粉颗粒作为底物,但异淀粉酶在颗粒表面的葡聚糖脱支中起作用。在几乎所有的陆地植物中,光控制着叶绿体酶的分布和活性,这些酶在可溶相和颗粒表面之间分配。总之,
为明天的世界利用淀粉
作为社会最重要的植物产品之一,淀粉的合成发生在特殊的细胞器中:叶绿体中的瞬时淀粉,以及异养组织中储存淀粉的淀粉体。由于植物块茎(如马铃薯)和种子胚乳(如玉米、小麦、大米)是迄今为止人类最大的淀粉来源,它不仅是对每日热量摄入贡献很大的基本食物,而且还是工业过程中的重要中间体,例如粘合剂和可生物降解塑料。
淀粉不溶于冷水,因为颗粒的结晶区域不允许水进入。然而,当温度升高时,结晶区域开始分离成膨胀的无定形形式(Damager 等人 2010)。淀粉糊化是指水和热的协同作用,破坏淀粉分子的分子间键,驱动氢键位点(羟基氢和氧)与更多的水结合。水的量和温度条件都会使水的渗透减少结晶区域的数量和尺寸,同时增加一般结构的随机性。在以下情况下,胶凝特性是加工要求和质地控制的一个重要问题: (i) 烹饪糕点、肉酱和奶油冻;以及 (ii) 为化学、制药和纺织工业生产原材料。
因此,必须从两个方面来改进这些活动:足以养活世界的数量和满足特定用途的质量。前者依赖农民,但两者的责任都在于以食品和化学工业为代表的加工链。因此,未来的挑战将是开发改良品种,最终目标是养活世界并释放对环境危害较小的化学产品。
WEB TOPIC 9.1 使用光
在使用光时,三个光属性尤其重要:数量、方向和光谱质量。前两个参数,数量和方向,对于植物截取光的部分的几何形状很重要。植物部分是扁平的还是圆柱形的?对于平叶,平面光传感器是最合适的,单位时间内落在已知面积的平面传感器上的能量被量化为辐照度(Web 表 9.1.A)。单位可以用能量表示,例如瓦特每平方米 (W m -2 )。时间(秒)包含在术语瓦特中:1 W = 1 焦耳 (J)s -1。光子的能量取决于它的频率,正如普朗克定律所表达的(见教科书公式 7.2)。
Web 表 9.1.A 光量化的概念和单位。
量轻。回想一下教科书第 7 章,当将光视为波时,光具有波长和频率。光也可以被认为是粒子流、光子流或量子流。在这种情况下,单位可以表示为每秒每平方米的摩尔数 (mol m –2 s –1 ),其中“摩尔”是指光子数(1 mol 光 = 6.02 × 10 23光子,阿伏伽德罗数) . 这种测量称为光子辐照度。
量子和能量单位可以相互转换,前提是光的波长是已知的。光子的能量与其波长有关,如下所示:
其中c是光速 (3 × 10 8 ms –1 ),h是普朗克常数 (6.63 × 10 –34 J s),λ 是光的波长,通常以 nm 表示 (1 nm = 10 –9米)。我们可以求解方程的h λ 部分,得到 1,988 × 10 -16,并将方程写为:
其中 λ 以纳米表示。从这个方程我们可以看到,在光谱的蓝色区域中,400 nm 的光子在光谱的红外区域具有 800 nm 光子的能量的两倍。400 nm 光的光子包含 4.97 × 10 –19 J。另一方面,800 nm 光子包含 2.48 × 10 -19 J。换句话说,光子的波长越高,其能量越低,如等式中较大的分母。
现在,假设我们每秒有 3 µmol 的 400 nm 光落在 1 m 2上,或者光子辐照度为 3 µmol m –2 s –1。这个量大约是在晴天照射到地球表面的 400 nm 蓝光量。如果我们想将光子辐照度转换为能量辐照度,我们必须首先将微摩尔转换为摩尔 (1 µmol = 10 –6 mol): (3 µmol m –2 s –1 ) × (10 –6 mol µmol –1 ) = 3 × 10 –6 mol m –2 s –1光子或量子。从阿伏伽德罗数计算量子数得出: (3 × 10 –6 mol quanta m–2 s –1 ) × (6.02 × 10 23量子摩尔–1 ) = 1.8 × 10 18量子–2 s –1。正如我们已经计算过的,400 nm 光的每个光子或量子包含 4.97 × 10 –19 J。因此 (4.97 × 10 –19 J 量子–1 ) × (1.8 × 10 18量子 m –2 s –1 ) = 0.9 J s –1 m –2。由于 1 J s –1 = 1 W,我们的辐照度为 0.9 W m –2。
光的方向。将我们的注意力转向光的方向,光可以直接从上方照射到平坦的表面,也可以倾斜地照射到表面。当光线偏离垂直方向时,辐照度与光线照射传感器的角度的余弦成正比(Web 图 9.1.A)。因此,当光线从上方直接照射到表面时,辐照度最大,并且随着光线变得更加倾斜而降低——类似于典型叶子的情况。校正光入射角的传感器据说是经过余弦校正的。
Web 图 9.1.A 辐照度和注量率。等量的准直光照射测量注量率的平面辐照型传感器 (A) 和球形传感器 (B)。使用准直光,A 和 B 将给出相同的光读数。当光的方向改变 45° 时,球形传感器 (D) 将测量与 B 中相同的量。相反,平面辐照度传感器 (C) 将测量等于 A 中的辐照度乘以角度的余弦的量C中的α。(根据Björn和Vogelmann 1994。)
自然界中有很多例子,其中遮光物体不是扁平的(例如,复杂的枝条、整株植物、叶绿体)。此外,在某些情况下,光可以同时来自多个方向(例如,来自太阳的直射光加上从沙子、土壤或雪向上反射的光)。在这些情况下,使用全向(从所有方向)测量光的球形传感器测量光更有意义。
当通过这种全向测量来测量光量时,测量的类型称为注量率(Rupert 和 Letarjet 1978),测量的光量可以用瓦特每平方米 (W m –2 ) 或摩尔每平方米表示平方米每秒 (mol m –2 s –1 )。从单位可以清楚地看出,光是以能量 (W) 还是光子 (mol) 来测量的。
与平面传感器相比,球形传感器对来自各个方向的光同样敏感(参见Web 图 9.1.A)。根据光线是准直的(光线平行)还是漫射的(光线沿随机方向传播),注量率与辐照度的值可能会彼此完全不同。它们仅在特殊条件下是等效的(有关详细讨论,请参见 Björn 和 Vogelmann 1994 和 Kirk 1994)。
光合有效辐射(PAR,400 到 700 nm)的平面传感器测量也可以基于能量 (W m –2 ) 或量子 (mol m –2 s –1 ) 来表示 (McCree 1981)。重要的是要注意 PAR 是一种辐照度型测量。在光合作用研究中,当 PAR 以量子为单位表示时,常被赋予专称光合光子通量密度(PPFD ))。然而,有人建议不再使用“密度”一词(Holmes et al. 1985),因为在国际单位制(Système Internationale d'Unités,或 SI 单位)中,“密度”可以指面积或体积。此外,面积包含在通量一词中。PPFD 在某些情况下被缩写为 PPF,但不清楚这个缩写是代表辐照度类型还是球形测量。
当光在湖泊或海洋等水中移动时,它会以这样一种方式散射,即其传播方向是随机的。因此,水生光合生物可以同时从上方、下方和侧面接收光。在海洋学和湖沼学中,从水面向底部传播的光称为下流辐照度,反向传播的光称为上涌辐照度。
在适用于植物生理学的专业测光表出现之前,光的测量单位是勒克斯或英尺烛光。这些测量基于人眼对光的感知,人眼对 555 nm 光谱绿色区域内的光最敏感。该波长两侧的灵敏度下降,并在对光合作用很重要的蓝色和红色波长区域内接近零。因此,勒克斯和英尺烛光在植物生理学中几乎没有用处。这些单位可以转换为辐照度和注量率的单位,但前提是可以获得有关光的光谱质量的详细信息,这只能通过使用称为光谱辐射计的仪器来获得,它测量每个波长的光量。
总之,在选择如何量化光时,将传感器几何形状和光谱响应与植物相匹配是很重要的。平坦的余弦校正传感器非常适合测量照射到叶子表面的光量;球形传感器在其他情况下更合适,例如在研究叶绿体悬浮液或树枝时。
晴天有多少光,PAR辐照度和PAR注量率有什么关系?在阳光直射下,PAR 辐照度和注量率均约为 2000 µmol m –2 s –1,但在高海拔地区可以测量到更高的值。能量单位的相应值约为 400 W m –2。当光线完全漫射时,辐照度仅为注量率的 0.25 倍。
WEB TOPIC 9.2 叶子的散热:鲍文比
暴露在充足阳光下的叶子的热负荷非常高。事实上,如果所有可用的太阳能都被吸收并且没有热量散失,那么有效水厚度为 300 µm 的叶子每分钟会升温 100°C。然而,这种巨大的热负荷通过长波辐射的发射、显性(或可感知的)热损失和蒸发(或潜伏)热损失消散(参见教科书图 9.14)。
如果叶片温度高于空气温度,叶片周围的空气循环会带走叶片表面的热量;这种现象称为显热损失。
蒸发热损失的发生是因为水的蒸发需要能量(见教科书第 4 章)。因此,当水从叶子中蒸发时,它会从叶子中吸收热量并使其冷却。人体通过相同的原理通过汗液冷却。
显热损失和蒸发热损失是叶片温度调节中最重要的过程,两者的比值称为鲍文比(Campbell 1977):
这个概念是由美国天体物理学家 Ira S. Bowen (1898–1978) 提出的。当蒸发率较低时,由于供水有限,博文比往往较高。因此,沙漠的鲍文比约为 10,半干旱地区为 2-6,温带森林和草原为 0.4 至 0.8,热带雨林为 0.2,热带海洋为 0.1(Nobel 1999)
在水分充足的作物中,蒸腾作用(参见教科书第 4 章)以及因此从叶子中蒸发的水分很高,因此鲍文比很低。另一方面,在一些仙人掌中,气孔关闭会阻止蒸发冷却;所有的热量都是通过显热损失消散的,鲍文比是无限的。具有非常高的鲍文比率的植物可以节约水分,但必须忍受非常高的叶片温度,以保持叶片和空气之间足够的温度梯度。缓慢的增长通常与这些适应相关。
可以在相对静止的一天在草坪上测量非常低的鲍文比率。在这些条件下,没有明显的热量损失,因为叶子周围的空气与叶子的温度相同;因此,鲍文比接近于零,散热主要是由于蒸发热损失。
在其他情况下,例如下午的棉花叶子,气孔蒸腾造成的水分损失通过蒸发热损失将叶子冷却到空气温度以下(参见教科书第 20 章)。在这种情况下,有显热增益而不是热损失,并且鲍文比变为负值。
可以通过测量鲍文比、净入射辐射、土壤的热量损失以及树冠上方的温度梯度和水蒸气浓度来计算整个树冠的蒸散率(Ibanez 和 Castellvi 2000)。
WEB TOPIC 9.3 C 3和C 4植物的地理分布
在具有 C 4光合作用的 15,000 多种物种中,它在草和莎草中最为常见,在草本和灌木中较少见,并且在树木中不存在(只有一棵夏威夷树例外,大戟属 forbesii)。气候是影响C 3植物和C 4草的自然分布的主要因素。在这里,我们讨论影响植物生长的两个最重要的气候参数:水和温度。显然,植物在没有水的情况下不会生长,因此影响光合途径分布的重要因素是生长期的温度。基于对全球自然植被随时间积累的许多系统调查,一幅清晰的图景正在浮现。C4类群存在于温暖到温带的环境中,在凉爽到寒冷的气候中并不常见(参见教科书的图 9.17)。下面我们构建了一张全球地图,描述了不同大陆上 C 3和 C 4类群的一般丰度。
Web 图 9.3.A世界稀树草原和草原中C 3和 C 4草 的地理丰度图。(由 Ehleringer、Cerling 和 Dearing 提供,2005 年。)
请注意,C 4类群在热带地区(纬度 0-20°)并不常见,因为茂密的热带森林往往会遮蔽 C 4草。C 4类群最常见于远离热带的热带稀树草原和草原地区;它们的丰度往往在沙漠地带以南(通常为 30-40° 纬度)减少。
气候可以沿着降水增加相对于蒸发水分流失的轴来表示。在这个梯度的上部,较湿的一端,我们会发现森林。在较干燥的一端,相对于蒸发需求而言,降水量较低,我们看到了沙漠。在Web 图 9.3.B中,我们看到这些不同的植被区反映了降水与蒸发比率的变化。C 4植物在这个半干旱地区最为常见。
Web 图 9.3.B 预计沿气候梯度出现的植被类型图,该气候梯度由输入降水与潜在蒸发率的比率估计。(由 Ehleringer 提供,未发表的图。)
在具有潮湿季风夏季的沙漠中,例如在非洲中部、次印度大陆和北美西部,C 4类群丰富。在接受冬季降雨的沙漠,如亚洲和北非的沙漠中,C 4类群很少。在北美,夏季降水的这种区域影响在美国西南部最为明显,那里与亚利桑那季风边界相关的降水差异很大,如图 9.3.C 所示。
Web 图 9.3.C美国西部不同州具有 C 4光合作用 的草种百分比的计算。请注意,夏季降雨的存在会影响 C 4丰度。C 4植物往往出现在温暖、夏季潮湿的地区。(由 Ehleringer、Cerling 和 Dearing 提供,2005 年。)
人类活动和动物的干扰会影响稀树草原和草原内C 3和C 4类群的分布。这反映了诸如放牧和火灾等干扰对树木在景观中的重要性的作用。
Web 图 9.3.D影响不同 C 4光合作用亚型 丰度的不同梯度的三轴三角形表示。(由 Ehleringer、Cerling 和 Dearing 提供,2005 年。)
在草原和稀树草原上,两种主要的 C 4光合作用亚型不具有相同的分布。C 4 NADP-me 草往往出现在较干燥的地区,例如大平原的短草草原。在大平原东部较湿润的边缘,矮草草原被高草草原所取代,以 C 4 NAD-me 草为主。
今天,农业实践导致 C 4植物生长在上述分布之外。这是由于在热带和温带地区广泛种植玉米、甘蔗和小米。
Web 图 9.3.E 玉米。(由田纳西大学农业科学与自然资源学院提供:www.utextension.utk.edu/fieldCrops/corn/index.htm)
Web 图 9.3.F 甘蔗。(由 USGS 提供,南佛罗里达虚拟之旅:www.sofia.usgs.gov/virtual_tour/pgcontrolling.html)
图 9.3.G 高粱。(由非洲作物网提供)
WEB TOPIC 9.4 计算叶气交换中的重要参数
蒸发 ( E ) 可以使用 Fick 定律定义(参见教科书第 3 章):
网络方程 9.4.1
其中E是蒸发速率;e i和e a分别是叶片内部和环境空气中水的分压;P是大气压;r是气孔阻力。比率 ( e i – e a )/ P是叶片内部和外部之间的水汽差(以摩尔分数表示;参见 Web WEB TOPIC 9.3)。
气体扩散阻力的概念很直观,但缺点是蒸发与r成反比。但是,可以将水蒸气的电导 ( g ) 定义为r的倒数。与r相比,g与E直接相关,是气体交换分析中常用的参数。因此,Web 方程 9.4.1 可以重新排列如下:
网络方程 9.4.2
Web 方程 9.4.2 可用于求解g:
网络方程 9.4.3
叶子的蒸发速率可以通过测量离开叶子的水量的设备来确定,也可以测量环境空气中水的蒸气压。假设叶片细胞间隙中的空气湿度为 100%,相对湿度为 100% 时水的蒸汽压是温度的函数。因此,我们通过测量叶片温度 来确定e i 。
由于 CO 2沿着与水相同的路径扩散,我们可以基于 Web 方程 9.4.2 编写定义光合 CO 2同化 ( A ) 的方程:
网络方程 9.4.4
其中C a和C i分别是环境空气和叶片细胞间隙中CO 2的分压。CO 2分子比H 2 O大,因此具有较小的扩散系数;两个扩散系数之间的差异根据经验确定为 1.6(von Caemmerer 和 Farquhar 1981)。在 Web 公式 9.4.4 中使用该校正因子允许我们将测量的水蒸气扩散阻力转换为 CO 2扩散阻力。
根据 Web 方程 9.4.4,我们可以计算叶片细胞间隙 中 CO 2 的分压:
网络方程 9.4.5
由于 Web 方程 9.4.5 右侧的所有变量都可以测量或计算,因此该方程是在实验中计算C i的基础,其中A是作为C i的函数测量的(von Caemmerer和法夸尔 1981)。
用水效率可以通过 Web 方程 9.4.2 和 9.4.4 的组合来量化:
网络方程 9.4.6
假设叶片温度为 30°C,大气相对湿度为 50%。对于 C 3植物,C a – C i通常为 10 Pa。叶温为 30°C,相对湿度为 50%,e i – e a = 2.1 × 10 3 Pa。来自 Web 公式 9.4.6 ,我们计算出A / E = 0.003 mol CO 2 (mol H 2 O) –1,或蒸腾比 ( E/A ) 为 336(参见教科书第 4 章)。如果可用水量减少,气孔关闭,蒸发量减少,从而提高用水效率。二氧化碳总量2同化也会减少,但植物会节约用水并增加生存机会。
这些方程已非常成功地用于促进我们对光合作用和植物对其环境的反应的理解。然而,每种技术都有局限性,这些方程假设整个叶片表面的气孔行为一致。当一些气孔关闭而另一些气孔打开时,可能会出现问题,特别是在叶肉的离散区域被叶脉相互隔离的叶子中。在某些条件下,在一个叶肉区域,气孔是开放的,光合速率相对较高,而在紧邻的区域,气孔部分关闭,叶肉的光合速率较低。这种现象被称为斑片状气孔并且可能出现在低通量率的光照下,或者当叶子受到压力时(Terashima 1992)。尽管斑片状的气孔可能反映了气孔和叶肉之间的正常相互作用(Siebke 和 Weis 1995),但斑片状会导致C i的测定不准确。在其他实验系统中,已显示斑块不影响通过传统气体交换方法计算细胞间二氧化碳(Kueppers 等人,1999)。
WEB TOPIC 9.5 大气CO 2的史前变化
地球上大气 CO 2的历史一直是缓慢但持续变化的历史之一,远低于当今大气 CO 2变化的速度。最后一百万年的大气二氧化碳历史被困在冰芯气泡中。
Web 图 9.5.A 气泡困在冰冻的冰块中。(NewScientist.com 提供:http: //www.newscientist.com/data/images/ns/cms/dn8369/dn8369-1_500.jpg)
当雪被压缩形成冰时,空气被困在雪中,形成可以持续数千年的气泡。在南极附近的南极洲,沃斯托克研究站的科学家们正在钻探冰层,以恢复过去 60 万年的大气历史。
Web 图 9.5.B 在南极洲靠近南极的沃斯托克场站鸟瞰图。在这个国际站,科学家们正在提取含有 60 万多年前被困的古代空气气泡的冰芯。(由冰下南极湖探索提供:http ://salegos-scar.montana.edu/images/Vostok%20Station.jpg )
这些冰芯数据表明,随着地球进出冰河时代,大气中的 CO 2水平在 180 ppm(冰期)和 280 ppm(间冰期)之间变化。这些重复的冰期循环反映了冰期二氧化碳吸收到海洋中,以及间冰期二氧化碳释放到大气中。
Web 图 9.5.C 在过去 60 万多年里,古代空气以冰泡的形式被困住的时间序列。在最上面一行,我们看到了气泡中的甲烷含量;在下面的线上,我们看到了同一时间段内的二氧化碳模式。中线代表冰的氢同位素比,它可以很好地代表气温记录。(由 RealClimate 提供:http ://www.realclimate.org/epica.jpg )
由于燃烧化石燃料,大气中的二氧化碳含量增加了。自 1950 年代以来,化石燃料消耗速度加快,导致今天大气中的二氧化碳水平大大超过冰芯记录中记录的水平。冰芯记录还显示,温度和大气中的二氧化碳水平彼此密切相关;全球温度反映在上面网络图 9.5.C中冰的氢同位素比率 δ D ) 中。
WEB TOPIC 9.6 预计未来大气中 CO 2的增加
随着不断增长的人口对交通、供暖和制造业的能源需求不断增加,人类对化石燃料(煤、石油和天然气)的使用持续增加。我们以 ppm 或百万分之几为单位测量大气中的 CO 2 。大气中 CO 2的增长率约为每年 3 ppm(参见教科书中的图 9.18)。
Web 图 9.6.A 在夏威夷莫纳罗亚测量的大气二氧化碳水平的高精度记录。(由 NOAA 地球系统研究实验室提供:http ://www.cmdl.noaa.gov/gallery2/v/gmd_figures/ccgg_figures/co2_mm_mlo.png.html )
请注意大气 CO 2数据 的循环性质,其中一个振荡周期正好是一年。这种年度模式反映了一年中某个位置的光合作用(减少大气 CO 2)和呼吸作用(增加大气 CO 2 )平衡的变化。春季和夏季,当生态系统内的光合作用速率超过呼吸速率时,大气中的 CO 2趋于减少。相反,当呼吸速率超过光合作用时,大气中的CO 2往往会在秋季和冬季增加。2007 年大气 CO 2的平均值达到 384 ppm,预计在 2015 年之前达到 400 ppm。
经济学家对全球 CO 2 排放 率有很好的估计。美国、欧洲国家、中国、日本和印度是最大的化石燃料排放源。
Web 图 9.6.B 当今导致大气 CO 2水平增加的主要化石燃料燃烧来源的全球分布。(由国际气候变化专门委员会提供:http: //arch.rivm.nl/env/int/ipcc/pages_media/SRCCS-final/graphics/jpg/large/Figure%20TS-02a.jpg)
一个令人惊讶的事实是,观察到的大气CO 2增加率实际上低于观察到的大气CO 2增加率。这是因为陆地上的植物和海洋中的藻类目前能够通过增强光合作用吸收大约一半的化石燃料排放。科学家们使用一种称为自由空气 CO 2富集 (FACE) 实验的现场实验方法来研究植物和生态系统如何对升高的 CO 2做出反应。在 FACE 实验中,管道将 CO 2注入包含完整生态系统的环形区域内部,如下所示。
Web 图 9.6.C 橡树岭国家实验室的落叶林周围的四个 FACE 环。(由美国农业部、落基山研究站、弗拉格斯塔夫实验室提供:http ://www.rmrs.nau.edu/USAMAB/images/southern-appalacian_aerial-Aug00.jpg )
这些 FACE 研究设施使科学家有机会了解生态系统内不同的植物生化、生理和生长过程将如何因长期暴露于升高的 CO 2水平而产生反应。由于生物质生产涉及的不仅仅是增加光合作用(即,还需要矿物质养分),因此随着大气 CO 2水平的持续增加,植物生长能否以线性、成比例的方式持续存在疑问。FACE 研究旨在解决生态系统将如何响应未来大气 CO 2环境以及生长响应是否在未来某个 CO 2水平上趋于平稳的问题。
全球变暖和气候变化是快速增加的 CO 2水平的预期影响。当然,这些只是科学家和其他人担心大气 CO 2升高的后果的众多原因中的两个。大气中的CO 2会增加多少尚不清楚。以下是基于两种可能情景的范围估计值。
Web 图 9.6.D在对比排放控制预测下 大气 CO 2浓度的预测变化。(由 ACACIA 提供:http://www.acacia.ucar.edu/images/co2.jpg)
在一种名为“一切照旧”的情景中,预计到本世纪末,大气中的 CO 2水平将达到 700 ppm。另一方面,遏制 CO 2排放的积极全球努力可能导致大气 CO 2稳定在 550 ppm。
WEB TOPIC 9.7使用碳同位素检测食品中的掺假
玉米和甘蔗等C 4植物的 碳同位素比 (δ 13 C) 为–10 至 –12 ‰,而 C 3食品的 δ 13 C 值通常为 –26 至 –28‰(另见图 9.24 教科书)。
Web 图 9.7.A C 3和C 4植物 碳同位素比值的变化。(由 Cerling 等人 1997 提供。)
由于环境因素影响碳同位素比,在 C 3到 C 4范围 内自然发生碳同位素比的变化。然而,两种光合作用途径之间碳同位素比值的差异足够大,足以保证区分食物物质是否基于C 4光合作用 的C 3 。
掺假是用另一种更便宜的食物物质或化合物代替。碳同位素经常用于检测 C 4糖对 C 3食品的替代,例如将甘蔗引入蜂蜜以提高产量。检测这种掺假的一种简单方法是检查餐馆中发现的果酱和果冻。以下是杰夫·埃勒林格 (Jeff Ehleringer) 在初中时作为一项科学项目进行的一项调查的结果。杰夫每次进餐馆都会收集果酱和果冻。他有机会从美国西部和欧洲部分地区收集果酱和果冻。
Web 图 9.7.B 在美国和西欧各国收集的果酱和果冻的碳同位素比率变化。(由 Ehleringer 提供,未发表。)
上面显示的结果很有趣,表明某些样品中发生了掺假。用于生产果酱和果冻的水果都是 C 3水果(葡萄、草莓、覆盆子、橙子、杏子、桃子等)。果酱和果冻的一个亚组的碳同位素比率似乎与稳定同位素比率相似C 3植物,它们应该是从中衍生出来的。这些都是杰夫在欧洲收集的样品,那里有真实性法律规定哪些材料可以用于制作果冻等加工食品。
相比之下,绝大多数果酱和果冻的碳同位素比率与C 4植物的碳同位素比率一致。然而,水果并非来自 C 4植物,而是来自 C 3植物。这些是掺假的果冻,很可能主要由糖浆和食品调味剂制成,在此过程中使用的食物很少。这些替代品在美国是合法的,因为在这里,我们没有关于食品生产的真实性法律。第三个小亚组由 50/50 C 3 /C 4食物来源制成的果酱组成。事实证明,这些是更昂贵的果酱和果冻。
还有许多其他食品经过碳同位素比率测试以检测掺假。其中常见的是果汁、香草(香草豆来自 CAM 植物)、啤酒(小麦和大麦是 C 3)和酒精饮料。
WEB TOPIC 9.8C 4类群扩展的重建
在高温和/或低大气CO 2条件下, C 4光合作用优于C 3光合作用。下面我们提供了一个 3-D 图形,说明光呼吸与光合作用的比率如何随着温度升高和/或 CO 2降低而增加。
Web 图 9.8.A对于具有 C 3光合作用的植物 ,光呼吸与光合作用的比率随 CO 2浓度和温度的变化而变化。(由 Ehleringer 和 Cerling 2001 提供。)
如教科书第 9 章所述,叶片中的光呼吸速率增加,因为随着温度升高和/或 CO 2降低 ,RuBP 羧化酶更可能与 O 2而不是 CO 2发生反应。光呼吸增加的结果是光合量子效率的降低。这导致环境条件下 C 4植物比 C 3更受青睐,反之亦然。
Web 图 9.8.B 预测的大气 CO 2范围和有利于具有 C 3或 C 4光合作用的植物的生长季节温度。(由 Ehleringer 等人 1997 提供。)
该模型导致预测 C 3和 C 4植物的丰度应在空间上变化(如 Web WEB TOPIC 9.3 中讨论的纬度函数)和大气 CO 2历史的函数(如 Web WEB TOPIC 9.5 中讨论的)。评估这个模型的秘诀是回顾植物化石,并将光合作用途径与史前大气中的 CO 2联系起来。这是一项艰巨的任务。
重建过去 10-1500 万年C 4植物的扩张可能是一个挑战,因为在许多地方的化石记录中没有很好地记录单个植物。大多数植物化石被认为是由于浸入厌氧水生环境而形成的。绝大多数植物在这些条件下不会变成化石,而是被微生物活动分解,导致我们可以用来重建 C 4植物随时间扩张的化石数量减少。但是,有很好的代理。
动物组织的碳同位素比率 (δ 13 C) 反映了它们所吃的食物。对于现代动物,可以从毛发、肌肉、骨胶原蛋白和牙釉质中进行同位素分析,以确定它们饮食中 C 3和 C 4食物来源的比例。毛发在毛发产生期间提供了动物饮食的连续记录。肌肉和骨骼胶原蛋白分析提供了对动物当前饮食的综合测量,如下面的网络图 9.8.C所示。
Web 图 9.8.C 非洲大草原常见食草动物的碳同位素比率。(由 Ehleringer 和 Cerling 2001 提供。)
动物牙齿的δ 13 C忠实记录了牙齿发育时期食物来源的碳同位素比例。牙釉质中的碳实际上是碳酸盐,它是由作为代谢食物的副产品产生的CO 2凝结而成的。在动物死亡并发生腐烂后,剩下并保存 C 3 /C 4饮食信号的唯一剩余组织是动物牙齿中的牙釉质。
对于许多食草动物,例如牛和马,牙齿生长是连续的,并且比具有固定牙齿生长期的动物(例如人类)提供了更长期的饮食记录。由于牙齿被保存了数百万年,牙釉质的δ 13可用于重建哺乳动物食草动物长时间食用的 C 3和 C 4植物的丰度。在下图中,我们绘制了现代动物牙齿的频率分布与 C 3和 C 4植物 观察到的频率分布:
Web 图 9.8.D具有 C 3和 C 4光合作用的叶子和以这些植物为食的食草动物牙齿的 频率直方图。(由 Ehleringer 和 Cerling 2001 提供。)
请注意,“ε”偏移为 14.1‰。这是与 CO 2冷凝形成碳酸盐相关的同位素富集。现在我们有了一个工具——动物牙釉质的碳同位素比率将记录 C 3与 C 4食物来源的丰度。
犹他大学的 Thure Cerling 和他的同事应用“牙釉质”工具来重建 C 3 /C 4植物的历史丰度。他们的结果非常有趣,如下面的Web 图 9.8.E所示。
Web 图 9.8.E 全球几个不同地区的食草动物牙釉质碳同位素比率的频率直方图。同位素比数据分为两个时间段,以说明大约 6 至 8 百万年前温暖地区出现以 C 4为主的生态系统。(由 Ehleringer 和 Cerling 2001 提供。)
直到 800 万年前,C 4植物还不是生态系统的重要组成部分。然后,在 6 到 900 万年前,C 4植物成为许多生态系统的重要组成部分,特别是在热带和亚热带纬度地区。这些结果与上述模型预测一致。预计在大气 CO 2水平低于临界阈值之前,地球上不会发生C 4光合作用。即使这样,它也应该首先出现在生长季节温度最高的地方。
目前还有大量证据表明,冰期(180 ppm)和间冰期(280 ppm)之间大气CO 2浓度值的波动很大,影响了C 3 /C 4植物的局部丰度。下图(网络图 9.8.F)是热带非洲沼泽中碳的时间序列分析。大约在 10,000 到 12,000 年前,这些沼泽周围的植被从以 C 4植物为主转变为以 C 3为主植物。这种转变通过显着变化是显而易见的,即进入沼泽的材料的碳同位素比率,特别是在冰期结束和我们进入当前的间冰期的时候。
Web 图 9.8.F 热带非洲三个不同湖泊系统中周围植被沉积的沼泽物质的碳同位素比率随时间的变化。请注意,大约 10,000-12,000 年前,生态系统从 C 4主导转变为 C 3主导。还显示了对 Byrd 冰芯数据的重建,表明大气 CO 2的增加与从 C 4到 C 3主导的生态系统的变化相吻合。(由 Ehleringer 和 Cerling 2001 提供。)
这些历史信息共同描绘了一段有趣的历史。C 3光合作用途径在地球历史的大部分时间里占主导地位。并且只是在地球历史上(6 至 8 百万年前)相对较近的时候,我们才看到以 C 4为主的生态系统的扩张。未来会怎样尚不清楚,因为人为燃烧化石燃料在大气中 CO 2中的含量正在迅速增加,远远超过过去 100 万年在地球上观察到的水平。
WEB TOPIC 10.1蓝光感应和光梯度
植物如何感知光信号的方向?
在单子叶植物的胚芽鞘和双子叶植物幼苗的下胚轴中测量了光照侧和阴影侧之间的光梯度,并用单侧蓝光照射。当用 450 nm 蓝光照射胚芽鞘时,在胚芽鞘的顶端和中间区域,入射到被照射面表面的光与到达阴影面的光之比为 4:1,并且8:1 在基地(网络图 10.1.A)。
Web 图 10.1.A 透射的 450 nm 蓝光在黄化玉米胚芽鞘中的分布。每帧右上方的图表显示了由光纤探头测量的胚芽鞘的面积。组织的横截面出现在每个帧的底部。它上面的轨迹显示了探头在每个点上感应到的光量。依赖于光梯度的传感机制会感知胚芽鞘的光照侧和阴影侧之间的光量差异,并且该信息将被转换为不相等的生长素浓度和弯曲。(在 Vogelmann 和 Haupt 1985 之后。)
另一方面,霉菌的孢子囊受到单侧蓝光照射,会产生透镜效应,结果,在孢子囊远端细胞表面测得的光量约为入射光量的两倍。受照面的表面。光梯度和透镜效应可能会影响弯曲器官如何感知单侧光的方向(Vogelmann 1994)。
WEB TOPIC 10.2保卫细胞渗透调节和蓝光激活的代谢开关
对光合藻类(如小球藻)的研究表明,蓝光照射会增加深色细胞的呼吸频率,其作用光谱是特定蓝光反应的典型特征(Kamiya 和 Miyachi 1974)。呼吸频率的这些变化与新陈代谢的急剧变化有关,这也可以在使用蓝光和红光的实验中观察到。
红光刺激这些藻类的光合作用碳固定,固定的碳结合到葡萄糖和蔗糖中。当蓝光的低光子通量被添加到红光处理中时,会观察到代谢转变;葡萄糖和蔗糖不再合成,固定碳用于有机酸、氨基酸和蛋白质的生物合成。
蓝光也是保卫细胞代谢的强大调节剂。用红光照射的保卫细胞会积累蔗糖(Talbott 和 Zeiger 1998);如果将蓝光的低光子通量添加到红光照射中,蔗糖停止积累,保卫细胞积累 K +和苹果酸2–(Web 图 10.2.A)。因此,蓝光刺激向保卫细胞中有机酸苹果酸合成的转变与光合藻类中有机酸和氨基酸合成的转变平行。
Web 图 10.2.A 蓝光刺激保卫细胞中的苹果酸合成。在红光下,保卫细胞主要合成葡萄糖和蔗糖;这种代谢途径被蓝光灭活,代谢转变为淀粉降解和苹果酸生物合成。(来自 Ogawa 等人,1978 年。)
蓝光和红光的实验性使用对于研究与气孔运动相关的渗透压调节途径非常有用(网络图 10.2.B)。教科书第 10 章中讨论的蓝光对质子泵的快速激活会在保卫细胞质膜上产生质子梯度,从而驱动钾和氯的吸收(参见网络图 10.2.B,第 1 部分)。蓝光还刺激淀粉水解和苹果酸生物合成。在低能量率的蓝光下,保卫细胞在分离的表皮中的长时间孵育导致大的气孔孔径伴随着广泛的淀粉水解(Tallman 和 Zeiger 1988)。
Web 图 10.2.B 保卫细胞中三种不同的渗透压调节途径。黑色箭头标识了导致渗透活性溶质在保卫细胞中积累的每个途径的主要代谢步骤。(1) 钾及其抗衡离子。钾和氯化物在质子梯度驱动的二次运输过程中被吸收;苹果酸是由淀粉水解形成的。(2)淀粉水解积累蔗糖。(3) 光合固碳产生的蔗糖积累。还指出了质外体蔗糖的可能摄取。(来自 Talbott 和 Zeiger 1998 年。)
保卫细胞还表现出依赖于蔗糖的渗透压调节阶段(参见教科书图 10.9)(Talbott 和 Zeiger 1998)。蔗糖可以来源于淀粉水解(参见网络图 10.2.B,第 2 部分)。另一方面,在环境 CO 2浓度下用红光照射的脱离表皮的保卫细胞运行第三种代谢途径,显示没有可检测到的钾吸收或淀粉水解(参见网络图 10.2.B,第 3 部分)(Tallman 和 Zeiger 1988)。在这些条件下,保卫细胞会缓慢积累蔗糖,而这种蔗糖积累会被光合电子传递抑制剂 DCMU(二氯苯基二甲基脲)阻断(Poffenroth 等人 1992;Talbott 和 Zeiger 1993)。最近一项关于红光照射和无 CO 2空气下的保卫细胞渗透调节的研究表明,在这些条件下,光合作用会因不存在 CO 2而受到抑制,红光会激活钾依赖性途径(参见网络图 10.2.B,第 1 部分)(Olsen 等人,2002 年)。这些研究强调了保卫细胞显着的代谢灵活性。
一项研究钙和脱落酸(ABA;参见教科书第 23 章)在红光和蓝光下对气孔孔径的影响发现,增加钙或 ABA 浓度会以浓度依赖性方式抑制蓝光刺激的气孔开放,但没有对红光刺激开口的影响(Parvathi 和 Raghavendra 1997)。这些对蓝光和红光的对比反应可以通过治疗对保卫细胞渗透压调节的影响来解释。ABA 和高钙浓度已被证明可抑制质子泵送和钾吸收,这对蓝光刺激的气孔开放至关重要。另一方面,红光刺激保卫细胞光合作用和蔗糖积累,而这种渗透压调节途径似乎对 ABA 和钙不敏感。
与视觉系统不同,蓝光和红光处理中的颜色信息似乎对光合生物没有功能意义。相反,它们戏剧性的实验效果似乎是类胡萝卜素和叶绿素的不同刺激的结果,它们分别被在饱和红光背景下施加的蓝光或单独的红光选择性地激发。
在太阳辐射下,由这些色素的激发激活的调节途径被叶绿体用来感知其环境中的关键特征并控制它们的新陈代谢。
WEB TOPIC 10.3胚芽鞘叶绿体
保卫细胞叶绿体是保卫细胞的一个显着结构特征(参见教科书图 10.1),其生理学和生物化学已经研究了几十年。相比之下,光致敏感胚芽鞘的叶绿体直到最近才被详细分析。Kenneth V. Thimann 和他的同事在 1960 年提出胚芽鞘叶绿体可能是燕麦胚芽鞘光感受器的一个可能位点,但在那十年后期对黄素假说的兴趣将注意力从胚芽鞘叶绿体转移,这些细胞器几乎被忽略了几十年。
最近的研究表明,胚芽鞘叶绿体释放氧气,通过光合作用固定 CO 2并进行叶黄素循环(Zhu et al. 1995)。深色、黄化的胚芽鞘梢端含有紫黄质和花药黄质,但没有玉米黄质,并且在受到照射时会积累玉米黄质(Quiñones 和 Zeiger 1994)。
当深色生长的胚芽鞘被红光预处理不同时间长度时,它们的玉米黄质含量与红光处理的长度成正比(Web 图10.3.A)。将具有不同玉米黄质含量的胚芽鞘暴露于与胚芽鞘的玉米黄质含量呈线性相关的短暂蓝光脉冲中,引发向光性弯曲(参见网络图 10.3.A)。最有趣的是,通过数据点的回归线外推为零(参见网络图 10.3.A,第 1 部分),这表明在没有玉米黄质的情况下没有向光反应(Quiñones 和 Zeiger 1994)。
Web 图 10.3.A 玉米胚芽鞘尖端的玉米黄质含量与响应蓝光脉冲的弯曲之间的关系。通过红光下的预照明时间 (1)、将含有玉米黄质的胚芽鞘转移到黑暗中 (2) 以及在 DTT(一种玉米黄质形成抑制剂)浓度增加的情况下进行饱和红光预处理(3 )。(在 Quiñones 和 Zeiger 1994 之后。)
红光处理的具有高玉米黄质含量的胚芽鞘在转移到黑暗中时会将其玉米黄质转化为紫黄质。在转移到黑暗后,对在不同时间间隔内发出的蓝光脉冲的向光弯曲与玉米黄质含量呈线性关系(参见网络图 10.3.A,第 2 部分)。
当玉米胚芽鞘在 DTT(玉米黄质形成的抑制剂)浓度增加的情况下进行饱和红光预处理和蓝光脉冲时,弯曲和玉米黄质含量随 DTT 浓度线性下降(参见网络图 10.3 .A,第 3 部分)。
因此,胚芽鞘叶绿体的玉米黄质含量与蓝光依赖的向光敏感性之间的关系与保卫细胞叶绿体的玉米黄质含量与气孔开放的蓝光敏感性之间的关系非常相似。
胚芽鞘和保卫细胞叶绿体具有一些明显不同于叶肉叶绿体的特性,包括高速率的氧气释放和低速率的光合碳固定、它们的叶黄素循环对低水平入射光子通量的高敏感性以及高淀粉含量(朱等人,1995)。胚芽鞘和保卫细胞叶绿体也表现出特定的蓝光响应,其作用光谱与蓝光刺激的气孔开放和胚芽鞘向光性的作用光谱非常匹配(Quiñones 等,1996)。
这些显着的相似性表明,这些独特的特征是专门从事信号转导的叶绿体的典型特征,与专门从事光合碳固定的叶肉叶绿体的经典作用相反。
WEB TOPIC 10.4气孔中光敏色素介导的反应
许多试图确定光敏色素在气孔运动中的作用的研究大多产生了负面结果。然而,最近的研究结果表明,光敏色素调节兰花兜兰和拟南芥npq1的无玉米黄质突变体的气孔运动。
如前所述,兜兰的保卫细胞缺乏叶绿素,不能显示红光刺激的开放,但具有看似正常的特定蓝光反应。然而,兜兰气孔也响应低通量率的红光或绿光而打开。这个开口可以被远红光逆转,暗示光敏色素是相关的光感受器(Talbott et al. 2002)。
在拟南芥npq1 突变体 中也可以观察到远红可逆的气孔开口。早期对npq1气孔的研究表明,尽管它们缺乏特定的蓝光响应,但它们会正常打开以响应白光。但是,如果在远红光背景下进行白光实验,白光刺激的开口会大大减少(Web 图 10.4.A)。野生型气孔对远红光不敏感(Talbott et al. 2003)。这些发现表明,在兜兰和拟南芥npq1中,依赖于光敏色素的开放弥补了气孔对光反应的主要成分的缺失(保护细胞光合作用)。兜兰和npq1中的特定蓝光反应)。
Web 图 10.4 . 来自拟南芥npq1无玉米黄质突变体的气孔缺乏蓝光反应,但显示出光敏色素反应。(A) 尽管npq1缺乏蓝光反应,但野生型和npq1气孔对白光显示出无法区分的剂量反应曲线。(B) 在 100 μmol m –2 s –1的远红光存在下,野生型气孔对白光的剂量-反应曲线保持不变,但npq1气孔的反应显着降低。这些结果表明,npq1中依赖于光敏色素的开放补偿了蓝光响应的缺失。(根据 Talbott 等人,2003 年。)
最近对拟南芥cop1突变体气孔的研究表明,它们在黑暗中仍然广泛开放(Mao et al. 2005)。此外,这项研究表明蛋白质 CRY1、CRY2、PHOT1 和 PHOT2 是玉米黄质介导的对蓝光的气孔反应的正调节剂,而 COP1 抑制这种调节。回想第 16 章,COP1 和隐花色素在体内和体外都与光敏色素相互作用。总之,这些结果表明了一种新的气孔运动控制方法,涉及光敏色素、COP1、CRY1、CRY2、PHOT1 和 PHOT2。
WEB TOPIC 11.1筛元素作为源和汇之间的传输单元
Susan Dunford,辛辛那提大学
证明糖在筛分元件中运输的方法
在 1686 年意大利解剖学家 Marcello Malpighi 进行的关于有机溶质易位的经典实验中,一棵树的树皮在树干周围形成一个环状结构(网络图 11.1.A)。1928 年,TG Mason 和 EJ Maskell 观察到这种称为环剥的处理对蒸腾没有直接影响,因为水在木质部中移动,进入树皮内部(Mason 和 Maskell 1928)(参见 Web Essay 4.2 中的一个实验)停止蒸腾)。然而,在树皮被去除的地方,树干中的糖运输被阻塞了。糖在腰部上方(即朝向叶子的一侧)积聚,并在处理区域下方耗尽。
Web 图 11.1 . 环剥后的树干(左)和稍后(右)。环剥是在树干周围成环去除树皮。在右边,从叶子中转移的物质已经聚集在腰带上方的区域并导致它膨胀。
最终,腰带下方的树皮会死亡,而上面的树皮会膨胀并保持健康。Mason 和 Maskell 得出结论,糖在树皮中运输,筛分元素是糖运输的细胞通道。后一个结论是基于观察到的叶和树皮蔗糖含量之间的高度相关性以及计算出存在于筛子元素中的高蔗糖浓度。
1940 年代,当放射性同位素可用于科学研究时,更复杂的韧皮部易位实验成为可能。可以通过多种方式将标记的有机化合物引入植物中。例如,二氧化碳可以用14 C 或11 C 标记,并提供给封闭在密封室中的完整成熟叶子。碳的这两种同位素11 C 和14 C,具有非常不同的半衰期(半衰期是放射性降低二分之一所需的时间)。11 ℃的半衰期为20分钟;那对于14C 是 5,600 年。出于这个原因,同位素用于不同类型的实验。Carbon-14 可用于分析存在放射性的化合物的长期实验。在进行这样的分析之前,碳 11 就会消失。当研究人员希望对同一植物进行重复测量时,Carbon-11 最有用。由于植物中的同位素只需要几个小时就会消失,因此一个实验中使用的放射性不会干扰下一个实验。
标记的二氧化碳通过光合作用的 CO 2固定反应结合到有机化合物中(参见 Web WEB TOPIC 8.2),并最终结合到运输糖中。在另一种类型的实验中,研究人员通过直接向叶子提供标记的运输糖(通常是蔗糖)来绕过光合作用反应。
为了确定糖易位的途径,我们必须确定同位素的组织或细胞位置,通常是通过一种称为放射自显影的技术。在组织放射自显影中,标记植物的组织被快速冷冻、冷冻干燥、包埋在石蜡或树脂中,然后切成薄片。然后在切片上涂上一层感光乳剂。
在曝光期间,供给植物的放射性化合物的辐射使胶片曝光,当胶片显影时,银粒出现在组织中存在标签的任何地方。组织切片和银粒图案的比较显示了标签在组织中的位置。就糖的运输途径而言,标签最初出现在韧皮部的筛分元件中,证实了早期实验的结果(网络图 11.1.B)。
Web 图 11.1.B 来自叶子的光合产物出现在茎部韧皮部的筛分中。14 CO 2被供应到牵牛花的源叶(Ipomea nil)。14 C被掺入光合作用过程中合成的糖中,然后被运输到植物的其他部分。标签的位置通过薄膜上深色颗粒的存在而在组织横截面中显示出来。(A) 显示了茎杆横截面的低放大倍数 (50x),揭示了由胶片中的银颗粒产生的黑点,如 (B) 中的高放大倍数 (325x) 所示。标签几乎完全局限于韧皮部的筛分元素。(由 D. Fisher 提供。)
影响源到汇模式的解剖和发育因素
韧皮部运输发生在从源到汇的筛元素中。虽然韧皮部的整体运输模式可以用这种方式简单地说明,但所涉及的特定途径通常更复杂,这取决于接近度、发育、血管连接和易位途径的改变。并非所有源都供应植物上的所有汇;相反,某些源优先提供特定的汇。对于草本植物,例如甜菜 ( Beta vulgaris ) 和大豆 ( Glycine max ),可以进行以下概括
源与接收器的接近程度是一个重要因素。植物上成熟的叶子通常为正在生长的茎尖和年轻的未成熟叶子提供光合产物;下部叶片主要供应根系。中间叶向两个方向输出,绕过中间的成熟叶。
在植物发育过程中,各种汇的重要性可能会发生变化。虽然枝条和根尖通常是营养生长过程中的主要库(并按此顺序),但种子和果实通常成为生殖发育过程中的主要库,特别是对于相邻和其他附近的叶子。
源叶优先供应与它们有直接血管连接的水槽(网络图 11.1.C),无论这些水槽是嫩叶还是根。例如,在枝条系统中,给定的叶子通常通过维管系统连接到茎上直接在其上方或下方的其他叶子。这样一排垂直的叶子被称为正畸。同一根茎叶间节间的数目因品种而异。
通过伤害或修剪对易位通路的干扰可以改变由此处概述的接近和血管连接建立的模式。在源和汇之间没有直接连接的情况下,称为吻合(单一吻合)的血管互连可以提供替代途径。例如,在甜菜中,从植物的一侧去除源叶会导致光合产物交叉转移到修剪侧的幼叶(沉叶)(参见Web 图 11.1.C)。去除植物的下部源叶可以迫使上部源叶将物质转移到根部,去除上部源叶可以迫使下部源叶将物质转移到植物的上部。
Web 图 11.1.C 韧皮部易位的源-汇模式。(A) 完整植物中单个标记源叶的放射性分布。在将14 CO 2供应给单一来源的叶子 4 小时后 1 周测定甜菜植物(Beta vulgaris )叶子中的放射性分布(箭头)。放射性标记的程度由叶子的阴影强度表示。叶子根据它们的年龄编号;最年轻、新出现的叶子被指定为 1。14C 标签主要转移到源叶正上方的汇叶(即与源叶在同一正畸上的汇叶;例如,叶子 1 和 6 是源叶 14 正上方的汇叶)。(B) 与 A 相同,只是在标记前 24 小时去除了与标记叶相对的植物一侧的所有源叶。植物两侧的沉叶现在从源头接收14 C 标记的同化物。(A 和 B 基于 Joy 1964 的数据。)
易位通路的可塑性取决于维管束之间相互连接的程度,因此也取决于所研究的物种和器官。在某些物种中,没有果实的树枝上的叶子不能将光合产物输送到相邻落叶树枝上的果实。但在其他植物中,例如大豆,光合产物很容易从部分落叶的一侧转移到部分落叶的一侧。
WEB TOPIC 11.2 阻止豆科植物中受伤的筛分元素的附加机制
Susan Dunford,辛辛那提大学
通过用蛋白质堵塞筛板孔和/或通过在孔中形成胼胝质来密封损坏的筛元件。另一种阻塞受伤筛管的机制发生在豆科植物(豆科)中。这些植物含有大的晶体蛋白体,在发育过程中不会分散。然而,在损伤或渗透压休克后,蛋白体迅速分散并堵塞筛管。该过程是可逆的并且由钙控制。可以从蚕豆中几厘米的距离触发蛋白质体的分散(Furch et al. 2007)。伤口(燃烧)引发电势波(动作电位),导致钙释放到筛子元素中,触发阻断反应。虽然其他植物家族具有在发育过程中不分散的蛋白质体,但尚不清楚其他植物是否具有类似的堵塞受伤筛管的机制。由于胼胝质合成也依赖于钙,蚕豆中的损伤进一步导致蛋白质体分散后胼胝质在筛孔中沉积(Furch 等人,2007 年)。
WEB TOPIC 11.3 取样韧皮部汁液
Susan Dunford,辛辛那提大学
由于韧皮部组织(如木质部组织)由导电细胞和非导电细胞的混合物组成,因此识别在筛子元件中易位的材料具有挑战性。基于放射性同位素标记和组织直接提取的方法不能区分转运中的化合物和转运途径之外的化合物。
一些物种倾向于从切断筛分元素的伤口中渗出韧皮部汁液,从而获得相对纯净的易位材料样品。渗出的驱动力是筛子元件中的高正压。然而,大多数物种不会渗出可检测量的韧皮部汁液,因为韧皮部有封闭伤口的封闭机制(见教科书第 11 章)。然而,可以通过用螯合剂 EDTA(乙二胺四乙酸)处理切面来增加渗出率(King 和 Zeevaart 1974)。胼胝质合酶——合成密封化合物胼胝质的酶——需要钙的存在,并且由于螯合剂非常有效地结合二价阳离子如钙,它们降低了可用于胼胝质合酶的钙浓度。
伤口渗出法的主要缺点是收集的液体可能不代表易位材料的真实成分。污染物可能来自受损的薄壁组织细胞,甚至来自筛子本身,而树液通常会被来自木质部的水稀释。此外,如教科书第 4 章所讨论的,筛子元件中膨胀压力的突然降低会导致这些细胞的水势下降。结果,来自周围的水沿着水势梯度进入筛元件,导致韧皮部的汁液被稀释。
收集韧皮部汁液的理想方法是使用微型注射器将单个筛子元件敲入。幸运的是,大自然提供了这样一种探针:蚜虫探针。蚜虫是一种小型昆虫,它们通过将由四个管状管心针组成的口器插入叶子或茎的单个筛子元件中来觅食(Web 图 11.3.A)。筛子元件中的高膨胀压力迫使细胞内容物通过昆虫的食道进入其肠道,在那里选择性地去除氨基酸并代谢一些糖。多余的汁液,仍然富含碳水化合物,然后以“蜜露”的形式排出(在Web 图 11.3.A中看到从蚜虫身体渗出的液滴)),可收集用于化学分析。在用 CO 2麻醉蚜虫后,通常用激光从昆虫身体上切下的蚜虫管心针收集汁液。与蜜露(蚜虫排泄物)相比,切断管心针的分泌物可以更准确地描述筛子中存在的物质,蜜露的成分已被昆虫改变。
Web 图 11.3.A 使用蚜虫敲击单个筛子并收集韧皮部汁液。(A)以椴树 ( Tilia americana ) 的树枝为食的蚜虫 ( Longistigma caryae ))。筛子元件中的高膨胀压力迫使细胞内容物通过蚜虫的食道进入其肠道。蚜虫分泌的蜜露由筛状元素汁液组成,其中选定的溶质,尤其是氨基酸,已在昆虫的肠道中被去除。筛子元件中的高膨胀压力迫使细胞内容物通过蚜虫的食道进入其肠道。照片中的昆虫正在释放一滴蜜露,它大约每 30 分钟释放一次。(B) 菩提树树皮的横切面,显示了在被切开之前已经渗出的蚜虫管心针的尖端。管心针的尖端位于单个筛子元件内;由蚜虫分泌的唾液鞘终止于细胞外。(来自 Zimmermann 和 Brown 1971 年。)
使用蚜虫的实验技术在韧皮部生理学研究中具有显着优势。特别重要的是蚜虫只敲击一个筛子,因此不存在其他细胞类型的污染问题。切断的管心针的渗出物可以持续数小时,这表明蚜虫阻止了正常的密封机制运行,或者当筛子元件被穿透时发生的压力下降不足以触发密封机制。
使用蚜虫的缺点包括难以将昆虫放置在所需位置并在不破坏它们的情况下切断管心针。此外,蚜虫可能通过将唾液分泌到植物组织中来诱导寄主植物的反应。然而,在收集树液进行分析所需的时间段内,这些反应的幅度可能可以忽略不计。
WEB TOPIC 11.4 韧皮部的氮运输
Susan Dunford,辛辛那提大学
就氮运输而言,研究最广泛的物种之一是经济上重要的大豆,一种具有固氮根瘤的豆科植物。研究表明,该物种发育种子的 12% 至 48% 的氮需求来自叶片中新合成的化合物,35% 至 52% 来自根部合成并从木质部转移到韧皮部的化合物(Layzell 和 LaRue 1982)。剩余的氮可能来自大豆叶中特殊储存蛋白的分解。
在最近的一项研究中(Ohtake 等人,2001 年),在 5 m M NaNO 3(充足的 N 供应)或 0.5 m M NaNO 3 (缺乏N 个条件)。将13 N -或15 N -标记的硝酸盐喂入茎的切割端,并比较硝酸盐衍生的 N 在豆荚、节和茎中的积累。使用正电子发射示踪成像系统 40 分钟获得茎、叶柄和豆荚中13 N 分布的实时图像。(网页图 11.4.A) 结果表明,N 缺乏植物的豆荚中的放射性大约是 N 充足植物的 10 倍。N 转移到豆荚中的速度在 N 缺乏植物中快得多的事实可能是由于缺氮植物中豆荚的强吸收活性。
Web 图 11.4.A 正电子发射示踪成像系统在 N 缺乏和 N 充足植物的豆荚位置周围检测到的图像。每个图像是 10 分钟内的平均强度。请注意,在 21-30 和 31-40 分钟。在 N 缺陷豆荚的图像中,随着放射性在豆荚中积累,豆荚图像变得明显。在 N 供应充足的工厂中无法看到类似的图像。
WEB TOPIC 11.5
监测糖高速公路上的交通:韧皮部的糖运输率
Susan Dunford,辛辛那提大学
糖分子沿韧皮部筛分的速度称为传质速率。传质率的测量是韧皮部生理学中最早的定量测定之一。早期的研究测量了在已知时间间隔内通过发育果实或储存器官(水槽)或成熟叶子(源)的重量减轻。水槽实验通常更准确。
例如,1926 年 Mason 和 Lewin 确定了大山药 ( Dioscorea alata ) 在生长季节的单个块茎的重量。干重的增加除以时间间隔以获得平均传质速率。该速率除以每根茎的平均筛分面积,得出的特定传质速率为 5.7 gh –1 cm –2的筛分。几项类似的研究获得了 0.2 到 4.8 gh –1 cm –2韧皮部的传质速率。如果假设筛分元素占据韧皮部横截面积的大约三分之一(合理估计),则这些结果产生的特定传质速率为 0.6 至 14.5 gh –1 cm –2用于筛元素。
使用放射性示踪剂确定传质速率的最新技术给出的速率与早期测量结果非常一致(Geiger 和 Swanson 1965)。在这种方法中,植物通常被修剪成单个成熟的源叶和单个未成熟的沉叶。标有14 C 的二氧化碳以供应速率等于固定速率的方式供应给源叶。在实验期间监测标签到达水槽组织的速率。供给的放射性CO 2每单位重量的碳含有预定量的放射性(比活度)。经过一段时间后,糖从源到汇的运输过程中达到与供应的 CO 2相同的比活度. 当达到这种称为同位素饱和的状态时,可以根据标签到达水槽组织的速率计算传质速率,如下所示:
其中 Bq 代表贝克勒尔,一个放射性单位,s 代表秒。(贝克勒尔或 [Bq] 相当于每秒 1 次崩解。另一个经常使用的放射性单位是居里或 [Ci],相当于每秒3.7 × 10 10次崩解。)通过这种方式,校正过境路径中筛子元素的横截面积后,可提供特定质量传递的估计值。对于运输蔗糖的甜菜,获得的值相当于 4.8 gh –1 cm –2的筛分元素,与早期调查中确定的值非常一致。
WEB TOPIC 11.6 质量流量转移的替代模型
Susan Dunford,辛辛那提大学
上述韧皮部中的质量流动是通常的教科书描述,其中强调压力是流动的驱动力和控制因素。简单管中的大流量由管端之间的压力差驱动;例子包括木质部容器和花园软管中的水流(参见教科书第 3 章)。然而,筛子元件不是简单的管子。
最近的分析强调了通过筛子元素进行溶质交换作为控制韧皮部流动的作用,并强调压力差仅作为流动阻力的结果存在这一事实。根据这种观点,当来源提供充足的糖供应时,韧皮部的一个很好的类比可能是沿着路径存在水槽的情况,就像猪在食槽里吃东西一样。如果槽已满,“由一头饥饿的猪造成的局部干扰会很快被该猪的一小部分大量位移所抵消,同时其他猪的可用食物也会略有减少”(Thompson 2006)。
模型仅与在其设计中所做的假设和所需参数的测量一样好。“槽中的猪”模型(或渗透压调节流)预测,韧皮部运输系统将在源和汇之间的膨胀差异相对较小的情况下最有效地工作(Thompson 2006)。在这样一个同质系统中,路径中所有筛子的膨胀可以同时独立地调节。压力波形式的信息将被快速传输,从而形成一个高效的筛管,可以在长距离内快速传输有关压力或树液浓度变化的信息。
什么样的测量可以让我们区分源和汇之间压力差大的质量流量和梯度小的质量流量?一个明显的答案是测量源和汇之间的压力梯度。此类研究的数量相对较少,并且仅限于小型草本植物。需要对更广泛的植物进行更多测量,因此需要开发能够测量沿同一运输流的膨压差异的技术,理想情况下是在树木等大型植物中。开发此类技术将是一项巨大的技术挑战。
WEB TOPIC 11.7韧皮部负荷实验
Susan Dunford,辛辛那提大学
筛元素质外负载的证据
韧皮部负荷的早期研究集中在质外体途径(参见教科书图 4.4)。许多致力于测试这些预测的研究为几种物种的质外体负荷提供了确凿的证据。一些更重要的证据是:
1.运输糖存在于质外体中。蔗糖是主要在韧皮部运输蔗糖的物种中的主要质外糖,例如甜菜(Beta vulgaris)和蚕豆(Vicia faba)。改变从源叶易位速率的处理和事件也改变了通过质外体的蔗糖通量(Geiger 等人 1974)或质外体蔗糖水平。
2.外源提供给甜菜源叶的蔗糖会在小叶脉的筛分和伴生细胞中积累,来自光合 CO 2固定的蔗糖也是如此(参见教科书图 11.15)。在蚕豆、豌豆(Pisum sativum)、蓖麻(Ricinus Communis)和其他物种中也进行了类似的观察。
3.PCMBS(对氯汞苯磺酸)是一种抑制蔗糖跨质膜转运但不进入共质体的试剂。当外源地向甜菜提供糖时,PCMBS 抑制从质外体吸收蔗糖。更重要的是,PCMBS 还抑制了叶肉中由 CO 2合成的蔗糖的输出,这意味着甜菜中的短距离运输通常包括质外体步骤(Giaquinta 1976)(网络图 10.7.A)。蚕豆、豌豆和其他物种中的 PCMBS 也抑制了同化物的负载。
4.转基因植物的实验进一步支持了蔗糖通过质外体的解释。(转基因生物通过各种重组 DNA 技术将克隆基因整合到其 DNA 中。)在其质外体中具有蔗糖切割酶(转化酶)的转基因番茄植物表现出非常缓慢的生长速度并且不能动员其体内的淀粉。源叶在长时间的黑暗时期(Dickinson et al. 1991)。显然,在质外体中水解蔗糖抑制了该物种源叶中韧皮部的负荷。只有当韧皮部加载途径包括质外体步骤时,才会出现这种结果。
Web 图 10.7.A PCMBS 对甜菜叶韧皮部运输的影响。添加 PCMBS 后,从甜菜叶中导出 pf 标记的光合产物会减少。光合作用没有受到影响,表明 PCMBS 没有改变叶片的光合作用特性。(来自 Fisher 2000,在 Giaquinta 1976 之后。)
一些物质通过扩散进入韧皮部
许多物质,如有机酸和植物激素,在韧皮部汁液中的浓度低于碳水化合物。这些物质可能不会主动加载到筛分-伴侣细胞复合物中,而是通过其他途径和机制进入筛分。它们可以直接通过扩散穿过筛子-伴侣细胞复合物的质膜的磷脂双层或通过这些细胞质膜中的被动转运蛋白被吸收,或者它们可以通过共质体扩散到筛子中。
一旦进入筛分元件,这些物质就会被大流量扫过易位流,动力是由仅某些糖或氨基酸的主动负载产生的。许多在植物中通常不存在的物质,例如除草剂和杀菌剂,可以在韧皮部中运输,因为它们能够以中等速率通过膜扩散。换言之,它们通过膜扩散的速度足够快,以允许在筛元件中大量积累,但速度足够慢,以至于它们在到达水槽组织之前不会完全从筛元件中丢失。此外,弱酸性的化合物往往被“困”在筛分元素中,在碱性环境中带负电(低 H +浓度),因此不太可能通过疏水膜扩散出细胞(Kleier 1988)。不在韧皮部运输的物质(如钙)可能根本不会进入筛分元素。
最近的一项研究对拟南芥基因AUX1(生长素流入载体)进行了表征,该基因编码一种生长素通透酶,该酶似乎作为一种生长素载体发挥作用(Swarup 等人,2001 年,Marchant 等人,2002 年,参见教科书图 19.9)。AUX1已定位于根部的原韧皮部细胞中(Swarup 等人,2001)。基因表达研究表明,AUX1促进 IAA 加载到叶维管运输系统中,以及 IAA 在初级根尖卸载和发育侧根原基 (Marchant et al. 2002)。
蔗糖-H +同向转运体在质外体装载者韧皮部的作用
假定蔗糖转运体将光合产生的蔗糖装载到质外体装载机的筛子中(参见教科书图 11.16 和教科书第 302-304 页)。载体存在于筛子或伴随细胞的质膜中。在筛子膜中发现的载体包括马铃薯(马铃薯)和番茄中的 SUT1、SUT2 和 SUT4 。在拟南芥和车前草 的伴生细胞质膜中发现了 SUC 2
如网络图 11.7.B 所示,SUC2 是参与韧皮部装载的主要蔗糖转运蛋白之一,存在于伴随细胞中。最近已通过反向遗传学鉴定了在编码 SUC2 的基因中含有转移的 DNA 插入的突变拟南芥植物 (Gottwald 等人 2000)。在纯合状态下,这些突变导致发育迟缓、发育迟缓和不育。突变植物的源叶含有大量过量的淀粉,放射性标记的糖不能有效地运输到根和花序。
Web 图 11.7.B这张显微照片显示了用两种荧光染料染色 的阔叶车前草(大车前草)的单个伴侣细胞。其中一种染料(绿色)与对 PmSUC2 蔗糖-H +同向转运体特异的抗体(间接)连接。第二种染料(蓝色)与 DNA 结合。由于这两种染料是在单个韧皮部细胞上发现的,该韧皮部细胞总是与筛子相邻,因此可以得出结论,蔗糖同向转运体位于该物种的伴生细胞膜中。(摘自 Stadler 等人,1995 年,由 N. Sauer 提供。)有趣的是,SUC2 转运蛋白的表达从叶尖开始,并在汇-源转换过程中向发育叶片的基部进行,这与光合产物输出显示的模式相同容量。
与 SUT1 的合作表明,在筛子膜中发现的同向转运蛋白的信使 RNA 是在伴随细胞中合成的(Kuhn 等人 1997;Vaughn 等人 2002)。这一发现与筛分元素缺乏核的事实一致。同向转运蛋白可能也在伴随细胞中合成,因为核糖体似乎不会在成熟的筛分元件中持续存在。
所有蔗糖转运蛋白都属于三大亚科之一;许多运营商所扮演的角色仍在调查中。SUT1 和 SUC2 似乎是韧皮部装载到伴随细胞或筛分元件中的主要蔗糖转运蛋白。这些和其他蔗糖转运蛋白的附加功能包括从转运流泄漏后从质外体回收蔗糖,将蔗糖从液泡转运到细胞质,将蔗糖吸收到萌发的花粉中,以及将蔗糖释放到发育中的种子的质外体中。(参见教科书中的韧皮部卸载,第 305 页。)
支持共塑性加载的聚合物捕获模型的研究
许多研究支持聚合物捕获模型。例如,从蔗糖合成水苏糖所需的酶位于中间细胞中。在甜瓜中,棉子糖和水苏糖以高浓度存在于中间细胞中,但不存在于叶肉细胞中。紫毛蕊花 ( Verbascum phoeniceum )中棉子糖和水苏糖合成的下调导致叶子中碳水化合物的积累,在长时间黑暗中输出糖的能力降低,并且在严重下调的植物中,会导致生长受损(McCaskill 和 Turgeon 2007)。然而,通过胞间连丝的质量流也被认为是溶质共塑性进入韧皮部的一种机制。
加载特性与加载机制的关系
什么特征——伴细胞的类型、运输糖或胞间连丝的丰度——是共生负荷的最佳预测指标?连接筛元素-伴随细胞复合体和周围细胞的胞间连丝的数量通常被认为是装载类型的诊断。然而,一些基于胞间连丝频率被归类为共塑性装载者的物种现在已被证明是非塑性装载的。在小脉韧皮部具有丰富胞间连丝的植物在叶肉细胞之间也往往具有丰富的胞间连丝,因此胞间连丝的频率可能与植物的其他一些特征有关。
运输糖的类型(单独的蔗糖或蔗糖加较大的寡糖)可以区分聚合物捕获和其他加载策略。然后可以使用喂食14 C-蔗糖的叶盘的放射自显影来区分质外负荷和被动共生负荷。在韧皮部集中糖分的物种中(质外体负载和聚合物捕获),静脉在放射自显影照片上应清晰可见。在通过向下浓度梯度扩散将糖从叶肉转移到韧皮部的物种中,静脉在放射自显影照片上不可见。Web 图 11.7.C在三种加载类型中证实了这些期望。
许多物种在其小静脉中具有不止一种类型的伴生细胞。例如,锦紫苏既有中间细胞,也有普通的伴细胞。有人提出,在某些物种中,主动加载和被动加载可能同时或在不同时间,在同一脉络的不同筛分元件中共存。然而,由于解剖学特征(如胞间连丝频率)的限制,同胞和质外通路不存在于同一个筛元素-伴随细胞复合体中。
Web 图 11.7.C 来自通过聚合物捕获(左,缠绕金鱼草,Asarina scandens),来自质外体(中间,芹菜,Apium Graveolens)和通过共质体(右,樱桃月桂)的被动扩散的物种的叶盘的放射自显影,月桂树)。叶子的处理方式类似于甜菜(教科书图 11.15),只是标记时间为一小时。标签(黑色)仅通过聚合物捕获(左)和来自质外体的主动加载(中)在小静脉中浓缩糖的物种中积累。(雷尼和特金 2009)
WEB TOPIC 11.8 韧皮部卸载实验
Susan Dunford,辛辛那提大学
运输糖可能在水槽质外体中水解
在共生韧皮部卸载中,运输糖(如蔗糖)通过胞间连丝移动到汇细胞。在水槽细胞中,蔗糖在被储存或进入与组织生长相关的代谢途径之前,可以在细胞质或液泡中代谢。然而,当韧皮部卸载是质外体时,代谢变化有额外的机会。运输糖可以在质外体中部分代谢,也可以原封不动地穿过质外体(Web 图 11.8.A)。例如,蔗糖可以在质外体中被转化酶水解成葡萄糖和果糖,然后葡萄糖和/或果糖会进入汇细胞。许多单糖转运蛋白主要定位在水槽组织中的事实支持了该途径的可能存在。
Web 图 11.8.A 蔗糖在水槽组织中非质体卸载的可能命运。(1) 进入质外体的蔗糖在从汇组织进入细胞之前可以被壁转化酶分解为葡萄糖和果糖,或者 (2) 蔗糖可以原封不动地被细胞吸收。(3)一旦从水槽组织进入细胞的共质体,蔗糖可以被细胞质转化酶分解成葡萄糖和果糖,或者(4)蔗糖可以原封不动地进入液泡。(5)一旦进入液泡,蔗糖可以被液泡转化酶分解为葡萄糖和果糖,也可以保持不变。
一项对马铃薯植物的研究表明,质外体卸载在伸长的匍匐茎中占主导地位(Viola et al. 2001)。匍匐茎是从马铃薯植物的主茎长出的地下侧枝,其特征是细长的节间和带钩的顶端,在其顶端形成块茎以响应环境信号。当匍匐茎开始块茎化时,韧皮部卸载从质外体转移到共质体运输。用与报告基因相连的质外转化酶基因 ( invGE ) 的启动子转化的马铃薯品系的组织化学分析显示,在延长匍匐茎中的转化酶活性与质外体卸载有关(网络图 11.8.B)。在发育中的块茎中,在一个小的顶端区域观察到质外体负荷和转化酶活性,这是在块茎形成过程中逐渐被肿胀的顶端下区域所吞噬的匍匐茎顶端区域。大部分块茎表现出共生卸载和缺乏转化酶基因的表达。
Web 图 11.8.B GUS 染色显示质外转化酶 (invGE) 的表达。(A) GUS 染色仅限于细长匍匐茎的顶端钩区域 (箭头)。(B) 发育中的块茎显示与顶端芽区域相关的 GUS 染色 (箭头)。(A) 中的钢筋 = 1 毫米;(B) 中的条 = 500 μm。(摘自 Viola 等人,2001 年。)
种子发育和贮藏器官卸荷的能量需求
开发种子已被证明是研究卸载过程的最有趣的系统。在大豆等豆科植物中,胚胎可以从种皮中去除。这样,可以在不受胚影响的情况下研究从种皮卸载到质外体,也可以单独研究胚的吸收。对豆类的研究表明,蔗糖进入质外体和进入胚胎都是由转运蛋白介导的,并且是活跃的。在像小麦这样的谷物中,只有胚胎吸收是活跃的;母体组织中蔗糖的损失(蔗糖流出)是被动的(降低浓度梯度),因为随后的主动步骤使质外体中的蔗糖浓度保持在较低水平。在玉米中,细胞壁转化酶通过将二糖分解成单糖来帮助维持低质外体蔗糖浓度。一般来说,糖质子同向转运机制似乎在从质外体吸收糖中起作用,就像在大豆胚中吸收蔗糖一样。
贮藏器官通常会以高浓度积聚糖,例如在甜菜主根和甘蔗茎中。这种糖的积累需要主动的膜运输,因为需要能量才能将糖逆着浓度梯度移动到储藏室中。
糖转运到储存细胞(如甜菜)的液泡中被认为是通过蔗糖-质子逆向转运体完成的(见教科书第 6 章)。在这种情况下,液泡 H + -ATP 酶将质子泵入液泡;然后,反端口载体将蔗糖移动到液泡中以换取质子,质子沿着其电化学电位梯度离开液泡(参见教科书图 6.11)。
WEB TOPIC 11.9 源叶中的分配:淀粉和蔗糖合成之间的平衡
Susan Dunford,辛辛那提大学
突变体和转基因植物的使用使我们能够提出一系列关于分配的新问题。例如,当竞争过程之一,蔗糖或淀粉合成被抑制或增强时会发生什么?缺乏淀粉的烟草突变体仅合成微量的淀粉,但能够通过将白天的蔗糖合成和输出速率加倍以及将大部分生长时间转移到白天来弥补储存碳的不足(Geiger 等人,1995 )。具有低 FBPase 的突变体或具有反义抑制 FPBase 表达的植物通常具有增加的淀粉积累,有时伴随着减少的蔗糖含量。然而,一些物种(有时是同一物种!)保持野生型蔗糖含量。据认为,一些其他酶活性补偿了这些植物中的低 FBPase 活性。低 FBPase 植物的光合作用和生长通常受到损害(Serrato et al. 2009)。
白天 将叶绿体中的磷酸丙糖与细胞质中的 P i交换的磷酸盐转运蛋白的活性也影响淀粉和蔗糖合成之间的平衡。当磷酸盐转运蛋白活性(参见教科书图 10.22)由于其 RNA 的反义抑制而降低 30% 时,马铃薯植物在白天积累了四倍的淀粉。在这些条件下,固定碳不能像对照一样离开叶绿体,合成了更多的淀粉。这些植物通过在夜间输出更多的固定碳来响应增加的淀粉积累,此时不同的转运蛋白在叶绿体和细胞质之间运行(参见教科书图 8.14)。
与刚刚描述的马铃薯植物一样,磷酸盐转运蛋白活性降低 80% 的烟草植物也在叶绿体中积累更多的淀粉,并利用夜间转运蛋白将固定碳从叶绿体中转运出来。然而,他们在白天而不是在夜间使用淀粉储备来合成易位的糖。磷酸转运蛋白活性受到抑制的植物通常在生长方面没有明显变化。他们只是绕过磷酸盐转运蛋白并利用替代方法将碳移出叶绿体。这些和其他结果揭示了植物惊人的灵活性(Flugge et al. 2003)。
WEB TOPIC 11.10 分区:蔗糖代谢酶在水槽中的作用
酸性转化酶可将蔗糖切割成果糖和葡萄糖分子,可与细胞壁结合或积聚在液泡中(参见 Web WEB TOPIC 10.8)。胡萝卜植物 ( Daucus carota) 当根中的细胞壁转化酶活性由于反义抑制而降低时,显示出改变的蔗糖分配。对根的分区减少,从而减少了主根的发育。由于这些植物的叶子也比对照植物多,因此它们的干重叶根比大大增加。转化植物的叶子中的蔗糖和淀粉水平都增加了几倍。大多数植物在根部的碳水化合物浓度显示出相反的变化。由于卸载到胡萝卜储存根中最有可能是质外体的,因此减少细胞壁中葡萄糖和果糖的形成将阻止糖吸收到水槽储存组织中,从而导致植物中分配模式的这些深刻变化(Tang 等人 1999) .
反向实验与转化酶在水槽需求中的作用一致。在拟南芥中,在根特异性启动子控制下的异源细胞壁转化酶的表达导致产生更多的次生根、更长的根,并因此产生更高的根干重。转基因植物还产生了更高的枝条生物量,这可能是由于从土壤中获取养分的能力更强(von Schweinichen 和 Buttner 2005)。
转化酶和蔗糖合酶的基因通常在水槽发育过程中的不同时间表达。在豆荚和玉米(玉蜀黍;Zea mays)籽粒中,发现转化酶活性的变化先于光合产物输入的变化。这些结果指出了转化酶和蔗糖合酶在控制输入模式中的关键作用,无论是在水槽发育的遗传程序期间还是在对环境压力的响应期间(参见 Web WEB TOPIC 10.8)。
上述研究强调了运输的变化,这是由于主要运输蔗糖的物种库中蔗糖代谢改变的结果。在运输蔗糖以外的其他碳水化合物(如糖醇)的物种中,源库比的变化也会导致在库组织中代谢糖醇的酶发生变化。易位碳水化合物的更多供应会增加酶活性,而限制供应会降低酶活性(Morandi et al. 2008)。
WEB TOPIC 11.11 淀粉贮藏库中库需求和光合速率的可能机制
Susan Dunford,辛辛那提大学
光合速率和水库需求是相互关联的过程,特别是在储存淀粉的物种中。增加的水槽需求与增加的光合作用相关,反之亦然。源叶中光合产物(淀粉、蔗糖或己糖)的积累可能是将光合速率与汇需求耦合的信号之一。可能的机制包括:
1.淀粉的抑制作用。 当汇需求低时,源中的高淀粉含量可能会物理破坏叶绿体、干扰 CO 2扩散或阻止光吸收。几乎没有证据支持这一假设。
2.磷酸盐可用性。 当汇需求低时,光合作用可能会因叶绿体中缺乏游离正磷酸盐而受到限制(Du et al. 2000)。在水槽需求量低的条件下,蔗糖合成通常减少,因此可用于与叶绿体中的磷酸丙糖交换的磷酸盐减少(通过磷酸盐转运蛋白)。如果在叶绿体中释放正磷酸盐的淀粉合成不能足够快地释放磷酸盐,就会导致磷酸盐缺乏。ATP 合成和 CO 2固定会下降。一项用磷酸盐转运蛋白反义 DNA 转化马铃薯植物的研究为这一假设提供了支持(Riesmeier 等人,1993)。表现出降低的磷酸盐转运蛋白活性的转化植物按比例将更多的碳分配到淀粉中,而将更少的碳分配到蔗糖中。这些影响伴随着幼苗光合作用的光和 CO 2饱和速率的降低。
3.由糖调节。 高糖水平会降低许多光合酶基因的转录率和表达(Koch 1996)。基因表达的变化与已经描述的源调整发生在同一时间范围内。例如,在菠菜(Spinacia oleracea)的源叶中,当可溶性碳水化合物由于从叶中输出的抑制而积累时,几种光合酶的 mRNA 会降低(Krapp 和 Stitt 1995)。尽管转录水平几乎立即开始下降,但光合酶活性的变化仅在几天后才明显。至少在这个物种中,光合作用似乎被抑制是因为基因表达的变化,而不是因为磷酸盐限制,如前所述。
WEB TOPIC 11.12 蛋白质和 RNA:韧皮部的信号分子
蛋白质作为信号分子
伴随细胞中合成的蛋白质可以清楚地通过连接两种细胞类型的胞间连丝进入筛分元件。如前所述,葫芦汁中的 P 蛋白 PP1 和 PP2 似乎是在伴侣细胞中合成的。因此,连接伴生细胞和筛子元素的胞间连丝必须允许这些大分子穿过它们。此外,PP1 和 PP2 的亚基随着易位流移动到下沉组织。
来自南瓜 ( Cucurbita maxima ) 的 P 蛋白亚基可以穿过嫁接结合,从 南瓜砧木(基底嫁接伴侣)移动到黄瓜 ( Cucumis sativus ) 接穗(上部嫁接伴侣),以及从南瓜接穗移动到黄瓜砧木. 这两种蛋白质都能够从筛分元件转移到伴生细胞;两种蛋白质都不能超出筛分元素-伴侣细胞复合物(la Cour Petersen 等人,2005 年)。此外,对于这两种蛋白质,尚未建立明确的信号传导功能。
其他蛋白质在易位流中从源移动到汇。例如,已在拟南芥和烟草植物中证明了蛋白质从伴侣细胞到筛分元件的被动运动。这些植物用来自水母的绿色荧光蛋白 (GFP) 基因转化,在拟南芥的SUC2启动子的控制下。SUC2 蔗糖-H +symporter 在伴随细胞内合成,因此在其启动子控制下表达的蛋白质,包括 GFP,也在伴随细胞中合成。GFP 在蓝光激发后通过其荧光定位,从伴生细胞穿过胞间连丝进入源叶的筛分元件(参见教科书图 11.23A)并在韧皮部内迁移到下沉组织。
最后,水母绿色荧光蛋白通过胞间连丝共塑性卸载到汇组织中,例如种皮、花药、根尖和输入叶片中的叶肉细胞(参见教科书图 11.23B)(Imlau 等人 1999,Stadler 等人. 2005)。由于水母 GFP 不太可能具有与胞间连丝结构相互作用的特定序列,因此其进出筛元素的运动很可能通过被动扩散发生。在拟南芥伴侣细胞中表达的 GFP 和其他蛋白质(例如泛素)之间的一些可溶性融合蛋白显示出相似的转运模式。然而,只有游离的 GFP 能够共塑性移动到根部的水槽组织中 (Stadler et al. 2005)。
还证明了改变细胞功能的蛋白质的韧皮部转运(下面的网络表 11.12.A)。例如,FLOWERING LOCUS T (FT) 蛋白似乎是花刺激物的重要组成部分,它响应诱导开花的条件从叶移动到顶端(参见教科书第 25 章)。PRms 蛋白是一种发病机制相关的蛋白,参与玉米对真菌病原体的防御反应。PRms 蛋白进入并穿过韧皮部,如其在烟草韧皮部渗出物中的存在以及其穿过移植物结合部的运动所示。PRms 可以跨移植联合体从 转基因原种转移到非转基因对照(Bortolotti et al. 2005)。然而,尚未证明蛋白质的卸载,其确切的作用机制也未知。
WEB 表 11.12.A 筛分液中发现的一些可溶性蛋白质的功能
功能 例子
糖代谢 蔗糖合酶、糖酵解酶
蛋白质降解 泛素
氧化还原调节 硫氧还蛋白h
蛋白质磷酸化 蛋白激酶
蛋白质折叠 伴侣
抗氧化防御 一套酶和自由基清除剂
保护韧皮部蛋白质免于
降解以及防御病原体
和以韧皮部为食的昆虫 蛋白酶抑制剂
RNA结合 CmPP16、PP2、富含甘氨酸的 RNA 结合蛋白
开花信号 FLOWERING LOCUS T 蛋白
(来源:Hayashi et al. 2000;Walz et al. 2004, Gaupels et al. 2008, Aki et al. 2008)
显然,蛋白质可以通过中间的筛子元件从源中的伴随细胞转运到下沉伴随细胞。然而,几乎没有证据表明在伴随细胞外合成的蛋白质有类似的运动。来自筛分元素-伴侣细胞复合体外部的其他信号可能会导致伴侣细胞中产生可移动的蛋白质。
RNA作为信号分子
在韧皮部运输的 RNA 由内源性 mRNA、致病性 RNA 和与基因沉默相关的小 RNA 组成(参见教科书第 2 章)。大多数这些 RNA 似乎作为 RNA 和蛋白质的复合物(核糖核蛋白 [RNP])在韧皮部中传播(Gomez 等人 2005,Kehr 和 Buhtz 2008)。韧皮部中的 RNP 类似于病毒 RNA 与其运动蛋白 (MP) 形成的复合物。病毒“运动蛋白”直接与胞间连丝相互作用以允许病毒核酸在细胞之间通过。
病毒在细胞间移动的机制可能不同于它们进入韧皮部和长距离运输的机制。虽然 MP 在通过胞间连丝在细胞间运动中的作用已经确立,但细胞间运动可能需要也可能不需要病毒外壳蛋白。虽然病毒外壳蛋白是韧皮部病毒易位的广泛需要,但可能不需要 MPs(Kehr 和 Buhtz 2008)。此外,内源性韧皮部蛋白可能参与病毒的韧皮部转运。例如,PP2 是一种众所周知的韧皮部结构蛋白,它能够封闭受损的筛分元件,它存在于黄瓜的韧皮部分泌物中,与类病毒(致病性)RNA 形成复合物。此外,PP2 和类病毒 RNA 同时从黄瓜砧木转移到南瓜接穗。运输后,
转录后基因沉默(参见教科书第 2 章)是一种系统,它清楚地证明了 RNA 在韧皮部长距离信号传导中的作用(van Bel 2003)。基因表达的 RNA 沉默导致靶 mRNA 降解,例如从转基因或病毒核酸转录的过量或外源 mRNA。当转基因与宿主基因同源时,宿主基因也被沉默。RNA 沉默是由病毒或转基因诱导的双链 RNA 的存在触发的。双链 RNA 由称为 Dicer 样蛋白的蛋白质加工形成称为短干扰 RNA (siRNA) 的小 RNA。这些 siRNA 被掺入复合物中,从而进行靶 mRNA 的降解。通过这种方式,基因被“沉默”(Eamens et al. 2008)。
RNA 沉默不仅在针对外来 mRNA 的防御过程中发挥作用,而且在发育过程中也发挥作用。称为 microRNA (miRNA) 的小 RNA 的形成方式与 siRNA 类似,并且同样被整合到介导 mRNA(植物)降解或抑制 mRNA 翻译(动物和昆虫)的复合物中(Eamens 等人,2008 年)(参见第 17 章)。
小 RNA 似乎满足了信号分子的所有要求:进入筛分元件并在韧皮部转运到下沉组织,从而触发功能变化。在韧皮部汁液中发现了被证明是真正的调节 RNA(siRNA 和 miRNA)的小 RNA,它们的水平对生长条件和病毒感染有反应(Yoo 等,2004)。此外,至少对于 siRNA,已经证明了小 RNA 的韧皮部转运。在野生型黄瓜接穗的汁液中发现了与病毒外壳蛋白基因序列互补的 siRNA,该接穗已移植到为转基因外壳蛋白表达而沉默的南瓜原种上。沉默发生在来自非沉默线的接穗的组织中,该线已经嫁接到来自沉默的壁球线的砧木上。那是,
在澳大利亚原产烟草的近亲本氏烟草 中也证实了从沉默的接穗到未沉默的砧木的相反方向的沉默信号的传输。放射性磷酸盐被用作韧皮部示踪剂,通过从砧木中去除源叶来操纵源库关系。沉默信号的传输遵循韧皮部源到汇的传输模式,从接穗到砧木(Tournier 等,2006)。
最后,在韧皮部运输的 RNA 会导致水槽发生明显的变化。由于 RNA 转运到接穗而导致的表型(外观)变化已在许多嫁接实验中得到证实:这些变化包括由于转录后基因沉默导致的烟草萎黄和由于运输突变同源框而导致的番茄叶片形态变化mRNA。在这两种情况下,RNA 运动都发生在顶瓣(朝向顶点)方向,但韧皮部的运动并未得到证实。然而,赤霉酸反应调节剂(称为 GAI)的 mRNA 定位于南瓜的筛分元件和伴生细胞,并在南瓜韧皮部汁液中发现。
表达调节基因突变体的转基因番茄植株矮小且呈深绿色。突变调节剂的 mRNA 定位于筛分元件,能够通过移植联合体转运到野生型接穗中,并卸载到顶端组织中。结果,突变表型在野生型接穗上出现了新的生长(Haywood et al. 2005)。在最后一个例子中,一种调节马铃薯块茎形成的转录因子在叶和匍匐茎中积累,以响应诱导性短日,并从上部嫁接伙伴(接穗,过度表达转录因子)穿过嫁接结合部向匍匐茎尖端移动。野生型原种),块茎诱导部位。增加块茎产量(Banerjee 等人,2006 年)。
信号传导中的浆细胞功能
被病毒征用以促进它们特定运动到和通过胞间连丝的内源性蛋白质被认为对内源性大分子具有类似的功能。已从韧皮部分泌物中鉴定出与 RNA 结合并增加叶肉细胞之间胞间连丝 SEL 的蛋白质(例如,PP2 和 CmPP16);此外,已在胞间连丝中鉴定出与渗出蛋白相互作用的蛋白质(例如,NtNCAPP1)。NtNCAP1 对胞间连丝转运的控制似乎具有特异性和选择性(Ding et al. 2003)。
据信,CmPP16 等蛋白质参与了大分子向筛分元件的运输和韧皮部的长距离运输。最近,来自南瓜的CmPP16通过蚜虫管心针被引入米筛元件中;CmPP16 向根部的运输似乎具有选择性(Aoki 等人,2005)。尽管尚未显示增加胞间连丝通透性,但前面描述的玉米发病机制相关蛋白 (PRms) 已位于转基因烟草植物中伴细胞和筛分元件之间的胞间连丝中。使用抗 PRms 抗体完成定位。PRms 增加了蔗糖的分配,减少了淀粉的分配,从而增加了转基因烟草植物源叶的蔗糖流出量(Bortolotti 等,2005),
WEB TOPIC 12.1 线粒体的分离
Ian M. Møller,丹麦奥胡斯大学;Allan G. Rasmusson,瑞典隆德大学
虽然可以通过完整的组织测量呼吸,但能够分离出未受污染的、完整的和功能性的线粒体通常是有用的。在这里,我们将考虑一些分离细胞器的原则。本次讨论并非详尽无遗,也不是一本包含食谱的食谱,需要一步一步地遵循。有用的一般参考文献是 Douce 1985,Møller 等人。1996 年,以及从 1987 年开始的《酶学方法》第 148 卷中的一些章节。
组织破坏
目的是使组织中尽可能多的细胞破裂,以释放线粒体,但不会破坏它们。虽然许多哺乳动物组织很容易均质化,但植物组织要坚韧得多,主要是因为细胞壁。有许多标准的均质器,包括带有旋转刀或刀片的混合器、榨汁机、球磨机以及研钵和研杵;应选择最适合特定植物材料的方法。这可能涉及一些初始优化实验。
对于特殊应用,细胞可能会被完全不同的方法破坏。分析植物细胞区室中的代谢物和辅助因子需要在亚秒级时间尺度上分离细胞器(叶绿体和线粒体)。为此目的,破坏没有细胞壁的原生质体,并通过快速过滤分离细胞器(Lilley 等人,1982)。
均质培养基
大鼠肝脏匀浆培养基仅含有渗透液和缓冲液。这种培养基不适用于植物组织,因为大中央液泡(哺乳动物细胞中不存在)的破坏会释放出其相当酸性的内容物,通常含有酚类和其他潜在有害物质。
让我们一一考虑从植物材料中分离完整和功能性细胞器的最佳均质培养基的成分。
渗透性。该成分是防止线粒体因肿胀和破裂而失去其基质含量所必需的。对于植物线粒体的分离,传统上使用 0.2-0.5 M的蔗糖或甘露醇;而 0.15 M KCl 是哺乳动物线粒体分离的标准溶液。在这两种情况下,这都不能精确地模拟细胞质中的条件,但它确实有效。
缓冲区。植物细胞胞质溶胶中的 pH 值约为 7.5,匀浆应在 pH 7-8 下缓冲。因此应该包括一个缓冲区,并且可以使用大量不同的缓冲区。选择 pKa 为 7-8 的廉价产品(例如,4-吗啉代丙烷磺酸 [MOPS]),并确保使用足够的量来平衡酸性液泡含量。组织类型、组织/培养基比例和缓冲液浓度决定了酸性液泡内容物是否被适当中和。显然,在深夜或清晨收获的柠檬或 CAM 植物等特殊组织需要特殊处理!
金属离子螯合剂。通常包含 EDTA 以主要结合 Ca 2+和 Mg 2+,否则它们可能会激活蛋白水解酶。
抗氧化剂。抗氧化剂(还原剂)如抗坏血酸、二硫苏糖醇或半胱氨酸主要用于保护蛋白质上的巯基免受氧化。
牛血清白蛋白(BSA)。这种来自奶牛血液的蛋白质通常用于保护线粒体:BSA 与磷脂酶对磷脂的作用释放的脂肪酸(其在血液中的功能)结合。BSA 还可以结合从液泡中释放的酚类物质。否则,这两组化合物以后都会很麻烦。此外,BSA 可以通过作为高浓度存在的替代底物来防止蛋白酶降解线粒体蛋白。
聚乙烯吡咯烷酮(PVP)。一种通常包含的聚合物,特别是在使用叶子材料时,用于吸附酚类化合物。
过滤
为了去除较大的组织碎片、细胞壁和通常的淀粉粒,匀浆总是要过滤,通常是通过网眼大小为 30-100 μm 的尼龙网。
线粒体的纯化
纯化的第一步通常是差速离心。这意味着过滤后的匀浆首先以低速离心短时间(例如,3000 g 5-10 分钟)并丢弃沉淀(包含细胞壁碎片、淀粉粒、细胞核、完整的质体)。然后将上清液更快、更长时间地离心(例如,10,000 g 离心 10-20 分钟)并收集沉淀(称为粗线粒体)。它包含完整和受损的线粒体,以及过氧化物酶体和质体膜。弃去上清液。
一旦线粒体被沉淀并从匀浆中潜在的破坏性可溶性物质中去除,培养基就可以大大简化。通常所谓的洗涤介质仅包含渗透性和弱缓冲液(不需要强缓冲液,因为不再有任何液泡内容可以中和)。然而,包含 EDTA 以结合二价阳离子以及 BSA 以吸附由磷脂酶作用释放的任何脂肪酸可能是明智的。重新悬浮的粗线粒体通常用洗涤介质稀释至 50-100 ml,并进行另一轮慢速和快速离心以去除更多污染物。
下一步的目的是将完整的线粒体与污染物分离。这通常涉及单独使用 Percoll(例如,Struglics 等人 1993)或与其他致密材料一起(例如,Day 等人 1985)进行密度梯度离心。Percoll(涂有 PVP 的胶体二氧化硅)是惰性的,无渗透活性。另一个优点是 Percoll 梯度是自产生的,因为 Percoll 微球在离心过程中非常缓慢地沉淀。粗线粒体在含有适当浓度 Percoll(通常为 25-30%)的洗涤介质上分层。如果 Percoll 浓度以及离心的速度和持续时间选择正确,完整的线粒体将形成一个明显的带,远离污染物。这个乐队可以收藏,通过反复稀释和离心洗掉 Percoll,立即使用,或在液氮中用 5% (v/v) 二甲亚砜(以保持完整性)冷冻,并在 –80°C 下储存直至使用。这种制剂可以稳定数月,并保留在内膜上形成质子电化学梯度的能力。
产量为每 100 g 鲜重 1-50 mg 线粒体蛋白,具体取决于组织。这仅代表组织中线粒体总量的一小部分。
植物材料之间的差异
如果实验的目的是研究特定的生理问题,那么植物材料通常是明确定义的。但是,在材料选择具有灵活性的情况下,遵循一定的经验法则是明智的:
选择易于大量获取的组织(至少 100-200 克鲜重),例如块茎或下胚轴。
选择有良好方案可用的组织。优化隔离协议可能需要花费大量时间和精力。
从某些材料中纯化线粒体可能很困难,因为细胞器之间的细胞器是异质的。例如,线粒体的密度在发育过程中会发生变化,在这种情况下,需要按发育阶段仔细分类组织。
从绿叶中纯化线粒体存在特殊问题,Day 等人描述了一个很好的协议。(1985 年)。从遗传模式植物中纯化全功能线粒体的方法已经可用。材料包括拟南芥悬浮细胞 (Kruft et al. 2001) 和栽培幼苗 (Escobar et al. 2006),而拟南芥叶子仍然存在纯度或功能完整性方面的问题 (Keech et al. 2005)。线粒体可以成功地从稻叶中纯化出来(Kristensen 等人,2004 年)。最后,Boutry 等人。(1984) 展示了如何从少量植物组织(低至 0.5 克鲜重)中分离纯化的线粒体。
线粒体的细分
线粒体包含四个隔室,每个隔室都有独特的蛋白质补充:外膜(包含大约 7% 的蛋白质)、膜间空间(可能 1-2%)、内膜(50-60%)和矩阵 (30–40%)。有时需要,例如当试图在线粒体内定位给定功能时,隔离线粒体隔室的内容;这通常按如下方式完成(例如,Agius et al. 2001)(Web 图 12.1.A):
网页图 12.1.A 线粒体隔室的细分。低渗介质会导致线粒体膨胀,因为基质会吸收水分。由于内膜 (IMM) 的表面积大大超过外膜 (OMM) 的表面积,因此后者破裂,释放出膜间空间 (IMS) 的内容物和一些 OMM。添加 osmoticum 会导致有丝分裂体——线粒体减去(一些)OMM——收缩,使它们不易受到机械损伤。可以通过超声处理和差速离心将有丝分裂体颗粒化并细分为 IMM 囊泡(亚线粒体颗粒,或 SMP)和基质。当在高盐介质中进行超声处理时,SMP 是由内向外的——也就是说,它们与完整线粒体中的 IMM 具有相反的方向(Møller 等人 1987)。OMM 通过离心从有丝分裂上清液中分离出来。在 OMM 上清液中发现了膜间蛋白。符号:小方块——基质蛋白(如苹果酸脱氢酶),三角形——膜间空间蛋白(植物线粒体没有已知标记),正方形和圆形——Fo内膜中的F 1 -ATP 酶(ATP 合酶),F 1面向基质。
外膜破裂,要么通过渗透膨胀,要么通过用一种特殊的去污剂洋地黄皂苷选择性溶解。在这两种情况下,避免破坏内膜至关重要,因为即使只有百分之几的线粒体释放基质也会导致体积很小的膜间空间受到非常大的污染。
颗粒线粒体。上清液包含至少一部分线粒体的膜间隙和外膜(通常只有 10-20%)。可以从该上清液中沉淀出外膜,并且将膜间空间蛋白留在溶液中。
沉淀的线粒体——通常称为线粒体,是没有外膜的线粒体——然后被破坏(例如,通过超声处理),并沉淀内膜。这将基质蛋白留在上清液中。内膜通常在破裂后重新密封并形成密封的囊泡(所谓的亚软骨颗粒),其侧面性可能因破裂方法和条件而异(Møller 等人 1987)。请注意,外膜部分通常包含一些内膜污染(例如,Agius 等人,2001)。
确定馏分纯度、完整性和功能性的方法
确定线粒体及其亚组分的纯度通常很重要(Agius 等,2001)。
线粒体的完整性通常通过利用完整膜对某些分子不可渗透的事实的酶测定来确定。例如,线粒体外膜对细胞色素c是不可渗透的,这是一种 12.5 kDa 的蛋白质,它太大而无法通过外膜孔,因此不能穿过完整的外膜到达内膜外表面酶的活性位点。膜。然而,在去污剂存在的情况下,细胞色素c的总活性可以测定氧化酶。因此,可以确定潜在的,即被膜隐藏的活性的百分比。潜伏期被用作外膜完整性的量度。同样,NADH 不能通过完整的内膜,该特性可用于确定内膜的完整性。
功能性通常使用氧电极进行测试(网络图 12.1.B)。在对分离的线粒体进行的实验中,在添加 ADP(称为状态 3)时观察到的电子流动速率(测量为在存在诸如琥珀酸盐等底物的情况下的氧摄取速率)比在其不存在时更高。ADP 提供了一种底物,可在 ATP 合成过程中通过 F o F 1 -ATP 酶合酶刺激电化学质子梯度的消散。一旦所有 ADP 都转化为 ATP,电化学质子梯度会再次建立并降低电子流动速率(状态 4)。有和没有 ADP 的比率(状态 3:状态 4)被称为呼吸控制比率。
Web 图 12.1.B 在从绿豆 ( Vigna radiata ) 分离的线粒体中琥珀酸氧化过程中 ADP 对呼吸频率的调节。体内通常存在有限量的 ADP,因此情况介于状态 3 和状态 4 之间。迹线下方的数字是氧气吸收率,表示为消耗的 O 2 (nmol min –1 mg protein –1 )。(数据由 Steven J. Stegink 提供。)
如果分离的线粒体显示出高耗氧率、高呼吸控制比率 (> 3) 和 ADP:O 比率接近理论值,类似于通常获得的值(参见教科书表 12.1),它们的状态非常好。请注意,对于具有明显替代氧化酶活性的线粒体(在细胞色素氧化酶抑制剂 KCN 存在下测量),呼吸控制比和 ADP:O 比应在替代氧化酶抑制剂(如水杨异羟肟酸或 N-没食子酸丙酯(参见 Web WEB TOPIC 12.3)。
线粒体活动可以原位确定
测量从线粒体分离的可溶性基质部分中酶的活性相对简单(见上文)。然而,与完整线粒体内的基质(300-500 mg 蛋白质/ml!)相比,该部分非常稀,并且蛋白质-蛋白质相互作用可能已经丢失。当测量含有膜的部分(完整的线粒体和亚线粒体颗粒)中酶的活性时,通常可以使用去污剂来去除内膜构成的渗透屏障(例如,Møller 等人,1996)。然而,也可以使用离子载体 alamethicin 将内膜透化为 <1000 Da 的分子。该程序可以测量基质和内膜酶在其天然蛋白质环境中的活性(Johansson et al. 2004)。
使用 alamethicin,甚至可以测量完整细胞内的细胞溶质和线粒体酶的活性,因为离子载体也可渗透质膜(Matic 等人,2005 年)。这允许测量细胞中的所有线粒体,而不仅仅是那些在细胞破裂时完整释放的线粒体。
WEB TOPIC 12.2 Q 循环解释了复杂 III 如何通过线粒体内膜泵送质子
Allan G. Rasmusson,瑞典隆德大学;Ian M. Møller,丹麦奥胡斯大学
大多数真核生物线粒体内膜中的电子传递链 (ETC) 由四个复合物组成,复合物 I 到复合物 IV。复合物 I、III 和 IV 在传输电子时将质子泵过线粒体内膜。对于每个电子对(对应于一个 NADH 或一个氧原子),配合物 I 泵送四个质子,配合物 III 泵送四个质子,配合物 IV 泵送两个质子。已经确定了哺乳动物配合物 III 和 IV 的详细三维结构,并在一定程度上确定了配合物 I。结构信息提高了对配合物中电子路径的理解 (Brandt 2006, Hosler et al. 2006, Klodmann et al. 2010,Efremov 和 Sazanov 2011)。
泛醌 (Q),也称为辅酶 Q,是线粒体内膜中的移动电子和质子载体,在结构和功能上类似于质体类囊体膜中的质体醌(Web 图 12.2. A)。Q 携带电子和质子的能力——以及逐步接受和捐赠它们的能力——被用于电子传输和质子泵浦(网络图 12.2.B )(Nicholls 和 Ferguson 2002)。为了被还原,Q 可以从复合物 I 或琥珀酸脱氢酶(但也可以从例如 II 型内部 NADH 脱氢酶;参见 Web WEB TOPIC 12.3)接收两个电子并从基质中吸收两个质子 (2 H + ),形成QH 2. 然而,在氧化位点(复合物 III),实际上同时发生了氧化和还原。A QH 2将在外 Q 位被氧化成 Q,释放两个电子。这些电子中的一个进入细胞色素c,而另一个被循环以将内部 Q 结合位点中的氧化 Q 还原一步以产生半醌。下一次 QH 2在外部 Q 结合位点被氧化时,内部 Q 位点中的半醌将获得第二个电子,成为 QH 2。所以,从两个QH 2,我们制造了一个Q 和一个QH 2,它们又可以被氧化。在每个循环中(即,对于每个传递到细胞色素c的电子),两个质子从基质中吸收,两个质子释放到膜间空间。因此,Q 循环介导了每个电子传输的额外质子的泵送,从而增加了能量守恒。
Web 图 12.2.A Q 的结构及其还原形式泛醇 (QH 2 )。AQ 可以吸收两个电子和两个质子,成为QH 2。或者,还原可以逐步进行,一次一个电子加一个质子。逐步还原产生相对短寿命的中间体泛半醌。QH 2的氧化是该过程的逆转。Q 分子有一个长的碳氢化合物尾部,将其锚定在膜内,在半醌和 QH 2结构中表示为 R。
Web 图 12.2.B泛醌 (Q) 的还原和氧化以及 Q 循环。配合物 III 和 Q 一起进行质子泵送。在这张图片中,我们还包括通过琥珀酸脱氢酶(复合物 II)的 Q 还原,以便我们可以看到更完整的过程。该过程包含两个步骤。每个步骤的反应物用蓝色表示,产物用红色表示,中间体用黑色表示。第一步的反应物Q分子,一个还原,两个氧化,与第二步的产物相同(即,我们回到相同的情况)。在每个步骤中,一个电子从琥珀酸脱氢酶转移到细胞色素c,但是来自基质的两个质子被运输到膜间空间。琥珀酸脱氢酶中的电子路径涉及一个 FAD 和几个与蛋白质结合的铁硫中心 (FeS)。在复合物 III 中,QH 2与外部 Q 结合位点结合,一个电子通过 Rieske FeS 和细胞色素c 1(与复合物结合)到达移动载体细胞色素c。另一个电子通过b型细胞色素(细胞色素b L和细胞色素b H)到达第二个内部 Q 结合位点,在那里它被捐赠给 Q(步骤 1)或半醌(步骤 2)。质子 (H +) 取自步骤 2 中的矩阵。下标 L 和 H 分别代表“低电位”和“高电位”。电位越高,分子越容易接受电子。(改编自 Nicholls 和 Ferguson 2002。)
如果我们观察从琥珀酸到细胞色素c的整个反应(参见网络图 12.2.B),我们会看到对于每个琥珀酸,四个质子从基质转运到膜间隙。然而,与此同时,这两个电子也被传输了出去。因此,这对应于两个正电荷的净抽出。由于从能量上讲,线粒体膜电位(决定将正电荷输送出去的能量成本)远大于 pH 梯度(决定质子输出的成本),因此复合物 III 泵送质子的能量需求较低而不是,例如,复合物 I,它泵送四个质子,包括它们的电荷。
已经确定了动物中质子泵复合物 III 和 IV 的详细三维结构(Iwata 等人 1998、Tsukihara 等人 1996、Hosler 等人 2006),现在也确定了复合物 I(Brandt 2006、Klodmann等人 2010,Hinchliffe 和 Sazanov 2005,Efremov 等人 2010,Efremov 和 Sazanov 2011a,Efremov 和 Sazanov 2011b)。结构信息提高了对配合物 III 和 IV 电子路径的理解,但后者的质子泵浦机制仍未完全阐明。络合物 III 的结构如图 12.2.C所示,显示了 Q 循环中涉及的氧化还原中心的确切位置。
Web 图 12.2.C 鸡线粒体复合物 III 的三维结构。蛋白质复合物是位于线粒体内膜(表示为灰色框)中的二聚体,但主要蛋白质部分突出到基质中。催化中心存在于跨越内膜并面向膜间空间的部分,并表示为二聚体的右侧部分。注意对称性,每个电子携带中心出现两次。蛋白质骨架根据不同的亚基着色。该图像是使用 Jmol 制作的,数据来自 PDB 条目 3h1h ( www.rcsb.org/pdb )。
WEB TOPIC 12.3 植物线粒体氧化磷酸化中的多重节能旁路
Allan G. Rasmusson,瑞典隆德大学;Ian M. Møller,丹麦奥胡斯大学
大多数真核生物线粒体内膜中的电子传递链 (ETC) 由四种大蛋白复合物组成,即对鱼藤酮敏感的 NADH 脱氢酶(复合物 I)、琥珀酸脱氢酶(复合物 II)、细胞色素bc 1复合物(复合物 III)和细胞色素c氧化酶(复合物 IV)。复合物 I、III 和 IV(后两者通常共同称为细胞色素途径)的电子传递活性与质子通过线粒体内膜的挤出相耦合。在此过程中形成和维持的电化学质子梯度被 ATP 合酶(也称为复合物 V)用于制造 ATP(网络图 12.3.A)。然而,植物 ETC 是高度分枝的。因此,植物氧化磷酸化系统具有多种通过 II 型 NAD(P)H 脱氢酶和替代氧化酶 (AOX) 进行电子传递的替代途径,此外,还有一种称为解偶联蛋白 (UCP) 的替代质子转运蛋白。这些蛋白质介导绕过质子转运多蛋白复合物 (I-V):II 型 NAD(P)H 脱氢酶绕过复合物 I,AOX 绕过复合物 III 和 IV,UCP 绕过 ATP 合酶(Siedow 和 Umbach 1995;Vanlerberghe 和McIntosh 1997;Møller 2001;Millenaar 和 Lambers 2003;Fernie 等人 2004;Rasmusson 等人 2004、2008;Vercesi 等人 2006;Vanlerberghe 2013)。II 型 NAD(P)H 脱氢酶和 AOX 在不泵送质子的情况下传输电子,而 UCP 允许质子从膜间空间流向基质,而无需合成 ATP。这样做的结果是,通过能量守恒旁路的通量将介导对 ATP 产生没有贡献的呼吸作用。同时,II型NAD(P)H脱氢酶和AOX将不受细胞腺苷酸状态的控制。本网络WEB TOPIC将描述这些能量旁路蛋白的特殊功能,并讨论它们的存在对植物的影响。
网页图 12.3.A植物线粒体内膜中电子传递链和 ATP 合成的组织。除了在几乎所有线粒体中发现的四种标准蛋白质复合物外,植物线粒体的电子传递链还含有额外的酶(以绿色表示)。这些额外的酶都没有泵出质子。此外,解偶联蛋白通过允许被动质子流入直接绕过 ATP 合酶。由于外膜中存在孔蛋白,NAD(P)H 有望在膜间隙和胞质溶胶之间自由扩散。植物中的多重旁路,其中动物只有解偶联蛋白,为植物能量耦合提供了更大的灵活性。特异性抑制剂——复合物 I 的鱼藤酮,复合物 III 的抗霉素,复合物 IV 的氰化物,和用于替代氧化酶的水杨基异羟肟酸 (SHAM) 是用于研究线粒体电子传递的重要工具。有些也有商业用途,例如鱼藤酮——它被用作杀虫剂,可以在不影响植物的情况下从湖中清除不需要的鱼。由于植物具有替代途径,因此它们可以在暴露于呼吸复合物的抑制剂时存活下来。缩写:AOX,替代氧化酶;ND(B1/B2/B4/A1/A2),各种 II 型 NAD(P)H 脱氢酶。他们可以在暴露于呼吸复合物的抑制剂后存活下来。缩写:AOX,替代氧化酶;ND(B1/B2/B4/A1/A2),各种 II 型 NAD(P)H 脱氢酶。他们可以在暴露于呼吸复合物的抑制剂后存活下来。缩写:AOX,替代氧化酶;ND(B1/B2/B4/A1/A2),各种 II 型 NAD(P)H 脱氢酶。
植物线粒体中的 NAD(P)H 脱氢酶
除酵母外,所有真核生物(包括植物)的 ETC 都含有一种质子泵 NADH 脱氢酶复合物 I,该酶可被鱼藤酮特异性抑制(参见网络图 11.3.A)。此外,植物、真菌和原生生物线粒体含有各种版本的鱼藤酮不敏感酶,能够氧化 NADH 和/或 NAD(P)H 并将电子传递给泛醌。这些 NAD(P)H 脱氢酶被归类为 II 型,而复合物 I 是 I 型 NAD(P)H 脱氢酶。II 型 NAD(P)H 脱氢酶相对较小,由 45-60 kDa 的单个多肽组成,而复合物 I 是 ca。总分子量接近 1 MDa 的 45 种多肽。植物的线粒体内膜含有 II 型 NAD(P)H 脱氢酶,它们面向基质或膜间隙,因此从基质或细胞质中氧化 NAD(P)H(参见Web 图 11.3.A)。一般来说,光合生物比异养生物具有更多的 II 型 NAD(P)H 脱氢酶基因(Møller 1997;Møller 和 Rasmusson 1998;Rasmusson 等人 1998;Kercher 2000;Møller 2001;Rasmusson 等人 2004、2008)。在一些“原始”动物进化枝中也发现了编码 II 型 NAD(P)H 脱氢酶的基因,例如海鞘、海胆和九头蛇(Matus-Ortega et al. 2011)。
植物 II 型 NAD(P)H 脱氢酶构成三个小蛋白质家族:NDA、NDB 和 NDC。所有都存在于线粒体中,但对于特定的蛋白质,其他区室的功能已通过靶向分析得到证明和/或建议。在马铃薯和拟南芥线粒体中,NDA 和 NDC 蛋白已定位于线粒体内膜的基质侧,而 NDB 蛋白则与线粒体内膜的外表面结合(Rasmusson 等人 1999;Michalecka 等人 2004; Elhafez 等人,2006 年;Carrie 等人,2008 年)。
所有线粒体的外膜都含有对鱼藤酮和复合物 III 抑制剂抗霉素 A 不敏感的 NADH-铁氰化物和 NADH-细胞色素b还原酶活性。然而,外膜活性与内膜 ETC 无关,也不会受到影响。在这里进一步处理。
内膜内基质表面存在三种类型的 NAD(P)H 脱氢酶活性
关于面向基质的 NAD(P)H 脱氢酶数量的大部分信息来自使用由内向外的内膜囊泡进行的实验。这种囊泡的基质表面面向培养基,而外部 NAD(P)H 脱氢酶隐藏在囊泡内,无法干扰测定。该方法补充了一种技术,其中使用透膜肽阿拉米辛为底物通过内膜形成通道(参见 Web WEB TOPIC 12.1)。使用这些方法进行的实验表明,在内膜的基质侧存在三种 NAD(P)H 脱氢酶活性(参见网络图 12.3.A)(Møller 和 Palmer 1982;Rasmusson 和 Møller 1991;Melo 等人 1996; Agius 等人 1998 年;Johansson 等人 2004 年):
复合物 I 泵送质子,不依赖于 Ca 2+,并被鱼藤酮和二亚苯基碘鎓 (DPI) 抑制。复合物 I 对 NADH [低K m (NADH)]具有高亲和力。
ND in (NADH) 不泵送质子,不依赖于 Ca 2+,并且对 DPI 不敏感。该酶对NADH的亲和力比复合物I低十倍[即,K m (NADH)高十倍]。这种活性很可能是由 NDA1 和 NDA2 催化的。
ND in (NADPH) 不泵送质子,是 Ca 2+依赖性的,并且对 DPI 敏感。尚未鉴定出催化这种活性的蛋白质,但可能是 NDC1。
由于 (NADH) 中复合物 I 和 ND对NADH 的亲和力不同,预计只有复合物 I 会在低基质浓度的 NADH 下参与。然而,当基质中的 NADH 浓度增加时(例如,如果 ETC 受到细胞中缺乏 ADP 的限制),(NADH)中的 ND可能会参与。然而,不同生理条件下基质中NADH的确切浓度尚未完全阐明。这部分是由于 NADH 形成的复杂动力学调节 (Hagedorn et al. 2004),部分是由于基质 NADH 的很大一部分是蛋白质结合的,而不是在溶液中游离 (Kasimova et al. 2006)。
当电子通过 II 型 NAD(P)H 脱氢酶传输时,只有细胞色素通路的两个质子泵位点参与电子从基质 NADH 到氧气的流动。因此,理论 ADP/O 产率为 1.5,除非 AOX 或 UCP 处于活性状态,在这种情况下产率会更低。
NDA 型的 II 型 NAD(P)H 脱氢酶蛋白存在于线粒体、内膜屏障内、马铃薯和拟南芥中(Rasmusson 等人 1999;Michalecka 等人 2003;Elhafez 等人 2006)。来自表达和突变分析以及序列比较的证据共同表明它们是 NADH 脱氢酶(Svensson 和 Rasmusson 2001;Moore 等人 2003;Michalecka 等人 2004;Elhafez 等人 2006;Escobar 等人 2006)。然而,内部NADPH脱氢酶的基因身份尚未确定。
在酵母酿酒酵母中,复合物 I 不存在,因此单一 II 型 NADH 脱氢酶 (Ndi1) 催化基质 NADH 的氧化。Ndi1 蛋白序列总体上与植物 NDA 蛋白相对相似。作为酵母中唯一的 II 型 NAD(P)H 脱氢酶,Ndi1 已被结晶并确定其结构(Web 图 12.3 B)。它是两个相同的≈50 kDa 多肽的同源二聚体,含有黄素腺嘌呤二核苷酸 (FAD) 作为其唯一的电子携带辅基。每个亚基的 C 末端结构域形成部分嵌入膜中的 α 螺旋。这将 FAD 定位在靠近膜表面的位置,在那里,来自水性基质隔室的 NADH 和来自疏水膜内部的泛醌都可以接触到它(Iwata 等人,2012;Feng 等人,2012)。
Web 图 12.3.B II 型 NADH 脱氢酶和替代氧化酶的结构。来自酿酒酵母的 Ndi1 (pdb: 4G9K; Iwata et al. 2012) 和来自布氏锥虫的替代氧化酶(pdb:3VV9; Shiba et al. 2013) 都是同源二聚体。各反应针对一种单体进行。每种酶都含有一个内部电子携带基团;Ndi1 的 FAD 和替代氧化酶的二铁中心。两种酶都部分嵌入线粒体内膜的内叶中,使用平行于膜平面的α-螺旋。由于蛋白质不跨越膜,亲水性氧化还原之间的电子转移使 NADH/NAD +和 H 2 O/O 2,并且疏水性泛醌(UQH 2 /UQ)不能涉及质子泵送穿过膜,并且反应释放的所有能量都以热量的形式释放出来。
氧化胞质 NAD(P)H 的外部脱氢酶有 3 种类型
植物线粒体可以通过外部脱氢酶直接氧化胞质 NADH 和 NADPH。没有一个外部脱氢酶泵送质子,这意味着当电子从脱氢酶移动到氧气时,最多涉及两个质子泵送位点(参见Web 图 12.3.A)。因此,对于 (NADH) 中的 ND ,理论最大 ADP/O 产率为 1.5。
分离的植物线粒体对外源 NADH 或 NAD(P)H 的氧化需要 Ca 2+,因此被二价和三价阳离子螯合剂 EDTA 和 EGTA 抑制(Coleman 和 Palmer 1971;Møller 等人 1981 )。然而,在一些植物组织中,NADH 的氧化很大程度上与 Ca 2+无关(Nash 和 Wiskich 1983,Escobar 等人,2006)。NADH 氧化的半最大活性所需的 Ca 2+浓度为 0.1–0.5 μM,具体取决于离子环境和呼吸状态(Moore 和 Åkerman 1982;Rugolo 等人 1991)。这与被认为存在于静止植物细胞的胞质溶胶中的 0.1–0.2 μM 游离 Ca 2+处于同一范围内。因此,外部的 NAD(P)H 氧化可能会被增加的 Ca 激活。2+浓度与由外部刺激引起的细胞兴奋有关。
在植物中的 II 型 NAD(P)H 脱氢酶中,NDB 型蛋白存在于线粒体内膜的外侧(Rasmusson 等人 1999;Michalecka 等人 2004;Elhafez 等人 2006)。NADPH 氧化由 NDB1 蛋白进行,该蛋白不接受 NADH,完全依赖于 Ca 2+ (Michalecka et al. 2004; Geisler et al. 2007)。在拟南芥中,NDB2 和 NDB4 是 NADH 脱氢酶,前者受 Ca 2+刺激,但后者不依赖于 Ca 2+ (Geisler et al. 2007)。因此,植物器官之间NADH氧化的Ca 2+依赖性变化很可能是由于Ca 2+依赖性和非Ca 2+ 依赖性NDB蛋白的丰度变化。
哺乳动物线粒体缺乏外部 NAD(P)H 脱氢酶。相反,他们有一个 Ca 2+内膜外表面的-依赖性甘油-3-磷酸脱氢酶,它直接向泛醌池提供电子。形成的磷酸二羟基丙酮通过胞质 NAD 依赖性 3-磷酸甘油脱氢酶转化回 3-磷酸甘油。这样,3-磷酸甘油和磷酸二羟丙酮这两种低分子量化合物可以穿梭还原能力(由例如 NADH、NADPH、铁氧还蛋白或有机酸携带的高能电子的统称)氧化还原对(如苹果酸/草酰乙酸)从胞质溶胶穿过外膜到达内膜,产生与通过外部 NADH 脱氢酶的植物型氧化产生的相同量的 ATP。酵母线粒体具有外部 NADH 脱氢酶和 3-磷酸甘油穿梭,
另一种氧化哺乳动物线粒体中发现的胞质 NAD(P)H 的方法是使用苹果酸/天冬氨酸穿梭将还原剂作为 NADH 转移到基质中,NADH 可以被内部 NAD(P)H 脱氢酶氧化。然而,尚不清楚这种穿梭机是否可以将细胞溶质还原剂导入植物线粒体(参见 Web WEB TOPIC 12.5)。在相反的方向上,NADH 可以通过苹果酸/草酰乙酸穿梭从基质穿梭到细胞质。通过这种方式,外部 NADH 脱氢酶也可以作为复合物 I 的旁路。在复合物 I 或内部 II 型 NAD(P) 的突变体中,外部 NADH 脱氢酶活性的上调形式支持这种旁路。 H 脱氢酶已失活(Sabar 等人 2000;Moore 等人 2003)。
多种酶的总体情况告诉我们,植物包含一个高度灵活的系统。还原力可以在细胞的隔室之间移动,并通过不同的脱氢酶进入ETC,具有不同的调节作用,并以ATP的形式产生不同的能量。
替代氧化酶
AOX 的存在是将植物线粒体与哺乳动物线粒体区分开来的特征之一。因此,这种酶受到了植物科学家的广泛关注,我们现在对其结构和活性的调节有了相当好的了解(Vanlerberghe 和 McIntosh 1997;Millar 等 2011;Vanlerberghe 2013;Moore 等 2013) . AOX 通常存在于植物和植物器官中并表达。它也存在于某些真菌和原生生物中,与以前的看法相反,甚至在几组“原始动物”中发现了它,但在脊椎动物或节肢动物中没有发现(McDonald et al. 2009)。
AOX 是一种喹啉-氧氧化还原酶,它不泵送质子。加氧酶将电子从泛醇(泛醌的还原形式)转移到氧气,并生成水作为反应的最终产物(参见网络图 12.3.B),因此必须将四个电子转移到氧气。该蛋白质含有一个催化二铁中心(Siedow 和 Umbach 2000;Berthold 和 Stenmark 2003;Shiba 等人 2013)。酶的功能形式是二聚体,两种多肽以共价或非共价方式相互结合(参见网络图 12.3.B)。该结构定位蛋白质,使其嵌入线粒体内膜的内叶,活性位点暴露于基质。
Web 图 12.3.C AOX 在植物线粒体中的结构和调控特征。AOX 的合成受多种细胞条件的转录调控,包括 ROS、有机酸和糖的水平升高,以响应压力和发育过程。此外,AOX 通过线粒体硫氧还蛋白系统在转录后进行修饰,该系统介导在单体之间具有二硫键的相对不活跃的形式与具有游离硫醇基团的更活跃的形式之间的转换。最后,在来自许多植物来源的 AOX 中,大量的底物会通过丙酮酸 (Pyr) 与还原酶的翻译后结合以及通过增加内层底物泛醇 (UQH 2 ) 的浓度来直接增加活性。膜。
当来自基质 NADH 氧化的电子流过 AOX 时,质子易位的三个位点(复合物 III 和 IV,参见Web 图 12.3.A )中的至少两个被绕过,因此 ATP 形式的能量守恒要小得多AOX 处于活动状态。因此,必须仔细监管 AOX 的活动。许多植物物种的基因组编码几种 AOX 亚型;例如,拟南芥中存在五个编码 AOX 蛋白的基因。AOX 异构体及其 mRNA 的相对量随发育、细胞氧化还原状态和外部因素而变化(Wagner 和 Krab 1995;McCabe 等人 1998;Millenaar 和 Lambers 2003;Clifton 等人 2006)。
除了决定 AOX 蛋白水平的 AOX 基因表达调节外,酶的活性也在翻译后受到调节(参见Web 图 12.3.C)。AOX 二聚体的两个亚基可以通过半胱氨酸残基之间的二硫键共价连接。还原的、非共价连接的二聚体是活性形式,这种形式似乎是体内的主要形式(Vanlerberghe 等人,1999)。线粒体硫氧还蛋白系统调节 AOX 活性(Gelhaye 等人 2004)。硫氧还蛋白通过减少二硫键来调节酶,AOX 的调节很可能涉及氧化还原活性半胱氨酸。硫氧还蛋白调节的存在将 AOX 活化水平与线粒体 NADPH 池和利用 NADP 的酶对柠檬酸循环代谢物的氧化联系起来(Vanlerberghe 和 McIntosh 1997;Møller 和 Rasmusson 1998)。
底物供应可以直接和间接地调节 AOX 活性。许多 AOX 酶(包括大豆 AOX)的活性受到 2-氧代有机酸的刺激,特别是丙酮酸(参见网络图 12.3.C),它通过与参与酶的相同半胱氨酸相互作用来激活 AOX。二聚化(Rhoads 等人 1998 年;Vanlerberghe 等人 1998 年)。这种激活可能是一种前馈机制,当糖酵解终产物丙酮酸可用时,它会上调 ETC 的能力。细胞色素途径和 AOX 途径都使用泛醇作为底物。在没有丙酮酸的情况下,细胞色素通路在 40% Q red /Q tot时饱和(减少 40% 的 UQ),此时 AOX 通路根本不参与。AOX 通路在 50% 还原时开始接受电子,在 80% 时未完全饱和(网络图 12.3.D )。在存在丙酮酸的情况下,AOX 通路以低得多的 Q red /Q tot (20%) 参与,而细胞色素通路不受影响。然而,丙酮酸对 AOX 的调节受到质疑,因为观察到正常的体内丙酮酸浓度似乎高于在体外最大程度地刺激 AOX 活性所需的丙酮酸浓度(Millenaar 等,1998) .
Web 图 12.3.D在丙酮酸不存在(上图)或存在(下图)的 情况下,纯化的大豆子叶线粒体氧化琥珀酸中呼吸频率对醌氧化还原状态的依赖性。Q r是泛醌(还原泛醌),Q t是总泛醌(还原 + 氧化)。Myxothiazol 是复合物 III 的抑制剂,在它的存在下,只有 AOX 是有活性的。(来自 Hoefnagel 等人,1995 年。)
植物线粒体也含有解偶联蛋白
哺乳动物线粒体既不包含 II 型 NAD(P)H 脱氢酶也不包含 AOX。然而,它们具有增加线粒体内膜的质子通透性的 UCP,并以这种方式消散质子梯度。这是另一种减少 ATP 产生和增加热量产生的机制,例如,用于体温调节(另见 Web Essay 12.6)。令人惊讶的是,植物线粒体也含有 UCP(Vercesi 等人 1995;Laloi 等人 1997;Jezek 等人 2000;Fernie 等人 2004;Vercesi 等人 2006)。我们不确定为什么植物线粒体需要两种不同的机制来实现相同的最终结果。UCP与阴离子载体有关。在体外,UCP' s 转运活性依赖于游离脂肪酸,受 ATP 和 GTP 等核苷酸抑制,但受超氧化物刺激(Considine 等,2003)。后一个结果表明 UCP 可以防止氧化应激(见 Web 论文 12.7)。
能量旁路蛋白的生理影响
由于植物呼吸消耗了大约一半的光合作用同化物,因此植物呼吸是地球上的主要过程之一。总呼吸通量的很大一部分是通过绕过能量守恒并产生很少或不产生 ATP 的途径进行的。从表面上看,这种呼吸对植物的生长和维持几乎没有用处。然而,特别是近年来的研究已经提供了一些关于呼吸能量旁路途径可能对植物有益的方式的见解。
一些产热(产热)花的呼吸频率是植物中最高的,事实上,甚至超过了温血动物的呼吸频率。外部 NADH 脱氢酶、AOX 和 UCP 在产热花中显得特别活跃,它们主要负责产热(Web Essay 12.6)。同时,很明显大多数植物组织的呼吸频率不足以使组织温度明显升高。
产热仅限于相对较少的植物物种。在非产热植物中,AOX 的合成在转录水平上受到多种生物和非生物胁迫(包括冷胁迫)的上调(Fiorani 等人 2005;Vanlerberghe 2013)。然而,冷感应显然不是为了加热组织。在冷应激期间,会形成活性氧 (ROS),而导致 ROS 升高的其他应激处理也会诱发 AOX (Clifton et al. 2006)。ROS(例如,超氧化物和过氧化氢)在有氧条件下作为电子传递的副产物形成(参见 Web Essay 12.7)。ROS 会对蛋白质、脂质和 DNA 造成损害,因此细胞必须限制它们的形成(Møller et al. 2007)。AOX 有助于防止 ETC 的过度减少,从而降低 ROS 的产生(Purvis 和 Shewfelt 1993;Millenaar 等人 1998)。Maxwell 等人支持这一点。(1999) 证明了 AOX 对限制活植物细胞中 ROS 形成的重要性。培养细胞中 AOX 的过表达降低了 ROS 的稳态水平,而 AOX 的抑制增加了它。在完整植物中也观察到了类似的结果(Cvetkovska 和 Vanlerberghe 2013)。这些结果表明线粒体是植物细胞中 ROS 产生和 ROS 信号传导的重要位点(Rhoads 和 Subbaiah 2007;Vanlerberghe 2013)。随着植物 UCP 的 ROS 刺激的发现和过度表达 UCP 的植物中 ROS 抗性的增加(Brandalise 等人 2003;Considine 等人 2003),情况变得更加复杂。通过降低通过质子泵复合物的电子传输阻力,UCP 活性可能与 AOX 一样,防止过度还原和 ROS 形成 (Fernie et al. 2004)。另一个支持 UCP 在 ROS 保护中起作用的观察结果是 AOX 活性被 ROS 产物抑制(Winger 等人 2005)。有关线粒体参与 ROS 代谢的更多信息,请参见 Web Essay 12.7。
II 型 NAD(P)H 脱氢酶和 AOX 都可以通过用氧气再氧化多余的 NADH 来充当还原剂溢出酶(Millenaar 和 Lambers 2003)。换句话说,这些酶将通过防止电子传递链的过度还原来改善氧化还原稳态。在 ADP 浓度低的条件下,还原剂溢出可以防止抑制柠檬酸循环,因此质子泵复合物受到高膜电位的限制。这样,柠檬酸循环可以为生物合成提供碳骨架(例如,用于氮同化的 2-酮戊二酸;参见教科书图 12.14),即使细胞中的 ATP 水平很高(Noctor 和 Foyer 1998)。在其他情况下,NADH 脱氢酶和 AOX 协同作用可能会氧化多余的 NADH。例子包括从硝酸盐(需要大量还原剂进行同化)转换为铵作为氮源(Escobar 等人,2006 年),以及在磷酸盐缺乏期间(Sieger 等人,2005 年)。NADH 脱氢酶和 AOX 的协同功能的进一步指示是 NDB 型 NADH 脱氢酶与替代氧化酶强烈共表达(Clifton 等人 2005;Clifton 等人 2006;Ho 等人 2007)。在这种情况下,还原剂将从线粒体基质穿梭到膜间空间,在那里,NADH 将在内线粒体膜的外表面上被氧化。NADH 脱氢酶和 AOX 协同作用的另一个迹象是 NDB 型 NADH 脱氢酶与替代氧化酶强烈共表达(Clifton 等人 2005;Clifton 等人 2006;Ho 等人 2007)。在这种情况下,还原剂将从线粒体基质穿梭到膜间空间,在那里,NADH 将在内线粒体膜的外表面上被氧化。NADH 脱氢酶和 AOX 协同作用的另一个迹象是 NDB 型 NADH 脱氢酶与替代氧化酶强烈共表达(Clifton 等人 2005;Clifton 等人 2006;Ho 等人 2007)。在这种情况下,还原剂将从线粒体基质穿梭到膜间空间,在那里,NADH 将在内线粒体膜的外表面上被氧化。
溢出的概念也与光呼吸条件有关(见教科书第 8 章),在这种条件下,有大量的甘氨酸必须被线粒体氧化。在此过程中产生的 NADH 有一半可能出口,但另一半必须迅速氧化(Krömer 1995)。有几个理由相信涉及通过能量旁路蛋白的还原剂溢出。ND在(NADH) 和叶线粒体中的 AOX 容量高于来自异养组织的线粒体 (Dry 和 Wiskich 1985; Igamberdiev 等人 1997),并且这两种蛋白质都被暗处理下调 (Svensson 和 Rasmusson 2001)。与这些观察结果一致,体内 AOX 活性(有关该方法的描述,请参见 Web Essay 12.9)被光上调,AOX 能力由黄化组织的绿化和nda 1的表达诱导马铃薯和拟南芥中的基因(编码内部 NAD[P]H 脱氢酶)是光依赖性的(Atkin et al. 1993; Ribas-Carbo et al. 2000, 2008; Svensson and Rasmusson 2001; Michalecka et al. 2003; Escobar et al. al. 2004;Rasmusson 和 Escobar 2007)。然而,拟南芥中只有一些光响应性 NADH 脱氢酶和 AOX 基因对强光处理有响应,此时溢出负荷应为最大(Yoshida 等人 2007, 2009)。除了 NADH 脱氢酶和 AOX,溢出也可能由细胞色素途径和 UCP 共同介导,这可能会改善光合作用产生的多余 NADH 的再氧化。为了支持这一观点,缺乏 UCP 的突变体光合速率降低(Sweetlove 等人,2006),
缺乏质子泵复合物 I 的突变烟草植物仍然可以存活,这显然得益于 NDin(NADH) 的作用,它以较低的 ATP 产量氧化基质 NADH。然而,这些植物的光合速率降低,表明 ND在(NADH) 不能完全补偿缺失的复合体 I (Noctor et al. 2004, 2007)。此外,已建议外部 NAD(P)H 脱氢酶支持光合作用。这些酶可以重新氧化从叶绿体中穿出的 NAD(P)H,以平衡基质中 NAD(P)H 与 ATP 的比率(Krömer 1995)。马铃薯 NDB1 外部 NADPH 脱氢酶能够调节细胞 NADPH/NADP 比率,但尚未观察到光合作用的重要性(Liu 等人,2008 年)。总之,有许多迹象表明线粒体——尤其是能量旁路蛋白——在支持光合作用中发挥作用,例如通过氧化过量的 NAD(P)H(另见 Raghavendra 和 Padmasree 2003)。
在 CAM 植物的酸化/脱酸循环中观察到 AOX 途径的特殊参与。CAM植物在夜间以苹果酸的形式固定CO 2 。这是通过胞质 PEP 羧化酶完成的,产生的苹果酸储存在液泡中。固定的 CO 2在白天由位于细胞质和线粒体中的苹果酸酶释放(参见教科书第 8 章)。罗宾逊等人。(1992) 使用氧鉴别技术测量 AOX 途径对 CAM 植物Kalanchoe daigremontian a中全叶呼吸的贡献. 他们发现,在一天的凌晨,叶子的呼吸频率增加了 35%。这种增加是由于 AOX 活性增加。详细的时间过程表明,在苹果酸代谢的同时,AOX 活性在早期增加了 2 到 3 倍。苹果酸在中午消失后,AOX 活性恢复到夜间观察到的低水平(Web 图 12.3. E)。一个合理的结论是液泡中的大量苹果酸通过线粒体中的苹果酸酶被氧化。这会在基质中产生 NADH,其在很大程度上通过 AOX 被氧化。释放的 CO 2然后可以通过叶绿体中的卡尔文循环重新固定。
Web 图 12.3.E在昼夜循环中 AOX 参与Kalanchoe diagremontiana中的苹果酸氧化。(A) 叶盘中 AOX 通路的通量变化。(B) 叶盘苹果酸浓度的变化。图底部的实心条代表黑暗时期。(来自 Robinson 等人,1992 年。)
WEB TOPIC 12.4 F o F 1 -ATP 合成酶:世界上最小的旋转马达
林肯塔伊兹,加利福尼亚大学,圣克鲁斯,加利福尼亚,美国
F o F 1 -ATP 合酶(也称为 F-ATP 酶)存在于线粒体、叶绿体和细菌的内膜中。正如教科书第 7 章所讨论的,这些大型的多亚基酶由水溶性催化复合物 (F 1 ) 组成,该复合物附着在一个完整的膜蛋白复合物 (F o ) 上,该复合物可跨膜运输质子(参见教科书图 7.30)。F 1复合体由至少五种不同类型的亚基(三种α、三种β、一种γ、一种δ和一种ε)组成。当 F 1复合物从膜上解离时,它作为 ATP 酶具有活性。事实上,在适当的条件下,完整的 F o F 1-ATP合酶可以反向运行并充当质子泵,利用ATP水解的能量将H +移动穿过膜。
我们对如何合成 ATP 的理解是由加利福尼亚大学洛杉矶分校的 Paul Boyer 提出的,他提出了 F-ATP 酶催化的结合变化机制(网络图 12.4.A)(Boyer 1997)。从对 ATPases 功能的详细了解,他提出 ATP 合成的结合变化机制包含三个重要组成部分:
Web 图 12.4.A从 F 1复合体顶部看到的绑定更改机制。存在三种不同构象的三个催化位点:松散、开放和紧密。(为清楚起见,只显示了三个 β 亚基。)底物(ADP + P i)最初与开放位点结合,并在紧密位点转化为 ATP。在步骤 1 中,γ 亚基的旋转引起构象变化,从而导致位点形成发生变化。结果,ATP从酶中释放出来。在步骤 2 中,底物再次与开放位点结合,另一个 ATP 在紧密位点合成。(根据 Duncan 等人,1995 年。)
1.需要能量的主要步骤不是从 ADP 和 Pi 合成 ATP ,而是从酶中释放 ATP。
2.底物结合,产物在三个独立但相互作用的催化位点释放,对应于三个催化亚基(β亚基)。每个催化位点可以以三种构象之一存在:紧密、松散或开放。
3.结合变化通过 γ 亚基的旋转与质子传输耦合。也就是说,质子通过 F o复合物沿着其电化学梯度向下流动导致 γ 亚基旋转。
然后 γ 亚基的旋转会导致催化复合物的构象变化,从而使 ATP 从酶中释放出来,并推动反应向前发展。当酶充当 ATP 驱动的质子泵时,情况正好相反。
结合变化模型的前两个预测得到了许多证据的支持,主要是动力学研究,现在被普遍接受。然而,将质子流耦合到 ATP 合成的旋转机制的预测更难以证明。两项重大突破也证实了第三个预测。
第一个突破是由英国剑桥的 John Walker 实验室确定了牛线粒体 ATP 酶的 F 1部分的晶体结构(Abrahams 等人,1994 年)。晶体结构表明,三个催化 β 亚基在构象和与其结合的核苷酸方面存在差异,与结合变化机制一致。
更令人兴奋的是发现γ亚基像轴一样插入催化复合物的中心,催化复合物由三个α亚基和三个β亚基交替排列成环形结构。此外,γ亚基与α和β亚基之间的界面是高度疏水的。界面的疏水性使亚基之间的相互作用最小化,这与 γ 亚基在催化复合物形成的孔内的旋转一致。换句话说,γ亚基看起来像一个由疏水界面润滑的分子轴承。
虽然通过阐明 F 1 -ATP 合酶的晶体结构回答了许多问题,但旋转模型不能通过酶的静态“快照”来测试。旋转的明确演示需要实时记录酶旋转的视频。但是,尽管它们对于蛋白质来说很大,但 F 1 -ATP 合酶仍然太小而无法在光学显微镜下观察到。
为了使酶的旋转可视化,东京工业大学的 Masasuke Yoshida 和他的同事想出了一种巧妙的方法,使酶比实际大得多(Noji 等人,1997 年)。如网络图 12.4.B所示,他们使用另一种蛋白质作为“胶水”,将用荧光染料标记的肌动蛋白丝连接到 γ 亚基的基部。然后他们附上了 F 1复杂的倒置到玻璃表面。如果 γ 亚基相对于催化复合物旋转,肌动蛋白丝应该随之摆动。由于与 ATP 合酶(约 1 μm)相比,灯丝非常长,因此在荧光显微镜下应该可以看到其旋转。换句话说,荧光标记的肌动蛋白丝大到可以在光学显微镜下观察到,它报告了 γ 亚基的旋转。
Web 图 12.4.B 一种可视化 γ 亚基旋转的方法。荧光标记的肌动蛋白丝连接到 γ 亚基的一个突出端。然后将 F 1复合物倒置到盖玻片上。当将 ATP 添加到盖玻片中时,肌动蛋白丝旋转。(在 Noji 等人 1997 之后。)
结果是惊人的!当将 ATP 添加到修饰酶中时,在荧光显微镜下可以看到肌动蛋白丝以每秒 4 转的速度绕一圈摆动(在Web 图 12.4.C中,旋转速率仅为 0.5 rps)。有关旋转 ATPase 的视频,请访问以下网站:http ://docencia.izt.uam.mx/docencia/alva/atpaseyoshida.htm. 打个比方,如果你是一个 γ 亚单位,这个旋转速度相当于在水中以每秒 4 转的速度在你的头上摆动一根几百米长的杆!然而,测量的速度无疑是低估了体内的实际速度,因为摆动如此大的质量需要巨大的扭矩。对 γ 亚基旋转运动的演示使得构建 ATP 合酶如何工作的模型成为可能(网络图 12.4.D)。由于他们对阐明 ATP 合成机制的贡献,Paul Boyer 和 John Walker 分享了 1997 年诺贝尔生理学或医学奖的一半。另一半前往 Jens Skou,因为他在 K + ,Na +方面的开创性工作-ATP 合酶,植物质膜 H + -ATP 合酶的哺乳动物对应物(参见教科书第 6 章)。
Web 图 12.4.C 在荧光显微镜下观察到的连接到 γ 亚基的旋转肌动蛋白丝的连续图像。图像之间的间隔为 133 ms,旋转速率为 0.5 rps(来自 Noji 等人,1997,由 S. Noji 提供。)
Web 图 12.4.D F o F 1 -ATPase 模型,显示催化复合物通过 β 亚基和 δ 亚基附着在膜上。当反应反向进行时(ATP 合成),质子通过 F o复合物沿着其电化学梯度扩散。质子通过通道的运动驱动整个 F o复合物在膜内的旋转。γ 亚基,它附着在 F o复合物,然后在催化复合物中转变,导致 ATP 合成所需的构象变化。假设催化复合物本身不旋转,而是锚定在膜上。δ亚基位于β亚基的外侧,作为β亚基的附着位点,将催化复合物锚定在膜上并阻止其旋转。在机械方面,F 1复合物及其膜锚充当固定外壳或“定子”,而 γ 亚基(可能还有 F o复合物)充当“转子”。(来自 Junge 等人,1997 年。)
WEB TOPIC 12.5 运输进出植物线粒体
Allan G. Rasmusson,瑞典隆德大学;Ian M. Møller,丹麦奥胡斯大学
植物线粒体必须与细胞质交换代谢物和信息(信号转导)。举一些中心例子,在必须发生大交换率的情况下,糖酵解的最终产物(丙酮酸和苹果酸)需要从胞质溶胶中吸收,几个柠檬酸循环中间体需要输出以用作构建块生物合成过程,光呼吸甘氨酸、丝氨酸、NH 4 +和CO 2需要交换。同样,ADP 和 P i必须吸收并输出 ATP 以供线粒体发挥其作为细胞动力源的作用。除了主要的运输过程外,植物线粒体还必须以较低的速率交换其他几种代谢物和辅酶。为了进行大量分子的运输,植物线粒体拥有一个线粒体载体蛋白家族。这些是具有共同一般结构的跨膜蛋白,它们通常运输相对较小的带电分子,例如代谢物(Picault 等人,2004 年)。在拟南芥中,线粒体载体蛋白家族有近 60 个成员(Palmieri, F. et al. 2011)。其中大多数没有功能特征,但数字仍然表明线粒体运输过程的复杂性。然而,
外膜可渗透小于 10 kDa 的分子(即所有非聚合化合物)。渗透性源于孔隙的存在,在大多数体外实验中,孔隙似乎是开放的。对动物的研究已经表征了线粒体外膜中的成孔蛋白,称为孔蛋白,它似乎可以调节跨膜的运输。植物线粒体也有孔蛋白,但它们的特征有待进一步研究。在我们的讨论中,我们将重点关注线粒体内膜的线粒体转运调节,这是线粒体的代谢边界。我们将首先考虑可以在没有特定载体蛋白帮助的情况下穿过内膜的相对较少的分子。然后,我们将讨论各种代谢物转运蛋白,最后,
小分子、中性分子和疏水分子在内膜上扩散
无论大小如何,带电或非常亲水的分子只能在特定蛋白质载体(通道或转运蛋白;参见教科书第 6 章)的帮助下穿过脂质双层。
小的中性分子可以扩散穿过脂质双层,不需要蛋白质转运蛋白。其中有O 2和CO 2,它们是呼吸作用的两个重要分子。在内膜的内表面上需要O 2 ,其中细胞色素c氧化酶和替代氧化酶的活性位点都位于该处。在柠檬酸循环中作为最终产物产生的 CO 2 (参见教科书图 12.6)需要从线粒体中扩散出来,最终丢失到周围环境中或重新固定在叶绿体中。然而,此外,CO 2也有可能作为碳酸氢盐(HCO 3– )。线粒体具有渗透活性并在低渗介质中膨胀。这意味着内膜对 H 2 O 也是可渗透的,但 H 2 O 很可能通过水通道/水通道蛋白移动。还有迹象表明,水通道蛋白可以将过氧化氢 (H 2 O 2 ) 转运穿过线粒体内膜(Calamita 等人 2005,Bienert 等人 2007)。
出于技术原因,重要的是几种众所周知的线粒体功能抑制剂可以扩散到线粒体中。它们这样做是因为它们不带电且疏水。这些抑制剂包括鱼藤酮,复合物 I的特异性抑制剂,抗霉素,复合物 III 的特异性抑制剂,HCN,复合物 IV 的质子化形式氰化物 (CN- )抑制剂(和其他含血红素的酶)和寡霉素,一种F o F 1 -ATP 合酶(复合物 V)的特异性抑制剂(参见教科书图 12.8)。
化学解偶联剂对于研究膜生物能非常有价值,因为它们具有共轭双键的结构允许它们以质子化形式和非质子化形式扩散穿过膜,从而消散电化学质子梯度。一个典型的例子是 FCCP(三氟甲氧基羰基氰化苯腙),一种非常有效的线粒体解偶联剂,如网络图 12.5.A 所示(Nicholls and Ferguson 2013)。
网页图 12.5.A解偶联剂(也称为质子载体)的作用机制。(A) FCCP(三氟甲氧基羰基氰苯腙)的质子化/去质子化,它是一种弱酸。(B) 在跨膜存在电化学质子梯度的情况下,FCCP 将被质子化,从而在膜的正侧获得一个质子,以中性形式穿过膜,并在负侧失去质子. 这是由电化学质子梯度驱动的。在阴性形式中,FCCP 将被膜电位驱回跨膜。最终结果是一个质子从膜的正极移动到负极,这导致电化学质子梯度的消散,以及一个电荷从膜的负侧向正侧的移动,这导致了电梯度的消散。阴影区域表示共轭双键系统(π-轨道系统)。(改编自 Nicholls 和 Ferguson 1992。)
无机离子的传输
无机磷酸盐 (H 2 PO 4 – ) 被吸收到基质中以交换羟基离子 (HO – )。吸收的能量由质子梯度 (ΔpH) 提供。我们将在下面看到磷酸盐梯度反过来推动其他代谢物的运输。
其他几种无机离子——Mg 2+、Ca 2+、K +和NH 4 + ——参与线粒体代谢,但它们通过植物线粒体内膜的机制尚不清楚。然而,NH 4 +也可以通过水通道蛋白以NH 3的形式运输。在哺乳动物线粒体中,通过 K +特异性通道摄取 K +并通过 K + /H +逆向转运蛋白排出,参与基质体积调节和细胞信号传导(Garlid 和 Paucek 2003)。K +的类似系统运输存在于植物线粒体中(Pastore 等人 1999;Chiandussi 等人 2002)。
正如 Web WEB TOPIC 12.3 中简要讨论的,哺乳动物和植物线粒体都含有解偶联蛋白 (UCP)。这种蛋白质促进质子穿过内膜的运动,因此部分地解耦电子传递并降低呼吸的 ATP 产量。
腺苷酸的运输
线粒体的重要功能之一是为细胞提供ATP。为此,线粒体具有腺嘌呤核苷酸转运蛋白,可促进 ADP 3-(向内)与 ATP 4-(向外)的交换(网络图 12.5.B)。这种交换是由膜电位(内部负)驱动的,因为一个负电荷会向外净移动。结合磷酸盐载体反应,这意味着一种 ADP 和一种磷酸盐的摄取和一种 ATP 的输出(即与线粒体 ATP 合成相关的转运事件)需要一个矢量质子——腺苷酸交换的电成分和磷酸盐吸收的 ΔpH 分量。
Web 图 12.5.B植物线粒体内膜中的转运蛋白。所有这些转运蛋白都由质子梯度的电和/或化学部分直接或间接驱动。无机磷酸盐 (P i ) 的吸收是由 ΔpH(羟基阴离子向相反方向移动)和产生的 P i驱动的梯度用于驱动二羧酸盐转运蛋白对二羧酸盐阴离子(苹果酸和琥珀酸)的吸收。反过来,二羧酸盐可以交换 2-酮戊二酸(也称为 α-酮戊二酸)或柠檬酸。在后一种情况下,柠檬酸盐在其一个酸基上被质子化以保持传输电中性。谷氨酸(输入)与天冬氨酸(输出)的交换在面包酵母中是产电的;这意味着它必须由电化学质子梯度驱动,因为电中性谷氨酸(谷氨酸2– + 2 H +)是针对带负电荷的天冬氨酸运输的(Cavero 等人,2003 年)。后一种转运蛋白对于苹果酸/天冬氨酸穿梭的运行很重要(参见Web 图 12.5.C)。类似地,电中性苹果酸/草酰乙酸交换参与苹果酸/草酰乙酸穿梭。(修改自 Siedow 和 Day 2000。)
柠檬酸循环中间体和相关化合物的转运
糖酵解的最终产物丙酮酸和苹果酸在内膜中都有转运蛋白(参见网络图 12.5.B)。丙酮酸–被用来交换羟基离子 (OH – ) (Divakaruni and Murphy 2012),苹果酸2–被用来交换 HPO 4 2–。
苹果酸2-的转运蛋白也转运琥珀酸2-,因此被称为二羧酸转运蛋白。苹果酸2-或琥珀酸2-可以反过来在三羧酸转运蛋白上交换柠檬酸2-。苹果酸2-也可以通过特殊的转运蛋白交换 2-酮戊二酸2- 。一个有趣的转运蛋白,草酰乙酸转运蛋白,将草酰乙酸2-交换为苹果酸2-(或柠檬酸2-),这允许减少当量的穿梭(见下文)。这些转运蛋白的联合活动使植物线粒体能够影响大多数柠檬酸循环中间体的净进口或出口(Laloi 1999, Palmieri, F. et al. 2011)。最后,谷氨酸/天冬氨酸转运蛋白促进谷氨酸的摄取。在酵母线粒体中,谷氨酸与一个质子一起被吸收,以换取带有两个负电荷的天冬氨酸,对应于一个 H +的净传输. 因此,它由电和化学质子梯度驱动。植物线粒体中存在类似的转运蛋白,但尚未显示质子协同转运,因此该转运在植物中可能是被动的。最近,已经确定了几种额外的代谢物转运蛋白(Picault et al. 2004, Palmieri, F. et al. 2011),并且转运蛋白的某些设置很可能仅在特殊发育条件下表达,例如储存养分的动员在培育幼苗时。
在一些情况下,线粒体参与细胞代谢意味着某些代谢物被吸收穿过内膜,但尚未描述载体。在光呼吸过程中,C 3叶中甘氨酸大量流入 - 以及 CO 2、丝氨酸和 NH 4 +流出 - 线粒体就是这种情况(参见教科书第 8 章)。脯氨酸也是如此,它在植物水分胁迫期间在细胞质中积累到高浓度(参见教科书,第 24 章),然后在再水化阶段通过涉及两种线粒体酶的途径降解(Yoshiba 等人. 1997).
辅酶的运输
辅酶(或在人类营养中被称为维生素)要么在线粒体内合成,要么进口(另见 Web Essay 12.8)。NAD + (Palmieri, L. et al. 2008a) 和硫胺素焦磷酸盐 (Frelin et al. 2012) 的载体已在植物线粒体中发现,它们很可能还含有辅酶 A 载体 (Palmieri, F. et al. 2011) )。
抗坏血酸生物合成的最后一步最近显示在线粒体内膜的外表面上。鉴于越来越多的证据表明抗坏血酸在去除线粒体内的 ROS 方面具有重要作用(参见 Web 论文 12.7),我们预计会在线粒体内膜中找到抗坏血酸转运蛋白。
叶酸(参与 1C 转移)的情况与抗坏血酸相反:植物细胞中许多叶酸代谢物的唯一合成位点是线粒体基质。因此,可以预期在内膜中有一种载体,专门用于将叶酸从植物线粒体中转运出来,尽管这种载体尚未被发现(Blancquaert 等人,2010 年,Palmieri,F. 等人,2011 年)(参见也是网络论文 12.8)。
还原当量传递——代谢穿梭
哺乳动物线粒体不能直接氧化胞质 NADH 或 NADPH,因此它们利用“穿梭机制”。内膜转运蛋白通过这些穿梭交换代谢物,使还原的化合物进入基质,以换取更多氧化的化合物进入细胞质。通过这种方式,还原当量被转运到基质中,最终被呼吸链氧化。穿梭车也可用于在相反方向运输还原当量。
虽然分离的植物线粒体可以通过两种外部 NAD(P)H 脱氢酶直接氧化添加的 NADH 和 NADPH(参见 Web WEB TOPIC 12.3),但它们也可以使用代谢穿梭(Web 图 12.5.C)。苹果酸/草酰乙酸穿梭在细胞质和基质中使用苹果酸脱氢酶来催化苹果酸(还原)和草酰乙酸(氧化)的相互转化。这两种化合物通过草酰乙酸转运蛋白进行交换(Oliver 和 McIntosh 1995,Palmieri,L.等人,2008b)。然而,这种交换不是由跨内膜的电化学质子梯度驱动的,因此它只能将还原当量从相对还原的隔室移动到相对氧化的隔室。由于就 NADH/NAD 比率而言,线粒体基质比胞质溶胶还原得多,草酰乙酸转运蛋白可能主要用于还原当量的输出(Krömer 和 Heldt 1991;Wigge 等人 1993)。
Web 图 12.5.C 代谢物穿梭于线粒体内膜。显示的两个穿梭机都已被证明可以在分离的线粒体中工作。(顶部) 苹果酸/天冬氨酸穿梭使用两种酶的同工型,苹果酸脱氢酶 (1) 和天冬氨酸氨基转移酶 (2),将苹果酸和天冬氨酸相互转化,然后使用两种转运蛋白进行交换,谷氨酸/天冬氨酸 (A) 和2-酮戊二酸(α-酮戊二酸)(B)。产电谷氨酸/天冬氨酸转运蛋白提供方向性,以便还原当量转移到线粒体基质中(参见网络图 12.5.B)。(底部) 苹果酸/草酰乙酸 (OAA) 穿梭在基质和胞质溶胶中使用苹果酸脱氢酶异构体 (1) 来相互转化苹果酸和 OAA,然后由 OAA 转运蛋白 (C) 进行交换。根据膜两侧的氧化还原条件,这种穿梭理论上可以在任一方向上转移还原当量。然而,在植物细胞中,它可能仅用于输出还原当量。(修改自 Siedow 和 Day 2000。)
在光呼吸条件下,大量甘氨酸在线粒体中被氧化产生 NADH,同时,过氧化物酶体需要 NADH 将羟基丙酮酸还原为甘油酸(见教科书第 8 章)。据认为,多达 50% 的基质 NADH 被输出,可能通过苹果酸/草酰乙酸穿梭(Krömer 1995)。
更复杂的苹果酸/天冬氨酸穿梭(参见网络图 12.5.C)涉及两种基质酶和两种胞质酶,以及两种内膜转运蛋白。因为天冬氨酸(两个负电荷)与谷氨酸加 1 个 H +(一个负电荷)交换,这种交换是生电的,它通过使用电化学质子梯度输出天冬氨酸为苹果酸/天冬氨酸穿梭提供动力,从而有助于进口酵母线粒体中的还原当量(Cavero et al. 2003)。这是否也发生在植物线粒体中尚不清楚。
蛋白质的运输——蛋白质输入
植物线粒体含有它们自己的 DNA (mtDNA) 和核糖体,并且能够合成 mtDNA 中编码的蛋白质(参见 Web WEB TOPIC 12.6)。然而,植物 mtDNA 仅编码线粒体中发现的少数蛋白质。绝大多数线粒体蛋白由核基因编码,必须从胞质溶胶中导入,然后在游离核糖体上合成。这些蛋白质是在 N 末端用前序列或靶向肽合成的,它被线粒体外膜上的受体识别 (Carrie et al. 2013)。
基质蛋白的导入需要包含两个多亚基蛋白复合物的精密机械——这些复合物位于外膜(TOM,外膜转运蛋白)和内膜(TIM,内膜转运蛋白)中。在将蛋白质导入正确的线粒体隔室的同时或之后,靶向肽通常被切割以产生成熟和活性的蛋白质(Millar 等,2006)。大多数用于其他隔室的蛋白质,例如膜间空间,要么仅通过这条路线的第一部分输入,要么一直输入到基质中,然后再次穿过内膜输出(Carrie et al. 2013)。
tRNA 的运输
哺乳动物 mtDNA 编码线粒体蛋白质合成所需的完整 tRNA。相比之下,植物 mtDNA 仅编码线粒体内蛋白质合成所需的一些 tRNA(Dietrich 等,1996)。缺失的 tRNA 通过涉及 TOM 复合物和外膜电压依赖性阴离子通道的机制输入(Salinas 等人,2008 年)。
WEB TOPIC 12.6 植物线粒体的遗传系统有几个特点
Allan G. Rasmusson,瑞典隆德大学;Ian M. Møller,丹麦奥胡斯大学
线粒体和质体中的遗传系统在结构和功能上都不同于核基因组及其基因表达。相反,线粒体和质体与细菌有几个共同的遗传特征。例如,几个基因一起转录,核糖体属于原核类型。这与线粒体作为变形菌门 α 亚类的内共生体的进化起源一致,变形菌门包括细胞内病原体立克次体 prowazekii (Gray et al. 1999)。
植物线粒体基因组及其表达
植物与其他真核生物的线粒体 DNA (mtDNA) 及其表达明显不同。例如,植物中的 mtDNA 非常大,并且物种之间的大小差异很大(Backert 等,1997)。植物中的线粒体基因组通常被描述为一个环状分子(网络图 12.6.A)。然而,在来自不同来源的线粒体中,经常观察到结构不同的 DNA 分子的混合。这些包括“主”单元和分支结构的线性重复,其功能、细胞分裂时的分布和遗传尚未完全了解(Bendich 2007;Kubo 和 Newton 2008)。几个重复的存在使基因组能够重组,改变基因顺序,甚至导致分裂成更小的亚基因组分子,每个分子都携带一个基因子集。Web 图 12.6.A中给出了如何发生这种情况的示例。尽管不同植物的 mtDNA 大小不同,但所有植物的基因数量似乎都相似。在拟南芥的 367 千碱基对 (kb) mtDNA 中(Unseld et al. 1997; Marienfeld et al. 1999),已知基因(构成 65 kb)分散在非编码序列的背景中。在其他植物物种的测序 mtDNA 中也可以发现类似的情况,例如甜菜(Kubo 等,2000)。植物mtDNA与哺乳动物的小得多(16 kb)的单个mtDNA分子有很大不同,哺乳动物的每个碱基对都具有编码蛋白质或控制转录和复制的功能,既不存在内含子,也不存在重复。
Web 图 12.6.A拟南芥mtDNA 中的重组。mtDNA 包含一个直接重复 (I) 和一个反向重复 (II)。两个重复的重组将改变基因顺序和/或将基因组分裂成两个独立的分子。(根据 Unseld 等人,1997 年。)
植物中线粒体基因的表达是由 RNA 聚合酶进行的,它与核 RNA 聚合酶不同,但与噬菌体中的酶有关。对于几个线粒体基因,这些噬菌体型聚合酶从多个启动子开始转录(Kühn 等人,2005)。植物mtDNA中的许多基因被内含子分解成外显子。在初级 RNA 加工成成熟 mRNA 的过程中,内含子被去除,该成熟 mRNA 可以被翻译成正确的多肽(网络图 12.6.B)。线粒体中的内含子属于所谓的自剪接II型组,其中剪接由内含子结构定义。拼接也可以反式工作模式——连接来自不同 RNA 分子的片段——从而组装来自不同初级转录本外显子的蛋白质编码阅读框。这允许基因的单个外显子独立存在于基因组中,即使在不同的亚基因组 DNA 分子中也是如此。由于线粒体基因通常与不相关的基因共同转录成多顺反子初级转录物,因此 RNA 加工还包括核酸内切反应,因此每个成熟的 mRNA 只编码一种蛋白质(参见Web 图 12.6.B)。线粒体 mRNA 可以多腺苷酸化,就像核编码蛋白质的 mRNA 一样。然而,线粒体 mRNA 的多聚腺苷酸化介导降解,而不是稳定 mRNA,这是来自核基因的 mRNA 的情况。线粒体 mRNA 末端由茎环和 RNA 结合蛋白指定和稳定(Gagliardi 和 Leaver 1999;Kuhn 等人 2001;Hauler 等人 2013)。
Web 图 12.6.B线粒体基因表达。拟南芥中的线粒体nad2基因编码呼吸复合物 I 的 NAD2 亚基。该图显示了将该基因表达为产生正确多肽的 mRNA 所需的 RNA 加工步骤。外显子a和b与核糖体蛋白 (rps4) 的基因共同转录,因此内切核酸酶必须切割 RNA。图中省略了rps4 RNA的命运。nad2外显子必须通过顺式和反式从两个单独的初级转录物连接起来拼接。在该基因中,在 RNA 水平上对序列的编辑仅在外显子中改变了 31 个碱基(由绿点表示)。为清楚起见,此处将不同的 RNA 成熟过程描述为连续事件,而在体内它们似乎以无序或同时发生。(在 Lippok 等人 1996 和 Unseld 等人 1997 之后。)
在植物线粒体中,发生了额外的 RNA 加工事件——RNA 编辑(Covello 和 Gray 1989;Gualberto 等人 1989;Hiesel 等人 1989)。在这个过程中,某些胞苷(C)被脱氨基成尿苷(U)。很少,U 被氨基化为 C。这意味着编码序列在 RNA 水平上发生了变化,从而恢复了用于翻译 DNA 序列已经发散的功能蛋白质的正确信息。编辑位点主要出现在 DNA 指定蛋白质序列和功能性 RNA 中,在 mtDNA 的其他位置很少见。原则上,单个碱基的重要性越大,它构成编辑位点的可能性就越高。线粒体 RNA 编辑已在陆地植物中发现,但在藻类中未发现。它也发生在质体中,尽管程度较轻(Marchfelder 等人,1998 年)。尽管有相当多的碱基可以编辑(高达基因碱基的 15%),但这一过程的功能相关性以及随之而来的 mtDNA 序列差异尚不清楚。据推测,从 C 到 U 的编辑可能导致 DNA 对紫外线辐射的敏感性降低,陆生植物比藻类更容易受到紫外线辐射的影响,但证据不足——相反,RNA 编辑可能是随机发生的功能变化一旦确立,就成为生存所必需的(Binder 和 Brennicke 2002;Fujii 和 Small 2011)。
在许多情况下,植物中的细胞器 RNA 加工已被证明涉及一类特殊的核编码蛋白,即五肽重复 (PPR) 蛋白(Schmitz-Linneweber 和 Small 2008,Fujii 和 Small 2011)。其中一些蛋白质通过与含有特定序列基序的 RNA 结合,作为编辑和剪接的特异性因子。植物 mtDNA 中的编辑位点有多种类型,预计需要许多不同的 PPR 蛋白。与此一致,与含有少量 PPR 基因 (<30) 的藻类、动物、真菌和原生生物相比,种子植物含有大约 500 个 PPR 基因!这使得 PPR 蛋白成为植物中的主要基因家族之一。
线粒体基因在进化过程中被转移到核基因组
线粒体基因组只编码一小部分线粒体蛋白质;与多达数千个核编码的线粒体蛋白相比,少于 40 个(Emanuelsson 等,2000)。通过进化,基因已从线粒体或其变形菌祖细胞转移到细胞核。这是一个仍在发生的过程,至少在植物中是这样。例如,细胞色素氧化酶的亚基 2 由所有研究的真核生物的线粒体基因组编码,除了一些豆科植物和原生生物。在豆科植物家族中,已经发现了几种基因转移的中间体。例如,功能基因可以在线粒体基因组中找到,而在核基因组中未表达,反之亦然(Adams 等,1999)。为了将线粒体基因成功转移到细胞核,网络图 12.6.C )。例如:(1) 核转录启动子必须插入基因的开头,(2) mRNA 应获得指定核添加 poly-A 尾的信号序列,以及 (3) 靶向序列是必要的将细胞溶质合成的蛋白质导入线粒体。为了正常发挥作用,还必须将调节不同细胞类型和不同条件下表达的元件引入启动子中。
Web 图 12.6.C将基因从线粒体转移到细胞核。如果发生几个罕见的事件,线粒体基因可以在功能上转移。线粒体 mRNA 必须进行逆转录,并将产生的 DNA 整合到核染色体中。然后必须将用于表达基因和将蛋白质引导至线粒体的 DNA 元件与其组装。如果发生这种情况,线粒体基因拷贝可以被删除而不会失去功能。
因为植物中大多数线粒体基因的编码序列是在 RNA 水平上编辑的,所以如果插入细胞核,线粒体基因组序列将不会编码功能性蛋白质。因此,整合到核基因组中的 DNA 在大多数情况下必须通过线粒体 mRNA 的逆转录产生。在对拟南芥的核基因组进行测序后, 大多数 mtDNA 的副本被发现整合到核染色体中 (Lin et al. 1999), 这表明大段 DNA 可以在细胞区室之间移动。然而,这些转移到核基因组的线粒体基因不能产生功能性蛋白质,除非对应于编辑位点的碱基被突变纠正。在其他突变进一步破坏序列之前,这极不可能发生。与其他真核线粒体不同,植物线粒体利用通用遗传密码。因此,预计该因素不会像在其他真核生物中那样阻止或延迟植物细胞器之间的基因转移。
线粒体功能在花粉发育过程中至关重要
与植物线粒体基因组直接相关的生理特征是一种称为细胞质雄性不育或cms的现象。表现出细胞质雄性不育的植物系不会形成有活力的花粉——因此称为雄性不育。细胞质一词是指这种特征以非孟德尔方式传播的事实。cms基因型总是与线粒体基因组一起母系遗传。由于稳定的雄性不育系可以促进杂交种种的产生,cms是植物育种中的一个重要性状。为此,cms许多物种都发现了在整个植物生命周期中不产生重大影响的性状,除了雄性不育。
相对于野生型植物,携带cms性状的植物在其 mtDNA 中具有明显的重排。这些重排产生了新的翻译阅读框,并与各种系统中的cms表型密切相关。核恢复基因可以克服 mtDNA 重排的影响,恢复cms基因型植物的生育力。如果种子是收获的产品,那么这种恢复基因对于cms的商业利用是必不可少的。
使用cms基因的一个有趣结果发生在 1960 年代后期,当时美国种植的 85% 的杂交饲料玉米来自称为cms -T (Texas)的cms玉米系 ( Zea mays ) . 在cms -T 玉米中,mtDNA 重排产生独特的 13 kDa 蛋白质,URF13 (Levings and Siedow 1992)。URF13 蛋白如何发挥作用导致雄性不育尚不清楚。在 1960 年代后期,出现了一种由真菌Bipolaris maydis(也称为Cochliobolus heterostrophus)。这种特定的种族合成了一种化合物(HmT-毒素),该化合物与 URF13 蛋白特异性相互作用,在线粒体内膜中产生孔,导致选择性通透性丧失。
HmT-毒素和URF13之间的相互作用使Bipolaris maydis race T成为cms -T玉米的特别毒力病原体,并导致美国玉米种植区流行,称为南方玉米叶枯病。由于这种流行病,cms -T 在杂交玉米生产中的使用已停止。替代的抗毒素cms性状现在正在使用中,但一些杂交玉米的生产仍然通过机械去雄来防止自花授粉。
与其他器官相比,每个细胞的线粒体数量和呼吸蛋白的表达在花药发育过程中非常高,花粉发育的能量需求过程发生在此处(Huang et al. 1994)。除了上述特定的cms性状外,雄性不育也是缺乏氧化磷酸化复合物亚基的突变植物的常见表型(Rhoads 和 Subbaiah 2007)。由于存在替代的非磷酸化呼吸途径,此类突变体可能是可行的,但通常在营养生长中表现出功能缺陷。
WEB TOPIC 12.7 呼吸作用会降低作物产量吗?
James N. Siedow,美国北卡罗来纳州杜克大学;Ian M. Møller,丹麦奥胡斯大学;Allan G. Rasmusson,瑞典隆德大学
植物呼吸在光合作用过程中每天可以消耗大量固定的碳,超过光呼吸造成的损失。植物呼吸代谢的变化会在多大程度上影响作物产量?
试图在呼吸能量代谢和细胞中发生的各种过程之间建立定量关系导致呼吸分为两个部分(Lambers 1985)。在生长呼吸中,还原的碳化合物被代谢,为添加新的生物质提供能量。需要另一个组件,维持呼吸,以使现有的成熟细胞保持活力状态。维持呼吸对能量的利用包括蛋白质和 RNA 周转作为主要成分,估计表明它可以代表总呼吸通量的 50% 以上。
有几个关于植物呼吸速率和作物产量之间关系的经验例子。在草料作物多年生黑麦草 ( Lolium perenne ) 中,产量增加 10% 至 20% 与叶片呼吸速率降低 20% 相关(Wilson 和 Jones 1982)。其他植物也发现了类似的相关性,包括玉米 ( Zea mays ) 和高羊茅 ( Festuca arundinacea)(兰伯斯 1985 年)。然而,后来的研究表明,“在多年生禾本科植物中选择低速率的成熟叶呼吸并不是选择高产品种的合适方法”(Kraus 和 Lambers 2001)。最近,基因型比较表明植物生长与呼吸代谢物水平、氧化还原载体水平和呼吸频率的差异之间存在很强的关联(Meyer 等人,2007;De Block 和 Van Lijsebettens 2011)。
尽管通过降低呼吸速率有可能提高作物产量,但在植物生理学家、遗传学家和分子生物学家以系统的方式在商业上利用这些变化之前,需要更好地了解控制植物呼吸的位点和机制。卢米斯和安托尔 1999)。此外,关于此类观察的一般适用性以及呼吸较慢的品系可能处于不利地位的条件还有很多需要了解,从而导致作物产量减少而不是增加。同样重要的是农业生产通常受到非生物和生物植物胁迫的强烈限制。所以,
最近的研究表明,目前难以预测分子水平上的定向变化对植物生产力的影响:
Nunes-Nesi 等人。(2005b) 发现,与野生型相比,线粒体苹果酸脱氢酶活性降低的转基因番茄植株的生产力有所提高。虽然从转基因植物中分离的线粒体的呼吸活性与野生型相比没有变化或更高,但转基因植物的叶片呼吸速率降低。转基因品系的光合作用显着增加,可能与抗坏血酸水平的增加有关。
西格等人。(2005) 研究了替代氧化酶对烟草细胞培养物生长的影响。考虑到替代氧化酶的能量浪费性质(参见 Web WEB TOPIC 12.3),人们可能会认为缺少这种酶的细胞系会比野生型生长得更快。因为替代氧化酶在植物对氧化应激的反应中起作用(参见 Web WEB TOPIC 12.3 和 Web 论文 12.7),缺乏替代氧化酶的细胞系预计也不能很好地处理非生物胁迫。结果令人惊讶——替代氧化酶表达非常低的转基因细胞系在正常、营养充足的条件下生长速度与野生型细胞一样快,而在常量营养素限制条件下(低磷酸盐或低氮)。
吉罗等人。(2008 年)研究了拟南芥中组合应力的影响。缺乏胁迫诱导的替代氧化酶异构体AOX 1a的突变体在中等光照下干旱处理后没有表现出表型。然而,在干旱和中等强光条件(很容易设想在自然界或田间发生)的组合下,突变植物明显受到压力并表现出活性氧水平升高的症状。由于线粒体不是施加压力的主要目标,这项研究还显示了多种细胞过程如何共同使植物能够抵抗外部压力。
植物呼吸涉及相互作用途径的复杂代谢网络以及基因表达和酶活性的复杂调节。在预测改变单个基因的表达对植物生产力的影响之前,我们显然需要更多地了解这些相互作用。此外,从整体碳代谢(包括光合代谢和异养代谢)来看,提高产量的生物技术尝试取得的进展相对较小。这部分是新陈代谢复杂性的结果,干扰会导致意想不到的副作用。然而,现在可以使用全局分析方法详细跟踪遗传变化对碳代谢的影响,
未来的另一个重要问题是开发能够很好地适应较高大气二氧化碳浓度及其相关气候影响(高温、干旱等)的最佳功能的植物。预测大气变化(二氧化碳和温度)对呼吸的影响尤其困难。这使得未来植物生长的预测模型的呼吸成分以及植物对未来大气的影响不太确定(Leakey et al. 2009; Smith and Dukes 2013)。
WEB TOPIC 12.8 膜的脂质成分影响植物的细胞生物学和生理学
John Browse,华盛顿州立大学
脂质突变体的表征和通过分子遗传手段对脂质组成的实验性修饰现已揭示了关于膜脂质在植物细胞生物学和生理学中的作用的一些广泛概括(另见 Web WEB TOPIC 26.3)。然而,观察到的表型的生化和物理基础仍然不确定。已显示脂肪酸组成的变化会改变叶绿体的大小和结构。消除多不饱和脂肪酸的突变会阻止光合作用并阻止植物自养生长(McConn 和 Browse 1998)。
令人惊讶的是,这种突变植物可以在蔗糖上生长,这表明光合作用是唯一绝对需要多不饱和膜的植物功能。然而,如教科书第 13 章所述,多不饱和脂肪酸也需要作为信号化合物的前体,这些化合物是花粉发育和植物防御等多种功能所必需的,例如茉莉酸(Howe et al. 1996; McConn and Browse 1998 ; Vijayan 等人,1998 年)。
膜生物学中研究最广泛的问题之一是脂质组成与生物体适应温度变化的能力之间的关系(Wolter et al. 1992)。例如,对寒冷敏感的植物在 0 到 12°C 的温度下会出现生长速度和发育急剧下降的情况。寒冷敏感植物因暴露于低温而引起的生理和生理变化,以及随后表现出的应激症状,被称为冷害(见教科书第 26 章)。
许多经济上重要的作物,如棉花、大豆、玉米、水稻和许多热带和亚热带水果,都被归类为对寒冷敏感。相比之下,大多数温带植物能够在寒冷的温度下生长和发育,并被归类为耐寒植物。
在试图将与冷害相关的生化和生理变化与单个“触发”或损伤部位联系起来时,有人提出冷害的主要事件是从液晶相到凝胶相的转变。细胞膜。根据该提议,从液晶相到凝胶相的转变将导致冷冻细胞代谢的改变,并导致对寒冷敏感的植物的损伤和死亡。脂肪酸的不饱和程度将决定发生这种损害的温度。已经对叶绿体膜提出了类似的假设,其中二饱和磷脂酰甘油(不含顺式的分子)的水平脂肪酸链中的双键)将决定植物物种的低温敏感性(Murata et al. 1992)。
然而,最近的研究表明,膜不饱和度与植物温度反应的关系比这些早期假设中所暗示的更为微妙和复杂。一方面,对五种不同拟南芥的研究突变体已经证明,降低不饱和度可以使植物在 22°C 下生长良好,但在 2 到 5°C 下生长时不如野生型植物强健。即使大多数突变体中的脂质变化不足以引起脂质相变,也观察到了这些结果。此外,这些突变体对低温的反应似乎与经典的低温敏感性截然不同,这表明正常的低温损伤可能与膜脂的不饱和水平无关(Hugly 和 Somerville 1992;Miquel 等人 1993)。
在一个特定的突变体fab1中,饱和形式的磷脂酰甘油占总叶磷脂酰甘油的 43%——比在许多对寒冷敏感的植物中发现的百分比更高。然而,突变体完全没有受到一系列低温处理的影响(与野生型对照相比),这些低温处理迅速导致黄瓜和其他对寒冷敏感的植物死亡(Wu and Browse 1995)。
在烟草中进行了一系列补充实验,烟草是一种对寒冷敏感的植物。烟草中外源基因的转基因表达已被专门用于降低饱和磷脂酰甘油的水平或导致膜不饱和度的普遍增加(Murata 等人 1992;Kodama 等人 1994;Ishizaki-Nishizawa 等人 1996) . 在每种情况下,冷却造成的损害都在一定程度上得到缓解。这些新发现清楚地表明,膜不饱和程度或特定脂质(例如二饱和磷脂酰甘油)的存在会影响植物对低温的反应。然而,膜脂成分并不是植物冷害敏感性的主要决定因素。
WEB TOPIC 12.9 子叶油藏的利用
John Browse,华盛顿州立大学
尽管三酰基甘油的动员途径在蓖麻中得到了最好的表征,但在其他油籽的储存组织中似乎是相似的。然而,并非所有种子都能将脂肪定量地转化为糖。在蓖麻中,当脂肪和蛋白质储备被充分利用后,胚乳会退化。在许多油料种子中,例如向日葵 ( Helianthus annuus )、棉花 ( Gossipium hirsutum ) 和南瓜科成员 (Cucurbitaceae),在食物储备用完后,子叶变成绿色并进行光合作用。
在这些组织中,只有部分储存的脂质转化为输出的碳水化合物。大部分源自脂质的碳保留在子叶中,在那里它有助于叶绿体和其他细胞结构的合成。乙酰辅酶 A 也直接用于通过呼吸产生能量。随着绿化过程的发生,这些细胞的过氧化物酶体群发生了转变:一些过氧化物酶体具有较少的乙醛糖体特征,而更多的是叶型过氧化物酶体。随着组织从异养代谢模式转变为更自养的代谢模式,这种转变与对储存脂质分解的需求减少和对光呼吸产物代谢的需求增加相一致。
WEB TOPIC 13.1 根结节的发展
豆科植物和根瘤菌之间的共生关系的建立涉及宿主和共生体中基因的激活(Geurts 和 Bisseling 2002)以及精细的信号交换(参见教科书第 13 章)。根瘤的形成是来自植物宿主的特殊器官,其中包含共生的固氮根瘤菌(参见教科书图 13.9),它涉及两个同时发生的过程:感染和根瘤器官发生。网络图 13.1.A显示了根结节开始和发展的不同阶段。教科书图 13.12 显示了感染过程的详细描述。
网页图 13.1.A 大豆根瘤的起始和发展阶段。(A) 与结节形成有关的事件: (1) 根部排泄物质;(2)这些物质吸引根瘤菌并刺激它们产生细胞分裂因子;(3)根皮层细胞分裂形成初级结节分生组织。(B) 感染和结节形成阶段: (4) 细菌附着在根毛上;(5) 靠近木质部的周轮中的细胞被刺激分裂;(6)感染线形成并随着初级结节分生组织和周环继续分裂而向内延伸;(7) 两个分裂细胞团融合成一个团块,同时感染线继续生长;(8) 结节伸长并分化,包括与根柱的血管连接。类杆菌被释放到中心的细胞中。
最近对两种紫花苜蓿和共生体Rhisobium meliloti的早期感染阶段和结节发育的研究表明,在感染过程的早期,在结节原基形成的周轮和内皮层中发生了微管的广泛重组(Timmers et al. 2019)。 1999)。通过免疫定位、荧光和激光共聚焦显微镜观察微管组织的变化(Web 图 13.1.B)。
网页图 13.1.B (A) 根部的横切面,显示面向 protoxylem 极(星号)的 pericycle 细胞(箭头)的激活。(B) 纵向截面。在 pericycle 活化细胞(箭头)中可以看到细胞分裂(箭头)。(C) 横截面上激活部位的详细信息。在面向 protoxylem 极(星号)的 pericycle 细胞(箭头)中可以看到微管细胞骨架的强标记。箭头指向细胞分裂。荧光强度由从低(蓝色)到高(红色)的颜色表示。(D) 未感染控制细胞的横切面。请注意周轮(星号)上的荧光水平非常低(报告微管)。在 AD 中,星号表示未活化的周细胞,黑色箭头表示活化的内皮细胞。A、B 和 D 中的条形图 = 25 μm,C 中的条形图 = 10 μm。(E和F)在根的横切面上,面对活化的周轮细胞(箭头)的内皮层细胞(箭头)的激活。星号表示 protoxylem 极,e:内皮,c:根皮层。(G 和 H)纵根切片显示皮质细胞激活过程中微管细胞骨架组织的变化。注意 (G) 所示的未感染根中皮质微管的组织,在 (H) 所示的感染根中不再明显。微管围绕 (H) 中所示的活化细胞中的细胞核 (箭头)。(I) 皮质细胞横切面显示微管细胞骨架,微管阵列 (绿色) 从细胞核 (红色) 辐射。随机组织的皮质微管细胞骨架网络显示在 (J) Bar = 10 μm 中。(K) 根纵向截面中的初始原基。用箭头表示的细胞分裂。星号表示激活的 pericycle。(来自 Timmers 等人,1999 年。)
这些发现表明,在感染后,周环首先被激活,然后是内皮层的激活,在那里结节原基形成。这些变化之后是外部组织中微管细胞骨架网络的重大重组,与根毛激活和卷曲、感染前线的形成以及感染网络的启动和生长有关。
WEB TOPIC 13.2 固氮测量
除N 2外,固氮酶还可以还原其他底物,如氰化物、叠氮化物和乙炔。N 2固定(还原)的直接测量需要质谱仪,这种仪器不容易获得,但乙炔还原为乙烯可以很容易地通过气相色谱法测量(Dilworth 1966)。乙炔还原涉及两个电子,C 2 H 2 + 2e – + 2 H + → C 2 H 4 ,与还原 N 2和 2 H +所需的八个电子相反:
因此,四个乙烯分子的还原对应于一个N 2分子的还原。然而,乙炔法有局限性:乙炔会阻止气体扩散到结核中,而根际微生物会产生乙烯。由于这些原因,乙炔法适用于比较研究(Dennison 等人,1992),而质谱法用于直接测量 N 2还原,这是精确量化固氮所必需的。
WEB TOPIC 13.3 蛋氨酸的合成
蛋氨酸由半胱氨酸合成
蛋氨酸和半胱氨酸是蛋白质中发现的两种含硫氨基酸。甲硫氨酸在质体中由半胱氨酸合成。在该途径的第一步,半胱氨酸和 O-磷酸高丝氨酸通过酶胱硫醚-γ-合酶反应形成胱硫醚(网络图 13.3.A)。胱硫醚被胱硫醚-β-裂解酶裂解成同型半胱氨酸、丙酮酸和氨。最后,蛋氨酸合酶甲基化同型半胱氨酸形成蛋氨酸(Lea 1997)。
Web 图 13.3.A 产生另一种含硫氨基酸蛋氨酸的半胱氨酸修饰。完整的路径参见教科书图 13.15。
WEB TOPIC 13.4 加氧酶
在氧固定中,分子氧在被称为加氧酶 的酶进行的反应中直接添加到有机化合物中。回想一下第 8 章的内容,在光呼吸过程中,氧直接结合到有机化合物中,反应涉及 1,5-二磷酸核酮糖羧化酶加氧酶 (rubisco) 的加氧酶活性,该酶是 CO 2固定酶 (Ogren 1984)。第一种含有来自分子氧的氧的稳定产品是 2-磷酸乙醇酸盐。
通常,加氧酶根据在催化反应中转移到碳化合物上的氧原子数分为双加氧酶或单加氧酶。在双加氧酶反应中,两个氧原子都被结合到一个或两个碳化合物中(Web 图 13.4.A,顶部和中间)。植物细胞中双加氧酶的例子是脂加氧酶,它催化两个氧原子与不饱和脂肪酸的加成(参见网络图 13.4.A,上图)和脯氨酰羟化酶,这种酶将脯氨酸转化为不太常见的氨基酸羟脯氨酸(参见Web 图 13.4.A,中间)。
羟脯氨酸是细胞壁蛋白延伸蛋白的重要组成部分(见教科书第 14 章)。从脯氨酸合成羟脯氨酸与合成所有其他氨基酸的不同之处在于该反应发生在脯氨酸掺入蛋白质之后,因此它是翻译后修饰反应。脯氨酰羟化酶定位于内质网,表明大多数含有羟脯氨酸的蛋白质存在于分泌途径中。
单加氧酶将分子氧中的一个原子添加到碳化合物中;另一个氧原子转化为水。单加氧酶有时被称为混合功能氧化酶,因为它们能够同时催化氧化反应和氧化酶反应(将氧气还原为水)。根据以下等式,单加氧酶反应还需要还原底物(NADH 或 NADPH)作为电子供体:
A + O 2 + BH 2 → AO + H 2 O + B
其中A代表有机化合物,B代表电子供体。
植物中一种重要的单加氧酶是统称为细胞色素 P450 的血红素蛋白家族,它催化肉桂酸羟基化为对香豆酸(参见Web 图 13.4.A,底部)。在单加氧酶中,氧首先通过与血红素基团的铁原子结合而被激活;NADPH 用作电子供体。混合功能氧化酶系统位于内质网,能够氧化多种底物,包括单萜和二萜以及脂肪酸。
Web 图 13.4.A 高等植物细胞中两种加氧酶反应的例子,双加氧酶(A 和 B)和单加氧酶(C)。
WEB TOPIC 14.1 多糖化学术语
多糖以其所含的主要糖类命名。例如,葡聚糖是由葡萄糖组成的聚合物;木聚糖是由木糖组成的聚合物;半乳聚糖是由半乳糖组成的聚合物。
对于支链多糖,多糖的主链通常由名称的最后一部分给出。因此,木葡聚糖具有葡聚糖主链(葡萄糖残基的直链),在侧链中木糖附着在其上;阿拉伯木聚糖具有带有阿拉伯糖侧链的木聚糖骨架(由木糖亚基组成)。然而,化合物名称并不一定意味着分支结构。例如,“葡甘露聚糖”是其主链中同时含有葡萄糖和甘露糖的聚合物的名称。因为糖可能呈现多种形式并且可能以多种方式连接,所以糖的命名并不简单,在此简要总结一下。
单糖(单糖残基)是具有经验式 (CH 2 O) n的多羟基醛或酮。它们通常包含一个不对称碳,因此它们可以作为两种立体异构体存在,称为 D 或 L 对映异构体(Web 图 14.1.A)。
Web 图 14.1.A D-和 L-葡萄糖以线性形式显示。碳以醛 (CHO) (C = O) 基团从末端开始编号。
单糖通常形成环状结构,而不是线性结构,因为羰基氧可以与羟基反应,通常形成五元环(呋喃糖环)或六元环(吡喃糖环)。这些环有一个新的手性中心,可以采用两种形式,称为 α 或 β端基异构体。因此,β-D-吡喃葡萄糖是 β 构型的六元环形式的 D-葡萄糖(Web 图 14.1.B)。在溶液中,单糖自由变旋(在 α 或 β 端基异构体之间转换);当在聚合物中连接时,异头构型是稳定的。
Web 图 14.1.B 葡萄糖可以形成 α 或 β 构型的五元环或六元环。五元环(呋喃糖;结构 1 和 2)不稳定,占总数的不到 1%。六元环(吡喃糖)大多为β构型(占总数的64%);其余 (36%) 以 α 形式存在。
多糖中的糖通过O-糖苷键连接在一起。我们通过指定由糖苷键连接的碳原子来指示连接模式。例如,在纤维素中,碳原子 1 与相邻葡萄糖残基中的碳原子 4 相连。因此,纤维素被称为(1→4)β-D-葡聚糖,因为它是一串通过碳 1 和 4 连接的 β-D-葡萄糖分子(Web 图 14.1.C)。它也可以称为(1→4)-连接的β-D-吡喃葡萄糖的聚合物。
Web 图 14.1.C 1→4-连接的 β-D-吡喃葡萄糖的直链,显示了碳的编号系统和糖苷键的构型。这是构成纤维素的葡聚糖。糖环通过氧原子(糖苷氧)连接。由于糖苷键的构型,这种聚合物中的重复单元是纤维二糖,一种二糖。
Web 图 14.1.D 重复的纤维二糖单元,葡萄糖残基以构象(“椅子”)形式绘制。这种绘制葡萄糖环的方式比在 Haworth 项目中更能代表单个原子的实际位置(如图 14.1.C 所示)。请注意,环状结构中的碳原子未显示在Web 图 14.1.C和Web 图 14.1.D 中;它们由环顶点表示。
WEB TOPIC 14.2 细胞壁的基质成分
Web 图 14.2. 电子显微照片显示了高尔基体和含有木葡聚糖(大箭头)和糖基化蛋白质(小箭头)的囊泡。这部分取自悬吊悬液培养的悬铃木细胞,用与胶体金颗粒偶联的两种抗体进行标记(大颗粒附着在抗木葡聚糖抗体上;小颗粒附着在检测糖基化蛋白质的抗体上)。
WEB TOPIC 14.3 细胞壁的机械性能:与Nitella的研究
典型植物细胞的小尺寸(20 到 100 µm)一直是细胞壁力学性能研究的严重障碍。为了测量来自高等植物的分离细胞壁的延伸性,研究人员必须将整个冷冻和解冻的器官或组织放入引伸计中,如教科书图 14.18 和 14.19 所示。虽然这样的测量可以给出定性的答案,但测量的延伸不能以定量的方式与活细胞的生长相关,因为施加的应力是单轴的(单向的),而由于膨胀压力引起的体内应力是多轴的(多向的)。
淡水绿藻Nitella和Chara的巨大节间细胞在离子传输、水渗透性和细胞质流的经典研究中占有重要地位(Hope 和 Walker 1975)。这些藻类的特征是直立的、分枝的同核细胞(多核)细丝,分化为节和节间,每个节都有专门的横向节间(Web 图 14.3.A)。
Web 图 14.3.A 腋下 Nitella的 细丝,包含几个节间和带有分支的侧节间。(来自 Taiz 等人,1981 年。)
节间细胞开始时是一个 20 毫米长的缩短圆盘,成熟时会伸长形成一个长约 6 厘米、宽 0.5 毫米的细长圆柱体。细胞通过在主要纵向方向上的扩散生长而膨胀。由于单个节间细胞很大,因此可以隔离它们的细胞壁并测量壁的机械性能。甚至可以通过使用多轴应力来模拟体内膨胀压力来研究单个细胞壁的各向异性(不相等)机械性能。
Web 图 14.3.B显示了用于研究Nitella节间细胞的多轴延伸性的实验装置。空的细胞壁圆柱体粘在移液管上,并在压力下用汞充气。液态汞是不溶的,因此在这些条件下是惰性的。为了响应由加压汞引起的多轴应力,细胞壁圆柱体膨胀,研究人员可以通过水平显微镜观察过程来监测长度和宽度的膨胀(Web 图 14.3.C)(Metraux 等人 1980 )。
Web 图 14.3.B 用于测量Nitella细胞壁多轴延伸性的设备。压力源是压缩空气罐。空气通过高压管进入压力计,然后从那里进入一个充满汞的移液器,该移液器粘在Nitella细胞壁圆筒的开口端。活节间保持在远端。墙壁浸入带有玻璃窗的灌注室中。用水平定向显微镜测量附着在墙壁表面的树脂珠的位移。插图显示了通过移动显微镜看到的带有标记珠的汞膨胀细胞壁圆柱体的视图。(照片来自 L. Taiz。)
Web 图 14.3.C 来自体外多轴细胞扩增实验的数据,显示长度和直径的膨胀以初始值的百分比表示。(在 Taiz 等人 1981 之后。)
通过对Nitella节间的多轴应力程序,可以使用微管抑制剂来改变纤维素微原纤维的方向,并检验微原纤维方向是造成细胞壁机械各向异性的原因的假设。如Web 图 14.3.C所示,控制单元的多轴延伸是高度各向异性的。不仅长度延伸是直径延伸的四倍,而且大部分长度延伸是不可逆的,而直径延伸几乎是完全可逆的。
这些结果与细胞的各向异性生长模式一致。Web 图 14.3.C还显示了用微管毒物N-苯基氨基甲酸异丙酯 (IPC)预处理细胞的效果,IPC 与秋水仙碱一样,会诱导细胞壁中纤维素微纤维的随机沉积。结果是壁的长度和直径的延伸大致相等,与该抑制剂诱导的各向同性生长模式一致。
Nitella也已被证明可用于研究体内细胞壁特性。应用于当代细胞扩增的生物物理控制研究的许多概念都来自斯坦福大学的 Paul Green 及其同事对活Nitella细胞的开创性实验(Green 1968)。从这些研究中得出的一个重要见解是,细胞壁的内部 25% 决定了细胞扩张的极性。
利用纤维素微纤维是结晶的这一事实,因此在用偏振光观察时会表现出双折射(双折射),加利福尼亚太平洋大学的 Paul Richmond 设计了一种光学技术来测量细胞膨胀的长度和直径以及方向细胞壁中的纤维素微纤维,同时 (Richmond 1983)。这种技术可以确定微纤维角与细胞扩张方向之间的关系。
如Web 图 14.3.D所示,在将秋水仙碱添加到生长培养基中后,微纤维角几乎立即开始从横向变为随机。然而,生长的各向异性直到大约 8 小时后才发生变化。在细胞表面积相对增加约 25% 后,从各向异性生长到各向同性生长的转变就完成了。
Web 图 14.3.D 秋水仙碱添加和去除对幼年Nitella的纤维素微纤维角和各向异性生长的影响节间。对秋水仙碱处理的生长反应是直径生长速率的增加和长度生长速率的降低。长度和直径绘制在对数刻度上;曲线的斜率表示相对增长率(见教科书第 16 章)。在零时加入秋水仙碱,并在 24 小时后除去。请注意,纤维素微纤维的平均角度在加入秋水仙碱后几乎立即开始变得不那么横向且更加随机,并且在去除秋水仙碱后立即开始变得更加横向。然而,生长各向异性直到加入秋水仙碱后 8 小时才发生变化,并且在去除秋水仙碱后大约需要 8 小时才能恢复。(在 Taiz 等人 1981 之后。)
由于在此期间由于持续的壁合成,壁厚保持不变,我们可以推断当细胞壁的内部 25% 被替换时,细胞膨胀的方向性发生了变化。因此,单元壁的内部 25% 似乎代表了壁的承重部分。暗示,外部的 75% 因拉伸而变得太弱,无法限制细胞扩张。
WEB TOPIC 16.1 Mougeotia : 扭曲的叶绿体
Mougeotia是一种丝状绿藻,其细胞含有单个带状叶绿体,位于两个大液泡之间并被一层细胞质包围(网络图 16.1.A)。叶绿体可以围绕其长轴旋转(Web 图 16.1.B ),并且可以通过垂直于光的方向来响应光。垂直方向称为“面位置”。
网络图 16.1.A (来自 Haupt 1982 和 Krami 1994。)
网络图 16.1.B (来自 Haupt 1982 和 Krami 1994。)
光敏色素与 Mougeotia叶绿体旋转反应有关,因为该系统对红光最敏感,而且远红光可以逆转红光效应。使用红光和远红光微光束,Wolfgang Haupt 和他在德国的同事表明,在Mougeotia中,光敏色素位于质膜附近的细胞质外围附近。当在显微镜下将一束红光照射到细胞表面时,即使叶绿体本身没有被照亮,与该微束相邻的叶绿体边缘也会旋转 90°。
平面偏振光实验
通过使用平面偏振光探测细胞内单个光敏色素分子的方向。每个光敏色素分子对于平面偏振光的吸收都有一个优选的方向。当这种光平行于颜料的吸收表面时,会出现最大的吸收。如果我们把颜料想象成一根棒,把偏振光想象成一个狭缝,当光缝平行于颜料的长轴时,比任何其他方向都会吸收更多的光(Web 图 16.1.C) .
网络图 16.1.C (来自 Haupt 1982 和 Krami 1994。)
Haupt 和他的同事发现,平面偏振红光引起叶绿体旋转的能力取决于相对于细胞长轴的偏振平面。这种现象在Web 图 16.1.D所示的实验中有所描述。用垂直于细胞轴振动的偏振红光 (R) 在整个表面上照射细胞的一半;另一半被平行于细胞轴 振动的光照亮。
网络图 16.1.D (来自 Haupt 1982 和 Krami 1994。)
叶绿体仅响应垂直方向振动的红光而从轮廓旋转到面部位置,从而在叶绿体中产生扭曲。在这些实验的基础上,得出结论,光敏色素分子具有确定的方向(Haupt 1982)。
两个额外的实验表明,在从 Pr 到 Pfr 的转换过程中,光敏色素的方向发生了变化(Kraml 1994)。在第一个实验中,如Web 图 16.1.E的左侧所示,细胞质层被一束平面偏振红光照射,该微束与细胞的长轴平行(上光处理)或垂直(下光处理)振动。轴。与网络图 16.1.D中显示的结果明显矛盾的是,叶绿体仅在红光平行于细胞长轴振动时旋转。
网络图 16.1.E (来自 Haupt 1982 和 Krami 1994。)
明显的矛盾是由于电池的圆柱形。因此,靠近两个边缘的光敏色素分子将相对于中心的光敏色素分子定向 90°。Web 图 16.1.E实验中偏振微束对准细胞边缘时吸收红光的光敏色素分子将与Web全细胞辐照实验中吸收光的光敏色素分子成 90° 取向图 16.1.D。
在第二个实验中,如图 16.1.E右侧所示,细胞右侧的细胞质层被一束平行于细胞长轴 振动的偏振红光微束照射。
在前面实验的基础上,我们可以预测出平行于细胞长轴振动的红光会引起叶绿体旋转。然而,红光处理后紧接着是一束远红光。对一半细胞(顶部)进行第二次远红光照射,该远红光垂直于细胞轴振动;对细胞的另一半(底部)进行第二次远红光照射,该远红光平行于细胞轴振动。如Web右侧图16.1.E,只有当远红光垂直于细胞轴振动时,远红光才能阻止红光诱导的叶绿体旋转。这一结果的解释是,光敏色素在 Pr 光转换为 Pfr 时会发生 90° 的方向变化,反之亦然(Web 图 16.1.F)。
网页图 16.1.F (来自 Haupt 1982 和 Krami 1994。)
叶绿体旋转模型
最后, Mougeotia 叶绿体旋转的机制是什么?已经描述的效果最好通过一个模型来解释,其中光敏色素位于Mougeotia的质膜上或位于膜下方直接形成圆柱形支架的微管上。很难想象 Pr 和 Pfr 如何在不与膜或微管圆柱体关联的情况下保持它们各自的方向。
编码Mougeotia光敏色素的核苷酸序列与其他已知光敏色素一致,表明光敏色素不是完整的膜蛋白,因为它缺乏疏水性跨膜结构域。另一方面,羧基末端的氨基酸序列与结合微管的蛋白质相似(Winands 和 Wagner 1996)。因此,证据表明光敏色素与质膜相邻的细胞骨架结合。
在旋转过程中,叶绿体从 Pfr 的局部区域移向 Pr 区域(参见Web 图 16.1.B)。由于光敏色素 Pfr 的活性形式的梯度, Mougeotia叶绿体响应单侧光而移动,其在细胞圆柱体周围形成交替的色素图案,如图 16.1.B所示。Pfr 的梯度迅速转化为肌动蛋白-肌球蛋白微丝相互作用的梯度,从而产生叶绿体旋转的动力(Wagner 1996)。
Pfr 作用的主要机制仍然不清楚。已知来自内部储存的钙离子和钙激活的钙调蛋白通过与微管支架相互作用参与反应,但光敏色素和钙之间的确切关系尚不清楚。使用抑制微管和微丝作用的药物的研究不支持微管在叶绿体运动机制中的作用。然而,细胞松弛素 B 的实验确实表明涉及微丝。
WEB TOPIC 16.2 光敏色素和高辐照度反应
HIR,例如对茎或下胚轴生长的抑制,通常在深色生长的黄化幼苗中进行研究。抑制暗生莴苣幼苗下胚轴伸长的 HIR 作用谱如图 16.2.A所示。. 请注意,活动的主峰位于光谱的远红色而不是红色区域,并且在蓝色和 UV-A 区域也有峰。由于植物色素介导的反应中没有红色峰是不寻常的,起初研究人员认为可能涉及另一种色素。1960 年代后期,德国弗莱堡的 Karl M. Hartmann 提出了一个模型来解释明显的差异。从 R. Emerson 和同事发现的光合作用增强效应(参见教科书第 7 章)中得到线索,Hartmann 推测 HIR 可能是 Pr 和 Pfr 形式的光敏色素相互作用的结果。
为了探究这种相互作用,Hartmann 同时用两种波长的光照射植物,使用两种在 HIR 中对生菜下胚轴抑制无效的波长:658 nm 和 768 nm(Web 图 16.2.A)。尽管在生理上不活跃,但这两个波长仍然是光化学的积极推动光敏色素转化,每一个都在相反的方向。通过仔细改变每个波长的辐照度,Hartmann 能够诱导植物中 Pfr 与总光敏色素的比率范围从接近零到更高的值。他能够证明,用于抑制莴苣下胚轴生长的 Pfr 与总光敏色素的最佳比例约为 0.03。值得注意的是,这正是植物受到 720 nm 的单一波长(HIR 的远红峰)照射时产生的比率。
Web 图 16.2 .抑制暗生莴苣幼苗下胚轴伸长的 HIR 作用谱。抑制下胚轴伸长的活性峰值出现在光谱的 UV-A、蓝色和远红色区域。(哈特曼 1967 年之后。) (点击图片放大。)
WEB TOPIC 16.3 光敏色素对离子通量的影响
光敏色素可以迅速改变膜的特性。我们已经看到,在黑暗时期之前需要低能量的红光来诱导夜间快速关闭小叶,并且 K +和 Cl -流入和流出伸肌和屈肌细胞介导了反应。然而,在黑暗中叶片闭合的速度(滞后时间约 5 分钟)似乎排除了基于基因表达的机制。相反,似乎涉及光敏色素诱导的膜通透性和转运的快速变化。
通过使用质子敏感的液体膜电极研究了质子膜质子泵在Samanea pulvini(叶柄底部的结构,包括伸肌和屈肌细胞)中的作用(Lee and Satter 1988, 1989)。在光敏色素介导的小叶关闭期间,屈肌细胞(在小叶关闭期间膨胀的细胞)的质外 pH 值降低,而伸肌细胞(在小叶关闭期间收缩的细胞)的质外 pH 值增加。因此,屈肌细胞的质膜 H +泵似乎被黑暗激活(假设光敏色素处于 Pfr 形式),而伸肌细胞的 H +泵似乎在相同条件下失活。
屈肌细胞质膜上增加的 H +泵活性应该增加膜电位,从而允许更多的 K +进入细胞(见教科书第 6 章)。相反,伸肌细胞中质膜H +泵活性的降低会促进K +离子的损失。与该模型一致,在小叶开放期间观察到非质体 pH 变化的相反模式。
还对 K + 通道 的光敏色素调节进行了研究。由于很难研究完整的枕叶中的膜通道,康涅狄格大学的 Richard Crain 和他的同事从Samanea叶子中分离出伸肌和屈肌细胞的原生质体(没有细胞壁的细胞)(Kim 等,1993)。他们通过测量当细胞外 K +浓度从 20 提高到 200 m M时发生的膜电位变化,间接确定了 K +通道的打开或关闭状态。当细胞外 K +浓度升高时,K +只有当 K +通道打开时,才能进入原生质体并使膜电位去极化。当伸肌和屈肌原生质体转移到持续黑暗中时,K + 通道的状态在 21 小时的潜伏期内表现出昼夜节律性,并且两种细胞类型相互变化,就像它们在体内一样。也就是说,当伸肌 K +通道打开时,屈肌 K +通道关闭,反之亦然。因此,叶片运动的昼夜节律起源于 K +通道开放的昼夜节律。
为了测试光敏色素对 K +通道的影响,研究人员首先用白光处理原生质体,然后将它们暴露在单独的红光或红光和远红光的短暂脉冲中,并将它们转移到持续的黑暗中。红光导致屈肌原生质体的K +通道打开,远红光逆转了红光的作用。伸肌原生质体被两种处理封闭。与红光相比,蓝光导致伸肌的 K +通道打开,而屈肌的 K + 通道关闭。因此,光敏色素似乎专门调节 K +屈肌细胞的通道。蓝光主要调节伸肌细胞,尽管它也可以在一天中的特定时间影响屈肌(Kim et al. 1993)。
根据迄今为止的证据,我们可以得出结论,光敏色素通过调节初级质子泵和/或屈肌和伸肌细胞的 K +通道的活动而导致小叶闭合。虽然效果很快,但它不是瞬时的,因此不太可能是由于光敏色素对膜的直接影响。相反,光敏色素通过一种或多种信号转导途径间接发挥作用,如光敏色素调节基因表达的情况。
然而,红光和远红光对膜电位的一些影响是如此迅速,以至于光敏色素也可能直接与膜相互作用。已经在单个细胞中测量了这种快速调制,并且已经从红光和远红光对根和燕麦 ( Avena ) 胚芽鞘表面电位的影响推断出。Pfr 的产生和可测量的潜在变化开始之间的延迟因生物体而异;例如,巨藻Nitella的去极化(内部相对于质膜外部的负性变小)约为 1.7 s,而Avena的超极化约为 4.5 s 。
细胞生物电势的变化意味着穿过质膜的离子通量的变化。Haupt的Mougeotia微束辐照实验(参见 Web WEB TOPIC 16.1)似乎支持光敏色素位于质膜上的观点,并且在 1970 年代进行的膜分离研究提供了证据,证明总光敏色素的一小部分与各种细胞器膜。
这些发现使一些研究人员提出膜结合光敏色素代表生理活性部分,光敏色素对基因表达的所有影响都是由膜通透性的变化引起的。然而,在序列分析的基础上,现在很清楚光敏色素是一种没有跨膜结构域的亲水性蛋白质。目前的观点是,Mougeotia 中的光敏色素与位于质膜正下方的微管有关。
如果光敏色素从一定距离对膜产生影响,无论多小,都将暗示“第二信使”的参与。例如,细胞溶质游离钙的快速变化被认为是几种信号转导途径中的第二信使,并且有证据表明钙在Mougeotia的叶绿体旋转中起作用(参见 Web WEB TOPIC 16.1)。然而,最近,钙作为光敏色素作用的第二信使的作用受到质疑,因此也可能涉及钙非依赖性机制。
WEB TOPIC 17.1 胚胎休眠
胚胎成熟需要特定的基因表达
拟南芥胚胎在产生大约 20,000 个细胞后进入休眠状态。休眠是由水分的流失和基因转录和蛋白质合成的普遍关闭引起的——不仅在胚胎中,而且在整个种子中。为了使细胞适应休眠的特殊条件,需要特定的基因表达。例如,A bscisic A cid Insensitive 3 ( ABI3 ) 和FUSCA3基因是启动休眠所必需的,并且对激素脱落酸敏感,脱落酸是启动种子和胚胎休眠的信号分子。ABI3还控制编码在胚胎发育成熟阶段沉积在子叶中的储存蛋白的基因的表达(参见教科书第 23 章)。LE AFY C OTYLEDON 1 ( LEC1 )基因在胚胎发育晚期也很活跃。因为lec1突变体不能在干燥中存活并且不会进入休眠状态,所以胚胎会死亡,除非它们在干燥发生之前通过隔离被救出。获救的胚胎将在培养中萌发并产生可育植物,这些植物与野生型植物一样,只是它们缺乏7S储存蛋白,并且它们的上表面有叶状子叶和毛状体。成熟lec1的正常外观和发育突变体表明LEC1基因仅在胚胎发生过程中是必需的。尽管lec1突变体最明显的缺陷仅在成熟期胚胎中可见,但在 整个胚胎发生过程中都可以检测到来自LEC1基因表达的 mRNA。有人提出,LEC1是营养发育的一般抑制因子,其表达在整个胚胎发生过程中是必需的(Lotan 等人 1998)。
WEB TOPIC 17.2 水稻胚胎发生
水稻展示了一种独特的胚胎发生模式,这是许多单子叶植物的典型特征(网络图 17.2.A)。与许多植物一样,水稻中与胚胎发生相关的分裂模式比拟南芥中的多变。然而,可以根据五个形态学定义的发育阶段来描述水稻的胚胎发生(Itoh et al. 2005):
1.合子阶段。 这个单细胞阶段是在单倍体卵子和精子融合之后。
2.球状阶段。 这个阶段发生在 2-4 DAP(授粉后的几天)。在初始水平分裂产生顶端细胞和基底细胞之后,一系列可变细胞分裂产生多层球状胚胎(参见网络图 17.2.A,A 部分)。
3.胚芽鞘阶段。在 5 DAP,胚芽鞘(特化的管状第一叶)、芽顶端分生组织、根顶端分生组织和胚根(胚根)形成(参见网页图 17.2.A,B 部分)。
4.幼年植物生长阶段。 在 6-10 DAP,枝条顶端分生组织开始形成几片营养叶(参见网络图 17.2.A,C 部分)。
5.成熟阶段。 在 11-20 DAP 期间,成熟相关基因的表达先于休眠开始(参见网络图 17.2.A,D 部分)。
Web 图 17.2.A 水稻(禾本科 [Poaceae] 家族中的一种单子叶植物)胚胎发育说明了球状阶段 (A)、胚芽鞘阶段 (B)、幼胚阶段 (C) 和成熟胚阶段 (D)。盾片是一种经过修饰的子叶,专门用于吸收发芽过程中胚乳释放的糖分。(由 Y. Nagato 提供。)
WEB TOPIC 17.3 墨角藻受精卵的极性
植物细胞感知它们在组织中的位置并呈现出适合该组织的极性。此外,细胞可以感知来自其环境的信息并对其采取行动,以改变其极性并在必要时重新定向生长。必须建立细胞极性以定向随后的扩展。最初是非极性的细胞,例如受精卵、孢子和花粉粒,后来变得极化并开始尖端生长,并且在分析极性的诱导和建立方面特别有价值。
各种各样的外部梯度,包括温度、光强度、pH、离子和电势梯度,可以极化和定向这些细胞的生长轴。因此,可以在没有与多细胞组织相关的复杂性的情况下通过实验操纵极性。我们对尖端生长细胞中极性建立的大部分理解来自对褐藻墨角藻受精卵中根状茎出现的研究。
Fucus Zygote 的极性最初不稳定,但后来固定
与高等植物不同,甚至与大多数其他藻类不同,某些褐藻,特别是墨角藻和Pelvetia ,会将它们的卵子和精子排入大海,在那里受精。受精卵最初没有细胞壁并且完全无极性。然而,极轴是在受精后的几个小时内建立起来的,以响应单侧光。轴最初并不稳定,只需改变光的方向即可多次改变。
极轴在受精后 10 到 14 小时内固定,之后它不会因光线方向的变化而改变,并且将成为假根的结构开始从变暗的一侧突出。
尽管合子仍然是一个单细胞,但它是两极分化的,具有两个结构不同的极,即叶状体极和根茎极,它们的命运完全不同。第一次合子分裂是不对称的,并且与极轴成直角。它建立了两个细胞,每个细胞都有它出现的极点的身份。较小的假根细胞产生细胞丝和将植物附着在岩石上的固着物。较大的菌体细胞分裂产生球状细胞团,从中形成植物的主体,菌体(Quatrano 和 Shaw 1997)。
钙通道再分布导致跨细胞电流
一种称为荧光二氢吡啶 (FL-DHP) 的染料可与哺乳动物细胞中的钙通道结合并干扰钙的摄取,已被用作检测墨角藻合子细胞膜极化的探针。在受精后的最初 6 到 8 小时内,响应单侧光照,FL-DHP 受体(可能是钙通道)重新分布并定位于墨角藻受精卵的阴暗面,这将成为根状茎极。如果光的方向改变,FL-DHP 结合蛋白的位置也会改变,再次集中在受精卵的暗面(Shaw 和 Quatrano 1996)。
受精卵暴露于单侧光后极性建立的最早事件之一是感应正电流,该电流流入阴影侧的细胞并通过外部介质循环返回(Web 图 17.3.A)。这种跨细胞电流主要由钙离子引起,约为 100 pA(1 皮安 = 10 –12安培),并在任何极性形态标志之前发展。
Web 图 17.3.A 对褐藻墨角藻受精卵中极性建立所涉及的事件的总结。(A) 受精卵被来自环境的不对称刺激极化,例如单侧光。(B) 电流流过(带电的钙离子移动)在假根将出现的位置处的极化但仍为球形的受精卵,由细胞阴影一半的 Ca 2+摄取驱动,假根将从中出现。电流(Ca 2+) 从对面流出。(C) 当肌动蛋白微丝在假根出现的部位组装并且细胞壁组装在受精卵周围时,细胞极性变得固定。细胞壁完全包围合子,但其组成在根状茎和菌体两半不同。含有硫酸化多糖的囊泡通过肌动蛋白丝转运至质膜,并仅在假根出现的部位沉积在细胞壁中。(D) 最后,受精卵分裂,根状细胞在其尖端生长。
这种现象与细胞极性建立的相关性表明,正电荷流入细胞的位置也是随后的根状茎生长的位置。在高等植物的一些尖端生长细胞中也观察到跨细胞离子电流,包括根毛和发芽的花粉粒,但尚未在通过扩散生长扩展的植物细胞中检测到跨细胞离子电流(Jaffe 和 Nuccitelli 1977)。
极化墨角藻受精卵中的离子电流可能来自质膜中离子通道的重新分布。这种电流会在整个膜上产生一个电势差,这可能会改变其他膜特性,例如膜蛋白的分布。电流也改变了细胞质的离子组成;影响的大小取决于形成电流的离子,这些离子在不同的细胞类型中有所不同。由于胞质溶胶中的 Ca 2+浓度通常非常低(在 10 –6和 10 –8 µM 之间),即使细胞内 Ca 2+浓度的小幅增加也会产生显着影响。
已测量细胞溶质钙的变化
荧光钙指示染料fura -2 已用于检测植物和动物细胞中的细胞内细胞溶质钙梯度。由于 fura-2 与钙结合时的激发光谱会发生变化,因此我们可以通过用适当的两个波长激发染料来确定两种形式的染料(有和没有结合钙)的细胞内浓度。两种排放物的比率提供了与染料浓度无关的钙浓度测量值。使用这种技术测量生长中的墨角根中的细胞溶质 Ca 2+梯度,研究人员观察到从尖端的 450 nM 到底部的 100 nM 的梯度(Brownlee 和 Pulsford 1988) 。
这种钙离子梯度可能对肌动蛋白丝的极化组装和高尔基衍生囊泡在根状茎极的矢量放电很重要。钙离子梯度也已显示在其他尖端生长的细胞中建立,例如发芽的花粉粒,其中生长方向和携带细胞壁成分的高尔基体囊泡沉积的区域由钙梯度预测(网络图17.3.B )。
Web 图 17.3.B 尖端生长的花粉管呈现出陡峭的细胞内钙离子浓度梯度,在生长尖端处具有最高水平。来自三种植物的花粉管用荧光钙指示染料显微注射以证明这种 Ca 2+梯度,范围从最末端的约 1 µM 到底部的约 0.2 µM。(Hepler 1997 年的照片,由 P. Hepler 提供。)
肌动蛋白细胞骨架变得极化
用药物放线菌酮 处理抑制蛋白质合成延迟了根状茎的形成,但不会阻止极性的建立。这一结果表明,虽然根状茎的形成需要合成新的蛋白质,但极性的建立不需要,因此极性的发展必须涉及现有成分的重新分配。随着极性的发展,肌动蛋白丝优先定位在受精卵的假根半部,并在由局部 FL-DHP 结合蛋白标记的部位从细胞核附近延伸到质膜 (Kropf 1994; 1997)。
肌动蛋白丝是动态的,它们从一组单体肌动蛋白亚基中组装受到高度调节。肌动蛋白丝位于细胞的根状茎一半,可能是响应组装或拆卸动力学的变化,并且这种定位涉及细胞肌动蛋白的重新分布。
细胞松弛素 B可以阻断极性的固定,细胞松弛素 B是一种破坏肌动蛋白丝的药物。用细胞松弛素 B 处理也会破坏极化过程中产生的离子电流(Brawley 和 Robinson 1985)。在许多类型的细胞中,肌动蛋白丝通过将分泌囊泡运输到质膜来参与细胞分泌。
高尔基衍生囊泡的分泌是局部的
在细胞的极性固定之前,细胞质细胞器变得不对称分布(网络图 17.3.C)。当光诱导极化时,高尔基体衍生的囊泡在墨角藻合子的根状半部的未来生长部位积聚(Quatrano 1978 )。在极性诱导后的几个小时内,囊泡的不对称分布可以通过随后用不同方向的光处理来改变。
Web 图 17.3.C 含有特定细胞壁成分的细胞质囊泡在墨角藻受精卵极性发育的早期变得不对称分布。(A)在固定极轴之前,甲苯胺蓝染色墨角藻合子。甲苯胺蓝染料染色囊泡或壁中的壁成分。(B) 建立根状茎-菌体极性后的胚胎,甲苯胺蓝染色局限于胚胎根状体部分的细胞壁。(来自 Quatrano 和 Shaw 1997,由 RS Quatrano 提供。)
在这个可能发生变化的阶段,细胞质囊泡在细胞阴影侧的假根形成的预期位置积累。随后,囊泡与质膜融合,将其内容物分泌到细胞壁中,导致假根出现。有证据表明钙梯度在触发极点的囊泡放电中起作用(Derksen et al. 1995)。
墨角藻受精卵 中光诱导极性的固定也需要细胞壁的存在。用细胞壁消化酶去除细胞壁并不能阻止单侧光诱导极性,但它确实阻止了轴的固定。在合成新的细胞壁之前,胚胎轴的方向保持不稳定(Kropf 等,1988)。
从这些观察中,可以设想在尖端生长的细胞中建立细胞极性期间可能发生的一系列事件。
在该过程早期出现的离子电流可能会引发细胞内 Ca 2+梯度的形成。
尖端细胞内钙的增加可能有助于组织和稳定细胞骨架的微丝成分。
细胞骨架将囊泡交通引导到生长的尖端。
可能紧邻质膜的钙梯度可能促进囊泡与质膜的融合,尽管这仍有待证明。
最后,细胞壁沉积可能通过与跨膜蛋白相互作用来固定细胞的极性。
WEB TOPIC 17.4 满江红根发育
通过研究蕨类植物和其他原始维管植物的顶端分生组织,我们对分生组织功能机制的理解得到了加强。这些生物的根和茎顶端分生组织有一个大的顶端细胞,位于分生组织的中心。顶端细胞是分生组织中所有细胞以及根或芽体的最终来源。澳大利亚国立大学的 Brian Gunning 详细研究了水蕨Azolla根部的细胞分裂模式(Gunning 1982)。
满江红根的不同寻常之处在于它们不会在植物的整个生命周期中生长。满江红根是一个确定的器官,根分生组织对其生长具有遗传决定的限制。这种情况与大多数根形成对比,其中分生组织的活动是不确定的——只要环境条件允许,它就会持续生长。
Azolla顶端细胞 的形状类似于具有四个或多或少三角形边的金字塔,仅分裂 50 到 55 次,在其完全停止分裂之前切断其四个平面中的每个平面中的衍生细胞。除根冠外,满江红根中的所有细胞都可以追溯到顶端细胞,其分裂平面的确定非常精确(Web 图 17.4.A)。
Web 图 17.4.A 在水蕨Azolla pinnata 的根系发育过程中,细胞以精确的模式分裂。(A) 这种精确的细胞分裂模式在根的纵向部分很明显。(B) 此处以更高的放大倍数显示,单个顶端细胞在三个三角形面处分裂,形成称为分生植物的楔形细胞。(C) 这张根图确定了在根的每一侧形成的 12 个分生植物。每个分生植物的后续分裂也以精确的模式产生特定数量的细胞,这些细胞将根据它们在分生植物中的位置进行分化。(D) 这是根部的横截面,显示了形成根部圆周的三种分生植物的衍生物。(E) (D) 中的横截面图显示了三种分生植物的边界。(A 来自 Hardham 和 Gunning 1979。A、B 和 D 由 A. Hardham 提供。)
将成为根体的细胞是通过平行于顶端细胞的三个内部三角形面的分裂产生的,形成一个称为分生 体的楔形细胞。三个派生单元中的每一个随后划分一定次数以形成构成根轴三分之一的扇区。顶端细胞及其每个衍生物的分裂平面和数量非常精确。我们可以识别出两种不同的分裂——形成的和增殖的——它们在产生的子细胞的命运上有所不同。增殖分裂产生的两个子细胞具有相同的命运。
形成性分裂可以是沿周的或背斜的,但它们与增殖分裂的不同之处在于两个子细胞具有不同的命运。也就是说,其中一个子细胞可能保持未分化,而另一个子细胞将分化为特定细胞类型。形成分裂建立了构成根部各种组织的细胞文件;增殖分裂增加了每个文件中的单元格数量。
在根部,大多数形成的分裂是周向的(纵向的),而增殖的分裂往往是背斜的(横向的)。分生植物内的纵向形成性分裂产生了用于根中细胞文件的祖细胞。例如,产生内皮层和内皮层细胞的分裂发生在根两侧的第四个分生植物中,描绘血管元件、周轮、外皮层和根毛-表皮细胞文件的分裂也是如此。一旦形成,祖细胞通常在后代分化之前完成几个横向增殖分裂。
WEB TOPIC 18.1 种子的进化
种子的起源和进化是一个引人入胜的故事,始于大约 3.7 亿年前的泥盆纪晚期。最早的种子植物是从一组称为原裸子植物的带有孢子的植物中出现的,最终产生了裸子植物和被子植物(Web 图18.1.A)。前裸子植物结合了蕨类植物的生殖周期和种子植物典型的营养结构。它们的传播单位是发展成配子体的孢子,从而产生雄性和雌性配子。与蕨类植物一样,前裸子植物的受精可能是由有鞭毛的精子介导的,这需要水来移动。相比之下,花粉在种子植物中进化为将精子传递给雌性配子体的载体,允许在没有水的情况下进行受精。
Web 图 18.1 . 发表在 Tansley 评论中的图Linkies 等人的种子进化。(新植物学家186: 817–831, 2010)。
网络图 18.1.B说明了与种子进化相关的一些主要结构变化。在已灭绝的种子蕨类植物和现代裸子植物中,多细胞单倍体巨配子植物围绕胚胎,是营养的主要来源(见图 18.1.B,a 和 b 部分)。在基底被子植物(睡莲科)中,主要的营养组织是来自母体组织的外胚层,次要部分来自二倍体胚乳,它是双重受精的产物(见图 18.1.B,c 部分)。在基础真双子叶植物和核心真双子叶植物中,三倍体胚乳作为种子的主要营养组织,通常由贮藏子叶补充(见图 18.1.B,d 和 e 部分)。所有种子都被称为种皮或种皮的死细胞保护性外层包围。然而,种皮有时可能会融合到果皮或“果壁”,源自子房壁。在这种情况下,“种子”实际上是一种果实。网络表 18.1.A列出了一些熟悉的例子,例如真正的种子与类似种子的果实。
Web 图 18.1.B Web 图 18.1.B 图发表在 Tansley 评论Linkies 等人的种子进化。(新植物学家186: 817–831, 2010)。
网络表 18.1.A
WEB TOPIC 18.2 幼苗生长可分为两种类型:Epigeal 和 Hypogeal
被子植物幼苗在轴的生长过程中就其子叶的命运分为两大类。子叶高于土壤表面的幼苗被称为表皮,而那些子叶留在土壤中的幼苗被称为低皮。伸长轴相对于子叶附着位点的位置通常决定了幼苗是表皮还是下皮。例如,菜豆(Phaseolus)、蓖麻(Ricinus)和洋葱(Allium)中幼苗茎轴的初始伸长区是下胚轴,位于子叶节下方(Web 图18.2.A)。因此,当下胚轴伸长时,它会将子叶提升到土壤上方。子叶节正上方的节间称为上胚轴。在大多数表皮幼苗中,下胚轴和上胚轴都伸长。相反,只有上胚轴在下胚轴幼苗中伸长,例如豌豆(Pisum)。草科成员的种子也是下胚层的,尽管芽轴的解剖结构有些不同。例如,在玉米 ( Zea ) 中,直接位于改良子叶或盾片上方的轴称为中胚轴(参见网页图 18.2.A,e 部分)。对于深植的种子,中胚轴有助于使枝条更靠近土壤表面。
Web 图 18.2.A 在选定的真双子叶植物和单子叶植物中不同类型的幼苗发育。(a) 菜豆 ( Phaseolus vulgaris );(b) 蓖麻(蓖麻);(c) 洋葱 ( Allium cepa );(d) 豌豆 ( Pisum sativum );(e) 玉米 ( Zea mays )。A-C:胚芽萌发;D-E:低温发芽。
WEB TOPIC 18.3 种子表现出初级和次级休眠
根据休眠开始的发育时间,可以区分不同类型的种子休眠。在正常条件下未能发芽的新分散的成熟种子表现出初级休眠,通常在种子成熟期间由脱落酸 (ABA) 诱导。(ABA 对种子休眠的调节将在本章后面讨论。)一旦初级休眠丧失,非休眠种子如果在一段时间内暴露于抑制萌发的不利条件下,可能会获得二次休眠。例如,如果暴露于高于最高发芽温度的温度下,燕麦(燕麦)的非休眠种子可能会处于休眠状态。相比之下,Phacelia dubia的种子(小花蝎子草)可以在低于发芽最低温度的温度下获得二次休眠。次生休眠的机制知之甚少。
在一年生双子叶杂草的种子休眠周期中,可以在自然界中观察到二次休眠。为了与季节同步,埋在土壤中的一群种子,称为土壤种子库,必须能够感知环境条件何时适合发芽和幼苗生长。种子休眠和寿命(在本章后面描述)以及种子对生物和非生物胁迫的抗性(见第 23 章和第 24 章)是有助于种子在土壤种子库中持久存在的关键特征。在温带地区,双子叶杂草种子在一年中的预定时间发芽。例如,夏季一年生植物通常在春季的有限时间内发芽,有时会在夏季进行第二轮发芽。虽然土壤湿润或土壤扰动可能会强烈刺激出苗,但发芽的年度周期并不取决于主要的环境条件,而是取决于环境的季节性波动。如果发芽条件不利,种子可能会发生二次休眠。在夏季一年生像蓼蓼,次生休眠是由温暖的夏季温度引起的。在冬季一年生植物中,例如Veronica hederofolia,夏季温度打破休眠,而冬季低温诱导二次休眠。因此,夏季一年生植物在春季发芽,而冬季一年生植物在秋季发芽(Web 图 18.3.A)。
Web 图 18.3.A夏季和冬季年度的次生休眠。每个月将种子埋在沙壤土中,并测量发芽率。然后将发芽百分比绘制为种植月份的函数。由于次生休眠(绿线),夏季一年生蓼的发芽率在春季最高,夏季最低。冬季一年生的Veronica hederofolia在秋季发芽最好(深红线),而冬季土壤温度较低会引起次生休眠。蓝线表示土壤温度的变化。在罗伯茨和洛克特 (1978) 和卡森 (1980/81) 之后。
WEB TOPIC 18.4 发芽的第三阶段可以是一步或两步过程
发芽的第三阶段可以是一个步骤过程,其中胚根在种皮(种皮)破裂后立即出现,或者它可能涉及两个步骤,其中胚乳必须在胚根出现之前经历弱化。在一步过程中,成熟种子中没有残留胚乳,因此种皮破裂加上初始胚根伸长导致萌发完成。虽然脱落酸 (ABA) 不抑制睾丸破裂,但它可以抑制胚根的出现(Web 图 18.4.A, 上面的部分)。两步过程更加复杂,因为成熟种子中存在残留的胚乳,可以物理地阻止胚根的出现(参见 Web 图 18.4.A,下半部分)。休眠释放发生在种子后熟过程中或在吸收过程中通过光敏色素调节的赤霉素 (GA) 途径(第一阶段)。ABA 抑制胚乳破裂但不抑制种皮破裂,而 GA、乙烯和油菜素内酯 (BR) 促进胚乳弱化并抵消 ABA 的抑制作用(Web 图 18.4.A,下半部分)。
Web 图 18.4.A激素相互作用调节烟草(A) 和芸苔属(B) 模式物种的种子休眠释放和萌发。(A)烟草sp。种子萌发分两步进行:种皮破裂,然后胚乳破裂。休眠释放和发芽促进发生在种子后熟(在室温下干燥储存几个月)期间或在吸收期间通过光敏色素-赤霉素 (GA) 途径发生。脱落酸 (ABA) 抑制胚乳破裂,但不抑制睾丸破裂。GA、乙烯和油菜素内酯 (BR) 促进胚乳破裂并抵消 ABA 的抑制作用。胚乳破裂和细胞壁重塑蛋白的基因表达受光、GA和乙烯的促进,而受黑暗、ABA和渗透压的抑制。(B)欧洲油菜种子发芽是一步完成的。成熟的种子缺乏胚乳,因此种皮破裂和初始胚根伸长完成了发芽过程。虽然 ABA 不抑制睾丸破裂,但 ABA 抑制随后的胚根生长(Schopfer 和 Plachy 1984)。(A 在 Leubner-Metzger 2003 之后;B 在 Kucera 等人 2005 之后。)
WEB TOPIC 18.5 趋向性、向地性和循环是综合信号
当胚根从种皮中出现时,重力可能是它遇到的第一个力,但根也会遇到土壤施加的力。根据种子的最终位置,土壤可能主要是沙子、粘土、壤土或其他一些结构。植物对土壤中的障碍物(例如岩石)做出反应,并重新定向它们周围的生长(向触性),直到它可以恢复与重力矢量对齐的生长。
与重力弯曲相反,在根触变反应中观察到内部 Ca 2+池的局部变化。在拟南芥中,已显示 Ca 2+水平的快速变化会引发活性氧物种的独立增加和质膜 pH 梯度的降低。在自然界中,根系生长反应是重力刺激和触触刺激的综合。
“波浪根”综合症首先由查尔斯·达尔文在《植物运动的力量》中描述,是向地性、向性和环绕信号整合的一个很好的例子。当拟南芥幼苗在倾斜 60 度的琼脂板上生长时,由于这三个信号,根部会形成波浪形图案(Web 图 18.5.A)。最初,根部在重力作用下倾向于向下生长,但在接触琼脂时,由于负向触性,它们倾向于向上生长。叠加在这两个信号上的是环绕,即根尖以螺旋生长模式振荡的趋势。这三个相互作用的因素的结果是一个波浪状的增长模式。
Web 图 18.5 . 根中的触变性。拟南芥幼苗在与垂直方向倾斜 60° 的培养皿中生长。由于向地性、向性性和环向性的相互作用,根部以波浪状生长。(照片由 Alessio Fortunati 博士提供。)
芽也会对触变性刺激做出反应:反复触摸会降低植物高度,并且被风吹过的树木具有弯曲远离风的生长习性。缠绕的茎和它们的特殊器官,如豌豆的卷须和牵牛花,对触摸和缠绕另一种植物的茎或花园栅栏有积极的反应,从而在植物继续向上生长时对其进行支撑(参见 Web 图 18.5.乙)。这些触动反应可能由位于膜上的机械敏感通道 (MscS) 介导。其中包括参与 Ca2+ 摄取的 Mid1-Complementing Activity (MCA) 家族蛋白和对离子无选择性且受张力控制的 MscS-Like (MSL) 家族蛋白。
Web 图 18.5.B芽中的触变性。(由红藤 [ Brunnichia ovata ] 围绕支撑物进行触变缠绕)。(由美国农业部 ARS 的 Christopher Meloche 拍摄。)
WEB TOPIC 18.6 根表现出负向光性
就像芽是负向重力和正向光性一样,根是正向重力和负向光性。蓝光已被证明可刺激根部的负向光性。在拍摄中,我们看到 PIN3 在单侧蓝光处理后从淀粉鞘中的对称质膜定位变为不对称质膜定位(参见教科书第 18 章)。在黑暗处理的根中,PIN3 在根帽小柱细胞的质膜上显示对称定位。在单侧蓝光曝光后,PIN3 在受照侧(最靠近光源)显示不对称定位。生长素流被重定向到根部的光照侧,根部弯曲远离光源。
WEB TOPIC 18.7蓝光导致皮层微管沿纵向重新定向
微管相对于生长轴水平排列。正如我们在教科书第 1 章中看到的,微管在细胞壁微纤维生物合成过程中对于引导酶复合纤维素合酶很重要。细长细胞中微管的默认方向是横向的,垂直于细胞轴。暴露于单侧蓝光后,新的微管在不到一分钟的时间内形成,这些微管纵向定向并平行于下胚轴。同时,先前存在的微管被翻转。光致缺陷照片中的微管重排突变体发生,但大大减少,PHOT 似乎是微管重排的主要蓝光受体。理论上,暴露于蓝光的细胞应沉积纵向取向的纤维素微纤维,这将抑制受照侧的伸长生长。然而,需要更多的实验来确定蓝光诱导的微管重排是否是向光弯曲的一个致病因素。在教科书第 18 章中,我们看到因受伤而发生的微管重排是由乙烯介导的。因此,微管重排对于一般的细胞壁重塑和细胞扩增很重要。
WEB TOPIC 18.8光敏色素和隐花色素有助于向光性
向光素不是唯一的蓝光感光体。光敏色素还吸收蓝光,隐花色素是另一组蓝光感光器。一些研究结果表明,光敏色素和向光素在细胞质中共同作用以调节向光性。例如,PHYA突变体对低蓝光有严重的向光性缺陷。PHYA 似乎通过促进 PHOT1 响应蓝光从质膜移动到胞质溶胶来增强向光性。
根据目前的模型,PHYA 和 PHOT1 之间的分子联系是 PHYTOCHROME KINASE SUBSTRATE 1 (PKS1)。PKS1 最初被确定为光调节光敏色素激酶的底物。PKS1、2 和 4 对于 PHOT1 介导的向光性很重要。PKS1 与 phot1 和 NPH3 相互作用,而 PKS4 是 PHOT1 底物。由于 PHYA 在蓝光照射后易位至细胞核,因此 PHYA 似乎通过 PIF4 和 PIF5 启动向光性所需的转录反应(参见教科书第 16 章)。在质膜上,已显示 PHOT1 和 PHYA 相互作用并与 PKS 相互作用,这可以提供一个模型 PHOT1 和 PHYA 如何共同调节向光性。
与光敏色素类似,隐花色素对 PHOT 依赖性向光性中的转录反应和细胞伸长很重要。因此,调节向光性的光感受器活动之间存在交叉调节(参见教科书第 15 章)。
WEB TOPIC 18.9避荫由隐花色素、生长素和油菜素类固醇调节
绿叶的叶绿素吸收蓝光和红光;因此,植物冠层下的光通常包含比阳光中更低的蓝光通量。适应阳光的植物可以通过启动避荫反应来对蓝光的较低通量做出反应。这种对蓝光低通量的避荫反应已被证明受隐花色素的调节。
冷冻色素很可能通过直接与光敏色素相互作用来调节避荫。研究表明,隐花色素 1 和 2(CRY1 和 2)在开花调控期间与光敏色素(PHYA 和 PHYB)相互作用(参见教科书第 20 章)。CRY1 和 CRY2 在体外都与 PHYA 相互作用,并且可以以 PHYA 依赖性方式被磷酸化。CRY1 的磷酸化也已被证明在体内以红光依赖性方式发生。
除了隐花色素外,在低蓝光条件下,幼苗的下胚轴伸长还需要生长素和油菜素内酯 (BR)。木糖葡聚糖内切葡糖基酶/水解酶( XTH ) 基因家族的成员是受蓝光调节的重要细胞壁修饰酶。XTH酶的不同亚群受生长素和 BR 的调节。使用突变体或化学抑制剂阻断生长素或 BR 信号传导的实验表明,响应于低通量蓝光的下胚轴伸长取决于生长素和 BR,并且这两种激素在阴凉处非冗余和非协同作用回避反应。
WEB TOPIC 18.10光敏色素反应显示生态型变异
迄今为止,我们对任何给定模式植物物种的光响应的大部分理解都来自对有限数量的品种或种质进行的实验。例如,拟南芥的大部分遗传分析是使用哥伦比亚或兰茨贝格直立生态型进行的,水稻和玉米的基因组测序工作集中在每个物种的两个种质上。因此,世界各地的植物研究计划都倾向于关注少数种质。
然而,在考虑光敏色素在生态环境中的作用时,必须检查更广泛的种质资源。对拟南芥和玉米光响应的调查揭示了巨大的生态变异,包括光响应的生理学和光敏色素基因家族。例如,拟南芥的 Wassilewskija (Ws) 种质包含自然发生的 phyD 基因缺失,而来自法国勒芒的种质 (Lm-2) 携带光稳定形式的 PHYA,它不能介导对连续远距离的反应。 -红灯。这些研究表明光敏色素反应的变化可能具有一定的适应性价值。确定这些变化如何有助于不同栖息地的适应性是未来的挑战。
WEB TOPIC 18.11分生组织活性的维持对于幼苗的建立至关重要
CLAVATA 通路对于芽分生组织的识别和维持很重要。尽管没有证据表明这种信号转导途径在根中起作用,但 CLAVATA 小信号肽 CLE19 和 CLE40 在根中表达。当 CLE19 过度表达时,根分生组织变得确定。CLE19 抑制筛选鉴定了处理 CLE19 的锌羧肽酶 SOL1。锌氨肽酶 APM1 已被确定为防止过早的初生根确定性。CLE 和 CLE 样肽在根内存在梯度,分生组织区的肽促进分生组织维持和抑制血管成熟,而成熟区的 CLE 肽促进血管发育。
WEB TOPIC 19.1双面、单面和等面叶片
根据其正面-背面结构,主要有三种叶片类型:双面、单面和等面。在传统的双面叶片中,叶片的近轴(上部)区域由表皮组成,表皮具有相对较厚的角质层和密集的栅栏叶肉细胞,可优化光捕获。叶的背面(下部)区域由具有丰富气孔和海绵状叶肉细胞的表皮组成,它们在气体交换和蒸腾调节中起作用(参见教科书图 1.3)。在双面叶片中,叶脉管系统也沿正面 - 背面轴排列,木质部组织在正面分化,韧皮部在背面分化。叶脉管系统中木质部和韧皮部的这种近轴 - 背轴发育反映了从枝条轴发出的血管痕迹中木质部和韧皮部的内外方向。单面叶形成管状,如洋葱(Allium cepa ) 和灯心草 ( Juncus glaucus ),没有上侧或下侧,似乎完全来自背轴组织。相反,等面叶可能是扁平的,如薄荷 Satureja 的情况,但在上下两侧都有正面组织(栅栏薄壁组织)。
WEB TOPIC 19.2机械应力改变 SAM 中的微管方向和 PIN1 分布
如果动物可以被认为是“精致的蛋白质雕塑”,那么植物就是精致的纤维素雕塑。植物的形状最终取决于其细胞及其周围细胞壁的形状。反过来,植物细胞的形状由细胞扩张过程中细胞壁施加的约束决定。在单个植物细胞的扩张过程中,细胞与细胞壁中纤维素微纤维的角度正交(即成直角)伸长,其方向由细胞的皮质微管控制(参见教科书第 1 章和第 14 章) . 因此,细胞的形状(和植物的形状)最终由微管决定。但是是什么控制了微管的方向?
越来越多的人支持这样一种观点,即在分生组织内起作用的机械因素决定了微纤维的角度,从而决定了单个细胞的机械性能。根据这个模型,分生组织的行为很像单个细胞,表皮层充当限制扩张的细胞壁,而内部细胞则充当驱动扩张的中央液泡。因此,表皮处于张力状态,而内部组织处于压缩状态。
像细胞壁一样,表皮层上的张力可以分为两个主要成分,切向应力和纵向应力。由于茎尖分生组织 (SAM) 的几何形状,两个应力分量的比率因区域而异(Web 图 19.2.A)。在中心区(CZ)和叶原基的尖端,表皮上的应力是各向同性的,即在所有方向上都相等。相比之下,在原基和分生组织之间的折痕以及茎的根尖下区域的表皮上的应力都是强烈的各向异性的,如图 19.2.B(A 和 B 部分)所示。在折痕中,纵向应力占主导地位,而在茎部中,切向应力占主导地位。
微管倾向于沿主应力轴排列,表明分生组织内的细胞通过沿适当轴增强其壁强度来响应应力向量。因此,纵向应力占主导地位的折痕区域的细胞会形成各向异性取向的微管,这些微管平行于纵向应力的方向(Web 图 19.2.B,B 和 C 部分)。类似地,在叶原基下方的茎区,主要应力是切向的,细胞发育出横向排列的微管。相反,在壁应力是各向同性的分生组织尖端的细胞会形成各向同性取向的微管。
Web 图 19.2.A SAM 中的机械应力。(来自 Besrard 等人,2011 年。)
Web 图 19.2.B 拟南芥 SAM 中的机械应力模式。(A) 分生组织被建模为压力容器。SAM 上的每个点在正径向 (r) 和经向 (s) 方向上都有一个坐标,P 是内部组织对 L1 层施加的压力。(B) 观察到的微管方向 (右) 与最高应力方向 (左) 一致。(C) 叶原基和 SAM 之间的边界域(折痕区域)中的微管和 PIN1 蛋白方向:PIN1(红色)和微管(绿色)模式是相关的。比例尺:5 毫米。(A 和 B,根据 Hamant 等人 2008 年;C 来自 Heisler 等人 2010 年。)
最近的研究表明,机械应力也可能决定质膜上 PIN1 分布的极性。PIN1 蛋白专门定位于与微管方向平行的质膜结构域,如折痕区域所示。如教科书图 19.2D 所示,分生组织折痕区域中的这种 PIN1 配置有利于生长素向发育中的叶原基极性运输。因此,在叶片起始过程中,PIN1 定位和微管方向似乎都可能对一个共享的上游调节器作出反应,该调节器在本质上似乎是生物力学的。
WEB TOPIC 19.3叶锯齿由 CUC2-生长素反馈回路的作用协调
在叶板发育过程中,叶缘(边缘)可能会形成称为锯齿的横向生长物(Web 图 19.3.A,左)。尽管边缘锯齿被许多基因修饰,但关键成分是生长素和CUC2(网络图 19.3.A,右)。CUC2的功能丧失突变导致锯齿减少,CUC2的过表达导致高度锯齿叶,这是一种依赖于 PIN1 和生长素信号传导的表型。
Web 图 19.3.A锯齿叶的发育。(A) 拟南芥莲座叶具有规则排列的边缘生长或锯齿 (黄色箭头)。(B) 参与叶锯齿形成的遗传和激素相互作用。PIN1 收敛,通过 PIN1 定位的生长素反馈加强,引导生长素流(红色箭头)沿叶缘朝向生长素最大值。CUC2 活动是指导 PIN1 收敛所必需的。生长素抑制 CUC2 表达,CUC2 表达仅限于锯齿之间的区域。
在发育早期,CUC2 沿叶缘均匀表达。CUC2 的功能是重新定位 PIN1 生长素外排载体,以便它们的方向会聚在叶缘细胞的一个子集上。PIN1的这种重新定向增强了生长素向这些边缘细胞的极性转运,最终建立了生长素梯度,其最大值或多或少地沿着叶缘均匀分布。在这些生长素最大值处刺激生长。随后,CUC2 表达被限制在生长素最大值之间的区域,其中 CUC2 可能参与抑制椎板生长。因此,叶片锯齿的程度可能是生长素促进生长和 CUC2 抑制生长之间平衡的结果。
WEB TOPIC 19.4根系表型研究进展
由于难以观察在不透明土壤介质中生长的复杂根系,根系结构的研究落后于植物研究的其他领域。主要限制是缺乏适当的方法来非侵入性地操纵和成像根,以及缺乏足够的数学和计算工具来描述根系统的复杂空间结构。生长方法的技术改进以及成像和分析技术以及种质资源的同步扩展推动了该领域的最新研究进展。用于提供进入根系的实验室生长方法包括水培法、琼脂板、纸袋/布袋、凝胶板、盒子和圆柱体生长系统以及气培装置。温室生长方法通常包括装满土壤、土壤替代品或沙子混合物的盆、圆筒、盘子和槽。还开发了配备土壤观察窗(称为 rhizotrons 和 minirhizotrons)的地下实验室,以补充田间和温室环境中的取芯和挖沟技术。同时,根系图像捕获技术得到扩展,包括数字扫描仪和照相机,以及从医学领域借用的方法,包括 X 射线照相、中子射线照相、激光扫描、磁共振成像 (MRI)、正电子发射断层扫描 (PET)、计算机断层扫描 (CT) 和微型计算机断层扫描 (μCT)。还开发了配备土壤观察窗(称为 rhizotrons 和 minirhizotrons)的地下实验室,以补充田间和温室环境中的取芯和挖沟技术。同时,根系图像捕获技术得到扩展,包括数字扫描仪和照相机,以及从医学领域借用的方法,包括 X 射线照相、中子射线照相、激光扫描、磁共振成像 (MRI)、正电子发射断层扫描 (PET)、计算机断层扫描 (CT) 和微型计算机断层扫描 (μCT)。还开发了配备土壤观察窗(称为 rhizotrons 和 minirhizotrons)的地下实验室,以补充田间和温室环境中的取芯和挖沟技术。同时,根系图像捕获技术得到扩展,包括数字扫描仪和照相机,以及从医学领域借用的方法,包括 X 射线照相、中子射线照相、激光扫描、磁共振成像 (MRI)、正电子发射断层扫描 (PET)、计算机断层扫描 (CT) 和微型计算机断层扫描 (μCT)。
根系统图像捕获方法包括二维(2D)和三维(3D)成像。此外,可以从通过摄影、扫描、X 射线照相和中子照相收集的 2D 数据重建 3D 图像。3D 图像捕获方法涉及表面重建方法或体积重建方法。对于表面重建,根系以相对较低的分辨率成像,并表示为称为表面模型的实体对象。3D 重建技术最初是为计算机视觉学科开发的,后来适用于根系统成像。网络图 19.4.A 描述了这种类型的根成像和分析平台。在这里,水稻幼苗生长在一个透明的结冷胶圆柱体中(参见 Web 图 19.4.A,B 和 C 部分)和根系统的图像如 Web 图 19.4.A(A 部分)所示。将盛有水稻的玻璃圆筒放置在旋转台上。载物台和数码相机均由计算机控制,以便在其旋转 360° 旋转时捕获根系统的多个 2D 图像。随后,使用定制设计的软件程序从 2D 图像生成 3D 根重建(Web 图 19.4.A,D 部分),并对描述根系统不同特征的几个根系统架构特征进行量化。这种方法的高通量潜力使研究人员能够对 425 种不同水稻种质的各种根系结构特征进行全基因组关联作图。这样,
来自医学领域的体积成像技术也已用于对根系统进行成像。X 射线计算机断层扫描 (CT) 和微计算机断层扫描 (μCT) 使用 X 射线束非破坏性地捕获在土壤基质中生长的根系的横截面切片。X 射线从成像体积周围的旋转位置发射和捕获,从而可以从周围的基底重建和提取根部图像。其他类似的方法使用不同的医学成像技术,包括磁共振成像 (MRI) 和正电子发射断层扫描 (PET),以获得一系列 2D 根图像,这些图像被重建为根系统结构的 3D 表示。
网页图 19.4.A3D 根生长和成像系统。A,用于捕获图像序列的 3D 数字成像系统示意图;在完整的 360° 旋转中,每旋转 9 度拍摄 40 张 2D 图像。(L-灯箱;OCT-光学校正槽;IT-内转盘;ET-外转盘;MI-磁接口;GC-生长筒;C-摄像头;CC-电脑控制转盘和摄像头)。B,含有结冷胶和 10 天龄 Azucena 水稻幼苗的生长筒。C,来自使用 3D 成像系统捕获的图像序列的代表性单个 2D 根系统图像。D,水稻根系的 3D 重建显示了五种根类型:初级 (pr)、胚冠 (ecr)、胚后冠 (pecr)、大侧根 (llr) 和小侧根 (slr)。初级、冠和大小侧根可以在视觉上相互区分。植物生理学156:455-465。网址:www.plantphysiol.org。版权所有美国植物生物学家协会。)
WEB TOPIC 20.1气候变化导致野生植物开花时间发生明显变化
植物对温度高度敏感,并且似乎使用温度信号以多种方式控制发育。我们已经看到,有些植物需要长时间的低温(春化)才能开花。温度的另一个影响是环境生长温度。植物能够感知低至 1ºC 的温差。在研究的许多植物中,环境温度升高会加速开花。值得注意的是,气候变化已经导致野生植物开花时间发生重大变化。响应温暖温度的开花取决于FT的表达,因为在没有FT的情况下,环境温度升高不会加速开花。FT的激活温度由 PHYTOCHROME INTERACTING FACTOR 4 (PIF4) 转录因子介导。这种蛋白质以温度依赖性方式结合FT基因,在温暖的温度下开启基因。
似乎不同的物种对环境温度有不同的敏感性,一些植物反应很小,而另一些植物则更多。这对物种如何适应气候变化具有重要意义。已经表明,那些对环境温度有反应的植物似乎能够随着气候的变化而扩大它们的范围,而那些不将环境温度作为重要发育线索的植物则留在原地,更有可能灭绝。最后,特别重要的是要记住,在田间生长的植物会暴露在广泛的信号中,并且预测它们如何通过基于实验室的实验(通常旨在最大限度地减少变量)对这些信息做出反应是很复杂的。的确,
WEB TOPIC 20.2英国 常春藤 ( Hedera helix ) 和 玉米 ( Zea mays )的 幼 期 和 成 期 特征 对比 .
网络表 20.2.A
WEB TOPIC 20.3嫁接成株的幼年分生组织开花
根据定义,诱导光周期不能诱导幼苗开花,这表明幼苗的枝条顶端分生组织不能开花,或者幼叶产生的花刺激量不足。LSDP Bryophyllum经历了一个幼年期,持续 5 个月到一年(取决于物种),在此期间它不能通过从 LD 转移到 SD 来诱导开花。然而,当幼年的苔藓植物将嫩枝嫁接到开花植物上,幼嫩的嫩枝迅速开花(Zeevaart 1985)。该结果表明,幼苗的枝条顶端分生组织能够开花,但由于幼叶产生的花刺激量不足而不能开花。
年龄是影响花卉刺激产生的另一个因素。与 SDP紫苏的嫁接研究表明,植物顶部的叶子比植物基部附近的叶子更能提供花刺激,这与基部叶子的幼年特征一致。实验如下进行。两组紫苏植物在不同的时间播种。当第一组长出五对叶子时,第二组只长出两对。将两组植物的第五对和第二对叶子嫁接到砧木上并在长日照下保持。一旦建立嫁接结合,通过每天将嫁接的叶子封闭在不透明的袋子中,在短时间内诱导嫁接叶子。第五个节点的叶子只需要短短 14 天就可以诱导开花,而第二个节点的叶子需要 28 天(Zeevaart 1986)。这一发现表明,来自第二个节点的幼叶越多,产生的花刺激就越少,因此需要更多的诱导光周期来诱导开花,而不是枝条上方的完全成叶。
WEB TOPIC 20.4能力和决心是花卉唤起的两个阶段
幼年一词对于草本植物和木本植物具有不同的含义。幼年的草本分生组织在嫁接到开花的成年植物时很容易开花(参见Web WEB TOPIC 20.3),而幼年的木本分生组织通常不会。两者有什么区别?
对烟草(Nicotiana tabacum,一种草本植物)的广泛研究表明,花香的唤起需要顶芽经过两个发育阶段(网络图 20.4.A)。一个阶段是获得能力。如果一个芽在给予适当的发育信号时能够开花,则称它是有能力的。
Web 图 20.4.A 一个简化的茎尖开花模型,其中营养分生组织的细胞获得了新的发育命运。为了开始花的发育,分生组织的细胞必须首先变得有能力。有能力的植物分生组织是一种能够通过花决定(致力于生产花)来对花刺激(诱导)作出反应的植物分生组织。通常表示确定的状态,但这可能需要额外的信号。(根据 McDaniel 等人,1992 年。)
例如,如果将营养枝条(接穗)嫁接到开花的砧木上并且接穗立即开花,则证明它能够对砧木中存在的花卉刺激水平做出反应,因此是有能力的。接穗未能开花将表明枝条顶端分生组织尚未达到能力。
一个有能力的植物芽经历的下一个阶段是决心。即使在从其正常环境中移除之后,如果芽进展到下一个发育阶段(开花),就可以说它是确定的。因此,即使将花决定的芽嫁接到不产生任何花刺激的营养植物上,它也会产生花。正如我们将在本章后面讨论的那样,花决定的分子机制开始被理解。
在白天中性烟草品系中,植物通常在产生约 41 片叶子或节后开花。在一项测量腋芽花量的实验中,开花烟草植物在第 34 片叶子上方(从底部开始)被斩首。从顶端优势释放,第 34 片叶子的腋芽长出,并在长出大约 7 片叶子(总共 41 片)后开花(Web 图 20.4.B,a 部分)。但是,如果从植物上切下第 34 个芽,然后生根或嫁接在靠近基部没有叶子的砧木上,它会在开花前产生几乎完整的叶子。这些结果表明,第三十四个芽尚未开花。
在另一个实验中,供体植物在第 37 片叶子上方被斩首。这一次,第 37 个腋芽在所有三种情况下仅产生了大约四片叶子后开花(网络图 20.4.B,b 部分)。该结果表明,在萌生37片叶子后,顶芽变成花决定的。
Web 图 20.4.B 展示烟草中腋芽的确定状态。开花供体植物的特定腋芽被迫生长,要么直接在其自身的植物上(原位)通过将枝条斩首,作为生根插条,或作为嫁接到植物基部的接穗。腋芽产生的新叶和新花用阴影表示。(a) 未确定芽时的结果。(b) 当花蕾被确定时的结果。(在麦克丹尼尔 1996 年之后。)
烟草品种间的茎尖广泛嫁接已经确定,开花前分生组织产生的节数是两个因素的函数:来自叶子的花刺激强度和分生组织对信号作出反应的能力。
在某些情况下,即使在先端确定后,开花的表达也可能会延迟或停止,除非它接收到刺激表达的第二个发育信号。例如,完整的黑麦草 ( Lolium temulentum ) 植物在单次暴露于漫长的一天后就会开花。如果在漫长的一天开始后 28 小时切除黑麦草茎顶端分生组织并在体外培养,它将在培养中产生正常的花序,但前提是培养基中存在激素赤霉酸 (GA)。因为从仅在短日内生长的植物培养的顶端从不开花,即使在 GA 存在下,我们可以得出结论,在黑麦草中测定需要长日,而 GA 是表达确定状态所必需的。
一般来说,一旦分生组织变得有能力,它就会随着年龄的增长(叶数)呈现出增加的开花趋势。例如,在受日长控制的植物中,在较老的植物中,实现开花所需的短日或长日周期的数量通常较少(网络图 20.4.C)。正如本章后面将要讨论的那样,这种随着年龄增长而增加的开花趋势有其生理基础,因为叶子产生花刺激的能力更强。
Web 图 20.4.C 植物年龄对长日照植物黑麦草 ( Lolium temulentum ) 开花所需的长日照 (LD) 诱导周期数的影响。一个感应长日循环包括 8 小时的日光和 16 小时的低强度白炽灯。植物越老,产生开花所需的光感应周期就越少。
WEB TOPIC 20.5昼夜节律的相移响应特征
研究人员通过将植物从 12 小时光照和 12 小时黑暗的循环转移到连续黑暗后的不同时间进行 2 小时光照处理,获得了多肉植物Kalanchoe blossfeldiana 中花瓣运动节奏的相移响应(较暗的曲线)。网页图 20.5.A)。
Web 图 20.5.A 昼夜节律中相移响应的特征。研究人员通过将植物从 12 小时光照和 12 小时黑暗的循环转移到连续黑暗后的不同时间进行 2 小时光照处理,获得了多肉植物Kalanchoe blossfeldiana花瓣运动节奏的相移响应(较暗的曲线)。该曲线显示了与未受光照射的植物相比,花瓣运动节奏的延迟或提前。短日照植物红色藜的光周期响应(红色鹅掌)(较浅的曲线)是在转移到黑暗后的不同时间通过 6 小时的光照处理获得的。该曲线显示了开花对夜间休息的反应节奏的延迟或提前。(Zimmer 1962 年Kalanchoe的数据。King和 Cumming 1972 年 藜属植物的数据。)
较深的曲线显示花瓣运动节奏的延迟或提前与未受光照射的植物相比。
短日照植物红藜(红鹅掌)的光周期时间响应(较浅的曲线)是在转入黑暗后的不同时间进行 6 小时光照处理得到的。
较浅的曲线显示开花反应节奏对夜间休息的延迟或提前。(Zimmer 1962 年Kalanchoe的数据。King和 Cumming 1972 年 藜属植物的数据。)
WEB TOPIC 20.6光敏色素 A 和 B 对开花的对比效果
如教科书第 16 章所述,光敏色素由多基因家族的成员编码,上一节中描述的红光和远红光的影响可能是由不同类型的光敏色素(A 和 B)介导的。在拟南芥、豌豆 ( Pisum sativum ) 和高粱 ( Sorghum bicolor ) 等 LDPs 中,光敏色素 B (phyB) 似乎是开花的抑制剂,因为PHYB基因中的突变会消除或减少 phyB 蛋白的数量,从而导致更多快速开花(Reed et al. 1994)。
远红光促进开花可能是由于 phyB 的 Pfr 形式的数量减少,这对 phyB Pfr 水平的影响与减少 phyB 总量的突变相同。如前所述,黑暗时期的红灯中断会阻止 SDP 的开花;因此,Pfr 形式的 phyB 也可能是 SDP 中开花的抑制剂。
在 LDPs拟南芥和豌豆中,PHYA基因的突变干扰了长日照开花的促进(Weller 等,1997);因此,Pfr 形式的 phyA 可以促进 LDPs 的开花。豌豆中phyA突变的影响非常强(突变植物基本上不能对感应光周期做出反应),而拟南芥中的phyA突变对感应光周期的反应能力只有轻微影响。phyA突变影响的物种差异可能是由于豌豆完全依赖phyA来感知感应光周期,而拟南芥为此还使用了蓝光感光器。
WEB TOPIC 20.7支持蓝光调节昼夜节律的作用
蓝光在调节昼夜节律和开花中的作用也得到了拟南芥开花时间突变体的研究支持:elf3 ( e ar l y f lowering 3 ) (Hicks et al. 1996; Zagotta et al. 1996)。elf3突变体在各种生长条件下开花时间早于野生型,对光周期不敏感;也就是说,它是日中性的。
elf3与荧光素酶报告基因的 转化揭示了昼夜节律的缺陷。当在连续光照下生长时,突变体没有显示出昼夜节律。值得注意的是,elf3突变体在恒定的白光下生长时也具有较长的下胚轴,类似于hy突变体,并且对所有波长的光的反应都比野生型低,尤其是对蓝光。这一发现表明,突变体中的生物钟是完整的,但光信号向生物钟的转导受损(Hicks 等人 1996;Zagotta 等人 1996)。
elf3突变体对蓝光的反应比对红光的反应更受损, 这一事实进一步表明蓝光光感受器在开花的光周期控制中起作用。
WEB TOPIC 20.8控制开花时间的基因
正如我们所见,马里兰猛犸象突变将一种日间中性烟草品种转化为 SDP。W. Garner 和 H. Allard 对这种开花时间突变体的分析发现,植物可以测量光周期作为花卉诱导的环境线索,并将马里兰猛犸象基因确定为调节这一过程的基因之一。
在豌豆 ( Pisum sativum ) 和拟南芥(Weigel 1995; Reid et al. 1996)中对开花时间基因进行了 最广泛的研究。在这些物种中,一系列突变可以改变开花的光周期控制的各个方面。例如,某些基因的突变将这些 LDP 转化为可以快速开花的日间中性植物。其他基因的突变导致日中性植物开花延迟很长。
因为这些突变消除了对光周期的反应,所以这些基因的正常(野生型)产物被认为与光周期有关。其他突变可以延迟或促进开花而不影响光周期反应。这些突变体被认为会影响参与开花自主调节的基因。
由于大多数生物调节系统都处于阳性和阴性控制之下,因此发现促进或延迟开花的突变也就不足为奇了。由于大多数突变导致基因活性的丧失或降低,突变时延迟开花的基因的野生型作用是促进开花。
同样,促进开花的突变很可能发生在通常抑制该过程的基因中。这些基因在遗传方面是开花的促进剂和抑制剂,但突变表型本身通常不能揭示受影响的开花机制。例如,消除对光周期反应的突变可能会阻止开花激素(花卉刺激)的产生,或者干扰分生组织中靶细胞接收激素信号的能力(分生组织能力)。
已分离出含有促进或延迟开花的突变的拟南芥植物。网络图 20.8.A 显示了在诱导光周期(长日照)中生长的野生型和巨茶( gi )突变体。植物在花蕾变得可见的阶段展示。gigantea突变体的开花延迟;因此,这种植物的生长时间大约是野生型的三倍,并且从初级顶端分生组织中形成了更多的叶子。
网页图 20.8.A (来自 Amasino 1996,由 R. Amasino 提供。)
由于GIGANTEA基因的突变延迟开花,该基因的正常作用是促进开花。网络图 20.8.B 显示了在非诱导光周期(短日照)中生长的野生型植物和 elf3突变植物。突变表型表明ELF3基因的正常作用是抑制开花。
网络图 20.8.B (由 K. Hicks 和 DR Meeks-Wagner 提供。)
探索这些基因作用的一种方法是通过嫁接研究。例如,如果来自具有延迟开花表型的突变植物的顶芽在嫁接到野生型枝条上时正常开花,则突变枝条顶端显然能够接收和响应开花信号。然后人们可能会怀疑这种突变会影响叶子产生开花信号。如果是这种情况,当嫁接到突变枝条上时,野生型枝条顶端区域应该表现出延迟开花。
这类嫁接研究已经确定了豌豆中的两种基因:控制可传播启动子和开花抑制剂产生的基因,以及控制茎顶端分生组织对这些信号的敏感性的基因(Reid 等,1996)。
例如,GIGAS基因被认为与可传播开花启动子的产生有关。野生型豌豆表现出定量的 LDP 表型。对于隐性gigas突变纯合的植物表现出严重延迟开花。例如,当在 16 小时的光周期下生长时,野生型在产生 16 片叶子后开花,而巨型突变体在产生 43 片叶子后开花。gigas植物延迟开花可能是由于抑制剂的存在或缺乏花刺激而引起的。
为了测试抑制剂,研究人员将早期开花日中性线的枝条嫁接到gigas砧木上。接穗的开花时间不受嫁接到突变体的影响,表明该突变体不产生开花抑制剂。然而,当将巨芽嫁接到早开花或野生型砧木上时,开花速度大大加快。这些植物不是在长出 40 片或更多片叶子后开花,而是分别在仅长出 14 片或 23 片叶子后开花(Beveridge 和 Murfet 1996)。
由于gigas突变体在嫁接后容易开花,因此其对来自叶子的开花刺激作出反应的能力不受突变的影响。因此,该突变被认为会影响花刺激物的产生。
阐明花诱导过程的另一种方法是分离由突变鉴定的基因并研究它们的特性。一旦基因被克隆,编码的蛋白质就可以在大肠杆菌中过度表达,并以足够的数量进行纯化,以研究其生化特性并产生特异性抗体。抗体可用于确定产生蛋白质的组织及其在细胞内的位置。定位可能为蛋白质的功能提供线索。例如,茎尖中的蛋白质可能参与开花信号的接收,而叶子中存在的蛋白质可能参与开花信号的产生。
拟南芥constans 突变体对日长不敏感,在长日照条件下开花晚于野生型。拟南芥的CONSTANS基因已被克隆并显示编码一种与锌指转录因子相似的蛋白质,这表明它充当转录调节剂(见教科书第 15 章)。野生型CONSTANS基因在叶片中表达,并且CONSTANS mRNA 水平在诱导光周期期间增加(Putterill 等人 1995)。
这种表达模式以及对光周期不敏感的突变表型表明该基因与开花的光周期控制有关。
WEB TOPIC 20.9光周期和春化对坎特伯雷钟开花的调控
在风铃培养基中表现出不同类型的行为(坎特伯雷钟)和其他一些物种:作用于叶子的短日照可以完全替代顶端的春化作用(网络图 20.9.A)。在这种情况下,春化和光周期似乎可以作为开花的替代途径。这两种途径之间的关系尚不清楚。一种可能性是春化可能使分生组织能够对在非诱导性长日光周期中形成的低水平花卉刺激作出反应。在诱导性短日光周期中,可能形成了足够高水平的花刺激,因此即使是能力降低的非春化分生组织也能够经历花转变。在这些情况下,春化和光周期相互作用以改变开花所需的能力阈值和花卉刺激水平。
Web 图 20.9.A 在 SDP风铃草培养基(坎特伯雷钟)中的开花控制。当连续长日照 (LD) 生长时,植物长成莲座状,茎不会伸长。八周的短日(SD)和长日导致伸长和开花。短短的几天可以用8周的低温代替。GA 3的施用导致茎伸长但不诱导开花。(来自 Wellensiek 1985 年的照片。)
WEB TOPIC 20.10花卉刺激物的自我繁殖特性
在至少三种情况下——苍耳属(SDP)、苔藓属 ( SLDP ) 和硅烯(LDP)——诱导状态似乎是自我传播的 (Zeevaart 1976)。也就是说,在受体植物被供体叶子诱导开花后在受体植物上发育的幼叶本身可以用作随后的嫁接实验中的供体叶子,即使这些叶子从未经历过诱导光周期。这种现象称为间接感应。
间接诱导的特点是即使在将新的供体连续嫁接到几株植物后,来自供体叶片的花刺激强度仍然保持不变(网络图 20.10.A)。这表明诱导状态以某种方式在整个植物中传播。尽管花刺激的这一特征有时被描述为类似病毒,但花刺激不太可能像病毒一样自我复制。相反,花刺激物很可能是一种在正反馈循环中诱导其自身产生的分子。在苍耳 ( Xanthium ) 中,从枝条中去除所有芽会阻止间接诱导,这表明分生组织或可能是生长素是诱导状态的传播所必需的。
Web 图 20.10.A苍耳和紫苏 中不同类型的叶片诱导。(A)苍耳子表现出间接诱导。诱导开花的植物的非诱导叶子能够诱导其他植物开花,即使它们从未接受过诱导光周期。这表明花卉刺激是自我繁殖的。(B) 在紫苏中,只有给予感应光周期的叶子才能作为花刺激的供体。在紫苏和苍耳子中,在连续的嫁接实验中,一片叶子可以继续诱导开花。(朗 1965 年)。
另一方面,在 SDP Perilla中不会发生间接诱导。在紫苏中,只有实际给予诱导光周期的叶子才能在嫁接实验中传递花刺激(参见网络图 20.10.A,B 部分)。因此,紫苏的花刺激物不会像苍耳子、苔藓植物和紫苏那样自我繁殖。紫苏叶中不存在正反馈回路的机制,或者花刺激物的易位仅限于分生组织,因此它永远不会进入叶子。
与需要有芽才能稳定诱导的苍耳子不同,紫苏叶即使从植物上脱落也能被稳定地诱导。一旦被诱导,紫苏叶就不能不被诱导,并且同一片叶子可以在连续的嫁接实验中继续作为花刺激的供体,而不会降低效力(Zeevaart 1976)。
WEB TOPIC 20.11赤霉素在不同开花环境要求的植物中诱导开花的例子
网络表 20.11.A
WEB TOPIC 20.12在其他物种中发现 ABCE 模型的变体
虽然 ABCE 模型是根据拟南芥和金鱼草(金鱼草)的基因实验制定的,但它的大部分价值源于它可以帮助我们了解花在不同植物中的具体特征。来自不同物种的花已经进化出多种结构,这似乎是通过修改 ABCE 模型描述的基础调控网络来实现的。例如,在百合科中,外部的两个轮生包含称为花被片的花瓣状结构,而不是萼片和花瓣,然后是雄蕊和心皮(网络 图 20.12.A,a 部分)。在郁金香 ( Tulipa gesneriana ) 的 ABCE 模型的背景下理解这种形态) 花,有人提出郁金香中的 B 基因活性已扩散到第 1 轮,从而使萼片更像花瓣。后来,当在郁金香中鉴定出 B 类基因时,事实证明确实如此:B 类基因GLO、DEFA和DEFB都在外轮中表达(Web 图 20.12.A,b 部分) )。
网页图 20.12.A
水稻和草科其他成员的花朵与拟南芥的花朵更加不同(网络 图 20.12.B,a 部分)。花被称为颖片的两个基部苞片包围。花的最外面的轮生由称为外稃和内稃的鳞片状结构组成。下一个轮由舌片组成,一组两个或三个额外的鳞片状结构,然后是雄蕊和心皮。对水稻和玉米的研究表明,B 类基因在禾本科植物和真双子叶植物中是相似的:这些基因指定了花片和雄蕊的身份,就像 B 类基因指定真双子叶植物的花瓣和雄蕊的身份一样(参见网络图20.12.B,b) 部分。水稻中单个 AP3/DEF 样基因的缺失(SUPERWOMAN1突变体)导致浆片被内稃样器官取代,雄蕊被心皮取代。这些同源异型转变类似于在拟南芥和金鱼草B 类突变体中观察到的转变,表明内稃和外稃与萼片同源,浆片与花瓣同源。水稻还含有 C 类基因MADS3,这是雄蕊形成所必需的。另一个基因,DROOPING LEAF ( DL ),它编码一个包含锌指和螺旋-环-螺旋结构域的 YABBY 转录因子,是水稻心皮形成所特别需要的。
网页图 20.12.B
WEB TOPIC 21.1进化有利于植物生命周期中的二倍体
陆地植物可能是从淡水藻类祖先进化而来的,其生命周期与现存的轮藻(如 Charophycean algae)相似。),与陆地植物关系最密切的藻类分类单元。这些藻类具有产生配子的多细胞单倍体。受精后,二倍体合子,唯一的孢子体阶段,直接进行减数分裂,产生单倍体孢子。在原始的非维管陆生植物中,如地钱、苔藓和金缕梅,单倍体配子体世代仍然是唯一的自由生活世代,但二倍体孢子体阶段已经变得更大和多细胞。从维管植物开始,二倍体孢子体开始自由生活,成为优势世代。种子植物具有最精细的孢子体和最减少的依赖配子体,代表了从单倍体为主向二倍体为主的生命周期转变的最后阶段。
在植物生命周期中推动从单倍体向二倍体转变的选择性优势仍在争论中。一个潜在的优势是杂合二倍体通过显性野生型等位基因的存在“掩盖”有害隐性突变的影响的能力。第二个优点是当孢子体阶段是多细胞时,减数分裂/合子生殖系统产生更大的遗传多样性。减数分裂只能发生在二倍体细胞中,当二倍体生物变成多细胞时,减数分裂的细胞数量增加,遗传多样性的潜力大大增加。出于这个原因,性的进化被认为是进化的主要趋势之一。
WEB TOPIC 21.2水果中的胎盘类型
图 21.2.A图说明了胎盘的基本类型。A,E,单个心皮的纵切面,其中有两纵排胚珠(A),或一个胚珠基部着生(E);B、C,具有融合心皮的雌蕊横切面;D,横切面和纵切面可见游离中央型胎盘。[B—E 由 EL Core 从植物分类学中重新绘制。Prentice Hall, Englewood Cliffs, NJ 1955。](图来自:Gifford 和 Foster,1989。维管植物的形态和进化,第三版,WH Freeman。)
WEB TOPIC 21.3配子体发育的变化
与Polygonum类型的巨型配子体发育的偏差基于以下形态标准:
1.参与胚囊形成的大孢子或大孢子核的数量。
2.在大孢子和配子体形成过程中发生的分裂总数。
3.成熟胚囊中细胞核的数量和排列及其倍性水平。
根据大孢子的数量,胚囊可分为三种类型:单孢子、双孢子和四孢子(Web 图 21.3.A)。在单孢子或蓼型胚囊中,珠心中二倍体大孢子母细胞的减数分裂产生四个单倍体大孢子。三个大孢子,通常是珠心珠孔端的大孢子,随后经历程序性细胞死亡,只留下一个功能性大孢子。在双孢子在胚囊中,减数分裂只产生两个大孢子,每个大孢子都含有两个单倍体核,因为在第二次减数分裂后没有胞质分裂和细胞板形成。离珠孔最近的大孢子随后经历程序性细胞死亡,留下一个具有两个单倍体核的功能性大孢子。在四孢子胚囊中,细胞板在两次减数分裂后都不能形成,从而产生一个单一的四核大孢子。所有三种模式都会产生一个功能性大孢子,它包含一个(单孢子)、两个(双孢子)或四个(四孢子)单倍体核。请注意,双孢子胚囊和四孢子胚囊的细胞核在遗传上与单孢子胚囊不同,因为它们来自两种或四种不同的减数分裂产物。
Web 图 21.3.A大配子体发育的三种主要类型:单孢子、双孢子和四孢子。
WEB TOPIC 21.4水稻细胞质不育的分子机制
最近,研究人员阐明了广泛用于水稻育种的“野生流产”或CMS-WA水稻系统中细胞质雄性不育(CMS)的分子机制。最初于 1970 年代在一种野生稻种中发现,WA 细胞质已与驯化的稻种Oryza sativa回交,以产生目前用于生产杂交水稻种子的 CMS-WA 系。
CMS-WA 系中的雄性不育是由嵌合线粒体基因WA352引起的。该基因存在于 CMS-WA 系的每个细胞中,但只有花药受到影响。为什么?有两个因素限制了 WA352 蛋白对花药的作用:首先,WA352基因似乎在花药中特异性表达;其次,即使WA352在转基因植物的叶线粒体中表达,WA352蛋白也不能积累。换言之,WA352 蛋白在营养组织的线粒体中快速转换,而不是在花药的线粒体中。
WA352 如何导致花药细胞死亡?WA352 与另一种线粒体蛋白 OsCOX11 ( Oryza sativa COX11) 相互作用,并抑制其功能(图 21.4.A,中图)。OsCOX11 是细胞色素c氧化酶的组装因子,在线粒体呼吸中起关键作用。酵母中的cox11突变体表现出高水平的活性氧 (ROS)、线粒体释放细胞色素c和程序性细胞死亡。类似地,水稻花药线粒体中的 WA352 导致高水平的 ROS、细胞色素c释放到细胞质中,以及 ROS 诱导的花药绒毡层细胞程序性细胞死亡。因此,水稻花药中的 WA352 模拟了酵母中的COX11基因。
Web 图 21.4.A线粒体和细胞核编码的线粒体蛋白的相互作用赋予水稻雄性生育力或不育性。左图,正常的线粒体基因允许正常的 OsCOX11 功能,从而导致男性生育能力,无论恢复基因 ( Rf ) 基因型如何。中心,细胞质雄性不育 (CMS) WA 细胞质具有重新排列的线粒体基因组,导致产生 WA352 蛋白,该蛋白抑制 OsCOX11 功能,导致雄性不育。对,细胞核编码的 Rf3 和 Rf4 恢复剂分别降低了 WA352 蛋白和WA352 mRNA 水平,从而恢复了男性的生育能力。(根据红马 2013 年。)
当 CMS 系用于杂交种子生产时,不向受精卵提供线粒体的花粉供体必须携带能够恢复生育力的核基因,这样杂交种子才能产生自交植物(图 21.4.B)。这些核基因被称为生育力恢复者(Rf) 基因。这些基因中的绝大多数包含称为五肽重复序列 (PPR) 的简并 35 个氨基酸重复序列的串联阵列。在植物中,由该基因家族成员编码的蛋白质(在拟南芥中数量超过 400 个)在叶绿体和线粒体中都起作用。PPR 蛋白是正常细胞器转录物的正确加工和翻译所必需的,但它们也能够使 CMS 植物中发现的重排嵌合转录物失活,从而逆转 CMS 表型。
Web 图 21.4.B在植物育种中使用细胞质雄性不育 (CMS) 系。该育种系统使用三个独立的系:细胞质遗传雄性不育系(CGMS系)或A系;a 维持系或 B 系,具有正常的细胞质、可育花粉和隐性生育恢复基因以维持 CMS;以及具有显性育性恢复基因的恢复系或R系以产生杂交种子。
在西澳水稻中,雄性生育力可以通过Rf3或Rf4基因恢复。这两个基因都显着降低了 WA 水稻花药中 WA352 蛋白的含量,但它们通过不同的机制发挥作用。Rf4 蛋白似乎在转录或转录后起作用以降低WA352转录水平,而 Rf3 似乎在翻译或翻译后起作用以防止 WA352 蛋白积累(参见教科书图 21.4.A,中图)。
WEB TOPIC 21.5各种类型的无融合生殖
植物中有两种类型的无融合生殖,这取决于未还原(二倍体)细胞的命运。这两种类型都出现在胚珠的二倍体体细胞组织中。如果未减少的细胞直接产生胚胎,这种类型的无性种子生产被称为孢子体无融合生殖。如果未减少的细胞产生二倍体胚囊,则该过程称为配子体无融合生殖。网络图 21.5.A比较了被子植物胚珠中的有性和无融合生殖途径。区分有性途径和无生殖途径的重要因素是未减少的体细胞的减少分裂或减数分裂。
Web 图 21.5.A被子植物中性途径和无融合生殖途径的比较。A 部分来自:http ://agritech.tnau.ac.in/crop_improvement/crop_imprv_repmode.html 。(另见 Koltunow, A., RA Bicknell 和 AM Chaudhury。1995。无融合生殖:无需受精即可产生遗传相同种子的分子策略。植物生理学。108:1345-1352。)
孢子体无融合生殖,也称为不定胚,是一个或多个营养胚在珠心或胚珠外皮内形成的过程。在大多数情况下,孢子体无性生殖不会干扰珠心中正常胚囊的形成,事实上,它甚至可能受到授粉和双受精的刺激。然而,通常情况下,无融合生殖胚胎之一会侵入胚囊并与有性胚胎竞争来自胚乳的营养。尽管孢子体无性生殖在被子植物中很少发生,但在柑橘中很常见,并且通常与多个胚胎或多胚有关(Web 图 21.5.B )。
Web 图 21.5.B作为多胚的结果,从单个橘子种子长出多株幼苗。照片提供:http: //jerry-coleby-williams.net/2012/08/25/natural-cloning-mandarin-style/polyembryony-triple-mandarin-embryo-citrus-reticulata-parramatta-sweets-2-2/
与孢子体无性生殖不同,配子体无性生殖产生胚囊而不是胚胎。因为它们是从未减少的细胞发育而来的,所以这些胚囊由二倍体细胞组成。在已知表现出配子体无融合生殖的植物中,约 75% 属于菊科、蔷薇科和禾本科三个科。有两种类型的配子体无性生殖:双孢子和无孢子。在双孢子中,胚囊直接从未减少的大孢子母细胞发育而来。在孢子中,珠心中的不同细胞产生胚囊。在这两种情况下,二倍体卵细胞在没有受精的情况下发育成胚胎,这一过程称为孤雌生殖(字面意思是“处女出生”)。二倍体协同细胞和反足细胞也有可能形成胚胎,在这种情况下,这个过程被称为无配子(参见网络图 21.5.A)。通常,双孢无融合生殖在胚珠内包含单个胚囊,而无孢无融合生殖则产生多个胚囊。因此,多胚可以由孢子体或配子体无融合生殖产生。
由于双孢子等机制直接依赖于减数分裂前体的异常分裂,因此影响减数分裂的突变有可能揭示无融合生殖的过程。尽管已经研究了许多候选基因,但迄今为止还没有发现无融合生殖的机制。
WEB TOPIC 21.6三种胚乳发育
被子植物的胚乳发育分为三种类型:核型、细胞型和圆形(网络图 21.6.A)。在最常见的游离核型中,初生胚乳核反复分裂而不形成壁,在中央细胞质内产生大量游离核(参见 Web 图 21.6.A[a])。同时出现一个中央液泡,将细胞核推到同胞细胞的外围。然后液泡尺寸减小并最终随着细胞核和细胞质的增殖而消失。最后,多核细胞质细胞化以产生多细胞组织。在某些情况下,如椰子,细胞化是不完整的。
在胚乳发育的细胞类型中,所有的核分裂都伴随着细胞壁的形成,因此胚乳从一开始就是细胞的(参见网络图 21.6.A[b])。具有细胞胚乳的植物的例子包括凤仙花、曼陀罗和矮牵牛。日光型胚乳发育是一种罕见的介于核型和细胞型之间的中间形式(参见网络图 21.6.A [c])。在大多数具有圆形胚乳的植物中,初生胚乳核的第一次分裂伴随着水平壁的形成。胚囊珠孔端的细胞随后经历多轮自由核分裂,而合点端细胞中的细胞核可能停止分裂或仅分裂一次或两次。各种被子植物属表现出圆形胚乳,包括Asphodelus (asphodel)、Muscari (grape hyacinth)、Saxifraga和Echium (琉璃苣)。最近的研究已经认识到所有三种类型的胚乳的许多变体(Floyd 和 Friedman 2000)。
Web 图 21.6.A传统上公认的三种胚乳类型。(来自弗洛伊德和弗里德曼,2000 年)。
WEB TOPIC 21.7水果类型和例子
WEB TOPIC 22.1脱落与农业的黎明
我们所知道的文明完全依赖于丰富的食物供应,而这只能由农业提供。在农业发展之前,人们生活在小型游牧群体中,他们的迁徙模式遵循来自野生动植物的食物的季节性供应。从狩猎和采集到耕种和畜牧业的转变导致建立了人口不断扩大的永久定居点。这种转变被认为是人类历史上最重要的(并且被某些人认为是最灾难性的!)文化变革,在世界各地至少独立进行了七次(Smith 1995)。
在被称为新月沃地的近东地区发现了一些最早定居点的遗迹,这是一片广阔的草原和林地拱形带,始于地中海东部边缘,向东弯曲约 2000 公里,到达扎格罗斯山脉。世界上已知最古老的农业定居点之一位于古城杰里科,位于约旦河谷现代城市杰里科以北 14 英里处。在这里,考古学家发现了大约 10,000 年前发生的从狩猎和采集向农业过渡的证据(Smith 1995)。
从狩猎和采集向农业过渡的第一步是驯化动植物。新月沃地的七种主要驯化品种是大麦、二粒小麦、单粒小麦、绵羊、山羊、牛和猪。其中最先被驯化的是谷物。地中海地区的谷物特别充足,适合驯化。在世界上 56 种大种子草中,有 32 种在地中海地区野生生长。最近的 DNA 分析已确定土耳其卡拉卡达格山脉附近的地区可能是单粒小麦的原产地(Heun 等,1997)。
所有证据表明,小麦和大麦在 10,000 至 9700 BP 之间仅经过 2 或 3 个世纪的驯化(Smith 1995)。考虑到即使是当今最原始的小麦和大麦驯化形式与它们的野生祖先之间也存在大量的形态和生理差异,很难想象仅通过自然选择会在如此短的时间内发生如此多的变化。显然,必须进行某种类型的人工选择(最有可能由女性进行)以加速进化过程。考古学家和植物学家试图重建这个选择过程。
在野生和驯化谷物之间的所有解剖学和生理学差异中,有两个被认为是最重要的。首先是种子休眠的丧失——某些种子在种植在潮湿的土壤中时无法发芽,除非给予额外的环境信号,例如寒冷或光照。植物驯化过程可能始于临时定居点附近种植的小花园地块。很容易想象游牧群体如何选择种子休眠的丧失,因为发芽和生长迅速的种子比发芽延迟的种子更有可能被收集。
在谷物驯化过程中发生的第二个关键变化是强壮的轴的发育。轴是小麦和其他谷物的花序或穗的主轴,小穗附着在其上。小穗是带有一个或多个小花或小花的小花序,以及一组微型苞片状的叶子。授粉后,果实(颖果)在小穗内发育。当野生型小麦的颖果完全成熟时,会形成一系列脱落层,将轴分成分散单元,由一个小穗连接到一小段轴上(网络图 22.1.A)。这个轴的分离从花序的顶部开始并向下延伸。因此,一棵成熟的野生小麦在被风触摸或吹动时很容易破碎成散布单元,考古学家将其称为易碎的穗轴。
Web 图 22.1.A 单粒 小麦的野生与驯化形式。野生品种的小穗在靠近轴的脱落区从成熟的头部脱落,在脱落的小穗上留下光滑的脱落痕。相比之下,具有坚韧的轴的驯化品种的脱落带不能正常发育,小穗一直留在头上,直到脱粒释放。请注意,小穗下方的羽轴断裂会留下粗糙的边缘,这往往会阻碍进入地面。
从人类的角度来看,易碎的轴是非常不受欢迎的特征。想象一下一个小型游牧群体的困境,他们精心安排了旅行时间,以配合野生谷物的成熟。由于轴非常脆弱,因此在接近成熟时间但在轴脱离之前到达是至关重要的。一个轻微的误判可能会给团队带来灾难。来得太晚,迎接他们的是一片贫瘠的秸秆,只剩下一把残粒。然而,作为一种安慰,他们可能会发现由于轴的脱落层未能发育而保持完整的罕见突变尖峰。这种特性被考古学家称为坚韧的轴. 如果随后收集具有坚韧轴表型的突变体并将其种植在花园中,它们的数量会随着时间的推移而增加。
选择坚韧的轴的第二种情况涉及收获方法。收割小麦最有效的方法是从麦秆的基部切掉,有证据表明,为此目的使用了带燧石的镰刀。然而,割收野麦必须在离层形成之前进行,否则易碎的麦穗会破碎,它们的小穗会飞到地上。因此,这种收获方法将有利于选择延迟脱落过程的突变。Hillman 和 Davies (1990a, 1990b) 在田间试验中证明,经过许多代,种群将被具有坚韧穗轴的品种所支配。一旦切割,这些小麦品种的茎就会被运送到另一个地方,
野生谷物的突变率是否足够快,足以解释它们在短短 200 到 300 年的时间内被驯化的原因?Sharma 和Waines (1980) 已经确定两个基因位点与单粒小麦的硬穗轴特征的进化有关。即使我们假设每百万个野生型小麦植物中只有一株发生将易碎的轴转变为坚硬的轴的突变,Hillman 和 Davies (1990a, 1990b) 估计具有坚硬轴的品种将成为主要形式在人类管理仅 200 年之后,野生小麦种群中的含量。更高的突变率将大大缩短这一时间,可能在 20 年内。
因此,实验结果和计算与考古证据非常吻合。新月沃地的农业最终导致了希腊和罗马以及所有西方文明的建立,始于控制脱落的基因突变。
WEB TOPIC 24.1角质、蜡和木栓质
角质,蜡和木栓质
所有暴露在大气中的植物部分都涂有脂质材料层,可减少水分流失并有助于阻止病原真菌和细菌的进入。涂层的主要类型是角质、木栓质和蜡(Web 图 23.1.A)。大部分地上部分都有角质;木栓质存在于地下部分、木质茎和愈合的伤口上。蜡与角质和木栓质都有关。
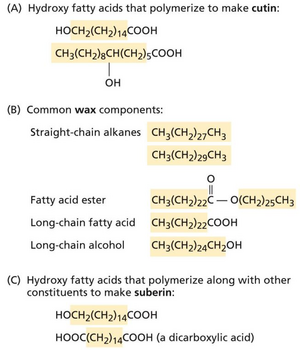
角质、蜡和木栓质由疏水化合物组成
角质Cutin 是一种大分子,一种由许多长链脂肪酸组成的聚合物,这些脂肪酸通过酯键相互连接,形成一个刚性的三维网络。角质由 16:0 和 18:1 脂肪酸形成,羟基或环氧基位于链的中间或与羧酸功能相对的末端(参见 Web 图 23.1.A,顶部)。
角质是角质层cuticle的主要成分,角质层是一种多层分泌结构,覆盖所有草本植物地上部分的表皮外细胞壁(Web 图 23.1.B)。角质层由一层蜡质外层、一层厚厚的嵌在蜡中的角质(the cuticle proper)、一层混在细胞壁的果胶、纤维素中的蜡和角质(the cuticular layer)。有人提出,除了角质之外,角质层还可能含有由长链碳氢化合物组成的第二种脂质聚合物,它被命名为cutan (Jeffree 1996)。
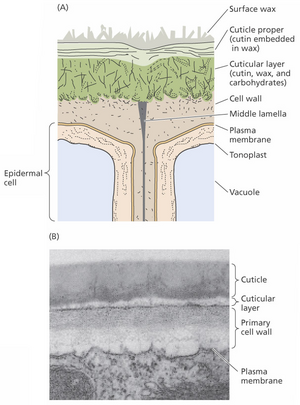
蜡不是大分子,而是极其疏水的长链酰基脂质的复杂混合物。蜡最常见的成分是 25 到 35 个碳原子的直链烷烃和醇(参见图23.1.A,中间)。长链醛、酮、酯和游离脂肪酸也存在于蜡中。角质层的蜡是由表皮细胞合成的。它们将这些细胞以液滴的形式留下,通过一种未知的机制穿过细胞壁上的孔隙。形成角质层外涂层的蜡通常以复杂的棒状、管状或板状结晶(网络图 23.1.C)。这些微结构的某些图案通过增加蜡表面的粗糙度来增强防水性。这种粗糙度可以防止水形成大的接触面积,并因此无法粘附到,已经疏水的表面。因此,水滴在接触后立即形成并带走污染颗粒,清洁植物表面(Neinhuis 等人,1992 年)。这种现象最早是在豆科莲花的叶子上描述的Lotus japonicus ,* 因此,它有时被称为“莲花效应”。
Suberin是一种聚合物,其结构知之甚少。与角质一样,木栓质由通过酯键连接的羟基或环氧脂肪酸形成。然而,木栓质与角质的不同之处在于它具有二羧酸(参见 Web 图 23.1.A,底部)、更多的长链成分以及作为其结构一部分的大量酚类化合物。
Suberin 是一种细胞壁成分,存在于整个植物的许多位置。我们已经注意到它存在于根内皮层的凯氏带中,它在皮层的质外体和中柱之间形成了一道屏障(见教科书第 4 章)。Suberin 是所有地下器官外侧细胞壁的主要成分,与周皮的软木细胞有关,软木细胞是木本植物二次生长过程中形成茎和根外皮的组织。木栓质也在叶片脱落部位和因疾病或受伤而受损的区域形成。
角质、蜡和木栓质有助于减少水分流失和病原体入侵
角质、木栓质和它们相关的蜡在植物与其环境之间形成屏障,起到保持水分和病原体进入的作用。角质层在限制植物地上部分的水分流失方面非常有效,但它并不能完全阻止蒸腾作用:即使气孔关闭,也会流失一些水分。角质层的厚度随环境条件而变化。原生于干旱地区的植物物种通常比来自潮湿栖息地的植物具有更厚的角质层,但是来自潮湿栖息地的植物在干燥条件下生长时通常会形成厚的角质层。同样,同一冠层的阳叶和阴叶往往表现出不同的角质层厚度。
角质层和深孔组织在排除真菌和细菌方面都很重要,尽管它们在病原体抗性方面的重要性似乎不如其他一些防御措施,例如植物抗毒素的产生和过敏反应。许多真菌通过机械方式直接穿透植物表面。其他人产生角质酶,一种水解角质并因此有助于进入植物的酶。
*不要与睡莲科的水生莲花相混淆。
