第九章 运动功能的组织
学习目标
完成本章学习后,学生应能回答以下问题:
- 什么是运动神经元(motor neuron)?α和γ运动神经元有何不同?
- 什么是运动单位(motor unit)?"大小原则(size principle)"如何解释运动单位的有序募集?
- 什么是反射(reflex)?为何反射对临床和科学理解具有价值?
- 肌梭(muscle spindle)感知肌肉的哪些状态信息?哪些传入纤维(afferent fiber)将这些信息传递至中枢神经系统(CNS)?
- γ运动神经元如何调控肌梭的反应?
- 基本脊髓反射的传导通路和功能是什么?
- 什么是中枢模式发生器(central pattern generator, CPG),它可用于哪些类型的运动?
- 在运动控制中,内侧和外侧下行通路的传导通路有何区别?
- 什么是去大脑僵直(decerebrate rigidity),它对肌张力的控制有何影响?
- 皮层运动区之间有何区别特征?
- 运动皮层神经元活动编码了哪些运动参数?
- 小脑的苔状纤维和橄榄小脑(攀爬)纤维传入系统在起源、拓扑结构和突触连接方面有何组织差异?
- 小脑皮质主要细胞元件之间的几何关系是怎样的?
- 浦肯野神经元(Purkinje neurons)的简单锋电位(simple spikes)和复杂锋电位(complex spikes)是什么?
- 基底神经节的直接通路(direct pathway)和间接通路(indirect pathway)是什么?它们的活动如何影响运动?
- 帕金森病(Parkinson disease)和亨廷顿病(Huntington’s disease)中直接通路与间接通路的活动平衡如何改变?
- 前庭-眼反射(vestibulo-ocular reflex)和视动反射(optokinetic reflex)如何协同稳定凝视?它们如何互补?
- 扫视(saccades)和平滑追踪运动(smooth pursuit movements)在视觉跟踪中起什么作用?
- 什么是眼球震颤(nystagmus)?正常个体中哪些类型的感觉刺激可诱发眼球震颤?
- 参与运动控制的中枢神经系统(CNS)各区域的躯体拓扑组织(somatotopic organization)是怎样的?
运动是人类与外界互动的主要方式。大多数活动——包括奔跑、伸手取物、进食、说话、书写和阅读——最终都涉及运动行为。运动控制是中枢神经系统(central nervous system, CNS)的主要任务,可定义为生成信号以协调身体和头部肌肉的收缩,从而维持姿势或产生运动(两种姿势之间的转换)。毫不意外,中枢神经系统的很大部分都参与运动控制。
由于神经系统的大部分区域参与运动控制,神经系统的损伤或疾病常导致运动功能的某些方面受损。相反,特定的运动症状有助于定位受损或功能障碍的区域——运动功能评估已被证明是一种重要的无创临床工具。
本章将逐一描述参与运动控制的主要中枢神经区域,从脊髓开始,接着是脑干、大脑皮层、小脑和基底神经节。眼动因其重要性及产生所需的特殊回路,将在本章末尾讨论。尽管每个中枢神经区域被单独描述,但这些区域并非孤立运作,大多数运动源自多个脑区的协同作用。例如,脊髓反射虽由脊髓局部回路介导,但仍可被下行运动指令所调控;而几乎所有源于大脑活动的自主运动,最终都是通过激活脊髓回路(或头面部肌肉对应的脑干核团)产生的。
脊髓组织的原理
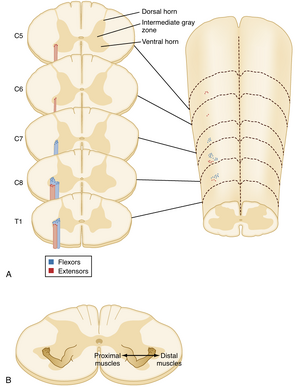
脊髓呈圆柱形,其中白质位于浅表,灰质则深埋于白质外壳之下。灰质形成连续柱状结构,纵贯脊髓全长。然而,进出脊髓的神经根聚集成离散的神经束,这些神经束构成了脊髓特定节段命名的依据(8个颈段、12个胸段、5个腰段、5个骶段和1个尾段)。在横截面上观察时,灰质柱通常呈H形或蝶形结构。这些"蝶翼"被分为背角(dorsal horn)和腹角(ventral horn),二者由中间带(intermediate zone)分隔(图9.1)(在某些脊髓节段还存在小的侧角,详见第11章)。如先前所述(第7章),背角是传入感觉信息的主要接收区,也是上行感觉通路(如脊髓丘脑束;参见第7章脊髓丘脑束)的主要起源。腹角是运动神经元(motor neurons)的所在部位,因此主要承担运动功能。相应地,它也是来自大脑的下行运动通路的主要靶点。构成脊髓腹角的运动神经元与脑神经核的运动神经元具有相似特征和组织原则,分别控制躯干肌肉以及头颈部肌肉。
躯体运动神经元
运动神经元是投射到肌细胞的神经元。由于运动神经元是中枢神经系统活动控制肌肉活动的唯一途径,因此被称为最后共同通路(final common pathway)。运动神经元分为两类:激活骨骼肌的躯体运动神经元,以及支配平滑肌和腺体并主要无意识发挥作用的自主运动神经元。本章中"运动神经元"特指躯体运动神经元;自主运动神经元将在第11章讨论。根据轴突直径,支配躯体骨骼(横纹)肌的躯体运动神经元主要分为两类:α运动神经元和γ运动神经元。
α运动神经元(α Motor Neurons)
α运动神经元是大型多极神经元,直径可达70μm(图4.10A)。其轴突通过腹根离开脊髓,或通过颅神经离开脑干,经周围神经分布至相应骨骼肌。在离开中枢神经系统(CNS)前,α运动神经元轴突会发出侧支投射至其他神经元。主轴突终末通过突触连接梭外肌纤维(extrafusal fibers),这些突触称为神经肌肉接头(neuromuscular junctions, NMJs)或运动终板。梭外肌纤维是构成骨骼肌主体的大肌纤维,负责产生收缩力(肌肉中还含有梭内肌纤维(intrafusal fibers),其功能将在本章后文及第12章详述)。
从CNS发出的运动神经元投射模式具有关键功能特征:每个神经元的轴突仅支配一块肌肉,但会在该肌肉内分支支配多个肌纤维。哺乳动物中,每个梭外肌纤维仅受一个α运动神经元支配。因此运动单位(motor unit)可定义为α运动神经元及其轴突支配的所有骨骼肌纤维的集合。运动单位是运动的基本功能单位,因为在正常情况下,α运动神经元的放电会引发该运动单位所有肌纤维的激活和收缩。如第6章所述,神经肌肉接头的安全系数(safety factor)大于1,因此运动神经元轴突的每个动作电位都会触发运动单位内所有肌纤维的动作电位。
重要原则是:不同肌肉的运动单位平均大小(即单个轴突支配的肌纤维数量)存在差异,这取决于对肌肉精细控制的需求。例如眼肌等需要精细控制的肌肉中,单个α运动神经元可能仅支配数个肌纤维;而在股四头肌等近端肢体肌肉中,单个α运动神经元可支配数千个肌纤维。
特定运动单位所属的肌纤维称为肌单位(muscle unit)。同一肌单位的所有肌纤维具有相同的组织化学类型(即均为慢缩型[type I]或快缩型[type IIA或IIB]纤维)。关于肌纤维类型的详细描述参见第12章。本章需重点了解的是:多种生理特性与此组织化学分类体系相关。具体而言:
- 慢缩型纤维:如其名所示,收缩和舒张速度缓慢,产生较低收缩力,但基本不会疲劳
- 快缩型纤维:收缩和舒张迅速,产生较大收缩力,但以不同速率发生疲劳
在许多情况下(无论是自主运动、反射动作还是维持姿势),首先被激活的往往是轴突最细小的运动单位。这些运动单位包含慢缩型纤维,因此产生的收缩力最小,使得初始收缩可被精细分级。这些单位倾向于持续或接近持续地活动,其抗疲劳特性具有重要功能意义。
随着更多运动单位(motor unit)被募集参与运动行为,具有更大轴突的运动神经元会逐步参与,这些轴突与快缩肌纤维形成突触连接,从而产生逐步增强的张力。这类最强大的运动单位通常仅在需要极大力量的任务中被募集(例如短跑、跳跃和举重),而这些任务人类只能维持短时间执行。
运动单位的有序募集帮助中枢神经系统(CNS)产生大范围的力值,并在不同力值水平保持相对精准的控制。这种募集模式被称为大小原则(size principle),因为运动单位是按运动神经元轴突尺寸的顺序被募集的。该原则基于小运动神经元比大运动神经元更易被激活的特性。回忆一下,当兴奋性突触激活时,它会打开突触后膜的通道并引发兴奋性突触后电流(excitatory postsynaptic current, EPSC)。根据欧姆定律,相同大小的EPSC在小运动神经元的轴突起始段会产生比大运动神经元更大的电位变化,这主要是因为小运动神经元的膜电阻更高。由于中枢神经系统的兴奋性突触后电位(EPSPs)幅度较小且需要叠加才能达到触发动作电位的阈值,当突触激活水平从零逐渐升高时,小运动神经元的去极化会更快达到动作电位阈值。虽然大小原则通常成立,但存在例外情况,此时下行运动通路可能需要对不同大小的运动神经元提供不同水平的突触驱动。
γ运动神经元(γ Motor Neurons)
γ运动神经元(γ motor neuron)比α运动神经元(α motor neuron)小,其胞体直径约35 μm。支配特定肌肉的γ运动神经元与支配同一肌肉的α运动神经元位于脊髓前角的相同区域。γ运动神经元不支配梭外肌纤维(extrafusal muscle fiber),而是与称为梭内肌纤维(intrafusal muscle fiber)的特化横纹肌纤维形成突触,这些纤维贯穿嵌入骨骼肌的感受器——肌梭(muscle spindle)。γ运动神经元的功能是调节这些感受器的敏感性(后文详述)。
腹角中运动神经元的拓扑组织
脊髓中运动神经元的空间分布具有拓扑组织形式。体内特定骨骼肌由位于腹角的α(alpha)运动神经元群(称为运动核)所支配。每个运动核呈现为沿头尾方向延伸的柱状结构,可跨越多个脊髓节段(见图9.1A)。支配躯干轴肌的运动神经元共同形成一个纵贯脊髓全长的神经元柱。在颈膨大和腰骶膨大处,这些神经元位于腹角的最内侧部分;在其他节段,它们构成整个腹角。支配四肢肌肉的运动神经元位于颈膨大和腰骶膨大处,形成轴肌支配柱外侧的神经元柱。支配肢体远端肌肉的运动神经元位于最外侧,而支配近端肌肉的神经元则位于更内侧(见图9.1B)。此外,支配屈肌的运动神经元位于支配伸肌的神经元背侧。需注意,支配同一肌肉的α和γ运动神经元在运动神经元柱内是混合分布的。
膨大部位与运动神经元连接的中间神经元也呈现类似的拓扑结构。总体而言,支配四肢肌肉的中间神经元主要位于背角深层的侧部以及背角与腹角之间的中间区域;而支配轴肌的中间神经元则位于腹角内侧部。所有这些中间神经元均接受来自初级传入纤维和脑下行通路的突触连接,因此它们既是脊髓反射弧的组成部分,也参与下行运动控制通路。
中间神经元系统的一个重要特征是:位于外侧的中间神经元同侧投射至支配肢体远端或近端肌肉的运动神经元,而内侧中间神经元则双侧投射。外侧中间神经元的这种排列方式使得肢体能够被独立控制。相比之下,内侧中间神经元的双侧分布实现了控制中轴肌(axial muscles)运动神经元的双侧协调,这些肌肉为躯干和颈部提供姿势支撑。
脊髓反射
尽管运动神经元是中枢神经系统(CNS)到肌肉的最终共同通路,因此决定了神经活动如何转化为肌肉收缩,但每个运动神经元仅直接作用于单个肌肉。然而,正常运动(或姿势)几乎不可能是由单个肌肉的孤立收缩引起的。它们反映的是大肌群的协调活动。例如,肘关节屈曲涉及屈肌(如二头肌)的初始爆发性活动,以及伸肌(如三头肌)的松弛。随后出现的是三头肌的爆发性活动,接着是二头肌的第二次爆发性活动,以使屈曲运动在预定位置停止。此外,肘关节屈曲过程中还会激活其他肌肉以维持整体平衡和姿势。
如肘关节屈曲的例子所示,运动中各肌肉扮演不同角色:(1)发起并主导运动的肌肉称为主动肌(agonist);(2)与主动肌作用相似的肌肉称为协同肌(synergist);(3)活动与主动肌作用相反的肌肉称为拮抗肌(antagonist);(4)最后,肌肉可作为固定肌(fixator)使关节固定并维持姿势。这些不同肌肉作用之间的关系也取决于具体执行的运动。例如,在肘关节屈曲时,Triceps作为Biceps的拮抗肌;而在前臂旋后(supination)时(若肘关节不发生旋转),同样具有旋后功能的Biceps再次成为主动肌,此时Triceps则扮演肘关节固定肌的角色。
运动控制需要灵活地联结(或解除联结)连接不同肌肉的运动神经元群的活动。脊髓环路是中枢神经系统实现这一运动控制功能的主要机制。事实上,来自大脑的下行通路主要靶向脊髓中间神经元,尽管也存在直接与运动神经元形成突触的下行轴突。
脊髓环路具有多个组织层级 。最基本的层级是节段水平(segmental level):即主要局限于单个或相邻几个节段的环路,且该环路在多个节段重复出现。后文将讨论的基础脊髓反射(即肌伸张反射、反肌伸张反射和屈曲反射)均由此类环路介导。 叠加在这种节段性结构之上的是脊髓固有系统(propriospinal system),即一系列轴突在脊髓内上下走行以连接不同节段的神经元。该系统协调不同脊髓节段的活动,这对涉及前肢和后肢的行为(如运动)至关重要。 最后,还存在与这些脊髓环路相互作用的下行运动通路(descending motor pathways)。这些通路传递与自主运动相关的信号,同时也对运动功能中更自动化(或无意识)控制的方面(如肌张力调节)起重要作用。
脊髓环路参与机体的所有运动,但其研究主要基于反射。反射(reflex)是对诱发刺激产生的快速、可预测、无意识且模式固定的反应。由于这些特性,脊髓反射被用于: ①识别和分类脊髓神经元 ②确定其连接方式 ③研究其反应特性。理解脊髓反射对认识脊髓功能至关重要。
反射的神经基础称为反射弧。反射弧可分为三部分:
- 传入支(afferent limb)(感觉受体和轴突):将信息传递至中枢神经系统
- 中枢成分(central component)(中枢神经系统内的突触和中间神经元)
- 传出支(efferent limb)(运动神经元):引发运动反应
例如,用反射锤轻敲髌腱会短暂拉伸股四头肌(刺激),激活感觉受体(肌梭中的Ia类纤维);感觉受体的激活向脊髓发送兴奋性信号(中枢处理),激活投射回股四头肌的运动神经元,引发收缩并产生踢腿动作(模式化反应)。个体能感知踢腿动作,但该过程是无意识的。
刺激与反应的可预测关联使反射成为临床医生和神经科学家研究脊髓功能的重要工具。但需注意:不能将特定神经元的功能局限地理解为仅参与特定反射,因为这些神经元同时也是下行运动通路的作用靶点,并参与自主运动的产生。
例如,屈曲反射弧的中间神经元同时也是运动中枢模式发生器的一部分。即使在反射弧传入支静息时,这些神经元仍可能保持活动状态。
在接下来的几个章节中,我们将详细讨论三个著名的脊髓反射。这些反射不仅阐明了脊髓回路和功能的重要特征,还具有重要的行为学和临床意义。当然,脊髓回路还介导许多其他反射(例如排尿反射(micturition reflex);见图11.3)。
肌牵张反射(Myotatic Reflex)或牵张反射(Stretch Reflex)
牵张反射(stretch reflex)正如其名所示,是由肌肉拉伸引发的一组运动反应。前文描述的膝跳反射(knee jerk reflex)就是其典型代表。该反射对于维持姿势至关重要,并能帮助克服自主运动过程中遇到的意外阻力。牵张反射的变化参与大脑指令的动作,其病理性改变是神经系统疾病的重要体征。相位性牵张反射(phasic stretch reflex)由肌肉快速、瞬时的拉伸引发,例如医生使用叩诊锤诱发的反射或运动过程中遇到意外阻力时产生的反射。紧张性牵张反射(tonic stretch reflex)则由较缓慢或持续的肌肉拉伸引发。负责启动牵张反射的感受器是肌梭(muscle spindle)。肌梭存在于几乎所有骨骼肌中,在精细运动控制的肌肉(如手部和眼部的小肌肉)中分布尤为密集。这种反射回路是调节肌肉活动的普遍机制。
肌梭(Muscle Spindle)的结构

肌梭(muscle spindle)正如其名,是一个梭形或纺锤形的器官,由一束特化的肌纤维组成,这些肌纤维接受丰富的感觉轴突和运动轴突支配(见图9.2)。肌梭直径约100μm,最长可达10mm。其神经支配部分包裹在结缔组织被膜内。肌梭位于普通肌纤维之间,通常靠近肌肉的肌腱附着处。肌梭的两端与肌肉内的结缔组织(肌内膜)相连。关键点在于:肌梭与普通肌纤维呈并联关系,因此能够感知肌肉长度的变化。
肌梭内的肌纤维称为梭内纤维(intrafusal fibers),以区别于构成肌肉主体的普通梭外纤维(extrafusal fibers)。单个梭内纤维比梭外纤维细得多,且不贯穿肌肉全长。其收缩力微弱,既无法显著影响肌张力,也不能直接引起肌肉整体长度的改变。
从形态学角度,肌梭内存在两类梭内肌纤维:核袋纤维(nuclear bag fibers)和核链纤维(nuclear chain fibers)(见图9.2B)。其命名源于纤维内细胞核的排列方式(肌纤维由发育过程中多个成肌细胞融合形成,故成熟肌细胞为多核细胞)。核袋纤维较核链纤维粗大,其细胞核在纤维中段(赤道区)聚集成簇,形似一袋橙子。核链纤维的细胞核则呈单行排列。从功能上,核袋纤维可分为bag1和bag2两种类型。如后文所述,bag2纤维在功能上与核链纤维相似。
梭内肌纤维(intrafusal fiber)的神经支配方式与由单一运动神经元支配的梭外肌纤维(extrafusal fiber)有显著差异。梭内肌纤维同时接受感觉和运动神经支配。其感觉神经支配通常包括单个Ia类传入纤维和数量不等的II类传入纤维(见图9.2B)。Ia类纤维属于直径最大的感觉神经纤维类别,传导速度为80~120米/秒;II类纤维直径中等,传导速度为35~75米/秒。Ia类传入纤维在肌梭内的每根梭内肌纤维上形成螺旋状终末结构,称为初级末梢(primary ending)。初级末梢可见于两种类型的核袋纤维(nuclear bag fiber)和核链纤维(nuclear chain fiber)。II类传入纤维则在核链纤维和bag2纤维上形成次级末梢(secondary ending),但不在bag1纤维上分布。初级和次级末梢具有机械敏感性通道,可感知梭内肌纤维的张力水平。
肌梭的运动神经支配由两种类型的γ运动轴突组成(见图9.2B)。动态型γ运动轴突(dynamic γ motor axon)终止于核袋1纤维(bag1 fiber),而静态型γ运动轴突(static γ motor axon)终止于核链纤维和核袋2纤维(bag2 fiber)。
肌梭检测肌肉长度变化
由于肌梭与梭外肌纤维平行排列,因此会随梭外肌纤维的牵拉或缩短而发生长度变化,从而响应肌肉长度的改变。与所有肌纤维类似,梭内肌纤维具有类似弹簧的特性,其长度变化会引起所受张力的改变,这种改变被Ia类和II类肌梭传入纤维的机械感受器所感知。非选择性阳离子通道Piezo2已被确认为主要转导通道,使肌梭感觉传入纤维能够感知肌肉长度变化时产生的机械应力改变。
图9.3显示了肌肉被牵拉时肌梭传入纤维活动的变化。可以明显看出Ia类和II类纤维对牵拉的反应存在差异。Ia类纤维既对肌肉牵拉程度敏感,也对其速率敏感;而II类纤维主要响应牵拉程度。因此,当肌肉被牵拉到新的更长长度时,II类纤维的放电频率随牵拉程度成比例增加(见图9.3左);当肌肉允许缩短时,其放电频率相应成比例降低(见图9.3右)。Ia类纤维也表现出类似的静态型反应,因此在稳态条件下(即肌肉长度恒定),其放电频率反映肌肉牵拉程度,这与II类纤维的表现相似。
当肌肉长度发生变化时,Ia组的放电反映了肌肉正在经历的拉伸或缩短速率。其活动在肌肉拉伸期间会超过基线水平,在肌肉缩短期间则低于基线(甚至可能停止)。这些反应被称为动态响应(dynamic responses)。这种动态敏感性(dynamic sensitivity)也意味着Ia组纤维的活动对瞬时和振荡性拉伸更为敏感,如图9.3中间图所示。特别值得注意的是"叩击模式"(tap profile),这对应于使用反射锤敲击肌腱时引起的附着肌肉短暂拉伸。肌肉长度的变化过于短暂,不足以引发II组纤维放电的显著改变,但由于这种刺激产生的变化速率(叩击曲线的斜率)极大,因此会在Ia组纤维中引发强烈的动态响应。因此,当使用反射锤敲击肌腱时,实际上是在评估涉及Ia组传入纤维的反射弧功能。更重要的是,这种反应的行为特征可以提供关于运动功能障碍来源的信息(例如中枢神经系统或周围神经系统,详见本章后续章节"下行运动通路损伤引起的运动缺陷")。
• 图9.3 初级末梢(primary ending)(Ia组)和次级末梢(secondary ending)(II组)对肌肉长度变化的反应。注意这些末梢在动态和静态响应特性上的差异。顶部波形表示肌肉长度变化,中间和底部分别显示Ia组纤维和II组纤维在不同肌肉长度变化期间的放电模式。
• 图9.4 γ运动神经元活动可以抵消卸载效应对肌梭传入纤维放电的影响。A,稳定拉伸期间肌梭传入纤维的活动。B,0毫秒时刺激α运动神经元引起梭外纤维收缩,导致肌肉缩短和张力增加,但肌梭上的张力被卸载,从而使传入纤维停止放电。放松后肌肉恢复原长度,梭内纤维张力恢复,Ia组传入纤维活动随之恢复。C,α和γ运动神经元共同激活使梭外和梭内纤维同时缩短,因此肌梭未发生卸载,传入纤维保持自发放电。(改绘自Kuffler SW, Nicholls JG. From Neuron to Brain. Sunderland, MA: Sinauer; 1976.)
γ运动神经元调节肌梭的敏感性
到目前为止,我们仅描述了在γ运动神经元(γ motor neuron)活动未发生变化时肌梭(muscle spindle)的行为方式。然而,肌梭的传出神经支配(efferent innervation)极为重要,因为它决定了肌梭对牵张(stretch)的敏感性。例如,在图9.4A中,显示了肌梭传入纤维(muscle spindle afferent fiber)在持续牵张期间的放电活动。如果仅有梭外肌纤维(extrafusal muscle fiber)收缩(这可以通过选择性刺激α运动神经元(α motor neuron)来实现;见图9.4B),肌梭会因肌肉缩短而卸载(unloaded)。此时,肌梭传入纤维可能停止放电,并对肌肉长度的进一步缩短失去敏感性。然而,如果同时刺激α和γ运动神经元,则可以防止肌梭的卸载。这种联合刺激使肌梭的梭内肌纤维(intrafusal muscle fiber)与梭外肌纤维同步缩短,从而维持梭内肌纤维赤道区的基线张力(baseline tension)(见图9.4C)。
值得注意的是,只有梭内肌纤维的两极区域会发生收缩;含有细胞核的赤道区由于缺乏收缩蛋白而不会收缩。然而,当两极区域收缩时,赤道区会被拉长并恢复其敏感性。反之,当肌肉松弛(α运动神经元活动降低)并被拉长(若其两端受到牵拉),同时γ运动神经元活动的减少允许梭内肌纤维也松弛(从而被拉长),从而避免梭内肌纤维中央区域的张力达到使传入纤维放电饱和的水平。因此,γ运动神经元系统使肌梭能够在广泛的肌肉长度范围内工作,同时保持对微小长度变化的高度敏感性。
在随意运动中,来自大脑的下行运动指令(descending motor command)通常会同时激活α和γ运动神经元,推测是为了维持肌梭敏感性,如前所述。这具有两个重要功能:第一,通过在肌肉长度变化时维持肌梭的敏感性,肌梭能够持续感知并向中枢神经系统(CNS)报告任何导致肌肉意外牵张的运动干扰,从而使CNS能够启动反射(见下一节)和随意运动的纠正。第二,若肌梭在运动过程中被卸载,这会通过Ia类反射弧(group Ia reflex arc)(见下一节)减少对主动肌(agonist muscle)α运动神经元的兴奋性驱动,从而阻碍预期运动的执行。
动态与静态γ运动神经元
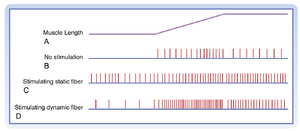
如前所述,γ运动神经元(γ motor neurons)分为动态型和静态型两种(见图9.2)。这使得中枢神经系统(CNS)能够对肌梭(muscle spindle)的敏感性进行精确调控。动态型γ运动神经轴突(dynamic γ motor axons)终止于核袋1型纤维(nuclear bag1 fibers),而静态型γ运动神经轴突(static γ motor axons)则与核链纤维(nuclear chain fibers)和核袋2型纤维(bag2 fibers)形成突触。激活动态型γ运动神经元时,Ia类传入纤维(group Ia afferent fibers)的反应增强,但II类传入纤维(group II afferent fibers)的活动不受影响;当静态型γ运动神经元放电时,II类传入纤维的反应性以及Ia类传入纤维的静态反应性均会增强。图9.5展示了刺激静态与动态纤维对Ia类传入纤维牵张反应的影响。下行通路(descending pathways)可优先影响动态或静态γ运动神经元,从而改变脊髓内反射活动的性质,并可能在自主运动过程中调节肌梭的功能。
相位性(或Ia类)牵张反射
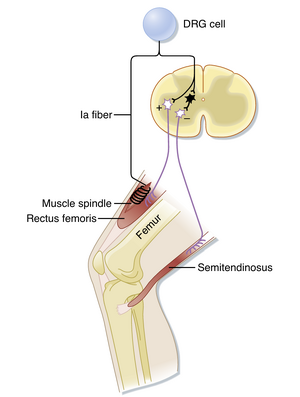
图9.6展示了负责相位性牵张反射(phasic stretch reflex)的反射弧(reflex arc),以股直肌(rectus femoris muscle)为例。快速牵拉股直肌会强烈激活肌梭的Ia类纤维,这些纤维将信号传入脊髓。在脊髓内,每条Ia类传入纤维会分支出大量兴奋性突触,直接(单突触性地)与支配同一肌肉(即同名肌,homonymous muscle)的几乎所有α运动神经元(α motor neurons)形成连接,同时与许多支配协同肌(如本例中同样参与膝关节伸展的股中间肌vastus intermedius)的α运动神经元形成突触。若兴奋足够强,运动神经元将放电并引发肌肉收缩。值得注意的是,Ia类纤维不与γ运动神经元形成联系,这可能是为了避免正反馈循环(positive-feedback loop)的发生。这种对α运动神经元的选择性靶向具有特殊性,因为大多数其他反射通路和下行通路会同时作用于α和γ运动神经元。
Ia类纤维的其他分支终止于多种中间神经元,但其中一种类型——交互性Ia抑制性中间神经元(reciprocal Ia inhibitory interneuron,图9.6中黑色神经元)——对牵张反射尤为重要。这些中间神经元可被识别,因为它们是唯一同时接收Ia类传入纤维和闰绍细胞(Renshaw cells,见图9.12)输入的抑制性中间神经元。它们终止于支配拮抗肌(本例中为屈膝的腘绳肌群,包括半腱肌semitendinosus)的α运动神经元。Ia类传入纤维的其他分支还与另一些神经元形成突触,这些神经元发出上行通路,向大脑多个区域(特别是小脑和大脑皮层)传递肌肉状态信息。
强直性牵张反射
强直性牵张反射可通过关节的被动弯曲引发。该反射回路包含来自肌梭的Ia类和II类传入纤维(group Ia and group II afferent fibers)。II类纤维通过单突触兴奋性连接作用于α运动神经元(α motor neurons),但也通过双突触和多突触通路对其进行兴奋。正常情况下,Ia类和II类传入纤维的持续活动有助于维持α运动神经元的基线放电频率;因此,强直性牵张反射参与肌张力的维持。其活动也影响维持姿势的能力。例如,当士兵立正站立时若因疲劳导致膝关节开始屈曲,股四头肌被牵拉,引发强直性牵张反射,股四头肌收缩增强,从而对抗屈曲并恢复姿势(需注意,腿部肌肉收缩还可减轻血液在腿部的淤积及可能的直立性低血压——晕厥)。
上述讨论表明,牵张反射可像负反馈系统一样控制肌肉长度。通过追踪牵张反射弧可见,其活动的变化会对抗肌肉长度偏离特定平衡点的改变。例如,若肌肉长度增加,Ia类和II类纤维的放电将增强,从而兴奋同名α运动神经元(homonymous α motor neurons),导致肌肉收缩并逆转牵拉。类似地,肌肉的被动缩短会卸载肌梭,导致运动神经元兴奋性驱动的降低,从而使肌肉放松。那么人类如何能够旋转关节?部分原因是γ运动神经元(γ motor neurons)在运动过程中被共激活,从而改变肌梭的平衡点;另一部分原因是该反射的增益(gain)或强度较低,使得运动神经元接收的其他输入能够覆盖牵张反射。
临床相关
亢进的牵张反射可导致震颤和阵挛(clonus),这些都属于不自主节律性运动类型。虽然牵张反射的负反馈作用有助于肢体在特定位置的稳定,但当肢体受到外部扰动时,引发刺激(肌肉牵张)与反应(肌肉收缩)之间的传导延迟会使牵张反射回路成为导致节律性运动的不稳定因素。具体而言,阵挛是由脊髓损伤患者肌肉持续牵张所引发的。正常情况下,施加的持续肌肉牵张会增强Ia群和II群纤维活动,经过延迟后引起肌肉收缩以对抗牵张,但由于牵张反射的增益远小于1,这种收缩并不能使肌肉完全恢复到初始长度。
这种部分代偿反过来又会导致Ia群和II群纤维活动减弱,使得肢体再次伸长但未完全复原。这种伸长再次增强Ia群和II群纤维活动,如此循环往复。延迟在建立这种振荡中至关重要,因为它使得反馈信号在肌肉完成代偿后仍持续存在,从而导致过度代偿并引发下一次过校正。然而,由于反射增益通常远小于1,这种振荡通常会快速衰减(过代偿幅度迅速减小),最终肌肉会在中间长度保持静止。相反,当下行运动通路受损时,脊髓连接性的改变和神经元兴奋性增加会导致反射亢进(相当于将牵张反射增益提升至接近1)。此时,连续的过代偿幅度显著增大,可观察到明显但短暂的振荡(阵挛)。若增益等于1,阵挛不会衰减,而是会持续至初始牵张刺激终止。
一般而言,系统的增益定义为特定输入对应的输出。在此情况下,系统的输入是施加的牵张刺激,输出则是牵张反射引发的收缩所产生的运动。
逆向肌牵张反射或Ib类反射
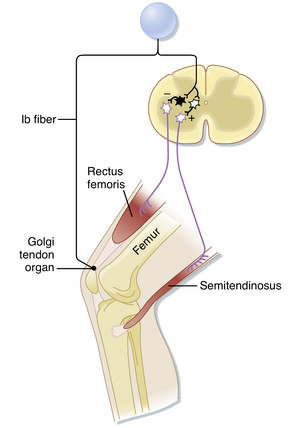
反向肌伸张反射(inverse myotatic reflex)的作用是抵抗肌肉力量水平的变化。正如牵张反射可视为调节肌肉长度的反馈系统,反向肌伸张反射(或称Ib群反射)可视为维持肌肉力量水平的反馈系统。以大腿上部为例,Ib群反射弧如图9.7所示。
该反射弧起始于高尔基腱器官(Golgi tendon organ)感受器,后者感知肌肉张力。高尔基腱器官位于肌腱与肌纤维连接处,因此与肌纤维呈串联排列,这与肌梭(muscle spindle)的平行排列形成对比(见图9.2)。高尔基腱器官直径约100~{\upmu\mathrm{m}},长度约1\mathrm{mm}。每个高尔基腱器官由Ib群传入纤维的终末分支支配。这些终末分支缠绕于肌肉肌腱(或肌肉内腱划)的胶原纤维束上。
由于其与肌肉的串联关系,高尔基腱器官(Golgi tendon organ)既可通过肌肉拉伸也可通过肌肉收缩被激活。在这两种情况下,高尔基腱器官感知的实际刺激是其所连接的肌腱中产生的力。对于拉伸而言,该反应源于肌肉的类弹簧特性,作用于肌肉("弹簧")的力与其被拉伸的程度成正比(基于胡克定律)。
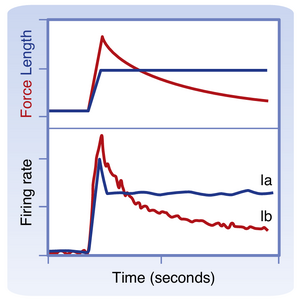
为区分肌梭(muscle spindle)和高尔基腱器官的响应特性,可比较当肌肉被拉伸并保持于较长长度时Ia组和Ib组纤维的放电模式(图9.8)。Ia组纤维的放电频率在拉伸恢复前持续保持增高。相比之下,Ib组纤维的放电频率最初呈现大幅增加(反映拉伸引起的肌肉张力增加),但随着横桥循环(cross-bridge recycling)及由此产生的肌小节(sarcomere)延长导致肌肉张力降低,其放电频率逐渐回归初始水平。因此,高尔基腱器官编码力信号,而肌梭编码肌肉长度信号。这一区分的进一步证据是:在等长收缩(isometric contraction)过程中,尽管肌肉长度(及相应的Ia组活动)未改变,但Ib组放电仍与力水平相关。
屈反射与运动
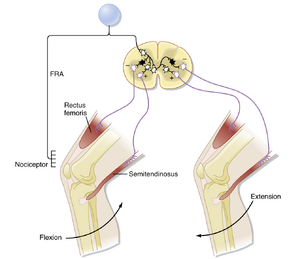
屈反射始于多种感觉受体(包括伤害感受器)的激活,这些信号可通过多种传入纤维(包括II组和III组纤维)传递至脊髓,这些传入纤维统称为屈反射传入(flexion reflex afferent, FRA)纤维。在屈反射中,传入冲动(1)通过兴奋性中间神经元激活同侧肢体屈肌的α运动神经元;(2)通过抑制性中间神经元抑制拮抗伸肌的α运动神经元(图9.9)。这种活动模式导致受刺激肢体一个或多个关节的屈曲。此外,连合中间神经元在脊髓对侧引发相反的活动模式(见图9.9),导致对侧肢体伸展,即交叉伸反射。对于人类下肢(或四足动物的前肢和后肢),反射的交叉伸展部分通过使对侧肢体能够支撑抬起屈曲肢体时转移的额外负荷,有助于维持平衡。
临床联系
在运动下行通路受损后,亢进的牵张反射可能导致痉挛(spasticity),表现为肢体被动旋转时产生巨大阻力。在此状态下,可能观察到所谓的折刀反射(claspknife reflex)。当存在痉挛时,尝试绕关节旋转肢体最初会遇到很大阻力。然而,若施加的力持续增加,会达到一个临界点,此时阻力突然消失,肢体可轻松旋转。这种阻力变化由反射性抑制引起。Ib类反射弧提示该通路活动增强可能是阻力突然释放的基础。事实上,折刀反射曾被认为源于高尔基腱器官(Golgi tendon organs)的激活,当时认为这些感受器对肌肉拉伸具有高阈值。然而后续研究表明,腱器官在极低力量水平下即可被激活,因此不再被认为是折刀反射的成因。目前认为该反射由分布于肌肉周围筋膜的其他高阈值肌肉感受器激活引起。来自这些感受器的信号激活中间神经元,进而导致同名运动神经元抑制。
由于屈曲通常使受累肢体靠近身体并远离伤害性刺激,屈曲反射属于一种回缩反射(withdrawal reflex)。图9.9展示了仅影响膝关节的屈曲反射神经回路。但实际上,屈曲反射中存在初级传入通路和中间神经元通路的高度发散。事实上,肢体所有主要关节(如髋、膝、踝)都可能参与强烈的屈肌回缩反射。屈肌回缩反射的具体表现因刺激性质和部位而异。
参与屈曲反射的中间神经元似乎也是中枢模式发生器(central pattern generator, CPG)的组成部分,该结构用于生成运动节律,这体现了反射回路的多功能特性。CPG是指能够在缺乏感觉输入时产生基础运动行为的节律性活动的神经元和回路集合。例如,FRA中间神经元的激活会导致同侧屈肌兴奋和伸肌抑制,而对侧呈现相反模式;脊髓两侧FRA中间神经元的交替激活可产生踏步模式。也就是说,行走运动可能源自两侧FRA中间神经元的交替激活。需注意的是,FRA回路中的这种节律性活动模式不一定依赖于FRA纤维自身的活动(例如可能由脑部下行通路激活)。
确定脊髓通过反射活动的组织方式
为证明这些神经环路确实参与运动节律(locomotion rhythm)的生成,研究者制备了可显示自发运动行为的脊髓标本(即当脑干被横断且体重获得支撑时,脊髓环路能够产生引发肢体执行正常运动序列的活动)。在其中一项实验中,记录了肢体屈肌(flexor)和伸肌(extensor)的肌电图(electromyographic, EMG)信号,并通过刺激屈肌反射传入(FRA)纤维来观察其对运动节律的影响(图9.10)。在未施加刺激时,屈肌与伸肌的EMG活动呈现自发的交替模式。若FRA纤维未参与运动环路,或至少不是产生节律的关键组成部分(见图9.10B),则刺激应仅引起短暂反应(即屈肌EMG记录中出现单个爆发,而伸肌EMG活动被短暂抑制),而对持续进行的EMG模式无长期影响。实验中确实观察到这种短暂反应(见图9.10A;刺激后即刻的EMG记录)。然而,通过比较刺激前后肌肉收缩的时间可发现,刺激还导致运动节律发生约180度的永久性相位偏移。垂直虚线标示了若刺激未引起EMG活动模式相位偏移时预期出现屈肌EMG反应的时间点。刺激前,每条虚线与屈肌EMG爆发的起始对齐;而刺激后,每条虚线则出现在屈肌爆发的末尾。因此,该刺激影响了运动中枢模式发生器(central pattern generator, CPG)本身,表明FRA中间神经元是这一CPG的关键组成部分(见图9.10C)。
该实验揭示的第二个重点是:运动CPG(以及广义的CPGs)可被强烈的传入纤维活动所调控。传入纤维的影响确保了模式发生器能够适应运动过程中地形环境的变化。这类变化可能在奔跑时快速发生,此时必须调整运动以确保协调性。
通过反射研究确定脊髓组织方式
汇聚(convergence)和发散(divergence)是反射通路及神经环路的普遍特征。在前述对反射的讨论中已描述了这些现象的多个实例。反射可用于识别和表征脊髓中的这些现象。例如,汇聚输入可通过图9.11所示的空间总和(spatial facilitation)现象进行验证。
单突触反射的时空总和现象
• 图9.10 屈曲反射传入(FRA)纤维刺激对运动节律的相位重置作用有助于识别中枢模式发生器(CPG)的神经元成分。A,膝关节屈肌和伸肌的肌电图记录。注意刺激施加前的节律性交替模式。各轨迹下方的实线垂直线表示屈肌收缩启动时刻,虚线垂直线表示若刺激未对节律模式产生持续效应时屈肌收缩本应启动的时刻。B和C,解释A中运动节律的CPG两种可能模型。B,未显示CPG中的FRA中间神经元(INs);C,显示FRA中间神经元。A中数据支持C所示模型。MN,运动神经元。(数据来源:Hultborn H等,Ann N Y Acad Sci 1998;860:70)
在本例中,通过电刺激两条神经中的Ia类纤维(见图9.11A)可诱发单突触反射(monosynaptic reflex)。反射反应的特征表现为从相应腹根记录的α运动轴突放电(以复合动作电位形式)。刺激神经A时,记录到小复合动作电位即反射A;同理,刺激神经B时记录到反射B。图9.11B显示运动核内包含的运动神经元。当单独刺激各神经分支时,放电区的α运动神经元被激活至阈值以上,因此每条神经单独受刺激时都会引发特定的一对α运动神经元发放动作电位。此外,每对运动神经元周围还存在由八个额外运动神经元组成的阈下边缘区(subliminal fringe),这些神经元虽被兴奋但未达到触发动作电位的程度。
当同时刺激两条神经时,记录到显著增大的反射放电(比较图9.11B右侧的RA、RB与RA+RB记录)。如图所示,该反射表现为七个α运动神经元的放电:四条来自各神经单独刺激时的放电神经元(每条神经两个),以及三条额外α运动神经元(位于易化区(facilitation zone)),这些神经元因同时处于两条神经的阈下边缘区而仅在双神经同时受刺激时放电。
类似效应也可通过重复刺激某条神经诱发,只要刺激间隔足够短,使第一波刺激的部分兴奋效应在第二波刺激到达时仍然持续。此效应称为时间总和(temporal summation)。空间总和(spatial summation)与时间总和均依赖于Ia类传入纤维在α运动神经元引发的EPSP特性(见图6.8)。
汇聚(convergence)也可导致刺激之间的抑制性相互作用,这种现象称为遮蔽现象(occlusion)。如果图9.11中两条神经中的一条神经所产生的一排冲动(volley)在运动神经元高度兴奋时到达运动核团,其反射放电量会相对较大(见图9.11C)。另一条神经的类似排冲动也可能产生较大的反射反应。然而,当两条神经同时被激活时,若两条神经单独激活时达到阈值的神经元存在显著重叠,则其共同引发的反射可能小于两个独立诱发反射的总和。在这种情况下,每条传入神经激活7个α运动神经元,但两条神经的排冲动共同仅导致12个α运动神经元放电,因为有两个运动神经元同时位于两条传入神经的个体放电区内。
空间总和(spatial summation)与时间总和(temporal summation)以及遮蔽现象也可用于证明脊髓神经元与各类反射回路之间的相互作用。首先,通过刺激肌肉神经中的Ia类传入纤维可诱发单突触反射放电(monosynaptic reflex discharge)。这是对一群α运动神经元反射兴奋性的测试。若选择刺激合适的肌肉神经,可记录到伸肌或屈肌α运动神经元的放电。随后,通过同时刺激其他类型传入纤维与来自肌肉的同源(homonymous)Ia类传入纤维,可观察Ia类刺激的反应是否发生变化。例如,刺激拮抗肌神经中的Ia类传入纤维会抑制对同源Ia类刺激的反应(这一过程由先前描述的Ia类交互抑制性中间神经元介导)。
• 图9.11 空间易化(spatial facilitation)。A,通过电诱发传入排冲动并记录腹根中运动轴突的反射研究装置。B,同时刺激两条肌肉神经传入纤维导致空间总和(R_{A}与R_{B})的实验。放电区(粉色区域)包围了每条神经分支单独受刺激时被激活至阈值的α运动神经元。C中,联合排冲动导致了遮蔽现象。(改绘自Eyzaguirre C, Fidone SJ. Physiology of the Nervous System. 2nd ed. Chicago: Mosby–Year Book; 1975.)
另一个例子是:若刺激皮肤神经的小型传入纤维以诱发屈曲反射(flexion reflex),支配伸肌的α运动神经元对Ia类刺激的反应会被抑制(而支配屈肌的α运动神经元反应则被增强)。
作为最后一个示例,刺激腹根(ventral root)会抑制Ia类群组(group Ia)响应并抑制对侧Ia类群组的抑制。由于腹根仅包含运动神经元轴突,这一结果表明存在轴突侧支(axon collaterals),它们通过兴奋抑制性中间神经元形成对同一运动神经元群的反馈(图9.12)。这些中间神经元被命名为Renshaw细胞(Renshaw cells)。由于腹根刺激还会抑制拮抗运动神经元的Ia类群组抑制,但不影响其他类型的中间神经元,因此对侧Ia类群组中间神经元特异性地被腹根刺激所抑制(而通过Ia类群组刺激被激活)。
• 图9.12 Renshaw细胞(RC)与运动神经元和Ia类抑制性中间神经元的连接。所示回路介导拮抗肌(本例为伸肌)的Ia类交互抑制,以及Renshaw细胞对该交互抑制的抑制。注意:与伸肌运动神经元相关联的Renshaw细胞和Ia类抑制性中间神经元数量相当,同时来自伸肌肌梭的Ia类输入也参与其中,但为简化图示未予显示。橙色细胞为抑制性,蓝色和绿色细胞为兴奋性。
下行运动通路
下行运动通路的分类
传统上将下行运动通路分为锥体束通路(pyramidal pathways)和锥体外通路(extrapyramidal pathways)。这一术语反映了临床上对锥体束疾病(pyramidal tract disease)与锥体外疾病(extrapyramidal disease)的二分法。在锥体束疾病中,皮质脊髓(锥体)束(corticospinal (pyramidal) tract)被阻断。该疾病的体征最初被归因于锥体束功能的丧失(其命名源于皮质脊髓束穿过延髓的锥体(pyramids of the medulla))。然而在多数锥体束疾病病例中,其他通路的功能也会发生改变,且锥体束疾病的大多数体征(参见后文"由下行运动通路损伤引起的运动缺陷"章节)显然不仅由皮质脊髓束的丧失单独引起,还反映了其他运动通路(有时称为锥体外系统(extrapyramidal system))的损伤。
运动通路的另一种分类方式
另一种分类运动通路的方法是基于它们在脊髓中的终止部位及其在运动和姿势控制中的作用。外侧通路(lateral pathways)终止于脊髓灰质的侧部(图9.13)。外侧通路可直接兴奋运动神经元,但其主要靶标是中间神经元(interneurons)。它们影响控制肢体远端精细运动的反射弧,以及激活肢体近端支撑肌群的反射弧。内侧通路(medial pathways)终止于内侧腹角的内侧中间神经元群(见图9.13)。这些中间神经元与双侧控制轴向肌群(用于平衡和姿势)的运动神经元连接,同时也参与部分近端肢体肌肉的控制。本书使用"外侧"和"内侧"术语对下行运动通路进行分类。然而,这种术语并不完全准确,部分原因是局部柱状排列的运动神经元胞体具有大的树突树,通常跨越大部分腹角。因此,任何运动神经元都可能接受来自所谓"内侧系统"或"外侧系统"通路的输入。
外侧系统
外侧皮质脊髓束与皮质延髓束
皮质脊髓束(corticospinal tract)和皮质延髓束(corticobulbar tract)起源于大脑皮层的广泛区域,包括额叶的初级运动皮层、前运动皮层、辅助运动区、扣带运动区,以及顶叶的体感皮层。这些通路的起源细胞包括皮层第五层的大、小锥体神经元(pyramidal neurons),其中包含Betz巨锥体细胞。尽管Betz细胞是初级运动皮层的标志性特征,但它们仅占这些通路神经元的极少部分(<5%),部分原因是它们仅存在于初级运动皮层,且即使在该区域,它们也仅占通路神经元的小部分。这些束路离开皮层进入内囊(internal capsule),随后经大脑脚(cerebral peduncle)穿过中脑,通过基底脑桥(basilar pons),最终在延髓腹侧表面形成锥体(pyramids)(见图9.13A)。皮质延髓轴突在脑干下行过程中离开束路,终止于各脑神经运动核。皮质脊髓纤维继续向尾侧延伸,在延髓最尾端区域,约85%的纤维交叉至对侧,随后在对侧外侧索(lateral funiculus)下行形成外侧皮质脊髓束(lateral corticospinal tract)。外侧皮质脊髓轴突终止于所有脊髓节段,主要投射至中间神经元,但也直接终止于运动神经元。未交叉的剩余轴突在同侧腹侧索(ventral funiculus)继续尾侧下行,形成属于内侧系统的腹侧皮质脊髓束(ventral corticospinal tract)。这些纤维中许多最终在终止的脊髓节段水平发生交叉(decussate)。
外侧皮质脊髓束(lateral corticospinal tract)在低等哺乳动物中是一个相对较小的传导束,但在灵长类(特别是人类)中无论在数量还是功能上都极为重要,其中包含超过100万条轴突。这个数字仍然只占大脑脚(cerebral peduncles)皮层传出纤维的很小比例,因为大脑脚内约有2000万条轴突。尽管如此,皮质脊髓通路对于手指精细独立运动的控制至关重要,因为单独的皮质脊髓束损伤通常会导致这种能力的永久性丧失,尽管其他运动能力常可随此类损伤恢复。事实上,在灵长类中,皮质脊髓束直接与运动神经元(motor neurons)形成的突触在控制手指肌肉的运动神经元中尤为普遍,这可能是进行独立、精细控制手指运动能力的基础。
• 图9.13 下行运动通路。显示了连接皮层和脑干运动区与脊髓的主要通路。A,外侧系统通路,包括皮质脊髓束(红色)和红核脊髓束(蓝色)。注意腹侧皮质脊髓束属于内侧系统,但为简化显示在A中。B,内侧系统通路,包括延髓(蓝色)和脑桥(绿色)网状脊髓束以及外侧前庭脊髓束(红色)。C-B,皮质延髓束;C-P,皮质脑桥束;C-S,皮质脊髓束;LCST,外侧皮质脊髓束;VCST,腹侧皮质脊髓束。
皮质延髓束(corticobulbar tract)是从皮层投射到脑干颅神经运动核团的传导束,其分支结构与外侧和腹侧皮质脊髓束相似。例如,部分皮质延髓束交叉到对侧面神经核(facial nucleus)的下部(支配下半面部肌肉)和舌下神经核(hypoglossal nucleus)。该成分的皮质延髓束组织结构与外侧皮质脊髓束类似。其余皮质延髓束以双侧方式终止,包括双侧面部上部(前额)的双侧支配。这种上下脸部输入的特殊排列具有重要临床意义,例如当单侧下半面部肌肉受损时与单侧上下脸部肌肉同时受损的情况表现不同。
红核脊髓束
红核脊髓束(rubrospinal tract)在非灵长类中比灵长类更重要,起源于中脑被盖(midbrain tegmentum)红核(red nucleus)的大细胞部(magnocellular portion)。这些纤维在中脑交叉后,经脑桥和延髓下行,最终在脊髓中位于外侧皮质脊髓束的腹侧。与皮质脊髓纤维类似,它们优先影响控制远端肌肉的运动神经元。红核神经元接受来自小脑和运动皮层的输入,可实现这两个运动系统的活动整合。
内侧系统
腹侧皮质脊髓束(ventral corticospinal tract)与大部分皮质延髓束(corticobulbar tract)可归类为内侧系统通路。这些束路终止于脊髓内侧组中间神经元及脑干中的对应神经元。中轴肌群由这些通路控制。这些肌肉常通过双侧收缩提供姿势支撑或其他双侧功能,如吞咽或皱眉。
其他内侧系统通路起源于脑干
包括桥脑与延髓网状脊髓束(pontine and medullary reticulospinal tracts)、外侧与内侧前庭脊髓束(lateral and medial vestibulospinal tracts),以及顶盖脊髓束(tectospinal tract)。
桥脑与延髓网状脊髓束
桥脑网状结构(reticular formation)内侧区神经元发出桥脑网状脊髓束。该束沿脊髓腹索(ventral funiculus)下行,终止于同侧内侧组中间神经元。其功能是激活控制近端伸肌(维持姿势)的运动神经元。
延髓网状脊髓束起源于延髓内侧神经元,尤其是巨细胞网状核(gigantocellularis reticular nucleus)。该束通过腹外侧索(ventral lateral funiculus)双侧下行,主要终止于内侧运动神经元群相关的中间神经元。此通路的功能以抑制为主。
外侧与内侧前庭脊髓束
外侧前庭脊髓束起源于前庭外侧核(lateral vestibular nucleus,亦称Deiter’s nucleus),位于延髓与桥脑交界处周围。此束通过脊髓腹索同侧下行,终止于内侧运动神经元群相关的中间神经元。外侧前庭脊髓束激活支配肢体近端伸肌(对姿势控制至关重要)的运动神经元。此外,该通路通过激活接受伸肌Ia类输入的交互性Ia组中间神经元(reciprocal group Ia interneurons),抑制屈肌运动神经元。外侧前庭核的兴奋性输入来自半规管(semicircular canals)与耳石器(otolith organs),抑制性输入则来自小脑皮质前蚓部(anterior vermis)的浦肯野神经元(Purkinje neurons)。外侧前庭脊髓束的重要功能是协助头部角加速度与线加速度后的姿势调节。
内侧前庭脊髓束起源于前庭内侧核(medial vestibular nucleus)。该束沿脊髓腹索下行至颈段与中胸段,终止于内侧组中间神经元。前庭内侧核的感觉输入主要来自半规管。此通路介导头部角加速度引起的头部位置调节。
顶盖脊髓束
顶盖脊髓束起源于中脑上丘(superior colliculus)深层(上丘与下丘所在区域称为顶盖(tectum))。其轴突在中脑导水管周围灰质(periaqueductal gray matter)下方交叉至对侧,沿脊髓腹索下行,终止于上颈段脊髓内侧组中间神经元。顶盖脊髓束调控由视觉、听觉与躯体刺激引发的头部运动。
单胺能(monoaminergic)通路
除外侧和内侧系统外,还有一些组织特异性较低的系统从脑干下行至脊髓。其中包括几种以单胺类物质作为神经递质的通路。
蓝斑(locus coeruleus)和蓝斑下核(nucleus subcoeruleus)是位于脑桥头端的核团,由含去甲肾上腺素(norepinephrine)的神经元组成。这些核团广泛投射至整个中枢神经系统(CNS),其向脊髓的投射通过外侧索下行。它们的末梢终止于中间神经元和运动神经元。该通路的主要效应是抑制性的。
延髓的中缝核(raphe nuclei)也广泛投射至整个中枢神经系统,并形成数条中缝-脊髓通路。在运动功能方面,其向前角的投射可能增强运动活动。
总体而言,单胺能通路通过改变脊髓环路(包括反射弧)的反应性发挥作用。这种方式可诱导兴奋性的广泛变化,而非引发离散运动或行为的特定改变。
下行运动通路损伤导致的运动缺陷
人类的运动障碍可能由通过内囊的传出性大脑皮层纤维损伤引起。这种情况可能发生于内囊供血中风后。尽管存在命名不当,但由此产生的障碍常被称为锥体束综合征(pyramidal tract syndrome)或上运动神经元疾病。该疾病的特征性运动变化包括:(1)相位性和紧张性牵张反射增强(痉挛);(2)肌力减弱,通常累及远端肌肉(尤其手指肌);(3)病理性反射,包括巴宾斯基征(Babinski sign)(轻划足底时出现拇趾背屈与其他趾扇形展开);(4)浅反射(如腹壁反射和提睾反射)减弱。值得注意的是,若仅皮质脊髓束受损(如延髓锥体病变时),上述大部分体征会显著减轻或消失。此时最突出的缺陷是对侧远端肌力减弱(尤其手指肌)和巴宾斯基征阳性。痉挛不会发生,反而肌张力可能实际降低。显然,痉挛的出现需要其他通路(如网状脊髓束)的功能紊乱,这可能在皮质对这些通路的起源核团(脑干核)的下行调控丧失后发生。
内侧系统通路中断产生的效应与皮质脊髓束损伤截然不同。内侧系统损伤的主要缺陷包括姿势肌张力初期降低和翻正反射丧失。长期效应包括运动障碍和频繁跌倒。然而,手部对物体的操作能力完全正常。
去大脑(decerebrate)标本
去大脑制备在实验研究中的应用
去大脑制备(decerebrate preparation)对于实验研究不同下行通路如何与脊髓回路相互作用具有重要意义。手术去大脑化可通过中脑横断(通常选择在丘间水平)或阻断该区域的供血血管实现。后者还会导致小脑前蚓部(anterior vermis)的损伤,这是重要的区别特征。丘间横断会中断部分下行通路(如起源于大脑皮层的通路),而其他通路(如起源于脑干的通路)则保持完整。
但需注意,皮质脊髓束(corticospinal tract)仅是皮层下行纤维的一个组成部分。许多其他皮层纤维投射至脑干各区域,包括内侧下行通路起源核团。这些皮层控制系统的缺失会导致完整下行通路的活性改变。受影响的动物因此表现出肌张力亢进(hypertonia)、部分脊髓反射(如屈曲反射(flexion reflex))被抑制,而其他反射(如牵张反射(stretch reflex))被增强,这种状态称为去大脑僵直(decerebrate rigidity)。去大脑动物会维持一种被称为"夸张站立(exaggerated standing)"的姿势。脑干损伤的人类患者也可能出现去大脑状态,其反射特征与动物制备模型高度相似。
网状结构(reticular formation)下行控制的缺失会导致脑桥网状脊髓通路(pontine reticulospinal pathway)活性增强,而延髓网状脊髓通路(medullary reticulospinal pathway)活性降低。这种活性变化分别通过增加兴奋性和减少抑制性(去抑制(disinhibition))作用于运动神经元,从而解释观察到的僵直现象。值得注意的是,切断背根可缓解这种肌张力亢进,表明网状脊髓束主要作用于γ运动神经元(γ motor neurons)。这是因为γ运动神经元活性通过增强肌梭敏感性改变肌肉刚度,进而引起Ia类和II类传入纤维(group Ia and group II afferent fibers)活性增强——这些纤维通过背根进入脊髓以支配α运动神经元(α motor neurons)。
当通过血管阻断实现去大脑状态时,由于小脑前蚓部浦肯野神经元(Purkinje neurons)损伤(该神经元是外侧前庭核(lateral vestibular nucleus)的主要抑制性投射源),外侧前庭脊髓束(lateral vestibulospinal tract)会过度活跃。此时切断背根不会消除这种肌张力亢进,表明外侧前庭脊髓束主要通过直接作用(单突触或经中间神经元)于α运动神经元实现其功能。
脑干对姿势和运动的控制
从去大脑动物表现出的伸肌张力亢进和阶段性牵张反射增强可明显看出,起源于脑干的运动控制通路具有重要作用。特定脑干系统已被确认参与调控姿势和运动。脑干回路还关键性地参与眼球运动控制,相关回路将在本章末尾单独讨论。
姿势反射
姿势反射的类型
当头部移动或颈部弯曲时会引发多种反射机制。姿势反射可分为三类:前庭反射(vestibular reflexes)、紧张性颈反射(tonic neck reflexes)和翻正反射(righting reflexes)。负责这些反射的感觉受体包括受头部运动刺激的前庭器官(vestibular apparatus)(见第8章)以及颈部的牵张感受器。
前庭反射是一类姿势反射。头部旋转会激活半规管(semicircular canals)的毛细胞(见第8章)。除了引发眼球运动外,前庭核接收的感觉输入还会导致姿势调整。这些调整通过外侧前庭脊髓束(lateral vestibulospinal tract)、内侧前庭脊髓束(medial vestibulospinal tract)和网状脊髓束(reticulospinal tracts)传递至脊髓的指令介导。外侧前庭脊髓束激活维持姿势的伸肌。例如,若头部向左旋转,左侧的姿势支撑会增强。这种增强的支撑可防止个体在头部持续左转时向左侧倾倒。左耳迷路功能丧失的患者容易向左侧跌倒;相反,左耳迷路受刺激(如炎症)的患者则倾向右侧跌倒。内侧前庭脊髓束引起颈部肌肉收缩以对抗诱发运动(前庭颈反射,vestibulocollic reflex)。
头部倾斜还会改变前庭器官耳石器(otolith organs)中单个毛细胞的线性加速度。毛细胞活动的变化可引发眼球运动和姿势调整。例如,当四足动物(如猫)将头部和身体前倾时(未弯曲颈部,因此不引发紧张性颈反射),前肢会伸展而后肢屈曲。这种前庭作用有助于使身体恢复原有姿势。相反,若四足动物将头部和身体后仰(未弯曲颈部),前肢会屈曲而后肢伸展。耳石器也参与前庭放置反应(vestibular placing reaction)。当动物(如猫)坠落时,椭圆囊(utricles)的刺激会引发前肢伸展以准备着陆。
紧张性颈反射是另一类姿势反射。这些反射由颈部肌肉中的肌梭(muscle spindles)激活。颈部肌肉的肌梭密度是全身最高的。若颈部弯曲(未伴随头部倾斜),颈部肌梭会绕过前庭系统直接引发紧张性颈反射。当颈部伸展时,前肢伸展而后肢屈曲;颈部屈曲时则产生相反效果。需注意这些效应与前庭系统引发的效应相反。此外,若颈部向左弯曲,左侧肢体的伸肌收缩增强,右侧肢体的屈肌放松。
第三类姿势反射是翻正反射。这些反射可将头部和身体的异常位置恢复正常。参与翻正反射的感受器包括前庭器官、颈部牵张感受器以及体壁的机械感受器。
脑干对运动的控制
脊髓的中枢模式发生器
如前所述,脊髓包含作为运动中枢模式发生器(central pattern generators, CPGs)的神经回路。这些CPG回路能产生非常规律的节律性输出,这种输出是刻板行为(如行走)的特征。然而,真实环境中的不规则性常需要对这些刻板输出进行调整(例如当行走中发现前方地面有坑洞时,可以延长腿部前摆动作越过坑洞,踏在后方坚实的地面上)。
这种调整可能源于脊髓的感觉输入。如图9.10所示,刺激外周神经中的FRA纤维可引起运动模式的相位偏移。调整也可能来自先前讨论的运动通路下行指令。在这种情况下,大脑可利用感觉数据(如视觉信息)对CPG活动进行预期性调整,从而避开潜在障碍物。此外,人类可以自主控制CPG的激活或关闭(即有意识地决定何时开始或停止行走)。
脊髓CPGs的这种自主调控起源于大脑皮层。然而,皮层对运动的大部分影响似乎是通过投射到脑干"运动区"(locomotor regions)来介导的。运动区可定义为受刺激时能引发持续运动的脑区。
脑干运动区
脑干存在多个此类运动区,分布于从丘脑底部到延髓的不同层面,并相互连接。最著名的是中脑运动区(midbrain locomotor region),被认为负责组织启动运动的指令。它位于中脑下丘水平。起源于运动皮层的自主活动可通过皮质延髓束投射至中脑运动区来触发运动。这些指令通过网状结构中继,再经网状脊髓束传至脊髓。
大脑皮层的运动控制
本章至此主要强调了反射和相对自动化的运动类型。现在我们将讨论更复杂的、目标导向的自主运动的神经基础。这类运动在重复时经常表现出可变性,且多由认知过程而非直接响应外部刺激而启动,因此需要大脑皮层运动区的参与。
首先,考虑产生自主运动所需的条件。例如,当执行手臂的伸展运动时,必须首先识别目标(或目的)并在外部空间中定位其位置。接着,需要基于手臂(尤其是手部)相对于目标的内部表征来确定肢体运动轨迹。最后,必须计算出生成预期轨迹所需的一组力。这一过程通常被视为不同坐标系之间的一系列转换。例如,视觉识别的目标位置在视网膜拓扑空间(retinotopic space)中被测量,但其位置在外部或世界空间中被感知(即静止目标的位置被感知为稳定状态,即使眼球运动导致目标在视网膜上的成像位置发生改变)。随后,轨迹计算将涉及以身体或手部为中心的系统,最终力的计算必须基于肌肉参考框架完成。
• 图9.14 额叶皮层的运动区。A和B,大脑半球的侧面观与内侧观,显示主要皮质运动区。FEF,额叶眼动区;PMA,前运动区;SMA,辅助运动区。B图插图为扣带沟壁结构,包含扣带运动区(CMAs)。括号内数字为扣带运动区的布罗德曼分区编号。C,运动区间连接示意图。
这些步骤构成线性序列,传统观点认为不同层级的运动区执行连续步骤。例如,运动的靶标被认为是通过顶叶后部大脑皮层(posterior parietal cerebral cortex)(图9.14A)中感觉信息的整合来识别的。该信息随后传递至辅助运动区和前运动区(premotor area),在此形成运动计划并转发至初级运动皮层(primary motor cortex),其活动与最终执行阶段(如产生适当力度)相关。运动皮层随后通过前文讨论的下行通路向脊髓和脑干运动核团传递指令。
皮层运动区
尽管有大量证据支持皮层运动系统通过层级结构产生自主运动的观点,但最新数据表明各运动区之间通过并行分布式网络而非严格层级进行信息传递(参见图9.14C)。例如:每个皮层运动区都对下行运动通路做出独立的重要贡献——初级运动皮层(primary motor cortex)仅提供额叶来源的皮质脊髓束中约半数纤维。此外,各运动区之间均存在双向连接,后文所述的单神经元记录研究结果提示每个运动区都在运动计划和执行的多个阶段发挥作用。这一争论构成了下文讨论的主题之一,因为关于分布式网络与层级组织的不同观点之争已持续数十年,并可能在未来一段时间内继续存在。
皮层运动区
大脑皮层运动区最初通过电刺激实验定义:施加到皮层的电刺激可诱发离散的对侧运动。然而,当其他皮层区域接受更高强度刺激时也可诱发运动。基于这些观察,运动区被定义为能以最低刺激强度诱发运动的区域。除电刺激研究外,电生理记录、解剖学实验、现代人类影像学研究结果以及损伤后观察均表明,大脑皮层的多个"运动"相关区域参与其中,包括:中央前回(precentral gyrus)的初级运动皮层、紧邻其吻侧的前运动区(premotor area)、半球内侧的辅助运动皮层(supplementary motor cortex),以及位于额叶扣带沟(cingulate sulcus)壁的三个扣带运动区(cingulate motor areas)(参见图9.14)。其他脑叶也存在与眼球运动特异性相关的皮层区域(参见"眼球运动"章节)。
皮层运动区的躯体拓扑组织
初级运动皮层
初级运动皮层
初级运动皮层(primary motor cortex)可定义为通过最小强度电刺激即可诱发运动的皮层区域。它在细胞构筑上基本对应于Brodmann第4区(见图10.3)。在人类中,该区域位于中央前回的组成部分——形成中央沟吻侧壁的区域以及该回顶端的尾侧半。根据早期采用表面电刺激的定位研究,运动皮层被描述为具有与体感皮层相似的地形学组织模式:面部、躯干和上肢的代表区位于大脑外侧表面,其中面部位于最下方(靠近外侧裂),躯干位于最上方,而下肢主要位于半球内侧面。这种躯体定位组织常以人体模型图或称为运动小人图(motor homunculus)的图形形式呈现(图9.15B)。小人图中各身体部位的变形程度大致反映了皮层对其运动控制的支配范围。这种简单的小人图模型与传统观点高度吻合,即运动皮层是运动指令在皮层的最后处理阶段,并将运动指令中继传递至脊髓。
从1960-1970年代开始,定位研究开始采用插入皮层深层(即输出层)的微电极进行刺激。这种被称为皮层内微刺激(intracortical microstimulation)的技术能以更低刺激强度诱发运动,从而实现了更高分辨率的运动皮层定位。研究显示其地形学组织远比既往想象的复杂(见图9.15C)。研究发现,每个关节的运动均可由分布于运动皮层广泛区域内的多个非连续柱状结构所诱发,这表明控制特定关节运动的细胞柱会与调控其他关节运动的细胞柱相互交织。总之,运动皮层可能具有对应于肢体或头面部的大型分区,但在每个分区内部,控制该身体部位肌肉的细胞柱呈现复杂的混合分布模式。
这种细胞柱的混合分布具有功能意义:大多数运动需要整个肢体的肌肉协调运作,而皮层内的连接主要呈现局部化特征(即连接不同细胞柱的轴突侧支主要局限在其起源柱周围1至3{\cdot}\mathrm{mm}范围内)。当控制某个关节运动的多个细胞柱与其他关节控制柱相互混合时,多关节运动就能以协调方式发生。
补充运动区
补充运动区(supplementary motor area, SMA)主要位于大脑半球的内侧面,紧邻初级运动皮层前方,对应于布罗德曼6区(Brodmann area 6)的内侧部分(见图9.14)。它被细分为两个区域:较靠后的部分称为SMA本体(SMA proper),前部称为前SMA(pre-SMA)。SMA本体与之前提到的其他运动区类似:包含完整的躯体定位图谱(somatotopic map),参与构成皮质脊髓束,并与其他运动区相互连接。相比之下,前SMA与其他运动区和脊髓的连接较弱,而是与前额叶皮层(prefrontal cortex)相连接。
刺激研究结果表明,与运动皮层类似,SMA中存在完整的躯体定位图谱。刺激SMA可诱发单一关节的孤立运动,这与刺激运动皮层后的反应相似,但刺激需要更高的强度和更长的持续时间;此外,诱发的运动通常比运动皮层刺激引发的更为复杂。不过,对初级运动皮层进行较长时间的刺激也可诱发复杂的、看似有目的的运动序列,因此二者的区别并非绝对。另外,刺激SMA可能产生发声或复杂的姿势运动,但也可能产生相反的结果:即暂时中止运动或语言。切除补充运动皮层会延缓对侧肢体的运动,并可能导致对侧手部出现强迫性抓握动作。
• 图9.15 运动皮层肌肉拓扑组织的传统观点与现代观点。A,大脑外侧面观,显示经过中央前回(初级运动皮层)的切面方向,该切面对应于B所示的断面。B,运动皮层肌肉拓扑的经典图示("肌肉小人")。C,运动皮层组织的现代观点,显示每个身体部位在多个离散区域被重复表征。
• 图9.16 运动皮层肌肉拓扑图的动态特性。抑制性GABA能中间神经元在塑造每个运动皮层区域电刺激引发的运动反应中起重要作用。A,两个初级运动皮层区域间兴奋性连接及单个区域内局部抑制性神经元的示意图。B,大鼠脑示意图,显示施加电刺激诱发运动的运动皮层(MC)区域(Vib区)和施加荷包牡丹碱阻断GABA能突触的区域(FL区)。FL,前肢;Vib,触须。C,前肢肌电图记录显示Vib区刺激在荷包牡丹碱应用前、应用期间及洗脱后的反应。注意Vib刺激在所有条件下均诱发触须运动,但仅当FL区抑制性中间神经元被阻断时才诱发前肢运动。(数据来自Jacobs K, Donoghue J. Science 1991;251:944)
前运动区
该区域位于初级运动皮层吻侧,占据大脑外侧表面的布罗德曼6区(见图9.14)。其与初级运动皮层的区别在于诱发运动需要更高的刺激强度。前运动区被划分为两个功能不同的亚区:背侧部和腹侧部。与运动皮层类似,两个亚区均具有躯体拓扑组织结构,并共同参与皮质脊髓束的构成。背侧部(PMd)包含相对完整的下肢、躯干、上肢和面部表征图。相比之下,腹侧部(PMv)的躯体定位图主要局限于上肢和面部,仅有少量下肢表征。因此PMv似乎专门负责上肢和头部运动的控制。两个亚区的第二个区别在于PMd包含大量近端肌肉表征,而PMv则有大量远端肌肉表征。
扣带运动区
这些运动区位于扣带沟内,大致与辅助运动区(SMA)处于相同的前后水平。
扣带运动区有三个(背侧部、腹侧部和吻侧部;见图9.14B)。每个区域均包含躯体定位图并参与皮质脊髓束的构成。这些区域的微电流刺激可诱发与运动皮层刺激相似的运动,但同样需要更高的刺激强度。运动过程中的单细胞记录显示,扣带运动区神经元的自发电活动与运动准备和执行相关。
皮层运动区的连接
【SMA未明确首次出现英文全称,原文为辅助运动区(应对应supplementary motor area)】
皮层运动区的神经活动
个体运动皮层神经元在运动控制中的作用已在训练过的猴类中得到广泛研究。在这些实验中,当猴类根据感觉提示立即执行预先习得的简单动作(如腕关节屈曲)时,会记录初级运动皮层(primary motor cortex)神经元的放电活动(图9.17)。研究发现,运动皮层神经元的放电频率会在动作启动前发生改变,且这种变化的起始时间与反应时间(即从提示到动作开始的时间)相关。此外,在此类任务中,运动皮层神经元放电的变化常与产生动作的肌肉收缩力及其变化速率相关,而非与关节位置相关。这些发现表明,这些神经元参与运动计划与执行的最终阶段,这与皮层运动区的层级化观点一致。
然而,即使在早期实验中,某些运动皮层神经元的放电频率似乎与更早期的计划阶段相关。此外,当训练猴子在提示后暂时抑制动作时,尽管没有任何运动发生,运动皮层神经元的放电频率仍会发生变化。这种"设定相关(set-related)"活动已在多种其他任务中得到充分证实,表明运动皮层活动可能与皮层其他运动区的活动共同参与早期的计划阶段。这也提示可能需要其他(可能是皮层下)系统来产生触发信号以启动运动。
在后续研究中,研究者使用了一种任务范式:训练动物操纵操作杆(manipulandum)(带有手柄和末端小圆圈的装置)来捕获面前表面上的发光目标(图9.18A)。这些实验表明,运动皮层手臂区域的神经元放电频率会随多个不同方向的运动而变化,因此可被描述为具有广泛调谐(broadly tuned)特性(见图9.18B)。即某个对特定方向(称为偏好方向)运动表现出最大放电增加的神经元,对其他方向的运动也会表现出较小程度的增加甚至减少(见图9.18C)。此外,不同神经元的偏好方向在360度的可能运动方向上呈均匀分布。
这些结果意味着单个神经元可能参与大多数手臂运动,但也提出了新问题:如何通过这种广泛调谐的神经元实现精确运动?有观点认为,虽然单个神经元活动的变化不能精确预测或指定即将发生的运动方向,但神经元群体的整体活动可以确定运动方向。为验证这一假设,研究者建立了将每个神经元活动表示为向量(见图9.18D)的模型。每个神经元向量的方向由其偏好方向决定,特定运动中向量的大小与运动前该神经元的放电频率成正比。来自数百个神经元的个体神经元向量(见图9.18D_{\circ}黑线)通过向量相加可获得结果向量或群体向量(见图9.18D_{\circ}红线),该向量能准确预测即将发生的运动方向。
其他皮质运动区的活动
前运动区(premotor area)和辅助运动区(supplementary motor area)的神经元活动在许多方面与初级运动皮层(primary motor cortex)相似。这些区域的神经元也表现出与即将发生的运动相关的活动,且其活动与位移、作用力、目标位置等运动参数相关——这与初级运动皮层活动的情况类似,这符合皮质运动区分布式网络的观点。然而各区域间似乎也存在差异,尽管这些差异可能更多是量级而非本质上的。例如,在前运动区和辅助运动区中,表现出与早期运动计划阶段相关活动的神经元比例要高于初级运动皮层中的同类神经元。此外,前运动区和辅助运动区可通过其功能偏好的不同进行区分:前运动区更显著参与由外部线索触发的运动(如图9.18所示任务),而辅助运动区更多参与由内部线索(即自我发起)引发的运动。研究还表明,这些区域各自都具有功能异质性(functionally heterogeneous),因此可进一步细分;不过这些细节已超出本文讨论范围。
• 图9.17 A,记录猴子执行训练过的腕部运动时皮质脊髓神经元(corticospinal neuron)活动的实验装置。使用刺激电极诱发逆向动作电位(antidromic spikes),用于特异性识别运动皮层神经元为锥体束神经元(pyramidal tract neuron)。猴子执行运动时不施加刺激。B,当屈肌需要产生力量时(无负载和屈肌负载条件),锥体束神经元(PTN)在运动开始或肌电活动(EMG)出现前就产生放电。此外,其放电频率与所需屈肌力量水平相关。在伸肌负载条件下,屈肌无需收缩即可产生运动,因此该PTN无活动。顶部轨迹显示腕部运动,三种实验条件下的运动轨迹完全相同。因此该细胞的活性涉及编码力量大小和方向,而非位移。【基于Evarts及其同事的工作。编辑注:本图基于EV Evarts的开创性研究;具体而言,EV Evarts, Relation of Pyramidal Tract Activity to Force Exerted During Voluntary Movement, J Neurophysiol, 1968, 31 (1):14-27. 类似图示可见于教材《Principles of Neural Science》第5版Kandel等著图37-12。】
小脑的运动控制
小脑在运动控制中作用的概述
20世纪早期,科学家们发现小脑损伤会导致运动协调障碍。即小脑的损伤或缺失不会导致瘫痪、感觉丧失或无法理解任务性质,而是导致无法执行流畅协调的运动。尽管有这些早期发现,要明确小脑在运动中的具体作用仍具挑战,尽管矛盾的是我们对其看似简单的解剖和生理机制已有相对详细的了解。小脑在自主运动和某些反射运动的学习与执行中起关键作用。本节将首先探讨小脑损伤的行为学效应,继而描述其内在连接及与中枢神经系统其他部分的联系,最后讨论其活动特性。
• 图9.18 A,实验装置中猴子握住机械臂远端捕捉光点。猴子首先捕捉中心光点,然后捕捉周围被点亮的任意目标。B,散点图显示一个运动皮层细胞在八个不同方向运动时的活动。T表示目标灯亮起时间,M表示运动开始时间(位于每个散点图的中心)。散点上的每个标记代表运动皮层细胞的动作电位,每行标记显示单次试验中细胞的活性。C,余弦函数拟合放电水平与运动方向的关系。水平条表示无即将运动时的平均自发放电频率。注意对于大多数运动方向,运动前即刻和运动期间的活性较基线有显著变化。
• 图9.18(续) D,运动皮层群体活动的矢量模型。黑线代表单个细胞矢量。当针对特定运动方向进行矢量合成时,最终的群体矢量(红色)基本指向即将发生的运动方向。(B和C修改自Georgopoulos AP, JF Kalaska, R Caminiti, JT Massey. J Neurosci. 1982;2:1527。D修改自Georgopoulos AP, JF Kalaska, R Caminiti, JT Massey. 见:Massion J, Paillard J, Schultz W, Wiesendanger M, 编. Experimental Brain Research Series, vol. 7: Neuronal Coding of Motor Performance. Berlin: Springer-Verlag; 1983。)
小脑损伤的行为后果
小脑单侧损伤会导致同侧身体运动功能障碍。这反映了运动指令到达脊髓运动神经元之前,大多数小脑相关输出通路经历的两次交叉。第一次交叉发生在小脑传出通路投射至对侧丘脑,继而从丘脑投射至同侧运动皮层。第二次交叉发生在运动皮层下行的运动通路中,约85%的轴突在延髓下部通过锥体交叉完成交叉。简而言之,小脑通过丘脑投射至对侧运动皮层,而皮质脊髓通路则在延髓下部再次跨越中线。
小脑损伤导致的特定运动缺陷取决于受影响最严重的小脑功能区域。若绒球小结叶(flocculonodular lobe)受损,其运动障碍与前庭器官损伤类似,包括平衡困难和步态异常,常伴有眼震。若小脑蚓部(vermis)受累,躯干运动将受影响;若中间区或半球受损,则出现肢体运动障碍。肢体受累部位取决于损伤区域:半球损伤对远端肌肉的影响比旁蚓部损伤更为显著。
小脑疾病的运动功能障碍类型
小脑疾病中的运动功能障碍类型包括协调性障碍、平衡障碍和肌张力异常。这种协调性缺失称为共济失调(ataxia),常表现为步态笨拙,或伴有辨距不良(dysmetria)——一种因运动方向和力量控制错误导致肢体无法流畅移动到目标位置的状态。共济失调也可表现为轮替运动障碍(dysdiadochokinesia),即手部快速交替旋前旋后动作难以执行。当尝试进行复杂运动时,会出现运动分解(decomposition of movement),此时运动以一系列离散步骤完成而非流畅连贯的动作序列。当受试者被要求触碰目标时,会出现意向性震颤(intention tremor),受累肢体(手或足)随着接近目标而震颤幅度逐渐增大。
平衡受损时可见姿势稳定性下降,患者倾向于向患侧倾倒,行走时可能采用宽基底步态(步态共济失调)。言语可能缓慢且含糊不清,此类缺陷称为断续性言语(scanning speech)。除前蚓部病变外(见前文去大脑强直章节),肌张力可能减退(hypotonia);张力减退可能伴随钟摆样膝跳反射(pendular knee jerk)。通过叩击髌腱诱发股四头肌的阶段性牵张反射可证实此现象:由于肌张力减退,下肢会持续摆动数次,而正常人仅会出现高度衰减的振荡。
这些障碍部分反映了肌肉收缩的时间协调异常。通过肌电图(EMG)评估可见,正常肢体运动涉及主动肌与拮抗肌活动的精确时序激活模式:初始主动肌激活后出现拮抗肌激活,最后再次出现主动肌激活。小脑损伤时,这些激活的相对时序出现异常(图9.19)。
小脑的组织结构
小脑("little brain")位于颅后窝,紧贴枕叶下方,通过三对小脑脚(上脚、中脚、下脚)与脑干相连。从外表面仅可见小脑皮质。皮质深部为小脑白质,白质内埋藏有四对深部小脑核团:从内侧到外侧依次为顶核(fastigial nucleus)、球状核(globose nucleus)、栓状核(emboliform nucleus)和齿状核(dentate nucleus)。中间两核团常被统称为中间核(interpositus nucleus)。大部分小脑传入纤维通过下脚和中脚进入皮质及核团,而小脑核团的传出纤维则通过上脚离开。
• 图9.19 小脑活动受阻会改变运动过程中肌电图反应的时序。通过冷却小脑核团暂时阻断其功能,观察猴子肘关节运动时发现:小脑功能缺失会破坏主动肌与拮抗肌肌电激活的时序关系,导致肢体异常加速和运动轨迹超过目标位置(运动过度,hypermetria)。(数据来自Flament D, Hore J. J Neurophysiol 1986;55:1221.)
小脑皮质的分区
小脑皮质可细分为三个吻尾方向排列的叶:前叶(anterior lobe)、后叶(posterior lobe)和绒球小结叶(flocculonodular lobe)(图9.20A)。小脑各叶被两条主要裂——原裂(primary fissure)和后外侧裂(posterolateral fissure)——分隔,每个叶由一个或多个小叶(lobule)组成。小脑皮质的每个小叶由一系列横向折叠的结构构成,称为小叶(folia)。
小脑皮质还可划分为纵向分区(见图9.20B,C)。最初,小脑皮质被分为三个这样的分区:中线上的蚓部(vermis)、蚓部两侧的旁蚓部(paravermis)以及外侧的小脑半球(lateral hemispheres)。基于髓鞘构筑学(白质中轴突束的分布模式)和特定分子(如aldolase C)的表达模式,这些区域现已被进一步细分为更多分区。尽管这些分区的功能意义尚未完全明确,但小脑传入纤维(尤其是橄榄小脑系统)的拓扑结构与这些分区精确对应,且小脑浦肯野神经元(Purkinje neurons)的感受野特性也倾向于遵循这一组织模式。
小脑皮质
传入系统
小脑传入系统主要有两类:苔藓纤维(mossy fibers)和橄榄小脑纤维(olivocerebellar fibers)。苔藓纤维因其在小脑皮质中的独特形态而得名:当苔藓纤维穿行于颗粒层时,其轴突偶尔会膨大并发出许多短而扭曲的细分支。这些结构称为玫瑰花结(rosettes),是这些纤维与颗粒细胞层神经元之间的突触接触点。苔藓纤维起源于多个部位,包括脊髓(脊髓小脑通路)、背柱核、三叉神经核、网状结构内的核团、前庭初级传入纤维、前庭核、小脑核以及基底脑桥核。特定苔藓纤维投射模式的细节超出本章范围,但以下几点值得注意:
- 苔藓纤维具有兴奋性。
- 它们传递来自身体和头部的本体感觉与外感觉信息,并至少在小脑皮质形成两个躯体拓扑图谱。然而,与运动皮层类似,这些图谱是"断裂"的——相邻身体区域未必对应小脑皮质的相邻区域,而是形成复杂的镶嵌模式。
- 传递前庭信息的苔藓纤维仅投射至绒球小结叶和蚓部区域。因此,绒球小结叶和蚓部区域有时被称为前庭小脑(vestibulocerebellum)。不过,这些区域也接收其他多种信息(如视觉、颈部、动眼相关),故其功能不仅限于前庭处理。
- 苔藓纤维的最大来源是基底脑桥核,其负责中继来自大部分大脑皮层区域的信息。
- 苔藓纤维通过所有三对小脑脚进入小脑,在投射至皮质前会发出侧支纤维至小脑核。
总之,通过苔藓纤维系统,小脑接收多种感觉信息,以及下行运动相关和认知相关的活动。
与苔状纤维(mossy fibers)的多样性起源不同,所有橄榄小脑纤维(olivocerebellar fibers)均起源于单一核团——位于延髓吻端、锥体背外侧的下橄榄核(inferior olivary nucleus)。几乎所有橄榄核神经元都是投射神经元,其轴突离开核团后不分出侧支,而是穿过脑干主要通过小脑下脚进入小脑。与苔状纤维类似,橄榄小脑轴突具有兴奋性,当它们穿过小脑白质向皮质上行时,会向小脑核发出侧支。在小脑皮质中,橄榄小脑轴突可与篮状细胞(basket cells)、星状细胞(stellate cells)和高尔基细胞(Golgi cells)形成突触,但与浦肯野神经元(Purkinje neurons)形成特殊的突触连接方式。每个浦肯野神经元仅接受单个爬行纤维(climbing fiber)的输入,该纤维沿其近端树突"攀爬"并形成数百个兴奋性突触(橄榄小脑轴突的末梢部分即被称为爬行纤维)。相反,每个橄榄轴突可分支形成约10-15根爬行纤维。
下橄榄核作为独特的脑区具有以下特征:首先,其神经元几乎全为投射细胞,因此细胞间几乎不存在局部化学突触相互作用;其次,橄榄神经元通过缝隙连接(gap junctions)实现电耦合——事实上,下橄榄核是中枢神经系统中神经元缝隙连接密度最高的区域。这种结构特征使橄榄神经元能够产生同步化活动并传递至小脑。下橄榄核的传入纤维可分为两大类:来自中枢神经系统多区域的兴奋性传入,以及来自小脑核和部分脑干核团的抑制性GABA能传入。尽管这些传入纤维可调节橄榄神经元的放电频率(这是大多数脑区的典型特征),但橄榄神经元的膜特性将这种调节限制在数赫兹范围内,并赋予其作为内在振荡器的潜能。橄榄传入活动不仅调节放电频率,还可改变神经元间电耦合的效率,从而改变传递至小脑的同步活动模式。此外,传入活动可能调节橄榄神经元振荡电位的表达。因此,下橄榄核的组织结构似乎专门用于产生小脑皮质整体的同步活动模式。这些模式的功能意义仍存争议,有假说认为它们为同步不同肌肉组合的运动指令提供门控信号。
• 图9.20 小脑的解剖学分区。A,小脑皮质折叠成叶(lobe)、小叶(lobule)和叶片(folia)的中矢状面示意图。B,雪貂小脑皮质展开示意图,显示早期将小脑皮质分为三个纵向区(蚓部、旁蚓部和半球区)及进一步细分为七个纵向带(A,B,C_{1},C_{2},C_{3},D_{1},D_{2})的划分方案。每个半球的浅黄色区域表示数据缺失区域。
• 图9.20续 C,展开的大鼠小脑示意图,显示其根据分子标记染色划分的20余个亚区:本例使用斑马蛋白II(醛缩酶C)染色。小脑右半部字母和数字表示斑马蛋白分区编号。中央罗马数字表示小脑小叶。左半球名称标注小脑小叶名称。C P,锥体连合;C r,脚;D P F L,背侧副绒球;F L,绒球;P a r,旁正中;pf,原裂;Sim,单小叶;VPFL,腹侧副绒球。(B图修改自Voogd J. In: Llinás RR, ed. Neurobiology of Cerebellar Evolution and Development. Chicago: American Medical Association; 1969. C图由Izumi Sugihara博士提供)
• 图9.21 小脑皮质三维观,显示部分小脑神经元。左侧切面沿小叶长轴,右侧切面与长轴垂直。BC,篮状细胞;BCA,篮状细胞轴突;C F,攀缘(橄榄小脑)纤维;C N,小脑核细胞;GC,高尔基细胞;Glm,突触小球;G r C,颗粒细胞;M F,苔藓纤维;PC,Purkinje细胞;P F,平行纤维;SC,星形细胞。
小脑皮质的细胞成分与传出纤维
尽管在脊椎动物进化过程中经历了极大扩展,小脑皮质的基本解剖结构几乎保持恒定。其神经回路也是脑区中最具规律性和模式化的代表。小脑皮质包含八种不同类型的神经元:Purkinje细胞、高尔基细胞、颗粒细胞、Lugaro细胞、篮状细胞、星形细胞、单极刷细胞和烛台细胞。除主要分布于接受前庭输入小脑区的单极刷细胞外,这些神经元存在于小脑皮质所有区域。在高等脊椎动物小脑皮质的三个分层中分布着这八种神经元类型(图9.21)。
最外层为分子层,包含星形细胞和篮状细胞。最深层是颗粒细胞层,该层具有中枢神经系统最高的细胞密度,包含颗粒细胞、高尔基细胞和单极刷细胞。分隔分子层与颗粒细胞层的是由Purkinje神经元胞体构成的Purkinje细胞层,这些胞体排列成单细胞厚度的片层结构。烛台细胞也位于此层。Lugaro细胞稍深在,位于颗粒细胞层上缘。
小脑皮质唯一的传出投射起源于Purkinje神经元,因其突触前终末释放GABA而具有抑制性。Purkinje神经元也发出局部投射。其余七种细胞类型均为局部中间神经元。其中,星形细胞、篮状细胞、高尔基细胞、Lugaro细胞和烛台细胞同为GABA能的抑制性中间神经元,而颗粒细胞和单极刷细胞则为谷氨酸能的兴奋性中间神经元。
小脑皮质的微环路
小脑皮层内大多数神经元的树突(dendrites)、轴突(axons)和突触连接模式都按照小叶(folium)的横轴(短轴)和纵轴(长轴)进行组织(图9.21)。在蚓部,小叶走向与矢状面垂直,这些轴分别位于矢状面和冠状面。在半球区域,小叶相对于矢状面呈不同角度定向,这种对应关系消失,此时必须以小叶的局部轴作为参考轴。
浦肯野神经元树突树是中枢神经系统(CNS)中最大的。它从浦肯野细胞层穿过分子层延伸到小脑皮层表面,沿小叶横轴延伸数百微米,而在纵向上仅延伸30至40微米,使其呈现扁平外观。其形态类似一棵平躺的树,位于与小叶横轴平行的平面内。因此,一组浦肯野树突树可以被想象成一叠薄饼,这叠薄饼沿着小叶的纵轴排列。
• 图9.22 小脑皮层的功能连接。由于小脑皮层回路的几何结构,细胞成分的功能连接可以通过电生理学方法确定。本图展示了一个经典实验范式:刺激小脑皮层会激活一束平行纤维(橙色)。沿此束排列的星状细胞、篮状细胞(绿色细胞)和浦肯野细胞(PCs;橙色细胞)的电位记录显示它们被平行纤维兴奋。相反,位于该束两侧的浦肯野细胞由于平行纤维与星状细胞、篮状细胞轴突的垂直空间关系,仅接收抑制信号(紫色区域)。
分子层中间神经元(星状细胞和篮状细胞)的树突树取向与浦肯野细胞树突树相似,但分布范围小得多。星状细胞和篮状细胞的轴突横向穿过小叶,与浦肯野神经元形成突触。星状细胞和篮状细胞的突触主要位于浦肯野树突上。此外,篮状细胞还在浦肯野胞体周围形成篮状结构(该细胞因此得名),并与胞体形成突触。
颗粒细胞是小型神经元,具有4-5个短且不分枝的树突,每个树突末端呈爪状膨大,与苔状纤维花结及高尔基细胞轴突终末通过复杂排列形成突触结构(glomerulus)。颗粒细胞的轴突穿过浦肯野细胞层上行至分子层,在此分叉形成平行纤维。这些平行纤维沿小叶纵轴(与浦肯野细胞、星状细胞和篮状细胞树突树的平面垂直)平行于小脑表面走行,并与浦肯野细胞、高尔基细胞、星状细胞和篮状细胞的树突形成兴奋性突触。
平行纤维与浦肯野细胞(Purkinje cells)、分子层中间神经元(篮状细胞和星状细胞,basket and stellate cells)树突树之间的正交关系具有重要的功能意义。这种排列方式可实现最大程度的汇聚(convergence)和发散(divergence)。单根平行纤维(长度可达6毫米)可穿过100多个浦肯野细胞树突树(以及中间神经元树突);然而,由于它仅穿过扁平树突树的短轴方向,因此与任何特定细胞仅形成1-2个突触。反之,单个浦肯野树突可接收约100,000根平行纤维的突触输入。因此,实验性激活一束平行纤维时,可兴奋与其排列方向一致的一列浦肯野细胞和中间神经元(图9.22)。此外,由于中间神经元的轴突走向与平行纤维垂直,这种兴奋束的两侧会伴随抑制效应。尽管这一经典电生理实验清晰地展示了小脑皮层的功能连接特性,但此类兴奋束是否存在于生理状态下仍未得到明确解答。
高尔基细胞(Golgi cells)是颗粒细胞层中的抑制性中间神经元。其轴突和树突分支的几何构型是皮层正交平面结构的一个例外——它们的树突和轴突构筑出近似锥形的区域:如同两个锥体尖端相接,胞体位于两锥尖相接处。树突树形成上锥体(常延伸至分子层),轴突形成下锥体。高尔基细胞的兴奋输入来自苔藓纤维(mossy fibers)、橄榄小脑纤维(olivocerebellar fibers)和颗粒细胞轴突(平行纤维),抑制输入来自篮状细胞、星状细胞和浦肯野细胞轴突侧支。它们通过抑制颗粒细胞参与反馈抑制环路(当被平行纤维激活时)和前馈抑制环路(当被苔藓纤维激活时),从而调控苔藓纤维-平行纤维通路对浦肯野细胞的信号传递。
卢格罗细胞(Lugaro cells)具有纺锤形胞体,两侧各发出一条相对不分枝的树突,沿小叶横轴方向延伸数百微米(通常位于浦肯野细胞层下方)。其主要输入来自浦肯野细胞轴突侧支,次要输入来自颗粒细胞轴突。其轴突终末主要分布于分子层,与篮状细胞、星状细胞(可能还有浦肯野神经元)形成突触。这些神经元似乎通过采集浦肯野神经元的活动状态,既提供正反馈信号(抑制那些抑制浦肯野神经元的中间神经元)又提供负反馈信号(直接抑制浦肯野神经元)。
单极刷细胞(unipolar brush cells)仅具有单根树突,末端形成紧密的小分支丛(形似刷子)。这些细胞接收来自苔藓纤维的兴奋性输入和来自高尔基细胞的抑制性输入。据推测,它们与颗粒细胞和高尔基细胞形成突触,因此可能在苔藓纤维-平行纤维通路中发挥兴奋性前馈连接作用。
烛台细胞(candelabrum cells)是位于浦肯野细胞层的GABA能神经元。其树突和轴突终末分布于分子层,轴突分支模式形似烛台。
小脑核
小脑皮层浦肯野细胞在运动协调中的活动
小脑深部核团(deep cerebellar nuclei)是小脑皮层(cerebellar cortex)的主要投射目标。这种投射具有地形学组织特征,即皮层每个纵向条带(longitudinal strip)都特异性地投射到小脑核团的特定区域。其大体模式为:蚓部(vermis)投射至顶核(fastigial nucleus)和前庭核(vestibular nuclei),旁蚓区(paravermal region)投射至间位核(interpositus nucleus),外侧半球(lateral hemisphere)则投射至齿状核(dentate nucleus)。
小脑深部核团的神经元进而将小脑的输出传递至脑的其他区域(主要例外是直接投射至前庭核的浦肯野神经元)。在讨论小脑深部核团输出时,根据核团细胞是否为GABA能(GABAergic)进行分类具有重要意义——因为GABA能细胞通过投射至下橄榄核(inferior olivary nucleus)形成负反馈环路,调控小脑的主要传入来源之一。值得注意的是,GABA能细胞会特异性地投射至下橄榄核的特定区域,这些区域既是其自身传入输入的来源,也是其对应皮层纵向条带接受攀缘纤维(climbing fibers)的起始核团。因此,小脑皮层、小脑核团与下橄榄核在功能上通过一系列闭合环路形成组织结构。非GABA能的兴奋性核团细胞则向从脊髓到丘脑的多种靶区发出投射。一般而言,每个核团均发出交叉的上行和下行投射纤维,这些纤维通过小脑上脚(superior cerebellar peduncle)离开小脑。顶核还发出大量非交叉纤维,以及另一组称为钩束(uncinate gyrus/hook bundle)的交叉投射,后者通过小脑下脚(inferior cerebellar peduncle)离开。
尽管各核团的具体靶区存在差异,但总体而言,小脑上行投射主要终止于中脑结构(如红核(red nucleus)和上丘(superior colliculus))以及丘脑腹外侧核(ventral lateral nucleus of thalamus)。丘脑腹外侧核连接初级运动皮层,从而将小脑与端脑的运动区域相联系(端脑运动区也通过包括基底脑桥(basilar pons)和下橄榄核在内的多条通路与小脑形成联系)。需要指出的是,小脑上行投射(尤其是来自齿状核的投射)也终止于端脑的非运动区,特别是额叶。下行纤维主要投射至基底脑桥核、下橄榄核和多个网状核团。最后,小顶核还发出少量小脑脊髓通路(cerebellospinal pathway)。顶核与前庭核团之间存在显著投射联系。
• 图9.23 浦肯野细胞对兴奋性输入的细胞外记录响应。A,颗粒细胞通过其上升轴突和平行纤维兴奋浦肯野细胞,并触发简单锋电位。B,攀缘纤维活动导致浦肯野细胞产生高频(约500 Hz)的锋电位爆发,称为复杂锋电位。注意初始锋电位之后的峰电位幅度较小,称为小锋电位(spikelets)。
通过苔藓纤维(mossy fiber)对小脑皮层的输入,经由颗粒细胞(granule cells)的兴奋作用,可引发浦肯野神经元(Purkinje neuron)产生单一动作电位,称为简单锋电位(simple spikes)(图9.23)。浦肯野神经元自发的简单锋电位放电频率通常在20至100 Hz之间,但可通过平行纤维(parallel fiber)输入的兴奋作用与小脑皮层中间神经元抑制作用的相对平衡进行更大范围的调节(从0至>200 Hz)。这种活动反映了小脑皮层的功能状态。有趣的是,2000年代早期的研究表明,简单锋电位的自发活动水平在小脑皮层不同区域存在系统性差异:斑马蛋白阴性(zebrin-negative)区域的放电频率平均是斑马蛋白阳性(zebrin-positive)区域的两倍。这一发现的完整意义尚未明确,但表明尽管小脑皮层环路在解剖结构上具有均一性,其功能可能存在显著差异。
相比之下,攀缘纤维(climbing fiber)放电会以全或无(all-or-none)的方式引发高频动作电位爆发,称为复杂锋电位(complex spikes)(见图9.23)。这种强效兴奋源于单个攀缘纤维与浦肯野神经元形成的突触连接,使得攀缘纤维放电与复杂锋电位之间具有近乎一对一的关系。因此,复杂锋电位能够覆盖皮层水平的其他活动,反映下橄榄核(inferior olivary nucleus)的功能状态。自发性复杂锋电位的平均放电频率仅约1 Hz。
由于攀爬纤维以如此低的频率产生复杂峰电位(complex spike),它们不会显著改变浦肯野细胞(Purkinje cell)的平均放电率。因此,学界普遍认为它们对直接塑造小脑皮层输出没有作用,也不参与实时运动控制。相反,学界通常认为其功能是改变浦肯野神经元对平行纤维(parallel fiber)输入的反应性。特别地,在某些情况下,复杂峰电位活动会导致平行纤维突触效能(synaptic efficacy)的长期抑制(long-term depression,LTD)。平行纤维突触的LTD被认为是运动学习(motor learning)的生物学基础。
根据主流假说,平行纤维系统(以及由此产生的简单峰电位)参与实时运动的生成。当预期运动与实际运动存在偏差时,这种误差会激活下橄榄核(inferior olivary nucleus)的复杂峰电位——其投射会聚于同一批浦肯野神经元,导致活跃的平行纤维突触产生LTD。突触强度的改变会引起运动输出调控的长期变化。如果这种变化导致运动正确执行,下橄榄核不会被激活,运动程序保持不变;但如果仍存在误差,橄榄小脑系统(olivocerebellar system)会触发更多复杂峰电位,导致突触效能进一步改变,以此类推。本质上,小脑回路中的这种相互作用为"熟能生巧"提供了生物学基础。
另一种观点认为,橄榄小脑系统直接参与运动控制(需注意这并不排除其在运动学习中的作用),尤其是协助运动指令的时序调控。这一观点源自小脑损伤后观察到的运动缺陷类型,并能解释前述下橄榄核的特殊性质:即其能在浦肯野细胞群中产生节律性、同步化的复杂峰电位放电。由于投射至小脑深部核团(cerebellar deep nuclei)的浦肯野轴突具有会聚特性,这些复杂峰电位会在小脑核神经元上产生同步化的抑制性突触后电流(inhibitory postsynaptic currents,IPSPs)。由于小脑核神经元的膜特性,这些同步化的IPSPs对深部核团细胞放电的影响与简单峰电位引起的IPSPs有本质区别——后者数量更多但基本不同步。具体而言,同步化的IPSPs可能引发核团细胞活动发生精确时序的大幅变化,继而作为门控信号传递至其他运动系统。事实上,自主运动似乎由一系列反映中枢振荡过程的周期性加速组成。橄榄小脑系统是否通过这种方式调控运动指令的时序,仍有待进一步验证。
基底神经节的运动控制
基底神经节的组成及相关核团
基底神经节的运动组成部分由一组皮质下核团构成,包括背侧纹状体(尾状核和壳核)、苍白球、黑质和底丘脑核(图9.24)。术语"纹状体(striatum)"源于这些核团的条纹状外观,特指由内囊前肢形成的纤维束分隔尾状核与壳核时产生的条纹结构。苍白球通常分为两部分:外侧部(external segment)和内侧部(internal segment)。壳核与苍白球的组合常被称为豆状核(lentiform nucleus)。底丘脑核属于间脑的一部分,而黑质位于中脑(见图9.24)。黑质(substantia nigra,意为"黑色物质")因其含有黑色素而得名。该核团致密部(pars compacta)的许多神经元含有黑色素——这是多巴胺(dopamine)合成的副产物。黑质的另一分区为网状部(pars reticulata)。
• 图9.24 基底神经节及其紧密关联脑区的组成。基底神经节的主要成分包括尾状核、壳核、苍白球和黑质网状部。基底神经节的大部分通过腹前核(VA)与腹外侧核(VL)与额叶皮层的运动区相连,并与上丘形成连接。来自黑质致密部的输入对基底神经节的正常功能至关重要。GPe,苍白球外侧部;GPi,苍白球内侧部。
基底神经节主要与两个丘脑核团——腹前核(ventral anterior, VA)和腹外侧核(ventral lateral, VL)进行信息传递,与板内核(intralaminar nuclei)或板内复合体(intralaminar complex)的联系较弱(见图9.24)。
基底神经节的连接与运作机制
除初级视觉皮层和听觉皮层外,大脑皮层的大部分区域都以拓扑方式投射到纹状体。皮质纹状体投射(corticostriatal projection)主要源于皮层V层的兴奋性谷氨酸能神经元。随后,纹状体通过直接通路和间接通路影响丘脑腹前核(VA)与腹外侧核(VL)的兴奋性(图9.25A)。丘脑神经元又进一步兴奋大脑皮层神经元,从而与大部分皮层形成闭合环路(即皮层→基底神经节→丘脑→皮层)。根据皮层区域和功能(运动与认知)的不同,已识别出多个独立环路;此处将重点以运动相关环路作为基底神经节运作的模型(见图9.25A)。
直接通路
通过基底神经节至丘脑,最终到达皮层运动区的直接通路的总体作用是增强运动活动。在直接通路中,纹状体投射至苍白球内侧部(GPi)。该投射具有抑制性,主要递质为GABA。GPi向丘脑的VA和VL核投射。这些连接同样以GABA为递质并发挥抑制作用。VA和VL核向前额叶皮层、前运动皮层及辅助运动皮层发送兴奋性连接。这些输入至皮层的信号影响运动规划,并调控皮质脊髓和皮质延髓神经元的放电。
• 图9.25 基底神经节运动控制的功能连接。A,基底神经节各组分与其他相关运动区的连接。皮层对尾状核和壳核的兴奋性输入通过直接通路和间接通路影响GPi及黑质网状部(SNpr)的输出。间接通路中的两个抑制性环节意味着该通路的活性对基底神经节至丘脑和上丘的输出具有与直接通路相反的效应。多巴胺(DA)是一种神经调质,分别作用于参与直接通路和间接通路的纹状体神经元上的\mathsf{D}_{1}和\mathsf{D}_{2}受体。B,帕金森病中发生的活性流变化,此时黑质致密部(SNpc)发生退行性变。C,亨廷顿病中的活性流变化,此时对GPe的抑制性调控丧失。加号(+)和减号(-)分别表示突触连接的兴奋性或抑制性性质。glu,谷氨酸;G P e,苍白球外侧部;G P i,苍白球内侧部;VA/VL,丘脑腹前核/腹外侧核。
直接通路(Direct Pathway)
直接通路的功能机制如下:纹状体(striatum)神经元在静息状态下活性较低,但在运动过程中会被来自皮层的输入激活。与之相反,苍白球内侧部(GPi)神经元具有较高的基础活性水平。当纹状体被激活时,其向苍白球(GP)的抑制性投射会降低GPi神经元的活性。GPi神经元本身具有抑制性功能,它们通常对丘脑腹前核(VA)和腹外侧核(VL)神经元施加紧张性抑制(tonic inhibition)。因此,纹状体的激活通过抑制GPi,导致VA和VL核神经元的去抑制(disinhibition)。当VA/VL神经元被去抑制后,其放电频率增加,进而激活大脑皮层运动区的靶神经元。由于运动区通过激活脊髓和脑干中的α与γ运动神经元来引发运动,基底神经节(basal ganglia)可通过增强运动皮层神经元活性来调控运动。
间接通路(Indirect Pathway)
间接通路的整体效应是降低大脑皮层运动区神经元的活性。该通路涉及纹状体至苍白球外侧部(GPe)的抑制性连接,而GPe又向底丘脑核(subthalamic nucleus)发送抑制性投射,底丘脑核则向GPi发送兴奋性投射(见图9.25A)。
在此通路中,GPe神经元受到纹状体GABA能(GABAergic)抑制性投射的抑制。由于GPe本身也释放GABA,其向底丘脑核的投射具有抑制性。因此,纹状体对GPe的抑制会导致底丘脑核神经元的去抑制,后者通过释放谷氨酸(glutamate)激活GPi神经元。GPi兴奋性增强的后果是通过其GABA能投射对VA和VL丘脑核施加更强的抑制。最终,丘脑神经元及其影响的皮层神经元活性均降低。
直接通路与间接通路的作用相互拮抗;其中任一通路活性的增强可能导致运动控制的失衡。这种失衡是基底神经节疾病的典型特征,可能改变皮层的运动输出。
黑质致密部(Substantia Nigra Pars Compacta)神经元对纹状体的作用
多巴胺(dopamine)是黑质致密部神经元产生的神经递质。在黑质纹状体通路(nigrostriatal pathway)中,多巴胺的释放对直接通路具有整体兴奋作用,而对间接通路具有抑制作用。然而这是一种调节性效应;多巴胺并非通过直接触发动作电位,而是通过改变纹状体细胞对其他递质的反应来发挥作用。这种对直接和间接通路的不同作用源于纹状体中型多棘投射细胞(medium spiny projection cells)表达不同类型的多巴胺受体\left(\mathrm{D}_{1}\right)与\mathrm{D}_{2}))。参与直接通路的纹状体细胞表达\mathrm{D}_{1}受体,而参与间接通路的细胞表达\mathrm{D}_{2}受体。多巴胺释放的总体效应是促进VA和VL核的活性,最终增强大脑皮层运动区的激活。
纹状体的基质区(Matrix)与纹状小体(Striosomes)分区
根据相关的神经递质,纹状体可细分为称为纹状体小体(striosomes,也称为斑块)和基质(matrix)的区域。与运动控制相关的皮质投射终止于基质区。边缘系统投射至纹状体小体。纹状体小体被认为与黑质致密部(pars compacta of the substantia nigra)形成突触联系,并影响多巴胺能的黑质纹状体通路。
基底神经节在运动控制中的作用
基底神经节影响皮质运动区。因此,基底神经节对运动通路的侧皮质脊髓系统具有重要调控作用。这种影响与基底神经节疾病中观察到的某些运动障碍表现一致。基底神经节也调控内侧运动通路,因为基底神经节疾病还可影响近端肌肉的姿势和张力。
各种基底神经节疾病中出现的功能缺损包括异常运动(运动障碍)、肌张力增高(齿轮样强直)和运动启动迟缓(运动迟缓)。异常运动包括震颤、手足徐动症(athetosis)、舞蹈症(chorea)、投掷症(ballism)和肌张力障碍(dystonia)。基底神经节疾病的震颤为3Hz的"搓丸样震颤(pill-rolling tremor)",出现于肢体静止时。手足徐动症表现为肢体远端缓慢的扭转动作,而舞蹈症则以四肢和面部肌肉快速抽动为特征。投掷症与肢体的挥摆动作(投掷样运动)相关。最后,肌张力障碍性运动是缓慢的不自主运动,可能导致身体姿势扭曲。
帕金森病(Parkinson disease)是以震颤、强直和运动迟缓为特征的疾病。该病由黑质致密部(substantia nigra pars compacta)神经元变性导致,进而引起纹状体多巴胺缺失。蓝斑(locus coeruleus)、中缝核(raphe nuclei)以及其他单胺能核团的神经元也会发生丢失。多巴胺的缺失会降低直接通路的活动性并增强间接通路的活动性(见图9.25B)。最终效应是GPi神经元活动性增加,并加强对VA和VL核神经元的抑制。VA和VL核兴奋性降低导致运动皮质区激活减少,出现运动启动困难和运动减慢(运动迟缓)。
在多巴胺能神经元完全丧失之前,给予左旋多巴(levodopa)可缓解帕金森病的部分运动症状。左旋多巴是多巴胺的前体物质,能够通过血脑屏障。通过降低基底神经节对VA和VL核的抑制作用,目前已开发出其他疗法以缓解帕金森病的一些破坏性症状。例如,在GPi或丘脑底核植入电极可用于抑制这些部位,从而减少对VA和VL核的抑制。尽管该技术被称为深部脑刺激(Deep Brain Stimulation, DBS)——可能暗示激活作用,但DBS通常抑制电极置入部位的局部活动。
眼球运动
眼球运动具有若干区别于其他运动行为的特征。与具有多关节和多肌肉的肢体运动相比,眼球运动相对简单但非常快速。例如,每只眼球仅由三对拮抗肌控制:内直肌与外直肌、上直肌与下直肌,以及上斜肌与下斜肌。这些肌肉使眼球能够绕三个轴旋转。假设头部处于直立位,这三个轴分别是垂直轴、左右向水平轴和扭转轴(沿视线方向延伸)。内直肌和外直肌控制绕垂直轴的运动;其余四块肌肉产生绕水平轴和扭转轴的运动。另一个简化特征是眼球运动无需补偿外部载荷。此外,眼球运动似乎可分为几种不同类型,每种类型由其专门的神经回路控制。眼球运动障碍还为神经系统问题的无创诊断提供重要临床线索。我们首先回顾不同类型的眼球运动,然后讨论其产生的神经机制。
眼球运动类型
前庭-眼反射(Vestibulo-ocular Reflex)
眼动
眼动(eye movement)的进化可能最初是为了保持外部世界的影像静止。相反,肢体运动的进化则是为了改变肢体相对于外部世界的位置。其原因是当眼球相对于外部世界运动时(即视觉场景在视网膜上滑动),视觉敏锐度会迅速下降。这种滑动的主要诱因是头部运动。前庭眼反射(vestibulo-ocular reflex,VOR)是补偿头部运动以维持视网膜上视觉场景稳定性的主要机制。
为了保持视网膜上视觉场景的稳定,VOR会产生与头部运动等幅且反向的眼球运动。这一反射由前庭系统(vestibular system)中毛细胞(hair cell)的激活所引发(见第8章)。需注意的是,前庭器官对头部加速度敏感,而非视觉线索,因此VOR在明暗环境中均可发生。从功能上看,VOR被称为开环系统(open-loop system),因为它会根据刺激(头部加速度)产生输出(眼球运动),但其即时行为并不受输出成功或失败的反馈调节。然而值得注意的是,至少在明光条件下,VOR未能匹配眼球与头部旋转时会导致视网膜滑动(retinal slip)(即视觉影像在视网膜上的滑动),这种误差信号可通过其他神经通路反馈至VOR回路,并随时间推移调整VOR的强度以消除误差。
头部运动有六种不同方式,常称为六自由度(six degrees of freedom):三个平移自由度与三个旋转自由度。为补偿这些不同类型的运动,存在平移性VOR和角VOR,以及处理不同方向运动的独立子系统(例如绕垂直轴或水平轴的旋转)。
视动反射
视动反射(optokinetic reflex,OKR)是中枢神经系统(CNS)稳定视网膜上视觉场景的第二机制,常与VOR协同工作。VOR仅由头部运动激活,而OKR则由视觉场景的运动激活——无论该运动是由场景自身移动还是头部运动引起。具体而言,该反射的感官刺激是视网膜上视觉场景的滑动,由运动敏感性视网膜神经节细胞(motion-sensitive retinal ganglion cell)检测。前者的一个例子是当你坐在火车中,相邻轨道的火车开始移动时:你的眼球会旋转以保持相邻车厢影像的稳定。这常会导致一种你在移动的感觉(这并不完全令人意外,因为OKR回路会接入与前庭系统相同的回路)。
OKR可与VOR协同稳定视觉影像,且在头部缓慢运动时对维持影像稳定尤为重要,因为VOR在此类条件下表现不佳。
扫视
动物生理学教材翻译
在具有中央凹(fovea)的动物中,眼睛相对于外界(即主要视觉场景)的运动能力变得尤为重要,这使得重要物体能够聚焦到分辨率最高的区域——中央凹。实现这种能力的眼动分为两类:扫视(saccadic)和平滑追踪(smooth pursuit)。将视觉场景中特定区域快速带入中央凹的极高速离散运动称为扫视(saccades)。例如,阅读本句时,你正通过一系列扫视将连续的单词带入中央凹以进行识别。然而,即使缺乏中央凹的动物也会产生扫视,因此扫视也可用于快速扫描视觉环境。
扫视是极其快速的眼球运动。人类的扫视速度可达800度/秒,而由典型前庭眼反射(VOR)和视动性眼震反应(OKR)刺激产生的运动速度通常低于10度/秒(人类OKR刺激可产生最高约120度/秒的速度,但仍远低于最大扫视速度)。扫视可以是自主性或反射性的。此外,尽管通常由视觉目标触发,它们也可朝向听觉或其他感觉线索、在黑暗中发生,或指向记忆中的目标。
有趣的是,视觉处理在扫视发生前和过程中似乎会被抑制,尤其是在负责视觉运动信息处理的大细胞视觉通路(magnocellular visual pathway)中。这种现象称为扫视抑制(saccadic suppression),其功能可能是为了避免因扫视导致的视觉场景突然快速移动感。扫视抑制的机制尚未完全明确,但在与视觉处理相关的皮层区域中,细胞对视觉刺激的反应性在扫视期间会降低并发生改变。
平滑追踪(Smooth Pursuit)
当扫视将移动目标带入中央凹后,平滑追踪系统可使其稳定停留在中央凹,即使目标持续运动。这种能力似乎仅存在于灵长类,允许对移动目标进行长时间连续观察。需注意,平滑追踪在某些方面可能与OKR相似;实际上二者可能不存在绝对差异,因为当目标尺寸增大时,目标与背景的区分会消失;然而,对于小型移动目标,平滑追踪需要抑制OKR。通过以下实验可观察这种抑制效应:将手指在本文前左右移动并用眼睛追踪,此时手指保持清晰对焦,而页面文字作为背景场景的一部分会因视网膜滑动而变得无法辨识。
眼球震颤(Nystagmus)
当存在持续的视动反射(optokinetic reflex,OKR)或前庭眼反射(vestibulo-ocular reflex,VOR)刺激时(例如持续向单一方向旋转),如前所述,这些反射最初会通过反向旋转眼球来维持视网膜上的稳定成像。然而,在持续刺激下,眼球会达到其机械运动极限,无法继续代偿,此时影像将开始在视网膜上滑动。为避免这种情况,眼球会向相反方向产生快速的扫视样运动,本质上将眼球复位以重新开始注视视觉场景。随后,由OKR或VOR诱导的慢速反向旋转将重新开始。这种慢速与快速运动交替出现的反向运动现象称为眼球震颤(nystagmus),可通过眼球震颤图(nystagmogram)记录(图9.26)。因此,眼球震颤可定义为包含快相和慢相的节律性眼球振荡运动。由于快相更易观察,眼球震颤的命名依据快相方向而定。
除由VOR或OKR刺激生理性诱发外,眼球震颤也可由前庭通路损伤引起(包括外周性损伤如cranial nerve VIII,或中枢性损伤如前庭神经核),是具有诊断意义的症状。
辐辏(Vergence)
共轭性眼动(conjugate eye movement)指双眼以相同方向和等幅度运动。这种协调机制可在眼动过程中维持目标物成像于双眼中央凹,是维持双眼视觉(binocular vision)且不产生复视(diplopia)的必要条件。然而,当目标物靠近时(<30 m),维持双眼中央凹成像需要双眼进行非对称运动。这种非共轭性运动,即辐辏运动(vergence movement),也是双眼注视接近或远离物体的必要条件。触发辐辏运动的刺激信号包括复视和模糊影像。需注意的是,在追踪接近物体的过程中,除辐辏运动外,晶状体还会发生近距视物的调节(accommodation),同时伴随瞳孔收缩。
• 图9.26 眼球震颤图显示眼球震颤期间的眼动轨迹。图中显示左向眼球震颤,因快相指向左侧(图中表现为向下偏移)。
眼动的神经回路与活动基础
眼外肌运动神经元
支配眼外肌(extraocular muscles)的脑神经核团有三组:动眼神经核(oculomotor nucleus)、滑车神经核(trochlear nucleus)和展神经核(abducens nucleus)。这三个核团有时被统称为眼外运动神经核,但具体所指(特定核团或全部)需根据上下文明确。动眼神经核包含支配同侧内直肌(medial rectus)和下直肌(inferior rectus)、同侧下斜肌(inferior oblique)以及对侧上直肌(superior rectus)的运动神经元;滑车神经核包含支配对侧上斜肌(superior oblique)的运动神经元;展神经核则包含支配同侧外直肌(lateral rectus)的运动神经元。这些运动神经元形成体内最小的运动单位之一(神经-肌肉比例为1:10),这与精确眼动所需的精细调控特性相符。
前庭-眼反射的神经回路基础
前庭-眼反射(VOR)通过使眼球向头部运动相反方向旋转来抵消头部运动。针对头部的旋转运动和平移运动存在独立的神经回路。前者的感受器是半规管中的毛细胞,后者则依靠耳石器(椭圆囊和球囊)中的毛细胞。角加速度前庭-眼反射的神经回路相对简单(但仍具复杂性),本节重点通过这些通路阐述该反射的工作机制。前庭传入纤维投射至前庭神经核;前庭神经核继而投射至各个动眼神经核;动眼神经核中的运动神经元发出轴突支配眼外肌。
关于角加速度前庭-眼反射通路:产生水平眼动的通路起源于水平半规管,而垂直眼动的类似通路则起源于前、后半规管。图9.27A展示了水平前庭-眼反射的基本回路。需注意图中仅显示源自左侧水平半规管和前庭神经核的主要中枢回路,但镜像对称的通路也存在于右侧半规管和前庭神经核。参与水平前庭-眼反射通路的前庭传入纤维主要与内侧前庭神经核形成突触,后者向双侧外展神经核发出投射:抑制性神经元向同侧投射,兴奋性神经元向对侧投射。对内直肌的控制通过外展神经核的核间神经元实现,这些神经元从外展神经核投射至控制内直肌的动眼神经核相应区域。值得注意的是,该通路的双重交叉使功能协同肌(如左内直肌与右外直肌)的反应得以协调一致。
垂直前庭-眼反射通路主要涉及上前庭神经核,该核团直接向动眼神经核发出双侧投射。
当头部向左旋转时(如图9.27B所示),水平半规管通路会发生如下反应。头部左旋会导致视觉影像向右滑动。然而,前庭动眼反射(VOR)的补偿机制会通过左侧半规管毛细胞对角加速度的去极化反应而被触发(见图8.27)。去极化的毛细胞会增加左侧前庭传入纤维的活动,从而激活左侧前庭内侧核的神经元。
这些神经元包括投射到对侧外展神经核的兴奋性前庭神经元,它们与运动神经元和核间神经元形成突触连接。运动神经元的兴奋会导致右侧外直肌收缩并使右眼向右转动,而右侧外展神经核核间神经元的兴奋会激活左侧动眼神经核的内直肌运动神经元,从而使左眼也向右转动。
• 图9.27 水平前庭动眼反射(VOR)的神经环路基础。A,前庭神经核接受来自水平半规管传入纤维的兴奋性输入,并投射到外展神经(第VI对脑神经)核。该核支配外直肌并投射到对侧动眼神经(第III对脑神经)核,后者控制内直肌。兴奋性神经元以红色表示;抑制性神经元以蓝色表示。注意仅显示源自左侧前庭神经核的主要通路,为清晰起见,右侧前庭神经核起始的镜像通路仅显示起始部分(虚线)。B,头部左旋引发的VOR环路活动流向。轴突增粗表示活动增强;与静息状态(A)相比,轴突变细表示活动减弱。注意左旋既引起左侧前庭传入纤维活动增强,也引起右侧活动减弱。I,下;L,外侧;M,内侧;MLF,内侧纵束;S,上;VI,前庭神经核。
在起始于左侧前庭内侧核向同侧外展神经核投射的抑制性前庭神经元通路上,这些细胞的活动会导致左侧外直肌运动神经元和右侧内直肌运动神经元(后者通过核间神经元至右侧动眼神经核)的抑制。因此,这些肌肉松弛,从而促进双眼向右转动。由此可见,眼睛既被一组肌群张力增强所"牵拉",又被拮抗肌群张力释放所"推动"。
需要再次说明的是,为清晰起见,图9.27中省略了源自右侧半规管的镜像通路,但头部左旋时通过这些通路的活动变化将完全相反,因此它们将与图中所示通路产生协同作用。简而言之,头部左旋会使右侧半规管的毛细胞超极化,从而导致右侧前庭传入活动减弱和右侧前庭神经核神经元的去促进(dis-facilitation)。
前庭连合通路的调节功能
连接两侧内侧前庭核的连合纤维(commissural fibers)具有兴奋性,但其终止于对侧前庭核的局部抑制性中间神经元,从而抑制该核的投射神经元。这一通路增强了对侧前庭传入纤维对其靶向前庭核神经元的作用。例如,左侧前庭核的连合细胞被激活后,会引起右侧内侧前庭核投射神经元的主动抑制,从而强化右侧传入活动减少导致的去易化(dis-facilitation)效应。事实上,即使单侧迷路切除(破坏了对这些核团的直接前庭传入输入)后,这一连合通路仍能有效调节对侧前庭核的活动。
重要的是,叠加在脑干回路之上的是小脑。小脑蚓部和绒球小结叶(flocculonodular lobe)接收初级前庭传入纤维或次级前庭传入纤维(前庭核神经元的轴突),或两者兼有,并通过单突触通路直接或经顶核(fastigial nucleus)的双突触通路(disynaptic pathway)反向投射至前庭核。小脑回路在生成前庭眼反射(VOR)中的确切作用尚有争议,但其重要性体现在:损伤这些回路会导致异常眼动(如自发性眼球震颤)及其他前庭功能障碍症状。
视动反射的神经回路基础
诱发视动反射(OKR)的刺激是视觉性的(视网膜滑动),因此光感受器是反射弧的起点。该反射的关键脑干中枢位于中脑吻端的被盖和前顶盖区,包括视束核(NOT)和一组统称为副视核(AON)的核团。方向选择性和运动敏感性的视网膜节细胞是向这些核团传递视觉信息的主要传入来源。此外,输入还来自枕叶和颞叶的初级及高级视皮层。后者的传入源在灵长类和人类中尤为重要。NOT和AON的细胞具有大感受野,其反应对视觉场景运动的方向和速度具有选择性。值得注意的是,NOT/AON细胞的最佳运动方向与半规管垂直轴旋转引起的运动高度对应,从而促进VOR与OKR的协调以产生稳定的视网膜成像。
临床关联
临床相关
前庭迷路功能的临床检测可通过两种方法实施:使用Bárány椅旋转患者以激活双侧迷路,或将冷水或温水注入单侧外耳道(温度试验)。当受试者在Bárány椅中被旋转时,旋转过程中会产生眼球震颤(nystagmus)。此时眼球震颤的快相方向与旋转方向一致。当旋转停止时,会出现反方向的眼球震颤(旋转后眼球震颤),因为停止旋转产生的效应等同于向相反方向加速运动。
当单侧迷路受到刺激(如梅尼埃病)或迷路功能丧失(可能由头部创伤或迷路病变引起)时,来自两侧前庭-眼反射通路(VOR pathways)的传入信号将失去平衡。这种情况可导致病理性眼球震颤。例如,左侧迷路受刺激可增加支配左水平半规管(horizontal semicircular duct)的传入纤维放电频率。此时产生的信号类似于头部正常左转时产生的信号。由于刺激持续存在,将引发左向眼球震颤:慢相右移(由VOR通路介导)伴随快相左移。右侧迷路损毁产生的效应与左侧迷路受刺激类似。值得注意的是,这种眼球震颤是暂时性的,表明相关神经回路具有随时间推移产生适应性调节的能力。
这些神经核的传出联系广泛且复杂,目前尚未完全阐明。存在至动眼神经核和展神经核的多突触通路,以及至前庭神经核的单突触传入,这些联系使前庭-眼反射(VOR)得以实现。此外还有向多个小脑前核(precerebellar nuclei)的投射,包括下橄榄核(inferior olivary nucleus)和基底脑桥核(basilar pontine nuclei)。这些通路经小脑绒球(flocculus)环路返回前庭神经核。总之,通过多条并行通路的协同作用,神经活动最终到达各动眼神经核,激活运动神经元,从而产生精确的眼球反向运动。
扫视运动的神经回路基础
扫视(Saccades)由中脑上丘(superior colliculus)或大脑皮层(额叶眼区[FEF]及顶后叶区域)的神经活动触发。上丘的神经活动与扫视方向及幅度的计算相关。实际上,上丘深层包含扫视位置的拓扑运动图谱(topographic motor map)。上丘将信息分别传递至控制水平和垂直扫视的中枢——水平凝视中枢与垂直凝视中枢。水平凝视中枢由展神经核附近的旁正中脑桥网状结构(PPFR)神经元构成(图9.28A)。垂直凝视中枢位于中脑网状结构,具体为内侧纵束吻侧间质核(rostral interstitial nucleus of the medial longitudinal fasciculus)和Cajal间质核(interstitial nucleus of Cajal)。由于水平凝视中枢的神经回路和运作机制比垂直凝视中枢更明确,本节将重点讨论前者。但需要指出,在垂直凝视中枢中也发现了具有类似活动模式的细胞群。
生成扫视运动的神经回路
热量试验(caloric test)更为实用,因为它能区分两侧迷路的功能障碍。颈部后仰约60度,使两侧水平半规管基本处于垂直位。若将温水注入左耳,由于加热导致内淋巴比重降低,左侧半规管袢外侧部分的内淋巴趋于上升。这将引发内淋巴的对流运动,结果导致左侧壶腹嵴毛细胞的动纤毛(kinocilia)向椭圆囊方向偏转,仿佛头部向左旋转;支配该半规管的传入纤维放电增加;并出现快相向左的眼球震颤(nystagmus)。这种眼球震颤会使人产生环境向右旋转的感觉,且受试者倾向于向右倾倒。若在耳内注入冷水则会产生相反的效应。记忆热量试验中眼球震颤方向的助记符为COWS("冷对侧,热同侧")。换言之,单侧耳注入冷水会导致快相朝向对侧的眼球震颤,而温水则引起快相朝向同侧的眼球震颤。
图9.28A概述了产生扫视运动的神经回路,图9.28B显示了凝视中枢中负责水平扫视的特定类型神经元的活动。每个水平凝视中枢都含有兴奋性爆发神经元(excitatory burst neurons, EBN),其投射至同侧外展神经核(abducens nucleus)的运动神经元和中间神经元(后者兴奋对侧动眼神经核的内直肌运动神经元)。此外还含有抑制性爆发神经元(inhibitory burst neurons, IBN),抑制对侧外展神经核。这些爆发神经元能产生极高频率的脉冲爆发(可达1000~\mathrm{Hz})。凝视中枢还包含具有紧张性活动和爆发-紧张性活动的神经元。
正常情况下,位于背侧中缝核的泛暂停神经元(omnipause neurons)同时抑制兴奋性和抑制性爆发神经元。当需要产生扫视运动时,来自额叶视区或上丘、或两者的信号会抑制泛暂停细胞并兴奋对侧的爆发细胞。兴奋性爆发神经元产生的高频爆发将强力驱动同侧外直肌和对侧内直肌的运动神经元(见图9.28A);同时,抑制性爆发神经元使拮抗肌松弛。这些神经元的初始爆发可使特定眼外肌产生强力收缩,克服眼外肌的黏滞阻力,从而实现快速运动。
平滑追踪运动的神经回路基础
关键要点
平滑追踪(smooth pursuit)涉及用眼睛跟踪移动目标(图9.29)。有关目标速度的视觉信息在一系列皮层区域进行处理,包括枕叶的视觉皮层(visual cortex)、多个颞叶区域以及额叶眼动区(frontal eye fields)。过去认为额叶眼动区仅与扫视控制相关,但最新证据表明该区域内存在专门负责扫视产生或平滑追踪的独立分区。事实上,可能存在两个独立的皮层网络,各自专门负责其中一种类型的眼球运动。来自多个皮层区域的神经活动通过脑桥核(pontine nuclei)和桥被盖网状核(nucleus reticularis tegmenti pontis)的部分结构传递至小脑。小脑的特定区域——即后蚓部(posterior lobe vermis)、绒球(flocculus)和副绒球(paraflocculus)——接收这些输入,并转而投射到前庭核(vestibular nuclei)。随后,前庭核的神经活动可传递至动眼神经核(oculomotor nuclei)、外展神经核(abducens nuclei)和滑车神经核(trochlear nuclei),其传导路径与前庭-眼反射(VOR)的描述一致。
辐辏运动的神经回路基础
辐辏运动(vergence)的神经回路机制尚未完全明确。存在位于动眼神经核周围脑干区域的前运动神经元(premotor neurons,即向运动神经元传递信号的神经元)。在某些皮层视觉区和额叶眼动区中,存在与双眼视网膜图像差异或辐辏运动期间图像变化相关的神经元。这些皮层区域的辐辏信号如何传递至脑干前运动神经元尚不清楚。小脑在辐辏运动中也发挥作用,因为小脑损伤会损害此类眼球运动。值得注意的是,导致VOR丧失的内侧纵束(medial longitudinal fasciculus)损伤不会影响辐辏功能。
• 图9.28 水平扫视通路。A,主要通路的回路示意图。EBN,兴奋性爆发神经元;FEF,额叶眼动区;IBN,抑制性爆发神经元;LBN,长潜伏期爆发神经元;OPN,全暂停神经元;PPRF,旁正中桥脑网状结构。B,参与扫视的部分神经元放电模式。右侧水平注视中心的爆发神经元兴奋会激活右侧外展运动神经元和左侧内直肌运动神经元。通向动眼神经核的上行通路通过内侧纵束。左侧水平注视中心同时被抑制。
• 图9.29 平滑追踪通路。平滑追踪眼动的刺激源是移动的视觉目标。这导致神经活动通过图中所示的回路传导,从而维持中央凹对目标的追踪。FEF,额叶眼动区;LGN,外侧膝状体核;MST和MT,高阶视觉联合区;MVN,前庭内侧核;NRTP,桥被盖网状核;SEF,辅助眼动区;V\uparrow,初级视觉皮层。
markdown
- 骨骼肌的梭外肌纤维(extrafusal skeletal muscle fibers)由α(α)运动神经元支配。一个运动单位(motor unit)由单个α运动神经元及其所突触连接的所有肌纤维组成。不同肌肉的运动单位大小差异显著;较小的运动单位能更精细地控制肌力。
- 大小原则(size principle)指α运动神经元根据其体积从小到大的有序募集。由于较小运动神经元连接较弱的运动单位,因此弱收缩和强收缩时运动控制的相对精细程度相似。
- 反射(reflex)是对刺激产生的简单、刻板的运动反应。反射弧(reflex arc)包括负责该反射的传入纤维、中间神经元和运动神经元。
- 肌梭(muscle spindle)是骨骼肌中的复杂感觉感受器。它们与梭外肌纤维平行排列,内含核袋(nuclear bag)和核链(nuclear chain)梭内肌纤维(intrafusal muscle fibers)。由于与主肌平行,肌梭可检测肌肉长度的变化。
- Ia类传入纤维(group Ia afferent fibers)在核袋1型、核袋2型和核链纤维上形成初级末梢(primary endings),II类纤维(group II fibers)在核链和核袋2型纤维上形成次级末梢(secondary endings)。
- 初级末梢同时呈现静态和动态反应,传递肌肉长度及其变化速率的信息。次级末梢仅呈现静态反应,仅传递肌肉长度信息。
- 与肌梭关联的梭内肌纤维由γ(γ)运动神经元支配。梭内肌纤维收缩不会直接引起肌肉张力或长度的显著变化;然而,当这些纤维的张力水平被调节时,γ运动神经元会影响肌梭对牵张的敏感性。
- 高尔基腱器官(Golgi tendon organ)位于肌肉肌腱中,因此与肌肉呈串联排列。它们由Ib类传入纤维(group Ib afferent fibers)支配。这种串联关系意味着腱器官可检测肌肉产生的力水平,无论该力源于被动牵拉还是主动收缩。
- 位相性牵张反射(phasic stretch reflex)(或称肌伸张反射(myotatic reflex))包含:(1)来自肌梭Ia类传入纤维到支配同一肌肉和协同肌的α运动神经元的单突触兴奋通路(monosynaptic excitatory pathway);(2)到拮抗肌运动神经元的双突触抑制通路(disynaptic inhibitory pathway)。
- 反肌伸张反射(inverse myotatic reflex)由高尔基腱器官引发。来自特定肌肉的Ib类纤维传入冲动通过双突触抑制支配该肌肉的α运动神经元,并兴奋拮抗肌的α运动神经元。
- 屈曲反射(flexion reflex)是重要的保护性反应,因其能使肢体远离伤害性刺激。该反射由支配多种感受器(尤其是伤害感受器(nociceptors))的传入纤维冲动引发。通过多突触通路,这些冲动引起同侧屈肌运动神经元兴奋和伸肌运动神经元抑制。同时,对侧出现相反作用模式(屈肌抑制和伸肌运动神经元兴奋),称为交叉伸肌反射(crossed extension reflex)。
- 下行通路可分为:(1)外侧系统(lateral system),终止于支配肢体肌肉的运动神经元和外侧中间神经元群;(2)内侧系统(medial system),终止于内侧中间神经元群。
- 外侧系统(lateral system)包括外侧皮质脊髓束(lateral corticospinal tract)和部分皮质延髓束(corticobulbar tract)。这些通路影响支配四肢(尤其是手指)肌群的对侧运动神经元,以及面部下部和舌部的肌肉。
- 内侧系统(medial system)包括腹侧皮质脊髓束(ventral corticospinal tract)、外侧和前庭脊髓内侧束(lateral and medial vestibulospinal tracts)、网状脊髓束(reticulospinal tract)和顶盖脊髓束(tectospinal tract)。这些通路主要影响姿势,并为四肢和手指运动提供运动背景。
- 运动(locomotion)由经中脑运动中心(midbrain locomotor center)传递的命令触发。然而,由脊髓回路形成并受传入输入(afferent input)影响的中枢模式发生器(central pattern generators)负责运动活动的详细组织。
- 随意运动(voluntary movements)依赖于大脑皮层运动区、小脑和基底神经节之间的相互作用。
- 大脑皮层运动区以平行分布式网络(parallel distributed network)形式排列,其中每个区域都参与各种下行运动通路。主要参与躯干和头部运动的区域包括初级运动皮层(primary motor cortex)、前运动区(premotor area)、辅助运动皮层(supplementary motor cortex)和扣带运动区(cingulate motor areas)。额眼区(frontal eye fields)对眼球运动至关重要,并帮助启动随意扫视(voluntary saccades)。
- 单个皮质脊髓神经元在相关肌肉发生随意收缩前放电。其放电通常与收缩力相关,而非关节位置。然而,单个神经元的活动可能在运动执行的不同时间点编码该运动的不同参数。
- 运动皮层神经元的群体活动可用于预测即将发生的运动方向。
- 小脑影响运动的速率、幅度、力量和方向,同时也影响肌张力、姿势以及眼球运动和平衡。
- 小脑的内在环路具有显著的一致性。小脑不同部位的功能差异主要源于不同的传入来源和传出目标。
- 解剖学和生理学技术表明,小脑皮层可被划分为许多功能不同的纵向功能区室(longitudinally running compartments)。
- 小脑的大部分输入通过苔藓纤维(mossy fibers)终止的通路实现。苔藓纤维兴奋颗粒细胞(granule cells),后者又可引发Purkinje细胞的单个动作电位(称为简单锋电位/simple spikes)。Purkinje细胞的轴突形成小脑皮层的唯一输出通路。
- 下橄榄核(inferior olivary nucleus)向小脑的投射以攀缘纤维(climbing fibers)形式终止,且是其唯一来源。每个Purkinje细胞仅接受来自单个攀缘纤维的大量输入。因此,每个攀缘纤维放电都会在Purkinje细胞中产生由多个动作电位组成的高频爆发,称为复杂锋电位(complex spike)。
- 尽管复杂锋电位活动相较于简单锋电位活动较为罕见,但复杂锋电位在Purkinje细胞群中精确同步。由于这些细胞汇聚到小脑核神经元(cerebellar nuclear neurons),这种同步可能使复杂锋电位活动显著影响小脑输出。复杂锋电位的同步源于下橄榄核神经元通过缝隙连接(gap junctions)实现的电耦合。
10 神经系统的整合功能
学习目标
完成本章学习后,学生应能回答以下问题:
- 新皮层(neocortex)的基本分层模式是什么?皮层输入和输出如何与该分层模式对应?皮层区域间分层模式差异的功能意义是什么?
- 大脑各叶的主要功能分别是什么?
- 脑电图(EEG)如何反映皮层活动?什么是诱发电位(evoked potentials)?
- 大脑优势半球如何与语言功能和利手偏好相关联?
- 失语症(aphasia)是什么?不同类型失语症中受损的功能有何不同?
- 突触和细胞过程如何支持学习与记忆?记忆在大脑中是如何分布的?
- 可塑性(plasticity)在神经系统发育和损伤后修复中起什么作用?
在前面的章节中,我们讨论了神经系统与身体及外部世界的相互作用,包括感觉事件的转导与分析、运动功能的组织,以及连接它们的相对简单的中枢过程(如牵张反射和前庭-眼动反射)。神经系统还具有其他能力——即所谓的整合功能或高级认知功能,这些功能与特定感觉模态或运动行为的关联较不直接。这些功能需要大脑皮层不同区域之间以及大脑皮层与其他脑区之间的相互作用。本章将讨论这些高级功能的神经基础。由于这些功能(以及感觉知觉和随意运动功能)高度依赖于大脑皮层,因此首先描述其基本组织结构。
大脑皮层
- 基底神经节(basal ganglia)包括多个端脑深部核团(包括尾状核(caudate nucleus)、壳核(putamen)和苍白球(globus pallidus))。基底神经节与大脑皮层、底丘脑核(subthalamic nucleus)、黑质(substantia nigra)和丘脑相互作用。
- 从大脑皮层经基底神经节传递的活动对投射至皮层运动区的丘脑神经元具有促进或抑制作用,这取决于基底神经节直接通路与间接通路的平衡状态。当这两种通路失衡时,会出现运动过度或运动不足障碍。
- 某些类型的眼动有助于稳定视觉世界的成像。这一点至关重要,因为当视觉世界在视网膜上移动或滑动时,视敏度会急剧下降。前庭-眼动(vestibulo-ocular)和视动(optokinetic)运动通过补偿头部或外部世界(或两者)的运动,帮助将视觉世界稳定在视网膜上。平稳追踪运动(smooth pursuit movements)允许追踪视觉目标,使其始终保持在中央凹(foveae)中心。
- 扫视(saccades)的作用是将视觉场景的特定部分移至视敏度最高的视网膜区域——中央凹(fovea),以便进行详细观察。
- 脑干中存在专门控制垂直和水平眼动的神经环路与区域。这些区域既被皮层(当进行随意眼动时)使用,也被引发反射性眼动的感觉输入所使用。
大脑皮层
人类大脑皮层体积约为600~\mathrm{cm}^{3},表面积达2500~\mathrm{cm}^{2}。皮层表面高度卷曲,形成称为脑回(gyri)的隆起结构。脑回之间被浅沟(sulci)或深沟(fissures)分隔(见图4.7)。这种折叠结构显著增加了能够容纳于颅骨有限固定空间内的皮层表面积。事实上,由于这种折叠结构,大部分皮层无法从脑表面直接观察。
大脑皮层可分为左右半球,并可进一步细分为若干脑叶(图10.1;另见图4.7),包括额叶(frontal)、顶叶(parietal)、颞叶(temporal)和枕叶(occipital)。中央沟(central sulcus)分隔额叶与顶叶,外侧裂(lateral fissure)将二者与颞叶分离。枕叶与顶叶在半球内侧表面由顶枕裂(parieto-occipital fissure)分隔(见图10.1)。外侧裂深部埋藏有另一脑叶——岛叶(insula)(见图4.6B)。边缘叶(limbic lobe)由一组结构组成,位于半球内侧,其最大组成部分海马结构(hippocampal formation)折叠进入颞叶的海马旁回(parahippocampal gyrus),无法从脑表面观察到。
大脑皮层两半球的活动通过大脑连合(cerebral commissures)的相互连接实现协调。大部分皮层通过庞大的胼胝体(corpus callosum)连接(见图4.9、10.1),颞叶部分则通过前连合(anterior commissure)连接。
大脑皮层可分为三种类型:新皮质(neocortex)、古皮质(archicortex)和旧皮质(paleocortex)。新皮质具有6层结构(图10.2),古皮质为3层,旧皮质为4-5层。人类约90\%的大脑皮层属于新皮质。
新皮质
新皮质中的神经元类型
新皮质包含多种不同类型的神经元(见图10.2)。锥体神经元(pyramidal neurons)是最主要的细胞类型,约占新皮质神经元的75\%。其余由各类非锥体神经元(nonpyramidal neurons)构成,包括星形细胞(stellate cells)和GABA能中间神经元(GABAergic interneurons)。锥体细胞具有大型三角形胞体、一个指向皮层表面的长顶端树突(apical dendrite)以及数个基底树突(basal dendrites)。轴突从胞体与顶端树突相对的位置发出,较大锥体细胞的轴突可投射至皮层下白质。轴突在穿过皮层下降过程中可能发出侧支(collateral branches)。锥体神经元释放兴奋性氨基酸谷氨酸(glutamate)。抑制性中间神经元释放GABA,具有不同大小和形态,轴突投射范围局限在皮层区域内。皮层中的星形细胞胞体较小,具有多个分支树突,大量存在于第四层,虽主要进行局部投射,但可能为谷氨酸能或GABA能(详见下节)。
• 图10.1 人类大脑左半球外侧(A)与内侧(B)示意图,标注主要解剖特征并用颜色区分脑叶。R、G、B和S分别代表胼胝体(corpus callosum)的嘴部(rostrum)、膝部(genu)、体部(body)和压部(splenium)。(引自Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 3rd ed. Philadelphia: Churchill Livingstone; 2006.)
• 图10.2 用三种不同染色方法显示的新皮质(neocortex)区域。尼氏染色(中央)显示所有神经元的胞体,揭示不同类型神经元在六层中的分布模式。高尔基染色(左侧)仅显示部分神经元群体,但可观察其树突细节。髓鞘韦格特染色(右侧)显示垂直走向的轴突束进出皮质,以及水平走向的纤维在同层神经元间建立连接。(引自Brodmann K. Vergleichende Lokalisationslehre der Grosshirnrinde in ihren prinzipien Dargestellt auf Grund des Zellenbaues. Leipzig: JA Barth; 1909.)
皮质层的细胞构筑
新皮质的六个层各具独特的细胞组成(见图10.2)。第I层(分子层)神经元胞体稀少,主要包含与顶树突形成突触的轴突末梢。第II层(外颗粒层)主要由星形细胞(stellate cells)构成。第III层(外锥体层)主要由小型锥体神经元组成。第IV层(内颗粒层)富含星形细胞和密集的轴突网络。第V层(内锥体层)主要由大型锥体神经元主导,这些神经元是皮质向大多数皮质下区域发出传出纤维的主要来源。第VI层(多形层)包含锥体细胞、梭形细胞和其他类型细胞。
皮质传入与传出纤维
中枢神经系统(CNS)其他区域向皮质的输入主要通过丘脑神经元中继,这在感觉和运动通路的早期章节已有描述。从丘脑到皮质的投射是皮质组织结构的重要组分,在分层模式中清晰可见。来自具有特异性(拓扑图谱化)皮质投射的丘脑核团的丘脑皮质纤维,主要终止于第IV层,但也分布于第III和VI层。其他丘脑核团(特别是中继脑干网状结构输入的核团)的神经元以弥散方式投射,终止于第I和VI层,可能在状态转换(如睡眠或觉醒)时对皮质活动进行整体调控。
除皮质下输入外,每个皮质区域都接受其他皮质区域的输入。存在连接远隔皮质区域的大型纤维束,连合纤维(commissural fibers)连接两侧半球的对应区域(这些投射终止于第I和VI层),但相对而言,皮质区域中最大的突触来源是局部连接,既包括区域内部也包括邻近区域的连接。
皮层传出轴突的起源
皮层传出轴突起源于锥体神经元(pyramidal neurons)。第II层和第III层较小的锥体细胞主要直接投射到相邻皮层区域,并通过胼胝体(corpus callosum)投射到对侧区域。第V层较大的锥体细胞通过多条通路投射到脊髓、脑干、纹状体和丘脑。第VI层的锥体神经元形成皮层-丘脑投射,这些投射靶向为其提供传入输入的相同丘脑核团,从而形成丘脑-皮层和皮层-丘脑的相互连接环路。
来自丘脑的特定输入模式对皮层组织具有另一种影响。如在感觉和运动系统中所讨论的,皮层输入的地形图式化(topographic mapping)定义了柱状组织结构。皮层柱是指从白质到皮层表面垂直方向上的狭窄区域,其中神经元由于共享来自丘脑的输入而具有协同活动。在皮层柱内部存在丰富的垂直连接,而横向连接(与相邻柱细胞的连接)较少,这使得皮层柱能够作为皮层的功能单位运作。然而尽管横向连接相对稀少,它们仍能产生强大的作用,例如运动皮层区域间的抑制性连接所示(见图9.16)。有趣的是,柱状组织既受遗传因素影响,也能被功能相互作用显著改变(参见"神经可塑性"章节)。
新皮层结构的区域差异
新皮层的构筑存在区域差异,这反映了皮层区域的功能特化。这种差异的不同方面是多种皮层分区方法的基础。最广泛使用的策略是细胞构筑学(cytoarchitectonics),即通过细胞密度和结构的差异进行分区。髓鞘构筑学(myeloarchitectonics,轴突密度和大小的差异)和化学构筑学(chemoarchitectonics,分子标记物的表达)也被用于皮层区域分类。
尽管已设计出多种细胞构筑学分区图谱,但最常使用的是Korbinian Brodmann的版本。该图谱将皮层划分为52个独立区域(图10.3),按Brodmann的研究顺序编号。常被提及的区域包括:Brodmann 3、1和2区(位于中央后回的主要躯体感觉皮层);4区(位于中央前回的主要运动皮层);6区(前运动皮层和辅助运动皮层);41和42区(颞上回的主要听觉皮层);以及17区(主要视觉皮层,大部分位于枕叶内侧)。后续研究证实Brodmann分区在细胞构筑、相互连接和功能方面具有独特性,但近期工作表明这些区域的大小和内部组织具有一定可塑性(参见"神经可塑性"章节)。
旧皮层与原皮层
人类大脑皮层约10%由旧皮层(archicortex)和原皮层(paleocortex)构成。旧皮层具有三层结构;原皮层有四到五层。原皮层位于旧皮层与新皮层交界处。
在人类中,海马结构是旧皮层的一部分。它折叠于颞叶内,仅当大脑被解剖时可见。海马皮层分为三层:分子层、锥体细胞层和多形层。这些层与新皮层的I层、V层和VI层相似。覆盖海马的白质称为海马槽(alveus),内含海马的传入和传出纤维。传出轴突汇聚形成穹窿(fornix)(图10.4)。
• 图10.3 人类大脑皮层的Brodmann分区。(改绘自Crosby EC, Humphrey T, Lauer EW. Correlative Anatomy of the Nervous System. New York: Macmillan; 1962.)
大脑皮层各叶的功能
大脑皮层的褶皱(脑叶与脑回)与功能之间不存在精确对应关系,但大脑半球各叶与功能存在总体关联,这有助于理解皮层的组织方式。
额叶
在临床中
额叶的主要功能之一是运动行为。如第9章所述,运动区(motor)、前运动区(premotor)、扣带回运动区(cingulate motor)和辅助运动区(supplementary motor)以及额眼区(frontal eye field)均位于额叶。这些区域对运动行为的规划和执行至关重要。人类语言优势半球(几乎总是左半球,后文将解释)的下额回(inferior frontal gyrus)内存在布罗卡区(Broca’s area),该区域对语言生成至关重要。此外,更前部的前额叶皮层(prefrontal cortex)在个性和情绪行为中起主要作用。
前额叶皮层的双侧损伤可能由疾病或手术性前额叶切除术(frontal lobotomy)导致。
• 图10.4 海马体(hippocampus)和杏仁核(amygdala)位于颞叶内侧。穹窿(fornix)作为海马体的主要输出通路,投射至乳头体(mammillary body),后者通过乳头丘脑束(mammillothalamic tract)连接丘脑前核(anterior nucleus of the thalamus)。图中还显示了扣带回(cingulate gyrus)、基底前脑区(basal forebrain area)(包括隔核(septal nuclei)、终纹床核(bed nucleus of the stria terminalis)和伏隔核(nucleus accumbens))以及前额叶皮层。(From Purves D. Sleep and wakefulness. In: Purves D, Augustine G, Fitzpatrick D, et al, eds. Neuroscience. 3rd ed. Sunderland, MA: Sinauer; 2004.)
此类损伤会导致注意力缺陷、计划与解决问题困难、冲动性和不恰当社交行为。虽然痛觉保留,但攻击行为减少且疼痛的动机-情感成分减弱。由于伦理原因以及现代药物疗法为精神障碍和慢性疼痛提供了更人道有效的管理手段,前额叶切除术如今已极少实施。
顶叶(Parietal Lobe)
顶叶包含体感皮层(somatosensory cortex)(见第7章)和相邻的顶叶联合皮层(parietal association cortex)。顶叶联合皮层接收来自体感、视觉和听觉皮层的信息,参与感觉信息的处理、感知和整合。与额叶的连接使体感信息能辅助自主运动活动。体感、视觉和听觉信息也可传递至语言中枢(如后文所述的韦尼克区(Wernicke’s area))。左顶叶损伤可能导致格斯特曼综合征(Gerstmann’s syndrome),表现为患者无法命名自己或他人的手指,并丧失数字计算能力。右顶叶负责确定空间情境。右顶叶局灶性损伤(通常由卒中或创伤性脑损伤引起)可导致半侧空间忽视综合征(hemispatial neglect syndrome),患者会"忽视"其左侧视野。实际上,他们失去了对左侧感觉空间的意识:可能无法识别自身左侧身体,以及左侧的人、物体和事件(详见本章后文"在临床中"专栏)。极少数情况下,左顶叶皮层损伤可能导致右侧忽视。
在临床中
顶叶与额叶皮层
对运动任务的规划和执行至关重要的两个区域是顶叶皮层(parietal cortex)和额叶皮层(frontal cortex)。前者之所以重要,是因为它能整合定义任务情境所需的感官信息(见第7章);后者则因其含有直接调控运动执行所有组成部分的神经元(见第9章)。在猕猴的顶下小叶(inferior parietal cortex)和额下回(inferior frontal cortex)中均发现了镜像神经元(mirror neurons)。这些细胞在个体执行特定运动任务时会被激活,同时在观察其他个体执行相同任务时也会产生反应。由于这些镜像细胞似乎能编码并响应特定任务,推测它们可能是理解他人意图、共情能力以及通过观察学习任务等功能的基础。在人类中,与镜像神经元行为一致的脑电图(EEG)活动定位于额下回和顶上小叶(superior parietal lobes)。
枕叶
枕叶(occipital lobe)的主要功能是视觉信息处理与感知(见第8章)。初级视皮层(primary visual cortex,Brodmann 17区)位于距状沟(calcarine sulcus)周围,其两侧分别为次级视皮层(Brodmann 18区)和三级视皮层(Brodmann 19区)。楔叶(cuneus gyrus)的这些区域受损会导致对侧视野下半部失明;舌回(lingual gyrus)损伤则导致对侧视野上半部失明。与额叶眼区(frontal eye fields)的连接可影响注视方向,而向中脑的投射则协助调控辐辏眼球运动、瞳孔收缩和调节反射——这些现象均发生于眼睛适应近视力时。
颞叶
颞叶(temporal lobe)具有多种功能,包括声音与前庭信息的处理感知,以及高阶视觉处理(见第8章)。例如,其下表面的颞下皮层(infratemporal cortex)参与面部识别。此外,视通路的一部分——迈耶环(Meyer’s loop)——会穿过颞叶。因此,单侧颞叶损伤可导致双眼视野上象限的视力丧失(与损伤部位对侧),称为同向性上象限盲(homonymous superior quadrantanopia,有时称为“空中馅饼”视觉缺损)。需注意,若损伤累及穿过顶叶的上部视通路,则可能引发与损伤对侧的同向性下象限盲(homonymous inferior quadrantanopia)。颞叶另一重要区域是韦尼克区(Wernicke’s area),它对语言理解至关重要。
边缘系统(limbic system)主导内侧颞叶(见图10.4),参与情绪行为以及学习与记忆(见“学习与记忆”章节)。边缘系统通过帕佩兹环路(Papez circuit)影响下丘脑,从而部分调控情绪行为。该环路从扣带回(cingulate gyrus)投射至内嗅皮层(entorhinal cortex)和海马(hippocampus),再经穹窿(fornix)延伸至下丘脑乳头体(mammillary bodies)。随后,乳头丘脑束(mammillothalamic tract)将下丘脑与前丘脑核(anterior thalamic nuclei)连接,后者又投射回扣带回(见图10.4)。此外,海马和杏仁核(amygdala)与前额叶皮层、基底前脑(basal forebrain)及前扣带皮层(anterior cingulate cortex)存在连接。
临床相关
大脑皮层不同叶区的功能已通过以下方面的研究得以确定:疾病引起的损伤效应、治疗人类疾病的手术干预、创伤性脑损伤以及动物实验。其他发现来自对癫痫发作和行为变化的观察,其中引发癫痫发作的脑区(癫痫发作灶)与行为变化相关。例如,运动皮层的癫痫灶可引起对侧肢体运动;具体运动形式与发作灶的躯体定位区相关。起源于躯体感觉皮层的癫痫发作会引起一种癫痫先兆(aura),表现为感知到触觉。类似地,起源于视觉皮层的发作会导致视觉先兆(闪光、色觉),听觉皮层的发作会导致听觉先兆(嗡嗡声、蜂鸣声、铃声),前庭皮层的发作则会引起旋转感。复杂行为可能源于颞叶联合区的癫痫发作;此外,若累及嗅皮层(钩回发作),可能感知到恶臭性先兆。
皮层的电活动
双侧颞叶损伤可导致克吕弗-布西综合征(Klüver-Bucy syndrome),其特征包括:无法通过视觉线索识别物体意义(视觉失认症,visual agnosia);倾向于用口腔检查所有物体(包括危险物品);对无关刺激过度关注;性欲亢进;饮食习惯改变;以及情感淡漠。虽然该综合征最初被描述为累及大部分或全部颞叶的大范围损伤所致,但近期研究强调了杏仁核(amygdala)的作用。杏仁核负责将恐惧与疼痛刺激建立条件反射,并通过与内侧前额叶皮层及前扣带回的连接,在这些刺激再次出现时触发情绪或回避反应。此外,杏仁核投射至伏隔核(nucleus accumbens)——基底神经节的一个区域,被称为“奖赏中心”。伏隔核通过接收来自脑干腹侧被盖区(ventral tegmental area, VTA)的多巴胺能输入,对愉悦事件产生信号响应。
脑电图
脑电图(electroencephalogram, EEG)是通过置于颅骨表面的电极记录大脑皮层的神经元电活动。EEG波形通常反映由锥体细胞突触电位产生所导致的细胞外电流总和,因此属于场电位(field potential)的一种。由于单个细胞产生的电流过小,无法被颅骨表面的电极检测为离散事件(若要记录单个神经元活动,需将微电极置于距离神经元数微米范围内),EEG波形反映的是大量神经元的协同活动。此外,只有当一组神经元的活动方向一致使其个体电流总和形成可检测的场时,才能在EEG上记录到相关事件。锥体神经元的排列方式(其顶树突平行对齐形成偶极层)特别有利于产生大幅场电位。该偶极层的一极朝向皮质表面,另一极朝向皮质下白质,因此具有相似排列方向的皮质锥体神经元群体产生的电流可叠加形成可测量的场电位。这种叠加需求也解释了为何EEG信号主要反映突触电位而非动作电位:电活动必须在时间上重叠才能叠加,而突触电位的持续时间远长于动作电位。
• 图10.5 嗜睡期、慢波(非快速眼动[non-REM])睡眠的1、2、4阶段以及REM睡眠期间的脑电图描记。(改编自Shepherd GM. Neurobiology. London: Oxford University Press; 1983.)
EEG波的极性可为正或负,但仅凭方向无法判断锥体细胞处于兴奋或抑制状态。例如,颅骨(或皮质)表面记录的负EEG电位可能由顶树突的兴奋或胞体附近的抑制产生;反之,正EEG波可能由顶树突的抑制或胞体附近的兴奋引起。
正常EEG描记包含多种频率的波形。主导频率取决于觉醒状态、受试者年龄、记录电极位置以及是否存在药物或疾病等因素。当正常清醒成人闭眼放松时,顶叶和枕叶记录的EEG主导频率约为8至12\mathrm{Hz},即α节律(alpha rhythm)。若要求受试者睁眼,波形同步性降低,主导频率增至13至30~\mathrm{Hz},称为β节律(beta rhythm)。δ节律(0.5{-}2\mathrm{Hz})和θ节律(3{-}7\mathrm{Hz})见于睡眠期间(参见下文;图10.5)。此外,EEG中确实存在短暂波形,因其形状有时被称为"棘波",但这不意味着其与动作电位相关。
诱发电位(Evoked Potentials)
临床意义
由刺激引发的脑电图变化称为皮层诱发电位(cortical evoked potential)。皮层诱发电位最易在被激活皮层区域上方的颅骨部位记录到。例如,视觉刺激产生的诱发电位最易在枕骨上方记录到,而体感诱发电位在额骨与顶骨交界处附近记录效果最佳。诱发电位反映大量皮层神经元的活动,也可能反映皮层下结构的活动。
与脑电波相比,诱发电位幅度较小。但通过信号平均(signal averaging)处理可增强其显现效果。该过程中,刺激被重复施加,每次试验记录的脑电图通过电子设备进行平均处理。随着每次刺激重复,诱发电位在刺激后固定时间出现。
当记录被平均时,与刺激随机时间关联的脑电图成分相互抵消,而诱发电位则叠加增强。
临床意义
诱发电位在临床上用于评估感觉通路的完整性,至少可评估至初级感觉接收区水平。这些电位可在昏迷患者以及年龄过小无法进行感觉检查的婴儿中记录。听觉诱发电位的初始部分实际反映脑干活动,因此该诱发电位可用于评估脑干结构功能。
临床意义
睡眠-觉醒周期具有约25小时的内源性周期节律,但通常会被昼夜节律所调控。昼夜节律的起源被认为是下丘脑视交叉上核(suprachiasmatic nucleus)。该核团接收视网膜投射,其神经元形成能适应明暗周期的生物钟。然而,当个体与环境隔离或跨时区(时差反应)时,这种调控会被破坏。视交叉上核损毁会导致包括睡眠-觉醒周期在内的多种生物节律紊乱。
睡眠-觉醒周期
睡眠与觉醒是机体呈现昼夜(约24小时)节律的众多功能之一。脑电图特征性变化与睡眠-觉醒周期中行为状态的改变相关。在清醒警觉的个体中,β波活动占主导,此时脑电图表现为去同步化(desynchronized)状态——显示低电压、高频率活动。闭眼放松的个体,其脑电图以α波(alpha waves)为主(见图10.5)。
入睡者会在30至45分钟内依次经历四个慢波睡眠阶段(称为第1至4阶段)(见图10.5)。第1阶段中,α波与低频θ波(theta waves)交替出现。第2阶段,脑电波进一步减慢,但慢波活动会被睡眠纺锤波(sleep spindles,即12到14 Hz的突发活动)和大K复合波(K complexes,大幅慢电位)打断。第3阶段睡眠与δ波(delta waves)和偶发纺锤波相关。第4阶段特征为无纺锤波的δ波活动。
脑半球优势与语言功能
在慢波睡眠(slow-wave sleep)期间,身体肌肉放松,但姿势会间歇性调整。心率和血压下降,胃肠蠕动增强。随着个体经历这些睡眠阶段,被唤醒的容易程度逐渐降低。当个体觉醒时,会以相反顺序经历睡眠阶段。
约每90分钟,慢波睡眠会转变为另一种睡眠形式,称为快速眼动睡眠(rapid eye movement sleep,REM sleep)。在REM睡眠中,脑电图(EEG)再次呈现去同步化。REM睡眠的低电压快速活动类似于觉醒状态受试者的EEG表现(见图10.5,底部轨迹)。由于此时EEG与清醒个体相似且难以唤醒睡眠者,故用"异相睡眠(paradoxical sleep)"来表征这种睡眠类型。此时肌肉张力完全丧失,但在多个肌肉(尤其是眼肌)中会出现阶段性收缩。由此产生的快速眼动(REM)正是此类睡眠命名的依据。同时发生多种自主神经变化:体温调节功能丧失,瞳孔缩小(meiosis)发生,阴茎勃起可能出现,心率、血压和呼吸呈现间歇性变化。每夜会发生数次REM睡眠周期。虽然此时难以从外部唤醒睡眠者,但内部觉醒活动频繁。多数梦境发生在REM睡眠期间。
慢波睡眠(非REM睡眠)与REM睡眠的比例随年龄变化。新生儿约有一半睡眠时间处于REM睡眠,而老年人REM睡眠极少。青年人的睡眠中约20%-25%为REM睡眠。
睡眠机制尚未完全阐明。对脑干中被称为网状激活系统(reticular activating system)的大范围区域进行刺激可引起觉醒和低电压快速EEG活动。过去认为睡眠是由网状激活系统活动水平降低所致。然而大量数据(包括下位脑干麻醉会导致觉醒,以及孤束核附近延髓区域的刺激可诱导睡眠等观察结果)表明,睡眠是主动过程。研究者试图寻找睡眠机制与使用特定神经递质(包括血清素(serotonin)、去甲肾上腺素(norepinephrine)和乙酰胆碱(acetylcholine))的脑干神经网络之间的联系;这些递质在大脑中的水平变化可影响睡眠-觉醒周期。但目前尚未建立关于睡眠神经机制的详细神经化学解释。
同样地,睡眠的目的仍不明确。但由于人类生命约三分之一时间用于睡眠,且极度睡眠剥夺可导致死亡,其必然具有重要价值。近期假说认为,在部分睡眠阶段中,清醒时获得并通过海马(hippocampus)和其他颞区活动模式编码的短期记忆会被传递到皮层区域进行巩固和长期储存。具有医学重要性的睡眠-觉醒周期障碍包括:失眠、学习记忆功能破坏、注意力与专注力缺失、遗尿、梦游、睡眠呼吸暂停和发作性睡病。
临床相关
脑电波图(EEG)在多种病理状态下会出现异常。例如,昏迷期间EEG以δ波活动为主。脑死亡的定义标准是持续平坦的EEG波形。
癫痫常引起特定的EEG异常,并可通过这些异常进行诊断。癫痫存在多种形式,图10.6展示了部分癫痫类型的EEG模式。癫痫发作可分为部分性发作和全面性发作。
一种部分性发作起源于运动皮层,导致对侧肌肉局部收缩。这种收缩可能扩散至其他肌肉,其扩散路径遵循运动皮层的躯体定位顺序(见第9章)。这种固定模式的扩散过程称为杰克逊行进(Jacksonian march)。复杂性部分发作(可能发生于精神运动性癫痫)起源于颞叶边缘结构,导致错觉和半目的性运动活动。在发作期间及发作间期,头皮电极记录可显示EEG棘波(见图10.6C,D)。
全面性发作涉及广泛脑区并伴有意识丧失。两种主要类型是失神发作(小发作)和强直-阵挛发作(大发作)。失神癫痫中意识短暂丧失(通常不超过15秒),EEG显示棘慢波活动(见图10.6B)。在强直-阵挛发作中,意识丧失时间更长,患者站立时可能跌倒。发作初期表现为全身肌张力增高(强直期),随后出现节律性抽动(阵挛期)。可能伴随大小便失禁。EEG显示广泛分布的发作活动(见图10.6A)。
• 图10.6 不同癫痫类型的脑电波图(EEG)异常。A:强直-阵挛发作(大发作)中强直期(左)和阵挛期(右)的EEG轨迹。B:失神发作(小发作)的棘慢波成分。C:颞叶癫痫患者的EEG轨迹。D:局灶性发作的EEG轨迹。(改绘自Eyzaguirre C, Fidone SJ. Physiology of the Nervous System. 2nd ed. St. Louis: Mosby; 1975.)
虽然右利手代表左半球的感觉运动优势,左利手代表右半球的感觉运动优势,但语言优势半球(cerebral dominance)被指定为存在语言中心的半球;在人类中,超过90%的右利手和左利手人群的左半球均为优势半球。这种优势性可通过以下方式证明:(1)左半球损伤导致语言功能缺损(失语症);(2)向左颈动脉注射短效麻醉剂时引发短暂性失语症(无法说话或书写)。非优势半球损伤及其麻醉剂注射通常不会显著影响语言功能。
半球间通讯与胼胝体
在全面发作(seizure)之间出现的EEG尖波被称为发作间期棘波(interictal spikes)。这类事件可通过实验进行研究。这些尖波源于皮质神经元的突然、持久去极化(称为去极化漂移,depolarization shifts),会触发重复动作电位。此类去极化漂移可能反映癫痫病灶(epileptic foci)的多种变化,包括皮质神经元中由再生性钙离子(\mathtt{C a}^{++})介导的树突动作电位,以及皮质回路中抑制性相互作用的减少。过度活跃神经元产生的电场电位以及钾离子(\mathsf{K}^{+})和兴奋性氨基酸的释放,也可能促进皮质兴奋性的增强。
左半球的多个区域参与语言功能。Wernicke区是位于颞上回(superior temporal gyrus)后部的大片区域,从听觉皮层后方延伸至顶叶。另一个重要语言区——Broca区,位于额下回(inferior frontal gyrus)后部,邻近运动皮层的面部代表区。Wernicke区损伤会导致感受性失语症(receptive aphasia),患者难以理解口语和书面语,但言语产生仍保持流畅(尽管内容可能无意义)。相反,Broca区病变会引起表达性失语症(expressive aphasia),患者虽能较好理解语言,但在言语生成和书写方面存在困难。
术语"感觉性失语症(sensory aphasia)"和"运动性失语症(motor aphasia)"常分别与"感受性失语症"和"表达性失语症"混用。但前者具有误导性:感受性失语症患者可能不存在听觉或视觉障碍,而表达性失语症患者的言语或书写相关肌肉运动控制可能正常。失语症并非源于感觉或运动技能缺陷,而是指无法将语言编码的感觉信息解码为概念,或无法将概念编码为语言。不过,优势半球的大范围病变可能导致混合型失语症,同时伴随感觉改变或部分语言表达相关肌肉的瘫痪。例如,运动皮层面部代表区的病变会导致无法控制言语所需的运动器官(声带、颌部、舌、唇),由于构音障碍(dysarthria)——一种机械性缺陷——表现为言语不清。但若上肢相关运动皮层未受累,患者仍可保留书写能力。
半球间通讯与胼胝体
两个大脑半球可相对独立运作(如单手控制),但需要跨半球信息传递以协调身体两侧活动。大部分信息通过胼胝体(corpus callosum)传输,部分则通过其他连合(commissures)传递(如前连合(anterior commissure)或海马连合(hippocampal commissure))。
胼胝体(corpus callosum)在脑区间信息传递中的重要性如图10.7A所示。具有完整视交叉(optic chiasm)和胼胝体且左眼被遮挡的动物,能够学会视觉辨别任务(visual discrimination task)(见图10.7A)。信息通过视交叉建立的双侧连接或通过胼胝体,或同时通过这两种途径传递至双侧大脑半球。当动物左眼睁开而右眼被遮挡时进行测试(见图10.7A,中间),任务仍能完成,因为两个半球都已习得该任务。若在动物训练前切断视交叉,结果仍然相同(见图10.7B)。推测信息是通过胼胝体在两个半球间传递的。这一发现可通过在训练前同时切断视交叉和胼胝体来验证(见图10.7C)。此时信息无法传递,每个半球必须独立学习该任务。
在人类患者中也进行了类似实验,这些患者为防止癫痫(epilepsy)的脑间传播接受了胼胝体手术切断(图10.8)。视交叉保持完整,但通过让患者将视线固定在屏幕中心点,视觉信息被导向某一侧半球。随后在注视点一侧闪现物体图片或名称,使关于图片的视觉信息仅到达对侧半球。屏幕下方的开口允许患者操纵不可见物体,这些物体包括投影图片中显示的内容。正常人能用任一手定位正确物体。然而胼胝体切断患者只能用与投影图像同侧的手(即接收视觉信息半球的对侧手)定位正确物体。要使手部探索并识别正确物体,视觉信息必须能到达皮层的体感(somatosensory)和运动区(motor areas)。当胼胝体被切断后,视觉区和运动区仅在大脑同侧保持相互连接。
另一项测试是要求患者口头识别图片中的物体。对投射在注视点右侧的图片,患者能做出正确言语反应,因为视觉信息仅到达左(语言优势)半球。然而患者无法口头识别呈现在左侧半视野的图片,因为视觉信息仅到达右半球。
临床相关
当使用不同形式的刺激时,在胼胝体(corpus callosum)横断患者中也可以观察到类似现象。例如,当向这类患者发出"抬起右臂"的言语指令时,他们能够毫不费力地执行。左半球的语言中枢将信号传递至同侧运动区,这些信号最终引发右臂运动。然而,这些患者无法响应"抬起左臂"的指令。除非胼胝体完整,否则左侧语言区无法影响右侧运动区。施加于身体右侧的躯体感觉(somatosensory)刺激可被胼胝体横断患者描述,但施加于左侧的相同刺激则无法被描述。若胼胝体被切断,到达右侧皮层躯体感觉区的信息将无法传递至语言中枢。
除语言功能外,通过研究胼胝体横断个体的表现,还可以比较两半球其他功能能力的差异。这类患者用右半球比用左半球更能解决三维拼图,表明右半球在空间任务中具有特殊功能。其他与右半球关联更密切的功能包括面部表情、肢体语言和语调(图10.9)。胼胝体横断患者缺乏正常的半球间协调。例如穿衣时,一只手可能在扣纽扣,而另一只手却在试图解开纽扣。对这些患者的观察表明,当两半球不再相互连接时,它们能够相当独立地运作。然而,一个半球可以通过语言表达自身,而另一个半球只能通过非语言方式交流。
• 图10.7 单眼学习过程中胼胝体在视觉信息半球间传递的作用。A,辨别任务基于区分十字与圆形。B,辨别任务基于三角形顶点朝上或朝下。C,辨别任务基于垂直与水平条形。
• 图10.8 胼胝体横断患者的测试示意图。A,患者注视后投影屏上的某一点,图片投射至注视点两侧。手部可触摸与投射图片对应的物体,但这些物体不可见。B,左手对左侧视野钥匙图片的反应。但言语反应为患者看到戒指图片。(重绘自Sperry RW. In: Schmitt FO, Worden FG, eds. The Neurosciences: Third Study Program. Cambridge, MA: MIT Press; 1974.)
学习与记忆
神经系统高级中枢的主要功能是学习与记忆。学习是一种神经机制,通过该机制,生物体的行为随经验而发生改变。记忆是所学内容的存储机制。
半球间差异的显著例证
半球间差异最为引人注目的例证之一是"半侧空间忽视(Hemispatial neglect)"现象,这是非优势半球(几乎总是右侧半球)顶叶皮层损伤所致。此类病例中,患者会忽视左侧视野内的物体和个体,绘制物体时左侧部分残缺不全,否认自身左臂左腿的存在,且无法完成身体左侧的穿衣动作。患者还会否认存在任何此类功能障碍(病觉缺失,anosognosia)。虽然患者可能对身体左侧的触觉和针刺刺激产生反应,但无法识别放置在左手掌中的物体。该损伤区域邻近第一躯体感觉(SI)皮层和视觉联合皮层,提示该区域在身体意象和近体空间感知中具有特殊作用。优势半球的类似损伤仅导致某些高级躯体感觉功能丧失,如书写触觉缺失(agraphesthesia,无法识别手掌上书写的字符)和实体觉缺失(astereognosis,无法仅通过触觉识别物体)。
记忆与学习的神经机制
哺乳动物的记忆与学习涉及复杂的神经回路系统,研究难度较大。替代性研究途径包括动物实验(特别是研究无脊椎动物的简单神经系统)、损伤后功能后果分析,以及细胞和通路水平的解剖/生理学研究。例如在海洋软体动物aplysia中,研究者成功分离出单个感觉神经元与运动神经元之间的连接,该连接显示出习惯化(habituation,学会不对无意义刺激的重复呈现作出反应)、敏感化(sensitization,在强刺激或伤害性刺激呈现后,对后续无害刺激的反应性增强)甚至联合条件反射(associative conditioning,学会在无关事件与重要事件关联后对前者作出反应)等学习特征。就习惯化而言,连续反应中递质的释放量会逐渐减少。这种变化涉及触发神经递质释放的\mathrm{Ca^{++}}电流改变,其原因是反复动作电位导致突触前\mathrm{Ca^{++}}通道失活。长期习惯化也可被诱导,此时残留神经末梢的突触终末数量和活性区会减少。
长时程增强
脊椎动物的研究聚焦于突触强度的动态变化机制。具体而言,大量研究关注突触的长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)。
LTP(长时程增强)的研究最为深入的是海马体内的在体(in vivo)和离体(in vitro)海马脑片制备实验。LTP和LTD(长时程抑制)也在中枢神经系统的其他区域被研究,包括新皮层和小脑(LTD是小脑研究的重点;见第9章)。对海马细胞区传入通路进行相对短暂的高频激活,可诱导兴奋性海马神经元突触反应的长时程增强。突触反应的增强(即LTP)在体外可持续数小时,在体内可能持续数天至数周甚至更久。这种突触效能增强的机制主要涉及突触后位点的改变。重复兴奋过程中释放的谷氨酸同时作用于AMPA和NMDA受体。NMDA受体的激活导致\mathrm{Ca^{++}}内流进入突触后神经元,从而触发第二信使通路,包括\mathrm{Ca^{++}}/钙调蛋白依赖性激酶II、蛋白激酶G和蛋白激酶C。这些激酶引起蛋白质磷酸化及神经递质受体反应性的改变。LTP过程中还会激活即刻早期基因。值得注意的是,突触后代谢型谷氨酸受体(mGluRs)的激活也可通过释放细胞内储存的\mathrm{Ca^{++}}诱导LTP和LTD,这一过程由mGluR介导的光滑内质网三磷酸肌醇(IP3)受体激活触发。
• 图10.9 通过胼胝体切断术患者研究确定的左右半球功能特化示意图。(修改自Siegel A, Sapru HN. Essential Neuroscience. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2005.)
记忆
关于记忆存储的阶段划分,区分短期记忆(short-term memory)和长期记忆(long-term memory)是有意义的。近期事件似乎通过持续的神经活动存储于短期记忆中,因为短期记忆仅持续数分钟。例如,短期记忆用于记住从索引中查到的书籍页码。但需注意,短期记忆不应与工作记忆(working memory)混淆,后者指在短时间内(数秒)使用、操纵和应用记忆的能力。工作记忆由前额叶皮层中持续活跃的神经元(在需要该信息的整个期间保持活跃)编码。长期记忆可进一步分为可被破坏的中间形式和难以破坏的持久形式。记忆丧失(即遗忘症)可能由记忆信息本身的丢失引起,也可能源于信息提取机制的干扰。长期记忆可能涉及结构改变,因为即使在破坏短期记忆的事件发生后,长期记忆仍能保持完整。
颞叶似乎对记忆特别重要,因为双侧切除海马结构(hippocampal formation)会严重且永久地破坏近期记忆。现有的长期记忆不受影响,但新的长期记忆无法再形成。因此,这类遗忘症患者能记住手术前的事件,却无法回忆新事件——即使经历多次重复接触,对术后遇到的人也必须反复重新认识。这种陈述性记忆(declarative memory)的丧失涉及对个人事件、地点和普遍历史的有意识回忆。然而,这类患者仍能学习某些任务,因为他们保留了程序性记忆(procedural memory)——一种涉及联想和运动技能的隐性记忆。若让此类患者完成复杂任务(如镜像书写),他们不仅在首次训练中有所进步,在后续几天表现也会更好,尽管他们否认之前有过相关经验。虽然参与程序性记忆的脑结构尚未完全明确,但已知小脑和基底神经节在此类记忆中起重要作用。
神经可塑性
可塑性(plasticity)通常指中枢神经系统改变其连接能力的能力。这种改变可发生于多种情境中,包括学习记忆、损伤和发育过程。中枢神经系统的损伤可诱导神经通路重塑,从而改变行为。可塑性在发育中的大脑最为显著,但成年大脑仍保留一定程度可塑性——这可通过某些干预后的反应证明,如脑部损伤、感觉剥夺甚至经验积累。
某些神经系统的发育可塑性可能在其关键期(critical period)达到最大。例如,在视觉通路发育期间,通过阻断单眼输入可改变其形成的某些连接,但仅限于发育早期的特定关键期。在此类视觉剥夺动物中,视觉连接会变得异常(图10.10),若在关键期后恢复正常视觉输入,既无法消除异常连接,也无法恢复被剥夺眼的功能性视力。相反,生命后期的类似视觉剥夺不会导致异常连接。此类实验观察到的可塑性变化可能反映了突触连接的竞争机制:功能性较差的连接会被修剪淘汰。
在细胞水平
临床相关
传统政策通常延迟对先天性白内障患儿实施矫正手术,直到儿童年龄较大更能承受手术压力。然而,若将矫正推迟至"关键期(critical period)"之后,则功能完全恢复的可能性显著降低。类似地,因单侧眼外肌相对薄弱导致斜视(内斜视(strabismus))而患有弱视(amblyopia)的儿童,往往优先使用未受影响的眼睛。目前对于这两种情况,早期手术已成为常规实践,以便通过双眼的平衡输入正确塑造皮层回路。
(以下为正文翻译)
对海马体(hippocampus)及其相邻且平行的内嗅皮层(entorhinal cortex)的细胞研究表明,当实验对象进入测试环境中的特定位置时,"位置细胞(place cells)"会产生动作电位。尽管存在大量位置细胞,但它们并不以类似地形图的有序方式分布。位置细胞在幼年动物具备探索能力时即已出现。最新研究揭示了"网格细胞(grid cells)"的存在,这些细胞同样对特定位置产生响应,但以六边形阵列分布,在后侧内嗅皮层形成类似环境空间的有序地图。虽然这种认知地图在任何情境下都是固定的,但环境改变或将个体转移至新测试环境时,网格细胞会生成新的适应该环境的地图。
由于内嗅皮层是海马体的主要输入源,针对伦敦出租车司机的研究显示:经过专业培训的资深司机其后侧海马体体积显著大于新手或普通人群——这些司机在获得执照前必须掌握极其详尽的街道信息和最优路线。临床上常见的"迷路"主诉(通常与失忆症相关),可能与空间记忆能力的丧失有关。
成人脑损伤后仍可发生可塑性改变。受损中枢神经系统(CNS)中确实会出现新轴突的萌芽(sprouting);然而,这些新芽未必能恢复正常功能,且许多神经通路似乎不会产生萌芽。若要改善中枢神经系统疾病和神经创伤后的医疗方案,深入了解成年中枢神经系统神经可塑性的相关知识至关重要。当前研究正在探索人类胚胎干细胞恢复中枢神经系统功能的潜力。
• 图 10.10 发育期感觉剥夺导致的视觉通路可塑性。通过向单眼注射放射性示踪剂后放射自显影技术显示眼优势柱。示踪剂被运输至外侧膝状体核,随后经突触转运至纹状皮质。皮质中显示出交替分布的标记带(来自注射眼)与未标记带(来自未注射眼)。A为正常模式,B为单眼视觉剥夺动物改变后的模式。示踪剂注射于未被剥夺眼,可见该眼的眼优势柱明显扩展。其他实验表明被剥夺眼的眼优势柱发生收缩。(A改绘自Hubel DH, Wiesel TN. Proc R Soc Lond B 1977;198:1;B改绘自LeVay S, Wiesel TN, Hubel DH. J Comp Neurol 1980;191:1)
• 图 10.11 左侧第一躯体感觉(SI)皮质(A)手指区域表征及第二、第三指截肢后该表征的重组(B)。(改绘自Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 3rd ed. Philadelphia: Churchill Livingstone; 2006.)
幻肢觉是成人神经可塑性的典型案例。截肢患者常在被截除肢体对应身体区域受刺激时感知到已缺失肢体的感觉。功能成像研究表明,这是由于周围皮质区域的连接向原服务于被截肢体的皮质区域扩散所致。
此类重组现象也可见于手部第二、第三指手术截肢后。术前,每个手指在中央后回(SI皮质)具有离散且体表拓扑定位的表征区域。术后,原被截除手指的表征区域现被邻近手指的扩大表征所占据(图10.11)。相反,先天性并指畸形(syndactyly,手部两个或多个手指融合)患者,其SI皮质中这些手指仅存在单一或大部分重叠的表征。矫正手术后,独立手指逐渐形成差异化表征。更值得注意的是,经过需要每日反复使用指尖的感觉辨别任务训练的猴子,其皮质也显示出相应改变:不仅SI皮质中指尖表征区域较训练前扩大,皮质记录到的指尖感受野数量也同步增加。
关键要点
- 大脑皮质可根据脑回和脑沟的模式分为若干叶。各叶通过病变效应可证实其独特功能。左大脑半球在多数个体中主导语言功能。韦尼克区(Wernicke's area,位于颞叶后部)负责语言理解,布罗卡区(Broca's area,位于额叶下部)负责语言表达。
11 自主神经系统及其中枢调控
学习目标
完成本章学习后,学生应能回答以下问题:
- 副交感神经系统与交感神经系统在整体组织结构上有哪些异同?
- 支配眼的副交感神经和交感神经分别产生哪些作用?当失去副交感或交感神经支配时会出现哪些症状?
- 排尿过程中膀胱的副交感和交感神经活动平衡会发生何种变化?
- 何谓"伺服机制(servomechanism)"?
- 调节体温、摄食与体重、以及水分摄入的具体反馈回路有哪些?
- 下丘脑在这些反馈回路中各发挥什么作用?
- 新皮质(neocortex)包含锥体细胞(pyramidal cells)和多种中间神经元。特异性丘脑皮质传入纤维主要终止于新皮质第四层;弥散性丘脑皮质传入纤维在Ⅰ层和Ⅵ层形成突触。第五层锥体细胞的轴突是向脊髓、脑干、纹状体和丘脑等皮质下结构输出的主要来源。
- 不同区域的皮质结构存在差异。Brodmann分区系统反映了这些结构差异,并与功能独立的区域相对应。
- 脑电图(EEG)反映了锥体细胞活动产生的电场,其波形随睡眠-觉醒周期状态、疾病和其他因素变化。皮质诱发电位是脑电图中由刺激触发的电位变化,为感觉传导提供重要临床信息。
- 睡眠期间的脑电图模式分为慢波睡眠和快速眼动(REM)睡眠。慢波睡眠经历1-4期的阶段性进展,每期具有特征性脑电图模式。多数梦境发生于REM睡眠期。睡眠由脑干机制主动产生,其昼夜节律性受视交叉上核调控。
- 两半球间的信息传递主要通过胼胝体实现。右半球在空间任务、面部表情、肢体语言和语音语调处理方面更具优势;左半球专门负责语言理解与生成、逻辑推理和数学运算。
- 记忆包括工作记忆(持续数秒)、短时记忆(持续数分钟)和长时记忆(持续数小时至终生)。记忆还可分为陈述性记忆、空间记忆和程序性记忆等不同形式。
- 海马和新皮质参与某些记忆形式(如陈述性记忆)的存储与提取。程序性记忆主要涉及小脑和基底神经节。
- 学习记忆的生物学基础可通过分子和细胞水平研究,使用不同动物及脑切片等多种实验模型。研究聚焦于长时程增强(LTP)和长时程抑制(LTD)等突触强度变化。
- 损毁研究和行为研究表明大脑终生具有可塑性。但生命早期的可塑性更强,"关键期"的突触竞争对神经环路的建立至关重要。
自主神经系统的功能与组织结构
自主神经系统(autonomic nervous system)的主要功能是协助机体维持内环境稳定(稳态(homeostasis))。当内部刺激信号提示需要调节机体环境时,中枢神经系统(central nervous system, CNS)及其自主神经传出通路会发出指令以引发代偿性反应。例如,体循环血压突然升高会激活压力感受器(baroreceptors),后者继而调节自主神经系统的活动,使血压回降至原有水平(参见第17章)。
自主神经系统包含感觉和运动两个部分。运动部分进一步分为交感神经(sympathetic)和副交感神经(parasympathetic)分支。由于自主神经系统的许多功能与内脏调控相关,因此有时也被称为内脏神经系统(visceral nervous system)。
为执行稳态功能,自主神经系统介导内脏反射(如胃结肠反射(gastrocolic reflex),即胃扩张触发肠道蠕动),并向中枢神经系统提供内脏状态的感觉信息——这种感知体验对任何饮食过量的人都不陌生。
更广泛地说,自主神经感受器的激活可引发多种感觉体验,如疼痛、饥饿、口渴、恶心和内脏充盈感;这些感知可进一步引发代偿性随意行为以协助维持稳态。
除在稳态调节中发挥核心作用外,自主神经系统还参与对外部刺激的适切协调反应,这些反应是躯体神经系统(somatic nervous system)执行随意行为时实现最佳功能所必需的。例如,自主神经系统根据环境光照强度的变化调节瞳孔大小,从而帮助视觉系统在宽泛的光强范围内正常工作。
本章将肠神经系统(enteric nervous system)也视为自主神经系统的一部分,尽管有时它被视为独立实体(另见第27章)。此外,由于自主神经系统受中枢神经系统调控,本章还将讨论自主神经系统的中枢成分。这些中枢成分包括下丘脑(hypothalamus)及边缘系统(limbic system)的高级中枢——它们与情绪(见第10章)和多种具有生存意义的内脏相关行为(如摄食、饮水、体温调节、生殖、防御和攻击)相关联。
自主神经系统的组织结构
自主感觉神经元位于背根神经节(dorsal root ganglia)和脑神经节(cranial nerve ganglia)中。与背根神经节的其他神经元类似,它们是假单极细胞:其轴突外周分支延伸至某一内脏,中枢分支则进入中枢神经系统。
关于自主运动传出,交感与副交感神经系统均采用双神经元运动通路。该通路由节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)组成:节前神经元胞体位于中枢神经系统内,节后神经元胞体位于自主神经节中(图11.1和图11.2)。此运动通路的效应靶点包括平滑肌、心肌和腺体。
肠神经系统包含位于胃肠道壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)中的神经元及神经纤维。
• 图11.1 交感神经与副交感神经通路的示意图。红色表示交感神经通路,蓝色表示副交感神经通路。节前神经元用深色表示,节后神经元用浅色表示。
交感神经系统(sympathetic nervous system)和副交感神经系统(parasympathetic nervous system)通常通过拮抗作用调节器官功能。为强调这种对立关系,交感神经系统和副交感神经系统有时分别被称为"战斗或逃跑(fight or flight)"系统和"休息与消化(rest and digest)"系统。当机体面临威胁时产生的"战斗或逃跑"反应,本质上反映了交感神经系统的强烈激活,这会引发多种生理反应,包括心率加快、血压升高、血液重新分配至肌肉、胃肠蠕动减弱及分泌减少、瞳孔扩大和出汗等。
然而在多数情况下,自主神经系统的这两个部分通过协同工作——时而拮抗、时而协同——来共同调节内脏功能。此外,并非所有内脏结构都接受双重神经支配。例如皮肤中的平滑肌和腺体,以及体内大多数血管仅接受交感神经支配;仅有小部分血管具有副交感神经支配。事实上,副交感神经系统并不支配体壁结构,仅支配头部、胸腔、腹腔和盆腔内的器官。
交感神经系统
交感神经节前神经元(preganglionic neuron)位于脊髓胸段和上腰段。因此,交感神经系统有时被称为自主神经系统的胸腰段部分。具体而言,交感神经节前神经元集中在脊髓胸段和上腰段的中间外侧细胞柱(intermediolateral cell column)(外侧角)(见图11.2)。部分神经元也可见于C8节段。除中间外侧细胞柱外,交感神经节前神经元群还分布于其他区域,包括外侧索(lateral funiculus)、中间灰质(intermediate gray matter)以及中央管背侧的灰质。交感神经节后神经元(postganglionic neuron)通常位于椎旁神经节(paravertebral ganglia)或椎前神经节(prevertebral ganglia)。椎旁神经节沿脊柱两侧排列形成两组神经节,每侧各神经节通过纵向走行的轴突相连构成交感干(sympathetic trunk)(见图11.1和11.2)。椎前神经节位于腹腔内,包括腹腔神经节(celiac ganglia)和肠系膜上下神经节(superior and inferior mesenteric ganglia)(见图11.1)。因此,椎旁和椎前神经节都与其靶器官保持一定距离。
【翻译说明】
- "intermediolateral cell column" 在神经解剖学中常译为"中间外侧细胞柱"或"中间外侧柱",此处根据上下文选择前者以明确其细胞群属性
- "lateral funiculus" 作为白质分区术语,采用"外侧索"的规范译法
- 关于脊髓节段命名"C8"保持原写法,因颈椎实际仅有7块椎骨,C8属于脊髓节段命名方式,直接沿用不翻译
• 图11.2 胸髓节段交感通路的细节。自主神经感觉纤维用蓝线表示;交感纤维用红线表示;节前轴突用实线表示,节后轴突用虚线表示。(改绘自Parent A, Carpenter MB. Carpenter’s Human Neuroanatomy. 9th ed. Philadelphia: Williams & Wilkins; 1996:295.)
节前神经元(preganglionic neurons)的轴突通常是细小的有髓神经纤维(称为B纤维,参见表5.1),但也有部分为无髓C纤维。它们经腹根离开脊髓,通过白交通支(white communicating ramus)进入同节段的椎旁神经节。白交通支仅存在于T1至L2节段。节前轴突可能在其进入平面的神经节内与节后神经元(postganglionic neurons)形成突触;也可能在交感干内向头侧或尾侧走行,并向经过的神经节发出侧支;或可能穿过神经节,离开交感干,进入内脏神经(splanchnic nerve)到达椎前神经节(prevertebral ganglion)(见图11.1和11.2)。内脏神经支配内脏器官,包含内脏传入纤维和自主运动纤维(交感或副交感)。
胞体位于椎旁神经节的节后神经元,通常通过灰交通支(gray communicating ramus)将其轴突送入脊神经(见图11.2)。31对脊神经每对都具有灰交通支。节后轴突通过外周神经分布至效应器,如位于皮肤、肌肉和关节中的竖毛肌、血管和汗腺。节后轴突通常为无髓纤维(C纤维),但存在例外情况。白交通支和灰交通支的名称反映了这些交通支中有髓与无髓轴突的相对含量。
内脏神经中的节前轴突常走行至椎前神经节并形成突触,也可能穿过神经节和自主神经丛(autonomic plexus),终止于更远的神经节。部分节前轴突穿过内脏神经直接终止于肾上腺髓质细胞,这些细胞相当于节后细胞。
从颈段延伸至尾段的双侧交感神经节构成神经节链,通常称为交感链(sympathetic chain)。这种结构作为分配系统,使局限于胸段和上腰段的节前神经元能够激活支配所有体节的节后神经元。然而椎旁神经节的数量少于脊髓节段数,因为部分节段神经节在发育过程中发生融合。例如:颈上交感神经节(superior cervical sympathetic ganglion)代表C1至C4融合的神经节;颈中交感神经节(middle cervical sympathetic ganglion)是C5和C6的融合;颈下交感神经节(inferior cervical sympathetic ganglion)由C7和C8的神经节合并而成。星状神经节(stellate ganglion)指颈下交感神经节与T1神经节的融合。颈上交感神经节向头颈部提供节后支配,颈中和星状神经节则支配心脏、肺和支气管。
副交感神经系统
副交感神经节前神经元(parasympathetic preganglionic neurons)分布于脑干的若干脑神经核和骶髓(S3-S4)灰质(见图11.1)。因此,自主神经系统的这一部分有时被称为颅骶部。含有副交感神经节前神经元的脑神经核包括:Edinger-Westphal核(第III对脑神经)、上泌涎核(第VII对脑神经)和下泌涎核(第IX对脑神经),以及迷走神经背核与疑核(第X对脑神经)。副交感神经节后细胞位于颅神经节中,包括睫状神经节(其节前输入来自Edinger-Westphal核)、翼腭神经节与下颌下神经节(输入来自上泌涎核),以及耳神经节(输入来自下泌涎核)。睫状神经节支配眼内的瞳孔括约肌和睫状肌。翼腭神经节支配泪腺以及鼻咽和口咽部的腺体。下颌下神经节投射至下颌下腺、舌下腺以及口腔内的腺体。耳神经节支配腮腺和口腔内的腺体。
其他副交感神经节后神经元位于胸腔、腹腔和盆腔内脏器官壁内或附近。肠神经丛(enteric plexus)的神经元中也包含可被视为副交感神经节后神经元的细胞。所有这些细胞均接受来自迷走神经(vagus nerves)或盆神经(pelvic nerves)的输入。迷走神经支配心脏、肺、支气管、肝脏、胰腺以及从食管至结肠脾曲的胃肠道。结肠和直肠的剩余部分,以及膀胱和生殖器官,则由骶部副交感神经节前神经元通过盆神经投射至盆腔神经节中的节后神经元所支配。
内脏传入纤维
自主神经中的内脏运动纤维常伴随内脏传入纤维。大多数传入纤维传递源自内脏感受器的信息。这些感觉受体的活动很少达到意识层面,但它们会启动反射弧的传入支。内脏-内脏反射和内脏-躯体反射均可由这些传入纤维引发。尽管这些内脏反射通常在潜意识层面运作,但它们对稳态调节和对外界刺激的适应至关重要。
内脏传入纤维释放的快速作用神经递质尚未完全明确,但许多此类神经元会释放兴奋性神经递质谷氨酸(glutamate)。内脏传入纤维还含有多种神经肽或其组合,包括血管紧张素II(angiotensin II)、精氨酸加压素(arginine vasopressin)、蛙皮素(bombesin)、降钙素基因相关肽(calcitonin gene–related peptide)、胆囊收缩素(cholecystokinin)、甘丙肽(galanin)、P物质(substance P)、脑啡肽(enkephalin)、催产素(oxytocin)、生长抑素(somatostatin)和血管活性肠肽(vasoactive intestinal polypeptide)。
能够介导意识感觉的内脏传入纤维包括走行于交感神经(如splanchnic nerves)中的伤害感受器。内脏疼痛由空腔脏器过度扩张、梗阻性收缩或缺血引起。由于疼痛的弥散性及其向躯体结构的牵涉倾向(见第7章),内脏疼痛的起源常难以定位。交感神经中的内脏伤害感受器通过交感链、白交通支和背根到达脊髓。伤害性传入纤维的末梢投射至背角和中央管周围区域,激活参与反射弧的局部中间神经元,以及包括向大脑传递疼痛信号的脊髓丘脑束细胞在内的投射细胞。
内脏神经系统
来自骨盆的主要内脏伤害性(visceral nociceptive)通路涉及腰骶段脊髓灰质的突触传递。这些神经元的轴突进入薄束(fasciculus gracilis),终止于薄束核(nucleus gracilis)。因此,背柱(dorsal columns)不仅包含精细触觉、振动觉和本体感觉的初级传入(其主要成分),还包含内脏疼痛通路的二级神经元(需注意躯体疼痛的二级轴突作为脊髓丘脑束的一部分走行于外侧索)。内脏伤害性信号随后传递至丘脑腹后外侧核(ventral posterior lateral nucleus, VPL),并推测从VPL传递至大脑皮层。通过手术在胸段下部制造背柱损伤以缓解盆腔器官癌症疼痛的治疗效果,正是基于对此通路的阻断。
其他内脏传入纤维走行于副交感神经中。这些纤维通常参与反射而非感觉(味觉传入纤维除外;见第8章)。例如,支配颈动脉窦的压力感受器传入纤维位于舌咽神经中。它们进入脑干,穿过孤束(solitary tract),终止于孤束核(nucleus of the solitary tract)(见图4.6E)。这些神经元与脑干网状结构的中间神经元连接,后者进而投射至控制心率和血压的自主神经节前神经元(见第18章)。
孤束核接收来自除盆腔器官外所有内脏器官的信息。该核可进一步分为多个亚区,分别接收特定内脏器官的信息。
肠道神经系统
位于胃肠道壁内的肠道神经系统(enteric nervous system)包含约1亿个神经元。该系统分为肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus):肌间神经丛位于肠道的纵行肌层与环行肌层之间,黏膜下神经丛位于肠道的黏膜下层。肌间神经丛的神经元主要控制胃肠运动(见第27章),而黏膜下神经丛的神经元主要调节体液稳态(见第35章)。
肌间神经丛中的神经元类型不仅包括兴奋性和抑制性运动神经元(可视为副交感节后神经元),还包括中间神经元和初级传入神经元。传入神经元支配胃肠道壁内的机械感受器,这些机械感受器是肠道神经丛内反射弧传入支的起点。局部兴奋性和抑制性中间神经元参与这些反射,输出信号通过运动神经元传递至平滑肌细胞。兴奋性运动神经元释放乙酰胆碱和P物质;抑制性运动神经元释放强啡肽和血管活性肠肽。肠道神经丛的回路网络极其复杂,即使肠道被完全移出体外仍能协调运动。但正常功能仍需依赖自主神经节前神经元的支配和中枢神经系统的调控。
自主神经节
自主神经节中的主要神经元类型是节后神经元(postganglionic neuron)。这些细胞接受来自节前神经元(preganglionic neuron)的突触连接,并投射到自主效应器细胞。然而,许多自主神经节也含有中间神经元(interneuron)。这些中间神经元在自主神经节内处理信息;肠神经系统可被视为这类信息处理的复杂范例。某些自主神经节中存在的一类中间神经元含有高浓度的儿茶酚胺(catecholamine),因此这些中间神经元被称为小强荧光(small, intensely fluorescent, SIF)细胞。SIF细胞被认为具有抑制性功能。
神经递质
自主神经节中的神经递质
无论是交感还是副交感神经节,其经典神经递质均为乙酰胆碱(acetylcholine)。自主神经节中的两类乙酰胆碱受体是烟碱型(nicotinic)和毒蕈碱型(muscarinic)受体,其名称源于它们对植物生物碱尼古丁(nicotine)和毒蕈碱(muscarine)的反应特性。烟碱型乙酰胆碱受体可被箭毒(curare)或六烃季铵(hexamethonium)等药物阻断,毒蕈碱型受体则可被阿托品(atropine)阻断。自主神经节中的烟碱型受体与骨骼肌细胞上的烟碱型受体略有不同。
烟碱型和毒蕈碱型受体均介导兴奋性突触后电位(excitatory postsynaptic potentials, EPSPs),但这些电位具有不同的时间进程。刺激节前神经元会引发一个快EPSP,随后出现一个慢EPSP。快EPSP由烟碱型受体激活引起,其通过离子通道开放实现;慢EPSP则由毒蕈碱型受体(主要是\mathrm{M}_{2}受体,见第6章)介导,该受体通过抑制钾电导产生的M电流(M current)发挥作用。
效应器器官对自主神经冲动的反应—续
a长横线(-)表示未发现明确的功能性神经支配。 b反应标记为^+至+{\mathrel{+{+}}},用于近似表示肾上腺素能和胆碱能神经活动对所列器官及功能调控的重要性。 c原位状态下因代谢性自我调节现象而以扩张效应为主。 d这些部位的胆碱能血管扩张作用的生理学意义尚存疑。
在生理释放的循环肾上腺素通常浓度范围内,骨骼肌和肝脏血管中主要发生β受体反应(血管舒张,vasodilation),而其他腹腔内脏血管中主要发生α受体反应(血管收缩,vasoconstriction)。肾血管和肠系膜血管还含有特异性多巴胺能受体,其激活可引起扩张,但其生理学意义尚未明确。f交感胆碱能系统引起骨骼肌血管舒张,但大多数生理反应不涉及此机制。 g有假说认为肾上腺素能纤维终止于平滑肌纤维的抑制性β受体,以及Auerbach神经丛副交感胆碱能(兴奋性)神经节细胞的抑制性α受体。 h取决于月经周期阶段、循环雌激素和孕酮水平及其他因素。 i手掌等部位存在“肾上腺素能出汗”现象。 j不同物种中介导特定代谢反应的受体类型存在显著差异。 引自Goodman LS, Gilman A. The Pharmacological Basis of Therapeutics. 6th ed. New York: Macmillan; 1980.
自主神经节中的神经元也释放作为神经调质的神经肽。除乙酰胆碱(acetylcholine)外,交感神经节前神经元可能释放脑啡肽(enkephalin)、P物质(substance P)、促黄体生成激素释放激素(luteinizing hormone–releasing hormone)、神经降压素(neurotensin)或生长抑素(somatostatin)。
去甲肾上腺素(norepinephrine)和多巴胺(dopamine)等儿茶酚胺类物质作为自主神经节中SIF细胞的神经递质。
节后神经元与自主效应器间的神经递质
交感节后神经元
交感节后神经元通常释放去甲肾上腺素(norepinephrine),可兴奋某些效应细胞,同时抑制其他细胞。靶细胞上的受体可能是α-肾上腺素能受体或β-肾上腺素能受体。根据药理学和遗传学特征,这些受体可进一步分为α₁、α₂、β₁、β₂和β₃受体亚型。表11.1列出了这些受体类型在不同靶器官中的分布及其被交感节后神经元激活时介导的作用。
α₁受体位于突触后膜,而α₂受体可位于突触前或突触后。位于突触前的受体通常称为自身受体(autoreceptor),通常抑制递质释放。通过使用特异性阻断剂可区分激活α₁或α₂受体的效应。例如哌唑嗪(prazosin)是选择性α₁-肾上腺素能拮抗剂,育亨宾(yohimbine)是选择性α₂-肾上腺素能拮抗剂。α₁受体的效应通过激活三磷酸肌醇(InsP3)和二酰甘油(DAG)第二信使系统介导(参见第3章;表3.1)。相比之下,α₂受体通过作用于G蛋白降低环磷酸腺苷(cAMP)的合成速率。
交感神经节后神经元
\upbeta受体最初是根据拮抗剂阻断它们的能力进行分类的,但这一分类已通过遗传学研究得到补充。\upbeta_{1}和\upbeta_{2}蛋白的研究远较\upbeta_{3}深入,但人们认为所有三类\upbeta受体蛋白均具有相似结构,包含七个跨膜区域,并由细胞内和细胞外结构域连接(参见第3章)。作用于\upbeta受体的激动剂药物会激活一种G蛋白(G protein),该蛋白刺激腺苷酸环化酶(adenylyl cyclase)以增加cAMP浓度。这一作用会因二磷酸鸟苷(guanosine diphosphate)的积累而终止。
\upbeta受体的活性可通过多种方式调控。它可被{\bf{α}}_{1}受体的作用拮抗。\upbeta受体还可因长期暴露于激动剂而发生磷酸化(phosphorylation)导致脱敏。\upbeta受体数量的调节是第三种调控机制。例如,\upbeta受体可通过内化(internalized)减少数量。相反,在某些情况下\upbeta受体数量可增加(上调,upregulated),例如去神经支配(denervation)后。需注意,α受体的数量同样受调控。
除释放去甲肾上腺素外,交感神经节后神经元还释放神经肽如生长抑素(somatostatin)和神经肽Y(neuropeptide Y)。例如,同时释放去甲肾上腺素和生长抑素的细胞支配胃肠道黏膜,而同时释放去甲肾上腺素和神经肽Y的细胞支配肠道和四肢的血管。交感神经节后神经元中的另一种化学介质是腺苷三磷酸(ATP)。
肾上腺髓质的内分泌细胞在许多方面与交感神经节后神经元相似(另见第43章)。它们接受交感神经节前神经元的输入,被乙酰胆碱激活,并释放儿茶酚胺。然而,肾上腺髓质细胞与交感神经节后神经元的不同之处在于,它们将儿茶酚胺释放入血液循环而非突触间隙。此外,其主要释放的儿茶酚胺是肾上腺素(epinephrine)而非去甲肾上腺素。在人类中,肾上腺髓质释放的儿茶酚胺80%为肾上腺素,20%为去甲肾上腺素。
部分交感神经节后神经元以乙酰胆碱而非去甲肾上腺素作为神经递质。例如,支配外泌汗腺(eccrine sweat glands)的交感神经节后神经元是胆碱能(cholinergic)的。涉及的乙酰胆碱受体为毒蕈碱型(muscarinic),因此可被阿托品(atropine)阻断。类似地,部分血管也受胆碱能交感神经节后神经元支配。除释放乙酰胆碱外,支配汗腺的节后神经元还释放神经肽,包括降钙素基因相关肽(calcitonin gene–related peptide)和血管活性肠肽(vasoactive intestinal polypeptide)。
副交感神经节后神经元
副交感神经节后神经元释放的神经递质是乙酰胆碱。这些神经元对各靶器官的作用列于表11.1。副交感神经节后作用由毒蕈碱受体(muscarinic receptors)介导。根据药理学结合研究、选择性拮抗剂的作用以及分子克隆技术,目前已鉴定出五种毒蕈碱受体类型(见第6章)。
\mathrm{M}_{1}受体激活可增强胃中胃酸分泌。\mathrm{M}_{2}受体是平滑肌(包括肠道、子宫、气管和膀胱的平滑肌)中最丰富的受体类型。此外,它们也存在于自主神经节和心脏中,在心脏发挥负性变时和变力作用(见第18章)。\mathrm{M}_{3}受体同样存在于多种器官的平滑肌中,虽然其丰度低于\mathrm{M}_{2}受体,但正常的收缩模式似乎需要两种受体之间的相互作用。\mathrm{M}_{4}受体与\mathrm{M}_{2}受体类似,存在于自主神经节中,因此参与这些部位的突触传递。\mathrm{M}_{5}受体存在于瞳孔括约肌、食管、腮腺以及脑血管中。
与肾上腺素能受体类似,毒蕈碱受体具有多样化的作用。部分效应通过特定的第二信使系统介导。例如,心脏的\mathrm{M}_{2}毒蕈碱受体可能通过IP3系统发挥作用,也可能通过抑制腺苷酸环化酶从而减少cAMP合成。毒蕈碱受体还可开启或关闭离子通道(尤其是\mathrm{K^{+}}或\mathrm{Ca^{++}}通道),这一作用可能通过G蛋白激活实现。毒蕈碱受体的第三种作用是通过影响内皮细胞(产生内皮源性舒张因子,EDRF)来松弛血管平滑肌。EDRF实质是一氧化氮(nitric oxide),即一氧化氮合酶(nitric oxide synthase)将精氨酸转化为瓜氨酸时释放的气体(见第18章)。一氧化氮通过刺激鸟苷酸环化酶升高环磷酸鸟苷(cGMP)水平,进而激活cGMP依赖性蛋白激酶,从而使血管平滑肌松弛(见第3章)。毒蕈碱受体的数量可受调控,暴露于毒蕈碱受体激动剂会通过受体内化(internalization)减少受体数量。
IN THE CLINIC
临床知识
查加斯病(Chagas disease)是由寄生虫克氏锥虫(Trypanosoma cruzi)感染所致。全球约有1800万人感染,每年约5万人因该病并发症死亡。最严重的临床表现包括食管、结肠和心脏的扩大。副交感神经控制的丧失是该病初期的重要特征:感染初期后,支配心脏、食管和结肠的副交感神经元会遭到破坏,导致心律失常(可能引发猝死)和蠕动不能(aperistalsis)。约30%感染者会出现可致死的慢性心肌病(心肌功能障碍)。尽管心肌病的发病机制尚未完全阐明,主流假说认为与自身免疫有关。已发现针对寄生虫抗原的抗体会与心脏的β-肾上腺素能受体和M₂乙酰胆碱受体结合。这些抗体不仅会引发破坏心肌的自身免疫反应,还能作为这些受体的激动剂,导致心血管系统对外界需求变化产生异常反应。
自主功能的中枢控制
自主神经节前神经元的放电活动受突触连接于其上的神经通路调控。影响自主神经活性的通路包括脊髓和脑干反射通路,以及源自下丘脑等更高级神经中枢的下行控制系统。
特定器官的自主神经调控实例
瞳孔
虹膜的扩张肌和括约肌分别受交感神经纤维和副交感神经纤维支配,共同决定瞳孔大小。通过胸段白交通支和交感干神经节激活眼的交感神经支配,可引起瞳孔扩张——这种反应见于情绪激动或疼痛刺激时。交感神经节后突触的神经递质是去甲肾上腺素,作用于α受体。
副交感神经系统对瞳孔大小的调控作用与交感系统相反。交感系统引起瞳孔扩张,而副交感系统则使瞳孔收缩。支配瞳孔括约肌的副交感节前神经位于中脑的Edinger-Westphal核,通过第III对脑神经(动眼神经)走行,因此该神经损伤可导致瞳孔扩大(散瞳)。
临床关联
交感神经对瞳孔的控制有时会受到疾病影响。例如,头颈部交感神经支配的中断会导致霍纳氏综合征(Horner’s syndrome)。该综合征的特征性三联征包括:瞳孔缩小(miosis,异常瞳孔收缩)、上睑下垂(ptosis,因上睑板肌(superior tarsal muscle)功能丧失导致的眼睑轻度下垂;亦称Müller肌)以及面部无汗(anhydrosis)。霍纳氏综合征可能由交感神经通路不同部位的损伤引起:(1) 中枢神经系统一级神经元(first-order neurons)的破坏,包括下丘脑——其发出的下行纤维通过脑干到达脊髓以调节交感功能;(2) T1节段脊髓发出的二级交感节前纤维(second-order sympathetic preganglionic fibers)中断,这些纤维进入颈交感链;(3) 支配Müller肌、面部汗腺及虹膜开大肌的三级节后纤维(third-order postganglionic fibers)损伤。在第一种情况下,脑干纤维的损伤会导致许多其他症状,具体取决于同时受损的脑干核团。
瞳孔大小通过瞳孔对光反射(pupillary light reflex)和近视力调节(accommodation)而缩小。在瞳孔对光反射中,照射到视网膜的光线由视网膜回路处理,兴奋W型视网膜神经节细胞(W-type retinal ganglion cells)(参见第8章)。这些细胞对弥散光照产生反应。部分W型细胞的轴突通过视神经和视束投射到顶盖前区(pretectal area),并在橄榄顶盖前核(olivary pretectal nucleus)形成突触。该核团的神经元同样对弥散光照产生反应。橄榄顶盖前核神经元的活动通过双侧连接作用于艾-韦核(Edinger-Westphal nuclei)中的副交感节前神经元,从而引起瞳孔收缩。此反射会导致双眼瞳孔括约肌收缩,即使光线仅照射单侧眼睛。
调节反应(accommodation response)对聚焦近处物体至关重要,包括瞳孔缩小、晶状体曲率增加和双眼会聚。该反应由视网膜M细胞的信息触发,这些信息通过膝-纹状体视觉通路(geniculostriate visual pathway)传递至纹状皮层(参见第8章)。触发调节的具体刺激被认为是视网膜图像的模糊和双眼图像的差异。信息在视觉皮层处理后,信号直接或间接传递至颞中皮层(middle temporal cortex),激活称为MT区的视觉区域神经元。MT区神经元将信号传递至中脑,激活艾-韦核的副交感节前神经元,从而导致瞳孔缩小。同时,信号传递至睫状肌使其收缩。睫状肌收缩使晶状体变圆并增强其屈光力。(会聚反应是由中脑动眼神经核【脑神经III】介导的躯体反应。)
瞳孔对光反射(Pupillary Light Reflex)
三期(晚期)梅毒累及中枢神经系统(如脊髓痨)患者的瞳孔对光反射可能消失。尽管瞳孔对光无反应,但其调节反应正常。这种现象称为阿盖尔·罗伯逊瞳孔(Argyll Robertson pupil)。其确切机制尚存争议。一种解释基于视束纤维投射至中脑顶盖前区的现象。梅毒性脑膜炎可能因蛛网膜下腔存在螺旋体而损伤这些纤维。需注意,顶盖前区也投射至中脑的埃丁格-韦斯特法尔核(Edinger-Westphal nucleus),该核团细胞发出支配眼的副交感神经纤维,控制瞳孔括约肌。尽管顶盖前橄榄核的输入通路中断,但投射至外侧膝状体的视束纤维未被破坏,因此视觉功能保留,调节反射时的瞳孔收缩也得以维持。
膀胱(Urinary Bladder)
膀胱活动受脊髓反射通路和脊髓上中枢共同调控(图11.3)。交感神经支配起源于脊髓上腰段的交感节前神经元。交感节后纤维可抑制膀胱体部的平滑肌(逼尿肌),同时兴奋膀胱三角区平滑肌和尿道内括约肌。膀胱充盈时,逼尿肌持续受抑制以防止排尿。这种抑制由去甲肾上腺素作用于β受体介导,而三角区及尿道内括约肌的兴奋则由去甲肾上腺素作用于α受体实现。
• 图11.3 膀胱调控反射的下行与传出通路示意图。为清晰起见,仅显示部分主要通路。(改绘自de Groat WC, Booth AM. In: Dyck PJ, Thomas PK, Lambert EH, Bunge R, eds. Peripheral Neuropathy. 2nd ed. Philadelphia: WB Saunders; 1984.)
膀胱充盈时内压较低(5~10 cm H₂O),但排尿开始时压力骤增。排尿可通过反射或意识控制触发。反射性排尿中,膀胱传入纤维激活脑干投射神经元,进而兴奋脑桥头端的排尿中枢(巴林顿核,Barrington’s nucleus)。下行投射同时抑制阻止排尿的交感节前神经元。当该上行通路活动达到阈值时,排尿中枢触发排尿指令,通过网状脊髓束到达骶髓。此时膀胱交感投射活动被抑制,副交感投射被激活。膀胱壁肌肉收缩引发机械感受器强烈放电,进一步激活脊髓上环路,最终实现膀胱完全排空。
排尿的脊髓反射通路
排尿也存在脊髓反射通路。这一通路在新生儿时期即可运作。然而随着发育成熟,脊髓上控制通路在触发排尿过程中逐渐占据主导地位。脊髓损伤后,成年人在脊髓休克(spinal shock)期间会出现膀胱失控(尿失禁)。当脊髓从休克中恢复后,由于脊髓排尿反射的增强,膀胱功能可部分恢复。但此时膀胱肌张力增高且无法完全排空,这种情况常导致尿路感染。
尿道外括约肌也参与排尿控制。该括约肌为横纹肌,由躯体神经——阴部神经(pudendal nerves)中的运动轴突支配。其运动神经元位于骶髓(sacral spinal cord)前角的Onuf核。
控制膀胱的副交感节前神经元位于骶髓(S2和S3或S3和S4节段)。这些胆碱能神经元通过盆神经(pelvic nerves)投射,分布至盆神经丛和膀胱壁的神经节。膀胱壁内的副交感节后神经元支配逼尿肌(detrusor muscle)、膀胱三角(trigone)和括约肌。副交感活动使逼尿肌收缩,同时松弛膀胱三角和尿道内括约肌,这些作用共同导致排尿(micturition)。部分副交感节后神经元为胆碱能,另一些为嘌呤能(释放ATP)。
排尿通常由排尿反射调控(见图11.3)。膀胱壁内的机械感受器可被膀胱壁肌肉的牵张和收缩激活。随着尿液积聚使膀胱扩张,机械感受器的传入纤维开始放电。
脑内的自主神经中枢
对自主神经输出的调控由分布于多个脑区的自主神经中枢(由局部神经元网络构成)维持。前文讨论的脑桥(pons)排尿中枢即为一例。此外还存在许多具有不同功能的自主神经中枢:延髓(medulla)内有血管舒缩中枢,延髓和脑桥存在呼吸中枢。自主神经中枢最密集的区域当属下丘脑(hypothalamus)。
下丘脑与视前区
下丘脑是间脑(diencephalon)的组成部分。图11.4展示了部分下丘脑核团。位于下丘脑前方的端脑(telencephalic)结构包括视前区(preoptic region)和隔区(septum),二者均参与调节自主神经功能。穿过下丘脑的重要纤维束包括穹窿(fornix)、内侧前脑束(medial forebrain bundle)和乳头丘脑束(mammillothalamic tract)。穹窿常被用作划分下丘脑内侧区与外侧区的解剖标志。
下丘脑具有多种功能(关于其内分泌调控功能的讨论详见第41章)。本文将重点阐述其对自主神经功能的调控作用。在自主神经调控方面,下丘脑的功能类似于工程学中称为伺服机制(servomechanism)的控制系统:即通过负反馈环路维持特定生理参数于设定点或设定值的调控系统。以下以体温调节、体重与脂肪量调控以及水摄入调控为例说明这一原理。
• 图11.4 从第三脑室视角观察下丘脑主要核团示意图。前方位于右侧。(改绘自Nauta WJH, Haymaker W. The Hypothalamus. Springfield, IL: Charles C Thomas; 1969.)
温度调节
恒温动物(homeothermic animals)能够在环境温度波动和机体活动水平变化(导致内源性产热)的情况下维持相对恒定的核心体温。这种能力依赖于皮肤、中枢神经系统(CNS)和内脏器官中三大类温度感受器(thermoreceptors)的信息输入。
外界温度信息由皮肤温度感受器提供。核心体温由视前区(preoptic area)(可能还包括脊髓)的中枢温度感受神经元监控,这些神经元通过局部血液温度进行监测。内脏温度感受器则监测这些器官的温度。所有感受器都将温度信息传递至视前区(传导通路后文详述)及下丘脑相关区域,共同维持核心体温恒定。因此,视前区与下丘脑共同构成以正常体温为设定点的伺服机制。
虽然来自各感受器的信号会被整合,但其相对重要性可能随不同条件而变化。环境温度变化引起的皮肤温度变化比核心体温变化更迅速且显著,因此皮肤感受器可能是应对外界温度变化的初始且最常用机制。中枢温度感受器对由内部因素(如运动)引起的温度变化更为重要,或当外界温度变化过于剧烈或持久,导致外周温度感受器信号不足以维持核心体温时发挥作用。最后,摄入冷热食物或液体引起的体温变化则由内脏温度感受器检测。
代表偏离伺服机制设定点的误差信号(即机体冷却或升温)会引发促使体温回归设定点的调节反应。这些反应通过自主神经系统、躯体神经系统和内分泌系统共同介导。
涉及体温降低的情况会触发多种反应,以增加产热(thermogenesis)并减少散热。产热的增加通过以下机制实现:战栗产热(shivering thermogenesis)(骨骼肌不同步收缩以增加产热)和棕色脂肪组织(BAT)产热(BAT thermogenesis)(在BAT产热中,氧化磷酸化与ATP合成解偶联,使反应释放的能量以热量形式散逸),以及甲状腺激素水平升高导致代谢增强。通过皮肤血管收缩和立毛(piloerection)减少散热。立毛对有毛动物有效,但对人类无效;后者仅表现为鸡皮疙瘩。此外,还会发生心动过速(tachycardia),这可能有助于向产热组织(脂肪和肌肉)提供代谢产物用于产热,并帮助将产生的热量分布至全身。最后,寒冷感知会影响启动自主行为的决策,例如决定穿上外套。
体温升高通常会引起相反方向的变化。甲状腺活动减弱,导致代谢活性降低和产热减少。通过出汗、流涎(某些动物而非人类)和皮肤血管扩张(因交感神经活动减弱)增加散热。然而,此时仍会出现心动过速,推测是为了优化皮肤循环灌注以促进散热。
早期研究发现视前区(preoptic region)和下丘脑前部(anterior hypothalamus)是散热中枢,而下丘脑后部(posterior hypothalamus)是保热中枢。例如,视前区损伤会阻止出汗和皮肤血管扩张,若将此类损伤个体置于温暖环境中会出现高热(hyperthermia)。相反,刺激散热中枢会引起皮肤血管扩张并抑制战栗。相比之下,乳头体(mammillary body)背外侧区域的损伤会干扰产热和保热机制,当个体处于寒冷环境中时可能导致低体温(hypothermia)。刺激该脑区可诱发战栗。
目前已知温度调节反应背后的神经环路和生理过程的许多细节,表明视前区(preoptic area)和下丘脑背内侧核(dorsal medial hypothalamic nucleus)是体温调节的关键组成部分。特别是视前区似乎是各种感觉信息输入的整合中枢。皮肤温度信息通过温度敏感性初级传入神经传递,这些传入神经在脊髓背角(dorsal horn)与神经元形成突触,进而投射并激活中脑尾侧的臂旁核(parabrachial nucleus)。来自内脏传入的信息也通过孤束核(solitary nucleus)中继至臂旁核。臂旁神经元继而激活视前区特定部位——视前区正中核(median nucleus of the preoptic area)内的神经元。许多正中核神经元对血液温度的局部变化敏感,并含有前列腺素E2(PGE2)受体3(EP3),该受体介导发热反应(参见后文"临床视角"专栏)。
临床相关
发热(伴随某些感染出现)可被视为体温调定点的上移。这种上移可由微生物释放致热原(pyrogen)或介导炎症反应的细胞释放致热原所引起。致热原升高调定点的作用主要通过前列腺素PGE2与视前区神经元上的EP3受体结合所介导。PGE2由外周组织和供应视前区的血管释放。PGE2与EP3受体结合会导致视前区神经元活动性降低。这种神经元活动性的降低通过寒战和BAT产热作用增加产热,并通过皮肤血管收缩减少散热,综合效应是升高体温。支持该发热机制的证据包括:向视前区注射PGE2可诱导发热的研究;以及选择性敲除视前神经元EP3受体后,PGE2注射失去诱导发热能力的研究。
摄食与体重的调节
能量稳态(energy homeostasis)对动物生存至关重要。其挑战在于:大多数细胞需要持续的营养供应才能正常运作,但多数动物并不持续进食,而是周期性摄食。因此,为维持能量稳态,摄食行为受多种因素调控:短期机制控制摄入行为,长期机制控制体重以保障充足的能量储备。其中既涉及享乐性因素(此处指进食带来的愉悦感)也涉及稳态性因素;但本章重点讨论后者,这下丘脑在能量稳态中的核心作用。
短期摄食行为受多种机制调控。首先,胃壁存在牵张感受器,当食物充盈胃部时传递扩张信号。这些信号通过迷走神经传入纤维传递至延髓的孤束核(solitary nucleus)。信息随后被传递至多个脑区:通过直接通路或臂旁核(parabrachial nucleus)中继传递至下丘脑,以组织对摄入物质的自主神经反应;传递至丘脑和皮层,使机体产生胃充盈的感知。下丘脑中,室旁核(paraventricular nucleus)、背内侧核(dorsomedial nucleus)、弓状核(arcuate nucleus)以及外侧下丘脑是这些信号的主要靶区。
#
感觉传入神经还能感知肠道和肝门静脉循环中的葡萄糖与脂质浓度,并以类似于牵张受体的方式将这些信息传递至孤束核,继而传至下丘脑。此外,胃和肠道在摄食时会释放多种激素,包括胆囊收缩素(cholecystokinin)、肽YY(peptide YY)、胰高血糖素样肽-1(GLP-1)和饥饿素(ghrelin)。下丘脑细胞具有这些激素的多种受体,可直接受其影响。此外,其他脑区细胞也含有这些激素的受体,因此可能形成通往下丘脑的间接通路。其中一个区域是最后区(area postrema),它位于孤束核背侧并向其投射。位于第四脑室底部的最后区不受血脑屏障保护(属于室周器官之一),其神经元可响应胆囊收缩素和GLP-1,从而减少摄食量(最后区还可通过引发呕吐反应响应化学毒素)。
长期体重的调控受多种因素影响,涉及神经系统与内分泌系统的相互作用。本节重点讨论下丘脑的作用及其对自主神经系统的控制,这为下丘脑作为伺服机制组成部分提供了另一例证。在此案例中,脂肪沉积量(adiposity)是受控参数。关于内分泌系统作用的更多细节,请参阅第38和39章。
早期通过损毁和电刺激的研究表明,下丘脑腹内侧区(ventromedial hypothalamus)和腹外侧区(ventrolateral hypothalamus)参与能量稳态调节。腹内侧区损毁会导致摄食量增加(食欲亢进)并引发肥胖,而对该区域的电刺激则会抑制摄食行为。研究还发现这些损毁会改变自主神经活动,增强副交感神经张力并降低交感神经张力,两者均会导致血液胰岛素水平升高,进而促进能量储存(见第39章)。这些观察结果支持了"下丘脑腹内侧区存在饱食中枢"的观点。然而另一种解释认为,主要受控变量可能并非单纯的摄食行为本身,而是体重——更具体地说是体脂水平(即脂肪沉积量)。因此,摄食行为的调控可能只是用于维持体重设定点的多种机制之一。与此复杂性一致的是,损毁实验可观察到初期因食欲亢进引发的动态体重增长期,随后进入无需食欲亢进即可维持较高体重的静态期。此外,即使通过固定饲喂量(正常量)防止下丘脑腹内侧区损毁动物出现食欲亢进,其仍会发展为肥胖,这提示其他代谢过程的调控发生了改变。最后,下丘脑腹内侧区损毁已被证实会改变能量消耗水平。
与下丘脑腹内侧部损伤不同,下丘脑外侧部(lateral hypothalamus)的损伤会抑制食物摄入(摄食减少,hypophagia)并导致体重下降;事实上,动物在此类损伤后可能因饥饿而死亡。相反,若存在食物,对下丘脑外侧部内侧前脑束(medial forebrain bundle)的电刺激会引发探索行为和摄食。这种刺激还会产生多巴胺依赖性奖赏(dopamine-dependent reward),这种奖赏既可介导自然奖赏(食物、性)的激励效应,也可介导大多数成瘾药物的奖赏效应。这些观察结果使人们认为下丘脑外侧部存在摄食中枢。然而,由于黑质(substantia nigra)神经元的多巴胺能轴突在通往纹状体(striatum)的路径中正好经过下丘脑外侧部的旁侧,因此这些纤维的缺失或激活可能是实验中观察到的效应的原因,这使得该解释变得复杂。不过,已发现下丘脑外侧部神经元可合成食欲素(orexin)等影响摄食行为的肽类,因此下丘脑外侧部可能在能量稳态中确实发挥着作用。
在较新的研究中,研究者已鉴定出多种参与摄食和体重调控的激素与神经肽,并阐明了内分泌系统与神经系统之间许多与能量稳态相关的相互作用。
在正常个体中,血液胰岛素水平与肥胖程度相关(此外还与葡萄糖和其他物质的血液浓度急剧变化相关)。类似地,由脂肪细胞(adipocytes,主要指形成白色脂肪组织的细胞)释放的激素瘦素(leptin)的蛋白水平也与肥胖程度相关。高水平的瘦素抑制食物摄入并刺激分解代谢过程(包括脂肪组织的减少),而低瘦素水平则会触发相反的作用。同样,高胰岛素水平会促进能量储存过程。
瘦素和胰岛素调控体重的能力与其对下丘脑(尤其是弓状核,arcuate nucleus)的作用有关,该核团神经元表达这两种激素的受体(另见第39章)。目前已鉴定出两类主要的响应瘦素和胰岛素的弓状核神经元:表达前黑素皮质素(proopiomelanocortin, POMC)及可卡因-苯丙胺相关转录物(cocaine- and amphetamine-related transcript, CART)的神经元会被瘦素和胰岛素激活,其活动会导致分解代谢增强;相反,另一组表达神经肽Y(neuropeptide Y, NPY)和刺鼠相关肽(agouti-related peptide, AgRP)的神经元活动会触发合成代谢过程,但被瘦素和胰岛素抑制。因此,体脂水平升高会导致瘦素和胰岛素水平升高,进而(1)增强POMC和CART表达神经元的活动,促进分解代谢;(2)抑制NPY和AgRP表达神经元的活动,减少合成代谢;二者共同作用使体脂水平回归设定值(set point)。降低体脂水平则会引发与上述过程相反的事件序列,使体脂水平回升至原有水平或设定值。
水摄入的调节
水摄入同样依赖于伺服机制(servomechanism)。液体摄入受血液渗透压和容量的影响(图11.5)。
当水分缺乏时,细胞外液变为高渗状态,进而导致细胞内液也变为高渗。大脑中存在神经元,可充当渗透压感受器(osmoreceptors)以检测细胞外液渗透压的升高(参见第35章)。这些渗透压感受器似乎位于终极板血管器(organum vasculosum of the lamina terminalis),这是室周器官(circumventricular organ)之一。室周器官围绕脑室分布,且缺乏血脑屏障。穹窿下器(subfornical organ)和终极板血管器参与口渴的调节。
• 图11.5 A,大鼠水摄入调节中可能起作用的脑区结构。LHA,下丘脑外侧区。B,传递血液渗透压和容量变化的神经回路。(A,改绘自Shepherd GM. Neurobiology. New York: Oxford University Press; 1983.)
水分缺乏还会导致血容量减少,这一变化由血管系统低压侧(包括心脏右心房)的感受器感知(参见第17章)。此外,血容量减少会触发肾脏释放肾素(renin)。肾素将血管紧张素原(angiotensinogen)分解为血管紧张素I(angiotensin I),后者随后水解为血管紧张素II(angiotensin II)(参见第34章)。这种肽类物质通过作用于另一个室周器官——穹窿下器中的血管紧张素II受体来刺激饮水行为。血管紧张素II还可引起血管收缩,并促进醛固酮(aldosterone)和抗利尿激素(antidiuretic hormone, ADH)的释放。
水分摄入不足通常比过量饮水更具危害性。然而,当摄入水量超过需求时,通过抑制视上核(supraoptic nucleus)神经元在后垂体腺终末释放ADH,可轻松排出多余水分(参见第41章)。如前所述,抑制ADH释放的信号包括血容量增加和细胞外液渗透压降低。下丘脑其他区域(特别是视前区和外侧下丘脑)以及下丘脑外的若干结构也参与水摄入的调节。
其他自主神经调控结构
关键要点
- 自主神经系统(autonomic nervous system)控制平滑肌、心肌和腺体。它帮助维持稳态并协调对外界刺激的反应。该系统包含感觉和运动成分,其运动成分由交感神经(sympathetic)和副交感神经(parasympathetic)分支组成。肠神经系统(enteric nervous system)通常被视为自主神经系统的一部分,但专门负责胃肠道的调控。
- 自主运动通路包含节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)。节前神经元位于中枢神经系统(CNS),而节后神经元位于外周神经节。交感节前神经元位于脊髓的胸腰段(thoracolumbar region),交感节后神经元位于椎旁神经节(paravertebral ganglia)和椎前神经节(prevertebral ganglia)。副交感节前神经元位于脑神经核或脊髓骶段,副交感节后神经元位于靶器官内部或附近的神经节。
- 自主传入纤维(autonomic afferent fiber)支配内脏的感觉受体。大多数功能是激活反射;部分传入纤维的激活也会产生可被意识感知的感觉。
- 肠神经系统包括胃肠壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)。肌间神经丛调节运动功能,黏膜下神经丛调控离子和水转运以及分泌功能。
前脑中除下丘脑外的其他区域也参与自主神经调控,包括杏仁核中央核(central nucleus of the amygdala)、终纹床核(bed nucleus of the stria terminalis)以及大脑皮层的多个区域。内脏信息通过上行系统传递至这些高级自主神经中枢,该上行系统涉及孤束核(nucleus of the solitary tract)、臂旁核(parabrachial nucleus)、导水管周围灰质(periaqueductal gray matter)和下丘脑。控制自主神经活动的下行通路起源于下丘脑室旁核(PVN)、去甲肾上腺素能A5细胞群(noradrenergic cell group A5)、延髓头端腹外侧区(rostral ventrolateral medulla)以及延髓腹内侧的中缝核(raphe nuclei)和邻近结构。
神经系统对免疫系统的影响
环境应激可导致免疫抑制(immunosuppression),表现为辅助T细胞(helper T cell)数量减少和自然杀伤细胞(natural killer cell)活性降低。免疫抑制甚至可通过经典条件反射诱发。此类效应的机制之一涉及下丘脑释放促肾上腺皮质激素释放因子(corticotropin-releasing factor)。该因子促使垂体释放促肾上腺皮质激素(adrenocorticotropic hormone, ACTH),进而刺激肾上腺皮质激素分泌,最终引发免疫抑制(见第43章)。其他机制包括神经对淋巴组织的直接作用。免疫系统也可能影响神经活动。
12 骨骼肌生理学
学习目标
完成本章学习后,学生应能回答以下问题:
- 骨骼肌纤维内的哪些结构参与向肌腱的纵向力量生成,哪些结构参与向细胞外基质的横向力量传递?
- 肌营养不良蛋白(dystrophin)的突变/缺陷如何影响骨骼肌?
- 骨骼肌纤维肌膜动作电位引发肌肉收缩的事件顺序和分子相互作用机制是什么?
- 如何在一分钟内通过哪些机制增强骨骼肌的收缩力量?
- 1型和2型骨骼肌纤维分类的基础及其募集模式是什么?
- 在什么情况下1型骨骼肌纤维可以转化为2型骨骼肌纤维,反之亦然?
- 耐力训练和抗阻训练通常会引起骨骼肌的哪些变化?哪些信号机制参与这些训练效应的产生?
- 哪些因素会导致疲劳的发生?
- 骨骼肌中哪些蛋白质的突变常与细胞内\mathsf{Ca}^{++}调节异常相关?
- 通过哪些机制可以实现骨骼肌纤维的修复?
