第七章 躯体感觉系统
学习目标
完成本章学习后,学生应能回答以下问题:
- 躯体感觉信息的主要模态有哪些?每种模态从外周传导到初级躯体感觉皮层的通路是什么?
- 躯体感觉系统的外感受、本体感受和内感受部分分别对应哪些身体区域和信息类别?
- 精细/辨别性触觉的主要感受器是什么?
- 小脑接收哪些类型的躯体感觉信息?
- 痛觉和温度触觉的主要感受器是什么?
- 什么是牵涉痛现象?
- 哪些蛋白质参与不同类别躯体感觉信息的转导?
- 下行通路如何调控上行躯体感觉通路的活性传导?
神经节细胞的中枢轴突过程通过背根进入脊髓的中枢神经系统(CNS),或通过脑神经进入脑干。一个中枢过程通常会产生大量分支,可能与多种细胞类型形成突触联系,包括体感通路的二级神经元。这些中枢分支的末端定位因传递信息类型而异:有些终止于进入节段水平或其附近,而另一些则投射到脑干核团。
作为体感信息感知通路组成部分的二级神经元(第一个突触)投射并突触于特定丘脑核团,三级神经元即位于此处。这些三级神经元继而投射到初级体感皮层(S-I)。在皮层内,体感信息在S-I和多个高阶皮层区域进行处理。体感信息也通过其他二级神经元传递至小脑,用于其运动协调功能。
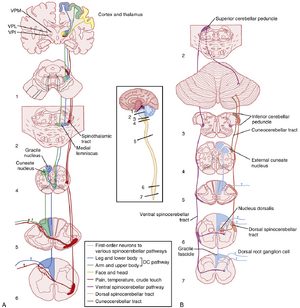
体感系统(somatosensory system)向中枢神经系统(CNS)提供关于身体状态及其与外界接触的信息。这是通过多种感觉受体实现的,这些受体将机械能(压力、牵张和振动)和热能转换为电信号。这些电信号称为发生器电位(generator potential)或受体电位(receptor potential),产生于一级体感神经元轴突的远端末端,在此处触发反映刺激特征信息的动作电位序列(参见第5章)。这些神经元的胞体位于背根神经节(图7.1A;参见图4.8)和脑神经节中。
每个被称为假单极细胞(pseudounipolar cell)的神经节细胞,从胞体发出一个短突起,随后分为两支:一支通向周围神经系统(PNS),另一支通向中枢神经系统(CNS)。PNS中的周围突起汇聚形成周围神经。纯感觉神经仅含有此类神经节细胞的轴突;而支配肌肉的混合神经则同时包含传入(感觉)纤维和传出(运动)纤维。在靶器官处,传入轴突的周围过程反复分支,每个终末分支以感觉受体的形式终止。大多数情况下,游离神经末梢自身即形成功能性受体,但某些情况下神经末梢被附属细胞包裹,整个结构(轴突终末加附属细胞)共同构成受体。
体感系统的组织结构与其他感觉系统存在显著差异,这具有实验和临床双重意义。特别值得注意的是,其他感觉系统的受体集中分布于单一高密度器官(如视觉系统的眼球),而体感受体则广泛分布于全身(包括头颈部)。
体感系统的细分
躯体感觉系统根据其受体的分布接收三大类信息。其外感受性(exteroceptive)部分负责提供皮肤与外界物体接触的信息,为此使用多种皮肤机械感受性(mechanoceptive)、伤害感受性(nociceptive,疼痛)和温度感受性(thermal)受体。理解该部分将是本章的主要重点。本体感觉(proprioceptive)成分提供身体和肢体位置及运动的信息,主要依赖于关节、肌肉和肌腱中的受体。本章将涵盖起源于这些受体并构成意识性和非意识性本体感觉功能的上行中枢通路。这些对运动控制有重要贡献的本体感觉系统将在第9章更详细讨论。最后,内感受性(interoceptive)部分具有监测身体内部状态的受体,包括检测肠道扩张或膀胱充盈的机械感受器(mechanoreceptors)。内感受性部分的某些方面也将在第11章讨论,因为它们与自主功能相关。
躯体感觉通路还可根据所传递的信息类型进行分类。公认的两大功能类别,各自包含若干躯体感觉子模态。精细辨别性触觉包括轻触、压觉、振动、颤动(低频振动)以及拉伸或张力。第二大类感觉功能是痛觉和温度觉。此处的子模态包括有害和无害的冷热感觉以及机械性和化学性疼痛。瘙痒也与疼痛密切相关,似乎由与疼痛系统相关的特定纤维传递。
临床相关
各种皮肤感觉受体的感觉功能已通过一种称为显微神经成像术(microneurography)的技术在人类受试者中得到研究。该技术通过将细金属微电极插入手臂或腿部的神经干,以记录单个感觉轴突的动作电位。当能够记录到单个感觉轴突的信号时,可绘制该纤维的感受野。通过此技术,在实验动物中研究的大多数类型的感觉受体也已在人类中被发现。
在表征感觉轴突的感受野后,电极可用于刺激同一感觉轴突。在这些实验中,受试者被要求定位感知到的感觉轴突感受野,结果发现其与绘制的感受野完全一致。
实验中的一个重要发现是:将这些体感亚模态传递至中枢神经系统的传入轴突具有不同直径,部分轴突被髓鞘包裹。需回顾的是,从外周神经记录的复合动作电位(见第5章表5.1)由一系列波峰组成,这表明神经中轴突的直径呈分组分布而非均匀分布。触觉信息主要由Aβ类大直径有髓纤维传递,而疼痛和温度信息则通过小直径、薄髓鞘(Aδ)和无髓鞘(C)纤维传递。通过选择性阻断或刺激特定直径的轴突类别,可单独研究不同的体感亚模态。
精细触觉与本体感觉
皮肤的神经支配
皮肤的低阈值机械感受器神经支配
皮肤是重要的感觉器官,因此富含多种体感受体及相关传入神经的支配。我们首先关注与精细触觉(discriminatory touch)相关的传入类型。这些传入纤维与所谓的低阈值机械感受器(low-threshold mechanoreceptors)相关。伤害感受器(nociceptor)和温度感受器(thermoceptor)的神经支配将在本章后续部分单独讨论。
为研究触觉受体的反应特性,通常使用小直径探针或金属丝按压皮肤的局部区域。通过该技术,在记录感觉传入纤维时可观察到两种基本反应类型:快适应性(FA)和慢适应性(SA)反应(图7.2)。两者数量相近。当探针首次下压皮肤时,FA纤维会触发短暂的动作电位爆发,但即使探针持续施压,其放电也会停止。它们可能在刺激终止时(即探针抬起时)再次爆发动作电位。相比之下,SA单元在刺激开始时即触发动作电位(或增加放电频率),并持续放电直至刺激结束。
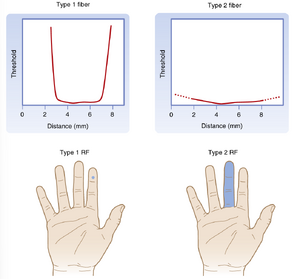
FA和SA传入纤维类别均可根据其感受野(receptive field)的其他特征进行细分,其中感受野被定义为能够通过刺激引发反应(即改变传入轴突放电)的皮肤区域。1型单位具有边界清晰的小型感受野。特别是在无毛皮肤(glabrous skin,即无有毛皮肤,如手掌和足底)中,感受野呈圆形或卵圆形,其内部对刺激具有相对均匀的高敏感性,而在边界处敏感性急剧下降(图7.3)。1型单位(尤其是SA1单位)对边缘刺激反应最佳。也就是说,当刺激边缘穿过其感受野时,它们产生的反应比整个感受野被刺激压陷时更强烈。
2型单位的感受野较宽,边界模糊,仅有一个最大敏感点,敏感度随距离逐渐降低(见图7.3)。相比之下,1型单位的感受野通常覆盖指尖约四个乳头状嵴,而2型单位的感受野则覆盖手指大部分区域(若非全部)。
感受野特性
目前已通过生理学方法鉴定出四类主要低阈值机械敏感性传入纤维(FA1、FA2、SA1和SA2)。这些轴突的周围末梢可能以游离神经末梢形式终止,或与毛囊相关联,或位于由支持细胞组成的特化受体结构中。
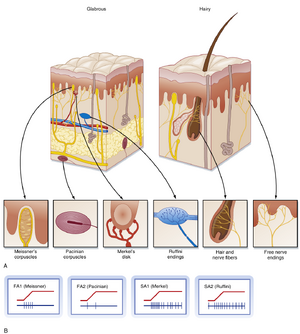
对于无毛皮肤,四类传入纤维与四种组织学确认的特异性受体结构相关,这些结构的位置和物理特性有助于解释这些感觉传入纤维的放电特性。FA1传入纤维终止于Meissner小体(Meissner’s corpuscles),而SA1传入纤维终止于Merkel盘(Merkel’s disks)。这两种受体均位于皮肤较浅层——Merkel盘位于基底表皮,Meissner小体位于表皮下方(见图7.2)。这些受体体积小且定向排列,可检测正上方皮肤表面所受压力,因此SA1和FA1传入纤维具有小型感受野。在无毛皮肤中,SA2传入纤维终止于Ruffini末梢(Ruffini endings),FA2传入纤维终止于Pacinian小体(Pacinian corpuscles)。这两类受体位于真皮层和结缔组织深层,因此对更大范围的刺激敏感。Pacinian和Meissner受体的被膜(capsules)可滤除缓慢变化或稳态刺激,从而使这些传入纤维选择性响应动态刺激。
在有毛皮肤中,感受器与传入纤维类别的对应关系与无毛皮肤类似。慢适应型1类(SA1)和2类(SA2)纤维分别连接Merkel小体和Ruffini末梢。环层小体(Pacinian corpuscles)同样是快适应型2类(FA2)传入纤维特性的结构基础,但它们不存在于有毛皮肤中,而是分布于肌肉和血管周围的深层组织。快适应型1类(FA1)传入纤维在有毛皮肤中没有完全对应的类似物,取而代之的是毛囊感受器(hair units)——这类传入纤维的自由末梢环绕包裹毛囊(见图7.2)。每个毛囊感受器约连接20根毛发,形成较大的卵圆形或不规则形状感受野。这些单元对单根毛发的运动都极为敏感。此外还存在响应皮肤接触的区域单位(field units),但与FA1单元不同,它们具有更大的感受野。
若干心理物理学和神经编码问题可与不同类别传入纤维的感受野特性和敏感度相关联。例如,触觉刺激的感知阈值究竟取决于外周感受器的敏感性还是中枢处理过程?事实上,通过显微神经电描记术(microneurography)可证明,手指FA1传入纤维的单个动作电位即可被感知,这表明感受器决定了敏感性;但对于其他皮肤区域,感知更依赖于中枢神经系统因素(如注意力)。
体感功能的重要行为学及临床评估指标是空间分辨力(spatial acuity)或两点辨别觉(two-point discrimination)。临床上医生会用两根针状物同时接触患者皮肤。当两刺激点间距超过特定阈值距离时(该距离因身体部位而异),患者通常能感知为两个独立刺激。最佳辨别力(最短阈值距离)出现在指尖。1类单元是空间分辨力的结构基础,考虑到1类单元比2类单元的感受野更小,这一现象并不意外。此外,某皮肤区域的两点辨别阈值距离与其1类单元密度密切相关,因为这些单元在无毛皮肤各处的感受野大小相似。但其密度从指尖到手掌再到前臂逐渐降低,这种递减与阈值距离的增大相关。值得注意的是,这种神经支配密度的差异也符合不同皮肤区域对触觉刺激总体敏感度的分布特征。
不同传入神经纤维类别的放电频率与感知刺激质量之间的关系,是显微神经成像技术观察到的另一重要因素。当采用短暂电流脉冲刺激单根SA(慢适应)纤维时(每个脉冲均诱发一次动作电位),可在该纤维的感受野区域产生持续的压感。随着脉冲频率升高,会感知到压力同步增强——SA纤维的放电频率编码了触觉刺激的强度。又如,重复刺激FA(快适应)纤维时,首先产生敲击感;当刺激频率增加时,则转变为振动感。值得注意的是,只要刺激仅激活特定纤维类别,其性质(如痛觉感知)均不会改变。这证明痛觉是独立的子模态,它使用区别于低阈值机械感受器的特定神经纤维束。
这些发现阐明了感觉系统的重要原则——标记线路原则。该理论认为:特定感觉的性质(即模态)源自于通过特异性传入神经束向中枢神经系统传递信息,这些传入束在神经系统中具有独特的靶向区域。因此,这些传入神经活动的变化仅会改变感觉的量化特征。后续将详细说明,不同体感子模态(即源自FA/SA机械感受器、本体感受器和痛觉感受器的信息)在丘脑和初级体感皮层等较高水平中枢神经系统中,似乎都使用相对独立的专属细胞群。
躯体神经支配
周围神经系统的轴突通过脊髓根(或通过支配头颈部的脑神经)进出中枢神经系统。特定脊髓节段的背根完全由相应背根神经节细胞的中央突构成。腹根主要由运动轴突组成,包括α和γ运动神经元轴突(见第9章),在特定节段水平还包含自主神经节前轴突(见第11章)。
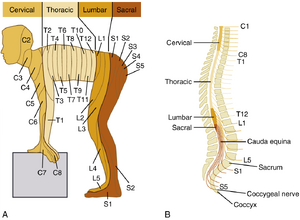
神经支配模式在胚胎发育过程中形成。成人阶段,特定背根神经节负责支配特定的皮肤区域——皮节(dermatome)。许多皮节在发育过程中会发生形变,主要由于四肢形成时发生的旋转运动,也与人体的直立姿势有关。但若将皮节序列展示于四足体位的人体模型时(图7.4),其分布规律就变得清晰可辨。
虽然一个皮节(dermatome)接受来自相应脊髓节段的最密集神经支配,但来自相邻脊髓节段的传入纤维侧支也向该皮节提供神经分布。单根背根(dorsal root)的横断仅导致对应皮节的轻微感觉丧失。要使任一皮节完全麻醉,需要阻断数个相邻背根。
临床相关
带状疱疹(shingles)是体现背根皮节组织结构的常见疾病。该疾病由水痘-带状疱疹病毒(herpes zoster virus)的再激活引起,该病毒在初次感染时通常引发水痘(chickenpox)。初次感染期间,病毒会感染背根(及脑神经)神经节细胞,并可在其中潜伏数年至数十年。当病毒再激活时,该特定背根神经节的细胞被感染,病毒沿外周轴突分支传播,导致疼痛或瘙痒的皮疹。这种皮疹以皮节性、带状分布局限于身体一侧(中线处终止),或按脑神经分布区域出现。
在背根内部,纤维并非随机分布:粗大的有髓鞘初级传入纤维占据背根的内侧位置;细小的有髓鞘和无髓鞘纤维则位于外侧。位于内侧的粗大传入纤维进入背柱(dorsal column)后分叉为向吻侧和尾侧走行的分支。这些分支发出侧支终止于多个相邻节段。吻侧分支还作为背柱-内侧丘系通路(dorsal column–medial lemniscus pathway)的一部分上行至延髓。终止于脊髓灰质局部的轴突分支将感觉信息传递至背角神经元,同时也构成反射通路的传入部分(见第9章)。
细胞水平
三叉神经核复合体(trigeminal nuclear complex)由四个主要部分组成,其中三个为感觉性。三个感觉部分(从吻侧到尾侧)分别是中脑核(mesencephalic nucleus)、主感觉核(chief sensory nucleus)和下行(脊髓)三叉神经核(descending trigeminal nucleus)。后两者是典型的感觉核,其中所含的细胞体为二级神经元。中脑核实际上包含一级神经元,因此与背根神经节类似。三叉神经复合体的第四部分是三叉神经运动核(motor nucleus of the trigeminal nerve),其运动神经元通过三叉神经投射至大咀嚼肌(temporalis、masseter、medial pterygoid和lateral pterygoid)以及下颌鳃弓的四块小肌肉(tensor tympani、tensor palati、digastric前腹和mylohyoid)(见第4章,图4.6D–E)。
面部神经支配
支配面部(主要是三叉神经)的初级传入纤维分布方式与支配躯体的纤维类似。三叉神经节(trigeminal ganglion,又称gasserian ganglion或semilunar ganglion)神经元的周围突通过三叉神经的眼支(ophthalmic)、上颌支(maxillary)和下颌支(mandibular)分支,支配面部的皮节样区域。这些纤维既传递触觉信息,也传递痛温觉信息。三叉神经还支配牙齿、口鼻腔及颅硬脑膜。
三叉神经节细胞的中枢突在脑桥中部水平进入脑干,该水平也对应于主要感觉三叉神经核(chief sensory trigeminal nucleus,颅神经V核)的位置。部分轴突终止于此核(主要为传递精细辨别触觉信息的大直径轴突),而其他轴突(传递触觉、痛觉和温度信息的中等及小直径轴突)形成下行三叉神经束,沿延髓下行至下行三叉神经核外侧。随着束的下行,轴突逐渐剥离并在此核形成突触。
本体感觉信息也通过三叉神经传递;然而,在这种特殊情况下,一级纤维的胞体位于中枢神经系统内的三叉神经核中脑部。这些神经元的中枢突终止于运动三叉神经核(参与与脊髓节段反射等效的节段性反射【参见第9章】)、网状结构以及主要感觉三叉神经核。
辨别性触觉与本体感觉的中枢躯体感觉通路
正如可能已明确的,不同躯体感觉子模态的信息主要通过不同的轴突组进入中枢神经系统,并靶向脊髓和脑干中的不同结构。在中枢神经系统内,这种分离在信息经脊髓和脑干上行时通过独立通路持续存在。例如,来自身体的精细辨别触觉信息由背柱-内侧丘系通路传递,而痛觉、温度觉和粗略触觉信息则由前外侧系统传递。
本体感觉信息通过另一条与背柱-内侧丘系通路部分重叠的路径传递。但需注意,这种功能分离并非绝对,例如背柱损伤后辨别性触觉能力可能部分恢复。前外侧系统将在疼痛相关章节讨论,因为它是该信息的关键通路。此处将详细探讨辨别性触觉与本体感觉的中枢通路。
背柱-内侧丘系通路
该通路的整体结构如图7.1A所示。背柱由背根神经节细胞(一级神经元)的大髓鞘轴突的上升支形成。这些轴突在脊髓各节段水平进入,向吻侧延伸至延髓尾端,终止于背柱核之一的突触:接受来自身体下部和腿部信息的薄束核(nucleus gracilis,通过称为薄束(fasciculus gracilis)的轴突束);以及接受来自身体上部和手臂信息的楔束核(nucleus cuneatus,通过楔束(fasciculus cuneatus))。需注意,背柱和背柱核中存在身体的躯体拓扑表征——腿部代表区位于最内侧,其次是躯干,最后是上肢。这种躯体拓扑结构是由于新传入的轴突在脊髓上行过程中逐渐添加至背柱外侧边缘的结果(例如腿部最外侧,手臂更内侧)。此类躯体拓扑图谱存在于躯体感觉系统的所有层面,至少延续至初级感觉皮层。
背柱核-内侧丘系通路(Dorsal Column–Medial Lemniscus Pathway)
背柱核(dorsal column nuclei)位于延髓,包含精细触觉和振动觉通路的二级神经元。这些细胞的反应特性与与其形成突触的初级传入纤维相似。背柱神经元与初级传入神经元反应的主要差异如下:(1)由于多个初级传入纤维汇聚于单个背柱神经元,背柱神经元的感受野更大;(2)由于不同类型初级传入纤维的汇聚,背柱神经元有时可对多种感觉受体类别产生反应;(3)背柱神经元常通过局部中间神经元介导抑制性感受野。
低位延髓背柱核投射神经元的轴突离开核团后,向腹侧继而向内侧弯曲,在与核团同水平的延髓中线处交叉,此时这些纤维称为内弓状纤维(internal arcuate fibers)。跨过中线后,此投射纤维束即形成内侧丘系(medial lemniscus)(见第4章,图4.6C{-}E),向吻侧投射至丘脑。掌握此交叉水平具有重要临床意义:若损伤发生在该水平以下(包括全部脊髓)的背柱-内侧丘系通路,将导致病灶同侧(ipsilateral)的精细体感辨别能力丧失;而该水平以上的损伤则引起对侧(contralateral)功能障碍。此外,由于内侧丘系内的纤维具有明确的躯体定位排列,局部损伤可导致特定身体区域的精细触觉选择性丧失。
该通路的第三级神经元位于丘脑的腹后外侧核(ventral posterior lateral nucleus, VPL),并投射至大脑皮层的体感区。
背柱-内侧丘系通路传递精细触觉和振动觉信息。这些信息对多种触觉辨别能力至关重要。例如,此通路损伤会降低空间分辨锐度,并可能丧失通过形状和质地识别物体的能力。临床上可通过测试书写觉(graphesthesia)(识别皮肤上书写的字母或数字的能力)是否受损,或判断皮肤上划线的方向感是否丧失。值得注意的是,即使背柱完全损伤,仍保留部分触觉功能,非伤害性触觉刺激的感知和定位仍可发生。因此,背柱通路传递的至少部分信息也通过其他上行通路传输。与精细触觉的严重缺损不同,背柱损伤不会影响皮肤痛温觉,因为这些感觉由脊髓前外侧区传递。但需注意,内脏痛觉在背柱损伤时会显著减弱。
面部精细触觉的三叉神经通路(Trigeminal Pathway)
传递面部、牙齿、口腔、鼻腔及颅脑膜信息的初级传入纤维,在三叉神经主感觉核(main sensory nucleus)和三叉神经下行核(descending nucleus)等多个脑干核团形成突触。
脊髓小脑与本体感觉传导通路
本体感受器(proprioceptor)提供身体各部位位置和运动的信息。这些信息除了用于局部反射(见第9章)外,主要有两个目标结构:小脑和大脑皮层。小脑利用这些信息参与运动的协调控制。传递至大脑皮层的信息则是产生对身体部位(如手部位置)有意识感知的基础,这种感知称为动觉(kinesthesia)。
图7.1B展示了将体感信息传递至小脑的主要通路。这些通路同时向小脑传递皮肤感觉和本体感觉信息。躯干及下肢的通路起始于背根神经节细胞,其轴突与Clarke氏柱(背核,nucleus dorsalis)形成突触。Clarke氏柱的细胞发出轴突进入同侧外侧索,形成脊髓小脑后束(dorsal spinocerebellar tract),通过小脑下脚进入小脑。脊髓小脑前束(ventral spinocerebellar tract)也将来自下肢的体感信息传递至小脑。注意脊髓小脑前束通路存在双重交叉(第一次交叉发生在脊髓水平,第二次交叉位于小脑白质内)。
上肢向小脑传递体感信息的上升通路较下肢更为简单(见图7.1B)。该通路起始于颈髓节段的背根神经节纤维,这些纤维在楔束(cuneate fasciculus)中上行至外侧楔束核(external cuneate nucleus)。外侧楔束核的轴突形成楔小脑束(cuneocerebellar tract),通过小脑下脚进入小脑。
上肢本体感觉信息传递至大脑皮层的通路与精细触觉通路相同:即背柱-内侧丘系通路(dorsal column–medial lemniscal pathway),其突触依次位于楔束核和丘脑腹后外侧核(ventral posterior lateral, VPL)。
头部的本体感觉信息由三叉神经中脑核(mesencephalic nucleus)的细胞传递。需注意的是,该核团内的神经元实际上是支配咀嚼肌(运动下颌的肌肉)及其他头部肌肉牵张感受器的初级传入神经元的胞体。这些神经元的中枢突投射至三叉神经运动核(参与局部反射)或邻近的网状结构。来自网状结构神经元的轴突加入三叉丘脑束(trigeminothalamic tract),最终终止于丘脑腹后内侧核(ventral posterior medial, VPM)。此外还存在三叉小脑通路(trigeminocerebellar pathway),负责将头部的体感(触觉和本体感觉)信息传递至小脑。
丘脑与皮层的体感区域
丘脑
丘脑腹后核复合体
丘脑腹后核复合体(ventroposterior nuclear complex)是间脑中上行躯体感觉信息的主要终止部位。该复合体由两个主要核团(VPL和VPM)以及一个较小的腹后下核(ventral posterior inferior, VPI)组成。内侧丘系(medial lemniscus)构成VPL核的主要输入来源,而来自三叉神经主感觉核(main sensory nucleus of the trigeminal nerve)的三叉丘脑束(trigeminothalamic tract)则为VPM核提供主要输入。这些核团分别接收来自脊髓丘脑束(spinothalamic tract)或等效三叉丘脑束传递的痛温觉信息的主要输入。VPI核接收少量脊髓丘脑束输入,其他丘脑核团也类似。
对腹后核复合体的单细胞记录研究表明,这些核团中许多神经元对刺激的反应与上行传导通路中的一级和二级神经元相似。丘脑细胞的感受野较小,但略大于初级传入纤维的感受野。此外,其反应可能主要由特定类型的感受器主导。例如,VPL和VPM核的细胞感受野通常反映来自某类皮肤感受器(FA或SA)或本体感受器的输入,这与它们接收内侧丘系输入的特性一致。
参与丘脑活动调节的机制包括GABA能中间神经元(GABAergic interneurons)和抑制性环路(见第6章)。例如,丘脑网状核(reticular nucleus of the thalamus)——包裹丘脑的薄层结构——主要由GABA能中间神经元组成,这些神经元投射至VPL、VPM及其他丘脑核团。丘脑皮质神经元和皮质丘脑神经元都发出轴突侧支到丘脑网状核,其抑制性中间神经元分别通过反馈和/或前馈抑制环路作用于丘脑核团内的神经元。
VPL和VPM核神经元与躯体感觉系统低级感觉神经元的一个区别在于:丘脑神经元的兴奋性取决于睡眠-觉醒周期的阶段。在嗜睡状态下,丘脑神经元倾向于交替产生兴奋性和抑制性突触后电位序列。这种交替的放电爆发会间歇性激活大脑皮层神经元,最终在脑电图上表现为α(α)节律或纺锤波。麻醉状态下也可观察到类似的丘脑活动模式。这两种状态中兴奋性与抑制性突触后电位的交替现象可能反映了丘脑神经元通过作用于NMDA和非NMDA谷氨酸受体(见第6章)的兴奋性氨基酸所达到的兴奋水平,也可能反映了丘脑网状核GABA能神经元通过循环连接对丘脑神经元的抑制作用。
体感皮层
丘脑中的三级感觉神经元向体感皮层投射。皮层的主要体感接收区称为S-I区和S-II区。S-I皮层(或初级体感皮层)位于中央后回,S-II皮层(次级体感皮层)则位于外侧裂的上缘。
如前所述,S-I皮层与体感丘脑类似,具有躯体定位组织(somatotopic organization)。S-II皮层也包含躯体定位图,此外皮层中其他几个尚未完全理解的区域也存在类似结构。在S-I皮层中,面部代表区位于中央后回外侧部(外侧裂上方)。手部和上肢其余部分的代表区位于中央后回的背外侧部,下肢代表区则位于大脑半球的内侧表面。将人体表面和面部映射到中央后回的图谱被称为感觉小人(sensory homunculus)。该图谱存在形变,因为分配给身体区域的神经组织体积与其神经支配密度成正比。因此,在人类中,口部区域、拇指和其他手指相对于其实际大小占据了不成比例的大片皮层区域。
感觉小人体现了体感信息的位置编码(place coding)机制。S-I皮层中的特定位置编码了身体或面部表面体感刺激的定位信息。例如,大脑通过中央后回特定神经元的激活来识别身体某部位受到了刺激。
躯体感觉皮层(Somatosensory Cortex,S-I)的形态与功能分区
S-I皮层具有多个形态和功能亚区,每个亚区均存在躯体定位图谱(somatotopic map)。这些亚区最初由Brodmann根据尼氏染色(Nissl-stained)切片中皮层各层神经元的排列方式进行划分,被称为Brodmann 3a、3b、1和2区(参见第10章)。皮肤传入在3b区和1区占主导,而肌肉和关节传入(本体感觉)则在3a区和2区占主导。因此,不同的皮层区域专门负责处理触觉和本体感觉信息。
在S-I皮层的任一特定区域内,沿皮层表面垂直线排列的所有神经元均具有相似的响应特性和感受野。因此,S-I皮层被认为具有柱状组织结构(columnar organization)。类似的柱状结构也见于其他初级感觉接收区,包括初级视觉皮层和听觉皮层(参见第8章)。S-I皮层中相邻的皮层柱可能处理不同感觉模态的信息。例如,到达3b区某皮层柱的皮肤信息可能来自快适应(FA)机械感受器,而相邻皮层柱的信息可能源自慢适应(SA)机械感受器。
除了负责体感信息的初级处理外,S-I皮层还参与高阶处理(如特征提取)。例如,1区的某些神经元对沿特定方向穿过感受野的刺激具有优先响应,而对相反方向的刺激无反应(Fig. 7.5)。这类神经元可能在感知刺激方向的能力中起重要作用,并帮助检测手部抓握物体的滑动。
躯体感觉皮层病变的影响
人类S-I皮层病变产生的感觉改变与丘脑体感区病变相似。但通常仅部分皮层受累,因此感觉缺失局限于感觉矮人图(sensory homunculus)对应的受损区域。例如,外侧感觉皮层损伤会导致面部感觉缺损,而前内侧感觉皮层损伤则导致下肢感觉缺损。受影响最显著的感觉模态是精细触觉和位置觉。图形觉(graphesthesia)和实体觉(stereognosis)(即通过触觉识别硬币、钥匙等物体的能力)尤其易受损。痛觉和温度觉可能相对保留,但皮层病变也可能导致痛觉缺失。相反,大范围皮层病变可能引发类似丘脑痛的中枢痛状态(见本章后文“脊髓丘脑束中断和丘脑病变对体感的影响”)。
痛觉与温度觉
痛觉与温度觉密切相关,常被归为一类,因其由重叠的受体介导,并通过周围神经系统(PNS)和中枢神经系统(CNS)中相同类型的纤维传导。这种标记线路(labeled lines)的后果之一是:痛觉并非由触觉通路的更强激活引起。实验证实了这一差异,例如重复刺激SA传入纤维仅会使触压觉增强,但不会引发痛觉。
伤害性感受器(nociceptors)与初级传入纤维
传导痛觉和温度觉的轴突属于传导速度相对较慢的Aδ和C类纤维。然而并非所有Aδ和C类轴突都传递痛温觉信息;部分非典型纤维对轻触觉的反应方式与低阈值机械感受器相似。
与典型低阈值机械感受器(其形态特化的感受器与反应特性相对应)不同,传递痛温觉信息的Aδ和C类轴突似乎主要起源于"游离神经末梢"(此描述并非完全准确;这些末梢大部分但并非全部被施万细胞覆盖)。尽管其末梢缺乏明显的形态学特化结构,Aδ和C类轴突仍构成一个异质性群体,对多种组织损伤性痛觉刺激或温度刺激(或两者)具有差异敏感性。这种感知组织损伤刺激(机械性、温度性或化学性)的能力由被称为伤害性感受器的结构介导。这些感受器与低阈值机械感受器具有某些共同特征,但在许多方面存在差异,例如其可被敏感化的特性(见后文)。事实上,存在相当数量的C纤维在首次被敏感化之前处于静默状态或对任何刺激均无反应。
在疼痛系统中,首要的功能性区分在于Aδ和C类轴突之间。Aδ轴突的信号传导速度快于C纤维,被认为是介导所谓"第一痛觉"的基础,而C纤维负责"第二痛觉"。因此,在受到伤害性刺激后,人们首先会感受到一种尖锐、刺痛、高度局限的感觉(第一痛觉),随后是更为钝性、弥散的烧灼感(第二痛觉)。通过选择性激活Aδ或C纤维的实验证明,Aδ纤维的活动产生类似于第一痛觉的感受,而C纤维的活动产生第二痛觉样感受。
• 图7.5 皮层神经元的特征提取。这些反应记录自猴躯体感觉皮层的神经元。如示意图箭头所示,刺激方向发生改变。注意当刺激从UW向RF方向移动时反应最强,从RW向UF方向移动时最弱。F, 手指;R,桡侧;U,尺侧;W,腕部。(引自Costanzo RM, Gardner EP. J Neurophysiol 1980;43:1319)
每个纤维类别在刺激敏感性方面又形成异质性群体,可根据纤维大小及其对机械、温度和化学刺激的敏感性进行分类。纤维可能具有低或高的机械刺激阈值,或完全对其不敏感。温度敏感性被分类为对温暖、伤害性热、凉爽和伤害性冷的反应性。需注意43^{\circ}\mathrm{C}和15^{\circ}\mathrm{C}分别是温度刺激被感知为疼痛的上下近似阈值。已测试对多种刺激性化合物的化学敏感性,包括辣椒素(存在于辣椒中)、芥子油和酸类物质。
脊髓灰质与三叉神经核
从躯体传递痛觉和温度信息的Aδ与C轴突的中央部分终止于脊髓背角。Aδ纤维投射至灰质的I层(背角最背侧部)、V层(背角基底部)和X层(中央管周围区域),而C纤维终止于I层和II层。Aδ和C纤维在脊髓中的不同终止模式表明,它们向中枢神经系统传递的信息是保持分离的,这与我们能够感受两种不同类型痛觉的能力相一致。
脊髓内初级传入终止模式的重要性还体现在其可能决定痛觉纤维与其他传入纤维(以及下行控制系统,见后文)之间发生相互作用的可能性。事实上,痛觉门控理论(gate control theory of pain)所指的现象是:非伤害性刺激(如揉搓受伤区域)能够阻断或减轻痛觉。此类刺激会激活大直径(Aα和\mathsf{A}\upbeta)纤维,其活动导致背角内中间神经元释放GABA和其他神经递质。GABA随后通过突触前和突触后机制共同作用,降低脊髓丘脑束细胞的活动性。在突触前,GABA同时激活\mathrm{GABA_{A}}和\mathrm{GABA_{B}}受体,分别导致突触前末梢部分去极化和Ca++通道的阻断。这两种作用都会减少传入末梢的递质释放,从而降低束细胞的兴奋性和痛觉信号(见第6章关于突触前抑制的章节)。
源自头部的伤害性和温度感受信息以与躯干四肢相似的方式进行处理。头部伤害感受器和温度感受器的初级传入纤维通过三叉神经进入脑干(部分也通过面神经、舌咽神经和迷走神经进入)。值得注意的是,三叉神经分布范围包括牙齿和头痛的痛觉。这些纤维随后通过三叉神经下行束在脑干内下行至延髓下部。部分机械感受传入纤维也加入三叉神经下行束。下行束内的轴突与三叉神经下行核内的二级神经元形成突触连接。
临床视角
中枢痛觉传导通路
中枢痛觉传导通路包括脊髓丘脑束(spinothalamic tract)、脊髓网状束(spinoreticular tract)和脊髓中脑束(spinomesencephalic tract)。脊髓丘脑束是躯体痛觉和温度觉最重要的感觉传导通路(见图7.1A),同时也参与触觉传导。该传导束起源于脊髓内的二级神经元(主要位于背角Ⅰ层和Ⅳ-Ⅵ层)。这些细胞的轴突在起源节段或其附近交叉至脊髓对侧,随后通过外侧索腹侧部上行至脑,经脑干到达丘脑,最终终止于丘脑的第三级神经元(主要位于丘脑腹后外侧核VPL,前文已述)。伤害性信号随后被传递至多个皮层区域,包括躯体感觉皮层,以及参与情感反应的皮层区域(如具有边缘系统功能的扣带回和脑岛)。
大多数脊髓丘脑束细胞接收来自皮肤伤害性感受器的兴奋性输入,但许多也能被肌肉、关节或内脏的有害刺激激活。仅有少数仅接受内脏传入。有效的皮肤刺激包括有害机械刺激、温度(热或冷)刺激和化学刺激。因此,不同脊髓丘脑束细胞以适合传导伤害性、温度或机械事件的方式作出反应。
部分伤害性脊髓丘脑束细胞接收来自多种不同类型皮肤感觉感受器的会聚性兴奋输入。例如,某个脊髓丘脑神经元可能被触觉刺激弱激活,但能被伤害性刺激更强激活(图7.6A)。这类神经元被称为广动力范围细胞(wide-dynamic range cells)或多觉型细胞(multireceptive cells),因其可被多种强度范围的刺激激活。广动力范围神经元主要传导伤害性事件;对触觉刺激的微弱反应似乎被高级中枢忽略。但在某些病理状态下,这些神经元可能因触觉刺激充分激活而产生痛觉,这可能是由于先前静息的致敏传入纤维活动所致。这可以解释某些机械刺激感受器激活引发疼痛的痛觉状态(机械性异常性疼痛)。其他脊髓丘脑束细胞仅被伤害性刺激激活,这类神经元常被称为高阈值细胞(high-threshold cells)或伤害特异性细胞(nociceptive-specific cells)(见图7.6B)。
• 图7.6 A,广动力范围(wide–dynamic range)或多感受性脊髓丘脑束细胞的反应。B,高阈值脊髓丘脑束细胞的反应。图表显示对分级机械刺激强度的反应。刷毛刺激是用骆驼毛刷反复划过感受野。压力刺激通过动脉夹附着皮肤施加,这对人类是临界疼痛刺激。夹捏通过刚性动脉夹附着皮肤实现,会产生明显痛感。挤压通过用镊子夹持皮肤皱褶施加,会对皮肤造成损伤。
由于传导内脏输入的细胞通常也传递来自皮肤感受器的信息,大脑可能会错误识别疼痛来源。这种现象称为牵涉痛(referred pain)。典型例子是当心肌缺血时,疼痛感出现在胸壁和左臂。
伤害性传入纤维释放的激活脊髓丘脑束细胞的神经递质包括谷氨酸(glutamate)和多种肽类物质,如P物质(substance P,SP)、降钙素基因相关肽(calcitonin gene–related protein,CGRP)和血管活性肠肽(vasoactive intestinal polypeptide,VIP)。谷氨酸似乎通过作用于兴奋性AMPA受体(参见第6章)发挥快速递质作用。但在重复刺激下,谷氨酸也可激活NMDA受体。肽类物质则表现为神经调质作用。例如通过与谷氨酸等兴奋性氨基酸的协同作用,SP可使脊髓丘脑束细胞反应产生长时间增强,这种反应增强现象称为中枢敏化(central sensitization)。CGRP似乎通过抑制酶解降解来增加SP释放并延长其作用时间。
脊髓丘脑束细胞通常具有抑制性感受野。抑制可能由弱机械刺激引发,但最有效的抑制刺激通常是伤害性刺激。这种伤害性抑制感受野可能非常大,可覆盖身体和面部大部分区域。这类感受野可能解释了经皮电神经刺激和针灸等物理干预手段能够抑制疼痛的机制。可抑制脊髓丘脑束细胞的神经递质包括抑制性氨基酸GABA和甘氨酸,以及单胺类物质和内源性阿片肽。
脊髓网状束神经元常具有大范围的(有时是双侧的)感受野,有效刺激包括伤害性刺激。这些背角神经元投射到延髓和脑桥网状结构(不要与丘脑网状核混淆)的多个区域。网状结构神经元(特别是产生去甲肾上腺素的)投射到丘脑髓板内核群,继而投射到大脑皮层的广泛区域。该环路参与注意机制和唤醒(参见第10章)。有趣的是,电刺激麻醉灵长类的丘脑髓板内核几乎可立即使其从麻醉状态苏醒。网状结构还发出下行网状脊髓投射,参与调控痛觉传递的下行系统。
脊髓丘脑束中断与丘脑损伤对躯体感觉的影响
脊髓中脑束(spinomesencephalic tract)的许多细胞对伤害性刺激产生反应,其感受野可大可小。该束的终止区位于多个中脑核团,包括作为内源性镇痛系统重要组成部分的中脑导水管周围灰质(periaqueductal gray)。动机性反应也可能由导水管周围灰质的激活引发。例如,刺激导水管周围灰质可诱发发声行为和厌恶反应。来自中脑的信息被传递至丘脑及杏仁核(amygdala),这为伤害性刺激触发情绪反应提供了多条通路之一。
源自头面部的痛温觉信息通过类似的中枢上行通路传递,其方式与躯体的痛温觉传导相似。三叉神经核内的神经元通过下行三叉丘脑束(descending trigeminothalamic tract)将痛温觉信息传递至对侧丘脑腹后内侧核(VPM nucleus),该束与内侧丘系紧密伴行。三叉丘脑核也以类似脊髓丘脑束的方式投射至丘脑板内核(intralaminar nuclei)及其他丘脑核团。丘脑核团继而投射至躯体感觉皮层以进行痛温觉的感知辨别,同时也投射至负责动机-情感反应的其他皮层区域。
脊髓丘脑束中断与丘脑损伤对躯体感觉的影响
当脊髓丘脑束及伴随的腹侧脊髓通路中断时,身体对侧区域的痛觉感知辨别成分与动机-情感成分均会消失。这一发现推动了被称为前外侧脊髓切开术(anterolateral cordotomy)的外科手术的发展,该术式曾广泛用于治疗疼痛(尤其是癌性疼痛)。由于药物治疗的进步以及术后疼痛常在数月至数年后复发,目前该手术已较少使用。疼痛复发可能反映疾病的进展或中枢痛状态的形成。除痛觉丧失外,前外侧脊髓切开术还会导致身体对侧的冷热觉消失。精细检测可能发现轻微的触觉缺陷,但由于脊髓背侧完整的感觉通路仍能提供充足的触觉信息,脊髓丘脑束中断引起的触觉损失可忽略不计。
丘脑痛症候群
破坏腹后外侧核(VPL)或腹后内侧核(VPM)会减弱对侧身体或面部的感觉。这些丧失的感觉特性主要反映通过背柱-内侧丘系通路(dorsal column–medial lemniscus pathway)及其三叉神经对应通路传递的信息。疼痛感觉中的感觉-辨别成分(sensory-discriminative component)也会丧失。然而,若内侧丘脑保持完整,疼痛的动机-情感成分(motivational-affective component)仍然存在。这种疼痛持续存在的原因可能与脊髓丘脑束和脊髓网状丘脑束(spinoreticulothalamic projections)向丘脑该区域的投射有关。某些个体中,通常由中风引起的体感丘脑损伤会导致中枢性疼痛状态,称为丘脑痛(thalamic pain)。丘脑痛患者报告称,即使最轻微的触摸也会感到疼痛,尽管刺激强度低于任何痛觉感受器的阈值。目前认为,这种痛觉敏感性源于低阈值背柱系统纤维的损伤后轴突发芽,与存活的丘脑神经元形成突触——这些神经元通常仅介导痛觉。与丘脑痛无法区分的疼痛也可能由脑干或皮质损伤引起。
神经病理性疼痛(Neuropathic Pain)
疼痛有时会在缺乏伤害性感受器(nociceptor)刺激的情况下发生。此类疼痛最常见于周围神经或参与传递伤害性信息的中枢神经系统结构受损后。由神经结构损伤引起的疼痛称为神经病理性疼痛(neuropathic pain)。神经病理性疼痛包括周围神经病理性疼痛(可能继发于周围神经损伤)和中枢神经病理性疼痛(有时在中枢神经系统结构损伤后发生)。
周围神经损伤继发疼痛的典型例子包括灼痛(causalgia)和幻肢痛(phantom limb pain)。灼痛可能在周围神经创伤性损伤后发展。尽管诱发痛减轻,但受损神经支配区域可能出现剧烈疼痛。即使使用强效镇痛药,此类疼痛也极难治疗。其部分成因是背根神经节细胞(dorsal root ganglion cells)产生自发性活动,这种活动可能与Na+通道上调有关。某些病例中,疼痛似乎由交感神经活动维持,因为交感神经阻滞可缓解疼痛。交感神经参与可能与受损的交感神经节后轴突向背根神经节的轴突发芽有关,并可能伴随初级传入神经元中肾上腺素受体(adrenoreceptors)的上调。幻肢痛见于部分创伤性截肢患者。显然,这种幻痛并非由疼痛感知区域的伤害性感受器激活引起,因为这些受体已不复存在(另见第10章)。
丘脑或脊髓丘脑皮质通路其他部位的损伤可能导致中枢性疼痛(central pain),即严重的自发性疼痛。然而,同一损伤对伤害性通路的阻断可能同时阻止或减弱外周刺激诱发的疼痛。目前对这类神经损伤引起的创伤性疼痛机制了解甚少。疼痛似乎依赖于伤害性系统中更远端神经元活动及反应特性的改变。
体感系统的换能机制(Transduction in the Somatosensory System)
躯体感觉系统的换能机制解析
解析躯体感觉系统的换能(transduction)过程存在诸多困难,这源于多种复杂因素。换能过程的核心发生在感觉神经元(背根神经节和三叉神经节细胞)轴突外周分支的特化末梢。这些末梢含有能被机械、温度和/或化学刺激激活的通道,这些通道允许电流流动从而产生局部发生器电位(generator potential)(参见第5章图5.14)。随后,发生器电位触发传入纤维的动作电位(参见第5章图5.14)。然而,躯体感觉轴突在全身分布密度较低,这使得相关蛋白的纯化工作极具挑战(例如与视网膜中的光感受器相比,后者在小面积区域以高密度聚集)。
换能过程的复杂性还体现在:发生器电位可被多种电压门控通道调控,包括兴奋性(如Na+和Ca++通道)和抑制性(K+通道)两类。此外,如前所述,许多情况下轴突末梢被包裹(如Pacinian corpuscles),这些附属结构的特性会改变换能过程。其作用方式可能是被动的(通过包裹结构的机械特性),也可能是主动的(附属细胞通过释放递质响应刺激)。后者的典型例子是Merkel细胞,最新证据表明Merkel细胞及其支配轴突均具有机械敏感通道,且Merkel细胞能释放神经递质。
尽管存在这些复杂因素,新实验技术和方法的出现正在加速我们对躯体感觉换能机制的认知。这些知识将有助于开发缓解慢性疼痛(有时甚至是致残性疼痛)的新型治疗策略。
机械换能
长期以来,属于DEG/ENaC家族的ASIC(酸敏感离子通道)蛋白被认为是皮肤机械激活电流的分子基础。这一假说源于两方面证据:其一,该蛋白同源物介导了线虫(Caenorhabditis elegans)等无脊椎动物的触觉;其二,某些ASIC蛋白在背根神经节细胞中高表达。然而,敲低ASIC蛋白并不影响背根神经节细胞的机械激活电流,表明其并非皮肤机械换能的分子基础。不过,此类敲低突变体的触觉和痛觉敏感性仍会发生改变,提示ASIC可能在换能过程中起调节作用。
目前认为Piezo2是介导皮肤快速适应机械反应的通道蛋白,因其能形成机械刺激激活的非选择性阳离子孔道。该通道的激活和失活动力学特性与其引发的快速适应机械激活电流一致,且可被钆、钌红等阻断剂抑制。此外,通过siRNA转染敲低神经节细胞的Piezo2表达可阻断其快速机械激活电流。最后,背根神经节细胞中已证实存在Piezo2 mRNA的表达。
热转导
已鉴定出与辣椒素(capsaicin)(辣椒中产生辛辣感的分子)结合的受体,该受体或其相关蛋白家族成员被发现表达于背根神经节细胞群中。这些蛋白属于TRP(瞬时受体电位,transient receptor potential)蛋白家族,已被证实是温度感觉的转导介质。
需要特别指出的是,许多离子通道(及其他蛋白如酶)对温度敏感;但在TRP通道的案例中,温度是直接作为门控机制起作用的。特定TRP通道被激活的温度范围在图7.7(下图)中用箭头标示,每个箭头的方向表示哪些温度会引起更强的激活。作为对比,图7.7还绘制了数种温度敏感纤维的放电频率随温度变化的曲线。注意传入神经的反应范围与单个热敏通道的激活范围基本匹配。然而,冷觉纤维的放电范围比任何单一TRP通道更广。这种差异的可能解释是:背根神经节细胞可能表达多种TRP通道,使其能够在更广的生理温度范围内产生响应。
• 图7.7 不同温度敏感传入纤维放电速率的温度依赖性。放电速率曲线下方展示了不同TRP通道的激活温度范围,箭头方向表示激活程度增加的方向。注意在某些情况下,传入纤维的激活范围(上图)与单个TRP通道的激活范围高度吻合,这表明该传入纤维可能仅需表达单一类型通道。其他案例中,传入纤维的激活范围提示需要多种TRP通道共同作用才能实现完整的响应能力。
细胞水平
动物生理学教材翻译
TRP蛋白家族成员最早在Drosophila(果蝇)中被发现,并参与Drosophila光感受器的光转导(phototransduction)过程。因此,其名称"瞬时受体电位(Transient Receptor Potential,TRP)"源于该基因突变会导致光刺激引发的去极化反应由正常持续状态变为短暂瞬态。基于序列同源性,已在哺乳动物中发现多个编码TRP蛋白的基因(仅人类就有27个),目前分为7个亚家族。TRP通道具有阳离子通透性,其结构与电压门控K+通道相似,为同源四聚体或异源四聚体,每个亚基含有6个跨膜结构域。TRP蛋白似乎具有多种功能(如光转导、化学转导和机械转导),并在多种细胞类型中表达。表7.1所列的TRP蛋白可作为温度传感器,其热敏感性覆盖生理相关温度范围。
转导过程的调控
与编码无害触觉的低阈值机械感受器类似,各类伤害性感受器转导蛋白的激活会产生引发传入神经动作电位放电的启动电位(generator potential),从而向中枢神经系统传递信息。此外,伤害性感受器的激活还会导致局部释放多种化学物质,包括速激肽(tachykinins)(SP和CGRP)。这些物质与损伤细胞释放的其他物质共同引发神经源性炎症(neurogenic inflammation)(周围皮肤红肿)。
除引起局部反应外,这些物质可能激活前文提及的不敏感或静息态伤害性感受器,使其获得对后续伤害性刺激的响应能力。静息态伤害性感受器的敏化(sensitization)被认为是异常性疼痛(allodynia)(由损伤前无害的刺激引发痛觉)和痛觉过敏(hyperalgesia)(对原有痛觉刺激的疼痛程度增加)的机制基础。热痛觉过敏由TRPV1通道敏化导致。已知引发机械性痛觉过敏和异常性疼痛的物质可增强Piezo2电流,提示该电流的变化是这些现象的分子基础。
参与温度转导的TRP家族蛋白(表7.1)
名称中第四个字母代表亚家族分类依据:V(vanilloid,香草素类)、M(melastatin,黑素瘤抑制蛋白类)、A(ankyrin-like,锚蛋白样类)。表中列出的蛋白至少在某些背根神经节细胞中表达,但也存在于其他细胞类型。
体感离心控制
感觉系统
感觉经验不仅是对环境事件的被动检测。相反,它更多依赖于对环境的主动探索。通过移动手部在表面移动来获取触觉线索(tactile cues)。视觉线索(visual cues)则通过眼睛扫描目标获得。因此,感觉信息通常是通过运动系统活动所获得的结果。此外,通往大脑感觉中枢的传导通路会受到下行控制系统(descending control systems)的调控。这些系统使大脑能够通过过滤传入的感觉信息来控制其输入,从而专注于重要信息并忽略次要信息。
触觉和本体感觉(proprioceptive)的体感传导通路受源自大脑皮层S-I区和运动区的下行通路调控。例如,皮层向背柱核(dorsal column nuclei)的投射有助于控制通过背柱-内侧丘系通路(dorsal column–medial lemniscus pathway)传导的感觉输入。
特别值得关注的是调控伤害性信息(nociceptive information)传导的下行控制系统。该系统可能在特定情况下抑制过度疼痛。例如,众所周知,战场上的士兵、事故受害者以及竞技中的运动员在受伤或骨折发生时往往感觉轻微甚至无痛感,而疼痛可能在事后出现并加剧。尽管调控疼痛的下行控制系统属于更广泛的离心控制系统(centrifugal control system)——该系统调节所有形式的感觉——但疼痛控制系统在医学上尤为重要,因此被单独命名为内源性镇痛系统(endogenous analgesia system)。
脑干的多个中枢及源自这些中枢的下行通路共同构成内源性镇痛系统。例如,中脑导水管周围灰质(periaqueductal gray)、蓝斑核(locus coeruleus)或延髓中缝核(raphe nuclei)的电刺激可抑制脊髓和脑干水平的伤害性神经元,包括脊髓丘脑束(spinothalamic tract)和三叉丘脑束(trigeminothalamic tract)细胞(图7.8A-C)。其他抑制性通路源自感觉运动皮层(sensorimotor cortex)、下丘脑(hypothalamus)和网状结构(reticular formation)。
图7.8
A. 上行疼痛通路的下行调控模型。A. 显示将疼痛信息传递至大脑的上行伤害感受通路(以脊髓丘脑束STT表示)及其调控(门控)信息输入的下行通路示意图。下行通路起始于导水管周围灰质(PAG),通过延髓头端腹内侧区(RVM)投射至脊髓背角。激活PAG或RVM可阻断脊髓水平的疼痛信息传递。B. 疼痛感知下行调控的标准模型。PAG和RVM中的紧张性GABA能中间神经元持续抑制投射细胞(需注意PAG不仅含有局部GABA能中间神经元,还接收来自其他脑区的GABA能末梢,两者可能共同参与对PAG投射细胞的紧张性抑制)。阿片类物质似乎通过抑制GABA能中间神经元,解除对投射神经元的抑制,其活动增强可阻断背根神经节(DRG)伤害感受细胞对STT细胞的激活。C. 平行抑制-兴奋模型。部分研究表明PAG和RVM同时存在兴奋性和抑制性细胞的投射。该模型中,疼痛信息传递的门控效应可能源于下行通路中兴奋与抑制活动的平衡。需注意示意图中将兴奋性与抑制性通路分列两侧仅为展示清晰。
图7.8(续)
D. 脑啡肽(Enk)可能的突触前和突触后作用位点。多数参与疼痛调控的下行通路末梢同时释放GABA和脑啡肽(Enk),后者似乎在突触前和突触后均有作用位点。其突触前作用可能阻止伤害感受器释放P物质(Sub P)。(A–C改绘自Lau BK, Vaughan CW. Curr Opin Neurobiol 2014;29:159;D改绘自Henry JL. In: Porter R, O’Connor M, eds. Ciba Foundation Symposium 91. London: Pitman; 1982.)
内源性镇痛系统可分为两个组分:一个组分以内源性阿片肽(endogenous opioid peptides)作为神经递质,另一个则不依赖阿片肽。内源性阿片是能激活多种阿片受体的神经肽,主要包括脑啡肽(enkephalin)、强啡肽(dynorphin)和β-内啡肽(β-endorphin)。阿片类镇痛作用通常可被麻醉拮抗剂纳洛酮(naloxone)阻断或逆转,因此纳洛酮常被用作判断镇痛是否由阿片机制介导的工具药。
阿片类物质介导的内源性镇痛系统
阿片类物质介导的内源性镇痛系统(opioid-mediated endogenous analgesia system)可通过外源性给予吗啡或其他阿片类药物激活——这是最古老的疼痛医学治疗方法之一,依赖于感觉控制系统的触发。阿片类物质通常通过突触前和突触后作用抑制伤害性传导通路(nociceptive pathways)的神经活动(见图 7.8D)。阿片类物质在伤害性传入末梢(nociceptive afferent terminals)的突触前作用被认为可阻止SP等兴奋性递质的释放。阿片类物质的突触后作用则产生抑制性突触后电位。为何抑制性神经递质能激活下行通路?一种假说认为,下行镇痛系统受到中脑和延髓抑制性中间神经元(inhibitory interneurons)的强直性抑制控制。阿片类物质的作用将抑制这些抑制性中间神经元,从而解除对下行镇痛通路的抑制。
部分内源性镇痛通路通过非阿片类神经递质运作,因此不受纳洛酮(naloxone)影响。例如,中缝核(raphe nuclei)的5-羟色胺(serotonin)神经元投射至处理伤害性信息的神经元,其释放的5-羟色胺可抑制伤害性神经元。其他脑干神经元在脊髓中释放去甲肾上腺素和肾上腺素等儿茶酚胺(catecholamines),这些物质也能抑制伤害性神经元,并可能参与内源性镇痛系统。此外,这些单胺类神经递质(monoamine neurotransmitters)还与内源性阿片类物质相互作用。毫无疑问,镇痛系统还涉及许多其他物质。
关键点
- 感觉神经元的胞体位于感觉神经节(sensory nerve ganglia)中:(1) 支配躯体的神经元位于背根神经节(dorsal root ganglia);(2) 支配面部、口腔、鼻腔和硬脑膜的神经元位于脑神经节(cranial nerve ganglia),但本体感觉神经元例外,其位于三叉神经中脑核(trigeminal mesencephalic nucleus)。它们外周端连接感觉受体,中枢端连接脊髓或脑干的二级神经元。
- 皮肤包含低阈值机械感受器(low-threshold mechanoreceptors)、温度感受器(thermoreceptors)和伤害性感受器(nociceptors)。肌肉、关节和内脏具有机械感受器与伤害性感受器。低阈值机械感受器可分为快速适应型与慢速适应型。
温度感受器包括冷感受器与热感受器。Aδ和C伤害性感受器(Aδ and C nociceptors)检测有害机械、温度和化学刺激,并可能因受损细胞释放化学物质而敏化。伤害性感受器自身释放肽类等物质可能参与炎症反应。
- 粗大初级传入纤维通过背根内侧部进入脊髓背索(dorsal funiculus);其侧支在背角深层、中间带和腹角形成突触。细小初级传入纤维通过背根外侧部进入脊髓;其侧支在背角形成突触。
- 粗大初级传入纤维的上行分支在薄束核与楔束核(dorsal column nuclei)的二级神经元形成突触。这些二级神经元经内侧丘系(medial lemniscus)投射至对侧丘脑,并与腹后外侧核(VPL nucleus)的三级神经元形成突触。等效的三叉神经通路由感觉主核(main sensory nucleus)中继至对侧腹后内侧核(VPM nucleus)。
- 脊髓背索通路传递颤动-振动、触压和本体感觉信号,同时也参与内脏感觉(包括内脏痛)的传导。
- 脊髓丘脑束包含伤害性(noceptive)、温度觉(thermoreceptive)和触觉神经元;其起源细胞主要位于脊髓背角,轴突交叉后于腹外侧索上行,主要终止于丘脑腹后外侧核(VPL)、腹后内侧核(VPM),以及腹后下核(VPI)和板内核(intralaminar nuclei)。等效的三叉神经通路由三叉神经脊束核中继,投射至对侧VPM和板内核。
- VPL与VPM核中的脊髓丘脑束中继有助于解释疼痛的感觉辨别成分。腹外侧索中与伤害性相关的平行通路包括脊髓网状束和脊髓中脑束;这些通路及脊髓丘脑束向内侧丘脑的投射共同参与疼痛的动机情感成分。
- 牵涉痛(referred pain)可用脊髓丘脑束细胞接受体壁与内脏的会聚性输入来解释。
- VPL与VPM核具有躯体定位组织结构,并包含抑制性回路。这些核团包含多个躯体定位图(somatotopic maps),每个图对应一种躯体感觉亚模态。躯体感觉皮层包括S-I区和S-II区,这些区域同样具有躯体定位组织。
- S-I皮层包含具有相似感受野和反应特性的神经元柱。部分S-I神经元参与特征提取。
- 躯体感觉通路的传递受下行调控系统调节。内源性镇痛系统调控伤害性传递,其使用内源性阿片肽、去甲肾上腺素和5-羟色胺等递质。
