第八章 特殊感觉
学习目标
完成本章学习后,学生应能回答以下问题:
- 什么是暗电流(dark current)?光子吸收如何改变它?
- 中心双极细胞(on-center bipolar cell)感受野中央与外周区域的突触通路分别是什么?关闭中心双极细胞(off-center bipolar cell)的呢?
- 视觉皮层简单细胞(simple cell)与复杂细胞(complex cell)的感受野特性是什么?
- 声音编码的频率理论(frequency theory)是什么?为何还需要位置理论(place theory)?
- 半规管和耳石器中的毛细胞通常转导哪些刺激?
- 嗅觉与味觉受体细胞间受体分子数量的差异会产生哪些功能性后果?
脊椎动物的进化呈现称为头部化(cephalization)的趋势,即特殊感觉器官在动物头部发育,同时伴随相应脑区的发育。这些特殊感觉系统包括视觉、听觉、前庭觉、嗅觉和味觉系统,能够检测和分析环境中的光、声及化学信号,并感知头部的位姿与运动。当这些系统为人类提供对环境的意识感知时最为人所熟知,但它们作为反射和潜意识行为的感官基础同样重要。
视觉系统
视觉是人类最重要的特殊感觉之一,与听觉共同构成人类主要的交流基础。视觉系统可检测400至750纳米波长的可见光,光线进入眼球后作用于视网膜这一特殊感觉上皮中的光感受器。
光感受器——视杆细胞(rod)和视锥细胞(cone)——能够区分光的两个属性:亮度(luminance)和波长(颜色)。视杆细胞对低光强度具有高敏感性,但无法提供清晰的视觉图像,也不参与色觉,其最佳工作环境为低照度条件(暗视觉)。
相比之下,视锥细胞对光的敏感度较低,因此最佳工作环境为日间光照条件(明视觉)。视锥细胞负责高视锐度和色觉功能。
视网膜是丘脑的衍生结构。视网膜内的信息处理由视网膜神经元完成,输出信号通过视神经中视网膜节细胞的轴突传递至大脑。这些轴突在视交叉处发生部分交叉,使得来自视觉空间一侧的所有输入传递至对侧大脑。在视交叉后方,视网膜节细胞的轴突形成视束并与脑内核团形成突触连接。人类的主要视觉通路投射至丘脑的外侧膝状体核(LGN),该核团再将视觉信息传递至视觉皮层。其他视觉通路投射至上丘、顶盖前区和下丘脑,这些结构分别参与眼球定向运动、瞳孔大小调控和昼夜节律管理。
眼球的结构
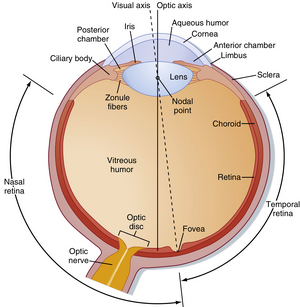
眼球壁由三个同心层组成(图8.1)。外层或称纤维膜,包括透明的角膜(含上皮层)和不透明的巩膜。中层或称血管膜,包含虹膜和脉络膜。虹膜内含有放射状和环状排列的平滑肌纤维,分别构成瞳孔开大肌和括约肌。脉络膜富含血管以支持视网膜外层,同时含有色素。眼球最内层的视网膜在胚胎学上起源于间脑,因此属于中枢神经系统(CNS)的一部分。视网膜的功能部分覆盖眼球后部全部区域,但视神经乳头(optic disc)处除外——此处是视神经轴突离开视网膜的位置。由于该位置缺乏感光受体,常被称为解剖学"盲点"(见图8.1)。
眼球的若干功能受肌肉控制。附着于外部的眼外肌负责将眼球对准视觉目标(见第9章),这些肌肉由动眼神经(第Ⅲ对脑神经)、滑车神经(第Ⅳ对脑神经)和外展神经(第Ⅵ对脑神经)支配。眼球内部也存在肌肉(眼内肌):睫状体中的肌肉通过调节晶状体形状来控制视网膜成像的聚焦;虹膜中的瞳孔开大肌和括约肌则通过类似相机光圈的方式控制入射光量。开大肌由交感神经系统激活,而括约肌和睫状肌由副交感神经系统控制(通过动眼神经;见第11章)。
光线通过角膜进入眼球,并穿过一系列透明的液体和结构,这些结构统称为屈光介质(dioptric media)。这些液体和结构包括角膜、房水、晶状体和玻璃体(见图8.1)。房水(位于前房和后房)与玻璃体(位于晶状体后方空间)共同维持眼球的形状。
虽然人眼的几何光轴穿过晶状体的节点(nodal point)并在视网膜上投射于中央凹(fovea)与视盘(optic disc)之间的某点(见图8.1),但眼球通过动眼神经系统定向至视觉目标的某一点(称为注视点(fixation point))。来自注视点的光线穿过晶状体节点后聚焦于中央凹,而视觉目标其余部分的光线则投射到中央凹周围的视网膜区域。
正常情况下,角膜和晶状体通过弯曲(折射)光线将视觉目标的光线清晰聚焦于视网膜。角膜是眼球的主要屈光结构,屈光力为43屈光度(diopters, D)。但与角膜不同,晶状体可通过改变形状将其屈光力调节于13至26D之间,从而使晶状体具备调节眼球光学焦点的能力。悬韧带(suspensory ligaments)(或称睫状小带纤维(zonule fibers))附着于睫状体(ciliary body)的眼球壁(见图8.1),固定晶状体位置。当睫状肌松弛时,悬韧带的张力使晶状体扁平化;当睫状肌收缩时,悬韧带张力降低,使具有一定弹性的晶状体呈现更趋近球形的形态。睫状肌由副交感神经系统通过动眼神经调控。
通过这种机制,晶状体使眼球能够聚焦(调节(accommodate))近处或远处的物体。例如,当来自远处视觉目标的光线进入正常眼(睫状肌松弛状态)时,目标影像可清晰聚焦于视网膜。然而,若注视近处视觉目标,光线最初会聚焦于视网膜后方(即视网膜影像模糊),直到调节发生——睫状肌收缩使晶状体更趋球形,其增加的凸度使晶状体对光波的折射力增强,从而使影像重新聚焦于视网膜。
光线在视网膜上的正确成像不仅依赖晶状体和角膜,还依赖虹膜(iris)调节通过瞳孔(pupil)进入眼球的光量。在此意义上,瞳孔类似于相机的光圈,其开合控制成像的景深(depth of field)以及晶状体产生的球面像差(spherical aberration)。瞳孔缩小时,景深增加,且光线通过晶状体中央区域(此处球面像差最小)。当眼球进行近距视觉调节或适应强光时,瞳孔会反射性收缩。因此,当人阅读或进行其他精细视觉工作时,充足的光线可提升影像质量。
视网膜
视网膜的分层
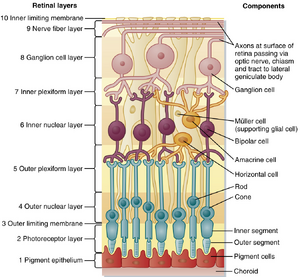
视网膜的10层结构如图8.2所示。最外层是色素上皮(pigmented epithelium)(第1层),位于脉络膜内侧。色素细胞具有触手状突起延伸至光感受器层(photoreceptor layer)(第2层),包裹视杆和视锥细胞的外节段。这些突起可防止光在光感受器之间的横向散射。此外,它们还发挥机械功能以维持第1层和第2层之间的接触,使色素上皮能够:(1)为光感受器提供营养并清除其代谢废物;(2)吞噬不断脱落的视杆细胞外节末端;(3)将代谢后的视觉色素重新转化为可运输回光感受器重复利用的形式。
临床联系
随着年龄增长,晶状体的弹性逐渐下降,导致晶状体对近视力调节的有效性逐渐降低,这种状况称为老视(presbyopia)。年轻人可改变晶状体屈光力达14D。然而到40岁时,调节能力减半;50岁后可能降至2D或更低。老视可通过凸透镜矫正。
屈光异常也可能由眼球大小与屈光介质折射力不匹配引起。例如在近视(myopia)中,远处物体的像聚焦于视网膜前方,可通过凹透镜矫正。反之,在远视(hypermetropia)中,远处物体的像聚焦于视网膜后方,可用凸透镜矫正。散光(astigmatism)是指角膜或晶状体(有时是视网膜)不同经线曲率半径不对称,通常可通过具有互补曲率半径的透镜矫正。
临床联系
成人视网膜第1层与第2层之间的连接处代表胚胎视杯发育过程中前壁与后壁的接触面,结构薄弱。视网膜剥离即发生于此层面,可导致视力丧失(因视网膜偏离眼球焦平面),并引发光感受器细胞死亡(因其存活依赖脉络膜血液供应,光感受器层本身无血管)。色素上皮退化还可导致黄斑变性(macular degeneration)——一种严重影响中央高敏视力和色觉但不累及周边视力的病变。
视网膜胶质细胞(即Müller细胞)在维持视网膜内部几何结构中起重要作用。Müller细胞呈放射状排列,与光线在视网膜中的路径平行。其外侧末端与光感受器内节段形成紧密连接,这些密集连接形成连续层状结构——外界膜(outer limiting membrane)(第3层)。
在外部限制膜内侧是外核层(outer nuclear layer ,第4层),包含视杆细胞和视锥细胞的胞体及细胞核。外网状层(outer plexiform layer,第5层)包含光感受器与视网膜中间神经元(包括双极细胞(bipolar cells)和水平细胞(horizontal cells))之间的突触,这些中间神经元的胞体位于内核层(inner nuclear layer ,第6层)。该层还包含其他视网膜中间神经元(无长突细胞(amacrine cells)和网间细胞(interplexiform cells))以及米勒细胞(Müller cells)的胞体。
内网状层(inner plexiform layer ,第7层)包含内核层视网膜神经元(包括双极细胞和无长突细胞)与神经节细胞之间的突触,神经节细胞的胞体位于神经节细胞层( ganglion cell layer ,第8层)。如前所述,神经节细胞是视网膜的输出细胞;其轴突负责将视觉信息传递至大脑。这些轴突形成视神经纤维层(optic fiber layer,第9层),沿视网膜内表面延伸并避开中央凹,最终进入视盘(optic disc),在此处离开眼球成为视神经。位于视神经纤维层的神经节细胞轴突部分始终保持无髓鞘状态,但到达视盘后会形成髓鞘。轴突穿过视网膜区域的髓鞘缺失特性,有助于使光线以最小失真穿过视网膜内层。
视网膜的最内层是由米勒细胞终足形成的内界膜( inner limiting membrane,第10层)。
光感受器结构:视杆细胞与视锥细胞
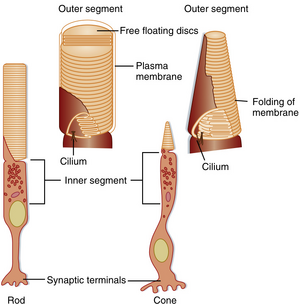
每个视杆或视锥光感受器细胞由胞体(位于第4层)、延伸至第2层的内节与外节,以及一组位于第5层与其他视网膜细胞形成突触的突触终末组成(图8.3)。视锥细胞的外节长度不及视杆细胞,其外节含有由质膜内折形成的盘膜堆叠结构。视杆细胞外节较长,含有游离漂浮的膜盘结构,这些膜盘在基部形成时便与质膜完全脱离。两类膜盘均富含视色素分子,但视杆细胞的视色素密度更高,这部分解释了其更高的光敏感性。单个光子即可引发视杆细胞反应,而视锥细胞可能需要数百个光子。
光感受器的外节通过特化的纤毛与内节相连,内节含有多种细胞器(包括大量线粒体)。内节是视色素被合成并整合入外节膜结构的位点。在视杆细胞中,色素被插入新形成的膜盘,随后这些膜盘向远端移位,最终在外节顶端脱落并被色素上皮细胞吞噬。该过程决定了视杆细胞外节的杆状形态。在视锥细胞中,视色素随机插入外节的膜折叠结构中,且不存在类似视杆细胞的膜盘脱落现象。
临床关联
如所述,视网膜神经节细胞的轴突在视神经纤维层(第9层)中穿过视网膜,于视盘(optic disc)处进入视神经。视神经纤维层中的这些轴突绕过黄斑(macula)和中央凹(fovea),与供应视网膜内层的血管路径相似。通过检眼镜(ophthalmoscope)进行体格检查时可观察到视盘。正常视盘中心有轻微凹陷。视盘外观的变化具有重要临床意义。例如,神经节细胞轴突的丧失(视神经萎缩,optic atrophy)可能导致凹陷加深;或因颅内压增高引起的视盘水肿(papilledema)可能导致视盘向玻璃体腔凸出。
视网膜的区域性差异
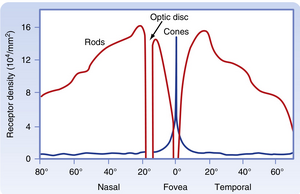
Macula lutea(黄斑区)是中央视觉区域,其特征为轻度增厚和浅淡色泽。其增厚源于高密度的光感受器(photoreceptor)和中间神经元(interneuron),这些结构是实现高分辨率视觉所必需的。其浅淡色泽则因视神经纤维和血管均绕行该区域分布。
Fovea(中央凹)是Macula lutea中的凹陷区域,具有视网膜最高的视觉分辨率,如前所述,注视点的光线正聚焦于此(眼球运动的主要功能之一是将目标物带入中央凹视野)。中央凹区域的视网膜层结构特殊,其中若干层似乎被推挤至周围黄斑区。因此,光线无需穿过视网膜内层即可到达中央凹光感受器,从而最大程度减少图像畸变和光损失。中央凹的视锥细胞具有异常细长的外节(outer segment),可实现高密度排列。事实上,中央凹的视锥细胞密度达到最大值,从而提供高视觉分辨率和高质量成像(图8.4)。
Optic disc(视盘)是神经节细胞轴突离开视网膜的区域,缺乏光感受器因而无光敏感性。该区域被称为视网膜感光表面的"盲点"(参见图8.4和8.9)。正常情况下人无法察觉盲点的存在,因为对侧眼可覆盖该视野区域,且心理加工过程会将不完整的视觉图像主观补全。
视觉转导
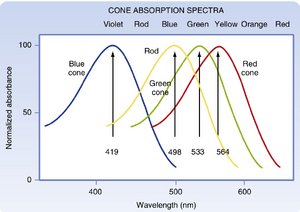
视网膜检测光信号的前提是光能被吸收。这一功能主要由视杆细胞(rod)和视锥细胞(cone)承担(少量神经节细胞也具有光敏感性),主要通过其外节中的视色素(visual pigment)分子实现。在两类细胞中,色素分子均由发色团(chromophore)11-顺式视黄醛(11-cis retinal)与视蛋白(opsin)结合而成。视杆细胞外节中的视色素为视紫红质(rhodopsin,亦称视紫质,因其吸光后呈紫色得名),最佳吸收波长为500nm。视锥细胞含有三种视色素变体(多数物种中每个视锥细胞仅表达其中一种),由不同视蛋白与视黄醛结合形成,其最佳吸收波长分别为419nm(蓝)、533nm(绿)和564nm(红)。但这些视色素的吸收光谱范围较宽,存在显著重叠(图8.5)。
尽管视杆细胞和视锥细胞的光谱敏感性存在差异,但其信号转导过程相似。视觉色素分子吸收光子会导致11-顺式视黄醛(11-cis retinal)异构化为全反式视黄醛(all-trans retinal),与视蛋白(opsin)解离,并转化为视黄醇(retinol)。这些变化触发第二信使级联反应,最终引起视杆或视锥细胞电活动的改变(本节后续讨论)。
全反式视黄醛与视蛋白分离会导致其失去吸光能力并发生漂白(即视觉色素褪色)。在视杆和视锥细胞中,视觉色素分子的再生是一个多步骤过程:全反式视黄醛被转运至视网膜色素上皮细胞层,在此被还原为视黄醇,经异构化和酯化重新生成11-顺式视黄醛。随后被转运回光感受器层,被外段摄取并与视蛋白重新结合,再生出可再次吸光的视觉色素分子。有证据表明视锥细胞还利用第二条途径再生视觉色素。该途径更为快速,涉及将视黄醛分子转运至Müller细胞并回收(见图8.2),而非通过色素上皮细胞。这种快速途径的潜在重要性将在本章后续"视觉适应"章节中讨论。
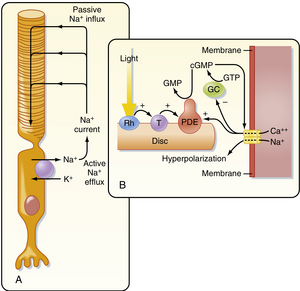
最终,由光子吸收引发的转导过程会导致光感受器发生超极化。要全面理解这一作用及其后果,需要了解光感受器在暗环境中的基础状态(即吸收光子前的状态)。在暗环境中,由于外段中的环鸟苷酸(cyclic guanosine monophosphate, cGMP)门控阳离子通道处于开放状态(图8.6A),光感受器维持轻度去极化状态(约-40mV)。这些通道允许Na⁺和Ca²⁺持续内流。由此产生的电流称为暗电流(dark current),其引起的去极化导致光感受器突触持续释放神经递质谷氨酸。
当光被视杆细胞吸收时(视锥细胞中会发生等效的序列过程),视紫红质(rhodopsin)的光异构化会激活一种称为转导蛋白(transducin)的G蛋白(见图8.6B)。该G蛋白进而激活与含视紫红质的盘膜结合的环鸟苷酸(cyclic guanosine monophosphate, cGMP)磷酸二酯酶(phosphodiesterase),将cGMP水解为5^{\prime}-GMP,并降低视杆细胞质中的cGMP浓度。cGMP的减少导致cGMP门控阳离子通道关闭、视杆细胞膜超极化以及神经递质释放减少。因此,cGMP作为"第二信使",将视紫红质吸收光子的过程转化为膜电位的变化。
总之,在所有光感受器中(视锥细胞经历的过程与视杆细胞转导过程类似),光能的捕获会导致:(1) 光感受器超极化;(2) 神经递质释放减少。由于转导部位与突触之间的距离极短,神经递质释放的调节无需动作电位的产生即可完成。
在细胞水平
视紫红质含有称为视黄醛(retinal)的生色团,这是视黄醇(retinol,即维生素A)的醛类形式。视黄醇来源于类胡萝卜素(carotenoids),如β-胡萝卜素(\upbeta -carotene)——胡萝卜中的橙色色素。与其他维生素类似,人类无法合成视黄醇,必须从食物中获取。严重缺乏维生素A的个体会患"夜盲症",即在低光照条件下视觉功能受损。
视杆细胞具有非凡的敏感性(能检测单个光子的捕获),这种敏感性通过放大机制得到增强:仅一个视紫红质分子的光激活即可激活数百个转导蛋白分子。此外,每个磷酸二酯酶分子每秒可水解数千个cGMP分子。类似过程也发生在视锥细胞中,但膜超极化发生速度比视杆细胞快得多,且需要数千个光子。
视觉适应
适应(adaptation)指视网膜根据环境光线调整其敏感度的能力。这种能力使视网膜能在广泛的照明条件下高效运作,反映了视锥系统和视杆系统分别在明光与暗光条件下的切换使用。
光适应
如前所述,光子的吸收导致11-顺式视黄醛(11-cis retinal)转化为全反式视黄醛(all-trans retinal),随后与视蛋白(opsin)分离(漂白过程)。视杆细胞和视锥细胞中的视色素以相似速率被漂白;然而视色素的再生(regeneration)在视锥细胞中比视杆细胞快得多。这种差异至少部分源于视锥细胞能够利用第二条再生途径(见前文)。这种更快的视色素再生机制可防止视锥细胞在强光条件下失去反应能力。相比之下,视紫红质(rhodopsin)分子再生的缓慢性意味着在略高于黄昏时分的照明强度下,几乎所有的视紫红质分子都会被漂白。因此,在强光条件下只有视锥系统工作,此时视网膜处于光适应(light-adapted)状态。
当人进入黑暗的电影院时,由于光适应状态的存在(视紫红质含量减少导致光敏感性降低),无法看到空座位(或其他物体)。当人在影院内停留时,逐渐恢复的座位观察能力反映了视紫红质的缓慢再生和视杆系统功能的恢复,这个过程称为暗适应(dark adaptation)。
暗适应(Dark Adaptation)
此过程指视网膜在低光条件下光敏感性的逐渐增强。视杆细胞通过视紫红质水平的恢复缓慢适应黑暗,事实上视网膜完全暗适应可能需要超过30分钟。相比之下,视锥细胞能快速适应黑暗,但其适应阈值相对较高,因此在环境光照水平较低时无法工作。在暗室中10分钟内,视杆视觉的敏感性就会超过视锥视觉,成为主要的视觉系统。
总之,在暗适应状态下,主要依靠视杆视觉工作,因此视敏度(visual acuity)较低且无法分辨颜色(称为暗视觉,scotopic vision)。然而当光照水平较高时(如电影放映时),视锥功能恢复(称为明视觉,photopic vision),视敏度和色觉也随之恢复。存在一个中间光照范围,此时视杆和视锥细胞均处于工作状态(称为中视觉,mesopic vision)。
色觉(Color Vision)
视锥细胞外段中的视色素含有不同的视蛋白。由于这些差异,三类视锥细胞在不同波长下的光吸收能力最佳。尽管视锥色素的最高吸收效率更接近紫色、绿色和黄色波长范围,但它们仍分别被称为蓝色素、绿色素和红色素(见图8.5)。视锥吸收光谱的差异构成了人类能够感知色彩(而非仅灰度层次)的生理基础。
根据三色理论 trichromacy theory,人眼之所以能分辨色彩,主要基于视锥细胞视色素吸收效率的差异——通过三种颜色的恰当混合即可生成其他任何颜色。但同时必须存在分析颜色亮度的神经机制,因为视色素吸收的光量以及细胞后续反应既取决于光线波长,也取决于其强度(见图8.5)。特定波长的光可能被两种或三种视锥色素吸收,但每种色素的吸收量因其在该波长下的效率而不同。当光强增强(或减弱)时,所有色素都会增加(或减少)吸收量,但它们之间的吸收比例保持不变。因此,神经系统必须具备比较不同类型视锥细胞对不同波长光吸收的机制,才能辨别不同色彩。颜色视觉至少需要两种视锥细胞参与。若存在三种视锥细胞,当所有细胞都吸收光线时,能减少色彩识别的模糊性,并确保可见光中大多数波长至少能被两类视锥细胞吸收。
拮抗加工理论opponent process theory则基于特定颜色组合会激活拮抗神经过程的观察:绿与红相互拮抗,黄与蓝相互拮抗,黑与白同样如此。例如,当灰色区域被绿色环包围时,该区域会呈现红色调;同时不存在发绿的红或发蓝的黄这类混合色。神经科学研究支持这一现象:绿光激活的神经元会被红光抑制,蓝光激发的神经元则受黄光抑制。具备这种特性的神经元存在于视网膜及视觉通路的更高级区域,其功能在于增强对拮抗色彩之间对比度的感知能力。
临床视角
色盲的观察结果与三原色理论(trichromacy theory)一致。色盲是一种遗传缺陷(性连锁隐性遗传),表现为一种或多种视锥机制(cone mechanisms)缺失。具有正常色觉的人群属于三色视者(trichromats),因其拥有三种视锥机制。缺失一种视锥机制的个体称为二色视者(dichromats)。当长波长视锥机制缺失时,称为红色盲(protanopia);中波长系统缺失导致绿色盲(deuteranopia);短波长系统缺失则引起蓝色盲(tritanopia)。全色盲者(monochromats)缺失两种或更多视锥机制。
视网膜回路
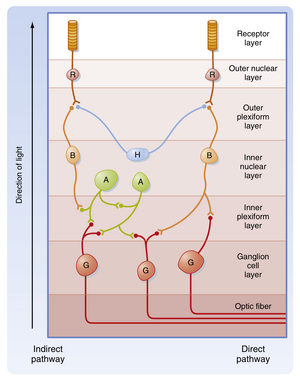
视网膜基本回路示意图如图8.7所示。该回路的几个特征值得注意:(1) 视网膜的输入由光刺激光感受器(photoreceptors)提供。(2) 输出由视网膜神经节细胞(retinal ganglion cells)的轴突传递至大脑。(3) 信息通过中间神经元(interneurons)在视网膜内进行处理。(4) 视网膜内最直接的信号通路路径为:光感受器→双极细胞(bipolar cell)→神经节细胞(见图8.7)。(5) 更间接的通路涉及光感受器、双极细胞、无长突细胞(amacrine cells)和神经节细胞,以及水平细胞(horizontal cells)提供的相邻通路间横向相互作用,这些结构共同实现视网膜内的信号处理。
视锥和视杆通路的功能差异
视杆细胞(rod)与视锥细胞(cone)通路在其光转导机制和视网膜环路中存在若干重要功能差异。如前所述,视杆细胞比视锥细胞含有更多视色素且具有更优的信号放大系统,且数量远超视锥细胞。因此,视杆细胞在弱光条件下(暗视觉)功能更佳,其功能丧失会导致夜盲症。此外,所有视杆细胞均含有相同视色素,因此无法传递颜色差异信号。再者,多个视杆细胞汇聚到单个双极细胞(bipolar cell),形成超大感受野和低空间分辨率。最后,在强光条件下,大部分视紫红质(rhodopsin)被漂白,导致视杆细胞在明视觉条件下失去功能。
视锥细胞具有较高的光激活阈值,因此在暗适应后不会被弱光激活。但它们能在日光条件下高效工作。由于视锥通路中仅有少量视锥细胞汇聚到单个双极细胞,故能提供高分辨率视觉。在中央凹(fovea)区域,视锥细胞与双极细胞形成一对一连接,完全不存在汇聚现象。这种低汇聚性使视锥通路具有极小感受野,能分辨相邻近的刺激源。视锥细胞还能以良好时间分辨率响应连续刺激。最后,视锥细胞含有三种不同视色素,因此具备色觉功能。视锥功能丧失会导致功能性失明,单纯视杆视觉无法满足正常视觉需求。
突触相互作用与感受野组织
单个光感受器的感受野呈圆形。感受野内的光照使光感受器细胞超极化,并减少其神经递质释放。光感受器与视网膜中间神经元的感受野共同决定了其活动所汇聚的视网膜神经节细胞的感受野特征。视网膜神经节细胞感受野的特性在视觉信息处理中至关重要,因为传递至大脑的所有视觉事件信息均包含于神经节细胞活动中。
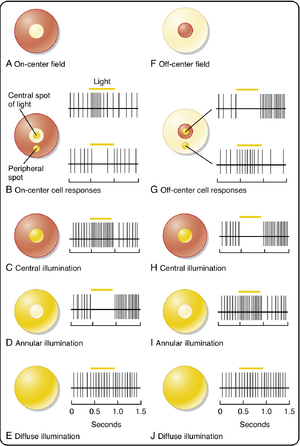
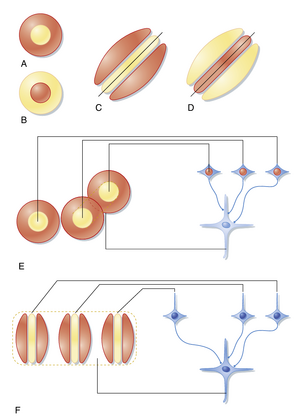
双极细胞(bipolar cell)从光感受器接收输入信号,可具有两种类型的感受野(receptive field)(见图8.8)。两者都具有中心-周边组织结构,其中作用于感受野中心区域的光线可兴奋或抑制该细胞,而作用于中心区域周围的光线则产生相反效应。具有位于中心的兴奋区域被抑制性环状区域包围的感受野,称为中心给光-周边撤光感受野(on-center, off-surround receptive field)(见图8.8A)。具有此类感受野的双极细胞被称为"给光型(on)"双极细胞。另一种类型的感受野具有中心撤光-周边给光结构,这类特征属于"撤光型(off)"双极细胞(见图8.8F)。
双极细胞感受野的中心反应仅来源于与双极细胞直接形成突触的光感受器。光感受细胞通过超极化(hyperpolarization)和减少谷氨酸释放来响应光照,通过去极化(depolarization)和增加谷氨酸释放来响应撤光。这说明"给光型"和"撤光型"双极细胞中心反应的差异在于它们对谷氨酸(glutamate)的响应方式。实际上,撤光中心双极细胞具有离子型谷氨酸受体通道(ionotropic glutamate receptor channels),这些通道会因谷氨酸作用而开放,因此当感受野中心的光刺激被移除时它们会被激活。相反,给光中心双极细胞具有代谢型谷氨酸受体(metabotropic glutamate receptors),这些受体在谷氨酸作用下会关闭通道。当感受野中心受光时,光感受器减少谷氨酸释放会导致更多代谢型通道保持开放状态,从而使细胞去极化。因此,给光中心双极细胞通过感受野中心的光刺激被激活。
双极细胞(bipolar cells)的拮抗性周边反应源于与其直接形成突触连接的光感受器(photoreceptors)周围的其他光感受器。这些周边光感受器(它们也直接与自身的双极细胞连接)通过水平细胞(horizontal cells)形成突触,后者参与由多个光感受器和双极细胞构成的复杂三联突触(triadic synapses)。水平细胞的信号通路会产生与中心反应介导光感受器直接引发的反应极性相反的响应。其机制在于:光感受器释放的谷氨酸(glutamate)使水平细胞去极化,因此与"撤光"双极细胞类似,水平细胞在光照时发生超极化。此外,由于它们通过间隙连接(gap junctions)形成电耦合,因此具有极大的感受野(receptive fields)。
当双极细胞感受野周边区域(例如环形区域,且不影响其直接连接的光感受器)处于黑暗时,邻近光感受器和水平细胞会去极化。去极化的水平细胞通过释放GABA作用于中心(及周边)光感受器终末,抑制其谷氨酸释放。当中心光照被周边黑暗包围时,给光中心双极细胞(on-center bipolar cells)的兴奋性增强。类似地,当中心暗点被亮环包围时,撤光中心双极细胞(off-center bipolar cells)会产生互补效应(参见图8.8)。
双极细胞可能对同时覆盖中心反应受体和周边反应受体的大面积弥散光照无响应,这是由于二者的作用相互拮抗。因此,双极细胞无法传递大面积视网膜光照强度的变化信号。然而,当小光点从周边向中心移动并再次返回周边时,其穿越感受野的过程会依次改变双极细胞的活动。这表明双极细胞对刺激的局部对比度(local contrast)最为敏感,起到对比度检测器(contrast detectors)的作用。
无长突细胞(amacrine cells)接收来自不同组合的给光中心和撤光中心双极细胞的输入,因此其感受野是两种区域的混合体。无长突细胞存在多种类型,且可能使用至少八种不同的神经递质。因此,它们在视觉信息处理中的作用十分复杂。
神经节细胞(ganglion cells)可能主要接收双极细胞输入、主要接收无长突细胞输入,或同时接收二者的混合输入。当以无长突细胞输入为主时,神经节细胞的感受野趋于弥散,且呈现兴奋性或抑制性特征。但大多数神经节细胞以双极细胞输入为主,并具有与其连接的双极细胞相似的中心-周边组织结构(center-surround organization)(见图8.8)。
视网膜各组分间的距离极短。因此,跨膜电位变化引起的递质释放调节及产生的突触后电位足以支持视网膜回路的大部分活动,除神经节细胞和部分能产生动作电位(action potentials)的无长突细胞外,其他细胞无需动作电位。目前尚不清楚无长突细胞产生动作电位的原因,但神经节细胞必须通过动作电位将信息从视网膜长距离传递至脑部。
P、M 和 W 细胞
实验表明,在灵长类动物中,视网膜神经节细胞可分为三大类:P细胞、M细胞和W细胞。P细胞和M细胞是较为同质的群体,而W细胞则具有异质性。P细胞因其投射至丘脑外侧膝状体核(LGN)的小细胞层(parvocellular layers)而得名,而M细胞则投射至LGN的大细胞层(magnocellular layers)。P细胞和M细胞具有中心-周边感受野(center-surround receptive fields),这与受双极细胞(bipolar cells)调控的特性一致。W细胞具有大而弥散的感受野,轴突传导速度较慢。它们可能主要通过无长突细胞(amacrine cells)通路产生影响,但与M和P细胞相比,对W细胞的了解较少。
这些细胞类型之间的若干生理差异对应着形态学差异(表8.1)。例如,P细胞的感受野较小(对应较小的树突野),轴突传导速度较M细胞慢。此外,P细胞在感受野中表现出线性响应,即它们对持续光照产生持续的动作电位紧张性放电(tonic discharge),但在整体光照水平恒定时,不会传递光照模式的变化信号。因此,当小物体进入P细胞的中心感受野时会改变其放电模式,但物体在感受野内的持续移动不会被传递。P细胞对不同波长的光有差异响应。由于存在蓝、绿、红三种视锥细胞(cones),颜色属性的组合可能有多种,但实际上已证实P细胞仅对红-绿或蓝-黄(红绿组合)呈现拮抗反应。这些机制可大幅减少由视锥颜色敏感度重叠引起的颜色检测模糊性,并可能为拮抗过程(opponency process)的观察提供基础。
| 特性 | P细胞 | M细胞 | W细胞 | |
|---|---|---|---|---|
| 胞体和轴突 | 中等 | 大 | 小 | |
| 树突树 | 有限 | 发达 | 发达 | |
| 感受野 | 大小 | 小 | 中 | 大 |
| 组织形式 | 中心-周边 | 中心-周边 | 弥散 | |
| 适应 | 紧张性tonic | 时相性Phasic | ||
| 线性性 | 线系 | 非线性 | ||
| 波长 | 敏感 | 不敏感 | 不敏感 | |
| 亮度 | 不敏感 | 敏感 | 敏感 | |
另一方面,M细胞对光的重新分布(例如物体在其大感受野内移动引起的刺激)以动作电位的位相性爆发(phasic bursts)响应。M细胞对波长差异不敏感,但对亮度变化的敏感性高于P细胞。
视觉通路
视网膜神经节细胞通过视神经(optic nerve)、视交叉(optic chiasm)和视束(optic tract)向大脑传递信息。图8.9展示了视觉目标、该目标在双眼视网膜上的成像以及视网膜神经节细胞向大脑两半球的投射关系。图中从上方视角显示了眼睛及视神经、视交叉和视束的结构。
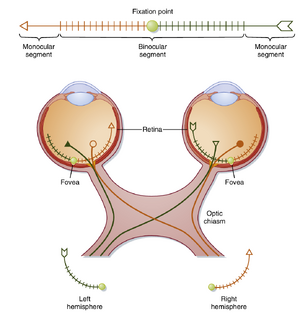
视觉目标(箭头)位于双眼视野中(见图8.9),在此案例中目标长度延伸至每侧视网膜的单眼区段(monocular segments)(即目标的一端只能被单眼看到,另一端只能被对侧眼看到)。目标中心的阴影圆圈代表注视点。目标在视网膜上的成像经过晶状体系统形成倒像。视觉目标的左半部分成像于左眼的鼻侧视网膜和右眼的颞侧视网膜;左视野的信息由左鼻侧视网膜和右颞侧视网膜接收。同理,视觉目标的右半部分成像于左颞侧视网膜和右鼻侧视网膜。晶状体系统同时导致垂直轴上的倒置,上方视野成像于下方视网膜,反之亦然。
视网膜神经节细胞的轴突是否在视交叉处交叉,取决于该细胞在视网膜中的位置(见图8.9)。来自每侧视网膜颞侧区的轴突通过视神经、视交叉外侧部和同侧视束,终止于同侧大脑。来自每侧视网膜鼻侧区的轴突通过视神经,在视交叉处交叉至对侧,随后经对侧视束终止于对侧大脑。此结构使得左视野的物体表征于大脑右侧,右视野的物体表征于大脑左侧。
临床要点
视觉通路在任何水平的阻断都会导致相应视野区域的缺损(见图8.9)。例如,视网膜上的微小损伤会导致该眼出现盲点(暗点),而纹状皮质的类似损伤则会在双眼产生对应的暗点。单侧视神经的阻断会导致该眼失明。视神经纤维在视交叉处交叉时受损,会引起双侧颞侧视野的视力丧失;这种情况称为双颞侧偏盲(bitemporal hemianopsia),因为交叉的纤维来源于每侧视网膜的鼻侧半。单侧整个视束、LGN、视辐射或视皮质的损伤会引起同向性偏盲(homonymous hemianopsia),即对侧整个视野的视力丧失。部分损伤会导致部分视野缺损。例如,舌回损伤会引起同向上象限盲(upper homonymous quadrantanopsia),即对侧上视野的视力丧失。
外侧膝状体核(LGN)
视网膜神经节细胞轴突(retinal ganglion cell axons)可在脑的多个部位形成突触,但视觉的主要靶区是丘脑的外侧膝状体核(lateral geniculate nucleus, LGN)。视网膜到LGN存在点对点投射(point-to-point projection),形成视网膜拓扑图(retinotopic map)。代表特定视网膜位置的细胞沿着可跨越LGN各层的投射线排列。
每侧眼的投射分布至LGN的三层:一个大细胞层(magnocellular layers,第1、2层接受M细胞输入)和两个小细胞层(parvocellular layers,第3-6层接受P细胞输入)。颜色编码的神经节细胞投射至主层之间的细胞群,即板内核区(intralaminar zones)。LGN神经元的特性与视网膜神经节细胞非常相似:例如,LGN神经元可被分类为P或M细胞,并具有中心激活(on-center)或中心抑制(off-center)感受野。
LGN还接受来自大脑皮质视区(visual areas)、丘脑网状核(thalamic reticular nucleus)以及脑干网状结构(brainstem reticular formation)多个核团的输入。LGN投射神经元的活动受到LGN内中间神经元和丘脑网状核中间神经元的抑制。这些细胞使用GABA作为抑制性神经递质。此外,LGN神经元的活动受到离皮质通路(corticofugal pathways)和通过单胺类神经递质传递信号的脑干神经元影响。这些控制系统对视觉信息进行过滤,可能在选择性注意中起重要作用。
纹状皮质
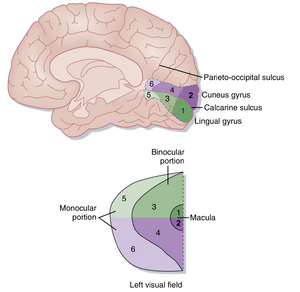
LGN通过视辐射(visual radiations)将信息投射至初级视皮质(primary visual cortex)或纹状皮质(striate cortex)。携带来自相应半视网膜下半部信息(因此对应上象限对侧视野)的视辐射纤维投射至舌回(lingual gyrus),该脑回位于枕叶内侧面,恰在距状沟(calcarine sulcus)下方。代表对侧下视野的视辐射轴突则投射至相邻的楔叶(cuneus gyrus),位于距状沟上方。这两个脑回沿距状沟及其边缘的部分共同构成初级视皮质(或称Brodmann 17区;图8.10)。
与LGN类似,纹状皮质(striate cortex)也包含视网膜拓扑映射。黄斑(macula)的神经表征占据两个脑回最后部且最大的区域,视网膜周边区域的投射则逐步向这些脑回更前部延伸。总体而言,视网膜各区域在纹状皮质表面呈现有序的映射分布(见图8.10)。
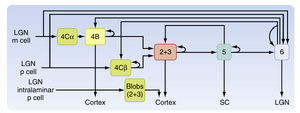
膝状体纹状皮质通路(geniculostriate pathway)主要终止于纹状皮质第4层(图8.11),而来自LGN板层内的轴突则终止于第2、3层中所谓的斑块(blobs)。类似地,代表单侧眼的轴突终止于第4C层内交替相邻的斑块区域,形成眼优势柱(ocular dominance columns)。此类柱状结构中的皮质神经元优先响应来自单侧眼的输入。在两个眼优势柱交界处附近的神经元对双眼输入的响应程度大致相当。
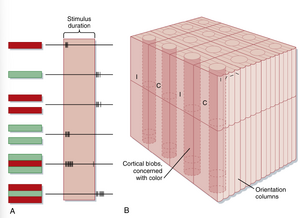
除第4C层的单眼细胞外,纹状皮质神经元的感受野比LGN神经元更为复杂。其他层的神经元可能具有双眼性(binocular),可响应双眼的刺激,尽管通常以单侧眼输入占主导(见第10章)。此外,第4C层外的皮质神经元常表现出方位选择性(orientation selectivity),即当刺激(如条状或边缘刺激)以特定方位和位置呈现时,神经元反应最佳(图8.12)。这些"简单细胞(simple cells)"的响应特性表明,其输入可能来自具有同心圆中心-周边型感受野的细胞群,这些细胞的"开启"中心呈线性排列,周围被拮抗区域包围。"复杂细胞(complex cells)"与简单细胞的相似之处在于具有方位特异性,但其感受野没有明确的兴奋区与抑制区之分,而是对感受野内任意位置的特定方位刺激均产生最佳响应。它们还可能表现出方向选择性(direction selectivity),即仅当刺激沿特定方向移动时才会响应(见图8.12)。复杂细胞的感受野可视为具有相似方位选择性的相邻简单细胞的组合。由于皮质特定区域内此类神经元往往具有相同的方位选择性,它们被认为构成了方位柱(orientation column)(图8.13)。
纹状体外视觉皮层
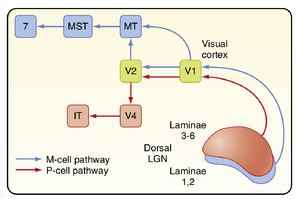
动物研究表明,在大脑皮层中除纹状皮层(Brodmann 17区,或称V1)外,至少还存在25个不同的视觉区域。纹状体外区域包含多个平行视觉处理通路。P通路起源于P细胞(parvocellular cells),负责形状和颜色的识别。该通路的组成结构包括LGN的3-6层、纹状皮层4Cβ层、V4(Brodmann 19区)以及颞下区的多个区域(图8.14)。形状处理包括复杂视觉模式(如面部)的识别。颜色信息与形状信息是分开处理的。M通路起源于M细胞(magnocellular cells),负责运动检测和眼球运动控制。该通路的皮层结构包括纹状皮层4B层和4Cβ层,以及颞叶外侧的MT区(内侧颞区)、MST区(内侧上颞区)和顶叶的Brodmann 7a区(见图8.14)。
如前所述,色觉可能依赖于视网膜中三种不同类型视锥细胞的存在,以及视觉通路中具有光谱拮抗(spectral opposition)特性的神经元。视网膜神经节细胞、LGN神经元和部分P细胞均表现出光谱拮抗特性。纹状皮层中的光谱拮抗神经元存在于皮层色斑(cortical blobs)中,这些细胞呈现双拮抗(double-opponency)特性——其中心部与周边部对两种颜色分别产生拮抗反应。图8.13A展示了一个中心部对红色有反应但对绿色无反应R+G-、周边部对绿色有反应但对红色无反应R-G+的细胞。图8.13B显示了眼优势柱、方位柱与皮层色斑的空间关系。
临床相关
纹状体外视皮层的损伤可导致多种功能缺陷。双侧颞下皮层损伤可能导致皮层性色盲(achromatopsia)或无法识别面容(prosopagnosia),甚至无法辨认近亲的面孔。MT区或MST区的损伤可能影响运动检测和眼球运动功能。
其他视觉通路
中脑的上丘(superior colliculus)是一种分层结构,对特定类型的眼球运动至关重要(参见第9章)。其最表浅的三层专门参与视觉信息处理,而深层结构则接收来自体感系统、听觉系统以及视觉系统的多模态输入,尤其是与眼球运动相关的皮质区域。
另一条视网膜投射通路到达顶盖前区(pretectum),该区域通过双侧激活Edinger-Westphal核中的副交感节前神经元,引发瞳孔对光反射中的瞳孔收缩。顶盖前区通过后连合(posterior commissure)相互连接,因此当单侧眼接受光照时,该反射可导致同侧(直接)和对侧(交感)瞳孔收缩。
视觉通路还包括与其他功能核团的连接。例如,视网膜至下丘脑视交叉上核(suprachiasmatic nucleus)的投射参与昼夜节律性(circadian rhythmicity)调节(参见第38章)。
听觉与前庭系统
听觉和前庭系统的外周部分共享骨迷路与膜迷路结构,均以毛细胞(hair cells)作为机械换能器,并通过前庭耳蜗神经(vestibulocochlear nerve, CN VIII)向中枢传递信息。然而,两者的中枢处理机制与感觉功能截然不同。
听觉系统的功能是转换声波信号,使生物体能够识别环境线索并进行种间交流。其最复杂的功能体现在语言处理方面。前庭系统则为中枢提供头部空间位置与运动信息,其对眼球运动的控制将在第9章讨论。
听觉
声音
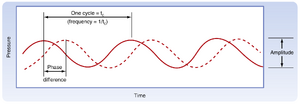
声波由空气或其他弹性介质(如水)中的压缩波与稀疏波构成。声波频率以赫兹\bf(Hz)为单位,例如中央A音的频率为440Hz。每个纯音由特定频率的正弦波产生,其特征除频率外还包括瞬时振幅与相位(图8.15)。但自然声波多为复合音,噪声则是具有任意频率组合的无用声波。
声波在空气中的传播速度约为335m/s,伴随的压力变化称为声压,单位为牛顿/平方米,但更常用声压级(sound pressure level, SPL)表示,其单位为分贝(dB):
公式 8.1:SPL = 20logP/PR
式中P为声压,PR为参考压力(0.0002 dyne/cm2)(即人耳对1000Hz纯音的绝对听阈)。声强增加10倍对应20dB,增加100倍对应40 dB。
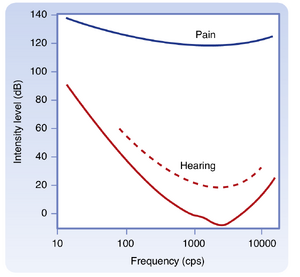
正常年轻人的耳对频率范围约20至20 000 Hz的纯音(pure tone)敏感。纯音的检测阈值随其频率变化(图8.16)。人耳对纯音的最低感知阈值出现在约3000 Hz处。相较于1000 Hz处的参考0 dB,这些频率的阈值约为-3至-5dB。在此标度下,正常语音的强度约为65 dB,其主要频率范围在300至3500 Hz之间。超过100 dB的声音会损伤外周听觉器官,高于120 dB的声音会引起疼痛和永久性损伤。随着年龄增长,人对高频声音的阈值会升高,导致听辨此类音调的能力下降,这种状况称为老年性耳聋(presbycusis)。
耳
外周听觉器官是耳,可分为外耳(external ear)、中耳(middle ear)和内耳(inner ear)(图8.17)。
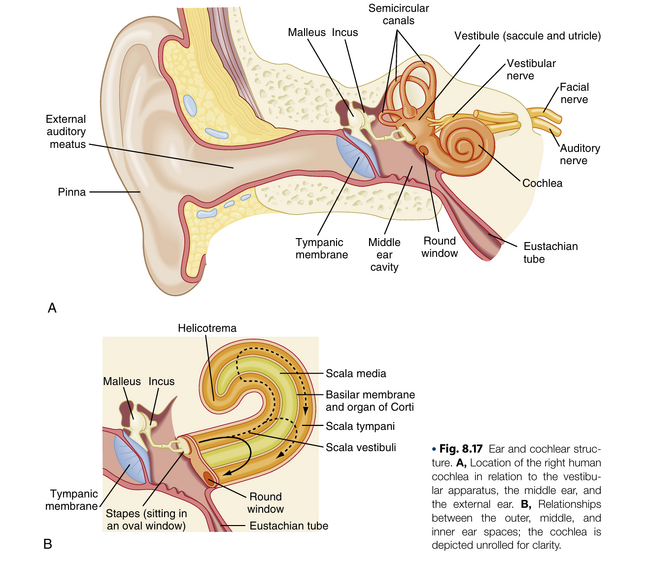
外耳
外耳包括耳廓(pinna)和外耳道(external auditory meatus,auditory canal)。外耳道内含有分泌耵聍(cerumen)的腺体,这种蜡状物质具有保护作用。耳廓帮助引导声音进入外耳道,并在声音定位中发挥作用。外耳道将声压波传递至鼓膜(tympanic membrane)。人类外耳道的共振频率约为3500 Hz,这种共振特性使得该频率范围内的声音感知阈值较低。
中耳
外耳与中耳通过鼓膜分隔(见图8.17A)。中耳内含空气,其中存在三块听小骨(ossicles),负责将鼓膜连接至内耳的卵圆窗(oval window)。卵圆窗旁是圆窗(round window),这是中耳与内耳之间另一个覆有膜的开口(见图8.17A和B)。
临床相关
中耳还具有其他功能。中耳内存在两块肌肉:附着于malleus的鼓膜张肌(tensor tympani)和附着于stapes的镫骨肌(stapedius)。当这些肌肉收缩时,可缓冲听小骨的运动并降低听觉装置的敏感性。这种作用可以保护听觉装置免受可预见的破坏性声音损伤。然而,突然的爆炸仍可能损伤听觉装置,因为中耳肌肉的反射性收缩发生得不够迅速。中耳腔通过eustachian tube与咽部相连。外耳与中耳之间的压力差可通过此通道达到平衡。若中耳积液(如感染时),eustachian tube可能发生阻塞。此时外耳与中耳之间的压力差会导致鼓膜疼痛性移位,极端情况下可引起鼓膜破裂。飞行或潜水时未平衡的压力变化同样会引起不适。
内耳
内耳包括骨迷路(bony labyrinth)和膜迷路(membranous labyrinths)。骨迷路是颅骨颞骨内一系列复杂但连续的腔隙,而膜迷路是由位于骨迷路内的一系列软组织腔隙和管道构成。耳蜗(cochlea)和前庭器(vestibular apparatus)即由这些结构形成。
听小骨(ossicles)包括malleus锤骨、incus砧骨和stapes镫骨。stapes具有插入卵圆窗(oval window)的底板(footplate)。卵圆窗后方是内耳充满液体的前庭(vestibule)。前庭与一个管状结构——前庭阶(scala vestibuli)相延续。声压波引起鼓膜(tympanic membrane)向内的运动,会导致听小骨链将stapes的底板推入卵圆窗(见图8.17B)。stapes底板的这种运动继而引起前庭阶内液体的移位。液体中产生的压力波通过耳蜗(cochlea)的基底膜(basilar membrane)传递至鼓阶(scala tympani,后文详述),并使圆窗(round window)向中耳方向膨出。
鼓膜和听小骨链共同构成阻抗匹配装置(impedance-matching device)。耳必须检测空气中传播的声波,但神经转导机制依赖于充满液体的耳蜗内的运动,而液体中的声阻抗远高于空气。因此,若无专门的阻抗匹配装置,到达耳的大部分声波将会被反射——正如人在水下游泳时岸边的声音会被水面反射一样。耳的阻抗匹配依赖于:(1)较大面积的鼓膜与较小面积的卵圆窗表面积之比;(2)由听小骨形成的杠杆系统的机械增益。这种阻抗匹配可使300到3500 Hz听力范围内的能量传递效率提高近30dB。
耳蜗是一个螺旋形器官(见图8.17A和B)。人类的耳蜗螺旋由2.5圈组成,从宽阔的基底延伸至狭窄的顶端,但其内部管腔在基底处较窄而在顶部较宽。耳蜗顶端朝向侧面(见图8.17A)。耳蜗的骨迷路部分被细分为多个腔室。前庭(vestibule)是朝向卵圆窗(oval window)的空间(见图8.17A)。
与前庭相延续的是前庭阶(scala vestibuli),这个螺旋形腔室延伸至耳蜗顶端,在此处通过蜗孔(helicotrema)与鼓室阶(scala tympani)相连并融合。鼓室阶是另一个螺旋形空间,沿耳蜗向下回旋并终止于圆窗(round window)(见图8.17B)。除蜗孔外,分隔这两个腔室的是膜迷路包裹的中阶(scala media)。
中阶(scala media),或称耳蜗管(cochlear duct)(见图8.17B和C),是一个膜包裹的螺旋管,沿耳蜗延伸于前庭阶与鼓室阶之间。中阶的一个壁由基底膜(basilar membrane)构成,另一个由赖斯纳膜(Reissner’s membrane)形成,第三个壁由血管纹(stria vascularis)组成(见图8.17C)。
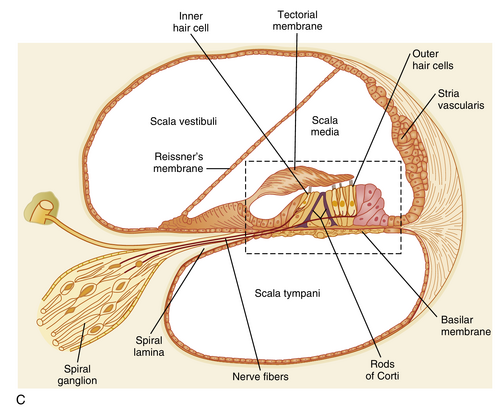
耳蜗内的腔室充满液体。骨迷路中的液体(包括前庭阶和鼓室阶)是外淋巴(perilymph),其成分与脑脊液相似。膜迷路中的液体(包括中阶)是内淋巴(endolymph),其成分与外淋巴差异显著。由血管纹产生的内淋巴含有高浓度[K⁺](约145 mM)和低浓度[Na⁺](约2 mM),并相对于外淋巴具有高正电位(约+80 mV)。因此,在延伸入内淋巴的毛细胞纤毛膜两侧存在极大的电位梯度(约140 mV)。(这些作为声音感受器的毛细胞将在后文详细讨论。)
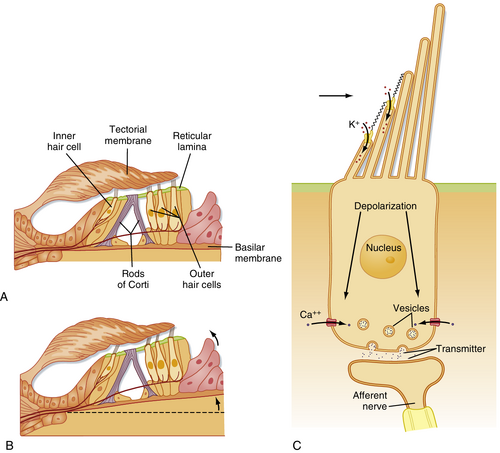
负责声音转导的神经装置是柯蒂氏器(organ of Corti)(见图8.17C),位于耳蜗管内。它坐落于基底膜上,由若干组件构成,包括三排外毛细胞(outer hair cells)、单排内毛细胞(inner hair cells)、胶状的盖膜(tectorial membrane)以及多种支持细胞。人类柯蒂氏器包含15,000个外毛细胞和3,500个内毛细胞。柯蒂氏柱(rods of Corti)提供刚性支架结构。位于毛细胞顶端的静纤毛(stereocilia)可描述为与盖膜接触的非运动性纤毛。
柯蒂氏器由前庭耳蜗神经(CN VIII)的耳蜗支(cochlear division)神经纤维支配。人类32,000条听觉传入纤维(auditory afferent fibers)起源于螺旋神经节(spiral ganglion)的感觉神经节细胞。这些神经纤维穿透柯蒂氏器并终止于毛细胞基部(图8.18;另见图8.17C)。约90%的纤维终止于内毛细胞,其余终止于外毛细胞。因此,每个内毛细胞约接受10条传入纤维的支配,而单个传入纤维可分支支配约5个外毛细胞。显然,内毛细胞提供了中枢神经系统处理听觉所需的大部分声信号神经信息。外毛细胞的感觉功能尚不明确。
临床相关
耳聋的常见病因是强声对毛细胞的破坏。例如工业噪音暴露或聆听高音量音乐均可导致毛细胞损伤。通常,耳蜗特定区域的毛细胞会因特定频率的高强度声音暴露而选择性受损(如位置理论(place theory)所预测,详见本章后续解释),从而导致离散频率范围内的听力丧失。Presbycusis(即随着年龄增长出现的高频听力丧失)可能因城市环境中长期噪音暴露导致的毛细胞损失而加剧。氨基糖苷类抗生素的高剂量使用也可导致听力减退,这类药物已知会损伤毛细胞上的K+通道。
声音转导
声音由柯蒂氏器(organ of Corti)完成转导。到达耳朵的声波引起鼓膜振动,这些振动通过听小骨传递至前庭阶(scala vestibuli)。这在前庭阶与鼓阶(scala tympani)之间形成压力差(见图8.17B),进而导致基底膜及其上的柯蒂氏器发生位移(见图8.18A和B)。由于基底膜与盖膜(tectorial membrane)相对位移产生的剪切力作用,毛细胞的静纤毛(stereocilia)发生弯曲。向上位移使静纤毛朝最长纤毛方向弯曲,导致K+通过K+通道内流并使毛细胞去极化;向下位移使静纤毛朝相反方向弯曲,导致K+通道关闭并使毛细胞超极化(见下节)。
除传入纤维(afferent fibers)外,柯蒂氏器还接受传出纤维(efferent fibers)支配,其中大多数终止于外毛细胞(outer hair cells)。这些耳蜗传出纤维起源于脑干的上橄榄核(superior olivary nucleus),常被称为橄榄耳蜗纤维(olivocochlear fibers)。外毛细胞长度具有可变性,这一特性提示外毛细胞长度的改变可能影响内毛细胞(inner hair cells)的敏感性或"调谐"功能。耳蜗传出纤维可能通过调控外毛细胞长度,进而影响耳蜗敏感性和大脑对声音的识别方式。其他终止于耳蜗传入纤维的传出纤维可能具有抑制作用,有助于提升频率分辨能力。
鉴于声刺激的频率和振幅范围广泛,毛细胞转导(hair cell transduction)必须提供快速响应也就不足为奇。纤毛偏转的快速响应基于直接通过尖端连接(tip links)打开离子通道——这些连接将每个静纤毛(stereocilium)的尖端与相邻更高静纤毛的干连接(见图8.18C)。纤毛偏转时,尖端连接受到杠杆作用,瞬时打开通道,允许K+进入(由于内淋巴中高[K+]和高电位),并使毛细胞去极化。目前提出了几种机制来解释高频响应所必需的、同等重要的快速适应(rapid adaptation)。尖端连接的“弹簧”响应允许其附着点沿静纤毛干移动,从而重置尖端连接的机械杠杆作用。此外,观察到Ca++可进入并与开放通道结合,使其需要更大的开启力,从而降低开放的统计概率。
诱导离子进入毛细胞的电位梯度包括毛细胞的静息电位和内淋巴的正电位。如前所述,毛细胞顶膜(apical membrane)两侧的总梯度约为140mV。因此,毛细胞顶膜K+电导的变化会导致快速电流流动,从而在这些细胞中产生感受器电位(receptor potential)。这种电流可在细胞外记录为耳蜗微音器电位(cochlear microphonic potential),即与声刺激频率相同的振荡事件。耳蜗微音器电位代表多个毛细胞感受器电位的总和。
毛细胞与视网膜光感受器类似,在去极化时会释放谷氨酸(glutamate)。神经递质在与毛细胞突触连接的耳蜗传入神经纤维(cochlear afferent nerve fibers)中产生兴奋性突触后电位(EPSP)。总之,当基底膜的振荡运动引起毛细胞跨膜电位的瞬时变化,并最终在耳蜗传入神经纤维中产生动作电位时,声音即被转导。听神经中大量耳蜗传入纤维的活动可在细胞外记录为复合动作电位(compound action potential)。
根据基底膜宽度和张力的差异,研究者最初得出结论:基底膜的不同部分具有不同的共振频率。例如,基底膜在基部宽度约为100μm,在顶端宽度约为500。其基部张力也更高。因此,研究者预测基底部的振动频率将高于顶端的振动频率,类似于乐器中较短的琴弦。实验表明基底膜以行波形式整体运动(图8.19),但在高频音调时基底膜的最大位移更靠近耳蜗基部,而在低频音调时最大位移更靠近顶端。
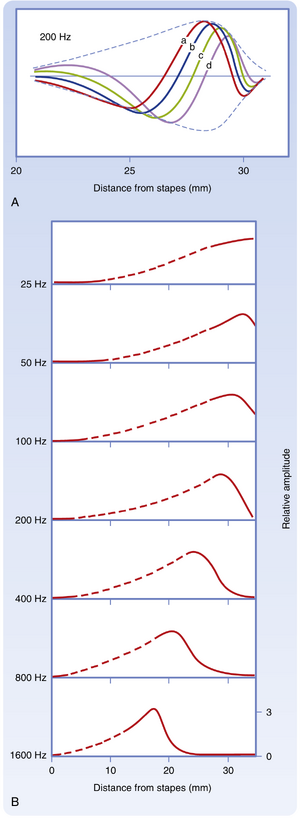
实际上,基底膜充当频率分析器的角色;它将刺激沿柯蒂氏器(organ of Corti)分布,不同的毛细胞(hair cell)对特定声音频率产生差异性反应。这是听觉位置理论(place theory of hearing)的基础。此外,由于柯蒂氏器不同位置毛细胞的静纤毛(stereocilia)和生物物理特性存在差异,这些细胞可能被调谐到不同频率。基于这些因素,基底膜和柯蒂氏器形成了所谓的音调拓扑图(tonotopic map)(图8.20)。
耳蜗神经纤维
柯蒂氏器中毛细胞释放的神经递质可以引发耳蜗神经初级传入纤维的动作电位。前庭耳蜗神经(vestibulocochlear nerve, CN VIII)的传入纤维是双极细胞,其胞体和轴突外均包裹髓鞘。胞体位于螺旋神经节(spiral ganglion),周围突与毛细胞基部形成突触,中枢突则在脑干的耳蜗核(cochlear nucleus)形成突触。
特征频率
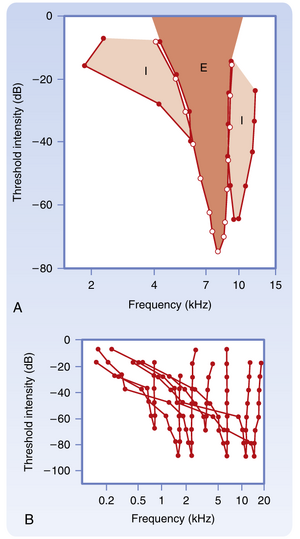
受到特定频率(称为特征频率(characteristic frequency))的声音刺激时,耳蜗传入纤维(cochlear afferent fiber)的放电达到最大值。特征频率可通过该纤维的调谐曲线(tuning curve)确定(图8.21)。调谐曲线是不同声音频率激活神经纤维的阈值曲线。影响单个传入纤维活动的主要因素是它们所支配的毛细胞沿基底膜(basilar membrane)的位置。这些毛细胞的位置之所以重要,是因为对于任何给定声频,当压力波沿基底膜传播时,都会存在一个基底膜最大位移的位置(见图8.19)。通常,调谐曲线在特征频率附近较为尖锐,但在高声压级时会变宽。调谐曲线可能包含兴奋区和抑制区(见图8.21A)。兴奋区的尖锐程度可能反映了抑制过程。
编码(Encoding)
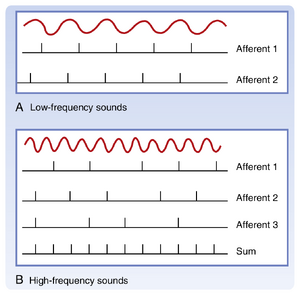
声音刺激的不同特征通过耳蜗神经纤维的放电模式进行编码。持续时间通过活动持续时间表示;强度通过神经活动量和放电纤维数量共同表示。对于低频声音,频率通过传入纤维倾向于与刺激同相位放电的特性(相位锁定(phase locking);见图8.22A)表示。若音调频率远高于1\mathrm{kHz},单个纤维无法在每个周期都放电,但即使声音周期短于传入纤维的绝对不应期,相位锁定仍可能发生。这使得中枢神经系统(CNS)能够通过传入纤维群体的活动检测更高频率信息,其中每个纤维都与刺激保持同相位放电,群体共同编码刺激频率(见图8.22B)。这一观察结果是听觉频率理论(frequency theory)的基础。
对于更高频率(>5000Hz),位置理论(place theory)占主导:CNS将通过激活支配耳蜗基部附近毛细胞的传入纤维的声音解释为高频。要解释从20到20{,}000Hz全范围的声频编码(双工理论(duplex theory)),需要同时运用位置理论和频率理论。
中枢听觉通路
耳蜗传入纤维与背侧和腹侧耳蜗核(dorsal and ventral cochlear nuclei)的神经元形成突触。这些核团的神经元轴突参与构成中枢听觉通路。来自耳蜗核的部分轴突交叉至对侧,在外侧丘系(lateral lemniscus,主要上行听觉传导束)中上行。其他轴突则与同侧或对侧的不同核团(如上橄榄核)连接,这些核团通过同侧和对侧外侧丘系投射。每个外侧丘系终止于中脑的下丘(inferior colliculus)。下丘神经元投射至丘脑的内侧膝状体核(medial geniculate nucleus, MGN),后者发出听觉辐射(auditory radiation)。听觉辐射最终到达位于颞叶上表面的初级听觉皮层(Brodmann 41区和42区)。
每个耳朵的输入在外侧丘系及以上水平的中枢听觉通路中均具有双侧投射。因此,单侧耳聋可能仅由耳蜗核或更外周结构的孤立损伤引起。中枢病变不会导致单侧耳聋,但可能影响整体语言感知敏感性或声源定位能力。
中枢听觉系统的功能组织
感受野与音调拓扑图
属于听觉系统的多个结构中的神经元反应可通过调谐曲线(tuning curves)进行描述(见图 8.21B)。通过绘制神经核团或听觉皮层内神经元的特征频率(characteristic frequency)分布,可揭示音调拓扑图(tonotopic map)——其中神经元按照其"最佳"频率有序排列。音调拓扑图已在耳蜗核(cochlear nuclei)、上橄榄复合体(superior olivary complex)、下丘(inferior colliculus)、内侧膝状体核(medial geniculate nucleus)和听觉皮层中被发现。事实上,一个特定的听觉结构可能包含多个音调拓扑图。
双耳交互作用
耳蜗核以上层级的多数听觉神经元可对双耳刺激产生反应(即具有双耳感受野)。双耳感受野有助于声音定位。人类可分辨声源间小至1度的角度差异。听觉系统通过多种线索判断声音来源,包括声音到达双耳的时间(或相位)差以及头部两侧的声强差异。
例如,内侧上橄榄核(medial superior olivary nucleus)的神经元具有内侧和外侧树突。内侧树突上的突触主要为兴奋性,其输入来自对侧腹侧耳蜗核(contralateral ventral cochlear nucleus);外侧树突上的突触主要为抑制性,输入来自同侧腹侧耳蜗核(ipsilateral ventral cochlear nucleus)。声音到达双耳的相位差异会影响作用于内侧上橄榄神经元的兴奋与抑制信号的强度和时序。外侧上橄榄核(lateral superior olivary nucleus)则处理双耳接收的声强差异,从而提供声源信息。上橄榄核神经元的活动可反映声音定位信息。
皮层组织
初级听觉皮层(primary auditory cortex)的若干特征与其他初级感觉区相似。听觉皮层不仅存在感觉映射(此处为音调拓扑图),还负责特征提取(feature extraction)。初级听觉皮层的神经元形成同频柱(isofrequency columns)(柱内神经元具有相同特征频率),并交替排列为总和柱(summation columns)与抑制柱(suppression columns)。总和柱神经元对双耳输入的响应强于单耳;抑制柱神经元对双耳输入的响应弱于单耳,且对单侧耳的响应占主导地位。部分神经元对频率变化方向具有选择性。
听觉皮层的双侧损伤会影响区分声音频率或强度的能力,并削弱声音定位和语言理解功能。但单侧损伤(尤其是非优势半球)影响较小(见第10章)。显然,频率辨别能力依赖于听觉通路较低层级的活动,可能涉及下丘(inferior colliculus)。
临床关联
临床上常用两种简单测试来区分最重要的耳聋类型:传导性耳聋(conduction loss)和感音神经性耳聋(sensorineural loss)。传导性听力损失(conduction hearing loss)发生在外耳(如耳道被耵聍阻塞)或中耳(如鼓膜破裂)的病变中。感音神经性听力损失(sensorineural hearing loss)反映内耳、耳蜗神经或中枢连接的病变。
韦伯试验(Weber test)用于评估传导性听力损失的程度。在此测试中,将振动的音叉底部置于受试者前额中央,并要求其定位声音方向。正常情况下,声音不会被定位到特定耳侧。然而,若受试者存在传导性听力损失(如鼓膜穿孔、中耳积液、耳硬化症或听骨链连续性中断),声音会被定位至患耳,因为此时声音通过骨传导至耳蜗。虽然声音也会传导至健侧耳蜗,但骨传导的声音对柯蒂氏器(organ of Corti)的激活效果不如正常通过鼓膜和听骨链传导的声音。韦伯试验中声音未被定位至健侧的原因之一可能是正常耳的听觉被环境声级所抑制(听觉掩蔽,auditory masking)。反之,在感音神经性听力损失患者(如柯蒂氏器、耳蜗神经或耳蜗核受损),声音会被定位至健侧。
任内试验(Rinne test)中,将振动的音叉置于受试者耳后骨部,并要求其指出声音消失的时间点。随后将音叉移至该耳外耳道附近。听力正常者会再次听到声音,因为空气传导至耳蜗的效率更高(即气导优于骨导)。若传导机制受损,当音叉移至外耳道附近时则无法听到声音。此时骨导优于气导。若为感音神经性听力损失,当音叉置于外耳道附近时会再次听到声音,因为感音神经性耳聋患者的内耳和耳蜗神经传递冲动的能力下降,无论声波振动是通过空气还是骨骼传导至耳蜗。由于气导效率高于骨导,感音神经性耳聋的骨导模式与正常耳相同。
前庭系统
前庭系统负责检测头部的角加速度和线加速度。来自前庭系统的信号使身体能够调整姿势以维持平衡,并触发头部和眼球的运动以稳定视网膜上的视觉图像。下文对前庭系统的描述将重点介绍前庭功能的感知方面,并简要介绍中枢前庭通路。前庭器官在运动控制中的作用将在第9章讨论。
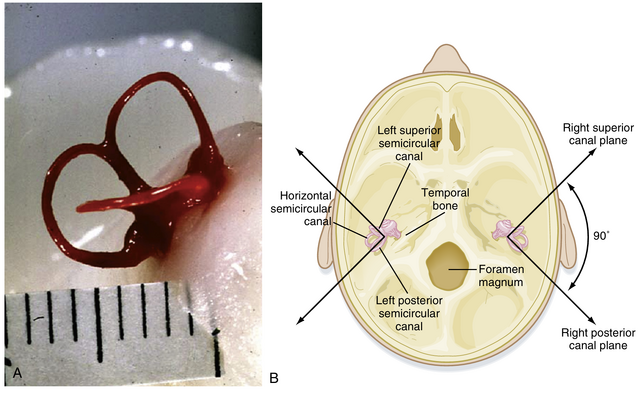
前庭器与耳蜗类似,由位于骨迷路内的膜迷路组成。每侧前庭器包含三个半规管(semicircular canals)和两个耳石器官(otolith organs)(图8.23;另见图8.17A)。这些结构含有内淋巴(endolymph),并被外淋巴(perilymph)包围。三个半规管分别称为水平管、前管和后管。耳石器官由椭圆囊(utricle)和球囊(saccule)组成(在图8.17A中统称为"Vestibule")。每个半规管在与椭圆囊连接处都有一个膨大部分称为壶腹(ampulla)。球囊通过蜗管与耳蜗相连,内淋巴(由耳蜗血管纹产生)可经此进入前庭器。
同侧三个半规管与对侧对应的共面半规管形成配对关系。头部两侧的水平管相互对应,而一侧的前管与对侧的后管形成配对(见图8.23B)。这种排列方式使得两侧对应的感觉上皮能够协作感知头部在空间中围绕三个几乎正交轴线的加速度。水平管并非真正水平:当头部相对地平线向下倾斜30度时,它们才位于水平面上。
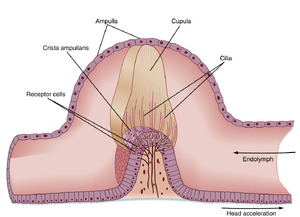
每个半规管的壶腹内含有称为壶腹嵴(crista ampullaris)的感觉上皮(图8.24)。壶腹嵴由垂直于半规管长轴的嵴状结构组成,表面覆盖含有前庭毛细胞(vestibular hair cells)的上皮。这些毛细胞由前庭神经(前庭蜗神经CN VIII的分支)的初级传入纤维支配。
与耳蜗毛细胞类似,每个前庭毛细胞顶端表面都有一组静纤毛(stereocilia)。但不同于耳蜗毛细胞的是,前庭毛细胞还含有一根大型的动纤毛(kinocilium)。壶腹毛细胞的纤毛嵌入称为壶腹帽(cupula)的胶状结构中。壶腹帽和壶腹嵴完全阻塞壶腹的管腔。当头部围绕与半规管平面垂直的轴线产生角加速度时,内淋巴的运动会偏移壶腹帽,从而弯曲毛细胞的纤毛,导致K⁺通道的开放或关闭。壶腹帽与内淋巴具有相同的比重,因此不受重力等线性加速力的影响。
耳石器官的感觉上皮称为椭圆囊斑(macula utriculi)和球囊斑(macula sacculi)(图8.25)。椭圆囊呈近水平方向排列,球囊呈垂直方向排列。它们的毛细胞嵌入覆盖每个斑区的上皮中。与壶腹嵴类似,斑区毛细胞的静纤毛和动纤毛也伸入胶状物质。但斑区的胶状物质含有大量由碳酸钙晶体组成的耳石(otoliths,"ear stones")。胶状物质与其耳石共同构成耳石膜(otolithic membrane)。耳石使耳石膜的比重达到内淋巴的两倍。因此,无论是线性加速度(如由重力产生的)还是角加速度,特别是当旋转中心位于头部之外时,耳石膜都会产生位移趋势。
前庭装置感觉上皮的神经支配
前庭神经初级传入纤维的胞体位于Scarpa神经节。这些神经元是双极的,其胞体和轴突均被髓鞘包裹。周围部分,前庭神经发出分支分别支配各个前庭上皮;中枢部分,前庭神经伴随耳蜗神经和面神经共同进入颅骨的内听道。
前庭转导
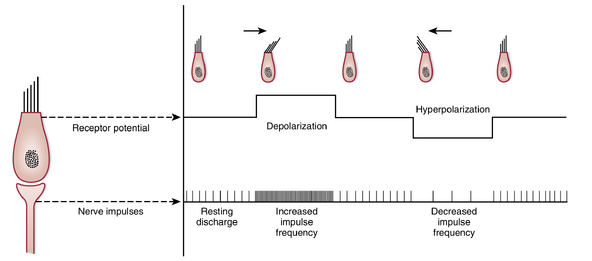
与耳蜗毛细胞类似,前庭毛细胞具有功能极性,其转导机制推测是相似的。当静纤毛向最长纤毛(此处指动纤毛)方向弯曲时,顶端膜对阳离子的通透性增加,由于内淋巴中高浓度的K+,K+内流导致前庭毛细胞去极化(图8.26)。反之,当纤毛背离动纤毛弯曲时,毛细胞发生超极化。毛细胞持续释放谷氨酸,因此与之形成突触的传入纤维具有静息放电。当毛细胞去极化时,神经递质释放增加,传入纤维的放电频率升高;当毛细胞超极化时,神经递质释放减少,传入纤维的放电频率降低。
半规管
头部的角加速度会导致内淋巴(endolymph)相对于头部产生微小运动(图8.27)。这种现象的产生是由于内淋巴的惯性使其抵抗膜迷路(membranous labyrinth)的初始加速度。这种滞后会推动顶帽结构(cupula),导致纤毛弯曲,从而改变前庭传入纤维(vestibular afferent fibers)的放电频率。特定壶腹嵴(ampullary crest)上的所有纤毛均朝向同一方向排列。水平半规管中的纤毛朝向椭圆囊(utricle),而其他壶腹(ampullae)中的纤毛则背向椭圆囊排列。
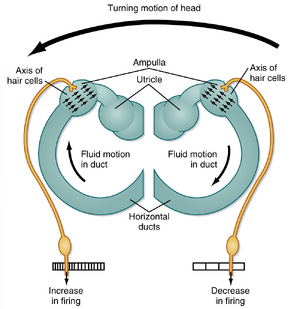
头部角加速度影响前庭传入纤维放电的机制可通过水平半规管的活动进行说明。图8.27显示当头部向左旋转(加速)时,从上方观察到的水平半规管和椭圆囊。当向左加速开始时,水平半规管内淋巴的惯性使右侧压力增加。这导致左侧水平半规管壶腹的毛细胞纤毛向椭圆囊方向弯曲,而右侧半规管的纤毛则背向椭圆囊弯曲。这些动作使左侧传入纤维放电频率增加,右侧放电频率降低。当头部以恒定角速度旋转(即无加速度)时,顶帽结构不再受力,因此两侧半规管的毛细胞将恢复静息状态放电。然而,当旋转停止时,内淋巴的惯性会对两侧顶帽结构产生作用力,其方向与原始加速度产生的方向相反。这将导致右侧传入纤维放电频率增加,而左侧放电频率降低。这种旋转后效应具有功能和临床意义。
临床相关
前庭迷路(vestibular labyrinth)的破坏(如梅尼埃病(Meniere’s disease))可导致眼球短暂节律性共轭偏斜,随后出现快速回扫运动(saccade)。这种现象称为眼震(nystagmus)(见第9章)。这些眼球运动常伴随眩晕感和恶心。大脑会将前庭系统两侧输入信号的差异解读为头部运动。一般认为这种破坏是由内淋巴(endolymph)浓度变化及其引发的毛细胞(hair cell)激活所致。单侧迷路损伤会导致输入信号不对称,从而引发异常眼球运动和相关的心理效应。
耳石器官(Otolith Organs)
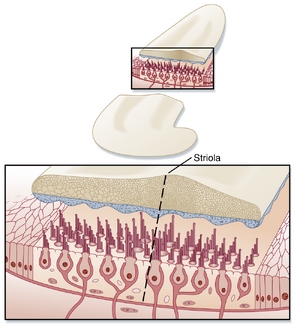
与壶腹嵴的毛细胞不同,耳石器官中的毛细胞并非全部朝向同一方向排列。
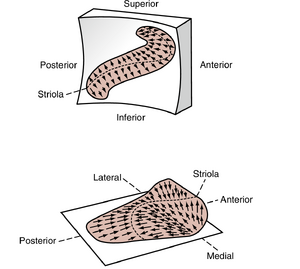
毛细胞的极化方向与耳石器官(otolith organ)上称为纹状线(striola)的嵴相关(见图8.25)。在椭圆囊中,纹状线两侧的毛细胞朝向纹状线极化;而在球囊中,毛细胞则背向纹状线极化。由于每个耳石器官的纹状线呈弯曲状,器官平面上存在所有取向的毛细胞(图8.28)。在头部的任何特定方位,毛细胞纤毛(cilia)的弯曲程度会根据其相对于重力矢量的取向而有所不同,从而形成从耳石器官到中枢神经系统(CNS)的特定输入模式。当头部倾斜至新位置时,耳石膜(otolithic membrane)相对于重力矢量的方位发生改变,毛细胞纤毛会以新方式弯曲。这种弯曲变化会改变耳石器官向CNS的输入模式,产生运动感觉,并可能触发多种反射。类似地,其他外力引起的线性加速度(如坠落时)或角加速度(如车辆转弯时,角加速度具有线性向心分量和瞬时切向分量)也会影响耳石器官的输出信号。
前庭中枢通路
前庭传入纤维(vestibular afferent fiber)通过前庭神经(vestibular nerve)投射至脑干。如前所述,这些传入纤维的胞体位于前庭神经节(Scarpa ganglion)。初级传入纤维终止于前庭神经核(vestibular nuclei)(见图4.6D-E)——位于延髓吻侧和脑桥尾侧,以及小脑的特定区域(最显著的是小结节(nodulus))。
前庭核(vestibular nuclei)发出多种投射,包括通过内侧纵束(medial longitudinal fasciculus, MLF;见图4.6C–E)向动眼神经核的投射。因此,前庭核能对眼球运动施加强有力的控制(前庭-眼反射;vestibule-ocular reflex, VOR)并不令人意外。其他投射形成外侧和内侧前庭脊髓束(lateral and medial vestibulospinal tracts),分别负责激活躯干和颈部肌肉,从而参与平衡调节和头部运动(前庭-颈反射;vestibulocolic reflex)。前庭通路还延伸至小脑、网状结构、对侧前庭复合体以及丘脑。通过向大脑皮层的投射,前庭至丘脑的通路介导对前庭活动的意识感知。前庭反射及其临床检测方法将在第9章详述。
化学感觉
味觉(gustation)和嗅觉(olfaction)帮助检测存在于食物、饮料或空气中的化学刺激。尽管这些感官可能不如其他感官重要,但它们极大地影响生活质量、食物选择,并对消化过程具有重要刺激作用。对其他动物而言,化学感觉具有更高的生存价值,其激活可引发多种社会行为,包括交配、领域行为和摄食。
味觉
通常我们所知的"味道"实际上是五种基本味觉属性的混合:咸(salty)、甜(sweet)、酸(sour)、苦(bitter)和鲜味(umami)。分别能高效诱发这些感觉的味觉刺激物为氯化钠、蔗糖、盐酸、奎宁和谷氨酸钠。鲜味被描述为具有蛋白质特性或肉类的风味。
注:是否存在第六种味觉,腴(fat,对游离脂肪酸的味觉),正处于争议中。
【译者注:“腴”是个人的翻译,目的是感官上与其他味觉保持一致。】
味觉受体
味觉感知依赖于味蕾中化学感受器(chemoreceptors)的激活。一个味蕾由50–150个受体细胞、支持细胞和基底细胞组成(图8.29A)。化学感受器细胞基底部与初级传入神经纤维形成突触,其顶端具有朝向味孔(taste pore)延伸的微绒毛(microvilli)。化学感受器细胞寿命仅约10天,它们持续被新分化的细胞替代,这些新细胞来源于味蕾基底部附近的基底细胞。
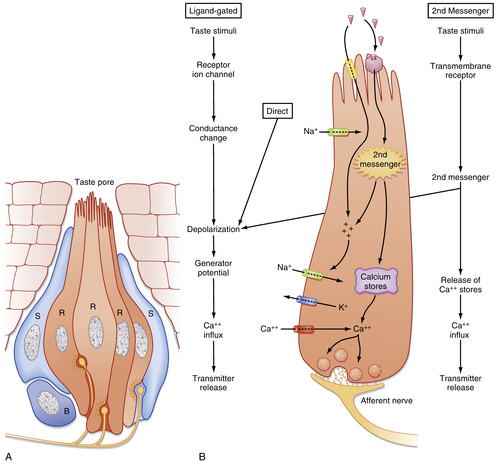
特异性针对某类味觉刺激的化学受体分子位于化学感受器细胞的微绒毛上,检测从舌表面黏液扩散至味孔的分子(部分黏液源自味蕾附近的腺体)。部分刺激物可直接进入细胞引发去极化(咸味的Na⁺和酸味的H⁺),或通过开启阳离子通道产生受体电位(同样适用于咸味和酸味);而其他刺激物(甜味的蔗糖、苦味的奎宁和鲜味的谷氨酸)则激活第二信使系统,后者可开启阳离子通道或直接激活细胞内Ca²⁺库(见图8.29B)。无论何种机制,受体去极化均导致谷氨酸释放,继而引发初级传入神经纤维的动作电位并向中枢神经系统传递。
味觉编码
然而,味觉编码并非完全基于化学感受器对不同基本味质的选择性,因为每个细胞可对多种刺激产生反应,尽管对某一种刺激的反应最强。由于大多数天然味觉物质包含能引发多个化学感受器反应的化学物质,味质的识别似乎依赖于化学感受器群体产生的模式化输入,每个感受器对刺激成分的响应存在差异。刺激强度则通过引发的总神经活动量来反映。
味蕾的分布与神经支配
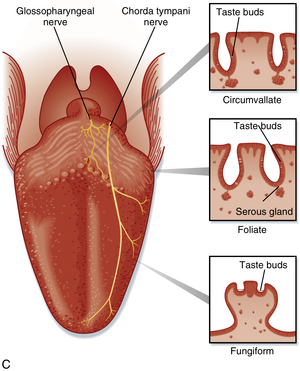
味蕾分布于舌、腭、咽和喉部的不同味觉乳头上。味觉乳头类型包括:位于舌前部的菌状乳头(fungiform papillae)、舌侧部的叶状乳头(foliate papillae),以及舌基部的轮廓乳头(circumvallate papillae)(见图 8.29C)。轮廓乳头可能包含数百个味蕾。人类舌部可拥有数千个味蕾。由于响应各类味质的味蕾广泛分布,舌部不同区域对不同味质的敏感度仅存在微小差异。味蕾的神经支配来自三对脑神经:面神经(CN VII)的鼓索支支配舌前2/3的味蕾,舌咽神经(CN IX)支配舌后1/3的味蕾(见图 8.29C),迷走神经(CN X)支配喉部和上食道的少量味蕾。
中枢味觉通路
第VII、IX、X对脑神经中味觉纤维的胞体分别位于膝状神经节(geniculate ganglion)、岩神经节(petrosal ganglion)和结状神经节(nodose ganglion)。传入纤维的中枢突进入延髓,加入孤束,并与孤束核(nucleus of the solitary tract)形成突触(见图 4.6D-E)。在包括某些啮齿类在内的动物中,孤束核的二级味觉神经元向同侧臂旁核(parabrachial nucleus)头侧投射,臂旁核再投射至丘脑腹后内侧核小细胞部(VPMpc)。猴类中,孤束核直接投射至VPMpc核。VPMpc核与大脑皮层的两个不同味觉区相连:一个位于S1皮层的面部区域,另一个位于岛叶。中枢味觉通路的一个特殊特征是其主要为同侧通路(与主要交叉的中枢体感通路不同)。
嗅觉
某些动物(嗅觉发达动物,macrosmatic animals;如猪、熊、犬)的嗅觉远比人类灵敏。犬类通过气味追踪其他动物的能力广为人知,昆虫利用信息素(pheromones)吸引配偶的行为亦是如此。然而,嗅觉对人类情感生活具有重要影响,气味能有效唤起记忆。它还能帮助人们避免食用腐败食物并察觉危险环境。例如,无色无味的天然气会添加具有不愉快气味物质,以便人们容易检测泄漏。
气味比味觉具有更多的基本性质。人类基因组中编码了多达1000种不同的气味受体(odor receptors),尽管其中仅约350种具有功能活性,但它们构成了基因组中最大的G蛋白偶联受体家族。嗅黏膜还含有三叉神经的体感受体。在进行嗅觉临床测试时,临床医生必须避免使用热刺激或有害刺激(如"嗅盐"中的氨)激活这些体感受体。
嗅觉受体(Olfactory Receptors)
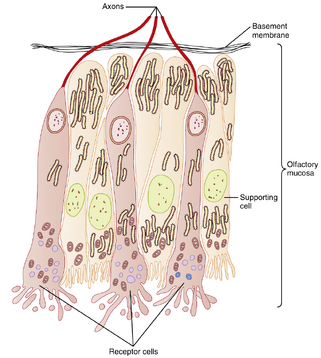
嗅觉化学感受细胞(olfactory chemoreceptor cells)位于嗅黏膜(olfactory mucosa)——鼻咽部的一个特化区域。嗅觉化学感受器是双极神经细胞(bipolar nerve cells)(图8.30)。这些细胞顶面的非运动纤毛含有化学感受器,可检测溶解于表层黏液中的气味分子。细胞另一端发出无髓鞘轴突(unmyelinated axon),与其他嗅神经纤维束汇合后穿过筛骨(ethmoid bone)筛板(cribriform plate)的孔道进入颅底。这些嗅神经在嗅球(olfactory bulb)形成突触,嗅球是大脑半球的组成部分,位于颅腔底部、额叶(frontal lobe)正下方(图8.31)。
人类约有1000万个嗅觉化学感受器。与味觉细胞类似,嗅觉化学感受器寿命较短(约60天),且持续更新。然而,嗅觉受体细胞是真正的神经元,因此成为终生生持续再生的两种神经元类型之一(另一种是海马齿状回颗粒细胞(granule cells of the hippocampal dentate gyrus))。
通过呼吸气流或进食时来自口腔的气流,气味分子可到达嗅黏膜。嗅探动作可增加气味分子的流入。气味分子暂时与鼻腔腺体分泌的嗅觉结合蛋白(olfactory binding protein)结合于黏液中。
嗅觉编码与味觉编码类似,因为大多数自然气味是复杂的,由多种能激活多种嗅觉化学感受器的分子组成。特定感知气味的编码依赖于众多嗅觉化学感受器的响应,而气味强度则通过传入神经活动的总体水平来表征。
中枢通路(Central Pathways)
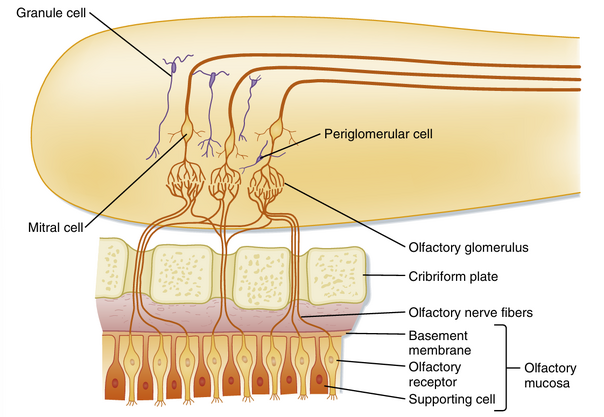
嗅觉通路的第一个突触位于嗅球(olfactory bulb)内。嗅球是大脑皮层的特化部分,位于额叶底面。其内部包含僧帽细胞(mitral cells)、中间神经元(颗粒细胞granule cells;球旁细胞periglomerular cells)以及独特的突触簇(嗅小球glomeruli,见图8.31),这些结构在此与嗅觉传入纤维相互作用。
当嗅觉传入纤维从嗅黏膜抵达嗅球时,它们在接近嗅小球的过程中分支,与僧帽细胞的树突形成突触。每个嗅小球接受数千条嗅觉传入纤维的投射,但所有投射至单个嗅小球的传入纤维都传递来自同一种嗅觉受体(olfactory receptor)的输入信号。这一点尤其值得注意,因为嗅觉受体细胞持续再生,新生的轴突必须精确导航至正确的嗅小球。
颗粒细胞和球旁细胞属于抑制性中间神经元。它们与僧帽细胞的树突形成树突-树突交互突触(dendrodendritic reciprocal synapses)。僧帽细胞的活动会去极化这些抑制性细胞,进而抑制原始及邻近的嗅小球。由于每个嗅小球通过接收特定气味特性组合的传入纤维投射而具有特异性,这种机制似乎能增强刺激对比度,类似于视网膜中水平细胞的作用。此外,这也为持续刺激的适应提供了机制。
僧帽细胞的轴突离开嗅球进入嗅束。自此,嗅觉连接变得高度复杂。嗅束内存在一个称为前嗅核(anterior olfactory nucleus)的核团,它接收来自嗅球的输入,并通过前连合(anterior commissure)投射至对侧嗅球。当每条嗅束接近脑基底部时,会分化为外侧嗅纹(lateral olfactory stria)和内侧嗅纹(medial olfactory stria)。外侧嗅纹的轴突终止于初级嗅皮质(primary olfactory cortex),包括前梨状皮质(prepiriform cortex)(在许多动物中还包括梨状叶(piriform lobe))。内侧嗅纹包含投射至杏仁核(amygdala)以及基底前脑(basal forebrain)的纤维。这些结构是边缘系统(limbic system)的组成部分或与其直接相连(见第10章)。
临床要点
嗅觉通常不作为常规神经学检查项目。然而可通过让患者吸入并辨识气味物质进行测试。检测时应交替封闭单侧鼻孔进行测试。需避免使用强刺激性气味物质(如氨水),因其可同时激活三叉神经纤维。颅底骨折或肿瘤(如嗅沟脑膜瘤)损伤单侧/双侧嗅球或嗅束后可导致嗅觉丧失(anosmia)。脑震荡亦可引起嗅觉缺失,因脑组织在颅腔内的突然运动可切断无髓鞘的嗅神经纤维。钩回发作(uncinate seizures,即起源于内侧颞叶的癫痫发作)时,患者常出现燃烧橡胶等令人不适的气味先兆。
关键要点
- 光线通过角膜和晶状体进入眼球,聚焦于衬覆眼后部的视网膜。角膜是屈光力最强的结构,但晶状体具有可调节的屈光力,使近物成像于视网膜。虹膜通过调节景深和入眼光量控制成像清晰度。
- 光感受器细胞的外段负责光信号转导。光感受器与视网膜双极细胞形成突触连接,后者继而与其他中间神经元及神经节细胞形成突触。神经节细胞通过视神经将信号传递至脑。视神经离开视网膜形成的视盘不含光感受器,故形成盲点。视网膜空间分辨率最高的区域是中央凹及其周围的黄斑区。
- 视杆细胞具有高敏感度,无辨色能力,在低光照条件下功能最佳。视锥细胞敏感度较低但空间分辨率更高。色觉依赖于三种具有不同光谱敏感性的视锥细胞。
- 双极细胞和多数神经节细胞具有同心圆式感受野,呈现中心激活/外周抑制(on-center/off-surround)或中心抑制/外周激活(off-center/on-surround)的组织模式。水平细胞介导这种中心-外周拮抗效应。光感受器、双极细胞和水平细胞通过膜电位变化和神经递质释放来响应刺激,而神经节细胞通过产生动作电位进行响应。
- 颞侧视网膜(temporal retina)的神经节细胞轴突向同侧脑部投射;鼻侧视网膜(nasal retina)的轴突则在视交叉(optic chiasm)处交叉。由于晶状体会反转落在视网膜上的图像,视野的每一侧都会被投射到双眼的对侧脑区。在丘脑的外侧膝状核(lateral geniculate nucleus, LGN)中,来自每只眼的输入终止于不同的层次,且M型神经节细胞(对运动敏感)和P型神经节细胞(对细节和颜色敏感)也分别投射到不同的层次。
- LGN通过视辐射(visual radiation)投射至初级视皮层(纹状皮层,primary visual/striate cortex),主要终止于第4层,该层存在有序的视网膜拓扑图谱(retinotopic map)。在此图谱中,来自每只眼的信息映射到交替相邻的点位上,形成在皮层垂直延伸的眼优势柱(ocular dominance columns)。第4层外的纹状皮层神经元对特定朝向的条状或边缘刺激反应最佳。偏好特定刺激朝向的细胞群聚形成朝向柱(orientation columns)。
- 纹外视区(extrastriate visual areas)具有不同功能。颞下皮层(inferotemporal cortex)的部分区域主要受P细胞调控,参与形状检测、色觉和面部识别。M细胞影响颞中皮层和顶叶皮层区域,这些区域负责运动检测和眼动控制。
- 纯音(pure tone)的特征包括振幅(amplitude)、频率(frequency)和相位(phase)。自然声音是纯音的组合。声压以分贝(decibels, dB)为单位测量,需参照基准水平。
- 耳廓(pinna)和外耳道(auditory canal)将空气传导的声波传递至鼓膜(tympanic membrane)。中耳的三块听小骨(ossicles)将鼓膜的振动传递至充满液体内耳(inner ear)的卵圆窗(oval window)。由于外耳道的尺寸和听小骨的力学特性,人类听觉在约3000 Hz频率处最为敏感。
- 内耳的耳蜗(cochlea)包含三个主要腔室:前庭阶(scala vestibuli)、鼓室阶(scala tympani)以及介于两者之间的蜗管(scala media/cochlear duct)。蜗管一侧以基底膜(basilar membrane)为界,其上分布着声音换能机制——柯蒂氏器(organ of Corti)。
- 当基底膜因卵圆窗传入前庭阶的压力波而产生振动时,柯蒂氏器毛细胞(hair cells)的静纤毛(stereocilia)会受到剪切力作用,从而打开机械门控K⁺通道。这导致膜电导变化,进而调控耳蜗神经纤维上的神经递质释放。
- 高频声波最佳激活耳蜗基部附近的毛细胞,低频声波则激活耳蜗顶部附近的细胞。这种音调拓扑(tonotopic organization)结构也存在于中枢听觉通路中,包括耳蜗核(cochlear nuclei)、上橄榄复合体(superior olivary complex)、下丘(inferior colliculus)、内侧膝状核(medial geniculate nucleus)和初级听皮层(primary auditory cortex)。
- 中枢听觉通路多个位点的听觉处理参与声源定位、频率与强度分析以及语音识别。
