第十八章 心脏和血管的调节
学习目标
完成本章学习后,学生应能回答以下问题:
- 副交感与交感神经系统如何调节心脏和血管系统的功能?
- 哪些因素会影响交感神经对阻力血管和容量血管的差异性调节?
- 压力感受器介导的反射如何模拟骨骼肌本体感受器反射的运作机制?
- 心肌自身存在的调节心肌性能的两个主要内在机制是什么?
- 调节心肌性能的主要激素有哪些?
- 动脉血中 O2、CO2 和 H+ 浓度的变化如何影响心肌性能?
- 血管平滑肌的肌源性机制是什么?它如何参与组织血流量的调节?
- 参与血流量调节的体液因子有哪些?它们的作用是什么?
心率和心肌性能的调节
心输出量(cardiac output, CO)定义为心脏每分钟泵出的血液总量。CO 可通过改变心率(heart rate, HR)或每次心跳时心室射出的血容量(称为每搏输出量(stroke volume, SV)来调节。数学上,CO 可表示为 HR 与 SV 的乘积:
公式 18.1:CO = HR × SV
因此,要理解心脏活动的调控机制,需考虑 HR 和 SV 的调节方式。HR 由自主神经系统(autonomic nervous system, ANS)通过调控心脏内在起搏点的活动来调节。SV 则取决于心肌性能(由心肌细胞收缩力决定)和心脏的血流动力学负荷。所有这些决定因素相互依存,因为 CO 的任一决定因素发生改变几乎都会影响其他因素。
心率的神经调控
虽然某些局部因素(如温度变化和组织牵张)可影响 HR,但 ANS 是调控 HR 的主要途径。
正常成年人的平均静息心率(heart rate, HR)约为70次/分钟,儿童则显著更快。睡眠期间,心率会下降10-20次/分钟。情绪激动时心率可能升高,而肌肉运动期间可增至150次/分钟以上。训练有素的运动员通常静息心率仅约50次/分钟。
自主神经系统(autonomic nervous system, ANS)的两个分支均对心脏起搏点(通常为窦房结(sinoatrial node, SA node)产生紧张性作用。交感神经系统增强自律性(automaticity),而副交感神经系统抑制之。心率的改变通常涉及这两个分支的交互作用:心率升高常伴随副交感活动降低与交感活动增强的组合反应;心率降低则与自主神经活动的相反变化相关。
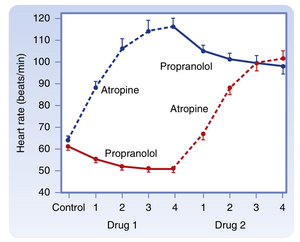
在健康静息个体中,副交感紧张通常占主导地位。当给予静息个体阿托品(atropine)(一种阻断副交感作用的毒蕈碱受体拮抗剂)时,心率通常显著升高。若给予普萘洛尔(propranolol)(一种阻断交感作用的β-肾上腺素能受体拮抗剂),心率通常仅轻微下降(图18.1)。当ANS两个分支同时被阻断时,青年人的平均心率约为100次/分钟。完全自主神经阻断后的心率称为固有心率(intrinsic heart rate)。
副交感神经通路
心脏副交感纤维起源于延髓,其胞体位于迷走神经背侧运动核或疑核(nucleus ambiguus)(见第11章)。在人类,离心的迷走神经纤维向下经颈总动脉附近的颈部区域,再通过纵隔与节后迷走神经细胞形成突触。这些细胞分布于心外膜表面或心壁内。大多数迷走神经节细胞位于窦房结和房室结(atrioventricular node, AV node)附近的心外膜脂肪垫中。
左右迷走神经分布于不同的心脏结构。右迷走神经主要影响窦房结:刺激该神经可减慢窦房结放电频率,甚至使其停止放电数秒。左迷走神经主要抑制房室传导组织,导致不同程度的房室传导阻滞(见第16章)。然而,传出迷走神经纤维的分布存在重叠:左迷走神经刺激同样可抑制窦房结,右迷走神经刺激也会阻碍房室传导。
交感神经通路
心脏交感纤维起源于脊髓上五或六个胸段及下两个颈段的中间外侧柱(见第11章)。这些纤维通过白交通支离开脊柱,进入椎旁神经节链。节前和节后神经元的突触连接主要位于星状神经节或颈中神经节,具体位置因物种而异。在纵隔内,交感神经节后纤维与副交感神经节前纤维汇合,形成复杂的混合传出神经丛分布于心脏。
在此神经丛中,交感神经节后纤维沿大血管外膜表面抵达心脏基底部。从心脏基底部开始,这些纤维以广泛的心外膜神经丛形式分布至各个心腔。随后它们通常伴随冠状血管穿入心肌。
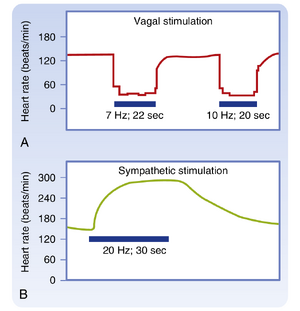
窦房结(SA node)和房室结(AV node)富含乙酰胆碱酯酶(acetylcholinesterase),这是一种能快速水解神经递质乙酰胆碱(ACh)的酶。当迷走神经刺激停止时,特定迷走神经刺激的效应会迅速衰减(图18.2A),因为ACh被快速分解。此外,迷走神经对SA结和AV结功能的效应具有极短的潜伏期(约50-100msec),因为释放的ACh能快速激活心肌细胞中特殊的ACh调控钾通道(KACh)。这些通道的快速开放是由于毒蕈碱受体通过鸟苷酸结合蛋白直接耦联至KACh通道。迷走神经的这两个特征——反应潜伏期短和衰减迅速——使其能够对SA结和AV结功能进行逐搏调控。
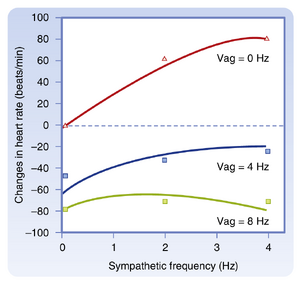
如图18.3所示,在SA结处副交感影响通常优于交感效应。当交感刺激频率从0增加至4Hz时,在无迷走神经刺激(0Hz)的情况下心率(HR)每分钟约增加80次。然而当迷走神经以8Hz频率受刺激时,交感刺激频率从0增至4Hz对心率的影响微乎其微。
与迷走神经活动后反应的突然终止不同,交感神经刺激的效果在刺激停止后逐渐衰减(见图18.2B)。神经末梢会摄取高达70%的交感神经刺激期间释放的去甲肾上腺素(norepinephrine);其余大部分通过血流带走。这些过程是缓慢的。此外,交感神经刺激对心脏的促进作用达到稳态值所需时间远长于迷走神经刺激的抑制作用。
心脏对交感神经刺激的反应启动缓慢主要有两个原因。首先,去甲肾上腺素似乎是从交感神经末梢缓慢释放的。其次,神经释放的去甲肾上腺素对心脏的作用主要通过一个相对缓慢的第二信使系统——环磷酸腺苷(cyclic adenosine monophosphate, cAMP;见第13章)介导。因此,交感神经活动改变心率和房室传导的速度远慢于迷走神经活动。迷走神经活动可以实现逐搏(beat-by-beat)的心功能调控,而交感神经活动则无法做到。
高级中枢的调控
不同脑区的刺激可显著影响心率、节律和收缩力(见第11章)。在大脑皮层中,调节心功能的中心位于大脑前半部,主要在额叶(frontal lobe)、眶皮质(orbital cortex)、运动区和前运动区(motor and premotor cortex)、颞叶前部(temporal lobe)、岛叶(insula)和扣带回(cingulate gyrus)。刺激丘脑(thalamus)的中线、腹侧和内侧核可引发心动过速。刺激下丘脑(hypothalamus)的后部和后外侧区也能改变心率。刺激下丘脑后部的Forel H2区可引发多种心血管反应,包括心动过速和相关肢体运动;这些变化类似于肌肉运动期间观察到的现象。毫无疑问,皮层和下丘脑中心启动了在兴奋、焦虑和其他情绪状态下发生的心脏反应。下丘脑中心也负责启动对环境温度变化的心脏反应。实验性改变视前区下丘脑前部的温度会影响心率和外周阻力。
刺激延髓的舌下神经旁区(parahypoglossal area)会交互激活心脏交感通路并抑制心脏副交感通路。在迷走神经被切断的动物中,延髓某些背侧区域存在明确的心脏加速点(增加心率)和增强点(增加心肌收缩力)。加速区在右侧更丰富,而增强点在左侧更普遍。下丘脑也存在类似的分布。因此,交感纤维主要通过脑干同侧下行。
IN THE CLINIC
岛叶皮层对心血管系统交感与副交感作用的平衡具有独特调节功能。电刺激研究发现,施加于左侧岛叶皮层的刺激主要诱发副交感神经反应(心动过缓与血管减压),而右侧岛叶皮层的刺激则引发交感神经作用(心动过速与血管加压)。与预期一致,急性卒中导致左侧岛叶皮层损伤的患者表现出交感神经张力增强,心律失常和心血管死亡风险升高。当卒中累及右侧岛叶皮层时,心血管死亡率/发病率未见显著变化。
压力感受器反射(Baroreceptor Reflex)
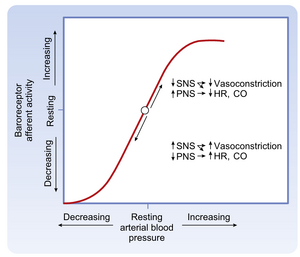
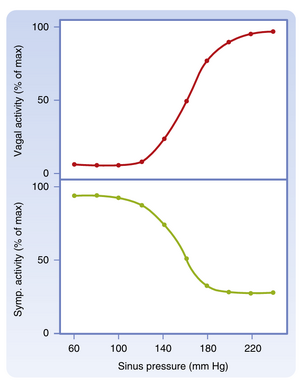
动脉血压的突然变化会引发逆向调节心率(HR)的反射活动。当动脉血压超过正常静息均值时,压力感受器(baroreceptor)活动增强,进而导致心率下降,反之亦然(图18.4)。位于主动脉弓和颈动脉窦的压力感受器负责介导此反射(详见"动脉压力感受器"章节)。图18.5展示了颈动脉窦压力变化对心脏自主神经活动的影响:在100-180 mmHg的颈动脉窦压力中间范围内,传出迷走神经与交感神经活动呈现交互性变化。当压力低于此范围时,交感神经活动强烈而迷走神经活动基本消失;当压力高于此范围时,迷走神经活动占主导地位而交感神经活动趋于最低。
班布里奇反射(Bainbridge Reflex)、心房受体与心房钠尿肽(Atrial Natriuretic Peptide)
1915年,Francis A. Bainbridge报道向犬体内输注血液或生理盐水可加快其心率。这种增速效应似乎与动脉血压无关,因为无论动脉血压是否变化,心率都会上升。但Bainbridge同时注意到,只要中心静脉压升高足以使右心扩张,就会出现心率加快现象。该反应被命名为班布里奇反射。双侧迷走神经切断术可消除此反应。
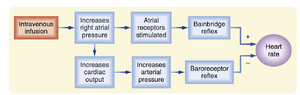
许多研究者已证实班布里奇(Bainbridge)的观察,并注意到反应的幅度和方向取决于当时的心率(HR)。当心率较慢时,静脉输注血液或电解质溶液通常会加速心跳。然而,当心率较快时,此类输注通常会减慢心跳。这些不同反应的原因是什么?血容量增加不仅会引发班布里奇反射(Bainbridge reflex),还会激活其他反射(值得注意的是压力感受器反射(baroreceptor reflex))。这些其他反射倾向于引起心率的相反变化。因此,由血容量改变引发的心率变化是这些拮抗性反射效应的结果(图18.6)。显然,当血容量增加时班布里奇反射占优势,但当血容量减少时压力感受器反射占主导地位。
两个心房都具有受血容量变化影响并能调节心率的感受器。这些感受器主要位于静脉心房连接处:右心房与腔静脉连接处,以及左心房与肺静脉连接处。这些心房感受器的扩张通过迷走神经向脑干发送传入冲动。传出冲动则由自主神经系统的两个分支的纤维从脑干传导至窦房结(SA node)。
心脏对自主神经活动变化的反应具有高度选择性。即使反射性心率增加显著,心室收缩力的变化通常可忽略不计。此外,神经介导的心率增加通常不伴有外周小动脉交感神经活动的增强。
心房感受器的刺激不仅增加心率,还增加尿量。肾交感神经纤维活动减弱可能部分解释了这种利尿作用。然而,主要机制似乎是神经介导的垂体后叶血管加压素(vasopressin)(抗利尿激素)分泌减少(参见第35和41章)。心房壁的牵张还会释放心房利钠肽(atrial natriuretic peptide,ANP)。ANP是一种28氨基酸肽,对肾脏具有强效利尿和排钠作用(另见第35章),并对阻力血管和容量血管产生血管舒张效应。因此,ANP是血容量和血压的重要调节因子。
临床关联
在充血性心力衰竭中,NaCl和水分的滞留主要是由于肾素-血管紧张素系统刺激增加了肾上腺皮质醛固酮的释放。充血性心力衰竭患者的血浆ANP水平也升高。通过增强肾脏对NaCl和水分的排泄,ANP逐渐减少液体滞留以及随之产生的中心静脉压升高和心脏前负荷增加。
呼吸性窦性心律不齐
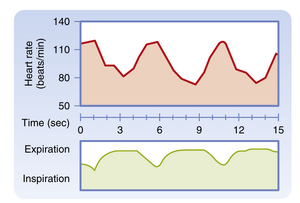
在大多数个体中可检测到与呼吸频率同步的心率(heart rate, HR)节律性变化,这种表现在儿童中更为明显。心率通常在吸气时加快,呼气时减慢(图18.7)。
心脏自主神经的记录显示,交感神经纤维活动在吸气时增强,而迷走神经纤维活动在呼气时增强。心率对迷走神经刺激停止的反应非常迅速,因为如前所述,迷走神经释放的乙酰胆碱(acetylcholine, ACh)可被乙酰胆碱酯酶快速水解。这种短潜伏期使心率能够以呼吸频率进行节律性变化。相反,交感神经末梢周期性释放的去甲肾上腺素(norepinephrine)被移除的速度非常缓慢。因此,伴随吸气发生的交感神经活动节律性变化不会引起心率的显著振荡性改变。由此可见,呼吸性窦性心律不齐(respiratory sinus arrhythmia)几乎完全由迷走神经活动的变化引起。事实上,当迷走神经紧张性增强时,呼吸性窦性心律不齐会更为显著。
反射性和中枢性因素共同参与启动呼吸性窦性心律不齐(图18.8)。肺部的牵张感受器在吸气时受到刺激,这一活动通过反射引起心率加快。该反射的传入和传出支均位于迷走神经中。胸内压在吸气时也会降低,从而增加流向右心的静脉回流量(见第19章)。右心房随之发生的牵张可引发Bainbridge反射。当增加的静脉回流经过时间延迟到达左心后,左心室输出量增加并提升动脉血压。这种血压升高又会通过压力感受器反射使心率减慢。
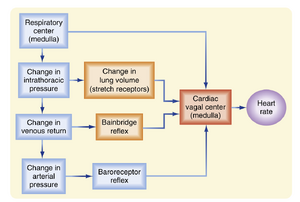
中枢性因素也参与呼吸性心律失常的发生。延髓的呼吸中枢直接作用于心脏自主神经中枢(见图18.8)。在心肺转流研究中,胸腔被打开,肺萎陷,静脉回流被分流至人工心肺机,动脉血压维持在恒定水平。在此类研究中,胸廓的节律性运动证明了延髓呼吸中枢的活动,并常伴随以呼吸频率同步的心率节律性变化。这种呼吸性心律失常几乎可以确定是由延髓内呼吸中枢与心脏中枢的直接相互作用所引发。
Chemoreceptor Reflex
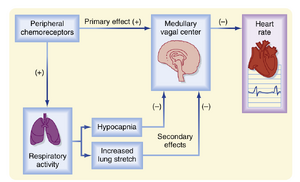
外周化学感受器刺激引发的心脏反应展示了当单一刺激同时激活两个器官系统时可能产生的复杂相互作用。颈动脉化学感受器(carotid chemoreceptors)的激活始终会增加通气频率(ventilatory rate)和深度(见25章),但通常仅轻微改变心率(HR)。通气反应的强度决定了颈动脉化学感受器刺激最终导致心率增加还是减少。由化学感受器引发的轻度呼吸刺激会适度降低心率;更显著的呼吸刺激仅会轻微增加心率。若化学感受器刺激引发的肺反应被阻断(如后文所述),心率反应可能会显著增强。
外周化学感受器刺激引发的心脏反应是原发性和继发性反射机制共同作用的结果(图18.9)。原发性反射刺激的主要效应是激活延髓迷走神经中枢(medullary vagal center),从而降低心率。呼吸系统介导的继发性反射效应则表现为:动脉化学感受器引发的呼吸刺激会抑制延髓迷走神经中枢。这种抑制作用的强弱与呼吸刺激水平相关:轻度呼吸增强仅微弱抑制迷走中枢,而显著的通气增加则会深度抑制该中枢。
临床应用
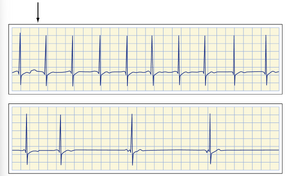
图18.11显示了一位四肢瘫痪患者的心电图,该患者无法自主呼吸,需气管插管和人工呼吸。当短暂断开气管导管(位于图上条带起始处,箭头指示)进行护理时,九次心跳后出现严重心动过缓。断开导管前患者心率为65次/分钟。人工呼吸停止后不到10秒,心率降至约20次/分钟。这种心动过缓可通过阿托品阻断迷走神经传出活动来预防,若在断开导管前对患者进行过度通气,则可显著延迟其发生。
心室受体反射
位于心室内膜表面附近的感受器可引发与动脉压力感受器相似的反射效应。这些内膜感受器的兴奋会导致心率和外周阻力降低。在心室心外膜区域也发现了其他感受器。尽管所有这些心室感受器均可被各种机械和化学刺激激活,但其确切生理功能仍不明确。
心肌功能的调节
心肌功能的内在调节
如前所述,心脏在缺乏任何神经或激素控制的情况下仍能自主启动搏动。心肌也能通过其自身固有的机制适应不断变化的血流动力学条件。例如,心脏去神经支配的赛犬(racing greyhounds)与神经支配完整的个体表现几乎相当。完全心脏去神经支配后,它们的最大奔跑速度仅下降5%。在这些犬中,赛跑时心输出量(cardiac output, CO)增加3至4倍主要通过每搏输出量(stroke volume, SV)的增加实现。正常情况下,运动时CO的增加伴随着心率(heart rate, HR)的成比例上升;SV变化不大(参见第19章)。这种去神经心脏的适应并非完全由内在机制完成;循环儿茶酚胺(catecholamines)的作用不容忽视。例如,若给予心脏去神经支配的赛犬β-肾上腺素能受体(β-adrenergic receptor)拮抗剂,其赛跑表现会受到严重损害。
心肌通过两种主要内在机制——Frank-Starling机制和心率调节机制(rate-induced regulation)——来适应血流动力学变化。Frank-Starling机制(Frank-Starling心定律)通过心肌纤维静息长度(resting length)的改变被激活,而心率调节机制则由心跳频率的变化所触发。
临床知识
心室感受器(ventricular receptors)被认为与血管迷走神经性晕厥(vasovagal syncope)的触发有关,这种头晕或短暂意识丧失的症状可能由心理压力或体位性应激引发。目前认为,心室充盈量减少与强烈心室收缩共同刺激了心室感受器。在安静站立的人体中,由于血液倾向于淤积在腹部和腿部静脉(参见第17章),心室充盈量减少。因此,通过压力感受器反射(baroreceptor reflex)(见图18.5),CO和动脉血压的下降会导致全身交感神经活动增强。心脏交感活动增强引发强烈的心室收缩,从而刺激心室感受器。心室感受器的兴奋启动自主神经变化,诱发血管迷走神经性晕厥:即迷走神经介导的显著心动过缓(bradycardia)与交感神经活动降低介导的全身性小动脉扩张(arteriolar vasodilation)的组合效应。
临床知识
在多种临床情况下,心脏会部分或完全失去神经支配:(1)外科移植的心脏完全去神经化,但其固有的节后副交感纤维(postganglionic parasympathetic fibers)仍然存在;(2)阿托品(atropine)可阻断迷走神经对心脏的作用,普萘洛尔(propranolol)可阻断交感β-肾上腺素能的影响;(3)某些药物(如利血平[reserpine])会耗竭心脏去甲肾上腺素(norepinephrine)储备,从而限制或消除交感控制;(4)在慢性充血性心力衰竭(chronic congestive heart failure)中,心脏去甲肾上腺素储备常严重减少,任何交感效应均被削弱。
Frank-Starling机制
20世纪10年代,德国生理学家Otto Frank和英国生理学家Ernest Starling分别研究了离体心脏对前负荷(preload)和后负荷(afterload)变化的反应(参见第16章)。当心室充盈压(前负荷)增加时,心室容积逐步增大,经过数次心搏后趋于稳定并维持在较大水平。达到平衡状态时,心室每次收缩射出的血液量(每搏输出量,stroke volume [SV])会相应增加,以匹配右心房静脉回流血量的增加。
心室容积的增大有利于心室收缩,使心室能够泵出更大的每搏输出量。这种心室容积增加与单个心室肌纤维长度的增加相关。肌纤维长度的改变主要通过改变相互作用的肌丝横桥(myofilament cross-bridges)数量来影响心脏功能(参见第16章)。最新证据表明,其主要机制涉及牵张诱导的心肌肌丝对Ca++敏感性的改变(参见第13和16章)。然而,存在一个最佳肌纤维长度。过高的充盈压会导致心肌纤维过度拉伸,反而可能抑制而非增强心室的泵血能力(参见图16.36)。
Starling还证明离体心脏能适应收缩期心室射血对抗力(即后负荷)的变化。左心室收缩时,只有当心室内压刚好超过主动脉压时,才会将血液射入主动脉(参见图16.40)。心室射血期间的主动脉压本质上构成了左心室后负荷。在Starling的实验中,通过从升主动脉到右心房储血器的管路中设置液压装置来控制动脉压。为保持右心房静脉回流恒定,储血器的静水压水平被严格维持。当Starling将动脉压提升至新的恒定水平时,左心室最初通过减少每搏输出量来应对增加的后负荷。由于静脉回流保持恒定,每搏输出量的减少伴随着心室舒张末期容积的增加和心肌纤维长度的延长。这种舒张末期纤维长度的改变最终使心室能够在更大的外周阻力下泵出正常的每搏输出量。如前所述,粗细肌丝间横桥数量的改变可能参与这一适应过程,但主要因素似乎是牵张诱导的收缩蛋白对Ca++敏感性的改变。
心脏对心率(HR)变化的适应也涉及心室容积的改变。例如在心动过缓(bradycardia)时,舒张期时间的延长使心室充盈量增加。由此产生的心肌纤维长度增加会提高每搏输出量。因此,心率的降低可能完全被每搏输出量的增加所补偿,从而使心输出量(cardiac output [CO])维持恒定。
右心室与左心室输出量的平衡
当心脏代偿涉及心室扩张时,必须考虑心室体积增大对心室内压产生的影响。根据拉普拉斯定律(参见第17章),如果心室扩大,每个心肌纤维为产生特定心室内收缩压所需的力量必须显著大于正常大小心室中纤维所产生的力量。因此,扩张心脏完成给定外部工作量所需的能量比正常大小心脏更多。因此,计算心室壁收缩心肌纤维后负荷时,必须同时考虑心室尺寸与心室内压(及主动脉压)。
包裹心脏的相对坚硬的心包(pericardium)决定了高压和高容积状态下的压力-容积关系。即使正常静息状态心率较慢时,心包仍对心脏容积有限制作用。在慢性充血性心力衰竭患者中,持续的心室扩张和肥大可能显著拉伸心包。这类患者心包对心脏充盈的限制作用所对应的压力和容积水平,与正常个体存在显著差异。
为评估心室功能变化,Frank-Starling机制常通过一组心室功能曲线来表征。例如,构建基础心室功能曲线时,需在特定范围内改变血容量,并在每个阶段测量每搏功(stroke work,即SV×平均动脉压)和心室舒张末期压力。随后在实验干预条件下进行类似观测。例如,去甲肾上腺素(norepinephrine)持续输注期间获得的心室功能曲线位于基础曲线上方且左移(图18.12)。显然,在给定左心室舒张末期压力(前负荷指标)水平下,左心室在去甲肾上腺素输注期间做功量高于基础状态。因此,心室功能曲线的上移和左移标志着心室收缩力的增强。相反,曲线下移和右移则提示收缩力受损及心衰倾向。
• 图18.12 持续输注去甲肾上腺素使心室功能曲线上移并左移。这种移位标志着心室收缩力的增强。(改绘自Sarnoff SJ, et al. Circ Res. 1960;8:1108.)
Frank-Starling机制能有效匹配心输出量与静脉回流量。任一心室突发性过量输出会迅速引起另一心室静脉回流量的增加。后者舒张期纤维长度的增加将提升该心室输出量,从而实现双心室输出量的动态平衡。通过这种方式,Frank-Starling机制维持着左右心室输出量的精确平衡。若两个心室未以串联形式存在于闭合循环中,任何微小但持续的输出量失衡都将导致灾难性后果。
心室输出量与心房平均压的关系曲线
描述心室输出量(CO)与心房平均压关系的两条心室曲线并不重合;左心室曲线通常位于右心室曲线下方(图18.13)。在左右心房压力相等时(图18.13中的A点和B点),右心室输出量超过左心室输出量。因此,回流至左心室的血量(作为右心室输出量的函数)超过左心室输出量,导致左心室舒张期容积和压力上升。根据Frank-Starling机制(首次出现术语),左心室输出量随之增加(从图18.13的B点向C点移动)。只有当双心室输出量相等时(A点和C点),系统才能达到平衡。然而在此状态下,左心房压力(C点)仍高于右心房压力(A点)。这正是正常情况下普遍存在的关系。
• 图18.13 右心室和左心室输出量分别与右心房和左心房平均压的关系。在任何给定的心输出量水平下,左心房平均压(如C点)始终高于右心房平均压(A点)。
临床意义
左心房压高于右心房压的事实解释了以下临床现象:在具有先天性房间隔缺损(atrial septal defects)且左右心房通过未闭卵圆孔(patent foramen ovale)相通的个体中,分流血流方向通常为从左心向右心流动。
频率诱导的调节机制
心肌收缩频率的变化也可调节心肌功能。图18.14显示了收缩频率变化对等长收缩乳头肌(isometrically contracting papillary muscle)产生张力的影响。初始状态下,心肌每20秒被刺激收缩一次。当突然将收缩频率改为每0.63秒一次时,产生的张力在后续数次收缩中逐步增强。达到新的稳态时,产生的张力比长收缩间期时的张力高出五倍以上。恢复长间期(20秒)则对张力产生具有相反影响。
收缩间期缩短引发的张力升高由细胞内[Ca²⁺](首次出现术语)浓度逐渐增加所致。两种机制共同导致细胞内[Ca²⁺]上升:每分钟去极化次数增加,以及每次去极化的Ca²⁺内向电流增强。
第一种机制中,Ca²⁺在每次动作电位平台期进入心肌细胞(参见第13和16章)。当搏动间期缩短时,每分钟的平台期次数增加。尽管随着搏动间期缩短,单个动作电位(及其平台期)持续时间会减少,但每分钟平台期次数增加对Ca²⁺内流的促进作用占主导地位,从而导致细胞内[Ca²⁺]升高。
• 图18.14 离体乳头肌收缩力(y轴)随收缩间隔从20秒变化至0.63秒再返回20秒时的改变。(改绘自Koch-Weser J, Blinks JR. Pharmacol Rev. 1963;15:601.)
在第二种机制中,当心搏间隔突然缩短时,内向钙电流(i_Ca)随着每次连续心搏逐渐增强,直至在新的基本周期长度下达到新的稳态。在离体心室肌细胞中,连续去极化时Ca²⁺内流逐渐增加(图18.15)。i_Ca幅值的增大和失活过程的减缓共同导致后续去极化过程中Ca²⁺内流量较首次去极化时更大。这种增强的Ca²⁺内流使收缩力增强。
心搏间隔的短暂改变也会显著影响收缩强度。当左心室发生期前收缩时(图18.16,心搏A),期前收缩本身(即期外收缩)较弱,而代偿间歇后的收缩(期后收缩,心搏B)则非常强健。在完整循环系统中,这种反应部分依赖于Frank-Starling机制。期前收缩前心室充盈时间不足导致其收缩力减弱,而随后伴随长代偿间歇的过度充盈(见图18.16,心搏B)则增强了期后收缩的强度。
期前收缩的弱化程度与其提前程度直接相关:期前收缩出现越早,其收缩力越弱。描述期前收缩强度与偶联间隔关系的曲线称为机械恢复曲线。图18.17显示了离体心室肌标本中获得的恢复曲线。
收缩力的恢复取决于心肌细胞收缩和舒张过程中Ca²⁺胞内循环的时程。在舒张期,从收缩蛋白解离的Ca²⁺被肌质网摄取以备下次释放。但此Ca²⁺需经历约500至800毫秒的延迟期,才能在下次去极化时从肌质网释放。因此期前收缩力减弱的原因是:前次舒张期时间过短,导致肌质网摄取的Ca²⁺中仅有少量能用于期前收缩时的释放。相反,期后收缩明显强于正常心搏,这是因为从最后一次常规心搏结束到期后收缩开始之间,肌质网有更长时间摄取大量Ca²⁺,从而释放更多Ca²⁺。
心肌性能的外源性调控
尽管完全离体的心脏能很好地适应前负荷(preload)和后负荷(afterload)的变化,但个体中仍有多种外源性因素影响心脏活动。通常,这些外源性调控机制可能压倒内源性机制。外源性调控因素可分为神经性和化学性成分。
神经调控
交感神经影响
交感神经活动增强心房和心室的收缩力。图18.18显示了在等容左心室制备中,电刺激左侧星状神经节引发的心室收缩变化。需注意,收缩期持续时间缩短,且心室舒张速率在舒张早期阶段增加;这两种效应均有助于心室充盈。对于任何给定的心动周期长度,缩短的收缩期可为舒张期留出更多时间,从而促进心室充盈。
• 图18.18 在等容左心室制备中,刺激心脏交感神经可引起左心室峰值压力及心室内压最大上升和下降速率(dP/dt)显著升高。(引自Levy MN,未发表记录。)
注:
- 首次出现的术语如“前负荷(preload)”“后负荷(afterload)”已按要求在括号中标注英文。
- 学名(如未出现)、人名(如Lee KS、Levy MN)、地名及参考文献名均保留原文未译。
- 图片链接及标注格式严格保留原Markdown语法。
- 数学符号(如\mathsf{x}-axis)保留原文格式。
交感神经活动还通过改变细胞内Ca++动态(参见第16章)来增强心肌性能。神经释放的去甲肾上腺素或循环中的儿茶酚胺与心肌细胞膜上的β-肾上腺素能受体(β-adrenergic receptors)相互作用(图18.19)。这种相互作用激活腺苷酸环化酶(adenylate cyclase),从而提高细胞内cAMP水平(参见图13.4)。结果,心肌细胞内促进多种蛋白质磷酸化的蛋白激酶被激活。
受磷蛋白(phospholamban)的磷酸化促进肌浆网对Ca++的再摄取,而肌钙蛋白I(troponin I)的磷酸化则降低收缩蛋白对Ca++的敏感性。这些效应促进舒张并降低舒张末期压力(参见第19章)。特定肌膜蛋白的磷酸化还会激活心肌细胞膜上的钙通道。
钙通道的激活增加了动作电位平台期Ca++的内流,并且每次心脏兴奋时从肌浆网释放的Ca++增多。由此增强心脏的收缩强度。图18.20显示随着异丙肾上腺素(isoproterenol)(一种β-肾上腺素能激动剂)浓度的增加,心室肌薄条收缩力与肌质中游离\left[Ca++\right](由水母素光信号指示)之间的相关性(另见图13.3)。
在完整动物中,增强心脏交感神经活动的整体效应可以通过心室功能曲线族来最佳理解。当施加于左星状神经节的电刺激频率增加时,心室功能曲线逐步左移。这些变化与去甲肾上腺素输注产生的效果类似(见图18.12)。因此,在任何给定的左心室舒张末期压力下,随着交感神经活动的增强,心室能够完成更多功。
Parasympathetic Influences
迷走神经抑制心脏起搏器、心房心肌和房室传导组织。迷走神经也抑制心室心肌,但其效应不如心房明显。在离体心脏灌流标本中,迷走神经刺激会使心室功能曲线右移,提示收缩力降低。迷走神经刺激可抑制左心室收缩力,这表现在恒定心室率下获得的压力-容积曲线中(图18.21)。迷走神经刺激的负性肌力效应(表现为收缩末期压力-容积关系斜率降低)可被毒蕈碱受体拮抗剂(muscarinic receptor antagonist)拮抗,并被β-肾上腺素受体拮抗剂减弱。结果表明迷走神经刺激通过至少两条通路降低心脏收缩力。
化学调控
肾上腺髓质激素
• 图18.19 心脏功能神经调控中交感与副交感系统相互作用的中间神经元及细胞内机制。AC,腺苷酸环化酶(adenylate cyclase);ACh,乙酰胆碱(acetylcholine);ATP,三磷酸腺苷(adenosine triphosphate);β,β-肾上腺素受体(β-adrenergic receptor);βγ,β/γ亚基;cAMP,环磷酸腺苷(cyclic adenosine monophosphate);Gs和Gi,刺激性及抑制性G蛋白(stimulatory and inhibitory G proteins);M,毒蕈碱受体(muscarinic receptor);NE,去甲肾上腺素(norepinephrine);NPY,神经肽Y(neuropeptide Y)。(改编自Levy MN. 载于:Kulbertus HE, Franck G主编. 神经心脏病学. Mt. Kisco, NY: Futura; 1988.)
• 图18.20 不同浓度异丙肾上腺素(Iso)对注射水母发光蛋白(aequorin)的大鼠心室肌中水母发光蛋白光信号(单位:纳安)及收缩力(单位:毫牛/平方毫米)的影响。水母发光蛋白光信号反映细胞内[Ca²⁺]的瞬时变化。μM,微摩尔浓度。(改编自Kurihara S, Konishi M. Pflügers Arch. 1987;409:427.)
• 图18.21 迷走神经刺激降低心室收缩力。人类心脏直视手术前在恒定心室率下测得的心室压力-容积曲线。A,对照压力-容积曲线通过下腔静脉闭塞时计算获得。由直线斜率定义的收缩末期压力-容积关系约为4 mmHg/mL。B,左迷走神经刺激期间,收缩末期压力-容积关系斜率降至约3 mmHg/mL,提示收缩力降低。LV,左心室。(重绘自Lewis ME, Al-Khalidi AH, Bonser RS, 等. Vagus nerve stimulation decreases left ventricular contractility in vivo in the human and pig heart. J Physiol. 2001;534:547.)
图18.19展示了迷走神经对心室心肌作用的机制。迷走神经释放的乙酰胆碱(ACh)通过与心室细胞膜上的毒蕈碱受体(M受体)相互作用,抑制腺苷酸环化酶(adenylate cyclase)及cAMP/蛋白激酶A级联反应。这种直接抑制作用可降低细胞膜的Ca²⁺电导,减少钙通道磷酸化,从而降低心肌收缩力。迷走神经释放的ACh还能通过激活邻近交感神经上的毒蕈碱受体抑制去甲肾上腺素(norepinephrine)释放,这是一种间接抑制机制。因此,迷走神经活动可通过拮抗伴随的交感神经活动对心室收缩力的兴奋作用来部分降低心室收缩力。类似地,交感神经释放的去甲肾上腺素及某些神经肽(包括神经肽Y)可抑制邻近迷走神经纤维释放ACh(见图18.19)。
肾上腺髓质
肾上腺髓质本质上属于自主神经系统(ANS)的组成部分(参见第11和43章)。肾上腺髓质分泌的主要激素是肾上腺素(epinephrine);同时也会释放少量去甲肾上腺素(norepinephrine)。肾上腺髓质分泌这些儿茶酚胺(catecholamines)的速率受交感神经系统活性的调控机制调节。因此,在激活交感神经系统的相同条件下,血液中儿茶酚胺的浓度会升高。然而,在正常情况下,循环儿茶酚胺对心血管系统的作用可能微乎其微。此外,例如运动引起的心肌收缩力显著变化,主要是由心脏交感神经纤维释放的去甲肾上腺素介导,而非肾上腺髓质释放的儿茶酚胺。
肾上腺皮质激素
关于肾上腺皮质类固醇如何影响心肌收缩力仍存在争议。与正常动物相比,从肾上腺切除动物获取并置于组织浴中的心肌在受到刺激时更容易出现疲劳。但在某些物种中,肾上腺皮质激素能增强收缩力。此外,糖皮质激素氢化可的松(hydrocortisone)能增强儿茶酚胺的强心作用。这种增强作用部分是通过肾上腺皮质类固醇抑制神经元外儿茶酚胺摄取机制的能力实现的。
临床视角
甲状腺激素能增强心肌收缩力。甲状腺功能亢进时,肌浆网对ATP水解和Ca²⁺摄取速率增加;甲状腺功能减退时则出现相反效应。甲状腺激素增加心脏蛋白质合成,这种反应会导致心脏肥大。这些激素还会影响心肌肌球蛋白同工酶的组成。通过增加具有最高ATP酶活性的同工酶,甲状腺激素增强了心肌收缩力。
临床视角
甲状腺功能低下(hypothyroidism)患者的心脏活动会受到抑制。而甲状腺功能亢进(hyperthyroidism)患者则呈现相反表现。典型甲亢患者会出现心动过速、高心输出量以及心房颤动等心律失常。此类患者的交感神经活性可能增强,或心脏对此类活性的敏感性可能提高。研究表明,甲状腺激素会增加心脏组织中β-肾上腺素能受体的密度(另见第42章)。在实验动物中,过量甲状腺素的给药可模拟甲亢的心血管表现。
肾上腺皮质功能不全(Addison’s disease)患者常出现心血管问题。血容量趋于下降,可能导致严重低血压和心血管衰竭,即所谓的Addison危象(参见第43章)。
细胞层面
甲状腺激素
甲状腺激素通过两种途径发挥其心脏作用:基因组(genomic)和非基因组(nongenomic)。基因组途径涉及甲状腺素(thyroxine,\mathsf{T}_{3})与核受体的相互作用,后者调控\mathsf{T}_{3}响应基因的转录。在甲状腺功能亢进症中,参与调节细胞内\left[\mathsf{Ca}^{++}\right]的心肌细胞蛋白(如肌浆网钙-ATP酶[sarcoplasmic endoplasmic reticulum calcium-ATPase,SERCA]、兰尼碱通道[ryanodine channel])的信使mRNA水平升高,收缩蛋白(如肌球蛋白重链、肌动蛋白、肌钙蛋白I)的含量也随之增加。因此,随着ATP水解和{\sf O}_{2}消耗的增加,收缩和舒张速率加快。在甲状腺功能亢进状态下,ATP的利用效率较低,热量散失的比例更大。若未治疗,严重的甲状腺功能亢进可导致心力衰竭。
Thyroid Hormones
甲状腺功能障碍引起的心血管变化也依赖于间接机制。甲状腺功能亢进会提高机体代谢率,进而导致小动脉舒张。如第19章所述,总外周阻力的降低会增加心输出量(CO)。
Insulin
胰岛素(Insulin)对心脏具有正性肌力作用(positive inotropic effect)。即使通过葡萄糖输注防止低血糖,并阻断\upbeta-肾上腺素能受体(\upbeta-adrenergic receptors),胰岛素的作用依然显著。实际上,\upbeta-肾上腺素能受体拮抗剂会增强胰岛素的正性肌力效应。这种收缩力的增强无法单纯通过心肌细胞葡萄糖转运的伴随性增加来合理解释。
Glucagon
胰高血糖素(Glucagon)对心脏具有强效的正性肌力和正性变时作用(positive chronotropic effect)。这种内源性激素在心血管系统的正常调节中可能并不重要,但已被临床用于增强心脏功能。胰高血糖素对心脏的作用及某些代谢效应与儿茶酚胺类似。胰高血糖素和儿茶酚胺均通过激活腺苷酸环化酶(adenylate cyclase)来提高心肌细胞内的cAMP水平。儿茶酚胺通过与\upbeta-肾上腺素能受体相互作用激活腺苷酸环化酶,而胰高血糖素通过不同机制激活该酶。尽管如此,与儿茶酚胺类似,cAMP的升高会增加肌膜(sarcolemma)钙通道的Ca++内流,并促进肌浆网释放和重摄取Ca++。
Anterior Pituitary Hormones
垂体功能减退(hypopituitarism)引起的心血管紊乱主要与肾上腺皮质和甲状腺功能缺陷相关。生长激素(growth hormone)至少在与甲状腺素(thyroxine)协同作用时会影响心肌。在切除垂体的动物中,单独使用生长激素对心脏功能低下的改善作用微弱,而单独使用甲状腺素可在基础条件下恢复足够的心脏功能。然而,当血容量或外周阻力增加时,单独使用甲状腺素无法恢复足够的心脏功能,但生长激素与甲状腺素联用可重建正常心脏功能。在某些心力衰竭动物模型中,单独给予生长激素可增加心输出量和心肌收缩力。
Blood Gases
本章前文已描述了由中枢及外周化学感受器刺激引起的心脏功能变化。这些效应通常占据主导地位。然而,O2和\mathrm{CO}_{2}确实对心肌具有直接作用。
氧
缺氧对心肌功能具有双相效应。轻度缺氧可增强心肌功能,而严重缺氧则因氧化代谢受限而抑制心肌功能。
二氧化碳与酸中毒
二氧化碳分压(partial pressure of carbon dioxide,{\mathrm{Pco}}_{2})升高——导致pH值下降——对心脏具有直接的抑制作用。该效应通过细胞内pH值(pH)变化介导。由Pco2升高引起的细胞内pH降低,会减少兴奋时肌质网(sarcoplasmic reticulum)释放的Ca++量。pH值降低还会减弱肌丝对Ca++的敏感性。而细胞内pH值升高则具有相反效应,即增强对Ca++的敏感性。
外周循环调节
外周循环本质上受双重调控:中枢通过神经系统调控,局部通过血管周围组织的状况调控。第14章(见图14.8和表14.1)描述了血管平滑肌的神经和体液调节机制,其中讨论了递质、激素及其受体。局部调控的各个方面将在第17章讨论,该章节将展示这两种调控机制在不同组织中的相对重要性。
小动脉参与全身血流速率的调节。这些血管对心脏泵向组织的血液流动产生最大阻力,因此在维持动脉血压中起重要作用。小动脉壁主要由允许管腔直径变化的平滑肌纤维构成(见图15.2)。当该平滑肌强烈收缩时,内皮内褶会完全闭塞管腔。当平滑肌完全舒张时,管腔达到最大扩张。部分阻力血管在特定时刻处于关闭状态。此外,这些血管的平滑肌保持部分收缩状态(即血管张力)。若全身阻力血管同时扩张,动脉血压将急剧下降。
血管平滑肌控制着总外周阻力、动静脉张力以及全身血流量分布。第14章讨论了血管平滑肌的特性。以下章节将回顾血管平滑肌张力的内在与外在调控,以及外周组织灌注的调节机制。
外周血流的内在或局部调控
自身调节与肌源性调节
在某些组织中,血流会根据组织现有的代谢活动进行调整。此外,当组织代谢稳定时,灌注压(动脉血压)的变化会引发血管阻力的改变,从而维持恒定的血流量。这种肌源性机制(myogenic mechanism)如图18.22所示,通常称为血流自动调节(autoregulation)。当压力从对照水平的100毫米汞柱(mmHg)突然升高或降低时,血流量会相应增加或减少。然而,即使压力维持在新的水平,血流也会在30至60秒内恢复到对照水平。
在20至120毫米汞柱的压力范围内,稳态血流相对恒定。通过计算血管床在稳态条件下的液压阻力(hydraulic resistance)(压力/流量)发现:阻力血管会随着灌注压升高而收缩,随着灌注压降低而扩张。这种对灌注压的响应不依赖于内皮细胞,因为在完整血管和去除内皮的血管中反应是相同的。根据肌源性机制,血管平滑肌会因血管壁两侧压力差(透壁压,transmural pressure)增加而收缩,因透壁压降低而舒张。目前尚不清楚血管扩张引发收缩的信号机制。然而,由于血管平滑肌的牵拉已被证明会提高细胞内[Ca⁺⁺]浓度,因此认为透壁压增加会激活膜钙通道。
• 图18.22 骨骼肌血管床的压力-流量关系。填充(红色)圆点表示灌注压从对照水平(线条交叉点)突然改变后立即获得的流量速率。空心(蓝色)圆点表示在新灌注压下获得的稳态流量速率。(改绘自Jones RD, Berne RM. Circ Res. 1964;14:126.)
细胞水平
瞬时受体电位(transient receptor potential, TRP)通道被认为参与肌源性机制。这些通道是黑腹果蝇(Drosophila melanogaster)基因的哺乳动物同源物,当该基因突变时,仅能对持续光刺激产生短暂反应。动脉的压力诱导性血管收缩反应(肌源性反应)似乎具有以下信号通路:压力→磷脂酶C活性增加→二酰甘油合成→TRP通道激活→平滑肌去极化及L型钙通道开放→细胞内[Ca⁺⁺]浓度和肌张力增加。这是调节血管阻力的一种方式。其他类型的TRP通道已被提出参与慢性缺氧性肺动脉高压和由α-肾上腺素能激动剂去甲肾上腺素引起的血管收缩。
在正常个体中,血压通过压力感受器反射(baroreceptor reflex)维持在一个相当恒定的水平。因此,在正常情况下,肌源性机制(myogenic mechanism)可能在调节组织血流中作用甚微。然而,当个体从卧位转变为立位时,下肢的跨壁压(transmural pressure)升高,毛细血管前血管会因这种机械牵张而发生收缩。
内皮介导的调节(Endothelium-Mediated Regulation)
如第17章所述,血管系统的内皮层(endothelium)能够产生多种可舒张(如一氧化氮)或收缩(如血管紧张素II和内皮素)血管平滑肌的物质。因此,内皮在调节特定血管床的血流中发挥重要作用。
代谢调节(Metabolic Regulation)
组织的代谢活动决定了该组织的血流。任何导致氧(O2)供应不足的干预措施都会促使血管舒张代谢物(vasodilator metabolites)的形成,这些代谢物从组织中释放并在局部作用于阻力血管使其扩张。当组织代谢率升高,或组织氧输送减少时,会释放更多的血管舒张物质(参见第17章)。
候选血管舒张物质(Candidate Vasodilator Substances)
钾离子、无机磷酸盐离子以及间质液渗透压可诱导血管舒张。骨骼肌收缩时:(1)K+和磷酸盐被释放;(2)渗透压升高。因此,这些因素可能参与活动性充血(active hyperemia,由组织活动增强引起的血流增加)。然而,在肌肉收缩过程中并非总能观察到磷酸盐浓度和渗透压的显著升高,且它们可能仅短暂增加血流。因此,这些因素可能不介导肌肉活动期间观察到的血管舒张。
骨骼肌收缩开始或心肌活动增强时,钾离子会被释放。因此,K+的释放可能是运动或心脏做功增加时观察到的血管阻力初始下降的基础。然而,K+的释放并不持续,而小动脉扩张在肌肉活动增强期间持续存在。此外,从活动的心肌和骨骼肌获得的再氧合静脉血,在注入测试血管床时并不会引发血管舒张。静脉血再氧合不太可能改变其K+、磷酸盐含量或渗透压从而中和其血管舒张效应。因此,必须有K+以外的某种物质介导组织代谢活动相关的血管舒张。
参与冠脉血流调节的腺苷(adenosine)可能也参与骨骼肌阻力血管的调控。此外,某些前列腺素(prostaglandins)可能在特定血管床中作为重要的血管舒张介质。因此,多种前列腺素被提出作为代谢性血管舒张的介质,但各自的相对贡献仍有待阐明。
基础血管张力(Basal Vessel Tone)
markdown 通过释放血管舒张物质(vasodilator substance)对血管阻力进行代谢控制,需要存在基础血管张力(basal vessel tone)。血管平滑肌的紧张性活动易于证实,但与骨骼肌的紧张性不同,血管平滑肌的紧张性与神经系统无关。因此,某些代谢因子必然负责维持这种紧张性。可能涉及以下因素:(1) 对血压施加的牵张产生的肌源性反应(myogenic response),(2) 动脉血中氧分压({\mathrm{Pao}}_{2})较高,或 (3) Ca++ 的存在。
反应性充血(Reactive Hyperemia)
若暂时阻断流向某血管床的动脉血流,解除阻断后的血流会立即超过阻断前的水平,并逐渐恢复到对照水平。这种血流增加称为反应性充血(reactive hyperemia)。此类现象为存在调节组织血流的局部代谢因子提供了证据。
图18.23所示的实验中,通过夹闭股动脉(femoral artery)15秒、30秒和60秒以阻断下肢血流。解除60秒阻断后,峰值血流比对照血流增加70%,并在110秒内恢复到对照水平。
在一定范围内,峰值血流(尤其是反应性充血的持续时间)与阻断时长成正比(见图18.23)。若在阻断期间使肢体运动,反应性充血会增强。这些观察结果以及未阻断肢体中代谢活动与血流之间的密切关系,支持局部组织血流调节存在代谢机制的观点。
• 图18.23 股动脉阻断15秒、30秒和60秒后,下肢反应性充血的曲线图。(From Berne RM. Unpublished observations.)
动脉与小动脉舒张的协调
当小动脉血管平滑肌因血管舒张代谢物(vasodilator metabolites)的作用而松弛(这些代谢物的释放由组织O2供应与O2需求比值下降引发),供应这些小动脉的上游小动脉的阻力可能同时降低。其结果产生的血流大于仅由小动脉舒张产生的血流。动脉与小动脉舒张的协调可能存在两种机制:第一,微血管的血管舒张可能具有传播性,当小动脉开始舒张时,舒张可沿血管从小动脉逆向传播至小动脉;第二,代谢物介导的小动脉舒张加速了供血动脉的血流。这种增大的血流速度增加了动脉内皮上的剪切应力,继而通过释放一种或多种血管舒张物质(如:一氧化氮、前列环素、{\mathrm{H}}_{2}O2、环氧二十碳三烯酸)引发血流介导的血管舒张。
IN THE CLINIC
外周血流的神经外源性调控
交感神经性血管收缩
脑髓质中的多个区域可影响心血管活动。刺激延髓背外侧区(加压区)会引起血管收缩、心率加快以及心肌收缩力增强。刺激加压区尾侧和腹内侧的脑中枢可降低动脉血压。该减压区通过直接抑制脊髓区域和抑制延髓加压区来发挥作用。这些区域并非解剖学上可辨识的独立细胞群构成的"真实中枢",而是构成了"生理性"中枢。
脑脊髓血管收缩区具有紧张性活动。增强该区域活动的反射或体液刺激会增加到达血管末梢神经分支的冲动频率。末梢释放的缩血管神经递质(norepinephrine)通过作用于阻力血管的α-肾上腺素能受体引发收缩效应。抑制血管收缩区可减少传出神经纤维的冲动频率,从而导致血管舒张。因此,外周循环的神经调节主要通过改变血管交感神经的冲动频率实现。手术切断肢体交感神经可消除交感血管张力,从而增加该肢体的血流量。随着时间的推移,血管张力会通过基础(内在)张力的增加而恢复。
加压区和减压区的紧张性活动都可能发生节律性变化,表现为动脉血压的波动。某些节律性变化(Traube-Hering波)以呼吸频率出现,由交感神经向阻力血管发出的冲动发生周期性波动所致。其他交感神经活动的波动(Mayer波)出现频率低于呼吸频率。
交感缩血管神经对阻力血管和容量血管的影响
交感神经系统的缩血管纤维分布有动脉、微动脉和静脉;与微动脉和小动脉相比,大血管受神经影响要小得多。容量血管(veins)对交感神经刺激的反应比阻力血管更强;容量血管在较低的刺激频率下即可达到最大程度的收缩,而阻力血管需要更高的频率。然而,容量血管缺乏\upbeta-肾上腺素能受体,因此对血管舒张代谢物的反应较弱。去甲肾上腺素(norepinephrine)是血管交感神经末梢释放的神经递质。循环激素(尤其是局部释放物质)等因素介导着神经末梢去甲肾上腺素的释放。
图18.24展示了阻力血管和容量血管对交感神经纤维刺激的反应。当动脉压保持恒定时,刺激交感神经纤维会减少血流量(阻力血管收缩)并降低组织血容量(容量血管收缩)。阻力血管收缩会重新建立毛细血管壁滤过和吸收力的平衡(见公式17.20)。
• 图18.24 交感神经刺激(2Hz)对下肢血流量和组织容积的影响。上箭头表示在容量血管排空引起的容积减少停止、血管外液流失开始显现时,组织容积曲线斜率的改变。组织容积的骤降是由于血液从容量血管和下肢流出所致。后期缓慢渐进性的容积下降(箭头右侧)则是由于血管外液进入毛细血管并从组织内移出。组织液的流失源于阻力血管收缩导致的毛细血管静水压降低。(From Mellander S. Acta Physiol Scand Suppl. 1960;50[176]:1.)
除血管口径的主动变化(血管平滑肌收缩和舒张)外,管腔内压的改变也会引起被动变化。管腔内压升高会使血管扩张,而压力下降则因血管壁弹性回缩导致口径缩小。
在基础血管张力下,当交感神经以生理频率受刺激时,可动员组织约三分之一的血容量。容量血管的基础张力非常低;若通过实验去除这些血管的神经支配,即使给予最大剂量的ACh(acetylcholine)也只能引发微小的容积变化。因此,在基础血管张力状态下,血容量接近组织的最大血容量。皮肤容量血管比肌肉容量血管能动员更多血液。这种差异部分源于皮肤血管对交感刺激更高的敏感性,但也是由于皮肤血管的基础张力低于肌肉血管。因此,在无神经影响时,皮肤容量血管比肌肉容量血管容纳更多血液。
生理性刺激可动员容量血管(capacitance vessels)中的血液。例如,在体力活动期间,交感神经纤维的激活会使外周静脉收缩,从而增强心脏充盈压。在动脉低血压(如出血时)情况下,容量血管收缩,从而纠正与失血相关的中心静脉压下降。
副交感神经影响
副交感神经系统(parasympathetic nervous system)颅部的传出纤维支配头部和部分内脏的血管,而骶部的纤维则支配生殖器、膀胱和大肠的血管。骨骼肌和皮肤不接受副交感神经支配。胆碱能纤维对总血管阻力的影响较小,因为体内仅小部分阻力血管接受副交感神经纤维支配。
临床应用
在失血性休克中,阻力血管收缩从而协助维持正常动脉血压。动脉低血压时,增强的小动脉收缩还可通过降低腔内压时微动脉后血管的弹性回缩作用,从组织中少量动员血液。此外,由于毛细血管静水压降低导致毛细血管对液体吸收增加,细胞外液被动员。
刺激唾液腺的副交感神经纤维会引起显著血管舒张。这种血管舒张由缓激肽(bradykinin)介导——该血管舒张多肽由淋巴管内酶作用于血浆蛋白底物局部生成。缓激肽也存在于其他外分泌腺(如泪腺和汗腺)中。其在汗液中的存在可能是皮肤血管扩张的部分原因。除缓激肽外,副交感神经纤维还释放另一种血管舒张剂——血管活性肠肽。神经元释放的ACh通过刺激内皮细胞分泌一氧化氮(NO)也能引起血管舒张(见第17章)。
体液因子
肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)对外周血管具有强大作用。如表14.1所示,在骨骼肌中,低浓度肾上腺素通过β₂-肾上腺素能效应扩张阻力血管,而高浓度则通过α₁-肾上腺素能效应引起收缩。在所有血管床中,去甲肾上腺素的主要效应是血管收缩。受刺激时,肾上腺可向体循环释放肾上腺素和去甲肾上腺素。然而在生理条件下,肾上腺髓质释放儿茶酚胺的效应弱于交感神经末梢释放的去甲肾上腺素。
局部体液物质在调节血管张力中起重要作用(表14.1)。部分物质由内皮释放(如一氧化氮、内皮素、血栓素A₂),另一些则来源于血管周围组织(如组胺、腺苷、血管紧张素II)。
血管反射
动脉压力感受器
压力感受器(或机械感受器)是位于颈动脉窦(carotid sinuses)和主动脉弓(aortic arch)的牵张感受器(图18.25和18.26)。颈动脉窦是颈内动脉起始处的轻微膨大区域。颈动脉窦产生的冲动通过颈动脉窦神经(Hering神经)传递至舌咽神经(cranial nerve IX),并经由后者到达延髓的孤束核(nucleus of the tractus solitarius, NTS)。NTS是化学感受器和压力感受器在中枢的投射位点。刺激NTS会抑制外周血管的交感神经传出(减压效应),而NTS的损伤则会引起血管收缩(加压效应)。主动脉弓压力感受器产生的冲动通过迷走神经的传入纤维到达NTS。
颈动脉窦和主动脉弓壁内的压力感受器神经末梢可响应动脉血压变化引起的血管牵张和形变。这些神经的放电频率随动脉血压升高而增加,随动脉血压降低而减少。当动脉压力升高时,冲动频率的增加会抑制脑部血管收缩区域,导致外周血管舒张和动脉血压下降。迷走神经心脏分支激活引起的心动过缓也参与这一降压过程。
颈动脉窦压力感受器比主动脉弓压力感受器更敏感。颈动脉窦压力的变化对全身动脉压和外周阻力的影响程度,比同等程度的主动脉弓压力变化更大。
颈动脉窦壁的受体对搏动性压力的响应强于恒定压力。如图18.27所示:在平均动脉血压正常水平(≈100 mmHg)时,窦神经单根纤维的冲动爆发由收缩早期的压力上升触发;在收缩晚期和舒张早期仅出现少量动作电位。当动脉压较低时,这种阶段性变化更为明显,但总体放电频率降低。诱发窦神经冲动的最低血压阈值约为50 mmHg;最大持续放电发生在约200 mmHg时。由于压力感受器具有适应性,在任何平均动脉压水平下,它们对高脉压的响应强于低脉压。
• 图18.25 颈动脉窦、颈动脉体及其神经支配示意图。(改绘自Adams WE. The Comparative Morphology of the Carotid Body and Carotid Sinus. Springfield, IL: Charles C Thomas; 1958.)
• 图18.26 主动脉弓前视图显示主动脉体(aortic bodies)和压力感受器的神经支配。(修改自Nonidez JF. Anat Rec. 1937;69:299)
• 图18.27 不同平均动脉压水平下,颈动脉窦(carotid sinus)单根传入神经纤维放电与主动脉血压时相性变化的关系。
颈动脉窦压力降低引发的血管阻力增加在不同外周血管床之间存在差异。这种差异性使得血流能够重新分布。改变颈动脉窦压力所引起的阻力变化在股血管最大,肾血管次之,肠系膜和腹腔血管最小。
此外,颈动脉窦反射的敏感性可以发生改变。局部应用去甲肾上腺素(norepinephrine)或刺激颈动脉窦交感神经纤维可增强其受体敏感性,使得特定程度的窦内压升高会产生更强的降压反应。高血压时压力感受器敏感性降低,因为高动脉压导致颈动脉窦变得更僵硬。因此,特定程度的颈动脉窦压力升高所引发的全身动脉压下降幅度,会小于正常血压水平时的反应。由此可见,高血压时压力感受器的设定点被提高,表现为阈值升高且压力感受器对跨壁压变化的敏感性降低。正如预期,颈动脉窦去神经支配可导致暂时性高血压,某些情况下甚至出现持续性高血压。
动脉压力感受器在短期血压调节中起关键作用,可应对血容量、心输出量(CO)或外周阻力(如运动时)的急剧变化。然而,血压的长期调控(数天或数周)则由个体的体液平衡决定,即液体摄入与排出之间的平衡。迄今为止,调控体液容量(进而调控血压)最重要的器官是肾脏(另见第35章)。
心肺压力感受器(Cardiopulmonary Baroreceptors)
心肺感受器位于心房、心室和肺血管中。这些压力感受器由迷走神经和交感神经传入纤维支配。心肺反射具有紧张性活动,能够通过改变外周阻力来响应心内压、静脉压或肺血管压的变化。
心房包含两种类型的心肺压力感受器:一种在房缩期(atrial systole)因心房张力激活(A型受体),另一种在房舒期(atrial diastole)因心房牵张激活(B型受体)。刺激这些心房感受器可通过迷走神经纤维向延髓迷走中枢发送冲动,从而减少肾脏交感神经活动,同时增加窦房结交感神经活动。这些交感神经活动的变化可增加肾血流量、尿量和心率(HR)。
心肺感受器(cardiopulmonary receptors)的激活还能通过抑制脑髓质中的血管收缩中枢引发反射性动脉血压降低。心肺感受器的刺激可抑制血管紧张素(angiotensin)、醛固酮(aldosterone)和血管加压素(vasopressin)(抗利尿激素)的释放;反射通路的阻断则会产生相反效应。
这些压力感受器激活在血容量调节中的作用在机体对出血的反应中尤为明显。血容量减少(低血容量)可增强肾脏交感血管收缩,促进肾素(renin)、血管紧张素、醛固酮和血管加压素的分泌(参见第35章)。肾血管收缩(主要为入球小动脉)会降低肾小球滤过率,并增加肾脏肾素释放。肾素作用于血浆底物生成血管紧张素II,后者刺激肾上腺皮质分泌醛固酮。血管加压素释放增加可减少肾水排泄,醛固酮释放则减少肾脏NaCl排泄。肾脏通过保水保盐使血容量增加。血管紧张素II(由血管紧张素I经血管紧张素转化酶作用生成)还可提高全身小动脉张力(见表14.1)。
临床视角
部分个体的颈动脉窦对外界压力异常敏感。因此,过紧的衣领或其他形式施加于颈动脉窦区域的外部压力可能引发显著低血压和晕厥。这种超敏反应被称为颈动脉窦综合征(carotid sinus syndrome)。
外周化学感受器
外周化学感受器由主动脉弓区域(主动脉体;见图18.26)和紧邻颈动脉窦内侧(颈动脉体;见图18.25)的小型高血管化结构组成。这些血管性结构对动脉血氧分压(Po₂)、二氧化碳分压(Pco₂)和pH值变化敏感。虽然主要调节呼吸,但也影响血管运动中枢。动脉血氧分压(Pao₂)降低可刺激化学感受器。来自颈动脉体和主动脉体的传入神经活动增强会刺激血管收缩区域,从而提高阻力血管和容量血管的张力。
动脉血二氧化碳分压(Paco₂)升高和pH值降低同样会刺激化学感受器。然而与高碳酸血症(PaCO₂升高)和酸中毒对髓质血管运动中枢的直接作用相比,这种反射效应较弱。当低氧和高碳酸血症同时发生时,化学感受器的效应会超过两者单独作用的总和。
心脏也存在化学感受器。这些心脏化学感受器可被心肌缺血激活,并传导因心肌供血不足引起的心前区疼痛(心绞痛)。
下丘脑
心血管反射的最优功能需要脑桥和下丘脑结构的完整性。此外,这些结构负责心血管系统的行为与情绪调控(另见第11章)。刺激前下丘脑(anterior hypothalamus)会引起血压下降和心动过缓,而刺激下丘脑后外侧区(posterolateral hypothalamus)则会升高血压和心率。下丘脑还包含一个温度调节中枢,可影响皮肤血管。通过皮肤冷刺激或灌注下丘脑的血液冷却进行刺激时,会引起皮肤血管收缩和热量保存;而皮肤热刺激则导致皮肤血管舒张和增强散热。
大脑
大脑皮层(cerebral cortex)也影响体内血流分布。刺激运动区和前运动区(motor and premotor areas)会影响血压,通常引发加压反应(pressor response)。但血管舒张和减压反应(depressor response)也可能被诱发,例如情绪刺激引起的脸红或晕厥。
皮肤与内脏
疼痛刺激可引发加压或减压反应,具体取决于刺激强度和部位。内脏扩张常诱发减压反应,而体表疼痛刺激通常引发加压反应。
肺反射
肺扩张会启动一个反射,引发全身血管舒张和动脉血压下降。相反,肺萎陷会引起全身血管收缩。介导此反射的传入纤维位于迷走神经,可能也存在于交感神经中。肺部牵张刺激这些纤维会抑制血管运动中枢(vasomotor areas)。肺扩张引起的减压反应幅度与扩张程度及现有血管收缩张力(vasoconstrictor tone)水平直接相关(另见第25章)。
中枢化学感受器
Pco2升高会刺激延髓化学敏感区(中枢化学感受器,central chemoreceptors),引发血管收缩和外周阻力(peripheral resistance)增加。将Pco2降至正常水平以下(如过度通气时)会减少延髓这些区域的紧张性活动,从而降低外周阻力。化学敏感区也受pH变化影响:血液pH降低会刺激这些脑区,而pH升高则抑制其活动。Pco2和血液pH的变化效应可能通过改变脑脊液pH实现,呼吸中枢(respiratory center)的作用机制可能与此类似。
\mathrm{Pao}_{2}对延髓血管运动区(medullary vasomotor region)几乎没有直接影响。缺氧(hypoxia)的主要效应通过颈动脉和主动脉化学感受器(carotid and aortic chemoreceptors)介导的反射实现。\mathrm{Pao}_{2}中度降低会刺激血管运动区,但严重降低则会抑制血管运动活动——这与大脑其他区域在极低O2张力下的抑制方式相同。
外周血流调节中外源性与内源性因素的平衡
临床相关
由于颅内肿瘤扩张施加过度压力可能引发的脑缺血,会导致外周血管收缩显著增强。这种刺激作用可能源于局部二氧化碳(CO₂)的积聚和氧气(O₂)的减少,也可能由颅内压力感受器的兴奋所引起。若发生长期严重缺血,中枢抑制最终会占主导地位,导致血压下降。
在脑和心脏这类对血液供应减少耐受性有限的重要器官中,内在血流调节机制(intrinsic flow-regulating mechanisms)占据主导地位。例如,在严重急性出血时,通过交感神经引发的血管收缩区(vasoconstrictor region)大量放电,对脑和心脏的阻力血管影响微乎其微,而皮肤、肾脏和内脏(splanchnic)血管则会发生强烈收缩。
在皮肤中,外在血管调控(extrinsic vascular control)占主导地位。皮肤血管不仅会强烈参与全身性血管收缩放电,还能通过下丘脑通路进行选择性反应,以参与体温调节所需的散热和保温功能。然而,局部温度变化可通过改变或覆盖中枢对阻力血管和容量血管(capacitance vessels)的影响来引发内在调控(另见第17章)。
• 图18.28 血管舒缩区(vasomotor region, VR)神经输入与输出示意图。箭头表示神经输入和输出方向。N,舌咽神经(Glossopharyngeal nerve);↑PCO₂,二氧化碳分压升高;↓PCO₂,二氧化碳分压降低;↑PO₂,氧气分压升高;↓PO₂,氧气分压降低;SA,窦房结(sinoatrial);X,迷走神经(vagus nerve)。
外周血管通过内在(intrinsic)和外在(extrinsic)机制的双重控制,可引发多种重要的血管调节。这种调控机制使机体能够将血流导向最需要的区域,同时减少对需求较低区域的供血。在某些组织中,外在和内在机制的作用比例是固定的;而在其他组织中,该比例可随组织活动状态的变化而改变。
在骨骼肌中,外源性(extrinsic)和内源性(intrinsic)机制会相互作用。静息状态的骨骼肌中,神经调控(血管收缩张力,vasoconstrictor tone)占主导地位——切断组织的交感神经后血流量立即大幅增加的现象可证明这一点。运动开始后,内在血流调节机制接管控制,由于代谢产物的局部增加,活动肌肉发生血管舒张。非活动组织则因全身性交感神经放电而出现血管收缩。然而,到达活动肌肉阻力血管的收缩冲动会被局部代谢效应所覆盖。这种双重控制机制的运行从而增加了需要部位的血液流量,并将其从相对不活跃的区域分流(另见第17章)。
类似效应也可能由Pco2升高引发。通常情况下,运动相关的过度通气会使Pco2维持在正常水平。但如果Pco2升高,由于\mathrm{CO}_{2}刺激延髓血管收缩区,将发生全身性血管收缩。在\mathrm{[CO}_{2}\mathrm{]}最高的活动肌肉中,小动脉平滑肌会因局部Pco2而松弛。影响血管运动区及受其影响的因素总结于图18.28。
关键要点
- 心脏功能通过多种内源性和外源性机制调节。调节心肌收缩的主要内源性机制是弗兰克-斯塔林机制(Frank-Starling mechanism)和速率诱导调节(rate-induced regulation)。
- 心率(HR)主要由自主神经系统(ANS)调节。交感神经活动提高心率,而副交感(迷走)神经活动降低心率。当两个系统同时激活时,迷走效应通常占优势。自主神经系统主要通过腺苷酸环化酶系统改变细胞膜的Ca++电导来调节心肌性能。
- 调节心率的反射包括压力感受器反射、化学感受器反射、肺膨胀反射、心房受体(Bainbridge)反射和心室受体反射。
- 某些激素(如肾上腺素、肾上腺皮质激素、甲状腺激素、胰岛素、胰高血糖素和垂体前叶激素)可调节心肌性能。动脉血中O2、\mathrm{CO}_{2}和\mathrm{H^{+}}浓度的变化会直接改变心脏功能,并通过化学感受器间接影响。
- 小动脉(阻力血管)主要通过其下游毛细血管调节血流量。构成小动脉壁大部分的平滑肌会对神经和体液刺激产生收缩和舒张反应。血流的神经调节几乎完全由交感神经系统完成。支配血管的交感神经具有紧张性活动;抑制延髓血管收缩中枢可降低外周血管阻力。交感神经刺激会收缩阻力血管和容量血管(静脉)。副交感纤维支配头部、内脏和生殖器,但不支配皮肤和肌肉。
