第九章 表皮
术语表皮(epidermis)指的是初生植物体最外层的细胞。它源自希腊语epi,意为“在...之上”,和derma,意为“皮肤”。在本书中,术语表皮指的是初生植物体所有部分的最外层细胞,包括根、茎、叶、花、果实和种子。然而,根冠(rootcap)上被认为没有表皮,顶端分生组织(apical meristems)上也没有分化为表皮。
茎的表皮来源于顶端分生组织的最外层细胞。在根中,表皮可能与根冠细胞有共同的起源,或者从皮层(cortex)的最外层细胞分化而来(第6章;Clowes, 1994)。茎和根表皮起源的差异使一些研究者认为根的表层应该有自己的名称,即根表皮(rhizodermis)或根被(epiblem)(Linsbauer, 1930; Guttenberg, 1940)。尽管起源不同,根和茎的表皮之间存在连续性。如果术语表皮和原表皮(protoderm)(用于未分化的表皮)仅用于形态学-地形学的意义上,并且忽略起源问题,这两个术语可以广泛用于指代整个植物的初生表面组织。
几乎没有或没有次生生长的器官通常在其存在期间保留其表皮。一个显著的例外是长寿的单子叶植物,它们没有次生维管系统的增加,但用一种特殊类型的周皮(periderm)取代了表皮(第15章)。在木本根和茎中,表皮的寿命取决于周皮形成的时间。通常,周皮在木本茎和根生长的第一年出现,但许多树种直到其轴比初生生长完成时厚许多倍时才产生周皮。在这些植物中,表皮以及下面的皮层继续生长,从而与维管柱(vascular cylinder)的周长增加保持同步。单个细胞在切向上扩大并在径向上分裂。这种延长生长的一个例子见于条纹枫(Acer pensylvanicum; syn. A. striatum)的茎中,其树干大约20年时可能达到约$20\mathrm{cm}$的厚度,但仍然保留着原始的表皮(de Bary, 1884)。这种老表皮的细胞并不...
图9.1
玉米(Zea mays)叶片的横切面显示叶片两侧均为单层表皮(epidermis)。此处可见一个气孔(stoma)(箭头所示)。不同大小的维管束(vascular bundles)由显著的维管束鞘(bundle sheaths, bs)与叶肉(mesophyll)分隔开。(引自Russell和Evert,1985,图1。$\copyright$ 1985,Springer-Verlag。)
在厚度为$5\mathrm{mm}$的轴中,表皮细胞的切向宽度是其两倍以上。这种大小关系清楚地表明,表皮细胞在茎增厚的过程中持续分裂。另一个例子是Cercidium torreyanum,这种树大部分时间无叶,但具有绿色的树皮和持久的表皮(Roth,1963)。
表皮通常由一层细胞组成(图9.1)。在某些叶片中,原表皮细胞(protodermal cells)及其衍生物会进行平周分裂(periclinal divisions,平行于表面分裂),从而形成由几层发育相关细胞组成的组织。(有时只有表皮的个别细胞会进行平周分裂。)这种组织被称为复表皮(multiple epidermis)或多层表皮(multiseriate epidermis)(图9.2和9.3)。兰科植物(orchids)的气生根和地生根的根被(velamen,源自拉丁语“覆盖物”)也是复表皮的一个例子(图9.2)。在叶片中,复表皮的最外层与普通的单层表皮相似,具有角质层(cuticle);内层通常含有少量或不含叶绿体(chloroplasts)。内层的一个功能是储存水分(Kaul,1977)。具有复表皮的代表性植物包括桑科(Moraceae,如大多数榕属Ficus)、海桐花科(Pittosporaceae)、胡椒科(Piperaceae,如豆瓣绿属Peperomia)、秋海棠科(Begoniaceae)、锦葵科(Malvaceae)、单子叶植物(Monocotyledoneae,如棕榈、兰科植物)等(Linsbauer,1930)。在某些植物中,表皮下层类似于复表皮,但来源于基本分生组织(ground meristem)。这些层被称为下皮层(hypodermis,源自希腊语“hypo”意为“下面”,“derma”意为“皮肤”)。对成熟结构的研究很少能确定该组织是复表皮还是表皮与下皮层的组合。只有通过发育研究才能正确揭示表皮下层的起源。
叶片中启动复表皮的平周分裂在发育过程中相对较晚发生。例如,在榕属(Ficus)中,叶片在托叶脱落之前具有单层表皮。随后,表皮细胞进行平周分裂(图9.3A)。类似的平周分裂在外层子细胞中重复发生,有时一次,有时两次(图9.3B)。在叶片扩展过程中,垂周分裂(anticlinal divisions)也会发生,并且由于这些分裂在不同层中不同步,层之间的发育关系变得模糊(图9.3B,C)。内层比外层扩展得更多,最大的细胞称为石细胞(lithocysts),它们产生一个钙化体,即钟乳体(cystolith),主要由附着在硅化柄上的碳酸钙组成(Setoguchi等,1989;Taylor, M. G.等,1993)。柄起源于细胞壁的圆柱形内生长。石细胞不分裂,但与表皮深度的增加保持同步,甚至超过表皮。
图9.2
兰科植物根的横切面,显示复表皮或根被。$(\times25.)$
图9.3
 Ficus elastica 叶片横切面中三个发育阶段的多层表皮(位于叶片两面)。A、B中的表皮用点状表示,C中的表皮具有厚壁。C中省略了叶片的一部分。钟乳体发育:A,钟乳体细胞壁增厚;B,纤维素柄出现;C,碳酸钙沉积在柄上。与其他表皮细胞不同,钟乳体细胞不进行平周分裂。(A, $\times207$ ; B, $\times163$ ; C, $\times234.$ )
通过向叶肉扩展(图9.3)。在某些植物(如Peperomia,图7.4)中,多层表皮的细胞保持径向排列,并清楚地显示出它们的共同起源(Linsbauer, 1930)。
植物地上部分的表皮通常被认为具有减少蒸腾作用导致的水分流失、机械保护以及通过气孔进行气体交换的功能。由于细胞的紧密排列和相对坚韧的角质层的存在,表皮还提供机械支持并增加茎的硬度(Niklas和Paolillo, 1997)。在茎和胚芽鞘中,处于张力状态下的表皮被认为是控制整个器官伸长的组织(Kutschera, 1992;但参见Peters和Tomos, 1996)。表皮也是各种代谢产物的动态储存区(Dietz等, 1994),并且是参与昼夜节律叶片运动和光周期诱导的光感知部位(Mayer等, 1973;Levy和Dean, 1998;Hempel等, 2000)。在海草(Iyer和Barnabas, 1993)和其他沉水被子植物中,表皮是光合作用的主要部位(Sculthorpe, 1967)。表皮是保护叶肉区域免受UV-B辐射损伤的重要保护层(Robberecht和Caldwell, 1978;Day等, 1993;Bilger等, 2001),在某些叶片中,上表皮细胞充当透镜,将光线聚焦在下方的栅栏薄壁细胞的叶绿体上(Bone等, 1985;Martin, G.等, 1989)。茎和根的表皮细胞都参与水分和溶质的吸收。
尽管成熟表皮在分生活动方面通常是被动的(Bruck等, 1989),但它往往长时间保留生长的潜力。如前所述,在多年生茎中,周皮在生命后期形成或根本不形成时,表皮会继续分裂以响应轴的周向扩展。如果形成周皮,其分生组织的来源——木栓形成层——可能是表皮(第15章)。不定芽可以在表皮中产生(Ramesh和Padhya, 1990;Redway, 1991;Hattori, 1992;Malik等, 1993),并且整个植物的再生已经通过组织培养中的表皮细胞(包括保卫细胞)实现(Korn, 1972;Sahgal等, 1994;Hall等, 1996;Hall, 1998)。因此,即使是高度分化的保卫细胞的原生质体也可以重新表达其全部遗传潜力(全能性)。
表皮(epidermis)是一种复杂的组织,由多种细胞类型组成,反映了其功能的多样性。该组织的基本物质由相对未特化的细胞——普通表皮细胞(ordinary epidermal cells)(也称为基本细胞(ground cells)、真表皮细胞(epidermal cells proper)、未特化表皮细胞(unspecialized epidermal cells)、铺路细胞(pavement cells))和分散在整个组织中的更特化的细胞组成。在更特化的细胞中,有气孔的保卫细胞(guard cells)和各种附属物(appendages),即毛状体(trichomes),包括由根的表皮细胞发育而来的根毛(root hairs)。
❙ 普通表皮细胞
成熟的普通表皮细胞(以下通常简称为表皮细胞)形状各异,但通常呈扁平状,深度较小(图9.4)。有些细胞,如许多种子的栅栏状表皮细胞,其深度远大于宽度。在细长的植物部位,如茎、叶柄、叶脉和大多数单子叶植物的叶子中,表皮细胞沿着植物部位的长轴方向伸长。在许多叶子、花瓣、子房和胚珠中,表皮细胞具有波浪状的垂直(垂周)壁。波浪状的模式由局部壁分化控制,这决定了壁扩展的模式(Panteris等,1994)。
表皮细胞具有活的原生质体,可以储存各种代谢产物。它们含有质体(plastids),这些质体通常只发育出少量的基粒(grana),因此缺乏叶绿素。然而,在生活在深荫处的植物以及沉水植物的表皮中,存在具有光合活性的叶绿体(chloroplasts)。淀粉和蛋白质晶体可能存在于表皮质体中,花青素(anthocyanins)存在于液泡中。
图9.4
Aloe aristata (百合科)叶表皮细胞的三维结构。每张图中的上表面是细胞的外表面。相反的一侧是与下方叶肉细胞接触的面。(来自Esau, 1977; 重绘自Matzke, 1947。)
表皮细胞壁的厚度变化
表皮细胞壁的厚度在不同植物和同一植物的不同部位有所不同。在壁较薄的表皮中,外平周壁(outer periclinal walls)通常比内平周壁(inner periclinal walls)和垂周壁(anticlinal walls)厚。在某些物种的叶子、下胚轴(hypocotyls)和上胚轴(epicotyls)中,平周壁具有交叉多片层结构(crossed-polylamellate structure),其中横向排列的纤维素微纤丝(cellulose microfibrils)的片层与垂直排列的微纤丝的片层交替出现(Sargent, 1978; Takeda和Shibaoka, 1978; Satiat-Jeunemaitre等, 1992; Gouret等, 1993)。在针叶树的叶子中发现了具有极厚壁的表皮(图9.5); 在某些物种中,壁的增厚是木质化的,可能是次生的,如此之大以至于几乎阻塞了细胞的腔。表皮细胞壁通常被硅化,如禾本科和莎草科植物(Kaufmann等, 1985; Piperno, 1988)。典型的传递细胞(transfer cells)的壁内生长(wall ingrowths)通常从海草和淡水植物的沉水叶子的外表皮壁发育而来(Gunning, 1977; Iyer和Barnabas, 1993)。
初生纹孔场(primary pit-fields)和胞间连丝(plasmodesmata)通常出现在表皮细胞的垂周壁(anticlinal wall)和内平周壁(inner periclinal wall)上,尽管叶片表皮和叶肉(mesophyll)之间的胞间连丝频率相对较低。曾有一段时间,人们认为胞间连丝也出现在表皮外壁(outer epidermal wall)上,并将其称为外连丝(ectodesmata)。随后的研究表明,细胞质束(cytoplasmic strands)并不存在于外壁中,但纤维间空间(interfibrillar spaces)的束可能从质膜(plasma membrane)延伸到纤维素壁(cellulosic walls)内的角质层(cuticle)。这些束需要特殊处理才能使其可见。据信含有果胶(pectin)的微通道(microchannels)已被报道存在于旱生植物(xerophytes)的表皮外壁中(Lyshede, 1982)。术语teichode(源自希腊语teichos,意为"墙",和hodos,意为"路径")已被提议作为外连丝(ectodesmata)(Franke, 1971)和微通道(microchannels)(Lyshede, 1982)的替代,这两者都不是细胞质结构。Teichodes被认为在叶片吸收和排泄中起通路作用(Lyshede, 1982)。
表皮外壁最显著的特征是角质层的存在
角质层(cuticle)或角质膜(cuticular membrane)主要由两种脂质成分组成:不溶性角质(cutin),构成角质层的基质(matrix),以及可溶性蜡(soluble waxes),其中一些沉积在角质层表面,即表皮蜡(epicuticular wax),另一些则嵌入基质中,即角质蜡(cuticular wax)或内角质蜡(intracuticular wax)。角质层是所有暴露在空气中的植物表面的特征,甚至延伸到气孔(stomatal pores)中并衬在气孔下室(substomatal chambers)的内表皮细胞壁上,气孔下室是与气孔相对的大型气孔下细胞间隙(substomatal intercellular spaces)(图9.5; Pesacreta和Hasenstein, 1999)。它是植物地上表面与其环境之间的第一道保护屏障,也是水分(包括蒸腾流(transpiration stream))和溶质(solutes)移动的主要屏障(Riederer和Schreiber, 2001)。在特殊情况下,角质层也在皮层细胞(cortical cells)中形成,并产生一种称为角质上皮(cuticular epithelium)的保护组织(Calvin, 1970; Wilson和Calvin, 2003)。
角质层的基质可能不仅由一种,而是由两种脂质聚合物组成,即角质(cutin)和角质烷(cutan)(Jeffree, 1996; Villena等, 1999)。与角质不同,角质烷对碱水解具有高度抗性。尽管某些物种的角质层似乎缺乏角质烷(如番茄果实、柑橘(Citrus)和欧石楠(Erica)叶片),但在其他一些物种中,角质烷可能是主要的或唯一的基质聚合物,特别是在甜菜(Beta vulgaris)中。据报道,角质烷是化石植物角质层的组成成分,并且在许多现存物种中报道了混合角质/角质烷角质层,包括挪威云杉(Picea abies)、棉属(Gossypium sp.)、苹果(Malus primula)、挪威槭(Acer platanoides)、欧洲栎(Quercus robur)、龙舌兰(Agave americana)和君子兰(Clivia miniata)。
大多数角质层由两个或多或少不同的区域组成,即角质层本身和一个或多个角质层(图9.6)。角质层本身是最外层区域,含有角质和嵌入的双折射(角质)蜡,但不含纤维素。其形成过程称为角质化(cuticularization)。表皮蜡(epicuticular wax)出现在角质层本身的表面,可以是无定形形式或各种形状的晶体结构(图9.7)。常见的形状包括管状、实心棒状、丝状、板状、带状和颗粒状(Wilkinson, 1979; Barthlott et al., 1998; Meusel et al., 2000)。表皮蜡赋予许多叶片和果实“霜状”外观。这种霜状外观是由蜡对光的反射和散射造成的。
图9.6
植物角质层的总体结构。细节:CL,角质层或网状区域,由纤维素微纤维穿过;CP,角质层本身,显示层状结构;CW,细胞壁;EW,表皮蜡;P,果胶层和中胶层;PM,质膜;T,teichode。(来自Jeffree, 1986。经剑桥大学出版社许可转载。)
图9.7
显示表皮蜡的表皮表面视图。A,Pisum叶片上表面的板状蜡突起。B,高粱(Sorghum bicolor)叶鞘下表面的蜡丝。(A,来自Juniper, 1959。$\copyright$ 1959,经Elsevier许可;B,来自Jenks et al., 1994。$\copyright$ 1994,芝加哥大学版权所有。)
蜡晶体。表皮蜡在减少角质层水分流失方面起着重要作用。商业上常用的将葡萄浸入加速果实干燥的化学物质中的做法,会导致蜡片紧密贴合并平行排列。这种变化可能促进了水分从果实向大气的移动(Possingham, 1972)。表皮蜡还增强了表皮表面排水的能力(Eglinton和Hamilton, 1967; Rentschler, 1971; Barthlott和Neinhuis, 1997),从而限制了污染物颗粒和水传播病原体孢子的积累。Klopstockia cerifera(安第斯蜡棕榈)和Copernicia cerifera(巴西蜡棕榈)的叶片上有一层异常厚的蜡层(可达$5\mathrm{mm}$),后者是巴西蜡棕榈,从中提取巴西棕榈蜡(Martin和Juniper, 1970)。
角质层位于角质层本身的下方,被认为是细胞壁的外层部分,不同程度地被角质覆盖。角质蜡、果胶和半纤维素也可能存在于角质层中。角质层的形成过程称为角化(cutinization)。在角质层下方通常有一层富含果胶的果胶层,它将角质层与外壁结合。果胶层与中胶层连续,在角质层深入延伸的地方形成角质钉(cuticular pegs)。
角质层(ultrastructure)的超微结构显示出相当大的变异性。在基质(matrix)中可能发现两种独特的超微结构成分:片层(lamellae)和纤丝(fibrillae)(图9.6)。纤丝可能主要是纤维素(cellulosic)的。植物物种在存在或不存在这些成分中的一种或另一种方面彼此不同。在此基础上,Holloway(1982)识别了六种结构类型的角质层。当两种成分都存在时,片层区域对应于真正的角质层(cuticle proper),而含有纤丝、网状的区域对应于角质层(cuticular layer(s))。角质层的超微结构似乎显著影响角质层的渗透性(permeability):具有完全网状结构的角质层比具有外层片层区域的角质层对某些物质更易渗透(Gouret等,1993;Santier和Chamel,1998)。无论如何,形成水和溶质通过角质层扩散的主要屏障的是角质层蜡(cuticular waxes),在很大程度上是通过创建一条曲折的路径,从而增加扩散分子的路径长度(Schreiber等,1996;Buchholz等,1998;Buchholz和Schönherr,2000)。根据实验证据(Schönherr,2000;Schreiber等,2001),Riederer和Schreiber(2001)得出结论,大部分穿过角质层的水以单分子形式在由无定形蜡(amorphous waxes)组成的所谓亲脂途径(lipophilic pathway)中扩散。一小部分水可能通过充满水的分子尺寸的极性孔(polar pores)扩散,水溶性有机化合物和无机离子可能遵循这一途径。角质层蒸腾作用(cuticular transpiration)与角质层厚度并不像人们可能直观得出的那样成反比(Schreiber和Riederer,1996;Jordaan和Kruger,1998)。事实上,厚角质层可能比薄角质层显示出更高的水渗透性和扩散系数(Becker等,1986)。
至少在部分物种中,角质层最初表现为完全无定形、电子致密的层,称为原角质层(procuticle)(图9.8)。随后,原角质层改变其超微结构外观,并转化为该物种典型的真正角质层。真正角质层的出现之后是角质层的出现,表明真正角质层不是新形成的层(Heide-Jørgensen,1991)。到角质层完全形成时,它比原来的原角质层厚几倍。角质层在
图9.8
植物角质层的真正角质层(CP)的发育以及初生细胞壁(PCW)内角质层(CL)发育的早期阶段。A-D,原角质层向片层真正角质层的转化。球形脂质(globular lipids)可能参与片层真正角质层的进一步构建,如E所示。E,涂有电子透明壳(electron-lucent shells)的球形脂质构建真正角质层/角质层过渡区。片层可能变得不那么规则。真正角质层表面显然存在一层无定形的表皮蜡膜(epicuticular wax film,EWF)。F,初生细胞壁(PCW)并入角质层。主要是径向的网状结构(reticulations)延伸到真正角质层。表皮蜡晶体(epicuticular wax crystals,EWC)在细胞扩张停止之前开始形成。(来自Jeffree,1996,图2.12a-f。$\copyright$ Taylor and Francis。)
厚度,其发育受环境条件的影响(Juniper 和 Jeffree,1983;Osborn 和 Taylor,1990;Riederer 和 Schneider,1990)。
角质(cutin)和蜡质(waxes)(或其前体)在表皮细胞中合成,必须通过细胞壁迁移到表面。这些物质所遵循的路径以及涉及的机制尚未达成一致。一些研究者推测,teichodes(ectodesmata,微通道)作为角质和蜡质穿过细胞壁的路径(Baker,1982;Lyshede,1982;Anton 等,1994)。大多数注意力集中在表皮蜡质上,其前体显然在内质网中产生,并在高尔基体中被修饰,然后通过胞吐作用从细胞质中排出(Lessire 等,1982;Jenks 等,1994;Kunst 和 Samuels,2003)。尽管在相当数量的分类群的叶片和果实的角质层中检测到了孔和通道(Lyshede,1982;Miller,1985,1986),但这些结构显然并不普遍存在。在形成管状(表皮蜡质)的Sorghum bicolor叶片的软木细胞中,无论是在细胞壁还是角质层中都没有发现孔或通道(图9.9;Jenks 等,1994)。一些研究者认为,蜡质前体不遵循特殊路径,而是通过挥发溶剂在细胞壁和角质层中扩散,然后在表面结晶(Baker,1982;Hallam,1982)。Neinhuis 及其同事(Neinhuis 等,2001)假设蜡分子与水蒸气一起移动,渗透角质层,类似于蒸汽蒸馏的过程。至少有一个基因,Arabidopsis基因CUT1,已被明确证实与蜡质生产有关。它编码一种非常长链脂肪酸缩合酶,是角质蜡质生产所必需的(Millar 等,1999)。
角质/角皮(cutin/cutan)具有高度惰性,对氧化浸渍方法具有抵抗力。角质层不会腐烂,因为显然没有微生物拥有降解角质/角皮的酶(Frey-Wyssling 和 Mühlethaler,1959)。由于其化学稳定性,角质层在化石材料中得以保存,并且在化石物种的鉴定中非常有用(Edwards 等,1982)。
图9.9
Sorghum bicolor叶鞘背面表皮蜡质丝状体的发育。A,蜡质丝状体从邻近硅细胞(sc)的软木细胞中伸出。最初,丝状体表现为圆形分泌物。B,随着进一步发育,分泌物表现为短圆柱体。C,D,随着继续发育,分泌物形成表皮蜡质丝状体的簇。(来自 Jenks 等,1994。$\copyright$ 1994 年芝加哥大学。版权所有。)
角质层特征也被证明在针叶树分类学中有用(Stockey 等,1998;Kim 等,1999;Ickert-Bond,2000)。
❙ 气孔(stomata)
气孔出现在初生植物体的所有地上部分
气孔(stomata,单数:stoma)是表皮上的开口(气孔或孔隙),每个气孔由两个保卫细胞(guard cells)包围(图9.10),通过形状的变化实现气孔的开启和关闭。术语“stoma”在希腊语中意为“嘴”,通常用于指代气孔及其两个保卫细胞。在某些物种中,气孔周围由与表皮其他基本细胞无异的细胞包围,这些细胞被称为邻近细胞(neighboring cells)。而在其他物种中,保卫细胞则由一个或多个在大小、形状、排列方式以及有时在内容物上与普通表皮细胞不同的细胞包围,这些独特的细胞被称为副卫细胞(subsidiary cells)(图9.5、9.13、9.14、9.15、9.17A、9.20和9.21)。气孔的主要功能是调节植物内部组织与大气之间水蒸气和$\mathrm{CO}_{2}$的交换(Hetherington and Woodward, 2003)。
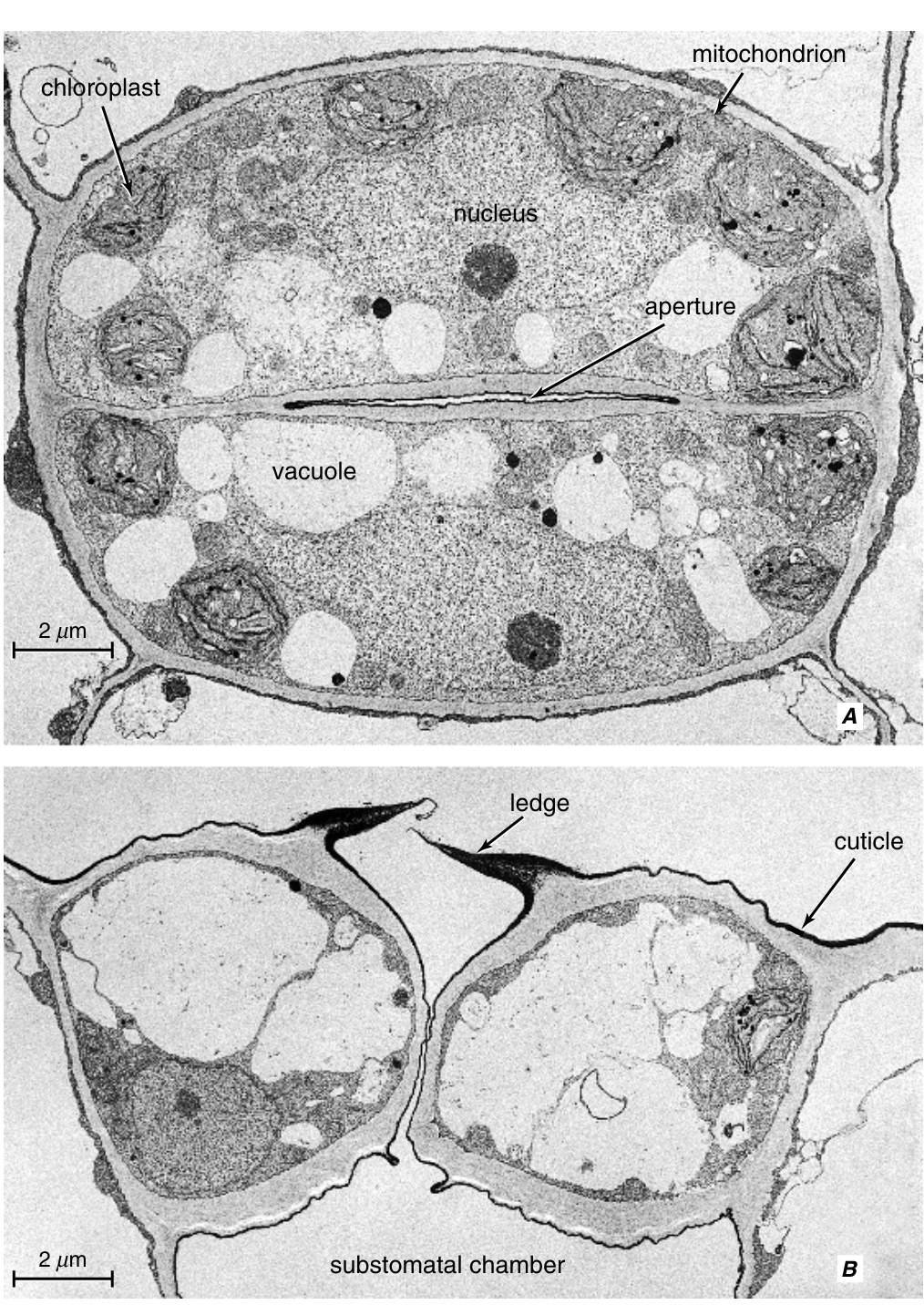 甜菜(Beta vulgaris)叶片气孔的电子显微照片,分别从表面(A)和横截面(B)观察。(来自Esau, 1977。)
图9.10
气孔(Stomata)出现在初生植物体的所有地上部分,但在叶片上最为丰富。一些不含叶绿素的陆生植物(如Monotropa、Neottia)的地上部分以及全寄生植物科Balanophoraceae的叶片(Kuijt和Dong,1990)缺乏气孔。根部通常没有气孔。在几种植物的幼苗根部发现了气孔,包括Helianthus annuus(Tietz和Urbasch,1977;Tarkowska和Wacowska,1988)、Pisum arvense、Ornithopus sativus(Tarkowska和Wacowska,1988)、Pisum sativum(Lefebvre,1985)和Ceratonia siliqua(Christodoulakis等,2002)。光合作用叶片的气孔密度差异很大。同一叶片的不同部位以及同一植物的不同叶片上的气孔密度也有所不同,并且受到光照和$\mathrm{CO}_{2}$水平等环境因素的影响。有研究表明,环境对气孔和毛状体数量的影响可能是通过表皮蜡质成分介导的(Bird和Gray,2003)。研究表明,幼叶中气孔的发育是由一种机制调控的,该机制感知同一植物成熟叶片周围的光照和$\mathrm{CO}_{2}$水平,而不是由幼叶自身调控的(Brownlee,2001;Lake等,2001;Woodward等,2002)。成熟叶片感知到的信息必须通过长距离的系统信号传递给发育中的叶片。在叶片中,气孔可能出现在两个表面(双面气孔叶)或仅出现在一个表面,要么是上表面(上气孔叶),要么更常见的是下表面(下气孔叶)。Willmer和Fricker(1996)中列出的一些气孔密度(每平方毫米,下表皮/上表皮)的例子包括Allium cepa 175/175、Arabidopsis thaliana 194/103、Avena sativa 45/50、Zea mays 108/98、Helianthus annuus 175/120、Nicotiana tabacum 190/50、Cornus florida 83/0、Quercus velutina 405/0、Tilia americana 891/0、Larix decidua 16/14和Pinus strobus 120/120。一般来说,旱生叶片的气孔密度高于中生和水生(水生形态)植物的叶片(Roth,1990)。在水生植物中,气孔通常分布在出水叶片的所有表面以及浮叶的上表面。沉水叶片通常完全没有气孔(Sculthorpe,1967)。在某些物种的叶片中,气孔以明显的簇状分布,而不是或多或少均匀分布,例如在Begonia semperflorens(每簇2至4个)和Saxifraga sarmentosa(每簇约50个)中(Weyers和Meidner,1990)。
气孔在表皮中的位置水平有所不同(图9.11)。它们可能与相邻的表皮细胞处于同一水平,或者可能被抬高。
图9.11
叶片下表皮的气孔(Stomata)。A–C,沿$\mathbf{D}$中虚线aa、bb和cc指示的平面切开的桃叶中的气孔和一些相关细胞。E–H、J,沿平面aa切割的各种叶片的气孔。I,沿平面bb切割的常春藤的一个保卫细胞(Guard Cell)。气孔在A、E、J中凸起。在H中略微凸起,在G中略微凹陷,在F中深度凹陷。各种保卫细胞中的角状突起是壁架(Ledges)的切面视图。有些气孔有两个壁架(E、F、G);其他只有一个(A、H、J)。壁架在A、F、H中是角质层(Cuticular)的。卫矛叶$(\mathbf{F})$具有厚的角质层;表皮细胞部分被角质(Cutin)堵塞。(A–D、F–J,$\times712$;E,$\times285$。)
气孔可能凸起或凹陷于表皮表面。在某些植物中,气孔仅限于称为气孔隐窝(Stomatal Crypts)的凹陷处,这些凹陷处通常含有显著发育的表皮毛(Epidermal Hairs)(图9.12)。
保卫细胞通常呈肾形
双子叶植物(Eudicots)的保卫细胞在表面视图中通常呈新月形,末端钝圆(肾形)(图9.10A和9.11D),并且在外部或内外两侧具有壁架。在切面视图中,这些壁架看起来像角。如果存在两个壁架,外壁架界定前腔,内壁架界定后腔。具有两个壁架的气孔实际上有三个开口,由壁架形成的外开口和内开口,以及由相对的保卫细胞壁在两者之间形成的中央开口。内开口很少完全关闭,根据气孔形成的阶段,外开口或中央开口可能是最窄的(Saxe, 1979)。保卫细胞被角质层覆盖。如前所述,角质层延伸通过气孔开口并进入气孔下腔。显然,保卫细胞的角质层在化学组成上与普通表皮细胞不同,并且比后者更透水(Schönherr和Riederer, 1989)。每个保卫细胞都有一个显著的细胞核、许多线粒体和发育不良的叶绿体,其中淀粉通常在夜间积累,并在白天随着气孔开放的增加而减少。液泡系统(Vacuolar System)被不同程度地分割。在关闭和开放的气孔之间,液泡体积的差异很大,从关闭气孔中细胞体积的很小一部分到开放气孔中超过$90\%$。类似于双子叶植物的肾形保卫细胞也出现在一些单子叶植物(Monocots)和裸子植物(Gymnosperms)中。
在禾本科(Poaceae)和一些其他单子叶植物科中,保卫细胞呈哑铃形;也就是说,它们在中间狭窄,两端扩大(图9.13)。禾本科中的保卫细胞核也呈哑铃形,中间几乎呈线状,两端呈卵形。其他单子叶植物科的哑铃形保卫细胞是否具有哑铃形细胞核仍有待确定(Sack, 1994)。在禾本科中,大多数细胞器,包括
图9.12
夹竹桃(Nerium oleander)叶片。A,横切面显示叶片下侧的气孔窝(stomatal crypt)。在夹竹桃中,气孔(stomata)和表皮毛(trichomes)仅限于气孔窝内。夹竹桃叶片具有复表皮(multiple epidermis)。B,气孔窝的扫描电子显微镜图像,显示气孔窝内排列着大量表皮毛。(A,$\times177$;B,$\times725$。)
图 9.13
水稻(Oryza;禾本科 Poaceae)的哑铃形保卫细胞(guard cells),显示(A)表面视图和 $\mathbf{(B{-}D)}$ 沿图 9.11D 中虚线 aa、bb 和 cc 指示的平面切面。A,保卫细胞显示在高焦平面上,因此细胞的狭窄部分中的腔(lumen)不可见。B,一个保卫细胞沿平面 bb 切割,显示哑铃形的细胞核。C,沿平面 aa 切割。D,沿平面 cc 切割。(引自 Esau, 1977。)
液泡(vacuoles)位于细胞的球状末端。此外,两个保卫细胞的原生质体(protoplasts)通过扩大末端之间的共同壁上的孔相互连接。由于这种原生质连续性,保卫细胞必须被视为一个单一的功能单元,其中膨压(turgor)的变化会立即实现。这些孔似乎是由于壁的不完全发育而产生的(Kaufman et al., 1970a; Srivastava and Singh, 1972)。有两个副卫细胞(subsidiary cells),分别位于气孔的两侧(图 9.13A 和 9.14)。
大多数针叶树的气孔深陷,看起来像是从副卫细胞悬挂下来,形成一个漏斗状的空腔,称为气孔上腔(epistomatal chamber)(图 9.5 和 9.15;Johnson and Riding, 1981;Riederer, 1989;Zellnig et al., 2002)。在它们的中间区域,保卫细胞在横切面上呈椭圆形,具有狭窄的腔。在它们的末端,保卫细胞呈三角形,腔较宽。这些气孔复合体的一个特征是保卫细胞和副卫细胞的壁部分木质化(lignified)。保卫细胞壁的非木质化区域出现在与其他细胞(副卫细胞和下皮细胞)接触的区域,即所谓的铰链区域(hinge areas),这些区域的壁相对较薄。这些壁特征似乎与针叶树气孔运动的机制有关。一个特别薄的未木质化保卫细胞壁条带也面向气孔。木质化的保卫细胞在被子植物中很少见(Kaufmann, 1927;Palevitz, 1981)。
在松科(Pinaceae)中,气孔上腔通常充满了表皮蜡管(epicuticular wax tubules),这些蜡管在气孔上形成一个多孔的“塞子”(plug)(Johnson and Riding, 1981;Riederer, 1989)。这些蜡管既来自保卫细胞,也来自副卫细胞。气孔塞也出现在其他针叶树中(罗汉松科 Podocarpaceae、南洋杉科 Araucariaceae 和柏科 Cupressaceae;Carlquist, 1975;Brodribb and Hill, 1997)以及两个无导管被子植物科(Winteraceae 和 Trochodendraceae)中。在无导管被子植物中,气孔被肺泡状物质堵塞,这些物质外观类似蜡,但成分是角质(cutinaceous)(Bongers, 1973;Carlquist, 1975;Feild et al., 1998)。
图 9.14
玉米(Zea mays)叶片闭合气孔的横切面。每个厚壁的保卫细胞都附着在一个副卫细胞上。
气孔塞(stomatal plugs)的功能尚不完全清楚(Brodribb and Hill, 1997)。最常见的观点是,气孔塞主要起到限制蒸腾失水的作用。虽然蜡质塞显然起到了这一作用,但Brodribb和Hill(1997)提出,针叶树的蜡质塞可能是为了适应湿润环境而进化出来的,其作用是保持气孔不被水堵塞。这将促进气体交换并增强光合作用。Feild等人(1998)同样得出结论,Drimys winteri(Winteraceae)中的角质气孔塞对促进光合作用活动比防止水分流失更为重要。早期的Jeffree等人(1971)计算了Picea sitchensis气孔中蜡质塞对气体交换的限制。他们得出结论,虽然蒸腾速率减少了约三分之二,但光合作用速率仅减少了约三分之一。蜡质塞还可能通过气孔防止真菌入侵(Meng et al., 1995)。
保卫细胞通常具有不均匀增厚的壁和径向排列的纤维素微纤维
尽管主要分类群的保卫细胞具有其独特的特征,但它们都有一个显著的特征——壁的不均匀增厚。
图9.15
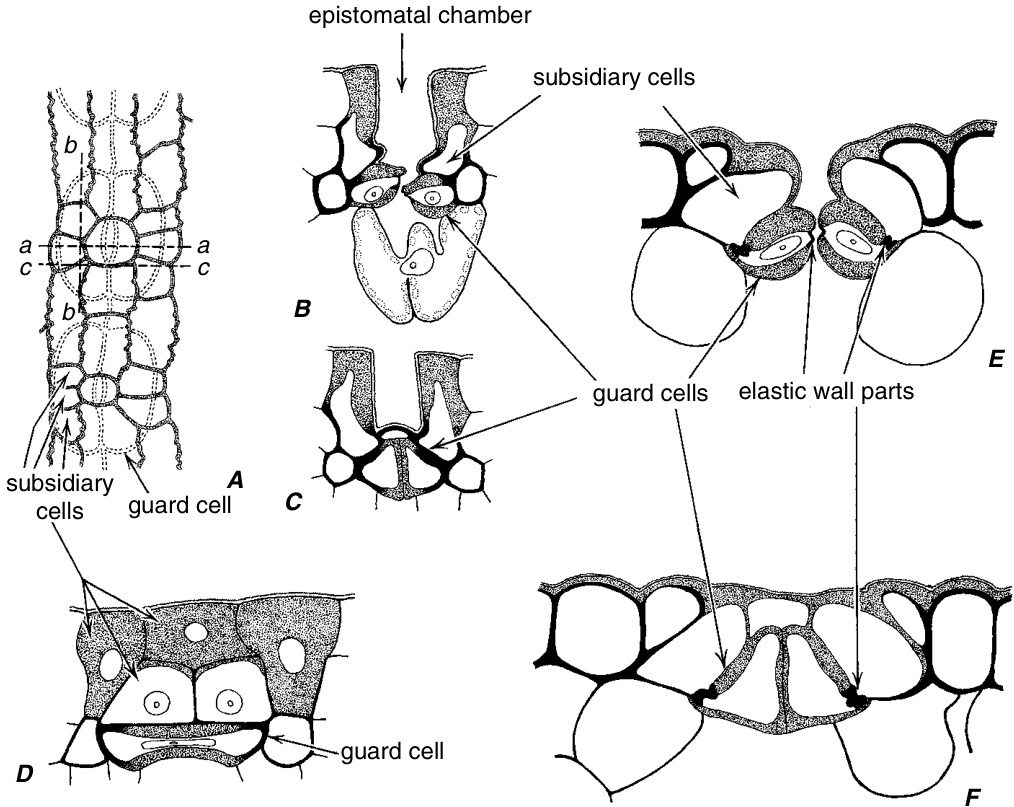 针叶树叶的气孔。A,Pinus merkusii表皮的两个深陷气孔的表面视图。保卫细胞被附属细胞和其他表皮细胞覆盖。Pinus(B-D)和Sequoia(E, F)的气孔和一些相关细胞。A中的虚线表示气孔切片的平面:aa,B,E;bb,D;cc,C,F。(A,×182;B-D,×308;E,F,×588。A,改编自Abagon, 1938。)
这一特征似乎与保卫细胞内膨压变化引起的形状和体积变化(以及随之而来的气孔孔径大小的变化)有关。在肾形保卫细胞中,远离气孔的壁(背壁)通常比靠近气孔的壁(腹壁)更薄,因此更具弹性。肾形保卫细胞在其末端相互连接处受到限制;此外,这些共同的保卫细胞壁在膨压变化期间几乎保持长度不变。因此,膨压的增加导致薄的背壁向远离气孔的方向凸出,而面向气孔的腹壁则变直或凹陷。整个细胞似乎向远离气孔的方向弯曲,气孔孔径增大。在膨压降低时,发生相反的变化。
在禾本科(Poaceae)的哑铃形保卫细胞中,中间部分的壁强烈不均匀增厚(其内壁和外壁比背壁和腹壁厚得多),而球状末端则具有薄壁。在这些保卫细胞中,膨压的增加导致球状末端的膨胀,从而使直的中间部分彼此分离。同样,在膨压降低时,发生相反的变化。
根据另一种假说,保卫细胞壁中纤维素微纤维的径向排列(径向微纤化)在气孔运动中比壁的差异增厚(differential wall thickening)起着更重要的作用(Aylor et al., 1973; Raschke, 1975)。随着肾形保卫细胞的背壁随着膨压的增加向外移动,径向微纤化将这种运动传递到与孔相邻的壁(腹壁),孔打开。在哑铃形保卫细胞中,微纤维主要在中部轴向排列。从中部,微纤维辐射到球状末端。通过偏振光学和电子显微镜识别了保卫细胞壁中微纤维的径向取向(Raschke, 1975)。图9.16展示了一些使用气球进行的实验结果,这些实验支持了径向微纤化在气孔运动中的作用。壁增厚和微纤维排列可能都对气孔运动有贡献(Franks et al., 1998)。
微管动力学与Vicia faba的气孔运动有关(Yu et al., 2001)。在完全打开的气孔中,发现保卫细胞微管从腹壁到背壁横向取向。在气孔关闭期间,响应于黑暗,微管变得扭曲和斑块化;在关闭的气孔中,它们似乎分解成弥散的片段。随着气孔响应于光的重新打开,微管再次变为横向取向。尽管已知皮质微管会响应细胞壁中的应力而改变取向(Hejnowicz et al., 2000),但用微管稳定和微管解聚药物处理Vicia faba气孔抑制了光诱导的打开和暗诱导的关闭,导致Yu等人(2001)得出结论,微管动力学可能在功能上与气孔运动有关。Marcus等人(2001)的研究进一步支持了微管在Vicia faba保卫细胞功能中的参与,他们得出结论,微管对于气孔打开是必要的,更具体地说,它们需要在导致气孔打开的离子事件($\mathbf{\nabla}\mathbf{H}^{+}$外流和${\bf K}^{+}$内流)上游的某个地方,可能参与导致离子通量的信号转导事件。
图9.16
研究保卫细胞壁中微纤维径向排列对气孔打开影响的模型。A,两个乳胶圆柱体在末端连接并部分充气。B,相同模型在更高压力下。可见一条窄缝。C,在充气的圆柱体上模拟径向微纤化的胶带带。缝比B中宽。D,径向微纤化延伸到圆柱体的末端,并且一些胶带沿着“腹壁”存在。充气导致形成比C中更宽的缝。(来自Esau, 1977;绘图改编自Aylor, Parlange, 和 Krikorian, 1973的照片。)
保卫细胞(guard cells)体积的增加部分由邻近表皮细胞(epidermal cells)(副卫细胞(subsidiary cells)或邻近细胞(neighboring cells))体积的减少来补偿(Weyers and Meidner, 1990)。因此,实际上是保卫细胞与其直接邻近细胞之间的膨压(turgor)差异决定了气孔(stomatal pore)的开启(Mansfield, 1983)。因此,气孔复合体(stomatal complex)应被视为一个功能单位。
蓝光(blue light)和脱落酸(abscisic acid)是控制气孔运动的重要信号
钾离子$(\mathbf{K}^{+})$在保卫细胞和副卫细胞或邻近细胞之间的运输被广泛认为是保卫细胞运动的主要因素,当${\bf K}^{+}$含量增加时气孔开放。一些研究表明,${\bf K}^{+}$和蔗糖(sucrose)都是主要的保卫细胞渗透剂(osmotica),${\bf K}^{+}$在早晨的早期开放阶段是主要的渗透剂,而蔗糖在下午早期成为主要的渗透剂(Talbott and Zeiger, 1998)。保卫细胞对${\bf K}^{+}$的吸收是由蓝光激活的质膜(plasma membrane) $\mathrm{H}^{+}$ -ATPase介导的质子$(\mathbf{H}^{+})$梯度驱动的(Kinoshita and Shimazaki, 1999; Zeiger, 2000; Assmann and Wang, 2001; Dietrich et al., 2001),并伴随着氯离子(Cl−)的吸收和苹果酸(malate2−)的积累,苹果酸是由保卫细胞叶绿体(chloroplasts)中的淀粉合成的。溶质浓度的升高导致水势(water potential)更负,从而引起水分向保卫细胞的渗透运动,保卫细胞膨胀,并在气孔部位分离。Allium属物种的保卫细胞在任何时候都缺乏淀粉(Schnabl and Ziegler, 1977; Schnable and Raschke, 1980),显然仅依赖$\mathrm{Cl^{-}}$作为${\bf K}^{+}$的反离子(counterion)。当$\mathbf{C}\mathbf{I}^{-}$、苹果酸(malate2−)和${\bf K}^{+}$从保卫细胞中流失时,气孔关闭。然后水分沿着其水势从保卫细胞原生质体(protoplast)移动到细胞壁(cell wall),降低保卫细胞的膨压,导致气孔关闭。
植物激素脱落酸(abscisic acid, ABA)作为一种内源信号,在抑制气孔开放和诱导气孔关闭中起着关键作用(Zhang and Outlaw, 2001; Comstock, 2002)。ABA的主要作用位点似乎是保卫细胞质膜和液泡膜上的特定离子通道,这些通道导致${\bf K}^{+}$和相关阴离子$\mathrm{\Delta}$以及苹果酸2−)从液泡和细胞质中流失。实验证据表明,ABA诱导细胞质pH和细胞质$\mathrm{Ca}^{2+}$的增加,它们在该系统中充当第二信使(Grabov and Blatt, 1998; Leckie et al., 1998; Blatt, 2000a; Wood et al., 2000; Ng et al., 2001)。几种蛋白磷酸酶和蛋白激酶也被认为参与了通道活性的调节(MacRobbie, 1998, 2000)。除了植物激素外,保卫细胞还对一系列环境刺激如光、$\mathrm{CO}_{2}$浓度和温度作出反应。气孔运动的复杂机制是深入研究和讨论的主题,并为我们理解植物中的信号转导提供了宝贵的信息(Hartung et al., 1998; Allen et al., 1999; Assmann and Shimazaki, 1999; Blatt, 2000b; Eun and Lee, 2000; Hamilton et al., 2000; Li and Assmann, 2000; Schroeder et al., 2001)。
尽管长期以来人们认为叶片表面的气孔开放程度相当均匀,但现在已知,尽管环境条件几乎相同,但叶片某些区域的气孔可能开放,而相邻区域的气孔可能关闭,从而导致斑块状的气孔导度(Mott and Buckley, 2000)。气孔斑块性已在大量物种和科中观察到(Eckstein, 1997),并且尤其常见但不限于被束鞘延伸(从束鞘延伸到表皮的薄壁组织板)分成独立隔室的叶片,这些延伸与叶脉网络相关(图7.3A; Terashima, 1992; Beyschlag and Eckstein, 2001)。这种叶片被称为异面叶(heterobaric leaves)。在这些叶片中,不同隔室的细胞间隙系统之间几乎没有或没有气体交换,因此叶片本质上是一组独立的光合作用和蒸腾作用单位(Beyschlag et al., 1992)。在双面气孔叶中,斑块性的模式和程度在上下表面之间可能不同(Mott et al., 1993)。胁迫因素,特别是那些对植物施加水分胁迫的因素,似乎在斑块性形成中起主要作用(Beyschlag and Eckstein, 2001; Buckley et al., 1999)。
气孔复合体的发育涉及一次或多次不对称细胞分裂
气孔(Stomata)在叶片的主要分生组织活动(meristematic activity)完成前不久开始发育,并在叶片通过细胞增大(cell enlargement)进行后期扩展的相当长一段时间内持续产生。在具有平行脉序(parallel venation)的叶片中,如大多数单子叶植物(monocots),气孔排列成纵向行(Fig. 9.17A),气孔的发育阶段可以在叶片依次分化的部分中顺序观察到。这一顺序是向基的(basipetal),即从叶尖向下。最早成熟的气孔出现在叶尖,而新形成的气孔则靠近叶基。在网状脉(netted-veined)叶片中,如大多数真双子叶植物(eudicots)(Fig. 9.17B),不同的发育阶段以弥散或镶嵌的方式混合在一起。年轻真双子叶植物叶片的一个显著特征是叶片齿上一些气孔早熟(precocious maturation)的倾向(Payne, W. W., 1979)。这些气孔可能作为排水器(hydathodes)的水孔(water pores)发挥作用(第16章)。
气孔的发育始于原表皮细胞(protodermal cell)的不对称(asymmetric)或不均等(unequal)的垂周分裂(anticlinal division)。这种分裂产生两个细胞,一个通常较大,类似于其他原表皮细胞,另一个通常明显较小,含有密集染色的细胞质(cytoplasm)和一个大细胞核(nucleus)。这两个细胞中较小的一个称为气孔分生细胞(stomatal meristemoid)。在某些物种中,分生细胞的姐妹细胞可能再次不对称分裂,产生另一个分生细胞(Rasmussen, 1981)。根据物种的不同,分生细胞可以直接作为保卫母细胞(guard mother cell, guard-cell mother cell, stoma mother cell)发挥作用,或者在进一步分裂后产生保卫母细胞。气孔复合体(stomatal complex)的形成需要在细胞分裂前将细胞核迁移到母细胞(parent cells)的特定位置,并精确地定位分裂面(division planes)。因此,气孔复合体一直是众多超微结构(ultrastructural)研究的对象,旨在确定微管(microtubules)在细胞板(cell plate)定位和细胞形状(cell shaping)中的作用(Palevitz and Hepler, 1976; Galatis, 1980, 1982; Palevitz, 1982; Sack, 1987)。
保卫母细胞(guard mother cell)的均等分裂产生两个保卫细胞(guard cells)(图9.18A和9.19A-C),通过细胞壁的差异沉积和扩张,保卫细胞获得其特有的形状。未来气孔(pore)位置的中胶层(middle lamella)膨胀(图9.18A,d),细胞之间的连接在此处减弱。随后,细胞在该位置分离,从而形成气孔开口(stomatal opening)(图9.18A,e)。气孔位置腹壁(ventral walls)分离的确切原因尚未确定,但已考虑三种可能性:中胶层的酶解(enzymic hydrolysis)、保卫细胞膨压(guard cell turgor)增加引起的张力,以及最终覆盖新形成气孔的表皮(cuticle)的形成(Sack, 1987)。在拟南芥(Arabidopsis)中,气孔的形成似乎涉及气孔位置透镜状增厚处电子致密物质(electron-dense material)的拉伸(Zhao and Sack, 1999)。保卫母细胞与相邻的表皮细胞(epidermal cells)处于同一水平。保卫细胞与相邻表皮细胞之间以及表皮与叶肉(mesophyll)之间发生各种空间重新调整(图9.19),因此保卫细胞可能升高到表皮表面之上或降低到表皮表面之下。即使在具有深陷保卫细胞的针叶树(conifers)叶片中,保卫母细胞也与其他表皮细胞处于同一水平(Johnson and Riding, 1981)。气孔下腔(substomatal chamber)在气孔发育过程中形成,早于气孔的形成(图9.19E)。
尽管未成熟保卫细胞的所有壁中都存在胞间连丝(plasmodesmata),但随着壁的增厚,它们会被壁物质封闭(截断)(Willmer and Sexton, 1979; Wille and Lucas, 1984; Zhao and Sack, 1999)。成熟保卫细胞的共质体隔离(symplastic isolation)进一步体现在,微注射到保卫细胞或其相邻细胞中的荧光染料无法穿过它们之间的共同壁(Erwee et al., 1985; Palevitz and Hepler, 1985)。
如前所述,副卫细胞(subsidiary cells)或邻近细胞(neighboring cells)可能来自与气孔相同的分生组织(meristemoid),或来自与保卫母细胞没有直接个体发育(ontogenetically)关系的细胞。在此基础上,气孔个体发育(stomatal ontogeny)可分为三大类(Pant, 1965; Baranova, 1987, 1992):中源型(mesogenous),所有副卫细胞或邻近细胞与保卫细胞有共同起源(图9.20);周源型(perigenous),所有副卫细胞或邻近细胞与保卫细胞没有共同起源(图9.21);中周源型(mesoperigenous),至少一个副卫细胞或邻近细胞与保卫细胞有直接的个体发育关系,而其他细胞则没有。
图9.17
扫描电子显微镜下显示的气孔表面视图。A,玉米(Zea mays)叶片,显示单子叶植物(monocots)叶片典型的气孔平行排列。在玉米中,每对狭窄的保卫细胞与两个副卫细胞相关,气孔两侧各有一个。B,马铃薯(Solanum tuberosum)叶片,显示双子叶植物(dicots)叶片典型的气孔随机或分散排列。马铃薯的肾形保卫细胞不与副卫细胞相关。(B,由M. Michelle McCauley提供)
在具有中生副卫细胞(mesogenous subsidiary cells)的气孔发育过程中(图9.20),气孔复合体(stomatal complex)的前体(即分生细胞,meristemoid)通过原表皮细胞(protodermal cell)的不对称分裂形成,随后两次不对称分裂将前体分割为保卫细胞母细胞(guard mother cell)和两个副卫细胞(subsidiary cells)。再进行一次均等分裂,最终形成两个保卫细胞(guard cells)。
外生副卫细胞(perigenous subsidiary cells)的起源在禾本科植物气孔的分化过程中得到了图示说明(图9.21)。分生细胞(meristemoid)直接作为保卫细胞母细胞(guard mother cell),是通过原表皮细胞(protodermal cell)的不对称分裂形成的短细胞。在保卫细胞母细胞分裂之前,副卫细胞通过两个相邻细胞(副卫细胞母细胞,subsidiary mother cells)的不对称分裂沿着这个短细胞的两侧形成。副卫细胞母细胞的分裂之前,其细胞核会迁移到靠近保卫细胞母细胞的副卫细胞壁上的一个肌动蛋白斑块(actin patch)处。在玉米叶片中,副卫细胞命运决定因子显然定位于这个肌动蛋白斑块,随后在有丝分裂完成后不久被转移到与斑块接触的子细胞核中。继承了这个细胞核的子细胞因此被决定分化为副卫细胞(Gallagher and Smith, 2000)。保卫细胞形成后的生长调整使副卫细胞看起来像是气孔复合体的组成部分。
图9.18
Nicotiana(烟草)气孔的表面观。A,发育阶段:a、b,分裂后不久形成保卫细胞母细胞;c,保卫细胞母细胞已增大;d,保卫细胞母细胞分裂为两个保卫细胞,仍然完全连接,但在未来气孔的位置上有肿胀的细胞间物质;e,年轻的保卫细胞之间形成气孔。B,从近轴表皮(adaxial epidermis)外侧观察到的成熟气孔。D,从远轴表皮(abaxial epidermis)内侧观察到的类似气孔。保卫细胞隆起,因此在B中看起来高于表皮细胞,在D中则低于表皮细胞。C,从表皮内侧观察到的保卫细胞。(A,$\times620$;B–D,$\times490$。)
图9.19
Nicotiana(烟草)叶片气孔发育的切面观。C,来自近轴表皮,带有一些栅栏细胞(palisade cells);其他来自远轴表皮。A–C,保卫细胞母细胞在分裂为两个保卫细胞之前和期间。D,具有薄壁的年轻保卫细胞。E,保卫细胞横向延伸并开始增厚其细胞壁。内部突起(inner ledge)和气孔下腔(substomatal chamber)已形成。F,成熟的保卫细胞具有上下突起和不均匀增厚的细胞壁。G,一个成熟的保卫细胞沿其长轴平行切割,并与叶片表面垂直。(所有,$\times490$。)
图9.20
Thunbergia erecta 叶片中具有中生副卫细胞(mesogenous subsidiary cells)的气孔发育过程。A,表皮细胞已经分裂并产生了一个小的气孔复合体前体。B,前体已经分裂,分离出一个副卫细胞。C,第二个副卫细胞和保卫细胞前体已经形成。D,保卫细胞前体的分裂完成了气孔复合体的形成。(引自 Esau, 1977;改编自 Paliwal, 1966。)
图 9.21
燕麦(Avena sativa)节间气孔复合体的发育。副卫细胞为周生(perigenous)。A,两个短细胞是保卫细胞前体。B,左侧,长细胞的核处于分裂形成副卫细胞的位置;右侧,副卫细胞已经形成。C,有丝分裂前的保卫细胞前体。D,有丝分裂后期的保卫细胞前体。E,由两个保卫细胞和两个副卫细胞组成的气孔复合体仍未成熟。F,气孔复合体的细胞已经伸长。G,气孔复合体成熟。(引自 Esau, 1977;图片来自 Kaufman 等, 1970a。)
不同的发育序列导致气孔复合体的不同构型
从表面观察,完全分化的保卫细胞及其周围细胞形成的模式被用于分类学目的。然而,需要注意的是,看起来相似的成熟气孔复合体可能经历了不同的发育途径。对于真双子叶植物(eudicots)的成熟气孔复合体,已经提出了几种分类方法,具有不同程度的复杂性(Metcalfe 和 Chalk, 1950;FrynsClaessens 和 Van Cotthem, 1973;Wilkinson, 1979;Baranova, 1987, 1992)。气孔构型的主要类型包括:无规则型(anomocytic),即保卫细胞周围的表皮细胞与其他表皮细胞无法区分,也就是说,缺乏副卫细胞(图 9.22A);不等型(anisocytic),即气孔被三个副卫细胞包围,其中一个明显小于另外两个(图 9.22B;见于 Arabidopsis,代表十字花科(Brassicaceae));平行型(paracytic),即气孔两侧各有一个或多个与保卫细胞长轴平行的副卫细胞(图 9.22C);十字型(diacytic),即气孔被一对副卫细胞包围,其共同壁与保卫细胞成直角(图 9.22D);辐射型(actinocytic),即气孔被一圈辐射状细胞包围,其长轴垂直于保卫细胞的轮廓(图 9.22E);环型(cyclocytic 或 encyclocytic),即气孔被一个或两个狭窄的副卫细胞环包围,数量为四个或更多(图 9.22F);四型(tetracytic),即气孔被四个副卫细胞包围,两个侧生和两个极生(末端),也见于许多单子叶植物(图 9.23)。同一物种可能表现出多种类型的气孔复合体,且模式可能在叶片发育过程中发生变化。
在大多数单子叶植物中,气孔复合体(stomatal complex)的构型与发育序列有相当精确的关系。Tomlinson (1974) 在检查了代表大多数单子叶植物科的约100种植物后,识别出由特定发育序列产生的气孔复合体的以下主要构型(图9.23)。分生细胞(meristemoid)通过原表皮细胞(protodermal cell)的不对称分裂产生(A)。它是两个细胞中较小的一个,似乎总是远端细胞(朝向叶尖)。分生细胞直接作为保卫母细胞(guard mother cell)发挥作用,通常与四个相邻细胞接触(B)。(注意,Tomlinson使用术语“相邻细胞(neighboring cells)”来指代在分生细胞启动时位于其旁边的细胞。)这些细胞可能不分裂,从而直接成为接触细胞(contact cells),即在成熟气孔复合体中与保卫细胞接触的细胞(F),如Amaryllidaceae、Liliaceae和Iridaceae中的情况。另一方面,相邻细胞可能会进行垂周分裂(anticlinal division)并产生衍生物。
图9.22
表皮表面视图,展示了气孔构型的主要类型。(A-D,来自Esau, 1977;E,图10.3b和F,图10.3h,重绘自Wilkinson, 1979, Anatomy of the Dicotyledons, 2nd ed., vol. I, C. R. Metcalfe和L. Chalk编辑,经牛津大学出版社许可。)
这些壁的取向在气孔复合体的发育中至关重要:它们可能完全是斜向的(C–E)或完全是垂直和/或平行于原表皮细胞列的(F-H)。随着相邻细胞的分裂,气孔复合体现在可以定义为保卫细胞和相邻细胞及其衍生物的组合$(\mathbf G)$,或保卫细胞和相邻细胞衍生物$(\mathbf{E},\mathbf{H})$。因此,气孔的接触细胞要么全部是衍生物(E–H),要么是衍生物和未分裂的相邻细胞的组合$(\mathbf G)$。G所示的类型复合体是常见的禾本科类型(Poaceae)。它也出现在许多其他科中,包括Cyperaceae和Juncaceae;H是许多Commelinaceae的特征,而E是Palmae的特征。
❙ 表皮毛
表皮毛(trichomes)(来自希腊语,意为毛发的生长)是高度可变的表皮附属物(图9.24和9.25)。它们可能出现在植物的所有部分,并可能在植物部分的整个生命周期中持续存在,或可能早期脱落。一些持续存在的表皮毛保持活力;另一些则死亡并变干。尽管表皮毛在科和较小的植物群中结构差异很大,但它们有时在给定的分类群中非常一致,并长期以来被用于分类目的(Uphof和Hummel, 1962;Theobald等, 1979)。
表皮毛通常与突起(emergences)(如疣和刺)区分开来,突起由表皮和表皮下组织形成,通常比表皮毛更庞大。然而,表皮毛和突起之间的区别并不明显,因为一些表皮毛位于由表皮下细胞组成的基部上。因此,可能需要进行发育研究以确定某些突起是否仅起源于表皮,或同时起源于表皮和表皮下组织。
表皮毛具有多种功能
生长在干旱生境中的植物往往比生长在更湿润生境中的类似植物具有更多毛的叶片 (Ehleringer, 1984; Fahn, 1986; Fahn and Cutler, 1992)。对干旱地区植物的研究表明,叶片毛状体 (pubescence) 的增加通过以下方式降低了蒸腾速率:(1) 增加太阳辐射的反射,从而降低叶片温度;(2) 增加边界层 (水蒸气必须扩散通过的静止空气层)。此外,至少某些旱生叶片的毛状体的基部或柄细胞完全角质化,阻止了质外体水流进入毛状体 (第16章;Fahn, 1986)。许多“空气植物”,如附生的凤梨科植物,利用叶片毛状体吸收水分和矿物质 (Owen and Thomson, 1991)。相比之下,在滨藜属 (Atriplex) 中,分泌盐分的毛状体从叶片组织中去除盐分,防止植物体内有毒盐分的积累 (Mozafar and Goodin, 1970; Thomson and Healey, 1984)。在叶片发育的早期阶段,含有多酚的毛状体可能起到保护作用,防止UV-B辐射损伤 (Karabourniotis and Easseas, 1996)。毛状体可能提供对昆虫的防御 (Levin, 1973; Wagner, 1991)。在许多物种中,毛状体密度与昆虫的取食和产卵反应以及幼虫的营养呈负相关。钩状毛状体可以刺穿昆虫及其幼虫 (Eisner et al., 1998)。分泌性 (腺体) 毛状体可能提供化学防御 (第16章)。虽然一些害虫会被毛状体分泌物毒害,但其他害虫则因被分泌物固定而变得无害 (Levin, 1973)。
毛状体可分为不同的形态类别
一些形态学的毛状体(trichome)类别包括:(1) 乳头状突起(papillae),这是小的表皮突起,通常被认为与毛状体不同;(2) 简单(不分枝)毛状体,这是一个大的类别,包括非常常见的单细胞(图9.25C–F)和多细胞毛状体(图9.241, J和9.25A, B);(3) 二至五臂的各种形状的毛状体;(4) 星状毛状体(stellate trichomes),所有这些毛状体都是星形的,尽管结构各异(图9.24C, E, F);(5) 鳞片状或盾状毛状体(scales, or peltate, trichomes),由盘状细胞板组成,通常长在柄上或直接附着在基部(图9.24A, B和9.25G, H);(6) 树枝状(分枝)毛状体(dendritic (branched) trichomes),这些毛状体沿着延伸的轴分枝(图$9.24\mathrm{D}$ ; Theobald et al., 1979);(7) 根毛(root hairs)。此外,还有许多特殊类型的毛状体,如刺毛(stinging hairs)、珍珠腺(pearl glands)、含钟乳体的毛状体(cystolith-containing hairs)(图9.25C, E, F)和水囊(water vesicles)(第16章)。解剖学特征也可以用于描述毛状体,如腺体(图9.25B, G, H)或非腺体;单细胞或多细胞;单列或多列;表面特征(如果有的话);壁厚度的差异(如果有的话);角质层厚度;毛状体内的不同细胞类型,即基部或足部(图9.25B, G)、柄、尖端或头部;以及晶体、钟乳体或其他内容物的存在。W. W. Payne (1978)编制了一份广泛的植物毛状体术语词汇表。
毛状体是从表皮细胞突起开始的
毛状体的发育复杂程度与其最终形态和结构有关。多细胞毛状体显示出特征性的细胞分裂和细胞生长模式,有些简单,有些复杂。第16章将讨论多细胞腺毛状体的一些发育方面。在这里,我们考虑三种单细胞毛状体的发育方面:棉纤维、根毛和拟南芥的分枝毛状体。
棉纤维 单细胞的棉花(Gossypium)毛状体,通常称为棉纤维,是
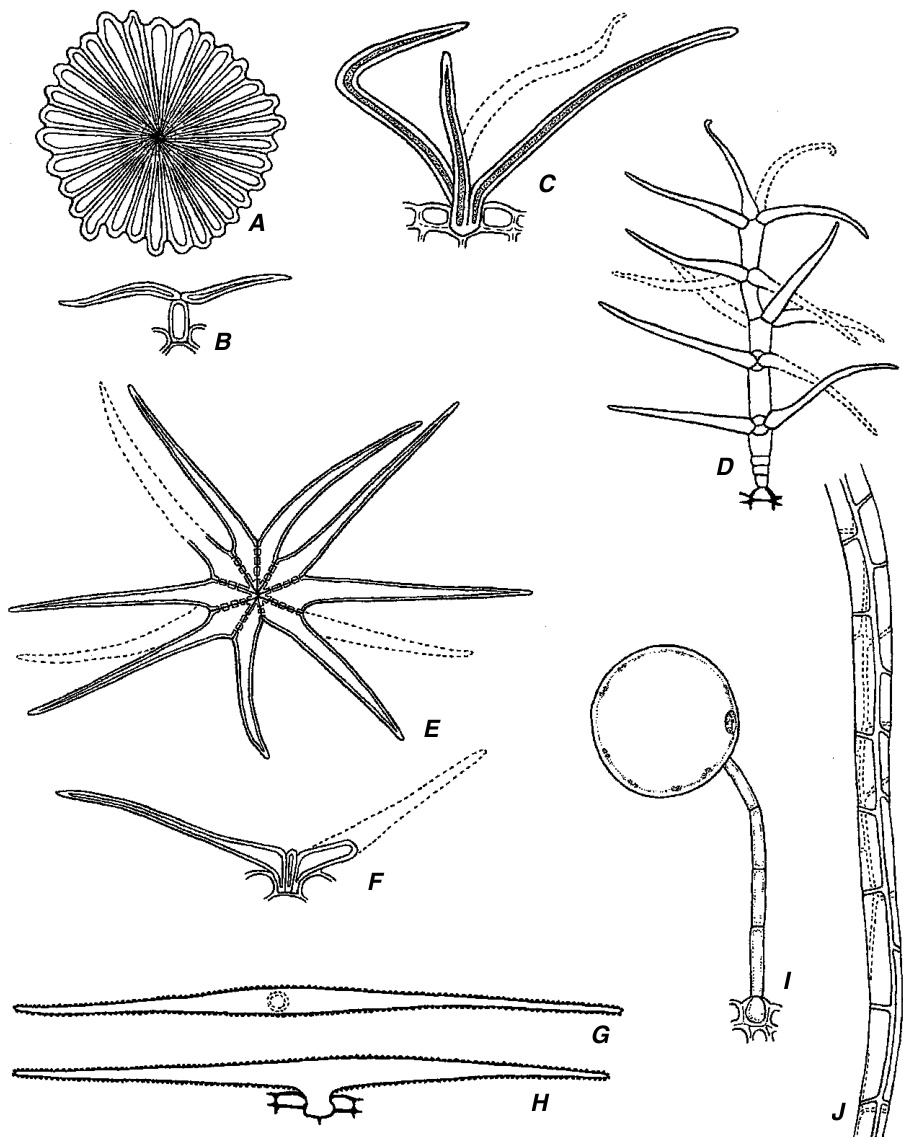 毛状体。A, B, Olea的盾状鳞片,表面$\mathbf{\eta}(\mathbf{A})$和侧面$\mathbf{(B)}$视图。C, Quercus的簇状星状毛。D, Platanus的树枝状毛。E, F, Sida的星状毛,表面$\mathbf{(E)}$和侧面$\mathbf{(F)}$视图。G, H, Lobularia的二臂T形单细胞毛,表面$(\mathbf G)$和侧面$\mathbf{\eta}(\mathbf{H})$视图。I, Chenopodium的囊状毛。J, Portulaca的多细胞蓬松毛的一部分。(A–C, I, $_{\times210}$ ; D–H, J, $\times105.$ )
图9.24
起源于胚珠(ovule)外珠被(outer integument)原表皮细胞(protodermal cell)的突起(Ramsey and Berlin, 1976a, b; Stewart, 1975, 1986; Tiwari and Wilkins, 1995; Ryser, 1999)。大多数毛状体(trichome)的发育是同步的,其发育可分为四个部分重叠的阶段。阶段1,纤维(fiber)起始发生在开花期(anthesis),纤维原始细胞(fiber initials)在胚珠表面形成明显的突起(图9.26A)。阶段2,纤维伸长(fiber elongation)随即开始(图9.26B),并在开花后持续12至16天,具体时间取决于品种。虽然皮层微管(cortical microtubules)在纤维原始细胞中随机排列,但随着纤维开始伸长,它们会横向排列在细胞的长轴上。纤维经历显著的伸长,长度可达直径的1000至3000倍(Peeters et al., 1987; Song and Allen, 1997)。伸长通过扩散机制(diffuse mechanism)发生;也就是说,它发生在纤维的整个长度上(图9.27A),尽管在尖端可能更快(Ryser, 1985)。一个大的中央液泡(central vacuole)通常位于细胞的基部,细胞器(organelles)或多或少均匀地分散在细胞质(cytosol)中(Tiwari and Wilkins, 1995)。棉纤维的初生壁(primary wall)明显分为两层,外层电子密度较高,由果胶(pectin)和伸展蛋白(extensin)组成,内层电子密度较低,由木葡聚糖(xyloglucan)和纤维素(cellulose)组成(Vaughn and Turley, 1999)。与具有扩散生长的细胞一样,新的壁材料被添加到整个细胞表面。角质层(cuticle)延伸到所有
图9.25
毛状体。A,Nicotiana(烟草)的一组普通毛状体和腺毛状体(具多细胞头)。B,烟草腺毛状体的放大图,显示腺头内容物的特征密度。C,Humulus的钩状毛状体,具钟乳体(cystolith)。D,长卷曲单细胞毛状体,E,Boehmeria的短刚毛,具钟乳体。F,Cannabis的钩状毛状体,具钟乳体。G,H,Humulus的腺盾状毛状体,分别显示横切面$(\mathbf G)$和表面$\mathbf{\eta}(\mathbf{H})$视图。(H来自比$\mathbf{G}$年轻的毛状体。)(A,F,$\times100$;B,D,E,$\times310$;C-G,$\times245$;H,$\times490.\$)
表皮细胞。第三阶段,当纤维接近其最终长度时,次生壁(secondary wall)形成开始,并可能持续20至30天。从快速细胞伸长期间的初生壁(primary wall)形成到伸长减缓及次生壁形成开始的转变,与微管(microtubules)和壁微纤维(wall microfibrils)的变化模式精确相关(Seagull, 1986, 1992; Dixon et al., 1994)。随着次生壁形成的开始,皮层微管(cortical microtubules)开始从横向转变为陡峭的螺旋取向。除了纤维素(cellulose),次生壁的第一层还含有一些胼胝质(callose)(Maltby et al., 1979)。成熟时,棉纤维的次生壁几乎由纯纤维素组成(Basra and Malik, 1984; Tokumoto et al., 2002)。棉花的绿绒突变体和一些野生棉种的次生壁含有不同数量的木栓质(suberin)和相关蜡质(waxes),这些物质通常以同心层的形式沉积,与纤维素层交替(Ryser and Holloway, 1985; Schmutz et al., 1993)。过氧化氢(hydrogen peroxide)被认为是棉纤维次生壁分化的信号(Potikha et al., 1999)。第四阶段,成熟期紧随壁增厚之后。纤维死亡,推测是通过程序性细胞死亡(programmed cell death)的过程,并变得干燥。
在一项优雅的研究中,Ruan等人(2001)发现棉纤维胞间连丝(plasmodesmata)的门控与蔗糖(sucrose)和${\bf K}^{+}$转运蛋白(transporter)及扩展蛋白(expansin)基因的表达之间存在相关性。连接棉纤维与下方种皮的胞间连丝
图9.26
发育中的棉花(Gossypium birsutum)纤维的扫描电子显微镜照片。A,开花当晚胚珠合点端(chalazal half)的纤维初始细胞(fiber initials)。初始细胞呈现为小突起。B,开花后两天,胚珠被幼嫩的纤维覆盖。(来自Tiwari和Wilkins, 1995。)
细胞表面的扩散生长标记
B 顶端生长
图9.27
通过扩散生长和顶端生长进行的细胞伸长。棉纤维的伸长在其整个长度上均匀发生,即通过扩散生长(A)。根毛和花粉管的伸长仅限于其顶端;即根毛和花粉管是顶端生长细胞$\mathbf{(B)}$。如果在这种细胞的表面做标记,然后让其生长,标记之间的相对距离在进一步伸长前后将反映所采取的伸长机制。(改编自Taiz和Zeiger, 2002. $\copyright$ Sinauer Associates。)
在伸长阶段开始时,膜不透性荧光溶质羧基荧光素(CF)的跨界面运动被完全阻断,导致相关基因显著下调。结果,溶质进入发育中的纤维的途径从最初的共质体途径转变为质外体途径。在伸长阶段,质膜蔗糖和${\bf K}^{+}$转运蛋白基因GLSUT1和GhkT1的表达达到最高水平。因此,纤维的渗透压和膨压升高,推动了快速伸长阶段。扩张蛋白mRNA的水平仅在伸长早期较高,之后迅速下降。总体而言,这些结果表明,棉纤维的伸长最初是通过细胞壁松弛实现的,最终通过细胞壁刚性增加和高膨压的丧失而终止。纤维胞间连丝对CF的不透性只是暂时的;在伸长阶段结束时或接近结束时,共质体连续性重新建立。在CF输入受限期间,大多数胞间连丝从无分支形式转变为分支形式。发育中的棉纤维为研究纤维素生物合成以及细胞分化和生长提供了一个极好的系统(Tiwari和Wilkins,1995;Pear等,1996;Song和Allen,1997;Dixon等,2000;Kim, H. J.和Triplett,2001)。
根毛 根的毛状体,即根毛,是表皮细胞的管状延伸。在一项涉及20个科37个物种的研究中,根毛的直径在5到17微米之间,长度在80到1500微米之间(Dittmer,1949)。根毛通常是单细胞且无分支的(Linsbauer,1930)。生长在空气中的Kalanchoë fedtschenkoi的不定根具有多细胞根毛,而生长在土壤中的同类型根则具有单细胞根毛(Popham和Henry,1955)。根毛是根的典型特征,但与根毛相同的管状突起可能从幼苗下胚轴的表皮细胞发育而来(Baranov,1957;Haccius和Troll,1961)。尽管根毛通常起源于表皮,但在鸭跖草科(包括Rhoeo和Tradescantia)中,“次生根毛”从距离根尖几厘米的外皮层细胞发育而来,位于较老的表皮(“初生”)根毛区域(Pinkerton,1936)。在拟南芥的schizoriza(scz)突变体中,根毛起源于表皮下层的细胞(Mylona等,2002)。根毛的主要功能被认为是扩展根的吸收表面,以吸收水分和养分(Peterson和Farquhar,1996)。根毛已被确定为高粱属物种中根系分泌物的唯一生产者(Czarnota等,2003)。
根毛向顶(acropetally)发育,即朝向根的顶端。由于大多数幼苗主根中根毛的向顶起始顺序,根毛在大小上表现出均匀的梯度变化,从最靠近顶端的根毛开始,到成熟长度的根毛结束。根毛在细胞分裂逐渐减弱的根区域起始为小的突起或膨大(图9.28A)。在拟南芥(Arabidopsis)中,根毛总是在最靠近根尖的细胞末端形成(Schiefelbein和Sommerville, 1990; Shaw等, 2000),起始部位的膨大与细胞壁的酸化密切相关(Bibikova等, 1997)。根毛起始部位还表现出扩张蛋白(expansin)的积累(Baluška等, 2000; Cho和Cosgrove, 2002)以及木葡聚糖(xyloglucan)和内转糖基酶(endotransglycosylase)活性的增加(Vissenberg等, 2001)。
与表现出扩散生长的棉纤维不同,根毛是顶端生长(tip-growing)的细胞(图9.27B; Galway等, 1997)。与其他顶端生长的细胞(最显著的是花粉管)(Taylor, L. P.和Hepler, 1997; Hepler等, 2001)一样,伸长的根毛显示出其内容物的极化组织,某些细胞器优先定位于细胞的特定部位(图9.28)。顶端富含来自高尔基体(Golgi)囊泡的分泌囊泡。这些囊泡携带细胞壁前体,通过胞吐作用释放到发育中的细胞壁基质中。顶端的钙离子($\left(\mathbf{C}\mathbf{a}^{2+}\right)$)内流似乎通过其对细胞骨架肌动蛋白(actin)成分的影响与分泌过程的调节密切相关(Gilroy和Jones, 2000)。在生长的根毛中,肌动蛋白丝束在皮层细胞质中延伸根毛的长度,并通过穿过液泡的细胞质链环回(图9.28E, F和9.29A; Ketelaar和Emons, 2001)。肌动蛋白丝在...
图9.28
发育中的野豌豆(Vicia sativa)根毛的微分干涉差(A-E)和共聚焦(F, $\mathbf{G}$)图像。A,新出现的根毛,大部分被一个大液泡(v)占据;s,外围的细胞质链。B, C,生长的根毛。顶端的平滑区域含有高尔基体囊泡(小括号)。C中的亚顶端区域被带有许多细胞器的细胞质链穿过(大括号)。D,生长终止的根毛,顶端附近有几个小液泡。E,完全生长的根毛,具有外围细胞质(s)和一个大的中央液泡(v)。F, G,免疫标记的肌动蛋白丝束。这些束与细胞的长轴平行排列。根毛的顶端(箭头指示的裂隙)似乎没有肌动蛋白。(A-E,相同放大倍数;F, G,相同放大倍数。来自Miller, D. D.等, 1999。$\copyright$ Blackwell Publishing。)
图9.29
生长中的Nicotiana tabacum根毛尖端的示意图。A,肌动蛋白丝(actin filaments)的分布。B,反向喷泉流(reverse fountain streaming)。(来自Hepler等,2001。经许可转载自《细胞与发育生物学年度评论》,第17卷。$\copyright$ 2001 by Annual Reviews. www.annualreviews.org)
根毛尖端的情况存在争议。一些报告指出,肌动蛋白丝在尖端形成一个三维网状结构——肌动蛋白帽(actin cap)(Braun等,1999;Baluška等,2000),而另一些报告则表明,肌动蛋白丝在尖端是无序的,数量很少或根本不存在(图9.28E、F和9.29A;Cárdenas等,1998;Miller, D. D.等,1999)。在生长的根毛和花粉管中,细胞质流动被描述为反向喷泉流(reverse fountain streaming),其中流动沿细胞的两侧向顶端移动,而在中央束中则向基部移动(图9.29B;Geitmann和Emons,2000;Hepler等,2001)。根毛的亚顶端部分积累了大量的线粒体,而基部区域则积累了大部分其他细胞器。细胞核迁移到发育中的根毛中,只要根毛在生长,它就位于离尖端一定距离的位置(Lloyd等,1987;Sato等,1995)。细胞核的定位是一个由肌动蛋白调控的过程(Ketelaar等,2002)。在伸长完成后,细胞核可能会处于一个或多或少随机的位置(Meekes,1985)或迁移到基部(Sato等,1995),并且细胞质极性消失。此时,肌动蛋白丝束穿过尖端(Miller, D. D.等,1999),这可以通过完全生长的根毛中发生的循环型细胞质流动来证明(Sieberer和Emons,2000)。微管(microtubules)在生长的根毛中呈纵向排列;当它们接近细胞尖端时,它们变得随机排列(Lloyd,1983;Traas等,1985)。微管显然负责将肌动蛋白丝组织成束,这些束与肌球蛋白一起能够运输分泌囊泡(Tominaga等,1997)。微管在确定细胞的生长方向中起作用(Ketelaar和Emons,2001)。根毛壁的延伸速度在萝卜根中为每小时${\bf0.1m m}$(Bonnett和Newcomb,1966);在Medicago truncatula中为每分钟$0.35\pm0.03\upmu\mathrm{m}$(Shaw, S. L.等,2000)。根毛通常是短命的,它们的寿命通常以天为单位。
图9.30
Arabidopsis毛状体中的丝状肌动蛋白细胞骨架。使用与小鼠Talin基因的肌动蛋白结合域融合的GFP在活体毛状体中可视化F-肌动蛋白。(由Jaideep Mathur提供。)
关于根毛结构、发育和功能的优秀综述由Ridge(1995)、Peterson和Farquhar(1996)、Gilroy和Jones(2000)以及Ridge和Emons(2000)提供。
拟南芥的毛状体
毛状体(trichomes)是发育中的叶原基表皮中最早开始分化的表皮细胞,拟南芥的毛状体也不例外(Hülskamp et al., 1994; Larkin et al., 1996)。毛状体的起始和成熟总体上沿着叶原基的近轴面(上表面)从顶端向基部方向进行,尽管在叶片继续生长的过程中,通常在成熟毛状体之间的区域会额外起始新的毛状体,这些区域的周围原表皮细胞仍在分裂。成熟时,拟南芥的叶毛状体通常具有三个分支(图9.30和9.31B)。
拟南芥叶片中的毛状体发育可以分为两个生长阶段(Hülskamp, 2000; Hulskamp and Kirik, 2000)。第一个阶段始于毛状体前体细胞停止分裂并开始进行核内复制(即在没有核和细胞分裂的情况下进行DNA复制;第5章)。初生的毛状体首先表现为叶片表面的一个小突起(图9.31A)。经过两到三次核内复制周期后,它从叶片表面长出并经历两次连续的分支事件。最后一次,即第四轮核内复制发生在第一次分支事件之后。此时,毛状体的DNA含量从正常原表皮细胞的2C(C为单倍体DNA含量)增加到32C(Hilskamp et al., 1994)。前两个分支与叶片的长轴(基部-远端)对齐(图9.31A)。远端分支随后垂直于第一个分支平面分裂,形成三叉毛状体(图9.31A, B)。通常认为,在分支之前——即在管状生长阶段——发育中的毛状体主要通过顶端生长增加大小,之后则通过扩散生长扩展。在第二阶段,即三个分支起始后,毛状体经历快速扩展,大小增加7到10倍(Hülskamp and Kirik, 2000)。随着毛状体接近成熟,细胞壁增厚,其表面被来源和功能未知的乳头状突起覆盖(图9.31B)。成熟毛状体的基部被8到12个矩形细胞环绕,这些细胞在毛状体开始分支时首次变得可识别(Hülskamp and Schnittger, 1998)。毛状体的基部似乎推入了周围细胞下方,形成了一个凹陷或插座;因此,这些周围细胞有时被称为插座细胞。这些细胞也被称为附属细胞,它们在个体发育上与毛状体没有密切关系(Larkin et al., 1996)。
图9.31
拟南芥叶片近轴面的扫描电子显微镜图像,显示(A)单个叶片上毛状体形态发生的各个阶段,以及$\mathbf{(B)}$具有乳头状突起的成熟毛状体。(由Jaideep Mathur提供。)
细胞骨架在毛状体形态发生(trichome morphogenesis)中起着至关重要的作用(Reddy and Day, I. S., 2000)。在毛状体发育的第一阶段,微管(microtubules)起主导作用;在第二阶段,肌动蛋白丝(actin filaments)起主导作用。微管负责建立毛状体分支的空间模式,微管的取向在决定生长方向方面起着决定性作用(Hülskamp, 2000; Mathur and Chua, 2000)。肌动蛋白丝(图9.30)在分支的延伸生长过程中起主导作用,靶向递送生长所需的细胞壁成分,并用于精细化和维持已经建立的分支模式(Mathur et al., 1999; Szymanski et al., 1999; Bouyer et al., 2001; Mathur and Hülskamp, 2002)。
由于其简单性和可见性,拟南芥(Arabidopsis)的叶毛状体为研究植物细胞命运和形态发生提供了一个理想的遗传模型系统。越来越多的毛状体发育所需的基因正在被鉴定出来。基于对相应突变体表型的遗传分析,人们对毛状体形态发生的调控和发育步骤的顺序有了更深入的了解。Oppenheimer (1998)、Glover (2000)以及Hülskamp及其同事(Hülskamp, 2000; Hülskamp and Kirik, 2000; Schwab et al., 2000)对拟南芥毛状体形态发生的一些优秀综述提供了参考。
❙ 表皮中的细胞模式
叶片中气孔和毛状体的空间分布是非随机的
人们早就知道,叶片表皮中气孔和毛状体的空间分布或模式是非随机的,并且它们之间存在最小间距。然而,控制模式形成的机制才刚刚被阐明。两种提出的机制受到了最多的关注:细胞谱系机制(cell lineage mechanism)和侧向抑制机制(lateral inhibition mechanism)。细胞谱系机制依赖于一系列高度有序的细胞分裂,通常是不对称的,这些分裂会自动产生不同类别的细胞。每个细胞的最终命运可以通过其在谱系中的位置来预测。侧向抑制机制不依赖于细胞谱系,而是依赖于发育中的表皮细胞之间的相互作用或信号传导来决定每个细胞的命运。第三种机制,即细胞周期依赖性机制(cell cycle-dependent mechanism),提出气孔模式与细胞周期有关(Charlton, 1990; Croxdale, 2000)。
几乎可以肯定的是,细胞谱系依赖机制是驱动真双子叶植物(eudicots)叶片气孔模式形成的主要力量(Dolan and Okada, 1999; Glover, 2000; Serna et al., 2002)。例如,在Arabidopsis中,气孔分生组织细胞的有序分裂模式导致一对保卫细胞被三个克隆或个体发育相关的附属细胞包围,其中一个明显比另外两个小(anisocytic气孔复合体;图9.22B)。因此,每对保卫细胞之间至少由一个表皮细胞隔开。已经鉴定出两种Arabidopsis突变体,too many mouths (tmm)和four lips (flp),它们破坏了正常的气孔模式并导致气孔聚集(Yang and Sack, 1995; Geisler et al., 1998)。有研究表明,TMM是受体复合体的一个组成部分,其功能是在表皮发育过程中感知位置线索(Nadeau and Sack, 2002)。第三个最近发现的Arabidopsis气孔突变体,stomatal density and distribution1-1 (sdd1-1),表现出气孔密度增加两到四倍,其中一部分额外的气孔以聚集形式出现(Berger and Altmann, 2000)。显然,SDD1基因在调控进入气孔途径的细胞数量以及气孔发育前发生的不对称细胞分裂数量中起重要作用(Berger and Altmann, 2000; Serna and Fenoll, 2000)。SDD1在分生组织细胞/保卫母细胞中强烈表达,而在其邻近细胞中表达较弱。有研究表明,SDD1产生一种信号,从分生组织细胞/保卫母细胞移动到邻近细胞,并刺激邻近细胞发育为普通表皮细胞,或抑制它们转化为额外的(卫星)分生组织细胞(von Groll et al., 2002)。SDD1的功能已被证明依赖于TMM的活性(von Groll et al., 2002)。(顺便提一下,尽管野生型Arabidopsis的叶片上的气孔模式是非随机的,但在同一植物的子叶上,气孔模式是随机的;Bean et al., 2002。)
在单子叶植物Tradescantia的叶片中,表皮细胞的活动可以分为四个主要区域或区域:增殖分裂区(基部分生组织)、无分裂的气孔模式形成区、有分裂的气孔发育区以及仅发生细胞扩展的区域(Chin et al., 1995)。当新细胞从基部分生组织移位时,它们在细胞周期中的位置显然决定了它们在到达模式形成区时是否会成为气孔细胞或表皮细胞(Chin et al., 1995; Croxdale, 1998)。Tradescantia中的气孔模式也受到晚期发育事件的影响,这些事件可能会阻止多达$10\%$的气孔初始细胞(保卫母细胞)的发育(Boetsch et al., 1995)。被阻止的初始细胞比气孔之间的平均距离更接近其最近的邻近初始细胞。这里可能涉及侧向抑制。被阻止的初始细胞会转换发育途径并成为普通表皮细胞。
与拟南芥叶片的气孔模式不同,叶片毛状体(trichomes)的间距不依赖于基于细胞谱系的机制。如前所述,毛状体和周围的附属细胞(accessory cells)没有克隆关系。没有有序的细胞分裂在毛状体之间提供间隔细胞。很可能是发育中的表皮细胞(epidermal cells)之间的相互作用或信号传导决定了哪些细胞会发育成毛状体。也许发育中的毛状体会招募一组附属细胞并抑制其他细胞发育成毛状体(Glover, 2000)。
两个基因,GLABRA1 (GL1)和TRANSPARENT TESTA GLABRA1 (TTG1),已被确定为拟南芥叶片毛状体发育起始和正确模式所必需的。这两个基因都作为毛状体发育的正调控因子(positive regulators)起作用(Walker et al., 1999)。强gl1和ttg1突变体在其叶片表面不产生任何毛状体(Larkin et al., 1994)。第三个基因GLABRA3 (GL3)也可能在叶片毛状体的起始中起作用(Payne, C. T., et al., 2000)。已知有两个基因是拟南芥叶片毛状体模式的负调控因子(negative regulators),即TRIPTYCHON (TRY)和CAPRICE (CPC)(Schellmann et al., 2002)。这两个基因都在毛状体中表达,并在初始毛状体边界细胞的侧向抑制(lateral inhibition)过程中共同起作用。
另一个在毛状体发育早期涉及的基因是GLABRA2 (GL2),它在毛状体的整个发育过程中都有表达(Ohashi et al., 2002)。gl2突变体中会产生毛状体,但其生长受阻,大多数不分支(Hülskamp et al., 1994)。还鉴定出另一个基因TRANSPARENT TESTA GLABRA2 (TTG2),它控制毛状体的早期发育。
被子植物根表皮有三种主要模式类型
类型1 在大多数被子植物(几乎所有的真双子叶植物(eudicots),一些单子叶植物(monocots))中,根的任何原表皮细胞(protodermal cell)都有可能形成根毛(root hair),根毛是随机排列的(图9.32A)。在禾本科(Poaceae)中,芦竹亚科(Arundinoideae)、竹亚科(Bambusoideae)、虎尾草亚科(Chloridoideae)和黍亚科(Panicoideae)表现出这种模式(Row and Reeder, 1957; Clarke et al., 1979)。
类型2 在基部被子植物(basal angiosperm)睡莲科(Nymphaeaceae)和一些单子叶植物中,根毛起源于不对称分裂(asymmetric division)的较小产物(图9.32B)。这些较小且较密的根毛形成细胞称为毛状体母细胞(trichoblasts)(Leavitt, 1904)。在一些科(泽泻科(Alismataceae)、天南星科(Araceae)、鸭跖草科(Commelinaceae)、血皮草科(Haemodora
图9.32
被子植物根表皮的三种主要模式类型。斜线细胞是根毛细胞,黑色细胞是无毛细胞。圆圈表示根毛基部的位置。A,类型1。任何原表皮细胞都可以形成根毛。B,类型2。根毛起源于不对称分裂的较小产物(毛状体母细胞)。C,类型3。有离散的垂直列,完全由较短的毛细胞和较长的无毛细胞组成。(来自Dolan, 1996,经牛津大学出版社许可。)
在Araceae、Hydrocharitaceae、Pontederiaceae、Typhaceae和Zingiberaceae中,毛状体细胞(trichoblast)位于初始原表皮细胞(initial protodermal cell)的近端(proximal end)(远离根尖)。而在Cyperaceae、Juncaceae、Poaceae和Restianaceae中,它位于初始细胞的远端(distal end)(朝向根尖)(Clowes, 2000)。在细胞分裂(cytokinesis)之前,细胞核迁移到初始细胞的近端或远端。毛状体细胞显示出相当大的细胞学和生物化学分化。例如,在Hydrocharis中,毛状体细胞与其较长的姐妹细胞(无毛细胞,atrichoblasts)不同,具有更大的细胞核和核仁、更简单的质体、更强的酶活性以及更多的核组蛋白(nucleohistone)、总蛋白、RNA和核DNA(Cutter和Feldman, 1970a, b)。
类型3 第三种模式,细胞排列成完全由较短的毛细胞或较长的无毛细胞组成的垂直列(图9.32C),以Arabidopsis和Brassicaceae的其他成员为例(Cormack, 1935; Bünning, 1951)。被称为条纹模式(striped pattern)(Dolan和Costa, 2001),它也出现在Acanthaceae、Aizoaceae、Amaranthaceae、Basellaceae、Boraginaceae、Capparaceae、Caryophyllaceae、Euphorbiaceae、Hydrophyllaceae、Limnanthaceae、Plumbaginaceae、Polygonaceae、Portulacaceae、Resedaceae和Salicaceae中(Clowes, 2000; Pemberton等, 2001)。在Onagraceae和Urticaceae的物种中发现了条纹和非条纹模式(Clowes, 2000)。
在Arabidopsis根中,毛细胞和无毛细胞类型以明显的位置依赖性模式指定:根毛细胞总是位于两个皮层细胞之间的径向(垂周)壁(radial (anticlinal) walls)交界处上方,而无毛细胞直接位于皮层细胞上方(图9.33; Dolan等, 1994; Dolan, 1996; Schiefelbein等, 1997)。有几个基因与Arabidopsis根表皮模式的建立有关,包括TTG1、GL2、WEREWOLF (WER)和CAPRICE (CPC)。在ttg1、gl2和wer突变体中,所有表皮细胞都产生根毛,表明TTG1、GL2和WER是根毛发育的负调节因子(negative regulators)(Galway等, 1994; Masucci等, 1996; Lee和Schiefelbein, 1999)。相比之下,cpc突变体不形成根毛,而过表达CPC的转基因植物将所有根表皮细胞转化为毛形成细胞,表明主要在无毛细胞中表达的CPC是根毛发育的正调节因子(positive regulator)(Wada等, 1997, 2002)。$_{C P C}$的表达受TTG1和WER控制,CPC通过控制GL2促进毛形成细胞的分化。已经表明,CPC蛋白从表达CPC的无毛细胞移动到毛形成细胞,在那里它抑制$_{G L2}$的表达(Wada等, 2002)。正如Schiefelbein (2003)所指出的,尽管Arabidopsis根和茎中毛细胞的分布非常不同
图9.33
拟南芥根的横切面。一层侧根冠细胞围绕在表皮周围。位于相邻皮层细胞径向壁连接处上方的染色较深的表皮细胞是根毛细胞。染色明显较浅的表皮细胞是无毛细胞。(经Schiefelbein等人许可转载,1997年。$\copyright$ 美国植物生物学家协会。)
相似的分子机制负责两种细胞类型的模式形成。
在拟南芥根中,共质体通讯(plasmodic communication)与表皮分化之间存在明确的关系。染料耦合实验表明,最初,根的表皮细胞是共质体耦合的(Duckett et al., 1994)。然而,当它们通过伸长区并进入分化区时,它们分化成毛细胞或无毛细胞,它们就变得共质体解耦。成熟的根表皮细胞不仅彼此共质体隔离,而且与下面的皮层细胞也隔离。拟南芥根所有组织中的胞间连丝(plasmodesmata)频率已被证明随着根龄的增加而急剧下降(Zhu et al., 1998)。拟南芥成熟下胚轴的表皮细胞是共质体耦合的,但与下面的皮层和根表皮隔离(Duckett et al., 1994)。
❙ 其他特化的表皮细胞
除了保卫细胞和各种类型的毛状体外,表皮还可能包含其他类型的特化细胞。例如,禾本科(Poaceae)的叶表皮系统通常包含长细胞和两种短细胞,硅质细胞(silica cells)和木栓细胞(cork cells)(图9.9和$9.34)\$。在植物的某些部位,短细胞在叶表面上方以乳头状、刚毛状、刺状或毛状的形式发育出突起。禾本科的表皮细胞排列成平行的行,这些行的组成在植物的不同部位有所不同(Prat, 1948, 1951)。例如,叶鞘基部内侧的表皮由仅由长细胞组成的均质表皮组成。在叶子的其他地方,发现了不同类型细胞的组合。包含长细胞和气孔的行位于同化组织上方;只有细长细胞或这些细胞与木栓细胞或刚毛或混合的短细胞对沿着叶脉排列。在茎中,表皮的组成也因节间(intermode)的水平和节间在植物中的位置而异。在禾本科和其他单子叶植物中发现的另一种特殊类型的表皮细胞是泡状细胞(bulliform cell)。
硅质细胞和木栓细胞经常成对出现
硅质$\mathrm{(SiO}_{2}{\cdot}n\mathrm{H}_{2}\mathrm{O)}$大量沉积在禾本科植物的茎叶系统中,硅质细胞之所以得名,是因为当它们完全发育时,它们的腔体充满了各向同性的硅质体。木栓细胞具有栓质化的壁,通常含有固体有机物质。除了短细胞的频率和分布外,硅质细胞中硅质体的形状或形式对于诊断和分类目的非常重要(Metcalfe, 1960; Ellis, 1979; Lanning and Eleuterius, 1989; Valdes-Reyna and Hatch,
图 9.34
甘蔗(Saccharum)表皮的表面观。A,茎的表皮,显示长细胞与短细胞对的交替排列:木栓细胞和硅细胞。B,叶片的下表皮,显示气孔与各种表皮细胞的分布关系。(A,$\times500$;B,$\times320$。改编自Artschwager,1940。)
1991年;Ball等人,1999年)。硅体(phytoliths),源自希腊语,意为植物石头,硅体或其各种形式在考古植物学和地植物学研究中扮演了重要角色(Piperno,1988;Mulholland和Rapp,1992;Bremond等人,2004)。根据Prychid等人(2004)的研究,单子叶植物中最常见的硅体类型是“晶簇状”球形硅体。其他形式包括“帽状”类型(“截头圆锥形”)、“槽状”以及无定形的碎片类型(硅砂)。硅体的形状不一定与包含它们的硅细胞的形状一致。
硅-木栓细胞对起源于叶和节间基部(间生)分生组织中短细胞原基的对称或均等分裂(Kaufman等人,1970b,c;Lawton,1980)。因此,子细胞最初大小相等。上部的细胞是未来的硅细胞,下部的细胞是未来的木栓细胞。硅细胞比木栓细胞更快地扩大,通常从表皮表面凸出并进入木栓细胞。硅细胞的细胞壁保持相对较薄,而木栓细胞的细胞壁则显著增厚并木栓化。随着硅细胞接近成熟,其细胞核分解,细胞内部充满纤维状物质,并偶尔含有脂滴,这两种物质可能是原生质体的残余。最终,衰老的硅细胞的腔体被硅填充,硅聚合形成硅体(Kaufman等人,1985)。木栓细胞在成熟时保留其细胞核和细胞质。在高粱(Sorghum)中,木栓细胞已被证明会分泌表皮蜡的管状丝状物(图9.9;McWhorter等人,1993;Jenks等人,1994)。
硅体可能出现在硅细胞以外的表皮细胞中,包括长表皮细胞和泡状细胞(Ellis,1979;Kaufman等人,1981,1985;Whang等人,1998)。硅沉积物在表皮细胞壁中大量存在。此外,表皮下细胞之间的细胞间隙也可能被硅填充。硅体和细胞壁中的硅有多种功能被提出。细胞壁硅的一个被提出的功能是为叶片提供支撑。在日本,硅以炉渣的形式广泛用作水稻的硅肥。经过这种处理的水稻叶片更加直立,使更多的光线能够到达下部叶片,从而增加冠层光合作用。硅的存在还增加了对各种昆虫和病原真菌及细菌的抵抗力(Agarie等人,1996)。关于硅细胞中的硅体可能充当“窗口”以及硅化毛状体可能充当“光导管”以促进光传输到光合作用叶肉细胞的假设已被测试,但发现不足(Kaufman等人,1985;Agarie等人,1996)。
泡状细胞是高度液泡化的细胞
泡状细胞(bulliform cells),字面意思是“形状像气泡的细胞”,出现在除Helobiae以外的所有单子叶植物目(Metcalfe, 1960)。它们要么覆盖整个叶片的上表面,要么局限于纵向叶脉之间的沟槽中(图9.35)。在后一种位置,它们在叶脉之间形成带状结构,通常由几个细胞宽。在通过这种带的横切面中,细胞通常形成扇形图案,因为中间的细胞通常最大且呈楔形。泡状细胞可能出现在叶子的两侧。它们不一定局限于表皮(epidermis),但有时伴随着下层叶肉(mesophyll)中类似的无色细胞。
泡状细胞主要是含水细胞,由于含有很少或不含叶绿素(chlorophyll)而呈无色。此外,尽管如前所述,它们可能积累硅(silica),但这些细胞中很少发现单宁(tannins)和晶体(crystals)。它们的径向壁很薄,但外壁可能与相邻的普通表皮细胞一样厚或更厚。细胞壁由纤维素(cellulose)和果胶物质(pectic substances)组成。外壁被角质化(cutinized)并带有角质层(cuticle)。
关于泡状细胞的功能一直存在争议。它们在叶片发育的某个阶段突然快速膨胀,被认为会导致叶片的展开,因此有时将这些细胞称为膨胀细胞(expansion cells)。另一个概念是,通过膨压(turgor)的变化,这些细胞在成熟叶片的吸湿性(hygroscopic)开合运动中起作用,因此也被称为运动细胞(motor cells)。还有一些研究者怀疑这些细胞除了储水之外还有其他功能。对某些禾本科植物叶片展开和吸湿运动的研究表明,泡状细胞并不积极或特别参与这些现象。
图9.35
禾本科植物叶片的横切面,显示泡状细胞在叶片上侧的位置。A, Saccharum (甘蔗),一种$\mathrm{C_{4}}$植物,B, Avena (燕麦),一种$\mathrm{C}_{3}$植物。注意甘蔗中叶肉和维管束之间的空间关联比燕麦更紧密。(来自Esau, 1977; 幻灯片由J. E. Sass提供。)
(Burström, 1942; Shields, 1951)。注意到泡状细胞的外壁通常相当厚,细胞腔(lumina)有时充满硅(silica),Metcalfe (1960)质疑具有这些特征的细胞如何具有重要的运动功能。
一些表皮毛含有钟乳体(cystoliths)
毫无疑问,最熟悉的钟乳体是Ficus的椭圆形钟乳体,如前所述,它们在叶的多层表皮中的钟乳体细胞(lithocysts)内发育(图9.3)。这种类型的钟乳体形成被Solereder(1908)认为是“真正的钟乳体”。钟乳体也出现在叶的单层表皮中,许多存在于毛状体中。钟乳体毛(图9.25C, E, F)或毛状钟乳体细胞出现在几个真双子叶植物科中,特别是Moraceae(Wu和Kuo-Huang,1997)、Boraginaceae(Rao和Kumar,1995;Rapisarda等,1997)、Loasaceae、Ulmaceae和Cannabaceae(Dayanandan和Kaufman,1976;Mahlberg和Kim,2004)。关于毛状钟乳体细胞中钟乳体分布和组成的大部分信息来自大麻(Cannabis sativa)的法医鉴定研究(Nakamura,1969;Mitosinka等,1972;Nakamura和Thornton,1973),因为钟乳体毛的存在是其鉴定的重要特征。
尽管大多数钟乳体的主体主要由碳酸钙组成,但一些含有丰富的碳酸钙和二氧化硅(Setoguchi等,1989;Piperno,1988)。还有一些主要由二氧化硅组成(一些Boraginaceae、Ulmaceae、Urticaceae和Cecro-piaceae的物种)(Nakamura,1969;Piperno,1988;Setoguchi等,1993)。由于后者含有很少或不含碳酸钙,因此并非所有研究者都将其视为钟乳体。例如,Setoguchi等(1993)将这种类似钟乳体的含细胞称为“硅化异细胞(silicified idioblasts)”。
关于钟乳体细胞-钟乳体发育的最详细信息来自对Pilea cadierei(Urticaceae)叶和节间的研究(图9.36;
图9.36
Pilea cadierei中钟乳体细胞的发育。A,钟乳体的柄从加厚的外部平周壁开始形成突起。B,钟乳体的柄向下生长,推动质膜向前;钟乳体细胞显著扩大,钟乳体细胞和钟乳体主体都变成纺锤形。C,接近成熟的钟乳体细胞。成熟时,钟乳体细胞的细胞质占据细胞外围和钟乳体及其柄周围的薄边界层。细节:pm,质膜;t,液泡膜;v,液泡。(A,B,改编自Galatis等,1989;C,来自Watt等,1987的照片,经牛津大学出版社许可。)
Watt 等人, 1987; Galatis 等人, 1989)。$P.$ cadierei 中的石细胞(lithocyst)是由原表皮细胞(protodermal cell)的不对称分裂起始的。较小的子细胞可能直接分化成石细胞,或者它可能经历另一次分裂产生一个石细胞。无论哪种情况,初始的石细胞都会变得极化,因为细胞核和大多数细胞器都靠近内部平周壁(internal periclinal wall),而外部平周壁(external periclinal wall)开始增厚。当分化中的石细胞的外部平周壁变得大约为普通原表皮细胞的两倍厚时,石细胞柄(stalk of the cystolith)作为一个栓状物开始形成,它向下生长,推动质膜向前。在柄形成过程中,石细胞开始迅速液泡化(vacuolate),液泡系统占据了整个细胞空间,除了柄和石细胞体(cystolith body)正在发育的区域。在与周围分裂细胞协调生长的同时,石细胞大大伸长,似乎滑到表皮(epidermis)下方。因此,曾经小而矩形的细胞显著增大并变成纺锤形。石细胞体的发育与石细胞的发育相协调,两者同时伸长并增加直径。随着石细胞分化的进行,微管(microtubule)的数量和组织不断变化,表明微管在石细胞形态发生(morphogenesis)中起重要作用(Galatis 等人, 1989)。当完全形成时,纺锤形石细胞体的长度可达 $200\upmu\mathrm{m}$,直径可达 $30\upmu\mathrm{m}$,其中部区域通过柄附着在外部平周壁上。成熟时,石细胞体富含碳酸钙。一些石细胞体还含有二氧化硅,并被硅质材料鞘(sheath of siliceous material)覆盖(Watt 等人, 1987)。
石细胞的生理意义仍不清楚。有人认为,石细胞的形成可能通过增强二氧化碳的供应来促进光合作用,或者它可能是类似于软体动物细胞中钙颗粒形成的解毒机制(detoxification mechanism)的产物(Setoguchi 等人, 1989)。
