泛素相关知识
泛素
泛素有76个氨基酸残基,以Gly-Gly结尾。
泛素可以共价连接在别的蛋白的Lys残基上(也可能为另一个泛素的7个赖氨酸残基之一),此过程由三个酶催化:
- 泛素活化酶E1 消耗ATP将泛素C端羧基与E1自己的半胱氨酸残基共价连接,形成硫酯键。
- 泛素结合酶E2 将E1上的泛素转移至E2的半胱氨酸残基上,形成硫酯键
- 泛素连接酶E3 将E2的泛素转移到靶蛋白的赖氨酸残基上,形成酯键。
参与泛素化的三种酶
泛素活化酶E1:已知的只有两种,Ube1和Uba6.
泛素结合酶E2:Ubc,人至少有38种E2。同一种E2可以和许多种E3相互作用。
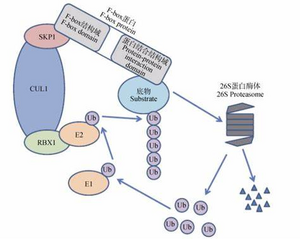
泛素连接酶E3:E3要识别特异性的底物,因此种类最多。可以分为两大类:
- HECT结构域E3:单亚基,修饰底物时先自身与泛素形成硫酯键,再将泛素转移至底物上。
- 含环指结构域E3:分为两类:单亚基和多亚基(比如APC/C和SCF)的。SCF E3包括Skp1、环指蛋白Rbx1、Cull、F-box蛋白。Cull为分子支架,一端结合Skp1,一端结合Rbx1。E2携带泛素结合Rbx1,F-box蛋白携带泛素化底物结合Skp1(通过F-box结构域)。
- 除了这两大类,人还有一些别的E3,但种类不是很多。
泛素化的功能
蛋白质降解:K48多聚泛素化导致。记忆:48谐音“死吧”因此导致蛋白酶体降解。
其他功能:泛素链也可以位于K6、K11、K27、K33、K63的位置上,甚至在一条泛素链有时会有多种连接方法。泛素有时候不会形成多聚链,而是单个泛素或者寡聚链。K63多聚泛素链与细胞表面受体胞吞、DNA损伤修复等有关。
去泛素化
去泛素化酶:人已知一百多种泛素化酶。
类泛素
类泛素有两种:一种是类泛素修饰蛋白,能够修饰别的蛋白,如SUMO、Nedd8、ISG15;一种是含有类泛素结构域的蛋白,不能修饰。
SUMO
SUMO即小的泛素相关的修饰物,有时称为苏素。哺乳动物有SUMO-1、SUMO-2、SUMO-3。
SUMO-1长101氨基酸,与泛素相比只有18%的序列相同,N端还有一段延伸序列,但三级结构却非常相似。
SUMO在C端的Gly-Gly后面还有较短的一段延伸序列,在Gly-Gly结合在底物上前,这段序列需要被切除。
SUMO化也是发生在底物的Lys残基上,但这个K位于ψKXE基序中。ψ代表疏水氨基酸。
SUMO活化酶E1是双亚基蛋白(Aos1+Uba2),分别和泛素活化酶的N端和C端类似。消耗ATP将SUMO共价结合在Uba2的半胱氨酸残基上。
SUMO结合酶E2目前只发现了一种:Ubc9.将SUMO转移到自身的半胱氨酸残基上。在体外,Ubc9自身即可催化SUMO转移到底物上。
随着研究进展,发现SUM连接酶E3可以结合Ubc9促进SUMO的转移。有多种。
原认为SUMO一般不发生多聚化,但发现SUMO-2和SUMO-3可以形成多聚化。
SUMO化的功能:RanGAP1被SUMO化后可以定位到核孔处;许多转录因子可以被SUMO化改变活性;某些蛋白SUMO化竞争泛素化位点,增强稳定性;有些蛋白的SUMO化反而导致泛素化降解;……
Nedd8
Nedd8由81个氨基酸组成,是与泛素最类似的类泛素。
E1是异源二聚体,ATP形成硫酯键;E2只发现一种Ubc12,转移到自己的半胱氨酸上;发现的E3数量很少。
功能有改变转录因子活性、改变蛋白质相互作用等。
