第十七章 种子休眠、萌发、幼苗建成
种子是植物特化的结构,用于下一代孢子体的传播。种子为种子植物门(Spermatophyta)所特有,该门包含被子植物和裸子植物。种子由胚珠发育而来——受精前的胚珠包含雌配子体,受精后则在其中进行胚胎发生(参见第21、22章)。包围胚胎的种子组织在胚胎发生及早期幼苗发育期间为胚胎提供贮藏养分。种子在脱离母体后还能保护胚胎免受环境影响。胚胎被封装成独立种子的演化,是植物繁殖摆脱水分依赖的众多适应性进化之一。因此,种子植物的演化标志着植物适应干旱陆地的重要里程碑。
本章首先描述不同类型种子的结构与组成,接着阐述种子萌发与幼苗建成的过程——此处指第一片光合叶片和最小根系的形成。在胚胎发生与萌发之间通常存在种子成熟期,最终进入静止状态(一种代谢速率降低的非萌发状态),此后种子脱离母体。静止状态确保萌发延迟至种子落入土壤,使其能获得幼苗生长所需的水分和氧气。虽然某些种子成熟后即可萌发,但另一些会保持休眠状态,需要额外处理或触发因子(如光照、低温或物理摩擦)才能萌发。这对许多农作物不成问题,因为人类对快速萌发种子的选育已导致休眠诱导基因的逐渐丢失。
种子开始萌发后,其贮藏养分即被动员以支持幼苗生长。大量酶被合成以降解种子中贮存的蛋白质、脂质和淀粉。激素在协调萌发与养分动员过程中发挥关键作用。
本章后续将探讨植物持续生长的相关过程,包括光形态建成(光诱导的发育)、功能性维管系统的发育,以及调控生长速率的机制。最后讨论使植物适应环境的差异性生长响应,包括向重性和向光性——即植物根据重力和光线定向的过程。
17.1 种子结构
尽管本章因被子植物种子的极端多样性和农业重要性而以其为重点,但理解被子植物与裸子植物种子的差异至关重要(详见网络专题17.1)。所有种子均包含三个基本结构:胚胎、养分贮藏组织和由死细胞构成的保护性外层——种皮(testa)。被子植物胚胎由胚轴(包括胚根)、下胚轴(附着一或两片子叶)以及带有胚芽(plumule,即第一片真叶原基)的茎尖组成。被子植物中滋养胚胎的贮藏组织是双受精形成的三倍体胚乳(参见第21章)。某些被子植物物种的种皮与果皮(心皮发育而来)融合。在谷物中,种皮与果皮融合,严格而言这类"种子"实为果实,但本书将统称为种子。图17.1展示了多种常见真种子及具种子形态的果实。
图17.1 种子与类种子果实。(A-D)真种子。(A)油菜籽(Brassica napus)。(B)巴西坚果(Bertholletia excelsa)。(C)咖啡豆(Coffea sp.)。(D)椰子(Cocos nucifera)。(E-I)单干闭果。(E)槭树(Acer sp.)具翅瘦果(翅果)。(F)草莓(Fragaria sp.)瘦果。(G)小麦等谷物(如小麦属Triticum spp.)颖果。(H)栎树(Quercus sp.)坚果。(I)向日葵等菊科植物(如向日葵属Helianthus spp.)连萼瘦果(具两心皮的瘦果)。单子叶植物的颖果与菊科植物的连萼瘦果通常被称作种子。
种子解剖结构在不同植物类群间差异显著
尽管具有共同特征,种子的尺寸范围却极为广泛——从仅重1微克的兰花粉尘状颗粒,到长度可达30厘米、重达20千克的海椰子(Lodoica maldivica)巨型种子。尽管胚胎结构相对简单且周围组织数量有限,不同植物类群的种子解剖结构仍展现出显著多样性。
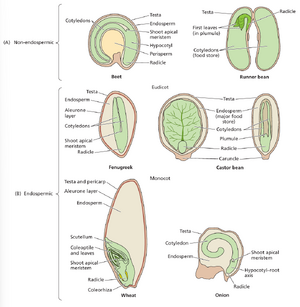
根据成熟时是否存在发育完善的三倍体胚乳,种子可大致分为有胚乳型与无胚乳型。图17.2展示了两类种子的典型代表。例如甜菜种子属于无胚乳型,因其三倍体胚乳在胚胎发育过程中基本被消耗殆尽。取而代之的是,外胚乳和贮藏子叶成为萌发期间的主要营养来源。外胚乳来源于珠心组织(即产生胚珠的母体组织,详见第21章)。菜豆(Phaseolus vulgaris)及多数豆科植物种子同样属于无胚乳型,它们依靠占据种子大部分体积的大型贮藏子叶作为营养储备。与之相对,蓖麻(Ricinus communis)、洋葱(Allium cepa)、面包小麦(Triticum spp.)和玉米(Zea mays)种子均属有胚乳型。
作为营养贮藏组织,胚乳通常富含淀粉、脂质和蛋白质。部分胚乳组织具有厚壁细胞,在萌发过程中降解后释放多种糖类。某些物种的胚乳最外层分化成特化的分泌组织,其增厚的初生壁称为糊粉层——该名称源于其细胞内部充满蛋白质贮藏液泡(PSVs),这类液泡最初被称为糊粉粒(见图1.23)。如第17.5节所述,糊粉层在调控某些真双子叶植物种子休眠中起重要作用。在小麦及禾本科(Poaceae)其他成员的种子中,分泌型糊粉层还负责萌发期间贮藏营养的动员过程。
谷类作物籽粒的胚胎高度特化,因其农业重要性及作为萌发期激素调控营养动员研究的经典模型系统,值得深入探讨。禾本科植物种子中存在特化的胚胎结构(详见第22章),主要包括以下部分(见图17.2B):
- 单片子叶经进化改造形成吸收器官——盾片,构成胚胎与淀粉质胚乳组织的交界面。萌发期间,胚乳动员的糖类由盾片吸收并转运至胚胎本体。
- 盾片基部鞘状结构延伸形成胚芽鞘,在幼芽穿过土壤生长时覆盖并保护初生叶。
- 下胚轴基部延伸形成包裹胚根的保护性鞘状结构,称为胚根鞘。
- 在禾本科某些物种(如玉米)中,上胚轴特化形成中胚轴(mesocotyl[1])(图17.2B未展示)。幼苗发育期间,中胚轴生长有助于将幼芽抬升至土表,尤其对深播种子至关重要(参见网络专题17.2)。
17.2 种子休眠
在种子成熟过程中,胚胎脱水并进入静止阶段。种子萌发需要复水,可定义为成熟种子中胚胎生长的恢复。萌发过程涵盖从干燥种子开始吸胀(湿润)(在17.4节种子萌发背景下讨论)到胚胎突破外围结构(通常以胚根为首)期间发生的所有事件。萌发的顺利完成取决于与营养生长相同的环境条件(见第18章):必须提供水分和氧气,且温度需处于生理范围内(即不抑制生理过程的温度区间)。然而,即使满足适宜环境条件,具有生活力(存活)的种子仍可能不萌发,此现象称为种子休眠。种子休眠是对萌发起始的内在时间阻断机制,为种子远距离传播提供额外时间窗口,同时通过阻止不利条件下的萌发来最大化幼苗存活率。种子库是在维持休眠与生活力条件下储存种子的场所,既包含天然库(如土壤)也包含人工库。
大多数成熟种子在散落时含水量通常低于0.1克/克干重。脱水导致代谢近乎停滞,种子进入静止或"休眠"状态。某些情况下种子会同时进入休眠。与因缺水、缺氧或温度不适导致的静止状态不同,种子休眠需要额外处理或信号才能萌发。
根据休眠起始的发育时间可区分不同类型休眠。在适宜条件下仍不萌发的新散播成熟种子呈现初级休眠。初级休眠解除后,若暴露于长期抑制萌发的不利环境,非休眠种子可能获得次级休眠(参见网络专题17.3)。
种子休眠机制存在两种基本类型:外源性与内源性
种子休眠兼具物理和生理机制。根据分类体系,初级休眠可分为外源休眠与内源休眠两大类型。
外源休眠(或称种皮强制休眠)指种皮或其他包被组织(如胚乳、果皮或花外器官)在萌发过程中对胚胎生长的物理抑制作用。此类种子的胚胎在去除或损伤种皮等外围组织后,遇水供氧即可迅速萌发。种皮可通过以下方式强制胚胎休眠:
- 水分不可透性:此类休眠(亦称硬实性)常见于旱生及半旱生植物,尤以豆科植物如三叶草(Trifolium属)和苜蓿(Medicago属)为典型。印度莲(Nelumbo nucifera)种子因不透水种皮可存活1200年,其蜡质角质层、栓化层及由木质化石细胞构成的栅栏层细胞壁共同阻隔水分渗入。机械或化学破皮可打破该休眠,自然界中动物消化道通过可致化学破皮。
- 气体交换阻碍:富氧环境可解除某些种子休眠,表明种皮等外围组织限制了胚胎氧气供应。野芥(Sinapis arvensis)种皮透氧性比透水性低10^4倍。另一些种子中,种皮酚类化合物的氧化反应会大量耗氧,降低胚胎氧可用性。
- 机械约束:萌发的首个可见标志通常是胚根突破外围结构(如存在胚乳则包括胚乳和种皮)。但拟南芥、番茄、咖啡和烟草等植物中,厚壁胚乳可能因过度坚硬阻碍胚根穿透。此类种子需通过产生细胞壁降解酶(通常在胚根突出部位)弱化胚乳细胞壁以完成萌发。
- 抑制物滞留。休眠种子通常含有次生代谢物,包括酚酸、单宁和香豆素类物质,对此类种子进行反复水洗常能促进萌发。种皮可通过阻碍抑制物从种子中逸出来维持休眠,也可能通过产生扩散至胚中的抑制物来诱导休眠。
内源休眠(亦称胚休眠)指源于种子自身、而非由种皮或其他周围组织物理或化学作用引起的休眠类型。该休眠受脱落酸(ABA)与赤霉素(GA)的激素比例调控(本节末尾将讨论),可能源于胚胎发育停滞导致胚体微小未成熟(参见网络专题17.4),或如苹果(Malus domestica)中因胚轴缺乏蔗糖供应所致。内源休眠通常在胚胎发育末期由ABA诱导产生。完全成熟的种子在吸胀后,需依赖内源ABA来调控和维持初级休眠。例如拟南芥、莴苣、大麦和烟草种子的休眠程度,与吸胀种子(而非干燥种子)中的内源ABA浓度呈正相关。休眠解除后,种子能在特定基因型允许的条件范围内萌发。
非休眠种子可表现胎萌和早熟萌发现象
某些物种的成熟种子不仅缺乏休眠,甚至在母株上直接萌发,此现象称为胎萌。真正的胎萌在被子植物中极为罕见,主要局限于红树林及生长于热带亚热带河口或河岸生态系统的植物。著名胎萌物种红树(Rhizophora mangle)即典型例证(图17.3)。该种子在果实未脱落时便萌发,形成细长标枪状繁殖体,可脱离母树插入周边软泥生根。
图17.3 湿地植物的胎萌现象。红树(Rhizophora mangle)的胎萌种子。
生理成熟种子在母株上萌发称为穗发芽,是部分谷类作物在潮湿成熟期的特征表现(图17.4A)。禾谷类(如小麦、大麦、水稻和高粱)的穗发芽会降低籽粒品质,造成严重经济损失。玉米中选育的胎萌突变体(vp),其胚粒可在果穗未离体时直接萌发(图17.4B)。部分突变体因ABA合成缺陷,另一类则对ABA不敏感,均导致ABA介导的正常休眠机制失效。外源ABA处理可部分抑制ABA缺陷型突变体的胎萌现象。玉米胎萌还需胚胎发育早期GA生物合成作为萌发诱导信号;GA与ABA双缺陷突变体不表现胎萌。这表明萌发受ABA:GA比例而非ABA绝对量调控。
图17.4 作物的胎萌现象。小麦(Triticum aestivum)穗发芽(A)与玉米(Zea mays)胎萌(B)。右图分别为两种作物未萌发的麦穗和果穗对照。
ABA:GA比例是胚胎种子休眠的主要决定因子
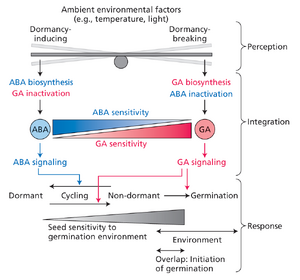
研究证实ABA抑制种子萌发,而GA则起促进作用。根据激素平衡理论,二者比例构成种子休眠与萌发的核心调控机制。ABA与GA在种子中的相对激素活性取决于两大要素:靶组织中各激素的存量,以及靶组织对激素的感知响应能力。而激素敏感性又由靶组织的信号通路决定(图17.5)。
ABA与GA的含量由其生物合成与失活速率的相对关系决定(参见第4章及网络附录3)。生物合成与失活途径的平衡受转录因子活性调控。如第17.3节所述,特定环境因子可改变种子内ABA:GA平衡从而促进萌发。某些处理(如后熟作用)通过降低ABA浓度促进萌发,而低温处理(或层积处理)则通过增加GA生物合成促进萌发(见图17.5)。后熟作用与低温处理将在17.3节后续内容中详细讨论。
调控种子休眠的另一关键因素是胚对ABA与GA的相对敏感性。最新模型表明,胚的激素敏感性同时受发育阶段和环境条件调控(见图17.5)。种子发育早期,ABA敏感性高而GA敏感性低,利于维持休眠状态;发育后期,ABA敏感性下降且GA敏感性升高,促进萌发进程。与此同时,种子对环境信号(如温度与光照)的敏感性逐渐增强,这些信号可刺激或抑制萌发。
ABA与GA并非调控种子休眠的唯一激素。例如乙烯与油菜素内酯均能削弱ABA抑制萌发的能力,这显然是通过负调控ABA信号转导途径实现的。同时,ABA抑制乙烯生物合成,而油菜素内酯则促进该合成过程。因此,激素网络可能协同调控种子休眠,正如其对多数其他发育现象的调控机制。
17.3 休眠解除
休眠解除涉及种子代谢状态的改变,使胚能重新启动生长。由于萌发是种子不可逆地发育成幼苗的过程,许多物种进化出精密机制以感知最佳环境条件。种子萌发的最终"决定"常具季节性特征,如网络专题17.3所述的次生休眠案例。本节将探讨引发休眠解除的环境信号。尽管各外部信号被单独讨论,但自然界中种子必须整合对多种环境因子(同时或相继出现)的响应。
鉴于ABA:GA比率对维持种子休眠具有决定性作用,解除休眠的环境条件最终被认为能激活影响ABA与GA响应平衡的基因网络。该假说与以下事实一致:用GA处理种子通常可替代积极环境信号以解除休眠。
光照是解除小种子休眠的重要信号
许多种子萌发需光(称为需光性),可能仅需短暂曝光(如'大急流'品种莴苣),间歇处理(如伽蓝菜属多肉植物),甚至特定光周期(短日照或长日照)。例如桦木属种子需长日照(16小时光照)萌发,而加拿大铁杉种子需短日照。光敏色素能感知红光(R)与远红光(FR)波长(见第16章),是光调控种子萌发的主要感受器。所有需光种子均表现出种皮限制性休眠,去除种皮和胚乳后胚根可在无光条件下伸长。光照对胚的作用是使胚根穿透胚乳,某些物种中该过程通过酶解珠孔区域(邻近胚根)细胞壁而实现。
许多草本和草地物种的小种子需要光才能萌发,其中许多种子如果被埋藏在光能穿透土壤的深度以下,就会保持休眠状态。即使这些种子位于土壤表面或附近,植被冠层的遮蔽程度(即种子接收到的R:FR光比例)也很可能影响它们的萌发。我们将在第19章中回到R:FR比例的影响,这与避荫现象相关。
一些种子需要低温或后熟来打破休眠
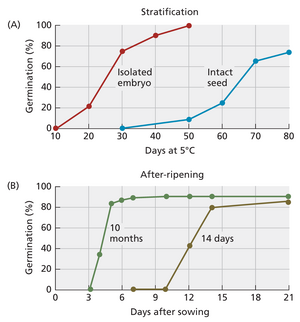
许多种子需要一段低温时期(1-10°C)才能萌发。对于适应温带气候的物种来说,这一要求具有明显的生存价值,因为这样的种子不会在秋天萌发,而是在来年春天萌发。通过低温处理来打破种子的休眠被称为层积处理,这一名称源于农业实践中将休眠种子分层堆放在土壤或湿沙中越冬的做法。如今,种子只需在冰箱中湿润储存即可。层积处理还有额外的好处,即它可以同步萌发,从而确保植物同时成熟。图17.6A展示了低温对苹果种子萌发的影响。完整的种子需要80天的低温处理才能达到最大萌发率,而分离的胚在约50天后表现出最大萌发率。因此,周围组织(种皮和胚乳)的存在使胚的低温需求增加了约30天。
一些种子可能需要一段后熟期,即在室温下干燥储存,然后才能萌发。后熟需求的持续时间可能短至几周(例如大麦,Hordeum vulgare)或长达5年(例如卷叶酸模,Rumex crispus)。在野外,后熟可能发生在冬季一年生植物中,其休眠通过夏季高温打破,使种子在秋天萌发。相反,在寒冷的冬季月份进行湿润低温处理对许多夏季一年生植物有效。园艺和农作物种子的后熟通常在特殊的干燥柜中进行,这些柜子保持适当的温度、通风和低湿度条件。
后熟持续时间对蓝茉莉烟草种子萌发的影响如图17.6B所示。仅后熟14天的种子在后续湿润后约10天开始萌发,而后熟10个月的种子仅3天后就开始萌发。当种子水分含量降至20%以下时,被认为处于‘干燥’状态。然而,如果种子过于干燥(水分含量5%或更低),后熟的有效性会降低。在几个物种中,ABA浓度在后熟期间下降,即使小幅下降也可能足以打破休眠。例如,在N. plumbaginifolia种子中,ABA浓度在后熟期间下降约40%。一般来说,后熟促进ABA浓度和敏感性降低,以及GA浓度和敏感性上升。
种子休眠可以通过各种化合物打破
大量化学物质,如呼吸抑制剂、巯基化合物、氧化剂和含氮化合物,已被证实在特定物种中能破除种子休眠。然而这些物质中仅有少数天然存在于环境中。其中硝酸盐(常与光照协同作用)可能是最重要的。某些植物如药用大蒜芥(Staphbrium officinale)的种子萌发绝对需要硝酸盐和光照。另一种破除休眠的化学物质是一氧化氮(NO),这种信号分子也参与多种胁迫响应(参见第15章)。无法合成NO的突变体萌发率降低,但通过外源NO处理可逆转此效应。在自然条件下,烟雾是许多物种种子萌发的强力化学刺激剂,由森林火灾产生。烟雾可能含多种萌发刺激物,其中活性最强的是karrikin类分子中的karrikinolide,其结构类似独脚金内酯植物激素(参见第4章)。
在上述三例中,化学刺激物似乎通过相同的基本机制破除休眠:下调脱落酸(ABA)生物合成或信号传导,同时上调赤霉素(GA)生物合成或信号传导,从而改变ABA与GA的比例。
17.4 种子萌发
萌发是指干燥种子开始吸水至胚体部分(通常为胚根)突破外围组织的全过程。严格来说,萌发以胚根突出为终结,不包括后续幼苗生长。为幼苗初期生长提供能量的贮藏养料快速动员过程始于萌发阶段。
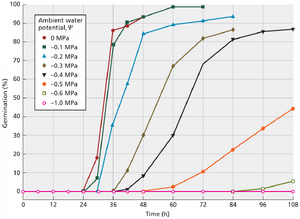
萌发需要适宜的水分、温度、氧气范围,通常还需光照和硝酸盐。其中水分是最关键因素。成熟风干种子的含水量在5%至15%之间,远低于完全活性代谢所需阈值。此外,吸水产生的膨压是驱动细胞扩张的基础——这恰是营养生长与发育的根基。如第6章所述,水分的吸收由从土壤到种子之间的水势梯度(Ψ)所驱动。例如番茄种子在较高环境水势(Ψ=0MPa)下培养可实现100%萌发,而在低水势(Ψ=-1.0MPa)下培养(此时水势梯度消失)则萌发完全受抑(图17.7)。
萌发与萌发后过程可根据吸水阶段划分为三个时期

正常情况下,种子吸水呈三相(图17.8):
- 阶段I:干燥种子通过吸胀作用快速吸水。
- 阶段II:吸胀吸水减缓,代谢过程(包括转录和翻译)重新启动。胚体扩张,胚根突破种皮。
- 阶段III:因幼苗生长导致水势(Ψ)下降,吸水恢复,种子贮藏养料被完全动员利用。
干燥种子在阶段I的初始快速吸水称为吸胀(imbibition),以区别于阶段III的吸水。尽管两种情况下均由水势梯度驱动吸水,但梯度成因不同:干燥种子中,水势方程中的基质势(Ψm)组分降低Ψ值并形成梯度。基质势源于水与固体表面的结合作用,如细胞壁微毛细管及蛋白质等大分子表面(见第5章)。细胞大分子复水激活基础代谢过程,包括呼吸作用、转录和翻译。
当所有潜在水结合位点达到饱和时吸胀停止,Ψm负值减小。阶段II中吸水速率减缓,直至水势梯度重建。因此阶段II可视为生长前的滞后期,此期间胚的溶质势(Ψs)因贮藏养分的分解及渗透活性溶质的释放而逐渐变负。种子体积可能因此增大导致种皮破裂,同时额外代谢功能启动,如细胞骨架重组和DNA修复机制激活。
阶段II中胚根突破种皮标志着萌发过程结束。伴随吸水产生的膨压增加使胚根细胞壁松弛延伸,引发细胞伸长。但许多种子中,胚根需先突破胚乳、种皮或果皮构成的屏障才能伸出。胚根伸出可分为单步或两步过程:单步过程中,周围组织在吸胀时物理弱化使胚根无阻碍伸出,或胚根充分扩张直接撑破周围组织;两步过程中,周围组织需先经历代谢性弱化,胚根才能伸出(参见网络专题17.5)。
阶段III因幼苗生长启动,细胞壁松弛和细胞扩张导致吸水速率急剧增加。因此阶段III胚的水势梯度由细胞壁松弛和溶质积累共同维持。
17.5 贮藏物质的动员
被子植物种子的主要养分贮藏于子叶或胚乳中。蛋白质、脂质和碳水化合物(淀粉)储存在这些组织的特殊结构中:淀粉储存在造粉体(amyloplasts,特化质体,见第1章)中;蛋白质储存在蛋白质贮藏液泡(protein storage vacuoles,PSVs)中;脂质储存在油体(oil bodies,或称脂滴 lipid droplets)中。所有植物均具备这三类特化的养分贮藏结构,但多数植物以某一类为主。萌发后发生大规模的贮藏物质动员,为幼苗生长提供营养、碳源、氮源、矿物质等,直至其实现自养。
淀粉是重要的碳贮藏形式,也是谷类作物的主要养分储备。胚乳是谷类贮藏淀粉的主要组织,但胚胎中也可积累。淀粉降解由α-淀粉酶和β-淀粉酶启动:α-淀粉酶从内部水解淀粉链产生α(1,4)-连接的葡萄糖残基寡糖;β-淀粉酶从末端降解这些寡糖产生麦芽糖,再由麦芽糖酶转化为葡萄糖。贮藏养分的动员在工业生产中至关重要,用于制造面包、饮料等所需的麦芽谷物。
蛋白质贮藏液泡为幼苗新蛋白质合成提供主要氮源和氨基酸(PSVs显微照片见图1.23)。贮藏蛋白由蛋白酶水解。蛋白质贮藏液泡还含有植酸钙镁phytin(植酸phytic acid的K⁺、Mg²⁺或Ca²⁺盐,植酸即肌醇六磷酸——一种糖醇),这是种子中磷酸盐的主要贮藏形式。养分动员期间,植酸酶phytase水解植酸钙镁释放磷酸盐及其他离子供幼苗利用。豆科植物是种子中贮藏大量蛋白质的典型代表。
油体含有脂质,这些脂质是高能碳源,在萌发期间会转化为蔗糖。(油体电镜照片见图1.25和图13.19。)除储存三酰甘油和磷脂外,油体还储存蛋白质,如油质蛋白(oleosins[2])、steroleosins和caleosins,其中油质蛋白占主导地位。油体普遍存在于油料作物种子中,如油菜籽、芥菜籽、棉籽、亚麻籽、玉米、花生、芝麻、椰子干、棕榈仁、大豆和葵花籽。在油料作物中,油体于胚胎内合成。如第13章所述,脂质在种子萌发期间通过脂肪酶活性、β-氧化和乙醛酸循环途径发生分解代谢。
谷物种子是理解淀粉动员的模型
谷物具有特化的淀粉动员机制,其作为脱落酸(ABA)和赤霉素(GA)在萌发与幼苗建成过程中功能的模型已被广泛研究。谷物种子由三部分组成:胚、胚乳及融合的种皮果皮(图17.9)。胚将发育为新幼苗,其具有特化的吸收器官——盾片。三倍体胚乳由两种组织构成:位于中央的淀粉质胚乳starchy endosperm,以及环绕其外围的糊粉层aleurone layer。糊粉层是特化的消化组织;淀粉质胚乳由薄壁细胞组成,这些细胞内的淀粉体充满淀粉粒。萌发期间,存活的糊粉层细胞合成α-淀粉酶及其他水解酶,并将其释放至淀粉质胚乳中。因此,胚乳中储存的养分储备被分解,溶解的糖类、氨基酸及其他产物通过盾片运输至发育中的胚。


如图17.9所示,萌发期间胚释放的赤霉素(GA)刺激谷物种子糊粉层产生并释放α-淀粉酶。GA进入糊粉细胞后,与其受体结合并启动信号转导途径(如第4章所述)。(GA在萌发期间的信号传导讨论见网络专题17.6。)GA信号传导导致转录激活因子GA-MYB表达增加,进而诱导糊粉层中α-淀粉酶基因表达(图17.10),促使α-淀粉酶产生并分泌至胚乳。GA还促进萌发后糊粉层的程序性细胞死亡。种子休眠期间,该过程被ABA抑制,确保糊粉层不会在萌发前发生程序性死亡。1960年代的实验证实了早期观察结果:大麦糊粉层分泌淀粉降解酶依赖于胚的存在。随后很快发现GA₃可替代胚刺激淀粉降解。当研究证实胚在萌发期间合成GA并释放至胚乳时,GA效应的意义得以明确。遗传学研究表明,虽然GA₁是谷物产生的唯一具生物活性的赤霉素,但糊粉层可响应任何生物活性GA(如GA₃)。
ABA抑制GA诱导的水解酶合成,这些酶对幼苗生长期间储备物质的分解至关重要。对于α-淀粉酶,ABA通过抑制GA依赖的α-淀粉酶mRNA转录发挥作用。
豆类种子是理解蛋白质动员的模型
除了作为发育中幼苗的食物储备外,贮藏蛋白还能增强对干燥和活性氧的耐受性,并有助于稳定细胞膜。种子贮藏蛋白可在胚、胚乳以及谷物的糊粉层中积累,不同组织类型可能贮存不同的蛋白质。表17.1列举了种子贮藏蛋白的实例,包括水不溶性球蛋白(如豆科植物的豆球蛋白和豌豆球蛋白)、醇溶性谷蛋白和碱溶性谷蛋白(存在于谷物中),以及水溶性清蛋白(存在于多种植物中)。部分贮藏蛋白与淀粉酶结构相似但缺乏水解活性,表明这些蛋白被特化用于贮藏功能。相较于其他蛋白质,种子贮藏蛋白通常含有更高比例的富氮氨基酸(如赖氨酸、精氨酸、谷氨酰胺和天冬酰胺)以及含硫氨基酸半胱氨酸。贮藏蛋白还是还原态碳的储备库,同时含有与植酸或球蛋白结合的矿物质离子(如K⁺、Mg²⁺或Ca²⁺)。种子休眠期间,其贮藏蛋白通过多种方式保持稳定:例如球蛋白可通过Mg²⁺和Ca²⁺离子静电聚集以防止蛋白酶解;贮藏蛋白还会通过半胱氨酸间的二硫键折叠成致密片层结构,使蛋白水解位点暴露量降至最低。
萌发过程中,蛋白酶通过降解贮藏蛋白来动员其中的氨基酸和氮素。休眠种子中的蛋白酶通常与贮藏蛋白在细胞内分区贮存,极少共存于蛋白贮藏液泡(PSVs)内。这些蛋白酶在种子吸胀前处于失活状态,且种子常含有蛋白酶抑制剂——这些抑制剂必须在蛋白酶水解贮藏蛋白前被降解。吸胀激活后,蛋白酶通过细胞内运输或区室融合进入PSVs。当pH值和氧化还原平衡达到酶活性适宜条件时,贮藏蛋白将被丝氨酸蛋白酶、天冬氨酸蛋白酶、金属蛋白酶以及内肽酶与外肽酶切割,为胚体萌发和幼苗建成提供合成新氨基酸和蛋白质的原料。在谷物中,赤霉素(GA)能增强糊粉层中半胱氨酸蛋白酶的表达,该酶对种子贮藏蛋白的动员至关重要。类似蛋白酶在木本多年生植物树皮与根系、以及多年生禾草根系的季节性贮藏蛋白再动员过程中同样发挥作用。网络专题17.7将探讨萌发I期和II期的蛋白质动员过程。
| 种子贮藏蛋白 | 蛋白类型及代表性植物 |
| 11S球蛋白(豆球蛋白类) | 大豆球蛋白(大豆 Glycine max) |
| 十字花科蛋白(甘蓝型油菜 Brassica canola) | |
| 谷蛋白(水稻 Oryza sativa),如麦谷蛋白(小麦属 Triticum spp.) | |
| 7S球蛋白(豌豆球蛋白类) | 豌豆球蛋白型亚基:菜豆蛋白(菜豆 Phaseolus vulgaris) |
| 豆球蛋白型亚基:豌豆豆球蛋白(豌豆 Pisum sativum) | |
| β-羽扇豆球蛋白(白羽扇豆 Lupinus albus) | |
| 2S清蛋白 | 单链型:SFA-8(向日葵属 Helianthus spp.) |
| 双链型:油菜籽蛋白(甘蓝型油菜 Brassica napus);羽扇豆δ2伴球蛋白(白羽扇豆 L. albus) | |
| 富硫醇溶蛋白 | α/β-麦醇溶蛋白(小麦属 Triticum spp.) |
| γ-麦醇溶蛋白(小麦属 Triticum spp.) | |
| B-大麦醇溶蛋白(大麦 Hordeum vulgare) | |
| 贫硫醇溶蛋白 | ω-麦醇溶蛋白(小麦属 Triticum spp.) |
| C-大麦醇溶蛋白(大麦 H. vulgare) | |
| 高分子量醇溶蛋白 | D-大麦醇溶蛋白(大麦 H. vulgare) |
来源:改编自A.L. Tan-Wilson与K. A. Wilson,2012《植物生理学》145:140-153。
油料种子是理解脂质再动员的模型
油体主要由三酰甘油组成,这些三酰甘油由胚合成。三酰甘油聚集体被磷脂单分子层和油质蛋白包裹——油质蛋白是嵌入脂质单分子层的结构蛋白(参见WEB TOPIC 17.8)。油质蛋白在休眠期稳定油体结构,调控油体大小,在萌发过程中乳化油体以实现脂质分解代谢,并调节脂质代谢。油质蛋白还赋予植物抗冻胁迫能力。油体磷脂膜还含有caleosins和steroleosins,二者分别具有过氧合酶活性和β-羟基类固醇脱氢酶活性。结合钙离子(Ca²⁺)的caleosins也存在于单细胞藻类和真菌中。油质蛋白仅存在于陆生植物中,被认为由caleosins演化而来。蛋白酶和脂肪酶分解油体后释放的脂肪酸经β-氧化作用,为萌发和幼苗建成提供能量与原料。对于甘蓝型油菜(Brassica napus ssp. napus)等油料种子,胚的油体中脂质的分解代谢对萌发至关重要。若通过遗传或化学手段阻断脂解过程,这类油料种子将无法萌发。
17.6 幼苗生长与建成
广义而言,幼苗建成指幼苗获得光合能力、吸收土壤水分养分、进行正常细胞与组织分化成熟,并对环境刺激产生适当响应的阶段。萌发后脱离种子依赖的生长过渡期尤为关键,此阶段幼苗极易受不利生物与非生物因素影响。例如大田环境中,约10%~55%的玉米幼苗和48%~70%的大豆幼苗在此阶段死亡。种子大小是决定存活的关键因素,较大种子具有更多营养储备,可为幼苗建成争取更长时间。但这一优势需与母株提供额外储备的代价相权衡。
光对幼苗出土发育有显著影响
萌发严格定义为胚根突破种皮,但胚其余部分也需脱离种皮,这标志着幼苗建成的开始。单子叶植物中,胚芽鞘在胚芽顶端分生组织出土及穿透土壤向光生长过程中提供保护。在双子叶植物中,胚芽顶端分生组织由上胚轴形成的顶钩和两片闭合子叶共同保护。顶钩的形成、维持及展开受光与激素互作调控。

幼苗建成的关键事件是胚芽破土见光,这会触发地上部发育的深刻转变。暗处生长的幼苗呈黄化状态(etiolated)——即具有细长上胚轴、顶钩(apical hook,双子叶植物)、闭合子叶以及非光合的原质体,导致未展开叶片呈淡黄色。相比之下,非定向光下幼苗的上胚轴粗短、无顶钩、子叶展开,叶片舒展且含有具光合活性的叶绿体(图17.11)。黑暗中的发育称为暗形态建成skotomorphogenesis,光照下的发育则称为光形态建成photomorphogenesis。当暗生长幼苗转入光照时,光形态建成启动,幼苗进入去黄化过程。
暗生长与光生长发育模式的转换涉及全基因组范围的转录与翻译变化,由多类光受体感知光信号触发(参见第16章)。
尽管过程复杂,从暗形态建成向光形态建成的转变却异常迅速。对暗生长的菜豆幼苗单次闪光照射数分钟内即发生以下发育变化:
- 茎伸长速率降低
- 顶钩开始展开
- 启动光合色素合成
光作为一种信号,诱导幼苗形态发生改变:从适应土壤中生长的形态转变为能高效获取光能并将其转化为生长必需的糖类、蛋白质和脂质的形态。
在促进植物光形态建成的各类光受体中,最重要的是吸收红光与蓝光的受体。光敏色素是一种蛋白质-色素复合体,主要吸收红光与远红光,但也吸收蓝光(参见第16章)。隐花色素是黄素蛋白,介导光形态建成中诸多蓝光响应,包括抑制下胚轴伸长、子叶扩展及叶柄伸长。
赤霉素与油菜素内酯共同抑制黑暗中的光形态建成

如第16章所述,光形态建成受到负调控。黑暗中,许多促进光形态建成的转录因子在细胞核内通过 CONSTITUTIVE PHOTOMOR PHOGENESIS 1(COP1)介导的泛素化及26S蛋白酶体途径降解;而在光照下该降解过程被阻止,使光形态建成得以进行。植物激素协调着这些变化在整个植株中的发生。
黑暗中,红光吸收型(Pr)光敏色素浓度较低。由于Pr会降低下胚轴对赤霉素(GA)的敏感性,内源GA在黑暗中对下胚轴细胞伸长的促进作用强于光照条件,导致暗培养幼苗呈现纤细形态。光照下,红光吸收型(Pr)光敏色素转化为远红光吸收型(Pfr),使下胚轴对GA的敏感性降低,导致下胚轴伸长显著受抑,幼苗呈现部分光形态建成特征。因此,缺乏GA的突变豌豆在黑暗中生长时虽无叶绿素,却表现出类似光培养幼苗的形态。这些结果共同表明:GA在黑暗中抑制光形态建成的某些方面,而红光可解除这种抑制。
油菜素内酯在抑制黑暗中的光形态建成方面具有平行作用。通过筛选黑暗培养中呈现表型的突变体,鉴定出油菜素内酯生物合成相关基因。黑暗条件下,油菜素内酯缺陷型拟南芥突变体植株矮小,且缺乏正常黄化幼苗的顶钩(图17.12)。GA同样抑制黑暗中的光形态建成,其生物合成突变体也表现出光培养幼苗的特征。GA与油菜素内酯的信号转导途径通过调控光敏色素互作因子与光敏色素途径相互作用(参见第16章)。
顶端弯钩张开受光敏色素、生长素和乙烯调控

胚胎发生过程中,单细胞经细胞分裂、细胞扩张与分化形成胚胎所有细胞类型及器官,包括根尖与茎尖分生组织(参见第22章)。种子萌发后,幼苗细胞继续进行细胞分裂、扩张及进一步分化。光照与激素对此生长过程的影响可表现为:顶端弯钩张开、维管系统与根毛形成,最终侧根与真叶发育(参见第18章)。
如前所述,黄化双子叶幼苗通常在茎尖后方形成顶端弯钩,用以保护茎尖分生组织。黑暗环境中的弯钩形成与维持源于乙烯诱导的不对称生长(图17.13)。在板结土壤中,气态激素乙烯无法扩散而积聚在萌发幼苗周围,导致三重反应:顶端弯钩更紧实,下胚轴缩短增粗,根系极度缩短。这种形态变化有助于幼苗穿透板结土壤,绕过石块等障碍物到达地表。生长素不敏感突变体无法形成顶端弯钩,而用极性生长素运输抑制剂N-1-萘基邻氨甲酰苯甲酸处理野生型拟南芥幼苗,同样会阻断弯钩形成。弯钩闭合形态源于下胚轴外侧较内侧更快速的伸长,以及生长素对内侧细胞伸长的抑制。因此,生长素与乙烯在顶端弯钩形成中具有协同作用。外侧组织相对于内侧的加速生长,可能反映了乙烯依赖的生长素侧向重分布现象,该过程与向光性弯曲中的机制类似(详见第17.8节讨论)。
光照后,顶端弯钩内侧伸长速率加快,使两侧生长速率趋于平衡而导致弯钩打开(参见网络附录2)。红光诱导弯钩打开,该效应可被远红光逆转,表明光敏色素是参与此过程的光受体。光敏色素与乙烯的密切互作调控弯钩打开。只要黑暗环境中弯钩组织持续产生乙烯,内侧细胞伸长便受抑制。红光抑制乙烯合成,促进内侧生长,从而使弯钩张开。
维管分化始于幼苗出土阶段
种子内胚胎发育期间,共质体和质外体运输通过扩散过程足以将水分、养分和信号传递至整个胚胎。然而萌发后,出土幼苗需要连续维管系统以快速高效输送物质。胚胎维管系统仅由原形成层束(未成熟维管组织)构成。

幼苗出土过程中,首先出现原生木质部与原生韧皮部细胞,随后形成更大的后生木质部与后生韧皮部细胞(图17.14)。随着原生韧皮部和原生木质部分化成熟,根与下胚轴间的维管组织形成连续性结构——下胚轴的维管组织排列方式与根类似。萌发幼苗的分化成熟模式与成熟植株不同(参见第19章)。在初生生长阶段的幼根及出土过程中,原生韧皮部成熟早于原生木质部:下胚轴和根部的韧皮部筛管发育近乎同步,而木质部分化在根部呈向顶方向进行。
根尖具有特化细胞

根冠位于根的最远端,由柱状细胞和构成侧帽的细胞组成(图17.15)。它代表一组独特的细胞,位于分生区下方,覆盖顶端分生组织(见第18章),并在根尖穿过土壤时保护其免受机械损伤。初生胚根的根冠第一层细胞具有特化的细胞壁,其表皮层可保护新生的根尖免受非生物胁迫。根冠的其他功能包括:在向重性过程中由柱状细胞感知重力;分泌黏液等化合物,协助根系穿透土壤并活化矿质养分。根冠细胞通过分生细胞不断更新,并经历发育程序性细胞死亡,从而影响未来的根系构型。表皮细胞位于根冠下方,在侧根帽上方暴露于根际环境中。
乙烯与其他激素调控根毛发育

根毛是根表皮细胞的延伸结构,通过增加根系表面积促进水分和矿质吸收,同时发挥机械锚定作用。根尖也是顶端生长的典型范例。虽然所有表皮细胞都可能分化为根毛细胞(生毛细胞)或非根毛细胞(非生毛细胞),但发育信号决定了二者的分布模式(图17.16A)。物种特异性信号和细胞间通讯共同决定根毛位置的基本格局。在石松属、卷柏属、木贼属等早期维管植物,基部被子植物睡莲科(睡莲),以及部分单子叶植物中,根毛源于根分生组织不对称分裂产生的小型细胞(图17.16B)。十字花科植物的根表皮则由非生毛细胞与生毛细胞交替排列构成(图17.16C)。生毛细胞分化受基因表达调控(参见网络专题17.9)。

乙烯是根毛发育的正向调节因子,经乙烯处理的根系会在异常位置产生过量根毛(图17.17)。反之,乙烯不敏感突变体或使用乙烯生物合成抑制剂的野生型植株根毛数量减少。这些现象表明乙烯在根毛分化中发挥正向调控作用。
根毛通过顶端生长实现伸长(见第2章和第21章),该过程通过生长素、茉莉酸甲酯、油菜素内酯和Ca²⁺信号的协同作用响应营养与水分状态。细胞内生长素浓度调控根毛伸长。拟南芥中,生长素从根尖通过向茎方向的流运输,该过程由生长素转运蛋白AUXIN RESISTANT 1 (AUX1)、PINFORMED 2 (PIN2)和ATP结合盒转运蛋白亚家族B4 (ABCB4)协同维持。非生毛细胞因AUX1摄取作用而具有较高生长素浓度。生毛细胞缺乏AUX1,其ABCB4活性维持着根毛伸长所需的最适生长素浓度。茉莉酸甲酯可促进根毛生长,而油菜素内酯则抑制根毛生长。
17.7 差异生长促进幼苗成功建成

为维持生存,幼苗需要具备功能的根-土界面、充分的气体交换以及有效的光合碳固定能力。幼苗通过程序化及环境响应机制——涉及优先细胞伸长——以实现建植。如第四章所述,达尔文父子在《植物的运动力》(1881)中记录的实验详细描述了多种植物生长过程中的器官弯曲与旋转现象。此类运动称为转头运动(个人译名,nutation)。回旋转头运动(circumnutation[3])指根、下胚轴和茎等生长器官尖端因器官圆周方向上生长速率的振荡性变化而产生的圆周或椭圆运动(图17.18)。随着器官伸长,其尖端的圆周运动在空间中勾勒出螺旋轨迹。转头运动与回旋转头运动均属感性运动,即具有自主性且不依赖外界刺激,尽管光照、温度和重力等外部因素可改变螺旋生长中的振荡模式。例如,在低重力地球轨道或回转器上进行的实验表明,回旋转头运动在近零重力条件下仍会发生,但其周期和振幅会受影响。遗传学证据也表明重力影响地上部的回旋转头运动。
这些感性运动的力学机制可通过建模纳入观测到的膨压与细胞体积变化。当幼苗下胚轴或上胚轴伸长时,表皮细胞常在器官单侧比另一侧伸长更显著,且伸长程度超过邻近的皮层细胞。随后另一侧表皮细胞会"追赶"并反超,从而维持差异生长。这导致茎或根产生扭转,引发转头运动。此外,差异生长可形成振荡性弯曲,同样产生扭转并引发回旋转头运动(见图17.18B)。弯曲程度影响回旋转头运动的振幅。螺旋运动在多数物种中呈逆时针方向,但在啤酒花等物种中呈顺时针。旋向性似乎与生长细胞内微管取向相关,该现象也指向转头运动的内在本质。
细胞间通过胞间连丝或激素运输实现的通讯可能参与局部细胞伸长。细胞扩张时,胞间连丝连接因细胞重构而中断,这可能局部影响生长。因此局部通讯与细胞伸长会暂时受阻,直至胞间连丝修复(耗时10min至数小时,因物种而异)。多种方法检测到回旋转头下胚轴下侧存在生长素与赤霉素的瞬时积累,但如第17.8节所述,这可能反映瞬时重力响应。此外,生长素似乎维持而非启动转头运动。拟南芥扭曲矮化突变株因质膜ABCB生长素转运蛋白缺失导致下胚轴与根部生长素外排受阻,其根与下胚轴均表现过度超转头运动。不同细胞的振荡性酸生长可能参与回旋转头运动,但实测pH振荡快于观测到的生长振荡。
幼苗根的转头运动同样基于皮层细胞与表皮细胞的差异伸长,对穿透土层至关重要。根转头运动受乙烯调控,并高度依赖由AUX1生长素摄取转运蛋白介导向地上部流动的生长素再摄取过程。
乙烯影响微管取向并诱导细胞横向扩张
当浓度高于0.1 μL·L⁻¹时,乙烯能降低伸长速率并促进横向膨大,导致下胚轴或上胚轴肿胀。植物细胞扩张的方向性由细胞壁中纤维素微纤丝的排列方向决定。横向微纤丝增强细胞壁的横向强度,从而使膨压作用于细胞伸长。微纤丝的排列方向又取决于皮层(外围)细胞质中微管皮层阵列的取向。在典型的伸长植物细胞中,皮层微管呈横向排列,从而形成横向排列的纤维素微纤丝。
当黄化幼苗经乙烯处理后(见图17.13),下胚轴细胞中的微管排列从横向转变为斜向或纵向(图17.19)。这种约90度的微管取向转变导致纤维素微纤丝沉积发生平行偏移。新沉积的细胞壁在纵向上而非横向上得到增强,从而促进横向扩张而非伸长。外源乙烯在施用后10分钟内即抑制伸长并促进横向扩张(图17.20A)。当乙烯被移除(替换为空气)时,细胞伸长随即恢复(见图17.20A)。若未移除乙烯,伸长生长则持续受抑制(图17.20B)。该实验可通过检测不同乙烯响应调控组分缺失时的效应来重复验证。当与乙烯受体互作的信号转导组分(如ein2;见第4章)缺失时,乙烯无法引发任何响应(见图17.20B)。相反,若下游转录激活缺失(如ein3/eil1突变体),虽能观察到微管重组对应的生长速率快速下降,但在乙烯持续存在时生长速率仍会恢复(见图17.20B),其效果如同移除乙烯(如图17.20A所示)。
(A)未处理组 (B)ACC处理组 图17.19 乙烯对微管取向的影响。(A)表达绿色荧光蛋白标记微管蛋白基因的对照组暗培养转基因拟南芥幼苗下胚轴中,微管呈横向排列。(B)经乙烯前体1-氨基环丙烷-1-羧酸(ACC)处理的幼苗下胚轴细胞中,微管呈纵向和斜向排列,该处理可增加乙烯产量。
图17.20 乙烯对暗培养拟南芥幼苗下胚轴伸长影响的动力学分析。(A)黄化野生型拟南芥暴露于乙烯及箭头所示时间点移除乙烯后的生长速率。需注意:乙烯暴露后的生长速率下降呈现两个明显阶段——阶段1为短暂抑制,阶段2为持续抑制。(B)黄化野生型幼苗及乙烯不敏感突变体(ein2与ein3/eil1)在箭头所示时间点暴露于乙烯后的生长速率。具有乙烯信号通路缺陷的ein3/eil1突变体(见第4章)在阶段1响应与野生型相同,但缺失阶段2响应;而ein2突变体的生长速率对乙烯完全不敏感。(引自Binder等, 2004a; Binder等, 2004b)
生长素促进茎和胚芽鞘生长,同时抑制根生长
查尔斯·达尔文与弗朗西斯·达尔文的观察最终促使生长素被鉴定为调控幼苗器官差异性弯曲的主要运输激素。在茎尖合成的生长素向下方组织运输。茎或胚芽鞘近顶端区域持续获得生长素供应是其细胞不断伸长的必要条件。由于健康植株伸长区内源生长素浓度已接近最适生长水平,外源喷施生长素仅能引起短暂且有限的生长促进。对于暗培养幼苗——其对超最适生长素浓度的敏感性高于光下植株——此类喷施甚至可能产生抑制作用。
然而,当通过切除含有伸长区的茎段或胚芽鞘段来移除内源生长素时,生长速率会迅速降至较低的基础速率。此类离体切段常对外源生长素作出响应,迅速将生长速率提升回完整植株的水平(图17.21A和B)。大部分伸长发生在外部组织,并非仅由生长素的组织渗透所致。当切段被纵向剖开时,其伸长过程中会向内弯曲,从而证明外层细胞具有更强的生长素响应性伸长能力。
生长素对根伸长的调控较难证实,这可能是因为生长素会诱导乙烯生成,而乙烯抑制根生长。根细胞的伸长还需表皮细胞中的GA生物合成。这三种激素在根组织中通过差异化互作调控生长:GA似乎是基础生长所必需的。然而,即使特异性阻断乙烯生物合成时,低浓度生长素(10^-10至10^-9M)仍促进完整根系的生长,而较高浓度(10^-6M)则抑制生长。因此,虽然根系可能需要最低浓度的生长素才能生长,但能促进茎和胚芽鞘伸长的生长素浓度却会强烈抑制根生长。当根系在排水良好或沙质土壤中生长时,根部产生的乙烯可自由扩散至土壤中,此时可观察到根伸长现象。但在板结土壤中,乙烯无法从根部扩散,根系便停止伸长并增粗。此类根系与乙烯处理的黄化幼苗表型相似(参见图17.13)。
生长素诱导伸长的最短滞后期为10分钟
当茎段或胚芽鞘切段被切除并置于灵敏的生长测量装置中时,可精确监测生长素响应的滞后期。例如,添加生长素仅10至12分钟后即显著刺激燕麦(Avena sativa)胚芽鞘和大豆(Glycine max)下胚轴切段的生长速率。经30至60分钟生长素处理后达到最大生长速率,该速率较基础速率提高5至10倍。如图17.21C所示,生长素诱导的伸长具有剂量依赖性——即必须达到生长素阈值浓度才能启动该响应。超过最适浓度后,生长素将产生抑制作用。生长素对生长的刺激需要能量支持,代谢抑制剂可在几分钟内抑制该响应。生长素诱导的生长对蛋白质合成抑制剂(如放线菌酮)同样敏感,表明该响应需要蛋白质合成参与。RNA合成抑制剂在稍长延迟后也会抑制生长素诱导的生长。
图17.21 生长素促进伸长。(A)和(B)分别显示耗尽内源生长素的燕麦胚芽鞘切段在水中(A)或生长素(IAA)(B)中培养18小时后的状态。半透明胚芽鞘内部的黄色物质为初生叶组织。(C)豌豆茎或燕麦胚芽鞘切段中IAA诱导生长的典型剂量效应曲线。离体胚芽鞘或幼茎切段的伸长生长随外源IAA浓度升高而变化。当浓度超过10-5M时,IAA效应逐渐减弱;约10-4M以上则转为抑制,表现为刺激作用减弱且曲线最终降至虚线下方(虚线代表未添加IAA时的生长)。(D)玉米胚芽鞘中生长素诱导伸长与细胞壁酸化的动力学过程。细胞壁pH值通过pH微电极测量。需注意细胞壁酸化与伸长速率增加的滞后期相似(10-15分钟),但pH变化稍慢,因其由生长素依赖性转录激活介导。(E)改绘自M. Jacobs与P. M. Ray. 1976. Plant Physiol. 58: 203-209。
生长素诱导的质子外排使细胞壁松弛
生长素通过增强质膜H⁺-ATPase活性诱导质外体酸化。如图17.21D所示,细胞壁酸化发生在接触生长素后10至15分钟,与生长动力学过程一致。如第2章所述,称为扩展蛋白的细胞壁蛋白在酸性pH环境下介导细胞壁松弛。一旦扩展蛋白活性使细胞壁充分松弛,膨压即启动细胞扩张。
在拟南芥中,生长素在胚轴细胞表面被感知,导致跨膜激酶1(TMK1)磷酸化质膜H⁺-ATP酶。该过程激活局部质外体酸化并引发细胞伸长。生长素与细胞表面的TMK1或其关联蛋白结合还能稳定顶钩区域的核AUX/IAA蛋白(见第4章),从而抑制生长素信号传导。在根中,抑制性浓度生长素的感知由TMK1介导,涉及核生长素响应,进而通过ABA不敏感转录因子1和2调控ABA信号传导(见第4章)。
其他生化过程(如新生细胞壁生物合成)是维持细胞长期扩张所必需的。生长素可促进早期响应基因小生长素上调RNA(SAURs)的转录。SAUR基因家族庞大(拟南芥含79个基因),各分支均有多个成员(拟南芥含10个分支)。由于SAUR蛋白数量众多且功能冗余,其功能尚未完全阐明。但已知SAUR19可抑制蛋白磷酸酶2C D分支(PP2C.D1)的活性,该酶通过去磷酸化作用使质膜H⁺-ATP酶失活。因此抑制PP2C.D1可增强H⁺-ATP酶活性,影响酸生长过程(见第2章)。
17.8 向性:定向刺激引发的生长响应
作为固着生物,植物必须依赖生长响应来竞争光照并获取土壤中的水分和矿物质。植物通过改变生长和发育模式应对外界刺激。幼苗建成阶段,重力、触碰和光照等非生物因素影响幼株的初始生长习性。向性是植物轴向(茎或根)不对称生长和各向异性细胞生长引发的、针对环境刺激的定向生长响应,可分为正向(向刺激源生长)或负向(背刺激源生长)。
初生幼苗首先遭遇的作用力是重力。向重力性使枝条向上生长获取光合作用所需光照,根系向下生长获取土壤中的水分养分。当茎尖突破土表即遭遇光照,向光性促使叶枝向光生长以最大化光合作用,而部分根系则背光生长。向触性是通过触碰和机械感知产生的差异生长,帮助根系绕避障碍物,并使捕蝇草叶片闭合捕获猎物。向水性是响应水或水蒸气梯度的定向生长,使根系向水源延伸。
向重力性涉及生长素的侧向重分布
暗培养的燕麦幼苗水平放置时,胚芽鞘会响应重力向上弯曲。根据二十世纪初温特和乔洛德尼分别提出的模型,水平放置的胚芽鞘尖端的生长素会横向运输至下侧,导致胚芽鞘下侧生长快于上侧(见下节)。这一乔洛德尼-温特通用模型随后被证实同样适用于向光性。支撑该模型的两个关键特性是生长素长距离运输的极性及重力非依赖性。图17.22A展示了通过生长素极性输出维持的根向与茎向极性运输流,某些组织中生长素极性运输速率可超过3mm·h⁻¹,快于扩散速率但慢于韧皮部运输速率(见第11章)。图17.22B展示利用放射性标记生长素证实幼苗胚轴切段根向极性运输的实验。
图17.22 生长素极性运输。(A) 生长素极性运输的方向根据其相对于植株基部(根-茎连接处)的运动方向描述。从茎向下移动的生长素呈向基性运输(朝向基部),直至抵达根-茎连接处。此后,向下的运动被描述为向顶性(朝向顶端)。生长素从根尖向根-茎连接处的移动同样属于向基性运输(朝向基部)。另一种表述中,从茎尖到根尖的极性运输称为向根性运输,反方向的极性运输则称为向茎性运输。(B) 测量生长素极性运输的供体-受体琼脂块法。含有放射性标记生长素的供体琼脂块置于下胚轴切段一端,受体琼脂块置于另一端。受体块中积累的放射性生长素含量可量化通过下胚轴切段的运输量。当下胚轴倒置时,放射性标记生长素无法从供体块运输至受体块。
图17.23 证实了生长素极性运输与重力无关。葡萄插条置于潮湿培养室后,其基部末端形成不定根,顶端末端则萌发新芽。当插条倒置时,根和芽形成的极性特征保持不变。由于向基性(向根性)极性运输使生长素在基部积累并刺激根分化,根部始终在基部末端形成(此时该端朝向上方)。无论插条重力方向如何,芽总是在生长素浓度最低的顶端末端形成。
图17.23 不定根生长具有极性。无论葡萄硬枝插条保持倒置(左)或直立(右)方向,不定根均从其基部末端生长,而腋芽萌发发生在顶端末端。因重力无关的极性运输,生长素在基部积累而在顶端耗竭。(改编自H. T. Hartmann与D. E. Kester. 1983. 《植物繁殖:原理与实践》第4版,普伦蒂斯霍尔出版社,新泽西州)
重力刺激扰动生长素的对称运动
幼苗根系中的生长素主要源于茎部。IAA(吲哚乙酸)通过外排载体PIN1引导的向根性定向流输送至根尖,并由以拟南芥ABCB19为代表的ABCB转运蛋白组(详见第4章)依赖ATP的活性维持。如图17.24所示,茎顶端分生组织的PIN蛋白负责引导生长素先向根尖移动,再沿茎向下进入根系。在根中,维管柱细胞的PIN蛋白将生长素运输至根冠的柱状(中央)区域。成熟植株中,IAA亦在根分生组织合成。PIN3外排载体将生长素移出柱状区,并为根系向性反应中生长素移出柱状区提供方向矢量。生长素经由AUX1渗透酶吸收进入相邻的侧根冠细胞,随后在PIN和ABCB外排活性的共同驱动下进入向茎性表皮流。该向茎性表皮流主要由PIN2决定,并由ABCB4维持(见图17.24)。PIN2定位于根表皮细胞上侧,将生长素从侧根冠向伸长区运输,在此处刺激细胞伸长。抵达伸长区后,生长素通过皮层细胞内侧面定位的PIN2横向运回维管柱。生长素从根冠到伸长区再循环的路径被称为喷泉模型。
图17.24 拟南芥幼苗中的生长素极性运输。(A)维管组织中的PIN运输蛋白将生长素导向根部(讨论见正文)。然后,根部维管柱中的PIN蛋白将生长素运输到根冠的柱状体。生长素随后移入侧根冠细胞,并通过侧根冠中的AUX1摄取和表皮中的PIN蛋白输出相结合而重新定向。PIN蛋白还参与将生长素重定向至伸长区,之后部分生长素移回维管柱。“喷泉模型”一词源于从茎部流出的生长素流在到达根冠后逆转方向这一事实。两个插图分别显示茎尖分生组织中的PIN1介导的生长素运动(上插图)和根尖中的PIN调控生长素循环(下插图)。(B)与ATP依赖性ABCB运输蛋白相关的生长素流。茎尖和根尖处的多向箭头表示非定向生长素运输。然而,当与极性定位的PIN蛋白结合时,会发生定向运输。多个ABCB在皮层和表皮组织中调控生长素向伸长区和分化区的动员。ABCB4调节伸长根毛中的生长素浓度。(改编自I. Biliou等人,2005年,《自然》433卷:39-44页。)
早期实验研究证实,胚芽鞘尖端是蓝光诱导向光性弯曲的感知部位,且生长素向阴影侧的侧向移动参与该响应(见第4章和第16章)。胚芽鞘尖端还能感知重力并重新分配生长素至下侧。例如,如果将切下的胚芽鞘尖端置于琼脂块上并水平放置,通过生物测定证明,从尖端下半部分扩散到琼脂块中的生长素量大于上半部分(图17.25)。
图17.25 生长素被运输到水平放置的燕麦胚芽鞘尖端下侧。(A)水平尖端上半部和下半部的生长素分别扩散到两个琼脂块中。(B)下半部琼脂块(左)在去顶胚芽鞘中诱导的弯曲度大于上半部琼脂块(右)。
根的向重力性也依赖于生长素重新分配。根部重力感知部位是根冠。当从生长中的根部移除根冠后,根部不再响应重力向下弯曲(图17.26)。事实上,根部生长速率略有增加,表明根冠提供了一种调节伸长区生长的抑制剂。切除一半根冠的显微外科实验证实,根冠在向重力弯曲期间将一种根部生长抑制剂(后来鉴定为生长素)运输至根部下侧。使用生长素运输抑制剂和生长素转运蛋白突变体的实验表明,生长素从根冠向伸长区的茎向运输是向重力性生长所必需的。
图17.26 显微外科手术对根生长方向的影响。显微外科实验证明,根冠是重定向生长素及随后在根向重力弯曲中差异抑制伸长所必需的。(A)垂直生长的根。(B)水平生长的根。(改编自S. Shaw和M. B. Wilkins,1973年,《植物》109卷:11-26页。)
根据当前根向重力性模型,垂直放置的根部中茎向生长素运输在各侧均等。然而,当根部水平放置时,来自根冠的信号将大部分生长素重定向至下侧,从而抑制下侧生长(图17.27)。与此模型一致,IAA在水平放置的根部下侧迅速积累,并集中于伸长区的表皮细胞中。使用报告基因构建体DR5:GFP(由生长素敏感的DR5启动子表达的绿色荧光蛋白组成)已证实生长素在水平放置的根冠中的移动。此外,在向重力性刺激根部的上侧观察到SAURs(见本节后文)。
重力感知由淀粉体的沉降触发
细胞感知重力的主要机制是通过细胞内沉降体的运动实现的。根冠柱细胞含有被称为平衡石的大型致密淀粉体(含淀粉质体)。这些平衡石能在60秒内沉降到细胞底部,与重力矢量对齐(见图17.27)。如前所述,移除完整根系的根冠会抑制根向重性但不影响生长,表明根冠柱细胞具有重力感应细胞(即平衡细胞)的功能。刺激感知(重力引起的平衡石位移)被认为通过膜受体和/或细胞骨架相互作用实现。由于无淀粉突变体对重力响应减弱,重力感知必然涉及其他信号通路。
在垂直生长的根中,PIN3蛋白均匀分布于柱细胞周围;但当根水平放置时,PIN3在6分钟内优先定位至这些细胞的下侧(见图17.27)。这种重分布发生在平衡石沉降后、根系弯曲前,被认为能加速生长素向根下侧的运输。结果导致生长素从柱细胞输出至根冠下侧,再通过表皮细胞运输回伸长区。不过,由于pin3突变体并非完全丧失向重性,其他不对称事件可能与PIN3定位协同改变生长素流。最可能的情况是质外体酸化作用发生不对称变化,通过不对称化学渗透势重定向生长素流,进而引发PIN3重分布,从而增强新方向的生长素流(渠化效应,见第18章)。AUX1和PIN2在各自表达域的活动同样为向重性响应所必需,因其功能缺失突变体会丧失向重性。
图17.27 拟南芥根重力刺激事件序列。底部时间轴非线性。时间轴下方展示幼苗不同响应阶段茎与根的差异生长。顶部显示平衡石沉降三阶段:左图为零时刻(幼苗首次旋转90度),中间与右图分别为旋转后约6分钟和2小时。红色箭头指示生长素流,箭头粗细表示流量大小。橙色标示生长素浓度较高细胞。根尖第6列细胞在零时刻呈绿色,2小时后渐变为蓝绿色,标示细胞质碱化程度(见图15.33)。柱细胞质膜上的紫色轮廓示意PIN蛋白分布。(据K. I. Baldwin等,2015,《美国植物学杂志》100:126-142)
在双子叶植物茎及类茎器官中,参与重力感知的平衡石位于淀粉鞘——包围茎维管束环的皮层最内层细胞(图17.28)。淀粉鞘与根内皮层连续,当重力矢量改变时淀粉体重分布。淀粉鞘细胞含ABCB19和PIN3,二者协同限制生长素流至维管系统(图17.29)。维管柱内PIN1介导的向下生长素运输流的选择性调控,以及ABCB19与PIN3对生长素横向进入淀粉鞘细胞的限制,似乎在向性弯曲中起基础作用。当重力矢量改变(如暴雨导致植株倒伏时),淀粉体在1小时内重新定向至淀粉鞘细胞底部,下胚轴随即上弯。后续事件的确切序列尚不明确,但重力刺激4小时后,下胚轴淀粉鞘细胞弯曲处下侧无PIN3信号。遗传学研究证实了淀粉鞘在茎向重性中的作用,拟南芥和番茄淀粉鞘淀粉体缺失突变体均表现出茎向重性生长减弱。
图17.28 茎秆淀粉鞘的重力感知机制。(A) 下胚轴中位于维管组织环外侧的淀粉鞘示意图。剖视图显示细胞底部的淀粉体。(B) 重力刺激后淀粉鞘细胞的淀粉体发生重新定位。
图17.29 双子叶植物茎秆维管组织(主要为木质部薄壁组织)对生长素的限制作用。(A) PIN3定位于毗邻维管组织的维管束鞘细胞内侧面,被认为可将生长素重定向至维管流。ABCB19同时将生长素排出维管束鞘细胞。箭头方向指示生长素流动方向。(B) 该区域横截面图显示ABCB19外排如何促进生长素重定向至维管柱
重力感知可能涉及pH与钙离子(Ca²⁺)作为第二信使
多项实验表明,pH与Ca²⁺梯度的局部变化是向重力性信号传导的组成部分。使用pH敏感染料监测拟南芥根系的胞内与胞外pH时,在根系转为水平位后不久即观察到快速变化(图17.30)。重力刺激2分钟内,根冠柱细胞的胞质pH从7.2升至7.5,而质外体pH从5.5降至4.5。这些变化早于可检测的向性弯曲约10分钟。胞外pH变化也可能是重要的信号要素,可通过改变化学渗透质子梯度来调节生长素响应。
图17.30 向重力性pH变化受Ca²⁺依赖通路调控。(A) 柱细胞响应重力刺激时pH敏感染料的成像。色标用于生成(B)中的pH数据。(B) 重力刺激后2分钟内胞质pH升高。(C) 使用Ca²⁺传感器观察重力刺激根顶端伸长区表皮细胞上侧(u.s.,左)与下侧(l.s.,右)的胞质Ca²⁺浓度。(D和E) 重力刺激根上侧(D)与下侧(E)细胞的胞质Ca²⁺浓度量化。曲线显示表皮细胞中最顶端(即距根尖最近)、次顶端、第三顶端和第四顶端细胞(B改编自J. M. Fasano等. 2001. Plant Cell 13: 907-921;D,E改编自G. B. Monshausen等. 2010. Plant J. 65: 309-318)。
胞质碱化与质外体酸化的结合表明,质膜H⁺-ATP酶的激活是介导根重力感知或信号传导的初始事件之一。极性生长素运输的化学渗透模型(见第4章)预测,质外体差异酸化与胞质碱化将导致受影响细胞中IAA的定向吸收和外排增加。
早期生理学研究提示,储存区释放的Ca²⁺可能也参与根向重力性信号传导。例如,用EGTA(乙二醇双(2-氨基乙基醚)四乙酸)处理玉米根系——该化合物可螯合Ca²⁺——能阻止细胞吸收Ca²⁺并抑制根向重力性。与[³H]IAA类似,⁴⁵Ca²⁺可极性运输至重力刺激根冠的下半部。因此Ca²⁺与pH信号传导似乎通过Ca²⁺依赖信号通路的传递来调控根向重力性弯曲。
向触性涉及Ca²⁺、pH与活性氧的信号传导
胚根突破种皮时,重力并非其遭遇的唯一作用力;胚根还会立即承受土壤施加的作用力。根据种子最终所处位置,土壤可能主要由沙、黏土、壤土或其他成分构成。植物通过重定向生长绕过土壤障碍物(如岩石)(向触性),直至能沿重力矢量恢复生长。在自然环境中,根系整合向重力性与向触性刺激以调控其生长响应。
生长素介导向触性过程中的差异细胞伸长生长。在根中,根冠柱细胞是触摸刺激的感知位点,信号在柱细胞内转导(图17.31)。机械刺激诱导第二信使Ca²⁺、pH和活性氧的浓度变化。触摸响应后,远离触摸刺激侧的根表皮细胞中胞质Ca²⁺浓度升高(图17.32A)。这触发质外体中活性氧增加,同时导致未接触侧的细胞质酸化和质外体碱化(图17.32B和C)。根的不对称生长由生长素重新分布介导——与向重性响应类似,生长素在根下侧积累。避障行为分为两个阶段:根首先远离障碍物弯曲(向触性),随后沿障碍物平行生长;当通过触觉感知不到障碍物时,根再次弯曲使生长方向与重力方向一致(向重性)。因此,在触觉信号持续期间,触觉感知会调控重力感知。
当生长中的根遇到致密土壤时也会触发触觉响应,导致根发生偏斜或波浪式生长。该响应整合了向重性、向触性和回旋转头运动。关于根向重性与回旋转头运动及向触性相互作用的讨论,参见WEB TOPIC 17.10。
图17.31 拟南芥初生根生长受触觉感知与重力感知协同调控。(A)初生根向下生长遇障时改变方向。根垂直生长至0分钟接触水平玻璃屏障。60分钟和180分钟处的白色箭头分别指示中央伸长区(CEZ)和远端伸长区(DEZ)的根弯曲点。320分钟处的白色箭头显示根沿屏障平行生长。(B)根尖绕障角度是重力与触觉的综合响应。正常情况下,根遇水平屏障时维持136°根尖角度直至到达屏障边缘。激光消融术去除根尖不同细胞类型以干扰向重性响应:去除整个根冠、外周细胞或柱细胞均改变根与水平玻璃屏障作用时的根尖角度,表明典型136°角度依赖向重性。同理,柱细胞不积累淀粉的pgm1突变体根尖角度亦发生改变。(B图改绘自G. D. Massa and S. Gilroy. 2003. Plant J. 33: 435-445)
图17.32 向触性过程中的Ca²⁺与pH变化。(A)垂直生长的根尖接触水平玻璃屏障时胞质Ca²⁺瞬时升高(顶部示意图)。上组图:根接触屏障(红线标记位点)后先挤压障碍物,最终侧向滑动,使弯曲发育处的上侧细胞拉伸。数字表示滑动开始后时间(此处为首次接触屏障后25分钟)。下组图:根遇障后胞质Ca²⁺荧光图像。根区域对应示意图框选处,数字表示滑动开始后时间。注意弯曲上侧表皮和皮层中Ca²⁺浓度(红色信号)升高。(B)初生根在含荧光pH指示染料(绿色荧光)的琼脂糖中生长图像,显示遇水平屏障前后状态。数字表示滑动开始后时间。根垂直生长时质外体pH两侧基本对称;根遇障侧滑时,弯曲形成处的根上侧质外体pH迅速升高。方框标示pH测量区域,箭头指示根弯曲位置。(C)沿(B)图根上侧(蓝线)与下侧(红线)测量的pH变化。绿线表示根尖角度。标尺=100μm。(改绘自G. B. Monshausen et al. 2009. Plant Cell 21: 2341-2356)
向水性涉及ABA信号传导与不对称细胞分裂素响应
向水性是指根系响应土壤不对称水势的生长现象(图17.33)。在水分受限的土壤中,根系向高水势区域的觅水适应性反应对植物生存至关重要。拟南芥、豌豆、水稻和黄瓜中,通过激光烧蚀去除根冠后向水性依然存在,表明感知部位并非根冠。水分梯度似乎由根伸长区的皮层细胞感知,该处ABA信号响应水势梯度被激活。向水性反应依赖于ABA信号通路——ABA不敏感突变体无此反应,而ABA超敏突变体则表现出快速向水性。ABA诱导MIZU-KUSSEI 1(MIZ1)的表达与积累【MIZU-KUSSEI 1 (MIZ1) 得名于两个日语词汇,分别意为"水"和"向性"】。MIZ1负调控内质网(ER)钙离子泵ECA1活性,导致韧皮部形成不对称钙离子梯度。钙离子沿此梯度扩散至低水势侧的根伸长区皮层细胞。
图17.33 根系向高水势的向水性生长。根系通过钙离子与ABA信号通路响应水分梯度。ABA刺激MIZ1表达,其负调控ER钙泵ECA1,导致接触低水势土壤侧的根系钙离子浓度升高。细胞分裂素通过ARR16和17在低水势侧诱导细胞分裂,引发不对称生长使根系向高水势侧弯曲。
细胞分裂素信号也参与向水性过程,其合成或响应突变体中该行为减弱。分生区不对称细胞分裂素合成与积累同样依赖MIZ1活性。表皮和皮层细胞中的A型细胞分裂素响应调节因子ARR16与ARR17分别被上调,使低水势侧产生更多可伸长细胞。虽然根系弯曲需细胞伸长参与,但生长素在向水性反应中的作用具有物种特异性:水稻和豌豆需要生长素信号或极性运输引发的侧向重新分布,而拟南芥和莲则不需要。
向光素是介导向光性的光受体
幼苗能向任意光照方向弯曲以优化吸光效率,此现象称为向光性。如第16章所述,蓝光诱导向光性尤为有效,两种黄素蛋白——向光素1和向光素2是向光性弯曲的光受体。向光性源于植物器官受光侧光激活向光素引发的快速信号事件,最终导致差异性伸长生长。与向重性类似,定向蓝光引起的弯曲反应可通过Cholodny-Went模型的生长素侧向重分布理论解释。
向光性由生长素侧向重分布介导
Charles与Francis Darwin通过证明胚芽鞘尖端感知光线而弯曲发生在尖端下方区域,首次揭示了向光性机制。他们提出某种"影响物质"从尖端运输至生长区,从而引发观测到的不对称生长反应,该物质后被证实为生长素。
直立生长的茎中,生长素从生长尖端极性运输至伸长区。但生长素亦可侧向运输,这种侧向转移是向性Cholodny-Went模型的核心。向光性弯曲中,茎尖生长素被侧向重分配至背光侧并刺激细胞伸长,差异性生长最终导致茎秆向光弯曲(图17.34与17.35)。
图17.34 胚芽鞘响应零分钟30秒单向蓝光脉冲后,受照侧与背光侧的生长时序。对照组胚芽鞘未接受光照处理。(改绘自M. lino与W. R. Briggs. 1984. Plant Cell Environ. 7: 97-104.)
图17.35 拟南芥暗适应幼苗中与向光素1依赖性向光性相关的根向生长素运输模型(幼苗内部红色箭头)。(改编自J. M. Christie等,2011,《PLOS生物学》9: e1001076;CC BY许可)
尽管向光性机制在植物物种间高度保守,但生长素合成位点、光感知位点及侧向运输位点的精确定义仍存困难。在玉米胚芽鞘中,生长素富集于顶端1至2毫米处;而光感应与侧向运输区域则延伸至距顶端5毫米处。该反应还强烈依赖于光通量(单位面积光子数)。迄今在所有研究的单子叶和双子叶植物真茎中,均观察到类似的生长素生物合成与富集区、光感知区及侧向运输区。
关于根的负向光性描述,参见网络专题17.11。
茎向光性分阶段发生
如前所述,向光性弯曲事件发生迅速。该过程可分为四个阶段:感知与早期信号放大事件、快速向光弯曲、信号衰减以及新角度下的伸长(图17.36)。向光性感知及早期事件(如磷酸化与去磷酸化)在蓝光照射后1秒至30分钟内发生;快速向光弯曲约在感知蓝光信号后30至150分钟出现;信号衰减期约在150至220分钟;最终伸长阶段始于初始蓝光信号感知后约220分钟。
图17.36 向光性连续阶段事件概要。在感知及早期事件阶段(1秒-50分钟),向光素1(phot1)感知信号并通过自磷酸化激活。激活的phot1直接磷酸化生长素转运蛋白ABCB19以阻断生长素运输,下胚轴伸长停止;同时磷酸化NPH3、PKS、CBC1和CBC2等蛋白放大向光信号。CBCs存在于下胚轴,但其是否介导向光性中的阴离子通道活性尚未明确,事件顺序亦未完全明晰。快速向光弯曲阶段(50-150分钟),质膜定位的PIN生长素外排蛋白在背光侧通过磷酸化激活,促进向光源方向伸长。衰减阶段(150-220分钟),生长素在下胚轴伸长区新生背光侧积累,此阶段细胞壁酸化对细胞伸长至关重要,并为后向光性伸长阶段奠定基础。在光轴伸长阶段,蓝光感知4小时后出现胞间连丝门控现象及不对称PIN定位。(由Candace Pritchard和Wendy Peer提供)
尽管向光素是亲水性蛋白,它们主要定位于质膜。下胚轴受光侧细胞感知低通量蓝光后,启动系列信号转导事件:照射后1分钟内,质膜发生瞬时去极化,细胞骨架重排——现存微管降解,新生的纵向微管形成(参见网络专题17.12)。
单侧蓝光照射约3分钟后,向光素1(phot1)发生自磷酸化。随后激活的phot1磷酸化生长素转运蛋白ABCB19。ABCB19受抑导致生长素在子叶节上方积累,向伸长区输送的生长素减少,从而迅速抑制下胚轴伸长与回旋转头运动。伸长停滞期间,聚集的生长素通过尚不明确的过程被侧向转移至下胚轴背光侧。单侧蓝光照射约15分钟后可检测到下胚轴上部背光侧的生长素积累,转移的生长素随后通过维管组织和表皮运输至下胚轴伸长区。
随着蓝光感应的持续,向光性信号通过活化的向光素1(phot1)作用于其他底物而得到放大。活化phot1的另一个主要底物是非向光性下胚轴蛋白3(NPH3),该蛋白最初从nph3突变体中鉴定发现——该突变体在低强度蓝光下不表现下胚轴弯曲。NPH3与根向光性蛋白2(RPT2)同属NPH3/RPT2样蛋白(NRL)家族,具有保守的C端磷酸化位点。NPH3磷酸化后可与14-3-3磷酸结合蛋白结合,这些蛋白调控多种细胞功能,包括质膜H+-ATP酶的质子泵活性(见第8章)、膜通道活性和受体功能。向光素1对NPH3的磷酸化作用建立了从幼苗受光侧到背光侧的14-3-3蛋白梯度,从而调节启动差异性弯曲的生长素运输功能。定位于质膜的光敏色素激酶底物(PKS)蛋白也直接被活化phot1磷酸化。PKS4还与NPH3互作,可能在调控向光性的负反馈回路中发挥作用。
自磷酸化的phot1随后通过网格蛋白介导的内吞作用内化。内化功能尚不明确,但可能在向光素信号传导或受体脱敏中起作用。在保卫细胞中,phot1磷酸化胞质激酶蓝光汇聚蛋白1/2(CBC1/2)(见第16章)。胞质phot1可能同样在下胚层中磷酸化CBCs,因为CBCs缺失会导致向光性弯曲部分延迟。蓝光信号蛋白1(BLUS1)也是已知的phot1底物,但BLUS1在向光性中的作用尚未证实。
下胚轴背光侧发生生长素依赖的质膜H+-ATP酶快速激活。与向重性过程类似,小生长素上调RNA(SAURs)在向光性中差异性表达——蓝光处理1小时内,生长素浓度较高的一侧表达量更高,从而介导质膜H+-ATP酶引发的细胞壁酸化作用。跨膜激酶1/4(TMK1/4)也以生长素依赖方式正向调节质膜H+-ATP酶。质外体酸化在向光性生长中起关键作用:向光性弯曲的茎或胚芽鞘背光侧的质外体pH值较受光侧更低。pH值降低预计会促进细胞伸长并增强生长素在细胞间的转运。
上述两个过程共同促进向光弯曲。在向光刺激后,SAURs同样在下胚轴背光侧积累,支持差异性细胞壁酸化作用。
约30分钟后可检测到向蓝光源的弯曲。在初始蓝光感应及早期事件后,持续的蓝光感知促使快速向光弯曲涉及下胚轴背光侧AGCⅧ蛋白激酶D6PK和PAX对PIN蛋白的激活,从而与ABCB19协同实现快速向光弯曲。在信号衰减阶段,phot1的降解削弱向光性信号,弯曲过程完成。弯曲完成后发生向光源的伸长生长。当伸长过程中整合向光性与向重性信号时,回旋转头运动重新出现。虽然早期向光事件中未观察到差异性pH变化,但质膜H+-ATP酶的活性对于细胞壁酸化至关重要,以实现向光弯曲后的下胚轴伸长。胞间连丝门控(见第1章)也参与向光性的衰减和伸长阶段——初始向光刺激4小时后可观察到胼胝质沉积。蓝光感知4小时后同样出现不对称的PIN蛋白定位。
尽管向光素是向光性的主要光受体,但光敏色素和隐花色素也能参与该响应(参见网络专题17.13)。
总结
种子需要复水,有时还需额外处理才能萌发。在萌发和建苗过程中,食物储备维持幼苗生长直至其实现自养。破土后,地上部分响应阳光的非定向信号启动光形态建成。同时,地上部分也响应定向信号,根据阳光(向光性)、重力(向重性)和水源(向水性)调整方向。根系向下延伸入土壤,通过调整生长避开障碍物(向触性)。维管组织分化形成,促进水分、矿物质和糖类从种子储备及环境向幼苗各部位运输。在建苗相关的所有发育途径中,激素作为信号介质发挥核心作用。
17.1 种子结构
- 种子由种皮(testa)包裹,而果实由果皮(pericarp)包围(图17.1)。
- 种子解剖结构在储存养分的类型、分布方式及种皮性质上差异显著(图17.2)。
17.2 种子休眠
- 种子休眠可分为外源性(由外围组织施加)或内源性(源于胚自身)(图17.3)。
- 内源性休眠可由高ABA:GA浓度或胚胎发育停滞引起。
- 不休眠种子可能表现胎萌现象和早熟萌发(图17.4)。
- 调控种子休眠的主要激素是脱落酸(ABA)和赤霉素(GAs)(图17.5)。
17.3 休眠解除
- 光照(尤其是红光)可破除多数小种子的休眠,该现象由光敏色素介导。
- 部分种子需低温层积或后熟作用破除休眠(图17.6)。
- ABA与GA并非唯一调控休眠的化学物质。硝酸盐、一氧化氮(NO)及烟雾中的化学物质也能破除某些种子的休眠。
17.4 种子萌发
- 萌发及萌发后过程依水分吸收分为三个阶段(图17.7, 17.8)。
17.5 储备物质动员
- 谷物糊粉层响应赤霉素,向周围胚乳分泌水解酶(含α-淀粉酶),使淀粉降解产物供胚利用(图17.9)。
- 胚分泌的赤霉素促进α-淀粉酶转录与合成(图17.10)。
- ABA抑制α-淀粉酶转录。
- 蛋白质储存液泡(PSVs)含植酸钙镁钾盐(肌醇六磷酸的K⁺ Mg²⁺ Ca²⁺盐),这是种子中磷酸盐的主要储存形式。萌发时植酸酶释放磷酸盐及其他阳离子。
- 储存蛋白保护种子抵御干燥损伤和活性氧侵害。
- 蛋白酶储存于细胞独立区室,极少存在于种子蛋白储存液泡中。
- 油体储存三酰甘油与磷脂。
- 油体还储存油质蛋白(oleosins)、caleosins(caleosins)和甾醇脂蛋白(steroleosins),这些嵌入脂质单层的蛋白质在休眠期稳定油体,调控油体大小,并在萌发时乳化油体。
- 萌发及建苗期间,蛋白酶和脂肪酶分解油体,释放的脂肪酸经β-氧化为过程提供能量和原料(参见第13章)。
17.6 幼苗生长与建苗
- 幼苗在首次见光时从暗形态建成(黑暗环境发育,即地下阶段)转为光形态建成(图17.11)。
- 黄化苗中,赤霉素和油菜素内酯抑制光形态建成(图17.12)。
- 光敏色素、生长素和乙烯调控胚钩展开(图17.13)。
- 维管分化始于幼苗出土阶段(图17.14)。
- 根冠覆盖根尖分生组织,在根系穿透土壤时提供保护(图17.15)。
- 根毛作为特化表皮细胞,增加根系吸水吸矿表面积,并协助植株固着(图17.17)。
17.7 差异性生长促成幼苗成功建苗
- 转头运动(nutation)是器官生长过程中的旋转现象。回旋转头运动(circumnutation)指根尖、下胚轴和茎尖等器官顶端呈现螺旋式生长,形成圆形或椭圆形振荡轨迹(图17.18)。
- 转头与回旋转头属感性运动,具有自主性且不受外界刺激影响。
- 乙烯引起微管重排并诱导细胞横向扩张(图17.19, 17.20)。
在最佳浓度下,生长素促进茎和胚芽鞘的生长,并抑制根的生长。然而,较高浓度的生长素可以抑制茎和胚芽鞘的生长(图 17.21)。
17.8 向性:对定向刺激的生长响应
- 极化的幼苗生长由极性生长素流引导(图 17.22, 17.23)。
- 在幼根顶端被重新导向茎端的生长素大部分来自茎(图 17.24)。
- 在胚芽鞘尖端,生长素的横向重新分布促进了胚芽鞘的向地性(图 17.25)。水平定向的根将生长素重新导向下侧,抑制伸长区的生长,这一活动由根冠介导(图 17.26, 17.27)。
- 根冠柱状细胞中的平衡石充当重力传感器(图 17.27)。
- 调控真双子叶植物茎和下胚轴向地性的平衡石位于淀粉鞘中(图 17.28)。
- 在真双子叶植物茎中,生长素局限于维管组织(图 17.29)。pH 和 Ca^2+ 在向地性信号传导中充当第二信使(图 17.30)。pH、Ca^2+ 和活性氧在向触性信号传导中充当第二信使(图 17.31, 17.32)。
- 在向触性过程中发生生长素重新分布。根伸长区的皮层细胞是感知土壤水势的部位(图 17.33)。在向光性弯曲过程中,下胚轴的遮荫侧伸长(图 17.34)。
- 如同向地性和向触性,向光性也涉及生长素的横向重新分布(图 17.35)。
- 下胚轴的向光性在照射后几秒内开始,并在几分钟内,向光素1自磷酸化,然后暂时阻断生长素运输并启动信号放大(图 17.36)。
- 弯曲可在30分钟时观察到,快速弯曲在50分钟时开始并持续到信号减弱。
- 向光性弯曲完成后,向光性信号减弱。
- 向光性的最后一步是下胚轴向光伸长。
网络材料
网络材料
- 网络主题 17.1 种子的演化:种子是何时及如何演化的?
- 网络主题 17.2 幼苗生长可分为两种类型:出土型和留土型:一些子叶上升到土壤表面以上,另一些则留在土壤下方。
- 网络主题 17.3 种子表现出初级和次级休眠:次级休眠可能难以打破。
- 网络主题 17.4 内源休眠的一个特例:胡萝卜中的胚胎发育停滞是内源休眠的一个例子。
- 网络主题 17.5 萌发阶段II可为一阶段或两阶段过程:萌发时胚乳的存在与否决定了阶段II的过程。
- 网络主题 17.6 经典实验——分裂谷物种子:一半仅有胚乳,另一半有胚乳和胚胎。哪一半能降解淀粉?
- 网络主题 17.7 萌发过程中种子贮藏蛋白的动员:种子贮藏蛋白被水解成小肽和氨基酸,可被运输并合成为新蛋白和肽。
- 网络主题 17.8 萌发过程中油体的组织与功能:油体表面的蛋白质防止油体融合并控制油体大小。
- 网络主题 17.9 拟南芥中的毛状体细胞身份:移动转录因子调控根毛形成。
- 网络主题 17.10 向触性、向地性和回旋运动是整合信号:植物同时感知多个信号并需要整合它们。
- 网络主题 17.11 根的向光性:根表现出负向光性。
- 网络主题 17.12 微管定向与蓝光:蓝光导致皮层微管在纵向上重新定向。
- 网络主题 17.13 发色团与向光性:光敏色素和隐色素对向光性有贡献。
更多学习辅助材料,请访问 oup.com/he/taiz7e。
