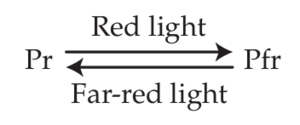第十六章 阳光带来的信号
阳光不仅是光合作用的能量来源,而且是调节各种发育过程的信号,从种子发芽到果实发育和衰老(图 16.1)。阳光还为植物生长提供方向性线索,并为植物运动提供非方向性线索。在前面的章节中,我们已经谈到了几种光感应机制。在第 11 章中,我们看到叶绿体在叶栅细胞内移动,使其表面或边缘朝向太阳(见图 11.12)。许多物种的叶子在太阳穿过天空的过程中能够向太阳弯曲,这种现象称为solar tracking(见图 11.5)。表 16.1 显示了各种条件下光强度和质量的范围。
在后续章节中,我们将遇到光调节植物发育的例子。例如,许多种子需要光才能发芽,这一过程称为photoblasty。阳光抑制茎的生长并刺激生长中的幼苗的叶片扩展,这是几种光诱导表型变化中的两种,统称为photomorphogenesis(图 16.2;另见第 17 章)。我们大多数人都熟悉这样的观察结果:靠近窗户的室内植物的枝条会朝着入射光生长。这种现象称为phototropism,是植物如何根据入射辐射的方向改变其生长模式的一个例子(图 16.3;另见第 17 章)。在某些物种中,叶子在夜间折叠(nyctinasty),在黎明打开(photonasty)。Photonastic movements是植物对无方向光的反应。正如我们将在第 20 章中讨论的那样,许多植物在一年中的特定时间开花,以响应日照长度的变化,这种现象称为photoperiodism。
除了可见光(图 16.4)外,阳光还含有紫外线 (UV) 辐射,它会损害膜、DNA 和蛋白质(见第 15 章)。许多植物可以感知紫外线的存在,并通过合成简单的酚类和黄酮类化合物来保护自己免受细胞损伤,这些酚类和黄酮类化合物充当防晒霜,并去除高能紫外线光子诱导的有害氧化剂和自由基。
到目前为止提到的所有光反应,包括对紫外线辐射的反应,都涉及检测特定波长的光并诱导发育或生理变化的受体。正如我们在第 4 章中看到的,激素信号转导涉及一系列反应,从激素受体开始,到生理反应结束。植物用来检测阳光的受体分子称为光感受器。与激素受体一样,光感受器对信号(此处为光)作出反应,启动通常涉及第二信使和磷酸化级联的信号反应(见图 4.4)。
在本章中,我们将讨论光调节生长和发育的主要信号机制,主要关注红光(600700 nm)、远红光(700-750 nm)、蓝光(400-500 nm)和 UV-B 辐射(290-320 nm)受体。
16.1 植物光感受器
色素,如叶绿素和光合作用的辅助色素,是吸收特定波长可见光并反射或透射未被吸收的波长(被感知为颜色)的分子。与光合色素不同,光感受器吸收给定波长的光子,并利用该能量作为启动光响应的信号。除 UVR8(本章末尾讨论)外,所有已知的光感受器都由蛋白质和吸光辅基(附着在光感受器蛋白质上的非蛋白质分子)组成,称为发色团。正如我们稍后将看到的,不同光感受器的蛋白质结构各不相同。光感受器的其他共同方面包括对 light quantity (光子数)、 light quality (波长依赖性)、光强度和持续时间的敏感性。在每种情况下,特定光感受器对光的感知都会启动细胞信号,最终调节特定的光反应。
在能够促进植物光形态建成的光感受器中,最重要的是那些吸收红光和蓝光的光感受器。光敏色素是吸收红光和远红光最强(600-750 nm)的光感受器,但它们也吸收蓝光(400-500 nm)和 UV-A 辐射(320-400 nm)。光敏色素介导营养和生殖发育的许多方面,我们将在后续章节中描述。三种主要光感受器介导 UV-A/蓝光的影响:隐花色素、向光素和 ZEITLUPE(ZTL,德语为“慢动作”)家族。隐花色素和光敏色素一样,在植物的光形态建成中起着重要作用,而向光素主要调节向光性、叶绿体运动和气孔开放。ZTL 光感受器家族在日长感知和昼夜节律中发挥作用。与激素信号传导一样,光信号传导通常涉及多个光感受器及其信号传导中间体之间的相互作用。
按照惯例,当描述全蛋白(蛋白质加发色团)时,植物光感受器用小写字母表示(例如,phy、cry、phot),当描述脱辅基蛋白(蛋白质减去发色团)时,用大写字母表示(PHY、CRY、PHOT)。为了与遗传惯例保持一致,我们将使用大写斜体(PHY、CRY、PHOT)表示编码光受体脱辅基蛋白的基因。
还从拟南芥中分离出一种独特的光受体系统,该系统专门用于感知紫外线(UV RESISTANCE LOCUS 8 或 UVR8),并负责几种 UV-B 诱导的光形态建成反应。 本章末尾讨论了 UVR8。
光反应由光质或吸收能量的光谱特性驱动
与激素受体的情况一样(见第 4 章),植物中不同的光受体系统可以相互作用,并且很难在整个太阳光谱中分离特定的响应,因为许多光受体可能同时吸收能量。例如,去黄化过程的特点是,在黑暗中生长的幼苗在暴露于光时会产生叶绿素,这是由于光敏色素和原叶绿素(见第 9 章)共同作用吸收红光,而隐花色素吸收蓝光与阳光。那么,我们如何在功能上区分对单个光感受器的内在反应?在许多情况下,不能排除光合作用的贡献,因为光合色素也吸收红光和蓝光。
为了确定哪些波长的光是引起特定植物反应所必需的,光生物学家通常会产生所谓的作用光谱action spectrum。作用光谱描述了生物对阳光反应的波长特异性。每个光受体的原子组成和排列不同,因此表现出不同的吸收特性。正如我们在第 9 章中看到的,光合作用作用光谱是绘制光响应(光合作用)幅度与波长的函数关系的图表(有关光谱和作用光谱的详细讨论,请参阅 WEB 主题 8.1)。然后可以将响应的作用光谱与候选光受体的吸收光谱进行比较。
类似的方法已用于识别参与信号通路的光受体。例如,红光刺激莴苣种子发芽,而远红光抑制莴苣种子发芽(图 16.5)。光对拟南芥种子发芽的这两种拮抗作用如图 16.6A 所示。刺激在红光区域 (660 nm) 处出现峰值,而抑制在远红光区域 (720 nm) 处出现峰值。当在用于研究光可逆分子的分光光度计中分别测量两种形式的光敏色素 (Pr 和 Pfr) 的吸收光谱时,它们分别与种子发芽的刺激和抑制作用光谱非常接近 (图 16.6B)。正如我们在第 16.2 节中讨论的那样,光敏色素的作用光谱和吸收光谱之间的密切对应性不仅证实了它作为参与调节种子发芽的光感受器的身份,而且还确定了种子发芽的红光/远红光可逆性是由于光敏色素本身的光可逆性。
类似地,蓝光刺激的向光性、气孔运动和其他关键蓝光响应的作用光谱都在 UV-A 区域(370 nm)中显示出峰值,在蓝色区域(~410-500 nm)中显示出峰值,具有特征性的“三指”精细结构(图 16.7A),表明存在共同的光感受器。向光素的光-氧-电压 2 (LOV2) 域的吸收光谱(包含发色团黄素单核苷酸 (FMN))与向光性的作用光谱相同(图 16.7B),这与向光素作为这些反应的光感受器一致。向光素作用的机制将在本章后面讨论。
植物对光的反应可以通过所需的光量来区分
光反应也可以通过诱导它们所需的光量来区分。光量称为fluence,定义为撞击单位表面积的总光子数。总通量 = 通量率 × 照射时间长度(持续时间)。请注意,此公式涉及两个部分:任何给定时刻的入射光子数和曝光持续时间。通量的标准单位是每平方米微摩尔量子(光子)(µmol m–2)。一些响应不仅对总通量敏感,而且对光的irradiance, or fluence rate也敏感。辐照度的单位是每平方米每秒微摩尔量子(µmol m–2 s–1)。(有关这些术语以及光测量中使用的其他术语的定义,请参阅第 9 章和 WEB 主题 9.1)。
由于只有当光子被其光感受器吸收时才会刺激光化学反应,因此入射辐射和吸收之间可能存在差异。例如,在光合作用中,表观量子效率被评估为电子传输速率或总碳吸收率作为入射光合光子通量密度(PPFD)的函数。然而,这种测量低估了实际量子效率,因为并非所有入射光子都被吸收。这一警告在评估绿色植物对红光或蓝光的光形态建成反应的剂量反应时也很重要,因为大部分光被叶绿素吸收。同样的原则也适用于对紫外线辐射的反应,因为表皮可以吸收不到 100% 的入射紫外线辐射。因此,基于所需的入射辐射量,诱导光响应所需的辐射量可能非常高,而基于光感受器的实际光子吸收量,则非常低。
16.2 光敏色素
光敏色素最初是在开花植物中发现的,是负责响应红光和远红光的光形态建成的光感受器。然而,它们是存在于所有陆生植物中的基因家族的成员,也存在于链状藻类、蓝藻、其他细菌、真菌和硅藻中。例如,细菌光敏色素 (bacteriophytochromes,BphPs) 调节 Rhodopseudomonas palustris光合装置的生物合成,以及Deinococcus radiodurans和Rhodospirillum centenum的色素生物合成。丝状真菌 Aspergillus nidulans 中的光敏色素似乎在性发育中发挥作用。因此,细菌和真菌光敏色素的这些功能在概念上类似于开花植物的光形态建成。
由于红光和远红光都无法穿透水深超过几米的深度,因此光敏色素作为水生生物的光感受器似乎不太有用。然而,最近的研究表明,不同的藻类光敏色素可以感知橙色、绿色甚至蓝色的光,这表明光敏色素有可能在自然选择过程中进行光谱调整以吸收不同的波长。
光敏色素是红光和远红光的主要光感受器
光敏色素是一种青蓝色(介于绿色和蓝色之间)或青绿色蛋白质,亚基分子量约为 125 千道尔顿 (kDa)。光敏色素的许多生物学特性都是在 20 世纪 30 年代通过研究红光诱导的形态发生反应(尤其是种子发芽)而确定的。光敏色素历史上的一个关键突破是发现红光(620-700 nm)的影响可以通过随后用远红光(700-750 nm)照射来逆转。这种现象首先在发芽的莴苣种子中得到证实(见图 16.5),但也在茎和叶的生长以及花的诱导和其他发育现象中观察到(表 16.2)。红光和远红光反应的可逆性最终导致人们发现,一种光可逆的光感受器——光敏色素,负责这两种活动。随后证明,这两种形式的光敏色素可以通过光谱区分(见图 16.6B)。
光敏色素可以在 Pr 和 Pfr 形式之间相互转化
在暗生长或黄化幼苗中,光敏色素以吸收红光的形式存在,称为 Pr。这种青蓝色的非活性形式在红光照射下会转化为一种吸收远红光的形式,称为 Pfr,它的颜色为淡青绿色,被认为是光敏色素的活性形式。
Pfr 可以在黑暗中恢复为非活性 Pr,但这是一个相对较慢的过程。然而,Pfr 可以通过远红光照射迅速转化为 Pr。这种转换-再转换特性称为光可逆性photoreversibility(也称为 photochromism),是光敏色素最显著的特征,可以在体内或体外测量,结果几乎相同。它通常被绘制成如下图所示:
因此,光可逆性是光敏色素的一个决定性特征。甚至在光谱的橙色、绿色或蓝色区域具有峰值吸光度的藻类光敏色素也在不同波长下表现出光可逆性。
值得注意的是,在红光或远红光照射后,光敏色素库从未完全转化为 Pfr 或 Pr 形式,因为 Pfr 和 Pr 形式的吸收光谱重叠。因此,当 Pr 分子暴露于红光时,它们中的大多数吸收光子并转化为 Pfr,但一些生成的 Pfr 也会吸收红光并转化回 Pr(见图 16.6B)。在红光饱和照射后,Pfr 形式的光敏色素比例仅为 88% 左右。同样,Pr 吸收的远红光量非常小,因此不可能通过广谱远红光将 Pfr 完全转化为 Pr。相反,会达到 98% Pr 和 2% Pfr 的平衡。这种平衡称为photostationary state。在没有红光的情况下,Pfr 也会恢复为 Pr。这个过程被称为thermal reversion,它有助于光稳定状态,并且对温度变化很敏感,温度变化会影响光敏色素的性能,因此有人提出光敏色素也可以作为温度传感器。
Pfr 是光敏色素的生理活性形式
由于光敏色素反应是由红光引起的,因此理论上,它们可能是由 Pfr 的出现或 Pr 的消失引起的。在大多数研究中,生理反应的幅度与光产生的 Pfr 量之间存在定量关系,但生理反应与 Pr 的损失之间不存在这种关系。这样的证据导致人们得出结论,Pfr 是光敏色素的生理活性形式。
使用窄波段红光 (R) 和远红光 (FR) 是发现和最终分离光敏色素的关键。然而,与实验室光生物学实验中使用的植物不同,在户外生长的植物永远不会暴露在纯“红光”或“远红光”下。在自然环境中,植物暴露在更宽的光谱下,正是在这些条件下,光敏色素必须发挥作用来调节对光环境变化的发育反应。事实上,如图 16.6B 所示,植物冠层本身可以对到达单个植物的入射光的数量和质量产生巨大影响。红光:远红光 (R:FR) 比率尤为重要,该比率受冠层影响很大,因为叶绿素吸收红光但不吸收远红光(见表 16.1)。因此,正如我们将在第 18 章中讨论的那样,在冠层下生长的植物使用光敏色素来感知R:FR 比率,以调节诸如避荫、竞争相互作用和种子发芽等过程。
光敏色素发色团和蛋白质都会对红光作出反应,发生构象变化。
功能活性二聚体形式的光敏色素是一种可溶性蛋白质,分子量约为 250kDa。光敏色素的进化起源很古老,早于真核生物的出现。细菌光敏色素是光依赖性组氨酸激酶,可作为传感蛋白,磷酸化相应的反应调节蛋白(见第 4 章)。然而,正如稍后讨论的那样,光敏色素保留了组氨酸激酶相关结构域,这是细菌双组分系统的特征。
在高等植物中,光敏色素发色团是一种称为光敏色素质phytochromobilin的线性四吡咯(图 16.8)。phytochromobilin在质体内部合成,并通过叶绿素合成的分支途径从血红素衍生而来。phytochromobilin从质体输出到细胞质,在那里它通过与半胱氨酸残基的硫醚键自催化附着到 PHY 脱辅基蛋白上。 (硫醚键是氧被硫取代的醚:R1—S—R2。)大多数被子植物中有三种光敏色素同工型(phyA–C),尽管许多阔叶植物物种含有多达五种(phyA–E)。每种 phy 同工型由单独的基因编码,每种基因在发育过程中都发挥着独特的作用。
图 16.9A 说明了光敏色素中的几个结构域。光敏色素的 N 端一半包含 PAS 和 GAF 结构域,它们共价结合发色团并赋予 bilin-lyase活性。N 端还包括 PHY 结构域,它使 Pfr 形式的光敏色素稳定。PAS-GAF-PHY 结构域构成光敏色素的发色团结合、感光区域。 “铰链”区将分子的 N 端和 C 端两部分分开。图 16.9B 显示了拟南芥 phyB 的光感应 N 端部分的晶体结构。
铰链区下游是两个 PAS 相关域 (PRD) 重复序列,它们介导光敏色素二聚化。PRD 被认为与将 Pfr 形式的 phyB 定位到细胞核有关,尽管它缺乏典型的核定位信号 (NLS)。植物光敏色素的 C 端区域包含一个 ATP 结合组氨酸激酶相关结构域 (HKRD),它不以组氨酸残基为目标进行磷酸化。
将植物光敏色素的结构域与原核生物光敏色素 Cph1(蓝藻光敏色素 1,cyanobacterial phy tochrome 1)和 BphPs 进行比较,可以发现植物和原核生物光敏色素之间存在一些差异,包括原核生物中不存在两个 PRD 结构域,以及植物中原核生物组氨酸激酶结构域被 HKRD 取代(见图 16.9A)。虽然所有光敏色素都含有四吡咯发色团,但 phytochromobilin与原核生物光敏色素中的发色团不同。
Pr 形式的光敏色素暴露于红光会导致发色团光敏色素发生原子级结构变化:Pr 发色团在碳 15 和 16 之间发生顺反异构化,C14—C15 单键发生旋转(见图 16.8)。发色团的变化导致蛋白质中关键的二级结构元素发生重排。
Pfr 被分配在细胞质和细胞核之间
光敏色素信号传导的主要步骤是光感受器从细胞质迁移到细胞核,这似乎是从藻类到植物的所有光敏色素中都存在的保守特征。在细胞质中,光敏色素全蛋白在非活性 Pr 状态下二聚化(图 16.10)。红光将 Pr 转化为 Pfr 与二聚体的构象变化有关,但这一变化目前仍未解决。phyA 和 phyB 都以光依赖的方式从细胞质移动到细胞核中(图 16.11),但它们通过不同的机制进行移动。phyA 和 phyB 都不包含典型的核定位信号 (NLS)。phyB 的 PRD 结构域可能充当 NLS,但它显然被 Pr 形式所掩盖。红光将 Pr 转化为 Pfr 可能会暴露 phyB 的 PRD 结构域的功能性 NLS,从而促进 phyB 进入细胞核。相反,phyA 的 PRD 结构域不能充当 NLS,因此它依赖于其他蛋白质,例如 FAR-REDELONGATED HYPOCOTYL1 (FHY1) 及其同源物 FHY1-LIKE (FHL),将其运输到细胞核中(见图 16.10)。
一旦进入细胞核,光敏色素就会与转录调节因子相互作用,介导基因转录的变化。因此,
光敏色素的一个重要功能是作为光激活开关,带来基因表达的全局变化。然而,如下一节所述,几种光敏色素反应(如茎伸长的抑制)在暴露于红光或远红光后数分钟甚至数秒内就会极快地发生。因此,光敏色素在细胞质中也能发挥重要作用,调节膜电位和离子通量以响应红光和远红光。
16.3 光敏色素反应
完整植物中不同光敏色素反应的种类繁多,包括反应类型(见表 16.2)和诱导反应所需的光量。对这种多样性的调查将显示单个光事件(Pr 对光的吸收)对整个植物的影响有多么不同。为了便于讨论,光敏色素诱导的反应可以逻辑地分为两种类型:
● 快速生化事件
● 较慢的形态变化,包括运动和生长
一些早期生化反应会影响后期的发育反应。这些早期生化事件的性质包括信号转导途径,将在本章后面详细介绍。在这里,我们重点关注光敏色素对整个植物反应的影响。正如我们将看到的,这种反应可以根据所需光的数量和持续时间以及它们的作用光谱分为各种类型。
光敏色素反应的滞后时间和逃逸时间各不相同
光敏色素光激活的形态反应通常在滞后时间(刺激和观察到的反应之间的时间)后通过视觉观察到。滞后时间可能短至几分钟,也可能长达数周。这些反应时间的差异是由光敏色素信号下游的多种信号转导途径以及与其他发育机制的相互作用引起的。这些反应中较快的通常是细胞器的可逆运动(参见 WEB 主题 16.1)或细胞的可逆体积变化(肿胀、收缩),但即使一些生长反应也非常快。例如,在茎中 Pfr 与 Pr 的比例增加后几分钟内,就观察到了红光对光照生长的藜 (Chenopodium album) 和拟南芥茎伸长率的抑制。然而,在拟南芥和其他物种中,诱导开花的时间会滞后数周。
光敏色素反应也体现在所谓的“ escape from photoreversibility.”现象中。红光诱导的事件只能在一段有限的时间内被远红光逆转,此后,该反应被认为“逃离”了光的逆转控制。这种逃离现象可以用一个模型来解释,该模型基于这样的假设:光敏色素控制的形态反应是响应细胞中一系列相互关联的生化反应的最终结果。通过去除 Pfr,序列的早期阶段可能完全可逆,但在序列的某个点上,会达到一个不可逆转的点,超过这个点,反应将不可逆地朝着响应方向进行。因此,逃离时间表示整个反应序列变为不可逆之前所需的时间——本质上是 Pfr 完成其主要作用所需的时间。不同光敏色素反应的逃逸时间差异很大,从不到一分钟到几小时不等。
根据所需光量,光敏色素反应可分为三大类
如图 16.12 所示,根据所需光量,光敏色素反应可分为三大类:极低通量反应 (VLFR)、低通量反应 (LFR) 和高辐照度反应 (HIR)。VLFR 和 LFR 具有特征光通量范围,在此范围内响应的幅度与通量成正比。然而,HIR 与辐照度成正比。
极低通量响应 (VLFRS) 一些光敏色素响应可由低至 0.0001 μmol m–2(几秒钟的星光,或萤火虫单次闪光发出的光量的十分之一)的通量引发,并在约 0.05 μmol m–2 时达到饱和(即达到最大值)。例如,在 0.001 至 0.1 μmol m–2 范围内的红光下,可诱导拟南芥种子发芽。在暗生长的燕麦 (Avena spp.) 幼苗中,红光可以在同样低的通量下刺激胚芽鞘的生长并抑制中胚轴 (胚芽鞘和根之间的细长轴) 的生长。
VLFR 是非光可逆的。诱导 VLFR 所需的微量光将不到 0.02% 的总光敏色素转化为 Pfr。由于通常会逆转红光效应的远红光仅将 98% 的 Pfr 转化为 Pr (如前所述),因此大约 2% 的光敏色素仍为 Pfr — 远远超过诱导 VLFR 所需的 0.02%。换句话说,远红光不能将 Pfr 浓度降低到 0.02% 以下,因此它无法抑制 VLFR。尽管 VLFR 是非光可逆的,但 VLFR 反应(例如种子发芽)的作用谱与 LFR 反应(下文讨论)的作用谱相似,支持光敏色素是参与 VLFR 的光感受器的观点。使用光敏色素缺陷突变体证实了这一假设,如本章后面所述。
低通量反应 (LFRS) 另一组光敏色素反应直到通量达到 1.0 μmol m–2 时才能启动,并且在约 1000 μmol m–2 时达到饱和。这些低通量反应 (LFR) 包括促进莴苣种子发芽、抑制下胚轴伸长和调节叶片运动等过程(见表 16.2)。
如图 16.6 所示,拟南芥种子发芽的 LFR 作用光谱包括红光区(660 nm)中的刺激主峰和远红光区(720 nm)中的抑制主峰。VLFR 和 LFR 均可通过短脉冲光诱导,前提是总光能加起来达到所需的通量。总通量取决于两个因素:通量率(μmol m–2 s–1)和照射时间。因此,只要光足够亮,短暂的红光脉冲就会引起响应,相反,如果照射时间足够长,非常暗的光也会起作用。这种通量率和时间之间的相互关系称为互易定律 law of reciprocity。VLFR 和 LFR 都遵循互易定律;也就是说,响应的大小(例如,发芽百分比或下胚轴伸长的抑制程度)取决于通量率和照射时间的乘积。然而,只有当所研究的光感受器对光子的吸收是所研究响应中的限速步骤时,互易定律才成立。当光感受器激活和测量响应(例如下胚轴伸长)之间的任何步骤变得受限时,互易性就会受到干扰。因此,对于许多响应,互易性的概念很难证明。
高辐照度响应 (HIRS) 第三类光敏色素响应称为高辐照度响应 (HIR),其中几种列于表 16.3 中。HIR 需要长时间或连续暴露于相对高辐照度的光。响应与辐照度成正比,直到响应饱和并且额外的光不再产生影响(参见 WEB 主题 16.2)。这些反应之所以被称为高辐照度反应而不是高通量反应,是因为它们与通量率(每秒撞击植物组织的光子数)成正比,而不是与通量(给定时间内撞击植物的总光子数)成正比。HIR 在比 LFR 高得多的光照强度下达到饱和状态 — 至少高 100 倍。由于持续暴露于弱光或短暂暴露于强光都不会诱导 HIR,因此这些反应不遵循互易律。
表 16.2 中列出的许多 LFR,特别是那些参与去黄化的 LFR,也符合 HIR 的条件。例如,在低光照强度下,白芥菜 (Sinapis alba) 幼苗中花青素产生的作用光谱表明了光敏色素,并在光谱的红色区域显示单个峰值。这种效应在远红光(光敏色素独有的光化学特性)下是可逆的,并且响应遵循互易律。然而,如果将暗生长的幼苗暴露在高辐照度光下数小时,作用光谱在远红光和蓝光区域包含峰值,则该效应不再是光可逆的,响应将与辐照度成比例。因此,相同的效应可以是 LFR 或 HIR,具体取决于幼苗暴露于光的历史。正如我们将在本节的其余部分讨论的那样,不同的光敏色素分子负责这些不同类型的响应。
光敏色素 A 介导对连续远红光的响应
拟南芥含有五种编码光敏色素的基因,PHYA-PHYE。五种光敏色素中的四种,phyB-phyE,似乎在植物中大多是光稳定的,并且主要在调节 LFR 中发挥作用,例如涉及 R:FR 比率变化的避荫。相反,phyA的Pfr会迅速降解,并控制植物 VLFR 和远红光 HIR。最近的研究表明,在信号传导过程中,phyB 及其光敏色素相互作用因子 (PIF) 靶标也会在细胞核中降解。因此,Pfr 周转似乎是植物光敏色素的保守特性。
在拟南芥的早期突变体筛选中,在连续白光下下胚轴伸长改变的突变体(统称为 hy 突变体)中发现了 phyB 突变。连续白光由光稳定的光敏色素 phyB-phyE 检测。由于已知远红 HIR 需要光不稳定的光敏色素,因此人们怀疑 phyA 一定是参与感知连续远红光的光感受器。对无法对连续远红光作出反应、反而长得又高又细的突变体进行筛选,从而鉴定出 phyA 突变体以及发色团形成有缺陷的其他突变体,这表明 phyA 介导对连续远红光的反应。
缺乏 phyA 的突变体也无法对毫秒脉冲光作出反应,但在低能量范围内对红光表现出正常反应(由 phyB 介导)。这一结果表明 phyA 也充当主要这种 VLFR 的光受体。当 phyA/phyB 双突变体在高通量红光(>100 μmol m–2 s–1)下生长时,它们甚至比 phyB 单突变体更长。PhyA 还被证明在拟南芥和水稻开花的光周期控制中发挥作用。
光敏色素 B 介导对连续红光或白光的反应
hy3 突变体的表征揭示了 phyB 在去黄化中的重要作用,因为在连续白光下生长的突变幼苗具有较长的下胚轴。phyB 突变体缺乏叶绿素和一些编码叶绿体蛋白的 mRNA,并且其对植物激素的反应能力受损。
除了调节白光和红光介导的 HIR 之外,phyB 似乎还能调节 LFR,例如光可逆种子发芽,这一现象最初导致了光敏色素的发现。野生型拟南芥种子需要光照才能发芽,其反应在低能量密度范围内表现出红光/远红光可逆性(见图 16.6A)。缺乏 phyA 的突变体对红光反应正常,而缺乏 phyB 的突变体则无法对低能量密度红光作出反应。这一实验证据有力地表明 phyB 介导光可逆种子发芽。
PhyB 在调节植物对遮荫处理的反应方面也发挥着重要作用。缺乏 phyB 的植物通常看起来像在茂密的植被冠层下生长的野生型植物。事实上,调节对植物遮荫的反应,如加速开花和增加伸长生长,可能是光敏色素最重要的生态学作用之一(见第 18 章)。
光敏色素 C、D 和 E 的作用正在显现
尽管 phyA 和 phyB 是拟南芥中光敏色素的主要形式,但 phyC、phyD 和 phyE 在调节对红光和远红光的反应方面发挥着独特的作用。双重和三重突变体的建立使得评估每种光敏色素在给定反应中的相对作用成为可能。phyD 和 phyE 在结构上与 phyB 相似,但在功能上并不冗余。 phyD 和 phyE 介导的反应包括叶柄和节间伸长(见第 18 章)以及开花时间的控制(见第 20 章)。拟南芥中 phyC 突变体的表征表明 phyC、phyA 和 phyB 反应途径之间存在复杂的相互作用。这种光敏色素基因功能的特化可能对微调光敏色素对光照条件的每日和季节性变化的反应很重要。已知光稳定光敏色素会异二聚化。因此,它们的相对表达将决定光响应性。事实上,它们的相对表达在植物物种之间可能有所不同,这解释了光响应性的差异。
16.4 光敏色素信号通路
植物中所有受光敏色素调节的变化都始于光感受器对光的吸收。光吸收后,光敏色素的分子特性会发生变化,影响光敏色素蛋白与其他细胞成分的相互作用,最终导致器官生长、发育或位置的变化(见表 16.2 和 16.3)。
分子和生物化学技术有助于揭示光敏色素作用的早期步骤和导致生理或发育反应的信号转导途径。这些反应分为两大类:
● 离子流动,导致相对快速的膨压反应
● 基因表达改变,通常导致较慢、较长期的反应
在本节中,我们将研究光敏色素对膜通透性和基因表达的影响,以及构成导致这些影响的信号转导途径的可能事件链。
光敏色素调节膜电位和离子通量
光敏色素可以快速改变分离的叶枕细胞中的磷酸肌醇组成,这些细胞在光脉冲的几秒钟内表现出快速的膨压变化。这种快速的膜调节是从红光和远红光对根和燕麦胚芽鞘表面电位的影响推断出来的,其中 Pfr 的产生和可测量的超极化(膜电位变化)开始之间的滞后时间很短。这些细胞电位的变化意味着离子穿过质膜的通量发生了变化,并表明一些光敏色素的细胞质反应是在质膜处或附近发起的。
一个长期存在的难题是丝状绿藻 Mougeotia 如何利用红光刺激叶绿体快速运动(参见 WEB 主题 16.1)。在包括拟南芥在内的许多物种中,叶绿体运动都是通过光感受器蛋白——向光素的作用由蓝光介导的。在 Mougeotia 中,向光性光感受器调节叶绿体运动由光敏色素和一种称为neochrome的光敏激素融合而成,neochrome表现出典型的bilin binding以及红光/远红光可逆性。因此,Mougeotia 似乎已经进化出利用红光作为信号来诱导通常由蓝光介导的反应(叶绿体运动)的能力。
光敏色素调节基因表达
正如光形态建成photomorphogenesis一词所暗示的那样,植物的发育受到光的深刻影响。细长的茎、折叠的子叶和叶绿素的缺失是暗生长、黄化幼苗发育的特征。通过光完全逆转这些症状需要长期的重大代谢改变,而这只能通过基因表达的变化来实现。光调控植物启动子与其他真核基因的启动子相似:一组模块化元件,其数量、位置、侧翼序列和结合活性可导致广泛的转录模式。没有一个单一的 DNA 序列或结合蛋白是所有光敏色素调控基因所共有的。
乍一看,光调控基因具有如此广泛的调控元件,任何组合都可以赋予光调控表达,这似乎有些矛盾。然而,如第 3 章所述,这种复杂的启动子元件允许通过多个光感受器的作用对许多基因进行不同的光和组织特异性调控。
光对转录的刺激和抑制可以非常迅速,滞后时间短至 5 分钟。使用 DNA 微阵列分析,可以监测响应光变化的基因表达的整体模式。 (有关转录分析方法的讨论,请参阅 WEB 主题 3.4。)这些研究表明,核输入会触发涉及数千个参与光形态建成发育的基因的转录级联。通过监测植物从黑暗转向光明后基因表达谱随时间的变化,已经确定了 PHY 基因作用的早期和晚期目标。
phyA 和 phyB 的核输入与刺激其活性的光质高度相关。也就是说,phyA 的核输入由红光或远红光或低通量广谱光激活,而 phyB 的输入由红光照射驱动,并可通过远红光逆转。光敏色素蛋白的核输入是光敏色素信号传导的主要控制点。
一些在从黑暗转向光明后迅速上调的早期基因产物本身就是激活其他基因表达的转录因子。 编码这些快速上调蛋白质的基因称为初级反应基因primary response genes。 初级反应基因的表达依赖于信号转导途径(下文讨论)并且与蛋白质合成无关。 相反,晚期基因或次级反应基因 secondary response genes的表达需要合成新的蛋白质。
光敏色素相互作用因子 (PIF) 在信号传导早期起作用
光敏色素相互作用因子 (Phytochrome interacting factors,PIF) 是一类碱性螺旋-环-螺旋 (bHLH) 转录因子,可调节光敏色素介导活动的各个方面,包括光形态建成、种子发芽、叶绿素生物合成、避荫和下胚轴伸长。PIF 主要通过充当暗诱导基因的转录激活剂(图 16.13A)以及抑制某些光诱导基因(图 16.13B)来促进黑暗中的黄化发育(暗形态建成skotomorphogenesis)。与 phyA 或 phyB 之一相互作用的 PIF 定义 phy 信号网络中的分支点,而与 phyA 和 phyB 两者相互作用的蛋白质可能代表汇聚点。这些因子中特征最明显的是 PIF3,它与 phyA 和 phyB 相互作用。
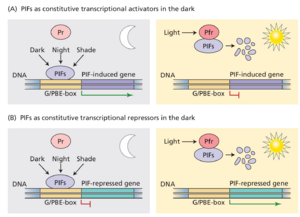
PIF3 和几种相关的 PIF 或 PIF 样蛋白 ( PIF-like proteins,PIL) 尤其引人注目,因为该基因家族至少有五个成员选择性地与处于活性 Pfr 构象的光敏色素相互作用。这些蛋白质位于细胞核中,可以与 DNA 结合,这一事实表明光敏色素与基因转录之间存在密切联系。
在高 R:FR 比率下,Pfr 的形成会通过磷酸化引发 PIF 蛋白的降解,通过蛋白酶体(见第 1 章和第 4 章)。PIF 的快速降解可能提供一种调节光响应的机制,该机制与 phy 蛋白的活性紧密相关。例如,在诱导避荫的低 R:FR 比率下(见第 18 章),PIF7 被去磷酸化并与靶基因启动子中的 DNA 结合。PIF7与保守的染色质重塑因子INO80的一个亚基互作会导致H2A.Z的驱逐,而H2A.Z通常与 DNA 紧密结合以阻止转录。H2A.Z 被驱逐会导致转录增加。在白光或高 R:FR 比下,如从阴凉处出现时,PIF7 的磷酸化会重置系统并抑制转录。
光敏色素信号传导涉及蛋白质磷酸化和去磷酸化
可逆磷酸化在调节光敏色素信号传导中起着重要作用。光敏色素本身被磷酸化,这种翻译后修饰可以调节它们的热逆转率并影响它们在拟南芥中的光敏性。对负责控制光敏色素磷酸化的激酶和磷酸酶的了解有限。尽管最近的证据加剧了关于光敏色素本身是否具有磷酸转移活性的争论,但已知光敏色素通过光调节激酶的作用控制信号传导伙伴(如 PIF3)的磷酸化状态。一组膜相关光敏色素激酶底物 (phytochrome kinase substrate PKS) 蛋白似乎通过直接磷酸化或与其他激酶相互作用来改变光敏色素活性。PKS1 与活性 Pfr 和非活性 Pr 形式的 phyA 和 phyB 相互作用。分子和遗传分析表明,这些蛋白质选择性地促进 phyA 介导的 VLFR。几种磷酸酶也被证明与 phy 相互作用并调节其磷酸化状态。
光敏色素诱导的光形态建成涉及蛋白质降解
如第 4 章所述,植物信号转导途径可能涉及抑制蛋白的失活、降解或去除。光敏色素信号通路也可以遵循这一一般原则。例如,phyA 在被光激活后会迅速降解。因此,除了磷酸化,蛋白质降解正在成为一种普遍存在的机制,调节许多细胞过程,包括光和激素信号传导、昼夜节律和开花时间(有关示例,请参阅第 4 章)。
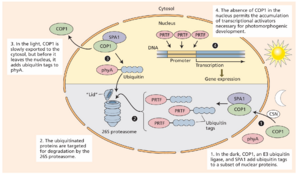
对在黑暗中表现出部分光形态建成的拟南芥突变体的遗传筛选导致了调节光敏色素光依赖性稳定性的抑制蛋白和激活与光形态建成相关的基因表达的转录因子的发现。在黑暗中,E3 连接酶组成性光形态建成 1 ( CONSTITUTIVE PHOTOMORPHOGENESIS 1,COP1) 被一种称为 COP 9 信号体 (COP 9 SIGNALOSOME ,CSN) 的蛋白质复合物在细胞质中募集并移入细胞核。COP1 与蛋白激酶光色素 A1 抑制剂 (SUPPRESSOR OF PHYTOCHROME A1,SPA1) 相互作用,对包括 PIF1 在内的光形态建成转录因子进行磷酸化、泛素化和降解靶向作用(图 16.14)。结果是光形态建成基因在黑暗中不表达。
在光照下,COP1 活性受到光感受器作用的抑制,尽管 COP1 在光照下失活的完整机制尚不清楚。光依赖性地将 COP1 输出到细胞质是一种缓慢的过程(见图 16.14),需要长时间暴露在光线下(超过 24 小时),并且可能是在长时间光照条件下抑制 COP1 激活的一种机制。总之,抑制 COP1 活性并输出到细胞质允许转录因子与介导光形态建成发育的基因中的启动子元件结合。
正如我们将在第 20 章中讨论的那样,COP1 也是降解开花调节剂 CONSTANS (CO) 和 GIGANTEA (GI) 所必需的。
16.5 蓝光反应和光感受器
据报道,高等植物、藻类、蕨类植物、真菌和原核生物都表现出蓝光反应。除了向光性之外,这些反应还包括藻类吸收阴离子、抑制幼苗下胚轴 (茎) 伸长、刺激叶绿素和类胡萝卜素合成、激活基因表达和增强呼吸作用。在某些藻类和细菌等运动单细胞生物中,蓝光介导趋光性,即运动单细胞生物朝向或远离光的运动。蓝光还会刺激细菌的感染过程,例如动物病原体布鲁氏菌。第 11 章介绍了一些与光合作用有关的蓝光反应,包括叶绿体运动、太阳跟踪和气孔开放。第 17 章将在种子发芽和幼苗建立的背景下讨论几种关键的蓝光反应——光生性、向光性和光形态建成。
蓝光反应具有特征性的动力学和滞后时间
蓝光对茎伸长的抑制和对气孔开放的刺激说明了蓝光反应的两个重要时间特性:
1. 光信号与最大响应率之间存在显着的滞后时间
2. 光信号关闭后响应的持久性
与大多数光形态建成变化相比,蓝光反应可能相对较快。然而,与典型的光合作用反应(在“亮灯”信号后几乎立即完全激活,并在灯熄灭后立即停止)相反,蓝光反应表现出可变持续时间的滞后时间,并在施加光脉冲后几分钟内以最大速率进行。
例如,蓝光仅在约 25 秒的滞后时间后才引起黄瓜幼苗生长率下降和短暂的膜去极化(图 16.15)。已经使用蓝光脉冲研究了在没有蓝光的情况下蓝光反应的持久性。例如,蓝光诱导的保卫细胞中 H+-ATPase 的激活在蓝光脉冲后衰减,但在几分钟后才会衰减。脉冲后蓝光响应的持续性可以用光化学循环来解释,其中光感受器的生理活性形式(由蓝光从非活性形式转化而来)在蓝光关闭后缓慢恢复为非活性形式。正如我们将在第 16.8 节中讨论的那样,对于光向性激素而言,该循环似乎涉及四个主要过程:受体被蛋白磷酸酶去磷酸化、与载脂蛋白中半胱氨酸侧链的共价碳硫键断裂(见图 16.9)、受体与其目标分子分离以及光驱动构象变化的暗逆转。因此,对蓝光脉冲响应的衰减率取决于光感受器活性形式恢复到非活性形式的时间过程。
16.6 隐花色素
隐花色素是蓝光光感受器,可介导多种蓝光反应,包括抑制下胚轴伸长、促进子叶扩张、膜去极化、抑制叶柄伸长、花青素产生和昼夜节律时钟同步。隐花色素 1 (CRY1) 最初是在筛选中发现,拟南芥突变体下胚轴在白光下生长时会伸长,但仍会受到红光的抑制,这表明光信号通路存在缺陷,不同于光敏色素。如本章后面所述,隐花色素是长期蓝光诱导的下胚轴伸长抑制的原因,而向光素介导快速抑制反应。
拟南芥中的三种隐花色素同工酶(cry1、2 和 3)是与微生物光裂解酶具有显著序列同源性的蛋白质,微生物光裂解酶是一种蓝光激活的酶,可修复因紫外线照射而导致的 DNA 中嘧啶二聚体。然而,隐花色素没有光裂解酶活性。后来在许多生物体中发现了隐花色素蛋白,包括蓝藻、蕨类植物、藻类、果蝇、老鼠和人类。隐花色素的 FAD 发色团被激活,引起蛋白质的构象变化。拟南芥隐花色素的结构域结构如图 16.16A 所示。与一类主要的光裂解酶类似,隐花色素与黄素腺嘌呤二核苷酸(FAD)和蝶呤 5,10-亚甲基四氢叶酸(MTHF) 作为发色团(图 16.16B 和 C)。蝶呤是吸光的蝶啶衍生物,常见于昆虫、鱼类和鸟类的色素细胞中。在光解酶中,蓝光被蝶呤吸收,然后激发能转移到 FAD。类似的机制可能在隐花色素中起作用,但缺乏确凿的证据。然而,很明显 FAD 是调节隐花色素活性的主要发色团。
蓝光吸收会改变结合的 FAD 发色团的氧化还原状态,而正是这一初级事件触发了光感受器激活(图 16.16D)。隐花色素在非活性或静止状态下与完全氧化的 FAD 结合。蓝光会形成半还原(半醌)中性 FAD 自由基(FADH•)。FADH• 由光还原和随后的 FAD 发色团质子化生成。光驱动的 FADH• 生成发生在微秒内(被认为代表了触发光感受器激活的信号状态)。在没有蓝光的情况下,FADH• 会恢复为 FAD。绿光对隐花色素功能的抑制作用已被观察到,大概是通过拮抗吸收该光谱区域的 FADH• 形成来实现的。
正如在光敏色素和向光素中一样,蓝光吸收的激活机制促进了蛋白质构象变化。在隐花色素的情况下,N 端光裂解酶同源区 (PHR) 的光吸收被认为会改变 C 端延伸 (CTE) 的构象,而 C 端延伸是信号传导所必需的。光裂解酶中没有这种 C 端延伸,但对于隐花色素信号传导显然是必不可少的。因此,我们可以将植物隐花色素视为分子光开关,其中 PHR 吸收蓝色光子会导致蛋白质在 C 端发生构象变化,从而启动与特定伴侣蛋白的结合,从而通过反式因子(如 ELONGATED HYPOCOCTYL 5 (HY5))启动基因转录。与光敏色素一样,由 PHR 介导的隐花色素二聚化可能对其信号传导很重要。事实上,隐花色素同型二聚化有助于通过调节活性/非活性受体分子的适当平衡来控制隐花色素的光敏感性。这是通过结合BLUE-LIGHT INHIBITORS OF CRYPTOCHROMES (BIC) 来实现的,BIC 可以通过抑制隐花色素的同型二聚化来抑制其光活化。
cry1 和 cry2 具有不同的发育效应
在转基因烟草或拟南芥植物中过度表达 CRY1 脱辅基蛋白会导致更强的蓝光诱导的下胚轴伸长抑制,以及花青素产量增加(图 16.17)。后来从拟南芥中分离出第二种隐花色素,称为 cry2。cry1 和 cry2 似乎在整个植物界中普遍存在。它们之间的主要区别在于,cry2 蛋白在蓝光下优先降解,而 cry1 则稳定得多。过表达 CRY2 基因的转基因植物仅显示出野生型中发现的下胚轴伸长的抑制作用略有增强,这表明与 cry1 不同,cry2 在抑制茎伸长方面并不起主要作用。然而,过表达 CRY2 的转基因植物显示出蓝光刺激子叶扩张的大幅增加。此外,cry1 和程度较小的 cry2 参与设定拟南芥的昼夜节律时钟,而 cry2 在诱导开花方面起着重要作用(见第 20 章)。已证明隐花色素同源物在调节苍蝇、小鼠和人类的昼夜节律时钟方面发挥作用。
还值得注意的是,在拟南芥中,已证明 cry1 的核和细胞质池具有不同的生物学功能。与预期相反,发现核而非细胞质 cry1 分子介导蓝光介导的膜去极化变化。这种反应显示几秒钟的时间过程,是 cry1 介导的对蓝光最快的反应之一。这种蓝光依赖性阴离子通道激活的机制尚不清楚。
cry1 和 cry2 通常存在于细胞核中,而 cry3 则位于叶绿体和线粒体中。cry3 的功能尚不清楚,尽管已证明它具有针对单链 DNA 损伤的光裂解酶活性。此外,cry3 信号传导机制明显不同于 cry1 和 cry2,因为它缺乏显著的 C 端延伸。
核隐花色素抑制 COP1 诱导的蛋白质降解
cry1 和 cry2 都存在于细胞核和细胞质中,没有证据表明隐花色素响应光而进入细胞核。图 16.18 表明,在黑暗中,COP1 与 SPA1 和其他因子协同作用,降解诱导光形态建成所需基因表达的转录因子(另见图 16.14)。在蓝光激活后,细胞核中的 cry1 与 SPA1 和 COP1 形成复合物,阻止它们起作用,从而阻止促进光形态建成的转录因子降解。与光敏色素信号传导的情况一样,转录因子丰度的增加促进了光形态建成的发育。
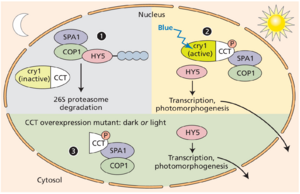
隐花色素的 C 端与 SPA1 结合并阻止 SPA1/COP1 作用。仅过度表达隐花色素 C 末端延伸 (CTE) 的拟南芥植物表现出与 cop 突变体相似的表型,后者在黑暗中生长时类似于在光照下生长的幼苗。图 16.18 中显示的模型可以解释 CTE 过度表达植物的表型。如果没有 PHR,CTE 可以采用活性构象,即使在没有光的情况下也能隔离 COP1 和 SPA1 的活性,从而促进关键光形态建成基因转录的增加。
蓝光诱导的隐花色素磷酸化似乎也对调节其活性很重要,对于 cry2 来说,促进其降解。光调节激酶参与隐花色素的磷酸化,这一过程似乎对维持其 C 端的活性构象很重要(见图 16.18)。
隐花色素还可以直接与转录调节因子结合
除了控制转录因子的水平外,隐花色素还可以直接与特定 DNA 结合蛋白结合并调节其活性。对于成花过程而言,cry2 已被证明可以直接与 bHLH 转录因子结合,例如 Cry-Interacting bHLH1 (CIB1)。CIB1 通过与 FLOWERING LOCUS T (FT) 启动子结合来调节花的起始。 FT是一种移动转录调节因子,它从叶子迁移到顶端分生组织并激活花分生组织身份基因转录(见第 20 章)。过表达 CIB1 的植物比野生型植物开花更早。同样,cry1 已被证明可以调节大豆芽中其他移动因子的光依赖性产生。这些移动因子通过维管系统移动到根部,在那里它们刺激结瘤(见第 14 章)。
隐花色素和其他光受体的相互作用
长期以来,人们一直怀疑隐花色素和光敏色素之间存在相互作用,因为已知几种发育过程(例如光形态建成和开花)受光敏色素控制,但 CRY2 基因突变导致这些反应发生改变。我们现在了解到,几种植物光感受器之间存在相互作用。受这些相互作用影响的许多发育过程可分为三类:茎或下胚轴伸长、开花和昼夜节律调节。
茎伸长受到红色和蓝色光感受器的抑制
如前所述,在黑暗中生长的幼苗茎伸长非常迅速,光对茎伸长的抑制是幼苗从土壤表面冒出的关键光形态建成反应(见第 18 章)。虽然光敏色素参与了这种反应,但伸长率降低的作用光谱在蓝色区域也表现出强烈的活性,这无法用光敏色素的吸收特性来解释。事实上,抑制茎伸长的作用光谱中 400 至 500 纳米的蓝色区域与向光性非常相似。
特定的蓝光介导的下胚轴反应可通过它们不同的时间过程与光敏色素介导的反应区分开来。光敏色素介导的伸长率变化可在约 10 到 90 分钟内检测到,具体取决于物种,而蓝光反应的滞后时间小于 1 分钟。对介导蓝光抑制下胚轴伸长的生长率变化的高分辨率分析提供了有关向光性激素、cry1、cry2 和 phyA 之间相互作用的宝贵信息。在滞后 30 秒后,经蓝光处理的野生型拟南芥幼苗在前 30 分钟内伸长率迅速下降,然后几天内生长非常缓慢。
蓝光引起的另一种快速反应是下胚轴细胞膜的去极化,这种去极化先于生长率的抑制(见图 16.15B)。这种膜去极化是由阴离子通道的激活引起的(见第 8 章),阴离子通道的激活促进了氯离子等阴离子的流出。使用阴离子通道阻滞剂 NPPB(5-硝基-2,3-苯丙基氨基苯甲酸)可防止蓝光依赖性膜去极化,并降低蓝光对下胚轴伸长的抑制作用。
对 cry1、cry2、phyA 和 phot1 突变体中相同反应的分析表明,在幼苗去黄化过程中,蓝光对茎伸长的抑制是由 phot1 启动的,cry1 和一定程度上的 cry2 在 30 分钟后调节反应(图 16.19)。蓝光处理的幼苗茎生长速度缓慢主要是由于 cry1 的持续作用,这也是拟南芥 cry1 突变体下胚轴较长(而野生型下胚轴较短)的原因。PhyA 似乎至少在蓝光调节生长的早期阶段发挥作用,因为 phyA 突变体中生长抑制不能正常进行。
光敏色素与隐花色素相互作用以调节开花
在拟南芥中,持续的蓝光或远红光促进开花,红光抑制开花。远红光通过 phyA 起作用,而红光的拮抗作用由 phyB 产生。人们可能认为 cry2 突变体开花会延迟,因为蓝光促进开花。然而,cry2 突变体在连续蓝光或连续红光下与野生型同时开花。只有当两者都存在时才会观察到延迟。因此,cry2 可能通过抑制 phyB 功能来促进蓝光下的开花。 Cry2 显然通过抑制与光敏色素相互作用的 EARLY FLOWERING 3 (elf3) 的活性来抑制 phyB 功能,表明这些信号通路会汇聚。
昼夜节律时钟受光的多个方面调节
如本章前面所述,几种植物过程表现出大致对应于 24 小时或昼夜节律周期的活动振荡。这种内源节律使用振荡器,该振荡器必须与外部环境的每日光暗循环同步。在旨在描述光感受器在此过程中的作用的实验中,将缺乏光敏色素的突变体与携带受昼夜节律钟调控的荧光素酶报告基因的线杂交。当 phyA 突变体在昏暗的红光下生长时,振荡器的速度减慢(即周期长度增加),但在高辐照度的红光下则不会。然而,phyB 突变体仅在高辐照度的红光下表现出计时缺陷。隐花色素 cry1 和 cry2 是蓝光介导的昼夜节律钟调控所必需的。这些研究表明,光敏色素和隐花色素都能调控拟南芥的昼夜节律钟。这种光输入似乎受到基因 EARLY FLOWERING 3 (elf3) 和 TIME FOR COFFEE(TIC) 的调节。elf3 中的突变会在黄昏时停止时钟的振荡,而 TIC 中的突变会在黎明时停止时钟。elf3/tic 双突变体完全失律,这表明 TIC 和 ELF 在节律的不同阶段与时钟的不同组成部分相互作用。
16.8 向光素
Winslow Briggs 及其同事早期尝试过鉴定具有向光性反应缺陷的拟南芥蓝光感光突变体,后来他们进一步扩展了这一尝试,并分离出几种非向光性下胚轴 (nph) 突变体,这些突变体对低强度蓝光的向光性反应受损。随后克隆了 NPH1 基因座,鉴定出向光性的光感受器。编码的蛋白质因其在介导向光性反应中的作用而被命名为向光素,但这些受体还控制几种蓝光反应,这些反应共同发挥作用,以优化光合作用效率并促进植物生长,特别是在弱光条件下。
被子植物含有两个向光素基因,即 PHOT1 和 PHOT2。 PHOT1 是拟南芥中的主要向光性受体,可介导对低和高蓝光通量率的向光性反应。phot2 可介导对高光强度的向光性反应。在拟南芥中,phot1 和 phot2 光受体的功能也有类似的重叠,包括叶绿体运动、气孔开放、叶片运动和叶片伸展。这些过程与向光性相结合,将有效的光捕获和 CO2 吸收整合在一起,以进行光合作用。因此,缺乏向光性突变体的生长受到严重损害,尤其是在低光强度下。
蓝光诱导 FMN 吸收最大值的变化,与构象变化有关
与主要位于细胞核中的隐花色素不同,向光素受体与血浆中膜,它们在其中作为光激活的丝氨酸/苏氨酸激酶发挥作用。图16.20A 展示了拟南芥光敏素 1 的结构域以及在植物或藻类中发现的三种相关蓝光光感受器的结构域:neochrome、ZEITLUPE 和aureochrome。光敏素包含两个感光的LIGHT-OXYGEN-VOLTAGE (LOV) 结构域,LOV1 和LOV2,每个结构域都与一个发色团黄素单核苷酸 (FMN) 结合。光谱研究表明,在黑暗中,一个 FMN 分子与每个 LOV 结构域非共价结合。在蓝光照射下,FMN 分子与光敏性分子中的半胱氨酸残基共价结合,形成半胱氨酸-黄素共价加合物(图 16.20B)。正如我们稍后讨论的那样,该反应会引起蛋白质构象发生重大变化,而这种变化可以通过暗处理来逆转。LOV2 结构域的三维结构类似于闭合的分子手,通过其核心内的非共价相互作用紧紧握住 FMN(图 16.20C)。图 16.20 还显示了在蓝光照射下,黄素辅因子和半胱氨酸残基之间形成共价键。
LOV2 结构域主要负责响应蓝光激活激酶
正如诱变实验所证明的那样,LOV2 结构域对于蓝光诱导的激酶激活和向光性光感受器的自身磷酸化至关重要。突变 phot1 的 LOV1 结构域中保守的半胱氨酸不会影响向光性响应性(图 16.21A 和 B),而 LOV2 中的等效突变会消除响应(图 16.21C)。这些研究和其他研究已经证明了 LOV2 在控制向光性功能方面的重要性。这在一定程度上归因于 LOV2 在向光性分子中的位置,它与称为 Jα 螺旋的蛋白质区域偶联,该区域对于将 LOV2 内的光驱动变化传播到激酶结构域非常重要。 LOV1 的功能仍不甚明了,但该结构域被认为在受体二聚化中发挥作用。
蓝光诱导构象变化,从而“释放”向光素的激酶结构域并导致自身磷酸化
虽然整个向光素分子的三维结构仍然缺乏,但许多遗传、生物化学和生物物理研究已经很好地理解了向光素光开关的工作原理。与隐花色素和光敏色素一样,向光素的 N 端感光区控制活性蛋白质C 端的活性,此区域包含丝氨酸/苏氨酸激酶结构域(见图 16.21A)。在黑暗中,包括 LOV 结构域在内的 N 端区域会“束缚”并抑制激酶结构域的活性(图 16.22)。LOV 结构域吸收蓝色光子会导致初级光化学变化,从而导致激酶结构域的释放和 Jα 螺旋展开激活。C 端激酶结构域的激活会导致多个丝氨酸残基上的受体自身磷酸化。激酶结构域的自身磷酸化是拟南芥中所有向光素介导的反应所必需的。 某种2A 型蛋白磷酸酶介导黑暗条件下向光素的去磷酸化和失活(见图 16.22)。
向光素触发植物运动,从而增强光利用
向光素激酶的激活会触发信号转导事件,从而改变器官或细胞器的方向,以改善光合作用的光利用。这些反应之一是向光性,即向光弯曲,在第 17 章中进行了描述。叶片中叶绿体的细胞内分布也会因对光照的响应而改变。如第 11 章所述,这一特征是适应性的,因为细胞内叶绿体的重分布会调节光吸收并防止光损伤(见图 11.12)。在弱光照下,叶绿体聚集在叶栅细胞的上壁和下壁附近,以最大限度地提高光吸收(图 16.23)。在强光照下,叶绿体移动到与入射光平行的侧壁,以避免过度的光吸收和光损伤。在黑暗中,叶绿体移动到细胞底部,尽管这种定位的生理功能尚不清楚。重分布反应的作用光谱显示了典型的三指精细结构,这是特定蓝光反应的典型特征(见图 16.7)。
拟南芥 phot1 突变体具有正常的回避反应和较差的积累反应。相反,phot2 突变体缺乏回避反应,但保留了相当正常的积累反应。来自 phot1/phot2 双突变体的细胞既缺乏回避反应,也缺乏积累反应。这些结果表明 phot2 在回避反应中起着关键作用,而 phot1 和 phot2 都对积累反应有贡献。研究表明,由于光氧化损伤,phot2 突变体实际上无法在阳光充足的田间条件下存活。
分离叶绿体回避反应受损的拟南芥突变体,鉴定出一种新的 F- 肌动蛋白结合蛋白CHLOROPLAST UNUSUAL POSITIONING1 (CHUP1),这与早期研究表明叶绿体运动通过细胞骨架的变化而发生一致。CHUP1 定位于叶绿体被膜,在叶绿体定位和运动中发挥作用。图 16.24 显示了拟南芥叶绿体运动模型。 phot1 和 phot2 均介导积累反应,并位于质膜上。介导回避反应的 phot2 也位于叶绿体膜上。在阳光充足的情况下,CHUP1 似乎通过蛋白质相互作用锚定在质膜上,并与叶绿体膜结合。CHUP1 募集 G-肌动蛋白和肌动蛋白聚合蛋白来延伸现有的 F-肌动蛋白丝(见图 1.32)。CHUP1 和叶绿体由插入的 G-肌动蛋白推动,产生叶绿体运动的动力。
蓝光通过激活质膜H+ATP酶启动气孔开放
气孔光生理学和与水和光合作用相关的感觉转导已在第 6 章和第 8 章中介绍,并在第 15 章描述的应激反应中再次讨论。对 phot1/phot2 双突变体的研究表明,向光素是气孔开放的主要蓝光光感受器。已经确定了向光素刺激气孔开放的感觉转导过程中的几个关键步骤。特别是,保卫细胞质子泵 H+-ATPase 在调节气孔运动中起着核心作用(图 16.25)。激活的 H+-ATPase 跨膜运输 H+,增加内部负电位,通过电压门控内向整流 K+ 通道驱动 K+ 吸收。K+ 的积累促进水流入保卫细胞,导致膨压增加和气孔开放。H+-ATPase 的 C 端具有调节酶活性的自抑制域。如果用蛋白酶实验性地去除这个自抑制域,H+-ATPase 就会不可逆地被激活。C 端的自抑制域被认为通过阻断其催化位点来降低酶的活性。相反,真菌毒素 fusicoccin 似乎通过将自抑制域移离催化位点来激活酶。
在蓝光照射下,H+-ATPase 显示 ATP 的 Km 较低,Vmax 较高,表明蓝光激活了 H+-ATPase。酶的激活涉及 H+-ATPase C 末端区域的丝氨酸和苏氨酸残基的磷酸化。蛋白激酶抑制剂可能会阻断 H+-ATPase 的磷酸化,从而阻止蓝光刺激的质子泵送和气孔打开。与梭孢菌素一样,C 末端的磷酸化似乎也会将自抑制域从酶的催化位点移开。
一种调节性 14-3-3 蛋白(见第 8 章)与保卫细胞 H+-AT Pase 的磷酸化 C 末端结合,但不与未磷酸化的 C 末端结合(见图 16.25)。相同的 14-3-3 同工型在梭孢菌素和蓝光处理下都能与保卫细胞的H+ATP酶结合。14-3-3蛋白与H+ATP酶的解离依赖于去磷酸化。
然而,向光素不会直接磷酸化 H+-ATPase。参与磷酸化 H+-ATPase 的激酶尚未确定。然而,向光素在保卫细胞质膜上激发后的早期信号转导事件已被确定,如图 16.26 所示。膜相关的保卫细胞特异性蛋白激酶称为BLUE LIGHT SIGNALING 1 (BLUS1),被 phot1 和 phot2 冗余地磷酸化。缺乏 BLUS1 的拟南芥突变体没有表现出蓝光诱导的气孔开放,但其他向光性激素反应没有受损,包括向光性和叶绿体重新定位。这种磷酸化事件对于启动早期转导事件至关重要,这些事件最终导致 H+-ATPase 的磷酸化和活化。
来自 BLUS1 的信号汇聚在调节 H+-ATPase 活化的蛋白磷酸酶 1 (PP1) 复合物上。PP1 是一种丝氨酸/苏氨酸蛋白磷酸酶,由催化蛋白磷酸酶 1c 亚基和调节亚基 PRSL1 ((PP1 REGULATORY SUBUNIT2-LIKE PROTEIN1) 组成,PRSL1可调节催化活性、亚细胞定位和底物特异性。PP1 通过向光性激素和质膜 H+-ATPase 之间的蓝光信号传导正向调节气孔开放。
蛋白激酶CONVERGENCE OF BLUE LIGHT AND CO2 1 (CBC1) 也由光介导的磷酸化激活。CBC1 及其同源物 CBC2 在蓝光下发生磷酸化,通过抑制 S 型阴离子通道促进气孔开放。由于 CBC 在低 CO2 浓度下磷酸化时也会促进气孔开放,因此它们被视为保卫细胞中光和 CO2 反应的整合者。
16.9 对紫外线的反应
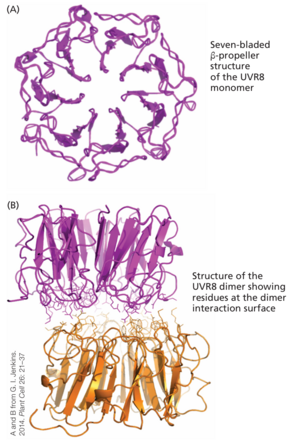
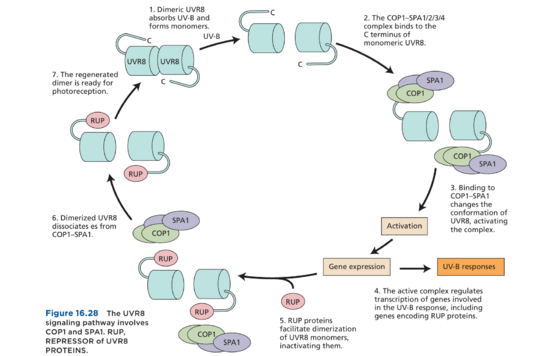
除了细胞毒性作用外,UV-B 辐射还能引发多种光形态建成反应,其中一些列于表 16.4 中。UV-B 水平适度增加可增强“喜阳”植物的 differential growth,并已被证明能促进杨树的芽形成。负责 UV-B 诱导发育反应的光感受器 UVR8 是一种七叶 β-螺旋桨蛋白,在没有 UV-B 的情况下会形成功能上无活性的同型二聚体(图 16.27)。与光敏色素、隐花色素和向光素不同,UVR8 缺乏辅基发色团。UVR8 的两个相同亚基在二聚体中通过色氨酸和附近的精氨酸之间形成的盐桥网络连接。色氨酸作为初级UV-B受体。
吸收 UV-B 光子后,色氨酸会发生结构变化,从而破坏盐桥,导致两个功能活性单体解离。然后单体与 COP1-SPA 复合物相互作用以激活基因表达,如图 16.28 所示。因此,尽管 COP1–SPA 充当负调节剂,靶向转录因子以在光敏色素和隐花色素响应期间降解(见图 16.14 和 16.18),但 COP1–SPA 充当 UV-B 信号传导期间的正调节剂,通过与细胞核中 UVR8 的 C 末端区域相互作用。UVR8–COP1–SPA 复合物随后激活光形态建成转录因子的转录,以控制 UV-B 诱导的许多基因的表达。这包括 UVR8 蛋白的抑制因子,它们介导无活性 UVR8 二聚体的重新结合以重置系统。