乙酰胆碱受体
15.1 简介
乙酰胆碱 (ACh) 由胆碱能神经元作为神经递质和几种非神经元细胞合成、储存和释放。它参与中枢神经系统 (CNS) 和周围神经系统 (PNS) 的突触传递,以及调节多种细胞活动的非神经元胆碱能系统。
ACh 通过两种不同类型的受体起作用:代谢型毒蕈碱受体和离子型烟碱受体 (nAChR)。自从 1905 年兰利在施用尼古丁后在横纹肌表面检测到一种受体物质以来,nAChR 一直是建立受体功能基础的关键人物。自从克劳德·伯纳德研究了中美洲箭毒蛙箭毒的作用以来,它也一直受到关注。肌肉 nAChR 是第一个被识别和纯化的神经递质门控离子通道,也是第一个被生化和电生理学表征的神经递质门控离子通道。
nAChR 属于五聚体配体门控离子通道的 Cys-loop 受体家族。它充当将 ACh 发出的化学信号转换为由离子通过孔隙的通量发出的电信号的转换器。因此,nAChR 参与化学突触,是重要生理过程的关键参与者。
在脊椎动物中,nAChRs 包括一类 ACh 激活的阳离子通道在神经元和非神经元细胞中表达。nAChR 与多种病理状况有关,包括神经肌肉、神经系统、神经退行性和炎症性疾病。nAChR 的结构和功能多样性以及它们在神经系统中的主要调节作用引起了人们对其作为多种疾病治疗靶点的兴趣,并激发了选择性配体和发现药物计划的发展。
15.2 亚基多样性和细胞分布
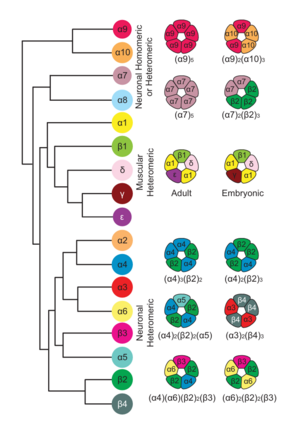
在脊椎动物中,有 17 种不同的 nAChR 亚基,它们结合在一起产生各种具有不同药理和生物物理特性、生理作用和定位的五聚体受体(图 15.1)
nAChR 亚基有两种类型:α 型,其激动剂结合位点含有保守的二硫键;和非 α 型。五聚体排列可以是同聚体(全部为 α 亚基)或异聚体,需要 至少一个α 亚基才能形成 ACh 结合位点。
亚基已分为肌肉型(α1+β1+δ+ε+γ)和神经元型(α2–α8、α9、α10+β2–β4),尽管神经元型亚基也在其他细胞中表达。控制功能性 nAChR 组合组装的规则大部分未知。虽然一些亚基可以与其他众多(尽管是特异性的)亚基结合,但其他亚基只能形成具有有限子集的功能性受体。
哺乳动物肌肉 nAChR 存在于两种发育调节的同工型中。胚胎肌肉 nAChR 由两个 α1、一个 β、一个 δ 和一个γ 亚基组成[(α1)2βγδ)]。在成年肌肉中,γ 亚基被 ε 亚基取代,产生具有 (α1)2βεδ 组成的成年 nAChR,它们表现出不同的电导和通道动力学。
受体携带两个位于 α/γ 或 ε 和 α/δ 界面的激动剂结合位点。肌肉型 nAChR 在电鱼和电鲻鱼的电器官中密度较高,在该领域极具价值。
在自主神经节中,α3 亚基是主要的 α 亚基,α3β4* 是主要的神经节型 nAChR。它们表现出不同的化学计量,(α3β4)2α3 和 (α3β4)2β4,或与其他亚基结合形成 α3β4α5 和 α3β4β2 受体。背根神经节中存在几种 nAChR。
α4 和 β2 亚基可以以两种不同的化学计量 (α4β2)2α4 组装,在 α4/β2 界面处携带两个 ACh 结合位点,在 α4/α4 处携带第三个 ACh 结合位点,从而降低激动剂敏感性,或 (α4β2)2β2,具有两个 ACh 结合位点。后一种化学计量对 ACh 和尼古丁的亲和力大约高出 100 倍,单通道电导率和钙通透性较低,并且其表达被尼古丁选择性上调 (Moroni 等人,2006)。这两个亚基也可以与其他神经元亚基组装。
α7 是该家族的同源成员,具有五个相同的结合位点,尽管仅占据一个就足以激活(Andersen 等人,2013 年)。它具有高钙通透性和极快的脱敏作用。α7 还可以与 β2 组装,异源 α7β2 nAChR 存在于人脑的特定区域。功能性α7β2 nAChR 可以由一个、两个或三个 β2 亚基形成,需要在 α7/α7 界面处有一个功能性结合位点。
α8 是禽类组织所特有的,在非洲爪蟾卵母细胞中表达时可以形成同源受体。
α9 可以在体外形成同源 nAChR,而鸡的 α10 可以形成同源受体,但哺乳动物不能。毛细胞 nAChR 具有化学计量 (α9)2(α10)3 和非典型药理学特征。
除了这些主要的 nAChR 外,还有其他天然亚型具有更复杂的组成。α5 亚基与 α4 和 β2 或 α3 和 β4 亚基组装时形成功能通道。α6 亚基以不同的排列方式与 β2 和 β3 或 α4、β2 和 β3 亚基结合。
新型 nAChR 亚型的鉴定、它们在天然组织中的功能作用和功能化学计量以及选择性配体的发现引起了人们的强烈兴趣。
15.3 生理作用
由于 nAChR 的广泛分布和亚型种类繁多,因此 nAChR 参与了 PNS、CNS 和非神经元细胞中的许多生理过程。
肌肉 nAChR 起着关键作用在神经肌肉传递中的作用。从运动神经元末端释放的 ACh 与突触后肌肉膜上的 nAChR 相互作用,导致离子通道打开,允许阳离子(主要是 Na+)流入。这种兴奋性突触后电流引起局部去极化(终板电位),从而触发电压依赖性钠通道的开放,产生传播动作电位,该电位扩散到整个肌肉细胞并引发肌肉收缩。由于乙酰胆碱酯酶 (AChE) 和扩散作用迅速将 ACh 从突触间隙中移除,因此反应有限。神经节 nAChR 在外周自主神经系统中起着关键作用,包括交感神经、副交感神经和肠道系统,并参与非自主生理过程。它们也存在于背根神经节中,在那里它们作为调节伤害性信号的治疗靶点具有重要意义。
神经元 nAChR 存在于突触后位置,在那里它们介导快速反应;突触前位置,在那里它们调节不同神经递质的释放;突触外位置,在那里它们通过与远处释放的ACh 相互作用参与体积传输。它们主要通过改变神经元兴奋性、改变神经递质释放和协调神经元群的放电在中枢神经系统中发挥调节作用。神经元 nAChR 介导突触可塑性;有助于认知过程和记忆;调节行为;并参与神经保护、神经元生成和尼古丁的奖励激励作用(Picciotto 等人,2012 年)。
神经元 nAChR 亚型种类繁多。其中,α4β2 是大脑多种功能最重要的调节受体之一,包括认知、情绪、意识、奖赏和伤害感受。α7 和 α4β2 是中枢神经系统中最丰富的 nAChR 之一。它在海马、皮质和皮质下边缘区域高度表达,参与认知、感觉处理信息、注意力、工作记忆和奖赏通路。α9α10 nAChR 在内耳生理学中起着根本性的作用,介导从脑干传出的橄榄耳蜗纤维与听觉感觉上皮的毛细胞之间的突触传递(Elgoyhen 等人,1994 年)。神经元 nAChR 也在非神经元细胞中表达,例如神经胶质细胞、免疫细胞、角质形成细胞以及内皮细胞和上皮细胞 (Wessler and Kirkpatrick, 2008)。
非神经元 nAChR 对迷走神经末梢或细胞释放的 ACh 作出反应,并以自分泌、旁分泌或近分泌的方式控制细胞增殖、粘附、迁移、分泌、存活和凋亡等过程。nAChR 存在于免疫系统中,它们调节炎症过程;特别是,α7 是胆碱能抗炎通路的关键参与者,该通路是迷走神经传出纤维和先天免疫系统之间的纽带。
nAChR 在无脊椎动物中也发挥着关键作用。昆虫具有几种 nAChR 亚型,它们参与神经系统中的兴奋性传递,而兴奋性传递是生理过程所必需的,包括嗅觉学习和记忆形成。它们是农用化学工业的目标,并导致了新烟碱等新型杀虫剂的开发。
线虫 nAChR 作为抗寄生虫药物的目标具有临床重要性;它们在自由生活的线虫秀丽隐杆线虫中得到了广泛的研究。奇怪的是,秀丽隐杆线虫拥有在单一物种中发现的最大的 nAChR 亚基家族和多种多样的受体,包括阴离子选择性 nAChR。nAChR 参与许多生理过程。在线虫肌肉中,存在一种异源左旋咪唑敏感的nAChR,它参与神经肌肉传递和蠕虫运动,是抗寄生虫药物的主要靶标。
15.4 结构组织
所有 nAChR 亚基共享一个基本支架,该支架由一个大的 N 端胞外结构域(约 200 个氨基酸)组成,由十条 β 链组成;三个跨膜结构域,具有由短环(M1-M3)隔开的 α 螺旋结构;一个大小可变的胞质环和一个携带两个螺旋区域(MX 和 MA)的氨基酸序列;以及第四个跨膜结构域(M4),具有相对较短的胞外 C 端。
nAChRs(包括肌肉、α3β4、α4β2 和 α7)的高分辨率 3D 结构已得到解决(Unwin,2005;Morales-Perez 等人,2016;Gharpure 等人,2019;Noviello 等人,2021;Zhao 等人,2021)。五个亚基围绕中心轴伪对称排列,形成具有清晰结构模块的受体:(i)N 端胞外结构域(ECD),携带正交结合位点;(ii)跨膜结构域(TMD),由每个亚基的四个 α 螺旋组成nit (M1–M4) 并包含离子孔;
和 (iii) 细胞内结构域 (ICD)。ECD 和 TMD 之间有一个结构过渡区,称为耦合区,这对于激动剂结合和通道开放之间的功能联系至关重要 (Bouzat 等人,2004)(图 15.2)。
15.4.1 细胞外结构域 (ECD) 和神经递质结合位点
ECD 由来自每个亚基的十条 β 链 (β1–β10) 的核心组成,形成 β 夹层结构。位于底部与 TMD 紧密接触的是 β6 和
β7 链之间的接头,它形成了高度保守的 Cys 环,该家族由此得名。
ECD 携带正交配体结合位点,距离 ECD-TMD 界面约 30 Å。每个结合位点位于相邻亚基之间的界面处;其中一个面称为主面 (+),由 α 型亚基提供,另一个面称为互补面 (-),由 α 或非 α 亚基提供。主面由环 A、环 B 和环 C 形成,它们构成一个芳香族残基 (色氨酸和酪氨酸残基) 巢,可以与 ACh 或其他配体的带正电的铵基团发生阳离子-π 相互作用。涉及环 B 中的色氨酸残基 (肌肉 nAChR 中的 W149) 和配体的带正电基团的阳离子-π 相互作用是大多数 nAChR 的一个关键特征。环 C 的尖端包含相邻半胱氨酸之间的二硫键,这是定义 α 型亚基的特征。互补面由来自三个 β 链不同部分的环 D–F 组成;由于与不同配体的不同相互作用,它与药物选择性相关(图 15.2)。除了阳离子-π 相互作用外,结合位点处配体的稳定力还包括偶极-阳离子、氢和范德华相互作用。
15.4.2 跨膜结构域 (TMD) 和离子渗透途径
TMD 由每个亚基的四个 α 螺旋组成(M1–M4)。该区域带有位于螺旋束中心对称轴上的离子通道孔,并以 M2 α 螺旋为界。15 个 α 螺旋(M1、M3 和 M4)的外环保护通道免受脂质的影响。脂质通过构象选择和动力学机制影响 nAChR 功能。M4 是与脂质域接触最外层的,可作为脂质传感器;脂质中暴露于该域的氨基酸的突变会改变通道功能。
由 M2 α-螺旋包围的离子孔呈现分层组织,其中通常同源残基的环沿 z 轴排列。在静止/关闭状态下,孔在膜中部被疏水性氨基酸环(从 M2 的细胞内端开始的第 16、9 和 13 位)最大程度地收缩。孔中最窄的点不能让水合阳离子通过;它对应于构成通道门的保守亮氨酸残基环 (L9)。位于 M2 细胞外端和细胞内端的三环带负电的残基提供了有利的静电环境,使阳离子能够通过孔隙转运。在细胞内端,选择性过滤器对电导率和离子选择性的影响最为显著 (Taly 等人,2009)。因此,在通过 nAChR 的渗透途径中,水合阳离子在负静电表面电位的帮助下进入细胞外前庭,并在孔隙上半部分遇到处于闭孔状态的疏水性收缩。激活后,疏水门打开并水合,允许通过细胞外跨膜细胞内偶联区
图 15.2
nAChR 的结构组织。α4β2 受体(蛋白质数据库代码:5KXI)的侧视图,显示功能域(Morales-Perez 等人,2016 年)。图中显示了 ECD 中两个相邻亚基之间界面处的 ACh 结合位点的示意图,其中显示了关键的芳香族残基和保守的二硫键,以及 TMD 的顶视图。
孔。然后,水合阳离子通过由富含极性和酸性氨基酸的 MX 和 MA α 螺旋形成的门户离开。细胞外前庭和细胞内门户都为微调电导和阳离子选择性提供了孔外的决定因素(Rahman 等人,2020 年)。
nAChR 是一种非选择性阳离子通道,可渗透 Na+、K+、Cs+ 和二价阳离子 Ca2+ 和 Mg2+。神经元型受体的 Ca2+ 渗透性 (P) 高于肌肉型。在神经元 nAChR 中,α7 中的 PCa2+/PNa+ 比率范围为 ∼1.1 至 >10。 15.4.3 细胞内结构域 (ICD)
大型 M3–M4 环是 nAChR 中保守性最低的区域,并且在序列和长度(约 80 至 260 个氨基酸)。它由一个短的后 M3 环、一个与膜平面平行的两亲螺旋 (MX)、一个保守性较差且无序的胞质环和 MA 螺旋组成。ICD 在功能表达、细胞运输和膜定位中发挥作用,并影响门控和传导。ICD 包含丝氨酸/苏氨酸和酪氨酸磷酸化的位点,以及与细胞骨架蛋白和信号通路调节剂(如激酶、G 蛋白和 Ca2+ 传感器)相互作用的位点。因此,它是调节、定位、上调和触发代谢反应的关键域。
15.4.4 激活的结构变化
通过分离结合位点和通道门的 50 Å 进行通信对于 nAChR 功能至关重要。广泛的诱变结合电生理学研究揭示了受体功能所需的关键氨基酸和相互作用,而对不同构象状态下的 3D 结构的比较则提供了对潜在结构变化的洞察。生物反应始于激动剂与正构位点的结合,这会导致环 C 从开放构象转变为封闭构象,从而覆盖激动剂。激动剂结合会导致整体上更紧凑的 ECD。ECD 处的运动会引起偶联区域中静电和疏水相互作用的重组,其中包括来自 ECD 的 β1–β2、Cys 和 β8–β9 环,以及来自 TMD 的 M2–M3 环、前 M1 区域和外周 C 末端。耦合区域的变化转化为 M2 的运动,导致 M2 上半部分的残基远离通道轴,打开疏水门并允许阳离子通过孔。在脱敏过程中,TMD 再次采用闭孔构象,尽管与静息状态的构象不同(Noviello 等人,2021 年;Zhao 等人,2021 年)。
15.5 分子功能和通道门控
nAChR 充当分子机器,其设计已调整为可作为对 ACh 作出反应的近乎完美的开关。基于 Monod–Wyman–Changeux 模型,功能响应可以解释为从几个离散构象状态中选择:关闭、打开和脱敏(图 15.3a)(参见第 I 卷,第 10 章)。在没有激动剂的情况下,受体主要处于
闭合的静息状态。激动剂结合触发通道开放,导致瞬时
传导状态,这一过程称为门控。通过孔的阳离子净流入使细胞膜去极化,从而增加神经元兴奋性并增加钙离子进入。通道保持开放几毫秒,并可产生重复的
关闭-打开循环。长时间暴露或高神经递质
图 15.3
nAChR 激活。(a)nAChR 激活的最小模型,显示三种主要构象状态:C,关闭;O,打开;D,脱敏。(b)从成人肌肉 nAChR 的全细胞记录中由 300 µM ACh 引起的典型宏观电流。 (c) 表达成年肌肉 nAChR (顶部)和 α7 (底部)的细胞在两种不同的 ACh 浓度下的单通道活动。对于肌肉 nAChR,每个簇包括单个 nAChR 的结合和门控活动,该 nAChR 采取关闭(C)或打开(O)状态。开放簇之间的静默期是贴片中的 nAChR 脱敏的时期(D)。随着 ACh 浓度的增加,通道开放的概率增加,这可以通过簇内关闭持续时间的减少来证明。相反,α7 通道电流的时间模式没有显示任何浓度依赖性,通道活动主要表现为短暂(~0.1-0.3 毫秒)的孤立事件。通道开放显示为向上偏转。膜电位:-70 mV。乙酰胆碱受体 231
浓度会导致脱敏状态,这是一种更稳定的非传导状态,具有
高激动剂亲和力。
尽管 nAChR 至少存在三种主要构象状态,但激活机制很复杂,因为每种主要类型都有多种状态,并且在关闭和打开以及打开和脱敏状态之间都有中间状态。特别是,
已经描述了配体结合受体的中间预激活关闭状态
(称为翻转或启动状态),激动剂将受体构象从关闭状态改变为这些预激活状态的能力与其功效有关(Lape 等人,
2008;Mukhtasimova 等人,2009)。每个主要类别中的构象状态数量
和状态之间的转换速率定义了通道动力学,这对于每个
nAChR 亚型都是唯一的。突变引起的动力学变化会导致通道病。
激动剂的效力和功效经典方法是根据从全细胞记录中获得的宏观峰值电流与激动剂浓度之间的关系来确定的。从宏观电流来看,激动剂存在下的衰减率已被用作脱敏率的估计值,电流增加率则被用作激活率的估计值,尽管这些相关性可能不准确,这取决于系统和受体动力学(图 15.3b)。激动剂结合的开放 nAChR 通道可以通过激动剂的解离转变为非传导状态,这一过程称为失活。大多数 nAChR 表现出快速的激活和失活动力学,这使它们能够在最短的时间间隔后保持激活状态并遵循高频动作电位序列。活性受体也可以转变为脱敏状态;脱敏的开始和恢复速度对于每种 nAChR 亚型都是特定的,并且可以通过细胞事件(例如磷酸化)进行调节。脱敏可能与控制特定受体亚型和情况的突触效力有关。在 nAChR 中表现出最快脱敏的 α7 中,它决定了反应的终止,并可能充当过滤器以避免由于钙内流而导致的细胞毒性;在肌肉 nAChR 中,脱敏在病理条件下可能很重要。脱敏在中枢神经系统也很重要,因为长期使用低浓度激动剂可能会促进脱敏而不会产生显着的激活(图 15.3a 中的 C 到 D 转换)。使用高分辨率单通道数据进行动力学分析是确定正常和病理状态下 nAChR 激活机制基础的关键(Mukhtasimova 等人,2009 年;Sine 等人,1995 年;Grosman 等人,2000 年)。它允许生成描述激活机制的门控模型;它可以从门控步骤中剖析结合;并且它提供有关激动剂亲和力、激活所需的结合激动剂分子数量、将结合事件与通道开放分开的构象变化数量以及每个激活步骤的速率常数的信息(参见第 I 卷第 10 章)。突变 nAChR 的单通道记录提供了有关受体上氨基酸如何参与激活过程的每个步骤以及底层结构基础的详细信息。骨骼肌中的 nAChR 在膜片钳应用史上占有特殊地位,因为它是第一个以亚毫秒分辨率记录单位电流的离子通道(Colquhoun 和 Sakmann,1981),也是第一个进行详细动力学分析的 nAChR。
肌肉 nAChR 的激活发生在来自同一受体分子的几次打开和关闭的序列中,因为脱敏时间与关闭和重新打开所需的时间相比很长。这些激活事件(簇)涉及与结合/门控转换相对应的关闭和打开,并由与脱敏状态相对应的长时间关闭分隔开。随着 ACh 浓度的增加,由于开放概率的增加,簇内封闭的持续时间减少,从而导致浓度依赖性激活模式(图 15.3c)。α7 表现出不同的行为,其激活模式主要表现为孤立的短暂开放,几乎没有激动剂浓度依赖性。这是因为脱敏开始的时间接近开放通道的寿命,而脱敏控制着通道关闭的速率。因此,每种 nAChR 亚型都有自己的动力学特征,可能经过调整以响应其生理作用。
过去几十年来,将 nAChR 视为单纯的离子型受体的传统观点受到了挑战。nAChR 还会激活细胞信号通路并影响更广泛的过程。通过钙诱导钙释放机制,细胞内 Ca2+ 通过通道短暂增加,可转化为持续、广泛的现象,即钙从细胞内库中释放,这一过程涉及 IP3 和
ryanodine 受体。该过程已在 α7 中得到广泛研究,并与生理作用有关,包括神经突生长 (Dajas-Bailador 和 Wonnacott,2004)。
不同的细胞内信号通路,如 JAK2/STAT3、PI3K/Akt 和 MAPK/
ERK,可在受体激活时触发,这取决于主要通过 ICD 介导的细胞特异性蛋白质-受体相互作用。因此,nAChR 作为双重代谢型/离子型受体发挥作用的能力延长了瞬时电反应,从而产生了涉及多个细胞内事件的更持久的反应。
15.6 药理学和药物调节
随着新的潜在治疗药物的出现,烟碱类药典不断增加尤其适用于各种神经系统和神经退行性疾病 (Wonnacott, 2014)。
15.6.1 正构配体
nAChR 可由大量化合物激活,从天然产物到充当完全或部分激动剂的合成化合物。nAChR 激动剂的核心元素是带电或可带电的氮原子;最简单的季铵阳离子四甲基铵可以激活 nAChR。
除了直链 ACh 衍生物激动剂(如胆碱和琥珀胆碱)外,多种杂环生物碱也是激动剂。从烟草植物 Nicotiana tabacum 的叶子中提取的生物碱 (-)-尼古丁是原型激动剂,是确定该家族药理学分类的象征。它可激活除 α9* 以外的所有 nAChR 亚型,并对 (α4β2)2β2 表现出极高的亲和力和功效。地棘蛙素是一种来自亚马逊青蛙皮肤提取物的双环生物碱,是最有效的非选择性激动剂之一;烟草生物碱盐酸阿那巴辛对 α7 和 α4β2 具有选择性,甚至咖啡因也是一种天然激动剂。(-)-金雀花碱是一种存在于豆科植物中的三环喹诺里西啶生物碱,对 α4β2 具有高亲和力,已成为戒烟和抗抑郁的先导化合物。伐尼克兰是一种用于戒烟的临床药物,是一种金雀花碱同类物,可作为 α4β2 和 α6α2β3* 受体的部分激动剂。具有不同 nAChR 选择性的合成化合物有很多; 5-碘-A-85380 和 PNU-282987 分别被广泛用于选择性激活 β2* 和 α7。
拮抗剂已被用作确定 nAChR 反应的工具。其中一些在临床上用作肌肉阻滞剂。d-筒箭毒碱与肌肉 nAChR 具有高亲和力结合,并已用于手术或机械通气期间的骨骼肌松弛。
有一系列毒素专门与 nAChR 相互作用并显示亚型选择性。从台湾带状金环蛇 Bungarus multicinctus 的毒液中分离出的 α-银环蛇毒素 (α-BTX) 对肌肉和 α7 nAChR 表现出伪不可逆结合。 nAChR 分为 α-BTX 敏感型(包括 α7 和肌肉 nAChR,以及显示可逆结合的 α9 受体)和 α-BTX 不敏感型(包括所有神经元 nAChR)。α-芋螺毒素是一系列由海洋芋螺产生的肽(12-19 个氨基酸),可作为 nAChR 的强效拮抗剂。由于它们对 nAChR 亚型具有选择性,因此它们是识别亚型的有用工具,也是临床治疗药物的线索(Wonnacott,2014 年)。
15.6.2 变构配体
nAChR 反应可以通过与不同于正构位点的位点(称为变构位点)结合的不同分子来调节。这些变构配体改变了构象状态之间转换的能量屏障,因此增强或抑制了受体功能。变构配体是有前途的治疗工具,因为它们保持了内源性激活的时间空间特征,由于正构位点比变构位点更保守,因此它们具有高选择性,并且它们允许高度的结构多样性和最终效果。从功能角度来看,变构配体分为 (i) 负变构调节剂 (NAM);(ii) 正变构调节剂 (PAM);(iii) 沉默变构调节剂 (SAM),它们对正构激动剂反应没有影响,但会阻断变构调节;(iv) 变构激动剂,它们从非正构位点激活受体(图 15.4)。单通道记录对于建立药物调节机制至关重要(图 15.5)。
NAM 通过不同的分子机制和位点抑制受体功能。它们可能
将 nAChR 稳定在非传导状态或增加脱敏的速度和程度。抑制也可能通过开放通道阻滞发生,其中药物物理阻断离子渗透。作用于不同 nAChR 亚型的 NAM 包括内源性化合物,例如类固醇,以及许多其他具有其他主要靶点的化合物,例如麻醉剂、钙阻滞剂、抗精神病药和抗抑郁药。抑制剂可以具有治疗益处。例如,奎尼丁和氟西汀在缩短慢通道先天性肌无力综合征中肌肉 nAChR 的延长通道开放方面具有治疗效果;六甲铵溴化物是一种开放通道阻滞剂,已被用作神经节阻滞剂来治疗高血压和其他疾病;α4β2 的 NAM 具有抗抑郁作用。
环状(围绕受体周边)和非环状脂质域(跨膜螺旋和亚基之间)也是各种疏水性、内源性和外源性化合物的位点,这些化合物通过影响脂质环境ent
抑制功能。
PAM 通过改变静息/开放和开放/脱敏状态之间的能量屏障来增强激动剂引起的反应,并可增强激动剂的效力和/或功效。 PAM 没有常见的化学支架; PAM 包含各种各样的结构,从钙和锌到复杂结构,包括内源性化合物(例如 α4β2 的雌二醇)、天然化合物(例如 α7 的黄酮类化合物)和合成化合物(Chatzidaki 和 Millar,2015 年)。
图 15.5
PAM 在人类 α7 的单通道和宏观电流水平上的作用。在没有(黑色轨迹)或存在 I 型 PAM(2 mM 5-HI,蓝色轨迹)的情况下,50 µM ACh 诱发的人类 α7 宏观电流,这只会增加峰值电流,或存在 II 型 PAM(1 µM PNU-120596,红色轨迹),这也会降低脱敏。右侧显示了在没有和存在 2 mM 5-HI 或 1 µM PNU-120596 的情况下,100 µM ACh 激活的人类 α7 的单通道记录轨迹。开口显示为向上的偏转。膜电位:-70 mV。
图 15.4
变构配体调节方案。变构配体可以激活 nAChR,或者可以增加(PAM)或减少(NAM)ACh 引起的反应。
α7 PAM 正在成为治疗神经系统疾病(如精神分裂症)、神经退行性疾病(如阿尔茨海默病和帕金森病)和炎症性疾病的新型疗法。通过增强 α7 活性,PAM 发挥促认知、神经保护和抗炎作用。根据它们对宏观电流的影响,它们被分为 I 型或 II 型。I 型 PAM 增强激动剂诱导的峰值电流而不会显着影响电流衰减,II 型 PAM 减缓脱敏的发生并重新激活脱敏受体。单通道水平的分析表明,PAM 可延长短暂的 α7 开放通道寿命,并在由连续开放组成的事件中诱导激活,这些开放可持续几毫秒到几秒,此持续时间与 PAM 的功效有关(图 15.5)。α4β2 有望成为认知障碍的靶点。在宏观电流水平上,α4β2 PAM 可产生激动剂浓度-反应关系的左移,而不会改变最大反应,而其他 PAM 则可提高功效。一些 PAM 可以对两种不同的化学计量表现出选择性。例如,desformylflustrabromine(一种海洋生物的天然产物)、NS 9283(在疼痛模型中显示出体内功效)和 Zn2+ 对 (α4β2)2α4 表现出更高的选择性,而内源性类固醇
17β-雌二醇对 (α4β2)2β2 表现出更高的选择性。
15.7 通道病和疾病
15.7.1 肌肉和神经节疾病
先天性肌无力综合征 (CMS) 代表一组异质性疾病,其中神经肌肉传递因突触前、突触或突触后蛋白(包括 nAChR)的遗传缺陷而受损(Engel 等人,2015 年)。nAChR 突变会降低表达或改变通道动力学,从而产生这种通道病。
由动力学变化介导的 CMS 分为慢通道 CMS 和快通道 CMS,慢通道 CMS 由于获得功能突变而表现出延长的 ACh 介导的突触后反应,而快通道 CMS 由于功能丧失突变而表现出反应减弱。慢通道 CMS 中的突变会增加激动剂亲和力、在没有激动剂的情况下打开的概率、打开率和/或降低关闭率;而快通道 CMS 中的突变会削弱打开、增加关闭率和/或降低激动剂亲和力。单通道电流的动力学分析在洞察突变的机制后果以及指导合理治疗方面尤其有效(Sine 等人,1995 年)。nAChR 是自身免疫性疾病的焦点。在重症肌无力中,针对肌肉 nAChR 的 ECD 主要免疫原性区域的自身抗体会减少功能性受体的数量,这与疾病严重程度相关。针对神经节 α3* nAChR 的特异性自身抗体会破坏胆碱能突触传递并导致自主神经衰竭。
15.7.2 神经系统和神经退行性疾病
常染色体显性夜间额叶癫痫 (ADNFLE) 是一种局灶性癫痫。在 ADNFLE 患者中发现了 α4、β2 和 α2 亚基的突变。
精神分裂症伴有海马 nAChR 功能障碍。它与 α7 基因 (CHRNA7) 的多态性以及该基因的部分重复有关,
这导致嵌合基因 CHRFAM7A。其基因产物 dupα7 缺少部分结合位点,并充当 α7 功能的负调节剂。α7 激动剂和 PAM 是治疗精神分裂症的有前途的药物。
nAChR 与其他神经系统疾病有关抑郁症、自闭症谱系障碍、注意力缺陷多动障碍和疼痛等神经疾病,因此,几种 nAChR 被视为潜在的可用药位点。
阿尔茨海默病 (AD) 与 nAChR 之间存在密切联系。AD 伴有早期胆碱能缺陷;nAChR 水平变化,特别是 α7 和 α4β2 表达降低;乙酰胆碱减少;胆碱能合成酶 (CHAT) 活性减弱。β-淀粉样肽 (Aβ) 与 α7 具有高亲和力;它们在皮摩尔浓度下激活 α7,但在患者体内发现的纳摩尔浓度下抑制。
寡聚 Aβ 也充当 α7β2 和 α4β2 nAChR 的 NAM。 α7 和 α4β2 的激动剂和部分激动剂以及 α7 的 PAM 因其促认知和神经保护作用而被纳入早期 AD 阶段的临床检测中 (Dineley 等人,2015)。
在帕金森病 (PD) 中选择性丢失的黑质多巴胺能神经元表达多种亚型的 nAChR。在 PD 患者的基底前脑和皮质中观察到烟碱结合位点的丢失,含有 α7 和 α6 的 nAChR 成为药物开发的目标。
15.7.3 尼古丁依赖
几种 nAChR 亚型与尼古丁成瘾和尼古丁诱导的行为密切相关。α4β2 nAChR 对尼古丁的敏感性最高。在吸烟者和长期接触尼古丁的动物的大脑中观察到 α4β2 nAChRs 的功能性上调,与中脑边缘多巴胺对尼古丁的反应敏感化相结合,这与尼古丁的整体成瘾性有关。在调节尼古丁/烟草强化的大脑区域中表达的其他 nAChR 亚基包括 α7、α6、α5、α4 和 β3,而 α4、α6 和 α5 基因的变异与烟草依赖有关 (Taly 等人,2009)。
15.7.4 癌症和炎症性疾病
非神经元 nAChRs 激活刺激细胞生长和血管生成的细胞信号,并且 nAChR 失调伴随许多癌症。全基因组关联研究表明,遗传变异,特别是 CHRNA3、CHRNA5 和 CHRNB4 中的变异,与肺癌风险增加有关。α7 参与大多数致癌反应,包括肺癌、口腔癌、食道癌、结肠癌和胰腺癌,α9 刺激乳腺癌的发生和发展。
nAChR 调节炎症过程。α7 存在于所有类型的免疫细胞中,并发挥重要的抗炎作用。它还调节小胶质细胞活化,诱导神经保护,与帕金森病、缺氧和缺糖以及全身缺血有关。非神经元 nAChR 参与多种皮肤病和风湿病的发病机制。
15.8 细胞生物学和调控
nAChR 的合成、折叠和组装发生在内质网 (ER) 内,需要信号肽的裂解、二硫键的氧化和一些残基的 N-糖基化。伴侣蛋白起着重要作用,它通过协助亚基呈现正确的折叠构象并消除错误折叠或未组装的亚基来保证严格的质量控制。只有正确组装的五聚体才能通过囊泡离开 ER,囊泡首先到达高尔基体,然后到达质膜。nAChR 伴侣包括 RIC-3(对胆碱酯酶 3 抑制剂具有抗性)、NACHO、淋巴细胞抗原 6 (LY6) 家族的小蛋白和 UBXN2A。尼古丁还参与 nAChR 生物合成和运输的几个步骤。因此,长期接触尼古丁会上调吸烟者原代神经元培养物和大脑中的 nAChR。通过增加表面受体,尼古丁的伴侣活性可能有助于其成瘾性和治疗效果,以及其癌细胞的增殖能力 (Crespi 等人,2018)。
在神经肌肉接头处,nAChR 以高密度聚集在骨骼肌突触后膜连接褶皱的顶部。在神经支配之前,nAChR 均匀分布在膜中。神经通过组合触发肌肉内一系列转录和翻译后调控机制的信号来诱导聚集。Agrin 是一种由神经末梢释放的蛋白质; rapsyn 是一种与 nAChR 相互作用的蛋白质;Musk 是一种肌肉跨膜酪氨酸激酶,它们是神经肌肉接头成熟的关键。成熟伴随着 γ 到 ε 亚基的转录转换。在成人肌肉中,仅在去神经支配后以及在某些 CMS 和肌源性疾病中才发现含有 γ 的 nAChR。
15.9 结论
nAChR 是一种分子机器,其设计已调整为可作为对 ACh 作出反应的近乎完美的开关。电生理记录,特别是单通道记录,结合诱变和细胞表达 h为理解 nAChR 如何对激动剂作出反应、人类疾病的分子基础以及药物调节机制做出了宝贵贡献。
定义构象状态下的高分辨率 3D 结构为受体激活和脱敏提供了结构基础,并成为定义合理药物设计所必需的药物作用位点和机制的一种手段。
