内向整流钾离子通道
9.1 简介
内向整流Inward rectification是指离子通道在任何给定的相反方向驱动力下允许的内向电流大于外向电流的趋势。Bernard首次在 K+ 去极化肌肉中描述了表现出强烈内向整流的钾电流,他使用术语“异常整流“anomalous rectification”来对比它们与在鱿鱼轴突中观察到的“正常”延迟整流的特性。我们现在知道,异常电流背后的通道是内向整流钾 (Kir) 通道家族的成员,内向整流是由细胞内 Mg2+ 和多胺对通道孔的电压依赖性阻断引起的。 Kir 通道表现出一系列内向整流特性,并受包括离子、核苷酸、脂质和蛋白质在内的多种信号调节。Kir 通道能够响应各种细胞内和细胞外信号来调节膜电位,这使它们能够控制各种重要的生理过程。最近通过 X 射线晶体学和单粒子低温电子显微镜 (cryo-EM) 获得的 Kir 通道高分辨率结构为了解离子选择性、配体诱导门控和内向整流的结构基础提供了见解。动物遗传学研究和 Kir 通道功能障碍与一系列人类疾病的联系继续表明这类钾通道在生理学和病理生理学中的重要性。
9.2 生理作用
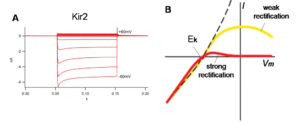
Kir 通道存在于多种细胞类型中,在控制膜兴奋能力和 K+ 稳态方面发挥着核心作用。根据内向整流的程度,它们可分为强(Kir2.x、Kir3.x)、中等(Kir4.x)和弱(Kir1.1 和 Kir6.x)内向整流(图 9.1)。
强内向整流的生物学意义在可兴奋细胞(如心脏细胞和神经元细胞)中表现得最为明显。这些细胞的静息膜电位通常略高于钾平衡电位 (EK),使 Kir 通道能够维持少量外向电流,使膜电位保持在 EK 附近。然而,当细胞兴奋并且其他电压门控 Na+ 或 Ca2+ 通道打开以触发动作电位时,强电压依赖性阻滞或配体诱导的强内向整流器关闭可确保动作电位不会短路。相反,弱内向整流器既能稳定静息电位,又能缩短动作电位,因为它们的活性在去极化膜电位时仍然很高。一个例子是 Kir6.2 和 SUR2A 形成的 ATP 敏感钾 (KATP) 通道。当在缺血条件下在心脏中激活时,KATP 通道els 缩短心脏动作电位的持续时间,保护心脏免受缺血性损伤。
Kir 通道也根据其功能和生理特性分为四类:经典 Kir 通道、G 蛋白偶联 Kir 通道、KATP 通道和 K+ 转运通道(图 9.2)。经典 Kir 通道由 Kir2 亚家族成员形成。它们表现出强大的内向整流,在电位正至 -40 mV 时电流流动很小。Kir2.1 是骨骼肌中的主要同工型。在心房和心室肌细胞中,Kir2.1 与 Kir2.2 或 Kir2.3 结合形成强大的内向整流 IK1 电流。在心脏中,负电压下较高的 K+ 电导率可确保稳定的静息电位,但在去极化电位下,内向整流会导致电导抑制,从而允许通常较长的平台电位,从而确保较长的不应期以避免心律失常(Anumonwo 和 Lopatin 2010)。在血管内皮细胞中,经典的 Kir 通道主要由 Kir2.2 亚基形成,在调节血管张力方面发挥着重要作用。
Kir2.x 通道也在骨骼肌和大脑神经元中表达,它们在那里调节细胞兴奋性。
G 蛋白门控 Kir 通道或 GIRK 通道 (Kir3.x) 是心脏、大脑和内分泌组织中 G 蛋白偶联受体 (GPCR) 激活电流的基础。在 Gαi 或 Gαo 偶联 GPCR 激活后,Gβγ 从异三聚体 G 蛋白中分离出来并直接与 Kir3.x 结合以激活通道。在心房心肌细胞中,乙酰胆碱激活的 K+ 通道 (IKACh) 由 Kir3.1/3.4 的异源组装体产生,在迷走神经释放乙酰胆碱时,GPCR M2 毒蕈碱受体会激活该通道,从而减慢心率 (Anumonwo 和 Lopatin 2010)。由同源 Kir3.2 或 Kir3.1、Kir3.2 和 Kir3.3 的异源体组成的 Kir3.x 通道在脑中也很突出,它们与突触可塑性和药物成瘾的潜在机制有关 (Luscher 和 Slesinger 2010)。在胰腺胰岛中,β 细胞中 Kir3 介导的电流在儿茶酚胺和生长抑素的作用下激活,从而抑制胰岛素分泌 (Jacobson 和 Shyng 2020)。 KATP 通道是成孔 Kir6.x 亚基和调节性磺酰脲受体亚基 (SURx) 的异八聚体复合物 (Nichols 2006)。它们在大多数可兴奋细胞中表达,用于将细胞能量与膜电位偶联。两种 Kir6.x 同工型 (Kir6.1 和 Kir6.2) 和三种主要的 SUR 同工型 (SUR1 和 SUR2 的两种剪接变体,SUR2A 和 SUR2B) 共同组装形成具有不同组织分布、门控特性和功能的 KATP 通道亚型。研究最深入的是胰腺内分泌细胞和神经元中发现的 Kir6.2/SUR1 亚型。在胰腺 β 细胞中,KATP 通道将葡萄糖代谢与胰岛素分泌偶联,对葡萄糖稳态至关重要。在心肌细胞中,Kir6.2/SUR2A 通道最为突出,对保护心脏免受缺血性损伤非常重要。在血管平滑肌和内皮细胞中,由 Kir6.1/SUR2B 形成的 KATP 通道在调节血管张力方面起着关键作用。KATP 通道也存在于骨骼肌中,参与糖原储存和肌肉萎缩感知。图 9.2 基于氨基酸序列比对和结构相似性的 16 个已知人类 Kir 通道的系统发育树。使用多序列和结构比对服务器 PROSMALS3D 生成序列比对,使用选定的 Kir 通道结构作为指南(蛋白质数据库 ID:4KFM、3SYO、3SPI、3JYC 和 6BAA)。使用 ConSurf 计算了反映 Kir 进化关系和距离的系统发育树,并使用 phylogeny.fr 服务器上的 TreeDyn 进行了渲染。通道的功能分类显示在右侧。
K+ 转运通道 (Kir1.x、Kir4.x、Kir5.x 和 Kir7.x) 是中度或弱整流器,主要在上皮细胞和神经胶质细胞中表达。肾上皮 Kir 通道在维持尿液和血液的稳态中起着重要作用,不仅通过调节 K+ 转运,还通过与各种转运蛋白的功能偶联调节其他离子(如 Na+ 和 Cl-)的浓度。Kir1.1 通道在面向管腔的顶端表面表达。K+ e通过 Kir1.1 通道的流出提供了跨顶膜的 K+ 浓度梯度,以支持对 Na+ 重吸收至关重要的 Na+/
K+/2Cl– 共转运蛋白的功能(Manis 等人,2020 年)。在面向毛细血管的基底外侧膜中,表达由 Kir4.1 和 Kir5.1 异源组装形成的 Kir 通道。通过这些通道的 K+ 运输提供了驱动 Na-K ATPase 活性所需的 K+,从而将单向 Na+ 重吸收回血浆。因此,
Kir4.1/Kir5.1 通道是跨上皮电压的重要决定因素,它维持电解质稳态,调节血容量,并最终有助于长期血压控制。在神经系统的星形胶质细胞和神经胶质细胞中,
同源 Kir4.1 通道介导在高神经元活动期间将过量的细胞外 K+ 吸收到星形胶质细胞中,这一过程称为“K+ 缓冲”(Beckner 2020)。这是由于 K+ 在细胞外空间积累时,EK 向比 Vm 更正的值转变,导致 K+ 流入星形胶质细胞以恢复正常的细胞外 K+ 浓度。最后,Kir7.1 是 Kir 通道家族中最近克隆的成员之一,也是了解最少的成员。该通道广泛表达为眼、肠、肾、脉络丛、呼吸道和脑中某些神经元的上皮细胞中的同源四聚体。在下丘脑室旁核的神经元中,黑皮质素-4受体(MC4R)的激活通过G蛋白独立的Kir7.1通道关闭使神经元去极化(Ghamari-Langroudi等人,2015),而这些神经元中Kir7.1的缺失会导致晚发型肥胖(Anderson等人,2019)。这些研究表明Kir7.1在能量稳态中起着作用。
9.3亚基多样性和基本结构组织
1993年,通过表达克隆分离出第一个Kir基因,编码Kir1.1和Kir2.1(Ho等人,1993;Kubo等人,1993)。从那时起,已鉴定出16个Kir通道基因,形成七个亚家族(图9.2)。大多数 Kir 通道都是由相同或相似的 Kir 蛋白组成的四聚体,每个 Kir 蛋白都含有两个跨膜螺旋 M1 和 M2,以及细胞质 N 端和 C 端。唯一的例外是 ATP 敏感钾 (KATP) 通道,它需要 Kir6 四聚体与四个额外的磺酰脲受体 (SUR) 共同组装,后者属于 ABC 转运蛋白家族。原核生物也拥有 Kir 通道,到目前为止已鉴定出九个基因。它们与哺乳动物 Kir 通道具有相同的架构,并被广泛用于高分辨率结构研究。然而,它们具有不同的门控特性,本章将不再讨论。各种亚基组合导致 Kir 通道的功能多样性。这在使用定义的 mRNA 或 cDNA 的重组表达系统中得到了最明显的证明。例如,与异源 Kir4.1/Kir5.1 通道相比,同源 Kir4.1 通道具有较低的单通道电导率和较低的 pH 敏感性。由不同的 Kir6.x 和 SURx 组合形成的 KATP 通道具有不同的单位电导率、开放概率和对细胞内 ATP 和 ADP 的敏感性。在天然组织中,不同的 Kir 蛋白具有不同但重叠的组织分布。准确识别天然电流背后的 Kir 通道组成可能具有挑战性,并且很大程度上依赖于 mRNA 和蛋白质表达、电生理学和基因缺失实验的证据。除了亚基组成外,可变剪接是增加多样性的另一种机制。已报道了 Kir1.1、Kir2、Kir3.2、Kir3.3、Kir4.1 和 Kir5.1 的多种剪接变体。在哺乳动物 Kir 成员中,Kir7.1 的氨基酸序列保守性最低,并且具有一些不寻常的特性,包括约 50 fS 时极小的单位电导率、较大的 Rb+ 与 K+ 电导率比以及对 Ba2+ 和 Cs+ 阻断的灵敏度大约低十倍。
每个 Kir 亚基都有两个跨膜螺旋(M1 和 M2)以及细胞质 N 和 C 末端(图 9.3)。两个跨膜螺旋通过细胞外转塔区、短孔螺旋和选择性过滤器连接。这种拓扑结构是所有钾通道中最简单的。现在,已经使用 X 射线晶体学或最近的单粒子低温电子显微镜解析了许多原核生物和哺乳动物 Kir 通道的高分辨率结构。两个 TM 螺旋和孔螺旋形成的跨膜结构域与细菌 KCSA 通道具有结构相似性。中央腔内排列着四个 M2 螺旋,它们在细胞质末端汇聚形成一个称为螺旋束交叉的收缩结构。包括塔环在内的外前庭大小和形状各异,这有助于单位电导和对各种阻滞剂(包括离子和肽毒素)的敏感性存在差异(Whorton 和 MacKinnon
2011)。胞质域由相邻亚基的 N 端和 C 端结合形成。Kir 蛋白的 N 端含有一个两亲螺旋,称为滑动螺旋或界面螺旋,与内膜平行,并且被认为在门控期间移动。值得注意的是,为了获得 Kir2 和
Kir3 通道的晶体结构,必须去除蛋白质的远端 N 端(Hansen、Tao 和
图 9.3
Kir 通道的结构。 (A) 与 PIP2 结合的鸡 Kir2.2 的晶体结构 (PDB ID3SPI)。主要域
和结构特征已标记。D172 是与多胺结合具有高亲和力的整流控制器。
胞质域中的 E224 和 E299 与多胺形成较弱的相互作用。为清晰起见,仅显示四个亚基中的两个。 (B) 从侧面
和顶部观察的小鼠 Kir3.2 与 PIP2 和 Gβ γ 复合物的晶体结构(PDB ID4KFM)。 (C) 与 ATP 和
格列本脲 (Glib) 结合的啮齿动物 Kir6.2/SUR1 KATP 通道的低温电子显微镜结构 (PDB ID6BAA)。
MacKinnon 2011;Whorton 和 MacKinnon 2011)。在 KATP 通道和 Kir3 通道的低温电子显微镜结构中,Kir 蛋白的远端 N 端分辨率也很差(Martin,
Yoshioka 等人 2017;Niu 等人 2020)。因此,远端 N 端可能是无序的并且相对灵活。有趣的是,在与通道抑制剂格列苯脲在 SUR 亚基结合的 KATP 通道的低温电子显微镜结构中,Kir6.2 N 端位于 SUR ABC 核心的两半形成的腔中,与结合的抑制剂相邻,这表明药物结合可以稳定内在无序的 Kir6 N 端(Martin 等人 2019)。胞质 C 末端结构域通过 C 接头与 M2 连接,将跨膜通道孔延伸到胞质中,使传导途径几乎加倍至
~60 Å。在胞质孔内,一个内在柔性环形成围绕中心孔轴的环带 (Pegan 等人,2005)。这个收缩点称为 G 环门,位于胞质结构域的顶点,位于螺旋束交叉门下方,人们认为两个收缩点都需要打开才能通过 K+。相邻亚基的 N 末端和 C 末端形成的亚基间界面对于配体感应和门控非常重要。一个突出的例子是 KATP 通道,其中 ATP 通过结合两个亚基之间的界面来抑制通道活性,并由一个亚基的 N 端和相邻亚基的 C 端的残基稳定 (Martin,
Yoshioka, et al. 2017)。
9.4 Kir 通道的门控
9.4.1 Kir 通道门控的调节器
Kir 通道在螺旋束交叉和 G 环门处的门控受到各种信号的调节,包括脂质、蛋白质、核苷酸和离子。然而,真核生物 Kir 通道的共同点是它们由膜磷脂酰肌醇 4,5-二磷酸 (PIP2) 激活。与 PIP2 复合的 Kir2 和 Kir3 通道的晶体结构表明,PIP2 在 TM 螺旋细胞质末端附近的口袋内结合。
M1 和 M2 中的带正电和疏水残基以及胞质域分别与带负电的磷酸盐头部和脂质尾部相互作用。这些残基的突变会降低通道开放概率,这可以通过添加外源性 PIP2 来逆转(Shyng 和 Nichols 1998;Baukrowitz 等人 1998;Huang、Feng 和 Hilgemann 1998)。在切除的膜片中,Kir 通道活性逐渐下降,这种现象称为衰竭,这归因于 PIP2 被 Mg2+ 依赖性脂质磷酸酶和磷脂酶分解。可以通过加入 EDTA 螯合 Mg2+ 或加入 MgATP 通过脂质激酶补充 PIP2 来减少或防止衰竭(Lin 等人 2003);相反,也可以通过应用
PIP2 抗体或聚阳离子(如聚赖氨酸或新霉素)来人工诱导(Rapedius 等人,2007 年),这些物质
与 Kir 通道竞争 PIP2 结合。
Kir 通道表现出广泛的自发活动。这种活动被称为
内在 Po,据推测反映了通道对 PIP2 的明显亲和力。
因此,自发活动较强的 Kir1 和 Kir2 通道被认为与 PIP2 具有较强的相互作用;而自发活动较低的 Kir3 通道被认为与 PIP2 具有较弱的相互作用(Zhang 等人,1999 年)。其他因素可以
以与 PIP2 相加、协同或竞争的方式调节通道活性。
例如,Gβγ 和 Na+ 的结合通过稳定 PIP2 相互作用显著增加神经元 Kir3.2 和心脏 Kir3.1/Kir3.4 (KACh) 通道的活性 (Whorton 和 MacKinnon 2011;Rosenhouse-Dantsker 等人2008)。Na+ 的类似作用也见于 Kir4.1/Kir5.1 通道 (Rosenhouse-Dantsker 等人,2008)。在 Kir2 通道中,最近的研究表明,第二个磷脂结合位点对 PIP2 敏感性至关重要,并与 PIP2 在通道开放方面具有协同作用 (Lee 等人,2013)。含有 Kir6.2 孔亚基的 KATP 通道表现出相对较高的内在 Po。然而,当在缺乏 SUR 的情况下人工表达时,Kir6.2 的开放概率非常低,类似于没有 Gβγ 和 Na+ 的 Kir3 通道 (Tucker 等人,1997)。因此,SUR 似乎增强或稳定了 Kir6.2 和 PIP2 之间的相互作用,类似于 Gβγ 对 Kir3 通道的影响。KATP 通道的一个主要特征是它们被细胞内 ATP 抑制。 ATP 与 PIP2 竞争,分别在空间上关闭或打开通道。ATP 结合在两个相邻 Kir6 亚基之间的界面上,并可能与也参与 PIP2 结合的残基结合(Driggers 和 Shyng,2023 年)。最后,细胞内 pH 会影响许多 Kir 通道的活性(Hibino 等人,2010 年)。细胞内酸化会降低 Kir1.1 和 Kir2.3 以及含有 Kir4.1 的通道的活性。KATP 通道对 pH 表现出钟形响应,并被温和的酸性 pH 激活,这被认为是由于 PIP2 结合位点旁边的组氨酸质子化导致 PIP2 结合增加。
9.4.2 Kir 通道门控期间的构象变化
在单通道记录中,几个 Kir 通道显示出爆发性的开放,中间穿插着长时间的关闭。在爆发中,可以观察到短暂的打开或闪烁。这些事件被称为快速门控。活动爆发之间的转换被称为慢速门控。Kir 通道孔环内的突变会影响爆发内动力学,表明快速门控发生在选择性过滤器处。有证据表明,选择性过滤器和外孔发生构象变化,并且该区域的收缩可能会捕获渗透离子并导致短暂的通道关闭。相反,爆发的频率和持续时间受到 M2 细胞内末端突变的影响,表明慢速门控涉及由大块疏水残基形成的螺旋束交叉门。有人提出,在门控期间会发生 M2 螺旋的运动,导致束交叉门变宽。具体而言,有人提出 M2 中间高度保守的甘氨酸残基可作为铰链,使 M2 弯曲,从而打开细胞质门;然而,这一观点最近受到了挑战,仍未得到解决(Black 等人,2021 年)。除了 M2,M1 和 M1 之前的 N 端滑动螺旋也与门控有关。M1 与 M2 在螺旋束交叉处附近形成氢键,这种相互作用在门控过程中被质子和 PIP2 改变(Rapedius 等人,2007 年),而滑动螺旋被认为将配体结合与通道门控偶联。有人提出,选择性过滤器和细胞质末端的门控可能耦合;然而,这种情况是否发生以及如何发生仍未得到解决(Black 等人,2021 年)。在没有和存在 PIP2 的情况下对 Kir2.1 的晶体结构进行比较,发现 PIP2 诱导的胞质结构域向跨膜结构域易位约 6 Å(Hansen、Tao 和 MacKinnon,2011 年)。将 M2 连接到胞质 C 末端结构域的 C 连接子从 apo 结构中的非结构化环转变为 PIP2 结合结构中的螺旋(也称为束缚螺旋),使 N 末端和 C 末端结构域中的带正电残基靠近膜 PIP2 以进行相互作用。在 Kir3.2 的低温电子显微镜结构中也观察到了类似的 PIP2 依赖性胞质结构域与跨膜结构域的“对接”(Niu 等人,2020 年)。请注意,具有和不具有 PIP2 的 Kir3.2 通道的早期晶体结构并未显示胞质域相对于跨膜域的位置差异;鉴于最近的 Kir3.2 低温电子显微镜结构,在 apo 结构中看到的对接胞质域现已归因于晶体接触引起的伪影(图 9.4)。除了胞质域垂直于膜的移动外,还观察到胞质域的刚体旋转。例如,在 Kir3 通道中,在 PIP2 结合结构中观察到胞质域相对于 apo 状态结构的旋转(从细胞外侧看时为顺时针方向)。有趣的是,Kir3.2 通道中胞质域的向上移动和旋转使胞质域允许 Gβγ 结合,这与功能研究一致,表明 Gβγ 激活通道需要 PIP2。在 Kir 中也观察到了胞质域的类似平移和旋转运动6.2 的 Kir6.2/SUR1 KATP 通道复合物,并与通道的配体结合和功能状态相关(Driggers 和 Shyng,2023)。
图 9.4
使用低温电子显微镜和 X 射线晶体学解析的 apo 和 PIP2 结合 Kir3.2 结构的比较。
顶部两个结构通过单粒子低温电子显微镜解析。在主要的 apo 低温电子显微镜结构中(蛋白质数据库 ID:6XIS),与主要 PIP2 结合结构(蛋白质数据库 ID:6XIT)中的对接 CTD 相比,细胞质结构域 (CTD) 从膜延伸约 6 Å。底部两个结构通过 X 射线晶体学解析。请注意,在 apo(蛋白质数据库 ID:3SYO)和 PIP2 结合(蛋白质数据库 ID:3SYA)结构中,CTD 都紧密对接在膜上。apo 结构中对接的 CTD 可能是由晶体接触引起的(Niu 等人,2020 年)。
如果 PIP2 和 Kir 通道激动剂通过打开细胞质门来刺激通道活性,那么人们可以预期这些门会发生配体依赖性的加宽。在主要由 PIP2 门控的 Kir2.2 中,螺旋束交叉门已被证明在 PIP2 存在的情况下会加宽,而 G 环门几乎没有变化,即使没有 PIP2,G 环门也已经打开(Hansen、Tao 和 MacKinnon,2011 年)。对于 Kir3.2,在未配体状态下,螺旋束交叉门和 G 环门均关闭。Gβγ 结合使 G 环门变宽,但不使螺旋束交叉门变宽,而 PIP2 使螺旋束交叉门变宽,但不使 G 环门变宽。只有当 PIP2 和 Gβγ 同时存在时,螺旋束交叉门和 G 环门才会变宽 (Whorton and MacKinnon, 2011; Whorton and MacKinnon, 2013)。值得注意的是,即使在迄今为止解析的哺乳动物 Kir 通道结构中门变宽,开口也不足以让完全水合的 K+ 通过,包括最近开放的 KATP 通道结构,这些通道在螺旋束交叉附近含有 Kir6.2 突变,导致通道组成性活跃 (Zhao and MacKinnon, 2021)。 MD 模拟研究的证据表明,
K+ 传导可能不需要完全打开下门来容纳完全水合的
K+。相反,靠近门的 K+ 局部部分脱水以及部分脱水的 K+ 与门残基的柔性侧链的相互作用可能足以允许 K+ 传导 (Black 等人,2020 年;Bernsteiner 等人,2019 年)。
9.5 离子选择性和传导
Kir 通道对 K+ 具有高度选择性。这种高 K+ 选择性是由选择性过滤器赋予的,选择性过滤器是传导通路中最窄的部分,具有特征序列基序 TXGYG 或 TXGFG。 Kir 通道的高分辨率结构表明,与其他 K+ 通道一样,苏氨酸的羟基氧和保守的 K+ 通道特征序列的主链羰基氧在每个 K+ 结合位点形成方形反棱柱(图 9.3)。在体内,所有 Kir 通道的传导都是电压依赖性的,这是由于内向整流所致。1969 年,Armstrong 提出了内向整流可能是由带正电的物质阻塞来自内部前庭的通道引起的这一观点,他注意到用内部 TEA 处理的 Kv 通道的电压依赖性阻断与表现出强烈内向整流的 Kir 通道的电压依赖性电流之间存在相似性。事实上,当通道与细胞内环境隔离时,内向整流就会消失。将 Mg2+ 应用于贴片的细胞质侧可重建大部分内向整流;然而,仍然缺少一个非常强的电压依赖性整流成分。可以通过将贴片移近细胞来恢复该成分,这表明细胞释放的物质产生了整流。
生化分析表明,细胞内多胺负责强电压依赖性内向整流(Lopatin、Makhina 和 Nichols 1994)。多胺是细胞中浓度低于毫摩尔的带正电的棒状分子。现在有充分的证据表明,强内向整流是由多胺与通道结合引起的,通过最初的弱电压依赖性相互作用,涉及孔胞质端附近的酸性残基(例如 Kir2.1 中的 Glu224 和 Glu229;图 9.3A),随后是强电压依赖性相互作用,涉及跨膜孔内衬的 M2 中带负电荷的残基(Kir2.1 中的 D172,称为整流控制器)。在显示弱内向整流的 Kir 通道亚型中,例如含有 Kir1.1 和 Kir6.x 的 KATP 通道,M2 中的整流控制器位置由不带电的 Asn 残基占据。值得注意的是,在除 Kir7.1 之外的所有 Kir 通道中,
内向整流的电压依赖性均受细胞外 K+ 浓度的调节。增加外部 K+ 可减轻 K+ 在外部位点结合的整流作用,并将 Mg2+ 和多胺从孔内较深的位点击倒。因此,通道开放的电压范围会移至更正的电压。
9.6 药理学
在 Kir 通道中,KATP 通道具有最丰富的药理学作用。1942 年,Mercel Janbon 在研究磺酰胺抗生素时发现磺酰脲类药物具有降血糖作用。这一偶然发现导致进一步开发磺酰脲类药物和其他相关化合物,如用于治疗 2 型糖尿病的格列奈类药物。这些药物抑制胰腺 β 细胞 KATP 通道,刺激胰岛素分泌并降低血糖。最近的 KATP 通道与高亲和力磺酰脲格列本脲复合物的低温电子显微镜结构表明,该药物与跨膜螺旋束形成的口袋结合,该跨膜螺旋束由来自 TMD1 的 TM 6、7、8 和 11 以及来自 TMD2 的 TM 15 和 16 组成 (Martin, Kandasamy, et al. 2017)。在该结构中,SUR1 的两个核苷酸结合域 (NBD) 是分开的,而 Kir6.2 的远端 N 端楔入由 SUR1 ABC 核心结构的两个跨膜束形成的裂缝中,紧邻结合药物。该结构表明格列本脲通过阻止 SUR1 中 NBD 的二聚化并捕获 Kir6.2 远端 N 端来抑制通道活性,从而防止 Kir6.2 发生打开通道所需的构象变化。其他结构不同的 KATP 抑制剂,包括卡马西平和瑞格列奈(一种典型的格列奈类药物),具有相似的结构机制。磺酰脲类和格列奈类药物也抑制其他 KATP 通道异构体,包括心脏 Kir6.2/SUR2A 通道和血管 Kir6.1/SUR2B 通道,但亲和力较低。打开 KATP 通道的药物,如二氮嗪、吡那地尔和克罗卡林,也在临床上用于治疗先天性高胰岛素血症、高血压和脱发。它们也通过结合由两个 SUR 核苷酸结合域二聚化时 SUR ABC 核心的跨膜螺旋形成的口袋来靶向 SUR 亚基 (Wu, Ding, and Chen, 2022)。现有 KATP 通道药物在临床使用中面临的一个挑战是缺乏所需的异构体特异性。虽然目前的药物都对某些 KATP 通道异构体表现出优先作用,但它们对其他 KATP 通道异构体有显著的脱靶效应。例如,通过激活胰腺 KATP 通道来治疗先天性高胰岛素血症的二氮嗪也会刺激血管 KATP 通道,导致药物诱导的坎图综合征,这种综合征通常与血管 KATP 通道的功能获得突变有关。除了靶向 SUR 亚基的药物外,还报道了靶向 Kir6.x 亚基的药物,包括抑制剂氰基胍(例如 PNU-37883)和罗格列酮。然而,它们也缺乏高异构体特异性,并且特征不太明显。高通量筛选 (HTS) 已确定了较新的抑制剂和激活剂,需要在这方面继续努力以克服当前的局限性。相比之下,其他 Kir 通道的药理化合物历来开发不足。主要抑制剂是 Ba2+ 或 Cs+,它们抑制所有 Kir 通道。最近使用小分子库的 HTS 和药物化学的基于分子靶标的方法已经产生了具有改进的效力和特异性的 Kir 通道调节剂。例如,Bhave 及其同事在 HTS 中采用铊通量测定法,确定 VU591 是第一个有效(IC50 为 240 nM)且选择性小分子 Kir1.1 通道阻滞剂。该化合物与默克公司开发的一种名为化合物 A 的 Kir1.1 抑制剂具有结构相似性,该化合物已被证明可以诱导排钠和利尿而不会导致钾流失、降低血压并保护肾脏免受高血压引起的肾损伤。这些化合物的衍生物也被探索用作针对埃及伊蚊的杀虫剂,以预防蚊子传播的疾病,例如寨卡病毒和登革热,因为抑制蚊子 Kir1 通道会破坏利尿和血淋巴 K+ 稳态(Weaver 和 Denton 2021)。另一个例子涉及 Kir3 通道,该通道越来越被认为是治疗癫痫、药物和酒精成瘾等疾病的重要靶点。最近基于功能和结构的筛选方法已将 ML297 鉴定为 Kir3.1/Kir3.2 通道的激活剂(EC50 为 160 nM)。有趣的是,ML297 的作用依赖于 PIP2 而不是 Gβγ,因此与 GPCR 无关。一些 ML297 衍生物在动物研究中已被证明具有镇痛作用,并且比心脏 Kir3.1/3.4 通道具有更好的效力和/或选择性。基于 ML297 的化合物的光开关版本称为光操作 GIRK 通道开放剂(或 LOGO),也已被证明具有抗氧化作用。een
为研究而开发,尽管由于缺乏异构体特异性,它们的使用受到限制。
最后,使用与酒精结合的 Kir3.2 结构模型,使用虚拟筛选开发了一种名为 GiGA1 的激活剂。该化合物以不依赖 G 蛋白的方式激活 Kir3.1/3.2 通道,但在机制上与 ML297 不同。
值得注意的是,GiGA1 已被证明可以减少急性癫痫小鼠模型中的癫痫发作持续时间和严重程度(Zhao 等人,2021 年)。这些研究突出了基于结构的药物开发的潜力。
9.6.1 肽毒素
除了小分子外,还发现了几种针对 Kir 通道的肽毒素。 Tertiapin 是从蜜蜂毒液中分离出来的,是 Kir1.1 和 Kir3.1/3.4 通道的强效抑制剂,并以纳摩尔亲和力结合在通道孔的外前庭中。最近,蜘蛛毒素 SpTx-1 已被证明可以通过与 Kir6.2 的细胞外侧结合(Kd 为 15 nM)来抑制由 Kir6.2 和 SUR1 组成的人类 KATP 通道。研究表明,SpTx-1 可以抑制几种与对磺酰脲类药物无反应的永久性新生儿糖尿病相关的功能获得性突变,这增加了该毒素可用于设计 Kir6.2 靶向抑制剂以治疗由功能获得性 KATP 通道突变引起的新生儿糖尿病或 DEND(发育迟缓、癫痫和新生儿糖尿病)综合征的可能性。
9.7 调节
据报道,许多 Kir 通道中都存在影响通道表达、运输和/或功能的翻译后修饰。最常见的翻译后修饰是磷酸化。研究表明,蛋白激酶(例如蛋白激酶 A 和 C(分别为 PKA 和 PKC))的磷酸化可以正向或负向调节各种 Kir 通道(包括 Kir1.1、Kir2.x、KATP 和 Kir7.1)的表面表达或门控。除了磷酸化之外,最近还报道了 Kir6.2 的 M2 中半胱氨酸残基 (C166) 的棕榈酰化与通道对 PIP2 的敏感性增强和 KATP 通道开放增加有关(Yang 等人,2020 年)。
膜 PIP2 增加了分离膜中所有 Kir 通道的活性。
然而,PIP2 是否对通道活性绝对必要,以及 PIP2 水平的生理变化是否调节 Kir 通道活性尚不清楚。最近的一项研究表明,在缺乏 PIP2 的脂质双层中重建的纯化 KATP 通道仍然可以打开 (Zhao and MacKinnon, 2021)。虽然有证据表明,在 Gq 蛋白偶联受体 (GqPCR) 激活后,磷脂酶 C 对 PIP2 的水解会抑制某些 Kir 通道的活性,包括 Kir3.x、Kir2.1 和 KATP 通道,但也有证据表明通道抑制是由于 GqPCR 激活后 PKC 介导的通道磷酸化 (Harraz、Hill-Eubanks 和 Nelson 2020)。除了 PIP2 之外,胆固醇是另一种与 Kir 通道调节有关的脂质。胆固醇
抑制 Kir2.1 的活性,同时增加 Kir3.2 的活性 (Levitan 2009)。
尽管最初假设胆固醇通过影响膜特性来影响通道功能,但最近的结构和功能研究提供了证据表明,胆固醇通过直接结合通道来调节这些通道,这可能会改变通道与 PIP2 的相互作用 (Rosenhouse-Dantsker 2019)。
与胆固醇一样,甲醇、乙醇和 1-丙醇等正构醇在 PIP2 存在下激活 Kir3.x 通道 (Glaaser and Slesinger 2015)。
Kir3.2 中的醇结合口袋已在细胞质域的亚基界面中被鉴定,与 Gβγ 激活通道的区域重叠。酒精结合位点与膜附近的胆固醇结合位点不重叠,酒精和胆固醇的激活作用是累加的,表明两种调节器通过不同的机制激活通道。
最后,影响 Kir 通道配体水平的生理信号可以调节 Kir 通道活性。作用于 GPCR 的神经递质和激素激活 Kir3.x 通道,导致三聚体 G 蛋白释放 Gβγ。相反,G 蛋白信号调节器 (RGS) 蛋白加速 Gα 亚基中的 GTP 水解并减少游离 Gβγ 的数量,导致 Kir3.x 通道活性降低 (Hibino 等人,2010)。对于 KATP 通道,一个关键的生理调节器是葡萄糖。高葡萄糖会增加细胞内 ATP 与 ADP 的比率以抑制 KATP 通道活性,而低葡萄糖会降低 ATP 与 ADP 的比率以打开通道。
9.8 细胞生物学:生物发生、运输、亚细胞靶向
Kir 通道的表面表达和定位受多种机制调控,
包括内质网 (ER) 输出信号、ER 网信号、高尔基体出口信号、内吞信号和靶向特定膜区室的信号。当在异源系统中表达时,不同的 Kir 通道表现出不同的表面表达水平,其中 Kir1.1 和 Kir2.x 的表达比 Kir3.x 和 Kir6.x 强得多。这主要是由于 Kir1.1 和 Kir2.1 中存在 ER 输出基序。在 Kir1.1 中,C 末端结构域中的 VLS 和 EXD 基序促进 ER 出口并正向运输到质膜。在 Kir2.x 中,C 末端结构域中的 FCYENE 基序
充当 ER 输出信号,而胞质 N 末端 (R44、
R46) 和 C 末端 (YXXΦ) 结构域中的其他基序则是从高尔基体到血浆膜的运输所必需的。对于 Kir3.x 通道,表面表达取决于亚基组成。
同源 Kir3.1 通道保留在 ER 中;相反,异源 Kir3.1/3.2 或
Kir3.1/3.4 通道在细胞表面有效表达。此外,Kir3.3 抑制含有 Kir3.2 或 Kir3.4 的通道的表面表达。复杂的表达模式归因于 ER 出口、ER 后到质膜运输和 ER 到溶酶体运输信号的相互作用,这些信号在不同亚基中存在差异。Kir6.x 通道的独特之处在于需要 SURx 进行表面表达。三肽 -RKR- 基序存在于 Kir6.x 的 C 端,也存在于 SURx 的胞质域中,位于第一个跨膜域和第一个核苷酸结合域之间,充当 ER 保留信号,以防止未组装或不完全组装的通道蛋白离开 ER(Zerangue 等人,1999 年)。在八聚体组装后,-RKR 基序被认为是屏蔽的,可能涉及 14-3-3 蛋白的结合(Heusser 等人,2006 年),以允许复合物离开 ER。因此,两个亚基中的 ER 滞留信号提供了一种质量控制机制,以确保只有正确组装的功能性通道才能传输到细胞表面(图 9.5)。类似的 ER 滞留信号 RAR 也存在于 Kir1.1 中,但血清糖皮质激素调节激酶 SGK-1 对 N 端丝氨酸的磷酸化会覆盖该信号以促进通道表面表达。许多 Kir 通道在极化细胞中表达,它们在这些细胞中的功能取决于对特定膜区域的正确靶向。例如,在突触后膜中,Kir3.1/3.2 与 Gi/o 偶联受体(如 γ-氨基丁酸 B 型 (GABAB))相关,以产生配体诱导的抑制性突触后电流。在肾上皮细胞的顶端膜中,Kir1.1 在功能上与 Na+-K+-2Cl− 同向转运蛋白相关,以平衡盐和水的稳态。极化表达可以通过通道与支架蛋白的相互作用实现。在肾上皮细胞中,Kir1.1 通过其 PDZ 结构域结合基序与 NHERF-1 和 NHERF-2 的 PDZ 结构域结合,导致通道靶向表达到顶端膜。在神经元和上皮细胞中,Kir2 通道靶向突触后树突和
图 9.5
KATP 通道的生物合成和运输调节。KATP 通道的异八聚体组装发生在
内质网 (ER) 中。Kir6.2 和 SUR1 都含有 -RKR- ER 保留基序。在未组装或部分组装的亚基中,RKR 信号暴露,导致 ER 滞留。组装完成后,RKR 信号被屏蔽,允许复合物从 ER 中退出。当组装的通道穿过反式高尔基网络 (TGN) 时,SUR1 中的两个 N 连接糖基化位点进一步修饰,成为成熟的复合糖基化 SUR1,在蛋白质印迹上可与 ER 中未成熟的核心糖基化 SUR1 区分开来。显示的蛋白质印迹来自仅用 SUR1 转染的 COSm6 细胞(左泳道)或用 SUR1 和 Kir6.2 一起转染的细胞(右泳道),并用抗 SUR1 抗体进行探测。 146 离子通道教科书第 II 卷
基底外侧结构域,通过 Kir2.x 通道 C 末端结构域中的 PDZ 结合基序与含有支架蛋白的 PDZ 结构域之间的相互作用。
类似的机制解释了肾上皮细胞基底外侧膜中 Kir4.1/Kir5.1 通道的表达。有趣的是,据报道,PDZ 结构域介导的相互作用也通过与含有分选连接蛋白 27 的 PDZ 结构域结合来促进 Kir3 通道的内吞运输(Hibino 等人,2010 年)。
除了 Kir 通道中存在的内在信号外,外在信号也调节 Kir 运输以调节表面通道的数量。快速而动态地调节运输可以适应不断变化的生理需求。在胰腺 β 细胞中,由于葡萄糖缺乏和脂肪细胞衍生的激素瘦素的作用,KATP 通道的表面表达通过增加通道运输而增加g 进入质膜,导致胰岛素分泌受到抑制 (Cochrane 和 Shyng 2019)。在肾上皮细胞中,涉及几种蛋白激酶的复杂信号机制调节 Kir1.1 通道的表面表达。除了 SGK-1 介导的磷酸化促进 Kir1.1 正向运输以响应高 K+ 或加压素外,蛋白酪氨酸激酶 Src 和 WNK 激酶(无赖氨酸激酶)可以通过内吞运输下调表面 Kir1.1 (Welling 和 Ho 2009)。这些制衡机制确保对生理需求做出适当反应,以维持 K+ 稳态。
9.9 Kir 通道病
目前,多种人类疾病与 Kir 基因突变有关。这些突变
可以通过影响 Kir 基因转录、Kir 蛋白
翻译、折叠、组装、运输、周转和门控来降低或增强通道功能。由于 Kir 通道在全身广泛表达,这些突变常常导致复杂的多效性病理。一个突出的例子是经典内向整流器
Kir2.1 的功能丧失突变。这些突变导致安德森-塔维尔综合征 (ATS),这是一种罕见的多系统疾病,其特征是 QT 间期长和室性心律失常、周期性麻痹和畸形特征。相反,功能获得性 Kir2.1 突变会导致 QT 变短,
这也会导致心律失常。另一个经典内向整流器 Kir2.6 的功能丧失突变与甲状腺毒性低钾性周期性麻痹有关,
这会影响甲状腺毒性条件下的骨骼肌兴奋性。
作为 G 蛋白介导信号通路的重要下游抑制效应子,Kir3.x 通道与多种人类疾病有关,包括癫痫、心律失常、成瘾和酒精滥用。Kir3.2 获得功能突变会导致 Keppen-Lubinsky 综合征,这是一种罕见的疾病,包括脂肪营养不良、肌张力亢进、反射亢进、发育迟缓和智力障碍。家族性醛固酮增多症 III 型,其特征是早期出现严重高血压和低钾血症,与 Kir3.4 选择性过滤器内或附近的突变有关。突变通道缺乏 K+ 特异性,并且对 Na+ 具有渗透性。在突变通道表达的球状带细胞中,Na+ 的流入会导致细胞去极化和细胞内 Ca2+ 浓度升高,从而激活增加醛固酮生成的转录途径。 Kir3.4(心脏 KACh 通道的一个组成部分)的功能丧失突变与长 QT 综合征有关,这表明这些乙酰胆碱激活的内向整流钾通道 147 也在心室复极中发挥作用。最后,最近一项针对酗酒者的全基因组关联研究发现 Kir3.2(KCNJ6)中存在单核苷酸多态性 (SNP),尽管 SNP 对 Kir3.2 功能的影响仍有待确定。尽管如此,这些研究表明 Kir3.2 是治疗酒精滥用的潜在靶点。
KATP 通道在感知细胞能量方面发挥着关键作用。Kir6.2 的功能丧失突变会导致先天性高胰岛素血症。相反,Kir6.2 的激活突变会导致短暂或永久性新生儿糖尿病和 DEND 综合征,其特征是发育迟缓、癫痫和新生儿糖尿病 (Gloyn 等人,2004)。此外,Kir6.2 中的多态性会略微增加通道活性,这与 2 型糖尿病风险增加有关。Kir6.1 的功能获得性突变现已与 Cantú 综合征有关,这是一种罕见的疾病,临床症状包括多毛症、心脏瓣膜异常和先天性肥厚性心肌病 (Grange、Nichols 和 Singh,1993)。K+ 转运 Kir 通道对于 K+ 稳态和整体电解质平衡至关重要。Kir1.1 的功能丧失突变是 Bartter 综合征 II 型的基础,这是一种失盐性肾病,导致低钾血症和碱中毒。多效性 SeSAME(癫痫、神经性耳聋、共济失调、智力低下和电解质失衡)或 EAST(癫痫、共济失调、神经性耳聋和小管病变)综合征是由 Kir4.1 功能丧失突变引起的。肾脏中 Kir4.1 功能受损会导致低钾性代谢性酸中毒,而神经胶质细胞中 Kir4.1 功能受损会导致神经组织钾水平升高,从而导致神经元去极化。Kir4.1 功能丧失还会消除耳蜗内电位并导致耳聋。最近,在一些多发性硬化症 (MS) 患者中检测到了针对 Kir4.1 的抗体,这表明一些 MS 病例可能属于一组由离子通道功能障碍引起的自身免疫性疾病。最后,Kir7.1 对于调节视网膜色素上皮和视网膜下空间体积的液体运输方向至关重要,并有助于维持视网膜周围的 K+ 稳态光感受器外节。Kir7.1 的功能丧失突变与雪花状玻璃体视网膜变性 (SVD)(一种发育性和进行性眼部疾病)和莱伯先天性黑蒙 (LCA) 有关,后者导致从出生第一年开始出现视力障碍。
9.10 结论
自半个多世纪前发现 Kir 电流以来,人们在理解这些电流背后的通道方面取得了很大进展,包括它们的内向整流、门控、运输机制以及它们在生理和疾病中的作用。然而,仍有许多问题。我们仍然没有完全了解 Kir 通道门控如何在结构层面发生,Kir 通道功能在时间和空间上受到调节的机制,以及 Kir 基因的遗传变异如何影响人类生理和病理生理。随着可用于研究 Kir 通道的工具不断进步,预计我们在 Kir 通道生物学各个方面的知识将继续增长和完善。特别令人兴奋的是,通过有针对性地操纵故障通道,利用不断增长的知识来促进健康。
