有关核孔运输的迷思
核孔复合体的主动运输需要消耗ATP吗?需要消耗GTP吗?
翟五:
在研究过的情况中,似乎不需要核苷酸的水解……
需要消耗ATP能量,表现出饱和动力学特征……
随后的步骤则需要GTP水解供能……
王金发:
主动运输的能量,由ATP和GTP提供……
MBoC:
未提及ATP的作用。
现在对这一问题进行一探讨,以下文段来自Nuclear-Cytoplasmic Transport -- Weidong Yang。
第 7 章 穿越核膜:整合膜蛋白的一种或多种运输机制?
摘要 已经提出了几种不同的机制来解释膜蛋白如何进入内核膜。这些机制包括使用核孔复合物的中央和外围通道的机制,这些通道涉及膜中的自由扩散、使用运输受体的定向运输、以内核膜蛋白作为其自身运输受体的定向运输、ATP 依赖性过程以及涉及膜融合的机制。然而,报告的差异是否反映了完全不同的机制、相同基本机制的不同许可步骤或实验操纵的产物仍不清楚。也可以合理地假设存在多种机制的硬件,但有些是仅在主要机制失败时使用的备用机制。如果是这样的话,还需要考虑生物背景、核孔结构、相关蛋白质和基序的丰度以及不同或竞争机制的能量消耗。在这里,我们根据这些因素、内核膜蛋白的环境和进化来评估支持这些拟议机制的现有数据。
7.1 简介
核膜 (NE) 在进化过程中的出现为真核生物提供了许多优势,首先是区室化以保护基因组免受潜在破坏性代谢酶的损害。数十亿年来,NE 进化出了许多额外的调节功能,因此现在发现 NE 蛋白参与了空间基因组组织、区间表观遗传沉默 、DNA 复制 、转录因子结合的转录调控、细胞周期调节 、多种信号通路(包括 ROS 信号传导和衰老) 、机械转导 、细胞机械稳定性和细胞迁移相互作用。然而,保护和调节基因组的这些优势是有代价的:NE 的存在还意味着细胞需要一些机制来将分子从细胞质运输到细胞核,反之亦然。
与由单个脂质双层组成的质膜不同,NE 更复杂,包含两个独立的脂质双层,即外核膜 (ONM) 和内核膜 (INM),由一个腔隔开 。ONM 与内质网 (ER) 相连续,由于布满核糖体,因此兼作 ER 的功能性亚域,尽管它还具有 ONM 特异性蛋白质。在其核质面上,INM 被核纤层覆盖,核纤层是中间丝层蛋白的聚合物,赋予 NE 结构稳定性 。这些层蛋白和 INM 的许多独特跨膜蛋白都与染色质蛋白结合,从而将基因组的部分连接到 NE。ONM 和 INM 在多个位置连接,在孔膜处以凸曲率和凹曲率弯曲,并通过 NE 形成孔,核孔复合体 (NPC) 插入其中。NPC 是大型蛋白质组装体,具有八重对称性,由约 30 个不同蛋白质亚型的多个副本组成核孔蛋白 (Nups) 是核内半透性通道,可调控大分子的核质交换 。NPC 的进化似乎与NE的进化平行,但具体顺序仍不清楚。一方面,一些原核生物具有发达的内质网,可有效地将细胞物理隔离,几乎形成一个NE(Acehan et al. 2014;Dacks et al. 016)。另一方面,NPC 蛋白具有内质网驻留 COP 蛋白的许多特征 。因此,人们认为这些 NPC 蛋白除了提供调节核酸和蛋白质交换的机制外,还可以利用膜弯曲功能形成 NE。因此,最早的 NE 可能伴随着 NPC。
从结构上讲,NPC 在酵母和哺乳动物之间高度保守。第一个 NPC 模型是在 20 多年前基于电子显微镜分析提出的,从那时起,人们付出了巨大的努力来充分阐明它们的完整结构,发表了几张电子断层扫描 NPC 图和单个核孔蛋白晶体结构。NPC 的核心支架由三个堆叠的环组成,形成一个中央通道:细胞质环和核质环夹着跨膜内环/辐条环。该通道可容纳直径达 ~39 纳米的货物运输。内环通过跨膜 Nups在外部与孔膜物理连接,内部则由 FG-Nups 排列,之所以这样称呼,是因为它们含有丰富的苯丙氨酸-甘氨酸 (FG) 重复序列。这些 FG 重复序列散布在 FG-Nups 中大部分无序的区域,这些区域被认为延伸到孔的中心,形成疏水性渗透屏障,阻止货物通过中央通道运输。 NPC 的每个面上都存在其他结构,即细胞质丝和笼状核篮,它们分别附着在细胞质环和核质环上。除了中央通道外,还有与孔膜相邻的 ~10 nm 外围通道,理论上可以容纳基于球状蛋白的斯托克斯半径的 ~60 kDa 蛋白质的转运(图 7.2)。
通过 NPC 进口可溶性货物已得到充分证实,涉及一种基于运输受体识别货物上存在的核定位信号 (NLS) 的共同机制(Güttler 和 Görlich 2011;Grossman 等人 2012)。相反,跨膜蛋白的转运似乎更为复杂,有证据表明存在多种不同的机制。
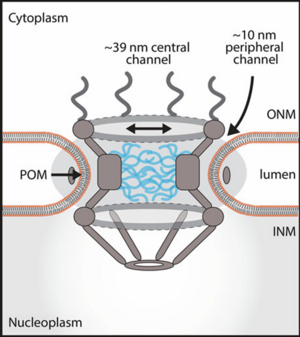
ONM 和 INM 都含有部分独特的跨膜蛋白组,通常称为 NET(nuclear envelope transmembrane proteins核膜跨膜蛋白),它们在 NE 中富集(Worman 和 Schirmer 2015)。由于 NET 是在与 NE 相邻的 ER 中合成的,因此它们应该能够通过简单的扩散到达 ONM。但是,一旦到达那里,就需要一种机制来专门在 INM 或 ONM 中富集 NET。
7.2 在没有 NPC 的情况下通过 INM
虽然通过 NPC 的运输通常被认为是 NET 穿越 NE 的主要途径,并且将成为本综述的主要重点,但值得注意的是,存在几种不需要 NPC 参与的运输机制。如果 NE 在第一个真核生物中先于 NPC 进化,那么将蛋白质送入细胞核的唯一方法就是通过囊泡融合或通过 NE 断裂。有趣的是支持作为后一种机制的典型代表,日本裂殖酵母Schizosaccharomyces japonicus在细胞分裂过程中表现出核膜断裂。组织培养中的癌细胞系中也有明显的核膜断裂,这可能反映了自噬事件。然而,这种蛋白质运输机制有很多缺点,因为无法控制哪些蛋白质进出细胞核。此外,如果没有调节核质运输的机制,核大分子浓度可能会与细胞质达到平衡,因此方向性将取决于细胞质浓度的波动。相反,在同时具有断裂/自噬和定向运输的系统中,当发生断裂时,可以确保方向性。应该注意的是,这种现象主要在组织培养中切除的肿瘤和癌细胞系中观察到,而不是在健康组织中,因此它可能与快速细胞分裂有关,而不是主要的运输机制,至少在含有 NPC 的真核生物中是这样。
囊泡融合为基础的穿越 NE 的机制也已被描述。疱疹病毒核外流(herpesvirus nuclear egress)就是一个例子。在疱疹病毒感染期间,病毒 DNA 复制和子代病毒衣壳的形成发生在核质内。然而,最终的病毒成熟和包裹发生在细胞质内,因此成熟的衣壳必须穿过 NE。在此途径中,病毒蛋白募集细胞激酶来过度磷酸化核纤层蛋白,从而削弱核纤层内的相互作用,促进其局部分解,使大型病毒衣壳能够进入 INM。在一个仍不太清楚的过程中,病毒颗粒被 INM 包裹,并以囊泡的形式进入 NE 的腔内。这些初级包膜病毒体与 ONM 融合,衣壳被释放到细胞溶胶中,然后在质膜上获得成熟的包膜。有趣的是,在果蝇幼虫的神经元细胞中,已经发现一种类似的囊泡介导机制可以穿过 NE,这是 Wnt-1 信号通路的一部分。在这项研究中,发现大型核糖核蛋白颗粒 (RNP) 在细胞核内形成,并通过 NE 出芽离开细胞核。此外,这种 NE 出芽还涉及核纤层磷酸化,这是疱疹病毒排出过程中所必需的。层蛋白分解的要求是反对这是主要机制的一个论点,因为层蛋白必须过度磷酸化才能分解,而许多层蛋白组装成细丝。因此,作为一个连续的过程来做这件事的能量成本将非常高,也许不可持续。同时,很明显存在一些层蛋白的间期磷酸化。另一个反对囊泡融合运输机制占主导地位的论点是,据报道,胶体金和大于核糖体的病毒颗粒通过 NPC 进入细胞核。因此,是否更普遍地涉及囊泡介导的运输机制尚不清楚。重要的是,目前还没有关于这种机制是否以相反方向发生的数据,即从 ONM 到 INM。然而,使用来自 非洲爪蟾卵母细胞的囊泡的体外 NE 组装系统,观察到不仅 NE 组装而且随后的核生长都需要囊泡融合蛋白(Hetzer 等人 2001)。虽然这可以解释为囊泡融合对于间期 NE 生长很重要,但需要注意的是,ER 通常是管状的,而囊泡在该检测系统中被用作起始材料,因此这可能反映了囊泡融合蛋白的异常使用。尽管如此,它确实表明这种囊泡融合运输机制的硬件已经到位,并表明当正常运输机制被破坏时,它可以被激活。
在高等真核生物中,NE 在有丝分裂前期分解,NE 的膜分布在整个 ER(Ellenberg 等人 1997 年)中,然后在末期重新组装。因此,没有理由积极采用上述运输机制,因为 NET 可以在 NE 分解和重新形成的过程中访问 INM。尽管如此,这仅适用于经历开放有丝分裂的生物体,并且有许多真菌有丝分裂是封闭的(Smoyer 和 Jaspersen 2014)。然而,鉴于 NE 蛋白密度仍然相对较低即使 NE 生长以适应基因组复制(Maul 1972;D’Angelo 等人 2006;Maeshima 等人 2011),也必须存在运输途径将蛋白质运送到 INM,而不依赖于有丝分裂 NE 分解。
7.2.1 通过 NPC 运输
虽然很明显自噬和囊泡融合可以在高等真核生物中发生,但人们普遍认为,蛋白质进出细胞核的主要途径是通过 NPC。这对 INM 注定的 NET 来说是一个障碍,因为它们被认为主要在翻译过程中插入 ER 膜(Laba 等人 2014),并且除了 NPC 所在的孔之外,NE 本质上是密封的。因此,为了遵循可溶性蛋白质通过 NPC 中央通道所采取的已确定的运输路线(Fiserova 等,2010;Yang,2013),NET 可能需要一种特殊的许可机制来在翻译过程中识别它们并结合蛋白质以稳定它们的疏水膜跨度,同时防止它们插入膜中,或者需要一种更复杂的机制来在运输之前将它们从膜中提取出来。这些机制可能非常耗能,因为维持膜外的疏水跨度在热力学上是不利的,因此人们普遍认为,一旦在翻译过程中嵌入 ER 膜,NET 就会在脂质双层中扩散到 ONM,在那里它们会遇到 NPC,并且很可能在嵌入膜的同时通过它们进行转运。
因此,有必要了解拟议的运输机制发挥作用的背景,并理解 NPC 的物理性质。除了 NPC 的中央通道外,在孔膜附近还存在直径约为 10 nm 的外周通道。只有三个 Nup 具有跨膜跨度,可将 NPC 结构锚定到孔膜上,电子断层扫描图表明这些通道之间有足够的间距,以允许膜结合蛋白在脂质双层中绕过它们 (Maimon 等人,2012 年;von Appen 等人,2015 年)。这些外周开口被认为可以容纳 NET 的核质质量,因为它们的跨膜结构域会扩散穿过孔膜的脂质双层,前提是它不超过 ~60 kDa 的极限,该极限是根据在 10 nm 通道中导航的球状蛋白的斯托克斯半径预测的,并且已通过融合蛋白进行了实验测试(Soullam 和 Worman 1995;Ohba 等人 2004)。因此,从简单的角度来看,想要穿越 NPC 的 NET 有两个可用的通道:与孔膜相邻的较小的外周通道或较大的中央通道,访问该通道可能需要从 NE 中提取。
7.2.2 提出的运输机制
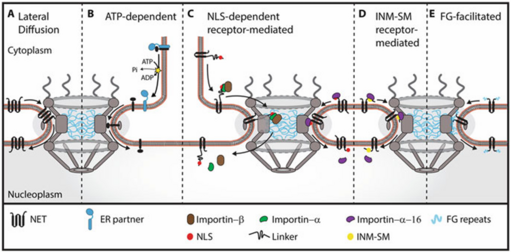
根据观察到的 INM 蛋白靶向要求不同,提出了五种涉及通过 NPC 转运的运输机制:横向扩散保留 lateral diffusion-retention、ATP 依赖 ATP-dependent,、NLS 依赖受体介导 NLS-dependent receptor-mediated、NLS 非依赖受体介导( NLS-dependent receptor-mediated,INM-sorting motif-mediated,INM 分选基序介导)和 NET-FG 基序促进NET-FG motif-facilitated(图 7.3)。所有这些机制是否存在于细胞中以及其中一种机制是否优于另一种机制仍存在争议。
7.2.2.1 横向扩散-滞留假说_LBR
INM 靶向蛋白质通过 NPC 运输的第一个提议机制是基于以下观察:病毒糖蛋白可以在 ER/Golgi 和 INM 之间自由扩散,并且 INM 蛋白可以在存在核滞留伙伴的情况下在融合异核体的细胞核之间交换。该模型称为“横向扩散-滞留”,认为 NET 可以在 ER 和 NE 的膜中横向扩散,并通过无方向的被动扩散穿过 NPC 的外周通道,同时保持嵌入在孔膜中(图 7.3a)。然后通过与核伙伴结合在 INM 中滞留。
通过 NPC 外周通道扩散的证据来自对所测试 INM 蛋白的核质域观察到的 ~60 kDa 大小限制。有关LBR 的早期研究表明,当其核质域从 ~22.5 kDa 增加到 ~70 kDa 时,它不再能够定位到 INM。将核质域的大小加倍仍然允许转位到 INM,但进一步将大小增加到 60 kDa 以上会阻止转位。此大小限制已验证数个靶向INM的结构。
横向扩散-保留模型的保留部分的支持来自对几种 NET 的核结合伙伴的鉴别。一个主要的结合伙伴是 INM 下的核纤层。据估计,每个哺乳动物细胞核中层蛋白的含量约为 900 万份,因此为 NET 提供了丰富且相对稳定的束缚点。这些包括大多数最初发现的 NET,例如因其与核纤层蛋白 B 结合而得名的核纤层蛋白 B 受体 (LBR)、LAP1 和 LAP2、emerin和 SUN2,以及迄今为止通过蛋白质组学研究发现的几乎所有特征较少的 NET,例如 NET5/Samp1、NET25/LEM2和其他。所测试的大多数 INM NET 也与染色质或染色质相关蛋白结合。例如,LBR 结合异染色质蛋白 1 (HP1) (Ye 和 Worman 1996),而 LEM 结构域蛋白家族(以 LAP2、emerin 和 Man1 命名)共享双螺旋基序,这有助于它们与染色质相关蛋白 BAF(自整合屏障因子)结合 (Brachner 和 Foisner 2011)。更具体的相互作用包括 LAP2β 与转录抑制因子的结合、无生殖细胞结合 (Nili 等人 2001)、emerin 与 Lmo7 的结合 (Holaska 等人 2006),以及几种指导特定基因组组织模式的 NET (Zuleger 等人 2013;Malik 等人 2014;Robson 等人 2016)。与核蛋白相互作用为这些 NET 提供稳定结合位点的想法一致,几项光漂白研究表明,与 ER 相比,NET 在 NE 中的移动性降低 (Östlund 等人 1999;Wu 等人 2002;Shimi 等人 2004;Zuleger 等人 2011)。此外,研究表明,在没有核保留伴侣层蛋白 A 的情况下,NETs emerin 和 MAN1 的移动性会增加 (Östlund 等人,2006 年)。
虽然扩散-保留模型最初是解释 INM 蛋白质运输的首选机制,最近的研究表明扩散和保留是蛋白质靶向 INM 的主要决定因素 (Boni 等人,2015 年;Ungricht 等人,2015 年),但已经描述了几种例外情况,表明 INM 定位需要其他因素 (Zuleger 等人,2012 年;Katta 等人,2014 年)。
7.2.2.2 ATP 依赖性运输
第一个有关“仅靠被动扩散和滞留可能不足以解释 INM 中的蛋白质富集”的假设来自于观察到 ATP 和温度依赖于跨膜报告构建体向 INM 的移动(Ohba 等人,2004 年)。在这项研究中,开发了一种依赖于雷帕霉素介导的报告构造蛋白结合的核滞留报告检测法体,构造蛋白包括mTOR的FRB结构域、LAPβ的N端、GFP标签。在低温下和细胞 ATP 耗尽时,报告基因在 INM 处的积累分别受到强烈和完全抑制,而报告基因构建体的 ER 移动性不受影响。由于囊泡融合需要能量,作者用 n-乙基马来酰亚胺处理细胞以阻断囊泡融合。这种治疗没有效果,表明 ATP 是 ER 中的许可步骤或 NPC 中的构象变化等单独功能所必需的。该系统使用外周而非中央 NPC 通道来运输报告基因,这是因为注射阻断中央通道运输的 WGA(wheat germ agglutinin,麦胚凝集素)并不能阻止易位,而注射针对跨膜 Nup gp210 的一个结构域的抗体(已知位于外周通道中)确实阻止了易位(Ohba 等人,2004 年)。这项研究的一个潜在警告是,实验系统使用了可能影响结果的人工报告基因。
随后的研究直接比较了六种不同的 NET 对 ATP 的需求,确定只有 emerin 和 SUN2 这两种被测蛋白需要 ATP(Zuleger 等人,2011 年)。虽然这项研究清楚地表明这种能量依赖性并不是普遍要求,但它并没有测试这种能量需求是否是 NET 子集的实际转位步骤或 ER 中较早的许可步骤所必需的。当 ATP 耗尽时,emerin 和 SUN2 在 NE 和 ER 中都表现出移动性降低,这一事实最初令人困惑,因为它表明这些蛋白质的功能性有了新的维度,但随后观察到 ATP 耗尽过程导致 ER 连续性中断,这至少可以部分解释这一结果。虽然 ER 连续性中断对 ER 扩散的影响预计也会影响 NE 转位,因为 NET 需要到达 ONM 才能转位,但它无法解释为什么在测试的六个 NET 中只有两个表现出 ATP 耗尽缺陷。因此,这两种蛋白质独有的许可步骤的想法与数据一致。例如,ATP 可能是分子伴侣介导的 NET 与 ER 中的伴侣分离或 NET 二聚体的分离所必需的,以减少蛋白质质量并允许通过外周通道扩散(图 7.3b)。同时,文献中也存在一些不一致之处。同一项研究使用体外检测系统观察了 ER 破坏,以研究 INM 蛋白质靶向要求,发现 NET 在 INM 的积累速度存在普遍限制(Ungricht 等人,2015 年),而另一项研究(Zuleger 等人,2011 年)中只发现了一部分蛋白质。此外,ER 破坏研究还发现,对于 SUN2,仅存在 ATP 不足以完全重现对 INM 的靶向性。相反,需要添加 HeLa 细胞裂解物和 ATP(Ungricht 等人,2015 年)。两项研究之间的差异可以通过使用体内系统 (Zuleger 等人,2011) 和体外系统 (Ungricht 等人,2015) 的差异来解释,但两者都发现了 SUN2 的特殊要求,这一事实进一步表明,将 SUN2 靶向 INM 可能需要在易位之前在 ER 中进行能量依赖性的许可步骤。
7.2.2.3 NLS 依赖性受体介导的运输
对 LEM 结构域蛋白 Heh1 (螺旋-延伸-螺旋-1)/Src1 和 Heh2(人类 Man1 和来自酿酒酵母的 LEM2 的直系同源物)的分析表明,两者都含有推定的 NLS,并且它们在 INM 的积累需要类似于可溶性货物运输的受体介导的运输途径(King 等人,2006)。研究表明,INM 处的富集需要转运受体 importin-α (Kap60) 和 importin-β (Kap95),以及 Heh1-YFP 和 Heh2-YFP 构建体的 Ran GTPase 循环。此外,删除假定的 Heh2 NLS 会消除 Heh2-YFP INM 定位,对已知酵母的分析揭示了 NLS 基序的普遍存在,支持了易位依赖于 NLS 的观点 (Lusk 等人,2007 年)。随后,另一个研究小组着手研究这种转运机制是否可以在高等真核生物中发挥作用,并证明了哺乳动物跨膜 Nup Pom121 足以驱动酵母中膜蛋白的核积累。此外,研究表明,Heh2 的 NLS 和接头能够将嵌入膜的报告基因靶向 HEK293T 细胞中的细胞核(Kralt 等人,2015 年)。其他人也提出,NLS 依赖性受体介导机制在哺乳动物细胞中起作用,但与酵母不同,酵母似乎是迄今为止测试的所有 NET 的机制,而在哺乳动物细胞中,它可能只适用于一小部分 NET。哺乳动物细胞中 Ran 依赖性机制的证据首先来自 LBR 结合 Ran GTPase(Ma 等人,2007 年)和 importin-α-16(KPNA4-16,一种膜相关的截短形式的 importin-α(Braunagel 等人,2007 年)的发现。值得注意的是,importin-α-16 缺乏 importin-β 结合域,这表明它可以独立发挥作用,并且考虑到它的大小,可能能够在与其货物结合的同时通过外周通道转运(Rexach 2006;Saksena 等人 2006)(图 7.3c,右)。在同时测试六个 NET 的 ATP 依赖性的研究中也观察到了 LBR 的 Ran 依赖性(Zuleger 等人 2011);然而,在显性负 RanQ69L 突变体存在的情况下,LBR 是六个测试的 NET 中唯一表现出转运缺陷的。至关重要的是,在测试的六个 NET 中,三个具有预测的与 importin-α/β 二聚体结合的 NLS,但其他两个含有 NLS 的 NET 不表现出 Ran 依赖性。此外,在几种哺乳动物 NET 中添加经典 NLS 未能产生 Ran 依赖性 (Zuleger 等人,2011),而在另一项研究中,SUN2 的 NLS 突变并未阻止 INM 积累 (Turgay 等人,2010),这表明这种机制特定于 NET 的一个子集。最近的一项研究使用体外测定来测量动力学并研究 INM 蛋白靶向的要求 (Ungricht 等人,2015),对 LBR 的 Ran 依赖性提出了质疑。由于这两项研究 (Zuleger 等人,2011;Ungricht 等人,2015) 使用了相同的 RanQ69L 突变体和 HeLa 细胞,因此这种明显的矛盾并不容易解决。为了解释这种差异,后一项研究的作者提出,先前观察到的 Ran 依赖性可以通过保留伴侣的输入缺陷来解释(Ungricht 和 Kutay 2015;Ungricht 等人 2015)。然而,鉴于丰富的 LBR 核结合伴侣(如层蛋白 B1)不受 RanQ69L 突变体的影响,更可能的是显性负突变体水平的差异在一项研究中产生了可测量的影响,而在另一项研究中则没有。然而,最初的酵母研究(King 等人 2006)最引人注目的方面是 importin-β 超过 90 kDa,而 importin-α 也刚好超过通过外周 NPC 通道转运的假定 60 kDa 极限。因此,假定的转运复合物超过能够通过外周 NPC 通道转运的最大尺寸的 3 倍。这些蛋白质与底物的晶体结构表明,这种复合物无法适应外周通道(Cingolani 等人,1999 年;Kobe,1999 年;Bayliss 等人,2000 年),因此,这导致了这样的假设:复合物通过 NPC 的中央通道转运。只有当跨膜蛋白从膜上移除或 NPC 的结构允许膜中的 NET 穿过核心 NPC 结构进入中央通道时,这才有可能。从脂质双层中提取单个跨膜结构域,以便 NET 可以作为可溶性货物运输的机制可能是可能的,尽管这在能量上极其不利。然而,对于具有多个跨膜跨度的蛋白质,这是否会发生是值得怀疑的。例如,LBR 包含 8 个跨膜结构域,它们都需要稳定化以防止聚集。更可能的解释是,importins 与一些其他未识别的蛋白质(结合核膜分选基序)一起翻译结合 N 端 NLS,这指示另一个尚未识别的装置阻止 C 端跨膜结构域插入膜中,直到运输后。然而,尽管这比实际将疏水序列从膜中拉出的能量不利性要小得多,但对于多跨膜 NET 来说,这似乎不太可能。一项使用基于 Heh2 的报告构建体对酵母的研究提供了另一种解释(Meinema 等人,2011 年)。在本研究中,合成的 INM 蛋白由 NLS、内在无序连接子和与人类 FKBP12 和 GFP 融合的 Heh2 的第一个跨膜结构域 (FKBP-GFP-NLS-L-TM) 组成,在雷帕霉素存在下,被困在与 FRB 融合的中央通道核孔蛋白 Nsp1 共同表达的细胞中,这意味着使用了 NPC 中央通道。
作者发现,连接子至少需要 120 个残基长度才能进行输入,并提出了一种运输机制,即未折叠的连接子穿过 NPC 支架,使运输中的蛋白质能够嵌入孔膜中,而其 NLS 与运输受体结合,可进入中央通道中的 FG 重复序列 (Meinema 等人,2011 年、2013 年)(图 7.3c,左)。尽管这种机制受到了批评,即测试构建体上的 N 端 NLS 和 C 端跨膜锚可能允许它们作为可溶性蛋白质进行易位,并且在 ER 膜整合发生之前由输入蛋白识别 NLS (Ungricht 和 Kutay,2015 年),但随后的研究证实,构建体嵌入 ER 膜中 (Laba 等人,2015 年)。另一项研究逐渐支持了 NET 有效切割 NPC 核心结构的可能性,因为单个核孔蛋白的晶体结构表明,大部分 NPC 结构可能具有高度可塑性 (Melcák 等人,2007 年;Solmaz 等人,2013 年;Sharma 等人,2015 年)。理论上,提出的 NPC 结构变化可以建模为一种永动机,在这种情况下,能量成本可能会保持在最低水平;然而,目前还没有足够的实验证据来开发这样的模型。
7.2.2.4 NLS 独立 (INM-SM) 受体介导的运输
据报道,一些 NET 还具有不同于 NLS 的分选基序,这是 INM 积累所必需的。杆状病毒包涵体衍生病毒的早期研究确定了病毒蛋白运输到 INM 所需的序列基序
7 导航核膜:一种或多种运输机制...
163
(Braunagel 等人,2004 年;Saksena 等人,2004 年)。所谓的内核膜
分选基序 (INM-SM) 由与带正电荷的氨基酸残基相邻的疏水性跨膜序列组成,存在于许多 NE 蛋白中,包括几种 LEM 和 SUN 结构域蛋白、LBR 和跨膜 Nups、
GP210 和 Pom121(Braunagel 等人,2004 年)。此外,包涵体衍生病毒蛋白 ODV-E66 的 INM-SM 和 LBR 和 nurim 的 INM-SM 与截短形式的核转运蛋白-α、导入蛋白-α-16 (KPNA-4-16) 结合 (Saksena 等人 2006;Braunagel 等人 2007)。如前所述,导入蛋白-α-16 缺乏导入蛋白-β 结合域,因此可能足够小,能够在与其货物结合时通过外周通道转运 (Rexach 2006;Saksena 等人 2006) (图 7.3d)。值得注意的是,导入蛋白-α-16 仍然包含一些与 FG 重复 Nups 相互作用的犰狳重复基序 (ARM)。虽然主要的 FG-Nups 位于 NPC 的中央通道中,但含有一些 FG 重复序列的几个 Nups 似乎位于孔膜和外周通道附近。这些包括含有三个 FG 并可能与孔膜结合的 Nup35(von Appen 和 Beck 2016)和跨膜 Nups、Ndc1 和 Pom121,它们分别含有 5 个和 24 个 FG(Batrakou 等人 2009;Kosinski 等人 2016)。因此,从理论上讲,importin-α-16 可以使用 FG-Nup 相互作用协商外周 NPC 通道,类似于运输受体协商中央 NPC 通道的方式,前提是这些 Nups 上的 FG 可在外周通道中访问。有趣的是,对酵母中 Heh2 运输的进一步分析表明,Kap60(importin-α)、Kap60-44 或 Kap60-30 的截短异构体是 Heh2 在 INM 富集所必需的(Liu 等人,2010 年),而之前未鉴定的 INM-SM 的突变减少了 INM 的积累。然而,其他人发现,在没有这个基序的情况下,Heh2 仍然定位到 INM(Meinema 等人,2011 年),随后认为对于 Heh2,所提出的 INM-SM 被用来确定膜中的蛋白质拓扑结构(Laba 等人,2014 年)。综合考虑,这些结果可能表明一些含有 INM-SM 的蛋白质具有多种进入细胞核的冗余机制。或者,INM-SM 可能反映了一个两阶段过程,其中翻译过程中的识别允许这些蛋白质进行随后的定向运输,而 NPC 中的运输复合物性质会发生一些变化。
7.2.2.5 NET 作为运输受体
INM 蛋白质积累的最终建议机制基于以下观察:运输受体本身含有 FG 重复序列;importin-β 有四个 FG,这些 FG 被认为通过瞬时 FG 受体-FGNup 相互作用促进通过 NPC 中央通道的运输(Rexach 和 Blobel 1995)。甚至有人提出,跨膜 Nup Pom121 使用其 FG 重复序列,同时保持嵌入孔膜中,以定位到其在 NPC 内的位置,即它充当自己的运输受体(Funakoshi 等人,2011 年)。如前所述,
有几个含有 FG 重复的 Nup 似乎位于近距离
靠近外周 NPC 通道,因此可能与中央通道中的 FG-Nups 功能类似。除了具有 24 个 FG 的 Pom121 外,这些 FG 还包括 Ndc1 和 Nup35。有趣的是,在两个 NET 的 N 端添加四个 FG 会增加它们的测量易位率,而敲低含有 FG 的外周通道 Nup35 会阻断这种影响 (Zuleger 等人,2011)。因此,NET 上的 FG 重复序列可能通过与 Nups 上的 FG 重复序列相互作用来促进它们通过 NPC 的运输,使 NET 能够放弃对运输受体的正常要求并充当它们自己的运输受体(图 7.3e)。人们可能认为,失去接触膜的 Nup35(von Appen 和 Beck 2016)会使外周通道变大,从而使 NET 运输更容易,但观察到的唯一影响是转位减慢,因此认为外周通道 Nups 促进了主动外周通道运输。这种影响的特异性进一步支持了这一点,因为只有添加了 N 端 FG 的 NET 和在其 N 端核质域中有两个 FG 的 LBR 受到影响(Zuleger 等人,2011 年)。事实上,在更中心位置的 Pom121 和 Nup35 中,FG 重复次数完全不同,这可能表明与几年前针对中央通道 Nups 提出的运输梯度平行(Ben-Efraim 和 Gerace,2001 年)。在这个模型中,FG 密度梯度可以促进方向性,直到运输货物深入 NPC 足够深,从而有合理的概率继续整个旅程。
7.3 哪种机制占主导地位?
上述每一项研究都使用了高度工程化的人工构建体或 GFP 融合到 NET,这可能会影响结果。此外,大多数研究只分析了一个或一小部分 NET。一项研究发现 NET 移动性范围很广,当直接比较 15 个 NET 时,仍然只直接比较了其中六个的 ATP、
Ran 和 FG 依赖性(Zuleger 等人,2011 年)。不同的 NET 亚组表现出不同的依赖性,这一发现提出了这些机制中哪种机制可能占主导地位的问题。为了解决这个问题,对大鼠肝脏 NE 中的蛋白质组学 (Schirmer 等人 2003) 中确定的 199 种预测跨膜蛋白进行了生物信息学分析 (Zuleger 等人 2011)。
虽然少数已知的酵母 NET 已经预测了 NLS (Lusk 等人 2007),但在这个更大的哺乳动物 NET 集合中,只有一小部分具有 NLS 预测,并且该群体的中位 NLS 预测分数远低于 0。因此,受体介导的易位不太可能成为哺乳动物 NET 的主要机制,除非存在完全不同且尚未确定的 NLS 类型。相反,对仅限于外周通道的扩散保留机制的预期基本尺寸排除极限得到了强烈支持。对于通过外周通道扩散的方面,观察到 NET 预测的核质质量存在显著限制,几乎所有 NET 的核质质量都远低于外周通道易位的 60 kDa 排除极限(Zuleger 等人,2011 年)。事实上,在 199 个预测的 NET 中,只有 4 个 NET 的核质质量高于 60 kDa,远低于算法对错误拓扑预测的预期速率。相比之下,这些预测的 NET 的腔内质量没有表现出这样的尺寸限制。扩散-保留机制的保留方面得到了预测的核质等电点在 9 和 11 之间的强烈聚集的支持。因此,这些蛋白质往往具有基本的核质域,可以与带负电荷的 DNA 相互作用,正如之前提出的 (Ulbert 等人,2006)。至于它们的大小,预测的腔内域在等电点上分布广泛,从而进一步强调了这种分布的非随机性 (Zuleger 等人,2011)。这表明扩散-保留是主要机制,正如其他人最近所主张的那样 (Boni 等人,2015;Ungricht 等人,2015)。然而,扩散-保留机制不一定与任何其他机制不相容。例如,一组 NET 通过外周通道在膜中扩散并被结合层蛋白和/或染色质保留,它们可以通过包含与外周通道 FG-Nups 相互作用的 FG 来帮助运输。事实上,与其他蛋白质相比,NET 中的 FG 重复序列非常丰富(Zuleger 等人,2011 年、2012 年;Kerr 和 Schirmer,2011 年)。有人可能会认为这是因为疏水性 FG 基序更可能随机出现在跨膜螺旋内;然而,虽然 FG 在 NET 中的富集率几乎是其他蛋白的 50 倍,但 FG 在 NET 中的富集率几乎是其他蛋白的 50 倍。超过基因组编码的所有蛋白质,
但它们仍然比基因组编码的其他预测跨膜
蛋白质丰富了大约十倍(Zuleger 等人,2011 年、2012 年;Kerr 和 Schirmer
2011 年)。因此,NET 中的 FG 似乎可能广泛促进它们的运输。
奇怪的是,在 NE 蛋白质组学中鉴定的可溶性蛋白质也表现出比非 NE 蛋白质更大的
包含 FG 的趋势(Kerr 和 Schirmer,2011 年)。在 NE 蛋白质组学研究中(Schirmer 等人,2003 年;Korfali 等人,2010 年、
2012 年;Wilkie 等人,2011 年)鉴定出的此类蛋白质很可能能够结合 NET。虽然
这些可溶性蛋白质也倾向于具有 NLS,但这提出了一个有趣的可能性
如果中央通道运输中断,这些 NET 本身可以充当运输受体,将这些伙伴运送到外周通道。
使用这种生物信息学方法来分析受体介导机制的可能相对用途,其中内在无序的连接子到达
中央 NPC 通道,由于当前内在无序预测的复杂性和错误而更加困难。因此,对已确认位于 INM 的 32 个 NET 进行了更有限的个体预测分析(Malik 等人 2010;
Korfali 等人 2010;Wilkie 等人 2011)。根据 NPC 的低温电子显微镜断层扫描和免疫金分析,一个内在无序区域必须跨越至少 20 纳米,甚至可能更多,才能从外围 NPC 通道到达中央通道(Reichelt 等人,1990 年;Hinshaw 等人,1992 年;Alber 等人,2007 年 a、b;von Appen 等人,2015 年)。在受拉的蛋白质中,氨基酸侧链的持久长度已测量为 0.35-0.55 纳米(Carrion-Vazquez 等人,1999 年;Rounsevell 等人,2004 年);然而,没有提出对易位 NET 施加拉伸力的机制。因此,使用较低的持久长度进入中央通道需要至少 57 个氨基酸的内在无序区域。在分析的 32 个已知
166
C. R. Dixon 和 E. C. Schirmer
INM NET 中,只有 emerin、MAN1、LAP2β、LAP1、SUN1、SUN2、NET5、
NET9/TOR1AIP2、NET25/LEMD2、NET31、NET39、Tmem214 和 POPDC2
具有足够长度的预测内在无序区域。LBR 处于临界状态
因为它在较大的内在无序预测中间有一个很大的下降,使得
每一半都略少于 57 个氨基酸残基。然而,当多个算法(例如 Chou-Fasman 和 Garnier-Robson)预测该区域内有 α 螺旋或 β 片层时(Chou 和 Fasman 1978;Levin 等人 1986),内在无序预测的可能性会降低,因此这些区域可能太短而无法进入 SUN1、SUN2、NET25/LEM2、NET39 和 LBR 的中央通道。因此,通过此处预测分析的已确认 INM NET 中,只有 28% 可能具有内在无序区域穿过 NPC 核心进入中央通道。其中,超过一半使用 PSORT-II 算法没有 NLS 预测(Nakai 和 Horton 1999)。因此,
理论上,只有 12% 的 NET 可以使用所描述的受体介导
机制,如果需要使用实验中发现的 120 个氨基酸长度(Meinema 等人,2011 年),则该数字将下降到 10% 以下。
最后,可以查询 NE 蛋白质组学数据集,了解其他自噬和囊泡融合机制硬件的可用性。仅对已知参与自噬的许多蛋白质子集进行采样,就会发现几个
(表 7.1)。有趣的是,蛋白质组学分析的组织之间存在差异,自噬蛋白 9A (ATG9A) 在肝脏 NE 中非常普遍,
而其他自噬蛋白在血液 NE 中占主导地位。有趣的是,来自
ESCRT 通路的蛋白质几乎只存在于血液 NE 中,这表明
不同的通路可能在不同的细胞类型中发挥作用。参与囊泡融合的蛋白质也存在相同类型的组织差异,例如,NSF 在血液 NE 中最为普遍,而 VAPB 在肝脏和肌肉 NE 中更为普遍(表 7.1)。囊泡运输蛋白也是如此。
7.4 结论
很明显,多种易位机制是可能的,因为支持这些不同机制的蛋白质存在于 NE 中。此外,其中一些蛋白质在 NE 蛋白质组学中恢复了数百张光谱,这一事实表明它们不仅仅是 ER 蛋白在有丝分裂后被捕获在 NE 中的产物,而且可能在 NE 中具有特定用途。然而,除了疱疹病毒感染等特殊情况外,自噬、囊泡融合和细胞分裂过程中的核膜断裂/破裂等机制可能实际上不用于哺乳动物的 NET 易位。有理由相信,这些蛋白质中的许多主要在有丝分裂和随后的重组中起 NE 分解作用,而且 ESCRT 和 Rab 蛋白确实已被证明对这些过程很重要 (Audhya 等人,2007 年;Olmos 等人,2015 年)。
哺乳动物细胞核也可能利用自噬来快速释放核压力或去除受损物质。这些机制是否在自噬和囊泡融合运输机制中发挥更重要的作用
进化早期细胞核和细胞质之间的蛋白质运输尚不清楚,
并且确定它们是否在系统发育上更接近最后一种真核生物共同祖先的生物体中更活跃将会很有趣。
我们得出结论,哺乳动物细胞中 NET 的主要运输机制是通过外周 NPC 通道在膜内进行非受体介导的横向扩散,然后通过结合核伙伴在细胞核中保留。
这似乎与酵母不同,酵母中受体介导的机制可能占主导地位。这可能反映了酵母中缺乏核纤层,因为迄今为止测试的大多数 NET 都被发现能够结合核纤层蛋白,这可能为哺乳动物提供更强的保留机制,从而减少定向运输的需要。在酵母中,缺乏这种强大的保留机制将需要额外的机制来赋予方向性。这些进化差异也可能反映在提出的其他机制上,例如,层状体的物理存在,在各种研究中被建议与NPC蛋白进行物理接触,如Nup153(Bastose等,1996;Smythe等,2000)和Nup35(Hawryluk-Gara等,2005)。这些接触可能会产生障碍,阻碍具有一定核质大小的NET从外周通道释放,而这需要额外的步骤。同样,酵母和哺乳动物之间细胞质丝状体Nup的结构及其与细胞骨架的接触的差异也可能增加对诸如INM-SM之类的许可步骤类型的要求。
关于是否存在多种机制,或者横向扩散-保留模型是否代表一种解释 INM 蛋白质运输的统一机制,一直存在争议(Zuleger 等人,2012 年;Katta 等人,2014 年;Ungricht 和 Kutay
2015 年)。我们认为,所有涉及 NPC 的机制都是横向扩散的变体。ATP 依赖性机制可能代表了转位前的许可步骤,例如伴侣破坏蛋白质二聚体,这样它们就足够小,可以通过外周通道。 INM-SM 机制可能同样主要许可运输前步骤。一些 NET,特别是那些具有酶功能的 NET,可能没有通过结合层蛋白或染色质在细胞核中形成的强大保留机制,因此需要定向机制。对于这些以及如果在细胞质中积累可能会产生负面影响的保留型 NET,受体介导的途径可能会提供方向性。这些途径可能涉及截断的 importins,这些 importins 可以与外周通道中的货物 NET 相适应,或者涉及通过核心 NPC 结构进入中央通道与完整运输机制相互作用的内在无序区域。数据中一些看似不一致的地方,例如 Heh2 是通过 INM-SM 受体介导机制还是 NLS 依赖性受体介导机制进行运输,可能反映了仅在主要机制失败时才使用的备用机制的存在。 NET 在运输过程中可以访问中枢和外周通道的可能性与核质运输的传统观点有很大不同。然而,NPC 的灵活性可以使这一点nd 与早期 FRAP 结果一致,表明 Nups 的周转率很高(Rabut 等人,2004 年)。虽然 GFP 融合可能影响了这些和许多 NET FRAP 结果,但它们与将 NPC 视为高度动态和可塑性组装体而非固体结构的新观点一起是有意义的。这也将成为防止 NPC 被货物阻塞的机制。认识到冗余备份机制的可能性也可能有助于解释该领域已发表研究中仍然存在的不一致之处,而含有 FG 的 NET 本身作为运输受体发挥作用的想法可以在中央通道运输有缺陷时提供备用系统,例如,当 NPC 在有丝分裂后重新形成时,或者当它们被阻塞时,就像在许多病原体感染中发生的那样(Gustin 和 Sarnow,2001 年、2002 年;Faria 等人,2005 年)。细胞使用需要最少能量、最少物理重组和最小阻力的机制是有道理的,因此横向扩散-保留明显占主导地位。然而,正如 NE 的进化使基因组远离可能导致 DNA 损伤的代谢氧化酶一样,一些 NET 和其他核蛋白如果在细胞核外积累,可能会对细胞质中的功能产生负面影响,因此细胞也会进化出利用 NPC 现有框架进行定向运输的机制。未来的挑战是研究每种机制的具体细节,特别是将蛋白质引导到特定机制的任何序列基序,并开发超分辨率工具,以便能够实时可视化每种传输机制,而不会因操纵系统而产生伪影。
