电压门控钾离子通道
4.1 简介
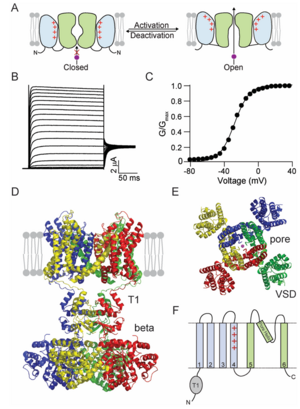
钾通道允许 K+ 离子穿过细胞膜。在电压门控 K+ (Kv) 通道家族中,K+ 通过通道的通量由膜电位控制(图 4.1A)。Kv通道是最大的 K+ 通道家族之一。Kv通道在生理学中发挥着多种作用。在神经元和肌肉细胞等电兴奋细胞中,Kv通道参与动作电位的复极化阶段,从而调节这些细胞的兴奋性。在内分泌细胞中,Kv通道的作用与激素的控制释放有关,而在免疫细胞中,Kv通道在免疫反应期间激活 T 细胞。 Kv通道参与细胞体积调节,K+通过Kv通道的移动与细胞周期进程和细胞死亡有关。
第一个被克隆的K+通道基因是来自果蝇的Shaker通道(图4.1B,C)(Papazian等人,1987年)。 Shaker K+通道的克隆预示着Kv 通道蛋白的结构功能研究的时代,其一直在进行,包括确定晶体结构和最近的低温电子显微镜结构。关于 Kv 通道的文献很多,本章简要总结了 Kv 通道的结构、功能和多样性的重要方面。
4.2 Kv 通道的结构
已报道了古细菌 Kv AP、大鼠 Kv 1.2 和人类 Kv 1.3 和 Kv 4.2 通道的结构。目前可用的最高分辨率结构是 Kv 1.2 通道的变体,通常称为 Kv 1.2–2.1 嵌合体或本章中为 Kv1.2* 通道(图 4.1 D、E)。
Kv通道是由相同(同源四聚体)或相似亚基(异源四聚体)组成的四聚体。Kv通道的每个亚基由三个不同的结构域组成(图 4.1F)。胞质 N 端是 T1 结构域,其后是六个跨膜片段(S1-S6),它们排列在两个不同的结构域中。四个亚基的 S5 和 S6 片段形成孔结构域,而 S1-S4 片段形成电压传感器结构域 (VSD)。孔结构域位于 Kv通道四聚体的中心,而 VSD 位于孔结构域的外围。
在 Kv1.2 结构中,每个亚基的 VSD 以domain-swap方式与相邻亚基的 S5 和 S6 片段相互作用。这种domain-swap方式也见于电压门控 Na+ 和 Ca2+ 通道,它们与 Kv通道类似,属于电压门控离子通道超家族。然而,domain-swap方式并不普遍。
在 Kv通道家族中,Eag (Kv10.1)、HERG (Kv11.1) 或 KvAP 通道未观察到domain-swap方式。domain-swap方式的重要性及其功能后果目前尚不清楚。
每个亚基的 T1 域以四聚体形式组装在一起,T1 域的四聚化对于指导 Kv通道组装非常重要。 T1 结构域可以形成同四聚体和异四聚体。但是,异四聚体化只能在属于同一 Kv 通道家族的亚基(例如 Kv 1 家族亚基)的 T1 结构域之间发生,因此将通道四聚体的组装限制在同一家族的亚基上。T1 结构域还形成各种 Kv 通道的附属亚基的结合位点,例如 β 亚基和 KChIP(K+ 通道相互作用蛋白)。
4.3 孔结构域
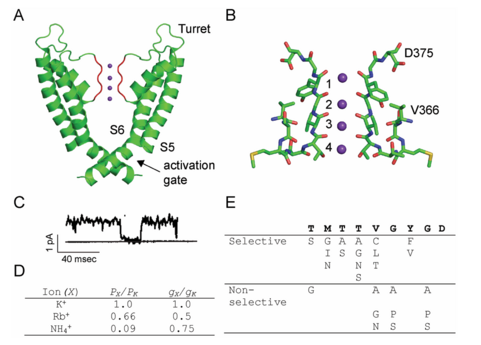
K+ 渗透途径位于孔结构域的中心四重轴上(图 4.2A)。离子通路细胞外一侧是选择性过滤器,K+ 的选择就在这里进行(图 4.2B)。选择性过滤器由四个离子结合位点组成,这些位点由主链羰基氧原子和来自 TVGYG 序列的 Thr 侧链构成。该序列在 K+ 通道中高度保守,并且 K+ 通道中选择性过滤器的结构基本相同。
离子渗透途径的细胞质侧是激活门。激活门由 S6 螺旋的束交叉形成。在关闭状态下,束中的 S6 螺旋紧密并置,因此通过束交叉的途径不够宽,无法通过水合 K+ 离子。在电压激活时,S6 螺旋经历铰链运动,导致束交叉以虹膜状方式加宽,从而允许 K+ 流过膜。S6 螺旋中保守的 Gly 残基充当此运动的铰链点。
4.4 离子选择性和渗透性
Kv 通道生理作用的基础是能够快速且有选择地将 K+ 传导过生物膜。 Shaker 通道的单通道测量表明通道电导率为 18 pS (图 4.2C,不同的通道有所不同。Kv通道与 K+ 通道家族的其他成员类似,对 K+ 的选择性高于对 Na+ 的选择性。使用反转电位测量法对 Shaker Kv通道的离子选择性进行测量,结果表明 K+ > Rb+ > NH4+ > Cs+ >> Na+ 的顺序(图 4.2D) 。相对电导率在对称离子条件下测量的各种离子通过 Shaker Kv 通道的电导率遵循 K+ > NH4+ > Rb+ 的顺序,而 Li+、Na+ 和 Cs+ 的电导率通常无法检测到 (Heginbotham 和 MacKinnon 1993)。二价离子 Ba2+ 充当阻断剂,因为 Ba2+ 可以与选择性过滤器结合但不能渗透过滤器。通道的离子选择性由选择性过滤器设定。对选择性过滤器残留物进行了广泛的突变研究,这些研究表明,只有少数替换可以保留离子选择性。非保守替换导致非选择性表型或导致电压门控钾通道 55 通道不导电或不在膜中形成四聚体组装。这些研究强调了选择性过滤器的精确结构对 K+ 选择性的作用大于对 Na+ 选择性的作用。
4.5 电压传感器域和电压门控机制
Kv 通道的核心特性是电压依赖性的孔隙打开,这是通过 VSD 的作用实现的。VSD 由 S1 至 S4 段组成。VSD 的结构在 Kv 1.2 通道或从 Kv AP 通道分离的 VSD 中可视化,显示 S1-S4 段排列成松散的束(图 4.3A)。 S4 片段的特征是,螺旋上每隔三个位置就有一个带正电的残基,主要是 Arg(图 4.3B)。这些残基可以感知跨膜电位的变化,从而转化为 S4 片段的运动,并与孔域的打开或关闭相关联。
Shaker K+ 通道中的测量表明,在电压门控期间,12-14个 eo 电荷会穿过场。门控电荷测量与 Shaker 通道中的电荷中和研究表明,S4 片段中的 R1-R4 残基对门控电荷有贡献(以及 S2 片段中的 E293)。电压门控期间 S4 段的变化已使用多种方法进行了评估,例如取代的 Cys 或 His 残基的可及性的变化。荧光方法也探测了 S4 运动的测量,这些方法可以实时可视化 S4 运动。这些研究总体上支持一种模型,其中四个最外层电荷从它们可接触内部溶液的环境转变为它们可接触外部溶液的环境。S4 段中带正电的残基通过 S1-S3 段中存在的反电荷 Asp 和 Glu 残基在膜中稳定下来。这些反电荷排列成两个簇,位于膜的两侧,称为内簇和外簇(图 4.3A)。这些反向电荷在 Kv通道中是保守的。预计 S4 片段中带正电的残基与反向电荷的顺序相互作用会促进 S4 片段的移动。有一段疏水残基,称为疏水垫片,将内部和外部电荷簇分开。S4 片段的移动需要带正电的残基通过这个疏水垫片。疏水垫片内是 Shaker 通道中保守的芳香残基 Phe290,当电荷通过疏水垫片时,它可以稳定电荷。
已经提出了不同的模型来描述 S4 片段的运动性质,例如滑动螺旋、螺旋螺钉或桨式运动,并且 S4 运动的程度也存在争议(Bezanilla 2005)。也有人提出,S4 运动的确切性质可能因所研究的特定 VSD 而异。
S4 段的运动与孔域耦合(图 4.3C)。电压门控的详细分析支持四个电压传感器的独立向外运动,随后是孔域的协同关闭到打开转变。
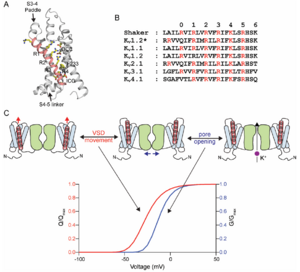
提出的将 S4 运动与孔隙打开耦合的传统机制是,去极化时 S4 段的向外运动会拉动 S4-S5 连接区域。 S4–S5 连接区与孔域中激活门后的 S6 片段的 C 末端区域相互作用。S4–S5 连接体的移动导致 S6 片段的移动,从而打开激活门以启动跨膜的 K+ 通量。除了这种传统模型外,还提出了其他耦合机制,涉及 S4 与孔域中片段之间界面的变化。
4.6 N 型和 C 型失活
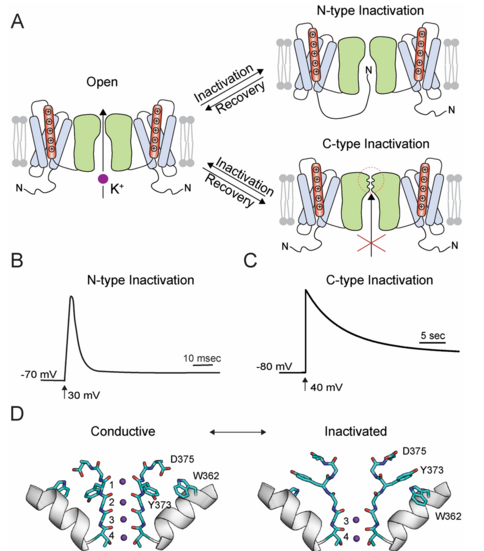
Kv 通道有两种失活机制,即 N 型失活和 C 型失活。在 N 型失活过程中,通道的 N 端与开放孔域结合并阻止 K+ 通过通道的流动。此失活过程发生在毫秒级,因此也称为快速失活(图 4.4B)。通过证明通道 N 端的遗传截断可消除 N 型失活,而通过反式添加与 N 端相对应的肽可恢复失活,确定了 N 端的作用。突变研究表明,N 端的结合位点是孔域中选择性过滤器下方的腔区。 N 端有许多磷酸化位点,磷酸化阻止 N 端与孔结合,表明 N 型失活可由蛋白质磷酸化调节。
N 端截短的 Shaker 通道不会发生 N 型失活,但仍会显示称为 C 型失活的失活过程。C 型失活的时间过程约为秒,比 N 型失活慢得多(图 4.4C)。因此,C 型失活也称为慢失活。 C 型失活过程的一个特征是依赖于渗透离子 。当 K+ 的细胞外浓度降低时,失活率会增加,而当渗透离子从 K+ 变为 Rb+ 时,失活率会降低。选择性过滤器内部和周围的突变会改变失活率 。这些研究表明 C 型失活涉及选择性过滤器。已经进行了使用定点标记、荧光测量和计算研究的研究,以解释 C 型失活过程中的结构变化 。这些研究支持在 C 型失活过程中选择性过滤器细胞外侧的局部结构变化。使用定点荧光标记的研究表明,C 型失活时孔域的转塔区域也会发生变化。
最近对 Kv 1.2 和 Shaker 通道的结构研究提供了 C 型失活状态下的通道结构 (Reddi 等人,2022)。这些结构显示选择性过滤器中外部两个离子结合位点的扩张,这是由保守的 Tyr 和 Asp 侧链的构象变化引起的 (图 4.4D)。该结构还显示了通道细胞外口和转塔区域的变化,这与先前对 C 型失活的生化和光谱研究一致。该结构表明,C 型失活期间通过选择性过滤器的离子传导的减少或损失是由于外部离子结合位点的破坏。需要进行计算研究来解释为什么外部离子结合位点的破坏会消除或减少通过通道的离子吞吐量。
4.7 Kv通道家族
哺乳动物的 Kv通道 α 亚基基因分为 12 个不同的家族 (Kv1–Kv12) 。本章介绍 Kv1-Kv6、Kv8 和 Kv9 家族。Kv7 和 Kv10–Kv12 通道在本书的其他章节中介绍。
从历史上看,当通道电流快速激活和失活时,Kv通道被归类为 A 型,当通道延迟激活且基本上不失活时,则被归类为延迟整流delayed rectifiers。A 型或延迟整流的 Kv通道可以存在于同一家族中。
4.7.1 Kv1 家族
Kv1 通道是果蝇Shaker通道的哺乳动物对应物。Kv1 通道是低压激活通道,在静息电位发生小的去极化时打开(表 4.1)。它们表现出快速激活动力学,并用于维持膜电位和调节电兴奋性。Kv1 家族由八个成员组成(Kv1.1 至 Kv1.8)。除 Kv1.7 亚基外,所有这些 Kv1 通道都在脑中以不同的水平表达,具体取决于特定位点。Kv1.1 至 Kv1.6 亚基在异源表达时形成同源四聚体。
在天然组织中,两个或多个不同 Kv1 亚基的异四聚体的形成也取决于在特定细胞中表达的 Kv1 亚基。亚基的家族特异性组装取决于 T1 结构域,该结构域仅允许 Kv1 亚基与 Kv1 家族的其他成员组装。组装的功能特性取决于亚基的特定组合。例如,Kv1.1 通道亚基缺乏 N 端失活肽,因此在同源 Kv1.1 通道中未观察到 N 型失活。含有 Kv1.1 亚基的复合物中的 N 型失活需要另一个具有 N 端失活肽的 Kv1 亚基的存在(或与带有 N 端失活肽的附属 β 亚基组装)。
在脑外,Kv1 亚基在各种可兴奋组织中表达,例如骨骼肌、心脏和胰腺胰岛中的 β 细胞,也在各种非兴奋组织中表达,例如免疫细胞。Kv1.3 通道在免疫细胞中表达,例如 T 淋巴细胞、巨噬细胞和小胶质细胞(参见第 III 卷第 7 章)。在 T 淋巴细胞中,K+ 通过 Kv1.3 通道向外移动是平衡 Ca2+ 流入所必需的,而 Ca2+ 的流入是 T 细胞活化所必需的。阻断 Kv1.3 通道可阻止钙离子内流,从而阻止 T 细胞活化和增殖。因此,Kv1.3 通道已被提议作为自身免疫和炎症疾病(如多发性硬化症、牛皮癣和 I 型糖尿病)的治疗靶点(Wulff、Castle 和 Pardo2009)。Kv1.5 通道在心房中表达,是超快速外向电流 IKur 的组成部分,对于动作电位期间的心房复极化很重要(参见第 III 卷第 5 章)。 Kv1.5 通道已被提议作为治疗心房颤动(心动过速的常见原因)的目标(Wulff、Castle 和 Pardo 2009),这是因为 IKur不存在于心室内,因此针对 Kv1.5 通道提供心房特异性治疗。
4.7.2 Kv2 家族
Kv2 通道是果蝇 Shab 通道的哺乳动物对应物。 Kv2 家族包括两个成员,Kv2.1 和 Kv2.2。Kv2 通道具有较高的激活电压阈值。它们缓慢激活并提供持续的 K+ 电流。它们广泛表达于大脑和内分泌细胞中。在神经元中,Kv2 通道是 somatic delayed rectifier current的基础,而胰腺 β 细胞中的 Kv2 通道在调节胰岛素释放中发挥作用。
Kv2 通道的一个显着特征是存在较大的 C 端。细胞质 C 端很长(人类 Kv2.1 中约 440 个氨基酸),占通道蛋白的约 70%。C 端影响通道活化动力学。存在多个磷酸化位点。 C 端磷酸化的程度和模式影响 Kv2 通道激活的电压阈值。
神经元膜上的 Kv2 通道有两种类型:自由扩散型和簇型,自由扩散型通道充当经典的延迟整流通道。簇型 Kv2 通道位于内质网 (ER) 和质膜 (PM) 的交界处。 Kv集群中的 2 个通道贡献
电压门控钾通道 61 通过与驻留在 ER 膜中的 VAMP(囊泡相关膜蛋白)相关蛋白 (VAP) 相互作用,形成 ER-PM 连接。目前尚不清楚这些簇的生理意义。Kv 2 通道形成这些簇并不依赖于离子通过通道的渗透,说明 Kv 通道也可以在细胞中发挥非电作用。
4.7.3 Kv 3 家族
Kv 3 通道是果蝇 Shaw 通道的哺乳动物对应物。有四个家族成员(Kv 3.1-Kv 3.4)。Kv 3 通道显示出较高的激活阈值,并且在高于 -10 mV 的电压下激活。它们还表现出非常快的激活和失活动力学。这些特性允许表达 Kv3 通道的神经元以非常快的速度发射动作电位。神经元在动作电位之后显示出不应期,这是由动作电位期间打开的Kv通道的失活时间引起的。由于 Kv3 通道的快速失活,表达 Kv3 通道的神经元中的不应期最短,从而允许高频发射。Kv3 通道在显示高频活动的神经元(例如听觉核中的神经元)中大量表达。与其他家族成员不同,Kv3.4 在非神经元组织中大量表达,特别是在骨骼肌和胰腺细胞中。 Kv3.1 和 Kv3.2 通道显示非失活电流(超过 1 秒的去极化),而 Kv3.3 和 Kv3.4 通道显示 A 型电流并快速失活。失活是 N 型的,受 N 端残基磷酸化调节。
4.7.4 Kv4 家族
Kv4 通道是果蝇 Shal 基因的哺乳动物对应基因。有三个家族成员(Kv4.1–4.3)。在异源表达中,Kv4 通道显示低激活阈值并显示快速激活动力学。异源表达中的通道通过 Kv4 亚基 N 端的失活肽进行 N 型失活。 Kv4 通道在神经系统中表达,也表达于心脏、肾脏和胰腺等其他组织中。Kv4 通道是神经元 A 型电流 (ISA) 的主要成分,也是心脏中 ITO 电流的快速成分。Kv4 通道的一个独特特征是它们经历了称为闭态失活 (CSI) 的过程。CSI 与 N 型和 C 型失活过程不同,因为它t 不需要孔打开。在 CSI 中,通道随着孔打开之前的电压传感器的移动而转变为失活状态。由于 CSI,Kv 4 通道通常在静息膜电位下失活,需要先前的超极化才能使通道从失活状态恢复并激活。
4.7.5 Kv 5、Kv 6、Kv 8 和 Kv 9
这些亚基不形成功能性同型四聚体离子通道,统称为电沉默亚基或 Kv S 。这些亚基与 Kv 2 亚基形成异四聚体。与 Kv 2 同型四聚体相比,Kv 2/Kv S 异四聚体表现出改变的生物物理特性。 Kv2 通道亚基广泛表达,而 KvS 亚基的组织表达受限。由于 Kv2 通道可以与 KvS 亚基共组装,因此 Kv2 异聚通道可以根据异四聚体复合物中伴侣 KvS 亚基的性质显示不同的生物物理特性,从而允许对电兴奋性进行微调。
4.8 Kv通道的药理学
K+ 通道的经典阻滞剂是四乙铵 (TEA)。TEA 从细胞外或细胞内结合到 K+ 通道孔以阻断离子运动。Kv1 通道对 TEA 阻断的敏感性不同 (Gutman 等人,2005 年)。对于外部 TEA,Kv 1.1、Kv 1.3 和 Kv 1.6 对 TEA 相对敏感(IC50 = 0.3–10 mM),而 Kv 1.2、Kv 1.4、Kv 1.5 和 Kv 1.7 对 TEA 相对不敏感(IC50 > 100 mM)。Kv 3 通道对亚毫摩尔浓度的 TEA 阻断高度敏感,而 Kv 4 通道对 TEA 阻断的敏感性较低。另一种常见的 K+ 通道阻断剂是 4-氨基吡啶 (4-AP),它通过与 Kv 通道孔中的腔体结合从细胞内侧阻断 Kv 通道。4-AP 阻断大多数 Kv 通道,IC50 范围从微摩尔到毫摩尔,具体取决于特定的 Kv 通道。选择性作用于特定 Kv 通道的小分子阻滞剂非常少。识别选择性小分子抑制剂的挑战在于 Kv 通道,尤其是同一亚家族的成员,表现出高度的序列同一性。一类重要的 Kv 通道阻滞剂是肽毒素,存在于蝎子、蜘蛛、蛇、海葵和其他有毒生物的毒液中(Tabakmakher 等人,2019 年)。作用于 Kv 通道的毒素可大致分为“孔阻塞”或“门控修饰”毒素。孔阻塞毒素与孔的细胞外口结合,并从物理上阻断 K+ 通过通道的渗透。孔阻塞毒素的例子有 Charybdotoxin 和 dendrotoxins,它们可以阻断 Shaker 家族 Kv 通道。这些孔阻塞毒素在前结构时代被广泛用于推断通道孔的结构特征。毒素阻塞通道的机制在 Kv1.2 通道与charybdotoxin 复合物的晶体结构中得到了结构阐明。电压传感器毒素与电压传感器域结合并修改通道的电压门控特性。电压传感器毒素的一个例子是 hana 毒素,它与 Kv2 通道的 VSD 结合。Kalium 数据库 (Tabakmakheret al. 2019) 中描述了在各种 Kv通道上活跃的通道毒素的完整目录。孔和 VSD 毒素表现出高度的阻断特异性,因为它们分别以塔塔区和电压传感器桨区为目标,并且这些区域在各种通道亚型之间显示出序列变异性。肽毒素还显示出与通道的更大相互作用表面,因此具有更多的相互作用,因此亲和力比 TEA 或 4-AP 等小分子阻滞剂更高。
4.9 Kv通道辅助蛋白
Kv1 通道与称为 β 亚基的辅助蛋白组装(Pongs 和 Schwarz 2010)。β 亚基有三种类型(β1-β3),由三种不同的基因编码。进一步的多样性来自剪接变体的存在(β1 称为 1.1、1.2 和 1.3),其在 N 端显示出改变的序列。
β 亚基组装为四聚体,β2 四聚体的晶体结构和与 Kv1.2 α 亚基的复合物已被报道(Long 等人,2007 年)。 β 亚基与醛酮还原酶的结构相似,并显示存在结合的 NADP+ 分子。生化研究表明分离的蛋白质具有弱氧化还原酶活性。β1 亚基在 N 端携带失活肽,当与不带有 N 型失活肽的 α 亚基共表达时,可以诱导 N 型失活。关联因此,与 β 亚基结合可赋予 Kv 通道 A 型行为,否则这些通道的行为将像延迟整流通道一样。β 亚基的另一个已确定的作用是它促进 Kv 通道表面表达的增加,这是通过对通道组装和/或运输到细胞膜产生有益影响来实现的。
Kv4 通道与两种类型的附属亚基相关:KChIP 和 DPP(二肽基氨基肽酶样蛋白)(Pongs 和 Schwarz 2010)。已经确定了与这些附属蛋白复合的 Kv4.2 通道的结构(Kise 等人 2021 年)。KChIP 是细胞质钙传感蛋白,与 Kv4 亚基的 N 端区域和 T1 结构域相关。 DPP 是跨膜蛋白,具有单个跨膜结构域和较大的胞外结构域。DPP 与 Kv 4 通道的相互作用通过 TM 结构域进行。KChIP 或 DPP 与 Kv 4 亚基的共表达会增加细胞表面表达并改变通道的门控特性。KChIP 和 DPP 蛋白在天然 Kv 4 通道中共同或单独存在。不同细胞类型中天然 Kv 4 通道的不同特性是由于这些附属亚基的不同组合而产生的。
4.10 Kv 通道的生物发生
在 Kv 通道的生物发生过程中,亚基共翻译整合到 ER 的脂质双层中 (Deutsch 2002)。靶向 ER 膜涉及通道多肽 N 端区域的信号序列,对Kv1.3 通道的研究表明 S2 片段充当信号序列。在 ER 膜中,Kv亚基折叠、寡聚化形成四聚体通道并与成熟通道复合物中存在的附属亚基结合。Shaker 家族Kv亚基在 S1-S2 环中携带糖基化位点。在生物发生过程中检测到糖基化变化。在 ER 中,Shaker 多肽被检测为未成熟的核心糖基化前体。经过适当的折叠和组装后,蛋白质被转移到高尔基复合体,其中寡糖链被修饰。可以区分未成熟和成熟形式的通道,因为它们在 SDS-聚丙烯酰胺蛋白凝胶上表现出不同的电泳迁移率。对同源四聚体 Kv 1 通道的研究表明,各种 Kv 1 通道亚基(异源表达)的细胞表面表达差异的决定因素是由于孔域中的序列差异。与辅助蛋白的结合促进了通道运输和细胞表面表达。
4.11 未解决的问题和研究方向
虽然在理解 Kv 通道的结构、功能和生理作用方面取得了很大进展,但仍有多个问题尚未解答。一个主要的未知数是 Kv 通道在关闭状态下的结构。这将是一项具有挑战性的工作,因为 Kv 通道通常在 0 mV 时打开,这是进行结构研究的条件。因此,要确定 Kv 通道的闭合状态,就需要蛋白质工程来改变电压依赖性,使通道在 0 mV 时闭合,或者需要开发一种方法来在施加电位的情况下进行结构研究。将闭合的 Kv 通道的结构与目前可用的开放通道结构进行比较,将有助于了解 VSD 的作用、孔域的打开/关闭过程以及 VSD 运动与孔隙耦合的机制。要了解这些电压门控和失活机制,就需要通过功能测量和这些过程背后的蛋白质动力学研究来补充结构研究。目前只有 Kv 1.2、Kv 1.3 和 Kv 4.2 通道的结构信息,需要了解属于其他家族的 Kv 通道的结构,以突出不同 Kv 通道家族之间功能差异的结构基础。Kv 通道在细胞膜上形成异源组装体。需要识别特定于各种 Kv 通道组装体的药理学,以了解生理作用并开发特定的治疗方法。我们对细胞膜中通道组装机制的理解存在差距,预计对组装机制的理解将导致可以纠正 Kv 通道组装错误的治疗方法,这是 Kv 通道病中通道功能障碍的主要原因。蛋白质组学方法已经确定了大量的翻译后关于 Kv 通道修饰 (PTM) 的研究,未来需要开展研究来剖析这些 PTM 对 Kv 通道功能的生理意义。
