第九章 光合作用:光反应
地球上的生命最终依赖于来自太阳的能量。光合作用是唯一能够收集这种能量的具有生物重要性的过程。
地球上的大部分能源资源来自近代或古代的光合作用(化石燃料)。本章介绍了光合作用能量储存的基本物理原理以及目前对光合器官结构和功能的理解。
光合作用一词的字面意思是“利用光进行合成”。正如我们将在本章中看到的,产氧光合生物(与植物一样,产生 O2 作为副产品)利用太阳能合成复杂的碳化合物。更具体地说,光能驱动碳水化合物的合成以及从二氧化碳和水中产生氧气。储存在这些碳水化合物分子中的能量以后可用于为植物中的细胞过程提供动力,并可作为所有生命形式的能量来源。本章讨论了光在光合作用中的作用、光合器官的结构以及从光激发叶绿素到合成 ATP 和 NADPH 的整个过程。
9.1 绿色植物的光合作用
维管植物中最活跃的光合组织是叶子的叶肉。叶肉细胞有许多叶绿体,叶绿体中含有专门吸收光的绿色色素,即叶绿素。在光合作用中,植物利用太阳能氧化水,从而释放氧气,并还原二氧化碳,从而形成大的碳化合物,主要是糖。最终导致 CO2 还原的一系列复杂反应包括类囊体反应和碳固定反应。
光合作用的类囊体反应发生在叶绿体中一种特殊的内膜,称为类囊体(见第 1 章)。这些类囊体反应的最终产物是高能化合物 ATP 和 NADPH,它们用于碳固定反应中糖的合成。这些合成过程发生在叶绿体的基质中,即围绕类囊体的水性区域。类囊体反应,也称为光反应,是本章的主题;碳固定反应将在第 10 章中讨论。
在叶绿体中,光能由两个称为光系统的不同功能单元转化为化学能。吸收的光能用于驱动电子通过一系列充当电子供体和电子受体的化合物进行的转移。大多数电子从 H2O 中提取,H2O 被氧化为 O2,最终将 NADP+ 还原为 NADPH。光能还用于在类囊体膜上产生质子动力势(见第 8 章);该质子动力势用于合成 ATP。
9.2 一般概念
在本节中,我们将探讨为理解光合作用奠定基础的基本概念。这些概念包括光的性质、色素的性质以及色素的各种作用。
光由具有特征能量的光子组成
光具有粒子和波的属性。波(图 9.1)的特征是波长,用lambda (λ) 表示,它是连续两个波峰之间的距离。频率用 nu (ν) 表示,是在给定时间内经过观察者的波峰数量。一个简单的方程式将任何波的波长、频率和速度联系起来:
c=λ×ν
其中 c 是波的速度 — 在本例中是光速(3.0 × 108 m•s-1)。光波是一种横向(左右)电磁波,其中电场和磁场都垂直于波的传播方向振荡,并且彼此成 90° 角。
光也可以被视为粒子,称为光子。每个光子都包含一定量的能量,这些能量不是连续的,而是以离散的水平传递的,称为量子。根据普朗克定律,光子的能量 (E) 取决于光的频率:
E= hν
其中 h 是普朗克常数(6.626 × 10-34 J•s)。光子如何与物质相互作用在很大程度上取决于它们的频率或能量,并且只有可见光谱中很窄的频率范围可用于光合作用(图 9.2)。能量低于红光的低频光子和能量高于紫光的高频光子不能驱动光合作用。
光合活性光的吸收会改变叶绿素的电子态
为了使光能为光合作用提供动力,必须捕获光能并将其转化为电或化学形式。该过程的第一步是与光合作用器官相关的色素吸收光。不同能量(或频率)的光以不同的方式与分子相互作用,从而诱导不同类型的转变。为了吸收光,吸收色素必须具有与光子能量相匹配的能量跃迁(光可激发的过程)。如果光子的能量与这种跃迁不完全匹配(即太低或太高),光就不会被吸收。因此,尽管照射到地球表面的阳光包含具有各种不同能量的光子,如图 9.3 所示,但只有一小部分光可用于光合作用。植物光合作用可以利用波长约为 400 至 700 nm 的光能(范围从紫色到红色和远红色波长,几乎与可见光谱相匹配;见图 9.2)。
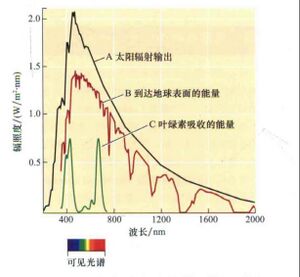
这种光子能量范围可以激发植物色素(主要是叶绿素)中的电子,从低能分子轨道到高能“激发态”(图 9.4)。叶绿素分子中的这种激发态是光反应的基本起点。相比之下,能量较低的红外辐射往往会激发化学键的振动或旋转,其能量会迅速以热量的形式消散,因此无法用于驱动光合作用。能量较高的光子(包括更深的紫外线)往往会直接电离分子,从本质上将电子从分子中击落,从而产生可能损害生物体的自由基化学材料。
图 9.3 中的蓝色曲线显示了叶绿体中典型叶绿素的吸收光谱。吸收光谱提供了分子或物质吸收的光能量与光波长的关系的量度。可以使用分光光度计确定特定物质的吸收光谱,如图 9.5 所示。分光光度法是用于测量样品对光的吸收的技术,在 WEB TOPIC 9.1 中有更详细的讨论。在许多情况下,吸收光谱被绘制为光的吸收率(在 y 轴上)与光的波长(在 x 轴上)的函数。但是,将吸收率绘制为频率的函数也是有益的,因为根据公式 9.2 所描述的关系,我们可以得到吸收率与光子能量的依赖关系。
叶绿素在我们眼中呈现绿色,因为它主要吸收光谱中红色和蓝色部分的光,因此未被吸收的光富含绿色波长(约 550 nm)(见图 9.3 和 9.4)。光的吸收可以用公式 9.3 表示,其中,叶绿素 (Chl) 在其最低能量或基态下吸收光子(表示为 hν)并转变为更高能量或激发态 (Chl*):
Chl + hν → Chl*
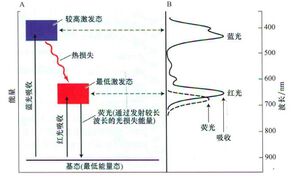
激发态分子中的电子分布与基态分子中的分布不同。红光的吸收通过将电子从低能轨道提升到高能轨道,将叶绿素激发到能量更高的“激发态”(图 9.4 中的“最低激发态”)。蓝光也可以被叶绿素吸收,最初产生的能量甚至比红光产生的更高(图 9.4 中的“更高激发态”)。
然而,这种高能激发态极不稳定,会迅速衰减到最低激发态,而最低激发态是驱动光合作用的反应的起点。初始光合作用反应必须非常迅速,才能战胜最低激发态的衰减;如果这些反应不使用激发态的能量,它最多只能持续几纳秒(1 纳秒 = 10-9秒)。
叶绿素的最低激发态可以通过几种替代途径衰减:
1. 激发叶绿素可以重新发射光子,从而返回到基态——这一过程称为荧光fluorescence。当它这样做时,荧光的波长比吸收波长略长(能量较低),因为在发射荧光光子之前,一部分激发能量被转化为热量。叶绿素在光谱的红色区域发出荧光(见图 9.4)。
2. 激发叶绿素可以直接将其激发能转化为热量,而不发射光子,从而返回基态。
3. 激发叶绿素可以参与能量转移,在此过程中,叶绿素将其能量转移给另一个分子,包括其他叶绿素。这样,数百个叶绿素分子可以在 50 到 100 纳米的长距离上转移能量。
4. 激发叶绿素可以形成一种高度活跃的状态,称为第一三线态叶绿素( triplet chlorophyll),它可以与氧气反应生成有毒副产物。
5. 激发态叶绿素可以引发光化学反应(photochemistry),其中激发态的能量引起化学反应,最终将能量储存在光合产物中。光合作用的光化学反应是已知最快的化学反应之一。这种速度是光化学胜过非储能衰减途径的必要条件。
光合色素吸收为光合作用提供能量的光
阳光的能量首先被植物的色素吸收。所有参与光合作用的色素都存在于叶绿体中。图 9.6 和 9.7 分别显示了几种光合色素的结构和吸收光谱。叶绿素和菌绿素( chlorophylls and bacteriochlorophylls )(某些细菌中发现的色素)是光合生物的典型色素。
叶绿素a 和 b 在绿色植物中含量丰富,而叶绿素 c、d 和 f 则存在于一些原生生物和蓝藻中。已发现几种不同类型的细菌叶绿素;a 型分布最广。WEB 主题 9.2 显示了不同类型光合生物中色素的分布。
所有叶绿素都具有复杂的环状结构,该结构在化学上与血红蛋白和细胞色素中的血红素基团相关(见图 9.6A)。长烃尾几乎总是附着在环状结构上。尾部将叶绿素锚定在其环境的疏水部分。环状结构包含一些松散结合的电子,是分子中参与电子跃迁和氧化还原(还原-氧化)反应的部分。
光合生物中发现的不同类型的类胡萝卜素是具有多个共轭双键的分子(见图 9.6B)。400 至 500 nm 区域的吸收带使类胡萝卜素呈现出其特有的橙色。例如,胡萝卜的颜色是由类胡萝卜素 β-胡萝卜素引起的,其结构和吸收光谱分别如图 9.6 和 9.7 所示。
类胡萝卜素存在于所有已知的天然光合生物中。类胡萝卜素是类囊体膜的组成成分,通常与构成光合器官的许多蛋白质密切相关。类胡萝卜素吸收的光能可以转移到叶绿素中进行光合作用;由于这种作用,它们被称为辅助色素。类胡萝卜素还有助于保护生物体免受光损伤,因为它可以“猝灭”三重态叶绿素等反应性中间体(见第 9.8 节和第 11 章)。
9.3 了解光合作用的关键实验
建立光合作用的整体化学方程式需要几百年的时间,需要许多科学家的贡献(历史发展的文献参考可以在本书的网站上找到)。1771 年,约瑟夫·普里斯特利 (Joseph Priestley) 观察到,一根蜡烛烧完后,在空气中生长的薄荷枝会再生空气中的某种物质,这样另一根蜡烛就可以燃烧。他发现了植物释放氧气的过程。 1779 年,荷兰生物学家 Jan Ingenhousz 记录了光在光合作用中的重要作用。
其他科学家确定了 CO2和 H2O 的作用,并表明有机物(特别是碳水化合物)是光合作用和氧气的产物。到十九世纪末,光合作用的平衡总体化学反应可以写成如下形式:
6CO2 + 6H2O→C6H12O6+6O2
其中 C6H12O6代表单糖,例如葡萄糖。正如我们将在第 10 章中讨论的那样,葡萄糖不是碳的实际产物固定反应,因此不应仅从字面上理解方程的这一部分。然而,实际反应在能量上与这里表示的大致相同。
光合作用的化学反应很复杂。目前至少已确定了 50 个中间反应步骤,并且毫无疑问还会发现更多步骤。20 世纪 20 年代,对不产生氧气作为最终产物的光合细菌的研究为光合作用的基本化学过程的化学性质提供了早期线索。从对这些细菌的研究中,C. B. van Niel 得出结论,光合作用是一个氧化还原过程。这一结论已成为所有后续光合作用研究的基础概念。
现在我们来讨论光合作用活性与吸收光光谱之间的关系。讨论一些有助于我们目前对光合作用的理解的关键实验,和光合作用的基本化学反应方程式。
作用光谱将光吸收与光合作用活动联系起来
作用光谱的使用对于我们目前对光合作用的理解的发展至关重要。作用光谱action spectrum描述了不同波长的光在促进生物反应方面的有效性。例如,可以通过测量不同波长下光强度(每秒每单位面积的光子数)增加时氧气释放速率来构建光合作用的作用光谱(图 9.8)。 (因为光合作用在强光下达到饱和,所以应在极低光照下测量氧气释放率,或通过半饱和点估计。)当特定波长强度的光被光合色素更有效地吸收时,其诱导光合作用的效率会更高。因此,作用光谱可以识别负责特定光诱导现象的发色团(色素)。
一些最早的作用光谱是由 T. W. Engelmann 在 19 世纪后期测量的(图 9.9)。Engelmann 使用棱镜将阳光散射成彩虹,然后落在水生藻类细丝上。将一群好氧的细菌引入系统。细菌会聚集在细丝中释放出最多氧气的区域。那是被蓝光和红光照亮的区域,这两种光被叶绿素强烈吸收。如今,作用光谱可以在房间大小的光谱仪中测量,其中一个巨大的单色仪将实验样品沐浴在单色光中。该技术更加复杂,但原理与恩格尔曼的实验相同。
作用光谱的一个特殊版本测量的是植物实际吸收的光的有效性,而不是总入射光。在这种情况下,光合作用的量子产率quantum yield——吸收光的分数可以计算出实际用于驱动高效光合作用的能量。正如我们在本节后面讨论的那样,低光照下光合作用的量子产率可以接近 1.0,这意味着几乎每个被吸收的光子都用于驱动光合作用。作用光谱对于发现在 O2释放的光合生物中运行的两个不同光系统非常重要。然而,在介绍这两个光系统之前,我们需要描述捕光的天线分子和光合作用的能量需求。
光合作用发生在包含光收集天线和光化学反应中心的复合体中
叶绿素和类胡萝卜素吸收的一部分光能最终通过形成化学键以化学能的形式储存起来。这种能量从一种形式到另一种形式的转化是一个复杂的过程,依赖于许多色素分子和一组电子转移蛋白之间的合作。
大多数色素充当天线复合物,收集光并将能量传输到反应中心复合物,在那里发生化学氧化和还原反应,从而实现长期能量储存(图 9.10)。本章后面将讨论一些天线和反应中心复合物的分子结构。
植物如何从天线和反应中心色素之间的这种分工中受益?即使在明亮的阳光下,单个叶绿素分子每秒也只能吸收几个光子。如果每个完整的反应中心都仅连接一个叶绿素分子,那么反应中心的酶大部分时间都会处于闲置状态,只是偶尔被光子吸收激活。但是,如果有多个色素分子把能量一起运输到一个共同的反应中心,系统在很大一部分时间内保持活跃。
1932 年,罗伯特·埃默森和威廉·阿诺德进行了一项关键实验,为光合作用过程中许多叶绿素分子在能量转换中的合作提供了第一个证据。他们将非常短暂(10-5秒)的闪光照射到绿藻Chlorella pyrenoidosa悬浮液中,并测量了产生的氧气量。闪光间隔约 0.1 秒,Emerson 和 Arnold 在早期研究中已经证明这个时间足够长,以至于可以在下一次闪光到来之前完成该过程的酶促步骤。研究人员改变了闪光的能量,发现在高能量下,当提供更强烈的闪光时,氧气产量不会增加:即光合作用系统被光饱和(图 9.11)。
在测量氧气产生与闪光能量的关系时,Emerson 和 Arnold 惊讶地发现,在饱和条件下,样品中每 2500 个叶绿素分子仅产生 1 个氧气分子。我们现在知道,每个反应中心都与数百个色素分子有关,每个反应中心必须运行四次才能产生 1 个氧分子,因此每个O2需要 2500 个叶绿素。
反应中心和大多数天线复合体是类囊体膜(光合膜)的组成部分。在真核光合生物中,这些膜位于叶绿体中;在光合原核生物中,光合作用的场所是质膜或由其衍生的膜。
光合作用的化学反应由光驱动
有一点要注意,公式 9.4 中所示的化学反应在能量上是上坡的,这意味着它不能在没有大量能量输入的情况下进行。公式 9.4 的平衡常数是根据所涉及每种化合物的生成自由能表计算得出的,约为 10-500。这个数字非常接近于零,因此我们可以确信,在整个宇宙历史中,没有一个葡萄糖分子是在没有外部能量的情况下由 H2O 和 CO2 自发形成的。驱动光合作用所需的能量来自光。以下是公式 9.4 的更简单形式:
CO2+ H2O → (CH2O) + O2
其中 (CH2O) 是葡萄糖分子的六分之一。大约需要十个光子来驱动公式 9.5 的反应。
光驱动 NADP+的还原和 ATP 的形成
光合作用的整个过程是氧化还原反应,其中电子从一种化学物质中移除,从而将其氧化,并添加到另一种化学物质中,从而将其还原。1937 年,罗伯特·希尔发现,在光照下,分离的叶绿体类囊体会还原多种化合物,例如铁盐。这些化合物代替 CO2 充当氧化剂,如以下方程所示:
4Fe3++2H2O → 4Fe2++O2+4H+
此后,许多化合物已被证明可充当人工电子受体,即后来的希尔反应。人工电子受体的使用对于阐明碳还原之前的反应具有不可估量的价值。氧气释放与人工电子受体还原相关的证明首次证明了氧气释放可以在没有二氧化碳的情况下发生,并导致了现在被接受和证实的观点,即光合作用中的氧气来自水,而不是二氧化碳。
我们现在知道,在光合作用系统正常运作期间,光会还原 NADP+,而 NADP+ 又充当卡尔文-本森循环中碳固定的还原剂(见第 10 章)。ATP 也是在电子从水流向 NADP+ 的过程中形成的,它也用于碳还原。
水被氧化为氧气、NADP+ 被还原为 NADPH 并形成 ATP 的化学反应被称为类囊体反应(thylakoid reactions),因为几乎所有的反应直到 NADP+ 还原都发生在类囊体中。碳固定和还原反应被称为基质反应,因为碳还原反应发生在叶绿体的亲水性区域,即基质中。虽然这种划分有些武断,但在概念上很有用。
放氧生物有两个串联运作的光系统
光合作用的光反应涉及两种光化学反应中心,包含在光系统 I 和 II(PSI 和 PSII)内,它们串联运作以进行光合作用的早期能量储存反应。PSI 优先吸收波长大于 680 nm 的远红光;PSII 优先吸收 680 nm 的红光,远红光驱动力很弱。光系统之间的另一个区别是:
● PSI 产生一种强还原剂,能够还原 NADP+,以及一种弱氧化剂。
● PSII 产生一种非常强的氧化剂,能够氧化水,以及一种比 PSI 产生的还原剂更弱的还原剂。
PSII 产生的还原剂重新还原 PSI 产生的氧化剂。图 9.12 以示意图的形式显示了这两个光系统的这些特性(参见 WEB主题 9.4)。
图 9.12 中描绘的光合作用方案称为 Z 方案(Z scheme ,因为它看起来像字母 Z),已成为理解释放 O2的(产氧)光合生物的基础。它解释了两个物理和化学上不同的光系统(I 和 II)的运作,每个系统都有自己的天线色素池和光化学反应中心。这两个光系统通过电子传输链连接。
地球上生命所需的几乎所有能量都来自光合作用,因此其效率控制着我们生态系统的最大总生产力。两个不同的参数决定了光合作用的效率:量子产率quantum yield和能量转换效率energy conversion efficiency。
图 9.11 所示的图表使我们能够计算光化学量子产率 ( quantum yield of photochemistry,Φ),其定义如下:
Φ = 光化学产物数量/吸收光量子总数
在低光强度下,随着光强度的增加,曲线显示出最高的、几乎线性的氧气释放量增加。在此范围内,光化学量子产率可高达 0.95,这意味着叶绿素吸收的 95% 的光子用于光化学。由于稳定的光合成产物 O2和固定 CO2(糖)的形成需要多个光化学事件,因此其形成的量子产率低于光化学量子产率。大约需要十个光子来产生一个 O2 分子,因此 O2产生的量子产率约为 0.1,即使该过程中每个光化学步骤的量子产率接近 1.0。有关量子产率的更详细讨论,请参见 WEB TOPIC 9.3。
虽然最佳条件下的光化学量子产率接近 1.0,但光合作用储存的能量部分(即能量转换效率energy conversion efficiency)要少得多。造成这种能量损失的一个主要原因是光子的能量被吸收,并在光反应中生成一系列中间体,最终形成 O2、NADPH 和 ATP。 The equilibrium constant for each step in this process has a large drop in free energy,这确保了正向反应比逆向反应快得多。这样,光子的能量就被“捕获”,防止其因逆反应而损失,从而增加了光捕获的量子产率,但代价是总能量存储的损失。
当 680 nm 红光被吸收时,每形成 1 摩尔氧气,总能量输入(见公式 9.2)为 1760 kJ。这个能量足以驱动公式 9.5 中的反应,该反应的标准态自由能变化为 +467 kJ•mol-1。因此,680 nm 红光子(最佳波长)的光能转化为化学能的最大效率约为 27%。蓝光也被光系统强烈吸收,量子效率相似。蓝色光子的能量含量比红色光子高出约 50%,但一旦被吸收,这些额外的能量就会迅速损失,导致形成稳定产品的能量转换效率降低。来自太阳的白光由光合有效辐射范围的光子组成,范围从约 400 到 700 nm,平均能量转换效率介于红色和蓝色光子之间。
在较高的光强度下,光合作用受到下游过程(例如 CO2 的固定)的限制,从而导致量子效率quantum efficiencies降低。图 9.11 显示,光合作用对光的响应在较高的光照下饱和。请注意,图 9.11 显示了短暂闪光的光饱和曲线,但在恒定光照下的曲线的总体形状是相似的。光强度越高,光合作用对进一步增加光强度的响应斜率越小。曲线的平坦化意味着光反应的量子效率在高光强度下会降低 - 也就是说,光子能量中的大部分会以热量的形式损失。当光子的到达速度慢于系统可以使用它们的最大速率时,系统就会“受光限制”。但是当光强度增加时,光子到达的速度会比可以使用的速度更快。正如我们在第 9.8 节中讨论的那样,光照过多会导致反应中间体的积累,从而导致光损伤。为了防止这些情况,植物会下调对光的捕获,从而将更多的能量以热量的形式耗散。
光反应产生的大部分能量都以固定碳的形式储存起来。这些固定碳中的大部分随后用于细胞维持过程,一小部分用于产生新的生物质(见第 11 章)。因此,制造新植物物质的总体能量转换效率只有百分之几,远低于理论最大值,限制了我们环境中可用的能量(以及二氧化碳的吸收率)。减少这些大量的能量损失是提高作物生产力的目标,尽管目前尚不清楚在多大程度上可以实现这一目标,同时仍能保持植物在其环境中的稳健性。
9.4 光合器官的构成
上一节解释了光合作用的一些物理原理、各种色素的功能作用的某些方面以及光合生物进行的一些化学反应。现在我们来讨论光合作用器官的结构及其组成部分的结构,并了解系统的分子结构如何导致其功能特征。
叶绿体是光合作用的场所
在具有光合作用的真核生物中,光合作用发生在称为叶绿体的亚细胞器中(见第 1 章)。图 9.13 显示了豌豆叶绿体的薄切片的透射电子显微照片。叶绿体结构最引人注目的方面是被称为类囊体的广泛内部膜系统。所有叶绿素包含在该膜系统内,这是光合作用的光反应的位点。
由水溶性酶催化的碳还原反应发生在基质stroma中,即类囊体外部的叶绿体区域。大多数类囊体似乎彼此非常紧密地联系在一起。这些堆叠的膜称为基粒片层grana lamellae(每一堆称为一个基粒granum),而没有堆叠的暴露膜称为基质片层stroma lamellae。
两层独立的膜,每个膜由脂质双层组成,合称为被膜envelope,包围大多数类型的叶绿体(图 9.14)。这种双膜系统包含各种代谢物运输系统。叶绿体还包含自己的 DNA、RNA 和核糖体。一些叶绿体蛋白质是叶绿体自身转录和翻译的产物,而其他大多数蛋白质由核 DNA 编码,在细胞质核糖体上合成,然后导入叶绿体。这种显著的分工在许多情况下延伸到同一酶复合物的不同亚基,本章后面将对此进行更详细的讨论。有关叶绿体的一些动态结构,请参阅 WEB ESSAY 9.1。
类囊体含有完整的膜蛋白
光合作用所必需的多种蛋白质都嵌入在类囊体膜中。在许多情况下,这些蛋白质的部分延伸到类囊体两侧的水性区域。这些完整的膜蛋白含有大量疏水性氨基酸,因此在非水性介质(如膜的碳氢化合物部分)中更稳定(见图 1.13)。
反应中心、天线色素-蛋白质复合物和大多数电子载体蛋白质都是整合膜蛋白。在所有已知情况下,叶绿体的整合膜蛋白在膜内具有独特的方向。类囊体膜蛋白有一个区域指向膜的基质侧,另一个区域指向类囊体的内部空间,称为内腔lumen(见图 9.14)。
类囊体膜中的叶绿素和类胡萝卜素以非共价但高度特异性的方式与蛋白质结合,从而形成色素蛋白复合物,其结构组织可优化能量向反应中心的传递和随后的电子传递。
光系统 I 和 II 在类囊体膜中空间分离
PSII 反应中心及其天线叶绿素和相关电子传递蛋白主要位于基粒片层中(图 9.15A)。PSI 反应中心及其相关天线色素和电子传递蛋白以及催化 ATP 形成的 ATP 合酶几乎全部位于基质片层和基粒片层边缘。连接两个光系统的电子传递链的细胞色素b6f 复合物分布在基质和基粒片层之间。所有这些复合物的结构如图 9.15B 所示。
发生在O2 释放光合作用中的两个光化学事件在空间上是分开的。这种分离要求移动载体在两个光系统之间移动电子,从基粒区域到类囊体的基质区域。这些可扩散的载体是氧化还原辅因子质体醌 (PQ) 和蓝色的铜蛋白质体蓝素 (PC),它们分别将电子从 PSII传送到细胞色素 b6f 复合物,和从细胞色素 b6f 复合物传送到 PSI,我们将在后面的第 9.6 节中详细讨论。此外,PSII 对水的氧化作用会将质子释放到基粒腔内(见第 9.6 节),这些质子必须扩散到基质层才能到达 ATP 合酶,然后用来驱动 ATP 的合成。PSI 和 PSII 之间这种巨大距离(几十纳米)的功能意义尚不完全清楚,但据认为,它允许两个光系统自我组织,从而提高两个光系统之间的能量分配效率。
类囊体中的 PQ 和 PC 分子比光中心多,这些电子载体“池”可以与多个 PSI 或 PSII 复合物相互作用。这使得光系统可以协同作用,而无需两个光系统之间严格的一对一化学计量或它们被光激发。相反,PSII 反应中心将还原当量送入脂溶性电子载体(质体醌)的公共中间池。PSI 反应中心从公共池中移除还原当量,而不是从任何特定的 PSII 反应中心复合体中移除。在某些物种中,包括许多维管植物,类囊体中的 PSII 相对多于 PSI,但在蓝藻中,PSI 的比例通常更高。这些不同化学计量的原因尚不完全清楚,但据认为它们有助于防止反应中间体的积累,并通过控制线性和循环电子流的相对速率来平衡 ATP 和 NADPH 的相对需求(参见第 9.7 节)。
不产氧光合细菌具有单个反应中心
不释放氧气(不产氧)生物仅包含单个光系统,类似于光系统 I 或II。这些较简单的生物对于详细的结构和功能研究非常有用,有助于更好地理解有氧光合作用。在大多数情况下,这些不产氧光系统进行循环电子转移,没有净还原或氧化。光子的部分能量被保存为质子动力(参见第 9.7 节),并用于制造 ATP。
紫色光合细菌的反应中心是第一个具有高分辨率结构的完整膜蛋白(参见 WEB 主题9.5)。对这些结构的详细分析以及对大量突变体的表征揭示了所有反应中心进行的能量存储过程中涉及的许多原理。
紫色细菌反应中心的结构在很多方面与产氧生物的 PSII 相似,尤其是在链的电子受体部分。构成细菌反应中心核心的蛋白质在序列上与 PSII 对应物相对相似,暗示了进化的相关性。与 PSI 相比,厌氧绿色硫细菌和日光菌的反应中心也发现了类似的情况。第 9.9 节讨论了这种模式的进化意义。
9.5 光吸收天线系统的组织
不同类别的光合生物的天线系统差异很大,而反应中心似乎也相似,即使在远亲生物中也是如此。天线复合体的多样性反映了不同生物对不同环境的进化适应,以及某些生物需要平衡两个光系统的能量输入。在本节中,我们将了解能量传递过程如何吸收光并将能量传递到反应中心。
天线系统含有叶绿素,与膜相关
天线系统的功能是将能量有效地传递到与其相关的反应中心。天线系统的大小在不同生物体中差异很大,从某些光合细菌中每个反应中心 20 到 30 个细菌叶绿素到维管植物中每个反应中心通常 200 到 300 个叶绿素,再到某些类型的藻类和细菌中每个反应中心几千个色素。天线色素的分子结构也相当多样,尽管它们都以某种方式与光合膜相关。在几乎所有情况下,天线色素都与蛋白质连接,形成色素-蛋白质复合物。
激发能量从吸收光的叶绿素传递到反应中心的物理机制主要通过荧光共振能量转移(通常缩写为 FRET)发生。通过这种机制,激发能量通过非辐射过程从一个分子转移到另一个分子。
共振转移的一个有用类比是两个音叉之间的能量转移。如果一个音叉被敲击并正确放置在另一个音叉附近,第二个音叉会从第一个音叉接收一些能量并开始振动。两个音叉之间的能量传递效率取决于它们之间的距离和相对方向,以及它们的振动频率或音高。类似的参数影响天线复合体中能量传递的效率,其中能量代替音高。
天线复合物中的能量传递通常非常有效:天线色素吸收的光子中约有 95% 到 99% 的能量被传递到反应中心,在那里可用于光化学反应。天线中色素之间的能量传递与反应中心发生的电子传递之间存在重要区别:能量传递是纯物理现象,而电子传递涉及化学(氧化还原)反应。
天线将能量集中到反应中心
天线内将吸收的能量集中到反应中心的色素序列具有吸收最大值,并逐渐向较长的红色波长移动(图 9.16)。吸收最大值的红移意味着激发态的能量在靠近反应中心时比在天线系统的外围部分略低。这种能量损失有助于推动剩余能量流向反应中心,在那里它可以启动光化学光反应。
由于这种安排,当激发从在 650 nm 处最大吸收的叶绿素 b 分子转移到在 670 nm 处最大吸收的叶绿素 a 分子时,这两个激发叶绿素之间的能量差异会以热量的形式损失到环境中。
为了将激发转移回叶绿素 b,必须重新补充以热量形式损失的能量。因此,反向转移的概率较小,因为热能不足以弥补低能量色素和高能量色素之间的差距。这种效应使能量捕获过程具有一定程度的方向性或不可逆性,使激发能更有效地传递到反应中心。本质上,系统牺牲了每个量子的一些能量,因此几乎所有的量子都可以被反应中心捕获。
许多天线色素-蛋白质复合物具有共同的结构基序
在所有含有叶绿素a和叶绿素b的真核光合生物中,最丰富的天线蛋白是结构相关蛋白质大家族的成员。其中一些蛋白质主要与PSII相关,被称为光捕获复合物II(LHCII)蛋白。其他的与 PSI 相关,被称为光捕获复合物 I (LHCI) 蛋白。这些天线复合物也称为叶绿素 a/b 天线蛋白。
其中一种 LHCII 蛋白的结构已被确定(图 9.17)。该蛋白含有三个 α 螺旋区域,可结合 14 个叶绿素 a 和 b 分子以及4个类胡萝卜素分子。LHCI 蛋白的结构通常与 LHCII 蛋白的结构相似。所有这些蛋白都具有显著的序列相似性,几乎肯定是共同祖先蛋白的后代。
类胡萝卜素或叶绿素 b 在 LHC 蛋白质中吸收的光被迅速转移到叶绿素 a,然后转移到其他含叶绿素的天线色素上。LHCII 复合物还参与调节过程,我们将在第 9.8 节中讨论。
9.6 电子传输机制
本章前面讨论了导致两个光化学反应串联运行的想法的一些证据。在本节中,我们将更详细地考虑光合作用过程中电子转移所涉及的化学反应。我们讨论了光对叶绿素的激发和第一个电子受体的还原、电子通过光系统 II 和 I 的流动、作为电子主要来源的水的氧化以及最终电子受体 (NADP+) 的还原。介导 ATP 合成的化学渗透机制将在第 9.7 节中详细讨论。
来自叶绿素的电子穿过按照Z方案组织的载体
图 9.18 显示了 Z 方案的简化版本,其中已知在从 H2O 到 NADP+ 的电子流中起作用的所有电子载体都以它们的中点氧化还原电位垂直排列,这可用于估计与未激发(或基态)相比在这些状态下存储的能量(有关更多详细信息,请参阅 WEB 主题 9.6)。已知相互反应的组分通过箭头连接,因此 Z 方案实际上是动力学和热力学信息的综合。垂直的大箭头表示光能输入到系统中。请注意,Z 方案的这种“能量图”视图并不表示各种状态的位置变化,也不暗示它们在这些方向上物理移动。这些反应的空间表示如图 9.19 所示,以及如图 9.15 所示的更详细的分子视图。
光子激发反应中心的特化叶绿素(PSII 为 P680;PSI 为 P700),并释放出一个电子。然后,电子穿过一系列电子载体,最终还原 P700(PSII 中的电子)或 NADP+(PSI 中的电子)。以下大部分讨论都描述了这些电子的运动,以及这些运动如何导致能量储存于最终产物中。
构成光合作用光反应的几乎所有化学过程都是由四种主要的蛋白质复合物进行的:PSII、细胞色素 b6f 复合物、PSI 和 ATP 合酶。这些四个必需的膜复合物在类囊体膜中以矢量方式定向,以发挥以下功能(见图 9.15 和 9.19):
● PSII 将类囊体腔内的水氧化为氧气,并在此过程中将质子释放到腔内。光系统 II 的还原产物是质体氢醌 (PQH2)。总反应导致电子从类囊体腔转移到类囊体膜基质侧,以及质子被释放到基质中(来自水氧化),和质子从基质中被吸收(通过 PQ 还原为 PQH2)。
● 细胞色素 b6f 氧化被PSII还原的PQH2 分子,并通过可溶性铜蛋白质体蓝素将电子传递给PSI。该氧化过程是一个复杂的循环,称为Q循环,涉及一系列电子和质子转移反应,不仅为PSI提供电子,还贡献于类囊体质子动力势(参见图9.25)。氧化涉及从PQH2 中移除两个质子和两个电子,形成PQ。该过程发生在PQH2 氧化位点,称为Qo,该位点面向类囊体腔,因此两个质子被释放到腔中。来自PQH2 的一个电子被转移到细胞色素 f,然后到质体蓝素,最终到PSI。另一个来自PQH2 的电子通过一系列血红素链转移,穿过类囊体膜从腔到基质侧。该电子转移导致另一个PQ分子被还原,从基质中摄取质子,同时在类囊体膜上产生一个电场(腔侧为正)。
● PSI 通过铁氧还蛋白 (Fd) 和黄素蛋白,铁氧还蛋白 - NADP+ 还原酶 (FNR) 的作用将基质中的 NADP+ 还原为 NADPH。总的反应导致电子从腔转移到类囊体膜的基质侧。
● 当质子从腔中扩散回基质时,ATP 合酶从 ADP 和无机磷酸盐 (Pi) 合成 ATP。总的反应导致质子从腔转移到类囊体膜的基质侧。
当激发态叶绿素还原电子受体分子时,能量被捕获。
如第 9.5 节所述,光的作用是激发反应中心的特殊叶绿素,要么通过直接吸收,要么更常见的是通过天线色素的能量转移。这种激发过程可以设想为电子从叶绿素能量最高的填充轨道移动到能量最低的未填充轨道(图 9.20)。较高的轨道具有较高的自由能,电子与叶绿素的结合较松散,如果附近有可以接受电子的分子,电子很容易丢失。
这个过程之所以发生,是因为激发态叶绿素的一个关键特性,该特性使它能够充当强电子供体(还原剂)和强电子受体(氧化剂)。如图 9.20 所示,基态叶绿素在其一个轨道上有一对电子(用上下箭头表示)。该轨道被两个不同自旋的电子占据,这一事实使该状态非常稳定,因此不容易丢失或获得电子。
激发该叶绿素会将两个电子中的一个提升到更高的轨道;在这种状态下,两个轨道仅部分填充,因此不稳定。如果这种激发的叶绿素不能与其他分子反应,它将重新形成基态并以荧光(光)或热量的形式损失多余的能量。但是,如果激发的叶绿素可以与附近的分子相互作用,它可以进行二次光化学反应,因为两个部分填充的轨道是反应性的。其中一个轨道可以很容易地放弃电子,使其成为强还原剂,而另一个轨道可以很容易地接受电子,使其成为强氧化剂,如图 9.20 所示。
在反应中心,第一个光化学反应涉及叶绿素上的激发电子转移到受体分子,形成电荷分离状态,其中还原电子受体带负电荷,叶绿素带正电荷。 (请注意,反应中心的总电荷保持不变;也就是说,电子不是由光“产生”的,而是被重新排列或从一个状态或分子移动到其他状态或分子。)PSI 和 PSII 反应中心具有不同的具体反应,正如我们在本节后面讨论的那样,但它们都涉及一系列类似的电子转移过程。
正如我们在第 9.2 节中提到的那样,叶绿素的激发态在几纳秒内衰减,以热量或荧光的形式损失其能量。为了与这种非生产性衰减相抗衡,光合作用的初始步骤必须非常快。换句话说,导致光合作用产物的“正向”速率必须比非生产性衰减快得多。事实上,PSI 和 PSII 中初始电荷分离态的形成速度比激发态的衰减速度快 1000 倍左右,仅需几皮秒(1 皮秒 = 10-12 秒)。如此快速的电子转移反应要求供体和受体分子紧密堆积在一起,并具有优化的能级以实现快速电子转移。这些要求由反应中心的特定结构满足,稍后将进行讨论。
从激发叶绿素到电荷分离态会导致一些能量损失,但第一个电荷分离态仍然非常不稳定。电子可以返回反应中心叶绿素并重新形成基态,同时损失所有储存的能量。然而,这种浪费的重组(recombination)过程似乎并没有在任何一个功能性反应中心中达到可观的程度。相反,受体将其多余的电子转移给次级受体,依此类推,沿着电子载体链向下移动。我们将此链称为受体侧电子载体,因为它们从激发的反应中心叶绿素接受电子。同时,氧化的叶绿素可以从附近的电子供体中提取电子,我们将其称为供体侧电子载体,因为它们最终将电子提供给反应中心叶绿素阳离子。供体侧反应产生完全还原的叶绿素,从而阻止电子从受体侧载体返回。
每个电子转移步骤(在受体侧和供体侧)都会逐渐稳定反应中心的电荷分离状态,从而防止重组。但是,由于能量守恒,这种稳定会导致能量损失,因此状态越稳定,其包含的能量就越少。这种权衡部分解释了第 9.3 节中讨论的量子产率和能量转换效率的差异。由于后续的电荷分离状态逐渐变得更加稳定,因此后续的正向反应也可能更慢。这很重要,因为最终由光反应驱动的生化反应比初始光化学反应慢得多,时间范围从毫秒到秒。
两个光系统的反应中心叶绿素吸收不同波长的光
正如本章前面所讨论的,PSI 和 PSII 具有不同的吸收特性。例如,反应中心叶绿素的还原态和氧化态具有不同的吸收光谱,可以使用分光光度计测量样品吸收的不同波长的光量(见图 9.5)。在氧化状态下,叶绿素在光谱的红色区域失去其特征性的强光吸收;它们被漂白。因此,可以通过时间分辨光学吸光度测量来监测这些叶绿素的氧化还原状态,其中直接监测这种漂白(参见 WEB 主题 9.1)。
使用此类技术,发现 PSI 的反应中心叶绿素在其还原(基态)状态下在 700 nm 处吸收最大。因此,这种叶绿素被命名为 P700(P 代表色素)。PSII 的类似光学瞬变在 680 nm,因此其反应中心叶绿素被称为 P680。紫色光合细菌的反应中心细菌叶绿素也被类似地鉴定为 P870。
细菌反应中心的 X 射线结构(参见 WEB 主题 9.5)清楚地表明 P870 是紧密耦合的细菌叶绿素对,或称二聚体,而不是单个分子。PSI(P700)和 PSII(P680)的主要供体也由叶绿素a 分子组成,尽管它们可能并非以有功能的二聚体发挥作用。在氧化状态下,反应中心叶绿素含有一个未配对电子。
PSII 反应中心是多亚基色素-蛋白质复合物


PSII 包含在多亚基蛋白质超复合物中(图 9.21)。在维管植物中,多亚基蛋白质超复合物具有两个完整的反应中心和一些天线复合物。反应中心的核心由两种膜蛋白(称为 D1 和 D2)以及其他蛋白质组成,如图 9.22 和 WEB TOPIC 9.8 所示。
主要供体有叶绿素、其他叶绿素、类胡萝卜素、脱镁叶绿素和质体醌(本节后面描述的两种电子受体)与膜蛋白 D1 和 D2 结合。这些蛋白质与紫色细菌的 L 和 M 肽具有一些序列相似性。其他蛋白质充当天线复合物或参与氧气释放。有些蛋白质,如细胞色素 b559,没有已知功能,但可能参与 PSII 周围的保护循环。
水被 PSII 氧化为氧气
水的氧化过程遵循以下化学反应:
2 H2O → O2+ 4H++ 4e-
该方程式表明,两个水分子中失去了四个电子,生成一个氧分子和四个氢离子(质子)。(有关氧化还原反应的更多信息,请参阅 WEB 附录 1 和 WEB 主题 9.6)。
水是一种非常稳定的分子。水氧化形成分子氧需要形成一种极强的氧化剂。光合氧气释放复合体 (OEC) 是唯一已知的进行此反应的生化系统,它是地球大气中几乎所有氧气的来源。
许多研究提供了大量有关氧气释放的信息(请参阅 WEB 主题 9.7)。高分辨率晶体结构和广泛的生物物理测量表明,OEC含有一个催化簇,含有四个锰 (Mn) 离子,以及 Cl– 和 Ca2+ 离子(参见 WEB 主题 9.7)。PSII 的 D1 蛋白含有一种特殊的酪氨酸残基,称为 YZ,它充当激发叶绿素 P680 的主要电子供体(见图 9.18),形成自由基氧化酪氨酸残基,进而从 OEC 中提取电子。 PSII 的每次连续激发都会导致 OEC 发生额外的氧化,从而产生一系列渐进的氧化状态 - 称为 S 状态,标记为 S0、S1、S2、S3 和 S4(参见 WEB 主题 9.7)。
当 OEC 中积累了四个氧化当量时,它会从两个 H2O 分子中提取四个电子以生成 O2。水的氧化还会将四个质子释放到类囊体腔中(参见图 9.19),这些质子最终通过 ATP 合酶的易位从腔转移到基质(参见第 9.7 节)。
脱镁叶绿素和两个醌从 PSII 接受电子
脱镁叶绿素(叶绿素中镁离子被两个氢离子取代的衍生物)是光系统II的早期电子受体。该结构变化使其化学与光谱特性区别于含镁叶绿素。脱镁叶绿素将电子传递给铁离子邻近的两个质体醌复合体。该过程与紫色细菌反应中心高度相似(详见网络专题9.5图9.5.B)。

两种质体醌(PQA与PQB)结合于反应中心,并依次从脱镁叶绿素接受电子。PQA每次仅能接受一个电子,因此其作为中继站将电子从脱镁叶绿素传递至PQB。PQB的功能更为复杂:在PSII首次激发后,PQB可接受一个电子,形成稳定紧密结合的自由基中间体(质体半醌)(图9.23);第二次PSII激发导致其从类囊体基质侧摄取两个质子,形成完全还原的质子化的质体氢醌(PQH2)。随后PQH2从反应中心复合体解离,进入膜疏水区域,将电子传递给细胞色素b6f复合体。此时PSII上空的QB位点可被氧化型PQ占据,重新形成PQB。
不同于类囊体膜的大型蛋白复合体,PQH2作为小型非极性分子,无论在完全氧化态(PQ)或完全还原态(PQH2)均可自由扩散于膜双分子层的非极性核心区域。这使PQ / PQH2系统能充当跨膜电子与质子穿梭载体。
流经细胞色素b6f复合体的电子亦运输质子

细胞色素b6f复合体是含多种辅基的大型多亚基蛋白(图9.24)。该复合体为功能性二聚体,包含两个b型血红素与一个c型血红素(细胞色素f)。c型细胞色素中血红素与蛋白共价连接;b型细胞色素中化学结构相似的原血红素基团则非共价连接(参见网络专题9.8)。此外,复合体含有一个里斯克铁硫蛋白(以发现者命名),其中两个铁离子通过两个硫离子桥接。多数辅因子的功能类似于线粒体细胞色素bc1复合体(在氧化磷酸化中起作用,详见第13章)。但细胞色素b6f复合体还包含其他辅因子,包括额外血红素基团(称血红素cn)、一个叶绿素和一个类胡萝卜素,其功能尚未完全阐明。
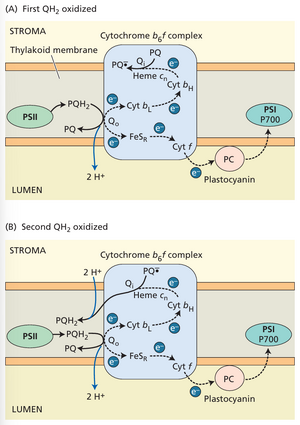
细胞色素b6f复合体及与之相关的线粒体电子传递链中的细胞色素bc1复合体,均通过一种称为Q循环的机制运作。该机制由彼得·米切尔于1975年首次提出,后经众多研究者修正(图9.25)。此机制中,由光系统II(PSII)光激发(见前文)或其他过程(见下段)形成的PQH2结合在类囊体腔侧的Qo位点。PQH2上的一个电子转移至Rieske铁硫中心,随后传递至细胞色素f、质蓝素(PC),最终到达光系统I的P700。从结合在Q位点的PQH2中移出一个电子会形成高活性质体半醌,该物质将电子传递给邻近的b型血红素。该电子随即通过b型和cn型血红素横跨类囊体膜,转移至另一结合位点Qi。需注意,图9.25显示b型血红素的还原在自由能层面呈"上坡"趋势,但由后续反应驱动推进。整体反应自由能为负值。
该过程导致一个电子跨类囊体膜转移,并释放两个质子进入腔室。Qₒ位点的第二次周转将第二个电子引入细胞色素b链,使结合在Qᵢ位点的PQ得以还原为PQH₂,同时从类囊体膜基质侧摄取质子。生成的PQH₂随后可扩散至Qₒ位点被氧化,将质子释放至腔室。总体而言,Q循环使每个从PQH₂传递至P700的电子对应释放两个质子进入腔室,从而增加可用于ATP合成的质子数量。
质体蓝素在细胞色素b₆f复合体与光系统I间传递电子
两个光系统位于类囊体膜不同位点(见图9.15),这要求至少存在一个能沿膜或在膜内移动的组分,以将PSII产生的电子传递至PSI。细胞色素b₆f复合体均等分布于膜的基粒区和基质区,但其体积庞大,难以成为光系统间可移动的电子载体。
如前所述,质体醌作为可移动载体将电子从PSII传递至细胞色素b₆f复合体。随后电子通过质体蓝素(PC)——一种小分子(10.5kDa)、水溶性、含铜蛋白质——在细胞色素b₆f复合体与P700间传递。该蛋白质存在于腔内(见图9.25)。某些绿藻和蓝细菌中,有时会以c型细胞色素替代质体蓝素;这两种蛋白质在这些生物体中的合成取决于生物体可利用的铜含量。
PSI反应中心氧化PC并还原铁氧还蛋白,后者将电子传递至NADP⁺
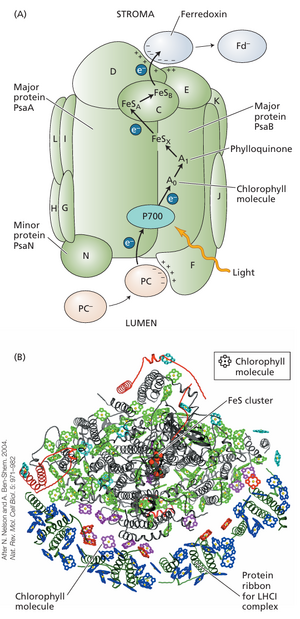
PSI反应中心复合体是一个大型多亚基复合体(图9.26)。与PSII中天线叶绿素虽与反应中心关联但存在于独立色素蛋白不同,PSI反应中心的核心天线由约100个叶绿素组成,是其固有部分。核心天线与P700结合于PsaA和PsaB两种蛋白质,其分子量范围为66-70kDa(参见网络专题9.8)。豌豆来源的PSI反应中心复合体除含有与蓝细菌类似的核心结构外,还包含四个LHCI复合体(见图9.26)。该复合体中叶绿素分子总数近200个,其中绝大多数作为天线系统组成部分,将光能汇集至发生光化学反应的 reaction center 核心区域。
核心天线色素形成环绕电子传递辅因子的碗状结构,这些辅因子位于复合体中心。PSI受体区起作用的电子载体处于还原态时均为极强还原剂。这些还原态物质极不稳定,因此难以鉴定。其中一种早期受体是叶绿素分子,另一种是醌类物质叶醌,亦称维生素K₁。
额外的电子受体包括一系列三种膜结合铁硫蛋白,也称为Fe-S中心:FeSx、FeSA和FeSB(见图9.26)。FeSx是P700结合蛋白的组成部分;FeSA和FeSB位于一个8 kDa蛋白质上,该蛋白质是PSI反应中心复合体的组成部分。电子通过FeSA和FeSB传递给铁氧还蛋白(Fd)——一种小型水溶性铁硫蛋白(见图9.18和9.26)。膜结合黄素蛋白铁氧还蛋白-NADP⁺还原酶(FNR)氧化还原态的铁氧还蛋白,并将NADP⁺还原为NADPH,从而完成始于水氧化的电子传递序列。
除还原NADP⁺外,PSI产生的还原态铁氧还蛋白在叶绿体中还具有其他功能,例如为亚硝酸盐还原提供还原剂(见第14章)以及调控某些碳固定酶(见第10章)。
部分除草剂阻断光合电子传递
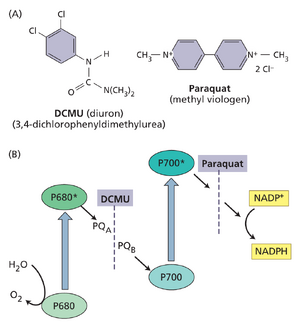
现代农业广泛使用除草剂清除杂草。目前已开发出多种不同类别的除草剂。部分除草剂通过阻断氨基酸、类胡萝卜素或脂质生物合成发挥作用,或通过干扰细胞分裂实现除草。其他除草剂如二氯苯基二甲基脲(DCMU,又称敌草隆)和百草枯则阻断光合电子传递(图9.27)。
DCMU通过竞争性占据质体醌(通常由PQB占据)的结合位点,阻断PSII醌受体处的电子传递。百草枯接受PSI早期受体的电子后,与氧气反应生成超氧阴离子22-,该物质对叶绿体组分具有强破坏性。
9.7 叶绿体中的质子转运与ATP合成
前文阐述了捕获的光能如何用于将NADP+还原为NADPH。该电子传递反应序列中的多个步骤还以质子电化学梯度形式储存能量,进而驱动光合磷酸化——即光依赖性ATP合成。此过程由丹尼尔·阿姆斯及其同事在1950年代发现。正常细胞条件下,光合磷酸化需要电子流参与,但在特定条件下电子流与光合磷酸化可独立发生。不伴随磷酸化的电子流称为解偶联。
学界普遍认同光合磷酸化通过化学渗透机制实现。该机制由彼得·米切尔于1960年代首次提出。相同机制驱动细菌和线粒体的有氧呼吸磷酸化(见第13章),以及多种离子和代谢物的跨膜转运(见第8章)。化学渗透似乎是所有生命形式膜过程的统一机制。
第8章讨论了ATP酶在细胞质膜化学渗透及离子转运中的作用。质膜ATP酶使用的ATP由叶绿体中的光合磷酸化和线粒体中的氧化磷酸化合成。本节重点探讨叶绿体内利用化学渗透及跨膜质子浓度差合成ATP的过程。
化学渗透的基本原理是:跨膜离子浓度差和电势差可作为细胞可利用的自由能源。根据热力学第二定律(详见网络附录1),任何物质或能量的非均匀分布均代表能量来源。膜两侧浓度不同的任何分子物种的化学势差均可提供此类能量源(见第8章)。
光合膜和电子传递系统的不对称性导致能量以两种形式储存。首先,电子通过光系统穿过类囊体膜从腔室(水裂解处)流向基质(NADPH生成处)。其次,如前述,质子随电子传递跨膜流动。质子转运的方向使电子传递导致基质碱性增强(H⁺离子减少),而腔室酸性增强(H⁺离子增多)(见图9.19和9.25)。
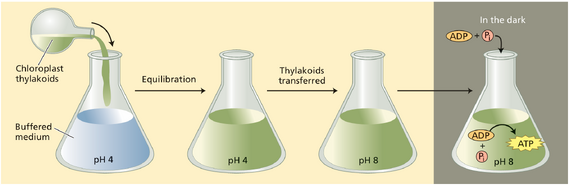
支持光合作用ATP形成化学渗透机制的部分早期证据源于安德烈·贾根多夫(Andre Jagendorf)与合作者设计的精妙实验(图9.28)。他们将离体叶绿体类囊体悬浮于pH4缓冲液中,缓冲液扩散跨膜使类囊体内外均在此酸性pH下达到平衡。随后将类囊体快速转移至pH8缓冲液,从而在类囊体膜两侧形成4个单位的pH差(内侧相对外侧呈酸性)。实验发现,该过程无需光能输入或电子传递,即可由ADP和Pᵢ合成大量ATP。该结果印证了后文化学渗透机制的预测。
米切尔提出可用于ATP合成的总能量——即质子动力(Δp)——由质子化学势和跨膜电势共同构成。从膜外到膜内的质子动力包含以下两个组分,其方程为:
Δ p = Δ E - 59mV × (pHi -pHo)
其中ΔE为跨膜电势,pHᵢ - pHₒ(或ΔpH)为跨膜pH差。比例常数(25°C时)为59毫伏每pH单位,故单位pH跨膜差等同于59毫伏膜电位。虽然普遍认为线粒体几乎仅以电势形式储存Δp,但叶绿体还将部分能量储存为pH梯度——该梯度导致类囊体腔相对基质呈酸性,进而对光捕获与电子传递的调控起关键作用(详见第9.8节)。
ATP由一种酶复合体(质量约400 kDa)合成,该复合体有多个名称:ATP合酶、ATP酶(源自其逆反应ATP水解)以及CFo-CF₁。此酶包含两部分:称为CFo的疏水性膜结合部分,以及伸入基质中的CF₁部分(图9.29)。CFo似乎形成跨膜通道供质子通过。CF₁由多个肽链组成,包括α肽和β肽各三个拷贝交替排列,类似橙瓣结构。催化位点主要位于β多肽上,而其他多肽被认为主要起调节功能。CF₁是该复合体中合成ATP的部分。
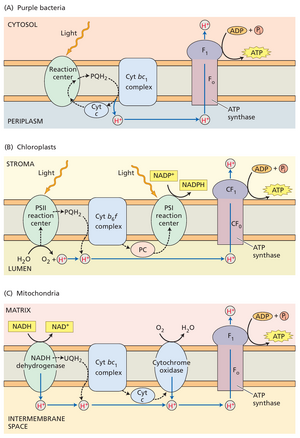
线粒体ATP合酶的分子结构已通过X射线晶体学和冷冻电镜技术解析。尽管叶绿体与线粒体酶存在显著差异,但二者整体结构相同,催化位点可能几乎一致。事实上,叶绿体、线粒体和紫色细菌中电子流与质子跨膜转运的耦合机制具有惊人的相似性(图9.30)。ATP合酶机制的另一个非凡之处在于:其内部轴及CFo的大部分结构在催化过程中会发生旋转。该酶实质上是一个微型分子马达(参见网络专题9.9和13.4)。酶每旋转一周可合成三分子ATP。
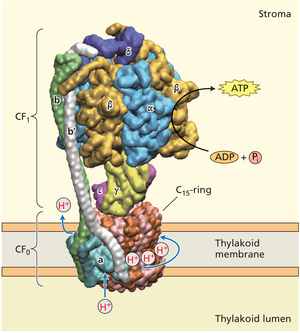
叶绿体ATP合酶CFo部分的直接显微成像显示其包含14个拷贝(某些蓝藻中为15个)的整合膜亚基c(见图9.29)。复合体每旋转一周,每个亚基可转运一个质子穿过膜。这表明质子转运与ATP合成的化学计量比为14/3(即4.69)。该参数的实测值通常略低于此值,其原因尚未明确。
循环电子流增强ATP输出以平衡叶绿体能量预算
9.6节所述的线性电子流途径产生ATP和NADPH,但其固定比例过低,无法满足CO₂固定及其他需ATP过程的需求。因此在特定条件下,光反应会提供额外的ATP来源。主要来源之一是循环电子流过程:电子从PSI还原侧经质体氢醌和细胞色素b₆f复合体流回P700。此循环电子流与质子从基质向腔室的泵送相耦合,可在不氧化水或还原NADP⁺的情况下用于ATP合成(见图9.15b)。循环电子流作为ATP来源对某些C₄碳固定植物(见第10章)的维管束鞘叶绿体尤为重要。
9.8 光合机构的修复与调控
光合系统面临特殊挑战:为在弱光下高效运作,其天线复合体必须足够大以吸收足量光能并转化为化学能。但在分子层面,光子能量可能造成损伤(尤其在不利条件下)。过量光能会导致超氧自由基、单线态氧和过氧化氢等毒性物质产生,若未能安全耗散则引发损伤。因此光合生物具有复杂的调控与修复机制来保护其光合装置。
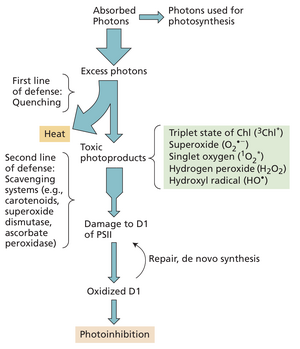
部分机制通过调节天线系统中的能量流动,以避免反应中心过度受激并确保两个光系统被均衡驱动。尽管这些过程非常高效,但并非万无一失,活性中间体有时仍会积累,导致有毒活性氧物种的产生。图9.31概述了应对这些问题的多级调控与修复体系。第一道防线是通过以热能形式淬灭过量激发能来抑制损伤;第二道防线包含清除或解毒已形成的活性氧物种并进行损伤修复的生物化学系统。超氧化物歧化酶和抗坏血酸过氧化物酶消耗超氧阴离子与过氧化氢,而类胡萝卜素和生育酚(维生素E)则淬灭单线态氧(1O2)。
类胡萝卜素的光保护作用
除作为辅助色素外,类胡萝卜素在光保护中起关键作用。若色素吸收的巨大能量无法通过光化学反应储存,光合膜极易受损,因此需要保护机制。该机制可视为安全阀,在能量损伤生物体前将其释放。当激发态叶绿素储存的能量通过激发传递或光化学反应快速耗散时,称为激发态被淬灭。
若叶绿素激发态未被激发传递或光化学反应快速淬灭,其可与分子氧反应形成激发态氧,被称为单线态氧(1O2)。当光系统内重组反应产生激发态叶绿素时,1O2*产率更高。这意味着光反应逆转(激发态叶绿素返回基态)不仅耗散能量,还会产生有害副产物。因此尽管仅少数激发反应中心发生重组,其产生的单线态氧能与细胞组分——尤其是脂质反应——并造成损伤,故至关重要。
另一种活性氧——超氧阴离子可在电子堆积于PSI反应中心时形成。超氧阴离子可与其他氧化还原组分作用产生过氧化氢(H2O2)及高活性羟基自由基(HO·)。后者与单线态氧类似,可损伤细胞组分。
类胡萝卜素通过快速淬灭叶绿素激发态实现光保护作用。其激发态能量不足以形成单线态氧,故以热能形式释放能量返回基态。
缺乏类胡萝卜素的突变体无法在光照与分子氧共存环境中生存——这对产氧光合生物极为不利。实验室条件下,非产氧光合细菌的类胡萝卜素缺失突变体可通过从培养基去除氧培养。
部分叶黄素类参与能量耗散
非光化学淬灭作为调节激发能传递至反应中心的主要过程,可视为根据光照强度等条件将PSII反应中心激发能流调节至可控水平的"音量旋钮"。该过程是绝大多数藻类与植物天线系统调控的核心环节。
非光化学淬灭是指通过不产生稳定光化学产物的过程,对叶绿素及其他天线色素(见图9.4)激发态的淬灭作用。在强光照射下,非光化学淬灭能使天线系统中大部分激发能以热能形式无害耗散,从而避免活性中间产物的积累,防止光损伤发生。
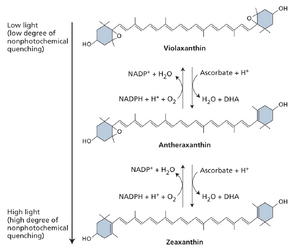
多种不同的非光化学淬灭过程具有各自独特的机制。其中响应最迅速的机制由类囊体腔酸化触发:酸化作用激活称为叶黄素类色素的特殊类胡萝卜素互变反应,并直接调控天线复合体形成非光化学淬灭状态(图9.32)。强光条件下,紫黄质通过中间产物花药黄质,在紫黄质脱环氧化酶催化下转化为玉米黄质。该酶定位于类囊体腔,在低pH环境下激活。高浓度质子还会直接调控与PSII天线相关的蛋白质特性,该蛋白在维管植物中称为PsbS蛋白。
类囊体腔酸化可在强光下发生——此时质子光驱动内流量超过其通过ATP合酶的外流量。当下游代谢反应受抑制时(如干旱缺水胁迫、热胁迫或冷胁迫条件下)同样会发生酸化。这些条件会减缓ATP的利用,耗尽叶绿体中ADP或ATP合酶底物无机磷酸盐(Pi),从而降低质子通过ATP合酶从类囊体腔释放的速率。因此,类囊体腔酸化可作为核心调控"信号",通过响应光能输入及代谢对能量的利用来调控光合作用。
PSII反应中心易受损且修复迅速
光抑制现象是影响光合机构稳定性的另一关键因素,当过量激发能到达PSII反应中心时,会导致其失活和损伤。光抑制是一系列复杂的分子过程,定义为过量光照对光合作用的抑制。
如第11章将详述,早期光抑制具有可逆性。但持续抑制会导致系统损伤,迫使PSII反应中心解体修复。损伤主要靶点为构成PSII反应中心复合体的D1蛋白(见图9.21)。当D1蛋白受强光损伤时,必须从膜上移除并替换为新合成分子。PSII反应中心其他组分不受过量激发能损伤,可循环利用,因此D1蛋白是唯一需要重新合成的组分(见图9.31)。
PSI在特定条件下(如植物遭遇低温强光)也易受活性氧损伤。PSI的铁氧还蛋白受体是强还原剂,可轻易将分子氧还原为超氧阴离子。该还原过程与电子向NADP⁺还原等正常途径竞争。超氧阴离子属活性氧系列,对生物膜极具破坏性,但经此途径产生的活性氧可通过超氧化物歧化酶和抗坏血酸过氧化物酶等系列酶的作用清除。
类囊体堆叠实现光系统间能量分配
维管植物光合作用由两个光吸收特性不同的光系统驱动,这一事实带来了特殊问题。若能量传递至光系统I(PSI)和光系统II(PSII)的速率未能精确匹配,且在光合作用速率受限于可用光照(低光强)的条件下,电子流速率将受限于接收能量较少的光系统。最理想的情况是能量输入对两个光系统均等。然而,单一色素排列无法满足此需求,因为不同时段的光强和光谱分布往往偏向于某一光系统。该问题可通过能量转移机制解决——该机制能根据环境条件将能量从一个光系统转移到另一个光系统。类囊体膜含有一种蛋白激酶,可使LHCII(本章前文所述的膜结合天线色素蛋白之一,见图9.17)表面的特定苏氨酸残基磷酸化。当质体醌(PSI与PSII之间的电子载体之一)以还原态积累时,该激酶被激活。若PSII激活频率高于PSI,还原态质体醌就会积累。磷酸化的LHCII随后从膜的堆叠区域迁移至非堆叠区域(见图9.15),这可能是因相邻膜负电荷间的排斥作用所致。最终结果是:未磷酸化的LHCII向PSII传递更多能量,而磷酸化的LHCII则向PSI传递更多能量。
9.9 光合系统的遗传学、组装与进化
叶绿体拥有自身的DNA、mRNA和蛋白质合成机制,但大多数叶绿体蛋白由核基因编码并输入叶绿体(见第1章)。本节将探讨主要叶绿体组分的遗传学、组装及进化。
叶绿体基因呈现非孟德尔式遗传模式
叶绿体和线粒体通过分裂而非从头合成方式增殖。鉴于这些细胞器含有细胞核不具备的遗传信息,此种繁殖模式并不意外。细胞分裂时,叶绿体被分配到两个子细胞中。然而在多数有性生殖植物中,仅母本植株向合子提供叶绿体。这类植物中,叶绿体编码基因不符合常规孟德尔遗传模式,因为子代仅从单亲获得叶绿体,导致出现非孟德尔式(即母系)遗传。众多性状以此方式遗传,例如网络专题9.10讨论的抗除草剂性状。
多数叶绿体蛋白由细胞质输入
叶绿体蛋白可由叶绿体DNA或核DNA编码。叶绿体编码蛋白在叶绿体核糖体合成;核编码蛋白则在细胞质核糖体合成后转运至叶绿体。叶绿体功能所需基因随机分布于核基因组与质体基因组中,但两组基因对叶绿体存活均不可或缺。例如参与碳固定的Rubisco酶(见第10章)包含两种亚基:叶绿体编码的大亚基和核编码的小亚基,两者均为酶活性所必需。Rubisco小亚基在细胞质合成后转运至叶绿体,并在其中完成酶组装。部分叶绿体基因还参与其他功能(如血红素和脂质合成)。调控叶绿体蛋白核基因的表达是复杂而动态的过程,涉及光敏色素与蓝光介导的光依赖性调控(见第16章)及其他因子。
细胞质合成的叶绿体蛋白转运是严格调控的过程。核编码的叶绿体蛋白(如Rubisco小亚基)以前体蛋白形式合成,其N端含有一段称为转运肽的氨基酸序列。该末端序列引导前体蛋白定向至叶绿体,协助其穿过外被膜与内被膜,随后被切除。电子载体质体蓝素是核编码的水溶性蛋白,但功能发挥于叶绿体腔中,因此需跨越三层膜抵达目标位置。其转运肽体积庞大,在引导蛋白质依次穿越内被膜与类囊体膜的过程中经历多步加工。
叶绿素的生物合成与分解是复杂的代谢途径
叶绿素是复杂的分子,其结构精妙地适配于光合作用中承担的光吸收、能量传递和电子传递功能(见图9.6)。与其他生物分子类似,叶绿素通过生物合成途径形成——简单分子作为结构单元被组装成更复杂的分子。该生物合成途径的每一步都由酶催化完成。
叶绿素生物合成途径包含十余个步骤(参见网络专题9.11)。该过程可分为多个阶段(图9.33),各阶段虽可独立分析,但在细胞内高度协调并受严格调控。这种调控至关重要,因为游离叶绿素及其多种生物合成中间体会损伤细胞组分。损伤主要源于叶绿素高效吸光,但缺乏结合蛋白时无法耗散能量,导致形成有毒的单线态氧。
衰老叶片中叶绿素的分解途径与生物合成途径截然不同。第一步由叶绿素酶催化脱去植醇尾链,随后镁脱螯合酶移除镁离子。接着通过氧依赖性加氧酶打开卟啉环结构,形成开链四吡咯。
四吡咯经进一步修饰生成水溶性无色产物。这些无色代谢物从衰老叶绿体输出后转运至液泡储存。叶绿素结合蛋白随后被回收用于合成新蛋白质,这对植物的氮素经济至关重要。
复杂光合生物由简单形态进化而来
植物和藻类中复杂的光合机构是漫长进化历程的最终产物。通过分析更简单的原核光合生物(包括不生氧光合细菌和蓝细菌),可深入理解这一进化过程。
叶绿体是半自主性细胞器,拥有自身DNA和完整的蛋白质合成系统。构成光合机构的所有叶绿素、脂质及多数蛋白质均在叶绿体内合成,其余蛋白质由细胞核基因编码并从细胞质输入。这种特殊分工如何形成?学界普遍认为叶绿体起源于蓝细菌与非光合真核细胞的共生关系,该关系称为内共生。
蓝细菌最初具备独立生存能力,但随时间推移,其正常细胞功能所需的大量遗传信息丢失,而光合机构合成所需的重要信息转移至细胞核。因此蓝细菌丧失宿主外独立生存能力,最终成为细胞不可分割的部分——叶绿体。
某些藻类的叶绿体源于真核光合生物的内共生。这些叶绿体被三层(某些情况下四层)膜包裹,这些膜被认为是原始生物质膜的残余。线粒体也被认为通过更早期的独立内共生事件起源。
关于光合作用进化的其他问题仍待阐明:最早光合系统的本质、两个光系统如何耦联、以及释氧复合体的进化起源。第二章 细胞壁:结构,功能和其扩张
