第二十章 成花和花部发育的调控
大多数人都期待着春天的到来和它带来的繁茂的花朵。许多度假者小心翼翼地安排旅行时间以配合特定的花开季节:南加州的 Blossom Trail 沿途的柑橘,荷兰。在华盛顿特区和日本各地,樱花用热烈的仪式迎接花朵。随着春天进入夏季,夏季进入秋季,秋季进入冬季,野花在指定的时间绽放。开花于正确的时间对于植物的生殖健康至关重要;异花授粉的植物必须同步开花与其他同类个体以及花粉在一年中最适合结籽的季节进行。
尽管开花和季节之间存在很强的相关性是众所周知的,这一现象构成了我们在本章中讨论的基本问题:
● 植物如何追踪一年四季的变化以及一天中的时间?
● 哪些环境信号影响开花,以及如何影响这些信号能被感知到吗?
● 环境信号如何传递以引起与开花相关的发育变化?
在第 19 章中,我们讨论了根和芽顶端的作用分生组织在营养生长和发育中。转向开花涉及形态发生模式的重大变化以及茎尖分生组织的细胞分化。最终,我们将会看到,这个过程导致了花器官的产生——萼片、花瓣、雄蕊和心皮。
20.1 花卉召唤:整合环境线索
植物生殖过程中一个特别重要的发展决策生命周期就是何时开花。茎尖分生组织致力于形成花的过程,被称为 floral evocation。推迟开花的承诺将增加可供调动的碳水化合物储备,使更多、条件更好的种子成熟。拖延开花,然而,也可能增加植物将被吃掉、因非生物胁迫而死亡或在繁殖之前在与其他植物竞争中被淘汰。考虑到这一点,植物已经进化出一系列非凡的生殖适应性——例如,一年生和多年生的生命周期。
一年生植物,如千里光 (Senecio vulgaris) ,可能在发芽后几周内开花。但树木可能要生长 20 年或更长时间才能开始开花。在整个植物界,不同物种的开花年龄范围很广,这表明植物的年龄,或者可能是大小,是控制转向生殖发育的内部因素。
开花严格响应内部发育因素而独立于任何特定环境条件的情况被称为自主调节。对于为了开花而绝对需要一组特定环境线索的物种,开花被认为是一种强制性或定性反应。如果开花是由某些环境线索促进的,但最终会在没有此类线索的情况下发生,则开花反应是兼性或定量的。具有兼性开花反应的物种,如拟南芥,依赖环境和自主信号来促进生殖生长。
光周期和春化是季节性反应的两个最重要的机制。光周期(见第 16 章)是对白天或夜晚长度的反应;春化是通过长时间的低温促进开花。其他信号,如光质、环境温度和非生物胁迫,也是植物发育的重要外部线索。
内部(自主)和外部(环境感应)控制系统的进化使植物能够精确调节开花,使其在最佳时间开花,以实现繁殖成功。例如,在特定物种的许多种群中,开花是同步的,这有利于异花授粉。响应环境线索而开花也有助于确保种子在有利条件下产生,特别是在水和温度方面。然而,这使得植物特别容易受到全球变暖等快速气候变化的影响,这可能会改变控制开花时间的调节网络(参见网络主题 20.1)。
20.2 茎尖和阶段变化
所有多细胞生物都会经历一系列或多或少明确的发育阶段,每个阶段都有其特征。在人类中,婴儿期、儿童期、青少年期和成年期代表了四个一般的发展阶段,青春期是非生殖期和生殖期的分界线。同样,植物也会经历不同的发育阶段。然而,与动物不同,植物不断从茎尖分生组织产生新器官。这种能力使植物能够通过控制相变的时间来使其发育与不断变化的环境同步。此外,植物必须整合来自环境的信息以及自主信号,以最大限度地提高其生殖适应性。本节描述了控制这些决策的主要途径。
植物经历三个发育阶段
植物的胚后发育可分为三个阶段:
1. 幼年期
2. 成年营养期
3. 成年生殖期
从一个阶段到另一个阶段的过渡称为phase change.
幼年期和成年营养期的主要区别在于后者具有形成生殖结构的能力:被子植物的花,裸子植物的球果。然而,开花代表成年期生殖能力的表达,通常取决于特定的环境和发育信号。因此,开花本身的缺失并不是幼年期的可靠指标。
从幼体到成体的转变经常伴随着营养特征的变化,例如叶形态、叶序(叶在茎上的排列)、多刺性、生根能力和落叶植物(如英国常春藤)的叶片保留(图 20.1;另见网络主题 20.2)。这种变化在木本多年生植物中最为明显,但在许多草本植物中也很明显。与从成年营养阶段到生殖阶段的突然转变不同,从幼体到成年营养阶段的转变通常是渐进的,涉及中间形式。
幼体组织首先产生,位于枝条的基部
三个发育阶段的时间顺序导致沿枝条轴的幼体空间梯度。由于高度的生长受限于顶端分生组织,最先形成的幼年组织和器官位于在枝条基部。在快速开花的草本植物中,幼年期可能仅持续几天,并且产生的幼年结构很少。相比之下,木本植物的幼年期更长,在某些情况下可持续 30 至 40 年(表 20.1)。在这些情况下,幼年结构可以占成熟植物的很大一部分。一旦分生组织转换到成年期,就只产生成年营养结构,最终开花。成年和生殖期因而位于枝条较高、外周的部分。
在确定向成株阶段的过渡时,获得足够大的尺寸似乎比植物的实际年龄更重要。阻碍生长的条件,例如矿物质缺乏、弱光、水分胁迫、落叶和低温往往会延长幼年期,甚至导致成年枝条恢复到幼年期。相反,促进旺盛生长的条件会加速向成年期的过渡。当生长加速时,接受正确的花诱导处理可导致开花。
虽然植物大小似乎是最重要的因素,但并不总是清楚与大小相关的哪个特定成分是关键的。在某些烟草属物种中,似乎植物必须产生一定数量的叶子才能将足够量的花刺激传递到顶端。
一旦达到成株期,它就会相对稳定,并在无性繁殖或嫁接期间保持。例如,从成熟英国常春藤植物的基部区域采集的插枝会发育成幼株,而从尖端采集的插枝会发育成成年植物。当从开花的银桦树 (Betula verrucosa) 的基部采集接穗并将其嫁接到幼苗砧木上时,前两年嫁接枝上没有花。相反,从成熟树的顶部取下的嫁接枝则自由开花。
“juvenility”一词对草本和木本物种有不同的含义。幼年草本分生组织嫁接到开花成年植物上时很容易开花(参见 WEB TOPIC 20.3),而幼年木本分生组织通常不会开花。因此,幼年木本分生组织被认为缺乏开花能力(参见 WEB TOPIC 20.4)。
阶段变化可能受到营养物质、赤霉素和其他信号的影响
茎尖从幼年期到成年期的过渡可能受到来自植物其余部分的可传递因素的影响。在许多植物中,暴露在低光照条件下会延长幼年期或导致幼年期的逆转。低光照条件的一个主要后果是减少顶端碳水化合物的供应;因此,碳水化合物供应,特别是蔗糖,可能在幼年期和成熟期之间的过渡中发挥作用。碳水化合物供应作为能量和原材料的来源,会影响顶端的大小。例如,在花店的chrysanthemum (Chrysanthemum morifolium) 中,花原基直到达到最小顶端尺寸才会起始。在拟南芥中,植物中的碳水化合物状态由小信号分子海藻糖 6-磷酸 (一种二糖) 传递。缺乏海藻糖 6-磷酸的植物即使在诱导条件下也会表现出非常延迟的开花,而海藻糖 6-磷酸可激活叶片和茎尖的开花途径。
顶端除了碳水化合物和其他营养物质外,还从植物的其他部分接收各种激素和其他因素。实验证据表明,施用赤霉素会导致几种针叶树科的幼年植物形成生殖结构(球果)。内源性赤霉素参与控制生殖加速松树球果产生的其他处理方法(例如根部去除、水分胁迫和氮缺乏)也常常导致植物中赤霉素的积累,这一事实也表明了这一点。
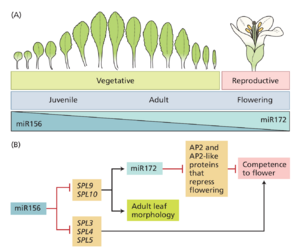
控制植物相变的一类主要保守分子是微小 RNA。微小 RNA 是小型非编码 RNA 分子,它们通过短序列同源区域靶向其他基因的 mRNA 转录本,从而干扰其功能(见第 3 章)。在拟南芥和许多其他植物(包括树木)中,微小 RNA156(miR156)是控制幼年到成年转变的关键(图 20.2)。miR156 的一些靶基因促进了向开花的转变。 miR156 的水平会随时间降低,一旦低于阈值,目标基因就会表达,并且相变成为可能。过度表达 microRNA 足以大大延迟拟南芥和杨树的相变。除了 miR156,microRNA172 (miR172) 也与拟南芥的相变有关(见图 20.2)。在发育过程中,miR172 水平会随着 miR156 水平下降而增加。与 miR156(其丰度受植物年龄控制)相反,miR172 似乎受到光周期控制(第 20.4 节中讨论)。miR172 的靶标包括几种转录本,它们编码参与抑制开花的转录因子。因此,miR172 促进了从成年营养生长到生殖生长的阶段转变。
20.3 昼夜节律:植物体内的时钟
生物体通常受到光和黑暗的每日循环的影响,植物和动物通常都会表现出与这些变化相关的节律行为。由光照期和黑暗期组成的 24 小时节律称为昼夜节律。昼夜节律的例子包括叶子和花瓣的运动(白天和夜晚的位置)、气孔的打开和关闭、真菌(例如 Pilobolus 和 Neurospora)的生长和孢子形成模式、蛹羽化的时间(果蝇)和啮齿动物的活动周期,以及光合作用和呼吸等代谢过程速率的每日变化。
当生物体从每日的明暗循环转变为连续的黑暗或连续的光照时,许多这样的节律至少会持续数天。在这种均匀的条件下,节律的周期接近 24 小时,因此使用术语昼夜节律(circadian rhythm,来自拉丁语 circa,“大约”,和 diem,“一天”)(见第 4 章)。由于这些昼夜节律在恒定的光照或黑暗环境中持续,因此它们不能直接响应光的存在或不存在,而必须基于内部起搏器,通常称为内源性振荡器endogenous oscillator。
单个振荡器机制可以与不同时间的多个下游过程相关联。 内源性振荡器被认为是由黎明、早晨、下午和晚上表达的四组基因的相互作用调节的。 光可以通过激活早晨和晚上的基因来增加振荡的幅度(图 20.3)。
内源振荡器与各种生理过程(如叶片运动或光合作用)相结合,并保持其节律。因此,内源振荡器可以被视为时钟机制,而正在调节的生理功能(如叶片运动或光合作用)有时被称为时钟指针。
AM 开花和花卉发育的控制 595 黎明和下午基因的相互抑制。 这个主题被称为“拨动开关”。 当一对中的一个为高时,另一个为低。仅此基序不会振荡。开关位于四元环内,其中每组基因都会关闭之前表达的组。在稳定状态下,单独的环也不会振荡:对角线 o相反的配对打开或关闭。 (A) 可防止出现此结果。
夜间基因在夜间早些时候关闭除黎明基因之外的所有基因,
“清理甲板”,然后在午夜至深夜再次开始黎明基因表达。
(D) 每日循环,一步一步
1. 黎明基因表达在午夜至深夜开始,
继续抑制下午基因 (A)。
2. 光激活早晨和晚上基因表达。
夜间基因受到黎明基因 (B) 的抑制,因此只有早晨基因表达。
3. 早晨基因关闭黎明基因 (B),允许下午基因 (A) 和晚上基因 (B) 表达。持续的光线激活晚上基因也有帮助。
TZ7E 20.03
昼夜节律表现出characteristic features
昼夜节律源于由三个参数定义的周期性现象:
1. 周期Period是重复周期中可比点之间的时间。通常,周期被测量为连续最大值(峰值)或最小值(谷值)之间的时间(图 20.4A)。
2. 相位Phase是周期中可以通过其与周期其余部分的关系识别的任何点。最明显的相位点是峰值和波谷位置。
3. 振幅Amplitude通常被认为是峰值和波谷之间的距离。生物节律的振幅通常会发生变化,而周期保持不变(例如,如图 20.4B 所示)。
在恒定的光照或黑暗中,节律会偏离精确的 24 小时周期。然后,节律会相对于太阳时漂移,根据周期是短于还是长于 24 小时而增加或减少时间。在自然条件下,内源振荡器被环境信号带动(同步)到真正的 24 小时周期,其中最重要的是黄昏时由亮到暗的过渡和黎明时由暗到亮的过渡(图 20.4C)。
这种环境信号被称为 zeitgebers (德语意为“时间提供者time givers”)。当这些信号被移除时(例如,通过转移到持续黑暗中),节律被称做自由运行 free-running,并恢复到特定生物体特有的昼夜节律(见图 20.4C)。
虽然节律是在内部产生的,但它们通常需要环境信号来启动它们的表达。此外,当生物体处于恒定的环境中数个周期时,许多节律会减弱(即振幅减小)。当此发生,一个环境zeitgeber,如从光到暗的转变,或温度的变化,对于重启节律而言是必要的。
Phase shifting将昼夜节律调整为不同的昼夜循环
在昼夜节律中,生理反应与内源振荡器的特定时间点耦合,因此反应发生在一天中的特定时间。单个振荡器可以耦合到多个昼夜节律,这些节律甚至可能彼此不同步。
当每日光明和黑暗的持续时间随着季节而变化时,这种反应如何保持准时?研究人员通常通过将生物体置于持续黑暗中并检查对自由运行节律中不同相位点给出的短脉冲光(通常少于 1 小时)的反应来测试内源振荡器的反应。当生物体适应 12 小时光照和 12 小时黑暗的循环,然后让其在恒定的光照或黑暗中自由运行时,与前一个适应循环的光照周期相吻合的节律阶段称为主观白天subjective day,,与黑暗周期相吻合的阶段称为主观夜晚subjective night。
如果在主观夜晚的最初几个小时内发出光脉冲,节律就会延迟;生物体会将光脉冲解释为前一天的结束(图 20.4D)。相反,在主观夜晚结束之前发出的光脉冲会提前节律阶段。换句话说,生物体会将光脉冲解释为第二天的开始。
如果光脉冲允许节律在季节变化时保持当地时间,那么这正是预期的反应。这些相移响应使节律能够被调整到大约 24 小时的周期,具有不同的光照和黑暗持续时间,并且它们表明节律可以适应日照长度的季节性变化。
光敏色素和隐花色素调整时钟
光信号引起相移的分子机制尚不清楚,但拟南芥的研究已经确定了昼夜节律振荡器及其输入和输出的一些关键元素(见第 16 章)。可以诱导相移的低水平和特定波长的光表明光响应必须由特定的光感受器而不是光合速率介导。例如,红光对亚热带豆科树 Samanea 有节奏的昼夜叶片运动的调整是一种由光敏色素介导的低通量响应(见第 16 章)。
每种光敏色素都充当红光、远红光或蓝光的特定光受体。植物也通过隐花色素 (CRY) 感知光线,CRY1 和 CRY2 蛋白参与植物中时钟的蓝光同步,就像它们在昆虫中一样(见第 16 章)。相比之下,哺乳动物中的 CRY 似乎不作为昼夜节律光受体发挥作用。令人惊讶的是,CRY 蛋白似乎也是红光正常同步所必需的。由于这些蛋白质不吸收红光,因此这一要求表明 CRY1 和 CRY2 可能在时钟同步过程中充当光敏色素信号传导的中间体。
在果蝇中,CRY 蛋白与时钟组件发生物理相互作用,因此构成振荡器机制的一部分。然而,拟南芥的情况似乎并非如此,在拟南芥中,cry1/cry2 双突变体在同步方面受损,但其他方面具有正常的昼夜节律。在植物中,光激活的 CRY2 通过直接上调关键开花基因 FLOWERING LOCUS T (FT) 的表达来激活对蓝光的开花反应(详细讨论见第 20.6 节)。
20.4 光周期现象:监测日长
正如我们所见,昼夜节律使生物体能够在白天或夜晚的特定时间重复特定的分子或生化事件。光周期现象,或生物体检测日长的能力,使事件有可能在一年中的特定时间发生,从而允许季节性反应。昼夜节律和光周期具有响应光明和黑暗循环的共同特性。
在赤道,昼夜长度相等且全年恒定。随着人们从赤道向两极移动,夏季白天变长,冬季白天变短(图 20.5)。植物物种已经进化出检测这些季节性日照变化的能力,它们特定的光周期反应受到它们起源的纬度的强烈影响。
动物和植物中都存在光周期现象。在动物界,日照长度控制着冬眠、夏季和冬季皮毛的发育以及生殖活动等季节性活动。受日照长度控制的植物反应很多;它们包括启动开花、无性繁殖、储存器官的形成和休眠的开始。
植物可以根据其光周期反应进行分类
许多植物物种在夏季长日照期间开花,多年来,植物生理学家认为长日照和开花之间的相关性是长日照期间合成的光合产物积累的结果。
怀特曼·加纳和亨利·阿拉德于 20 世纪 20 年代在马里兰州贝尔茨维尔的美国农业部实验室进行的研究证明这一假设是错误的。加纳和阿拉德发现一种突变烟草品种‘马里兰猛犸象Maryland Mammoth’长势旺盛,高度达到约 5 米,但在夏季的普遍条件下无法开花(图 20.6)。然而,这些植物在冬季自然光照条件下在温室中开花。
这些结果最终促使 Garner 和 Allard 测试了人工缩短日照的影响,方法是从下午晚些时候到第二天早上用不透光的帐篷覆盖在夏季长日照期间生长的植物。这些人工短日照也导致植物开花。Garner 和 Allard 得出结论,日照长度,而不是光合产物的积累,是开花的决定因素。他们能够在许多不同的物种和条件下证实他们的假设。这项工作为随后对光周期反应的广泛研究奠定了基础。
尽管植物发育的许多其他方面也可能受到日照长度的影响,但开花是研究最多的反应。开花物种往往属于两种主要的光周期反应类别之一:短日照植物和长日照植物。
● 短日植物 (SDP) 仅在短日照下开花(定性qualitative SDP),或者其开花因短日照而加速(定量quantitative SDP)。
● 长日照植物 (LDP) 仅在长日照下开花(定性 qualitativeLDP),或者其开花因长日照而加速(定量quantitative LDP)。
长日照植物和短日照植物之间的本质区别在于,只有当日照长度超过每 24 小时周期中的某个持续时间(称为临界日照长度)时,LDP 中的开花才会得到促进,而 SDP 中促进开花需要日照长度小于临界日照长度。临界日照长度的绝对值在不同物种间差异很大,只有对不同日照长度范围内的开花进行检查,才能确定正确的光周期分类(图 20.7)。
LDPs 可以有效地测量春季或初夏日照长度的延长,并延迟开花,直到达到临界日照长度。许多小麦品种 (Triticum aestivum) 都有这样的表现。SDP 通常在秋季日照长度缩短到临界日照长度以下时开花,就像许多菊花品种一样。然而,单独的日照长度是一个模糊的信号,因为它无法区分春季和秋季。
植物表现出几种避免日照长度信号模糊性的适应性。一种是存在幼年期,阻止植物在春季对日照长度作出反应。另一种避免日照长度模糊性的机制是将温度要求与光周期反应结合起来。某些植物物种,如冬小麦,直到寒冷期 (春化或越冬(vernalization or overwintering) 发生后才对光周期作出反应。(我们将在第 20.7 节讨论春化作用。)
其他植物通过区分白天变短和变长来避免季节模糊性。例如“双日照植物”分为两类:
● 长短日植物 (Long–short-day plants,LSDP) 仅在连续的长日和短日之后开花。 LSDPs,例如 Bryophyllum、Kalanchoe 和夜开茉莉 (Cestrum nocturnum),在夏末和秋季开花,此时白天变短。
● 短长日植物 (Short–long-day plant,SLDP) 仅在连续的短日和长日之后开花。SLDPs,例如白三叶草 (Trifolium repens)、坎特伯雷风铃草 (Campanula medium) 和 Echeveria harmsii,在早春开花,以响应白天变长。
最后,在任何光周期条件下开花的物种被称为日中性植物。Day-neutral plants (DNPs)日中性植物 (DNP) 对日照长度不敏感。DNP 中的开花通常受自主调节 - 即内部发育控制。一些日中性物种,如芸豆 (Phaseolus vulgaris),在赤道附近进化,那里的日照长度全年保持不变。许多沙漠一年生植物,如沙漠画笔 (Castilleja chromosa) 和沙漠马鞭草 (Abronia villosa),只要有足够的水,就会迅速发芽、生长和开花。这些也是 DNP。
叶子是感知光周期信号的部位
LDP 和 SDP 中的光周期刺激都由叶子感知。例如,用短光周期处理 SDP 苍耳的单片叶子足以引起花朵的形成,即使植物的其余部分暴露在长日照下也是如此。因此,作为对光周期的反应,叶子会传递一个信号,调节茎尖向开花的过渡。发生在叶子中的光周期调节过程导致将花刺激传递到茎尖,这些过程统称为光周期诱导photoperiodic induction。
光周期诱导可以在与植物分离的叶子中进行。例如,在 SDP Perilla crispa(薄荷家族的成员)中,暴露在短日照下的切除叶子随后嫁接到在长日照下保持的非诱导植物上会导致开花。该结果表明光周期诱导取决于仅在叶子中发生的事件。
夜晚的长度对于花卉诱导很重要
在自然条件下,白天和夜晚的长度构成了 24 小时的光明和黑暗循环。原则上,植物可以通过测量光照或黑暗的持续时间来感知关键的日照长度。早期光周期研究中的许多实验工作都致力于确定光照黑暗周期的哪一部分是开花的控制因素。结果表明 SDP 的开花主要取决于黑暗持续时间(图 20.8A)。如果光照时间长于临界值,则有可能在 SDP 中诱导开花,前提是这些光照时间之后是足够长的夜晚(图 20.8B)。
同样,当白天短而夜晚短时,SDP 不会开花。更详细的实验表明,SDP 中的光周期计时就是测量黑暗持续时间的问题。例如,只有当 cocklebur (Xanthium strumarium)的黑暗期超过 8.5 小时, soybean (Gly cine max)超过十小时,才会开花。黑暗时间的长短也对 LDP 很重要(见图 20.8)。研究发现,这些植物在短日照下开花,前提是伴随的夜晚也很短;然而,长日照后紧接着长夜是无效的。
夜间中断可以抵消黑暗期的影响
这是强调黑暗期的重要性的一个原因是,可以通过短暂的光照中断(称为night break)使其无效(见图 20.8A)。相反,用短暂的黑暗期打断漫长的一天并不能消除长日的影响(见图 20.8B)。仅几分钟的暗期中断处理可有效防止许多 SDP(包括苍耳和牵牛花)开花,但通常需要更长时间的暴露才能促进 LDP 开花。此外,暗期中断的效果因时间而异。对于 LDP 和 SDP,在 16 小时黑暗期的中间附近进行暗期中断被发现最有效(图 20.9)。暗期中断效应的发现导致了商业方法的发展,用于调节园艺物种的开花时间,例如 alanchoe、菊花和一品红 (Euphorbia pulcherrima)。
夜间的光周期计时取决于昼夜节律时钟
夜晚长度对开花的决定性影响表明,测量黑暗中的时间流逝对于光周期计时非常重要。大多数现有证据都支持基于昼夜节律的机制。根据时钟假说,光周期计时取决于第 20.3 节讨论的内源性昼夜节律振荡器(见图 20.3;另见第 16 章)。中央振荡器与涉及基因表达的各种生理过程相结合,包括光周期物种的开花。
测量暗期中断对开花的影响可用于研究昼夜节律在光周期计时中的作用。例如,当大豆植物(SDP)从 8 小时光照期转变为延长的 64 小时黑暗期时,开花对暗期中断的反应表现出昼夜节律(图 20.10)。
这种类型的实验为时钟假设提供了强有力的支持。如果此 SDP 只是通过黑暗中特定中间体的积累来测量夜晚的长度,那么任何大于临界夜晚长度的黑暗期都应导致开花。然而,如果光照中断的时间与内源性昼夜节律振荡器的某个阶段不完全一致,那么长时间的黑暗期就不会诱导开花。这一发现表明,SDP 中的开花需要足够长时间的黑暗期和在昼夜节律周期的适当时间发出黎明信号(见图 20.3)。
昼夜节律振荡器在光周期测量中的作用的进一步证据是,光周期响应可以通过光处理发生相移(见 WEB TOPIC 20.5)。
外部巧合模型The external coincidence model 基于振荡光敏感度 24 小时周期的振荡
如何测量 8 到 9 小时的临界黑暗持续时间,如 SDP Xanthium?1936 年,Erwin Bünning 提出,光周期对开花的控制是通过对光具有不同敏感度的阶段的振荡来实现的。该提议已演变为外部巧合模型The external coincidence model ,其中昼夜节律振荡器控制光敏感和光不敏感阶段的时间。
光促进或抑制开花的能力取决于光的相位。当在节律的光敏相位期间施加光信号时,其效果要么是促进 LDP 开花,要么是阻止 SDP 开花。如图 20.10 所示,对光的敏感和不敏感相位在黑暗中继续振荡。只有在节律的光敏相位完成后,从暗期中断或黎明开始暴露于光线时,SDP 才会开花。如果对 LDP 进行类似的实验,只有在节律的光敏相位期间发生暗期中断时,才会诱导开花。换句话说,当光照与节律的适当相位一致时,SDP 和 LDP 都会诱导开花。在没有黎明和黄昏光信号的情况下,敏感和不敏感阶段的持续振荡是昼夜节律振荡器控制的各种过程的特征(见图 20.3)。
CONSTANS 表达和光的巧合促进了 LDP 中的开花
日照时间本身就是一种强大的外部刺激,可帮助植物感知季节何时变化以及何时是开花的正确时间。根据外部巧合模型,植物开花反应仅在昼夜循环的某些时间对光敏感。促进拟南芥在长日照下开花的调控途径的关键组成部分是一种名为 CONSTANS (CO) 的基因,它编码一种锌指转录因子。 CO 首次在拟南芥突变体 co 中发现,该突变体无法进行光周期开花反应。 CO 的表达受昼夜节律钟控制,其 mRNA 丰度的每日波动表明了这一点(图 20.11A 和 B,顶部曲线)。然而,遗传学和分子研究表明,在 LDP 拟南芥中,CO 蛋白仅在长日照下积累(见图 20.11A 和 B,中间曲线),这就是加速开花的原因。
外部巧合机制的一个关键特征是,当 CO 昼夜节律的光敏阶段(在叶子中产生,即感知光周期刺激的位置)与光(外部信号)的存在相吻合时,LDP 中的开花得到促进。在短日照期间发生的 CO mRNA 增加不会导致 CO 蛋白增加,因为 CO 表达完全发生在黑暗中。相反,在长日照期间,CO 基因表达会伴随 CO 蛋白水平的急剧增加,因为至少有一部分 CO 表达期与光照期重叠(见图 20.11B)。
长日照对拟南芥开花有诱导作用,因为在这些条件下 CO 蛋白水平会增加,外部巧合模型的一个重要特征是光可以使活性 CO 蛋白积累到促进开花的水平。CO mRNA 的昼夜节律振荡解释了光周期感知和昼夜节律钟之间的联系,使植物能够测量日照长度的变化。但光是如何引起 CO 蛋白积累的呢?
有证据表明,在长日照条件下,CO 蛋白的丰度在整个昼夜循环中都会波动,在光照期间会出现两个峰值诱导,这为光的功能提供了线索。一个峰值出现在黎明前,另一个峰值出现在一天结束时(见图 20.11B)。昼夜 CO 蛋白谱部分基于光照和黑暗条件下 CO 降解速率的差异。在黑暗中,CO 被泛素标记并被 26S 蛋白酶体快速降解(见第 4 章)。光照似乎增强了 CO 蛋白的稳定性,使其能够在白天积累。这解释了为什么 CO 仅在其 mRNA 在光照期间积累时才促进开花。
然而,情况比简单的光照-黑暗开关调节 CO 蛋白周转更复杂。光照对 CO 稳定性的影响取决于几种不同光感受器的功能。早晨,当 CO 达到黎明前的峰值时,光敏色素 B (phyB) 和 ZEITLUPE (ZTL)(后者是一种LOV蓝光光感受器(见第 16 章))似乎会促进光诱导的 CO 降解,通过未知机制急剧降低其水平。相比之下,傍晚时分,隐花色素 phyA 和 FLAVIN-BINDING KELCH REPEAT, F-BOX 1 (FKF1)(一种 ZTL 同源蓝光光感受器)会拮抗这种降解并允许 CO 蛋白积聚(见图 20.11B;另见网络主题 20.6)。日长依赖性CO表达和CO积累的调控是使得拟南芥能够测量日长变化的核心机制。
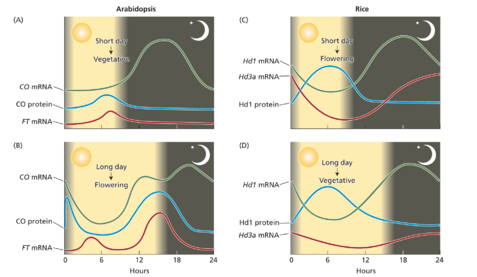
SDP 使用巧合机制来抑制长日照条件下的开花
对 SDP 水稻开花的研究表明,水稻和拟南芥中光周期感应的基本外部巧合机制是保守的。水稻基因 Heading-date1 (Hd1) 和 Heading-date3a (Hd3a) 分别编码与拟南芥 CO 和 FT (FLOWERING LOCUS T) 同源的蛋白质。在转基因植物中,拟南芥中 FT 的过度表达和水稻中 Hd3a 的过度表达导致快速开花,而与光周期无关,表明 FT 和 Hd3a 都是开花的强启动子。此外,在诱导光周期(拟南芥长日照,水稻短日照)期间,天然 FT 和 Hd3a 基因表达量显著升高(图 20.11C)。此外,水稻 Hd1 和拟南芥 CO 表现出相似的 mRNA 积累昼夜模式。水稻和拟南芥的区别在于,在 SDP 水稻中,Hd1 在长日照下充当 Hd3a 表达的抑制剂(图 20.11D),而在短日照下充当其表达的激活剂(见图 20.11C)。
与拟南芥中发生的情况相反,在水稻中,长日照下 Hd1 表达与光照的巧合通过抑制 Hd3a 的表达来抑制开花。因此,SDP 水稻中的开花仅在短日照条件下发生,此时 Hd1 主要在黑暗中表达。此外,Hd1 对 Hd3a 表达的影响(抑制与诱导)似乎根据日照长度而以不同的方式调节。 Hd1在光照期间积累,与光照周期无关,但处于生化活性状态,仅在短日照下启动 Hd3a 转录。值得注意的是,SDP 和LDP 对光周期的不同反应部分是由于日照长度对光周期传感系统中 CO/Hd1 活性的相反影响。
然而,值得注意的是,光周期现象更加复杂,其他调节机制肯定会存在,这些机制可以微调 SDP 和 LDP 对日照长度变化的反应(方框 20.1)。
方框 20.1 参考自然环境中光周期开花的分子机制
如本章所示,开花受光质、光周期、温度等环境因素组合控制。与实验室动物一样,生理研究中使用的植物通常在受控的环境条件下生长,例如固定温度的明暗循环。事实上,大多数生物研究实验室都采用简化的环境条件,以尽量减少环境变化并获得可靠和可重复的数据。这种方法在模型植物中的应用在阐明各种基本生理过程方面非常成功。
然而,与动物一样,植物在实验室和自然环境中在生理和分子水平上的反应往往不同。例如,最近的研究表明,LDP 拟南芥在自然长日照下比在受控条件下的长日照下开花更早。此外,令人惊讶的是,FT 转录本的丰度在室外的早晨和黄昏达到峰值(图 A)。在实验室条件下,通常不会观察到一天早些时候 FT mRNA 的高积累(见正文中的图 20.11)。实验室和室外条件下开花时间和 FT 表达谱的差异是由红光:远红光 (R:FR) 比率和日温度变化的综合作用造成的。阳光下的 R:FR 比率接近 1.0,但在实验室通常使用的光源下则超过 2.0,这表明研究中使用的实验室生长条件是红光富集的。这可以部分解释与室外相比,实验室条件下拟南芥开花延迟的原因,因为红光通过破坏 CO 蛋白的稳定性来抑制开花。此外,在自然环境下,早晨 CO 蛋白的降解率降低,表明在此条件下 CO 稳定性的增加与 FT 诱导之间存在相关性(见图 A)。此外,全天的温度波动强烈影响 FT 表达模式。通过调整 R:FR 比率和每日温度循环的设置,使其更接近自然条件,可以在受控实验室条件下重现户外观察到的开花反应。
在户外,FT mRNA 丰度在早晨和黄昏达到峰值。与传统实验室长日照条件下的 FT 表达模式相比,户外 FT 的额外早晨峰值加速了拟南芥的开花。在自然的长日照条件下,早晨 CO 蛋白的降解率降低,这表明这种条件下 FT 峰值的诱导是由于 CO 稳定性的增加。此外,作为吸收远红光的主要光受体,phyA 似乎有助于响应 R:FR 比率为 1.0 和室外每日温度循环而产生 FT 早晨峰值。(根据 Y. H. Song 等人 2018 年。自然植物 4:824–835。)
PhyA 是负责吸收远红光的主要光受体,可能也参与温度感应。在拟南芥中,PHYA 基因中功能丧失的等位基因在生长室中长日照条件下表现出开花略微延迟。相比之下,phyA 突变体在田间开花延迟更为明显。此外,在自然条件下,早晨的 FT 转录本水平因 phyA 突变而大大降低,这表明 phyA 在开花调节中起着至关重要的作用,而这种作用在实验室条件下一直被低估。
显然,在自然条件下研究植物对于提高我们对植物生物学和生理学的理解至关重要,并将帮助我们为气候变化下的粮食安全制定未来方案。 ■
BOX20.1到此结束
光敏色素是光周期现象中的主要光感受器
暗期中断实验非常适合研究光周期反应期间接收光信号的光感受器的性质(见第 16 章)。暗期中断对 SDP 开花的抑制是第一个被证明受光敏色素控制的生理过程之一(图 20.12)。
在许多 SDP 中,只有当提供的光照剂量足以使 Pr(吸收红光的光敏色素)的光转化饱和为 Pfr(吸收远红光的光敏色素)时,暗期中断才会有效(见第 16 章)。随后暴露于远红光,将色素光转化回生理上不活跃的 Pr 形式,从而恢复开花反应。
图 20.13 显示了 SDP 中开花反应的抑制和恢复作用光谱。当使用暗生长的牵牛幼苗来避免叶绿素的干扰时,在 660 nm 处获得峰值,即 Pr 的最大吸收值。相反,苍耳的光谱提供了绿色植物中反应的一个例子,其中叶绿素的存在会导致 Pr 的作用光谱和吸收光谱之间出现一些差异。这些作用光谱加上暗期中断反应的红光/远红光可逆性证实了光敏色素作为光受体的作用,参与了 SDP 的光周期测量。LDP 的暗期中断实验也表明光敏色素参与了这一过程。因此,在某些 LDP 中,夜间红光中断会促进开花,而随后暴露于远红光会阻止这种反应。
在 LDP 大麦 (Hordeum vulgare)、黑麦草 (Lolium temulentum) 和拟南芥中观察到了远红光促进开花的昼夜节律 (图 20.14)。该响应与远红光的辐照度和持续时间成正比,因此是高辐照度响应 (HIR;见第 16 章)。与其他 HIR 一样,phyA 是介导对远红光响应的光敏色素。与 phyA 在促进 LDP 开花中的作用一致,PHYA 基因突变会延迟拟南芥的开花。相反,当 phyB 吸收红光时,它会延迟开花,与红光和远红光的拮抗作用一致,phyB 突变会促进拟南芥的开花。然而,在某些 LDP 中,光敏色素的作用比在 SDP 中更复杂,因为蓝光光感受器也参与了响应。
蓝光光感受器调节某些 LDP 的开花
在某些 LDP 中,例如拟南芥,蓝光可以促进开花,这表明蓝光光感受器可能参与开花的控制。正如我们在第 16 章中讨论的那样,由 CRY1 和 CRY2 基因编码的隐花色素是控制拟南芥幼苗生长的蓝光光感受器。如第 20.3 节所述,CRY 蛋白也与昼夜节律振荡器的同步有关。已经使用 WEB TOPIC 20.7 中提到的荧光素酶报告基因构建体研究了蓝光在开花中的作用及其与昼夜节律的关系。拟南芥开花时间突变体 ztl 的研究也支持蓝光对昼夜节律和开花的调节作用(见 WEB TOPIC 20.7 和 20.8)。
几种蓝光光感受器参与了拟南芥中诱导光周期的感应。一种隐花色素基因 CRY2 的突变(见第 18 章)导致长日照下的开花延迟。此外,cry1/cry2 双突变体在长日照下的开花时间比 cry2 稍晚,表明 CRY1 和 CRY2 在促进拟南芥开花时间方面存在一些功能冗余。
另一种蓝光光感受器在拟南芥的光周期开花中起着至关重要的作用。 FKF1 的功能是将 CO 表达的诱导与长日照期相一致,而不是短日照期,从而使拟南芥sis 来区分季节。在长日照下,功能丧失的 fkf1 突变体开花非常延迟,并且无法感知诱导光周期。相反,FKF1 蛋白的过量产生促进了长日照下的开花。此外,FKF1 同源物 ZTL 似乎在开花调节中拮抗了 FKF1。与 fkf1 突变体一样,长日照下,高 ZTL 蛋白水平的植物比野生型植物开花晚得多相反,ZTL 基因的功能丧失等位基因会导致早开花。
隐花色素 FKF1 和 ZTL 很可能通过调节 CO 蛋白的稳定性来调节开花,从而使其在长日照条件下积累。如前所述,CO 蛋白在 LDP 中起着促进开花的作用。
20.5 长距离信号传导参与开花
虽然花的诱导发生在枝条的顶端分生茎,但在光周期植物中,诱导光周期是由叶子感知的。这表明必须从叶子向顶端传输长距离信号,这已通过在许多不同植物物种中进行的广泛嫁接实验得到实验证明。这种信号的生化性质长期困扰着生理学家。这个问题最终通过分子遗传学方法得到解决,花刺激物被鉴定为一种蛋白质。在本节中,我们回顾了发现花刺激物(称为成花素florigen)的背景,成花素在开花期间充当长距离信号。
嫁接研究为可传递的花刺激物提供了第一个证据
光周期诱导叶片产生的生化信号被传送到远处的目标组织(茎尖),在那里刺激反应(开花),满足了激素效应的重要标准。 20 世纪 30 年代,Mikhail Chailakhyan 假设存在一种通用的开花激素,他将其命名为成花素。
支持成花素的证据主要来自实验,在这些实验中,通过将光周期诱导的供体植物的叶子或枝条嫁接到非诱导受体植物上来刺激其开花。例如,在 SDP Perilla crispa中,将在诱导短日照下生长的植物的叶子嫁接到在非诱导长日照下生长的植物上会导致后者开花(图 20.15A)。此外,在具有不同光周期要求的植物中,开花刺激似乎相同。因此,将在长日照下生长的 LDP 烟叶的诱导枝嫁接到 SDP ‘Maryland Mammoth’ 烟草上会导致后者在非诱导(长日照)条件下开花。
DNP 的叶子也被证明会产生嫁接传递的花刺激(表 20.2)。例如,将开花日中性品种大豆‘Agate’的单片叶子嫁接到短日品种‘Biloxi’上,即使后者在非诱导性长日照下生长,也会导致‘Biloxi’开花。同样,将开花日中性品种烟草(Nicotiana tabacum,cv. Trapezond)的枝条嫁接到LDP Nicotiana sylvestris上,可诱导后者在非诱导性短日照下开花。
嫁接研究还表明,在某些物种中,例如苍耳(SDP)、落叶松(SLDP)和蝇子草(LDP),不仅可以通过嫁接诱导开花,而且诱导状态本身似乎可以self-propagating(参见网络主题 20.9)。在少数情况下,开花甚至可以通过不同属之间的嫁接来诱导。当开花的 Calendula officinalis 的枝条被嫁接到营养生长中的Xanthium砧木上,SDP Xanthium strumarium 在长日照条件下开花。类似地,将 LDP 矮牵牛的嫩枝嫁接到喜冷的二年生天仙子 (Hyoscy amus niger) 砧木上,会导致后者在长日照下开花,尽管它没有经过春化处理 (图 20.15B)。
在 Perilla crispa中(见图 20.15A),花刺激物从供体叶片到嫁接处移位与 14C 标记同化物从供体移位密切相关,并且这种移位取决于嫁接处维管连续性的建立。这些结果证实了早期环剥研究的结果,表明花刺激物与韧皮部中的光同化物一起移位。
成花素在韧皮部中转移
叶片产生的光周期成花刺激物通过韧皮部转移到茎尖分生组织,在那里促进成花。阻止韧皮部转移的处理,例如环剥或局部热灭活,通过阻止成花刺激物移出叶片来阻止开花。
可以通过在诱导后的不同时间去除叶片,并比较信号到达距离诱导叶片不同距离的两个芽所需的时间来测量成花素的移动速率。 这种测量的基本原理是,尽管去除了叶片,但当开花时,阈值量的信号化合物已经到达芽。 通过这种方式,可以确定足够量的信号离开叶片的时间。此外,比较两个不同位置芽的诱导时间可以测量信号沿茎移动的速率。
使用此方法的研究表明,开花信号的移动速率与韧皮部中糖的转运速率相当或略慢(见第 11 章)。例如,SDP 藜成年叶片中的花刺激物在长夜开始后的 22.5 小时内完成输出。在 LDP Sinapis 中,花刺激物从叶片中的移动早在长日处理开始后 16 小时就已完成。
由于成花刺激物与韧皮部中的糖一起转运,因此它受源库关系的影响。靠近茎尖的诱导叶比通常为根部提供养分的茎基部的诱导叶更容易引起开花。同样,位于诱导叶和顶芽之间的非诱导叶将倾向于抑制开花,因为它们是芽的首选源叶,从而阻止来自更远端诱导叶的花刺激物到达其目标。
20.6 成花素的鉴定
20.5 节中描述的开创性嫁接实验确定了从叶子到顶端分生组织的长距离信号对刺激开花的重要性。 自 20 世纪 30 年代以来,已经进行了许多分离和表征成花素的尝试,但均未成功。一个重大突破是通过基因筛选鉴定了拟南芥中的FLOWERING LOCUS T (FT)。
拟南芥的蛋白 FLOWERINGLOCUS T (FT) 是成花素
根据外部巧合模型,当 CONSTANS 基因在光照期间表达时,拟南芥等 LDP 就会开花。CO 基因的表达似乎在叶和茎的韧皮部伴胞中最高。一组实验表明,通过在成熟叶片的小脉韧皮部中特异性表达 CO,可以挽救 co 突变体对光周期不敏感的开花。相反,在 co 突变体的顶端分生组织中表达 CO 并没有恢复开花表型,这支持了以下观点:CO 专门在叶片韧皮部中起作用,以刺激响应长日照而开花。其他研究表明,当将叶韧皮部中表达 CO 的转基因枝条嫁接到 co 突变体上时,所有枝条都会诱导开花,而不仅仅是那些表达 CO 的枝条。这一观察结果表明,CO 表达会产生一种可通过嫁接传递的花刺激,从而导致顶端分生组织开花。
CO 活性的信号输出直接由 FT 的表达介导,FT 的表达也只在伴胞中观察到。在拟南芥中,长日照期间的 CO 表达会导致 FT mRNA 增加(见图 20.11)。然而,与 CO 不同,FT 在伴胞或顶端分生组织中表达时都会刺激开花。 FT 基因(或其相关基因,如前面讨论过的水稻中的 Hd3a)的表达在多种物种的花诱导光周期中被诱导。当 FT 基因被引入到开花不受光周期影响的多种植物物种中时,它会加速开花。此外,FT 蛋白可以从叶子移动到顶端分生组织,从而表现出成花素所具有的所有特性。
根据目前的模型,在诱导光周期下,FT 蛋白通过韧皮部从叶子移动到分生组织。该过程有两个关键步骤:FT 从伴胞输出到筛管分子,以及在茎尖激活 FT 靶基因,从而触发花的发育。内质网 (ER) 是蛋白质从伴胞运输到筛管分子的主要途径之一。内质网定位蛋白 FT INTERACTING PROTEIN1 (FTIP1) 是 FT 进入韧皮部转运流所必需的,韧皮部转运流将其带到分生组织(图 20.16)。一旦进入花分生组织,FT 蛋白就会进入细胞核并与 FLOWERING D (FD) 形成复合物,FLOWERING D (FD) 是一种在分生茎中表达的碱性亮氨酸拉链 (bZIP) 转录因子。FT 和 FD 形成的复合物随后激活花身份基因,例如 APETALA1 (AP1)。
在拟南芥中,这些事件启动了正反馈回路,使分生组织保持开花状态。在被 FT 蛋白激活后,FD 触发了SUPPRESSOR OF OVEREXPRESSION OF CONSTANS1 (SOC1) 和 AP1 的表达。这两个靶标都激活了 LEAFY(LFY;我们将在本章后面讨论的花身份基因),LFY 直接激活 AP1 和 FD 的表达,形成两个正反馈回路(见图 20.16)。由于这些正反馈回路的作用,拟南芥的花芽分化是不可逆的。然而,一些物种的分生组织缺乏这样的正反馈回路,因此,在没有连续诱导光周期的情况下,会恢复产生叶子。
此外,在宿主植物中合成的 FT 蛋白很可能能够进入附着在其上的寄生植物的茎中。一旦到达那里,宿主 FT 蛋白就会通过与寄生植物产生的 FD 蛋白发生物理相互作用来触发开花相关基因的激活。通过使用植物间移动信号——FT 蛋白——寄生植物可以使其开花与宿主植物的开花同步,并优化其生殖适应性。
20.7 春化:利用冷处理促进开花
春化是通过对水合种子(即吸水的种子)或生长中的植物(干种子对冷处理没有反应,因为春化是一个活跃的代谢过程)进行长时间的冷处理来缓解开花抑制的过程。没有冷处理,需要春化的植物会延迟开花或保持营养状态,并且它们无法对诱导光周期等开花信号做出反应。在许多情况下,这些植物会长成莲座状,茎不会伸长(图 20.17)。在本节中,我们将研究开花对冷需求的一些特征,包括诱导温度的范围和持续时间、感知位置、与光周期的关系以及可能的分子机制。
春化作用使茎尖具备开花能力
植物对春化作用敏感的年龄差异很大。冬季一年生植物,如谷类的冬季形式(在秋季播种,在随后的夏季开花),在其生命周期的早期对低温作出反应。事实上,如果种子已经吸收水分并变得具有代谢活性,许多冬季一年生植物可以在发芽(即种子长出胚根)之前进行春化。其他植物,包括大多数二年生植物(在播种后的第一个季节长成莲座状,在随后的夏季开花),必须达到最小尺寸,然后才能对低温敏感以进行春化。
春化作用的有效温度范围为从略低于冰点到约 10°C,最适温度通常为 1 至 7°C。冷处理时间越长,冷效应越强,直至反应饱和。反应通常需要暴露于低温下数周,但确切的持续时间因物种和品种而异。
暴露于高温等去春化条件(图 20.18)会导致春化作用丧失,但暴露于低温下的时间越长,春化作用越持久。
春化作用似乎主要发生在茎尖分生组织中。当只有茎尖受冷时,局部冷却也会导致开花,这种影响似乎与植物其余部分所经历的温度基本无关。切下的茎尖已成功进行春化处理,对于可以对种子进行春化处理的物种,主要由茎尖组成的胚胎碎片对低温敏感。
从发育的角度来看,春化处理导致分生组织获得进行花转变的能力。然而,正如本章前面所讨论的,开花能力并不能保证开花。春化要求通常与特定光周期的要求有关。最常见的组合是要求冷处理后需要长日照——这种组合导致高纬度地区在初夏开花(参见 WEB TOPIC 20.10)。在某些小麦和大麦品种中,短日照可以取代冷介导的春化,这一过程称为谷物中的 SD 春化。
春化可能涉及基因表达的表观遗传变化
要发生春化,在冷处理期间需要主动代谢。需要能量来源(糖)和氧气,而低于冰点的温度会抑制代谢活动,对春化无效。此外,细胞分裂和 DNA 复制似乎也是必需的。在某些植物物种中,春化会导致分生组织形成花序的能力发生稳定变化。
春化如何稳定地影响能力的一种解释是,在冷处理后,分生组织中的基因表达模式会发生变化,这种变化会持续到春季和整个生命周期的剩余时间。基因表达的稳定变化不涉及 DNA 序列的改变,并且可以通过有丝分裂或减数分裂传递给后代细胞,这被称为表观遗传变化。因此,即使在诱导变化的信号(在这种情况下是寒冷)不再存在后,基因表达的表观遗传变化仍然是稳定的。基因表达的表观遗传变化发生在许多生物体中,从酵母到哺乳动物,并且通常需要细胞分裂和 DNA 复制,就像春化一样。
在 LDP 拟南芥中,已证实特定靶基因的表观遗传调控参与了春化过程。在需要春化和长日照来加速开花的冬季一年生拟南芥中,已鉴定出一种作为开花抑制剂的基因:FLOWERING LOCUS C (FLC) 。FLC 在非春化茎尖区域高度表达。春化后,该基因在植物生命周期的剩余时间内被表观遗传关闭,允许响应长日照而开花(图 20.19)。在下一代中,然而,该基因再次被打开,恢复了对寒冷的要求。因此,在拟南芥中,FLC 基因的表达状态是决定分生组织能力的主要因素。在拟南芥中,已证明 FLC 通过直接抑制叶片中关键花信号 FT 以及茎尖分生组织中转录因子基因 SOC1 和 FD 的表达来发挥作用(见图 20.16)。
FLC 的表观遗传调控涉及染色质重塑导致的染色质结构稳定变化(见第 3 章)。春化导致 FLC 基因的染色质失去常染色质(转录活性 DNA)特有的组蛋白修饰,并获得异染色质(转录无活性 DNA)特有的修饰,例如特定赖氨酸残基的甲基化。冷诱导 FLC 从真染色质转变为异染色质,有效地沉默了该基因。
可能已经进化出一系列春化途径
许多需要春化的植物在秋季发芽,利用最适合其生长的凉爽潮湿条件。这些植物的春化要求确保开花直到春天才会发生,从而使植物能够以营养方式度过冬天(花朵对霜冻特别敏感)。春化植物不仅必须感知寒冷暴露,而且还必须具有测量寒冷暴露持续时间的机制。例如,如果植物在秋季初暴露于短暂的寒冷中,然后在秋季晚些时候恢复温暖的温度,那么重要的是植物不要将短暂的寒冷暴露视为冬天,而将随后的温暖天气视为春天。因此,春化作用只有在暴露于足以表明整个冬季已经过去的寒冷天气后才会发生。
类似的测量芽从休眠中释放之前的寒冷时间的系统存在于许多温带多年生植物种。来测量寒冷持续时间的机制尚不清楚,但在拟南芥中,有些基因只有在长时间暴露于寒冷后才会被诱导,这些基因对春化过程至关重要。
似乎没有一种特定的春化途径在所有开花植物中保守。如前所述,FLC 是负责拟南芥春化要求的开花抑制因子。FLC 编码一种 MADS 盒蛋白,该蛋白与我们在本章后面讨论的调节蛋白有关,例如 DEFICIENS 和 AGAMOUS,它们参与了花的发育。在谷类植物中,一种编码不同类型蛋白质的基因,一种含锌指的蛋白质,称为 VRN2(春化 2),充当开花抑制因子,产生春化要求。
看来,开花植物的主要群体是在温暖的气候中进化的,因此没有进化出一种测量冬季持续时间的机制。在地质时期内,由于大陆漂移和其他因素,地球的某些地区逐渐形成了温带气候。许多植物群体的成员适应了这些新的温带生态位,并发展出了春化和芽休眠等反应,因此这些反应很可能在不同的植物群体中独立进化。
20.8 参与开花的多种途径
很明显,向开花的过渡涉及一个复杂的相互作用因素系统。叶片产生的可传递信号(包括植物激素)是决定自主调节和光周期物种的茎尖所必需的。
赤霉素和乙烯可诱导开花
在天然生长激素中,赤霉素(见第 15 章)可对开花产生强烈影响(见 WEB TOPIC 20.11)。外源赤霉素可引发开花,无论是应用于莲座丛 LDP(如拟南芥)还是在短日照下生长的双日照植物(如落地生根)。
赤霉素似乎在长日照下对拟南芥开花的促进作用较弱,在短日照下则较强。赤霉素信号传导的中心抑制因子 DELLA 蛋白下调 FT、LFY 和 SOC1 基因的表达。 DELLA 蛋白还与 FT 的转录调节因子相互作用,例如 CO、FLC 和 PHYTOCHROME 相互作用因子 4 (PIF4)(见第 4 章)。赤霉素刺激 DELLA 的蛋白酶体降解,导致 FT、LFY 和 SOC1 上调,从而促进开花(见图 20.16)。外源施用的赤霉素也可以在非诱导条件下和未经春化的需冷植物中引起少数 SDP 开花。如第 20.2 节中关于相变的讨论所述,通过添加赤霉素,还可以促进几种裸子植物科的幼苗中球果的形成。因此,在某些植物中,外源赤霉素可以绕过自主开花的内源性触发因素,以及日照长度和温度的主要环境信号。如第 4 章所述,植物含有许多赤霉素类化合物。这些化合物中的大多数要么是赤霉素活性形式的前体,要么是其无活性代谢物。
植物中的赤霉素代谢受日照长度的强烈影响。例如,在 LDP 菠菜 (Spinacia oleracea) 中,赤霉素水平在短日照下相对较低,植物保持莲座状。当植物转入长日照环境后,13-羟基化途径(GA53 → GA44 → GA19 → GA20 → GA1;参见网络附录 3)的所有赤霉素水平都会增加。然而,生理活性赤霉素 GA1 增加了五倍,这是导致伴随开花的茎明显伸长的原因。
除了赤霉素,其他生长激素也可以抑制或促进开花。一个具有商业重要性的例子是乙烯和释放乙烯的化合物显著促进菠萝(Ananas comosus)开花——这种反应似乎仅限于菠萝科(Bromeliaceae)的成员。
开花的转变涉及多种因素和途径
遗传学研究已确定,有四种不同的发育途径控制LDP拟南芥的开花(见图20.16):
● 光周期途径始于叶片,涉及多种光感受器。在长日照条件下的LDP中,这些光感受器之间的复杂关系导致CO蛋白在叶片韧皮部伴胞中积累。CO激活其下游靶基因 FT 在韧皮部中表达。FT 蛋白(“成花素”)进入筛管分子,并转移到顶端分生组织,在那里刺激开花。如图 20.16 中分生组织的放大图所示,FT 蛋白与转录因子 FD 形成复合物。然后,FD-FT 复合物激活下游靶基因,如 SOC1、AP1 和 LFY,这些基因会打开花序分生组织侧面的花同源基因。
● 在自主途径和春化途径中,开花要么是对内部信号(产生固定数量的叶子)的反应,要么是对长时间低温的反应。在拟南芥的自主途径中,与该途径相关的所有基因都在分生组织中表达。自主途径通过减少开花抑制基因 FLOWERING LOCUS C (FLC) 的表达起作用,FLC 是 SOC1 表达的抑制剂。春化作用也会抑制 FLC,但通过不同的机制(表观遗传开关)。由于 FLC 基因是共同的靶标,因此自主途径和春化途径被归为一组。
● 赤霉素途径主要在非诱导短日照下开花,在长日照下也略有需要。外源赤霉素可以通过促进 FT、SOC1 和 LFY 的表达来促进这些非诱导条件下的开花。
所有四种途径主要集中在关键花卉调节剂 FT 在维管系统中的表达上。然后,FT 蛋白传递诱导信号,使 SOC1、LFY 和 AP1 在分生组织中表达(见图 20.16),进而激活花器官发育所需的下游基因,如 AP3、PISTILLATA (PI) 和 AGAMOUS (AG),我们将在下一节中看到。
20.9 花分生组织和花器官发育
一旦flowering has been evoked,花朵的形成就开始了。花朵的形状极其多样,反映了保护发育中的配子体、吸引传粉者、促进自花授粉或异花授粉以及产生和散播果实和种子的适应性。尽管存在这种多样性,但遗传和分子研究现已确定了一个基因网络,这些基因控制着与拟南芥和金鱼草 (Antirrhinum majus) 的花朵不同的花朵的花形态发生。这种调控网络的变化现在似乎也能解释其他物种的花形态发生。
在本节中,我们将重点介绍拟南芥的花发育,该植物已被广泛研究。首先,我们概述了从营养期到生殖期的过渡过程中发生的基本形态变化。然后,我们考虑分生组织上四轮花器官的排列,以及控制正常花发育模式的基因类型。
拟南芥的茎尖分生组织随着发育而变化
花分生组织通常可以通过其较大的尺寸与营养分生组织区分开来。在营养分生组织中,中心区域的细胞缓慢地完成其分裂周期。从营养发育到生殖发育的转变以茎尖分生组织中心区域内细胞分裂频率的增加为标志(见第 18 章)。分生组织大小的增加主要是由于这些中心细胞分裂率的增加。
在营养生长阶段,拟南芥顶端分生组织产生节间非常短的叶片,从而形成叶基莲座丛(图 20.20)。当生殖发育开始时,营养分生组织转变为初生花序花序分生组织。初生花序分生组织primary inflorescence meristem产生细长的花序轴,花序轴上长有两类侧生器官:茎生叶(或花序内叶)和花。茎生叶的腋芽发育成次级花序分生组织secondary inflorescence meristems,其活动重复了主花序分生组织的发育模式。拟南芥花序分生组织具有无限生长的潜力,因此表现出不确定生长 indeterminate growth。花从花序分生组织侧面形成的花分生组织中产生(图 20.21)。与花序分生组织相反,花分生组织是确定的determinate。
四种不同类型的花器官以单独的轮whorls开始
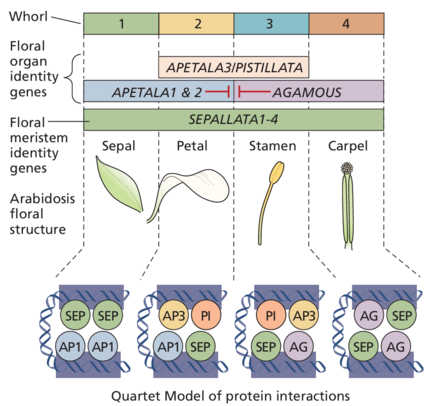
花分生组织产生四种不同类型的花器官:萼片、花瓣、雄蕊和心皮。这些器官组以同心环的形式开始,称为轮whorls,围绕分生组织的侧面(图 20.22)。最内层器官心皮的起始消耗了顶端圆顶中的所有分生细胞,并且只有花器官原基(细胞分裂的局部区域)在花芽发育时存在。在拟南芥中,轮生花的排列如下:
● 第一轮(最外层)由四个萼片组成,成熟时为绿色。
● 第二轮生由四片花瓣组成,成熟时为白色。
● 第三轮生包含六个雄蕊(雄性生殖结构),其中两个比其他四个短。
● 第四轮(最内轮)是一个单一的复杂器官,即雌蕊(雌性生殖结构),由一个子房/两个融合的心皮组成,每个心皮包含许多胚珠,以及一个顶部有柱头的短花柱。
两大类基因调节花发育
突变研究使我们能够识别出两类调节花发育的关键基因:花分生组织身份基因和花器官身份基因。
1. 花分生组织身份基因Floral meristem identity genes编码转录因子,这些因子对于花器官身份基因的初始诱导必不可少。它们是发育中的花分生组织中花器官身份的正调节剂。
2. 花器官身份基因 Floral organ identity genes 直接控制花器官身份。这些基因编码的蛋白质是转录因子,它们与其他蛋白质辅因子相互作用,控制下游基因的表达,这些基因的产物参与花器官的形成或功能。
虽然某些基因恰好适合这两大类,但重要的是要记住,花卉发育涉及复杂的非线性基因网络。在这些网络中,单个基因通常发挥多种作用。例如,进化已经招募了相同的转录因子 APETALA2,首先调节花分生组织身份,然后调节花器官身份(表 20.3)。
| 基因 | 转录因子家族 | 功能 | 表达区域 | 同源基因 |
|---|---|---|---|---|
| CONSTANS (CO) | 锌指 | 激活光周期长时的开花 | 长光周期下的叶片 | AtCO(马铃薯);Hd1(稻米) |
| FLOWERING D (FD) | bZIP | florigen受体,激活通过AP1的开花 | 顶端分生组织 | OsFD1(稻米) |
| SUPPRESSOR OF OVEREXPRESSION OF FLOWERING1 (SOC1) | MADS | 激活下游的开花 | 叶片和顶端分生组织 | - |
| PHYTOCHROME INTERACTING FACTOR4 (PIF4) | bHLH | 响应高温激活florigen | 叶片和顶端分生组织 | - |
| FLOWERING LOCUS C (FLC) | MADS | 花芽抑制因子 | 叶片和顶端分生组织 | - |
| SHORT VEGETATIVE PHASE (SVP) | MADS | 低温下抑制开花 | 叶片和顶端分生组织 | - |
| FLOWERING LOCUS M (FLM) | MADS | 抑制开花 | 叶片和顶端分生组织 | - |
| LEAFY (LFY) | LFY | 花分生组织身份基因 | 顶端分生组织 | RLF(稻米);FLORICAULA(凤仙花) |
| APETALA1 (AP1) | MADS | A类同源基因,花分生组织身份 | 花分生组织,第一轮 | SQUAMOSA(凤仙花);ZAP1,GLOSSY15(玉米) |
| APETALA2 (AP2) | AP2/EREBP | A类同源基因,花分生组织身份 | 花分生组织,第一轮 | BRANCHED FLORETLESS1(玉米) |
| PISTILLATA (PI) | MADS | B类同源基因 | 第二、三轮 | GLOBOSA(凤仙花) |
| AGAMOUS (AG) | MADS | C类同源基因 | 第三、四轮 | PLENA和FARINELLI(凤仙花);ZAG1和ZMM2(玉米) |
| SEPALLATA (SEP) 1, 2, 3, 4 | MADS | E类同源基因 | 第一至四轮 | DEFH49,DEFH20,DEFH72,AmSEP3B(凤仙花);ZMM3,8,14(玉米) |
| CAULIFLOWER (CAL) | MADS | 分生组织身份 | 花分生组织 | - |
| FRUITFULL (FUL) | MADS | 花分生组织身份 | 花分生组织和茎生叶 | - |
花分生组织身份基因调节分生组织功能
花分生组织身份基因必须处于活性状态,才能使在茎端分生组织或花序分生组织侧面形成的未成熟原基成为花分生组织。(回想一下,在其侧面形成花分生组织的顶端分生组织被称为花序分生组织;见图 20.21。)例如,花分生组织身份基因 FLORICAULA (FLO) 缺陷的金鱼草 (Antirrhinum) 突变体会形成不产生花的花序。flo 突变体不会在苞片腋中发育花分生组织,而是在苞片腋中发育额外的花序分生组织。因此,野生型 FLO 基因控制确定花分生组织身份的决定步骤。
在拟南芥中,LEAFY(LFY)、FLOWERING D(FD)、CONSTANS1 过度表达的抑制因子(SOC1)和 APETALA1(AP1)是遗传途径中必须激活才能建立花分生组织身份的关键基因(见表 20.3)。LFY 是金鱼草 FLO 基因的拟南芥版本。正如我们在图 20.16 中看到的,LFY、FD 和 SOC1 通过整合来自涉及环境和内部线索的几种不同途径的信号,在花的诱发中发挥核心作用。lfy 和 fd 双突变体无法形成花,突出了 LFY 和 FD 作为花分生组织身份基因的作用,它们是花发育起始的主要调节器。
同源异型突变导致花器官身份基因的鉴定
决定花器官身份的基因被发现为花同源异型突变体。果蝇 (Drosophila) 的突变导致鉴定出一组编码转录因子的同源异型基因,这些转录因子决定特定结构发育的位置。同源异型基因充当主要发育开关,可激活特定结构的整个遗传程序。因此,同源异型基因的表达赋予器官身份。
花器官身份基因首先被鉴定为单基因同源异型突变,它改变了花器官身份,导致一些花器官出现在错误的位置。最初在拟南芥中发现了决定花器官身份的五个关键基因:APETALA1 (AP1)、APETALA2 (AP2)、APETALA3 (AP3)、PISTILLATA (PI) 和 AGAMOUS (AG)。这些基因的突变极大地改变了两个相邻轮生花器官的结构,从而改变了其身份(图 20.23)。例如,具有 ap2 突变的植物缺乏萼片和花瓣(见图 20.23B)。具有 ap3 或 pi 突变的植物在第二轮中产生萼片而不是花瓣,在第三轮中产生心皮而不是雄蕊(见图 20.23C)。 ag 突变纯合子的植物缺乏雄蕊和心皮(见图 20.23D)。因为这些基因的突变会改变花器官的身份,而不会影响花的形成,所以根据定义,它们是同源异型基因。
器官身份基因在花发育中的作用通过实验得到了生动的说明,在这些实验中,两种或三种活性因功能丧失突变而消失。在四重突变的拟南芥植物(ap1、ap2、ap3/pi 和 ag)中,花分生组织不再产生花器官,而是产生绿色的叶状结构;这些叶状器官的产生具有轮生叶序,这是正常花朵的典型特征(图 20.24)。该实验结果表明,叶子是茎分生组织产生的器官的“基态”,而 AP1 和 AP2 等其他基因的活性是将叶状“基态”器官转化为花瓣、萼片、雄蕊和雌蕊所必需的。这一结果支持了 18 世纪德国诗人和自然科学家约翰·沃尔夫冈·冯·歌德 (1749-1832) 的观点,他推测花器官是高度改良的叶子。
ABC 模型部分解释了花器官身份的确定
我们刚刚描述的五个花器官身份基因分为三类 - A,B 和 C - 定义了由三种不同类型的基因编码的三种不同类型的活动(图 20.25):
● 由 AP1 和 AP2 编码的 A 类活动控制第一和第二轮中的器官身份。
A 类活动的丧失导致第一轮中形成心皮而不是萼片,第二轮中形成雄蕊而不是花瓣。
● 由 AP3 和 PI 编码的 B 类活动控制第二和第三轮中的器官决定。
B 类活动的丧失导致第二轮中形成萼片而不是花瓣,第三轮中形成心皮而不是雄蕊。
● 由 AG 编码的 C 类活性控制第三和第四轮中的事件。C 类活性的丧失导致第三轮中形成花瓣而不是雄蕊。此外,在没有 C 类活性的情况下,第四轮(通常是心皮)被a new flower取代。因此,ag 突变体花的第四轮被萼片占据。花分生组织不再是确定的。花在花内继续形成,器官的模式(从外到内)为:萼片、花瓣、花瓣;萼片、花瓣、花瓣;等等。
ABC 模型解释了两个远亲真双子叶植物(金鱼草和拟南芥)的许多观察结果,并提供了一种理解相对较少的关键调节器如何组合提供复杂结果的方法。ABC 模型假定每个轮生器官的身份由三种器官身份基因活动的独特组合决定(见图 20.25):
● A 类活动单独指定萼片。
● A 类和 B 类活动是花瓣形成所必需的。
● B 类和 C 类活动形成雄蕊。
● 仅 C 类活性决定心皮。
该模型进一步提出,A 类和 C 类活性相互抑制;也就是说,除了在确定器官身份方面发挥作用外,A 类和 C 类基因还相互排斥在表达域之外。
虽然该模型预测并解释了野生型花和大多数突变体器官形成的模式,但并非所有观察结果都可以仅用 ABC 基因来解释。例如,整个植物中 ABC 基因的表达不会将营养叶转化为花器官。因此,ABC 基因虽然是必需的,但不足以将花器官身份强加到叶子发育程序上。正如我们接下来讨论的那样,花分生组织身份基因编码的转录因子也是花瓣、雄蕊和心皮形成所必需的。
拟南芥 E 类基因是 A、B 和 C 基因活动所必需的
自从 A、B 和 C 基因被鉴定以来,另一类花同源基因,即 E 类基因被发现。在花同源突变体的突变体筛选中鉴定的其他三个基因 AGAMOUS-LIKE1-3 (AGL1-3) 的突变在单独突变时仅产生细微表型。然而,agl1/agl2/agl3 三重突变体的花仅由萼片状结构组成,这表明先前在三个单独突变的 AGL 基因中观察到的细微表型是由于功能冗余造成的。由于三重突变体具有富含萼片的表型,因此三个 AGL 基因被重新命名为 SEPALLATA1-3 (SEP1-3),并作为 E 类基因添加到 ABC 模型中(图 20.26)。 (D 类基因是胚珠形成所必需的,将在本节后面描述。)
另一个 SEPALLATA 基因 SEP4 与其他三个 SEP 基因重复,赋予萼片身份,并有助于其他三种器官类型的发育。sep 四重突变体显示所有四种花器官类型都转化为叶状结构,类似于 ap1、ap2、ap3/pi 和 ag 四重突变体(见图 20.24 和 20.26)。值得注意的是,通过表达 E 类基因与 A 类和 B 类基因的组合,可以将子叶和营养叶转化为花瓣(图 20.27)。
ABCE 模型是基于拟南芥和金鱼草的遗传实验而制定的。不同物种的花通过修改 ABCE 模型描述的调控网络而进化出不同的结构(参见 WEB TOPIC 20.12)。
根据四重奏模型,花器官身份受 ABCE 蛋白四聚体复合物的调控
迄今为止在植物和动物中已鉴定的所有同源异型基因都编码转录因子。然而,与包含同源框序列的动物同源基因不同,大多数植物同源基因属于一类称为 MADS 框(MADS box )基因的相关序列。首字母缩略词 MADS 基于一个大基因家族的四个创始成员(微染色体维护 1 [MCM1]、AGAMOUS、DEFICIENS 和血清反应因子 [SRF])。决定花器官身份的许多基因都是 MADS 框基因,包括金鱼草的 DEFICIENS 基因和拟南芥的 AGAMOUS (AG)、PISTIL LATA (PI) 和 APETALA3 (AP3) 基因(见表 20.3)。MADS 框基因具有一个称为 MADS 框的特征保守核苷酸序列,该序列编码称为 MADS 结构域的蛋白质结构(图 20.28A)。与 MADS 结构域相邻的是中间区域,其后是 K 结构域,K 结构域是主要参与蛋白质-蛋白质相互作用的卷曲螺旋区域。MADS盒基因转录因子形成四聚体,与 位于其靶基因的调控区的CC(A/T)6GG 序列(即所谓的 CArG-box)结合。当四聚体与同一靶基因上的两个不同 CArG-box 结合时,这些盒子会靠近,从而导致 DNA 弯曲(图 20.28B)。
并非所有同源基因都是 MADS 盒基因,也并非所有包含 MADS 盒域的基因都是同源基因。例如,同源基因 AP2 是 AP2/ERF(乙烯反应元件结合因子)转录因子家族的成员,而花分生组织身份基因 SOC1 是 MADS 盒基因。
为了更机械地理解ABCE 模型,一种生化相互作用模型,称为四重奏模型 Quartet Model,已被提出(图 20.29)。在四重奏模型中,ABCE 基因组合的四聚体直接结合 DNA 并指定花器官。该模型基于以下观察:MADS 盒基因二聚化,两个二聚体可以结合在一起形成四聚体。这些四聚体被假设结合靶基因上的 CArG 盒并修改其表达(见图 20.28B)。虽然所有 MADS 盒蛋白都可以形成高阶复合物,但并非所有这些蛋白都能结合 DNA。例如,B 类因子(AP3 和 PI)仅作为异二聚体结合 DNA,而 A、C 和 E 类的同二聚体和异二聚体都可以结合 DNA。根据该模型,由不同的同源二聚体和异源二聚体组成的四聚体控制花器官身份。例如,AP3-PI 异源二聚体直接与 AP1 和 SEP3 相互作用以促进花瓣形成,并在 SEP3 作为支架的帮助下间接与 AG 相互作用。一般来说,SEP 蛋白似乎充当辅助因子,通过与其产物形成复合物为 ABC 基因提供花特异性活性,并且似乎是激活 ABC 基因表达所必需的。
D 类基因是胚珠形成所必需的
根据 ABCE 模型,心皮形成需要 C 类和 E 类基因的活性。然而,似乎与 C 类基因密切相关的第三组 MADS 盒基因是胚珠形成所必需的。这些胚珠特异性基因被称为 D 类基因。由于胚珠是心皮内的结构,因此 D 类基因严格来说不是“器官身份基因”,尽管它们在指定胚珠方面以大致相同的方式发挥作用。D 类活性最早是在矮牵牛中发现的。沉默已知参与矮牵牛花发育的两个 MADS 盒基因 FLORAL-BINDINGPROTEIN7/11 (FBP7/11) 会导致花柱和柱头在胚珠正常占据的位置生长。当 FBP11 在矮牵牛中过表达时,胚珠原基在萼片和花瓣上形成。
在拟南芥中,SHATTERPROOF1 或 SHATTERPROOF2 (SHP1、SHP2) 或SEEDSTICK (STK) 的异位表达足以诱导萼片转化为带有胚珠的心皮器官。此外,stk/shp1/shp2 三重突变体缺乏正常的胚珠。因此,除了 C 类和 E 类基因外,D 类基因也是正常胚珠发育所必需的。
花朵的花不对称性受基因表达调控
虽然许多花朵(如拟南芥的花朵)是径向对称的,但许多植物已经进化出具有双侧对称性的花朵,这使得它们能够形成专门的结构来吸引传粉者。例如,金鱼草花朵的近轴(背部)花瓣的形状与远轴(腹部)花瓣的形状有明显差异(图 20.30)。这是如何发生的?同样,与 ABCE 模型一样,遗传学提供了答案。自 18 世纪以来,人们就知道了破坏左右对称花朵发育的突变。Carl Linnaeus 是第一个描述柳穿鱼(Linaria vulgaris)自然发生的突变体的人,该突变体将双侧对称的花朵转变为径向对称的形式(图 20.31)。Linaria的花的花冠通常有四个雄蕊和一个蜜距。林奈描述的这个奇异的标本有五雄蕊和五条蜜距。林奈将这种异常的径向对称状态称为 peloria,源于希腊语“怪物”一词。
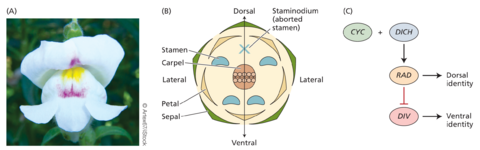
最近,Antirrhinum majus 中的类似突变体(“peloric”)使人们能够从遗传上剖析花对称性指定的分子机制。突变基因 RADIALIS (RAD) 的克隆揭示了 RAD 控制花不对称的调控机制(见图 20.30)。RAD 编码 MYB 家族的转录因子,该转录因子抑制另一个称为 DIVARICATA (DIV) 的关键基因。当 DIV 发生突变时,它会导致花朵的所有花瓣看起来像近轴花瓣。因此,DIV 决定了花朵的远轴花瓣身份。其他突变体的分析表明 RAD 决定近轴花瓣身份。
RAD 转录因子由另外两个基因 CYCLOIDEA 和 DICHOTOMA 激活,这两个基因在近轴花瓣中表达。因此,RAD 的表达使得 DIV 在花的近轴部分受到抑制。当 RAD 不在花的底部表达时,DIV 会表达并决定花的远轴命运。
到目前为止,我们对花发育的理解主要基于三种模式物种,即拟南芥、金鱼草和水稻。未来的挑战之一是探索在更广泛的开花植物中调节花发育的基因网络的变化。第二个挑战是尝试了解花发育途径是如何从非开花祖先进化而来的。这类研究有朝一日可能会解开达尔文的“可恶之谜”——被子植物的进化。
