第十八章 细胞死亡
多细胞生物的发育和维持不仅取决于细胞生长和细胞分裂,还取决于细胞死亡。例如,在动物发育过程中,精心安排的细胞生长、分裂和死亡模式有助于确定肢体和器官的大小和形状。成年动物组织大小的维持通常需要细胞以与产生相同的速度死亡,这一过程称为细胞周转。这种正常的细胞死亡也发生在植物的发育过程中以及花叶的衰老过程中,也可能发生在单细胞生物中,包括酵母和细菌。大多数正常的细胞死亡都是自杀,其中一系列分子事件从内部摧毁了细胞,但分子机制可能大不相同。在本章中,我们将重点介绍一种分子上不同的细胞自杀形式,称为凋亡(来自希腊语,意思是脱落,如树叶从树上掉下来),尽管它只发生在动物细胞中。细胞凋亡被认为发生在所有动物中,而且它是迄今为止我们细胞死亡最常见的方式。它也是研究最深入的细胞死亡形式。凋亡细胞会经历特征性的形态和生物化学变化,部分原因是将自身包装起来,以便被附近的细胞快速吞噬和消化。图181显示正常大鼠细胞(图A)和经历两种不同细胞死亡形式的同类型大鼠细胞(图BD)。在凋亡中,细胞收缩和凝聚,细胞骨架崩溃,核膜解体,核染色质凝聚和碎裂(图181B)。凋亡细胞表面通常形成多个大突起,称为水泡(电影18.1),如果细胞很大,它会分裂成膜包裹的碎片,称为凋亡小体。重要的是,细胞及其碎片的表面会发生化学改变,因此邻近细胞(通常是脊椎动物中的巨噬细胞)会在细胞和碎片溢出其内容物之前迅速吞噬它们(图181C)。这样,细胞就会干净利落地死亡,细胞及其碎片也会迅速被清除,而不会引起破坏性的炎症反应。由于凋亡细胞被吃掉和消化得如此之快,因此即使在大量细胞因凋亡而死亡的组织中,也通常很少看到死细胞。受损或感染的细胞也会因凋亡而死亡,确保它们在威胁动物健康之前被消灭。然而,严重受损或受压的动物细胞有许多非凋亡方式死亡。这些通常被归类为细胞坏死。一种常见的、主要是被动形式的细胞坏死发生在细胞因急性组织损伤(如创伤或血液供应受阻)而溶解时:细胞肿胀并破裂(图181D),将其内容物溢出到邻近细胞上并引发炎症反应。在其他形式的细胞坏死中,细胞积极参与死亡过程,并根据诱导应激的性质和所涉及的分子机制,赋予它们特殊名称,例如坏死性凋亡或焦亡。
在本章中,我们讨论了脊椎动物中细胞凋亡的主要功能、其分子机制和调控,以及过度或不足的细胞凋亡如何导致人类疾病。
凋亡消除不需要的细胞
许多发育和成年脊椎动物组织中发生的细胞凋亡数量令人震惊:健康成年人中每秒至少有100万个细胞以这种方式死亡(并被细胞分裂取代)。这么多细胞死亡似乎非常浪费,尤其是绝大多数细胞在自杀时都是完全健康的。如此大规模的细胞死亡有什么好处?
在某些情况下,特别是在动物发育过程中,细胞死亡的作用是显而易见的。细胞凋亡有助于在胚胎发育过程中塑造我们的手和脚:这些附属物最初是铲状结构,各个手指只有在它们之间的细胞死亡时才会分开,如图182中的小鼠爪子所示。在其他情况下,当细胞形成的结构不再需要时,它们会因细胞凋亡而死亡。例如,当蝌蚪在变态过程中变成青蛙时,尾巴中的细胞会因细胞凋亡而死亡,而青蛙不需要的尾巴会消失。细胞凋亡在发育过程中也起着质量控制过程的作用,消除异常、错位、无功能或对动物有潜在危险的细胞。脊椎动物的适应性免疫系统中就出现了引人注目的例子,细胞凋亡会消灭正在发育的T和B淋巴细胞,这些细胞要么无法产生可能有用的抗原特异性受体,要么产生使细胞具有潜在危险性的自身反应性受体(第24章将对此进行讨论);它还会消灭大多数因感染而激活并增殖的淋巴细胞,因为它们已经帮助消灭了致病微生物。
在既不生长也不萎缩的成人组织中,必须严格控制细胞死亡和细胞分裂以确保它们保持平衡。例如,如果成年大鼠的部分肝脏被切除,肝细胞增殖就会增加以弥补损失。相反,如果给大鼠服用苯巴比妥这种刺激肝细胞生长和分裂(从而导致肝脏增大)的药物,然后停止苯巴比妥治疗,肝脏细胞凋亡会大大增加,直到肝细胞数量恢复正常,通常在一周左右。因此,通过调节细胞死亡率和细胞出生率,肝细胞数量保持恒定。负责控制这种显著的调节在很大程度上是未知的。
动物细胞可以识别其各种细胞器中的损伤,如果损伤足够大,它们可以通过凋亡自杀。一个重要的例子是DNA损伤,它可以产生促进癌症的突变,如果不修复。细胞有多种检测DNA损伤的方法(见图1760),如果无法修复,细胞就会因凋亡而死亡。
细胞凋亡依赖于由胱天蛋白酶介导的细胞内蛋白水解级联反应
一类专门的细胞内蛋白酶家族通过在特定氨基酸序列处裂解大量但特定的细胞内蛋白质来触发细胞凋亡,从而引起细胞凋亡期间发生的剧烈变化。由于这些蛋白酶在其活性位点处具有半胱氨酸,并在特定的天冬氨酸处裂解其靶蛋白,因此它们被称为胱天蛋白酶(c代表半胱氨酸,asp代表天冬氨酸)。并非所有的胱天蛋白酶都参与细胞凋亡:事实上,第一个被鉴定的人类胱天蛋白酶,胱天蛋白酶-1,主要通过裂解两种促炎性细胞外信号分子(细胞因子,第24章讨论)的前体来帮助刺激炎症反应。参与细胞凋亡的胱天蛋白酶在几乎所有细胞的胞质溶胶中都以无活性的前体(通常称为procaspases)的形式存在,在细胞凋亡期间被激活。这些凋亡胱天蛋白酶主要分为两类:起始胱天蛋白酶和执行胱天蛋白酶。
起始胱天蛋白酶,顾名思义,启动凋亡程序。在哺乳动物中,它们主要是胱天蛋白酶-8和胱天蛋白酶-9。它们以无活性的可溶性单体形式存在,只有当单体二聚化时才会被激活。当凋亡信号触发特定衔接蛋白复合物的组装时,就会发生二聚化,然后该复合物会募集多个相同的起始蛋白酶单体以形成更大的活化复合物,单体在其中二聚化并被活化。活化的蛋白酶二聚体中的每个单体随后在特定位点切割其伴侣,形成成熟的、活化的起始蛋白酶二聚体(图183)。
起始蛋白酶的主要功能是激活执行蛋白酶,从而协调凋亡程序。脊椎动物中有三种执行蛋白酶:caspase-3、caspase-6和caspase-7。与起始蛋白酶不同,执行蛋白酶通常以无活性的可溶性二聚体形式存在,通过裂解激活,几乎总是由起始蛋白酶介导(图184)。每个起始蛋白酶可以激活一个或多个执行蛋白酶的许多副本,从而导致蛋白酶级联扩增。一旦被激活,执行者胱天蛋白酶就会催化广泛的蛋白质裂解事件,这些事件负责以特征性方式杀死细胞,并为被临近细胞快速吞噬和消化做好准备。胱天蛋白酶启动的蛋白水解级联不仅具有自我扩增和破坏性,而且不可逆,因此一旦细胞开始走向凋亡,就无法回头。
执行者胱天蛋白酶在凋亡过程中切割数百种不同的细胞蛋白,但这些靶蛋白在凋亡中的作用仅在少数情况下为人所知,我们在此提到了其中几种。例如,胱天蛋白酶-6切割核层蛋白会导致核层不可逆破裂(第12章讨论)。胱天蛋白酶-3切割抑制蛋白,该抑制蛋白通常将特定的DNA降解内切酶保持在非活性形式,从而释放内切酶以在凋亡期间切割细胞核中的DNA(图185)。某些调节肌动蛋白细胞骨架的蛋白质的裂解会导致细胞皮层中的肌动蛋白聚合,而这会导致细胞凋亡时表面起泡,如前所述(参见电影18.1)。其他肌动蛋白调节剂和一些将细胞附着到其邻近细胞上的细胞粘附蛋白的裂解有助于凋亡细胞聚集并与邻近细胞分离,从而使邻近细胞更容易吞噬它。正如我们稍后讨论的那样,质膜中两种磷脂转移蛋白的裂解会导致磷脂酰丝氨酸暴露在凋亡细胞的表面,在那里它充当邻近吞噬细胞的“吃我”信号。重要的是,阻止任何单个蛋白质裂解步骤都不能阻止凋亡细胞死亡,尽管它会按预期在每种情况下改变其特性。
起始蛋白酶如何在凋亡信号的作用下首先被激活?我们的细胞使用两种主要的激活途径:一种是从细胞外部发出信号,称为外部途径,另一种是从线粒体发出信号细胞内,称为内在或线粒体途径。正如我们现在讨论的那样,每个途径都使用自己的起始蛋白酶和衔接蛋白。
细胞表面死亡受体的激活启动细胞凋亡的外在途径
与细胞表面死亡受体结合的细胞外信号蛋白触发细胞凋亡的外在途径。死亡受体是跨膜蛋白,包含细胞外配体结合结构域、单个跨膜结构域和细胞内死亡结构域,这是受体激活凋亡程序所必需的。这些受体是同源三聚体,属于肿瘤坏死因子(TNF)受体家族,该家族有8个成员,包括TNF本身的受体和Fas死亡受体。激活死亡受体的配体也是同源三聚体,属于TNF信号蛋白家族。
关于死亡受体如何触发细胞凋亡的外部途径的一个相对容易理解的例子是杀伤性(细胞毒性)淋巴细胞表面的Fas配体激活靶细胞表面的Fas受体(第24章讨论)。Fas信号在调节T和B淋巴细胞数量方面发挥着作用,正如Fas信号失活导致这些细胞异常增加的研究结果所表明的那样。如图186所示,三聚体Fas配体与三聚体Fas受体聚集,在受体尾部暴露死亡结构域,然后结合并聚集一种称为FADD的小细胞内衔接蛋白。成簇的FADD蛋白依次募集多个无活性的单体起始蛋白酶(主要是caspase-8)的拷贝,这些蛋白酶寡聚化,在靶细胞质膜的细胞质表面形成一个大的死亡诱导信号复合物(DISC)。caspase-8的寡聚化使caspase二聚化和活化,然后caspase自身裂解形成成熟、活性的caspase-8二聚体,这些二聚体可以裂解和激活下游执行蛋白酶以诱导细胞凋亡。
不同细胞类型对Fas诱导的细胞凋亡的敏感性各不相同。许多细胞产生抑制蛋白,可抑制外在凋亡途径。例如,一些细胞会产生一种称为FLIP的蛋白质,这种蛋白质与caspase-8相似,但缺乏蛋白酶活性,因为它缺少活性位点所需的关键半胱氨酸。FLIP与DISC中的caspase-8二聚化,并阻止其激活执行者caspase来启动细胞凋亡。这样,FLIP设置了一个抑制阈值,外部途径必须通过激活caspase-8来克服该阈值才能触发细胞凋亡。正如我们稍后讨论的那样,外部途径要杀死某些细胞类型,就必须克服另一种caspase抑制剂,它通过招募内部凋亡途径(我们现在讨论的途径)来实现这一点。
细胞凋亡的内在途径取决于线粒体释放的蛋白质
细胞还可以从细胞内部激活其凋亡程序,通常是对发育信号或DNA损伤等损伤作出反应。在脊椎动物细胞中,这些凋亡反应由细胞凋亡的内在途径介导,该途径也称为线粒体途径,因为它取决于线粒体蛋白质释放到细胞溶胶中,这些蛋白质通常位于这些细胞器的膜间隙中(见图1247)。这些释放的蛋白质中最重要的是细胞色素c,它是线粒体电子传递链的水溶性成分,因此在线粒体氧化磷酸化产生ATP的过程中起着核心作用(见图1418)。
然而,当它被释放到细胞溶胶中(图187)时,它就具有了全新的功能:它可以诱导细胞凋亡,而与其电子传递活性无关。(在进化过程中,线粒体和细胞色素c如何获得其在细胞凋亡中的惊人作用,这仍然是一个重要的谜团。)
一旦释放到细胞溶胶中,细胞色素c就会与一种名为Apaf1(凋亡蛋白酶活化因子)的衔接蛋白结合1),导致适配器结合dATP并寡聚化成一个大的轮状七聚体。然后,七聚体将无活性的起始蛋白酶9单体招募到复合物中,形成更大的结构,称为凋亡小体(图188)。Caspase-9由凋亡小体内的二聚化激活,就像另一种主要起始蛋白酶caspase-8由DISC内的二聚化激活一样(见图186)。一旦被激活,caspase-9就会裂解并激活下游执行者caspases,介导细胞凋亡。
内在途径是脊椎动物中绝大多数细胞凋亡的原因。上游信号要激活内在途径,它们必须改变线粒体外膜,以便膜间隙中的可溶性蛋白质(如细胞色素c)可以扩散到细胞溶胶中。这一关键的外膜通透步骤由Bcl2蛋白家族成员之间的相互作用控制,正如我们现在所讨论的。
Bcl2蛋白是细胞凋亡内在途径的关键控制者
内在途径受到严格调控,以确保细胞仅在适当的时候通过凋亡自杀。这种调节主要是Bcl2蛋白家族的功能,该家族以第一个描述的家族成员(B细胞淋巴瘤-2)命名,如下所述。在哺乳动物细胞中,这些蛋白质之间复杂的相互作用控制着线粒体外膜的通透性,从而控制细胞色素c和膜间隙中的其他可溶性蛋白质,这一过程称为线粒体外膜通透化(MOMP)。与caspase家族一样,Bcl2蛋白家族存在于所有动物中,并且得到了显著的保守性;例如,人类Bcl2蛋白在秀丽隐杆线虫中表达时可以抑制细胞凋亡。
哺乳动物Bcl2家族蛋白有三种结构和功能类别:
(1)抗凋亡Bcl2家族蛋白,包括Bcl2本身,通过阻止MOMP来抑制细胞凋亡。
(2)促凋亡Bcl2家族效应物可以通过在外线粒体膜上产生开口来直接诱导MOMP。
(3)第二类促凋亡Bcl2家族蛋白,称为BH3-only蛋白(原因稍后解释),通过调节其他两类来促进细胞凋亡。
这三类蛋白活性之间的平衡在很大程度上决定了MOMP是否发生,从而决定了哺乳动物细胞是通过细胞凋亡的内在途径生存还是死亡。
如图189所示,抗凋亡Bcl2家族蛋白(包括Bcl2本身和特大号-Bcl(BclxL,没错xl指的是衣服号码的xl))具有四个独特的Bcl2同源性(BH)结构域(BH1~4)。两种主要的促凋亡Bcl2家族效应物Bak和Bax在结构上与Bcl2相似,但缺少BH4结构域。第二类促凋亡Bcl2家族蛋白的成员仅在BH3结构域中与Bcl2具有序列同源性,因此被称为仅BH3蛋白;它们是迄今为止最大的Bcl2蛋白类。
当凋亡刺激触发内在途径时,促凋亡的Bcl2家族效应物Bak和Bax被激活,并通过在线粒体外膜中聚集成各种大小的寡聚体来触发MOMP,通过不确定的机制在膜上产生开口,允许细胞色素c和其他膜间蛋白逃逸进入细胞溶胶(图1810A和B)。这些促凋亡效应物中的至少一种是内在凋亡途径在哺乳动物细胞中起作用所必需的:缺乏这两种蛋白质的突变小鼠细胞不会经历MOMP或参与内在凋亡途径。
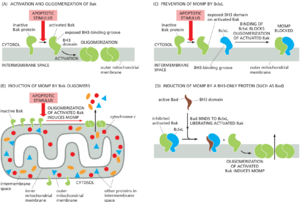
即使在没有凋亡信号的情况下,Bak也会与线粒体外膜结合(见图1810A和B),而Bax主要位于细胞溶胶中,直到凋亡信号激活它,导致它重新定位到外膜,在那里它寡聚化。正如我们下面讨论的那样,Bak和Bax的激活通常依赖于激活的BH3特异性蛋白。
抗凋亡Bcl2家族蛋白(如Bcl2和BclxL)也位于线粒体外膜的胞浆表面,它们有助于防止不适当的MOMP。它们通过与活性促凋亡效应物Bak和Bax的BH3结构域结合,从而防止其寡聚化(图1810C)。哺乳动物抗凋亡Bcl2家族蛋白至少有五种,每个哺乳动物细胞都需要至少一种来避免凋亡并因此存活。此外,许多这些抗凋亡蛋白必须被抑制才能通过内在途径诱导凋亡,而BH3only蛋白介导这种抑制。
BH3-only蛋白是Bcl2家族蛋白中最大的亚类,当它们在细胞中响应凋亡刺激而产生或激活时,会促进MOMP,从而导致细胞凋亡。它们至少通过两种方式实现这一点。
1,某些BH3only,如Bad,抑制特定的Bcl2亚家族,通过用BH3结合Bcl2的BH3结合位点。与Bax/Bak竞争Bcl2。
2,一些BH3only,如Bim,Bid,直接结合并且激活Bax/Bak。
通过这些方式,BH3特异性蛋白提供了凋亡刺激和凋亡内在途径之间的重要联系,不同的刺激激活或诱导不同的BH3特异性蛋白的产生。例如,当细胞遭受无法修复的DNA损伤时,肿瘤抑制蛋白p53(第17章和第20章讨论)会在细胞核中积聚,并激活编码BH3only:Puma和Noxa的基因转录(见图189),然后触发MOMP和细胞凋亡,从而消除可能变成癌细胞的潜在危险细胞。我们将看到,一些细胞外生存信号通过阻止细胞存活来促进细胞存活,通过抑制某些BH3特异性蛋白的合成或活性而发生细胞凋亡(见图1813B)。
如前所述,在某些细胞中,外在凋亡途径必须招募内在途径来帮助杀死靶细胞;BH3特异性蛋白:Bid是这两条途径之间的纽带。Bid在这些细胞中通常处于非活性状态,但当死亡受体激活外在途径时(见图186),起始蛋白酶caspase-8会裂解Bid,产生一种活性形式的蛋白质,该蛋白质会转移到线粒体外膜以激活Bax和/或Bak,导致它们寡聚化并触发MOMP。激活的死亡受体需要MOMP来杀死这些细胞,因为它会从线粒体膜间隙释放蛋白质,中和这些细胞胞质中存在的抑制蛋白,这种抑制蛋白通常会阻止细胞凋亡,我们将在下文中解释。
一种凋亡抑制剂(IAP)和两种抗IAP蛋白有助于控制某些哺乳动物细胞胞质中的胱天蛋白酶活化
由于凋亡胱天蛋白酶级联的激活会导致某些细胞死亡,因此细胞采用多种机制来帮助确保这些蛋白酶仅在适当的时候被激活。FLIP蛋白在外在凋亡途径中对胱天蛋白酶-8的抑制就是前面讨论的一个例子(见第1095页)。
胱天蛋白酶抑制蛋白(称为凋亡抑制剂(IAP))提供了另一道防线,以防止不适当的胱天蛋白酶活化。这些蛋白质首先在某些昆虫病毒(杆状病毒)中发现,这些病毒编码IAP蛋白,以防止被病毒感染的宿主细胞激活caspase并通过凋亡杀死自己,从而抑制病毒的复制。大多数动物细胞也产生IAP蛋白,尽管大多数这些蛋白质并不调节caspase和凋亡。
哺乳动物细胞似乎只有一种IAP可以直接抑制caspase活性。它被称为XIAP(因为它在X染色体上编码),它存在于我们许多细胞的细胞质中。它与caspase-9(启动caspase)和caspase-3和caspase-7结合并抑制它们,从而设置这些caspase必须克服的抑制阈值才能触发凋亡。在这些细胞中,XIAP还有助于调节三种caspase蛋白的水平:它具有泛素连接酶结构域,可对XIAP结合的caspase进行多泛素化,标记它们以便在蛋白酶体中破坏(见图367)。
当细胞凋亡的内在途径被激活时,MOMP从线粒体膜间隙释放的蛋白质中有两种抗IAP蛋白,称为Smac和Omi。在胞质溶胶中含有XIAP的细胞中,这些抗IAP蛋白与XIAP结合并阻止其抑制caspase,从而促进caspase活化和细胞凋亡(图1811)。这就是为什么外在凋亡途径需要招募内在途径(涉及MOMP和caspases9、3和7)来诱导某些细胞凋亡,如前所述;这些细胞在胞质溶胶中表达XIAP。
细胞外存活因子以各种方式抑制细胞凋亡
如第15章和第21章所述,细胞外信号调节动物细胞的大多数活动,包括细胞凋亡。它们是正常社会控制的一部分,在这种情况下,确保单个细胞的行为有利于整个生物体,当需要细胞时存活,当不需要细胞时自杀。一些细胞外信号分子刺激细胞凋亡,而另一些抑制细胞凋亡。我们已经讨论了激活死亡受体进行tr的信号蛋白,例如Fas配体刺激细胞凋亡的外在途径。其他刺激细胞凋亡的细胞外信号分子在脊椎动物发育过程中尤为重要:例如,血液中甲状腺激素的激增会向蝌蚪尾部的细胞发出信号,使其在变态时发生细胞凋亡。在小鼠中,局部产生的信号蛋白刺激发育中的手指和脚趾之间的细胞自杀,从而塑造了这些手指(见图182)。然而,在这里,我们关注通过抑制细胞凋亡促进细胞存活的细胞外信号分子,它们统称为存活因子。大多数动物细胞需要来自其他细胞的此类信号来避免发生细胞凋亡,通常通过内在途径。这种令人惊讶的安排显然有助于确保细胞仅在需要时和需要的地方存活。例如,一些神经细胞在发育中的神经系统中过量产生,然后争夺它们通常连接的靶细胞分泌的有限数量的生存因子。接收到足够生存信号的神经细胞存活,而其他神经细胞则因凋亡而死亡。这样,存活的神经元数量会自动调整,以使其适合它们连接的靶细胞数量(图1812)。局部或系统产生的有限数量的生存因子的类似竞争可能有助于控制其他组织中的细胞数量,无论是在发育期间还是在成年期。生存因子通常与细胞表面受体结合,从而激活抑制凋亡程序的细胞内信号通路(第15章中讨论),通常通过调节Bcl2蛋白家族成员的表达或活性来抑制凋亡程序。例如,一些生存因子刺激抗凋亡Bcl2家族蛋白(如Bcl2本身或BclxL)的合成(图1813A)。其他一些生存因子通过抑制促凋亡BH3特异性蛋白(如Bad)的功能起作用(图1813B)。一些正在发育的神经元(如图1812所示)使用一种违反直觉的替代策略,其中生存因子受体在未被占用时刺激细胞凋亡,而在生存因子结合时停止这样做。所有这些情况的最终结果都是一样的:细胞存活取决于生存因子与细胞表面受体的结合。
健康邻居吞噬并消化凋亡细胞
凋亡细胞死亡是一个整洁的过程。凋亡细胞及其碎片不会破裂并释放其内容物。相反,它们通常保持完整,直到它们被邻近细胞(通常是人类的巨噬细胞)迅速吞噬和消化,不留痕迹。这样,细胞凋亡就避免了引发破坏性的炎症反应。吞噬过程依赖于凋亡细胞表面的化学变化,这种变化显示出吞噬细胞识别的各种吞噬信号。
这些信号中最重要的是带负电荷的磷脂磷脂酰丝氨酸。在健康细胞中,磷脂酰丝氨酸通常仅位于质膜脂质双层的内层(见图1015);它由特定的磷脂翻转酶保持在那里,该酶利用ATP水解将磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)从外层翻转到内层。然而,在正在经历凋亡的细胞中,PS通过两种机制在细胞表面积累。首先,执行者胱天蛋白酶裂解磷脂翻转酶,从而使其失活,阻止PS和PE从外层转移到内层。其次,执行者caspases裂解并激活磷脂乱序酶,该酶将质膜磷脂非特异性地转移到内外脂质小叶之间,从而使它们在两个小叶之间乱序。这两种导致PS暴露在凋亡细胞表面的机制如图1814和电影18.2所示。
即使在没有caspase激活的情况下,PS也会出现在细胞表面的某些形式的坏死性细胞死亡中;破坏质膜就足以做到这一点。凋亡和坏死细胞上的PS被各种可溶性桥接蛋白识别,这些蛋白与暴露的PS和邻近吞噬细胞表面上的特定受体相互作用,从而触发细胞骨架和其他变化,从而启动吞噬过程。
巨噬细胞是专业的吞噬细胞,会吞噬死细胞、微生物、细胞碎片、乳胶珠和几乎任何其他颗粒,但它们不会吞噬生物体内的健康细胞,即使是那些在激活时会在其表面暂时暴露磷脂酰丝氨酸的健康细胞,例如血小板和一些T淋巴细胞。原因之一是,我们几乎所有的细胞表面都显示信号蛋白,这些蛋白与巨噬细胞表面的抑制受体结合,刺激受体阻止吞噬作用。因此,除了表达细胞表面的“吃我”信号(如刺激吞噬作用的磷脂酰丝氨酸)外,凋亡细胞还必须去除或灭活阻止吞噬作用的“不吃我”信号。
细胞凋亡过度或不足都会导致疾病
许多人类疾病中,过多的细胞发生凋亡,从而导致病理性组织损失。最常见和最显著的例子是心脏病发作和中风,它们分别由心脏或大脑血液供应的急性中断引起。在这些情况下,许多细胞最初会因坏死而死亡。如果通过动脉导管或使用凝块破坏药物疏通阻塞的血管,缺氧组织中的一些存活细胞会因细胞凋亡而死亡,从而导致组织损失。希望未来能够阻止细胞凋亡的药物以及能够阻止某些形式的坏死性细胞死亡的药物能够减少组织损失及其致残性后果。
还有其他疾病,其中细胞凋亡导致的死亡太少。例如,如前所述,小鼠和人类的突变会使编码Fas死亡受体或其配体的基因失活,从而阻止n某些类型的淋巴细胞正常死亡,导致这些细胞在脾脏和淋巴腺中异常积聚。在许多情况下,这会导致自身免疫性疾病,因为一些自身反应性淋巴细胞无法被消除并对个体自身组织产生反应。淋巴细胞的增加还会导致淋巴细胞癌,称为淋巴瘤。事实上,凋亡减少对许多类型的癌症有重要影响,因为癌细胞中对凋亡的正常抑制控制通常存在缺陷。例如,Bcl2基因首次在一种常见的人类淋巴瘤中发现,其中染色体易位导致抗凋亡Bcl2蛋白的过量产生(如前所述,Bcl2因这种B细胞淋巴瘤而得名)。携带易位的淋巴细胞中Bcl2蛋白的增加通过抑制凋亡促进癌症的发展,从而异常延长细胞存活时间并增加其数量;Bcl2的增加还降低了细胞对抗癌药物的敏感性,这些药物通常通过导致癌细胞凋亡而起作用(第20章讨论)。
同样,编码肿瘤抑制蛋白p53的基因在约50%的人类癌症中发生突变,因此它不再促进细胞凋亡或细胞周期停滞以响应DNA损伤(如第17章和第20章所述)。因此,缺乏p53功能使癌细胞即使在DNA受损的情况下也能存活和增殖;这样,细胞逐渐积累更多的突变,其中一些突变使癌症更加恶性。由于许多抗癌药物通过p53依赖机制诱导细胞凋亡(和细胞周期停滞),p53功能的丧失也会使癌细胞对这些药物的敏感性较低。
如果凋亡减少会导致癌症,那么我们应该能够用促进凋亡的药物治疗癌症。这种方法最近导致了小分子化学物质的开发,这些化学物质通过与这些蛋白质的BH3结合槽高亲和力结合来阻断抗凋亡Bcl2家族蛋白(如Bcl2和BclxL)的功能,其方式与促凋亡的BH3特异性蛋白非常相似(见图1810D)。这些BH3模拟药物(图1815)激活细胞凋亡的内在途径,增加某些癌症中肿瘤细胞死亡的数量,尤其是那些依赖特定抗凋亡Bcl2家族蛋白生存的癌症。
大多数人类癌症都是癌,发生在肺、肠道、乳腺和前列腺等上皮组织中(第20章讨论)。
此类上皮癌细胞表现出许多行为异常,包括在特殊细胞连接处粘附细胞外基质和彼此的能力下降。在下一章中,我们将讨论这些至关重要的结构,它们负责将我们的细胞保持在组织和器官中的正确位置。
摘要
当动物细胞受到严重损坏或压力、不再需要或对生物体构成威胁时,它们可以激活各种细胞内死亡程序并自杀。在大多数情况下,这些死亡都是由细胞凋亡引起的,在凋亡过程中,细胞萎缩,细胞核和细胞凝聚并经常碎裂,邻近的吞噬细胞在细胞质内容物泄漏之前迅速吞噬细胞或碎片。细胞凋亡是由一种称为胱天蛋白酶的蛋白水解酶介导的,这种酶会裂解特定的细胞内蛋白质,从而快速而干净地杀死细胞。凋亡胱天蛋白酶以无活性前体的形式存在于几乎所有有核动物细胞中。当凋亡刺激激活衔接蛋白时,就会发生起始胱天蛋白酶的激活,衔接蛋白会使无活性的起始胱天蛋白酶单体在大型活化复合物中靠近,单体通过二聚化被激活。活化的起始胱天蛋白酶二聚体会自我裂解,然后通过裂解激活下游执行胱天蛋白酶二聚体;激活的执行者胱天蛋白酶随后裂解细胞中的数百种靶蛋白。扩增的、不可逆的胱天蛋白酶级联负责所有细胞凋亡事件,包括那些集体杀死细胞并准备被邻近细胞吞噬和快速消化的事件。细胞使用两种不同的途径激活起始胱天蛋白酶以触发细胞凋亡:外在途径由细胞外配体与细胞表面死亡受体结合激活;内在途径由发育信号或应激信号从细胞内部激活。每条途径都使用自己的起始胱天蛋白酶、衔接蛋白和活化复合物。在外在途径中,死亡受体通过衔接蛋白募集胱天蛋白酶-8以形成称为DISC的活化复合物。在内在途径中,细胞内信号诱导线粒体外膜通透化(MOMP),从而将可溶性蛋白质从线粒体膜间隙释放到细胞质中;释放的细胞色素c激活衔接蛋白Apaf1,后者募集caspase-9单体形成称为凋亡体的大型活化复合物。抗凋亡和促凋亡的细胞内Bcl2家族蛋白相互作用,严格控制MOMP,以确保凋亡的内在途径通常仅在细胞死亡对动物有利时才被激活。
MBoC,号称“细胞生物学圣经”,图片精美的很!
本书迅雷链接:https://pan.xunlei.com/s/VOETEWx9eARqy741ZvgWbsmpA1?pwd=gawe#
