第十八章 营养生长和器官形成:植物轴向的初生生长
正如我们在第 17 章中讨论的那样,幼苗中的发育程序确保了能够从土壤中吸收养分和水分的光合作用植物的功能建立。在下一个生长阶段,幼苗中未分化的细胞将采用新的命运,以产生专门的细胞类型或器官,从而增强在多变的环境条件下对资源的竞争。分化和生长的模式导致器官形状和功能的多样性。
在本章中,我们讨论了植物从幼苗状态过渡、沿主轴扩展并开始产生确定的侧生器官(例如叶子)的发育过程。我们首先考虑细胞分裂的基本特征以及导致根和茎顶端分生组织分化的过程的启动,然后讨论叶子的发育。我们研究单叶的叶片形成,包括叶组织的边缘扩张、分化为近轴和远轴区域以及沿近端-远端轴的形态发生。我们还讨论了复叶是如何通过这些发育途径的变化而产生的。最后,我们讨论了控制表皮和维管组织特化细胞发育的基因网络和激素信号。第 19 章将讨论不确定分枝系统的受控形成和生长,以及多年生植物的二次生长。
18.1 分生组织:不确定生长的基础
植物发育表现出显著的可塑性,这在很大程度上可以归因于称为分生组织的特殊组织。分生组织可以广义地定义为包含分裂的细胞的区域,这些细胞既可以自我复制,又可以为分化的植物体产生创始细胞。几种类型的分生组织有助于植物的营养发育。
根尖分生组织 (RAM) 和茎尖分生组织 (SAM) 分别位于根和茎的顶端。居间分生组织,例如维管形成层和草叶从中长出的茎组织,代表由分化组织包围的增殖组织。被称为分生组织的细小的表层细胞簇会形成毛状体或气孔等结构(有关植物分生组织的历史概述,请参阅 WEB ESSAY 18.1)。
根和茎尖分生组织使用类似的策略来实现不确定的生长
虽然很难想象植物的两个部分比茎和根更不同,但 RAM 和 SAM 的功能方式相似。两者都包含一个空间定义的细胞簇,称为初始细胞,其特点是分裂速度慢且命运不确定。随着细胞分裂的极化模式将一些初始细胞移位到分生组织边缘,它们会呈现各种不同的命运,这些命运有助于根或茎的径向和纵向组织以及侧器官的发育。
RAM 和 SAM 都必须平衡新细胞的产生和细胞不断向分化组织中募集的过程,以保持恒定的大小。RAM 和 SAM 行为的共同方面是否可以追溯到类似的潜在机制?这些机制如何调节以维持芽和根的特征组织,并使其能够对一系列不同的环境做出适应性生长反应?根和芽的不同生长和器官发生模式是否对 RAM 和 SAM 的功能提出了特殊要求?为了回答这些问题,第 18.2 节和第 18.3 节讨论了 RAM 和 SAM 的基本特征以及有助于它们建立和维持的遗传定义的信号通路的例子。
18.2 根尖分生组织
根生长的许多方面反映了对苛刻环境的适应。根系固定植物并从土壤中吸收水分和矿物质营养,具有复杂的生长和向性模式,使它们能够探索和利用充满障碍的异质环境。尽管 RAM 产生的细胞在远离尖端时会分裂、分化和伸长,但诸如根毛(见第 17 章)和侧枝(见第 19 章)等侧生枝条会在细胞伸长完成的区域远离根尖出现。这种空间分离有助于防止剪切力对侧生器官造成损害,这为我们提供了一个有用的机会,让我们只关注根尖处的那些过程,这些过程有助于维持一组初始细胞并调节它们的分裂活动。在本节中,我们考虑了生成更详细地介绍根尖组织的组成,讨论有助于根生长和功能的细胞行为的区域差异。然后,我们回顾实验证据,表明根的协调生长取决于生长素依赖性和细胞分裂素依赖性的基因活动程序的组合,这些程序由特定类别的转录因子和反应调节剂协调。
根尖有四个发育区
根发育的基本特征可以通过首先区分根内具有不同细胞行为的区域来最好地描述。虽然不可能绝对精确地定义它们的边界,但将根划分为以下区域提供了一个有用的空间框架,这与我们讨论潜在机制有关(图 18.1)。
● 根冠占据根的最远端部分。它代表了一组独特的初始衍生物,它们远离分生区。这些分裂的分化产物覆盖顶端分生组织,并在根尖被推过土壤时保护它免受机械损伤。根冠的其他功能包括感知重力,以实现重力性(见第 17 章),以及分泌化合物,帮助根部穿透土壤并调动矿物质营养。
● 分生区位于根冠正下方。它包含一簇充当初始细胞的细胞,这些细胞以特征性的极性分裂,产生进一步分裂并分化成构成根的各种成熟组织的细胞。这些初始细胞周围的细胞有小液泡,并迅速膨胀和分裂。
● 伸长区是细胞快速和广泛伸长的部位。尽管一些细胞在该区域内伸长时继续分裂,但随着与分生组织的距离增加,分裂率逐渐降低至零。
● 成熟区是细胞获得分化特征的区域。细胞在分裂和伸长停止后进入成熟区,在该区域,细胞生长物(称为根毛)和侧根等侧生器官可能开始形成。分化可能开始得更早,但细胞直到到达该区域才达到成熟状态。第 19 章详细介绍了侧根的发育。
根据物种的不同,这四个发育区可以占据根的第一毫米多一点的区域,也可以延伸到根远端区域的较长部分。
不同根组织的起源可以追溯到特定的初始细胞
鉴于构成根的组织是逐渐线性发展的,因此将它们的起源追溯到亚顶端区域的特定初始细胞相对简单。在大多数植物根中,内侧纵向横截面(图 18.2A)显示出长细胞files,这些files汇聚在静止中心(quiescent center,QC)的顶端附近,其得名是因为与周围组织相比,其细胞分裂率相对较低。QC 可以由少至一个或多达数百个细胞组成,并且通常难以与相邻的初始细胞区分开来。在水生蕨类植物满江红Azolla中,单个位于中心的顶端细胞似乎通过在整个营养发育过程中保持低但一致的有丝分裂活动来履行 QC 和初始细胞的作用(参见 WEB 主题 18.1)。在这里的讨论中,我们将使用定义明确且相对简单的拟南芥根作为模型。
拟南芥的 QC 仅由四个细胞组成,由于这些细胞在胚胎发育后很少分裂,因此 QC 或周围初始细胞的机械或遗传消融会导致生长的明显变化。在拟南芥中,四组不同的初始细胞都与 QC 相邻,可以根据它们的位置和它们产生的组织来定义(图 18.2B):
● 根冠柱初始细胞Columella initials。这些首字母位于 QC 正下方(远端),形成根冠中央部分(根冠柱) 。
● 表皮 - 侧根冠初始细胞Epidermal–lateral root cap initials.。这些初始细胞位于根冠的侧面,首先向外侧分裂产生子细胞,然后向外侧分裂形成两列细胞,成熟为侧根冠和表皮。
● 皮层 - 内皮层初始细胞Cortical–endodermal initials。皮层 - 内皮层初始细胞位于表皮 - 侧根冠初始细胞的内部并与之相邻,向外侧分裂产生子细胞,然后向外侧分裂形成皮层和内皮层细胞层。
● 中柱初始细胞Stele initials。这些初始细胞位于根冠的正上方(近端),形成维管系统,包括中柱鞘。
生长素和细胞分裂素有助于 RAM 的维持和功能
生长素和细胞分裂素在 RAM 的维持中起重要作用。生长素最初由从茎向根部运输到主根顶端,但随着主根伸长和分枝被 QC 内或周围产生的生长素所取代。一组离散的生长素反应因子 (AUXIN RESPONSE FACTORS,ARF) 和细胞分裂素反应的拟南芥反应调节剂 (ARABIDOPSIS RESPONSE REGULATORS,ARR)(见第 4 章)是根生长所必需的。QC 和周围细胞中的生长素积累和合成维持了编码一组转录因子的基因的表达,这些转录因子在 RAM 组织中起作用(图 18.3)。两种称为 PLETHORA 1 和 2 的转录因子以及 WOX(WUSCHEL 同源框)转录因子家族的成员在这些细胞中大量存在,并且是正常 RAM 功能所必需的。具体来说,WOX5 在一小部分根尖细胞,包括 QC 和周围的初始细胞,中表达,对维持其未分化状态很重要。
根部生长素依赖性分生组织的维持也涉及细胞分裂素。当成熟细胞进一步远离根的分生区(也称为分裂区)的 QC 时,在没有 WOX5 的情况下,高生长素和 PLETHORA 表达会促进细胞分裂并抑制激活细胞分裂素反应的 ARR 基因。随着细胞分裂的进行,PLETHORA 水平通过稀释逐渐降低,ARR 基因表达和细胞分裂素信号传导增加,从而降低生长素浓度,抑制细胞分裂,并促进细胞伸长的转变(见图 18.3)。生长素和细胞分裂素反应之间的这种拮抗作用类似于在未分化愈伤组织培养物中观察到的拮抗作用,其中生长素:细胞分裂素比率的改变可用于选择性地启动芽或根的发育。切除根尖、施用生长素和细胞分裂素以及过表达 PLETHORA和 WOX 基因均可用于改变根部分生组织的大小
和位置.
18.3 茎尖分生组织
与根尖分生组织一样,茎尖分生组织 (SAM) 最初在胚胎发生过程中形成,并维持一组未确定的细胞。然而,这两种分生组织类型在这些细胞的后代如何融入器官方面存在显著差异。虽然侧根起始发生在根尖后方(见第 19 章),但叶子和相关的腋枝在茎尖附近形成。代替保护根尖的根冠,幼叶原基重叠并包裹茎尖(图 18.4)。
茎尖分生组织这一术语特指初始细胞及其未分化的衍生物,但不包括包含完全致力于特定发育命运的细胞的相邻区域。[1] 更具包容性的术语茎尖是指顶端分生组织加上最近形成的叶原基。SAM 的大小、形状和组织因植物种类、发育阶段和生长条件而异。苏铁的 SAM 是维管植物中最大的,直径超过 3 毫米;另一方面,拟南芥的 SAM 直径小于 50 µm,仅包含几十个细胞。在给定物种中,SAM 大小也可能随时间发生显著变化,SAM 形状可能从扁平到隆起。其中一些变化与营养物质的可用性或生长速度的季节性差异有关,包括休眠或开花的开始。
在本节中,我们首先考虑 SAM 的基本组织,讨论有助于其功能的细胞行为的区域差异。然后,我们讨论证据表明,与 RAM 一样,SAM 依赖于移动激素、肽和转录因子活性的局部差异来形成和维持。
SAM有distinct的层和区域
在活跃的 SAM 的中心是中心区 ( central zone ,CZ),包含一簇不经常分裂的初始细胞,可以与根 QC 中的类似细胞进行比较(图 18.5A)。外围区 (peripheral zone ,PZ) 位于 CZ 两侧,由细胞质致密的细胞组成,这些细胞分裂更频繁,产生的细胞后来被整合到叶子等侧生器官中。肋区 ( rib zone,RZ) 靠近 CZ,包含分裂细胞,这些细胞产生茎的内部组织。这些分裂频率的区域差异叠加在细胞分裂平面的不同模式上。在大多数被子植物分生组织中,两个最外层细胞层反向分裂并维持 L1(表皮)和 L2 层(图 18.5B),每层只有一个细胞厚。L1 和 L2 有时统称为原套。位于原套内部的细胞称为 L3 或原体,具有更多变化的分裂平面,这增加了三维细胞数量并增加了组织体积。这些分裂平面的差异是通过跟踪 SAM 中细胞分裂模式的精妙实验发现的(参见 WEB 主题 18.2)。
正向和负向相互作用的组合决定了顶端分生组织的大小
在整个发育过程中,SAM 通过平衡外周区域分化过程中细胞的损失与通过初始细胞分裂产生更多细胞来维持其大小中心区。核心尺寸控制机制的逻辑很简单:在中心区靠近初始细胞的地方产生正调节剂,增加分生细胞的数量,而在初始细胞中产生负调节剂,抑制正调节剂。较大的分生组织具有更多的初始细胞,并产生更高剂量的负调节剂,自然限制分生组织的大小;较小的分生组织产生较少的负调节剂,允许更多的正调节剂增加分生组织的大小。最终这两个相互作用的因子达到平衡并保持恒定的分生组织大小。
分生组织大小的关键正调节剂是 WUSCHEL (WUS) 同源域转录因子。WUSCHEL 是第一个表征的 WOX 基因,由于导致拟南芥 wuschel 突变体茎尖呈现不规则的“mop-top”外观而命名(有关同源框基因的描述,请参阅第 22 章)。WUS 与根中的 WOX5 一样,对于维持顶端初始的身份至关重要。与 WUS 活性相反的是 CLAVATA (CLV) 基因编码的分生组织大小的关键负调节因子(来自拉丁语,意为“棒状”,用来描述拟南芥 clv 突变体增大的 SAM)。分子和生化分析表明,CLV 蛋白在物理上相互作用,起到肽受体蛋白激酶信号传递的作用,其输出起到限制分生组织大小的作用。CLV1 是一种富含亮氨酸重复 (LRR) 受体样激酶 (RLK),具有细胞外配体结合域和细胞内激酶信号结构域(见第 4 章)。
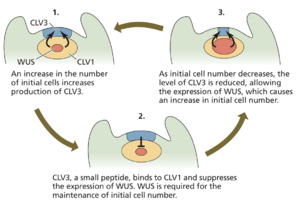
CLV2 与 CLV1 相似,但缺乏细胞内激酶结构域,因此似乎依赖于与其他细胞内蛋白质的相互作用来进行信号输出。CLV3 是 CLAVATA3/胚胎周围区域相关 (Embryo Surrounding Region-Related,CLE) 信号肽家族中一个由 13 个氨基酸组成的小成员,在未分化细胞中表达(图 18.6),并与 CLV1 和 CLV2 结合,以启动抑制 WUS 表达的信号传导过程。WUS 是维持初始细胞不确定性和数量所必需的。这反过来又导致 CLV3 的产生减少,从而导致 WUS 依赖的未分化细胞产生的抑制解除。该反馈回路在生长过程中为 SAM 中的初始细胞提供了一个稳定的池。
KNOX 类同源域转录因子通过调节细胞分裂素和 GA 浓度来帮助维持 SAM 中的增殖
我们已经讨论了 SAM 中与 RAM 中类似的维护机制,但 SAM 中存在一些独特的机制。例如,靠近分生组织中更多能细胞的侧生器官的产生似乎需要额外的调节水平,这是由KNOX(KNOTTED 1 同源框)转录因子家族成员介导的。
KNOTTED 这个名字源于玉米中观察到的结状凸起,这些玉米中编码这些转录因子的基因发生突变。随后,对拟南芥芽无分生组织( shoot meristemless ,stm)突变体的研究表明,该突变是由于 SAM 形成和维持所需的 KNOX 转录因子的缺失造成的。STM 几乎存在于整个分生组织中,但不存在于侧翼位置的细胞群中,这些细胞群致力于成为叶原基(图 18.7 中标记为 P0)。
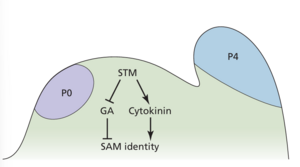
KNOX 蛋白的功能部分在于调节植物激素细胞分裂素和赤霉素 (GA) 的浓度(图 18.7)。将细胞分裂素应用于分生组织可挽救 stm 突变体中的分生组织崩溃,而 SAM 中的 STM 表达可激活编码异戊烯基转移酶的基因的转录,这些基因参与细胞分裂素的生物合成这些观察结果支持了 STM 上调细胞分裂素介导的分生组织稳定的观点。
除了上调细胞分裂素合成外,KNOX 基因还通过抑制 SAM 中 GA 的积累来稳定分生组织。遗传实验表明,在 SAM 中人工激活 GA 信号传导会破坏分生组织的稳定性。在多种物种中,KNOX 基因表达直接抑制 GA 20-OXIDASE1 的转录,其是一种催化 GA 活性形式生物合成中限速步骤的酶(见第 4 章)。
局部生长素积累促进叶片起始
枝条上的叶片排列或叶序通常是物种的特征,可分为三种基本模式:互生、对生(对生)和螺旋(图 18.8)。叶序模式与茎尖分生组织上叶原基的起始模式直接相关(图 18.9A),但可能因环境条件、影响分生组织大小的突变或离散顶端细胞组的消融而改变。
使用生长素流出抑制剂 N-1-萘邻苯二甲酰胺酸 (NPA) 或 PIN-FORMED 1 (PIN1) 生长素流出转运蛋白的突变(见第 4 章)破坏茎尖微尺度极性生长素运输会导致叶原基定位改变或完全消除(图 18.9B)。在番茄和拟南芥中,随着生长素浓度的降低,叶片起始也会在黑暗中减慢或停止。将一滴生长素置于拟南芥 pin1 突变体的茎尖上会导致异位叶片起始(图 18.9C)。通过对荧光生长素报告基因和 PIN1-GFP 的显微镜观察,也可以推断出茎尖的生长素通量和积累情况。(见第 4 章)。多个细胞之间 PIN 不对称的协调放大了来自基底细胞层的生长素在茎尖的定向流动。这些结果证明了生长素在叶片起始中的作用,尽管细胞分裂素也可能发挥其他作用。
机械应力和扩展细胞的物理相互作用也可以调节分生组织的发育。其中一些相互作用及其研究方法在 WEB 主题 18.3 中进行了描述。
腋生分生组织形成于叶原基的腋部
腋生分生组织位于叶的近轴面(上部)与茎部交接处。它们与叶原基同时形成,并保持休眠状态直到它们在发育后期长出形成分枝。最初抑制腋生分生组织不仅允许植物根据环境形成分枝,而且还减少了由于 DNA 复制而导致的突变的积累。这可能使大型多年生植物(如树木)能够存活多年而不会积累有害突变。
腋生分生组织的起始涉及三个主要步骤:正确定位初始细胞、划定分生组织边界和建立适当的分生组织。许多控制叶片起始和叶片生长的基因也调节腋生分生组织的起始。生长素的生物合成、运输和信号传导都是腋生分生组织起始所必需的,这些途径缺陷的突变体无法形成新的腋生分生组织。
其他调节因子是腋生枝所特有的:番茄(图 18.10)、水稻和拟南芥的 LATERAL SUPPRESSOR 转录因子基因突变不影响叶片发育,但会导致发育阶段腋芽形成完全受阻。 LATERAL SUPPRESSOR 的mRNA 在叶原基的腋中积累,新的腋生分生组织在此发育(图 18.11)。
18.4 叶片发育
从形态上讲,叶片是所有植物器官中变化最大的。 植物上任何类型的叶片(包括从叶片进化而来的结构)的统称是叶节。 叶节包括光合作用叶片(我们通常所说的“叶片”)、保护性芽鳞片、苞片(与花序或花相关的叶子)和花器官。在被子植物中,叶子的主要部分扩展为扁平结构,称为叶片或叶片(图 18.12)。中到晚泥盆世种子植物中扁平叶片的出现是叶子进化的关键事件,因为它可以最大限度地捕获光线。叶片的形成也创造了两个不同的叶域:近轴(上表面)和远轴(下表面)。根据近轴-远轴叶结构,已经进化出几种类型的叶子(参见 WEB 主题 18.4)。
在大多数植物中,叶片通过称为叶柄的柄附着在茎上。然而,一些植物有无柄叶,叶片直接附着在茎上(见图 18.12B)。在大多数单子叶植物和某些真双子叶植物中,叶基扩展为围绕茎的鞘。许多真双子叶植物有托叶,即叶原基的小突起,位于叶基的背面。托叶保护正在发育的幼叶,是早期叶片发育过程中生长素合成的场所。
叶可以是单叶或复叶(见图 18.12B 和 C)。单叶有一个叶片,而复叶有两个或多个叶片,即小叶,附着在共同的轴或叶轴上。一些叶子,如一些金合欢属植物的成年叶没有叶片,而是有一个扁平的叶柄模拟叶片,即叶状体。在某些植物中,茎本身像叶片一样扁平,被称为叶状枝,例如仙人掌 Opuntia。
生长决定叶子的形状
尽管形状各异,但所有叶子都是从 SAM 侧面的圆顶形原基开始的(见图 18.9A)。在第 17 章中,我们讨论了幼苗下胚轴和根在Nutational生长中的各向异性(定向)生长及其对环境刺激的反应。Nutational生长是由细胞壁相互作用限制的细胞files之间不同的各向异性扩张速率引起的,如第 2 章所述。下胚轴的向性也基于各向异性的细胞伸长。根部的向性反应涉及器官的各向异性生长,但也涉及抑制各向异性生长以实现器官弯曲。受控的各向同性和各向异性生长的更复杂组合决定了叶片的形状(图 18.13)。
叶片差异生长的模式由与特定身份相关的基因表达区域决定 - 例如,叶片的近轴侧和远轴侧或分生组织的不同区域。这些区域内的局部细胞壁改变可以改变生长速度或方向,并通过发育产生新的形状。叶片中程序性细胞扩张的机械约束的复杂性可以通过细胞的功能分化进一步阐述,以实现代谢或生殖专门化和环境相互作用。
在发育过程中对叶片进行动态成像为特定领域的细胞对叶片形状和生长的贡献的详细模型提供了基础(见图 18.13B)。然后可以测量与特定基因或基因簇表达相关的叶片部分,以确定它们对特定间隔内叶片形状和生长率的贡献(见图 18.13C 和 D)。将实际测量值与计算模型进行比较,以改进生长模型。然后将其与缺乏关键调节基因的突变体生长观察值以及使用报告基因对基因表达模式进行成像(见第 3 章)进行比较,以高分辨率了解基因功能。这种方法已成为研究所有植物器官生长的标准。
18.5 叶极性的建立
叶片沿三个轴排列:从基部到尖端(近端-远端)、从中线到边缘(内侧-外侧)和从顶部到底部(近轴-背面)(见图 18.12)。沿每个轴的生长量决定了叶片的最终形状。例如,扁平叶片优先沿内侧-外侧和近端-远端轴生长。细胞类型沿这些轴形成图案:拟南芥中相对简单的叶片包含近轴表皮和单层近轴栅栏叶肉细胞,以及三层海绵状叶肉和背轴表皮。但是这些模式是如何在发育过程中建立和维持的呢?我们将看到,这些轴的模式是相互关联的,涉及共享的分子调节器。
来自 SAM 的信号启动了近轴 - 远轴极性
由于叶原基是从 SAM 侧面的一组细胞发育而来的,因此叶子与 SAM 具有固有的位置关系:叶原基的近轴侧来自与 SAM 相邻的细胞,而远轴侧来自较远的细胞。
20 世纪 50 年代的显微外科研究表明,SAM 和叶原基之间的通信是建立叶近轴 - 远轴极性所必需的。例如,将 SAM 与原基初始(I)分开的横向切口导致初始径向发育而不形成任何近轴组织(图 18.14A)。由此产生的“叶子”呈圆柱形,仅包含远轴组织(它被远轴化了)。然而,两个允许 SAM 和原基之间畅通无阻通信的边缘切口并没有破坏近轴 - 远轴对称性(图 18.14B)。
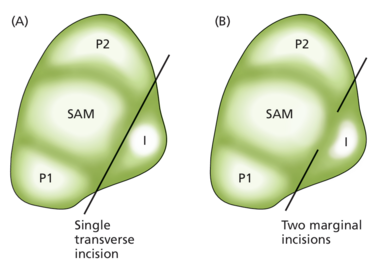
使用激光烧蚀和显微解剖对这些外科实验进行改进,产生了类似的结果,表明 SAM 和叶子之间的信号是指定或维持近轴身份所必需的。传统上,这种信号被解释为从分生组织到叶子的信号,但最近的研究提出了信号可能从叶子传播到分生组织的可能性,实验表明,从叶子近轴侧去除生长素可能是近轴特征化的必要条件。然而,尚不清楚从叶子中去除生长素是信号本身还是其下游结果,近轴信号的性质仍然是个谜。这些结果还强调了叶子发育的另一个关键特征,即近轴-远轴模式是沿内-侧轴生长所必需的。我们将在本节后面更详细地研究这一点。
转录因子组之间的拮抗作用决定了近轴叶和远轴叶的极性
对近轴叶和远轴叶身份的分子基础的首次洞察来自于对金鱼草 (Antirrhinum majus) 中功能丧失突变体 phantastica (phan) 的分析 (图 18.15A)。phan 突变体产生的叶片近轴叶和远轴叶对称性发生改变,范围从无法产生叶片的远轴针状叶到叶片上同时存在近轴叶和远轴叶特征的叶片 (图 18.15B)。在拟南芥和其他物种中使用突变体 (如 phan) 进行的分子遗传学实验已经阐明了调节近轴叶和远轴叶极性的机制。
复杂的基因表达网络决定了近轴叶和远轴叶的命运,并使这两个身份在空间上保持分离 (图 18.16)。我们目前的理解是,指定近轴命运的基因抑制指定远轴命运的基因,反之亦然,从而在叶片的每一侧产生相互排斥的域。 KNOX1在叶原基中的表达最初由生长素诱导,并阻止早熟叶片分化,但随后在大多数植物物种的近轴和远轴区域均受到抑制。 详细的基因表达研究表明,除了叶片和 SAM 之间的信号外,叶片的近轴和远轴模式也继承自 SAM,其中 III 类同源域-亮氨酸拉链 (HD-ZIP III) 基因在中心表达,编码 KANADI(马拉雅拉姆语为“镜像”)转录因子的基因在周边表达。叶原基在两者之间的边界处形成并继承了这种模式。
MYB 转录因子、HD-ZIP III 蛋白和 KNOX1 抑制促进近轴身份
金鱼草中的 PHAN 基因编码 MYB(Myelobastosis)转录因子,拟南芥中的 ASYM METRIC LEAVES 1 和 2(AS1 和 AS2)基因编码类似的蛋白质。拟南芥 AS1 和 AS2 通过激活编码 HD-ZIP III 转录因子的基因间接抑制叶片近轴侧的 KNOX1 基因,进而激活 WOX3 对 KNOX1 的抑制(见图 18.16A)。 HD-ZIP III 转录因子的名称源于其特征结构:DNA 结合同源域、固醇结合域和亮氨酸拉链蛋白二聚化域。HD-ZIP III 近轴身份基因的表达通常仅限于叶原基的近轴域(见图 18.16A)。当这些基因发生突变或失活时,近轴特征就会消失。当 HD-ZIP III 基因在整个叶片中异位表达时,远轴组织会呈现近轴特征,例如产生腋芽。HD-ZIP III 对近轴身份的重要性通过 microRNA 干扰的额外调节水平得到证明(见第 3 章)。miR166 在远轴区域的表达靶向多个 HD-ZIP III mRNA(见图 18.16B)。
叶片外侧特征由生长素、KANADI 和 YABBY 决定
生长素在叶片外侧发育中起着重要作用。 ARF3 和 ARF4 是独特的生长素反应因子,它们由生长素结合直接激活(见第 4 章)并增强了远轴 YABBY 表达和远轴特征(见图 18.16)。远轴特征还取决于抑制 AS1/2 基因表达并激活 YABBY 基因在远轴组织中转录的KANADI转录因子的存在。YABBY 是锌指螺旋-环-螺旋转录因子,因某些 yabby 家族突变体的叶子与澳大利亚小龙虾(yabbies)的爪子相似而得名。
当 yabby 和 kanadi 突变组合时,几乎完全丧失远轴侧身份。相反,当 KANADI 基因过度表达时,会观察到异位形成远轴组织。目前尚不清楚 KANADI 转录因子如何促进远轴身份。
叶片生长依赖于生长素,并受 YABBY 和 WOX 基因调控
除了促进近轴 - 远轴极性外,YABBY 基因还促进叶片生长。在缺乏所有 YABBY 基因活性的情况下,叶原基保留少量近轴 - 远轴极性,但无法启动叶片生长。在叶片生长过程中,YABBY 正向调节近轴 - 远轴域界面中 WOX1 和 WOX3 的表达,它们是叶片和边缘生长所必需的(见图18.16B)。如图 18.16B 所示,WOX1 和 WOX3激活编码细胞色素p450 单加氧酶的基因的表达,该酶产生一种未知的移动信号,促进地上器官(包括叶子)中的细胞分裂活动。生长素似乎是另一种在叶片形成中起作用的信号,因为生长素生物合成或分布减少的高阶突变体具有更小和更窄的叶子。
叶子近端-远端极性也取决于特定基因的表达
叶子发育也表现出沿其长度的极性,称为近端-远端极性。正在发育的叶原基可纵向分为从分生组织延伸的四个主要区域:边界分生组织、下叶区、叶柄和叶片(见图 18.16A)。
当原基开始向外生长并远离 SAM 时,近端-远端极性变得明显。SAM 和原基之间的边界形成一个低细胞分裂和扩张区,将这两个细胞组分开,使叶子在物理上与分生组织分离。杯状子叶 (CUC) 1 和 2 转录因子是该过程的关键调节因子,正如其名称所暗示的那样,cuc1/cuc2 双突变体表现出子叶和叶器官融合以及生长停滞。叶下部区域在形成托叶或叶鞘的叶片中起着重要作用(见图 18.12)。
在这些情况下,创始细胞(产生叶原基)通过依赖于 WOX 基因表达的机制将其他细胞招募到原基中。被招募成为托叶或叶鞘的细胞起源于原基的侧面。
注定要成为叶柄的叶原基区域以叶柄上叶片 (BOP) 基因的表达为特征,该基因编码二聚锌指转录激活因子,这些因子是建立拟南芥叶片近端部分叶柄身份所必需的(见图 18.16A)。 bop1/bop2 双突变体缺乏叶片和叶柄之间的正确区分,而两个单突变体都在通常是叶柄的地方形成叶片。BOP1 和 BOP2 均在近轴域中表达,它们在该域中冗余地抑制叶柄区域的层状生长。
在复叶中,KNOX1 基因的去抑制促进小叶的形成
复叶已从单叶形式独立进化多次。尽管复叶的形式和复杂性存在很大差异,但导致其形成的发育机制非常相似。通过延迟分化,单个叶原基可以重新部署 SAM 在叶片起始期间使用的基因调控网络,以形成小叶原基并产生复叶 (图 18.17)。与 SAM 上叶原基起始期间发生的情况类似,PIN1 蛋白会聚焦生长素流,形成沿原基侧翼间隔的局部生长素最大值 (图 18.18)。这些区域长出,形成小叶。
KNOX1 也是参与复叶发育的调节网络的重要组成部分,因为它抑制叶片分化并允许小叶形成(见图 18.18)。细胞分裂素在 KNOX 蛋白的下游起作用,促进小叶发育。例如,番茄叶原基中关键细胞分裂素生物合成基因的过度表达会导致小叶数量增加。相反,细胞分裂素降解基因的过度表达会导致小叶数量减少。共享途径控制不同物种中叶锯齿和小叶的形成,如 WEB 主题 18.5 中所述。
18.6 表皮细胞类型的分化
表皮是植物初生体最外层的细胞,包括营养和生殖结构。表皮通常由来自 L1 层或protoderm的单层细胞组成。在某些植物中,例如桑科、秋海棠科和胡椒科的某些物种,表皮具有两个或更多个细胞层,这些细胞层来自原皮层的平周分裂。
在所有被子植物中发现的表皮细胞主要有三种类型:铺板细胞、毛状体和保卫细胞。铺板细胞 pavement cells是相对未特化的表皮细胞,可被视为原表皮的默认发育命运(参见第 22 章)。毛状体是芽表皮的单细胞或多细胞延伸,具有多种形式、结构和功能,包括防止昆虫和病原体侵袭、减少水分流失和提高对非生物胁迫条件的耐受性。毛状体的发育和功能在 WEB 主题 18.6 中讨论。保卫细胞是围绕气孔或毛孔的成对细胞,存在于枝条的光合作用部分。保卫细胞通过对光和其他因素作出严格调控的膨压变化来调节叶片与大气之间的气体交换(见第 6、8 和 16 章)。在这里,我们将气孔的发育描述为模式形成和细胞分化的模型系统。
保卫细胞的身份由专门的表皮谱系决定
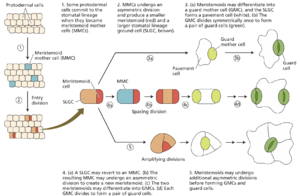
几乎所有陆生植物都有气孔。气孔的发育取决于细胞依次采用一系列不同的身份。我们对气孔发育的理解源于对细胞谱系的追踪,但在鉴定出具有更多、更少或扭曲气孔的拟南芥突变体后,这一理解才真正开始取得进展(图 18.19)。许多突变体的名称都暗示了气孔的口状形状。
在真双子叶植物中,例如拟南芥,在发育中的原表皮(将形成叶表皮)中建立了一个分生组织母细胞 (MMC) 群。每个 MMC 不对称分裂,产生两个形态不同的子细胞——一个较大的stomatal lineage ground cell (SLGC) 和一个较小的meristemoid (图 18.20)。meristemoid 可以经历不同数量的不对称扩增分裂,产生多达三个 SLGC,meristemoid 最终分化为 guard mother cell (GMC),由于其圆形形态而易于识别。然后,GMC 经历一次对称分裂,形成一对围绕气孔的保卫细胞。在分生组织扩增分裂后,产生的 SLGC 可以分化为铺板细胞,这是成熟叶片表皮中最丰富的细胞类型,或者它们可以不对称分裂(spacing divisions)以产生次级分生组织。虽然这个谱系被称为气孔谱系,但分生组织和 SLGC 能够进行重复分裂,这意味着这个谱系实际上负责产生叶片中大多数表皮细胞。
两组bHLH转录因子调控气孔细胞身份转变
在拟南芥的气孔相关谱系中,从一种细胞身份转变为另一种伴随着并且依赖于三种bHLH转录因子之一的表达:SPEECHLESS(SPCH),MUTE,FAMA。SPCH的转录活性驱动MMC的组成,导致进入不对称分裂。MUTE促进类分生组织分化为GMC,促进GMC的终末细胞分裂。并驾齐驱地,MUTE诱导FAMA,而FAMA促进气孔保卫细胞的分化,阻止进一步的分裂。拟南芥mute突变体有增殖分裂,但没有气孔。fama突变体形成成簇的不成对的保卫细胞。此外,两类bHLH-亮氨酸拉链蛋白,SCREAM(SCRM)和SCRM2,被鉴定为SPCH,MUTE和FAMA的partner。在scrm突变体中,整个表皮由气孔组成。
细胞间的肽信号调节气孔图示
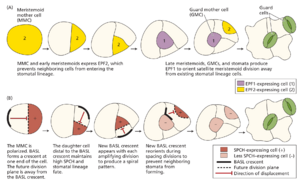
气孔间隔至少一个细胞长度,以最大限度地实现叶片和大气之间的气体交换。间隔由细胞间通讯和引导细胞分裂的内在因素调节(图 18.21A)。表皮模式因子 ( EPIDERMAL PATTERNING FACTOR ,EPF) 家族的分泌肽由气孔谱系细胞表达。 EPF2 由 MMC 和早期分生类分生组织表达,而 EPF1 由晚期类分生组织、GMC 和幼年保卫细胞表达。EPF 肽与 ERECTA(或 ERECTA 样蛋白)和 TOO MANY MOUTHS 形成的受体样激酶 (RLK) 异二聚体结合,导致募集 BAK1/SERKs 成分以激活激酶活性(参见第 4 章)。EPF2 由原表皮细胞中的受体检测,而 EPF1 由 SLGC 和 GMC 检测。EPF1 通过提供位置信息来防止气孔成簇或成对形成。EPF2 抑制相邻细胞进入气孔谱系并促进分生类分生组织母细胞铺面细胞的形成。这些途径的突变会导致气孔密度或气孔聚集的变化。叶肉也有助于气孔模式的形成。EPF 样肽之一 EPFL9 是一种正调节或气孔密度,由下层叶肉产生并释放到表皮,在那里它与 RLK 复合物结合。实验表明,EPFL9 的消耗会导致气孔数量减少,这表明其功能对正常的气孔发育很重要。
气孔谱系中的内在极性有助于气孔间距
气孔发育过程中一些关键分裂的方向有助于维持“单细胞间距规则”。MMC 和分生组织的分裂被认为是不对称的,因为两个子细胞有不同的命运;在这种情况下,子代在物理上也不同,因为 SLGC 比分生组织大。分裂后不久,两个子代细胞均表达 SPCH蛋白,但随后在两个细胞中较大的一个中被下调。极性在定向不对称分裂中起着重要作用。极性由标记 MMC 一端的极性蛋白控制。然后,分裂的方向使得极性蛋白只存在于其中一个子细胞中(图 18.21B)。在拟南芥中发现的一种这样的蛋白质是 BREAKING OF ASYMMETRY IN THE STOMATAL LINEAGE (BASL)。BASL 调节不对称表皮细胞分裂的多个方面,并且独立于气孔谱系,但它在分裂前以新月形存在于表皮细胞(包括 MMC 和分生细胞)的膜上,并在分裂后留在 SLGC 中(见图 18.21B)。
环境因素也会调节气孔密度
气孔密度和孔径对环境敏感。水分亏缺、光照和 CO2 等因素会导致气孔密度发生变化,以平衡 CO2 吸收和限制水分流失。例如,水分亏缺会诱导脱落酸 (ABA),而这已被发现会激活 MAP 激酶信号级联,导致下调 SPCH。温度升高通过 phyB 和 bHLH 转录因子PHYTOCHROME 相互作用因子 4 (PIF4) 降低气孔密度,PIF4 可协调光和温度响应与生长(见第 4 章和第 16 章)。温度升高会抑制 phyB 活性,然后 phyB 和 PIF4 都会在气孔谱系前体中积累并抑制 SPCH 表达。相反,phyB 的高光激活会抑制 PIF4 水平并增加 SPCH 表达,从而导致气孔密度增加。在黑暗中,通过抑制 EPFL9 和 CONTITUTIVE PHOTOMORPHOGENIC 1 (COP1) 来抑制气孔形成,COP1 靶向 SCRM 进行降解(有关 COP1 在光响应中的作用的讨论,见第 16 章)。在高 CO2 浓度下,气孔密度降低。这是通过三肽基肽酶 CO2 反应分泌蛋白酶激活细胞外 EPF2 并诱导 EPF2 表达以响应高 CO2 而发生的。
单子叶植物的气孔发育涉及一些与拟南芥同源的基因
禾本科植物的保卫细胞呈哑铃形,而不是像真双子叶植物和一些其他单子叶植物那样呈肾形(见图 6.12)。单子叶植物保卫细胞两侧有一个subsidiary细胞,有助于其功能。在禾本科植物中,气孔形成离散的细胞files(图 18.22)。在这些files中,未分化的细胞不对称分裂以产生较小的和较大的细胞。较小的细胞成为保卫母细胞,它将对称分裂形成围绕中央孔的两个保卫细胞。GMC 旁边的细胞不对称分裂形成两个subsidiary细胞,保卫细胞两侧各一个,这增加了它们的开放效率。主要 bHLH 的直系同源物存在于禾本科植物中,但其作用与拟南芥略有不同。在模式禾本科植物 Brachypodium 中,SPCH 已被复制且部分冗余,SCRM1 控制早期不对称分裂,而 SCRM2 则在 GMC 分化后期起作用。MUTE 直系同源物从 GMC 移出以指定副细胞身份。在禾本科植物和苔藓中也发现了 TOO MANY MOUTHS、EPF1 和 ERECTA 的直系同源物,表明它们的功能是保守的。然而,在禾本科植物中尚未鉴定出 BASL 的直系同源物,这表明其他蛋白质可执行类似 BASL 的功能。例如,形成玉米副细胞的定向不对称分裂由 PANGLOSS1 (PAN1) 和 PAN2 协同进行。 PAN 是富含亮氨酸重复受体样激酶,位于与 GMC 接触的辅助母细胞中,以诱导极化细胞分裂。它们很可能被玉米 MUTE 直系同源物上调。
18.7 叶片中的脉络模式
叶片维管系统是一个复杂的互连脉络网络,由两种主要传导组织类型木质部和韧皮部以及非传导细胞(如薄壁组织、厚壁组织和纤维)组成。叶片维管系统的空间组织(其脉络模式)既因物种而异,也因器官而异。脉络模式分为两大类:网状脉络(大多数真双子叶植物中存在)和平行脉络(许多单子叶植物的典型特征)(图 18.23)。
尽管叶脉模式各异,但它们都具有共同的层次结构。根据叶脉与母脉连接处的宽度,叶脉被分为不同的大小类别——初级、次级、三级等等(图 18.24)。最小的细脉盲端终止于叶肉中。叶维管系统的层次结构反映了不同大小的叶脉的层次功能,直径较大的叶脉负责大量运输水、矿物质、糖和其他代谢物,直径较小的叶脉负责韧皮部装载(见第 11 章)。
叶片脉络模式如何发展的问题长期以来一直吸引着植物生物学家。为了使叶片维管系统有效地发挥其长距离运输功能,叶脉必须有效地分布在整个光合组织中,并且叶脉的许多细胞类型必须在维管束的径向和纵向尺寸内正确排列。因此,维管组织的分化受到严格的发育控制也就不足为奇了。在本节中,我们首先描述叶片与植物其余部分的维管连接的发展。然后我们讨论如何建立叶片的高级脉络模式。
初级叶脉是与先前存在的维管系统不连续地出现的
十九世纪中叶,瑞士植物解剖学家 Carl Wilhelm von Nägeli 在追踪初生枝条中维管束的来源时,发现了一个惊人的现象。在种子植物茎的成熟部分,纵向维管束形成一个连续的传导系统,该系统始于根茎交界处,结束于生长尖端附近。Nägeli 曾假设维管系统必须从先前存在的维管系统向上(向上)生长到枝条的生长尖端。相反,他发现叶维管束起源于称为原形成层的维管前体细胞,与 SAM 中新出现的叶原基不连续地相关(图 18.25)。从那里,维管束向下(向基部)分化,朝向叶片正下方的节点,并与较老的维管束形成连接。进入叶片的维管束部分后来被称为叶迹(见图 18.25)。
Nägeli 发现,茎中连续的纵向维管束实际上是由单个叶迹组成的。物种在叶迹发育的确切过程中可能有所不同,但种子植物茎初级维管系统作为叶迹的集合体的基本解释似乎是普遍的。
生长素canalize启动叶迹的发育
有几条证据表明,生长素刺激维管组织的形成。一个例子是生长素在受伤后维管组织再生中的作用(图 18.26A)。去除伤口上方的叶子和嫩枝可防止导管再生,但通过在伤口上方的切割叶柄上涂抹生长素可恢复导管再生,这表明叶子中的生长素是导管再生所必需的。如图 18.26B 所示,再生木质部元素的files起源于维管束上部切割端的生长素源,并向基部前进,直到它们与下方维管束的切割端重新连接,与生长素流动的假定方向相匹配。因此,切割维管束的上端充当生长素源,下部切割端充当生长素汇。
这些观察结果以及其他系统(例如芽接)中的类似观察结果导致了这样的假设:随着生长素流组织,其刺激并极化其自身的运输,逐渐被引导(或canalize)到远离生长素来源的细胞files中;这些细胞files随后可以分化形成维管组织。
与此想法一致,局部生长素应用(如刚刚描述的伤害实验)诱导远离应用部位的窄条带中的维管分化,而不是在宽阔的细胞领域中。新的维管系统通常会向预先存在的维管束发展并与之结合,从而形成连通的维管网络。因此,我们预测正在发育的叶片痕迹充当生长素源,而现有的茎脉系统充当生长素汇。
最近对叶脉的研究支持这种生长素在分子水平上流动的source–sink model或canalization model。在这个模型中,在一个或多个细胞中合成的生长素被输出,并通过吸收到相邻细胞中产生定向流动。然后通过定向输出机制放大该梯度以canalize运输载体。
向基运输的生长素从叶原基的 L1 层运输启动叶痕原形成层的发育
生长素canalize伴随着 PIN1 生长素流出载体的重新分布,以至于 PIN1 的分布可用于预测组织内生长素流动的方向。图 18.27A 显示了表达与绿色荧光蛋白 (GFP) 融合的拟南芥PIN1 蛋白的番茄植株的 SAM。根据 PIN1 蛋白的细胞定位,生长素被导向叶原基初始层 (P0) 的 L1 层中的汇聚点。相反,生长素被导向新生叶原基 (P1) 的起始中脉 (叶迹)。
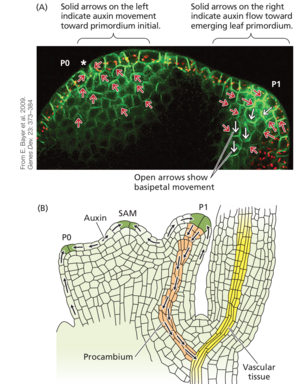
图 18.27B 显示了拟南芥的中脉形成的模型。生长素通过 PIN1 转运蛋白在 L1 层中向叶原基 (P1) 尖端的canalize导致生长素在尖端积累。生长素从该高浓度生长素区域流出,通过 PIN1 蛋白向基节方向向其正下方的老叶迹线通道化。
现有的维管系统引导叶迹的生长
显微外科实验表明,茎中现有的维管束是叶迹原形成层的定向发育所必需的。图18.28A 显示了表达与 GFP 融合的拟南芥 PIN1 的番茄植株顶端的 PIN1 分布。从叶原基初始(P0)出现的叶迹已连接到其下方叶原基的现有叶迹(P3),如图18.28B 所示。但是,如果 P3 被手术切除,来自 P0 的叶迹将连接到茎另一侧的叶原基的维管束(P2)(图 18.28C 和 D)。这些结果表明,要么现有的维管束充当了生长素汇,从而促进了生长素canalize,要么它产生了不同的信号来指导叶纹的发育。
维管束发育始于原形成层分化
在叶脉形成过程中,基本分生组织细胞分化为前原形成层 pre-procambium 细胞——介于基本细胞和原形成层细胞之间的稳定中间状态。前原形成层细胞的形状是等直径的(大约是立方体形状),在解剖学上与基本分生组织细胞没有区别。前原形成层的细胞分裂与维管束的生长方向平行,从而形成原形成层特有的细长细胞(图 18.29A)。原形成层的分化沿基方向进行。
原韧皮部Protophloem是从原形成层细胞形成的第一个维管组织,其分化从下方的维管束开始,并向叶原基顶端进行。相反,初生木质部的分化落后于初生韧皮部,是不连续的,并且既向叶原基顶端进行,又向下方的维管束顶端进行。
高阶叶脉按可预测的层次顺序分化
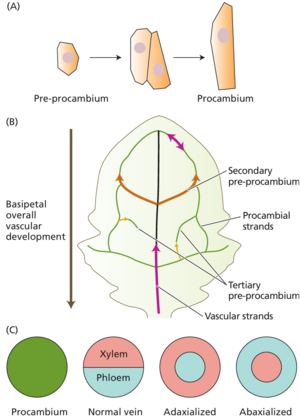
叶维管化的层次顺序在拟南芥中得到了最深入的研究。一般来说,叶脉的发育和图案化是沿着叶基方向进行的(图 18.29B)。换句话说,叶脉在发育中的叶子顶端的发育阶段通常比在叶基部更前。
叶脉形成的模式遵循拟南芥的典型过程。在叶原基中形成的第一个原形成层——叶迹——代表未来的主脉或中脉。随着叶子的生长,第一对次级脉的次级前原形成层(图 18.29B 中的橙色箭头)从中脉发育出来,然后向叶顶,朝着叶尖的中脉成环。三级叶脉的前原形成层叶脉从次级叶脉中延伸出来,并与其他延伸的strands重新连接或在叶肉中结束(图 18.29B 中的橙色箭头)。原形成层沿着原形成层strand(图 18.29B 中的绿线)从前原形成层分化而来。木质部分化发生在大约 4 天后,可以沿着维管束连续发育,也可以形成不连续的岛状(图 18.29B 中的洋红色箭头)。
叶脉内维管组织的正确分化取决于叶片正常的近轴-远轴极性。 图 18.29C 中显示的四个圆圈表示存在和不存在近轴-远轴极性时的维管分化。 左侧的绿色圆圈代表未分化的原形成层。 在正常的近轴-远轴极性条件下,木质部在近轴侧发育,韧皮部在远轴侧发育。但是,如果叶子已经近轴化,就像 phan 突变体一样,木质部细胞会包围韧皮部,而在远轴化突变体(例如 KANADI 基因家族的突变体)中,韧皮部细胞会包围木质部细胞。
译注:好合理。木质部在近轴侧分化,如果周围全是近轴组织,那就周围全是木质部。
生长素调节高阶叶脉的形成和模式化
正如叶迹发育一样,生长素的分布对于指导高阶叶脉的发育至关重要。在叶缘,近轴-远轴界面触发生长素生物合成基因的表达。由此产生的叶缘生长素积累被认为会刺激叶片的扩张,并且这种积累在形成锯齿的区域最强(图 18.30)。叶缘的生长素最大值也对应于叶缘与叶脉末端相关的特殊孔隙称为水孔hydathodes(见第 6 章)。生长素从这些生长素最大值移向主脉,并启动前原形成层的分化,最终形成次生叶脉。图 18.30B 说明了生长素从其在水孔区域的合成位点到从叶子中心的中脉形成的发育叶脉的canalize。
生长素合成和运输对叶脉的重要性由缺乏生长素合成或极性运输的拟南芥突变体的表型显著证明(图 18.31)。正常的叶脉模式在 yuc1/yuc2/yuc4/yuc6 四重突变体中几乎完全消失(见图 18.31B),这种突变体中生长素的生物合成显着减少。N-1-萘基邻苯二甲酰胺酸 (NPA) 对细胞生长素流出的药理学阻断减少了叶脉分枝和整体叶片扩张(见图 18.31C)。六重突变体中 PIN 活性的丧失在很大程度上重现了 NPA 对分枝的影响,但对整体叶片大小的影响较小(见图 18.31D)。但是,ATP 结合盒 B (ABCB) 生长素流出转运体也与 NPA 结合并受到 NPA 的抑制,而双 abcb 突变体保留了 PIN 活性,但表现出 NPA 处理后叶片扩张的减少(见图 18.31E)。
- ↑ The terms initial cells and stem cells are often used interchangeably by developmental biologists. To avoid confusion with the term ap plied to the primary plant axis, we use the terms undifferentiated cells, initial cells, or initials throughout this textbook
