第四章 信号和信号转导
作为固着生物,植物会不断根据环境做出调整,要么为了利用有利条件,要么为了在不利条件下生存。为了促进这种调整,植物进化出了复杂的传感系统,以优化水和养分的利用;监测光量、光质和方向;并保护自己免受生物和非生物威胁。查尔斯·弗朗西斯·达尔文对草类胚芽鞘在光刺激下弯曲生长过程中的信号转导进行了开创性研究。他们观察到,在胚芽鞘尖端可以感知到单向光,但弯曲反应发生在更靠后的芽组织上。这让达尔文夫妇得出结论,一定有一个移动信号将信息从胚芽鞘组织的一个区域传输到另一个区域,并引发弯曲反应。后来,这种移动信号被鉴定为生长素,即吲哚-3-乙酸,这是第一个被发现的植物激素。
一般来说,引发一种或多种植物反应的环境输入被称为信号,而对该信号作出生化反应的物理成分被称为受体。受体要么是蛋白质,要么是与吸光色素相关的蛋白质(就光受体而言)。一旦受体感知到其特定信号,它们就必须传导信号(即将其从一种形式转换为另一种形式),以放大信号并触发细胞反应。受体通常通过改变其他蛋白质的活性或使用称为第二信使的细胞内信号分子来实现这一点;然后这些分子会改变基因转录等细胞过程。因此,所有信号转导途径通常涉及以下事件链:
信号→受体→信号转导→反应
在许多情况下,初始反应是产生次级信号,例如激素,然后将其运输到作用位点并引起主要生理反应。现在已经确定了植物信号转导中涉及的许多特定事件和中间步骤,这些中间体构成了信号转导途径。
我们从简要概述指导植物生长的外部线索类型开始本章。接下来我们讨论植物如何利用信号转导途径来调节基因表达和翻译后反应。一个令人惊讶的发现是,在大多数情况下,植物信号转导途径通过灭活、降解或重新定位调节转录的抑制蛋白来发挥作用。信号需要通过第二信使进行放大,还需要信号传输机制来协调整个植物的反应。最后,我们研究了单个刺激-反应级联如何与其他信号通路整合,称为交叉调节,以塑造植物对其时间和空间环境的反应。
4.1 信号的时间和空间方面
植物信号转导机制可能相对较快或极慢(图4.1)。当一些食肉植物,尤其是捕蝇草(Dionaea muscipula)捕捉昆虫时,它们使用改良的叶片陷阱,在触摸刺激后几毫秒内关闭。同样,含羞草(Mimosa pudica)在被触摸时会迅速折叠小叶。幼苗在水平放置几分钟后,就会根据重力重新调整方向。这种快速反应机制通常涉及释放随着时间的推移而被能量依赖过程隔离的离子。在较长时间内发生的环境反应通常涉及离子第二信使的快速细胞质流入,随后是酶活化、激素反应和/或基因转录和蛋白质翻译。相反,被食草昆虫攻击的植物可能会在几个小时内释放挥发物来吸引昆虫捕食者。在这个时间尺度上发生的过程通常涉及新的转录和翻译活动(见第 3 章)。
长期环境反应会改变发育程序,从而在植物的整个生命周期内塑造植物结构。长期反应的例子包括响应养分供应调节根部分枝、生长向阳叶或遮荫叶以适应光照条件、当茎尖被食草动物损坏时激活侧芽生长。
植物的长期反应可以持续数月或数年。例如,许多植物物种需要长时间的低温(称为春化)才能开花(见第 20 章)。染色质重塑通常与此类长期反应有关(见第 3 章)。植物对环境信号的反应在空间上也不同。在细胞对环境信号的自主反应中,信号接收和响应都发生在同一个细胞中。相反,非细胞自主反应是信号接收发生在一个细胞中,而响应发生在远端细胞、组织或器官中的反应。细胞自主信号传导的一个例子是保卫细胞的开放,其中蓝光激活膜离子转运体,通过向光素蓝光受体使保卫细胞膨胀(见第 16 章)。同一器官中非细胞自主信号传导的一个例子是成熟叶片暴露于高光强度时形成额外的气孔,这一过程需要将信息从一个器官传输到另一个器官(见第 18 章)。
4.2 信号感知和放大
尽管性质和组成千差万别,但所有信号转导途径都具有共同的特征:初始刺激被受体感知并通过中间过程传输到启动生理反应的位点(图 4.2)。刺激可能来自发育编程或外部环境。当响应机制达到最佳点时,反馈机制会减弱这些过程并重置传感器机制。
受体遍布整个细胞,并在整个界中保存下来
受体可以位于质膜、细胞质、内膜系统或细胞核中,例如激素和触觉受体(图 4.3)。在某些情况下,受体会从一个区室移动到另一个区室。许多植物受体与细菌系统中的受体相似。例如,细菌机械敏感离子通道 MscS((Mechanosensitive channel of Small conductance,小电导机械敏感通道)的同源物存在于植物细胞的质膜和叶绿体被膜(可能是内膜)中。机械敏感通道充当拉伸受体,帮助细胞和质体适应渗透诱导的肿胀。植物受体可以感知本章后面描述的激素细胞分裂素和乙烯的存在,它们来自细菌的“双元”调节系统。几种植物光受体与细菌中的类似蛋白质不同并承担了新功能。例如,隐花色素/光裂合酶超家族的细菌成员是黄素蛋白,可修复紫外线在 DNA 中产生的嘧啶二聚体。在植物中,隐花色素缺乏 DNA 修复所需的关键残基,而是介导茎伸长的光控制,叶片扩展、光周期开花和昼夜节律时钟(见第 16 章)。
其他植物受体与动物和真菌中的受体更相似,但通常具有额外或修改的成分。 植物 F-box 受体/泛素连接酶系统就是例子,它是几种植物激素受体复合物不可或缺的部分(见图4.3)。 真核 E3 泛素连接酶复合物存在于细胞质和细胞核中,与细胞器膜相关,将泛素共价连接到底物蛋白上,标记它们以便通过26S 蛋白酶体降解。 在 E3 连接酶的 SCF(Skp、Cullin 和 F-box 蛋白)亚家族中,底物识别由 F-box 蛋白介导。基于 SCF 的激素受体复合物似乎是植物中泛素连接酶机制的独特适应。
所有生物体中最保守的机制之一是通过激酶修饰蛋白质、脂质或核酸,激酶添加来自ATP的磷酸基团以改变这些分子的性质。蛋白激酶通过磷酸化靶蛋白的丝氨酸、苏氨酸、酪氨酸或组氨酸来传递和放大信号,可以改变其生物活性或与其他蛋白质和脂质的结合。当一种蛋白质既起到受体的作用,又通过磷酸化另一种分子来传递信号时,它就被称为受体激酶。尽管几乎所有的蛋白激酶家族在动物和植物之间都是保守的,但它们往往存在差异。例如,动物有大量的质膜 G 蛋白偶联受体 (GPCR),它们可以检测多种细胞外信号,并通过一大群异三聚体 G 蛋白在细胞内传递这些信号。植物有少量的异三聚体 G 蛋白,这些蛋白与动物的 G 蛋白有共同的起源,但迄今为止尚未明确证明类似的 GPCR 功能。相反,植物拥有数百种受体样丝氨酸/苏氨酸激酶(RLK),这些类型的蛋白在其他界中很少见。
信号必须在细胞内放大才能调节其目标分子
如果将受体视为信号进入信号网络的门路,则受体位置在某种程度上规定了后续信号通路的长度;此类通路可以由几个信号步骤或复杂的信号事件级联组成。在质膜处感知信号通常会激活具有许多中间体的转导途径。对于必须最终到达细胞核以调节基因表达的信号通路,除非通过信号放大事件进行增强,否则通路上的信号强度将逐渐减弱。在没有放大的情况下,任何必须穿过细胞质才能转移到细胞核的激活信号中间体都会因其扩散和失活机制(例如,通过去磷酸化、降解或隔离)而被稀释。此外,许多化学信号以非常低的浓度存在,受体也可以以非常低的密度出现,因此初始信号可能非常弱。信号放大级联用于调整、维持甚至增强更大距离的信号强度。为了将微弱的初始信号事件提升到检测阈值以上或将其传播到细胞质中,细胞采用放大机制,例如磷酸化级联和第二信使。
进化保守的 MAP 激酶放大细胞信号
蛋白质磷酸化是调节植物中蛋白质活性、定位和丰度的重要机制。植物有几种属于著名蛋白激酶家族的蛋白激酶。这些蛋白激酶家族中的许多也存在于动物和酵母中,但它们在植物中的相对丰度和生物学作用与在这些其他系统中发现的相比有显著不同。激酶可以作用于细胞表面或调节细胞内过程。例如,丝裂原活化蛋白激酶 (MAP 激酶) 信号放大级联在所有真核生物中起作用,并在多种植物反应。如图 4.4 所示,受体感知的信号可以产生 MAP 激酶激酶激酶(缩写为 MAP3K)的初始磷酸化,而后者又利用 ATP 磷酸化 MAP 激酶激酶(MAP2K)。磷酸化的 MAP2K 然后通过磷酸化 MAP 激酶(MAPK)来放大信号。然后,MAPK 通过磷酸化靶蛋白来进一步放大信号,以激活或修改细胞过程。在信号感知的几分钟内,MAP3K/MAP2K/MAPK 级联可以触发一系列下游响应。 MAP3K、MAP2K 和 MAPK 家族成员数量众多,且在广泛的环境、发育和生殖细胞反应中发挥重要作用,这表明该组激酶在植物中经历了功能多样化。然而,多种反应中共同的 MAP 激酶模块表明与其他信号传导组分的组合相互作用。
进化保守的激酶调节程序化和可塑性植物发育
组氨酸磷酸化蛋白激酶可能代表进化最古老的磷酸化模块。细菌采用由组氨酸激酶组成的双元受体系统,这些激酶磷酸化具有转录活性的蛋白质。相同的模块可以在植物激素细胞分裂素的检测和信号转导中找到,如本章后面所述。
细胞周期依赖性蛋白激酶家族也存在于所有界中。顾名思义,这些激酶需要与细胞周期蛋白结合才能获得功能。细胞周期中,细胞周期蛋白的表达存在差异,不同细胞周期蛋白与特定细胞周期依赖性激酶的结合调节其在细胞周期每个步骤中对离散调节剂的磷酸化。大量植物细胞周期蛋白和细胞周期依赖性激酶之间的程序化相互作用为细胞分裂的基本过程提供了自适应控制。
在植物中,一大类 AGC 激酶在进化上与动物环磷酸腺苷 (A 类)、环磷酸鸟苷 (G 类) 和 Ca2+ 依赖性 (C 类) 蛋白有关。尽管植物 AGC 激酶与动物 AGC 激酶有明显的共同祖先,但它们在结构和功能上与动物 AGC 激酶不同。在藻类和维管植物中存在与向光素蓝光受体类似的 AGC 激酶,这些受体在向光性、叶绿体运动和气孔对蓝光的反应中起作用(见第 16 章)。在高等植物中,AGC 家族已经扩展,包括 D6 蛋白激酶 (D6PK)、与 BREVIX RADIX 相关的蛋白激酶 (PAX) 和 PINOID 激酶,所有这些激酶都通过 PIN 形成 (PIN) 生长素流出载体蛋白的磷酸化激活激素生长素的定向细胞外排。PINOID 激酶似乎还调节 PIN 蛋白的亚细胞分布,以至于它的名字来源于拟南芥 pinoid 和 pin1 功能丧失突变体的相似性。第 4.4 节描述了极性生长素运输的重要性。一些植物 AGC 激酶在被磷脂酰肌醇依赖性激酶 1 (PDK1) 磷酸化时与脂质信号传导过程(本章后面介绍)相关。
Ca2+ 结合蛋白激酶代表植物中另一组蛋白激酶家族。这些激酶作为 Ca2+信号传导的组成部分发挥作用,并在本节后面的 Ca2+ 第二信使的背景下讨论。
细胞外信号由受体样激酶感知和传递
受体样丝氨酸/苏氨酸激酶 (RLK) 是一个突出的激酶家族,可磷酸化丝氨酸或不太常见的苏氨酸蛋白残基。一大类 RLK 包括跨质膜受体,具有细胞外富含亮氨酸重复 (LRR) 配体结合域和细胞内丝氨酸/苏氨酸激酶域,用于信号传递。配体与 RLK 受体结合导致与共受体二聚化,以启动磷酸化两种 RLK 的细胞内激酶域。这些反过来又启动多个磷酸化依赖性信号传导过程。RLK 的配体依赖性二聚化和活化的一个研究得很好的例子是细胞表面 FLAGELLIN SENSITIVE 2 受体与致病细菌的 flg22 肽结合,从而刺激与 BRI1 ASSOCIAT ED KINASE (BAK1)/SOMATIC EMBRYOGENESIS 受体激酶 (SERK) 共受体的相互作用以启动免疫反应(图 4.5)。类似的受体相互作用启动对真菌病原体几丁质的免疫反应。这些反应将在第 24 章中详细讨论。
BAK1/SERK 共受体还在调节植物生长和发育的细胞间通讯中发挥作用。例如,表皮模式因子肽激素与其 RLK 结合会导致与 BAK1/SERK 和 TOO MANY MOUTHS 共受体发生异源化,从而调节表皮模式和气孔发育。类似的共受体在与控制花脱落的肽激素结合后与 BAK1/SERK 受体相互作用。研究最深入的 RLK 激素受体是油菜素类固醇不敏感 1 (BRI1),它在与油菜素类固醇结合后与 BAK1/SERK 家族的 RLK 发生异源化,并调节生长和花特征的多个方面(见图 4.5 和 4.34)。在许多 LRR RLK 依赖性信号传导事件中,相关的细胞质激酶在下游信号传导中发挥作用。
另一组 RLK 在监测和调节细胞壁完整性和扩张方面起着重要作用。如第 2 章所述,细胞分裂后新细胞壁的形成及其在发育和生长过程中的维持或重组需要微调。植物细胞需要在细胞生长过程中以及在受到病原体或食草动物攻击时感知其细胞壁的组成。一组类似于在长春花中首次发现的蛋白质 (CrRLK1) 的 RLK 与 LORELEI 家族的辅助受体一起发挥作用,以监测细胞壁的完整性。这是通过与面向细胞壁的质膜外叶相关的 Glc2-N-聚糖结合马来凝集素结构域实现的。在这些 CrRLK1 样 RLK 中,研究最深入的是 FERONIA,它与分泌的快速碱化因子 (RALF) 肽结合,并通过细胞浆 Ca2+的短暂增加和许多蛋白质(包括 FERONIA 本身)的差异磷酸化来刺激质外体 pH 的增加。类似的机制在受精过程中调节花粉管的完整性,而花粉受体激酶复合物的异源化在结合 LURE 花粉引导肽后调节花粉管的生长。
磷酸酶是蛋白质磷酸化的“关闭开关”
蛋白质磷酸化可以对蛋白质的功能、定位和丰度产生多种影响。磷酸化的影响可以通过从底物蛋白质中去除磷酸盐添加的磷酸酶来逆转。磷酸酶可以根据结构相似性、它们去磷酸化的特定氨基酸残基或刺激其去磷酸化活性的分子相互作用进行分组。2A (PP2A) 和 2C (PP2C) 亚家族的细胞浆丝氨酸/苏氨酸特异性蛋白磷酸酶是植物中起作用的主要蛋白磷酸酶。磷酸酶对磷酸化蛋白的去磷酸化通常是负反馈调节回路的一部分,而前面提到的许多蛋白激酶依赖性磷酸化事件都受到磷酸酶的拮抗。
其他蛋白质修饰可以重新配置细胞过程
蛋白质的相互作用和细胞分布可以通过磷酸化以外的修饰来调节。如第 1 章所述,高尔基体和内质网 (ER) 中蛋白质的糖基化可以改变其在胞内,甚至胞外的活性和目的地。其他蛋白质修饰会改变与其他蛋白质的相互作用、与膜的结合,甚至改变蛋白质本身的活性。最常见的修饰是将胞浆蛋白质靶向膜复合物和表面。这些修饰包括 (1) N-肉豆蔻酰化,即将 14 碳肉豆蔻酰基添加到蛋白质的 N 端甘氨酸残基上;(2) 异戊烯化,即将来自萜类生物合成的法尼基磷酸盐或牻牛儿牻牛儿基分子(参见网络附录 4)附着在特征性的 C 端半胱氨酸残基上; (3) S-酰化,一种发生在膜表面的可逆过程,转移酶将 C-16 或 C-18 脂肪酸附着到硫醇残基上,以稳定膜相互作用;(4) 蛋白质中半胱氨酸残基的S-亚硝基化,一氧化氮添加到半胱氨酸残基上可防止二硫键的形成或抑制酶活性。蛋白质亚硝化在程序性发育和应激反应中均起作用(见第 15 章)。蛋白质活性也可以通过添加类似于泛素的进化保守肽来改变(见第 3 章),但不标记蛋白质以进行降解。在大多数情况下,添加修饰肽可激活或稳定目标蛋白质。在某些情况下,肽修饰会改变蛋白质的核或细胞质定位,以调节下游转录过程。
Ca2+ 是植物和其他真核生物中最普遍的第二信使
第二信使代表了另一种增强或传播信号的策略。这些小分子和离子在信号感知后迅速产生或在相对较高的水平上动员,并可以改变目标信号蛋白的活性。所有真核生物中最普遍的第二信使可能是钙离子,即二价阳离子 Ca2+,它在植物中参与大量不同的信号通路,包括共生相互作用、植物防御反应以及对各种激素和非生物胁迫的反应。当 Ca2+ 通透性离子通道打开,允许 Ca2+ 从 Ca2+ 库被动流入细胞质时,细胞质 Ca2+ 水平会迅速增加(图 4.6)。
通道活动必须被严格调节,以保持对细胞质 Ca2+ 升高的时间和持续时长的精确控制。 通常,离子通道是门控的,这意味着通道孔通过跨膜电位、膜张力、翻译后修饰或配体结合的变化而打开或关闭(参见第 8 章)。 植物中已鉴定出几种 Ca2+ 通透性通道家族; 这些包括质膜定位谷氨酸样受体 (GLR) 和环核苷酸门控通道 (CNGC)。 电生理学和其他证据支持在液泡膜和内质网中存在 Ca2+ 通透性通道。
一旦受体介导的信号激活 Ca2+ 通透性通道,Ca2+ 传感器蛋白就会作为信号中介发挥关键作用,将 Ca2+ 信号与细胞活动的变化联系起来。大多数植物基因组包含四个主要Ca2+ 传感器多基因家族:钙调蛋白 (CaM) 和钙调蛋白样蛋白、Ca2+ 依赖性蛋白激酶 (CDPK)、Ca2+/钙调蛋白依赖性蛋白激酶 (CCaMK) 和钙调磷酸酶-B 样蛋白 (CBL)——与 CBL 相互作用蛋白激酶 (CIPK) 协同发挥作用。这些传感器家族的成员通过与 CaM 结合或以 Ca2+ 依赖的方式磷酸化靶蛋白来调节靶蛋白的活性。靶蛋白包括转录因子、各种蛋白激酶、Ca2+-ATPase、产生活性氧 (ROS) 的酶和离子通道。最后,细胞器和质膜中的 Ca2+ 泵和 Ca2+ 交换器主动从细胞溶胶中去除 Ca2+ 以终止 Ca2+ 信号传导(见图 4.6)。
细胞质或细胞壁 pH 值的变化可以作为激素和应激反应的第二信使
植物细胞利用细胞膜上的质子动力(即电化学质子梯度)来驱动 ATP 合成(参见第 9 章和第 13 章)和激发次级主动运输(见第 8 章)。除了具有这种“管家”活性外,质子似乎还具有信号活性并充当第二信使的作用。在静息细胞中,细胞质 pH 通常保持恒定在 pH 7.5 左右,而细胞壁酸化至 pH 5.5 或更低。细胞外 pH 可以响应各种不同的内源性和环境信号而快速变化,而由于细胞缓冲能力,细胞内 pH 值变化发生得更慢。例如,在生长中的下胚轴中,植物激素生长素通过其 C 端的磷酸化触发质膜 H+-ATPase 的激活。这导致细胞壁变得更酸,据信这通过激活细胞壁松弛酶(如扩张蛋白)来促进细胞扩张(见第 2 章)。然而,在根部,生长素抑制细胞扩张,生长素触发细胞壁的快速碱化,这一过程已被证明是 Ca2+ 依赖的。在植物的许多环境应激反应中观察到类似的 Ca2+ 依赖性 pH 值变化(见第 15 章)。
运输蛋白被 Ca 2+激活或失活以促进细胞外和细胞内 pH 变化的具体情况目前尚不清楚,这些 pH 值变化的下游靶点也是一样。当然,细胞壁的 pH 值会影响弱酸性小分子(如植物激素)的质子化状态,从而影响它们通过扩散进入细胞的能力。因此,细胞壁 pH 调节可能代表一种微调激素吸收和信号传导的机制。也有证据表明,钾离子通道和水通道蛋白存在 pH 依赖性门控。
导致 pH 信号传导目标识别困难的原因是,酸性和碱性氨基酸的存在使所有蛋白质都对 pH 敏感。这种敏感性是否具有生理相关性取决于这些氨基酸的 pKa 值(解离常数)以及它们的质子化状态对蛋白质与其他蛋白质、底物或配体相互作用的能力有多重要。
活性氧物质作为第二信使,介导环境和发育信号
近年来,活性氧物质 (ROS) 不仅作为呼吸和光合作用等代谢过程的细胞毒性副产物出现,而且还是调节植物对各种环境和内源信号反应的信号分子。ROS 是通过氧的部分还原产生的活性分子(参见 WEB ESSAY 13.7)。大多数 ROS 形成于线粒体、质体、过氧化物酶体和细胞壁中。在细胞信号传导方面,质膜定位的 NADPH 氧化酶构成了最容易理解的 ROS产生酶家族。 NADPH 氧化酶(或呼吸爆发氧化酶同源物,RBOH)将电子从胞浆电子供体 NADPH 转移至膜外,以减少细胞外分子氧。产生的 ROS(超氧化物)可歧化为过氧化氢,这是一种更能透过膜的 ROS,也可通过特定的水通道蛋白通道进入细胞。
NADPH 氧化酶活性通过其 N 端氨基酸的磷酸化和 Ca2+ 的直接结合来调节(见图 4.6)。一些负责磷酸化 NADPH 氧化酶 N 端的激酶已被鉴定为 CDPK 和 CBL 依赖性 CIPK。因此,NADPH 氧化酶介导的氧化爆发通常出现在 Ca2+ 信号通路的下游,例如在防御信号中,其中 ROS 生成缺陷的突变体表现出对病原体的易感性增加。然而,也有证据表明 NADPH 氧化酶产生的 ROS 可以在 Ca2+ 信号上游发挥作用。
ROS 信号的目标包括半胱氨酸氨基酸残基的硫醇侧链,这些硫醇侧链可以被氧化修饰以形成分子内(多肽/蛋白质内)或分子间(不同 [多] 肽/蛋白质的氧化交联)二硫键。这种二硫键通常会改变受影响蛋白质的构象,从而改变其活性(见第 10 章和第 13 章)。ROS 对脂质的氧化也在应激反应中起作用(见第 15 章),氧化还原调节已被证明可以改变几种转录因子和转录激活因子的 DNA 结合活性或细胞定位。质外体中分泌的多胺的氧化也可以促进 ROS 的产生以及适应应激反应中更高的 ROS 水平。在细胞壁中,结构蛋白的酪氨酸残基、多糖的阿魏酰(阿魏酸)结合物和单木质素被氧化交联以改变细胞壁的强度或屏障特性(见第 2 章)。
脂质信号分子充当第二信使,调节各种细胞过程
甘油磷脂和鞘脂是植物质膜的主要脂质成分,是其物理特性(例如膜表面电荷、流动性、局部膜曲率)的重要决定因素。几种磷脂酶水解磷脂的特定键以产生脂质信号分子(见第 13 章)。例如,酰基水解酶去除脂肪酰基链,从而产生溶血磷脂。溶血磷脂是具有生物活性的小脂质,其特征是单个碳链和极性头部基团(图 4.7A)。它们比相应的磷脂更亲水,并且与质子泵的调节有关。磷脂酶 A (PLA) 家族的成员裂解任一酰基酯键,释放脂肪酸和溶血磷脂。磷脂酶 C (PLC) 水解甘油磷酸键,产生二酰甘油 (DAG) 和磷酸化头部基团。许多 PLC 优先裂解磷脂酰肌醇,释放 DAG 和肌醇磷酸盐,如肌醇 1,4,5-三磷酸盐 (IP3)。DAG 和 IP3 可作为信号分子,在各种发育和应激反应过程中调节 Ca2+ 通量(图 4.7B)。DAG 在寒冷反应中发挥作用,而 IP3 在氮缺乏、温度、水分不足和盐胁迫反应中发挥作用。
DAG 也经常被二酰甘油激酶迅速转化为磷脂酸 (PA)。当磷脂酶 D (PLD)从磷脂酰胆碱 (PC) 和其他磷脂中释放磷脂头部基团,作为干旱、盐、寒冷和病原体反应中的信号成分时,也可以形成 PA。PA 是一种锥形脂质,可能通过增加局部负膜曲率来促进囊泡出芽、对接和融合。PA 还通过促进疏水性氨基酸插入脂质双层来增强膜结合蛋白的一些相互作用。PA 的带负电荷的头部基团也用于与效应蛋白上带正电荷的结合口袋发生静电相互作用。在保卫细胞中,当激素脱落酸 (ABA) 与 PYL/PYR/RCAR 受体结合(见第 4.5 节)时,气孔关闭得到促进,从而促进其与作用于下游信号靶标的蛋白磷酸酶 2C 异构体的抑制性相互作用(参见第 15 章)。研究表明,ABA 依赖性的 PA 增加会促进PYR/PYL/RCAR 与蛋白磷酸酶 2C ABI1 的相互作用并抑制其活性。PA 似乎还会调节微管和肌动蛋白细胞骨架的动力学。它通过结合并由此负向调节肌动蛋白加帽蛋白的活性来增强肌动蛋白丝的形成,肌动蛋白加帽蛋白是一种以 Ca2+ 非依赖性方式与肌动蛋白丝生长端结合的蛋白质,可阻断亚基交换(见第 1 章)。
4.3 激素与植物发育
如果没有细胞、组织和器官之间的有效通讯,多细胞生物的形态和功能就不可能存在。在高等植物中,代谢、生长和形态发生的调节和协调通常取决于植物各个部分向另一个部分发出的化学信号。这个想法起源于 19 世纪的德国植物学家 Julius von Sachs (1832-1897)。
Sachs 提出化学信使负责不同植物器官的形成和生长。他还提出,重力等外部因素可能会影响这些物质在植物内的分布。事实上,从那时起,人们已经意识到,大多数将环境线索转化为生长和发育反应的信号网络都会调节这些内源性化学信使的代谢或重新分布。尽管萨克斯不知道这些信使的身份,但他的想法最终导致了它们的发现。
激素是化学信使,它们在一个细胞中产生,并通过与特定蛋白质相互作用来调节另一个细胞中的细胞过程,这些蛋白质充当与细胞信号转导途径相关的受体。与动物激素一样,大多数植物激素能够在极低的浓度下激活靶细胞中的反应。激素信号通常涉及激素从其合成位点到其作用位点的传输。一般而言,被运输到远离其合成部位的组织中的作用部位的激素被称为内分泌激素,而作用于合成源附近细胞的激素被称为旁分泌激素。激素也可以在合成它们的同一细胞中发挥作用,在这种情况下,它们被称为自分泌效应物。大多数植物激素都具有旁分泌活性,因为植物缺乏动物中发现的、由经典内分泌激素使用的快速循环系统。然而,尽管植物没有像动物内分泌系统那样的激素分泌腺,但通过维管系统进行较慢的长距离激素运输是植物的共同特征。尽管激素控制发育的细节非常多样化,但所有基本的激素途径都具有共同的特征。例如,信号感知和发育编程通常都会导致激素生物合成的增加或减少。然后激素被运输到到作用位点。受体对激素的感知会导致转录或转录后(例如磷酸化、蛋白质周转、离子排出)事件,最终引发生理或发育反应。此外,抑制激素合成的负反馈机制和分解代谢或隔离可以减弱反应,这些因素结合起来导致活性激素浓度恢复到信号前水平。通过这种方式,植物重新获得对下一个信号输入作出反应的能力。
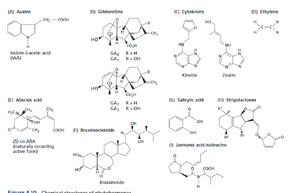
植物发育受十种主要激素调控:生长素、赤霉素、细胞分裂素、乙烯、脱落酸、油菜素类固醇、茉莉酸(主要是茉莉酸-异亮氨酸)、水杨酸、哌可酸酯pipecolates和独脚金内酯(图 4.10)。此外,几种肽会触发相邻或远端细胞的反应来调节生长。迄今为止,植物中研究最深入的肽激素靶标是受体样激酶异二聚体CLAVATA1/2。CLAVATA3 肽激素通过与 CLAVATA1/2 相互作用在短距离内起作用,以控制胚胎发育和顶端分生组织模式(见第 18 章和第 22 章)。其他 CLAVATA3/ 胚胎周围区域相关 (CLE) 肽与 C 端编码肽 (CEP) 一起在氮同化和与根瘤菌共生体的相互作用中发挥作用(见第 14 章)。其他肽类激素通过受体相互作用调节表皮细胞模式、叶肉细胞中的导管分子分化和细胞壁修饰。事实上,信号分子和生长调节剂的名单在未来几年可能会继续扩大。这里我们简要介绍了生长素、赤霉素、细胞分裂素、乙烯、脱落酸、油菜素类固醇和独脚金内酯。第 24 章将讨论茉莉酸、水杨酸和哌可酸酯在生物相互作用中的作用。
生长素是在早期对向光性过程中胚芽鞘弯曲的研究中发现的
生长素对植物生长至关重要,生长素信号传导几乎在植物发育的每个方面都发挥作用。生长素是第一种在植物中研究的生长激素,是在查尔斯和弗朗西斯·达尔文在《植物的运动力量》(1881 年)中预测其存在后发现的。达尔文夫妇研究了金丝雀草(Phalaris canariensis)幼苗鞘叶(胚芽鞘)和其他物种幼苗下胚轴在单向光照射下的弯曲情况,并得出结论:在顶端产生的信号向下传播,导致阴影侧的下部细胞比光照侧生长得更快。随后,他们发现该信号是一种可以扩散穿过明胶块的化学物质(图 4.11)。植物生理学家将化学信号命名为希腊语中的 auxein,意为“增加”或“生长”,并将吲哚-3-乙酸 (IAA;见图 4.10A) 确定为主要的植物生长素。
在某些物种中,4-氯-IAA、苯乙酸和吲哚-3-丁酸 (IBA) 可作为天然生长素,但 IAA 是迄今为止最丰富且生理上最重要的形式。生长素也由生活在植物内、上或附近的各种微生物(植物生物群落)产生,并用于促进有利于微生物的植物生长。由于 IAA 的结构相对简单,研究人员能够快速合成具有生长素活性的多种分子。其中一些化合物,如 1-萘乙酸 (NAA)、2,4-二氯苯氧乙酸 (2,4-D) 和 2-甲氧基-3,6-二氯苯甲酸 (二氯苯甲酸dicamba),现在被广泛用作园艺和农业中的生长调节剂和除草剂。
赤霉素促进茎的生长,被发现与水稻的“疯苗病”有关。
第二类植物激素是赤霉素(缩写为 GA,按发现时间顺序编号)。该组包含大量化合物,它们都是四环(四环)二萜酸,但其中只有少数化合物,主要是 GA1、GA3、GA4 和 GA7,具有内在生物活性(见图 4.10B)。生物活性赤霉素最显著的作用之一是诱导矮化幼苗节间伸长,这是通过其在促进细胞伸长中的作用实现的。赤霉素在植物生命周期中还有其他不同的作用:例如,它们可以促进种子发芽(见第 17 章)、开花过渡(见第 20 章)、花粉发育和花粉管生长(见第 21 章)和果实发育(见第 21 章)。
赤霉素最早由黑泽英一于 1926 年发现,并由薮田贞二郎和须木佑介于 20 世纪 30 年代作为真菌藤仓赤霉(现更名为藤仓镰刀菌)中的天然产物分离出来,这些激素的不寻常名称由此而来。感染藤仓镰刀菌的水稻植株会长得异常高大,导致倒伏(倒伏)和产量下降;因此得名 bakanae,即“疯苗病”。通过将赤霉素施用于未感染的水稻幼苗,可以复制这种过度生长。
藤仓镰刀菌产生几种不同的赤霉素,其中最丰富的是 GA3,也称为赤霉酸,可商业上用于园艺和农艺用途。例如,将 GA3 喷洒到葡萄藤上,可生产出我们现在在杂货店经常购买的大而无籽的葡萄(图 4.12A)。在矮生植物和莲座植物的茎伸长中获得了惊人的反应,特别是在遗传矮生豌豆 (Pisum sativum)、矮生玉米 (corn; Zea mays)(图 4.12B)和许多莲座植物(图 4.12C)中。
在首次鉴定出镰刀菌 中的赤霉素后不久,人们发现植物也含有类似赤霉素的物质,但其含量远低于真菌。第一种被鉴定出的植物赤霉素是 GA1,它是在 1958 年在菜豆种子提取物中发现的。我们现在知道赤霉素在植物中普遍存在,除了藤仓镰刀菌外,还存在于几种真菌中。迄今为止研究的大多数植物都含有 GA1 和/或 GA4,因此我们赋予这些赤霉素“激素”功能。除了 GA1 和 GA4 之外,植物还含有许多无活性的赤霉素,它们是生物活性赤霉素的前体或失活产物。
在组织培养实验中,细胞分裂素被发现是细胞分裂促进因子
在寻找刺激植物细胞分裂的因子时,发现了细胞分裂素,这些因子与植物激素生长素一起起作用。在生长素存在的情况下,发现了一种小分子,它可以刺激烟草髓薄壁组织在培养中增殖(图 4.13A)。这种诱导细胞分裂的分子被称为激动素。虽然激动素是一种合成的细胞分裂素,但其结构类似于天然存在的细胞分裂素,如玉米素(见图 4.10C)。
我们将在后面的章节中看到,细胞分裂素已被证明对许多生理和发育过程有影响,包括叶片衰老(见第 23 章)、顶端优势(见第 19 章)、顶端分生组织的形成和活性(见第 18 章)、配子体发育(见第 21 章)、促进库活性、维管发育和打破芽休眠(见第 19 章)。此外,细胞分裂素在植物与生物和非生物因素(包括盐和干旱胁迫、大量营养素(包括硝酸盐、磷酸盐、铁和硫酸盐)、共生固氮细菌和丛枝菌根真菌,以及致病细菌、真菌、线虫和病毒)的相互作用中发挥着重要作用(图 4.13B)(另见第 15 章和第 24 章)。
乙烯是一种气态激素,可促进果实成熟和其他发育过程
乙烯是一种化学结构简单的气体(见图 4.10D),1901 年,Dimitry Neljubov 首次将乙烯鉴定为植物生长调节剂,当时他证明了乙烯能够改变实验室中的黄化豌豆幼苗生长(图 4.14A)。随后,乙烯被鉴定为植物组织合成的天然产物。乙烯调节植物的多种过程,包括种子发芽和幼苗生长、细胞扩增和分化、叶片和花朵衰老和脱落(见第 17 章和第 22 章),以及对生物和非生物胁迫的反应(见第 15 章和第 24 章),包括偏上生长(图 4.14B)。植物生物群落细菌已被证明可以通过操纵乙烯及其代谢前体的水平来影响植物的生长和应激反应。脱落酸调节种子成熟和气孔关闭以应对水分胁迫。
脱落酸调节种子成熟和应对水分胁迫的气孔关闭
脱落酸 (ABA) 是维管植物中普遍存在的激素,也存在于苔藓、一些植物病原真菌和多种后生动物中。ABA 是一种萜类化合物,20 世纪 60 年代被鉴定为一种生长抑制化合物,与芽休眠的开始和促进棉花果实脱落有关。然而,后来的研究表明,ABA 促进的是衰老,即脱落之前的过程,而不是脱落本身。从那时起,ABA 还被证明可以调节盐度、脱水和温度应激反应,包括气孔关闭(见第 15 章)。ABA 还促进种子成熟和休眠(见第 17 章),并调节根和芽的生长、异叶(单个植物上产生不同类型的叶子)和开花,以及对病原体的一些反应(见第 24 章)。
油菜素类固醇调节光形态建成、萌发和其他发育过程
油菜素类固醇,最初称为油菜素,最初作为油菜花粉中的促生长物质被发现。随后的 X 射线分析表明,真双子叶植物中生物活性最高的油菜素被称为油菜素内酯,是一种类似于动物类固醇激素的多羟基类固醇。已鉴定出多种油菜素类固醇,主要是油菜素内酯生物合成或分解代谢途径的中间体。已知有两种油菜素类固醇具有活性,即油菜素内酯及其直接前体油菜素甾酮,尽管哪种形式占主导地位取决于植物种类和组织类型。油菜素类固醇是普遍存在的植物激素,与生长素和赤霉素一样,似乎早于陆生植物的进化。在被子植物中,油菜素类固醇在许多器官(例如花、叶、根)中的含量较低,在花粉、未成熟种子和果实中的含量相对较高。油菜素类固醇在植物的多种发育现象中起着关键作用,包括细胞分裂、细胞伸长、细胞分化、光形态建成、生殖发育、发芽、叶片衰老和应激反应。 油菜素类固醇合成不足的突变体表现出生长和发育异常,包括矮化和顶端优势减弱。拟南芥缺乏油菜素类固醇的突变体也表现出暗中去黄化生长,在玉米中表现出雌性化的雄花和雄穗。
独脚金内酯抑制分枝并促进根际相互作用
独脚金内酯存在于约 80% 的植物物种中,是一组萜类内酯(见图 4.10H),最初被发现是根寄生植物(如独脚金属)和列当属(Orobanche 和 Phelipanche 属)的宿主衍生发芽刺激剂。它们还促进与丛枝菌根真菌的共生相互作用,促进从土壤中吸收磷酸盐。此外,独脚金内酯抑制枝条分枝并刺激形成层活动和次生生长(见第 19 章)。独脚金内酯在根部具有类似的功能,它们可以减少不定根和侧根的形成,促进根毛的生长。在水稻中,类胡萝卜素 zaxinone 和 β-环柠檬酸与独脚金内酯来自相同的途径,已被证明可以改变根的生长和分枝。在森林和灌木丛火灾产生的烟雾中发现的 Karrikins 与独脚金内酯相似,可以刺激种子发芽(见第 17 章)。根际微生物群落还产生类胡萝卜素来改变多种植物的根系生长。
4.4 植物激素代谢和体内平衡
要成为有效信号,植物激素的浓度必须以细胞类型特异性和组织特异性的方式进行严格调节。 简单来说,任何给定组织或细胞中的激素浓度由其浓度增加率(例如,通过局部合成和激活或从植物其他部位导入)与其浓度降低率(例如,通过失活、降解、隔离或流出)之间的平衡决定(图 4.18)。 然而,激素水平的调节因许多因素而变得复杂。首先,初级激素生物合成途径可能通过次级生物合成机制得到增强。其次,一种激素可能有多种结构变体,其生物活性可能存在很大差异。最后,正如我们稍后将看到的,可能有多种从系统中去除活性激素的机制。
在本节中,我们讨论了局部(细胞或组织内)调节激素浓度的机制。我们将在第 4.5 节中介绍植物不同部位之间的激素运输。
正负因素协同作用,维持激素稳态。
吲哚-3-丙酮酸是生长素生物合成的初级中间体
IAA 在结构上与氨基酸色氨酸相关,主要在 ER 表面通过两步过程合成,其中色氨酸通过色氨酸氨基转移酶 (TAA) 转化为吲哚-3-丙酮酸 (IPyA) 作为中间体(图 4.19)。在生物合成途径的第二步中,被称为 YUCCAs (YUCs) 的黄素单加氧酶家族成员迅速将 IPyA 转化为 IAA。 YUCCA 酶因其增加的顶端优势、高大的花序和狭窄的上位叶而得名,这些特征与丝兰植物相似,当编码 YUCCA 酶的基因过表达时,在拟南芥中就会发现这些特征(图 4.20)。IAA 生物合成与快速分裂和生长的组织有关,尤其是在芽中。尽管几乎所有植物组织似乎都能产生低水平的 IAA,但芽顶端分生组织、幼叶和幼果是生长素合成的主要部位。在产生吲哚硫代葡萄糖苷防御化合物的植物中(见第 24 章),IAA 也可以通过以吲哚乙腈为中间体的途径从色氨酸合成(见网络附录 3)。在玉米籽粒中,IAA 似乎也可以通过非色氨酸依赖途径合成。
生长素在高细胞浓度下是有毒的,如果没有稳态控制,激素很容易积累到有毒水平。生长素可通过细胞质中和细胞质膜表面的生长素双加氧酶 (DAO) 的氧化降解分解代谢,从而确保当浓度超过最佳水平或对激素的反应完成时永久去除活性激素。Gretchen Hagen 3 (GH3) 酰胺合成酶家族催化 IAA 与细胞质中的氨基酸共价结合,并且通过该途径与 Glu 和 Asp 的结合也可以通过随后的 DAO 氧化导致信号活性永久降低。然而,IAA 的大多数氨基酰基结合物作为储存形式,可以从其中通过 ER 中的酶促过程快速释放 IAA。IAA 还可以通过吲哚-3-乙酸 O-甲基转移酶 1 (IAMT1) 可逆地转化为甲基-IAA。吲哚-3-丁酸 (IBA) 是一种在园艺中常用来促进插穗生根的化合物,它可在过氧化物酶体中通过 β-氧化迅速转化为 IAA。人们认为,游离和结合的 IBA 都是植物中天然存在的,可作为特定发育过程的生长素来源。在某些植物物种中,生长素还被证实与肽、复合聚糖(多个糖单元)或糖蛋白结合,但这些结合物的确切生理作用仍不清楚。图 4.21 显示了生长素的储存和分解代谢命运图。 (B) 不可逆(降解)
生长素在内膜区室(主要是 ER)中的隔离似乎也调节了可用于信号传导的生长素水平。大量的生长素结合蛋白 1 (ABP1) 主要存在于内质网腔中,而诸如“短”PIN -FORMED(PIN) 蛋白 (PIN5、6 和 8) 以及 PIN 样 (PIL) 蛋白等转运蛋白介导 IAA 跨内质网膜移动(图 4.22)。一些谷胱甘肽 S 转移酶可以结合生长素,并可能在细胞质中充当伴侣。如第 1 章所述,液泡内部在拓扑上位于细胞“外部”。进入酸性液泡的一些生长素预计将被质子化(不带电),因此很容易通过液泡膜扩散回细胞质中。然而,阴离子生长素由液泡膜转运蛋白 WALLS ARE THIN1 (WAT1) 从液泡中输出。另一种液泡膜蛋白 IBA1 转运蛋白 (TOB1) 已被证明可以将次要生长素吲哚丁酸从液泡中转移出来。
众所周知,外源施用的生长素具有毒性,尤其是对双子叶植物,这为合成生长素家族奠定了基础,例如 2,4-二氯苯氧乙酸 (2,4-D),它们长期以来一直被用作除草剂。导致生长素过度表达的突变如果没有对生长素水平进行稳态控制,往往会致命。
合成生长素作为除草剂比天然生长素更有效的原因是,合成生长素比天然生长素更少受到稳态控制(降解、结合、运输和封存)的影响。
合成激素用作植物生长调节剂来优化作物产量或用作除草剂来杀死杂草。人工激素对植物生长调节或除草剂的功效通常取决于剂量和施用时间。例如,合成生长素用于苹果园中的疏果,以确保剩余果实的大小将产生较高的市场价值。大多数消费者更喜欢大果实,因此,少量大果实通常比大量小果实更有利可图。相反,在播种作物种子前几周,通常在行栽作物田中使用合成生长素,如 2,4-D 和麦草畏。这种“烧毁”可确保土壤中的杂草种子在发芽期间死亡,不会与作物争夺光、水和养分。
赤霉素是由二萜贝壳杉烯氧化合成的
赤霉素在植物的不同部位合成,包括发育中的种子、萌发的种子、发育中的叶片和伸长的节间。生物合成途径始于质体,产生含有 20 个碳原子的线性(直链)前体分子,即法尼基法尼基焦磷酸或 GGPP,然后转化为 贝壳杉烯。该化合物被与 ER 相关的酶依次氧化,产生 GA12,这是迄今为止研究的所有植物中形成的第一个赤霉素。胞质溶胶中的双加氧酶能够将 GA12 氧化为途径中的所有其他赤霉素,这些途径可能以某种方式相互连接,从而形成复杂的代谢网络。
涉及赤霉素生物合成和分解代谢的途径受到严格的遗传控制。迄今为止,已描述了几种机制,包括通过称为 GA 2-氧化酶的酶家族使赤霉素失活、通过甲基转移酶进行甲基化以及与糖结合。这些途径的遗传调控在植物发育中起着重要作用。例如,正如我们将在第 18 章中看到的那样,KNOXI 基因在茎尖分生组织中的表达对于分生组织的正常功能至关重要,它通过抑制赤霉素生物合成和促进赤霉素失活来降低赤霉素水平。当细胞中的赤霉素超过阈值水平时,赤霉素生物合成也受到反馈抑制的调节。外源赤霉素的应用会导致GA20ox 和 GA3ox 基因的下调,其产物催化生物活性赤霉素(GA1 和 GA4)形成的最后两个步骤。赤霉素和赤霉素拮抗剂也被用作植物生长调节剂。例如,将 GA 施用于葡萄可以增加单个果实的大小。GA 拮抗剂烯效唑和多效唑可用于抑制 GA 生物合成。这些植物生长调节剂可用于降低玉米等植物的高度,减少倒伏,并在温室中减少园艺和观赏作物的节间和叶柄伸长。
细胞分裂素是具有异戊二烯侧链的腺嘌呤衍生物
细胞分裂素是腺嘌呤衍生物,最常见的一类细胞分裂素具有类异戊二烯侧链,包括异戊烯腺嘌呤 (iP)、二氢玉米素 (DHZ) 和高等植物中最丰富的细胞分裂素——玉米素。
细胞分裂素主要由质体中的 ADP/ATP 和二甲基烯丙基二磷酸 (DMAPP) 制成。图 4.24 显示了细胞分裂素生物合成途径的简化示意图。
图 4.24 细胞分裂素生物合成的简化生物合成途径。细胞分裂素生物合成的第一步是由异戊烯基转移酶 (IPT) 催化的,是将二甲基烯丙基二磷酸 (DMAPP) 的异戊烯基侧链添加到腺苷部分 (ATP 或 ADP)。iPRTP 或 iPRDP 分别由细胞色素 P450 单加氧酶 (CYP735A) 转化为 ZTP 或 ZDP,最终转化为玉米素。二氢玉米素 (DHZ) 细胞分裂素由各种形式的反式玉米素通过未知酶 (未显示) 制成。反式玉米素的核苷和核苷酸形式可以相互转化,并且可以通过 LONELY GUY (LOG) 家族的细胞分裂素核苷 5′-单磷酸磷酸水解酶从核苷中形成游离的反式玉米素。iPRDP,异戊烯基腺嘌呤核苷 5′-二磷酸;iPRTP,异戊烯基腺嘌呤核苷 5′-三磷酸;ZTP,反式玉米素核苷 5′-三磷酸;ZDP,反式玉米素核苷 5′-二磷酸。反式玉米素核苷
除了唯一活性形式的游离碱基外,细胞分裂素还以核苷(其中核糖附着于嘌呤环的 9氮)、核苷酸(其中核糖部分含有磷酸基团)或糖苷(其中糖分子附着于嘌呤环的3、7 或 9 氮,或附着于玉米素或二氢玉米素侧链的氧)的形式存在于植物中。除了这种糖基化介导的失活之外,活性细胞分裂素水平也通过细胞分裂素氧化酶的不可逆裂解而分解代谢降低。与其在促进细胞分裂中的作用一致,细胞分裂素是茎尖分生组织正常运作所必需的,因此受到严格调控(见第 18 章。在抑制赤霉素水平的同时,KNOX 基因表达通过上调细胞分裂素生物合成基因异戊烯基转移酶 7 (IPT7) 来增加茎尖分生组织中的细胞分裂素水平(见图 4.24)。
乙烯由蛋氨酸通过中间体 ACC 合成
几乎所有高等植物的部分都可以产生乙烯,尽管生产率取决于组织类型、发育阶段和环境输入。例如,某些成熟果实在乙烯反应中会发生呼吸爆发,乙烯成熟时这些果实中的水平会增加(见第 21 章)。乙烯来自蛋氨酸和中间体 S-腺苷甲硫氨酸,后者在阳循环中产生(图 4.25)。生物合成中第一个关键且通常限速的步骤是 S-腺苷甲硫氨酸通过酶 ACC 合酶转化为 1-氨基环丙烷-1-羧酸 (ACC)。然后,ACC 通过称为 ACC 氧化酶的酶转化为乙烯。ACC 直接作为苔藓中的信号化合物发挥作用,有证据表明 ACC 与被子植物中的谷氨酸样受体相互作用(见第 21 章)。由于乙烯是一种气态激素,因此没有证据表明乙烯在
,当生物合成被药理学中断时,乙烯会迅速从植物组织中扩散出来。
脱落酸由类胡萝卜素中间体合成
ABA 几乎在含有叶绿体或淀粉体的所有细胞中合成,并已在每个主要器官和组织中检测到。ABA 是一种 14 碳萜类化合物或倍半萜类化合物,在植物中通过 40 碳类胡萝卜素中间体的间接途径合成(图 4.26)。该途径的早期步骤发生在质体中。
类胡萝卜素被酶 NCED(9-顺式环氧类胡萝卜素双加氧酶)裂解是 ABA 合成中一个限速、高度受控的步骤,产生 14 碳前体分子黄素,随后进入细胞质,在那里一系列氧化反应将黄素转化为 ABA。 ABA-8′- 羟化酶进一步氧化导致 ABA 失活。ABA 也可以通过结合失活,但这是可逆的。两种类型的失活也受到严格监管。
在发育过程中或响应不断变化的环境条件时,ABA 浓度在特定组织中可能会发生剧烈波动。例如,在种子发育过程中,ABA 水平可以在几天内增加 100 倍,达到微摩尔范围内的平均浓度,然后随着成熟而下降到非常低的水平(见第 21 章)。在水胁迫(即脱水胁迫)条件下,叶片中的 ABA 可以在 4 到 8 小时内增加 50 倍(见第 15 章)。
油菜素类固醇来源于
甾醇菜油素类固醇
油菜素类固醇由植物甾醇菜油素类固醇合成,其结构与胆固醇相似。
与 ER 相关的细胞色素 P450 单加氧酶 (CYP) 酶家族成员催化油菜素类固醇生物合成途径中的大多数反应(图 4.27)。生物活性油菜素类固醇水平也受各种失活或分解代谢反应的调节,包括差向异构化、氧化、羟基化、磺化和与葡萄糖或脂质结合。然而,迄今为止,仅鉴定出少数负责油菜素类固醇分解代谢和失活的酶。
活性油菜素类固醇的水平也受油菜素类固醇依赖性负反馈机制的调节,其中激素浓度高于某个阈值会导致油菜素类固醇生物合成减少。这种衰减是由油菜素类固醇生物合成基因的下调引起的。晚期 C-6 氧化途径 图 4.27 简化的油菜素类固醇生物合成和分解代谢途径。油菜素类固醇生物合成的前体之一是菜油甾醇。(在该途径的不同分支中,胆固醇和谷甾醇也可以作为前体。)黑色箭头表示生物合成事件的顺序;实线箭头表示单个反应,虚线箭头表示多个反应。如图所示,蓖麻甾酮是油菜甾醇的直接前体,可通过两条平行途径合成:早期和晚期 C-6 氧化途径(更多详情可参见
全反式-β-胡萝卜素被 β-胡萝卜素异构体异构化为 9-顺式-β-胡萝卜素。 9-顺式-β-胡萝卜素被类胡萝卜素裂解双加氧酶裂解(在虚线红线处),产生胡萝卜素内酯。 独脚金内酯合成和信号传导的最后阶段发生在细胞质中。
以及参与油菜素类固醇分解代谢的基因的上调。因此,与野生型植物相比,对油菜素内酯反应能力受损的突变体会积累高水平的活性油菜素类固醇。
丙环唑是一种常用的杀菌剂,因为它能抑制细胞色素 P450 酶的活性,而细胞色素 P450 酶会在真菌病原体中合成结构固醇麦角固醇。当以较高浓度使用时,这种杀菌剂会降低草坪草和玉米的生长。这些观察结果导致人们发现,玉米 nana1 矮化和花性突变体(见图 4.16)缺乏油菜素类固醇的生物合成。
独脚金内酯由β-胡萝卜素合成
与脱落酸一样,独脚金内酯和其他脱辅基胡萝卜素信号分子由质体中的类胡萝卜素前体衍生,其途径一直保留到中间体胡萝卜素的合成。独脚金内酯等信号分子的合成始于类胡萝卜素前体的裂解(图 4.28)。多种细胞色素 P450 同工酶可产生独脚金内酯和类似的信号分子,这些分子因物种而异。类胡萝卜素裂解也可以通过非酶促氧化过程发生。独脚金内酯信号通路将在第 19 章中讨论。
4.5 植物内激素的运动
提供位置信息来调节细胞分化模式的激素被称为形态发生素。通过合成、运输和周转的组合,形态发生素分子在组织内达到分级分布,进而引起一系列浓度依赖性反应。到目前为止,我们已经研究了控制植物激素合成、周转和细胞内分布的机制。在本节中,我们将重点介绍激素在植物细胞、组织和器官之间的移动。亲脂性激素(如脱落酸和独脚金内酯)可以跨膜扩散,但在某些组织中,它们也由 ATP 结合盒亚家族 G (ABCG) 转运蛋白主动运输。例如,一种ABCG 蛋白将独脚金内酯从根尖运输到分化的根组织。 ABA 和细胞分裂素可以在木质部蒸腾流中长距离移动,最近有研究表明它们可以主动运输到根部的维管系统中。在根表皮中合成的赤霉素也可以通过硝酸盐/肽转运体 NPF3 被这些细胞吸收。生长素和细胞分裂素也可以随着韧皮部的源库流移动。最近的研究表明,主动运输机制控制着根维管组织中的赤霉素水平,导致这种生长激素在控制根伸长的扩张内皮细胞中积累。作为一种气态化合物,乙烯在脂质双层中的溶解度比在水相中更高,并且可以自由穿过质膜。相反,它的前体 ACC 是水溶性的,被认为是通过木质部运输到芽组织。目前尚不清楚油菜素类固醇是否具有内分泌或旁分泌活性。
油菜素类固醇似乎不经历从根到茎和从茎到根的易位,因为豌豆和番茄的实验表明,野生型与缺乏油菜素类固醇的突变体的相互砧木/接穗嫁接并不能挽救后者的表型。相反,油菜素类固醇信号传导和生物合成途径的成分在整个植物中表达,特别是在幼小的生长组织中。尽管植物中存在多种激素运输机制,但生长素是唯一一种明确显示通过高度受调控的矢量流发挥作用的植物激素。这些统称为极性生长素运输。
植物极性由极性生长素流维持
几乎所有植物都存在极性生长素运输,包括苔藓植物和蕨类植物。早期对这一现象的研究主要集中于幼苗向光性反应过程中顶端和表皮组织中的生长素运动(见第 17 章)。长距离极性生长素运输通过
维管组织从顶端组织和幼叶的合成位点到根尖的生长素运输调节茎的伸长、顶端优势和侧枝(见第 19 章)。在根尖重新定向到根表皮的生长素流是根重力反应所必需的(见第 17 章)。
极性生长素运输已通过放射性标记的生长素示踪剂测定和离散组织中生长素含量的质谱分析得到验证。最近,使用生长素报告基因报告单个细胞和组织中的相对生长素浓度已成为可视化完整植物中生长素水平的首选方法。最常用的报告基因基于 DR5,这是一种与报告基因融合的人工生长素反应启动子(其活性易于可视化)。 DR5 与 β-葡糖醛酸酶 (GUS) 的融合物被广泛使用(例如,见图 16.11 和 21.10),β-葡糖醛酸酶 (GUS) 在与发色底物(例如对硝基苯基 β-D-葡糖醛酸)一起孵育时会产生蓝色。然而,基于 DR5 的报告基因需要基因转录才能发挥作用,这会延迟对生长素的反应。更具活力的生长素报告基因 DII-Venus 基于黄色荧光蛋白变体与 AUX/IAA 生长素共受体蛋白的“降解子”部分的融合,该蛋白在存在生长素的情况下会迅速翻转(见本节后面的描述)。当存在生长素时,DII-Venus 会迅速降解。还开发了含有两个荧光蛋白的生长素报告基因,这两个荧光蛋白由一个生长素结合蛋白连接。例如,在 AuxSen 报告基因中,生长素与来自细菌色氨酸阻遏物的连接子结合会导致荧光共振能量从一个荧光蛋白转移到另一个荧光蛋白,从而提供细胞生长素水平的比率指示。按照惯例,从茎尖和根尖到根茎过渡区的生长素运输被称为基瓣流,而根部向下的生长素流动被称为顶瓣运输。由于这个术语可能令人困惑,一个较新的术语将术语根向运输分配给所有流向根尖的生长素,将术语向茎运输分配给任何远离根尖的方向流动。向茎部和向根部的极性生长素运输都是影响程序化和可塑性定向生长的主要机制。极性运输以细胞间方式进行,而不是通过共质体;也就是说,生长素通过质膜离开细胞,扩散穿过细胞壁,然后通过其质膜进入下一个细胞(图 4.29)。整个过程需要代谢能量,极性运输对 O2 缺乏、蔗糖耗竭和代谢抑制剂的敏感性就是明证。在某些组织中,极性生长素运输速度可超过 10 mm h-1,这比扩散速度快,但比韧皮部转运速度慢得多(见第 12 章)。极性运输特定于所有天然和一些合成生长素;其他弱有机酸、无活性生长素类似物和 IAA 结合物运输较差。尽管胚胎中的极性生长素浓度梯度似乎最初是由局部生长素合成建立的,但它们被质膜中的特定转运蛋白放大和延伸。利用质膜 ATPases 产生的质子梯度产生极性生长素流的细胞过程由生长素运输的化学渗透模型描述。
IAA 是一种弱酸 (pKa 4.75)。在质外体中,质膜 H+-ATPases 通常维持 pH 值为 5 至 5.5 的细胞壁溶液,15% 至 25% 的生长素存在于亲脂性、未解离的形式(IAAH)沿浓度梯度被动扩散穿过质膜。因此,生长素可以从任何一侧进入细胞。生长素的吸收通过 AUXIN1/LIKE AUXIN1(AUX1/LAX)存在于质外体中的两亲性阴离子 IAA 的二次主动运输(见第 8 章)加速。
AUX1 在质膜上的极化定位
发生在一些细胞中,例如原生韧皮部,但 AUX1 最重要的贡献是它在创建驱动极性生长素运输流的细胞汇中的作用。
拟南芥 aux1 突变体中的向射生长素流动完全被破坏,导致无重力根生长;在与侧根冠相关的启动子的控制下表达 AUX1 完全恢复了该突变体中的重力生长。化合物 1-萘氧基乙酸通常用作 AUX1/LAX 蛋白的生长素吸收活性的抑制剂。在缺氮条件下上调的 NRT1.1 和 1.5 硝酸盐转运蛋白也会运输生长素,从而增加根细胞的生长素吸收能力。
生长素流出 在胞质溶胶的中性 pH 值下,生长素的阴离子形式 IAA- 占主导地位。IAA- 向细胞外的运输是由细胞内的负膜电位驱动的。然而,由于膜的脂质双层不透阴离子,因此生长素从细胞中输出必须通过质膜中的转运蛋白进行。当 PIN 生长素流出载体蛋白处于极性定位时(即,仅存在于细胞一端的质膜上),生长素被吸收进入细胞,随后通过 PIN 流出,从而产生净极性运输(见图 4.29B)。PIN 蛋白家族以拟南芥 pin1 突变体形成的针状花序命名(图 4.30A)。不同的 PIN 家族成员介导每个组织中的生长素流出,pin 突变体在这些组织中表现出与此功能一致的表型。在 PIN 蛋白中,PIN1 是研究最多的,因为它对植物芽极性发育和器官发生的几乎每个方面都至关重要。 ATP 结合盒 (ABC) 整合膜转运蛋白大家族中的一组 ATP 依赖性转运蛋白可放大输出通量并阻止输出生长素的再吸收,尤其是在生长素浓度较高的小细胞中。拟南芥、玉米和高粱中 ABCB(ABC“B”类)基因缺陷会导致不同严重程度的矮化表型、重力倾向改变和生长素输出量减少(图 4.30B)。一般而言,ABCB 均匀分布在茎尖和根尖细胞的质膜上,而不是极性分布。但是,当特定的 ABCB 和 PIN 蛋白同时出现在细胞的同一位置时,生长素运输的方向性会增强; PIN 野生型 br2 L. Gälweiler 和 K. Palme 友情提供 图 4.30 与生长素流出蛋白缺失相关的表型。 (A) 拟南芥中的 PIN1。 (左) 免疫荧光显微镜下观察到拟南芥花序传导细胞基端的 PIN1 蛋白定位。 (右) 拟南芥的 pin1 突变体。 图 17.1B 中可以看到正常的野生型拟南芥植物。 (B) BR2 (Brachytic 2) 基因编码 ABCB 要求玉米中生长素正常运输的 br2 突变体节间较短。该突变体是使用 Mutator 转座子通过插入诱变产生的。研究人员不知道的是,Mu8 转座子含有 BR2 基因的一个片段。BR2 基因片段的表达产生了干扰 RNA (RNAi),从而沉默了 BR2 的表达(见第 3 章)。br2 突变体具有紧凑的下茎(中间和右侧),但雄穗和穗(左侧和中间)正常。
萘基邻苯二甲酰胺 (NPA) 与 ABCB 生长素运输蛋白及其调节剂结合,并用作 ABCB 和 PIN 生长素流出活性的抑制剂。
生长素运输受多种机制调节
正如预期的那样,对于如此重要的功能,
生长素运输受转录和转录后机制的调节。编码在生长素代谢(见 WEB 附录 2)、信号传导和运输中起作用的酶的基因受发育程序和环境线索的调节。几乎所有已知的植物激素都会影响生长素运输或生长素依赖性基因表达。生长素本身调节编码生长素转运体的基因的表达,以增加或减少其丰度,从而调节生长素水平。与许多信号转导途径一样,生长素转运体的磷酸化是一种关键的调节机制。例如,AGC 激酶 D6PK 激活 PIN 蛋白子集的生长素转运活性,而向光素 1 感光体激酶使 ABCB19 在向光反应中的流出活性失活(见第 17 章)。膜组成和细胞壁结构也调节转运蛋白活性,因为 PIN1 和 ABCB19 在质膜中的定位都依赖于结构固醇或鞘脂,而 PIN1 极性定位在拟南芥的纤维素合酶缺陷突变体中被消除。此外,一些天然化合物,主要是黄酮类化合物,可作为生长素流出抑制剂。黄酮类化合物可作为活性氧 (ROS) 清除剂,并且是一些金属酶、激酶和磷酸酶的抑制剂。它们对生长素运输的影响似乎主要来自这些活动。调节生长素转运蛋白进出质膜的细胞运输在植物发育中起着特别重要的作用。特定的伴侣蛋白是成功将生长素转运蛋白引导至质膜所必需的。例如,AXR4 蛋白调节 AUX1 的运输,而免疫亲和素样蛋白 TWISTED DWARF 1(以拟南芥中 twd1 突变体的表型命名)调节多种 ABCB 生长素转运蛋白的折叠和运输到质膜。但在胚胎发育过程中,调节极性生长素运输的最重要的细胞运输过程是指导 PIN1 外排转运蛋白极性定位的过程。荧光蛋白报告基因(如 DR-GFP/RFP 和 DII-Venus)已用于研究微观生长素浓度梯度如何通过 PIN1 的矢量定位得到加强,从而在胚胎发育过程中形成定向生长素运输流。换句话说,通过建立运输蛋白和维管组织,生长素的小方向流动被放大和稳定,这些运输蛋白和维管组织的结构可保持生长素向生长组织的定向流动。生长素报告基因已通过与其他生长素测量方法的比较得到广泛验证,如表 4.1 中总结的那样。PIN 生长素外排蛋白的极性定位被认为涉及四个过程:● 初始各向同性(无方向)运输到质膜。多种实验方法表明,PIN 向质膜的运输涉及保守的分泌过程(见第 1 章)。表 4.1 用于测定植物中生长素水平的方法
指示生长素依赖性
反应的位置,但报告活性在某些情况下可能受到其他因素的限制;
这些可能是人工启动子
(DR5、DII-Venus)或与生长素
反应基因启动子的融合
●“转胞吞”和极化
plas 中的浓度ma 膜域。在根部成熟表皮细胞中,PIN2 也观察到了这一过程,但这一过程尚未得到很好的表征,似乎也不是由生长素积累引起的。此外,与 PIN1 相比,PIN2 极性定位的动态性和生长素敏感性要低得多,被认为主要由发育编程决定。在胚胎发生过程中观察到的 PIN1 和 PIN7 与生长素梯度的极性排列被认为是胞吞作用的结果,但迄今为止,这尚未在亚细胞水平上得到证实。PIN 的极性定位和活性需要 D6PK 和 PINOID AGC 激酶的活性。PINOID 这个名字源于拟南芥 pinoid 和 pin1 突变体表型的相似性。● 通过与细胞壁相互作用实现稳定。基因或药理学破坏细胞壁生物合成导致拟南芥中 PIN1 极性完全丧失。
● 在发育过程中,一组 AGC 激酶对 PIN1 上的多个位点进行组合磷酸化,从而调节和微调生长素流出。
4.6 激素信号通路
激素作用位点是具有特定受体的细胞,这些受体可以结合激素并启动信号转导级联。植物利用大量受体激酶和信号转导激酶来引起激素靶细胞的生理反应。在本节中,我们将研究与每种主要植物激素相关的受体类型和信号转导通路。
细胞分裂素和乙烯信号转导途径源自细菌的双组分调节系统
在细菌中,双组分调节系统是介导对环境刺激的广泛反应的重要信号系统。该信号系统的两个组成部分包括膜结合组氨酸激酶传感蛋白和可溶性反应调节蛋白(图 4.31A)。传感蛋白接收输入信号,在组氨酸残基上进行自身磷酸化,并通过将磷酸基转移到反应调节器上保守的天冬氨酸残基上,将信号传递给反应调节器。磷酸化激活的反应调节器(其中许多起转录因子的作用)随后引起细胞反应。传感蛋白有两个结构域,一个输入结构域,用于接收环境信号,另一个传递结构域,用于将信号传输到反应调节器。反应调节蛋白也具有两个结构域,一个接收结构域,接收来自传感蛋白的发射结构域的信号,另一个输出结构域,介导反应。
这种简单的细菌双组分系统的修饰存在于由植物激素细胞分裂素和乙烯激活的信号转导途径中。细胞分裂素信号传导由磷酸化中继系统介导,该系统由跨膜细胞分裂素受体、磷酸转移蛋白和核反应调节器组成(图 4.31B)。拟南芥中的细胞分裂素受体称为 CRE1、AHK2 和 AHK3,其氨基酸序列与双组分系统中的组氨酸激酶相关。然而,这些细胞分裂素受体被描述为杂交传感器组氨酸激酶,因为它们既包含细菌传感器输入和组氨酸激酶(传递)结构域,又包含细菌反应调节蛋白的接收结构域。
最初细胞分裂素受体被假设位于质膜中,这反映在配体结合结构域的名称中,即环化组氨酸激酶相关传感细胞外膜(CHASE)。然而,拟南芥和玉米的大多数细胞分裂素受体实际上位于内质网膜中,其中 CHASE 结构域位于内质网腔中,而传递和接收结构域位于细胞质中(图 4.32)。细胞分裂素与其受体的 CHASE 结构域结合,触发传递域上组氨酸残基的自身磷酸化,随后将相同的磷酸基转移到接收域上的天冬氨酸残基。然后磷酸基转移到拟南芥组氨酸磷酸转移 (AHP) 蛋白。新磷酸化的 AHP 充当信号中间体,通过将磷酸基转移到 ARR 接收域上的天冬氨酸,将膜感知的细胞分裂素信号传输到核定位反应调节器(称为 ARABI DOPSIS 反应调节器或 ARR)(见图 4.32)。ARR 的这种磷酸化会改变其活性,从而引起细胞反应。ARR 反应调节器由多基因家族编码。它们分为两个基本类别:A 型 ARR 基因,其产物仅由接收域组成;B 型 ARR 基因,其产物还包括一个包含 DNA 结合转录本的输出域tion 激活位点(见图 4.32)。A 型 ARR 通过与其他蛋白质相互作用,以依赖于 A 型 ARR 的磷酸化状态的方式对细胞分裂素信号进行负向调节。B 型 ARR 由磷酸化激活,这使它们能够调节一组靶基因(包括编码 A 型 ARR 的基因)的转录,从而引起与细胞分裂素反应有关的细胞变化。一个称为 KISSME DEADLY (KMD) 的 F-box 蛋白家族通过 E3 泛素连接酶复合物 SCFKMD 靶向 B 型 ARR 蛋白进行降解,从而负向调节细胞分裂素反应。
乙烯受体由一个多基因家族编码(在拟南芥中为 ETR1、ETR2、ERS1、ERS2 和 EIN4),其也与细菌双组分组氨酸激酶在进化上相关。然而,拟南芥中只有两种乙烯受体(ETR1 和 ERS1)具有内在组氨酸激酶活性,而且这种活性似乎在信号传导中不起重要作用。与细胞分裂素信号传导相比,乙烯信号传导途径不涉及磷酸化传递系统。乙烯受体位于 ER 膜上,与两种下游信号传导蛋白相互作用,即CTR1(即组成性三重反应1,constitutive triple response1) 和EIN2(图 4.33)。 CTR1 是一种可溶性丝氨酸/苏氨酸激酶,它总是与乙烯受体物理相关。EIN2 是一种 ER 跨膜蛋白,具有胞质 C 末端结构域,是 CTR1 激酶活性作用的靶点。乙烯不敏感 3 (EIN3)/乙烯不敏感类 (EIL) 家族的转录因子需要由EIN2来稳定,这些转录因子可激活乙烯反应基因的转录。
乙烯受体作为负调节因子发挥作用,在没有激素的情况下主动抑制激素反应。在没有乙烯的情况下(当受体“开”时),乙烯受体激活 CTR1 激酶,然后直接磷酸化失活EIN2 失活,EIN2 被泛素化并在蛋白酶体中降解(见图 4.33)。因此,活性 CTR1 也是乙烯反应途径的负调节因子。
当乙烯与内质网腔侧乙烯受体的 N 端跨膜结构域结合时,受体失活,CTR1“关闭”。这导致 EIN2 被一种尚未鉴定的磷酸酶去磷酸化,并且随后其胞质 C 端被未知蛋白酶蛋白水解切割。CTR1 与 EIN2 和类似蛋白质的相互作用也调节受体的稳定性,以确保乙烯反应机制能够快速重置。在乙烯存在下,切下的EIN2 C端与 乙烯结合 FBOX 1 和 2 (EBF1/2) mRNA 的 3′ 非翻译区结合,使其靶向 P 体(参见第 3 章)进行降解。这阻止了 EBF1/2 激活 EIN3/EIL 通过蛋白酶体降解。释放的 EIN2C 端结构域迁移到细胞核中,在那里它与 EIN2 相关蛋白 1 (ENAP1) 相互作用,共同激活 EIN3。ENAP1 与染色质相关,其与 EIN2 C 端结构域的结合通过增加组蛋白乙酰转移酶 (HAT) 对与转录激活相关的 H3K23 乙酰化位点的访问来促进乙烯反应基因处的 EIN3 活性(参见第 3 章)。在乙烯抑制基因的启动子中,ENAP1、EIN3 和 EIN2 C 端之间的相互作用会募集 SRT1/2 组蛋白去乙酰化酶 (HDAC) 以去乙酰化其 H3K9,从而抑制转录。通过这种方式,EIN2 C 端可以稳定并激活EIN3 。取决于启动子序列,乙烯调节基因的转录通过与 EIN3/EIL 转录因子的相互作用而被诱导或抑制。乙烯反应因子 1 (ERF1) 和其他转录因子的激活可调节第二级乙烯反应,从而引起植物细胞对乙烯反应功能的众多变化。
受体样激酶介导油菜素类固醇和某些生长素信号通路
最大的植物受体激酶类由受体样丝氨酸/苏氨酸激酶 (RLK) 组成。
许多 RLK 定位于质膜,作为跨膜蛋白,含有细胞外配体结合结构域和细胞质激酶结构域,通过磷酸化靶蛋白的丝氨酸或苏氨酸残基将信息传递到细胞内部。一些 RLK 还被证实能磷酸化酪氨酸残基。已鉴定出几种 RLK 的配体,包括由生物相互作用物产生的化学信号以及内源性植物激素,如油菜素类固醇、生长素和肽类激素。RLK 介导的油菜素类固醇信号通路结合了信号放大和阻遏物失活策略,将细胞外油菜素类固醇激素信号转化为转录反应。简而言之,油菜素内酯与质膜中的油菜素类固醇受体激酶油菜素类固醇不敏感 1 (BRI1) 结合会触发磷酸化级联反应,导致阻遏蛋白油菜素类固醇不敏感 2 (BIN2) 失活。这导致转录因子 BRI1-EMSSUPPRESSOR1 (BES1) 和 BRASSINAZOLE-RESISTANT 1 (BZR1) 的激活以及随后的基因表达(图 4.34)。
BRI1 受体属于 RLK 的质膜亮氨酸富集重复序列 (LRR) 亚家族,包含一个结合油菜素内酯的 N 端胞外结构域、一个跨膜结构域和一个对酪氨酸、丝氨酸或苏氨酸残基具有特异性的胞质激酶结构域(见图 4.34)。与油菜素内酯结合后,BRI1 的同型二聚体被激活并与 RLK BRI1 相关受体激酶 1 (BAK1) 进行异源寡聚化(见图 4.34);两种 RLK 在激活过程中都会发生自磷酸化和转磷酸化。在没有油菜素内酯结合的情况下,BRI1 与 BRI1-激酶抑制剂 1 (BKI1) 相互作用,从而阻止与 BAK1 的结合。BRI1 激活后,BKI1 从质膜释放,BRI1 和 BAK1 二聚化,BRI1 磷酸化并激活 BR 信号激酶 (BSK) 和组成性差异生长 1 (CDG1)。当这些质膜锚定受体样细胞质激酶被激活时,它们会磷酸化并激活丝氨酸/苏氨酸磷酸酶 BRI1 抑制酶 1 (BSU1)。这反过来又会使阻遏蛋白 BIN2 失活。 BIN2 是一种丝氨酸/苏氨酸蛋白激酶,在缺乏油菜素内酯的情况下,它通过磷酸化负向调节密切相关的转录因子 BES1 和 BZR1。活性 BIN2 对 BES1/BZR1 的磷酸化至少具有两种调节作用。首先,BIN2 介导的转录因子磷酸化阻止它们穿梭到细胞核,并导致它们滞留在细胞质中。其次,磷酸化阻止 BES1/BZR1 与靶启动子结合,从而阻止它们作为转录调节因子的活性。在油菜素内酯存在的情况下,活化的磷酸酶 BSU1 使 BIN2 去磷酸化并促进其通过 26S 蛋白酶体系统降解,从而关闭其活性(参见图 4.34B 中的步骤 5 和 6)。然后,BES1 和BZR1 被蛋白磷酸酶2A (PP2A) 去磷酸化,BES1 和 BZR1 的活性形式进入细胞核,在那里调节油菜素内酯反应基因的表达(见图 4.34B)。
核心 ABA 信号成分包括磷酸酶和激酶
除了蛋白激酶外,蛋白磷酸酶(从蛋白质中去除磷酸基团的酶)在信号转导途径中起着重要作用。一个描述得很好的例子是PYR/PYL/RCAR 依赖的激素 ABA 信号转导途径。START(甾体激素急性调节蛋白相关脂质转移)结构域蛋白超家族的成员 PYR/PYL/RCAR ,包含预测的疏水性配体结合口袋,构成核心 ABA 信号转导途径的初始步骤。该亚家族的 14 个成员已在拟南芥中被鉴定。它们的命名反映了它们的发现:PYRABACTIN RESISTANCE1 (PYR1) 表示其突变体对合成的磺酰胺化合物 pyrabactin 具有抗性,该化合物模拟 ABA 作用;PYR1-LIKE (PYL);和 ABA 受体的调节成分(RCARs)。
PYR/PYL/RCAR 蛋白亚家族在从真双子叶植物到苔藓植物中都保持保守,这些蛋白质位于细胞质和细胞核中。它们以 ABA 依赖的方式与 PP2C 磷酸酶相互作用,以调节蔗糖非发酵相关激酶 2 (SnRK2) 家族的丝氨酸/苏氨酸蛋白激酶的下游活性。在没有 ABA 的情况下,这些 PP2C 会与 SnRK2 的 C 末端结合,并通过从激酶域内称为活化环的区域去除磷酸基团来阻断 SnRK2 激酶活性(图 4.35A)。由于 PP2C 的同一结构域不是与受体就是与激酶相互作用,这些相互作用对于单个 PP2C 亚型来说是互斥的。ABA 结合会改变 PYR/PYL/RCAR 受体的构象,从而允许或增强与 PP2C 的相互作用,从而抑制 PP2C 磷酸酶活性。这将 SnRK2 激酶从抑制中释放。然后,SnRK2 蛋白可以自由地磷酸化它们的许多靶蛋白,包括调节气孔孔径的离子通道 、结合 ABA 的响应元件基因启动子的转录因子,从而活化ABA响应基因的表达(图 4.35B)。因此,ABA 信号转导基于逆转 PP2C 蛋白磷酸酶和 SnRK2 激酶活性之间的平衡。正如对生长素受体的描述,受体和 PP2C 的表达差异以及它们对 ABA 和彼此的亲和力的差异允许对不同细胞类型中各种 ABA 浓度做出不同的反应。
这些相同的 PP2C 还与参与细胞 ABA 反应的其他蛋白质相互作用,包括其他蛋白激酶、Ca2+ 传感器蛋白、转录因子和离子通道,可能通过去磷酸化特定的丝氨酸或苏氨酸残基来调节它们的活性。PYR/PYL/RCAR 依赖性信号通路在响应 ABA 的气孔关闭中起主要作用,这将在第 15 章中讨论。
植物激素信号通路通常采用负调控
大多数信号转导途径最终通过诱导选定靶基因表达的变化来引发生物反应。大多数动物信号转导途径通过激活一系列正调节因子来诱导反应。相反,大多数植物转导途径通过灭活阻遏蛋白来诱导反应。例如,乙烯与 ETR1 结合会导致阻遏物 CTR1 分离并激活转录因子 EIN3(见图 4.33)。同样,油菜素类固醇与受体激酶 BRI1 结合会导致阻遏蛋白 BIN2 失活,从而激活转录因子 BES1 和 BZR1(见图 4.34B)。
为什么植物细胞进化出基于负调节而不是动物细胞中看到的正调节的信号通路?采用负调节剂的信号转导途径的数学建模表明,负调节剂会导致下游反应基因的更快诱导。反应速度,特别是对干旱等环境压力的反应速度,可能对固着植物的生存至关重要。因此,在大多数情况下,植物采用负调节信号通路很可能在进化过程中赋予了选择优势。
植物细胞中描述了几种不同的分子机制来灭活阻遏蛋白:
这些包括去磷酸化以调节阻遏物活性、将阻遏物重新定位到另一个细胞区室以及阻遏蛋白的降解。
如前所述,油菜素类固醇途径利用蛋白质去磷酸化来灭活阻遏蛋白 BIN2(见图 4.34)。
几种植物激素受体包括泛素化机制的组成部分,并通过蛋白质降解介导信号传导。
蛋白质降解作为一种抑制激素反应抑制剂的机制,首次作为为生长素信号通路的一部分被描述。从那时起,泛素-蛋白酶体途径已被证明是大多数(如果不是全部)激素信号通路的核心。简而言之,一种称为泛素的小蛋白质首先被一种称为 E1 泛素活化酶的酶以 ATP 依赖的方式激活(图 4.36A;另见图 1.17)。泛素标签被转移到称为 E2 泛素结合酶的第二种酶上。然后,该酶与一类大型蛋白质复合物(称为 S 期激酶相关蛋白 1 (Skp1)/Cullin/F-box (SCF) 复合物)结合,该复合物可作为 E3 泛素结合蛋白n 连接酶。上标术语应用于 E3 连接酶名称(例如 SCFTIR1),以指示复合物包含哪种 F-box 蛋白。在特定的 SCF 蛋白复合物中,Skp1 和 Cullin 成分缩写为全部大写(例如拟南芥 SKP1 和 CULLIN),因为它们是由特定基因编码。 F-box 蛋白通常会将靶蛋白招募到 SCF 复合物中,这样它们就可以被 E3 连接酶标记上多个泛素副本(见图 4.36A)。这种多泛素化可作为标记物,使蛋白质被 26S 蛋白酶体降解,26S 蛋白酶体是一种大型多蛋白复合物,可降解泛素标记的蛋白质。在植物中,F-box 基因家族已大大扩展到数百个基因,据推测参与降解了类似数量的不同靶标。例如,先前描述的 KMD 蛋白作为 SCFKMD E3 泛素连接酶复合物的一部分发挥作用,并直接与 B 型 ARR 蛋白相互作用,以负向调节细胞分裂素信号通路(见图 4.32)。这些 F-box 蛋白中有几种是激素受体复合物的组成部分,在许多激素信号通路中,降解的目标蛋白是转录抑制因子(图 4.36B 和 C)。这发生在生长素、JA-Iles 和赤霉素(所有小分子有机酸)的信号通路中,表明共同机制适应特定信号。在生长素信号通路中,生长素受体基因家族 TIR1/AFB1-5 中的基因编码 SCF 复合物的 F-box 成分,该复合物在降解生长素/吲哚-3-乙酸 (AUX/IAA) 抑制生长素反应基因转录的因子中发挥作用(图 4.37A)。生长素反应基因通常具有位于其启动子区域的生长素反应元件 (AuxRE) 结合位点。生长素反应因子 (ARF) 是转录因子,它们结合到这些 AuxRE 基序并抑制或激活转录(见图 4.37A)。当生长素浓度较低时,AUX/IAA 阻遏蛋白与 ARF 形成异二聚体,从而抑制转录激活。AUX/IAA/ARF 复合物还通过与 TOPLESS (TPL) 蛋白相互作用招募染色质重塑因子。TPL 招募组蛋白去乙酰化酶 (HDAC) 以维持染色质处于转录非活性状态。在生长素存在的情况下,AUX/IAA 阻遏物被招募到 TIR1/AFB 受体复合物中,并被泛素标记,以便被 26S 蛋白酶体降解(见图 4.36B)。这使得 ARF 能够二聚化甚至寡聚化,并通过募集组蛋白乙酰转移酶 (HAT) 激活基因转录。因此,TIR1 和 AUX/IAA 充当生长素共受体,生长素充当“分子胶”来促进 AUX/IAA 的泛素化和降解。该途径的许多靶基因包括编码生长素代谢酶和 AUX/IAA 阻遏物的基因,它们最终反馈给系统以降低活性生长素水平并终止 ARF 依赖性信号传导。TPL 还可以直接与缺乏 AUX/IAA 相互作用域但具有生长素结合位点的专门 ARF (ARF3/ETTIN) 相互作用。当生长素与 ARF3/ETTIN 结合时,TPL 解离,转录被解除抑制。这是唯一已知的生长素促进转录而不泛素化和 AUX/IAA 阻遏蛋白降解的情况。茉莉酸和赤霉素还促进 SCF 泛素 E3 连接酶的 F-box 蛋白与其转录阻遏靶蛋白之间的相互作用(图 4.37B 和 C)。F-box 蛋白 CORONATINE-INSENSITIVE1 (COI1) 起 JA-Ile 受体的作用。与生长素一样,JA-Ile 促进 COI1 与 JA-Ile 诱导基因表达的阻遏物(称为 JA-ILE ZIM-DOMAIN (JAZ) 蛋白)之间的相互作用(见图 4.37B),从而靶向 JAZ 蛋白进行降解。与 AUX/IAA 蛋白类似,JAZ 阻遏蛋白抑制茉莉酸反应基因的转录,但在这种情况下,它通过与 TPL 和一种新型相互作用蛋白 NINJA 相互作用,结合并抑制碱性螺旋-环-螺旋 (bHLH) MYC 转录因子。JA-Ile 诱导的 JAZ 阻遏蛋白的泛素依赖性降解导致这些转录因子的释放和激活,从而触发茉莉酸反应基因表达的诱导。赤霉素信号传导也涉及 SCF 复合物的成分(见图 4.37C)。然而,赤霉素受体 GIBBERELLIN INSENSITIVE DWARF 1 (GID1) 本身并不作为 F-box 蛋白发挥作用。相反,当 GID1 与赤霉素结合时,受体会发生构象变化,从而促进 DELLA 阻遏蛋白的结合(见图 4.36C)。这反过来又会诱导 DELLA 蛋白的构象变化,并促进 GID1 结合的 DELLA 与 SCFSLY1 相互作用,SCFSLY1 是拟南芥中的一种 E3 泛素连接酶,含有 F-box 蛋白 SLY1(见图 4.36C)。实际上,赤霉素受体 GID1 与 DELLA 阻遏蛋白的结合会通过 F-box 蛋白 SLY1 触发后者的泛素化,随后 26S 蛋白酶体会降解 DELLA 蛋白。 DELLA 降解会导致光敏色素相互作用因子 (PIF) 转录因子(如 PIF3 和 PIF4)以及其他 bHLH 转录因子的释放和激活,从而引发基因表达的变化。在另一个例子中,DELLA 降解会导致 α-淀粉酶基因表达的转录激活因子表达增加;α-淀粉酶活性是发芽过程中淀粉降解所必需的(参见 WEB 主题 17.6)。正如此处的讨论所表明的那样,生长素、JA-Ile 和赤霉素通过直接针对核定位抑制蛋白的稳定性来发出信号,从而诱导转录反应。这种短信号转导途径为核基因表达的快速变化提供了手段。但是,没有信号放大的机会,就像涉及激酶级联或第二个
在生长素信号传导中起作用的 ARF 和 AUX/IAA 蛋白的结构特征已通过 X 射线晶体学确定,并反映在图中。JAZ 阻遏蛋白的结构特征仅部分已知。(C)相比之下,赤霉素还需要一个单独的受体蛋白 GID1 来形成 SCFSLY1 和 DELLA 阻遏蛋白之间的复合物。在这三种情况下,添加多个泛素(多泛素)标记了抑制蛋白的降解。这会触发 ARF、MYC2 和 PIF3/4 转录因子的激活,导致生长素、JA-Ile 和赤霉素诱导的基因表达变化。信号转导途径的组织可能有助于解释为什么需要相对高浓度的生长素和赤霉素等信号才能引起生物反应。 4/29/22 9:48 AM 04_Taiz7e-Ch04.indd 142 信号和信号转导 143 (B) 茉莉酸反应 JAZ 抑制蛋白抑制 MYC2 转录因子,TPL/NINJA 募集组蛋白去乙酰化酶。转录激活。 JAZ 阻遏物被活化的受体 SCFCOI1 泛素化。
可以说,关闭信号反应的能力与启动信号的能力同样重要。植物通过各种机制终止信号。
如前所述,化学信号(如植物激素)可以通过氧化或与糖或氨基酸结合而降解或失活。
它们还可以被隔离到其他细胞区室中,以在空间上与受体分离。
通过磷酸化激活的受体和信号中间体可以通过磷酸酶介导的去磷酸化灭活。例如,MAP激酶途径的活化成分被MAP激酶磷酸酶灭活,从而确保细胞对MAP激酶介导的信号传导的持续时间和强度进行严格控制(见图4.4)。同样,离子转运蛋白和细胞清除剂可以快速降低第二信使的升高浓度以关闭信号放大。正如我们所见,蛋白质降解为植物细胞提供了另一种机制来调节信号转导途径关键成分(如受体或转录因子)的丰度。反馈调节代表了另一种用于减弱反应的关键机制。例如,编码 AUX/IAA 生长素抑制蛋白的 AUX/IAA 基因在其启动子区域具有生长素反应元件结合位点。因此,AUX/IAA 蛋白可以结合到其自身基因的启动子上并抑制其自身的表达。当生长素信号传导触发 AUX/IAA 抑制因子的降解时,随后的生长素反应基因转录会导致 AUX/IAA 蛋白的替换,从而导致反应减弱或终止(见图 4.37A)。激素信号传导途径通常受到几个负反馈调节环的影响。赤霉素途径很好地说明了这一点(图 4.38)。生物活性赤霉素(GA4 在这个赤霉素(例如)是通过涉及多种酶催化反应的复杂生物合成途径合成的。该途径中的最后两种酶由 GA20ox 和 GA3ox 基因家族的成员编码。如图 4.38 所示,在没有赤霉素的情况下,DELLA 转录调节因子促进编码 GA20ox 和 GA3ox 酶的基因的表达,从而导致赤霉素生物合成增加。同时,DELLA 抑制编码赤霉素分解代谢酶 GA2ox 的基因的表达,从而导致赤霉素降解减少。由于 DELLA 的这两种作用,赤霉素浓度增加。在存在赤霉素的情况下,DELLA 蛋白被蛋白酶体途径降解。结果,赤霉素生物合成减少,赤霉素分解代谢增加。因此,赤霉素会负面调节其在细胞中的浓度。这些正反馈和负反馈回路有助于确保在植物发育过程中保持适当的赤霉素水平和反应。光通过核时钟蛋白 GIGANTEA (GI) 进一步调节 GA 反应。GI 是植物昼夜节律时钟的组成部分(见第 19 章),并调节多种信号机制,包括感知光合作用产生的糖。GI 的丰度随着白天的推移而增加,并在夜间下降。由于 GI 稳定了 DELLA 阻遏物,并且 GI-DELLA 相互作用在黑暗开始时得到增强,因此 GA 反应基因的表达在一天结束时和大部分夜晚受到高度抑制。随着日照的临近,这种影响会减弱。这种调节确保 GA 调节的下胚轴生长发生在有光合产物等资源可用时。GI 表达的时间因拟南芥生态型及其采集纬度而异。这表明 GI 的作用是优化与日照长度和生长季节相关的生长。细胞对信号的响应输出通常是组织特异性的。许多环境和内源信号可以触发各种通常高度多样化的植物反应。通常,特定的组织或细胞类型在暴露于信号时不会显示整个潜在响应范围,而是表现出不同的响应特异性。例如,植物激素生长素促进生长中的地上组织细胞扩张,同时抑制根部细胞扩张。它引发根周鞘细胞亚群的侧根起始,诱导茎尖分生组织中的叶原基,并控制发育中植物器官的维管分化。组织和细胞的发育环境如何决定对一个简单信号的如此不同的反应?如上所述,生长素信号转导涉及生长素依赖性的 TIR1/AFB 受体和 AUX/IAA 抑制蛋白的相互作用,导致 AUX/IAA 降解并释放 AUX/IAA 介导的 ARF 转录因子活性抑制(见图 4.37A)。所有这些信号成分均由多基因家族编码(在拟南芥中有 6 个 TIR1/AFB 基因、29 个 AUX/IAA 和 23 个 ARF),并具有不同的表达模式、生化特性和生物学功能。这些成分在植物体内的表达位置、表达程度、结合亲和力的强度以及它们所经历的细胞生长素水平都会影响最终生长素反应的形状。例如,虽然看起来所有 TIR1/AFB 都可能以生长素依赖的方式与许多不同的 AUX/IAA 相互作用,但并非所有这些蛋白质都在所有细胞类型中表达。此外,生长素促进这些相互作用的剂量因受体/抑制剂组合的不同而有很大差异,因此一些 TIR1/AFB–AUX/IAA 复合物在非常低的生长素浓度下形成,而其他复合物则需要高得多的生长素水平才能稳定地相互作用。在叶原基和花雌蕊中,ARF3 调节生长素依赖性极性发育,而无需 AUX/IAA 相互作用。差异敏感性和表达也可能是实现其他激素信号转导途径组织特异性的机制,其中受体或其他信号传导成分由多基因家族编码。激素反应受其他内源分子调节我们对植物激素信号的了解很大一部分来自涉及药理激素模拟物和抑制剂的实验。在某些情况下,模拟物或抑制剂已用于识别作为潜在激素受体的结合蛋白。在其他情况下,药物已被用于操纵信号通路,以促进识别对激素作用至关重要的酶、转运体和受体。除了主要的激素除了本文所述之外,还有许多其他植物化合物可作为信号传导过程的调节剂。在某些情况下,结构类似于主要激素的分子可以作用于特定细胞类型的受体,产生类似于相关激素的作用。这种现象在衍生自产生脱落酸和独脚金内酯的相同生物合成途径的类胡萝卜素化合物中观察到。分子
结构上与激素相似的激素也可能竞争激素转运蛋白或结合位点。例如,一些苯丙烷类化合物,如反式肉桂酸,似乎以这种方式调节生长素的运输和反应。其他分子可能保护信号分子免于氧化或周转,正如在内源性黄酮醇和黄酮醇单糖苷存在下生长素的非酶氧化减少所见。最后,一些分子可能会影响细胞环境的变化,从而改变激素途径调节成分的活性。由于特定于该谱系的选择压力,许多这些化学调节剂在植物的一个子集中具有更明显的活性。
植物使用电信号进行组织间通信
尽管植物缺乏神经系统,但它们确实使用长距离电信号在植物体相距较远的部分之间进行通信。植物中最常见的电信号类型是动作电位,即由电压门控离子通道产生的细胞质膜的瞬时去极化(见第 8 章)。动作电位已被证明可以介导敏感植物(含羞草;见第 24 章)的触觉诱导小叶闭合,以及捕蝇草的快速闭合(~0.1 秒),当昆虫触碰捕蝇草叶近轴侧的触觉敏感触发毛时(图 4.39A)每次触碰触发毛都会被机械敏感受体检测到,从而激活初始 Ca2+ 流入和以 K+ 流出为特征的动作电位(电信号)。为了避免意外触发捕蝇草闭合,必须在 20 秒内触碰两根触发毛,或者必须快速连续触碰一根触发毛两次,以达到阈值 Ca2+ 水平(图 4.39B)。
总共需要五个动作电位来刺激茉莉酸信号传导,并由此产生消化酶和消化猎物的“绿胃”的其他成分。
研究表明,电信号可以促进植物远程部分之间对各种压力的快速通信,这表明电信号是植物的一般生理特征。正如我们将在第 24 章中讨论的那样,电信号可以通过脉管系统在整个植物中传播,以响应咀嚼昆虫造成的损伤。然而,与动物神经系统不同,植物缺乏通过神经递质分泌将电信号从一个神经元传递到另一个神经元的突触,信号传播速度要慢得多。植物维管系统中电信号传输的机制仍不甚明了。
交叉调节使信号转导途径得以整合
在植物细胞内,信号转导途径从不孤立地发挥作用,而是作为复杂的信号相互作用网络的一部分运行。这些相互作用解释了植物激素经常与其他信号表现出激动(加性或正性)或拮抗(抑制或负性)相互作用的事实。经典的例子包括初级相互作用
赤霉素和脱落酸在种子发芽控制中的拮抗相互作用(见第 17 章)。
信号通路之间的相互作用被称为交叉调节,并提出了三类(图 4.40):
1. 初级交叉调节涉及以正或负方式调节共享转导成分的不同信号通路。
2. 二级交叉调节涉及一条信号通路的输出,该信号通路调节第二个信号的丰度或感知。
3. 三级交叉调节涉及两条相互影响的不同通路的输出。
植物信号传导不是基于简单的线性转导事件序列,而是涉及许多通路之间的交叉调节。了解这种复杂的信号通路如何运作将需要一种新的科学方法。这种方法通常被称为系统生物学,它采用数学和计算模型来模拟这些非线性生物网络并更好地预测它们的输出。
二级相互作用
转导
三级相互作用
两条输入通路调节控制反应的单个共享蛋白质或多个共享蛋白质。两种途径对
具有相同的影响。
两种输入途径
汇聚在共享的
蛋白质上,但其中一种途径
抑制另一种途径的作用。
两种输入途径
调节单独的
反应。此外,一种途径增强了另一种途径的输入水平或感知。
与正相互作用类似,不同之处在于一条通路抑制另一条通路的输入水平或感知。
一条信号通路的反应促进了另一条通路的反应。
其中一条通路的反应抑制了 的反应,反应(通路输出)显示为星号。绿色(正)或红色(负)线表示一条通路影响另一条通路的位置。三种类型的交叉调节可以是正的,也可以是负的。
对外部和内部信号的短期和长期生理反应都源于信号向机械途径的转化(转导)。
为了激活可能远离初始信号位置的区域,信号中间体在传播(传输)之前被放大。一旦发挥作用,信号通路通常会重叠成复杂的信号网络,这种现象称为交叉调节,以协调综合生理反应。
4.1 信号的时间和空间方面
■ 植物使用信号转导来协调对刺激的快速和缓慢反应(图 4.1、4.2)。
4.2 信号通路受体和扩增
■ 受体存在于整个细胞中,并且在细菌、植物、动物和真菌界中是保守的(图 4.3)。
■ 必须放大信号中间体以防止信号级联稀释;MAPK 扩增途径在真核生物中是保守的(图 4.4)。
■ 植物受体样丝氨酸/苏氨酸激酶 (RLK) 的多样化家族在病原体反应以及生长和发育中发挥作用(图 4.5)。
■ 信号也可以通过第二信使放大,例如 Ca2+、H+、活性氧 (ROS) 和修饰脂质(脂质信号分子),尽管解析它们的信号靶标可能具有挑战性(图 4.6)。
■ 修饰的脂质调节生长和应激反应(图 4.7)。
4.3 激素与植物发育
■ 激素可以向合成位点内、附近或远处的细胞发出信号(图 4.8)。
■ 激素是保守的化学信使,可以在极低的浓度下在细胞之间传递信号并启动生理反应(图 4.9)。
■ 除乙烯外,植物激素均含有环状结构(图 4.10)。
■ 在研究因向光性引起的胚芽鞘弯曲时(图 4.11),第一个被鉴定的生长激素是生长素。
■ 赤霉素类生长激素可用作生长调节剂(图 4.12)。
■ 组织培养实验揭示了细胞分裂素作为细胞分裂促进因子的作用
(图 4.13)。
■ 乙烯是一种促进果实成熟和其他发育过程的气态激素
(图 4.14)。
■ 脱落酸调节种子成熟和气孔关闭以应对水分胁迫(图 4.15)。
■ 油菜素类固醇是一种脂溶性激素,可调节许多过程,包括光形态发生、发芽和花性别认同
(图 4.16)。
■ 独脚金内酯由胡萝卜素的酶促裂解而来,可调节从主根茎轴的分枝(图 4.17)
4.4 植物激素代谢和体内平衡
■ 激素浓度受到严格调控,因此信号能够及时产生响应,而不会影响对未来相同信号的敏感性(图 4.18)。
■ 吲哚-3-乙酸是主要的生长素,由色氨酸合成,以吲哚-3-丙酮酸(IPyA)为中间体(图 4.19)。
■ 赤霉素 (GA) 均来自 GA12,GA12 在细胞溶胶中氧化(图 4.23)。
■ 细胞分裂素是腺嘌呤衍生物(图 4.24)。
KNOX 基因促进茎尖分生组织中细胞分裂素的浓度,同时抑制赤霉素的水平。
■ 乙烯由蛋氨酸合成(图 4.25),并以气体形式迅速扩散出植物;
没有乙烯分解代谢的证据。
■ 脱落酸由 40 碳类胡萝卜素合成(图 4.26);其浓度在发育过程中可能会发生剧烈波动。
■ 油菜素类固醇来源于菜油甾醇,其结构与胆固醇相似(图 4.27)。
■ 独脚金内酯和其他脱辅基类胡萝卜素信号化合物来源于类胡萝卜素,类似于脱落酸(图 4.28)。
4.5 植物体内激素的运动
■ 生长素梯度和极性运输是程序化和可塑性发育的核心组成部分。
■ 生长素的极性运输由化学渗透梯度驱动,主要受极化流出载体调节(图 4.29)。
■ 极性生长素运输调节器官发生并维持植物形态的极性(图 4.30)。
4.6 激素信号传导途径
■ 细胞分裂素和乙烯途径使用衍生的双组分调节系统,其中包括膜结合传感器蛋白和可溶性反应调节蛋白(图 4.31–4.33)。
■ 油菜素甾体和某些生长素途径利用跨膜受体样丝氨酸/苏氨酸激酶 (RLK) 磷酸化靶蛋白的丝氨酸或苏氨酸区域(图 4.34)。 ■ 脱落酸途径通过 PYL/PYR/RCAR 受体调节磷酸酶和激酶(图 4.36)。
■ 大多数植物激素途径采用负调节剂(失活阻遏物),从而更快地激活下游反应基因(图 4.36、4.37)。
■ 多种受体同工型和调节剂使激素表现出组织和器官特异性反应。
■ 植物还可以使用动作电位进行快速作用、长距离电信号传导,尽管这种信号的传输尚不明确(图 4.39)。
■ 关闭信号通路是通过反馈机制降解或隔离化学信号来实现的(图 4.38)。
■ 信号转导途径的整合是通过交叉调节实现的(图 4.40)。
